-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
炎症,慢病
炎症,作为一种保护机制,其本身是有益的。因受伤或感染而产生的急性炎症具有适应性,能够成功支持先天和适应性免疫反应的精心协调。然而,无论是由心理因素还是器质性因素(如抗原或损伤)引起的,持续或反复激活免疫系统都会导致长期的炎症反应,从而引发低度慢性炎症。
失调的炎症作为影响最常见慢性病的驱动因素,它不分青红皂白地影响着整个人体。
人体,作为一个综合系统,一个变量的紊乱会通过多种途径对其他关键因素“造成”连锁反应,并且过程还与反馈相关。人体需要一种通用的方式在其不同的解剖部分之间进行交流,即一种共同的生理机制。炎症可能是了解疾病在体内如何发展和进展的关键,炎症不仅是身体系统的“表达语言”,也是解决多种慢性疾病的指标或目标。
因此,普遍存在的疾病彼此独立、需要通过离散的特定干预措施进行管理的孤立观点已不再站得住脚。疾病的“表型”特征只是整个系统紊乱的一种表现,即一个人身上“多种不同疾病”的个例,实际上是由炎症这一共同线索串联起来的。
因此,识别具体的炎症来源、标志物,并综合这些指标来判别定位这些影响的靶器官或组织,是预防和管理慢性病的重要思路。
未来的预防医学需要无创、便捷且准确的方法来判别炎症源和炎症反应影响的靶器官或组织。例如,识别促炎细胞因子如IL-1、IL-6、IL-12、IL-18、TNF-α、IFN-α,组织代谢物如尿酸盐晶体和肝素结合蛋白的变化以及是否高负荷状态,是未来医学的重要一环。
随着大数据和多组学技术的发展,目前还可以通过分析体温、血压、心率等生理指标的变化,同时结合微生物组学、基因组学、蛋白组学数据,识别出与炎症水平相关的身体标志物,将有助于为个体综合治疗管理提供更加全面的依据。
本文将回顾了促炎和抗炎调节的局部免疫级联以及与神经和心理通路相互关联的反馈回路。
共同探讨和尝试了解身体这个精细调节的系统,如果遭受持续不断的“超负荷”将导致全身性炎症,从而导致慢性疾病的出现。描述了几种常见疾病的途径,以及这些详细理解对临床医学、预防和卫生系统等的启思。

■ 免疫系统的主要目标:
清除体内外来或非自身细胞物质,如细菌、病毒、真菌、寄生虫和受损细胞。
■ 免疫系统由两个分支组成:
先天免疫系统是基本的首道防线,负责启动炎症反应。
适应性免疫系统进化得更高级,能够在生物体一生中接触抗原时“学习”并形成“记忆”。

免疫系统的两个分支虽然功能各异,但都致力于保护身体的健康。它们的主要任务是协同工作,并有效清除体内的有害物质(非自身细胞物质)。这两个分支都负责监测整个身体的抗原存在情况;但每个分支的启动方式却不同。
简而言之,这两个分支就像是身体的两支特种部队,各有所长,但通力合作,共同守护健康。
■ 初级淋巴器官
包括骨髓和胸腺,淋巴细胞在此生成和/或分化。例如,T 细胞在胸腺中分化并经历正向和负向选择,使 T 细胞进入血液,只有当识别具有主要组织相容性复合体 (MHC) 标记的细胞并呈递抗原时,T 细胞才会被激活。
■ 次级淋巴器官
包括淋巴结和脾脏,它们是幼稚免疫细胞的储存器。淋巴结过滤淋巴系统并提供抗原激活白细胞与 B 细胞和 T 细胞之间的相互作用。
幼稚白细胞监测血液和组织中的外来抗原和/或被免疫信使(如细胞因子)招募到炎症部位并被激活。一旦被激活,白细胞就会清除受影响区域的外来抗原、受感染、受伤或死亡的细胞,并协助修复。
免疫细胞利用细胞因子作为自分泌、旁分泌或内分泌信使,在彼此之间以及与其他生物系统之间进行交流,从而产生协同、拮抗或多重效应。
注:自分泌(Autocrine)信使:
自分泌信使是指细胞释放的化学物质作用于同一细胞自身。这种信号传递方式使细胞可以调节自身的功能和活动。例如,一种细胞产生某种激素或生长因子后,会通过自分泌方式使自身的生理活动发生变化。
旁分泌(Paracrine)信使:
旁分泌信使是指细胞释放的化学物质作用于邻近的细胞。这种类型的信号传递对于局部细胞间的通讯至关重要。例如,在伤口愈合过程中,某些细胞释放的生长因子可以影响周围细胞的增殖和修复能力。
内分泌(Endocrine)信使:
内分泌信使是指细胞或腺体释放的激素通过血液循环到达远离其来源的靶细胞,通常这种信号传递作用于身体内的多个系统。例如,胰腺分泌的胰岛素通过血液传播,调节各个组织的糖代谢。
细胞因子环境可以调节适应性免疫反应。例如, IL-2(白细胞介素 2) 和 IFN-γ(干扰素-γ) 的产生支持细胞毒性 T 淋巴细胞的激活,是抵抗细菌和病毒所必需的。然而,高水平的IL-4和IL-6支持B淋巴细胞的激活和增殖,有利于抗体的产生。
先天免疫系统不仅涉及细胞防御,还涉及物理和化学屏障。
物理屏障包括皮肤和呼吸系统及胃肠道系统的粘膜。化学屏障是胃的酸性 pH 值。
尽管先天免疫系统比较简单,但它是造成即时非特异性炎症的原因,例如皮肤割伤引起的发热、发红、疼痛、肿胀。
利用识别细菌常见膜配体的模式识别受体 (PRR),先天免疫系统可以检测多种微生物抗原并引发炎症反应。
注:模式识别受体(Pattern Recognition Receptors,PRR)是存在于宿主细胞表面或细胞内的一类受体,主要负责识别和应对病原体(如细菌、病毒、真菌和寄生虫)以及其他有害物质(如损伤相关分子模式,DAMPs)。这些受体在先天免疫系统中发挥关键作用,帮助机体快速识别并响应感染和损伤。
此外,血液中还存在可溶性模式识别受体,包括补体系统。补体是一系列蛋白质,可导致微生物膜上“穿孔”,并有助于招募炎症细胞。
积极参与先天免疫反应的免疫细胞包括巨噬细胞(活化单核细胞)、中性粒细胞、自然杀伤 (NK) 细胞和树突状细胞 (DC)。
利用吞噬作用清除抗原或微生物,并产生活性氧来杀死微生物。
裂解病毒感染的细胞。一旦被激活,NK 细胞就会继续通过细胞因子招募新的免疫细胞。
也称为抗原呈递细胞 (APC),会迁移到淋巴结以引发适应性免疫系统的激活。
对先天免疫系统有效性至关重要的细胞因子包括 IL-1、IL-6、TNF-α、IFN-α。这些免疫信使会引发发烧、疼痛和疲劳(临床上称为疾病行为),并激活下丘脑-垂体-肾上腺轴 (HPA轴)。
■ IL-1(白细胞介素-1):
IL-1是一种主要的促炎细胞因子,由巨噬细胞、单核细胞和其他免疫细胞产生。
它有两种主要形式:IL-1α 和 IL-1β。
主要功能包括促进炎症反应、刺激T细胞和B细胞的增殖、诱导发热,并参与机体对感染和损伤的反应。IL-1还可以促进其他细胞因子的产生,增强免疫反应。
■ IL-6(白细胞介素-6):
IL-6是一种多功能细胞因子,由多种细胞产生,包括巨噬细胞、内皮细胞和肌肉细胞。
它在急性炎症、免疫反应和细胞增殖中发挥重要作用。IL-6可以刺激B细胞分化为抗体产生细胞,促进T细胞增殖,并参与急性期反应,增加急性期蛋白的产生。
■ TNF-α(肿瘤坏死因子-α):
TNF-α是一种主要的促炎细胞因子,由巨噬细胞、T细胞和其他细胞产生。
它在免疫反应和炎症中发挥关键作用,能够诱导细胞凋亡、促进炎症反应、增强免疫细胞的活性,并参与各种疾病的病理过程,如自身免疫病和感染。
■ IFN-α(干扰素-α):
IFN-α是干扰素家族中的一种,主要由病毒感染的细胞、T细胞和树突状细胞产生。
它在抗病毒免疫中发挥重要作用,能够增强细胞的抗病毒能力,抑制病毒复制,并刺激邻近细胞产生其他抗病毒蛋白。IFN-α还可以增强白细胞的活性,促进适应性免疫反应。
这些细胞因子在免疫反应、炎症以及与多种疾病(如感染、癌症和自身免疫疾病)的发展中扮演着重要的角色,它们的相互作用和调控对于维持机体的免疫平衡和健康至关重要。
更进化的适应性免疫系统仅存在于脊椎动物中,负责增加抗原清除的强度和特异性,以及发展记忆,以便在二次接触时更快地清除抗原。

在人类中,适应性反应需要10-14 天才能产生原发性抗原特异性反应。
T 细胞有两种主要类型:辅助性T (TH) 细胞 (CD4+) 和细胞毒性T (TC) 细胞 (CD8+),它们在血液和淋巴系统中循环,并驻留在次级淋巴器官中。
一旦 T 细胞通过 APC 呈现抗原,它们就会分化为记忆细胞和效应细胞。TC效应细胞是细胞毒性 T 淋巴细胞 (CTL),可裂解携带抗原的细胞。
APC(抗原呈递细胞,Antigen-Presenting Cell)
是免疫系统中的一种特殊细胞,负责捕获、处理和呈递抗原(如病原体、毒素和其他外源性物质)以激活T细胞,从而启动适应性免疫反应。APC在免疫反应中的作用至关重要。
■ 常见的APC包括:
树突状细胞:最有效的抗原呈递细胞,负责捕获外来物质并在淋巴结中激活T细胞。
巨噬细胞:具有吞噬和消化病原体的能力,也能呈递抗原。
B细胞:虽然主要功能是产生抗体,但也能作为APC呈递抗原。
■ 抗原呈递的过程
抗原呈递涉及以下步骤:
捕获抗原:APC通过吞噬或内吞作用捕获外源性抗原,通常是在感染的部位或周围组织。
处理抗原:APC内的酶会将捕获的抗原分解成小肽片段。
呈递抗原:这些小肽片段与主要组织相容性复合体(MHC)分子结合,然后被转运到APC的细胞表面。

编辑
■ MHC分子分为两类:
MHC I类:呈递内源性抗原,通常由所有有核细胞表达,主要激活CD8+细胞毒性T细胞。
MHC II类:呈递外源性抗原,通常由APC(如树突状细胞和巨噬细胞)表达,主要激活CD4+辅助T细胞。
■ T细胞激活与免疫应答
T细胞激活:当T细胞的T细胞受体(TCR)识别并结合APC表面的抗原-MHC复合物时,它们被激活。激活后的T细胞会增殖,分化为效应T细胞,参与免疫应答。
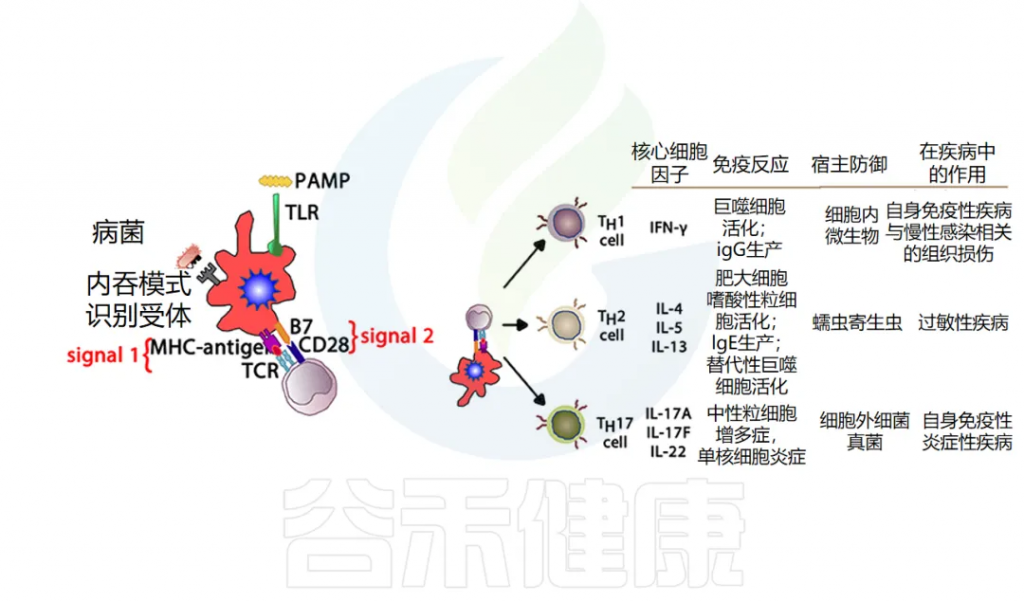
TH效应细胞功能:负责产生细胞因子并指导 B 细胞发育或动员。先天免疫细胞产生的当前细胞因子环境会影响 TH细胞的发育,进而影响免疫反应的进程,使其倾向于两个主要方向之一。
TH1 细胞产生细胞因子 IL-2、IFN-γ 和 TNF-α,这些细胞因子可驱动 CTL 活化并支持细胞免疫。这种细胞介导的免疫反应对于针对细胞内细菌和病毒产生有效反应至关重要。
注:CTL是适应性免疫系统中的主要效应细胞,负责识别和消灭被病毒感染的细胞以及肿瘤细胞。其主要功能是通过释放细胞毒性因子来诱导靶细胞凋亡,从而发挥抗感染和抗肿瘤的作用。
另一方面,TH2 细胞产生IL-4和IL-5,进而支持B细胞活化和分化,也称为体液免疫。
TH和TC记忆细胞通过血液和淋巴系统监测身体是否反复接触抗原。这两种细胞类型对于快速、有效地对抗原产生二次反应都至关重要。
其他T细胞亚群的作用
其他T细胞亚群也被定义为在宿主防御中发挥关键作用,并且更多 T 细胞亚群的重要性日益得到认可:T 调节细胞(Treg)和 TH17 细胞。
Treg细胞在调节其他免疫反应中起着核心作用,它们释放 TGF-β 和 IL-10 来下调 TH1 和 TH2 细胞的过度活化,如果不加以控制,这些细胞分别可能导致自身免疫或过敏性疾病。
TH17 会释放 IL-17,在涉及中性粒细胞募集(尤其是对粘膜)的抗菌防御中起重要作用,在防御某些特定病原体(如念珠菌)方面发挥着特别重要的作用。
■ 体液免疫的重要性
体液免疫反应,在对抗细胞外微生物和在对抗原的原发性和继发性反应期间产生抗体反应方面非常重要。
未成熟 B 细胞遍布全身,在淋巴结中浓度较高。活化的 B 细胞成为效应浆细胞,并制造抗原特异性抗体,以中和游离抗原或标记受感染细胞以进行破坏。
记忆 B 细胞是长效细胞,通过为吞噬或溶解免疫细胞创造更大的攻击目标(如在原发性反应中)来支持在第二次接触期间更快地清除。
例如,NK 细胞和巨噬细胞检测抗体复合物,从而导致抗体中和抗原或受感染细胞的吞噬。此外,抗体可以激活或延续补体级联。
当身体感受到感染、创伤、缺血、物理、化学或其他形式的“危险”时,就会引发炎症。
暴露于病原体相关分子模式 (PAMP) 和损伤相关分子模式 (DAMP) 会导致单核细胞-巨噬细胞谱系细胞激活,从而表达促炎基因并抑制抗炎基因。
■ 病原体相关分子模式 (PAMP)
定义:PAMP是指广泛存在于病原体(如细菌、病毒、真菌和寄生虫)中的特征分子,相较于宿主细胞而言,这些分子是特异性地存在于病原体中。
常见的PAMP示例包括:
特点:
PAMP通常是高度保守的分子结构,使得宿主的免疫系统能够快速识别和应对多种病原体。
功能:
PAMP通过与宿主细胞的模式识别受体(PRR,如Toll样受体等)结合,激活免疫反应,包括炎症反应、白细胞的招募和抗体的产生。它们在启动先天免疫反应中起到关键作用。
■ 损伤相关分子模式 (DAMP)
定义:DAMP是指宿主细胞在受到损伤、死亡或应激时释放的内源性分子。这些分子可以被免疫系统识别,从而触发免疫反应。
常见的DAMP示例包括:
特点:DAMP并不是特定于病原体的,而是在细胞受到损伤或应激时由宿主自身细胞释放的。
功能:DAMP通过与模式识别受体相互作用,促进免疫细胞的活化,诱导炎症反应,帮助机体清理损伤细胞并启动修复过程。
细胞因子和趋化因子在炎症中的作用
细胞因子、趋化因子和其他化学物质的产生会介导非特异性细胞募集和体液介导的血管变化。这些细胞过程由各种细胞内信号传导和核转录途径介导。
促炎反应:NF-κB 和 AP-1
NF-κB 和 AP-1 这两种转录因子在促炎反应中扮演关键角色,它们能够驱动促炎细胞因子(如TNF-α 和 IL-1)、趋化因子(如 CCL2 和 CXCL8)以及内皮粘附分子的表达,从而影响炎症反应的进程。
干扰素反应因子 IRF3 和 IRF7
另一方面,干扰素反应因子 IRF3 和 IRF7 则主要负责促进 I 型干扰素(如 IFN-α 和 β)的产生,这些干扰素在对抗病毒防御中具有重要作用。
然而,炎症反应并不仅仅由这些分子机制所限定。实际上,除了病原体引起的免疫激活外,非抗原性刺激也能触发炎症过程。
非抗原刺激引发的炎症反应
非抗原刺激可能被视为“危险”并引发炎症反应;这些影响包括创伤,如辐射、缺血、毒素暴露,甚至心理压力。
这些因素可能通过各种机制诱发炎症,包括激活神经内分泌通路(如情绪压力所见,见抑郁症部分),或通过上调刺激炎症信号传导的“应激”通路,如缺血性中风中的小胶质细胞激活。
环境毒素和化学物质的影响
如农药残留、添加剂、防腐剂等,也可能通过激活细胞色素 P450 通路、诱导活性氧或代谢为具有免疫毒性作用的反应中间体和新抗原,来诱发炎症活动。也就是说,我们日常接触的化学物质可能正悄悄影响着我们的免疫系统。
芳烃受体 AhR 在炎症中的角色
在探讨了化学物质如何诱发炎症之后,我们进一步了解到芳烃受体AhR在其中扮演的角色。芳烃受体AhR激活可以介导对一系列内源性和外源性配体的炎症反应,在粘膜免疫和正常屏障功能中发挥关键作用,同时也是各种致癌因素途径,如二恶英的致病。强调了环境因素与炎症性疾病之间的复杂联系。
临床上,炎症的典型表现是疼痛、发热、发红、肿胀和功能丧失。组织损伤会导致组胺释放,刺激毛细血管扩张,导致血管淤滞,使吞噬细胞迁移和血浆渗漏(发红、发热和肿胀)。
缓激肽的释放会增加含有神经末梢的组织的疼痛敏感性。功能丧失被认为是对疼痛的神经反射。
吞噬活性可清除病原体,炎症级联的下调可导致愈合。
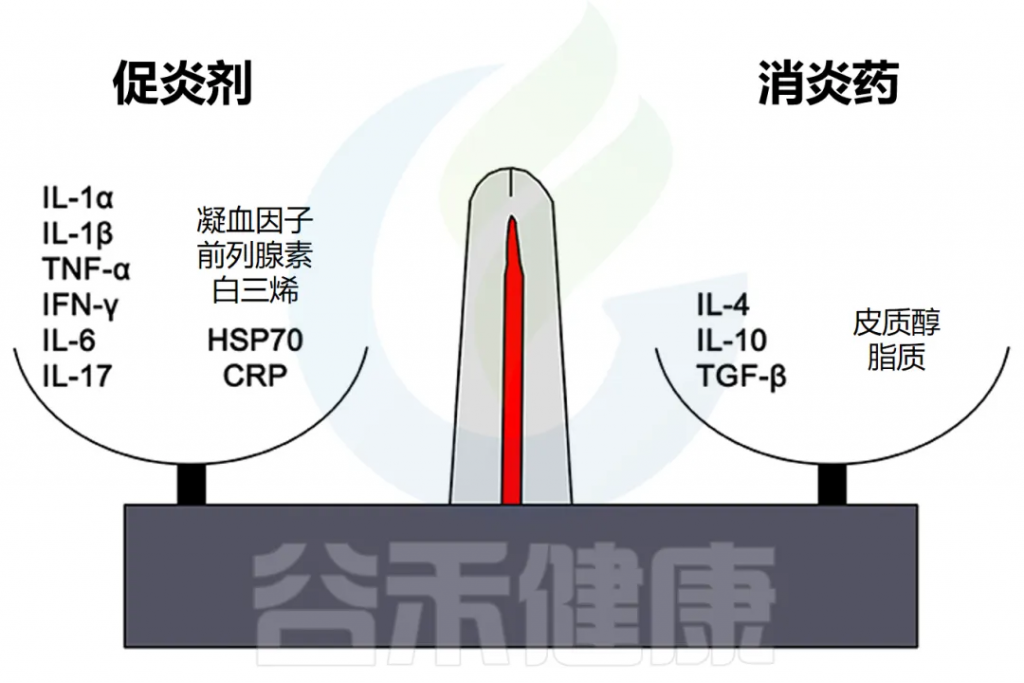
细胞因子在炎症中的双重作用
IL-1、IL-6 和 TNF-α 等因子有利于炎症,而 IL-10 和 TGF-β 等细胞因子可抑制炎症。
然而,这些区别并不是绝对的,有些因素起着双重作用。例如,IL-4 会干扰某些肿瘤的炎症,但有利于过敏症中的抗体产生。
慢性炎症中IL-6的作用
在慢性炎症的背景下,IL-6 通常被认为是促炎的,然而,也有 IL-6 具有抗炎作用的例子,也可能表明其他自然的持续过程,如组织修复。因此,在检查炎症水平时,结合背景至关重要,才得出正确的结论。
doi.org/10.3389/fmed.2018.00316
此外,炎症平衡的非细胞因子介质包括促炎化学物质,如 CXCL8 趋化因子和某些金属蛋白酶,以及抗炎剂,包括抗菌肽、TIMP(金属蛋白酶组织抑制剂)和趋化因子 CCL2 。
这些“宏观”炎症变化受免疫调节途径控制。然而,免疫反应释放的免疫介质和细胞因子会触发神经元反应,从而放大局部炎症反应,并触发全身神经内分泌和神经反应,最终导致炎症过程消退并恢复正常的稳态。
这些正常的反馈回路可能会因中枢神经系统长时间或不适当的激活而中断,从而导致激素抑制不足导致过度炎症,或因过度或长时间的抗炎反应导致不受控制的感染。
炎症会导致全身不适反应
可能会出现发烧、恶心、食欲不振、疲倦,睡眠质量差、易怒、情绪低落、注意力不集中、健忘、社交退缩等。
这些症状是由促炎细胞因子引发的,包括 IL-1α、IL-1β、TNF-α、IFN-γ、 IL-6等。虽然它们是对感染的局部反应,但它们会刺激大脑细胞因子系统,导致出现疾病症状,促使人们减少活动,多休息更好地应对感染。
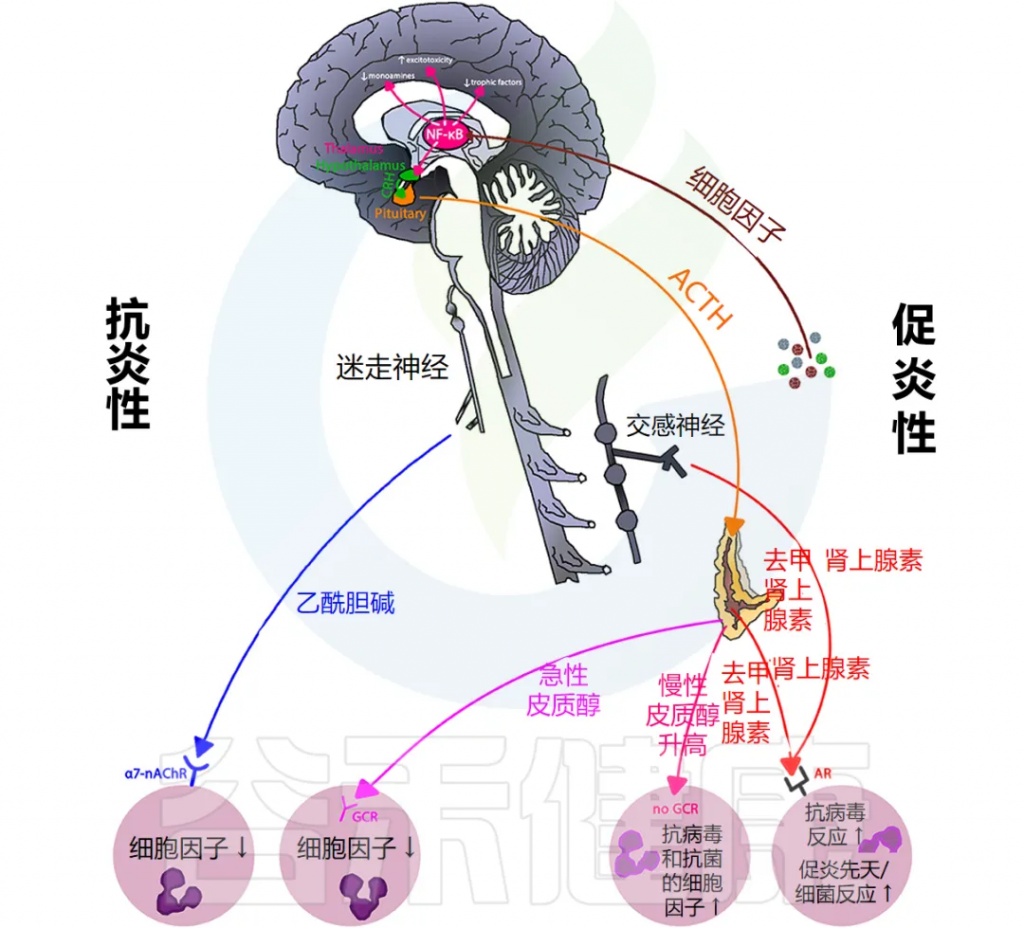
炎症通过激活许多不同的反馈回路触发全身反应。中枢神经系统 (CNS) 对环境刺激反应迅速,导致神经递质和神经肽与免疫介质刺激的相同信号通路结合。
炎症部位释放的免疫调节剂与疼痛通路的神经递质受体相互作用,反过来,局部神经肽可以释放组胺等促炎介质来增强局部炎症反应。
神经对炎症的反应很快,但会随时间而变化,并且可能对炎症过程产生放大或抑制作用,因此临床上观察到的疾病行为会随时间而变化。
总体而言,这些神经反应模式旨在维持正常的生理稳态,以响应免疫系统刺激和正常组织功能的恢复。
下图说明大脑免疫系统的主要通路和反馈回路。
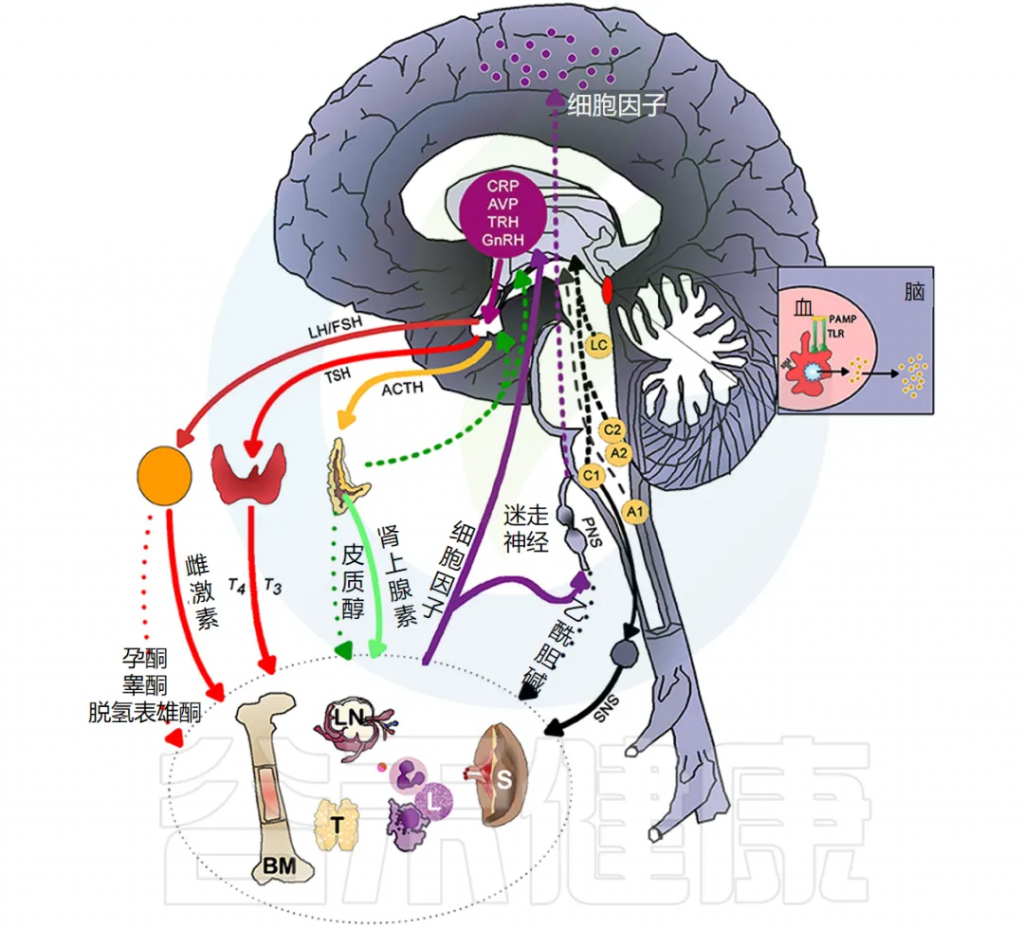
doi.org/10.3389/fmed.2018.00316
交感神经系统 (SNS) 激活促进免疫细胞活动和全身免疫反应,而副交感神经系统 (PNS) 和下丘脑-垂体-肾上腺 (HPA) 轴通常会抑制炎症反应。然而,慢性应激反应系统的激活会导致免疫细胞过度活跃并促进全身炎症(详情将在下一节讨论)。
大脑中有小胶质细胞、巨噬细胞和树突状细胞等免疫细胞,它们在受到炎症刺激时会产生细胞因子和前列腺素,刺激神经和非神经脑细胞受体,从而影响大脑功能。
小胶质细胞和神经元可以对外周细胞因子的产生作出反应。此外,小胶质细胞是免疫系统中的常驻神经细胞,对细菌脂多糖 (LPS) 敏感,由于 Toll 样受体 (TLR) 的表达,它可直接引发中枢神经系统炎症,而无需外周细胞因子的参与。
无论是与实际年龄还是慢性疾病状态相关的衰老大脑,都有更多反应性小胶质细胞,它们对刺激有过度的细胞因子反应,并破坏神经可塑性以及行为和认知功能。
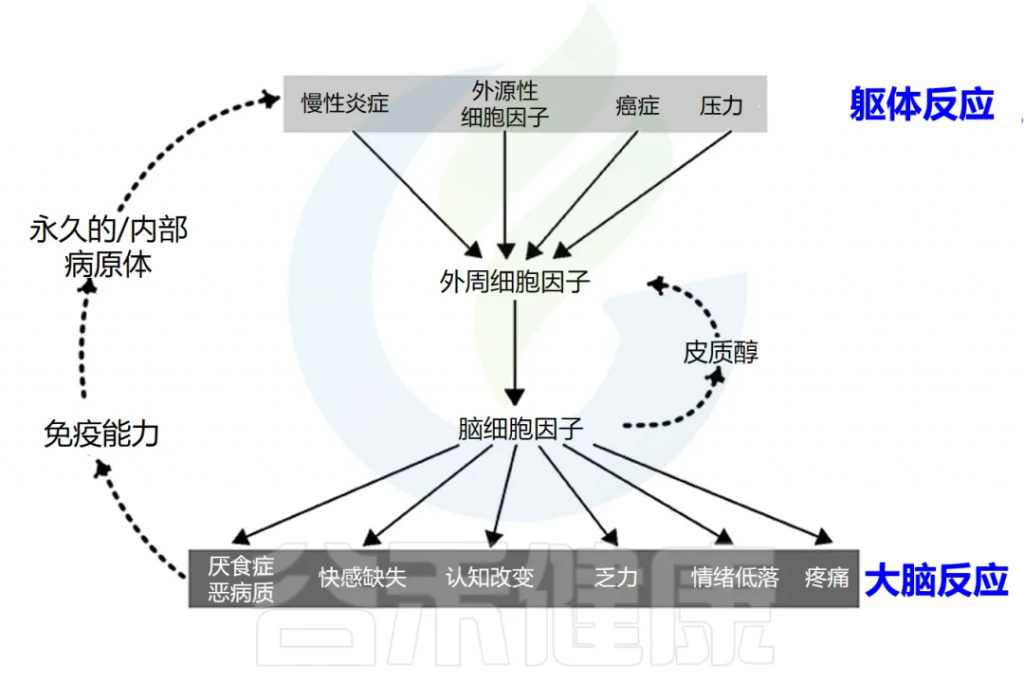
doi.org/10.3389/fmed.2018.00316
大脑对外周免疫反应的监测
大脑还通过传入神经刺激、体液途径、跨血脑屏障的细胞因子交换以及血管周围巨噬细胞和脑小静脉内皮细胞上的 IL-1 受体激活来监测外周免疫反应。
抗炎细胞因子的调节作用
大脑中的抗炎细胞因子 IL-10 和 TGF-rβ 可改善疾病体验。在健康状态下,大脑中的促炎和抗炎细胞因子保持平衡。由于衰老与先天免疫系统活动增加有关,因此大脑会产生大量的促炎细胞因子,但抗炎细胞因子的产生会减少,从而导致更明显的疾病行为。
皮质醇的基本功能
皮质醇是一种糖皮质激素,影响身体的日常功能,如能量利用/储存、记忆形成、呼吸、心率、胃肠功能和情绪。它有稳定的昼夜节律,但也会因内部(如过度免疫活动)和外部(如感知到的威胁)压力源而释放。皮质醇是下丘脑-垂体-肾上腺 (HPA) 轴的终产物。
HPA轴与皮质醇的调控
下丘脑的促肾上腺皮质激素释放激素 (CRH) 会启动垂体前叶释放促肾上腺皮质激素 (ACTH)。ACTH 通过血流传播并刺激肾上腺皮质产生皮质醇。
通过对海马中的糖皮质激素受体进行负反馈,皮质醇会阻止 CRH 和 ACTH 的进一步释放。其他各种激素,包括雄激素、雌激素、垂体后叶激素、加压素和催产素,都可以调节HPA轴。
皮质醇与免疫系统的相互作用
在调节良好的系统中,免疫细胞会表达糖皮质激素受体,从而使皮质醇抑制免疫细胞活化和促炎细胞因子释放。
然而,慢性压力可能会长时间升高皮质醇水平,导致糖皮质激素受体表达下调。因此,不受调节的免疫细胞会产生过量的促炎细胞因子。
“
皮质醇作为HPA轴的终产物,在调节身体对压力的响应、维持生理平衡以及抑制免疫反应中发挥着关键作用。理解皮质醇的生理作用及其调控机制,对于我们认识压力如何影响健康具有重要意义。同时,慢性压力下皮质醇水平的变化及其对免疫系统的潜在影响,也提示我们在面对长期压力时需要采取适当的应对策略,维护身心健康。
自主神经系统直接连接大脑和周围器官和组织。其两个独立分支发出相反的信息,即交感神经兴奋和副交感神经放松。
■ 交 感 神 经 系 统
交感神经支配将大脑直接与肾上腺髓质联系起来,让身体做好“战斗或逃跑”的准备。
交感神经激活后,肾上腺髓质会释放儿茶酚胺、肾上腺素和去甲肾上腺素,这些物质会导致心率、血压和呼吸频率增加,并将血液从非重要器官转移到主要肌肉群和大脑。
尽管儿茶酚胺的半衰期较短且在血液中代谢迅速,但交感神经系统 (SNS) 也直接支配作为免疫细胞储存器的次级淋巴结构。因此,慢性交感神经激活和去甲肾上腺素释放可导致免疫失调。例如,去甲肾上腺素促进核因子 κB (NF-κB) 活化,这会增加几种促炎介质的基因表达,进而增强炎症。
此外,肾上腺素在应激期间会增加 IL-6 和 TNF-α 的产生。因此,肾上腺素和去甲肾上腺素可以诱导促炎细胞因子的产生并增强全身炎症。
■ 副 交 感 神 经 系 统
副交感神经与交感神经的平衡
副交感神经系统 (PNS) 通过多种方式对抗交感神经系统,例如减慢心率、降低呼吸频率、促进消化和平静情绪。迷走神经具有传入和传出神经纤维,用于大脑和周围神经之间的双向通讯。
副交感神经的免疫调节作用
副交感神经激活会导致乙酰胆碱释放。乙酰胆碱可以与免疫细胞表面的 α7 烟碱型乙酰胆碱受体 (nAChR) 结合。α7 nAChR 刺激可抑制 NF-κB 改变炎症表达,从而导致细胞因子产生减少和抗炎作用。
PNS在压力管理中的角色
在静息期间,PNS控制着器官和身体功能。长期压力下,如果交感神经占主导地位,PNS对免疫功能的调节作用可能会受到抑制。
维持平衡的自主神经系统
即休息时迷走神经占主导地位,以及 PNS 的动态、可变激活,与情绪反应和压力脆弱性有关。Porges 的多重迷走神经理论利用进化和发展的方法,将 PNS 活动和社会沟通与支持对宁静、潜在危险和危及生命的环境做出适应性反应的电路层次联系起来。
神经内脏整合模型,以描述压力源(无论来源如何)如何从外周感觉汇聚到大脑,这些信息如何整合,以及 PNS 反应的灵活性,对于理解个体生理如何受到调节至关重要。
心率变异性的评估与意义
无论使用哪种视角,心率变异性 (HRV) 都可以评估 PNS 对 SNS 的影响,PNS 激活的变异性越大(即身体越平衡、越灵活),HRV 就越高。
因此,与 HRV 较低的人相比,HRV 较高的人功能更好,幸福感更强(例如,社交、情感、心理、生理),包括炎症更低。对于初级保健临床医生和为弱势群体服务的医疗工作者来说,HRV 可以作为个人功能状况的良好估计,包括免疫功能的间接替代指标。
炎症消退的其他途径
虽然本文主要关注神经内分泌系统和免疫系统之间的交集,但我们认识到还有其他途径可以消退炎症。例如,脂质介质(如消退素、保护素和马来素)在关闭和清除急性炎症反应方面起着关键作用。此外,这些生物活性脂质似乎可以阻断 NF-κB 活化,这与皮质醇和乙酰胆碱的作用相似。
Tips
因受伤或感染而产生的急性炎症具有适应性,能够成功支持先天和适应性免疫反应的精心协调。然而,无论是心理上还是器质性(即抗原、损伤)相关的,持续或重复激活免疫系统都会导致长期暴露,从而导致低度炎症。
这种慢性炎症会破坏多个系统,因为它会影响神经系统,并通过细胞因子受体在多个身体组织中表达而局部破坏多个系统。
作为一个综合系统,人体需要一种通用的方式在其不同的解剖部分之间进行交流,即一种共同的生理机制。炎症可能是了解疾病在体内如何发展和进展的关键,炎症受促炎和抗炎细胞因子的产生所调节。
因此,普遍存在的疾病彼此独立、需要通过离散的特定干预措施进行管理的孤立观点已不再站得住脚。疾病的“表型”特征只是整个系统紊乱的一种表现。在综合系统中,一个变量的紊乱会通过多种途径对其他关键因素“造成”连锁反应,并且总是与反馈相关,以调节“致病变量”的行为。
例如,外部因素和内部因素可导致相同的表型结果;社会经济地位低和脂肪组织过多都与慢性炎症有关。这种炎症加剧会导致大脑细胞因子信号增加,损害学习和记忆,并导致抑郁症状或病态行为;
这种反馈导致负面或不健康的系统性循环进一步传播。因此,不受控制或失调的炎症将慢性身心疾病的表现结合在一起,这些疾病通常普遍存在于高压力、脆弱的人群中(例如少数民族、社会经济地位较低等)。
目前,大多数疾病的病因都是由外部致病因素和/或内部生物医学变化导致疾病的宏观和/或微观表现所致。然而,一个显而易见但很少被提出的问题是:这些疾病是如何促成的?
大多数疾病(无论是急性还是慢性)都是由炎症引起的。
神经内分泌—免疫平衡失调,无论是受到“压力”和侵入性病原体等外部因素刺激,还是受到糖尿病或肾衰竭等代谢紊乱等内部因素刺激,都会导致免疫细胞活动失控。抗炎机制的同步丧失导致细胞因子负荷升高,进而激活 NF-κB和基因转录调控。
此外,许多疾病都是触发了“相关”疾病共病,如心脏病和糖尿病。疾病分类只提供了表型分类或命名,而不考虑潜在的病因和生理网络相互作用。
这些见解挑战了当前对“多重患病”的方法,一个人的表型疾病集合是精细调节的相互关联的生理网络反应的出现结果。
这里我们看到了,体内促炎与抗炎活动的微妙平衡,为我们提供了一种有效且高效的机制,以应对所有可能威胁生物体生存的内外干扰。这种平衡确保了我们能够迅速而恰当地响应各种挑战。
接下来我们将详细(但也不全面)地概述许多常见慢性疾病背后的一些重要炎症机制。特别是强调了,通过刺激下丘脑-垂体-肾上腺 (HPA) 轴而激活的炎症与慢性交感神经激活对疾病的促进之间的关联。
过去 30 年来,过敏性呼吸道疾病(过敏性气道疾病、哮喘和过敏性鼻炎)的患病率不断上升;哮喘影响约 8% 的人口,过敏性鼻炎影响 15% 至 20% 的人口。
过敏原的类型
过敏是指对环境中普遍存在且本质上相对无害的病原体产生的不适当的破坏性反应。
常年诱因包括:
屋尘螨、动物皮屑、霉菌、蟑螂蛋白。
季节性诱因包括:草、树、杂草的花粉。
更多过敏原及过敏的预防措施详见:
过敏的机制
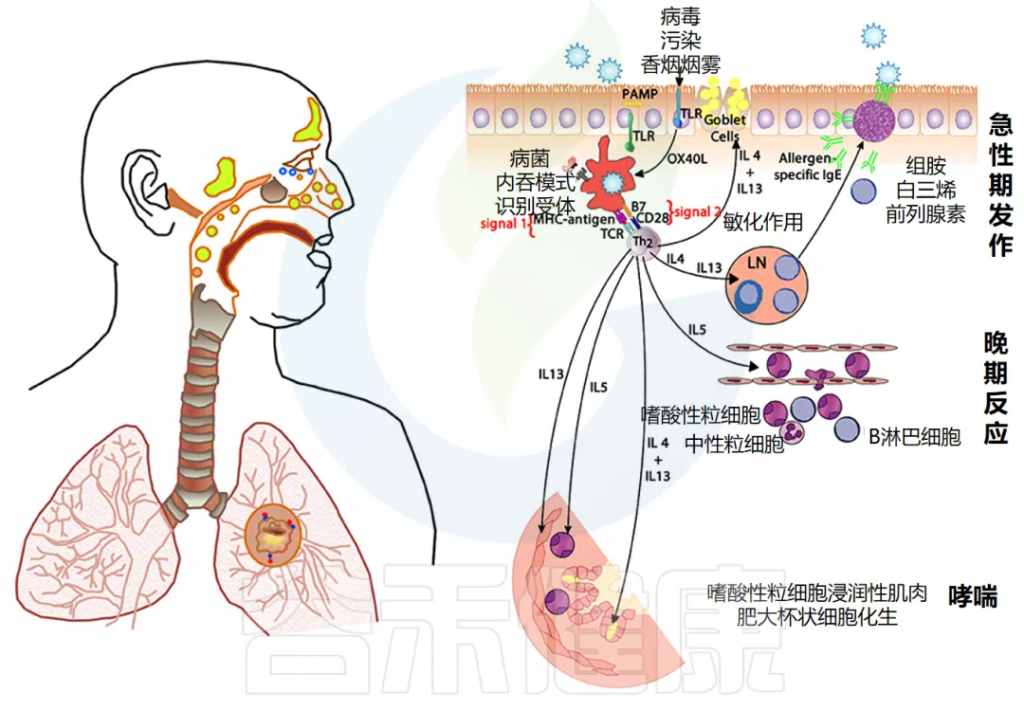
过敏症,即在TH2 型 T 细胞的驱动下,对普遍存在的抗原产生过量 IgE 抗体。过敏症是由过敏原特异性 IgE 反应引起的,可通过表皮皮肤测试(下图)或血液过敏原特异性 IgE 测量来证实。
此类测试可揭示致敏的存在,但只有一小部分人会发展出临床上明显的过敏性疾病:过敏性皮炎(湿疹)、过敏性鼻炎、哮喘、食物过敏和其他过敏反应等。
特应性具有很强的遗传决定性
如果父母一方患有特应性,则患过敏性疾病的可能性约为 50%,而如果父母双方都患有特应性,则患过敏性疾病的可能性为 70%。
doi.org/10.3389/fmed.2018.00316
哮喘
哮喘是一种疾病,表现为反复发作的呼吸道受阻。特征包括时好时坏的气道堵塞、慢性的支气管炎症和对刺激表现出极强的敏感性。
过敏性哮喘的成因
这些问题主要是由于气道对某些过敏物质的强烈反应引起的,尤其是由一些特定化学物质(如白三烯)引发的过敏反应。
不过,对于约30%没有明确过敏原的哮喘患者,这种病可能是因为对多种刺激(如感染、药物、寒冷、胃酸倒流和运动)过度反应引起的。
非过敏性哮喘的成因
在所谓的“非过敏性”哮喘患者中,包含许多不同的亚群。其中一些亚群表现与典型过敏反应相似,但不产生过敏抗体,而另一些亚群则表现出不同的免疫特征。
过敏性呼吸道疾病的免疫机制
对于过敏性呼吸道疾病,免疫系统的某些细胞会将入侵体内的外来物(称作抗原)处理和呈递给免疫细胞,导致过敏反应的发生。这一过程需要多种信号进行协调,类似打响并引导免疫反应。
如果在抗原呈递过程中,有些特定信号分子(如IL-4)成为主导,会导致免疫细胞趋向于“过敏反应”,这时体内如哮喘的表现就可能加重。
doi.org/10.3389/fmed.2018.00316
自身免疫性疾病影响大约 5% 的人口 ,并表现为一系列全身性疾病(如狼疮、硬皮病)和器官特异性性疾病(如慢性荨麻疹、甲状腺炎)。
自身免疫性疾病的成因
自身免疫性疾病是当身体的免疫系统错误地攻击自身组织时发生的。这种情况通常是因为身体的“中枢”和“外周”耐受机制失效了。
有些人可能携带自身抗体或免疫细胞,但这并不意味着他们一定会得自身免疫性疾病。这些抗体和细胞在某些情况下可能有助于清除体内的损伤产物。
自身免疫性疾病的诊断
在怀疑患有自身免疫性疾病的个体血清中检测抗体,在许多情况下都具有很大的诊断帮助作用。
例如,在系统性红斑狼疮 (SLE) 中检测 ANA,在类风湿性关节炎中检测抗环瓜氨酸肽 (anti-CCP),在乳糜泻中检测组织转谷氨酰胺酶 (tTG) 抗体。
然而,重要的是不要根据这些抗体的存在推断它们具有致病性。事实上,大多数可以识别抗体的自身免疫性疾病实际上主要由 T 细胞介导的病理学介导,抗体只不过是诊断上有用的附带现象。这些细胞介导的疾病的例子通常由相对较新定义的 TH17(IL-17 分泌)途径的过度活动主导,并涉及淋巴细胞和/或中性粒细胞浸润和炎症组织破坏,包括 1 型糖尿病、牛皮癣、桥本甲状腺炎、多发性硬化症、类风湿关节炎、克罗恩病。
自身免疫性疾病的风险因素
这些疾病的发生受遗传和环境多方面因素的影响,比如遗传缺陷、自身抗原的异常暴露或环境因素(如感染)都会增加风险。基因尤其在6号染色体上的影响较大,这与免疫系统在识别和耐受自体组织时发挥的作用有关。
doi.org/10.3389/fmed.2018.00316
心血管疾病是世界范围内慢性发病和死亡的最大原因,主要涉及冠状动脉和脑动脉。其基础是动脉粥样硬化,这是一种血管慢性炎症性疾病。
动脉粥样硬化的病理过程
动脉粥样硬化斑块的关键部位是其肩部区域,该区域被活化的 T 细胞、巨噬细胞和肥大细胞浸润,这些细胞会产生促炎介质和酶。斑块破裂会引发血小板聚集和血栓形成,导致急性缺血、临床症状和潜在的远端细胞死亡。
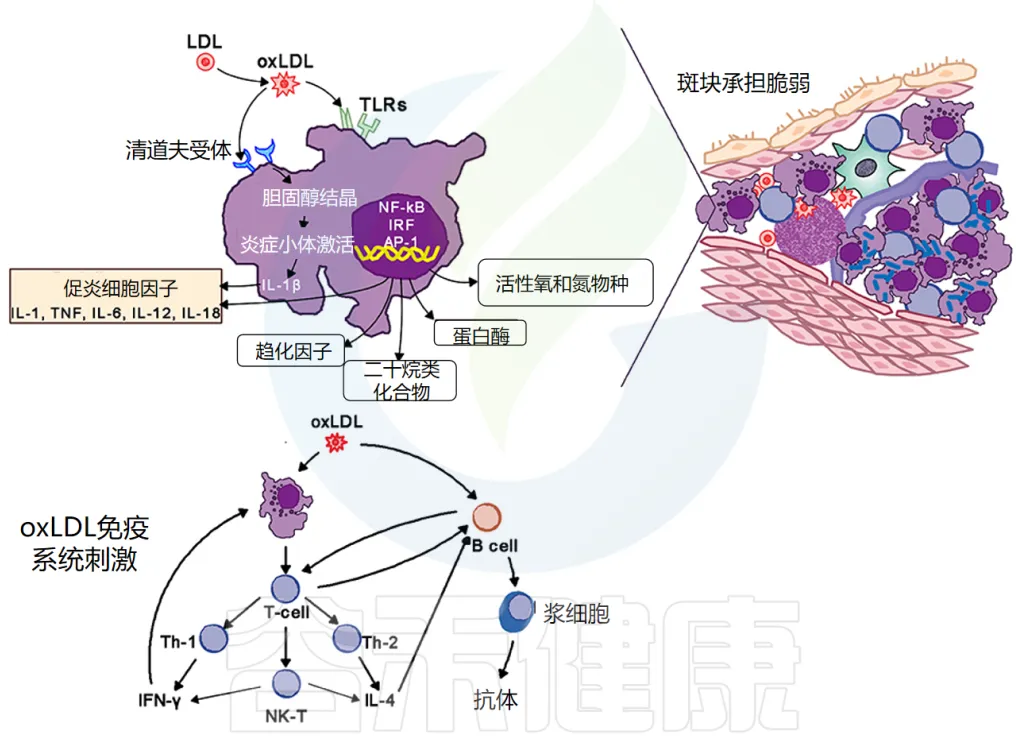
巨噬细胞在动脉粥样硬化中的作用
巨噬细胞是动脉粥样硬化病变的标志。
泡沫细胞的形成:它们通过清道夫和 Toll 样受体 (TLR) 摄入氧化低密度脂蛋白 (oxLDL)。胆固醇在细胞质中酯化,将巨噬细胞转化为泡沫细胞。
泡沫细胞的炎症作用:氧化脂蛋白向斑块周围的细胞发出信号,尤其是向内皮细胞和泡沫细胞发出信号,增加粘附分子的表达,进而吸引更多的单核细胞和淋巴细胞进入局部活化的内皮细胞。
泡沫细胞和活化的内皮细胞产生促炎细胞因子——IL-1、IL-6、IL-12、IL-18、IFN-γ、TNF-α,这会加剧炎症反应。
动脉粥样硬化病变的组成与免疫反应
动脉粥样硬化病变包含巨噬细胞、T细胞、树突状细胞、蛋白聚糖和平滑肌细胞以及从血液中渗出的胆固醇。氧化胆固醇会触发先天性和适应性免疫反应,导致 T 细胞活化和抗体产生。
TH2 细胞产生 IFN-γ,具有促炎作用,并通过激活巨噬细胞进一步驱动炎症活动,而 TH2 细胞产生 IL-4 和 IL-5。
TH1 和 TH2 活性是自我调节的:
在斑块内,TH1活性占主导地位,但被巨噬细胞和 TH2 细胞产生的 IL-10 所平衡(下图)。
doi.org/10.3389/fmed.2018.00316
动脉粥样硬化的免疫调节和治疗策略
不同免疫细胞之间的相互作用有可能显著影响斑块炎症的结果。
实验研究表明,输注 IFN-γ、IL-12 或 IL-18 均会增加动脉粥样硬化,而输注 CD50L 和 oxLDL 抗体则会减少动脉粥样硬化。
抗炎治疗的潜力
TGF-β 被发现具有抗炎作用,一方面限制白细胞的募集,另一方面促进胶原蛋白的合成,从而稳定斑块。
此外,衣原体等生物体可能会激活 TLR 并促进动脉粥样硬化的炎症过程 。
他汀类药物的治疗作用
在治疗上,他汀类药物可抑制 Rho/ROCK 通路并阻断 IL-1β 的促炎作用。
扩展阅读:
心脏自主神经调节异常(心脏自主神经重塑,交感神经活动增加而副交感神经活动减少)会增加恶性心律失常和心源性猝死的风险,尤其是在患有心血管疾病的患者中。
如前提到的,交感神经激活具有促炎作用,而副交感神经调节具有抗炎作用,炎症可能在心律失常的发生中起着核心作用。
炎症生物标志物与猝死风险
事实上,炎症生物标志物水平升高与心源性猝死风险增加有关。在一项 17 年的随访期内,无论老年人是否患有心脏病(心力衰竭或心肌梗死),IL-6 或 C反应蛋白 (CRP) 水平升高都与心脏猝死风险增加有关。即使在调整基线风险因素后,IL-6 仍存在心脏猝死风险,但 CRP 则不存在。
炎症与心房颤动的关联
促炎途径也可能在心房颤动 (AF) 中发挥重要作用。研究证实,炎症过程会损害心房并促进电紊乱,最终导致 AF。具体来说,他们在孤立性心房颤动患者的心房活检中发现淋巴单核细胞浸润,但在对照受试者(Wolf-Parkinson’s-White 综合征患者)中从未发现过。
随后,许多临床研究证实了炎症生物标志物(CRP、IL-2、IL-6、IL-8、TNF-α;单核细胞趋化蛋白-1)与持续性和阵发性心房颤动之间存在密切关联。
抗炎治疗在心律失常治疗中的潜力
炎症与心房颤动(心律不齐的一种)和心源性猝死(心脏突然停止导致的死亡)有密切关系。因此,针对炎症的治疗可能成为治疗心律失常的新方法。
抗炎药物,如非甾体抗炎药(NSAID)和皮质类固醇,已经被证明可以降低手术期间心房颤动的风险。然而,在其他患者中,这些药物反而可能增加心房颤动的发生率。此外,这些药物对室性心律失常(心室的心律不齐)和猝死的影响还不清楚,需要进一步研究。
炎症正在成为衰老的最重要机制(称为炎症衰老),并在大多数解释模型中发挥着不可或缺的作用。
衰老是细胞损伤不断积累的结果,而这种损伤与无法清除损伤相关分子模式 (DAMP) 有关——坏死细胞的分解产物、细胞外 ATP、尿酸、淀粉样蛋白原纤维、游离胆固醇晶体。
注:关于损伤相关分子模式 (DAMP),我们在文章前面介绍过。
组织先天免疫细胞对DAMP的响应
组织先天免疫细胞包括巨噬细胞、脑中的小胶质细胞、肝脏中的库普弗细胞、骨中的破骨细胞和肾脏中的系膜细胞可以检测 DAMP。
慢性炎症与衰老
DAMP 负荷的增加导致炎症小体复合物的持续激活,从而释放促炎细胞因子(IL-6 和 IL-18),引起持续的低度慢性炎症。
慢性炎症的特征是血清或受影响器官组织内和周围促炎标志物持续低水平升高,临床上与神经退行性疾病、代谢紊乱、癌症、肌肉骨骼疾病、心血管疾病和虚弱有关。
衰老过程中炎症标志物的变化
与年轻人相比,50 岁以上的人群中促炎标志物(如 IL-6、IL-18、TNF-α 和 CRP)和血清淀粉样蛋白 A 升高 2-4 倍。值得注意的是,即使在没有特定疾病的情况下,多个器官的慢性低度炎症也会导致功能衰竭。
IL-6与衰老相关性
特别是,IL-6 水平较高与虚弱和残疾程度增加有关,临床上与步行速度慢、肌肉力量弱、小腿功能差和贫血有关。在老年患者中,体质虚弱的患者促炎标志物水平较高,而抗炎标志物水平较低,如皮质醇、IL-10。
扩展阅读:
免疫衰老
免疫衰老是指随着年龄增长,适应性免疫系统功能衰退,先天免疫系统过度活跃。
虽然绝对淋巴细胞计数保持不变,但 B 细胞、T 辅助细胞 (CD4+) 和 T 细胞毒性细胞 (CD8+) 的绝对数量减少,而 NK 细胞数量增加。
幼稚 T 细胞也会减少,导致对新抗原的反应减弱,T 细胞和 B 细胞克隆扩增,尤其是针对 CMV、EBV 和 VZV 等疱疹病毒的细胞。
因此,衰老的身体对新抗原呈递的反应能力下降,对已知抗原的记忆反应下降,使老年人更容易患上传染病 。此外,终生接触抗原会导致先天免疫细胞逐渐激活,进一步增加促炎细胞因子释放和慢性低度炎症 (下图)。

doi.org/10.3389/fmed.2018.00316
已经提出了两种炎症衰老机制:
脂肪在免疫功能中起着重要作用,因为白细胞浸润水平高——网膜脂肪占基础循环 IL-6 的 10-35%。
因此,随着年龄相关体重的增加,低度炎症会持续存在,这尤其会增加动脉粥样硬化中患糖尿病的风险。促炎细胞因子通过血脑屏障的被动扩散最初会由于 HPA 轴激活而引发主动的抗炎反应,从而导致肾上腺排出皮质醇。然而,过度的促炎负荷可激活 CRP 释放细胞,从而进一步激活 HPA 轴,最终导致皮质醇水平长期升高,进而导致糖皮质激素不敏感,进一步加剧促炎状态。
较高的外周炎性细胞因子负荷会影响衰老的小胶质细胞,从而触发脑内细胞因子的加速产生。高脑细胞因子负荷会影响神经元功能,导致与年龄相关的心理功能特征。
炎症与虚弱症
虚弱症本来就是由于高促炎负荷导致的炎症所致,而尿路感染或肺炎等感染导致的促炎负荷过度增加则极易导致虚弱症。
IL-1β对大脑功能的影响
IL-1β 的增加会触发影响大脑不同部位的适应不良疾病行为;谵妄会导致工作记忆受损和冷漠(海马体)、焦虑加剧和长期严重的活动减退(杏仁核)、HPA 轴激活(室旁核)以及无热感染和过度低体温(内侧视前核)。
如今,肥胖已成为最可预防的发病和过早死亡原因。肥胖可以通过体重指数 (BMI) 来评估,BMI在30-39 表示肥胖;40 或更高则被认为是病态肥胖。
脂肪组织的功能与影响
脂肪组织,特别是位于中心的脂肪组织,其行为方式很像内分泌腺,可以调节其他组织的活动,并受同位神经系统和免疫系统的影响。
巨噬细胞位于脂肪组织中。无论是肥胖发病机制中的一个关键因素,还是由于携带过量脂肪组织的身体压力所致,肥胖都与循环中促炎细胞因子的增加有关。
因此,肥胖个体会经历一种似乎与剂量相关的慢性炎症状态,并且无论不良健康行为和疾病状况如何都会存在。
压力会加剧肥胖个体的促炎状态
例如,肥胖女性对急性应激源表现出比非肥胖女性更强烈的炎症应激反应。脂肪组织产生的促炎细胞因子(如 IL-1、IL-6 和 TNF-α )或应激反应可激活下丘脑-垂体-肾上腺 (HPA) 轴;因此,肥胖、全身炎症和应激反应之间的关系本质上是周期性的。在中断此周期之前,临床医生和其他健康倡导者必须首先意识到它的存在。
减肥可降低炎症
包括 CRP、TNF-α、IL-6 和 IL-18,单独控制饮食或结合身体活动干预后,这种效果可持续维持长达 2 年。通常,联合干预(饮食和身体活动)最有效,因为可以减少脂肪质量组成;然而,由于脂肪减少和身体活动增加之间的内在联系,很难确定哪个因素推动了炎症的减少。
例如,与身体活动较少相比,身体活动较多可降低慢性炎症,但当考虑 BMI 和瘦素水平时,这种关系不再存在。
在一项纵向研究中,低度炎症的增加与肥胖有关,但与身体健康无关。
总之,尽管身体活动和锻炼与降低炎症有关,但由于个人脂肪量的管理与全身炎症升高密切相关,因此似乎是整体健康的更关键因素。
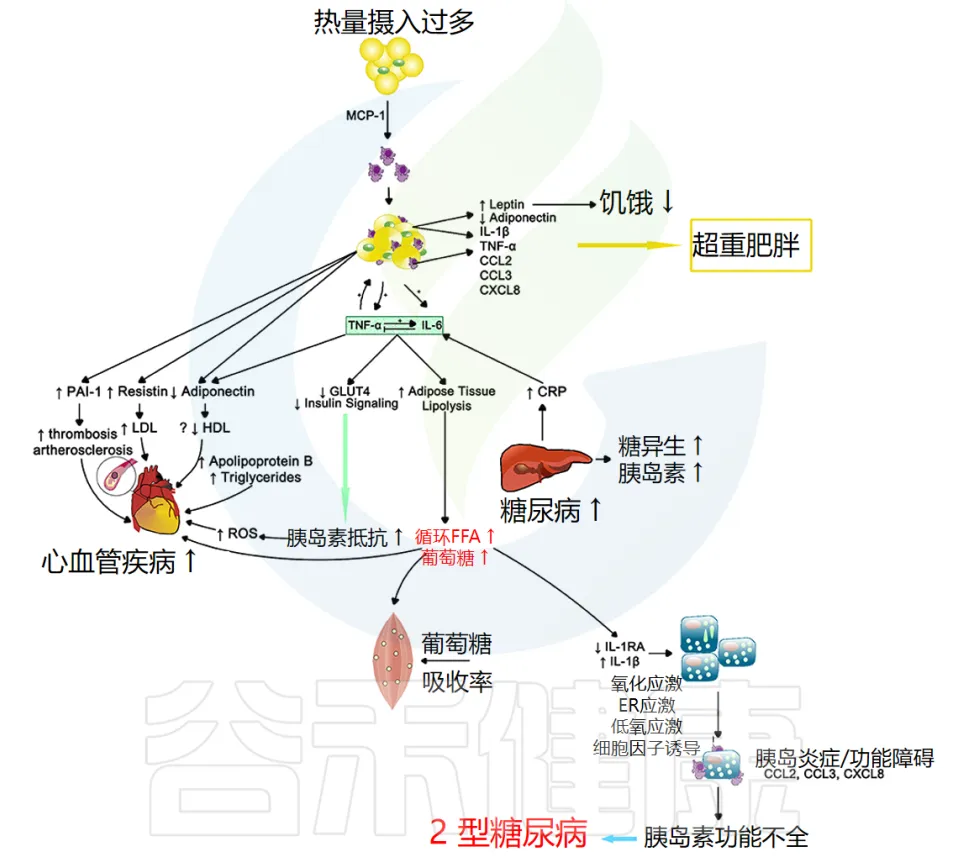
当个体细胞对胰岛素吸收血液中葡萄糖的信息不敏感时,就会发生胰岛素抵抗。
这种不敏感性导致胰腺产生更多的胰岛素;从而引发一个永无止境的负面循环,这通常会导致 β 细胞疲劳或凋亡,并引发 2 型糖尿病等代谢疾病。全身性炎症似乎在这两种代谢异常中都起着关键作用(下图)。
doi.org/10.3389/fmed.2018.00316
注:CRP指的是C反应蛋白(C-reactive protein)。C反应蛋白是一种由肝脏产生的蛋白质,其水平在体内炎症或感染时会升高。CRP常被用作炎症的生物标志物。
炎症与胰岛素抵抗的关系
较高的 CRP 水平与胰岛素抵抗有关,这表明炎症加剧可能导致 2 型糖尿病进展。事实上,在控制了 BMI 和 2 型糖尿病家族史后,女性健康研究中的 CRP 和 IL-6 升高 在 4 年期间独立预测了 2 型糖尿病的发展。因此,全身性炎症本身就可以促进胰岛素抵抗,但肥胖似乎会使情况更加复杂。
肥胖与炎症的相互作用
如肥胖部分所述,BMI 增加或肥胖与全身炎症(例如 CRP、IL-6 和 TNF-α 水平)增加有关。肥胖引起的炎症也与胰岛素抵抗的形成有关,即使控制 BMI 也是如此,这表明胰岛素抵抗带来的额外身体压力除了脂肪量外,还会增加慢性炎症。
此外,胰岛素抵抗会加剧炎症相关疾病,如丙型肝炎感染 ,而类风湿性关节炎患者服用 TNF-α 抑制剂会增加他们的胰岛素敏感性。
扩展阅读:
胎球蛋白 A 在胰岛素抵抗中的作用
有充分证据表明炎症与胰岛素抵抗和/或 2 型糖尿病之间存在关联。胎球蛋白 A 是一种肝脏急性期蛋白,可能提供关键机制。胎球蛋白 A 水平升高与胰岛素抵抗和/或 2 型糖尿病的横断面发生和纵向发展相关 。
胎球蛋白 A 有两种内源性效应支持这些数据:
治疗 2 型糖尿病的行为和药物干预可减轻炎症
与通过生活方式管理降低 BMI 可减轻炎症类似,减肥干预可降低血浆 IL-18 并增加胰岛素敏感性;这表明降低 BMI 和/或脂肪组织的努力可以改善对胰岛素的敏感性。二甲双胍和罗格列酮等血糖控制药物可同时减轻炎症并增加胰岛素敏感性;然而,炎症改善的确切机制仍不清楚。
IL-18(白细胞介素-18):
IL-18(白细胞介素-18)是一种由免疫系统细胞产生的细胞因子,属于白细胞介素家族。它在免疫反应中发挥重要作用,特别是在促进炎症和调节免疫细胞活性方面。
IL-18的主要功能和作用包括:
精神和身体疲劳是抑郁症的主要症状,包括注意力不集中、动力不足或没有动力、对以前喜欢的活动缺乏兴趣、睡眠和食欲紊乱、易怒、无望和社会孤立。
几十年来, HPA 轴失调一直与抑郁症有关;然而,抑郁症与炎症之间的关系最近才有所发展。
抑郁症与炎症的新认识
抑郁症常常与炎症相关疾病如心血管疾病和癌症并发 ;这表明慢性炎症可能与抑郁症有关。事实上,社区成年人的重度抑郁症和抑郁症状与慢性炎症有关,其严重程度呈现剂量依赖性模式。
由于长期和过度的应激激活导致免疫细胞不受控制或失调,可能会导致这种观察到的关系(下图)。
doi.org/10.3389/fmed.2018.00316
与非抑郁个体的免疫细胞相比,抑郁症患者的免疫细胞由于皮质醇敏感性降低而具有更高的 NF-κB 活性,从而创造了一种有利于持续产生促炎细胞因子的细胞内环境。
抑郁和炎症之间的关系是双向的
例如,在健康志愿者中,接触促炎细胞因子可产生病态行为或抑郁样症状,包括消极情绪、疲劳和精神运动迟缓。
细胞因子会影响血清素和多巴胺等神经递质的产生和代谢,而这些神经递质在情绪中起着至关重要的作用。
抗炎药物在抑郁症治疗中的作用
与同时服用抗抑郁药和安慰剂的患者相比,在临床抑郁症患者中,当同时服用非甾体抗炎药(如 COX-2 抑制剂或阿司匹林)时,血清素和去甲肾上腺素再摄取抑制剂的抗抑郁作用会增强。
抑郁症的周期性与炎症
抑郁症,尤其是重度抑郁症,具有周期性,因此增加确定其起源的困难:全身炎症增加还是抑郁症状增加。炎症对心理健康有影响吗?鉴于抑郁症与炎症之间存在显著联系,答案是肯定的。
炎症与其他精神疾病的关联
精神分裂症、躁郁症和创伤后应激障碍等其他精神疾病也与炎症加剧有关。因此,临床医生在治疗患有慢性炎症性疾病或抑郁症和其他潜在神经精神疾病的患者时,需要敏锐地意识到这种心理-生理关系。慢性炎症,无论是精神障碍的驱动因素还是结果,都开始模糊我们对身体和心理健康状况的理解,提示我们需要将它们视为相互关联的整体体验。
扩展阅读:
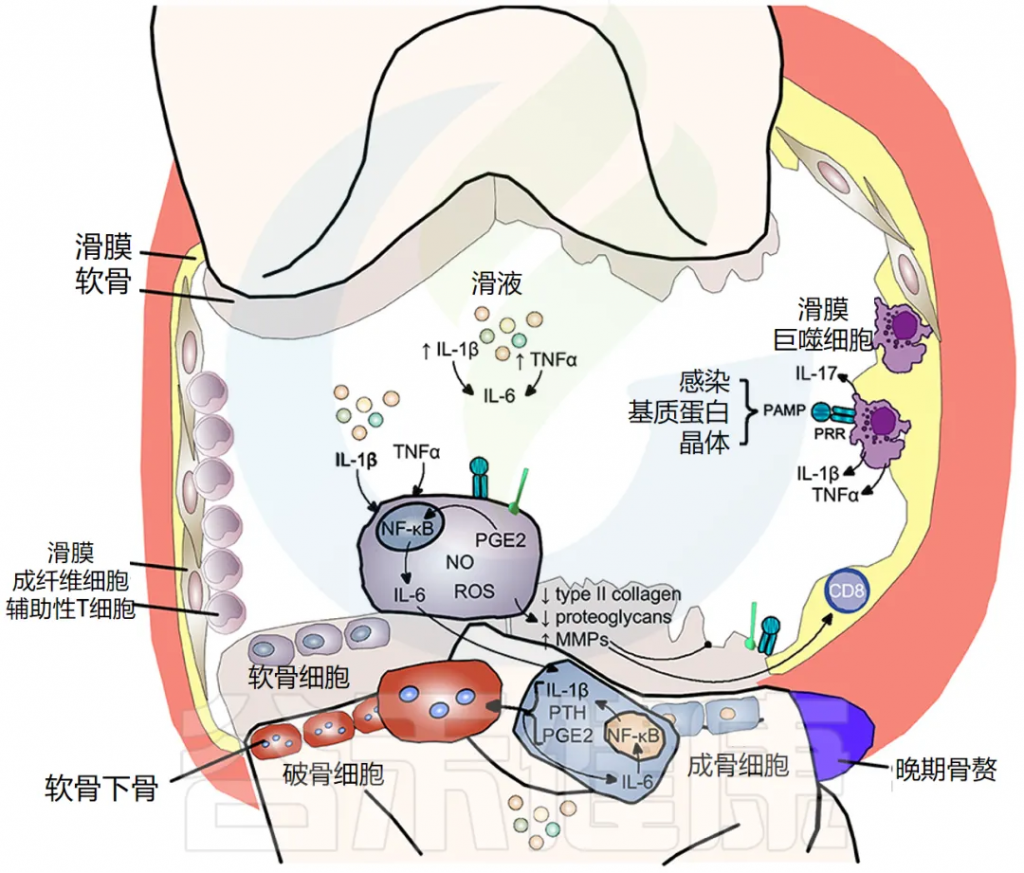
软骨破坏、软骨下骨重塑和滑膜炎症是骨关节炎的典型特征。最初,骨关节炎被认为是一种导致软骨损失的“磨损”疾病,这是临床上的主要特征;然而,现在显然滑膜炎是该疾病的主要驱动因素。流行病学研究表明,骨关节炎的进展与滑液中促炎细胞因子的数量相关,特别是 IL-1β、TNF-α 和 IL-6。
滑膜炎症是骨关节炎的一个重要的早期特征
其特征是滑膜内膜增生、巨噬细胞和淋巴细胞浸润、新血管生成和纤维化。滑膜炎导致滑液、滑膜、软骨下骨和软骨中的促炎细胞因子 IL-1β 和 TNF-α 增加。滑膜炎的程度在临床上与疼痛和功能丧失、骨赘形成和软骨损失的进展相关。
炎症的引发因素与机制
炎症可由感染性和非感染性刺激物引发,如透明质酸、滑液中的蛋白质和晶体,导致模式识别受体 (PRR) 和 Toll 样受体 (TLR) 激活,从而增加滑液中炎性细胞因子,如 IL-1β 和 IL-17。
炎症——软骨破坏
IL-1β 和 TNF-α 以及 PRR 和 TLR 的刺激,使软骨细胞内原本严格控制的合成/分解软骨稳态转向分解代谢程度更高的状态。一氧化二氮、自由基氧和前列腺素 E2 的产生增加,增加了基质金属蛋白酶 (MMP) 的释放,并抑制了软骨细胞中 II 型胶原蛋白和蛋白聚糖的表达,导致软骨破坏。
骨关节炎中的骨重塑
IL-1β 和 TNF-α 也显著上调软骨细胞释放 IL-6,激活成骨细胞释放 IL-1β、PTH 和 PGE2,进而激活破骨细胞活性,导致软骨下骨吸收。同时,这些介质刺激细胞间 IL-6 产生,维持破骨细胞活性。骨赘反映新骨形成,仅在疾病晚期出现(下图)。
doi.org/10.3389/fmed.2018.00316
现在人们认识到骨关节炎是一种由低度炎症驱动的全身性疾病和衰老,与智力衰退、脑血管病和心血管疾病等常见衰老情况有关。肥胖,特别是内脏脂肪,会导致促炎细胞因子产生显著增加,而脂肪因子、血糖水平升高和ox-LDL都会加剧低度炎症活动。特别是脂肪因子与直接扰乱软骨稳态有关;减肥的好处更可能来自于炎症负荷的减少,而不是关节机械负荷的减少。
随着对健康和疾病理解的深入,我们认识到19世纪的生物医学模型已不足以应对21世纪的慢性疾病挑战。现代研究显示,疾病是一个相互关联的复杂网络构成,而非孤立事件。炎症作为连接宏观疾病与个体体验的桥梁,强调了疾病发生的多因素性质。
面对这一现实,临床医学需要超越传统的生物医学方法,采用更全面的生物心理社会模型,关注患者的生活环境和心理状态。
监测炎症标志物如CRP、IL-6等,对于评估和控制疾病至关重要,尽管这些指标的解读需要考虑多种影响因素。
成功控制炎症疾病状态需要三个简单的步骤:
预防等于减少促炎活性
鉴于炎症在疾病发病机制和/或预后中的作用,我们需要改变疾病和疾病预防的方法。由于炎症活动会导致患病并产生可定义的疾病,因此成功的预防计划需要针对个人及其社会环境中促进促炎刺激的那些领域。
个体层面的抗炎预防
个人层面的预防策略应该从孕期就开始着手,目的是增强并维持母亲的适应能力,这一过程应该持续终身。
为了提高身体的适应力,我们应该采取以下措施:
“你吃什么,你就是什么”,这句老话在近年来得到了新的科学支持。随着理论和技术的发展,我们的饮食与健康之间的联系变得更加清晰。一个低饱和脂肪和精制糖、高复合碳水化合物、高纤维、富含鱼类蛋白质、坚果中的健康多不饱和脂肪酸(PUFA)、新鲜水果和蔬菜的饮食模式,一直被认为是健康的黄金标准。
肠道微生物研究为我们提供了更深入的理解
肠道微生物不仅帮助我们消化食物,还影响我们的免疫系统、肠壁的完整性,甚至影响大脑功能和行为。脑-肠轴理论认为,这些细菌及其消化副产物能够调节炎症、神经递质、神经递质前体的产生,以及肠神经系统的功能。
现在,我们已经能够测肠道微生物组的组成,并且可以实时观察食物变化对肠道微生物组的影响。复合碳水化合物和不饱和脂肪有助于支持抗炎细菌的生长,而简单碳水化合物(如精制糖)和不健康的脂肪(如过多的omega-6脂肪酸)则支持促炎细菌。肠道炎症的加剧与身心健康的损害密切相关。因此,关注肠道健康,选择加工程度较低的食物,或采取慢食的生活方式,是预防和干预炎症的关键步骤。
➣
总的来说,对疾病的理解应转向综合征概念,这有助于我们更好地识别和治疗如纤维肌痛等复杂疾病(例如,多达50%的纤维肌痛患者有抑郁症史)。未来的医学实践需要整合跨学科的知识,以更全面地理解炎症的作用,更有效地管理慢性疾病,并推动医学向更精准的方向发展。
主要参考文献:
Wang Y, Ma H, Zhang X, Xiao X, Yang Z. The Increasing Diagnostic Role of Exosomes in Inflammatory Diseases to Leverage the Therapeutic Biomarkers. J Inflamm Res. 2024 Jul 25;17:5005-5024.
Bennett JM, Reeves G, Billman GE, Sturmberg JP. Inflammation-Nature’s Way to Efficiently Respond to All Types of Challenges: Implications for Understanding and Managing “the Epidemic” of Chronic Diseases. Front Med (Lausanne). 2018 Nov 27;5:316.
Giacca M. SARS-CoV-2 infection boosts inflammation in atherosclerotic plaques. Nat Cardiovasc Res. 2023 Nov;2(11):966-967.
Matter MA, Tschaikowsky T, Stähli BE, Matter CM. Acute-on-chronic inflammation in acute myocardial infarction. Curr Opin Cardiol. 2024 Aug 20.
谷禾健康
突然全身奇痒,抓挠后出现红色或白色“疙瘩”,要命的是随着抓挠的进行,痒感丝毫未减,反而越抓越痒,这种情况有时会莫名其妙的出现,持续数小时甚至几天,此起彼伏,反反复复。
这就是我们常说的“荨麻疹”。荨麻疹又称风疹块,是一种免疫相关皮肤病,至少有20%的人一生中患过此病。可表现为皮肤瘙痒、血管性水肿或两者兼有。
根据荨麻疹的持续时间,可分为两种主要类型:急性荨麻疹(AU)和慢性荨麻疹(CU)。急性荨麻疹多为自限性疾病,持续时间少于6周,多与感染、药物或某些食物有关。慢性荨麻疹的特征是自发或可诱发,持续时间超过6周,包括慢性自发性荨麻疹(CSU)和慢性诱发性荨麻疹,病因大多时候不明确,它极大地影响了患者的生活质量,给他们带来了沉重的负担,本文重点围绕慢性荨麻疹展开。
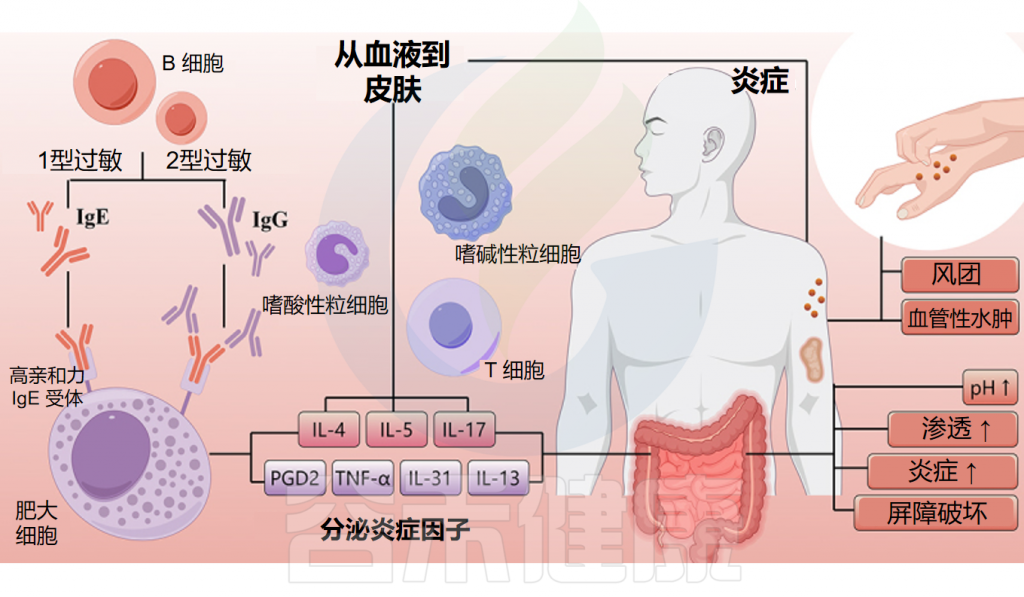
慢性荨麻疹(CU)的发生发展被认为与免疫系统密切相关。相关研究表明,CU病变中有大量免疫细胞浸润,如肥大细胞、嗜酸性粒细胞和嗜碱性粒细胞。肥大细胞的激活是CU发生发展的关键因素,因为它会触发组胺的释放,从而导致疾病的特征性症状。
在慢性荨麻疹活动期,血液中的嗜酸性粒细胞和嗜碱性粒细胞被吸引到皮肤,与肥大细胞通过细胞因子等介质相互作用,影响IgE受体介导的肥大细胞脱颗粒。这些细胞间的相互作用对荨麻疹局部微环境的形成至关重要。
目前,慢性荨麻疹(CU)的主要治疗方法是第二代非镇静性H1抗组胺药(nsAH)。然而,目前的治疗对某些CU患者的疗效有限。近年来,几种创新的靶向治疗方案(如 dupilumab和Bruton酪氨酸激酶抑制剂)目前正在进行临床试验,用于治疗慢性荨麻疹。
令人惊喜的是,许多研究发现,肠道菌群失衡与某些皮肤病的发展有关。临床研究表明慢性荨麻疹患者的肠道菌群发生了改变,这表明肠道微生物在慢性荨麻疹的发展中发挥着作用。慢性荨麻疹患者中能够产生短链脂肪酸的拟杆菌、双歧杆菌等丰度显著下降,导致短链脂肪酸的免疫调节受损;免疫细胞出现功能障碍和表达异常;与此同时,肠杆菌等机会性病原体增多,脂多糖的促炎作用增强,使肥大细胞更易于激活,这些因素都可能在慢性荨麻疹的发生和发展中发挥重要作用。
在本文中,我们先带大家认识了解什么是荨麻疹及一些风险因素,慢性荨麻疹的一些发病机制,并通过查阅整理相关文献具体讲述了肠道微生物群与慢性荨麻疹之间存在怎样的互作,并探索了基于肠道菌群的潜在治疗策略。
荨麻疹是一种炎症性皮肤病,以出现瘙痒性风团和血管性水肿(或两者兼有)为特征。
•风团是皮肤表面的红色或苍白肿胀,通常周围有红斑,可持续几分钟至24小时。风团通常很痒,但也会引起灼热感。
•血管性水肿是指皮肤或粘膜深层真皮层内的肿胀。肿胀通常呈皮肤色,但也可能呈红斑。血管性水肿可能无症状、发痒或引起灼痛。可能需要长达72小时才能消退。
2017年,全球荨麻疹发病率为1.6亿例新发病例。但每种荨麻疹亚型在不同人群中的患病率均不同,大约有20%的人一生中患过此病。
◮荨麻疹在不同人群中的发病率不同
急性荨麻疹(AU)在5岁以下儿童中的患病率最高,而慢性荨麻疹(CU)(尤其是慢性自发性荨麻疹)在30岁以上的女性中发病率最高。成年慢性自发性荨麻疹患者的年龄大于成年慢性诱导性荨麻疹患者(平均年龄约30-70岁vs约20-40岁),发病年龄也更晚(约30-50岁vs约20-35岁)。
◮女性的患病率高于男性
成人中,除胆碱能性荨麻疹(CholU)外,所有类型的荨麻疹在女性中的患病率均高于男性,而胆碱能性荨麻疹在男性成人和儿童中均更为突出;在较小的儿童中,女性患病率不存在或不太明显。
◮荨麻疹不会传染
一些研究但并非所有研究表明非白人患者中急性荨麻疹和慢性荨麻疹的患病率都较高。但荨麻疹不是感染性疾病,故不具备传染性。
所有类型的荨麻疹和急性荨麻疹的终生患病率分别为3–22%和6–19%。慢性荨麻疹的总体终生患病率为4.4% ,时点患病率(大多数研究中为1年患病率)从美国和欧洲的≤1.5%到墨西哥、韩国和中国的3–4%。
根据荨麻疹持续时间、频率和病因进行分类,可分为自发性荨麻疹(包括急性荨麻疹和慢性荨麻疹)、物理性荨麻疹、特殊类型的荨麻疹(例如接触性荨麻疹)以及与历史原因引起的荨麻疹相关的疾病(例如色素性荨麻疹)。
约80%的荨麻疹为自发性,10%为物理性荨麻疹,不到10%属于特殊类型。
◮急性荨麻疹
急性荨麻疹(AU)是指出现症状的持续时间少于六周的荨麻疹,急性发作,全身有瘙痒及大小不一的风团。约三分之二的自发性荨麻疹是急性的(过敏性或非过敏性)。
研究表明,患有过敏性疾病的人急性荨麻疹的发病率更高。50.2%的急性荨麻疹患者有花粉过敏、过敏性哮喘或特应性皮炎。
一项前瞻性研究,研究对象为800余名12~24个月大的特应性皮炎儿童,在未接受抗组胺药治疗的研究组中(n=396),18个月内16.2%的患者出现了急性荨麻疹。
◮慢性荨麻疹
慢性荨麻疹(CU)是指反复发作性的风团,伴或不伴血管性水肿,持续时间大于6周。慢性荨麻疹又可分为慢性自发性荨麻疹(CSU)和慢性诱导性荨麻疹(CIndUs)。其中,CSU约占CU的60%–80%。
慢性荨麻疹平均病程为3-5年,有些甚至可达20年以上,会导致瘙痒剧烈,睡眠障碍,继发心理社会问题,对生活质量影响较大。本文重点讲述的就是慢性自发性荨麻疹与肠道微生物群的联系以及可能提供的新型治疗方法。
除此之外,还有以下的荨麻疹类型:
◮物理性荨麻疹
物理性荨麻疹的共同特点是对不同的外部特定物理刺激(机械、冷、热、光)的荨麻疹反应,可分为以下几种。
皮肤性荨麻疹(人为荨麻疹):表现为用手搔抓或用钝器划过皮肤数分钟后沿划痕出现条状隆起,风团大多出现得很快,而且瘙痒剧烈,但一般约半小时后可自行消退。
注:皮肤性荨麻疹是物理性荨麻疹最常见的形式。
延迟压力性荨麻疹:与皮肤病性荨麻疹不同,这种类型的荨麻疹的典型病变是深部疼痛性肿胀,在暴露于垂直静态压力后4-8小时出现,并持续8-48小时。典型的受累部位是手掌和脚底,以及暴露于压力(例如坐在硬椅子上)时的臀部和背部。
压力性荨麻疹在男性中的发病率是女性的两倍,平均发病年龄为30岁。压力性荨麻疹可能会成为重体力劳动者的一种致残性疾病。
寒冷性荨麻疹:寒冷性荨麻疹是指接触寒冷后出现的荨麻疹反应。
热性荨麻疹:热性荨麻疹是一种罕见的物理性荨麻疹,由皮肤直接接触热物体或热空气引起。
日光性荨麻疹:日光性荨麻疹是由波长在280至760nm之间的光引起的。对于个别患者,诱发波长各不相同,但主要是紫外线引起的。
振动性血管性水肿:振动性血管性水肿是一种罕见的疾病,其中强烈的振动机械力(例如使用气动锤)会诱发血管性水肿。
◮特殊类型的荨麻疹
特殊类型的荨麻疹主要有以下几种:
胆碱能性荨麻疹:与物理性荨麻疹通过外部刺激引起症状不同,胆碱能性荨麻疹的病变是由于体温短暂升高引起的。
肾上腺素能性荨麻疹:肾上腺素能性荨麻疹是一种极为罕见的疾病,其特征是针尖大小的红色风团,带有白色光晕,与胆碱能性荨麻疹不同。风团是由压力引起的,而不是由运动或体温升高引起的。
这种疾病对β-肾上腺素能受体阻滞剂普萘洛尔的治疗有反应,它既可用于诊断目的,也可用于预防发作。
接触性荨麻疹:接触性荨麻疹是指化学物质与皮肤接触的部位出现风团。这种疾病可能严格局限于接触部位,如荨麻(荨麻疹或异株荨麻疹,荨麻疹由此得名),但可能会出现全身性症状,尤其是在IgE介导的过敏性接触性荨麻疹中。
水源性荨麻疹:水源性荨麻疹是一种独特的荨麻疹形式,需要与接触性荨麻疹相区别,因为水本身并不是致病因子,但会从角质层中释放出水溶性过敏原,然后扩散到真皮层后成为过敏原。
女性患此病的几率是男性的五倍,平均发病于青年时期。病变类似于胆碱能性荨麻疹,躯干上大多有针尖大小的风团。
◮早期症状
荨麻疹患者早期可在接触诱因,如过敏原或物理、化学刺激后,先有不同程度的皮肤瘙痒后出现风团,或以全身各部位风团(以躯干和四肢近端为主)为最初的表现。
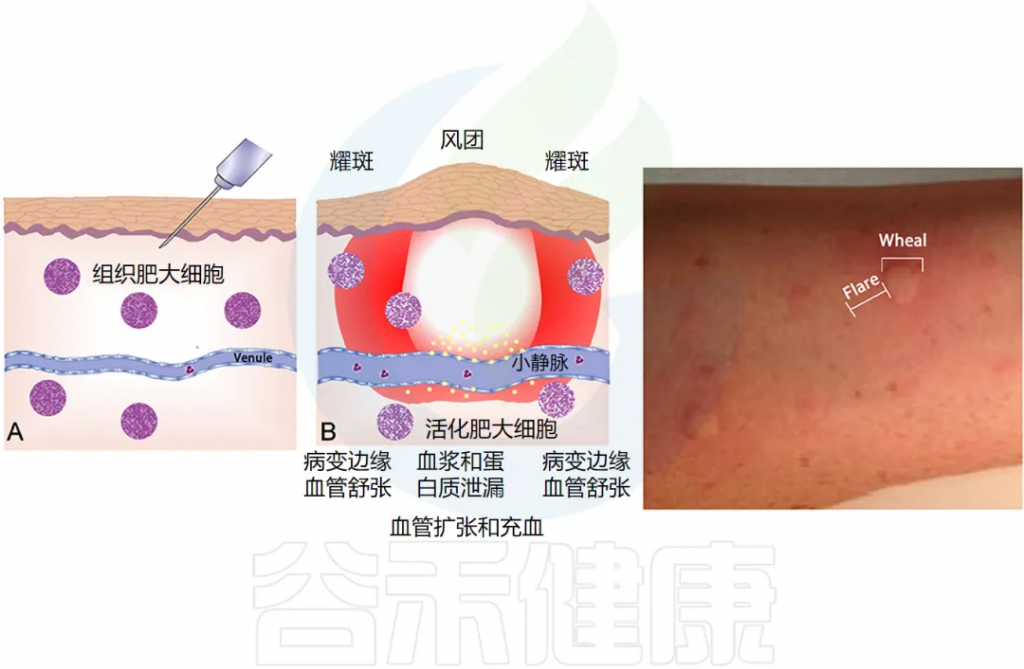
注:风团是一种局限的隆起于皮肤、黏膜表面的中心性水肿性团块,是由于肥大细胞活化导致皮肤、黏膜小血管扩张及渗透性增加引起的。
◮典型症状
荨麻疹典型表现为突然自觉皮肤瘙痒,很快瘙痒部位出现大小不等的红色或苍白色风团,圆形、椭圆形或不规则形,可孤立分布或扩大融合成片,皮肤表面凹凸不平,类似于橘皮样外观,周围多伴有红晕。
数分钟至数小时内水肿减轻,风团变为红斑并逐渐消失,不留痕迹,单个风团的持续时间一般不超过24小时,但新风团可此起彼伏,不断发生。风团每天发作或间歇发作,持续时间≥6周即为慢性荨麻疹。
◮可能伴有的症状
▪ 病情严重者可伴有心慌、烦躁甚至血压降低等过敏性休克症状;
▪ 胃肠道黏膜受累时可出现恶心、呕吐、腹痛和腹泻等;
▪ 累及喉头、支气管时可出现胸闷、呼吸困难甚至窒息;慢性荨麻疹引起气管炎,气管炎常蔓延至喉部,引起喉炎。喉炎症状严重时甚至会导致窒息。
▪ 感染引起者可出现寒战、高热、甚至全身中毒症状。
▪ 心血管系统:患者出现发热、头痛、气短、四肢无力等症状,有时会突然消退,然后急剧加重。有些患者会得心肌炎。
急性荨麻疹(AU)多与食物药物过敏、感染等因素相关。已报告的AU风险因素包括人口密度高和个人及父母有过敏性疾病史。AU患病率较高或风险较高可能还与贫困和较低的社会经济地位有关。
对于多达95%的慢性荨麻疹患者来说,这种病症是“特发性的”,意味着没有明确的病因。但以下一些因素可能导致患慢性荨麻疹的风险上升。
1.感染
慢性自发性荨麻疹可能是感染引起,如幽门螺杆菌感染、病毒感染等。感染引起的炎症会刺激体内免疫系统,出现免疫反应,导致皮肤血管通透性增加,进而出现慢性自发性荨麻疹。
各种病毒(如病毒性上呼吸道病毒、肝炎病毒、柯萨奇病毒等)、细菌(如金黄色葡萄球菌所致的扁桃体炎、慢性中耳炎、幽门螺旋杆菌感染等)、真菌及寄生虫感染均可引起。
2.食物
如果本身属于过敏体质,在食用易过敏食物后,如海鲜、芒果后,可能会导致皮肤发生过敏反应,从而出现慢性自发性荨麻疹。
此外,腐败食物、某些食品添加剂如水杨酸盐、甲苯酸盐、亚硫酸盐等也可能引起荨麻疹。
3.药物
如果长期服用青霉素类、头孢类等药物,可能会导致身体产生过敏反应,从而诱发慢性自发性荨麻疹。
4.遗传因素
在涉及双胞胎的研究中,遗传因素可以部分解释荨麻疹的易感性。几种基因的多态性(包括TNFRS11A 、TBXA2R和PLA2G4A)已被证明与荨麻疹易感性或多种非甾体抗炎药诱发的血管性水肿有关。
慢性荨麻疹(CU)的遗传易感性与IFNγ、IL-6、IL-17RA、IL-10、TGFβ、IL-6、肿瘤坏死因子 (TNF)、PTPN22、IL-1、IL-2和HLA I 类和 II 类等位基因的基因多态性有关。
例如,HLA-DR4与自身免疫性慢性自发性荨麻疹 (CSU)和其他自身免疫性疾病(例如类风湿性关节炎和1型糖尿病)密切相关。
5.呼吸道吸入物及皮肤接触物
常见呼吸道吸入物包括花粉、动物皮屑、粉尘、尘螨、真菌的孢子及一些挥发性化学品等,皮肤接触物如某些植物、动物毛发、昆虫叮螫、毒毛虫刺激等都可能会诱发荨麻疹。
6.物理刺激
如果皮肤受到冷热刺激、压力过大、摩擦、日光照射等物理刺激,可能会诱发荨麻疹,建议患者调整生活习惯,在生活中注意皮肤卫生,尽量使用温水清洗皮肤,避免使用刺激性的洗漱用品,以免加重荨麻疹症状。
7.自身原有疾病
研究发现,在诊断出自身免疫性疾病(包括类风湿性关节炎、系统性红斑狼疮、I型糖尿病和乳糜泻)之前和之后,分别约有80%和20%的患者被诊断为慢性自发性荨麻疹。
患有自身免疫性甲状腺疾病的患者,尤其是女性患者,患慢性自发性荨麻疹的风险要高得多。高达25%的慢性自发性荨麻疹(CSU)患者,尤其是自身免疫性荨麻疹标志物阳性的患者,有CSU家族史。
此外,患有消化性溃疡病和异常子宫出血的女性患者被证实具有更高的慢性荨麻疹 (CU)风险。
◮心理压力
心理压力是可能诱发荨麻疹的因素之一,如情绪波动、精神紧张、抑郁等可能会诱发荨麻疹。它通过影响免疫系统和神经内分泌系统,进而可能导致荨麻疹的发生或加重症状。
注:部分慢性荨麻疹患者可存在凝血功能和免疫功能异常。
急性荨麻疹一般发病数小时后会自行消退,而慢性荨麻疹的症状会持续六周以上,甚至可能持续数月至数年。由于反复发作,迁延不愈,慢性荨麻疹会严重影响患者及其家属的生活质量。
根据有无特定的诱发因素,慢性荨麻疹分为慢性自发性荨麻疹(CSU)和慢性诱导性荨麻疹(CIndU)。CSU约占慢性荨麻疹的2/3,因此,了解慢性自发性荨麻疹的发病机制就显得格外重要,有助于发现新的治疗靶点,为临床提供多样化的诊疗思路。
1
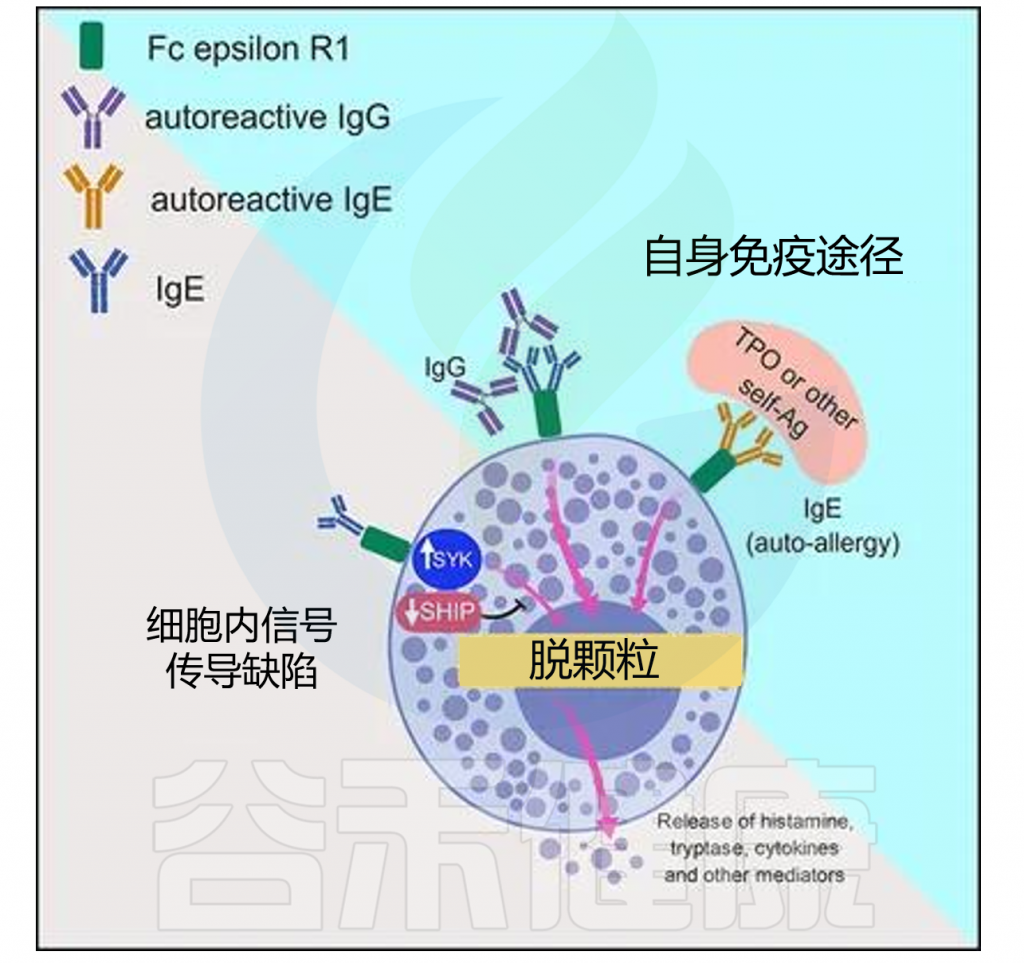
自身免疫在慢性自发性荨麻疹(CSU)中起关键作用,是CSU最主要的机制之一。肥大细胞(MC)通过I型自身免疫反应和IIb型自身免疫反应活化并脱颗粒,2种类型的CSU存在不同的临床特征。
慢性荨麻疹的表现和病理生理
Cai R,et al.Gut Microbes.2024
◮自身过敏反应引发慢性自发性荨麻疹
I型自身免疫反应又称自身过敏反应,其特征是具有抗自身抗原的IgE抗体。IgE自身抗体通过其高亲和力受体抗IgE Fc受体I与相应的自身抗原交联导致肥大细胞的活化,激活下游的一系列生化反应,引发慢性自发性荨麻疹(CSU)。
目前已发现的针对自身抗原的IgE抗体包括抗甲状腺过氧化物酶(TPO)抗体、抗甲状腺球蛋白(TG)抗体、抗双链DNA(dsDNA)抗体、抗白细胞介素-24抗体、抗组织因子(TF)抗体等。
◮绝大部分CSU患者具有IIb自身免疫反应
IIb型自身免疫反应的特征是具有抗IgE的IgG自身抗体或抗FcεRI的IgG自身抗体。FcɛRI与补体C5a受体均在肥大细胞和嗜碱性粒细胞上表达,且被证实在IgG-抗FcɛRI介导的脱颗粒中发挥作用。

PURIST研究的结果表明,约88%的CSU患者至少具有3个IIb型自身免疫反应CSU诊断标准中的1个,不到10%的CSU患者3个标准全部符合,并且这些患者往往表现为更严重的病情、低水平的总IgE和高水平的TPO抗体。
IIb型自身免疫反应CSU的诊断标准:1)自体血清皮肤试验阳性;
2)体外嗜碱性粒细胞组胺释放试验或嗜碱性粒细胞活化标志物阳性;
3)针对抗IgE的IgG自身抗体或抗FcεRI的IgG自身抗体的免疫测定阳性。
◮患有自身免疫性疾病可能导致CSU风险增高
多种自身免疫性疾病可与慢性自发性荨麻疹(CSU)伴发,最常见的是桥本甲状腺炎(≥21%)和白癜风(2%)。CSU患者合并自身免疫性疾病与自身免疫性疾病家族史以及甲状腺功能减退/亢进的发生率较高有关,并且自身免疫性疾病与IIb型自身免疫反应CSU有关。
此外,全基因组关联研究结果显示CSU与自身免疫性疾病之间具有遗传重叠,CSU的易感遗传因素主要通过与自身免疫特征的关联来表现。
荨麻疹发病机制的关键途径
doi: 10.1038/s41572-022-00389-z.
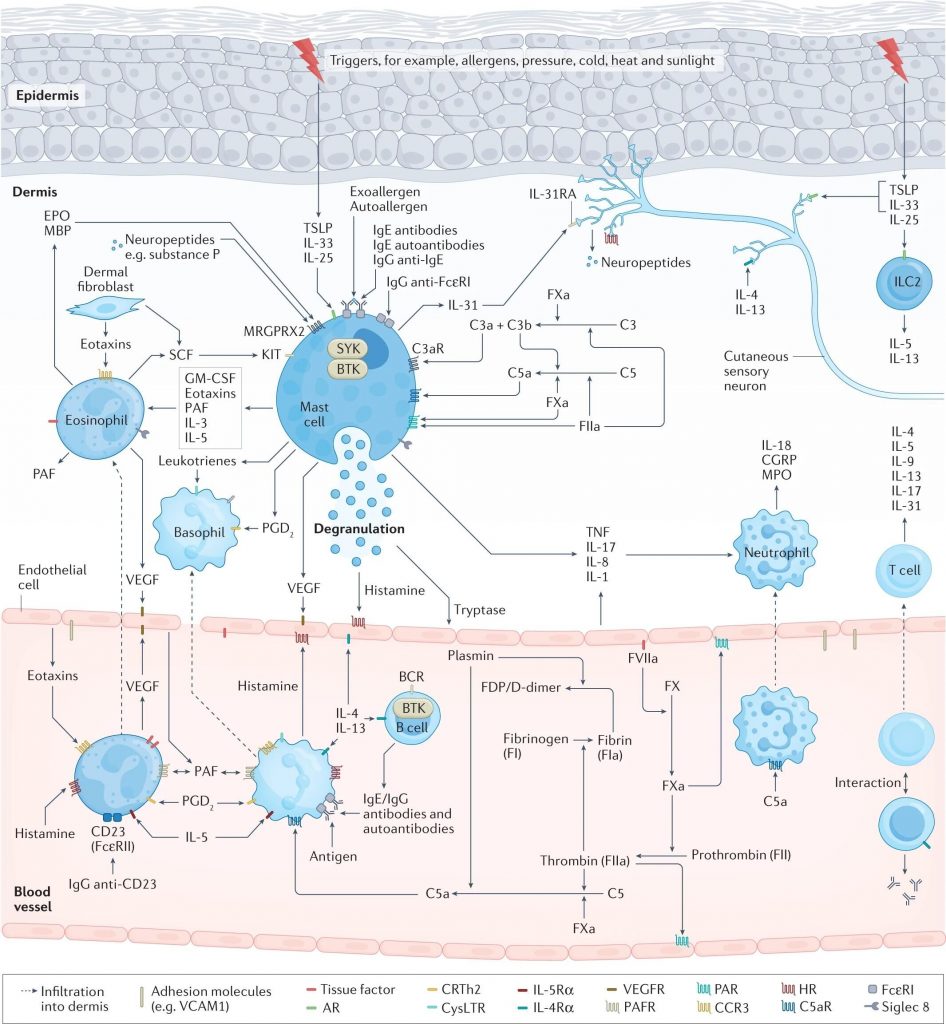
肥大细胞活化和脱颗粒导致荨麻疹的症状和体征,这是由于组胺和其他介质的释放所致,这些介质激活皮肤感觉神经(瘙痒)、扩张皮肤血管(红斑)并诱导血浆外渗(水肿和其他免疫细胞的流入)。
在过敏性荨麻疹中,上皮细胞释放警报素、TSLP、IL-33和IL-25,皮肤驻留组2先天淋巴细胞(ILC2)活化,T 细胞(主要是辅助T细胞 2 (TH 2 细胞))极化并释放 TH2细胞因子,例如 IL-4、IL-5 和 IL-13,B 细胞产生过敏原特异性 IgE,随后过敏原交联肥大细胞表面的 IgE-FcεRI 复合物,从而触发肥大细胞活化。
慢性自发性荨麻疹(CSU)可能由于一系列复杂的多步骤相互关联的事件而出现,包括细胞浸润(主要是嗜酸性粒细胞、嗜碱性粒细胞、中性粒细胞和T细胞)、自身免疫(例如,IgE/IgG 组胺释放自身抗体)、神经源性炎症(通过皮肤瘙痒感觉神经介导的组胺依赖性和组胺非依赖性瘙痒信号通路)、补体级联的激活(例如,通过产生过敏毒素 C5a)和组织因子启动的凝血级联外在途径的激活。
2
◮CSU依赖于肥大细胞的信号激活
肥大细胞(MC)是慢性自发性荨麻疹(CSU)的关键效应细胞,CSU中风团和血管性水肿的发展依赖于肥大细胞激活信号和受体、信号通路、抑制性受体和介质。MC来自骨髓造血祖细胞,随后迁移到外周组织,并在干细胞因子和IL-3的影响下进行终末分化。
MC主要由针对自身变应原的IgE或FcεRI α链的自身抗体通过FcεRI激活,胸腺基质淋巴细胞生成素、血浆衍生外泌体、IL-33、IL-4、IL-13、IL-5、补体C5a和MAS相关G蛋白偶联受体-X2也可激活MC。
肥大细胞(MC)活化后释放的各种介质可导致感觉神经激活、血管扩张、血浆外渗以及参与荨麻疹的细胞募集,引起CSU的症状和体征(皮肤瘙痒和血管水肿)。
研究发现腺苷、动力相关蛋白1和琥珀酸受体1也可调节MC的活性,CSU患者的血浆腺苷水平升高,并且腺苷水平可预测重度CSU患者对非镇静H1抗组胺药是否有反应。
慢性荨麻疹机制模型
doi: 10.3389/fimmu.2019.00627.
◮嗜碱性粒细胞可以产生组胺,参与风团的诱导
嗜碱性粒细胞与肥大细胞一样,可以产生组胺、白三烯和细胞因子等,参与CSU风团的诱导。嗜碱性粒细胞还表达FcεRI,可被抗FcεRI自身抗体激活。在CSU患者中经常观察到外周血嗜碱性粒细胞减少,可能是嗜碱性粒细胞从循环迁移到组织的结果。
奥马珠单抗可能通过降低嗜碱性粒细胞上FcεRI和IgE的密度,使嗜碱性粒细胞从外周血迁移到组织的数量减少,外周血嗜碱性粒细胞增多,从而达到治疗慢性自发性荨麻疹(CSU)的作用。而血液循环中嗜碱性粒细胞数量降低则提示CSU患者对奥马珠单抗反应不佳。
◮嗜酸性粒细胞参与慢性荨麻疹的发病
嗜酸性粒细胞表达低亲和力的IgE受体FcεRII/CD23,可被IgG-抗FcεRII/CD23结合并激活。
嗜酸性粒细胞可能通过3种方式参与慢性荨麻疹(CU)发病:
1)产生干细胞因子,促进组织中肥大细胞的募集和局部成熟;
2)嗜酸性粒细胞蛋白主要碱性蛋白、嗜酸性粒细胞阳离子蛋白和嗜酸性粒细胞过氧化物酶可促进肥大细胞脱颗粒;
3)活化后表达抗组织因子(TF),TF是凝血级联反应中凝血酶的主要激活因子。此外,研究发现10%的CSU患者出现嗜酸性粒细胞减少症,且与IIb型自身免疫反应、疾病高活动度和治疗反应差有关。
◮T细胞在CSU中起调节作用
辅助性T(Th)1细胞/Th2和Th17相关细胞因子的水平在CSU中显著升高,并与疾病的活动度相关。
Th1反应通常与ASST阳性有关;Th2细胞产生IL-4、IL-5和IL-13等多种细胞因子,可刺激IgE的产生及诱导肥大细胞、嗜碱性粒细胞和嗜酸性粒细胞的激活。Th17通过分泌细胞因子IL-6促进肥大细胞的增殖,并诱导其趋化。
调节性T细胞(Tregs)靶向许多不同的免疫细胞亚群和组织,可防止炎症反应过度并支持组织修复和稳态。体内外证据表明Tregs通过OX40-OX40配体信号抑制肥大细胞脱颗粒。研究表明,血液循环中CD4 + CXCR5 +细胞比例、滤泡辅助性T细胞比例和Tfh/滤泡调节性T细胞的比值异常均与CSU严重程度呈正相关,提示这些细胞可能参与CSU发病的免疫机制。
◮免疫细胞相互作用共同促进CSU的发生和发展
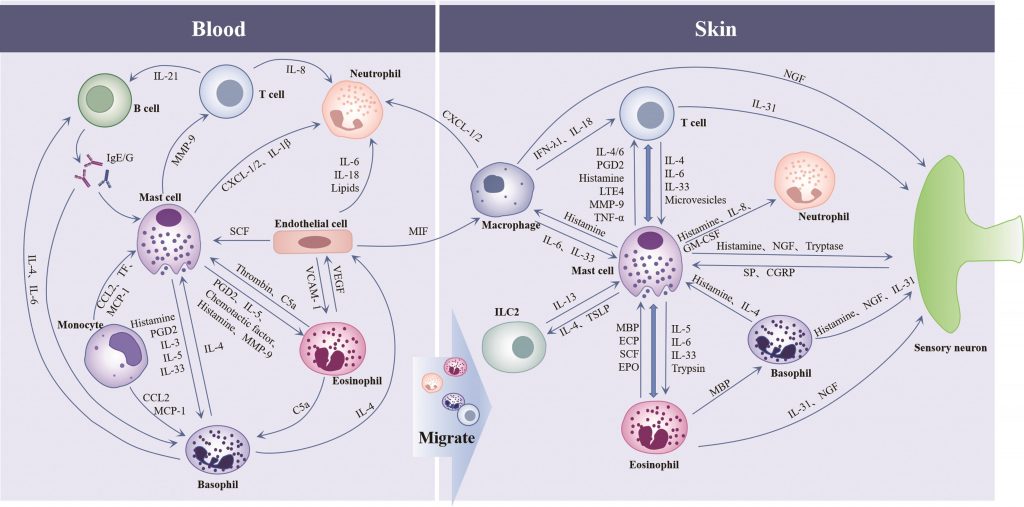
慢性自发性荨麻疹的发病机制涉及包括免疫细胞在内的多种细胞(如血管内皮细胞、神经元)的共同参与。
先天免疫和适应性免疫在CSU中存在极其复杂的相互作用,肥大细胞是先天免疫和适应性免疫之间的重要纽带:活化的肥大细胞通过释放炎症介质和趋化因子[组胺、前列腺素D2、基质金属蛋白酶-9和趋化因子C-X-C模体配体1/2等]促进嗜酸性粒细胞、嗜碱性粒细胞、中性粒细胞和T细胞向皮肤迁移,来自肥大细胞的IL-4、TSLP是先天淋巴样细胞的共刺激细胞因子。
嗜碱性粒细胞和T细胞产生IL-4可影响肥大细胞的趋化;单核细胞通过趋化因子C-C模体配体2(CCL2)/单核细胞趋化蛋白-1(MCP-1)作用于肥大细胞和嗜碱性粒细胞,促进其激活;巨噬细胞可通过分泌IL-6促进MC增殖和成熟,并释放干扰素-λ1调节T细胞的发育。
B细胞产生的IgE/IgG抗体与肥大细胞和嗜碱性粒细胞的FcεRIα结合并导致一系列的活化反应,来自嗜碱性粒细胞的IL-4和IL-6可增强B细胞的存活和增殖;内皮细胞产生的SCF影响MC的发育和成熟,通过迁移抑制因子激活巨噬细胞,通过IL-6、IL-18、肿瘤坏死因子(TNF-α)和脂肪因子与中性粒细胞相互作用参与CSU的发病。
免疫细胞在CSU患者中的相互作用
doi: 10.11817/j.issn.1672-7347.2023.230037.
3
◮神经元释放神经肽导致血管扩张、血浆外渗
在慢性自发性荨麻疹(CSU)中,神经元通过释放神经肽如P物质和降钙素基因相关肽(CGRP)等来调节肥大细胞的功能,可能导致血管扩张、血浆外渗。
◮免疫细胞释放炎症介质和细胞因子导致瘙痒
免疫细胞释放的炎症介质和细胞因子[如组胺、IL-31和神经生长因子(NGF)]等作用于神经元,可导致神经源性炎症和瘙痒症状。
MRGPRX2在皮肤肥大细胞(MC)上高度表达,可由神经肽如P物质激活,并导致MC释放组胺,进而引起CSU患者皮肤反应性的增高。另有研究发现CSU患者的焦虑与抑郁风险是对照组的6倍,CSU对焦虑或抑郁的影响与瘙痒和睡眠障碍有关,有效缓解瘙痒可以促进自然睡眠,从而改善CSU患者的情绪。
4
◮肠道菌群在CSU发病中发挥重要作用
近年来,肠道菌群与慢性自发性荨麻疹(CSU)之间的关联逐渐受到关注。研究发现CSU患者和健康对照组之间肠道微生物群的α多样性和β多样性存在差异。
通过16S核糖体RNA基因测序发现CSU患者由于有益菌(主要是产短链脂肪酸菌)的减少,导致短链脂肪酸的生成减少而有害代谢产物(脂多糖)的产生增加,从而通过促进Th2细胞的分化,IgE的产生激活肥大细胞,参与CSU的发病。
研究发现慢性荨麻疹(CU)患者血浆脂质代谢特征与健康对照组不同:CU患者血浆磷脂酰丝氨酸、磷脂酰乙醇胺和磷脂酰甘油水平显著升高,而磷脂酰胆碱水平显著下降。
肠道微生物与慢性荨麻疹之间的关联研究总结

Cai R,et al.Gut Microbes.2024
以上研究表明CSU患者肠道微生物群组成和代谢物的紊乱以及它们之间的相互作用可能参与了慢性自发性荨麻疹(CSU)的发病。此外,研究人员发现毛螺菌科及其下属类群是抗组胺药治疗应答者和无应答者肠道微生物群的主要差异,应答者的毛螺菌科丰度高于无应答者,提示毛螺菌科是抗组胺药在CSU患者中的疗效预测标志。
我们将在下面的章节中具体讲述肠道微生物群在慢性自发性荨麻疹发病和治疗中的作用。
5
◮遗传因素在慢性自发性荨麻疹发病中占一定作用
部分慢性自发性荨麻疹(CSU)患者存在家族史,遗传因素在CSU的发病中可能存在潜在作用。研究通过飞行质谱法对ORAI钙释放激活钙调节因子1(ORAI1)多态性进行基因分型,发现ORAI1基因单核苷酸多态性(SNP)rs12320939和rs3741596与CSU易感性相关,ORAI1基因编码的Orai1参与肥大细胞脱颗粒、白三烯分泌、组胺释放以及TNF-α分泌。
补体C5a受体1(C5AR1)-1330T等位基因也与CSU易感性相关,可作为CSU的危险因素,Fcε受体Ia(FCER1A) rs2298805等位基因与CSU风险和总IgE血清浓度有关。
此外,研究发现经地氯雷他定治疗后出现镇静的患者中,组胺受体H1(HRH1) rs901865 G等位基因的频率明显高于rs901865 A等位基因,提示HRH1基因多态性可能与CSU患者地氯雷他定治疗后的镇静副作用有关。
◮环境因素参与CSU的发病
环境因素可能参与慢性自发性荨麻疹(CSU)的发病,细颗粒物(PM2.5)通过Gadd45b/促分裂原活化蛋白激酶4(MEKK4)/c-Jun氨基末端激酶(JNK)途径调节活性氧的产生,促进IgE介导的肥大细胞活化。
此外,人类广泛暴露于全氟和多氟烷基物质(PFAS)环境中,PFAS可能通过食物和饮用水被人体吸收,通过因果中介分析发现IL-4是全氟庚酸与CSU相关性的部分中介(14.8%),血清中的PFAS水平升高与CSU发病风险增加相关。因此,持续暴露在不利环境因素中可能会导致CSU的发病并加剧其病情。
◮非免疫学致病因素
非免疫学致病因素也参与慢性自发性荨麻疹(CSU)的发病。例如房屋尘螨可能穿过皮肤屏障,直接触发神经元释放P物质,导致肥大细胞脱颗粒;性激素可能通过遗传、微生物和环境因素的复杂网络导致女性的CSU患病率较男性高。
此外,研究发现凝血-补体系统可通过下游的肥大细胞或嗜碱性粒细胞激活轴参与CSU的发病。维生素D、金黄色葡萄球菌、热激蛋白和硫醇/二硫化物稳态等也被发现通过各种机制参与CSU的发生。
人们普遍认为慢性自发性荨麻疹(CSU)主要是一种免疫介导的炎症性疾病。I型和II型自身免疫,特别是针对自身过敏原的IgE抗体和针对IgE或其高亲和力受体(FcεRI)的IgG自身抗体的存在,被认为在CSU的发生和发展中发挥作用。
皮肤肥大细胞的活化、脱颗粒和介质释放对CSU的致病性至关重要。CSU的症状主要由组胺的释放引起,以及其他介质,包括前列腺素D2(PGD2)、肿瘤坏死因子(TNF)和各种白细胞介素(IL),例如 IL-4、IL-5、IL-13、IL-17 和 IL-31,它们会影响驻留的皮肤细胞和其他募集的靶细胞,如T细胞、嗜酸性粒细胞和嗜碱性粒细胞。
这些募集的细胞在肥大细胞、活化的内皮细胞、辅助T(Th)2细胞和其他细胞释放的趋化因子(例如 IL-5、补体3a、补体5a、TNF、IL-17 等)的作用下从血液迁移到皮肤中。
健康的肠道对整体健康至关重要,研究表明,肠道微生物群失衡可能导致皮肤病。菌群失衡通过炎症和免疫系统紊乱与牛皮癣、特应性皮炎和痤疮等皮肤病有关。慢性荨麻疹是一种免疫介导的皮肤病,也可能受到肠道菌群的影响。慢性自发性荨麻疹是慢性荨麻疹不同亚型相关研究的主要焦点。
最近的研究检查了慢性自发性荨麻疹(CSU)患者的肠道菌群,发现CSU患者和健康对照者(HC)之间的微生物组成存在显著差异。研究主要发现CSU患者的α多样性低于 HC。
注:肠道菌群的α多样性是指单个样本中的物种多样性,可以使用 Chao1 值、ACE 值和 Shannon 指数等指标来衡量。Beta多样性是对样本间多样性差异的比较。
①患者中肠杆菌等机会性病原体水平升高
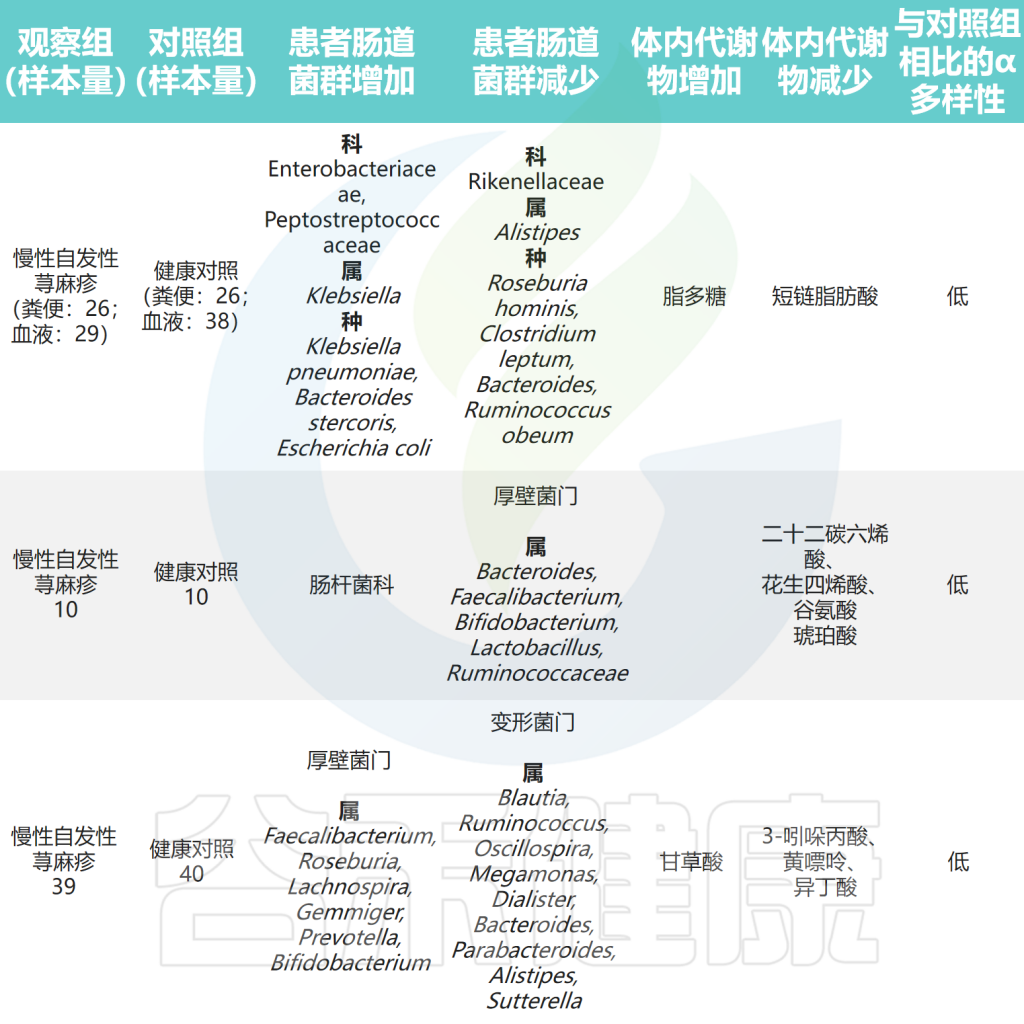
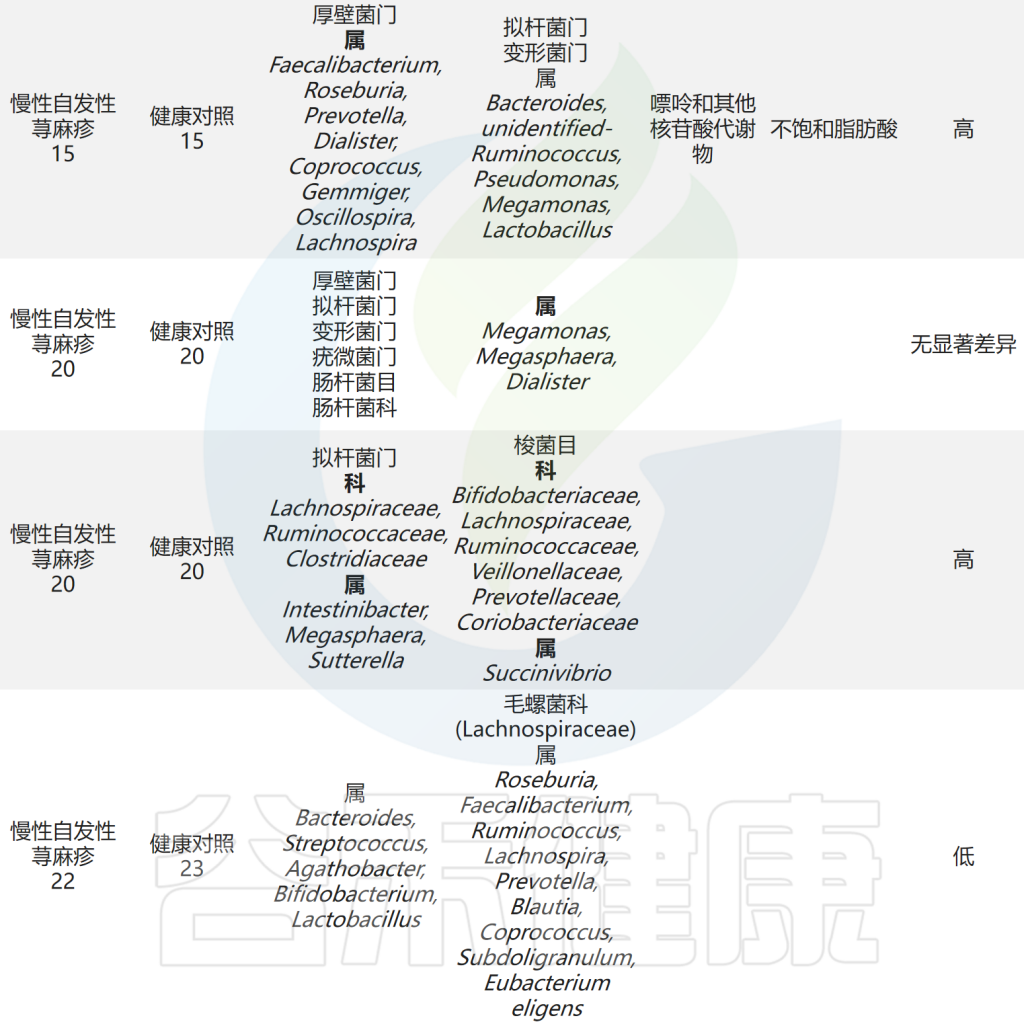
肠杆菌科(Enterobacteriaceae)是肠道菌群中促炎成员之一。初步研究探索了慢性荨麻疹患者肠道微生物组的变化。结果显示,肠杆菌科在慢性荨麻疹患者的粪便样本中更为普遍,还观察到慢性自发性荨麻疹(CSU)组的大肠杆菌(Escherichia coli)和克雷伯氏菌(Klebsiella spp.)的丰度较高。

最近的一项研究使用多组学分析分析了慢性自发性荨麻疹(CSU)患者肠道微生物组的组成,结果显示CSU患者的肠道菌群多样性较低,但肺炎克雷伯氏菌的水平较高。此外观察到Clostridium disporicum与低生活质量之间存在正相关性。
除上述结果外,还发现CSU组的乳酸杆菌属、Turicibacter属和Lachnobacterium属水平较高。采用孟德尔随机化分析探讨了肠道菌群与CSU之间的因果关系。该研究发现Verrucomicrobia门、Defluviitaleaceae科UCG011属和Coprococcus 属是荨麻疹的潜在危险因素。
②幽门螺杆菌感染人群更易患慢性荨麻疹
已知幽门螺杆菌(HP)定植于胃和十二指肠,可导致持续感染。荟萃分析显示,CU患者的HP感染患病率高于对照组,并且HP阴性患者比阳性患者更容易出现症状自发缓解。
另一项研究表明,根除幽门螺杆菌可使CU临床缓解的概率增加一倍。研究人员提出了一个假设,认为H. pylori的 kDa 混合蛋白质成分可能刺激人类肥大细胞脱颗粒。此外,一些细菌基因(如cagA、vacA和nap)可能编码特定蛋白质,触发增强促炎途径的免疫反应。
③拟杆菌、双歧杆菌有益菌水平下降
拟杆菌(Bacteroidetes)是肠道菌群的主要成分,是生产短链脂肪酸(SCFA)的物种之一,特别是乙酸和丙酸。研究发现CSU患者中拟杆菌的丰度低于对照组,这表明拟杆菌可能对CSU具有保护作用。
研究表明,拟杆菌主要通过产生荚膜多糖A和短链脂肪酸对人体免疫力产生调节作用。荚膜多糖A在维持和平衡免疫系统功能以及预防细菌和病毒感染方面发挥作用。乙酸盐和丙酸盐都是有效的抗炎剂,能够抑制中性粒细胞和巨噬细胞释放促炎细胞因子。
注:据报道CSU组厚壁菌门的数量也减少,厚壁菌门和拟杆菌门占肠道有益菌群的90% 。厚壁菌门可分解不溶性膳食纤维释放营养物质,促进肠道不同菌种增殖。
此外,研究发现健康人群中考拉杆菌属(Phascolarctobacterium)的含量较高。而患有慢性自发性荨麻疹和症状性皮肤划痕症(CSD)的患者,其Subdoligranulum和Ruminococcus bromii的含量明显较低。
对照组中的乳杆菌和双歧杆菌相对含量明显高于慢性荨麻疹患者,表明它们可能具有预防慢性荨麻疹的作用。这可能归因于它们诱导调节性T(Treg)细胞的能力。
此外慢性自发性荨麻疹患者肠道菌群中负责产生短链脂肪酸的毛螺菌科成员水平降低。在孟德尔随机化分析中,伯克氏菌目(Burkholderiales)和嗜木聚糖真杆菌属(Eubacterium xylanophilum)被发现具有预防荨麻疹的潜在作用。
如上所述,慢性自发性荨麻疹(CSU)患者的肠道微生物群发生了明显的变化。与对照组相比,CSU患者的肥大细胞更容易被激活,这可能与激活信号的阈值较低或抑制信号的暴露减少有关。
肠道微生物群的一些代谢物在其中也发挥着重要作用,脂多糖(LPS)和促炎细胞因子可使肥大细胞更易于激活,而短链脂肪酸(SCFA)可抑制肥大细胞激活。这些影响肥大细胞活化的因素与肠道菌群有关。
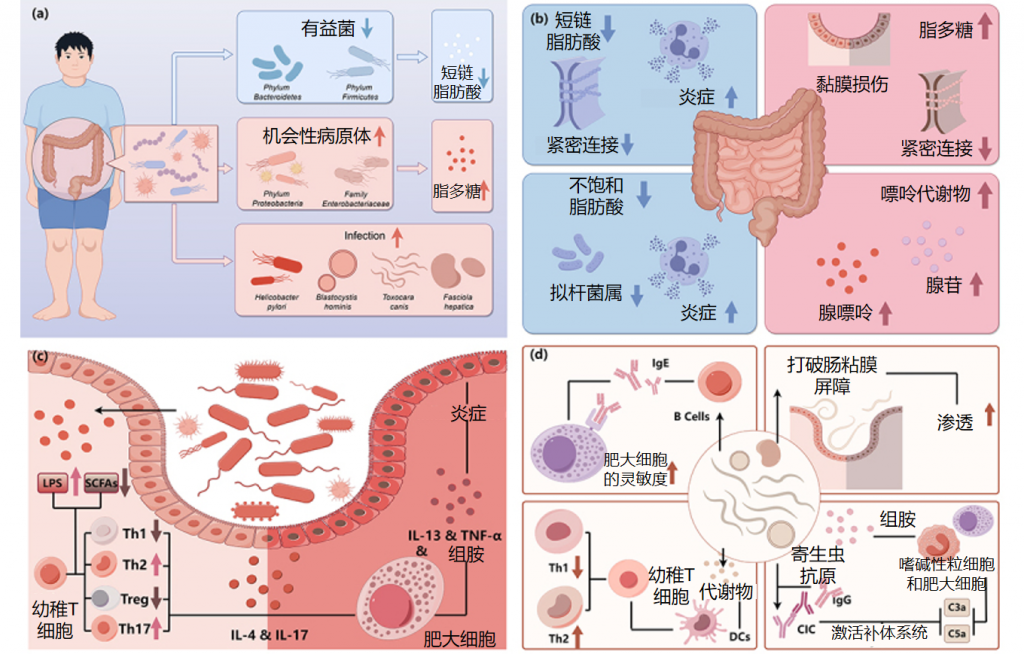
慢性荨麻疹中肠道菌群的改变及影响
Cai R,et al.Gut Microbes.2024
①短链脂肪酸的免疫调节受损
短链脂肪酸通过增强前列环素E2和IL-10的产生,从而减轻炎症,同时促进Treg细胞的分化,抑制Th17细胞的活性,在免疫调节中发挥关键作用。通过动物实验发现,短链脂肪酸可以减轻肥大细胞驱动的皮肤炎症。
利用16S 测序和定量 PCR 识别了慢性荨麻疹患者的菌群。产生短链脂肪酸的有益细菌减少。短链脂肪酸(SCFA)不仅有助于维持免疫微环境,还能稳定肠粘膜上皮屏障。通过降低 pH 值来增强肠道菌群的多样性、维持上皮屏障的完整性以及调节粘液的分泌可以作为其他保护机制。发现慢性自发性荨麻疹患者的平均粪便pH值(7.17)高于对照组(6.7),这与短链脂肪酸的产生减少有关。
②短链脂肪酸减少进一步诱发免疫反应失常
慢性荨麻疹患者普遍存在细胞因子表达异常和调节性T细胞(Treg)功能障碍。Th2细胞释放细胞因子如 IL-4、IL-5 和 IL-13,这些细胞因子刺激IgE的产生并可激活肥大细胞、嗜碱性粒细胞和嗜酸性粒细胞。
此外,IL-4可增强 IgE 受体的表达。基于先前的证据提出一个假设,即短链脂肪酸的减少将进一步抑制 Treg 细胞的产生和功能,从而导致 Th1/Th2 比例失衡以及 IL-4 和 IgE 的产生增加。乳杆菌和双歧杆菌也可能通过 Treg 细胞的分化抑制炎症,从而发挥对慢性荨麻疹的保护作用。
与对照组相比,慢性荨麻疹患者的Th17细胞有所增加。CSU组中的Prevotella属比对照组组中的更丰富,并且在小鼠实验中显示出刺激 Th17 免疫反应并募集中性粒细胞以引发持续炎症。
③脂多糖促炎作用增强
革兰氏阴性菌是肠道菌群的主要成分,其细胞壁上的脂多糖可通过 Toll 样受体4 刺激 IgE 诱导的肥大细胞脱颗粒和炎症介质的释放。在慢性自发性荨麻疹(CSU)患者的肠道中发现机会性病原体增加,而短链脂肪酸水平降低导致肠粘膜通透性增强,最终导致循环脂多糖水平升高。
在慢性荨麻疹患者的粪便中发现肠杆菌科细菌数量增加,肠杆菌科细菌是产生脂多糖的主要机会性病原体,可促进Th2细胞分化并产生IL-4。此外,高水平的肺炎克雷伯菌会增加受体小鼠的被动皮肤过敏性休克反应,并升高血液中的脂多糖水平。
④不饱和脂肪酸也对CSU的发病有影响
代谢组学分析表明,短链脂肪酸是主要代谢物,但不饱和脂肪酸(如花生四烯酸和二十二碳六烯酸)可能对慢性自发性荨麻疹(CSU)的发病也至关重要。这些脂肪酸能促进拟杆菌生长并具有抗炎作用。
研究进一步发现,不饱和脂肪酸花生四烯酸的氧化产物(如白三烯,参与免疫反应和炎症过程)与毛螺菌和吉米菌属(Gemmiger)与呈负相关,而毛螺菌的下降是慢性自发性荨麻疹患者肠道菌群特征。
寄生虫感染也被认为是导致慢性自发性荨麻疹(CSU)发病机制相关的肠道微生态异常的因素。多项研究已经探讨了体内寄生虫感染与CSU之间的关系,并进行了总结。
◮感染寄生虫的人群更易患CSU
与健康对照组相比,CSU患者更易诊断出原生动物感染,并且弓蛔虫血清阳性和尖线虫的致敏风险显著增加。此外,他们的片吸虫病和人芽囊原虫等位基因患病率也较高。在CSU儿童中,人芽囊原虫是最常见的寄生虫。

通过分析蛔虫科(Anisakis simplex和Toxocara canis)整个幼虫的粗提取物和分离成分,在荨麻疹与寄生虫感染之间的关联中, Anisakis似乎比Toxocara发挥更重要的作用,而原肌球蛋白是关键标志物。
◮蠕虫感染会导致肥大细胞和嗜碱性粒细胞激活
蠕虫感染可能通过涉及肥大细胞和嗜碱性粒细胞激活的各种途径影响慢性自发性荨麻疹(CSU)的发生和进展。寄生虫特异性IgE通过高亲和力IgE受体 (FceRI) 激活肥大细胞和嗜碱性粒细胞。诸如犬弓首蛔虫或肝片吸虫之类的蠕虫和诸如人芽囊原虫或蓝氏贾第鞭毛虫之类的原生动物能够诱导宿主产生针对其抗原的高水平特异性 IgE 抗体,这可导致宿主肥大细胞致敏和脱颗粒。
此外,蠕虫寄生会破坏人体的保护屏障,引发Th2免疫反应和组织修复。寄生虫本身会抑制Th1细胞的分化并促进Th2细胞的发育,而B细胞则通过产生 IgG1-3来辅助Th1反应,与寄生虫抗原形成免疫复合物(CIC)。该过程会激活补体系统并产生过敏毒素C5a和C3a来作用于肥大细胞,从而导致荨麻疹的发生。
慢性荨麻疹(CU)是一种常见且临床上具有挑战性的疾病。目前,已有一些标准化方案治疗慢性自发性荨麻疹(CSU)。其主要治疗方法是使用第二代非镇静性H1抗组胺药(nsAH)。
然而,这些治疗对CSU患者的有效性可能受到多种因素的影响,包括肠道菌群。一些患者表现出 nsAH 耐药性,nsAH 耐药性患者的肠道或全身炎症反应更为强烈。据推测,肠道菌群失调可能是 nsAH 耐药性的一个促成因素。
◮肠道菌群失调可能是一些患者使用nsAH疗效不佳的原因

对有无nsAH耐药性的慢性自发性荨麻疹(CSU)患者肠道菌群进行了比较研究,发现有 nsAH 耐药性的 CSU 患者肠道菌群中普雷沃氏菌(Prevotella)、巨单胞菌属(Megamonas)、大肠杆菌属(Escherichia)、琥珀酸弧菌属(Succinivibrio)、克雷伯菌属(Klebsiella)和Colidextribacter属的水平较高。相反,没有nsAH耐药性的CSU患者的Blautia属、Alistipes属和Anaerostipes属水平较低。
注:在另一项研究中,毛螺菌属被确定为nsAH特征的生物标志物。
◮幽门螺杆菌根除疗法有助于缓解CSU症状
荟萃分析显示,幽门螺杆菌(Hp)可能与CSU的发展和持续有关。研究发现,HP 根除疗法在缓解CSU症状方面具有显著效果。并且接受抗生素治疗以根除HP的CSU患者的缓解率明显更高,无论HP根除状态如何。
◮治疗会导致CSU患者的肠道微生物群发生改变
此外,目前的治疗也已被证明会导致CSU患者肠道微生物群发生改变。在接受奥马珠单抗治疗后,在菌类水平上观察到Alphaproteobacteria和Betaproteobacteria的相对丰度显著下降,在属水平上观察到Burkholderia、Rhodococcus和Sphingomonas 的相对丰度显著下降。这种减少可能是促成良好结果的一个因素。
而肠道菌群与慢性荨麻疹之间的相关性提供了一种有利的治疗途径。通过调节肠道微生态来治疗慢性荨麻疹是目前一个突出的研究重点。
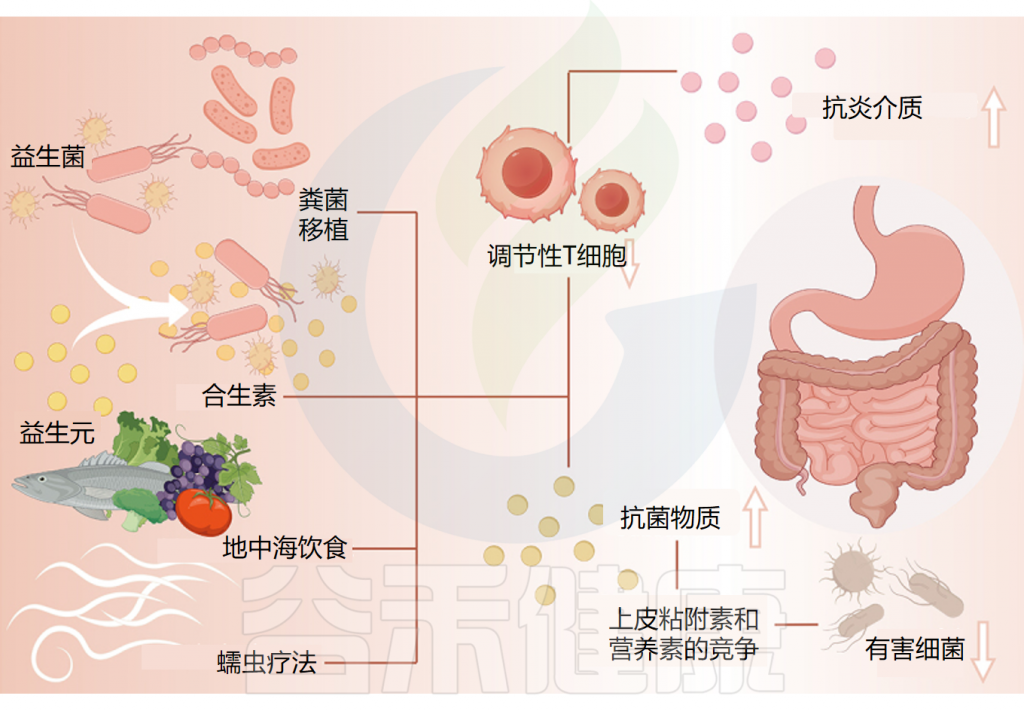
针对肠道微生物群的慢性荨麻疹相关疗法
Cai R,et al.Gut Microbes.2024
可以通过几种机制来阐明益生菌对慢性荨麻疹的保护特性。
①减少炎症并促进抗炎环境
首先,有证据表明慢性荨麻疹(CU)患者的Treg细胞数量和功能均有所减少。研究表明,益生菌和相关化合物可以诱导 Treg 细胞的生成以对饮食抗原作出反应。并通过刺激抗炎介质的合成,这种诱导可以减少炎症并促进抗炎环境,从而作为针对CU的保护机制。
②分泌抗菌物质,改善肠道菌群失调
此外,益生菌通过分泌抗菌物质、抑制细菌毒素产生以及与病原体竞争上皮粘附和营养,维持肠道菌群平衡,改善肠道屏障功能,从而减少体内有害代谢物的产生。
由于慢性荨麻疹患者肠道菌群的改变,可能会导致肠道微生态失调,而服用益生菌可以改善肠道菌群的稳态。
③一些特定益生菌改善了慢性荨麻疹的严重程度
研究证据表明,某些肠道微生物群具有针对慢性荨麻疹(CU)的保护作用,有助于参与慢性荨麻疹的治疗和缓解。
研究了两种益生菌(唾液乳杆菌LS01和短双歧杆菌BR03)组合对难治性慢性自发性荨麻疹患者临床进展的影响。在益生菌干预期间,38名患者中,9名(23.7%)临床症状轻度改善;1名(2.6%)显著改善;1名(2.6%)荨麻疹症状完全消失。但27名患者 (71.1%) 的症状保持不变。
研究结果证实了这种益生菌组合在降低某些慢性自发性荨麻疹患者的症状评分方面的治疗效果,主要是那些尽管使用 H1 抗组胺药治疗但仍持续存在的患者,从而提高了他们的整体生活质量而没有副作用。
还进行了一项随机安慰剂对照研究,纳入了206名慢性荨麻疹儿童,两组儿童均使用了地氯雷他定干混悬剂。治疗组有104名儿童同时使用了益明佳®(六种菌的冻干混合物,浓度为每克5×109 CFU 活菌)。经过4周的监测,治疗组的风团大小和发作频率均显著减少,80.8%的患者具有明显效果(包括显著改善和完全缓解),而安慰剂组为 62.5%。
这些研究进一步证实了某些益生菌菌株组合对改善慢性荨麻疹症状有效,并为使用益生菌治疗慢性荨麻疹提供了支持。
益生元是指含有不可消化成分的补充剂或食物,它们不仅能选择性地促进有益的本土益生菌的生长或活性,还能增强免疫系统。
①服用益生元降低了有过敏风险婴儿的荨麻疹发病率

在一项前瞻性、双盲、安慰剂对照研究中,有过敏风险的足月婴儿在出生后前6个月内,42名婴儿被喂食含益生元(0.8g/100ml 半乳寡糖(scGOS)/低聚果糖(lcFOS))的低过敏性配方奶粉,50 名婴儿被喂食安慰剂(0.8 g/100 ml 麦芽糊精),随后完成了5年的随访。
研究证实,低聚糖益生元 (scGOS/lcFOS) 从生命早期开始,一直到5岁,对高风险婴儿的过敏性荨麻疹具有保护作用。scGOS/lcFOS组儿童的过敏性荨麻疹发病率(6%)低于安慰剂组儿童(38%)。
另一项对照试验中,父母有特应性皮炎病史的健康足月婴儿,以低过敏性配方奶粉喂养,并分为两组,干预组添加益生元(8g/升 scGOS/lcFOS),安慰剂组添加安慰剂(8g/升麦芽糊精)。6 个月干预期结束时,进行盲法随访,直至婴儿2岁。安慰剂组过敏性荨麻疹的累积发病率(10.3%)高于干预组(1.5%)。
综上所述,益生元单独应用已被证明能有效预防荨麻疹。还需在更大人群、更广泛年龄范围和多种益生元条件下进行长期研究,以评估其潜在预防作用。
合生元结合了益生菌和益生元的协同作用,兼具益生菌和益生元的特性,从而有益于宿主的健康。
①合生元的使用改善了患者生活质量,并减少了瘙痒等疾病症状
对42名慢性荨麻疹患者进行了为期8周的随机对照临床试验。通过计算机随机化,以1:1的分配比将患者分为对照组(仅抗组胺药)和干预组(抗组胺药+合生元)。干预组每天服用两次名为LactoCare的口服益生菌胶囊,其中含有大量有益细菌,包括鼠李糖乳杆菌、干酪乳杆菌、嗜酸乳杆菌、短双歧杆菌、保加利亚乳杆菌、长双歧杆菌、嗜热链球菌以及低聚果糖作为益生元。
对照组和干预组皮肤病生活质量指数改善率分别为44%和66%。同时接受联合治疗的患者可能会在瘙痒、荨麻疹数量和总评分方面有更显著的降低。
粪便微生物移植(FMT)在改变肠道微生物群方面非常有效,是一种可行的治疗方法。在FMT之后观察到的一系列疾病(炎症性肠病、糖尿病、癌症、肝硬化和肠脑疾病)的临床反应变化表明微生物群与宿主之间存在错综复杂的联系。
①粪菌移植改善皮肤炎症,减轻荨麻疹症状
研究表明,粪便微生物移植(FMT)在皮肤病学中具有治疗潜力。FMT抑制多种炎症细胞因子,迅速逆转皮肤表皮增厚。小鼠研究显示,FMT可提高肠道短链脂肪酸水平,恢复肠道微生物群至供体状态。此外,FMT降低IgE水平,平衡Th1/Th2反应,调控Treg细胞,减少肥大细胞、嗜酸性粒细胞和嗜碱性粒细胞,从而减轻特应性皮炎的过敏反应。
曾报道了一例病例,一名女性患者六年来反复出现阵发性胃部不适和荨麻疹,接受了四次经内镜肠内管结肠FMT。经过一年,患者症状明显改善,恢复正常社交和饮食。16S rRNA 测序分析显示,FMT 后肠道菌群发生显著变化,包括普雷沃氏菌增加,拟杆菌和粪杆菌减少,有助于维持肠道菌群稳态。
①地中海饮食缓解全身炎症和氧化应激
饮食是塑造肠道菌群、宿主代谢物和屏障免疫系统的关键因素。饮食变化会迅速影响肠道菌群的多样性,有利于特定细菌种群的增殖,同时影响肠道pH值、肠道通透性和细菌代谢物的产生,也可能引发炎症。
有研究表明,地中海饮食可能会影响肠道菌群,进而影响慢性荨麻疹。这种饮食的特点是混合了富含纤维的复杂碳水化合物、以抗动脉粥样硬化和抗炎作用而闻名的多不饱和脂肪酸,以及具有抗氧化特性的生物活性化合物,如黄酮类化合物、植物固醇、萜烯和多酚,是营养饮食的典范。
研究表明,地中海饮食的抗炎和抗氧化特性可能有助于缓解全身炎症和氧化应激,而这两者都是慢性自发性荨麻疹(CSU)的发病机制。此外,坚持地中海饮食与恢复肠道菌群平衡有关,拟杆菌门和特定有益梭菌群数量增加,而变形菌门和芽孢杆菌门数量减少。地中海饮食促进有益细菌及其代谢物的生长,同时缓解菌群失调并降低脂多糖水平。
注:慢性自发性荨麻疹(CSU)患者组的平均地中海饮食评分为5.40±1.88,而对照组的平均地中海饮食评分为6.30±1.39。CSU 患者7天内的荨麻疹活动评分与地中海饮食评分呈负相关,而荨麻疹控制测试评分呈正相关。
②利用蠕虫疗法减轻免疫反应
蠕虫疗法是一种利用寄生蠕虫(如线虫、吸虫和绦虫)来调节宿主免疫系统的治疗方法。其理论基础是寄生蠕虫在长期进化过程中,发展出一系列机制来逃避宿主的免疫攻击,从而在宿主体内生存。这些机制可以通过调节宿主的免疫反应,降低过度活跃的免疫反应,从而可能对某些免疫和炎症性疾病产生治疗效果。
蠕虫疗法作为一种过敏免疫疗法,已被发现可治疗多种免疫和炎症疾病,如类风湿性关节炎和多发性硬化症。来自动物研究的有力证据表明,蠕虫不仅可以降低寄生虫特异性免疫反应,还可以调节自身的免疫力和过敏性炎症反应,改善代谢平衡。
蠕虫疗法有两种作用方式:(1)直接通过免疫系统影响;(2)通过改变肠道微生物群,从而对生物体产生影响。蠕虫通过操纵动物的自然免疫反应来逃避免疫识别和对抗。由于这种免疫调整,宿主体内先前存在的过敏或免疫相关疾病可能会缓解或完全消失。
但这种疗法目前主要在研究阶段,尚未被广泛接受或应用于临床实践。需要更多的研究来确定其安全性和有效性。
小结
通过使用益生菌、益生元、合生元、饮食调整和粪菌移植在改善肠道菌群中展现潜力,从而有助于治疗或改善慢性荨麻疹的症状,应在临床和科研中得到更多关注和应用。
尽管蠕虫疗法展示出了对慢性荨麻疹的治疗前景,但其过程尚不明确。临床试验样本量有限,难以评估安全性和有效性。此外,药物的临床应用障碍和生产成本高,限制了其快速临床应用。
肠道微生物群的组成和代谢物的改变对慢性荨麻疹的病理状态有显著影响。研究发现,慢性自发性荨麻疹(CSU)患者的肠道微生物组多样性减少,有益菌如拟杆菌、双歧杆菌丰度下降,而条件性致病菌肠杆菌等丰度上升,导致菌群失调。短链脂肪酸的生成减少,脂多糖的水平升高,引起肠道促炎和抗炎T细胞亚群失衡,转向促炎表型。这种促炎反应可能激活肥大细胞,使得免疫调节受损,加重慢性荨麻疹患者的症状。
通过针对肠道微生物群,有望开发新的治疗策略,如通过使用益生菌、益生元、合生元、饮食调整和粪菌移植来改善肠道菌群,有助于减少氧化应激,减轻炎症,从而治疗或改善慢性荨麻疹的症状。
然而目前关于肠道微生物群在慢性荨麻疹中的具体作用机制的研究仍相对不足。我们期待未来有更多的研究能够深入探讨和揭示肠道微生物群在慢性荨麻疹发病机制中的确切作用。这将为通过肠道微生物群治疗慢性荨麻疹提供新的视角和方法。我们相信这些基于肠道细菌的治疗策略在慢性荨麻疹的治疗和预防中具有巨大的应用潜力。
主要参考文献
Cai R, Zhou C, Tang R, Meng Y, Zeng J, Li Y, Wen X. Current insights on gut microbiome and chronic urticaria: progress in the pathogenesis and opportunities for novel therapeutic approaches. Gut Microbes. 2024 Jan-Dec;16(1):2382774.
Kolkhir, P., Giménez-Arnau, A.M., Kulthanan, K. et al. Urticaria. Nat Rev Dis Primers 8, 61 (2022).
Zuberbier T, Bernstein JA, Maurer M. Chronic spontaneous urticaria guidelines: What is new? J Allergy Clin Immunol. 2022 Dec;150(6):1249-1255. doi: 10.1016/j.jaci.2022.10.004. Erratum in: J Allergy Clin Immunol. 2023 Feb;151(2):580.

谷禾健康

宏基因组分箱工具的历史可以追溯到2000年代初,当时它们被创建用于自动化处理从环境样本中获得的短DNA片段的分箱。
此后,各种方法被提出以分箱不同类型的序列,如短序列、组装的重叠序列和有误差的长序列。
本文对宏基因组分箱工具的各个方面进行了描述,包括优化、可视化和评估。近期,分箱工具加入了新特征,如图形结构(assembly graph和read overlap graph),以捕捉准确的序列邻域信息。这些特征的综合运用推动了从环境样本中还原微生物基因组的进展。

宏基因组分箱是一种在宏基因组分析流程中用于处理复杂数据的方法。宏基因组数据通常通过二代测序技术(如Illumina和MGI)或第三代测序技术(如Pacific Biosciences和Oxford Nanopore Technologies)获得,前者产生50到300个碱基对的短序列,后者产生10 kbp到超过1 Mbp的长序列。
这些数据由于包含噪声和冗余,使得组装原始基因组具有计算复杂性。专用于宏基因组的组装工具通常利用经验法则或简化策略来解决复杂问题,不追求最优但可在合理时间内获得可行解的策略。
只是由于宏基因组复杂的组成,它们不总是能生成完整的基因组。因此,宏基因组分箱及精化方法被用于恢复称为宏基因组组装基因组(MAGs)的草图基因组。大多数分箱方法利用与分类学无关的无监督技术,将序列分配至代表不同分类群(如物种、属或更高阶层)的虚拟箱中。这些方法推动了微生物生态学的发展,通过病原体识别和肠道微生物群分析改善了人类健康,并促进了生物技术的发展。
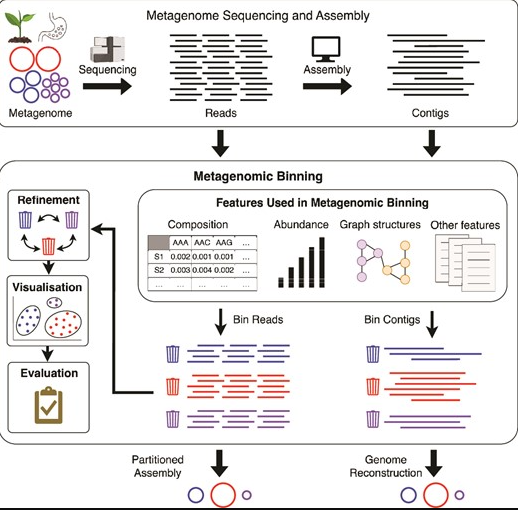
宏基因组分箱的各个方面
doi: 10.1093/bib/bbae372.
该图展示了从获得宏基因组序列到组装,最终获得宏基因组箱体的过程。
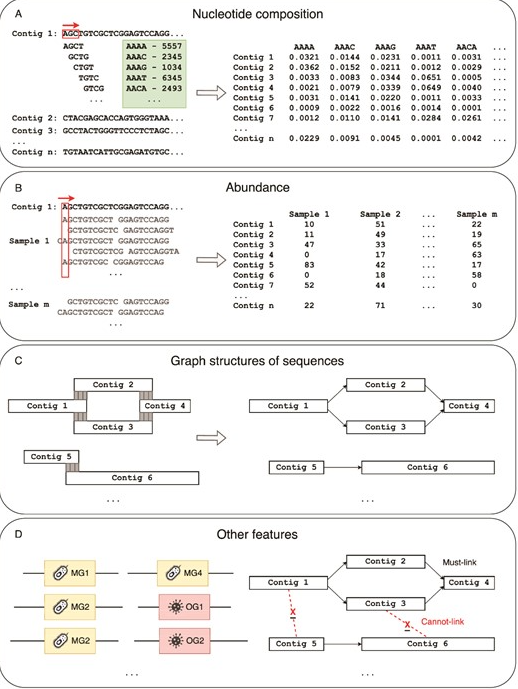
doi: 10.1093/bib/bbae372.
在宏基因组分箱中使用的特征。主要特征包括(A)核苷酸组成;(B)丰度;(C)序列图结构;以及(D)其他特征,如特殊基因和约束信息。
1
使用核苷酸特征的分箱方法
寡核苷酸在基因组序列中的频率(称为k-mers)携带特定于分类的信号。基于核苷酸组成的方法建立在每个分类群具有独特核苷酸组成的假设之上,通过比较核苷酸含量(如鸟嘌呤-胞嘧啶(GC)含量和寡核苷酸的标准化频率),可以将序列分配到不同的分类箱中。
使用组成特征的宏基因组分箱工具的比较
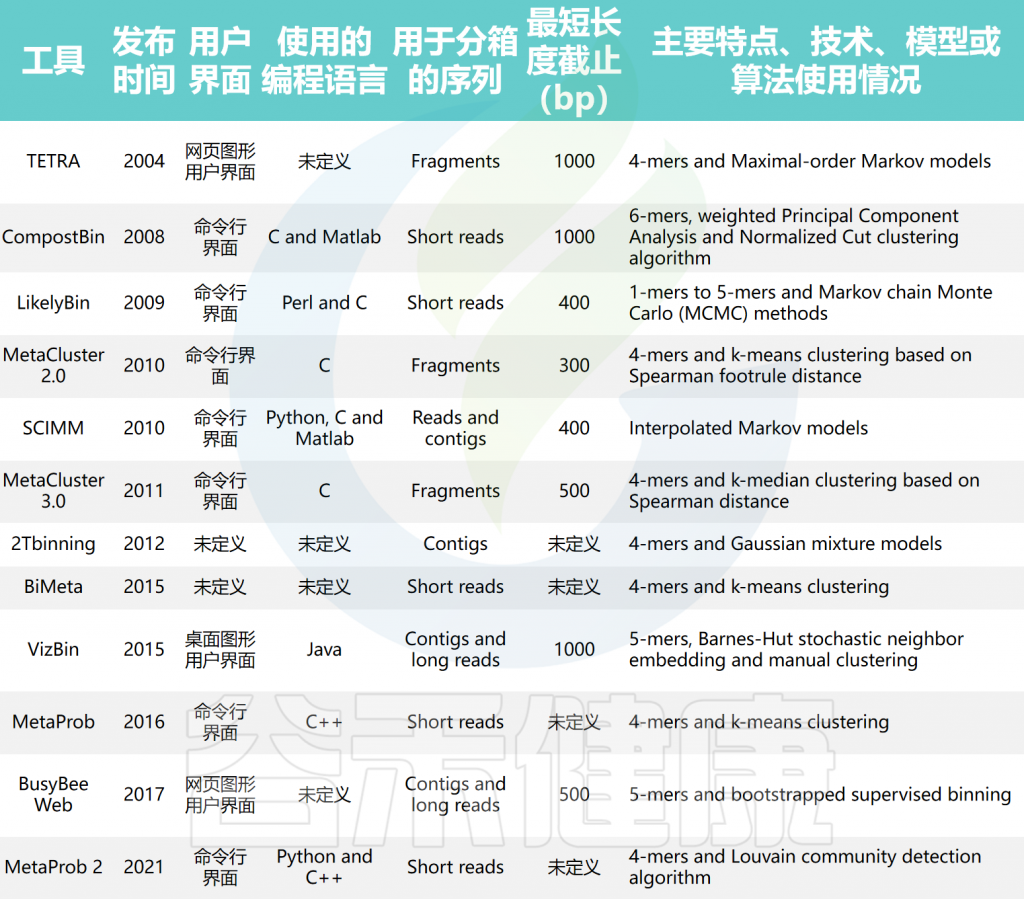
doi: 10.1093/bib/bbae372.
2
使用丰度特征的分箱方法
基于核苷酸组成的方法在处理具有高基因组相似性和低丰度物种的序列分箱时遇到困难。然而,基因组的每个组成部分在样本中的比例应一致。
因此,通过估计序列(contigs或reads)的丰度,可以识别来自同一染色体的序列,因为它们在每个样本中的丰度应相同。这些序列也应属于同一生物,因为它们在每个样本中的比例应一致。
为克服基于组成方法的挑战,引入了基于丰度的分箱方法。这些方法在处理具有相似组成特征的密切相关生物(例如同种的不同菌株)的序列时显示出改进的效果。
基于丰度的分箱方法可以细分为处理单个样本的方法(如AbundanceBin和MBBC工具)和处理多个样本的方法(如Canopy工具)。使用单个样本的方法假设测序遵循Lander-Waterman模型,即一个碱基被测序的次数符合泊松分布。使用多个样本的方法则假设序列的丰度特征会随不同样本中底层生物体丰度的变化或差异丰度而变化。
使用丰度特征的宏基因组分箱工具的比较

doi: 10.1093/bib/bbae372.
3
结合核苷酸和丰度特征的分箱方法
基于组成和丰度的方法(或混合方法)利用了寡核苷酸频率的变化和覆盖信息。一旦为每个序列计算了核苷酸组成和丰度特征,可以将它们组合(例如为每个序列形成一个连接的特征向量)进行聚类,或者分层使用(例如先用组成特征聚类再用丰度特征)。这些方法通常优于单纯的组成或丰度方法。因此,混合分箱工具已成为当前宏基因组数据集分箱的首选。
混合宏基因组分箱工具的比较
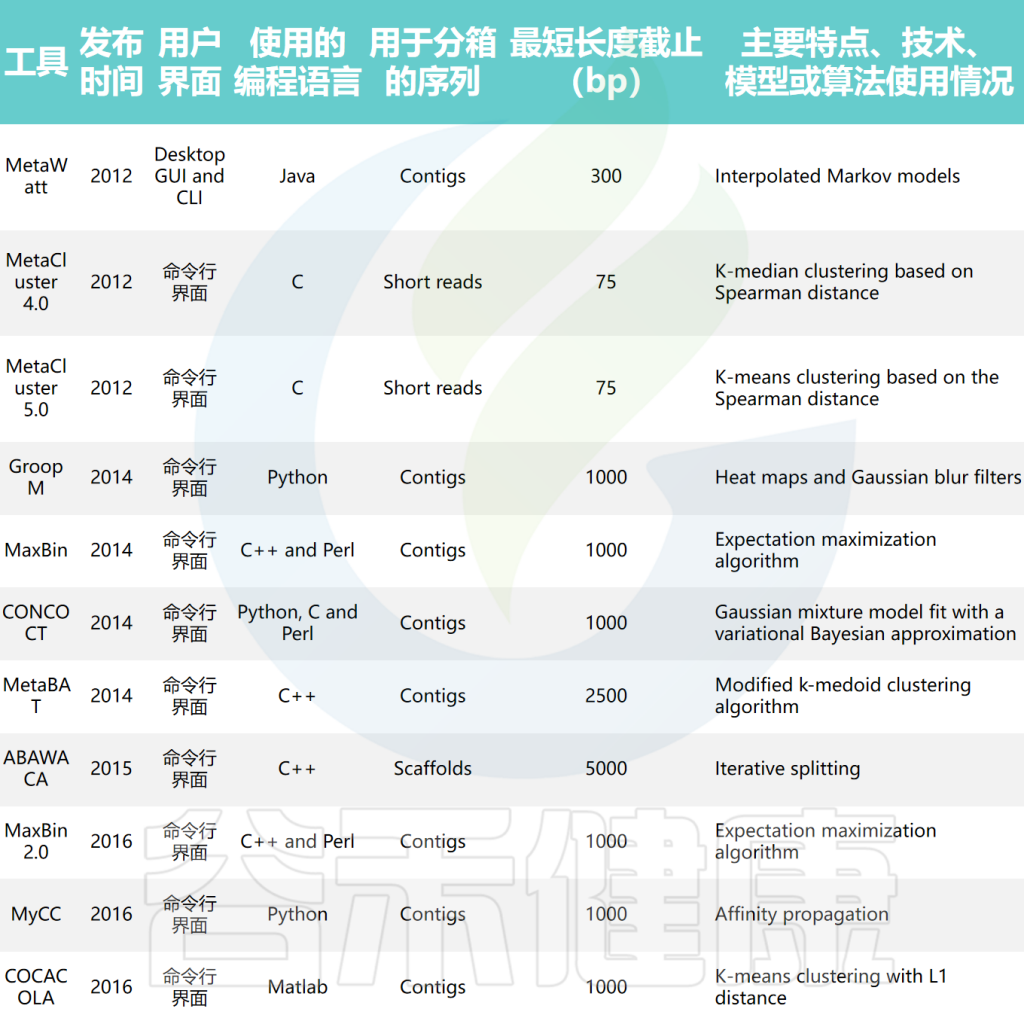
doi: 10.1093/bib/bbae372.
4
使用序列的图形结构作为特征的分箱方法
直到2010年代后期,宏基因组分箱方法主要依赖于核苷酸组成和丰度特征来进行序列分箱。在大多数分箱工具中,序列被表示为特征向量,分箱基于距离或概率计算。此类工具通常将序列视为独立的数据点,而没有考虑到一些序列可能来源于连续的基因组区域。
图是一种数据结构,由一组顶点或节点及其间的连接(称为边)组成。在一些图中,边可以有权重,表示连接的强度。图可以表示节点间的复杂关系和邻域信息,而这可能无法在欧几里得或概率空间中体现。因此,宏基因组分箱已转向使用图结构来表示分箱中的序列。
使用特殊图形结构的宏基因组分箱工具的比较
doi: 10.1093/bib/bbae372.
5
使用其它特征的分箱方法
除了上述主要的分箱类别外,一些工具还使用其他特征进行宏基因组分箱,以改进分箱结果。BMC3C工具在组成和覆盖信息之外利用密码子使用信息。COCACOLA工具考虑了来自成对末端读取的链路信息来优化分箱过程,虽然这些信息在一些组装图中也有体现。mBin和nanodisco工具使用细菌DNA甲基化特征来精确地将可移动遗传元件映射到其对应的宿主细菌分箱。
单拷贝标记基因是另一种常用的辅助分箱特征。单拷贝标记基因是存在于大多数细菌基因组中的特殊基因,每个基因组中仅出现一次。因此,一些分箱工具利用单拷贝标记基因来估计分箱数量并优化分箱结果。BV-BRC宏基因组分箱算法、MaxBin、MaxBin 2.0、MetaCoAG和SingleM等工具使用单拷贝标记基因来估计分箱过程中初始化的分箱数量。GroopM和MyCC等工具则利用单拷贝标记基因来优化最终的分箱结果。
两个常用的约束条件,must-link和cannot-link,经常用于判断一对contigs是否应被放置在同一分箱或不同分箱中。一些工具使用分类注释来确定这些约束条件。例如,SolidBin工具通过将contigs比对到参考基因组,如果contigs比对到同一物种则生成must-link约束,如果比对到不同属则生成cannot-link约束。分类注释可以通过如NCBI或GTDB等公共数据库获取。
由于病毒不编码单拷贝标记基因,专门为病毒设计的分箱工具结合了病毒特定的信息用于分箱。VRhyme工具使用蛋白质冗余评分,CoCoNet工具基于NCBI RefSeq病毒数据库进行训练,PHAMB工具使用病毒同源组,ViralCC工具则利用病毒-宿主邻近结构。利用这些病毒特定信息,使病毒分箱工具能够从宏基因组数据中恢复病毒宏基因组组装基因组(vMAGs)。
6
集成多种方法的分箱工具
集成分箱工具结合了多种宏基因组分箱方法的结果,以优化和提高基因组分箱结果的准确性。例如,DAS Tool、MetaWRAP、MetaBinner和BASALT等工具。这些工具使用不同的指标和额外信息,如单拷贝标记基因,从多个分箱结果中确定一组非冗余的分箱。
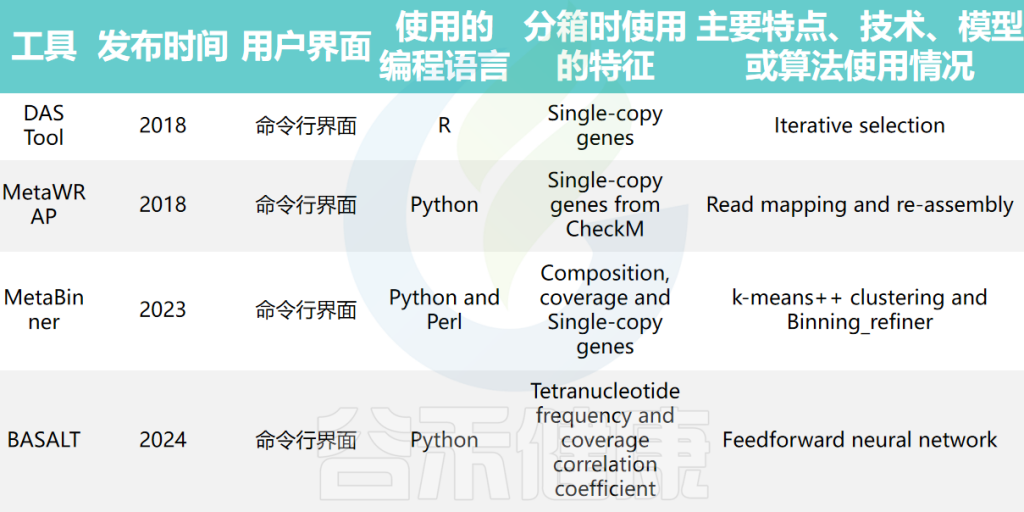
doi: 10.1093/bib/bbae372.
1
优化分箱的工具
分箱优化工具尝试提高所得基因组分箱的质量和准确性。早期的分箱优化工具通过利用分箱内的序列相似性进行优化,而近期的工具则使用组装图的连通性信息进行优化,如GraphBin、GraphBin2、METAMVGL和UGMAGrefiner等。
分箱优化工具的结果可能依赖于初始分箱结果的质量。在某些情况下,初始分箱结果中的错误可能会被传播,导致更差的结果。此外,这些工具大多只在分箱之间调整contigs,而不调整分箱的数量。
宏基因组箱细化工具的比较
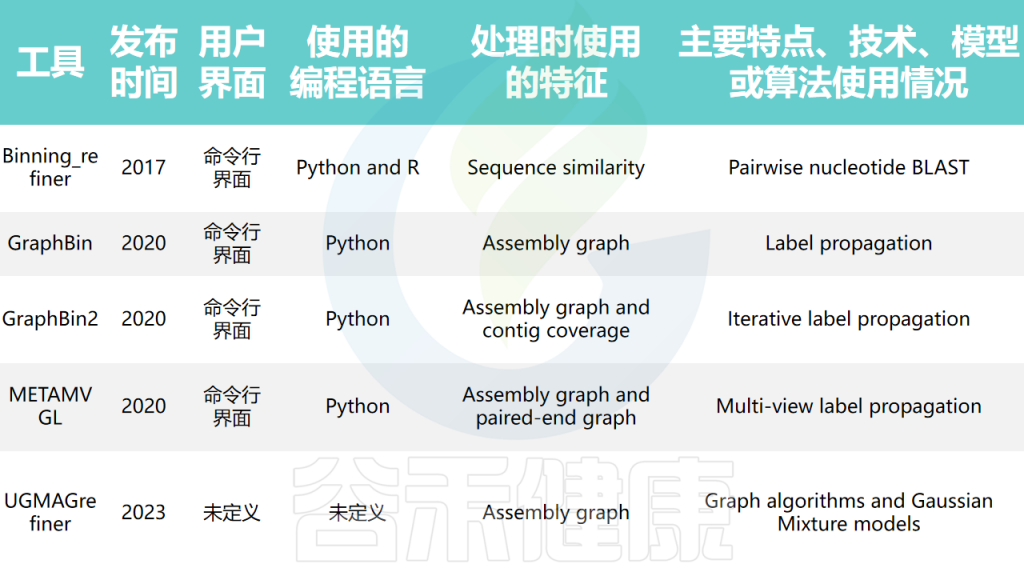
doi: 10.1093/bib/bbae372.
2
可视化分箱的工具
分箱序列由于使用复杂的算法和模型,常常难以理解。分箱可视化工具可以帮助生物学家了解序列如何被分组,并识别潜在的不正确结果。例如,分箱可视化可以展示相似序列如何被聚类,检测可能表示错误分箱序列的异常情况,以及确定覆盖模式不规则的序列。
大多数可视化工具使用覆盖度和GC含量来可视化分箱,通过散点图、热图和等高线图等不同类型的图生成覆盖度与GC含量的序列图。
宏基因组箱可视化工具的比较
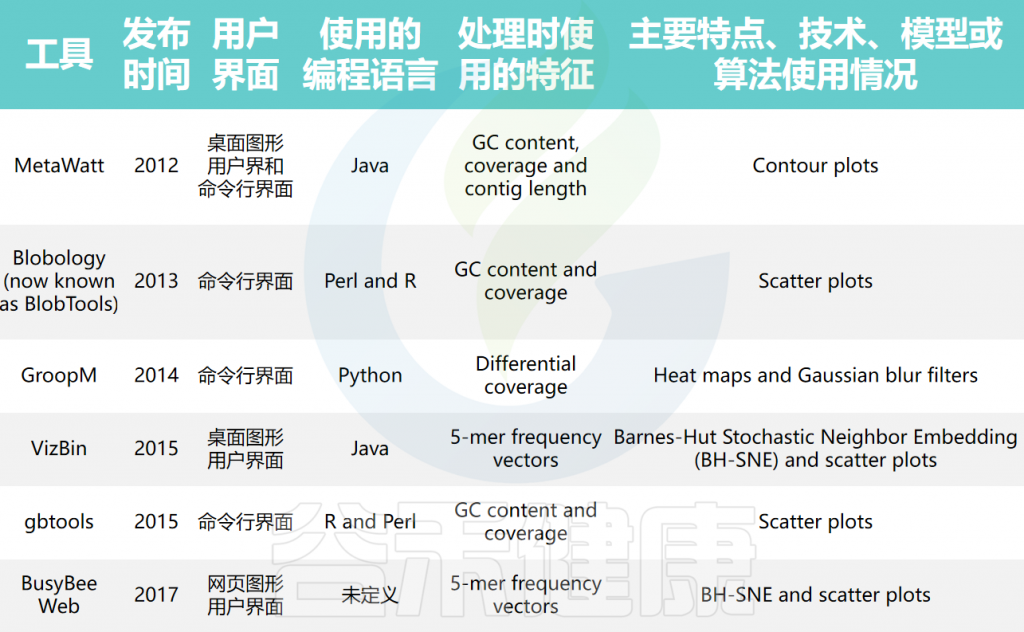
doi: 10.1093/bib/bbae372.
3
评估分箱的工具
随着宏基因组分箱工具和充足计算能力的普及,从各种环境样本中快速生成微生物基因组草图变得可能。为了从不断增加的微生物基因组草图中得出关于环境动态的可靠结论,确定基因组的质量变得至关重要。
此外,评估宏基因组分箱结果的准确性并确保其按预期运行也变得至关重要。在多方努力下,形成了文件如宏基因组解释的关键评估(CAMI),提供了金标准真实数据集以促进这些方法的标准基准。提出了多种指标来评估宏基因组分箱结果,包括精确度、召回率、F1-score、纯度、完整性和污染情况。
下表总结了一些用于评估宏基因组分箱结果并计算这些质量指标的自动化工具。CheckM和BUSCO是宏基因组研究中广泛使用的两种分箱评估工具,可用于确定实际宏基因组数据的MAGs质量以及模拟或模拟数据集的分箱结果。

doi: 10.1093/bib/bbae372.
自2021年以来,新开发的许多宏基因组分箱工具都显示出使用深度学习技术的趋势。其主要思想是学习序列特征的低维表示(low-dimensional representation)或嵌入(embedding),获取这些嵌入的聚类以生成分箱。
例如,VAMB是最早在宏基因组分箱中使用深度学习技术的工具之一。随后出现了许多基于深度学习的分箱工具,包括使用变分自编码器(variational autoencoders,简称VAE)的CLMB和LRBinner工具,使用孪生神经网络(Siamese neural networks)的SemiBin和SemiBin2工具,使用前馈神经网络(feed-forward neural networks)的COMEBin工具,以及使用图神经网络的RepBin和UnitigBIN工具。深度学习技术的应用使宏基因组分箱工具能够准确高效地处理大规模复杂数据集的分箱。
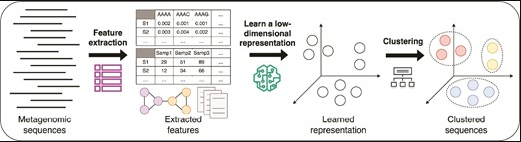
doi: 10.1093/bib/bbae372.
图中展示了典型的基于深度学习的宏基因组分箱流程包括:首先,从宏基因组序列中提取特征(包括核苷酸组成、丰度、图结构等)。接着,利用深度学习模型学习序列特征的低维表示或嵌入。最后,将序列的嵌入聚类以获得分箱。
基于机器/深度学习的宏基因组分箱工具能够有效利用通用图形处理单元(GPGPUs/GPUs)的高效增强的数值计算能力,非常适合对具有数百万序列的大规模宏基因组数据集进行分箱。
然而,目前大多数工具需要将整个数据集加载到内存中进行特征向量计算,这在计算内存不足时可能会成为挑战。对于非常大的数据集和特定使用场景,批处理技术在机器/深度学习应用中有利于数据的处理。
基于核苷酸和特征丰度的分箱方法,由于微生物基因组的核苷酸组成可能因基因组大小、氧气需求和氮含量等因素而异,此外,重复区、低复杂度区、聚合区段、文库制备步骤和测序偏差可能导致基因组序列具有不均匀的测序覆盖,因此,即使来自同一基因组的序列之间,其核苷酸组成和丰度特征可能存在高度差异。这种与基因组平均核苷酸组成或平均丰度不匹配的基因组序列通常会被错误分箱。
在组装过程中,非常相似的读段被合并为单个重叠群,随后在重新进行读段映射以估计覆盖率时,这些重叠群相比于其对应的基因组表现为过度代表。高保守区域,包括rRNA基因重复和编码转移RNA(tRNA)的基因,由于其高度相似性和重复性,常常被错误分箱,且许多分箱不包含任何编码rRNA的区域。类似的,重复序列如可转座元件(包括转座子和插入序列)和噬菌体也很少被正确分箱。
为准确地将这些序列重新添加到其适当的基因组中,可能需要在分箱结束时进行额外步骤,例如标记基因分析。使用Rfam或SILVA等数据库的标记基因分析可以帮助识别并可能纠正分箱中rRNA和tRNA基因的位置。
此外,分析物种的菌株水平变异在计算上具有挑战性,由于菌株间的高度相似性和组装质量较差,大多数分箱方法无法在菌株级别上生成MAG。这些方法常将相似菌株的重叠群归在一起,导致产生高度污染的分箱。
大多数宏基因组分箱工具仅关注细菌和古细菌,特别是依赖于这些生物单拷贝标记基因的工具。这些工具可能错误分箱或丢弃病毒序列,因为病毒缺乏普遍的标记基因。
此外,尽管基于单拷贝标记基因的方法可以适用于真菌和原生生物,但它们在宏基因组研究中仍未得到充分表征。鉴定真菌基因组也具有挑战性。
有问题相当于还有进步优化的空间,有挑战相当于还有突破的机会。希望这篇文章能够帮助读者们用更新的眼光审视宏基因组的发展。
参考文献
Mallawaarachchi V, Wickramarachchi A, Xue H, Papudeshi B, Grigson SR, Bouras G, Prahl RE, Kaphle A, Verich A, Talamantes-Becerra B, Dinsdale EA, Edwards RA. Solving genomic puzzles: computational methods for metagenomic binning. Brief Bioinform. 2024 Jul 25;25(5):bbae372.
谷禾健康
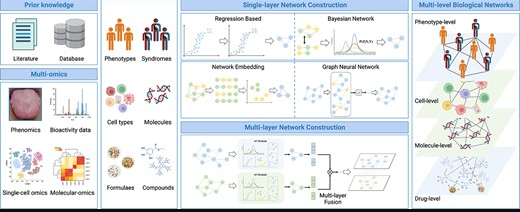
传统中医在数千年的疾病预防和治疗中,融合了临床实践经验和理论,视人体为复杂系统,以整体观和辨证施治为特征。目前中医面临的主要挑战包括揭示人体复杂系统的生物学基础,阐明中医术语及其关系,并根据中医理论推动精准医学的发展。
随着生物信息学、系统生物学和计算生物学等跨学科领域的兴起,现代医学的研究范式已从“还原论”转向“整体论”,诊断和治疗策略也从“单病、单靶点和单药物”转为“多靶点和系统调控”,强调系统生物学在分析复杂疾病机制中的重要性。
中医网络药理学(TCM-NP)在这一背景下产生,是传统与现代医学、信息科学和系统科学的跨界创新成果,其特征与中医整体观和辨证施治原则高度一致,已经成为传统医学研究的前沿和热点领域。
近期发表在《Briefings in Bioinformatics》上的一篇文章,详述了中医网络药理学(TCM-NP)的发展及其在人工智能(AI)术下的应用。TCM-NP作为一种新兴的跨学科领域,结合AI方法和多组学数据,提供了理解传统医学的新视角。
文章将涉及的AI方法框架分为三部分:网络关系挖掘(Network relationship mining)、网络靶点定位(Network target positioning)和网络靶点导航(Network target navigating),并介绍了它们在揭示中医寒/热综合征的生物学基础和临床价值方面的应用。
通过网络拓扑分析,研究揭示了不同中草药在寒/热综合征相关网络模块中的分布模式,指导了中医方剂的精准使用。此外,文章强调了开发深度可解释网络关系推理框架的重要性,以提高模型的可解释性和特征学习能力。
方法框架
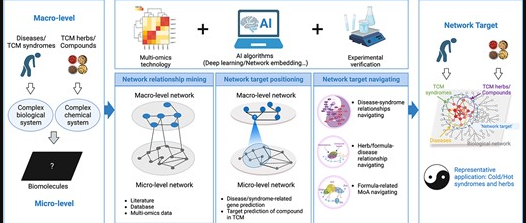
doi: 10.1093/bib/bbad518.
图中展示了中医网络药理学(TCM-NP)的网络靶点概念及其关键方法框架。中药/复方与中医证候/疾病的关系体现在中药/复方对疾病相关分子网络模块的调控作用上。
从方法论角度看,基于人工智能的潜在网络靶点识别可分为“网络关系挖掘”、“网络靶点定位”和“网络靶点导航”三个方面。
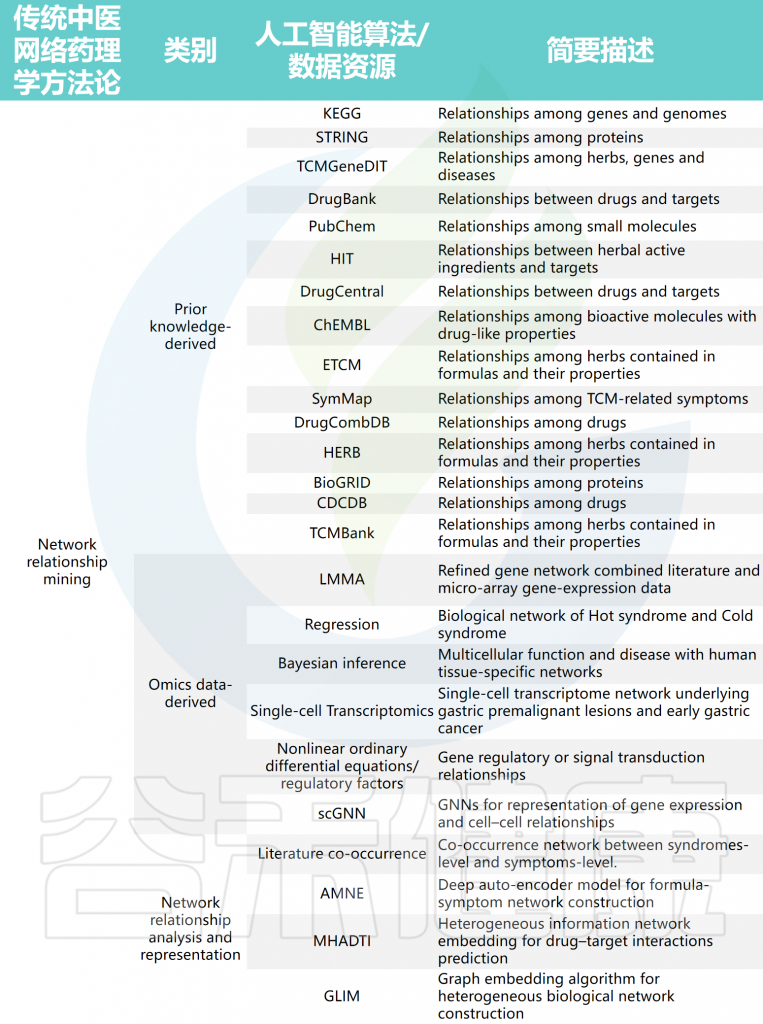
接下来将概述TCM-NP中涉及的基于AI的方法的进展,下表是TCM-NP涉及的代表性AI算法/数据资源。
TCM-NP涉及的代表性AI算法/数据资源

doi: 10.1093/bib/bbad518.

doi: 10.1093/bib/bbad518.
图中展示了网络关系挖掘框架,从已有的知识、文献和组学数据中挖掘表型、细胞、分子和药物之间的网络关系。这些方法可分为单层和多层网络构建,用于揭示不同生物层次间的互联关系。
▷ 从已有的知识挖掘网络关系
从先验知识中挖掘网络关系,这些关系主要涉及疾病/证候层面、生物分子层面和药物/方剂层面。
在药物/方剂层面,主要运用自然语言处理技术从已有知识中挖掘与疾病/证候相关的临床症状关系,通过中医临床诊断治疗理论,不仅可以通过挖掘临床表型条目推断临床症状的相似性,还可以推断证候与表型之间的关系。
药物/方剂层面的成分结构相似性关系主要从PubChem、ChEMBL、CDCDB和DrugCombDB等数据库中挖掘,方剂中草药及其属性关系则从ETCM、HERB和TCMBank等数据库中获取。在分子层面,蛋白质相互作用(PPI)、信号和转录调控关系主要从STRING、KEGG和BioGRID等数据库挖掘。
中医“辨证施治”理论根据患者不同的证候和表型特征提供治疗方案,因此存在证候/表型与草药/方剂疗效之间的关系,如从SymMap数据库或文献共现分析中挖掘。
值得关注的是宏观和微观对象之间的关系,包括从HIT、TCMGeneDIT、DrugCentral和DrugBank等数据库中挖掘的化合物或天然产物与其相关的分子靶点之间的关系。这些从文献或公共数据库中挖掘的网络关系为从系统角度理解中医提供了生物学基础,并为运用AI方法开展深入的方法论分析奠定了数据基础。
▷ 从组学数据中挖掘网络关系
从组学数据中挖掘网络关系,以转录组学为例,挖掘潜在关系的常见方法是使用经典机器学习算法,如统计分析或回归,构建共表达网络。
例如,有研究者应用基于机器学习(ML)的策略,结合基因共表达模式和网络拓扑特征,构建了寒热证候的分子网络,并识别出一系列证候相关的生物标志物。
▷ 网络关系分析与表达
对多层网络关系的分析也推动网络关系的挖掘。在疾病/证候相关的网络关系分析中,不同表型组成的网络模块的相似性被评估,以研究相同疾病下不同证候或相同证候下不同疾病的界限,例如表型层级与疾病/证候层级之间的关系。
临床表型网络(CPN),研究证候的交叉边界和症状的共现。在草药/方剂相关的网络关系分析中,可通过整合草药靶点关系评估相同方剂内不同草药网络模块的相似性,也可以评估方剂和其临床干预证候的网络模块的相似性。
此外,对疾病/证候和草药/方剂的网络分析表明,多层级的网络节点具有模块化特征,且不同层级的网络模块之间存在类似关系。这一规律为“网络靶点”理论提供了重要启示,也是中医网络药理学方法学发展的基础。
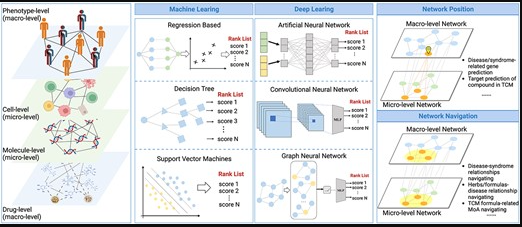
doi: 10.1093/bib/bbad518.
该图展示了网络靶点分析框架,主要涉及使用经典的机器学习方法和基于深度学习的方法,对包括表型、细胞、分子和药物在内的多层生物网络进行解剖,以实现网络靶点的定位和导航分析。
▷ 解决疾病/综合征相关基因预测问题
主要解决两个问题。第一个问题是基于AI的网络分析模型解决中医证候的基因预测问题,证候可以视作个性化的临床表型特征,对个性化临床表型相关基因的预测是实现个性化诊断和治疗的重要途径。
基于生物网络的表型/证候相关基因预测算法核心思想是利用“多层模块关系”法则,基于网络拓扑特征进行预测。传统的机器学习方法,如回归和随机游走(RW),最先应用于表型/证候的基因预测。CPHER算法是具有代表性的算法之一,提供了宏观和微观生物网络相关AI算法研究的范例,并成功应用于复杂疾病的机制分析。
以CIPHER算法为灵感,一系列基于网络的证候相关表型或临床相关症状的基因预测算法被提出,例如PTsGene结合中医临床表型与实验结果建立了中医症状-基因数据库,实现了高精度的疾病-证候基因预测。
近年来,随着GNN学习算法的提出,将表型-分子网络视为复杂图结构进行学习和推断已成为热门,并取得了优异表现。例如,CIPHER-SC融合单细胞信息建立多层生物网络,通过图卷积神经网络实现疾病基因预测。
▷ 解决中草药化合物的靶点预测问题
第二个问题是解决中草药化合物的靶点预测问题,提高预测准确性。类似于疾病/证候的基因预测,准确预测草药/方剂及其化合物相关靶点也是揭示中药药理学的前提。
DrugCIPHER药物-靶点预测算法是一个代表性算法,通过基于网络的回归分析实现了化合物相关靶点的高精度预测。与传统机器学习方法相比,深度学习模型能够整合大量异质信息,如药物相似结构、疾病治疗信息和药物活性,从而进行更复杂的药物-靶点预测任务。
中医药有“多成分、多靶点和系统调节”的显著特点。解读中医生物学基础的另一关键挑战是从生物网络的角度理解各种中医术语之间的关系,即网络靶点导航,包括疾病-证候关系、草药/方剂-疾病关系、方剂的配伍及其成分的协同作用。
▷ 疾病-证候关系
关于疾病-证候关系,表型和证候都是对复杂人体的临床描述。从宏观角度,通过分析疾病相关表型与证候相关临床特征的网络拓扑相似性,可以揭示疾病与证候之间的关系。
例如临床表型网络(CPN),为个性化的中医诊断和治疗提供了基础。从微观角度,可以通过基于疾病表型和证候特征进行基因预测或组学数据分析,然后构建相似性度量和相关分析,来实现疾病诊断与证候辨别的整合。
例如,挖掘寒热证候与神经-内分泌-免疫(NEI)生物网络之间的关系,分析脾虚证候的生物学基础及其与消化系统疾病的关系,分析冠心病(CHD)中PBS证候的生物学基础并建立诊断标志物,以实现“同病异治”。
▷ 草药/配方—疾病关系
关于草药/方剂-疾病关系,主要指在特定疾病或证候上下文中,基于网络的草药/方剂精准推荐。通常,基于AI的方剂推荐方法通过先验知识中的宏观信息推断草药/方剂模块与特定症状/证候之间的关系。随着多组学和微观层次网络分析的积累,通过整合草药/方剂-靶点网络与疾病/证候-基因网络,可以作出更精准的推荐。例如智能方剂推荐系统FordNet整合多层信息,是宏观和微观信息结合的代表性工作。
此外,通过草药/方剂-靶点网络与疾病/证候-基因网络的模块间关联分析,还可以发现中药方剂的新适应症。例如,利用基于网络药理学的方法研究能与多个靶点结合良好的中药候选物,并成功找到治疗阿尔茨海默病的最佳中药方剂。
▷ 草药/方剂相关成分的药理作用
通过挖掘草药/方剂中多成分的作用机制,以及应用AI方法挖掘方剂的配伍规律,实现了对草药/方剂模块间草药-草药关系的分析。
中药方剂相关作用机制(MoA)的研究框架包括:识别中药方剂中的活性成分;构建中药方剂所干预的疾病/证候网络;基于疾病/证候相关网络发现中药方剂活性成分的网络靶点。
目前,该框架已广泛应用于多种方剂的作用机制分析。通过识别草药-草药关系进一步建立方剂的关联规则,探索方剂的配伍规律。研究者建立了一个基于距离的互信息模型(DMIM)来测量草药之间的相互作用,构建了草药网络,从而识别出许多方剂中草药之间的有用关系。
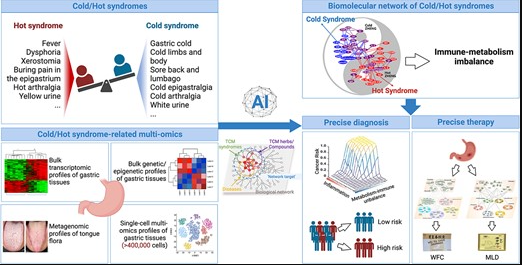
doi: 10.1093/bib/bbad518.
图中展示了在中医网络药理学中,寒热证候及其草药的构建、分析和应用,通过收集和解析与寒热证候相关的多组学数据,首次构建了寒热证候相关的分子网络,以促进胃病的精准诊断和治疗。
▷ 通过中医网络药理学揭示寒热证候的生物基础
在寒热证候的模型中,以患者的一系列临床特征为特征,揭示证候相关的生物基础涉及理解与宏观临床特征相关的微观生物分子。
早在2007年,研究人员首次利用文献挖掘和网络拓扑分析方法在NEI系统背景下构建了寒热证候的分子网络。研究表明,寒证相关的子网络主要由激素相关因素组成,而热证相关的子网络则以免疫相关因素为主,这两个网络通过神经递质相连。
该研究开创了运用中医网络药理学方法揭示中医证候生物基础的先例。随后,研究人员通过结合CIPHER网络靶点定位算法和寒热证候相关的转录组学数据,揭示寒热证候涉及代谢-免疫调节的不平衡网络,并识别出证候相关的生物标志物,包括寒证相关的LEP和NOS1以及热证相关的CCL2。这些发现表明,可以通过中医网络药理学方法论来解决寒热证候的生物基础问题。
▷ 指导中药方剂的精准使用
另一方面,通过网络靶点导航分析,即分析寒热证候相关分子网络与寒热草药靶点网络之间的拓扑关系,揭示不同寒热草药的作用机制,指导中药方剂的精准使用。
通过网络拓扑分析发现,寒证相关草药往往富集于热证相关网络模块,而热证相关草药则富集于寒证相关网络模块,这种分布模式与中医“温寒凉热”的原则一致。
此外,将网络分析与实验验证相结合,还可以揭示方剂的药理机制,指导患者的个性化治疗。例如,基于胃炎寒热证候相关生物网络,研究团队揭示了治疗胃炎的两种代表性中药方剂——胃复春(WFC)和墨洛丹(MLD)的不同作用机制,其中WFC侧重于调节炎症路径,而MLD则侧重于抑制脂肪酸代谢,这将有助于临床实践中胃炎的精准治疗。
综上所述,多模态数据与AI技术的整合是网络药理学方法中的重要研究方向和热点。基于AI的网络整合分析主要包括三个方面:多组学数据的整合、组学数据与先验知识的整合以及多源异构生物网络的整合。
第一方面主要涉及使用生物网络数学表示组学数据中的多层次信息,如细胞-细胞、细胞-分子和分子-分子关系。未来,随着多组学数据的积累,预计会出现与中医相关的整合算法。
第二方面,基于网络的先验知识与组学数据整合对于减少噪声和有限样本的影响至关重要,贝叶斯网络是常用的AI模型,将知识派生关系视为先验分布,组学派生关系视为后验分布。近年来,几种深度学习模型,包括迁移学习,被用于整合先验知识和组学数据之间的关系。
第三方面,尽管不同生物网络可能代表异构信息,但它们可以建模为邻接矩阵,从而在统一的AI算法下进行整合,这为从网络药理学角度整合异构生物网络提供了可能性。
参考文献
Zhang P, Zhang D, Zhou W, Wang L, Wang B, Zhang T, Li S. Network pharmacology: towards the artificial intelligence-based precision traditional Chinese medicine. Brief Bioinform. 2023 Nov 22;25(1):bba
谷禾健康
危重病人|肠道
对于重症患者来说,肠道是一个脆弱的器官,胃肠道 (GI) 功能障碍很常见,胃肠道功能障碍可能表明病情危重。据报道,重症监护病房 (ICU) 中近 50% 的患者入院时肠细胞受损。
在重症患者中,患有胃肠道功能障碍的患者比没有胃肠道功能障碍的患者死亡率更高。因此,监测重症患者的胃肠道状况非常重要。
长期以来,人们一直假设肠道是危重疾病的“发动机”。孤立地看,肠道的每个组成部分都会因危重疾病而严重受损,导致局部和远处器官受损。胃肠道稳态失衡是全身炎症发病和进展的重要因素,最终可导致多器官衰竭和死亡。
与此同时,危重患者往往病情不稳定,伴有多器官损害。他们处于由内分泌、免疫、神经和炎症机制介导的严重应激状态。由于药物、危重疾病、手术、精神压力或正常饮食中断等各种因素,使得危重患者的肠道承受着巨大的压力。
重症患者的致病事件包括肠系膜灌注不足、肠道运动失调和肠道屏障失效,导致管腔底物易位;随后是局部和全身免疫反应的加剧。这些事件可能引发肠道、循环系统细胞,肝脏、胰腺和肺等其他器官之间的病理性相互作用。例如,肠道和肝脏之间存在相互作用,肠道和肝脏通过胆道、门脉和体循环进行双向交流。然后,毒性因子可以通过门脉血流和肠系膜淋巴离开肠道,导致远处器官损伤。
在急性中毒的情况下,致命并发症的发生概率会随着血管内皮功能障碍初始水平的增加而上升。导致中毒的一些体液因素是由正常肠道菌群产生的代谢产物。在健康人中,这些代谢产物几乎无法突破肠道屏障(IB,即分隔肠食糜和血液的结构系统)。然而,肠道菌群代谢产物漏入血液与多种慢性疾病的发病机制密切相关。
在重症疾病中,肠道菌群的直接或间接损伤会导致继发性肠道菌群功能障碍,这为细菌代谢物和细胞成分以影响疾病结果的剂量进入血液创造了前提条件。这些物质混合物的组成取决于肠道菌群的构成,而每个人的肠道菌群构成是个体化的,这种多样性可能是急性疾病并发症不可预测性的一个决定因素。
与此同时,肠道菌群是免疫系统发育和调节的关键,影响宿主对感染的易感性和反应。肠道菌群失调和肠道通透性增加会促进致病微生物过度生长和肠道病原体相关分子模式 (PAMP) 易位至淋巴系统和门脉系统,削弱人体对感染或损伤的防御能力,并加重器官损伤。
因此,与健康状态相比,危重疾病会极大地改变肠道的所有元素——上皮、粘液、肠道屏障、免疫系统和微生物群及其代谢物。肠道损伤反过来会导致局部和远处损伤以及多器官功能障碍综合征。目前已有几种针对病原菌群的治疗方法,虽然这些方法目前都不是 ICU 的标准治疗方法,但已显示出很大的效果潜力,值得我们了解和进一步去证实。
本文我们来了解一下危重疾病患者的肠道,包括细胞凋亡、肠道通透性过高、肠道菌群变化等带来的影响,重点关注所涉及的病理生理机制和相关治疗干预措施。
本文目录
01 为什么要关注重症监护患者的肠道?
全身性应激、胃肠衰竭
02 危重疾病中的肠道
03 危重疾病中的肠道菌群失调及影响因素
ICU患者微生物群的变化
危重疾病中微生物群不稳定的病因
其中药物对微生物群的影响
04 肠道损伤和肠道菌群改变的后果
免疫不平衡、感染以及感染并发症、多重耐药菌
05 急重症患者的肠-器官轴
急重症患者的肠-器官轴
胆汁酸引起的肠道损伤
胰酶引起的肠道和肠道外损伤
肠肺连接:肠系膜淋巴
肠-脑轴:谵妄
06 肠道菌群产生的有毒代谢物
脂多糖LPS、氨、TMAO
吲哚硫酸盐、吲哚乙酸盐
对甲酚硫酸盐、 单胺、其他
07 机体危急状态下的急性肠道缺氧
胃肠道平滑肌痉挛、胃肠停滞
急性循环障碍、急性脑功能不全
08 机体危急状态下如何保护肠道和肠道屏障
系统性肠炎保护手段
紧急保护肠炎的手段
预防和干预措施
09 结语
全身性应激,如重大创伤、烧伤或手术,会扰乱肠道平衡,导致绒毛上皮脱落、肠细胞功能障碍、肠道屏障丧失以及肠腔成分易位到血液循环。
在轻度全身性炎症中,例如在心脏直视手术中,内毒素(脂多糖 LPS)从肠腔漏入血液循环。
另一方面,无论在全身炎症反应综合征还是新生儿脓毒症患者中,肠道菌群都会转向致病菌种的重大转变,同时微生物多样性也会降低。
革兰氏阴性菌(如大肠杆菌、克雷伯氏菌、肠杆菌属)和革兰氏阳性菌(如葡萄球菌、肠球菌、链球菌属)均在新生儿、婴儿和成人的菌血症或脓毒症中发挥作用。
因此,肠道屏障受损可导致细菌易位和菌血症,从而导致全身炎症,在易感患者中,可导致脓毒症、感染性休克和循环衰竭,伴或不伴有多器官功能障碍综合征 (MODS)。
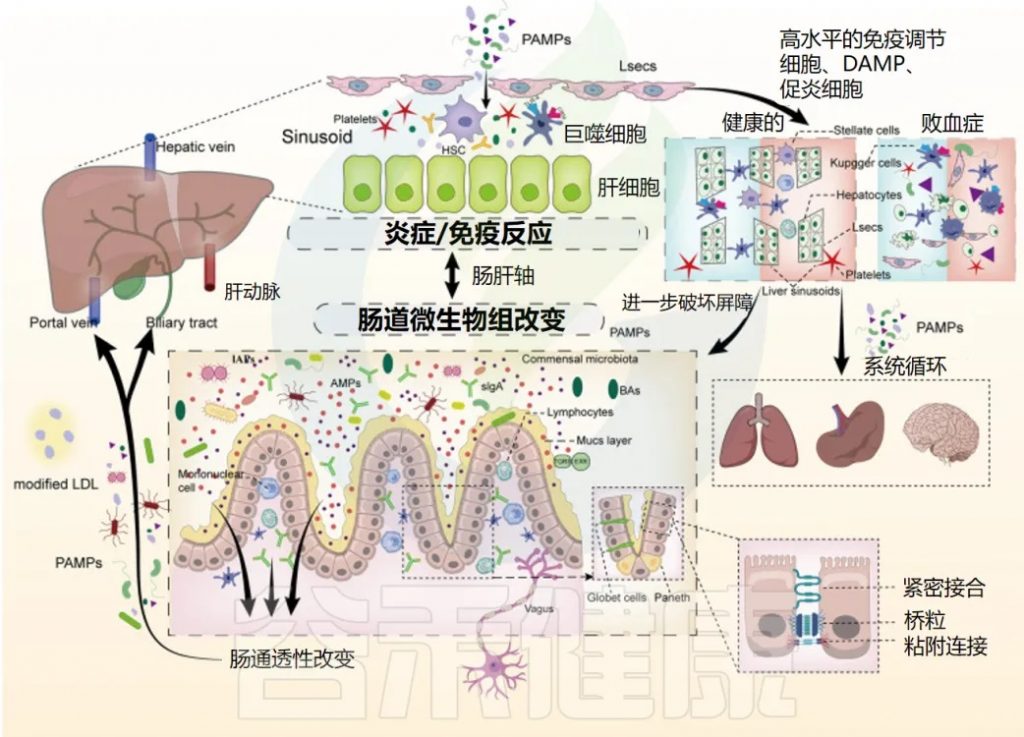
Zhang X et al. Crit Care. 2022,13;26(1):213.
简称:IEC,肠上皮细胞;DAMP,损伤相关分子模式;LSEC,肝窦内皮;PAMP,病原体相关分子模式。
脓毒症期间肠道屏障受损和肝脏免疫功能的复杂相互作用
肠道屏障的破坏:
在脓毒症期间,多种机制导致肠道屏障破坏,包括 IEC 凋亡、黏液层改变和细胞间连接破坏,从而导致肠道 PAMP 通过淋巴管、门脉循环或胆道易位到肝脏。
肝脏的免疫防御:
肝脏对免疫防御的调节至关重要,肝窦内皮细胞、巨噬细胞、星状细胞和肝细胞等效应细胞可立即识别和对抗病原体、清除细菌并释放细胞因子。
不适当免疫反应或过度炎症的影响:
当发生不适当的免疫反应或过度炎症,肝脏中 DAMP 水平高且促炎细胞因子产生时,肝窦的正常结构被破坏,这些细胞通过凋亡和自噬受损,导致细菌清除功能障碍和代谢紊乱。
结果,肠道屏障进一步受损,肠道菌群失调加剧,远端器官因 PAMP 和 DAMP 扩散和全身炎症而受损。
以下章节将讨论肠道局部事件的作用、肠肝轴的重要性、胆汁和胰腺酶的贡献以及肠肺联系。
上述有害事件并非总是悄无声息的,可能会带来临床定义不明确的胃肠道衰竭。其症状包括:
急性胃肠道损伤的分级系统
最近提出了一种急性胃肠道损伤的分级系统,严重程度依次为:
胃肠道衰竭的早期诊断具有挑战性
因为多达50%的危重患者可能出现肠内喂养问题,包括呕吐、胃排空延迟、腹泻。由于肠内营养对肠道屏障有益,肠外喂养可能会导致胃肠道生理进一步恶化。
胃肠道衰竭与临床结果的关联
肠道功能障碍和胃肠道衰竭与重症监护病房 (ICU) 住院时间延长和死亡率增加有关。ICU 入院第一天出现3种或3种以上胃肠道症状(胃残留量高、肠鸣音消失、呕吐、腹泻、肠胀气和胃肠道出血)的患者死亡率会增加3倍。
胃肠道衰竭的生物标志物
为了辅助诊断胃肠道衰竭,血浆或尿液中肠道脂肪酸结合蛋白 (I-FABP)、肠道菌群监测、肝脏脂肪酸结合蛋白 (L-FABP) 和回肠胆汁酸结合蛋白 (I-BABP) 和/或瓜氨酸的水平会有所帮助。
总之,这些数据进一步支持了肠道屏障功能障碍与全身炎症之间的关联,如下图所示。
胃肠道衰竭过程中的致病事件
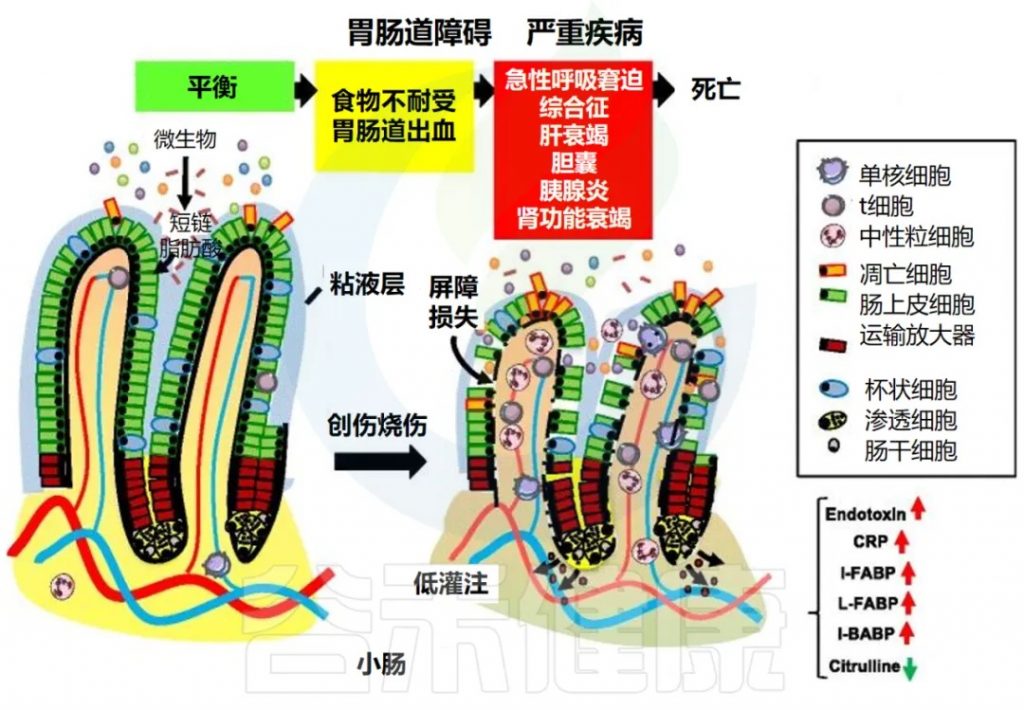
de Jong PR, et al., Crit Care. 2016 18;20(1):279.
在稳态条件下,小肠中的潜在毒性成分被限制在管腔内,而肠细胞则允许跨上皮屏障吸收营养物质,例如短链脂肪酸。
在重症患者中,如果遭受严重创伤或烧伤或接受手术,维持肠道屏障的保护机制会因循环和神经内分泌失调而失效。这会导致胃肠道衰竭,并伴有口服不耐受、胃肠道出血或肠梗阻等临床症状。
胃肠道衰竭是一种进行性临床综合征,其早期主要出现胃肠道症状,随后可能会出现肠外紊乱,例如急性呼吸窘迫综合征 (ARDS)、肝功能衰竭、胆囊炎、胰腺炎或肾功能衰竭。胃肠道衰竭与组织层面上皮脱落、绒毛缩短和小肠炎症细胞浸润有关。
急性胃肠道损伤 (AGI) 的定义与分类
2012 年,欧洲重症监护医学会 (ESICM) 腹部问题工作组将急性胃肠道损伤 (AGI) 定义为危重患者因急性疾病导致的胃肠道功能障碍,并建议对 AGI 严重程度进行四级分类,但主要依赖症状和体征,不足以诊断潜在疾病。
AGI的生物标志物及其临床有效性
一些生物标志物,例如血肠脂肪酸结合蛋白 (i-FABP)、D-乳酸 (D-la) 、脂多糖 (LPS),肠道菌群以及黏蛋白等已被提议作为肠道屏障功能和检测 AGI 的可能标志物。然而,它们在 AGI 诊断和分类中的临床有效性仍不清楚。尚无研究评估过这些生物标志物在不同 AGI 严重程度等级的危重患者中的作用。
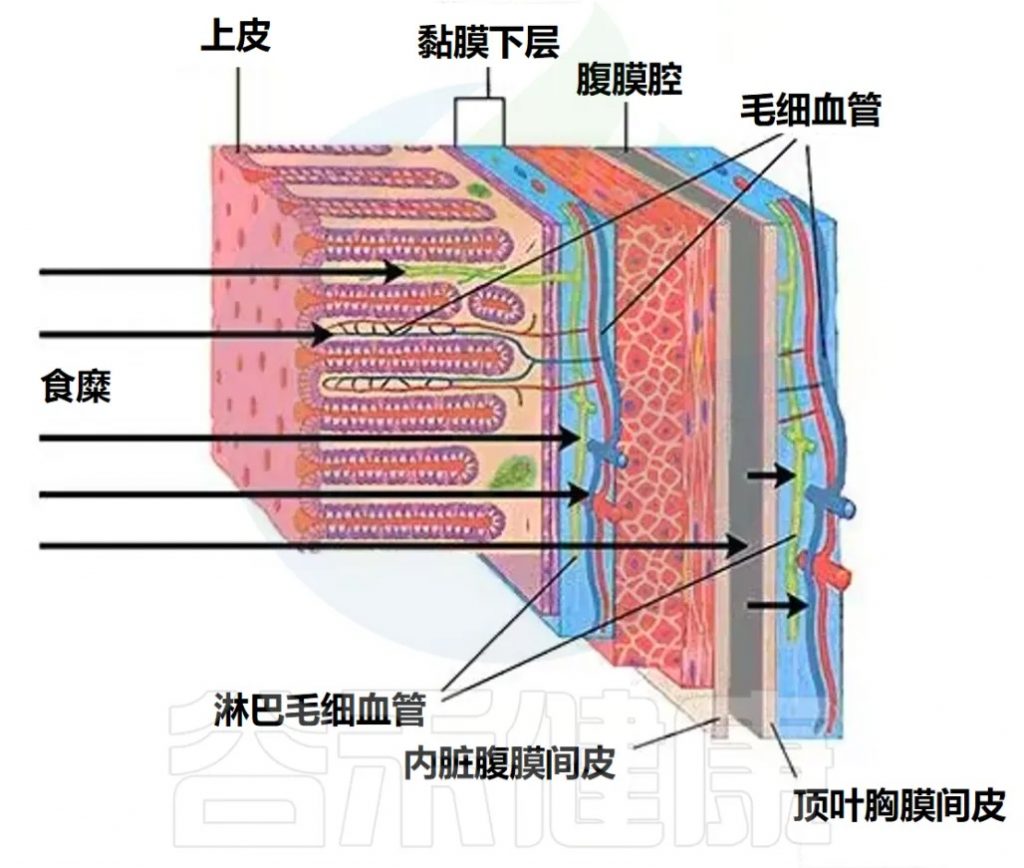
肠道屏障的现代概念
在 10 年前,“肠道屏障” 一词就被用来表示肠粘膜上皮。如今,“肠道屏障” 一词还包括与粘膜下层的血液和淋巴毛细血管的上皮、黏蛋白和内皮相关的共生细菌。
肠道屏障的组成元素
未被肠壁毛细血管网络吸收的物质在进入血液的过程中必须克服其他肠道屏障元素,这些元素包括:
黏蛋白层与上皮细胞的功能
厚度为150微米的黏蛋白层由水合糖蛋白组成,将上皮细胞与侵蚀性环境——食糜分隔开来。在粘膜缺血期间,黏蛋白的形成受损,这对微生物密度高的结肠最为危险。
通常情况下,共生的需氧细菌会从小肠和结肠上皮细胞的顶端表面排斥致病微生物,向上皮细胞提供必要的底物。
厚度为20微米的上皮细胞单层的主要功能是选择性吸收食糜中的物质。
胃肠道粘膜的吸收表面积
由于小肠中的绒毛和大肠中的隐窝的存在,胃肠道粘膜的吸收表面积接近200平方米。通常,物质吸收主要通过跨细胞途径进行。细胞间运输的比例大概与粘膜表面积的比例相当,大约为0.1%。
细胞间接触的结构与重要性
两种类型的细胞间接触(紧密连接和粘附连接)由肌动蛋白组成,通过将相邻细胞的浆膜与其细胞骨架连接起来,提供上皮的强度。细胞间接触是多种外来物质的生物靶标,随着这些外来物质破坏作用的增加,细胞间运输的重要性也会增加。
健康人的肠道屏障对生活在肠道中的细菌不渗透。肠道微生物(大肠杆菌,拟杆菌)等的DNA仅在肠道屏障受损时才会出现在血浆中。需要从体内排出的物质通过被动扩散从胃肠道食糜中进入血液。
菲克扩散第一定律(理解肠道物质吸收的基础)
它们的吸收大致可以用菲克扩散第一定律来描述,该定律表明:
物质通量密度(J)与膜两侧的浓度差(Ci – C0)和膜的渗透系数(D)成正比。
这一定律在生物学中用于解释物质如何通过生物膜进行吸收和扩散。
Ivnitsky, JJ, et al. 2022. J Evol Biochem Phys 58, 1075–1098.
注:J = D(Ci – C0)
J:物质通量密度,单位为mol m^-2 s^-1,表示单位时间单位面积上通过的物质量。
D:膜的渗透系数,单位为m s^-1,表示物质通过膜的难易程度。
Ci和C0:分别是膜两侧(上皮侧和内皮侧)的物质浓度,单位为mol m^-3。
生物利用度和影响因素
肠道微生物产生的毒性废物的生物利用度随着(Ci – C0)或D的增加而增加。
(Ci – C0)的增加意味着食糜中这些物质的浓度增加,从而增加了它们被吸收的可能性。
D的增加意味着膜的渗透性增加,这可能是由于胃肠道上皮和血管内皮的状态改变,例如炎症或损伤。
食糜水压对物质吸收的影响
由于气体形成增加或平滑肌痉挛导致的食糜水压增加,可能会增加物质的吸收率。这可能是由于压力增加导致物质更容易通过肠道屏障进入血液。
食糜中形成的部分物质能够穿过上皮,进入粘膜下层的血液和淋巴毛细血管网络,进一步进入门静脉系统和胸导管的血管中。通常,这是主要的路径。另一部分物质则通过腹膜的内脏层和壁层,进入胸导管的淋巴管或下腔静脉系统的血液毛细血管网络。
大肠中由于没有连续的纵向肌层,这一过程的腹膜扩散得以促进,而这些肌层集中在狭窄的结肠带(taenie coli),因此不构成扩散的障碍。
注:腹膜扩散是指物质通过腹膜从一个部位扩散到另一个部位的过程。腹膜是覆盖腹腔内部器官的一层薄膜。
研究表明,氨和细菌脂多糖(LPS)能够通过腹膜扩散进入血液。这意味着这些物质可以穿过腹膜,从肠道区域移动到全身循环系统。参与腹膜扩散的物质在进入全身循环过程中可以避免在肝脏中的首过代谢。
在门静脉高压(通常由于肝脏疾病引起)会减慢物质从肠道扩散到门静脉系统的速度。这会导致更多的物质通过腹膜扩散到其他区域。因为腹膜扩散被用于通过腹膜透析进行解毒。
注:避免首过代谢:在肝脏中,许多物质会在第一次通过时被代谢掉(这叫做首过代谢)。但是,通过腹膜扩散的物质能够避开肝脏的首过代谢,直接进入全身循环。这使得这些物质更快速地在体内发挥作用。
综上所述,腹膜扩散是一种重要的生理过程,对在特定情况下的物质交换和解毒有重要作用。
因此,肠壁的功能是维持胃肠道食糜和血液之间物质的浓度梯度,对这些物质的选择性吸收。
肠上皮细胞凋亡与危重疾病
小鼠在盲肠结扎穿刺和感染假单胞菌肺炎后,肠上皮细胞凋亡均上调。值得注意的是,通过过表达 B 细胞淋巴瘤 2 (Bcl-2) 来预防肠道细胞凋亡可提高这两种模型中的生存率。相反,脓毒症会导致隐窝增殖大幅减少。
危重疾病对肠道细胞迁移的影响
危重疾病也会减慢沿隐窝/绒毛轴的向上迁移,导致绒毛长度明显缩短。其中背后的分子决定因素很复杂,在坏死性小肠结肠炎中缺乏 TLR4 的小鼠中迁移速度更快,但在缺乏 TLR4 的脓毒症小鼠中迁移速度更慢。
此外,阻断磷酸化粘着斑激酶 (P-FAK) 会导致肠细胞迁移进一步减慢,而肠道特异性 Bcl-2 的过度表达可防止脓毒症引起的肠细胞迁移减慢。
危重疾病还会诱发肠屏障通透性过高
这种过高在脓毒症发作后 1 小时内开始,并持续至少 48 小时。
屏障功能受损是由紧密连接和相关蛋白的变化所介导的,导致管腔内容物外流,并可能损害远处器官。从机制上讲,脓毒症会导致紧密连接蛋白-2 和连接粘附分子 (JAM)-A 增加,而紧密连接蛋白-5 和闭合蛋白则减少。闭合小带 (ZO)-1 也会根据模型系统而不同地减少。
MLCK在肠屏障功能中的作用
肌球蛋白轻链激酶 (MLCK) 磷酸化肌球蛋白调节轻链,导致肌动蛋白-肌球蛋白环收缩,增加旁细胞通透性。
MLCK 激活常见于细菌感染,抑制 MLCK 可提高脓毒症小鼠模型的存活率,并改善烧伤小鼠模型的屏障功能和紧密连接重排。值得注意的是,在存在癌症或长期饮酒等慢性合并症时,肠道上皮和屏障功能的改变会加剧。
黏液层的保护作用
黏液还通过阻止细菌和消化酶与肠道上皮接触,在宿主防御中发挥关键作用。黏液的疏水性可显著降低带正电荷的水溶性毒性分子穿过表面的能力。
危重疾病对黏液层和肠道通透性的影响
危重疾病会导致黏液层受损,进而导致上皮细胞功能障碍。缺血/再灌注会导致黏液层疏水性丧失,肠道通透性改变。
此外,创伤/出血性休克后,大鼠黏液和绒毛高度损失减少,上皮细胞凋亡和通透性过高增加。值得注意的是,H2阻滞剂可减少肠道黏液的产生,并导致体外屏障功能障碍。
肠道淋巴假说认为,来自肠腔的有害介质通过肠系膜淋巴到达肺部,在那里造成组织损伤。
多项研究支持这一假说,结扎肠系膜淋巴管可以减少肺损伤,减弱危重病啮齿动物模型中的中性粒细胞活化,提高生存率。此外,注射创伤出血引起的肠系膜淋巴可诱发肺通透性过高和肺损伤。
与此相辅相成的是危重病的肠肺轴。小鼠脓毒症后,肺部群落以肠道相关细菌为主,生态分析显示肠道可能是肺部细菌的来源。这与ICU急性呼吸窘迫综合征患者肠道特异性细菌的丰富性相一致。
在危重疾病发作的数小时内,微生物群的密度和组成会发生剧烈变化,有益健康的微生物群会转变为促进疾病的致病微生物群。
大量新出现的数据表明,危重疾病与微生物群之间存在联系。
重症监护领域最大规模的研究调查了美国肠道项目的1000多名患者,包括 115 名ICU患者在转入ICU和转出ICU后48小时内或转出ICU第10天后的皮肤、舌头和粪便中的微生物群。
转入ICU时,粪便和皮肤的 α 多样性 (组内) 显著降低:
重症患者的肠道微生物群失调
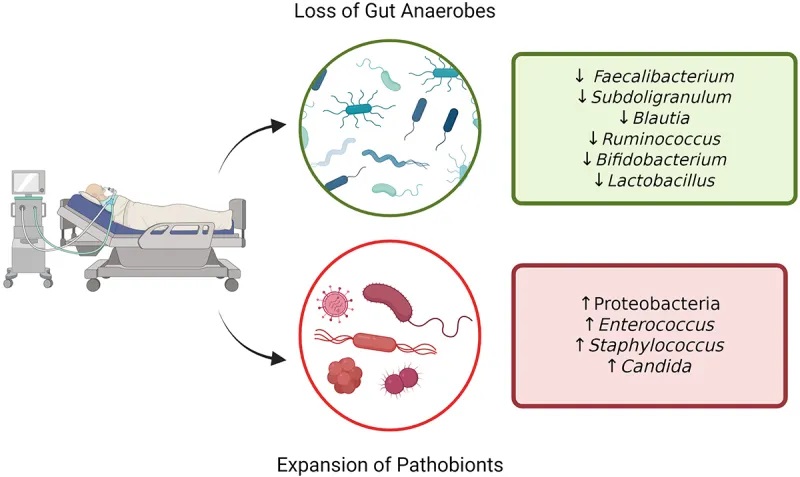
doi: 10.1080/19490976.2024.2351478
微生物群多样性的显著受损
一项针对 34 名 ICU 患者的前瞻性研究显示了互补结果,该研究显示与 15 名健康对照者相比:
一项针对 14 名脓毒症 ICU 患者的小型研究也观察到微生物群多样性的丧失,其中 35% 的患者粪便中只有 1-4 个细菌类群。
致病菌增加
总体而言, ICU 中变形菌占主导地位,厚壁菌数量减少,而脓毒症患者中肠球菌、葡萄球菌和肠杆菌的数量均增加。值得注意的是,在基础条件下,肠道微生物群内的分类群在时间上相对稳定,尽管可能受到饮食和环境因素的影响。
相反,在 ICU 患者中,向致病菌的转变几乎立即发生。在儿科 ICU 患者中也观察到了菌群失调的进展
通常情况下,下列菌群占主导地位:
一些在正常肠道菌群组成中发挥积极作用的菌群减少,如产生丁酸的关键菌属:
多项研究报告称,双歧杆菌丰度减少,该菌在维持免疫调节和营养吸收方面发挥着重要作用。
最近的研究比较了几个危重病人的微生物群组成,发现了一些人际差异,如多样性和丰富度降低。
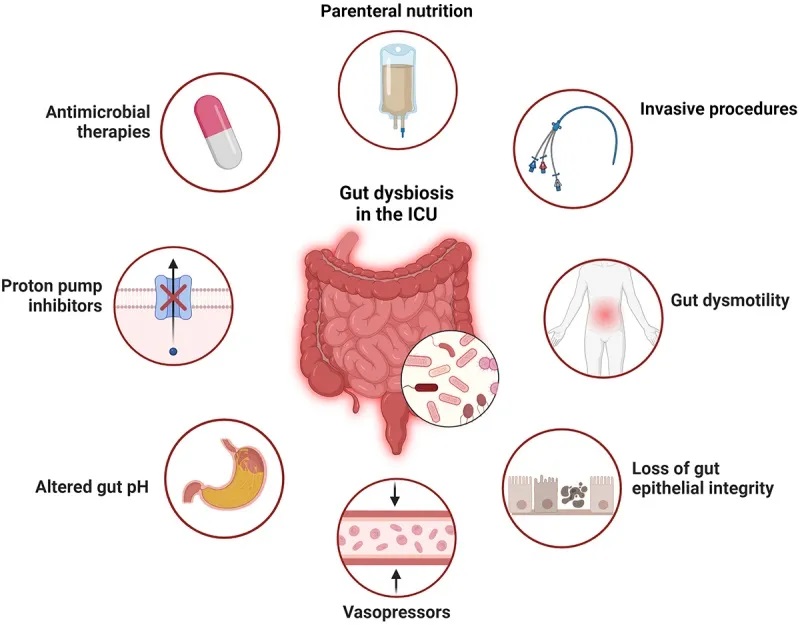
病因是多方面的:
宿主内在因素
危重疾病本身会导致肠道菌群发生重大变化,这可能是由宿主环境的整体变化引起的。宿主内在因素包括循环休克、全身性酸中毒、粘膜血流改变、炎症等。
值得注意的是,细菌可以通过表达祖先或新获得的基因在危重疾病环境中变得具有新的毒性。
治疗对微生物群的影响
ICU 患者接受的许多治疗都会产生脱靶效应,直接改变微生物群。已证明会影响微生物群的药物包括抗生素、质子泵抑制剂和阿片类药物。
营养成分
碳水化合物、脂质和蛋白质改变会影响微生物群。
扩展阅读:
营养方式
途径(肠内/肠外)会改变健康状态下的微生物群。肠外营养后拟杆菌增多,屏障功能受损,这可以通过肠内营养补充来逆转。
微生物-微生物相互作用的改变
有一种假设认为,在危重病期间,定植抗性(Colonization Resistance, CR)机制的破坏有助于病原菌的扩张。
当肠道中的厌氧发酵菌减少,同时肠杆菌科细菌增加时,这可能表明定植抗性的稳态机制受到了干扰。厌氧发酵菌通过产生短链脂肪酸、降低肠道pH值、维持厌氧环境和抑制炎症来抑制肠杆菌科细菌的生长。
像粪肠球菌这样的其他常见ICU病原菌也会在急性疾病期间因定植抗性机制的破坏而受到影响。例如,在接受了造血干细胞移植的个体中,抗生素治疗与万古霉素耐药性粪肠球菌(VRE)的肠道过度生长有关,VRE是院内感染的常见原因。
导致危重疾病中菌群失调的因素
doi: 10.1080/19490976.2024.2351478
抗生素对微生物群的双刃剑作用
由于入院患者病情危急,重症监护病房经常使用抗生素。最近对肠道菌群作用的理解取得进展,凸显了这些药物的潜在有害影响,因为这些疗法针对的是致病菌,但也针对构成我们菌群的共生菌。
抗生素的影响是多因素的
它取决于抗生素的固有特性(类别、药代动力学和药效学特性)和使用方式(如剂量、持续时间、给药途径)。
举例:克林霉素对微生物群的特定影响
克林霉素改变细菌多样性,并有利于固有耐药微生物 (如艰难梭菌、肠球菌或肠杆菌)的生长,成为促使感染艰难梭菌 (CDI) 的主要危险因素。
其他类别抗生素的影响
同样的方式,大环内酯类、糖肽类或氟喹诺酮类已被证明可以显著改变肠道菌群的组成。
利福昔明 (通常用于肝性脑病) 似乎对微生物多样性的影响有限,而有利于有益细菌的生长。
SDD和SOD对肠道菌群的影响
由于其直接作用于微生物群而具备特殊地位,选择性肠道去污(Selective digestive tractdecontamination,SDD) 或选择性口咽去污 (SOD) 在危重病人中经常被使用,可用于改变微生物群。和未治疗的患者,接受SDD治疗患者的主要变化是肠杆菌科细菌减少了,肠球菌增加了,以及对厌氧菌的影响。相反,SOD似乎对微生物群的影响有限。
非抗生素药物对肠道菌群的潜在影响
通过分析荷兰1,135暴露于各种常用药物患者的肠道微生物群,研究得出非抗生素药物也可能影响肠道微生物群。其中,质子泵抑制剂,二甲双胍,非甾体类抗炎药或他汀类药物对肠道菌群组成的影响达到可检测水平。
重症监护特异性治疗对微生物群的影响
在除了所有被提到的因素外,许多重症监护特异性治疗,如人工喂养、机械通气、质子泵抑制剂和血管升压药也可能导致微生物群失调。其中,阿片类药物,这种有助于减慢肠道蠕动,被广泛应用于 ICU患者的药物可能通过增加肠球菌和葡萄球菌种类而调节微生物群,并有利于它们的菌群异位,如脓毒症的小鼠模型。
微生物群是免疫发展的基石
一方面是肠道粘膜免疫,另一方面是全身免疫。事实上,许多结构(如派尔集合淋巴结)都参与免疫调节,例如通过免疫球蛋白A (IgA),它构成了主要的肠道免疫成分,可能针对某些肠道微生物群。
肠道微生物群改变可能导致免疫系统失调
小鼠粘膜 IgA 浓度降低与γ-变形菌(包括肠杆菌)数量增加有关,而γ-变形菌数量增加与促炎特性有关。同样,IgA 的缺失会导致多形拟杆菌诱导促炎状态。
微生物群对T细胞(Th17)的影响
微生物群的改变也会对T细胞产生影响,特别是 TH17细胞,这些细胞参与抗菌防御并对肠上皮细胞起作用,从而产生抗菌肽。
SARS-CoV-2感染与微生物群的关系
在SARS-CoV-2感染的情况下,微生物群的特殊修饰是与促炎症状态相关的:瘤胃球菌和梭状芽胞杆菌属的存在与炎症标志物的阳性、阴性、特异性相关。
后来的研究证实了这些观察结果,发现不具代表性的肠道细菌与免疫调节特性和重症患者高浓度的血浆细胞因子以及生物标志物密切相关。然而,少数危重病人和大部分接受抗生素治疗的患者的存在,这些观察结果的普遍性受到限制。
通过对粪便样本的病毒转录活性分析,这些标记为SARS-CoV-2高传染性的特征的种群具有更广的细菌丰度并有更强进行核苷酸、氨基酸和碳水化合物的合成和新陈代谢的生物能力。相比之下,标记有低传染性的粪便样本具有较高产生短链脂肪酸的细菌丰度。
危重病人预后与医疗保健相关感染
在许多其他场景中,危重病人的预后与医疗保健相关的感染情况密切相关,后者发生率可能高达25%,这对生存或发病率的影响有显著差异。
特定细菌携带与感染风险
直肠携带特定的可培养细菌,特别是在ICU患者中检测到的肠杆菌或肠球菌属似乎与随后感染相同微生物的患病率有关。
这些观察结果被近期一个在ICU患者中进行的研究所证实,研究发现咽喉或直肠携带超广谱beta-内酰胺酶的肠杆菌(ESBL-E)是发生ESBL-E呼吸机相关性肺炎的一种危险因素。
口腔和口咽微生物群的变化
特别是在非机械通气患者中,改变口腔和口咽微生物群存在的大肠杆菌、铜绿假单胞菌或金黄色葡萄球菌会导致非特异性医院获得性肺炎 (HAP) 风险增加。
肠道微生物群的多样性与感染
粪便菌群多样性改变在ICU患者中很常见,也可能增加感染率。首先,在动物研究中,肠道微生物群似乎有一个对感染的直接保护作用,特别是肺炎链球菌肺炎。
肠道菌群失调与危重病医院获得性感染联系
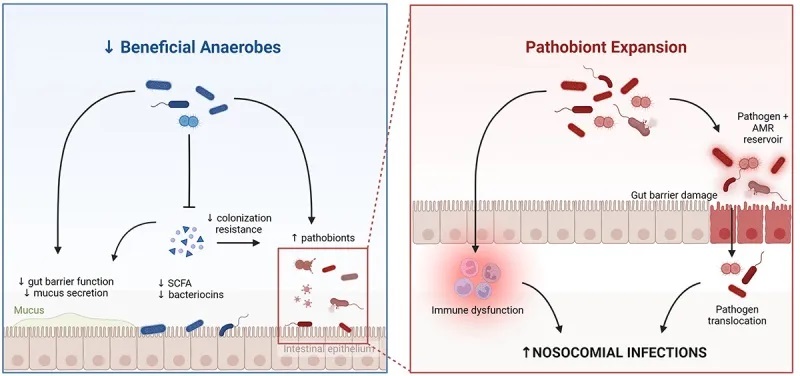
doi : 10.1080/19490976.2024.2351478
共生厌氧菌的丧失导致肠道屏障完整性的破坏,以及对病原菌类群的定殖抗性受损。致病菌(如肠杆菌科)的扩张,加上上皮屏障完整性受损和全身免疫功能障碍,使得肠道致病菌(通过易位和传播)以及由于全身免疫防御受损而导致的其他病原体能够发生侵袭性感染。
呼吸机相关性肺炎(VAP)
呼吸机相关性肺炎 (VAP) 是ICU患者中常见的医院并发症,肠道细菌可能在VAP的发病机制中起作用。这些细菌可以定植于口咽微生物群,然后通过机械通气进入呼吸系统,可能导致感染。
肠道微生物组与呼吸系统微生物组的关系
最新研究表明,肠道微生物组对呼吸系统微生物组有影响。在急性呼吸窘迫综合征患者中,肠道中拟杆菌属的增加可能与呼吸系统的微生物群变化有关。
在机械通气的病人中,与发展成为呼吸机相关性肺炎的患者相比,那些没有发展成呼吸机相关性肺炎的人似乎呈现出不同的微生物群。同样在感染情况下,改变的肠道微生物群似乎对处在危重情况下的宿主预后有影响。
选择性肠道去污(SDD)的临床应用
在动物研究中,无菌或抗生素治疗的小鼠 (即诱导菌群失调) 似乎更多易患严重结肠炎。在ICU患者中,选择性肠道去污(SDD)的使用与更好的患者结局有关,特别是在抗生素耐药率低的ICU中,但这些观察结果尚未在ICU中确认对于中度到高度抗生素耐药的患者是否有益,以及与静脉使用头孢菌素无关。
肠球菌属与ICU患者短期预后
一项主要研究发表的文章最终表明,一个ICU入院时的优势肠球菌属与短期预后相关。ICU患者肠道菌群的多样性与肠道菌群肠球菌的丰度密切相关,这肯定了肠球菌的意义,可能是一种菌群失调的标志物,也与其高相对丰度导致更差的结局有关。
此外,最近对接受异基因治疗造血细胞移植患者的研究显示,饮食可能会通过改变其他肠球菌属的丰度来影响菌群失调的严重程度,而这可能会引起移植物抗宿主病(GVHD)。
多重耐药菌(MDRO)成了重症监护机构日益加重的负担。
微生物群与定植抗力
定植抗力:未发生改变的微生物群似乎是一个对抗微生物耐药的关键因素,因其有对抗外源性细菌的能力,包括具有抵抗力的细菌。
耐药菌与抗生素的使用相关
研究证实,肠道耐万古霉素肠球菌的浓度与抗生素使用(这些抗生素有显著的抗厌氧菌活性)显著相关,从而改变细菌的保护屏障并促进耐药微生物增殖。
微生物群对多重耐药菌的抑制作用
在动物模型中,梭状芽胞杆菌可减缓艰难梭菌感染,布劳特氏菌Blautia和梭状芽胞杆菌可以抑制耐万古霉素的肠球菌、乳酸杆菌、梭菌目和厌氧李斯特菌感染。
抗生素与细菌抗药性
几项研究分析并证实了给予抗生素后,细菌的抗药性增加,抗生素的使用改变增殖防御、应激、以牺牲敏感细菌,选择多重药耐药菌,如肠杆菌 (包括产生广谱β-内酰胺酶的大肠杆菌)或万古霉素耐药肠球菌属。
β-内酰胺酶菌株的影响
产生β-内酰胺酶菌株的高浓度定植也可能有影响:最近的一项动物研究表明,这些先前定植的菌株经过全身治疗后可能使肠道内的抗生素失活,因此保护微生物群免受菌群失调,这些观察为旨在保护微生物群的解决方案发展铺平了道路。
肠道去污(SDD)与细菌耐药性
作为抗生素治疗的一种特殊形式,肠道去污 (SDD) 似乎不会增加ICU细菌耐药性的出现,这看起来与直肠较低的耐药革兰阴性菌载量似乎是矛盾的。一些观察指出,SDD在ICU患者离开ICU后出现的细菌耐药性有关。
耐药微生物的临床影响
较高的相对丰度耐药微生物在微生物群中具有重要的临床影响,因为它们在促进感染的发生,直肠细菌移位和脱落,在高浓度大便中的MDRO与环境污染有关,并可能在MDRO传播中发挥重要作用。
门静脉是从脾脏和胃肠道到肝脏的主要高速公路,约占肝脏血液供应的 70%。这种解剖位置使肝脏成为清除全身性细菌感染和维持免疫系统稳态的中心位置。
肝巨噬细胞(KC)在肝脏免疫中的作用
肝巨噬细胞(KC,Kupffer Cells)位于肝窦内壁,是第一个遇到来自肠道的细菌或微生物产物的巨噬细胞群。
晚期肝病患者的KC功能受损及其后果
全身性感染是这些患者死亡的主要原因。许多此类感染是由肠道细菌易位引起的,通常导致菌血症,在更严重的情况下,会导致脓毒症。
细菌易位
细菌易位可通过分析肠系膜淋巴管或门静脉血样来证明。
在一项经典研究中,对接受开腹手术的创伤患者进行门静脉取样,血培养未发现细菌易位的证据。更灵敏的方法,如大肠杆菌β-半乳糖苷酶免疫染色或电子显微镜或分子测序,为大多数患者的肠系膜淋巴结(MLN)细菌易位提供了直接证据。
肠-肝串扰机制
人类和动物模型研究均提供了更多关于肠肝串扰机制的细节。
菌血症会增加自发性细菌性腹膜炎的风险,五分之一的住院肝硬化患者会发生自发性细菌性腹膜炎。
微生物驱动的炎症也会加重肝病。例如,结肠微生物群的改变与肝硬化并发症肝性脑病患者的内毒血症和炎症有关。
肠道菌群失调与肝脏疾病
肠道细菌失调也可能导致肝移植术后感染和器官排斥。事实上,大鼠急性肝排斥伴有肠道微生物群改变、肠道屏障完整性受损、细菌易位、血浆内毒素水平升高以及全身炎症反应。
肠道菌群失调还可引发肝脏局部炎症,促进中度肝病进展为脂肪性肝炎。
最近的一项研究表明,肠道巨噬细胞中微生物依赖性的趋化因子受体 CX3CR1 的激活对于维持肠道稳态和屏障完整性至关重要,因此对于控制脂肪性肝炎进展至关重要。
晚期肝病导致的循环异常与肠道损伤的恶性循环
由于晚期肝病通常会导致循环异常(门静脉高压、内脏血管扩张),这些事件可能形成恶性循环。肠道屏障受损会导致细菌易位,从而导致肝脏炎症和肝功能障碍,导致循环异常加剧,造成进一步的肠道损伤。
全身性炎症中的肠-肝串扰

DOI: 10.1186/s13054-016-1458-3
肝脏的防御功能
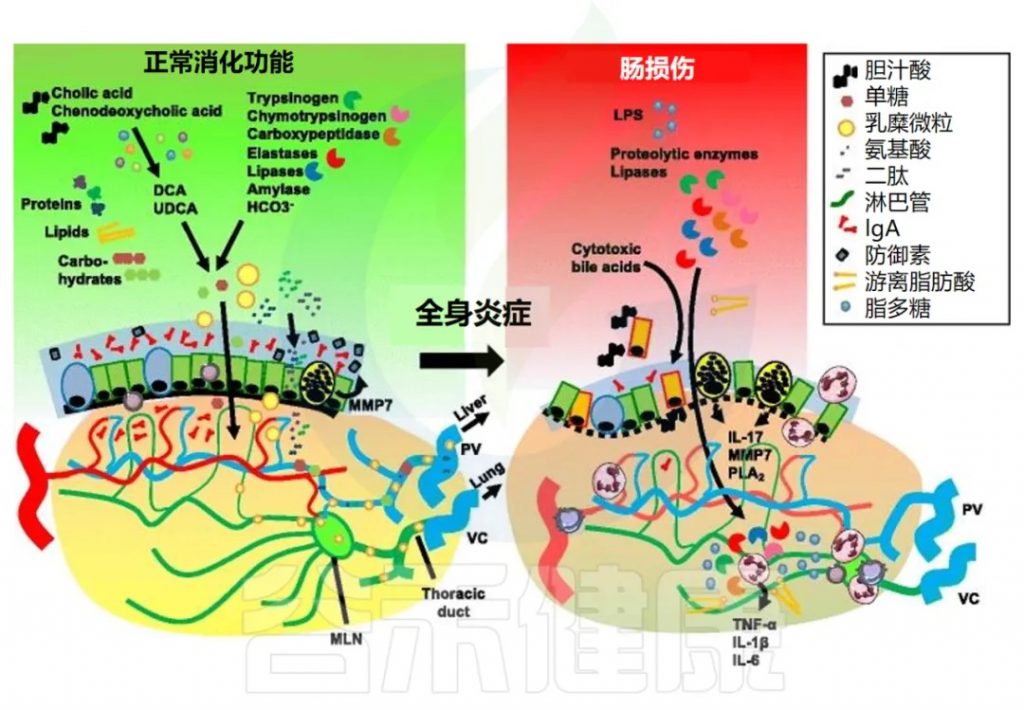
除了肝脏作为次级防火墙外,胆道分泌物和胰腺外分泌物也有严格的区域划分。胆汁酸和胰酶通过胰管排泄,促进脂质、碳水化合物和氨基酸的消化和吸收。
胆汁酸的合成与转化
初级胆汁酸在肝脏中合成为胆固醇的衍生物,例如胆酸和鹅去氧胆酸。这些胆汁酸在肠道菌群中转化成次级胆汁酸、脱氧胆酸 (DCA)、石胆酸和熊去氧胆酸 (UDCA)。
胆汁的释放与肠肝循环
胆汁在十二指肠细胞餐后产生的胆囊收缩素 (CCK) 刺激下释放到十二指肠腔内。胆汁酸与膳食脂质一起被重吸收,并通过肠肝循环返回肝脏,而饱和的消化酶通常会被排泄和消除。
胆汁酸对肠道屏障的影响
胆汁酸可能为蛋白酶突破肠道屏障并引起全身炎症反应铺平道路。重要的是,不同类型的胆汁酸对肠道屏障有不同的影响。例如,胆酸、DCA和鹅去氧胆酸在体外对肠上皮屏障表现出破坏作用,而熊去氧胆酸 (UDCA)则并非如此。
饮食与肠道屏障的关系
上皮细胞暴露于与高脂饮食相对应浓度的DCA会在体外和体内破坏上皮屏障。相反,低脂饮食中常见的DCA浓度不会影响上皮完整性。在这种情况下,肠内营养与完全肠外营养对危重患者肠道屏障的影响是高度相关的。
完全肠外营养增加肠道通透性,除胆汁酸的作用外,还可能涉及多种机制。
肠内喂养对肠道屏障的综合影响
其他研究表明,富含脂质的肠内喂养对实验性休克中的肠道屏障具有保护作用,而胆囊收缩素 (CCK) 受体拮抗剂可逆转这种保护作用。这些数据表明肠内营养对肠道屏障具有内在的保护作用。
因此,尽管肠内喂养会刺激肠腔内胆汁酸的释放,从而可能损害上皮内壁,但其对肠道屏障的有利作用似乎占主导地位。
胰腺酶对危重患者的局部和全身作用最近重新受到关注。
胰腺酶的消化功能
外分泌性胰腺的腺泡细胞分泌多种酶,这些酶在十二指肠腔内激活后可降解蛋白质(胰蛋白酶原、糜蛋白酶原、羧肽酶、弹性蛋白酶)、脂质(胰脂肪酶、磷脂酶)和糖(胰淀粉酶)。导管细胞产生碳酸氢盐 (HCO3− )。这种胰液是在胆囊收缩素 (CCK) 刺激下分泌的。
肠缺血期间胰腺酶的影响
在肠缺血期间,这些蛋白酶可能导致保护性粘液层和上皮紧密连接的降解,导致肠道通透性增加和肠壁丝氨酸蛋白酶渗透。这首先由胰管结扎得到证实,此举可减轻出血相关休克实验模型中的肠屏障破坏。防止胰酶内流进入肠腔可减少黏液层降解、降低对内皮细胞的毒性并降低循环中性粒细胞的活化。
胰酶在体内的毒性作用
当黏液层已受损时,胰酶(包括胰蛋白酶、糜蛋白酶、弹性蛋白酶、淀粉酶和脂肪酶)在体内的毒性作用会增强。相反,在肠上皮细胞 (IEC)单分子膜上增加黏液层可减轻胰蛋白酶对肠屏障的破坏作用。
活性蛋白酶易位与多器官衰竭的关系
重要的是,活性蛋白酶易位至循环系统与多器官衰竭风险增加有关,这很可能是由肠道局部自身消化过程引起的,该过程释放组织或微生物因子,从而引发全身炎症反应。
药物抑制胰腺酶的潜在益处
这些数据表明,药物抑制胰腺酶可消除这些病理生理事件,改善危重疾病的循环紊乱。
最近的一篇论文在三种大鼠实验性休克模型(出血性休克、腹膜炎和内毒素休克)中证明了这一概念,重点是丝氨酸蛋白酶。所有休克模型都会导致肠壁蛋白酶活性增加。
蛋白酶抑制剂的应用与效果
腔内注射蛋白酶抑制剂(ANGD、氨甲环酸和抑肽酶)可显著减少小肠和远处器官(心脏、肺)的组织损伤,这与显著提高生存率相关。
值得注意的是,需要直接侵入性地施用蛋白酶抑制剂才能在肠道内产生较高的腔内浓度,这限制了其直接应用于临床实践。或者,通过肠内喂养持续输送蛋白酶抑制剂已被证明在一例脓毒症休克病例中是成功的。
总之,这些数据表明,在肠道缺血条件下,胰腺酶可介导危重患者的有害局部和全身影响,如下图所示:
DOI: 10.1186/s13054-016-1458-3
肠道、体循环和远端器官之间的直接解剖学联系由来自肠道的淋巴管提供。进食后,肠系膜淋巴富含脂质(乳糜微粒)、脂溶性维生素和各种其他亲脂性大分子。这些传入淋巴管从肠绒毛尖端流向肠系膜淋巴结,最终流入胸导管、心脏和肺循环。
肠系膜淋巴结在免疫反应中的作用
在这个网络中,肠系膜淋巴结是腔内抗原被抗原呈递细胞(巨噬细胞、树突状细胞)过滤和吸收的部位,这些细胞可以指导适应性免疫反应。这种特殊粘膜免疫系统的细胞参与者在肠系膜淋巴结和固有层之间穿梭,并被肠道共生菌群分隔开来。
该过程所涉及的机制之一是分泌性 IgA 在粘液层中的沉积,这是对胃肠道异常大量细菌负荷的一种适应。
肠系膜淋巴与肝脏网状内皮系统的关系
肠系膜淋巴避开了门脉循环,从而绕过了肝脏的网状内皮系统,即由肝脏巨噬细胞介导的二级防火墙。
任何未经过滤的管腔成分,如内毒素和胰酶,以及离开肠系膜淋巴结的局部产生的细胞因子和激活的免疫细胞,都能够直接泄漏到血液循环中。
肠系膜淋巴与急性肺损伤的关系
来自肠系膜淋巴的细胞毒因子将首先通过肺循环。对肺内皮的直接毒性作用可导致急性肺损伤,最终导致 “急性呼吸窘迫综合症”(Acute Respiratory Distress Syndrome),这被称为肠-淋巴-肺轴。
肠系膜淋巴引流的作用
消除肠系膜淋巴引流可以防止由于出血性休克导致的内皮通透性过高和肺损伤。这意味着肠系膜淋巴在一定程度上参与了肺损伤的病理过程。
肠系膜淋巴液成分的研究
但是几乎所有关于肠系膜淋巴液成分的研究都是使用动物模型进行的(下表)。

DOI: 10.1186/s13054-016-1458-3
值得注意的是,研究指出细菌或其产物不是肠系膜淋巴液毒性成分的原因:
致病因素可能包括,急性期蛋白和促炎脂质介质,尤其是脂肪酶产生的游离脂肪酸(FFA)。这些成分的细胞毒性与FFA与蛋白质的比率有关,通过补充白蛋白可以逆转这种作用。
注意白蛋白的双重作用
白蛋白在休克后的肠系膜淋巴中大量上调,这是控制脂质细胞毒性的潜在补偿机制。然而,糖基化的白蛋白与内在的细胞毒性相关,因此白蛋白对肺损伤既可能有保护作用,也可能有害。
整体来看,这些发现提示肠系膜淋巴中的特定蛋白质和脂质成分在休克后对肺损伤有复杂的影响,为理解其毒性机制提供了新的视角。
谵妄是一种非特异性的急性神经功能障碍状态,表现为波动性意识模糊和认知障碍。在 ICU 中,谵妄与死亡率增加、通气和住院时间增加以及幸存者的长期认知障碍有关。
虽然对谵妄的发病机制了解甚少,但最近的研究强调了肠道菌群失调和肠脑轴异常的潜在作用。与未患谵妄的老年人相比,患有谵妄的老年人的肠道菌群组成存在显著差异,肠杆菌科细菌与意识障碍和谵妄严重程度有关。
一项孟德尔随机化研究表明,脱硫弧菌科、脱硫弧菌目、Candidatus Soleaferrea的存在会增加谵妄的风险,而草酸杆菌科、Holdemania属、Ruminococcus gnavus 属、Eggerthella 属的存在会降低谵妄的风险。
注:
Holdemania属参与肠道丁酸的产生,在维持肠道稳态和抵抗炎症方面发挥着作用。
草酸杆菌科在草酸的分解代谢中起着重要作用,草酸代谢失衡会对机体造成严重损害,如引发肾脏疾病、全身和局部炎症、心脑血管并发症等。
这些对谵妄发生率的影响的具体机制以及肠道微生物群内的相互作用需要进一步研究。
肠道菌群的双重作用:正常的肠道菌群能够合成人体必需的物质,同时也可能生成有毒物质。在特定条件下,这些有毒物质可以引发全身性的病理过程。这一假说已经存在了一个多世纪,现已被证实。
研究的快速增长:过去十年中,关于肠道轴(如肠肝轴、肠脑轴)以及肠道微生物群的研究数量呈指数级增长。这表现在相关出版物数量的显著增加,尤其是在PubMed上,从2010年至2019年,这些关键词的出版物增长倍数分别是12倍到61倍不等。
下面将讨论具有全身毒性的细菌来源物质以及含氮营养物质(蛋白质、氨基酸、氨基醇、磷脂)和脂多糖的降解产物。
脂多糖(LPS)的特殊作用
肠道微生物产生了大量的LPS,即使在健康个体中,血液中也可能检测到LPS。LPS通过多种途径穿过小肠和结肠,大多数情况下通过门静脉到达肝脏。
内毒素水平
成人结肠食糜中革兰氏阴性细菌脂多糖混合物(称为内毒素)的含量为 2.5 g/L。在血浆中,它要低 9 个数量级:10 ng/L 左右,这是巨噬细胞和内皮细胞炎症激活的阈值。
LPS水平在不同疾病中的变化
该值在牙周炎、糖尿病、肝硬化和阿尔茨海默病中适度增加,在脓毒症中达到 500 ng/L。血浆中内毒素水平升高可定义为内毒血症。
内毒素与TMAO
血浆内毒素和 TMAO 水平呈正相关。在血浆中,内毒素既以具有生物活性的游离形式存在,也以与血液蛋白的复合物形式存在,这在实验室研究中并不总能检测到。
内毒素的生物学效应
内毒素具有明显的内皮毒性,表现为氧化应激、糖萼破坏、白细胞粘附、血管痉挛和血栓形成以及血脑屏障通透性增加。血液中内毒素含量是脓毒症的典型特征,会导致细胞因子风暴和脓毒症休克。
不同细菌LPS的促炎特性
大肠杆菌脂多糖的促炎特性比普通拟杆菌(Bacteroides vulgatus)和多氏拟杆菌(Bacteroides dorei)脂多糖强得多。
LPS的转运途径
小肠:旁细胞途径、网格蛋白介导的内吞作用、微胞饮和脂筏介导的内吞作用、杯状细胞相关抗原通道和乳糜微粒途径。
结肠:网格蛋白介导或囊泡介导的蛋白质转运途径。
脓毒症对LPS转运的影响
肠道屏障受损会导致大量LPS进入体循环,引发不受控制的免疫炎症反应。
LPS的处理和解毒
肝脏通过清道夫受体(SR)吞噬LPS。
酰基水解酶(AOAH)和碱性磷酸酶负责解毒。
AOAH去除脂质A部分的二级脂肪酰基链,控制LPS毒性。
血浆中的LPS结合蛋白
LPS结合蛋白(LBP)、CD14、杀菌/通透性增加蛋白(BPI)和脂蛋白。
LBP主要由IEC和肝细胞产生,促进LPS与免疫细胞的相互作用。
LPS诱导的信号通路
TLR4信号通路包括:MyD88依赖性、非依赖性和IFN-β依赖性通路。
这些通路导致细胞因子增加和细胞损伤。
保护机制
高浓度的LBP和可溶性CD14,可能有助于限制LPS的有害反应。
BPI在肠上皮中表达,可能作为一种保护机制。
健康影响
内毒素会引起血栓素依赖性肺血管收缩,在较高浓度下(脓毒症休克的典型症状)会引起全身血管扩张和肺动脉高压。内毒素血症会增加血脑屏障对内毒素和其他物质的通透性,增加肺毛细血管的通透性,引起非心源性肺水肿,并损害肝脏和肾脏的功能。
LPS 激活的 TLR4 信号通路概述
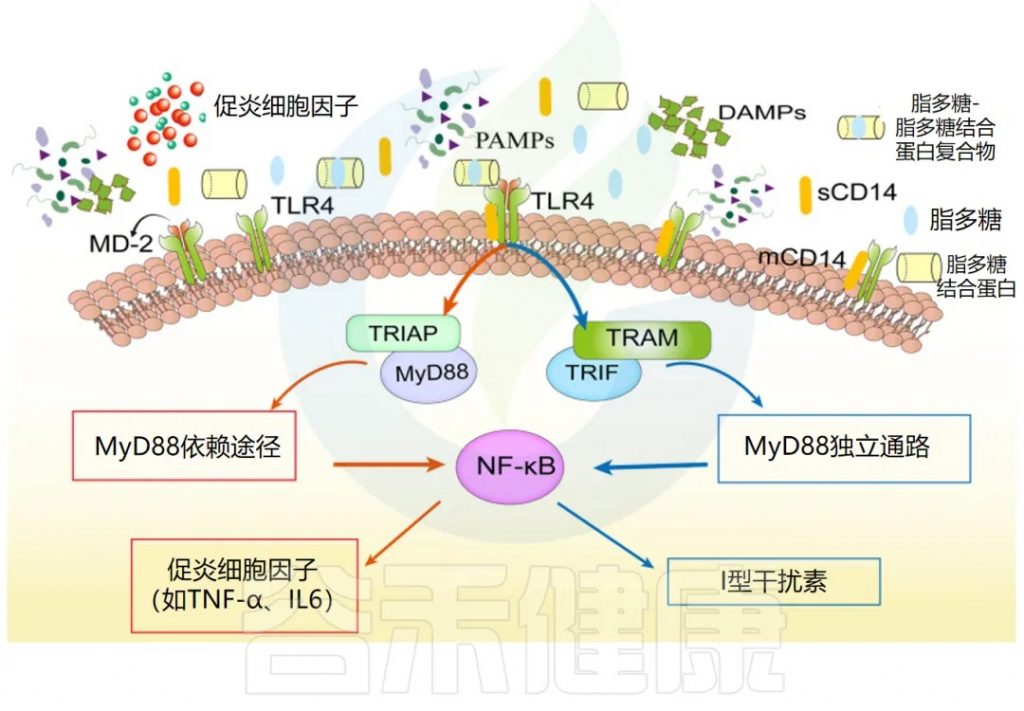
doi.org/10.1186/s13054-022-04090-1
LBP 和 CD14 促进 LPS 识别,由 TLR4 和 MD-2 受体复合物介导。TLR4 信号激活分为 MyD88 依赖性、MyD88 非依赖性和 TRIF 依赖性通路,介导促炎细胞因子 (TNF-α、IL-6 等) 和 I 型干扰素基因的激活。
IL,白细胞介素;LBP,LPS 结合蛋白;LPS,脂多糖;
MD-2,髓系分化-2;MyD88,髓系分化因子 88;
TLR4,Toll 样受体 4;
TRIF,Toll/IL-1R 结构域含衔接子诱导 IFN-β;
TNF,肿瘤坏死因子
胃肠道中氨的产生
胃肠道占体内产生的氨的至少 2/3。在肠细胞中,氨形成的主要机制是谷氨酰胺酶反应,而在大肠中,则是细菌的代谢活动:氨基酸和含氮碱基的脱氨作用,以及从血液扩散到粘膜腔面的尿素的水解。
肠道菌群与氨的产生
与结肠粘膜相关的微生物的尿素分解活性是肠道菌群产生的氨的一半来源。大鼠大肠食糜中的氨含量是小肠的三倍:分别为 45 和 15 mmol/kg。
氨的循环与肝脏的作用
氨从肠食糜中通过门静脉和经腹膜扩散进入全身循环。在一天中,健康人约有4克氨从肠道进入血液(主要通过门静脉)。
注:门静脉是一条主要的静脉血管,负责将肠道以及胃、脾、胰腺的血液,输送到肝脏。其主要功能是从胃肠道收集富含营养物质的血液,并输送到肝脏进行处理、代谢和解毒。门静脉系统在维持体内生理平衡和代谢稳定方面起着重要作用。
由于在肝脏中被中和,肝静脉血浆中的氨浓度比门静脉血浆中的氨浓度低2-3倍,而且显著低于源自结肠的肠系膜静脉血浆中的氨浓度。也就是说,肝脏在处理氨方面起到了显著作用。
动脉血浆中的氨浓度
动脉血浆中的正常氨浓度([NH3] + [NH4+])为30 µM。
氨的神经毒性及其症状
随着氨浓度的增加,逐渐出现神经毒性。早期的研究(I.P. Pavlov的实验室)表明,高水平的氨会导致毒性症状。
具体症状:
注:共济失调(Ataxia)是一种影响个人协调和控制运动功能的神经系统障碍。它通常表现为不稳的步态、手部和身体的协调性差、精细运动能力下降以及平衡困难。
大肠中的氨池
体积和浓度:大肠食糜的平均体积为0.4升,氨的含量为5.7–39.0 mM。
总氨量:大肠内总氨池为2.3–15.6毫摩尔。
氨的潜在扩散
假设均匀分:如果这些氨均匀分布在血液(5升)、淋巴液(2升)和大肠食糜中,会显著提高血液中的氨水平。
严重后果:这种分布将导致血液中的氨含量增加到311–2108 µM,远远超过昏迷阈值(200 µM),导致严重的神经毒性乃至昏迷。
总结来说,肝脏在保持氨浓度在安全范围内起到了关键作用。如果氨从肠道中大量扩散到血液中,可能会导致严重甚至致命的神经毒性反应。因此,理解氨的代谢和扩散过程对于预防和处理氨中毒具有重要意义。
氨的细胞内扩散与pH关系
氨以非离子形式NH3进入细胞。在pH = 7.36时,这对于正常血浆是典型的(考虑到氨的碱性常数pKa = 9.15,t = 37°C),NH3形式的比例约为1.6%。在细胞质中,pH较低,这导致即使在血液中氨含量正常的情况下,氨也会扩散进入细胞。在代谢性酸中毒或气体性碱中毒时,血浆和细胞质之间的pH差异增加,从而加剧了沿 NH3浓度梯度向细胞供应氨。在这些情况下,即使没有高氨血症,也有可能出现毒性作用。
氨对血管内皮细胞的毒性作用
氨不仅对神经系统有毒性作用,还对血管内皮细胞具有毒性。
引起氧化应激和NO积累:导致细胞内自由基和反应性物质的增加。
增加细胞通透性:使内皮细胞的膜更容易让大分子物质通过,这可能会破坏血脑屏障的完整性。
引起星形胶质细胞肿胀:氨处理的内皮细胞培养基可以引起星形胶质细胞的肿胀,这可能与脑水肿的形成有关。
破坏细胞外基质和增加旁细胞通透性:高浓度氨会破坏细胞外基质,进一步增加内皮细胞单层的旁细胞通透性。
这些影响表明,在高氨血症情况下,氨不仅直接影响神经元,还可能通过破坏血管内皮细胞,间接导致脑水肿和其他脑部病理变化。这为理解氨毒性在多个层面的影响提供了重要的见解。
氨与TLR4的激活
在内皮细胞中,氨激活了负责对内毒素炎症反应的Toll样受体4(TLR4),这导致氧和氮自由基的过度产生,内皮细胞肿胀,以及其对参与肝性脑病病理过程的物质的通透性增加。
高氨血症导致脑小动脉扩张
高氨血症导致了依赖于内皮细胞的一氧化氮介导的脑小动脉扩张,这可能在急性肝功能衰竭中导致颅内压增加和脑水肿。
氨对血脑屏障通透性的影响
静脉注射乙酸铵到兔子体内增加了血脑屏障(BBB)对聚乙二醇PEG400的通透性,慢性肝性脑病患者的血脑屏障通透性也增加了。
因此,这些机制表明,氨对血管内皮和脑部环境的多重负面影响,这对于理解肝性脑病和其他高氨血症相关脑病的发生和发展十分重要。这些发现强调了有效管理氨水平和保护血脑屏障的重要性,以预防相关脑损伤。
三甲胺-N-氧化物的形成与功能
三甲胺-N-氧化物(TMAO) 是一种对人类来说很基本的氨衍生物,其有用功能(作为渗透压物质)在海洋动物中得以保留。它是在肝脏中由梭菌、大肠杆菌、肠杆菌、不动杆菌、变形杆菌在结肠腔内氧化三甲胺(L-肉碱、胆碱、卵磷脂或甜菜碱的分解产物)而形成的。
血浆中TMAO的浓度与影响因素
血浆中三甲胺的浓度比 TMAO 的浓度低 38 倍。健康人血浆中 TMAO 浓度的数据在 6 个月内每天摄入1.5克L-肉碱的情况下从 0.17-34.62 μM 不等。它还会随着肠道菌群中 Gammaproteobacteria比例的增加而增加。
饮食与TMAO的关系
当小鼠被转移到富含胆碱的饮食中时,其血液中的 TMAO 含量会增加。无菌 (无细菌) C57BL/6J 小鼠即使接受富含胆碱的饮食,其血液中也缺乏 TMAO。将这些小鼠转移到非无菌环境中会导致其血液中出现 TMAO。
TMAO的全身毒性及其表现
TMAO 的全身毒性表现为全身炎症。在评估血液中 TMAO 水平升高引起内皮氧化应激的能力时,有相互矛盾的数据,既存在也不存在此类迹象。
体外实验显示,TMAO 具有诱发血管痉挛的能力。血浆三甲胺氧化物 (TMAO) 水平升高与心血管疾病 、肝脂肪变性、肾纤维化和血栓形成有关,并且会增加房颤血栓栓塞的风险。
一些研究表明,循环系统疾病与三甲胺水平有关,而与三甲胺氧化物 (TMAO) 无关。
调节TMAO水平的方法
口服抗生素可阻止补充卵磷脂或肉碱后血液TMAO水平上升。
肠道菌群的作用
特定肠道菌株的移植可以显著改变TMAO水平和血液凝固特性。
研究显示,非血栓性小鼠的肠道物质移植不会影响无菌小鼠的TMAO水平,而促血栓性小鼠的移植则会增加TMAO和凝血。
因此,血液中高浓度的TMAO 和/或三甲胺会增加全身炎症、血管痉挛、血栓形成、肝损伤和肾损伤的风险。
吲哚是色氨酸的代谢物,在大肠中,梭菌将其代谢为 3-吲哚丙酸,乳酸杆菌将其代谢为吲哚-3-醛,以及许多表达色氨酸酶但不代谢吲哚的细菌相互竞争。在后一种情况下,游离吲哚进入肝脏,在那里被酰化形成吲哚硫酸盐和吲哚乙酸盐。与分别具有神经保护和免疫调节特性的 3-吲哚丙酸酯和吲哚-3-醛不同,吲哚硫酸盐和吲哚乙酸盐具有内皮毒性。
它们在血液中的积累与慢性肾衰竭和心血管疾病风险有关。正常情况下,血浆中硫酸吲哚酚的含量为 10−7-2.4×10−6 Mol,慢性肾衰竭时血浆中硫酸吲哚酚的含量为2.5×10−4-5.0×10−4 Mol。
对甲酚硫酸盐的形成与来源
对甲酚硫酸盐是在大肠上皮细胞和肝细胞中通过对甲酚的硫酸化形成的,对甲酚是芳香族氨基酸酪氨酸和苯丙氨酸脱氨和脱羧的产物,在拟杆菌科、双歧杆菌科、梭菌科、梭杆菌科、毛螺菌科、乳酸杆菌科、卟啉单胞菌科、葡萄球菌科、瘤胃球菌科和韦荣球菌科的细菌参与下形成。每天,大肠中都会形成 50-100 毫克对甲酚。
对甲酚硫酸酯在慢性肾衰竭中的影响
对甲酚硫酸酯在慢性肾衰竭患者血浆中浓度为 116–568 μM,而正常浓度为 15–35 μM,具有内皮毒性。肺水肿患者血液中对甲酚硫酸酯含量增加。给小鼠施用对甲酚硫酸酯可增加肺毛细血管通透性,激活白细胞,增加自由基氧物质的产生,并导致细胞死亡和间质性肺水肿。
吲哚硫酸盐、吲哚乙酸盐和对甲苯磺酸盐的肾脏清除率
吲哚硫酸盐、吲哚乙酸盐和对甲苯磺酸盐的肾脏清除率较低,因此在肾衰竭时会在血液中蓄积。正常情况下,这些物质的血浆池中 95–97% 以与白蛋白的复合物形式存在。
在肾功能不全时,它们以游离形式存在的含量会增加,同时伴有内皮毒性的增加。表现为炎症、血管痉挛、缺血、血栓形成、组织胰岛素抵抗和多器官衰竭的发展,以及现有疾病心血管并发症风险的增加。
单胺的形成与肠道细菌的作用
单胺是在肠食糜中由氨基酸在可诱导脱羧酶的作用下形成的,其中一些脱羧酶依赖于磷酸吡哆醛。肠道细菌的脱羧酶活性最高。在新生儿的肠食糜中,单胺含量微不足道,但随着细菌在胃肠道的定植而增加。
微生物群与单胺的形成
微生物群从 L-酪氨酸形成对酪胺和对章胺,从 L-色氨酸形成色胺和血清素,从组氨酸形成组胺。进入门静脉系统的单胺量通常不超过肝脏中和它们的能力,主要通过结合。在内皮功能障碍中,肝脏中单胺合成增强和(或)结合受损,导致血液中单胺含量升高。
单胺的血管收缩作用
酪胺、色胺、章鱼胺和血清素在释放到血液中时,具有血管收缩作用。章鱼胺输注会导致猪出现过度换气和肺静脉-动脉分流增加的低氧血症。
血液中血清素的积累会导致血清素综合征
其症状包括心动过速、动脉高血压、高热、血液凝固增加,严重的情况下还会出现横纹肌溶解症和多器官衰竭。
组胺会导致支气管痉挛,参与炎症的发病机制,增加血液粘度,并损害微循环。
单胺的全身生物活性与急性中毒并发症
肠道菌群产生的单胺的全身生物活性的特点是它们对血液循环、肺部气体交换过程、血液凝固和(或)炎症的影响。这决定了单胺参与急性中毒并发症发病机制的可能性,即:心血管疾病、脓毒症、凝血病和继发性急性肺损伤。
直接肠毒性物质
乙醇、多种霉菌毒素、砷和重金属盐均具有直接的肠道毒性。
非甾体抗炎药的应用
非甾体抗炎药因其特殊毒性可用于急性胃肠炎的实验模型。类似地,葡聚糖硫酸盐和2,4,6-三硝基苯磺酸盐用于急性结肠炎的实验模型。
霉菌毒素的作用
某些霉菌毒素通过增强内毒素的作用加剧肠炎的炎症损伤,例如,霉菌毒素T-2和脱氧雪腐镰刀菌烯醇能增加肠炎时对聚乙二醇PEG 4000的通透性。
肠黏膜通透性增加的原因
除了外来化合物或其代谢产物直接损伤肠道上皮和血管内皮,急性中毒中常见的急性缺氧、胃肠道平滑肌痉挛和胃肠道淤滞也会增加肠黏膜通透性。
机体危急状态下的急性肠道缺氧是由外部呼吸和血液循环障碍引起的。在急性严重中毒中,此类状态包括外毒性休克,在没有呼吸支持的情况下,呼吸中枢抑制、神经肌肉阻滞和支气管阻塞综合征。由于血液循环集中,胃肠道比维持身体生命活动的最重要器官(即大脑、肺和心脏)经历更深的缺氧。
▸ 急性肠道缺氧的原因:
• 外部呼吸和血液循环障碍
• 外毒性休克
• 呼吸中枢抑制、神经肌肉阻滞和支气管阻塞综合征
▸ 缺氧对肠道的影响:
• 肠细胞特别容易受到ATP氧化再合成中断影响
• 可导致炎症、溃疡和出血
• 增加肠内皮通透性
▸ 缺氧的实例:
• 高原反应中的肠道损伤
• 运动中的气体缺氧导致细胞因子水平升高和肠通透性增加
• 溶血性贫血和急性失血中肠通透性增加
▸ 细胞毒素的作用:
• 抑制能量代谢酶或解偶联氧化磷酸化
• 加剧生物组织的能量不足状态
• 破坏结肠上皮细胞对大肠杆菌的屏障功能
▸ 氧化磷酸化的重要性:
大肠粘膜中氧化磷酸化活性更高的小鼠对某些损伤具有更强的抵抗力
▸ 小肠 vs 大肠:
• 小肠的黏膜下毛细血管丛比大肠发达
• 大肠对缺血性损伤更敏感
▸ 缺氧对黏膜的影响:
• 减少肠道黏蛋白的形成
• 导致黏膜发生炎症变化
总的来说,缺氧对肠道健康的重要影响,以及各种因素(如毒素、能量代谢变化)如何加剧这种影响,从而导致肠道功能障碍和相关健康问题。
胃肠道平滑肌痉挛是胆碱酯酶抑制剂和血清素类药物中毒的特征性症状之一,但也可能是血液循环集中引起的急性缺氧反应,或肠杆菌产生的血清素对肠道平滑肌产生痉挛作用的结果。
大肠的血清素刺激除了自身平滑肌痉挛外,还伴有微血管动脉痉挛。有人提出了肌肉痉挛-缺血-疼痛三联征是肠易激综合征中肠易激通透性增加的一个因素的假说。在急性中毒中,肠易激对此类变化的反应可能相似。
▸ 胃肠停滞的危害
在复苏和重症监护室患者中,胃肠停滞是一个潜在的致命并发症,常见于阿片类药物、胆碱能拮抗剂和血清素激动剂的毒性作用下。这种情况也典型地发生在伴有昏迷的严重中毒和烷基化物质急性中毒时。
▸ 肠道菌群的影响
在停滞状态下,肠道菌群产生的有害物质通过肠壁的通透性增加。停滞加剧了细菌生长而未被清除,导致肠腔内毒性物质特别是氨的浓度升高,氨的细胞毒性作用加剧对结肠细胞的损伤,进一步减少黏蛋白的产生。
▸ 继发性肠炎功能障碍
继发性肠炎功能障碍:急性疾病中会出现继发性肠炎功能障碍,这是由于直接损伤、胃肠停滞、缺氧和胃肠组织平滑肌痉挛导致的。此功能障碍增加了肠道对菌群代谢物和细菌成分的通透性。
▸ 毒性物质和内毒血症
继发性肠炎功能障碍结合肠道菌群毒性物质产生的增加和气体形成,促进了毒性物质进入全身循环并可能导致内毒血症,这在急性严重疾病中形成了一个恶性循环。
总之,胃肠停滞和继发性肠炎功能障碍在疾病恶化中扮演重要角色,尤其是在急性毒性和严重病患中,需要密切监测和适当处理。
严重的内毒素血症和高氨血症是休克的典型症状。在脓毒症、创伤性和出血性休克中观察到血液中内毒素水平升高。在实验中,通过给动物施用内毒素可以重现脓毒症休克。
因心脏骤停而入住重症监护室的患者血浆中的氨浓度比有自主循环的患者高 4.8 倍。在胰岛素和热休克期间,狗和兔子的血浆和脑组织中的氨含量会增加很多倍。通过给动物施用铵盐,可以重现胰岛素和热休克的主要症状。
失血性休克时,内毒血症的来源是肠道。内毒血症的发生分为三个阶段:
1)肠道组织和门静脉血液中低分子量和中等分子量物质含量增加;
2)体循环中这些物质含量开始增加;
3)门静脉和颈动脉血液毒性达到同等程度。
急性脑功能不全(ACI)
这是由弥漫性脑损伤引起的急性中枢神经系统功能障碍。ACI常发生在严重中毒的情况下,临床表现包括意识模糊、运动障碍、分解代谢加速以及中枢性急性呼吸和循环障碍。虽然其特征性不强,但它是危及生命的状态。
发病机制:ACI的发病机制尚不完全清楚,可能与急性缺氧及随之而来的介质混乱有关。
细菌代谢物的影响:细菌代谢物(如内毒素和氨)参与了急性脑梗死的发病机制。高氨血症与急性肝衰竭、脑水肿和颅内压升高有关,并可加剧缺氧的影响。
实验研究:在动物模型中,高氨血症通过加重血液和脑中的氨和谷氨酰胺积累,促进了与氨盐中毒症状相似的神经系统疾病的发展。
内毒素的作用:内毒素增加动物对急性脑缺氧的敏感性。实验表明,内毒素可以加剧脑损伤,特别是在缺氧条件下。
复杂病理状态的参与:文献数据表明,内毒素和氨可能在脓毒症、急性循环系统疾病、第二性急性肺病变以及急性脑功能不全等多种病理状态的发病机制中发挥作用,复杂化急性中毒。
总之,急性脑功能不全是一种复杂的病理状态,细菌代谢产物如内毒素和氨在其发病机制中可能发挥了重要作用,特别是在加剧中毒和缺氧条件下的神经损伤和代谢紊乱。
全身炎症中肠道与其他器官之间的直接和间接相互作用
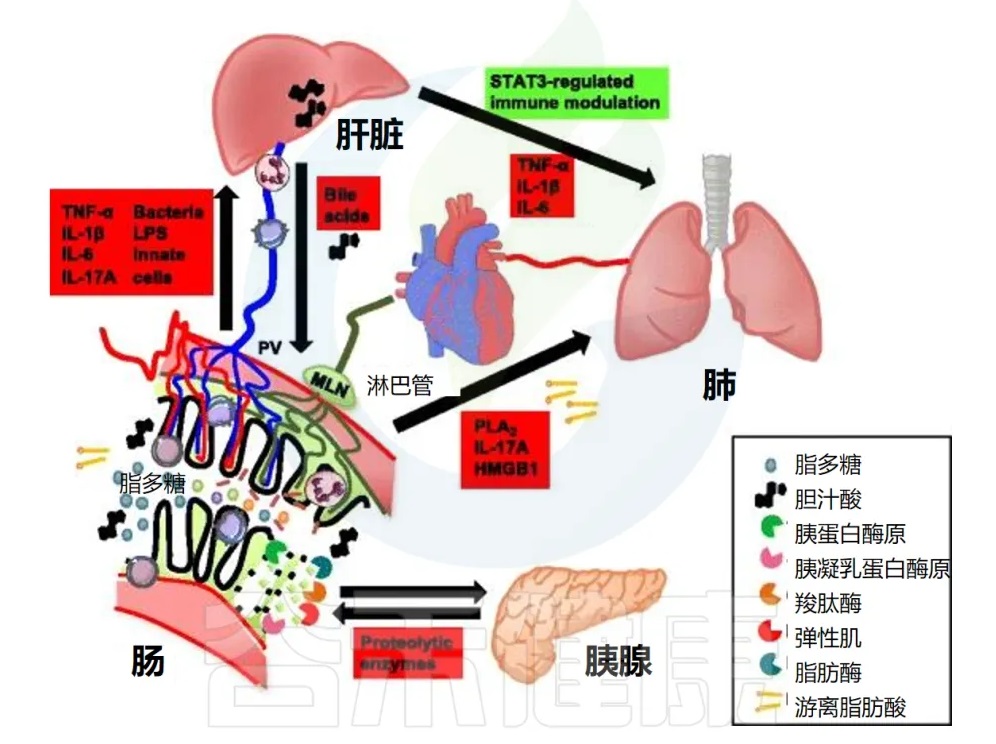
DOI: 10.1186/s13054-016-1458-3
小肠腔内成分可通过门静脉 ( PV ) 和肝脏扩散到血液循环中。这包括促炎成分,例如脂多糖 ( LPS )、细菌 DNA、全细菌、其他细菌产物和游离脂肪酸 (FFA)。
肠腔内的毒性成分,包括 FFA、磷脂酶 A2 ( PLA 2 ) 的炎症产物、促炎细胞因子(例如IL-17)和损伤相关分子底物,例如高迁移率族蛋白 1 ( HMGB1 ),可通过肠系膜淋巴到达肺循环。来自肝脏的胆汁酸,包括胆酸、DCA 和鹅去氧胆酸,会介导对肠上皮细胞的细胞毒性作用。
肝脏巨噬细胞 (KC) 中的 STAT3 信号在稳态条件下保持耐受性,而 KC 在全身炎症中会产生高水平的促炎细胞因子,对肺实质产生毒性作用。
最后,胰腺产生的活性丝氨酸蛋白酶、弹性蛋白酶和脂肪酶可导致肠道组织局部组织破坏和免疫细胞激活,从而加剧全身炎症反应。
对胃肠道和全身炎症系统之间密切关系的基本了解有望在未来为危重疾病带来更有效的治疗方式。
肠道上皮完整性和通透性
目前尚无针对重症患者床边肠道上皮、通透性或黏液的治疗方法。但已有多种临床前策略可能成为未来的潜在目标。例如,在盲肠结扎和穿刺或肺炎假单胞菌感染后,表皮生长因子(EGF)改善肠道细胞凋亡、增殖和通透性,即使在脓毒症发作 24 小时后开始使用也是如此。
肌球蛋白轻链激酶(MLCK) 的膜通透性抑制剂可改善小鼠急性酒精中毒和烧伤后的肠道通透性并防止 occludin 和 ZO-1 减少。使用黏液替代物也可以预防创伤/出血性休克引起的肠道损伤。
选择性消化道净化 (SDD) 针对的是致病性肠道细菌,与益生菌和FMT相反。多项研究和荟萃分析表明,SDD 可有效降低来自低抗生素耐药性环境的死亡率。SDD 仍然存在争议,因为理论上人们担心它可能诱导多种药物耐药性。
上皮屏障靶向治疗
由于 claudin-2 在门控旁细胞通道形成和紧密连接TJ通道调节中的作用,它可能是调节上皮屏障的理想治疗靶点 。事实上,调节 TJ 通道门控动力学和蛋白质分子间相互作用可能对炎症相关屏障失效(如 occludin S408 去磷酸化)具有治疗价值。然而,还需要更多的研究来确定调节门控活性以用于治疗目的的药理学方法。
此外,microRNA-155 可减轻脓毒症小鼠的炎症和肠道屏障功能障碍,通过抑制 NF-κB 信号传导降低 TNF-α 和 IL-6 水平。
针对肠道微生物群
可以通过增加“有益健康”的细菌、减少“致病”的细菌或防止细菌毒力因子的改变来靶向微生物群。许多方法已在患者身上尝试,结果各不相同。
益生菌是活的非致病性微生物,有助于保护肠道屏障,抑制病原体传播,最大限度地减少细菌移位,并预防感染。
尽管如此,一项流行病学调查中的基因组分析发现,在 ICU 患者中,有 6 例独立的事件发生益生菌从胶囊转移到血液,导致菌血症。
益生元是不可消化的膳食成分,其中大部分由不可消化的寡糖组成,可特异性地促进有益肠道微生物群的发育和代谢,改善肠道菌群的平衡,有益于人体健康。在小鼠脓毒症模型中,补充纤维素与全身炎症部分减少有关,这表明微生物具有生存益处。
粪便微生物移植 (FMT) 可挽救由脓毒症患者病原体引起的致命脓毒症,这与产丁酸拟杆菌的扩散、病原体清除的改善以及通过干扰素调节因子 3 恢复宿主免疫力有关。FMT 可能是治疗脓毒症的一种选择;然而,供体筛查是必要的,以防止可能导致不良感染的细菌扩散。此外,重要的是要考虑 FMT 在不同患者群体中的优势和风险。
材料选择
一个完全不同的策略是使用吸收性材料来防止肠源性毒素和细菌产物进入血液循环和肝脏。事实上,针对高钾血症和高磷血症的阳离子交换树脂已显示出疗效。
不可吸收的纳米孔碳降低了接受胆管结扎的大鼠的门静脉压力和肝脏生化标志物,从而降低了内毒素诱导的肝脏巨噬细胞刺激。因此,通过针对肠肝轴,吸附材料是脓毒症的一种可能的治疗策略。
高密度脂蛋白(HDL)
作为一种潜在的治疗方法,一项研究表明,HDL 能够中和 LPS,并通过小鼠体内 SR-BI 介导的 LPS 摄取加速 LPS 清除。HDL 颗粒上的大量载脂蛋白 (Apo) 在清除内毒素、预防感染方面发挥着至关重要的作用。
例如,当LPS与Apo AI或Apo E结合时,对 LPS 的炎症反应会受到抑制,但 Apo AII 和 Apo CI 与 LPS 结合会增强炎症。
一项对 63名严重脓毒症患者的研究表明,第 1 天 HDL 水平 < 20 mg/dL 和 Apo AI < 100 mg/dL 与总体和脓毒症相关的 30 天死亡率增加、重症监护病房住院时间延长以及医院内获得性感染有关。
重组 HDL 输注可减轻大鼠肺、肝和肠道中内毒素诱导的组织学组织损伤。此外,小鼠的 111-铟细菌标记突显了 HDL 摄取可能促进肝脏细菌清除的可能性。因此,HDL 可能是未来脓毒症预防和治疗的重要目标。
肠内给药聚乙二醇结合磷酸盐
目前尚无临床治疗手段可以防止细菌中新毒力因子的诱导。然而,基础研究表明,细菌感知腔内磷酸盐和磷酸盐缺乏在诱导毒力方面起着关键作用。因此,腔内(而非静脉内)磷酸盐的充足有可能诱使细菌“相信”患病宿主是健康的。临床前数据表明,肠内给药聚乙二醇结合磷酸盐可提高小鼠腹腔内脓毒症的存活率 。
总之,系统性肠炎保护措施包括纠正肠道菌群的组成,旨在抑制其细胞毒性物质的形成和炎性细胞因子的产生。继发性肠炎功能障碍的紧急预防包括消除胃肠道器官的缺氧和炎症,以及使用药物保护粘膜免受食糜的侵害。
危急状态处理
在身体处于危急状态时,治疗需要纠正病理机制,包括胃肠道的急性缺氧。早期氧疗可能有助于预防内毒症,与其急性缺氧会增加氨的毒性作用相辅相成。
抗缺氧剂的使用
包括氙气、一氧化氮 (II)、氢气和硫化氢在内的气体混合物可作为氧疗的重要补充。这些混合物具有神经保护作用,并可能对心脏有益。
炎症的管理
消除炎症是治疗的一重要部分。如氢化可的松在一定剂量下可以预防败血症模型中的大鼠功能障碍和内毒血症。
益生元的作用
益生元对肠炎具有保护作用,尤其是那些能够在肠粘膜上形成保护屏障的物质(如果胶和单宁酸明胶),可以防止微生物群产生的有害物质进入血液。
益生元屏蔽作用时间
这种屏蔽作用在小肠吸收剂运输期间发挥,其保护作用时间在服药后10-48分钟至160-288分钟之间。
整体而言,益生元、氧疗、抗缺氧剂及抗炎药物共同构成了一套应对肠炎及相关危机状态的综合治疗方案。
ICU 患者的主要微生物群变化和恢复菌群失调的可用方法
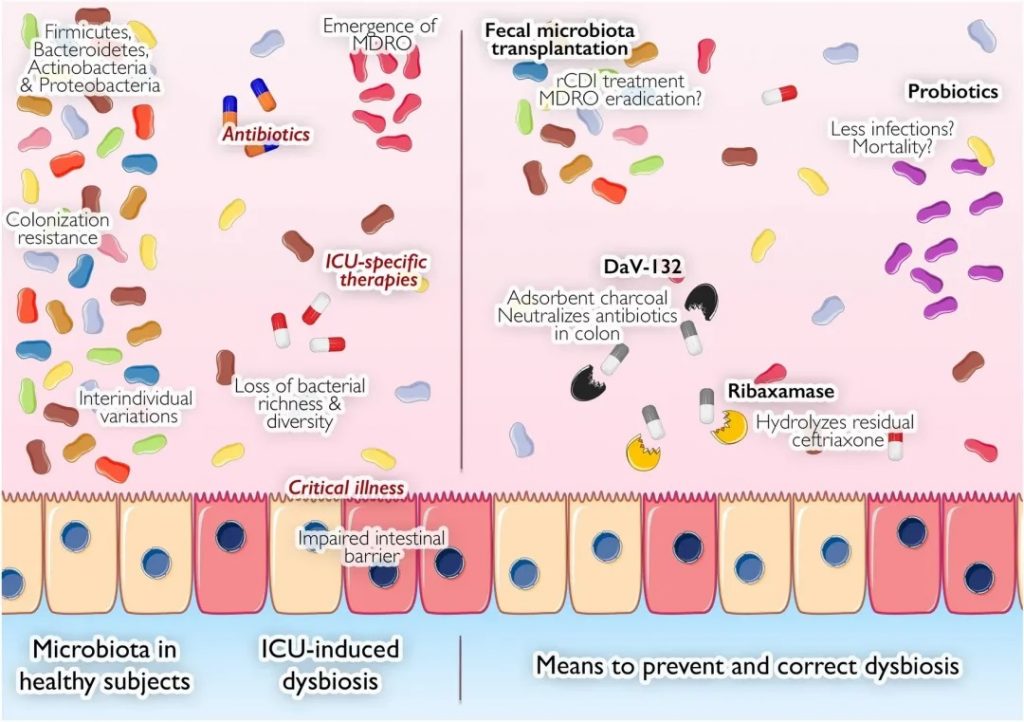
doi.org/10.1186/s13613-021-00976-5
预防菌群失调的有前景的方法正在出现,并在ICU中有潜在的应用。
◆ β-内酰胺酶使用
在患者接受β-内酰胺类抗生素治疗时,服用这种酶以分解在肠道中的抗生素,从而减少其对肠道有益菌的破坏。
应用场景:尤其适用于接受广谱抗生素治疗的患者,以预防艰难梭菌感染(CDI)和其他与菌群失调相关的疾病。
在接受β-内酰胺类药物治疗的患者中使用β-内酰胺酶显示出对微生物组完整性的保护作用。利巴克酰胺酶是一种具有上述作用的药物。它来源于地衣芽孢杆菌的β-内酰胺酶,可水解肠道中残留的头孢曲松和其他β-内酰胺残基,具有优异的耐受性和不变的药代动力学。
在动物研究中,使用利巴克酰胺酶可防止抗生素给药后微生物多样性的改变。作为Ambler B类β-内酰胺酶,利巴克酰胺酶在体内不受β-内酰胺酶抑制剂(如他唑巴坦或舒巴坦)的影响。在 I 期研究表明利巴沙姆酶耐受性良好之后,最近发表的首项 II 期研究似乎证实,静脉注射头孢曲松后,利巴沙姆酶辅助治疗降低了 CDI 风险。
◆ 吸附活性炭使用
服用吸附性非特异性活性炭,它能在结肠中捕捉和中和抗生素,从而保护肠道微生物群。
应用场景:适用于需要长期抗生素治疗的患者或者在医院环境下接触多重耐药菌的患者。
另一种从消化道中消除抗生素以避免其影响的创新可能性是使用吸附性非特异性活性炭,口服给药并中和结肠中的残留抗生素,而不会改变回盲部向上的消化吸收。如:DaV-132 已在 I 期临床试验中进行了测试,受试者为接受一天阿莫西林治疗的健康受试者,在接受较长疗程莫西沙星治疗的患者中,DaV-132 显示出很高的抗生素吸收能力(> 99%)。最近,这种治疗方法显示出降低艰难梭菌感染动物死亡率的潜在迹象;针对艰难梭菌结肠炎高风险患者的研究正在进行中。
◆ 合理使用抗生素策略
通过选用窄谱抗生素、适当缩短抗生素疗程和采用降阶梯治疗方案来减少抗生素对肠道的影响。
应用场景:医院和诊疗机构,特别是在重症监护单位和其他高风险环境中应用。
截至今天,这种预防抗生素相关菌群失调的方法是由抗生素管理推动的,即尽可能优先选择对肠道影响较小的药物和剂量。
研究表明,即使短暂接触广谱抗生素也会增加耐药性的风险。换句话,即使没有确凿证据证明降阶梯治疗对细菌耐药性的出现有特定影响,从广谱抗菌药物降阶梯至窄谱或生态影响较小的药物仍然是重症患者需要考虑的重要事项,正如国际指南中提到的那样。
到目前为止,大多数医生都是以减少抗菌谱为基础进行降阶梯治疗,但这并不是其对肠道菌群影响的唯一决定因素。例如,亚胺培南的抗菌谱非常广,但其对肠道菌群的影响尚未证实。在为患者确定合适的抗生素时,仍然需要精确的数据来考虑与菌群相关的因素。
◆ 益生菌和合生元使用
补充有助于维持肠道健康的特定益生菌菌株,或结合使用益生元来促进这些有益菌的生长。
应用场景:在抗生素治疗期间或之后使用,以帮助恢复和维护肠道菌群的平衡。
在ICU中,这些疗法的使用发表了迄今为止最大规模的益生菌荟萃分析(2700名重症患者)后得到了澄清。该研究纳入的试验使用了许多益生菌:主要是布拉氏酵母菌、乳酸杆菌属和双歧杆菌属。重要的是,使用益生菌与感染率降低(尤其是呼吸机相关性肺炎 VAP)和抗生素使用减少有关,但与生存率提高无关。在这项荟萃分析中,植物乳杆菌显示出对减少感染的显著作用。
最近一项涉及 2653 名危重患者的大型前瞻性安慰剂对照试验未能证明预防性使用益生菌对这些患者有益以避免 VAP 。但这些结果需要在其他研究中证实,尤其是益生菌应经过精确的安全性评估:益生菌中含有的乳酸杆菌属与少数脓毒症、肺炎、脓肿或感染性心内膜炎病例有关。
预防性摄入益生菌似乎可以降低艰难梭菌相关腹泻的发生率及其副作用;迄今为止,益生菌预防也并不总被推荐 。此外,益生菌在其他情况下还与负面影响有关。
2008 年的一项研究表明,益生菌与因急性胰腺炎入院的重症患者较高的死亡率有关,从而强调使用益生菌并非没有副作用,而且目前不可能给所有重症患者使用益生菌。
益生元是细菌用来调节微生物群组成的外在特定底物,而合生元(益生元和益生菌的组合)也是控制危重患者菌群失调的潜在选择。在上述荟萃分析中,单独使用益生菌和合生元在感染发生方面没有差异。正如最近的一项荟萃分析所述,合生元疗法和益生元可能在预防院内感染等事件方面发挥作用。迄今为止,评估合生元在危重患者中的应用的 RCT 结果不一致,未能证明辅助合生元疗法对感染发生的明显益处。
新一代益生菌目前正在开发中。它们与现有抗生素的不同之处在于,它们已经过识别、选择,并仔细分析了体外证明的特定特性。益生菌在许多其他潜在适应症中得到了研究,但在脓毒症情况下的数据仍然缺乏,也许由于抗生素的使用,这一点更为重要,只有少数研究且样本量较小。
因此,结合肠道菌群检测技术辅助临床判别,有助于益生菌、益生元的合理使用。
◆ 粪便微生物移植 (FMT)
将筛选过的健康供体的粪便通过结肠镜、灌肠或者胶囊等方式移植到患者的肠道内,以重建多样化的微生物群。
应用场景:多用于治疗复发性艰难梭菌感染,也在研究应用于其他病症如多重耐药菌携带者、某些炎症性肠病等。
粪便微生物移植 (FMT) 是一种将健康捐赠者的粪便引入患者的胃肠道 (GI) 以重建肠道微生物群并治疗与菌群失调相关的疾病的过程。
由于 FMT 粪便几乎包含来自健康供体的所有细菌、病毒、真核生物和代谢物,与益生菌中包含的单一或少数几种细菌菌株相比,它可能提供一种更全面的方法来逆转菌群失调和恢复微生物群。然而,它引入了从供体传播有害微生物(包括病原体)的风险,这可能对本已脆弱的人体宿主造成有害影响。
为了减少和预防与输注粪便物质相关的任何不良事件,潜在捐献者已经规定按照 FMT 临床实践共识会议的要求接受医学访谈和详尽检测。获得的移植物可以冷冻,这不会明显降低疗效,之后可以通过多种方式给药:经典的给药方式是上、下途径,但为了患者的依从性,现在更倾向于冻干或冷冻药丸。
在 ICU 中,可以考虑 FMT 的其他适应症,如脓毒症和多器官衰竭的辅助治疗:很少有病例报告描述 FMT 用于原因不明的脓毒症休克并伴有大量腹泻的危重患者,或抗生素相关性腹泻患者。然而,在 ICU 中进行 FMT 面临着若干挑战。与干细胞一样,自体或异源 FMT 是两种可用的技术;然而,在 ICU 中,考虑到危重患者的微生物群在早期发生变化,似乎很难考虑自体 FMT,因此似乎只有异源 FMT 可行。此外,由于这两种技术都难以获得粪便移植,因此在常规实施 FMT 时需要考虑许多因素。
这些方案的实施需要根据个体患者的病情、治疗阶段以及总体健康状况来量身定制,同时与医疗专业人士密切合作以确保安全性和效果最佳。
危重疾病对肠道的影响是多方面的,包括上皮细胞损伤、粘液层变化、免疫系统紊乱、微生物群失调等。肠道损伤反过来会导致局部和远处损伤以及多器官功能障碍综合征。
针对病原菌群的治疗方法,如益生菌、益生元和粪菌移植等,虽然尚未成为ICU的标准治疗,但已显示出改善肠道屏障功能和调节肠道菌群的潜力。
除了微生物组之外,不同患者之间的临床变量也存在很大的异质性,这可能会影响患者对 ICU 中微生物疗法的反应。年龄、性别、合并症和导致危重疾病的潜在诊断等因素需要与微生物群表型一起考虑。
例如,已知患者的基本因素(如生物性别)会与微生物组相互作用,研究发现,男性和女性的肠道微生物群落存在差异,这些基于性别的微生物组差异会影响疾病免疫反应的性别二态性。
因此,需要进一步研究以理清重要的患者因素(例如性别、微生物群失调和疾病发病机制)之间的关系,以便在重症监护的异质领域中满足个性化精准微生物疗法的需求。
健康和危重疾病状态下的肠道
doi.org/10.1186/s40560-019-0372-6
a)在健康状态下,肠道干细胞在隐窝 (灰色和橙色) 中增殖,分裂成子细胞,并以单细胞层向上迁移到绒毛顶部。大多数上皮细胞是肠细胞 (白色和橙色),但也有杯状细胞、肠内分泌细胞和簇状细胞。上皮被连续的粘液层 (灰色) 包围。这可作为管腔微生物 (红色和绿色) 的屏障,这些微生物也可被分泌性 IgA (浅红色) 识别。通透性也通过紧密连接介导,其中上皮细胞之间的复杂机制可作为选择性屏障,允许溶质和水通过,但阻止较大分子的移动。
b)在危重疾病状态下,增殖减少,细胞凋亡增加,导致绒毛长度缩短。粘液层受损,不再均匀。随着紧密连接的变化导致高渗透性,肠道屏障功能受到损害,细菌能够易位(红色杆状体代表固有层中的细菌)。
在我们的日常,尤其临床实践中,需要应用敏感、非侵入性且易于测量的早期肠道损伤生物标志物(例如瓜氨酸、肠道菌群特征、肠道脂肪酸蛋白和连蛋白等)。
肠道菌群检测和生物标志物的应用为我们提供了新的视角和工具,以更好地理解和应对危重疾病中的肠道损伤。随着对胃肠道和全身炎症系统的研究的深入和治疗方法的创新,有望在未来为危重疾病患者带来更有效的治疗策略,指导重症患者的早期药物干预,以恢复或预防肠道损伤并改善其预后,提高生存率和生活质量。
主要参考文献:
Zhang, X., Liu, H., Hashimoto, K. et al. The gut–liver axis in sepsis: interaction mechanisms and therapeutic potential. Crit Care 26, 213 (2022).
Cho NA, Strayer K, Dobson B, McDonald B. Pathogenesis and therapeutic opportunities of gut microbiome dysbiosis in critical illness. Gut Microbes. 2024 Jan-Dec;16(1):2351478.
Yu H, Wan X, Yang M, Xie J, Xu K, Wang J, Wang G, Xu P. A large-scale causal analysis of gut microbiota and delirium: A Mendelian randomization study. J Affect Disord. 2023 May 15;329:64-71.
Grishin, S.M., Crimes committed by medical workers as a result of improper performance of their professional duties (based on the case-law of the European part of Russia 2015–2017), Meditsina, 2018, no. 1, pp. 1–14.
de Jong PR, González-Navajas JM, Jansen NJ. The digestive tract as the origin of systemic inflammation. Crit Care. 2016 Oct 18;20(1):279.
Windsor, J.A., McClave, S.A. (2023). Intestinal Dysfunction and Failure in Acute Pancreatitis. In: Nightingale, J.M. (eds) Intestinal Failure. Springer, Cham.
Otani, S., Coopersmith, C.M. Gut integrity in critical illness. j intensive care 7, 17 (2019).
Assimakopoulos, S.F., Triantos, C., Thomopoulos, K. et al. Gut-origin sepsis in the critically ill patient: pathophysiology and treatment. Infection 46, 751–760 (2018).
Suzuki T. Regulation of the intestinal barrier by nutrients: the role of tight junctions. Anim Sci J. 2020;91:e13357.
Johansson MEV, Ambort D, Pelaseyed T, Schütte A, Gustafsson JK, Ermund A, et al. Composition and functional role of the mucus layers in the intestine. Cell Mol Life Sci. 2011;68:3635–3641.
Cornick S, Tawiah A, Chadee K. Roles and regulation of the mucus barrier in the gut. Tissue Barriers. 2015;3:e982426.
Schroeder BO. Fight them or feed them: how the intestinal mucus layer manages the gut microbiota. Gastroenterol Rep (Oxf) 2019;7:3–12.
Sicard J, Le Bihan G, Vogeleer P, Jacques M, Harel J. Interactions of intestinal bacteria with components of the intestinal mucus. Front Cell Infect Microbiol. 2017;7:387.
Faderl M, Noti M, Corazza N, Mueller C. Keeping bugs in check: the mucus layer as a critical component in maintaining intestinal homeostasis. IUBMB Life. 2015;67:275–285.
Kumar M, Leon Coria A, Cornick S, Petri B, Mayengbam S, Jijon HB, et al. Increased intestinal permeability exacerbates sepsis through reduced hepatic SCD-1 activity and dysregulated iron recycling. Nat Commun. 2020;11:483.
Mukherjee S, Hooper LV. Antimicrobial defense of the intestine. Immunity. 2015;42:28–39.
Beumer C, Wulferink M, Raaben W, Fiechter D, Brands R, Seinen W. Calf intestinal alkaline phosphatase, a novel therapeutic drug for lipopolysaccharide (LPS)-mediated diseases, attenuates LPS toxicity in mice and piglets. J Pharmacol Exp Ther. 2003;307:737–744.
Akiba Y, Mizumori M, Guth PH, Engel E, Kaunitz JD. Duodenal brush border intestinal alkaline phosphatase activity affects bicarbonate secretion in rats. Am J Physiol Gastrointest Liver Physiol. 2007;293:G1223–G1233.
Malo MS, Moaven O, Muhammad N, Biswas B, Alam SN, Economopoulos KP, et al. Intestinal alkaline phosphatase promotes gut bacterial growth by reducing the concentration of luminal nucleotide triphosphates. Am J Physiol Gastrointest Liver Physiol. 2014;306:G826–G838.
Szychowiak P, Villageois-Tran K, Patrier J, Timsit JF, Ruppé É. The role of the microbiota in the management of intensive care patients. Ann Intensive Care. 2022 Jan 5;12(1):3.

谷禾健康

这篇文章总结了关于肠道微生物群(GM)在糖尿病中的作用的研究现状与结论,内容来自《Diabetes》、《Diabetes Care》和《Diabetologia》最近举办的一次国际专家论坛,该论坛在2023年的欧洲糖尿病研究协会年会上举行。论坛参与者包括在肠道微生物组和代谢领域的领军研究人员,其中既有临床医生,也有基础科学家。
讨论主要分为四个主题:流行病学、生理学和病理生理学、技术和方法以及临床应用。他们得出的结论如下:
肠道微生物群参与2型糖尿病的病理生理过程。微生物产生的代谢物与疾病有正面和负面的关联,而且最近通过人类的孟德尔随机化研究,发现了肠道微生物功能(如丁酸盐生产基因)与葡萄糖代谢之间的机制联系。
肠道微生物群的高度个体化特性是研究的一大障碍。需要大型队列和深度测序的方法来稳健地评估关联性和因果关系。
由于单次采样对于捕捉糖尿病个体内肠道微生物群的动态变化有些困难,建议未来需要要对个体多次重复测量的研究,就是要增加纵向队列的研究。
未来还需要大量研究来确定这些不断扩展的知识如何应用于糖尿病的诊断和治疗。新技术和改进的计算工具将对实现这一目标很重要。
研究小组承认,对肠道菌群在代谢疾病中的作用的理解存在许多差距,这并非糖尿病领域所独有,而是反映了更广泛的需求。开展更多控制良好的前瞻性和回顾性人体研究,并在机制上跟进模型系统研究,改进计算工具,将有利用将目前的微生物组数据应用于未来糖尿病的诊疗。
Perspectives
1)
肠道菌群与糖尿病之间的流行病学关联
肠道微生物群是人体最大且最复杂的微生物群落,它连接着我们的外部和内部环境。对肥胖症和心血管代谢疾病(包括2型糖尿病)中肠道微生物群进行流行病学研究的动机源于啮齿动物研究,这些研究证明了肠道微生物群、脂肪性和葡萄糖耐受性之间的联系。
在人类研究中,流行病学研究观察到肥胖症患者的微生物多样性降低,但通过对小型队列进行16S rRNA基因测序或全基因组宏基因组学分析的荟萃分析,并未发现普遍适用的与肥胖相关的肠道微生物特征(换句话说,微生物与疾病的研究需要大队列和大数据库)。
然而,一项对以色列和美国34057名个体进行深度测序全基因组宏基因组学的大规模肠道微生物研究显示,肠道微生物与表型之间存在一致的关联,并且基于微生物组数据训练的机器学习模型对体重指数(BMI)和糖化血红蛋白(HbA1c)的预测准确性可以在不同队列间复制。
通过对训练队列进行子采样,发现随着队列规模的增加,预测准确性也随之提高,约7500-10000个体的样本量可以获得可重复的结果(目前谷禾糖尿病模型使用了9989个样本队列)。这一发现强调了在人类肠道微生物横断面研究中使用大型队列(包含数百名个体)和深度测序组学的必要性,以充分代表人群中的个体异质性以及地区和人口统计学变异。
Byndloss M, et al.Diabetes Care.2024
胃肠道(GI)沿线的微生态和生理差异反映了各种环境因素的变化,这些变化依赖于物理、营养和生物学的宿主因素。这些因素导致肠道不同区域的细菌及其生理功能的适应和差异,通过可能影响葡萄糖代谢和糖尿病风险的多向交互产生效果。
以下是影响不同区域微生物数量和组成的主要因素:
pH值:从胃(pH1.0–4.4)到小肠(pH 5.5–7.0),然后更为渐进地到达结肠,在那里由于复杂碳水化合物(纤维)的微生物发酵,pH值可能再次下降(pH5.5)。在粪便中pH值再次升高(可达pH7.8)。
肠道蠕动:在小肠中,肠道通过时间较短,肠蠕动更为强烈,而在大肠中则不然。
肠道上皮细胞:小肠的泛素细胞分泌抗菌肽(AMPs),充当天生防御屏障以减少细菌定植;而M细胞从肠腔中捕获细菌。
氧气浓度:从小肠到大肠,氧气水平逐渐降低。
膳食营养:主要在小肠中由宿主酶消化和快速吸收蛋白质、脂肪和简单碳水化合物,因此限制了细菌对这些营养物质的获取;而部分未消化的膳食残留(例如复杂碳水化合物和部分水解的蛋白质/氨基酸)则积聚在大肠,为细菌提供营养。
宿主糖基:它是由杯状细胞产生的粘液层的一部分,在大肠中远比小肠厚,也是肠道细菌的营养来源,支持其生长。
胆汁酸:分泌至小肠,抑制和有利于某些参与其代谢和再循环的特定细菌的生长。
以上所有生物和非生物因素影响生态条件,使得细菌群体可以在向肠道最远端部分移动时更加密集(从十二指肠的每克102–104个细菌到回肠的107–109个,以及结肠的1011–1012个),并导致细菌组成的差异,其中兼性厌氧菌优先在小肠定殖,而严格厌氧菌在大肠内的微生物中占主导地位,包括丁酸盐生产者。
因此,为了在种族/民族、生活方式和其他人口特征差异之外识别疾病特异性的微生物特征,重要的是在大型人群中进行研究,并将来自不同研究的健康个体/对照参与者作为参考;这些方法已被证明可以提高疾病预测准确性。
2)
肠道微生物代谢与葡萄糖稳态的关联
多项观察性研究报告了肠道微生物群与2型糖尿病之间的关联。在全球流行病学研究中发现,2型糖尿病和糖耐量受损/空腹血糖异常患者的肠道微生物组成发生了一致的改变,这些改变在代谢综合征中也存在,主要特征是微生物多样性降低和产生短链脂肪酸(SCFA)丁酸盐的细菌丰度减少。一些研究还观察到机会性病原体的增加。
最近,粘液降解菌Ruminococcus gnavus被确定为代谢综合征多个特征的预测因子,包括低度炎症、腰围增大、血清甘油三酯升高、糖化血红蛋白升高和高密度脂蛋白胆固醇降低。然而,正如对不同疾病(包括胃肠道和代谢性疾病)肠道菌群改变的荟萃分析所指出的,这些特征中的几个并非疾病特异性,可能代表了一般的肠道菌群的失调。
与葡萄糖代谢和2型糖尿病相关的肠道微生物代谢物和信号分子,肠道微生物群的结构蛋白和分泌蛋白参与调节免疫反应和炎症,正如F. prausnitzii(普拉梭菌)分泌的蛋白质(微生物抗炎分子[MAM]),它能够抑制核因子-κB(NF-κB)通路。另一个例子是A. muciniphila(AKK菌)的外膜蛋白Amuc_1100,它能改善肠道屏障并降低炎症。
①短链脂肪酸
肠道菌群生成短链脂肪酸(SCFAs),SCFAs调节几个过程,包括肠道蠕动和pH值、肠道屏障免疫反应以及通过影响糖异生、胰岛素敏感性和胰岛素分泌的途径来调节系统代谢。
此外,SCFAs调节免疫细胞功能,增强肠道屏障,并刺激肠神经的信号传导。其中丁酸盐还为结肠细胞提供主要能量,并通过激活过氧化物酶体增殖物激活受体γ(PPARγ)增加结肠细胞的β-氧化(β-ox)。
然而,人类研究显示,2型糖尿病患者粪便或血液中不同SCFAs的水平存在广泛变异,这可能是由于方法学局限性造成的。支持SCFAs在调节葡萄糖代谢中作用的最强有力证据来自动物研究和最近一项使用孟德尔随机化统计方法的人类研究(参见下文)。
②胆汁酸
胆汁酸是两性分子,可介导膳食脂肪和脂溶性维生素的吸收。这些分子也被认为是调节脂质、葡萄糖和能量代谢的主要参与者。因此,在2型糖尿病和其他肥胖相关疾病中发现了胆汁酸池的改变,并被认为可能是2型糖尿病病理生理学的潜在贡献因素。
12α-羟基化胆汁酸水平的增加和6α-羟基化胆汁酸水平的降低与胰岛素抵抗有关,并在2型糖尿病患者中出现。胃旁路手术后观察到6α-羟基化胆汁酸水平增加,可预测2型糖尿病的缓解。
干预研究也调查了胆汁酸在人类代谢中的潜在重要性。在减肥手术后,系统性胆汁酸水平升高以及肠道信号激发GLP-1释放的现象得到了验证,尤其是餐后增加被认为特别重要。
然而,在一些进行过胆囊切除术的个体中发现胆汁酸反应过度,并与GLP-1和胰岛素反应的进一步增强相关联。在2型糖尿病患者中,已证明二甲双胍通过减少脆弱拟杆菌的丰度来改善葡萄糖代谢,这与肠道中甘牛胆酸水平的增加和法尼醇X受体(FXR)的抑制有关。
然而,对肠道微生物群与胆汁酸之间直接相互作用及其与2型糖尿病及相关疾病的发展和治疗的关联的理解仍然有限,还需要更多的人体研究来探索。
③色氨酸代谢物
肠道菌群色氨酸代谢物,如吲哚丙酸(IPA)和吲哚丙烯酸(IA),通过孕烷X受体(PXR)改善肠道屏障,并通过肠道免疫细胞上的芳香烃受体(AHR)进行信号传导,增加白介素-22(IL-22)的产生,从而调节免疫和代谢反应。
④其他代谢物
在血液中,IPA和IA还提供抗氧化和抗炎功能。研究还表明,3-吲哚丙酸(色氨酸的代谢产物)的循环水平升高与胰岛素分泌和敏感性改善以及2型糖尿病风险降低相关。
咪唑丙酸和支链氨基酸(BCAAs)通过激活雷帕霉素复合体1(mTORC1)的机制型靶标来损害胰岛素信号传导。
肠道菌群还产生乙醇,与脂肪肝病和胰岛素抵抗有关。
肠道微生物群产生的氨基酸代谢物也与2型糖尿病相关(前两个图)。研究表明,3-吲哚丙酸(色氨酸的代谢产物)的循环水平升高与胰岛素分泌和敏感性改善以及2型糖尿病风险降低相关。
此外,在存在胰岛素抵抗和2型糖尿病的个体中,血浆组氨酸代谢的细菌产物——咪唑丙酸水平增加。来自肠道菌群对芳香氨基酸代谢的这些代谢物和其他一些代谢物也与欧洲和美国独立队列中的心血管事件风险和死亡率有关。
肠道菌群还产生乙醇,与脂肪肝病和胰岛素抵抗有关。
Byndloss M, et al.Diabetes Care.2024
3)
肠道菌群或其代谢产物和降糖药物治疗的关系
支持肠道微生物群在2型糖尿病中作用的证据已通过观察性和干预性研究得到加强。这些研究表明,二甲双胍使用者的肠道菌群中多种细菌物种的相对丰度发生了变化。
二甲双胍使用者肠道菌群发生显著变化
在多个涉及接受二甲双胍治疗个体的队列研究中,发现大肠杆菌(Escherichia coli)的相对丰度升高,而Intestinibacter bartlettii的丰度降低。
此外,最近一项大规模宏基因组研究发现,接受二甲双胍治疗的个体中Escherichia marmotae增加,而Romboutsia timonensis减少。
随机试验和对未使用药物的个体的研究为这些肠道菌群差异在2型糖尿病中的因果效应提供了支持。这些研究表明,肠道菌群组成的变化转化为丙酸盐和丁酸盐产生的增加以及胆汁酸池的调节,这可能介导了二甲双胍降血糖效应的一部分。
然而,肠道菌群也可能是约30%服用二甲双胍的个体经历短暂或持续肠道不适的原因(例如,通过一些大肠杆菌属种增加气体产生)。
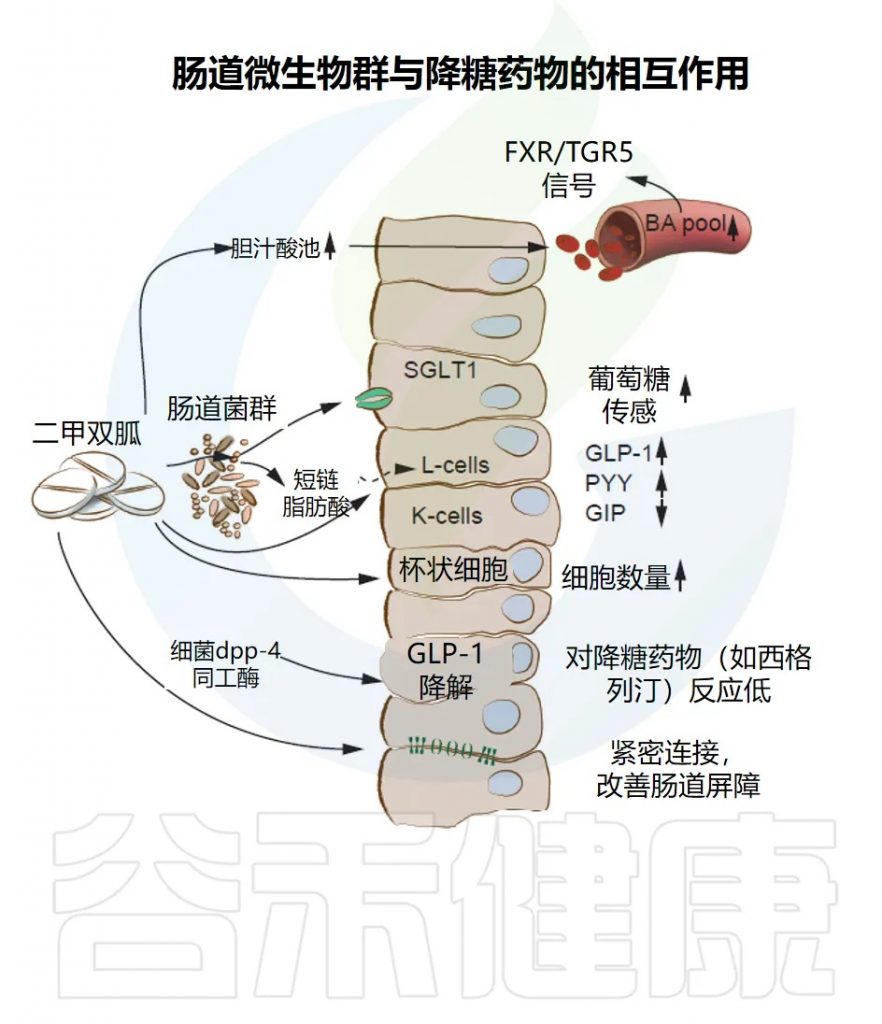
Byndloss M, et al.Diabetes Care.2024
肠道微生物代谢物参与二甲双胍的作用机制
肠道微生物代谢物参与二甲双胍的作用机制,包括通过胆汁酸受体FXR和TGR5进行胆汁酸信号传导,以及生产短链脂肪酸,这些都调节了内分泌细胞(K细胞和L细胞)中胰高血糖素样肽-1(GLP-1)、胃抑制多肽(GIP)和肽YY(PYY)等促胰岛素分泌激素的释放。
其他与二甲双胍作用相关的肠道菌群依赖机制包括通过钠-葡萄糖共转运蛋白1(SGLT1)改善葡萄糖感知和提高肠道屏障功能(例如,恢复紧密连接和增加产粘蛋白的杯状细胞)。
然而,肠道菌群通过表达二肽基肽酶-4(DPP-4)同工酶,可能降低GLP-1活性并影响降糖药物的疗效。
其他降糖药物与肠道微生物群的关联
关于其他口服降糖药物,研究表明二肽基肽酶4(DPP-4)抑制剂和α-葡萄糖苷酶抑制剂对肠道微生物群和微生物代谢物有影响,但钠-葡萄糖共转运蛋白2(SGLT2)抑制剂、噻唑烷二酮类和胰高血糖素样肽1(GLP-1)受体激动剂的影响较不明确。
迄今为止,大多数涉及SGLT2抑制剂的研究都是在小鼠模型中进行的,少数现有的人体研究结果存在矛盾,无法清楚地区分SGLT2抑制剂的效果与之前或同时使用二甲双胍治疗或同期生活方式改变的影响。
GLP-1受体激动剂可能通过激活上皮内淋巴细胞GLP-1受体产生抗炎作用,进而可能有助于调节肠道微生物群。尽管需要更多研究,但现有证据表明肠道菌群可能介导一些降糖治疗的益处,某些益生菌或益生元可能通过影响肠道微生物或其功能进一步改善这些药物的降糖效果。
需要进一步的干预和转化研究来确定药物诱导的肠道菌群变化是否在介导健康效应中起因果作用,并揭示潜在机制。
重要的是,肠道菌群还可能影响降糖药物的效果,例如通过表达人类DPP-4的同源物,这可能降低GLP-1的活性并影响葡萄糖代谢(下图)。由于细菌DPP-4同源物似乎对一些靶向人类DPP-4的药物具有耐药性,因此可能需要抑制细菌同工酶来改善当前药物的代谢反应。
4)
孟德尔随机化在阐明因果关系中的作用
肠道微生物群能够通过多种方式影响和与宿主健康互动,因果关系的方向通常是双向的甚至是多向的。肠道微生物群特征在不同层次(如群落、物种、途径、基因和代谢物)能影响宿主表型(例如改变肥胖的风险),同时,表型的发展(如肥胖)又可以反过来改变肠道微生物群。
孟德尔随机化(MR)是一种统计方法,利用与暴露相关的人类遗传变异体来区分疾病结果的因果效应、混杂、反向因果关系或其他因素导致的关联。为了应用MR研究肠道微生物与2型糖尿病的联系,所研究的肠道微生物特征需要受到一个或多个强烈的人类遗传变异体的影响,以便在工具变量分析中用作工具。
尽管已经有若干全基因组关联研究针对不同的肠道菌群特征(如肠道细菌分类群的相对丰度和人类粪便微生物代谢物)进行,但研究其在2型糖尿病中的因果作用的大型MR研究仍然有限,且尚未在重复研究中得到证实。
部分鉴定出与粪便短链脂肪酸(SCFA)水平相关的人类遗传变异体,并报告了肠道菌群丁酸盐生成潜力(即负责肠道丁酸盐生成的基因)与口服葡萄糖耐量测试中胰岛素反应改善之间的潜在因果联系。这些作者还发现异常的粪便丙酸水平与2型糖尿病风险增加之间存在因果关系。
另一项MR研究报告称,2型糖尿病和肾脏疾病提高了血浆中肠道菌群依赖的代谢物三甲胺氧化物(TMAO)的水平,并提出此前观察到的较高TMAO水平与心血管疾病风险升高的证据可能是由于混杂或反向因果关系,而非因果效应。
另一项近期研究则表明某些细菌属与2型糖尿病之间可能存在因果联系。考虑到MR(如多效性和与弱工具变量相关的问题)及肠道菌群研究(如方法学差异、个体间异质性和个体内可变性)的局限性,需要进行大型高质量研究,以评估使用MR的宿主遗传变异体模拟特定肠道菌群特征(无论是特定细菌物种、属还是代谢产物)的能力,以理解与2型糖尿病发病机制的因果关系。
Relationship
▸ 膳食纤维摄入量较少可能导致2型糖尿病
膳食纤维摄入量减少与2型糖尿病风险增加有关;因此,新的糖尿病管理饮食建议鼓励多食用加工程度低的植物性食物,如全谷物、蔬菜、全水果、豆类、坚果和种子。
饮食是肠道生态系统的驱动因素,微生物可及碳水化合物促进菌群多样性和短链脂肪酸生成,从而减少炎症并支持肠道屏障的维持。
就肠道菌群和葡萄糖代谢而言,增加纤维摄入量与不同菌种水平的增加有关,例如Prevotella copri(现已更名为Segatella copri)。研究还表明,纤维对 HbA 1c的有益作用可能是由特定的基线肠道菌群组成和纤维促进的短链脂肪酸产生菌的多样性介导的。
▸ 肠道微生物的特定成分会影响其宿主反应
然而,即使在控制良好的饮食干预中也会观察到不同的影响,而且鉴于肠道菌群的个体间差异很大,对肠道菌群的饮食反应是高度个性化的。
精准营养或“个性化”营养是一个不断发展的领域,它基于识别可用于设计饮食干预措施的个体特定反应预测特征。利用关于肠道菌群成分的个人数据以及血液生物标志物和饮食习惯等其他信息,机器学习方法已被用于预测标准化膳食后的血糖反应,其准确度高于其他预测方法。
这些研究表明,肠道微生物的特定成分会影响其宿主的特定反应(即在不同细菌存在的情况下,对饮食的反应不同)。因此,肠道菌群至少在一定程度上决定了人类代谢的异质性。肠道菌群可改变且代谢活性高,为更精确的生活方式干预和新疗法提供了可能性。
知识差距、挑战和机遇
目前已有数个大型的高质量参考基因组目录 ,它们为人类研究中肠道微生物的分类和功能表征提供了极大的便利。然而,这些数据库并非没有局限性。
对于流行病学分析而言,肠道菌群数据充满了挑战,包括个体间和个体内巨大的变异性、高维性(即观察到的肠道菌群特征的数量可能大于样本和受试者的数量)和稀疏性(即肠道菌群特征,如物种,仅在部分样本中检测到)。
在种群水平上,肠道菌群由数千个相互作用的物种组成,每个物种在不同宿主之间以及在同一宿主内随时间推移都具有遗传多样性;然而,常见的分析往往忽略了这种非独立性、微生物之间复杂的加性与相互作用效应,以及肠道菌群的可修改性和波动性。然而,最近的一些分析表明,不同细菌物种的个体内变异和对宿主生理的适应模式不同。
其他挑战与肠道微生物群可能影响和响应的大量表型和环境因素有关。大规模群体研究的重要性在人体遗传学中已被无可置疑地证明;大多数多基因性状已知受许多具有小效应的遗传变异影响,但这些变异可以汇总成具有临床重要性的强大多基因风险评分。
类似地,大规模宏基因组研究结果表明,单一的细菌物种可能与人类表型存在低效应大小的关联,或以低丰度存在。因此,需要大样本量以获得足够的统计能力和涵盖个体间变异性,以获得可复制的结果和高预测准确性。
为了更好地理解肠道菌群变异和动态对2型糖尿病的长期影响,前瞻性研究至关重要。在目前发表的少数前瞻性研究中,肠道菌群特征与中国地区多样人群中发生的2型糖尿病事件和西班牙一项临床试验的子集相关,这些研究均使用16S rRNA基因测序。
在一个拥有18年随访的大规模芬兰基于人群的队列研究中,肠道菌群特征也与2型糖尿病有关,使用的是浅层宏基因组测序。然而,在这些研究中,发生病例的数量有限,分析的分辨率也有限。
例如,Faecalibacterium prausnitzii是下一代益生菌最有希望的候选者之一,但也有其他有希望的候选者,如Akkermansia muciniphila和P. copri。关于F. prausnitzii,已在人体肠道中发现了几种潜在亚种,它们具有利用复杂多糖的不同功能潜力 。
与此观察一致,大型宏基因组学研究也发现了几种F. prausnitzii 亚种,但仅其中一部分亚种与 BMI 呈负相关。就P. copri 而言,已发现其与宿主代谢表型(如内脏脂肪和葡萄糖反应)呈正相关和负相关。
这些不一致的发现可以部分地用种内和种间多样性来解释。例如,这些差异可能将同一物种内的菌株定义为共生菌或致病菌,如脆弱拟杆菌和艰难梭菌的情况,这取决于该菌株是否编码毒力因子。
Perspectives
在进化过程中,哺乳动物必须适应充满微生物、病毒和真菌的世界。在无菌的宫内环境中,哺乳动物在出生期间和出生后立即暴露于潜在的有害微生物中。进化创造了实质性的屏障,包括胃肠道运输过程、免疫球蛋白A (IgA) 、粘液、上皮层、内皮屏障、淋巴结和肝脏,所有这些屏障阻止微生物易位进入体内,但为微生物生态系统创造了最佳储存库。上消化道中的微生物数量较少。同时,大肠内微生物密度和丰富度较高,从小肠到大肠,pH值和有氧/厌氧条件发生生理变化,大肠内为厌氧条件。
1)
微生物的基本功能
肠道微生物除了对哺乳动物造成潜在的有害威胁外,还为哺乳动物提供必需功能,包括训练免疫系统、保护其免受病原体的侵害(即抗定植)、代谢功能、营养物质供应(如维生素)、肠道蠕动和外来生物的解毒。
同时,微生物和宿主在小肠中竞争营养物质,微生物产生的常量营养素副产物被提供给宿主。
营养物质(即纤维)和哺乳动物代谢物(如葡萄糖醛酸苷、粘液多糖和胆汁酸)通过微生物代谢进行发酵或转化。微生物代谢以及微生物细胞的死亡和周转形成了外周血中微生物代谢物池,其中约30%的外周血代谢物与肠道菌群及其代谢物有关。
这些微生物代谢物被G蛋白偶联受体(GPCR) 或芳烃受体(AHR)等受体识别,或被哺乳动物酶(如 TMAO)进一步加工,通过表观遗传修饰调节哺乳动物基因表达,对代谢健康产生影响。
2)
不可消化纤维及其代谢物的作用
不可消化的碳水化合物是大肠中特定细菌的能量来源,这些细菌含有宿主所缺乏的酶,这些酶可以代谢这些纤维并促进SCFA的产生。大量研究表明,外源性短链脂肪酸(尤其是丙酸和丁酸)对糖尿病样表型的啮齿动物模型有益。然而,1型和2型糖尿病临床试验的证据尚不明确。
在结肠中,短链脂肪酸(SCFA)通过与GPCR和游离脂肪酸受体2和3结合激活肠内分泌细胞(EEC),诱导肠道肽(主要是GLP-1和肽YY)的释放。为了支持这一发现,啮齿动物和人类补充益生元可以改善葡萄糖耐量和胰岛素抵抗,并且与肠道肽水平升高有关 。
在一项研究中,高纤维饮食改善了2型糖尿病患者的葡萄糖耐量,这种效果与粪便丁酸水平和循环GLP-1水平升高有关。GLP-1通过增加胰岛素分泌、促进胰岛素敏感性和减少肝葡萄糖生成来调节葡萄糖稳态。
此外,短链脂肪酸(SCFA)对于维持整体肠道健康和肠道屏障至关重要,因为丁酸是结肠细胞的主要燃料来源。相反,丁酸减少会促使结肠细胞进行无氧糖酵解,从而增加上皮氧合,破坏结肠的厌氧环境。
3)
肠道菌群在肠道屏障功能中的作用
肠道微生物在肠道屏障功能中起着至关重要的作用。肠道屏障受损会导致肠漏,从而引发低度全身性炎症,这是肥胖和糖尿病的特征。尽管这些机制主要在实验模型中进行研究,但导致全身性炎症的一个潜在机制是来自革兰氏阴性细菌细胞包膜的脂多糖(LPS)内毒素增加,也称为代谢性内毒血症。
肠道菌群失调会导致促炎反应,影响葡萄糖稳态
脂多糖(LPS)可以作用于全身特定的病原体相关分子模式 (PAMP) — Toll 样受体 4 (TLR4) — 从而引发促炎免疫反应,从而对葡萄糖稳态产生负面影响。一系列研究表明A. muciniphila通过作用于 TLR4 和肠道屏障,在介导肠道微生物改变对全身炎症的一些影响方面发挥潜在作用;
然而,关于其在代谢疾病中介导葡萄糖代谢作用的证据较少 。然而,还需要更多的研究来确定TLR4以外的 PAMPs 对代谢物的感知是否与调节宿主-微生物串扰和人类肠道屏障完整性有关。
与此同时,在肥胖个体的肠道中观察到促炎性巨噬细胞的积聚、CD8αβ T 细胞浸润和 IgA+ 免疫细胞减少 ,导致胰岛素抵抗。肠道菌群调节策略可以减轻高热量饮食对肠道免疫的不利影响。例如,减少促炎性巨噬细胞的比例并增加 3 型先天淋巴细胞和调节性 T 细胞与改善葡萄糖代谢有关。
尽管如此,了解驱动肠道微生物与免疫相互作用的精确分子机制及其在人类中的应用也需要未来进行广泛的研究。
Progress
在微生物组领域,将现象学与实际生物学区分开来需要工具和方法来识别机制,以解析微生物组是否是代谢疾病的驱动因素或提供治疗机会。在这里,我们讨论了推动该领域发展的最有希望的技术发展。
模型系统
在比较研究肠道微生物与代谢疾病之间关系的模型系统时,必须同时考虑传统模型(例如无菌和无菌小鼠)和新兴技术(例如器官芯片和非鼠类GF模型,如斑马鱼和猪)。
无菌模型有利于研究肠道菌群与特定疾病的关联
无菌动物已被广泛用于研究人类肠道微生物在肥胖和糖尿病中的作用。这些动物出生时没有任何微生物群,可以在没有微生物组的情况下对干预措施进行研究。因此,我们可以深入了解微生物组是否对给定的生物过程必不可少。
通过将整个肠道菌群(通过供体粪便)或特定的分离菌株定植到无菌小鼠体内,建立无菌疾病模型。研究表明,将肥胖和2型糖尿病患者粪便中的微生物接种到无菌动物体内后,无菌动物成功复制了疾病表型,这为肠道菌群与代谢疾病的关联提供了证据。
此外,从患有病态肥胖和糖尿病的人的肠道中分离出一种过度生长的产生内毒素的细菌阴沟肠杆菌B29,它在无菌 C57BL/6J 小鼠中诱发了肥胖、脂肪肝和胰岛素抵抗,而这些小鼠对高脂饮食引起的代谢缺陷具有抵抗力。敲除B29菌株中产生内毒素的基因或C57BL /6J小鼠中的Tlr4基因可预防代谢缺陷,强调了特定肠道细菌和宿主反应在代谢疾病的发生和发展中的因果关系。
然而,某些关于肠道微生物小鼠的概念一直流传,而这些概念只是研究一种基因型的结果。例如,GF C57BL/6J 小鼠对饮食诱导的肥胖具有抗性,而 GF Swiss Webster 小鼠则不能;因此,由于大多数 GF 小鼠研究都使用 C57BL/6J 小鼠,因此 GF 小鼠通常必须比传统小鼠吃得更多才能维持体重,这已成为事实。这些模型对高脂饮食的不同反应凸显了遗传背景在研究结果中的重要性。
其他GF模型(如猪和斑马鱼)的存在补充了 GF 小鼠的使用。在开发与人类微生物群相关的无菌模型时,GF 猪和仔猪比小鼠能提供更多与人类相关的见解,尽管饲养它们所需的空间对于许多机构而言过于宽裕,或限制了研究只能使用少数动物。另一方面,无菌斑马鱼已被证明可用于研究肠道微生物和不同宿主细胞发育阶段 。
鱼体的透明度、在不同细菌存在下荧光标记和成像不同细胞类型的能力,以及饲养和繁殖斑马鱼的便利性,都有利于研究特定问题。这些模型不能完全复制人类生理学,但它们允许在严格控制的条件下进行纵向和侵入性采样,这在探究机制问题时非常重要。
器官芯片利于研究人体组织内的相互作用
器官芯片(如肠道芯片)提供了更多与人类相关的系统,因为它们可以直接从人体组织或血液来源的诱导性多能干细胞中获得,这些干细胞保留了宿主的遗传特征,因此,它们使我们可以在受控环境中研究复杂的人体组织和细胞相互作用。
最近的研究已经证明了在半厌氧环境中将微生物群接种到肠道芯片中的能力,目前许多研究小组正在测试在这些芯片上接种日益复杂的群落的效率。虽然肠道芯片模型缺少一些关键的细胞类型,如免疫细胞,但重大进展包括能够连接不同的器官芯片,如肠道芯片和神经元芯片,以模拟肠脑相互作用。利用器官芯片研究微生物组的创造性方法将继续涌现,并可能填补重要的空白,补充动物模型。
了解细菌基因和功能
对细菌全基因组进行测序和组装的能力是一种非常强大的方法,可用于识别菌株的谱系和相关性,以及识别可能与人类健康或疾病相关的特定细菌表型所涉及的假定途径。如果我们思考已从基因改造小鼠研究中阐明的人类疾病机制,就不难想象在细菌中进行同样研究可以获得的大量信息。敲除和操纵细菌基因的能力并不是什么新鲜事。
近80年的细菌遗传学研究已经阐明了病原体如何在肠道上皮中定植并分泌毒素从而导致霍乱等疾病,它们如何相互共享信息以适应不同的环境,以及营养选择如何驱动它们在宿主中的组成。大肠杆菌可以被认为是 C57BL/6 小鼠的细菌版本;其基因定义明确且易于改造,而且它已经成为在特定环境下测试改造效果的主力。然而,共生肠道细菌的多样性远不止大肠杆菌;因此,研究人员正在积极寻求对肠道j基因的更深入了解,例如使用拟杆菌和梭菌作为代表性生物 ,因为大量人类和小鼠研究已经证明了这些生物在健康和疾病中的重要作用。
人工智能等先进计算工具通过预测蛋白质的三维结构,为细菌基因组中未注释部分提供了新的见解,AlphaFold2 等技术极大地推进了这一任务。通过分析这些结构,研究人员可以根据它们的形状和结合位点推断出可能的功能。这些潜在作用可以通过生化和微生物学研究中的实验验证来证实。这些知识,特别是关于蛋白质如何影响代谢途径的知识,对于将微生物活动与糖尿病等健康状况联系起来至关重要,有助于深入了解疾病机制和潜在的治疗靶点。
无参考数据分析
目前,微生物组测序分析中依赖数据库的方法最关键的问题是它们在检测新型或研究不足的微生物方面存在局限性。当使用基于已充分表征的细菌的参考基因组的数据库分析微生物群落样本时,不匹配的序列会被忽略或错误分类。
这一过程导致对微生物生态系统的看法出现偏差,可能会遗漏在健康和疾病(包括糖尿病)中发挥重要作用的关键成分。因此,推进微生物组研究需要开发和使用能够发现和表征这些代表性不足的微生物实体的方法。
从宏基因组测序数据中从头组装基因组是微生物组研究中一种强大的方法,该方法涉及直接从测序读取构建基因组,而不依赖于参考数据库。
该方法使用先进的计算算法将样本中的 DNA 片段拼凑在一起,从而可以识别来自各种生物体的遗传物质,包括那些以前未测序或编目的生物体。通过组装这些基因组,研究人员可以发现新物种并揭示新的基因功能,从而大大扩展我们对微生物多样性及其在包括人体在内的各种环境中的潜在作用的理解。
对于16S测序来说,由于其经济和丰富的样本积累,对于构建疾病的大数据库来说存在很大的优势,虽然16S分辨率没有宏基因组高,但是通过方法和技术的弥补,可以大大提供16S的预测精准度。
例如谷禾健康结合宏基因组数据和已有的菌群构成数据,通过算法可以大大提高扩增子数据的物种分辨率。此外病毒、真菌、寄生虫和部分16S难区分的病原菌目前通过增加靶向引物进行tNGS的方式来实现,大大拓展了二代测序微生物多样性检测领域的涵盖范围。
这种方法在揭示微生物生命的全部范围方面特别有用,包括可能在健康和疾病中发挥关键作用的物种或基因。
了解小肠微生物群
小肠是营养吸收、肠肝循环和承受肠道激素刺激的主要部位;因此,深入了解人体这一部位的微生物功能至关重要。然而,我们对人类微生物组的大部分了解都基于粪便样本和结肠微生物群,因为即使使用现代内窥镜检查方法,获取小肠微生物群也很困难。
最近的进展使用了创新方法,例如可摄入的胶囊,它可以对整个胃肠道中的肠道物质进行取样。由于每个胶囊都由肠道中不同的 pH 值触发,因此这种方法可以提供肠道群落的微生物图谱。这些工具正在进一步完善和商业开发,以用于诊断和研究。但需要注意的是,样本采集到胶囊内后,微生物有可能继续生长,因此不能准确地代表原生微生物群落。
此外,这些胶囊和其他胶囊都是为空腹状态下的取样而开发的,因此对餐后反应的研究仍然有限,尽管这些反应对于全面了解微生物对葡萄糖代谢调节的贡献可能很重要。解决这些问题对于确保使用此类设备进行微生物组研究的可靠性和准确性至关重要。
同工酶和小分子筛选
微生物组研究中,同工酶和小分子筛选对于识别可以作为治疗目标的特定细菌产物至关重要。微生物同工酶是具有不同分子结构但催化与宿主酶相同反应的酶。筛选这些产物可以揭示微生物代谢的变化,这些变化可能会影响健康并可能干扰药物治疗,例如细菌 DPP-4 同工酶的情况。
小分子筛选专注于识别微生物产生的生物活性化合物 。这些化合物可对宿主的病理生理学产生显著影响。通过识别特定的同工酶和小分子,研究人员可以针对它们进行降解或增强,从而为糖尿病等疾病提供潜在的治疗策略。
Treatment
如上所述,目前尚未发现针对1型或2型糖尿病的诊断性和广义的粪便微生物群分类学特征。因此,未来的研究应转向在大规模前瞻性人群中进行菌种和菌株水平的研究,并在可能的情况下,重点研究胃肠道肠道微生物的功能分析,特别关注稳定同位素前体,以研究不同胃肠道区域重要微生物代谢物的生成和底物通量。
1
高纤维饮食和基于短链脂肪酸的治疗
关于基于肠道菌群的糖尿病疗法,高纤维饮食已被证明可有效控制1型和2型糖尿病患者的血糖水平并降低胰岛素抵抗。尽管膳食纤维通过肠道菌群直接起作用的方式仍有待证实,但这些试验强调了将肠道菌群调节策略纳入糖尿病干预试验的潜在重要性,特别是对于生产有益代谢物(如 SCFA)而言。
但是,如上所述,口服短链脂肪酸(丁酸盐)补充剂的干预试验并未显示在1型或2型糖尿病患者的血糖控制或其他糖尿病调节标志物上 ,可能是因为给药部位与内源性产生不同。对于其他短链脂肪酸,包括丙酸盐和乙酸盐,数据太少,无法得出关于对代谢调节的可能影响的任何结论。
2
传统益生菌和新一代益生菌
用于糖尿病的益生菌疗法可分为传统益生菌,特别是乳酸杆菌和双歧杆菌菌株,它们历来被用于发酵食品或补充剂中以促进健康,以及下一代益生菌,它们是最近被鉴定为人类肠道菌群成员的新菌种菌株。这些菌株与健康有关,但在疾病环境中存在会减少。
传统益生菌
关于传统益生菌,一项关于益生菌(双歧杆菌、乳酸杆菌和唾液链球菌菌株)的开放标签试验发现,益生菌对1型糖尿病患者的兄弟姐妹的1型糖尿病易感性和进展有益。
针对新发1型糖尿病的前瞻性随机对照试验 (RCT) 正在进行中(NCT03961854、NCT03961347、NCT04769037 和 NCT05767450),一项规模较小的试验显示,其对长期 1 型糖尿病仅有中等效果。
在2型糖尿病中,最近的一项荟萃分析描述了这些益生菌菌株在代谢控制和降低胰岛素抵抗方面具有一定功效。
新一代益生菌
关于下一代益生菌,在人体中产生的数据较少。例如,尽管特定菌株(例如Akkermansia)与健康的代谢表型相关,但使用A. muciniphila的 RCT 干预并未发现强烈的代谢影响。
这一发现可能是由于这些测试菌株与代谢综合征缺乏因果关系、通过胃后活力降低、剂量不足或引入人体肠道时缺乏定值。
由于小肠对1型和2型糖尿病的病理生理学都很重要,因此需要进一步分析1型和2型糖尿病患者的小肠微生物群,并研究确定的下一代益生菌菌株组合作为糖尿病的可能干预措施。然而,这种努力应该考虑细菌菌株的植入条件、对其他细菌成员的生态或功能依赖性、以及功能上的潜在冗余。
3
供体粪菌移植
在完成针对特定菌株组合的研究之前,供体粪菌移植(FMT)可能有助于了解调节肠道菌群的效果以及这种调节对糖尿病病理生理和潜在可逆性的影响。
最近发表了一项研究,探新鲜粪菌移植在维持残余β细胞功能和抑制新发1型糖尿病患者自身免疫方面的功效。其他针对 2 型糖尿病和胰岛素抵抗的研究显示,FMT 对胰岛素抵抗和非酒精性脂肪肝疾病有适度影响 ,而一项研究表明对这些参数没有影响。
此外,微囊供体 FMT 和纤维补充的联合干预显示出对葡萄糖代谢有益的影响,这表明干预设计不仅需要合成菌株联合体,还需要饮食支持(例如纤维来滋养菌株)。最后,评估生活方式干预后自体 FMT 是否有助于防止体重反弹的研究发现,饮食引起的低丰度细菌变化可能是维持减肥效果的原因,这可以指导更精准的干预措施,减少伦理负担,降低传播疾病的风险。
总体而言,与针对性菌株或代谢物的干预措施相比,供体 FMT 是一种更为分散的方法。此外,现有数据集中的粪便物质给药方式(胶囊与新鲜 FMT)、肠道 pH 值(例如由于抗酸药)和结肠转运时间存在差异,并且施用的粪便微生物群的数量似乎也会影响供体细菌菌株的植入。
关于糖尿病和基于肠道菌群的疗法的试验结果,使用随时间动态测量葡萄糖代谢(例如混合餐测试或连续血糖监测)可以更好地了解在 FMT 和施用确定的菌株组合期间肠道微生物、饮食和葡萄糖稳态之间的相互作用。
对小肠微生物组的研究仍不足,但对肠道微生物的新认识越来越多地将其与人类糖尿病联系起来。对人类 FMT 的干预研究已经能够从因果关系中分离出关联,并且确实显示出一些临床益处,虽然平均而言相对较小的治疗效果和伦理问题阻碍了这种治疗方法在糖尿病临床护理中的广泛实际应用。
因此,还需要在多民族队列中对肠道菌群和糖尿病之间的前瞻性关联进行更多研究。与此同时,还应探索合成的肠道菌群衍生的细菌菌株或群落和工程系统在糖尿病中靶向肠道输送已识别代谢物的治疗潜力。
Perspectives
在过去二十年中,肠道微生物的改变与糖尿病患者的异常葡萄糖代谢和脂肪变性有关。流行病学研究中的较大样本量现已开始显示肠道菌群与肥胖或2型糖尿病相关的人类代谢特征之间的相关性的大小和可能的一致性;然而,对于1型糖尿病,情况就不那么明朗了。
未来的研究应更严格地考虑糖尿病药物与种族和饮食摄入之间的相互作用。此外,近年来,人们对肠道菌群的功能有了更多的了解,而不仅仅是其成分,这些信息与之前关于特定代谢物(包括短链脂肪酸、支链氨基酸和胆汁酸)与肥胖和糖尿病之间联系的报告非常吻合。
关于肠道菌群成分,只有少数研究探讨了噬菌体和真菌的作用以及这些菌落与细菌菌株在糖尿病中的相互作用。显然,未来的研究还需要关注小肠微生物群的功能,以及开发足够的生物信息学流程和正确组装基因组。
我们还必须考虑到,迄今为止的大多数数据都是在小鼠研究中产生的,由于小鼠和人类在饮食、遗传和寿命方面存在巨大差异,其与人类糖尿病的相关性需要进一步证实。尽管如此,在人类糖尿病环境中对单一菌株和粪菌移植的人体干预研究表明,存在一系列临床代谢效应(与药物更一致的效果相比),但没有严重的副作用。
总之,经过近二十年的研究,我们仍然必须期待未来的努力,以阐明肠道微生物研究对人类糖尿病的临床诊断和治疗适用性。
主要参考文献
Caesar R. Pharmacologic and Nonpharmacologic Therapies for the Gut Microbiota in Type 2 Diabetes. Can J Diabetes. 2019 Apr;43(3):224-231.
Ridaura VK, Faith JJ, Rey FE et al (2013) Gut microbiota from twins discordant for obesity modulate metabolism in mice. Science 341:1241214.
Sze MA, Schloss PD (2016) Looking for a signal in the noise: revisiting obesity and the microbiome. mBio 7:e01018-16.
Duvallet C, Gibbons SM, Gurry T, Irizarry RA, Alm EJ (2017) Meta-analysis of gut microbiome studies identifies disease-specific and shared responses. Nat Commun 8:1784.
Pasolli E, Truong DT, Malik F, Waldron L, Segata N (2016) Machine learning meta-analysis of large metagenomic datasets: tools and biological insights. PLoS Comput Biol 12:e1004977.
Rothschild D, Leviatan S, Hanemann A, Cohen Y, Weissbrod O (2022) An atlas of robust microbiome associations with phenotypic traits based on large-scale cohorts from two continents. PLoS One 17:e0265756.
谷禾健康

肠球菌属(Enterococcus)是厚壁菌门中一种革兰氏阳性球菌,常成对或短链出现,大部分物种无鞭毛,没有明显的荚膜。
其耐受性非常好,可在10至45°C的温度范围内生长,pH值范围4.6–9.9内生长,对胆汁盐也具有耐受性。目前,肠球菌属包含四十多种已知菌种,可以存在于各种环境中,包括人类、动物和昆虫的消化系统,食物、水源、土壤和一些植物中。
但在35-37°C下生长最佳,因此非常适合在人体肠道内定植。人体肠道中常见的肠球菌是粪肠球菌(E.faecalis)(90-95%)和屎肠球菌(E.faecium)(5-10%)。而粪肠球菌也是其模式菌种。
肠球菌可以发酵多种底物,包括葡萄糖、甘油、乳酸、苹果酸、柠檬酸、氨基酸和许多α-酮酸。能量产生的主要途径是葡萄糖通过糖酵解途径同质生成l-乳酸。粪肠球菌还可以通过降解粘蛋白来获取能量。
肠球菌具有“多种面孔”,其的健康益处可能是由于能够产生具有抑菌活性的“肠素”(细菌素),对李斯特菌、金黄色葡萄球菌等具有抑制作用。
进而可被用作天然的食品生物防腐剂。一些特殊的肠球菌株还被用作益生菌,具有不同有益特性:如刺激免疫力、抗炎活性、降胆固醇作用以及预防/治疗肠易激综合征和抗生素引起的腹泻,减少鼻窦炎患者的复发等。
然而,就像一枚硬币的两面,尽管它们具有促进健康的特性,但它们也具有有害特性。肠球菌也被视为机会性病原体,其表现出复杂的毒力机制,能够在各种宿主组织中定植,并对许多抗生素具有耐药性,包括四环素、β-内酰胺类药物、氟喹诺酮类药物、头孢菌素、磺胺甲噁唑/甲氧苄啶等,还可能导致耐药性的传播。
它们能够从胃肠道转移到各种组织和器官,进而造成感染或疾病。目前,肠球菌是革兰阳性菌中仅次于葡萄球菌属的重要医院感染病原菌,其感染最常见的为尿路感染,其次为腹部和盆腔等部位创伤和术后感染、败血症、心内膜炎和脑膜炎。此外由于其具有耐药性,所以感染治疗起来会更困难。同时,在心力衰竭、房颤、肥胖和炎症性肠病患者中发现了肠球菌属丰度的增加。
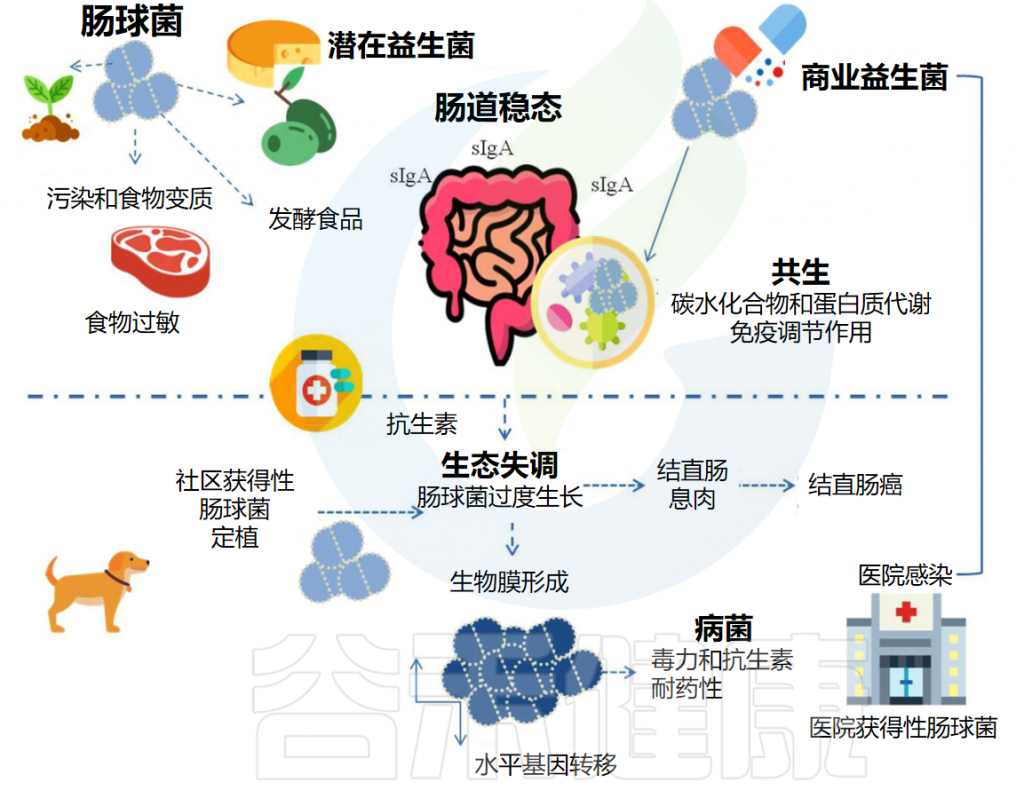
1
形态
肠球菌属(Enterococcus)是一种革兰氏阳性、不生芽孢的兼性厌氧菌,细胞呈球形或卵圆形,大小约在0.6~2.0μm×0.6~2.5μm,呈单个、成对或短链状排列。
大部分物种无鞭毛,但极少部分菌株可以通过稀少的鞭毛而运动。没有明显的荚膜。在35-37°C下生长最佳,因此非常适合在人体肠道内定植。
注:DNA G+C 含量(mol%):35.1–44.9
2
发现历史
“肠球菌”一词最早于1899年提出,用于描述具有致病能力的肠道共生菌。由于形态和生化上的相似性,肠球菌曾被归为链球菌属。
1970年,基于生化和培养特性分析,建议将其归为独立的肠球菌属。1984年,这一建议得到广泛接受,并在1986年版《伯杰氏系统细菌学手册》中出现。
2009年,基于16S rRNA基因相似性提出肠球菌科,包括肠球菌属(Enterococcus) 、迷走球菌 (Vagococcus)、Tetragenococcus和Melissococcus。迄今为止,肠球菌属已包含五十多个物种。
肠球菌的发现历史
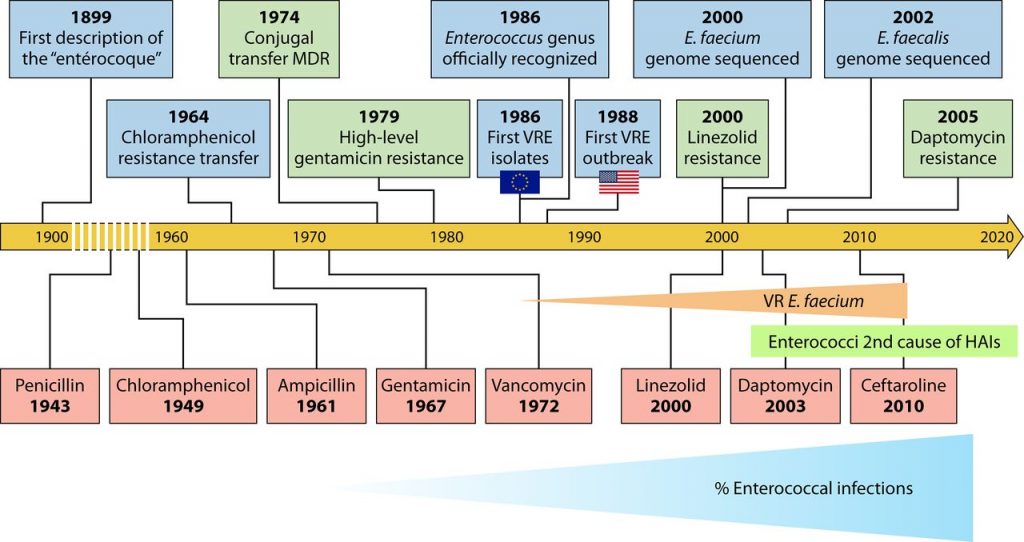
doi: 10.1128/CMR.00058-18.
3
常见物种及分布
肠球菌(粪肠球菌和较少的屎肠球菌)在出生后7-10天内定植于大多数健康母乳喂养婴儿的消化系统中。这些微生物主要来自母亲生殖道的生理菌群,但肠球菌也会动态地定植于剖宫产新生儿的胃肠道。
这些菌种对胆汁盐表现出抵抗力,这使它们能够穿过人体消化系统并在大肠中定植。成年人也会从某些食物中获得各种肠球菌种,例如猪肉、家禽和凝乳酶奶酪。
▸ 粪肠球菌为模式菌种
粪肠球菌(Enterococcus faecalis)是肠球菌的模式菌种。人体肠道中主要存在以下两种肠球菌:粪肠球菌(E.faecalis)(90-95%)和屎肠球菌(E.faecium)(5-10%)。人体中较少见的菌群还有E.casseliflavus、E.gallinarum和E.raffinosus。肠球菌很少从阴道和口腔中分离出来,如果发现,极有可能是病原体感染。
粪肠球菌(Enterococcus faecalis)
粪肠球菌(Enterococcus faecalis)是一种革兰氏阳性菌,它不能形成孢子,但对恶劣的环境条件相当耐受,在肠道免疫中起重要作用
粪肠球菌是人类肠道的正常居民,存在于大约90-95%的人中。这种细菌通常是生命早期定植于人类胃肠道的首批微生物之一,在肠道免疫系统的发育中发挥着重要作用。
Enterococcus faecalis T-110:这种粪肠球菌菌株与枯草芽孢杆菌TO-A和丁酸梭菌TO-A结合使用作为益生菌(B10-THREE)。这三种菡株一起可以减少手术患者的术后感染并缩短急性腹泻患儿的住院时间。
Enterococcus faecais YM0831:一项交叉研究发现,对健康人类受试者单次施用该菌株可显著改善血糖对蔗糖耐量试验的反应。
▸ 肠球菌的常见种
临床上分离率最高的是粪肠球菌(E.faecalis),其次是屎肠球菌(E.faecium)。除此之外,还有以下的菌种:
向上滑动阅览
鸟肠球菌(E.avium)
酪黄肠球菌(E.casseliflavus)
坚忍肠球菌(E.durans)
鸡肠球菌(E.galinarum)
芒地肠球菌(E.mundii)
恶臭肠球菌(E.maladoratum)
希拉肠球菌(E.hirae)
孤立肠球菌(E.solitarius)
棉子糖肠球菌(E.raffinosus)
假鸟肠球菌(E.pseudoavium)
粪肠球变异株(E.faecalis var)
Enterococcus gallinarum
Enterococcus gilvus
Enterococcus haemoperoxidus
Enterococcus hawaiiensis
Enterococcus hermanniensis
Enterococcus hirae
Enterococcus inusitatus
Enterococcus italicus
Enterococcus lactis
Enterococcus lemanii
Enterococcus malodoratus
Enterococcus moraviensis
Enterococcus mundtii
Enterococcus olivae
Enterococcus pallens
Enterococcus pernyi
Enterococcus phoeniculicola
Enterococcus plantarum
Enterococcus pseudoavium
Enterococcus quebecensis
Enterococcus raffinosus
Enterococcus ratti
Enterococcus rattus
Enterococcus rivorum
Enterococcus rotai
Enterococcus saccharolyticus
Enterococcus silesiacus
Enterococcus sp.
Enterococcus sp. 2011_Ileo_MS_B2
Enterococcus sp. C6I11
Enterococcus sp. SI-4
Enterococcus sulfureus
Enterococcus termitis
Enterococcus thailandicus
Enterococcus ureasiticus
Enterococcus ureilyticus
Enterococcus viikkiensis
Enterococcus villorum
Enterococcus xiangfangensis
environmental samples
▸ 粪肠球菌和屎肠球菌是人体肠道中常见的肠球菌物种
肠球菌种的分布会因环境、人类和动物而异。粪肠球菌和屎肠球菌在人类胃肠道中最为常见,人类粪便中的粪肠球菌数量为每克105至107个,屎肠球菌的数量为每克104至105个。
▸ 其他动植物中的肠球菌
牲畜中分离出的屎肠球菌和粪肠球菌丰度低于从人类粪便中分离出的。家畜中常见的肠球菌有屎肠球菌(Enterococcus faecium)、盲肠球菌(Enterococcus cecorum)、粪肠球菌(Enterococcus faecalis)、Enterococcus hirae和耐久肠球菌(Enterococcus durans);相比之下,鹑鸡肠球菌(Enterococcus gallinarum)和鸟肠球菌(Enterococcus avium)是罕见的。
粪肠球菌(Enterococcus faecalis)是狗和猫的直肠和扁桃体中常见的一种。而鸽子肠中最常见的是柱状肠球菌(Enterococcus columbae),其次是盲肠球菌(Enterococcus cecorum)。
此外,在爬行动物、蜗牛、采蜜昆虫、白蚁中也发现了肠球菌。肠球菌还可以从食物、植物、土壤和水中分离出来。虽然这些细菌被认为只是植物菌群的临时组成部分,但在良好的条件下,它们可以在植物表面繁殖。从植物中分离出粪肠球菌、屎肠球菌、海氏肠球菌(Enterococcus hirae)、Enterococcus mundtii、Enterococcus casseliflavus和硫肠球菌)。
它们通常从花中分离出来,而不是从芽或叶中分离出来。这表明昆虫可能参与了肠球菌的传播。
▸ 一些食物中也存在肠球菌
肠球菌是许多食物中常见的一部分,尤其是那些动物来源的食物,如牛奶和奶制品、肉类和发酵香肠。它们通常被认为是食品的二级污染物,通常在其腐败中起作用,尽管某些菌株对成熟和香气有积极的影响。
然而,随着某些类型奶酪的开发。肠球菌甚至被用作某些产品中的益生菌培养物。
另一方面,已经证明在发酵剂和食物肠球菌菌株中存在毒力因子,以及毒力决定因素向发酵剂菌株的转移。
▸ 一些具有致病性的肠球菌
以下是临床中发现具有致病性的常见肠球菌物种:
Enterococcus avium
Enterococcus gallinarum
Enterococcus faecium
Enterococcus faecalis
Enterococcus raffinosus
Enterococcus durans
Enterococcus columbae
Enterococcus villorum
Enterococcus dispar
4
生存条件
▸ 肠球菌的耐受性非常好,但人体肠道温度最适宜生长
肠球菌可在10至45°C的温度范围内生长,但大多数物种在35-37°C下生长最佳。许多(但不是全部)品种能在42°C甚至45°C以及(缓慢地)在10°C下生长。
粪肠球菌和屎肠球菌均可在60°C的高温下存活 30 分钟。
▸ 肠球菌耐高盐、高碱、高胆汁、干燥
肠球菌可在pH值范围4.6–9.9内生长,最适pH值为 7.5。它们还可耐受40%(w/v)胆汁盐并在其中生长。粪肠球菌可在6.5% NaCl 中生长,并具有阳离子稳态,这被认为有助于其抵抗pH值、盐、金属和干燥。
5
代谢
肠球菌可以发酵多种底物,包括葡萄糖、甘油、乳酸、苹果酸、柠檬酸、氨基酸和许多α-酮酸。能量产生的主要途径是葡萄糖通过糖酵解途径同质生成l -乳酸。
由于肠球菌可以利用多种糖源,因此它可以在多种环境中生存。在肠道中,粪肠球菌的大部分能量来自未吸收糖的发酵。粪肠球菌还可以通过降解粘蛋白来获取能量,粘蛋白是一种由肠道杯状细胞产生的高度糖基化的碳水化合物。
注:能量也可以通过一些氨基酸的降解获得,如精氨酸、酪氨酸、丝氨酸、苯丙氨酸等。
▸ 在不同环境条件下,可代谢产生不同的物质
在有氧条件下,葡萄糖代谢为乙酸、乙酰和CO2。在pH 5.0-6.0时,丙酮酸被粪肠球菌转化为乳酸,但在中性或微碱性的pH下,丙酮酸以2:1:1的比例转化为甲酸盐、乙醇和醋酸盐。
在营养缺乏的情况下,丙酮酸转化为乙醇和醋酸盐。粪肠球菌通过诱导的特异性苹果酸酶代谢苹果酸。葡萄糖酸盐被磷酸化为6-磷酸葡萄糖酸盐,然后异化为乳酸盐和二氧化碳。
粪肠球菌能将甘油氧化为乙酸、二氧化碳和少量过氧化氢和微量乙酰甲基甲醇;将棘皮酸水解成甘氨酸和苯甲酸。
▸ 肠球菌还具有的代谢通路
卟啉和叶绿素代谢
丙酸代谢
蛋白质输出
嘌呤代谢
嘧啶代谢
丙酮酸代谢
RNA降解
核黄素代谢
次级胆酸生物合成
链霉素生物合成
苯乙烯降解
硫代谢
牛磺酸和亚牛磺酸代谢
硫胺素代谢
色氨酸代谢
缬氨酸、亮氨酸和异亮氨酸的生物合成
缬氨酸、亮氨酸和异亮氨酸降解
维生素B6代谢
β-丙氨酸代谢
2-氧代羧酸代谢
丙氨酸、天冬氨酸和谷氨酸代谢
氨基糖和核苷酸糖代谢
精氨酸和脯氨酸代谢
精氨酸生物合成
抗坏血酸和醛糖酸代谢
不饱和脂肪酸的生物合成
生物素代谢
丁酸代谢
C5-支链二元酸代谢
氯代烷和氯代烯烃降解
氯环己烷和氯苯降解
柠檬酸循环(TCA循环)
芳香族化合物的降解
果糖和甘露糖代谢
半乳糖代谢
谷胱甘肽代谢
甘油脂代谢
甘油磷脂代谢
甘氨酸、丝氨酸和苏氨酸代谢
糖酵解/糖异生
乙醛酸和二羧酸代谢
6
毒力
肠球菌作为一种条件性致病菌,与其致病性有关的特性包括毒力因子和抗生素耐药菌株的增加。
毒力因子是一种效应分子,这些因子有助于其在宿主体内定植和引起感染,会增强微生物致病能力。肠球菌的毒力因子在其致病性中起着重要作用。
▸ 肠球菌能够产生的一些毒力因子
肠球菌中最常见且描述最详尽的毒力因子是聚集物质(agg、asa1)、溶细胞素(cyl)、明胶酶(gelE)、细胞外表面蛋白(esp)、粘附于胶原蛋白(ace、acm)和粘连样心内膜炎抗原(efaAfs和efaAfm)。
粪肠球菌和屎肠球菌主要毒力因子
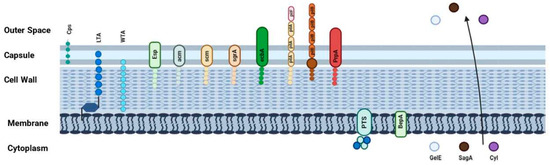
Sangiorgio G,et al.Pathogens.2024
毒力因子的具体作用机制
聚集物质(agg和asa1)是诱导肠球菌菌株表面蛋白的毒力因子,可在细菌结合过程中促进聚集体的形成,并介导与上皮细胞的特异性结合以进行定植以及携带毒力特性和抗生素抗性基因的质粒的交换。
此外,聚集物质可以与细胞外基质蛋白结合,如I型胶原、纤连蛋白和血小板反应蛋白。agg基因增加肠球菌表面的疏水性,诱导胆固醇定位于吞噬体并延缓与溶酶体囊泡融合。不过迄今为止,agg决定簇仅存在于粪肠球菌菌株中。
溶细胞素(或β-溶血素)是一种具有双重功能的蛋白质细菌素/溶血素,是肠球菌中研究最多的毒力因子。它是一种肽类毒素,能够通过在细菌靶细胞的细胞质膜上形成孔隙来裂解细胞 。由产生溶细胞素的肠球菌感染引起的死亡频率比不产生溶细胞素的肠球菌感染引起的死亡频率高5倍。
明胶酶是一种胞外锌金属内切肽酶(EC 3.4.24.30),参与明胶、胶原蛋白、β-胰岛素、血红蛋白、酪蛋白和其他生物活性肽的水解。明胶酶能够裂解纤维蛋白并损伤宿主组织,从而使细菌迁移和扩散,这使得其与肠球菌特别是粪肠球菌的毒力有关。此外,这种蛋白酶在生物膜的形成中起着重要作用。
细胞外表面蛋白(esp)是一种与细胞间粘附(特别是粘附于真核细胞和逃避宿主的免疫反应)有关的致病基因决定簇。该基因可促进定植,位于肠球菌属内高度保守的染色体区域,在屎肠球菌中最常见。
efaA毒力基因与心内膜炎密切相关。最为人所知的是粪肠球菌的efaAfs和屎肠球菌的efaAfm。
总体而言,屎肠球菌菌株中这些毒力因子的发生率低于粪肠球菌菌株。毒力最高的肠球菌种是在临床中的分离株,其次是食品分离株,然后是发酵剂菌株。
许多因素会影响肠球菌种的毒力,例如:
(1)在胃肠道(正常的栖息地)定植的能力;
(2)粘附于多种细胞外基质蛋白的能力,包括血小板反应蛋白、乳铁蛋白和玻璃粘连蛋白;
(3)粘附于尿道上皮、口腔上皮和人胚肾细胞的能力。
大多数感染被认为是内源性的,细菌通过肠道上皮细胞易位,然后通过淋巴结引起感染,从而扩散到体内的其他细胞。
7
耐药性
肠球菌对常用抗生素的耐药性是另一个重要的毒力特性,这极大地增强了肠球菌的致病性,使其成为可能引起感染的条件性致病菌。
▸ 肠球菌对许多常用抗生素具有耐药性
肠球菌对许多β-内酰胺类药物、氟喹诺酮类药物、林可胺类药物、头孢菌素、磺胺甲噁唑/甲氧苄啶和低浓度氨基糖苷类药物具有天然耐药性。
肠球菌还可以通过质粒或转座因子从其他微生物获得耐药性,对氯霉素、红霉素、四环素、青霉素、氨苄西林、大环内酯类、氨基糖苷类(如庆大霉素、卡那霉素、链霉素)和糖肽类药物尤其是万古霉素表现出耐药性。
▸ 对万古霉素具有耐药性的肠球菌会造成严重的健康后果
万古霉素耐药菌株会带来严重的健康问题,一项报告了7066例由肠球菌引起的菌血症病例,所有病例中有28%是抗生素耐药性的。万古霉素耐药肠球菌(VRE)的死亡风险为75%,而感染敏感菌株的患者死亡风险为45%。
数据显示,在从血液中分离的肠球菌中,2%的粪肠球菌和60%的屎肠球菌分离菌对万古霉素具有耐药性。
万古霉素耐药肠球菌(VRE)对临床医生来说是一个挑战,因为这种抗生素传统上被认为是治疗肠球菌感染的“最后手段”,因为它经常被用来替代过敏患者的青霉素、氨苄西林和氨基糖苷类药物。
因此,人们开始评估新药作为万古霉素的替代候选药物,例如喹奴普丁和达福普汀、恶唑烷酮和达托霉素。
▸ 其他动物和环境中也存在耐药性肠球菌,并可能影响人体
在世界各地的食用动物和环境中都发现了其他抗生素耐药性肠球菌。事实上,从牛(80%)、鸡(62-64%)、猪(57%)、动物源性食品(如白肉和红肉) 、未煮熟的食物(如生菜)、污水中分离出的肠球菌(粪肠球菌、屎肠球菌和鸡肠球菌)中观察到了较高的庆大霉素、卡那霉素、链霉素、四环素和糖肽耐药性。
肠球菌抗生素耐药性的主要机制
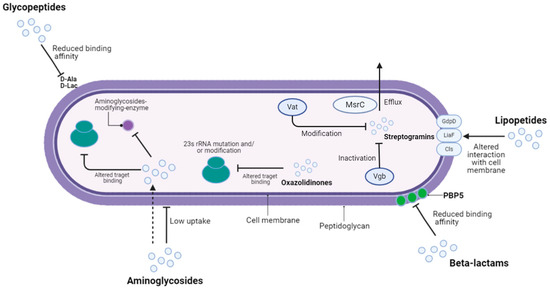
Sangiorgio G,et al.Pathogens.2024
总体而言,在所有这些不同的宿主和环境中都出现了高抗生素耐药性,表明耐药基因在菌株间存在传播。
8
细菌素
细菌素是核糖体合成的、细胞外释放的抗菌肽,对一些细菌物种有抑菌活性。
▸ 肠球菌能够产生具有抑菌活性的肠素
肠球菌产生的细菌素被称为“肠球菌素”,对其他肠球菌和菌群具有抑菌活性。肠球菌素分为四类:
(I类)羊毛硫抗生素肠素,如溶细胞素;
(II类)非羊毛硫抗生素肠素 ,有三个亚类,如肠素A(II-1类)、肠素Q(II-2类)和肠素B(II-3类);
(III类)其次是环状肠素,如肠素AS-48;
(IV类)高分子量肠素,如肠溶素A。
注:大多数已知的肠素属于II类。
肠球菌产生的细菌素
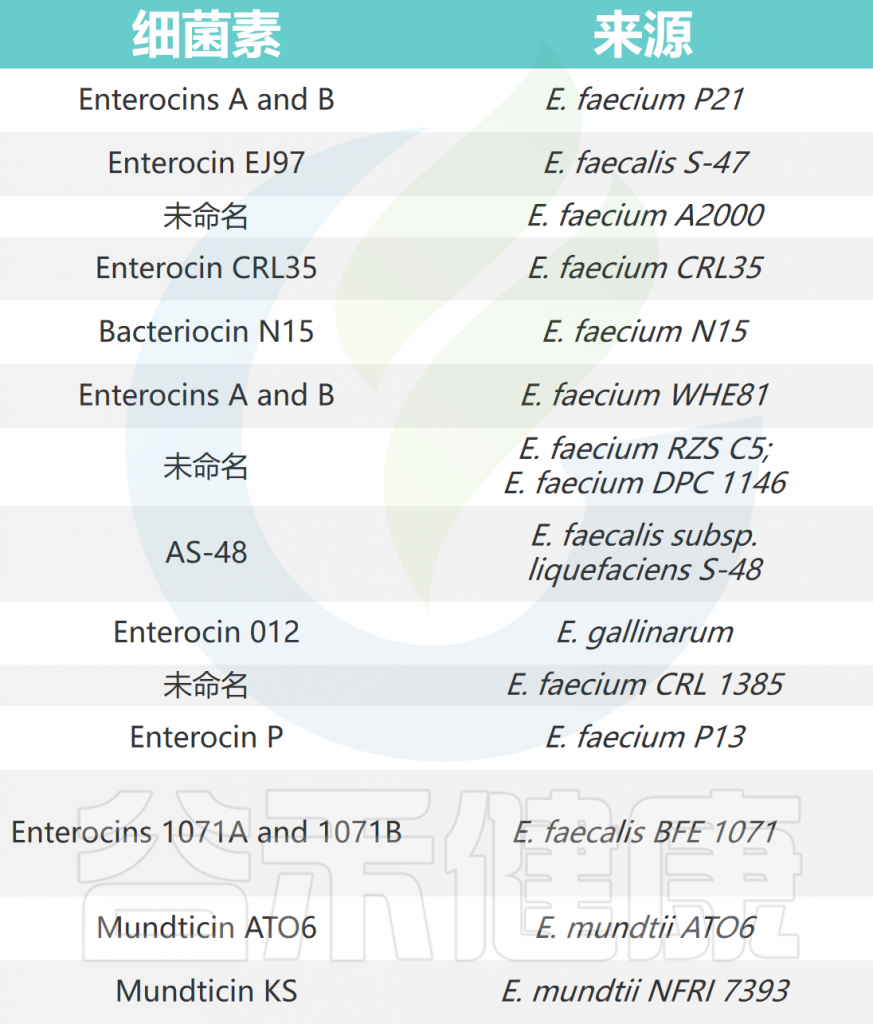
doi: 10.1099/mic.0.026385-0.
▸ 肠球菌素对李斯特菌、金黄色葡萄球菌等具有抑菌活性
已从乳制品、发酵肉以及蔬菜和植物中分离出产”肠球菌素”的肠球菌。它们对李斯特菌(Listeria)、梭菌(Clostridum)和金黄色葡萄球菌(Staphylococcus aureus)有抑菌活性。
E. faecium RZS C5 是一种天然奶酪分离物,具有抗李斯特菌特性。来自E. faecalis S-47的肠素 EJ97也表现出抗李斯特菌特性,浓度为20 AU ml−1时,6小时后细菌数量减少 ,24小时后完全抑制。
肠素 AS-48(由E. faecalis A-48-32 产生)可抑制罐装水果和蔬菜中冷藏和高温条件下凝结芽孢杆菌(Bacillus coagulans)细胞的生长。细菌素对抗革兰氏阴性菌的活性并不常见,但来自E. mundtii的细菌素 ST15已被证明可有效对抗一系列革兰氏阳性菌和革兰氏阴性菌,包括不动杆菌(Acinetobacter)、芽孢杆菌(Bacillus)、梭菌(Clostridium)、克雷伯氏菌(Klebsiella)、乳酸杆菌(Lactobacillus)和假单胞菌(Pseudomonas)。
▸ 肠球菌素如何发挥抑菌作用?
细菌素的杀菌作用被认为是由于细胞膜的通透性。细菌素的随机卷曲肽与细胞膜接触后形成螺旋结构,该结构融入并跨越膜,从而产生孔隙。这种作用方式已在肠素P中观察到。由此产生的孔隙导致K+离子泄漏、膜电位耗散和抑制氨基酸吸收。ATP 驱动的细胞吸收K+和细菌素介导的K+释放的循环会导致细胞死亡,从而抑制一些菌种的定值。
9
与其他菌的互作
肠球菌作为一类广泛存在于人类和动物肠道中的微生物,它们与肠道微生物群中的其他成员之间存在着复杂的相互作用。以下是谷禾通过查阅相关文献对肠球菌与其他肠道微生物群相互作用的总结:
▸ 屎肠球菌可以抑制李斯特菌、伤寒沙门氏菌等
屎肠球菌(Enterococcus faecium)是一种在人体中广泛存在的细菌,它能够产生一种名为肠球菌素的抗菌物质,这种物质具有广谱抗菌活性,可以抑制如植物乳杆菌(Lactobacillus plantarum)、单核细胞增生李斯特菌(Listeria monocytogenes)以及伤寒沙门氏菌(Salmonella paratyphi)等细菌的生长。
除此之外,一些研究表明肠球菌还可以抑制Peptoclostridium的生长与活性。
注:肠球菌因为这一特性可作为生物防腐剂,它们通过抑制病原菌和降解菌的生长,确保了产品的质量和安全。与传统的化学防腐剂相比,肠球菌素等具有更佳的生物相容性和环境友好性。
▸ 抑制肠球菌的细菌
Blautia producta 的共生菌株通过产生特定的抗菌化合物,可以抑制并排除粪肠球菌(E.faecium)。
此外,肠道中的枯草芽孢杆菌(Bacillus subtilis)释放一种抑制性化合物,可以阳止金黄色葡萄球菌的定植能力,或抑制肠球菌(Enterococcus faecalis)的毒力因子表达。
肠球菌(Enterococcus)是人类微生物群的天然组成部分。它们常定植于下消化道,口腔和生殖道中较少见。
★ 肠球菌是人体共生菌之一
人体肠道中约有106至107个肠球菌,结肠中发现的肠球菌高达1%,其中大多数是粪肠球菌(105-107 CFU/克粪便)或屎肠球菌(104 -105 CFU/克粪便)。
除了粪肠球菌(E. faecalis)和屎肠球菌(E. faecium)外,还经常分离出盲肠肠球菌(E. cecorum)和坚忍肠球菌(E. durans),偶尔也会检测到干酪肠球菌(E.caseliflavus)、海氏肠球菌(E. hirae)、鸡肠球菌 (E. gallinaroum)和鸟肠球菌(E. avium)。
参与营养物质代谢、激活免疫细胞
由于肠球菌在人体微生物群中存在大量,这表明它们可能在消化道中发挥重要作用。作为共生菌,它们参与营养物质(碳水化合物、脂质和蛋白质)的代谢,以及维持其生存环境的pH值,合成对正常功能很重要的维生素和其他代谢物,防止腐败细菌的定植和扩散,并对人体免疫系统(体液免疫和细胞免疫)产生影响。
研究发现,粪肠球菌(E.faecalis)可以起免疫调节作用,负责激活CD4、CD8(CD 分化簇)细胞和B淋巴细胞。
同时肠球菌还会影响肠道淋巴系统(肠道相关淋巴组织,是负责产生分泌性免疫球蛋白A(sIgA)的免疫器官)。sIgA 是肠道屏障的重要组成部分,它可以防止微生物粘附到上皮细胞上、中和细菌毒素、覆盖和凝集微生物,并具有抑菌作用。
作为一种益生菌
一些肠球菌菌株(如屎肠球菌M74和屎肠球菌SF-68)已被证明可作为一种安全有效的益生菌制剂。例如FortiFlora®和Cernivet®(含屎肠球菌SF68)和含粪肠球菌的Symbioflor®1。
• 缓解肠易激综合征和抗生素引起的腹泻

肠球菌益生菌可用于治疗或预防某些人类疾病,特别是在治疗腹泻方面。研究发现屎肠球菌(E.faecium strain SF68)可以缓解肠易激综合征症状和接受抗生素治疗的慢性肺结核患者的腹泻发病率,并预防了粘膜炎(可能是维生素缺乏的后果)。
使用屎肠球菌SF68 治疗腹泻被认为是抗生素治疗的替代方案。临床研究还显示,屎肠球菌对治疗儿童和成人肠炎有效, 对屎肠球菌SF68 治疗肠炎的“双盲”对照研究表明,腹泻持续时间和大便正常化时间显著减少。
• 减少鼻窦炎患者的复发

使用肠球菌还可以治疗慢性和复发性上呼吸道感染、鼻窦相关的慢性疾病(慢性鼻窦炎)。
一项双盲、安慰剂对照研究调查了157名患有慢性复发性鼻窦炎的患者在使用细菌免疫刺激剂(由人粪肠球菌细菌的细胞和自溶物组成)治疗期间急性复发的发生情况,并与使用安慰剂的患者进行了比较。结果表明,在使用粪肠球菌制成的免疫刺激剂后,复发的发生率(50次)约为安慰剂下观察到的复发次数(90次)的一半。
目前,粪肠球菌的益生菌制剂(有时富含大肠杆菌和乳杆菌)被推荐用于治疗鼻窦炎或支气管炎以及普通感冒等疾病。
注:在德国,粪肠球菌(DSM 16431) 以 Symbioflor 1的商品名作为药物出售,推荐用于治疗急性和复发性鼻窦炎或支气管炎。
• 一些菌种能产生丁酸,具有抗炎作用
已发现E. durans M4-5 能产生丁酸、短链脂肪酸 (SCFA),其可诱导显著的抗炎作用并有助于肠道上皮的完整性。
• 降低胆固醇水平

研究发现肠球菌(例如E.faecium M-74、E.durans KLDS)还具有降低胆固醇水平的特点。这些细菌产生一种水解酶,可催化胆汁酸解离过程,帮助胆固醇整合到细菌细胞壁中,或在酸性环境中帮助沉淀。
• 抗癌、免疫调节作用
此外,一些肠球菌还表现出抗诱变、抗致癌和免疫调节作用。
最近,菌株E. durans LAB18s还被推荐用作膳食硒补充剂的来源,而E.faecium LCW 44和E.durans 6HL 分别被证实对革兰氏阳性菌和革兰氏阴性菌具有很强的抑制作用。
益生菌E. faecium M-74 可用于治疗患有髓性白血病患者的胃肠道并发症。在小鼠模型中发表的另一份报告表明,海氏肠球菌(Enterococcus hirae)有助于形成抗癌免疫反应。
在食品中的益处
• 改善发酵乳制品的质地和口感
肠球菌存在于未经处理的牛奶、奶酪、肉类和植物产品(发酵蔬菜)等食品中。在食品工业中,精选的肠球菌菌株有助于改善发酵乳制品的香气、质地和口感。
肠球菌菌株可以将蛋白质降解为肽和氨基酸,分解柠檬酸盐,并产生具有脂解和蛋白水解特性的芳香物质。它们具有蛋白水解、脂解以及柠檬酸和丙酮酸代谢的能力,因此被用作乳制品的发酵剂。
• 一种天然的食品防腐剂
此外,肠杆菌通过产生肠素来抑制腐败微生物的增殖,这些细菌素可用作食品防腐剂。
由于它们对热处理(烹饪、巴氏灭菌或发酵)具有耐受性,因此它们也可用作食品生产中的天然防腐剂和卫生指标。
在养殖业中的作用
益生菌制剂也用于养殖业,以预防或治疗肠道疾病,或作为生长促进剂。
• 免疫调节作用、防止腹泻
例如,一些肠球菌益生菌被纳入饲料添加剂类别,用于稳定单胃动物和反刍动物消化道的微生物群落。屎肠球菌NCIMB 11181 和屎肠球菌DSM 7134 菌株已获批准作为牛和猪的饲料添加剂。益生菌屎肠球菌SF68®和粪肠球菌Symbioflor 1 也用于预防或治疗猪、家禽、牲畜和宠物的腹泻。屎肠球菌SF68对幼犬肠粘膜和消化系统发育具有免疫调节作用。
• 促进生长、提高代谢效率
此外,肠球菌对动物的生长和健康特征具有积极影响。用肠球菌益生菌属喂养猪,发现能减少肠道病原体。同样,给断奶后小猪口服屎肠球菌NHRD IHARA可提高血清和粪便中的IgA水平,改善小猪的生长。研究还表明,屎肠球菌能促进鸡的生长、肠道形态和盲肠微生物群的稳态。据报道,屎肠球菌还能提高肉鸡的代谢效率,降低炎症反应。
• 抑制水生病原体,改善鱼类生长
另一方面,许多研究表明肠球菌在水产养殖中具有有益作用。一些研究报道了屎肠球菌对水生病原体具有广泛的抑制作用,包括Yersinia ruckeri、哈维氏弧菌(Vibrio harveyi)、无乳链球菌(Streptococcus agalactiae)和维氏气单胞菌(Aeromonas veronii)。
此外,许多试验发现了将屎肠球菌添加到饲料中以改善鱼类生长和刺激免疫反应的功效。
肠球菌属(Enterococcus)普遍存在于人类及动物肠道内。正常情况下,肠球菌被认为是一种无害的共生菌,甚至被认为对许多胃肠道和全身疾病有积极作用。
然而,当与宿主的共生关系被破坏时,肠球菌可引起一些感染或疾病。目前,肠球菌是革兰阳性菌中仅次于葡萄球菌属的重要医院感染病原菌,其感染最常见的为尿路感染,其次为腹部和盆腔等部位创伤和术后感染、败血症、心内膜炎和脑膜炎。此外由于其具有耐药性,所致感染治疗困难。
注:目前几乎所有的院内肠球菌感染都是由粪肠球菌或屎肠球菌引起的。其中,粪肠球菌是致病性最强的菌种,但屎肠球菌的重要性日益增加,因为它通常对抗菌药物的耐药性更强。
肠球菌血流感染

肠球菌血流感染(BSI)与高死亡率相关。最近一项对加拿大医院的大型调查研究显示,住院患者肠球菌BSI发病率为每100000人 6.9 例,其中大多数病例由粪肠球菌引起(每100000人4.5例)。
• 肠球菌血流感染的死亡风险很高
在瑞士, 2008年至2014年间肠球菌血流感染发病率有所增加(每100000人9至14例),总体而言,院内肠球菌BSI的死亡率相当高,为25%至50%。
大多数肠球菌性血流感染病例被认为是肠球菌从肠道易位到血液所致。其他感染途径包括静脉注射、心内膜炎、尿路感染和脓肿。
肠球菌血流感染的死亡危险因素包括病情严重程度、患者年龄以及使用第三代头孢菌素或甲硝唑。
研究发现,感染溶血性、庆大霉素耐药粪肠球菌菌株的患者与感染非溶血性、庆大霉素敏感菌株的患者相比,三周内死亡风险增加5倍。
2
尿路感染
肠球菌是从尿路感染中分离出的最常见的革兰氏阳性菌,2011年至2014年期间,国家医疗保健安全网络报告了超过 20000 例病例。在这些病例中,超过50%是由粪肠球菌引起的,其次是“其他肠球菌种”(约30%)和屎肠球菌(约 20%)。
最令人担忧的是,约85%的屎肠球菌分离株对万古霉素具有耐药性,并且耐药分离株的比例每年都在增加。
3
心内膜炎
在肠球菌引起的感染中,感染性心内膜炎(IE)是治疗难度最大的感染之一。肠球菌占所有IE病例的10%至20%,其中大多数是由粪肠球菌引起的。
在感染性心内膜炎中,细菌在心内膜定植会导致组织内出现赘生物,并在细菌周围形成生物膜状基质,免疫系统或抗生素都难以穿透这些基质。
4
根管治疗失败
粪肠球菌(E. faecalis)是根管治疗失败的一个重要原因,部分原因是它对许多消毒剂和抗菌剂具有耐药性。
• 根管治疗常用的消毒剂无法完全杀灭粪肠球菌
在导致根管治疗失败的慢性和持续性根尖周围病变病例中尤其如此,24%~77%的病例中分离出粪肠球菌。氢氧化钙是根管治疗常用的消毒剂,已证实其本身无法完全杀死粪肠球菌,其他消毒剂如柠檬酸也是如此。
粪肠球菌能在根管内长时间耐受饥饿,并通过牙槽骨和牙周膜的血清复苏。获得充足食物后,粪肠球菌利用SprE和GelE蛋白酶及胶原结合蛋白Ace与牙本质结合并形成生物膜,进而影响根管治疗的效果。
注:一旦感染,最有效的治疗方法包括用次氯酸钠或洗必泰溶液长时间冲洗根管。在初始过程中使用洗必泰或次氯酸钠冲洗被认为是预防粪肠球菌感染根管和防止失败的最佳选择。
5
组织挫伤
肠球菌感染在宿主体内引发病理变化。这可能由宿主的炎症反应,或是粪肠球菌分泌的毒素、蛋白酶及有毒代谢副产物直接造成的组织损伤引起。
• 肠球菌脂磷壁酸具有炎症性
肠球菌脂磷壁酸(LTA)与多种生物过程有关,LTA的一些特性包括调节宿主的免疫反应和介导肠球菌粘附于宿主细胞。
研究发现肠球菌的LTA与革兰氏阴性菌的脂多糖一样具有炎症性。肠球菌结合物质(EBS)(至少部分源自 LTA)缺陷且蛋白质粘附素AS缺陷的粪肠球菌菌株在注射到兔子体内会诱发临床疾病症状。
• 肠球菌溶细胞素和蛋白酶对细胞具有一定毒性
肠球菌溶细胞素和两种蛋白酶(一种是锌金属蛋白酶(明胶酶)、一种是丝氨酸蛋白酶)是会导致疾病严重程度的分泌因子。溶细胞素的存在还被证实会促进粪肠球菌在血液中的出现。
这种毒素它既具有细菌素活性,又会对多种哺乳动物细胞类型有毒性。
使用兔眼内炎模型获得了由细胞溶素引起的病理损伤最直接和定量的证据。感染后24小时 β 波反应减弱和视网膜结构完全破坏明确证明了细胞溶素在组织病理学中的作用。
在无菌大鼠模型中,一种蛋白水解(Gel+)菌株表现出致龋活性,而三种非蛋白水解菌株几乎没有致龋性。
• 产生过量的过氧化氢造成细胞损伤

除了分泌蛋白外,粪肠球菌和屎肠球菌还被证明会产生有毒的氧代谢物,从而导致细胞或器官损伤。
一项研究表明,所检测的绝大多数(87/91)粪肠球菌菌株产生超氧化物(O2–),而屎肠球菌分离株产生超氧化物的频率较低。经研究推测,氧自由基的膜损伤作用可能会增强附近肠上皮细胞的细胞损伤。此外,细胞外超氧化物和过氧化氢的产生会损害结肠上皮细胞 DNA。
6
食源性肠球菌的危害
肠球菌的威胁不仅存在于临床感染。由于卫生条件差造成的污染导致食品中存在肠球菌也具有一定危害。粪肠球菌或屎肠球菌是造成手工和传统奶酪污染的最常见原因,但也发现了其他菌种(E.casseliflavus、E.durans、E.hirae和E.gallinarum)。
例如,从散装牛奶储罐中分离出E. casseliflavus和粪肠球菌。禽肉在加工过程中也可能被粪肠球菌和屎肠球菌污染,这种情况很常见。
• 对抗生素的耐药性会通过被肠球菌污染的食物传播
抗菌药物的广泛使用促进了耐药微生物的出现和传播。食物链是耐药性在环境和人类之间传播的关键因素。

人们发现临床材料和食物之间的细菌耐药性特征相似。最常见的是,这些细菌菌株对链霉素、红霉素、四环素和利福平表现出耐药性。
从即食食品中分离的肠球菌菌株中检测到氨基糖苷类、四环素类和大环内酯类药物的耐药基因水平转移。
研究显示,携带耐药基因的食源性肠球菌数量众多可能会显著降低抗生素治疗肠道感染的有效性。由于其高度适应能力,食物中的肠球菌会暂时或永久地定植于消化道,这增加了基因转移至肠道菌群的危险。
• 肠球菌会导致食物腐败
肠球菌也会导致食物腐败。它们会产生酪胺、组胺、苯乙丙氨酸、尸胺和腐胺等热稳定性胺,这些胺可引起过敏反应或中毒。
7
肠球菌在其他疾病中的丰度变化
通过查阅相关文献和谷禾的数据库,我们还发现肠球菌和以下疾病的联系:
• 移植物抗宿主病
一些细菌如肠球菌(Enterococcus spp.)与移植物抗宿主病(GVHD)高风险有关。
• 心力衰竭和房颤患者中丰度增加
与对照相比,心力衰竭患者肠道菌群中的肠球菌属(Enterococcus)丰度增加,在心脏病变患者中也观察到肠球菌属和肠球科的升高。
较多的基因和属种表明房颤患者体内可能存在多种有害细菌过度生长。瘤胃球菌(Ruminococcus)、链球菌(Streptococcus)、韦荣氏球菌(Veillonella)和肠球菌(Enterococcus)等在房颤患者中更为富集。
• 肥胖和炎症性肠病中肠球菌数量增加
肥胖是一种慢性代谢性疾病,引起肥胖的因素众多,如遗传因素、环境变化、生活和饮食习惯等,其中肠道微生物群的影响越来越受到人们的重视。
在属的水平上,分枝杆菌属、粪杆菌属、拟杆菌属、副拟杆菌属、粪杆菌属、毛螺菌属等显著减少,而梭菌属、芽孢杆菌属、布劳氏菌属、肠球菌属(Enterococcus)、萨特氏菌属、克雷伯氏菌属、柯林氏菌属、普雷沃氏菌属和乳酸杆菌属显著增加。
而在活跃期炎症性肠病与某些菌群的数量过多有关,如:
肠杆菌科(Enterobacteriaceae) ↑↑↑
梭杆菌属(Fusobacterium) ↑↑↑
咽峡炎链球菌(Streptococcus anginosus) ↑↑↑
肠球菌(Enterococcus) ↑↑↑
• 可能存在一定的致癌作用
肠道微生物群中的几种菌,这些细菌除了它们的致病性之外,还被可能对结肠直肠癌具有致癌作用,包括幽门螺杆菌、肝螺杆菌(Helicobacter hepaticus)、牛链球菌(Streptococcus bovis)、大肠杆菌、脆弱拟杆菌(B. fragiis)、败血梭菌(Clostnidium septicum)、粪肠球菌(Enterococcus faecalis)、具核梭杆菌(F.nucleatum)和牙龈卟啉单胞菌(Porphyromonas gingivalis),这些细菌都显示出潜在的致癌作用。
此外,肝外胆管癌患者体内也检测到大量肠球菌(Enterococcus)。
• 百岁老人肠球菌属含量较低
研究发现,与100岁以下人群相比,百岁老人体内肠道细菌(如拟杆菌属、脱硫弧菌属、瘤胃球菌科、乳杆菌、嗜粘蛋白阿克曼氏菌、发酵短杆菌属)含量较高,而Faecalibacter、普雷沃氏菌属、克雷伯氏菌属、链球菌属、肠杆菌属、肠球菌属含量较低。因此,我们推测肠球菌的丰度过高可能不利于健康。
肠球菌属(Enterococcus)是一种革兰氏阳性、兼性厌氧球菌,广泛存在于胃肠道中,在阴道或口腔中较少见。粪肠球菌(Enterococcus faecalis)和屎肠球菌(Enterococcus Faecium)是人类中最常见的菌种。作为共生菌,肠球菌定植于消化系统中并参与营养物质代谢及调节人类的免疫系统。
肠球菌还因其生物特性(酶和蛋白水解活性)而被用作食品发酵的发酵剂,或因其产生的抗菌细菌素(称为肠素)而被用作天然的食品生物防腐剂。一些特殊的肠球菌株还被用作益生菌,具有不同有益特性:如刺激免疫力、抗炎活性、降胆固醇作用以及预防/治疗肠易激综合征和抗生素引起的腹泻,减少鼻窦炎患者的复发等。
然而,就像一枚硬币的两面,尽管它们具有促进健康的特性,但它们可能具有有害特性。由于肠球菌菌株表现出复杂的毒力机制,使其能够在各种宿主组织中定植,并对许多抗生素具有耐药性,可能会导致耐药性的传播,肠球菌也被视为机会性病原体。
它们能够从胃肠道转移到各种组织和器官,进而造成感染或疾病。目前,肠球菌是革兰阳性菌中仅次于葡萄球菌属的重要医院感染病原菌,其感染最常见的为尿路感染,其次为腹部和盆腔等部位创伤和术后感染、败血症、心内膜炎和脑膜炎。此外由于其具有耐药性,所以感染治疗起来会更困难。同时,在心力衰竭、房颤、肥胖和炎症性肠病患者中发现了肠球菌属丰度的增加。

需要更深入地了解具体肠球菌种的健康益处、毒力特性,尤其是抗生素耐药性的增加,以便充分认识到肠球菌在改善健康和致病方面的复杂性。
通过深入理解肠球菌与宿主之间的微妙平衡,我们可以更好地利用这种微生物来促进人类健康,并开发新的治疗策略来对抗相关疾病。
主要参考文献
Krawczyk B, Wityk P, Gałęcka M, Michalik M. The Many Faces of Enterococcus spp.-Commensal, Probiotic and Opportunistic Pathogen. Microorganisms. 2021 Sep 7;9(9):1900.
Sangiorgio G, Calvo M, Migliorisi G, Campanile F, Stefani S. The Impact of Enterococcus spp. in the Immunocompromised Host: A Comprehensive Review. Pathogens. 2024 May 15;13(5):409.
García-Solache M, Rice LB. The Enterococcus: a Model of Adaptability to Its Environment. Clin Microbiol Rev. 2019 Jan 30;32(2):e00058-18.
Dubin K, Pamer EG. Enterococci and Their Interactions with the Intestinal Microbiome. Microbiol Spectr. 2014 Nov;5(6):10.1128/microbiolspec.BAD-0014-2016.
Kayser FH. Safety aspects of enterococci from the medical point of view. Int J Food Microbiol. 2003 Dec 1;88(2-3):255-62.
Byappanahalli MN, Nevers MB, Korajkic A, Staley ZR, Harwood VJ. 2012. Enterococci in the Environment. Microbiol Mol Biol Rev 76:.
Chajęcka-Wierzchowska W, Zadernowska A, Zarzecka U, Zakrzewski A, Gajewska J. Enterococci from ready-to-eat food – horizontal gene transfer of antibiotic resistance genes and genotypic characterization by PCR melting profile. J Sci Food Agric. 2019 Feb;99(3):1172-1179.
Fisher K, Phillips C. The ecology, epidemiology and virulence of Enterococcus. Microbiology (Reading). 2009 Jun;155(Pt 6):1749-1757.
Ramos S, Silva V, Dapkevicius MLE, Igrejas G, Poeta P. Enterococci, from Harmless Bacteria to a Pathogen. Microorganisms. 2020 Jul 25;8(8):1118.
Fiore E.Van Tyne D.Gilmore MS. 2019. Pathogenicity of Enterococci. Microbiol Spectr 7:10.1128/microbiolspec.gpp3-0053-2018.
Ben Braïek O, Smaoui S. Enterococci: Between Emerging Pathogens and Potential Probiotics. Biomed Res Int. 2019 May 23;2019:5938210.

谷禾健康

自闭症谱系障碍 (ASD) 是一种神经发育障碍,其特征是社交沟通和行为障碍,经常伴有兴趣或活动受限和重复的模式。遗传和环境都与自闭症有关。
近年来,多种类型的研究都将肠道菌群与自闭症的病因联系起来。前面我们的文章有提到,肠道微生物群影响宿主健康的许多方面,包括免疫系统控制、肠道激素调节和神经传递。它会改变摄入的药物及其代谢、毒素清除以及多种影响宿主的物质的产生。肠道菌群可以通过“肠-脑轴”的相互关系直接或间接地影响大脑。
近期研究表明,肠道微生物群可以通过中间细胞因子和代谢物诱发神经炎症。炎症偏差是肠道微生物群影响自闭症患者肠脑轴的潜在病因候选者。
神经炎症因素会导致肠道屏障完整性丧失、小胶质细胞激活和神经递质失调,从而导致自闭症。它强调了神经炎症中间体与自闭症患者肠道微生物群改变相关的潜在作用。具体而言,脑源性神经营养因子、钙卫蛋白、S100B、RANTES、嗜酸细胞趋化因子等细胞因子以及一些代谢物和微小RNA已被视为病因生物标志物。
了解肠道和大脑之间的相互作用,微生物群和神经炎症生物标志物的变化,是理解自闭症谱系障碍的病因、诊断、预后和治疗的基础背景。目前,自闭症谱系障碍的诊断是基于临床症状的,这可能会导致延误。基于与肠道微生物群相关的神经炎症过程的生物标志物可能是一种更客观精确可行的自闭症谱系障碍检测方法。
本文我们来详细了解一下神经炎症生物标志物在自闭症谱系障碍的发病机制和潜在诊断试验中的作用,还概述了益生菌及其他营养干预措施用作自闭症儿童的治疗策略及孕妇的饮食建议。
深入了解自闭症的复杂病理机制,结合生物标志物监测、肠道菌群管理和营养干预,或将为受影响的个体及其家庭提供更有针对性的支持和干预措施。
近 20 年前,有人提出了肠道菌群与自闭症之间的潜在关联。尽管自闭症的确切病因尚不完全清楚,但现有文献表明,自闭症患者存在肠道菌群失调和神经炎症。
自闭症的肠道菌群
总体而言,自闭症人群表现出菌群失调的迹象,与健康对照组相比,下列菌群和许多其他微生物的丰度有所不同:
拟杆菌门 / 厚壁菌门
普雷沃氏菌
梭菌属
乳杆菌属
双歧杆菌属
粪杆菌属
链球菌属
肠杆菌科
疣微菌属
梭杆菌门
大肠杆菌
肠球菌属
阿克曼菌属
考拉杆菌属
肠道菌群失调的识别与炎症途径
最近也有研究指出,自闭症儿童的肠道菌群失调和炎症可通过宿主粪便 DNA 特异性甲基化来识别。患有菌群失调的自闭症患者的炎症和免疫途径显著丰富,包括IL-2、IL-6 和 IL-12 的产生以及 Toll 样受体 (TLR3) 信号通路的激活。
多项研究一致证实了早期的发现,即菌群失调在各种神经退行性和神经精神疾病中会引起神经炎症。
自闭症儿童微生物组改变的潜在影响

doi.org/10.1016/j.bbr.2024.115177
菌群失调:免疫信号通路中断与自闭症严重程度
NLRP3炎症小体、1型干扰素和NF-κB信号通路等免疫信号通路的中断是菌群失调可能导致的后果之一。Th17/Tregs比例发生改变,巨噬细胞极化、TNF-α、IL-1β、IL-18、IL-6 失衡也是可能的。
另一方面,炎症和免疫失调已被证明与自闭症的发展和/或严重程度有关。先前对自闭症病例的研究表明,TNF-α、干扰素-γ、IL-2、IL-4、IL-5、IL-6、IL-8、IL-17、IL-10 等炎症标志物的水平升高。
神经炎症生物标志物与微生物交替和自闭症行为的关联研究


doi.org/10.1007/s10753-024-02061-y
关于自闭症患者肠道微生物组成和代谢物与炎症,这三个因素之间的确切关系需要进一步研究。总体而言,肠道菌群似乎通过炎症在自闭症中发挥关键作用。
一些研究已将蛋白质和肽类生物标志物作为自闭症早期诊断的研究对象。S100 钙结合蛋白 β 亚基 (S100B) 在星形胶质细胞和其他神经外细胞(包括EGC)中表达。
注:EGC,enteric glial cells,肠神经胶质细胞,EGC是肠神经系统的重要组成部分。它调节肠道稳态、参与维持肠黏膜屏障功能,调控炎症反应,在消化及非消化系统疾病中发挥着重要作用。
S100B对神经元的影响取决于浓度
浓度在几纳摩尔剂量下可产生营养作用,在微摩尔水平下可产生毒性。
S100B 促进神经炎症
细胞外蛋白 S100B 与促炎细胞因子协同作用,在较高浓度下可作为细胞因子,从而显著促进神经炎症。
自闭症 S100B 显著升高
尽管存在争议,但多项研究发现与健康人相比,自闭症患者的 S100B 显著升高,支持该因素在 ASD 的病因和发展中可能发挥的作用。
外周 S100B 浓度升高的来源可能是受损的神经元或 EGC。
在最近的一项研究中,血浆 S100B 水平与粪便钙卫蛋白浓度(胃肠道炎症状态的客观标志物)之间的相关性表明,不仅脑星形胶质细胞,还有 EGC 也可能参与自闭症的病理生理学。
肠道微生物群与S100B的相互作用
有一种假说认为,自闭症患者肠道胶质细胞衍生的 S100B 表达的改变可能是由微生物群改变、肠道屏障破坏甚至致病菌引起的,这些因素共同诱发肠道炎症并将 EGC 转化为反应性 EGC。
另一项小鼠体内研究表明,肠道微生物群的多样性随着 S100B 水平或口服给药而增加。
厚壁菌门(包括乳杆菌)和拟杆菌门(包括Barnesiella和丁酸杆菌属)均受 S100B 水平的影响。然而,在一组自闭症儿童中观察到拟杆菌门水平较高,而厚壁菌门水平较低。可以考虑研究 S100B 作为自闭症诊断和治疗中的潜在生物标志物。
BDNF(脑源性神经营养因子) 是神经生长因子家族(神经营养因子)的蛋白质成员。BDNF 在突触前位点(调节神经递质释放)和突触后位点(增强离子通道功能)中都发挥着关键作用,因此它通常会影响神经可塑性,从而影响行为相关疾病。
BDNF与自闭症病理生理学的关联
多种神经系统疾病都存在 BDNF 水平异常,包括精神分裂症、抑郁症甚至自闭症。最近的研究显示,与对照组相比,自闭症患者的 BDNF 水平发生了改变,这表明 BDNF 可能在自闭症病理生理学中发挥作用。
与重度自闭症相比,轻度表型患者的 BDNF 水平相对较高,强调了该因子可能具有保护作用。自闭症患者脑内抗凋亡信号通路中 BDNF 的下调是自闭症病理生理的可能机制之一。
作为神经保护剂的 BDNF 表达减少可能是由炎症因子(包括 IL-1β 和 TNF)升高引起的;因此,它可能在神经炎症中起负调节作用。
肠道菌群与BDNF的相互影响
自闭症患者肠道菌群失调可能通过免疫失调和释放穿过血脑屏障的炎症因子(如 IL-1β)导致这种炎症状态。
还需要进一步研究了解自闭症患者肠道微生物改变的诱导和改变,是否可以通过 BDNF 水平进行监测和控制。
受激活、正常 T 细胞表达和分泌的调节,RANTES(CCL5)和嗜酸细胞趋化因子(CCL11)是由多种细胞释放的促炎趋化因子,包括血细胞、成纤维细胞、内皮细胞、上皮细胞、神经元和神经胶质细胞。
详情展开如下:
RANTES
RANTES是一种重要的趋化因子,属于CC亚家族的β趋化因子。它由多种细胞类型表达和分泌,包括T细胞、单核细胞、NK细胞、上皮细胞和血小板等。
RANTES的主要功能是通过与其特异性受体结合来诱导白细胞向炎症部位迁移,从而在炎症反应中起关键作用。
这些受体包括CCR1、CCR3、CCR4和CCR5。RANTES不仅能够促进T细胞的活化和增殖,还能调节Th1/Th2细胞效应平衡。
嗜酸细胞趋化因子
嗜酸细胞趋化因子是一类属于CC趋化因子家族的小细胞因子,主要作用是选择性地募集嗜酸性粒细胞。
这些因子在多种组织中表达,并通过与特定受体结合来诱导嗜酸性粒细胞向特定位置迁移。主要包括CCL11、CCL24和CCL26。
不仅在过敏性疾病如哮喘和过敏性鼻炎中发挥重要作用,还参与了其他炎症反应和肿瘤的发展。
RANTES和嗜酸细胞趋化因子在自闭症中的神经炎症作用
自闭症儿童的血浆中 RANTES和嗜酸细胞趋化因子水平明显较高。由于RANTES和嗜酸细胞趋化因子充当促炎介质,它们的升高意味着两者都在 自闭症中发挥神经炎症作用。
尽管Shen等人报告 RANTES 或嗜酸细胞趋化因子与自闭症的行为模式之间没有显著相关性,但Han 等人和 Hu 等人分别发现 RANTES 和嗜酸细胞活化趋化因子与自闭症相关。此外,其他研究表明这两个因素的增加都与自闭症相关。
肠道菌群诱导RANTES介导的炎症
早期研究发现,NOD 样受体家族含有吡啶结构域的 6-肠道菌群轴以及随后的 IL-6 和 TNF 释放是肠道菌群失调与 RANTES 介导的免疫失调之间的可能联系。
关于基因编码的表达,已发现肠道菌群可以操纵嗜酸细胞活化趋化因子的表达水平。在这方面,接受抗生素治疗的小鼠的微生物组发生了改变,嗜酸细胞活化趋化因子升高,小胶质细胞结构不同。
小胶质细胞是中枢神经系统中的常驻免疫细胞,是抵御病原体和损伤的第一道防线。它们不断探测大脑环境,寻找感染、损伤或疾病的迹象。小胶质细胞对全身炎症信号特别敏感。TNF-α和IL-6等促炎细胞因子水平升高可激活小胶质细胞,使其从静息状态转变为活化状态。
激活的小胶质细胞可以吞噬细胞碎片、死细胞和病原体,并释放细胞因子和趋化因子来协调免疫反应。它们在中枢神经系统中发挥双重作用:促进炎症以抵御威胁,并在威胁过去后促进组织修复和炎症消退。慢性小胶质细胞活化与神经炎症有关。
粪菌移植与行为改善
此外,研究发现,小鼠的嗜酸细胞活化趋化因子水平在粪菌移植后发生了变化。关于肠道微生物群与自闭症的关系,在自闭症小鼠中,通过肠道微生物群移植,研究人员观察到焦虑样行为和重复性行为得到改善,而 RANTES 和嗜酸细胞活化趋化因子的水平得到改善。
这些结果表明,RANTES 和嗜酸细胞活化趋化因子在中枢神经系统突触传递和发育中起着重要作用,它们的水平与小鼠的微生物群结构有关。
特定菌群与趋化因子水平呈负相关
研究发现,梭菌科、丹毒丝菌科、普氏菌科、CandidatusArthromitus、变形杆菌属与 RANTES 和嗜酸细胞活化趋化因子的水平呈负相关。
通过益生菌改善
体内外用和口服益生菌治疗已报告与RANTES有关的菌株,包括副干酪乳杆菌SGL04、植物乳杆菌SGL07、发酵乳杆菌SGL10、短乳杆菌 SGL12裂解物以及鼠李糖乳杆菌GG有关。
同样,含有嗜酸乳杆菌、鼠李糖乳杆菌 GG和双歧杆菌的益生菌也改变了动物体内嗜酸细胞活化趋化因子基因的表达。
总的来说,这些研究的重要发现表明肠道菌群通过 RANTES和嗜酸细胞活化趋化因子的炎症因子在自闭症发病机制和严重程度中的潜在机制。
细胞因子粒细胞-巨噬细胞集落刺激因子 (GM-CSF) 驱动髓系造血细胞生物学的许多方面,包括存活、增殖、分化和功能活动。它还通过树突状细胞和 T 细胞功能影响免疫系统。GM-CSF 可引发中枢神经系统慢性炎症,并作为神经元生长因子刺激神经元和神经胶质细胞分化。
GM-CSF在自闭症中的复杂作用
一些早期研究认为自闭症患者的 GM-CSF 水平较低,但随后的研究在自闭症患者大脑中发现 GM-CSF 水平较高。
研究发现,在同时出现胃肠道症状的自闭症儿童中,GM-CSF-IL-1α、TNF-α 和干扰素-α 的水平较高。自闭症中 GM-CSF 水平的变化可能表明炎症过程可能与发育和神经免疫障碍有关。
Takada 等人的共培养实验结果首次表明,GM-CSF 诱导的巨噬细胞可抑制自闭症个体神经元的树突状生长。这种现象是通过促炎细胞因子IL-1α和TNF-α的分泌介导的,并可能导致更严重的行为影响。
肠道菌群与GM-CSF的关联
有趣的是,GM-CSF 水平随着肠道菌群的变化而变化,且主要与 IL-17a有关,IL-17a 是一种与 自闭症患者行为症状严重程度相关的细胞因子。
不同种类的肠道细菌与 GM-CSF 有关,包括副拟杆菌、普氏菌、链球菌、梭菌、罗伊氏乳杆菌、卷曲乳杆菌、粪肠球菌、布劳特氏菌、丁酸单胞菌、罗斯氏菌、Anaerotruncus、Blautia。一项重要发现表明,肠道菌群代谢物(如短链脂肪酸)可能会改变 GM-CSF 水平。
一项研究表明,使用含有长双歧杆菌、保加利亚乳杆菌和嗜热链球菌的益生菌可增加神经免疫因子 GM-CSF。
总之,肠道菌群改变导致 GM-CSF 神经炎症因子的变化,为了解自闭症患者发病机制提供了思路。
高迁移率族蛋白 1 (HMGB-1) 是 HMGB 蛋白家族中最丰富的成员之一,具有许多潜在作用。作为核蛋白,它在DNA调控活动中起关键作用。作为一种细胞外因子,它在免疫细胞对炎症作出反应时主动释放,也会被坏死或受损细胞被动释放。
HMGB-1的多功能性和在炎症中的作用
HMGB1 具有多种膜受体,称为病原体识别受体,其中 TLR4、TLR9 和晚期糖基化终产物受体 (RAGE) 是主要受体。通过与这些受体的相互作用,HMGB1可促进细胞炎症。HMGB1 可以穿过血脑屏障,促进神经突生长和细胞迁移,或介导损伤后的神经炎症。
HMGB-1与自闭症严重程度的相关性
已知自闭症患者血浆中的HMGB-1水平会升高,并且与自闭症的严重程度呈正相关。
另一种有效的炎症分子——表皮生长因子受体与自闭症儿童的症状严重程度有关,而 HMGB1 水平与之相关。
肠道功能障碍与HMGB-1水平的联系
研究发现,自闭症患者的 HMGB1 水平较高与胃肠道功能障碍较高有关,这可能意味着肠道是发病机制的一部分。
类似的研究表明,粪便中的HMGB1水平与自闭症儿童的胃肠道体征严重程度相关,这与自闭症相关的菌群失调有关。伴有肠道炎症的微生物群失调可导致单核细胞的激活,上调 HMGB1 的排泄,从而形成促炎反馈回路。
扩展阅读:炎症回路和肠道微生物
HMGB-1与自闭症行为表现的关联
较高水平的 HMGB1 和 TLR4 也与小鼠的自闭症样行为有关,可能是通过激活 HMGB1/TLR4 信号级联实现的。
自闭症儿童血清中 TLR4 水平升高,并且与他们的多动评分呈正相关。这进一步强调了炎症因子在自闭症行为表现中的作用。
HMGB-1在神经炎症中的作用机制
HMGB1/RAGE/TLR4 轴的激活会导致白细胞浸润到神经细胞中,从而引起持续的中枢神经系统炎症。有研究表明,神经炎症与自闭症的发生密切相关,其机制是激活炎症小体系统。此外,HMGB1 可以与内源性分泌性 RAGE 结合,导致血浆 RAGE 水平下降。这可能通过干扰神经肽催产素从外周到大脑的运输,导致自闭症的病理生理。
益生菌和肠道菌群改变对自闭症患者 HMGB1 水平的影响可以强化这一想法,并可以进一步研究。HMGB1 可能通过神经炎症在自闭症发病机制中发挥关键作用,并可以指导治疗策略。然而,它是自闭症病理生理学中一个非常潜在的因素,尚未明确阐明,需要更多研究。
骨桥蛋白 (OPN) 是一种可溶性促炎细胞因子,在自身免疫性神经炎性疾病中发挥着明确的作用,同时也是控制骨组织生物矿化的非胶原骨基质的组成部分。
OPN的功能多样,根据其位置和环境,OPN 参与局部炎症、细胞粘附、免疫反应、趋化性和防止细胞凋亡。
OPN在免疫调节中的作用
Heilmann 等人认为 OPN 可以在急性炎症期间激活免疫系统、减少组织损伤并刺激粘膜修复,同时在慢性情况下促进 Th1 反应并增强炎症。
OPN与神经系统疾病的关系
OPN 与多发性硬化症和阿尔茨海默病等神经心理疾病的发病机制有关。CD11c + 细胞表达分泌性磷蛋白1 及其编码蛋白 OPN 与阿尔茨海默病的认知障碍和常见神经病变有关。
注:CD11c+ 是一种在多种免疫细胞上表达的分子,主要与树突状细胞(DCs)相关。CD11c+ 标记物在免疫系统中具有重要的生物学功能。例如,在炎症性关节炎模型中,CD11c+ 树突状细胞的存在与疾病的严重程度呈负相关。
OPN在自闭症研究中的发现
有研究发现血清中 OPN 水平升高与病情严重程度有关,表明 OPN 在神经炎症和大脑特异性自身抗体的产生中的作用。他们的发现可以支持 OPN 是自闭症机制中重要神经炎症因子的观点。
在代谢紊乱中,人们讨论了 OPN 与肠道微生物群之间可能存在的相互作用。然而,OPN 与肠道微生物群在神经系统疾病(尤其是自闭症患者)中的作用尚未得到研究,这可能是未来研究的一个潜在目标。
钙卫蛋白是一种与钙结合的蛋白质,主要存在于中性粒细胞中,中性粒细胞是一种白细胞,在炎症和细胞损伤时会增加。
粪便中的钙卫蛋白可以指示肠道炎症,并可作为生物标志物。
钙卫蛋白与自闭症
考虑到肠道炎症在自闭症发展中可能发挥的作用,许多研究已经研究了自闭症患者中钙卫蛋白水平的关联,但结果并不一致。
一些报告显示,自闭症患者及其亲属的钙卫蛋白水平可能高于对照组。
钙卫蛋白与炎症及自闭症的关联
钙卫蛋白水平也与巨噬细胞炎症蛋白 1β 的较高表达呈中等相关性,而巨噬细胞炎症蛋白 1β 与自闭症诊断观察计划的沟通分量表和总分相关,表明它可能在微生物-神经元串扰中发挥作用。不太可能的是,一些研究发现自闭症患者和对照组之间的钙卫蛋白水平没有统计学上显著差异,因此,有和没有胃肠道症状的自闭症患者的钙卫蛋白水平没有明显变化。
钙卫蛋白水平与肠道菌群的关系
Laghi 等人的研究表明,钙卫蛋白水平较高与肠道中普雷沃氏菌较多和阿克曼氏菌减少有关,表明这些细菌可能分别具有炎症或保护作用。
益生菌疗法对自闭症患者的影响
Santocchi 等人发现益生菌疗法(包括 多种链球菌、双歧杆菌、乳杆菌)对自闭症患者的适应功能有有利影响,但对有或无胃肠道症状的钙卫蛋白水平没有明显影响。这表明益生菌对自闭症患者的影响比减少肠道炎症更为复杂,钙卫蛋白作为可能的神经炎症介质的作用应得到进一步研究。
总体而言,钙卫蛋白研究的异质性可能是由于试验个体的多样性、所用方法的准确性以及对微生物群改变和钙卫蛋白的同时研究不足造成的。但我们仍然可理解宿主微生物群失调和炎症诱导的钙卫蛋白会触发导致自闭症方面的神经炎症机制。
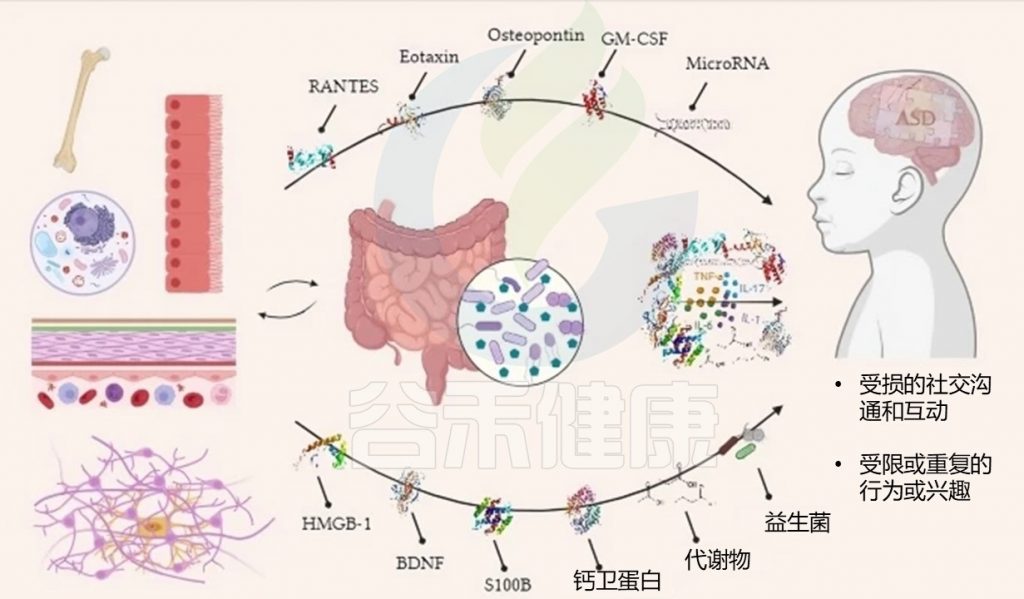
doi.org/10.1007/s10753-024-02061-y
在自闭症患者中,许多肠道微生物衍生的代谢物尤为突出,例如复合多糖或代谢氨基酸,它们可以作为神经递质。其中几种代谢物最近被讨论作为自闭症的早期诊断生物标志物。
特定菌群与短链脂肪酸的生产
肠道微生物通过一组重要的代谢物来调节宿主的生理机能,这些代谢物是短链脂肪酸,主要构成乙酸盐 (AA)、丁酸盐 (BTA) 、丙酸盐 (PPA)。
自闭症患者短链脂肪酸研究不一致
与某些研究不同,其他研究报告称自闭症患者的 乙酸盐、丙酸盐和丁酸盐水平高于对照组。这些肠道菌群相关的短链脂肪酸在宿主的炎症反应中表现出相互冲突的促炎和抗炎作用,可能是由于结合受体和局部浓度的差异。一些动物研究表明,补充微生物代谢物乙酸盐和丁酸盐可以逆转社会行为表型。
相反,在大鼠脑室内注射丙酸盐会诱发自闭症样症状,包括反应性神经胶质增生。丙酸盐可通过调节自闭症中的 PTEN/AKT 通路导致神经胶质增生、神经回路紊乱和神经炎症反应。
短链脂肪酸在自闭症和肠道微生物群中的意义

doi.org/10.1016/j.bbr.2024.115177
由于关于自闭症患者短链脂肪酸水平的发现数据不一致且尚待研究,因此需要进一步研究来验证短链脂肪酸在自闭症病理生理学中的潜在作用。它们可能被视为自闭症患者神经炎症生物标志物和肠道微生物群改变的指标。
COX1 和 COX2
脂质是大脑的主要成分,脂质代谢物是大脑发育和体内平衡的调节分子。作为脂质介质的主要脂质代谢物是前列腺素 (PG) 和白三烯 (LT),它们分别由花生四烯酸 (AA) 和其他不饱和脂肪酸在环氧合酶 (COX) 和脂氧合酶 (LOX) 的代谢下代谢。
已知 PGE2 信号在大脑形态形成中发挥作用,COX2/PEG2 信号受损与 MIA 模型中的自闭症发病机制有关。COX 通路涉及两种限速酶,COX-1 和 COX-2。
用于诱导 MIA 的内毒素和 MIA 模型中产生的炎症介质(IL-1β、IL-6、TNF-α、IFN、AA)均可诱导 COX-2。此外,有证据表明 COX-2 介导 N-甲基-D 天冬氨酸 (NMDA) 神经毒性。
COX2 和 自闭症
先前的研究使用自闭症患者的外周血单核细胞作为小胶质细胞的替代品,观察到在先天免疫刺激下上述细胞因子的产生增加。这种增加发生在有微生物感染后行为症状和认知功能波动史的自闭症患者中。有趣的是,自闭症患者血浆中的 COX-2 和 PGE2 升高,同时 α-突触核蛋白水平降低。因此,阻断 COX-2 可能有助于减轻自闭症患者的神经炎症和随后的神经元损伤。另一方面,脑中 COX-2 的上调可能具有神经保护作用,部分调节脑血流。
关于 COX-2 抑制剂在 ASD 患者中的临床试验数据很少。只有一项随机、双盲、安慰剂对照试验研究了 COX-2 抑制剂塞来昔布对 ASD 患者行为症状的疗效。
该试验将塞来昔布作为利培酮的辅助治疗,持续 10 周;使用异常行为检查表 (ABC) 评估行为症状。发现ABC分量表的易怒、嗜睡和刻板行为有显著改善。
当使用塞来昔布控制病毒性流感等综合征引起的 自闭症行为症状恶化时,也经常观察到 COX2 抑制剂塞来昔布减轻行为症状。吡格列酮具有多种抗炎作用,包括抑制小胶质细胞上 COX-2 的表达。吡格列酮对创伤性脑损伤有有益作用。
综上所述,COX-2抑制剂可能对有COX2激活迹象的自闭症患者有益,尤其是在急性和/或亚急性期。
自闭症患者中犬尿氨酸代谢产物的变化
例如,自闭症的患者尿液中神经毒性色氨酸代谢物的浓度增加。有报道称,自闭症患者中犬尿氨酸代谢物的靶分子 NMDAR 亚基的多态性 ,以及其他色氨酸代谢物的水平改变。
据报道,大约三分之一的自闭症患者具有高循环 5-HT 水平,这主要反映了肠道产生并储存在血小板中的 5-HT。5-HT 水平的变化可能与肠道 5-HT 代谢的变化和/或肝脏和肺部 5-HT 清除率的变化有关。然而,高血清素血症和特征性 ASD 行为症状之间的关联尚未得到一致证实。
同样,抑制 5-羟色胺再摄取转运蛋白 (SERT) 作用的选择性 5-羟色胺再摄取抑制剂 (SSRI) 对 自闭症患者并没有普遍有益的作用。这些发现表明,其中存在复杂的潜在机制。
有趣的是,对主要致病成分和生物内表型(包括血液中 5-羟色胺水平)的分析发现,与自闭症患者的免疫功能障碍有关。在同一研究人群中,免疫成分对表型变异的贡献最大;这些结果支持免疫激活对自闭症受试者血清素代谢的影响。
色氨酸影响大脑功能的 4 种不同途径
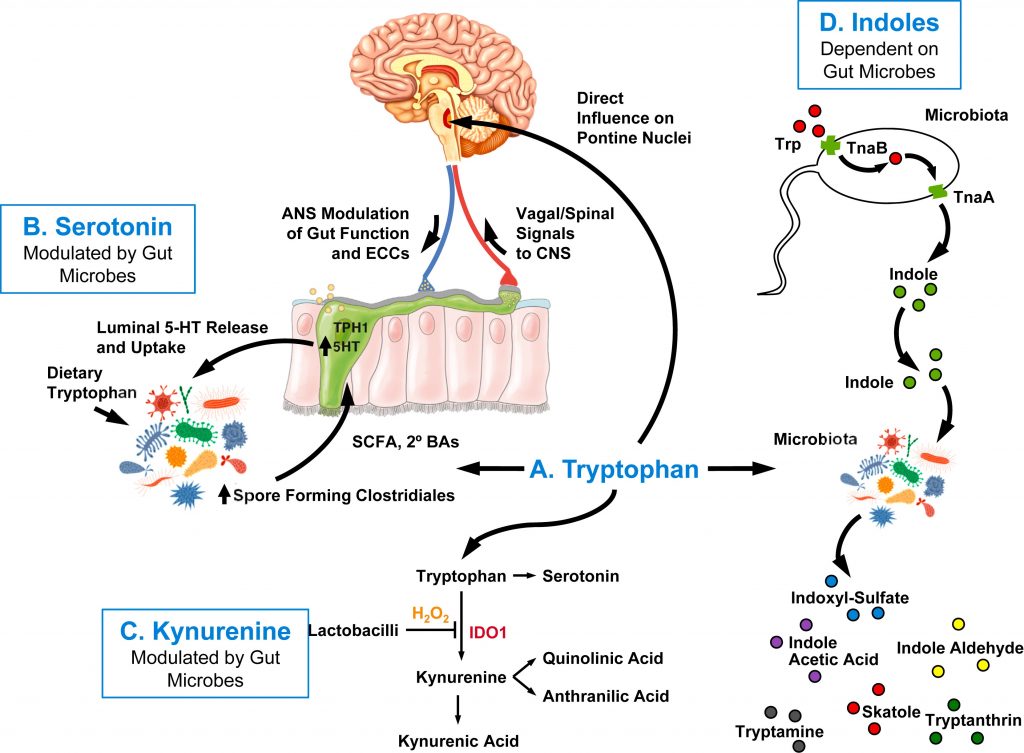
doi.org/10.1016/j.biopsych.2023.10.018
色氨酸[A]、血清素[B] 、犬尿氨酸[C]、吲哚[D]。其中三种途径依赖于肠道微生物代谢,而另一种途径中,色氨酸通过体循环到达缝核,无需微生物修饰。
自闭症与血清素代谢物研究的总结
SERT多态性与自闭症
米诺环素对色氨酸代谢的影响
当色氨酸代谢物的复杂稳态受损时,米诺环素可能对特定情况有效,从而导致犬尿氨酸代谢物的毒性作用恶化。将米诺环素用作自闭症患者的治疗选择需要谨慎选择自闭症患者。
miRNA 在神经系统中的作用
超过 60% 的人类基因受微小 RNA (miRNA) 控制,微小 RNA 是一种小型非编码 RNA,长度约为 18 到 24 个核苷酸,可作为表观遗传调控因子。miRNA 可改变大脑的可塑性和神经元的发育,其失调会导致多种神经系统疾病,包括自闭症。miRNA 已充分证实其可调控多种细胞和生理过程,包括造血、免疫反应、炎症。此外,miRNA 还受宿主-微生物群相互作用的影响,并在菌群失调和诱发炎症中发挥关键作用。
miR-146a 是自闭症中失调最严重的miRNA
一项深入研究发现,自闭症患者中存在过度表达的 miRNA,它们可能通过失调的炎症基因在神经发育受损中发挥作用。
此外,一些研究还发现,miRNA 通过与调节炎症小体表达的 3′-UTR 基因相互作用直接或间接激活炎症小体。具体而言,动物研究表明 miR-146a 的增加或减少可能是自闭症的潜在原因。
一项产后临床研究比较了自闭症和健康对照者的 miRNA,证实 miR-146a 是自闭症中失调最严重的 miRNA。
miR-146a 和 miR-155 在自闭症中的作用
另一项使用体外模型和死后人脑组织的研究也发现,早在儿童时期即可在自闭症患者脑中检测到 miR-146a 过表达。肠道菌群-宿主相互作用的变化可能诱导 miR-146a,从而促进神经炎症途径。值得注意的是,miR-146a 诱导的核因子 κB 增强了肠-脑轴的炎症信号通路。
研究表明,脆弱拟杆菌、鼠李糖乳杆菌 GG、嗜酸乳杆菌、保加利亚乳杆菌和大肠杆菌Nissle 1917与 miR-146a 表达相关。
另一项研究表明,miR-146a 对某些炎症细胞因子表达至关重要,其在大脑中的缺失会导致 miR-155整体补偿性上调。蛋白质羰基化增强和半胱氨酸硫醇水平降低是氧化应激介质激增导致神经炎症通量升高的额外指标。
miR-146a和miR-155如何与慢性炎症相关?
多项研究已将 miR-146a 和 miR-155 与慢性炎症所指的各种病理状况联系起来。一种可能的解释是,肠道毒素(如 LPS)能够穿过血脑屏障并进入体循环,可能激活 NF-kB-miRNA-146a-miRNA-155 信号通路。该通路会将来自微生物组的致病信号传递到大脑,这可能会扰乱先天免疫反应并导致神经炎症。
肠道菌群失调也可能改变 miR-155
一项研究增加了证据表明,自闭症儿童的杏仁核、额叶皮质和小脑中的 miR-155 表达增加。miRNA-155 参与细菌脂多糖对 TLR 的激活、肿瘤坏死因子-α 和 IL-6 的激活以及对树突状细胞上细胞因子信号传导抑制因子 1 的调节。这些活动,加上微生物群失调的变化,可以使 miRNA-155 成为肠脑轴和自闭症神经炎症机制中的候选角色。
早期研究发现,发酵乳杆菌、唾液乳杆菌、鼠李糖乳杆菌GG、嗜酸乳杆菌、德氏乳杆菌、双歧杆菌和大肠杆菌 Nissle 1917 等益生菌可以改变 miR-155的水平。
miR-181在自闭症中的潜在影响
研究发现自闭症患者的 miR-181 上调,预计会影响自闭症相关的神经连接蛋白 1基因。神经炎症和免疫失调是与 miR-181 家族相关的众多生理过程中的两种。
另一方面,一些研究表明肠道菌群可以调节小鼠的 miR-181。还有研究显示,鼠李糖乳杆菌和德氏乳杆菌益生菌会影响炎症疾病中 miR-181a 的表达。此外,来自肠道菌群的代谢物可能影响不同状态下的 miR-181表达。总之,这些证据强化了 miR 介导肠道微生物群可能通过自闭症中的神经炎症过程发挥作用的论点。
生酮饮食对miRNA及自闭症的影响
一项小型介入性随访研究,分析七名儿童包括在生酮饮食之前和生酮饮食 4 个月之后收集的血液和粪便样本。经过 4 个月的随访发现,生酮饮食 导致促炎细胞因子(IL-12p70 和 IL-1b)和脑源性神经营养因子 (BDNF) 的血浆水平下降。肠道微生物群的变化、肠道中丁酸激酶表达的增加以及血浆中 BDNF 相关 miRNA 水平的变化。这些队列研究结果表明,生酮饮食可能通过减少炎症、逆转肠道微生物群失调以及影响与大脑活动相关的 BDNF 通路对自闭症社交能力产生积极影响。
生酮饮食诱导的神经炎症变化的拟议间接途径
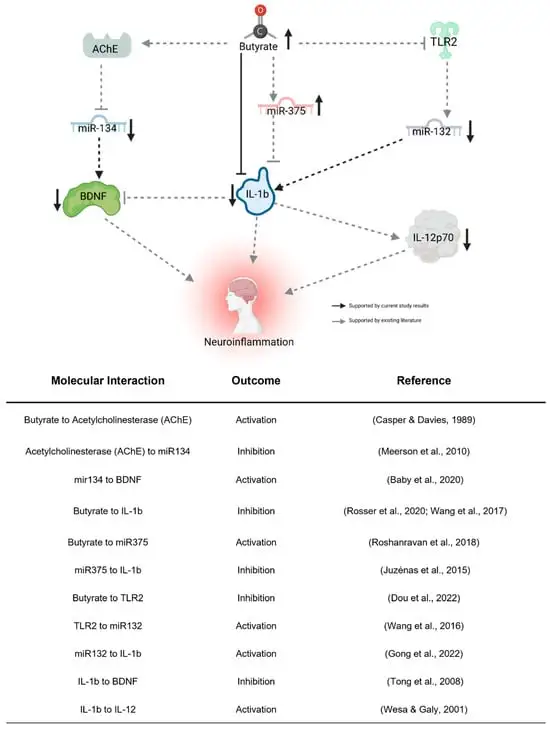
doi.org/10.3390/nu16101401
益生菌可以通过各种机制影响宿主的健康。据最近的研究,它们可以作为治疗工具,通过恢复肠道菌群的健康平衡、调节组织中的神经递质水平以及减少肠道炎症来治疗自闭症。
动物模型显示,益生菌显著改变了大鼠的社交和情感行为以及血液中 IL-6、IL-17a 和 IL-10 等细胞因子的水平。另一方面,只有少数试验从炎症调节和免疫系统调节方面评估了益生菌对自闭症的影响。
益生菌在炎症和自闭症管理中的作用试验

doi.org/10.1007/s10753-024-02061-y
有研究评估了婴儿双歧杆菌与牛初乳产品联合用于自闭症儿童的情况。一些患者出现胃肠道症状和异常行为的频率较低,可能是由于TNF-α和 IL-13 减少所致。
益生菌对自闭症儿童炎症标志物和症状的影响
有研究表明,粪便中TNF-α水平与自闭症严重程度之间存在很强的相关性,表明胃肠道炎症和通透性可能通过炎症途径参与自闭症。他们可以通过补充益生菌(包括乳酸杆菌、双歧杆菌和 链球菌)显著降低自闭症儿童粪便中的TNF-α水平。
在患有胃肠道问题的自闭症儿童亚组中,益生菌治疗组的一些胃肠道症状、适应性功能和感觉状况比安慰剂治疗组有较大改善。
益生菌混合物的应用
目前尚无针对自闭症核心缺陷的药物。因此,迫切需要为自闭症患者开发新的药理学方法。总体而言,这些发现表明益生菌可能是一种有前途的治疗方法,因为它们对自闭症症状有有益的影响。考虑到免疫系统功能障碍与行为异常之间存在关联,以及肠道微生物群可能通过炎症介质对 自闭症产生影响,建议在益生菌给药期间检查神经炎症变量,并确定改变这些变量的最有效配方。
无麸质和无酪蛋白饮食
研究发现,单纯的无麸质饮食对自闭症儿童的症状、行为或智力能力没有显著影响。
当无麸质饮食结合其他干预措施(如维生素、矿物质、必需脂肪酸、肉碱、硫酸镁浴、消化酶和无酪蛋白、无大豆饮食)时,观察到在非言语智力能力和自闭症症状方面有显著改善。
改良的生酮无麸质饮食
一项研究评估了补充MCT的改良生酮无麸质饮食对自闭症症状的影响,为期3个月的干预导致自闭症核心特征显著改善。
低FODMAP饮食
一项实施低FODMAP饮食的研究在自闭症儿童中未发现行为问题的显著差异。
适合自闭症谱系障碍儿童的饮食模式
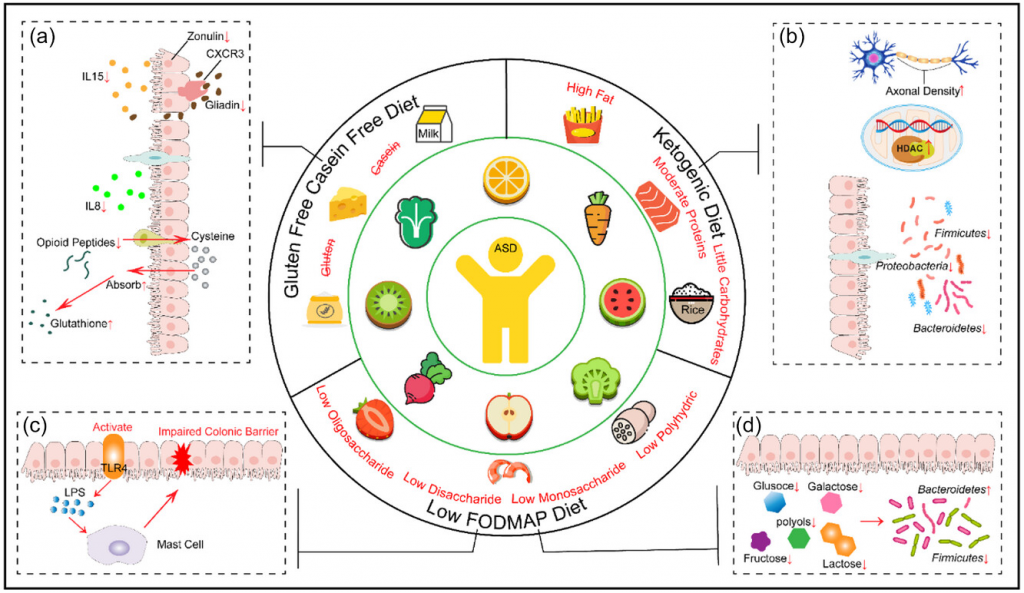
doi.org/10.1002/fft2.380
a)无麸质/无酪蛋白(GFCF)饮食可以使肠黏膜组织正常化,恢复肠上皮细胞对半胱氨酸的吸收,提高谷胱甘肽水平,增加甲基供体,防止甲基化抑制;
b)生酮饮食(KD)可以优化肠道菌群结构,降低厚壁菌门、拟杆菌门和变形菌的丰度,调节组蛋白去乙酰化酶活性,增加脑神经元轴突的密度;
c、d)低发酵寡糖-双糖-单糖-多元醇(FODMAP)饮食可以通过激活toll样受体修复受损的结肠屏障,同时调节肠道菌群以恢复肠道稳态。
必需脂肪酸补充
多项研究调查了ω-3脂肪酸补充对自闭症症状、发展年龄和营养状况的影响。综合分析显示,ω-3脂肪酸补充显著改善了干预组的刻板行为、多动、社交沟通、非言语智力能力、发展和营养状况。
肉碱
肉碱补充在自闭症患者的一年营养计划中显示出改善非言语智力能力和症状的效果。
萝卜硫素
萝卜硫素是一种存在于十字花科蔬菜中的膳食异硫氰酸酯,是一种营养保健食品。几项研究探索了萝卜硫素在自闭症治疗中的潜力,报告显示在行为和生化标志物方面有所改善。
多项研究调查了维生素补充对自闭症患者症状严重程度和生活质量的影响。
维生素A
维生素A补充对自闭症症状有显著缓解作用,特别是通过增加血清中的维生素A水平来改善社交响应性。
维生素D
维生素D补充在减少多动、减轻易怒方面有效,并可能与ω-3联合使用时进一步改善自闭症症状。
矿物质
锌的补充被认为可以增强自闭症患者的认知-运动功能。
肌肽
肌肽补充对自闭症儿童的睡眠障碍有积极作用,但对自闭症症状的严重程度影响不大。
益生元
一项针对 30 名自闭症儿童的为期 6 周的研究表明,益生元干预显著减轻了胃肠道不适并改善了排便,但对睡眠或胃肠道症状没有显著影响。研究发现,韦荣球菌科和双歧杆菌减少,拟杆菌属和普拉梭菌增加。
一项为期 12 周的小规模试点研究针对 8 名患有 自闭症和胃肠道合并症的儿童,发现益生元补充剂可显著减少异常行为(嗜睡、多动、刻板行为和易怒)并改善胃肠道症状,这可能是由于肿瘤坏死因子α 和IL-13 的产生减少所致。

doi.org/10.1016/j.rasd.2024.102352
近期研究表明,孕妇饮食中某些营养素含量高与患自闭症的风险增加有关。
在这些饮食因素中,孕妇饮食中水果和蔬菜上的农药残留可能是导致胎儿神经发育异常的重要暴露因素。
孕妇蛋白质营养不良和高咖啡因摄入量均与胎儿发育受限和后代患自闭症的风险增加有关。
每日盐的摄入量也可能是一个条件性危险因素。具体而言,盐摄入量增加对身体免疫系统和肠道微生物群有显著影响,导致肠道稳态失衡和炎症的发生,进一步通过菌-肠-脑轴导致神经发育异常。
母亲怀孕期间不良的饮食模式会增加后代患自闭症的风险。例如,高能量、高密度饮食和西式饮食均可导致自闭症发病率增加。
与这些不良饮食因素相反,怀孕期间摄入足够的维生素和 omega-3 多不饱和脂肪酸与后代自闭症发病率较低相关。
此外,增加孕妇膳食中的锌含量可以预防与自闭症相关的社交缺陷和焦虑症状。除了避免上述与孕期不良饮食有关的潜在风险因素外,患有糖尿病、肥胖或高血压等潜在风险的孕妇应特别注意每日膳食摄入量。
肥胖孕妇的饮食建议
基于人群的流行病学调查发现,母亲肥胖和怀孕期间体重大幅增加均与后代患自闭症的风险增加有关。
膳食纤维摄入不足会导致肠道中的短链脂肪酸水平异常。高膳食纤维干预和短链脂肪酸疗法可以缓解由此产生的后代的认知和社交功能障碍。高纤维饮食可能减少突触损伤和小胶质细胞缺陷,降低后代神经发育障碍风险。所有母亲无论胖瘦,都应在怀孕期间避免高脂肪饮食,以降低后代患精神疾病的风险。
动物研究表明,母鼠的高脂饮食选择性地促使雄性子代脑内免疫细胞过度消耗5-HT,从而导致神经系统异常。
孕期高脂、高糖饮食可能导致炎症介导的神经发育障碍,增加自闭症风险。肥胖女性在孕期应限制脂肪和糖摄入,增加膳食纤维摄入,以降低后代精神疾病风险。
糖尿病孕妇的饮食建议
众多研究发现母亲孕期患糖尿病与子代罹患自闭症风险增高显著相关。
短暂性高血糖可能引发持续性表观遗传改变和紧密连接蛋白表达抑制,伴随活性氧产生和超氧化物歧化酶(SOD)表达的抑制。动物研究显示,高血糖可诱导子代杏仁核中活性氧产生和SOD表达抑制,诱导自闭症样表型。
母亲糖尿病介导的氧化应激可能导致消化道功能障碍、肠道通透性增加、肠道微生物组成改变和神经元基因表达抑制,最终导致后代出现自闭症表型。母亲糖尿病可能抑制造血干细胞SOD表达、诱导炎性细胞因子,导致子代自闭症患者免疫功能紊乱。
妊娠期糖尿病女性应控制碳水化合物摄入,适量摄入具有抗糖尿病作用的食物,如洋葱和苦瓜。传统植物,如葱属、苦瓜属和荆芥属植物,含有抗糖尿病功效成分,可能有助于控制血糖。
维生素B6和维生素D的补充对降低后代罹患自闭症风险和改善糖尿病相关并发症有益。矿物质如锌和铬有助于保护糖尿病患者免于产生胰岛素抵抗。
妊娠高血压孕妇的饮食建议
妊娠期高血压与后代神经发育障碍和自闭症风险增加有关。
DASH饮食是一种有效的降低血压的饮食干预措施,通过增加粗粮、蔬菜、蛋白质、纤维素、钙和钾的摄入,并限制食盐摄入,可以显著降低血压。高质量的DASH饮食还与降低后代焦虑、行为缺陷和神经发育障碍的风险相关。
补钙和增加膳食钾的摄入也有助于预防妊娠高血压。此外,高血压的发病与肠道菌群有关,通过增加南美油藤的摄入量,可以缓解高血压。
类风湿性关节炎孕妇饮食建议
母亲类风湿性关节炎也与后代患自闭症的风险增加有关,可能通过炎症或免疫机制导致自闭症的发展。目前尚无特定的饮食模式来预防这种风险,但食用具有抗炎症或自身免疫反应的食物,如含有酚类和三萜类化合物的水果和蔬菜,可能是一种潜在的替代方案。
需要进一步研究来探索孕期饮食与菌群和炎症之间的联系,并开发有效的预防策略。
扩展阅读:深度解析 | 炎症,肠道菌群以及抗炎饮食
鉴于自闭症病理生理的复杂性和不明确性,近年来人们对炎症机制和免疫失调的作用进行了研究。自闭症中的失调途径在病因上也可以追溯到肠道微生物群失调。
这些变化可能通过释放的代谢物、BDNF的神经信号通路和神经炎症生物标志物(包括 S100B、HMGB-1、OPN、miRNA、RANTES、嗜酸细胞趋化因子和 GM-CSF)与自闭症症状和严重程度有关。
本文强调了介质作为触发机制和桥梁作用,一方面是肠道微生物群失调引起的炎症,另一方面是自闭症中枢神经系统神经炎症过程。益生菌作为恢复自闭症微生物群的适用治疗选择,表明肠道微生物群的相关性和潜在的有益影响。
然而,考虑到微生物群改变类型、神经炎症介质的巧合、干预时间长度以及自闭症年龄和症状等个体差异,评估个体肠道菌群状况以及不同益生菌及其他配方的功效对于自闭症的干预至关重要。
随着对微生物群与自闭症关系的深入理解,一个多维度的临床视角逐渐显现。我们可以通过分析微生物群的变化、相关的代谢产物、神经炎症介质以及它们与自闭症患者中枢神经系统的相互作用,在临床上描绘出自闭症的发展轨迹,这些研究的整合可能有助于我们构建一个综合的框架,用于自闭症的早期识别、干预和长期管理。
主要参考文献
Zarimeidani F, Rahmati R, Mostafavi M, Darvishi M, Khodadadi S, Mohammadi M, Shamlou F, Bakhtiyari S, Alipourfard I. Gut Microbiota and Autism Spectrum Disorder: A Neuroinflammatory Mediated Mechanism of Pathogenesis? Inflammation. 2024 Aug 2.
Yu R, Hafeez R, Ibrahim M, Alonazi WB, Li B. The complex interplay between autism spectrum disorder and gut microbiota in children: A comprehensive review. Behav Brain Res. 2024 Aug 2;473:115177.
Allan NP, Yamamoto BY, Kunihiro BP, Nunokawa CKL, Rubas NC, Wells RK, Umeda L, Phankitnirundorn K, Torres A, Peres R, Takahashi E, Maunakea AK. Ketogenic Diet Induced Shifts in the Gut Microbiome Associate with Changes to Inflammatory Cytokines and Brain-Related miRNAs in Children with Autism Spectrum Disorder. Nutrients. 2024 May 7;16(10):1401.
Li, Wentian, et al. “Dietary nutrients that potentially mitigate autism spectrum disorder and dietary recommendations for children and pregnant women.” Food Frontiers 5.3 (2024): 920-946.
Aldegheri, Luana, et al. “Impact of Human Milk Oligosaccharides and Probiotics on Gut Microbiome and Mood in Autism: A Case Report.” Microorganisms 12.8 (2024): 1625.
Ross FC, Mayer DE, Gupta A, Gill CIR, Del Rio D, Cryan JF, Lavelle A, Ross RP, Stanton C, Mayer EA. Existing and Future Strategies to Manipulate the Gut Microbiota With Diet as a Potential Adjuvant Treatment for Psychiatric Disorders. Biol Psychiatry. 2024 Feb 15;95(4):348-360.
Kim J. Autism Spectrum Disorder and Eating Problems: The Imbalance of Gut Microbiota and the Gut-Brain Axis Hypothesis. Soa Chongsonyon Chongsin Uihak. 2024 Jan 1;35(1):51-56.
Camberos-Barraza, J.; Guadrón-Llanos, A.M.; De la Herrán-Arita, A.K. The Gut Microbiome-Neuroglia Axis: Implications for Brain Health, Inflammation, and Disease. Neuroglia 2024, 5, 254-273.
Jyonouchi H. Autism spectrum disorder and a possible role of anti-inflammatory treatments: experience in the pediatric allergy/immunology clinic. Front Psychiatry. 2024 Jun 24;15:1333717.

谷禾健康

众多的文献和谷禾之前写过的文章都阐述了微生物群与人类健康密切相关。这种联系甚至可能在还未出生的时候就已经开始形成。微生物群的存在和活动从母体怀孕前到幼年的过程中,持续地参与和调节着人体的各种生理功能,从而在每一个生命阶段都扮演着至关重要的角色。
在受孕之前,男性和女性生殖道中的微生物就具有关键作用,它们可以在受孕期间产生影响。例如女性阴道、子宫颈内膜、子宫、输卵管和卵巢中的微生物群,其特征是生物量低,并且与生殖和子宫健康相关。精液微生物群可能会干扰受孕和早产。据报道,怀孕期间典型的精液细菌(如嗜酸乳杆菌)的存在率较高与早产有关,而另一种常见的精液细菌——卷曲乳杆菌(Lactobacillus crispatus)被确定为具有保护作用。
在怀孕期间,母体微生物的变化与所经历的生理和激素变化同步。阴道微生物多样性降低,乳杆菌成员增加,潜在地加强了它们的免疫保护功能,而较低水平的乳杆菌与早产风险增加相关。妊娠三个月后肠道中促炎的微生物更丰富,产短链脂肪酸的微生物减少。同时妊娠期口腔微生物群的特征是活菌数量增加,同时致病菌水平较高。需要注意的是,口腔生态失调与妊娠期糖尿病、先兆子痫和胎儿紊乱的风险增加相关。
此外,母婴间的垂直传播与婴儿健康相关。一些有益菌种(双歧杆菌、乳杆菌)可以从母亲传播到婴儿体内并定植。但与此同时,一些抗生素抗性基因也会随着微生物的转移,从而使新生儿对一些药物具有耐药性,这将不利于一些新生儿疾病的治疗。
因此了解从受孕到生命最初几年期间关键的微生物群非常重要。本文总结了有关人类生殖微生物群的现有证据,以及生命早期的微生物集群,重点是对婴儿发育和健康结果的潜在影响。
研究还发现:包括特定益生菌和其他益生菌混合物在内的一些饮食策略可能会成为潜在的工具,调节母婴微生物群,并在整个生命周期中实现健康结果。
★ 生命早期的微生物群对代谢和免疫非常重要
生命的前1000天(即从怀孕到出生后的前2年)对于先锋微生物在人体内的定植以及免疫系统的发育和成熟都是至关重要的。因此,这一时期被认为是一个“关键时期”,在此期间,任何事件都将对代谢、免疫和微生物行为产生关键影响,从而影响人类健康。
而对逐步形成的新生儿微生物群的任何改变和破坏都有可能在短期和长期增加个体患病的风险和倾向。
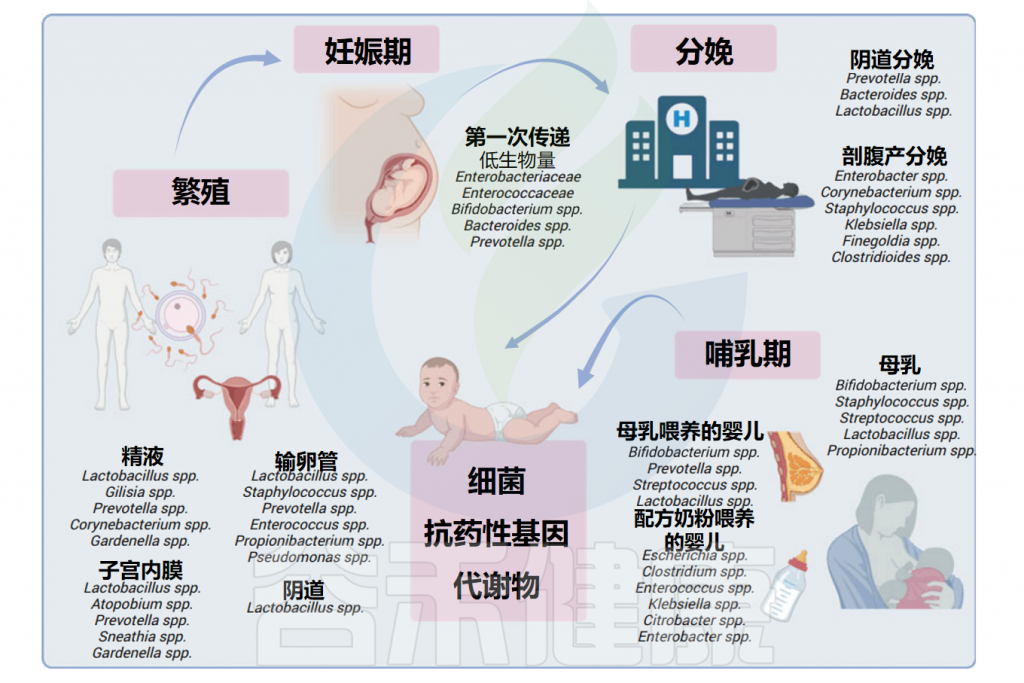
▸ 阴道微生物群
母体微生物群是新生儿最相关的产前和产后微生物来源。
阴道微生物群是一个复杂的生态系统,大约由200多种细菌组成,最主要的阴道种群是乳杆菌(Lactobacillus),在阴道中已检测出超过20种乳杆菌,占细菌群落的近70%。以及其他不太丰富的细菌,如普雷沃氏菌属、链球菌属、拟杆菌属和韦荣氏球菌属。
✦ 阴道微生物群主要分为五种类型
阴道微生物群主要分为五种类型,它们在组成和丰度方面都不同,每个类型都会以一种细菌为主导:
卷曲乳杆菌(CSTI),加氏乳杆菌(CSTII),惰性乳杆菌(CSTIII),多元组(CSTIV表现出较低的乳杆菌属丰度)和詹氏乳杆菌(CSTV)。
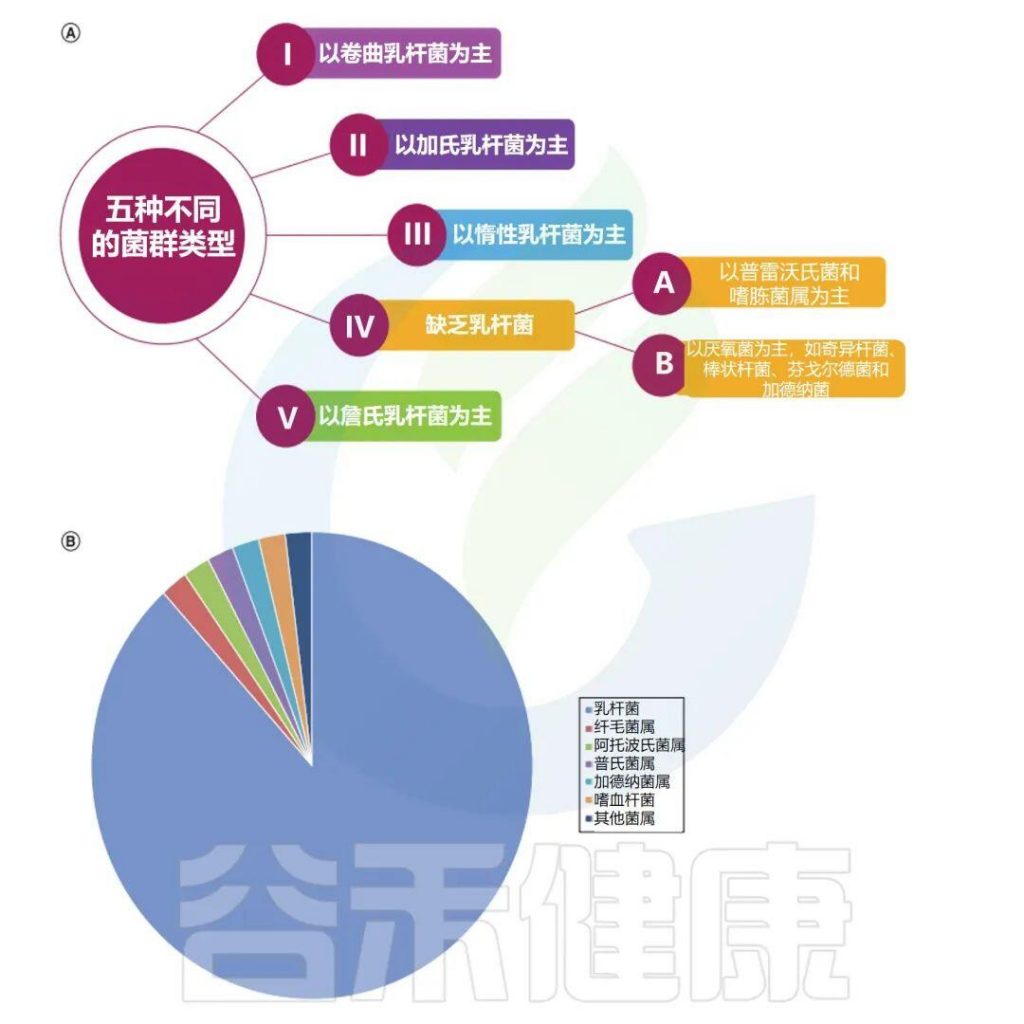
阴道微生物群会因地理位置、种族和卫生条件而异。例如,在美国的非裔美国人和西班牙裔妇女中CSTIV的丰度较高,这些成员在维持低pH值和代谢物分泌中起重要作用,以防止病原体在阴道中定植。
✦ 阴道微生物群会随激素水平、分娩、母乳喂养而变化
越来越多的研究证据表明阴道微生物群是阴道健康的重要生物标志物。然而,阴道微生物群并非一成不变。事实上,阴道微生物群显示出时间动态变化,有些群落发生变化,有些则相对稳定,这取决于核心菌群。

最近一项涉及比利时3345名妇女(18-98岁)的研究显示,阴道微生物群与激素变化(雌激素水平和避孕药的使用)正相关。
相反,阴道微生物群与分娩和母乳喂养等因素呈负相关。此外,同一项研究表明,富含阴道加德纳菌(Gardnerella)、普雷沃氏菌属(Prevotella)和拟杆菌(Bacteroides)的阴道微生物群与更年期、月经卫生和避孕药具使用有关。
▸ 子宫、输卵管的微生物群对生殖健康也有影响
女性生殖系统含有对女性健康有影响的细菌,这些细菌也存在于阴道之外。先前的几项研究表明,女性上生殖道(UFRT)中存在微生物群,包括子宫颈内膜、子宫、输卵管和卵巢,其特征是生物量低,并且与生殖和子宫健康相关。
✦ 子宫内膜也以乳杆菌为主,但与阴道菌群有所不同
子宫内膜微生物群的特征是大量乳杆菌(Lactobacillus),其次是加德纳菌(Gardnerella), 普雷沃氏菌属、Atopobium和Sneathia,这也在阴道中发现。然而,似乎子宫内膜细菌群与阴道中的细菌群有些不同,这表明这两种微生物群是相关的,但并不相同。
✦ 输卵管中的菌群
此外,输卵管中也有一些细菌定居,如乳杆菌属、葡萄球菌属、肠球菌属、普雷沃氏菌属和丙酸杆菌,与假单胞菌属。
▸ 男性生殖道的微生物群
之前很少有人研究男性生殖道中的微生物群。最近的研究显示,精液中存在微生物群,其中芽孢杆菌门(Bacillota)是最主要的门,其次包括拟杆菌门、假单胞菌门和放线菌门,其中最常见的属有乳杆菌属、普雷沃氏菌属、Gillisia、棒状杆菌属和加德纳菌。
✦ 男性的生殖道微生物群对生育健康有一定影响
阴道加德纳菌在阴道微生物群中的优势可能与男性炎症有关,这或与阴道定植/感染有关。有人认为,男性和女性生殖微生物群之间存在联系,影响生育、生殖健康和妊娠。
事实上,之前的大多数关于精液微生物组研究都集中在不孕不育问题上,突出了微生物特征和多样性的差异。据报道,男性微生物群受到包括环境在内的不同因素的影响。此外,精液微生物群可能会干扰受孕和早产。据报道,怀孕期间典型的精液细菌(如嗜酸乳杆菌)的存在率较高与早产有关,而另一种常见的精液细菌——卷曲乳杆菌(Lactobacillus crispatus)的优势已被确定为具有保护作用。
总之,女性和男性的生殖微生物组与生殖健康密切相关。研究显示,微生物可作为生物标志物,有助于开发诊断和治疗不孕症的新工具。
生殖过程发生在“微生物环境”下,这些微生物及其代谢物需得到更多关注,因为它们与孕前阶段密切相关。
在怀孕期间,妇女的生理和代谢有所变化,以便为胎儿提供最佳子宫内环境,促进其健康发育。妊娠期间的内分泌、免疫和代谢变化,会营造一种促炎状态,反映在阴道、肠道和口腔的微生物群变化中。
研究微生物标志物与妊娠结局之间的关系,有助于预防和调整与妊娠并发症相关的不利微生物变化。
▸ 阴道微生物群
据报道,怀孕后阴道微生物多样性降低,而乳杆菌成员增加,潜在地加强了它们的保护功能。
✦ 较低水平的乳杆菌与早产风险增加相关
就个别物种而言,卷曲乳杆菌与来自足月妊娠的样本相关。进一步证明,病史包括反复尿路感染的妇女表现出早产风险增加。在足月分娩和早产分娩之间,已经观察到阴道微生物群在组成、稳定性和多样性方面的差异。
加特纳菌(Gardnerella)、Atopobium和Uraplasma spp.的存在,以及较低水平的乳杆菌成员或较高水平的白色念珠菌的存在,已被发现与早产风险有关。
因此,在妊娠期间检测阴道微生物组内的异常可以用作预测早产可能性的微生物生物标志物,特别是在妊娠前三个月检查阴道微生物组。

最近的一项研究报告称,无抗生素的阴道微生物群移植(VMT)和供体移植解决了复发性流产后的阴道生态失调问题。这些研究表明,VMT是一种潜在的治疗具有不良生育和妊娠结局的严重阴道生态失调的方法,然而,还需要进一步的研究。
▸ 肠道微生物群
虽然在妊娠的前三个月期间,肠道微生物群的组成保持稳定,并且类似于孕前微生物群,但是从妊娠的前三个月结束起,其组成发生了根本的变化。
✦ 妊娠三个月后促炎的微生物更丰富,产短链脂肪酸的微生物减少
这些变化反映了更具促炎性的特征,包括妊娠晚期假单胞菌门(肠杆菌科成员)和放线菌门(主要是双歧杆菌成员)的增加,以及短链脂肪酸(SCFA)生产者的减少。
肠道微生物群与多种妊娠表型有关,包括体重增加、轻度炎症和胰岛素抵抗。
✦ 怀孕期间的饮食、营养、抗生素的使用会影响后代的微生物
已经有研究广泛证明,怀孕期间暴露于抗生素会改变母亲的微生物生态系统,从而改变后代的微生物生态系统。怀孕期间使用抗生素会增加阴道内葡萄球菌物种,此外,肠道以外的其他区域的潜在微生物转移可能与过敏和肥胖的风险增加有关。
此外,微生物群在怀孕期间受到母亲的饮食和营养状况的影响,也对其后代的微生物群组成产生影响。人体研究表明,妊娠期女性肠道微生物群的变化易受孕前母体最大体重指数(身体质量指数)的影响,也易受妊娠期体重增加的影响。较低的双歧杆菌属物种在超重和肥胖的母亲以及在怀孕期间体重增加过多的母亲中观察到。
另一项研究报告了怀孕期间体重状况的类似变化和较低水平的拟杆菌物种,以及更丰富的葡萄球菌和大肠杆菌物种在超重孕妇中被发现。
母体肠道微生物群的这种变化可能与通过阴道分娩出生的新生儿的肠道定植过程的差异有关。
▸ 口腔微生物群
怀孕还会引起口腔微生物群的变化。比较孕妇和非孕妇口腔中几种物种的丰度时,已经报道了显著的差异。
✦ 怀孕时口腔中的微生物数量增加,致病菌水平也较高
妊娠期口腔微生物群的特征是活菌数量增加,同时致病菌水平较高,例如牙龈卟啉单胞菌(Porphyromonas gingivalis),Aggregatibacter actinomycetemcomitans和假丝酵母(Candida genus)。
✦ 口腔生态失调与妊娠期并发症存在一定关联
越来越多的证据表明口腔感染和与妊娠并发症(包括早产)之间的联系。还有证据表明,妊娠期口腔生态失调与妊娠期糖尿病、先兆子痫和胎儿紊乱的风险增加相关。
这些数据表明,口腔微生物群在孕产妇和新生儿结局中也起着关键作用,包括妊娠并发症、早产风险和早期胎儿/新生儿微生物定植。
越来越多的证据表明了细菌从母亲到孩子的垂直传播。垂直传播是一个显著的过程,其中细菌菌株在母亲和新生儿之间交换。
研究人员探索了各种母体菌群来源,包括粪便、母乳、阴道微生物群和皮肤,以揭示这些关键细菌菌株的来源。影响婴儿肠道定植的关键因素包括出生时的胎龄、分娩方式、产前暴露、遗传、抗生素的使用和是否纯母乳喂养。
▸ 特定的垂直传播——例如双歧杆菌
双歧杆菌属(Bifidobacterium)是从母亲传播到婴儿肠道的最常见的微生物,主要传播源是母乳和粪便,出生时的胎龄、出生地、分娩方式和抗生素使用等变量可能会影响双歧杆菌的状态。
✦ 双歧杆菌等菌属从出生时自母亲传播到婴儿体内并定植
已知胃肠道微生物的早期正常定殖有助于免疫系统的发育,并有助于通过调节环境来维持体内平衡。

一项纵向研究表明长双歧杆菌(B.longum)和B. Brief的菌株似乎从出生到4个月一直存在于婴儿的微生物生态系统中。
通过宏基因组测序,我们深入了解了母体肠道到婴儿肠道的传播,外部因素的影响——地点、出生模式和抗生素的使用,每个因素都在形成婴儿微生物群中发挥作用。
双歧杆菌属物种表现出持久性和适应性。与母乳中发现的生物活性化合物(如母乳低聚糖)一起,在支持婴儿肠道微生物群和免疫系统的成熟方面发挥着至关重要的作用。
▸ 抗生素抗性基因转移
双歧杆菌等有益菌可以由母亲传递给婴儿并定植,与此同时,一些带有抗生素抗性基因的微生物也在母体到婴儿之间转移。
抗生素抗性微生物(ARMs)分布广泛,在人、动物之间传播,并通过动物性食物传播。它们携带抗生素抗性基因(ARG),整个细菌群体中的ARG组被称为抗性组。
✦ 耐药病原体可能从母体转移至新生儿体内
生命早期,尤其是围产期和产后,是婴儿肠道微生物群和免疫力发育的关键时期。此外,婴儿的免疫系统尚未成熟,因此他们特别容易获得和携带耐药病原体。这导致每年估计有214000名新生儿因抗生素抗性病原体引起的脓毒性感染而死亡。
婴儿肠道中抗生素耐药微生物菌株的主要来源尚不确定;虽然母体微生物群是主要来源,但其他个体和环境也是相关的,并可能导致婴儿耐药性。微生物在出生、哺乳和密切接触期间从母亲传播给后代。
✦ 母乳喂养、剖腹产等因素影响抗性基因的转移
各种围产期因素,如剖腹产、抗生素暴露、早产和母乳喂养会影响微生物从母亲到婴儿的垂直传播。一些研究阐明了抗生素抗性基因(ARG)在新生儿出生后不久就存在,表明ARMs的最初定殖发生在出生后不久,可能来自与母亲或医院环境的接触。一些研究表明,母亲向婴儿传播耐药细菌,包括各种抗生素耐药菌株,如大肠杆菌, 链球菌等。
众所周知,母乳喂养对婴儿健康有益,为婴儿提供营养和细菌。然而,对于发育中的婴儿来说,母乳似乎是耐药细菌和精氨酸的来源之一。在人乳中发现了耐药菌株。宏基因组分析揭示了母乳中高水平的精氨酸和遗传元素,类似于婴儿对母乳的抵抗力。这表明母亲通过抗性细菌的转移在发展婴儿的肠道抗性中起作用。
需要更多的研究来了解耐药细菌在母体与婴儿间的垂直传播,以理解其对婴儿最初肠道定植的影响。这种更深入的理解将有助于开发控制抗生素耐药基因在母婴之间传播的策略。
在出生时,除了来自环境的微生物之外,新生儿还会遇到来自阴道和母体肠道的数量巨大、种类繁多的微生物。
新生儿中的微生物群定植是一个与健康密切相关的敏感、动态过程。早期多样的微生物建立和特定短链脂肪酸的产生对免疫系统的成熟至关重要。
▸ 最早的新生儿微生物群
✦ 母体与婴儿之间的微生物接触最早可能始于子宫收缩时
不同的研究报告了通过培养依赖性和独立性方法确定的第一次粪便中存在细菌,即胎粪。一些研究人员认为,微生物接触可能最早始于子宫收缩和胎膜破裂期间,从而解释了胎粪中细菌的存在。
首个微生物群由变形菌门(Pseudomonadota)和芽孢杆菌门(Bacillota)的物种组成,如肠杆菌科(Enterobacteriaceae)和肠球菌科(Enterococcaceae)。
此外,还发现了其他菌属,包括双歧杆菌属、拟杆菌属和普雷沃氏菌属。与7天新生儿微生物群相比,首次通过的胎粪微生物群显示出更高的微生物多样性和丰富性,这表明新生儿出生时大量接触微生物,但只有少数能够在肠道中定植并持续存在,以便在出生后的第一年逐步进化。
▸ 影响新生儿微生物群的因素
肠道微生物群会随时间进化,变得更加多样。因此,新生儿定植是一个脆弱的、动态的和逐步的过程,它会受到许多母婴因素以及环境因素的影响。
其中,最相关的因素包括:孕龄、分娩方式(阴道分娩与剖腹产)、地点(医院与家庭)、喂养方式(母乳、混合膳食或婴儿配方奶粉)以及产妇健康状况、遗传、药物、接触异生物质或物理化学制剂的环境、兄弟姐妹、宠物以及人与人之间的水平微生物传播等。
✦ 抗生素的使用

分娩期抗生素预防可能会改变出生后第一周的肠道微生物群,包括放线菌的减少以及假单胞菌属和杆菌属比例的稳步增加。
另一项研究报道,分娩期间施用的抗生素也可以改变新生儿的口腔微生物群,从而导致在抗生素治疗后假单胞菌门的丰度更高。这可能会对儿童发育产生重要影响。
此外,据观察,在妊娠中期和晚期接受抗生素治疗的儿童患肥胖症的风险增加了84%,这可能是由于肠道微生物的变化引起的。
✦ 早产影响婴儿的肠道微生物群平衡
此外,有几项研究报道早产婴儿的微生物群是不平衡的。例如,已有研究表明,与足月婴儿相比,早产胎粪微生物组导致无菌小鼠粪便移植后免疫功能改变、生长受限和激素水平变化。
然而,早产儿有其他合并症,因为他们大多数是通过剖腹产出生的,在出生时和住院期间暴露于抗生素;他们也用母乳喂养,并在新生儿重症监护室呆了更长时间,这些因素可能都会影响早产婴儿的肠道微生物群。
✦ 母亲的健康状况也会影响婴儿的微生物群
也有越来越多的证据表明,子宫内炎症导致围产期并发症增加。婴儿健康和微生物群的母婴传播之间的关联可能受到诸如母亲糖尿病等因素的驱动、特应性疾病、饮食,身体质量指数和围产期抗生素使用。
研究人员观察到患有妊娠期糖尿病(GDM)前期的母亲所生婴儿的胎粪中含有丰富的细菌,这些细菌通常在成年糖尿病患者中观察到。母亲的高脂肪饮食影响婴儿微生物群,表现为拟杆菌属显著减少。
此外,婴儿微生物群影响免疫系统发育的分子机制尚未完全了解,尽管有越来越多的证据表明肠道微生物群在儿童期和成年期的疾病和健康中具有免疫调节活性。
✦ 顺产的婴儿微生物群与母亲肠道微生物更相似
先前已经证明,阴道出生的新生儿具有类似于阴道和肠道母体微生物群的微生物群,富含乳杆菌和普雷沃氏菌,尽管也存在其他细菌,如肠杆菌科,包括埃希氏菌属或克雷伯菌属。
而通过剖腹产出生的新生儿呈现出与口腔、皮肤和环境微生物群相似的独特微生物群。母体肠道似乎也是早期定植细菌的重要来源,因为在经阴道分娩的新生儿中,已发现72%的肠道细菌来自母体肠道,相比之下,经剖腹产出生的受试者中只有41%来自母体肠道,已显示双歧杆菌属在新生儿肠道定植过程中作为先锋细菌的成员,剖腹产出生的婴儿表现出拟杆菌属的延迟定植和多样性降低。
✦ 母乳喂养有助于母亲的微生物群在婴儿中定植
出生后,母乳喂养既支持了微生物的肠道定殖,又促进了免疫系统的成熟。据报道,母乳喂养和配方奶粉喂养的新生儿微生物群之间存在差异。
此外,母乳喂养的停止,而不是补充和固体食物的引入,对婴儿微生物群产生了关键影响。传统上,母乳被认为是无菌的。尽管如此,证据表明,母乳样本中存在活微生物,包括葡萄球菌和链球菌,是最丰富的微生物群,其次是乳酸菌、双歧杆菌和某些假单胞菌(Pseudomonas和Acinetobacter)。

最近的一项研究表明,婴儿肠道中27.7%的细菌来自母乳,10.3%来自乳晕皮肤,从而突显了母乳喂养对婴儿肠道微生物群的潜在影响。
此外,母乳和婴儿肠道之间共享的微生物和病毒种类也有被发现。
饮食是塑造我们肠道微生物群的一个关键因素。因此,建议进行饮食和营养咨询以及营养补充,以便在孕前和妊娠阶段达到适当的营养状态。最近有报道称,怀孕期间以及随后的母乳喂养期间,母亲的饮食对母亲和婴儿的微生物群都有重要影响。
★ 地中海饮食有助于改善母婴的健康水平
母亲的蛋白和纤维摄入量会影响母乳成分,如微生物群、脂质、母乳低聚糖(HMO)和microRNA表达谱。地中海饮食(MD)被证明在怀孕期间能够改善母婴健康结果,包括生长受限、胎儿和新生儿大脑发育、儿童神经发育。
妊娠期地中海饮食,主要是水果、蔬菜和豆类的摄入量增加,红肉的摄入量减少,与Acidaminoacaeae家族水平以及短链脂肪酸生产者的丰度较高有关。
植物蛋白、纤维和多酚的摄入量增加与瘤胃球菌属(Ruminococcus)、Christenselacae科、Dehalobacterium和真/优杆菌属(Eubacterium)以及短链脂肪酸生产菌的存在增加有关。
✦ 饮食不仅改善肠道微生物,对阴道、口腔微生物也有影响
大多数关于饮食-怀孕-微生物群的可用数据都集中在肠道微生物群上,但据报道,增加水果、维生素D、纤维和酸奶的摄入量与女性阴道卷曲乳杆菌(L.Crispatus)有关;纤维摄入与较高的异质性相关。
有限的证据表明饮食对阴道微生物群和妊娠结局的影响。在这种情况下,仍需确定哪些食物、食物成分、营养素和其他膳食化合物会影响围产期妇女的微生物群(肠道、口腔和阴道),以及对母婴结局的潜在影响。
对围产期饮食干预的研究兴趣日益增加,以及在怀孕期间使用益生菌、益生元和共生体来调节微生物群和促进“有利的微生物垂直传播”。有一些证据表明,在怀孕和哺乳期间服用益生菌可以起到保护作用,而益生元和其他益生菌的证据较少。
值得注意的是,脆弱和敏感人群需要特殊的安全性考虑,包括安全性和与妊娠、哺乳和婴儿期相关的不良反应的潜在报告。
▸ 益生菌对生育能力的影响
补充乳杆菌有利于重建阴道菌群平衡
阴道感染会影响乳杆菌的平衡,导致可能影响生育能力的细菌的生长。因此,补充乳杆菌应有助于重建平衡。
一项涉及健康女性的体外受精研究显示,在阴道定植卷曲乳杆菌(L.Crispatus)后,受孕结果很有希望。
补充益生菌有助于提高精子质量
在不孕症和辅助生殖医学的病例中,已报道了精液微生物群组成的差异,使用益生菌可能在精液特征和质量参数方面具有有益的效果。研究已经显示出Lacticaseibacillus rhamnosus CECT8361和B.longum CECT7347在弱精子症男性中,补充为期六周可以改善精子质量参数和活力,并降低DNA片段和活性氧(ROS)水平。
另一方面,有报道称,共生菌(Flortec, Lacticaseibacillus paracasei B21060 和阿拉伯半乳聚糖、低聚果糖和l-谷氨酰胺)对少弱畸形精子症患者精液质量和数量具有一定的改善作用。
此外,系统综述和荟萃分析表明,益生菌有利于精子活力。然而,关于益生菌对接受辅助生殖的女性的功效,存在相互矛盾的证据。这表明需要更多临床研究来证明益生菌对生育能力的影响。
▸妊娠期使用益生菌降低疾病风险
孕期服用益生菌为减少母婴健康风险提供了方案。现有研究主要集中在早产风险、减少生殖器感染、妊娠期糖尿病(GDM)和先兆子痫前期等方面,这些往往被视为次要健康结果。
益生菌有助于改善孕妇生殖器感染
孕妇经常患有复发性尿路感染(UTIs)、外阴阴道念珠菌病(VVC)和细菌性阴道病(BV)。这些问题与不利的母婴妊娠结果有关,包括早产风险和胎儿生长受限。益生菌已被提出作为治疗BV和UTI的预防性替代品,通过维持或恢复阴道微生物群或防止病原体在尿道定植。
先前的研究表明,益生菌组合,即嗜酸乳杆菌、乳双歧杆菌(B.lactis)和长双歧杆菌(B.longum),对孕妇B组链球菌(GBS)定植具有潜在的治疗作用。

此外,最近的研究表明益生菌菌株在治疗妊娠期GBS感染方面的有效性,其中一项临床研究报告称,补充鼠李糖乳杆菌GR-1和罗伊氏乳杆菌RC-14被证明对治疗GBS感染有效。
最近一项涉及36名GBS阳性女性的研究报告称阴道共生菌显著增加,对阴道GBS有影响。而一项对18项研究的系统综述和荟萃分析表明,抗生素和益生菌显著降低了细菌性阴道病(BV)的复发率,提高了治愈/缓解率。其他报告益生菌对阴道炎影响的研究也显示了类似的结果。
✦ 降低先兆子痫的风险

最近一项涉及70149名孕妇的研究发现,益生菌(嗜酸乳杆菌[LA-5],乳双歧杆菌[Bb12]还有鼠李糖乳酸杆菌GG [LGG])显著降低先兆子痫的风险。
这项研究还强调了“时机”(即何时进行益生菌干预)的相关性,因为在怀孕前或怀孕早期食用益生菌没有观察到任何影响。孕晚期(而非孕前或孕早期)摄入益生菌牛奶与降低先兆子痫风险显著相关(调整后的 OR:0.80(95% CI 0.68 至 0.94)p 值:0.007)。孕早期(而非孕前或孕晚期)摄入益生菌与降低早产风险显著相关(调整后的 OR:0.79(0.64 至 0.97)p 值:0.03)。
然而另一项系统综述报告称,与安慰剂相比,益生菌会导致肥胖受试者的先兆子痫风险增加。肥胖与先兆子痫的风险较高有关。因此,需要更多的研究来确定弱势群体中与益生菌相关的风险。
预防妊娠期糖尿病,改善胰岛素敏感性
鼠李糖乳杆菌(L.rhamnosus)GG和乳双歧杆菌(B.lactis)BB12与饮食相结合已被证明可以预防妊娠期糖尿病(GDM),降低血糖浓度和改善胰岛素敏感性。
另一种益生菌菌株,鼠李糖乳杆菌(L.rhamnosus) HN001菌株能够降低GDM的患病率,特别是在中老年妇女和那些以前患有妊娠期糖尿病的妇女中。
最近的一项系统综述包括30多项在怀孕期间进行的研究,表明益生菌干预对改善血糖控制、降低低密度脂蛋白胆固醇(VDL)和甘油三酯以及减少炎症标记物的潜在作用。
益生菌补充剂可能会降低妊娠期糖尿病(GDM)的发病率,并有助于控制健康孕妇和超重和肥胖妇女的血糖参数。
最近的荟萃分析显示,益生菌将GDM发病率降低了33%,当使用多种菌株益生菌组合时,效果更好。一项系统综述和荟萃分析还报告称,摄入酸奶(活微生物)可以降低GDM的风险,并降低空腹血糖。
减少产后压力和抑郁
越来越多的数据显示益生菌对抑郁、焦虑和情绪的潜在用途。一项研究(系统综述和荟萃分析)显示,益生菌在减少孕妇和哺乳期妇女的焦虑和抑郁方面具有积极作用。
其他研究报告了益生菌和对照组在抑郁评分方面没有差异,然而,在总体精神健康评分方面,报告了焦虑的降低。
▸ 出生后使用益生菌的有益作用
文献中有数据和研究表明特定益生菌的有益作用,例如布拉氏酵母菌,鼠李糖乳酸杆菌GG(LGG),罗伊氏乳杆菌和动物乳双歧杆菌(Bb12)。
婴儿早期使用益生菌的主要目标是:
1)预防腹泻和感染;
2)预防过敏;
3)预防坏死性小肠结肠炎和早产儿迟发性败血症、预防婴儿绞痛。
此外,一项系统综述强调了灭活益生菌的潜在益处,灭活益生菌在生命的早期和敏感期以及敏感人群是一种安全的替代品,如早产儿和儿科人群。
产后使用益生菌的另一个例子与患有乳腺炎的女性有关,包括感染性乳腺炎和葡萄球菌乳腺炎。
在探索微生物群与人类健康之间的复杂关系时,我们发现,从受孕到生命最初几年,微生物群在每一个生命阶段都扮演着不可或缺的角色。母体的微生物环境不仅影响着怀孕过程中的生理变化,还直接关系到婴儿的健康和发育。通过了解这些微生物的作用,我们可以更好地认识到早期干预的重要性,尤其是通过饮食和生活方式的调整来优化母婴微生物群。
随着科学研究的不断深入,我们有望开发出更有效的策略,以促进母婴健康,预防潜在的健康问题。未来的研究将继续揭示微生物群的奥秘,帮助我们在整个生命周期中实现更好的健康结果。
主要参考文献
Samarra A, Flores E, Bernabeu M, Cabrera-Rubio R, Bäuerl C, Selma-Royo M, Collado MC. Shaping Microbiota During the First 1000 Days of Life. Adv Exp Med Biol. 2024;1449:1-28.
Arzamasov AA, Nakajima A, Sakanaka M, Ojima MN, Katayama T, Rodionov DA, Osterman AL (2022) Human milk oligosaccharide utilization in intestinal Bifidobacteria is governed by global transcriptional regulator NagR. mSystems 7(5):e00343–e00322.
Calvo-Lerma J, Selma-Royo M, Hervas D, Yang B, Intonen L, González S, Martínez-Costa C, Linderborg KM, Collado MC (2022) Breast milk lipidome is associated with maternal diet and infants’ growth. Front Nutr 9:854786.
Canha-Gouveia A, Pérez-Prieto I, Rodríguez CM, Escamez T, Leonés-Baños I, Salas-Espejo E, Prieto-Sánchez MT, Sánchez-Ferrer ML, Coy P, Altmäe S (2023) The female upper reproductive tract harbors endogenous microbial profiles. Front Endocrinol 14:1096050.
Mikami K, Kimura M, Takahashi H (2012) Influence of maternal Bifidobacteria on the development of gut Bifidobacteria in infants. Pharmaceuticals 5(6):629–642.
Garcia-Mantrana I, Selma-Royo M, Gonzalez S, Parra-Llorca A, Martinez-Costa C, Collado MC (2020) Distinct maternal microbiota clusters are associated with diet during pregnancy: impact on neonatal microbiota and infant growth during the first 18 months of life. Gut Microbes 11(4):962–978.
García-Mantrana I, Bertua B, Martínez-Costa C, Collado MC (2016) Perinatal nutrition: how to take care of the gut microbiota? Clin Nutr Exp 6:3–16.
Li W, Tapiainen T, Brinkac L, Lorenzi HA, Moncera K, Tejesvi MV, Salo J, Nelson KE (2021) Vertical transmission of gut microbiome and antimicrobial resistance genes in infants exposed to antibiotics at birth. J Infect Dis 224(7):1236–1246.

谷禾健康
认识免疫疗法
免疫疗法是一种利用人体自身的免疫系统来对抗疾病的方法,尤其是在癌症治疗中,它通过激活或增强免疫系统来识别和攻击癌细胞。这一疗法的核心在于激发免疫系统对肿瘤细胞的特异性反应,从而达到治疗目的。
免疫疗法具有高度的选择性和靶向性,能够减少对正常细胞的伤害,降低传统化疗和放疗的副作用。免疫疗法的种类多样,包括单克隆抗体、免疫检查点抑制剂、肿瘤疫苗、过继细胞疗法等。
肠道微生物群与癌症治疗之间的关联已经成为癌症研究领域的热点。多项研究表明,肠道微生物群的组成和功能与癌症患者的免疫疗法反应性密切相关。肠道微生物群不仅在维持肠道健康中起着关键作用,而且在调节全身免疫反应、影响药物代谢和毒性反应中也扮演着重要角色。例如,某些特定的肠道细菌在调节免疫检查点抑制剂的疗效中起到关键作用,而抗生素的使用可能会干扰这一过程,影响治疗效果。
本文我们来了解肠道微生物组对 ICI (免疫检查点抑制剂) 疗效的影响,讨论了微生物组与先天和适应性免疫细胞相互作用以改善 ICI 反应的机制,微生物组衍生的代谢物和分子介导的抗肿瘤免疫反应对 ICI 的机制,同时也包括操纵肠道微生物组以提高 ICI 疗效的治疗策略和正在进行的临床试验。
•
首先了解下关于免疫疗法相关的一些关键知识和问题:
免疫疗法利用人体自身免疫系统对抗疾病主要通过以下几种方式:
免疫检查点抑制剂(ICI):
免疫检查点抑制剂通过阻断 PD-1 或 CTLA-4 等蛋白质,解除对免疫细胞的抑制,使免疫系统能够更有效地识别和攻击肿瘤细胞。
过继性细胞免疫治疗:
从患者体内提取免疫细胞(如 T 细胞),在体外进行基因修饰或培养扩增,使其具有更强的识别和攻击肿瘤细胞的能力,然后再回输到患者体内,发挥抗癌作用。
例如,CAR-T 细胞疗法就是通过对T细胞进行基因改造,使其表面表达能够特异性识别肿瘤抗原的嵌合抗原受体(CAR),从而增强对肿瘤细胞的杀伤能力。
肿瘤疫苗:
包括预防性疫苗(如预防某些病毒感染引起的癌症,如 HPV 疫苗预防宫颈癌)和治疗性疫苗。治疗性疫苗通过向患者体内引入肿瘤相关抗原,刺激免疫系统产生针对肿瘤细胞的特异性免疫反应。
单克隆抗体治疗:
利用人工制备的单克隆抗体特异性地结合肿瘤细胞表面的靶点,直接杀伤肿瘤细胞或通过标记引导免疫系统攻击肿瘤细胞。
总之,免疫疗法旨在激发、增强或调节人体自身的免疫系统,使其能够更有效地识别和消除异常细胞,从而达到治疗疾病的目的。
✦✧✦
免疫功能是一把双刃剑,过强或过弱都会危害人体健康,因此,需要对患者进行免疫功能的监测和评估。
人体免疫可以从三个层面进行探讨:
在免疫细胞中,淋巴细胞谱系与髓样细胞谱系,各占半壁江山,共同抵抗外界对人体的侵袭。
淋巴细胞是构成免疫系统的主要细胞类别,占外周血白细胞总数的 20%-45%,成年人体内约有 1012 个淋巴细胞。
淋巴细胞可分为许多表型与功能均不同的群体,如 T细胞、B细胞、NK细胞等,T 细胞和 B 细胞还可进一步分为若干亚群。淋巴细胞不同亚群的比例、数量以及功能会直接影响机体的免疫状态。
一,T淋巴细胞(简称T细胞)
起源于骨髓造血干细胞,在胸腺素及胸腺微环境影响下分化成熟为T细胞,故T细胞又称胸腺依赖性淋巴细胞。
T 细胞主要参与细胞免疫,表达CD3抗原,其中,T 细胞又包括辅助T细胞(Th)和细胞毒性T细胞(Tc),它们分别表达 CD4 和 CD8。
T淋巴细胞亚群的临床意义
它能反映机体当前的免疫功能、状态和平衡水平,并可以辅助诊断某些疾病,对分析发病机制,观察疗效及检测预后都有重要意义。
例如:CD4+/CD8+ 比值是指在血液中,CD4+ T细胞的数量与CD8+ T细胞数量的比率。这个比值对于评估免疫系统的健康状况非常重要。

CD4+/CD8+的其他临床应用场景
——器官移植
跟移植前相比,器官移植后CD4+/CD8+明显增加,则可能发生排斥反应。
——肿瘤病人
在肿瘤病人外周血中T淋巴细胞亚群数值都有异常,其特征是患者体内 CD3+细胞、CD4+细胞明显减少,而 CD8+细胞明显增加;CD4+/CD8+比值显著降低,说明肿瘤患者的细胞免疫功能处于免疫抑制状态,患者对识别和杀伤突变细胞的能力下降,形成了肿瘤的生长转移。
——再生障碍性贫血与粒细胞减少症
患者的外周血 CD4+细胞数减少,CD8+细胞数增多,CD4+/CD8+比值明显下降。
二、B/NK 淋巴细胞的临床意义
B 细胞主要参与体液免疫,表达 CD19 抗原;NK 细胞表达 CD16 和/或 CD56,在机体中不依赖抗原刺激自发地发挥细胞毒效应。淋巴细胞在免疫应答中起核心作用。
NK 细胞(CD3-CD16+和/或CD56+)能够介导对某些肿瘤细胞和病毒感染细胞的细胞毒性作用。
注:以上内容参考自 赛欧细胞
2007~2013 年
小鼠研究表明肠道菌群可以刺激抗肿瘤免疫反应。
2015年
两项临床前小鼠研究首次将肠道菌群与 ICI 反应联系起来。
2018 年
小鼠和人类研究表明,肠道菌群的组成和多样性可以预测对 ICI 免疫疗法的反应。将对 ICI 有反应的患者的粪菌移植到无菌或抗生素治疗的小鼠中,可以改善肿瘤控制并改善对 ICI 的反应。
2019~2020 年
前瞻性研究证实,非小细胞肺癌(NSCLC)、肝细胞癌 (HCC)、黑色素瘤、肾细胞癌 (RCC) 患者的肠道菌群与 ICI 结果之间存在显著相关性。
在非小细胞肺癌 (NSCLC) 和肾细胞癌 (RCC) 中,细菌多样性较高的患者对抗 PD-1 疗法更敏感。对ICI 无反应者进行 FMT 后口服补充Akkermansia muciniphila 可恢复抗 PD-1 治疗反应 。
在黑色素瘤患者中,肠道菌群的多样性和组成与抗 PD-1 治疗反应呈正相关。大多数情况下,对 ICI 有反应的患者肠道中粪杆菌和瘤胃球菌科的丰度较高,其外周CD4 + T 细胞和 CD8 + T 细胞数量增加。另一项针对转移性黑色素瘤患者研究表明,长双歧杆菌、产气柯林斯菌(Collinsella aerofaciens)、屎肠球菌(Enterococcus faecium)在有反应患者的基线粪便中更为丰富。
回顾性研究表明,抗生素与生存率下降和对 ICI 的反应减弱有关,支持抗生素引起的菌群失调与 ICI 疗效不佳之间存在因果关系。
2021 年
两项临床试验发现,ICI反应者的FMT联合抗PD-1疗法克服了黑色素瘤患者对 PD-1 阻断的耐药性。
肠道菌群和 ICI 疗效的时间表
doi:10.1186/s13045-022-01273-9
以上是肠道菌群对调节免疫检查点抑制剂(ICI)免疫治疗外,肠道菌群还可以影响细胞免疫转移(ACT)免疫治疗、CpG寡核苷酸(CpG-ODN)免疫疗法和基于细胞的免疫疗法。
ACT疗法
抗生素暴露降低了小鼠的ACT疗法疗效,而通过给予细菌脂多糖(LPS)来影响治疗效果,通过toll样受体4信号(TLR)传导恢复了治疗效果。另一项研究表明,肠道菌群通过增加CD8α+ DC的丰度和上调IL-1来维持ACT疗法的治疗效果。
注:过继性细胞转移(Adoptive Cell Transfer, ACT)疗法,是一种利用患者自身的免疫细胞进行癌症治疗的方法。它涉及从患者体内分离出T细胞,然后在体外进行改造,使其能够识别并攻击肿瘤细胞,最后再输回患者体内。包括TIL、TCR-T以及CAR-T等几种治疗方法。
CpG-ODN免疫疗法
在CpG-ODN免疫疗法中,肠道菌群激活TLR4,直接或间接启动肿瘤相关骨髓细胞对CpG-ODNs的TLR9依赖反应。CpG-ODN的有效性在无菌和暴露抗生素的小鼠中被削弱,影响了肿瘤坏死因子(TNF)和IL-12的产生。
注:CpG-ODN免疫疗法是一种利用CpG寡脱氧核苷酸(CpG ODN)来激活和调节免疫系统的治疗方法。它通过激活多种免疫细胞如自然杀伤细胞(NK细胞)、单核/巨噬细胞、树突状细胞(DC)、B细胞和T细胞等,来增强机体的免疫反应。
基于细胞的免疫疗法
肠道菌群介导的胆汁酸代谢增加了肝脏中CXCR6+自然杀伤T(NKT)细胞的丰度,并在肝细胞癌中发挥抗肿瘤作用。
总之,肠道菌群在调节免疫治疗方面发挥着重要作用,影响细胞免疫转移和各种免疫疗法效果,并通过不同机制影响治疗效果。这些研究揭示了肠道菌群对免疫疗法的关键影响,包括调节免疫细胞活性和相关信号通路,进而影响肿瘤治疗的效果。
★ 毛螺菌科(Lachnospiraceae)
不可切除肝细胞癌(HCC)患者在接受抗PD-1药物治疗后,有客观临床反应的患者的粪便样本中Lachnoclostridium富集,且与胆汁酸等特定细菌代谢物的高浓度相关。类似的现象也在对抗PD-1治疗有反应的黑色素瘤患者中观察到。Lachnospiraceae的某些菌株与改善无进展生存期(PFS)相关。
★ 瘤胃球菌科(Ruminococcaceae)
Ruminococcaceae家族的共生菌通过降低肠道通透性促进宿主健康,并在产生短链脂肪酸如乙酸和丙酸中起重要作用。
临床研究表明,瘤胃球菌属在多种癌症类型中与ICI治疗反应性正相关,但其对ICI毒性的潜在影响及通过SCFA直接影响ICI效果的证据有限。不同瘤胃球菌属对ICI治疗反应的影响各异,表明需要进一步研究以开发基于肠道菌群组成的治疗反应预测生物标志物。
★ 颤螺旋菌科(Oscillospiraceae)
Faecalibacterium与ICI反应性:观察研究表明,Oscillospiraceae特别是F. prausnitzii的丰度与黑色素瘤患者对ICI的反应正相关,并减少不良事件。
Faecalibacterium刺激Tregs增殖并释放抗炎细胞因子如IL-10和IL-33,有助于维持肠道内抗炎因子平衡。
Faecalibacterium可能通过诱导CTLA-4+ Tregs的扩增增强抗CTLA-4治疗的效果,并作为增强疗效的辅助剂。
Faecalibacterium衍生的效果与免疫细胞频率增加相关,可能增强抗PD-1治疗的疗效,但研究结果存在差异。
★ 乳酸杆菌科(Lactobacillaceae)
乳酸菌作为共生菌具有免疫调节特性,常用作益生菌,临床前研究表明其能增强小鼠对anti-CTLA-4的反应,可能作为ICI治疗成功与否的生物标志物。
乳酸菌增强免疫应答:乳酸菌与小鼠树突细胞共培养可促进细胞成熟,增强免疫反应,提高IFN-γ和Granzyme B的产生,增加肿瘤中的CD8+ T细胞浸润,减缓肿瘤生长。
乳酸菌与PD-1抑制剂的协同效应:乳酸菌ZW18和L. reuteri的补充可优化肠道菌群组成,增强抗PD-1治疗的效果,通过不同机制提高CD8+ T细胞的活性和肿瘤组织中的IFN-γ表达。
★ 拟杆菌门
系统性抗生素治疗可能破坏其与厚壁菌门的比例,拟杆菌门增多,引起肠道菌群失衡和抗肿瘤免疫的负面影响。
负面影响:研究发现,拟杆菌门的丰度与黑色素瘤患者对免疫治疗的反应率呈负相关,高水平拟杆菌属与较差的ICI治疗反应有关。
拟杆菌门的增多可能抑制外周细胞因子反应,并促进免疫抑制细胞如Tregs和骨髓源抑制细胞的频率,从而影响ICI治疗的效果。
正面影响:尽管拟杆菌门的整体丰度与不良的ICI治疗反应相关,但某些物种如B. caccae、B. fragilis、B. thetaiotaomicron在转移性黑色素瘤患者中可能具有免疫刺激效应。
尽管拟杆菌门的某些物种对宿主免疫系统有益,但整体丰度与ICI治疗效果呈负相关。特定拟杆菌属的加入可能通过促进效应免疫反应来增强ICI治疗的效果,但需要更多研究来验证这一点。
★ 疣微菌科(Akkermansiaceae)
积极作用:Akkermansia muciniphila是一种在人体和动物消化系统中丰富的菌种,能分解黏蛋白,其丰度在对anti-PD-1/PD-L1治疗有反应的多种癌症患者中较高,有助于增强免疫反应和提高治疗效果。
增强免疫应答:A. muciniphila通过刺激树突细胞释放IL-12,减少免疫抑制Tregs的招募,增强Th-1相关免疫反应,与无进展生存期(PFS)相关。
注:该菌能通过其细胞膜中的脂质二酰基磷脂酰乙醇胺调节TLR1-TLR2分子途径,并在宿主代谢调节中发挥关键作用。
尽管A. muciniphila通常与正面的临床结果相关,但一些研究显示其在肠道微生物群中的主导地位可能预示着对anti-PD-1阻断的反应较差。
作为预测生物标志物和治疗策略:A. muciniphila的积极效果使其成为预测ICI治疗反应的潜在生物标志物,其口服给药在临床前模型中能将无反应者转变为有反应者,但剂量是关键因素。
★ 红蝽菌科(Coriobacteriaceae)
研究发现,对anti-PD-1治疗有反应的黑色素瘤患者中C. aerofaciens的丰度更高,且带有响应者菌群(包括C. aerofaciens)的无菌小鼠显示出更强的T细胞激活,导致增强的anti-PD-1效果和减缓的肿瘤生长。
C. aerofaciens的增加不仅促进T细胞激活,还通过提高IL-17A和CXCL1及CXCL5趋化因子的产生来促进炎症环境,同时减少紧密连接蛋白的表达,增加肠道通透性,这些免疫调节效应提示C. aerofaciens对ICI活性的重要性需要进一步探索。
★ 双歧杆菌科(Bifidobacteriaceae)
多项研究表明,双歧杆菌科的存在与增强的免疫介导的肿瘤抑制和ICI治疗的疗效相关。双歧杆菌与多种癌症(包括肾细胞癌、结直肠癌、黑色素瘤、非小细胞肺癌和三阴性乳腺癌)中ICI治疗的有效性增强有关。
双歧杆菌通过改变树突细胞的功能、促进CD8+ T细胞浸润、增加干扰素-γ的产生等机制,提高抗肿瘤反应。
双歧杆菌产生的肌苷通过T细胞特异性腺苷2A受体A2AR信号传导增强抗肿瘤能力,双歧杆菌通过抗原交叉反应,使表达特定新抗原的肿瘤对T细胞介导的破坏更加敏感。
双歧杆菌的这些特性使其成为潜在的预测ICI治疗反应的生物标志物,并且其作为单一治疗或与ICI治疗结合的策略在临床前模型中显示出前景。
临床前和临床研究中不同细菌对 ICI 治疗效果的积极和消极影响
doi.org/10.1016/j.xcrm.2024.101487
细菌种群与ICI治疗结果之间的关联
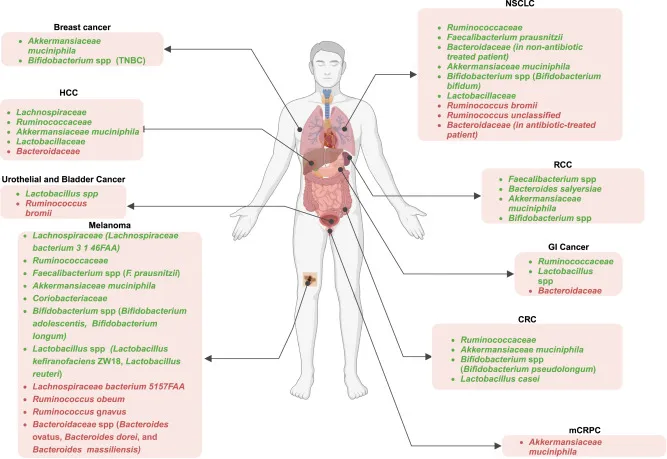
doi.org/10.1016/j.xcrm.2024.101487
注:癌症患者中绿色高亮细菌的存在或高丰度与不同癌症类型对ICI治疗的积极反应相关,而非应答患者中红色高亮细菌的流行率更高。
TNBC,三阴性乳腺癌;HCC,肝细胞癌;NSCLC,非小细胞肺癌;RCC,肾细胞癌;GI,胃肠道;CRC,结直肠癌;mCRPC,转移性去势抵抗性前列腺癌。
研究表明,肠道菌群调节 ICI 反应,有必要详细探索特定细菌种类和微生物代谢物对 ICI 的作用机制。
肠道菌群可调节先天性和适应性免疫,并影响 TME 中的抗肿瘤免疫反应。如下表,特定细菌种类在免疫背景下影响TME 以提高 ICI 疗效的复杂机制。

肠道菌群调节先天免疫、适应性免疫和肿瘤抗原,以改善 ICI 反应。
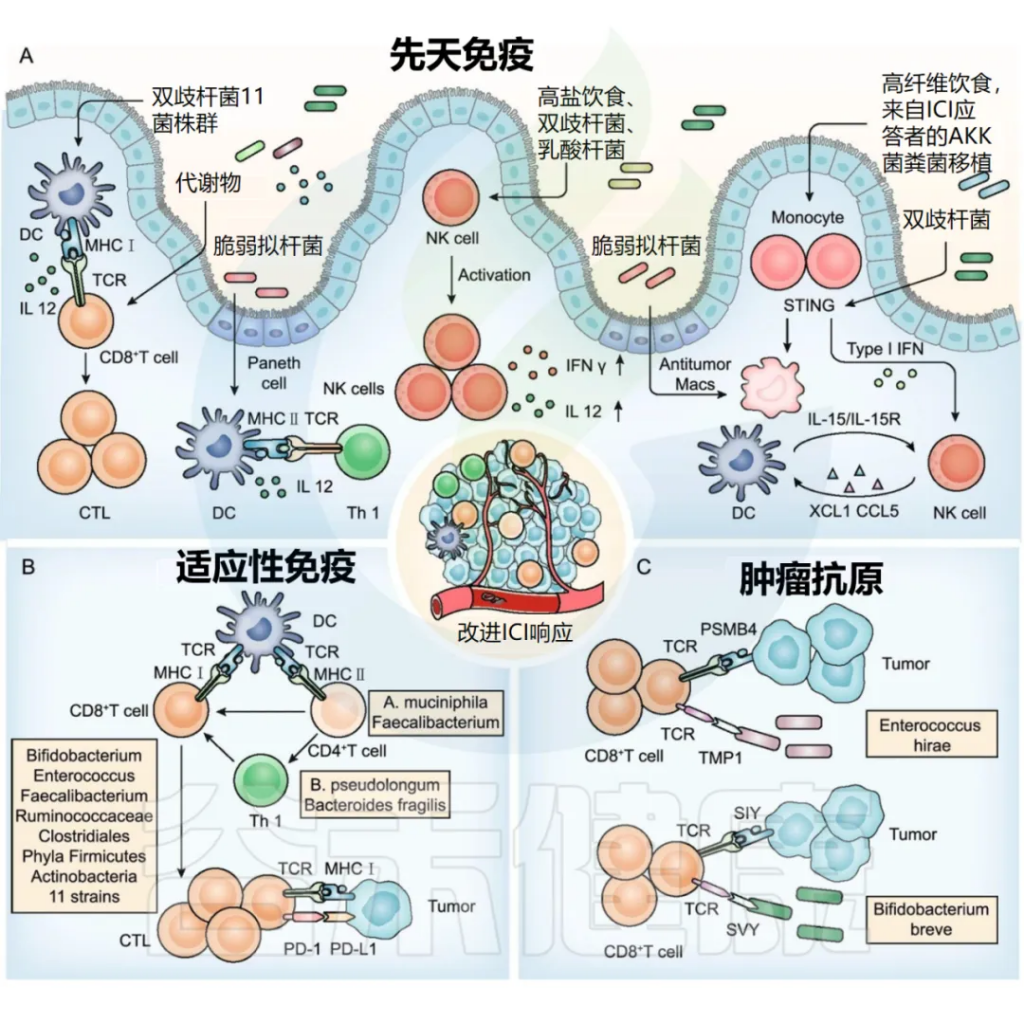
doi:10.1186/s13045-022-01273-9
■ 树突状细胞
双歧杆菌、十一种菌株及其代谢物和脆弱拟杆菌促进树突状细胞成熟或活化,随后活化 CD8 + T 细胞和 Th1 细胞。
树突状细胞 (DC) 是一组特殊的抗原呈递细胞,在 T 细胞活化和抗肿瘤免疫中起着至关重要的作用。肠道菌群抗原或含有免疫调节剂的代谢物可用于动员和激活树突状细胞 ,逆转未成熟树突状细胞诱导的免疫耐受。
例如,口服双歧杆菌可增加树突状细胞 (DC) 活化,进而支持改善肿瘤特异性CD8 + T细胞应答,并恢复抗 PD-L1 疗法在肠道菌群“不利”的小鼠中的治疗效果。
11 种菌株与 ICI 相结合,可强力诱导干扰素 (IFN) γ + CD8 + T 细胞,以依赖于固有层 cDC1 和主要组织相容性复合体 (MHC) I 类的方式抑制肿瘤生长。
脆弱拟杆菌通过触发树突状细胞成熟和刺激 IL-12 依赖性 Th1 细胞免疫反应,增强了 CTLA-4 阻断的抗肿瘤作用。
此外,万古霉素介导的肠道微生物组成调节通过增加 cDC1 和上调 IL-12,提高了抗肿瘤特异性效应 T 细胞的活性。
■ NK细胞
植物乳杆菌增加 NK 细胞活化;
高盐饮食增加肠道通透性和肿瘤内双歧杆菌的定位,并增强 NK 细胞活化以诱导抗肿瘤免疫。
NK 细胞可以调节TME 中的DC 和 CD8 + T 细胞丰度并影响对 ICI 的反应。越来越多的研究发现 NK 细胞和肠道菌群之间的相互作用。
注:NK 细胞也被称为自然杀伤细胞,是一类重要的淋巴细胞,主要起着免疫监视和细胞毒灭活的作用。这些细胞在体内寻找并摧毁受感染或变异的细胞,帮助维持身体的免疫功能。NK 细胞是免疫系统中的重要组成部分,对抗病毒感染和肿瘤细胞具有重要作用。
具有高微生物多样性的 NSCLC 患者在 PD – 1 阻断反应中具有更高丰度的独特记忆 CD8 + T 细胞和外周 NK 细胞亚群。
植物乳杆菌有效增加天然细胞毒受体(NCR)蛋白的表达并促进 NK 细胞活化以触发先天免疫。
次优剂量的 PD-1 阻断联合高盐饮食显著抑制了小鼠的肿瘤生长。
高盐饮食的双重作用
研究发现,高盐饮食会导致肠道通透性增加,以及双歧杆菌在肿瘤内部的定殖(即定居和繁殖)。这些变化会促进自然杀伤细胞(NK细胞)的活化,进而增强身体对肿瘤的免疫反应,从而发挥抗肿瘤作用。
由于高盐饮食与慢性炎症、心血管疾病和自身免疫性疾病有关,因此食用高盐饮食被认为是一种不健康的生活方式。免疫系统会转向促炎作用,然而,这种不良副作用被发现对肿瘤免疫有益。
高盐饮食增加了肠道的通透性,有利于双歧杆菌进入肿瘤部位,刺激自然杀伤细胞(NK细胞)并激活T细胞,导致肿瘤细胞的破坏并增加苯甲酸盐水平。肿瘤细胞通过程序性细胞死亡受体蛋白L1逃避破坏,L1与PD受体结合并使T细胞失活。
尽管抗PD-1疗法可以恢复T细胞功能,但由于某些肿瘤的PD-1分泌功能,它并非对所有肿瘤都有效。通过测量苯甲酸盐水平可以指导抗PD-1疗法的效果。高盐环境提供了一种避免肿瘤细胞检查点抑制的途径,通过干扰免疫介导的炎症,这可以通过调节盐水平被用作治疗方式。
总之,高盐饮食是一把双刃剑,但通过影响肠道微生物组和其他细菌产物,在肿瘤免疫中有希望的作用,需要进一步研究以揭示其潜在的好处。
■ 单核细胞/巨噬细胞
喂食高纤维饮食、用产生 cdAMP 的A. muciniphila单定植或从 ICI 反应者转移粪便菌群可触发单核细胞-IFN-I-NK 细胞-DC 级联;
双歧杆菌以 STING 信号和 IFN-I 依赖的方式促进基于 CD47 的免疫治疗;
脆弱拟杆菌诱导巨噬细胞表型极化为M1。
IFN-I (I型干扰素)和单核吞噬细胞水平的偏差导致免疫失调和免疫抑制性 TME。微生物诱导的 IFN-I 信号传导介导从先天免疫到适应性免疫的转变(上图)。
注:I型干扰素是一类干扰素,包括多种干扰素如IFN-α和IFN-β等,在免疫系统中起着重要的调节和抗病毒作用。
微生物衍生的干扰素基因刺激物 (STING) 激动剂(如 c-di-AMP)诱导肿瘤内单核细胞发出 IFN-I 信号传导,从而使单核吞噬细胞转向抗肿瘤巨噬细胞 (Macs) 并引发单核细胞-IFN-I-自然杀伤 (NK) 细胞-DC 串扰。
喂食高纤维饮食、用产生 cdAMP 的A. muciniphila进行单定植或从 ICI 应答者转移粪便微生物群可改善抗肿瘤反应和 ICI 疗效。
类似地,研究显示双歧杆菌优先定植于肿瘤部位,以 STING 信号和 IFN-I 依赖的方式促进基于 CD47 的免疫治疗。
脆弱拟杆菌诱导巨噬细胞表型极化为M1,并上调细胞中 CD80 和 CD86 的表达,促进先天免疫。
■ CD8 + T 细胞
双歧杆菌、肠球菌、粪杆菌、瘤胃球菌和梭菌目促进 CD8 + T 细胞浸润至肿瘤组织;
厚壁菌门和放线菌门可提高ICI 应答者外周血CD56 + CD8 + T 细胞的活化;
11 种菌株可增加体循环中效应 IFNγ + CD8 + T 细胞的比例。
多项研究已证实,特定肠道菌群可在体循环或 TME 中 诱导 CD8 + T 细胞(上图)。例如,具有相对丰富的有益菌群(包括梭菌目、瘤胃球菌科或粪杆菌)的黑色素瘤患者,其抗原呈递增加,外周血和 TME 中的效应 CD4 + T 细胞和 CD8 + T 细胞功能改善,从而改善了 ICI 的抗肿瘤功效。
临床试验的证据表明,厚壁菌门和放线菌门在 FMT 与 PD-1 阻断反应者联合治疗中富集。FMT 和 PD-1 阻断联合治疗可刺激外周血单核细胞 (PBMCs) 中的粘膜相关不变 T (MAIT) 细胞和 CD56 + CD8 + T 细胞,并上调肿瘤部位 CD8 + T 细胞上人类白细胞抗原 (HLA) II 类基因 CD74 和 GZMK 的表达。
同时,FMT 联合 PD-1 阻断治疗后,难治性转移性黑色素瘤中的肠球菌相对丰度增加,导致肿瘤内 CD8 + T 细胞浸润增加和肿瘤细胞坏死。
此外,双歧杆菌和 11 种菌株也可以增加依赖树突状细胞 (DC) 的 CD8 + T 细胞的丰度,以提高 ICI 治疗效果。
■ CD4 + T 细胞
B. pseudolongum和脆弱拟杆菌刺激 Th1 免疫反应;
A . muciniphila触发CCR9+CXCR3+CD4+T 淋巴细胞募集到瘤床;
粪杆菌可增加 CD4 + T 细胞比例。
在小鼠模型中,B. pseudolongum主要通过肠道微生物代谢物肌苷促进 Th1 转录分化和抗肿瘤免疫反应,从而提高 ICI 疗效。
脆弱拟杆菌通过促进固有层树突状细胞的动员来刺激 IL-12 依赖的 Th1 免疫反应,从而恢复对 ICI 的免疫反应。
FMT无反应小鼠口服补充A. muciniphila可通过触发 CCR9 + CXCR3 + CD4 + T 淋巴细胞募集到瘤床来恢复抗 PD-1 反应。
注:瘤床(Tumor Bed)是指在肿瘤手术切除后,原有肿瘤所在的部位,包括切除肿瘤组织后的创面以及周围组织。瘤床的特征和变化对于肿瘤的预后和治疗效果起着重要作用。
在人类患者中,粪杆菌增加了外周血中的 CD4 + T 细胞比例和血清 CD25 的产生,并降低了外周血中的 Treg 细胞比例,从而诱导了伊匹单抗的长期临床益处。
注:伊匹单抗(yervoy)是首个免疫检查点抑制剂,于2013月由FDA批准上市,用于治疗转移性黑色素瘤或无法手术切除的黑色素瘤。伊匹单抗是一种抗CTLA-4抗体。
CTLA-4表达于T细胞表面,是第一个用于临床研究的Chemicalbook抑制性受体靶点。CTLA-4在T细胞活化阶段发挥抑制功能:T细胞活化后,CTLA-4在T细胞表面上调表达,一方面与CD28竞争性结合共刺激分子B7,另一方面传导抑制性信号来终止细胞活化,CTLA-4在维持免疫系统内稳态中起至关重要的作用。
肠道菌群通过提供肿瘤交叉抗原来增强肿瘤细胞的免疫原性,从而改善 ICI 的疗效,包括抗原表位 TMP1 和抗原表位 SVY。
肿瘤免疫原性降低是肿瘤细胞抵抗T细胞杀伤的重要机制。
一方面,肠道菌群可以通过作用于肿瘤细胞表面的UBA6,直接增强肿瘤细胞的先天免疫原性,从而增强ICI反应。
另一方面,肠道菌群可以通过提供肿瘤交叉抗原来间接增加肿瘤细胞的免疫原性,从而促进ICI的疗效。已鉴定出肠道微生物表达的抗原与肿瘤细胞之间存在一些交叉反应性(上图C ) 。
Enterococcus hirae 基因组中的抗原表位尾长卷尺蛋白1(TMP1)与蛋白酶体亚基β4型(PSMB4)肿瘤抗原具有高度相似性。它们同时激活CD8 + T细胞,提高PD-1阻断疗法的疗效。
已证明共生菌短双歧杆菌表达的抗原表位SVYRYYGL(SVY)与肿瘤表达的抗原表位SIYRYYGL(SIY)相似,导致SVY特异性T细胞识别SIY并抑制肿瘤生长。
肠道微生物群及其代谢物对免疫疗法影响的机制
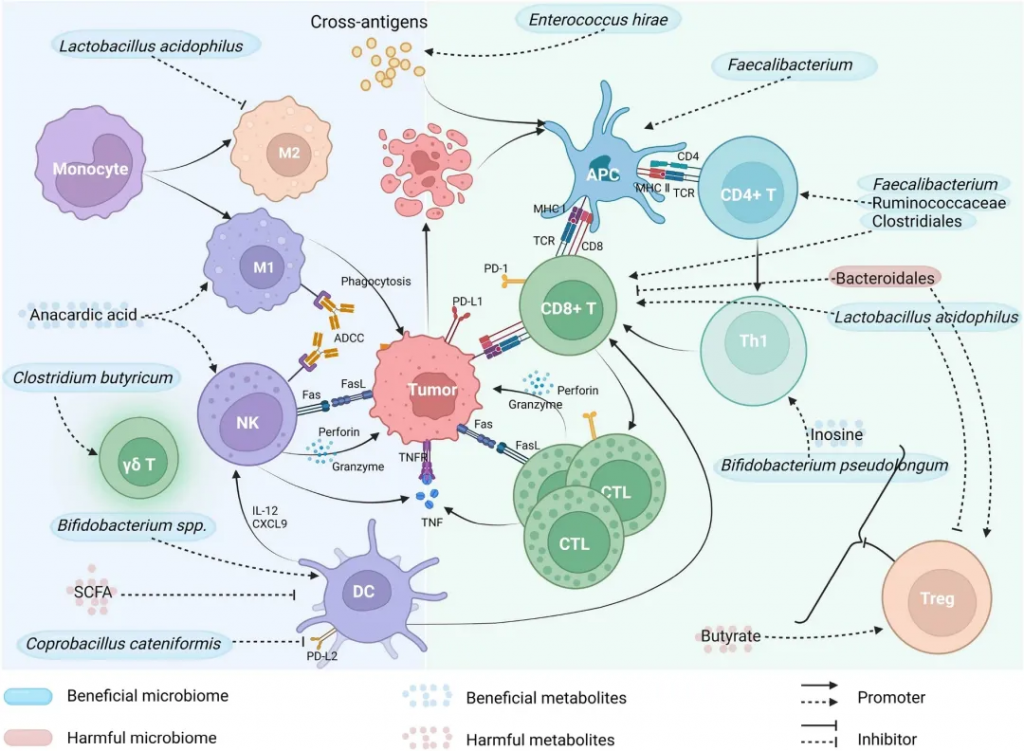
doi.org/10.1186/s40164-023-00442-x
肠道微生物群调节抗肿瘤免疫的主要方式之一是通过代谢物。肠道微生物群合成或转化大量代谢物,这些代谢物是可以从肠道中的原始位置扩散的小分子,影响局部和全身抗肿瘤免疫反应,从而促进 ICI 疗效。
这里进一步讨论不同肠道菌群代谢物的机制以及肠道菌群特征的其他特征介导抗肿瘤免疫反应。
肌苷是人体正常代谢产物,生理状态下参与核酸代谢、能量代谢和蛋白质合成,能激活免疫细胞、刺激新陈代谢。以往研究表明肌苷具有免疫抑制作用。而近年来更多研究发现肌苷可以重编程肿瘤微环境 (TME),改善ICI治疗的反应性。目前的研究表明,肌苷主要通过以下机制影响ICI疗效。
肠道微生物代谢物肌苷促进ICI疗效的潜在机制
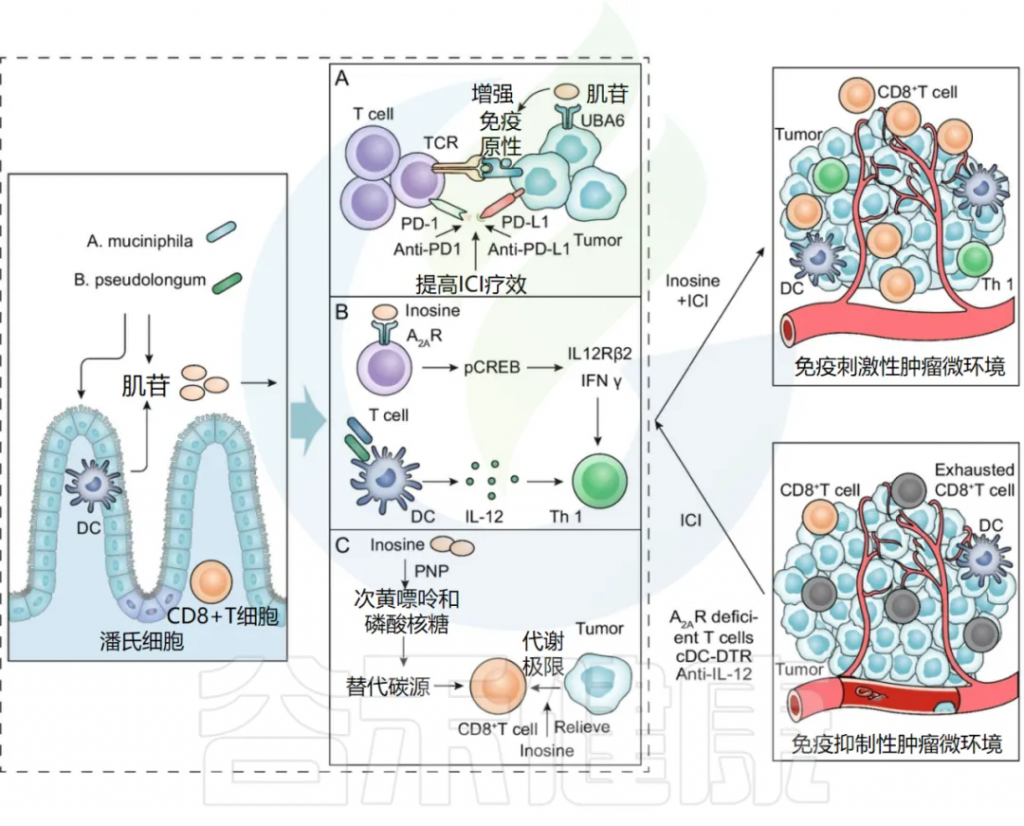
doi:10.1186/s13045-022-01273-9
肠道菌群A. muciniphila和B. pseudolongum的嘌呤代谢物肌苷,与ICI联合治疗可发挥协同抗肿瘤作用。
A) 肌苷增加肿瘤细胞的免疫原性
肌苷通过增强肿瘤抗原呈递和激活IFNγ及TNFα信号通路,提升肿瘤细胞的免疫原性,使免疫细胞更易识别并杀死肿瘤细胞。此外,肌苷还能通过抑制UBA6酶,增强T细胞介导的细胞毒作用,从而提高免疫检查点抑制剂(ICI)的疗效。
B) 肌苷促进免疫细胞活化
肌苷可能通过作用于肠癌、膀胱癌和黑色素瘤小鼠模型中T淋巴细胞上的A2AR,增强ICI疗效。它通过肌苷-A2AR-cAMP-PKA信号通路刺激cAMP反应元件结合蛋白(pCREB)的磷酸化,从而上调IL12Rβ2和IFNγ转录,促进Th1细胞分化和在TME中的聚集。
ICI 与肌苷联合使用的体内抗肿瘤作用需要共刺激物,例如 CpG 和 IL-12。肌苷还可以增强植物血凝素 (PHA) 介导的免疫反应,提高肿瘤抗原水平,并增强 T 淋巴细胞分化和增殖。此外,肌苷通过激活巨噬细胞刺激B淋巴细胞分化和抗体产生,发挥抗病毒和抗肿瘤作用。
C) 肌苷为CD8 + T细胞提供了替代碳源
肌苷可以在葡萄糖受限时作为CD8 + T细胞的替代碳源,缓解肿瘤细胞对CD8 + T细胞能量代谢的限制。
注:T 细胞通过嘌呤核苷磷酸化酶(PNP)将肌苷代谢为次黄嘌呤和磷酸化核糖。肌苷的核糖体亚基进入中央代谢途径,为糖酵解途径和戊糖磷酸途径(PPP)提供 ATP 和生物合成前体。
结肠厌氧菌从未消化和吸收的碳水化合物或肠道上皮细胞分泌的糖蛋白中产生短链脂肪酸 (SCFA)。
肠道微生物衍生的短链脂肪酸与实体瘤的纳武单抗或派姆单抗治疗之间的关联已得到证实。
注:纳武单抗OPDIVO(nivolumab)具有免疫检查点抑制活性和抗肿瘤活性,用于先前有过治疗的晚期鳞状NSCLC患者。
派姆单抗(Pembrolizumab),是一种人源化单克隆抗体,主要用于治疗多种实体瘤和淋巴瘤。
研究发现,短链脂肪酸是重要的物理和化学屏障,可刺激潘氏细胞和杯状细胞产生 AMP 和粘液,从而维持肠粘膜屏障的完整性。
短链脂肪酸在复杂的肠道微生物免疫和代谢网络中发挥关键作用,影响免疫细胞和肿瘤细胞的活性(下图)。
肠道菌群代谢物SCFAs增强ICI疗效的潜在机制
doi:10.1186/s13045-022-01273-9
A) SCFAs抑制癌细胞增殖并诱导癌细胞凋亡
Faecalibaculum rodentiumPB1和H. biformis的代谢产物SCFAs中的丁酸,可抑制HDAC的活性和钙调神经磷酸酶介导的NFATc3转录因子的激活,从而阻断肿瘤细胞的增殖。
A . muciniphila产生的丙酸通过GPR43激活细胞周期抑制剂p21并下调IAP抑制剂,从而抑制癌细胞增殖,诱导细胞凋亡,提高ICI的抗肿瘤作用。
B) SCFAs改善抗肿瘤免疫反应
丁酸可以通过IL-12信号诱导CD8+T细胞中ID2的表达,直接增强CD8 + T细胞的抗肿瘤细胞毒作用。
SCFA 中的戊酸和丁酸促进 IFNγ 和 TNFα 等效应分子的表达,增强 CTL 的抗肿瘤作用。
C) SCFA为免疫细胞提供能量
SCFA 通过调节糖酵解、TCA 循环和 β-氧化等代谢途径,为 B 细胞、记忆 T 细胞和效应 T 细胞提供能量,从而增强 ICI 疗效。
漆树酸能调节抗肿瘤免疫反应
在前瞻性研究中,对接受 ICI 治疗的黑色素瘤患者粪便细菌的代谢组学分析显示,Bacteroides caccae显著富集,ICI 反应组的漆树酸水平大幅升高(62 倍,P < 0.01)。
注:漆树酸是一类具有生物活性的有机化合物,主要存在于腰果壳液中(Cashew Nut Shell Liquid, CNSL),也可以在其他漆树科植物中找到。这类化合物以酚类结构为特征,并具有多种生物学和药理学活性,包括抗菌、抗病毒、抗氧化和抗炎作用。
漆树酸激活先天免疫
漆树酸通过磷酸化丝裂原活化蛋白激酶 (MAPK) 触发巨噬细胞中的经典活化途径,从而激活先天免疫。
漆树酸促进适应性免疫反应
漆树酸还能诱导中性粒细胞胞外陷阱( NET) 的产生,从而促进巨噬细胞、NK 细胞和 T 淋巴细胞产生肿瘤浸润免疫细胞,从而调节适应性免疫和抗肿瘤免疫。
临床前模型中,漆树酸的抗肿瘤作用
在乳腺癌模型中,漆树酸增加了肿瘤浸润的NK细胞和CTL的水平,并诱导了肿瘤细胞的凋亡(下图)。
doi:10.1186/s13045-022-01273-9
一些研究显示,肠道菌群代谢物,如次级胆汁酸或色氨酸,具有免疫抑制作用(上图5D、E)。
例如,胆汁酸代谢物3-氧化石胆酸和丰富的肠道代谢物异石胆酸可以抑制Th17细胞的分化。
此外,次级胆汁酸3β-羟基脱氧胆酸在DCs中表现出较弱的免疫刺激特性,从而诱导Foxp3的表达,增加Tregs的数量,促进免疫逃逸。
喂食次级胆汁酸或胆汁酸代谢细菌Clostridium scindens能减弱NKT细胞介导的肝脏选择性肿瘤抑制。
IL-2通过激活STAT5-5-羟色氨酸(5-HTP)-AhR轴,诱导CD8+ T细胞的耗竭,并强烈表达色氨酸羟化酶1。
色氨酸代谢物有效促进乳腺癌肿瘤细胞的运动和迁移。
在接受纳武单抗治疗的黑色素瘤和肾细胞癌患者中,血清中犬尿氨酸/色氨酸比值的增加与总体生存率的降低有关。
非小细胞肺癌患者中,低血浆色氨酸代谢物-3-羟苯甲酸水平与延长的无进展生存期(PFS)显著相关。
肽聚糖(PG)和多糖(PSA)
肠球菌(Enterococcus)表达和分泌同源NlpC/p60 PG水解酶SagA,可以促进先天免疫传感蛋白NOD2的表达,并增强ICI抗肿瘤效力。此外,以NOD1依赖的方式识别源自微生物的PG可以促进系统性先天免疫。
Leuconostoc mesenteroides NTM048或脆弱拟杆菌产生的PSA作为免疫刺激剂,能够增强粘膜屏障并影响系统性免疫反应。PSA可被小肠中的DCs识别,并激活CD4+ T细胞分泌细胞因子,促进T细胞增殖,改善Th1/Th2细胞失衡,并促进淋巴组织形成功能。
TLRs(如TLR9及其激动剂CpG-ODN)在病原体识别和免疫反应启动中起着重要作用。艰难梭菌毒素A结合的DNA激活了TLR9信号和先天免疫反应。
外膜囊泡(OMV)
由细菌自然分泌的微生物来源外膜囊泡(OMVs)可以重新编程肿瘤微环境,并已被开发用于肿瘤免疫治疗剂、细菌疫苗、佐剂和药物递送载体。
OMVs表达肿瘤抗原,诱导先天免疫反应和抗原特异性T细胞介导的抗肿瘤免疫;生物工程改造的OMVs可表达多种肿瘤抗原,触发协同抗肿瘤免疫反应。
带有磷酸钙(CaP)外壳的OMVs能促进细胞毒性T细胞渗透和M2型巨噬细胞向M1型极化,有效改善免疫抑制性TME。此外,全身给药的细菌OMVs能特异性靶向并积聚在肿瘤床中,随后诱导产生抗肿瘤细胞因子CXCL10和IFN-γ,有效增强抗肿瘤免疫反应。
免疫检查点抑制剂(ICI)治疗在杀死肿瘤细胞的同时可能扰乱宿主的免疫平衡,导致免疫相关性结肠炎、肺炎,甚至危及生命的心肌炎。
多项研究表明,肠道微生物群在免疫相关不良事件(irAEs)中的作用是一把双刃剑。
一些肠道细菌的保护作用
小鼠模型验证了双歧杆菌、脆弱拟杆菌和伯克氏菌可在抗CTLA-4治疗的背景下改善肠道免疫病理学。
一项前瞻性研究显示,拟杆菌门的增加和参与多胺运输及维生素B生物合成的微生物基因途径与治疗转移性黑色素瘤患者ipilimumab造成的结肠炎的抵抗性有关。
注:Ipilimumab是一种单克隆抗体,主要用于治疗某些类型的癌症,如黑色素瘤、肾癌等。其作用机制是通过阻断细胞毒性T淋巴细胞抗原-4(CTLA-4),从而增强免疫系统对癌细胞的攻击能力。
另一些肠道菌群与ICI引起的高风险毒性有关
在接受抗PD-1治疗的黑色素瘤患者中,Lachnospiraceae 和Streptococcus 的富集与irAEs的增加有关。
肠道菌群的双重作用
有趣的是,不同的肠道微生物基线可能同时与良好的抗癌反应和ICI引起的毒性有关。在26名接受ipilimumab治疗的转移性黑色素瘤患者中,基线时富含Faecalibacterium和Firmicutes的患者易同时发生免疫治疗引起的结肠炎和增强的ICI敏感性,称为ICI背景下的疗效-毒性耦合效应。
肠道菌群作为预测生物标志物
肠道微生物如拟杆菌,也可用作预测接受联合CTLA-4和PD-1阻断治疗的晚期黑色素瘤患者ICI治疗毒性的生物标志物。
肠道菌群的重构与治疗毒性
通过重构肠道微生物组和增加结肠黏膜中Tregs比例,FMT这种治疗方式已在两例患者中显示出对免疫治疗引起毒性的有益效果。
这些研究表明,肠道微生物组对ICI引起的毒性具有复杂的正负作用。在充分筛选和操控肠道微生物组以增强ICI反应和减少irAEs之前,还需要更多证据。
了解肠道微生物群及其代谢物对抗肿瘤免疫和免疫治疗反应的生物机制,对于合理调控微生物活动以提高免疫检查点抑制剂(ICI)的疗效至关重要。下面介绍了结合肠道微生物群与ICI的治疗策略。
doi:10.1186/s13045-022-01273-9
粪菌移植(FMT)治疗指的是将个体的全部肠道微生物群进行移植,通常从ICI响应者中获取。
FMT制剂可以通过口服冻干胶囊或通过结肠镜或胃镜直接给药。FMT最初用于治疗对传统疗法耐药的艰难梭菌感染。
FMT增强抗肿瘤效果
近年来,多项研究表明,FMT可以增强ICI的抗肿瘤效果并克服对免疫治疗的耐药性。
FMT的应用是逆转ICI免疫治疗耐药性和减少irAEs的一种新方法。
FMT与ICI治疗结合的临床试验
目前,一些评估FMT与ICI治疗结合的安全性和有效性的临床试验正在进行中。
武汉大学人民医院肿瘤中心陈永顺教授团队与善泰健康合作的题为”Fecal microbiota transplantation plus tislelizumab and fruquintinib in refractory microsatellite stable metastatic colorectal cancer: an open-label, single-arm, phase II trial (RENMIN-215) “前瞻性临床研究结果在线发表于《eClinicalMedicine》上。
注:《eClinicalMedicine》是LANCET(柳叶刀)的高端金色子刊,医学类一区TOP期刊,影响因子15.1。

该研究对至少二线系统治疗失败的微卫星稳定型(MSS)晚期结直肠癌患者进行了创新性治疗。
从2021年5月10日至2022年1月17日,共纳入20名患者。中位随访时间为13.7个月。该方案耐受性良好,无因不良反应导致死亡。通过“三联疗法”(肠道菌群移植 + PD-1单抗 + 靶向药)有效延长难治型结直肠癌患者的生存期,粪便中双歧杆菌丰度较低、毛螺菌科丰度高和外周血中扩增的 TCR 可能是预后预测和风险分层的宝贵分类因素。
这一突破性的临床研究成果具有重要的科研价值和临床应用前景,同时也充分证明了善泰健康坚持采集山区儿童供体制备优质肠道菌群的价值。
一些评估FMT联合ICI治疗安全性和有效性的临床试验正在进行中(下表)。

doi:10.1186/s13045-022-01273-9
FMT治疗的安全性考量
尽管FMT治疗在接受ICI治疗的患者中显示出有前景的结果,但其长期安全性仍存在担忧。
2019年报道的两项独立临床试验中,两名患者在接受来自同一供体的FMT后,感染了产超广谱β-内酰胺酶(ESBL)的大肠杆菌,其中一名患者死亡。这一研究促使美国食品药品监督管理局发布安全公告,警告FMT治疗的感染风险。
一项对供体粪便中多药耐药生物进行检测的回顾性队列研究显示,在66名受试者中,有6人(9%)在任何时间点检测出多药耐药生物。
因此,应定期筛查供体粪便,以严格限制可能导致不良感染事件的生物的传播,这对于免疫缺陷患者尤为重要。进一步的临床研究,对于更好地理解供体FMT的来源、移植程序和受体表型,对于成功的ICI-FMT联合治疗至关重要。
益生菌是指“当以适当剂量给予时,对宿主健康有益的活微生物群”。早期针对癌症患者的临床试验主要评估益生菌如何改变微生物群组成或调节抗肿瘤免疫。
一项针对乳腺癌患者的临床试验评估了益生菌(13种有益菌株)对TME中CD8+ T细胞浸润的影响(NCT03358511)。
接受益生菌(乳双歧杆菌和嗜酸乳杆菌)治疗的CRC患者在肿瘤、黏膜和粪便中有更多的丁酸盐生成细菌(NCT03072641)。
另一项试验表明,接受益生菌治疗的患者结肠黏膜中的IL-1b、IL-10、IL-23A mRNA水平较低(NCT01895530)。
益生菌作为免疫佐剂的作用
特定肠道微生物,如双歧杆菌、Akkermansia、肠球菌、粪杆菌、Ruminococcaceae,在ICI免疫治疗中起着免疫佐剂的作用。
多项临床试验正在评估益生菌与ICI联合使用的安全性和有效性。例如,MRx0518(粪肠球菌胶囊)主要依靠自由鞭毛蛋白激活TLR5和NF-κB信号通路,发挥抗肿瘤作用。
EDP1503是一种基于双歧杆菌的癌症免疫治疗新佐剂。临床试验(NCT03775850)显示,EDP1503与帕姆单抗联合使用是安全且耐受良好的,生物标志物研究发现,EDP1503通过上调CD8+ T细胞/Treg细胞的比例发挥作用。
doi:10.1186/s13045-022-01273-9
随着细菌基因工程技术的发展,通过改造肠道微生物群或其代谢物来改善免疫检查点抑制剂(ICI)的抗肿瘤反应变得可行。与FMT相比,基因工程药物具有特异性。
基因工程细菌的临床前模型应用
目前,经过基因改造的营养缺陷型和可诱导性大肠杆菌、双歧杆菌、李斯特菌和沙门氏菌已被用于静脉内、肿瘤内和口服给药途径的临床前模型中,显示出抗肿瘤效果。
利用工程菌作为药物载体
利用多种菌株(包括沙门氏菌和梭菌)在固体肿瘤中的靶向特性,使它们成为递送和诱导免疫刺激剂、延缓肿瘤生长和转移的理想载体。
工程化细菌的临床试验进展
SYNB1891是一种基于大肠杆菌生物学设计的双重固有免疫激动剂,被改造后表达STING激动剂CADPR,可刺激IFNs表达并实现抗肿瘤效果。正在进行临床试验以探索SYNB1891联合阿替利珠单抗在晚期实体瘤中的安全性和有效性。
工程化益生菌增强T细胞活性
L-精氨酸通过调节T细胞代谢来增强T细胞存活和抗肿瘤活性。
工程化益生菌大肠杆菌Nissle 1917菌株在肿瘤部位定植,并持续将代谢产物氨转化为L-精氨酸。在小鼠中,该菌株的肿瘤内注射增加了细胞内L-精氨酸浓度,触发肿瘤内CD4+ T细胞和CD8+ T细胞浸润,并在与抗PD-L1联合使用时产生协同抗肿瘤效果。
这些结果表明,工程化微生物治疗能够通过代谢调控肿瘤微环境,以增强免疫治疗的疗效。
通过调控肠道微生物群来增强免疫检查点抑制剂(ICI)疗效的治疗策略还包括调整饮食和生活方式、摄取益生元和避免使用抗生素。
肿瘤治疗疫苗的开发
利用肿瘤交叉抗原和肠道微生物来源的免疫激活剂,开发新的肿瘤治疗疫苗,如Ty21a、JNJ-64041809、VXM01。这些疫苗的开发为增强ICI疗效提供了新的途径。
微生物衍生药物的应用
EO2401是一种结构上与肿瘤相关抗原相同的微生物衍生多肽药物,EO2401联合纳武利尤单抗的临床试验正在胶质母细胞瘤和肾上腺皮质癌患者中进行。
口服微生物群衍生化合物(如噬菌体和微生物代谢物)可能比完整或特定活菌移植更加实际和精确。噬菌体作为一种治疗策略,可以调节肠道微生物群、免疫系统和肿瘤微环境。
短链脂肪酸戊酸(VPA)是一种微生物来源的代谢物。评估VPA与ICI联合使用在实体瘤患者中安全性和有效性的临床试验已经在进行中。
菌群影响ICI疗效的准确性
肠道菌群对肿瘤ICI治疗的影响是多方面的,甚至是双向的。未来研究需要准确分类针对免疫细胞或通路的有利和不利的菌群特征,并充分了解它们在不同肿瘤微环境中的作用。
提高治疗策略的精准度
了解菌群-代谢物-免疫轴有助于直接操纵来自肠道菌群的特定免疫刺激代谢物或化合物,而不是整个或独特的活菌移植,以改善ICI反应。其他促进抗肿瘤免疫反应的菌群衍生分子的作用可能成为未来ICI临床前或临床研究的方向。
肠道菌群作为预测有效性的生物标志物
患者的菌群数据可以与其他已知的相关预测标志物(如PD-L1表达和肿瘤突变负荷)相结合,以预测免疫治疗的潜在疗效或不良事件。
提高临床试验的有效性
在人体临床试验中,需要全面监测影响肠道菌群的因素,如饮食、益生菌、抗生素、药物、心理健康、宿主免疫系统、宿主遗传学、地理因素、肿瘤类型和分期等。
整合微生物学、遗传学、免疫学、代谢组学、分子病理学和流行病学的多层次多维度研究设计将成为未来个性化癌症治疗的一部分。
通过这些策略和研究方向,我们可以更深入地理解肠道微生物群在抗肿瘤免疫治疗中的作用,并开发出更有效的治疗方案。
肠道微生物组与免疫调节
肠道微生物组与先天性和适应性免疫细胞发生相互作用,增强先天性免疫细胞的中间效应,增强适应性免疫细胞的抗肿瘤作用,增加肿瘤细胞的免疫原性,从而重新编程TME的免疫力并改善ICI反应。
微生物代谢物与ICI效率
微生物衍生的循环代谢物调节多种人体生理,并从其在肠道中的原始位置扩散,介导局部和全身抗肿瘤免疫反应,从而促进ICI效率。
肠道微生物组与ICI相结合的治疗策略
例如适当的抗生素选择、益生菌摄入、FMT和细菌基因工程,可能为肠道微生物组及其代谢物成为ICI的优良佐剂提供新的可能性。进一步了解ICI与肠道微生物组协同作用的机制并准确识别免疫刺激和免疫抑制菌株或途径,有望开发更有效的ICI联合治疗策略并推进精准医疗策略。
肠道微生物群在癌症治疗中的应用前景广阔
首先,肠道微生物群的特性有望用于早期检测和预后评估。通过分析患者的粪便样本,可以评估其肠道微生物群的组成,预测对特定免疫疗法的反应性,从而为临床医生提供个性化的治疗方案。
其次,肠道微生物群的调节可能成为提高治疗效果的策略。例如,通过益生菌/益生元的补充、饮食调整或粪便微生物群移植,可以优化肠道微生物群的组成,增强免疫系统的抗癌能力。
肠道微生物群在癌症治疗中的作用日益受到重视,其在预测治疗反应、优化治疗策略和开发新型抗癌药物方面具有巨大潜力。
未来的研究需要进一步深入探索肠道微生物群与癌症治疗之间的具体作用机制,以及如何在临床实践中有效利用这些发现,为癌症患者带来更好的治疗效果和生活质量。
附录:
免疫疗法的治疗效果如何评估?
免疫疗法的治疗效果可以通过以下多种方式进行评估:
肿瘤大小和数量的变化
通过影像学检查,如 CT、MRI 等,观察肿瘤的大小、数量以及是否有新的病灶出现。这是评估治疗效果的常见指标之一。如果肿瘤缩小或消失,通常表明治疗有效。
肿瘤标志物水平
某些肿瘤会产生特定的蛋白质或生物标志物,检测血液中这些标志物的水平变化可以辅助评估治疗效果。
症状改善
患者的症状,如疼痛、呼吸困难、乏力等的减轻或消失,也可以反映治疗的效果。
生存时间
包括无进展生存期(PFS),即从治疗开始到肿瘤出现进展或患者死亡的时间;总生存期(OS),即从治疗开始到患者死亡的时间。较长的 PFS 和 OS 通常表示治疗效果较好。
免疫细胞的活性和数量
通过检测血液中免疫细胞(如T细胞、NK细胞等)数量、活性和表型,了解免疫系统的状态,评估免疫疗法对免疫系统的激活和调节作用。
免疫相关指标
如细胞因子水平、免疫检查点分子的表达等,也可以作为评估免疫治疗效果的参考。
患者的生活质量
通过问卷调查等方式评估患者在身体功能、心理状态、社会功能等方面的生活质量改善情况。
需要注意的是,免疫疗法的效果评估可能较为复杂,有时可能会出现假性进展或延迟反应等特殊情况,需要综合多种评估指标和患者的具体情况进行判断。
免疫疗法可以用于哪些癌症的治疗?
免疫疗法目前已被广泛应用于多种癌症的治疗,以下是一些常见的例子:
随着研究的不断深入,免疫疗法的应用范围还在不断扩大,有望为更多癌症患者带来希望。
免疫疗法的治疗周期一般是多久?
免疫疗法的治疗周期并没有一个固定的标准,会因癌症类型、患者个体情况、治疗方案以及治疗反应等多种因素而有所不同。
一般来说,免疫治疗可能需要持续几个月到几年不等。
对于某些癌症,如黑色素瘤,可能需要进行几个月的初始治疗,然后根据治疗效果和患者的耐受性,决定是否继续维持治疗。维持治疗的周期可能会持续数月甚至数年。
在肺癌的治疗中,免疫治疗的周期也会因病情和治疗方案而异。有的患者可能需要持续治疗 2 年左右,而有些情况下可能会更长。
对于一些治疗效果显著且耐受性良好的患者,医生可能会建议长期使用免疫治疗药物以防止癌症复发。
需要注意的是,医生还会定期评估患者的病情、治疗效果和不良反应,从而调整治疗方案和治疗周期。
免疫疗法治疗效果和患者耐受性有哪些关系?
免疫疗法的治疗效果和患者的耐受性密切相关。
首先,患者对免疫治疗的耐受性好,能够按计划完成治疗疗程,这有助于药物充分发挥作用,从而提高治疗效果。如果患者因耐受性差而频繁中断治疗或减少药物剂量,可能无法达到理想的治疗浓度和作用时间,影响对肿瘤细胞的抑制和杀灭效果。
其次,耐受性不佳可能导致严重的不良反应,如严重的免疫相关炎症等。这些不良反应不仅会影响患者的生活质量,还可能需要使用大量的药物来控制,这些药物之间的相互作用有时会干扰免疫治疗药物的疗效。
另外,耐受性差可能使患者心理负担加重,产生焦虑、恐惧等不良情绪,影响患者的治疗依从性和信心,进而间接影响治疗效果。
相反,良好的耐受性能够让患者保持积极的心态,更好地配合治疗,有助于增强免疫系统的功能,提高免疫治疗的效果。
总之,患者对免疫疗法的耐受性在很大程度上影响着治疗效果,而治疗效果的好坏也会反过来影响患者的耐受性和治疗依从性。
免疫疗法的优势和劣势
免疫疗法与其他传统疗法(如手术、放疗、化疗)相比,具有以下优势和劣势:
优 势
长期效果:免疫疗法有可能产生持久的免疫记忆,一旦有效,其疗效可能持续较长时间,甚至实现长期的肿瘤控制或治愈。
全身性治疗:能够激发全身性的免疫反应,不仅可以作用于局部肿瘤病灶,还可以对转移灶发挥作用,减少肿瘤复发和转移的风险。
低毒性:相比化疗等方法,免疫治疗的全身性副作用通常较轻,对正常细胞的损伤相对较小,患者的生活质量相对较高。
适用范围广:对于一些晚期或转移性肿瘤,以及传统治疗方法无效的患者,免疫疗法仍可能有一定的效果。
当然,免疫疗法也可以与其他治疗方法(如化疗、放疗或靶向疗法)结合使用,从而增强治疗效果。
劣 势
起效较慢:免疫治疗发挥作用通常需要一定的时间,不像手术能迅速切除肿瘤,也不像化疗有时能较快地缩小肿瘤体积。
个体差异大:不同患者对免疫治疗的反应差异较大,部分患者可能疗效不佳。
价格昂贵:免疫治疗药物的研发和生产成本较高,导致治疗费用昂贵,给患者带来较大的经济负担。
潜在的免疫相关不良反应:虽然相对较轻,但仍可能出现免疫相关的炎症反应,如免疫性肺炎、免疫性肝炎、免疫性肠炎等,需要密切监测和及时处理。
预测疗效困难:目前还缺乏准确可靠的方法来预测哪些患者能够从免疫治疗中获益,导致治疗的选择存在一定的盲目性。
随着研究的不断深入和技术的进步,免疫疗法的优势有望进一步扩大,劣势也有望逐渐得到改善。在实际治疗中,医生会根据患者的具体情况,综合考虑各种疗法的特点,制定最适合的个体化治疗方案。
免疫疗法的适用人群有哪些?
免疫疗法的适用人群主要包括以下几类:
晚期癌症患者
对于一些晚期癌症,如晚期黑色素瘤、非小细胞肺癌、肾癌、膀胱癌等,在传统治疗方法效果不佳时,免疫疗法可能成为一种有效的治疗选择。
具有特定基因突变的患者
例如携带微卫星高度不稳定(MSI-H)或错配修复缺陷(dMMR)的实体瘤患者,往往对免疫治疗有较好的反应。
肿瘤突变负荷(TMB)高的患者
TMB 高通常意味着肿瘤产生了更多的新抗原,更容易被免疫系统识别,免疫治疗效果可能更好。
部分血液系统恶性肿瘤患者
如某些类型的淋巴瘤等。
一线治疗后复发或进展的患者
在其他治疗方案失败后,免疫疗法可能为他们提供新的治疗机会。
然而,并非所有癌症患者都适合免疫疗法。医生会综合考虑患者的身体状况、肿瘤类型、基因突变情况等多种因素,来判断患者是否适合接受免疫治疗。同时,在治疗过程中也会密切监测患者的反应和副作用,以便及时调整治疗方案。
哪些人群不适合免疫疗法?
以下人群可能不适合免疫疗法:
自身免疫性疾病控制不佳的患者
如患有严重的类风湿关节炎、系统性红斑狼疮等,免疫治疗可能会加重自身免疫反应,导致病情恶化。
器官功能严重障碍的患者
例如存在严重的心肺功能不全、肝肾功能衰竭等,可能无法耐受免疫治疗带来的潜在副作用。
处于急性感染期的患者
身体正在对抗严重的感染,此时进行免疫治疗可能会进一步影响免疫系统的平衡,加重感染或影响治疗效果。
怀孕或哺乳期妇女
免疫治疗可能对胎儿或婴儿产生潜在的不良影响。
对免疫治疗药物成分过敏的患者
这会引发严重的过敏反应,危及生命。
患有精神疾病或无法配合治疗和随访的患者
免疫治疗需要患者密切配合治疗和定期随访,以监测疗效和不良反应。
对于每个患者是否适合免疫疗法,需要医生根据患者的具体情况进行综合评估和判断。
免疫疗法有哪些不良反应?
免疫疗法的副作用是一个重要的问题,因为它们可能会影响患者的生活质量和治疗效果。
免疫疗法的副作用包括疲劳、发热、恶心、呕吐、腹泻、皮疹、瘙痒、呼吸困难、头痛、肌肉疼痛、关节疼痛等。需要对这些副作用进行评估和管理。
免疫疗法可能会引起多种不良反应,免疫疗法的副作用可以分为两类:
与免疫疗法直接相关的副作用包括免疫相关不良事件(irAE)和免疫检查点抑制剂相关不良事件(ICI-AE)。
皮肤反应:如皮疹、瘙痒、白癜风等。
胃肠道反应:如腹泻、结肠炎、恶心、呕吐等。
内分泌系统紊乱:可能导致甲状腺功能异常(甲状腺功能减退或亢进)、垂体炎、肾上腺功能不全等。
肝脏毒性:表现为转氨酶升高、肝炎等。
肺部问题:如肺炎、咳嗽、呼吸困难等。
心血管系统不良反应:如心肌炎、心包炎、心律失常等,严重情况下可能危及生命。
关节和肌肉疼痛:可能出现关节炎、肌痛等症状。
神经系统症状:头痛、头晕、外周神经病变等。
这些不良反应的发生机制主要与免疫系统被过度激活,攻击自身正常组织和器官有关。不过,并非每个接受免疫治疗的患者都会出现不良反应,且不良反应的严重程度因人而异。在治疗过程中,医生会密切监测患者的身体状况,以便及时发现和处理这些问题。
免疫疗法在治疗周期内需要注意什么?
在免疫疗法的治疗周期内,需要注意以下几个方面:
饮食方面:保持均衡的饮食,摄入富含蛋白质、维生素和矿物质的食物,以增强身体的抵抗力。避免食用过多油腻、辛辣和刺激性食物。
作息规律:保证充足的睡眠,规律作息,避免过度劳累,有助于维持免疫系统的正常功能。
按时复查:按照医生的要求定期进行血常规、肝肾功能、肿瘤标志物等检查,以及影像学检查(如 CT、MRI 等),以便及时监测治疗效果和发现可能出现的不良反应。
关注身体变化:留意自身的身体状况,如是否出现发热、咳嗽、皮疹、腹泻、关节疼痛等异常症状。若有不适,及时告知医生。
用药管理:严格按照医嘱用药,不可自行增减药量或停药。
心理调节:保持积极乐观的心态,避免过度焦虑和紧张,可以通过适当的运动、与家人朋友交流等方式缓解心理压力。
避免感染:注意个人卫生,勤洗手,避免去人员密集、容易感染的场所。
运动适度:根据自身身体状况,进行适量的运动,如散步、瑜伽等,但避免剧烈运动和过度劳累。
告知医生其他用药:如果在治疗期间需要使用其他药物,包括保健品、中草药等,应提前告知医生,以防药物相互作用影响免疫治疗效果或增加不良反应风险。
主要参考文献
Zhao W, Lei J, Ke S, Chen Y, Xiao J, Tang Z, Wang L, Ren Y, Alnaggar M, Qiu H, Shi W, Yin L, Chen Y. Fecal microbiota transplantation plus tislelizumab and fruquintinib in refractory microsatellite stable metastatic colorectal cancer: an open-label, single-arm, phase II trial (RENMIN-215). EClinicalMedicine. 2023 Nov 14;66:102315.
Yousefi Y, Baines KJ, Maleki Vareki S. Microbiome bacterial influencers of host immunity and response to immunotherapy. Cell Rep Med. 2024 Apr 16;5(4):101487.
Lu Y, Yuan X, Wang M, He Z, Li H, Wang J, Li Q. Gut microbiota influence immunotherapy responses: mechanisms and therapeutic strategies. J Hematol Oncol. 2022 Apr 29;15(1):47.
Balan Y, Sundaramurthy R, Gaur A, Varatharajan S, Raj GM. Impact of high-salt diet in health and diseases and its role in pursuit of cancer immunotherapy by modulating gut microbiome. J Family Med Prim Care. 2024 May;13(5):1628-1635.
Kang X, Lau HC, Yu J. Modulating gut microbiome in cancer immunotherapy: Harnessing microbes to enhance treatment efficacy. Cell Rep Med. 2024 Apr 16;5(4):101478.
Zhang, M., Liu, J. & Xia, Q. Role of gut microbiome in cancer immunotherapy: from predictive biomarker to therapeutic target. Exp Hematol Oncol 12, 84 (2023).