-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

细菌耐药性
抗生素耐药性细菌感染的发生率正在上升,而新抗生素的开发由于种种原因在制药行业受重视程度下降。
最新在《柳叶刀-微生物》(The Lancet Microbe)上,科学家提出了基于细菌适应性、竞争和传播的生态原则的跨学科研究方法,可能开辟新途径来对抗抗生素耐药性感染。
许多兼性细菌病原体使用人类粘膜表面作为其主要储藏库,并在微生物组和宿主的某些病理状态下诱发传染病,以帮助其横向传播到新的宿主生物体。
有益的细菌共生体可以战胜特定的病原体,从而降低病原体传播和引起严重感染的能力。然而,尽管具有临床相关性,但对其自然栖息地中的共生-病原体相互作用的了解仍然很少。
本文将在人类微生物组和宿主生物学背景下讨论细菌病原体和共生体之间相互作用的研究最新内容,为预防和治疗传染病提供一些新视角。
The Gut Microbiome
对人类微生物组完整性作为健康需求的日益认可,正在极大地改变人们对细菌微生物组成员及其相互作用的评价,无论是微生物之间的互动还是与宿主的互动。这种理解的变化使得微生物生态学的原则成为了预防和治疗主要人类疾病的创新方法的核心。
从海量数据中分析推断出的微生物组特征正被考虑作为不同疾病诊断中的生物标志物,这些疾病包括各种类型的癌症,如结肠癌或乳腺癌,以及自身免疫性疾病,如类风湿性关节炎或银屑病。
粪便微生物移植在治疗艰难梭菌感染方面已被有效使用,而补充微生物组成员(例如AKK菌)或微生物组产品(例如短链脂肪酸),已显示出在改善代谢紊乱和癌症的健康结果方面的潜力。
然而,环境与人类相关的微生物生态系统之间存在根本性差异。许多环境微生物组代表了广阔、不受限制的生态系统,通常具有无限的生命周期,对微生物扩散几乎没有障碍。相比之下,与宿主相关的微生物组,如人类肠道中的微生物组,是受限的生态系统,具有较短的生命周期。
与宿主相关的微生物组需要特定的细菌机制来在个体和世代之间传播,并在其首选的生活条件之外暂时持续存在。
此外,宿主将微生物定殖者暴露于环境栖息地以外的压力源中,特别是通过其粘膜免疫系统。
Microbial Symbiosis and Pathogenicity
▸ 过去,对共生体和病原体的理解不全面
从历史上看,对与宿主相关的微生物生态系统的研究,曾局限于不同研究团队分别对中性或共生的细菌共生体和有害病原体进行的独立调查。因此,对这些不同组的与宿主相关细菌的当前理解高度不对称,且存在对病原体的强烈偏见,这阻碍了对人类微生物组生态的全面理解。
虽然这些细菌组在自然栖息地中有广泛的相互作用,但关于共生菌和病原体相互作用的实验研究却很少。例如,典型的病原体可以被发现几乎是人类微生物组的驯化成员,而共生菌则可以与病原体勾结,这会像多重微生物感染中那样。
▸ 共生菌和致病菌的区分较复杂
尽管在感染医学中,共生菌和致病菌之间的传统区分仍然是一个重要标准,但在生态学上下文中,这两组微生物固有的属性重叠使得这种区分变得不够充分。
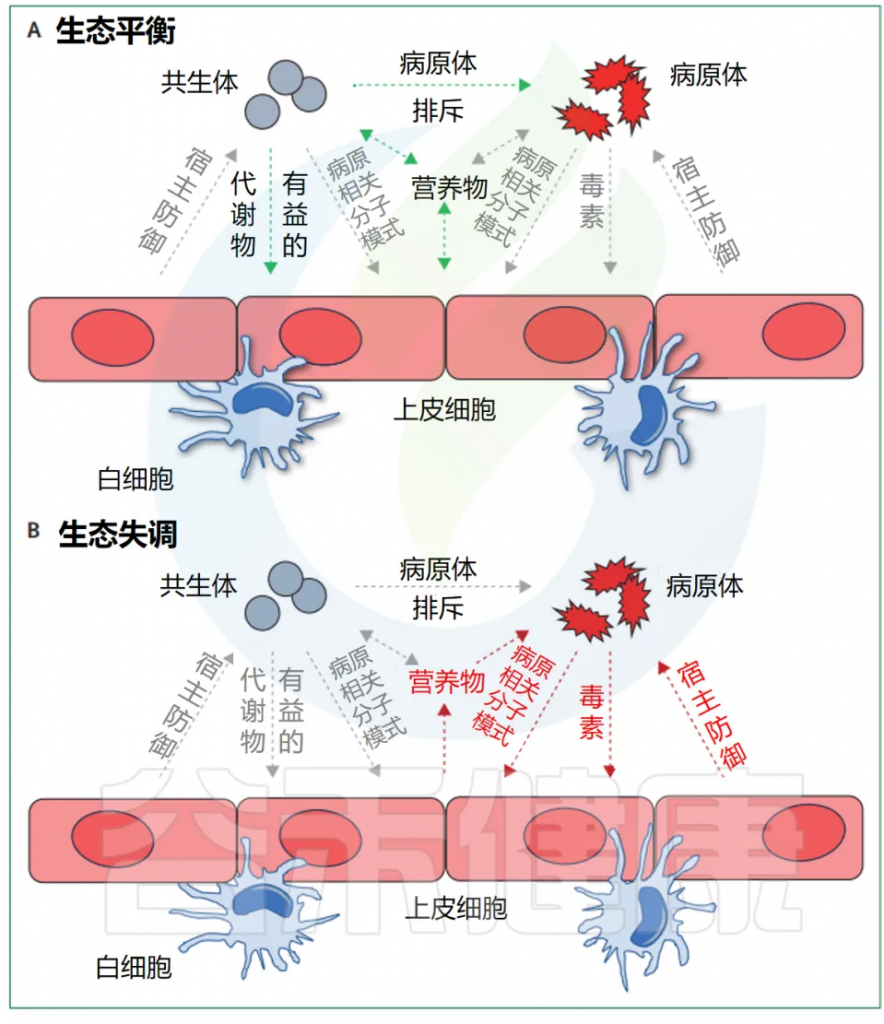
有益的共生现象和对立的致病性代表了细菌行为范围的两个极端(下图),尽管很少有细菌微生物组成员表现出真正的致病行为。多细菌物种或菌株可以根据其环境背景和宿主生理状态动态改变其作为共生体或病原体的能力,这进一步使区别变得复杂。
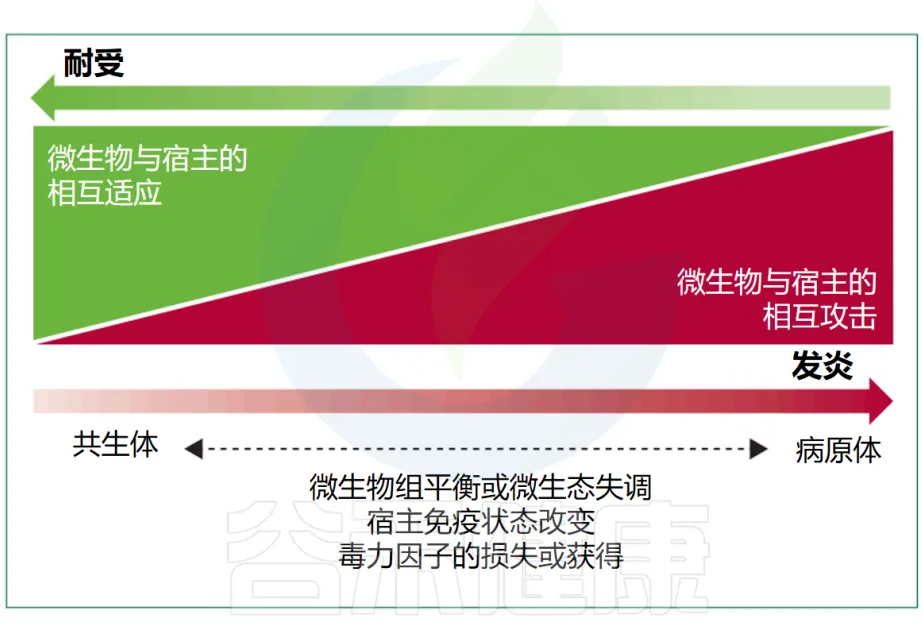
Maier L, et al. Lancet Microbe. 2024
例如,微生物组失调和宿主免疫缺陷,可以将肠球菌(Enterococcus faecium)从一个几乎无害的肠道微生物组成员转变为血流感染的原因。
单个水平基因转移事件可以改变共生生活方式和致病生活方式之间的平衡,例如,当预测的编码毒素成为肠出血性大肠杆菌或皮肤定植和口咽定植的白喉杆菌的主要毒力因子时。这意味着,原本可能是相对无害的微生物,在获得某些特定基因后,其生物学性质和行为可能发生显著变化,从而增加了其致病潜力。这种基因的转移和表达可以使这些微生物在宿主体内表现出更强的侵袭性和病原性,从而对宿主健康构成更大的威胁。
Redefining “Infection”
条件性细菌病原体之间的共生与致病性的动态变化,这挑战了当前对“感染”一词的使用,这种使用往往不一致。
《柳叶刀-微生物》全体作者建议仅将“感染”这个术语,保留用于由特定器官组织中出现的细菌菌株引起的病理状态。例如下列情况:
因此,在这篇个人观点文章中,我们也建议将常规引起感染的细菌称为病原体,而不常引起感染的细菌称为共生菌,尽管这些术语有其局限性,并不能适当描述所有类型的微生物与宿主之间的对抗关系。
目前病原体与共生菌之间的界限模糊,也挑战了科赫的假说,该假说提出了特定微生物与相应疾病之间的单一因果关系。然而,实际上,有些疾病是由多种细菌种类的间接效应引起的,当微生物群落失衡而不仅仅是这些种类的存在,导致了一种特定的病理状态,而这种状态目前并不被视为典型的感染。
Understanding of Bacterial Pathogens and Symbiotic Bacteria
微生物组科学,尤其测序技术的快速进展以及新技术的出现,为微生物学开启了一个新阶段,这一阶段的研究将细菌病原体和共生菌整合在一起,超越了简化的研究方法。
为了探究环境变化如何影响细菌微生物组成员的动态行为变化,来自不同背景的微生物学家应当合作,并结合系统生物学、天然产物化学、粘膜免疫学和临床传染病等互补学科的专业知识。这些新方法可能有助于回答一些最相关和明显的问题:
Future Research on Commensal Bacteria
由于其高度的临床相关性以及培养和操控相对容易,像S. flexneri(志贺氏菌)、S. aureus(金黄色葡萄球菌)和 S. pneumoniae(肺炎链球菌)这样的主要细菌病原体已经被研究了几十年,远超过典型的宿主相关共生菌。相比之下,主要的人类相关共生菌,例如来自属如拟杆菌属、梭菌属(Clostridium)、Cutibacterium,仅被少数实验室研究。
实际上,大多数人类微生物组成员仍然难以培养,并且在遗传上不易处理。在特定情况下可以成为偶发性病原体的一些共生菌,如医院获得性大肠杆菌、粪肠球菌(E.faecium)或表皮葡萄球菌(Staphylococcus epidermidis),已经在一定程度上被研究。但为什么这些特定的细菌比其他更无害的共生菌更频繁地引起侵袭性感染,这一点仍然不清楚(如下表)。


Maier L, et al. Lancet Microbe. 2024
The Important Role of Symbiotic Bacteria in Human Health
越来越多的证据表明,一些共生细菌对人类健康至关重要。
▸ Blautia producta 抑制粪肠球菌
例如,Blautia producta 的共生菌株通过产生特定的抗菌化合物,可以抑制并排除粪肠球菌(E.faecium),而Staphylococcus lugdunensis的共生菌则可以抑制并排除金黄色葡萄球菌。
▸ 枯草芽孢杆菌阻止金黄色葡萄球菌
肠道中的枯草芽孢杆菌(Bacillus subtilis)释放一种抑制性化合物,可以阻止金黄色葡萄球菌的定植能力,或抑制肠球菌(Enterococcus faecalis)的毒力因子表达。
一些共生菌还能产生对宿主有直接益处的化合物,例如促进肿瘤疗法的成功。病原体的研究可以帮助理解这些有益共生菌的生物学特性,并利用它们来对抗细菌感染。
共生菌的许多重要特性在不同菌株间可能会有所不同,这取决于例如获得或丢失移动遗传元素,如编码抗性或适应性特征的基因岛。用于病原体菌株特异性分类的现有方法,如序列分型方案,也可以应用于共生菌。这些方法可以帮助提升当前的诊断策略,达到个性化感染医学的新水平,不仅监测特定有害病原体的存在,还监测如那些保护免受潜在病原体定植的特定有益共生菌的缺失。
bacterial pathogens and symbiotes
▸ 共生菌的宿主特异性适应
与许多主要的细菌病原体一样,很多共生菌也特定于特定的宿主物种。这种适应过程导致宿主特异性,可能作为一种策略来增加细菌在与其他适应性较差的微生物竞争中的生存能力。这些基础机制对于病原体来说理解得很少,对于非致病性共生菌来说则基本上是不清楚的。
▸ 共生菌的粘附与持续定殖机制
特定宿主的持续定殖往往依赖于有效地粘附到上皮细胞的结合基序,如表面蛋白、蛋白多糖或糖脂。尽管在许多主要病原体中已经在一定程度上研究了相应的细菌粘附素,但现在才开始探索共生微生物中的这些机制。
▸ 共生菌与宿主免疫系统的相互作用
细菌在上皮表面的生存受到粘膜宿主防御机制的限制,这些机制包括IgA、抗菌肽和脂质以及活性氧和氮化合物的产生。先天和适应性免疫机制,通过感知与微生物相关的分子模式分子或通过粘膜白细胞检测微生物抗原来启动,有助于粘膜免疫过程,导致促炎或抗炎信号和效应分子的释放。
宿主的持续定殖依赖于细菌耐受抗菌免疫效应分子的能力或通过诱导免疫耐受来减少它们的表达。具有对抗菌宿主效应分子增强耐受性的细菌甚至可以诱导和利用抗菌宿主反应来消除更易感的竞争者。
根据宿主免疫反应,与微生物群其他成员的拮抗干扰已在表皮葡萄球菌和鼠伤寒沙门氏菌中得到记录。广泛的研究揭示了主要病原体的免疫逃避机制,但共生菌是否使用类似或不同的策略仍然未知。
▸ 共生菌免疫调节的复杂性及其潜在影响
例如,一些肠道共生菌通过产生非炎症性鞭毛蛋白来钝化先天免疫反应,这些蛋白抑制人类的Toll样受体5,或产生可以在粘膜表面诱导调节性T细胞的短链脂肪酸,以促进免疫耐受。然而,这些潜在的控制机制可能会被干扰,并可能在宿主无法启动耐受并以炎症反应的情况下导致疾病,例如当口腔共生菌异位定殖在肠道时。
doi.org/10.1016/S2666-5247(24)00049-1
总的来说,宿主相关生态系统中的细菌间的相互作用很大程度上依赖于分泌的因子,这些因子可以通过专门的分泌系统以单独的可溶性分子的形式释放出来,或者作为膜囊泡的组成部分释放出来(上图)。
因此,细菌病原体的分泌毒力因子已经被广泛研究。相比之下,共生菌分泌的初级或次级代谢产物或蛋白质介质如何调节与病原体和宿主的相互作用的研究较少。这些研究显示,例如一些共生菌可以释放杀菌素等分子,消灭金黄色葡萄球菌等病原体,或产生营养物促进艰难梭菌等病原体的扩展,由此凸显了宿主相关微生物生态系统中的一个新的复杂层面。
Fitness mechanisms of facultative human pathogens
许多主要的人类细菌病原体不是专性病原体,而是作为常见微生物组成员定植于人类或动物体表面,但不会引起疾病(下表)。

doi.org/10.1016/S2666-5247(24)00049-1
事实上,在大多数兼性病原体的共生生活方式中,急性感染是罕见的。然而,研究主要集中在S.flexneri、金黄色葡萄球菌、肺炎链球菌等病原体的毒力机制上,而在共生行为期间引导这些生物体与其他微生物组成员竞争的适应性的机制仍然被忽视。
从微生物的角度来看,感染是否以及哪些类型确实对细菌有利,或者应该被视为偶然事件,而不利于它们在几代宿主中的长期进化成功,目前尚不清楚。
Importance of a Deep Understanding of Bacterial Infections
现在比以往任何时候都更需要深入理解细菌感染,因为全球抗菌药物抗性和细菌感染的负担日益增加。目前对细菌感染的了解主要限于少数模型病原体,如金黄色葡萄球菌和肺炎链球菌。相比之下,一些臭名昭著的抗生素抗性细菌种类,根据以下病原体种属的首字母被命名为ESKAPE病原体,包括粪肠球菌、金黄色葡萄球菌、肺炎克雷伯菌、鲍曼不动杆菌、假单胞菌和肠杆菌,这些病原体的研究细节远不够充分。
▸ ESKAPE病原体的持久抗性与适应性进化
抗生素抗性机制在某些情况下可能会给细菌带来适应性的负担,即抗性可能会影响细菌的其他生存能力,但在没有抗生素的环境中,这种抗性通常会消失。然而,一些被称为ESKAPE病原体的细菌已经进化出了一种能力,使它们能够在医疗环境之外保持这种抗性特征。补偿性突变可以帮助这些细菌克服由于抗性而带来的适应性负担,从而促进抗性菌的成功和抗性的传播。
▸ 社区相关的抗性细菌扩散
这就是为什么社区相关的甲氧西林抗性金黄色葡萄球菌(MRSA)和万古霉素抗性屎肠球菌(VRE)等细菌,能够如此有效地在社区中扩散和扩张,甚至以牺牲它们对抗生素敏感的同类为代价,这一现象仍然是科学界未解之谜。这表明这些细菌可能已经发展出了一些未知的机制来维持和增强其抗性,即使在抗生素使用减少的环境中也是如此。这种现象需要进一步的研究来解明其背后的具体机制和因素。
The Relationship Between Bacterial and Ecological Success
生态学概念在普通微生物学和环境微生物学领域很常见,但尚未广泛应用于对病原菌的理解。
细菌在与其他微生物组成员的竞争中的成功依赖于多种机制,包括利用生长限制性营养物质的能力,从其他细菌那里获取促进生长的共同物质如聚合物水解酶或微量金属捕获剂,抵抗由微生物群体成员释放的抗菌分子,或者附着在少数上皮细胞附着点上。
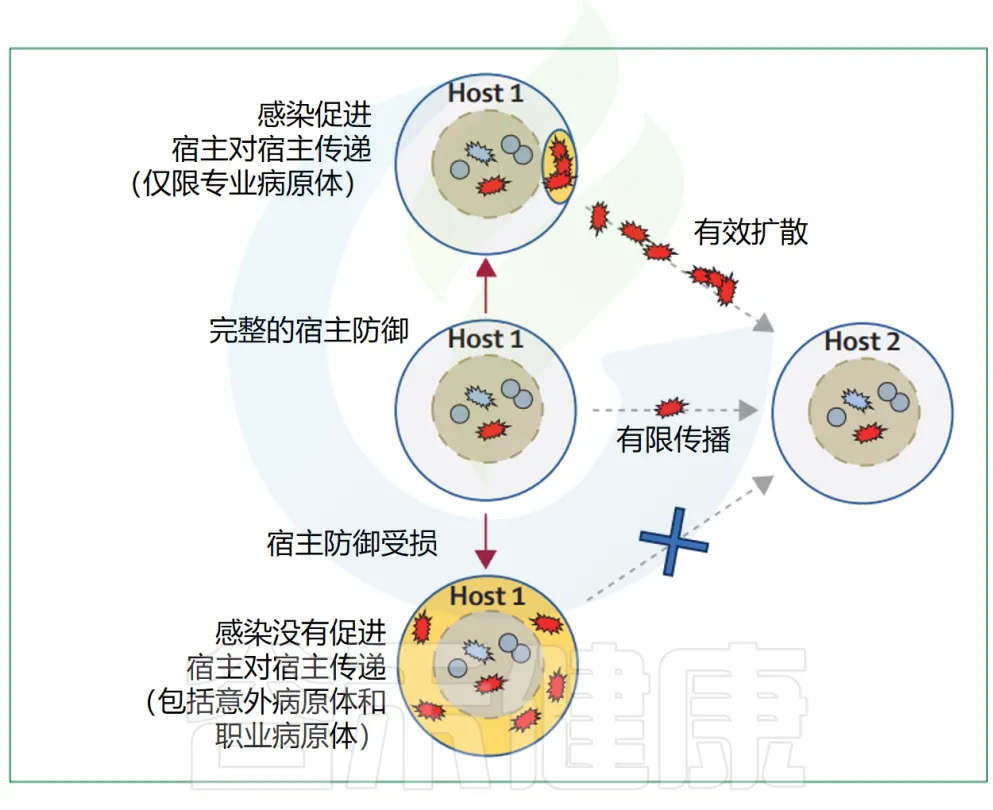
一个细菌种类或菌株的长期生态成功来自于该种类在特定宿主体内的增殖和向新宿主体传播的综合效应。为了研究一个种类在特定宿主体内的增殖,应采用一系列研究策略,从共生菌的研究到对主要专业和偶发病原体的调查。
细菌有两种主要的传播方式:垂直传播和横向传播。
每个人体内都有大量细菌,它们组成了独特的微生物组。这些细菌有的倾向于垂直传播,有的倾向于横向传播,不同细菌的传播方式和速度是不一样的。
2022年的一项研究就发现,微生物组中的细菌在这两种传播方式的偏好上有所不同。我们已经对一些常见的致病细菌的横向传播有了较多了解,比如幽门螺杆菌、肺炎链球菌、金黄色葡萄球菌等。它们能在人群中快速传播,传播过程也被很好地监测和记录。但目前对这些细菌是如何在人体外存活,又是如何进入新的人体的,还不太清楚。
The association between the epidemic spread of pathogens
主要病原体的流行扩散很可能与它们引起的感染类型和严重程度有关(下图)。
▸ 感染类型
疾病特性对细菌传播的贡献在引起腹泻的病原体(如志贺氏菌)中最为明显,这类病原体通过污染的污水传播而获益。
其他常见的感染表现可能也具有类似的作用。例如,金黄色葡萄球菌引起的典型感染——化脓性皮肤和伤口感染,会导致大量的S.aureus细胞在体表出现,从而支持通过皮肤接触的宿主间传播。
类似的机制也可以使尿生殖道病原体,如淋病奈瑟菌Neisseria gonorrhoeae在宿主间迅速传播。引起呼吸道感染的病原体,如百日咳博德特氏菌Bordetella pertussis、化脓性链球菌Streptococcus pyogenes或肺炎链球菌S pneumoniae则通过咳嗽或打喷嚏的个体释放的气溶胶传播。
▸ 严重程度
关于疾病的严重程度如何通过支持传播来增强病原体的适应性已有讨论,例如在SARS-CoV-2的背景下,但尚未对细菌病原体进行系统性评估。值得注意的是,大多数专业化的细菌病原体并非人类微生物组的核心成员,它们只是暂时性地定植在人类体内(见表1),这就需要它们具备有效的横向传播机制。
专业人类病原体(如志贺氏菌和淋病奈瑟菌N.gonorrhoeae)的持续定植在人群中较为罕见,或仅在人群的一小部分(如金黄色葡萄球菌)或特定年龄组(如化脓性链球菌或肺炎链球菌)中发现,这表明维持广泛的致病力涉及与其他微生物组成员竞争时的重大适应性负担。
诸如粪肠球菌(E.faecium)和表皮葡萄球菌( S.epidermidis )等偶然病原体表达的因子有助于其免疫逃避能力,但几乎不表达任何侵袭性毒素,这可能导致这些病原体在人类微生物组中比大多数专业病原体具有更高的患病率和持久性。
由于偶发性病原体主要在免疫力低下的个体中引起感染,它们也常被称为机会性病原体。然而,这一术语也经常用于诸如金黄色葡萄球菌和肺炎链球菌等专业病原体,这些病原体在免疫力低下的个体中引起的感染类型不同且更为严重(通常是血流感染),而在免疫力正常的个体中则不然。因此,专业病原体有时也可能引起偶发性感染,这种感染并不促进病原体的传播。偶发性人类感染也可以由适应于非人类宿主的病原体如军团菌(Legionella pneumophila)或霍乱弧菌引起,这些病原体只在特定的环境条件下感染人类。
The association between the epidemic spread of pathogens
在自然环境中同时研究共生菌和病原体,可以帮助我们更好地控制微生物,对抗感染以及其他与微生物组相关的疾病。
共生细菌对传染病的影响远比先前假设的要复杂得多。一些共生菌种采用主动防御策略,如释放抗菌肽或通过依赖接触的V型、VI型或VII型分泌系统消除其他细菌,这些系统在针对特定目标物种的特异性上可能有很大差异。此外,共生菌还可以使用更微妙的抑制策略来增加其在抗击病原体定植方面的生态成功,这基于代谢干扰。
共生细菌群落可以以依赖于群落多样性及其与病原体的代谢重叠的协作方式,阻止诸如克雷伯肺炎菌和鼠伤寒沙门氏菌等病原体获取营养物。
病原体的排除可能是由于共生菌释放的金属载体螯合必需的微量金属,或产生抑制性代谢产物而产生的。例如,一些肠道共生菌可以将原生胆酸转化为抑制肠道病原体艰难梭菌C difficile孢子生长的次生胆酸代谢产物。
Challenges in Fecal Microbiome Transplantation Treatment
粪便微生物组移植(FMT)是治疗艰难梭菌感染的一种有效策略。粪便微生物组移植成功至少部分是由于恢复了有益细菌群及其代谢产物,这些代谢产物能抑制艰难梭菌的生长。然而,粪便微生物组移植难以标准化,其对抗其他病原体的效果仍不明确。
目前,临床前和临床试验正在评估使用基于共生菌的生命治疗产品来预防处于风险中的个体被抗生素耐药病原体定植。然而,那些防止病原体定植的共生菌往往比目标病原体更易受抗生素影响,这可能会消除共生菌的有益效果,并在抗生素治疗期间加剧与菌群失调相关的疾病。
因此,研究人员需要平衡使用共生菌治疗产品的风险和好处。深入了解不同共生菌菌株对抗生素的敏感性,以及这些菌株如何与目标病原体相互作用。只有通过深入的研究和严格的监测,才能确保共生菌的治疗潜力得到充分发挥,同时避免不良后果的发生。
系统评估关键共生菌群的抗生素敏感性,并将这些知识纳入个性化的、基于微生物组的抗生素管理方案中,对于最小化广谱抗生素对微生物组的附带伤害至关重要。
除了我们通常使用的抗生素之外,许多针对人类的其他药物也可能意外地影响到人体肠道中的有益细菌。这种药物的副作用在未来的医疗实践中需要被特别注意,特别是对于那些需要同时使用多种药物治疗多种疾病的患者。此外,人体内的微生物群体本身可能是一种新型抗菌剂的重要来源。通过系统地研究和描述这些微生物产生的创新化合物,我们可能会发现新的药物,这些药物有望用于预防或消除病原体在人体内的定植。
Antibiotic Resistance Issues in Treatment
在现代医疗中,我们常用的广谱抗生素不仅攻击病原体(引起病症的微生物),还会影响到人体内的有益共生细菌。这种广泛的攻击会导致细菌之间的抗药性基因传递,特别是通过一些可以在不同细菌间转移的元素,如质粒和噬菌体。这种基因的传递可能导致抗生素更难以消灭病原体。
由于这种抗药性基因的传递,需要更好地监控不仅是病原体的抗药性发展,也要监控那些可能是抗药性传播者的共生菌。这样可以更有效地控制病原体的传播和抗药性的发展。
此外,通过理解这些微生物之间的生态关系,可以更好地发现病原体的弱点,从而开发出新的治疗方法。
这些方法不仅限于传统的抗生素,还包括能够利用有益共生菌或宿主防御机制的新型药物。这些新药物的开发需要在模拟真实生态环境的实验模型中进行,比如使用人类挑战模型,这种模型允许我们在受控的环境中测试病原体和治疗方法。
总之,通过更好地理解微生物之间的相互作用和生态平衡,可以开发出更有效的策略来对抗病原体,同时减少对有益共生菌的损害。这种方法有助于限制病原体的传播和疾病的爆发。
主要参考文献:
Maier L, Stein-Thoeringer C, Ley RE, Brötz-Oesterhelt H, Link H, Ziemert N, Wagner S, Peschel A. Integrating research on bacterial pathogens and commensals to fight infections-an ecological perspective. Lancet Microbe. 2024 Apr 9:S2666-5247(24)00049-1. doi: 10.1016/S2666-5247(24)00049-1. Epub ahead of print. PMID: 38608681.
谷禾健康
幽门螺杆菌(helicobacterpylori,H.pylori)是革兰氏阴性,螺旋形,微需氧细菌,是一种独特的,能持续定植于人类胃粘膜并能引起胃感染的细菌。
世界上有超过一半的人感染了幽门螺杆菌,但很多没有临床症状。幽门螺杆菌与人类宿主之间有着很复杂的关系。
21年的时候谷禾整理总结过一篇关于正确认识幽门螺杆菌(H.pylori)的文章,内容包括了幽门螺杆菌感染症状,其与人体微生物群的关系,宿主和环境决定因素,细菌定植和持久性决定因素,免疫机制等多方面信息。详见:
目前临床普遍指出幽门螺杆菌是一种比较难处理的感染,因为会复发而且通常对治疗有抵抗力。幽门螺杆菌的标准抗生素治疗根除成功率低于60%,且存在多种长期副作用。研究发现营养和补充策略可能有助于支持传统抗生素治疗。一些营养素可以降低细菌定植水平并改善胃损伤症状。营养还可以增强标准抗生素治疗的疗效,同时预防抗生素副作用。
因此哪些食物和补充剂可能有助于支持传统疗法也是很多感染者关注的事情,所以本文主要讨论幽门感染的症状,及其感染后对健康或营养等正面和负面影响,以及有证据发现了哪些天然补充剂可以对抗幽门螺杆菌。
但是要注意,一些食物和补充剂与减少幽门螺杆菌负荷或改善对传统疗法的反应有关。但是不要使用以下任何策略来代替医生的建议,虽然其中一些策略与处方药一起使用可能会有所帮助。
幽门螺杆菌(H. pylori) 是一种定植于胃中的革兰氏阴性螺旋状致病菌。
这种细菌是第二大最常研究的病原体(仅次于大肠杆菌)。马歇尔(Barry Marshall)和沃伦(Robin Warren)因将幽门螺杆菌的存在与胃部炎症(胃炎)和消化性溃疡病联系起来而荣获2005年诺贝尔医学奖。
幽门螺杆菌感染最常见于儿童早期,并持续终生。幽门螺杆菌感染人体的具体途径和机制还不清楚,研究人员推测可能存在以下几种传播途径:
•口腔-口腔传播:幽门螺杆菌可以通过唾液传播,例如在亲密接触或共用餐具时,细菌可以从一个人的口腔传播到另一个人的口腔。这是最常见的传播途径。
•通过被污染的食物和水传播:食用被感染幽门螺杆菌的食物或水也是感染的途径之一。如果食物或水受到污染,细菌可以进入消化系统。
•粪口传播:如果正常人接触了感染者的粪便,再通过进食、洗脸等方式接触自身的口腔,也可能感染幽门螺杆菌。
•医源性感染:还有一类特殊的感染途径,主要是感染者经过消化内镜检査后,未经彻底灭菌,可导致其他人检查时感染幽门螺旋杆菌,
注:感染期间会触发偏向Th1的特异性免疫反应。其中Th1代表T细胞辅助型1细胞,是一种参与细胞免疫应答的淋巴细胞亚群。在这种情况下,Th1细胞会释放干扰素γ等细胞因子,促进巨噬细胞的活化和细胞毒性T细胞的增殖,以帮助清除幽门螺杆菌感染。
尽管存在免疫反应,幽门螺杆菌通常不会从体内完全清除,因为该细菌具有一系列机制,使其能够逃避或抑制宿主反应。
幽门螺杆菌是最常见的人类病原体之一,感染超过50%的人口。幽门螺杆菌存在于发展中国家大约70–80%的人口中,以及发达国家13%–50%的人口中。近年来,发达国家幽门螺杆菌感染率有所下降。
研究表明,幽门螺杆菌至少自大约6万年前人类迁出非洲以来就已经存在了。
▸ 典型症状
一些感染幽门螺杆菌的患者不会出现症状。然而,在几乎所有感染者中,感染都会对胃内壁造成进行性损伤。
当患者无法清除感染时,可能会导致胃酸产生增加、胃组织损伤和终生慢性炎症。据报道有以下症状 :
胃灼热
打嗝和腹胀
腹泻或便秘
上腹部或中腹部疼痛
长期并发症
大约20%的幽门螺杆菌感染者会患上幽门螺杆菌相关疾病。这些疾病包括胃炎和胃或十二指肠溃疡。
感染还可能引起或加剧的其他问题包括:
缺铁性贫血
特发性血小板减少性紫癜(容易瘀伤)
维生素B12缺乏症
这些问题可能是由于感染期间胃中某些维生素的代谢能力下降所致。
幽门螺杆菌也被认为是非胃肠道疾病的危险因素,如动脉粥样硬化(动脉硬化)、缺血性心脏病(心脏供血减少)和中风。需要更多信息来确定这些关联的重要性和原因。
尽管大多数人都没有注意到幽门螺杆菌感染,但其他人可能会出现胃部不适或疼痛、胃灼热和腹胀。从长远来看,幽门螺杆菌可能会增加维生素B12缺乏的可能性。
▸ 儿童感染
幽门螺杆菌感染主要在儿童早期获得,并且主要在家庭内传播。受感染的母亲和兄弟姐妹是幽门螺杆菌最常见的家族来源。
大多数感染儿童不会出现任何并发症。与成人相比,儿童期幽门螺杆菌感染引起的胃部炎症和溃疡较少。然而,一些儿童会出现胃部烧灼感、恶心、呕吐和食欲不振等症状。
在成人中,幽门螺杆菌感染与Th1/Th17反应升高相关。然而,在儿童中,幽门螺杆菌感染与营养不良、缺铁性贫血、腹泻以及生长、体重和认知功能受损有关,尤其是在食物摄入不足时。
▸ 饮食不卫生
食用受污染的水或食物可能导致感染。食用没有完全熟透的肉,其中含有大量的细菌,也会导致幽门螺杆菌进入肠道。
与感染者密切接触可增加感染风险。与患有幽门螺杆菌感染患者共餐,不使用公筷,也容易导致病菌传染。
▸ 高盐高脂饮食
较高的盐摄入量与幽门螺杆菌感染率增加有关。研究发现,幽门螺杆菌在高盐条件下生长得更好,这可能解释了这种相关性。此外,高脂肪食物的摄入也增加了感染风险。
▸ 刺激性食物
经常食用辛辣刺激性食物,比如辣椒、花椒、生姜等,刺激胃肠道黏膜,从而降低机体抵抗力,使幽门螺杆菌更容易侵入并感染。
▸ 吸烟
幽门螺杆菌感染在吸烟者中更为常见,根除治疗效果较差。尼古丁会增加胃中幽门螺杆菌的毒性活性。
患有毒性更强的幽门螺杆菌感染的吸烟患者患胃癌的风险大大增加。众所周知,吸烟会导致许多不良的健康结果和不良影响。
▸ 本身有消化道疾病
患有慢性胃炎、消化性溃疡等消化道疾病的人群胃黏膜防御功能存在一定缺陷,更易受到幽门螺旋杆菌感染。
大多数生物体液中都可以检测到幽门螺杆菌。除了细菌在胃内壁的主要居住部位之外,这还包括唾液、血液、呼气气体、粪便和尿液。
幽门螺杆菌检测可以通过多种方法进行,常见的方法包括:
•呼气测试
无创13C-尿素呼气试验(13C-UBT),患者服用标记了尿素的药物后,通过呼气样本检测呼气气体中的尿素分解产物,以确定是否存在幽门螺杆菌感染。是检测幽门螺杆菌感染的首选方法。
•血清抗体检测
通过检测患者血清中的抗幽门螺杆菌抗体水平来判断是否感染幽门螺杆菌。
•粪便抗原检测
通过检测患者糞便样本中的幽门螺杆菌抗原来确认感染情况。
•胃镜检查
通过胃镜检查取得胃黏膜组织标本,进行组织学检查或快速尿素酶试验以确认是否感染幽门螺杆菌。
此外通过分子靶向基因也可以检测,并且能区分幽门螺杆菌是否携带毒力基因。这种方法可以帮助医生更准确地诊断幽门螺杆菌感染,并制定更有效的治疗方案。
▸ 不同测试方法的效果如何
幽门螺杆菌检测的不同方法及其有效性有所不同(敏感性和特异性),具体如下表:
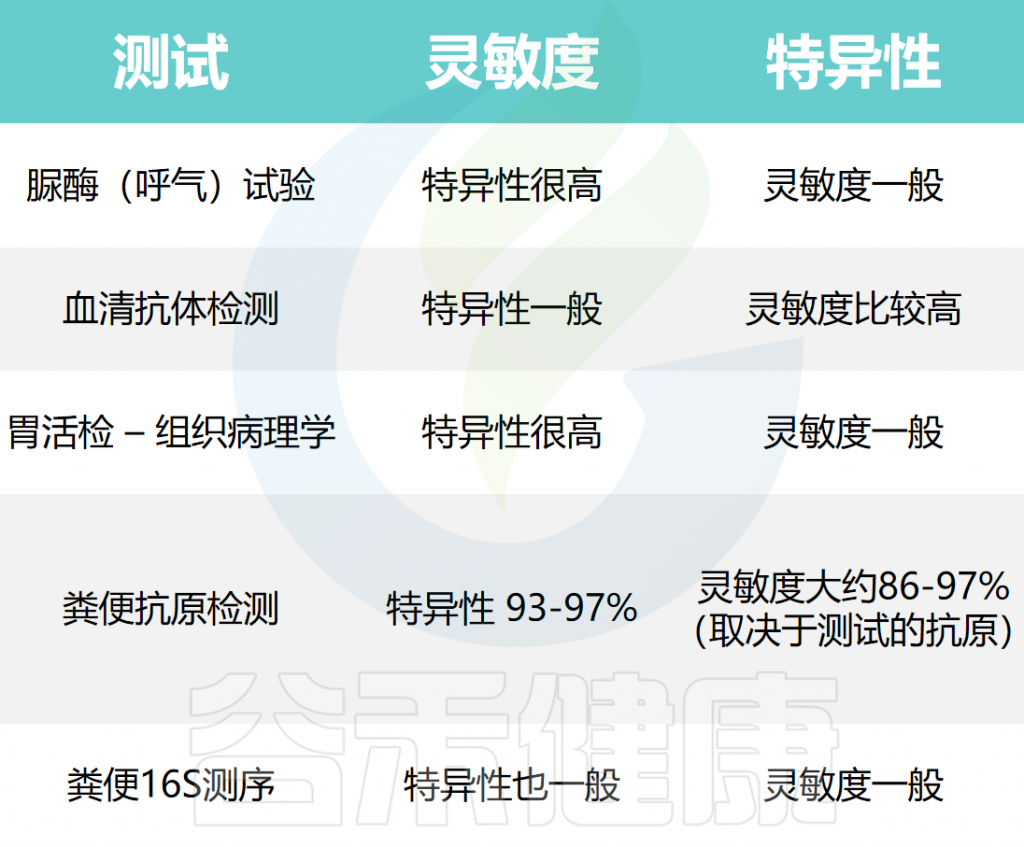
较高的灵敏度(真阳性率)表明,在幽门螺杆菌真实存在的情况下,该测试能够更好地检测幽门螺杆菌。较低的特异性(真阴性率)表明该测试可能将那些没有幽门螺杆菌的人显示为患有幽门螺杆菌。在大约20%的幽门螺杆菌感染者中,胃活检和血液检测可能无法检测到幽门螺杆菌。
幽门螺杆菌血清测试可以在活动性感染的个体中或在感染被根除后检测到针对幽门螺杆菌的抗体。因此,血清学检测并不是幽门螺杆菌治疗后随访的良好检测方法。
▸ 标准根除治疗
对于出现胃溃疡等感染症状的人来说,必须根除毒性的幽门螺杆菌。然而,对于无症状幽门螺杆菌阳性儿童和成人是否应该接受治疗,存在着相互矛盾的观点,主要是因为抗生素治疗本身具有很强的副作用。
幽门螺杆菌的传统治疗方法称为标准三联疗法,包括短期疗程的两种抗生素(通常是克拉霉素和阿莫西林)以及质子泵抑制剂(胃酸减少药物,例如奥美拉唑或兰索拉唑)。
注:14天三联疗法优于同等的7或10天三联疗法。
由于幽门螺杆菌适应酸性环境,因此用质子泵抑制剂减少胃酸可以抑制幽门螺杆菌的生长,并且在短期标准三联疗法期间是有益的。然而,长期使用 质子泵抑制药(PPI)可能会导致胃壁萎缩。
幽门螺杆菌感染的标准治疗可能会改变健康的肠道微生物群,导致腹胀、腹泻和恶心。据估计,这些副作用会影响超过50%的患者,并与依从性下降和治疗失败相关。
对抗生素的耐药性或残留幽门螺杆菌的再感染也可能导致清除幽门螺杆菌的治疗失败。据统计,标准三联疗法的有效性在60%到80%之间。
▸ 影响幽门螺杆菌治疗效果的因素
•遵守处方与否
不遵守医生处方是根除失败的主要原因。治疗依从性低于80%会降低治疗成功率。
•药物代谢酶的突变
根除失败的另一个原因是细胞色素 P450 2C19(CYP2C19)的突变。CYP2C19 是参与质子泵抑制剂(奥美拉唑或兰索拉唑)代谢的主要酶。当 CYP2C19 比平时更有效地发挥作用时,药物降解速度更快,疗效更低。
影响质子泵抑制剂有效性的CYP2C19 SNP包括rs4244285(A)和rs4986893(A)。
•口腔中的幽门螺杆菌储存
牙菌斑可以作为幽门螺杆菌的储存库,因此保持适当的口腔卫生对于预防再次感染至关重要。多项研究表明,未经治疗的牙周病会增加根除幽门螺杆菌后再次感染的风险。建议使用抗菌漱口水或牙周治疗来减少口腔幽门螺杆菌的数量,以提高抗生素治疗后的根除率。
例如,在一项研究中,口腔感染的治疗将胃内幽门螺杆菌根除的成功率从61%提高到82%。
•抗生素耐药性
对抗生素克拉霉素的耐药性增加导致全世界标准三联疗法的疗效急剧下降。替代抗生素治疗方案已被证明可以克服克拉霉素耐药性,并且现在是实现提高根除率(超过 90%)的首选治疗方法。
患者依从性、抗生素耐药性和CYP酶活性等因素都可能影响幽门螺杆菌治疗的有效性。
有限的数据表明幽门螺杆菌可能会改变维生素吸收、肠道微生物组和食欲相关激素。需要更多的研究来证实这些假设。
▸ 对营养的影响
幽门螺杆菌感染会损害铁和维生素B12的吸收。
幽门螺杆菌感染者的维生素C浓度降低20%。
胃中β-胡萝卜素和维生素E的浓度也降低。
一些研究还报告感染者的叶酸吸收减少。
▸ 影响调节食欲的激素
多项研究表明,受感染者的生长素释放肽水平较低,而瘦素浓度较高。
由于瘦素会降低食欲,而生长素释放肽会刺激生长激素的释放,因此幽门螺杆菌感染可能会导致生长减缓,特别是对于已经面临营养不良风险的儿童。
在一些针对感染儿童的研究中,根除幽门螺杆菌会增加胃饥饿素水平,并导致体重和身高的增长。
然而,关于幽门螺杆菌和瘦素之间的联系的研究在某些情况下是相互矛盾的。大多数研究发现亚洲和欧洲幽门螺杆菌阳性受试者的循环生长素释放肽水平较低,但在美洲地区结果却不一样。
当评估根除幽门螺杆菌对生长素释放肽水平的影响时,也得到了相互矛盾的结果。在一项针对受感染退伍军人的研究中,生长素释放肽水平比根除前高出近六倍,但瘦素水平在根除后七个月也显着增加。
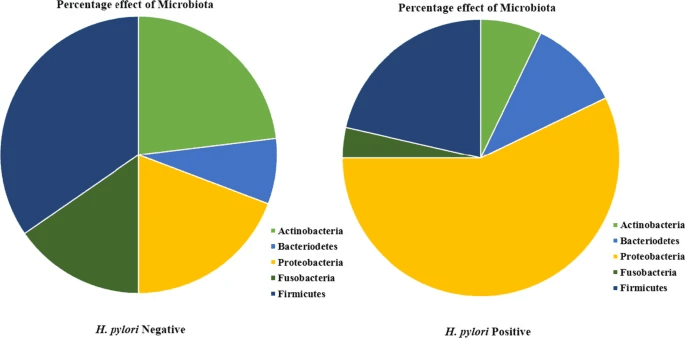
▸ 与肠道微生物群
幽门螺杆菌改变胃细菌群落,增加变形菌门、螺旋菌门和酸杆菌门的细菌,减少放线菌门、拟杆菌门和厚壁菌门的细菌。
幽门螺杆菌感染也会改变儿童粪便中双歧杆菌/大肠杆菌的比例,但这可以通过摄入酸奶形式的益生菌来改善。
幽门螺杆菌对微生物群的影响
doi: 10.1007/s12038-020-00078-7.
与幽门螺杆菌阳性患者相比,幽门螺杆菌阴性患者的微生物群更加复杂和多样化。
尽管幽门螺杆菌感染胃,但它对消化系统内部和外部的健康都有影响。
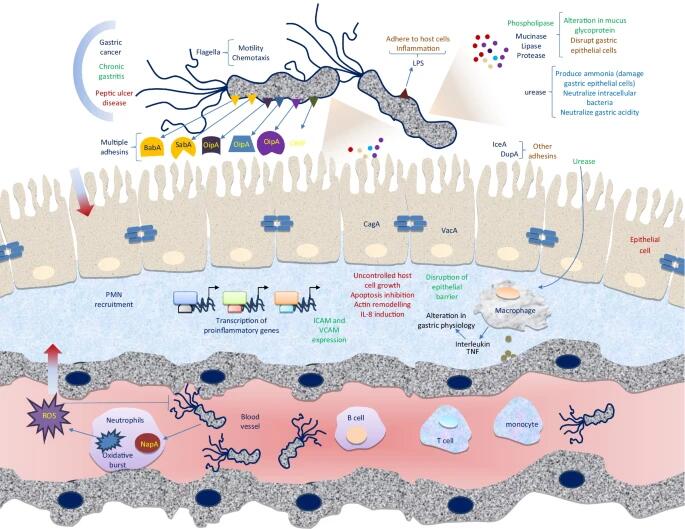
幽门螺杆菌的毒力和发病机制
doi: 10.1007/s42770-021-00675-0.
幽门螺旋杆菌的定植、疾病形成和感染取决于四个主要阶段:(1)适应胃粘膜的酸性环境; (2)利用鞭毛向上皮细胞移动; (3)穿透上皮细胞细胞屏障和对特定受体的附着,以及(4)组织损伤和其他有害的健康影响。
1
胃炎和消化不良
尽管大多数感染幽门螺杆菌的患者不会出现症状,但感染仍然会对胃壁造成进行性损害,这种损害可能是不可逆转的。幽门螺杆菌感染是慢性胃炎(胃内壁炎症或刺激)的主要原因。
消化不良,是一组与上消化道有关的症状。它本身并不是一种疾病,但它与多种疾病有关。每年大约25%的西方人口患有消化不良,消化不良是就胃肠道疾病咨询医生的最常见原因之一 。
据估计,少数10%至12%的消化不良患者在幽门螺杆菌根除后获得显著改善,并且缓解可能会在根除后延迟数月至一年。
2
胃溃疡
研究表明,大约一半的消化性(胃)溃疡是由幽门螺杆菌感染引起的,另一半主要由非甾体抗炎药(NSAID)引起的。
感染幽门螺杆菌的患者患消化性溃疡病的风险要高出3.5倍。
大约15 – 20%感染幽门螺杆菌的受试者会出现消化性溃疡,这与炎症加剧、胃泌素水平升高和盐酸分泌增加有关。
幽门螺杆菌感染成功治疗的患者十二指肠或胃溃疡复发率显著降低。
3
胃癌
世界卫生组织(WHO)已将幽门螺杆菌列为I类致癌物。幽门螺杆菌感染已被确定为胃癌的主要危险因素。
许多试验已经证明通过幽门螺杆菌筛查和根除来预防癌症的可能性,特别是在高危人群中。六项临床试验显示,在根除治疗后,无症状成人的胃癌发病率从2.4%下降至1.6%。
然而,即使根除幽门螺杆菌后,胃癌有时也可能发生。尽管缺乏持续的幽门螺杆菌感染,但幽门螺杆菌特异性Th17细胞仍然存在于血液和胃粘膜中,尽管幽门螺杆菌被根除,但这种持续的炎症可能导致胃癌风险持续增加。
4
MALT淋巴瘤
持续的幽门螺杆菌定植也是粘膜相关淋巴组织 (MALT) 淋巴瘤的最强危险因素,并且存在于超过90%的病例中。
根除幽门螺杆菌已被证明可以使大约80%的早期胃MALT淋巴瘤患者得到持久缓解。
5
儿童营养不良
如果在儿童时期很早就感染幽门螺杆菌,可能会导致营养不良和生长迟缓,特别是当食物摄入量或品种较差时。
在儿童中,幽门螺杆菌感染与缺铁性贫血、腹泻病以及生长和认知功能受损有关。
幽门螺杆菌感染与成人和儿童的主要胃酸之一盐酸分泌减少有关。低盐酸会损害多种营养素的吸收,并增加对有害微生物肠道感染的易感性。缺乏微生物保护可能会增加营养不良的发生率并降低儿童的生长速度。
6
缺铁性贫血
幽门螺杆菌是缺铁性贫血的常见原因。许多研究报告了幽门螺杆菌感染与缺铁性贫血(IDA)之间的关联。
即使在幽门螺杆菌患病率较低的国家,幽门螺杆菌引起的IDA也多于乳糜泻(另一种被认为是IDA主要原因的疾病)引起的IDA。
注:幽门螺杆菌感染与缺铁性贫血的关联在儿童中比成人更常见。
幽门螺杆菌通过多种机制引起IDA:
(1)由于胃炎、消化性溃疡病或胃癌引起的出血导致铁丢失增加;
(2)由于炎症导致胃酸和抗坏血酸分泌减少;
(3)竞争,因为铁是幽门螺杆菌的重要生长因子,它与宿主竞争铁的吸收。
缺铁性贫血和幽门螺杆菌感染之间的关联如此密切,以至于欧洲强烈建议对所有不明原因的IDA患者采用幽门螺杆菌感染的检测和治疗策略。
与单独口服铁补充剂相比,幽门螺杆菌根除疗法与铁补充剂一起施用显著增加了铁、铁蛋白和血红蛋白水平。即使对于未接受铁补充剂治疗的患者,根除幽门螺杆菌也能改善缺铁性贫血的症状。
7
维生素B12缺乏症
幽门螺杆菌感染与维生素B12缺乏之间存在关联。幽门螺杆菌感染会损害食物中维生素B12的吸收,导致恶性贫血。
根除幽门螺杆菌已被证明可以改善维生素B12的吸收。
8
特发性血小板减少性紫癜
特发性血小板减少性紫癜(ITP)的特点是血小板的自身免疫性破坏,从而导致瘀伤。重要证据表明幽门螺杆菌是某些ITP病例的病原体。
ITP患者幽门螺杆菌感染的患病率高于健康个体。而根除幽门螺杆菌后,ITP患者的血小板计数显著增加。这种效应在几份报告中得到证实。
幽门螺杆菌相关ITP的长期预后良好。在一项为期8年的随访研究中,成功根除后未见复发。目前美国血液学会建议对感染幽门螺杆菌的ITP患者进行根除治疗。
9
自身免疫性甲状腺疾病
幽门螺杆菌感染会显著增加格雷夫斯病的风险,但不会增加桥本甲状腺炎的风险。
Graves病又称毒性弥漫性甲状腺肿,是一种自身免疫性甲状腺疾病,是由于机体免疫系统紊乱,导致甲状腺激素分泌过多而出现的临床综合征。
甲状腺功能正常但有甲状腺结节(甲状腺异常生长)的患者比没有甲状腺结节的患者更容易感染幽门螺杆菌。
在接受根除治疗的幽门螺杆菌阳性患者中,抗甲状腺过氧化物酶(TPO)和甲状腺球蛋白的自身抗体显著下降,但在拒绝治疗的患者中则没有显著下降。
此外,幽门螺杆菌感染可能会降低甲状腺功能减退患者甲状腺素治疗的疗效。
10
类风湿性关节炎
当B细胞(一种白细胞)受到幽门螺杆菌产生的脲酶的长期刺激时,它们可以获得产生自身抗体的潜力,包括IgM类风湿因子抗体。
类风湿性关节炎患者发生消化性溃疡的风险增加,但尚不清楚这是否与幽门螺杆菌感染率增加直接相关,还是由于大量使用非甾体抗炎药(NSAID)所致。还可能导致溃疡。
根除幽门螺杆菌后,一些研究发现关节炎症状有所改善,而另一些研究则报告关节炎症状没有变化。目前,数据是相互矛盾的,幽门螺杆菌和类风湿性关节炎之间的联系似乎很弱。
11
其他自身免疫性疾病
一些小型研究发现格林-巴利综合征患者的幽门螺杆菌细菌载量较高。尤其是急性炎性脱髓鞘性多发性神经病(AIDP) 型吉兰-巴利综合征患者的相关性特别强。
系统性硬化症患者中幽门螺杆菌感染与胃肠道、皮肤和关节症状恶化有关,表明这种关联可能很重要。
幽门螺杆菌感染似乎是发生抗水通道蛋白4(AQP4)抗体阳性视神经脊髓炎的危险因素之一,根除幽门螺杆菌可能是该疾病的一种可能的辅助治疗。
12
血糖和胆固醇
幽门螺杆菌感染与胆固醇升高、糖化血红蛋白(HbA1c)升高和较高的BMI相关。然而,其他研究并未发现这种关系,幽门螺杆菌的这些影响仍然是一个争论的话题。
在一些研究中,成功根除幽门螺杆菌可显著降低空腹胰岛素、HbA1c 和 HOMA-IR 水平。然而,也有报告显示根除幽门螺杆菌对平均HOMA-IR和CRP水平或HbA1c水平没有影响。
幽门螺杆菌对体重指数和肥胖的影响尚不确定。一项研究表明,患有幽门螺杆菌的成年人的BMI水平较高,而另一项研究表明,根除幽门螺杆菌会增加消化性溃疡病患者的BMI和肥胖发生率。然而另一组研究表明幽门螺杆菌感染与体重指数之间没有关联。
13
糖尿病
2型糖尿病患者更容易感染幽门螺杆菌。
有几个因素可以解释这种关系:
1)糖尿病引起的免疫力受损可能会增强个体对幽门螺杆菌感染的敏感性;
2)糖尿病引起的胃肠蠕动和胃酸分泌减少可能会促进病原体在肠道定植和感染;
3)葡萄糖代谢的改变可能会在胃内壁产生化学变化,从而促进幽门螺杆菌定植;
4)糖尿病患者比健康人更容易接触病原体,因为他们经常去医院。
5)糖尿病患者对常见的抗幽门螺杆菌治疗也更有抵抗力,并且再次感染的风险也更高。
另一方面,幽门螺杆菌会导致胰岛素抵抗和糖尿病并发症。幽门螺杆菌可能通过增加氧化应激和降低血液的总抗氧化能力来加剧糖尿病。幽门螺杆菌还可能通过诱导慢性炎症和影响胰岛素调节胃肠激素来促进胰岛素抵抗。
在一项以医院为基础的研究中,幽门螺杆菌感染与45岁以下参与者的胰岛素分泌和敏感性下降有关。
一项针对日本患者的大型研究揭示了幽门螺杆菌感染与代谢综合征(糖尿病的前兆)之间存在显著关系。
最后,2型糖尿病患者根除失败的风险较高。因此,一些研究不鼓励糖尿病患者治疗幽门螺杆菌感染,以避免感染恶化。
14
心血管疾病
心血管疾病患者是否应该接受幽门螺杆菌检测并进行治疗仍然是一个争论的话题。有迹象表明幽门螺杆菌感染与心血管疾病有关,但有关这种关联的原因和机制的研究尚无定论。
多项研究已将幽门螺杆菌感染与胆固醇水平的变化联系起来。研究表明,低密度脂蛋白胆固醇升高与胃部炎症程度相关,根除幽门螺杆菌可使胆固醇水平正常化 。幽门螺杆菌感染还与动脉硬化有关,在一些研究中会增加外周动脉疾病的风险,但在其他研究中则不然。
在年轻的急性心肌梗死(AMI)幸存者和死于AMI的患者中,幽门螺杆菌感染的患病率较高。幽门螺杆菌感染也与较高的中风发病率相关。
在一些研究中,幽门螺杆菌与过早冠状动脉疾病有关,但在其他研究中则不然。
15
阿尔茨海默病
一项非常大的横断面研究发现,幽门螺杆菌感染与60-90岁成年人的认知能力较差密切相关。
幽门螺杆菌的一种蛋白质在实验室中被证明可以形成淀粉样蛋白结构,因此有可能在阿尔茨海默病中发挥作用。这是否真的发生在体内还有待研究。
一些研究发现阿尔茨海默病与幽门螺杆菌感染之间存在相关性,一项针对阿尔茨海默病患者的小型研究发现,根除幽门螺杆菌可改善认知状态和五年生存率。
16
帕金森病
幽门螺杆菌可以结合左旋多巴,左旋多巴是治疗帕金森病的主要药物之一。这会降低药物的吸收并可能降低治疗效果。
丹麦的一项大型研究发现,帕金森病诊断与帕金森病诊断前5年或更长时间的幽门螺杆菌根除治疗之间存在关联。这表明过去的幽门螺杆菌感染可能与当前的帕金森病相关。
一些研究表明,根除幽门螺杆菌可以减少帕金森病的运动波动。一项研究发现,根除治疗后,步幅有所改善,但刚性却恶化。令人担忧的是,经历根除失败并在治疗后仍保持幽门螺杆菌阳性的患者的运动功能迅速下降。
目前,不建议对帕金森病患者进行幽门螺杆菌治疗,因为根除失败可能会导致运动功能恶化。
17
皮肤病
在一项研究中,100%的中度或重度银屑病患者幽门螺杆菌阳性,而只有37%的轻度银屑病患者感染。当银屑病治疗中加入根除幽门螺杆菌时,银屑病症状的改善更快。此外,仅接受根除治疗的患者的银屑病也得到改善。
在一项研究中,81%也有胃部不适的红斑痤疮患者体内存在幽门螺杆菌。在接受根除治疗的幽门螺杆菌阳性患者中观察到红斑痤疮严重程度显著改善。
幽门螺杆菌可能还是慢性自发性荨麻疹(荨麻疹)的多种原因之一。在慢性荨麻疹患者中,根除幽门螺杆菌后的总体缓解率为31%。
18
偏头痛
多项研究表明,成功根除治疗幽门螺杆菌后偏头痛症状有所改善。然而,这种关联的强度因研究而异,需要更多的研究来解释这些差异。
例如,在一项研究中,观察到17%的患者偏头痛完全消失,其余患者报告根除幽门螺杆菌后临床有所改善。另一项研究发现,感染清除后,84%的患者临床偏头痛发作的严重程度显著改善。
并且在其他研究中,偏头痛受试者中幽门螺杆菌感染的患病率更高。
幽门螺杆菌感染通常被认为与一些疾病的发生风险增加有关,例如消化道溃疡和胃癌。然而,一些研究表明幽门螺杆菌感染也可能对某些疾病具有预防作用,虽然这种观点仍在科学界存在争议。
1
胃食管反流病
幽门螺杆菌可减少胃酸分泌,从而防止胃酸反流,胃酸过多会导致持续性胃灼热和其他并发症。
一些研究和荟萃分析得出的结论是,根除幽门螺杆菌会加重胃食管反流病(GERD),而另一些研究则报告没有效果。幽门螺杆菌感染还与巴雷特食管和食管腺癌等GERD相关疾病的较低发病率有关。然而,这种关联受到质疑,因为世界上一些地区显示出这种关联,而另一些地区却没有。
2
炎症性肠病
多项研究表明幽门螺杆菌感染与较低的炎症性肠病发病率相关。
当小鼠被注射幽门螺杆菌DNA或感染活细菌时,它们对结肠炎和结肠炎相关症状(如出血和体重减轻)的抵抗力更强。
亚洲炎症性肠病患者的幽门螺杆菌感染率显著低于非炎症性肠病患者,表明幽门螺杆菌感染可能可以预防炎症性肠病的发展。这种相关性尚未得到充分解释,可能需要更多的研究来确定。
3
乳糜泻
乳糜泻与幽门螺杆菌感染较低有关。这就提出了一个问题:幽门螺杆菌感染是否可以预防乳糜泻。需要进一步的研究来确定潜在的机制及其意义。
4
哮喘和过敏
虽然由于卫生和生活条件的改善,许多国家幽门螺杆菌感染的患病率正在下降,但西方人群中哮喘和鼻炎等过敏性疾病的患病率却增加了32%。
多项流行病学研究表明,幽门螺杆菌感染与哮喘等过敏性气道疾病的发病率较低有关。
携带幽门螺杆菌的个体患有伴随过敏性疾病(包括哮喘、湿疹和过敏性鼻炎)的可能性降低了30%。然而,对于幽门螺杆菌在这种情况下是否确实具有保护作用,或者其他潜在因素是否共同降低了幽门螺杆菌感染率并增加了哮喘和过敏症的发生率,科学家们存在分歧。
动物研究
幽门螺杆菌使适应性免疫反应偏向免疫耐受而非免疫,一方面促进持续感染,另一方面抑制自身攻击性和过敏性T细胞反应。
特应性皮炎、过敏性鼻炎和哮喘是通过Th2途径细胞因子介导的,包括IL-4、IL-5、IL-9和IL-1。Tregs抑制Th2反应和过敏相关的IgE产生。小鼠早期感染幽门螺杆菌会增加气道中Treg细胞的数量,从而预防哮喘的发生。
有趣的是,与成年期感染的小鼠相比,新生儿时感染幽门螺杆菌的小鼠对过敏原的反应表现出较低水平的过敏性气道炎症。
儿童的联系
一项针对人类的研究发现,儿童过敏与幽门螺杆菌感染之间存在负相关,但成人则不然。
儿童期感染幽门螺杆菌似乎与哮喘和过敏风险降低有关。与轻度过敏或无过敏的儿童相比,严重过敏的儿童幽门螺杆菌阴性或感染毒性较低菌株的可能性明显更高。对这种现象的一种解释可能是“卫生效应”,即生命早期接触微生物可以防止以后发生过敏性疾病。
然而,在世界某些地区,幽门螺杆菌感染的低发病率与儿童过敏患病率较高并不相关。一些研究人员认为,幽门螺杆菌感染很可能只是几种传染性病原体之一,与不良的卫生习惯有关,这可以降低发生过敏的可能性。
5
多发性硬化症
令人惊讶的是,一些研究表明幽门螺杆菌感染对多发性硬化症具有保护作用。
与健康对照或视神经多发性硬化症患者相比,传统多发性硬化症患者的幽门螺杆菌感染频率明显较低。
然而,迄今为止,很少有可靠的流行病学数据支持幽门螺杆菌对多发性硬化症发展的保护作用。目前,这种联系纯粹是推测性的。
在大多数情况下,补充和营养疗法不能永久根除幽门螺杆菌。话虽这么说,一些食物和补充剂与减少幽门螺杆菌负荷或改善对传统疗法的反应有关。虽然我们建议不要使用以下策略来代替医生的治疗,但其中一些策略与处方药一起使用可能会有所帮助。
以下的一些补充和营养疗法可能有效:
▸ 使用乳酸菌和酵母菌益生菌
在许多临床研究中,在针对幽门螺杆菌的抗生素治疗中添加某些益生菌可以提高整体疗效并减少胃肠道副作用。
•有助于提高根除率,减轻不良反应
使用益生菌乳杆菌、双歧杆菌和布拉氏酵母菌可将幽门螺杆菌根除率提高约10%,并将治疗不良反应减少约15%。
•有助于对抗幽门螺杆菌的益生菌
研究表明有益于对抗幽门螺杆菌定植的益生菌包括:嗜酸乳杆菌、罗伊氏乳杆菌、德氏乳杆菌 (L.delbrueckii ssp) 。保加利亚乳杆菌与嗜热链球菌、L.gasseri、L.johnsonii 、L.salivarius、L.brevis、保拉迪酵母(Sboulardii)和婴儿双歧杆菌。
•减少治疗副作用的益生菌
有效减少幽门螺杆菌治疗副作用的益生菌包括:鼠李糖乳杆菌、罗伊氏乳杆菌、布拉氏链球菌、动物双歧杆菌属、乳酸菌、丁酸梭菌和枯草芽孢杆菌。
益生菌改善感染率的具体作用机制目前尚不清楚。研究表明,益生菌降低了幽门螺杆菌在胃中有效定殖的能力,但尚不清楚这种影响是否是通过空间和营养物质的竞争、胃pH值的变化、其他细菌产生的化学物质或其他变化来解释的。
益生菌补充剂通常被认为是安全的,它们很少会对免疫系统受损的人产生副作用。为了避免任何不良反应或意外的相互作用,请在开始使用新的益生菌之前咨询您的医生。
▸ 发酵食品和饮料
某些发酵饮料——尤其是葡萄酒、啤酒和发酵奶——在支持幽门螺杆菌治疗方面已经产生了有希望的临床结果。
•发酵产生的微环境不利于幽门螺杆菌定植
一项对英国10,000多人进行的横断面研究发现,适量饮用葡萄酒和啤酒在一定程度上可以预防幽门螺杆菌感染。作者认为,适量饮用葡萄酒和啤酒可能会在胃中产生一个对幽门螺杆菌不利的环境,从而更容易根除细菌。
然而,另一项研究发现,饮酒与幽门螺杆菌感染呈正相关,这表明葡萄酒和啤酒中除酒精之外的某种成分可能是其明显益处的原因。
酸奶和开菲尔等发酵乳制品也被发现可以预防幽门螺杆菌感染。此外,在一项针对347名患者的试验中,在常规疗法中添加酸奶可提高根除率。
▸ 西兰花芽和芸苔类蔬菜
萝卜硫素是西兰花和西兰花芽中发现的一种化合物,可以抑制幽门螺杆菌的生长。
•萝卜硫素保护胃黏膜有助于减少炎症
研究人员认为萝卜硫素可以保护胃粘膜,从而减少炎症。粘膜健康状况的改善也可能使幽门螺杆菌更难在胃中有效定植,这解释了一些研究中发现的定植率降低的原因。
在确诊幽门螺杆菌感染的无症状患者中,每天食用70克西兰花芽可导致定植强度显着降低。另一项研究还报告称,在接受西兰花芽苗处理后,九名受试者中有四名幽门螺杆菌定植消失。
在感染幽门螺杆菌的2型糖尿病患者中,除了标准三联疗法外,西兰花芽粉在幽门螺杆菌根除方面显示出相当大的改善,并且还显示出受试者的心脏健康状况得到改善。在小鼠中,注射萝卜硫素可有效消除幽门螺杆菌感染。
其他芸苔类蔬菜(卷心菜、菜花、大白菜、小白菜、油菜、甘蓝、芥菜)也含有与萝卜硫素类似的化合物,称为异硫氰酸盐。摄入大量异硫氰酸盐的患者患胃癌的风险较低。
▸ 铋
有重要的临床证据支持使用铋作为抗幽门螺杆菌“四联疗法”的一部分,与四环素、硝基咪唑和质子泵抑制剂(PPI)一起使用 。
您的医生可能会或可能不会推荐铋作为幽门螺杆菌治疗的一部分。在尝试使用铋之前请先咨询您的医生,因为仅批准铋用于治疗腹泻,大量使用可能会对肾脏产生毒性。
在有限的、低质量的临床研究中,以下物质显示出对抗幽门螺杆菌感染的前景,然而目前没有足够的证据支持它们在这种情况下的使用,并且不应该用它们来代替医生开出的处方。
▸ 蔓越莓
在蔓越莓汁公司赞助的一项研究中,定期饮用蔓越莓汁可有效降低幽门螺杆菌定植水平。
蔓越莓汁中含有的化学物质会降低细菌粘附细胞的能力,从而降低它们在这些细胞上定殖的能力。这可以解释为什么补充能够改善幽门螺杆菌感染的治疗结果。
当给感染幽门螺杆菌的小鼠喂食酸果蔓汁后,80%的小鼠在治疗后痊愈。治疗后4周根除率为20%。在约15%的无症状定植儿童中,服用蔓越莓汁三周可抑制幽门螺杆菌定植率。然而,在大多数幽门螺杆菌呈阴性的受试者中,清除效果在停止食用后并未持续存在。
与传统的抗幽门螺杆菌抗生素(例如甲硝唑和克拉霉素)结合使用,蔓越莓的食用可以提高幽门螺杆菌危险人群的根除率并抑制感染。
▸ 其他浆果
蓝莓、覆盆子、草莓、黑莓、越橘和接骨木浆果提取物可增强幽门螺杆菌对克拉霉素的敏感性,并对克拉霉素耐药的幽门螺杆菌菌株表现出强大的抑菌活性。
当幽门螺杆菌感染的成年人在90天的时间内饮用蓝莓汁时,14%的人在第35天的尿素呼气测试呈阴性。这种效果在第90天也得以维持。
▸ 大蒜
长期食用大蒜并不影响幽门螺杆菌感染的发生,但摄入大蒜的患者幽门螺杆菌定植率明显低于未摄入大蒜的患者。
在中国西部地区,吃生大蒜的人幽门螺杆菌感染水平明显较低。多项研究证明,食用大蒜科蔬菜与降低胃癌风险相关,支持大蒜中的化合物可能对胃健康或幽门螺杆菌定植有益的理论。
大蒜含有称为硫代亚磺酸盐的化学物质,例如大蒜素,已被证明对细菌有毒,这可能解释了补充剂如何能够改善治疗效果。这些化学物质还具有很强的抗氧化能力。因此,摄入抗氧化剂的下游益处也可以解释补充大蒜对感染和其他免疫过程的积极影响。
其他研究表明大蒜抑制细菌群体感应,这也可以解释感染率下降的原因。生大蒜或大蒜粉片的提取物可以在实验室中杀死幽门螺杆菌。在动物研究中,大蒜提取物还可以预防幽门螺杆菌引起的胃炎。
▸ 多不饱和脂肪酸
多不饱和脂肪酸、omega-3和-6在实验室中可抑制幽门螺杆菌的生长,并降低胃炎的患病率。
补充8周的多不饱和脂肪酸(PUFA)可以诱导53%的患者细菌清除,6个月后这一比例为20%。多不饱和脂肪酸可减少幽门螺杆菌感染引起的氧化应激和炎症,并减少小鼠胃癌的形成。
然而,一项研究表明,在基于铋的四联疗法中添加 PUFA 对根除幽门螺杆菌或炎症标志物没有影响。
一种名为二十二碳六烯酸(DHA)的特定omega-3化合物可降低幽门螺杆菌在50%小鼠胃内壁定殖的能力。将DHA与标准三联疗法相结合可降低小鼠幽门螺杆菌感染的复发率。月见草油(富含omega-6不饱和亚油酸)可治愈大鼠溃疡。
与传统根除方案相比,鱼油的幽门螺杆菌根除率明显较差,但无论幽门螺杆菌状态如何,它都能改善非溃疡性消化不良患者的症状。
▸ 人参
在一项早期临床研究中,将人参添加到传统的幽门螺杆菌根除方案中可显著提高根除率。
一些研究人员认为,人参可以改善抗体分子的反应,从而保护身体免受微生物的侵袭。这可能有助于解释治疗中所见的改善。
▸ 姜黄素
姜黄素已被用于治疗消化性溃疡以及预防幽门螺杆菌的生长。姜黄治疗4周后,48%的患者消化性溃疡痊愈,治疗12周后,76%的患者痊愈。第一周和第二周期间腹痛和不适明显减轻。
姜黄素可预防溃疡并抑制细菌群体感应。这可能有助于解释幽门螺杆菌治疗的保护作用。姜黄素能够根除小鼠体内的幽门螺杆菌,但似乎不能完全根除人类体内的细菌。姜黄素在人体中的吸收不良可能导致这种无效。
▸ 乳香胶
乳香胶是由黄连木植物产生的树脂,目前正在研究其用于治疗胃病的效果。
乳香胶治疗幽门螺杆菌的临床试验显示出消极和积极的结果,表明益处可能是有限的或纯粹是互补的。
在一些研究中,乳香胶无法根除小鼠或人类的幽门螺杆菌感染。其他研究表明,乳香可以预防患者体内与幽门螺杆菌相关的炎症,并在某些情况下实现根除。
▸ 乳铁蛋白
乳铁蛋白与铁离子结合,从而限制细菌对铁的利用。测试口服乳铁蛋白效果的临床试验有阳性和阴性结果。除抗生素和质子泵抑制剂治疗外,补充乳铁蛋白可提高有效根除率并降低副作用严重程度。
另一项针对幽门螺杆菌阳性患者的研究表明,单独使用乳铁蛋白可有效抑制幽门螺杆菌在胃中的定植。
在小鼠中,乳铁蛋白可减少细菌定植和幽门螺杆菌诱发的胃炎。
▸ 蜂胶和蜂蜜
蜂胶和生蜂蜜具有抗幽门螺杆菌活性。蜂胶还具有抗炎和免疫刺激活性——这两种机制在幽门螺杆菌感染的病理生理学中显然很重要。
橡树和麦卢卡蜂蜜具有很强的抗幽门螺杆菌活性。在消化不良患者中,每周至少摄入一次蜂蜜可降低幽门螺杆菌感染的患病率。
没有临床证据支持下面列出的对抗幽门螺杆菌感染的方法。以下是现有基于动物和细胞的研究的总结,这应该指导进一步的研究工作。然而,下面列出的研究不应被解释为支持任何健康益处。
▸ 姜
姜根传统上用于治疗各种胃肠道疾病,包括消化不良、消化性溃疡、晕动病和炎症。
生姜提取物可以保护胃免受压力引起的胃壁损伤,并抑制胃酸分泌,从而限制幽门螺杆菌的生长。
在动物研究中,生姜提取物可预防和治疗幽门螺杆菌引起的感染和炎症。研究表明生姜抑制细菌群体感应,这可以解释感染率下降的原因。
▸ 绿茶
在恒河猴的小型试验中,绿茶提取物显示出抗幽门螺杆菌粘附作用。绿茶提取物还被证明可以部分抑制细菌使用的酶,从而限制其生长。
在动物研究中,服用绿茶儿茶素可根除36%的幽门螺杆菌。同样,在动物研究中,在饮用水中添加绿茶多酚可以剂量依赖性地抑制幽门螺杆菌感染。
▸ 其他物质
超过80种植物提取物具有抗幽门螺杆菌活性。然而,在大多数情况下,缺乏对人类的研究。这意味着没有临床证据建议使用它们来对抗幽门螺杆菌感染。目前正在调查的一些植物、化合物和补充剂如下:
主要参考文献:
Hołubiuk Ł, Imiela J. Diet and Helicobacter pylori infection. Prz Gastroenterol. 2016;11(3):150-154.
Matsushima K, Nagai S. Unraveling the mystery of the hygiene hypothesis through Helicobacter pylori infection. J Clin Invest. 2012 Mar;122(3):801-4.
Kalali B, Mejías-Luque R, Javaheri A, Gerhard M. H. pylori virulence factors: influence on immune system and pathology. Mediators Inflamm. 2014;2014:426309.
Biljana Novkovic, 17+ Ways to Naturally Support H. pylori Treatment. 2021, November 3, selfhacked.
Malfertheiner P. Diagnostic methods for H. pylori infection: Choices, opportunities and pitfalls. United European Gastroenterol J. 2015 Oct;3(5):429-31.
Malfertheiner P. Diagnostic methods for H. pylori infection: Choices, opportunities and pitfalls. United European Gastroenterol J. 2015 Oct;3(5):429-31.
Taj Y, Essa F, Kazmi SU, Abdullah E. Sensitivity and specificity of various diagnostic tests in the detection of Helicobacter pylori. J Coll Physicians Surg Pak. 2003 Feb;13(2):90-3.
Talebi Bezmin Abadi A. Helicobacter pylori: A Beneficial Gastric Pathogen? Front Med (Lausanne). 2014 Aug 25;1:26.
Joe Cohen, Nattha Wannissorn. What is H. Pylori? Test & Treatment,December 15, 2022. Selfhacked
Suarez G, Reyes VE, Beswick EJ. Immune response to H. pylori. World J Gastroenterol. 2006 Sep 21;12(35):5593-8.
Malnick SD, Melzer E, Attali M, Duek G, Yahav J. Helicobacter pylori: friend or foe? World J Gastroenterol. 2014 Jul 21;20(27):8979-85.
Yang YJ, Sheu BS. Metabolic Interaction of Helicobacter pylori Infection and Gut Microbiota. Microorganisms. 2016 Feb 16;4(1):15.
Testerman TL, Morris J. Beyond the stomach: an updated view of Helicobacter pylori pathogenesis, diagnosis, and treatment. World J Gastroenterol.
2014 Sep 28;20(36):12781-808.Al Sayed A, Anand PS, Kamath KP, Patil S, Preethanath RS, Anil S. Oral Cavity as an Extragastric Reservoir of Helicobacter pylori. ISRN Gastroenterol. 2014 Feb 20;2014:261369.
Hołubiuk Ł, Imiela J. Diet and Helicobacter pylori infection. Prz Gastroenterol. 2016;11(3):150-154.
Nair MR, Chouhan D, Sen Gupta S, Chattopadhyay S. Fermented Foods: Are They Tasty Medicines for Helicobacter pylori Associated Peptic Ulcer and Gastric Cancer? Front Microbiol. 2016 Jul 25;7:1148.
Safavi M, Sabourian R, Foroumadi A. Treatment of Helicobacter pylori infection: Current and future insights. World J Clin Cases. 2016 Jan 16;4(1):5-19.
Yang YJ, Chuang CC, Yang HB, Lu CC, Sheu BS. Lactobacillus acidophilus ameliorates H. pylori-induced gastric inflammation by inactivating the Smad7 and NFκB pathways. BMC Microbiol. 2012 Mar 19;12:38.
Canducci F, Armuzzi A, Cremonini F, Cammarota G, Bartolozzi F, Pola P, Gasbarrini G, Gasbarrini A. A lyophilized and inactivated culture of Lactobacillus acidophilus increases Helicobacter pylori eradication rates. Aliment Pharmacol Ther. 2000 Dec;14(12):1625-9.
Sakamoto I, Igarashi M, Kimura K, Takagi A, Miwa T, Koga Y. Suppressive effect of Lactobacillus gasseri OLL 2716 (LG21) on Helicobacter pylori infection in humans. J Antimicrob Chemother. 2001 May;47(5):709-10.
Holz C, Busjahn A, Mehling H, Arya S, Boettner M, Habibi H, Lang C. Significant Reduction in Helicobacter pylori Load in Humans with Non-viable Lactobacillus reuteri DSM17648: A Pilot Study. Probiotics Antimicrob Proteins. 2015 Jun;7(2):91-100.
Takagi A, Yanagi H, Ozawa H, Uemura N, Nakajima S, Inoue K, Kawai T, Ohtsu T, Koga Y. Effects of Lactobacillus gasseri OLL2716 on Helicobacter pylori-Associated Dyspepsia: A Multicenter Randomized Double-Blind Controlled Trial. Gastroenterol Res Pract. 2016;2016:7490452.
Cruchet S, Obregon MC, Salazar G, Diaz E, Gotteland M. Effect of the ingestion of a dietary product containing Lactobacillus johnsonii La1 on Helicobacter pylori colonization in children. Nutrition. 2003 Sep;19(9):716-21.
Pantoflickova D, Corthésy-Theulaz I, Dorta G, Stolte M, Isler P, Rochat F, Enslen M, Blum AL. Favourable effect of regular intake of fermented milk containing Lactobacillus johnsonii on Helicobacter pylori associated gastritis. Aliment Pharmacol Ther. 2003 Oct 15;18(8):805-13.
Linsalata M, Russo F, Berloco P, Caruso ML, Matteo GD, Cifone MG, Simone CD, Ierardi E, Di Leo A. The influence of Lactobacillus brevis on ornithine decarboxylase activity and polyamine profiles in Helicobacter pylori-infected gastric mucosa. Helicobacter. 2004 Apr;9(2):165-72.
Zhao HM, Ou-Yang HJ, Duan BP, Xu B, Chen ZY, Tang J, You JY. [Clinical effect of triple therapy combined with Saccharomyces boulardii in the treatment of Helicobacter pylori infection in children]. Zhongguo Dang Dai Er Ke Za Zhi. 2014 Mar;16(3):230-3.
Zhang L, Eslick GD, Xia HH, Wu C, Phung N, Talley NJ. Relationship between alcohol consumption and active Helicobacter pylori infection. Alcohol Alcohol. 2010 Jan-Feb;45(1):89-94.
Shimbo I, Yamaguchi T, Odaka T, Nakajima K, Koide A, Koyama H, Saisho H. Effect of Clostridium butyricum on fecal flora in Helicobacter pylori eradication therapy. World J Gastroenterol. 2005 Dec 21;11(47):7520-4.
Kim MN, Kim N, Lee SH, Park YS, Hwang JH, Kim JW, Jeong SH, Lee DH, Kim JS, Jung HC, Song IS. The effects of probiotics on PPI-triple therapy for Helicobacter pylori eradication. Helicobacter. 2008 Aug;13(4):261-8.
Islek A, Sayar E, Yilmaz A, Artan R. Bifidobacterium lactis B94 plus inulin for Treatment of Helicobacter pylori infection in children: does it increase eradication rate and patient compliance? Acta Gastroenterol Belg. 2015 Jul-Sep;78(3):282-6.
Yanaka A, Fahey JW, Fukumoto A, Nakayama M, Inoue S, Zhang S, Tauchi M, Suzuki H, Hyodo I, Yamamoto M. Dietary sulforaphane-rich broccoli sprouts reduce colonization and attenuate gastritis in Helicobacter pylori-infected mice and humans. Cancer Prev Res (Phila). 2009 Apr;2(4):353-60.
Cengiz N, Uslu Y, Gök F, Anarat A. Acute renal failure after overdose of colloidal bismuth subcitrate. Pediatr Nephrol. 2005 Sep;20(9):1355-8. doi: 10.1007/s00467-005-1993-7.
Chey WD, Leontiadis GI, Howden CW, Moss SF. ACG Clinical Guideline: Treatment of Helicobacter pylori Infection. Am J Gastroenterol. 2017 Feb;112(2):212-239. doi: 10.1038/ajg.2016.563. Epub 2017 Jan 10. Erratum in: Am J Gastroenterol. 2018 Jul;113(7):1102.
Harjai K, Kumar R, Singh S. Garlic blocks quorum sensing and attenuates the virulence of Pseudomonas aeruginosa. FEMS Immunol Med Microbiol. 2010 Mar;58(2):161-8. doi: 10.1111/j.1574-695X.2009.00614.x. Epub 2009 Sep 18.
Jakobsen TH, van Gennip M, Phipps RK, Shanmugham MS, Christensen LD, Alhede M, Skindersoe ME, Rasmussen TB, Friedrich K, Uthe F, Jensen PØ, Moser C, Nielsen KF, Eberl L, Larsen TO, Tanner D, Høiby N, Bjarnsholt T, Givskov M. Ajoene, a sulfur-rich molecule from garlic, inhibits genes controlled by quorum sensing. Antimicrob Agents Chemother. 2012 May;56(5):2314-25.
Castro M, Romero C, de Castro A, Vargas J, Medina E, Millán R, Brenes M. Assessment of Helicobacter pylori eradication by virgin olive oil. Helicobacter. 2012 Aug;17(4):305-11.
Park SH, Kang JS, Yoon YD, Lee K, Kim KJ, Lee KH, Lee CW, Moon EY, Han SB, Kim BH, Kim HM, Park SK. Glabridin inhibits lipopolysaccharide-induced activation of a microglial cell line, BV-2, by blocking NF-kappaB and AP-1. Phytother Res. 2010 Jan;24 Suppl 1:S29-34.
Sarkar A, De R, Mukhopadhyay AK. Curcumin as a potential therapeutic candidate for Helicobacter pylori associated diseases. World J Gastroenterol. 2016 Mar 7;22(9):2736-48.
Dabos KJ, Sfika E, Vlatta LJ, Giannikopoulos G. The effect of mastic gum on Helicobacter pylori: a randomized pilot study. Phytomedicine. 2010 Mar;17(3-4):296-9.
Takeuchi H, Trang VT, Morimoto N, Nishida Y, Matsumura Y, Sugiura T. Natural products and food components with anti-Helicobacter pylori activities. World J Gastroenterol. 2014 Jul 21;20(27):8971-8.
Okuda M, Nakazawa T, Yamauchi K, Miyashiro E, Koizumi R, Booka M, Teraguchi S, Tamura Y, Yoshikawa N, Adachi Y, Imoto I. Bovine lactoferrin is effective to suppress Helicobacter pylori colonization in the human stomach: a randomized, double-blind, placebo-controlled study. J Infect Chemother. 2005 Dec;11(6):265-9.
Salem EM, Yar T, Bamosa AO, Al-Quorain A, Yasawy MI, Alsulaiman RM, Randhawa MA. Comparative study of Nigella Sativa and triple therapy in eradication of Helicobacter Pylori in patients with non-ulcer dyspepsia. Saudi J Gastroenterol. 2010 Jul-Sep;16(3):207-14.
Nakamura M, Haruma K, Kamada T, Mihara M, Yoshihara M, Sumioka M, Fukuhara T, Chayama K. Cigarette smoking promotes atrophic gastritis in Helicobacter pylori-positive subjects. Dig Dis Sci. 2002 Mar;47(3):675-81.

谷禾健康

牛奶蛋白过敏(CMPA)是婴儿最常见的食物过敏类型之一。粪便病原菌培养显示产气荚膜梭菌阳性率超过30%,明显高于其他细菌。因此推测产气荚膜梭菌定植可能是婴儿牛奶蛋白过敏的发病因素之一。
一项真实世界的研究,杨敏团队从我国一家大型三甲医院(广州市妇女儿童医疗中心)招募患有腹泻、粘液便和/或血便的 0-6 个月婴儿的研究中,通过飞行质谱法证实了用于检测产气荚膜梭菌的粪便病原体培养物,并通过PCR鉴定了潜在的毒素基因。随访12个月后,记录牛奶蛋白过敏和食物过敏的诊断。通过Pearson相关分析评估相关性。
这项研究表明产气荚膜梭菌肠道定植在婴儿中很常见,与婴儿牛奶蛋白过敏和食物过敏的发生有关。
产气荚膜梭菌是一种厌氧、革兰氏阳性芽孢杆菌,是一种可引起胃肠道或皮肤和深层组织感染的细菌。产气荚膜梭菌的定植可能导致侵袭性胃肠道感染,产生肠毒素,可能破坏肠上皮细胞间的紧密连接,造成上皮损伤,引起肠道菌群失衡,导致宿主免疫反应异常。
本文我们来详细看一下这项研究过程及相关结果,结合产气荚膜梭菌的生物学特性、毒素等相关知识,深入探讨产气荚膜梭菌定植对婴幼儿过敏相关疾病及其他健康问题的影响,了解这些可以帮助我们更好地了解其在婴幼儿免疫系统发育中的作用,为临床上预防和治疗相关疾病提供新的思路和方法。
在这项广州妇女儿童医疗中心的研究中,共招募了358名0-6个月的婴儿。对这些婴儿粪便样本进行病原培养,其中128名产气荚膜梭菌呈阳性。
共有270名婴儿(44.07% 为女孩;平均年龄为 2.78 ± 2.84 个月)参加了为期 12 个月的跟踪调查。
注:
▪ 2020年1月1日至2021年12月31日期间因胃肠道症状住院或门诊的所有0-6个月大的婴儿
▪ 排除先天性代谢性疾病、免疫缺陷性疾病和恶性肿瘤的患者

doi: 10.1186/s13099-023-00572-x
专门针对食物过敏和牛奶蛋白过敏的临床诊断,其中包括湿疹、过敏性鼻炎以及食物蛋白诱导的过敏性直肠结肠炎等相关病症。食物过敏是根据症状、饮食排除和口服食物挑战进行临床诊断的。
病程差异
产气荚膜梭菌阴性组与产气荚膜梭菌阳性组显著差异(P < 0.001)。
喂养方式
纯母乳喂养组、母乳添加配方奶喂养组和纯配方奶喂养组产气荚膜梭菌定植阳性率分别为 32.14%、46.43%、21.43%(P<0.05)(下表)。
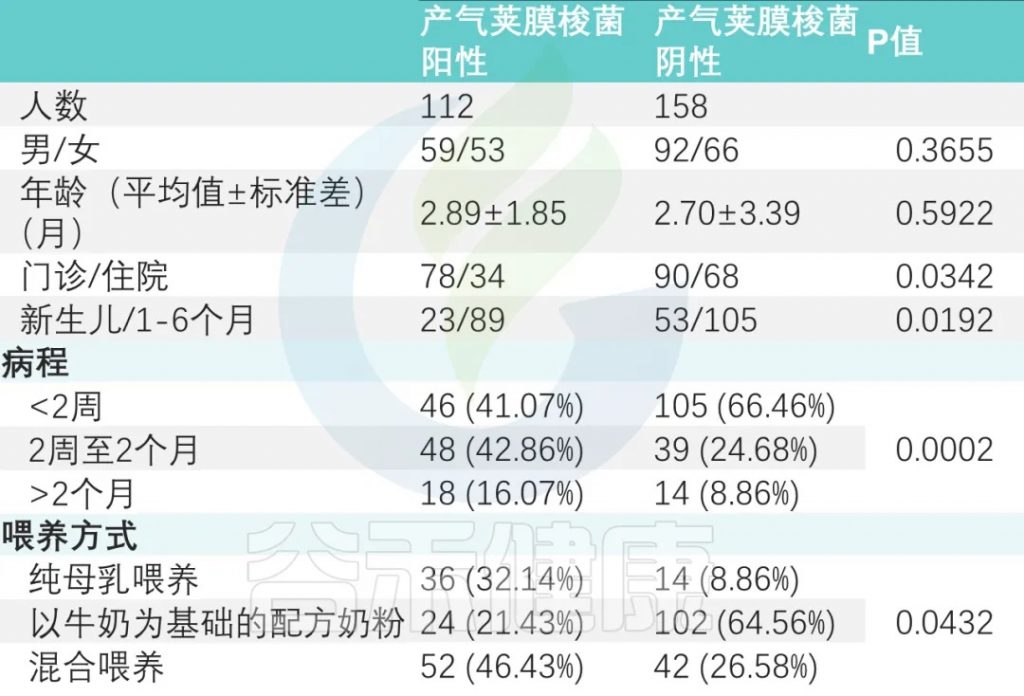
doi: 10.1186/s13099-023-00572-x
主要症状及诊断
主要症状是腹胀、腹泻和粘液便和/或血便。
有或没有产气荚膜梭菌定植的婴儿,腹胀和粘液样便和/或血便的发生率存在显著差异(P<0.05)。
与产气荚膜梭菌阴性组相比,阳性组NEC(坏死性小肠结肠炎)和FPIAP(食物蛋白诱发的过敏性直肠结肠炎)发生率显著升高(下表)。
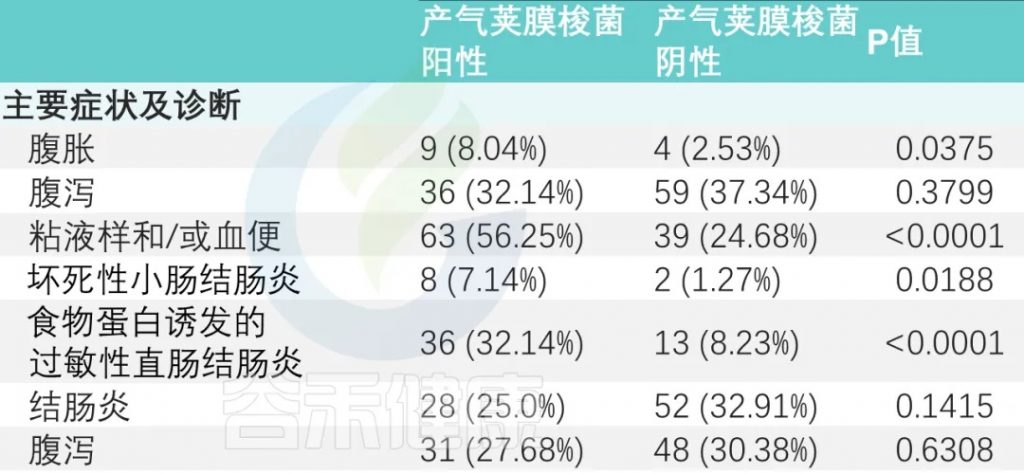
抗生素
甲硝唑给药率:产气荚膜梭菌阳性组高于阴性组(33.9% vs. 10.76%)(P < 0.0001)。
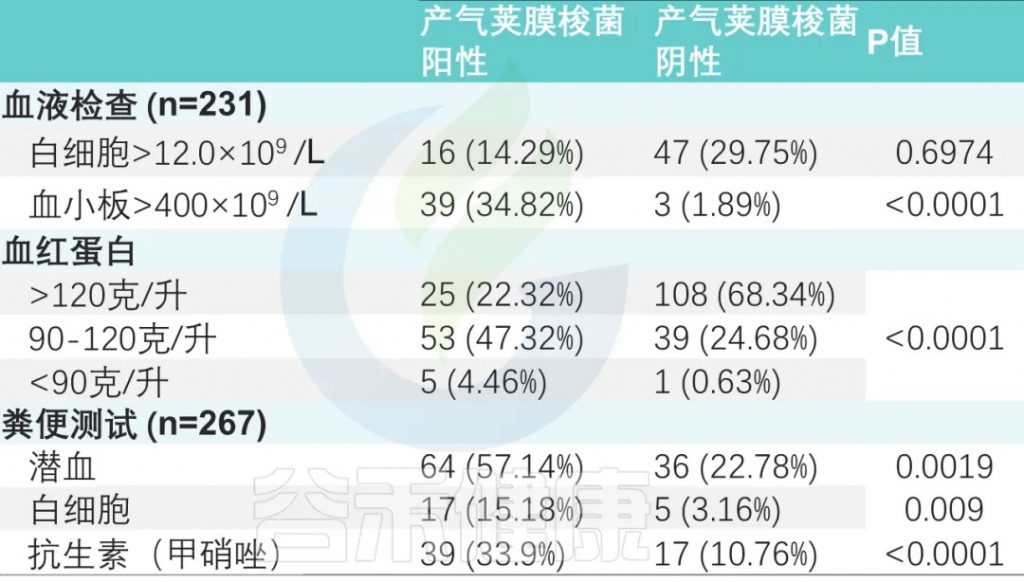
血常规检查 (231名患者)
两组之间白细胞增多、血小板增多和中性粒细胞减少事件的数量存在显著差异。
粪便常规检查 (267次)
粪便潜血阳性率为37.45%(100/267),
粪便白细胞阳性率为8.2%(22/267)。
两组比较差异有显著性(P <0.001)(下表)。
在 30 名患者不同时间点(0、2、4、12 和 24 周)的 85 份粪便样本中检测到了潜在的特异性毒素基因。
产气荚膜梭菌携带潜在特异性毒素基因的出现率如下:
没有携带其他毒素的分离株。
对83份样本进行基因型鉴定,其中:
17例患者中同时检测到A基因型和C基因型。
经过12个月的随访调查,根据症状、饮食排除和口服食物挑战,临床诊断如下:
24.44%的病例(66/270)食物过敏,其中18.5%的儿童(50/270)患有牛奶蛋白过敏。
在产气荚膜梭菌阳性组队列中:
这两个比例都显著高于产气荚膜梭菌阴性组 [分别为7.59%(12/158)和5.06%(8/158)] (P<0.0001)
(下图)。
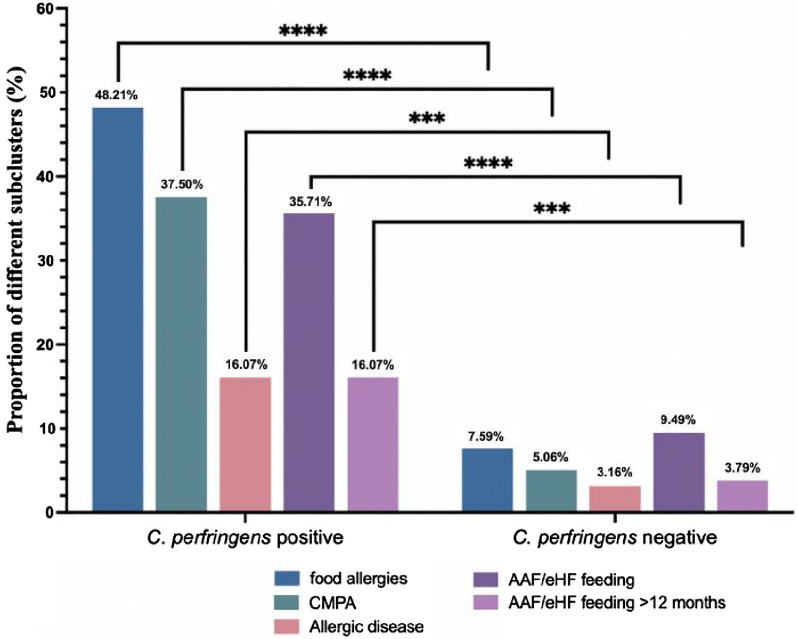
共有8.52%(23/270)的儿童被诊断为过敏性疾病,其中:
共有20.37%(55/270)的儿童喂养氨基酸配方奶粉(AAF)或深度水解配方奶粉(eHF),其中8.89%(24/270)喂养时间超过12个月。
产气荚膜梭菌阳性组氨基酸配方奶粉/深度水解配方奶粉利用率为35.71%,高于阴性组9.49%(P < 0.0001)。两组中喂养氨基酸配方奶粉和/或深度水解配方奶粉超过12个月的儿童人数分别为 16.07%和 3.79%(P = 0.0005)
为了探索产气荚膜梭菌阳性与食物过敏之间的相关性,进行了皮尔逊相关分析,生成了热图,显示食物过敏与产气荚膜梭菌阳性显著相关,粪便潜血、粪便中的白细胞、抗生素使用、血小板增加,血红蛋白减少(P <0.0001)。
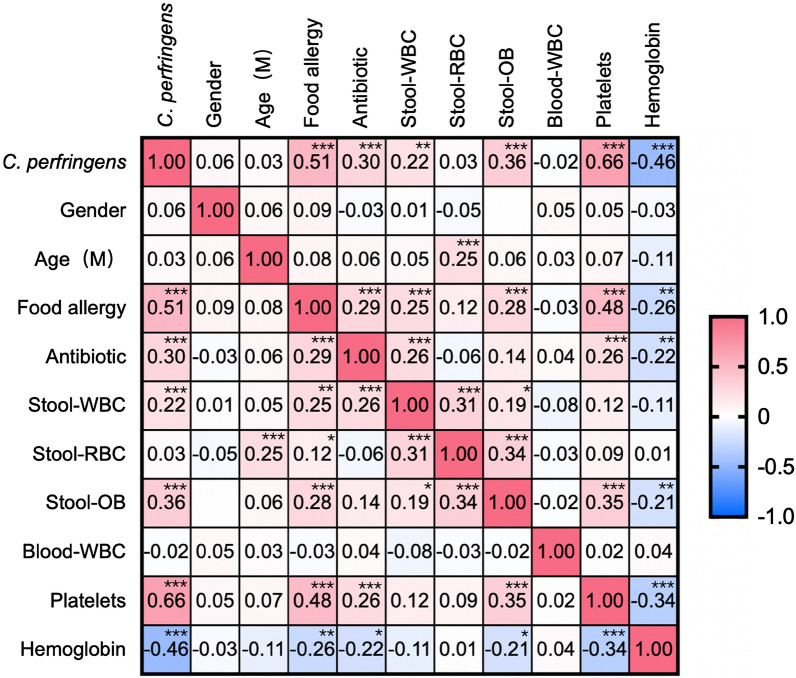
据报道,血小板与食物过敏反应有关,并且与过敏反应的严重程度相关。我们的研究显示食物过敏与血小板之间呈正相关(P<0.0001),这与报道的研究一致。婴儿食物过敏的常见症状包括腹泻和血便,常被误诊为急性或慢性肠炎而采用抗生素治疗。持续便血可能导致贫血,这可以解释本研究中食物过敏与抗生素使用(P<0.0001)和血红蛋白水平(P=0.0001)之间的相关性。
这项真实世界研究结果首次表明,产气荚膜梭菌在有胃肠道症状的中国婴儿中定植率很高,并且与食物过敏和牛奶蛋白过敏的发生有关。
产气荚膜梭菌广泛存在于健康人和动物的胃肠道中。
本研究显示,有胃肠道症状的婴儿中有33.52%有产气荚膜梭菌定植,新生儿和1~6月龄婴儿产气荚膜梭菌阳性率分别为30.25%和45.88%。不同的定植率可能是由于不同的患者群体、分娩方式、喂养方法和胃肠道疾病状况所致。
产气荚膜梭菌和艰难梭菌是可能与婴儿胃肠道感染和过敏相关的致病性梭菌。
先前的研究表明,产气荚膜梭菌定植可能导致多种病理状况,从无症状感染到严重危及生命的败血性休克,例如气性坏疽、食物中毒、坏死性肠炎、抗生素相关性腹泻、菌血症、肠毒血症和严重血管内感染溶血。
研究重点是产气荚膜梭菌感染及其产生一系列致命毒素(七种主要毒素型 A-G)和酶(例如卵磷脂酶、纤维蛋白酶、透明质酸酶、胶原酶和 DNA 酶)的能力,这些酶有助于其侵袭性。
大多数已确定的腹泻相关病原体是病毒,但在近 80% 的报告病例中并未发现特定病原体。这些病例的病因可能包括产气荚膜梭菌胃肠道感染和饮食/环境因素。
目前还没有关于产气荚膜梭菌定植是否影响儿童食物过敏发生的报道。在112名确诊产气荚膜梭菌定植婴儿队列中,其中 48.21% 出现食物过敏,37.5% 出现牛奶蛋白过敏,这两种患病率均显著高于产气荚膜梭菌阴性组(7.59% 和 5.06%),并且显著高于一般儿科人群中报告的水平。
此外,相关分析显示,食物过敏与该研究队列中产气荚膜梭菌定植、抗生素使用、粪便潜血、粪便白细胞、血小板和血红蛋白水平显著相关。该研究结果清楚地表明,产气荚膜梭菌在出生后第一年定植可能会促进食物过敏和牛奶蛋白过敏的发生。
研究表明,产气荚膜梭菌肠毒素(CPE)在促进紧密连接分解和诱导上皮损伤方面发挥着关键作用,从而导致微生物群变化并触发宿主免疫反应。免疫细胞群的变化很大程度上是由环境和微生物抗原驱动的。
关于产气荚膜梭菌定植与食物过敏的研究很少,但结果并不一致。有报道,过敏婴儿的拟杆菌和/或克雷伯氏菌定植率较高,而产气荚膜梭菌/丁酸梭菌定植率较低。
总之,研究人员推测产气荚膜梭菌定植会因其肠毒素而引起侵袭性胃肠道感染,导致紧密连接分解、上皮损伤、微生物群变化、宿主免疫反应异常,并最终导致食物过敏。
需要进一步的研究来阐明产气荚膜梭菌定植的婴儿发生食物过敏的潜在免疫学和分子机制。
总的来说,产气荚膜梭菌定植为婴儿牛奶蛋白过敏和食物过敏提供了一个思路,应用肠道菌群检测可以帮助识别食物过敏的风险,从而采取相应的预防措施。
此外,对于产气荚膜梭菌定植的抵抗力、空间和特定营养物质的竞争或毒素功能的研究,也能为进一步探索肠道菌群与过敏关系及预防和治疗提供了新的视角。
通过深入研究肠道菌群的变化及其与过敏疾病的关联,这可能涉及有效的药理学抑制剂/化合物的合理设计,调节补充剂/益生菌等各种方式对肠道菌群加以改善,有望为未来开发更加个性化的过敏预防和治疗策略提供重要参考。
这里我们来系统地了解一下产气荚膜梭菌。
产气荚膜梭菌是一种革兰氏阳性,产毒厌氧细菌,有荚膜、非运动、无鞭毛,属于梭菌属,是人类和动物肠道固有的机会病原体。
芽胞形成能力强,可在不利环境下存活
可以形成在传播过程中至关重要的孢子。产气荚膜梭菌孢子对高温、氧气或低营养水平等应激环境具有极强的抵抗力。当遇到有利条件时,内生孢子迅速萌发,产气荚膜梭菌的世代时间最短,为 6.3 分钟。在缺氧环境下生长迅速,能快速繁衍和侵袭宿主组织。对抗生素和化学消毒剂具有一定耐受性。
这些特征有利于其在不同的环境生态位中生存,包括土壤、粪便、污水、食物以及人类和动物的肠道。
这种“生存能力”意味着产气荚膜梭菌与许多感染和疾病有关,包括食源性细菌性疾病等。
具有多种水解酶
可分解蛋白质、脂肪等营养物质,为自身生长提供营养。
产气荚膜梭菌产生大量胞外降解酶,例如蛋白酶(例如梭菌蛋白酶)、透明质酸酶(mu毒素)、胶原酶和糖苷内切酶。
内切-N-乙酰半乳糖酰胺酶 EngCP,在 A 型菌株引起的气性坏疽期间很重要,而两种锌金属蛋白酶则导致 G 型菌株引起的禽坏死性肠炎。
最广为人知的产气荚膜梭菌降解酶是神经氨酸酶,它从宿主细胞表面或粘液中的各种唾液酸糖结合物上产生游离的神经氨酸。产生三种神经氨酸酶,分别为NanJ、NanI、NanH。
产生多种细胞外毒素
已知它能分泌超过20 种毒素,每种毒素类型都与特定疾病相关
A型和C型毒素被认为会引起人类疾病。
A型毒素是导致大多数与产气荚膜梭菌相关的食物中毒和非食源性腹泻疾病的主要因素。根据CDC对食源性疾病暴发的流行病学监测数据,产气荚膜梭菌占5%的暴发事件,10%的疾病病例,4%的住院率。
男性的发病率略高(65%),大多数病例发生在20-49岁人群中。
C型毒素与1944年-1949年在德国战后出现的地方性坏死性肠炎,以及在巴布亚新几内亚高地出现的猪痢有关。严重营养不良会增加对 C 型感染的易感性。
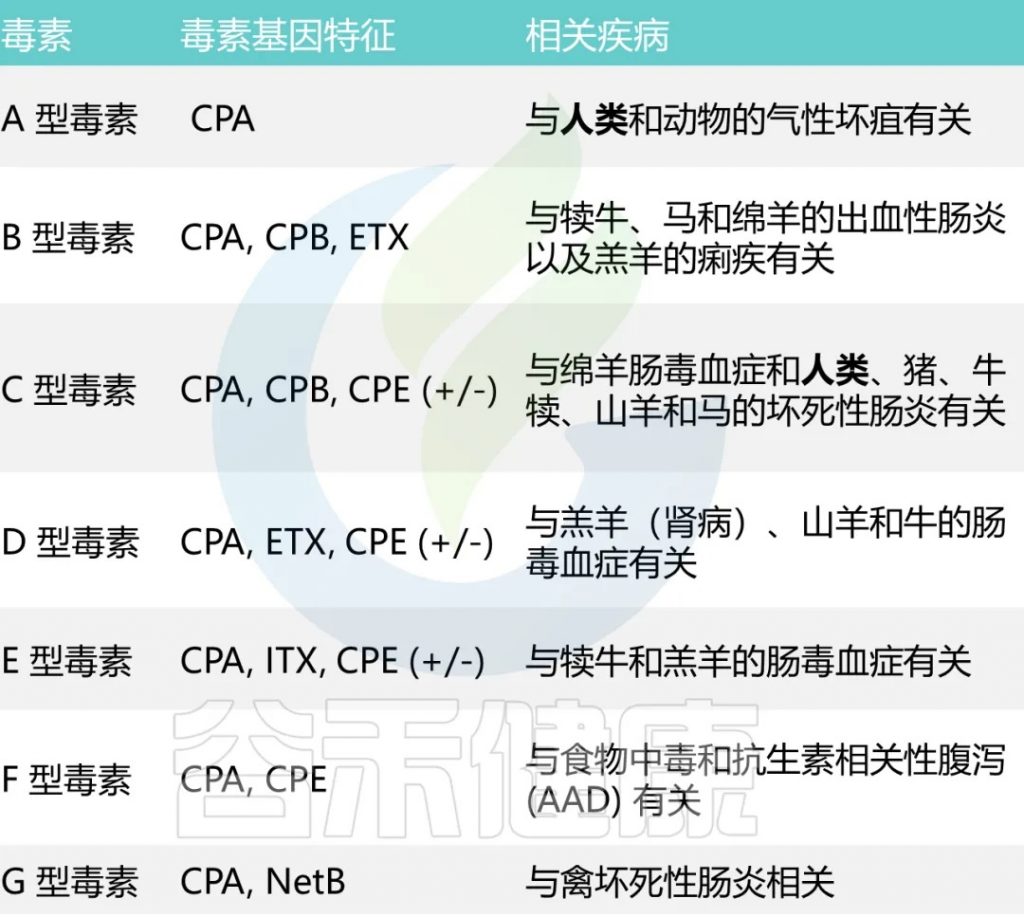
CPE基因,在孢子形成后细胞裂解时产生肠毒素CPE,可能会导致胃肠炎。
产气荚膜梭菌主要毒素的结构域示意图
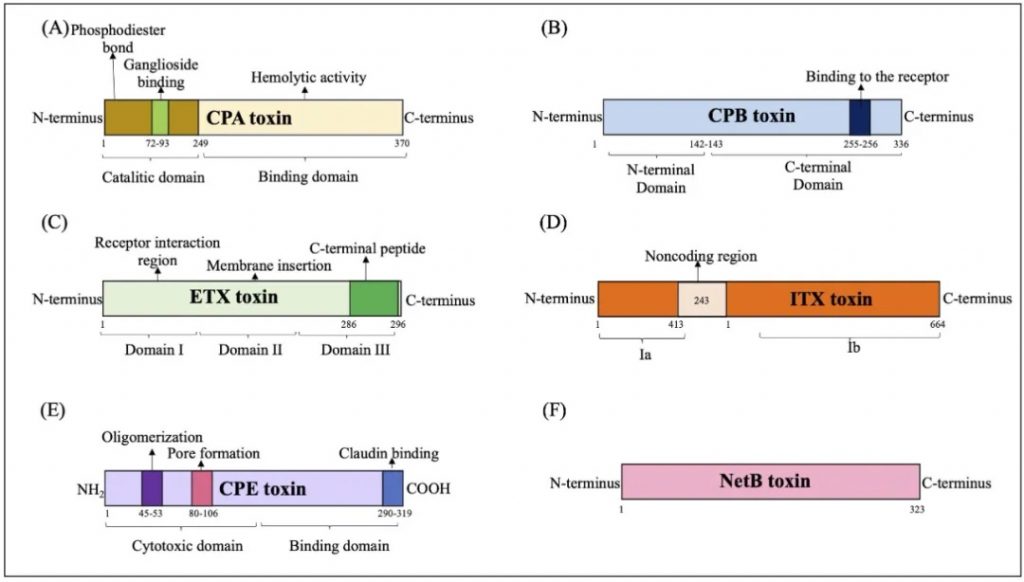
doi.org/10.1080/22221751.2024.2341968
(A) CPA 毒素:CPA毒素与GM1a相互作用,水解磷脂酰胆碱(PC)和鞘磷脂(SM),导致二酰甘油(DAG)和神经酰胺(CER)的形成,并激活原肌球蛋白激酶A受体(TrKA),并触发细胞内信号级联与IL-8释放。磷脂酰肌醇 3 (IP3) 的激活促进细胞质内钙 (Ca+) 进入。
(B) CPB 毒素:CPB 与血小板内皮细胞粘附分子 1 (PECAM-1) 结合,随后释放三磷酸腺苷 (ATP) 并形成允许离子交换进出细胞的孔。
(C) ETX 毒素:ETX 毒素与蛋白质“髓磷脂和淋巴细胞”(MAL) 相互作用,形成活性孔,诱导离子跨细胞膜运输和交换。
(D) ITX 毒素:Ib与脂解刺激脂蛋白受体(LSR)受体的结合介导其进入宿主细胞,通过内吞作用促进Ia进入通道的形成,随后肌动蛋白丝解聚,产生形态变化和改变细胞通透性。
(E) CPE 毒素:CPE毒素与紧密连接蛋白受体结合,通过离子交换和渗透失衡促进细胞表面孔的形成。
(F) NetB 毒素:通过形成允许 Na+、Cl–y 和 Ca2+等离子进入的七聚体亲水孔来识别细胞膜中的无胆固醇区域。
有研究培养从 333 名婴儿的粪便样本中分离出的产气荚膜梭菌,其中29.4% 的婴儿在出院前已被产气荚膜梭菌定植。
三个因素与携带概率呈负相关:
产气荚膜梭菌在母乳中生长不良,说明母乳喂养在早产新生儿护理中的重要性。
长期使用抗生素或持续气道正压通气(CPAP)氧气治疗会在早产儿肠道中为产气荚膜梭菌创造一个不利的环境,从而降低携带的可能性。
产气荚膜梭菌分离物在营养丰富的培养基或母乳中生长,可以作为单一培养物,也可以与婴儿双歧杆菌共培养,婴儿双歧杆菌被选为代表典型的竞争性肠道物种。
食源性疾病
产气荚膜梭菌是食源性疾病(食物中毒)的常见原因,产生肠毒素导致急性胃肠炎。食源性产气荚膜梭菌会导致:腹泻、腹部绞痛、胀气和腹胀。
通常,人们在摄入细菌及其孢子后,当微生物在肠道中形成孢子时,就会形成毒素,通常在 6-24 小时内就会出现症状。腹泻突然发生,但通常症状会在 24-48 小时内消失。
非食源性胃肠道感染
这种类型的感染通常归因于抗生素的使用。但有些人即使不服用抗生素,也会因产气荚膜梭菌而出现偶发性胃肠道症状。免疫系统较弱的人患此类疾病的风险最大。
非食源性产气 荚膜梭菌胃肠道感染导致:
这种类型的产气荚膜梭菌感染通常发生在最近服用过抗生素的60 岁以上成年人中。症状与食源性梭菌感染相似,但持续三天到几周不等。
这种类型的梭菌感染可导致严重脱水(体内水分流失)。然而,人们通常会康复。
一项研究表明,与健康个体 [5%] 相比,IBD 成年患者[19-27%] 产气荚膜梭菌的患病率更高,这表明与 IBD 存在潜在关联。
产气荚膜梭菌具有大量HMO消化所需的糖苷水解酶,表明它具有婴儿肠道机会性定植的可能性,从而导致临床疾病。
皮肤和深层组织感染
产气荚膜梭菌与严重外伤后可能发生的严重皮肤和深层组织感染(气性坏疽)有关。
从受污染的伤口(例如复合性骨折、产后子宫)开始,感染会在 1-3 天内扩散。
皮肤或深层组织产气荚膜梭菌感染(气性坏疽)会导致:
有时,感染仅导致厌氧性筋膜炎或蜂窝织炎。
其他感染
如乳腺炎、子宫内膜炎等。
促进定植
定植能力,即体内持续和增殖/存活的能力,是一些产气荚膜梭菌感染(例如F型菌株非食源性人类胃肠道疾病)的重要特征,产气荚膜梭菌定植通常涉及生长/生存和粘附所需的营养获取。例如,F型非食源性胃肠道疾病即使在腹泻时也能持续长达数周,这表明肠道粘附和营养获取对于这些 F型菌株在腹泻时稳定定植于肠道是必需的。
肠道粘附
为了在胃肠道中定殖,产气荚膜梭菌使用多种分子策略,包括产生唾液酸酶。虽然产气荚膜梭菌产生三种唾液酸酶,但 NanI 是由持续存在于肠道中的 F 型非食源性胃肠道疾病菌株产生的。这种相关性表明 NanI 对产气荚膜梭菌慢性肠道疾病有重要贡献。
NanI 的蛋白酶激活可能进一步促进产气荚膜梭菌菌株引起的定植。
增加营养物质的获取
多项体外研究支持 NanI 对与肠道感染相关的产气荚膜梭菌菌株的生长和存活的贡献。例如,NanI在宿主粘蛋白或培养的 Caco-2 细胞存在的情况下支持F 型非食源性疾病菌株 F4969 的体外生长和存活。这种生长促进涉及 NanI 生成的唾液酸的产生和利用,然后唾液酸可以被产气荚膜梭菌代谢。
可能涉及几种潜在的机制:
NanI 可能通过修饰肠细胞表面来促进产气荚膜梭菌粘附,从而允许暴露用于结合的未知受体,和/或减少该表面上唾液酸的负电荷。
大批量烹制并在不安全温度下保存的食物,通常会导致产气荚膜梭菌食物中毒的爆发。通常与产气荚膜梭菌食物中毒有关的特定食物包括:
产气荚膜梭菌食物中毒的爆发往往发生在为大量人群提供服务并且将食物保持在适当温度可能很困难的环境中,例如医院、学校食堂、监狱、疗养院和提供餐饮的大型活动。
组织感染
食物中毒
将食物煮至安全的内部温度杀死细菌。使用食物温度计进行检查,尤其是整只家禽和大块烤肉。
如果煮熟的食物不尽快食用,请将其保持在60 ℃或更高温度或4℃或更低温度。
烹饪食物或将其从保持安全内部温度的器具中取出后 2 小时内,将剩菜冷藏在4℃或更低的温度下。如果食物暴露在32℃以上的温度下(例如炎热的汽车或野餐),请在 1 小时内冷藏。
热食可以直接放入冰箱。
将大锅食物(例如汤和炖菜)和大块肉类(例如烤肉)分成小份,以帮助其在冰箱中快速冷却。
食用前将剩菜重新加热至74℃或更高温度。
主要参考文献
Huang KY, Liang BS, Zhang XY, Chen H, Ma N, Lan JL, Li DY, Zhou ZW, Yang M. Molecular characterization of Clostridium perfringens isolates from a tertiary children’s hospital in Guangzhou, China, establishing an association between bacterial colonization and food allergies in infants. Gut Pathog. 2023 Oct 8;15(1):47.
Yao PY, Annamaraju P. Clostridium perfringens Infection. [Updated 2023 Aug 8]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan-.
McDonald AG, Lisacek F. Simulated digestions of free oligosaccharides and mucin-type O-glycans reveal a potential role for Clostridium perfringens. Sci Rep. 2024 Jan 18;14(1):1649.
Low KE, Smith SP, Abbott DW, Boraston AB. The glycoconjugate-degrading enzymes of Clostridium perfringens: Tailored catalysts for breaching the intestinal mucus barrier. Glycobiology. 2021 Jun 29;31(6):681-690.
Mehdizadeh Gohari I, A Navarro M, Li J, Shrestha A, Uzal F, A McClane B. Pathogenicity and virulence of Clostridium perfringens. Virulence. 2021 Dec;12(1):723-753.
Camargo A, Rámirez JD, Kiu R, Hall LJ, Muñoz M. Unveiling the pathogenic mechanisms of Clostridium perfringens toxins and virulence factors. Emerg Microbes Infect. 2024 Apr 9:2341968.
Arjomand Fard N, Wine E. Clostridium perfringens: A Potential Pathobiont in Inflammatory Bowel Disease. J Crohns Colitis. 2024 Feb 16:jjae019.
Kiu R, Shaw AG, Sim K, Acuna-Gonzalez A, et al., Particular genomic and virulence traits associated with preterm infant-derived toxigenic Clostridium perfringens strains. Nat Microbiol. 2023 Jun;8(6):1160-1175.

谷禾健康

血清素,5-羟色氨(5-HT)不仅充当体内系统的神经递质和激素,而且还是胃肠系统中的旁分泌信使。
5-HT神经元系统起源于中脑中缝核,下面示意图强调了血清素(5-HT)神经元与释放不同神经递质的其他神经元以及神经胶质细胞之间的解剖相互作用。
中枢神经系统几乎所有区域的神经末梢都会释放5-HT。换句话说,可能很难找到不受5-HT调节的神经元/细胞通信的单一参与者。血清素是一种抑制性神经递质,会抑制其它神经递质的分泌,比如(多巴胺,肾上腺素等)。所以它有时也被人们称为:“幸福激素”或“幸福神经递质”。
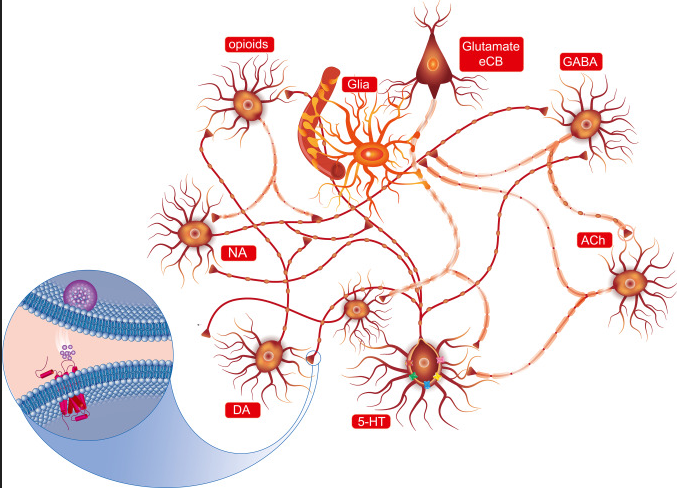
目前(血清素)5-HT系统是开发治疗中枢神经系统疾病药物的重要靶点。但是血清素仅有5%左右来自中枢神经产生,体内大约95%的血清素是由肠嗜铬(EC)细胞(胃肠道中最常见的神经内分泌细胞类型)通过感测来自肠腔和循环系统的信号合成和分泌的。肠道菌群及其代谢物、营养物质和激素是调节EC细胞分泌5-HT的主要因素。要注意,由于5-HT不能穿过血脑屏障,中枢和外周5-HT系统在解剖学和功能上是分开的。
循环血小板可以从胃肠道中隔离5-HT,并将其存储或需要时释放以促进止血并将其分布到身体各个部位。因此,肠道来源的5-HT调节多种功能,包括肠运动和分泌反射、血小板聚集、葡萄糖稳态、免疫反应和骨骼发育和心脏功能。
此外,血清素的生理作用受到多种蛋白质的调节,这些蛋白质调节其合成、储存、释放、再摄取和降解。血清素信号传导由至少14种不同的受体介导。
研究发现血清素传输的改变发生在许多中枢神经系统(CNS)疾病中,血清素过低或血清素使用障碍与精神分裂症、焦虑症、抑郁症、成瘾、癫痫、肥胖、强迫症、多发性硬化症、帕金森病和阿尔茨海默病的有关。因此,各种精神活性药物和药物的作用通常通过直接或间接机制涉及5-HT系统。
血清素产生和随后分解的速度之间的相对平衡是决定一个人拥有多少可用的“活性”血清素的主要因素之一。研究表明,一些补充剂能够增加血清素水平,如色氨酸,抗抑郁药物,维生素D、omega-3脂肪酸和某些益生菌,具有较强证据支持。此外,阳光照射,适当锻炼、积极思考、社交互动等也是增加血清素的重要手段。
与此同时,由于药物、补充剂或草药的组合导致也会血清素升高至不安全水平而引起血清素综合征。它可能导致意识混乱、发烧、呕心、不自主的肌肉痉挛、癫痫发作甚至死亡。任何食用改变血清素水平的产品的人都应该注意到这些症状。
然而,迄今为止,缺乏在体内相关探测这种难以捉摸的神经递质所需的有效工具。最近的技术进步,例如血清素 FSCV(”阶段性”测量)和 FSCAV(”环境”测量),刚刚开始揭示血清素活性对行为相关时间尺度的复杂性和影响。此外,血液高效液相色谱法也被用来测定血清素水平。
但是,血清素的变化受多方面因素的影响,其中大部分血清素是在肠道产生的。血清素与肠道菌群之间存在密切关系。因此利用肠道菌群的大数据库可以帮助我们从新的角度评估血清素,尤其是肠源性血清素的变化尺度和动态,可以反映个体整体的生理状态和代谢特点。
本文将探讨血清素的发现进化及其与光的作用,产生代谢,影响的生理功能和疾病,以及增加血清素水平的潜在自然方法。此外还有血清素综合征的定义,危害以及注意事项。希望本文的能够为5-HT在营养、临床医学和健康领域的应用提供一些见解。
血清素存在于身体的大部分器官中,例如皮肤、肠道、肺、肾、肝脏和睾丸中,以及地球上几乎所有生物体中,包括真菌、植物和动物中。血清素在系统发育上很古老,并且在植物和神经元出现之前就已进化。
根据文献,血清素的进化始于近三十亿年前单细胞生物中的前体色氨酸。色氨酸合成血清素需要氧气和光。保守的血清素生物合成途径始于蓝藻、绿藻和真菌的单细胞系统,并不断进化到目前在人脑中的位置。
▸ 阳光对血清素的合成以及水平有重要影响
血清素进化分析中出现的一个重要概念是它与光的关系。从色氨酸吲哚环的光吸收特性开始,随着系统发育的进一步发展,阳光对人类的血清素水平以及情绪、睡眠和自杀意念都有影响。与色氨酸结合并减轻与季节性情感障碍(SAD) 相关的抑郁症的最有效的光类型是蓝光。
色氨酸的光捕获特性归因于其吲哚结构。叶绿体中的色氨酸合成特别高,叶绿体吸收蓝光波会激发色氨酸的吲哚结构,使其失去吲哚环结构中的一个电子,从而被氧化。叶绿体细胞器含有色氨酸合成所需的基因和酶,类似于蓝细菌中的基因和酶。水果、蔬菜和坚果中的色氨酸含量要高得多。
拓展:除此之外,色氨酸产生烟酸及其所有前体。 NAD+和NADP+辅因子几乎参与细胞代谢的所有方面。从色氨酸从头合成NADH是这些辅酶比利用膳食烟酰胺或烟酸更重要的来源。在细胞核中,烟酸对于DNA修复很重要,并且色氨酸捕获光似乎是导致DNA光损伤的原因,该损伤与突变和缺乏修复的细胞死亡相关。
尽管光合作用具有营养价值,但对细胞来说却是一个主要风险。破坏光收集率和光利用率之间的平衡会扰乱光合作用,导致活性氧(ROS)的产生。如果不加以控制,活性氧会损害蛋白质功能和膜完整性,并对光合生物构成严重威胁。色氨酸产生荧光光产物,抑制培养的受精海胆卵和小鼠成纤维细胞的生长和分化。
因此,从细菌到哺乳动物的多种细胞都会受到光氧化色氨酸的损害。阳光对人体皮肤造成的损害很大程度上归因于色氨酸通过吡咯酶、犬尿氨酸和烟酸途径代谢的作用。
大约于1937年从纯化浓缩的牛血清中鉴定出一种具有吲哚核的血管收缩物质,并将其命名为“5-羟色胺”(5-HT)。5-HT后来被称为“血清素”,该术语源自其衍生物“血清”及其调节血管内张力的能力。
1960年,人们发现肠道是5-HT生物合成的主要枢纽;对大鼠进行全胃肠切除术导致尿液中5-HT和主要代谢物5-羟基吲哚乙酸(5-HIAA)大幅减少。这一发现以及大脑中完整的5-HT水平表明,神经元5-HT生物合成独立于其肠道来源。
▸ 血清素(5-HT)合成
人体也是从色氨酸生物合成血清素。色氨酸被色氨酸羟化酶(TPH)分解,产生前体5-羟基色氨酸(5-HTP),然后被氨基酸脱羧酶(AADC)转化为5-HT。
TPH是5-HT合成中的特异性限速酶,它包含两种亚型,即TPH1和TPH2。TPH1负责外周5-HT的合成,主要在肠道肠嗜铬(EC)细胞中表达。TPH2主要表达于中枢神经系统(脑干裂齿核)和肠神经系统 。
色氨酸羟化酶(TPH)需要分子氧(O2)和四氢生物蝶呤(tetrahydrobiopterin,简写为BH4)作为共底物。该酶对亚铁(Fe2+)有绝对需求。
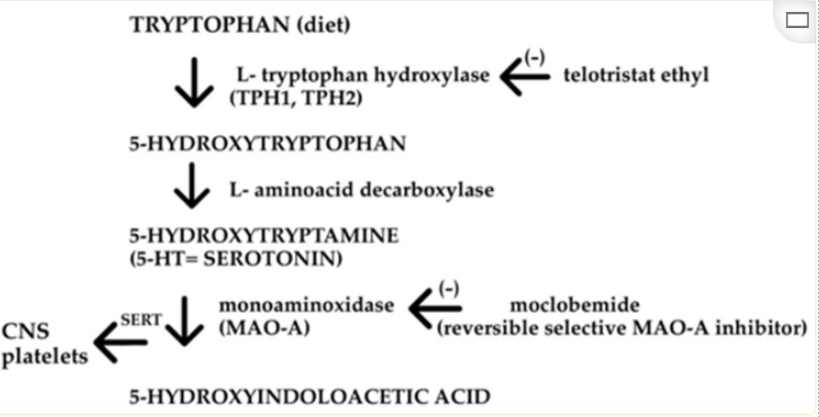
Guzel T and Mirowska-Guzel D.Molecules.2022
拓展:
四氢生物蝶呤(tetrahydrobiopterin)是一种天然存在的营养素,简写为BH4。是参与5-羟色胺、多巴胺、去甲肾上腺素、肾上腺素、褪黑素、一氧化氮生物合成的酶的重要辅助因子;
四氢生物蝶呤缺乏症是一种常染色体遗传性疾病,是迄今得以确认的5000~6000种人类的罕见病之一,四氢生物蝶呤缺乏症通过对新生儿进行疾病筛查,检出高苯丙氨酸血症(HPA)后可得到进一步确诊。BH4缺乏症主要会对人的神经系统造成损害,导致患儿出现智力低下、癫痫等症状。
♢色氨酸羟化酶活性影响血清素的水平
色氨酸羟化酶(TPH)是神经递质血清素 (5-HT) 生物合成中的限速酶。因此,TPH催化活性的增加或减少会导致神经元5-HT含量的相应变化。
TPH需要还原蝶啶辅助因子、分子氧和非血红素铁来羟基化其底物L-色氨酸。这四个因素中任何一个的组织含量的改变都可能改变TPH活性。TPH的翻译后修饰,包括磷酸化和半胱氨酸氧化,会导致其催化活性发生显著变化。
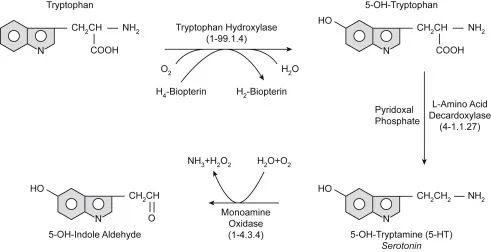
doi.org/10.1016/B978-0-444-64125-0.00001-3
上图显示了从色氨酸合成血清素的过程。色氨酸羟化酶和一般L-氨基酸脱羧酶的作用与必要的辅助因子一起显示。血清素代谢为5-OH-吲哚醛,与生长素(吲哚醛)类似,生成过氧化氢(H2O2 )。血清素也是脊椎动物合成褪黑激素的前体。
♢肠嗜铬细胞合成全身95%的血清素
除了在CNS(中枢神经系统)中合成外,胃肠粘膜内的肠嗜铬细胞(EC细胞)合成和分泌高达95%的全身血清素,也存在胰岛、乳腺和脂肪组织中。这些细胞对化学和机械刺激做出反应,但也收集来自肠道微生物群的信号以释放血清素。
肠嗜铬细胞(EC细胞)细胞激活将血清素释放到附近细胞的间隙中。 EC细胞感知胃肠道内的餐后变化,包括pH值、营养和毒素。
EC细胞产生高浓度的血清素,而调节系统从肠道间质空间去除高水平的血清素,该调节系统抑制血清素能传递并防止血清素中毒。血清素在肠细胞中循环或隔离以去除间质血清素。肠粘膜的肠细胞通过 SERT 吸收血清素,单胺氧化酶将其分解,然后粘膜下毛细血管将血清素转运到血液中。
▸ 血清素的吸收
我们现在知道,几乎血液中的所有5-HT都由血小板携带,血小板不会产生5-HT,而是在肠道循环时吸收它。因此,血清素在肠道中分泌并被血小板吸收后,就变成了“血清血清素”。
一旦5-HT被释放到固有层,它就会通过血清素再摄取转运蛋白(SERT)被上皮细胞吸收。接下来,5-HT 扩散到血流中,被血小板吸收并转运到外周靶组织。然而,血清素在体内可以通过多种方式被吸收和代谢,并且其吸收可以根据给药途径而变化。
一般来说,口服血清素不容易被吸收,因为它的活性形式很难穿过血脑屏障。中枢和外周血清素库在功能上彼此不同,因为它们分别控制大脑和外周区域的血清素依赖性行为。这就是为什么脑细胞必须从L-色氨酸或5-羟色氨酸(5-HTP)(L-色氨酸的副产品)产生自己的血清素。
注释:血清素再摄取过程,例如细胞X若是释放出了很多血清素,与其相靠近的细胞Y就会检测到周围血清素浓度的变化。信号发出后一段时间,细胞X会“回收”周围的血清素。这个过程叫神经递质的再摄取。再摄取不仅可以减少细胞X所需要生成的血清素,更能控制细胞之间信号的的传输。
▸ 血清素(5-HT)降解
过量的血清素以及大脑和肠道会通过几种不同的机制“失活”。例如,称为血清素转运蛋白的蛋白质可以有效地“清理”或“去除”(重新摄取)神经突触中的血清素,并将其带回神经元中以供重复使用,或者,释放到血液中的血清素要么被血小板吸收,要么在肝脏和肺部被单胺氧化酶(MAO-A)、乙醛和乙醇脱氢酶等酶分解(代谢)。
血清素主要被单胺氧化酶(MAO)分解代谢为5-羟基吲哚醛(5-HIA),然后被醛脱氢酶(ALDH)代谢为5-羟基吲哚乙酸(5-HIAA)。
单胺氧化酶有两种亚型:MAOA和MAOB。前者对5-HT的亲和力较高。5-HT也可以通过芳烷基胺N-乙酰基转移酶(AANAT)代谢为N-乙酰基血清素(NAS),随后通过羟基吲哚O-甲基转移酶(HIOMT)转化为褪黑激素。
此外,吲哚胺2,3-双加氧酶(IDO)对色氨酸、5-HTP、5-HT和褪黑激素等多种血清素通路成分的吲哚部分具有广泛的底物特异性。因此,5-HT也可以通过IDO进入犬尿氨酸途径。与抑郁症相关的血清素减少和犬尿氨酸增加与IDO活性有关。因此,除了Tph之外,犬尿氨酸途径对于调节血清素合成和可用性至关重要。
▸ 血清素周转和传递的复杂性
血清素(5-HT)在体内的周转速度非常快,尽管大脑中的5-HT含量只占体内总量的很小一部分(3%~5%),但在大脑中的循环速度却非常迅速。
♢血清素的周转速率非常快
研究表明,在健康的大鼠身上,5-HT的周转速率为15分钟到一个多小时。使用多室模型时,5-HT的合成、释放和降解可以被视为“后进先出”,这意味着这些过程发生得非常迅速,不到5分钟就会完成。
5-HTP是5-HT的前体,无需转运蛋白即可轻松穿过血脑屏障,并增加大脑5-HT水平,从而产生抗抑郁样作用。然而,5-HTP的快速药代动力学(在人体中的半衰期约为2小时)使其作为药物不切实际,神经药理学界将注意力转向更有效和安全的选择性血清再吸收抑制剂(SSRI)。
SSRIs可以通过阻断血清素转运蛋白(SERT)来提高大脑中细胞外5-HT水平,从而具有抗抑郁功能。根据临床反馈,目前SSRIs的药理潜力有限,只有三分之一的患者在治疗后情绪得到改善。因此,单独使用SSRIs抑制SERT活性可能不足以提高细胞外5-HT水平以引发大脑的抗抑郁反应,而用第二种协同药物治疗抑郁症则可以提高细胞外5-HT水平,从而超出其效果(这个不在本文讨论范围,下次有机会再讨论SSRIs与其他药物的协同互作)。
▸ 血清素(5-HT)受体
哺乳动物的受体存在巨大的多样性。有数百个血清素受体克隆,人脑至少有20个独立的5-HT受体神经元转录本。血清素与人脑中至少14种特定受体蛋白特异性结合,调节神经元中的离子通道、c-AMP 水平和激酶活性。
5-HT受体存在于身体的每个细胞中。为什么这么多,为什么分布这么大?可以推测,是由于动物体内制造和获取色氨酸的困难导致血清素利用率低。受体的功能是警告细胞环境中存在化学物质,而不去除或改变化学物质。
♢人体拥有众多的血清素受体
因此,如果化学物质供应短缺,受体分子的出现允许其作用传递到整个生物体。为了使其发挥最大效果,需要一种有效的血清素分配机制。动物的血液中含有特定的色氨酸和血清素结合蛋白,有助于将这些分子转运到特定的目标区域,例如大脑。
血脑屏障交界处的神经胶质细胞具有特殊的转运蛋白,用于浓缩色氨酸并将其递送至血清素神经元。血清素能神经元发育出长的无髓鞘轴突,可以吸收色氨酸并利用整个大脑和肠道合成血清素所需的酶。总之,色氨酸的丧失促进了高度分支、无髓鞘的神经网络和大量特定受体的形成,以最大限度地发挥血清素的作用。
迄今为止,已鉴定出14种血清素能受体,可以精确、快速地传递血清素的神经化学信息。此外,多种机制影响血清素再摄取,包括除SERT之外的其他单胺转运蛋白(例如多巴胺转运蛋白[DAT]、去甲肾上腺素转运蛋白[NET]和有机阳离子转运蛋白[OCT])对血清素的混杂再摄取。进一步强调该系统的复杂性,对血清素再摄取的显著控制是通过与SERT偶联的G蛋白的血清素自身受体实现的。
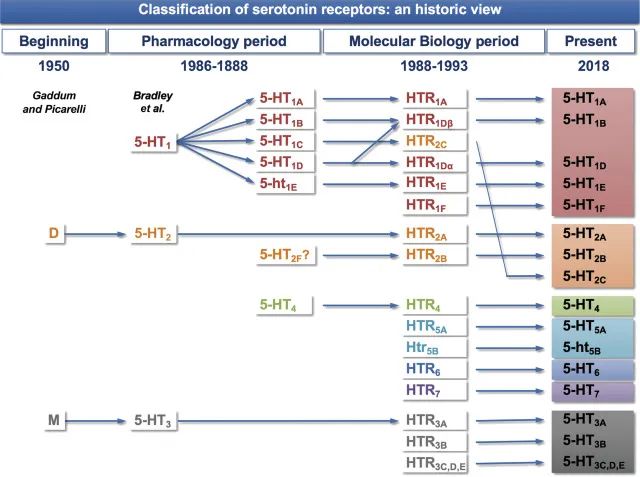
doi.org/10.1016/B978-0-444-64125-0.00005-0
过去了近10年。 5-HT受体的数量保持不变:14种受体亚型分为7个家族。
新发现与表达5-HT受体的细胞表型的鉴定及其与其他相关神经递质和神经递质受体的共定位有关,其中一些在神经元中,另一些在神经胶质细胞或星形胶质细胞中。免疫组织化学的应用增加了有关这种共定位的新信息。许多研究都集中在与偏头痛相关的大脑区域中5-HT受体的表达。
具有相似化学结构的血清素代谢物在细胞外的浓度可能比血清素本身高出近500倍,进一步阻碍测量,表明代谢过程很复杂。快速再摄取机制与快速代谢相结合,不仅减少了血清素可检测的时间,而且一些代谢物已被证明会显著降低微电极检测探针的完整性。总之,这些情况使体内血清素的测量和理解以及最终血清素活性与行为的对应关系变得复杂。
▸ 血清素(5-HT)反馈
血清素神经元在形态、连接性、电生理参数和基因表达方面表现出相当大的多样性。血清素神经元具有多种共递质,包括GABA或谷氨酸,以及许多不同的神经肽。
这些神经元能通过相同的神经递质语言进行交流,感知并相互调节血清素的释放,形成反馈回路。
反馈机制包括直接和间接的多突触途径,调节血清素系统的功能。不同区域的血清素神经元对反馈抑制的敏感性存在差异,与行为环境有关。
♢血清素的反馈机制可能影响人体系统功能
反馈机制可能不是维持血清素神经元稳态的主要作用,而是控制系统功能的重要机制。反馈的改变可能与多种与血清素相关的疾病有关,血清素选择性再摄取抑制剂可能通过重新平衡不同亚群间的相互作用发挥作用。
总而言之,血清素系统内的大量反馈机制在调节网络动态和塑造血清素神经传递的时间和空间方面发挥着关键作用。
▸ 肠道微生物与血清素合成,传递
肠道微生物群可以通过多种机制影响大脑中的血清素水平和神经传递,包括肠道中血清素的产生、SERT的调节、免疫系统相互作用、迷走神经通讯以及短链脂肪酸等代谢物的产生。
使用无菌小鼠或抗生素相关微生物群扰动进行的干预研究提供了令人信服的证据,研究使用无菌(GF)和抗生素治疗的小鼠,这些小鼠的外周5-HT水平显著降低,这种现象在正常肠道微生物定植后会逆转,表明5-HT和肠道微生物群之间的新型相互作用对于维持肠道稳态至关重要。
♢肠道微生物群对合成血清素有重要影响
越来越多的证据表明,外周5-HT是宿主与微生物群相互作用的关键介质,这对于维持肠道健康至关重要。膳食色氨酸(Trp)的很大一部分要么进入犬尿酸途径,要么被肠道微生物分解代谢为吲哚;只有一小部分用于外周5-HT合成。话虽如此,肠道微生物却是宿主5-HT合成的重要介质,这一过程主要由微生物代谢物驱动,向EC细胞发出信号并促使宿主机通过TPH1生成5-HT。
此外,宿主血清素能系统受到TLR2的严格调节。TLR2激活会降低5—羟色胺转运蛋白(SERT)表达和活性,而高水平的5-HT对TLR2表达产生负反馈效应。与此同时,TLR2 缺陷的小鼠表现出结肠5-HT水平和Tph1表达降低,非造血细胞(很可能是肠上皮细胞)中TLR2的激活负责肠道中5-HT的产生。这些发现与之前的观察结果一致,即Akkermansia muciniphila的外膜蛋白(Amuc 1100)通过TLR2信号传导促进5-HT生物合成。
此外,多形拟杆菌和齿双歧杆菌已被证明可以通过短链脂肪酸(例如乙酸盐和丙酸盐)的作用恢复EC细胞网络,从而促进5-HT合成,并增加肠道5-HT水平。
相反,胃内施用假长双歧杆菌可通过减少EC细胞数量来降低结肠5-HT水平,而鼠李糖乳杆菌GG上清液则上调结肠中的SERT表达。
此外,一些细菌菌株,如大肠杆菌、肺炎克雷伯菌和植物乳杆菌,可以直接转化色氨酸以从头合成5-HT ,而一些葡萄球菌则表达葡萄球菌AADC(sadA)基因负责转化5-HTP至5-HT。尽管已有证据,但这些细菌中5-HT的生理功能以及这种细菌来源的5-HT是否与宿主具有任何生物学相关性仍然难以捉摸。
虽然肠道产生的血清素不能穿过血脑屏障,它会影响血脑屏障的通透性,从而导致大脑炎症。此外,肠道微生物群对迷走神经的刺激可以改变动物和人类大脑中血清素、GABA 和谷氨酸的浓度,无菌雄性小鼠实验表现出类似焦虑的行为,并改变大脑中血清素的丰度。
♢使用精神药物产生的个体副作用差异可能与肠道菌群有关
其实抗抑郁和治疗精神障碍的药物包括SSRIs引起的副作用存在个体差异的事实可以用肠道微生物失调来解释。肠道血清素能神经元参与肠道蠕动的调节,这一事实可以很好解释恶心、便秘或腹泻等不良反应。
最近来自一项专门针对大鼠的氟西汀的小型临床前研究,其中体重增加伴随着某些细菌菌株(例如乳酸菌)的破坏,已知乳酸菌与体重调节有关。从临床试验和临床经验来看,一些患者似乎特别反应大,并且可能因使用SSRIs而体重显著增加 。这是否是由于个体的肠道微生物组成造成的,这也可能未来治疗领域需要关注的领域。
然而,在许多不同的精神疾病中也检测到其水平的改变。一些胃肠道功能障碍的症状可能是由于神经内分泌免疫刺激导致中枢神经系统活动失调、外周水平(肠)失调或两者(脑肠轴)的组合所致。此外,多项研究证明了5-HT在肝脏中的促纤维化作用,表明它与血小板衍生生长因子协同作用,刺激肝星状细胞增殖。
♢血清素是宿主与微生物群互作的关键介质
最近的一项研究指出大约50%的肠道来源5-HT受到肠道微生物群的调节,特别是以梭状芽孢杆菌科(Clostridiaceae)和苏黎世杆菌属(Turicibacteraceae)为主的孢子形成细菌,对宿主肠道蠕动、止血和骨化产生下游影响。
虽然大部分肠道5-HT由肠嗜铬细胞从基底外侧分泌到周围肠道组织中,但一些肠嗜铬细胞含有的5-HT则从顶部分泌到肠腔中,这表明肠道微生物暴露于宿主-衍生的5-HT。事实上,微生物对宿主肠嗜铬细胞的影响不仅调节肠道组织和血液中的5-HT水平,而且还调节肠腔和粪便中的5-HT水平。
一项新的研究表明,产孢肠道细菌(Turicibacter sanguinis)中的一种新型血清素传感器可能对宿主脂质和类固醇代谢很重要。这些发现支持了一个新兴概念,即双向信号通路可以影响细菌群落结构并对宿主生理产生影响。
为了解决粘膜血清素和肠道微生物组之间的串扰本质上是否是双向的,并可能导致细菌功能反应改变的问题,研究人员通过口服补充血清素或进行基因改造来限制血清素再摄取,他们发现粪便血清素水平的增加与肠道微生物群落结构的改变有关,特别是孢子形成细菌相对丰度的增加。生物信息学方法显示, Turicibacter属的孢子形成细菌表达蛋白质 CUW_0748,该蛋白质与哺乳动物血清素转运蛋白 (SERT) 具有序列和预测同源性,SERT 是一种膜转运蛋白,负责包括肠道在内的许多器官中血清素的再摄取和失活。
培养实验表明,细菌种Turicibacter sanguinis能够摄取血清素,而且这种作用可被选择性血清素再摄取抑制剂(SSRI) 氟西汀抑制。单独使用血清素或与氟西汀联合暴露时, T. sanguinis的转录组分析产生了基因表达的强烈变化,进一步支持了血清素介导的细菌反应作用。
总的来说,这些数据可能对抗抑郁药物的使用具有重要的临床意义。未来的研究将产生负责细菌对宿主血清素反应及其对宿主生理机能的后续影响的替代机制。
血清素有助于控制不同生物群体的新陈代谢。除了中枢神经系统和肠神经系统中发生的神经元交换之外,血清素还影响身体周围的组织。此外,血清素负责介导多种非神经元过程和功能,例如膀胱调节、止血、呼吸驱动、免疫反应、血管张力和肠道炎症。
血清素通过胃肠道中的5-HT受体在分泌、血管舒张、蠕动、疼痛感知和恶心中发挥关键作用。中枢血清素在调节情绪和行为以及通过降低食欲影响整体能量平衡方面发挥着至关重要的作用。
注:几种调节中枢血清素功能的药物(例如芬氟拉明、西布曲明和氯卡色林)最初被批准并用作抗肥胖治疗,但随后由于其不良心血管和致癌作用而被撤回。
在过去的十年中,人们利用特定血清素相关基因敲除的动物模型,对外周血清素在控制全身能量代谢中的作用进行了广泛的研究。以下是汇总的一些关键的相关的健康功能。
众所周知,脑干含有离散的含血清素(5-羟色胺,5-HT)神经元组,从尾髓质延伸到中脑头端。各种类型的血清素受体在整个大脑中分布不均匀,对目标部位的作用也不同。
血清素能神经元位于脑干中缝核,从那里它们投射到多个大脑区域并刺激多种血清素受体亚型。血清素能功能障碍与多种精神疾病有关,并且可能主要导致焦虑和抑郁等负面情绪。
血清素功能障碍会导致负面情绪和行为
突触内血清素的摄取受血清素转运蛋白(5-HTT)的功能和可用性的调节。血清素再摄取率的双重差异与5-HTT基因调节区域的功能多态性有关,并可能导致产生负面情绪状态的风险。
除了焦虑和抑郁等负面情绪状态外,血清素能功能障碍也可能有助于冲动行为、攻击性和过量饮酒的发病机制和维持。
脑干5-HTT可用性的增加与压力引起的血清素周转率下降相关。研究结果表明,产前和产后的压力暴露可以引起应激激素轴激活的长期改变,并可能影响血清素能神经传递。
血清素影响神经兴奋进而与一些精神疾病有关
5-HT在控制由神经网络振荡产生的节律性电活动方面至关重要,神经网络振荡是由反复兴奋和反馈以及前馈抑制的协调活动产生的兴奋和抑制平衡(E/I)之间的精确平衡决定的。血清素能功能的功能改变与多种疾病的缺陷有关,例如抑郁症、焦虑症、精神分裂症和明显的癫痫症。这些病理情况与5-HT的改变及其与不同神经递质系统的相互作用相关,例如GABA、多巴胺(DA)、大麻素(CB)等。导致E/I平衡改变并影响突触可塑性。
中枢神经系统中突触5-HT可用性的增加与情绪升高和焦虑减少相关,这构成了几类广泛使用的抗抑郁药的基础,这些抗抑郁药可通过以下方式防止5-HT从突触间隙中去除:阻断血清素转运蛋白(SERT)。
有一些证据表明血清素能系统在丛集性头痛(CH)病理生理学中的潜在作用。研究数据表明,丛集性头痛(CH)的特点是血浆血清素代谢升高,这表明中枢 5-羟色胺系统可能参与丛集性头痛的发生。
血清素的神经营养作用
在脊椎动物、线虫和果蝇等动物中,存在着一类称为星形胶质细胞的支持细胞,它们可能是最早出现的用于增强血清素营养作用的次级细胞。
1957年就有人提出血清素系统是一个”营养系统”。血清素可以通过受体介导的葡萄糖利用率和营养因子释放的变化。血清素纤维可以被认为是大脑的“滴灌系统”。只要轴突完好无损,血清素就能有效地释放到整个大脑中。而在老年和神经退行性疾病中,人脑中的血清素轴突会退化。
在哺乳动物中,血清素通过与神经胶质细胞的相互作用,形成了一种间接但重要的营养关系。高亲和力血清素受体已在星形胶质细胞、小胶质细胞、双极细胞和雪旺细胞等上发现。
血清素受体的激活可以促进神经胶质细胞的分化,诱导神经营养因子mRNA的表达,还可以刺激星形胶质细胞释放营养因子S100。
反过来,星形胶质细胞为血清素能神经元提供色氨酸,两者之间存在密切的营养相互作用,在海马体尤为明显。
季节性情感障碍和自杀
血清素的减少会对正常的大脑稳态(结构和功能)产生严重影响,并影响一个人继续生活的愿望。令人惊讶的是,阳光对人类大脑的血清素系统具有显著的作用。
几十年前就报道了情感障碍的季节性变化,并且从有记录的历史最早时期就已经注意到了。有些北半球文化制定了特殊的节日来纪念地球上的光的最低点,并举行庆祝活动来对抗冬季的阴暗(例如农神节和冬至)。
季节性情感障碍包括秋季/冬季复发性重度抑郁发作,春季/夏季缓解,可通过血清素药物和/或光疗法有效治疗。光疗法或抗抑郁药物治疗与心理社会功能和生活质量评估的显著改善相关。
光疗法对人体血清素参数有影响。研究表明,健康受试者和非季节性抑郁症患者在重复可见光照射后,血液血清素会增加。101 健康男性的颈静脉血样显示,冬季大脑中血清素的周转率最低,并且与明亮阳光的持续时间直接相关。
通过该程序测量的血清素的产生随着亮度的增加而迅速增加。无论一年中的什么时间,在明亮的日子里,血清素水平都较高,并且血清素的含量反映了特定一天暴露在阳光下的时间——前一天的条件没有影响。在一组有季节性情感障碍病史的患者中,测量到的血浆生物蝶呤和色氨酸水平显著降低,而光疗后则升高。
蓝光可有效增加叶绿体光合作用过程中色氨酸的吸收,并且这种光可有效治疗患有季节性情感障碍的患者。正如植物叶绿体系统所提到的,在人类研究中蓝光可能是最有效的。蓝光可以抑制褪黑激素水平并有助于昼夜节律相移。当使用窄带蓝光(468nm)时,光疗法可有效显著减少 HAMD21。
有人提议,应根据有关光的神经生物学效应的新知识重新评估家庭和工作场所的照明标准。这可能被认为是一个社会为实现有利于增强普通人群血清素功能的条件而采取的第一步,也是对血清素与阳光的特殊关系的承认,这种特殊关系在地球生命之初就开始出现。
外周血清素在调节肠道感觉、运动、肠腺分泌、维持肠道平衡等方面发挥着重要作用,健康状态下它不会穿过血脑屏障,影响中枢神经系统。
在人类肠道中,内皮细胞充当肠道内容物的传感器。在乙酰胆碱、腔内压力升高、低pH等一定刺激下, 肠嗜铬细胞(ECs)释放5-HT,激活肠壁内源性感觉神经元,引起肠内分泌反射和蠕动,而外源性神经元则也可被5-HT激活,引起疼痛、不适、恶心和呕吐。
血清素的分泌增加会导致肠道产生不适症状
当肠道受到刺激时,5-HT增加并与外源性初级传入神经末梢的5-HT 3受体结合,使肠神经系统(ENS)和内脏传入神经高度敏感,从而产生不适、腹痛、和腹泻。还有报道称,IBS-D 患者肠粘膜中的5-HT 和 5-HT 3受体显著高于健康对照者,表明 IBS 患者的 5-HT 系统受损。
在胃肠道中,血清素会引发恶心、肠道分泌和蠕动等反应,并且还与肠易激综合征等胃肠疾病有关。
例如,阿洛司琼(一种 5-HT 3拮抗剂)被证明可有效治疗伴有腹泻的IBS,而替加色罗(一种 5-HT 4激动剂)可有效治疗伴有便秘和慢性便秘的 IBS。5-HT 3拮抗剂阻断肠嗜铬细胞释放的 5-HT 对肌间神经丛固有初级传入神经元的影响,5-HT 4激动剂可引起蠕动反射。
这些作用机制可能涉及5-HT调节感觉神经传递和肠道反射运动。但这些药物的安全性存在问题,临床应用受限,需要进一步探索新的治疗靶标。此外,对肠嗜铬细胞5-HT作用的认识也需要重新审视。
5-羟色胺是一种肠神经系统生长因子
5-羟色胺(5-HT)不仅是肠神经系统(ENS)中的重要神经递质,也是ENS发育所需的关键生长因子。5-HT能够促进神经嵴源性前体细胞的分化和新神经元的生成,对ENS的出生后生长和维持至关重要。
缺乏神经元5-HT合成酶TPH2会导致ENS神经元数量显著降低,表明5-HT在ENS正常发育中的关键作用。此外,环境刺激可能通过改变5-HT能神经元的活动,从而对ENS的结构和功能产生持久影响,这为理解肠易激综合征等胃肠道功能障碍的发病机制提供了新线索。
血清素促进肠粘膜生长
肠神经元中的5-HT不仅影响肠粘膜的生长和维持,也影响ENS的生长和维持。缺乏5-HT再摄取转运蛋白SERT的小鼠,其肠粘膜生长和细胞增殖明显增强,因为SERT负责5-HT的失活。给予选择性5-HT再摄取抑制剂(SSRI)也会产生类似效果。这种作用主要是通过神经元5-HT而非肠嗜铬细胞5-HT介导的,因为删除TPH2(神经元5-HT合成酶)会减弱SERTKO小鼠的效果,而删除TPH1(肠嗜铬细胞5-HT合成酶)则不会。
5-HT 2A受体阻滞剂和乙酰胆碱拮抗剂都可以抑制SERTKO或SSRI增强肠粘膜生长的效果,表明这种作用是通过5-HT 2A受体介导的,而该受体主要表达在粘膜下胆碱能神经元上。这些神经元为上皮细胞提供神经支配,可能是促进粘膜干细胞/增殖细胞增殖的关键机制。
肠嗜铬细胞衍生的5-羟色胺与肠道炎症
缺失5-HT再摄取转运蛋白(SERT)会延长和增强粘膜中5-HT的作用,加重TNBS诱导的结肠炎和IL-10缺失相关的结肠炎。这是因为肠细胞通常表达SERT,缺失SERT会放大肠嗜铬细胞释放的5-HT的作用。
增强5-HT的作用会增强炎症,表明5-HT具有促炎作用。实验证实,这种促炎作用依赖于肠嗜铬细胞分泌的5-HT,因为缺失TPH1(肠嗜铬细胞5-HT合成酶)可以保护肠道免受炎症。
肠嗜铬细胞分泌的5-HT可以刺激树突状细胞上的5-HT 7受体,启动先天免疫反应,最终导致适应性免疫反应和肠道炎症。免疫系统的许多效应细胞也表达5-HT受体并对5-HT有反应。
相反,缺失TPH2(神经元5-HT合成酶)会增加炎症的严重程度,表明神经元5-HT具有抗炎作用,可能通过保护ENS免受炎症的神经毒性作用。
因此,5-HT在肠道中可以同时发挥”剑”(促炎)和”盾”(抗炎)的作用,其平衡对肠道健康非常关键。肠嗜铬细胞分泌的5-HT在肠道炎症发生和发展中起关键作用。
血清素受体及其在胃肠道中的功能
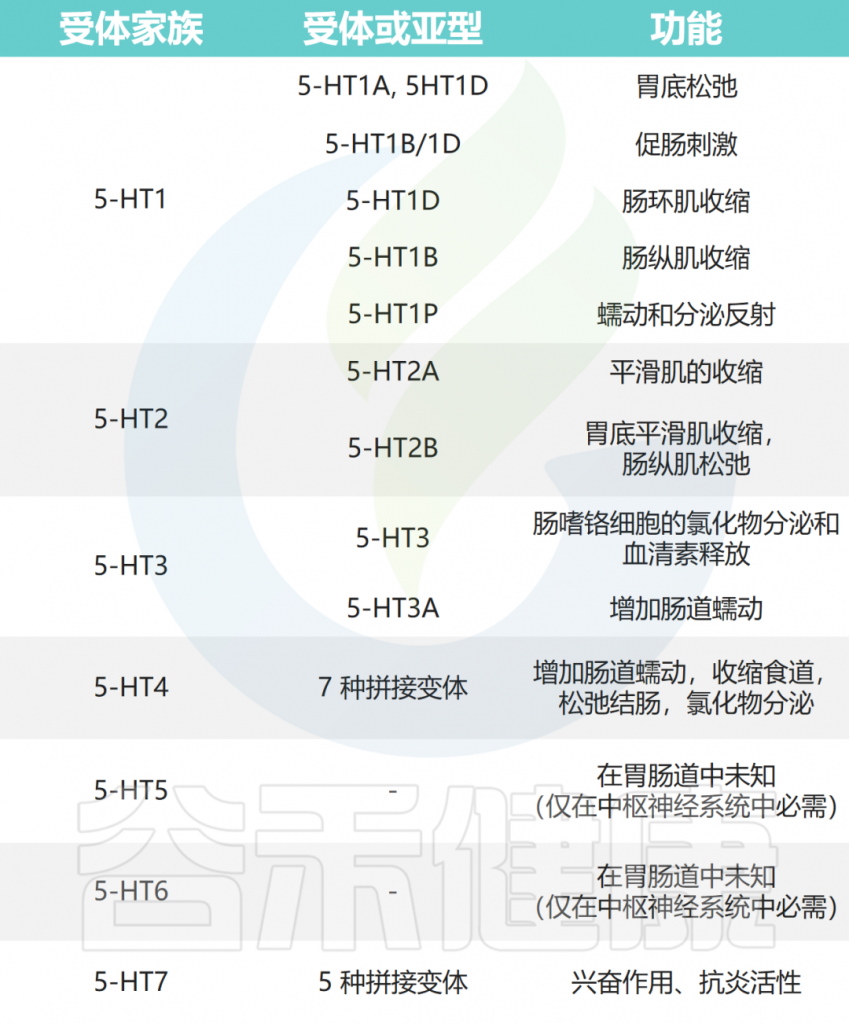
Guzel T and Mirowska-Guzel D.Molecules.2022
重点:血清素与肠脑轴
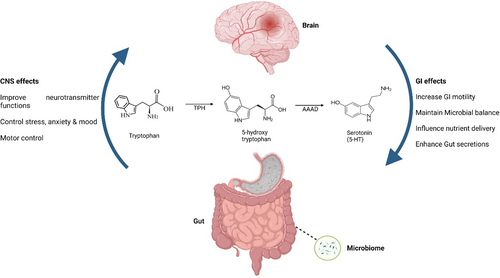
胃肠道和中枢神经系统通过称为脑肠轴的通讯途径连接。该路径允许信息双向流动。在这个网络的起点和终点,血清素作为神经递质发挥着关键作用
一项研究评估了Akkermansia muciniphila及其细胞外载体(EVs)对小鼠结肠和海马血清素能系统相关基因的影响,对Akkermansia muciniphila进行干预4周,观察结肠、海马和血清中的血清素水平通过ELISA测量小鼠以及人结肠癌细胞(Caco-2)的细胞活性。结果显示,通过肠-脑轴的血清素信号传导/代谢可能被考虑用于改善血清素相关疾病的新治疗策略。
在最近的一项研究中,衍生的齿双歧杆菌(B.dentium)已被用来调节哺乳动物的血清素能水平和肠脑轴,结果显示与齿状双歧杆菌相关的小鼠粪便中乙酸盐增加,研究结果表明齿状双歧杆菌和细菌代谢物乙酸盐是能够调节多个宿主组织中血清素能系统的关键组成部分,并与成人行为的功能变化相关。
下表显示了对益生菌补充剂通过肠-脑轴改善血清素信号传导的系统评价:

doi.org/10.1002/fsn3.3826
血清素被认为是一种重要的循环激素因子,它通过直接作用于心脏细胞或通过刺激心脏的化学敏感神经而与正常心血管功能有关。
类癌肿瘤患者血清素水平升高
类癌肿瘤(一种罕见的缓慢生长的癌症)患者心血管系统中的血清素活性水平升高,这与心律失常等某些症状有关,从而导致血流阻塞和瓣膜纤维增生。
类癌瘤又称类癌,是一组发生于胃肠道和其他器官嗜铬细胞的新生物,其临床、组织化学和生化特征可因其发生部位不同而异。此种肿瘤能分泌5-羟色胺(血清素)、激肽类、组织胺等生物学活性因子,引起血管运动障碍、胃肠症状、心脏和肺部病变等。
此外,据报道,暴露于显著升高的血清素水平(无论是由于高浓度的 5-HT 本身,还是用高水平的选择性血清素再摄取抑制剂 (SSRI) 处理)的小鼠胚胎在许多不同的部位都表现出异常生长。
血清素控制血管平滑肌的收缩
血清素被认为负责控制全身血管平滑肌细胞的收缩——这些肌肉细胞在整个循环系统中尤为突出,它们负责通过收缩或扩张血管来控制血流。据信,“S2”型血清素受体在这一功能中发挥着关键作用。
事实上,对血清素(5-HT)的一些最早的科学研究是由于它的血管收缩作用——通常直到后来它的其他生理和心理作用才变得明显。
例如,动物研究报告称,静脉注射血清素可以引起心血管系统的多种反应,导致血压升高或降低,具体取决于它在体内活跃的位置和时间。
血清素还可以通过其他“间接”机制来控制血压,例如通过放大其他血管活性物质(如NET、血管紧张素II和组胺)的反应。
血清素系统血清素(5-HT)是睡眠和清醒时大脑的关键调节剂/递质,中缝背侧(DR)和中缝(MR)是脑干的主要含5-HT核团,为前脑提供广泛的血清素能神经支配。这些中缝核涉及多种高阶功能,尤其是睡眠和意识。
血清素可用于调节睡眠和清醒
中缝背侧和中缝与脑干、下丘脑、视前区以及对清醒和睡眠至关重要的皮质结构具有相互联系。虽然血清素能DR/MR细胞的电生理学特性表明其在唤醒/觉醒中发挥作用,但血清素能传递的多样性(部分与5-HT受体的异质性相关)表明5-HT也可用于调节睡眠。
现在新出现的证据表明,5-HT DR 神经元是复杂神经回路的关键组成部分,其中(1)DR对前脑发挥兴奋作用,部分由来自外侧下丘脑的食欲素输入驱动;(2)DR在清醒时抑制腹外侧视前区(VLPO)的睡眠活跃神经元;(3)DR 与对睡眠压力做出反应的神经元相互作用,因此与腺苷一起,可以通过VLPO 神经元亚群的 5-HT 兴奋将生物体从清醒状态转变为NREM 状态;(4)DR/MR 在快速眼动(REM)睡眠中发挥着许可作用,因为它们在REM期间的虚拟沉默会抑制REM活跃神经元,从而触发REM睡眠状态。
血清素受体已在所有主要类型的骨细胞(成骨细胞、骨细胞和破骨细胞)中被发现。最近的数据表明,肠道来源的血清素可能介导低密度脂蛋白(LDL)受体相关蛋白的骨骼效应。
一些证据表明,使用SSRI(选择性血清素再摄取抑制剂)(可增加全身血清素水平)可能与骨量减少、骨质流失增加和骨折风险增加有关。
血清素过高会导致骨量减少、骨质流失增加
LRP5(LDL受体相关蛋白5)在成骨细胞和肠嗜铬细胞中表达,是Wnt信号的辅助受体。LRP5抑制肠嗜铬细胞中色氨酸羟化酶(TPH1)的表达,从而降低5-HT的分泌,导致血液和血小板中5-HT水平下降。
成骨细胞表达5-HT 1B受体,可直接响应循环中的5-HT,抑制成骨细胞增殖。因此,肠嗜铬细胞5-HT生物合成的降低,最终导致成骨细胞增殖增加,骨量增加。
而抑制肠道TPH1可增加骨量,说明使用不穿过血脑屏障的外周TPH抑制剂可能是一种治疗骨质疏松症的有效方法。
注:与外周5-HT的促骨作用不同,中枢5-HT通过抑制交感神经活动而抑制骨量增长。
总之,肠嗜铬细胞分泌的5-HT具有内分泌激素的作用,在调节骨代谢中发挥重要作用。这为开发新的治疗骨疾病的靶向药物提供了新思路。
除了对骨骼代谢的影响,肠嗜铬细胞分泌到血液中的5-HT还对肝脏再生产生作用。
在肝脏中,5-HT作为一种生长因子,可促进部分肝切除后的肝脏再生。肝脏再生的能力与血小板携带5-HT的数量直接相关。
血清素有助于推动肝脏再生
5-HT可激活肝细胞表面的5-HT2受体,从而促进肝细胞的增殖和DNA合成,推动肝脏再生。
缺乏色氨酸羟化酶1(TPH1)的小鼠,其肝脏再生能力受损,证实了肠嗜铬细胞来源的5-HT在这一过程中的关键作用。
总之,肠嗜铬细胞分泌的5-HT通过激活肝细胞上的受体,发挥了促进肝脏再生的内分泌功能。这为利用5-HT调节肝脏损伤后的再生提供了新的治疗思路。
禁食期间,内源性葡萄糖产生和脂肪分解增加,而葡萄糖摄取降低。这由激素(胰岛素、胰高血糖素等)和自主神经系统协调调节。
进食后,代谢转向合成代谢状态,胰岛素增加抑制内源性葡萄糖产生,促进肌肉和脂肪组织的葡萄糖摄取。
血清素可以提高胰岛素敏感性
下丘脑、脑干和皮质边缘区域参与葡萄糖感应,形成复杂的神经元网络,调节机体能量代谢。5-HT可通过中枢和外周机制影响葡萄糖代谢,包括调节胰岛素和胰高血糖素分泌。
5-HT1D和5-HT2A受体介导的作用可抑制胰高血糖素分泌,从而改善高血糖。5-HT可通过促进肌肉葡萄糖摄取和糖原合成来提高胰岛素敏感性。
此外,胰腺β细胞具有合成5-HT的机制,因为人类胰岛中存在编码关键酶色氨酸羟化酶(TPH)和芳香族氨基酸脱羧酶(AADC)的基因。
血清素会减少胰高血糖素分泌
5-HT1D和5-HT2A受体亚型也存在于胰腺α细胞中,表明5-HT在胰高血糖素分泌中发挥着额外作用。事实上,在人类胰岛中,研究表明5-HT会减少胰高血糖素分泌。
在体内,5-HT1D受体激动剂舒马普坦降低了人体胰高血糖素水平。从机制上讲,葡萄糖诱导邻近β细胞分泌5-HT,通过5-HT1F 受体降低α细胞中的环 AMP水平,并抑制胰高血糖素分泌。
与此一致,5-HT1F 受体的药理学激活减少了糖尿病小鼠的胰高血糖素分泌和血浆葡萄糖。据推测,α细胞的血清素控制受损可导致高胰高血糖素血症,从而导致高血糖。因此,5-HT1F 受体激动剂可能是治疗糖尿病等高血糖疾病的一种有前途的治疗方法。
5-羟色氨酸(5-HTP)被认为与主要饮食失调(例如厌食症)相关的许多心理和行为症状有关。由于这些原因,一些研究人员建议补充色氨酸可能有潜力治疗厌食症。
色氨酸是血清素的前体,也是一种只能在饮食中获得的必需氨基酸,因此,过度的饮食限制可能会导致大脑5-HT储存减少。血清素作用于多个大脑部位来调节进食行为,包括脑干中的多个核团、下丘脑亚区域(例如弓状核和室旁核)以及中皮质边缘多巴胺系统。
血清素调节饱腹感从而影响食欲
血清素和含下丘脑肽的细胞之间以及与缩胆囊素和其他肽之间存在重要的相互作用。血清素在行为水平上具有多种影响,其范围从调节短期饱腹感和饱足感以响应胃扩张和肠道营养素的存在,到调节奖赏和由条件线索引起的行为反应。
对血清素系统在控制食欲和摄食中的作用的大部分了解是从20世纪70年代到90年代初使用血清素释放剂和再摄取抑制剂芬氟拉明进行的研究中发展起来的,最初使用外消旋dl-芬氟拉明,后来使用更有效的异构体d-芬氟拉明。事实上,直到1997年,芬氟拉明因与瓣膜性心脏病相关而被撤回作为抗肥胖治疗药物,它一直是研究支持食物摄入和饱腹感的血清素机制的典型化合物。
d-芬氟拉明通过增加这些受体的5-HT可用性来间接减少食物消耗,而不是直接刺激突触后受体。然而,在大鼠中证明,d-芬氟拉明在服用一定剂量后仍然能够减少食物摄入量,并阻断 d-芬氟拉明增加下丘脑内侧区域 5-HT 传输的能力。这些发现清楚地表明d-芬氟拉明对5-HT受体有直接作用。
细胞外血清素水平升高通常会导致食物摄入量
减少,反之亦然
大脑中血清素能神经元的活动增强通常会导致食物摄入量减少和体重减轻,但也有其他研究报告了一些例外情况。据推测,大脑中5-HT容量传输通常会减少食物摄入量,因为一方面,5-HT水平升高会引起吞咽不足,另一方面,5-HT水平降低会导致食物摄入量增加,即食欲亢进。
事实上,通过脑血管内注射5,7-二羟色胺(血清素能神经元的神经毒素)或对氯苯丙氨酸(通过抑制5-羟色氨酸羟化酶减少5-HT合成)诱导的5-HT 水平降低,可诱导喂食大鼠的食欲亢进。
一些研究人员指出,某些神经元群释放到大脑中的血清素量似乎很大程度上取决于食物摄入量。这导致了这样的假设:血清素系统可能在食欲和饮食行为的调节中发挥着至关重要的作用——尽管这种潜在功能的确切性质尚不完全清楚。
在大脑中,自主神经和随意神经系统中的血清素能系统会导致饮食不足和过量。
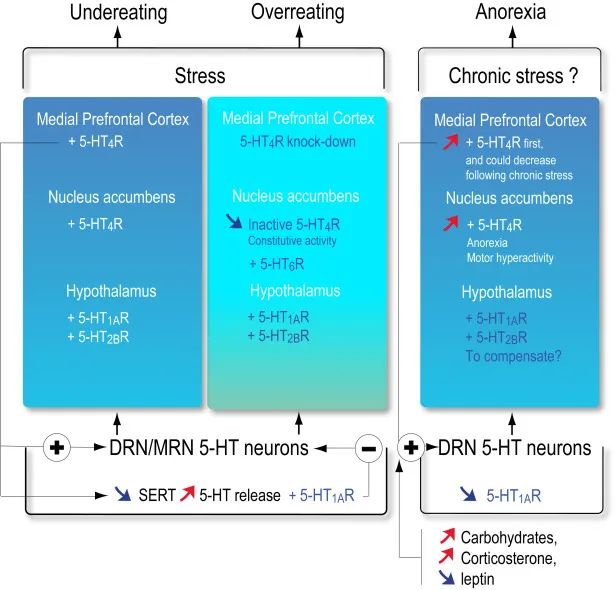
doi.org/10.1016/B978-0-444-64125-0.00028-1
药理学和遗传学之间的合作关系:特定血清素受体有助于减少和增加食物摄入量
大量药理学研究,无论是否结合使用 5-HTR KO 小鼠,收集的证据表明5-HT容量传输通常有助于减少食物摄入通过大脑特定区域的特定 5-HTR,破译了饮食行为的一些细胞内基础。
一些初步证据表明,碳水化合物的摄入尤其可能会影响血清素——可能是通过与胰岛素分泌相关的机制发挥作用。其他大量营养素,例如蛋白质,似乎没有这种作用,这表明这种作用可能特定于某些类型的营养素或食物。
血清素调节外周其他激素进而影响能量代谢
现在越来越多的证据表明外周血清素作为一种能够调节外周代谢的激素具有明显的作用。与经典的禁食激素胰高血糖素类似,由于肠道Tph1表达上调,循环 5-HT 因禁食而显著升高。禁食期间,5-HT 有效促进脂肪细胞的脂解作用,从而为肝糖异生提供底物,而5-HT也显著上调这一过程。
另一方面,肠道来源的5-HT还可以通过降低敏感性激素的激活,抑制白色脂肪组织的褐变和棕色脂肪组织的产热过程,从而有效地减少能量消耗。并减少负责产热的解偶联蛋白1的表达。因此,肠道来源的 5-HT 通过增加短期能量可用性和促进长期能量保存,在驱动对营养缺乏的多种生理适应方面发挥着关键作用。
矛盾的是,在肥胖条件下,循环5-HT水平也会升高。肥胖人类和啮齿动物高脂肪饮食后,循环和肠道来源的5-HT水平会升高。外周 5-HT 调节胰岛中葡萄糖刺激的胰岛素分泌,高脂饮食导致外周5-HT水平增加,通过肝脏中脂肪储存的增加导致肝脂肪变性。
肠道5-HT的药理学或遗传减少可预防饮食引起的肥胖、肝脂肪变性和葡萄糖不耐受,说明肠道来源的5-HT升高在驱动代谢功能障碍中的致病作用。在人类肥胖中,EC细胞的密度和TPH1的表达都会增加 ,但驱动这种变化的机制仍然未知。
先前的文献表明,5-HT及其受体升高可能作为一种有效的营养物质、促有丝分裂和抗凋亡因子,然而还可能促进致癌进展。文献进一步证明5-HT受体在许多癌症类型中表达,包括结直肠癌(CRC)、胰腺癌、肝细胞癌(HCC)、乳腺癌、肺癌和前列腺癌,它们促进肿瘤细胞的生长和存活。
多种肿瘤中血清素水平较高
较高的全身5-HT水平存在于多种肿瘤中,并且与肿瘤复发和不良生存密切相关 。肿瘤细胞和正常细胞对5-HT刺激有不同的反应。 5-HT促进CRC细胞增殖,但不增加正常结肠隐窝细胞的有丝分裂率。正常结肠隐窝的增殖受到自主神经和内分泌调节,而结肠癌细胞的分裂仅需要内分泌信号传导。
在人胆管癌组织中,TPH1表达增加和MAOA表达减少促进5-HT的分泌。通过抑制5-HT1A、2A、2B、4和6或TPH1可以特异性逆转分泌。
血清素水平会影响肿瘤血管生长
5-HT也是肿瘤血管生成中有效的血管生成因子。低浓度的5-HT在体外可诱导内皮细胞增殖、迁移和管形成,体内血管生成通过5-羟色胺受体依赖于TR3/Nur77,而与血管内皮生长因子A(VEGF-A)无关。人体内大部分5-HT储存在血小板中。在肿瘤微环境中,血小板聚集导致5-HT大量释放,促进肿瘤微血管的形成。
此外,5-HT阳性细胞的存在与较高的微血管密度和VEGF表达相关。在肿瘤发生过程中,肿瘤微环境中 VEGF(一种血管生成介质)的释放促进了血管生长的增加和异常血管重塑。
在TPH缺陷小鼠的结肠癌同种异体移植物中,与野生型小鼠相比,微血管密度降低。TPH 缺陷小鼠中 VEGF 和 VEGFR2 的表达相似,但基质金属蛋白酶12 (MMP-12) 和血管抑制素的表达较高。
MMP-12可以将纤溶酶原裂解成血管抑制素,血管抑制素是一种内源性血管生成抑制剂。小鼠的肺癌和黑色素瘤的同种异体移植物也比野生型小鼠小,这可能是由于eNOS浓度降低(导致血管舒张)以及肿瘤生长的血液补充不足所致。然而,有研究报道5-HT作为血管收缩剂,可以通过选择性地收缩肿瘤小动脉来抑制结肠癌的生长。
近年来,5-HT与肿瘤浸润免疫细胞之间的关系也被揭示。例如,5-HT通过激活5-HTR来抑制TNF-α和IL-1β的释放。在单核细胞/巨噬细胞中,5-HT调节细胞因子的分泌并介导中性粒细胞募集和T细胞激活。
与身体和大脑中的其他生物活性物质一样,血清素水平需要精心平衡,以维持整体健康的最佳状态。
但是人们常常错误地认为“更多”总是“更好”,而事实并非如此!举例来说,血清素水平升高可能导致血清素综合症,这是一种可能致命的严重疾病。
此外,血清素水平升高有时会使其他已有疾病(例如强迫症)的症状恶化。
血清素综合症是由于药物、补充剂或草药的组合导致血清素升高至不安全水平而引起的。它可能导致意识混乱、发烧、不自主的肌肉痉挛、癫痫发作甚至死亡。虽然有点罕见,但血清素综合症是一种严重的疾病,任何食用改变血清素水平的产品的人都应该意识到这一病症。
▸ 什么是血清素综合症?
当人的系统中血清素过多时,就会出现血清素综合症——无论是由于过量服用一种药物,还是由于组合使用多种药物来增加血清素水平。这可能非常危险,并会导致许多严重的并发症,从轻度(意识模糊、腹泻、颤抖)到严重(谵妄、癫痫发作、昏迷)。
尽管有些人可能更容易患血清素综合症,并且严重程度可能有所不同,但任何血清素水平升高的人都会出现症状。即使服用一剂改变血清素的药物也可能导致血清素综合征。
警告:血清素综合症是一种潜在的致命疾病,需要紧急治疗。如果您使用过精神活性药物/草药/补充剂并注意到下述任何症状,请尽快寻求医疗帮助。
▸ 症状
由于血清素会激活全身的许多受体,因此血液中过量的血清素会产生广泛的影响。这些症状从轻微到危及生命不等。
大脑中血清素过多会导致:
困惑
搅动
对刺激的敏感性增加(高度警惕)
焦躁不安
焦虑
发烧
对心脏和血管的影响包括:
心率过快
血压飙升
通过作用于肠道,过量的血清素会导致 :
腹泻
恶心
呕吐
它还可能导致:
出汗过多
肌肉痉挛或肌张力增加
瞳孔扩张
发抖
震颤(有节奏的颤抖)
危及生命的症状包括:
谵妄
代谢性酸中毒
横纹肌溶解症(肌肉组织分解,释放有毒蛋白质)
体温极高(超过41°C)
昏迷
血清素综合征最明显的症状可能是重复的、不自主的肌肉收缩。
♢症状会持续多久?
症状通常在服用改变体内血清素水平的药物后6至8小时出现,并且症状非常严重。如果治疗得当,轻微症状通常会在24-72小时内消失,但可持续长达3天。更严重的病例需要住院治疗,并且可能需要更长的时间才能康复。
♢长期影响
血清素综合征症状的持续时间完全取决于违规药物在您的系统中停留的时间。一旦治疗得当,一般不会产生长期影响。然而,如果不及时治疗,严重的血清素综合征可能会导致死亡。康复后,重新评估所有当前药物以防止血清素综合征再次发生非常重要。
▸ 血清素综合症的原因
影响血清素水平的多种药物和补充剂之间的相互作用是导致血清素综合征的最常见原因。
♢非处方药和处方药
1) 抗抑郁药和抗焦虑药
选择性5-羟色胺再摄取抑制剂(SSRI)、5-羟色胺-去甲肾上腺素再摄取抑制剂(SNRI)和三环类抗抑郁药(TCA)是治疗抑郁和焦虑的常用药物。它们通过延长大脑中血清素的活性来发挥作用。
最常与血清素综合征相关的抗抑郁药和抗焦虑药包括:
西酞普兰(Celexa)
艾司西酞普兰(Lexapro)
氟西汀(百忧解)
帕罗西汀(Paxil、Pexeva)
舍曲林(左洛复)
维拉佐酮(Viibryd)
氟伏沙明(Luvox)
文拉法辛(Effexor)
氯米帕明(Anafranil)
丙咪嗪(托法尼)
沃替西汀(Trintellix,Brintellix)
2) 单胺氧化酶抑制剂
单胺氧化酶抑制剂(MAOIs)是用于帮助治疗各种情绪障碍和帕金森病的药物。它们通过阻断单胺氧化酶发挥作用,单胺氧化酶会分解大脑中发现的几种神经递质,包括血清素。这会产生更多的血清素来作用于大脑。
滥用 MAOIs 或与其他增加血清素的药物联合使用可能会导致血清素综合征。这些包括但不限于:
司来吉兰
联非美烷
吗氯贝胺
吡林多(吡拉齐多)
托洛沙酮(胡莫酰)
利奈唑胺(Zyvox)
3) 抗生素
利奈唑胺是一种抗生素,常用于治疗对其他抗生素(如链球菌、VRE 和 MRSA)耐药的细菌感染。利奈唑胺还可以稍微阻断血清素的分解(通过阻断 MAO)。
4) 偏头痛药物(曲普坦类药物)
曲坦类药物通常是医生为中度至重度偏头痛患者开出的第一种药物。曲普坦类药物还会激活大脑中的血清素受体,并存在发生血清素综合征的风险,特别是与阿片类药物或抗抑郁药联合使用时。
他们包括:
阿莫曲坦(Axert)
那拉曲坦(Amerge)
利扎曲普坦(Maxalt)
舒马曲坦(Imitrex)
佐米曲普坦(佐米格)
5)阿片类药物
目前用于缓解疼痛的阿片类药物处方和阿片类药物滥用呈上升趋势。一些阿片类药物可以延长血清素的作用(通过阻止再摄取),从而导致大脑中产生更多的血清素。阿片类药物可引起血清素综合征,尤其是与其他改变血清素的药物联合使用时。
阿片类药物包括但不限于:
曲马多
哌替啶
美沙酮
芬太尼
吗啡
他喷他多
6) 丁螺环酮 (Buspar)
丁螺环酮通常用于改善焦虑,并与其他抗抑郁药联合治疗情绪障碍。它激活血清素受体。过量单独使用或与其他抗抑郁药联合使用可能会导致血清素中毒。
7) 治恶心药物
甲氧氯普胺 (Reglan) 通常用于治疗胃部问题,如胃灼热、恶心、呕吐和消化不良。据报道,有两例患者因联合服用甲氧氯普胺和抗抑郁药而导致血清素综合征。
任何与血清素受体相互作用的恶心药物都会增加血清素综合征的风险。示例包括:
格拉司琼(Kytril,Sancuso)
昂丹司琼(Zofran)
8) 右美沙芬
右美沙芬是一种止咳药,存在于许多非处方药中,例如 Robitussin、Delsym、NyQuil 和 Dimetapp。右美沙芬可以延长大脑中血清素的作用(阻止再摄取)。
在一份病例报告中,一名 63 岁的抑郁女性在服用右美沙芬-异丙嗪止咳糖浆与抗抑郁药艾司西酞普兰 (Lexapro) 组合两周后出现了血清素综合征 。
9) 过敏药物
在一项案例研究中,一名患者服用曲马多治疗颈部疼痛并联合苯海拉明治疗季节性过敏后出现血清素综合征。
♢草药和补品
1) 圣约翰草
圣约翰草是一种草药,几个世纪以来一直被用来治疗抑郁症,其疗效已得到临床证明。然而,圣约翰草可以与许多药物(包括 SSRI)产生负面相互作用,这些组合可能会导致血清素综合征。
2) S-腺苷-L-蛋氨酸 (SAM-e)
在多项试验中, SAMe改善了抑郁症状,也改善了对传统SSRI药物无反应的患者的抑郁症状。SAM- e可以显著提高血清素的产生,因此理论上,如果大剂量服用或与其他药物联合使用,可能会带来患血清素综合征的风险。
3) 人参
临床试验表明,人参可以降低更年期女性的抑郁症。它会增加大脑中的血清素(尤其是海马体),但是当大量服用或与影响血清素水平的其他药物联合使用时,会带来患血清素综合征的风险。
4) L-色氨酸
L-色氨酸直接增加血清素的产生。如果服用剂量过高,或与另一种增加血清素水平的药物(例如单胺氧化酶抑制剂,MAOI)联合使用,则存在发生血清素综合征的潜在风险。
♢食品
由食物引起的血清素综合症的可能性极小,因为以标准量摄入时,这些食物中的活性化合物含量相对较低。然而,重要的是要了解哪些食物有可能增加血清素水平,尤其是与血清素药物结合使用。
1)姜黄(姜黄素)
姜黄含有高含量的姜黄素,在临床试验中已被用于改善人类患者的情绪。在小鼠中,姜黄素会增加血清素水平,在服用其他增加血清素的药物时应谨慎使用。
2) 藏红花
在多项临床试验中,与服用SSRIs类似,藏红花可以减轻患者的抑郁症。对大鼠的研究表明,藏红花与血清素系统相互作用,因此它可能会影响血清素综合症 。
3)富含色氨酸的食物
当有血清素综合症的风险时,应避免食用色氨酸含量高的食物,因为色氨酸会直接增加血清素的产生。这些包括火鸡、鸡肉、大豆、鸡蛋、南瓜子、花生和一些奶酪。
一些精神疾病——例如抑郁症,与大脑中异常的血清素活动有关。由于这些联系,研究人员非常关注研究针对血清素系统的不同方法(通常是为了提高血清素的水平或整体活性)。
最著名和最广泛使用的抑郁症治疗方法之一,选择性血清素再摄取抑制剂(SSRI)可显著增加整个大脑的血清素水平(具体来说,通过防止神经元突触“清除”血清素,从而使其对整体大脑活动产生更持久、更强的影响)。
然而,SSRIs仍然有几个相当大的缺点。其一,许多抑郁症患者对此没有成功的反应。其次,即使对这些药物治疗有反应的患者,SSRIs 也经常会引起许多明显的副作用,包括恶心、皮肤反应、体重增加、睡眠障碍和性功能障碍。此外,来自动物研究的一些初步证据表明,长期使用 SSRI 可能会加重潜在的血清素缺乏症。
由于这些原因,一些人不愿意依赖药物治疗,而更愿意尝试非化学治疗。
在下面的部分中,我们将讨论一些已提出的可能增加血清素水平或活动的各种生活方式、饮食和基于补充剂的方法。然而,请记住,这些背后的科学大多仍处于初步阶段,并且这些生活方式策略或补充剂均未获得正式批准用于治疗抑郁症或任何其他精神或医疗状况。
这些只是补充方法,这意味着虽然它们可能有助于支持和增强传统治疗的有效性,但仅靠它们可能还不够。与往常一样,在采取本文讨论的任何“补充”策略之前,请务必先与你的医生讨论任何重大的生活方式、饮食或其他变化!
▸ 生活方式和行为因素
已经确定了几种可能影响大脑中血清素系统的行为方法和其他生活方式因素。
1)锻炼
锻炼对生理和心理健康有多种显着益处,包括提高血清素水平和对整体情绪产生积极影响。
例如,一些人类研究报告称,从事有氧运动会导致大脑血清素水平增加,并且如果保持良好的运动习惯,这种增加可能会持久。
如果可能的话,户外锻炼可能会更有益。例如,阳光照射与血清素水平升高有关,这反过来又可能转化为整体情绪的改善。
2)积极情绪诱导
一些证据表明,像听积极的音乐这样简单的事情,或参与其他愉快的经历,如在大自然中散步,可能会对大脑的血清素水平产生影响。
一项针对20名健康受试者的研究报告称,听愉快的音乐可以短期提高他们的血清素水平,并改善他们的情绪。此外,参加自然散步、冥想和按摩等有趣的活动都可能对血清素水平和整体情绪产生潜在的有益影响。
然而,值得注意的是,这些“情绪诱导”效应也可能产生相反的效果:例如,据报道,听“消极”或“不愉快”的音乐和其他刺激会降低人的情绪。
3)社交互动
一些证据还表明,积极的社交互动也可能对血清素水平和情绪产生潜在的有益影响。
例如,据报道,一个人经历的积极的面对面社交互动的数量与血清素水平有很强的相关性。
4)健康的睡眠习惯
毫不奇怪,睡眠对于大脑和整体心理健康非常重要。据报道,拥有健康且均衡的睡眠时间表对于维持整个大脑的血清素平衡非常重要。据信,造成这种情况的至少部分原因是大脑在睡眠期间产生并释放大量的血清素。
相反,睡眠不足会使血清素受体“脱敏”。反过来,这可能会扰乱大脑血清素系统的整体活动——睡眠不足甚至与抑郁症可能性增加有关。
▸ 饮食因素和补充剂
除了上述一些与生活方式相关的和其他“基于行为”的技术之外,研究人员还确定了许多饮食因素和基于补充剂的方法,它们也可能对一个人的血清素总体水平产生影响。
然而,值得注意的是,这些补充剂的功效仍然“没有足够的证据”,并且需要在健康人群中进行更多的后续研究来证实它们的效果。与往常一样,请务必先与您的医生讨论任何饮食改变或新的补充剂,因为这是避免与其他生活方式或健康相关因素发生任何潜在负面相互作用的最佳方法。
考虑到所有这些要点,研究表明以下一些补充剂可能有助于增加血清素并支持情绪平衡。
1) L-色氨酸和5-HTP
在体内,血清素是由5-HTP制成的,而5-HTP是由L-色氨酸制成的。因此,从理论上讲,增加这些“组成部分”(代谢前体)中的任何一个的水平都可以导致血清素总体水平的增加。
有限的研究表明,服用 L-色氨酸可能会提高血浆血清素水平,并可能改善缺乏血清素的人的某些认知、运动或肠道问题。
2)益生菌
在消化道中,益生菌恢复肠道微生物组并影响肠脑轴。肠道细菌的重要性之一是因为它们产生大量的色氨酸,而色氨酸是用来制造血清素的。一些研究表明,帕金森病等神经系统疾病与肠道细菌多样性较低或较少有关。
根据一项研究,据报道,为期8周的益生菌疗法(2.0×10^9 CFU/g瑞士乳杆菌和2.0×10^9 CFU/g长双歧杆菌)可增加110名抑郁症患者的色氨酸水平。理论上,增加色氨酸可以增加血清素的产生。
同样,一项动物研究报告称,给予大鼠14天的益生菌(婴儿双歧杆菌)可提高血液色氨酸水平。
3)维生素D
维生素D有助于身体(包括大脑)制造、释放和使用血清素。然而,补充剂的益处尚不确定。
维生素D会激活一种酶,将色氨酸转化为血清素。因此,增加维生素D的摄入量可能会增加血清素水平,从而有可能支持心理健康。
4) Omega-3 脂肪酸
虽然维生素D有助于神经元产生血清素,但omega-3多不饱和脂肪酸 EPA(二十碳五烯酸)、DHA(二十二碳六烯酸)和ALA(α-亚麻酸)可能有助于神经元释放血清素,并提高其整体活性(例如例如通过增加血清素受体的敏感性)。
在一项针对大鼠的动物研究中,低水平的omega-3脂肪酸——特别是α-亚麻酸(ALA)——与较低的血清素活性有关。相关地,DHA缺乏与仔猪大脑血清素水平降低有关。
在另一项动物研究中,几组怀孕的老鼠被喂食缺乏或富含α-亚麻酸的饮食。研究发现,与富含ALA饮食的大鼠相比,缺乏ALA饮食的大鼠前额叶皮层中的血清素水平降低了 65%,这进一步表明 omega-3 脂肪酸与血清素水平及整体健康之间存在潜在联系。
5) B族维生素
身体需要维生素B6来从其前体(例如5-HTP)产生血清素(具体而言,维生素B充当酶辅因子)。此外,维生素B12和叶酸(维生素B9)都是叶酸循环所必需的,叶酸循环有助于将色氨酸转化为血清素。
几种不同的B族维生素(包括B6、B9和B12)被认为对于血清素的产生和释放至关重要。在一些初步研究中,维生素缺乏症与认知结果不佳有关,尽管补充这些维生素是否对健康人类使用者具有直接的心理健康益处尚未完全确定。
6) 锌
根据一些早期研究,一些科学家认为锌可能靶向并激活血清素受体。根据对17项观察性研究数据的一项荟萃分析,据报道,与非抑郁个体相比,抑郁个体的血锌水平较低,这可能暗示了血清素相关机制。
另一项针对37名重度抑郁症患者的研究显示,连续12周每天补充25毫克锌可减轻抑郁症状。除了直接补充外,膳食锌还可以通过红肉、牡蛎、螃蟹、全谷物等几种常见食物获得。
7) 镁
研究人员推测,镁补充剂可能会通过增加大脑中血清素的可用性(减少再摄取)来提高血清素水平。
例如,根据一项初步研究,60名被诊断为轻度至中度抑郁症的患者每天补充500毫克镁(氯化镁)8周,可显著改善抑郁症状。据报道,这种镁治疗对焦虑症状也有显著的效果。
8) 肌醇
来自细胞和动物研究的一些早期证据表明,“类维生素”化合物肌醇可能会增加血清素受体的敏感性 。
由于其与大脑血清素系统的相互作用,一些研究人员提出,肌醇的作用可能类似于常见的血清素靶向抗抑郁药物(例如选择性血清素再摄取抑制剂 SSRI)。
根据一项针对30名患有经前综合症相关情绪障碍症状的女性的研究,据报道,在六个月经周期(约6个月)内使用肌醇治疗可减轻情绪症状并改善整体情绪。
虽然其中一些早期发现很有希望,但仍需要更多的研究来证实这些对人类的影响。
中枢血清素功能障碍与多种临床疾病的焦虑感、威胁感和不安全感增加有关。患有重度抑郁症和酒精依赖的患者中,焦虑与血清素转运蛋白可用性降低直接相关。由于威胁感和不安全感与特定性别的行为模式和荷尔蒙调节相互作用,冲动攻击可能是血清素能功能障碍的次要相关因素。在强迫症中,血清素周转率的增加而不是减少可能会干扰丘脑“噪声过滤器”和逆转学习期间的眶额功能,从而导致额-纹状体-丘脑神经回路过度激活和行为不灵活。
血清素功能障碍可能是由发育早期的社会压力因素引起的,并且似乎可以调节青少年和成年人以及非人类灵长类动物对压力和镇静药物。第一项表观遗传学研究表明,DNA 甲基化的改变可能导致五羟色胺转运蛋白基因(5-HTT) mRNA 转录减少,从而减少中枢血清素转运蛋白的表达。血清素系统的药物遗传学还需要考虑各种基因,尤其是 5-HTT、色氨酸羟化酶 2(TPH2)和A 型单胺氧化酶(MAO-A) 的基因,所有这些基因证明了功能上重要的多态性,并且发现或可能影响血清素的突触活性。这些超出了本章的范围,尽管读者需要记住它们与此处描述的血清素受体药物遗传学相互作用的潜力。
注意,血清素只是神经递质“单胺”家族的一员,该家族还包括其他主要神经递质,如去甲肾上腺素和多巴胺。研究人员目前认为所有这些神经递质共同作用来影响和调节情绪和神经疾病。
身体的所有细胞和器官,尤其是大脑,都受到血清素系统的影响。阳光的作用可能是帮助维持身心平衡。这与血清素参与人类体内平衡的观点是一致的并有助于心智的出现。
通过总结发现5-HT和其他系统建立的串扰对于每个系统都是特定的。这意味着药物作用机制的精确确定是极其复杂的,但它也代表了一个令人难以置信的来源,可以从中汲取灵感,为中枢神经系统疾病开发新的治疗策略。
主要参考文献:
Müller, C. P., & Cunningham, K. A. (Eds.). (2020). Handbook of the Behavioral Neurobiology of Serotonin. Volume 31.
Liu N, Sun S, Wang P, Sun Y, Hu Q, Wang X. The Mechanism of Secretion and Metabolism of Gut-Derived 5-Hydroxytryptamine. Int J Mol Sci. 2021 Jul 25;22(15):7931.
Li H, Wang P, Zhou Y, Zhao F, Gao X, Wu C, Wu T, Jiang L, Zhang D. Correlation between intestinal microbiotal imbalance and 5-HT metabolism, immune inflammation in chronic unpredictable mild stress male rats. Genes Brain Behav. 2022 Jul;21(6):e12806.
Kwon YH, Wang H, Denou E, Ghia JE, Rossi L, Fontes ME, Bernier SP, Shajib MS, Banskota S, Collins SM, Surette MG, Khan WI. Modulation of Gut Microbiota Composition by Serotonin Signaling Influences Intestinal Immune Response and Susceptibility to Colitis. Cell Mol Gastroenterol Hepatol. 2019;7(4):709-728.
Yano JM, Yu K, Donaldson GP, Shastri GG, Ann P, Ma L, Nagler CR, Ismagilov RF, Mazmanian SK, Hsiao EY. Indigenous bacteria from the gut microbiota regulate host serotonin biosynthesis. Cell. 2015 Apr 9;161(2):264-76.
Wu L, Ran L, Wu Y, Liang M, Zeng J, Ke F, Wang F, Yang J, Lao X, Liu L, Wang Q, Gao X. Oral Administration of 5-Hydroxytryptophan Restores Gut Microbiota Dysbiosis in a Mouse Model of Depression. Front Microbiol. 2022 Apr 28;13:864571.
Haq S, Wang H, Grondin J, Banskota S, Marshall JK, Khan II, Chauhan U, Cote F, Kwon YH, Philpott D, Brumell JH, Surette M, Steinberg GR, Khan WI. Disruption of autophagy by increased 5-HT alters gut microbiota and enhances susceptibility to experimental colitis and Crohn’s disease. Sci Adv. 2021 Nov 5;7(45):eabi6442.
Akram N, Faisal Z, Irfan R, Shah YA, Batool SA, Zahid T, Zulfiqar A, Fatima A, Jahan Q, Tariq H, Saeed F, Ahmed A, Asghar A, Ateeq H, Afzaal M, Khan MR. Exploring the serotonin-probiotics-gut health axis: A review of current evidence and potential mechanisms. Food Sci Nutr. 2023 Dec 7;12(2):694-706.
Guzel T and Mirowska-Guzel D. The Role of Serotonin Neurotransmission in Gastrointestinal Tract and Pharmacotherapy. Molecules. 2022 Mar 3;27(5):1680.
Kwon YH, Khan WI. Peripheral serotonin: cultivating companionship with gut microbiota in intestinal homeostasis. Am J Physiol Cell Physiol. 2022 Aug 1;323(2):C550-C555.

谷禾健康

肠道微生物群在食物消化、免疫激活和肠道内分泌信号通路的调节中扮演关键角色。同时,它们通过产生特定的代谢化合物与中枢神经系统(CNS)及身体其他部位进行密切交流。
这些代谢物包括次级胆汁酸、短链脂肪酸(SCFAs)、谷氨酸(Glu)、γ-氨基丁酸(GABA)、多巴胺(DA)、肾上腺素、吲哚、血清素(5-HT)和组胺等神经递质以及其他重要信号分子。
这些神经递质和主要菌群代谢物对肠道微生物及人体健康有着深远的影响。肠道细菌主要利用GABA、多巴胺、谷氨酸、血清素和组胺等神经递质,以及短链脂肪酸、色氨酸和次级胆汁酸等菌群代谢产物,与中枢神经系统进行双向通讯。这些信号分子通过传入迷走神经纤维传输到大脑,大脑则通过传出的迷走神经纤维将信号发送回肠壁中的肠神经细胞和粘膜免疫系统。下丘脑-垂体-肾上腺轴(HPA轴)也参与了这一复杂的信号调控网络。
这些神经递质和菌群代谢物的协调作用,对维持肠道生态平衡和免疫稳态至关重要。一旦出现失衡,就可能导致主要胃肠道疾病,甚至影响神经系统功能,引发神经退行性疾病。
相应的,通过对肠道菌群的分析和前期构建的研发数据队列,我们可以评估出血清中神经递质和菌群代谢产物的水平情况。因为肠道这些指标可以反映肠道微生物在神经递质代谢和信号传递中的作用,从而为评估个体的神经功能和代谢状态提供重要线索。
谷禾健康肠道菌群检测报告新增了这方面的相关指标,本文总结和解读这些神经递质及肠道菌群代谢物,并总结了含量过高和过低对人体健康的影响和一些饮食生活和药物干预措施。

编辑
细菌具有许多不同的代谢方式。一些细菌只需要二氧化碳作为它们的碳源,被称作自养生物。另外一些细菌依靠有机物形式的碳作为碳源,称为异养生物。而人体的肠道微生物群主要就是异养生物,他们通过消化膳食成分和其他人体内的物质来获取营养,从而维持它们的生存和繁殖。这些微生物对于人体健康至关重要。
肠道菌群是宿主消化的关键组成部分,分解复杂的碳水化合物,蛋白质,并且在较小程度上分解到达下胃肠道的脂肪。该过程产生大量微生物代谢物,其可以局部和全身起作用(在被吸收到血流中之后)。这些途径都可以产生潜在有益和潜在毒性的代谢物。
// 肠道菌群将膳食成分转化为各种代谢物
例如细菌可以将多糖、蛋白质、脂肪等大分子营养物质分解为单糖、小肽或氨基酸等,进而产生短链脂肪酸、次级胆汁酸、吲哚、苯酚、硫化氢、谷氨酸、组胺等物质。
细菌除了在分解和合成代谢中能产生多种代谢产物,还被证明可以产生或消耗多种神经递质,包括多巴胺、去甲肾上腺素、血清素或γ-氨基丁酸 (GABA)等。多项的研究证据表明,细菌对这些神经递质的操纵会对宿主的生理及健康产生影响。
注:初步的人体研究还表明,基于微生物群的干预也可以改变神经递质水平。
那么胃肠道与大脑、神经系统甚至全身其他器官是如何相互联系的呢?肠脑轴(Gut-Brain Axis)被称为肠-脑轴或肠道-大脑轴,指的是肠道和大脑之间存在着复杂的相互关系和通讯机制。
// 大部分信号通过双向迷走神经传递
大多数进出肠道的信号都通过双向迷走神经传输,该双向迷走神经在延髓处离开大脑,并在颈静脉孔处离开头骨。颈部迷走神经与控制吞咽和言语的咽喉肌肉通信,胸部迷走神经可降低心率。迷走神经通向胃肠道的分支放松和收缩平滑肌并控制腺体组织的分泌。迷走神经的的腹腔分支与十二指肠相连,其余部分与结肠的远端相连。
髓质迷走神经的节前神经元与固有层和外肌层的肌肉层和粘膜层通信。神经节中的感觉细胞向孤束核(NTS)发送信号,从孤束核向蓝斑(LC)、杏仁核、丘脑和延髓头端腹外侧发送信息。
胃肠道通过迷走神经与中枢神经系统连接
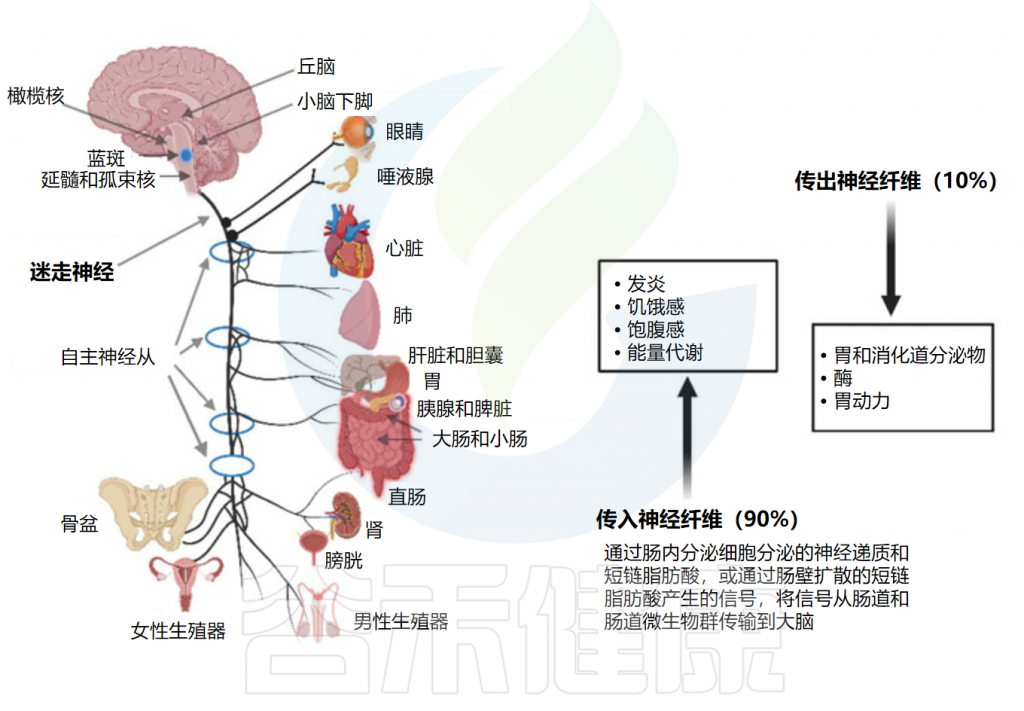
Dicks LMT.Microorganisms.2022
传入神经也与食道、肝脏和胰腺中的受体相连。尽管迷走神经与肠壁的所有层接触,但神经不穿过肠壁,因此不与肠道微生物群直接接触。信号一般通过肠壁粘膜下层和肌间神经丛的肠神经系统(ENS)中的1亿至5亿个神经元到达肠道微生物群。
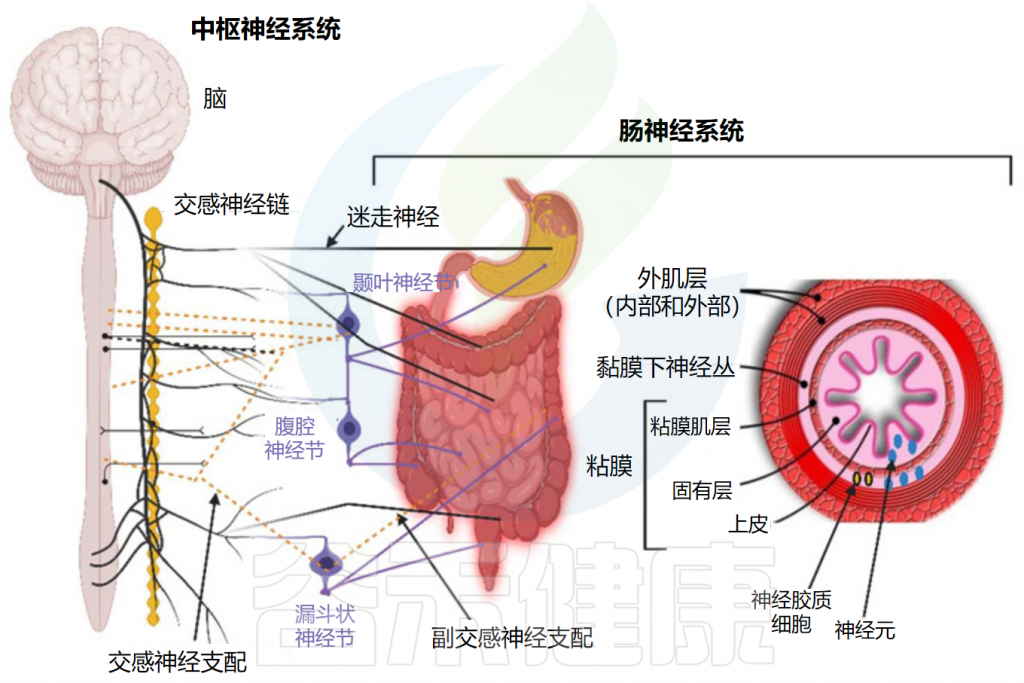
Dicks LMT.Microorganisms.2022
// 肠神经系统功能下降会导致便秘、排便障碍
尽管与迷走神经相关,但小肠和大肠中的部分功能独立于迷走神经。这可能是由于独立的感觉和运动神经元,能够调节肌肉活动、肠壁运动、液体分泌、粘膜层血流和粘膜屏障功能。
与肠神经系统相关的功能下降通常表现为便秘、失禁和排便障碍。这通常发生在老年人身上,被称为先天性巨结肠或肠假性梗阻。最近的研究表明,肠神经系统是动态的,并且不断变化,由细胞凋亡和神经发生过程维持。
与胃肠道相连的神经元有许多受体,它们与肠内分泌细胞(EECs)释放的激素或其他激素相互作用,在维持肠道稳态方面发挥着重要作用。
到目前为止,已经对十多种不同类型的EEC进行了表征。它们作为感觉细胞,协调血清素(5-HT)、神经肽Y(NPY)、血管活性肠肽(VIP)、胆囊收缩素(CCK)、γ-氨基丁酸(GABA)、生长抑素、胰高血糖素样肽(GLP)-1/2、胃饥饿素等的分泌变化。这些感觉细胞上的受体通常由肠道神经元表达,也由迷走传入神经、脑干和下丘脑表达。
// 胆囊收缩素、胰高糖素样肽-1等带来饱腹感
胆囊收缩素、胰高血糖素样肽-1(GLP-1)和肽YY(PYY)水平在餐后长达6小时内保持较高水平。富含蛋白质的饮食会刺激CCK的产生。CCK与胰腺中的特定受体(CCK-A受体)、大脑中的受体(CCK-B受体)以及中枢神经系统中的其他受体结合,这会带来饱腹感。
同时,胰腺释放脂肪分解酶、蛋白分解酶和碳代谢酶。当CCK与胰腺中的钙调神经磷酸酶相互作用时,转录因子NFAT 1-3被激活,刺激胰腺细胞肥大和增殖。
注:高CCK水平会增加焦虑,而生长抑素和胰腺肽可防止CCK的过度释放。
// 胃饥饿素、生长激素释放肽促进食欲
胃饥饿素(ghrelin)在禁食期间由胃释放,进入循环系统并穿过血脑屏障。胃饥饿素通过与位于迷走神经节上的Ghrelin受体(GHSR)的相互作用刺激食欲。
较高的ghrelin水平与升高的多巴胺(DA)水平相关,而多巴胺水平反过来又向中枢神经系统发送饱腹感信号。
一旦进入大脑,生长激素释放肽就会激活弓状核神经元上的受体,导致神经肽Y(NPY)和刺鼠关联蛋白(AgRP)的产生增加。
大脑和脊髓中高水平的NPY与其他神经递质(如GABA和谷氨酸)一起分泌。NPY刺激食欲,以脂肪的形式调节能量的储存,但也能减轻焦虑、压力和疼痛。NPY还调节睡眠模式并保持低血压。
富含低聚果糖和菊粉的饮食会抑制生长素释放肽的产生,并增加肠上皮内分泌L细胞GLP-1的产生。
// 胃饥饿素的产生受到一些肠道菌群的影响
一项研究总结了肠道微生物群对激素释放的影响。胃饥饿素的产生受到拟杆菌某些物种(Bacteroides)、Coriobacteriaceae、韦荣氏菌属(Veillonella)、普雷沃氏菌(Prevotella)、双歧杆菌某些种类(Bifidobacterium)、乳酸杆菌某些品种、粪球菌属(Coprococcus)和瘤胃球菌(Ruminococcus)的刺激,但受到双歧杆菌、链球菌、乳酸杆菌、粪杆菌、拟杆菌、埃希氏菌、志贺菌(Shigella)和链球菌(Streptococcus)的抑制。
这清楚地表明,激素水平的调节是物种特异性的,需要更多的研究来确定所涉及的特定因素。
// 拟杆菌等细菌还影响其他激素的作用
拟杆菌产生与胰岛素、神经肽Y和黑色细胞刺激素(α-MSH)同源的分子。这些分子诱导与循环系统中的免疫球蛋白发生交叉反应,直接对抗生长素释放肽、瘦素、胰岛素、肽YY和神经肽Y。
Rikenellaceae和梭菌科(Clostridiaceae)的一些菌株产生酪蛋白分解酶B(ClpB),可模拟α-MSH水平增加时产生的饱腹感。与ClpB相互作用产生的免疫球蛋白可对抗α-MSH并减少其厌食作用,导致饱腹感降低。
肠嗜铬细胞(EC)控制反射和胃酸分泌,但也产生血清素(5-HT)。D、G、I、K和L型细胞控制酶分泌,单核细胞启动肌电迁移,N细胞调节收缩,S细胞(位于小肠)调节酸度水平,A细胞分泌胃促生长素和内脂素-1,P细胞分泌瘦素。
胃肠道除了通过各种激素使大脑形成不同的感觉和反应外,神经递质也对胃肠道健康及其中的微生物群产生重要影响。谷禾最新的报告中已将神经递质作为健康的重要指标,让我们一起来了解一些重要神经递质对健康的影响。
神经递质一般可分为氨基酸(例如,谷氨酸、天冬氨酸、D-丝氨酸、GABA和甘氨酸)、单胺(多巴胺、去甲肾上腺素、肾上腺素、组胺和血清素)、微量胺(例如,苯乙胺、酪胺、章鱼胺、色胺)、肽(催产素、生长抑素、P物质、可卡因和阿片肽)、气体递质(一氧化氮、一氧化碳和硫化氢)、嘌呤(三磷酸腺苷和腺苷)等。
其中,血清素(5-HT)、γ-氨基丁酸(GABA)、谷氨酸、多巴胺、组胺和一氧化氮被认为是关键的神经递质,将进行更深入的讨论。

血清素又名5-羟色胺(5-HT),主要存在于中枢神经系统和肠道,是一种抑制性神经递质。在中枢神经系统中,血清素充当神经递质,参与调节情绪、睡眠和食欲。它有助于幸福感,有助于调节对压力和焦虑的反应。此外,血清素负责介导多种非神经元过程和功能,例如膀胱调节、止血、呼吸驱动、免疫反应、血管张力和肠道炎症。
血清素作为神经递质发挥着关键作用,但是大脑仅含有大约5%的血清素,而胃肠道系统中的肠嗜铬细胞(ECC)负责产生约90%的人体总血清素。血清素主要由色氨酸合成,而色氨酸则是一种必需氨基酸,必须通过饮食摄入。肠道血清素水平受色氨酸羟化酶TPH1和TPH2调节。
▸ 血清素的合成受到肠道微生物群的调节
肠道微生物群可以影响血清素的产生。研究表明,肠道菌群可以影响血清素的前体物质如色氨酸的代谢,促进血清素的产生。肠嗜铬细胞受到肠道微生物群(特别是短链脂肪酸)的刺激,产生血清素。短链脂肪酸会增加肠嗜铬细胞中的TPH1表达和血清素合成,从而导致循环血清素浓度升高。
一项研究表明乙酸钠(10-50 mM)显著增加人体中TPH1 mRNA 的表达。然而,较高水平的丁酸盐(8.0和16.0mM)分别抑制TPH1表达13.5和15.7倍。
另一项单独的研究表明,无菌小鼠的神经元功能障碍可以通过肠道微生物群的重新定植来逆转。多项研究证实了这一点,并提供了明确的证据表明5-HT的合成受到肠道微生物群的调节。
过高或过低的血清素含量都不利于人体健康
▸ 血清素含量过高的危害
血压异常、心血管问题:5-羟色胺是一种强血管收缩剂和平滑肌收缩刺激剂。高血清素水平可能导致血管过度收缩,增加血压和心血管疾病风险。
神经功能异常:5-羟色胺过高时,由于其抑制植物神经功能,使得交感神经过于兴奋,此时可导致植物神经功能发生紊乱。引起神经功能异常的表现,比如手抖、乏力、出汗、头晕、失眠、胸闷、心悸等。
与炎症性肠病有关:在对患有结肠炎的小鼠进行的研究中,观察到5-HT产量增加。随着5-HT水平的增加,固有层树突状细胞(DC)上7型血清素(5-HT7)受体的表达被激活,并触发促炎免疫反应。而抑制5-HT7受体可减轻肠道炎症。
注:5-HT4受体的激活在成人神经系统的成熟中起着重要作用,因为它调节神经元的形成并保护细胞。
▸ 血清素含量过低的危害
情绪低落、抑郁:5-羟色胺在大脑皮层及神经突触中的含量较高,是一种能产生愉悦情绪的信使。如果该物质的含量偏低,容易影响大脑活动,可能对患者的情绪造成影响,使患者处于较为低落的状态中,常伴有悲观、失落、忧愁等负面情绪。可能导致抑郁、焦虑和情绪波动等心理健康问题。
睡眠障碍:5-羟色胺是一种抑制性神经递质,如果其含量比较低,可能导致中枢神经系统持续处于较为兴奋的状态中,可能导致患者出现睡眠障碍的情况,常有入睡困难、早醒、多梦等表现。
记忆力衰退:在一定程度上,5-羟色胺通常能保护神经元,使其免受兴奋性神经毒素的影响。如果5-羟色胺的含量比较低,可能导致神经元受损,进而影响患者的记忆力。
消化问题:血清素在肠道中也扮演重要角色,过低的血清素含量可能导致消化问题,如胃肠道不适、食欲不振和胃肠道功能紊乱。
最近的一份报告表明一些神经递质可能作为肠道细菌的生长底物。高水平的血清素(5-HT)可能会降低肠壁通透性,而低水平的5-HT会降低人紧密连接蛋白(Occludin)的表达并削弱肠壁,导致通透性增加和肠漏的形成。
▸ 提高血清素水平的方法
一些精神疾病,例如抑郁症与大脑中异常的血清素水平有关。那么血清素过低时可以通过哪些方法来提高呢?
饮食调理:要想补充血清素,要多吃一些富含蛋白质的食物,如鸡蛋、坚果、瘦肉、鱼、虾等,其色氨酸含量较高,进入体内能够促进血清素的合成,升高血清素。
药物补充:血清素低一般可以在医生指导下通过口服药物辅助补充,如选择性血清素再摄取抑制剂(SSRI)、血清素-去甲肾上腺素再摄取抑制剂、三环类抗抑郁药等,可以抑制血清素再摄取,减缓血清素的分解,从而增加血清素的含量。
多晒太阳:阳光照射与血清素水平升高有关,色氨酸的光捕获对于血清素的合成有重要影响。吸收蓝光波会激发色氨酸的吲哚结构,使其失去吲哚环结构中的一个电子,从而被氧化。阳光对人类的血清素水平以及情绪、睡眠和自杀意念都有影响。
锻炼:锻炼对生理和心理健康有多种显著益处,包括提高血清素水平和对整体情绪产生积极影响。例如,一些人类研究报告称,从事有氧运动会导致大脑血清素水平增加,并且如果保持良好的运动习惯,这种增加可能会持久。
积极情绪诱导:正如低血清素水平可能会对我们的情绪产生负面影响一样,消极情绪也会导致血清素水平下降。一些证据表明,使用认知和行为策略积极诱导积极情绪可能有助于维持健康的血清素水平。血清素水平和情绪之间的这种“双向影响”可能会影响一系列身心健康问题。
使用补充剂:在体内,血清素是由5-HTP制成的,而5-HTP是由L-色氨酸制成的。因此,从理论上讲,增加这些“组成部分”(代谢前体)中的任何一个的水平都可以导致血清素总体水平的增加。
维生素D有助于身体(包括大脑)制造、释放和使用血清素。维生素D会激活一种酶,将色氨酸转化为血清素。如果维生素D水平较低,我们的大脑就会产生较少的血清素。因此,增加维生素D的摄入量可能会增加血清素水平,从而有可能支持心理健康。
▸ 血清素过高一般补充药物或补剂需注意
当人的系统中血清素过多时,就会出现血清素综合症。血清素综合征是由于药物、补充剂或草药的组合导致血清素升高至不安全水平而引起的。
最常与血清素综合征相关的抗抑郁药和抗焦虑药包括:
偏头痛药物(曲普坦类药物):曲坦类药物通常是医生为中度至重度偏头痛患者开出的第一种药物。曲普坦类药物还会激活大脑中的血清素受体,并存在发生血清素综合征的风险,特别是与阿片类药物或抗抑郁药联合使用时。
他们包括:
除此之外单胺氧化酶抑制剂、阿片类药物、丁螺环酮 (Buspar)、恶心药物、右美沙芬、迷幻剂,可卡因,以及一些草药和补品如圣约翰草、人参、姜黄、藏红花在使用时也需特别注意,可能会引起血清素综合症。
γ-氨基丁酸(GABA)是一种非蛋白氨基酸,于1950年首次在大脑中被发现,主要在中枢神经系统中发挥作用,是哺乳动物大脑中最主要的抑制性神经递质。GABA的作用是减缓神经系统的活动,帮助维持神经系统的平衡,防止过度兴奋导致的不良反应。
研究发现 , GABA具有激活脑内葡萄糖代谢、促进乙酰胆碱合成、降血氨、抗惊厥、降血压、改善脑机能、精神安定、促进生长激素分泌等多种生理功能。多项研究还证明GABA与一些神经系统疾病如
焦虑、抑郁、癫痫、自闭症谱系障碍(ASD)和注意力缺陷多动障碍存在关联。

▸ 人体肠道内的一些菌群也可以产生GABA
GABA可由多种生物体合成,包括人类、植物和细菌。在合成过程中,GABA由谷氨酸通过谷氨酸脱羧酶(GAD)产生。在人类微生物群中,几种胃肠道细菌含有编码GAD的基因,该基因负责GABA的产生。
双歧杆菌、乳酸杆菌和拟杆菌是最著名的GABA产生菌,尤其是脆弱拟杆菌(b.fragilis)。人们还描述了一种新的“吃GABA”物种,瘤胃球菌科中的Evtepia gabavorous。E.gabavorous对GABA的依赖性很明显,因为菌株只有在产生GABA的情况下才能生长。
▸ 一些微生物可以改变GABA受体的功能
已经描述了三类γ-氨基丁酸受体(GABAR),即GABAR A、GABAR B和GABAR C。GABAR B将从激素、神经递质和信息素接收到的信号转移到信号转移途径。
已知少数微生物可以改变GABAR的功能。鼠李糖乳杆菌JB-1改变大脑中GABAR的表达,从而减少焦虑和抑郁。因此,很可能某些乳酸杆菌在焦虑和抑郁的调节中起着关键作用。乳酸杆菌治疗可提高海马和前额叶皮层的GABA水平。结肠中微生物群产生的乙酸盐通过血脑屏障转移到下丘脑,并进入GABA神经胶质细胞循环途径。
▸ GABA含量过高的危害
神经系统抑制过度:GABA作为一种抑制性神经递质,过高的GABA水平可能导致神经系统抑制过度,影响神经传导和神经元活动,引发头晕、嗜睡和思维迟钝等症状。
肌无力、运动障碍:GABA可以影响肌肉的收缩和松弛,过高的GABA含量可能导致肌肉过度松弛,引起肌无力和运动障碍。
心律失常、血压下降:GABA的过高水平可能导致心血管系统的抑制,影响心脏的收缩力和心率,引起心律失常和血压下降。
情绪低落:神经系统受到GABA调节,过高的GABA含量可能导致情绪低落、注意力不集中和记忆力减退等情绪和认知问题。
呼吸困难:GABA过高可能影响呼吸中枢的功能,导致呼吸抑制,引起呼吸困难和缺氧症状。
▸GABA含量过低的危害
神经系统问题:GABA是一种重要的神经递质,含量过低可能导致神经传导异常,引发焦虑、抑郁和神经紊乱等问题。
睡眠障碍:GABA参与调节睡眠过程,GABA含量过低大脑容易兴奋,从而可能导致失眠、睡眠质量下降和睡眠障碍。
情绪不稳定:GABA也是一种帮助平静和放松的神经递质,是身体自产的一种有效的抗应激化学物质。GABA不足可能影响情绪调节功能,导致情绪波动大、易怒和情绪不稳定。
肌肉紧张:GABA参与肌肉松弛,含量过低可能导致肌肉紧张、痉挛和纤维肌痛。
▸ 调整GABA水平的方法
饮食:有些食物成分可以增加GABA水平,比如:燕麦、茶叶、核桃、香蕉、杏仁、菠菜和鱼类。还有矿物质镁,和维生素B6也可能增加GABA水平。
运动:瑜伽可以提高GABA水平,还有其他一些运动方式,也可以适当提高GABA水平。冥想的人会增加 GABA 水平,并降低皮质醇和去甲肾上腺素水平。
药物:调整体内GABA水平的药物和途径包括苯二氮䓬类药物(如苯巴比妥)和催眠药物(如扎来普隐)。此外,通过调整神经元GABA受体的活性和GABA转运体的功能也可以影响GABA水平。
草药类:
卡瓦对 GABA 的影响很复杂,因为该植物含有 6 种精神活性化合物。卡瓦主要的精神活性化合物之一是卡瓦因,在人类研究中,卡瓦改善了焦虑、失眠、抑郁、睡眠质量、认知、紧张和不安的症状
注:卡瓦与许多细胞色素酶有复杂的相互作用,这可能会影响肝脏。
厚朴在中药中被广泛应用,具有多种功效,可在动物和试管研究中,厚朴显示出抗氧化性能。还可保护大脑、心脏、肝脏,并具有抗癌和抗炎特性。
缬草中的活性成分主要存在于其根中,戊酸似乎是最有效的活性成分,戊酸通过多个 GABAA 受体亚基正向调节 GABA ,可以促进放松、减轻压力和改善睡眠。
黄芩,含有生物活性黄酮类化合物,可作为有效的抗氧化剂,不仅具有抗焦虑和抗惊厥作用,还可以改善认知、神经元再生。
柠檬香蜂草,具有复杂的药理学特征,含有许多精神活性有机化学物质,从多酚到萜烯。其中迷迭香酸是其最有效的精神活性化合物。迷迭香酸通过间接抑制将 GABA 转化为 L-谷氨酸的酶来增加 GABA 水平。
黑籽油,其提取物可改善炎症、血压和焦虑。
南非醉茄提取物与其他 GABA 正变构调节剂结合显示出协同效应,并且当 GABA 含量较低时似乎会增加 GABA 活性。
薰衣草,安全可靠地改善了焦虑和睡眠质量。
茶氨酸,可以减少心理和生理压力反应,同时改善情绪和放松,可以轻微增加大脑中的单胺水平,例如血清素、多巴胺、甘氨酸、GABA(增加约 20%)。
芹菜素,存在于许多传统使用的草药中,包括洋甘菊、小白菊、芹菜、金光菊、西番莲等。芹菜素通过其对苯二氮卓受体的活性增强 GABA 传输。它具有抗癌和抗氧化特性,甚至可以减少 tau 蛋白和β淀粉样蛋白的沉积和积累,这可能会降低患阿尔茨海默病和神经炎症的风险。它还会抑制谷氨酸家族的 NMDA 受体。
绿茶,EGCG(表没食子儿茶素没食子酸酯)是一种绿茶化合物,通过正向调节苯二氮卓受体来增加 GABA活性。
牛磺酸,一种与心脏和大脑健康有关的氨基酸,存在于许多饮食来源中,可以与 GABAA 和 GABAB 受体结合,每天摄入量少于 3 克其补充剂,不会产生副作用。
GABA 拮抗剂或“负调节剂”可阻断 GABA 的作用。
以下是可能阻断 GABA 的物质列表:
谷氨酸(Glu)是大脑中最丰富的游离氨基酸,也是大脑主要的兴奋性神经递质。在记忆存储中发挥着关键作用,它还可以帮助我们说话、处理信息、思考、运动、学习新事物和集中注意力学习等。
注:谷氨酸也是γ-氨基丁酸(GABA)的前体,这二者之间的平衡对于我们大脑健康非常重要。
谷氨酸被归类为非必需氨基酸,这意味着它可以在体内以足够的数量合成。对各种动物肠道进行仔细平衡研究的结果,结果表明膳食谷氨酸几乎在肠道内定量代谢,主要是通过肠细胞。
谷氨酸可以以两种不同的方式合成:首先,它可以通过谷氨酸脱氢酶或多种转氨酶从α-酮戊二酸合成。其次,谷氨酸可以由其他氨基酸合成;氨基酸的“谷氨酸家族”包括谷氨酰胺、精氨酸、脯氨酸和组氨酸。
▸ 谷氨酸的作用
化学信使:谷氨酸将信息从一个神经细胞传递到另一个神经细胞。作为主要的兴奋性神经递质,它向大脑和全身发送信号。它有助于认知功能、记忆、学习和其他大脑功能 。
脑细胞的能量来源:当细胞的主要能量来源葡萄糖储备低时,可以使用谷氨酸。
学习和记忆的调节:谷氨酸有助于随着时间的推移增强或减弱神经元之间的信号,以塑造学习和记忆。
疼痛传递器:较高水平的谷氨酸与增加的疼痛感有关。
影响免疫:谷氨酸受体存在于免疫细胞(T细胞、B细胞、巨噬细胞和树突状细胞)上,这表明谷氨酸在先天免疫系统和适应性免疫系统中均发挥作用。
保护肠道:谷氨酸是肠细胞的主要营养素之一。谷氨酸还可以通过帮助产生抗氧化剂谷胱甘肽来保护肠壁。一项动物研究发现,补充 L-谷氨酸有助于改善仔猪的肠道完整性,这有利于营养物质的消化和吸收。
注:谷氨酸还可以预防由于幽门螺杆菌和长期使用阿司匹林等非甾体抗炎药引起的胃肠道损伤。
睡眠和清醒的介质:大鼠模型研究表明,当我们清醒或快速眼动(REM)睡眠期间,谷氨酸水平最高。丘脑是个例外,在非快速眼动睡眠期间谷氨酸水平最高。
在过去的30年中,越来越多的研究进展还揭示了谷氨酸及其受体在神经退行性疾病疾病(阿尔茨海默氏症、肌萎缩侧索硬化症、多发性硬化症、癫痫、帕金森等)以及肠道疾病如克罗恩病和溃疡性结肠炎的病因中起核心作用。
▸ 谷氨酸含量过高的危害
谷氨酸是大脑中必不可少的(也是主要的兴奋性)神经递质。然而,谷氨酸在某些情况下会变得有害——这一过程称为谷氨酸兴奋性毒性 (GE)
由于谷氨酸是神经元的兴奋剂,过多会导致神经元过度激活并死亡,从而破坏神经元。
神经系统疾病:谷氨酸作为兴奋性毒素的作用,与多种神经退行性疾病有关,例如多发性硬化症、 阿尔茨海默病和肌萎缩性侧索硬化症。谷氨酸失调也被认为是纤维肌痛和慢性疲劳综合征的原因之一。
心理健康障碍:谷氨酸过多(或过少)也与抑郁症和精神分裂症等心理健康障碍有关。大量研究发现,在患有重度抑郁症的人中经常发现高水平的谷氨酸或过度活跃的谷氨酸受体。
偏头痛:高浓度的谷氨酸盐和偏头痛之间也有密切的联系。一项研究发现,偏头痛患者的血浆谷氨酸水平显著升高。另一项研究得出结论,GABA能药物(那些改变 GABA 作用的药物)可能有助于治疗偏头痛。
糖尿病:有一些证据表明,随着时间的推移,高水平的谷氨酸会导致1型和2型糖尿病的发生。一项研究发现,谷氨酸水平对两种类型的糖尿病中β细胞的损失都有直接和间接的影响。
▸ 谷氨酸含量过低的危害
注意力不集中:如果谷氨酸太少,我们无法对进入大脑的刺激做出快速反应,无法很好地记住事物,难以集中注意力,学习会更加困难。
情绪障碍:谷氨酸是大脑里需求量比较大的一种氨基酸,主要是参与脑内蛋白质或者是脂肪酸等的合成和代谢,过低可能影响人的精神状态,也可能诱发神经衰弱。研究人员发现,阻止大鼠吸收谷氨酸会导致类似抑郁的效果,这可能反映了快感缺失。
▸ 降低谷氨酸水平的方法
在饮食中降低:最好限制或避免使用富含谷氨酸的食物包括:酱油、硬奶酪、腌肉、谷物(尤其是含有麸质的)、骨汤,快餐、方便面、沙拉酱等。
PPAR -γ激活剂:PPAR -γ激活剂可能是对抗GE(谷氨酸兴奋性毒性)的最佳方法之一。许多食物和草药具有降低谷氨酸兴奋性毒性的能力。例如:黄芪、绿茶、紫锥菊、棕榈油、大豆、厚朴、奶蓟草、甘草、牛至、百里香油、高丽参、姜黄素、黑籽油、槲皮素 。
补充维生素:维生素B6有助于减少谷氨酸过量,因为参与将谷氨酸转化为GABA。维生素B6缺乏可能是谷氨酸过量积累并且不能正确转化为 GABA 的一个原因。辅酶Q10-也可以改善谷氨酸兴奋性毒性、线粒体功能和氧化应激 。
▸ 提高谷氨酸水平的方法
运动:锻炼的参与者的谷氨酸或GABA水平增加。即使在停止运动后效果仍然存在,这表明谷氨酸水平会随着运动而发生更持久的变化。
饮食:天然高谷氨酸食物包括:发酵、陈化、腌制、压力烹制的食品。其中包括:陈年奶酪、慢煮肉类和家禽、蛋、酱油、大豆蛋白、鱼露,某些蔬菜,如蘑菇、成熟的西红柿、西兰花和豌豆、核桃、大麦麦芽。
补充剂:身体将谷氨酰胺转化为谷氨酸。谷氨酰胺可以作为补充剂使用,也可以在肉类、鱼类、鸡蛋、奶制品、小麦和一些蔬菜中找到。
扩展阅读:
作为耳熟能详的一种神经递质,你真的了解多巴胺的全部作用以及利与弊吗?下面由谷禾带你一起了解下。
多巴胺(DA)主要在黑质、腹侧被盖区和下丘脑中产生,并释放到大脑的伏隔核和前额皮质中。它通常被称为奖励神经递质,在认知、奖励、饱腹感、运动、愉悦和动机等重要功能中发挥着重要的外周和中枢作用,影响睡眠、情绪、注意力、工作记忆和学习等。
▸ 肠道微生物群能够影响多巴胺的代谢
肠道微生物群是肠道和中枢神经系统中多巴胺生物利用度的主要贡献者。一些肠道微生物已被证明对多巴胺能神经元发挥神经保护作用,以减少多巴胺损失。另一方面,其他微生物可以通过内毒素刺激炎症反应,进一步降低多巴胺浓度,从而产生负面影响。
帕金森病肠道中的有益微生物群往往会减少,而诱发病理过程的微生物水平则会升高。
左旋多巴是多巴胺的天然前体,外周给药时可穿过血脑屏障,增加大脑中多巴胺的水平。然而,肠道微生物代谢的左旋多巴会降低其利用率,而外周产生的多巴胺会导致不良副作用。
将来,肠道微生物群的筛查或肠道微生物群的绘图可能对于选择用于精神治疗的药物变得重要。随着测序、克隆、基因操作、病毒(包括噬菌体)靶向、成像技术的最新进展,这将成为可能。
▸ 多巴胺的作用
调节情绪、影响认知:多巴胺参与调节情绪和情感反应,特别是与愉悦和奖赏感有关。多巴胺水平的变化可以影响人的情绪状态,使人感到快乐、满足或兴奋。
多巴胺还可以影响认知功能,包括记忆、学习、决策和注意力等。它促进神经元之间的连接和信息传递,有助于提高认知能力。
影响躯体运动:多巴胺是锥体系统中的重要递质,与躯体运动功能有密切关系。多巴胺在大脑基底神经元中起着关键作用,参与调节运动控制和协调。多巴胺的不足会导致运动障碍,如帕金森病。
调节体内激素水平:多巴胺也参与调节内分泌系统的功能,影响激素的分泌和调节身体的代谢。它与垂体前叶的调节密切相关,影响生长激素、泌乳素等激素的分泌。多巴胺还通过负反馈机制调节腺垂体激素的合成和释放,维持体内激素水平的稳定。
调节心血管活动:多巴胺的作用可以导致心率的增加,这是由于多巴胺通过激活β1-肾上腺素能受体增加心脏的兴奋性和传导速度,从而加快心率。然而,在高剂量下,多巴胺也可以通过抑制交感神经系统来降低心率。
多巴胺还通过激活β2-肾上腺素能受体来引起血管舒张,特别是在冠状动脉和周围血管中。这种血管扩张的作用有助于降低外周阻力,减少心脏的负担。
影响胃肠道功能:多巴胺在胃肠道系统中也扮演着重要的角色,调节胃酸、胃蛋白酶、胰腺碱性物和酶的分泌,影响十二指肠溃疡的病理演变。当中枢多巴胺功能缺损时易出现溃疡症,如帕金森病患者常患有溃疡症。而多巴胺功能亢进的精神分裂症患者很少有溃疡症。
多巴胺还可以影响胃肠道的消化和吸收功能。它可以调节肠道的血流和肠道蠕动,促进营养物质的吸收和利用。
与成瘾性相关:多巴胺与大脑中的奖赏系统密切相关。当个体接触到有奖赏性的刺激时,多巴胺会被释放,产生愉悦感和满足感。这种奖赏性体验会强化行为,促使个体不断追求这种奖赏。脑内奖赏效应可能是产生精神依赖性和强迫性觅药行为的主要原因。
▸ 多巴胺含量过高的危害
多巴胺过高可能会导致一系列健康问题和危害,包括但不限于:
情绪不稳定:多巴胺有兴奋的作用,含量过高会使得患者脾气暴躁,情绪波动过大,容易生气,对外界也过于敏感。可能导致焦虑、紧张和不安情绪,影响个体的心理健康。
血压、心律失常:多巴胺过多使得神经过度兴奋,出现血压增高,同时伴有头晕、头痛、阵发性颜面潮红以及恶心、呕吐等高血压的表现。还引起患者心率增快,心率增快可引起窦性心动过速,甚至引起心律失常的情况发生。
睡眠问题:多巴胺过高可能干扰睡眠,导致失眠或睡眠质量下降。使睡眠不深、易醒、睡眠中断等现象更为频繁,以及睡眠中的惊醒、噩梦等情况。
可能引起一些精神疾病:多巴胺过高与精神疾病之间存在密切的关系,特别是在以下几种精神疾病中:精神分裂症、躁郁症、药物成瘾、帕金森病。总的来说,多巴胺过高与多种精神疾病之间存在复杂的相互作用关系,多巴胺系统的异常可能是某些精神疾病发病机制的重要因素之一。
▸ 多巴胺含量过低的危害
抑郁和情绪低落:多巴胺是调节情绪的神经递质之一,多巴胺不足会影响大脑中与情绪调节相关的区域,导致情绪不稳定、抑郁和情绪低落等问题。
帕金森病:缺乏多巴胺会导致帕金森病,患者可出现静止性震颤、肌肉强直、运动迟缓,以及尿频、便秘、体位性低血压、不安腿综合征等症状,多巴胺严重缺乏时患者可出现全身肌肉僵硬、生活不能自理等。
精神疾病风险增加:多巴胺与精神疾病如精神分裂症等有关,多巴胺含量过低可能增加患上精神疾病的风险。
▸ 提高多巴胺水平的方法
饮食:在饮食方面有一些食物可以促进多巴胺的分泌,应该多吃富含酪氨酸的食物来促进多巴胺的分泌,建议患者多吃香蕉、橘子,以及巧克力等等这样的食物来促进多巴胺分泌。
体育锻炼:想要促进多巴胺的分泌,也可以通过参加体育锻炼来达到这样的目的。因为人在体育锻炼的时候血压升高、心率增快,这种情况会促进多巴胺分泌。
保持心情愉悦:观看有趣的事物、听音乐会提高身体的快感和愉悦感,可以刺激多巴胺的释放。
增加多巴胺的药物:增加多巴胺的药主要左旋多巴、普拉克索,另外还要配合抗胆碱药物金刚烷胺等药治疗。
多晒太阳:当皮肤暴露于阳光下时,身体会产生维生素D,同时也会促进多巴胺的释放。
▸ 降低多巴胺水平的方法
服用药物:多巴胺是一种神经递质,当多巴胺分泌过多时,会导致精神兴奋。患者可以在医生的指导下服用抗精神病药物进行治疗,如利培酮片、奥氮平片等,可以有效改善症状。
调整饮食结构:食用含色氨酸的食物可增加多巴胺分泌,减少摄入可降低多巴胺分泌。
心理调整:如果精神过于紧张或兴奋,多巴胺分泌会增多,建议及时调整心态,通过心理治疗、暗示治疗等方式来缓解情绪,从而能使多巴胺迅速下降。
组胺是人体内的一种生物胺,最为熟知的作用是作为过敏反应的介质,但也是神经系统、肠道、皮肤和免疫系统中重要的信号分子。
组胺还是肠道稳态的重要调节剂。通过增强分泌和蠕动,组胺促进潜在有毒物质的快速清除。这种生物胺对于肠道细菌的生存也至关重要。与健康个体相比,组胺不耐受患者的肠道菌群失衡或失调。
组胺主要由肥大细胞和嗜碱性粒细胞等免疫细胞产生和释放。一些细胞如树突状细胞或T细胞可以表达组氨酸脱羧酶,这是一种在刺激后合成组胺的酶。
尽管如此,一些食物中的微生物群和部分人体肠道微生物群也可以分泌组胺。
产生组胺的细菌包括乳杆菌属、乳酸乳球菌(Lactococcus lactis)、酒类酒球菌(Oenococcus oeni)、小片球菌、嗜热链球菌、摩根氏菌、肺炎克雷伯菌、肠杆菌属、弗氏柠檬酸杆菌和哈夫尼菌属(Hafnia alvei)。
▸ 组胺的作用
信号传导:在中枢神经系统中,组胺作为一种神经递质,参与睡眠调节和体温调节等生理过程。组胺对感觉神经末梢有强烈的刺激作用,尤其对调节痛和痒的神经,该效应由H1受体所调节。
除此之外,有研究发现组胺还会影响伤口愈合、食欲和情绪等方面。
介导过敏反应:当免疫系统对过敏原产生过度反应时,免疫细胞(如肥大细胞和嗜酸性粒细胞)会释放存储在细胞内的组胺。释放的组胺会结合到特定的受体上,引发一系列生理反应,例如瘙痒、肿胀、打喷嚏等。
扩张血管,影响血压:组胺对人心血管系统最突出的作用是扩张小血管。血管扩张使外周阻力降低,血压下降,并伴有潮红、头痛等症状。
组胺还增加毛细血管的通透性,使渗出增加,引起水肿,严重时甚至导致循环血量减少,可能引起休克。组胺对心脏的直接作用包括增强心肌收缩力、加快心率和减慢房室传导。
刺激胃酸分泌:首先,组胺可以刺激胃黏膜细胞中的H2受体,当组胺与H2受体结合时,会激活细胞内的信号转导通路,导致胃壁上的壁细胞释放胃酸。
其次,组胺还可以通过刺激嗜酸性细胞(胃窦细胞)来促进胃酸的分泌。嗜酸性细胞是胃黏膜中的一种细胞类型,它们包含大量的组胺。当胃黏膜受到刺激时,嗜酸性细胞会释放存储的组胺。释放的组胺通过与H2受体结合,刺激壁细胞分泌胃酸。
影响排便:一项研究中,发现细菌产生的组胺与小鼠结肠运动和粪便排出量增加有关,并且组胺受体拮抗剂治疗在很大程度上阻断了细菌组胺对结肠运动的影响。
收缩平滑肌:此外,组胺会诱导平滑肌细胞(包括支气管和肠道)收缩,哮喘患者对组胺比正常人敏感100~1000倍,组胺可引起支气管痉挛导致呼吸困难。组胺收缩胃肠平滑肌和子宫平滑肌还会引起痉挛性腹痛。
▸ 组胺含量过高的危害
组胺中毒:在健康人体内,会因摄入组胺含量高的食物(例如鲭鱼)导致血液中组胺浓度升高而出现严重症状——组胺中毒。
组胺中毒症状多种多样,可能包括口腔麻木、头痛、头晕、心悸、低血压、吞咽困难、脉搏微弱、荨麻疹、面部肿胀、潮红、呕吐、恶心和腹泻等。
组胺中毒的症状可能持续数小时或一天,但在极少数情况下,症状可能会持续数天。
过敏反应:组胺是一种重要的组织胺,过高的组胺浓度可能引发过敏反应,包括皮肤瘙痒、荨麻疹、呼吸困难等症状。
胃肠道反应:组胺过高可能引起胃肠道症状,如胃灼热、胃痛、腹泻和恶心和消化不良等问题。
肠道肥大细胞过度增生和过度活跃,使组胺浓度较高,还会导致粘膜炎症性疾病,产生腹泻和腹痛。
皮肤和呼吸道症状:组胺过高可能导致皮肤血管扩张和炎症反应,引发红肿、瘙痒和刺痛等皮肤问题。
除此之外,还会引起呼吸道症状,如喉咙发痒、喉咙肿胀、咳嗽和哮喘等呼吸系统问题。
▸ 降低谷氨酸水平的方法
低组胺饮食:组胺过高的基础是基于低组胺含量食物的消除饮食。一般来说,公认的饮食指南尚未制定;但是,建议避免食用富含组胺的食物如奶酪、油性鱼类和贝类,以及生发酵肉制品、腌菜、发酵豆制品、葡萄酒和啤酒、鸡蛋、巧克力和蘑菇。
此外,应避免食用会刺激内源性组胺释放的蔬菜和水果(如菠菜、西红柿、柑橘类水果、草莓、茄子、鳄梨、木瓜、香蕉、猕猴桃、菠萝和李子)。
施用抗组胺药物:纠正组胺不耐受的药物方案基于使用组胺受体阻滞剂、肥大细胞膜稳定剂和其他具有抗组胺活性的药物。在这方面,H1R拮抗剂是最有效的,特别是依巴斯汀。每天服用20毫克该药物,持续12周,46%的患者出现临床缓解。
补充生物活性物质:维生素C被用作纠正组胺不耐受的佐剂。每日剂量300-500毫克可增强组胺降解并抑制肥大细胞脱颗粒。
天然类黄酮(非瑟酮、山奈酚、槲皮素、芦丁和木犀草素)和活性生物碱小檗碱在体外抑制肥大细胞脱颗粒。这些都有助于减轻组胺不耐受。
▸ 组胺含量过低的危害
虽然组胺含量过低的情况相对较少见,但也可能会对身体产生一些影响,包括:
伤口愈合缓慢:组胺在人体中起着重要的调节作用,其能够帮助调节纤维细胞生长因子的生成,该成分可以加速局部肉芽的生长,帮助促进伤口的愈合。因此组胺含量较低时,伤口愈合能力也会减弱,速度会随之减慢。
消化不良:组胺可以通过刺激胃部,进而起到促进胃酸分泌的效果。若身体中没有组胺,则会导致胃酸减少,无法有效消化分解食物,进而引起消化不良的问题。
情绪问题:组胺还可以作为神经递质帮助调节中枢神经系统,而一旦没有组胺或缺少组胺,则会影响中枢神经系统稳定性,引起睡眠异常、激素水平紊乱等情况,进而导致情绪不良、抑郁和焦虑等心理问题。
血管扩张问题:组胺在血管平滑肌收缩和扩张中起到调节作用。组胺含量过低可能导致血管扩张不足,影响血液循环和血压调节。
免疫力下降:组胺对免疫细胞,如吞噬细胞、T细胞、B细胞等,起到增强活性的功效,因此组胺还具有增强免疫功能的作用。若人体缺少该物质,则人体免疫力会下降,无法有效抵抗细菌、真菌等有害物质的侵入。
扩展阅读:

一氧化氮(NO)是一种无色气体,是一种半衰期很短(平均5s后即失活)的神经递质。在人体内扮演着重要的生物学角色,一氧化氮具有以下作用:
▸ 一氧化氮的作用
神经信号传递:一氧化氮与传统的神经递质不同,它不是在突触前膜释放后通过突触间隙传递信号,而是可以直接穿透细胞膜,影响邻近的细胞。这种特性使得NO可以快速地在神经元之间传递信号,参与短期和长期的神经调节过程。
记忆和学习:一氧化氮在大脑的学习和记忆形成过程中发挥关键作用。研究表明,NO参与调节长时程增强(LTP)的过程,这是一种与学习和记忆形成密切相关的神经突触强化机制。
血管扩张:虽然这不是直接作为神经递质的功能,但一氧化氮在调节血管舒张中的作用也影响到大脑的功能。NO可以促进血管扩张,从而增加血流量,改善大脑的血液供应。这对于维持大脑健康和功能至关重要。
神经保护作用:一氧化氮在一定条件下可以发挥神经保护作用,帮助减轻神经损伤和促进神经修复。然而,NO的过量产生也可能导致神经毒性,因此其在神经保护中的作用是把双刃剑。
疼痛调节:一氧化氮在调节疼痛感知中也起着作用。它参与了疼痛信号的传递过程,可能通过调节疼痛相关神经递质的释放来影响疼痛感知。
提高运动表现:一氧化氮通过增强流向肌肉的血液、增加氧气和营养物质的输送以及减少运动过程中代谢废物的积累来提高运动表现。这可以提高耐力、力量和恢复时间。
▸ 一氧化氮含量过高的危害
一氧化氮(NO)作为一种神经递质,在适量情况下对人体具有重要的调节作用。然而,一氧化氮含量过高可能会对人体产生一些不良影响。
神经毒性:过高的一氧化氮含量可能对神经系统产生毒性作用,损害神经元的结构和功能,导致神经元凋亡和神经退行性疾病的发生。
过高的一氧化氮含量还可能干扰神经元之间的正常传导,影响神经信号的传递和神经网络的功能,导致神经系统失调和功能障碍。
氧化应激:过高的一氧化氮含量可能导致氧化应激反应的增加,引发细胞损伤和炎症反应,加速细胞老化和疾病的发展。
血管扩张过度:一氧化氮是一种强效的血管舒张因子,过高的一氧化氮含量可能导致血管扩张过度,造成血压下降和循环血容量不足,甚至引发休克。
免疫抑制:过高的一氧化氮含量可能抑制免疫系统的正常功能,降低机体对抗病原体的能力,增加感染和疾病的风险。
▸ 降低一氧化氮水平的方法
一氧化氮测定值过高,需要根据引起的原因进行处理,多考虑是慢性支气管炎引起的,但也不排除是支气管哮喘、阻塞性睡眠呼吸暂停低通气综合征等疾病导致的。
慢性支气管炎:多考虑是细菌感染引起的,但也不排除是长期吸烟或吸入有害的物质导致的,进而会导致气管、支气管黏膜等组织出现慢性非特异性炎症的情况,在临床通常会出现气促等症状。建议患者在医生的指导下服用盐酸溴己新片、硫酸沙丁胺醇片等药物治疗。
支气管哮喘:多考虑是遗传因素引起的,但也不排除是环境因素导致的,进而会出现气道慢性炎症的情况,在临床通常会出现呼吸急促等症状。建议患者在医生的指导下使用硫酸特布他林气雾剂、布地奈德气雾剂等药物治疗,必要时通过支气管热成形手术等方式缓解。
改善生活方式:降低体内一氧化氮水平的措施和药物包括改变饮食习惯、减少摄入高脂肪食物、增加运动量、避免暴饮暴食等。药物方面可以使用一氧化氮合成酶抑制剂或其他降低一氧化氮水平的药物。
▸ 一氧化氮含量过低的危害
神经传导障碍:一氧化氮作为神经递质在神经元之间传递信号,调节神经传导。一氧化氮含量过低可能导致神经传导障碍,影响神经网络的功能和神经元的正常活动。
情绪和认知问题:一氧化氮参与调节情绪和认知功能,影响大脑的神经传导。一氧化氮含量过低可能导致情绪波动、注意力不集中和认知功能下降。
勃起功能障碍: 有研究表明,NO是阴茎神经元(自主神经支配海绵体并穿透腺海绵体组织)和阴茎血管外膜层神经网络中勃起功能的生理促进剂。而一氧化氮含量过低可能会引起男性性功能障碍,使阴茎无法勃起。
炎症反应增加:一氧化氮在炎症过程中发挥重要作用,可以调节炎症反应和免疫反应。一氧化氮含量过低可能导致炎症反应增加,影响炎症的调节和细胞修复过程。
▸ 提高一氧化氮水平的方法
补充L-精氨酸或者L-胍氨酸:补充NO的途径第一种办法,最直接的方法是增加NO合酶原料L-精氨酸或者L-胍氨酸。大部分蛋白质都含有这两种氨基酸,比如,鱼类、瘦肉、牛羊肉、鸡鸭、蛋类、鱼虾、豆制品、坚果类、巧克力、芝麻、核桃、乳制品等。

适当运动:运动可以调节机体血管内一氧化氮合成酶,使其合成酶含量增加,可以较多地产生一氧化氮,并且运动时由于血液循环加速,也可使其辅助产生一氧化氮,达到较好的补充作用。
补充硝酸盐和亚硝酸盐:亚硝酸盐还原酶在生理条件下发挥功能,催化硝酸盐和亚硝酸盐生成NO增加。补充硝酸盐和亚硝酸盐最容易的是食用水果和蔬菜,其中含有大量硝酸盐和亚硝酸盐,在体内就可以转化为NO。而且我们平常吃的新鲜蔬菜和水果都含有大量天然抗氧化剂,可以防止补充硝酸盐和亚硝酸盐产生亚硝胺。例如茶叶和巧克力中的多酚类,葡萄里的白藜芦醇和原花青素,胡萝卜里的胡萝卜素,番茄里的番茄红素,核桃油和胡麻油中Ω3等。
除了神经递质,肠道菌群代谢物在人体健康中也扮演着重要角色。肠道菌群代谢物是由肠道微生物产生的化合物,可以影响人体的免疫系统、新陈代谢和神经系统等。

研究表明,肠道菌群代谢物与多种疾病的发展密切相关,包括肥胖、糖尿病和炎症性肠病。因此,了解和维护良好的肠道菌群代谢物平衡对于维持人体健康至关重要。
短链脂肪酸(SCFAs)是一类由1~6个碳原子组成的有机脂肪酸,主要包括乙酸、丙酸和丁酸,结肠是其主要产生部位,多由未消化吸收的碳水化合物经结肠内厌氧菌酵解产生。
在结肠中存在的总短链脂肪酸中,健康人体内的90%-95%是乙酸盐、丙酸盐和丁酸盐。
短链脂肪酸主要由双歧杆菌(Bifidobacterium)、乳杆菌(Lactobacillus)、毛螺菌科(Lachnospiraceae)、经黏液真杆菌属(Blautia)、粪球菌属(Coprococcus)、罗氏菌属(Roseburia)和粪杆菌属(Faecalibacterium)在结肠中产生,并为结肠上皮细胞提供能量。
这些短链脂肪酸粘附于游离脂肪酸受体(FFAR),例如位于肠上皮细胞表面的GPR43(FFAR2)和GPR41(FFAR3)。
• 降低肠道pH,减少有害菌生长
短链脂肪酸的存在会使回肠(小肠末端)到盲肠(大肠起点)的肠道pH值降低,从而防止有害细菌(如肠杆菌科和梭状芽胞杆菌)过度生长。
• 防止肠漏,保护肠道健康
短链脂肪酸有助于修复“肠漏”,通过增加粘蛋白2(MUC-2)的分泌来加强肠壁,丁酸盐通过上调紧密连接蛋白claudin-1来保护肠道屏障功能从而防止脂多糖穿过屏障。
患有炎症性肠病的个体粪便短链脂肪酸水平较低,伴随着厚壁菌门和拟杆菌门的减少。
• 为结肠细胞提供能量
丁酸盐是结肠细胞的主要能量来源,结肠细胞是构成肠道内壁的细胞。与身体中使用糖(葡萄糖)作为主要能量来源的大多数其他细胞不同,肠道内壁细胞(结肠细胞)主要使用丁酸盐。如果没有丁酸盐,这些细胞就无法正确执行其功能。
• 抗炎、抗癌特性
丁酸盐也是一种组蛋白脱乙酰酶抑制剂(HDAC抑制剂),通过诱导细胞凋亡(细胞自然死亡)来帮助预防结肠癌及癌症并发症,并在上皮细胞的氧消耗中发挥重要作用,氧气的平衡状态可以防止生态失调。
丁酸盐的抗炎特性,部分原因是其抑制核转录因子(NF-κB)的激活,通过下调NF-κB信号通路,丁酸盐可以调节促炎细胞因子的产生。
• 影响宿主食欲,调节体重
乙酸盐通过刺激生长素释放肽的分泌来降低食欲。与此相一致的是,丙酸盐喂养会诱导脑干、下丘脑和脊髓的背侧迷走神经复合体中FOS(fos原癌基因,AP-1 转录因子亚基)的表达,这引发了一个问题,即短链脂肪酸诱导的外周感觉神经元活动的刺激是否可以介导对宿主饮食行为的影响。
• 短链脂肪酸的其他生理功能
短链脂肪酸调节体内的其他几种生理功能,例如中枢神经系统中小胶质细胞的成熟和功能,血清素、GABA和多巴胺产生的信号向神经元的传输,以及结肠中阴离子的分泌。后者是由于刺激结肠中的烟碱类Ach受体,导致Ach产生增加,并刺激杯状细胞分泌更多粘液。
在免疫细胞中,短链脂肪酸调节T细胞的分化。在肠内分泌细胞中,短链脂肪酸刺激肠道激素的释放。胆汁盐与短链脂肪酸结合,在肠肝循环中发挥着不可或缺的作用,在神经元通路和中枢神经系统信号传导的调节中同样重要。
肠道微生物群产生的短链脂肪酸通过血管转运至大脑,调节神经元、小胶质细胞和星形胶质细胞的功能,并影响血脑屏障。
微生物产生的短链脂肪酸在微生物群-肠-脑轴通讯、保护肠道屏障和炎症反应中发挥着关键作用。特别需要注意的是,过量的短链脂肪酸和缺乏短链脂肪酸对人体健康都是不利的。例如丁酸并不总是越多越好,低浓度丁酸促进细胞增殖和生长,高浓度丁酸反而抑制细胞增殖和生长,增加肠道的通透性。

▸ 调整短链脂肪酸水平的方法
补充直接含有短链脂肪酸的食物:主要来源是乳制品,黄油等,其中含有丁酸盐。例如,黄油大约含有3%至4%的丁酸。这听起来可能不多,但它比大多数其他食物都多。
通过菌群调节增加短链脂肪酸的食物:吃大量富含纤维和抗性淀粉类的食物,例如水果、蔬菜和豆类,与短链脂肪酸的增加有关。
以下类型的食物最适合在结肠中产生短链脂肪酸:菊粉、低聚果糖、抗性淀粉、果胶、阿拉伯木聚糖、阿拉伯半乳聚糖。
扩展阅读:
脂多糖是革兰氏阴性细菌细胞壁外壁的组成成分,是由脂质和多糖构成的物质(糖脂质)。
脂多糖是一种内毒素(Endotoxin),当其作用于人类或动物等其他生物细胞时,就会表现出多种的生物活性。脂多糖的生理作用主要是通过存在于宿主细胞的细胞膜表面的Toll样受体(TLR4)而体现的。
▸ 脂多糖含量过高的危害
然而,高浓度的脂多糖在人体内可能会引发一系列潜在危害和不良影响。
引发炎症:在血液中,脂多糖与单核细胞、树突细胞、巨噬细胞和B细胞(这些都是白细胞)结合,并引导它们产生转录因子NF-κB和AP-1。然后,这些转录因子,刺激炎症细胞因子TNF-a、IL-1b、IL-6的产生。
脂多糖还可以增加一氧化氮,超氧化物(一种自由基)和类二十烷酸(增加炎症的脂肪分解产物,如PGE2)的产生。
内毒素作用:脂多糖中的脂蛋白部分即内毒素,具有毒性作用,如果血液中的脂多糖水平过高,还会引发脓毒血症,这是一种致命的毒素反应,可造成发热、组织功能损伤、器官衰竭甚至死亡。
因此,要注意控制脂多糖含量,避免过高的脂多糖摄入,保持身体的免疫平衡和健康状态,有助于预防上述危害的发生。及时监测和调节脂多糖水平,是维护身体健康的重要措施。
▸ 降低脂多糖水平的方法
首先,低密度脂蛋白胆固醇LDL可以和他结合,通过新的表位来降低脂多糖。
其次,研究显示,在小鼠中,益生菌双歧杆菌,可以通过改善肠道屏障功能,来降低LPS水平。即补充益生元和益生菌,有助于矫正肠道菌群失衡。最常用的益生菌,乳酸杆菌属和双歧杆菌属,是革兰氏阳性菌,因此不含LPS。
最后,许多植物营养素,如槲皮素和小檗碱,都通过作用于肠壁的紧密连接,来抑制肠道对内毒素的吸收。乙酰胆碱刺激迷走神经,可降低巨噬细胞中炎症细胞因子(TNF-a、IL-6等)的释放。
除此之外,Omega-3脂肪酸和乳铁蛋白,也有助于降低LPS的产生,适当的运动也是有益的。
在肠道中,结合的初级胆汁酸受微生物群作用并转化为次级胆汁酸,从而进一步增加胆汁酸库的多样性和整体疏水性。
主要通过胆汁酸水解酶进行的微生物去结合是肠道环境中微生物进一步修饰胆汁酸的关键一步。
胆汁酸水解酶编码基因已在各种肠道微生物中检测到并表征,包括双歧杆菌(Bifidobacterium)、乳杆菌(Lactobacillus)、肠球菌(Enterococcus)、梭菌(Clostridium)、拟杆菌(Bacteroides)等。
▸ 次级胆汁酸的作用
影响脂肪、胆固醇的消化吸收:次级胆汁酸在肠道中有助于脂肪的消化和吸收。它们可以促进脂肪乳化和吸收,帮助机体获取必要的营养。
次级胆汁酸还在胆固醇代谢中起着重要作用。它们参与胆固醇的代谢和排泄,有助于维持胆固醇的平衡。
影响肠道菌群的结构、多样性:胆汁酸是微生物群丰度、多样性和代谢活性的重要决定因素。在人体中,牛磺-β-鼠胆酸和牛磺酸胆酸对多种微生物的发展至关重要。
研究发现小鼠肠道微生物群落过度增殖和细菌易位,通过使用口服胆汁酸,以诱导法尼醇X受体激活,从而抑制细菌过度生长。
肠道微生物群和胆汁酸之间存在双向相互作用。肠道微生物群可以调节胆汁酸的合成和代谢,相反,胆汁酸可以改变肠道菌群的组成。
调节肝胆功能:次级胆汁酸可以影响胆囊的收缩和胆汁的排放,调节胆囊功能,维持胆汁的正常分泌和排泄。
次级胆汁酸还有助于肝脏代谢废物及药物,还可以刺激肝细胞的再生,有利于肝脏功能的恢复。
影响肠道屏障功能、调节免疫:微生物群和胆汁酸之间的相互作用会影响肠道屏障功能的维持,调节先天免疫和适应性免疫,并调节定植抵抗力。
胆汁酸也限制炎症小体的激活。FXR和SHP通过与NLRP3炎症小体和胱天蛋白酶-1的物理相互作用来抑制炎症小体的组装,而TGR5环磷酸腺苷(cAMP)途径的激活通过诱导其泛素化来阻断NLRP3炎性小体的激活,这最终限制了白细胞介素-1β和白细胞介素-18的产生。
▸ 次级胆汁酸含量过高的危害
胆汁反流:次级胆汁酸过高可能导致胆汁反流,即胆汁逆流到胃或食管中,引起胃灼热、食管炎等消化道问题。
胆囊结石、肝脏损伤:过高的次级胆汁酸水平可能导致胆囊内胆固醇结晶形成,增加胆囊结石的风险,引起胆囊疾病和疼痛。
过量的次级胆汁酸可能对肝脏产生负担,导致肝脏功能异常,容易形成肝硬化,还可能会导致肝炎的出现。
消化问题:高水平的次级胆汁酸可能干扰消化系统的正常功能,导致消化不良、腹泻等问题。
免疫系统异常:异常的次级胆汁酸水平可能影响免疫系统的平衡,导致免疫功能异常,增加感染和疾病的风险。
▸ 降低次级胆汁酸水平的方法
饮食调整:胆汁酸高的患者在饮食上应注意清淡,减少摄入高胆固醇、高脂肪食物和辛辣的食物,以减少胆汁酸的产生。增加膳食纤维摄入,有助于降低次级胆汁酸的含量。
药物治疗:医生可能会考虑使用胆汁酸螯合剂来帮助降低体内次级胆汁酸的含量。这些药物可以帮助排出多余的胆汁酸,从而减少其在体内的积累。
控制体重:肥胖会增加肝脏负担,导致脂肪肝等肝病,进而影响胆汁酸的代谢。通过合理饮食和适度运动,保持健康的体重,一定程度上可以达到降低总胆汁酸的效果。
治疗原发病:某些肝脏疾病,如肝炎、肝硬化等,可能会导致总胆汁酸升高。建议在医生指导下积极治疗原发病,如服用复方甘草酸苷片、消炎利胆片等药物,可以降低总胆汁酸。
▸ 次级胆汁酸含量过低的危害
消化问题、营养不良:次级胆汁酸的不足可能导致脂肪的消化和吸收受阻,影响脂肪和脂溶性维生素的吸收,可能导致营养不良。
增加脂肪肝风险:次级胆汁酸不足可能影响胆固醇的代谢和排泄,导致胆固醇积聚在体内,增加动脉粥样硬化等心血管疾病的风险。
次级胆汁酸不足还会增加脂肪肝的风险,影响肝脏功能和健康。
胆汁淤积:次级胆汁酸含量过少时,可能影响胆汁的流动性和排泄功能,导致胆汁在胆道中积聚和凝结,从而增加胆汁淤积的风险。
此外,次级胆汁酸的不足也可能影响胆汁的化学成分和性质,使其更容易形成胆固醇结晶或胆结石,进一步加剧胆汁淤积的情况。
▸ 提高次级胆汁酸水平的方法
饮食调整:增加摄入富含胆汁酸的食物,如动物肝脏、蛋黄、牛奶和奶制品等。此外,适量摄入脂肪和胆固醇也有助于促进胆汁酸的合成。
药物治疗:医生可能会考虑使用胆汁酸补充剂来增加体内次级胆汁酸的含量。包括亮菌甲素(胆汁分泌促进剂)、去氢胆酸、抑氨酚、利胆醇(苯丙醇)、鹅去氧胆酸、胆宁等等。这些补充剂可以帮助增加胆汁酸的合成和释放,从而提高其含量。
营养补充:一些营养素如维生素B12和叶酸被认为对胆汁酸的合成有益,可以通过补充来帮助提高次级胆汁酸的含量。
适当运动:适量的体育锻炼有助于促进胆汁分泌。有氧运动,如快走、跑步、跳舞,能够提高胆囊收缩力和肠蠕动,促进胆汁分泌与排泄。
扩展阅读:
对甲酚(p-Cresol)是人体肠道菌群的代谢产物之一,可由肠道中的一些厌氧菌代谢食物中的特定化合物如酪氨酸产生。因分子量极小极易通过肠道屏障和血脑屏障。
目前人类肠道菌群中至少有55种细菌可以产生“对甲酚”,包括双歧杆菌科、肠杆菌科、Coriobacteriae、拟杆菌科、梭杆菌科、乳杆菌科和梭状芽孢杆菌科等。
▸ 对甲酚含量过高的危害
虽然对甲酚是人体肠道菌群的代谢产物,但过多的对甲酚在肠道内积聚可能对人体健康产生不利影响。
可能导致孤独症:目前已在孤独症患者的血、尿、粪便样本中发现对甲酚和对乙酚水平明显异常升高,并发现孤独症患者的重复刻板行为、交流与认知障碍症状的加重与尿液中对甲酚升高密切相关。
器官损伤:对甲酚在一定浓度下可能对肠道黏膜有刺激作用,影响肠道的正常功能。此外,高浓度的对甲酚也可能对肾脏和其他器官产生毒性影响。
神经损伤:对甲酚极易穿过血脑屏障,过量的对甲酚可能对中枢神经系统产生影响,引起头晕、头痛、恶心、呕吐等神经系统症状。长期暴露还可能导致神经系统损伤和功能障碍。
其他问题:过量的甲酚还会导致便秘,以及可能对呼吸系统、循环系统、免疫系统等产生影响,引起呼吸困难、心血管问题、免疫功能异常等。
一些研究表明,高浓度的甲酚还可能对人体具有致癌作用,增加患结直肠癌的风险。
▸ 降低对甲酚水平的方法
增加膳食纤维摄入有助于促进肠道蠕动,减少有害代谢产物的积累,摄入益生菌和益生元可以减少有害菌的生长,降低对甲酚的产生。适量摄入蛋白质,避免过度摄入。此外过度加热食物可能会破坏其中营养成分增加有害代谢物产生。
内源性吲哚及其衍生物是来源于肠道菌群的色氨酸代谢物,具有一系列生物活性。
吲哚衍生物可以影响胃肠道的蠕动,会影响便秘或腹泻等状况;吲哚及其衍生物已被证明可以加强肠道屏障功能,有助于防止病原体和有害物质进入血液。
最近的研究表明,吲哚主要通过激活AhR和PXR受体来发挥抗炎活性,从而影响免疫系统的功能,显著改善肠道健康(炎症性肠病、出血性结肠炎、癌症结直肠癌),并进一步促进人类健康(糖尿病、中枢系统炎症和血管调节)。
吲哚在人体内可以作为一种信号分子,参与调节细胞生长、分化和凋亡等生物学过程。吲哚还可能对神经系统产生影响,包括调节神经传导、神经元活性和神经递质释放等。吲哚在神经系统中的作用与情绪调节、认知功能等有关。
吲哚还具有一定的抗氧化性质,可以帮助清除自由基和减轻氧化应激对细胞的损伤。吲哚可能在一定程度上保护细胞免受氧化损伤的影响。
▸ 吲哚含量过高的危害
尽管吲哚对于改善肠道甚至全身疾病至关重要,但过高的吲哚含量可能对健康造成一些危害,包括但不限于以下几个方面:
影响情绪:越来越多的证据表明吲哚和吲哚化合物对大脑代谢、生理和宿主行为有影响。在拥有产生吲哚的大肠杆菌的大鼠中,吲哚的慢性过量产生已被证明会增强焦虑样行为和抑郁。
导致肠道损伤:硫酸吲哚酚(IS)是吲哚的衍生物之一,而过量的硫酸吲哚酚会诱导肠上皮细胞(IEC)损伤。在IEC-6细胞中,硫酸吲哚酚处理可显著增加TNF-α的释放、环氧合酶-2和诱导型一氧化氮合酶的产生以及硝基酪氨酸的合成,表明肠上皮细胞是硫酸吲哚酚诱导的肠道炎症的靶点。
与硫酸吲哚酚一起培养的结肠显示出收缩性降低,这表明该毒素可能对结肠平滑肌细胞产生有害影响并导致肠道蠕动受损。
影响神经系统:其次,硫酸吲哚酚可损伤神经元和神经干细胞,损害神经营养因子和神经递质,诱发氧化应激和神经炎症。例如,通过作用于中枢神经系统胶质细胞,硫酸吲哚酚促进神经炎症并表现出促炎作用。
与肾病相关:并且强有力的证据表明,硫酸吲哚酚在肾功能不全的情况下积累时是有害的。硫酸吲哚酚会损害近端肾小管细胞并诱导炎症和纤维化发展。肾脏通过肾小管分泌实现硫酸吲哚酚的高清除率,而硫酸吲哚酚与血浆蛋白结合超过90%,受到蛋白结合的限制,并且血液透析患者的血浆水平相对较高,这也表明与肾脏疾病密切相关。
免疫抑制:吲哚含量可能影响免疫细胞的活性和功能。高浓度的吲哚可能抑制免疫细胞的功能,如抑制T细胞的活性、影响免疫细胞的增殖和分化等,从而降低机体对病原体的抵抗能力。
▸ 降低吲哚水平的方法
放松身心:高度紧张和某些精神疾病会导致体内吲哚水平过高,多洗热水澡,调节好神经和心理,改善睡眠有助于降低吲哚水平。
食用发酵食品:通过对14名健康男性进行随机交叉研究设计,探讨了发酵乳制品对人类血清代谢组的影响。与牛奶组相比,酸奶摄入组餐后血中吲哚-3-丙酸和吲哚乙酸浓度较低。
同样,C反应蛋白水平轻度升高的健康超重男性在接受抗炎膳食混合物后,饮用500mL餐后奶昔(由300mL蛋奶冻、150mL奶油干酪和50mL鲜奶油组成)。受试者在后期表现出吲哚-3-丙酸血浆浓度降低。
使用药物:一些药物可能影响吲哚类物质的生成。例如,一些抗生素和非甾体抗炎药物被发现可以改变肠道微生物群的组成和功能,从而影响吲哚类物质的生成。
此外,一些药物可能直接干扰色氨酸代谢途径,从而影响吲哚类物质的生成。
减少高蛋白饮食:吲哚是蛋白质的代谢产物,减少高蛋白饮食,尤其是富含色氨酸的食物,有助于降低体内的吲哚含量。
▸ 吲哚含量过低的危害
免疫失调:吲哚在一定浓度下可以调节免疫系统的功能,过低的吲哚含量可能导致免疫系统功能下降,增加感染、致病菌定植、炎症的风险。
神经系统问题:吲哚在神经系统中具有调节作用,过低的吲哚含量可能影响神经传导、神经递质释放等,导致神经系统功能异常,如情绪不稳定、认知功能下降等问题。
代谢紊乱、抗氧化能力下降:吲哚在人体内参与多种代谢过程,过低的吲哚含量可能导致代谢紊乱,影响体内物质的合成和代谢平衡。
吲哚具有一定的抗氧化性质,过低的吲哚含量可能导致机体抗氧化能力下降,增加氧化应激对细胞的损伤风险。
▸提高吲哚水平的方法
补充益生菌、益生元:临床试验表明,益生菌可以抵消肠道微生物失衡造成的负面影响,并可导致吲哚产生属及其衍生物的富集,如乳杆菌(Lactobacillus)。
益生元(包括菊粉和低聚半乳糖)已被证明可以显著提高产生吲哚的益生菌(例如双歧杆菌和乳酸杆菌)的丰度。在对肠道微生物失衡进行一定纠正后,吲哚作为具有调节作用的配体,对炎症反应具有抑制作用。
调节饮食:肠道微生物通过色氨酸调节吲哚水平。色氨酸是人体必需氨基酸之一,需要完全依赖饮食摄入。
以下是一些富含色氨酸的常见食物:肉类(牛肉、猪肉、鸡肉、火鸡)、鱼类(鳕鱼、鲑鱼、金枪鱼)、贝类(蛤蜊、扇贝)、蛋(鸡蛋、鸭蛋)、豆类(大豆、黑豆、红豆)、奶制品(牛奶、乳制品)。菠菜、花椰菜、蘑菇、芝麻、松子、香蕉、菠萝、樱桃、草莓、蓝莓。燕麦、大麦、小麦、黑米、糙米。核桃、杏仁、腰果、葵花子、南瓜子、亚麻籽。
粪菌移植:通过粪菌移植(FMT)将产生吲哚的益生菌(乳酸杆菌、双歧杆菌等)移植到患者的肠道中,可以改善肠道微生物群。据观察,肠道中产生吲哚的微生物群的丰度增加,吲哚及其衍生物的水平受到间接影响。
扩展阅读:
苯酚(Phenol)是一种常见的有机化合物,也是人体肠道微生物的代谢产物之一。在人体的肠道中,肠道微生物通过代谢食物中的复杂碳水化合物和蛋白质等产生苯酚。苯酚的生成通常是通过肠道微生物对酪氨酸(一种氨基酸)的代谢产生的。
苯酚在人体内具有一定的生理作用,苯酚在肠道内可以被吸收到血液循环中,进而影响全身的代谢和生理功能。
抗氧化作用:苯酚具有一定的抗氧化性质,可以帮助清除体内的自由基,减少氧化应激对细胞的损伤,有助于维护细胞健康。
免疫调节:苯酚可能对免疫系统产生一定调节作用,有助于平衡免疫反应,调节免疫细胞的活性,提高机体的抵抗力。
维护肠道健康:适量的苯酚可以促进肠道微生物的平衡,维持肠道健康,有利于消化吸收和排泄功能的正常进行。
▸ 苯酚含量过高的危害
但过高的苯酚含量可能对健康产生不利影响。过高的苯酚含量可能导致肠道菌群失衡、肠道炎症、毒素积累等问题,从而影响整体健康。
肠道健康问题:过高的苯酚含量可能导致肠道微生物失衡,影响肠道菌群的稳定性,进而引发肠道炎症、肠道细菌感染等肠道健康问题。
毒性作用:苯酚具有一定的毒性,过高的苯酚含量可能对肠道黏膜和组织造成损害,导致肠道溃疡、出血等严重问题。
神经系统问题:苯酚可能穿过血脑屏障影响神经系统功能,过高的苯酚含量可能导致神经系统问题,如头晕、头痛、神经炎症等。
代谢紊乱、肝脏负担增加:过高的苯酚含量会影响人体的代谢平衡,导致代谢紊乱,影响体内物质的合成和代谢过程。
苯酚在体内主要通过肝脏代谢,过高的苯酚含量会增加肝脏的负担,可能导致肝脏损伤和功能异常。
免疫系统问题:过高的苯酚含量可能影响免疫系统的功能,导致免疫调节失衡,增加感染和炎症的风险。
▸ 降低苯酚水平的方法
增加膳食纤维摄入,促进肠道健康减少苯酚产生。多摄入新鲜水果和蔬菜等富含维生素和矿物质,适量控制蛋白质摄入,避免添加剂和防腐剂的加工食品。增加饮食多样化。
肠道微生物可从鸟氨酸、精氨酸、赖氨酸、酪氨酸和组氨酸等氨基酸前体产生腐胺、胍胺、尸胺、酪胺和组胺等多胺。
腐胺具有一定的生理作用,如调节肠道运动,但是高浓度的腐胺可能与肠炎、癌症和神经退行性疾病的发展有关。
▸ 腐胺含量过高的危害
臭味问题:腐胺是一种具有刺鼻臭味的化合物,其在胃肠道中含量过高可能导致口臭等问题,影响个人的生活质量。
导致胃肠道疾病:高浓度的腐胺会对人体产生毒性作用,影响肠道黏膜的健康,导致肠道炎症,肠道通透性增加。从而易患结肠炎、炎症性肠病、结直肠癌。
致癌风险:一些研究表明,腐胺被认为是潜在的致癌物质,过高的腐胺含量可能通过诱发DNA损伤、促进细胞增殖、影响基因表达等途径参与致癌过程。
影响认知功能:过高的含量可能导致神经系统问题,如情绪不稳定、认知功能下降等。
▸ 调整腐胺水平的方法
腐胺主要来自于肠道菌群代谢转化,发酵食品,如豆腐、豆酱、酸奶奶酪,以及高蛋白特别是动物蛋白,加工肉类以及硝酸盐含量高的食物会促进腐胺转化。
想要降低体内腐胺水平,需要减少高蛋白摄入,适量控制动物蛋白摄入量,减少发酵食品以及高硝酸盐食物如加工肉类、腌制食品等,增加膳食纤维摄入,新鲜水果和蔬菜富维生素和矿物质有助于维持肠道菌群平衡减少腐胺转化。
硫化氢(H2S)是蛋氨酸、半胱氨酸等含硫氨基酸通过一些肠道微生物(如沙门氏菌、埃希氏菌、梭杆菌等)发酵产生的一种微生物代谢物。H2S也来源于无机硫酸盐和亚硫酸盐添加剂的还原,以及肠道磺胺类物质的分解代谢。
越来越多的研究发现它在哺乳动物体内广泛存在,微生物产生的H2S可能反过来塑造肠道微生物群落本身的组成。这对宿主的健康有很多影响,包括帮助训练和调节免疫系统,而且具有重要的细胞保护作用。它已经称为继一氧化氮和一氧化碳之后,被发现的第3种气体信号分子,具有舒张血管、调节血压等多种生理功能。其代谢异常与心脏病和高血压等多种心血管疾病有关。
▸ 硫化氢浓度过高的危害
虽然硫化氢在一定程度上也具有抗菌作用,但过量的硫化氢对人体健康可能造成负面影响。
中枢神经系统损害:硫化氢在高浓度下可能对神经元产生毒性作用,导致神经元损伤和神经元死亡,还会影响血脑屏障的功能,使得有害物质更容易进入大脑,从而引发神经系统疾病(如帕金森病、阿尔茨海默病)。
胃肠道疾病:高浓度的硫化氢会引发肠道阻塞、炎症反应,以及可以使覆盖在肠道上的保护性黏液层变性,出现黏膜损伤等问题。此外,一些研究还发现高水平的肠道内硫化氢与某些疾病如慢性炎症性肠病、结直肠癌等相关联。
胃胀气:硫化氢作为一种气体,如果在肠道中积累过多,可能会引起胃肠道胀气。
影响消化功能:硫化氢可抑制胃酸分泌,影响消化酶活性,导致消化不良、腹胀和腹泻。硫化氢还可能影响肝脏功能,导致转氨酶升高、出现黄疽等症状。
▸ 降低硫化氢水平的方法
减少高硫蛋白食物的摄入,比如蛋类、肉类、鱼类以及大豆制品等。多摄入富含维生素B6的食物,如香蕉等,此外高纤维食物也可减少硫化氢的转化产生。
扩展阅读:
谷禾肠道菌群检测基于大规模匹配血清代谢组和肠道菌群检测,构建了基于肠道菌群的神经递质和菌群代谢物评估。通过上文对各项指标的解读,我们可以了解其具体意义,以及对健康的影响机制。借助肠道菌群这一重要工具,让我们可以探知自身的情绪、神经系统以及免疫和重要代谢毒素的变化与异常。
此外通过调整肠道微生物群落的结构,可以影响神经递质的水平,调节免疫系统的功能,改善肠道黏膜屏障的完整性,从而减少炎症反应,改善疾病症状。因此,我们可以借此进行更加个性化和有效的干预。
主要参考文献
Dicks LMT. Gut Bacteria and Neurotransmitters. Microorganisms. 2022 Sep 14;10(9):1838.
Braga JD, Thongngam M, Kumrungsee T. Gamma-aminobutyric acid as a potential postbiotic mediator in the gut-brain axis. NPJ Sci Food. 2024 Apr 2;8(1):16.
Guzel T, Mirowska-Guzel D. The Role of Serotonin Neurotransmission in Gastrointestinal Tract and Pharmacotherapy. Molecules. 2022 Mar 3;27(5):1680.
Dicks L.M.T., Hurn D., Hermanus D. Gut Bacteria and Neuropsychiatric Disorders. Microorganisms. 2021;9:2583.
Yang X., Lou J., Shan W., Ding J., Jin Z., Hu Y., Du Q., Liao Q., Xie R., Xu J. Pathophysiologic Role of Neurotransmitters in Digestive Diseases. Front. Physiol. 2021;12:567650.
Strandwitz P. Neurotransmitter modulation by the gut microbiota. Brain Res. 2018;1693:128–133.
Van De Wouw M., Boehme M., Lyte J.M., Wiley N., Strain C., O’Sullivan O., Clarke G., Stanton C., Dinan T.G., Cryan J.F. Short-chain fatty acids: Microbial metabolites that alleviate stress-induced brain-gut axis alterations. J. Physiol. 2018;596:4923–4944

谷禾健康

目前越来越多营养概念诸如”低碳水化合物饮食”正在流行,然而,所有的碳水化合物都是不好的吗? 其实并非如此。
其中,抗性淀粉就是一种特殊的碳水化合物,它与我们通常所熟知的淀粉有区别。抗性淀粉之所以得名,是因为它能够抵抗人体消化酶的作用,逃离被吸收的命运,直接进入肠道。这种特性使得抗性淀粉拥有许多健康功效,它不仅能调节血糖,还能促进有益菌的生长,改善肠道功能,甚至还能增强饱腹感,帮助控制体重。
抗性淀粉天然存在于豆类(如扁豆、鹰嘴豆)、某些谷物(如大麦、燕麦)、块茎(如土豆、山药)等食物中。此外,各种食品加工和烹饪方法可以提高食品中的抗性淀粉含量,进一步使这种淀粉的潜在膳食来源多样化。
作为一种膳食纤维,抗性淀粉可以作为微生物发酵的底物,例如拟杆菌属,瘤胃球菌,双歧杆菌等可以发酵抗性淀粉。
一些肠道细菌促进抗性淀粉发酵产生短链脂肪酸。短链脂肪酸的主要功能是改善肠上皮屏障的完整性,缓解局部和全身炎症,产生全身效应,影响代谢健康、免疫功能,甚至可能影响大脑健康。
目前代谢性疾病负担正在增加,一些膳食可以通过调节肠道菌群干预疾病,其中抗性淀粉也很重要,它结合了传统和科学,促使研究人员和消费者重新审视传统饮食习惯并认识到其潜在的健康影响。
本文探讨了抗性淀粉和肠道微生物组之间复杂的相互作用,包括抗性淀粉影响微生物群落的机制、这些相互作用对健康的影响。此外,还讨论了富含抗性淀粉的饮食对肠道健康的影响。随着对肠道菌群在健康和疾病中的作用了解越来越多,强调从天然来源获取抗性淀粉的饮食将会不断增长,为营养干预提供新途径。
▼
什么是抗性淀粉?
抗性淀粉(RS)是一种不被人体消化酶分解的淀粉,被认为是膳食纤维。
淀粉作为葡萄糖的储存形式天然存在于植物中。食品中的淀粉可分为慢消化淀粉(SDS)、快速消化淀粉(RDS)或抗性淀粉(RS)。
一般淀粉在小肠中迅速分解并转化为葡萄糖,并迅速吸收到血液中,而抗性淀粉则抵抗正常消化,因此得名。它不会分解成葡萄糖,而是不受干扰地通过消化道,直到到达结肠。
首先,淀粉的基本结构基于两种不同的葡萄糖聚合物——直链淀粉和支链淀粉。
直链淀粉主要是由α-1,4-葡萄糖单元组成的线性分子,与支链淀粉的分支结构形成对比,支链淀粉还包含α-1,6键连接。
这两种组分的比例及它们在淀粉颗粒内的排列方式显著影响淀粉的可消化性。这些分子越密集、排列越紧密,消化酶就越难接近它们。
抗性淀粉(RS)是一种独特的膳食纤维,不是在小肠中消化,而是在大肠中发酵。不同食物类别(包括谷物、豆类、块茎和某些加工食品)中抗性淀粉的含量差异很大。
doi.org/10.1016/j.fochx.2024.101118
谷物,特别是大麦、燕麦和全麦等全谷类食物,是抗性淀粉的重要来源,尤其是在它们经过最低限度加工的情况下。比如,煮熟并冷却大米会增加其抗性淀粉含量,这是由于直链淀粉的逆淀粉化作用。
扁豆、鹰嘴豆等豆类也富含抗性淀粉。它们的抗性淀粉含量归因于它们的高直链淀粉和支链淀粉比率,这有助于它们缓慢的消化率。烹饪和冷却过程进一步增加了其抗性淀粉含量。
块茎,包括马铃薯和山药,含有抗性淀粉,尤其是在煮熟和冷却时,这是一个诱导淀粉回生的过程。这使得冷土豆沙拉等菜肴成为良好的抗性淀粉来源。
某些加工食品,特别是那些由全谷物制成或含有 抗性淀粉作为成分的食品,可能是重要的抗性淀粉来源。经过挤压烹饪等过程的全麦面包和意大利面保留了大量的抗性淀粉。
了解这些来源及其抗性淀粉含量对于饮食计划和营养优化至关重要。
在此基础上,抗性淀粉可以根据其起源和特性大致分为四种主要类型:
RS1型(RS1):由于食物基质和蛋白质外壳形成的保护屏障,这种形式的 RS 在物理上无法被酶接近。常见的来源包括全谷物和种子。
RS2型(RS2):RS2 的特点是其天然颗粒形式,主要存在于某些生食中。例子包括生土豆、青香蕉、高直链淀粉玉米。这些来源的高直链淀粉含量导致紧密堆积的颗粒结构,限制了酶的获取。
RS3型(RS3):也称为逆行淀粉,当某些食物煮熟然后冷却时会形成 RS3。这种冷却过程导致淀粉分子的重新排列和重结晶,进一步使它们对酶分解具有抵抗力。煮熟和冷却的土豆、意大利面和米饭等食物是 RS3 的主要来源。
RS4型(RS4):这种类型包括食品中天然不存在的化学改性淀粉,例如一些商业生产的面包和糕点。各种工业过程在淀粉分子中引入交联或取代,以增强其对消化的抵抗力。
部分分类有:
RS5型(RS5): 这是一个较新的类别。它需要通过加热和冷却含有特定脂质(例如脂肪或蜡)的淀粉类食品的过程产生的抗性淀粉。例如含有脂肪成分的面包或含有人工制造的淀粉-脂质复合物的食物。

虽然这些类别有助于讨论和研究,但许多现实世界的食物都含有抗性淀粉类型的混合物。此外,食品加工方法,储存条件和其他食品成分的存在等因素可以显着调节这些食品中的抗性淀粉含量。
抗性淀粉的潜在健康益处和生理影响主要来自其在大肠中的发酵。然而,这些益处的程度和特异性可能因抗性淀粉类型而异。例如,不同的抗性淀粉类型可能优先促进特定微生物物种的生长或导致挥发性脂肪酸的产生速率不同。
总之,抗性淀粉的生化结构和分类对于确定其与肠道微生物组的相互作用以及随后的健康结果至关重要。全面了解这些基础方面对于旨在利用抗性淀粉潜在益处的饮食干预的研究和应用至关重要。
保持血糖稳定
由于抗性淀粉消化缓慢,因此可以保持血糖水平稳定。这可以帮助减少餐后血糖峰值,这对糖尿病患者特别有益。
抗性淀粉具有第二餐的效果:根据一项小型研究的结果,早餐吃抗性淀粉可以降低午餐时的血糖。
2022年1月发表在《Frontiers in Nutrition》 的一篇评论指出,在饮食中添加抗性淀粉是一种简单的生活方式调整,可以帮助糖尿病管理。
促进心脏健康
2018年6月《Nutrition Research》发表的荟萃分析结果,抗性淀粉可以通过降低胆固醇水平有益于心脏健康。它还可以改善血糖控制,正如2017年《Nutrition Journal》上发表的一项针对超重成年人的小型研究所证明的那样,它通过促进肠道中健康细菌的生长来实现这一点,这些细菌产生具有有益作用的短链脂肪酸。
根据2022年3月发表在《国际分子科学杂志》上的一篇评论,短链脂肪酸有助于调节交感神经系统。抗性淀粉可能有助于治疗因神经系统过度活跃而加剧的心脏病,例如慢性心力衰竭、高血压和冠状动脉疾病。
减肥效果
抗性淀粉非常有饱腹感,可能会降低食欲。与其他碳水化合物相比,它的热量也较低,通过这些方式,抗性淀粉可能有助于减肥。
虽然早期研究表明抗性淀粉可能在减肥中发挥作用,但还需要进一步的研究来证实任何此类益处。2017 年《营养杂志》上发表的研究表明,每天吃 30 克抗性淀粉,持续六周,18 名超重成年人减少饥饿激素和无意识地吃零食,但不会改变身体成分。
支持肠道健康
抗性淀粉的作用类似于纤维,而纤维会被肠道中的健康细菌发酵。“这些有益的肠道细菌可以产生短链脂肪酸,这对肠道健康有帮助。
例如,短链脂肪酸可以帮助保持肠道内壁坚固,并有助于粘液产生和炎症,还可能有助于降低结直肠癌的风险。这在后面章节我们会详细阐述。
成人每天应摄入约15克抗性淀粉。然而,据估计大多数人每天的摄入可能不到这个量。
抗性淀粉食品含量表
(每100克食品的平均含量)
注:如果要增加摄入量时,请逐步增加,一下子吃太多可能会腹胀和胀气。
挤压烹饪,广泛用于生产即食谷类食品和零食,可以增加最终产品的抗性淀粉含量,取决于应用的条件,诸如含水量、螺杆速度和温度等参数可以进行调整以优化抗性淀粉的形成。
退火过程涉及水化淀粉颗粒而不使其明胶化,已发现这一过程可以增加一些谷物中的抗性淀粉含量。
发酵,是各种文化中历史悠久的烹饪和保鲜方法,具有提高抗性淀粉水平的固有能力。这一过程通常涉及有益细菌或酵母分解和发酵糖类,可以改变淀粉结构,使更多的淀粉对消化具有抗性。例如,将谷物发酵制成酸面包或某些传统非洲菜肴不仅赋予了独特的风味,还增加了它们的抗性淀粉含量。
虽然探索和应用这些方法可以显著增加抗性淀粉含量,但必须考虑更广泛的营养后果。并非所有增加抗性淀粉的方法都是普遍有益的。有些加工方法可能会剥夺食物的重要营养素,或引入不良化合物。
在增强抗性淀粉获得肠道健康益处,和确保食物整体营养价值保持完整之间取得平衡至关重要。
抗性淀粉(RS)与肠道微生物组之间错综复杂的相互作用主要发生在结肠,结肠是大多数未消化碳水化合物达到代谢目的的地方。
肠道微生物群发酵抗性淀粉
人类结肠内有着丰富多样、复杂的微生物群,对发酵未消化膳食成分,尤其是抗性淀粉,起着至关重要的作用。
抵达结肠后,抗性淀粉将被居住在肠道的微生物群体进行厌氧发酵。这一发酵过程导致了短链脂肪酸的产生,主要是乙酸、丙酸和丁酸,以及氢气、甲烷和二氧化碳等气体。
在短链脂肪酸中,丁酸在结肠健康中发挥着关键作用。作为结肠细胞的主要能源来源,丁酸还具有抗炎性能,加强结肠防御屏障,并潜在降低结肠癌的风险。此外,短链脂肪酸通过调节肠道pH值,有利于有益菌的生长,同时抑制致病菌株的增殖。
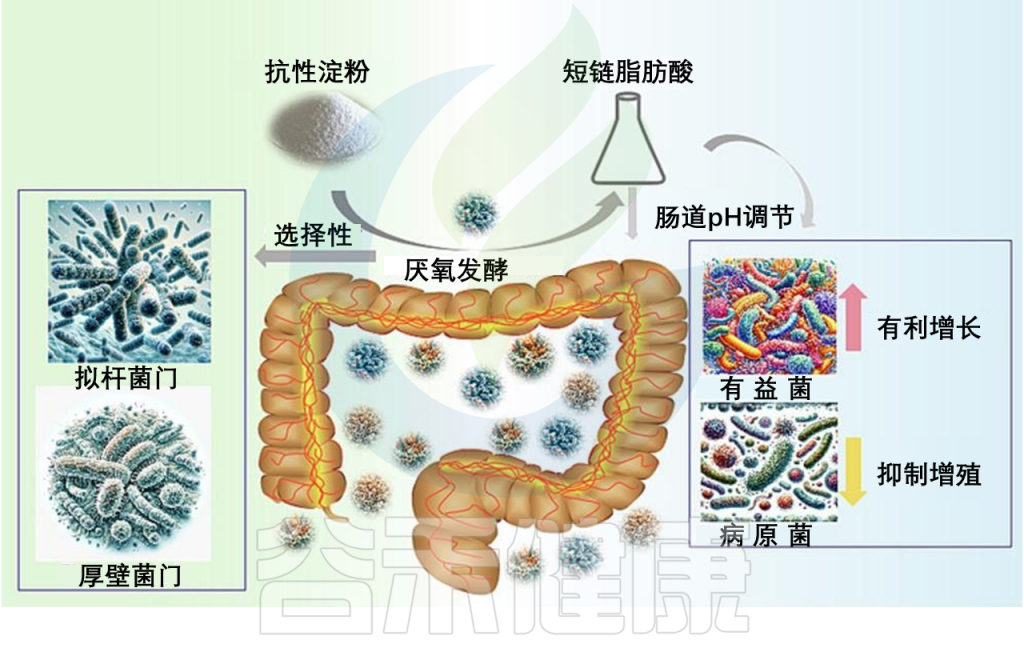
doi.org/10.1016/j.fochx.2024.101118
选择性发酵:抗性淀粉增多→有益菌随之增加
抗性淀粉发酵的另一个有趣的方面是其选择性。并非所有肠道微生物都能够有效发酵抗性淀粉;特定菌群,特别是来自拟杆菌门和厚壁菌门的细菌群,是主要的抗性淀粉发酵者。
这种选择性发酵会导致肠道微生物组成的变化。持续的抗性淀粉摄入可以促进这些抗性淀粉发酵细菌的增殖,使肠道富含有益微生物,进一步提高发酵效率和短链脂肪酸的产生。因此,抗性淀粉和肠道微生物群之间的动态相互作用有望进行有针对性的干预,有可能通过饮食策略调节肠道微生物组成和活性。
抗性淀粉为微生物发酵提供了底物,作为回报,肠道微生物会产生有益于宿主健康的代谢物。
前面我们了解了结肠中抗性淀粉发酵的机制,这里了解这一过程中的关键微生物参与者也很重要。
拟杆菌门
积极参与抗性淀粉发酵的主要群体属于拟杆菌门,尤其是拟杆菌属,拟杆菌的代谢能力使它们能够在各种复杂的碳水化合物中茁壮成长,包括抗性淀粉。它们的酶库有助于将抗性淀粉分解成更简单的单元,然后发酵以产生短链脂肪酸。
厚壁菌门
抗性淀粉发酵的另一个重要贡献者是厚壁菌门,尤其是瘤胃球菌属,瘤胃球菌是这一领域的关键物种,因其在启动抗性淀粉降解方面的无与伦比的效率。瘤胃球菌(R. bromii)进行的初步降解使抗性淀粉更易于其他微生物群进一步发酵。考虑到在摄入富含抗性淀粉饮食的个体中的统治地位,其重要性变得明显。此外,瘤胃球菌的丰度较高与改善的肠道健康状况相关,表明其潜在的保护作用。
放线菌门
虽然拟杆菌门和厚壁菌门脱颖而出,但另一个门放线菌门通过双歧杆菌属促进抗性淀粉发酵。双歧杆菌是备受推崇的益生菌,已知具有无数的健康益处。在抗性淀粉的背景下,双歧杆菌发酵它以产生短链脂肪酸,从而降低肠道 pH 值,从而创造不利于病原菌的环境。此外,抗性淀粉的双歧杆菌效应,即补充抗性淀粉导致双歧杆菌增加,已在各种研究中得到充分证明。
产甲烷古细菌
古菌,特别是产甲烷的Methanobrevibacter smithii,在抗性淀粉发酵领域也发挥作用。
M. smithii消耗其他微生物在抗性淀粉发酵过程中产生的氢气,将其转化为甲烷。这种氢气的去除至关重要,因为它防止了结肠中氢气的积累,否则可能会阻碍发酵过程。因此,M. smithii通过维持其他发酵者的适宜环境,间接支持抗性淀粉发酵过。
总而言之,结肠中的抗性淀粉发酵并不是归因于单个微生物分类群的孤立过程。这是一项涉及多个微生物群体的协同合作,每个微生物群体都为该过程及其健康益处做出了独特的贡献。
只有少数菌群如瘤胃球菌和青春双歧杆菌能够利用淀粉,这些细菌本身并不直接产生丁酸盐,而是依靠与其他肠道细菌的交叉喂养相互作用来产生丁酸盐。
他们的集体行动强调了肠道是一个代谢“器官”的概念,其中饮食成分,主要是抗性淀粉,以协调的方式代谢。
丁酸梭菌(Clostridium butyricum)是一种降解抗性淀粉的菌,能够在多种类型和来源的抗性淀粉上生长,在这个过程中产生大量的丁酸盐。它通过使用一种酶系统来实现这一点,该酶系统虽然是迄今为止在能够降解抗性淀粉的细菌中发现的最简单的酶系统,但在抗性淀粉的消化过程中表现出高度的协同作用和功能多样性。在一个生物体中,消化抗性淀粉和丁酸生产的结合有可能绕过交叉喂养网络的复杂性,而交叉喂养网络通常是抗性淀粉消耗过程中生产丁酸所必需的。
这种独特的性状组合表明,它可能作为一种与抗性淀粉协同使用的菌株,促进更广泛的丁酸反应,从而为更多人群解锁这种益生元的健康益处。
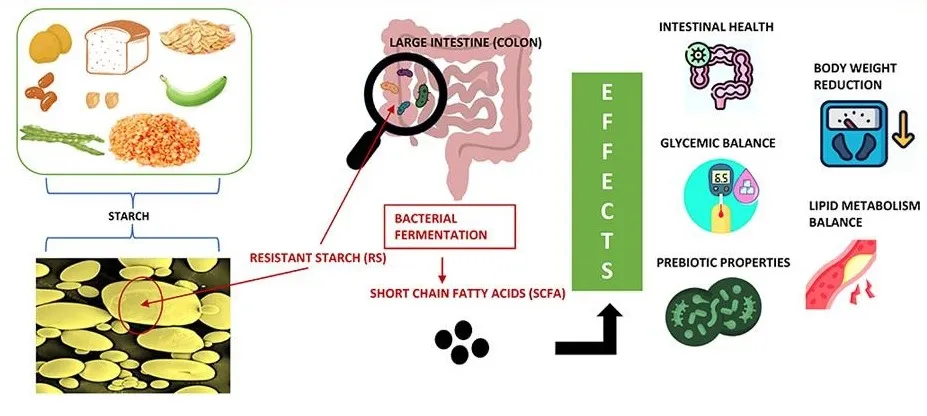
doi.org/10.1016/j.jff.2022.105094
我们了解到肠道微生物群领域及其与抗性淀粉的错综复杂互动是广阔而多层次的。抗性淀粉可以影响肠道微生物群的组成和功能,但同样明显的是,这些影响的程度和性质受到各种因素的调节。揭示这些因素可以增进我们对肠道健康复杂性的理解,并帮助更有效地定制膳食和治疗干预措施。
个体肠道微生物群的基线组成
一个主要决定因素是个体肠道微生物群的基线组成。每个人的肠道微生物群具有独特的特征,受到遗传、早期生活暴露、抗生素和饮食模式等因素的影响。引入膳食时,抗性淀粉可能会因个体肠道微生物的起始点而在个体之间产生不同效应。例如,基线拟杆菌水平较低的个体,在摄入抗性淀粉后,可能会比那些已经拥有更高丰度的个体出现这些细菌增加更显著。
不同类型的抗性淀粉会被特定菌群优先代谢
消费的抗性淀粉类型是另一个重要因素。根据其物理化学性质和来源,抗性淀粉有多种类型:RS1、RS2、RS3、RS4。每种类型可能会被特定微生物类群优先代谢。例如,瘤胃球菌对高直链淀粉玉米中的RS2表现出明显的偏好,而某些拟杆菌物种可能更青睐来自逆行淀粉的RS3。因此,膳食中包含的抗性淀粉类型可以引导微生物群变化的轨迹。
其他营养素的影响
抗性淀粉消费的膳食背景也不容忽视。其他膳食纤维、蛋白质、脂肪和微量营养素的存在可以影响抗性淀粉的可获得性和发酵性。例如,富含可溶性纤维的饮食可能通过促进有益菌(如乳杆菌)的生长来放大抗性淀粉的益生效应。相反,富含蛋白质的饮食可能会使一些结肠细菌转向蛋白质发酵,产生像氨之类的潜在有害化合物。
抗性淀粉摄入的持续时间
抗性淀粉摄入的持续时间也起着关键作用。初始引入抗性淀粉可能会导致微生物群组成的快速变化。然而,随着摄入时间的延长,微生物群可能会稳定下来,表明适应性。长期摄入抗性淀粉可以导致更具弹性和多样化的微生物群,这些微生物群更能抵抗干扰和潜在的菌群失调。
其他宿主相关因素
最后,宿主相关因素,如年龄、健康状况和遗传,调节着抗性淀粉与微生物群的相互作用。与微生物群的年龄相关变化、肠道传输时间的差异和酶活性可能会影响抗性淀粉在肠道中的发酵。同样,患有肠道紊乱症状如肠易激综合征(IBS)或炎症性肠病(IBD)的个体可能对抗性淀粉有不同反应,鉴于这些情况下肠道环境和微生物群的组成发生了改变。
总之,抗性淀粉与肠道微生物群之间的互动是一个受多种因素影响的动态过程。认识和理解这些因素对于个性化营养策略旨在利用抗性淀粉的肠道健康益处是至关重要的。这些见解呼唤着在营养和肠道健康领域采取更个性化的方法,更胜于一刀切的建议。
抗性淀粉已成为膳食的关键成分,其影响远远超出了其营养价值。抗性淀粉最重要的作用之一在于它能够维持肠道的屏障功能。这种错综复杂的粘膜细胞和细胞间连接是我们全身健康的关键,可防止病原体入侵并维持代谢平衡。鉴于肠道相关疾病的负担不断加重,了解抗性淀粉如何影响这一屏障可以为疾病预防和治疗干预提供关键的见解。
肠道屏障是一个动态和反应灵敏的系统,而不是一个静态的实体。在其核心,上皮细胞形成前线,作为对管腔环境的主要防御。
抗性淀粉促进粘蛋白分泌
抗性淀粉通过支持细胞更新和促进粘蛋白的分泌来增强上皮屏障,粘蛋白是一种糖蛋白,可润滑和保护上皮表面免受潜在病原体和研磨性食物颗粒的侵害。粘蛋白层不仅形成保护毯,还为共生细菌提供栖息地,有助于宿主和微生物群之间的双向关系。
抗性淀粉正向调节紧密连接蛋白
紧密连接蛋白,结合上皮细胞的微观结构,对于维持屏障完整性至关重要。这些蛋白质决定了屏障的渗透性,决定了哪些物质被允许通过,哪些物质仍然被排除在外。在“肠漏”的情况下,这些蛋白质会受到损害,导致肠道通透性增加。这种情况会允许不需要的物质(包括病原体和毒素)进入血液,引发全身炎症。研究表明,抗性淀粉正向调节这些蛋白质。抗性淀粉发酵产生短链脂肪酸,特别是丁酸盐,在上调紧密连接蛋白的表达、强化肠道屏障方面发挥作用。
抗性淀粉间接影响局部免疫反应
驻留在肠道粘膜内的免疫细胞为屏障的防御机制增加了另一层。在这里,抗性淀粉展示了其免疫调节能力。通过改变肠道微生物群组成,抗性淀粉间接影响局部免疫反应。它促进有益细菌的生长,进而与免疫细胞相互作用,指导它们的功能。这种串扰确保了潜在病原体的迅速消除,同时保持了对膳食抗原和共生微生物的耐受性。
抗性淀粉通过神经,免疫,血管等相互作用,间接提供保护
除了这些直接影响外,抗性淀粉诱导的肠道微生物群变化也会影响肠脑轴。肠道和中枢神经系统之间的这种双向沟通渠道对整体健康至关重要。肠道屏障功能的破坏与神经系统疾病有关,强调了抗性淀粉等膳食成分在神经保护中的重要性。
此外,肠道内的血管结构,包括血液和淋巴管,在屏障功能中发挥作用。它们确保营养吸收和免疫细胞运输。抗性淀粉通过其代谢物调节血管内皮屏障,优化营养吸收并确保有效的免疫监测。
总之,抗性淀粉与肠道屏障的细胞、免疫和血管成分错综复杂的相互作用,为应对环境挑战提供了强大的防御能力。拥抱抗性淀粉的治疗潜力可以重新定义面向胃肠道健康及其他方面的策略。
炎症是免疫系统对病原体、伤害或有害刺激发起的保护性反应,当放松管制时,可能会成为一把双刃剑。特别是在肠道内,持续的炎症会加剧从炎症性肠病发展到结直肠癌等多种疾病。人们的注意力已经转向可以调节炎症的饮食成分,其中抗性淀粉已成为一个至关重要的参与者。
抗性淀粉促进抗炎短链脂肪酸 (丁酸盐) 产生
与其他淀粉不同,抗性淀粉在小肠中抵抗消化,基本完好无损地到达结肠。一旦进入结肠,抗性淀粉就会充当某些有益肠道细菌的底物,导致短链脂肪酸的产生,主要是乙酸盐、丙酸盐和丁酸盐。值得注意的是,丁酸盐因其显着的抗炎作用而得到认可。丁酸盐通过抑制促炎细胞因子的产生来发挥作用,例如TNF-α和IL-6,它们在炎症传播中起着核心作用。
抗性淀粉影响免疫细胞分化
抗性淀粉发酵和随后的短链脂肪酸产生已被证明会影响免疫细胞分化,尤其是调节性 T 细胞(Tregs)。这些细胞在维持肠道免疫稳态方面起着不可或缺的作用。Tregs数量的增加与炎症减少有关,这证明了它们抑制异常免疫反应的能力。短链脂肪酸,特别是丙酸盐,影响幼稚T细胞分化为Tregs,确保肠道内平衡的免疫反应。
抗性淀粉影响肠道神经系统
肠道神经系统功能微妙,确保肠道蠕动和分泌,同时与免疫系统密切相互作用。肠道神经系统的破坏会导致肠道运动障碍,从而为细菌过度生长和炎症创造有利的环境。抗性淀粉通过其代谢物,尤其是丁酸盐,影响肠道神经系统功能。它有助于维持肠道神经元的健康和功能,随后促进肠道的定期肌肉收缩,最大限度地减少细菌停滞和炎症的机会。
抗性淀粉维持平衡的肠道pH值
此外,抗性淀粉可以通过调节肠道的 pH 值来影响肠道炎症。抗性淀粉发酵产生的短链脂肪酸导致结肠中的微酸性环境。这种酸度阻止了病原菌的生长,同时促进了有益共生细菌的增殖。这两个细菌群之间的平衡对于维持肠道健康至关重要,任何向致病性优势的转变,称为生态失调,都可能引发炎症。通过维持酸性 pH 值,抗性淀粉间接阻止炎症的发生和发展。
总之,抗性淀粉在调节肠道炎症中的复杂作用揭示了其潜在的治疗应用。它能够改变微生物组成,促进抗炎短链脂肪酸的产生,影响免疫细胞分化,并维持平衡的肠道pH值,这表明其在确保肠道稳态方面的多方面方法。随着肠道相关炎症的患病率不断上升,利用抗性淀粉的益处可以为提供预防和治疗潜力的新型饮食干预铺平道路。
肠道和免疫系统之间的界面是人体内最具活力的相互作用之一。我们整个免疫系统的近70%都存在于肠道内,随时准备对来自食物和病原体的各种抗原做出反应。正是在这种背景下,抗性淀粉等膳食成分占据了中心位置。抗性淀粉不仅仅是消化过程中的旁观者,它还以多种方式塑造和影响肠道的免疫反应。
抗性淀粉发酵产物,减少促炎细胞因子
抗性淀粉天然抵抗上消化道的消化,到达结肠基本保持不变。在结肠中,抗性淀粉由特定菌群发酵,导致短链脂肪酸的产生增加,主要是乙酸盐、丙酸盐和丁酸盐。除了作为结肠细胞的能量底物外,这些短链脂肪酸还调节各种免疫细胞功能。例如,短链脂肪酸可以降低炎性细胞因子的表达并增加抗炎介质,从而有效地抑制过度的免疫反应。特别是丁酸盐对中性粒细胞功能具有深远的影响,并减少炎症介质如TNF-α和IL-6的产生。
肠道相关淋巴组织 (GALT) 是免疫系统不可或缺的一部分,在维持肠道稳态方面起着至关重要的作用。在 GALT 内,树突状细胞不断对肠道的管腔内容物进行采样。这些细胞在遇到细菌代谢物(如抗性淀粉发酵产生的短链脂肪酸)时,其活性受到调节,导致调节性T细胞的产生增加,这些T细胞在控制炎症和自身免疫方面起着关键作用。此外,已经注意到短链脂肪酸对巨噬细胞的直接影响,观察到抗炎细胞因子产生增加和促炎细胞因子产生减少。
抗性淀粉增强屏障功能,减少LPS易位
抗性淀粉发酵产物会影响肠道屏障的完整性。维持肠上皮层连续性的紧密连接蛋白被短链脂肪酸上调,从而增强屏障功能,并减少细菌内毒素如脂多糖(LPS)进入体循环的易位。LPS易位减少导致内毒素血症相关免疫激活减少,有益于整体健康。
抗性淀粉促进有益菌生长,IgA升高
抗性淀粉作为一种益生元,选择性地滋养有益菌,进而积极调节免疫反应。例如,双歧杆菌和乳酸杆菌等有益细菌的富集通常与抗性淀粉消耗有关,与免疫球蛋白 A(IgA)的产生增强有关,IgA是粘膜防御中的一抗。升高的IgA水平在中和病原体和维持粘膜稳态方面起着关键作用。
从本质上讲,抗性淀粉与免疫系统之间的相互作用强调了饮食、微生物群和免疫力之间复杂的相互作用。通过其发酵产物和肠道微生物群的调节,抗性淀粉有可能成为调节免疫反应和维持肠道健康的重要膳食成分。它带来了全身益处,并为免疫调节的饮食策略开辟了途径。
抗性淀粉越来越被认为是一种重要的膳食成分,不仅因为它对肠道健康的直接影响,还因为它更广泛的代谢影响,特别是与代谢综合征有关。代谢综合征是一组疾病,包括血压升高、高血糖、腰部脂肪过多以及胆固醇或甘油三酯水平异常,会增加患心脏病、中风和糖尿病的风险。抗性淀粉减轻代谢综合征方面的潜力主要归因于其肠道微生物群发酵产物,如乙酸盐、丙酸盐和丁酸盐。
尤其是丁酸盐,在维持肠道屏障完整性方面发挥着重要作用,并具有抗炎特性,这对于对抗与代谢综合征相关的炎症过程至关重要。丁酸盐还通过增强结肠中的能量消耗和脂肪氧化,与改善胰岛素敏感性有关,胰岛素敏感性是代谢综合征的关键因素。此外,丙酸盐具有糖异生作用,有可能调节血糖水平,这对患有或有2型糖尿病风险的人至关重要。
此外,抗性淀粉在食欲调节中的作用也值得一提。随着短链脂肪酸的产生,它们会刺激厌食激素的释放,如肽YY(PYY)和胰高血糖素样肽-1(GLP-1),从而增加饱腹感并减少卡路里摄入量。这种食欲调节作用,加上对血脂和血压的潜在益处,使抗性淀粉消费成为预防或管理代谢综合征的有前途的策略。
体重管理和肥胖的全球挑战与饮食成分及其代谢结果有着内在的联系。肥胖的增加伴随着 2 型糖尿病、心血管疾病和几种癌症风险的增加,使其成为最重要的健康问题。从这个角度来看,抗性淀粉不仅作为一种膳食纤维脱颖而出,而且作为对抗肥胖症的潜在变革性膳食成分脱颖而出。
一些研究表明,抗性淀粉可能对体重管理有直接影响。一个主要机制是食物的热效应,这是消化和加工食物时消耗的能量的量度。抗性淀粉对立即消化具有抵抗力,往往会增加这种热效应,导致在大肠发酵过程中消耗更高的能量。这不仅有助于负能量平衡,还会影响脂肪储存并增强脂肪氧化,这对体重管理至关重要。此外,如前几节所述,抗性淀粉发酵导致短链脂肪酸的产生,短链脂肪酸通过释放 PYY 和 GLP-1 等激素在控制食欲方面发挥积极作用。调节食欲等同于减少热量摄入,这是体重管理的一个重要方面。
此外,抗性淀粉与改善肠道健康有关,这对肥胖有间接影响。健康的肠道生物群与更瘦的表型有关。当肠道微生物群发酵抗性淀粉时,它会导致微生物组成的变化,有利于与肥胖呈负相关的有益菌。
近日,一项针对 37 名超重或肥胖参与者的随机安慰剂对照交叉设计试验(ChiCTR-TTRCC-13003333) 中,研究人员测试了抗性淀粉作为膳食补充剂是否会影响肥胖相关的结果。
研究表明补充抗性淀粉 8 周有助于实现体重减轻(平均 -2.8 公斤)并改善体重超重个体的胰岛素抵抗。
补充青春双歧杆菌(一种与减轻研究参与者肥胖显著相关的物种)可以保护雄性小鼠免受饮食引起的肥胖。从机制上讲,抗性淀粉诱导的肠道微生物群变化会改变胆汁酸分布,通过恢复肠道屏障来减少炎症,并通过调节ANGPTL4抑制脂质吸收,提高脂肪组织对FGF21的敏感性。
次级胆汁酸,例如甘氨脱氧胆酸、脱氧胆酸、甘氨胆酸和牛磺脱氧胆酸,对于提高胰岛素敏感性和改善肝脂肪变性具有重要作用。胆盐水解酶负责次级胆汁酸的去偶联。补充抗性淀粉降低了胆盐水解酶的产生,增加了次级胆汁酸的水平。
抗性淀粉至少可以部分通过青春双歧杆菌促进体重减轻,并且肠道微生物群对于抗性淀粉的作用至关重要。
因此,持续食用富含抗性淀粉的食物可能会导致肠道环境不太容易使体重增加和肥胖。
糖尿病是一种以慢性高血糖为特征的代谢紊乱,是一个不断升级的全球健康问题,具有从个人健康恶化到国家经济负担的多方面影响。鉴于发病率不断上升,迫切需要饮食干预来缓解或可能逆转这种疾病的进展。抗性淀粉是一种引人注目的膳食成分,其多种代谢影响与糖尿病管理和血糖控制有关。
糖尿病管理的核心是调节餐后血糖和胰岛素反应。摄入抗性淀粉似乎有利地调节这些反应。与快速消化的淀粉不同,抗性淀粉不会直接导致餐后血糖峰值,因为它绕过了小肠的消化,它在大肠中的发酵会产生短链脂肪酸。特别是,丙酸盐可促进肝脏葡萄糖产生调节,降低餐后葡萄糖偏移的风险。此外,丁酸盐在促进胰高血糖素样肽-1(GLP-1)分泌中的作用。
注:GLP-1是一种增强胰岛素分泌和减少胰高血糖素释放的激素,协调血糖水平。
此外,长期服用抗性淀粉与提高胰岛素敏感性有关,这是 2 型糖尿病发病机制的关键因素。研究表明,食用富含抗性淀粉的饮食的胰岛素抵抗个体表现出胰岛素敏感性的显著改善。这种改善被认为与短链脂肪酸的抗炎特性有关,尤其是丁酸盐,以及它在减少氧化应激中的作用,氧化应激有助于胰岛素抵抗。此外,抗性淀粉培养有益肠道微生物群组成的能力对代谢健康有间接影响,进一步强调了其在糖尿病管理中的潜在作用。
莲子抗性淀粉抑制高脂血症大鼠中下列菌群的生长:
莲子抗性淀粉促进初级胆汁酸(CA、CDCA 、β-MCA)和次级胆汁酸(LCA、UDCA)的产生,降低高脂血症中TCA、DeHydro-LCA、isoLCA、LCA-3-S、THDCA的含量。
Blautia、norank_f__Muribaculaceae、norank_f__Eubacteria_coprostanoligenes_group与 DeHydro-LCA、isoLCA、TCA、LCA-3-S、 TCHO、TG和 LDL-C呈正相关。
莲子抗性淀粉通过调节肠道菌群并加速肝脏中胆固醇分解为胆汁酸来改善血脂水平。
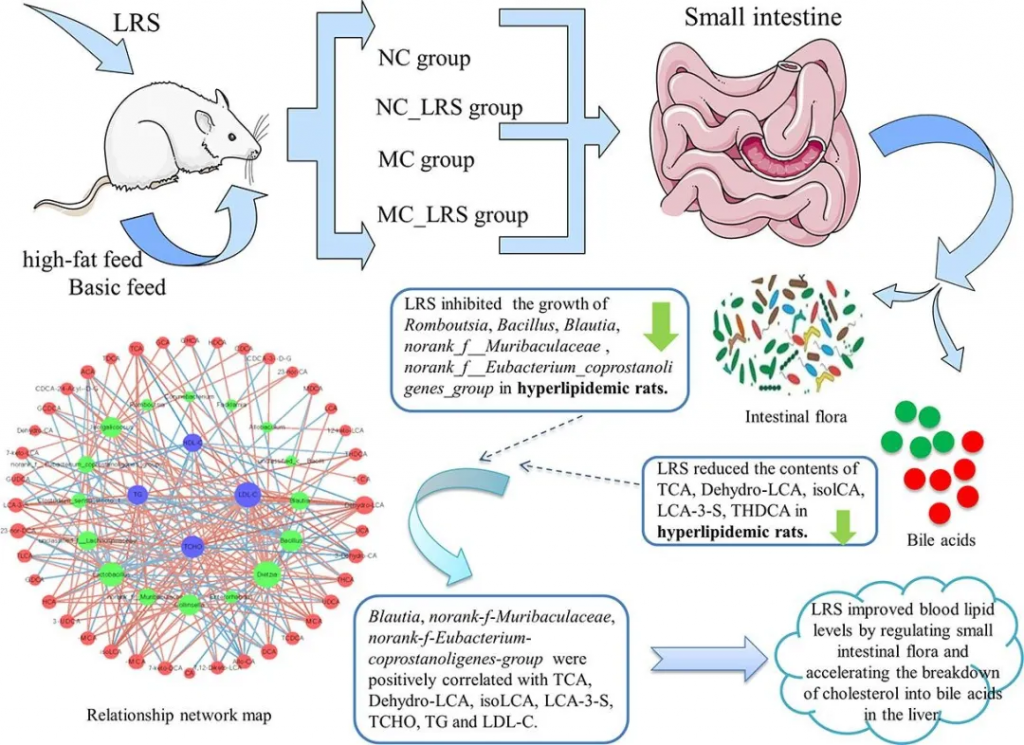
doi.org/10.1016/j.foodchem.2022.134599
认知能力下降是衰老的常见后果。缺乏纤维和高饱和脂肪的饮食模式会引发促炎症途径和代谢功能障碍,从而加剧认知障碍。新的证据强调了富含纤维的饮食对神经认知的益处以及肠道-微生物-大脑信号传导的关键作用。
经过为期20周的饮食方案,包括含有5%重量比来自芸豆(PTB)、黑眼豆(BEP)、扁豆(LEN)、鹰嘴豆(CKP)或菊糖纤维(INU)的抗性淀粉的西式饮食(实验组),与不含抗性淀粉的西式饮食(对照组),发现抗性淀粉特别是来自扁豆的抗性淀粉,可以改善西式饮食引起的认知障碍。
从机理上看,抗性淀粉通过改善肠道菌群-代谢组,包括增加短链脂肪酸和降低支链氨基酸水平,从而改善神经认知功能评估。这种肠道菌群-代谢物-大脑信号级联抑制了神经炎症、细胞衰老和血清瘦素/胰岛素水平,同时通过改善肝功能增强脂质代谢。总的来说,数据证明了抗性淀粉的益生菌效应可通过调节肠-脑轴改善神经认知功能。
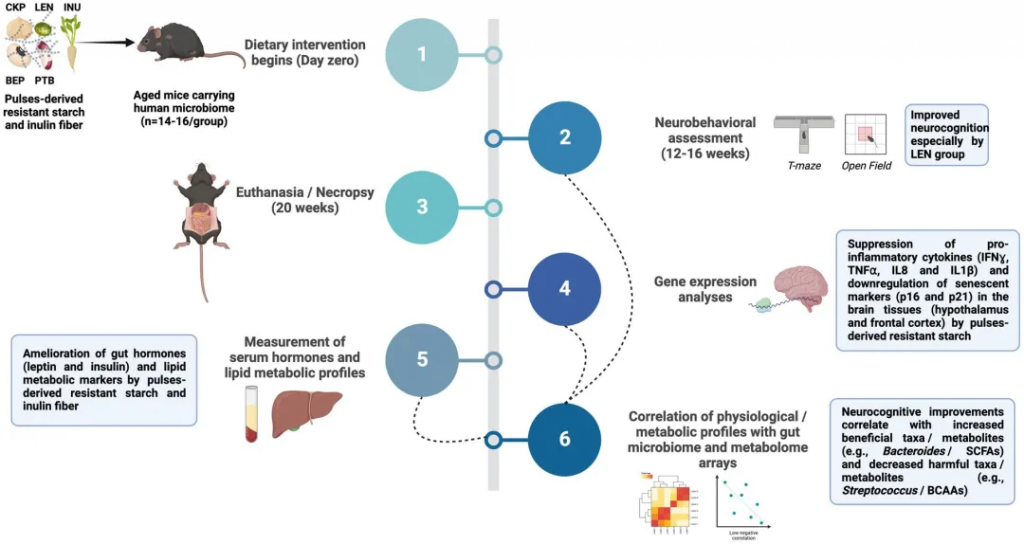
doi.org/10.3389/fnut.2024.1322201
溃疡性结肠炎是一种复杂的炎症性疾病,发病率不断上升。一项研究通过酶法分离方法从紫甘薯中获得抗性淀粉(PSPRS)。然后,研究了PSPRS的结构特性及其对葡聚糖硫酸钠诱导的结肠炎的保护功能。
结构表征结果表明,PSPRS的结晶度从CA型转变为A型,并且在酶水解过程中层状结构被完全破坏。与结肠炎小鼠相比,PSPRS给药以剂量依赖性方式显著改善病理表型和结肠炎症。
ELISA 结果表明,给予PSPRS的结肠炎小鼠表现出较高的 IL-10 和 IgA 水平,但较低的 TNF-α、IL-1β 和 IL-6 水平。同时,高剂量(300 mg/kg)的PSPRS显著增加了乙酸盐、丙酸盐和丁酸盐的产生。
16S rDNA高通量测序结果显示,PSPRS治疗组中厚壁菌门与拟杆菌门的比例以及潜在益生菌水平显著增加,如乳杆菌、Alloprevotella, 毛螺菌科_NK4A136_组、双歧杆菌。同时,高剂量 PSPRS 显著抑制了拟杆菌属、葡萄球菌属和阿克曼氏菌等有害细菌 (p < 0.05)。因此,PSPRS有潜力成为促进肠道健康、缓解溃疡性结肠炎的功能食品。
慢性肾病是与心血管疾病、发病率和死亡率风险增加相关的主要健康问题。最近的研究表明,慢性肾病的进展可能与肠道菌群的变化有关。抗性淀粉是一种膳食纤维,可以作为微生物发酵的底物。一些研究发现补充抗性淀粉可以改善慢性肾病患者的肠道菌群紊乱。
在 2022 年随机对照试验的荟萃分析中,发现补充抗性淀粉可以降低患有透析患者血液中硫酸吲哚酚、磷、IL-6和尿酸的水平。
抗性淀粉还对肠道环境产生有益影响,包括增加Ruminococcus bromide。
Ruminococcus brucei是厚壁菌门的主要成员之一,是一种主要的抗性淀粉发酵菌株。通过其针对抗性淀粉的特殊活性,Ruminococcus brucei从淀粉中释放能量以逃避宿主酶的消化。此外,摄入富含抗性淀粉的食物可以增加肠道短链脂肪酸水平,调节微生物代谢物,并改善葡萄糖稳态和胰岛素敏感性。
通过摄入抗性淀粉,胆固醇和甘油三酯降低,胰岛素敏感性提高,可以大大降低代谢综合征的发生率。慢性肾病患者也可能受益于更好的葡萄糖代谢、血脂水平和更好的体重管理。
近年来,富含抗性淀粉(RS)的食物因其多方面的健康益处而受到越来越多的关注,从肠道健康到调节全身新陈代谢。
益处
作为一种必需的膳食成分,抗性淀粉与典型的淀粉不同,主要是由于其对小肠消化的抵抗力,它基本上完好无损地到达大肠,在那里它作为微生物发酵的底物,产生有益的代谢物,如短链脂肪酸。
抗性淀粉中天然丰富的食物包括青香蕉、豆类、全谷物和某些类型的煮熟然后冷却的食物,如土豆和米饭。食用此类食物的好处之一是它们有可能增强血糖控制。富含抗性淀粉的食物具有较低的升糖指数,转化为较慢的餐后血糖升高。这一特性对患有糖尿病等代谢紊乱的人特别有益。此外,抗性淀粉发酵产生的短链脂肪酸,特别是丁酸盐,丁酸盐是结肠细胞的主要能量来源,并具有抗炎特性,使其对结肠健康不可或缺。
注意事项
抗性淀粉摄入量的快速和大量增加会导致胃肠道不适,包括腹胀、胀气和排便习惯改变。通常建议逐渐将富含抗性淀粉的食物引入饮食中,以使肠道微生物群有时间适应。此外,患有某些健康状况的人,例如患有肠易激综合征(IBS)或特定碳水化合物不耐受的人,应谨慎对待富含抗性淀粉的食物,并在专业指导下。抗性淀粉的发酵有时会加剧这些人的症状。
总之,虽然富含抗性淀粉的食物具有许多健康益处,尤其是在肠道健康和代谢调节方面,但个人应注意摄入饮食中的抗性淀粉的来源和数量。
最好取得平衡:优化健康益处,同时最大限度地减少潜在的不利影响。
抗性淀粉的作用超越了其个人益处,使其成为各种饮食模式和制度的关键成分。
地中海饮食
例如,当考虑因其保护心脏的益处而广受赞誉的地中海饮食时,我们发现豆类,抗性淀粉的天然来源,是其成分的基石。经常食用豆类,其丰富的抗性淀粉含量不仅有助于增强肠道健康,还有助于与这种饮食模式相关的心脏保护作用,因为抗性淀粉具有调节餐后血糖反应的潜力。
旧石器饮食
旧石器时代的饮食,俗称旧石器饮食,是另一个有趣的领域,其中抗性淀粉找到了相关性。对旧石器饮食的当代解释集中在块茎和某些根的消费上,当通过特定方法制备时,例如烹饪后冷却,这些根会富含抗性淀粉。这证实了我们的祖先可能已经消耗了大量的抗性淀粉,为他们的肠道微生物群提供了可发酵的底物。从理论上讲,肠道微生物与其宿主之间的共生关系已经共同进化了数千年,而抗性淀粉可能是推动这一进化过程的关键饮食元素。
低碳和生酮饮食
低碳水化合物和生酮饮食,在减肥和代谢健康方面很受欢迎,通常会限制淀粉的摄入。然而,将抗性淀粉整合到这些饮食中可以提供明显的优势。由于抗性淀粉不表现出与普通淀粉相同的消化率,因此它的加入不会显著提高血糖水平。这意味着这种饮食的人可以获得抗性淀粉的好处,例如增强肠道健康和饱腹感,而不会影响酮症或低碳水化合物方案的状态。从根本上说,抗性淀粉允许当代饮食方法之间的共生关系,重点是减肥或代谢益处,以及滋养肠道微生物群的古老进化重要性。
将抗性淀粉纳入饮食中不仅要承认其生理益处,还要了解其最佳摄入量并融入各种饮食中,以最大限度地发挥其潜力。随着越来越多的证据描绘抗性淀粉的多方面优势,从调节肠道微生物群到调节血糖水平,向更广泛的公众提供可操作的指南变得至关重要。
循序渐进
首先,身体可能需要一些时间来适应饮食中添加抗性淀粉。因此,需要循序渐进逐步添加。
添加少量抗性淀粉。例如,早餐中加入一根绿色香蕉,午餐中加入四分之一杯扁豆。
食物中获取
最好从食物中获取抗性淀粉,常见的食物补充包括:青香蕉、豆类(豌豆、扁豆)、全谷物(燕麦和大麦)、煮熟并冷却的米饭。
注:增加纤维摄入量时,要慢慢喝大量的水,以减少胃肠道副作用。

补充剂
补充性抗性淀粉通常以粉末形式服用,可混合到食品或饮料。如绿色香蕉粉、木薯粉等。
烹饪,可进一步提高抗性淀粉的含量
必须认识到并非所有抗性淀粉来源都是一样的。虽然豆类、全谷物和某些块茎天然富含抗性淀粉,但烹饪方法可以进一步调节其抗性淀粉含量。例如,烹饪然后冷却土豆或米饭等淀粉类食物可以增加其抗性淀粉含量,提供了一种直接的策略来提高饮食中的抗性淀粉水平,而无需任何剧烈变化。
抗性淀粉的推荐每日摄入量通常在 15-30 克之间。这可以通过多样化的饮食来实现,包括冷意大利面沙拉、隔夜燕麦或豆类菜肴等食物。
考虑个人的消化耐受性的重要性
抗性淀粉摄入量的突然激增会导致一些人的胃肠道不适。因此,谨慎的做法是在几周内逐渐增加抗性淀粉的摄入量,让肠道进行调整。此外,将富含抗性淀粉的食物与益生菌食物(如酸奶或开菲尔)相结合,可以产生协同效应,为有益的肠道细菌茁壮成长营造一个好的环境。与任何饮食改变一样,应根据个人口味、健康状况和饮食习惯定制抗性淀粉,确保方法既平衡又可持续。
抗性淀粉作为益生元可以调节肠道微生物群,对于肠道菌群失调相关的许多疾病包括炎症性肠病、肠易激综合征、结直肠癌等具有重要意义,为这些疾病辅助治疗的潜在用途奠定了基础。
抗性淀粉的另一个治疗意义在于其抗炎特性。慢性炎症在心血管疾病、2型糖尿病和某些癌症等多种疾病的发病和进展中发挥着关键作用。肠道微生物群发酵抗性淀粉会产生短链脂肪酸,尤其是具有抗炎作用的丁酸,可以抑制促炎细胞因子,使抗性淀粉成为减轻炎症引起的疾病的潜在候选者。
抗性淀粉也有望成为对抗肥胖和相关并发症的饮食策略。鉴于其调节饱腹感、提高胰岛素敏感性和调节脂质代谢的能力,抗性淀粉可以作为代谢综合征和相关病症的辅助或预防措施。例如,将抗性淀粉纳入饮食中可以改善糖耐量受损个体的餐后葡萄糖反应,强调其潜在的治疗相关性。
抗性淀粉在个性化营养方面的潜力也不容忽视,但仍需谨慎对待。剂量、持续时间和个体差异在决定抗性淀粉在任何治疗应用中的功效方面发挥着关键作用。
个体对抗性淀粉的反应可能存在很大差异。年龄、遗传、肠道微生物群组成和整体健康状况等因素会影响人们处理抗性淀粉摄入及益处。例如,摄入相同量抗性淀粉的两个人可能会表现出不同的餐后葡萄糖反应或结肠中不同的短链脂肪酸产生情况。此外,肠道微生物群将抗性淀粉发酵成有益代谢物的能力在个体之间可能有所不同,特别是在微生物群多样性高的人和微生物群较少的人之间差异较大。
这种个体差异突出了个性化营养方法的必要性。与其采取一刀切的抗性淀粉摄入建议,不如根据个人独特的代谢和菌群特征来定制饮食建议。随着深入探索个性化医疗时代,整合肠道菌群数据或许能为优化个人抗性淀粉摄入、获得健康效益提供更精准的建议。
主要参考文献:
Chen Z, Liang N, Zhang H, Li H, Guo J, Zhang Y, Chen Y, Wang Y, Shi N. Resistant starch and the gut microbiome: Exploring beneficial interactions and dietary impacts. Food Chem X. 2024 Jan 3;21:101118.
Li H, Zhang L, Li J, et al., Resistant starch intake facilitates weight loss in humans by reshaping the gut microbiota. Nat Metab. 2024 Mar;6(3):578-597.
Junejo SA, Flanagan BM, Zhang B, Dhital S. Starch structure and nutritional functionality – Past revelations and future prospects. Carbohydr Polym. 2022 Feb 1;277:118837.
Arp CG, Correa MJ, Ferrero C. Modified celluloses improve the proofing performance and quality of bread made with a high content of resistant starch. J Sci Food Agric. 2023 Apr;103(6):3041-3049.
Du X, Wu J, Gao C, Tan Q, Xu Y. Effects of Resistant Starch on Patients with Chronic Kidney Disease: A Systematic Review and Meta-Analysis. J Diabetes Res. 2022 Jul 18;2022:1861009.
Tekin T, Dincer E. Effect of resistant starch types as a prebiotic. Appl Microbiol Biotechnol. 2023 Feb;107(2-3):491-515.
Wang, Z.; Gao, M.; Kan, J.; Cheng, Q.; Chen, X.; Tang, C.; Chen, D.; Zong, S.; Jin, C. Resistant Starch from Purple Sweet Potatoes Alleviates Dextran Sulfate Sodium-Induced Colitis through Modulating the Homeostasis of the Gut Microbiota. Foods 2024, 13, 1028
Chen R, Zhang C, Xu F, Yu L, Tian F, Chen W, Zhai Q. Meta-analysis reveals gut microbiome and functional pathway alterations in response to resistant starch. Food Funct. 2023 Jun 6;14(11):5251-5263.
Kadyan S, Park G, Hochuli N, Miller K, Wang B, Nagpal R. Resistant starches from dietary pulses improve neurocognitive health via gut-microbiome-brain axis in aged mice. Front Nutr. 2024 Jan 24;11:1322201.
Pickens TL, Cockburn DW. Clostridium butyricum Prazmowski can degrade and utilize resistant starch via a set of synergistically acting enzymes. mSphere. 2024 Jan 30;9(1):e0056623.

谷禾健康

糖,作为我们日常饮食中不可或缺的一部分,不仅为我们提供能量,还影响着我们的健康。然而,糖与健康的关系比我们想象的要复杂得多。
它们可以是单糖(例如葡萄糖、果糖、半乳糖)或二糖(例如蔗糖、麦芽糖、乳糖)或更复杂的形式(例如聚合物或多糖)。
然而,当这些类型的糖作为成分添加到加工食品中以赋予甜味时,它们通常与慢性疾病相关的过量糖摄入有关。例如,添加糖与代谢综合征、肥胖、心脏病、胰岛素抵抗、脂肪生成、糖尿病和相关的视网膜病、肾脏疾病和炎症有关。
糖与这些疾病之间的联系至少部分是通过肠道微生物组实现的,这意味着现有糖和新型甜味剂消耗的增加,改变了微生物组可用的碳水化合物库,在肠道中创造了独特的环境,包括充满了外源微生物或经过适应的内源微生物,其中一些是致病性的。
高糖摄入量会通过肠道微生物群的平衡,例如,改变变形菌门和拟杆菌门的比例,从而增加促炎特性、降低免疫调节功能和降低调节上皮完整性的能力。高肪高糖饮食通过消耗 Th17 诱导微生物促进代谢疾病。
有时候明明知道糖或甜食不能吃多,可就是忍不住… 超加工食品和垃圾食品以及添加糖和人造甜味剂等成分会改变肠道中的微生物组成。这会增加有害菌数量,不利于健康,然而,当我们吃这些食物越多,相关有害菌越繁殖,增加我们对某些食物的渴望,从而陷入恶性循环中。
为了了解糖类对我们健康的影响,我们需要清楚地了解它们是什么、有何不同,以及为什么某些类型被认为“不太健康”,而另一些类型“更有利于健康”,不同种类的糖会影响不同的菌群,本文我们来了解一些关于糖的基本知识,探讨不同种类的糖对肠道菌群和健康的影响,以及如何通过饮食调节来优化肠道菌群,从而促进全身健康。
▼
糖从哪里来?
最早人们从咀嚼甘蔗中感受到甜味,甘蔗种植可以追溯到公元前9000年~6500年之间的大洋洲。后来甘蔗种植传到中国。
起初,糖仅限于医疗用途,是贵族的奢侈品。但在17世纪,南美和加勒比地区出现了奴隶经营的糖料种植园,降低了糖的成本,增加了糖的供应。从那时起,糖被添加到日常食品中,如茶、水果、面包和肉类,工人阶级也能享用,成为西方生活的必需品。
随着人们对糖的了解越来越深入,从最初对糖的简单使用,到逐渐认识到糖的多样性和复杂性。
膳食糖包括不同来源的糖,可以是天然存在的或添加的。目前有几种膳食糖的定义,其中包括添加糖、游离糖、总糖等。认识不同类型的糖之间的区别,对于更好地理解糖摄入量与健康之间的关联至关重要。
“天然糖”: 即天然存在于食物中的糖,如水果中的果糖和葡萄糖,牛奶中的乳糖等。这些糖是食物固有的成分,通常与食物中的其他营养成分(如纤维、维生素和矿物质)共同存在。
“添加糖”,即在食品加工和制备过程中添加的所有糖和糖浆。它们不包括牛奶、水果和蔬菜中的天然糖分。
含糖饮料是饮食中添加糖的最大来源。这些糖不是食物固有的成分,而是额外添加的。添加糖常见于加工食品、饮料、甜点和调味品中。过量摄入添加糖与肥胖、糖尿病、心脏病等健康问题密切相关。
“游离糖”,根据世界卫生组织的定义,包括制造商、厨师或消费者添加到食品中的所有单糖和双糖,以及天然存在于蜂蜜、糖浆和果汁中的糖。成人摄入量要控制在每日能量的10%以内。
完整水果中天然存在的糖以及母乳或婴儿配方奶粉、牛/羊奶中天然存在的乳糖,以及无糖奶制品不是游离糖。
可以看到,一般来说,游离糖和添加糖没有太大区别。因此,如果看到一些食品标签写着「无游离糖」、「无添加糖」其实都是差不多意思。
“总糖”,包括食物中天然存在的所有糖以及添加的糖。例如牛奶和水果中的糖以及产品中可能存在的任何添加糖。
这些定义自然包括所有单糖和双糖。
注:单糖如葡萄糖、果糖、半乳糖,是最基本的糖单元,不能再分解为更简单的糖。
双糖如蔗糖、乳糖、麦芽糖,由两个单糖分子组成。
糖的常见膳食来源
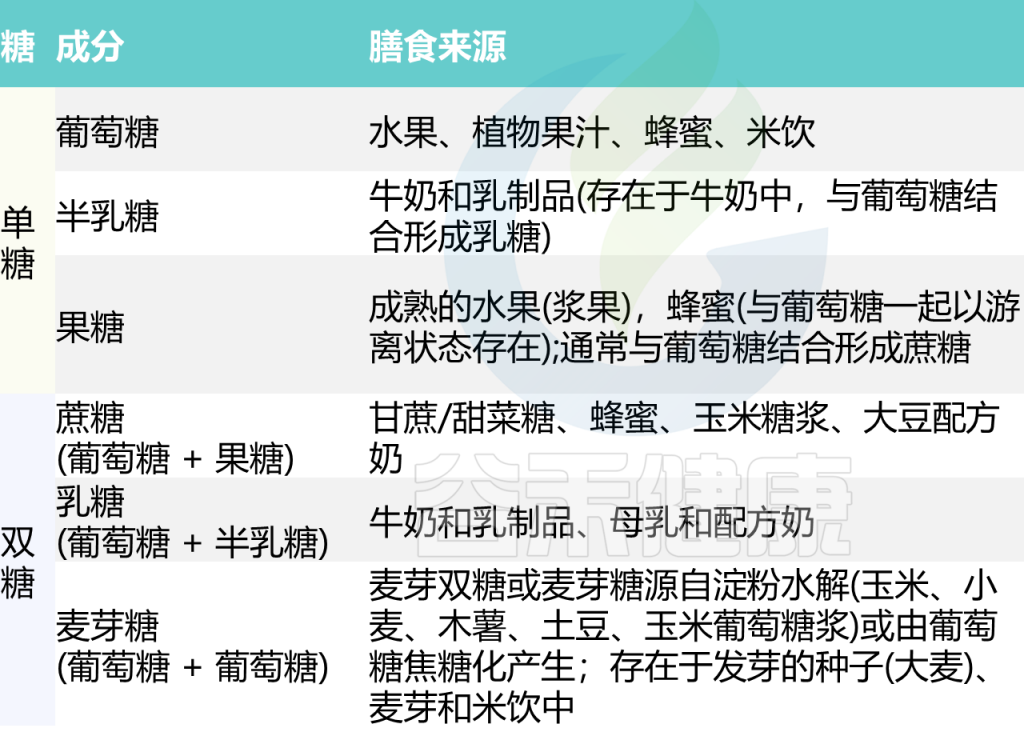
10.1097/MPG.0000000000001733
首先,根据《GB28050-2011预包装食品营养标签通则》:
当食物或饮料中的单双糖含量≤ 0.5g/100(固体)或100 mL(液体)时,可以标注为“无糖”、“不含糖”或“0糖”。
低糖一般指固体产品每100克中含糖量不超过5克,或液体每100毫升中含糖量不超过2.5克。
“0蔗糖”,就是没有添加蔗糖。我们常见的糖,比如说白砂糖、冰糖、红糖、黄糖、黑糖的主要成分都是蔗糖。也就是没有添加白砂糖这类糖。
市面上所谓的无糖食品,如无糖糕点、无糖月饼、无糖粽子等,这些食品只是不放蔗糖,但是有别的果糖,木糖醇等。所以严格来说,也不是没有糖。
果糖GI(升糖指数)较低,对血糖更友好;不易产生龋齿;增强口感等诸多优势,成为了不少所谓无糖食品的甜味来源。
不要以为只有蛋糕、饼干、甜甜圈和糖果等含有添加糖,添加糖隐藏在许多意想不到的食物中,例如加工冷冻食品、婴儿食品、干果、谷物、麦片、即食燕麦片、沙拉酱、番茄酱、烧烤酱、意大利面酱、调味酸奶、蛋白质棒等,甚至一些有机食品和其他健康食品中。
加工食品中的隐形糖
食品制造商在生产“低脂”和“脱脂”产品时,通常会提高糖含量以保持风味和质地。有些高档饮料可能含有比你想象的更多的糖,有时候午餐吃的“健康”沙拉上的“精简”调味料也是如此。
糖的主要功能是它们的甜味。所有糖都会传达一定的甜味感觉,但甜味的强度、质量和时间分布(定义为强度随时间的变化)因糖的类型而异。
普通糖的相对甜度值占等浓度蔗糖甜度的百分比
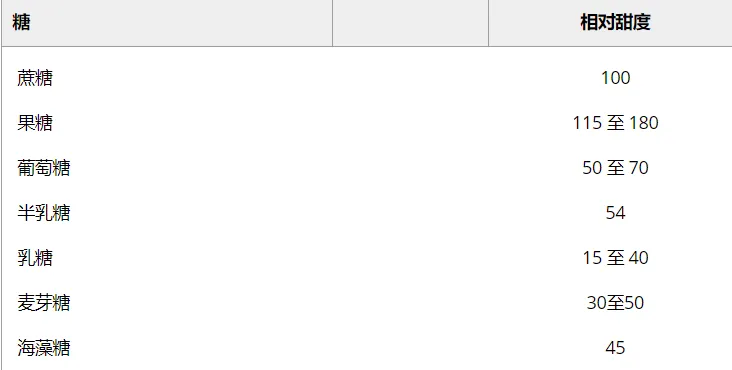
doi.org/10.1111/1541-4337.12194
不同糖类食物升高血糖的速度和程度不同,用GI值表示。葡萄糖的GI值定义为100,其他食物与之比较。
也就是说,高GI的食物会快速升高血糖,身体分泌大量胰岛素使血糖快速下降,造成饥饿感,导致吃的更多,恶性循环。
高 GI 被定义为 70 或更高,与面包、早餐麦片或大米有关,精制的糖通常GI值较高,蔗糖的GI为65。
用加工过的谷物或其他碳水化合物来源代替蔗糖可能会导致升糖指数更高,从而对血糖反应产生更大的影响。
而低 GI 被定义为 55 或更低,与豆类、面食、水果和乳制品有关,天然全食中的糖GI值较低。
果糖的GI值非常低。
并非所有加工食品都具有高 GI,也有中等 GI 的加工食品与蔗糖相当,包括各种巧克力或谷物棒、蛋糕或某些早餐谷物。
很多人都喜欢各式各样的糖,它为食物和饮料增添了风味,包括甜点、糖果、奶茶、冰淇淋、汽水等。然而,随着人们对健康饮食意识的提高,糖分摄入对健康影响的讨论也日益增多。糖分的摄入不仅关系到口感享受,更与我们的身体健康紧密相连。
注:适用于人类饮食的糖一词是一个统称。例如,食糖基本上是纯蔗糖,而果汁、蜂蜜和糖浆通常含有蔗糖、葡萄糖、果糖和不同的低聚糖。这里说的“糖”包括所有这些术语。
从有利的角度来说,糖是身体的首选燃料来源,也是日常活动的必需营养素。当我们吃糖时,我们的系统中有消化酶将其分解成葡萄糖,这是细胞所需的能量形式。糖也会以糖原的形式储存在肌肉和肝脏中,以供将来用作能量。
当你处于饥饿或禁食状态时,肝脏中储存的葡萄糖会通过糖原分解和糖异生的过程释放出来,为肌肉提供稳定的燃料流并保持血糖稳定。
当你吃东西时,胰岛素激素会刺激糖酵解的过程,将吃的糖分解成能量。身体需要持续供应葡萄糖,这就是为什么每隔几个小时吃一次各种碳水化合物来源很重要。
没有糖,你可能会难以集中注意力和记住事情,如果糖不足,可能会感到疲劳,甚至出现脑雾等。
糖能让我们快乐,有些人甚至经常渴望吃糖。当吃糖时,大脑中会释放负责愉悦奖励和动机的神经递质多巴胺。吃糖和甜食的动力很大程度上是由多巴胺系统控制的,这就是为什么当你吃甜食时,情绪会发生变化。
但任何食物都讲究适量,过量摄入糖分也会给身体带来一系列的健康问题。
影响大脑功能
过多的添加糖会改变大脑的功能,并与认知能力下降和退行性疾病(如阿尔茨海默病和痴呆)有关。
2019 年一项针对 1,200 多名 60 岁以上马来西亚成年人的研究发现,过量摄入糖与较差的认知功能有关。
影响血糖
食用大量精制碳水化合物和添加糖会导致血糖急剧上升,你可能会在一段时间内感到精力充沛,但是这种短期修复可能会让你更加难受,陷入迟钝和疲劳。
它还可能导致胰岛素抵抗,从而导致长期高血糖。随着时间的推移,高血糖会对神经、心脏、眼睛和肾脏的小血管造成损害。
对于患有糖尿病或其他代谢疾病的人来说,即使是适量的糖也可能过多,这涉及代谢的问题,我们后面会详细讲。
影响体重
含糖产品,尤其是饮料,不会让你感到饱腹,而糖分的飙升会让你感觉更饿。饥饿感的增加会导致你吃得比你需要的多,甚至暴饮暴食。
增加压力
吃糖还会让人上瘾。甜食可以在短期内降低压力荷尔蒙皮质醇的水平,但从长远来看,它们可能会引起问题。糖会在大脑中释放舒缓的化学物质。问题在于,这种感觉良好的效果是暂时的,一旦消失,就会导致摄入更多的糖。
皮肤老化更快
过量糖分与皮肤老化加速有关,皮肤的弹性和紧致度主要依赖于胶原蛋白。糖化产物AGEs通过与这些蛋白质结合,使它们硬化和断裂,导致皮肤失去弹性和紧致度,加速出现皱纹和松弛。
糖化过程还会产生自由基,增加氧化应激,损伤皮肤细胞,干扰细胞的正常功能和修复过程,还可能激发炎症反应。
增加患慢性病的风险
过量添加糖会增加体内炎症和氧化应激,从而损害器官和组织。过量食用添加糖还与心血管疾病、 2型糖尿病、非酒精性脂肪肝和认知能力下降等慢性疾病的风险增加有关。
以上是我们了解到糖对人体直接影响,接下来我们逐步深入到糖在体内如何被处理,以及它如何间接通过影响肠道微生物群来影响健康。
糖进入人体内是如何消化的?
食用后,糖代谢在口腔内开始。口腔微生物组具有代谢糖的能力;然而,并非所有口腔微生物都以同样的方式代谢糖。变形链球菌被认为是口腔中与龋齿有关的关键微生物。
● 蔗糖长期以来被认为是最容易致龋的糖源。
● 乳糖致龋性低于葡萄糖、果糖、麦芽糖和蔗糖。
● 海藻糖的致龋性比蔗糖低,并且可能具有抗致龋特性。
注:糖并不是导致龋齿的唯一饮食因素。膳食来源的淀粉还可以直接通过微生物的新陈代谢或通过其在口腔中有限的水解成糖来促进龋齿。
在胃中糖的消化较少。食物进入小肠后,消化过程加速。胰腺分泌的胰液中含有多种消化酶,如淀粉酶,继续分解糖分子。小肠壁上的细胞也产生酶,如蔗糖酶、乳糖酶和麦芽糖酶,这些酶帮助将双糖分解成单糖,如葡萄糖和果糖。
单糖通过小肠壁的特殊运输蛋白被吸收进入血液。葡萄糖的吸收主要通过两种机制进行:
葡萄糖和半乳糖的“搬运工”:SGLT1、GLUT2
它们主要通过一种叫做SGLT1的”搬运工“被吸收。它位于肠细胞面向食物的一侧。SGLT1会抓住葡萄糖和半乳糖,同时也会抓住钠离子,然后把它们一起带进肠细胞内。这个过程像坐电梯,要消耗能量,通过Na+K+-ATP酶把钠离子泵出肠上皮细胞。
注:SGLT1,钠葡萄糖连接转运蛋白-1,是肠道中主要的葡萄糖转运蛋白(和传感器)
当葡萄糖和半乳糖进入肠细胞后,会遇到另一位”搬运工”叫GLUT2。GLUT2会把它们从肠细胞的另一侧送出去,进入我们的血液。然后,血液会把这些糖类运送到肝脏,供身体使用。
GLUT2 的神经元在大脑的不同区域充当葡萄糖传感器,有助于控制葡萄糖稳态和进食行为。
果糖:GLUT5搬运工数量有限,果糖吸收不良
而果糖的吸收方式有点不同。它主要通过一位叫做GLUT5的”搬运工”进入肠道细胞内,这个过程不需要消耗能量。然后和葡萄糖、半乳糖一样,果糖也通过GLUT2进入血液,最后到达肝脏。
不过,由于GLUT5这个”搬运工”的数量有限,而且很容易被果糖占满,所以果糖的吸收速度比葡萄糖和半乳糖要慢一些。
当单独大量摄入果糖(不含葡萄糖)时,会超过正常的果糖吸收能力,导致果糖在远端小肠和结肠中通过。这会导致胃肠道不适,包括痉挛和腹泻。这种现象被称为果糖吸收不良。
常见膳食糖和甜味剂的使用和吸收
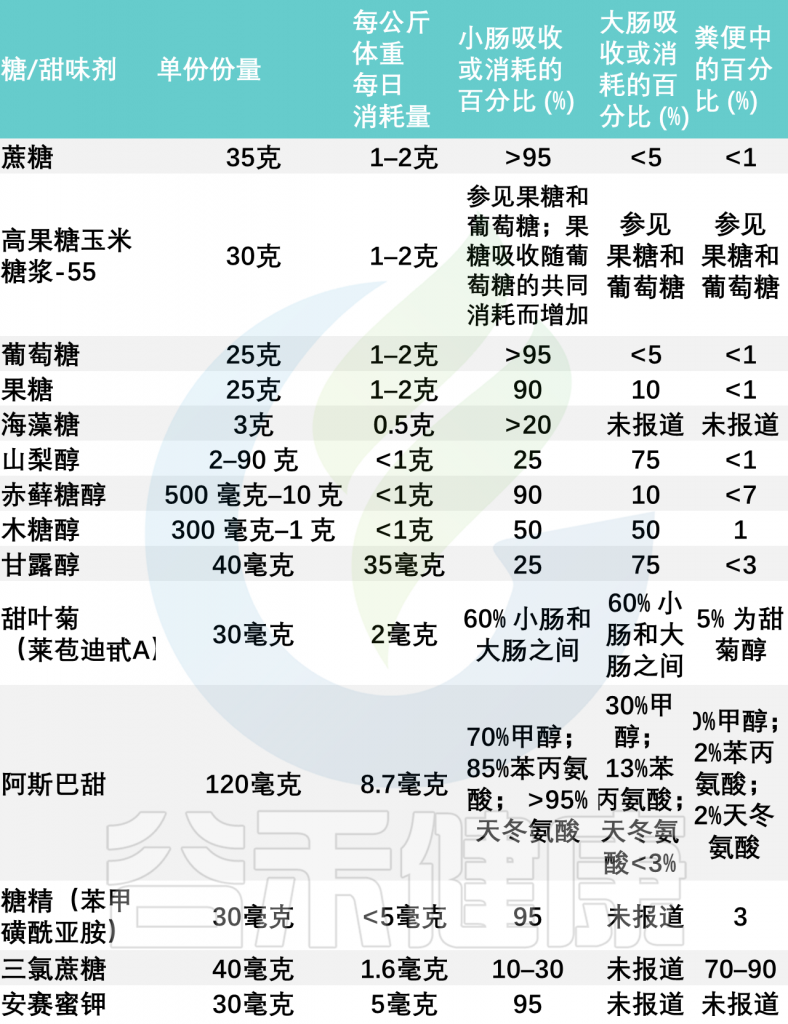
doi: 10.1093/advances/nmz118
大多数糖和甜味剂通过糖转运蛋白在小肠中被主动吸收,因此,与大肠相比,小肠肠道环境中的糖和甜味剂含量丰富约10倍。这些可用糖是小肠微生物的重要底物。
当然,大肠中也并不缺乏糖和甜味剂。果糖、糖醇和一些甜味剂(例如三氯蔗糖)在小肠中被动地、缓慢地或非常差地吸收,高达 30-90% 的糖和甜味剂会进入大肠。过量食用这些糖和甜味剂很容易导致吸收不良并溢出到大肠。在那里它们成为肠道微生物的食物来源。这可能带来肠道菌群的变化,导致胃肠道不适和其他健康问题。
肠道菌群对糖的适应
宿主糖/甜味剂吸收、微生物产物和不同肠道条件的复杂性,会导致肠道内产生过多的肠道微环境。
“餐厅假说”——不同微生物觉得舒适的区域不同
在餐厅假说中,每一个环境都可以看作一家提供不同食物的餐厅,微生物在最能满足其营养和环境需求的环境中茁壮成长,这个环境就是它的生态位,且这个环境中来自其他微生物的竞争最少。
肠道从头到尾像是一个微生物主题公园,不同区域有不同的”餐厅“和”居民“。这就是肠道微生物的”生物地理学”。
沿着肠道找到的微生物变化,可能取决于肠道不同部位存在的糖/甜味剂的变化。微生物就好比食客,环境提供什么,它们就吃什么,最终你在哪里找到它们,取决于哪里有它们最爱的食物。
当然,相同的微生物可以存在于多个不同的、空间上分离的微环境中。也就是说微生物可以在不同的餐厅吃,为了最好地利用每种微环境,相同的微生物可能需要不同的调节、代谢和遗传适应。
这就可以理解为什么有些微生物在适应的环境是好的,在特定条件或特定肠道位置就开始致病。
微生物对糖的适应能力让它们在各种环境中生存并发挥作用,从而也会影响到人体健康。
碳水化合物改变肠道菌群的能力主要依赖于这些底物的不可消化或可消化性质。
可消化的碳水化合物,例如蔗糖或乳糖,通过一系列胃肠道酶降解为单糖(例如葡萄糖、果糖)后在小肠中被吸收。
果糖、糖醇和一些非营养性甜味剂(例如三氯蔗糖)在小肠中被动、缓慢或吸收很差,并溢出到大肠。这种动态会导致肠道菌群发生显著改变,包括微生物多样性减少以及与代谢健康状况相关的某些细菌门的相对丰度改变。
高糖饮食:拟杆菌门↓↓ 变形菌门↑↑
促炎,破坏肠道屏障
摄入大量葡萄糖、果糖或蔗糖的饮食模式会导致肠道微生物多样性的丧失,其特征是拟杆菌门比例降低和变形菌门比例增加。
变形菌占健康肠道微生物群的一小部分,但如果它们批量增加,可能会发生炎症。该门内的γ-变形菌纲和肠杆菌科携带脂多糖(LPS)分子,这些分子是炎症反应的强烈触发因素。
该门内的γ-变形菌纲和肠杆菌科携带脂多糖(LPS,内毒素)分子,这些分子是炎症反应的强烈触发因素。
在肠上皮细胞中,LPS 诱导IL-8的释放,这是一种负责诱导炎症反应的关键趋化因子,进而改变紧密连接并导致上皮完整性受损。
而拟杆菌属是拟杆菌门中的优势属,它能很好地适应竞争激烈的肠道环境,并利用复杂的植物和宿主衍生的多糖。该属与许多健康益处有关,包括下调肠道炎症反应。
变形菌门和拟杆菌门之间的平衡,在维持肠黏膜的免疫稳态和上皮完整性方面发挥作用。与此一致,一项研究表明,IBD患者粪便微生物群中肠细胞IL-8表达水平与肠杆菌科呈正相关,而拟杆菌属、普雷沃氏菌属和脆弱拟杆菌的丰度降低。
高糖饮食:短链脂肪酸↓↓ 促炎,破坏肠道屏障
过量摄入膳食糖会减少肠道中短链脂肪酸的产生,这可能导致肠道屏障受损。这会导致中性粒细胞浸润迅速增加,同时加速脂多糖(LPS)的转移。LPS与TLR4结合,激活核因子-κB(NF-κB)信号通路,最终诱导炎症因子IL-6、IL-1β和TNF-α的产生。
另一方面,过量的膳食糖含量使脆弱拟杆菌和普雷沃氏菌大量繁殖,从而破坏肠黏膜。同时,可溶性糖细菌Sutterellaceae的相对丰度增加,而属于厚壁菌门的Lachnospiraceae和Lactobacillaceae的丰度下降,最终增加了炎症细胞因子IL-6、TNF-a、Lcn2、Cox2的水平。中性粒细胞浸润增加和炎症因子产生加重了IBD的发生和发展。
膳食糖对肠道微生物组的调节
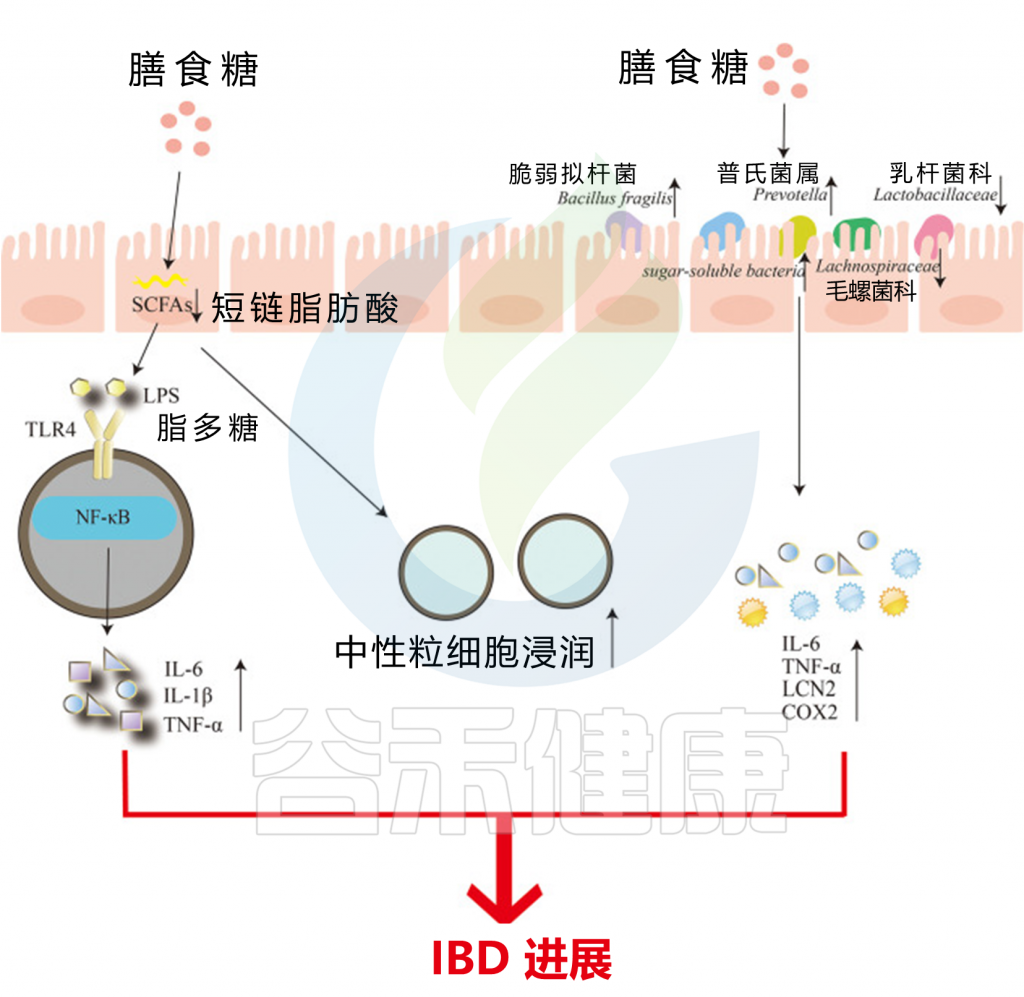
doi : 10.3389/fimmu.2022.988481
糖介导的巨噬细胞炎症
高水平的饮食糖导致TLR4活性增加,进而激活下游的NF-κB和MAPK信号通路,从而促进炎症因子IL-6、IL-1β和TNF-α的上调。此外,膳食糖介导的树突状细胞和中性粒细胞炎症也是通过激活 TLR4 来实现的。
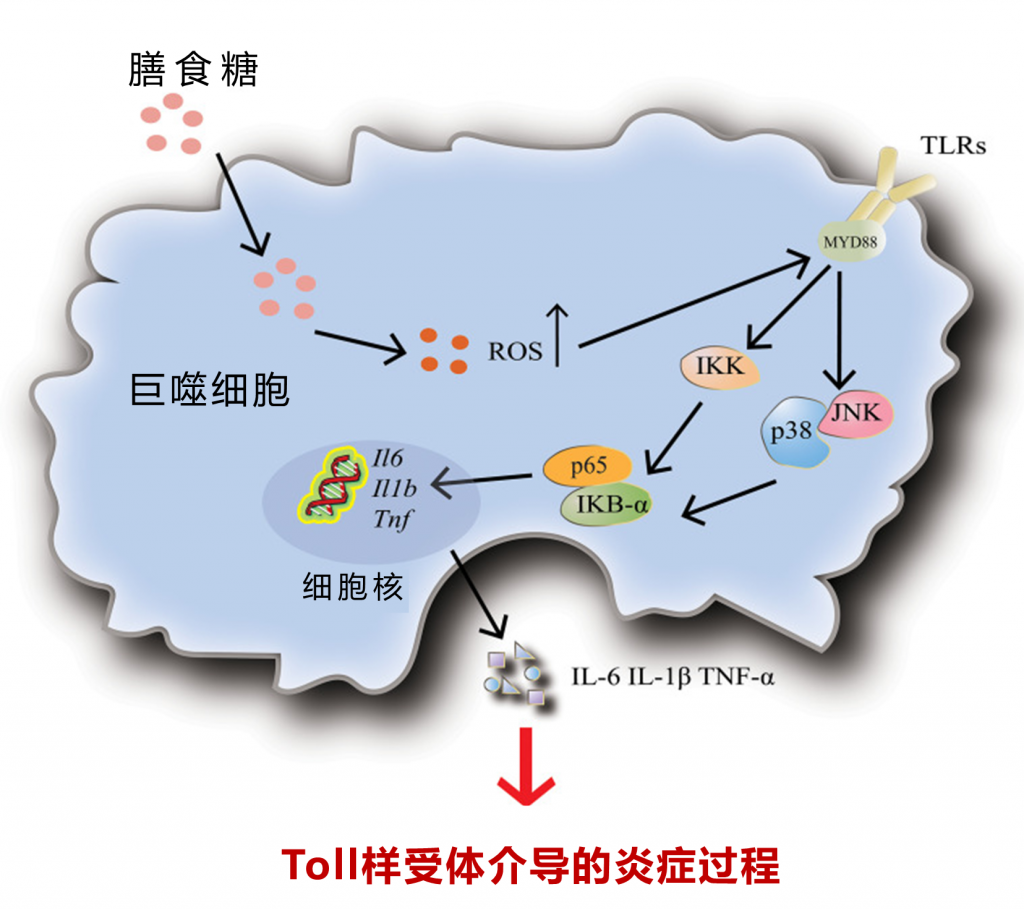
doi : 10.3389/fimmu.2022.988481
类风湿关节炎(RA)是由遗传、环境和内源性因素引起的最常见的全身性慢性自身免疫性疾病之一。其特点是全身炎症和持续性滑膜炎。
近年来大量研究表明,含糖饮料在类风湿性关节炎的发病机制中发挥着关键作用。在一项后续调查中,研究人员发现,与不喝含糖饮料的女性相比,每天喝 1 美元含糖饮料的女性患血清阳性类风湿关节炎的风险更高,尤其是 55 岁以上的女性。
随后的一项研究表明,含糖饮料导致类风湿关节炎,除了在自身免疫镶嵌中发挥重要作用外,还在于它更有可能改变微生物群,从而影响下游炎症途径。大量摄入葡萄糖、果糖和含糖饮料会减少肠道中的有益菌群,尤其是普雷沃氏菌,它被发现与类风湿关节炎的发病机制有关。此外,与高糖西方饮食相比,地中海饮食可以降低类风湿关节炎的发病率。
多发性硬化症(MS)是一种中枢神经系统自身免疫性疾病,其症状影响全身多个系统,包括视力障碍、运动障碍、疲劳、认知和情绪障碍、疼痛等。
一项研究指出,患有多发性硬化症的受试者比对照组摄入更多的碳水化合物。
虽然高糖饮食对多发性硬化症的影响尚未在临床研究中得到证实,但在多发性硬化症的疾病模型中发现,高葡萄糖和高蔗糖饮食可以加重实验性自身免疫性脑脊髓炎(EAE)的病情进展。
一方面,高糖饮食可以直接作用于CD4+ T细胞,通过诱导T细胞分化为Th17细胞,从而增加EAE小鼠体内Th17细胞的比例。
另一方面,高糖饮食通过改变肠道微生物组结构刺激 Th17 细胞分化并加剧 EAE。
牛皮癣是一种慢性炎症性皮肤病,其特征是表皮角质形成细胞异常增殖和分化。
新的研究数据表明,饮食成分(简单的糖和脂肪)而不是肥胖本身会加剧牛皮癣。西方饮食激活了IL-23信号通路,进一步增加了IL-23刺激后γδT细胞中IL-17A的产生。细胞因子IL-17A对于皮肤炎症的全面发展是必需的。
同时,IL-23 过度表达,导致喂食西方饮食的小鼠微生物多样性下降和明显的肠道菌群失调。当 IL-23 释放后,小鼠从西方饮食转向标准饮食时,皮肤炎症减少,肠道微生物群部分逆转。
因此,牛皮癣患者应考虑少糖的健康饮食模式。
炎症性肠病(IBD)是一种慢性炎症性胃肠道疾病,主要包括克罗恩病和溃疡性结肠炎。肠道中的共生菌群和粘液层对于体内平衡至关重要,因为它可以防止病原微生物的入侵和粘附,并有助于维持肠道屏障的完整性。
近年来,由于西方饮食(即高脂和高糖饮食)在世界各地的同步兴起,IBD也已成为全球健康问题。最近的临床和实验研究表明,高脂肪饮食可能是IBD的触发因素,但高糖在IBD发病机制中的作用仍存在争议。
一项具有里程碑意义的研究表明,2 型糖尿病可通过肠上皮细胞的转录重编程和改变紧密粘附连接的完整性而导致肠屏障功能障碍;它还可以通过引起肠道微生物代谢敏感性的变化来增加疾病风险。
此外,基于人群的研究表明,约 10% 的 IBD 患者认为吃含糖食物会引发病情发作并使症状恶化。在一些前瞻性研究中,还发现食用高果糖玉米糖浆和 含糖饮料与 IBD 风险呈正相关。
生命早期过量摄入添加糖会通过肠道微生物群对记忆功能产生负面影响。
糖改变了肠道菌群,尤其是显著增加了Parabacteroides丰度,特别是P. distasonis和P. johnsonii,与记忆表现呈负相关。
在幼年大鼠中实验性富集这些Parabacteroides物种也会损害记忆功能,表明糖诱导的Parabacteroides在认知缺陷中起因果作用。这些发现突出了肠-脑轴在介导早期生活饮食对神经认知发育影响方面的重要性。
在采用回顾性和纵向方法的情况下,发现高糖饮食与重度抑郁或抑郁症状之间存在显着相关性。
我国的一项大型研究发现,每周饮用四杯或以上 含糖饮料(特别是软饮料或苏打水)的人,与饮用少于一杯的人相比,抑郁症状的患病率增加了一倍。另一项研究发现,每天摄入超过 500 mL 含糖饮料的人患抑郁症和自杀意念的风险增加 60%。
其他研究表明高糖饮食会导致焦虑、压力、多动和行为问题。当然,研究要应对大量混杂因素,需进一步研究其相关性。
成瘾和多巴胺能改变
摄入美味食物,包括糖,刺激下丘脑腹侧被盖区(VTA)释放多巴胺,激活奖赏通路(从VTA到NAcc),这可以超越饱食信号。
反复接触美味食物会改变中脑边缘多巴胺回路,破坏稳态控制,强化食物线索,增加进食。
这些多巴胺能信号通路被认为对奖赏动机和记忆至关重要,特别是情景记忆和工作记忆。
奖赏通路的激活导致糖的寻求和摄入增加。多巴胺信号传导的改变可导致NAcc可塑性降低,这会导致成瘾病例中的记忆损害。
在大鼠模型中,过量摄入糖会引起成瘾的迹象,表现为暴饮暴食、戒断、抑郁样行为、奖赏寻求增加等。
间歇性糖摄入导致NAcc胞外多巴胺增加,脑啡肽mRNA表达减少,以及与戒断相关的阿片样修饰。糖还激活下丘脑(饱食和饥饿行为的主要调节器),抑制生长素和瘦素的产生,减少饱腹感,促进过度摄入。
肠道菌群紊乱和神经炎症
高脂肪和高糖饮食通过减少保护性微生物数量、影响肠黏膜、破坏紧密连接和增加细菌易位而损害肠壁通透性,导致炎症细胞因子信号增加。
人类和动物研究表明,糖摄入会显著改变肠道菌群。
果糖与粪肠球菌和嗜热链球菌(两种具有抗炎特性和促进肠道健康的有益菌)显著负相关。
使用高果糖饮食的啮齿动物研究,微生物群的剧烈变化、促炎细胞因子增加、抗炎细胞因子减少、肝脏脂质积累和神经炎症。这些损伤被观察到独立于体重或热量摄入而发生。
肠壁通透性的结构损伤使脂多糖进入血流,激活Toll样受体-4,导致促炎细胞因子过度产生。
这种低度全身炎症被称为代谢性内毒素血症,可导致几种慢性炎症状况,果糖诱导的菌群失调引发小鼠海马神经炎症和神经元丢失,可能突出了与糖和肥胖相关的神经和精神障碍的潜在机制。
代谢综合征是一组健康状况,例如高血糖,它们共同增加心血管疾病和糖尿病的风险。
根据小鼠实验,饮食、肠道细菌和免疫细胞之间错综复杂的关系有助于预防肥胖和其他代谢状况。
哥伦比亚大学的研究人员发现,在小鼠体内,某些肠道细菌通过诱导辅助性T17(TH17)细胞水平上升,有助于预防代谢综合征的疾病。作者发现,这些免疫细胞减少了肠道对脂质的吸收。
高脂肪、高糖饮食消除了有益细菌,但给小鼠补充细菌可以防止它们患上肥胖和代谢综合征。仔细观察该饮食中的成分发现,其高糖含量促进了Erysipelotrichaceae的生长,从而杀死了免疫调节细菌。
从饮食中去除糖可以防止小鼠出现肥胖或代谢综合征,但前提是这些动物仍然含有细菌诱导的 TH17细胞。
糖尿病是最常见与糖摄入相关的疾病。糖是否是糖尿病的独特原因或促成因素是另一个有争议的问题。许多前瞻性和回顾性研究的结果各不相同且不一致。然而,大多数研究发现糖,特别是果糖和含糖饮料摄入量与2 型糖尿病 (T2DM) 风险呈正相关。
食用含糖饮料会导致胰岛素信号受损以及空腹血糖和胰岛素增加,这种关联在女性中尤其明显。
来自 175 个国家的重复横截面数据的计量经济学模型表明,糖分与糖尿病风险呈剂量依赖性显着相关,糖分减少与糖尿病发病率下降相关。
也有一项对照干预试验的荟萃分析显示,在能量匹配的替代研究中,当糖被替换为其他宏量营养素时,含糖饮料并不会对血糖控制产生不利影响。只有当饮食摄入过多卡路里时,含糖饮料才会对血糖控制产生有害影响,这表明能量平衡而不是饮食中的糖本身是导致2型糖尿病发展的关键因素。
膳食糖可扩大病原体,并消除在代谢疾病中协调保护性肠道免疫反应的共生细菌
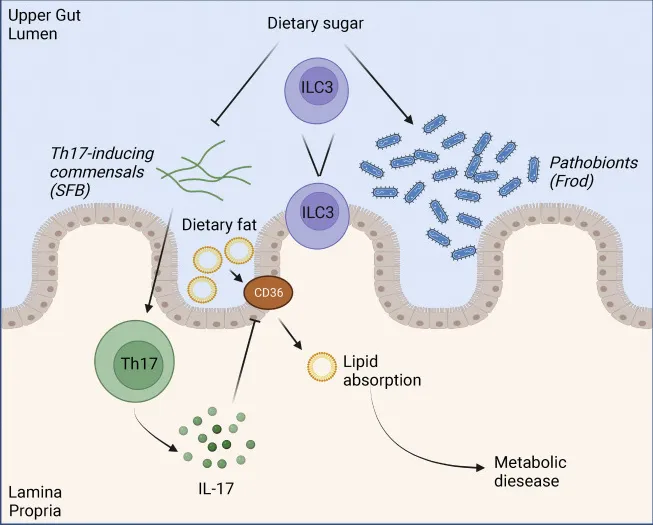
doi.org/10.1016/j.cmet.2022.09.006
注:Frod, Faecalibaculum rodentium; SFB, 分节丝状菌
膳食蔗糖支持一种致病菌(Frod)的生长,该致病菌在上肠中超过SFB,这是一种需要ILC3的反应。共生SFB诱导Th17免疫,通过下调脂肪酸转运蛋白CD36的表达来抑制脂质吸收。膳食糖导致诱导Th17的SFB丢失,促进过度脂质吸收,在小鼠饮食诱导的代谢性疾病早期阶段促进过度肥胖。
自 1975 年以来,全球肥胖率增加了两倍,而糖消费量的下降以及肥胖人数的持续增加,这是为什么呢?一种解释认为这种转变是由代际延迟引起的。由于儿童消费往往预示着成人肥胖,因此成人肥胖(例如,40-70 岁)的增加反映了 20 世纪50年代-80年代儿童饮食不良。
另一种提出的解释是从传统糖向糖替代品(低热量、人工甜味剂)的转变,2008 年至 2015 年间,全球糖替代品的年增长率约为 5.1%。近年来的研究开始调查这些糖替代品的影响,并发现特定甜味剂与肥胖、心血管疾病及其他疾病之间的联系。
接下来,我们来看看甜味剂对肠道菌群有哪些影响,如何通过肠道菌群影响健康。
多元醇(也称为糖醇),多元醇的常见例子是木糖醇、山梨糖醇、赤藓糖醇、甘露醇、异麦芽糖醇、麦芽糖醇和乳糖醇。
多元醇与肠道菌群组成和功能之间的关系在不同的动物模型中也得到了强调。
木糖醇是一种五碳多元醇,天然存在于水果、浆果、蔬菜、燕麦和蘑菇中,其甜度为蔗糖的95%。人体也会产生一小部分。木糖醇常用于无糖糖果和口香糖。
在较高剂量下,木糖醇引起双歧杆菌属、乳酸杆菌属和Erysipelotrichaceae的丰度增加,而Blautia和葡萄球菌的含量减少。
山梨糖醇,是一种异构多元醇,天然存在于苹果,梨,桃子,杏子和一些蔬菜中。IBS患者对山梨糖醇有不良的胃肠道反应,对健康个体是安全的,在高剂量时具有通便作用,大多数健康个体可耐受∼10 g 山梨糖醇/天,仅伴有轻微的胃肠道不适,例如肠胃胀气或腹胀。
几项研究表明,山梨糖醇的摄入会扰乱肠道菌群。相应地,接受10%山梨糖醇(2.07 g/day)16天的雄性Wistar大鼠表现出盲肠和结肠中乳酸杆菌丰度和丁酸盐水平的增加。
异麦芽酮糖醇用于泡泡糖、明胶、巧克力、涂料、烘焙食品和酸奶。它能量低,不致龋,并且与其他多元醇一样甜。异麦芽酮糖醇的未消化或未吸收部分到达结肠并由肠道微生物群发酵;摄入的异麦芽酮糖醇的发酵部分为∼90%。
临床试验:
一项研究测试了19个人连续4周每天消费30克异麦芽糖醇在交叉设计中的效果,以及额外4周的安慰剂对照干预,每天30克蔗糖。与安慰剂相比,异麦芽糖醇显著提高了双歧杆菌数量。因此,异麦芽糖醇可能有助于健康的结肠环境。
乳糖醇是一种非天然存在的糖醇,通过乳糖氢化而得。与其他多元醇相比,其甜味能力有限,因此通常与强甜味剂结合使用。乳糖醇可作为益生元增强肠道微生物群,不致龋。
临床试验:
低剂量的乳糖醇(每天10克)在75个人身上测试7天,增加了双歧杆菌群,这导致了乙酸和乳酸的增产。这一事实可能有助于交叉喂养,其他细菌可以产生丙酸和丁酸。
在40个人身上测试了通过巧克力棒逐步补充麦芽糖醇,持续6周,达到每天45.6克,增加了双歧杆菌。
注:这几项研究都是在2006年到2010年间发表的,文献中极少有其他关于多元醇的最新人类研究。

doi.org/10.3390/diabetology3040042
口服不同的非营养性甜味剂会也出现肠道菌群失调的情况。
糖精是一种水溶性酸,在pH值较低的环境中易被吸收。在人体中,85%-95%的摄入糖精作为完整分子被吸收,因为它不经历胃肠道代谢。一旦被吸收,它就会与血浆蛋白结合,分布到全身,并通过主动管状运输从尿液中排出。少量未吸收的糖精通过粪便排出,高浓度的非营养性甜味剂可能改变肠道微生物群的组成。
当给予 0.1 mg/mL 糖精 10 周时,肥胖雄性小鼠表现出葡萄糖耐量受损、罗伊氏乳杆菌减少以及粪便拟杆菌属和梭状芽胞杆菌目增加。
连续 6 个月服用 0.3 mg/mL 糖精,引发肝脏 TNF-α 和 iNOS(诱导型一氧化氮合酶)过度表达,同时Turicibacter、棒状杆菌、Roseburia丰度增加,瘤胃球菌含量和Anaerostipes降低。
临床试验:
一项研究调查了7天内相当于每天360毫克的糖精补充对七名健康人的葡萄糖耐受性和微生物变化的影响。研究人员发现,在补充前后发展出较差的血糖反应的个体中,微生物群的变化更为明显,即拟杆菌属过度,而Clostridiales不足。
每天补充180毫克糖精(可接受日摄入量[ADI]的20%)对20个个体的肠道微生物群、血液代谢组和葡萄糖耐受性的影响,并与另外五组各包含20个个体的对照组和非营养性甜味剂补充组进行了比较。
糖精显著增加了普雷沃氏菌和Bacteroides xylanisolven的水平。普雷沃氏菌与基线时的葡萄糖耐受性测试增量曲线下面积(GTT-iAUC)呈正相关,而Bacteroides xylanisolven与此曲线呈负相关。作者认为这些变化是有害的。实验期间丁酸也增加了。大多数微生物顶级负荷与糖酵解和葡萄糖代谢有关。
三氯蔗糖(E-955)是一种低热量、无营养的合成甜味剂,其结构与蔗糖非常相似。像糖精一样,三氯蔗糖不会被人体代谢;然而,与糖精不同的是,大多数摄入的三氯蔗糖通过胃肠道在粪便中被排出,其余到达肾脏进行尿液排泄。
大鼠每天服用 1.1、3.3、5.5 或 11 毫克/公斤的三氯蔗糖 12 周后,体重增加,拟杆菌、双歧杆菌、梭菌和乳杆菌数量减少。
临床试验:
一项研究调查了高剂量的三氯蔗糖(每天780毫克)连续7天对34名男性干预组和对照组的肠道微生物群及代谢反应的影响,补充后肠道微生物群没有变化。
然而在另一项研究中,20个个体每天补充102毫克的三氯蔗糖,为期2周,确实改变了肠道微生物群,在试验期间增加了Eubacterium 和Dorea longicatena。Eubacterium与基线时的葡萄糖耐受性测试增量曲线下面积(GTT-iAUC)呈正相关,而Eubacterium与之呈负相关。作者认为这些变化是有害的。大多数微生物顶级负荷与嘌呤代谢相关。
阿斯巴甜是市场上使用最广泛的糖替代品之一,当它被人体加工时,在肠道酯酶和肽酶的作用下产生3种常见的代谢产物包括天门冬氨酸、苯丙氨酸和甲醇,类似于水果、果汁、发酵饮料在体内的分解。
甜叶菊是一种灌木,属于菊科,由于甜味强度高,由甜菊糖苷引起,因此被用作天然无热量甜味剂。
临床试验:
一项研究测试了240毫克/天(占ADI的8%)阿斯巴甜对20个健康个体2周内的影响,并发现它改变了肠道微生物群,Bacteroides fragilis(脆弱拟杆菌)、Bacteroides acidifaciens(产酸拟杆菌)和Bacteroides coprocola(粪拟杆菌)的丰度增加,许多微生物顶级负荷与多胺代谢有关。
此外,在这次干预中,每天摄入180毫克(占ADI的75%)的甜叶菊也改变了肠道微生物群:
两种Prevotella减少了,而Bacteroides coprophilus、Parabacteroides goldsteinii和一种Lachnospira增加了。几种微生物顶级负荷与脂肪酸生物合成有关。
甜味剂对肠道菌群的影响

doi.org/10.3390/diabetology3040042
低聚糖在自然界中广泛存在,常见于某些蔬菜、水果和全谷物中。低聚糖是由3-10个单糖分子通过糖苷键连接而成的碳水化合物,准确来说,它们不属于单糖双糖类的范畴,比单糖和双糖的结构更复杂一些,且低聚糖对甜味影响微乎其微,这里我们主要来了解一下它们的益生元作用以及对肠道健康的其他益处。
肠道益生菌通过细胞外降解和/或完整内化以进行细胞内水解,将功能性低聚糖用作能量来源。不可消化的功能性低聚糖的同化可改善益生菌的生长和活性,同时改变短链脂肪酸、氨基酸和胆汁酸代谢物的产生。肠道微生物群及其代谢物相结合,可以逆转宿主肠道微生物群的动态平衡失调并修复肠道损伤。这些代谢物还激活肠道中的先天性和适应性免疫反应,有助于减轻肠道炎症和屏障功能障碍。
低聚半乳糖在食品加工过程中具有较高的稳定性,可用于食品应用。此外,低聚半乳糖比果糖玉米糖浆具有更高的溶解度、更好的保湿能力、更低的甜度(蔗糖的三分之一)和更高的粘度。这些特性为食品提供了令人愉悦的味道、质地特性和口感的改善。
低聚半乳糖的益生元潜力
实验和临床研究证明, 低聚半乳糖选择性地促进双歧杆菌的生长,增加乙酸盐和丙酸盐的产量。
在含有成人型微生物群的动态且经过验证的大肠模型中,确定了长双歧杆菌、双歧杆菌、链状双歧杆菌、加氏乳杆菌、唾液乳杆菌参与 GOS 发酵和代谢。
低聚半乳糖对肠道健康的影响
低聚半乳糖可有效缓解小鼠结肠炎,改善体重减轻症状并减少结肠缩短。它通过抑制结肠分泌白介素 (IL)-6、肿瘤坏死因子 (TNF)-α 和髓过氧化物酶来调节炎症反应。
低聚木糖因其成本竞争力、热稳定性和 pH 稳定性、感官特性以及对人类健康的多维影响,而具有作为食品成分的巨大潜力。
低聚木糖天然存在于竹笋、水果和蔬菜中,而商业低聚木糖通常源自木质纤维素材料,如玉米芯、稻草、麦麸、甘蔗渣、竹子等。
XOS已显示出多种有益作用,包括刺激益生元的生长、减少肠道内的腐败产物、降低血液胆固醇水平和抑制血糖水平。
低聚木糖的益生元潜力
XOS可以抵抗上胃肠道的消化,并选择性地刺激结肠中有益细菌的生长/活性,从而有利于宿主的健康。 DP 为 2-5 的低聚木糖作为唯一碳源可显着改善体外乳杆菌、双歧杆菌和拟杆菌的生长。
支链低聚木糖的发酵速度缓慢可能有利于益生菌的生长和丁酸的积累。此外,低聚木糖还能抑制病原微生物的生长,如肠球菌、大肠杆菌、艰难梭菌和产气荚膜梭菌。
低聚木糖对肠道健康的影响
与传统化疗策略相比,低聚木糖可能是肠道免疫干预的有用替代品。来自杏仁壳的部分O-乙酰化和脱乙酰木寡糖对大鼠胸腺细胞表现出直接的免疫刺激作用,增强了T细胞有丝分裂原诱导的增殖。
甘露寡糖是新兴的益生元,具有许多生物活性特性,可以刺激各种类型肠道益生菌的生长,并在胃肠道的不同部位释放有益的发酵产物。此外,甘露寡糖通过在结肠细胞中诱导不同的基因标记物,表现出抗癌和免疫调节作用。
甘露寡糖的益生元潜力
不同来源的甘露寡糖表现出不同的益生元活性。
甘露寡糖的结构影响其被益生菌利用的情况。分子量较低的甘露寡糖具有更好的细胞扩散性和分子移动性,因此更容易被利用。
甘露寡糖对肠道健康的影响
甘露寡糖可以直接激活肠道巨噬细胞,并抑制DSS诱导的促炎介质的产生。
壳寡糖表现出良好的理化性质,如低粘度和高溶解度。而且它们在人体肠道内很容易降解消化并进入血液循环,是理想的营养食品添加剂。
壳寡糖的益生元潜力
壳寡糖作为一种天然抗菌剂,不仅能抑制多种致病细菌、真菌和病毒的生长,而且对益生菌具有增殖作用。
带正电的壳寡糖与带负电的细胞壁成分结合,从而改变微生物膜的渗透性、细胞质膜屏障功能和/或微生物细胞的营养物质运输。
抗菌活性与壳寡糖的结构特征和靶微生物的类型有关。
壳寡糖对肠道健康的影响
壳寡糖已被公认具有抗炎活性,因此可能在炎症性肠病治疗中具有巨大潜力。
壳寡糖可以在生长、侵袭和转移阶段干扰癌细胞的增殖。
婴儿配方奶和母乳之间的主要区别之一是 HMO。 HMO 是母乳中继乳糖和脂质之后的第三大固体成分,占母乳总量的 1%。可以帮助肠道菌群增殖,抑制病原体粘附,从而有助于婴儿身体和免疫系统的发育。
人乳低聚糖的益生元潜力
到目前为止,已经研究了几种 HMO 成分的益生元作用,可以改变肠道微生物组成。
HMO 对病原微生物具有抗粘附作用。
HMO 的益生元活性,高度依赖于其组成和结构特征以及菌株特异性。
人乳低聚糖对肠道健康的影响
人乳低聚糖可通过调节肠道微生物群的生长和代谢,以及激活黏膜和全身免疫应答,有益于肠道健康。
母乳喂养可显著保护婴儿和幼儿期腹泻,降低发病率和死亡率。

HUIZENG HU / Getty Images
世界卫生组织建议,成人和儿童每日添加糖摄入量不应超过总能量摄入的10%,进一步降低到5%会有额外的健康益处。但是控糖不是马上能做到,以下方式或许能帮你控制糖摄入量。
调节肠道菌群缓解糖摄入的危害
★ 增加膳食纤维的摄入
膳食纤维是有益菌群的”粮食”,可以促进有益菌的生长,抑制有害菌的繁殖。同时,膳食纤维还能增加饱腹感,减少对糖的渴求。
关于膳食纤维详见:膳食纤维对代谢健康和肥胖的影响
★ 特定植物化学物质
姜黄素是一种从姜黄中提取的主要生物活性化学成分,已被发现具有一系列神经保护作用,包括减少淀粉样蛋白负荷、神经炎症、氧化应激、感染和炎症。
研究表明,姜黄素通过多种途径抑制高果糖引起的炎症。
在一些临床试验中,食用姜黄素后,血浆葡萄糖和甘油三酯的降低以及β细胞功能和afamin水平的改善也很明显。
姜黄素丰富了有益的肠道菌群,包括科水平上的Oscillospiraceae和Rikenellaceae ,属水平上的Oscillibacter、Alistipes、Pseudoflavonifractor、Duncaniella、Flintibacter。这些微生物组与改善代谢综合征、减少炎症以及对肝脏和心血管健康的潜在积极作用有关。
★ 选择低GI食物
低GI食物释放糖分较慢,不会引起血糖的快速升高,有助于维持肠道菌群的稳定。相反,高GI食物会导致血糖的快速波动,刺激有害菌群的生长。与豆类、面食、水果和乳制品有关,天然全食中的糖GI值较低。
★ 摄入益生元
益生元是一类能够选择性地刺激肠道有益菌群生长的物质,如我们前面章节提到的低聚果糖、低聚半乳糖等。摄入益生元可以优化肠道菌群的组成,减少对糖的渴求。
★ 尽可能避开高脂饮食
研究表明,含糖饮料和高脂饮食的共同摄入会破坏肠道微生物的平衡。这样的肠道微生态变化会使小鼠易感化学诱导性结肠炎。肠道炎症的增强与病原体的有利定植相关。
蔗糖溶液摄入使高脂饮食背景下Prevotellaceae和Enterobacteriaceae的相对丰度显著升高。通常Prevotellaceae成员与加重肠道炎症相关。
因此,选择低脂低糖,富含膳食纤维的饮食方式可以帮助肠道稳态,可参考地中海饮食。
其他有利控糖的措施
★ 设定具体、实用的目标
可以寻找逐步减少糖摄入量的实用方法通常更容易实现。
逐步做到少喝或不喝额外的含糖饮料,包括普通苏打水、运动饮料、果汁、许多瓶装茶、调味拿铁和咖啡奶精都含有大量糖。
可以尝试水、不加糖的茶或咖啡、100% 果汁等代替。
★ 选择天然食品,而非加工食品
从天然来源摄入足够的糖,对于维持充足的能量水平和全天保持血糖稳定是必要的。
因此,最好选择尽可能接近自然状态的食物。
水果是大自然的糖果。可以将它们用作原味酸奶、煎饼和烘焙食品等食品中的甜味剂。它们还可以很好地融入冰沙和果汁中。
除了甜味和风味外,水果还富含维生素、矿物质和抗氧化剂。
整个水果是健康饮食的重要组成部分。
一些专家建议从不同的食物类别中选择一些天然食品,例如:
全谷物:燕麦片(未调味)
蛋白质:亚麻籽或奇亚籽
可以尝试自制食品
减少外出就餐或外带食物,避免食用过多不了解的添加糖成分。
同时,也可以避开一些沙拉酱、意大利面酱等,可能含较多糖。
★ 烘焙时更换糖
如果想避免添加糖,那么需要限制蛋糕和饼干等烘焙食品。但这并不意味着彻底放弃。
不要使用全糖版本,而是尝试使用其他成分来尝试最喜欢的食谱。流行的糖替代品包括苹果酱、磨碎的水果或蔬菜、干果或花生。当然也可以少用糖而不添加其他成分。
一些人造甜味剂(例如阿斯巴甜和糖精)不适合烘焙。
尝试用香料代替食糖进行烘焙,比如说:
香草(天然且不加糖)、肉桂、肉豆蔻、丁香、甘草、干根或提取物(来自植物的天然甘草,而不是糖果)等。
★ 可以适当阅读食物标签
查看营养成分表中的”总糖“或”碳水化合物-糖“项,了解食品中糖的总含量。
查看配料表,了解食品中所含糖的种类。常见的糖包括蔗糖、葡萄糖、果糖、麦芽糖、乳糖等。
很多时候,配料表中的成分按照重量从高到低排列。如果糖出现在配料表的前几位,说明该食品中糖的含量较高。
注意营养成分表中的”每份含量”或”每100克/毫升含量”,了解每份食品或每100克/毫升食品中糖的具体含量,算一下总量,要不要吃完。
★ 如果一定需要甜味剂,可以尽量选择天然的
天然甜味剂有多种选择,热量不一定低。但一些天然甜味剂,如罗汉果和甜叶菊,也可以尝试,下表供参考,总的来说取决于自身健康状况、口味偏好以及如何使用。

注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
McDougle M, de Araujo A, Singh A, et al. Separate gut-brain circuits for fat and sugar reinforcement combine to promote overeating[J]. Cell metabolism, 2024, 36(2): 393-407. e7.
Gillespie, K.M.; Kemps, E.; White, M.J.; Bartlett, S.E. The Impact of Free Sugar on Human Health—A Narrative Review. Nutrients 2023, 15, 889.
Kawano Y, Edwards M, Huang Y, et al. Microbiota imbalance induced by dietary sugar disrupts immune-mediated protection from metabolic syndrome[J]. Cell, 2022, 185(19): 3501-3519. e20.
Prinz P. The role of dietary sugars in health: molecular composition or just calories?[J]. European Journal of Clinical Nutrition, 2019, 73(9): 1216-1223.
Garcia, K.; Ferreira, G.; Reis, F.; Viana, S. Impact of Dietary Sugars on Gut Microbiota and Metabolic Health. Diabetology 2022
Pessoa, J.; Belew, G.D.; Barroso, C.; Egas, C.; Jones, J.G. The Gut Microbiome Responds Progressively to Fat and/or Sugar-Rich Diets and Is Differentially Modified by Dietary Fat and Sugar. Nutrients 2023
Yang S, Wu C, Yan Q, et al. Nondigestible functional oligosaccharides: enzymatic production and food applications for intestinal health[J]. Annual Review of Food Science and Technology, 2023, 14: 297-322.
Satokari R. High intake of sugar and the balance between pro-and anti-inflammatory gut bacteria[J]. Nutrients, 2020, 12(5): 1348.
Noble E E, Olson C A, Davis E, et al. Gut microbial taxa elevated by dietary sugar disrupt memory function[J]. Translational Psychiatry, 2021, 11(1): 194.
Ma X, Nan F, Zhang D. Excessive intake of sugar: An accomplice of inflammation[J]. Frontiers in immunology, 2022, 13: 988481.
Conz, A.; Salmona, M.; Diomede, L. Effect of Non-Nutritive Sweeteners on the Gut Microbiota. Nutrients 2023, 15, 1869
Shon W J, Jung M H, Kim Y, et al. Sugar-sweetened beverages exacerbate high-fat diet-induced inflammatory bowel disease by altering the gut microbiome[J]. The Journal of Nutritional Biochemistry, 2023, 113: 109254.
Lamichhane, G.; Liu, J.; Lee, S.-J.; Lee, D.-Y.; Zhang, G.; Kim, Y. Curcumin Mitigates the High-Fat High-Sugar Diet-Induced Impairment of Spatial Memory, Hepatic Metabolism, and the Alteration of the Gut Microbiome in Alzheimer’s Disease-Induced (3xTg-AD) Mice. Nutrients 2024, 16, 240.

谷禾健康

随着国家卫生健康委发布2024版食养指南,以及前几天在上海举办的临床医学与营养食品论坛,越来越多的人开始重视日常膳食的营养与健康。
而说到脂肪,很多人都会“谈脂色变”,想要避免脂肪的摄入,这其实是不正确的。脂肪作为人体必需的基本营养素之一,是不可缺少的。缺乏脂肪会导致人体营养不良、激素失衡,皮肤受损、免疫力下降等一系列问题。
需要明确的是,并非所有脂肪都对健康产生相同的影响,它们之间存在着显著的差异。饱和脂肪和反式脂肪,常见于高加工食品、烘焙食品、油炸食品和一些红肉中,过量摄入这些脂肪可能会导致肥胖、增加心血管疾病和其他健康问题的风险。
而相对优质的不饱和脂肪,对人体健康有着多方面的益处。例如Omega-3脂肪酸能降低血液中的低密度脂蛋白,同时提高高密度脂蛋白水平,从而减少心血管疾病的风险。
2022年底,国家心血管病中心专家委员会心血管代谢医学专业委员会发布了《Omega-3脂肪酸在心血管疾病防治中的作用中国专家共识》,该共识全面、科学地呈现omega-3脂肪酸(高纯度鱼油)在心力衰竭、心肌病、高血压和猝死等多个方面的详细知识,为中国人群的omega-3脂肪酸在预防和治疗心血管疾病中的临床应用提供参考。
此外还具有支持大脑和神经发育、产生抗炎作用、改善认知、抗忧郁、使皮肤更显年轻、调节视网膜健康等作用。
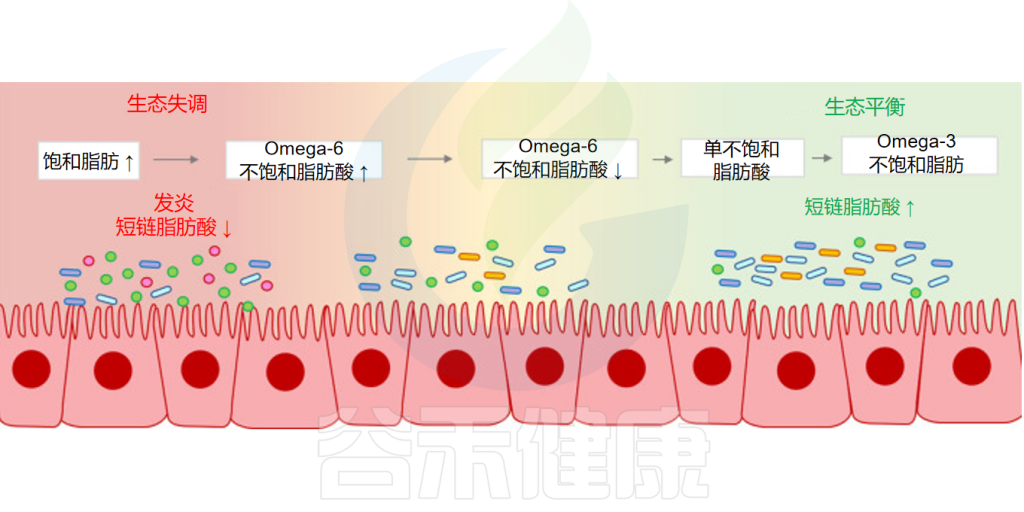
目前的研究认为功效范围从最不健康到最健康:饱和脂肪(SFA)<Omega-6不饱和脂肪酸<单不饱和脂肪酸 (MUFA)<Omega-3不饱和脂肪酸。
特别需要注意的是,人体不饱和脂肪酸Omega-6与Omega-3的比率可能是心血管疾病风险的重要标志。尽管都是人体所必需的重要不饱和脂肪酸,但是在对待炎症方面却展现出了截然不同的作用。Omega-6不饱和脂肪酸促进炎症的发生,引起身体的“失火”;Omega-3不饱和脂肪酸则恰恰相反,缓解并抑制炎症,从而预防重大疾病的发生。
可见他们两者的平衡是非常重要的。这种不平衡可能导致多种疾病,包括血栓形成、炎症、哮喘和炎症性肠病等。
肠道微生物群是我们消化系统中不可或缺的一部分,而不饱和脂肪酸作为一种重要的营养物质,其在消化和吸收的过程中必定有微生物的参与作用。
已经有一些研究发现摄入Omega-3不饱和脂肪酸有助于恢复抗炎肠道微生物群,而健康和多样化的微生物群可以在一定程度上增加Omega-3不饱和脂肪酸的体内转化和代谢。
鉴于不饱和脂肪酸对人体的重要性,以及其作为当前人们关心的重要营养素。本文将以Omega-3脂肪酸为例来讲述这类不饱和脂肪酸对人体的健康益处,可能存在的一些安全隐患。以及主要的饮食来源,日常生活中该如何补充Omega-3不饱和脂肪酸。希望能够在人们日常饮食和临床补充中提供一定的帮助,以此来更好地针对自身情况调节膳食。
我们经常在一些食品或添加剂中听到富含不饱和脂肪酸,那么究竟什么是脂肪酸?什么又是不饱和脂肪酸呢?
脂肪酸是一类含有羧基的脂肪族化合物,通常存在于动植物的脂肪和油中。脂肪酸是构成脂肪分子的基本单元,你可以简单理解为脂肪是由许许多多的脂肪酸分子构成的。
脂肪酸在人体中起着重要作用,包括提供能量、构建细胞膜、合成激素、帮助脂溶性维生素的吸收和保护身体脏器等。
▸ 脂肪酸可分为饱和脂肪酸和不饱和脂肪酸
脂肪酸根据碳氢链饱和与不饱和可分成两类:一类是分子内不带碳碳双键的饱和脂肪酸,如硬脂酸、软脂酸等;另一类是分子内带有一个或几个碳碳双键的不饱和脂肪酸,如亚麻酸、亚油酸、油酸。
饱和脂肪酸通常是固态的,而不饱和脂肪酸则通常是液态的。
饱和脂肪酸(Saturated fatty acid),指不含不饱和双键的脂肪酸。一般来说,动物性脂肪如牛油、猪油比植物性脂肪含饱和脂肪酸多。但也不是绝对的,如椰子油、可可油、棕榈油中也含有丰富的饱和脂肪酸。奶制品(如奶油、奶酪和全脂牛奶)中也有较多的饱和脂肪酸。
一般较常见的饱和脂肪酸有辛酸、癸酸、月桂酸、豆蔻酸、软脂酸、硬脂酸、花生酸等。
▸ 过量食用饱和脂肪酸会增加心血管疾病风险
饱和脂肪酸摄入过多是导致血胆固醇、三酰甘油、低密度脂蛋白胆固醇(LDL-C)升高的主要原因,继发引起动脉管腔狭窄,形成动脉粥样硬化,增加患心血管疾病的风险。
根据世界卫生组织和其他健康机构的建议,应该适度摄入饱和脂肪酸,并将其与不饱和脂肪酸(如单不饱和脂肪酸和多不饱和脂肪酸)相结合,以维持健康的饮食平衡。
不饱和脂肪酸就是指含有不饱和键的脂肪酸,是构成体内脂肪的另一种不可缺少的脂肪酸。根据双键个数的不同,分为单不饱和脂肪酸和多不饱和脂肪酸二种。
▸ 单不饱和脂肪酸
单不饱和脂肪酸(MUFA)是一类含有一个不饱和键的脂肪酸,它们在橄榄油、芥花籽油、花生油等植物油中含量丰富。单不饱和脂肪酸的主要代表是油酸(ω-9脂肪酸),它在橄榄油中的含量可达84%以上。
油酸具有多种健康益处,包括降低低密度脂蛋白(LDL)胆固醇水平,提高高密度脂蛋白(HDL)胆固醇比例,从而有助于预防动脉硬化。此外,单不饱和脂肪酸还具有抗氧化功能、降血糖功能、调节血脂功能和降低胆固醇功能。
▸ 多不饱和脂肪酸
多不饱和脂肪酸(PUFA)指含有两个或两个以上不饱和键的脂肪酸,根据双键的位置及功能又将多不饱和脂肪酸分为Omega-3系列和Omega-6系列。
Omega-3脂肪酸(Ω3)
需要注意的是,Omega-3脂肪酸并不单指一种物质,而是一组多不饱和脂肪酸。因其第一个不饱和键位于甲基一端的第3个碳原子上,故名Omega-3。
Omega-3脂肪酸主要有α-亚麻酸(ALA)、十八碳四烯酸(SDA)、二十碳五烯酸(EPA)、二十二碳五烯酸(DPA)和二十二碳六烯酸(DHA)。
注:ALA是Omega-3脂肪酸的母体,可去饱和并延伸形成其他Omega-3脂肪酸。
omega-3多不饱和脂肪酸的化学结构
Omega-3必须靠食物来获取
Omega-3是一种对人体健康非常重要的不饱和脂肪酸,它对心脏健康、大脑发育和炎症反应有着重要作用。
Omega-3不饱和脂肪酸同时也是人体合成各种激素及内生性物质必要的营养素,但人体无法自行合成,因此必须通过饮食来获取。Omega-3主要存在于深海油性鱼类(如三文鱼、鲭鱼、沙丁鱼)和一些植物性食物(如亚麻籽、奇亚籽、核桃)中。
Omega-6脂肪酸(Ω6)
同理,不饱和键位于第六个碳原子上的脂肪酸,则称为Omega-6脂肪酸。Omega-6脂肪酸在人体内也至关重要,胆固醇必须与Omega-6的亚油酸(LA)相结合,才能正常运转和代谢;人脑中的不饱和脂肪酸Omega-6和Omega-3各占一半。
Omega-6不饱和脂肪酸的食物来源非常丰富,玉米、大豆等植物及其加工产品如炒菜离不开的玉米油、大豆油等植物油以及我们常吃的猪肉、牛肉、羊肉里,Omega-6不饱和脂肪酸的含量都不少。
Ω3与Ω6的平衡对于炎症至关重要!
尽管都是人体所必需的重要不饱和脂肪酸,但是在对待炎症方面却展现出了截然不同的作用。Omega-6不饱和脂肪酸促进炎症的发生,引起身体的“失火”;Omega-3不饱和脂肪酸则恰恰相反,缓解并抑制炎症,从而预防重大疾病的发生。可见他们两者的平衡是非常重要的。
▸ 拓展:反式脂肪酸又是什么?
在生活中我们还能听到一些食品因含有反式脂肪酸而被认为是不健康的产品,反式脂肪酸(trans fatty acid,TFA)是含有反式非共轭双键结构不饱和脂肪酸的总称。
如果与双键上2个碳原子结合的2个氢原子在碳链的同侧,空间构象呈弯曲状,则称为顺式不饱和脂肪酸,这也是自然界绝大多数不饱和脂肪酸的存在形式。反之, 双键上两个碳原子结合的两个氢原子分别在碳链的两侧,其空间构象呈线性,则称为反式不饱和脂肪酸。
与不饱和脂肪酸不同,反式脂肪酸往往对身体有许多危害。研究发现,反式脂肪酸与心血管疾病发生风险之间存在正相关关系。除此之外还会影响生育和胎儿发育、降低记忆、促进肥胖和血栓的形成、影响神经行为。
鉴于对人体的重要性,以及其作为当前人们关心的重要营养素。本文将具体讲述Omega-3不饱和脂肪酸对人体的健康益处,以及可能存在的一些隐患。
首先我们需要清楚的是,Omega-3脂肪酸包括了一类多不饱和脂肪酸,并不单单指一个物质。主要有α-亚麻酸(ALA)、十八碳四烯酸(SDA)、二十碳五烯酸(EPA)、二十二碳五烯酸(DPA)和二十二碳六烯酸(DHA)。而ALA是Omega-3脂肪酸的母体,可去饱和并延伸形成其他Omega-3脂肪酸。
▸ α-亚麻酸主要来自植物
α-亚麻酸(ALA)的主要来源是植物,主要集中在一些种子和坚果以及植物油中。亚麻籽、奇亚籽、核桃和蓝蓟籽油是ALA的良好来源,而红花油、向日葵油、玉米油和大豆油则富含亚油酸(18:2 ω-6)。
亚麻籽及其油通常含有45-55%ALA形式的不饱和脂肪酸。大豆油、菜籽油和核桃含有5-10%ALA形式的不饱和脂肪酸。
一些含有α-亚麻酸(ALA)的食物
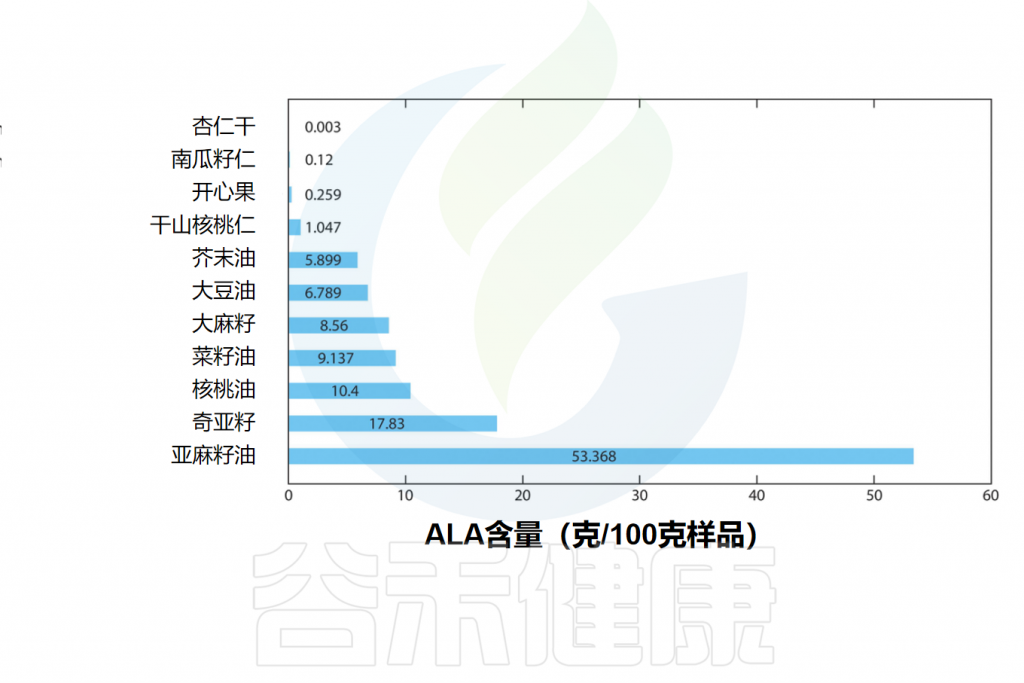
▸ 深海鱼中含有较多的EPA和DHA
尽管人体能以ALA为前体合成EPA和DHA。然而,ALA生物转化为EPA和DHA的能力有限;因此,我们需要从饮食中摄取。
EPA和DHA最重要的饮食来源是油性深海鱼类(例如鲑鱼、金枪鱼、鲱鱼、沙丁鱼、鲭鱼)和海豹、鲸鱼等海洋哺乳动物的脂肪。除此之外,龙虾、雪蟹、扇贝、章鱼等动物也含有一定量的Omega-3脂肪酸。
一些含有DHA/EPA、ALA的食物
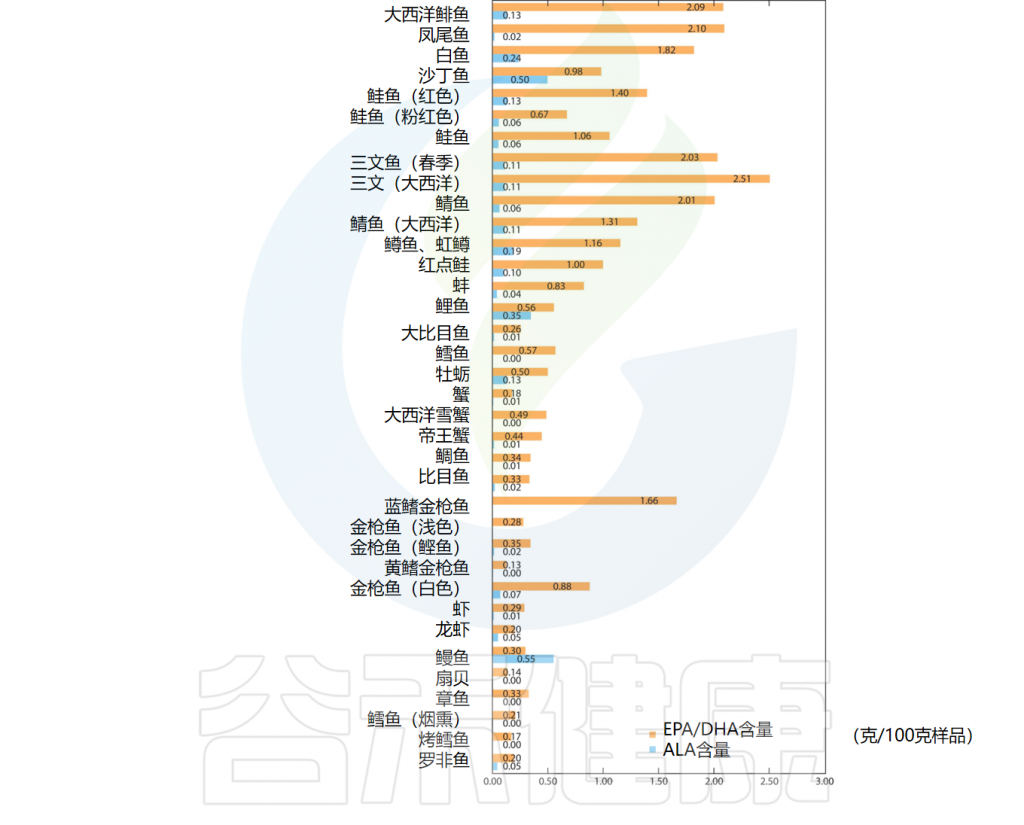
▸ 一些藻类和真菌也可以合成Omega-3
微藻和一些微生物(真菌)也含有Omega-3脂肪酸。据报道,海藻是生物圈中Omega-3脂肪酸(DHA)的主要生产者,许多藻类已被确定为DHA的来源。
寇氏隐甲藻(Crypthecodinium cohnii)和裂殖壶菌(Schizochytriumsp)是DHA的两个主要藻类来源,其含量分别占总脂肪酸的55%和40%。
Omega-3脂肪酸,特别是EPA和DHA,其实是由浮游植物合成,最终通过食物网转移并沉积到鱼类和海洋哺乳动物的脂质中。
注:最近,十八碳四烯酸(SDA)受到了关注,在饮食中补充SDA比补充ALA更能提高EPA水平。紫草科的植物,如玻璃苣、Echium vulgare和Buglossoides arvensis、大麻油和鱼类,都是SDA的良好来源。然而,SDA并不是人类饮食的主要成分。
Omega-3可以以乙酯(EE)、三酰甘油(TAG)、游离脂肪酸(FFA)或磷脂(PL)形式存在。研究人员表明,各种形式的Omega-3的消化和吸收高度依赖于膳食中的脂肪含量,这会增强胰酶的活性。
膳食脂肪消化
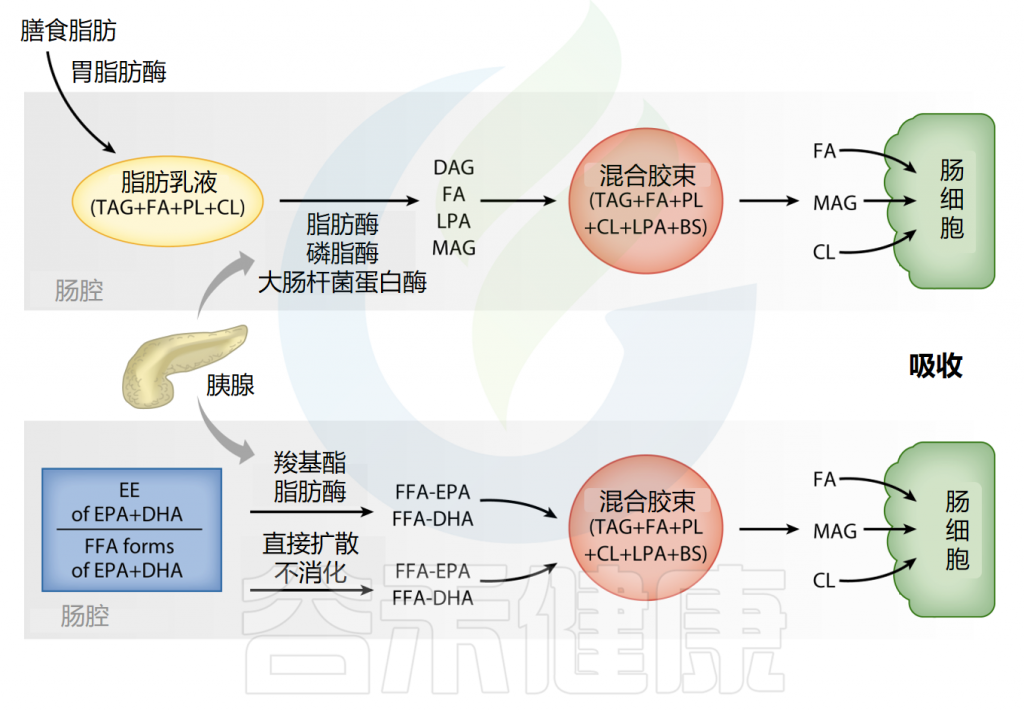
Shahidi F,et al.Annu Rev Food Sci Technol.2018
α-亚麻酸(ALA)被称为必需脂肪酸,因为人类不能从头合成ALA,植物性食品是ALA的主要膳食来源。尽管不能合成ALA,但人体可以通过进一步的去饱和和延伸过程来代谢它,这些过程被认为主要发生在肝脏中。
▸ ALA在人体可代谢转化成EPA、DHA
从膳食ALA合成其他Omega-3脂肪酸的代谢途径如图所示。SDA是从ALA合成的第一个代谢物,随后导致EPA、DPA和DHA的合成。
从ALA合成Omega-3不饱和脂肪酸的代谢途径
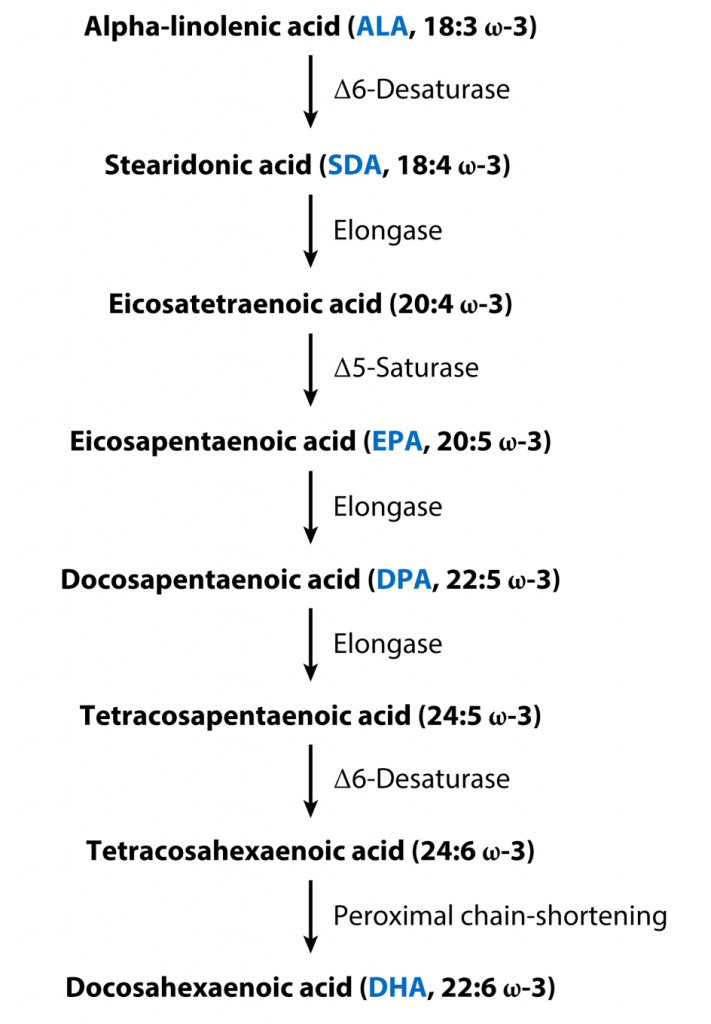
Shahidi F,et al.Annu Rev Food Sci Technol.2018
另一个主要途径涉及从亚油酸合成Omega-6不饱和脂肪酸,其中花生四烯酸是主要的最终产物。
▸ 胰岛素和矿物质水平会影响转化率
由于人类饮食中的α-亚麻酸(ALA)水平通常低于亚油酸,因此Omega-6脂肪酸的血浆和细胞水平往往高于Omega-3脂肪酸。
观察到,摄入ALA显著增加血浆和母乳中的EPA和DPA水平,而仅观察到DHA的轻微增加。另一项使用稳定同位素的研究表明,从ALA转化为EPA、DPA和DHA的效率分别为0.2%、0.13%和0.05%。
该转化需要去饱和酶(Δ5和Δ6)、微粒体系统的延长酶以及过氧化物酶体中的氧化以缩短链。一份报告显示,胰岛素水平低以及蛋白质和矿物质(铁、锌、铜和镁)缺乏可能会降低Δ6去饱和酶活性,从而抑制亚油酸和ALA转化为Omega-6和Omega-3。
▸ Ω6和Ω3对于许多激素的合成至关重要
Omega-6和Omega-3不饱和脂肪酸对于一些激素的合成至关重要,例如前列腺素(PG)、前列环素(PGI)、血栓素(TX)、白三烯、氢过氧四烯酸、羟基二十碳四烯酸等。
这些物质参与多种生理作用,包括促/抗炎、促/抗血小板聚集、血管舒张、血管收缩、免疫反应以及细胞生长和增殖。
不同脂肪酸衍生的物质其功能有时相反
例如,源自花生四烯酸的前列腺素的功能与源自 EPA的前列腺素不同。由花生四烯酸形成的PGE2和TXA2在血小板中产生,并通过有效的化学活性和血小板聚集促进炎症,并充当血管收缩剂。
然而,EPA衍生的PGE和TXA仅起到血管扩张剂和抗聚集剂的作用。因此,Omega-6和Omega-3不饱和脂肪酸在生理功能中起着重要作用,这种不平衡可能导致多种疾病,包括血栓形成、炎症、哮喘和炎症性肠病。
此外DHA已被证明是大脑灰质的主要成分,其磷脂形式已被证明是视网膜、睾丸和精子的主要成分。
作为一种重要的不饱和脂肪酸,Omega-3脂肪酸对我们的健康产生着深远的影响。它被认为是一种必需的营养物质,能够帮助维持心血管健康、影响大脑和视力功能、改善炎症、睡眠等。
了解Omega-3脂肪酸对人体健康的积极影响至关重要,跟着谷禾一起探索Omega-3脂肪酸如何成为我们健康生活的重要组成部分。
• 维护心血管健康
Omega-3可以帮助降低心脏疾病风险。它们通过降低血液中的甘油三酯水平、低密度脂蛋白(LDL)中不良胆固醇,减少血小板聚集(降低血栓形成风险)、降低血压同时提高高密度脂蛋白(HDL)中良性胆固醇量来实现这一点。这些作用共同帮助维护心血管系统的健康。
• 抗炎作用
Omega-3脂肪酸可以通过影响炎症介质的产生来调节炎症反应。具体来说,它们能够减少前列腺素E2(PGE2)和白三烯B4(LTB4)等促炎因子的生成。
Omega-3脂肪酸还通过影响多种信号通路来发挥抗炎作用,包括抑制核因子κB(NF-κB)信号通路。
• 调节大脑健康
Omega-3脂肪酸,特别是DHA,是大脑和神经系统正常发育和功能所必需的,是构成脑细胞膜的成分,也是维护脑部健康的重要功臣。它对儿童大脑发育至关重要,有助于提高学习能力和注意力。在成人中,足够的Omega-3摄入量与降低认知衰退和阿尔茨海默病的风险有关。
• 眼部健康
DHA是视网膜的主要成分,对维持视力至关重要。Omega-3的摄入与降低年龄相关的黄斑变性风险有关,这是老年人失明的一个主要原因。
黄斑变性是指由于年龄、遗传、不良环境、慢性光损伤等各种因素的影响,使眼部视网膜处的黄斑发生萎缩,或代谢异常,导致患者出现视力异常的疾病。
• 抗抑郁和焦虑、消除偏头痛
研究表明,Omega-3可以帮助改善抑郁和焦虑症状。尤其是EPA,被认为在调节情绪和抗抑郁中起着重要作用。
Omega-3还能帮助抑制导致疼痛和发炎的“不良”前列腺素的分泌。它也能减少血液的粘度,以促进脑部的血液循环。这将会减少偏头痛的发作次数,亦能减低其严重程度和待续时间。
• 使皮肤更显年轻
Omega-3能令皮肤均衡保湿及保持健康。它能强化围绕于每一个细胞周围的纤柔细胞膜,使细胞获得充足滋养,同时能有效地把细胞内的废物予以排除。它能使真皮层分泌出更强力的胶原和弹性纤维,帮助消除皱纹和细纹,并挺实渐呈松弛的皮肤。
• 改善睡眠质量
一些研究表明,Omega-3的摄入与改善睡眠质量有关,可能通过影响睡眠调节的神经传递物质和激素实现。例如DHA,被认为可以调节褪黑素的产生。褪黑素是一种重要的睡眠调节激素,它帮助调整人体的生物钟和睡眠周期。
此外,Omega-3脂肪酸还可能带来其他潜在健康益处。为了提供更有力的证据,谷禾综合了大量研究资料,探讨了Omega-3不饱和脂肪酸对各种疾病的影响,旨在帮助大家更深入了解Omega-3不饱和脂肪酸。
1
心血管疾病
由于高脂肪饮食,世界范围内的心血管疾病和相关死亡率越来越高。已经对Omega-3不饱和脂肪酸对主要心血管疾病的影响进行了大量研究,如心肌梗死、中风、先天性心脏病、心律失常、心房颤动、亚临床动脉粥样硬化、冠心病、心力衰竭、心源性猝死、瓣膜病和外周动脉疾病。
• 大量人群数据显示较高的Omega-3摄入量的心血管疾病风险较低
格陵兰岛、加拿大北部和阿拉斯加食用传统饮食的原住民,尽管膳食脂肪摄入量较高,但心血管疾病(特别是冠心病)死亡率远低于预期。饮食中的保护成分被认为是由于定期摄入鲸鱼和海豹肉、鲸脂和多脂鱼而含有大量的Omega-3不饱和脂肪酸。
日本人的传统饮食也具有较低的心血管死亡率,这种饮食富含海鲜,包括富含脂肪的鱼类,有时还包括海洋哺乳动物,其中含有大量的EPA和DHA。从前瞻性和病例对照研究中积累的大量证据表明,西方人群中较高的EPA和DHA摄入量与较低的心血管疾病风险相关。
• Omega-3降低心血管疾病风险的具体作用
Omega-3不饱和脂肪酸,尤其是DHA和EPA,通过改变脂质和止血因素(例如血小板聚集和出血时间)来降低心血管疾病的临床风险。
DHA已被证明具有抗血小板聚集、降低三酰甘油作用和抗心律失常作用。在控制高脂饮食的多变量男性模型中,饱和脂肪酸的血清水平较高与冠心病风险增加相关,而Omega-3不饱和脂肪酸中DHA和DPA与冠心病风险呈负相关。
据报道,Omega-3不饱和脂肪酸还可以降低心脏对室性心律失常的敏感性,延缓动脉粥样硬化斑块的生长(通过减少粘附分子表达和血小板衍生生长因子并具有抗炎作用)。降血压,并发挥抗血栓形成和低甘油三酯(空腹和餐后)作用,因此具有心脏保护作用。
Omega-3对心率和血压的影响归因于一氧化氮生成率的增加,减轻对去甲肾上腺素和血管紧张素II的血管收缩反应,增强血管舒张反应,改善动脉顺应性。
Ω3脂肪酸减少心血管疾病风险的机制
Bae JH,et al.Adv Nutr.2023
下图总结了Omega-3对心血管健康的生理影响:

编辑
Shahidi F,et al.Annu Rev Food Sci Technol.2018
• Ω6与Ω3的比率可能是心血管疾病风险的重要标志
此外,Ω6(亚油酸和花生四烯酸)与Ω3(EPA、DHA和亚麻酸)的比率被认为是分析心血管疾病风险的重要生物标志物。然而据报道,组织中的Ω3水平在心血管风险评估中可能比Ω6或AA/EPA比率具有更好的预后和诊断效用。
对之前发表的文章进行了系统综述分析,了解Omega-3不饱和脂肪酸对心血管健康的影响。谷禾将其整理在下图中。


Shahidi F,et al.Annu Rev Food Sci Technol.2018
2
糖尿病
多项研究表明,补充Omega-3不饱和脂肪酸或鱼油对2型糖尿病具有有益作用。研究发现,食用Omega-3不饱和脂肪酸饮食八周后可增加老年人的胰岛素敏感性,并显著降低血清C反应蛋白。
• Omega-3对糖尿病的影响还存在争议
回顾了以前的一些研究,发现Omega-3不饱和脂肪酸对2型糖尿病或代谢综合征患者的血浆三酰甘油(TAG)水平有有利影响,但对总胆固醇、高密度脂蛋白 (HDL)、低密度脂蛋白(LDL)、空腹血糖或糖化血红蛋白水平没有直接影响。
关于Omega-3不饱和脂肪酸在糖尿病和胰岛素抵抗中的作用仍然存在争议。因此,需要进一步的临床研究来确定Omega-3是否影响人类糖尿病和胰岛素抵抗。
omega-3与糖尿病的研究结果总结

Shahidi F,et al.Annu Rev Food Sci Technol.2018
3
癌症
在过去的十年中,多项实验和流行病学研究表明,Omega-3不饱和脂肪酸可以降低患癌症的风险。
据报道,Ω3不饱和脂肪酸具有抗癌作用,而饱和脂肪酸和Ω6不饱和脂肪酸可能会促进癌症的发展。Ω3不饱和脂肪酸已被证明可以影响多种类型的癌症,包括前列腺癌、结肠癌、乳腺癌、肺癌、结直肠癌、卵巢癌、胰腺癌、皮肤癌和胃癌。此外,Ω3被证明可以提高化疗的疗效和耐受性。
• Omega-3可能的抗癌机制
提出了一些关于Omega-3抗癌作用的分子机制:
(a)减少花生四烯酸衍生的类二十烷酸的生物合成,这导致对癌细胞的免疫反应、炎症调节、细胞增殖、细胞凋亡、转移和血管生成改变;
(b)影响导致新陈代谢、细胞生长和分化变化的转录因子的活性;
(c)改变雌激素的代谢活性,随后雌激素刺激的细胞生长减少;
(d)自由基和活性氧产生的改变;
(e)调节胰岛素敏感性和膜流动性。
据报道,Omega-3不饱和脂肪酸通过降低环加氧酶 COX-2和PGE2水平侵入并抑制肿瘤细胞生长,因此可以作为天然COX抑制剂。
此外,Ω6与Ω3的比率低于5被认为可减缓癌症进展。同时,增加Ω6的摄入量被证明会促进动物和人类患乳腺癌、前列腺癌和结肠癌。
Ω6促肿瘤作用背后的机制包括脂质过氧化、17-β-雌二醇(E2)环氧化后产生致癌物,以及通过增强其他化合物(例如染色质)的基因毒性作用而产生致癌作用。
• 每天适当补充Ω3对癌症患者有积极作用
最近的一项研究表明,将Ω3与1α,25-二羟基维生素D3结合可显著增加乳腺癌细胞系的细胞凋亡。膳食补充Ω3不饱和脂肪酸、α-生育酚、亚麻酸、纤维和植物雌激素对乳腺癌患者具有积极作用。研究表明亚麻籽对乳腺癌患者具有抗增殖活性,并建议绝经前妇女每天摄入25克亚麻籽。
还有研究发现,使用Ω3作为接受放射治疗的头颈癌患者的营养补充剂,有助于他们通过增加蛋白质热量摄入来维持体重并耐受抗癌治疗,从而提高他们的生活质量。
!
一些因素会影响Ω3对癌症的效果
某些因素可能会影响Ω3不饱和脂肪酸对癌症的不一致结果:Ω3不饱和脂肪酸的来源、类型(ALA、DHA或EPA)、形式和含量的差异以及Ω6与Ω3的比率和遗传因素,例如COX和脂氧合酶修饰基因的多态性。
需要更多的临床试验来找出针对特定癌症病理的Ω3有效剂量和配方。
4
阿尔茨海默病和认知能力
多项流行病学研究表明,较低的Ω3不饱和脂肪酸摄入量会增加认知能力下降或痴呆的风险,尤其是阿尔茨海默病。
有足够的临床证据表明Ω3不饱和脂肪酸可以预防阿尔茨海默病。DHA是大脑中膜磷脂的主要成分,特别是在大脑皮层、线粒体、突触体和突触小泡中。
• 不饱和脂肪酸影响脑功能的机制
不饱和脂肪酸对脑功能的作用机制包括改变:
(a)膜流动性;
(b)膜结合酶的活性;
(c)受体的数量和亲和力;
(d)离子通道的功能;
(e)神经递质的产生和活动,以及信号转导,控制神经递质和神经元生长因子的活动。
Omega-3不饱和脂肪酸可导致人体淋巴细胞增殖、TNFα产生、自然杀伤细胞活性以及白细胞介素IL-1 和白细胞介素IL-2产生减少。
• 不饱和脂肪酸的缺乏会影响儿童神经系统
研究人员调查了317名足月婴儿的脐动脉和脐静脉 脂肪酸组成以及早期新生儿神经系统状况,并报告说,较低的胎儿DHA、花生四烯酸(AA)和必需脂肪酸水平会对早期产后神经系统状况产生负面影响。此外,早期新生儿缺乏不饱和脂肪酸可能导致亨廷顿舞蹈症、精神分裂症、高血压和成年后食欲信号增强。
多项研究表明,必需脂肪酸,尤其是Omega-3不饱和脂肪酸的缺乏会导致注意力缺陷多动障碍 (ADHD)。而服用Omega-3不饱和脂肪酸可显著改善缺陷多动障碍儿童的生活质量、注意力集中能力、睡眠质量和血红蛋白水平。
• Ω3脂肪酸的摄入对老年人的认知有益
摄入鱼类和Ω3不饱和脂肪酸已被证明对健康老年人具有积极的认知健康作用,而在考虑阿尔茨海默病患者时,补充Ω3还可以使患有记忆障碍或轻度认知障碍和阿尔茨海默病的老年人受益。
5
抑郁症
据世界卫生组织称,抑郁症可能成为全球第二大疾病。多项流行病学研究表明,食用鱼类与降低抑郁症风险相关。
• 早期发育时缺乏DHA会增加成年后患抑郁症风险
研究发现补充Ω3(EPA+DHA的混合物)对精神分裂症孕妇有积极作用。EPA已被证明可以作为一种抗抑郁剂,引起大脑结构变化,包括大脑侧脑室容量减少和神经元周转减少。
基于28项临床试验的荟萃分析研究提供的证据表明,EPA在治疗抑郁症方面可能比DHA更有效。此外,早期发育过程中DHA的缺乏可能会影响中枢神经系统,并增加成年后患抑郁症的可能性。摄入或补充鱼油/Ω3不饱和脂肪酸已被证明可以保护青少年(15-25 岁)免受重度抑郁症。
• Ω3脂肪酸作为抗抑郁药的机制
使用Ω3脂肪酸作为抗抑郁药的可能作用机制包括:
(a)调节炎症细胞因子的分泌,因为其可能会引发重度抑郁症的体征和症状;
(b)膜流动性增加,导致内皮细胞转运血清素(5-HT)增加;
(c)额叶皮质中DHA浓度增加,这可以增加多巴胺浓度和(多巴胺)D2受体结合;
(d)与神经元细胞膜受体和第二信使相互作用,导致情绪改变。
然而,关于Ω3不饱和脂肪酸潜在抗抑郁能力的一些发现存在矛盾;因此,需要进一步的随机对照试验来研究使用EPA占主导地位的Ω3不饱和脂肪酸制剂的诊断或临床显著抑郁症患者。
6
大脑、视觉发育、妇幼保健
• Omega-3不饱和脂肪酸对大脑发育至关重要
多项研究报告了膳食Omega-3不饱和脂肪酸对大脑发育的重要作用。膳食Ω3摄入量低会增加产前或产后发育期间大脑花生四烯酸 (AA)/DHA的比例。
该比率的变化减少了神经元迁移、神经发生、胚胎皮质板扩张、突触修剪、脑葡萄糖摄取和代谢的延迟,并导致谷氨酸和单胺突触功能受损。
• Omega-3脂肪酸与孕妇及儿童健康相关
DHA是视觉系统中视网膜感光器和皮质灰质的重要结构成分;怀孕期间补充DHA有助于视觉系统的成熟。在妊娠后半期,DHA在神经皮质组织和视网膜膜突触中迅速积累。
大量流行病学研究表明Omega-3脂肪酸与孕期孕产妇健康和儿童健康相关。Omega-3脂肪酸影响妊娠时长、出生体重、围产期抑郁、妊娠高血压/先兆子痫、产后神经发育、认知发育、自闭症谱系障碍、多动症、学习障碍、特应性皮炎、过敏和呼吸系统疾病等。
怀孕期间补充Omega-3脂肪酸已被证明与高等级立体敏锐度、词汇理解力、接受性词汇、言语智商以及从婴儿期到9岁的较高认知分数呈正相关。
Omega-3脂肪酸作为一种重要的营养物质,被广泛认为对人体健康有益,而肠道微生物群则是我们消化系统中不可或缺的一部分。它们之间是否存在某种联系?让我们一起来了解下。
一项使用来自876名同时测得16S微生物组和Ω3不饱和脂肪酸的数据研究表明,在调整混杂因素后,总Ω3不饱和脂肪酸和DHA的血清浓度与微生物组α多样性(香农指数)显著相关。
在调整膳食纤维摄入量后,这些关联仍然显著。对2型糖尿病患者进行的一项随机对照试验显示,与沙丁鱼饮食相比,2型糖尿病患者的厚壁菌门与拟杆菌门的比率显著下降。
补充Ω3脂肪酸可以增加产短链脂肪酸细菌的丰度
健康志愿者补充8周的Ω3不饱和脂肪酸导致产生短链脂肪酸的肠道微生物群持续且可逆地增加。然而,发现微生物多样性缺乏显著变化,这与小鼠研究一致,其中α-多样性没有变化或只有微小变化。
值得注意的是,短期饮食干预无法改变肠道微生物组的主要个体差异。
总而言之,Omega-3不饱和脂肪酸可能通过影响肠道微生物组和连接肠道与脂肪组织、肝脏和胰腺的代谢物来减轻高血糖和胰岛素抵抗。因此,补充Omega-3不饱和脂肪酸可能有助于通过肠道器官轴的有利变化恢复葡萄糖稳态。
膳食中摄入Ω3不饱和脂肪酸(例如DHA和EPA)可以改变肠道微生物群,但膳食补充剂的持续时间或改变肠道微生物群的剂量尚不清楚。多项人类和动物研究表明,DHA和其他Ω3不饱和脂肪酸摄入量的增加与有益肠道细菌的增加相关。
然而,这些研究不仅物种组成的变化不同,而且对生物体的功能益处也不一致。尽管如此,大多数研究表明,虽然参与者和DHA来源存在异质性,但更多的DHA摄入量会增加细菌α多样性以及双歧杆菌等抗炎细菌的丰度,而促炎细菌的丰度则会减少。
Ω3脂肪酸摄入量对肠道微生物群影响的研究
编辑
编辑
Kerman BE,et al.Curr Opin Clin Nutr Metab Care.2024
有助于抑制炎症因子
此外,补充DHA可恢复肠道屏障。在患有炎症性肠病的小鼠中,摄入DHA会特异性抑制促炎细胞因子,促进血液中的抗炎细胞因子,并减少大脑中小胶质细胞的激活。
编辑
来自喂食DHA的小鼠的粪菌移植表示,微生物群赋予移植小鼠抗炎作用。在一项针对HIV感染认知障碍参与者的研究中,摄入DHA24周并没有改善认知能力,尽管它对肠道微生物群有积极作用并降低了血清炎症标志物水平。
总之,一些证据表明增加Ω3不饱和脂肪酸摄入量对人类和动物有恢复作用。
一项针对不吃海鲜的素食主义者和纯素食者的队列研究显示,尽管Ω3不饱和脂肪酸血液水平较低,但痴呆或认知能力下降的风险较低。
居住在加利福尼亚州洛马琳达的人群,食用不含红肉、鸡肉或海鲜的植物性饮食与较低的心血管疾病和神经退行性疾病有关。
与吃肉的人相比,素食主义者的黄嘌呤、组氨酸、支链脂肪酸、乙酰化肽、神经酰胺和长链酰基肉碱等代谢物的水平较低。而这些代谢物许多与胰岛素抵抗、心血管风险增加和炎症有关。
• 更稳定的肠道微生物有利于将ALA转化为其他Ω3脂肪酸
英国的一项前瞻性研究(196名杂食者、231名素食者和232名纯素食者)报告称,随着时间的推移,素食者和纯素食者中的Ω3不饱和脂肪酸水平保持稳定,这表明ALA的内源性转化为EPA和DHA可能足以在多年内保持Ω3不饱和脂肪酸水平的稳定。
植物性饮食产生这些有益效果的方法之一是促进肠道微生物组更加多样化和稳定。例如,与杂食动物相比,素食主义者和素食者的某些拟杆菌门数量明显更高。纤维可以增加乳酸菌的丰度。植物性食物中富含的多酚可以增加肠道中双歧杆菌和乳酸菌的丰度,并具有抗炎特性。高植物纤维摄入量还支持纤维发酵成短链脂肪酸。
我们推测,在海鲜摄入有限且DHA与EPA水平较低的群体中,对Omega-3脂肪酸的缺乏反应可能受到饮食习惯和肠道微生物组成的影响。
• 多样而稳定的微生物群有助于缓解Omega-3摄入不足带来的负面影响
在摄入高纤维植物性饮食的人群中,多样而稳定的微生物组有助于促进抗炎状态,其丰富的短链脂肪酸、抗氧化剂和长链脂肪酸(如Ω6)可能补偿DHA或EPA水平低下的负面效应。
相反,在缺乏Omega-3脂肪酸、偏好加工肉类、低纤维植物饮食和不健康生活方式的西方饮食背景下,较低的微生物多样性和菌群失衡可能促进炎症性疾病,如阿尔兹海默病(AD)的慢性炎症途径激活。
编辑
Kerman BE,et al.Curr Opin Clin Nutr Metab Care.2024
开展了PreventE4(NCT03613844)研究,这是一项针对365名根据APOE4基因型分层、认知正常个体进行的为期两年的2克DHA与安慰剂对照的随机双盲试验。
PreventE4的主要目标是补充DHA六个月后,根据APOE4基因型,脑脊液(CSF)DHA水平的变化。次要目标包括脑成像结果的变化,而探索性目标则包括在基线、干预后6个月和24个月时评估的肠道微生物组及脑脊液和血浆的代谢组指标。研究人员预期,DHA补充将通过肠道微生物组成和代谢组的变化,部分解释对脑脊液DHA水平、成像和认知结果的影响。
• 补充Ω3脂肪酸有助于微生物群更健康、多样化
DHA补充将把西方饮食诱导的微生物表型转变为更健康、多样化的微生物群,这将与脑脊液DHA水平的显著提升、血浆和脑脊液中炎症标志物的降低以及成像和认知测量的改善相关联。
相比之下,DHA补充后未发生变化的西方饮食微生物表型可能不会对DHA补充产生有益反应。
最后,尽管Ω3/Ω6水平在血液和脑脊液中有所提高,但在基线时就拥有多样化和健康微生物群的个体可能只会显示较小的临床结果变化。
Ω3脂肪酸,作为一种对人体至关重要的脂肪酸,它在维持人体健康方面扮演着极其重要的角色。这种脂肪酸不仅对心血管健康有益,还能在许多其他方面促进身体健康,如改善大脑功能、降低炎症等。
然而,任何物质的摄入都应当遵循一个基本原则,那就是“过犹不及”。正如所有营养素一样,Ω3脂肪酸也需要适量摄入。既不应该摄入过少,以免身体无法获得必要的营养支持,也不应该过量摄入,因为这可能会导致一些不良的健康影响。
Omega-3脂肪酸可能会影响血小板功能,减少血小板计数和反应性,延长出血时间,并增加抗凝剂与促凝代谢物(分别为前列环素和血栓素)的比例。
除了融入血小板膜外,Omega-3脂肪酸(EPA和DHA)还与花生四烯酸竞争代谢转化的环氧合酶和脂氧合酶途径,从而降低血栓素A2的产生。
血小板功能的调节取决于 EPA 和 DHA 的剂量,主要发生在剂量大于 2 克/天时。这些影响似乎主要是由 EPA 的作用介导的。由于这些影响,有人担心长链 omega-3 PUFA,尤其是高剂量使用时,会不利地促进出血并延长出血时间。
• 当前的研究还没有发现Omega-3和失血过多存在相关性
关于Omega-3脂肪酸可能导致出血过多的可能性,一项研究汇总了来自19项精心设计的临床试验的证据,这些患者接受了重大手术(冠状动脉搭桥术、颈动脉内膜切除术和股动脉插管术)。
根据这些数据,得出的结论是,无论是单独使用EPA/DHA还是使用抗血栓/抗血小板药物治疗的患者,长链Omega-3脂肪酸都不会增加临床上显著出血的风险。
2018年的出版物报告了之前未发表的8项肠内营养临床试验数据,其中包括鱼油作为Omega-3脂肪酸的来源;这些试验针对不同的患者组(N=600名患者)提供了不同剂量的 EPA+DHA(1.5-10.2 克/天),持续时间不同(8天至52周)。Omega-3不饱和脂肪酸对凝血参数没有影响,并且Omega-3不饱和脂肪酸组和安慰剂组在出血事件方面没有差异。
Omega-3不饱和脂肪酸增加出血是理论上的考虑;然而,可能还需要更多的人体临床试验来证明其安全性,以打消人们的顾虑。
一些临床试验表明,Omega-3脂肪酸可能与患房颤(AF)的可能性增加有关,特别是对于心血管风险高或血脂升高的人群。
一些试验提供了不同剂量和不同配方中Omega-3脂肪酸对房颤的影响,较高的Omega-3脂肪酸补充可能会增加房颤的风险。
基线时没有心血管疾病、癌症或心房纤颤的参与者被随机分配接受840毫克/天Omega-3 不饱和脂肪酸(460毫克EPA和380毫克DHA)或橄榄油作为安慰剂。5.3年后,两组之间的房颤事件发生率没有较大差异(3.7%与3.4%)。
然而,使用较高剂量的Omega-3不饱和脂肪酸的试验发现,房颤风险增加。例如,每天3.2克EPA+DHA作为游离脂肪酸的治疗导致3.5年后发生心房纤颤的可能性更高(2.2%对比1.3%)。
在REDUCE-IT实验中,与对照组相比,随机接受每天近4克纯化EPA乙酯的患者在中位4.9年后发生房颤的风险显著增加。OMEMI 试验中约1.6克/天的Omega-3脂肪酸(930 毫克EPA和660毫克DHA)中间剂量也导致治疗组与安慰剂相比发生更多房颤。
包括2012年至2020年间发表的7项随机对照试验。在81210名患者中,72.6%参加了每天测试≤1g Omega-3不饱和脂肪酸的试验,27.4%参加了每天测试>1g Omega-3不饱和脂肪酸的试验。随访时间为4.9年。使用较高剂量的Omega-3脂肪酸与房颤风险增加相关。
因此,大多数最近试验的荟萃分析表明,Omega-3不饱和脂肪酸可能会增加房颤的风险,特别是在高剂量使用时。
最近的研究认为,Omega-3不饱和脂肪酸对房颤的影响是U形的:中等剂量时它们会降低房颤风险,但高剂量时会增加风险。
鉴于Omega-3不饱和脂肪酸改善心血管的能力,2019年,美国心脏协会更新了之前的建议,即每天使用2-4克EPA+DHA来降低甘油三酯。
作为单一疗法或作为其他降甘油三酯疗法的辅助疗法。欧洲心脏病学会和欧洲动脉粥样硬化学会发布了《血脂异常管理临床实践指南》的更新版,特别建议“在患有甘油三酯的高危患者中尽管使用他汀类药物治疗,但其水平在1.5至5.6mmol/L(135–499 mg/dl)之间,Omega-3不饱和脂肪酸应考虑与他汀类药物一起使用。”
美国脂质协会声明称,“对于年龄≥45岁患有临床动脉粥样硬化性心血管疾病(ASCVD)的患者,或年龄≥50岁患有糖尿病且需要药物治疗且有≥1个额外危险因素的患者,空腹甘油三酯为135至499 mg/dl高强度或最大耐受他汀类药物治疗,建议使用Omega-3不饱和脂肪酸以降低ASCVD风险”。
美国心脏协会重申了之前对心血管疾病患者使用EPA+DHA的支持并扩展它,指出对于患有流行性冠心病(例如近期发生心肌梗死)的患者的建议基本保持不变:对于这些患者来说,补充Omega-3不饱和脂肪酸治疗是合理的。即使该临床人群的冠心病死亡率可能略有下降(10%),也可以证明采用相对安全的疗法进行治疗是合理的。
Omega-3可以通过饮食和补充剂获得。饮食来源主要包括富含Omega-3的鱼类,如三文鱼、鲭鱼、鲑鱼和金枪鱼。对于不常吃鱼或希望通过补充剂摄入Omega-3的人,可以考虑鱼油补充剂、藻油补充剂(适合素食者)或亚麻籽油补充剂。
定期检查健康状况,特别是心血管健康指标和血脂水平,可以帮助评估Omega-3补充的效果,并根据需要调整摄入量。
Omega-3脂肪酸,作为一类不饱和脂肪酸,主要包括α-亚麻酸(ALA)、二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),对人体健康具有重要影响。
许多研究已经证明,Omega-3脂肪酸对心血管健康具有显著益处,能有效降低心血管疾病的风险,包括降低血压、减少甘油三酯水平及抑制炎症。
此外,Omega-3脂肪酸对大脑健康也至关重要,特别是DHA,它是大脑结构的重要组成部分,对维持认知功能、预防认知衰退有重要作用,还能在一定程度抗抑郁。
在孕妇和婴儿的营养中,Omega-3脂肪酸对神经系统的发育同样不可或缺,还有助于提高视力和认知能力的发展。
尽管Omega-3脂肪酸的健康益处众多,但它们在人体内不能自主合成,必须通过饮食来获取。这就需要通过富含Omega-3的食物如三文鱼、鲭鱼、鲑鱼和沙丁鱼等深海鱼类;此外,亚麻籽、奇亚籽、核桃以及高品质的亚麻籽油和藻类油也是优质的植物性Omega-3来源,或是通过补充剂来确保足够的摄入量。
Omega-3不饱和脂肪酸与肠道微生物群的多样性相关,足量的Omega-3有助于抑制炎症因子修复肠道屏障,同时更稳定健康的肠道微生物有利于将α-亚麻酸转化为Ω3脂肪酸,维持Omega-3的稳定水平,增加健康益处。
需要注意的是,补充Omega3脂肪酸时也应适度适量,无论是饱和脂肪酸还是不饱和脂肪酸,如果摄入量超过了人体的能量需求,多余的脂肪酸就会在体内转化为脂肪储存起来,导致人体肥胖,以及可能存在的一些未被发现的隐患,重要的是根据每个人自身的需求来制定精准的日常膳食。
主要参考文献
Kerman BE, Self W, Yassine HN. Can the gut microbiome inform the effects of omega-3 fatty acid supplementation trials on cognition? Curr Opin Clin Nutr Metab Care. 2024 Mar 1;27(2):116-124.
Djuricic I, Calder PC. Pros and Cons of Long-Chain Omega-3 Polyunsaturated Fatty Acids in Cardiovascular Health. Annu Rev Pharmacol Toxicol. 2023 Jan 20;63:383-406.
Shahidi F, Ambigaipalan P. Omega-3 Polyunsaturated Fatty Acids and Their Health Benefits. Annu Rev Food Sci Technol. 2018 Mar 25;9:345-381.
Li JJ, Dou KF, Zhou ZG, Zhao D, Ye P, Zhao JJ, Guo LX. Role of omega-3 fatty acids in the prevention and treatment of cardiovascular Diseases: A consensus statement from the Experts’ Committee Of National Society Of Cardiometabolic Medicine. Front Pharmacol. 2022 Dec 12;13:1069992.
Patel D, Evanchuk J, Wang R, Dunbar CL, Munhoz J, Field CJ. Regulation of immune function in healthy adults: one-stop guide on the role of dietary fatty acids, gut microbiota-derived short chain fatty acids, and select micronutrients in combination with physical activity. Appl Physiol Nutr Metab. 2023 Aug 1;48(8):554-568.
Yan Y, Jiang W, Spinetti T, Tardivel A, Castillo R, Bourquin C, Guarda G, Tian Z, Tschopp J, Zhou R. Omega-3 fatty acids prevent inflammation and metabolic disorder through inhibition of NLRP3 inflammasome activation. Immunity. 2013 Jun 27;38(6):1154-63.
Bae JH, Lim H, Lim S. The Potential Cardiometabolic Effects of Long-Chain ω-3 Polyunsaturated Fatty Acids: Recent Updates and Controversies. Adv Nutr. 2023 Jul;14(4):612-628.
Samrit T, Osotprasit S, Chaiwichien A, Suksomboon P, Chansap S, Athipornchai A, Changklungmoa N, Kueakhai P. Cold-Pressed Sacha Inchi Oil: High in Omega-3 and Prevents Fat Accumulation in the Liver. Pharmaceuticals (Basel). 2024 Feb 7;17(2):220.
Rinninella E, Costantini L. Editorial: Polyunsaturated fatty acids and gut microbiota. Front Nutr. 2023 Jul 28;10:1256817.

谷禾健康
肥胖和代谢综合征在全球范围内日益流行,是21世纪人类健康面临的重大威胁之一。据世界卫生组织(WHO)全球数据估计,目前全球约13%(即近65亿)成年人口受肥胖症影响。

肥胖和代谢综合征对健康的危害包括增加患心血管疾病、糖尿病和高血压的风险,影响身体的免疫系统和内分泌系统,还可能导致肝脏疾病等。
更令人担忧的是,模型预测到2030年,约五分之一的成年人将患有肥胖症,这些数字突显了寻求新疗法的迫切需要,这些新疗法将独特地利用肥胖和代谢综合征背后的复杂途径来促进体重减轻以及代谢和免疫系统的调节。
“肥胖”是指身体过度脂肪堆积,超过正常范围的体重。通常是由于摄入热量过多,消耗热量不足导致的。同时肥胖患者还伴有慢性低度炎症,以及肠内分泌和神经激素的失调。
体重通过激素、神经和代谢途径之间复杂的相互作用进行调节,并受到许多环境因素的影响。能量摄入和支出之间的不平衡可能是由于多种因素造成的,包括饮食行为的改变、异常的饱腹感或饥饿感以及低能量支出。
目前主要有两种新兴的治疗方式:通过肠道微生物群和膳食纤维。肠道微生物群通过涉及粘膜和全身免疫、激素和神经系统的多种机制,深刻影响能量稳态的各个方面。
膳食纤维对新陈代谢和肥胖的益处也已通过机制研究和临床试验得到证明,在本文,我们讨论了不同纤维的理化特性、纤维和肠道微生物群如何相互作用以调节体重稳态的最新发现,以及与使用膳食纤维作为补充策略。
了解膳食纤维沿胃肠道的生理效应,包括肠道微生物群的作用,将支持开发利用微生物群和临床特征来预测个体对纤维补充反应的精准医学方法,用于调节免疫、代谢和体重稳态。随着临床前和临床研究继续探索膳食纤维能够促进哪些与健康相关的微生物群和代谢物,对这种纤维-微生物群的相互作用将为开发基于纤维的精准营养提供框架,以实现更优化、个性化的肥胖和代谢综合征相关治疗。
为了更好地预防和改善肥胖,我们需要先了解关于肥胖的一些知识。
✦ 肥胖患者肠内分泌和神经激素会失调
肥胖不仅仅是体重过高,其实是一种复杂的慢性进行性疾病,其特征是体内脂肪堆积过多以及肠内分泌和神经激素信号通路失调,从而增加食欲和能量储存。
✦ 肥胖还伴有慢性低度炎症
肥胖也被描述为一种慢性低度全身炎症,循环促炎细胞因子水平升高,对中枢神经系统(CNS)以及参与能量和代谢稳态的所有器官产生负面影响。
肥胖个体下丘脑尺寸的增加被认为是由于下丘脑炎症所致,这将加剧能量稳态失调。内脏脂肪组织和胃肠道失调似乎是全身炎症的主要原因。来自肥胖动物模型的大量证据支持肠道微生物群衍生的脂多糖数量增加通过增强细胞旁运动或通过乳糜微粒运输的跨细胞途径进入体循环的作用,从而启动许多炎症途径,进一步导致体重增加。
尽管来自人类研究的证据不如来自动物模型的结果清楚地表明肠道来源的脂多糖与肥胖之间的关联,但人体中的一些研究结果已将全身性脂多糖增加与肥胖联系起来,特别是与肥胖相关的代谢疾病风险。
此外,一些人类研究的结果表明,高水平的餐后内毒素血症先于2型糖尿病的发生,这表明存在潜在的致病作用。
在正常生理条件下,能量稳态通过调节饮食行为和能量储存的肠内分泌和神经激素信号通路受到严格控制。除了胰腺产生胰岛素和胰高血糖素之外,胃肠道和脂肪组织也会产生主要整合在下丘脑内的信号,以调节食物摄入和能量消耗。
✦ 肠内分泌激素有促食欲和抑制食欲两种作用
肠内分泌激素,由整个胃肠道中专门的肠内分泌细胞(EEC)响应营养和其他信号而释放。这些激素在胃肠道和远处器官中发挥局部作用,协调能量稳态的维持,包括饥饿、饱腹感、肠道屏障完整性、肠道转运、血糖控制和整体能量平衡。
肠内分泌激素的功能可根据其促食欲(刺激食欲)和厌食(抑制食欲)特性大致分类。胆囊收缩素(CCK)、肽 YY(PYY)、胰高血糖素样肽1(GLP1)、葡萄糖依赖性促胰岛素多肽(GIP)和胃泌酸调节素是主要由小肠EEC产生并在餐后释放以诱导饱腹感和减少食物的摄入。
从胃中释放的生长激素释放肽和从结肠中的EEC释放的胰岛素样因子5(INSL5)充当促食欲信号。瘦素和脂联素从脂肪组织中释放,也有助于调节饮食行为和能量稳态。
主要肠道激素及其对能量稳态的影响


Deehan EC,et al.Nat Rev Gastroenterol Hepatol.2024
✦ 进食速度和食物适口性也会影响能量摄入
然而,肠道源性食欲激素的水平并不一定与能量摄入相关;此外,一些研究表明,人类对急性饮食的激素反应并未表现出对常量营养素摄入量长期差异的实质性适应。这些发现表明,其他因素,例如食物能量密度和食物摄入速度以及食物的适口性,可能会增加人类的能量摄入。
✦ 中枢神经系统调节饥饿、饱腹感和能量储存
中枢神经系统是多种肠道源性激素的重要作用部位,也是通过整合涉及自主下丘脑回路、皮质执行回路和皮质边缘奖励通路的大脑网络来调节饥饿、饱腹感和能量储存的中枢调节器。
下丘脑的弓状核内有两个独立且相对的神经元群:促食欲NPY-AgRP神经元和促厌食POMC-CART神经元。
NPY-AgRP神经元被能量不足和信号(如生长激素释放肽)激活,以刺激食物摄入,并被胃肠道中营养物质的存在和饱足信号(如CCK和PYY)抑制。相比之下,瘦素等信号激活POMC-CART神经元会抑制进食,并由于释放与大脑黑皮质素受体结合的α-黑素细胞刺激激素而改变葡萄糖代谢。
✦ 肥胖患者的能量信号受损导致易暴饮暴食
有证据表明,肥胖成人中营养信号的受损会导致暴饮暴食和肥胖。在一项针对健康体重个体和肥胖个体的单盲、随机、对照交叉研究中,结果显示,肥胖个体在大脑对摄入营养素的反应中表现出整体和营养特异性受损。因此肠道和脂肪源性激素以及中枢神经系统共同是能量稳态治疗操纵的基本目标。
过去二十年的研究表明,肥胖代谢特征的特征是人类血清胆囊收缩素、胰岛淀粉样多肽、胃饥饿素、INSL5和胰岛素水平升高,同时瘦素、GLP1和PYY水平降低。
重要的是,这些血浆激素水平被发现随着减肥手术后肥胖的解决而恢复正常,从而强调了它们作为关键治疗靶点的作用。
✦ 激素药物的疗法会受到胃肠道耐受性的影响
针对肥胖的内源性神经分泌机制的药物是治疗肥胖和代谢综合征最有效的长期药物疗法。GLP1激动剂(索马鲁肽、利拉鲁肽和西他列汀)已被证明对持续减肥和改善心脏代谢功能具有良好功效。
使用作用于GIP、GLP1或胰高血糖素受体的双重和三重激素受体激动剂的临床试验已显示出在减肥和改善代谢参数方面的卓越功效。
然而,这些基于肠降血糖素的疗法的使用目前受到高成本、有限的医疗保健覆盖范围和胃肠道耐受性问题的限制。此外,人们还担心这些药物对肠道功能的长期影响。
✦ 基于饮食的疗法将是未来的趋势
由于这些限制,人们越来越有兴趣开发替代性肠促胰岛素靶向疗法,特别是基于饮食的方法,通过使肠促胰岛素激素(如GLP1和GIP)水平正常化来治疗肥胖并预防肥胖相关代谢功能障碍的发生。
在动物模型和人类中进行的大量研究表明膳食纤维摄入对宿主代谢和减肥有好处,因此增加膳食纤维摄入量作为一种基于饮食的肥胖疗法已引起广泛关注。
膳食纤维是碳水化合物的一种聚合物,主要存在于植物食物中,可抵抗哺乳动物基因组中编码的酶的消化;它们到达近端结肠,在其中经历肠道微生物群不同速率和程度的糖分解发酵。
✦ 目前大部分人群膳食纤维摄入不足
膳食纤维的生理益处多种多样,取决于其理化特性和摄入量,膳食纤维的推荐膳食摄入量为每1000kcal 14克(成年女性每天25克,成年男性每天38克)。然而,目前大部分人群通常每天摄入的纤维少于15克,即推荐量的一半左右。
✦ 肠道微生物在纤维代谢促进健康中起重要作用
几项大型前瞻性研究已经证明了纤维消耗与代谢健康之间的关联,目前的工作强调了肠道微生物群在将膳食纤维摄入与有益效果联系起来。
越来越多的证据表明,肠道微生物群通过涉及免疫、激素和神经系统影响的多种机制,深刻影响能量稳态的各个方面,并且肠道菌群失调或肠道微生物类群的异常组成可能会导致能量代谢紊乱并对脂肪组织、肌肉和肝脏造成影响。
肠道微生物群发酵纤维会释放出多种代谢物,包括短链脂肪酸、酚类和吲哚化合物、支链脂肪酸、乳酸、琥珀酸和各种气体(氢气、二氧化碳、甲烷、一氧化氮和含硫化合物)。
肠道微生物产生代谢物的途径和前体对饮食摄入具有高度适应性;因此,通过特定的饮食干预措施(例如膳食纤维)来针对微生物代谢是改善代谢功能障碍和肥胖的关键因素。
短链脂肪酸是通过微生物可接触的膳食纤维发酵产生的主要代谢物,人体肠腔中主要短链脂肪酸的相对比约为乙酸盐(60):丙酸盐(20):丁酸盐(20)。
短链脂肪酸可以通过与G蛋白偶联受体相互作用并抑制组蛋白脱乙酰化来介导多种局部和外周效应,从而导致基因表达的表观遗传调节变化。
丁酸盐在结肠中被结肠细胞用作能量来源,而丙酸盐和乙酸盐通过门静脉吸收到肝脏,其中丙酸盐主要用作糖异生和脂肪生成的底物;相反,乙酸盐以更高的量进入体循环。
✦ 短链脂肪酸影响激素分泌从而改善葡萄糖代谢
除了纤维对胃排空和抑制消化的影响已得到充分证明外,增加饮食中的纤维含量可能会通过产生短链脂肪酸来帮助减肥和葡萄糖代谢。
大量体外和小鼠研究表明,短链脂肪酸通过G蛋白偶联受体GPR41和GPR43(也称为FFAR3和FFAR2)直接刺激肠道肠内分泌细胞分泌胰高血糖素样肽-1(GLP-1)和肽YY(PYY)。
体内研究表明,急性直肠输注醋酸盐或短链脂肪酸混合物会增加PYY和GLP1的全身水平。此外,一项人体研究表明,与单独使用菊粉相比,在20名健康成年人中,急性口服菊粉丙酸盐会增加全身PYY和GLP1的水平,并减少食物摄入量,这表明丙酸盐水平增加在调节血糖新陈代谢方面发挥着作用。
✦ 短链脂肪酸影响神经系统抑制食欲和能量摄入
短链脂肪酸还可以直接与肠神经系统相互作用,从而允许肠道来源的短链脂肪酸向大脑直接发出信号。小鼠研究表明,短链脂肪酸给药可通过中枢神经系统相关机制抑制食欲和能量摄入。
此外,体外和小鼠研究表明,短链脂肪酸可以通过多种机制增强血脑屏障,包括减少氧化和促炎途径以及增加紧密连接蛋白。
在小鼠研究中,乙酸盐和丁酸盐已被证明可以穿过血脑屏障并刺激迷走神经和下丘脑,从而调节食物摄入量和饱腹感。使用功能性磁共振成像的人体研究表明,结肠丙酸盐输送减少了与食物渴望相关的大脑区域的活动,并减少了食物摄入量。
需要注意的是,尽管在人脑和脑脊液中发现了可测量浓度的短链脂肪酸,但人脑对循环短链脂肪酸的摄取似乎有限,这表明一些记录在案的循环短链脂肪酸对大脑活动的影响可能是这是由于短链脂肪酸诱导的与免疫和内分泌系统的相互作用,而不是大脑内的直接相互作用。
短链脂肪酸对能量稳态的作用机制
Deehan EC,et al.Nat Rev Gastroenterol Hepatol.2024
✦ 短链脂肪酸影响脂肪的分解和积累
在培养的小鼠和人类脂肪细胞中,乙酸盐和丙酸盐已被证明能够以G蛋白偶联受体依赖性方式促进脂肪分解并抑制脂肪生成,从而可能减少非脂肪组织和脂肪组织中的全身脂质循环和脂肪积累,同时还提高胰岛素敏感性。
在人类研究中,短链脂肪酸的直肠给药已证明可以促进全身脂肪分解,并且在体外培养的人类脂肪细胞中,短链脂肪酸也已被证明可以刺激瘦素分泌。短链脂肪酸还可以减少人类外植体脂肪组织的促炎细胞因子分泌,因此可能有助于减少与肥胖相关的全身低度炎症。
注意:仍然存在一些不确定性
然而,尽管大量工作支持短链脂肪酸在调节体重增加和宿主代谢方面具有潜在的有益作用,但该领域关于短链脂肪酸在肥胖中的作用仍然存在很大的不确定性,因为许多影响主要体现在小鼠模型无法在人类研究中复制。
事实上,据报道短链脂肪酸水平升高和降低都与肥胖有关。然而,大多数人类研究测量粪便样本中的 短链脂肪酸,这反映了生产、吸收和利用的净结果,并不一定反映可能更相关的全身水平。
为了支持这一观点,对160名BMI在19.2 kg/m2至41kg/m2且葡萄糖代谢正常或受损的参与者进行的横断面研究中证明,全身短链脂肪酸水平与空腹甘油呈负相关。三酰甘油和游离脂肪酸,与空腹GLP1呈正相关,而粪便水平与这些参数均无关联。此外还发现循环醋酸盐与胰岛素敏感性之间呈负相关,而丙酸盐与胰岛素敏感性呈正相关。
总体而言,研究短链脂肪酸对宿主代谢的生理影响的可用人体体内数据仍然有限。由于纤维、肠道微生物群和人体新陈代谢之间相互作用的复杂性,目前尚不清楚增加纤维摄入量的有益影响是由于微生物代谢和某些代谢物(例如短链脂肪酸)的产生或其他有据可查的影响而产生的纤维的变化,包括运输时间、营养吸收或粪便膨胀和结合的改变。
除了短链脂肪酸之外,肠道微生物群还在膳食纤维发酵过程中产生乳酸和琥珀酸,然而,这些代谢物通常被认为是微生物生产短链脂肪酸的中间体。
✦ 肥胖和代谢综合征患者乳酸和琥珀酸含量增加
乳酸和琥珀酸以低浓度存在于血液和组织中,与没有肥胖的人相比,在肥胖和代谢综合征患者中检测到的水平有所增加。乳酸是宿主衍生的葡萄糖代谢产物,当糖酵解通量超过线粒体氧化时,血液中的乳酸会增加。
✦ 乳酸可能作为活性信号分子减少促炎反应
因此,乳酸可以被认为是葡萄糖代谢受损的生物标志物。此外,体外和小鼠研究表明,乳酸可以作为活性信号分子,调节脂肪细胞功能和代谢,并通过GPR81依赖性和非GPR81依赖性来减少脂肪组织和免疫细胞功能中的促炎症反应。
由于这些有益的发现,有人建议通过增加纤维摄入量和由此产生的乳酸产量来靶向GPR81可能代表肥胖和代谢紊乱的新治疗靶点。
✦ 琥珀酸作为代谢稳态的一种信号分子
尽管琥珀酸传统上被认为是三羧酸循环的代谢物,但目前的研究已证明琥珀酸可作为参与应激和组织损伤的代谢信号。
肠腔中琥珀酸含量较低,但对小鼠的研究发现,细胞外琥珀酸的浓度随着纤维摄入量的增加而增加。琥珀酸可以通过与几种不同细胞类型(包括脂肪细胞和免疫细胞)上的琥珀酸受体1(SUCNR1;也称为GPR91)结合而充当信号分子。
在人类中,横断面研究报告称,血浆琥珀酸水平、肥胖和葡萄糖代谢损伤之间存在负相关。据报道,琥珀酸还可以充当生热激活剂和褐变剂,并且对脂肪分解具有影响。
一项使用脂肪细胞特异性Sucnr1敲除小鼠和从肥胖人群中分离出的人类脂肪细胞的研究发现,通过与SUCNR1相互作用调节脂肪细胞中的生物钟和瘦素表达,琥珀酸诱导的代谢效应具有新功能。
✦ 琥珀酸可能有助于解释代谢与炎症之间的联系
还有强有力的证据表明琥珀酸-SUCNR1信号传导可以充当代谢应激和炎症之间的联系。
利用人类原代巨噬细胞证明,细胞外琥珀酸可以诱导巨噬细胞产生抗炎作用。有趣的是,肥胖与全身琥珀酸水平高有关,但脂肪组织驻留巨噬细胞中琥珀酸受体的表达减少,这可能有助于解释为什么肥胖患者往往无法控制炎症。
在小鼠模型中,研究表明,肠道微生物群响应补充低聚果糖 的饮食而产生的琥珀酸增加,通过充当肠道糖异生的底物并随后减少肝脏葡萄糖的产生来改善血糖控制和能量代谢。
随着越来越多的研究检查琥珀酸诱导的生理效应,它可能有助于阐明细胞外琥珀酸的作用及其在调节宿主代谢中的局部和全身作用模式以及如何最好地针对这些途径。
✦ 微生物发酵膳食纤维产生的气体会导致一些胃肠道症状
膳食纤维经微生物发酵还会进一步产生H2、CO2和CH4等气体。然而,纤维发酵过程中气体产量的增加可能会引起不良症状,并且是个体不耐受高水平纤维的主要原因之一。
因此,还需要进行更多研究来增加肠道气体对宿主生理和代谢影响的了解,使用纤维和大量营养素的饮食控制来减轻患有与产气相关的胃肠道疾病的患者症状。
了解膳食纤维在胃肠道中的生理效应机制,包括其与肠道微生物群的作用,将有助于开发基于膳食纤维的补充策略,以调节免疫、代谢和体重稳态。
所有膳食纤维的共同特征是它们的低聚或多聚碳水化合物结构可抵抗小肠的消化,并且如果分离和合成,则对人类健康显示出生理益处。然而,纤维之间的化学和物理结构以及理化特性存在巨大的异质性。
常见分离和合成的商业膳食纤维

Deehan EC,et al.Nat Rev Gastroenterol Hepatol.2024
✦ 膳食纤维的差异会影响其对人体的作用
具有较长、无支链的线性碳水化合物结构(如纤维素)通常不溶于水性溶剂,阻碍了人类肠道微生物群对其进行发酵,使较少的微生物能够接触到这种结构。
相比之下,具有混合连接或支链的低聚合物和聚合物通常可溶于水,更容易被肠道微生物接近。因此,随着聚合度的增加,可溶性纤维倾向于将水和其他化合物截留在聚合物内和聚合物之间,从而以浓度依赖性方式增加粘度。分子量也会影响微生物的发酵和短链脂肪酸生产速率;然而,分子量与发酵之间的关系取决于纤维结构,且不一定是线性的。
尽管纤维通常根据物理化学性质(例如溶解度、粘度、结合能力或发酵性)进行分类,但这种分类并不能反映离散纤维结构所表现出的全部性质。
例如,来自高粱或稻米等草类的阿拉伯木聚糖低聚物或简单结构的聚合物很容易发酵,而复杂结构的阿拉伯木聚糖要么在整个结肠中缓慢发酵,要么很难被人类肠道微生物群作用。
因此,了解纤维的结构和理化特性,尤其是分离或合成后的纤维,对于更精确地应用纤维来治疗肥胖至关重要。
膳食纤维的理化特性影响它们在胃肠道中的作用,从而决定它们对炎症、代谢和能量稳态的影响。
✦ 粘性纤维和较大纤维会增加饱腹感并减少摄入
从口腔开始,粘性纤维和大纤维颗粒(如谷类麸皮)可以通过获得更坚硬和耐嚼的食物基质来延长咀嚼和口腔感官暴露,从而改变内分泌相对饱腹感的反应并减少能量摄入。
当食品应用中热量密集的糖和脂肪减少时,菊粉、低聚果糖和微纤丝纤维等纤维也可以保持感官特性(如甜味和口感)。天然食品中的纤维基质进一步充当唾液淀粉酶等消化酶的屏障。咀嚼过程中这些三维植物细胞壁结构的维持影响细胞内成分(如淀粉)沿胃肠道的生物利用度。
增加食糜粘度的纤维,例如较高分子量的混合连接或支化聚合物和微纤丝纤维,可促进胃扩张并延迟胃排空。小肠腔内增加的食糜粘度通过限制营养物质向粘膜扩散和内源性消化酶的活性进一步延迟营养物质吸收,这通过触发回肠破裂进一步减慢近端胃肠传输。
✦ 纤维结构影响脂质的吸收和利用率
除了粘度之外,某些纤维结构还可以结合或捕获化合物,例如常量营养素和微量营养素、酚类和胆汁酸,从而延迟或阻止小肠吸收。胆汁酸与膳食纤维的结合会干扰胆汁酸的肠肝循环并阻碍胶束形成,从而减少脂质的吸收和利用率。
此外,增加纤维结合胆汁酸向大肠的输送可能会导致微生物胆汁盐水解酶和 7α-脱羟酶将初级胆汁酸转化为次级胆汁酸。对人类和小鼠的研究以及使用分离的人类胰岛和哺乳动物培养细胞的体外实验表明,这些次级胆汁酸通过多种膜和核受体(包括G蛋白偶联胆汁酸受体(TGR5)和法尼醇X受体,导致饱腹感增加、肝糖原合成、肝脏、棕色脂肪和肌肉组织中的胰岛素分泌和能量消耗。
一项针对肥胖和2型糖尿病患者(n=23)的研究证明,将结合胆汁酸输送到回结肠区域可降低餐后血糖和空腹胰岛素水平,并增加GLP1分泌,这支持了胆汁酸在葡萄糖代谢中的作用。
✦ 膳食纤维会影响小肠对营养的反应
尽管了解甚少,但膳食纤维可能会进一步改变驻留的小肠微生物群,在大鼠模型中显示这种相互作用会影响小肠营养感应,特别是低聚果糖诱导的脂质感应,从而促进肠内分泌细胞(EEC)释放GLP1以增加饱腹感。
在培养细胞、动物模型和人类中进行的大量工作也表明微生物代谢物与胃肠道味觉受体表达和活性的改变有关,从而导致味觉偏好和食物摄入的改变。
最后,所有膳食纤维,无论是天然存在的、分离的还是合成的,都可以通过简单地用不可消化的碳水化合物代替一部分可消化的化合物来减少能量摄入,这与能够在不改变感官特性的情况下在食物中实现更高水平的较低粘性纤维相关。
总体而言,小肠的营养吸收率受到结构依赖性的影响,增加了纤维消耗的阻碍。这有助于促进饱腹感,减弱餐后血糖、血脂和炎症反应,而这些反应通常在肥胖症中失调。
纤维摄入量的增加相当于未吸收的营养物质增加,这些营养物质到达近端结肠并可供人体肠道微生物群利用。
膳食纤维对胃肠道的生理影响
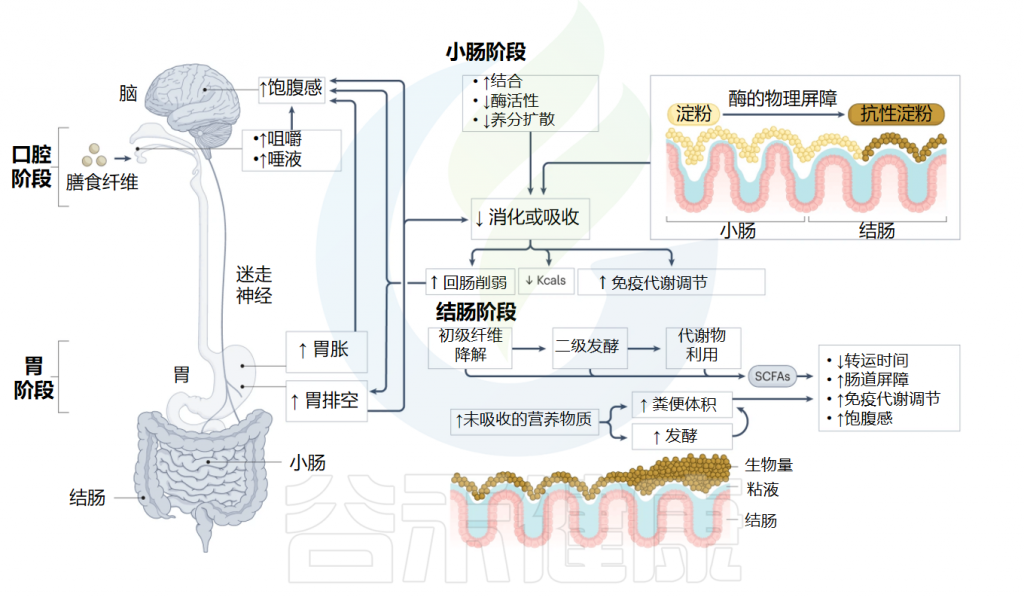
Deehan EC,et al.Nat Rev Gastroenterol Hepatol.2024
✦ 微生物对膳食纤维作用改善排便和减轻炎症
与小肠中的化合物结合的纤维进一步在结肠中被作用,使底物和其他生长因子接近利用它们的特定微生物。肠道微生物群对发酵缓慢或发酵不良的化学和物理结构,如大纤维颗粒、纤维素或车前草,通过刺激蠕动、粘膜分泌和抑制水的重吸收来提供其他胃肠道益处,这已被证明可以增加体积和软化人类粪便。
这些纤维通过抑制微生物发酵可能减少结肠转运时间,促进结合化合物的排泄并减轻全身炎症。尽管可发酵纤维还可以通过增加微生物生物量以及产生短链脂肪酸和气体来影响结肠转运时间,但纤维发酵的主要生理效应归因于假定有益微生物的结构特异性扩张以及随后结肠内短链脂肪酸和其他代谢物的产生。
✦ 富含膳食纤维的饮食使肠道微生物群更丰富
纤维到达结肠时会引发微生物群落内复杂的交互作用,这些群落共同获取、降解和利用代谢产物,最终丰富了成员多样性。
初级降解和次级发酵释放短链脂肪酸、气体和其他代谢产物,被代谢物利用者进一步转化,影响与结肠细胞的相互作用。
消耗可发酵纤维支持多种微生物群成员,解释了纤维结构多样的饮食与多样化微生物群的关联,这是健康肠道微生物组的特征。
结肠中成员的富集和代谢产物的促进取决于纤维结构、个体群落和生态因素,如结肠微环境。研究表明,特定饮食可增加能量利用,降低脂肪含量,并提高胰高血糖素样肽-1(GLP-1),而食物摄入量无显著变化。
✦ 复杂结构的膳食纤维增加结肠远端的短链脂肪酸产量对代谢有利
尽管纤维发酵过程中微生物群落产生的副产物主要发生在结肠近端,但通过消耗具有结晶或复杂结构的纤维可以减慢发酵速率,从而减轻肠道气体的产生并将短链脂肪酸输出转移到远端。
研究表明,增加短链脂肪酸远端产量可通过上调PYY和GLP1等肠内分泌激素,对人类的饱腹感、血糖和能量代谢产生有利影响。
事实上,在肥胖男性中,远端结肠中施用的醋酸盐增加了脂肪氧化和循环PYY;然而,当在近端结肠中施用醋酸盐时,没有看到效果。尽管向增加脂肪氧化和PYY产生的转变意味着有利的能量代谢,但仍需要进一步研究来确定是否可以通过增加远端结肠中纤维发酵和短链脂肪酸的产生来减少体重和肥胖。
✦ 远端结肠可能是未来治疗肥胖的靶点
糖分解发酵向远端结肠的扩展和延伸进一步减少了膳食和粘膜蛋白质的发酵。蛋白水解发酵的抑制部分是由于肠道微生物对碳水化合物而非氨基酸的普遍偏好,以及乳酸和纤维发酵过程中结肠pH值降低抑制蛋白水解酶。
人类蛋白水解发酵的减少可能会随后降低被认为有害和促炎的病原体(例如脱硫弧菌)和代谢物(例如氨或对甲酚)的水平。纤维和蛋白质发酵之间的平衡已在人类身上得到证实,因为增加抗性淀粉的剂量以及将饮食模式从高蛋白、低碳水化合物转变为体重维持饮食已被证明可以增加粪便中的短链脂肪酸并减少支链脂肪酸,支链氨基酸发酵产生的代谢物。
促进结肠中短链脂肪酸的产生可能会通过刺激粘液分泌、上调紧密连接蛋白、增加抗菌肽浓度和调节结肠上皮增殖来增强胃肠道屏障完整性,共同减轻细菌脂多糖的易位和随之而来的代谢性内毒素血症。总之,这些结果支持将远端结肠作为控制肥胖的治疗靶点。
除了膳食纤维结构之外,还有一些生态因素会影响纤维发酵过程中促进健康相关的微生物和代谢物的产生。
✦ 结肠转运时间影响微生物群和宿主代谢
结肠转运时间被认为是影响肠道微生物群和宿主代谢的关键因素,转运时间较慢与纤维发酵速率降低和短链脂肪酸减少、远端结肠pH值和蛋白水解发酵增加以及肠道对粪便能量的回收减少。
体外实验进一步表明,结肠pH值的降低可通过选择对酸敏感的微生物(如拟杆菌)来塑造参与纤维结构发酵的独特微生物群落。由于参与结肠纤维发酵的大多数共生微生物是专性厌氧菌,因此如在炎症中观察到的那样,结肠微环境中氧浓度的增加,也通过支持耐氧微生物(例如大肠杆菌)的大量繁殖来形成特殊菌群成员。
✦ 不同人群对补充膳食纤维会产生个性化反应
由于生态因素影响微生物对膳食纤维的个体化反应,因此在实施基于可发酵纤维的治疗策略来预防和治疗肥胖和代谢综合征时,需要从个人生态角度出发。
据报道,纤维引起的肠道微生物群变化仅限于少数主要反应类群,而其余成员和代谢副产物则发生更多个性化变化。
例如,数十年的人类研究证实,低聚果糖和低聚半乳糖等益生元寡糖可通过选择性促进经常用作益生菌的乳酸菌和双歧杆菌来增加乳酸和乙酸,从而为人类带来健康益处。
丁酸盐生产菌
体外研究还表明,厌氧丁酸菌、真杆菌、粪杆菌等丁酸盐生产菌可以通过乳酸和乙酸的交叉喂养或通过利用抗结晶淀粉、木聚糖和菊粉等底物来富集。
丙酸盐生产菌
另外,丙酸盐生产者,如拟杆菌属、副拟杆菌属、葡萄杆菌属和韦荣球菌属,可以通过交叉饲喂乳酸和琥珀酸盐或通过降解底物(如酯化抗性淀粉、果胶和木聚糖)来富集。
下一代益生菌
下一代益生菌有望改善患有肥胖和代谢综合征的成年人的代谢,其中包括Akkermansia muciniphila或Anaerobutyricum soehngenii ,这两种细菌已被证明可以通过补充纤维来丰富。
小结
因此,可发酵膳食纤维可用于选择性地扩大肠道微生物群内与健康相关的类群。然而,仍需要进行更多研究来阐明与肥胖和代谢功能障碍有因果关系的其他共生微生物和代谢物,并可通过选择膳食纤维来靶向。
肠脑轴连接肠道和中枢神经系统,促进双向通讯。这一过程牵涉到肠神经系统、迷走神经、内源性大麻素系统以及神经免疫和神经内分泌通路。
肠道代谢产物可直接调节神经系统活动,通过作用于肠神经元、迷走神经和交感神经末梢,或者经体循环传输至大脑。
★ 肠道微生物产生的多种神经递质会影响食欲
此外,肠道微生物还产生多种神经递质,如血清素、多巴胺、乙酰胆碱和GABA(γ-氨基丁酸),这些物质通过迷走神经在肠神经系统或中枢神经系统内发挥作用。一项小鼠研究指出,细菌肽聚糖片段与大脑下丘脑神经元上的NOD2相互作用,调节食物消耗和体温,进而影响食欲。
研究者还发现,从肥胖小鼠体内提取的微生物移植到瘦小鼠体内,可影响大脑奖励系统,与微生物代谢产物3-3′-羟苯基丙酸存在因果关系,影响多巴胺能和阿片类标记物,进而调节食欲行为和动机。进一步分析显示,嗜黏蛋白阿克曼菌(Akkermansia)、Muribaculum、普雷沃氏菌(Prevotellaceae)和副拟杆菌(Parabacteroides)的水平与3-3′-羟苯基丙酸血浆水平相关。
肥胖症中微生物群与肠道之间的相互作用
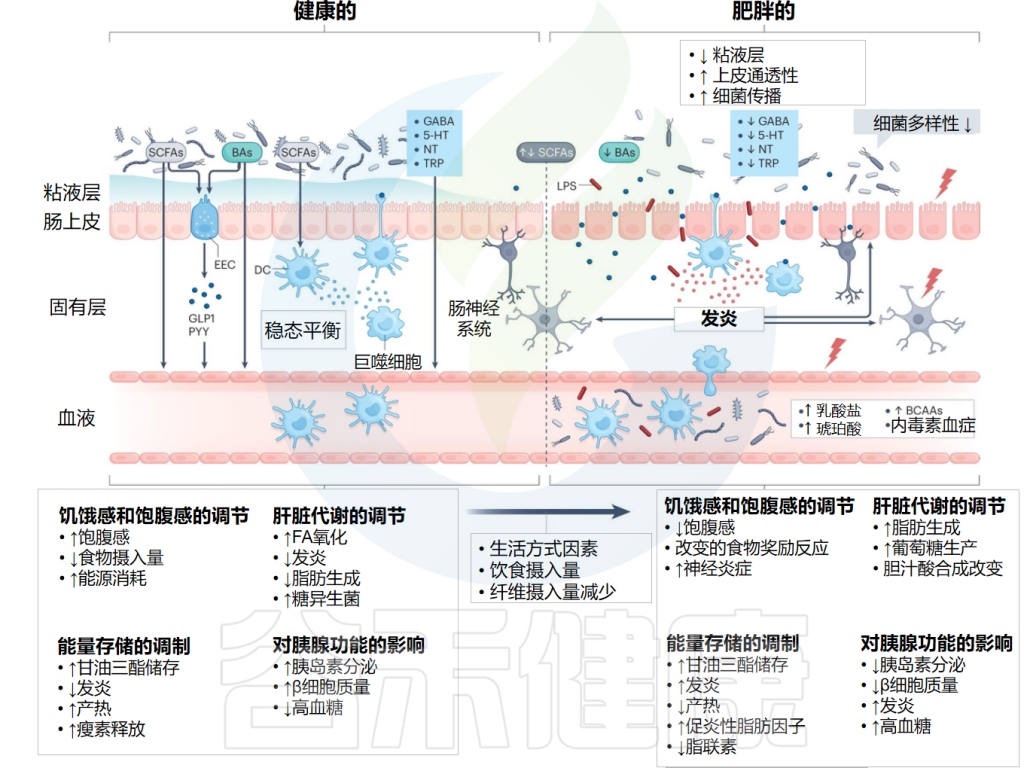
Deehan EC,et al.Nat Rev Gastroenterol Hepatol.2024
这些研究共同表明,肠道微生物群与宿主相互作用,通过不同的自主神经和体细胞神经内分泌途径改变新陈代谢,并且肥胖患者的这些相互作用发生了实质性改变。实际上,每个途径都代表了可以通过饮食干预(例如增加纤维摄入量)进行调节的潜在途径。
扩展阅读:
治疗肥胖症的精准医学方法是通过个性化的诊断和治疗方案来帮助患者减肥和改善健康状况。这种方法结合了先进的科学技术和专业知识,以确保每位患者都能得到最有效的治疗。
通过精准医学方法,医生可以根据患者的基因、生活方式、肠道微生物群和其他因素制定个性化的治疗计划,从而更好地管理和治疗肥胖。
对于减肥饮食干预的反应存在着高度的个体差异,这种差异可以归因于多种因素,包括遗传背景、微生物群组成以及生活方式因素(如进餐时间、睡眠、锻炼和昼夜节律)。为了实现减肥效果,需要确定影响个体对饮食干预反应的关键因素,并制定个性化的营养策略。
✦ 肠道微生物群是预测减肥效果的良好指标
研究表明,基线微生物宏基因组谱,尤其是与纤维降解相关的几个基因的存在,与随后的体重减轻密切相关。在一项为期6个月的减重研究中,研究人员发现,个体的肠道微生物群是预测体重减轻效果的一项重要指标。
特定的肠道细菌,如布劳特氏菌(Blautia wexlerae)和多氏拟杆菌(Bacteroides dorei),在含量丰富的个体往往能更好地预测体重减轻效果。
此外,体重减轻与活泼瘤胃球菌(Ruminococcus gnavus)、马赛拟杆菌(Bacteroides Massiliensis)和芬氏拟杆菌(Bacteroides Finegoldii)相关。
✦ 具有高发酵肠道微生物水平时增加纤维摄入有利于减肥
这些微生物群,如阿克曼氏菌和普雷沃氏菌,由于其处理植物来源复杂纤维的能力,与富含纤维的饮食密切相关。相比之下,食用低纤维饮食的个体通常具有更高水平的拟杆菌;而食用高纤维饮食的人群普雷沃氏菌更丰富。在人类减肥试验中,与普雷沃氏菌水平较高的个体相比,以拟杆菌为主的个体在摄入富含纤维的饮食时通常不太可能减肥或维持体重减轻效果。
这些发现表明,高水平发酵代谢的肠道微生物群(如普雷沃氏菌)可能更有利于减肥,尤其是在增加纤维摄入量时。
最后,试验(n=1002)的数据显示,肠道微生物群组成是餐后脂质和血糖反应,以及空腹心血管代谢标志物的良好预测因子。然而,必须指出的是,肠道微生物群组成仅解释了餐后甘油三酯、葡萄糖和C肽升高的5-7%变化,其他因素也在其中起作用。
将基于精准医学的方法应用于肥胖和代谢紊乱的另一种方法是根据个体的潜在病理生理学和行为特征使用针对表型的干预措施。
肥胖表型通常可分为四类:异常饱腹感、异常餐后饱腹感、情绪性进食和异常静息能量消耗。针对每种表型进行了可行性试验,比如通过使高纤维饱腹感异常的个体饮食,可以关闭大脑饥饿中枢并实现最大的胃扩张。支持这一概念的是,与接受标准治疗的参与者相比,接受表型定制生活方式干预的参与者减重更多,代谢和临床参数改善更显著。
✦ 根据不同表型采取饮食会有更好的效果
在一项为期12周的饮食干预试验中,患有肌肉胰岛素抵抗或肝脏胰岛素抵抗的人被随机分配到高单不饱和脂肪酸饮食或低脂肪、高蛋白和高纤维饮食。具有肌肉胰岛素抵抗的个体(n =149)在食用低脂肪、高蛋白和高纤维饮食时代谢参数有更多改善,而具有肝脏胰岛素抵抗的个体食用高单不饱和饮食时,肝脏胰岛素抵抗(n=93)有更大的改善。
需要注意的是,另一种基于代谢表型的方法根据CORDIOPREV-DIAB试验显示出相互矛盾的结果。可能是由于研究人群的差异或饮食干预措施的组成差异造成的,说明了基于某些表型设计精准饮食干预措施的还存在一些挑战。
通过营养干预进行个性化葡萄糖优化研究旨在测试这种通过根据组织特异性胰岛素抵抗表型调节膳食营养素含量来改善葡萄糖稳态参数和心脏代谢健康的方法。
尽管开发个性化营养干预措施存在相关的挑战,但这些原理验证研究总体上支持使用基于生物和表型因素开发个性化饮食干预措施的基本概念。
此外,了解肠道微生物及其基因途径如何与饮食成分相互作用可能有助于设计更有效的个性化疗法,并有可能提高饮食干预减肥的成功率。
膳食纤维的结构和理化多样性为开发基于纤维的策略提供了潜力,还能从一定程度上改善肥胖和代谢综合征药物和手术疗法。
富含纤维的天然食品,如全谷物、蔬菜、水果、豆类、坚果和种子,为以肥胖为中心的医学营养疗法提供了非淀粉多糖和抗性淀粉的混合来源,分离和合成的浓缩和均匀特征纤维为针对代谢综合征病理生理学的营养保健品开发提供了途径。
✦ 膳食纤维对于控制肥胖有重要作用
几种纯化的食品级膳食纤维已经作为食品成分或补充剂在市场上销售,其中许多可以被选定的微生物群落获取、降解和利用。
一项包含22项随机对照试验、总共1428名参与者的系统回顾和荟萃分析表明,使用分离的可溶性膳食纤维补充剂(菊粉、低聚果糖、抗性玉米糊精、瓜尔豆胶、亚麻籽粘液、海藻酸盐粉、葡甘露聚糖和黄原胶)的个体至少12周后, 与对照干预措施相比 ,体重减轻和代谢功能改善显著更高(可消化的碳水化合物),支持补充分离纤维在控制肥胖中的作用。
然而,体重的减少相对适度(平均差-1.25公斤),表明单独分离的可溶性纤维可能无法实现实质性的体重减轻。
!
补充膳食纤维需要和个体特征相匹配
使用基于膳食纤维的策略相关挑战在于需要什么剂量才能产生有益效果以及个人对这些剂量的反应如何?
通常,小鼠和大鼠模型中使用的剂量转化为人类每日摄入量>100 g ,这可能会导致严重的副作用。事实上,一项对18名参与者进行的纵向、随机交叉研究表明,补充30克菊粉会增加促炎细胞因子(如IL-6和TGFβ)以及肝酶的水平。
另一项结合使用人体组织样本、人体结肠活检离体培养和细胞培养模型的研究表明,饮食中的β-果聚糖可引发人体巨噬细胞和患有活动性肠道炎症的炎症性肠病患者的活检样本中的促炎症反应。研究人员推测,在缺乏发酵纤维(如β-果聚糖)所需的特定微生物类群(如罗氏菌属和普氏粪杆菌)的个体中,这些未发酵的纤维可能会在胃肠道中诱发炎症反应。
这些研究强调了基于将特定纤维混合物与宿主现有微生物功能特征相匹配的个性化饮食疗法的必要性。
了解膳食纤维如何沿着胃肠道表现并与人体肠道微生物群相互作用后,可以根据纤维独特的理化特性、对肠道微生物群的影响以及对饱腹感、血糖、血脂或炎症反应的影响来合理选择纤维。
✦ 根据对肠道微生物群的影响等选择合适的纤维
一个商业化的例子是PolyGlycopleX,它是海藻酸钠、魔芋胶和黄原胶的混合物,协同相互作用形成高粘性和凝胶形成的多糖复合物,先前已证明可以促进饱腹感并降低总胆固醇水平。
注:人们可以推测,将PolyGlycopleX与有利于丙酸产生的可发酵纤维混合物配对可能会增强临床反应,因为人类补充丙酸已被证明对饱腹感和胆固醇代谢有良好的影响。
39名患有高心脏代谢疾病风险的成年人服用含有七种可发酵纤维的专有混合物,可以改善葡萄糖和胆固醇代谢的替代标志物,并显著调节肠道微生物群的组成和功能特征。
快速(菊粉)和缓慢(抗性淀粉)发酵纤维的混合物,旨在将乙酸盐的产生扩展到远端结肠,也被证明可以在健康个体的餐后促进能量消耗并减弱血糖反应,但有趣的是,它并没有患有糖尿病前期的个体。
这些结果强调了微生物发酵能力的改变以及正常体重个体和肥胖或代谢功能障碍个体之间短链脂肪酸代谢的差异会影响对纤维补充剂的反应。
✦ 纤维引起的微生物变化会影响代谢、信号传导
虽然纤维混合物是一种新兴方法,可以部分克服对纤维补充的个性化反应,但仍需要精心设计的临床前和临床研究来开发和确定此类纤维混合物单独以及与治疗肥胖症和代谢综合征的护理标准相结合的功效。
对14名成年人进行的受控饮食研究中使用特定的纤维组合,证明不同的纤维组合在微生物功能基因表达和生长中引发了共同的和纤维特异性的反应。
例如,豌豆纤维和菊粉或豌豆纤维、菊粉、橙纤维和大麦麸的组合都促进了多种拟杆菌的生长,并增加了阿拉伯低聚糖和低聚木糖利用的途径。
此外,纤维诱导的特定微生物基因的变化可能与宿主葡萄糖代谢、钙调神经磷酸酶和AKT信号传导、细胞凋亡、激肽释放酶-激肽蛋白酶和免疫过程的变化相关。
尽管体外研究进一步证明了离散纤维结构能够操纵肠道微生物组的潜力,但仍需要在人体中进行额外的随机对照试验来确认纤维补充剂的生理效应。
膳食纤维和健康相关细菌基因组之间的联系表明,活体微生物的施用,无论是益生菌、活体生物治疗药物还是粪菌移植,都可能与选择性发酵的膳食纤维相互作用。
与将益生菌和益生元结合在一起的互补合生元不同,这种精确配对是协同合生元开发的基础,其中精确开发底物以供共同施用的活微生物选择性利用,从而为宿主带来健康益处。
✦ 膳食纤维协同合生元改善代谢和肥胖
一些早期的临床前和临床研究结果表明,协同合生元可能并不总是可预测地相互作用以促进健康。例如,根据三氯蔗糖与乳果糖的比率估计,在94名肥胖个体中补充益生元低聚半乳糖、益生菌青春双歧杆菌或协同合生元已被证明可以类似地增强肠道屏障完整性。
然而,根据系统评价和荟萃分析的报告,合生元补充剂,或益生元(或多种益生元)和益生菌(或多种益生菌)的一般配对,已显示出减轻体重和纠正肥胖代谢失调的希望。
一个例子是Pendulum Glucose Control,它是菊粉、低聚果糖、嗜黏蛋白阿克曼菌(Akkermansia muciniphila)、拜氏梭菌、丁酸梭菌和婴儿双歧杆菌专有混合物,已被证明可以改善2型糖尿病患者的葡萄糖代谢,这些患者单独通过饮食和运动治疗。
✦ 膳食纤维的摄入与粪菌移植的效果会相互影响
整个粪便微生物群落的管理可能会进一步受益于精确膳食纤维的共同管理,这些纤维支持群落内与健康相关的成员或调节防止微生物植入的环境限制。
在一项研究中,粪菌移植与不可获取的微晶纤维素 (n=17) 配对,但不是可发酵纤维混合物(n=17)(抗性麦芽糖糊精、IV型抗性淀粉和阿拉伯胶),改善了接受者中肥胖和代谢综合征患者的胰岛素敏感性。
微晶纤维素是一种食品添加剂,也常用作药物包衣材料。它是一种水溶性纤维素衍生物,具有优异的增稠、乳化、稳定等功能。在食品工业中,微晶纤维素常用于调制冰淇淋、奶油、果冻等产品;在药物制剂中,微晶纤维素常用作控释药物的包衣剂。
补充微晶纤维素有助于增加群落丰富度以及几种与健康相关的类群的植入或富集,例如Akkermansia、Christensenellaceae和Phascolarctobacter,这可能是通过将结肠环境转向更有利的条件,例如减少肠道炎症。
捐赠者在获得粪便之前的饮食会进一步影响粪菌移植的功效。例如,与遵循地中海减肥(n=16)或健康饮食指南(n=19)饮食后接受自体粪菌移植胶囊的个体相比,含有绿茶和较高膳食纤维的地中海饮食在粪菌移植后8个月可减弱体重增加。
总体而言,将益生菌、活生物治疗和粪菌移植疗法与具有离散结构的新型纯化的膳食纤维相结合,将有助于开发创新的营养保健品和药物疗法,通过平衡失调的肠道微生物群来针对代谢综合征的病理生理学。
主要参考文献
Deehan EC, Mocanu V, Madsen KL. Effects of dietary fibre on metabolic health and obesity. Nat Rev Gastroenterol Hepatol. 2024 Feb 7.
Lin D, Peters BA, Friedlander C, Freiman HJ, Goedert JJ, Sinha R, Miller G, Bernstein MA, Hayes RB, Ahn J. Association of dietary fibre intake and gut microbiota in adults. Br J Nutr. 2018 Nov;120(9):1014-1022.
Ricardo-Silgado ML, McRae A, Acosta A. Role of Enteroendocrine Hormones in Appetite and Glycemia. Obes Med. 2021 May;23:100332.
Crooks B, Stamataki NS, McLaughlin JT. Appetite, the enteroendocrine system, gastrointestinal disease and obesity. Proc Nutr Soc. 2021 Feb;80(1):50-58.
Brown SSG, Westwater ML, Seidlitz J, Ziauddeen H, Fletcher PC. Hypothalamic volume is associated with body mass index. Neuroimage Clin. 2023;39:103478.
She Y, Mangat R, Tsai S, Proctor SD, Richard C. Corrigendum: The interplay of obesity, dyslipidemia and immune dysfunction: a brief overview on pathophysiology, animal models, and nutritional modulation. Front Nutr. 2023 Oct 11;10:1304102.
Gill SK, Rossi M, Bajka B, Whelan K. Dietary fibre in gastrointestinal health and disease. Nat Rev Gastroenterol Hepatol. 2021 Feb;18(2):101-116.
Mah E, Liska DJ, Goltz S, Chu Y. The effect of extracted and isolated fibers on appetite and energy intake: A comprehensive review of human intervention studies. Appetite. 2023 Jan 1;180:106340.
谷禾健康
微生物组学研究现已超越微生物群落组成分析得到更广泛的使用。大量的人类微生物组研究证据表明,肠道微生物组的功能变化对炎症和免疫反应的影响起到关键的影响作用。
16S rRNA分析是微生物组研究作为最常用便捷且具有成本效益的测量技术,用于分析微生物组的菌落组成,但标记基因测序无法直接提供群落功能组成的信息。于是开发了生物信息学工具,利用16S rRNA基因数据来预测微生物组功能。
其中,PICRUSt2已成为最流行的功能概况预测工具之一,可生成整个群落通路丰度。“功能”通常指的是基因家族,如KEGG同源基因和酶分类号,可以预测任意的特性。
“
PICRUSt1 具有一定的局限性
微生物群落标记基因测序的一个局限性在于它无法提供有关采样群落功能组成的信息。PICRUSt1于2013年开发,可根据标记基因测序图谱预测细菌群落的功能潜力。
PICRUSt (Phylogenetic Investigation of Communities by Reconstruction of Unobserved States) 的原理基于已测细菌基因组的16S rRNA全长序列,推断它们的共同祖先的基因(同源基因)功能谱,对Greengenes数据库中其它未测物种的基因功能谱进行推断,构建古菌和细菌域全谱系的基因功能预测谱,最后,将测序得到的菌群组成“映射”到数据库中,对菌群代谢功能进行预测。
PICRUSt1是为从16S标记序列预测功能而开发的,已被广泛使用,但有一定的局限性。标准PICRUSt1工作流程要求输入序列只能根据Greengenes数据库的兼容版本进行有参比对而生成的OTU表。PICRUSt1使用的细菌参考数据库自2013年以来未进行更新,并且缺少成千上万个最近添加的基因家族。
“
PICRUSt2 具有更准确更全的数据库
2018年推出了全新版本的PICRUSt,即PICRUSt2(https://github.com/picrust/picrust2) ,该方法在PICRUSt1原始方法上有所改进。
具体而言, PICRUSt2包含一个更新的,更大的基因家族和参考基因组数据库,可与任何可操作的分类单位(OTU)筛选或去噪算法互操作,并能够进行表型预测。
基准测试表明,PICRUSt2比PICRUSt和其他竞争方法总体上更准确。PICRUSt2还允许添加自定义参考数据库。
PICRUSt1流程将预测限制为Greengenes参考数据库中的OTU,因此排除了其他16S rRNA基因测序数据集中的许多公开序列。PICRUSt2无需再以GreenGene注释的OTU表为输入,可以直接读取OTU的代表序列自动完成物种注释,并进一步根据物种丰度组成预测群落功能。
•用于预测的参考基因组数据库扩大了10倍以上。
•允许输出MetaCyc 本体预测,可与普通宏基因组学的结果比较。
•从Castor R包中添加隐藏状态预测算法。
•通路丰度的推断现在依赖于MinPath,这使得这些预测更加严格。
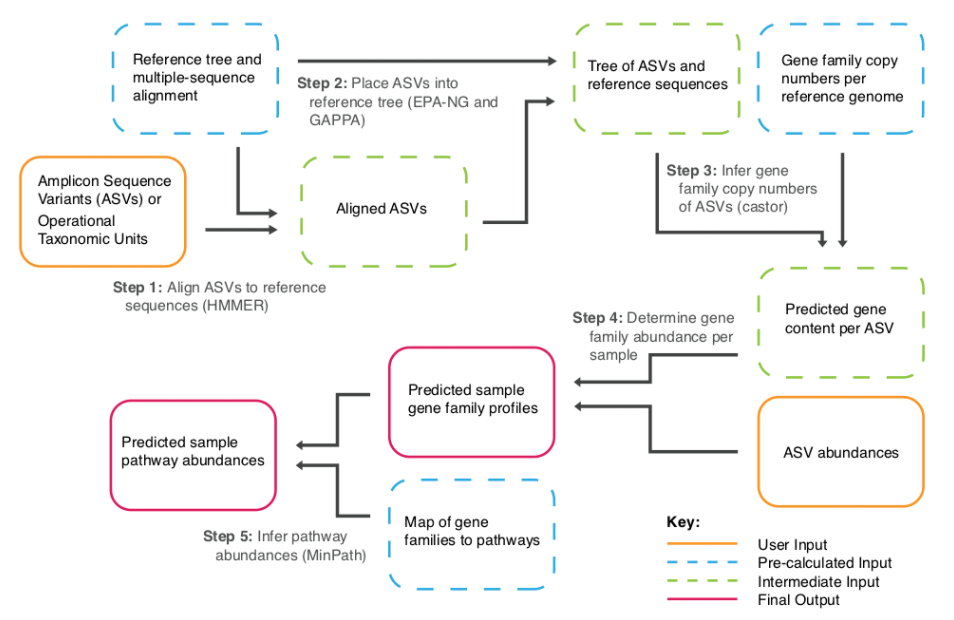
Picrust2集成了现有的开放源代码工具,以预测环境采样的16S rRNA基因序列的基因组。PICRUSt2中的系统发生放置基于三个工具的输出:HMMER、EPA-ng、GAPPA,以将研究序列(即OTU和ASV)放置到参考树中。
使用的方法更快的R包castor用于核心隐藏状态预测功能。然后生成元基因组图谱,可以通过贡献序列对其进行分层。最后,基于元基因组图谱预测途径的丰度。
默认情况下,输出文件包括对酶分类(EC)编号,KEGG直系同源物(KO)和MetaCyc途径丰度的预测。
谷禾报告中针对性的添加了碳水化合物活性酶数据库(CAZy)、肠道代谢模块(GMM)和肠脑模块(GBM)。GMM和GBM是从KEGG的KO映射出来的。
EC_metagenome_out/ 细菌群落酶(EC)功能的丰度预测结果
ECpred_metagenome_unstrat_descr.tsv 为包含基因名称的丰度表,结构同上

KO_metagenome_out/ KO(KEGG Orthology)功能基因注释结果
KOpred_metagenome_unstrat_descr.tsv 为包含基因名称的丰度表,第一列是以KO ID名称代表特定的功能基因,第二列是功能基因的描述。
丰度计算由16S rRNA拷贝数标准化后的OTU丰度表推断得到。
KEGGpathways_out/ KEGG代谢通路注释结果
上述预测得到的以KO ID为名称的KO功能,实则代表了特定的功能基因,将这些功能基因映射到具体的KEGG代谢途径(KEGG pathway)中,并统计各途径在各样本中的丰度,获得该表。
KEGGpath_abun_unstrat_descr.tsv为包含代谢通路的丰度表
pathways_out/ 代谢通路pathway添加注释,基于METACYC数据库的注释结果
METACYCpath_abun_unstrat_descr.tsv为包含代谢通路的丰度表

GMMmodelout/ 菌群代谢产物模块预测结果,modules.tsv为丰度表
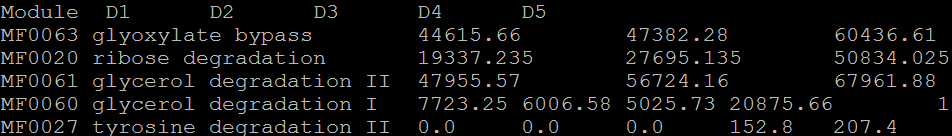
GBMmodelout/ 菌群神经递质代谢产物模块预测结果,modules.tsv为丰度表
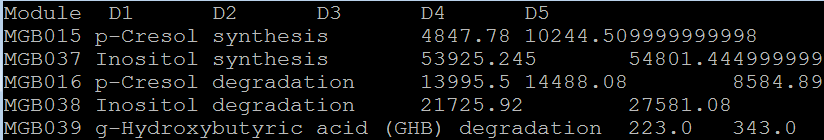
CAZYout/ 菌群碳水化合物代谢CAZy预测结果,pred_metagenome_unstrat.tsv为丰度表
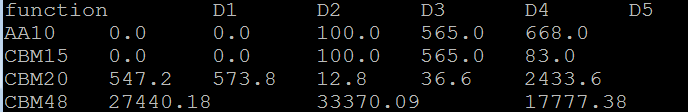
COG_metagenome_out/ COG预测结果
COGpred_metagenome_unstrat_descr.tsv 为丰度表
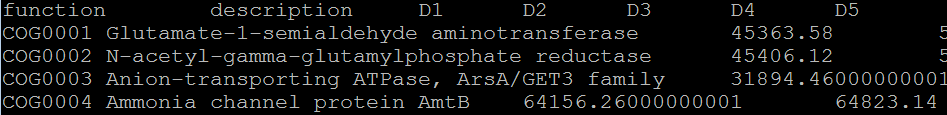
PFAM_metagenome_out/ PFAM功能域模块预测结果
pred_metagenome_unstrat.tsv为丰度表
TIGRFAM_metagenome_out/ TIGRFAM功能域模块预测结果
pred_metagenome_unstrat.tsv为丰度表
out.tre 所有OTU代表序列构建的系统发育树文件
Intermediate/ 一些中间文件
KEGG,全称Kyoto Encyclopedia of Genes and Genomes,是一个从分子水平信息,特别是基因组测序和其他高通量实验技术产生的大规模分子数据库,以了解细胞、有机体和生态系统等生物系统的高级功能和效用的数据库资源。
MetaCyc,全称Metabolic Pathways From all Domains of Life,一个庞大而全面的数据库,只包含非冗余且通过实验手段阐明过的代谢通路。里有参与初级和次级代谢的各种通路以及相关代谢物,生物化学反应,酶和基因等信息,通过存储具有代表性的实验验证的代谢通路,来对所有生命的代谢过程进行分类。
CAZy, 全称为Carbohydrate-Active enZYmes Database,碳水化合物酶相关的专业数据库,内容包括能催化碳水化合物降解、修饰、以及生物合成的相关酶系家族。
其包含五个主要分类:糖苷水解酶(Glycoside Hydrolases, GHs)、糖基转移酶(GlycosylTransferases, GTs)、多糖裂解酶(Polysaccharide Lyases, PLs)、糖酯酶(Carbohydrate Esterases, CEs)和氧化还原酶(Auxiliary Activities, AAs)。
此外,还包含与碳水化合物结合结构域(Carbohydrate-Binding Modules, CBMs)。五大分类和一个结构域下,都分别建立了多个Family。
GHs:糖苷键的水解和/或重排
GTs:糖苷键的形成
PLs:糖苷键的非水解裂解
CEs:水解碳水化合物的酯类
AAs:与 CAZymes 协同作用的氧化还原酶
CBMs:与碳水化合物结合
★ METACYC与KEGG都可以用来微生物的代谢通路预测,那么两者有什么区别呢?
MetaCyc的代谢物信息相较于KEGG提供内容更多,除了基础的物质信息以外,还包括物质的化学性质(如:油水分配系数、拓扑极性表面积、标准吉布斯自由能等)。
KEGG在通路方面的检索方式比MetaCyc更简单一些,通过通路名称或一个代谢物即可检索到相关的通路,而MetaCyc除了通路名称外,还需要提供通路中包含的4个底物才能检索到对应的通路;另外,在通路的完整度上,KEGG中更加注重的是在所有物种中的通路汇总到一张图上,而MetaCyc更加注重的是不同物种中通路的差异化。
KEGG的通路会覆盖的更全一些,而MetaCyc相对会少一些,但是MetaCyc可以补充部分KEGG通路上不全的部分,因此KEGG与MetaCyc可以相互补充,达到相得益彰的效果。
// 提示
想要查询不同功能的细节,解释生物学现象等,可以从数据库官网上查询,例如:
KEGG通路层级汇总:
Picrust2输出KEGG只有KO,KO层级通常有7、8千的功能条目。缺少PICRUSt1中分类合并为一级、二级、三级的3级通路,这里我们重新整理KEGG的层级数据并实现此功能,合并后仅剩500多个条目,方便比较和描述。
生成的分类层级文件
Picrust2/KEGG.PathwayL1.raw.txt
Picrust2/KEGG.PathwayL2.raw.txt
Picrust2/KEGG.Pathway.raw.txt
KEGG官网页面上给出了所有pathway的名字及其隶属关系,分成三个级别。
一级分类:共7个,分别是Metabolism(代谢)、Genetic Information Processing(遗传信息处理)、Environmental Information Processing(环境信息处理)、Cellular Processes(细胞过程)、Organismal Systems(有机系统)、Human Diseases(人类疾病)和Drug Development(药物开发)。

二级分类:在一级分类下面的分类,例如一级分类Cellular Processes下面包括5个二级分类:Transport and catabolism、Cell growth and death、Cellular community – eukaryotes、Cellular community – eukaryotes和Cell motility。
三级分类:二级分类下面的分类,例如二级分类Cell motility下面包括3个三级分类:Bacterial chemotaxis、Flagellar assembly和Regulation of actin cytoskeleton。

富集分析的结果一般都是三级分类,因此使用二级分类对三级分类进行汇总,可以快速找到相关的通路。例如Cell growth and death(细胞生长与死亡)相关通路。
根据3级层级分类通路数据,做KEGG分类层级图
预测信息可视化
得到的上述菌群功能丰度表之后,可以参考OTU丰度表做类似可视化分析。例如相对丰度构成图,主成分分析PCA图,功能差异图等。