-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康

消化是人体生命活动的重要组成部分,分解食物提供能量、促进生长发育、参与免疫功能,然而越来越多的人出现了消化不良。
★ 消化不良在人群中很常见
消化不良在全球范围内都是一种常见的疾病,其发病率在不同地区和人群中有所不同。在中国,消化不良的发病率较高,尤其是城市人群中更为常见。据统计,中国城市居民中消化不良的发病率约为20%-30%。
消化不良主要分为器质性消化不良和功能性消化不良(本文主要讲述功能性消化不良)。功能性消化不良其广义上是一种胃肠道多种症状的综合征,主要包括上腹痛或灼热感,餐后饱胀感及早期饱腹感。
随着对功能性消化不良了解的深入,目前研究发现,消化不良病理生理与脑–肠–微生物群轴紊乱、内脏高敏感性、局部低度炎症、胃肠道感染等因素相关。
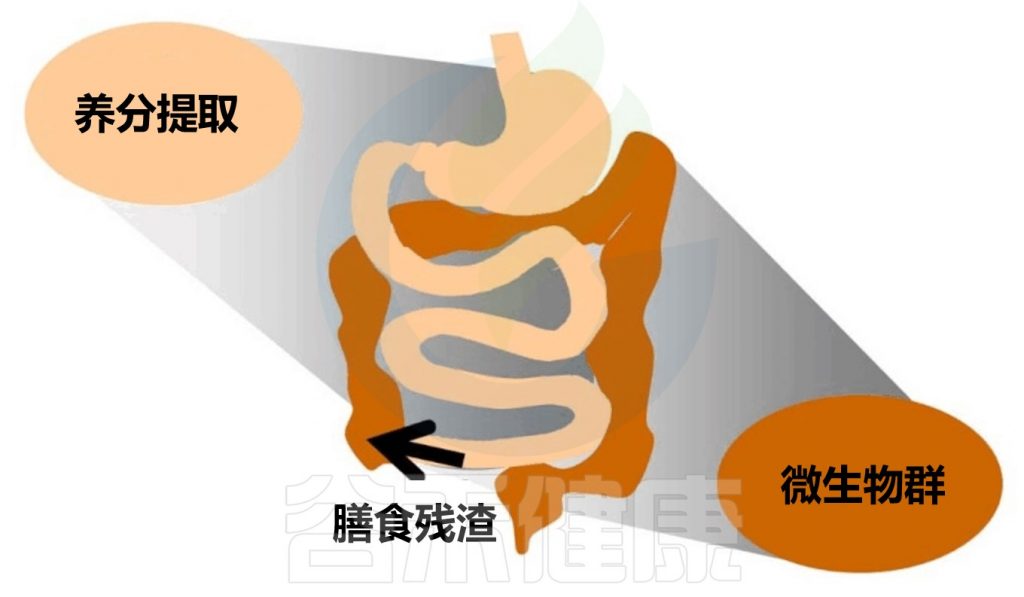
肠道菌群可以帮助人体消化吸收,同时还可以合成一些对人体有益的物质,在消化过程中扮演着重要角色。肠道菌群作为新的研究切入点,将有助于探索新的改善功能性消化不良的方法。
在了解消化不良前,我们先来看看人体消化的生理过程:
膳食摄入的消化反应

Livovsky DM,et al.Nutrients.2020
在禁食期间,胃肠道会进行周期性的运动,这种运动被称为迁移运动复合体(MMCs)。迁移运动复合体的功能是将残留物从小肠推进到结肠,以便在新的食物进入之前清空肠道。迁移运动复合体包括静止期和强烈的运动和分泌活动期之间的交替,这种刻板模式有助于保持肠道的健康和功能正常。
在进食开始之前,消化系统已经开始做准备工作,例如,预期即将进食的膳食会刺激唾液和胃液的分泌。当食物进入口腔并被吞咽后,消化系统会进入消化间期运动模式。
食物进入胃后,胃壁会收缩并几乎塌陷,这种主动放松被称为胃适应。固体颗粒通过蠕动活动激活胃窦,启动研磨过程,将食物转化为食糜。
餐后阶段胃会逐渐重新收缩,将食糜推入小肠。胃和小肠的活动会适应消化过程的要求,从口腔开始并延伸到末端回肠,食物被消化并随后被吸收。未被吸收的残留物最终到达结肠,成为肠道微生物群的底物,这些微生物会影响宿主的生理和消化功能。
因此,消化系统的正常活动对于人体的健康和营养摄入非常重要。如果消化系统不正常,可能会导致消化问题和其他健康问题。
消化不良是一种常见的临床症状,主要分为器质性消化不良和功能性消化不良。
器质性消化不良是指由某种器官疾病引起的消化不良。一般通过检查,可以明确诊断是由某个器官的病变引起的消化不良症状,例如肝病、胆道疾病、胰腺疾病、糖尿病等。
✦疾病影响消化
这些疾病会影响到消化道内部的消化酶分泌、肠道蠕动、食物吸收等消化过程,导致消化不良症状的出现,如腹胀、腹泻、便秘、恶心、呕吐、胃痛等。

功能性消化不良是最常见的消化系统疾病,大部分消化不良患者都是属于功能性消化不良。功能性消化不良没有明显的器质性病变,但出现了消化不良症状。
由于功能性消化不良患者病情的反复性与迁延不愈,其生活质量明显降低,同时,所带来的社会医疗成本的增加和生产力的下降也不容忽视。
▸ 发病率
在全球范围内,功能性消化不良女性发病率普遍高于男性。不同地区功能性消化不良的患病率也存在明显差异 :西方国家总体较高,约为10%~40%,亚洲国家较低约为5%~30%。
▸高发人群
•饮食不规律的人群:饮食不规律、暴饮暴食、偏食等不良饮食习惯容易导致消化不良。
•长期服用药物的人群:长期服用某些药物,如抗生素、非甾体抗炎药等,可能破坏肠道菌群平衡,导致消化不良。
•精神压力大的人群:精神压力大、情绪波动较大的人群容易出现消化不良症状。
•高龄人群:随着年龄的增长,人体消化功能逐渐下降,高龄人群容易出现消化不良症状。
•婴幼儿:婴幼儿是消化不良的高发人群之一。由于婴幼儿的消化系统尚未完全发育成熟,消化酶的分泌不足,肠道菌群的构成不稳定等因素,使得婴幼儿容易出现消化不良的症状。

▸ 诊断标准与症状
功能性消化不良的诊断标准:
•餐后饱胀感:即在正常量的膳食后感到不舒服;
•早饱:进食后不久即有饱感,以致摄入食物明显减少,无法完成正常量的膳食;
•上腹疼痛或灼痛:上腹胀多发生于餐后,或呈持续性进餐后加重。
注:满足以上一项或多项,并且没有可以解释这些症状的任何结构性疾病(包括上消化道内窥镜检查)的证据;则可以判断为功能性消化不良
根据主要临床症状可大致分为上腹痛综合征和餐后不适综合征两种亚型。
✦持续时间长,并伴有精神症状
在病程中症状也可发生变化,起病多缓慢,经年累月,持续性或反复发作,不少患者有饮食,精神等症状。
早饱和上腹胀常伴有嗳气。恶心、呕吐并不常见,往往发生在胃排空明显延迟的患者,呕吐多为当餐胃内容物。
不少患者同时伴有失眠、焦虑、抑郁、头痛、注意力不集中等精神症状。这些症状在部分患者中与“恐癌”心理有关。
▸ 功能性消化不良和其他胃肠道疾病的关系
伴有肠易激综合征
许多功能性消化不良患者报告伴有肠易激综合征症状,并且这两种症状经常一同出现在更严重的患者中。
注:虽然这两种情况或多或少都与特定的胃肠道症状有关,但没有结构或生化异常可以解释这些症状。
胰腺功能异常
少数但一定人群的功能性消化不良患者存在胰酶异常或胰腺外分泌功能障碍。胰酶异常和胰腺外分泌功能障碍是否直接影响功能性消化不良症状尚不清楚。
肝脏疾病与消化不良直接存在关联
肝脏疾病如肝硬化、肝炎等也可能导致功能性消化不良症状,如腹胀、食欲不振等。这些疾病可能会影响肠道菌群的平衡,导致消化不良。
功能性消化不良的发病机制尚未完全阐明,可能与胃肠运动异常、内脏超敏反应、肠道菌群紊乱、病原微生物感染、遗传因素、社会心理和神经因素、环境因素等多方面调控异常有关。
需要注意的是,肠道菌群数量和紊乱是功能性消化不良的重要病因之一,将在下文中重点讲述。
➤ 1
√功能性消化不良患者胃排空受损
功能性消化不良的发病机制涉及胃调节、胃排空和十二指肠运动的紊乱。
胃排空——食物由胃排入十二指肠的过程称为胃排空。
一项随机、双盲对照研究发现,功能性消化不良患者的症状与胃调节受损之间存在密切关系 。几份报告表明,一些功能性消化不良患者胃排空受损,一项荟萃分析表明,几乎35%的功能性消化不良患者胃排空明显延迟。
√内脏高敏感性影响功能性消化不良
内脏高敏感性是导致功能性消化不良发展的关键病理生理机制。内脏超敏反应可以通过对肠道机械化学刺激的感知增加,这通常表现为疼痛和灼痛感加重。
辣椒素受体(Trpv1)的激活由神经生长因子 (NGF)、热刺激、辣椒素、前列腺素、酸性pH值和炎症介质触发,进一步释放加剧内脏痛觉的神经肽。
那么一般哪些因素会引起或导致人体胃排空受损或内脏高敏感性,常见的原因如下:
1.神经调节失衡:人体内部的神经系统对内脏的感知和调节非常重要。如果神经系统出现失衡,会导致内脏高敏感性,从而引起胃排空受损以及消化不良等症状。
2.饮食不当:食物的种类、质量和摄入量都可能影响胃排空。比如,吃得太快、咀嚼不充分、进食过多或者过少都会导致胃排空受损。
饮食中过多的刺激性食物(如辛辣、油腻的食物)或者过多的咖啡因、酒精等刺激物质,都可能刺激内脏,导致内脏高敏感性。
3.精神压力:长期的精神紧张、焦虑、抑郁等情绪问题,也会影响人体内部神经系统的平衡,进而导致胃排空受损或内脏高敏感性。
4.慢性疾病:一些慢性疾病,如炎症性肠病、胃溃疡等,也会引起胃排空受损以及内脏高敏感性,从而导致消化不良等症状。
5.长期用药:某些药物,如非甾体类抗炎药、抗生素等,长期使用也可能导致内脏高敏感性。
➤ 2
社会心理因素会导致功能性消化不良症状。
√心理对功能性消化不良具有重要影响
一项针对瑞典人群的研究表明,在10年的随访后,焦虑会使患功能性消化不良的风险增加近8倍。在日本,儿童时期的被虐待与功能性消化不良和功能性消化不良症状的严重程度有关。
此外,病理生理学研究表明,社会心理因素和精神障碍可能通过调节大脑中的信号处理在功能性消化不良中发挥作用以及应激激素对痛觉的影响。
社会心理因素和应激激素也会影响胃肠道的其他方面,例如运动、免疫系统激活、渗透性和微生物群。
√功能性消化不良对精神疾病也有反作用
多项研究强调,与健康人相比,功能性消化不良患者的焦虑和抑郁患病率显著增加。这些观察结果表明,精神疾病在功能性消化不良的发病机制中起着重要作用。
另一方面,由于低度肠道炎症中的细胞因子反应,功能性消化不良症状被认为会诱发焦虑或抑郁,这在功能性消化不良患者心理困扰的发展中起着重要作用。
➤ 3
家族史和遗传多态性可能与功能性消化不良相关。许多研究报告了功能性消化不良风险与遗传多态性之间的关联。
遗传多态性是在同一群体中,某个基因座上存在两个或两个以上的等位基因,且等位基因的频率大于0.01的现象。
GNB3 825C>T、SCL6A4 5HTTLPR、CCK-1R 779T>C等基因多态性被认为与功能性消化不良相关。最近的一项荟萃分析发现,GNB3 825C>T中的次要等位基因 (T) 与上腹疼痛综合征亚型的易感性增加有关。
➤ 4
运动不足、睡眠障碍、高脂肪摄入和饮食不规律等生活方式因素与功能性消化不良的病理生理学有关。
√不健康生活方式导致功能性消化不良发病率高
研究发现,睡眠障碍和运动不足与功能性消化不良相关;脂肪摄入过多会加重功能性消化不良的临床症状,不规律的饮食模式也与功能性消化不良相关。
➤ 5
研究表明,沙门氏菌、幽门螺杆菌、空肠弯曲菌、蓝氏贾第鞭毛虫和诺如病毒等病原微生物导致的急性肠胃炎均与功能性消化不良症状有关。
其机制可能与导致胃肠道Cajal间质细胞(ICC)和肌间神经节受损有关,其发生率在功能性消化不良患者约为10%。
√病因微生物感染会加重消化不良症状
最近的一项荟萃分析证实,根除病原体后症状改善比未治疗的对照组效果更好。在持续时间超过4-12周且内镜检查已排除器质性原因的消化不良患者中,成功根除幽门螺杆菌可使症状缓解率提高10%至15%(或至少症状改善)。
➤ 6
来自动物和临床研究的证据表明,肠道菌群在功能性消化不良中起着重要的作用,影响许多致病机制,包括胃肠动力受损、内脏敏感性、免疫激活、粘膜通透性增加和肠脑轴功能改变等。
在人体中,微生物(包括细菌、古细菌、病毒和真菌)的数量远远超过宿主细胞的数量。
微生物组在调节生理功能(包括胃肠运动功能、上皮屏障保护以及肠道和中枢神经系统之间的相互作用)中发挥着重要作用。然而,微生物失调在功能性消化不良患者中非常常见。
•普雷沃氏菌丰度降低
一项研究将功能性消化不良患者的胃液成分与健康对照组进行了比较,报告称与对照组相比,功能性消化不良中普雷沃氏菌属(Prevotella)的频率显著降低。
这种生态失调的原因可能是胃排空延迟,这可能会改变胃的酸度、粘液稠度和部分氧合作用,从而改变胃的细菌定植。
扩展阅读:肠道重要基石菌属——普雷沃氏菌属 Prevotella
•拟杆菌与变形菌比例增加
功能性消化不良患者胃液的微生物群显示拟杆菌与变形菌的比例增加,而未检测到酸杆菌(Acidobacteria)。然而,健康人的胃液中含有酸杆菌,并且拟杆菌与变形菌的比例较低。
•细菌代谢物分泌出现异常
与对照组相比,功能性消化不良患者的胆汁酸阳性胃液样本比例增加更多。由于胆汁酸从十二指肠反流到胃中,生理上发生在胃运动期间,功能性消化不良患者可能会出现胃动力障碍。
物种丰富度的增加表明胃液微生物群的数量和多样性足以使细菌的代谢物和成分影响胃。因此,可能表明肠道的有毒细菌细胞成分,如脂多糖,刺激白细胞产生促炎细胞因子,引发胃部炎症,从而增加粘膜通透性,这可能导致胃肠神经系统功能障碍。
由于脂多糖和胆汁酸会增加粘膜的通透性,因此患者的炎症可能是由含有此类潜在毒性物质的液体回流引起的。
当比较功能性消化不良患者和健康对照组的上消化道微生物组时,功能性消化不良组口腔、食道、胃和十二指肠中的链球菌(Streptococcus)水平较高。
链球菌丰度与上消化道不适呈正相关,表明链球菌与功能性消化不良患者的胃肠道症状之间存在联系。此外,功能性消化不良组表现出更高水平的厚壁菌门。
• 厚壁菌、变形菌丰度增加
根据这些发现,在一项比较功能性消化不良患者和健康受试者十二指肠粘膜微生物群的不同研究中,十二指肠粘膜中最普遍菌属中也有链球菌。
此外,通过分析功能性消化不良和肝郁脾虚综合征大鼠的粪便样本的微生物组成,与对照组相比,该模型中厚壁菌门、变形菌门(Proteobacteria)和蓝藻门(Cyanobacteria)的水平升高,而拟杆菌门的丰度较低。
上述研究表明,功能性消化不良中的微生物改变并不局限于胃肠道中的一个部位,突出了稳态失衡在这些疾病的发病机制中的潜在重要性。
小肠细菌过度生长 (SIFO) 的定义是小肠中存在过量的细菌,并且与胃肠道症状有关。
最近的研究分析了功能性消化不良患者十二指肠的细菌属水平。
链球菌相对丰度增加
澳大利亚的一项研究报道,与对照组相比,功能性消化不良患者的链球菌(Streptococcus)相对丰度增加,尽管不显著(这可能是因为样本量小),并且链球菌的丰度与厌氧属普雷沃氏菌、韦荣球菌(Veillonella)和放线菌(Actinomyces)的丰度之间存在负相关,这些菌群功能性消化不良患者中显著减少。
β多样性发生显著变化
此外,报告的十二指肠的β多样性在患者和对照组之间存在显著差异,而α多样性保持不变,表明该疾病可能涉及更复杂的微生物群结构变化,而不是仅特定属的相对丰度变化。
奈瑟菌和卟啉单胞菌丰度降低
最近的一项研究表明,在使用质子泵抑制剂(PPI)治疗之前,功能性消化不良患者和对照组的十二指肠粘膜奈瑟菌(Neisseria)和卟啉单胞菌(Porphyromonas)丰度降低,但微生物负荷没有差异。
总体而言,研究证实功能性消化不良患者中确实发生了微生物数量和多样性方面的明显变化。
功能性消化不良患者的微生物变化




Brown G,et al.Neurogastroenterol Motil.2022
谷禾还检测了一些功能性消化不良人群的肠道菌群,虽然个体直接存在一定差异,但是共同之处是菌群紊乱,核心菌异常较多,多项病原菌超标。
案例一
基本信息和病症:
1岁3个月,食物过敏,厌食,功能性消化不良,生长发育不良
菌群构成:
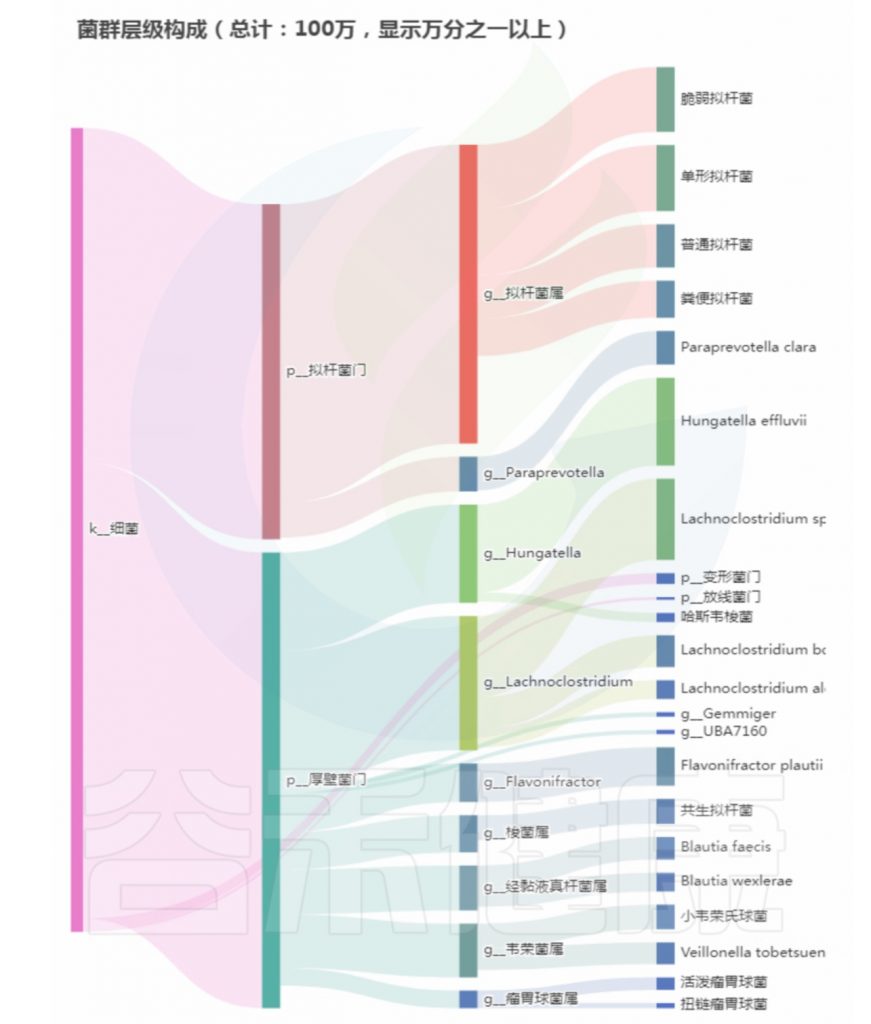

重要菌群情况:
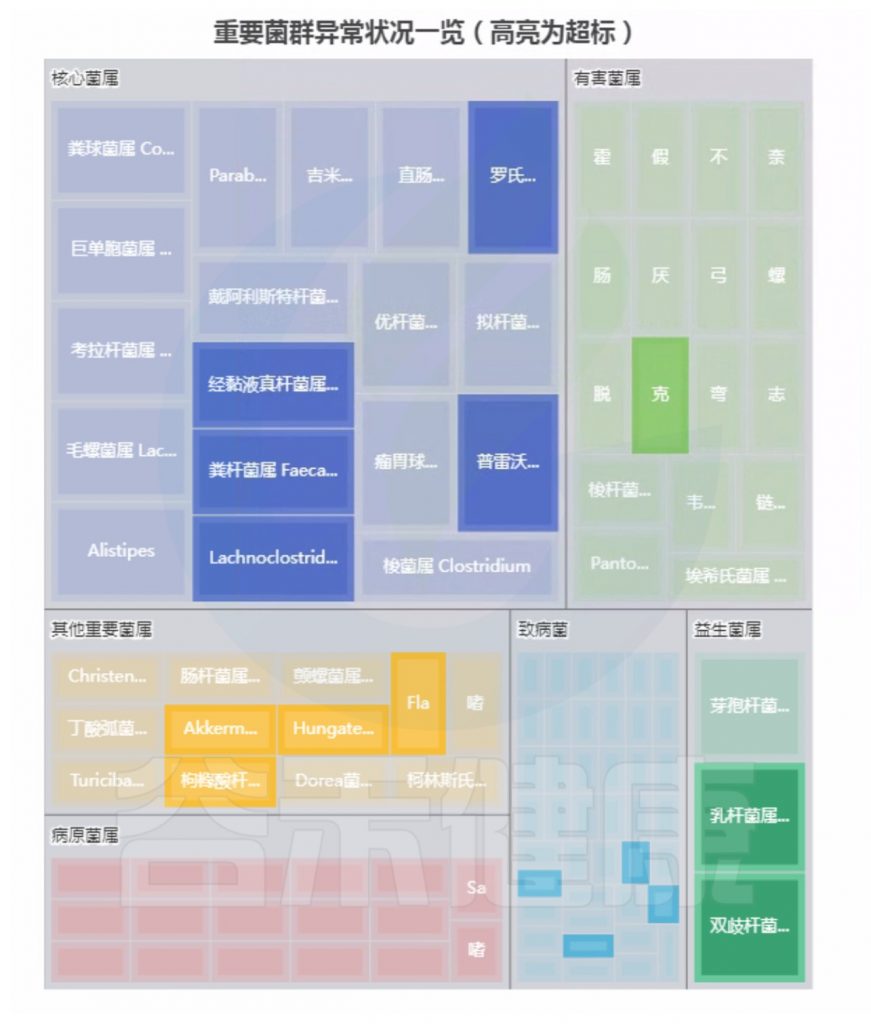



注:高亮部分是异常菌属。
总结:菌群失衡,核心菌属异常较多,普雷沃氏菌属(Prevotella)缺乏,多种致病菌超标。
案例二
基本信息和病症:
43岁,每天大便不成形;容易急性肠胃炎;消化不良
菌群构成:
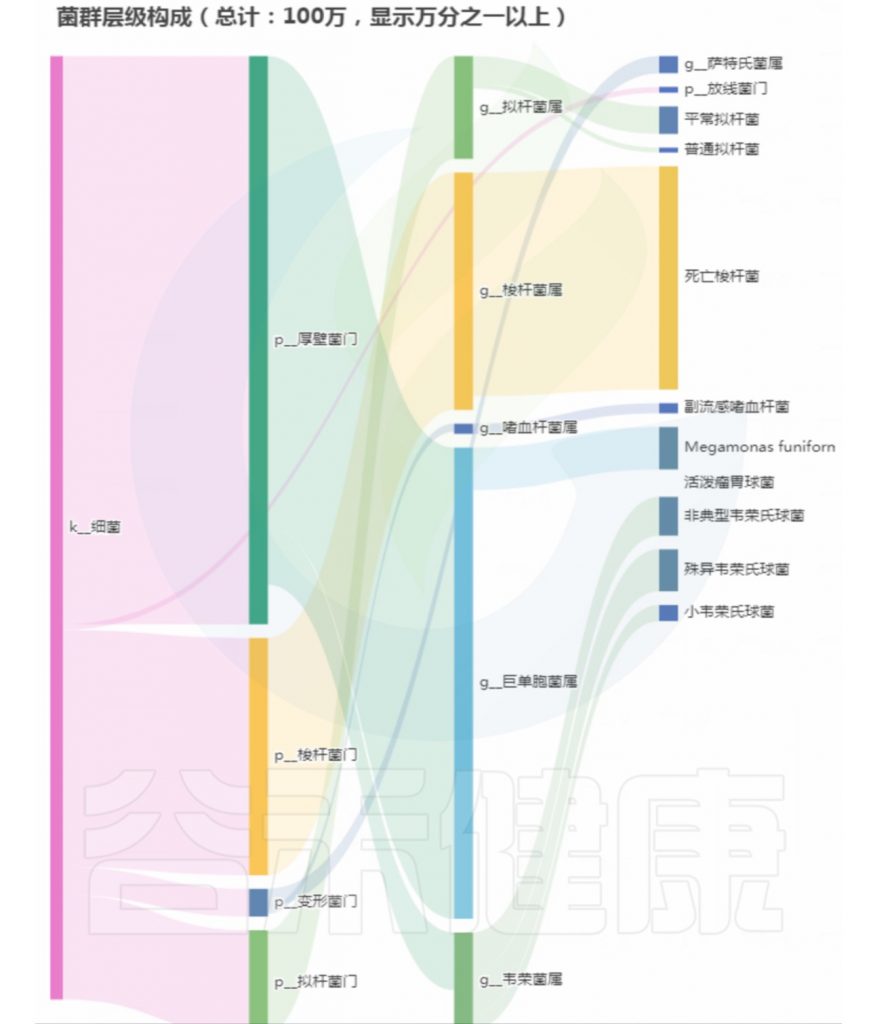

重要菌群情况:
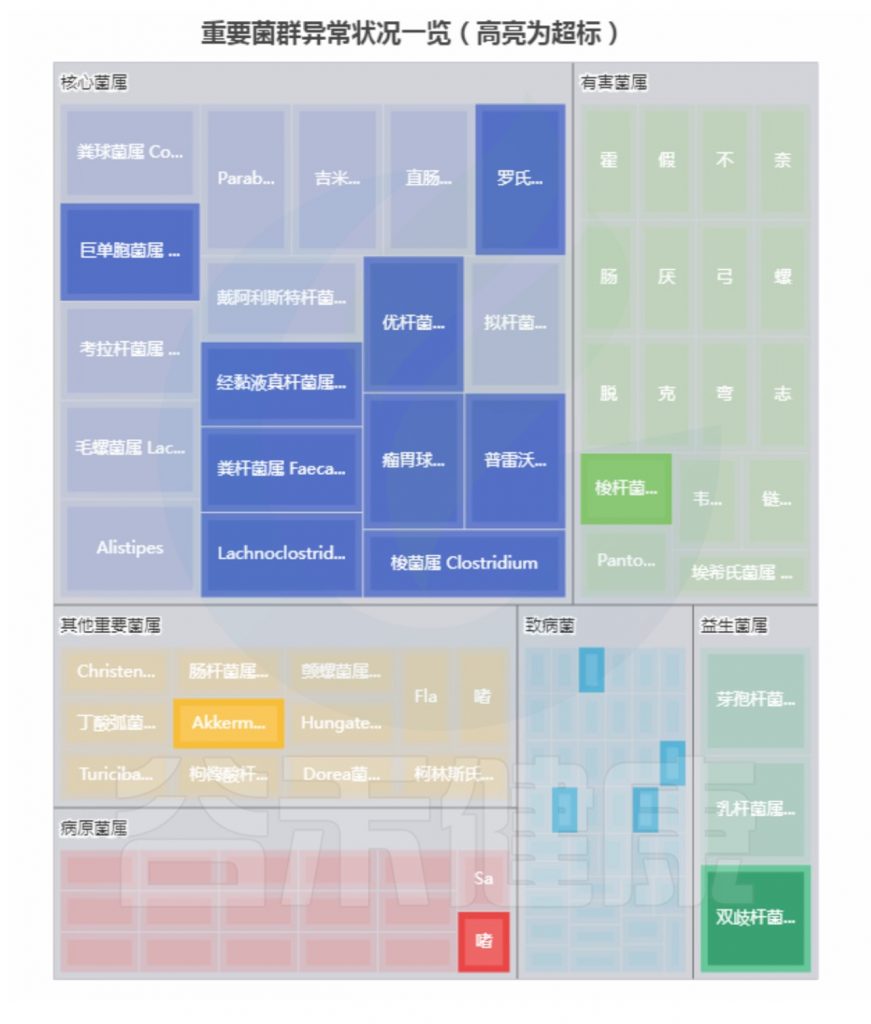



<来源:谷禾健康肠道菌群检测数据库>
总结:菌群失衡,菌群多样性低,核心菌属大量异常,致病菌和病原菌多项超标。
功能性消化不良是一种复杂的多因素导致的功能性胃肠疾病,目前其确切的发病机制尚不明确。
★ 肠道菌群在功能性消化不良中起重要作用
多个研究表明,肠道菌群紊乱在功能性消化不良的发生发展起着重要作用,是功能性消化不良的重要发病机制。影响包括胃肠动力受损、内脏高敏感性、免疫激活、粘膜通透性增加和中枢神经系统疾病。
肠道微生物群参与功能性消化不良发病机制

Tziatzios G,et al.Microorganisms.2020
胃肠运动异常是功能性消化不良的基本病理机制,包括胃排空延迟、胃容受性舒张受损及消化期间移行性复合运动(MMC)III期异常。
✦外来菌的增殖抑制胃肠道蠕动
消化期胃和小肠移行性复合运动可将胃肠内容物和致病菌机械性地迁移向远端肠道,而功能性消化不良患者经常出现非传播性和逆传性活动,这可能诱导或加重近端小肠细菌随反流十二指肠液迁移到胃。
而胃排空延迟又导致反流菌能较长时间保留在胃和十二指肠中,引起菌群分布失调的同时,外来菌的增殖可产生内毒素脂多糖刺激免疫应答,进而,抑制胃肠道蠕动,加重功能性消化不良症状。
✦细菌代谢物是胃肠动力的重要来源
短链脂肪酸是肠道共生菌发酵膳食纤维代谢物,除了作为胃肠动力的重要能量来源,也可直接激活肠神经系统以调控肠内分泌细胞合成和分泌某些胃肠激素,如肠激素肽、胆囊收缩素、胰高血糖素样肽等,进而调节胃肠道动力及胃排空。然而在代谢组学研究中发现功能性消化不良大鼠存在短链脂肪酸水平显著降低。
更准确地说,细菌产生的短链脂肪酸不仅调节功能性消化不良中十二指肠碳酸氢盐的分泌,同时它们在十二指肠的快速吸收也可能影响管腔细菌定植抑制。
5-羟色胺影响胃肠道动力
相关研究证实肠道微生物群在调节5-羟色胺(5-HT)合成中起着关键作用,而5-羟色胺水平是影响胃肠道动力的重要因素之一。
大肠杆菌产生的脂多糖延迟胃排空
此外,已发现大肠杆菌(Escherichia coli)产生的细菌脂多糖会导致胃排空显著延迟 ,而双歧杆菌当用作益生菌使用时时可显著增强小肠蠕动。
由上述研究可知,胃肠动力异常可能诱发菌群失调,而菌群失调可反过来进步一步影响胃肠动力,介导功能性消化不良发生发展,但菌群失调与功能性消化不良的因果关系仍需更深入的研究加以验证。
✦心理因素和肠道炎症相互影响
功能性消化不良患者处于十二指肠低度炎症状态。这种慢性低级别的炎症反应会引起疼痛和敏感性。
此外,焦虑或抑郁等心理学因素似乎与慢性炎症反应相互影响,心理压力和由此产生的皮质醇释放激素分泌也会增加十二指肠的局部炎症和全身炎症反应。
✦炎症状态下肠屏障功能发生改变
多项研究报道了功能性消化不良患者肠道中免疫细胞(如肥大细胞、巨噬细胞和嗜酸性粒细胞)数量的增加。
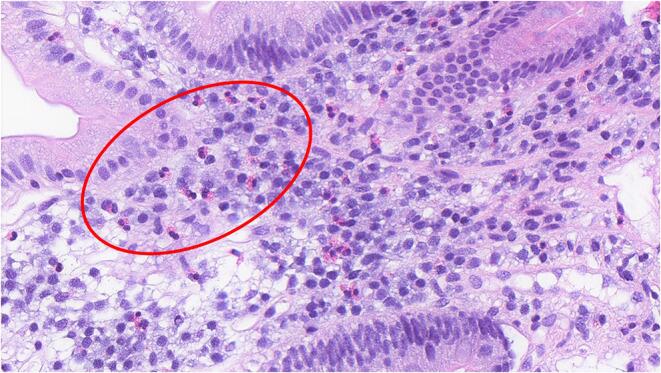
十二指肠活检切片中嗜酸性粒细胞增多

Hari S,et al.Front Allergy.2022
活化的肥大细胞释放细胞因子、组胺、前列腺素和类胰蛋白酶,它们与肠屏障功能障碍和伤害感受通路的改变有关。
嗜酸性粒细胞影响肠道通透性
在生理条件下,十二指肠屏障由粘液层、上皮和下面的固有层组成。在功能性消化不良中,屏障的功能障碍体现为粘膜完整性丧失和通透性增加。
此外,功能性消化不良中嗜酸性粒细胞的募集和激活也发生,这可能使组织损伤和屏障功能障碍持续存在。
正常与功能性消化不良的屏障功能对比
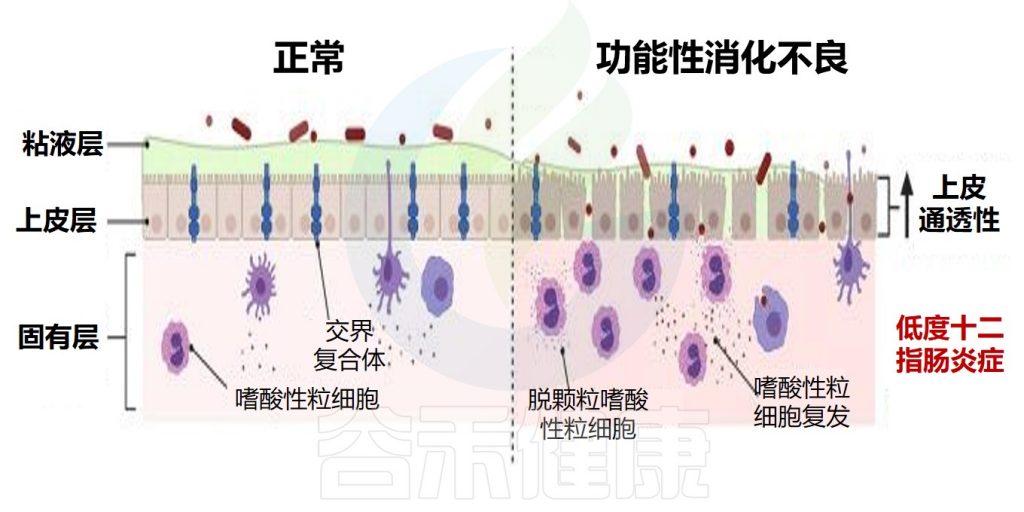

Hari S,et al.Front Allergy.2022
✦肠道菌群也会破坏肠道通透性
肠腔黏膜表面是毒性和免疫原性颗粒面对黏膜相关免疫系统的第一道屏障。肠道微生物菌群失调在功能性消化不良中非常常见。
有害菌破坏紧密连接增加肠道通透性
有研究表明,霍乱弧菌(V.cholera)、艰难梭菌(Clostridium difficile)和产毒素的大肠杆菌的各种菌株已显示可通过直接破坏紧密连接(TJ)、毒素或蛋白酶的产生以及炎症级联反应的活化来增强肠道通透性。
益生菌可以促进屏障完整性
相反,肠道益生菌可以通过增加闭合蛋白、紧密连接蛋白ZO-1和ZO-2的表达来促进屏障完整性。
另外,肠道菌群的某些代谢产物也能够破坏肠道通透性,例如,细菌细胞壁脂多糖易位可以诱导免疫反应和炎症反应,加剧肠道屏障损害并进一步增加肠道的通透性。
扩展阅读:什么是肠漏综合征,它如何影响健康?
除了影响黏膜屏障功能,微生物群也参与调节免疫系统的发育和功能,在先天免疫系统中起关键作用。
✦肠道菌群调节肠上皮免疫功能
研究发现,肠道微生物区系通过激活肠上皮细胞的模式识别受体和内质网应微信号促进免疫系统的发育,从而促进肠上皮细胞的增殖、抗菌肽和黏液的产生,调节与免疫功能相关细胞因子的分泌,如白细胞介素1β、白细胞介素18和白细胞介素25。
✦微生物代谢物也可促进免疫反应
肠道微生物群及其代谢物还通过Toll样受体(TLRs-TLR2、TLR4)干扰信号,并促进促炎细胞因子的产生和免疫反应。
此外,它们的代谢物也可能具有炎症特性或对T细胞分化产生直接影响。
小结
综上所述,肠道菌群失调在影响黏膜生物屏障的同时,可能也导致黏膜机械屏障、化学屏障及免疫屏障等多种屏障功能低下,并可能介导黏膜低度炎症和内脏高敏性的发生。
生物失调的影响
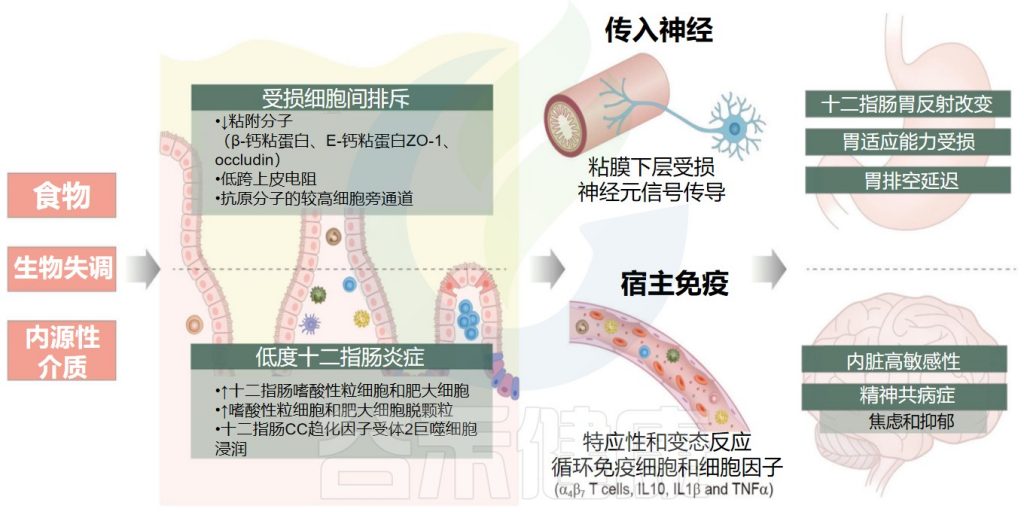

Kim SH.Korean J Gastroenterol.2022
脑-肠轴是连接胃肠道和中枢神经系统的传导通路,包括中枢神经系统、脑和脊髓、自主神经系统、肠神经系统和下丘脑垂体肾上腺轴。
肠道菌群与脑-肠轴存在双向交互作用:
肠道菌群通过神经、内分泌、免疫等至少三种途径与中枢神经系统相通;中枢神经系统调节肠道的运动、分泌及肠道黏膜通透性来影响肠道菌群,或通过肠腔分泌的激素直接调节菌群的基因表达而影响肠道菌群的组成和功能。
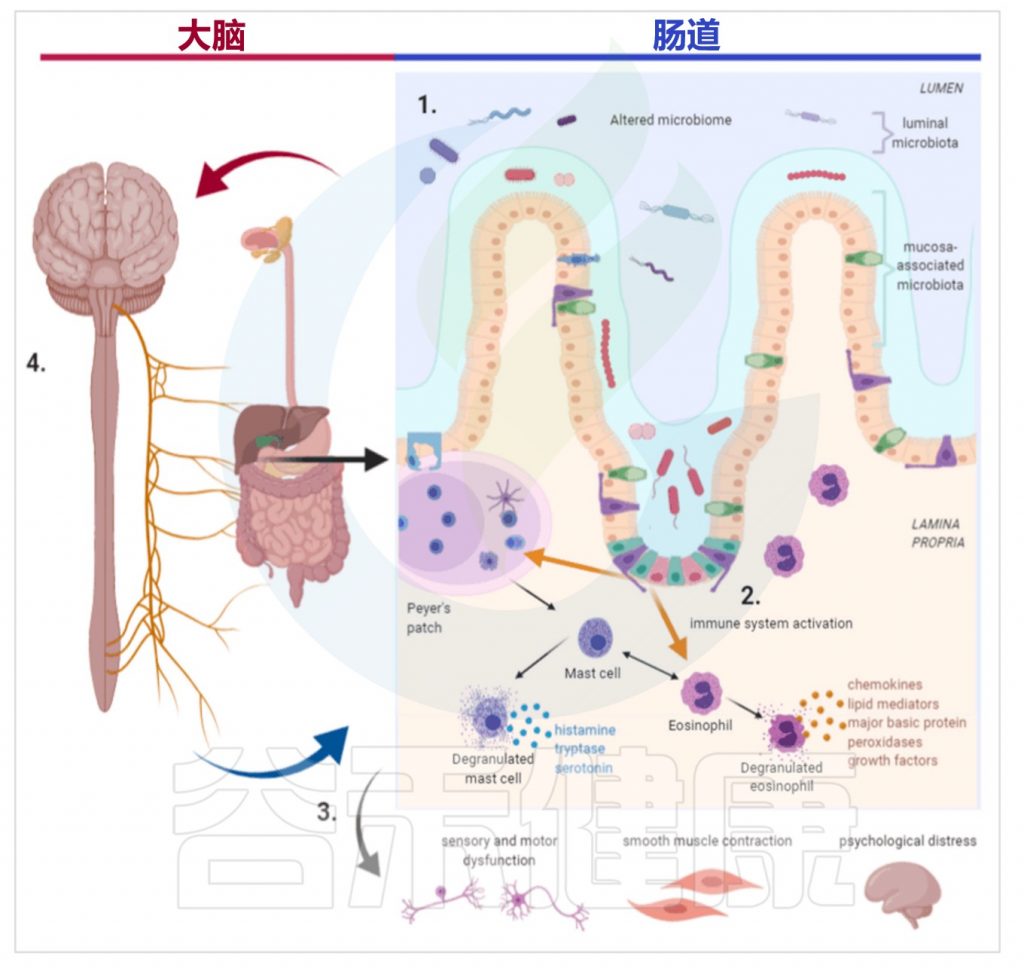

Brown G,et al.Neurogastroenterol Motil.2022
肠道菌群通过肠-脑轴影响5-羟色胺、脑源性神经营养生长因子(BNDF)等神经递质的合成、释放和下丘脑-垂体-肾上腺轴的发育,调节中枢神经系统的发育、功能和行为,影响焦虑、抑郁样情绪障碍和应激反应。
✦功能性消化不良患者伴有精神症状
功能性消化不良属于典型的身心疾病,常有焦虑、抑郁的表现。一项为期12年的前瞻性研究也说明功能性消化不良患者中有1/2~2/3先出现焦虑再有胃肠道症状,提示了功能性消化不良的中枢发病机制。
功能性消化不良患者的中枢神经系统改变
功能性神经影像学,如功能核磁共振,使我们能直接观察到中枢神经系统的改变,证明其与功能性消化不良症状的相关性。
结果显示功能性消化不良患者额叶皮层、感觉皮层、脑岛、前扣带皮层、丘脑、海马体和杏仁核的改变,与功能性消化不良内脏超敏反应、消化不良症状、生活质量及焦虑和抑郁有关。
精神心理应激影响内脏高敏感性
有研究认为功能性消化不良患者在精神心理应激的情况下可通过刺激中枢神经系统的情感活动系统参与患者内脏高敏感性的形成,从而对胃肠道产生影响。
因此,研究人员推测肠道菌群通过脑-肠轴对中枢神经系统的调节,导致消化不良伴焦虑抑郁的发生发展。
✦肠道菌群对肠脑轴具有重要作用
随着研究不断深入,越来越多证据证实肠道菌群与脑-肠-菌群轴功能密切相关。
菌群代谢物影响中枢神经系统信号
一方面,肠道微生物能通过合成和释放短链脂肪酸、次级胆汁酸和色氨酸等代谢物,与肠内分泌细胞,自下而上影响激活内源性中枢神经系统信号机制。
此外,肠道菌群失调会增加脂多糖的产生和分泌,而脂多糖不仅是影响中枢神经系统功能的一个强有力的因素,还会促进其他炎症因子的产生,如肿瘤坏死因子﹣α、白细胞介素﹣1β等,以上炎症因子可影响中枢神经系统的功能, 紊乱神经肽的合成和分泌。
激活肠神经系统信号
另一方面,肠道微生物也可独立完成或促进某些神经活性物质的合成和分泌,如5-羟色胺、γ-氨基丁酸、去甲肾上腺素、多巴胺等,这些小分子物质能通过与肠内分泌细胞相互作用,激活肠神经系统信号机制。
上述研究表明,肠道菌群失调可能诱导脑-肠-微生物群轴功能紊乱,其机制涉及神经、免疫和内分泌信号传导。
✦迷走神经的作用
在生态失调和胃肠道不适的精神状况的背景下,应该注意的一个重要方面是迷走神经的作用。
众所周知,压力会增加肠道通透性并通过各种神经调节剂改变胃肠道微生物组的组成,同时压力可以减少迷走神经活动,这可能会促进胃肠道炎症。
注:虽然目前还没有关于迷走神经刺激对胃肠道微生物组影响的数据,但可以推测迷走神经可能通过其对肠道通透性的影响对肠道微生物组产生影响。
迷走神经的传出可能在肠道中具有抗炎作用,同时降低肠道通透性——这两种作用都可能归因于通过迷走神经活动加强紧密连接。
心理治疗对功能性消化不良患者微生物群和胃肠道症状的影响,也可以用迷走神经的影响来解释。
心理疾病对功能性消化不良的表现有影响
现在人们可能想知道心理疾病的患病率是否在不同的功能性消化不良亚组中有所不同。
已经表明情绪和焦虑障碍在非疼痛主导型功能性消化不良患者中,比在疼痛主导型功能性消化不良患者中更常见。
另一项研究还表明上腹痛与神经质、虐待和躯体化之间存在相关性。
这些发现强调了未来重点关注功能性消化不良患者的心理合并症和特定症状之间的可能联系,研究心理治疗对功能性消化不良患者特别是微生物组的这些有趣影响。
未来随着研究深入,有望更好地理解脑-肠-微生物组轴,功能性消化不良的治疗方法也能更加个性化。
药物经口服途径进入人体,不可避免地与肠道菌群发生相互作用。
多项研究表明,肠道微生物能通过编码多种酶,影响口服药物在体内的吸收、代谢、转化等过程,进而影响药物活性成分的有效性和毒性。
改变微生物群的药物在治疗消化不良中得到了有效证实。
利福昔明是一种广谱抗生素,具有革兰氏阳性、革兰氏阴性、需氧和厌氧覆盖,在胃肠道腔内生物利用度高,全身不良反应极小。
•消化不良症状缓解
在一项随机试验中,利福昔明治疗优于安慰剂治疗,其中79%的患者在服用利福昔明后报告消化不良症状缓解,而安慰剂组在8周时这一比例为47%。
•利于有益细菌生长
在其他胃肠道疾病中,利福昔明治疗已被证明可以保护结肠菌群,增加乳酸杆菌和双歧杆菌(Bifidobacterium)的丰度,从而产生积极效应,利于有益细菌的生长,从而改变整体成分。
扩展阅读:肠道核心菌属——双歧杆菌,你最好拥有它
•益生菌治疗后餐后腹胀改善
益生菌可能在功能性消化不良中发挥治疗作用,三项研究表明,在幽门螺杆菌阳性和阴性消化不良患者中服用益生菌加氏乳杆菌(Lactobacillus gasseri OLL2716)12周后,餐后饱腹感和腹胀症状得到改善。
35.5%的幽门螺杆菌阴性功能性消化不良患者的症状得到了缓解,而安慰剂患者的症状缓解率为17%。
扩展阅读:如果你要补充益生菌 ——益生菌补充、个体化、定植指南
•恢复胃液微生物群
加氏乳杆菌还被证明可以“恢复”功能性消化不良患者异常的胃液微生物群。在服用益生菌12周之前,功能性消化不良患者的胃液显示拟杆菌比变形菌占优势,并且不存在酸杆菌(Acidobacteria),益生菌治疗后,这些比例发生了变化,以反映与健康志愿者相似的微生物群组成。
此外,虽然没有收集小肠细菌数据,但用凝结芽孢杆菌(Bacillus coagulans MY01)和枯草芽孢杆菌(Bacillus subtilis MY02)治疗8周后,功能性消化不良患者的有效率比安慰剂提高了28%。
这些发现提供了初步证据,表明患者症状与肠道微生物群中某些属的丰度有关,这些微生物群可以通过治疗性抗生素和益生菌制剂进行调节。
尽管有这些显著的具体变化,但仍需要对更多不同地理区域的患者群体进行进一步研究,以验证疾病中的微生物组变化。
15项观察性研究和一项随机对照试验的系统回顾发现,高脂肪、小麦、FODMAP(可发酵低聚糖、双糖、单糖和多元醇)和咖啡因等天然食品化学物质含量高的食物与功能性消化不良有关。
扩展阅读:肠道微生物群与健康:探究发酵食品、饮食方式、益生菌和后生元的影响
饮酒与功能性消化不良症状的关联尚不明确,可能取决于酒精的类型。
以下是一些饮食调理建议:
•少食多餐:每天分成5-6餐,每餐食量适中,避免暴饮暴食。
•避免过度饮酒和吸烟:酒精和烟草会刺激胃肠道,加重消化不良症状。
•避免食用刺激性食物:如辛辣、油腻、烧烤等食物,容易引起胃肠道不适。
•增加膳食纤维摄入量:膳食纤维可以促进肠道蠕动,缓解便秘症状。建议多食用蔬菜、水果、全谷类食品等富含膳食纤维的食物。
•注意饮食卫生:避免食用过期食品、生冷食物等容易引起胃肠道感染的食物。
•喝足够的水:保持足够的水分摄入可以促进肠道蠕动,缓解便秘症状。
•食用易消化的食物:如米粥、面条、煮熟的蔬菜等,可以减轻胃肠道负担,缓解消化不良症状。
注意:饮食调理虽然可以缓解功能性消化不良症状,但如果症状持续或加重,建议及时就医进行诊断和治疗。
扩展阅读:20种有效改善肠道健康的科学方法
胃酸抑制的主要药物包括两类药物:质子泵抑制剂(PPI)和组胺H2受体拮抗剂。
•上腹痛和反流症状缓解
一项荟萃分析发现,在两到八周内服用标准剂量的质子泵抑制剂,在减少功能性消化不良症状方面优于安慰剂。
注:治疗益处仅出现在有上腹灼痛和反流样疼痛的患者身上,而不出现在有运动障碍相关问题的患者身上。
•消化不良症状的风险降低
组胺H2受体拮抗剂也是功能性消化不良治疗的一种选择。十二项随机对照试验将H2拮抗剂与安慰剂进行了比较,显示消化不良症状的相对风险降低了23%。
对于以进餐相关症状为特征的功能性消化不良伴餐后窘迫综合征的患者,促胃肠动力药可以减轻症状。
对29项比较促动力药(主要是西沙必利)与安慰剂的试验的回顾发现,功能性消化不良的整体症状显著减少。
对功能性消化不良患者的12项随机对照试验的回顾发现,心理治疗(即认知行为治疗和其他形式的心理治疗)比对照组具有统计学上的显著益处。
认知行为疗法:是一种心理治疗方法,旨在通过调整患者的思维方式和行为习惯,来改善其身体和心理健康问题。在功能性消化不良患者治疗中,认知行为疗法可以帮助患者意识到自己不良的思维和行为习惯,如过度焦虑、负面情绪、饮食习惯不当等,从而通过改变这些不良习惯,减轻和预防消化不良症状的发生。
此外,认知行为疗法还可以帮助患者学会应对压力和情绪问题的技巧,提高其身心健康水平。
•症状严重程度、疼痛强度减弱
认知行为疗法 (CBT)导致症状严重程度、疼痛强度减弱,并进一步降低疾病对患者生活的影响。
•胃动力显著增加
此外,与对照组相比,干预组胃排空率显著增加,胃动力参数发生变化。基于这些结果,认知行为疗法可被视为功能性消化不良患者的有效治疗选择。
注:心理治疗不应作为功能性消化不良的一线治疗,因为数据质量低,缺乏盲法心理干预和主观症状评分导致偏倚风险高。如果药物治疗无效,可以考虑心理治疗。
中药具有多成分、多靶点和多途径的优势,目前中医对功能性消化不良肠道菌群的研究仍处于探索阶段。
中药在治疗功能性消化不良方面具有一定的疗效,可以缓解消化不良症状,改善消化功能,提高生活质量。研究证实,中药能逆转肠道菌群失调,维持肠道微生态平衡。
注:中药治疗功能性消化不良应根据患者的具体情况进行个体化治疗,避免不必要的药物过敏或不良反应。同时,中药治疗应在专业医生的指导下进行。
基于菌群干预后,原先消化不良患者的肠道菌群有了好转:
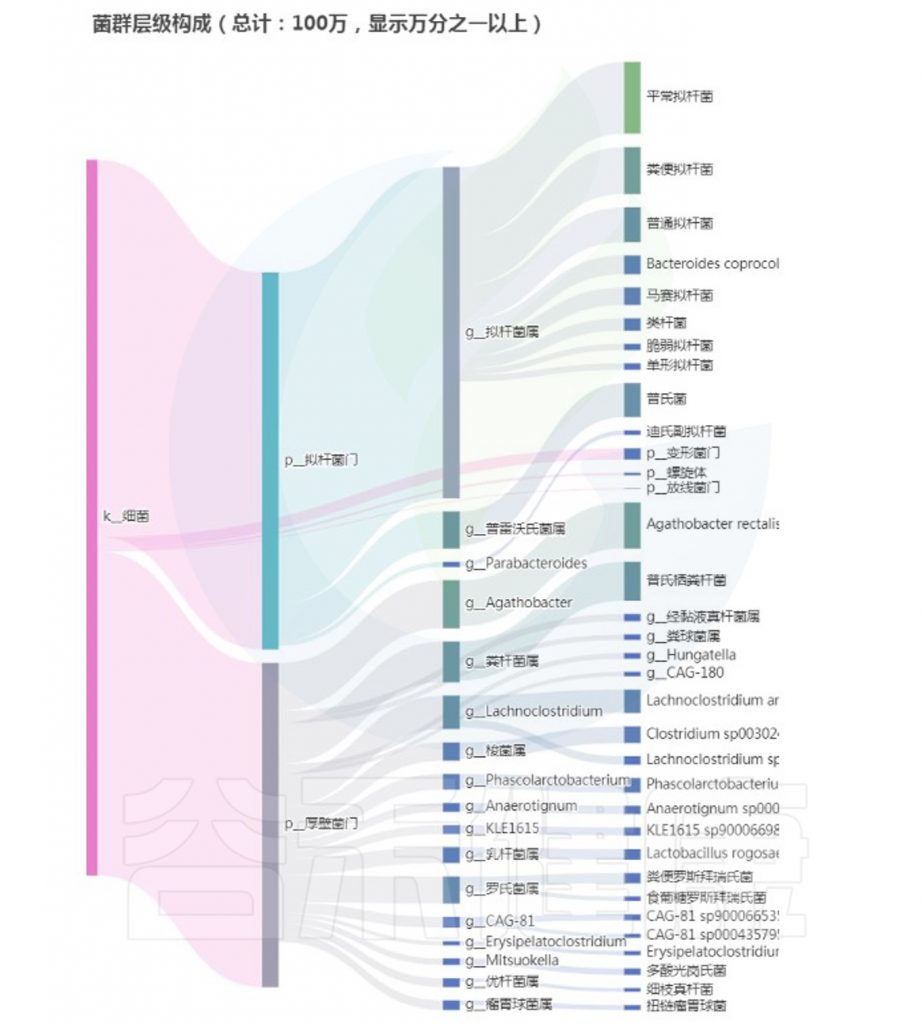

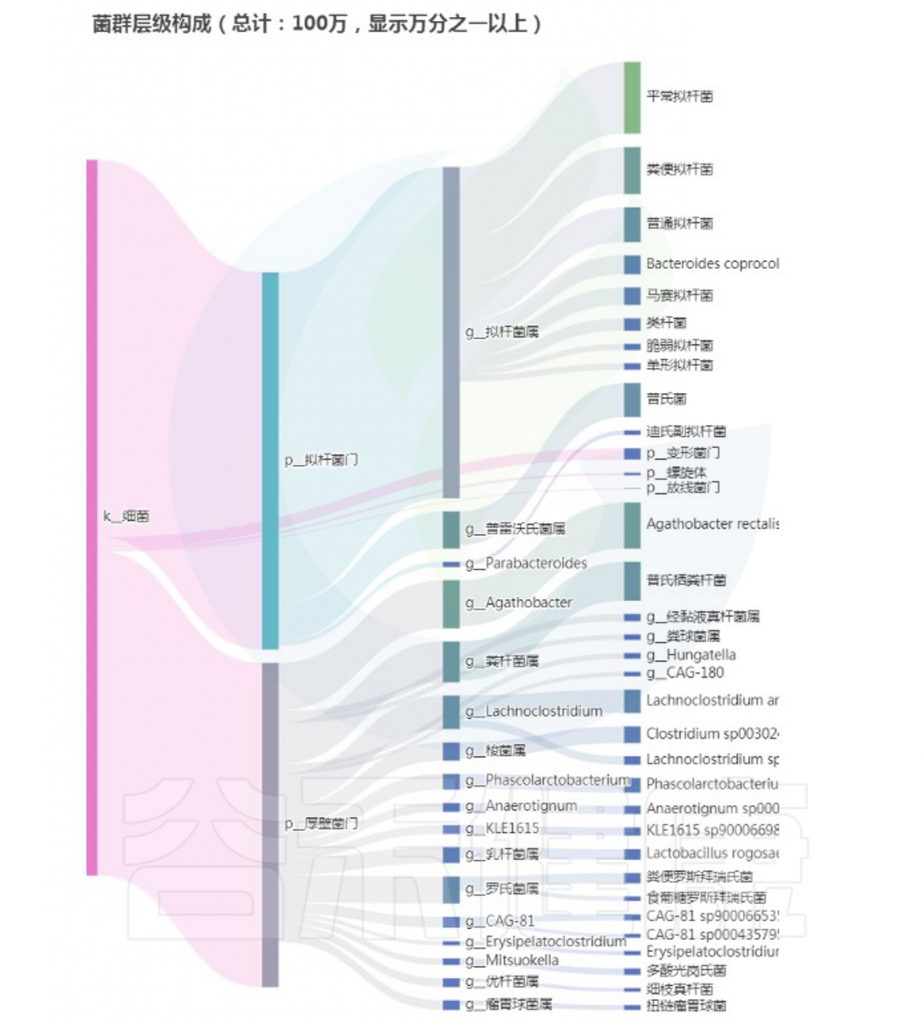






<来源:谷禾健康肠道菌群检测数据库>
从以上菌群评估报告显示,核心菌属和重要菌属没有异常,整体菌群平衡和多样性良好,健康评分显著提升,检测者反馈消化不良症状大幅减轻。
功能性消化不良是一种常见的消化系统疾病,其症状包括腹胀、腹泻、便秘等,给患者带来很大的困扰和痛苦。目前,传统的治疗方法主要是针对症状进行缓解,但效果并不理想。近年来的研究表明,肠道微生物与功能性消化不良密切相关,肠道菌群干预成为了治疗功能性消化不良的新途径。
谷禾的肠道菌群检测经验和研究表明肠道菌群的紊乱和异常特征可以对部分功能性消化不良患者症状背后的病理进行分类和解析,为针对性干预和改善提供了新的可能。对肠道微生物与功能性消化不良之间的关系的进一步深入研究和应用有望带来更有效的治疗方法。
主要参考文献
Singh R, Zogg H, Ghoshal UC, Ro S. Current Treatment Options and Therapeutic Insights for Gastrointestinal Dysmotility and Functional Gastrointestinal Disorders. Front Pharmacol. 2022 Jan 25;13:808195. doi: 10.3389/fphar.2022.808195. PMID: 35145413; PMCID: PMC8822166.
Martinez-Guryn K, Hubert N, Frazier K, Urlass S, Musch MW, Ojeda P, Pierre JF, Miyoshi J, Sontag TJ, Cham CM, Reardon CA, Leone V, Chang EB. Small Intestine Microbiota Regulate Host Digestive and Absorptive Adaptive Responses to Dietary Lipids. Cell Host Microbe. 2018 Apr 11;23(4):458-469.e5. doi: 10.1016/j.chom.2018.03.011. PMID: 29649441; PMCID: PMC5912695.
Shah A, Talley NJ, Holtmann G. Current and Future Approaches for Diagnosing Small Intestinal Dysbiosis in Patients With Symptoms of Functional Dyspepsia. Front Neurosci. 2022 May 6;16:830356. doi: 10.3389/fnins.2022.830356. PMID: 35600619; PMCID: PMC9121133.
Miwa H, Nagahara A, Asakawa A, Arai M, Oshima T, Kasugai K, Kamada K, Suzuki H, Tanaka F, Tominaga K, Futagami S, Hojo M, Mihara H, Higuchi K, Kusano M, Arisawa T, Kato M, Joh T, Mochida S, Enomoto N, Shimosegawa T, Koike K. Evidence-based clinical practice guidelines for functional dyspepsia 2021. J Gastroenterol. 2022 Feb;57(2):47-61. doi: 10.1007/s00535-021-01843-7. Epub 2022 Jan 21. PMID: 35061057; PMCID: PMC8831363.
Mounsey A, Barzin A, Rietz A. Functional Dyspepsia: Evaluation and Management. Am Fam Physician. 2020 Jan 15;101(2):84-88. PMID: 31939638.
Tziatzios G, Gkolfakis P, Papanikolaou IS, Mathur R, Pimentel M, Giamarellos-Bourboulis EJ, Triantafyllou K. Gut Microbiota Dysbiosis in Functional Dyspepsia. Microorganisms. 2020 May 8;8(5):691. doi: 10.3390/microorganisms8050691. PMID: 32397332; PMCID: PMC7285034.
Brown G, Hoedt EC, Keely S, Shah A, Walker MM, Holtmann G, Talley NJ. Role of the duodenal microbiota in functional dyspepsia. Neurogastroenterol Motil. 2022 Nov;34(11):e14372. doi: 10.1111/nmo.14372. Epub 2022 Apr 11. PMID: 35403776; PMCID: PMC9786680.
Hari S, Burns GL, Hoedt EC, Keely S, Talley NJ. Eosinophils, Hypoxia-Inducible Factors, and Barrier Dysfunction in Functional Dyspepsia. Front Allergy. 2022 May 31;3:851482. doi: 10.3389/falgy.2022.851482. PMID: 35769556; PMCID: PMC9234913.
Rupp SK, Stengel A. Bi-Directionality of the Microbiota-Gut-Brain Axis in Patients With Functional Dyspepsia: Relevance of Psychotherapy and Probiotics. Front Neurosci. 2022 Feb 28;16:844564. doi: 10.3389/fnins.2022.844564. PMID: 35295092; PMCID: PMC8919856.

谷禾健康

编辑
癌症一直是全球人类关注的重点,近年来癌症的发病率迅速增加,例如乳腺癌、前列腺癌和肺癌非常普遍。胃肠道癌在发病率和死亡率方面位居首位,并造成重大的社会经济负担。
胃肠道癌症包括胃癌、肝癌、食道癌、胰腺癌和结直肠癌等,占所有癌症的四分之一以上。
▷生活行为影响胃肠道癌症
目前的证据表明,社会经济发展导致生活方式的一些改变。如吸烟和饮酒是癌症最常见的风险因素,越来越多的共识也将饮食习惯列为胃肠道癌症的相关风险因素。这些行为与各种慢性非传染性疾病和胃肠道癌症的出现直接或间接相关。
▷肠道微生物影响胃肠道癌症
肠道微生物群在人类的健康和疾病状态中都发挥着重要作用。大量研究证明肠道微生物群对胃肠道癌症(包括食管癌、胃癌、结直肠癌、肝癌和胰腺癌)具有一定的影响。
在本篇文章中,讲述了胃肠道癌症的一些基本特征,并探讨了在社会进步的背景下,不健康的行为、饮食,及其影响的肠道微生物群变化对胃肠道癌症的影响。希望在未来有助于胃肠道癌症的预防、诊断和治疗。
本文主要分三部分讲述
Part1:胃肠道癌症的一些基本特征
Part2:不良生活方式对胃肠道癌症的影响
Part3:肠道微生物与胃肠道癌症的关系
胃肠道 (GI) 癌症,包括胃癌、肝癌、食管癌、胰腺癌和结直肠癌,胃肠道癌症是全球最常见的癌症,也是导致死亡的主要原因之一,它们的患病率正在持续上升。
疫情前的数据统计,2018年,约有500万例新增胃肠道癌症病例,超过300万例相关死亡。
胃肠道癌症严重危害人们健康
从GLOBOCAN数据库获得的数据估计,2020年食管癌新发病例超过60万例,相关死亡超过50万例。
使用同一数据库,分析估计2020年全球有110万例胃癌新发病例和超过70万例相关死亡。
同样,结直肠癌的发病率一直在以惊人的速度上升,2020年全球估计有190万新病例和90万例相关死亡。
胃肠道癌症已经成为不容忽视的健康问题,下面先来了解一下这些癌症:
▼
食管癌是第四常见的胃肠道癌症。
鳞状细胞癌是食管癌最常见的组织学类型
食管癌有两种主要的组织学亚型:腺癌和鳞状细胞癌 (SCC)。鳞状细胞癌是世界范围内的主要亚型。
我国食管癌90%以上为鳞状细胞癌,少数为腺癌。大多数食管癌患者表现为疾病晚期;因此,平均5年内总生存率仅为18%。
注:腺癌在美国和北欧排名第一(约60%)。
✦食管癌的症状
早期无明显症状
食管癌在早期往往是无明显症状的,偶有表现为胸骨后隐痛不适。随着肿瘤增大,患者会出现进食时吞咽不适或异物感。常表现为进食速度减慢并常需汤水送饭。
病情加重导致肿瘤增大阻塞食管
数月后因肿瘤进一步增大并阻塞食管腔,患者只能进食流质,当肿瘤完全阻塞管腔时,病人表现为“滴水难通”。从症状出现至完全梗阻一般约一年时间。
因此,有可疑症状时应尽早到医院检查。
✦男性食管癌的发病率高于女性
食管癌的男女差异较大,男性患食管癌的比例明显高于女性。食管癌在男性患者中的发生率是女性患者的三倍。
鳞状细胞癌的主要危险因素是饮酒和吸烟,而腺癌的主要危险因素是胃食管反流(尤其是糜烂性食管炎和巴雷特食管)、吸烟和肥胖。
胃食管腔因过度接触(或暴露于)胃液而引起的临床胃食管反流症和食管黏膜损伤的疾病称为胃食管反流。
▼
胃癌是全球第五常见癌症,也是癌症相关死亡率的第三大原因。
✦胃癌的症状
根据癌组织浸润深度分为早期胃癌和进展期胃癌(中、晚期胃癌)。
胃癌早期较难诊断
胃癌及癌前病变的症状隐匿且无特异性,因此早期胃癌很难发现。事实上,中国只有5~10%的胃癌能被早期诊断。
如捉摸不定的上腹部不适、隐痛、泛酸、食欲减退、轻度贫血等部分类似胃十二指肠溃疡或慢性胃炎症状。
随着病情的进展,胃部症状渐转明显出现上腹部疼痛、食欲不振、消瘦、体重减轻和贫血等。后期常有癌肿转移、出现腹部肿块、左锁骨上淋巴结肿大、黑便、腹水及严重营养不良等。
✦胃癌在不同人群中差异很大
非贲门胃癌 (NCGC) 占胃癌病例的近75%。与其他胃肠道癌症类似,非贲门胃癌的流行病学在不同人群中差异很大。
非贲门胃癌在东亚的发病率(韩国每10万人中有34人;日本每10万人中有28人)明显高于欧洲或美国(每10万人中有6人)。
✦影响胃癌的风险因素
除了幽门螺杆菌感染外,胃癌的其他主要危险因素包括年龄增长、性别、种族、饮食摄入类型、社会经济地位、遗传和吸烟。
尽管在过去几十年美国胃癌的发病率有所下降,但50岁或以下人群的非贲门胃癌发病率却出现升高,并且经常出现诊断晚和预后不良的情况。
▼
结直肠癌是常见的消化道恶性肿瘤,也是导致癌症相关死亡的第二大原因,每年全世界约有180万新发病例。
发病多在40岁以后,好发部位为直肠及直肠与乙状结肠交界处,男女比约为2:1。
✦结直肠癌的症状
结直肠癌的临床表现随其病灶大小、所在部位及病理类型而有所不同。
早期症状:
腹部不适:可能表现为腹胀、腹部隐痛等不适症状,疼痛多出现在中下腹部,逐渐加重;
排便习惯的改变:可能出现便频、腹泻或便秘,腹泻和便秘可交替出现,还可能出现腹部隐痛、肛门坠胀感等。
中期症状:
腹部肿块:当肿瘤生长到一定大小后,可能在腹部触及肿块,初期可推动,待到侵袭周围组织后则不易推动;
恶心、呕吐:当肿瘤侵犯胃部时,患者可能出现恶心、呕吐等症状;
晚期症状:
肠梗阻:以左侧结肠多见,由肿瘤向肠壁四周侵袭浸润,导致肠腔狭窄引起肠梗阻,多为慢性不完全性肠梗阻。可先出现腹胀、腹痛、肠鸣音亢进、便秘、粪便变细等;
全身中毒症状:以右侧结肠多见,由于肿瘤消耗体内营养,并造成慢性长期出血,还可继发感染,因此可出现贫血、消瘦、发热、无力、水肿等全身中毒症状;
转移症状:结肠癌晚期时可出现多处转移,肝转移可造成肝大、黄疸、腹水;肺转移可出现咳嗽、气促、血痰或呼吸困难等症状;脑转移可出现偏瘫、昏迷;骨转移可出现骨痛、跛行等。发展到最后可出现恶病质表现,引起全身多器官功能衰竭。
✦影响结直肠癌的风险因素
超过90%的结直肠癌病例是偶发的,这突显了除了癌症相关基因之外,环境风险因素的重要性。例如不健康的饮食模式、超重、肥胖、2型糖尿病、久坐不动、吸烟和饮酒。
正如在其他胃肠道癌症流行病学研究中观察到的那样,不同国家和地理区域之间的结直肠癌发病率差异很大,澳大利亚和新西兰的发病率最高,中南亚的发病率最低。
工业化影响了结直肠癌的发病率
多项研究支持高人类发展指数与结直肠癌发病率和死亡率之间的关系;发达国家通常报告的发病率最高。尽管经济发展和随之而来的工业化有望改善医疗保健的可及性,但这极大地影响了生活方式和不健康习惯。
尽管如此,许多欠发达国家的发病率正在上升,加拿大和巴西等国家的结直肠癌发病率的巨大差异可能不仅与卫生政策有关,还与地区贫困有关。
扩展阅读:结直肠癌防治新策略——微生物群
▼
一般分为肝细胞癌和肝内胆管癌
原发性肝癌一般可分为肝细胞癌(HCC)和肝内胆管癌(ICC),这两种约占肝癌75-85%的病例。
预后不良是该疾病的标志;因此,肝癌的发病率和死亡率密切相关。肝癌在胃肠道癌症中的发病率与死亡率均排名第三。此外,肝癌是全球第六至第七常见的癌症,也是导致癌症相关死亡的第四大原因。
✦肝癌的症状
早期症状:肝癌从第一个癌细胞形成发展到有自觉症状,大约需要2年时间,在此期间,病人可无任何症状或体征,少数病人会出现食欲减退,上腹闷胀、乏力等,有些病人可能轻度肝肿大。
中、晚期症状:肝癌的典型症状和体征一般出现于中、晚期,主要有肝痛、乏力、消瘦、黄疸、腹水等。
转移症状:如果肝癌出现转移,可能出现相对应的症状。肺转移可能出现咳嗽、咳痰等症状,骨转移可能出现疼痛的症状。
✦肝癌的地区差异较大
肝癌的全球分布差异很大,近75%的病例发生在亚洲,其中中国占病例的50%以上,蒙古的发病率最高(93.7/100000)。
在过去的四十年里,一些国家,如美国、加拿大、新西兰和澳大利亚,出现了肝癌病例增加的趋势。
✦影响肝癌的风险因素
病毒性肝炎
乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)以及饮酒被认为是世界范围内肝细胞癌最重要的危险因素。
非酒精性脂肪肝
随着肥胖、糖尿病和相关代谢综合征的高度流行,非酒精性脂肪肝被认为是慢性肝病最常见的原因之一,也是肝细胞癌的相关原因。
工业化进程影响着社会经济环境,人们生活方式的改变,有利于高热量的西方化饮食,并增加了肥胖和糖尿病的发病率。
扩展阅读:
▼
胰腺癌是五种主要胃肠道癌症中最不常见的,累计5年生存率仅为5–15%。
胰腺癌的发病率近年来呈快速上升的趋势,死亡率排在首位,因此也被称为“癌中之王”。
✦胰腺癌的症状
胰腺癌是最致命的癌症之一,其特点是:难发现(发现多为晚期),病程短,发展恶化速度快,中位生存期为3-6个月,正所谓 “无声杀手”。
胰腺癌的早期临床表现往往是无特异性的,与许多其它常见疾病症状相似。中后期主要症状有:不明原因的厌食,消化不良及体重下降;腹部不适或疼痛;黄疸。
✦影响胰腺癌的风险因素
高人类发展指数国家胰腺癌的发病率和死亡率均高出3-4倍,其中北美、欧洲和澳大利亚/新西兰报告的发病率最高,男性患者的发病率略高于女性患者。
高体重指数(BMI)、2型糖尿病,以及酗酒和吸烟是胰腺癌的可变风险因素。关于胰腺癌的风险,发现吸烟者与非吸烟者的发病率比值约为1.74。大量饮酒似乎与胰腺癌有关,是胰腺炎的相关原因,胰腺炎也是胰腺癌的一个既定风险因素。
注:胰腺癌通常具有高度侵袭性,由于非特异性的临床表现而难以诊断。此外,同一国家的国家和地区的诊断准确性差异很大,主要与城市、大都市和高度发达的中心有关。
扩展阅读:“隐藏高手” 胰腺癌的新出路——微生物
中国是全球肝癌、食管癌、胃癌新发病例和死亡人数最多的国家,2020年新增确诊病例121万。中国结直肠癌发病率也在快速上升,占2020年全球发病率的40%以上。
中国胃肠道肿瘤负担沉重,发病率高于世界平均水平。
★ 胃肠道癌症与生活习惯有关
中国近几十年经历了饮食和营养、身体活动及吸烟等生活方式的快速变化。大量证据支持胃肠道癌症与饮食和其他生活行为风险因素有关。
统计与胃肠道癌症风险相关的饮食等生活因素的时间趋势,将有助于衡量由这些因素引起的胃肠道癌症发病的未来趋势,影响预防癌症的公共卫生政策,并优化健康促进的资源分配。
研究团队根据1991年至2011年中国健康与营养调查 (CHNS) 的数据描述和预测了中国饮食和生活方式因素以及相关胃肠道癌症负担的时间趋势。
Wu Y,et al.Gastroenterology.2021
下面来讲述一下这些生活方式与胃肠道癌症之间的具体关系:
▼
饮酒是全球疾病负担的主要风险因素,饮酒会增加患癌症的风险。1990年至今,全球成人人均酒精消费量增加,当前饮酒率从45%增加到47%,终生戒酒率从46%减少到43%,预计到2030年这两种趋势将持续。
✦大量饮酒会增加癌症风险
酒精饮料导致近4%的癌症,而最高风险与大量饮酒有关。考虑到不同的饮酒模式,研究表明癌症风险与饮酒频率、每天通常饮酒的量和偶尔大量饮酒之间存在不同的关联,所有这些都与风险增加有关。
教育状况、饮食、吸烟、个人偏好以及地区和宗教习惯是与饮酒或戒酒模式相关的多种生活方式因素中的一部分,可能会混淆当前的研究结果。
几种胃肠道癌症与饮酒有关:
鳞状细胞食管癌与饮酒有关,但与食管腺癌无关。
研究显示关于结直肠癌和胰腺癌的不同结果;胰腺癌的风险似乎与大量饮酒有关,而 结直肠癌的风险与中度或大量饮酒有关。
关于胃癌,世界癌症研究基金会/美国癌症研究所2018年的报告观察到,酒精摄入量 >45 克/天的人群患胃癌风险增加。
肝细胞癌与饮酒直接相关;该关联主要由酒精相关性肝硬化、乙型或丙型肝炎病毒携带者饮酒以及可能大量饮酒驱动。
✦酒精致癌的一些途径
酒精可能通过多种途径促进致癌作用,包括:乙醇及其代谢物乙醛会影响DNA甲基化,导致致癌基因的表达;乙醛形成DNA加合物,损害DNA合成和修复并导致突变。
除此之外,炎症、氧化应激的诱导、叶酸吸收的破坏、免疫系统功能下降、微生物群失调、肝硬化和雌激素调节的变化也可能在癌症发展中发挥作用。
▼
吸烟是多种疾病的主要危险因素,包括胃肠道癌症。
★ 烟草的危害非常大
尽管近几十年来吸烟率有所下降,但与吸烟相关的疾病和死亡仍然是一个令人严重关切的问题,也是一个全球健康问题。
《2019年全球疾病、伤害和风险因素负担研究》确定,就残疾调整寿命而言,吸烟是87个风险因素中的主导因素。
烟草烟雾含有不同的化学制剂,包括活性氧(ROS)和活性氮(RNS)。氧化损伤导致遗传和表观遗传改变、基因失调、调节元件破坏和炎症反应途径激活,在恶性循环中导致活性氧的进一步生成,并可能最终演变为癌症的发生和发展。
✦吸烟者患胃肠道癌症风险更高
食管鳞状细胞癌风险增加
过去几十年的研究支持吸烟与胃肠道癌症之间的关系。吸烟也与食管鳞状细胞癌风险增加20-30%有关,重要的是,注意到烟酒联合使用的具有协同作用。
吸烟人群患胃癌风险较高
数据还表明,吸烟是贲门型和非贲门型胃癌的危险因素。对于其他胃肠道癌症,吸烟率较高的吸烟者患胃癌的风险更高。
荟萃分析还支持吸烟在结直肠癌发展中的作用。 吸烟是肝癌和胰腺癌的公认危险因素。2014年美国卫生部长的报告显示,目前吸烟者因吸烟而患肝癌的风险增加了70%,以前吸烟者增加了40%。
在那些每天吸烟量最大的人中,患胰腺癌的风险最高。荟萃分析研究发现,与不吸烟者相比,当前吸烟者的胰腺癌患者比值升高,但重度吸烟者的比值更高,随着戒烟后的年数成比例下降。
戒烟的好处已经得到了很好的证实。戒烟者的死亡和癌症风险降低。
戒烟和控制烟草消费需要战略规划。成功的戒烟尝试与社会经济地位、教育水平、获得原烟草广告、反烟草运动以及与其他吸烟者一起生活有关。
▼
高脂饮食可显著促进胃肠道肿瘤的发生和发展,主要涉及代谢重编程和多种致癌分子的改变。
高脂饮食与胃肠道癌症的关联
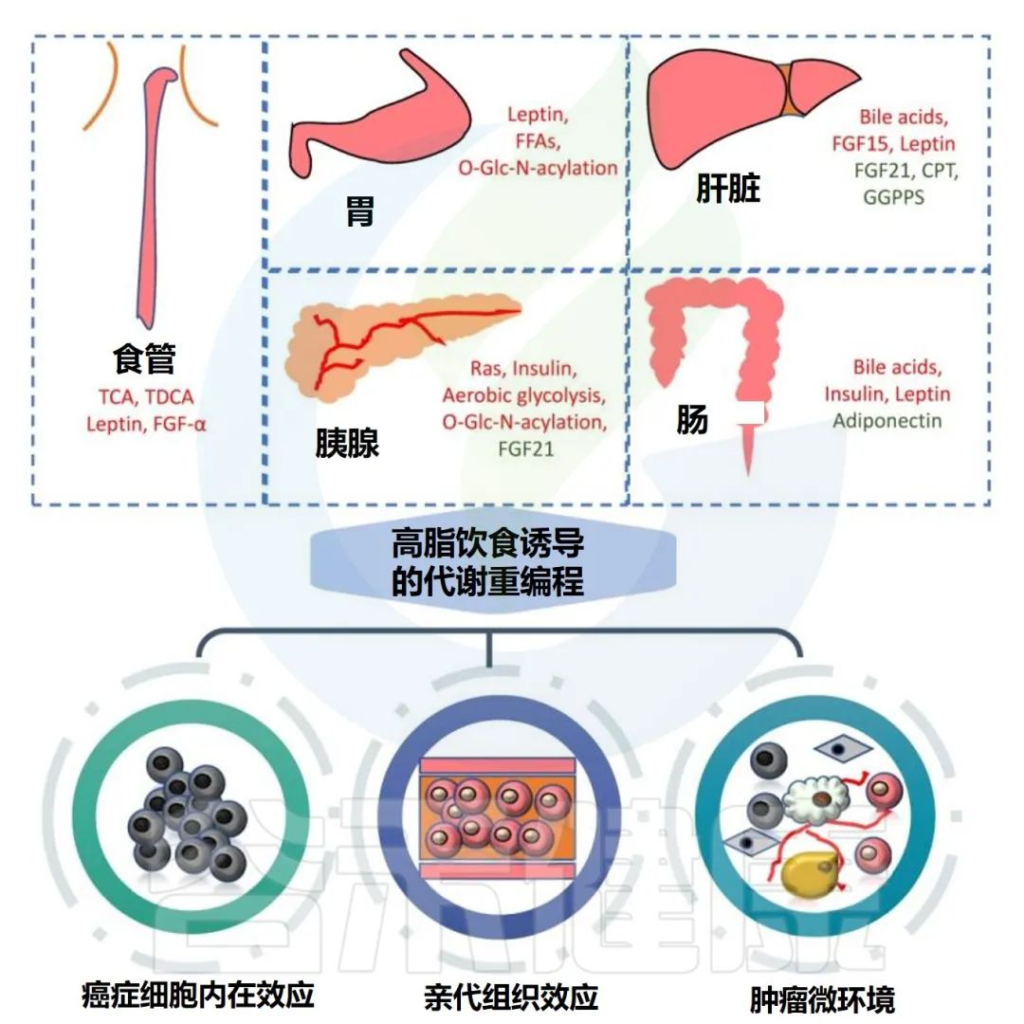
Tong Y,et al.Theranostics.2021
✦高脂饮食下食管癌发病率较高
早在1994年,就发现喂食高脂饮食的小鼠食管癌发病率较高,提示高脂饮食与食管癌之间存在关联。
胆汁酸组成发生变化
高脂饮食可导致小鼠胆汁酸组成发生变化,尤其是牛磺胆酸和牛磺熊去氧胆酸,导致小鼠巴雷特食管和食管癌的发病率增加。
巴雷特食管——食管下段的鳞状上皮被柱状上皮覆盖,可能与反流性食管炎相关,并有发生腺癌的可能。
促炎和致瘤因子增加
喂食高脂饮食的小鼠的食管腺癌具有更高的生长和代谢活性,脂肪组织中促炎和致瘤因子(如瘦素、IGFBP)的表达增加,而抗炎和生长抑制分子减少。
在临床流行病学研究中,发现“肉和脂肪”与食管腺癌和食管鳞状细胞癌密切相关。同时还发现,较高比例的脂肪会加剧食道癌和食道胃腺癌的发生,而碳水化合物会降低食道腺癌的发生。
✦过量膳食脂肪易导致胃癌
许多流行病学研究报告说,膳食脂肪可能是胃癌的危险因素。
瘦素在胃癌中发挥重要作用
瘦素被认为在肥胖相关的胃肠道恶性肿瘤中发挥重要作用,因为它在血管生成、细胞凋亡、细胞增殖和细胞迁移中发挥作用。
瘦素是一种由脂肪组织分泌的激素,它在血清中的含量与动物脂肪组织大小成正比。瘦素作用于位于中枢神经系统的受体,从而调控生物的行为以及新陈代谢。
它还显示通过调节mTOR、STAT3和ERK依赖性途径、PI3K依赖性途径和MAPK依赖性途径来促进粘蛋白产生和胃肠道肿瘤形成。
作用机制
过度的瘦素和瘦素信号激活通过抑制胃肠道上皮细胞中的细胞因子信号3的抑制剂以及增加与肠上皮相关的异位分子如肠粘蛋白2和潘氏细胞标志物PLA2的表达而导致胃肿瘤,以及转录因子SRY-box转录因子2和H+/K+ATP酶的表达降低。
由于瘦素受体(OBR)信号介导的胃上皮细胞器稳态、组织完整性和干性基因表达的破坏,与高脂饮食相关的脂肪毒性会诱发癌前病变。
简而言之,高脂饮食通过上皮细胞中PI3K-Akt通路的上调,促进β-连环蛋白并破坏细胞器稳态,并且可以上调癌症干细胞的特性。
一项研究发现,在高脂饮食喂养的8-20周内,胃壁细胞出现线粒体损伤,并伴有粘膜厚度增加。游离脂肪酸(FFAs)的添加可以复制这种表达并促进后生变化,表明游离脂肪酸的脂质毒性诱导壁细胞死亡和癌前病变的发生。
还有研究发现高脂饮食可以为转移提供足够的能量,并增加O-Glc-N-酰化水平,从而促进脂肪酸受体CD36的转录激活。CD36上调导致癌症细胞脂肪摄取增加,形成促进癌症转移的恶性循环。
✦高脂饮食促进了肝癌
研究证实,高脂饮食可导致疏水性胆汁酸的肝脏滞留显著增加,这与肠道微生物的变化显著相关。同时,肝内胆汁酸的合成和转运紊乱,导致多种炎性细胞因子释放和胆汁酸严重沉积,促进癌症的发生。
此外,调节新陈代谢的各种分子也发生了变化。例如,饮食诱导的肥胖小鼠肝脏中的FGF21和CPT2减少,而FGF15、IRE1α和瘦素上调,然后与其他病理变化联系起来,促进致癌作用。
FGF21减少与过度增殖、TGF-β和Smad信号以及肝脏中上皮-间质转化和Wnt信号通路/β-连环蛋白 信号的异常表达密切相关。
脂肪酸氧化酶CPT2在高脂喂养小鼠体内显著下调,导致酰基肉碱在肝细胞癌组织和血清中蓄积,协同抑制脂肪酸氧化和激活STAT3,共同促进肝癌发生。
高脂饮食产生的代谢变化导致肝脏炎症
长期高脂饮食可降低小鼠香叶基香叶基二磷酸合酶的表达。肝香叶基香叶基二磷酸合酶敲除增强肝激酶B1超法尼基化,通过调节AMPK 活性破坏线粒体功能并促进糖酵解。这些代谢变化导致肝脏炎症,巨噬细胞和促炎细胞因子浸润,进而促进肝脏病理进展。
IRE1α与癌症内质网应激有关,并驱动发病机制。一方面,IRE1α促进NFκB途径的肥胖相关抑制剂的激活,导致肝脏中产生典型的促炎细胞因子,如肿瘤坏死因子和白细胞介素6。
另一方面,它维持STAT3的激活,从而促进肝细胞增殖。瘦素信号通路可以通过下游PI3K/Akt信号激活mTOR,而mTOR间接激活真核起始因子4E,从而刺激编码增殖和抗凋亡因子的mRNA的翻译。
同时,高脂饮食可显著提高血清DPP4水平,促进DPP4/CL2/血管生成的级联反应和DPP4调节的巨噬细胞浸润介导的炎症反应,所有这些都在高脂饮食相关的肝细胞癌进展中起着关键作用。
✦高脂饮食对胰腺癌有影响
高脂饮食降低了上皮对癌症的防御
高脂饮食能促进细胞增殖,抑制异常细胞清除。西方饮食诱导小鼠胰腺上皮细胞过度增殖,并导致突变频率和可能性增加。高脂饮食喂养显著降低了RasV12转化细胞的清除能力,从而损害了上皮对癌症的防御。
高脂饮食可以产生炎症和免疫抑制性肿瘤微环境。发现喂食高脂饮食的小鼠的胰腺组织具有更高的KRAS活性、纤维化基质、更短的存活时间和更高程度的胰腺上皮内肿瘤和胰腺导管腺癌。
高脂饮食导致高胰岛素血症
高脂饮食还可以导致高胰岛素血症并加速胰腺上皮内肿瘤小鼠中的形成和进展。同时发现增加的内源性胰岛素会促进高脂饮食诱发的癌前病变和胰腺癌,这表明可能存在致癌机制。
胰腺导管腺癌发展的机制可能与DNA损伤有关。给 小鼠喂食高糖、高脂肪饮食,高糖处理的正常胰腺细胞系在体外表现出明显的DNA损伤和KRAS突变增加,他们还发现KRAS突变细胞在正常和高糖条件下均具有生长优势环境。
✦高脂饮食促进结直肠癌的发生和转移
对结直肠癌和高脂饮食的流行病学研究证实了它们之间的联系。
高脂饮食促进结直肠癌的发生和转移。伴随着APC基因的杂合丢失和ERK1/2、AKT和mTOR 信号通路的下调。
以下几种途径在高脂饮食促进结直肠癌中发挥关键作用:
JNK通路在肥胖和胰岛素抵抗中起着至关重要的作用并促进致癌转化和细胞增殖。
STRA6通路充当高脂饮食和结直肠癌之间的桥梁,维持结直肠癌干细胞。高脂饮食促进肿瘤组织中STRA6的增加,而STRA6激活转导JAK2-STAT3信号级联。
高脂饮食还可以激活MAPK、ERK和PI3K/Akt信号通路。在一项研究中,高脂饮食引起的肥胖可促进炎症相关结直肠癌的发生,这是由PI3K/Akt途径和肿瘤微环境中IL-12、MCP-1、IL-6和TNF-α的增加驱动的。
关于高脂饮食对细胞因子或肥胖因素的影响,也有许多研究。血清胰岛素、瘦素、TNF-α、IGF1水平升高,以及增殖细胞核抗原、COX-2、细胞周期蛋白 D1、β-连环蛋白和 NFκB 蛋白水平升高表明高脂饮食促进通过炎症和代谢异常形成结肠腺瘤,并影响细胞周期。
▼
慢性心理压力也被认为是包括癌症在内的多种疾病发展的危险因素。
慢性应激刺激下丘脑-垂体-肾上腺轴和交感神经系统,导致应激相关介质的合成和肾素-血管紧张素系统的激活 。
皮质类固醇和儿茶酚胺的过量产生会导致促炎细胞因子的产生和代谢变化,包括胰岛素抵抗的增加和脂肪分解释放游离脂肪酸。
✦慢性心理压力造成炎症环境
总而言之,这些改变似乎创造了一个炎症环境,加剧代谢综合征、糖尿病和胰岛素抵抗的发病机制以及其他非传染性慢性和免疫介导疾病的发展,所有这些都可能由慢性心理压力介导。
在癌症中,肾上腺素能受体在肿瘤细胞和肿瘤微环境中过度表达。肾上腺素能受体的下游激活反过来会抑制细胞凋亡和DNA修复,并具有增强细胞周期进程的原癌效应。
肾上腺素能受体的激活会诱导PI3K/AKT信号通路,从而刺激细胞增殖和血管生成。此外,应激介导的炎症反应和免疫功能改变可能会损害免疫监视机制,进一步促进癌变。
▼
恶性肿瘤的发展是一个多步骤的过程,病毒已被确定为肿瘤促进剂。肿瘤促进剂刺激信号通路和细胞增殖,最终导致癌症。
✦乙肝病毒、丙肝病毒感染易诱发肝癌
乙型肝炎病毒和丙型肝炎病毒感染是目前肝细胞癌最重要的全球危险因素,肝细胞癌是肝癌的主要组织学类型。
注:来自肝细胞癌高患病率地区的患者在诊断时往往比患病率地区的患者更年轻。
乙型肝炎病毒引起的慢性坏死性炎症性疾病会诱发肝细胞突变,估计发生肝细胞癌的风险为10-25%,并且取决于是否存在活动性乙型肝炎病毒感染或肝硬化。
丙型肝炎病毒是一种不整合到宿主基因组中的RNA病毒。丙型肝炎病毒引起的肿瘤发生可能是重复性损伤、再生和纤维化的结果,并且近90%的丙型肝炎病毒相关肝细胞癌之前有肝硬化。
扩展阅读:细菌,真菌,病毒——感染,免疫反应以及治疗用药差异
▼
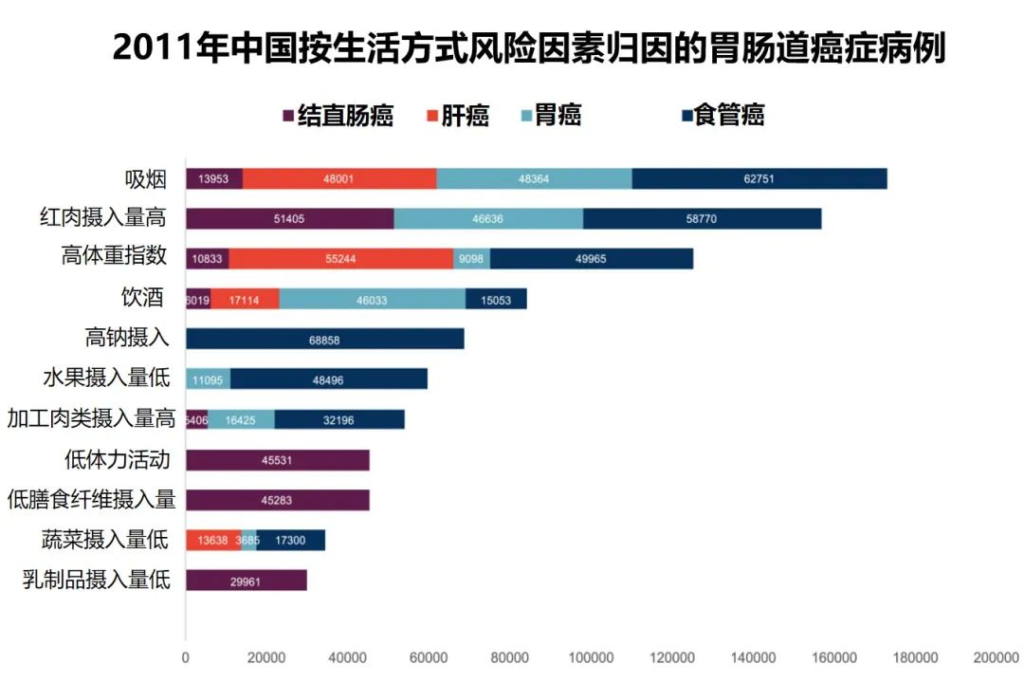
研究团队应用比较风险评估方法估计归因于每个风险因素的胃肠道癌症的人群归因分数
2011年中国不同生活方式危险因素的胃肠癌归因分数
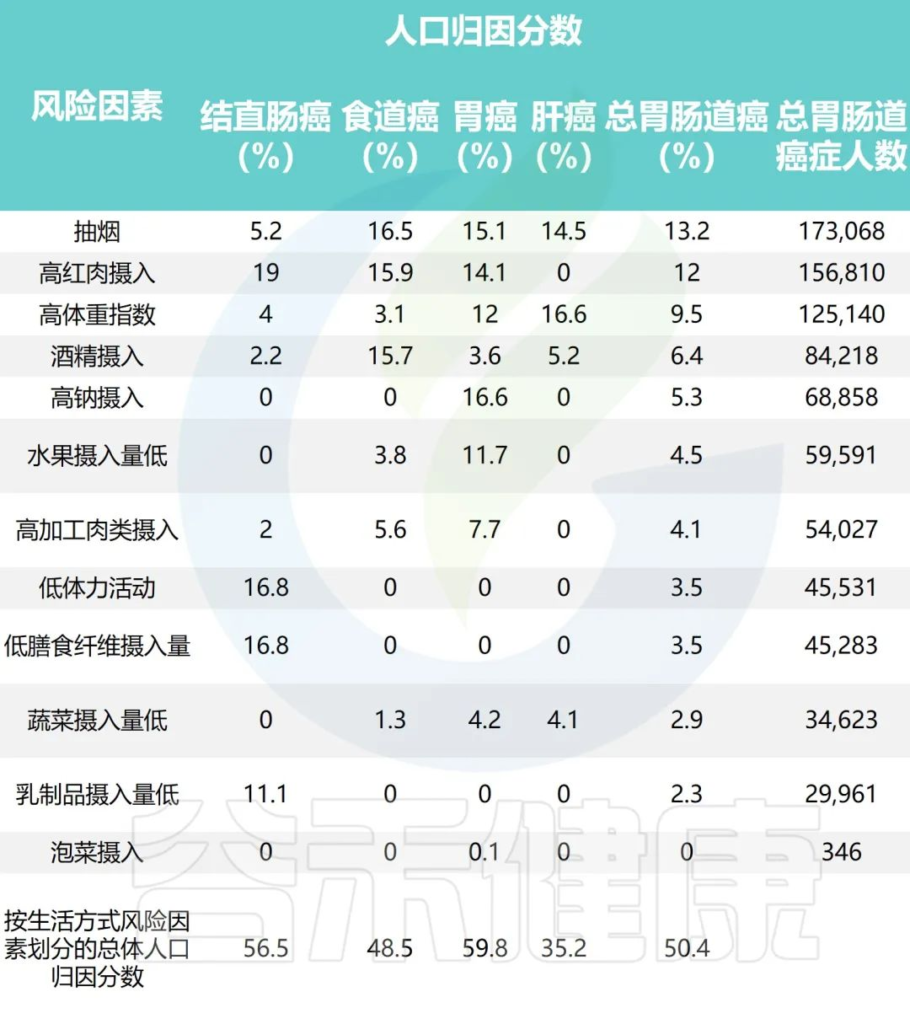
Wu Y,et al.Gastroenterology.2021
•高红肉摄入与51405例结直肠癌病例相关(PAF=19.0%)
•据估计,高身体质量指数(BMI)导致55244例新发肝癌病例 (PAF=16.6%)
•吸烟是食管癌的首要归因危险因素,占48364例病例 (PAF=16.5%)
•高钠摄入量与最多(68,858)例胃癌(PAF= 6.6%) 相关。
研究团队还根据1991年至2011年中国健康与营养调查估计了生活方式因素的时间趋势,同时预测了2011年至2031年生活方式因素的流行程度和胃肠道癌症的相关负担。
1991年至2031年按生活方式风险因素划分的胃肠癌病例的历史和预测趋势
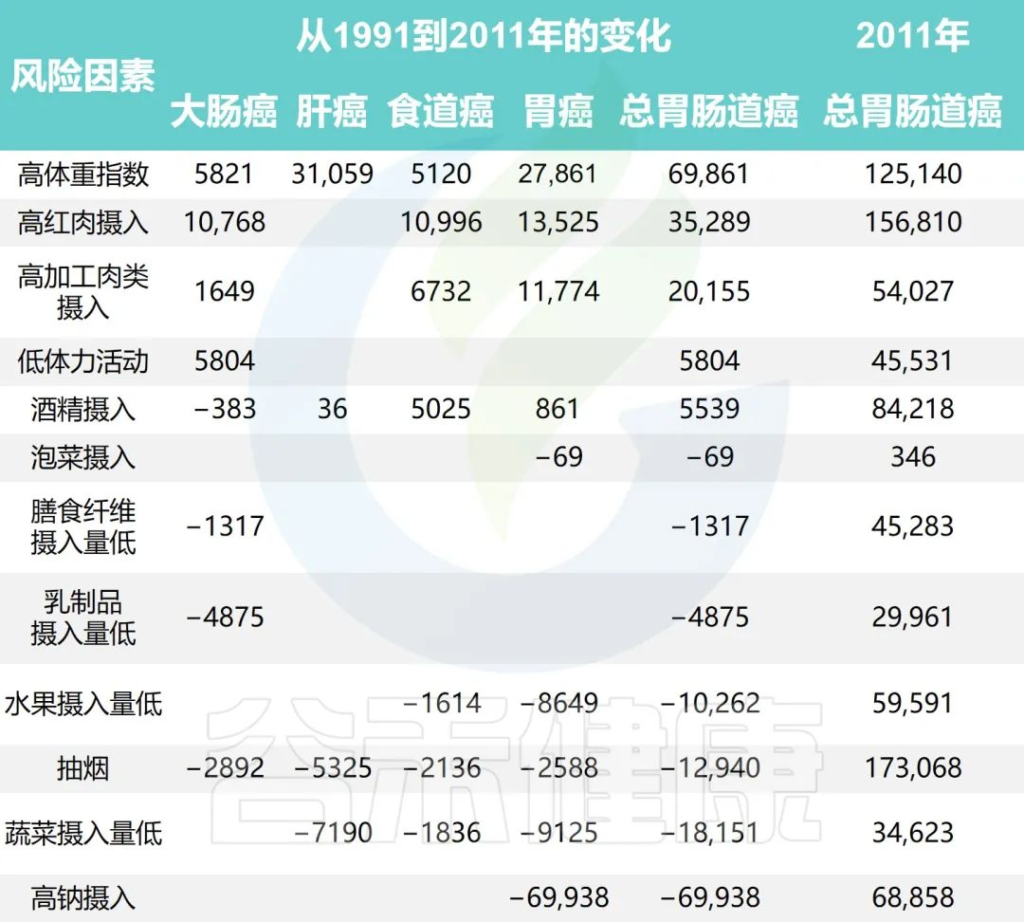
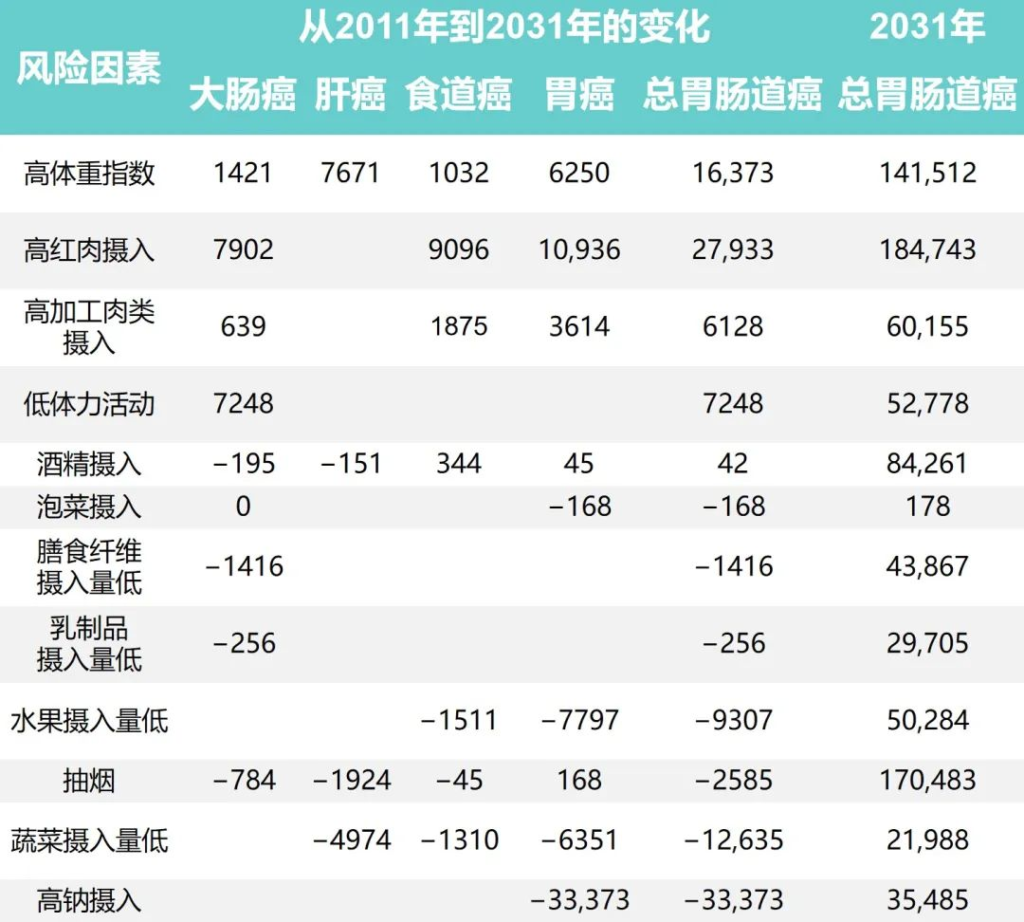
Wu Y,et al.Gastroenterology.2021
•钠摄入量降低减少了胃癌
随着时间的推移,钠摄入量、低蔬菜摄入量、低水果摄入量和吸烟情况有所改善。人口的平均钠摄入量已从1997年的7.5 克/天减少到2011年的5.6克/天,预计到2031年将进一步减少到3.3克/天。
相应的归因胃癌病例估计为138796、68858和 35484,每20年下降约50%。
•蔬菜、水果的摄入增加有助于减少胃肠道癌症
随着平均蔬菜摄入量从252.6克/天上升到323.8克/天,肝癌、食管癌和胃癌的相关数量从1997年的 52774例减少到2011年的34623例。
水果摄入量表现出类似的趋势,1997年总体水果摄入量为18.2克/天,2011年中国人水果消费量为69.6克/天,与1997年相比新增病例减少10262例;到 2031 年,由于水果摄入量增加,预计年发病率将再次下降。
扩展阅读:常见水果对肠道菌群、肠道蠕动和便秘的影响
•吸烟减少胃肠道癌症的发病率也减少
同时,与2011年和1991年相比,吸烟减少与胃肠道癌症事件减少12940例相关,预计2011年至2031年期间将进一步减少。
•饮酒使得胃肠道癌症病例增加
从1997年到2011年,与饮酒相关的胃肠道癌症病例增加了5539例,之后的预测趋势也稳定在每年约84000例。
•锻炼、乳制品和膳食纤维摄入影响结直肠癌
体力活动、乳制品和膳食纤维摄入量仅与结直肠癌有关。据估计,2011年身体锻炼不足与45531例结直肠癌病例相关,预计到2031年还会有7248例病例发生。
1997年、2011年和2031年的预计平均膳食摄入量乳制品分别为5.8克、12.4克和17.6克,膳食纤维分别为10.5克、10.8克和11.1克。2011年,摄入不足分别导致了29961起和45283例结直肠癌病例。
扩展阅读:
人类肠道微生物群在人类的健康和疾病状态中都发挥着重要作用。在过去的十年中,微生物与肿瘤之间的相互作用引起了人们的广泛关注,人们努力了解复杂微生物群落的各种特征,以及微生物群参与癌症预防、致癌和抗癌的可能机制。
大量研究表明,微生物失调通过多种途径促进癌症易感性。肠道微生物主要通过其细菌或分泌的代谢物成分导致消化道肿瘤的发生。
微生物群及其相关代谢产物不仅通过诱导炎症和免疫失调与致癌作用密切相关,还会干扰抗癌药物的药效学。
肠道微生物组与胃肠道癌症的关联
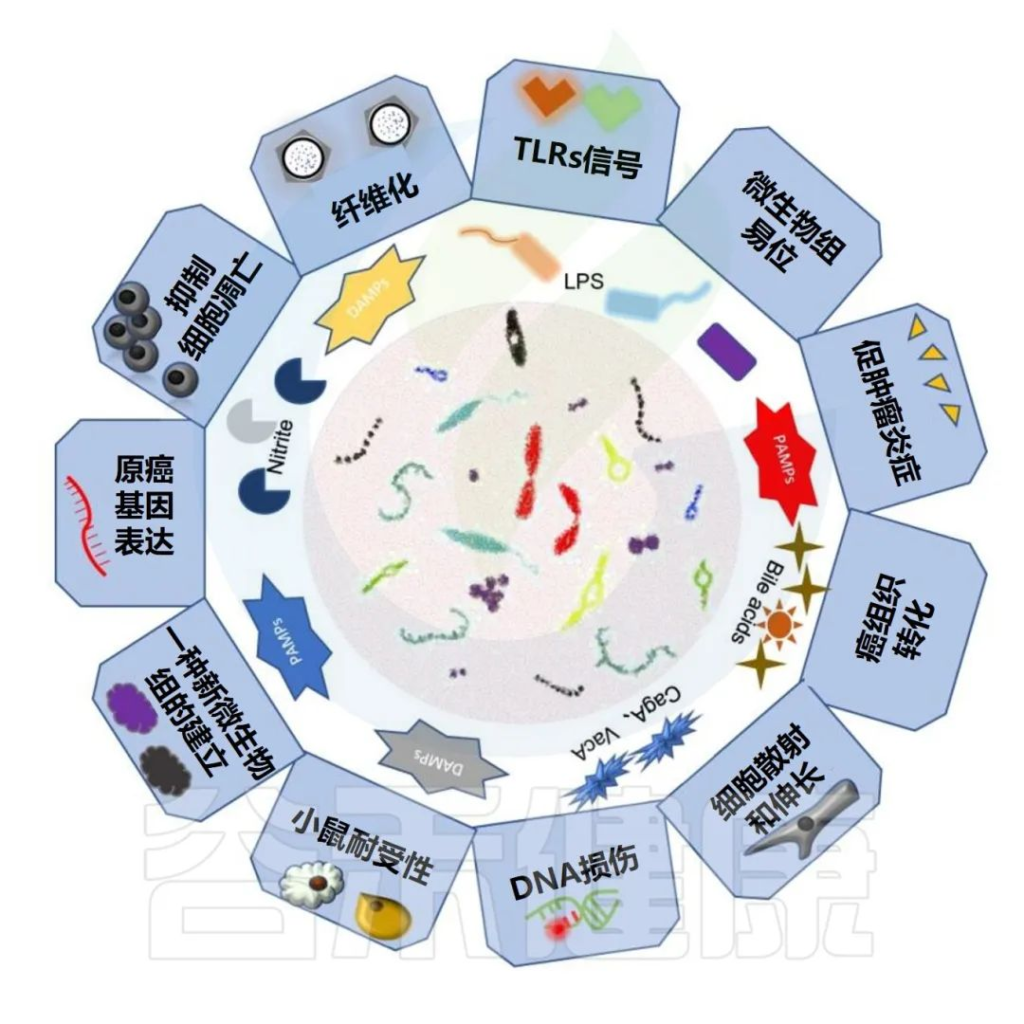
Tong Y,et al.Theranostics.2021
▼
√幽门螺杆菌影响胃癌患病率
胃癌被认为是一种与炎症相关的癌症。幽门螺杆菌(H.Pyloni)感染被称为I类危险因素,可以刺激免疫反应和炎症,调节许多信号通路,并诱发胃酸缺乏、上皮萎缩和发育异常。因此,有效根除幽门螺杆菌可预防胃癌。
癌蛋白细胞毒素相关基因A(CagA)和空泡毒素A(VacA) 是幽门螺杆菌的关键毒力因子。幽门螺旋杆菌感染会显著增加患胃癌的风险。
空泡毒素A可通过直接作用于线粒体 ,导致细胞空泡形成,并在人源性胃上皮细胞内诱导自噬 , 上调 MAP激酶和ERK1/2表达, 激活血管内皮生长因子, 上调细胞生长和分化所必需的 Wnt/β-catenin 信号通路, 抑制GSK3通过PI3K/Akt信号通路。
幽门螺杆菌感染个体中炎症细胞因子增加
在幽门螺杆菌感染个体的胃中发现炎症细胞因子的积累增加,包括干扰素-γ、肿瘤坏死因子、IL-1、IL1β、IL-6、IL-7、IL-8、IL-10和IL-18。
因此,多种类型的免疫细胞受到刺激,包括淋巴细胞、外周单核细胞、嗜酸性粒细胞、巨噬细胞、嗜中性粒细胞、肥大细胞和树突细胞。
包含ERK/MAPK、PI3K/Akt、NF-κB、Wnt/β-catenin以及STAT3的致癌通路的活性随着幽门螺杆菌的感染而上调。相反,肿瘤抑制通路因诱导的P53突变而失活。
此外,幽门螺杆菌感染可导致E-钙粘蛋白和抑癌基因的CpG 岛甲基化,包括编码三叶因子2(TFF2)和叉头盒转录调节因子(FOXD3)的基因,导致显著增加胃癌的风险。
扩展阅读: 正确认识幽门螺杆菌
√其他微生物群
目前的测序技术使研究人员能够深入研究肠道微生物群的复杂性。
幽门螺杆菌阳性个体的微生物群落特征是以下细菌的数量增加:
变形杆菌(Proteobacteria) ↑↑↑
螺旋体(Spirochaetes) ↑↑↑
酸杆菌门(Acidobacteria) ↑↑↑
而以下菌群的数量减少:
放线菌门(Actinobacteria) ↓↓↓
拟杆菌门(Bacteroidetes) ↓↓↓
厚壁菌门(Firmicutes) ↓↓↓
相反,幽门螺杆菌阴性个体携带更丰富的厚壁菌、拟杆菌和放线菌。
√肠道微生物失调增加胃癌发生率
微生物失调也与胃癌发生有关。使用定量PCR,已经表明胃癌患者的微生物群组成非常多样化。
例如卟啉菌属(porphyromonas)、奈瑟菌属(Neisseria)、苍白普氏菌(prevotella pallens)、Streptococcus sinensis的减少,以及大肠杆菌、 肺炎克雷伯菌(Klebsiella pneumoniae)、鲍氏不动杆菌(Acinetobacter baumannii)和毛螺菌科(Lachnospiraceae)的富集。
扩展阅读:
全面认识——肺炎克雷伯菌 (Klebsiella pneumoniae)
来源于幽门螺杆菌的致病成分,如外膜蛋白磷脂酶C-γ2、BAK蛋白和镍结合蛋白,帮助微生物在胃粘膜层定植,然后加剧胃炎的进程,最终增加胃中肿瘤发生的可能性。
肠道微生物与食管癌
据报道,食管癌与常见的潜在危险因素密切相关,如人类乳头状瘤病毒和EB病毒的感染,尽管致病机制仍有争议。除了病毒,细菌感染也会导致食管恶性肿瘤的形成。
√感染幽门螺杆菌的人群食管癌呈下降趋势
在最近20多年来,在感染幽门螺杆菌的普通人群中,食管腺癌的发病率呈下降趋势,尤其是在东部人群中。与此同时,食管鳞状细胞癌的发病率也有所下降。
胃食管反流病是巴雷特食管的主要原因,巴雷特食管是食管腺癌的一种癌前病变。通过抑制壁细胞功能或诱导萎缩性胃炎的发展,慢性幽门螺杆菌感染可以抑制壁细胞分泌盐酸,从而增加胃肠道的pH值,最终导致食管腺癌降低。
√食管炎患者体内肠杆菌丰度较高
与正常人群相比,食管炎和巴雷特食管患者胃中肠杆菌科的相对丰度更高。
有人认为,抗生素可能会改变胃食管反流病患者食道中的微生物组。定植在食管和胃中的肠道微生物群通过质子泵抑制剂(PPIs)的治疗而显著改变。然而,质子泵抑制剂引起的变化是否有益还没有定论。
最新的系统综述和荟萃分析表明,质子泵抑制剂不会减少发育不良和巴雷特食管相关食管腺癌的发展。
√食管中的微生物参与致癌过程
食道传统上被认为是无微生物的部位,只有有限的微生物来自吞咽和胃食管反流。通过应用16S rRNA 测序技术,发现一些特定的微生物栖息在食管粘膜中,包括厚壁菌门、拟杆菌门、变形菌门、放线菌门和梭杆菌门。
此外,与正常食管相比,食管鳞状细胞癌(I-II 期)和食管鳞状异型增生 (ESD) 患者的食管中发现了不同的微生物群落。
与正常胃粘膜微生物群一致,早期食管鳞状细胞癌和食管鳞状异型增生样本中最常见的门是变形菌门、厚壁菌门和拟杆菌门。当食管微生物群失调时,它们参与食管的致瘤过程。
已经发现人类远端食管具有其自身特征性的微生物群。包括厚壁菌门和链球菌在内的革兰氏阳性细菌在正常食管中占主导地位,而革兰氏阴性厌氧菌/微需氧菌,如拟杆菌、变形菌、梭杆菌和螺旋体,主要与食管炎和巴雷特食管有关。
注:脂多糖是革兰氏阴性菌细胞壁的重要组成部分,通过多种机制参与肿瘤发生过程。这些包括激活导致NF-κB激活的先天免疫反应, 促进包括IL1β、IL6、IL8和TNFα在内的炎症相关介质的释放和延迟胃排空。
▼
结直肠中的肠道微生物组是人体中最复杂的群落。细菌种群主要包括厚壁菌门和拟杆菌门和变形杆菌门。
√饮食、微生物代谢物影响结直肠癌
各种因素都会导致结直肠癌,而饮食是与结直肠癌相关的重要环境因素。许多不同的肠道微生物群代谢物具有致瘤或抗肿瘤特性。
在结肠细胞上表达的脂多糖受体抑制细胞死亡,通过Toll样受体2激活细胞免疫反应,然后刺激下游促炎细胞因子信号传导,导致肿瘤发生。
脂磷壁酸是一种来自革兰氏阳性菌细胞壁的元素,被认为是脂多糖的对应物。高脂肪饮食会增加硫酸盐还原菌的相对丰度,例如普通脱硫弧菌,它将初级胆汁酸转化为次级胆汁酸,如石胆酸和脱氧胆酸,具有潜在的致瘤性。
丁酸盐具有抗肿瘤作用
相反,丁酸是一种重要的短链脂肪酸 ,由结肠细菌从饮食中的可发酵纤维中产生,已被证明具有抗肿瘤作用。
参与发酵过程最重要的丁酸盐产生微生物群是普拉梭菌(Faecalibacterium prausnitzii)和直肠真杆菌(Eubacterium rectale)。
丁酸被结肠细胞中的线粒体利用,这有助于维持健康的能量平衡并有益于结肠上皮细胞增殖。GPR109a是一种在免疫细胞上表达的短链脂肪酸受体,主要激活丁酸的配体,然后抑制炎症细胞因子,从而抑制炎症过程。宿主免疫反应通过干扰素γ对抗DNA甲基化介导的GPR109a沉默,从而相应地促进抗癌作用。
丁酸通过诱导P21基因表达、抑制激活蛋白-1(AP-1)信号通路以及增加c-Fos和ERK1/2的磷酸化来发挥各种化学预防作用。此外,尿石蛋白如尿石蛋白A是水果和坚果的肠道微生物群代谢产物,含有大量鞣花酸。据报道,它们可以抑制Wnt信号传导,并显示出对癌症的益处。
扩展阅读:如何通过喂养菌群产生丁酸调节人体健康
√长期炎症容易导致结直肠癌
肠道微生物群引起的通路
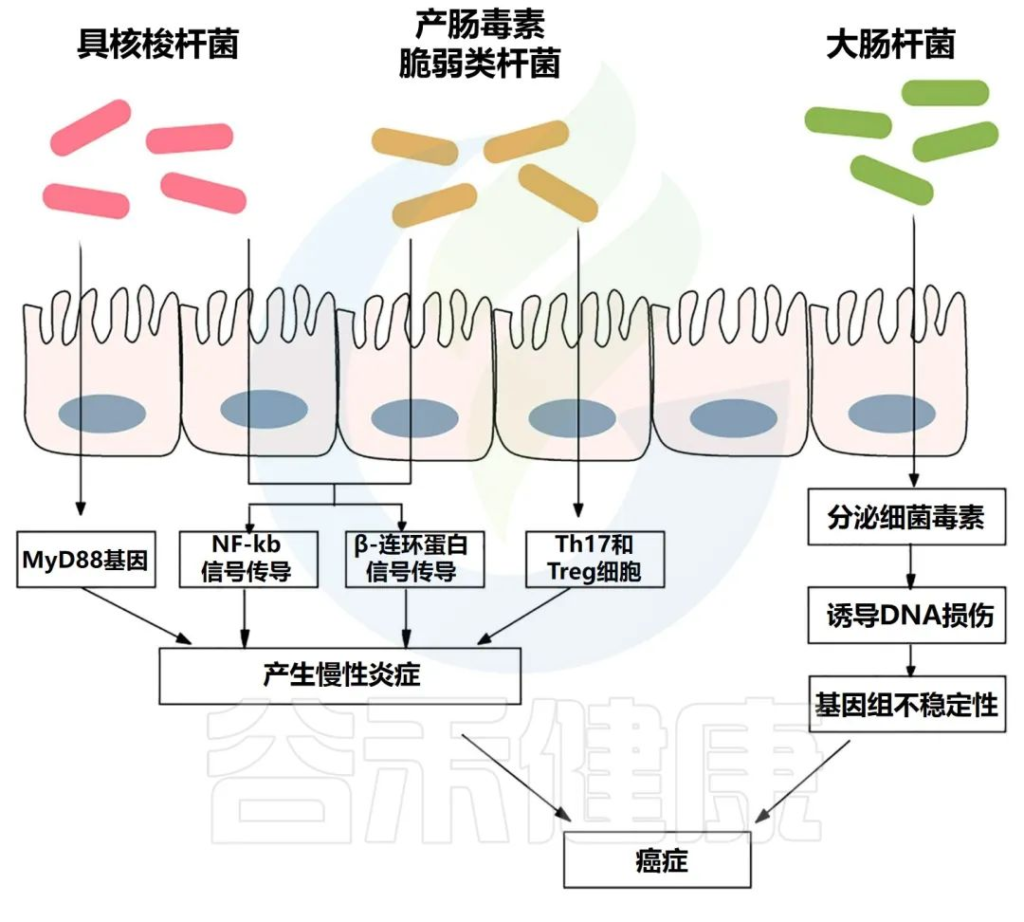
Si H,et al.Semin Cancer Biol.2021
慢性炎症会产生大量炎症介质,如肿瘤坏死因子、白细胞介素6、白细胞介素1b和其他细胞因子,它们会激活NF-κB,从而导致结肠癌发生。
炎症性肠病与更高的结直肠癌风险相关。例如,与局限性结肠炎患者相比,全结肠炎患者患癌症的风险更高。
与健康受试者相比,炎症性肠病患者的肠道微生物群具有较低的多样性和生态失调,其特征是厚壁菌门和拟杆菌门的丰度较低。
产肠毒素脆弱拟杆菌与炎症性肠病的存在显著相关。炎症性肠病和结直肠癌都有一个共同的过程,即转化生长因子-β (TGF-β)、TNFα、NF-κB、ROS 和其他信号分子水平升高,导致肠道微生物失调。
已经证明伴有炎症性肠病的结直肠癌患者比没有炎症性肠病的患者预后更差。
扩展阅读:肠道菌群失调与炎症性肠病的关联
√肠道菌群失调导致结直肠癌风险增加
如果肠道微生物群保持在失调状态,有益共生体的多样性和丰度可以最小化。一旦受干扰的微生物过度生长,它们就会产生积累的外毒素和内毒素。
如大肠杆菌的细胞致死性膨胀毒素和大肠杆菌素,痢疾志贺菌的细胞致命性膨胀毒素,脆弱芽孢杆菌的脆弱芽孢杆菌毒素,粪肠球菌的细胞外超氧化物和过氧化氢等。
这些细菌毒素能够直接或间接诱导DNA损伤、基因组不稳定、肿瘤发生和腺癌的侵袭。
此外,微生态失调导致结肠上皮细胞暴露于致癌物质的增加。未修复的DNA和碱基切除修复(BER)中间体的积累导致基因组不稳定,并最终致癌。
注意:微生物生态失调会使免疫反应失调并增加炎症,导致PIK3CA基因突变,这可能会加速结直肠癌的发生或生长。
//梭杆菌粘附素A可作为生物标志物
梭杆菌粘附素A(FadA)是一种由梭杆菌表达的细胞表面毒力因子,经常在腺瘤性息肉或结直肠癌患者中检测到。
FadA与内皮上的E-钙粘蛋白相互作用,并调节E-钙粘素/β-连环蛋白通路,导致转录因子、癌基因和炎症基因的表达增加。
它还促进梭杆菌粘附并入侵表达E-钙粘蛋白的细胞,从而直接影响上皮细胞的增殖和生长。最近的一份报告表明,结直肠癌组织中梭杆菌的总体丰度是邻近正常组织的400多倍。因此,FadA可能是结直肠癌诊断和治疗的潜在生物标志物。
▼
虽然肝脏通常被认为是无菌的,但肝脏环境受到胃肠道微生物群通过肝门静脉系统产生的病原体或代谢物的极大影响。
肝细胞癌和胆管癌是最常见的肝癌组织学类型。酒精性肝病、非酒精性脂肪肝以及食源性污染物黄曲霉毒素B1、乙型或丙型肝炎病毒感染被认为是肝细胞癌的主要危险因素。
值得注意的是,肠道菌群失调是非酒精性脂肪性肝病的主要诱因之一。
√肠道微生物失调会导致肝癌发生
肝脏通过过滤血流以及代谢和中和肠道微生物产生的毒素对宿主微生物群落产生重要影响。肠道微生物失调会导致肝癌发生,因为微生物群和微生物代谢物可被肝脏常驻免疫细胞检测到,并能够改变肝脏代谢。
肝细胞癌患者粪便中大肠杆菌的丰度远高于健康对照者粪便中的大肠杆菌,而迪茨氏菌科(Dietziaceae),假单胞菌属(Pseudomonas)和草酸杆菌科(Oxalobacteraceae)在胆管癌患者的胆管样本中比非胆管癌个体的样本更丰富。
据推测,肠道微生物的过度生长可能会促进肝癌的发展,这需要进一步探索。
√幽门螺杆菌促进肝癌的生长和迁移
幽门螺杆菌通常栖息在人的胃中。然而,来自肠道的幽门螺杆菌可以通过门静脉的血流到达肝组织,在吞噬消除后幸存下来,或者通过十二指肠反向迁移。
已在肝细胞癌患者的肝组织中发现幽门螺杆菌产生的代谢物 。已经表明,来自幽门螺杆菌的脂多糖通过增加白细胞介素8和转化生长因子β1的水平直接促进肝癌的生长和迁移。
作为螺杆菌科的一员,幽门螺杆菌通过激活NF-κB 和Wnt信号通路、肝细胞更新和氧化应激导致肝细胞癌的发展。
此外,一些螺杆菌属物种,如胆螺杆菌(H.bilis)、H.ganmani和H.hepaticus,与胆管癌特异性相关,但与胆管中的非肿瘤疾病无关。
√肠道微生物代谢物影响肝癌
微生物代谢物会扰乱肝脏中的代谢途径和免疫反应。
Toll样受体4(TLR4)识别来自细菌的脂多糖(LPS),并通过脂多糖诱导的TNF-β和IL-6激活库普弗细胞。它还可以通过上皮调节蛋白等生长因子刺激星状细胞,并启动各种炎症和致癌途径。LPS-TLR4通路可促进肝细胞癌,而去除脂多糖或Toll样受体4 基因失活可降低肝细胞癌的发展。
库普弗细胞——是位于肝脏中的特殊巨噬细胞,是单核吞噬细胞系统的一部分。
胆酸和鹅脱氧胆酸是肝脏产生的主要初级胆汁酸。它们通过增加活性氧的产生而导致DNA损伤,从而诱发肝癌的发展。
此外,胆汁酸也被证实可以调节肠道微生物群。胆汁酸数量减少会导致肠道菌群过度生长并加速炎症。梭菌产生的脱氧胆酸的肠肝循环会导致DNA损伤并在肝星状细胞中引发衰老相关分泌表型。
这个过程涉及许多炎症细胞因子和生长因子,从而导致炎症和肥胖相关的肝细胞癌转变。脱氧胆酸和石胆酸被证明可通过DNA损伤直接促进癌症。
▼
胰腺是胃外消化器官。胰腺导管腺癌(PDAC)是全球最致命的癌症之一,是最常见的胰腺癌类型。越来越多的研究表明,肠道微生物群可能通过促进炎症、激活免疫反应和使癌症相关炎症持续存在来影响胰腺癌发生。
√幽门螺杆菌感染是胰腺导管癌的风险因素
对数百项胰腺癌荟萃分析的回顾表明,幽门螺杆菌感染是胰腺导管腺癌的一个重要危险因素。除胰腺导管腺癌外,幽门螺杆菌还参与急性和慢性胰腺炎以及自身免疫性胰腺炎。
许多源自幽门螺杆菌的致病成分,包括氨和脂多糖,以及由此产生的大量炎性细胞因子,都会损害胰腺。
幽门螺杆菌感染激活NF-κB和AP-1,导致细胞过程失调。白细胞介素8水平升高会加速炎症反应,最终导致胰腺癌发生。
此外,幽门螺杆菌感染持续激活STAT3可通过上调抗凋亡和促增殖蛋白(包括Bcl-xL蛋白、MCL-1、生存素、c-myc和细胞周期蛋白D1)的表达来促进胰腺癌进展。
√炎症及免疫反应与胰腺癌
微生物引起轻微和持续的免疫反应和炎症反应,会导致胰腺癌的形成。
已经进行了许多研究来探索可能的机制。在各种免疫细胞上表达的toll样受体使免疫细胞能够识别多种微生物相关分子模式 (MAMP) 和非感染性炎症损伤相关分子模式 (DAMP),然后激活NF-κB和MAPK信号通路。这些过程引发并延续胰腺炎,最终促进胰腺癌的进展。
NLRs是细胞质模式识别受体(PRRs),参与NF-κB的激活和炎症小体的形成。P38丝裂原活化蛋白激酶(P38 MAPKs)对细胞因子有反应,参与细胞分化、凋亡和自噬,从而加速胰腺导管腺癌的过程。因此,P38抑制剂可能是治疗癌症的药物。
味觉受体2型成员38(TAS2R38)是一种苦味受体。有趣的是,T2R38不仅在口腔细胞中表达,也在胰腺癌细胞中表达。铜绿假单胞菌(Pseudomonas aeruginosa)是T2R38的独特配体,据称可激活 T2R38,诱导多药耐药相关蛋白1(ABCB1),并参与癌症侵袭和转移。
此外,梭杆菌属存在于8.8%的胰腺癌组织中。值得注意的是,梭杆菌属的状态是胰腺癌的一个独立的阴性预后生物标志物。
扩展阅读:梭杆菌属Fusobacterium——共生菌、机会致病菌、致癌菌
√其他肠道微生物对癌症的作用




Tong Y,et al.Theranostics.2021
研究显示生活方式对胃肠道癌症风险的影响越来越大。吸烟、饮酒、饮食构成、肥胖等都是影响胃肠道癌症的重要因素。
肠道微生物群与人类密切相关,在人类健康和疾病中也发挥着重要而独特的作用。肠道微生物群还能够与化学治疗剂和免疫治疗剂发挥协同作用。
基于对肠道微生物群的研究,人们也在探索新的治疗靶点,以及使用人类肠道微生物群的诊断、预测和预后癌症生物标志物。加速肠道微生物组研究在精准医学中的转化。
生活行为及肠道微生物群与胃肠道癌症之间的准确关系需要进一步探索,将对我们的日常生活和临床治疗将产生重大影响。
主要参考文献:
Jardim SR, de Souza LMP, de Souza HSP. The Rise of Gastrointestinal Cancers as a Global Phenomenon: Unhealthy Behavior or Progress? Int J Environ Res Public Health. 2023 Feb 18;20(4):3640. doi: 10.3390/ijerph20043640
谷禾健康
播种肠道,喂养心灵
在新冠疫情的影响下,我们的生活方式和社交模式都发生了很大的改变。随着社交距离的要求和封锁措施的实施,我们不得不放弃了很多与朋友和家人的互动,这给我们的身心健康带来了很大的影响。
然而,随着疫情的好转和社交限制的逐渐放松,我们有了更多的机会去重新建立社交联系和友谊。
社会关系对于群居动物(例如我们人类和其他灵长类动物)的健康和福祉至关重要。越来越多的证据表明,肠道微生物组通过所谓的“肠-脑轴”,在我们的身心健康中发挥着关键作用,而且细菌可以通过接触等方式在社交中传播。
本文来了解一下,社会关系与肠道菌群之间的一些有趣的关联。

从动物到人类都有一个微生物组,或者更确切地说,有几个微生物组。消化系统、皮肤和身体的其他部位承载着微生物群落,也就是肠道微生物群、皮肤微生物群等。
在过去的10-15年中,随着DNA测序技术的不断进步,人们有了更清晰的视野来观察微生物组的多样性和复杂性。
一般关于微生物组与社会性之间联系的研究都集中在病原体和感染上。
任何场所,不管是曾经在医院就医,或生过孩子,还是与咳嗽和打喷嚏的人一起乘坐公共交通工具等,微生物都可以通过身体接触或共享环境将疾病从一个人传播到另一个人。
一些研究人员认为,对感染的恐惧可能是人类对陌生人根深蒂固的戒心的一种解释。
越来越多的迹象表明,社会伙伴之间的微生物共享也正在影响其他事情。例如,大黄蜂可能会被一种有害的剧毒寄生虫感染。2011 年,研究人员发现大黄蜂携带一种微生物,这种微生物通过蜂巢进行社会传播,保护蜜蜂免受这种寄生虫的侵害,这是有益社会传播的明显案例。
在一些啮齿动物研究中,特定细菌的存在与否可以决定小鼠是否表现出社交缺陷,避免与同伴互动。肠道细菌在吸引果蝇为其配偶方面发挥了作用。微生物可以影响身体产生催产素等荷尔蒙,后者在亲密关系中起着强大的作用。
扩展阅读:微生物和你的爱情生活有什么关系?
对于人类,我们知道合住一所房子的人也有共同的微生物群。2014年,芝加哥大学和阿贡国家实验室的微生物学家 Jack Gilbert 和他的同事对七个家庭及其住宅进行了六周多的研究,他们发现每个家庭中的微生物群很容易相互区分,每个人都可以被家人识别。研究期间搬家的三个家庭都带着他们的微生物特征。
在婴儿出生后的第一年,肠道中一半的微生物菌株与母亲共享。母亲的影响力随着时间的推移而减弱—— 大约从 3 岁时的 27% 下滑到 30 岁时的 14%,但并没有消失。
其他家庭成员也是肠道微生物的重要来源。4 岁以后,孩子与父亲和母亲共享的微生物菌株数量相似。
分开生活的时间越长,彼此远离的双胞胎共享的肠道微生物就越少。一起长大的双胞胎有大约30%的共享菌株,在分开生活30年后下降到大约10%.
共享甚至发生在几个农村生活组的家庭之间:与来自不同村庄的人相比,来自同一个村庄不同家庭的人往往在肠道微生物方面有更多的重叠。
住在一起的人,往往有相同的口腔微生物菌株,而且住在一起的时间越长,他们共享的越多。

人类有体味,许多动物都有气味标记腺体。几十年前,研究人员提出,产生气味的不是动物本身,而是微生物,微生物产生挥发性有机化合物,这些化合物通过空气传播,从而产生真正的气味。如果我们用气味来相互交流,微生物很可能是产生交流的中间人。
牛津大学实验心理学系教授 Robin Dunbar 博士说:我们不仅在社会世界中进化,也在微生物世界中进化。
社会关系对人类健康和死亡率产生持续影响,高度社会融合和良好的人际关系的影响,远远超过戒烟或保持正常体重等个人行为对死亡率的保护作用。
研究表明,身心健康以及长寿的主要预测指标是我们亲密关系的质量和数量。事实上,饮食、体重、酒精摄入和环境污染物(包括空气质量差)等其他生活方式方面对健康和幸福的影响,要比良好的社交和心情影响要小。

对微生物群数据整合研究已有 60 年历史的威斯康星纵向研究中,发现与家人和朋友的社交与人类粪便微生物群的差异有关。
对配偶 (N = 94) 和兄弟姐妹对 (N = 83) 的分析进一步表明,与兄弟姐妹相比,配偶拥有更相似的微生物群和更多共同的细菌类群。与独居者相比,已婚者拥有更多样化和更丰富的微生物群落。这些结果表明,人与人之间的互动,尤其是持续的亲密婚姻关系,会影响肠道菌群。
研究人员还发现,拥有更强大社交网络的人通常具有更多样化的肠道微生物组,而更孤立、微生物多样性更少的人面临更大压力和焦虑的风险更高。健康的肠道微生物组及其多样性甚至与新生儿时期更高水平的社交能力相关。
而且这种现象不仅限于人类。灵长类动物研究实际上表明,黑猩猩社会中,通过社会互动共享微生物(水平传播)比母婴微生物共享(垂直传播)导致更高的肠道微生物组多样性。

来自佛罗里达州立大学和其他机构的研究人员比较了疫情前和疫情后的数据,发现人类社会中个体的四个特征有所下降:外向性,开放性,宜人性和尽责性。但是第五个特征,神经质,在人群中,尤其年轻人中增加了。最近对 COVID 流行期间近 5000 人进行的一项横断面研究发现,神经质与焦虑和抑郁呈正相关。
研究人员评估了 672 名成年人(23 ~ 69 岁),发现当按上面提到的五大人格特质进行分层时,微生物组的多样性和组成显示出显著差异。
LEfSe分析人格特征肠道微生物丰度的两组差异
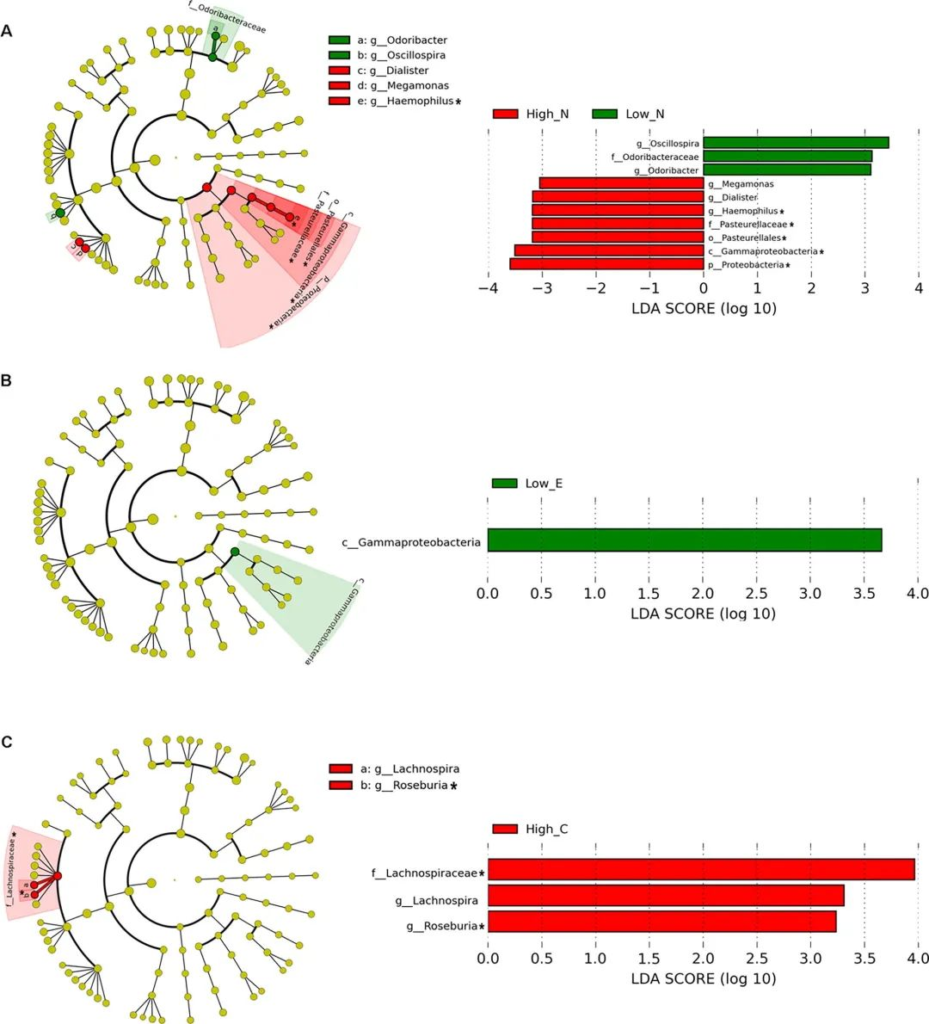
doi.org/10.1016/j.bbi.2017.12.012
对于神经质特征得分较高的个体,研究人员发现γ-变形杆菌(Gammaproteobacteria )的水平升高,其中包括多种属,包括潜在的病原体,如肠杆菌(Enterobacter)、埃希氏菌(Escherichia)、嗜血杆菌、克雷伯氏菌(Haemophilus)、假单胞菌(Pseudomonas)、志贺氏菌(Shigella)和弧菌(Vibrio)。这些菌群水平升高也见于责任心得分较低的个体,这与较低的动机和自律水平有关。
作者还在这些高度神经质-责任心较低的个体中发现了 HPA 轴激活和炎症标志物升高。
此外,值得注意的是,肠道屏障通透性增加允许细菌移位到肠腔外,以及循环中革兰氏阴性细菌脂多糖 (LPS) 毒素的存在可能在神经质的生理学中发挥作用。
人类微生物组杂志的一项研究描述了肠道微生物通过神经、免疫、内分泌和神经递质途径对人格特征的影响。该研究包括 655 名平均年龄为 42 岁的成年人(83% 为北美人)。
作者发现,焦虑和压力的增加以及睡眠质量的下降与微生物组组成的改变和多样性的降低显着相关,特定的细菌属与特定的行为特征相关。例如,特定的拟杆菌属菌株与抑制性神经递质 (GABA) 的产生有关,这种神经递质对于抵御压力和抑郁症很重要。

扩展阅读:
近日,来自爱尔兰科克大学的研究人员发现,社交焦虑症中的肠道微生物群发生变化。对 49 个粪便样本(31 个病例和 18 个性别和年龄匹配的对照)分析,通过 β 多样性衡量的总体微生物群组成,发现社交焦虑症组和对照组之间存在差异,并且在属和种水平上发现了一些分类学差异。
在属水平上发现,Anaeromassillibacillus和Gordonibacter在社交焦虑症组中升高,而Parasuterella在健康对照中富集。
在物种水平上,发现Anaeromassilibacillus sp An250在社交焦虑症患者中更丰富,而Parasutterella excrementihominis在对照组中含量更高。肠道代谢模块“天冬氨酸降解I”在社交焦虑症患者中升高。

邓巴数字表明,人类无法在认知上管理大于 150 人的有意义的社会群体。尽管这个数字本身一直存在争议,但很明显,个人的社交需求因人格类型和内在特征而异:
注释:邓巴数字——人类社交网络的节点不会超过150个,即和你保持友好关系的人在150人以内。这个著名的论断是由英国牛津大学人类学家罗宾·邓巴在20世纪90年代提出。
对于我们所有人来说,无论性别、年龄或现有社交网络规模,如果长期处于相对隔离状态,有时甚至是绝对隔离,对我们的社交都显著影响。尽管网络是一种帮助我们保持高效和虚拟连接的工具,但它并没有显著减轻与封锁相关的孤独感和抑郁感,尤其是对于那些可能很少接触和/或不太习惯使用网络的老年人。
尽管很少有关于 COVID 感染对大脑本身影响的纵向研究,但英国的一项此类调查评估了近 400 名在感染 SARS-CoV-2 之前和康复后接受过脑部扫描的人。研究人员发现,与匹配的对照组相比,COVID 感染者的全脑体积和灰质总量减少,默认网络(default network)发生显着变化,这表明社交技能和网络规模的丧失。
注释:默认网络(Default Mode Network)的概念被提出,并引起了很多神经科学家的关注。默认网络是由在脑处于静息状态时相互联系、维持健康代谢活动的若干脑区组成的网络,在个体从事如监控外界环境、记忆提取和控制自身心理状态等多种事务中发挥着重要作用。
默认模式网络会随着年龄的增长而发生变化,反映的是大脑神经细胞自发活动的组织模式,可能会与大脑的学习、记忆及认知等功能相关。(参考自百度百科)。
在急性感染 SARS-CoV-2 病毒后,许多人的健康状况发生了长期变化。事实上,据估计,全世界有超过6500 万人患有所谓的“长新冠”(Long COVID)。与长新冠相关的问题包括大脑特定问题,如心理健康状况、疲劳、睡眠问题和认知障碍。
与长新冠相关的各种各样的大脑相关问题以及数百万人遭受这些问题的困扰,促使研究人员和普通公众研究新冠病毒感染如何以及为什么会影响大脑。
一些可能导致大脑损伤的因素包括:病毒传播到大脑、与感染相关的炎症、代谢问题、微生物组变化和血管损伤。然而,同样重要的是要强调,许多人在疫情期间可能经历过与感染无关的类似大脑问题,这反映了在大规模封锁措施的背景下发生的压力、不健康饮食和生活方式的改变。
扩展阅读:
阳康后是否会二次感染,长新冠与肠道菌群的关联,多种潜在的相关干预措施
在 2023 年 3 月发表在《大脑、行为和免疫》杂志上的一项研究中,研究人员在动物模型中研究了 SARS-CoV-2 病毒,发现该病毒激活了大脑中的免疫细胞,加剧了大脑炎症。重要的是,我们现在知道大脑中的免疫细胞(称为小胶质细胞)可能在情绪、认知等方面发挥作用,而肠道菌群积极参与了这一过程。
肠道微生物影响大脑的方式有很多。例如,有些可能会分泌通过血液传播到大脑的信使分子。其他细菌可能会刺激从大脑底部延伸到腹部器官的迷走神经。细菌分子可能通过最近发现的位于肠道内壁的“神经足”细胞将信号传递给迷走神经,这些细胞感知其生化环境,包括微生物化合物。每个细胞都有一个长长的“脚”,向外延伸,与附近的神经细胞(包括迷走神经细胞)形成突触状连接。
扩展阅读:
间接影响也包括像炎症和免疫。越来越多的研究人员将炎症视为抑郁症和自闭症等疾病的关键因素。肠道细菌是免疫系统正常发育和维持的关键,研究表明,微生物的失调会破坏该过程,并促进炎症。
肠道微生物产物可能会影响肠内分泌细胞,这些细胞位于肠道内壁并释放激素和其他肽。其中一些细胞有助于调节消化和控制胰岛素的产生,但它们也会释放神经递质血清素,它会从肠道中逸出并传播到全身。
神经精神疾病的药物开发已经滞后了几十年,而且许多现有药物并不对所有患者都有效,甚至会引起不必要的副作用。越来越多的研究人员在基于微生物的治疗或“精神益生菌”中看到了一种有前途的替代方法。
事实上,临床研究表明,补充精神益生菌,不仅可以改善情绪和行为,还可以将大脑活动朝积极的方向转变,功能性磁共振成像证明了这一点。常见的精神益生菌例如:
• 干酪乳杆菌 W56(Lactobacillus casei W56)
• 乳酸乳球菌 W19(Lactococcus lactis W19)
• 嗜酸乳杆菌 W22(Lactobacillus acidophilus W22)
• 乳双歧杆菌 W52(Bifidobacterium lactis W52)
• 副干酪乳杆菌 W20(Lactobacillus paracasei W20)
• 植物乳杆菌 W62(Lactobacillus plantarum W62)
• 乳双歧杆菌 W51( Bifidobacterium lactis W51)
• 双歧双歧杆菌 W23(Bifidobacterium bifidum W23)
• 唾液乳杆菌 W24 (Lactobacillus salivarius W24)
精神益生菌的潜在作用模式
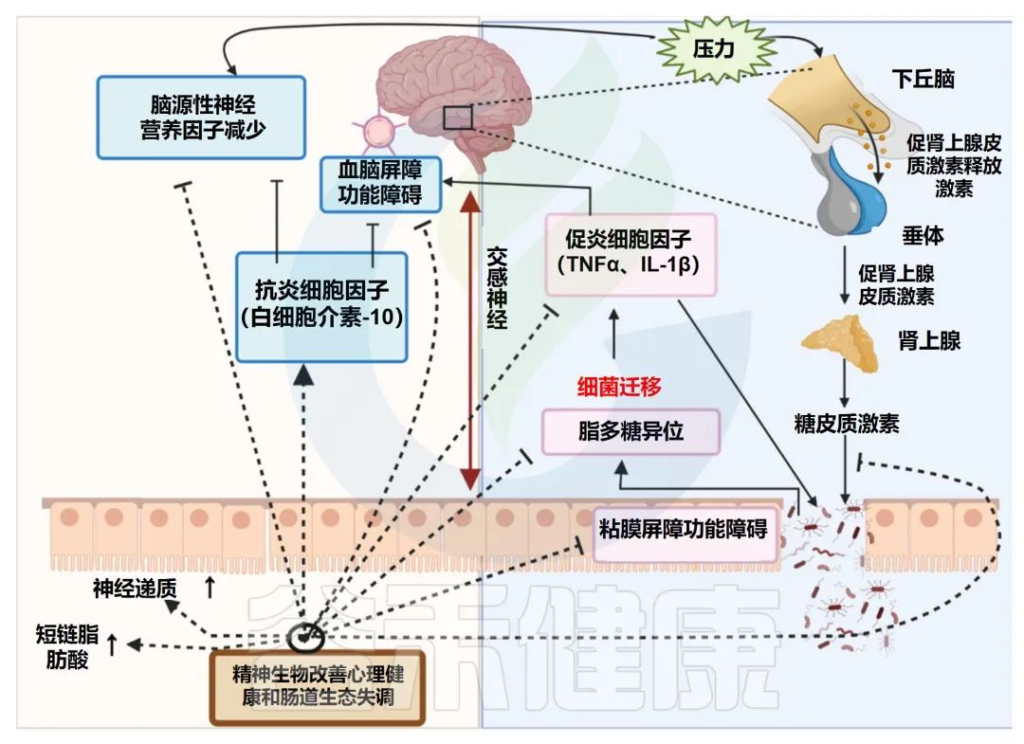
Singh S,et al.Microorganisms.2022
详见:环境污染物通过肠脑轴影响心理健康,精神益生菌或将发挥重要作用
当我们都在适应新常态时,逆转隔离对身体的影响与重新参与社交一样重要。一个重要的步骤是积极地重新调整平衡肠道微生物群,并重振肠脑轴。
健康的微生物有助于预防疾病。所以,平衡我们身体内部微生物种群与身体外部的消毒防护之间的关系很重要。继续坚持洗手,但要多吃纤维、发酵食品和益生菌,减少糖、重加工和红肉的过量摄入。
同时,加强锻炼、减少压力,野外能多走走就多走走。环境中的微生物也可以被摄入,并成为我们肠道菌群的一部分,在肠道内一些微生物种群可以帮助促进健康的肠道细胞。
扩展阅读:
“玩泥巴”也有利于健康?接触环境微生物群可能调节肠道菌群和免疫系统
结语
总的来说,肠道菌群与社会关系之间存在复杂的相互关联。
社会关系对肠道菌群的组成和多样性有着直接的影响。一个人的家庭环境、工作环境、与其他人的接触等因素都可能对肠道菌群产生影响。
此外,肠道菌群也可以反过来影响社会行为和认知能力。肠道菌群可以通过与中枢神经系统交流,来影响人体的认知和行为。肠道中特定种类的菌群可以影响情绪,从而表现出焦虑、抑郁等症状。
共享微生物带来的好处,可能会促使我们人与人之间彼此互动,同时我们也可以积极地去寻找和维护社交和友谊,以保持身心健康和肠道微生物群的健康。
主要参考文献
Holt-Lunstad, J., Smith, T. B., Baker, M., Harris, T. & Stephenson, D. Loneliness and social isolation as risk factors for mortality: a meta-analytic review. Perspect. Psychol. Sci. 10, 227–237 (2015)
Yang, Y. C. et al. Social relationships and physiological determinants of longevity across the human life span. Proc. Natl Acad. Sci. USA 113, 578–583 (2016)
Johnson KV. Gut microbiome composition and diversity are related to human personality traits. Hum Microb J. 2020 Mar;15:None.
Christian L.M. Gut microbiome composition is associated with temperament during early childhood. Brain Behav Immun. 2015;45:118–127.
Moeller A. Social behavior shapes the chimpanzee pan-microbiome. Sci Adv. 2016;2
Kim HN, Yun Y, Ryu S, Chang Y, Kwon MJ, Cho J, Shin H, Kim HL. Correlation between gut microbiota and personality in adults: A cross-sectional study. Brain Behav Immun. 2018 Mar;69:374-385.
Johnson KV. Gut microbiome composition and diversity are related to human personality traits. Hum Microb J. 2020 Mar;15:
Valles-Colomer M, Blanco-Míguez A, et al., The person-to-person transmission landscape of the gut and oral microbiomes. Nature. 2023 Feb;614(7946):125-135.
Barrett E., Ross R.P., O’Toole P.W., Fitzgerald G.F., Stanton C. γ-Aminobutyric acid production by culturable bacteria from the human intestine. J Appl Microbiol. 2012;113:411–417
Bruce-Keller A., Salbaum J.M., Berthoud H.-R. Harnessing gut microbes for mental health: getting from here to there. Biol Psychiatry. 2018;83:214–223
Lindenfors P, Wartel A, Lind J. ‘Dunbar’s number’ deconstructed. Biol Lett. 2021 May;17(5):20210158.
Dunbar, R. I. M. The anatomy of friendship. Trends Cogn. Sci. 22, 32–51 (2018)
Butler MI, Bastiaanssen TFS, Long-Smith C, Morkl S, Berding K, Ritz NL, Strain C, Patangia D, Patel S, Stanton C, O’Mahony SM, Cryan JF, Clarke G, Dinan TG. The gut microbiome in social anxiety disorder: evidence of altered composition and function. Transl Psychiatry. 2023 Mar 20;13(1):95.
Pollet, T. V., Roberts, S. G. & Dunbar, R. I. Extraverts have larger social network layers. J. Individ. Differ. 32, 161–169 (2011)
Roberts, S. G., Dunbar, R. I., Pollet, T. V. & Kuppens, T. Exploring variation in active network size: constraints and ego characteristics. Soc. Netw. 31, 138–146 (2009)
Savignac H.M., Kiely B., Dinan T.G., Cryan J.F. Bifidobacteria exert strain-specific effects on stress-related behavior and physiology in BALB/c mice. Neurogastroenterol Motil. 2014;26:1615–1627
Robb, C. E. et al. Associations of social isolation with anxiety and depression during the early COVID-19 pandemic: a survey of older adults in London, UK. Front. Psychiatry 11, 591120 (2020).
Douaud, G. et al. SARS-CoV-2 is associated with changes in brain structure in UK Biobank. Nature 604, 697–707 (2022)
Bzdok, D., Dunbar, R.I.M. Social isolation and the brain in the pandemic era. Nat Hum Behav 6, 1333–1343 (2022).
Bagga D, Reichert JL, Koschutnig K, Aigner CS, Holzer P, Koskinen K, Moissl-Eichinger C, Schöpf V. Probiotics drive gut microbiome triggering emotional brain signatures. Gut Microbes. 2018 Nov 2;9(6):486-496.

谷禾健康

越来越多的证据表明,肠道菌群定植紊乱和微生物多样性减少与全球非传染性疾病 (NCD) 的增加有关。影响儿童和青少年的非传染性疾病包括肥胖及其相关合并症、自身免疫性疾病、过敏性疾病和哮喘。饮食变化也与非传染性疾病的发病机制有关,并且由于饮食是肠道微生物群组成和功能的主要驱动因素之一,因此人们开始关注通过饮食干预,来促进健康的肠道微生物群,最终促进健康。
一些生物活性营养素,如长链多不饱和脂肪酸 (LC-PUFA)、铁、维生素、蛋白质或碳水化合物,已被确定在婴儿出生后的前 1000 天对婴儿生长、神经发育发挥重要作用,以及肠道菌群的建立和成熟。LC-PUFA 是中枢神经系统 (CNS) 的结构成分,对视网膜发育或海马可塑性至关重要。最近,乳脂球膜 (MFG) 的成分被添加到婴儿配方奶粉中,因为它们在婴儿发育中起着关键作用。
大量摄入蛋白质会导致婴儿期体重增加更快,但这与后来的肥胖有关。可消化的碳水化合物提供葡萄糖,这对中枢神经系统的充分运作至关重要;不易消化的碳水化合物 [例如人乳低聚糖 (HMO)] 是肠道细菌的主要碳源。婴儿期缺铁性贫血与精神和精神运动发育的改变有关。与维生素 B6 和 B12 密切相关的叶酸代谢控制表观遗传变化。
从历史上看,重点一直放在早期营养对生长模式和儿童体脂成分的影响上。证据表明,生命早期摄入过多的能量和快速或缓慢的生长模式与不良的发育结果有关;事实上,婴儿期体重快速增加是晚年肥胖的重要预测指标。
肠道菌群与营养失调与多种儿科疾病有关,营养素的摄入和肠道微生物群的定植和成熟是相互关联的,因此通过饮食干预来促进健康的肠道微生物群是一种有前途的方法,可以改善儿童健康结果。

本文讨论和总结评估营养和肠道微生物群对儿童健康结果影响的临床研究的最新发现,并分享使用营养方法有利地改变肠道微生物群以改善儿童健康结果的研究成果。
脂肪酸是许多脂质的主要成分,必须通过婴儿饮食提供必需的脂肪酸,以实现健康成长、神经发育、免疫系统和胃肠功能。
婴儿的脂肪摄入量占比
在生命的头几个月,多不饱和脂肪酸 (PUFAs) 的需求增加,因为快速生长和神经发育。婴儿的脂肪摄入量在母乳喂养期间很高,从开始添加辅食后的第一年下半年逐渐减少。脂肪营养需求量占每日总能量摄入:
细分各类脂肪酸的摄入量
最近,不同的国家确定亚油酸的摄入量应占总能量的 4%,而 α 亚麻酸应占总能量的 0.5%。
长链多不饱和脂肪酸 (LC-PUFAs)、n-3 二十二碳六烯酸 (DHA, 22 : 6n-3) 和花生四烯酸 (ARA, 20 : 4n-6) 是中枢神经系统细胞膜的功能成分,在神经传递具有关键作用。
欧洲食品安全局 (EFSA) 委员会已确定:
0 ~ 24 个月的 DHA 摄入量为 100 毫克/天;
0 ~不到6个月的 ARA 摄入量为 140 毫克/天;
ARA 和 DHA 由母乳提供
婴儿的 DHA 状态是通过母乳提供的,它取决于母亲的 DHA 状态;尽管如此,母乳中的 ARA 浓度始终接近总脂肪酸的 0.5%,通常高于 DHA,与 DHA 相比更稳定。
与大脑发育相关的脂肪酸
大量的 n-3 和 n-6 LC-PUFA 在器官和组织的膜中迅速积累。在胎儿生命的最后三个月和生命的头两年,DHA 在脑组织中积累,特别是在与注意力、运动控制和感觉统合相关的灰质区域,而 ARA 负责海马可塑性。
已经表明,ARA 的延伸产物肾上腺酸 (ADA,22:4n-6) 是细胞膜中的重要成分。ADA构成了大脑中近一半的n-6 LC-PUFA,n-6 LC-PUFA的含量远远超过n-3 LC-PUFA。
均衡摄入DHA和ARA对大脑功能和发育至关重要
事实上,生命早期较高的 DHA/ARA 比率与更好的认知结果相关。已经表明,神经发育结果有利于 DHA 与 ARA 的比例为 1:1 或 1:2,而与1:1和1:2的比例相比,1.5∶1的比例会降低大脑发育过程中红细胞中ARA的浓度。
在脂肪酸摄入量和线性生长之间建立关系的研究得出了不同的结论。其中一些人认为必需脂肪酸对于婴儿期的最佳线性生长很重要,也有研究人员没有发现任何关联。
乳脂球膜蛋白的健康益处
另一方面,脂肪的研究工作表明,乳脂球膜 (MFGM) 蛋白代表母乳的生物活性部分,可提供一些健康益处。这种膜组分由不同的生物活性成分(磷脂酰胆碱、鞘磷脂、胆固醇和脑苷脂、神经节苷脂等)组成,它们对大脑发育和免疫功能有积极影响并保护新生儿胃肠道调节肠道菌群组成。
饮食中脂肪酸的分布与肠道菌群的关联
我们通常认为饮食中脂肪过多会造成肥胖,实际上,饮食中脂肪酸的分布也可能改变肠道微生物群的组成和肥胖状况。最近,表明人乳中的 sn-2 脂肪酸与婴儿肠道微生物群之间存在显着关联;ARA 和 DHA 与拟杆菌属(Bacteroides)、肠杆菌科(Enterobacteriaceae)、韦荣球菌属(Veillonella)、链球菌属(Streptococcus)和梭菌属(Clostridium)有关,参与短链脂肪酸(乙酸盐、丙酸盐和丁酸盐)生产的细菌,具有重要的免疫调节功能,在抵抗肠道病变的发展等方面发挥着关键作用,并且在母乳喂养后 13-15 天显着增加。
扩展阅读:脂肪毒性的新兴调节剂——肠道微生物组
蛋白质在生命的前 1000 天非常重要,因为它们在细胞结构中发挥着重要作用,并且是酶和神经递质的组成部分。
蛋白质推荐量
在出生后的头 6 个月内,每公斤体重/天的蛋白质推荐量为:
0 至 6 个月大时为 0.58 克;
6 至 36 个月大时为 0.66 克。
母乳中蛋白质种类多,有多种功能
母乳含有 400 多种蛋白质,多种功能如抗菌、免疫调节活性或刺激营养吸收等。蛋白质缺乏会导致生长发育不良以及运动和认知发育迟缓;然而,高蛋白质摄入会导致婴儿期体重增加更快,并与以后的肥胖相关。
使用婴儿配方奶粉喂养的婴儿在生命的前四个月内表现出正常的婴儿生长模式,婴儿的总蛋白质减少 1.0 g/dl(类似于母乳)。
辅食中蛋白质影响婴儿生长及肠道菌群组成
补充食品中的蛋白质来源和摄入量会显着影响婴儿生长并可能影响超重风险;以肉类和奶制品为基础的辅食会导致不同的生长模式,尤其是身高。
同时,补充喂养期间相关类型的富含蛋白质的食物,对配方奶喂养婴儿的肠道微生物组成和代谢物有影响;吃肉的儿童肠道群落富含厚壁菌门和粪杆菌属,同时变形杆菌门和双歧杆菌属减少。
扩展阅读:肠道菌群与蛋白质代谢
碳水化合物需求量
每日总能量摄入中的总碳水化合物需求量占比如下:
0 ~ 6 个月为 40-45%
6 至 12 个月以下为 45-55%
12 至 36 个月以下为 45-60%(接近成年人)
葡萄糖
葡萄糖对于中枢神经系统的充分运作起着关键作用,因为它是生长、神经冲动和突触的主要能量来源。葡萄糖由不同的碳水化合物提供给婴儿,例如乳糖,作为母乳中的主要糖分(范围为 6.7 至 7.8 g/dl),以及多种低聚糖,其含量约为 1 g/dl。
母乳低聚糖
母乳低聚糖 (HMO) 构成了婴儿无法消化的母乳碳水化合物的重要部分。母乳低聚糖具有益生元功能,可喂养胃肠道微生物群,并促进有益菌的生长;此外,它们还与多种生物学功能有关,例如对胃肠道发育和全身免疫的影响、双歧杆菌生成活性和抗感染、炎症调节、肠神经元激活和肠道运动,以及中枢神经系统功能的增强。
母乳低聚糖包括酸性低聚糖,主要是唾液酸化 [例如 6′-唾液酸乳糖 (6′-SL)、3′-唾液酸乳糖 (3′-SL)] 或中性低聚糖 [例如 2′-岩藻糖基乳糖 (2′-FL)]。
岩藻糖基聚糖是母乳中最丰富的母乳低聚糖形式 (80–90%) 。
聚糖
聚糖(glycans)是微生物的碳源,对宿主细胞和微生物之间的识别、信号传导和表观遗传调控至关重要,与广泛的免疫和代谢紊乱有关。双歧杆菌属和乳杆菌属与的生长之间存在显着相关性。在哺乳早期和晚期的婴儿肠道中。
几个临床前模型已经证明母乳低聚糖对认知功能的影响,但人类的临床数据尚未公布。
关于糖没有特定推荐量,2岁以下避免添加糖
关于糖,没有针对婴儿期糖的特定的每日参考摄入量。ESPGHAN 营养委员会建议,避免在 2 岁以下儿童的饮食中添加糖分。还建议避免饮用果汁或含糖饮料,因为过早摄入这些饮料会增加日后患 1 型糖尿病的风险。
为什么婴儿在 6 个月左右时需要添加辅食?与铁等营养素的需求有关
在婴儿出生前,胎儿会从母体中吸收铁元素,积累在肝脏中,以备出生后使用。然而,母乳中的铁含量相对较低,因此在婴儿 6 个月左右时,需要从饮食中摄取外源性铁以满足营养需求。
铁的需求量
0 ~ 6 个月为 0.3 毫克/天;
6 ~ 12 个月以下为 6-11 毫克/天;
12 ~ 36 个月以下的需求量为 3.9-9 毫克/天。
缺铁有哪些影响?
缺铁会影响大脑、神经和精神运动发育,因为铁是神经递质所需酶的组成部分。缺铁会导致携氧能力降低,从而导致生长发育所需的葡萄糖转化受限;这些限制可能导致生长迟缓、体重减轻和年龄增长,但与神经发育不同的是,它们可以通过补铁治疗来克服。
缺铁影响肠道菌群组成
母乳是短双歧杆菌的主要来源,它可以在二价金属通透酶和乳铁蛋白的帮助下获得管腔铁,促进这些有益细菌的生长,并从细菌病原体中隔离铁。缺铁导致肠道微生物群落失调,这反映在肠杆菌科(Enterobacteriaceae)和韦荣球菌科(Veillonellaceae)的相对丰度增加,以及与健康对照相比,红蝽菌科(Coriobacteriaceae)肠杆菌科和双歧杆菌科/肠杆菌科的丰度降低。
Coriobacteriaceae被确定为一个潜在的生物标志物,将运动与健康改善联系起来。
扩展阅读:人与菌对铁的竞争吸收 | 塑造并控制肠道潜在病原菌的生长
纯母乳喂养的婴儿摄入的维生素 D 低于最低推荐摄入量,远低于每日参考摄入量。
维生素D推荐摄入量
为避免因维生素D而可能出现的病症,例如骨矿化不足或软骨病,母亲每天补充 400 至 2000 IU 可以增加母乳中的维生素 D 水平;建议纯母乳喂养的婴儿接受阳光照射和补充维生素 D。
0 至 36 个月以下的婴儿维生素 D 营养需求为:
10 微克/天。
缺乏维生素D会引起什么?
维生素D诱导神经生长因子,促进神经突生长,抑制海马神经元凋亡。关键神经发育时期的缺陷会导致生命后期的行为、记忆和学习障碍。
低水平的维生素 D 会导致肠道通透性增加,产生慢性低度炎症状态。
维生素 D 与肠道菌群之间存在关联,在 3-6 个月大的不同种族婴儿的肠道微生物群组成中观察到一些差异,这些婴儿的母亲在怀孕期间补充了维生素 D 以预防其后代的哮喘和过敏症。
扩展阅读:维生素D与肠道菌群的互作
维生素 B12 的需求量
0 ~ 6 个月为 0.4 微克/天,
6 ~ 不到 12 个月为 0.5 至 0.8 微克/天,
12 ~ 36 个月以下为 0.6 至 1 微克/天。
叶酸的需求量
EFSA 推荐:
0 ~ 6 个月的叶酸营养需求为 65 微克/天,
6 ~ 12 个月婴儿的叶酸摄入量为 80 微克/天,
12 ~ 36 个月以下的需求量为100微克/天;
1-17 岁儿童的叶酸 (FA) 摄入量上限已确定为 200 – 800 微克/天。
叶酸和维生素B12的作用
叶酸和维生素 B12(钴胺素)作为参与广泛生物过程的辅助底物和辅助因子发挥着重要作用,例如核酸合成、糖酵解、糖异生和氨基酸代谢。
此外,叶酸和维生素 B12 以及单碳代谢循环所需的其他微量营养素辅助因子的状况可能会影响 DNA 甲基化,从而对健康产生长期影响。
叶酸——必须,但不要过量
众所周知,怀孕期间缺乏叶酸会导致后代出现神经管缺陷的风险更高。然而,高剂量的叶酸与更好的状态无关,与母亲或后代无关;事实上,怀孕期间摄入量高于 400 微克/天并没有明显的好处。母乳喂养期间补充叶酸可导致母乳总叶酸适度增加。
在儿童中,叶酸缺乏与认知发育受损以及腹泻和呼吸系统疾病增加相关;然而,补充叶酸对于减少这些病症并没有明显帮助。
过量摄入叶酸可能会产生潜在的不利影响,包括几种疾病(例如癌症、神经系统疾病、生长综合征、呼吸系统疾病和多发性硬化症)的发病率增加。
目前,由于食用补充剂或强化食品,很多欧洲儿童摄入大量叶酸;目前尚不清楚这些摄入量是否会造成伤害,尤其是在早期发育过程中,而许多组织中正在发生大量表观遗传变化。
缺乏维生素B12有什么影响?
当母亲的维生素B12状况不佳时,母乳中的含量会降低,会影响后代维生素B12的状态。维生素 B12 对中枢神经系统的代谢和维持至关重要,与叶酸一起在同型半胱氨酸代谢和髓磷脂的保护中起着关键作用。因此,维生素 B12 缺乏会导致覆盖颅神经、脊神经和周围神经的髓鞘受损,从而导致神经精神疾病的发展。
B族维生素缺乏影响肠道菌群
通过基因组重建和预测,针对几种B族维生素,预测整个微生物群落的代谢表型,发现微生物群落中有相当一部分是辅助营养物种(它们无法自己合成某些生命所需的化学物质,需要从外部环境中获取这些物质才能生存),它们的生存完全依赖于从饮食和/或原养型微生物中获取一种或多种B族维生素,通过特定的拯救途径(一种代谢途径,通过这种途径,微生物可以从外部环境或其他微生物的代谢产物中回收利用某些生命所需的化学物质,以满足自身生存所需)来实现。
膳食摄入影响:
母体甲基供体的摄入(胆碱、甜菜碱、叶酸、蛋氨酸)会改变其后代的DNA甲基化。观察到这种摄入量,特别是在围孕期,会影响婴儿口腔中与代谢、生长、食欲调节和维持 DNA 甲基化反应相关的基因的 DNA 甲基化。
细菌合成影响:
除了膳食摄入外,细菌叶酸生物合成也备受关注。细菌叶酸生物合成可以提供额外的叶酸来源,对健康结果和/或 DNA 甲基化具有重要意义。
在体外结肠模型中,研究发现补充甲钴胺和乳清可以提高厚壁菌门和拟杆菌属的比例,同时减少变形杆菌属的数量,其中包括一些病原体,如大肠杆菌(Escherichia)和志贺氏菌属(Shigella)等,以及假单胞菌属(Pseudomonas)。此外,研究还发现甲钴胺可以促进肠道细菌对脂质、萜类化合物和聚酮化合物的代谢,诱导外源性物质的降解,抑制转录因子和次级代谢产物(如维生素 B12)的合成。
扩展阅读:如何解读肠道菌群检测报告中的维生素指标?
新生儿肠道菌群的建立及发育
新生儿的肠道菌群既直接来自母亲,也来自分娩后的环境。微生物组在生命的头几个月经历动态演替和成熟,这一过程伴随着身体指标以及器官和神经认知发育的快速变化。
新研究结果强调母乳喂养和婴儿饮食会影响肠道微生物组成和功能。一项使用宏基因组鸟枪法测序的综合研究表明,停止母乳喂养(而不是引入固体食物),可以推动婴儿肠道微生物组的功能成熟,使其接近成人状态。
新生儿肠道菌群的影响因素
新生儿微生物组和免疫系统的不成熟似乎与肠道感染的易感性增加有关,特别是在 LMIC(中低收入国家) 环境中。虽然新生儿获得微生物群的时间各不相同,但多次接触,包括分娩方式、母婴饮食、药物、获得安全水和卫生设施以及多种宿主因素,是微生物群组成的主要决定因素。
母乳对婴儿的发育和成熟起着重要作用,微生物组在断奶时进入过渡阶段,此时微生物组会发生其他变化。
儿童营养不良和生长障碍是由膳食摄入不足和炎症之间复杂的相互作用驱动的,炎症通常是持续和/或反复感染和慢性疾病(包括镰状细胞病、艾滋病毒、先天性心脏病、心理障碍和内分泌或代谢疾病)的结果。
肠病是营养不良的一个重要驱动因素
肠病可能是肠病原体相关性腹泻病的结果,这在 LMIC 环境中的儿童中很常见,并且与死亡率、生长迟缓和认知发育不良的风险较高有关。
而这些环境中的许多儿童在存在或不存在已知肠病原体的情况下患有无症状肠病。这种肠病与非特异性持续粪口污染、反复肠道感染和小肠细菌过度生长 (SIBO) 有关。这种肠病与其他慢性肠道炎症有一些相似之处,包括克罗恩病和溃疡性结肠炎。它与发育迟缓密切相关,可能通过营养吸收不良和食欲抑制间接影响生长,并通过生长激素-胰岛素样生长因子 1 (IGF-1) 轴直接影响生长。
肠道通透性增加也会对发育产生负面影响
肠屏障功能障碍和肠道通透性增加可能导致微生物和/或微生物产物易位,从而激活先天免疫反应并促进全身炎症,从而对生长产生负面影响。
扩展阅读:什么是肠漏综合征,它如何影响健康?
肠道微生物群会影响多种宿主功能,包括代谢调节和信号传导,通过获取膳食营养素和微生物群衍生的代谢物、免疫耐受和对病原体的抵抗力、昼夜节律以及与儿童健康成长相关的其他途径。
肠道菌群失调可能影响儿童生长发育
由于疾病、环境或药物暴露或其他损害而破坏微生物组的正常多样性和组成,可能导致生态失调,这是一种以致病菌大量繁殖、共生体丧失和多样性丧失为特征的状态。在一些人群中,生态失调与肥胖、2 型糖尿病、肝脂肪变性和肠道疾病有关。在儿童和部分人群中,生态失调与生长和神经认知发育不良以及反复感染、免疫力改变和炎症增加有关。
与营养良好的儿童相比,营养不良的儿童拥有“不太成熟”的肠道菌群,其多样性较低。生态失调导致营养提取效率低下、吸收不良、易患肠杆菌科等侵袭性疾病和肠道炎症,从而影响生长。
肠道微生物群与发育迟缓之间存在密切关联,表明存在因果机制
谷禾健康与长沙妇幼儿童保健中心实验室合作发表的临床研究,揭示了肠道微生物群对患有严重急性营养不良 (SAM) 等严重儿科病理状况的儿童的重要性;临床诊断为生长发育迟缓 (FTT) 的受试者和正常生长正常的早产受试者 (NFTT-pre) 在不同年龄段表现出明显的肠道菌群发育轨迹中断,并且其α多样性的发展以及观察到的 OTU 和 Shannon 指数不足,尤其是在具有 FTT 的受试者中。
此外,与正常相比,FTT组中细菌如拟杆菌、双歧杆菌、链球菌和大多数年龄歧视性细菌分类群的顺序定殖和富集及其微生物功能紊乱。我们的研究结果表明,发育迟缓的婴儿肠道菌群发育不全,具有潜在的临床和实践意义。

肠道菌群失调还与共生微生物的易位和系统传播以及对病原体的易感性有关。此外,共生细菌抵抗肠道炎症的功能能力降低,如产生短链脂肪酸和色氨酸分解代谢配体(驱动芳烃受体激活),可导致肠道炎症。
恢复肠道菌群稳态,可促进儿童生长发育
共生菌还维持先天性淋巴样细胞,这是白细胞介素IL-22 的主要来源,IL-22 可刺激抗菌肽,帮助防止病原菌的微生物移位和入侵。恢复稳态微生物组和相关代谢物,有可能逆转与生态失调相关的表型,并促进儿童的生长发育。
确定肠道微生物群落结构和功能的变化(包括确定它们与疾病的因果关系)以制定有效的干预措施,对恢复肠道微生物群落结构并改善健康生长发育至关重要。
确定可以在怀孕、婴儿期和儿童期实施的干预措施,以预防或改善这些导致生长发育不良的驱动因素,对于改善短期和长期健康与发育至关重要。
扩展阅读:
怀孕期间母体肠道菌群的组成和功能似乎与出生结局密切相关,包括体重和胎龄。在健康的非妊娠成人中,肠道微生物群由相对稳定的种群组成,主要由拟杆菌门、厚壁菌门、放线菌门、变形菌门和疣微菌门组成。微生物组的组成和多样性在怀孕期间发生了变化。例如,在怀孕期间,肠道微生物群 α 多样性和产丁酸菌减少,而双歧杆菌、变形菌和产乳酸菌增加。
最近对来自刚果、印度、巴基斯坦和危地马拉的孕妇进行的一项纵向研究表明,怀孕期间肠道微生物群的个体属和 α 多样性(丰富度)有所减少。
妊娠期肠道菌群与新生儿生长关联
最近进行了一项研究,以了解津巴布韦农村地区妊娠期肠道微生物群分类群与代谢功能对胎龄、出生体重和新生儿生长的关联。
结果证明,抗性淀粉降解细菌,主要是瘤胃球菌科、毛螺菌科和真细菌科,是主要的肠道类群,并且是出生体重、新生儿生长和胎龄的重要预测因子。
此外,这项研究表明,与淀粉和能量代谢、信号和维生素 B 代谢相关的细菌功能,与出生体重增加有关。这些结果表明,非洲农村地区母亲食用富含淀粉的饮食的饮食模式,可能会推动选择影响婴儿健康和成长的物种。
扩展阅读:肠道核心菌属——毛螺菌属(Lachnospira)
肠道菌群变化分别与妊娠糖尿病和高脂血症有关
谷禾健康与江南大学食品科学与技术国家重点实验室合作的临床研究成果表明妊娠糖尿病 (GDM) 通常与高脂血症合并症有关。改变的人类肠道微生物群分别与妊娠糖尿病和高脂血症有关,但与合并症无关。发现链球菌(Streptococcus)、粪杆菌(Faecalibacterium)、韦荣球菌(Veillonella)、普雷沃氏菌(Prevotella)、嗜血杆菌(Haemophilus)和放线菌( Actinomyces )在糖尿病加高脂血症人群中显着更高。此外,几种细菌与患有妊娠糖尿病和高脂血症的参与者的空腹血糖和血脂水平相关。
扩展阅读:肠道重要基石菌属——普雷沃氏菌属 Prevotella
母体微生物群的干预:益生菌
针对母体微生物群的干预措施有可能显着影响婴儿健康,因为孕期生态失调和母体暴露会影响微生物群的建立、免疫发育和代谢健康。正在评估妊娠期膳食补充益生菌(对宿主健康有益的活微生物),以预防妊娠相关并发症和不良出生结果,包括早产和极低出生体重。
一些数据表明,益生菌对孕妇或哺乳期妇女在治疗妊娠糖尿病 (GDM)、B族链球菌定植和乳腺炎方面具有有益作用。
鉴于已知的安全性,益生菌作为妊娠干预措施特别有吸引力。然而,迄今为止的研究还没有定论。在新西兰、芬兰、丹麦、瑞典、澳大利亚、伊朗和我国的女性中,补充各种益生菌和混合物(包括乳酸杆菌、链球菌和双歧杆菌菌株)对出生人体测量没有影响。但有一些数据表明益生菌单独或联合使用可能与低收入国家早产儿死亡率、坏死性小肠结肠炎和/或新生儿败血症的降低有关。
新生儿和婴儿是考虑针对微生物组进行干预的关键人群,因为婴儿微生物组在出生后经历快速进化。此外,婴儿期是生长和神经认知发育的关键时期,也是发病率和死亡率最高的时期。
婴儿肠道菌群的定植
来自拟杆菌门和放线菌门的专性厌氧菌会迅速定植婴儿肠道,主要是双歧杆菌属、拟杆菌属和梭菌属,在生命的前 6 个月内,其特点是多样性低。
母体肠道微生物群似乎对婴儿肠道的定植有显着贡献,而阴道和皮肤来源的细菌似乎更短暂,并且不会在新生儿期后持续存在于婴儿肠道中。
婴儿肠道菌群->免疫系统->宿主
婴儿肠道微生物群为免疫系统的发育提供信息,而免疫系统又协调维持宿主-微生物共生的关键特征。因此,肠道微生物组成和代谢的异常可能会破坏正在发育的免疫系统。
母乳喂养->断奶,肠道菌群变化
婴儿期的母乳喂养还通过母乳中微生物种类的直接转移和其他主要成分的调节影响婴儿生长和塑造肠道微生物群,例如人乳低聚糖(HMO – 人类酶无法消化的复合糖),分泌IgA 和抗菌因子。
断奶,即逐渐将固体食物引入婴儿饮食,是婴儿发育的一个重要里程碑。断奶也是肠道菌群快速扩张的时期,包括双歧杆菌、乳杆菌、韦荣球菌(Veillonella)、柯林氏菌(Collinsella)、普雷沃氏菌、粪杆菌属和大肠杆菌属以及参与复杂多糖代谢的其他物种的多样化和扩张。
断奶期微生物群受干扰,可能导致肠道感染的易感性
断奶时微生物群的扩大还与强烈免疫反应的诱导有关,一种“断奶反应”,其特征是与生命后期的免疫成熟和耐受性相关的调节性 T 细胞的扩增。
在小鼠中,断奶期间限制微生物组的成熟会导致免疫发育受损并增加对肠道感染的易感性。此外,在母乳喂养率高且在长时间断奶期间也接受补充饮食的孟加拉国社区队列中,发现了一个独特的“过渡”长双歧杆菌进化枝,它携带利用母乳和食物底物的酶。这种过渡性长双歧杆菌在断奶期间引入固体食物后会扩大,并且在孟加拉国以外的婴儿队列中也得到证实,尽管患病率要低得多。 这些发现表明,底物和混合喂养的持续时间也会影响肠道微生物组的结构和功能。
断奶期过后,肠道菌群高度依赖于饮食习惯
农村地区的儿童表现出拟杆菌门的显着富集和厚壁菌门的枯竭,普雷沃氏菌属的细菌数量独特丰富,显示出利用富含多糖的营养素的能力。
然而,在工业化国家,这些普氏菌肠型不太常见,断奶后微生物组的特征是拟杆菌和瘤胃球菌肠型的存在。
在试图了解微生物群落是如何共同配置的,包括描述组成成员之间的相互作用以及这些群落随着年龄的增长而成熟时,需要较大的样本人群队列,这也是谷禾一直推进的事情。
微生物群是否有一个稳定的架构?
综合众多的研究结果确定了一个由几十个细菌分类群组成的核心“生态群”,这些分类群在孟加拉国、印度和秘鲁的出生队列的健康成员中,在 20 个月及以后表现出一致的协变。研究得出结论,生态群网络是微生物群组织的一个保守的一般特征,建议这样的生态群可以提供一个框架来描述营养不良儿童的生态失调。
我们建议这样的生态群可以用作定量指标,用于定义旨在重新配置肠道微生物群落的靶向干预措施的功效。
婴儿绞痛、反流和便秘常常引起父母的痛苦也是儿科就诊的主要原因。如前所述,母乳喂养婴儿的微生物群通常被认为富含双歧杆菌和乳杆菌等“有益”细菌,以及梭菌等产气细菌的生长减少。
益生菌:罗伊氏乳杆菌DSM 17938减少哭闹
在随机对照试验中,与安慰剂相比,使用罗伊氏乳杆菌(L. reuteri)DSM 17938 治疗绞痛婴儿可显着减少哭闹时间、反流和功能性便秘。
相比之下,报道了与L. reuteri DSM 17938 相比,安慰剂组在治疗 1 个月时的烦躁时间短暂减少和睡眠持续时间更长。这种烦躁增加仅发生在配方奶喂养的婴儿中,而不发生在母乳喂养的婴儿中。
另一项最近的研究评估了L. reuteri DSM 17938 在 1 个月和 3 个月大时通过显着减少哭闹时间来预防绞痛。一般来说,罗伊氏乳杆菌DSM 17938 似乎可以减少患有绞痛的母乳喂养婴儿的哭闹时间,但是,这种益生菌在绞痛配方奶喂养婴儿中的作用需要进一步研究。
同样对于绞痛的预防,使用L. reuteri DSM 17938 似乎是有效的,但这需要在其他研究环境中得到证实。
扩展阅读:认识罗伊氏乳杆菌(Lactobacillus reuteri)
为了促进“有益”细菌的生长,婴儿配方奶粉中添加了特定的益生元,并在临床试验中进行了评估。
益生元:低聚半乳糖降低绞痛和反流的风险
在最近的一项双盲随机对照试验中,摄入补充低聚半乳糖的配方奶显示出与母乳喂养参照组相似的双歧杆菌和乳杆菌发育趋势,并且与接受不含低聚半乳糖的配方奶粉的婴儿相比,降低了绞痛和反流的风险。
合生元:减少哭闹、减轻疾病发作
人们对合生元提供“有益”细菌及其底物的兴趣也越来越大。
与随机分配到安慰剂配方奶粉的对照组相比,给婴儿喂食七种益生菌菌株和低聚果糖的混合物后,婴儿在第 7 天和第 30 天的哭闹时间减少了 50% 以上。
在另一项前瞻性双盲随机对照试验中,评估了含有嗜热链球菌(Streptococcus thermophilus)、保加利亚乳杆菌(L. bulgaricus)和动物双歧杆菌( B. animalis ssp. lactis)的合生酸奶饮料的效果。
与安慰剂相比,乳糖和菊糖对疾病发作(腹泻、上呼吸道感染和发热性疾病)的影响减少了发烧天数。 干预组大便稀便的频率更高,需要照顾孩子的次数也更多,但差异无统计学意义。
注意:
作者强调益生菌的干预并不是适合所有有症状的婴儿,婴儿的肠道菌群变化较快,益生菌及其组合的干预需要充分评估肠道菌群及其功能,了解其肠道菌群网络结构下,选择对应症状的干预方式才能确保安全和发挥干预的效果。
总的来说,在得出任何确定的结论之前,需要更多的研究来评估益生元和合生元在这些在不同类型儿童及其整体肠道微生态条件下的作用。
扩展阅读:
肠道微生物群与健康:探究发酵食品、饮食方式、益生菌和后生元的影响
人们还关注肠道菌群失调在过敏表型发生发展中的作用。
肠道菌群 & 过敏性疾病
肠杆菌科/拟杆菌比率↑ — 食物致敏的风险↑
据报道,在基于人群的加拿大健康婴儿纵向发育 (CHILD) 出生队列研究中,婴儿粪便中低肠道微生物群丰富度和升高的肠杆菌科/拟杆菌比率与随后食物致敏的风险增加有关。
瘤胃球菌科↓
–食物敏感 –特应性湿疹 –炎症性先天免疫反应过度
他们还发现食物敏感的婴儿在 1 岁时瘤胃球菌科的丰度下降。这可能与过敏性疾病高风险婴儿的病例对照研究结果一致,发现瘤胃球菌科的相对丰度较低与未出现任何过敏表现的婴儿相比,随后出现特应性湿疹的婴儿的粪便样本中。
值得注意的是,瘤胃球菌属的相对丰度较低也与炎症性先天免疫反应过度有关。
总的来说,这些发现进一步支持了这样一种假设,即缺乏潜在的免疫调节细菌可能会增加发生过敏表现的风险。由于瘤胃球菌能够降解纤维,并且是成人“核心”微生物组的一部分,未来的研究应该检验其重要性。
益生菌 & 肠道菌群
鼠李糖乳杆菌GG — 产丁酸菌↑
在最近的一项研究中,研究了益生菌对牛奶过敏婴儿肠道微生物组的影响。报道称,添加了鼠李糖乳杆菌GG (LGG) 的深度水解酪蛋白 (EHCF) 配方导致了与丁酸盐生产相关的特定细菌的富集。
丁酸盐是一种已知的结肠细胞底物,与增强肠道完整性有关。与单独使用 EHCF 相比,接受 EHCF + LGG 治疗的婴儿在治疗 6 个月后的丁酸产量呈双峰分布。
已知的丁酸盐生产者,Faecalibacterium,Blautia,Ruminococcus,Roseburia在高丁酸盐样本中富集,而拟杆菌显着减少。与牛奶不耐受的孩子相比,牛奶耐受的孩子Blautia和Roseburia富集。正如作者推测的那样,这些物种可能导致丁酸盐产量增加和肠道完整性增加。
扩展阅读:
肠道核心菌属——经黏液真杆菌属(Blautia),炎症肥胖相关的潜力菌
肠道核心菌属——普拉梭菌(Faecalibacterium Prausnitzii),预防炎症的下一代益生菌
母亲摄入益生菌降低孩子发病率
在该团队随后的2份研究中,其中在一项随机对照试验中,与无菌安慰剂牛奶相比,孕妇在围产期摄入含益生菌的低脂发酵牛奶可降低其孩子 2 岁和 6 岁时的湿疹发病率。然而,临床益处似乎与 3 个月或 2 岁时对肠道微生物多样性的影响无关。
由于益生菌仅给予母亲,另一种解释可能是通过影响母乳成分。在婴儿期益生菌随机对照试验的另一项后续研究中,对长期肠道微生物群的建立没有影响, 这与之前的报道一致。
注意:
虽然说荟萃分析报告,怀孕期间、母乳喂养期间和/或给婴儿服用益生菌可降低婴儿湿疹的风险,但证据仍然薄弱。因此,专家机构未能推出具体的指导方针。然而,在考虑所有关键结果时,世界过敏组织现在建议使用益生菌预防有过敏孩子高风险的孕妇和哺乳期母亲以及有高风险患过敏性疾病的婴儿(基于家族史)。
在他们的指南中,他们强调该建议是有条件的并且基于低质量的证据,并不能给出关于最有效的菌株、剂量或治疗的开始和持续时间的具体指导。因此,仍然需要更具体的指南和研究基础。
肠易激综合症
在一项评估肠易激综合征儿童低发酵底物饮食的初步研究中,该饮食与腹痛频率和严重程度的降低显著相关。与无反应者相比,对治疗有反应的儿童在基线和干预期间似乎具有不同的粪便微生物组。
在一项更大的、双盲、随机、交叉研究中,同一组使用 16S 测序研究了低发酵低聚糖、二糖、单糖和多元醇 (FODMAP) 饮食对肠易激综合症儿童的临床结果和肠道微生物组成的影响。
低 FODMAP 饮食减少了腹痛,并且对饮食有反应的儿童的微生物群具有更强的糖分解能力。作者建议,鉴定具有更强糖分解能力的微生物群可能作为预测对低 FODMAP 饮食反应的生物标志物。
克罗恩病
肠道微生物群环境的变化被认为是克罗恩病患者纯肠内营养治疗特性的中介。令人惊讶的是,与没有炎症性肠病家族史的健康对照相比,克罗恩病患儿在纯肠内营养过程中肠道微生物多样性、普拉梭菌和丁酸盐浓度有所降低。
当参与者恢复正常饮食时,这后来又恢复到治疗前的水平。伴随着这种假定的“不健康”微生物群,矛盾的是临床结果得到改善,结肠炎症标志物减少。然而,这些发现的相关性需要进一步阐明。
乳糜泻
在乳糜泻中,坚持严格的无麸质饮食 (GFD) 有时很困难,患者可能仍会出现临床症状和营养缺乏,随后持续发炎和肠道菌群失调。
由于特定的益生菌已被证明可以减轻炎症,因此在一项双盲探索性试验中,新诊断出患有乳糜泻的儿童被随机分配到摄入长双歧杆菌CECT 7347 或安慰剂组 3 个月。无论治疗如何,对 GFD 的依从性与生长参数呈正相关,与安慰剂组相比,益生菌组的身高有所增加。此外,益生菌处理减少了脆弱拟杆菌的数量组和分泌型 IgA。
在另一项评估两种益生菌短双歧杆菌菌株对 GFD 患儿影响的随机对照试验中,与安慰剂相比,干预减少了炎性细胞因子 TNFα 的产生。
总的来说,这些研究表明益生菌对患有乳糜泻的儿童可能有益,但需要在更大规模的试验中验证。
扩展阅读:双歧杆菌:长双歧杆菌
青年糖尿病环境决定因素 (TEDDY) 研究最近的一份报告中,该研究包括芬兰、瑞典、德国和美国患 1 型糖尿病的高风险儿童,肠道的组成和多样性都存在很大差异。即使在这个具有同源人类白细胞抗原 (HLA) II 类基因型并因此具有相似遗传风险的人群中,根据地理区域也存在显着差异。
这些差异的根本原因尚不清楚,因为即使在对早年生活和饮食变量进行调整后,差异仍然存在。
在同一项前瞻性队列研究中,还检查了早期接触益生菌和膳食可溶性纤维(可能影响肠道微生物群组成和形成免疫反应)与胰岛自身免疫的关系。与后期补充或无益生菌相比,益生菌暴露(≤27 天)与胰岛自身免疫风险降低相关。 相反,儿童早期膳食可溶性纤维的摄入与胰岛自身免疫或 I 型糖尿病无关。未来的研究需要检验这些发现的重要性。
人们一直对肠道菌群失调在影响儿科人群的大量疾病中的作用感兴趣。
儿童生长迟缓和认知发育不良的驱动因素是多方面的,包括饮食摄入量和多样性不足、暴露于反复感染、慢性疾病和肠道病理学,包括肠病和 SIBO。最近的研究表明,肠道菌群失调与发育迟缓之间存在密切关联,表明存在潜在的因果关系。这些研究强调需要确定肠道微生物群落的结构和功能改变,并恢复微生物组稳态和相关代谢物以促进低收入环境或国家儿童的生长发育。
儿童时期的肠道微生物组成高度依赖于饮食习惯。在营养不良的儿童中,与标准营养干预措施(如 RUSF)相比,含有当地可用成分的低热量密度 MDCF 可改善微生物组的成熟度和生长。未来我们需要努力探究不同地理环境和不同饮食习惯下中婴儿期微生物群的多样性,更深入地了解它们与免疫发育和生长的联系。
鉴定具有更高定植效率和临床有效性的适合当地的菌株可能提供巨大的潜力来优化可在怀孕、婴儿期和儿童期实施的干预措施,这可能会导致针对肠道微生物群的治疗和预防策略得到改进,并且也可能成为安全和具体指南的基础。
主要参考文献:
Njunge JM, Walson JL. Microbiota and growth among infants and children in low-income and middle-income settings. Curr Opin Clin Nutr Metab Care. 2023 Mar 6.
Videhult FK, West CE. Nutrition, gut microbiota and child health outcomes. Curr Opin Clin Nutr Metab Care. 2016 May;19(3):208-13.
Cerdó T, Diéguez E, Campoy C. Infant growth, neurodevelopment and gut microbiota during infancy: which nutrients are crucial? Curr Opin Clin Nutr Metab Care. 2019 Nov;22(6):434-441.
WHO. Levels and trends in child malnutrition: key findings of the 2021 edition of the joint child malnutrition estimates. United Nations Children’s Fund (UNICEF), World Health Organization, International Bank for Reconstruction and Development/The World Bank. 2021.
Gizaw Z, Yalew AW, Bitew BD, et al. Stunting among children aged 24-59 months and associations with sanitation, enteric infections, and environmental enteric dysfunction in rural northwest Ethiopia. Sci Rep 2022; 12:19293.
West CE, Renz H, Jenmalm MC, et al. The gut microbiota and inflammatory noncommunicable diseases: associations and potentials for gut microbiota therapies. J Allergy Clin Immunol 2015; 135:3–13.
Troesch B, Biesalski HK, Bos R, et al. Increased intake of foods with high nutrient density can help to break the intergenerational cycle of malnutrition and obesity. Nutrients 2015; 7:6016–6037.
Hiltunen H, Löyttyniemi E, Isolauri E, Rautava S. Early nutrition and growth until the corrected age of 2 years in extremely preterm infants. Neonatology 2018; 113:100–107.
Zheng M, Lamb KE, Grimes C, et al. Rapid weight gain during infancy and subsequent adiposity: a systematic review and meta-analysis of evidence. Obes Rev 2018; 19:321–332.

谷禾健康

以前我们科普过肠道菌群在门级别水平分类的肠道细菌四大常见菌门——拟杆菌门,厚壁菌门,变形菌门,放线菌门。
详见:肠道细菌四大“门派”——拟杆菌门,厚壁菌门,变形菌门,放线菌门
但是随着研究范围以及样本的扩大,发现我们人体肠道内除了这些常见的菌群之外,还有许多小众门派的菌群在肠道平衡中也扮演着重要的角色,它们同样可以帮助我们消化食物、维持肠道健康、增强免疫力等等。这些微生物组通常作为宿主基因组的功能扩展,在宿主生理和新陈代谢的调节中起着至关重要的作用。
在本文中,我们将深入探讨这些小众门派的菌群,揭示它们的神秘力量和重要性,帮助我们更好地了解肠道菌群的多样性和复杂性。
我们根据谷禾肠道数据库人群检出比例的丰度排名依次介绍这些菌及其与肠道和人体健康的相关信息。
根据人群检出丰度依次为:
疣微菌门 Verrucomicrobia
梭杆菌门 Fusobacteria
蓝藻门 Cyanobacteria
酸杆菌门 Acidobacteria
软壁菌门 Tenericutes
绿弯菌门 Chloroflexi
互养菌门 Synergistetes
芽单胞菌门 Gemmatimonadetes
黏胶球形菌门 Lentisphaerae
浮霉菌门 Planctomycetes
硝化螺旋菌门 Nitrospirae
脱铁杆菌门 Deferribacteres
螺旋体 Spirochaetes
装甲菌门 Armatimonadetes
绿菌门 Chlorobi
迷踪菌门 Elusimicrobia
衣原体 Chlamydiae
这里我们对门层级中的常见肠道菌群逐个介绍。
疣微菌门(Verrucomicrobia)是一类革兰氏阴性细菌,是细菌分类学中的一个门级分类单元。这类细菌的细胞形态多样,包括球形、杆状、螺旋形等,常见于土壤、水体和动物肠道等环境中。
疣微菌门是细菌域内的一个新分支,1997年被列为一个门。它们代表系统发育树中的一个独特谱系,包含许多环境物种以及少量培养物种。
疣微菌门是一类广泛存在于自然环境中的细菌,包括多种典型的菌种,例如常听说的Akkermansia muciniphila,其他还有Opitutus terrae、Prosthecobacter debontii等。这些菌种在不同的环境中具有不同的代谢和生理特性。
▼
疣微菌门存在于肠道粘膜内层,在健康个体中大量存在,它们可以分解多糖类物质,如黏多糖和纤维素等,从而提供能量和营养物质。
疣微菌门还可以产生短链脂肪酸,如丙酸和丁酸等,这些物质对肠道健康和免疫系统的调节具有重要作用。
虽然说疣微菌门仅占肠道微生物群落总数的一小部分,但结果表明,一些疣微菌种系型对多糖和木聚糖的降解做出了重大贡献。基因组编码多种糖苷水解酶、硫酸酯酶、肽酶、碳水化合物裂解酶和酯酶,具有水解多种多糖的机制。
▼
在肠道微生物组中,疣微菌门是一个重要的菌群之一。 谷禾肠道数据库中大约56.29%的人群有检出。
⇒
研究表明,疣微菌门的丰度与肠道健康密切相关。疣微菌门有助于人体肠道的葡萄糖稳态, 具有抗炎特性,可进一步帮助肠道健康。研究表明 该菌与foxp3 基因之间存在正相关关系,foxp3 基因是一种在人类中表达抗炎和免疫力的基因。
⇒
一些疾病如肥胖症、炎症性肠病、睡眠障碍和2型糖尿病等,与疣微菌门的丰度降低有关。其他如哮喘、自闭症等疾病人群中丰度也会变化。
⇒
其中,Akkermansia muciniphila(简称AKK菌)是疣微菌门中研究较多的菌种之一。研究表明,Akk菌可以降低肥胖、糖尿病、肠炎、肠癌等疾病的风险。这是因为Akk菌可以促进肠道黏液层的生长和维护,增强肠道屏障功能,减少有害菌的生长,降低肠道内毒素的水平,从而保护肠道健康。
详见:
肠道重要菌属——Akkermansia Muciniphila,它如何保护肠道健康
梭杆菌门 (Fusobacteria)是细菌门之一,它们是一类革兰氏阴性菌,通常是长杆状或螺旋状的。在谷禾肠道数据中,该菌的检出率是49.16%.
梭杆菌门包括多种典型的种属,如:Fusobacterium nucleatum(具核梭杆菌)、
Fusobacterium varium(变异梭杆菌)、
Fusobacterium necrophorum等。
▼
梭杆菌门广泛存在于自然环境中,包括土壤、水体和动物肠道等。已证明梭杆菌门下的许多物种可以自由生活,而无需与周围环境中的其他生物结合。其中大部分包括在海洋环境中发现的物种,例如 Llyobacter 属和 Psychrilyobacter 属的成员。
Photograph by Hipersynteza
自由生活的梭杆菌属的最好例子之一是 Psychrilyobacter atlanticus 物种,它可以在大西洋的海洋沉积物中找到。
它们是一类厌氧菌,通常生长在肠道内的低氧环境中。梭杆菌门在人体内的分布广泛,不仅存在于肠道中,还存在于口腔、阴道和皮肤等部位。
▼
⇒
一些研究表明,梭杆菌门可能与肠道疾病有关。例如,一些研究发现,梭杆菌门在结肠癌组织中的含量明显高于正常组织。此外,梭杆菌门也与炎症性肠病(IBD)和肠道感染有关。
⇒
在口腔中,梭杆菌门的存在则与龋齿和牙周炎等口腔疾病有关。
然而,梭杆菌门在肠道菌群中也扮演着有益的角色。梭杆菌门可以产生一些对人体有益的代谢产物,如丙酮酸和丁酸等。一些研究表明,梭杆菌门可能参与了肠道菌群的稳态维持和代谢功能。
⇒
吸烟者的梭杆菌丰度显著更高(P = 0.009,FDR = 0.027 )。
⇒
每日食用面包的人群中,梭杆菌丰度也显着更高(P = 0.005,FDR = 0.015)。
⇒
饮用更多咖啡的个体表现出略显着更高的梭杆菌属丰度( P= 0.02,FDR = 0.20)。
总的来说,梭杆菌门在人体健康中的作用还需要进一步的研究和探索。虽然它们可能与一些疾病有关,但在肠道菌群中的作用也不容忽视。
扩展阅读:梭杆菌属Fusobacterium——共生菌、机会致病菌、致癌菌
蓝细菌门(Cyanobacteria),是一类原核生物,也被称为蓝藻或蓝藻菌门。
蓝绿藻植物菌门下物种又称蓝细菌、蓝绿菌、蓝藻或蓝菌,包括蓝鼓藻、蓝球藻等生物。过去曾长期被归于藻类,但实际上蓝菌与真核生物非常不同,例如没有核膜,没有细胞器,其遗传物质DNA也不构成染色体,这些都是细菌的特征,因此现时已被归入细菌域。
▼
蓝细菌分布极广,普遍生长在淡水、海水和土壤中,主要分布在含有机质较多的淡水中;在极端环境(如温泉、盐湖、贫瘠的土壤、岩石表面或风化壳中、冰雪上、植物树干等)中也能生长;蓝菌有些还可穿入钙质岩石(如钙藻类)或土壤深层中(如土壤蓝藻),故有“先锋生物”的美称。
▼
蓝菌是一类能透过产氧光合作用获取能量的细菌,但有些也能透过异营来获取能量。
蓝绿菌在地球上已存在约21亿年,是目前以来发现到的最早的光合放氧生物,对地球表面从无氧的大气环境变为有氧环境起了巨大的作用。通过刺激生物多样性和导致厌氧生物接近灭绝,显著的改变了在地球上生命形式的组成。根据内共生学说,在植物和真核藻类发现的叶绿体是从蓝细菌祖先通过内共生进化而来的。
▼
以下是一些常见的典型菌种:
Anabaena(鱼腥藻):这是一种常见的蓝藻,可以在淡水和海水中生长。它们通常形成长链,其中一些细胞可以进行氮固定,这对于生态系统的氮循环非常重要。
Microcystis(微囊藻):这是一种广泛分布的蓝藻,可以在淡水和海水中生长。它们通常形成大量的胞囊,这些胞囊可以释放出毒素,对水生生物和人类健康造成威胁。
Spirulina(螺旋藻):这是一种广泛应用于食品和保健品的蓝藻。它们富含蛋白质、维生素和矿物质,被认为具有多种健康益处。
▼
谷禾肠道数据库中大约39.06%的人群有检出,但一些研究表明,它们可能与肠道健康和一些疾病有关。
一些研究发现,蓝细菌在肠道中的丰度与炎症性肠病(如克罗恩病和溃疡性结肠炎)的发生有关。
蓝细菌中的一些代表性菌种,如前面提到的Anabaena sp.和Microcystis sp.,可能产生毒素,对人体健康造成威胁。
⇒
在一些污染的地区,其中绝大多数淡水湖泊中发现了大量的蓝藻水华。蓝藻毒素早就被认为通过肝脏影响与之相关的健康问题,食用受蓝藻污染的饮用水相关的健康问题也包括胃肠炎和肠道不适,其中肠道微生物组发挥了关键作用。但蓝藻毒素的作用机制仍然是一个关键的、大部分未被探索的问题。
肠道蓝细菌丰度与人类健康和疾病的潜在联系

doi.org/10.3390/life12040476
⇒
在谷禾肠道样本人群中,发现渐冻症部分群体里发现蓝藻门(蓝细菌)比较高。结合研究发现蓝菌门生物皆含有神经毒素BMAA(β-N-methylamino-L-alanine),并可能透过食物链不断累积产生生物放大作用,对人类的损害可能会逐渐增加。BMAA已证实会对动物产生强烈的毒性,加速动物脑神经退化、四肢肌肉萎缩等等,小量BMAA积累对小鼠已能选择性杀死神经元。
因此需要注意,在水体中的过度生长会导致水体富营养化,产生毒素,对人体健康和生态环境造成危害。需要加强对蓝细菌的监测和管理。
酸杆菌门 (Acidobacteria) ,虽然这个名字听起来都是嗜酸性的,但一些物种可以在中性和弱碱性环境中找到。
虽然一些研究表明酸杆菌门有超过 18 个类别,但只有三个类别是众所周知的。它们是:
(Holophagae 纲在某些文献中被描述为一个目)
▼
下面了解一下酸杆菌门下的3个常见属:
◗ 酸杆菌属
酸杆菌门下第一类重要的菌属——酸杆菌属(Acidobacterium Genus),通常存在于酸性环境中。
荚膜酸杆菌(Acidobacterium capsulatum)是该组中最受欢迎的成员之一(由大约 8 个菌株组成)。与该类别的其他成员一样,荚膜酸杆菌是一种革兰氏阴性细菌。
酸杆菌属也是好氧菌,它们本质上是嗜温的;在适中的温度(20~45°C之间)生长良好。
与这些细菌相关的一些其他特征包括:
◗ Terracidiphilus属
酸杆菌门下第二类重要的菌属——Terracidiphilus 属,由已知可产生用于分解几丁质和寡糖的细胞外酶的生物体组成。
该属中最受欢迎的物种之一是 Terracidiphilus gabretensis。这种细菌常见于针叶林中,它在碳汇中起着重要作用。
◗ Terriglobus 属
Acidobacteria 门下第三类重要的菌属——Terriglobus属,是革兰氏阴性菌,与 Granulicella 和 Adaphobacter 属密切相关。
该组的成员是土壤中常见的好氧化学有机异养生物。虽然这些生物通常存在于土壤(根际土壤)中,但在淡水生境中也有。
目前,该属有 5 个知名物种,其中包括:
该属的一些特征为:
图源:Biology LibreTexts
与这些细菌相关的一些其他特征包括:
▼
据估计,酸杆菌是土壤中主要菌群,约占土壤中所有微生物的 20%。
在环境中,酸杆菌在养分循环中起着重要作用。
碳循环 ——通过降解各种碳源(糖和蛋白质等),这些细菌将碳返回到环境中。然后,这些碳被植物和其他生物用于各种功能,循环继续。
氮循环 ——目前,Geothrix fermantans是酸杆菌门内唯一已知在氮循环中发挥一定作用的物种。通过减少硝酸盐来实现的。
硫循环 ——嗜热氯酸杆菌是需要硫来生长和发育的酸杆菌的一个例子。硫代谢有助于硫循环。
▼
与人体肠道和健康的关系方面,目前对于酸杆菌的研究还比较有限。
一些研究表明,酸杆菌门可能在人体肠道中存在,谷禾肠道数据库中大约33.05%的人群有检出。
肠道微生物群落的失衡与多种疾病的发生有关,而酸杆菌门的数量在某些疾病中可能会发生变化。
⇒
一些研究表明,肠道炎症性疾病患者的肠道中酸杆菌门的数量较低。
⇒
妊娠期糖尿病患者中酸杆菌门显著增加,并与血糖水平呈正相关。
⇒
在特发性肾病综合征患者中,酸杆菌门显著减少。
⇒
糖尿病肾病具有与健康对照不同的肠道微生物群,酸杆菌门在糖尿病肾病患者中增加。
⇒
一项研究中,幽门螺杆菌阳性受试者的微生物群落表明变形杆菌、酸杆菌和螺旋体的数量增加。
扩展阅读:正确认识幽门螺杆菌
但是,目前还需要更多的研究来探究酸杆菌门与人体肠道和健康之间的具体关系。
软壁菌门(Tenericutes),在谷禾肠道数据中,该菌的检出率是29.61%.
这些细菌通常是无细胞壁的,因此它们的形态非常多样化,也被称为无壁菌门。由质膜包围的细胞组成的革兰氏阴性菌。
软壁菌门由从厚壁菌门进化而来的细菌组成。尽管一些研究人员强烈认为软壁菌门应该被整合到厚壁菌门中,但两个显着特征使软壁菌门有别于厚壁菌门:
目前,软壁菌门的分类地位尚不确定。随着未来鉴定出更多新的软壁菌门细菌谱系,软壁菌门的分类定位和单系性可能会受到进一步挑战。
▼
软壁菌门普遍存在于许多环境中。16S rRNA 测序已经在包括深海在内的不同环境中识别出大量未知的软壁菌门进化枝,这表明这些细菌可能代表独立生活的微生物,其生活方式与宿主无关。
事实上,在深海冷泉和盐水池中分别发现了Candidatus Izemoplasma和 Haloplasma自由生活。这些深海自由生活的软壁菌门细菌表现出新陈代谢的多样性和适应性的灵活性,表明有可能从海洋甚至其他极端环境中分离出更多的软壁菌门细菌。
▼
⇒
一项关于老年2型糖尿病认知障碍的研究发现参与者中,认知障碍患者的血红蛋白和高密度脂蛋白水平较低,相对糖尿病对照组而言,认知障碍糖尿病患者的软壁菌门Tenericutes丰度较低。
⇒
在长寿村社区老年人的肠道菌群中,厚壁菌门、软壁菌门Tenericutes和放线菌门的相对丰度显著低于城市化城镇社区。
扩展阅读:健康长寿的步伐永不停歇
⇒
一项研究将86名儿童(5-15岁)被分为三组:
与对照组相比,在代谢性不健康肥胖受试者中,软壁菌门(Tenericutes)以及α和β多样性显著降低。与对照组相比,互养菌门(Synergistetes)和拟杆菌属在代谢健康肥胖人群中更为普遍。
总的来说,软壁菌门在肠道中的作用和其与健康的关系还需要进一步的研究和探索。
注意,软壁菌门在临床上比较难分辨。它们往往不太可能生长,也不太可能被经典微生物学技术识别,一般通常需要进行分子鉴定。属内的敏感性特征通常变化很大,这使得针对他们的特异性鉴定以及合理选择抗菌药物非常重要。
绿弯菌门(Chloroflexi)是一类光合细菌,可以利用光合作用产生能量。又称作绿非硫细菌,还有一部分称作热微菌的细菌也属于绿非硫细菌。绿弯菌门的细菌生活在海洋,淡水等环境中。
该门包括六类:
▼
绿弯菌门由不同的生物群组成,包括无氧光合自养生物、好氧化学异养生物、嗜热生物以及通过有机氯化化合物的还原脱卤获得能量的厌氧生物。
典型的绿弯菌门细菌是线形的,通过滑行来移动。它们是兼性厌氧生物,在光合作用中不产生氧气,不能固氮。利用3-羟基丙酸途径,而不是常见的卡尔文途径来固定二氧化碳。
图源:de-academic
所有已知的成员都是丝状的,具有不寻常的滑动机制作为一种运动方式,虽然大多数革兰氏染色呈阴性,但没有一个具有革兰氏阴性菌特有的脂多糖外膜。
绿弯菌门包含生态和生理上多样化的细菌群,已在越来越广泛的厌氧生境中检测到这些细菌,包括沉积物、温泉、产甲烷厌氧污泥消化池,它们在这些地方非常丰富,并发挥着重要的发酵作用有助于污泥粒化。绿弯菌门是固体废物和废水处理系统中最主要的门之一。特别是,Anaerolineae 类已被确定为全面厌氧反应器中的核心微生物种群之一。
绿弯菌门可能参与了肠道中的一些代谢过程,例如氨基酸、葡萄糖和脂肪酸的代谢。
▼
虽然绿弯菌门在人群中不是常见菌,但目前人体肠道和口腔中也逐步检测到绿弯菌门细菌,谷禾肠道数据库中大约25.28%的人群有检出。
⇒
在门水平上,利福昔明治疗后腹泻型肠易激综合征患者的绿弯菌门(Chloroflexi)(P=0.008)、Deinococcus-Thermus菌(P=0.038)和酸杆菌群(P=0.028)增加。
⇒
在门水平上,与格雷夫斯病相比,格雷夫斯眼眶病患者中Deinococcus-Thermus菌和 绿弯菌门(Chloroflexi) 的比例显着降低。
⇒
小型研究发现,新冠肺炎刚痊愈的人与健康对照相比,绿弯菌门(Chloroflexi)显著降低。
扩展阅读:阳康后是否会二次感染,长新冠与肠道菌群的关联,多种潜在的相关干预措施
此外,一些研究还发现,绿弯菌门的存在与一些肠道疾病,如炎症性肠病和肠道肿瘤等有关联,但具体的机制还需要进一步研究。
互养菌门(一般翻译为 Synergistetes),也有翻译为增效菌门或协同菌门。在谷禾肠道数据中,该菌的检出率是24.61%.
Synergistetes细菌是最近认识到的一个门,其中已分离出 40 种生物,并且有超过三百个 16S rRNA 序列可用。
这个门的分类学历史很短,最近才被确定为细菌域内的一个独立门。第一个代表性物种,Synergistes jonesii,最初从夏威夷山羊的瘤胃中分离出来,以其命名,最初被分类在 Deferribacteres 门中。
▼
来自该门的物种共有的表型特征包括它们的革兰氏阴性细胞壁、厌氧、杆状/弧菌状细胞形状
图源:researchgate
虽然脂多糖存在于双层细胞膜中是一个重要特征,但在互养菌门物种中尚未被报道,但它们确实含有参与脂多糖生物合成的各种蛋白质的基因。虽然有些物种不能分解糖,但所有互养菌门都具有发酵氨基酸的能力。
它们可以利用多种有机物作为碳源和能源。
一些Synergistetes菌属可以利用蛋白质、脂肪酸和多糖等有机物进行代谢,同时还可以参与肠道中的硫循环和氮循环等过程。
一些Synergistetes菌属还可以产生一些对人体有益的代谢产物,如短链脂肪酸等。
▼
互养菌门主要栖息在厌氧环境中,包括动物胃肠道、土壤、油井和废水处理厂,它们也存在于人类疾病部位,如囊肿、脓肿和牙周病区域。
由于它们存在于疾病相关部位,互养菌门被认为是机会性病原体,但它们也可以在健康个体的脐部微生物组和正常阴道菌群中发现。
该门的其他物种已被确定为厌氧消化池中用于生产沼气的污泥降解的重要贡献者,并且是通过生产氢气用于可再生能源生产的潜在候选者。
常见菌属:Aminiphilus是一类革兰氏阴性菌,通常生长在富含有机物的水体中。它们可以利用氨基酸和蛋白质等有机物作为碳源和能源。
▼
⇒
大多数人类培养的菌株来自感染部位,表明互养菌门在感染过程中增殖。互养菌门的不同分支和物种表现出不同的感染倾向:
⇒
在牙周炎患者中发现了一些互养菌门OTU,并且在牙周炎患者的患病部位龈下菌斑中比健康部位更丰富。
⇒
2型糖尿病和牙周炎患者的微生物群比非糖尿病牙周炎患者的微生物群显示出更少的互养菌门。
⇒
在坏死性溃疡性牙龈炎的病例中,互养菌门聚类A OTUs的检测水平和比例高于牙龈炎期间。
⇒
研究显示,精神病患者患抗精神病药引起的便秘的风险很高,互养菌门在便秘组的肠道微生物群中显著增高。
⇒
互养菌门可能保护甲状腺,在格雷夫斯病患者的肠道菌群中,互养菌门与促甲状腺激素受体抗体(TRAb)水平呈负相关。
芽单胞菌门(Gemmatimonadetes)是一类革兰氏阴性菌,包括:
芽单胞菌纲(Gemmatimonadetes)
芽单胞菌目(Gemmatimonadales)
芽单胞菌科(Gemmatimonadaceae)
芽单胞菌门目前仅有一属得到正式命名,即芽单胞菌属(Gemmatimonas),是一类革兰氏阴性细菌,通过出芽方式繁殖。
图源:alchetron
芽单胞菌门可以在各种环境中生长,包括土壤、淡水、海水和沉积物等。在肠道中,芽单胞菌门也是一种常见的微生物群落成员。
▼
芽单胞菌门可以利用多种有机物和无机物作为碳源和能源,包括葡萄糖、氨、硝酸盐、硫酸盐等。此外,芽单胞菌门还可以在低氧或缺氧条件下生长,并且能够耐受一定的重金属和有机污染物。
一些研究表明,芽单胞菌门可能在土壤和水体中发挥重要的生态功能,如有机物分解和氮循环等。此外,芽单胞菌门可能与一些环境污染物的降解有关。因此,芽单胞菌门在环境保护和生态平衡方面具有重要的作用。
芽单胞菌门的代表性菌种包括:
Gemmatimonas aurantiaca、
Gemmatimonas phototrophica等。
这些菌种具有一些特殊的代谢特征,例如Gemmatimonas aurantiaca可以利用多种有机物作为碳源和能源,同时还具有一定的光合作用能力。
▼
芽单胞菌门与人体健康的关系尚未得到充分研究。谷禾肠道数据库中大约20.11%的人群检出。
一些研究发现,芽单胞菌门可能与肠道炎症的发生有关。
⇒
可能与骨质疏松相关:
芽单胞菌门和绿弯菌门,在原发性骨质疏松症患者和 正常对照组,以及骨质减少患者和正常对照组之间存在显着差异 ( p < 0.01 ) 。
⇒
补充唾液酸Neu5Ac对小鼠肠道形态、肝功能和肠道微生物影响的研究表明,肠道微生物群组成呈剂量依赖性变化,在门水平上,芽单胞菌门显着增加。
注:N-乙酰神经氨酸 (Neu5Ac) 是人类唾液酸的主要形式。
需要进一步的研究来探究芽单胞菌门与人体健康的关系。
黏胶球形菌门(Lentisphaerae)是一个相对较小的门,球形或椭圆形,通常是厌氧或微好氧的,可以生长在不同的环境中,如土壤、淡水、海水、动物肠道等。在谷禾肠道数据中,该菌的检出率是18.42%.
▼
黏胶球形菌门的代谢特征是多样的,包括无氧呼吸、发酵、光合作用等。
一些菌属可以利用多种碳源和氮源进行生长,如Lentisphaera和Victivallis可以利用多种碳水化合物和蛋白质作为碳源和氮源。
一些Lentisphaerae菌属还具有产生酸和气体的能力,如Fibrobacteres可以产生乳酸和乙酸。
Lentisphaerae还被发现可以参与到肠道中的多糖代谢和蛋白质降解等代谢过程中。
在黏胶球形菌门内的Victavallales属,可以酶解唾液酸、岩藻糖、半乳糖和 N-乙酰氨基葡萄糖,降解粘蛋白,其糖基水解酶图谱与AKK菌非常相似。
▼
⇒
一项研究发现,黏胶球形菌门(Lentisphaerae)在健康人的肠道中的丰度较高,而在患有炎症性肠病和非酒精性脂肪性肝病 (NAFLD) 的患者中的丰度较低。
⇒
研究还发现更好的睡眠质量与更好的认知灵活性和更高比例的肠道微生物门Verrucomicrobia和Lentisphaerae有关。
⇒
也有研究发现黏胶球形菌门( Lentisphaerae)与帕金森疾病相关。
扩展阅读:肠道微生物与帕金森以及相关影响因素
⇒
可能与他汀类药物的代谢有关,高脂血症患者接受了 10 mg/天的瑞舒伐他汀治疗 4-8 周,蓝细菌门和黏胶球形菌门(Lentisphaerae)与低密度脂蛋白胆固醇水平呈正相关。
⇒
横断面研究发现,黏胶球形菌门(Lentisphaerae)在多发性硬化患者中显著降低。
扩展阅读:肠道微生物群在多发性硬化中的作用
⇒
经常食用面包的受试者的肠道微生物群中,互养菌门和黏胶球形菌门(Lentisphaerae)的相对丰度显着更高(分别为P = 0.009,FDR = 0.028 和P = 0.004,FDR = 0.011)。
浮霉菌门(Planctomycetes)形成了一个独特的细菌门,具有独特的特征组合,例如,缺乏肽聚糖的蛋白质细胞壁,以及在细胞质内形成独立隔室的细胞内膜。
浮霉菌门的细胞结构
doi: 10.1038/nrmicro2578.
▼
浮霉菌门包括多个典型菌属,如Planctomyces、Gemmata、Pirellula、Rhodopirellula等。这些菌属通常是好氧或微好氧的,可以生长在不同的环境中,如海水、淡水、土壤、沉积物、动物肠道等。主要与大型藻类、海绵和地衣等颗粒或生物相关,具体取决于物种及其硫酸酯酶可代谢的多糖。大多数浮霉菌门生长在 pH 值从 3.4 到 11 不等的营养贫乏的贫营养环境中。
大多数浮霉菌门是嗜温的,但有一些 浮霉菌门是嗜热的(50°C -60°C)。通常添加的营养素有 N-乙酰氨基葡萄糖、酵母提取物、蛋白胨和一些微量元素和大量元素。
▼
一些浮霉菌属还具有产生酸和气体的能力,如Pirellula可以产生乳酸和乙酸。另外,浮霉菌门还具有一些特殊的代谢特征,如一些菌属可以利用甲烷和硫化氢作为能源和碳源,如Anammoxoglobus和Brocadia。
浮霉菌门包括一些具有非常不寻常的生理学的物种,比如一些浮霉菌可以合成甾醇,这是一种真核生物的典型能力,在细菌中并不常见。
浮霉菌门的另一个不寻常的代谢特征是它们拥有编码C1转移酶的基因。这些酶以前只在产生甲烷的古细菌和一组甲烷氧化的变形菌中被发现,它们在具有一个碳原子的化合物的代谢中发挥作用。比较基因组学和蛋白质组学表明,厌氧氨氧化和非厌氧氨氧化浮霉菌之间的区别超出了铵的代谢。
▼
浮霉菌门是人类消化道微生物群的一部分。谷禾肠道数据库中大约13.92%的人群有检出。它们的多样性因环境而异,包括个体的地理起源和抗生素治疗。
⇒
在两名患有白血病和再生障碍性中性粒细胞减少症的发热患者的血液中检测到与浮霉菌门密切相关的 DNA 序列。
⇒
G. massiliana的分离来自靠近这些患者的医院供水系统,可能支持消化道进入途径的假设,即摄入受污染的水然后在免疫功能低下的患者的血液中易位。Gemmata属的可能作为潜在的机会性病原体进入消化道。
硝化螺旋菌(Nitrospirae) 是革兰氏阴性菌,通常呈螺旋状。以其氧化亚硝酸盐和硝酸盐的能力而闻名。谷禾肠道数据库中大约11.04%的人群有检出。
硝化螺旋菌存在于各种环境中,包括土壤、淡水、海洋栖息地、污水处理厂等。在亚硝酸盐和硝酸盐等含氮化合物含量高的环境中,它们尤其丰富。
▼
硝化螺旋菌作为一种好氧化学自养亚硝酸盐氧化细菌,在硝化过程中发挥着关键作用。这些细菌通常与氨氧化细菌或古菌密切相关,这些细菌将氨转化为亚硝酸盐,亚硝酸盐被硝化螺旋菌进一步氧化为硝酸盐。
然而,在“相互喂食”的相互作用中,硝化螺菌也可以用尿素或氰酸盐释放的氨提供氨氧化剂,尿素或氰酸酯被进一步硝化。
图源:Mmolecular
硝化螺旋体成员甚至单独催化两个硝化步骤,因此被称为完全氨氧化剂或“comammox”生物体。这与传统的硝化细菌不同,传统的硝化细菌需要两种不同类型的细菌来完成这些步骤。
一些硝化螺旋菌菌株利用H2和甲酸盐等替代底物,使用氧气或硝酸盐作为末端电子受体,并可以在好氧亚硝酸盐氧化的同时利用这些能源。这种代谢的多样性使硝化螺旋菌能够在广泛的栖息地定居,并维持环境条件的变化,如氧气浓度的变化。
doi.org/10.1016/j.tim.2018.02.001
一些种类的硝化螺旋菌还能够利用硫化合物或铁等替代电子受体,进行厌氧呼吸。
已知一些种类的硝化螺旋菌参与有机物的降解,而另一些种类则参与甲烷的生产。
▼
⇒
比较墨西哥城儿童(西方化,高动物蛋白和精制糖饮食)和 Me’phaa 儿童(非西方化,高纤维饮食)的肠道菌群,这两个人群主要区别在于不同种类的饮食。研究发现,Me’phaa 儿童表现出更高的绿弯菌门(Chloroflexi)和硝化螺旋菌(Nitrospirae)。
注:来自格雷罗州“Montaña Alta”地区的 Me’phaa 是一个前西班牙土著群体,他们主要靠种植豆类和扁豆,玉米等为生。还收集野生食用植物,并种植一些水果和蔬菜。肉类几乎只是在特殊场合食用的,并不是日常饮食的一部分。其生活方式和墨西哥城形成鲜明对比。
⇒
但也有研究发现,耐药癫痫患者表现出硝化螺旋菌富集(Kruskal-Wallis检验:p<0.05)。
⇒
一项关于胃微生物群的研究发现,硝螺旋菌门存在于所有胃癌患者中,但在慢性胃炎患者中完全不存在。
⇒
乳铁蛋白可以降低硝化螺旋菌水平。
脱铁杆菌(Deferribacteres)是1999年首次被描述的一门细菌。这些细菌以其还原铁和其他金属的能力而闻名,它们存在于各种环境中,包括深海热液喷口、温泉和地下水。
脱铁杆菌是革兰氏阴性细菌,通常是杆状的。它们是厌氧菌,通常在低氧环境中被发现。脱铁杆菌也是嗜热的,一些种类的脱铁杆菌能够进行化能生长,这意味着它们可以通过氧化无机化合物(如铁或硫)来获得能量。
G. thiophilus 阴性染色细胞的电子显微照
Janssen et al. 2002
脱铁杆菌中最著名的一种是脱铁杆菌脱硫菌,它能够还原铁和硫化合物,它被认为在深海环境中这些元素的循环中发挥着重要作用。
▼
脱铁杆菌属细菌最有趣的特征之一是它们能还原铁。这个过程包括将电子从铁转移到细菌,然后细菌可以利用这些电子产生能量。这一过程在许多环境中都很重要,因为它可以帮助维持生态系统中铁和其他金属的平衡。
除了还原铁,一些种类的脱铁杆菌还能还原其他金属,如锰和铀。脱铁杆菌属细菌在碳循环中也很重要,因为它们能够分解有机物并释放二氧化碳。一些种类的脱铁杆菌已知参与复杂有机化合物的降解,如木质素和纤维素。这一过程在许多环境中都很重要,因为它有助于循环营养物质,维持生态系统的平衡。
▼
谷禾肠道数据库中大约4.92%的人群有检出。
⇒
脱铁杆菌门可能与环境高温高湿导致的肠道菌群失调和轻微肠炎有关。
研究分为三组实验:
脱铁杆菌门是唯一在三组中具有差异丰度的门(P < 0.05),从正常对照组和高温高湿组的0.05%增加到广谱益生菌治疗组的1%。
⇒
一项研究发现,与正常对照和葡萄糖调节受损 (IGR) 患者相比,2型糖尿病患者中的脱铁杆菌门显着增加。
也发现脱铁杆菌门与镁摄入量呈负相关。
⇒
大鼠给予大麦或麦芽(7-8膳食纤维/100 g)4周,与对照大鼠相比,大麦组大鼠盲肠微生物群中的脱铁杆菌门的丰度低于对照组。
扩展阅读:谷物调节肠道菌群,促进代谢健康
在糖尿病中,关于脱铁杆菌门的研究不一致,有研究认为,糖尿病的改善与脱铁杆菌门相对丰度的降低有关,也有研究发现糖尿病的改善与脱铁杆菌门相对丰度的升高有关。
⇒
研究橄榄苦苷摄入对晚期2型糖尿病的缓解作用,发现橄榄苦苷可以增加Verrucomicrobia和脱铁杆菌门的相对丰度。
⇒
膳食菊粉治疗糖尿病组中脱铁杆菌门相对丰度下降。膳食菊粉通过抑制炎症和调节肠道微生物群来缓解2型糖尿病的不同阶段。
⇒
皮质酮治疗的小鼠中,拟杆菌门减少,脱铁杆菌门显著增加,水苏糖使拟杆菌门和脱铁杆菌恢复到正常水平。
⇒
较低的色氨酸补充量降低了脱铁杆菌门的丰度,而较高的色氨酸补充量不仅恢复了丰度,而且增加了丰度。
扩展阅读:色氨酸代谢与肠内外健康稳态
螺旋体(Spirochaetes),是革兰氏阴性菌,可运动的螺旋状细菌,断面呈圆形,以横向分裂繁殖,长度有 5 到 250 微米。螺旋体的独特之处在于,它们具有细胞内鞭毛。螺旋体属于双膜细菌门。
图片来源:crondon
螺旋体的细胞体被包裹在几层中。这些包括外膜和内膜、肽聚糖层以及细胞质膜。
其中一些是人类的严重病原体,会导致梅毒、雅司病、莱姆病和回归热等疾病。螺旋体属有螺旋体、密螺旋体、疏螺旋体、钩端螺旋体等。
▼
螺旋体可以在水(地表水/淡水)、湖泊、盐沼沉积物、泥浆、沉积物、深海喷口、血液和淋巴等各种栖息地中找到。
图源:Oxford Nanopore Technologies
▼
螺旋体本质上是化学异养的,能够在厌氧条件下繁衍生息。
螺旋体的一个很好的例子是 Spirochaeta isovalerica。它是专性厌氧菌,它们通过发酵碳水化合物产生乙酸盐、乙醇、二氧化碳和氢气来生存。
许多种类的螺旋体对环境有益,并在固氮和有机物分解等过程中发挥重要作用。密螺旋体的某些种类生活在牛胃的瘤胃中,在那里它们为宿主分解纤维素和其他难以消化的植物多糖。
一些物种也被用于生物技术和工业应用,如生物燃料和生物塑料的生产。
▼
谷禾肠道数据库中大约4.04%的人群有检出。
⇒
钩端螺旋菌病是由动物传染给人类的,一种常见的传播形式是让受污染的水接触到皮肤、眼睛和粘膜中未愈合的伤口。水由于与受感染动物的尿液接触而受到污染。——Leptospira
莱姆病 —— Borrelia burgdorferi,
Borrelia garinii, Borrelia afzelii
扩展阅读:夏季来临,警惕蜱虫叮咬感染疾病——莱姆病
回归热 ——复发性疏螺旋体(Borrelia recurrentis)
梅毒——梅毒螺旋体(Treponema pallidum)
雅司病(皮肤、骨骼和关节的热带感染)
—— T. pallidum subspeciespertenue
肠道螺旋体病——Brachyspira pirosicoli和Brachyspira aalborgi
文森特心绞痛—— Borrelia vincentii
⇒
在马来西亚北部的一个农村地区,与富裕人孩子相比,相对经济困难的土著儿童肠道微生物群表现出最多的微生物多样性。
Aeromonadales、拟杆菌门、瘤胃球菌科(Ruminococcaceae)、Deltaproteobacteria和螺旋体(Spirochaetes)富集,这与富含纤维的食物的分解有关。
装甲菌门(Armatimonadetes),以前被称为候选门OP10,其成员分布在各种环境中,包括土壤、岩石、淡水和海洋沉积物。谷禾肠道数据库中大约3.31%的人群有检出。
装甲菌门细菌的特征是其独特的细胞壁结构,其中包含一层肽聚糖和一层类似于革兰氏阴性菌的外膜层。它们还具有形成长而有分支的细丝的能力。绿弯菌门是与装甲菌门亲缘关系最密切的正式门。
已经发现一些种类的装甲菌门在碳和氮循环等环境过程中发挥着重要作用。
在装甲菌门中,属于Armatimonasis纲的菌株 YO-36 T和属于Chthoonomonadetes纲的菌株 T49 T是唯一有效命名的分离株。
T49 T中枢代谢和碳固定通过常规糖酵解和三羧酸循环进行。T49 T的一个有趣特征是它在 4.7 到 5.8 的窄 pH 范围内生长。
▼
很少有关于人体肠道菌群内装甲菌门的研究。
在一些关节炎患者的滑液中也检测到了Armatimonadetes门细菌,这些可能是游离污染物或机会性定植剂,而不是病原体。
在人体肠道中,装甲菌门的作用尚不清楚,待进一步研究和探索。
绿菌门(Chlorobi)是一类光合细菌,也被称为绿菌门,谷禾肠道数据库中大约1.9%的人群有检出。
绿菌门是一类光合细菌,能够利用光能进行光合作用,产生能量和有机物质。
▼
在人体肠道菌群中,Chlorobi包含以下几个菌属和菌种:
包括Chlorobium limicola、Chlorobium phaeobacteroides、Chlorobium tepidum等。
包括Prosthecochloris aestuarii、Prosthecochloris vibrioformis等。
包括Chloroherpeton thalassium等。
包括Chloronema giganteum等。
▼
⇒
有研究显示B 族链球菌定植的孕妇肠道菌群中检测到大量的绿菌门(Chlorobi),同时还有大量Lentisphaerae、Parcubacteria、Chloroflexi、Gemmatimonadetes、Acidobacteria、Fusobacteria 、 Fibrobacteres。
GBS感染孕妇的OTU水平与炎症指标存在显着相关性。表明包括绿菌门在内的多种菌改变与 GBS 阳性孕妇的炎症状态和新生儿血气指标有关。
⇒
一项研究发现,酒精性肝病患者肠道菌群中,携带的厚壁菌门(p=0.03)和绿菌门(Chlorobi)(p=0.009)的数量存在显著差异。
同样,携带绿菌门(Chlorobi)(p=0.01)和coprothermobacterota(p=0.03)的患者的肝脏失代偿严重程度也有显著差异。
扩展阅读:深度解析 | 肠道菌群与慢性肝病,肝癌
很少有关于人体肠道菌群内绿菌门的研究。可能其存在来源于饮食摄入或环境。在人体肠道中,绿菌门的作用尚不清楚,它们的作用和功能尚待进一步研究和探索。
迷踪菌门(Elusimicrobia),也称为”隐微菌门”,谷禾肠道数据库中大约1.44%的人群有检出。
它们是一类非常小的细菌,通常直径只有0.2-0.4微米。迷踪菌门的细胞壁非常薄,甚至可以说是缺乏细胞壁,这使得它们对抗生素的抵抗力较弱。
▼
迷踪菌门中的一些菌种是共生菌,与其他生物共同生活,例如Candidatus Endomicrobium trichonymphae与白蚁肠道中的Trichonympha寄生在一起,共同分解木质素。
迷踪菌门的代谢功能多样,包括产生氢气、甲烷、酒精等。迷踪菌门在生态系统中扮演着重要的角色,例如在土壤中参与有机物分解、在海洋中参与碳循环等。
▼
⇒
一项研究发现,在肥胖的2型糖尿病患者中,厚壁菌门丰度较高,而迷踪菌门(Elusimicrobia)丰度较低。
⇒
在两种大型急性辐射综合症动物模型的辐射暴露后的肠道菌群研究显示,哥廷根小型猪 (GMP)模型中的迷踪菌门在辐照后持续增加,表明它可用作肠道损伤的潜在生物标志物,以及对健康的潜在负面影响。
⇒
一项针对低质量睡眠和肠道菌群的研究显示Tenericutes 和 迷踪菌门(Elusimicrobia)在睡眠障碍患者中显著增加且与睡眠质量成正相关。
扩展阅读:肠道菌群与睡眠:双向调节
在人体肠道中,迷踪菌门的作用也还需要进一步研究。
衣原体门(Chlamydiae),革兰氏阴性细菌,是专性寄生菌,它们的生长完全在其它生物的细胞内进行。
衣原体门细菌比一般细菌小,有的比病毒小,直径约为0.2-1.5微米。通常呈球形或椭圆形,没有细胞壁,但具有外膜和内膜。
编辑
图源:Science Photo Library
最开始,科学界普遍认为衣原体门的细胞壁不含肽聚糖,然而最近已有研究显示其细胞壁上的确有肽聚糖存在,并成功辨认出几种蛋白质。
衣原体是一类专性真核细胞内寄生、具有独特发育周期、可以在多种真核生物宿主(包括人、动物、原虫等)中繁殖的细菌,不能自主生长和繁殖。
▼
在人体肠道菌群中,Chlamydiae包含以下几个菌属和菌种:
包括Chlamydia trachomatis、Chlamydia pneumoniae、Chlamydia psittaci 等。
包括Parachlamydia acanthamoebae、Parachlamydia boviseptica 等。
▼
衣原体门是一种常见的病原体,可以引起多种疾病,包括性传播疾病、肺炎、结膜炎等。
衣原体的类型和相关疾病已知的与人类疾病有关的衣原体有三种,分别是鹦鹉热衣原体、沙眼衣原体和肺炎衣原体。这三种衣原体均可引起肺部感染。
鹦鹉热衣原体可通过感染有该种衣原体的禽类,如鹦鹉、孔雀、鸡、鸭、鸽等的组织、血液和粪便,以接触和吸入的方式感染给人类。
沙眼衣原体和肺炎衣原体主要在人类之间以呼吸道飞沫、母婴接触和性接触等方式传播。
▼
在谷禾肠道菌群数据库中大约有0.14%的人群有检出。
如果肠道感染衣原体,因感染肠道黏膜细胞可能导致腹泻、腹痛、恶心和呕吐,还可能会引发发热;腹泻和呕吐可能导致脱水、营养不良。
总之,衣原体作为一类常见的病原体,引起多种疾病,需要引起足够的重视和预防。
更多关于衣原体的介绍详见:
肠道微生物群一直伴随着人类的进化,并在人类的健康生活和高质量长寿中扮演着不可忽视的重要角色。
随着人类活动范围的不断扩大,一些以前未曾接触过的微生物会通过各种途径进入人体肠道,从而有机会在人体内生存和繁殖,并在人际之间传播。
同时,随着工业化的发展,我们原有的肠道菌群也面临着挑战,逐渐接受新的菌群、新的食物和添加剂等。
肠道菌群中一些占比较少的菌属,对人体健康和疾病的影响虽然研究较少,但这并不意味着它们的作用微弱。这些小众门派的菌属在自然界经过数亿年的进化选择,能够适应更恶劣的环境和在更寡营养条件下生存。此外,一些菌属具有特定的代谢功能,这些功能对我们的身体产生何种影响,以及它们如何影响人类的大尺度进化,都值得关注和研究。
尽管这些菌门的研究相对较少,但已经发现了一些有意思的结果。例如:
Akkermansia可以帮助减轻肥胖、改善胰岛素抵抗和代谢综合征等问题;具核梭杆菌(Fusobacterium nucleatum)与口腔疾病和肠炎结直肠癌的发病关系。莱姆病的罪魁祸首为伯氏疏螺旋体(Borrelia burgdorferi)。
在大人群水平上研究和探索这些菌属的来源及其代谢与人体健康的关系,将有助于发现和完善肠道菌群对人体健康的作用。这将为我们提供更好的方法来预防和治疗与肠道菌群相关的疾病,从而提高人类的健康水平。
主要参考文献:
Heinz Schlesner, Cheryl Jenkins,James T. Staley.The Phylum Verrucomicrobia: A Phylogenetically Heterogeneous Bacterial Group. The Prokaryotes pp 881–896
Hu C, Rzymski P. Non-Photosynthetic Melainabacteria (Cyanobacteria) in Human Gut: Characteristics and Association with Health. Life (Basel). 2022 Mar 25;12(4):476. doi: 10.3390/life12040476. PMID: 35454968; PMCID: PMC9029806.
Verma D, Garg PK, Dubey AK. Insights into the human oral microbiome. Arch Microbiol. 2018 May;200(4):525-540. doi: 10.1007/s00203-018-1505-3. Epub 2018 Mar 23. PMID: 29572583.
Doocey CM, Finn K, Murphy C, Guinane CM. The impact of the human microbiome in tumorigenesis, cancer progression, and biotherapeutic development. BMC Microbiol. 2022 Feb 12;22(1):53. doi: 10.1186/s12866-022-02465-6. PMID: 35151278; PMCID: PMC8840051.
ohn D. Coates. (2010). Phylum XVII. Acidobacteria phyl. nov.
Miriam Gonçalves de Chaves. (2019). Acidobacteria Subgroups and Their Metabolic Potential for Carbon Degradation in Sugarcane Soil Amended With Vinasse and Nitrogen Fertilizers.
Sadaf Kalam et al. (2020). Recent Understanding of Soil Acidobacteria and Their Ecological Significance: A Critical Review.
Anna M. Kielak et al. (2016). The Ecology of Acidobacteria: Moving beyond Genes and Genomes.
Bong Suk Shim. (2011). Current Concepts in Bacterial Sexually Transmitted Diseases.
Jones and Bartlett Learning. Infectious Diseases Affecting the Respiratory System.
Yu-Jie Zhang, Sha Li, Ren-You Gan, and Tong Zhou. (2015). Impacts of Gut Bacteria on Human Health and Diseases.
Caitlin A. Brennan and Wendy S. Garrett. (2019). Fusobacterium nucleatum — symbiont, opportunist and oncobacterium.
K. W. Bennett and A. Eley. (1993). K. Fusobacteria: New taxonomy and related diseases Free.
Kevin Afra, Kevin Laupland, Jenine Leal, Tracie Lloyd, and Daniel Gregson. (2013). Incidence, risk factors, and outcomes of Fusobacterium species bacteremia.
Radhey Gupta and Mohit Sethi. (2014). Phylogeny and Molecular Signatures for the Phylum Fusobacteria and its Distinct Subclades.
John D. Coates. (2010). Phylum XVII. Acidobacteria phyl. nov.
Miriam Gonçalves de Chaves. (2019). Acidobacteria Subgroups and Their Metabolic Potential for Carbon Degradation in Sugarcane Soil Amended With Vinasse and Nitrogen Fertilizers.
Sadaf Kalam et al. (2020). Recent Understanding of Soil Acidobacteria and Their Ecological Significance: A Critical Review.
Anna M. Kielak et al. (2016). The Ecology of Acidobacteria: Moving beyond Genes and Genomes.
Zheng R, Liu R, Shan Y, Cai R, Liu G, Sun C. Characterization of the first cultured free-living representative of Candidatus Izemoplasma uncovers its unique biology. ISME J. 2021 Sep;15(9):2676-2691. doi: 10.1038/s41396-021-00961-7. Epub 2021 Mar 21. PMID: 33746205; PMCID: PMC8397711.
Bhandari V, Gupta RS. Molecular signatures for the phylum Synergistetes and some of its subclades. Antonie Van Leeuwenhoek. 2012 Nov;102(4):517-40. doi: 10.1007/s10482-012-9759-2. Epub 2012 Jun 19. PMID: 22711299.
Wang Z, Pu W, Liu Q, et al. Association of Gut Microbiota Composition in Pregnant Women Colonized with Group B Streptococcus with Maternal Blood Routine and Neonatal Blood-Gas Analysis. Pathogens. 2022;11(11):1297. Published 2022 Nov 4. doi:10.3390/pathogens11111297
He H, Lin M, You L, Chen T, Liang Z, Li D, Xie C, Xiao G, Ye P, Kong Y, Zhou Y. Gut Microbiota Profile in Adult Patients with Idiopathic Nephrotic Syndrome. Biomed Res Int. 2021 Feb 18;2021:8854969. doi: 10.1155/2021/8854969. PMID: 33681383; PMCID: PMC7910048.
Zhang J, Zhang X, Zhang K, et al. The Component and Functional Pathways of Gut Microbiota Are Altered in Populations with Poor Sleep Quality – A Preliminary Report. Pol J Microbiol. 2022;71(2):241-250. Published 2022 Jun 19. doi:10.33073/pjm-2022-021
Carbonero F, Mayta A, Bolea M, et al. Specific Members of the Gut Microbiota are Reliable Biomarkers of Irradiation Intensity and Lethality in Large Animal Models of Human Health. Radiat Res. 2019;191(1):107-121. doi:10.1667/RR14975.1
Lage OM, Bondoso J. Planctomycetes and macroalgae, a striking association. Front Microbiol. 2014 Jun 3;5:267. doi: 10.3389/fmicb.2014.00267. PMID: 24917860; PMCID: PMC4042473.
Kaboré OD, Godreuil S, Drancourt M. Planctomycetes as Host-Associated Bacteria: A Perspective That Holds Promise for Their Future Isolations, by Mimicking Their Native Environmental Niches in Clinical Microbiology Laboratories. Front Cell Infect Microbiol. 2020 Nov 30;10:519301. doi: 10.3389/fcimb.2020.519301. PMID: 33330115; PMCID: PMC7734314.
Bell A, Severi E, Owen CD, Latousakis D, Juge N. Biochemical and structural basis of sialic acid utilization by gut microbes. J Biol Chem. 2023 Feb 8;299(3):102989. doi: 10.1016/j.jbc.2023.102989. Epub ahead of print. PMID: 36758803; PMCID: PMC10017367.
Wang J, Wang Y, Gao W, Wang B, Zhao H, Zeng Y, Ji Y, Hao D. Diversity analysis of gut microbiota in osteoporosis and osteopenia patients. PeerJ. 2017 Jun 15;5:e3450. doi: 10.7717/peerj.3450. PMID: 28630804; PMCID: PMC5474093.
Bakhti SZ, Latifi-Navid S. Interplay and cooperation of Helicobacter pylori and gut microbiota in gastric carcinogenesis. BMC Microbiol. 2021 Sep 23;21(1):258. doi: 10.1186/s12866-021-02315-x. PMID: 34556055; PMCID: PMC8461988.
Glover JS, Ticer TD, Engevik MA. Characterizing the mucin-degrading capacity of the human gut microbiota. Sci Rep. 2022 May 19;12(1):8456. doi: 10.1038/s41598-022-11819-z. PMID: 35589783; PMCID: PMC9120202.
Wu N, Zhou J, Mo H, Mu Q, Su H, Li M, Yu Y, Liu A, Zhang Q, Xu J, Yu W, Liu P, Liu G. The Gut Microbial Signature of Gestational Diabetes Mellitus and the Association With Diet Intervention. Front Cell Infect Microbiol. 2022 Jan 14;11:800865. doi: 10.3389/fcimb.2021.800865. PMID: 35096649; PMCID: PMC8795975.
Castillo-Álvarez F, Pérez-Matute P, Oteo JA, Marzo-Sola ME. The influence of interferon β-1b on gut microbiota composition in patients with multiple sclerosis. Neurologia (Engl Ed). 2021 Sep;36(7):495-503. doi: 10.1016/j.nrleng.2020.05.006. Epub 2020 May 31. PMID: 34537163.
Zhang Y, Lu S, Yang Y, Wang Z, Wang B, Zhang B, Yu J, Lu W, Pan M, Zhao J, Guo S, Cheng J, Chen X, Hong K, Li G, Yu Z. The diversity of gut microbiota in type 2 diabetes with or without cognitive impairment. Aging Clin Exp Res. 2021 Mar;33(3):589-601. doi: 10.1007/s40520-020-01553-9. Epub 2020 Apr 16. PMID: 32301029.
Harakeh S, Angelakis E, Karamitros T, Bachar D, Bahijri S, Ajabnoor G, Alfadul SM, Farraj SA, Al Amri T, Al-Hejin A, Ahmed A, Mirza AA, Didier R, Azhar EI. Impact of smoking cessation, coffee and bread consumption on the intestinal microbial composition among Saudis: A cross-sectional study. PLoS One. 2020 Apr 29;15(4):e0230895. doi: 10.1371/journal.pone.0230895. PMID: 32348307; PMCID: PMC7190147.
Fuerst JA, Sagulenko E. Beyond the bacterium: planctomycetes challenge our concepts of microbial structure and function. Nat Rev Microbiol. 2011 Jun;9(6):403-13. doi: 10.1038/nrmicro2578. PMID: 21572457.
Gong X, Liu X, Chen C, Lin J, Li A, Guo K, An D, Zhou D, Hong Z. Alteration of Gut Microbiota in Patients With Epilepsy and the Potential Index as a Biomarker. Front Microbiol. 2020 Sep 18;11:517797. doi: 10.3389/fmicb.2020.517797. PMID: 33042045; PMCID: PMC7530173.
Yuan X, Chen R, McCormick KL, Zhang Y, Lin X, Yang X. The role of the gut microbiota on the metabolic status of obese children. Microb Cell Fact. 2021 Feb 27;20(1):53. doi: 10.1186/s12934-021-01548-9. PMID: 33639944; PMCID: PMC7916301..
Zhuang X, Tian Z, Li L, Zeng Z, Chen M, Xiong L. Fecal Microbiota Alterations Associated With Diarrhea-Predominant Irritable Bowel Syndrome. Front Microbiol. 2018 Jul 25;9:1600. doi: 10.3389/fmicb.2018.01600. PMID: 30090090; PMCID: PMC6068233.
Polo PG, Çolak-Al B, Sentürk H, Rafiqi AM. Gut bacteria after recovery from COVID-19: a pilot study. Eur Rev Med Pharmacol Sci. 2022 Nov;26(22):8599-8611. doi: 10.26355/eurrev_202211_30397. PMID: 36459041.
Dix C, Wright O. Bioavailability of a Novel Form of Microencapsulated Bovine Lactoferrin and Its Effect on Inflammatory Markers and the Gut Microbiome: A Pilot Study. Nutrients. 2018 Aug 17;10(8):1115. doi: 10.3390/nu10081115. PMID: 30126153; PMCID: PMC6115941.
Sánchez-Quinto A, Cerqueda-García D, Falcón LI, Gaona O, Martínez-Correa S, Nieto J, G-Santoyo I. Gut Microbiome in Children from Indigenous and Urban Communities in México: Different Subsistence Models, Different Microbiomes. Microorganisms. 2020 Oct 16;8(10):1592. doi: 10.3390/microorganisms8101592. PMID: 33081076; PMCID: PMC7602701.
Stewart OA, Wu F, Chen Y. The role of gastric microbiota in gastric cancer. Gut Microbes. 2020 Sep 2;11(5):1220-1230. doi: 10.1080/19490976.2020.1762520. Epub 2020 May 23. PMID: 32449430; PMCID: PMC7524314.
Chen S, Zheng Y, Zhou Y, Guo W, Tang Q, Rong G, Hu W, Tang J, Luo H. Gut Dysbiosis with Minimal Enteritis Induced by High Temperature and Humidity. Sci Rep. 2019 Dec 10;9(1):18686. doi: 10.1038/s41598-019-55337-x. PMID: 31822775; PMCID: PMC6904617.
Do MH, Lee HB, Oh MJ, Jhun H, Choi SY, Park HY. Polysaccharide fraction from greens of Raphanus sativus alleviates high fat diet-induced obesity. Food Chem. 2021 May 1;343:128395. doi: 10.1016/j.foodchem.2020.128395. Epub 2020 Oct 15. PMID: 33268179.
Phillippi DT, Daniel S, Pusadkar V, Youngblood VL, Nguyen KN, Azad RK, McFarlin BK, Lund AK. Inhaled diesel exhaust particles result in microbiome-related systemic inflammation and altered cardiovascular disease biomarkers in C57Bl/6 male mice. Part Fibre Toxicol. 2022 Feb 9;19(1):10. doi: 10.1186/s12989-022-00452-3. PMID: 35135577; PMCID: PMC8827295.
Nuli R, Cai J, Kadeer A, Zhang Y, Mohemaiti P. Integrative Analysis Toward Different Glucose Tolerance-Related Gut Microbiota and Diet. Front Endocrinol (Lausanne). 2019 May 27;10:295. doi: 10.3389/fendo.2019.00295. PMID: 31191448; PMCID: PMC6546033.
Zhong Y, Nyman M, Fåk F. Modulation of gut microbiota in rats fed high-fat diets by processing whole-grain barley to barley malt. Mol Nutr Food Res. 2015 Oct;59(10):2066-76. doi: 10.1002/mnfr.201500187. Epub 2015 Aug 26. PMID: 26184884.
Shafiee NH, Razalli NH, Muhammad Nawawi KN, Mohd Mokhtar N, Raja Ali RA. Implication of food insecurity on the gut microbiota and its potential relevance to a multi-ethnic population in Malaysia. JGH Open. 2022 Feb 1;6(2):112-119. doi: 10.1002/jgh3.12709. PMID: 35155820; PMCID: PMC8829104.
Lee KC, Herbold CW, Dunfield PF, Morgan XC, McDonald IR, Stott MB. Phylogenetic delineation of the novel phylum Armatimonadetes (former candidate division OP10) and definition of two novel candidate divisions. Appl Environ Microbiol. 2013 Apr;79(7):2484-7. doi: 10.1128/AEM.03333-12. Epub 2013 Feb 1. PMID: 23377935; PMCID: PMC3623213.

谷禾健康

人类肠道微生物组是一个多样化的生态系统,我们已经知道,它在多个器官系统健康中发挥着重要作用,肠道微生态失调可能导致各种常见疾病,如糖尿病、神经精神疾病、癌症等。
新的研究表明,肠道微生物组的改变与眼部疾病相关。
基于小鼠实验,已经开始对人类微生物组及其与眼部病理学的关系进行临床研究。
葡萄膜炎、年龄相关性黄斑变性、青光眼、干眼综合征和霰粒肿等病理学正在探索中,对微生物组的深入研究可能扩展这些疾病的治疗方案。

本文总结目前检查肠-眼轴的临床研究,尤其是改变微生物组来缓解眼部疾病的潜在治疗方法。
研究发现,10% 的炎症性肠病患者会出现眼部疾病(巩膜外层炎、葡萄膜炎、结膜炎等)。肠道和与之相对较远的眼睛之间有什么关联?我们从以下几个方面来看:
▼
视网膜是眼睛后部的一层,里面装满了神经细胞,可以捕获图像并将其发送到大脑。
在所有的眼组织中,从免疫的角度来看,视网膜被认为是一种特权组织。它有三层保护(内部的血液-视网膜屏障;外层血视网膜屏障;以及血水屏障),以及通过“抵抗”和“容忍”策略,来保护它免受来自内部和外部环境的伤害。
这些血液视网膜屏障的变化可能通过募集炎症细胞和随后的眼内炎症导致视网膜疾病的发展,例如葡萄膜炎。
此外,它还受到自身防御系统的保护,如小胶质细胞和补体系统,以维持视网膜稳态。
视网膜由于更新和修复能力差而非常脆弱,因此即使是轻微的损伤也会产生毁灭性的后果。
年龄相关性黄斑变性是一种全身免疫性疾病,局部表现为眼部免疫环境下调所致。免疫反应改变的迹象表现为先在视网膜色素上皮中逐渐积累,后在玻璃膜疣中逐渐积累的沉积物,构成有利于免疫系统显著激活的抗原刺激。
在衰老过程中,所有防御系统的效率都会降低,与年龄相关的形态功能和免疫变化伴随着慢性低水平炎症。“炎症”过程也会导致与年龄相关的视网膜疾病。
▼
眼睛的物理变化被认为是由于肠道内壁的炎症与肠道通透性增加有关。肠道通透性/肠漏综合征的变化允许细菌、毒素或免疫化合物穿过粘膜肠道屏障并传播到不同位置,包括眼睛表面。这些化合物直接影响眼睛或可能通过分子模拟引发眼睛的免疫反应。分子模拟是一种可能引发自身免疫性炎症的机制,因为保护屏障受损以及细菌或毒素的长期存在。
扩展阅读:
▼
在许多层面上,肠道微生物群和免疫化合物与眼睛的视网膜相互作用。不健康、失调的肠道微生物群和活化的免疫细胞会在眼睛中引发炎症,并影响视网膜、眼睛微生物组和眼睛润滑,从而导致眼部相关疾病。
肠道微生物组及其代谢物,尤其是短链脂肪酸,都可以通过直接或间接修改不同细胞类型的表观基因组来调节免疫细胞的关键功能。
损害眼睛的危及视力的免疫反应是眼内炎症性疾病的典型特征。葡萄膜炎、年龄相关性黄斑变性、与干眼症相关的干燥综合征、糖尿病视网膜病变、青光眼和感染性角膜炎与肠道微生物组异常有关。
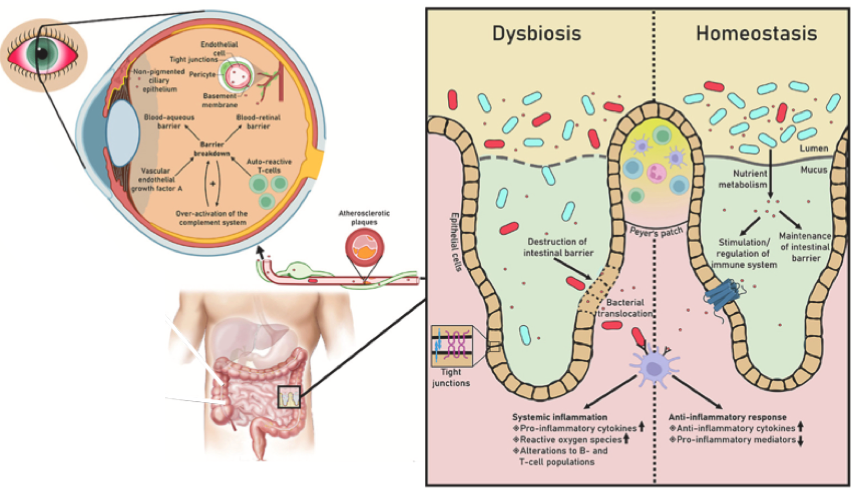
doi.org/10.1016/j.preteyeres.2022.101117
接下来,我们来看一下具体哪些肠道菌群与眼部相关疾病有关。
▼
在糖尿病视网膜病变中,与健康对照组相比,主要的分类门,包括拟杆菌门、放线菌门、粪杆菌门和梭菌门被耗尽。
在两项评估糖尿病视网膜病变队列中微生物组多样性的研究中,发现多样性下降,这与临床前小鼠模型一致。
▼
与对照小鼠相比,Bacteroides caecimuris在患病小鼠中显着增高。受影响的小鼠缺少健康肠道微生物组典型的菌群,如Rikenella,Muribaculaceae, Prevotellaceae UCG-001, Bacilli 等。
肠道微生物组变化与眼部疾病之间的联系可以通过多种机制来解释。肠道生态失调可以有利于增加肠道通透性,允许微生物及其代谢物诱导眼细胞炎症。微生物失衡也可能是血液视网膜屏障破裂和中枢神经系统氧化应激增加的原因。所有这些假设也可以解释视网膜色素变性小鼠模型中的神经炎症,氧化应激和细胞死亡。
▼
年龄相关性黄斑变性( ARMD )是一种多因素疾病,由遗传和环境因素的复杂组合引起。
与改变的肠道微生物群相关的肠道通透性增加,允许肠道代谢物和产物的更高易位,可能调节视网膜特异性免疫细胞。有趣的是,LPS 引起的慢性炎症会加速营养不良 P23H 大鼠的神经变性,导致营养不良视网膜的形态和生理紊乱恶化。
宏基因组测序评估了 ARMD 患者和对照组,研究人员发现 ARMD 患者中以下菌群含量较高 :
而以下菌群在对照组中含量较高:
研究人员推测可能与谷氨酸降解和精氨酸生物合成途径增加有关。谷氨酸是一种众所周知的视网膜兴奋性神经递质,因此其减少可能导致视网膜神经传递不足。
关于谷氨酸代谢详见:兴奋神经递质——谷氨酸与大脑健康
此外,患者也缺乏负责脂肪酸延伸途径的细菌。在这方面,长链多不饱和脂肪酸可能对视网膜生理学产生关键影响,并可能促进ARMD发展。
相比之下,对照组中Bacteroides eggerthii 的丰度可能对该疾病具有保护作用,因为它能够产生短链脂肪酸。这些代谢产物可能通过改变淋巴细胞从肠道向眼睛的迁移来调节眼内炎症。
▼
一项针对12名新生血管性年龄相关性黄斑变性(nAMD)患者的试验发现,与对照组相比,nAMD患者存在“微生态失调”。值得注意的是,研究人员发现了Anaerotruncus的增加,这也与小鼠模型中炎症信号的增加有关,这表明肠道微生物变化和nAMD进展相关的可能作用机制。
▼
在青光眼患者中,研究人员发现肠易激综合征是一种与微生物群失调相关的疾病,会显著增加患青光眼的几率(OR=5.84)。
除了发现青光眼患者与对照组的细菌谱存在差异外,还注意到视觉效果与巨单胞菌和Blautia属的丰度呈负相关。
扩展阅读:
肠道核心菌属——巨单胞菌属(Megamonas),不同人群差异大
肠道核心菌属——经黏液真杆菌属(Blautia),炎症肥胖相关的潜力菌
▼
一项视网膜研究了一组特发性颅内高压患者,再次发现与对照组相比微生物群存在差异。
有趣的是,使用乙酰唑胺治疗的患者发现乳酸杆菌增加,这被认为对肠道微生物健康有益。
总的来说,在眼部病理中,菌群可能发生改变或破坏,见下表:
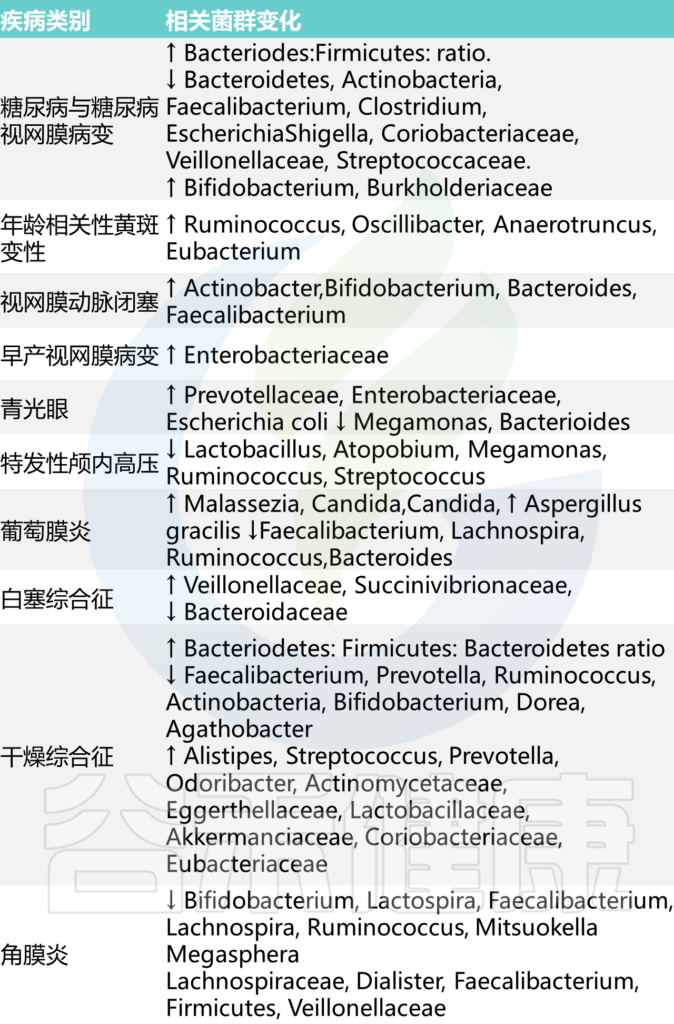
Russell MW, et al., Eye (Lond). 2023
肠道微生物组可以调节炎症信号的变化。因此,如果肠道组织受到影响,导致全身促炎状态,那么眼部后果可能是继发于或平行于肠道炎症轴的,或者可能在主要过程中有所不同。
▼
在葡萄膜炎的情况下检查了肠道失调,发现各种抗炎微生物群减少。但也有研究人员注意到葡萄膜炎的肠道失调,病例和对照组之间的没有显著差异,研究人员认为细菌可能与这种病理状态无关。
进一步探讨这种可能性,有研究人员发现,与对照患者相比,致病性念珠菌属和曲霉菌属增加了。另一项研究发现与对照患者相比,角膜炎患者的肠道失调,这两项研究都发现了标记的细菌群落变化。这些研究也检测了真菌的变化,注意到致病性曲霉、念珠菌和马拉色菌增加的趋势,这些真菌已被证明表现出抗真菌耐药性并参与其他疾病过程。
两项试验检测了白塞病葡萄膜炎患者的微生物群差异,发现病例和对照组之间存在显著差异。白塞病患者的微生物群多样性也显著降低。上述数据表明肠道健康和眼部病理之间可能存在联系。
然而,目前尚不清楚真菌和细菌是否直接介导眼部病理,是否与免疫系统有关,或者是否有其他未发现的途径在起作用。
扩展阅读:膳食真菌在癌症免疫治疗中的作用: 从肠道微生物群的角度
▼
研究人员发现,视网膜动脉阻塞(RAO)患者与健康对照相比,不同分类属的细菌有所增加。这项研究还发现RAO患者的三甲胺-N-氧化物(TMAO)显著增加,TMAO是一种微生物群衍生的代谢产物,已被发现是心血管不良事件、死亡率和血栓形成的独立风险因素。
在这项研究中,TMAO和阿克曼菌Akkermansia丰度呈正相关,表明微生物群和RAO之间存在潜在的机制联系。然而,必须注意的是,在其他研究中,Akkermansia被发现与TMAO浓度呈负相关,这表明TMAO可能不是病因,或者,TMAO本身可以在眼部病理学中发挥中介或主要作用。如上所述,这项研究并不是为了证明一种联系,也不是为了简单地假设一种联系的存在。
肠道微生态失调的眼部临床研究

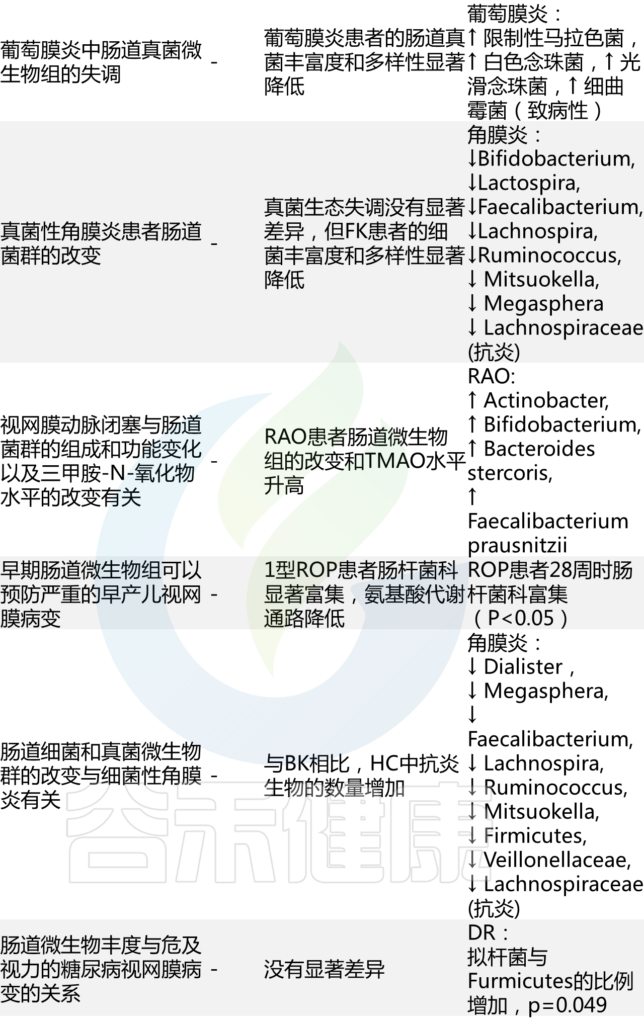
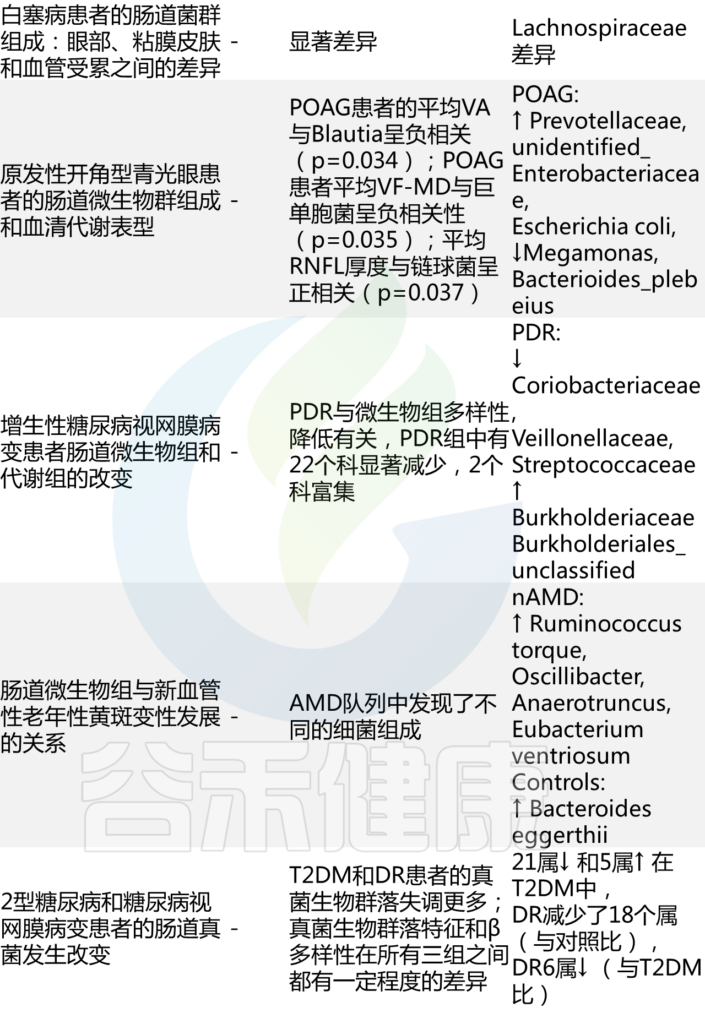
Russell MW, et al., Eye (Lond). 2023
有四项临床研究(≤23名患者)通过粪菌移植(FMT)或益生菌补充靶向肠道微生物群,来治疗眼部疾病。
▼
Watane等人于2021年对10例干燥综合征并发干眼症的患者进行了粪菌移植。粪菌移植后三个月,没有副作用报告,患者自我报告的干眼症症状在一半的队列中减轻了。
▼
Filippelli等人于2021和2022年对10名成人和13名儿童患者的益生菌补充剂及其治疗霰粒肿的疗效进行了研究。在这两项研究中,均使用了含有嗜热链球菌、乳酸乳球菌和德氏乳杆菌的益生菌。所有接受益生菌制剂治疗的成年患者霰粒肿消退时间显著缩短,而这种影响对于只有小于2.0mm的小霰粒肿的儿童来说也是如此。
Napolitano等人于2021报道了一例有三年前葡萄膜炎病史的患者的病例。患者服用了含有乳酸双歧杆菌、两歧双歧杆菌和短双歧杆菌的益生菌补充剂。两个月后,该患者的视觉功能增加,葡萄膜炎的临床症状减少。益生菌配方并不包括患者微生物组中不存在的物种。
扩展阅读:如果你要补充益生菌 ——益生菌补充、个体化、定植指南
除了以上的临床研究外,其他可能的干预措施:
▼
高纤维饮食会促进某些细菌在肠道中占据优势地位,这些细菌会产生短链脂肪酸,促进调节性 T 细胞分化,并降低发生眼部炎症的倾向。一些实验正在直接使用短链脂肪酸来测试它作为肠外自身免疫性疾病的治疗干预,已有研究人员发现,在小鼠身上,它对自身免疫性葡萄膜炎有保护作用。
▼
一项涉及衰老小鼠的研究中,高血糖饮食导致光感受器退化和视网膜色素上皮细胞萎缩,这在喂食正常饮食的小鼠中是看不到的。恢复到低血糖饮食可以逆转疾病的特征,并改变肠道中 AMD 保护因子(包括血清素)的水平。
▼
高脂饮食会导致肠道渗透性增加,从而使细菌产物如脂多糖和其他病原体相关分子模式的分子易位增加,它们通过先天免疫系统的模式识别受体 ( 特别是Toll样受体和Nod样受体)影响促炎信号转导,引起低度全身性炎症,加剧脉络膜新生血管形成,最终加重病理性血管生成。
在一项研究中,在4周龄的C57BL/6小鼠中研究了高脂肪饮食对泪腺功能的影响。结果显示,高脂饮食的小鼠表现出病理变化,包括眼泪分泌水平降低、炎症性CD4+T细胞增加 ,细胞浸润、TNF-α和IL-1β等促炎因子增加以及腺泡和肌上皮细胞凋亡增加。将标准饮食引入之前高脂肪饮食的小鼠后,泪腺的病理变化部分逆转,包括炎症细胞和促炎因子的减少以及抗炎胞质分裂素的上调。
▼
在啮齿动物模型中,在开始隔日禁食方案后的 1 周内,间歇性禁食已被证明可以降低血压和心率,这两者都是 糖尿病性视网膜病变等眼部血管疾病的已知危险因素。
另一项早期限时喂养(从早上 8 点到下午 2 点随意喂养,剩下的 18 小时禁食)被证明可以降低餐后胰岛素、血压、氧化应激和夜间食欲同时增加人类受试者的胰岛素敏感性和 β 细胞功能。这项研究和其他研究进一步支持间歇性禁食的有益作用,并表明它可能通过降低血压和胰岛素敏感性来治疗眼部血管疾病。
连续 7 个月的隔日禁食,增加了产生肠粘液的杯状细胞的数量,并降低了血浆 PGN 的浓度,表明肠血管屏障完整性得到改善。
▼
动物研究表明,锌通过减少氧化应激来改善视网膜的抗氧化过程。特别是,肠道菌群竞争锌的供应,锌对共生代谢途径和细菌毒力因子都很有用。然而,锌缺乏及其过量的存在都会改变微生物组的组成。
▼
膳食补充类胡萝卜素和锌可以预防或延缓眼部疾病的进展,可能是通过它们的抗氧化和抗炎特性。叶黄素和玉米黄质两种叶黄素,它们天然集中在人眼的黄斑中。它们充当蓝光的光学滤光片,并作为常驻抗氧化剂和自由基清除剂,以减少氧化应激引起的损伤。
由于人类无法合成类胡萝卜素,因此供应取决于含类胡萝卜素的食物,例如绿叶蔬菜、西兰花、豌豆、玉米和蛋黄。
▼
大量摄入 omega-3 长链多不饱和脂肪酸 (LCPUFA) 与年龄相关黄斑变性风险降低有关。而大量摄入 omega-6 LCPUFA 与风险增加有关。LCPUFAs高度集中在眼睛中,对视网膜的视觉功能至关重要。此外,它们是对氧化应激的促炎和抗炎免疫反应的重要调节剂。ω-3和ω-6 LCPUF之间的比例似乎对预防慢性低度炎症很重要。可以通过某些富含脂肪的鱼,亚麻籽和藻类等补充。
▼
膳食多酚可减少氧化应激,在视网膜色素上皮细胞中具有抗炎作用,并与各种白细胞介素和信号通路的调节有关。在丁香、浆果、红酒或绿茶中富含。
其他对眼部健康至关重要的营养物质包括:
维生素 A、番茄红素、硫辛酸、维生素 C、姜黄素、白藜芦醇、槲皮素、葡萄籽提取物、绿茶提取物等。
微生物组的复杂性对研究微生物变化有挑战,因为微生态失调可能归因于多种菌群的同时过度生长或损失。目前的文献并没有直接分析出因果关系。
除了目前的试验涉及的非特异性干预之外,其他干预措施也可能有效果。一项对36名患者进行的17周的随机前瞻性研究表明,通过逐步引入发酵食品等相对不那么激烈的措施,可以对免疫功能产生类似的影响。
关于发酵食品详见:肠道微生物群与健康:探究发酵食品、饮食方式、益生菌和后生元的影响
也有研究人员认为,应该谨慎采用通过改变微生物组来改善系统健康的干预措施。30名患者使用益生菌增加微生物多样性,然而却因这种补充而患上了小肠细菌过度生长和D-乳酸酸中毒。开始抗生素治疗后,患者症状减轻(P=0.005)。
由于许多原因,选择与疾病相关的正确益生菌并不容易。同一属和种的不同菌株可能对宿主产生完全不同的影响。应充分了解特定细菌菌株的特定特性和特征以及对宿主健康的影响。
因此,需要更大规模的前瞻性临床试验研究益生菌补充剂对各种眼部疾病的影响,对于进一步阐明这些干预措施的疗效至关重要。有必要研究在剂量和配方方面选择更合适的益生菌方案。
为了建立肠道菌群与眼部病变缓解之间的因果治疗关系,未来的研究可能考虑将微生物组-免疫-眼部效应与纯粹的微生物组-眼部效应分离开来。
临床试验检查了肠道微生物群和眼部病理之间的联系,显示了这两个系统之间的联系。
通过饮食、益生元和益生菌以及粪菌移植等方式调节肠道微生物群,可能都会成为预防和/或治疗眼部疾病的有效方案。
充分结合肠道菌群检测全面评估患者的菌群健康状况,可以考虑采用更有针对性的干预措施,而不仅仅是粪菌移植和益生菌补充剂。
大规模的随机对照临床试验可能会进一步证明这种联系,并阐明新的靶点治疗机制。
主要参考文献:
Zysset-Burri DC, Morandi S, Herzog EL, Berger LE, Zinkernagel MS. The role of the gut microbiome in eye diseases. Prog Retin Eye Res. 2023 Jan;92:101117. doi: 10.1016/j.preteyeres.2022.101117. Epub 2022 Sep 6. PMID: 36075807.
Napolitano P, Filippelli M, Davinelli S, Bartollino S, dell’Omo R, Costagliola C. Influence of gut microbiota on eye diseases: an overview. Ann Med. 2021 Dec;53(1):750-761. doi: 10.1080/07853890.2021.1925150. PMID: 34042554; PMCID: PMC8168766.
Russell MW, Muste JC, Kuo BL, Wu AK, Singh RP. Clinical trials targeting the gut-microbiome to effect ocular health: a systematic review. Eye (Lond). 2023 Mar 14. doi: 10.1038/s41433-023-02462-7. Epub ahead of print. PMID: 36918627.
Shivaji S. A systematic review of gut microbiome and ocular inflammatory diseases: Are they associated? Indian J Ophthalmol. 2021 Mar;69(3):535-542. doi: 10.4103/ijo.IJO_1362_20. PMID: 33595467; PMCID: PMC7942081.
Bai X, Xu Q, Zhang W, Wang C. The Gut-Eye Axis: Correlation Between the Gut Microbiota and Autoimmune Dry Eye in Individuals With Sjögren Syndrome. Eye Contact Lens. 2023 Jan 1;49(1):1-7. doi: 10.1097/ICL.0000000000000953. Epub 2022 Nov 11. PMID: 36544282.
Scuderi G, Troiani E, Minnella AM. Gut Microbiome in Retina Health: The Crucial Role of the Gut-Retina Axis. Front Microbiol. 2022 Jan 14;12:726792. doi: 10.3389/fmicb.2021.726792. PMID: 35095780; PMCID: PMC8795667.

谷禾健康

癌症是一种恶性肿瘤,它可以发生在人体的任何部位,包括肺、乳房、结肠、胃、肝、宫颈等。根据世界卫生组织的数据,全球每年有超过1800万人被诊断出患有癌症,其中约有1000万人死于癌症。癌症已成为全球范围内的主要健康问题之一。
癌症免疫疗法的概念在很早前就提出,但直到最近才被广泛接受为对抗癌症的新型选择。随着现代生物医学技术的发展,已经开发了各种类型的免疫治疗策略。
然而,癌症患者对免疫疗法的个体反应各不相同,并且经常观察到严重的副作用,这限制了这种新方法的进一步利用。
近年来的研究表明,肠道微生物群在免疫疗法的效果及副作用中的起到一定的介导作用,因为某些微生物物种或相关代谢物与癌症患者的反应密切相关。
已经对植物或动物天然产品的营养价值以及它们对肠道微生物群和肿瘤免疫疗法的调节进行了大量研究。膳食真菌因其丰富的营养价值和对人体的调节功能而成为近年来的研究热点。
本文将重点介绍天然产物中膳食真菌的摄入与肠道微生物群调节之间的关系,以及它们在癌症免疫治疗中的生物学作用和潜在机制。
本文出现的专业名词
CTLA-4(细胞毒性T淋巴细胞相关蛋白4),是一种蛋白受体,其作为免疫检查点起作用并下调免疫应答。
PD-1(程序性死亡受体1),是一种重要的免疫抑制分子。通过向下调节免疫系统对人体细胞的反应,以及通过抑制T细胞炎症活动来调节免疫系统并促进自身耐受。
PDL1(细胞程序性死亡-配体1),是一种跨膜蛋白,细胞程序性死亡受体-1(PD-1)与细胞程序性死亡-配体1(PD-L1)结合,可以传导抑制性的信号,减低淋巴结CD8+ T细胞的增生与免疫系统的抑制有关。
CAR-T细胞:技术人员通过基因工程技术,将T细胞激活,并装上定位导航装置CAR(肿瘤嵌合抗原受体),专门识别体内肿瘤细胞,并通过免疫作用释放大量的多种效应因子,它们能高效地杀灭肿瘤细胞,从而达到治疗恶性肿瘤的目的。
什么是癌症免疫疗法?
癌症免疫疗法是一种治疗癌症的新型方法,它利用人体自身的免疫系统来攻击癌细胞。传统的癌症治疗方法如化疗、放疗等是通过外源性方式杀死癌细胞来治疗癌症,但这些方法也会对正常细胞造成损伤。而免疫疗法则是通过激活或增强人体自身的免疫系统来攻击癌细胞,从而达到治疗癌症的目的。
癌症免疫疗法的优点是可以避免传统癌症治疗方法的副作用,同时可以提高患者的生存率和生活质量。然而,癌症免疫疗法仍然存在一些挑战和限制,如个体间治疗效果差异较大、治疗费用较高等问题,但其作为治疗癌症的新兴手段有着不错的前景。因此,目前仍需要进一步的研究和发展,以提高癌症免疫疗法的治疗效果和安全性。
免疫检查点阻断疗法(ICB)
免疫检查点阻断疗法(ICB)是一种新型的癌症免疫疗法,它通过阻断肿瘤细胞和免疫细胞之间的信号传导通路,从而激活免疫系统攻击癌细胞。
在正常情况下,免疫系统会通过检查点来控制和限制免疫细胞的活性,以避免对正常细胞的攻击。但是,癌细胞可以利用这种机制来逃避免疫系统的攻击,从而导致肿瘤的生长和扩散。 免疫检查点阻断疗法的主要作用是通过抑制免疫检查点分子的功能,从而激活免疫细胞攻击癌细胞。
免疫检查点阻断疗法(ICB)是基于“免疫监视”理论和在T细胞上发现免疫检查点分子(包括CTLA-4和PD-1等)的最具革命性的技术之一。
▸ 作用机理
CTLA-4与CD80/86细胞结合后转导的信号和PD-1与PD-L1结合后转导的信号抑制T细胞的“过度激活”,在预防慢性疾病的异常免疫反应中起重要作用。
阻断受体分子增强了肿瘤杀伤活性
然而,为了增强T细胞清除癌细胞的活性,需要取消这些信号。根据以往的研究,使用CTLA-4或PD-1/PD-L1单克隆抗体治疗的患者通过上调免疫活性产生了显著的抗肿瘤反应。
机理研究表明,CTLA-4或PD-1/PD-L1阻断显著增强了肿瘤特异性T细胞中的T细胞受体信号,从而导致更强的肿瘤杀伤活性,肿瘤微环境中T细胞的浸润和存活率也相应提高。
▸ 免疫检查点阻断适用于的癌症
目前,免疫检查点阻断已被批准用于各种类型的癌症,包括黑色素瘤、非小细胞肺癌、肾细胞癌、头颈部鳞状细胞癌、膀胱癌、肝细胞癌、霍奇金淋巴瘤,作为一线或二线治疗。
此外,许多其他靶向共刺激因子的激动性和拮抗性免疫检查点调节剂,如4-1BB、ICOS、GITR、OX-40、CD40等,目前正在研究中。
✦免疫检查点阻断疗法的局限性
随着临床实践的进展,免疫检查点阻断疗法仍有许多局限性。一个显著的问题是不同类型的癌症反应普遍较低。
•个体差异影响免疫检查点阻断疗法效果
虽然抗PD-1/PD-L1的有效性已经在黑色素瘤和非小细胞肺癌中得到明确证明,但来自其他类型癌症的结果不太明确,并且个体对免疫检查点阻断疗法的反应各不相同,这表明包括遗传、环境、行为甚至肠道微生物群在内的其他因素对免疫检查点阻断治疗效率的影响。
•会出现重度免疫相关毒副反应
免疫检查点阻断疗法的另一个限制是相关的副作用,称为重度免疫相关毒副反应(irAEs)。重度免疫相关毒副反应是免疫检查点阻断疗法诱导的过度炎症反应,可影响多个器官,在某些情况下甚至导致死亡。
据报道,免疫检查点阻断疗法总的重度免疫相关毒副反应发生率约为70-90%。irAEs最常见的症状涉及皮肤、胃肠道、肝脏、内分泌器官和肺,而它在不同类型的癌症和治疗中有所不同。
例如,结肠炎是胃肠道中最常见的irAEs类型,免疫检查点阻断治疗的10-20%的患者中发生。皮肤反应,包括皮疹、瘙痒和白癜风,也是免疫检查点抑制剂治疗中常见的副作用,其中大约50%的患者受到影响。
重度免疫相关毒副反应发生的确切机制仍在研究中,有人提出,过度激活的T细胞攻击正常组织,细胞因子不受控制的分泌,自身抗体的扩增,甚至免疫检查点抑制剂抗体与正常组织的结合(脱靶效应)是导致重度免疫相关毒副反应发生的原因。
肠道微生物影响ICB疗法
有趣的是,已经发现肠道微生物群可能影响免疫检查点阻断疗法的疗效以及相关重度免疫相关毒副反应的发生率。
•调节宿主免疫反应
粪便移植(FMT)已被证明可有效改善黑色素瘤或上皮肿瘤患者对PD-1治疗的总体反应,这表明肠道微生物群在PD-1治疗后调节宿主免疫反应中的重要作用。
•降低相关副作用发病率
另一方面,一项针对接受抗CTLA-4治疗的黑色素瘤患者的研究表明,拟杆菌(Bacteroidetes)的富集与结肠炎的发病率降低密切相关。
尽管有这些发现,但仍然迫切需要提高效率并消除免疫检查点阻断疗法的副作用,这依赖于对宿主与免疫检查点阻断反应的机制的深入理解,以及宿主免疫反应、免疫检查点阻断疗法和肠道微生物群之间相互作用。
嵌合抗原受体免疫疗法
嵌合抗原受体免疫疗法(CAR-T细胞疗法)是一种新型的癌症免疫疗法,它利用改造后的T细胞来攻击癌细胞。
CAR-T细胞疗法的基本原理是将患者的T细胞收集后,通过基因工程技术将其改造成能够识别并攻击癌细胞的CAR-T细胞,再将其注入患者体内。
▸ 作用机理
传统上,T细胞活化依赖于T细胞受体与细胞表面主要组织相容性复合体(MHC)呈递的特异性抗原(包括肿瘤细胞相关抗原)之间的相互作用,这种相互作用经常被肿瘤细胞下调。
为了克服这一问题,研究人员设计了一种嵌合抗原受体蛋白(由癌症抗原特异性B细胞的外结构域和T细胞的细胞内结构域组成),并在患者的正常T细胞中人工表达,以产生CAR-T细胞。
CAR-T细胞具有更强的杀伤性
与正常T细胞相比,CAR-T细胞在体外和体内对肿瘤细胞表现出更高的亲和力和更强的杀伤活性。CAR-T疗法最早用于治疗包括淋巴瘤和白血病在内的血癌,与传统疗法相比,CAR-T疗法表现出更好的效果。
✦嵌合抗原受体免疫疗法适用于的癌症
目前,CAR-T疗法已被批准用于治疗各种癌症,包括复发性或难治性多发性骨髓瘤、弥漫性大B细胞淋巴瘤、高级别B细胞淋巴瘤、原发性纵隔大B细胞淋巴瘤、急性淋巴细胞白血病等。
此外,CAR-T疗法治疗其他类型癌症的潜力也在临床和临床前研究中进行了评估。
✦嵌合抗原受体免疫疗法的局限性
•产生耐药性、抗原逃逸
CAR-T疗法也有明显的缺点,最具挑战性的问题之一是肿瘤对单一抗原靶向CAR构建体的耐药性。
尽管施用CAR-T细胞最初产生高反应率,但相当比例的患者经历了靶抗原表达的部分或完全丧失,这被称为抗原逃逸。
据报道,70-90%的急性淋巴细胞白血病患者在初始阶段对CD19 CAR-T治疗表现出持久的反应;但复发后CD19抗原表达下调或丢失的比例为30-70%
在CAR-T治疗的多发性骨髓瘤患者中,也观察到包括B细胞成熟抗原(BCMA)在内的其他靶点的下调。
•全身细胞因子释放综合征
CAR-T治疗在临床上的另一个挑战是全身细胞因子释放综合征(CRS),其特征是低血压、心功能障碍、循环衰竭、呼吸衰竭、肾衰竭、多器官系统衰竭等,如果控制不好可能会危及生命。
注意:促炎性白细胞介素1和白细胞介素6被认为是CAR-T治疗中CRS的关键介质;因此,IL-6/IL-6R阻断被认为是消除CRS的潜在途径。
然而,即使使用tocilizumab,一种食品药品监督管理局批准的用于治疗严重全身细胞因子释放综合征的IL-6R单抗,症状仍然持续并最终导致患者死亡。
迄今为止,仍然缺乏对抗CAR-T疗法诱导的全身细胞因子释放综合征的有效策略。
此外,CAR-T治疗实体瘤的疗效因组织浸润能力低而降低,导致治疗结果较差。利用局部注射代替全身给药来促进CAR-T细胞的肿瘤浸润,而这仅适用于单个肿瘤病变/低转移疾病。
✦肠道微生物可能在CAR-T疗法起作用
最近发现了肠道微生物群和CAR-T疗法的反应/毒性之间的相关性。
根据一项队列研究,肠道微生物谱与B细胞恶性肿瘤患者接受抗CD19 CAR-T细胞治疗后的反应和毒性密切相关,这表现在接受/未接受抗生素治疗的患者中不同的细菌分类和代谢途径,以及暴露于抗生素的患者中观察到的较差存活率和增加的神经毒性。
最新发表的一项研究表明,在开始CAR-T治疗前,患者的基线肠道菌群特征可以预测之后对治疗的应答情况,但前提是这些患者没有预先使用广谱抗生素,因为这会破坏菌群与治疗反应间的关联。
然而,关于肠道微生物群在CAR-T治疗结果中的作用,仍然有很大程度的未知,并且仍然缺乏对其机理的认识,需要更多相关研究阐述其机制。
其他免疫疗法
除了上述的主流癌症免疫疗法,还有其他几种已经开发或正在研究的免疫疗法。
细胞因子疗法
白细胞介素-2(IL-2)是细胞因子疗法的典型例子,并于1992年被批准用于治疗转移性肾细胞癌,但包括毛细血管渗漏综合征和多器官功能障碍在内的严重毒性限制了白细胞介素-2的使用。
T细胞受体工程疗法
T细胞受体工程(TCR-T)疗法是一种类似CAR-T的过继细胞转移(ACT)疗法,其特点是通过植入肿瘤抗原特异性TCR分子对T细胞进行基因修饰。
TCR-T的优势已在临床前和临床研究中得到充分证明
除此之外,癌症疫苗和溶瘤病毒疗法也被认为是治疗癌症的有效策略。然而,肠道微生物群在调节癌症免疫疗法的效率或毒性方面的作用仍然需要解决。
肠道微生物群是生活在消化道中的复杂微生物群落,与身体的任何其他部分相比,其数量和种类最多。
众所周知,人类肠道中的微生物对宿主的健康起着重要作用。微生物群成分之间的相互作用以及它们与宿主免疫系统的关系以多种方式影响疾病的发展。
例如,它通过定居粘膜表面和分泌各种抗微生物物质来保护宿主免受病原体的侵害,这有助于增强免疫反应。
此外,肠道菌群在消化代谢、控制上皮细胞增殖分化、调节胰岛素抵抗、脑肠联系等方面发挥着重要作用。
★ 肠道菌群对癌症免疫治疗的效果和副作用有显著影响
关于癌症免疫疗法,来源于肠道微生物群的组成、生物活性和代谢产物显示出对治疗的效率和副作用有显著影响。
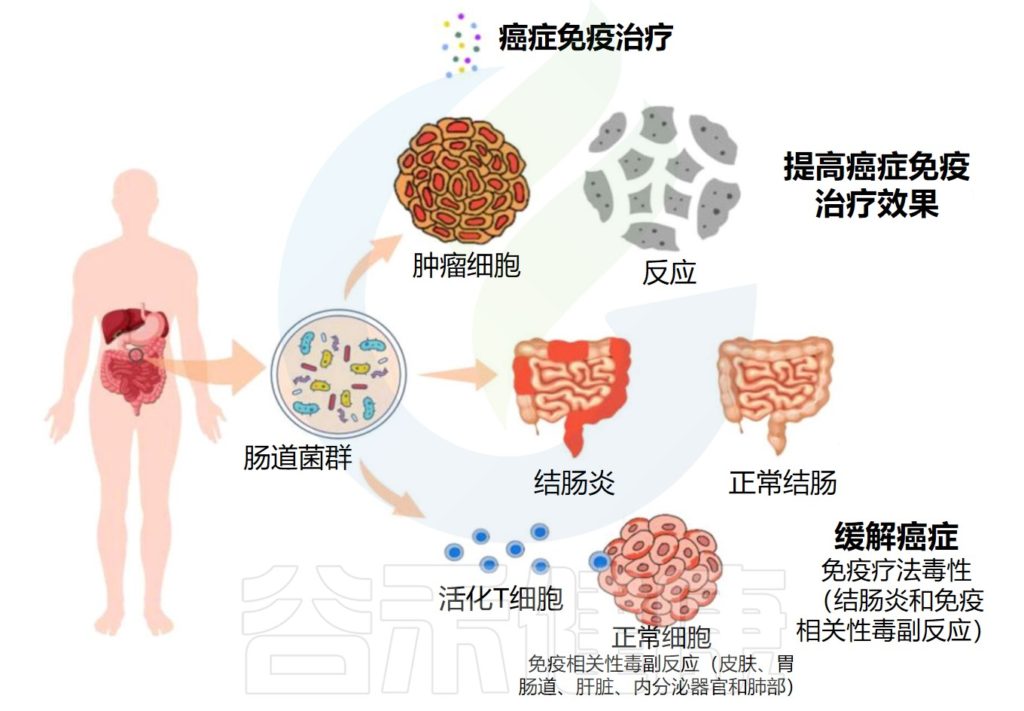
编辑
Wei Y,et al.Front. Oncol.2023
肠道菌群影响癌症免疫疗法效果
先前的一些研究已经揭示了黑色素瘤中肠道微生物群和抗PD-1功效之间的关系。
肠道菌群影响黑色素瘤细胞的生长
检查了在两个设施中饲养的遗传相似的小鼠中黑色素瘤的皮下生长。
他们发现,其中一组肿瘤生长更具侵略性,这与肿瘤内CD8+ T细胞积累显著降低有关,而这受肠道菌群组成的影响。
不同肠道微生物群接受癌症免疫治疗反应不同
一组研究人员检查了接受抗PD-1治疗的黑色素瘤患者的肠道微生物群,并观察到有反应者和无反应者之间肠道微生物群的多样性和组成有显著差异。
肠道微生物影响CAR-T治疗的患者生存率
此外,一项回顾性队列研究发现,在CAR-T治疗前四周暴露于抗生素可能会降低患者的生存率并增加神经毒性的发生率,这强调了肠道微生物群与CAR-T治疗效率之间的关联。
特定的肠道微生物在癌症免疫治疗中的参与也被发现。
✦双歧杆菌在免疫治疗中的抗肿瘤作用
在抗PD-1免疫治疗前从转移性黑色素瘤患者收集的粪便样本,发现长双歧杆菌(Bifidobacterium Longum)、产气柯林斯菌(Collinsella aerofaciens)以及屎肠球菌(Enterococcus faecium)在应答者中更丰富,这表明在PD-1免疫疗法的背景下双歧杆菌的抗肿瘤作用。
✦拟杆菌影响CTLA-4阻断剂的抗肿瘤作用
类似地,先前的研究表明CTLA-4阻断的抗肿瘤作用依赖于不同的拟杆菌物种,因为T细胞对多形拟杆菌(B.thetaiotaomicron)或脆弱拟杆菌(B.fragilis)
的特异性反应与CTLA-4阻断剂的疗效相关。
✦肠道菌群调节癌症免疫治疗效率
为了确定肠道菌群在调节患者对免疫检查点阻断治疗反应中的生物学作用,评估了粪菌移植(来自PD-1应答者)和抗PD-1给药联合治疗PD-1难治性黑色素瘤患者的疗效。
结果显示,应答者表现出先前被证明与抗PD-1反应相关的类群丰度增加,CD8+ T细胞激活增加,白细胞介素8表达髓系细胞频率降低。
应答者具有不同的蛋白质组和代谢组特征,跨域网络分析揭示了肠道微生物群在调节这些变化中的主导作用。这些结果证实了肠道微生物群在提高抗PD-1对黑色素瘤的效率方面的作用。
✦肠道微生物增强PD-1疗法对抗其他癌症
除此之外,还发现肠道微生物群在增强PD-1疗法对抗其他癌症类型。某些肠道微生物物种在调节癌症免疫疗法效率方面的生物学作用已经在以前的研究中得到了解决。
双歧杆菌(Bifidobacterium)在抗PD-1治疗过程中有利于促进抗肿瘤免疫应答。
脆弱拟杆菌(B.fragilis) 肠道定植与CTLA – 4阻断治疗之间的因果关系已通过粪便移植和脆弱拟杆菌植入得到很好的证明。
阿克曼菌提高了黑色素瘤患者PD-1的阻断效果
在一项类似的研究中,嗜黏蛋白阿克曼菌(Akkermansia muciniphila)在调节黑色素瘤患者对抗pd -1治疗的反应中的起作用。
在无应答者粪菌移植后口服嗜黏蛋白阿克曼菌(A.muciniphira),显著恢复了PD-1阻断的功效。
总之,这些发现强调了肠道菌群在提高癌症免疫治疗效率方面的重要性。
肠道微生物群改善癌症免疫疗法的毒性
关于癌症免疫治疗中肠道微生物群的另一个问题,是肠道微生物的组成或生物活性的改变如何影响免疫疗法相关毒性风险。
✦肠道菌群影响癌症免疫治疗后结肠炎的患病率
研究表明,肠道菌群的组成可以预测患者在接受阻断CTLA-4的单克隆抗体治疗后是否会发生结肠炎。
无结肠炎患者的拟杆菌门比例较高
16S rRNA基因测序/16S rDNA测序结果显示,在治疗前,结肠炎组和无结肠炎组的微生物组成相似,但治疗后仍无结肠炎的患者的拟杆菌门比例较高。
以下菌属在结肠炎耐药患者粪便中含量较高:
拟杆菌(Bacteroidaceae)、
巴恩斯氏菌科(Barnesiellaceae)
Rikenellaceae
注:上面三种细菌都是拟杆菌门下的生物
宏基因组测序分析进一步显示,与多胺转运和B族维生素生物合成相关的4个微生物模块在无结肠炎患者的微生物区系中更为丰富。
✦肠道微生物群缓解CAR-T疗法副作用
肠道微生物群也可用于预测抗PD-1/PD-L1疗法的副作用风险。
免疫相关毒副反应程度不同下的菌群丰度也不同
根据一项观察性研究,严重免疫相关毒副反应的患者以下菌属丰度较高:
链球菌(Streptococcus)
Paecalibacterium
Stenotrophomonas
轻度免疫相关毒副反应患者则富含Faecaliberium和毛螺菌(Lachnospiraceae)。
类似地,另一项临床研究显示,在经历临床显著性或不显著性irAEs的患者之间,肠道微生物群存在明显的组成差异。
拟杆菌丰度可能影响免疫治疗的相关副作用
在一项更全面的研究中,77名接受靶向PD-1和CTLA-4的联合免疫检查点阻断治疗的晚期黑色素瘤患者的血液、肿瘤和肠道微生物组被分析,在以结肠炎和黏膜白细胞介素1b上调为特征的毒性患者中发现肠拟杆菌丰度显著更高。
此外,如上所述,在接受CD19 CAR-T治疗的B细胞淋巴瘤和白血病患者中,抗生素暴露与神经毒性的高发相关。这间接证实了肠道菌群可以缓解CAR-T治疗的相关副作用。
肠道微生物治疗了免疫疗法引起的结肠炎
作为免疫检查点阻断疗法的另一个常见副作用,结肠炎通常用免疫抑制药物治疗,包括皮质类固醇或靶向肿瘤坏死因子-α (TNF-α)的药物,所有这些都具有明显的副作用。
显示结肠炎和炎症性肠病可以通过肠道微生物群操作成功治疗。
谷禾与浙一团队合作的研究,通过比较不同CAR-T治疗阶段的肠道菌群的多样性和组成,我们发现患者之间和治疗阶段之间的肠道菌群特征存在差异,并且可能反映复发/难治性多发性骨髓瘤(MM)、急性淋巴细胞白血病(ALL)和非霍奇金淋巴瘤(NHL)患者对治疗的反应。

这项研究对于理解肠道菌群在CAR-T治疗血液恶性肿瘤患者的治疗反应性中的生物学作用具有重要意义,并可能指导治疗干预以增加疗效。MM、ALL和NHL的治疗反应以及多发性骨髓瘤中严重细胞因子释放综合征的发生与特定的肠道菌群变化相关。
小结
总的来说,肠道微生物群在调节癌症免疫疗法的疗效和副作用方面的生物学作用已被充分证明,这预示着未来促进癌症免疫疗法的新策略的发展。
随着对肠道菌群的深入了解,最近也对优化患者和健康人群肠道微生物的潜在方法进行了评估。
粪菌移植和单菌移植(益生菌给药)在改善患者健康方面取得了良好的效果,但对暴露于粪菌移植的异体菌株的患者可能是有害的,并使人们容易患上自身免疫性疾病等慢性疾病。
相反,饮食干预或益生元补充可能更适合普通人群,因为它被认为危害较小,更容易被接受。同时,有必要阐明饮食干预对肠道微生物群调节机制。
不同饮食对肠道菌群的影响
许多膳食补充剂被确定具有“微生物调节”活性。
✦大量摄入动物性食品导致菌群结构不健康
动物性食品是动物来源的食物,包括畜禽肉、蛋类、水产品、奶及其制品等。
总的来说,动物性食品中氨基酸发酵产物含量较高,碳水化合物发酵产物含量较低,而氨基酸发酵产物含量与耐胆汁的拟杆菌(Bacteroides)和梭状芽孢杆菌(Clostridia)等微生物数量呈正相关。
相比之下,有益细菌,如双歧杆菌(Bifidobacteria)与动物食品的消费呈负相关。
高脂肪和动物性饮食可以促进沃氏嗜胆菌生长(Bilophila wadsworthia)——产生硫化氢的细菌,这可能是胃肠道炎症的原因。然而,大量摄入多不饱和脂肪会促进瘤胃球菌(Ruminococcus)在肠道内的生长。
✦富含纤维的饮食有助于维持肠道菌群稳态
几项研究揭示了纤维在植物性饮食中的作用。例如,富含碳水化合物和纤维的饮食增加了肠道微生物的多样性和丰富性,其特征是拟杆菌门(Bacteroidetes)数量增加,厚壁菌门/拟杆菌门比例降低。
高纤维摄入还促进了厚壁菌(Firmicutes)和变形菌(Proteobacteria)的生长,而这两种细菌在食用高脂肪饮食的受试者中通常很低。而大量摄入单糖而非纤维导致拟杆菌(Bacteroides)大量生长。
素食不含任何肉类或鱼类,但富含碳水化合物和纤维。食用素食导致短链脂肪酸的产生增加,这有利于预防胃肠道炎症和维持肠道微生物菌群的稳态。
✦优质的蛋白可以增加肠道菌群多样性
研究发现蛋白质的摄入增加了肠道菌群的多样性;然而,影响取决于蛋白质的来源。
值得注意的是,乳清和豌豆蛋白的摄入增加了双歧杆菌(Bifidobacterium)和乳酸杆菌(Lactobacillus)的水平,同时限制了脆弱拟杆菌(Bacteroides fragilis)和产气荚膜梭菌(Clostridium perfringens)的生长。
此外,豌豆蛋白增加了胃肠道中短链脂肪酸的水平。同时,动物蛋白饮食刺激耐胆汁厌氧菌。
植物化学物质对肠道菌群的调节
除了评估动物或植物性饮食对肠道微生物群的作用,还评估了植物化学物质以及益生元对肠道微生物群的调节活性。
包括多酚、类胡萝卜素、植物甾醇、木脂素、生物碱在内的植物化学物质已被证明对肠道微生物群的调节具有积极作用。
✦类胡萝卜素有助于维持肠道免疫稳态来提高抗肿瘤效率
补充类胡萝卜素如虾青素或视黄酸有助于通过诱导IgA产生来维持肠道免疫稳态。一项研究表明越橘花青素的消耗通过调节肠道微生物群的组成来促进免疫检查点阻断疗法的效率。
抗PD-L1抗体的抗肿瘤效率在口服越橘花青素后增强,同时在粪便中富集梭状芽孢杆菌(Clostridia)和约氏乳杆菌(Lactobacillus johnsonii)。
✦益生元通过调节共生微生物增强抗肿瘤效果
益生元,包括低聚果糖、低聚半乳糖、大豆低聚糖、菊粉等。通过增加共生菌如乳酸杆菌和双歧杆菌的数量,在调节肠道微生物群方面发挥作用。
一项研究报告称,口服菊粉凝胶可以通过调节共生微生物来增强α-PD-1治疗的抗肿瘤疗效,并通过激发记忆性CD8+T细胞反应来产生有效的长期抗肿瘤效果。
膳食真菌对肠道微生物群的影响
尽管在植物和动物的天然产物中发现了有趣的发现,但很少有研究研究来自膳食真菌的天然产物,这也可能对肠道微生物的组成和生物活性的调节有潜在影响。
1
香菇多糖调节了肠道微生物多样性
香菇是一种富含多种多糖的食用菌,研究表明,给予香菇多糖显著改变了小鼠小肠、盲肠、结肠和远端结肠(粪便)微生物群的多样性。具体而言,减少了拟杆菌(Bacteroidetes)与增加了变形菌(Proteobacteria)。
一项研究报道,香菇副产物(LESDF-3)可以促进拟杆菌(Bacteroides)的产生,表明香菇在调节肠道菌群方面的重要性。
与此同时,多项研究也证实了冬虫夏草多糖、黑木耳多糖、灵芝多糖、灰树花多糖、平菇多糖、猴头菌多糖、野生羊肚菌多糖在重塑肠道菌群、调节免疫等方面的生物学功能。
2
灵芝孢子油可以增强免疫活性,减少有害菌
灵芝长期以来被认为在药物治疗和饮食补充方面有价值。
根据最近的一项研究,灵芝孢子油具有很强的免疫增强活性,可导致几种有益细菌的丰度升高:
罗伊氏乳杆菌(Lactobacillus reuteri) ↑↑↑
肠乳酸杆菌(Lactobacillus intestinalis) ↑↑↑
Turicibacter ↑↑↑
Romboutsia ↑↑↑
并降低葡萄球菌(Staphylococcus)和幽门螺杆菌(Helicobacter)的丰度。
这些肠道菌群的改变进一步导致一系列关键代谢产物的分泌,如多巴胺、谷氨酰胺、蛋氨酸、L-苏氨酸、硬脂酰肉碱等,以增强巨噬细胞的吞噬能力和自然杀伤细胞的细胞毒性。
3
膳食真菌中的β-葡聚糖移植有害菌,上调
有益菌丰度
菊粉是一种存在于各种天然产品中的天然多糖,被认为是一种强有力的益生元,有趣的是,膳食真菌中的β-葡聚糖也表现出与菊粉相当的效果。
β-葡聚糖是由葡萄糖单位组成的多聚糖。它能够活化巨噬细胞、嗜中性白血球等,因此能提高白细胞素、细胞分裂素和特殊抗体的含量,全面刺激机体的免疫系统。
具体而言,β-葡聚糖可以通过抑制有害肠道微生物群的增殖,同时上调有益拟杆菌的丰度,从而调节肠道微生物群的结构和组成。
此外,β-葡聚糖和菊粉都能选择性地促进双歧杆菌(Bifidobacterium)的生长。来自蘑菇的D-葡聚糖对肠道菌群的调节也有类似的作用,因此可以认为是一种新型的益生元。
膳食真菌在调节肠道微生物群中的作用总结于下表:
膳食真菌中生物活性成分在调节肠道菌群中的作用

Wei Y,et al.Front. Oncol.2023
膳食真菌对癌症免疫治疗的影响
先前的研究已经调查了来自膳食真菌的关键成分在癌症免疫调节中的作用。
✦真菌中β-葡聚糖增强抗肿瘤免疫反应
真菌细胞壁的主要成分是β-葡聚糖,据报道,β-葡聚糖可作为有效的免疫调节剂,通过调节单核细胞骨髓源抑制细胞(MDSCs)的分化和功能来增强抗肿瘤免疫反应。
骨髓源抑制性细胞——它含义是骨髓来源的一群抑制性细胞,是树突状细胞、巨噬细胞或粒细胞的前体,具有显著抑制免疫细胞应答的能力。
姬松茸多糖刺激MDSC从M2向M1型分化,通过toll样受体2介导抑制肿瘤免疫逃避。
后来发现,自然杀伤细胞、巨噬细胞和树突状细胞负责介导真菌产物引起的抗肿瘤免疫反应。
✦双孢菇多糖激活自然杀伤细胞对结肠癌细胞的治疗作用
一项研究表明,双孢蘑菇多糖MH751906通过激活肠道自然杀伤细胞对结肠癌产生免疫治疗作用,这些激活的自然杀伤细胞对人结肠癌细胞具有稳定的杀伤作用。
✦灵芝中的成分在抗肿瘤过程中起到重要作用
灵芝多糖可部分或完全拮抗B16F10黑素瘤细胞对腹腔巨噬细胞活力的抑制,提示其在癌症免疫治疗中的潜在作用。
后续研究发现灵芝的抗肿瘤作用来自于在体内刺激树突状细胞成熟和启动对Th1辅助细胞极化的适应性免疫应答。
两项研究均表明灵芝介导的免疫调节机制在抗肿瘤过程中起作用。
✦其他一些膳食真菌成分的抗肿瘤作用
一项研究报告称牛肝菌RNA也可以刺激自然杀伤细胞对抗骨髓性白血病。
另一项研究揭示了孤苓多孔菌多糖-蛋白复合物的免疫调节活性,通过激活巨噬细胞介导的宿主免疫应答发挥抗肿瘤作用。
此外,云芝多糖肽(PSP)可增强巨噬细胞的吞噬作用,增加细胞因子和趋化因子的表达,促进树突状细胞和T细胞向肿瘤的浸润,具有免疫治疗肿瘤的作用。
膳食真菌在癌症免疫治疗中的确切作用除了少数报道了相关作用的研究外,在很大程度上仍然是未知的。
✦膳食真菌可以增强免疫阻断疗法效果
一项研究发现蛹虫草多糖通过抑制肿瘤相关巨噬细胞和T淋巴细胞之间的PD-1/PD-L1轴,将免疫抑制巨噬细胞转化为M1表型并激活T淋巴细胞,这可能提高抗PD-1/PD-L1免疫治疗的有效性。
另一项研究表明,人参多糖改变了肠道菌群和犬尿氨酸/色氨酸的比例,增强了PD-1/PD-L1免疫治疗的抗肿瘤作用。阐明了真菌多糖通过肠道菌群增强免疫检查点阻断疗法抗肿瘤作用。
✦提高癌症疫苗疗效
除了增强免疫检查点阻断疗法的治疗效果外,服用真菌产物也有提高癌症疫苗疗效的报道。口服香菇菌丝体提取物可增强肽疫苗的抗肿瘤活性,表明香菇提取物在癌症免疫治疗中具有重要作用。
总的来说,全面了解膳食真菌在癌症免疫治疗中的作用及其分子机制是非常有前景的,肠道菌群在这一过程中的参与也需要进一步研究。
膳食真菌在调节针对癌症的宿主免疫反应中的作用总结于下图:
膳食真菌在治疗各种类型癌症中的生物学作用和机制

Wei Y,et al.Front. Oncol.2023
膳食真菌对癌症免疫治疗的临床研究
迄今为止,已经进行了一些临床研究来评估真菌产物的抗肿瘤活性和潜在机制。
•灰树花抑制肺癌或乳腺癌转移
研究表明,灰树花能抑制肺癌或乳腺癌的转移,减小肿瘤的大小,这是通过增加自然杀伤细胞活性和促进Th1细胞反应实现的,而Th2细胞活性降低。
•灵芝多糖对晚期癌症的抗肿瘤作用
另一项研究表明,灵芝多糖对多种类型的晚期癌症具有抗肿瘤作用,这是通过刺激宿主免疫反应来实现的,包括白细胞介素2、白细胞介素6、人干扰素-g(IFN-g)的分泌增加,自然杀伤细胞活性增强,而白细胞介素-1b和肿瘤坏死因子的浓度较基线降低。
48名乳腺癌患者接受了灵芝孢子粉,并显示治疗后患者血清中肿瘤坏死因子的浓度显著降低,这伴随着肿瘤负荷的减轻。
•双孢蘑菇对前列腺癌具有一定抗肿瘤作用
此外,一项I期试验证明双孢蘑菇通过调节白细胞介素15水平和骨髓源抑制性细胞活性对前列腺癌具有抗肿瘤作用。
•平菇和羊角草也具有抗肿瘤活性
平菇,也被发现通过调节宿主免疫具有抗肿瘤作用。
通过临床试验研究了羊角草的抗肿瘤活性,发现血清中人干扰素-g和白细胞介素12水平随着自然杀伤细胞活性的升高而升高,提示Th1免疫应答参与了羊角草的靶向抗肿瘤活性。
临床上还评估了活性己糖相关化合物(AHCC,从担子菌蘑菇香菇中获得)对腺癌的抗肿瘤作用和免疫调节活性,治疗导致中性粒细胞增加,CD4+/CD8+、CD3+/CD16+/CD56+NK细胞的比例也相应增加,而淋巴细胞和单核细胞的数量减少。
总的来说,真菌产品的抗肿瘤作用以及分子机制已被很好地记录,然而,大多数结论仅基于小样本得出。
此外,尽管临床研究已经证实真菌产品可以增强化疗和放疗的抗肿瘤作用,但关于真菌产品在癌症免疫治疗中的有效性的临床证据仍然缺乏。因此,还需要额外的试验来研究真菌产品对癌症免疫治疗的临床效果。
膳食真菌在不同癌症中的作用总结下图:
膳食真菌治疗不同类型癌症的结果

Wei Y,et al.Front. Oncol.2023
近年来,随着高通量多组学技术(包括微生物扩增子、宏基因组、宏转录组、代谢组)的发展,肠道微生物群对人类健康的生物学相关性已得到充分认识。
肠道微生物在调节宿主免疫稳态方面具有多种功能,这有利于预防许多疾病,对改善癌症免疫治疗也有一定作用。
由于肠道微生物群与癌症患者在治疗时的临床特征密切相关,因此可通过评估其肠道微生物群来预测个体的情况。
食用真菌含有多种能被肠道微生物识别的营养物质,对肠道微生物群起到多种影响,并在癌症免疫治疗中起到作用。对膳食真菌和肠道微生物群的研究将为当前的免疫抗癌疗法提供非常有价值的帮助。
主要参考文献
Wei Y, Song D, Wang R, Li T, Wang H and Li X (2023) Dietary fungi in cancer immunotherapy: From the perspective of gut microbiota. Front. Oncol. 13:1038710. doi: 10.3389/fonc.2023.1038710.
Waldman AD, Fritz JM, Lenardo MJ. A guide to cancer immunotherapy: From T cell basic science to clinical practice. Nat Rev Immunol (2020) 20(11):651–68. doi: 10.1038/s41577-020-0306-5.
June CH, O’Connor RS, Kawalekar OU, Ghassemi S, Milone MC. Car T cell immunotherapy for human cancer. Science (2018) 359(6382):1361–5. doi: 10.1126/science.aar6711.
Zhao Q, Jiang Y, Xiang S, Kaboli PJ, Shen J, Zhao Y, et al. Engineered tcr-T cell immunotherapy in anticancer precision medicine: Pros and cons. Front Immunol (2021) 12:658753. doi: 10.3389/fimmu.2021.658753.
Tan S, Li D, Zhu X. Cancer immunotherapy: Pros, cons and beyond. BioMed Pharmacother (2020) 124:109821. doi: 10.1016/j.biopha.2020.109821.
Yan Z, Zhang H, Cao J, Zhang C, Liu H, Huang H, et al. Characteristics and risk factors of cytokine release syndrome in chimeric antigen receptor T cell treatment. Front Immunol (2021) 12. doi: 10.3389/fimmu.2021.611366.
Fan Y, Pedersen O. Gut microbiota in human metabolic health and disease. Nat Rev Microbiol (2021) 19(1):55–71. doi: 10.1038/s41579-020-0433-9.

谷禾健康

人类微生物组有多种来源(比如通过母亲向婴儿的垂直传播,通过饮食等)。环境暴露允许人类与整个微生物生态系统相互作用,并且有新证据表明,生态系统中微生物的多样性可能影响人类微生物群的组成,从而对免疫功能和健康结果产生影响。
人类在富含微生物的环境中进化,病原体和共生菌共同调节着肠道微生物群和免疫系统。然而,城市化、土地利用变化、相关的生物多样性损失,以及室内时间的增加,都使我们减少了对更具多样性的环境微生物群的接触。
“卫生假说”的一个扩展假设是,如果减少与更多样的环境微生物群接触,可能导致人类微生物群的不利变化,从而导致各种疾病,比如自身免疫性疾病、过敏和哮喘。
近期的动物和人类研究,证明了环境微生物群暴露对宿主微生物组的影响;从而提供了环境微生物群对人体肠道微生物群和免疫功能的潜在调节作用的证据。
本文主要介绍研究人员提出的,环境微生物群暴露可能会改变人体肠道微生物群和免疫功能,且基于该理论的微生物群针对性改善措施。
目前有几项人类干预研究发现,与自然环境的相互作用(如接触土壤、植物物质)会影响皮肤、口腔、鼻腔和肠道微生物群,这里重点关注肠道微生物群,包括儿童和成人人群。4项研究总结如下:

doi.org/10.1016/j.mucimm.2023.03.001
通过这些研究,我们可以看到对影响肠道微生物组和/或免疫功能的干预措施研究包括:
直接接触堆肥和土壤混合物,在微生物富集的沙坑中玩耍(包括植物物质和商业园艺土壤);接触室外绿地和绿墙等。
沙坑
添加富含微生物的土壤粉末可使沙子微生物群多样化,影响儿童微生物群
一项双盲安慰剂对照研究,在干预组中,3-5岁的儿童暴露于富含微生物多样化土壤的操场沙子中,或者在安慰剂组中,视觉相似但微生物贫乏的泥炭沙子(n=13)。孩子们每天在沙盒中玩两次,每次20分钟,持续14天。
肠道变形杆菌多样性仅在干预组0至14天之间下降(线性混合效应模型简称LMM:P = 0.02, Q = 0.03),而安慰剂组则保持在基线水平(LMM:P > 0.6)。
在第14天,与安慰剂组相比,干预中的肠道变形杆菌辛普森多样性较低(t检验P<0.016,Q = 0.06),但在第28天不再降低(t检验P = 0.23)。
肠道菌群潜在变化与免疫标志物之间的关联
进一步探讨了肠道菌群测量值是否与线性混合效应模型的免疫参数相关。
——干预组中血浆中IL-17A的水平降低
干预组的肠道变形细菌多样性(辛普森和香农)降低,这种减少与血浆IL-17A水平降低有关。
注:IL-17是一种促炎细胞因子,与几种免疫介导的疾病有关,包括炎症性肠病,类风湿性关节炎和多发性硬化症。
——干预组中血浆中IL-10的水平增加
其他几种已知健康结果的肠道菌群与血浆IL-10水平相关。其中,厚壁菌门与拟杆菌门的比值(肥胖相关)与IL-10呈负相关,拟杆菌属的相对丰度与血浆中IL-10水平呈正相关。
注:IL-10是一种抗炎细胞因子,可通过限制促炎细胞因子的分泌以及调节巨噬细胞,T细胞和B细胞来预防自身免疫性疾病。
扩展阅读:肠道细菌四大“门派”——拟杆菌门,厚壁菌门,变形菌门,放线菌门
Faecalibacterium和Roseburia相对丰度的变化直接相关,而Romboutsia相对丰度的变化与IL-10水平的变化呈负相关。
扩展阅读:肠道核心菌属——普拉梭菌(Faecalibacterium Prausnitzii),预防炎症的下一代益生菌
编辑
doi.org/10.1016/j.ecoenv.2022.113900
总的来说,该研究支持免疫介导疾病的生物多样性假说,干预组儿童的免疫应答与安慰剂组儿童的免疫应答不同。环境微生物群可能有助于儿童健康。
绿地
邻近自然绿地对儿童特异性过敏具有保护作用
来自加拿大健康婴儿纵向队列研究的数据(699名婴儿)表明,婴儿早期生活在邻近自然绿地,在3岁时对多种吸入性特应性过敏的发展具有保护作用(优势比 = 0.28[95%CI 0.09,0.90])。4 个月大时肠道微生物群的放线菌门多样性介导了这种关系。
自然植被与更大的物种丰富度相关,但降低了小婴儿肠道中放线菌门的辛普森多样性。
这听起来有点矛盾。
我们知道,双歧杆菌作为益生菌可以预防特应性疾病,双歧杆菌属于放线菌门,为什么减少放线菌多样性值,反而可能降低过敏风险有利健康?
实际上,放线菌多样性辛普森测量值较低,表明物种分布不均匀,且少数优势双歧杆菌富集。
越来越多的证据表明,当大量的成人双歧杆菌相关物种,如B. catenulatum和青春双歧杆菌(B. adolescentis)在幼年时主导肠道菌群时,特异反应的风险更大。
也就是说,本来放线菌的辛普森多样性与吸入物致敏状态之间的正相关,但这种相关性因接近自然绿地而降低,据推测,这是婴儿主要双歧杆菌物种(如婴儿双歧杆菌)富集的结果。
鉴于早期双歧杆菌定植和低多样性的肠道微生物组的重要性,自然植被通过婴儿特异性双歧杆菌富集对吸入物致敏的保护作用值得进一步研究。
总之,该研究强调了促进自然城市绿地保护的重要性,通过降低特应性疾病的易感性来改善儿童健康。
扩展阅读:肠道核心菌属——双歧杆菌,你最好拥有它
绿墙
办公场所空气流通的绿墙会改变微生物组并调节上班族的免疫系统
最近的一项研究发现,暴露在办公场所的绿墙(带有植物)14天后,可能增加皮肤微生物组的多样性,绿墙研究中观察到的变化与对人类健康有益的变形杆菌和乳酸杆菌有关。
这种变化与血液样本中细胞因子转化生长因子βmRNA的表达有关,表明环境微生物群在免疫功能中的潜在作用。
由于没有直接接触绿墙,这些发现表明,皮肤微生物组和免疫功能可能与接触三种治疗的空气生物群落有关;然而该研究并未对空气微生物组进行评估。
空气微生物组的研究
不过呢,这一想法得到了一项小鼠研究的支持,在这项研究中,小鼠暴露于无土壤、低多样性土壤和高多样性土壤的空气微生物群中,在暴露7周后,各组之间的粪便和盲肠微生物群的群落组成存在显著差异。
关于空气微生物组对肠道微生物组和免疫功能的潜在影响的证据尚处于起步阶段,由于目前对低生物量样本的微生物组研究的局限性,在人类中建立这种关系将具有挑战性。
方法偏差
迄今为止,包含比较组的人类研究相对较少,也存在一系列潜在的方法偏差。例如,两项研究中的分配偏差,没有将微生物群暴露与干预措施的其他因素(如自然因素)隔离,干预措施的相对短期性质以及干预措施停止后的随访期。需要更多研究。
样本量
所有研究中的样本量相对较小。
精细化程度
目前微生物组分析侧重于相对较高的分类群,在DNA提取和测序技术以及生物信息学方面,通常缺乏明确性和精细度。还需要对免疫功能进行更全面的评估。
普遍性
在确定这些发现如何适用于所调查的场景之外时,还必须考虑这些发现的普遍性。
由于暴露环境组成的潜在差异以及暴露人群的行为差异(如室内时间、饮食、体力活动),此类干预措施调节肠道微生物群的普遍性尚不清楚。
对于健康状况较差的人,目前还没有关于环境微生物群如何影响其肠道生态和免疫功能的数据。关于暴露于环境微生物群作为调节肠道微生物群的工具的一个潜在问题是安全性。虽然我们总是与环境微生物群接触,但在建议改变这种接触时,我们必须注意潜在的感染风险增加(例如环境中的病原体),特别是对于免疫系统受损的人群。
虽然以上不足可能会影响我们对环境微生物群暴露如何影响肠道微生物群的理解,但研究提供了初步证据,表明这些暴露可能会改变人体肠道微生物群和免疫功能。
关于剂量、治疗持续时间和干预停止后变化的持续性,仍有许多问题,但随着这一领域研究的增长,预计将有更多明确的研究证据提供。
研究人员认为,可以采取几种方法来改善对更多样环境微生物群的暴露。具体如以下几个方向:
行为改变:
土壤摩擦、园艺、更多时间在绿地中户外活动;
优化人们常接触空间中的环境微生物群:
在室外环境中,更大的植被多样性与更多样的土壤微生物多样性和更多样的空气生物群落相关联;
而在室内环境中,环境微生物群可以通过建筑设计特征来改变,包括允许阳光和通风的窗户、控制湿度和温度以及减少室内污染物。
均质化、富含微生物的土壤可用于重建城市游乐场。
微生物接种的油漆和瓷砖:
这可能正在成为一种新的策略,作为一种更具针对性的方法,可以在不太可能有绿地的环境中,调节环境微生物群,从而调节人类微生物群。(例如边界生物安全、潜艇或太空旅行)
与其他基于微生物群干预措施并用:
环境微生物组暴露干预措施可与其他基于微生物组的干预措施一起使用,以实现协同增效,从而增强和/或延长任何益处。例如,如果暴露于更多样的环境微生物群延长其效力,粪菌移植给药的频率可能会降低。
暴露于环境微生物群可能会改变人体肠道微生物群和免疫功能,这一领域的研究尚处于起步阶段,需要进行更多的研究,以更好地了解暴露的类型和剂量、不同人群发现的普遍性,并确保此类干预措施的安全性。
这些研究为我们拓宽视野,应对城市居民免疫介导疾病的高发病率,新的可持续的基于自然的预防性干预措施正在涌现,增加户外活动与自然重新建立联系,生物多样性粉末用来制造沙子,重建城市栖息地,或者绿墙的建筑改造也可以成为新的选择。
主要参考文献:
Buchholz V, Bridgman SL, Nielsen CC, Gascon M, Tun HM, Simons E, Turvey SE, Subbarao P, Takaro TK, Brook JR, Scott JA, Mandhane PJ, Kozyrskyj AL. Natural Green Spaces, Sensitization to Allergens, and the Role of Gut Microbiota during Infancy. mSystems. 2023 Feb 15:e0119022. doi: 10.1128/msystems.01190-22. Epub ahead of print. PMID: 36790181.
Soininen L, Roslund MI, Nurminen N, Puhakka R, Laitinen OH, Hyöty H, Sinkkonen A; ADELE research group. Indoor green wall affects health-associated commensal skin microbiota and enhances immune regulation: a randomized trial among urban office workers. Sci Rep. 2022 Apr 20;12(1):6518. doi: 10.1038/s41598-022-10432-4. PMID: 35444249; PMCID: PMC9021224.
Stanhope J, Weinstein P. Exposure to environmental microbiota may modulate gut microbial ecology and the immune system. Mucosal Immunol. 2023 Mar 9:S1933-0219(23)00015-6. doi: 10.1016/j.mucimm.2023.03.001. Epub ahead of print. PMID: 36906178.
Roslund MI, Puhakka R, Grönroos M, Nurminen N, Oikarinen S, Gazali AM, Cinek O, Kramná L, Siter N, Vari HK, Soininen L, Parajuli A, Rajaniemi J, Kinnunen T, Laitinen OH, Hyöty H, Sinkkonen A; ADELE research group. Biodiversity intervention enhances immune regulation and health-associated commensal microbiota among daycare children. Sci Adv. 2020 Oct 14;6(42):eaba2578. doi: 10.1126/sciadv.aba2578. PMID: 33055153; PMCID: PMC7556828.
Sacks D, Baxter B, Campbell BCV, Carpenter JS, Cognard C, Dippel D, Eesa M, Fischer U, Hausegger K, Hirsch JA, Shazam Hussain M, Jansen O, Jayaraman MV, Khalessi AA, Kluck BW, Lavine S, Meyers PM, Ramee S, Rüfenacht DA, Schirmer CM, Vorwerk D. Multisociety Consensus Quality Improvement Revised Consensus Statement for Endovascular Therapy of Acute Ischemic Stroke. Int J Stroke. 2018 Aug;13(6):612-632. doi: 10.1177/1747493018778713. Epub 2018 May 22. PMID: 29786478.
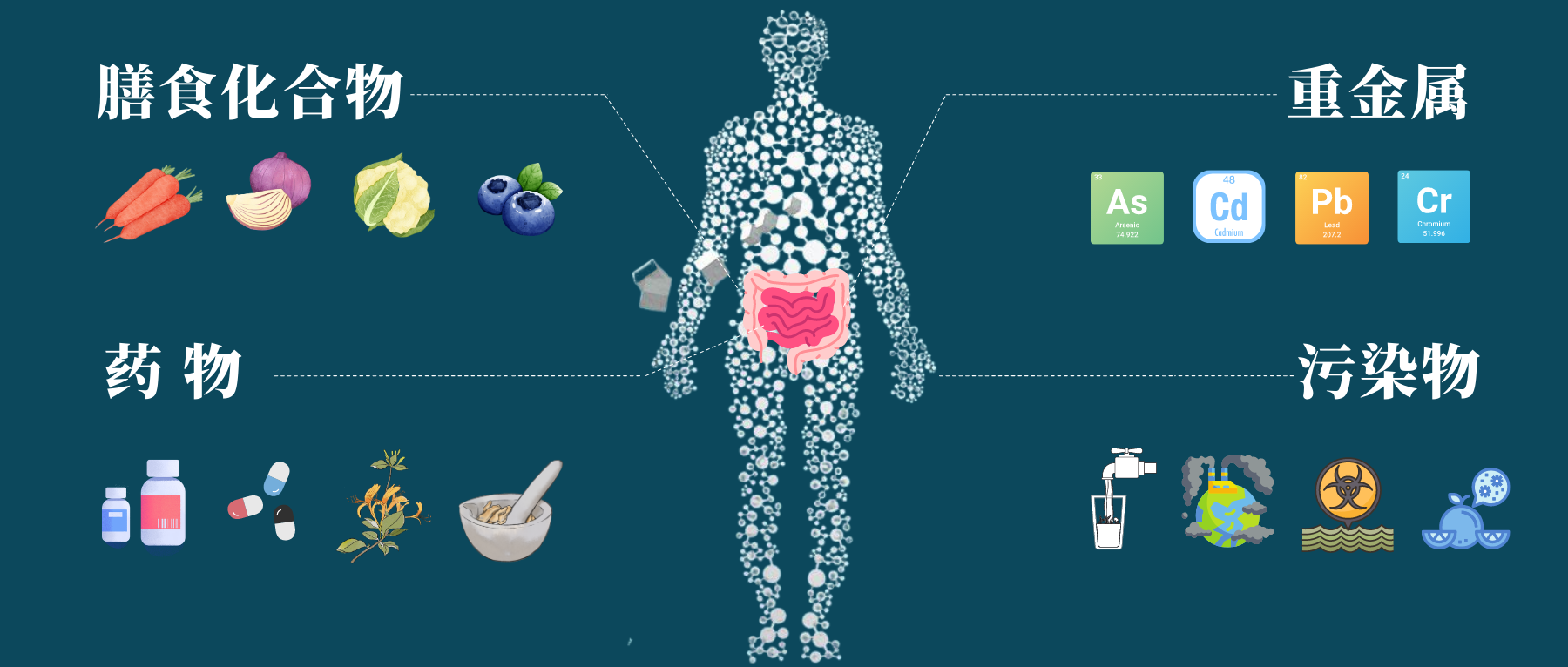
谷禾健康
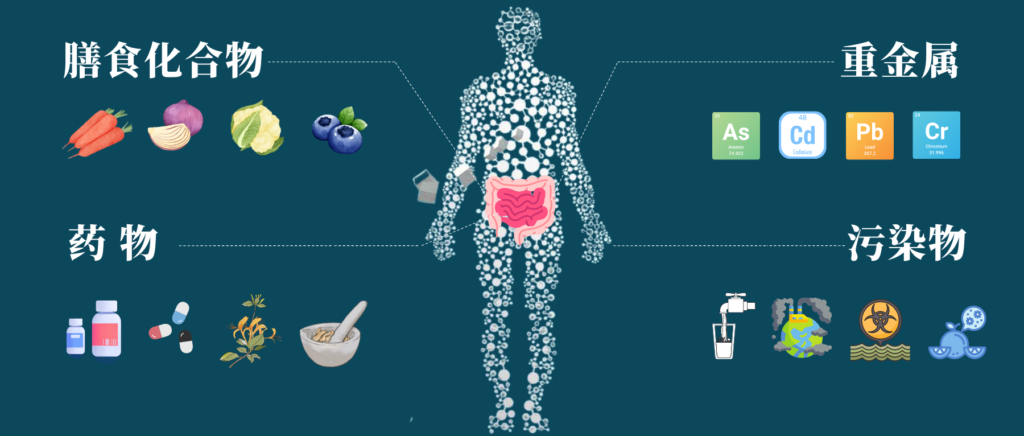
肠道菌群和人体健康息息相关,我们经常讲饮食、生活方式等都可以影响肠道菌群的组成,除了这些耳熟能详的因素之外,其他异源物如环境中的污染物,重金属,药物等都会影响肠道菌群,反过来,细菌也可以通过生物积累或化学修饰影响这些化合物。
通过皮肤接触、吸入或摄入等方式,我们每天都在和异生素接触,可能通过补充剂或药物自愿摄入异源物,或者通过受污染的食物和水被动摄入异源物。
肠道微生物群可以在吸收之前或之后与摄入的化合物相互作用。
了解肠道微生物群如何处理膳食成分的分子机制,是用“功能性食品”、益生菌和益生元治疗不同疾病的理论基础,有利于根据患者的代谢状况和肠道微生物群进行个性化营养定制。
与饮食类似,对肠道微生物群改变重金属、污染物、药物毒性进行研究,可以从肠道菌群代谢角度打开视野,进一步探讨从体内去除有害化合物并预防疾病的方法。
本文主要介绍了肠道微生物群对基本营养物质、重金属、污染物、药物、中草药等产生的代谢作用,并提供了基于肠道菌群的改善方式,以减轻这些有毒元素造成的损害。
什么是异源物?
异源物(xenobiotics),也就是说外源物质,来自希腊语,是指使人体从外界(包括肠道中的细菌作用产物)摄入体内的化学物质,例如药物、毒物、食品添加剂、环境污染物等。
人类肠道微生物群是一个多样而复杂的微生物群落,与宿主一起进化。肠道微生物群是宿主代谢过程的组成部分。
有时候会把肠道微生物群比作“器官”,可以干扰调节代谢的宿主基因。
人体肠道微生物群和异源物之间的大多数相互作用发生在胃肠道粘膜上。由于消化道的范围不同,不同的区域为微生物和代谢过程提供了不同的栖息地。
当我们说异源物的微生物代谢时,应该在宿主代谢过程的背景下进行。后者往往是同时发生的和相互竞争的。
▼ 异源物是怎么进入人体代谢的?
异源物经口服、吸收后在肠上皮细胞之间或通过肠上皮细胞传递,可被宿主酶处理或不被宿主酶处理。之后,它们可以通过门静脉输送到肝脏。
在肝脏中,异源物受到许多代谢酶的影响。因此,外源性代谢产物进入全身循环,从而使其分布到组织中并影响其他器官。
代谢产物可以与消化道的上皮细胞局部相互作用。当外源性药物通过静脉注射时,它们跳过了“第一道”代谢,立即进入全身循环。
而循环的外源性代谢产物进一步代谢并通过胆汁排泄排出,然后通过肠肝循环在小肠中重新吸收,或通过肾脏排出到尿液中。
▼ 异源物怎么和肠道菌群相遇?
可以通过多种途径与肠道微生物相遇。
小肠外源物中未被吸收或吸收不良的物质,继续进入大肠,被肠道微生物转化。
容易吸收或静脉注射的外源性物质最终可以通过胆汁排泄,到达肠道细菌。
▼ 肠道菌群影响异源物的生物转化
除了上面说的代谢过程外,肠道微生物群还可以影响异源物的生物转化,从而影响其功能和毒性。
同样,异源物可以诱导基因表达在人类肠道微生物群的直接参与异源物的代谢。结果表明,即使在短期暴露于异源物期间,这种表达也会上调。
异源物和微生物群之间的复杂相互作用
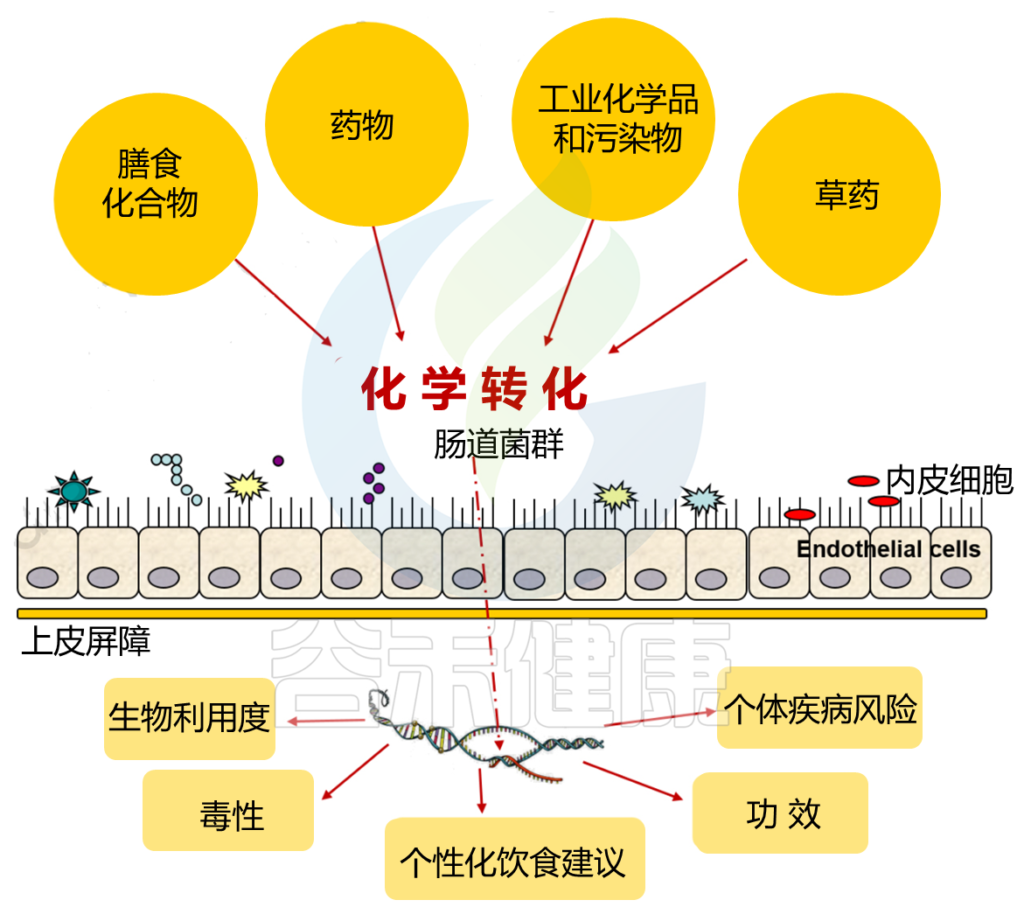
DOI: 10.2174/1389200221666200303113830
肠道微生物群对几种外源性物质的生物转化已通过体外和体内模型进行了广泛研究。然而,由于许多其他因素,例如在到达肠道细菌更普遍的肠道下部之前的有效吸收,或肝脏中的异源代谢,防止肠道微生物群遇到特定代谢产物,人类的异源物生物转化可能会发生很大变化。
同样,暴露于异源物质时,肠道菌群的结构和功能会发生特定变化。
摄入的外源物质的这些直接代谢导致了几种情况:
人类微生物群和异源物质相互作用是一个复杂的代谢网络,影响着双方。
饮食是人类健康的基石,目前已有许多研究将饮食模式与健康结果联系起来,这其中离不开肠道菌群的深度参与。在我们之前的多篇文章中也有相关阐述,这里我们简要回顾一下膳食化合物的代谢,重点关注重金属,污染物,药物代谢等异源物,逐一了解肠道菌群对异源物代谢过程,及其与健康之间的关联。
肠道菌群可以从多种膳食化合物中提取营养和能量,该过程的程度和类型在个体之间差异很大,主要是因为肠道微生物酶的存在和丰度不同,这里主要关注膳食蛋白质、脂类和多酚的转化。
膳食蛋白质可以用来做什么?
它可以体液平衡、细胞修复、血液凝固、激素、产生酶等。它也是肠道菌群的食物,主要作为氨基酸来源,可用于蛋白质合成和代谢能量的产生。
而肠道微生物群参与蛋白质代谢,它们在营养利用和宿主反应之间的相互作用中起着关键作用。
关于肠道微生物群参与蛋白质代谢详见:
小肠中的蛋白酶和许多肽酶对于将膳食蛋白质消化为氨基酸和寡肽是重要的。
肠道微生物群具有利用氨基酸的专门酶。
肠上皮细胞参与氨基酸分解代谢,并通过调节肠道屏障功能在先天免疫和适应性免疫中发挥重要作用。
肠道微生物生活在肠腔中,与粘蛋白密切相互作用,其任何变化都可能改变粘蛋白分泌。据推测,肠道微生物群利用必需和非必需的管腔氨基酸。
➤ 肠道菌群的组成及位置影响氨基酸代谢
肠道菌群的组成及其在肠道中的位置,对于确定膳食蛋白质的生产速率和氨基酸的代谢命运至关重要。
约氏乳杆菌(Lactobacillus johnsonii)
约氏乳杆菌是小肠中的常见居民,这种菌缺乏编码参与氨基酸生产的生物合成途径的基因。
约氏乳杆菌不利用氨,也不参与硫同化的代谢途径。但约氏乳杆菌产生一种胞外蛋白酶、3种寡肽转运蛋白、超过25种胞浆肽酶和20种氨基酸渗透酶型转运蛋白。这些有助于约氏乳杆菌吸收外源氨基酸或肽用于蛋白质合成。
➤不同菌群蛋白水解活性可能直接导致人类疾病
这里拿乳糜泻来举例,肠道微生物群与乳糜泻有关。乳糜泻是一种常见的自身免疫性疾病,其特征是对小麦基食物中的膳食面筋产生炎症反应。
这种富含脯氨酸的蛋白质避免了宿主蛋白酶的完全消化,从而产生了高分子量的免疫原性肽。肠道微生物群可能通过改变面筋蛋白水解来影响乳糜泻。
乳糜泻患者的肠道菌群是如何引发疾病的?
健康人和乳糜泻患者的粪便悬浮液,对面筋蛋白和免疫原性肽的处理方式不同。
一般健康人通过乳酸杆菌产生肽,而乳糜泻患者不一样,乳糜泻患者会多一些铜绿假单胞菌,这种铜绿假单胞菌产生的面筋衍生肽,更加易于穿过小鼠肠道易位,并引发增强的面筋特异性免疫应答。
所以说,鉴定负责肠道微生物面筋加工的特定蛋白酶,不仅可以更好地理解乳糜泻,还可以为该疾病的治疗干预提供信息,包括酶或益生菌治疗。
肠道微生物还可以将从膳食蛋白质中获得的氨基酸(包括l-苯丙氨酸、l-酪氨酸和l-色氨酸)代谢为一系列生物活性产物。例如,肠道细菌可以将l-色氨酸代谢为多种产物,包括抗氧化剂吲哚-3-丙酸、神经递质色胺和吲哚,后者可以通过肝脏酶进行羟基化和硫酸化,生成尿毒症毒素硫酸吲哚。
关于色氨酸代谢详见:
肠道微生物对脂质吸收很重要。
➤ 胆固醇的吸收
饮食胆固醇是西方饮食中与心血管疾病风险增加相关的主要成分。吃进去的胆固醇,被小肠吸收,随后经历胆汁排泄和肠肝循环。
➤ 肠道微生物群对胆固醇的影响
粪甾醇不能被重新吸收并被排出体外。通过肠道微生物的减少,胆固醇产生了不可吸收和排泄的粪甾醇。因此,这种转变有效地去除了循环中的胆固醇。
人类粪便中高达50%的类固醇是粪甾醇。高胆固醇降低患者和低胆固醇降低患者体内微生物群,分别定植的无菌小鼠,产生不同数量的粪甾醇。
还有研究表明,降低胆固醇的细菌可能会降低血清胆固醇。
➤ 降低胆固醇的细菌
对降低胆固醇的肠道细菌——产粪甾醇真细菌的研究表明,粪甾醇合成可能涉及氧化为5-胆甾-3-酮,然后烯烃异构化为4-胆甾-3-烯酮,共轭还原和酮还原。
确定负责这些修饰的酶并确定其在患者体内的丰度可能是关键,因为抑制胆固醇重吸收是降低胆固醇水平的有效方法。
关于脂质代谢,详见:
多酚是天然植物化合物,是人类饮食中最丰富的抗氧化剂,可以预防慢性退行性疾病。
多酚包括植物源性食物中存在的一类次级代谢产物,当它们作为纯化合物或富含多酚的提取物被纳入饮食中时,可以通过调节肠道微生物群的组成产生健康影响。当每天摄入高达2g时,多酚是重要的膳食生物活性成分。
它们的微生物调节是预期的,它们的化学结构,包括许多酚基团,表明了潜在的抗菌作用。
即使是不可吸收的聚合物化合物也会被肠道微生物群转化为可吸收的生物活性代谢物。
膳食多酚的生物利用度主要取决于肠道微生物群的组成:
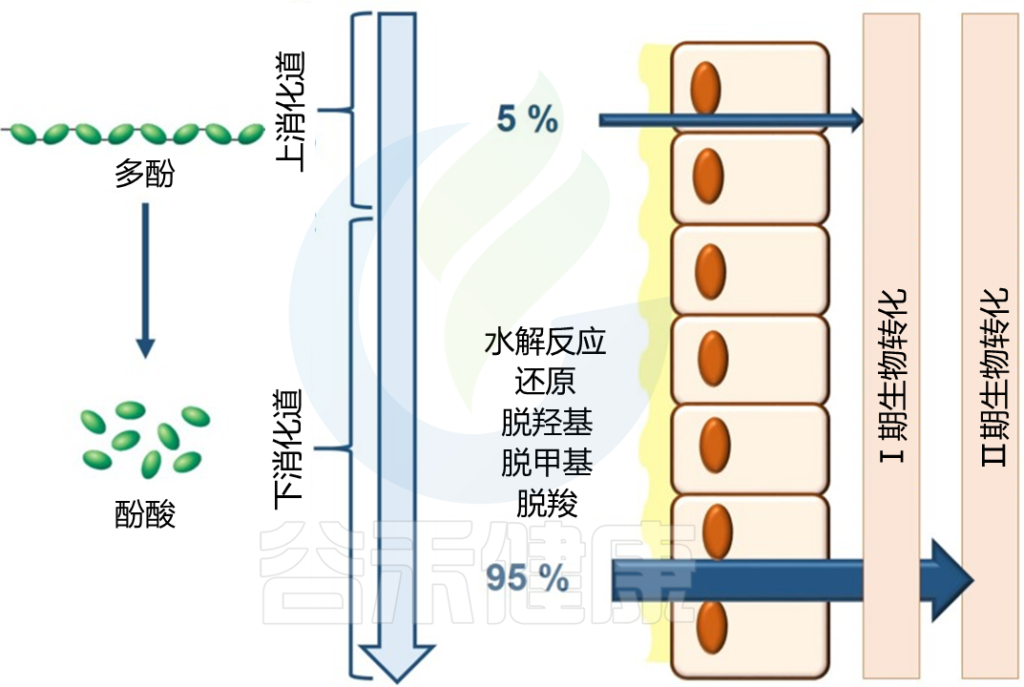
Westfall S, et al., Front Neurosci. 2019
肠道微生物群进行的三个主要分解代谢过程是水解、裂解和还原反应。在这些分解代谢反应之后,释放的苷元可能进行 II 期代谢并被肠道微生物群转化为简单的酚类衍生物,从而促进身体吸收。
关于肠道菌群代谢多酚详见:
近年来,人们越来越关注环境污染物对健康带来的影响。虽然说大多数污染物不直接针对肠道微生物群,但其中一些污染物可以通过不同途径进入人体,并与肠道微生物相互作用。
肠道菌群 ⇔ 污染物
肠道菌群活动可以改变这些化学品的毒性和生物利用度,并延长宿主接触有害化合物的时间。
暴露于环境污染物会改变肠道菌群的组成,导致能量代谢、免疫系统功能、营养吸收和/或产生其他毒性症状。
在评估这些物质的安全性时,必须考虑肠道微生物代谢的后果。这里讨论了几种与人类疾病风险有关的化学物质——重金属、持久性有机污染物和杀虫剂,有证据表明微生物代谢会影响其毒性。
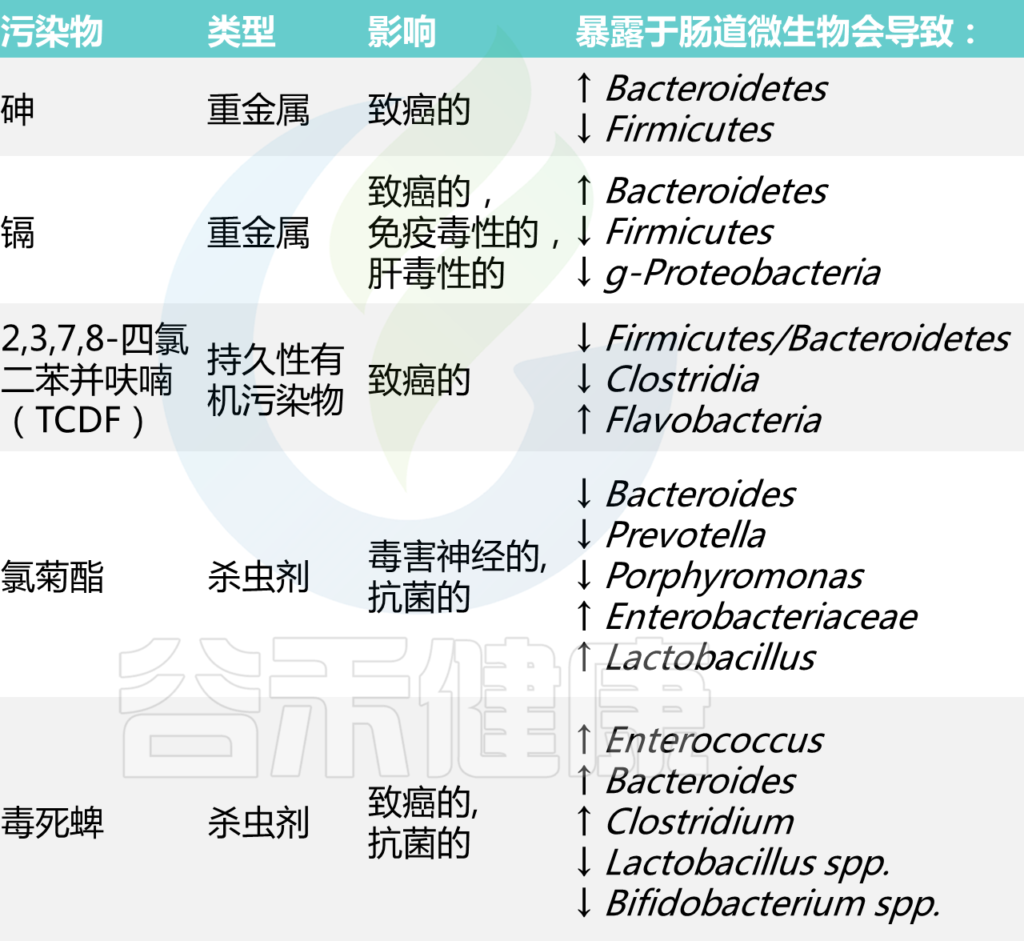
DOI: 10.2174/1389200221666200303113830
环境中的重金属与许多有害影响有关,包括致癌、氧化应激和对免疫系统的影响。几项研究表明,接触重金属也可能导致肠道微生物群失调。我们将以砷、镉、铅为例,展示重金属如何与肠道微生物相互作用,又会带来哪些健康后果。
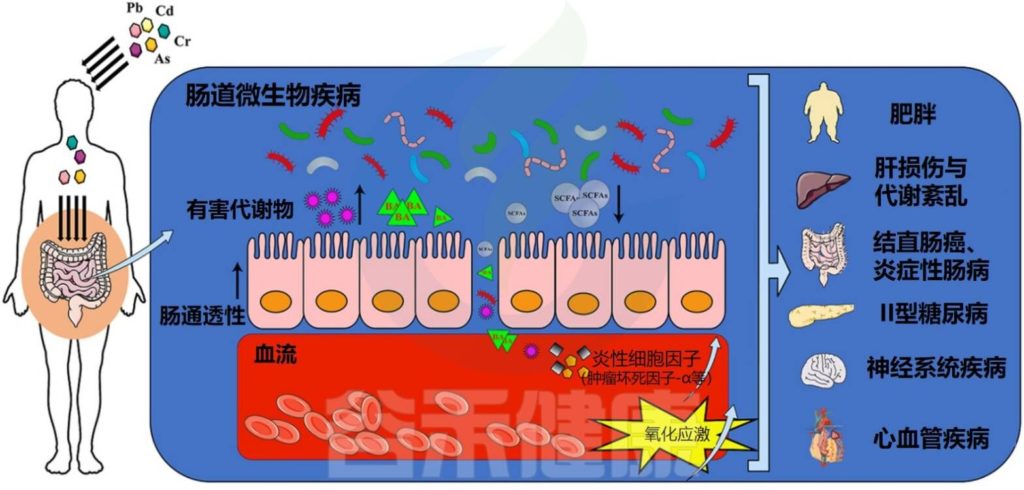
Liu X, et al.,Environ Pollut. 2023
砷(As)
砷(As)是最常见的有毒环境化合物之一。它具有已知的致癌作用。砷能够以砷酸盐[As(V)]的形式附着于固体表面。As(V)摄入并暴露于肠道微生物群后,会诱导硫化和甲基化。
研究发现,小鼠仅4周暴露于10mg/L的砷,就会显著干扰肠道微生物群的组成和代谢组学特征,拟杆菌门的丰度显著增加,而厚壁菌门的丰度则显著减少。这些变化与含吲哚的代谢产物、脂质代谢产物、异黄酮代谢产物和胆汁酸代谢产物有关。
➤砷暴露通过影响菌群及其代谢产物,损伤肝脏,从而影响健康
砷暴露会导致肠道微生物死亡,从而进一步损害肠道中的砷代谢。一旦砷不能代谢出体外,宿主的健康就会受到影响。砷暴露导致的肝脏损伤可能是由于肠道微生物代谢产物(如LPS)的变化所致。这种代谢产物是肝脏损伤的重要指标,并间接激活肠-肝轴。这表明肝脏是砷毒性的主要靶器官之一。
➤砷暴露影响脂质代谢,碳水化合物代谢
砷暴露极大地影响血清和肝脏的脂质稳态,主要影响脂质代谢,脂质代谢失衡与神经系统疾病有关,例如帕金森氏症、阿尔茨海默氏症和肌萎缩侧索硬化症;而肠道菌群在宿主脂质代谢中起着极其重要的作用,因为细菌产生的短链脂肪酸是宿主脂质合成、脂肪酸氧化和脂肪分解稳态的主要调节剂。
扩展阅读:
砷暴露还显着影响碳水化合物代谢途径。在砷暴露小鼠的肠道基因组中,参与淀粉利用系统的基因丰度显著增加。
➤食源性砷暴露不同于水源性砷暴露,会延长砷在胃肠道中的滞留时间
研究发现,小鼠粪便样本中接触30天砷,厚壁菌门和拟杆菌门的比例没有变化,该比率在暴露后 60 天显着降低,并且糖酵解、糖异生和肌醇磷酸代谢等碳水化合物代谢相关基因显著下调。
食源性砷暴露的影响是持久的。砷会导致参与丙酮酸代谢的几种酶水平下降,乙酸激酶和3-羟基丁基辅酶a脱氢酶水平下降,从而导致能量代谢异常。淀粉利用系统中susB、susC、susD和susR基因的增加,虽然缓解了这一情况,但碳水化合物代谢最终受到影响。
镉(Cd)
镉(Cd)用于电池、塑料、金属镀层和颜料的生产。镉以其致癌性、免疫毒性和肝毒性而闻名,它还诱导氧化应激。
研究人员发现雄性小鼠暴露于低剂量的镉(饮用水中为10mg/L)10周后,厚壁菌门和g-变形菌门的丰度降低,盲肠和粪便中拟杆菌门的丰度增加。肠道微生物组组成的这些变化与雄性小鼠血清中脂多糖(LPS)水平升高、肝脏炎症和能量代谢失调有关。
➤镉暴露影响脂肪代谢,引起“肠漏”,减少短链脂肪酸,引发炎症
镉暴露会引起代谢功能的显着变化,影响脂肪代谢并最终导致脂肪堆积。
镉暴露引起的肠道菌群失调会增加 FITC-葡聚糖,FITC-葡聚糖是肠道通透性的重要生物标志物,肠道通透性的增加会改变炎症和新陈代谢。
镉暴露会导致产短链脂肪酸菌数量急剧减少,并降低丁酸和丙酸的含量,短链脂肪酸减少会导致能量代谢受损,也会诱发炎症反应。
铅(Pb)
铅暴露没有明确的阈值。研究发现,血液中任何浓度的铅都会对成人和儿童产生毒性作用。铅中毒可直接影响中枢神经系统、肾脏和血压。
铅通过消化系统在体内蓄积,并对肠道微生物的组成产生显着影响,除了改变肠道多样性、菌群的组成之外,在一定程度上也改变代谢功能。铅对菌群影响主要是,厚壁菌门丰度减少,拟杆菌门丰度增加:
扩展阅读:
铅暴露还会导致某些代谢物和代谢途径发生变化。主要涉及胆汁酸、维生素、氮代谢、氧化应激、防御机制和能量代谢。而且,宿主释放有害代谢产物等变化可能会加剧铅造成的损害。
氮代谢的主要变化是UreE的激活;亚硝酸盐加速向一氧化氮生成,一氧化氮过量可能导致氧化应激、神经毒性、免疫抑制等问题。
注:UreE是一种激活尿素酶的共蛋白,导致尿素酶升高,最终导致肠道细菌中尿素的减少。
重金属暴露后肠道菌群紊乱引起的主要代谢变化
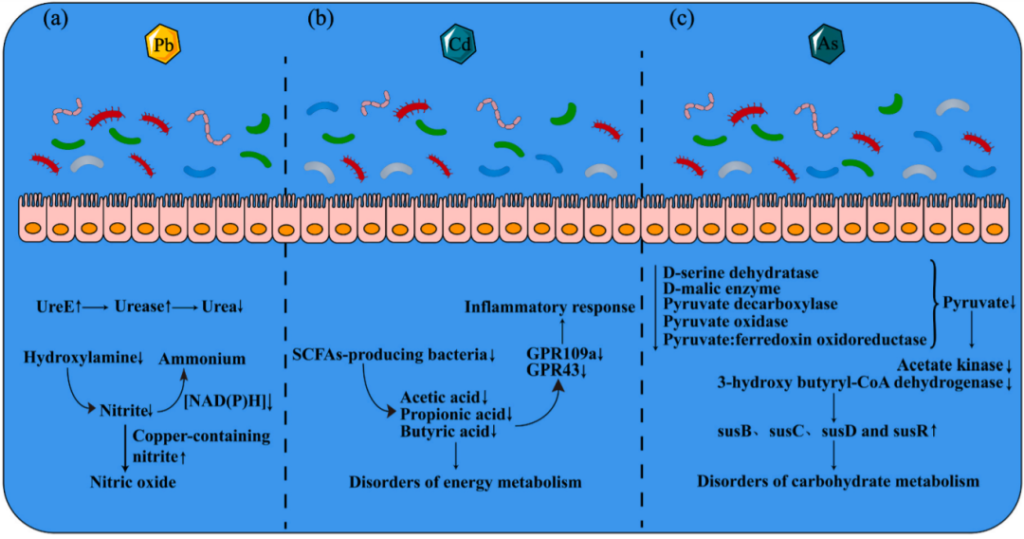
Liu X, et al.,Environ Pollut. 2023
肠道微生物群的研究为评估重金属毒性机制提供了一种新的途径。
持久性有机污染物(POP),包括有机氯农药、多氯联苯(PCB)、多溴二苯醚和多环芳烃(PAHs),是一种持久性和高毒性的合成化合物,可在生物组织中积累,可能与肥胖、糖尿病、自身免疫性疾病和某些发育障碍发病率上升相关。
扩展阅读:
通常,持久性有机污染物在摄入食物或水后会暴露于肠道微生物群,因此需要了解它们对肠道微生物的影响。
多氯联苯(PCB)
多氯联苯具有优异的介电财产和化学稳定性,因此用于制造冷却液、变压器、液压油和润滑剂。多氯联苯被认为是致癌物,可在小鼠暴露2天内显著改变肠道微生物群组成。肠中的产气荚膜梭菌Clostridium perfringens 和贝氏梭菌Clostridium beijerinckii可以降解多氯联苯,通过去除氯原子并打开苯环。
暴露于2,3,7,8-四氯二苯并呋喃(TCDF)(一种PCB)至少5天,可降低厚壁菌门/拟杆菌门的比例,降低梭状芽胞杆菌的水平,并增加盲肠内容物中的黄杆菌Flavobacteria水平。上述肠道微生物群的改变与胆汁酸代谢的变化有关。此外,TCDF还可以抑制法尼素X受体(FXR)信号通路,从而引发细菌发酵导致的宿主的严重炎症和代谢紊乱。
扩展阅读:环境污染物通过肠脑轴影响心理健康,精神益生菌或将发挥重要作用
杀虫剂
在食品材料、水和土壤中检测到多种农药残留,这使得农药成为一个严重的环境问题。一些杀虫剂具有抗菌活性,因此能够改变肠道微生物组的组成。
氯氰菊酯(PEM)
氯氰菊酯(PEM)低剂量用于大鼠,结果降低了拟杆菌、普雷沃氏菌和卟啉单胞菌的丰度,增加了肠杆菌科和乳杆菌的丰度。这些菌群变化可能促进氯氰菊酯的神经毒性。
毒死蜱(CPF)
毒死蜱(CPF)是一种有机磷杀虫剂,通常用于水果、蔬菜和葡萄园。毒死蜱可以通过肝脏或肠道中的细胞色素P450酶代谢。毒死蜱增加了肠球菌、拟杆菌和梭菌的水平,但降低了大鼠肠道中乳酸杆菌和双歧杆菌的水平。
毒死蜱诱导的肠道失调导致粘膜屏障受损,细菌易位增加,并激活先天免疫系统。
以上是重金属等异源物对肠道菌群带来的影响,肠道菌群的变化也会给宿主健康造成影响。基于肠道菌群的层面进行干预,在一定程度上,可以帮助人体免受有害异源物积累带来的健康困扰,这些干预措施包括益生菌,饮食,运动等。
益生菌对重金属的作用
两种重金属解毒策略如下:
✔ 益生菌对重金属诱导的肠道细菌失调的保护
➦ 传统益生菌:
研究表明,鼠李糖乳杆菌(Lactobacillus rhamnosus sp.shermanii JS)和丙酸杆菌(Propionibacterium freudenreichii)能够在体内和体外成功解毒重金属。
有研究发现,含有鼠李糖乳杆菌GR-1 的益生菌降低了孕妇血液中砷和汞的含量。
以下菌株通过肠道重金属隔离和刺激肠道蠕动促进重金属的粪便排泄,从而减少重金属在肠道中的吸收,并逆转重金属引起的肠道菌群变化:
植物乳杆菌TW1-1
植物乳杆菌CCFM8610
乳酸片球菌(Pediococcus acidilactici strain BT36)
蜡样芽孢杆菌
植物乳杆菌CCFM8661
植物乳杆菌CCFM8610
扩展阅读:客观认识植物乳杆菌 (L. plantarum) 及其健康益处
罗伊氏乳杆菌P16
扩展阅读:认识罗伊氏乳杆菌(Lactobacillus reuteri)
短乳杆菌23017
➦ 下一代益生菌:
普拉梭菌Faecalibacterium prausnitzii 是一种可以生产短链脂肪酸能力的人类肠道共生菌,参与微生物的解毒作用。
扩展阅读:肠道核心菌属——普拉梭菌(Faecalibacterium Prausnitzii),预防炎症的下一代益生菌
➦ 重组细菌:
由于一些天然益生菌的不足,重组菌成为重金属污染微生物解毒研究的热点。重组乳酸乳球菌pGSMT/MG1363,产生一种类似于谷胱甘肽 S-转移酶的融合蛋白,具有解毒功能。将重组乳酸乳球菌菌株喂给新生大鼠后,血铅水平显著降低。
Pb结合结构域(PbBD)是已证明具有吸附Pb2+能力的蛋白质之一。通过构建大肠杆菌PbBD并将其引入草鱼体内,结果表明,大肠杆菌PbBD可通过与Pb2+()结合,来减少组织中的Pb积累。
益生菌解毒重金属的机制
与细胞壁上的多糖的金属络合,以降低重金属浓度,通过转运蛋白的重金属离子,与细胞内金属螯合蛋白结合形成沉淀,以及通过酶反应转化为低毒形式等。
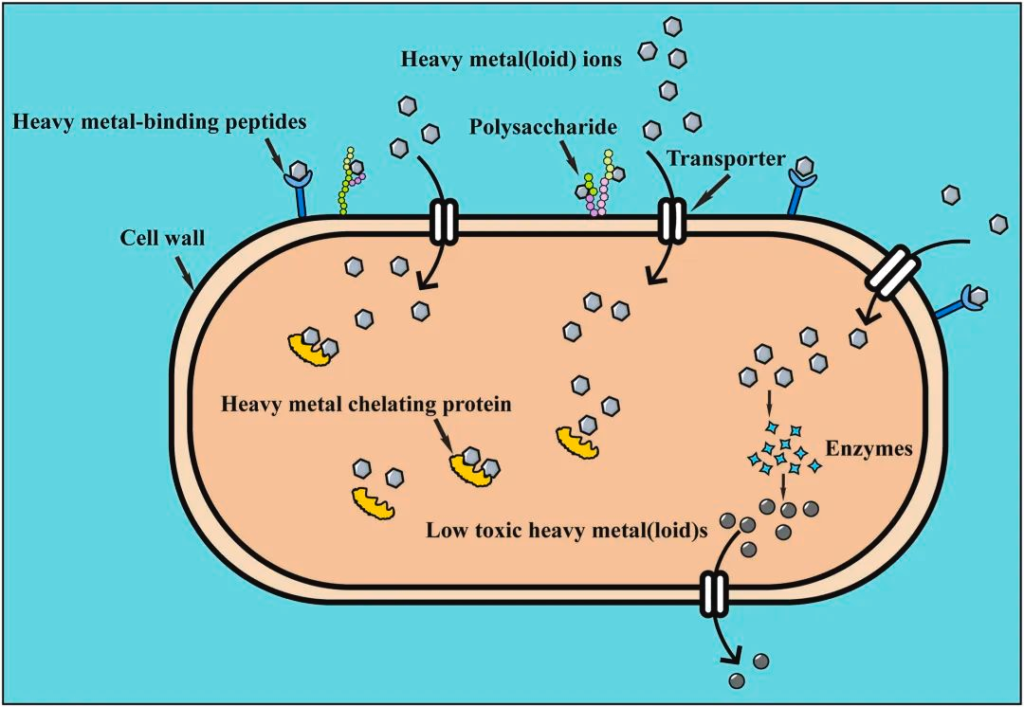
doi.org/10.1016/j.envpol.2022.120780
以上是第一种解毒策略,通过益生菌和重组细菌可以显著减少重金属对肠道微生物的影响,逐渐恢复健康的肠道菌群。接下来看第二张解毒策略:
✔ 肠道菌群防御反应的存在减少重金属的吸收
拮抗菌群的增加,可以减少宿主组织中镉的积累,从而降低发生一系列镉诱导疾病的风险。这种防御反应可能通过增加细胞外磷的浓度来增加铅的沉淀,从而降低肠道中的铅浓度。
——肠道微生物组可以直接影响砷代谢
在暴露于急性砷的小鼠肠道中,第一种反应被发现是一种防御机制,其特征是携带砷抗性基因或参与砷解毒机制的细菌数量增加。
动物研究也表明,肠道细菌通过将砷转化为粪便排泄,限制了砷在宿主体内的积累,降低了砷对宿主的影响。无机砷通过细胞膜上的磷转运蛋白或水通道蛋白进入生物体,并通过生物还原和生物甲基化进一步转化为各种其他形式的砷。
绝大多数无机砷的转化是由肠道菌群进行的,但肠道微生物对砷的处理在肠道的不同位置有所不同:
——肠道菌群抵抗铬吸收,有助于防止铬毒性
肠道微生物中的Cr(VI)耐受细菌,如副乳杆菌CL1107,在体外表现出Cr(VI)的减少,将Cr(IV)还原为Cr(III),其在中性或碱性条件下更难溶解。Cr(III)的低溶解度及其不能透过细胞,增加了粪便中铬的排泄量。
其他可能有用的措施
1、饮食
与排出重金属有关的食物包括:
螺旋藻、香菜、蓝莓等;
富含果胶的食物,如苹果、梨和柑橘类水果;
富含硫的食物,如西兰花、洋葱和大蒜等。
新鲜蔬菜榨汁:
绿叶蔬菜富含叶绿素,叶绿素在身体的解毒过程中非常重要,有助于清除血液中的重金属和毒素。同时,蔬果汁有利于增强肝功能,肝脏能够有效地处理和消除体内的毒素。
2、净化水源
例如:通过滤水器,帮助净化水中的重金属、有毒化学物质和污染物;或者饮用矿泉水等方式。
3、适量运动
出汗是一种自然的身体过程,可以帮助我们清除体内的毒素和废物。确保定期锻炼身体,让身体出汗排毒。
对于身体来说,药物是一种异源物质。身体可能会限制药物在胃肠道的吸收;加剧其在肠道和肝脏中的新陈代谢。
为什么不同人用药效果不一样?
药物明明是用于治病的,为什么可能带来所谓的副作用或者说毒性,甚至更严重后果?
肠道菌群是如何影响药物代谢,从而对身体带来不同影响?
用于神经系统疾病的药物,也与肠道菌群相关?
一个人服用多种药物,为什么会叠加健康风险?
本章节我们用常见的抗炎药,止泻药,癌症药物,神经系统药物,抗病毒药物来举例,从肠道菌群的角度来了解药物代谢的相关问题。
➤ 微生物对前药转化率不同,会影响患者疗效
抗炎药,尤其是针对胃肠道的抗炎药,由肠道细菌直接(化学修饰)或间接(通过微生物群和宿主细胞之间的相互作用)转化。此外,这些药物中的一些作为前药摄入,依赖微生物代谢将非活性前体转化为药物活性化合物。
肠道微生物将柳氮磺吡啶还原为磺胺吡啶后,柳氮磺嗪转化为活性抗炎剂5-ASA,然后进一步代谢为非活性N-乙酰基5-ASA。偶氮还原率和乙酰化率的差异,可以解释柳氮磺吡啶对患者的不同治疗效果。
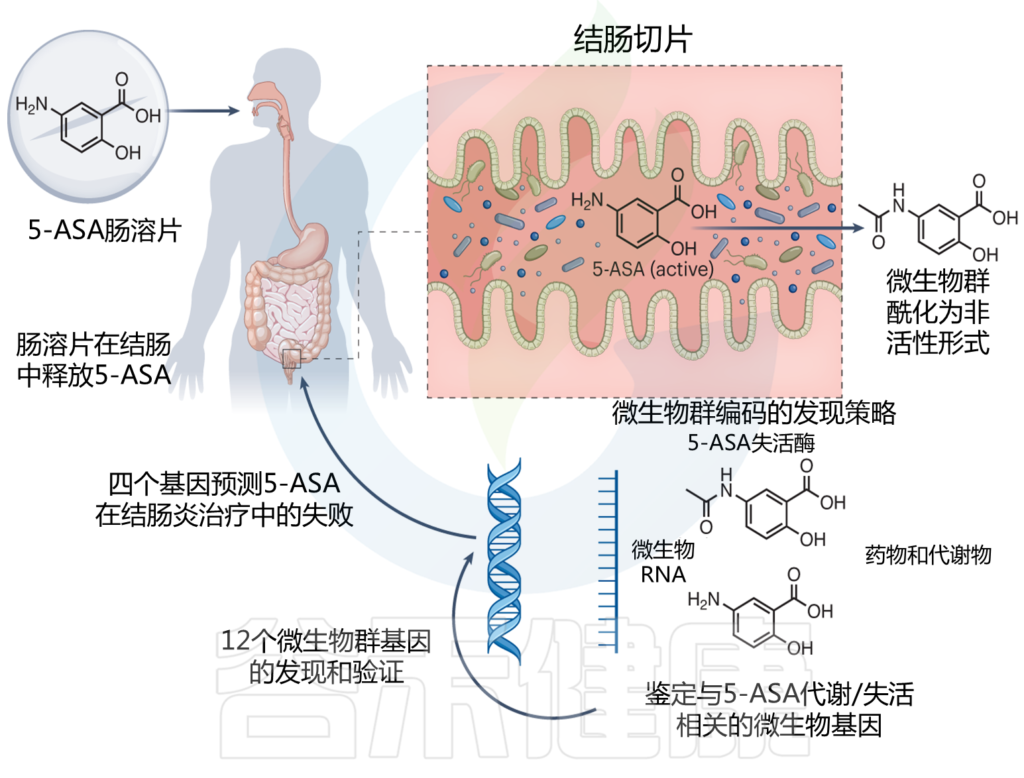
Macpherson AJ, et al., Nat Med. 2023
止泻药,洛哌丁胺的N-氧化物的减少也是肠道微生物活性激活前药的一个例子。
然而,对患者体内负责这些活动的特定生物和酶有更好的理解,有助于管理药物选择和给药等治疗。
个体之间对癌症化疗的治疗反应的一些差异,例如临床疗效和不良反应,也可能是由于肠道微生物群与药物相互作用的现象。肠道细菌可以直接改变化疗药物及其代谢产物的结构,从而改变与宿主细胞的相互作用。
➤ 癌症治疗:药物效果因人而异,可能与肠道菌群或肿瘤相关微生物对药物的结构改变有关
肠道菌群改变常用癌症药物的化学结构。在体外研究中,由于直接的化学修饰,大肠杆菌或魏氏李斯特菌(Listeria welshimeri)等细菌可以提高或降低30种抗癌药物的疗效。大肠杆菌也可以通过类似代谢活动来改变体内化疗的效果。
已知肠道微生物会降低化疗药物吉西他滨的活性浓度。大肠杆菌也可以阻止吉西他滨的疗效,因为它被微生物胞苷脱氨酶转化为其非活性代谢物。有意思的是,胞苷脱氨酶也作为嘧啶挽救途径的一部分存在于人类细胞中。因此,微生物酶在这种抗癌剂代谢中的真正影响仍然不确定。
➤ 神经药物作用于大脑,却也受控于肠道菌群
除了影响局部作用的药物外,肠道菌群代谢还会影响靶向远处器官系统的治疗效果。一些药物,如用于帕金森病治疗的口服左旋多巴,在穿过血脑屏障后,左旋多巴在大脑中被宿主酶局部代谢,以恢复多巴胺水平。然而,在到达大脑之前,药物在肠道中仍有广泛的代谢,导致浓度和患者反应发生显著变化。
一些短乳杆菌菌株,以及粪肠球菌、迟缓埃格特菌(Eggerthella lenta )能够在体外脱羧左旋多巴,但人类中大多数控制左旋多巴转化的肠道微生物和酶尚不清楚,需要更多的研究来揭示肠道菌群与各种神经药物之间的相互作用。
➤ 怎么看待同时服用不同种类药物,死亡风险升高?
拿抗病毒药物举例,如带状疱疹药物索罗夫定。据观察,服用索罗夫定的人,如果同时服用抗癌药物5-氟尿嘧啶,死亡风险会增加,这是为什么?
可能是因为索罗夫定溴戊酸脲的肠道微生物代谢产物减少,使二氢嘧啶脱氢酶失活,这反过来促进5-氟尿嘧啶的积累,导致更显著的毒性。
也可能与不同人群中酶的活性的显著差异有关。因此,同时服用这些药物带来药物不利影响的风险系数较高。
➤ 基于对肠道菌群药物代谢的了解,开发相应的方法提高疗效或减轻不良反应
地高辛主要用于治疗心力衰竭和心房颤动等心脏疾病,但是肠道菌群可以让它失活。地高辛具有狭窄的治疗窗口,用药过量会导致中毒反应,因此在临床上使用地高辛需要仔细监测以防止可能的心脏毒性。
当迟缓埃格特菌(Eggerthalla lenta)转化为没有治疗作用的代谢产物时,心力衰竭和心房颤动的治疗受到损害。
可能的机制与地高辛暴露时,迟缓埃格特菌中双基因细胞色素编码操纵子的上调有关。这种基因表达的蛋白质产物是Cgr1-Cgr2(心苷还原酶)复合物,它可以与地高辛结合并,将其还原为非活性代谢物。
既然我们了解到了这一点,那么有没有什么办法能阻止肠道菌群让地高辛失活?
研究人员认为,高蛋白饮食可以通过精氨酸防止肠道微生物群对地高辛的失活。也就是说饮食控制可以用来改变微生物的药物代谢,因为知道了细菌有独特的营养需求。不过随着对肠道细菌转化药物的机制了解的增加,也可以开发其他治疗方法来提高药物疗效或减轻不良反应。
所有这些研究都强调了揭示药物微生物转化的所有方面的重要性,可以从研究的药代动力学中明显地影响药物的作用。了解异源代谢过程是有必要的,这可能会影响药物的疗效、剂量和避免毒性。
草药在全世界范围内用于预防和治疗各种疾病已有数千年的历史。随着对天然药物的需求不断增长,中草药在世界范围内的重要性正日益增加。
肠道微生物群将中医药化学物质生物转化为代谢物,这些代谢物具有与其前体不同的生物利用度和生物活性/毒性。
接下来,我们从生物利用度和毒性这两方面,来详细了解,肠道菌群在中草药代谢中发挥什么样的作用,如何提高中草药的生物利用度,对毒性产生的正面或负面影响如何,用什么方法可以利用肠道菌群来降低中草药毒性等。
人在服用中草药后可分为两个阶段:
◗ 草药的生物利用度低,容易到达结肠与肠道菌群相遇
在草药中,许多成分的口服生物利用度非常低,因为它们是高极性化合物,亲脂性差。因此血流中的浓度水平有限。比如说,多酚的生物利用度通常低于 10%,人参皂苷的生物利用度可低至0.1%。
由于生物利用度低,这些化合物可以很容易地通过小肠并到达结肠。未被吸收的化合物就不可避免地与肠道菌群接触,并产生相互作用。
◗ 肠道菌群和中草药之间的相互作用是如何发生的?
首先,肠道微生物群与中草药之间的直接相互作用是双向的:
除了直接相互作用之外,中药与肠道菌群之间还会发生间接相互作用。在这类反应中,宿主的免疫和代谢系统起到了连接两端的桥梁作用。
免疫系统可以合成和释放一系列物质,如免疫球蛋白 A 和其他抗菌肽,可以调节肠道菌群组成。吸收的中草药可以调节胃肠道的免疫系统,最终导致肠道菌群发生变化。
比如说,一种中药化合物杜鹃花醇,可以改变牛乳腺上皮细胞中抗菌肽的表达,从而增强对金黄色葡萄球菌感染的防御能力。
◗ 在草药口服生物利用度低的问题中,肠道菌群能发挥作用吗?
出于患者方便和治疗依从性考虑,大多数药物是口服给药的。优化新药开发的主要特性之一是口服吸收度高。
糖苷,如三萜苷和黄酮苷,是许多草药含量中最常见的代表之一。由于氢键增加、糖部分的分子柔性和极性表面积,它们的肠道吸收有限。肠道微生物群可以将这些分子修饰成更亲脂性和极性更小的分子。
◗ 肠道菌群可以根据化合物的结构性质催化一系列代谢反应
草药中的糖苷首先在肠道中通过逐步水解(去糖基化和酯化)代谢。该过程产生的次生糖苷和/或苷元通常具有更好的肠道吸收和更好的生物利用度。它们通过骨架保留修饰(例如三萜苷)、骨架分裂(例如类黄酮苷)或骨架重排(例如环烯醚萜苷)进一步转化。
许多细菌门,其中拟杆菌门和厚壁菌门占优势,编码有丰富的糖苷水解酶基因,因此,它们用来进行糖苷水解。
◗ 不同肠道细菌可以合作处理单个化合物的代谢,单个细菌菌株也能够转化不同的化合物
梭杆菌K-60能使人肠道菌群中的槲皮苷去糖基化,而四种细菌菌株(Pedicoccus Q-5、链球菌S-3、拟杆菌JY-6、双歧杆菌B-9)参与了苷元(槲皮素)的进一步代谢。
丁酸梭菌通过各种反应机制,如脱糖基化、脱水、缩合、分子内环化和/或脱氢,能够转化属于不同结构类型的几种化合物,即紫草素、乌头碱和栀子苷。
然而说到中草药颇有争议,并不是所有人都认可,所谓“是药三分毒”,有人认为它会带来药物性肝损伤,这是一种常见的药物不良反应,可导致肝功能衰竭等问题。
近年来研究表明,中草药可以与肠道菌群相互作用,这种相互作用可以极大地影响其毒性和疗效。
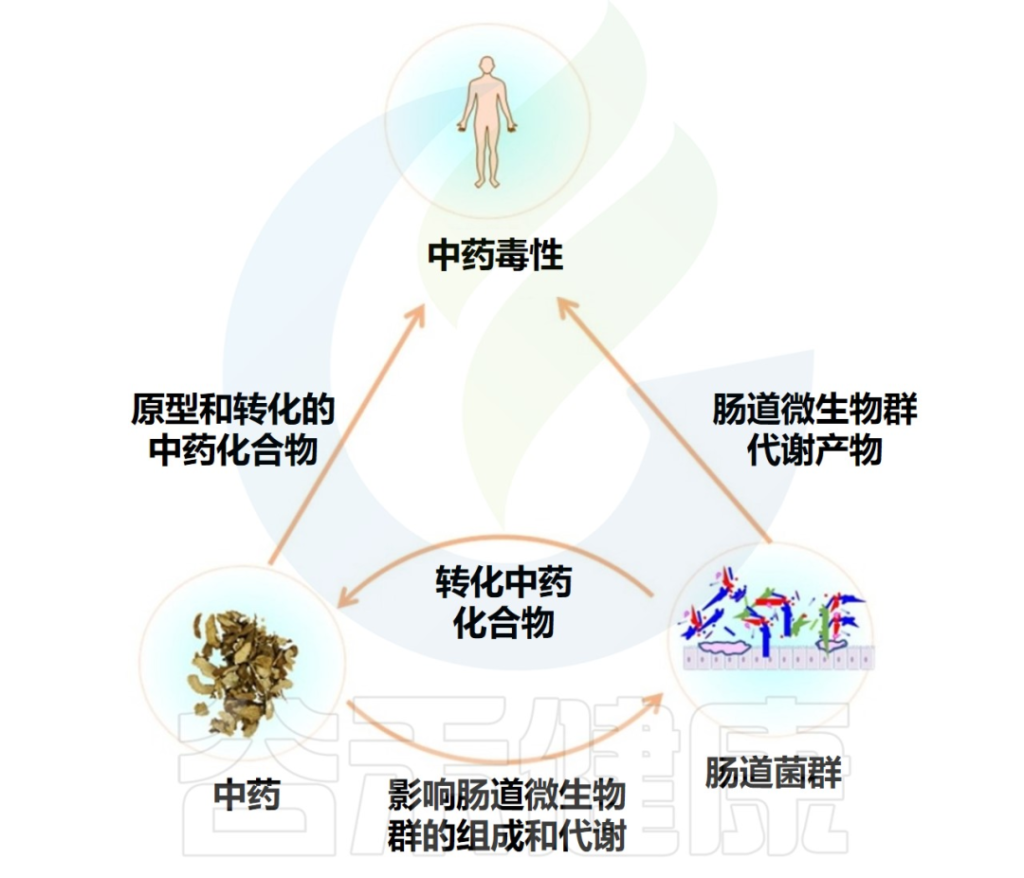
doi.org/10.1016/j.biopha.2020.111047
肠道菌群可以合成和释放一系列具有代谢异源物能力的酶,这些酶可以转化中药化合物,从而直接改变中药的毒性,这种改变包括增加毒性、减少毒性、解毒、激活毒性。
注:这些酶例如,β-葡萄糖醛酸酶、 β-葡萄糖苷酶、 β-半乳糖苷酶、α-鼠李糖苷酶等。
接下来从这四方面展开了解,肠道菌群对中药毒性的直接影响。
► 增加毒性
苦杏仁苷是一种在杏仁中发现的化合物,杏仁是一种用于治疗呼吸系统疾病如支气管炎、肺气肿的中药,但也可能有毒性,表现为恶心、呕吐、胸闷、头晕。
而肠道菌群可以水解苦杏仁苷的糖苷键,从而释放扁桃腈,扁桃腈是一种可以自发分解产生苯甲醛和有毒氢氰酸的化合物。因此,肠道菌群对苦杏仁苷毒性的修饰具有重要作用。
除了苦杏仁苷外,肠道菌群也可以代谢熊果苷、葛根素【与消化链球菌属 (Y-10)有关】、大豆苷【与双歧杆菌属 (K-111)有关】等其他中药成分,产生毒性更强的代谢物。
► 降低毒性
乌头(附子)的侧根是临床广泛用于治疗心力衰竭的中药,但常对神经和心血管系统产生毒性作用。
乌头生物碱是影响附子药理活性和毒性的主要化合物。在临床上有个办法来降低毒性,附子通常经过数小时的煮沸处理,然后再给患者开处方。
在胃肠道中,肠道菌群可以通过脱酰、酯化和去除甲基羟基以类似的方式转化乌头生物碱,参与的菌群与脆弱拟杆菌、肺炎克雷伯菌、丁酸梭菌有关。因此,肠道菌群降低了其毒性。注意肠道的这种减少的程度是有限的,口服大剂量依然会导致急性毒性。
除了乌头生物碱之外,肠道菌群还会对黄芩苷、对羟基苯甲酸丁酯转化为毒性较小的化合物。
► 解毒
这里的排毒,和前面章节的药物代谢机制类似,将活性中药化合物转化为非活性产物。
草酸盐是一种草药化合物,存在于许多中药中,能够诱发高草酸尿症、肾结石和心脏传导障碍。肠道菌群可以在甲酰辅酶 A转移酶和草酰辅酶 A脱羧酶的帮助下,解毒草酸盐。
► 激活毒性
这与前面解毒相反,激活是指肠道菌群将无毒化合物转化为有毒化合物。
苏铁甙是苏铁科植物中的一种偶氮糖苷,具有肝毒性和致癌能力。肠道菌群可以将苏铁甙转化为其苷元(甲氧基甲醇),苷元可以进一步转化为重氮甲烷,一种具有肝毒性和致癌作用的有毒化合物。
中药与肠道菌群的直接相互作用,不仅会导致中药化合物的转化,还会导致肠道菌群的组成和代谢发生变化,从而进一步影响中药的毒性。
以上我们可以看到,肠道菌群对毒性的影响并不是固定的,可能是增加毒性或者减小毒性。那么当发现某些肠道菌群可能会增加中草药毒性时,我们能做些什么尽可能阻止毒性增加呢?
由于肠道微生物群在调节中药毒性方面的重要作用,靶向肠道微生物群已成为控制中药毒性的新前沿。这里总结了靶向肠道菌群降低中药毒性的可能方法。
1、炮制减毒
许多中药在用于临床或制造中药之前要经过煮沸、漂、蒸等特殊处理,也就是“炮制”。
炮制的增效和降毒作用机制是中药现代化的重要问题。研究表明,煮沸等炮制可以将有毒化合物转化为无毒或毒性较小的化合物,从而改变中药的毒性,如前面说的乌头根。
近年来,研究人员证明炮制可以影响肠道微生物群,从而影响中药的药理作用。
甘遂是一种有毒的中药,用于治疗水肿、腹水和哮喘。由于其强烈的毒性,如肝脏和胃肠道毒性,通常用醋煎烤以降低毒性。最近的一项研究表明,醋制甘遂显著减少了甘遂中的10种有毒化合物,如甘遂素B、甘遂素C和甘遂素E。同时,醋制甘遂可以显著改变肠道微生物群的组成,显著提高了短链脂肪酸水平。
注:醋制是是中药炮制中重要的炮制方法。
考虑到肠道微生物群产生的短链脂肪酸具有抗炎和肠粘膜保护作用,可以推断醋制可以调节肠道微生物群的组成和代谢,从而降低甘遂的毒性。
2、中药组合
肠道微生物群释放的β-葡萄糖醛酸酶是一种重要的酶,可以将草药中的糖苷水解为苷元,这一过程可以增加草药化合物和药物的毒性。
非甾体抗炎药和β-葡萄糖醛酸酶抑制剂等化学药物的组合可以降低化学药物的毒性。
一些中药化合物(如黄芩苷)可以抑制细菌β-葡萄糖醛酸酶的活性,其与化学药物(如CPT-11)的组合可以降低CPT-11的毒性。
槲皮素的细菌代谢产物3,4-二羟基苯乙酸可以减少对乙酰氨基酚引起的肝损伤。因此,可以推断,具有抑制细菌酶的能力的中药可以与其他有毒中药或化学药物结合,以降低其毒性。
3、饮食
我们已经知道,饮食在调节肠道微生物群组成和功能中具有重要作用。同样,研究人员也想办法寻找饮食和药物之间的关联。上一章节我们已经了解到,高蛋白饮食可以抑制地高辛失活,并可用于降低某些患者(原本要更高剂量的患者)的地高辛毒性风险。
4、其他(FMT)
其他方法包括粪便微生物群移植(FMT)、益生元和益生菌的补充以及肠道微生物群的工程都有可能降低药物的毒性。
粪菌移植可以显著改善难治性免疫检查点抑制剂诱导的结肠炎,还可以显著改善FOLFOX(一种含有5-氟尿嘧啶、亚叶酸和草酸铂的方案)诱导的大肠癌癌症动物模型中的肠粘膜炎和腹泻。
预防性服用一种益生菌菌株干酪乳杆菌鼠李糖亚种,可显著降低FOLFOX诱导的结肠癌症动物模型中的肠道粘膜炎和腹泻,但不会改变FOLFOX的抗肿瘤作用。
TGF-β阻断剂和大肠杆菌Nisle 1917的组合增强了Galunisertib的肿瘤抑制作用。
肠道微生物群工程是直接治疗疾病和改善药物疗效的新兴前沿,如苯丙酮尿症和左旋多巴。尽管这些方法尚未用于控制中草药的毒性,但可以预见,这些方法将在不久的将来会引入,从而改善中草药毒性。
➭ 肠道微生物组、宿主因素和异源代谢的多方面相互作用是复杂的。微生物异源代谢可导致生物活化、解毒,通过加强肠粘膜屏障来防止吸收。肠道微生物的各种酶反应拓宽了我们对外来生物如何代谢的看法,代谢产物可以发挥新的活性。
➭ 破译异源物的肠道微生物转化,特别重要的是从患者处获取关于饮食或外源性暴露的广泛信息,有助于其与特定健康结果联系起来。
准确评估异源物质引起的肠道微生物群扰动,是将肠道微生物群失调与宿主健康状况联系起来和开发微生物群导向疗法的前提和基础。
➭ 重金属等环境污染物的暴露对肠道微生物群的扰动,会影响代谢和生理功能,部分导致代谢疾病的病因或进展。当然还需要更多深入、系统的研究,来确定重金属等污染物暴露对肠道微生物群的和时间效应。
➭ 了解肠道菌群对药物毒性和疗效的调节作用背后的分子机制,有助于改进药物开发和精准医学,更有效地评估风险,并开发个性化营养。
在不同的临床环境中为个体指导个性化营养膳食及肠道干预,或者制定相应益生菌补充方案,是提高中草药价值的重要研究方向。
将肠道微生物如何转化药物的知识整合到药物开发和实施的所有阶段,将有助于设计合适的治疗方案并改善患者对药物的临床反应。
主要参考文献
Liu X, Zhang J, Si J, Li P, Gao H, Li W, Chen Y. What happens to gut microorganisms and potential repair mechanisms when meet heavy metal(loid)s. Environ Pollut. 2023 Jan 15;317:120780. doi: 10.1016/j.envpol.2022.120780. Epub 2022 Nov 29. PMID: 36460187.
Mehta RS, Mayers JR, Zhang Y, Bhosle A, Glasser NR, Nguyen LH, Ma W, Bae S, Branck T, Song K, Sebastian L, Pacheco JA, Seo HS, Clish C, Dhe-Paganon S, Ananthakrishnan AN, Franzosa EA, Balskus EP, Chan AT, Huttenhower C. Gut microbial metabolism of 5-ASA diminishes its clinical efficacy in inflammatory bowel disease. Nat Med. 2023 Feb 23. doi: 10.1038/s41591-023-02217-7. Epub ahead of print. PMID: 36823301.
Koppel N, Maini Rekdal V, Balskus EP. Chemical transformation of xenobiotics by the human gut microbiota. Science. 2017 Jun 23;356(6344):eaag2770. doi: 10.1126/science.aag2770. PMID: 28642381; PMCID: PMC5534341.
Lindell AE, Zimmermann-Kogadeeva M, Patil KR. Multimodal interactions of drugs, natural compounds and pollutants with the gut microbiota. Nat Rev Microbiol. 2022 Jul;20(7):431-443. doi: 10.1038/s41579-022-00681-5. Epub 2022 Jan 31. PMID: 35102308.
Macpherson AJ, Sauer U. Secrets of microbiota drug metabolism. Nat Med. 2023 Feb 23. doi: 10.1038/s41591-023-02227-5. Epub ahead of print. PMID: 36823300.
Zhang Q, Bai Y, Wang W, Li J, Zhang L, Tang Y, Yue S. Role of herbal medicine and gut microbiota in the prevention and treatment of obesity. J Ethnopharmacol. 2023 Apr 6;305:116127. doi: 10.1016/j.jep.2022.116127. Epub 2023 Jan 2. PMID: 36603782.
Feng W, Liu J, Huang L, Tan Y, Peng C. Gut microbiota as a target to limit toxic effects of traditional Chinese medicine: Implications for therapy. Biomed Pharmacother. 2021 Jan;133:111047. doi: 10.1016/j.biopha.2020.111047. Epub 2020 Dec 4. PMID: 33378954.
Chen F, Wen Q, Jiang J, Li HL, Tan YF, Li YH, Zeng NK. Could the gut microbiota reconcile the oral bioavailability conundrum of traditional herbs? J Ethnopharmacol. 2016 Feb 17;179:253-64. doi: 10.1016/j.jep.2015.12.031. Epub 2015 Dec 23. PMID: 26723469.
Collins SL, Patterson AD. The gut microbiome: an orchestrator of xenobiotic metabolism. Acta Pharm Sin B. 2020 Jan;10(1):19-32. doi: 10.1016/j.apsb.2019.12.001. Epub 2019 Dec 10. PMID: 31998605; PMCID: PMC6984741.
Feng Y, Cao H, Hua J, Zhang F. Anti-Diabetic Intestinal Mechanisms: Foods, Herbs, and Western Medicines. Mol Nutr Food Res. 2022 Jul;66(13):e2200106. doi: 10.1002/mnfr.202200106. Epub 2022 May 11. PMID: 35481618.
Teschke R. Aluminum, Arsenic, Beryllium, Cadmium, Chromium, Cobalt, Copper, Iron, Lead, Mercury, Molybdenum, Nickel, Platinum, Thallium, Titanium, Vanadium, and Zinc: Molecular Aspects in Experimental Liver Injury. Int J Mol Sci. 2022 Oct 13;23(20):12213. doi: 10.3390/ijms232012213. PMID: 36293069; PMCID: PMC9602583.

谷禾健康

在20世纪初,Elie Metchnikoff(著名生物学家,酸奶之父)发现了有益的肠道微生物,该微生物可使肠道健康正常化并延长寿命,后来被称为“益生菌”。益生菌是指“以适当的剂量给予宿主健康有益的活生物体” 。
益生菌如今越来越受欢迎,主要是因为它们对我们整体健康的重要性。益生菌主要存在于人体肠道内,通过维持肠道微生物平衡,在宿主体内发挥有益作用。
不久前发表于《自然•化学》的一项最新研究成果表明,“吃土”也能调节肠道微生物组和治疗肠炎。
究其原因是许多益生菌来源于土壤微生物 (SBO)。细菌在土壤中有着惊人的多样性和丰富性,它们在土壤生态系统中的作用方式与它们在肠道生态系统中的作用相似。
注:该研究中的“吃土”并不是直接食用土壤,而是“人造土”,通过人工合成的方法构建的土壤仿生材料。事实上,自然界土壤中的微生物与肠道菌群中的微生物并不完全相同,且土壤中可能存在有害物质,如重金属、农药等,因此,直接食用土壤可能会引起不必要的健康问题。
考虑土壤微生物的多样性和复杂性,为了让大家更好地了解来源于土壤微生物的益生菌,本文将介绍其中最常见的土壤益生菌及其作用。希望对未来益生菌的选择和恢复肠道微生态提供一定价值。
▼
土壤微生物一词涵盖了土壤中高度多样化的细菌(和其他生命形式),这些细菌在土壤中自然存在。在引入工业化和现代农业之前,我们每天都会定期接触这些细菌。近年来,一些土壤微生物已被分离并用作益生菌。
许多土壤微生物的一个关键特征是它们可以形成孢子。当条件不太有利时,土壤微生物会形成小孢子,这是细菌的一种休眠形式,具有坚硬的保护性外涂层。在这种形式下,细菌对热、酸和大多数抗生素具有高度抵抗力。
土壤微生物和肠道微生物组息息相关
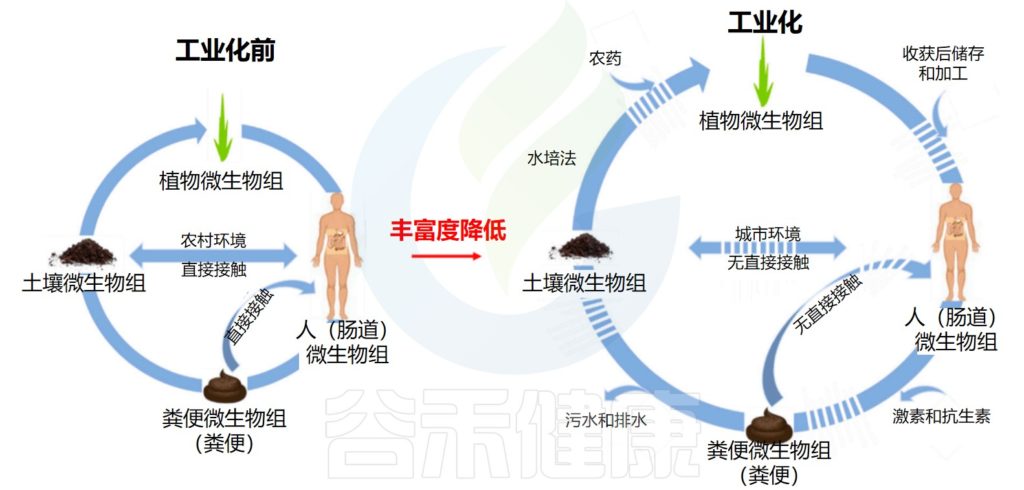
doi: 10.3390/microorganisms7090287
▼
• 通过触发抗体来帮助调节免疫系统;
• 对抗肠易激综合征,调节肠道功能;
• 减轻炎症;
• 治疗腹泻、腹痛和腹胀;
• 帮助消化和营养吸收;
• 防止感染;
• 支持情绪和心理健康;
• 支持平衡肠道微生物群;
• 促进新陈代谢,加速脂肪流失;
• 缓解过敏症状
▼
以下是益生菌中最常用的八种土壤微生物:
Bacillus coagulans(凝结芽孢杆菌)
Bacillus subtilis (枯草芽孢杆菌)
Bacillus clausii(克劳氏芽孢杆菌)
Bacillus indicus (印度芽孢杆菌)
Bacillus licheniformis(地衣芽孢杆菌)
Enterococcus faecium (屎肠球菌)
Enterococcus faecalis(粪肠球菌)
Clostridium butyricum(丁酸梭菌)
注:印度芽孢杆菌是Bacillus属的微生物,原产地为中国。
在下文中介绍了八种来源于土壤微生物的益生菌在人类临床试验中的作用,以确定哪些菌株有较好的治疗前景。
01
凝结芽孢杆菌 (Bacillus coagulans)
凝结芽孢杆菌(Bacillus coagulans)是一种产生L-乳酸的革兰氏阳性细菌。最适生长温度为45-50℃,最适pH为6.6-7.0。它表现出乳酸杆菌科的许多典型特征,但与大多数乳酸菌不同,凝固芽孢杆菌可以形成孢子。
图源:JBMbio
六种凝结芽孢杆菌菌株在人体临床试验中得到充分研究:
✦六种不同菌株显示能够调节肠道微生物群、改善肠易激综合征
GBI-30, 6086
Bacillus coagulans GBI-30, 6086 (“Ganeden BC30”):通过至少10项人类随机对照试验,这是研究最深入的土壤菌株之一。GBI-30、6086已被证明可以改善肠易激综合征 、免疫功能并且可能有益地调节肠道微生物群。
体外研究还表明,它可能有助于果糖和乳糖的消化。
LBSC (DSM 17654)
Bacillus coagulans LBSC (DSM 17654):两项随机对照试验表明该菌株对肠易激综合征患者和急性腹泻或腹部不适患者有益。
MTCC 5856
MTCC 5856(“LactoSpore”):两项随机对照试验表明,该菌株可显著减轻肠易激综合征患者的腹胀、腹痛和抑郁症状。
SANK 70258
Bacillus coagulans SANK 70258 (“Lacris-S”):
一项随机对照试验和一项开放研究发现,该菌株可改善健康成人的大便频率,减少大便次数,且无不良影响。
最近一项使用人体肠道模型系统的研究发现,该菌株抑制了肠杆菌科中的促炎细菌,并增加了健康个体中产丁酸盐的毛螺菌科的丰度。
注:自1966年以来,该菌株已在日本用作食品成分。
SNZ 1969
Bacillus coagulans SNZ 1969:一项安慰剂随机对照试验发现,这种菌株显著改善了结肠转运时间并减少了轻度间歇性便秘人群的肠道不适。它也被证明对细菌性阴道病有效。
另一项使用SNZ 1969以及克劳氏芽孢杆菌和枯草芽孢杆菌的随机对照试验发现,胃肠道不适的成年人的嗳气、腹胀、疼痛和总体症状有所减轻。
Unique IS-2
Unique IS-2(“ProDURA”):四项人类随机对照试验发现该菌株对儿童和成人的细菌性阴道病和肠易激综合征均有效。该菌株还被证明可以在体外代谢果糖。
所有这六种菌株都作为食品成分进行了安全评估,并获得了食品药品监督管理局的“公认安全”(GRAS) 状态。
▸ 小结
这些凝结芽孢杆菌菌株似乎是安全的、耐受性良好的,并且可能对患有细菌性阴道病或肠易激综合征的患者特别有益。
枯草芽孢杆菌(Bacillus subtilis)是一种形成孢子的革兰氏阳性细菌,被认为是人类肠道的正常居民。
枯草芽孢杆菌天然存在于纳豆中,纳豆是一种由发酵大豆制成的日本传统食品。
在引入抗生素之前,枯草芽孢杆菌培养物就已在世界范围内广泛用作免疫刺激剂,以帮助治疗泌尿道和胃肠道疾病。
B.subtilis可以产生一种降解草酸盐的酶,也可能产生少量维生素K2。

图源:eol.org
三种枯草芽孢杆菌菌株已证明对人类有治疗作用,并已通过作为食品成分的安全性测试:
✦三种不同菌株显示能够改善人体健康状况
DE111
Bacillus subtilis DE111:在训练期间对运动员进行的两项随机对照试验发现枯草芽孢杆菌DE111具有良好的耐受性。女运动员的体脂率下降幅度更大;男性运动员发现血液中的炎症标志物减少,对身体机能没有影响。
其他安慰剂随机对照试验发现枯草芽孢杆菌DE111改善了肠道不规律,增加了抗炎免疫细胞群的活性,降低了空腹血糖并降低了健康成人的总胆固醇。
该菌株被食品药品监督管理局公认为安全。
CU1
Bacillus subtilis CU1(“LifeinU”):一项随机对照试验发现,为期10天的B. subtilis CU1补充剂耐受性良好,并改善了老年人的免疫功能(粪便和唾液 中的免疫球蛋白)。
它没有表现出任何抗生素耐药性,并被证明在体外不存在产毒活性。
MB40
Bacillus subtilis MB40 (“OPTI-BIOME”) :
一项随机对照试验发现,该菌株在健康成人中具有良好的耐受性,可降低男性受试者的腹胀强度和胃肠道症状,并适度改善总体健康状况。
该菌株被食品药品监督管理局公认为安全 。
在亚洲对另外两种菌株进行了深入研究:
R0179
Bacillus subtilis R0179(“Medilac-S”):
该菌株存在于亚洲益生菌制剂Medilac-S中,该制剂还含有Enterococcus faecium R0026。几项安慰剂随机对照试验发现,两种菌株的制剂减少了肠易激综合征相关的腹痛,并改善了结肠镜检查的肠道。
最近一项针对临床试验的荟萃分析得出结论,Medilac-S也可有效诱导溃疡性结肠炎的缓解。
两项随机对照试验还发现,分离的枯草芽孢杆菌R0179具有良好的耐受性,并在通过人体胃肠道后存活下来。
TO-A
Bacillus subtilis TO-A (“BIO-THREE”) :
这种枯草芽孢杆菌菌株与E. faecalis T-110和C. butyricum TO-A相结合,作为益生菌在亚洲得到了相当深入的研究。在随机对照试验中,这三种菌株已被证明可以减少手术患者的术后感染并缩短急性腹泻患儿的住院时间。
▸ 小结
通常研究的枯草芽孢杆菌菌株似乎是安全的、耐受性良好的,并且没有不良反应的报道。一些菌株似乎对改善免疫功能和肠道规律性特别有益。
克劳氏芽孢杆菌(Bacillus clausii)是一种形成孢子的革兰氏阳性细菌,以其对金黄色葡萄球菌和艰难梭菌的抗菌活性而闻名。它被认为是一种共生微生物,已从健康个体的小肠和粪便中回收。
只有两种菌株组合已在人类身上进行过研究:
✦两种不同菌株组合显示对过敏、肠易激综合征有益
Bacillus clausii OC、NR、SIN和T
自1958年以来,这四种菌株已被广泛研究并用作药物制剂Enterogermina(美菌纳)。这些菌株已被证明具有酸和胆汁抗性,并且在人类单次口服给药后可在粪便中恢复4-12天。
这些菌株可能对那些有过敏症、减少鼻塞和抗组胺药需求的人特别有益。
它也被证明可以减少幽门螺杆菌抗生素治疗期间的副作用。
一项针对40名诊断为“小肠细菌过度生长”患者的研究发现,服用美菌纳一个月可使 47%的患者的葡萄糖呼气试验结果恢复正常。
值得注意的是,这个比率与许多用于小肠细菌过度生长治疗的抗生素所见的正常化率相当。只有一名患者报告了便秘的副作用。
尽管美菌纳有许多记录在案的益处和总体安全性,但仍有零星的克劳氏芽孢杆菌败血症病例报告。大多数报告都是在老年人、重病患者或免疫功能低下的个体中使用益生菌。
Bacillus clausii UBBC-07
在一项针对印度急性腹泻儿童的安慰剂对照随机试验中,该菌株被证明可以改善粪便稠度并缩短腹泻持续时间。该菌株经过了毒理学研究,被确定可供人类安全食用。
▸ 小结
克劳氏芽孢杆菌已在许多随机、安慰剂对照试验中证明了疗效,并且可能对过敏或肠易激综合症患者特别有益。
脓毒症的个别病例报告表明,老年人、重病或免疫功能低下的人以及最近服用广谱抗生素的人可能禁忌使用它。
印度芽孢杆菌(Bacillus indicus)是一种形成孢子的细菌,因其能够有效刺激免疫系统并产生高水平的类胡萝卜素、维生素和喹啉而受到吹捧。
✦暂未有毒性或致病性的发现
体外和动物研究未能发现B.indicus HU36的任何潜在毒性或致病性,该菌株是益生菌中最常用的菌株,并且没有关于人类感染的报道。
▸ 小结
关于人类印度芽孢杆菌的科学研究,目前还缺乏人类证据。
地衣芽孢杆菌(Bacillus licheniformis)是一种革兰氏阳性、产芽孢的细菌,通常用于工业酶生产。
在所有基于土壤使用的益生菌中,地衣芽孢杆菌可能是最具争议的。
✦可能具有一定毒性
根据一些报道,地衣芽孢杆菌可能是一种机会性病原体,可导致免疫功能低下的宿主感染。
然而,其他报告得出的结论是,地衣芽孢杆菌的毒力非常低。地衣芽孢杆菌存在于韩国传统消费的许多发酵食品中,并且已从健康人类志愿者的胃肠道中分离出来,因此至少某些菌株似乎是共生的。
虽然已经出现了与大量该物种的分离相关的急性自限性胃肠炎病例, 对肠上皮细胞的毒性或直接影响尚未得到证实。很难确定这些报告病例中的物种(数量相当有限)是否积极参与了感染,或与一种不明病原体一起分离。
只有四项关于分离的地衣芽孢杆菌的人体研究,没有一项提供菌株信息,并且只有一项是随机和安慰剂对照的。
▸ 小结
虽然含有地衣芽孢杆菌的传统发酵食品几乎是安全的,但目前没有足够的证据支持大剂量补充地衣芽孢杆菌。最好谨慎行事,避免使用含有该物种的益生菌。
✦发酵碳水化合物
Enterococcus faecium是革兰氏阳性菌。虽然它不形成孢子,但它可以耐受多种环境条件。E. faecium是人类肠道的正常居民,发酵碳水化合物并产生乳酸作为副产品。
粪肠球菌的一些菌株可以在传统发酵食品中找到。
by Dennis Kunkel Microscopy
✦可能致病
然而,粪肠球菌也可能致病,引起新生儿脑膜炎和心内膜炎等疾病。这种细菌的许多菌株已经产生了抗生素抗性和毒力因子,使其能够聚集并形成生物膜。
在美国,80-90%的医疗器械相关感染可归因于耐抗生素粪肠球菌。因此,人们担心将其用作益生菌。
已经研究了许多不同的菌株,但只有两种菌株值得强调,它们已经在多项人体试验中进行了研究:
M-74
Enterococcus faecium M-74:该菌株有许多与之相关的“随机”临床试验,但每一个菌株都服用益生菌和50微克硒。
许多益生菌指出这些研究表明粪肠球菌可以降低胆固醇,但缺乏硒对照组意味着硒单独提供治疗效果是完全合理的。
R0026
Enterococcus faecium R0026 (“Medilac-S”):
该菌株存在于亚洲益生菌制剂Medilac-S中,该制剂还含有枯草芽孢杆菌R0179,并在国内得到了很好的研究。
如前面所述,多项随机对照试验发现,双菌株制剂可减少肠易激综合征相关的腹痛,并改善结肠镜检查的肠道准备,还可以有效诱导溃疡性结肠炎的缓解。
▸ 小结
除了Medilac-S中的菌株外,很少有精心设计的随机对照试验证明了粪肠球菌的功效。
鉴于其可能获得多重抗生素耐药性并引起感染。谨慎使用高剂量的分离粪肠球菌。
Enterococcus faecalis是一种革兰氏阳性菌。与Enterococcus faecium类似,它不能形成孢子,但对恶劣的环境条件相当耐受。
✦在肠道免疫中起重要作用
粪肠球菌是人类肠道的正常居民,存在于大约90-95%的人中。这种细菌通常是生命早期定植于人类胃肠道的首批微生物之一,在肠道免疫系统的发育中发挥着重要作用。
T-110
Enterococcus faecalis T-110:这种粪肠球菌菌株与枯草芽孢杆菌TO-A和丁酸梭菌TO-A结合使用作为益生菌(BIO-THREE)。这三种菌株一起可以减少手术患者的术后感染并缩短急性腹泻患儿的住院时间。
YM0831
Enterococcus faecalis YM0831:一项交叉研究发现,对健康人类受试者单次施用该菌株可显着改善血糖对蔗糖耐量试验的反应。
▸ 小结
除了BIO-THREE中的菌株外,很少有精心设计的随机对照试验证明了Enterococcus faecalis作为益生菌的功效,还需要更多的研究。
✦丁酸梭菌是肠道重要的菌属
丁酸梭菌(Clostridium butyricum)是人类胃肠道的天然居民。它是肠道中发酵膳食纤维并产生有益的短链脂肪酸丁酸盐的众多细菌之一。丁酸盐作为结肠上皮细胞的能量来源,有助于维持肠道屏障,具有抗炎作用,并可预防结肠癌。
doi.org/10.1007/s00535-015-1084-x
三种菌株已在人体中得到充分研究:
✦三种不同菌株显示能够调节肠道稳态、减轻肠炎
CBM 588
Clostridium butyricum CBM 588:这种丁酸梭菌菌株早在1963年就用作益生菌,用于一种名为Miyairisan的药物制剂中。它已经过安全性评估,不携带任何编码任何已知毒素或毒力因子的基因。
两项随机对照试验发现,该菌株可减少接受幽门螺杆菌根除治疗的患者的腹部症状和腹泻发生率的副作用。
另一项针对溃疡性结肠炎患者的安慰剂对照随机对照试验发现,接受MIYAIRI 588治疗的受试者中,患上肠结肠炎的人数较少。
尽管其影响在统计学上并不显著,而安慰剂组则服用乳糖,这会加重许多人的结肠炎。
TO-A
Clostridium butyricum TO-A:这种丁酸梭菌菌株与粪肠球菌T-110和枯草芽孢杆菌TO-A结合使用,作为益生菌在亚洲得到了广泛使用和深入研究。
A Tai Ning
该菌株包含在一种名为阿泰宁的产品中,最近在一项大规模、多中心、的随机对照试验中显示,该菌株对以腹泻为主的肠易激综合征具有显著益处。
该研究包括200名患者。4周后,与安慰剂组相比,益生菌组在整体肠易激综合征症状、大便频率和生活质量方面有显著改善。
几项研究发现丁酸梭菌降低了早产儿败血症和腹泻的发生率,并改善了抗原特异性免疫治疗。在动物研究中,丁酸梭菌已被证明可以改善肠道稳态并减轻结肠炎。
▸ 小结
丁酸梭菌是肠道重要的菌属,在随机试验中似乎是安全且耐受性良好的,并且帮助增加丁酸盐水平的同时,极少引起毒性。
➣土壤基益生菌的安全性仍存在争议,值得进一步关注
支持者声称它们是益生菌,可以使肠道功能正常化、帮助消化、有益地刺激免疫系统并帮助重新播种肠道微生物群。他们还称赞土壤微生物具有抵抗胃酸的能力并且不需要冷藏。
反对者认为,由于它们形成孢子的性质,它们会迅速增殖,与我们常驻的肠道微生物竞争,在某些情况下,它们甚至可能致病。由于它们的孢子形成能力和对大多数抗生素的天然抗性,意外的过度生长将很难治疗。
在随机、安慰剂对照的人体临床试验中,许多单独的土壤微生物菌株已被证明是有益的,几乎没有报告不良反应。
然而,其他菌株的临床证据有限或没有临床证据,可能会导致免疫系统受损的人感染。我们需要进行更细致的讨论——考虑每个特定物种、菌株和配方,而不是广泛地给土壤微生物贴上好或坏的标签。
基于土壤的微生物得到了很好的研究,并且已经在随机临床试验中显示出对一些症状有效,但仍需更多研究来确定其安全性和有效性。建议选择使用高质量和经过临床测试的菌株,在服用益生菌制剂前最好咨询医生的建议。
每个人对益生菌的反应都不同。反应将取决于服用的益生菌、剂量、肠道中已有的微生物以及肠道和免疫系统的健康状况。
可以通过微生物测序技术来检测使用益生菌前后的肠道菌群组成及相关健康状况。再选择针对自身特定健康状况的益生菌菌株。
同时也期待更多关于土壤微生物的单个菌株和配方在不同情况下影响肠道微生物群和肠道环境的研究。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献:
Mu Y, Cong Y. Bacillus coagulans and its applications in medicine. Benef Microbes. 2019 Jul 10;10(6):679-688. doi: 10.3920/BM2019.0016. Epub 2019 Jun 17. PMID: 31203635.
Jäger R, Purpura M, Farmer S, Cash HA, Keller D. Probiotic Bacillus coagulans GBI-30, 6086 Improves Protein Absorption and Utilization. Probiotics Antimicrob Proteins. 2018 Dec;10(4):611-615. doi: 10.1007/s12602-017-9354-y. PMID: 29196920; PMCID: PMC6208742.
Acosta-Rodríguez-Bueno CP, Abreu Y Abreu AT, Guarner F, Guno MJV, Pehlivanoğlu E, Perez M 3rd. Bacillus clausii for Gastrointestinal Disorders: A Narrative Literature Review. Adv Ther. 2022 Nov;39(11):4854-4874. doi: 10.1007/s12325-022-02285-0. Epub 2022 Aug 26. PMID: 36018495; PMCID: PMC9525334.
Ianiro G, Rizzatti G, Plomer M, Lopetuso L, Scaldaferri F, Franceschi F, Cammarota G, Gasbarrini A. Bacillus clausii for the Treatment of Acute Diarrhea in Children: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Nutrients. 2018 Aug 12;10(8):1074. doi: 10.3390/nu10081074. PMID: 30103531; PMCID: PMC6116021.
Kovács ÁT. Bacillus subtilis. Trends Microbiol. 2019 Aug;27(8):724-725. doi: 10.1016/j.tim.2019.03.008. Epub 2019 Apr 15. PMID: 31000489.
Marzorati M, Van den Abbeele P, Bubeck S, Bayne T, Krishnan K, Young A. Treatment with a spore-based probiotic containing five strains of Bacillus induced changes in the metabolic activity and community composition of the gut microbiota in a SHIME® model of the human gastrointestinal system. Food Res Int. 2021 Nov;149:110676. doi: 10.1016/j.foodres.2021.110676. Epub 2021 Aug 30. PMID: 34600678.
Kawarizadeh A, Pourmontaseri M, Farzaneh M, Hosseinzadeh S, Ghaemi M, Tabatabaei M, Pourmontaseri Z, Pirnia MM. Interleukin-8 gene expression and apoptosis induced by Salmonella Typhimurium in the presence of Bacillus probiotics in the epithelial cell. J Appl Microbiol. 2021 Jul;131(1):449-459. doi: 10.1111/jam.14898. Epub 2020 Dec 7. PMID: 33058340.
Muras A, Romero M, Mayer C, Otero A. Biotechnological applications of Bacillus licheniformis. Crit Rev Biotechnol. 2021 Jun;41(4):609-627. doi: 10.1080/07388551.2021.1873239. Epub 2021 Feb 16. PMID: 33593221.
Gudiña EJ, Teixeira JA. Bacillus licheniformis: The unexplored alternative for the anaerobic production of lipopeptide biosurfactants? Biotechnol Adv. 2022 Nov;60:108013. doi: 10.1016/j.biotechadv.2022.108013. Epub 2022 Jun 22. PMID: 35752271.
Gök ŞM, Türk Dağı H, Kara F, Arslan U, Fındık D. Klinik Örneklerden İzole Edilen Enterococcus faecium ve Enterococcus faecalis İzolatlarının Antibiyotik Direnci ve Virülans Faktörlerinin Araştırılması [Investigation of Antibiotic Resistance and Virulence Factors of Enterococcus faecium and Enterococcus faecalis Strains Isolated from Clinical Samples]. Mikrobiyol Bul. 2020 Jan;54(1):26-39. Turkish. doi: 10.5578/mb.68810. PMID: 32050876.
Stoeva MK, Garcia-So J, Justice N, Myers J, Tyagi S, Nemchek M, McMurdie PJ, Kolterman O, Eid J. Butyrate-producing human gut symbiont, Clostridium butyricum, and its role in health and disease. Gut Microbes. 2021 Jan-Dec;13(1):1-28. doi: 10.1080/19490976.2021.1907272. PMID: 33874858; PMCID: PMC8078720.
Chen D, Jin D, Huang S, Wu J, Xu M, Liu T, Dong W, Liu X, Wang S, Zhong W, Liu Y, Jiang R, Piao M, Wang B, Cao H. Clostridium butyricum, a butyrate-producing probiotic, inhibits intestinal tumor development through modulating Wnt signaling and gut microbiota. Cancer Lett. 2020 Jan 28;469:456-467. doi: 10.1016/j.canlet.2019.11.019. Epub 2019 Nov 14. PMID: 31734354.