-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康

药物是我们许多疾病的第一道,有时是最后一道防线,但尽管进行了数十年的研究,我们仍然不完全理解为什么某种药物对一名患者有效,而对另一名患者无效。
而人类肠道微生物组是这个环节里缺失的拼图之一,因为它能够平行和扩展药物代谢的宿主途径,以及更复杂的宿主-微生物组相互作用。
众所周知,微生物组可以调节宿主健康和疾病的许多方面,并且越来越被认为是药物作用的关键介质。然而,研究药物、微生物群和宿主之间复杂的多向关系是一项具有挑战性的工作,并且支持这些相互作用的生物学机制通常不是很清楚。
在本文中,我们概述了目前的证据,这些证据支持微生物群作为药物治疗益处和副作用的贡献者,特别关注用于治疗精神障碍、2型糖尿病和癌症的微生物群。
关键词
• 微生物组
• 药物
• 新陈代谢
• 抗精神病药
• 二甲双胍
• 癌症
药物微生物组学是一门新学科,旨在了解肠道微生物生态学、药理学、环境线索和宿主基因型之间的相互作用。
在这里,宿主和微生物细胞的这种超实体作为一个基因组和代谢单元发挥作用,其中两个生理实体都受到直接的选择压力,并且可以平等或独特地调节其周围环境的影响。这种复杂的相互作用产生了独特的功能和表型输出。
重要的是,这种对人体的整体看法也首先需要重新定义什么是药物治疗。Lipinski五法则,即根据药理化合物的分子特性(例如,吸收、分布、代谢和排泄或ADME)创建了一套指南,以评估药物相似性并预测人类口服活性的可能性,可能不再完全适合目的。
Lipinski 五法则
Lipinski 五法则是药物化学中一个重要的经验法则,用于预测药物分子是否具有良好的口服吸收性。
五法则具体规定:
较大的分子难以穿过细胞膜;
分子量越大,通常意味着药物的吸收性越差
反映药物的脂溶性
过高的logP值表示药物过于脂溶,可能在脂肪组织中蓄积;
过低则难以穿过细胞膜
主要指分子中-OH和-NH基团的数
过多的氢键供体会降低药物穿过细胞膜的能力
主要指分子中N和O原子的数量
过多的氢键受体同样会影响药物的膜渗透性
反映分子的柔性
过多的可旋转键会增加分子的熵,不利于与靶点结合
这些规则都与数字5或其倍数有关,因此称为”五法则”。
应用原则:
如果一个化合物违反上述规则中的2条或更多,可能在口服吸收方面存在问题。这些规则主要适用于通过被动扩散方式吸收的药物
不适用于天然产物和抗生素等特殊类别的化合物。
现代观点:
随着对人体微生物组认识的深入,这些规则可能需要扩展,以考虑:
药物与肠道微生物的相互作用
对整个宿主-微生物共同体的影响
营养因素对药物作用的调节
这些规则在药物研发早期阶段特别有用,可以帮助筛选具有潜在口服活性的候选药物分子。
鉴于微生物群在调节宿主功能中的作用和许多药物的作用 ,应扩大 Lipinski 五法则的范围,不仅包括靶向宿主细胞的化合物,还包括可以改变肠道微生物功能的化合物。此外,人们可能要考虑特定营养在调节药物对全身影响中的作用。
例如,强心苷地高辛(一种用于治疗心力衰竭的药物)作用方式的研究表明,存在于地高辛代谢Eggerthella lenta中的黄素和[4Fe-4S]簇依赖性还原酶 Cgr2 使地高辛失活,并受到精氨酸的抑制。这样的结果强调了从全息的角度考虑药理学的重要性,以增加最初针对宿主细胞的药物完全有效的可能性。
微生物群在调节全息菌体的健康和福祉方面的广泛作用为治疗提供了新途径,但我们目前对宿主、微生物群和环境之间复杂相互作用的理解仍处于起步阶段。
治疗药物↔微生物群相互作用
几项研究表明,环境(例如营养和药物)而不是宿主遗传学是调节微生物动力学的最重要因素 。特别是,最近的临床和人群研究表明,治疗药物可以改变微生物群组成,但微生物群同样会影响药物的可用性。
由微生物生物转化(活化、再活化、失活)引起的药代动力学改变已得到认可80年,已知有60多种药物被修饰。被微生物群激活的前药示例包括:
•protonsil,最早的非抗生素抗菌药物之一 ;
•柳氮磺吡啶,用于治疗类风湿性关节炎;
•洛伐他汀,用于降低胆固醇。
被微生物群重新激活的药物包括抗癌药物伊立替康,它在胆汁分泌到肠道后被细菌β-葡萄糖醛酸酶修饰 ,而心脏药物地高辛则是微生物群灭活药物的一个例子。
通过菌群代谢物间接改变药代动力学
微生物群还可以通过产生代谢物来间接改变药物药代动力学,这些代谢物竞争负责药物修饰的宿主酶的活性位点(例如、细菌对甲酚与镇痛对乙酰氨基酚之间的竞争)或通过改变负责药物作用的肝细胞色素P450酶的表达水平。
抗糖尿病药物二甲双胍等治疗药物也可以直接影响肠道微生物群落和新陈代谢,导致宿主代谢发生变化。
总体而言,药物-微生物群相互作用涵盖广泛的药物化学、治疗适应症和副作用,正如 Typas 实验室最近的一项综合研究所证明的那样。他们测试了超过1000种宿主靶向药物,发现24%的药物在体外抑制了代表性肠道细菌菌株的生长。
发现对细菌生长有显著影响的药物包括用于治疗心理健康障碍、2型糖尿病(T2D)和癌症的药物。
肠道和大脑之间的联系已经建立起来,肠道甚至被称为我们的第二大脑 。然而,对微生物组的研究显示,这两个器官比此前认为的联系更紧密。众所周知,肠道微生物群可以调节大脑发育,其成分的改变与焦虑、精神分裂症、双相情感障碍和抑郁症等精神障碍有关。
▷治疗精神疾病的药物与微生物群存在相互作用
此外,已发现用于治疗这些疾病的药物与微生物群相互作用。特别是,当筛选宿主靶向药物抑制肠道细菌生长的能力时,抗精神病化合物被确定为明显高占比。
进一步的研究支持这一发现,这些研究表明非典型抗精神病药(AAP)的给药会诱导肠道微生物群组成的抗生素异常改变。有趣的是,还有证据表明存在反比关系,因为抗生素诱导的生态失调与焦虑和抑郁等精神障碍有关。
下图展示了肠道微生物群作为脑-肠轴中央调节因子和潜在药物的相互作用。抗精神病药和精神药物直接影响肠道菌群组成,导致菌群失调和宿主代谢紊乱。此外,益生菌、益生元和抗生素等调节肠道微生物的手段也会影响宿主心理状态。
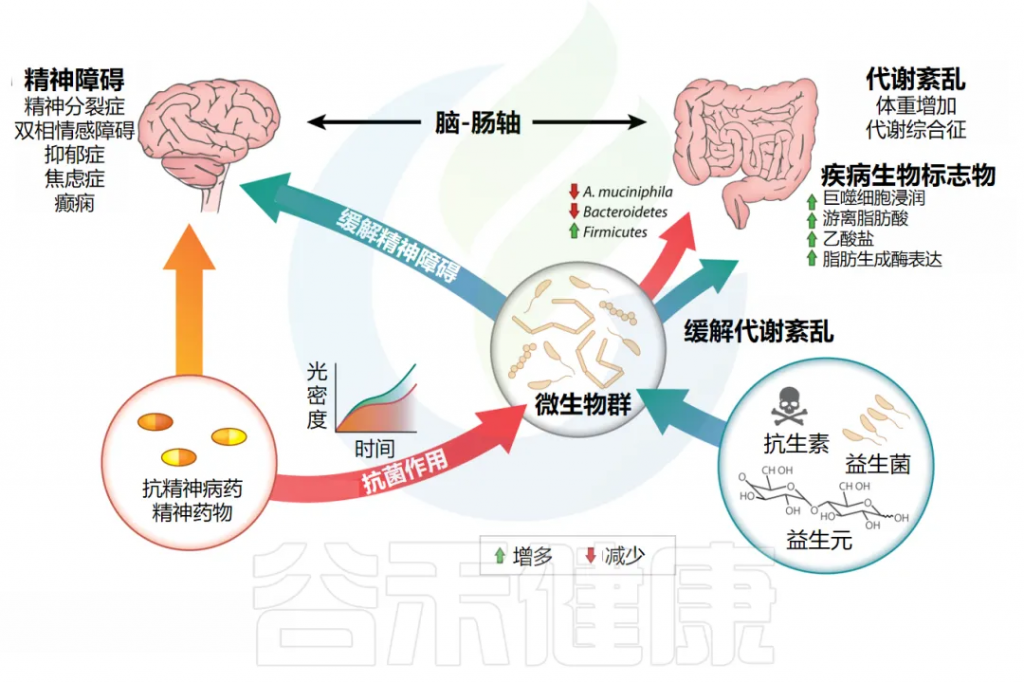
doi: 10.1146/annurev-pharmtox-010919-023612.
▷抗精神病药的副作用可能是药物对微生物的影响引起
有人提出,与抗精神病药(AAP)使用相关的几种代谢副作用,包括体重增加、心脏代谢紊乱和代谢综合征的发展,可能是由药物对微生物群的作用引起的。
例如,已发现儿童和小鼠长期暴露于利培酮会增加厚壁菌门/拟杆菌门比率。此外,在AAP处理组中观察到嗜粘蛋白阿克曼菌的减少,已知该物种具有有益的抗炎特性,可以防止肠道屏障功能障碍和脂肪量发育。
此外,一项涉及无菌(GF)小鼠的研究显示,肠道微生物群是导致奥氮平治疗后观察到的体重增加的原因 。同样,当与抗生素联合给药时,奥氮平的代谢副作用在雌性大鼠中被部分消除。
注释:奥氮平适用于有严重阳性症状或阴性症状的精神分裂症和其他精神病的急性期及维持期。可用于治疗中、重度躁狂发作。
同一项研究还报告说,奥氮平治疗增加了代谢功能障碍的几个标志物,包括脂肪组织中巨噬细胞浸润、血浆中游离脂肪酸丰度的增加以及脂肪生成酶表达的改变。
最近有研究表明,低聚半乳糖益生元的给药可缓解奥氮平诱导的体重增加。总而言之,这些发现表明抗精神病药可以通过对肠道微生物群的影响对宿主代谢产生深远影响。
▷精神药物会引发多种微生物反应
已知与微生物群相互作用的精神药物不仅限于抗精神病药(AAP)类的药物,还可以引发多种微生物反应。一项研究证明了这一点,该研究发现抗抑郁药氟西汀诱导微生物群组成的微小改变,而其他精神药物如锂、阿立哌唑和丙戊酸(VPA)则具有更强的效果。
有趣的是,短链脂肪酸(SCFA)水平因药物治疗而异,这些变化可以映射到已知的SCFA生产者细菌类群(例如拟杆菌门或梭菌属)。目前,解释这些药物对微生物群影响的机制在很大程度上是未知的。
有人提出,选择性5-羟色胺再摄取抑制剂抗抑郁药,如氟西汀和艾司西酞普兰,由于其外排泵抑制剂作用,可以起到抗菌剂的作用。相反,某些微生物群落能够降解氟西汀。
阿立哌唑和丙戊酸(VPA)提供了药物-微生物群相互作用的另一个例子。这种用于治疗癫痫发作、癫痫和情绪波动的药物已被证明在怀孕期间由母亲服用会增加儿童患自闭症的风险。这一发现导致了临床相关动物VPA诱导的自闭症大鼠模型的开发,其中对怀孕大鼠施用 VPA 会产生具有自闭症样表型的后代。重要的是,后代也表现出生态失调,肠道微生物群落的变化与在自闭症患者中观察到的变化相似。然而,这种微生物改变是否会导致这种疾病仍有待证明。
对微生物群在调节宿主行为中的作用的更深入理解使对其进行干预的新方法成为可能,例如使用精神益生菌,已发现益生元和益生菌都可以减轻人类的抑郁和焦虑。
T2D(II型糖尿病)的一线治疗是二甲双胍,属于双胍类药物。直到最近,关于二甲双胍作用机制的研究主要集中在其在肝脏中的抗糖异生作用上。
▷肠道微生物群是二甲双胍治疗的关键介质
现在有越来越多的证据表明肠道微生物群是二甲双胍治疗效果的关键介质。与口服或十二指肠内给药方法相比,静脉内给药在降低血糖水平方面效果较差。
此外,尽管全身暴露大大减少,但仅限于肠道的二甲双胍缓释制剂表现出与标准制剂相当的降糖特性。
下图显示了二甲双胍通过改变肠道微生物群组成调节葡萄糖稳态,其机制可能包括增加有益短链脂肪酸的产生和通过激活G蛋白偶联受体增强肠道激素GLP-1和PYY的分泌。
GLP-1的分泌也可能通过增加SGLT1表达恢复葡萄糖感应或通过调节 TGR5/FXR 胆汁酸受体活性来增强,这是由胆汁池改变(甘氨酸-熊去氧胆酸水平升高)引起的。此外,细菌肽Amuc_1100可能与 Toll 样受体2相互作用,以改善屏障功能并减少代谢性内毒素血症。
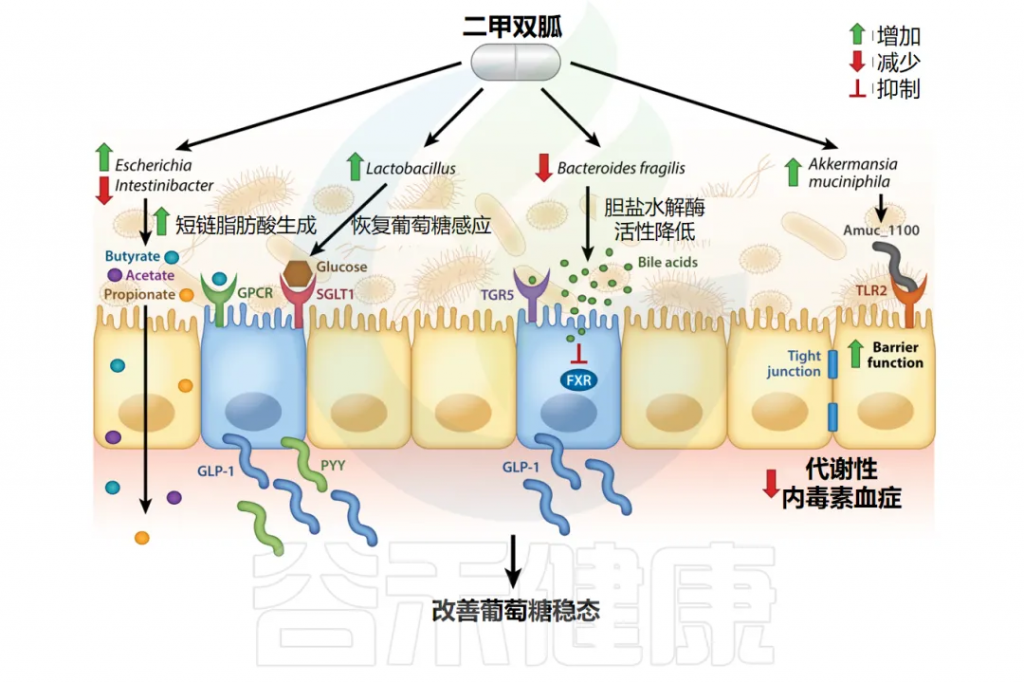
doi: 10.1146/annurev-pharmtox-010919-023612.
目前尚不完全了解肠道微生物群如何促进二甲双胍调节葡萄糖稳态的能力。一种可能性是二甲双胍诱导微生物结构和功能的改变,从而改善与T2D相关的生态失调。
▷使用二甲双胍调节了肠道微生物群组成
几项宏基因组学研究报告称,与非糖尿病个体相比,糖尿病个体的肠道微生物群组成发生了变化。根据二甲双胍治疗状态的进一步分层显示,未经治疗的个体的肠道菌群的特征是产生丁酸盐的分类群枯竭,包括罗氏菌属(Roseburia)、罕见小球菌属(Subdoligranulum)和梭菌目(Clostridiales)。
相比之下,二甲双胍治疗与大肠杆菌属的增加和肠杆菌属的减少有关。值得注意的是,同一项研究还表明,将二甲双胍治疗个体的微生物群移植到饲喂高脂肪饮食的无菌小鼠中足以增强葡萄糖耐量。
▷可能通过短链脂肪酸、肠道屏障或肠道激素来起到治疗作用
有人提出,这些细菌类群丰度的变化可能通过增加短链脂肪酸的产生来介导二甲双胍的治疗作用,这与啮齿动物模型中葡萄糖和能量稳态的改善有关。
有证据表明,短链脂肪酸可以通过与G蛋白偶联受体的相互作用、通过其组蛋白脱乙酰酶抑制活性或仅作为能量来源触发肠内分泌细胞分泌GLP-1和PYY。因此,二甲双胍可能通过促进产生短链脂肪酸的物种的生长来间接刺激这些激素的释放。
或者,二甲双胍诱导的微生物群变化可能通过促进肠道屏障的完整性来调节葡萄糖稳态。已观察到二甲双胍可增加小鼠和人类中嗜粘蛋白不动杆菌的相对丰度,并且该物种的益生菌给药增强了葡萄糖耐量并改善了胰岛素信号转导。
从嗜粘蛋白不动杆菌中分离的外膜蛋白被证明可激活Toll样受体2(TLR2),并概括了完整嗜粘蛋白不动杆菌对小鼠葡萄糖和脂质代谢的积极影响 。有人认为TLR2信号可以增强肠道屏障功能,从而改善与糖尿病相关的代谢性内毒素血症。
也有人提出,肠道微生物群通过影响肠道激素的分泌来介导二甲双胍的作用。已发现服用二甲双胍的个体表现出肠促胰岛素激素胰高血糖素样肽1(GLP-1)的血浆水平升高,一些研究还报告了肽YY(PYY) 的增加,它与食欲控制有关。
当观察到二甲双胍单药治疗2型糖尿病个体样本中 PYY水平与拟杆菌门和厚壁菌门属丰度变化之间存在相关性时,二甲双胍对肠道激素分泌和微生物群之间可能存在联系。
▷二甲双胍使用增加了埃希氏菌和乳酸菌等
同时,微生物组成和代谢的调节可能会导致药物的副作用。与二甲双胍使用相关的胃肠道问题与埃希氏菌和志贺氏菌属的增加有关 ,并且二甲双胍已被证明会破坏细菌叶酸代谢 ,这可能解释了与其使用相关的叶酸状态降低的原因。
然而,二甲双胍治疗恢复了SGLT1表达和葡萄糖感应,同时也增加了乳酸菌的相对丰度。至关重要的是,将二甲双胍预处理的微生物群移植到喂食高脂肪饮食的大鼠的小肠中,也恢复了SGLT1表达和葡萄糖感应,支持肠道微生物群介导的机制。需要进一步的研究来准确确定乳酸菌如何上调这种营养传感器以增强GLP-1分泌和降低血浆葡萄糖水平。
▷二甲双胍还会影响胆汁酸代谢
微生物群还与二甲双胍对胆汁酸池的影响有关,这可能有助于该药物的抗高血糖作用。胆汁酸是溶解脂质以供肠道摄取所必需的,并且可以通过与膜受体蛋白(如G蛋白偶联受体5(TGR5)和法尼醇X受体(FXR))结合来改变代谢。
多项研究表明,二甲双胍治疗会诱导胆汁酸库的改变 ,并且有充分的证据表明胆汁酸与肠道微生物群之间存在串扰。
在一项研究中,在二甲双胍治疗个体中观察到的胆酸水平升高与微生物群的结构变化显著相关。研究人员推测,这些变化可能通过增加TGR5活性间接增加GLP-1水平。
有趣的是,另一项研究表明,补充胆酸会在小鼠中触发相同的微生物变化,这表明二甲双胍对微生物群的影响是该药物对胆汁酸代谢影响的结果。然而,这种相互作用似乎也以相反的方向发生,并且胆汁酸谱的变化可能是由二甲双胍诱导的微生物群改变驱动的。
靶向宏基因组学分析显示,二甲双胍治疗两个月后,T2D患者微生物群中胆盐水解酶(bsh)基因增加。这可以解释观察到的未结合胆汁酸的增加,这种影响与血糖水平显著呈负相关。最近的研究表明,二甲双胍通过降低脆弱拟杆菌丰度,提高糖熊去氧胆酸水平,据报道,糖熊去氧胆酸可抑制肠道FXR信号转导,从而改善胰岛素抵抗。
▷微生物群还可以影响其他治疗2型糖尿病的药物
小檗碱
虽然许多研究致力于了解二甲双胍-微生物群的相互作用,但也有证据表明微生物群在介导用于治疗2型糖尿病(T2D)的其他药物中的作用。据报道,小檗碱是一种具有抗糖尿病特性的传统中药,通过肠道细菌的降低活性转化为更易吸收的形式 ,并且在中国和非洲人群之间发现的小檗碱药代动力学特征的差异可归因于肠道微生物群组成的变化。
与二甲双胍类似,有人认为有益的短链脂肪酸的产生增加或微生物群对胆汁酸受体信号传导的抑制可能支持小檗碱的治疗效果。此外,小檗碱与能够合成支链氨基酸的细菌种类丰度降低有关,支链氨基酸是与胰岛素抵抗和肥胖发展有关的代谢物。
阿卡波糖
阿卡波糖是一种α-葡萄糖苷酶抑制剂,通过延迟小肠中复合碳水化合物的消化来帮助调节葡萄糖稳态。由于这种药物会影响可用于细菌发酵的底物,因此可能会选择性地促进某些分类群的生长,因此可以预期对微生物群产生影响。
事实上,几项研究表明,阿卡波糖会改变肠道中细菌群落的组成。在一项涉及52名糖尿病前期个体的随机对照试验中,阿卡波糖治疗与乳酸菌和糖尿病菌属的显著增加有关,后者与血糖水平呈负相关。
这表明微生物群结构的改变可能是该药物治疗效果的部分原因。与这一假设一致,一项单独的研究揭示了阿卡波糖诱导的肠道微生物群改变与改善血糖控制相关的胆汁酸池变化之间的密切关联。有趣的是,同一项研究还发现,可以根据他们的微生物群是以拟杆菌属还是普雷沃氏菌属为主来预测个体对阿卡波糖治疗的反应,这一结果可能具有重要的临床意义。
目前支持肠道微生物群参与其他T2D药物作用机制的证据还较少。有研究表明,噻唑烷二酮类药物吡格列酮可抑制高脂饮食啮齿动物中变形菌门的增加,而罗格列酮则恢复了细菌在回肠粘膜的空间分布,但未恢复其组成。
在T2D个体中,还观察到利拉鲁肽治疗后嗜粘蛋白不动杆菌的增加,这意味着肠道屏障功能可能得到改善。此外,一些用于提高GLP-4水平的二肽基肽酶-1抑制剂也可能通过微生物群发挥有益作用。例如,在喂食西方饮食的小鼠中,维格列汀治疗诱导了乳酸杆菌和短链脂肪酸的产生增加,而西格列汀也被发现部分纠正了糖尿病大鼠与高脂肪/高碳水化合物饮食相关的生态失调。
需要进一步的研究来评估这些药物诱导的微生物群变化与其治疗效果之间是否存在因果关系。
微生物在癌症的病因中起着重要作用,约占全球癌症的20%。了解肠道微生物群与癌症之间复杂相互作用所涉及的挑战因可能影响这两种因素的外部因素以及难以辨别微生物改变是疾病的原因还是结果而加剧。
▷癌症会直接或局部破坏微生物组
癌症可能直接和局部破坏微生物组,通过可溶性因子(例如CC-趋化因子配体25)间接破坏,以及通过改变的代谢效应全身破坏。此外,导致微生物群失调或影响微生物群产生毒素或代谢物的几种环境因素可以促进癌症或改变抗癌药物治疗。
此外,癌症和肠道菌群失调可能有一个共同点,即发生在这两个过程的上游。例如,宿主生活方式的选择和免疫系统状态可以调节微生物组和癌症的发展。
▷化疗会对肠道微生物群产生负面影响
几项研究表明,化疗药物会对肠道微生物群产生负面影响。例如,研究发现,在结直肠癌(CRC)大鼠模型中,基于伊立替康的化疗导致菌群失调,其特征是诱发腹泻的细菌(如梭菌簇XI和肠杆菌科)增加。
此外,暴露于为期5天的清髓性化疗方案的非霍奇金淋巴瘤患者表现出变形菌门的显著增加,同时厚壁菌门和放线菌门的丰度降低。
注释:清髓性化疗(Myeloablative chemotherapy)是一种强度较大的化疗方案,主要用于血液系统恶性肿瘤的治疗,特别是在造血干细胞移植之前的预处理阶段。主要特点就是使用大剂量化疗药物,能够彻底清除骨髓中的造血细胞。
一项调查吉西他滨对胰腺癌异种移植小鼠肠道菌群影响的研究发现,厚壁菌门和拟杆菌门种群减少,变形菌门和疣微菌门属增加。观察到的与炎症过程相关的细菌增加与癌组织中 NF-κB 的上调一致,这可能对吉西他滨治疗的结果产生负面影响。
注释:吉西他滨(Gemcitabine)是一种常见的嘧啶核苷类似物抗代谢药和抗肿瘤剂,能靶向抑制DNA合成,导致细胞自噬(autophagy)和凋亡(apoptosis)。
还值得注意的是,对结直肠癌小鼠模型的一项研究表明,细菌能够通过胞苷脱氨酶活性将吉西他滨代谢成无活性形式。总体而言,各种化疗药物可能引发肠道菌群失调,这可能会导致有害的副作用或降低药物疗效。
▷肠道微生物群会影响抗癌药物的疗效
相反,有证据表明肠道微生物群可以增强某些抗癌药物的疗效。例如,对无菌小鼠的研究表明,微生物群是对奥沙利铂或联合免疫疗法的最佳反应所必需的。同样,有报道称,已知会扰乱微生物生态系统的抗生素使用会对癌症治疗结果产生负面影响。
已经证明,肠道微生物群对用于治疗多种癌症的抗代谢药物5-氟尿嘧啶(5-FU)的疗效做出了重大贡献。细菌能够以最有效的氟嘧啶形式转化和排泄5-FU,以更高的功效靶向宿主。至关重要的是,这种机制依赖于完整的细菌核糖核苷酸挽救途径。肠道细菌也可能在对5-FU和其他用于治疗结直肠癌的药物产生耐药性中发挥作用。
据报道,与未复发的患者相比,化疗后肿瘤复发患者的Fusobacterium nucleatum丰度增加。研究发现,该物种通过靶向特异性 microRNA 和激活自噬来促进结直肠癌细胞的化疗耐药。这些观察结果强调了解开药物-微生物群相互作用所涉及的生化途径以改善癌症治疗结果的重要性。
由于已经确定肠道微生物群可以调节抗癌药物的作用(下表),旨在针对微生物群的干预措施可能代表有前途的佐剂或针对这种疾病的新疗法。

doi: 10.1146/annurev-pharmtox-010919-023612.
事实上,已经表明益生菌的给药可以改善患者的反应,尤其是与免疫疗法结合使用时。例如,据报道,口服双歧杆菌可促进PD-1配体1特异性抗体治疗在黑色素瘤小鼠模型中的疗效。
随后,三项研究进一步探讨了肠道微生物群对抗PD-1免疫治疗反应的作用。发现补充双歧杆菌可以将小鼠从与抗CTLA-4治疗相关的免疫病理学中拯救出来,而不会影响抗肿瘤免疫的刺激,而在抗CTLA-4治疗的情况下,也观察到脆弱拟杆菌具有抗癌特性。
然而,益生菌的潜在益处并不局限于免疫治疗,研究结果证明,两歧双歧杆菌 G9-1 通过抑制菌群失调和减轻炎症反应改善小鼠模型中 5-FU 诱导的粘膜炎 。此外,嗜酸乳杆菌和干酪乳杆菌益生菌菌株经证实可增加体外 5-FU 细胞凋亡能力 。
用于促进有益细菌生长的益生元化合物也可能增强抗癌药物的作用,已经有研究表明,当与化疗阿霉素联合给药时,菊粉显示出增强的抗肿瘤作用。
肠道微生物群也可以通过使用经过基因改造的细菌菌株来靶向,这些菌株将细胞毒性分子直接递送到肿瘤微环境。该策略在一项涉及减毒鼠伤寒沙门氏菌菌株的研究中成功实施,该菌株被设计为在达到群体密度阈值时同步循环裂解,导致抗肿瘤毒素溶血素E的周期性释放。口服这种工程菌株可提高5-FU在肝直肠转移小鼠模型中的疗效。
总体而言,这些研究提供了令人鼓舞的证据,表明基于微生物群的新型疗法可能是改善未来癌症治疗结果的有效方法。
药物-微生物群-宿主相互作用本质上是复杂的,因此需要结合实验和计算方法来进行解剖。用于此任务的实验工具可分为两大类:体外模型和体内模型。
▷选用的模型至关重要
体外模型为药物-微生物群相互作用的机制基础提供了深刻的见解,并可用于同时筛选大量实验条件。然而,要测试这些相互作用对宿主的生物学相关性,需要超越体外方法,利用无脊椎动物模式生物,这些模式生物有助于高通量技术,能够阐明体内药物-微生物群相互作用的影响。
黑腹果蝇已被提议作为药物发现和研究微生物群对宿主生理学作用的合适模型 ,但迄今为止尚未在该模型中进行专注于这两个因素之间相互作用的研究。相比之下,秀丽隐杆线虫由于其多功能性、易于处理、成本和可扩展性,在药物-微生物-宿主相互作用研究中越来越重要。
例如,秀丽隐杆线虫已成功用于探索负责抗癌药物 5-FU和多柔比星生物转化的微生物机制,并研究微生物群如何介导二甲双胍的延长寿命效应。
与所有动物模型一样,秀丽隐杆线虫既有优点也有缺点,在尝试解决与药物-微生物-宿主相互作用相关的问题时必须权衡这些优点和缺点。虽然在秀丽隐杆线虫中建立微生物单一关联很容易,从而能够进行高度的实验控制和操作,但其他模型更适合研究药物如何与微生物群落相互作用以影响治疗结果。
其中包括广泛用于药物-微生物群研究的小鼠模型以及斑马鱼,它在该领域的发展势头越来越好。
▷研究药物与微生物群相互作用的计算方法
研究药物与微生物群相互作用需借助分析微生物群复杂数据集的计算方法。
可以通过16S测序与QIIME2或mothur等平台结合使用,或通过使用Kraken2、Centrifuge、bioBakery或CLARK-S的宏基因组学数据集来分析结构水平的药物诱导变化。还可以使用MetaVelvet或metaSPAdes组装宏基因组,并且可以使用prokka等工具进行基因注释,以识别通过药物治疗差异富集的功能。
在功能水平上,可以使用SAMSA2、MetaTrans或Anvi’o分析元转录组数据;使用MetaLab或MaxQuant获取宏蛋白质组学数据;以及使用 PhenoMeNal或Workflow4Metabolomics的代谢组学数据。
至关重要的是,必须整合多个数据集才能形成具有生物学相关性和意义的结论。例如,多组学方法被有效地用于鉴定人类微生物组中可以代谢结直肠癌药物的某些代谢型。在这里,作者结合使用代谢组学和宏基因组学分析来解开这个错综复杂的问题并提取有用的生物学见解。
开发上述工具是为了解决与微生物生态系统相关的广泛问题。然而,可用于专门研究这种现象的工具数量有限。
PharmacoMicrobiomics是2011年发布的门户网站数据库,旨在探索药物和微生物之间的相互作用。最近,微生物药物协会数据库发布,其中包含5000多个条目,详细介绍了1000多种不同药物和近200种不同微生物之间的临床或实验支持的相互作用。
此外,2017年发布的 DrugBug 是一种生物信息学工具,包含491种人类肠道细菌菌株的代谢功能,并使用随机森林机器学习算法来预测人类肠道微生物组中存在的微生物酶对药物的生物转化。作者以地高辛为例来验证他们的工具,发现它准确地预测了参与该药物代谢的细菌属和酶,正如之前的体外和体内研究所支持的那样。
旨在整合微生物和宿主多组学数据集的新计算工具是一项有难度的计算工作,可能会为药物-微生物群-宿主相互作用提供进一步的机制见解。
模拟宿主代谢最成功的计算框架是基于约束的重建和分析(COBRA),它已经不断发展和完善了十多年。该框架已用于模拟肠道微生物组(AGORA)中773种不同细菌的代谢,该数据库现在构成了一个大型数据库的一部分,包含人类和微生物群代谢模型(Virtual Metabolic Human)并考虑了环境线索,例如营养输入。
此外,集成在COBRA工具箱中的微生物组建模工具箱、COMETS或CarveMe等工具可用于模拟微生物之间或微生物与宿主之间的代谢交换。
基于生理学的药代动力学(PBPK)模型使我们能够对宿主体内隔室的药物动力学进行数学建模。COBRA和PBPK模型整合的成功例子包括左旋多巴治疗帕金森病患者的研究和异烟肼给药的计算模拟,异烟肼是一种用于治疗结核分枝杆菌感染的抗菌药物。
然而,目前缺乏将微生物的作用整合到 COBRA-PBPK 模型中的模型。在未来几年,除了药物和营养物质等外部因素外,我们还将越来越多地使用整合微生物和宿主代谢的计算模型。
这些关于微生物组与药物吸收、分布、代谢和排泄(ADME)关系的基础性发现在药物开发管线和医疗实践中的转化应用仍然滞后于基础研究。制药行业在评估药物代谢和药代动力学时,目前还较少考虑微生物群对药物ADME特性的影响。
目前仍缺乏标准化的体外测试方法来评估候选药物的微生物代谢,而且在临床前动物模型的药代动力学研究中,也很少评估个体间或物种间微生物组差异可能产生的作用。这种疏忽可能会带来深远的影响。考虑到目前科学认知上的重大空白,以及在微生物组和药理学研究交叉领域工作所需要的专业化和跨学科专业知识(包括概念和方法论方面),这种情况也是可以理解的。
目前理解中的许多关键差距源于研究微生物组在药理学中作用的方法的局限性。关于微生物药物代谢的大多数数据都使用培养依赖性方法,要么在药物存在的情况下培养细菌分离株,要么通过人类粪便样本的离体培养。
虽然这些方法具有许多实际优势,但它们不能用于研究难以培养的肠道微生物群成员,并且在模拟饮食和宿主代谢物等环境因素的作用或微生物群改变药物处置和作用机制的更间接机制方面的能力有限。此外,鉴定负责的酶和由此产生的代谢物仍然是一个主要瓶颈。
参考文献
Trepka KR, Olson CA, Upadhyay V, Zhang C, Turnbaugh PJ. Pharma[e]cology: How the Gut Microbiome Contributes to Variations in Drug Response. Annu Rev Pharmacol Toxicol. 2024 Aug 6.
Pryor R, Martinez-Martinez D, Quintaneiro L, Cabreiro F. The Role of the Microbiome in Drug Response. Annu Rev Pharmacol Toxicol. 2020 Jan 6;60:417-435.
Strebhardt K, Ullrich A. 2008. Paul Ehrlich’s magic bullet concept: 100 years of progress. Nat. Rev. Cancer 8:473–80
Moreno L, Pearson AD. 2013. How can attrition rates be reduced in cancer drug discovery?. Expert Opin. Drug Discov. 8:4363–68
Kundu P, Blacher E, Elinav E, Pettersson S 2017. Our gut microbiome: the evolving inner self. Cell 171:1481–93
Veber DF, Johnson SR, Cheng HY, Smith BR, Ward KW, Kopple KD 2002. Molecular properties that influence the oral bioavailability of drug candidates. J. Med. Chem. 45:122615–23
Spanogiannopoulos P, Bess EN, Carmody RN, Turnbaugh PJ 2016. The microbial pharmacists within us: a metagenomic view of xenobiotic metabolism. Nat. Rev. Microbiol. 14:5273–87
Haiser HJ, Gootenberg DB, Chatman K, Sirasani G, Balskus EP, Turnbaugh PJ 2013. Predicting and manipulating cardiac drug inactivation by the human gut bacterium Eggerthella lenta.Science 341:6143295–98
Falony G, Joossens M, Vieira-Silva S, Wang J, Darzi Y et al. 2016. Population-level analysis of gut microbiome variation. Science 352:6285560–64
Rothschild D, Weissbrod O, Barkan E, Kurilshikov A, Korem T et al. 2018. Environment dominates over host genetics in shaping human gut microbiota. Nature 555:7695210–15
David LA, Maurice CF, Carmody RN, Gootenberg DB, Button JE et al. 2014. Diet rapidly and reproducibly alters the human gut microbiome.Nature 505:7484559–63

谷禾健康

在现代医学的发展历程中,口服药物因其便捷性和经济效益一直占据着重要地位。然而,随着科学研究的深入,我们逐渐认识到一个复杂现象:药物与人体肠道微生物群之间存在着密切而微妙的相互作用。
这种相互作用有时可能带来积极的效果,例如,二甲双胍这种常用的糖尿病药物能有益地调节肠道菌群。然而,更多情况下,药物可能会导致肠道菌群的失衡,引发一系列健康问题。
对于大多数药物而言,我们仍然缺乏全面深入的了解。这导致在药物的研发和使用过程中,往往没有充分考虑到它们对肠道微生物组的潜在影响。一些药物可能直接表现出抗菌作用,而一些则可能通过改变胃肠道的微环境间接影响微生物平衡。例如,广泛使用的抗精神病药物奥氮平就被发现具有内在的抗菌特性,其使用与肠道微生物群组成的改变以及肥胖等副作用密切相关。
近期,科学界提出了一个概念——”肠道中性“。什么是肠道中性呢?通俗来讲就是,设计和使用药物和配方时,尽量减少与肠道微生物群的不良相互作用。实现这一目标的策略多种多样,包括开发”肠道友好型”药物、采用特殊的药物包装技术,以及结合益生菌和粪便微生物群移植等辅助疗法。
本文将深入探讨药物与肠道微生物组之间复杂的相互作用,分析当前研究面临的挑战,并展望未来可能的解决方案。希望为优化药物治疗效果、减少不良反应,以及促进个体化医疗的发展提供新的思路和方向。
肠道菌群参与药物代谢可能直接导致毒性反应
就比如说:抗焦虑药物硝西泮在梭菌、拟杆菌、真细菌的作用下发生硝基还原,产生7-氨基硝西泮,这是一种致畸代谢物,会干扰妊娠期间胎儿的正常发育。
多重用药也会加剧潜在的肠道微生物组毒性
同时服用索利夫定(一种抗病毒药物)和 5-氟尿嘧啶 (5-FU)(一种抗肿瘤药物)会导致拟杆菌属B. vulgatus、 B. thetaiotaomicron、B. fragilis、B. uniformis、B. eggerthii将索利夫定代谢为 (E)-5-(2-溴乙烯基) 尿嘧啶,从而抑制 5-FU 代谢。这会导致未代谢的 5-FU 在生物体内蓄积,从而增加出血、感染、胃肠道紊乱、呼吸困难、心律失常的风险。
类似地,肠道微生物代谢地高辛可导致多达 10% 的患者药物失活。地高辛用于治疗心律失常,被Eggerthella lenta所含的糖苷还原酶灭活。
药物引起的微生物群失调会破坏肠道微生物群与各种健康系统的联系,从而破坏药物的治疗目的。
例如,用于治疗精神分裂症和躁郁症的精神药物如氯氮平、利培酮、奥氮平,会使微生物群失调从而破坏肠-脑轴,导致神经能量学(神经细胞系统的能量代谢和需求过程)改变和认知障碍。
奥氮平是一种多受体作用药物,主要通过阻断多巴胺D2受体和5-羟色胺5-HT2A受体发挥抗精神病作用。主要用于治疗精神分裂症、双相情感障碍、难治性抑郁症等。常见的副作用可能有体重增加和代谢综合征风险增加、嗜睡、口干等。
与对照组相比,奥氮平在 21 天内使 Sprague-Dawley 大鼠的体重增加了 30%,同时 TNF-α 和血糖增加了 3 倍,血液甘油三酯增加了 2 倍。
这些变化可能会破坏神经能量、认知和情绪稳定,从而导致治疗效果恶化。
此外,代谢功能障碍带来的社会和心理负担,即体重增加,可能导致不依从治疗和进一步恶化心理健康。
药物引起的菌群失调也会阻碍联合用药的治疗
在抗菌耐药性的体外模型中,接触抗抑郁药(尤其是舍曲林)会增加细菌对氯霉素、四环素、环丙沙星等抗生素的耐药性。这是由于肠道代谢组的变化,例如细胞内活性氧化物质的产生增加、外排泵的表达、持留细胞的形成和接合质粒的转移。
抗抑郁药可诱导多种抗生素耐药性并增强抗生素持久性
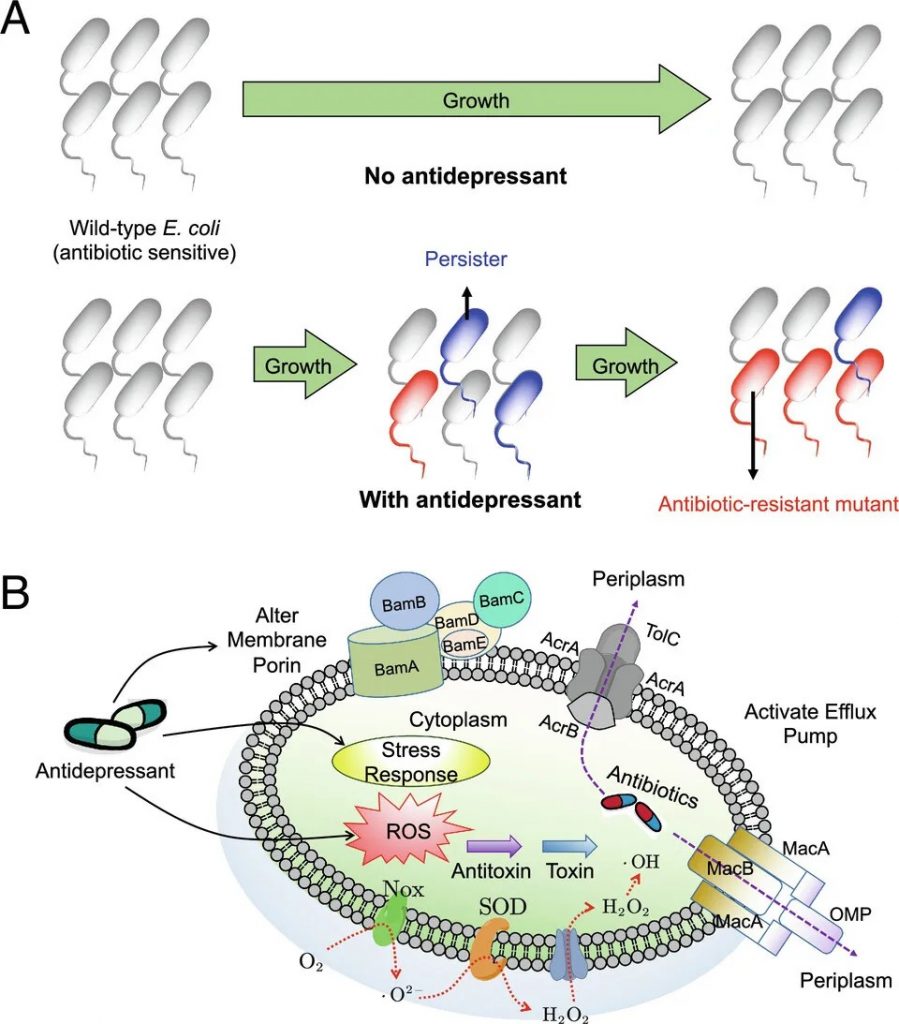
doi.org/10.1073/pnas.2208344120
随着抗抑郁药的广泛使用和对抗生素耐药性的担忧,对药物微生物组学的关注至关重要。
有必要采取策略来克服药物与肠道的不良相互作用,减轻肠道介导的代谢和毒性,同时有利于全面了解药物微生物组学,总结如下图。
克服药物-肠道不良相互作用的策略
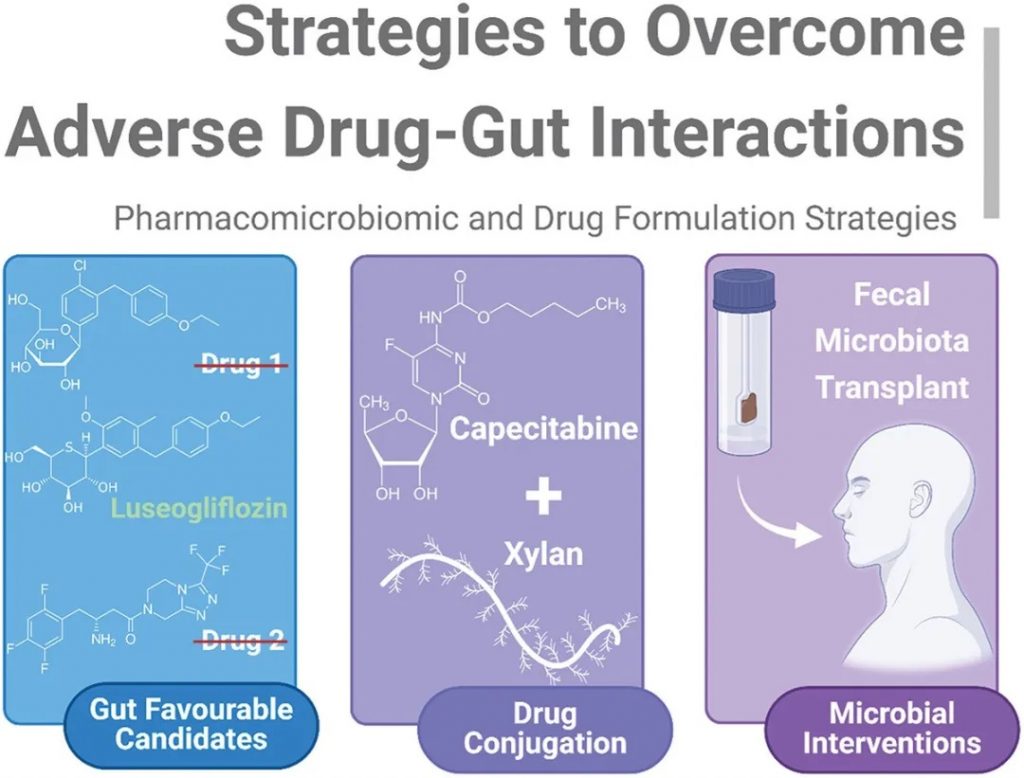
doi.org/10.1080/17425255.2024.2407616
可归纳为不同的子类:
1)药物的内在特性:应选择对肠道中性或阳性的候选药物以确保最大程度的治疗效果。
2)药物结合:益生元纤维与药物的直接结合,如培西他滨-木聚糖-硬脂酸结合物,可减少药物固有的任何非预期代谢或抗菌作用。
3)微生物干预:粪便微生物群移植允许采用非药物方法来减轻非预期的药物-肠道毒性。
药物微生物组学是一个新兴领域,大多数药物-肠道相互作用仍不为人所知。“肠道中性”的概念和基因组测序的进步可能会重振未充分利用的疗法。
★ 鲁拉西酮可能比奥氮平更适合某些患者
与奥氮平不同,非典型抗精神病药物鲁拉西酮在动物研究中对体重、葡萄糖代谢、炎症或肠道微生物群多样性没有显著影响。
注:尽管疗效相当,但鲁拉西酮的处方量仍然不足,这可以归因于该药物的监管和市场批准时间相对较短(与其他抗精神病药物相比)、生物利用度较差以及药物的食物效应,使得患者必须随餐服药,从而给患者的依从性带来了挑战。
与抗精神病药物相比,增加其使用可以减轻微生物组介导的毒性,强调药物微生物组学在药物选择中的重要性。
这些发现强调了鲁拉西酮在维持肠道微生物群平衡方面的优势,可能使其成为代谢敏感患者的更好选择。
★ 卢塞格列净:增加短链脂肪酸,积极调节肠道菌群
类似地,用于治疗糖尿病的钠-葡萄糖协同转运蛋白 2 抑制剂卢塞格列净 (luseogliflozin) 通过增加短链脂肪酸 (SCFA) 来积极调节肠道微生物群。这些短链脂肪酸阻碍了小糖的吸收,从而降低血糖并有助于糖尿病管理。
因此,制药行业必须在候选药物过程中考虑药物对肠道微生物群的影响,通过在早期临床前研究中筛选微生物组介导的毒性。
洛拉米星(lolamicin)证明了这一点。
注:一种针对脂蛋白转运系统的革兰氏阴性细菌特异性抗生素。
★ 洛拉米星:保护肠道菌群,防止艰难梭菌定植
研究发现,洛拉米星对 130 多种多重耐药临床分离菌有活性,在多种急性肺炎和败血症感染小鼠模型中显示出疗效,并且不损害小鼠肠道菌群,防止艰难梭菌的继发感染。与对照组相比,C57BL/6小鼠在服用洛拉米星后,其 α 或 β 多样性没有显著下降。
注:洛拉米星对致病革兰氏阴性菌的选择性杀死是由于致病菌与共生菌中靶标的序列同源性低;这种双重选择策略可以作为开发其他微生物组保护抗生素的蓝图。
洛拉米星保护肠道菌群并防止艰难梭菌定植
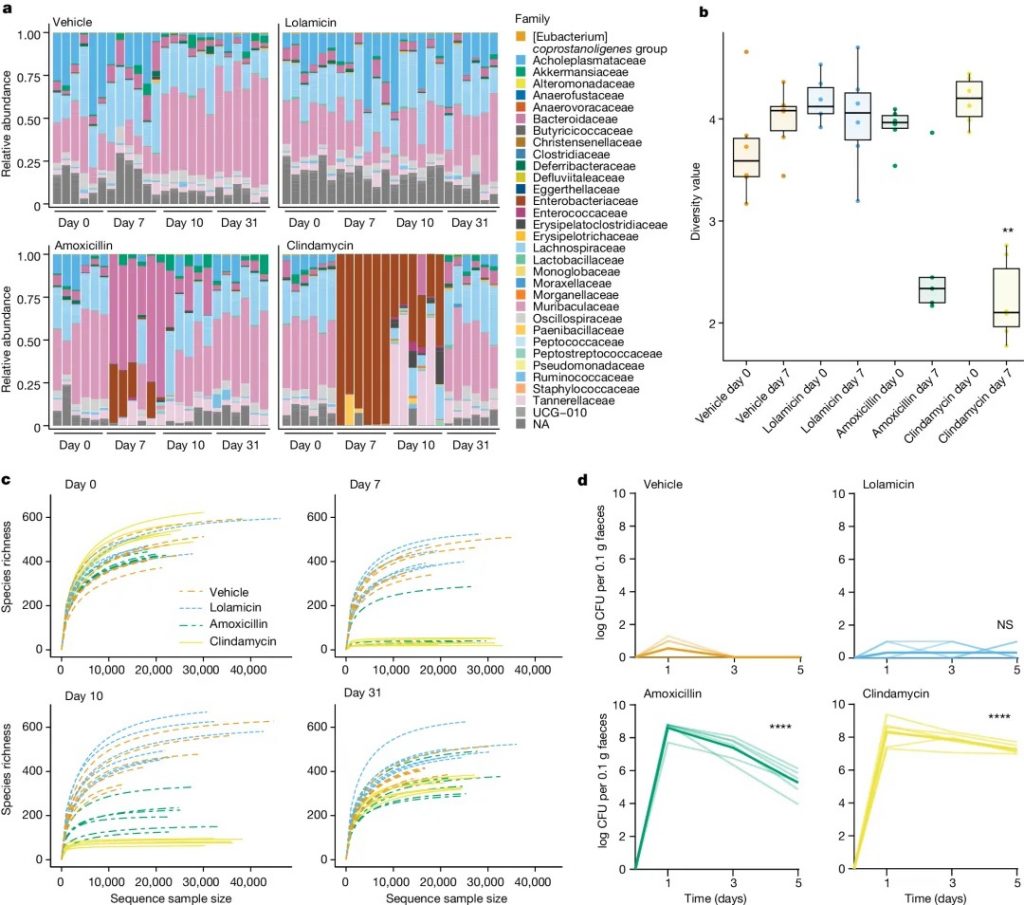
doi.org/10.1038/s41586-024-07502-0
a 在施用抗生素前(第 0 天)和施用抗生素后(第 7 天、第 10 天和第 31 天)31 天内科水平上的菌群变化。
b 用 Shannon 指数测量的施用抗生素前(第 0 天)和后(第 7 天)的多样性分析。
c 在施用抗生素之前(第 0 天)和之后(第 7 天、第 10 天和第 31 天)通过 alpha 稀疏度测量的物种丰富度。
d 从用 1.2 × 104 个艰难梭菌菌株 630孢子进行攻击(第 0 天)开始直至感染后 5 天,用载体、洛拉霉素、阿莫西林或克林霉素治疗的小鼠粪便样本中艰难梭菌的每日计数。
这些观察结果表明,共生双歧杆菌的损失减少,短链脂肪酸的产生增加,消除了机会性致病菌的生长(如艰难梭菌),并维持了适当的肠道屏障功能。
丰富肠道微生物群的策略性药物配方和赋形剂可以减轻微生物群介导的代谢和毒性。
★ 季铵化壳聚糖对姜黄素的影响
硫酸软骨素功能化的棕榈酸和半胱氨酸共接枝的季铵化壳聚糖,将姜黄素的生物利用度提高了 3 倍,同时改善了肠道微生物丰富度,并调节了炎症巨噬细胞和中性粒细胞。
壳聚糖是一种天然多糖,具有良好的生物相容性、生物降解性和黏膜粘附性,在药物递送领域有着广泛的应用。
半胱氨酸能与黏膜层中的糖蛋白形成二硫键,因此将其与壳聚糖偶联可显著提高壳聚糖的黏膜粘附能力,因其能粘附于黏膜层并延长肠道停留时间,是一种很有前途的结肠定位药物递送策略。
棕榈酸是一种十六烷饱和脂肪酸,可作为疏水链供体接枝亲水聚合物,提高疏水性药物的包封率。
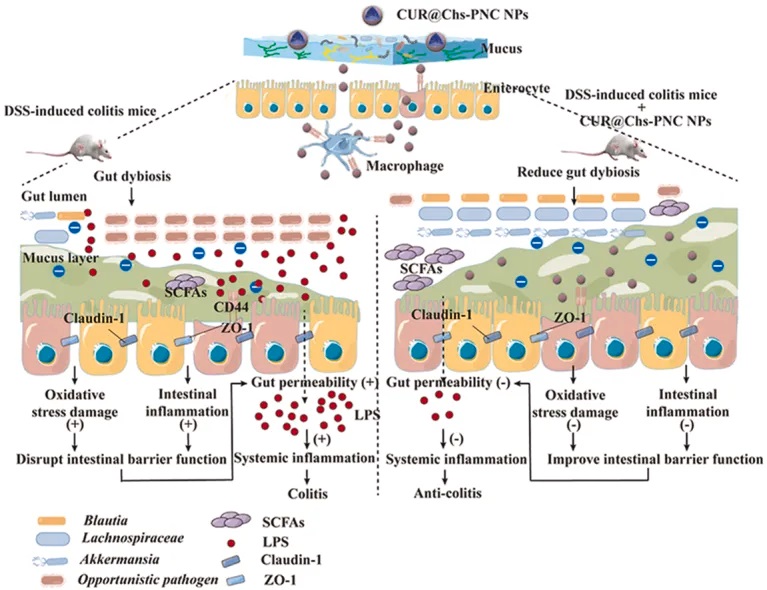
doi: 10.1016/j.mtbio.2023.100617
★ 槲皮素可用于缓解 5-FU 引起的粘膜炎
槲皮素也有类似的改善作用,槲皮素是一种五羟基黄酮类化合物,在饮食和作为食品补充剂的重要性已众所周知,但由于其不稳定性、溶解性差和生物利用度低,其口服利用受到限制。
研究人员制备了载槲皮素的壳聚糖衍生物纳米粒子,显著提高了生物利用度。
主要通过增加粘膜粘附性和增加胃滞留时间来提高槲皮素的生物利用度。
该方式显著减轻了 5-Fu 诱导的空肠绒毛和隐窝破坏。有效地减弱了空肠中促炎因子的表达并增强了claudin-1的表达,从而改善了肠道屏障功能。
同时,通过降低拟杆菌的丰度部分逆转了 5-Fu 诱发的粘膜炎小鼠肠道菌群的改变。
doi.org/10.1021/acsfoodscitech.0c00121
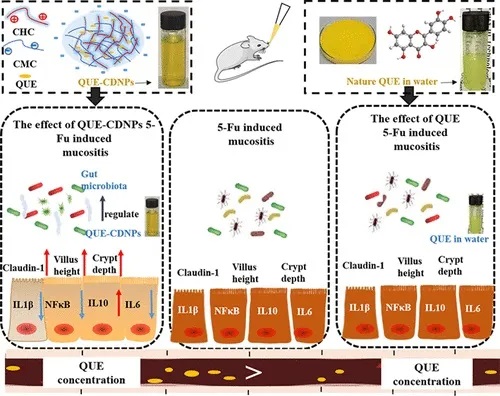
★ 菊粉-脂质核壳微胶囊对鲁拉西酮的影响
菊粉是一种天然存在的可溶性膳食纤维,属于益生元,微胶囊采用脂质作为外壳,能够保护内部包裹的药物,避免其在胃酸和上消化道中的降解。这种核壳结构确保了药物能够稳定地到达肠道。
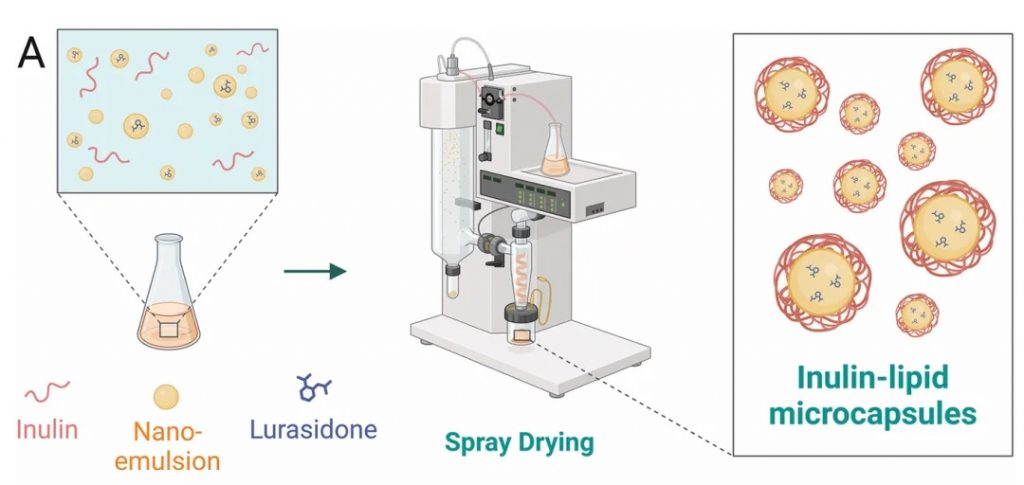
DOI: 10.1002/adfm.202403914
使用菊粉-脂质核壳微胶囊(ILM)靶向肠道微生物群,模拟鲁拉西酮的药物食物效应,获得了类似的益处,同时增加肠道微生物群的丰度和多样性,使口服生物利用度提高了 8.7 倍。
提高溶解度和生物利用度
菊粉-脂质核壳微胶囊(以下简称ILM)显著提高了鲁拉西酮的溶解度和生物利用度。在体外模拟肠道条件下,ILM在空腹和进食状态下都显示出较高的药物溶解度,其空腹/进食状态溶解度比接近1,有效缓解了食物效应。体内药代动力学研究进一步证实,ILM使鲁拉西酮的口服生物利用度提高了8倍以上。
改善肠道微生物组
ILM显著增加了肠道微生物的丰度和多样性(Shannon指数)。研究发现,ILM促进了多种共生菌的生长,而抑制了少数菌种。这种微生物组的改善可能与药物的增强吸收有关。
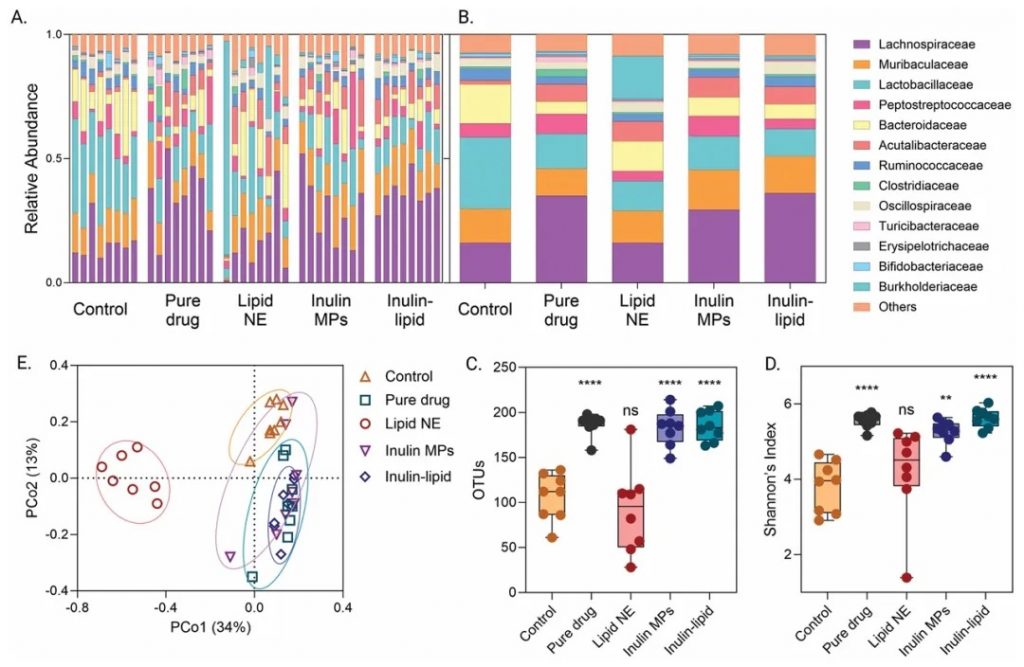
DOI: 10.1002/adfm.202403914
减轻肠道炎症
ILM降低了肠道组织中促炎细胞因子(IL-1β、IL-6和TNF-α)的水平,有效缓解了肠道炎症。
增加血浆和粪便中的5-HT水平
ILM显著提高了血浆和粪便中的5-羟色胺(5-HT)浓度。研究发现,5-HT水平与肠道微生物的丰度和多样性呈现正相关趋势,这暗示ILM通过调节肠道微生物可能增强了鲁拉西酮的药效学反应。
★ 直接药物-益生元膳食纤维结合也可改善肠道菌群
在一项临床前研究中探索了卡培他滨-木聚糖-硬脂酸结合物 (SCXN)。卡培他滨是一种用于治疗结直肠癌的抗代谢药物,通常会导致严重的肠道微生物失调。
SCXN对肠道微生物群的影响:
肠道屏障功能:
药物耐受性:
抗肿瘤效果:
SCXN 调节肠道菌群
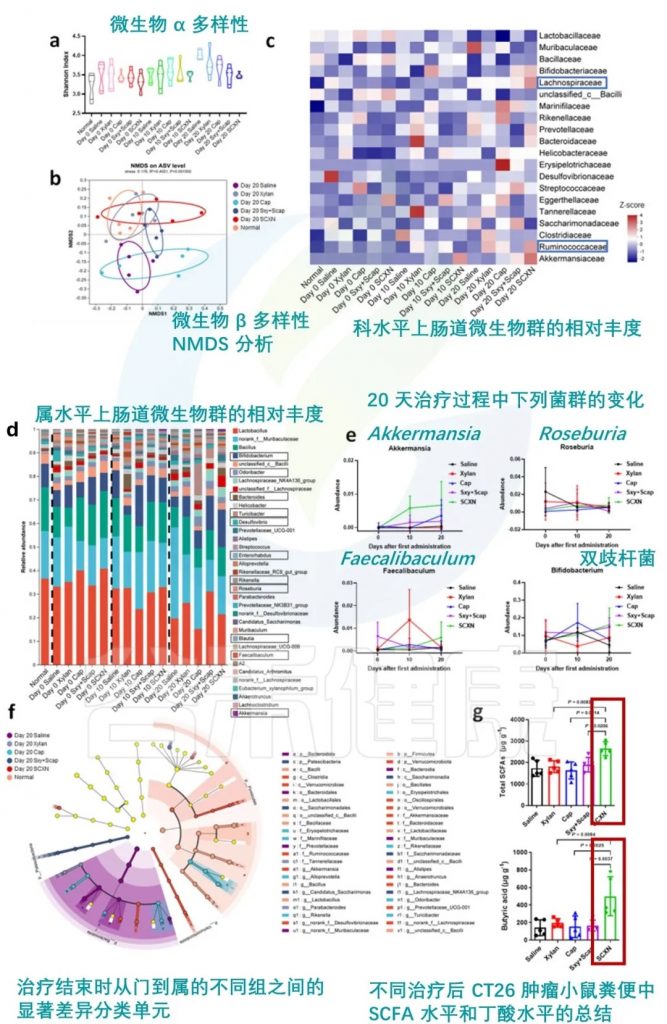
编辑
doi: 10.1038/s41467-023-40439-y
但值得注意的是,这些研究并未考虑先前存在的严重疾病以及无法裂解药物-益生元结合物的影响。
饮食干预/改变提供了一种管理肠道微生物组介导的代谢和毒性的简单方法。
★ 半乳寡糖对奥氮平引起的菌群失调的影响
补充细菌可发酵的半乳寡糖可减轻奥氮平引起的菌群失调、体重增加、甘油三酯和血糖水平。然而,通常需要高剂量的益生元才能发挥治疗作用,这可能会限制其作为辅助疗法的使用。
★ 工程化乳酸乳球菌对抗生素引起的菌群失调的影响
抗生素的使用对肠道菌群的干扰最强烈,但也是可预测的。由于临床用抗生素的药代动力学特性已得到很好的表征,因此可以设计适时的预防措施,以最大限度地减少抗生素在肠道中存在的影响。一项研究开发了一种工程活生物治疗药物(eLBP),用于预防抗生素引起的肠道菌群失调。
研究人员利用合成生物学方法,设计了一种分泌β-内酰胺酶的乳酸乳球菌,可以在小鼠肠道中降解广谱抗生素β-内酰胺类药物,从而保护肠道微生物群落不受抗生素的影响。
该eLBP可以维持肠道微生物多样性,防止抗生素耐药基因的富集,并保持对艰难梭菌的定植抵抗力。这种方法为减少抗生素治疗相关并发症提供了新的策略。
当给 C57BL/6 小鼠服用时,氨苄青霉素引起的菌群失调得到缓解,且不影响血清药物浓度。
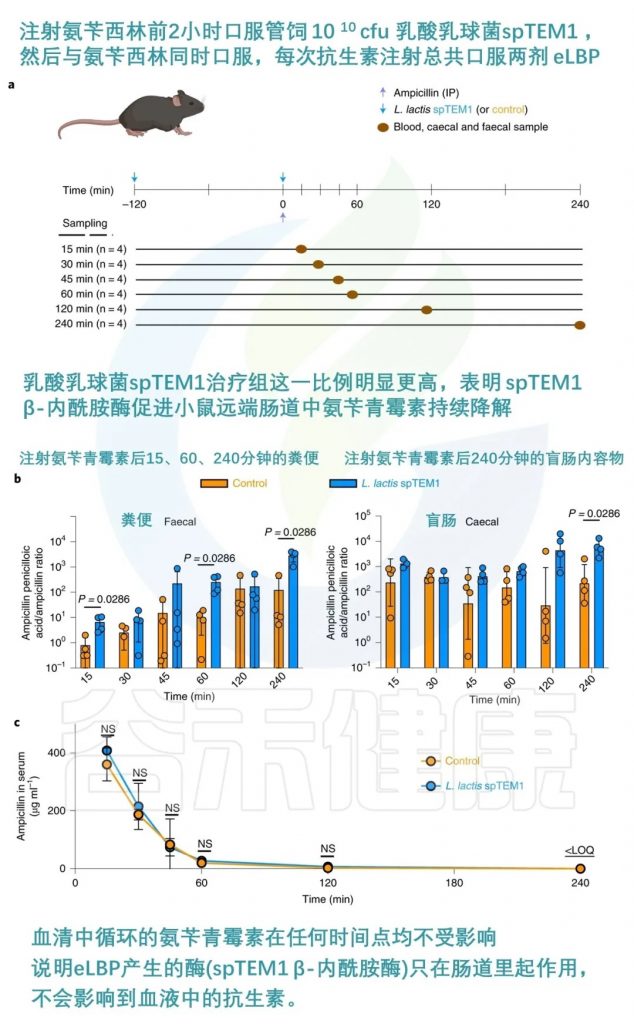
doi.org/10.1038/s41551-022-00871-9
★ 植物乳杆菌IS-10506→氨氯地平吸收率提升2倍
同样,补充植物乳杆菌IS-10506 可通过增加 ATP 结合盒转运蛋白的存在使氨氯地平的吸收率提高 2 倍。
并非所有益生菌都能有效缓解药物引起的菌群失调,有些菌株可能会损害抗生素治疗后的微生物组恢复。因此,选择具有恢复正常生化状态功效的益生菌至关重要。
其他补充疗法(例如 FMT)可解决微生物介导的毒性。接受 FMT 作为抑郁症辅助疗法的患者抑郁症状有较大改善,肠道微生物状况也有所改善。
药物微生物组学领域处于起步阶段,完整的药物微生物组图谱尚未绘制完成,但仍表现出巨大的潜力,将药物微生物组学整合到药物开发和治疗实践中,可以为临床医生和患者提供替代性的疗法,增强治疗效果和最大限度减少不良反应。
鲁拉西酮有益于肠道的特性就是一个典型的例子。作为一种非典型抗精神病药物,鲁拉西酮长期以来处方不足。它的疗效与奥氮平、氯氮平等竞争性抗精神病药物相当,但不会引发肠道菌群失调或影响代谢功能。因此,鲁拉西酮可能更适合代谢敏感的患者,避免了与治疗目标相冲突的风险,降低了加重精神疾病的可能性。
这些例子提醒我们,在药物设计的早期阶段以及开具现有药物时,必须考虑药物微生物组学,以确保实现本文所说的“肠道中性”。通过优先考虑“肠道中性”,可以开发和开出维持肠道微生物组平衡的药物,从而降低与菌群失调和微生物介导的毒性相关的风险。
需要各学科跨领域合作研究,以充分了解药物-微生物组相互作用,并实施战略配方和补充疗法,为更安全、更有效的药物治疗铺平道路,最终有益于患者的护理和健康。
过去二十年对药物-微生物组相互作用的理解已经取得了显著进展,发现了克服不利相互作用的关键策略。
例如,为了提高药物的生物利用度,研究人员设计了基于益生元的递送载体,用于封装或结合药物,既提升了药物疗效,又减少了对肠道微生物组的负面影响。在这种情况下,实现“肠道中性”旨在提高药物的耐受性和安全性。
不过这在临床环境中的研究仍然相对缺乏。这凸显了迫切需要开展针对人类的缓解策略研究,这样有希望将新的发现转化为临床实践,最终改善患者的护理和治疗结果。
控制药物-微生物组相互作用面临诸多挑战,需要有针对性的研究工作。这些挑战包括微生物采样、测序的技术限制,以及获取和分析大数据所需的成本等。为了克服这些障碍,肠道菌群检测技术的进步和标准化,构建预测大数据模型和临床前模型的完善显得尤为重要。通过精确的检测和分析,我们可以更好地理解药物对肠道微生物组的影响,以及微生物组如何影响药物的代谢和疗效。
尽管面临挑战,“肠道中性”的药物和制剂的前景依然很不错。这为那些曾因肠道代谢问题或毒性反应而被搁置的治疗方法重新带来了希望。在药物开发的早期阶段考虑药物微生物组学,是减少后期意外毒性的有效途径。对于现有的疗法,应用肠道中性的制剂可能带来突破性的改善。无论采取何种策略,追求“肠道中性”和调节药物微生物组学,都为我们站在口服药物递送和精准医疗领域的前沿提供了有力的支持。
总的来说,肠道菌群检测在药物微生物组学的研究和临床应用中起着至关重要的作用。这不仅有助于开发更安全、高效的治疗方案,提升患者的护理和治疗效果,也将推动药物研发和个性化医疗的进步,最终促进人类健康水平的提升。
主要参考文献
Kamath, S., & Joyce, P. (2024). A critical need for ‘gut neutrality’: mitigating adverse drug–microbiome interactions. Expert Opinion on Drug Metabolism & Toxicology, 1–4.
Muñoz, K.A., Ulrich, R.J., Vasan, A.K. et al. A Gram-negative-selective antibiotic that spares the gut microbiome. Nature 630, 429–436 (2024).
Wang Y, Yu Z, Ding P, Lu J, Mao L, Ngiam L, Yuan Z, Engelstädter J, Schembri MA, Guo J. Antidepressants can induce mutation and enhance persistence toward multiple antibiotics. Proc Natl Acad Sci U S A. 2023 Jan 31;120(5):e2208344120.
Doll JPK, Vázquez-Castellanos JF, Schaub AC, Schweinfurth N, Kettelhack C, Schneider E, Yamanbaeva G, Mählmann L, Brand S, Beglinger C, Borgwardt S, Raes J, Schmidt A, Lang UE. Fecal Microbiota Transplantation (FMT) as an Adjunctive Therapy for Depression-Case Report. Front Psychiatry. 2022 Feb 17;13:815422.
Xie Y, Xu W, Jin Z, Zhao K. Chondroitin sulfate functionalized palmitic acid and cysteine cografted-quaternized chitosan for CD44 and gut microbiota dual-targeted delivery of curcumin. Mater Today Bio. 2023 Mar 24;20:100617.
Lang T, Zhu R, Zhu X, Yan W, Li Y, Zhai Y, Wu T, Huang X, Yin Q, Li Y. Combining gut microbiota modulation and chemotherapy by capecitabine-loaded prebiotic nanoparticle improves colorectal cancer therapy. Nat Commun. 2023 Aug 7;14(1):4746.

谷禾健康

这篇文章总结了关于肠道微生物群(GM)在糖尿病中的作用的研究现状与结论,内容来自《Diabetes》、《Diabetes Care》和《Diabetologia》最近举办的一次国际专家论坛,该论坛在2023年的欧洲糖尿病研究协会年会上举行。论坛参与者包括在肠道微生物组和代谢领域的领军研究人员,其中既有临床医生,也有基础科学家。
讨论主要分为四个主题:流行病学、生理学和病理生理学、技术和方法以及临床应用。他们得出的结论如下:
肠道微生物群参与2型糖尿病的病理生理过程。微生物产生的代谢物与疾病有正面和负面的关联,而且最近通过人类的孟德尔随机化研究,发现了肠道微生物功能(如丁酸盐生产基因)与葡萄糖代谢之间的机制联系。
肠道微生物群的高度个体化特性是研究的一大障碍。需要大型队列和深度测序的方法来稳健地评估关联性和因果关系。
由于单次采样对于捕捉糖尿病个体内肠道微生物群的动态变化有些困难,建议未来需要要对个体多次重复测量的研究,就是要增加纵向队列的研究。
未来还需要大量研究来确定这些不断扩展的知识如何应用于糖尿病的诊断和治疗。新技术和改进的计算工具将对实现这一目标很重要。
研究小组承认,对肠道菌群在代谢疾病中的作用的理解存在许多差距,这并非糖尿病领域所独有,而是反映了更广泛的需求。开展更多控制良好的前瞻性和回顾性人体研究,并在机制上跟进模型系统研究,改进计算工具,将有利用将目前的微生物组数据应用于未来糖尿病的诊疗。
Perspectives
1)
肠道菌群与糖尿病之间的流行病学关联
肠道微生物群是人体最大且最复杂的微生物群落,它连接着我们的外部和内部环境。对肥胖症和心血管代谢疾病(包括2型糖尿病)中肠道微生物群进行流行病学研究的动机源于啮齿动物研究,这些研究证明了肠道微生物群、脂肪性和葡萄糖耐受性之间的联系。
在人类研究中,流行病学研究观察到肥胖症患者的微生物多样性降低,但通过对小型队列进行16S rRNA基因测序或全基因组宏基因组学分析的荟萃分析,并未发现普遍适用的与肥胖相关的肠道微生物特征(换句话说,微生物与疾病的研究需要大队列和大数据库)。
然而,一项对以色列和美国34057名个体进行深度测序全基因组宏基因组学的大规模肠道微生物研究显示,肠道微生物与表型之间存在一致的关联,并且基于微生物组数据训练的机器学习模型对体重指数(BMI)和糖化血红蛋白(HbA1c)的预测准确性可以在不同队列间复制。
通过对训练队列进行子采样,发现随着队列规模的增加,预测准确性也随之提高,约7500-10000个体的样本量可以获得可重复的结果(目前谷禾糖尿病模型使用了9989个样本队列)。这一发现强调了在人类肠道微生物横断面研究中使用大型队列(包含数百名个体)和深度测序组学的必要性,以充分代表人群中的个体异质性以及地区和人口统计学变异。
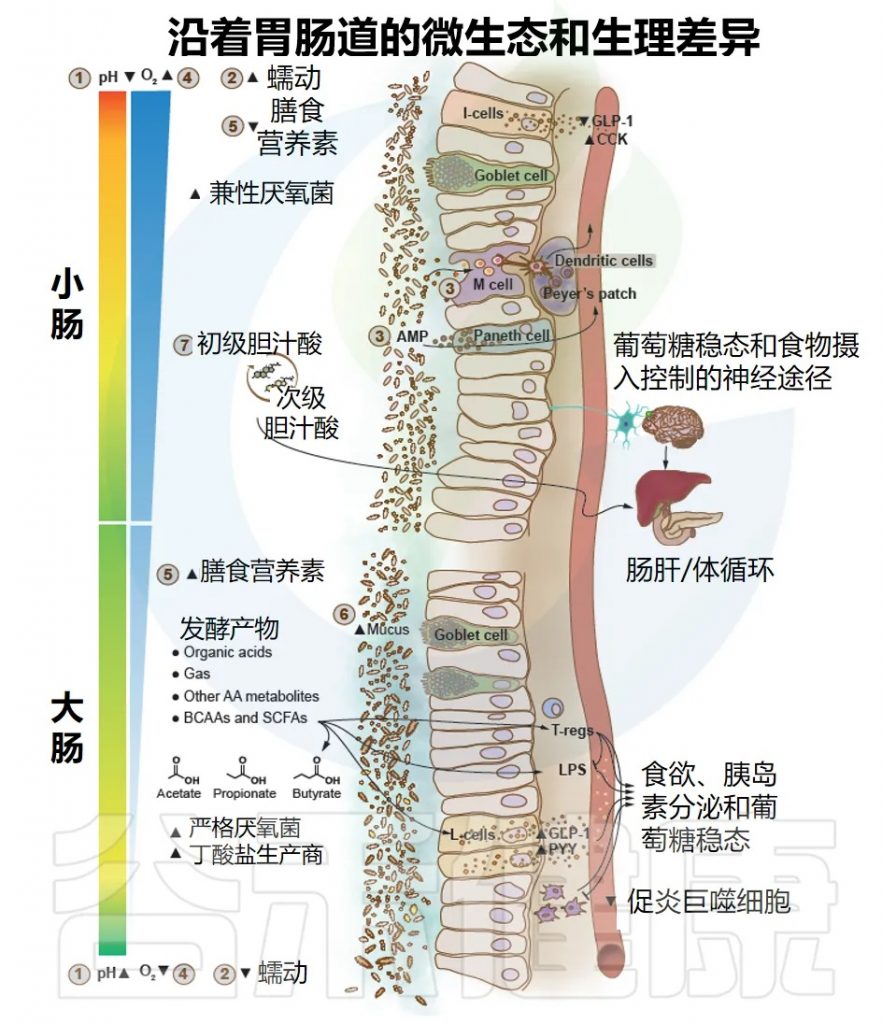
Byndloss M, et al.Diabetes Care.2024
胃肠道(GI)沿线的微生态和生理差异反映了各种环境因素的变化,这些变化依赖于物理、营养和生物学的宿主因素。这些因素导致肠道不同区域的细菌及其生理功能的适应和差异,通过可能影响葡萄糖代谢和糖尿病风险的多向交互产生效果。
以下是影响不同区域微生物数量和组成的主要因素:
pH值:从胃(pH1.0–4.4)到小肠(pH 5.5–7.0),然后更为渐进地到达结肠,在那里由于复杂碳水化合物(纤维)的微生物发酵,pH值可能再次下降(pH5.5)。在粪便中pH值再次升高(可达pH7.8)。
肠道蠕动:在小肠中,肠道通过时间较短,肠蠕动更为强烈,而在大肠中则不然。
肠道上皮细胞:小肠的泛素细胞分泌抗菌肽(AMPs),充当天生防御屏障以减少细菌定植;而M细胞从肠腔中捕获细菌。
氧气浓度:从小肠到大肠,氧气水平逐渐降低。
膳食营养:主要在小肠中由宿主酶消化和快速吸收蛋白质、脂肪和简单碳水化合物,因此限制了细菌对这些营养物质的获取;而部分未消化的膳食残留(例如复杂碳水化合物和部分水解的蛋白质/氨基酸)则积聚在大肠,为细菌提供营养。
宿主糖基:它是由杯状细胞产生的粘液层的一部分,在大肠中远比小肠厚,也是肠道细菌的营养来源,支持其生长。
胆汁酸:分泌至小肠,抑制和有利于某些参与其代谢和再循环的特定细菌的生长。
以上所有生物和非生物因素影响生态条件,使得细菌群体可以在向肠道最远端部分移动时更加密集(从十二指肠的每克102–104个细菌到回肠的107–109个,以及结肠的1011–1012个),并导致细菌组成的差异,其中兼性厌氧菌优先在小肠定殖,而严格厌氧菌在大肠内的微生物中占主导地位,包括丁酸盐生产者。
因此,为了在种族/民族、生活方式和其他人口特征差异之外识别疾病特异性的微生物特征,重要的是在大型人群中进行研究,并将来自不同研究的健康个体/对照参与者作为参考;这些方法已被证明可以提高疾病预测准确性。
2)
肠道微生物代谢与葡萄糖稳态的关联
多项观察性研究报告了肠道微生物群与2型糖尿病之间的关联。在全球流行病学研究中发现,2型糖尿病和糖耐量受损/空腹血糖异常患者的肠道微生物组成发生了一致的改变,这些改变在代谢综合征中也存在,主要特征是微生物多样性降低和产生短链脂肪酸(SCFA)丁酸盐的细菌丰度减少。一些研究还观察到机会性病原体的增加。
最近,粘液降解菌Ruminococcus gnavus被确定为代谢综合征多个特征的预测因子,包括低度炎症、腰围增大、血清甘油三酯升高、糖化血红蛋白升高和高密度脂蛋白胆固醇降低。然而,正如对不同疾病(包括胃肠道和代谢性疾病)肠道菌群改变的荟萃分析所指出的,这些特征中的几个并非疾病特异性,可能代表了一般的肠道菌群的失调。
与葡萄糖代谢和2型糖尿病相关的肠道微生物代谢物和信号分子,肠道微生物群的结构蛋白和分泌蛋白参与调节免疫反应和炎症,正如F. prausnitzii(普拉梭菌)分泌的蛋白质(微生物抗炎分子[MAM]),它能够抑制核因子-κB(NF-κB)通路。另一个例子是A. muciniphila(AKK菌)的外膜蛋白Amuc_1100,它能改善肠道屏障并降低炎症。
①短链脂肪酸
肠道菌群生成短链脂肪酸(SCFAs),SCFAs调节几个过程,包括肠道蠕动和pH值、肠道屏障免疫反应以及通过影响糖异生、胰岛素敏感性和胰岛素分泌的途径来调节系统代谢。
此外,SCFAs调节免疫细胞功能,增强肠道屏障,并刺激肠神经的信号传导。其中丁酸盐还为结肠细胞提供主要能量,并通过激活过氧化物酶体增殖物激活受体γ(PPARγ)增加结肠细胞的β-氧化(β-ox)。
然而,人类研究显示,2型糖尿病患者粪便或血液中不同SCFAs的水平存在广泛变异,这可能是由于方法学局限性造成的。支持SCFAs在调节葡萄糖代谢中作用的最强有力证据来自动物研究和最近一项使用孟德尔随机化统计方法的人类研究(参见下文)。
②胆汁酸
胆汁酸是两性分子,可介导膳食脂肪和脂溶性维生素的吸收。这些分子也被认为是调节脂质、葡萄糖和能量代谢的主要参与者。因此,在2型糖尿病和其他肥胖相关疾病中发现了胆汁酸池的改变,并被认为可能是2型糖尿病病理生理学的潜在贡献因素。
12α-羟基化胆汁酸水平的增加和6α-羟基化胆汁酸水平的降低与胰岛素抵抗有关,并在2型糖尿病患者中出现。胃旁路手术后观察到6α-羟基化胆汁酸水平增加,可预测2型糖尿病的缓解。
干预研究也调查了胆汁酸在人类代谢中的潜在重要性。在减肥手术后,系统性胆汁酸水平升高以及肠道信号激发GLP-1释放的现象得到了验证,尤其是餐后增加被认为特别重要。
然而,在一些进行过胆囊切除术的个体中发现胆汁酸反应过度,并与GLP-1和胰岛素反应的进一步增强相关联。在2型糖尿病患者中,已证明二甲双胍通过减少脆弱拟杆菌的丰度来改善葡萄糖代谢,这与肠道中甘牛胆酸水平的增加和法尼醇X受体(FXR)的抑制有关。
然而,对肠道微生物群与胆汁酸之间直接相互作用及其与2型糖尿病及相关疾病的发展和治疗的关联的理解仍然有限,还需要更多的人体研究来探索。
③色氨酸代谢物
肠道菌群色氨酸代谢物,如吲哚丙酸(IPA)和吲哚丙烯酸(IA),通过孕烷X受体(PXR)改善肠道屏障,并通过肠道免疫细胞上的芳香烃受体(AHR)进行信号传导,增加白介素-22(IL-22)的产生,从而调节免疫和代谢反应。
④其他代谢物
在血液中,IPA和IA还提供抗氧化和抗炎功能。研究还表明,3-吲哚丙酸(色氨酸的代谢产物)的循环水平升高与胰岛素分泌和敏感性改善以及2型糖尿病风险降低相关。
咪唑丙酸和支链氨基酸(BCAAs)通过激活雷帕霉素复合体1(mTORC1)的机制型靶标来损害胰岛素信号传导。
肠道菌群还产生乙醇,与脂肪肝病和胰岛素抵抗有关。
肠道微生物群产生的氨基酸代谢物也与2型糖尿病相关(前两个图)。研究表明,3-吲哚丙酸(色氨酸的代谢产物)的循环水平升高与胰岛素分泌和敏感性改善以及2型糖尿病风险降低相关。
此外,在存在胰岛素抵抗和2型糖尿病的个体中,血浆组氨酸代谢的细菌产物——咪唑丙酸水平增加。来自肠道菌群对芳香氨基酸代谢的这些代谢物和其他一些代谢物也与欧洲和美国独立队列中的心血管事件风险和死亡率有关。
肠道菌群还产生乙醇,与脂肪肝病和胰岛素抵抗有关。
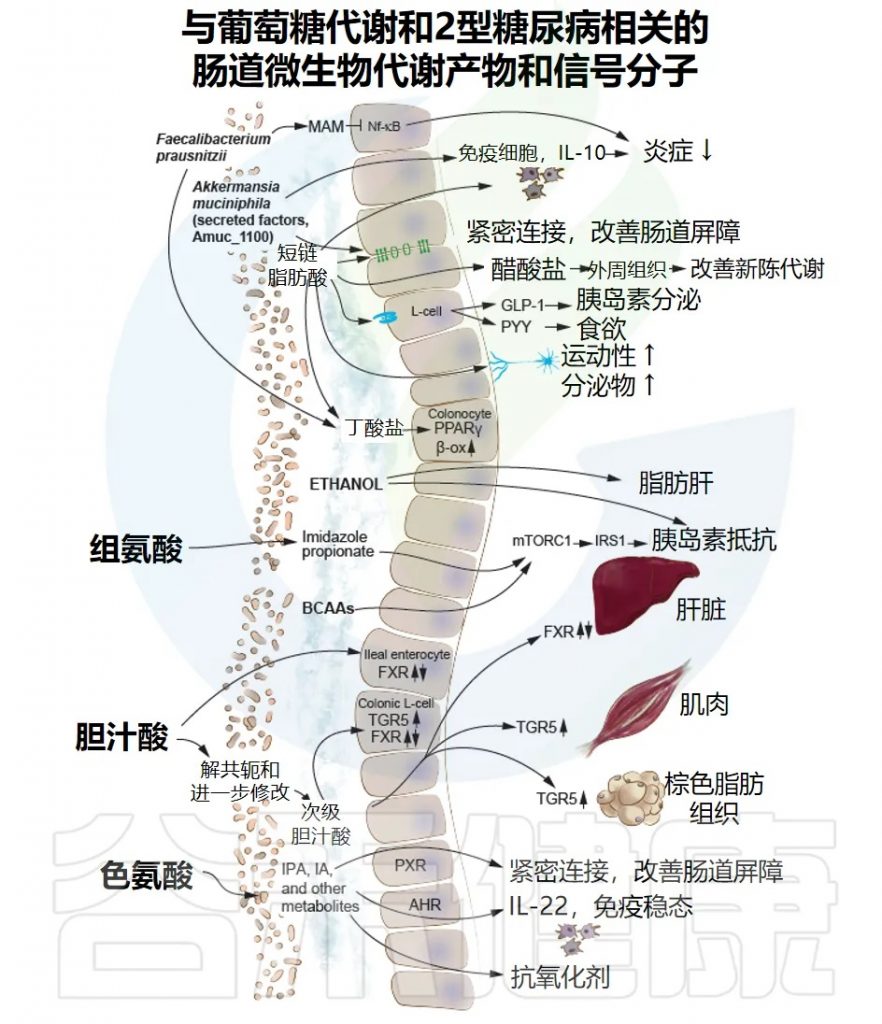
Byndloss M, et al.Diabetes Care.2024
3)
肠道菌群或其代谢产物和降糖药物治疗的关系
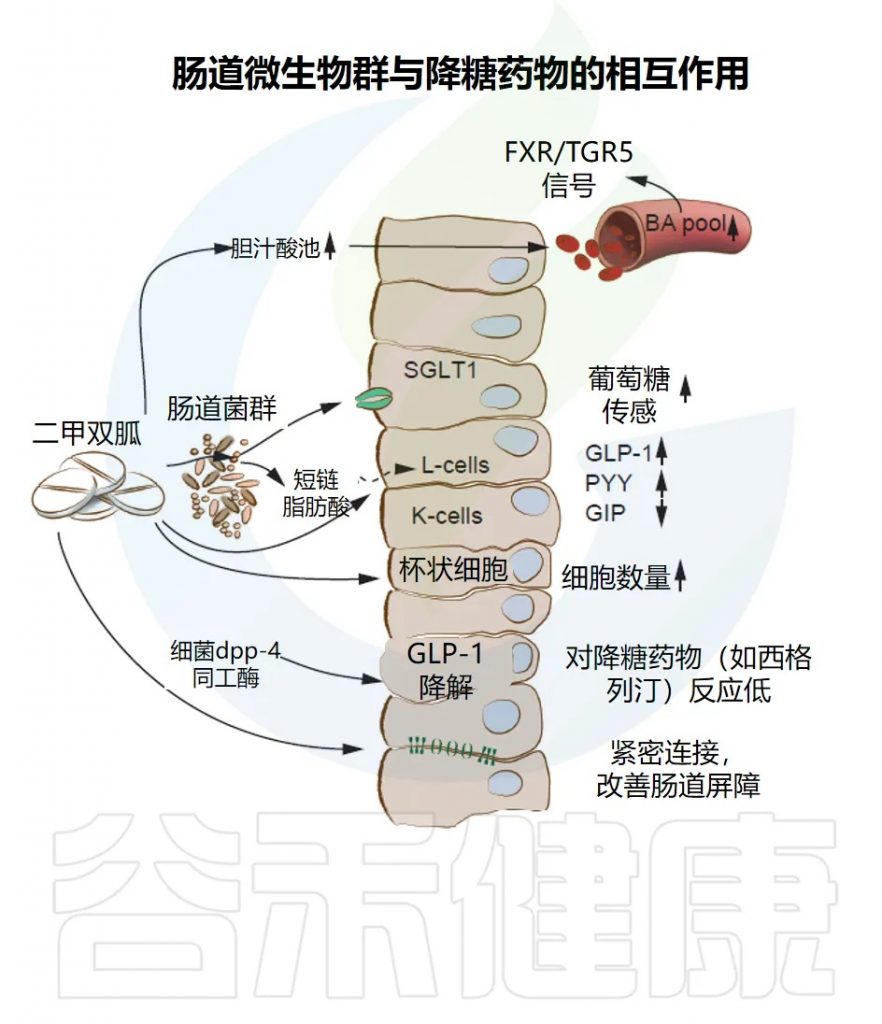
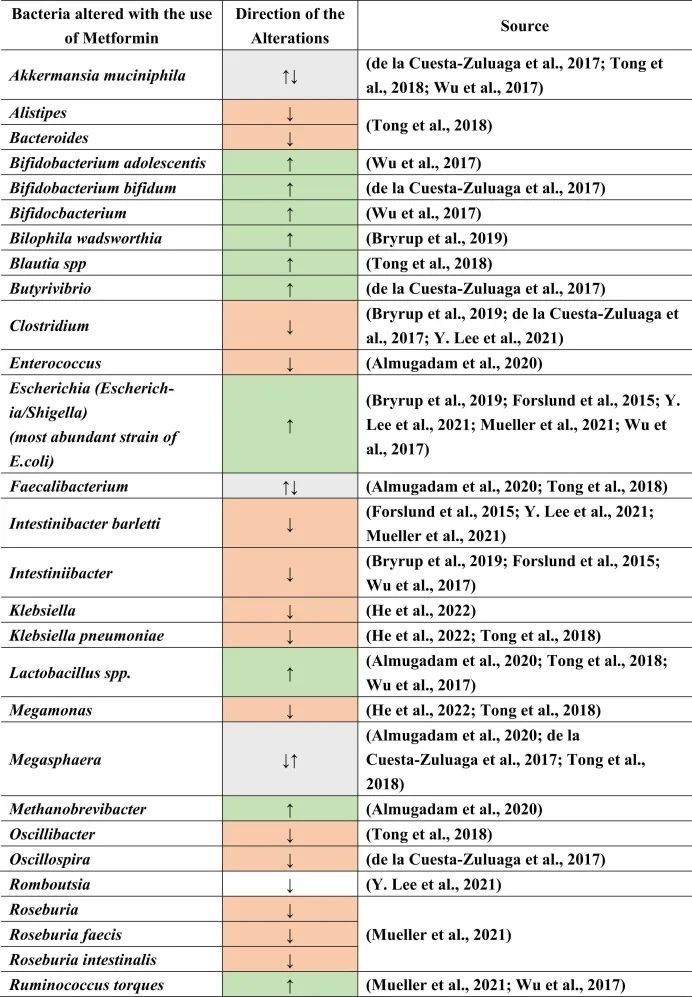
支持肠道微生物群在2型糖尿病中作用的证据已通过观察性和干预性研究得到加强。这些研究表明,二甲双胍使用者的肠道菌群中多种细菌物种的相对丰度发生了变化。
二甲双胍使用者肠道菌群发生显著变化
在多个涉及接受二甲双胍治疗个体的队列研究中,发现大肠杆菌(Escherichia coli)的相对丰度升高,而Intestinibacter bartlettii的丰度降低。
此外,最近一项大规模宏基因组研究发现,接受二甲双胍治疗的个体中Escherichia marmotae增加,而Romboutsia timonensis减少。
随机试验和对未使用药物的个体的研究为这些肠道菌群差异在2型糖尿病中的因果效应提供了支持。这些研究表明,肠道菌群组成的变化转化为丙酸盐和丁酸盐产生的增加以及胆汁酸池的调节,这可能介导了二甲双胍降血糖效应的一部分。
然而,肠道菌群也可能是约30%服用二甲双胍的个体经历短暂或持续肠道不适的原因(例如,通过一些大肠杆菌属种增加气体产生)。
Byndloss M, et al.Diabetes Care.2024
肠道微生物代谢物参与二甲双胍的作用机制
肠道微生物代谢物参与二甲双胍的作用机制,包括通过胆汁酸受体FXR和TGR5进行胆汁酸信号传导,以及生产短链脂肪酸,这些都调节了内分泌细胞(K细胞和L细胞)中胰高血糖素样肽-1(GLP-1)、胃抑制多肽(GIP)和肽YY(PYY)等促胰岛素分泌激素的释放。
其他与二甲双胍作用相关的肠道菌群依赖机制包括通过钠-葡萄糖共转运蛋白1(SGLT1)改善葡萄糖感知和提高肠道屏障功能(例如,恢复紧密连接和增加产粘蛋白的杯状细胞)。
然而,肠道菌群通过表达二肽基肽酶-4(DPP-4)同工酶,可能降低GLP-1活性并影响降糖药物的疗效。
其他降糖药物与肠道微生物群的关联
关于其他口服降糖药物,研究表明二肽基肽酶4(DPP-4)抑制剂和α-葡萄糖苷酶抑制剂对肠道微生物群和微生物代谢物有影响,但钠-葡萄糖共转运蛋白2(SGLT2)抑制剂、噻唑烷二酮类和胰高血糖素样肽1(GLP-1)受体激动剂的影响较不明确。
迄今为止,大多数涉及SGLT2抑制剂的研究都是在小鼠模型中进行的,少数现有的人体研究结果存在矛盾,无法清楚地区分SGLT2抑制剂的效果与之前或同时使用二甲双胍治疗或同期生活方式改变的影响。
GLP-1受体激动剂可能通过激活上皮内淋巴细胞GLP-1受体产生抗炎作用,进而可能有助于调节肠道微生物群。尽管需要更多研究,但现有证据表明肠道菌群可能介导一些降糖治疗的益处,某些益生菌或益生元可能通过影响肠道微生物或其功能进一步改善这些药物的降糖效果。
需要进一步的干预和转化研究来确定药物诱导的肠道菌群变化是否在介导健康效应中起因果作用,并揭示潜在机制。
重要的是,肠道菌群还可能影响降糖药物的效果,例如通过表达人类DPP-4的同源物,这可能降低GLP-1的活性并影响葡萄糖代谢(下图)。由于细菌DPP-4同源物似乎对一些靶向人类DPP-4的药物具有耐药性,因此可能需要抑制细菌同工酶来改善当前药物的代谢反应。
4)
孟德尔随机化在阐明因果关系中的作用
肠道微生物群能够通过多种方式影响和与宿主健康互动,因果关系的方向通常是双向的甚至是多向的。肠道微生物群特征在不同层次(如群落、物种、途径、基因和代谢物)能影响宿主表型(例如改变肥胖的风险),同时,表型的发展(如肥胖)又可以反过来改变肠道微生物群。
孟德尔随机化(MR)是一种统计方法,利用与暴露相关的人类遗传变异体来区分疾病结果的因果效应、混杂、反向因果关系或其他因素导致的关联。为了应用MR研究肠道微生物与2型糖尿病的联系,所研究的肠道微生物特征需要受到一个或多个强烈的人类遗传变异体的影响,以便在工具变量分析中用作工具。
尽管已经有若干全基因组关联研究针对不同的肠道菌群特征(如肠道细菌分类群的相对丰度和人类粪便微生物代谢物)进行,但研究其在2型糖尿病中的因果作用的大型MR研究仍然有限,且尚未在重复研究中得到证实。
部分鉴定出与粪便短链脂肪酸(SCFA)水平相关的人类遗传变异体,并报告了肠道菌群丁酸盐生成潜力(即负责肠道丁酸盐生成的基因)与口服葡萄糖耐量测试中胰岛素反应改善之间的潜在因果联系。这些作者还发现异常的粪便丙酸水平与2型糖尿病风险增加之间存在因果关系。
另一项MR研究报告称,2型糖尿病和肾脏疾病提高了血浆中肠道菌群依赖的代谢物三甲胺氧化物(TMAO)的水平,并提出此前观察到的较高TMAO水平与心血管疾病风险升高的证据可能是由于混杂或反向因果关系,而非因果效应。
另一项近期研究则表明某些细菌属与2型糖尿病之间可能存在因果联系。考虑到MR(如多效性和与弱工具变量相关的问题)及肠道菌群研究(如方法学差异、个体间异质性和个体内可变性)的局限性,需要进行大型高质量研究,以评估使用MR的宿主遗传变异体模拟特定肠道菌群特征(无论是特定细菌物种、属还是代谢产物)的能力,以理解与2型糖尿病发病机制的因果关系。
Relationship
▸ 膳食纤维摄入量较少可能导致2型糖尿病
膳食纤维摄入量减少与2型糖尿病风险增加有关;因此,新的糖尿病管理饮食建议鼓励多食用加工程度低的植物性食物,如全谷物、蔬菜、全水果、豆类、坚果和种子。
饮食是肠道生态系统的驱动因素,微生物可及碳水化合物促进菌群多样性和短链脂肪酸生成,从而减少炎症并支持肠道屏障的维持。
就肠道菌群和葡萄糖代谢而言,增加纤维摄入量与不同菌种水平的增加有关,例如Prevotella copri(现已更名为Segatella copri)。研究还表明,纤维对 HbA 1c的有益作用可能是由特定的基线肠道菌群组成和纤维促进的短链脂肪酸产生菌的多样性介导的。
▸ 肠道微生物的特定成分会影响其宿主反应
然而,即使在控制良好的饮食干预中也会观察到不同的影响,而且鉴于肠道菌群的个体间差异很大,对肠道菌群的饮食反应是高度个性化的。
精准营养或“个性化”营养是一个不断发展的领域,它基于识别可用于设计饮食干预措施的个体特定反应预测特征。利用关于肠道菌群成分的个人数据以及血液生物标志物和饮食习惯等其他信息,机器学习方法已被用于预测标准化膳食后的血糖反应,其准确度高于其他预测方法。
这些研究表明,肠道微生物的特定成分会影响其宿主的特定反应(即在不同细菌存在的情况下,对饮食的反应不同)。因此,肠道菌群至少在一定程度上决定了人类代谢的异质性。肠道菌群可改变且代谢活性高,为更精确的生活方式干预和新疗法提供了可能性。
知识差距、挑战和机遇
目前已有数个大型的高质量参考基因组目录 ,它们为人类研究中肠道微生物的分类和功能表征提供了极大的便利。然而,这些数据库并非没有局限性。
对于流行病学分析而言,肠道菌群数据充满了挑战,包括个体间和个体内巨大的变异性、高维性(即观察到的肠道菌群特征的数量可能大于样本和受试者的数量)和稀疏性(即肠道菌群特征,如物种,仅在部分样本中检测到)。
在种群水平上,肠道菌群由数千个相互作用的物种组成,每个物种在不同宿主之间以及在同一宿主内随时间推移都具有遗传多样性;然而,常见的分析往往忽略了这种非独立性、微生物之间复杂的加性与相互作用效应,以及肠道菌群的可修改性和波动性。然而,最近的一些分析表明,不同细菌物种的个体内变异和对宿主生理的适应模式不同。
其他挑战与肠道微生物群可能影响和响应的大量表型和环境因素有关。大规模群体研究的重要性在人体遗传学中已被无可置疑地证明;大多数多基因性状已知受许多具有小效应的遗传变异影响,但这些变异可以汇总成具有临床重要性的强大多基因风险评分。
类似地,大规模宏基因组研究结果表明,单一的细菌物种可能与人类表型存在低效应大小的关联,或以低丰度存在。因此,需要大样本量以获得足够的统计能力和涵盖个体间变异性,以获得可复制的结果和高预测准确性。
为了更好地理解肠道菌群变异和动态对2型糖尿病的长期影响,前瞻性研究至关重要。在目前发表的少数前瞻性研究中,肠道菌群特征与中国地区多样人群中发生的2型糖尿病事件和西班牙一项临床试验的子集相关,这些研究均使用16S rRNA基因测序。
在一个拥有18年随访的大规模芬兰基于人群的队列研究中,肠道菌群特征也与2型糖尿病有关,使用的是浅层宏基因组测序。然而,在这些研究中,发生病例的数量有限,分析的分辨率也有限。
例如,Faecalibacterium prausnitzii是下一代益生菌最有希望的候选者之一,但也有其他有希望的候选者,如Akkermansia muciniphila和P. copri。关于F. prausnitzii,已在人体肠道中发现了几种潜在亚种,它们具有利用复杂多糖的不同功能潜力 。
与此观察一致,大型宏基因组学研究也发现了几种F. prausnitzii 亚种,但仅其中一部分亚种与 BMI 呈负相关。就P. copri 而言,已发现其与宿主代谢表型(如内脏脂肪和葡萄糖反应)呈正相关和负相关。
这些不一致的发现可以部分地用种内和种间多样性来解释。例如,这些差异可能将同一物种内的菌株定义为共生菌或致病菌,如脆弱拟杆菌和艰难梭菌的情况,这取决于该菌株是否编码毒力因子。
Perspectives
在进化过程中,哺乳动物必须适应充满微生物、病毒和真菌的世界。在无菌的宫内环境中,哺乳动物在出生期间和出生后立即暴露于潜在的有害微生物中。进化创造了实质性的屏障,包括胃肠道运输过程、免疫球蛋白A (IgA) 、粘液、上皮层、内皮屏障、淋巴结和肝脏,所有这些屏障阻止微生物易位进入体内,但为微生物生态系统创造了最佳储存库。上消化道中的微生物数量较少。同时,大肠内微生物密度和丰富度较高,从小肠到大肠,pH值和有氧/厌氧条件发生生理变化,大肠内为厌氧条件。
1)
微生物的基本功能
肠道微生物除了对哺乳动物造成潜在的有害威胁外,还为哺乳动物提供必需功能,包括训练免疫系统、保护其免受病原体的侵害(即抗定植)、代谢功能、营养物质供应(如维生素)、肠道蠕动和外来生物的解毒。
同时,微生物和宿主在小肠中竞争营养物质,微生物产生的常量营养素副产物被提供给宿主。
营养物质(即纤维)和哺乳动物代谢物(如葡萄糖醛酸苷、粘液多糖和胆汁酸)通过微生物代谢进行发酵或转化。微生物代谢以及微生物细胞的死亡和周转形成了外周血中微生物代谢物池,其中约30%的外周血代谢物与肠道菌群及其代谢物有关。
这些微生物代谢物被G蛋白偶联受体(GPCR) 或芳烃受体(AHR)等受体识别,或被哺乳动物酶(如 TMAO)进一步加工,通过表观遗传修饰调节哺乳动物基因表达,对代谢健康产生影响。
2)
不可消化纤维及其代谢物的作用
不可消化的碳水化合物是大肠中特定细菌的能量来源,这些细菌含有宿主所缺乏的酶,这些酶可以代谢这些纤维并促进SCFA的产生。大量研究表明,外源性短链脂肪酸(尤其是丙酸和丁酸)对糖尿病样表型的啮齿动物模型有益。然而,1型和2型糖尿病临床试验的证据尚不明确。
在结肠中,短链脂肪酸(SCFA)通过与GPCR和游离脂肪酸受体2和3结合激活肠内分泌细胞(EEC),诱导肠道肽(主要是GLP-1和肽YY)的释放。为了支持这一发现,啮齿动物和人类补充益生元可以改善葡萄糖耐量和胰岛素抵抗,并且与肠道肽水平升高有关 。
在一项研究中,高纤维饮食改善了2型糖尿病患者的葡萄糖耐量,这种效果与粪便丁酸水平和循环GLP-1水平升高有关。GLP-1通过增加胰岛素分泌、促进胰岛素敏感性和减少肝葡萄糖生成来调节葡萄糖稳态。
此外,短链脂肪酸(SCFA)对于维持整体肠道健康和肠道屏障至关重要,因为丁酸是结肠细胞的主要燃料来源。相反,丁酸减少会促使结肠细胞进行无氧糖酵解,从而增加上皮氧合,破坏结肠的厌氧环境。
3)
肠道菌群在肠道屏障功能中的作用
肠道微生物在肠道屏障功能中起着至关重要的作用。肠道屏障受损会导致肠漏,从而引发低度全身性炎症,这是肥胖和糖尿病的特征。尽管这些机制主要在实验模型中进行研究,但导致全身性炎症的一个潜在机制是来自革兰氏阴性细菌细胞包膜的脂多糖(LPS)内毒素增加,也称为代谢性内毒血症。
肠道菌群失调会导致促炎反应,影响葡萄糖稳态
脂多糖(LPS)可以作用于全身特定的病原体相关分子模式 (PAMP) — Toll 样受体 4 (TLR4) — 从而引发促炎免疫反应,从而对葡萄糖稳态产生负面影响。一系列研究表明A. muciniphila通过作用于 TLR4 和肠道屏障,在介导肠道微生物改变对全身炎症的一些影响方面发挥潜在作用;
然而,关于其在代谢疾病中介导葡萄糖代谢作用的证据较少 。然而,还需要更多的研究来确定TLR4以外的 PAMPs 对代谢物的感知是否与调节宿主-微生物串扰和人类肠道屏障完整性有关。
与此同时,在肥胖个体的肠道中观察到促炎性巨噬细胞的积聚、CD8αβ T 细胞浸润和 IgA+ 免疫细胞减少 ,导致胰岛素抵抗。肠道菌群调节策略可以减轻高热量饮食对肠道免疫的不利影响。例如,减少促炎性巨噬细胞的比例并增加 3 型先天淋巴细胞和调节性 T 细胞与改善葡萄糖代谢有关。
尽管如此,了解驱动肠道微生物与免疫相互作用的精确分子机制及其在人类中的应用也需要未来进行广泛的研究。
Progress
在微生物组领域,将现象学与实际生物学区分开来需要工具和方法来识别机制,以解析微生物组是否是代谢疾病的驱动因素或提供治疗机会。在这里,我们讨论了推动该领域发展的最有希望的技术发展。
模型系统
在比较研究肠道微生物与代谢疾病之间关系的模型系统时,必须同时考虑传统模型(例如无菌和无菌小鼠)和新兴技术(例如器官芯片和非鼠类GF模型,如斑马鱼和猪)。
无菌模型有利于研究肠道菌群与特定疾病的关联
无菌动物已被广泛用于研究人类肠道微生物在肥胖和糖尿病中的作用。这些动物出生时没有任何微生物群,可以在没有微生物组的情况下对干预措施进行研究。因此,我们可以深入了解微生物组是否对给定的生物过程必不可少。
通过将整个肠道菌群(通过供体粪便)或特定的分离菌株定植到无菌小鼠体内,建立无菌疾病模型。研究表明,将肥胖和2型糖尿病患者粪便中的微生物接种到无菌动物体内后,无菌动物成功复制了疾病表型,这为肠道菌群与代谢疾病的关联提供了证据。
此外,从患有病态肥胖和糖尿病的人的肠道中分离出一种过度生长的产生内毒素的细菌阴沟肠杆菌B29,它在无菌 C57BL/6J 小鼠中诱发了肥胖、脂肪肝和胰岛素抵抗,而这些小鼠对高脂饮食引起的代谢缺陷具有抵抗力。敲除B29菌株中产生内毒素的基因或C57BL /6J小鼠中的Tlr4基因可预防代谢缺陷,强调了特定肠道细菌和宿主反应在代谢疾病的发生和发展中的因果关系。
然而,某些关于肠道微生物小鼠的概念一直流传,而这些概念只是研究一种基因型的结果。例如,GF C57BL/6J 小鼠对饮食诱导的肥胖具有抗性,而 GF Swiss Webster 小鼠则不能;因此,由于大多数 GF 小鼠研究都使用 C57BL/6J 小鼠,因此 GF 小鼠通常必须比传统小鼠吃得更多才能维持体重,这已成为事实。这些模型对高脂饮食的不同反应凸显了遗传背景在研究结果中的重要性。
其他GF模型(如猪和斑马鱼)的存在补充了 GF 小鼠的使用。在开发与人类微生物群相关的无菌模型时,GF 猪和仔猪比小鼠能提供更多与人类相关的见解,尽管饲养它们所需的空间对于许多机构而言过于宽裕,或限制了研究只能使用少数动物。另一方面,无菌斑马鱼已被证明可用于研究肠道微生物和不同宿主细胞发育阶段 。
鱼体的透明度、在不同细菌存在下荧光标记和成像不同细胞类型的能力,以及饲养和繁殖斑马鱼的便利性,都有利于研究特定问题。这些模型不能完全复制人类生理学,但它们允许在严格控制的条件下进行纵向和侵入性采样,这在探究机制问题时非常重要。
器官芯片利于研究人体组织内的相互作用
器官芯片(如肠道芯片)提供了更多与人类相关的系统,因为它们可以直接从人体组织或血液来源的诱导性多能干细胞中获得,这些干细胞保留了宿主的遗传特征,因此,它们使我们可以在受控环境中研究复杂的人体组织和细胞相互作用。
最近的研究已经证明了在半厌氧环境中将微生物群接种到肠道芯片中的能力,目前许多研究小组正在测试在这些芯片上接种日益复杂的群落的效率。虽然肠道芯片模型缺少一些关键的细胞类型,如免疫细胞,但重大进展包括能够连接不同的器官芯片,如肠道芯片和神经元芯片,以模拟肠脑相互作用。利用器官芯片研究微生物组的创造性方法将继续涌现,并可能填补重要的空白,补充动物模型。
了解细菌基因和功能
对细菌全基因组进行测序和组装的能力是一种非常强大的方法,可用于识别菌株的谱系和相关性,以及识别可能与人类健康或疾病相关的特定细菌表型所涉及的假定途径。如果我们思考已从基因改造小鼠研究中阐明的人类疾病机制,就不难想象在细菌中进行同样研究可以获得的大量信息。敲除和操纵细菌基因的能力并不是什么新鲜事。
近80年的细菌遗传学研究已经阐明了病原体如何在肠道上皮中定植并分泌毒素从而导致霍乱等疾病,它们如何相互共享信息以适应不同的环境,以及营养选择如何驱动它们在宿主中的组成。大肠杆菌可以被认为是 C57BL/6 小鼠的细菌版本;其基因定义明确且易于改造,而且它已经成为在特定环境下测试改造效果的主力。然而,共生肠道细菌的多样性远不止大肠杆菌;因此,研究人员正在积极寻求对肠道j基因的更深入了解,例如使用拟杆菌和梭菌作为代表性生物 ,因为大量人类和小鼠研究已经证明了这些生物在健康和疾病中的重要作用。
人工智能等先进计算工具通过预测蛋白质的三维结构,为细菌基因组中未注释部分提供了新的见解,AlphaFold2 等技术极大地推进了这一任务。通过分析这些结构,研究人员可以根据它们的形状和结合位点推断出可能的功能。这些潜在作用可以通过生化和微生物学研究中的实验验证来证实。这些知识,特别是关于蛋白质如何影响代谢途径的知识,对于将微生物活动与糖尿病等健康状况联系起来至关重要,有助于深入了解疾病机制和潜在的治疗靶点。
无参考数据分析
目前,微生物组测序分析中依赖数据库的方法最关键的问题是它们在检测新型或研究不足的微生物方面存在局限性。当使用基于已充分表征的细菌的参考基因组的数据库分析微生物群落样本时,不匹配的序列会被忽略或错误分类。
这一过程导致对微生物生态系统的看法出现偏差,可能会遗漏在健康和疾病(包括糖尿病)中发挥重要作用的关键成分。因此,推进微生物组研究需要开发和使用能够发现和表征这些代表性不足的微生物实体的方法。
从宏基因组测序数据中从头组装基因组是微生物组研究中一种强大的方法,该方法涉及直接从测序读取构建基因组,而不依赖于参考数据库。
该方法使用先进的计算算法将样本中的 DNA 片段拼凑在一起,从而可以识别来自各种生物体的遗传物质,包括那些以前未测序或编目的生物体。通过组装这些基因组,研究人员可以发现新物种并揭示新的基因功能,从而大大扩展我们对微生物多样性及其在包括人体在内的各种环境中的潜在作用的理解。
对于16S测序来说,由于其经济和丰富的样本积累,对于构建疾病的大数据库来说存在很大的优势,虽然16S分辨率没有宏基因组高,但是通过方法和技术的弥补,可以大大提供16S的预测精准度。
例如谷禾健康结合宏基因组数据和已有的菌群构成数据,通过算法可以大大提高扩增子数据的物种分辨率。此外病毒、真菌、寄生虫和部分16S难区分的病原菌目前通过增加靶向引物进行tNGS的方式来实现,大大拓展了二代测序微生物多样性检测领域的涵盖范围。
这种方法在揭示微生物生命的全部范围方面特别有用,包括可能在健康和疾病中发挥关键作用的物种或基因。
了解小肠微生物群
小肠是营养吸收、肠肝循环和承受肠道激素刺激的主要部位;因此,深入了解人体这一部位的微生物功能至关重要。然而,我们对人类微生物组的大部分了解都基于粪便样本和结肠微生物群,因为即使使用现代内窥镜检查方法,获取小肠微生物群也很困难。
最近的进展使用了创新方法,例如可摄入的胶囊,它可以对整个胃肠道中的肠道物质进行取样。由于每个胶囊都由肠道中不同的 pH 值触发,因此这种方法可以提供肠道群落的微生物图谱。这些工具正在进一步完善和商业开发,以用于诊断和研究。但需要注意的是,样本采集到胶囊内后,微生物有可能继续生长,因此不能准确地代表原生微生物群落。
此外,这些胶囊和其他胶囊都是为空腹状态下的取样而开发的,因此对餐后反应的研究仍然有限,尽管这些反应对于全面了解微生物对葡萄糖代谢调节的贡献可能很重要。解决这些问题对于确保使用此类设备进行微生物组研究的可靠性和准确性至关重要。
同工酶和小分子筛选
微生物组研究中,同工酶和小分子筛选对于识别可以作为治疗目标的特定细菌产物至关重要。微生物同工酶是具有不同分子结构但催化与宿主酶相同反应的酶。筛选这些产物可以揭示微生物代谢的变化,这些变化可能会影响健康并可能干扰药物治疗,例如细菌 DPP-4 同工酶的情况。
小分子筛选专注于识别微生物产生的生物活性化合物 。这些化合物可对宿主的病理生理学产生显著影响。通过识别特定的同工酶和小分子,研究人员可以针对它们进行降解或增强,从而为糖尿病等疾病提供潜在的治疗策略。
Treatment
如上所述,目前尚未发现针对1型或2型糖尿病的诊断性和广义的粪便微生物群分类学特征。因此,未来的研究应转向在大规模前瞻性人群中进行菌种和菌株水平的研究,并在可能的情况下,重点研究胃肠道肠道微生物的功能分析,特别关注稳定同位素前体,以研究不同胃肠道区域重要微生物代谢物的生成和底物通量。
1
高纤维饮食和基于短链脂肪酸的治疗
关于基于肠道菌群的糖尿病疗法,高纤维饮食已被证明可有效控制1型和2型糖尿病患者的血糖水平并降低胰岛素抵抗。尽管膳食纤维通过肠道菌群直接起作用的方式仍有待证实,但这些试验强调了将肠道菌群调节策略纳入糖尿病干预试验的潜在重要性,特别是对于生产有益代谢物(如 SCFA)而言。
但是,如上所述,口服短链脂肪酸(丁酸盐)补充剂的干预试验并未显示在1型或2型糖尿病患者的血糖控制或其他糖尿病调节标志物上 ,可能是因为给药部位与内源性产生不同。对于其他短链脂肪酸,包括丙酸盐和乙酸盐,数据太少,无法得出关于对代谢调节的可能影响的任何结论。
2
传统益生菌和新一代益生菌
用于糖尿病的益生菌疗法可分为传统益生菌,特别是乳酸杆菌和双歧杆菌菌株,它们历来被用于发酵食品或补充剂中以促进健康,以及下一代益生菌,它们是最近被鉴定为人类肠道菌群成员的新菌种菌株。这些菌株与健康有关,但在疾病环境中存在会减少。
传统益生菌
关于传统益生菌,一项关于益生菌(双歧杆菌、乳酸杆菌和唾液链球菌菌株)的开放标签试验发现,益生菌对1型糖尿病患者的兄弟姐妹的1型糖尿病易感性和进展有益。
针对新发1型糖尿病的前瞻性随机对照试验 (RCT) 正在进行中(NCT03961854、NCT03961347、NCT04769037 和 NCT05767450),一项规模较小的试验显示,其对长期 1 型糖尿病仅有中等效果。
在2型糖尿病中,最近的一项荟萃分析描述了这些益生菌菌株在代谢控制和降低胰岛素抵抗方面具有一定功效。
新一代益生菌
关于下一代益生菌,在人体中产生的数据较少。例如,尽管特定菌株(例如Akkermansia)与健康的代谢表型相关,但使用A. muciniphila的 RCT 干预并未发现强烈的代谢影响。
这一发现可能是由于这些测试菌株与代谢综合征缺乏因果关系、通过胃后活力降低、剂量不足或引入人体肠道时缺乏定值。
由于小肠对1型和2型糖尿病的病理生理学都很重要,因此需要进一步分析1型和2型糖尿病患者的小肠微生物群,并研究确定的下一代益生菌菌株组合作为糖尿病的可能干预措施。然而,这种努力应该考虑细菌菌株的植入条件、对其他细菌成员的生态或功能依赖性、以及功能上的潜在冗余。
3
供体粪菌移植
在完成针对特定菌株组合的研究之前,供体粪菌移植(FMT)可能有助于了解调节肠道菌群的效果以及这种调节对糖尿病病理生理和潜在可逆性的影响。
最近发表了一项研究,探新鲜粪菌移植在维持残余β细胞功能和抑制新发1型糖尿病患者自身免疫方面的功效。其他针对 2 型糖尿病和胰岛素抵抗的研究显示,FMT 对胰岛素抵抗和非酒精性脂肪肝疾病有适度影响 ,而一项研究表明对这些参数没有影响。
此外,微囊供体 FMT 和纤维补充的联合干预显示出对葡萄糖代谢有益的影响,这表明干预设计不仅需要合成菌株联合体,还需要饮食支持(例如纤维来滋养菌株)。最后,评估生活方式干预后自体 FMT 是否有助于防止体重反弹的研究发现,饮食引起的低丰度细菌变化可能是维持减肥效果的原因,这可以指导更精准的干预措施,减少伦理负担,降低传播疾病的风险。
总体而言,与针对性菌株或代谢物的干预措施相比,供体 FMT 是一种更为分散的方法。此外,现有数据集中的粪便物质给药方式(胶囊与新鲜 FMT)、肠道 pH 值(例如由于抗酸药)和结肠转运时间存在差异,并且施用的粪便微生物群的数量似乎也会影响供体细菌菌株的植入。
关于糖尿病和基于肠道菌群的疗法的试验结果,使用随时间动态测量葡萄糖代谢(例如混合餐测试或连续血糖监测)可以更好地了解在 FMT 和施用确定的菌株组合期间肠道微生物、饮食和葡萄糖稳态之间的相互作用。
对小肠微生物组的研究仍不足,但对肠道微生物的新认识越来越多地将其与人类糖尿病联系起来。对人类 FMT 的干预研究已经能够从因果关系中分离出关联,并且确实显示出一些临床益处,虽然平均而言相对较小的治疗效果和伦理问题阻碍了这种治疗方法在糖尿病临床护理中的广泛实际应用。
因此,还需要在多民族队列中对肠道菌群和糖尿病之间的前瞻性关联进行更多研究。与此同时,还应探索合成的肠道菌群衍生的细菌菌株或群落和工程系统在糖尿病中靶向肠道输送已识别代谢物的治疗潜力。
Perspectives
在过去二十年中,肠道微生物的改变与糖尿病患者的异常葡萄糖代谢和脂肪变性有关。流行病学研究中的较大样本量现已开始显示肠道菌群与肥胖或2型糖尿病相关的人类代谢特征之间的相关性的大小和可能的一致性;然而,对于1型糖尿病,情况就不那么明朗了。
未来的研究应更严格地考虑糖尿病药物与种族和饮食摄入之间的相互作用。此外,近年来,人们对肠道菌群的功能有了更多的了解,而不仅仅是其成分,这些信息与之前关于特定代谢物(包括短链脂肪酸、支链氨基酸和胆汁酸)与肥胖和糖尿病之间联系的报告非常吻合。
关于肠道菌群成分,只有少数研究探讨了噬菌体和真菌的作用以及这些菌落与细菌菌株在糖尿病中的相互作用。显然,未来的研究还需要关注小肠微生物群的功能,以及开发足够的生物信息学流程和正确组装基因组。
我们还必须考虑到,迄今为止的大多数数据都是在小鼠研究中产生的,由于小鼠和人类在饮食、遗传和寿命方面存在巨大差异,其与人类糖尿病的相关性需要进一步证实。尽管如此,在人类糖尿病环境中对单一菌株和粪菌移植的人体干预研究表明,存在一系列临床代谢效应(与药物更一致的效果相比),但没有严重的副作用。
总之,经过近二十年的研究,我们仍然必须期待未来的努力,以阐明肠道微生物研究对人类糖尿病的临床诊断和治疗适用性。
主要参考文献
Caesar R. Pharmacologic and Nonpharmacologic Therapies for the Gut Microbiota in Type 2 Diabetes. Can J Diabetes. 2019 Apr;43(3):224-231.
Ridaura VK, Faith JJ, Rey FE et al (2013) Gut microbiota from twins discordant for obesity modulate metabolism in mice. Science 341:1241214.
Sze MA, Schloss PD (2016) Looking for a signal in the noise: revisiting obesity and the microbiome. mBio 7:e01018-16.
Duvallet C, Gibbons SM, Gurry T, Irizarry RA, Alm EJ (2017) Meta-analysis of gut microbiome studies identifies disease-specific and shared responses. Nat Commun 8:1784.
Pasolli E, Truong DT, Malik F, Waldron L, Segata N (2016) Machine learning meta-analysis of large metagenomic datasets: tools and biological insights. PLoS Comput Biol 12:e1004977.
Rothschild D, Leviatan S, Hanemann A, Cohen Y, Weissbrod O (2022) An atlas of robust microbiome associations with phenotypic traits based on large-scale cohorts from two continents. PLoS One 17:e0265756.
谷禾健康

随着生活方式的变化和环境压力的增加,慢性疾病的发病率正在全球范围内急剧上升。这些慢性疾病,包括心血管疾病、糖尿病、抑郁症和多种自身免疫性疾病,不仅对个人的健康和生活质量构成了严重威胁,也给全球卫生系统带来了前所未有的挑战。
我们知道抗生素对肠道菌群会产生很大影响,事实上,其他这些药物也被报告具有类似的改变肠道微生物群的效果。这引发了人们对药物通过影响肠道微生物群从而影响健康和疾病的关注。特别是,肠道微生物群与大脑之间的相互作用,也就是所谓的“肠-脑轴”,成为一个热点领域,这可能为一些神经系统疾病的新治疗方法提供线索。
另一方面,神经系统疾病的治疗面临着许多难点,其中包括疾病机制的复杂性、治疗效果的个体差异、长期药物治疗的副作用,缺乏针对疾病根本原因的治疗方法。这些难点突显了寻找新的治疗目标和策略的重要性。
本文我们来了解一下药物引起的生态失调,以及日常处方药包括二甲双胍、他汀类药物、质子泵抑制剂和非甾体抗炎药为什么以及如何可能通过微生物群改变肠脑轴,以抑郁症、多发性硬化症、帕金森病和阿尔茨海默病等神经系统疾病为例来说明。
关于药物和肠道菌群及其与神经系统疾病之间的关联研究,提供了一个全新的视角,对于开发新的神经系统疾病相关治疗方法具有重要意义。
不同的细菌种群在消化道的不同部位繁殖,这是由于不同的微环境所致。关于居住在胃和肠道中的肠道细菌组成的总结见下图:
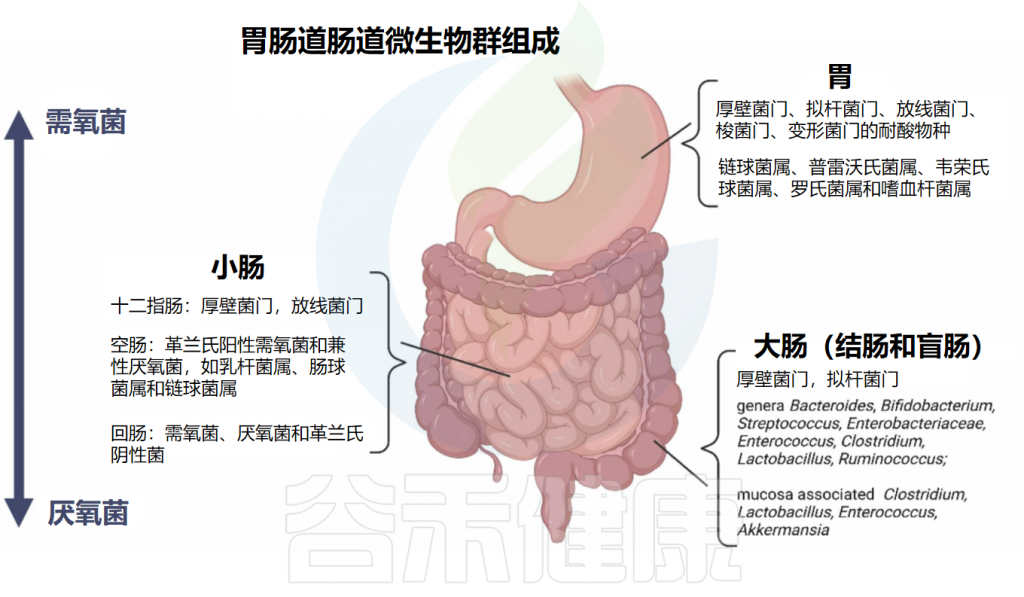
doi.org/10.1016/j.brainresbull.2024.110883
从上消化道到下消化道,细菌种类从需氧菌过渡到厌氧菌。
肠脑轴定义了肠神经系统(ENS)和中枢神经系统(CNS)之间的连接。随着研究的深入,微生物群在这一轴线中扮演着至关重要的角色。现已将肠脑轴扩展到了微生物群-肠-脑轴(MGBA)。
微生物群-肠-脑轴是肠道菌群和CNS之间的双向通信路径,肠道菌群可能通过细菌产生的神经递质和代谢物(所谓的化学信号)、迷走神经、免疫系统或包括下丘脑-垂体-肾上腺轴(HPAA)在内的神经内分泌系统影响大脑。
微生物群-肠-脑轴通信图
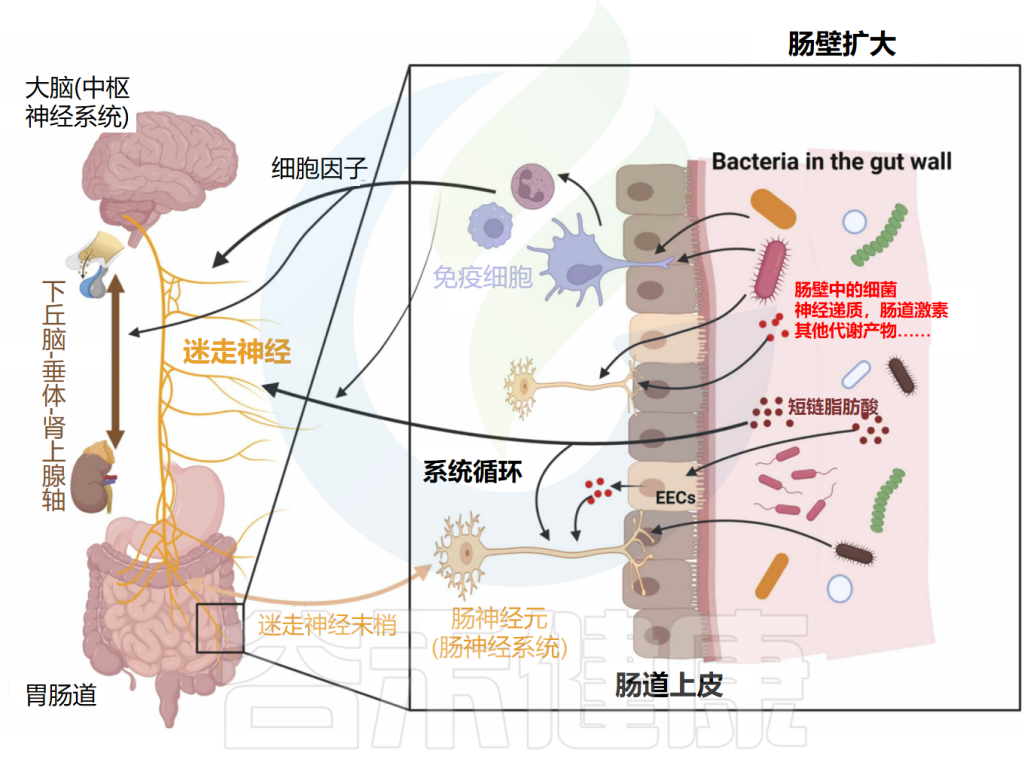
doi.org/10.1016/j.brainresbull.2024.110883
神经、免疫和内分泌介质,如神经递质、细胞因子和肠激素,是微生物群-肠-脑轴双向路径中的通信者。释放的细胞因子在免疫细胞识别细菌后可直接影响大脑。细胞因子和迷走神经也可以影响下丘脑-垂体-肾上腺轴(HPA轴)。细菌还可以通过其脂多糖(LPS)直接与肠神经元通信,触发肠神经元上的TLR4。
间接路径包括由肠道细菌产生的代谢物,如神经递质和短链脂肪酸(SCFAs)。这些代谢物可以进入全身血液循环,从而影响大脑。此外,这些代谢物可以刺激肠道中的肠内分泌细胞(EECs),然后它们在血液中释放肠激素。细菌代谢物和肠激素也可以通过属于迷走神经的肠神经元发送传入信号。
另一方面,大脑通过传出迷走神经纤维和其他肠神经系统(ENS)细胞进行通信。它因此在诸如粘液分泌和肠蠕动等重要方面影响肠生理。
关于微生物群-肠-脑轴在我们前面的文章已经详细阐述,详见:
最新研究速递 | 柳叶刀:肠道微生物群在神经系统疾病中的作用
抗糖尿病药物二甲双胍是 2 型糖尿病的一线治疗药物,已用于2 型糖尿病患者 60 多年。
口服后,二甲双胍在小肠吸收后的生物利用度约为40-60%。它在人肠道中的浓度比血浆中高 30-300 倍。
二甲双胍发挥什么作用?
二甲双胍通过改善胰岛素的作用、抑制肝脏糖异生、抑制肝脏中的胰高血糖素信号传导、增加骨骼肌中的葡萄糖摄取和降低体重来调节血糖水平,从而发挥其作用。新的研究表明,它通过抑制不同肿瘤类型的发作或进一步生长,具有抗癌作用。此外,二甲双胍已被证明通过与肠道菌群的相互作用降低葡萄糖水平。
二甲双胍对肠道微生物的影响
二甲双胍的肠道改变作用可能是由于对肠道微生物组的直接作用和/或通过其他代谢物的间接作用。高胰岛素血症也会改变肠道微生物群。因此,通过二甲双胍降低胰岛素会引起肠道微生物群的间接变化。
在接受二甲双胍治疗的患者中肠道菌群变化
doi.org/10.1016/j.brainresbull.2024.110883
由于二甲双胍诱导的肠道菌群改变,该药物也正在研究用于治疗IBD、自身免疫病等,和/或用于恢复其他肠道改变药物的作用。
研究人员讨论了二甲双胍改善抗精神病药物引起的代谢功能障碍的可能性,代谢功能障碍主要通过各种途径引起体重增加,如胰岛素抵抗和高血糖,并影响神经活性物质(如神经递质和神经肽)。
二甲双胍→肠道菌群→改善抗精神病药物副作用
用抗精神病药物治疗的小鼠比微生物组耗尽的小鼠体重增加更大,这表明肠道菌群在体重管理中的作用。在抗精神病药物治疗的小鼠中,发现许多菌群减少,如乳酸杆菌和阿克曼菌。另一方面,大肠杆菌和双歧杆菌增加。特别是二甲双胍可以减少体重增加,A.muciniphila也显示了这一点。后者已被提议作为缓解全身炎症的益生菌治疗。因此,二甲双胍可以通过肠道微生物组改善抗精神病药物使用的副作用。
人体研究是在较小的队列规模(5-25名受试者)中进行的,还没有足够的数量。然而,对小鼠模型的研究充分证实了二甲双胍和肠道菌群之间的相互作用。
他汀类药物是预防心脏病和动脉粥样硬化最常用的心血管药物之一。超过2亿人单独或联合服用各种类型的他汀类药物。他汀类药物通过抑制HGM-CoA还原酶产生胆固醇的酶来降低低密度脂蛋白(LDL)。
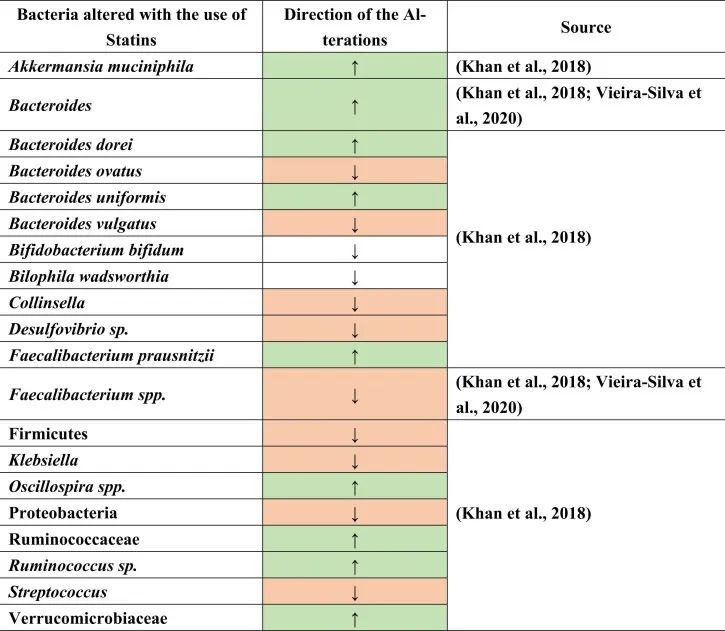
在人类中进行的研究很少,以确定他汀类药物对肠道微生物群的影响,数据不一致。例如,瑞舒伐他汀在动力不足的人体试验中没有显示出显著变化。另一方面,它引起了肠道菌群功能潜力的显著改变,即细菌代谢物的水平。
他汀类药物治疗促炎菌降低
一项荟萃分析研究表明,他汀类药物通过降低Bact2肠型(Bacteroides 2)的发生率,而具有抗炎作用。
注:有研究人员根据在肠道占有优势地位的细菌种类将人的肠道微生物组成划分为4种“肠型”:拟杆菌1型(Bact1)、拟杆菌2型(Bact2)、瘤胃球菌型(Rum)和普氏菌型(Prev),其中拟杆菌2型可以被归类为“不健康肠型”,它与肥胖和系统性炎症水平高有关。
观察到接受他汀类药物治疗的患者Bact2较低,拟杆菌水平降低。这一结果可以进一步解释,在他汀类药物治疗下,粪杆菌属(Faecalibacterium)也可能增加,或者拟杆菌与粪杆菌属的比例较低,导致Bact2发生率降低。
他汀类药物治疗与产丁酸菌的增加有关
具体而言,与未治疗的高胆固醇血症患者相比,阿托伐他汀治疗的高胆固醇血症患者的下列菌群丰度增加:
促炎菌群减少,如:
与未经治疗的高胆固醇血症患者相比,在减少的共生菌中也测量到了Oscillospira(抗炎菌),Firmicutes,Proteobacteria,Desulfovibrio属和条件致病菌,包括克雷伯氏菌,链球菌和柯林斯菌属。
此外,在相同的比较中观察到Bilophila wadsworthia和双歧双歧杆菌(胆汁酸相关物种)的相对减少。他汀类药物治疗后,也观察到不同种类的拟杆菌如B.dorei和B.uniformis的丰度增加,同时B.vulgatus和B.ovatus的生长降低。这些结果表明他汀类药物引起的肠道菌群变化,可能通过肠道菌群进一步影响GBA。
doi.org/10.1016/j.brainresbull.2024.110883
质子泵抑制剂(PPIs)用于预防胃病。很多患者尤其是老年人,会同时服用质子泵抑制剂和其他药物,如止痛药或抗抑郁药,以抵消后者对胃的副作用。
PPI对人体健康的影响
虽然说PPI的作用主要针对胃,但许多研究表明肠道微生物群发生了改变。PPI对微生物组诱导的人体代谢的影响还包括口腔,胃和小肠细菌过度生长(SIBO),肠道艰难梭菌的增加和沙门氏菌感染,肝性脑病,自发性细菌性腹膜炎,社区获得性肺炎,炎症性肠病的不良后果以及功能途径的变化。
PPI对肠道菌群的影响
许多这些疾病和改变是PPI使用后继发的生态失调的后果。一般来说,拟杆菌门丰度较低,厚壁菌门丰度较高。胃肠道中特定的菌群失调:
Naito等人总结了下列菌群丰度的相对增加:
而下列菌群减少:
功能性消化不良患者使用PPI的菌群变化
另一项研究得出结论,功能性消化不良与对照组相比,与粘液相关的细菌,如奈瑟氏菌(Neisseria)、卟啉单胞菌(Porphyromonas)、硒单胞菌(Selenomonas)、梭杆菌、嗜血杆菌(Haemophilus)的丰度较低。
使用PPI后对照组和功能性消化不良的普雷沃氏菌减少。停用PPI后,奈瑟氏菌仍然增加,表明药物使用后微生物变化持续存在。此外,其他细菌群如Holdemania和Blautia,Granulicatella,Rothia和Dorea,以及梭状芽孢杆菌簇XIVa和XIVb在PPI使用者中也有所增加。
在物种水平上:
反流性食管炎使用PPI治疗的菌群变化
由于PPI是给有胃病或反流问题的人服用的,因此一项研究仅检查了PPI治疗前后反流性食管炎患者的粪便微生物群组成。其中,在治疗的不同时间间隔中,乳杆菌(兼性厌氧菌)如加氏乳杆菌,罗伊氏乳杆菌和瘤胃乳杆菌,发酵乳杆菌,短乳杆菌的亚群在治疗后显著增加。
同样,对于链球菌属、肠杆菌科下的兼性厌氧菌计数以及葡萄球菌(也是兼性厌氧菌)也是如此。
有关于口服空肠弯曲菌或罗伊氏乳杆菌等研究显示,迷走神经传入信号发生变化,并在切除迷走神经的小鼠中恢复正常。
使用PPI后,细菌向下消化道区域的转移
在口腔,喉咙和鼻腔中发现了许多上述菌群,这表明由于使用PPI导致胃酸降低,细菌向下消化道区域的转移。通过PPI使用粪便样品显示远端肠道部分与上部胃肠道部分的定植,增加下列菌群:
减少下列菌群:
在一项健康双胞胎的研究中也观察到了同样的情况,结论是生态失调主要是由于咽部和口腔微生物群定殖到下肠道引起的,导致与上述文献相同的细菌改变。
PPI使用与肠道菌群多样性及SIBO相关影响
PPI的使用会导致细菌种群的进一步变化。例如,在PPI治疗后,远端肠道由上肠道的微生物群定殖。总体而言,微生物多样性较低,细菌种类减少,而上消化道中肠道共生菌的丰度较高。
小肠细菌过度生长(SIBO)是后一种情况的一个例子,导致链球菌,埃希氏菌,克雷伯菌,拟杆菌,乳酸杆菌,肠球菌,韦荣氏菌的丰度增加;双歧杆菌和放线菌科的减少。
与细菌转移相关联的是肠道的副交感神经刺激减少,如小肠细菌过度生长。下表总结了菌群的变化。
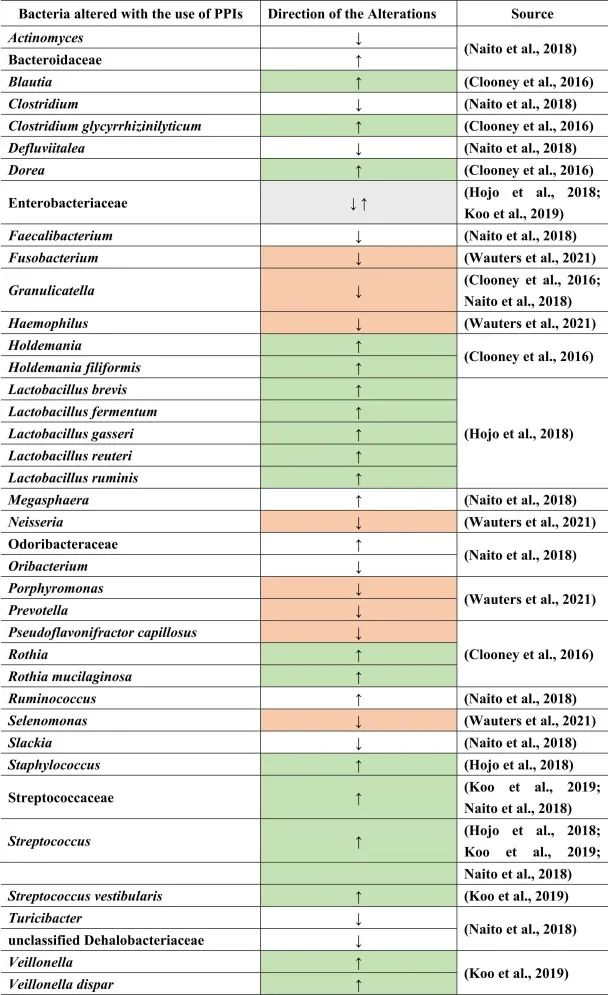
doi.org/10.1016/j.brainresbull.2024.110883
PPI使用增加链球菌,导致功能性消化不良等疾病患者消化不良症状持续
此外,在功能性消化不良,肝硬化,血液透析,类风湿性关节炎和癌症患者中观察到生态失调,这些患者表现出链球菌属的特异性增加。质子泵抑制剂用于缓解消化不良,尤其是幽门螺杆菌感染。然而,随着它增加链球菌的丰度,消化不良症状可能持续存在。来自胃窦胃炎患者的活检显示链球菌数量过多,证实了链球菌与消化不良的关系。
PPI引起肠道微生物失衡,增加肠道感染机会
总之,PPI用于预防其他药物(如NSAIDs)引起的消化不良,其作用是通过减少酸的产生。然而,它改变了肠道环境,使近端肠道细菌转移到肠道的远端。同时,它会导致一些菌群的丰度增加或减少。因此,这种生态失调导致更多的机会的肠道感染,涉及有害细菌,如艰难梭菌或沙门氏菌。
PPI治疗消化不良,影响肠道菌群,改变细菌丰度和细菌移位。主要影响链球菌丰度和艰难梭菌感染的高发病率。
与上述其他药物组一样,非甾体抗炎药(NSAIDs)用于疼痛和抗炎,或低剂量阿司匹林作为心血管健康的血小板聚集抑制剂。NSAIDs也可能导致菌群失调及后果,如小肠细菌过度生长。大量使用NSAID诱导肠道病变。这是由于肠细胞死亡和免疫系统破坏导致肠道屏障受损的结果,从而导致革兰氏阴性细菌的增殖和革兰氏阳性细菌的减少。
PPIs和NSAIDs共同作用于肠道病变与微生物群失衡
PPIs和NSAIDs在由于生态失调引起的肠道肠病中发挥联合作用。NSAIDs可导致胃病,PPIs可减少其发生。NSAIDs和PPIs的联合摄入导致肠病,因为PPIs将微生物群从上胃肠道转移到远端肠道。
例如,用阿司匹林治疗会导致肠道微生物群组成的变化,增加普雷沃氏菌,拟杆菌,Ruminococcaceae,Barnesiella。
塞来昔布和布洛芬增加了酸性氨基球菌科(Acidaminococcaceae)和肠杆菌科的丰度。
与非使用者或萘普生使用者相比,布洛芬会导致丙酸杆菌科(Propionibacteriaceae),假单胞菌科,Puniciecoccaceae,Rikenellaceae的富集。
吲哚美辛诱导拟杆菌,普氏菌科的增加;变形菌门,α变形菌纲,根瘤目(Rhizobiales),假单胞菌科的减少。
同一项研究显示了性别特异性效应,因为女性肠道中的厚壁菌门较低,而男性肠道中的厚壁菌门较高。
一项比较研究表明,各种非甾体抗炎药诱导的生态失调增加了分类群,如肠杆菌科,酸性氨基球菌科,丙酸杆菌科,假单胞菌科,Punicecoccaceae,Rikenellaceae。
总结上述结果,在导致生态失调和NSAID肠病的不同细菌类群和物种中发现了明显的变化。
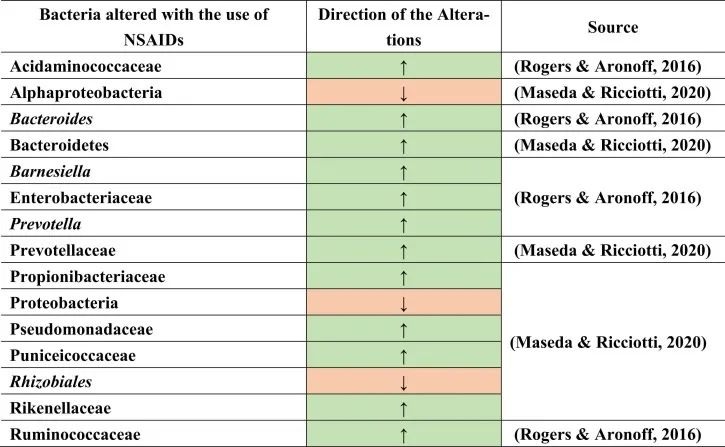
doi.org/10.1016/j.brainresbull.2024.110883
抗抑郁药(例如选择性5-羟色胺再摄取抑制剂SSRIs)是抑郁症的一线治疗方法。5-羟色胺是选择性5-羟色胺再摄取抑制剂(SSRIs)的靶标,增加了其在大脑中的可用性水平。
肠脑轴与抑郁症之间存在联系,但只有少数人体研究抗抑郁药对肠道菌群的影响。
抗抑郁药对肠道菌群的影响
艾司西酞普兰改变了肠道菌群,Christensenellaceae,Eubacterium ruminantium group,Fusobacterium显著增加,同时乳酸杆菌丰度相应降低,拟杆菌发生了显著变化。
注:艾司西酞普兰是一种用于治疗抑郁症和广泛性焦虑症的药物,通过增加大脑中神经递质5-羟色胺的水平来改善情绪。
Le Bastard等人的文章研究了非典型抗精神病药物治疗对双相情感障碍患者的影响,结果显示Lachnospiraceae的相对丰度增加(p=0.029),Akkermansia和Sutterella的相对丰度降低(p=0.0006)。
在荷兰队列的另一项研究中,B.dorei(p=0.051)和Coprococcus eutactus(p=0.041)与抗抑郁药呈正相关,而Eubacterium hallii与抗抑郁药呈负相关(p=0.055)。
在小鼠模型中存在许多关于SSRIs诱导的肠道改变的研究。常见的选择性5-羟色胺再摄取抑制剂(SSRI)舍曲林,氟西汀和帕罗西汀显示出对革兰氏阳性细菌如葡萄球菌和肠球菌的活性。
产毒肠杆菌随着SSRIs的使用而减少
其他潜在的产毒肠杆菌,如铜绿假单胞菌,肺炎克雷伯菌,柠檬酸杆菌属和摩根氏菌(M. morganii),产气荚膜梭菌和艰难梭菌也在一定程度上随着SSRIs的使用而减少。这些结果是在体外研究的基础上发现的。
服用某些抗抑郁药(如氟西汀)的抑郁成年人更容易发生艰难梭菌感染(CDI)。据报道,在小鼠中,艾司西酞普兰和锂在相似程度上增加了血清素水平。然而,这项研究没有讨论生态失调是根本原因。虽然SSRI对抑郁症的作用机制与这些药物的任何抗菌作用无关,但仍然可以看到微生物群落的潜在变化,并可能影响与情绪相关的其他炎症或生理参数。
抑郁症或重度抑郁症是最常见的神经精神疾病。它是导致残疾、发病率和死亡率的主要原因之一,导致生活质量低下。大约每五个人一生中就被诊断出一次。
抑郁症的基本症状
抑郁症是一种复杂的疾病,具有不同的症状和病理生理学。根据DSM-5,它被诊断出患有持续2周以上的一系列以下症状:持续的抑郁情绪,快感缺失,孤独感,动机降低,食欲和睡眠障碍,精神运动激动,注意力不集中,疲劳,内疚感或无价值感以及自杀念头。
抑郁症的病因
病因或病理生理学通过许多机制来解释,但整体上仍不清楚,可能有以下情况:
1) 血清素,去甲肾上腺素和多巴胺水平低,谷氨酸水平高;
2) HPA轴的改变;
3) 由于免疫介质的不平衡导致错误的免疫细胞通信,特别是微胶质细胞,引起系统性炎症;
4) 最后但同样重要的是与肠道微生物组-脑-肠轴有关的微生物群。
抑郁症的肠道菌群变化
迄今为止,研究发现,在门水平上,拟杆菌,变形杆菌,放线菌,放线菌增加,而抑郁症患者粪便中的厚壁菌减少。
在科的水平上,下列菌群有所增加:
下列菌群有所减少:
在属的层面上,提到了下列菌属减少:
下列菌属增加:
在少数细菌群体中,如Prevotellaceae,Prevotella,Bacteroides enterotype 2,双歧杆菌,Parasutterella,在不同的研究中发现了差异。
抑郁症患者菌群改变与二甲双胍,他汀类药物,
PPIs和NSAIDs使用者菌群改变有关
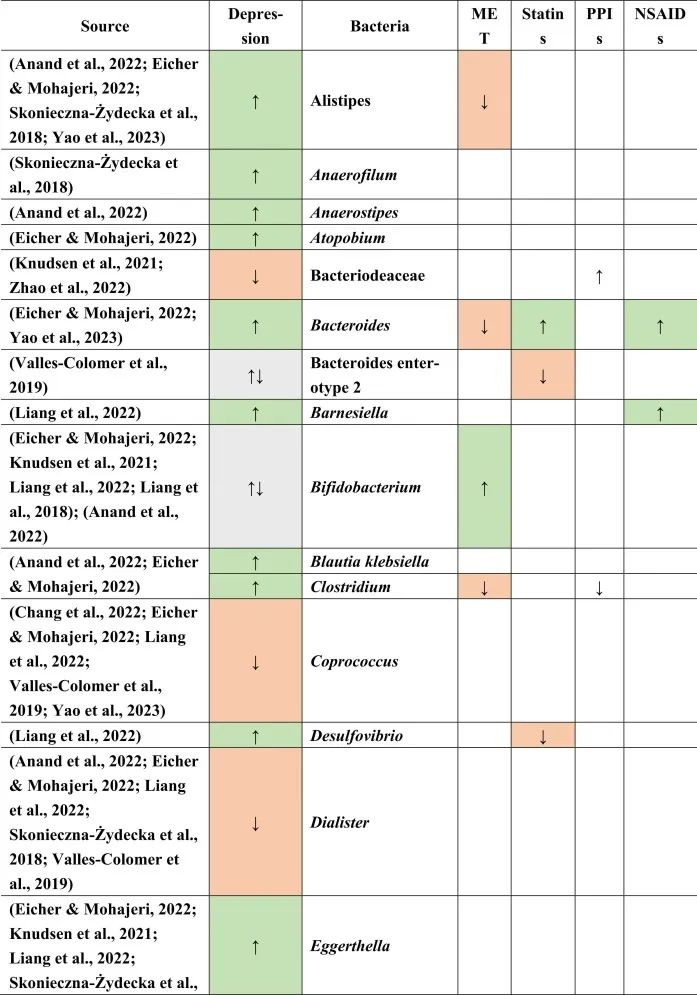
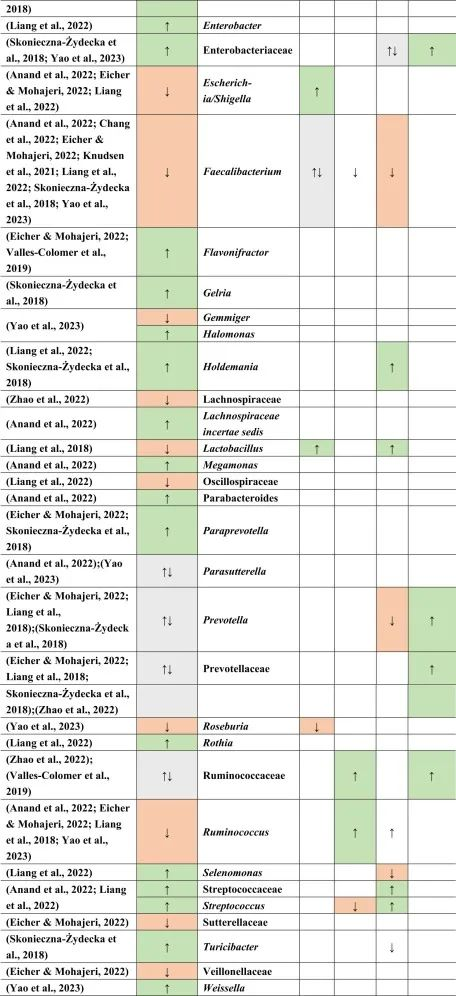
doi.org/10.1016/j.brainresbull.2024.110883
在比较抑郁症患者的肠道菌群与上述药物引起的生态失调时,可以观察到不同细菌分类群水平与一种或多种药物的相似性。
拟杆菌的增加可能对抑郁症有潜在益处
拟杆菌在使用他汀类药物和非甾体抗炎药(NSAIDs)以及抑郁症患者的肠道中都有所增加。拟杆菌是一种产生γ-氨基丁酸(GABA)的革兰氏阴性菌,具有免疫触发LPS和抗炎SCFAs,从而引发免疫反应。
抑郁症与血清素减少相关的系统性和神经炎症都有关联。然而,原本拟杆菌产生的短链脂肪酸和GABA在抑郁症患者体内的含量较低,那么拟杆菌的增加,也增加了GABA和短链脂肪酸,有助于缓解抑郁行为。
他汀类药物和PPIs → 瘤胃球菌↑
瘤胃球菌(Ruminococcus)是一种产短链脂肪酸菌,在他汀类药物和PPI的使用者中增加,再次抵消了短链脂肪酸的低含量。后者也可能是抑郁症患者在口服他汀类药物或PPIs后,粪杆菌属数量低下的原因,粪杆菌是已知的丁酸盐生产者,对肠道屏障稳态和抗炎作用很重要。
他汀类药物 → Bact2↓
特别是他汀类药物可以降低拟杆菌2型(Bact2),这反过来可能导致抑郁症状。
抑郁症可能与他汀类药物和PPI的使用呈负相关,因为抑郁症患者的瘤胃球菌较低,而他汀类药物和PPI使用者的瘤胃球菌较高。
二甲双胍和PPI → 梭菌↓
二甲双胍和PPI中可以降低梭菌丰度,但在抑郁症中没有,因此,二甲双胍和PPI可能有助于减少梭菌。
梭菌的过度生长可能带来的不利结果大于有利结果,例如,艰难梭菌具有毒性和传染性,而梭菌簇XIVa产生短链脂肪酸带来益处。
二甲双胍 → 大肠杆菌↑
血清素可能通过迷走神经影响体液肠-脑通路。大肠杆菌和链球菌与肠杆菌科物种参与血清素合成。在抑郁症患者中,大肠杆菌低丰度,链球菌高丰度,二甲双胍可以缓解低水平的大肠杆菌,因为在使用二甲双胍后大肠杆菌的丰度增加。
他汀类药物抵消PPIs
NSAIDs和PPIs可能分别对肠杆菌科和链球菌产生相同的作用,而他汀类药物可能抵消PPIs的作用,与链球菌数量减少呈正相关。
药物影响与谷氨酸途径的菌群
拟杆菌,乳酸杆菌,双歧杆菌,链球菌也可能参与谷氨酸途径。因此,它们的药物诱导影响可能在单独或通过彼此的相互作用提高谷氨酸能神经传递中发挥作用。
关于谷氨酸详见:兴奋神经递质——谷氨酸与大脑健康
因此,二甲双胍,他汀类药物,PPIs和NSAIDs药物诱导的菌群失调可能各自影响抑郁症的发展和进展,并且它们的作用可能相互抵消或加剧。
扩展阅读:
多发性硬化症是中枢神经系统中最丰富的自身免疫性疾病。全世界有250多万人受到影响,其中大多数是年轻人。它是一种慢性炎症性疾病,其特征是神经纤维脱髓鞘和轴突继发性破坏,表现为白质组织病变。
多发性硬化的症状
症状因受影响的组织区域而异。第一个最常见的症状是视神经炎引起的视觉障碍以及感觉障碍和疲劳。间歇性症状是运动障碍,疼痛,认知,心理和植物障碍,使疾病具有进行性或复发性。
多发性硬化的病因
炎症过程通过自身反应性外周T淋巴细胞侵入中枢神经系统来解释。然而,这种自身免疫反应的出现尚不清楚。脂肪因子和细胞因子水平之间的遗传不平衡,爱泼斯坦-巴尔病毒(EB病毒)感染引起的自身反应性,维生素D缺乏,吸烟以及改变微生物-肠-脑轴的细菌和病毒肠道生态失调,都与多发性硬化的病理生理学有关。
多发性硬化患者与健康对照组微生物群不同
移植了多发性硬化患者粪便物质的GF小鼠复制了自身免疫性脑脊髓炎(一种在动物中发现的脱髓鞘疾病)的表型。这些结果与具有健康对照粪便物质的GF小鼠形成对比。甚至疾病的严重程度和/或活动性似乎也与不同的微生物组成有关。一般来说,抗炎菌群丰度较低。
多发性硬化的微生物群特征
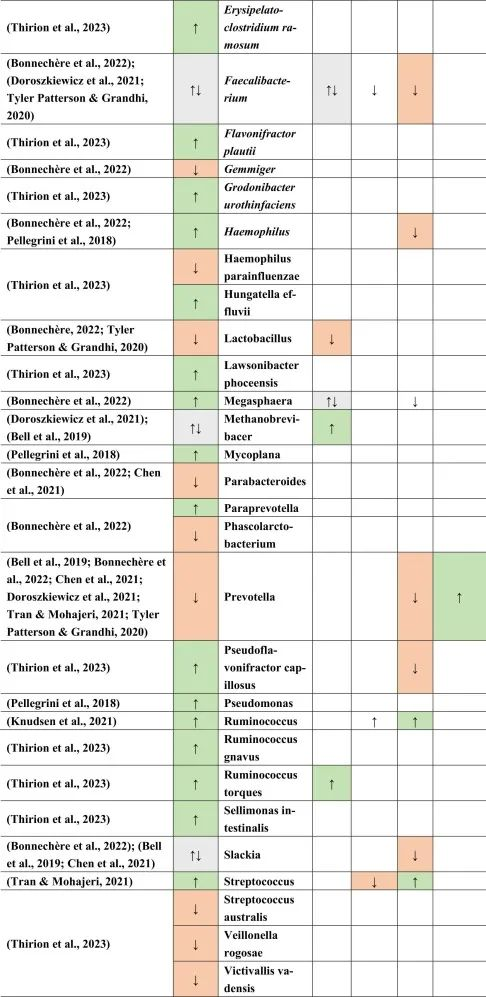
临床活跃的病例(即复发性发作)与临床非活跃的治疗前患者相比,具有更丰富的微生物组。
在比较细菌种类时,临床上不活跃的多发性硬化患者的普拉梭菌(Faecalibacterium prausnitzii)和Gordonibacter urolithinfaciens的丰度显著高于临床活跃的多发性硬化患者。
同一研究发现61种在微生物组成上有差异的物种。多发性硬化中富集的物种如下:
减少的菌群包括:
总体而言,多发性硬化患者的微生物组成丰富度低于健康对照组。这也与多发性硬化相关细菌物种相关的特定炎症生物标志物的丰度更高有关。
其他研究产生了类似的结果,下列菌群增加:
下列菌群减少:
总体而言,拟杆菌门减少,相应的物种也有所减少,例如B.coprocola,B.coprophilus,B.stercoris。
在Faecalibacterium,Slackia,Clostridium,Methanobrevibacter和Butyricimonas中观察到不一致的结果。
在所有引用的有关多发性硬化的文献中,阿克曼菌的增加和普雷沃氏菌的减少一直是菌群持续改变的原因之一。
doi.org/10.1016/j.brainresbull.2024.110883
他汀类药物,NSAID → 拟杆菌↑
与多发性硬化患者相比,他汀类药物和非甾体抗炎药使用者的拟杆菌(一种革兰氏阴性细菌属和SCFA和GABA生产者)增加。
多发性硬化、二甲双胍→Bilophila wadsworthia↑
另一种革兰氏阴性物种Bilophila wadsworthia 在多发性硬化和二甲双胍中增加,但在他汀类药物中减少,这表明二甲双胍可能对多发性硬化患者不利,而他汀类药物对多发性硬化患者有利。革兰氏阴性细菌由于其细胞壁中存在LPS而诱导宿主免疫应答。
多发性硬化、PPI→链球菌↑ 他汀类→ 链球菌↓
链球菌属也是如此,在多发性硬化患者和PPI使用者中发现链球菌数量增加,而在他汀类药物使用者中发现链球菌数量减少。链球菌是一种条件致病菌,可产生神经毒素,乙酸盐和5-羟色胺(5-HT)。
多发性硬化、二甲双胍、PPI → Blautia↑
另一方面,Blautia 在多发性硬化,二甲双胍和PPI中增加。Blautia是丁酸盐生产者,这对于肠道屏障和血脑屏障等完整性以及小胶质细胞成熟和活化很重要。
二甲双胍和PPIs → 梭菌↓
然而,在多发性硬化症患者中,二甲双胍和PPIs使用者的梭状芽孢杆菌数量减少。梭菌产生SCFA,这可能影响Treg细胞,影响多发性硬化患者的自身免疫。
产短链脂肪酸菌Ruminococcus在多发性硬化和他汀类药物和PPI使用后增加。
Prevotella是LPS携带者和GABA生产者和丙酸生产者,NSAIDs增加,多发性硬化和PPIs减少。
双歧杆菌和乳酸杆菌,GABA和乙酸盐生产者在多发性硬化和摄入MET后分别增加和减少,表明这两个属可能影响多发性硬化疾病和进展。
从结果来看,多发性硬化与药物引起的生态失调之间可能存在许多关联。然而,需要更明确的研究结果来证明这些假设的关联。
扩展阅读:
帕金森病(PD)主要症状是运动症状,伴有运动障碍,僵硬,静息性震颤和姿势不稳,由多巴胺缺乏引起,多发生在黑质。路易体聚集体由错误折叠的蛋白质聚集体组成,即淀粉样蛋白,主要是α-突触核蛋白淀粉样蛋白,是多巴胺能神经元破坏的主要原因。
帕金森病的非运动前驱症状及其对疾病进展的影响
帕金森患者在很大程度上受到非运动症状的影响,其中许多症状在运动功能缺失发生前数十年就已出现。胃肠功能障碍,抑郁情绪,睡眠障碍,肌肉和关节疼痛是这些前驱症状中的一些。前者最常见的是便秘或胃排空延迟,流涎,吞咽困难,胃轻瘫和SIBO。患有这些前驱胃肠道疾病的患者帕金森进展更为严重。在ENS神经元中也观察到淀粉样蛋白的形成,特别是在小鼠和帕金森患者的早期。最近的研究表明,大脑中路易体的形成是由小鼠胃肠道中的淀粉样蛋白纤维诱导的,并且通过迷走神经干切断术大大降低了路易体形成的风险。
淀粉样蛋白的交叉形成与肠道微生物的潜在关联
淀粉样蛋白的形成不一定仅限于一种蛋白质。产生淀粉样蛋白的蛋白质可以相互交叉形成淀粉样蛋白。分子过程仍然未知,但可能发生在人类之间以及人类和非人类淀粉样蛋白之间。肠道微生物群中的多个物种能产生包含淀粉样蛋白的生物膜。有人提出,肠道淀粉样蛋白理论上可以通过迷走神经路径传输到大脑,并与α-突触核蛋白交叉促使形成淀粉样蛋白。
大肠杆菌、假单胞菌、链球菌、葡萄球菌、沙门氏菌、分枝杆菌、克雷伯菌、柠檬酸杆菌和芽孢杆菌是肠道中产生这种胞外淀粉样蛋白的候选细菌。Nuzum等人还指出产短链脂肪酸菌的总体丰度较低。因此,肠道微生物群可能既能启动也能调节帕金森病的发起。
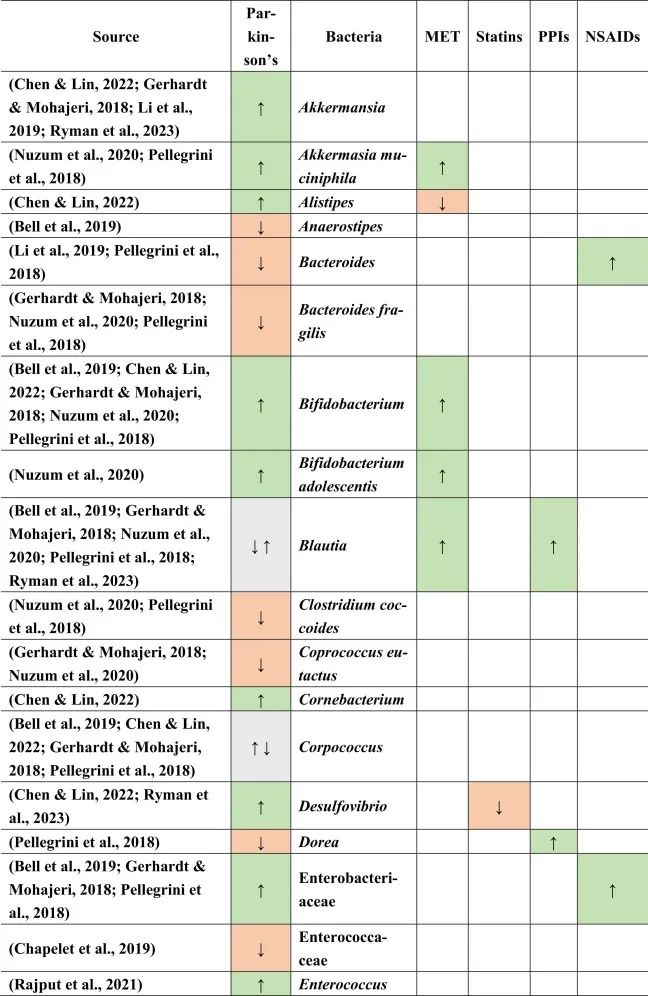
帕金森患者的肠道菌群特征
当比较帕金森患者与健康对照组的微生物组成时,在帕金森患者中主要是下列菌群增多:
下列菌群减少:
乳杆菌科不一致,显示出较高和较低的丰度。
doi.org/10.1016/j.brainresbull.2024.110883
在比较帕金森的生态失调和药物引起的生态失调时,假设如下:PPI诱导小肠细菌过度生长,并增加沙门氏菌感染的风险。两者都可能影响帕金森,因为小肠细菌过度生长也在帕金森病患者中发现,沙门氏菌是细胞外淀粉样蛋白的产生者。然而,在PPI和帕金森中没有观察到沙门氏菌作为一个共同因素。
与多发性硬化类似,瘤胃球菌科在帕金森,他汀类药物和NSAIDs中增加。然而,已知短链脂肪酸可以增强BBB的完整性,因此可以降低炎症因子通过大脑从而形成细胞外淀粉样蛋白的风险。
帕金森,他汀类药物,PPI → 粪杆菌↓
另一方面,粪杆菌(Faecalibacterium)是一种已知的丁酸盐生产者,对肠道和BBB完整性以及抗炎菌群具有重要意义,在帕金森,他汀类药物和PPI中减少,这表明粪便杆菌可能是帕金森病患者屏障减弱和炎症过程加剧的原因之一。
二甲双胍和PPIs可能有助于逆转粪杆菌的不利影响
因为二甲双胍和PPIs增加了Blautia的存在,而帕金森患者则减少了Blautia。同样,由于他汀类药物和非甾体抗炎药,瘤胃球菌科的丰度增加,也可以补偿粪杆菌和其他不利菌的影响。这也表明,没有一种药物会产生所有负面或正面影响,例如,PPI会增加Blautia(一种有利的短链脂肪酸生产菌)并同时增加小肠细菌过度生长,这是人体的负面过程。
菌群之间的相互作用力量不可忽视
总体而言,与本文提到的其他药物相比,二甲双胍对微生物组产生的影响与帕金森病中所见的影响最相似。在帕金森患者和二甲双胍使用者中均观察到Akk菌(短链脂肪酸生产者和LPS携带者),青春双歧杆菌(GABA生产者)和大肠埃希氏菌(LPS携带者,5-HT-metabolsier)的丰度增加,其中第一种和后一种细菌是革兰氏阴性,其细胞壁中存在LPS,但也分别产生短链脂肪酸和5-HT。
同样,它们都传达了有利和不利的影响,这表明没有一种细菌是某种疾病发病机制的主要决定因素。菌群之间的相互作用和相对丰度似乎对疾病发作和进展的总体影响很重要。
阿尔茨海默病(AD)是老年痴呆症最常见的形式,约占全球痴呆症病例的50-70%。由于其患病率随着年龄的增长而增加,并且世界人口正在老龄化,阿尔茨海默的发病率在未来几年将更高。在大多数情况下,它始于新形成的记忆的丧失,神经认知和执行功能(如语言和视觉空间取向)进一步下降。
阿尔茨海默病的病理生理学
病理生理学是多方面的,导致不可逆的神经元细胞和突触丢失。除年龄外,阿尔茨海默的其他标志是不溶性淀粉样β斑块的积累,其次是Tau蛋白的神经原纤维缠结,神经递质的失衡和神经炎症。随着年龄的增长,肠道微生物组会发生实质性变化,因此,有人认为与年龄相关的肠道菌群失调也可能导致阿尔茨海默的发病。
扩展阅读:
老年人肠道菌群失衡与阿尔茨海默病发病
在老年人中,随着促炎细菌与抗炎细菌比例的增加以及产短链脂肪酸菌的减少,导致肠漏,BBB紊乱和小胶质细胞活化。后者在清除Aβ斑块方面很重要,当其清除能力因Abeta的过度产生或由于炎症性结构变化导致的能力丧失而受阻时,淀粉样斑块可能会在阿尔茨海默病患者的大脑中积累。
淀粉样蛋白的细菌来源与神经炎症加剧
据推测,淀粉样蛋白也被推测可能来自细菌源,类似于帕金森,要么在大脑中与其他淀粉样结构交叉播种,要么由于肠漏引起的系统性炎症而加剧神经炎症。此外,据报道,通过显著阳性的SIBO呼吸试验(p=0.025)报告细菌移位。阿尔茨海默患者的细菌移位和LPS水平升高都会加剧神经炎症。
主要发现表明促炎细菌埃希氏菌/志贺氏菌水平升高,抗炎直肠真杆菌水平降低。它们失衡可能是认知障碍和淀粉样蛋白合成的主要原因之一,因为在促炎细胞因子和抗炎细胞因子之间发现了各自的相关性,而且大肠杆菌也属于产生淀粉样蛋白的细菌。
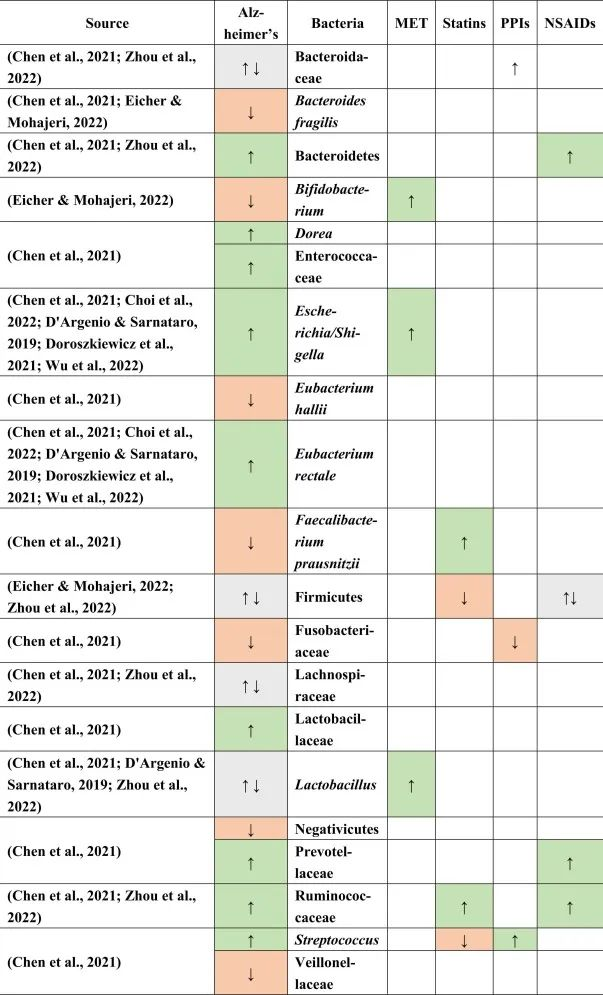
阿尔茨海默患者的肠道菌群特征
据报道,阿尔茨海默患者中下列菌群增加:
下列菌群减少:
在厚壁菌门,乳酸杆菌,Lachnospiraceaea和拟杆菌科中发现了不一致的结果。
doi.org/10.1016/j.brainresbull.2024.110883
他汀类药物 → 普拉梭菌↑ → 抗炎
在上述药物和阿尔茨海默病患者中,他汀类药物的使用与改变的微生物群的关联最强。特别是,产丁酸菌普拉梭菌在他汀类药物使用者中增加,这可能有助于维持血脑屏障,因为丁酸盐在抗炎过程和小胶质细胞活化和成熟中起主要作用。
他汀类药物联合PPI → 抵消链球菌富集
他汀类药物与PPI一起使用,可能有助于抵消由于PPI使用而导致的链球菌富集,因为链球菌被认为会产生细胞外淀粉样蛋白。
瘤胃菌科是一种短链脂肪酸生产者,在他汀类药物以及NSAID使用者和阿尔茨海默患者中升高,可能具有与帕金森病相同的补偿作用,因为在阿尔茨海默患者中观察到短链脂肪酸丰度较低。
与帕金森一样,在阿尔茨海默患者中观察到阳性小肠细菌过度生长结果,PPI可能是其主要贡献者,无论是否口服NSAIDs。
扩展阅读:
有力的证据表明药物使用与肠脑轴之间、肠脑轴与神经系统疾病之间分别存在联系。由于药物和神经系统疾病,菌群失调环境中存在共同的细菌菌株。少数药物可以在特定疾病情况下缓解菌群失调,但也可能引起菌群失调。菌群彼此之间及其相互作用将影响肠脑轴,药物在共病患者中通经常联合使用。因此,它们的效果可能相互抵消或加剧细菌种群的相应变化,并与神经系统疾病中的菌群失调呈正面或负面关联。
由于肠道微生物群会因食物、环境、生活方式等各种因素而发生变化,因此在这类研究中也应考虑伴有共病的老年人。当老年人同时服用多种药物且因食欲不振而饮食不佳时,可能会预期其肠道微生物群发生不同的变化。然而,药物引起菌群失调及其通过肠脑轴对神经系统疾病影响的相关性仍是一个新领域。
本文中有些数据也是有限的,没有考虑原发病情况、其他药物的合并使用、药物剂量、药物暴露和服药时间、年龄、性别、患者饮食、共病等混杂因素,缺乏大队列数据支持,目前还没有足够的数据来得出建议性的结论。因此,还需要更多的工作来克服现有的局限性并提供更加坚实的证据基础,包括设计大型的、多中心的、随机对照试验,以收集高质量的数据来验证这些初步发现。
主要参考文献
Garg K, Mohajeri MH. Potential effects of the most prescribed drugs on the microbiota-gut-brain-axis: A review. Brain Res Bull. 2024 Jan 18;207:110883.
Garg K, Mohajeri MH. Potential effects of the most prescribed drugs on the microbiota-gut-brain-axis: A review. Brain Res Bull. 2024 Jan 18;207:110883.
Deng X, Zhang C, Wang P, et al., Cardiovascular Benefits of Empagliflozin Are Associated With Gut Microbiota and Plasma Metabolites in Type 2 Diabetes. J Clin Endocrinol Metab. 2022 Jun 16;107(7):1888-1896.
Epishina IV, Budanova EV. Rol’ mikrobioty cheloveka v razvitii neirodegenerativnykh zabolevanii [A role of human microbiota in the development of neurodegenerative diseases]. Zh Nevrol Psikhiatr Im S S Korsakova. 2022;122(10):57-65.
He D, Han H, Fu X, Liu A, Zhan Y, Qiu H, Ma L, Zhang X, Wang X. Metformin Reduces Blood Glucose in Treatment-Naive Type 2 Diabetes by Altering the Gut Microbiome. Can J Diabetes. 2022 Mar;46(2):150-156.
Knudsen JK, Bundgaard-Nielsen C, Hjerrild S, Nielsen RE, Leutscher P, Sørensen S. Gut microbiota variations in patients diagnosed with major depressive disorder-A systematic review. Brain Behav. 2021 Jul;11(7):e02177.

谷禾健康

为什么一种药物对一位患者反应良好,但对另一位患者反应不佳,甚至在某些情况下会导致严重的药物不良反应?
研究表明,一些药物的反应率在50%-75%,也就是说很多人服用药物后其实没有得到实际的改善,这并不代表该药物没用,可能只是对一些人效果不大,这是什么原因导致的呢?
这其实与药物反应个体差异(简称IVDR)相关。这种差异归因于多种因素,包括遗传、年龄、性别、生活方式、疾病状态、周围环境、肠道微生物群和药物相互作用等。
在精准医学正在加速来临的时代,根据个人的遗传、环境和生活方式因素制定量身定制的医疗干预措施成为可能,然而,药物反应的个体差异是实施精准医疗的主要障碍。因此,需要更好地了解药物反应的个体差异,以提高药物疗效或预防不良反应。
研究表明,在肠道中,药物和微生物群之间存在复杂的相互作用:
▸ 一方面,药物可以导致肠道微生物群的组成和功能的改变,导致微生物代谢和免疫反应的变化。
例如,二甲双胍可以减少肠道中的脆弱拟杆菌,降低该菌的胆盐水解酶活性,使GUDCA水平升高,以不依赖于肠道AMPK的方式,抑制肠道FXR信号,发挥改善代谢的作用。
▸ 另一方面,肠道微生物群可能改变药物,包括产生催化或降解药物分子的酶、改变药物在宿主体内的代谢水平以及与药物分子竞争代谢酶等方式,直接或间接地改变药物的吸收、分布、代谢和排泄,从而影响药物疗效。
例如,同样使用华法林的心血管疾病患者,有些人对该药物反应较低,这部分患者的肠道中拟杆菌、志贺氏菌、克雷伯氏菌较多,华法林是一种抗凝血药物,通过抑制维生素K的活性来减少血液凝块的形成。志贺氏菌有助于产生维生素K。因此,如果肠道中的志贺氏菌数量较多,它们可能会提供足够的维生素K,从而减少华法林的抗凝血效果。
本文我们来了解一下,常用药物和肠道微生物组之间复杂的双向相互作用,通过人体各个系统中的不同例子来阐述具体的机制。对这方面的逐步了解,有助于改善药物的效果,同时最大程度地减少不良反应,也有助于推动精准医疗的发展。
药物反应的个体差异(IVDR)是指不同个体在使用相同药物时表现出的不同反应情况。这种差异可以涉及药物的吸收、分布、代谢、排泄等方面。
了解个体差异可以帮助医生更好地调整药物剂量和选择合适的药物,以最大程度地提高治疗效果并减少不良反应的发生。
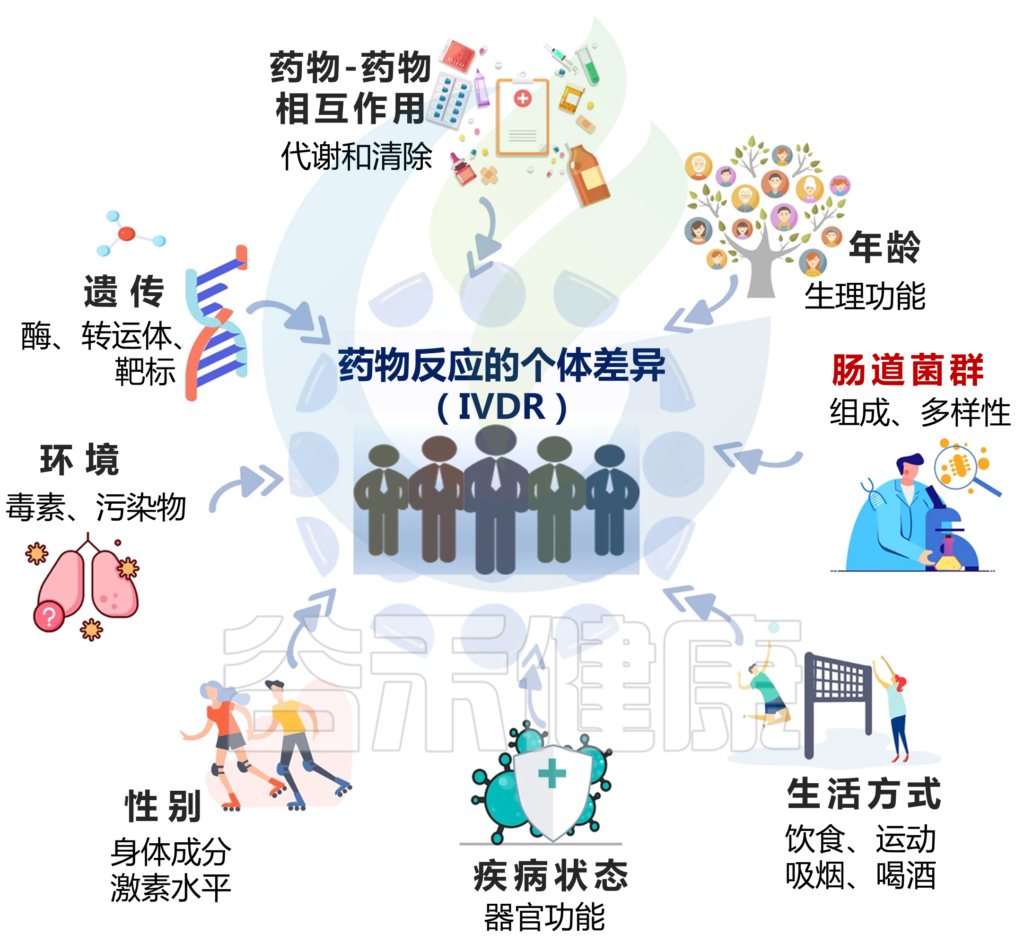
Zhao Q, et al., Signal Transduct Target Ther. 2023
IVDR是多种因素共同作用的结果,包括:
1)遗传学
编码药物代谢酶、转运蛋白和靶标的单个基因的变异会影响其代谢和对药物的反应,导致IVDR。
2)年龄
由于生理功能的差异,如肝肾功能、身体成分和激素水平的变化,年轻和老年患者可能会经历不同的药物反应。例如,老年患者可能肾功能和肝代谢降低,导致PK改变。
3)性别
男性和女性之间的生物差异会影响药物反应。由于身体成分和激素水平的差异,女性可能有更高的药物浓度,这将影响药物代谢和清除。
4)生活方式
饮食、运动、吸烟等因素,酒精摄入可以通过改变药物代谢和从体内清除的方式来影响药物反应。
5)疾病状态
患有某些疾病或病症的患者可能会因器官功能变化、药物代谢改变或药物受体表达改变而经历IVDR。例如,肝病患者的药物代谢可能会降低,肾病患者的药物清除率可能会降低。
6)药物-药物相互作用
同时使用多种药物可能会导致药物-药物的相互作用,从而改变药物的吸收、分布、代谢、排泄。
7)环境因素
暴露于环境毒素和污染物会影响药物代谢和清除,可能导致IVDR.
8)肠道微生物群
肠道微生物群也可能影响药物药代动力学(PK)和药效学(PD),个体之间肠道微生物群组成的变化会导致IVDR。
肠道微生物群与药物治疗之间的关联
doi: 10.1038/s41575-021-00499-1
总体而言,了解这些因素对于优化药物治疗和将药物不良反应风险降至最低至关重要。
药物遗传学专注于识别影响药物代谢、转运、药效学 (PD) 等的遗传变异。
药物基因组学是一个更广泛的领域,考虑整个基因组及其对药物反应的影响。
尽管药物遗传学和药物基因组学取得了进展,人类基因组贡献的变异性可能在20%-95%,因此,仅遗传因素不足以解释药物反应的个体差异,其他因素,例如肠道微生物群也很重要。
肠道微生物群可以通过直接转化药物或调节宿主的代谢或免疫系统,来改变药物的药效学和药代动力学。
药物微生物组学一词,用来描述肠道微生物群和药物反应之间的相互作用,这些相互作用可以改变药效学(即药物吸收、分布、代谢、排泄及其血浆药物浓度动态的变化)或药代动力学(即药物靶点或生物途径的变化,导致生物体对药物作用的不同易感性)。
接下来,我们就从人体八大系统的具体疾病中来一一了解,微生物群与药物之间的相互作用。了解这种相互作用有助于开发针对微生物群的方法,以提高药物疗效并减少不良反应。
现代医疗体系下的药物种类很多,我们按照以下几大类来介绍常见的药物:心血管系统、内分泌系统、消化系统、神经系统、运动系统、泌尿生殖系统、呼吸系统、癌症。
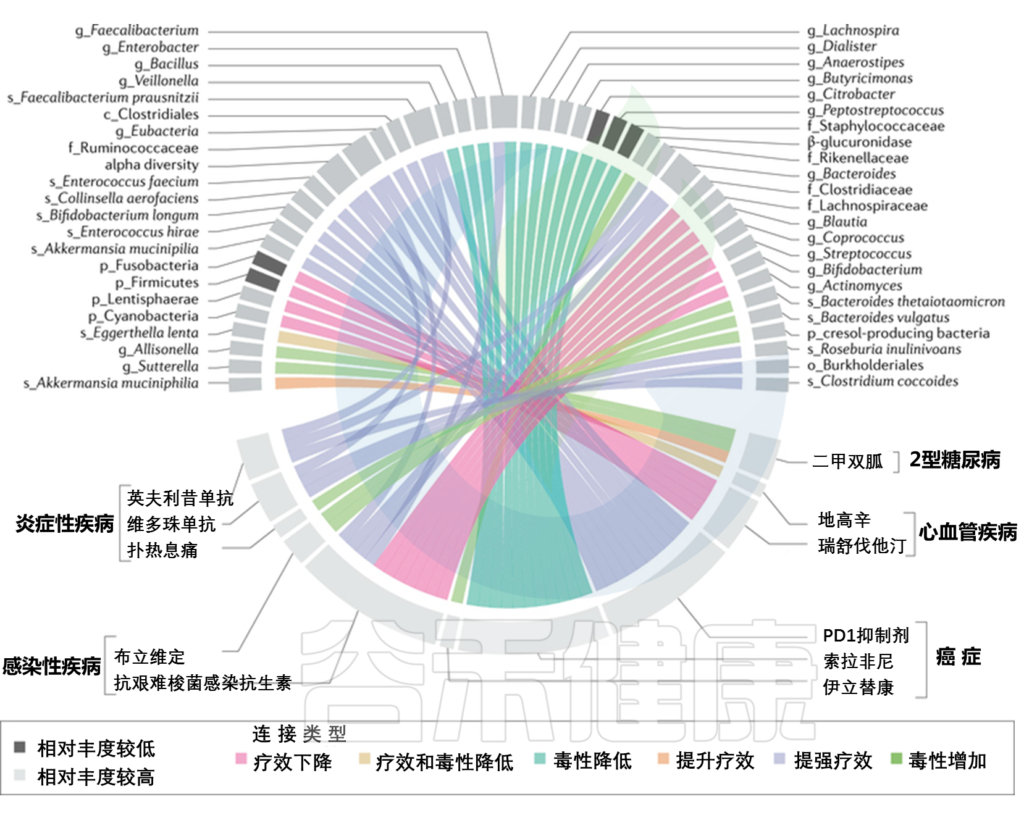
Zhao Q, et al., Signal Transduct Target Ther. 2023
华 法 林
华法林:防治血栓,但治疗窗口有限
华法林是一种维生素K拮抗剂,用于预防和治疗血栓形成和栓塞的疾病,然而,其治疗窗口有限,IVDR明显,促使许多研究确定影响治疗结果的遗传因素。
对华法林低反应者,志贺氏菌等菌群较多
已知肠道微生物群和维生素K代谢之间有联系。一项研究首次建立了肠道微生物群和IVDR与华法林之间的联系。针对200名对华法林有不同程度反应的患者的试验表明,拟杆菌、志贺氏菌、克雷伯氏菌在低反应者中表现突出。
华法林是通过抑制维生素K的作用,来防止血液凝结,维生素K参与合成凝血因子,在血液凝固过程中起着重要的角色,而志贺氏菌具有产生维生素K所必需的酶,可能出现一边抑制一边合成的情况,这可能是患者对华法林反应较弱的原因。相比之下,肠球菌与对华法林的反应增加有关。
▸
还需要更多的研究来证实和完善结果。
他汀类药物
他汀类药物:降胆固醇、抗炎、抗血栓
他汀类药物通常用于降低“坏”胆固醇,治疗心血管疾病。通过抑制HMG-CoA,减少肝脏中胆固醇的从头合成。
注:“坏”胆固醇,是指低密度脂蛋白胆固醇,简称LDL-C。
HMG-CoA,3-羟基-3-甲基戊二酰辅酶A,是一种参与胆固醇和同化代谢的重要酶。
近几十年的研究表明,他汀类药物具有许多多效性作用,包括抗炎、抗血栓形成和抗氧化,这可能与其心血管保护特性有关。他汀类药物可抑制Rho激酶和Rac1蛋白的功能,这两种蛋白与动脉粥样硬化的进展有关,动脉粥样硬化是心血管疾病的主要危险因素。他汀类药物还激活PPAR-γ.
注:PPAR-γ,过氧化物酶体增殖物激活受体γ,这是一种有助于调节炎症、脂肪代谢和糖代谢的核受体。
他汀类药物可以改变肠道微生物群的结构
一项研究发现,他汀类药物治疗显著增加了某些抗炎相关菌(如拟杆菌、Butyricimonas、 Mucispirillum),这可能有助于改善高血糖。
另一项研究表明,他汀类药可能通过PXR(孕酮X受体)介导的机制改变胆汁酸的复杂性,从而导致肠道失调,带来不良影响。
他汀类药物→改变胆汁酸→菌群失调
胆汁酸是在肝脏中从胆固醇合成的,对膳食脂肪的消化和吸收至关重要。他汀类药物通过直接抑制新生胆固醇的合成,可以抑制肝脏中的胆汁酸合成,从而改变人体肠道中的胆汁酸。肠道中胆汁酸的数量和结构的改变,可能通过改变肠道菌群直接或间接诱导出复杂而显著的生理反应。
▸
要更多的研究了解他汀类药物治疗对肠道微生物组的长期影响,以及这些变化是否始终对心血管疾病有益。此外,评估他汀类药物治疗和IVDR的可能风险和益处至关重要。
地高辛
地高辛:提高心脏泵送效率,但对10%患者无效
地高辛,是一种可以提高受损或虚弱心脏泵送效率的药物,从而提高临床稳定性和运动能力。然而,在低流量充血性心力衰竭中,由于特定菌株的失活,地高辛可能对10%的患者无效,这突出了IVDR对人类和微生物群的重要性。地高辛的失活是通过Eggerthella lenta将地高辛转化为失活状态二氢地高辛介导的。
E. lenta:可能成为地高辛失活的微生物标志物
在另一项开创性研究中,发现一个编码E. lenta细胞色素、心脏甙还原酶(cgr)的操纵子,被鉴定为地高辛转录激活,表明这可能是地高辛失活的可预测的微生物组生物标志物。
精氨酸增加→调节E.lenta→抑制地高辛失活
研究人员还探索了内源性地高辛相关物质可能被选择失活的可能性,并确定了合理的饮食干预是否可以调节体内地高辛的灭活。如前所述,E.lenta的增殖与精氨酸有关,精氨酸不仅能改善增殖,还能防止地高辛失活。因此,无论是饮食还是微生物群产生的精氨酸浓度的增加,都可能抑制这种不需要的微生物群功能。
饮食中增加蛋白质→提高地高辛水平
为了验证这一假设,研究人员使用两种不同饮食的小鼠进行了一项体内实验:一种不含任何蛋白质,另一种含有蛋白质总热量摄入的20%。结果表明,蛋白质摄入的增加显著提高了血液和尿液中的地高辛水平,但仅在携带地高辛减少菌株的小鼠中。
▸
总之,这些发现对受益于地高辛治疗的心力衰竭患者,具有重要的临床应用价值。此外,鉴定药物失活的预测性微生物群标志物,可能有助于制定个体微生物群落为基础的个性化治疗指南。
血管紧张素转换酶抑制剂(ACE-Is)
一代ACE-Is药:卡托普利,降压
卡托普利是第一代ACE-Is药物,通过抑制中枢和外周部位的肾素-血管紧张素系统(RAS)用于治疗高血压。除了其抗高血压作用外,卡托普利也会影响肠道微生物群的组成。研究表明,卡托普利在停药后保持其抗高血压活性。
一项用卡托普利治疗大鼠的实验中,下列菌群丰度增加:
此外,卡托普利可减少自身区域的神经元炎症,并减少交感神经驱动,它平衡了肠道微生物群。
最近的研究结果还表明,接受卡托普利治疗的母亲通过重建肠道微生物群、改善肠道病理和通透性以及恢复雄性后代失调的肠脑轴,具有持续的降压作用。
卡托普利治疗的怀孕大鼠中,梭菌属和梭菌目的存在率较高
与没有治疗的怀孕大鼠相比,用卡托普利治疗的怀孕大鼠在肠道微生物群中下列梭菌目平均丰度更高,例如:
因此,卡托普利可能会影响人类肠道微生物群的生长和组成,从而改变药物的有效性。
二代ACE-Is药:贝那普利和依那普利,治疗心血管疾病
贝那普利和依那普利是第二代血管紧张素转换酶抑制剂,主要用于治疗心血管疾病,如动脉高血压、充血性心力衰竭。这些药物通过抑制ACE的活性发挥作用,导致血管紧张素II生成减少。
注:ACE,血管紧张素转化酶,参与调节血管张力、血压以及体液平衡等生理过程。
血管紧张素Ⅱ,是一种使血管变窄并升高压力的激素。
最近研究表明,贝那普利和依那普利都有能力对肠道微生物群产生积极影响。
贝那普利治疗:促进肠道微生物群结构的恢复
贝那普利主要在肝脏中代谢,并转化为二酸贝那普利的形式,这会影响肠道微生物群。
依那普利治疗:改变肠道菌群,降低TMAO
依那普利可以降低血液中TMAO的水平。高浓度的TMAO与心血管疾病的高发病率有关。依那普利通过改变肠道微生物群的组成和控制尿液中甲胺的排泄,来影响血浆TMAO水平。
注:TMAO,三甲胺N-氧化物,一种由肠道微生物群代谢某些营养物质产生的化合物
心血管系统:药物-微生物相互作用

Zhao Q, et al., Signal Transduct Target Ther. 2023
▸
这些发现表明,ACE-Is可能在改善肠道微生物群组成和心血管健康方面有效。通过促进肠道微生物群结构的恢复和降低TMAO水平,贝那普利和依那普利可能有助于降低心血管疾病的风险。
其他降血压药物:药物-微生物相互作用
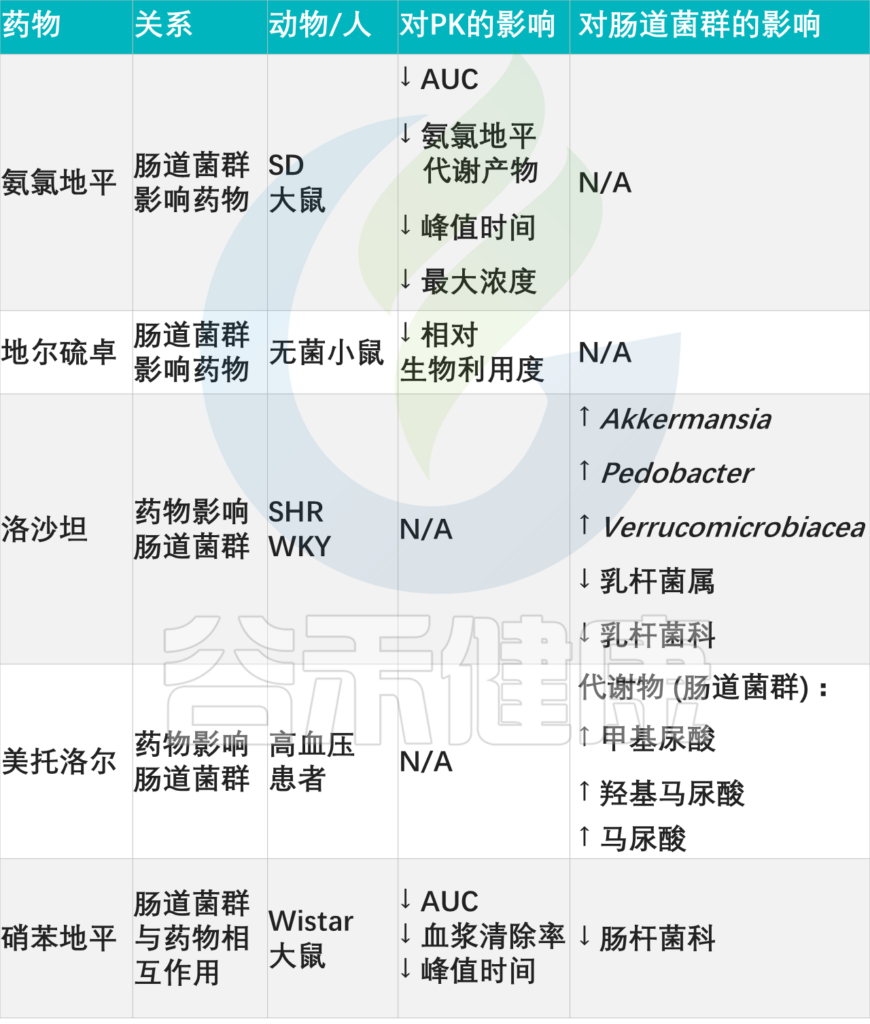
doi: 10.3389/fmed.2021.742394
内分泌系统是一个复杂的腺体系统,产生激素,负责调节各种身体功能,目前的证据表明,微生物群在内分泌系统的调节中发挥着重要作用,并可影响内分泌疾病的IVDR。
下面列出抗糖尿病药物和肠道微生物群之间相互作用的几个案例。
二甲双胍
二甲双胍是一种常见的抗糖尿病药物,也可以减少肥胖、降低心血管疾病和癌症的发病率等。
研究逐步发现,肠道微生物群调节葡萄糖代谢和能量平衡的机制,特别是可能参与IVDR的机制。
肠道菌群如何影响二甲双胍的抗高血糖作用
将未经治疗的2型糖尿病患者的粪便,移植到无菌小鼠身上,与对照小鼠相比,葡萄糖耐量显著改善。确定A.muciniphila及其金属结合蛋白的表达,是二甲双胍-微生物群相互作用的关键因素。
另一项研究表明,二甲双胍的抗高血糖作用涉及一种新的机制——脆弱拟杆菌-GUDCA-FXR轴。该途径依赖于肠道微生物群,并涉及肠道FXR信号的激活,以改善代谢功能障碍。发现二甲双胍可减少脆弱拟杆菌,防止GUDCA降解。
注:GUDCA,甘氨熊脱氧胆酸,一种FXR的拮抗剂
二甲双胍→抗炎→对心血管疾病的保护作用
包括激活AMPK途径和抑制NF-κB途径。越来越多的证据表明,微生物群介导的途径可能与二甲双胍的治疗作用有关。例如,二甲双胍治疗引起的肠道微生物群结构变化可能导致葡萄糖、激素、胆汁酸、短链脂肪酸和免疫的改变。
二甲双胍→调节肠道菌群→改善认知功能
二甲双胍不仅具有抗炎和抗氧化作用,还与神经保护有关,有研究表明二甲双胍的使用与2型糖尿病患者患痴呆症的风险降低有关,轻度认知障碍得到改善。这其中部分有益作用通过肠道微生物群的组成和功能来调节,从而增加短链脂肪酸和胆汁酸的产生。
二甲双胍对肠道菌群的影响

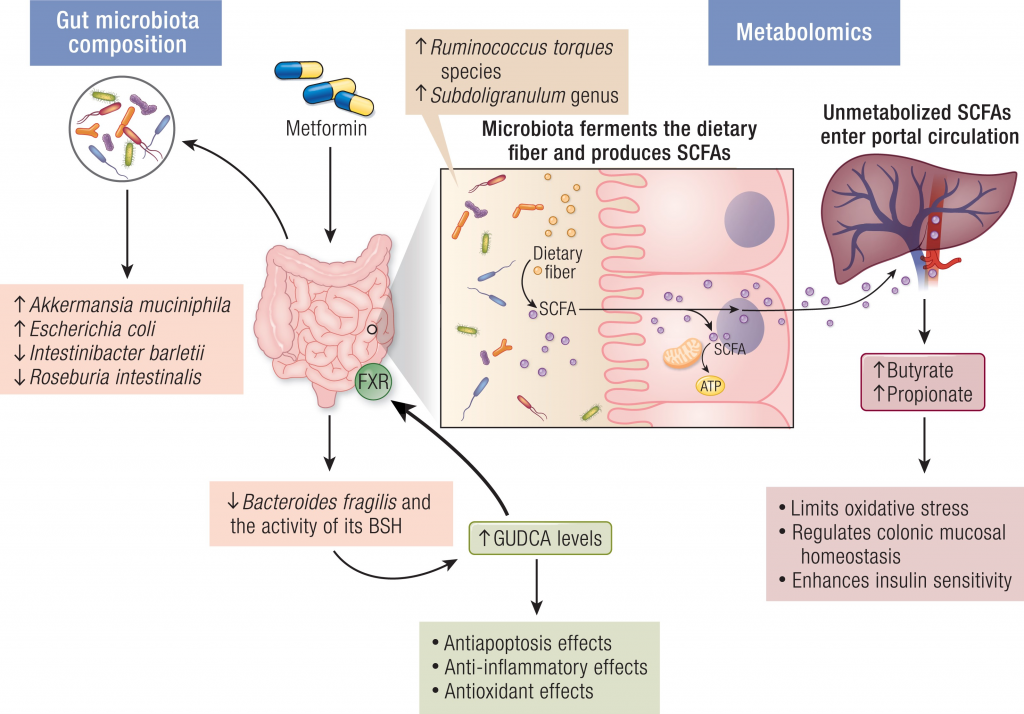
doi.org/10.1210/endrev/bnad029
▸
总的来说,新出现的证据表明,微生物群介导的肠道微生物群结构变化机制,可能是其多效性作用的原因。这对开发针对肠道微生物群及其与IVDR相互作用的新疗法具有重要意义。
α-葡萄糖苷酶抑制剂(AGI)
AGI是一类改变小肠中碳水化合物吸收和代谢的药物。这些药物会显著影响肠道微生物群的结构和变异性,这可能对管理代谢疾病(如2型糖尿病)有重要意义。阿卡波糖和米格列醇是两种常用的AGI。
阿卡波糖:产短链脂肪酸菌,乳杆菌 ↑↑
拟杆菌科、肠杆菌科、部分梭菌属 ↓↓
在体外,实验表明,阿卡波糖通过抑制麦芽糖导入物选择性地抑制大肠杆菌的生长,而临床试验表明,阿卡波糖增强了产短链脂肪酸菌的丰度,例如普雷沃氏菌属、乳杆菌属、粪杆菌属(Faecalibacterium)。短链脂肪酸对代谢健康有益,用乳杆菌治疗可以降低血糖。
此外,一项研究表明,在肠道微生物群中发现的Dialister在阿卡波糖治疗后增强,并与HbA1c呈负相关,这表明它可能在控制葡萄糖代谢中发挥作用。阿卡波糖也被证明可以增加双歧杆菌和乳杆菌,并减少高脂血症或2型糖尿病患者粪便中有害的拟杆菌科、肠杆菌科和卵磷脂酶阳性梭菌。
注:HbA1c在医学中指糖化血红蛋白,以反映最近两到三个月内的平均血糖水平
米格列醇:抗炎,逆转高能量饮食引起的菌群变化
米格列醇在小鼠中具有抗炎特性,可以抑制炎症反应的组织学和分子指标,并减少高脂肪高糖饮食产生的肠道转运时间。摄入高能量饮食会增加Erysipelotrichaceae和Coriobacteriaceae,但米格列醇可以逆转这种作用。据推测,肠道炎症的减少与肠道微生物群的这些变化有关。
▸
总的来说,AGI特别是阿卡波糖,可能有助于重建2型糖尿病患者的肠道微生物群平衡。通过增加产短链脂肪酸菌和减少潜在的有害菌,这些药物可能会对代谢健康产生积极影响。需要更多的研究来充分阐明其影响。
胰高血糖素样肽-1受体激动剂
GLP-1(胰高血糖素样肽-1)是肠内分泌细胞通过饮食产生的一种肠内激素,GLP-1在增强葡萄糖诱导的胰岛素分泌、抑制胰高血糖素分泌、抑制食欲和胃排空方面的作用,使其成为治疗糖尿病和超重的有力靶点。
最近的研究强调了肠道微生物群通过诱导GLP-1分泌来调节饱腹感和葡萄糖稳态的功能,GLP-1受体激动剂(如利拉鲁肽)作为一类新兴的抗糖尿病药物,已被证明可以调节肠道微环境,并改变肠道微生物群组成。
利拉鲁肽:改变厚壁菌门/拟杆菌门比例,有争议
通常,厚壁菌门与拟杆菌门的比例是肠道微生物群结构的重要指标。这在我们之前的一篇文章有讲述这方面内容,详见:
研究表明,利拉鲁肽可以使正常体重的糖尿病小鼠的肠道菌群比例向瘦体比例转变,从而使厚壁菌门与拟杆菌门的比例更高。
有趣的是,另一项研究表明,利拉鲁肽降低了厚壁菌门与拟杆菌门的比例,以降低单纯超重和糖尿病超重个体的体重,而与血糖状况无关。
这种差异可能归因于不同水平的高血糖和使用的不同模型系统。
GLP1受体激动剂已被证明可极大改变糖尿病雄性大鼠的肠道微生物群结构。这些变化包括选择性增强几种产短链脂肪酸菌,如拟杆菌、毛螺菌科和双歧杆菌。此外,GLP1受体激动剂可至少部分重建肠道微生物群的稳态。
二肽基肽酶-4抑制剂(DPP4Is)
DPP4Is(例如西格列汀和维达格利汀)是用于2型糖尿病的一线抗2型糖尿病药物。DPP4Is主要通过抑制GLP-1降解来降低血糖。先前的研究表明,肠道微生物群与DPP-4相关功能可能是DPP4Is的目标,可能为DPP4Is调节肠道微生物群不一致性开辟新的治疗应用。
研究表明,DPP4Is可以通过增加拟杆菌门来改善血糖控制,从而大大恢复高脂饮食诱导的肠道微生物群改变。
西格列汀:产短链脂肪酸菌↑↑适度恢复菌群失调
西格列汀对肠道微生物群影响的研究表明,拟杆菌门减少,厚壁菌门和软壁菌门(Tenericutes)增加。然而,西格列汀适度恢复了2型糖尿病大鼠的微生物群失衡,并改变了产短链脂肪酸菌的丰度。
维达利汀:乳杆菌↑↑ Oscillibacter↓↓
类似地,维达利汀给药与糖尿病大鼠的拟杆菌门增加和厚壁菌门减少,厚壁菌与拟杆菌门比例降低有关。此外,维达利汀通过调节肠道微生物群产生益处,导致乳杆菌增加和Oscillibacter减少。为了阐明变异机制,研究人员通过实验证实,维达利汀抑制盲肠内容物中的TLR配体,并恢复抗菌肽水平和回肠隐窝深度。研究还表明,DPP4Is可能通过对肠道微生物群的影响,间接减少肝脏中促炎细胞因子的分泌。
▸
总的来说,这些研究强调了DPP4Is对肠道微生物群的重要性,并揭示了改善葡萄糖稳态和IVDR的有希望的策略。
内分泌系统:药物-微生物相互作用

Zhao Q, et al., Signal Transduct Target Ther. 2023
消化系统是药物微生物组学最广泛的领域之一,对药物代谢和疗效至关重要。肠道微生物群会影响用于治疗各种消化系统疾病的药物的结果,例如,炎症性肠病(IBD)和肠易激综合征(IBS)。IBD患者的肠道微生物群组成和功能发生了改变,这可能会影响IVDR。
柳氮磺吡啶(SAS)
SAS是一种最初开发的药物,旨在治疗细菌感染引起的炎症。后来发现它在治疗溃疡性结肠炎方面有效。该药物由氨基水杨酸盐和磺胺吡啶组成,它们通过偶氮键连接在一起。SAS的一个独特特性是它不会在上游胃肠道中快速吸收。相反,它被结肠中的肠道微生物群分解为其各个组成部分。
随后,磺胺吡啶被吸收到血液中,而美沙拉秦(5-氨基水杨酸,5-ASA)可以在结肠中失活。
SAS+益生菌:5-ASA和磺胺嘧啶恢复
一项针对健康受试者的PK研究表明,肠道微生物群对激活SAS至关重要。这一发现或许可以解释为何该药物在治疗溃疡性结肠炎(UC)方面比克罗恩病(CD)更为有效。
通过给予益生菌菌株(例如嗜酸乳杆菌L10、乳酸双歧杆菌B94、唾液链球菌K12),可以增强肠道菌群SAS的功能。
在一项体外试验中,研究人员在厌氧条件下将大鼠结肠的内容物与SAS单独或SAS与益生菌联合孵育。发现益生菌具有偶氮还原酶活性,使其能够代谢SAS。经与SAS和益生菌共同培养后,样本中的5-ASA和磺胺嘧啶含量得到了更大程度的恢复。
尽管SAS是一种有效且廉价的溃疡性结肠炎治疗方法,但一些患者在使用时报告了不良反应,如恶心、皮疹和厌食症。这可能是由SAS通过肠道微生物群代谢引起的。因此,SAS不如其他溃疡性结肠炎治疗方法受欢迎。
质子泵抑制剂
PPIs是广泛用于治疗酸性疾病的药物,包括消化性溃疡、胃食管反流、消化不良、胃十二指肠病、出血。
PPI 有效,但长期使用可能存在不良反应
基于其疗效和安全性特点,质子泵抑制剂治疗在近几十年快速扩大。然而,与长期使用PPIs相关的安全性和可能的不良反应仍存在争议。据估计,高达70%的PPIs处方被认为是不必要的。一旦开始使用,很少重新评估PPIs的原始适应症,试图停药后不必要的长期使用也随之产生。
PPI:肠道菌群多样性↓↓ 部分口腔菌群增加↑↑
荷兰一项基于患者的大规模临床试验表明,PPI与肠道微生物群多样性减少和分类学变化之间存在很大相关性。
分析来自不同队列的16S数据发现,PPI的使用导致部分肠道微生物群丰度下降,口腔微生物群增加。

例如,肠杆菌科、肠球菌科和乳杆菌科增加,瘤胃球菌科和双歧杆菌科减少。而典型口腔微生物群的改变表现为下列菌群增加:
此外,观察到的变化似乎是PPI的一类功效,剂量的增加与微生物群的更大变化有关。
PPI的使用与可预测的功能变化
最近的研究表明,PPI的使用与24个分类群和133个途径高度相关,具有可预测的功能变化,包括脂肪酸生物合成、脂质生物合成和L-精氨酸的生物合成增加,嘌呤脱氧核糖核酸的降解。
PPI→胃酸↓↓→增加肠道感染的易感性
另一项受流行药物直接影响肠道微生物群的体外实验表明,生长速度发生了显著变化,这意味着PPIs与细菌H+/K+ATP酶的结合可能介导直接影响。 PPIs引起的胃酸减少,使口腔微生物群能够定植肠道微生物群,导致分类稳态改变,并可能增加对肠道感染的易感性,例如艰难梭菌、弯曲杆菌和沙门氏菌。
儿童期使用PPI,可能与日后肥胖相关
此外,PPI的启动和停用可能导致肠道微生物群的改变,可能加剧肝硬化。长期使用PPI,特别是在儿童时期,会导致肠道微生物群的永久性改变,可能导致日后的肥胖。
▸
虽然PPI被广泛认为是无害和有效的,但临床上应该重新评估其广泛、长期的影响和OTC的可及性。PPI使用的快速而广泛的转变导致了肠道微生物群的变化,影响了多达五分之一的人群。仔细评估PPIs诱导的肠道微生物群改变带来的长期影响,特别是在早期发育过程中,以及对晚年健康和疾病的潜在影响,这一点很重要。
非甾体抗炎药
非甾体抗炎药通常用于缓解疼痛和炎症,但它们的使用会导致不良反应,如胃溃疡和小肠粘膜损伤。
这是由于细菌葡萄糖醛酸酶在肠道中代谢非甾体类抗炎药,类似于CPT-11的情况,它将药物转化为损害肠道粘膜的有毒代谢产物。肝脏中产生的非甾体抗炎药的葡萄糖醛酸苷通过胆汁到达肠道,在胆汁中细菌GUSs将其水解为苷元。这些苷元随后被细胞色素P450重吸收并转化为潜在的细胞毒性中间体,从而引起肠道毒性。
注:CPT-11属于盐酸伊立替康注射液
与CPT-11一样,最近的一项研究表明,Inh1(抑制剂1)是一种新型的微生物特异性GUSs抑制剂,可以减少双氯芬酸的肠道药物不良反应。这表明抑制GUSs是减少某些药物不良反应的一种很有前途的方法。
虽然肠道微生物群产生对生物体具有有益功能的GUS,但条件致病菌或肠道致病菌,如产气荚膜梭菌和大肠杆菌,负责对药物进行去葡萄糖醛酸化反应,产生有害代谢产物。这是由于GUSs的细胞内变化,包括构象、疏水性和迁移率的变化。细菌GUSs诱导的ADR的增强潜力,尤其是肠道损伤,并非NSAIDs和CPT-11独有。
其他药物,包括抗肿瘤酪氨酸激酶抑制剂,瑞格菲尼和静脉补剂类黄酮,是GUSs 的底物。这些证据强调了了解细菌酶在IVDR中的重要性,以制定减少药物不良反应的策略的价值。
消化系统:药物-微生物相互作用
Zhao Q, et al., Signal Transduct Target Ther. 2023
初步研究表明,微生物群可能在调节神经系统IVDR中发挥关键作用。其中一个例子是使用益生菌来提高抗抑郁药物的有效性。多项研究表明,某些肠道微生物群菌株可以产生神经递质,如血清素和γ-氨基丁酸(GABA),可以调节情绪和焦虑。
通过补充益生菌,研究人员希望增加这些神经递质的可用性,改善对抗抑郁药治疗的反应。另一个领域是微生物群对神经退行性疾病的影响,例如帕金森病,常用的治疗药物是左旋多巴。
左旋多巴、卡比多巴和恩他卡朋
左旋多巴是一种治疗帕金森病的药物,帕金森病是一种神经系统疾病,表现为震颤、僵硬和行动困难。左旋多巴口服,必须通过小肠重新吸收才能到达大脑,在那里它被酪氨酸脱羧酶(tyrDC)转化为多巴胺。该药物的有效性取决于大脑的生物利用度,该药物通常与儿茶酚胺代谢抑制剂(如卡比多巴和戊卡彭)一起使用,以抑制脑外代谢。
E.lenta 代谢左旋多巴,可能与高血压风险相关
新出现的证据表明,肠道微生物群可以代谢左旋多巴。某些物种,如粪肠球菌(E.faecalis)和乳杆菌含有酪氨酸脱羧酶。然而,这种微生物群代谢减少了大脑中可获得的左旋多巴的量,导致药效降低。此外,左旋多巴的微生物群代谢也会导致药物不良反应,因为E.lenta和其他十个物种可以进一步将多巴胺转化为间酪胺,从而导致高血压危机。
残留左旋多巴也可以与微生物群相互作用
绝大多数左旋多巴通过肠道氨基酸转运载体输送到循环系统,还有10%左右残留,也可以与微生物群相互作用,通过其代谢产物影响肠道稳态。Clostridium sporogenes 能够将L-多巴胺脱氨化为3-(3,4-二羟基苯基)丙酸,后者可以体外抑制回肠运动。
粪肠球菌:98.9%效率代谢左旋多巴和恩他卡朋
肠道微生物群也可以直接代谢卡比多巴和恩他卡朋。例如,粪肠球菌能以98.9%的效率代谢左旋多巴和恩他卡朋。反过来,恩他卡朋会减少一些物种,例如Ruminococcus torques,后者仍能以84%的效率代谢恩他卡朋。
▸
这些发现说明了肠道微生物群和IVDR之间的复杂相互作用,这可能会影响药物的疗效和安全性。这些有利于拓宽我们对药物-微生物群相互作用的了解,并探索神经和精神疾病的新治疗策略。
运动系统的健康可能受到各种疾病的影响,例如骨关节炎、类风湿性关节炎和骨质疏松症,这些疾病会导致疼痛、僵硬和活动能力下降。近年来,人们越来越关注肠道微生物群在这些疾病的病理学和治疗中的影响,如甲氨蝶呤、非甾体抗炎药等。
甲氨蝶呤(MTX)
甲氨蝶呤是一种用于治疗自身免疫性疾病(如类风湿关节炎)的强效细胞毒性药物。其潜在作用基于抑制二氢叶酸还原酶和胸苷酸合成酶,从而防止嘧啶和嘌呤的从头合成。虽然甲氨蝶呤是有效的,但它也有很高的不良反应发生率,包括胃肠道、血液学、肾毒性和肝毒性。
甲氨蝶呤:E.faecium↓↓ Lachnospiraceae↑↑
可能影响对甲氨蝶呤反应的一个潜在因素是肠道微生物群。研究表明,甲氨蝶呤治疗可以改变肠道微生物群的组成,降低肠道细菌的丰度,尤其是粪肠球菌(E.faecium)的丰度,并增加Lachnospiraceae的丰度。然而,部分有益菌(如瘤胃球菌科、拟杆菌科、脆弱拟杆菌)的减少可能会加剧胃肠道药物不良反应,特别是肠道粘膜炎。
甲氨蝶呤和肠道微生物群之间的联系是双向的
肠道微生物群的变异性可能会影响甲氨蝶呤的治疗反应。研究发现,肠道微生物群多样性较高的患者,具有丰富的Prevotella maculosa,对甲氨蝶呤的反应更好。尽管看起来不错,但甲氨蝶呤的应答率极其不稳定,介于10%-80%之间,只有40%的患者能够达到治疗所需的药物浓度,并且不良反应显著。
▸
已经探索了遗传因素来预测甲氨蝶呤的IVDR,但尚未达到临床相关性。需要更多的研究来评估。肠道微生物群可能在甲氨蝶呤的PD中发挥重要作用,进一步的探索可能有助于患者个性化治疗。
神经、运动系统:药物-微生物相互作用

Zhao Q, et al., Signal Transduct Target Ther. 2023
泌尿生殖系统的微生物群会影响几种药物的疗效和毒性,导致该系统出现了药物微生物组学领域。特别是,泌尿生殖微生物群会影响雄激素剥夺治疗(ADT)的有效性,这是癌症的常见治疗方法。ADT通常涉及使用雄激素合成抑制剂(如醋酸阿比特龙),或雄激素受体拮抗剂(如恩扎鲁胺、醋酸德格雷)。
醋酸阿比特龙、恩扎鲁胺、醋酸地加瑞克
最近的研究揭示了ADT对免疫系统和肠道微生物群的影响,以及这如何影响前列腺癌症的进展。
醋酸阿比特龙是ADT中广泛使用的药物,研究强调了胸腺依赖性T细胞在调节前列腺癌进展中的关键作用,由于CD4+和CD8+T细胞的消耗,导致IVDR控制的肿瘤发展的部分减少。
醋酸阿比特龙→ A.muciniphila ↑↑ → 维生素K2 ↑↑
前列腺癌患者接受醋酸阿比特龙治疗后,重塑肠道微生物群并促进抗炎菌A.muciniphila的增殖,从而提高微生物群产生维生素K2。
此外,研究表明,具有较高α-多样性的微生物群和特定的肠道微生物群,如A.muciniphila,与更好的疗效相关。
进一步研究发现,接受口服雄激素靶向治疗(ATT)的男性的泌尿生殖微生物群组成,与接受促性腺激素释放激素(GnRH)激动剂或拮抗剂单一治疗或不接受ADT的男性有所不同。例如,A. muciniphila、瘤胃菌科等能够合成类固醇的菌,在接受口服ATT治疗的男性的微生物群中丰富,这可能会影响疾病进展和免疫疗法。
肠道菌群→调节循环性激素→促进ADT耐药性
另一项研究表明,肠道微生物群可以通过对人体细胞的影响,也可以通过直接的生物转化或合成来调节循环性激素的水平,从而促进ADT耐药性。前列腺癌患者表现出更高水平的菌株,如A. muciniphila、瘤胃菌科,它们能够通过CYP17A1样细菌酶合成类固醇激素。使用CYP17A1抑制剂醋酸阿比特龙培养细菌可抑制雄激素生物合成。然而,微生物群对雄激素水平降低的反应导致能够合成雄激素的菌株的扩增,尚待阐明。
▸
总之,微生物群调节循环性激素的能力和能够合成雄激素的细菌的扩张,可以驱动对ADT的耐药性。未来的研究有必要澄清肠道微生物群、前列腺癌和治疗之间的复杂相互作用。
药物可能会影响呼吸微生物群的组成和功能,相反,微生物群可能会影响药物代谢和反应。例如,抗生素可以减少微生物群的多样性,并促进可能导致慢性呼吸道疾病的机会性病原体的生长。吸入皮质类固醇可以增加微生物群的多样性,降低致病菌的丰度,这可能有助于其治疗效果。
此外,呼吸道微生物群会影响药物向肺部的输送。最著名的例子之一是使用抗生素异烟肼(INH)、利福平(RIF)和吡嗪酰胺(PZA)进行抗结核治疗。
异烟肼、利福平、吡嗪酰胺
研究抗结核抗生素对结核分枝杆菌感染小鼠肠道微生物群结构的影响,发现在小鼠模型中,异烟肼、利福平、吡嗪酰胺治疗三个月会导致显著和持久的生态失调。肠道微生物群的组成发生了改变:
研究进一步表明,单剂量利福平降低了微生物群的多样性,而与未用抗生物治疗的小鼠的肠道微生物群相比,单独使用异烟肼或吡嗪酰胺会导致微生物群组成的改变。
具体而言,异烟肼富集Gordonibacter,而吡嗪酰胺富集Marvinbryanti。 结核病感染不会显著改变肠道微生物群组成,但它被发现可以调节粘膜免疫反应。
在人类中,一线抗结核药物治疗似乎对肠道微生物群的影响很小。然而,一些菌株可以调节宿主的免疫反应,如:
研究还发现,抗结核病药物可以减少肠道稳态所需的微生物群,增加复发结核病的风险。与无结核病患者相比,先前治疗的患者的T细胞对2型表位的识别能力也较差。人类肠道中的2型表位与分枝杆菌(mycobacteria)有关。
▸
抗结核病治疗的多年试验有助于更深入地了解微生物群在结核病进展中的重要性。抗结核抗生素和宿主调节剂的组合,可以缩短结核病的治疗时间,减轻严重程度,减少再次感染的风险。对宿主-病原体相关性、宿主免疫学和宿主靶向治疗的研究表明,这种方法可能对结核病的治疗有益。
呼吸系统:药物-微生物相互作用

Zhao Q, et al., Signal Transduct Target Ther. 2023
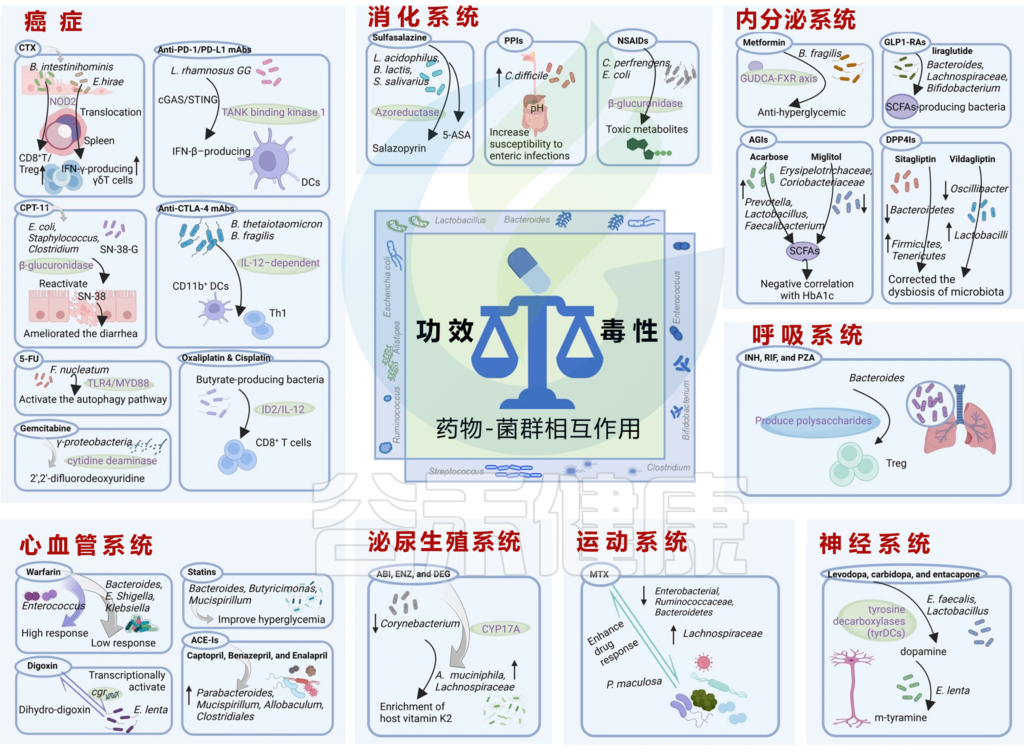
在癌症方面,肠道微生物群对于几种癌症的发病机制、进展和 IVDR 至关重要。这里介绍几种代表性药物和肠道微生物群在癌症患者中相互作用的机制,见下表。
Zhao Q, et al., Signal Transduct Target Ther. 2023
关于癌症药物与微生物群之间的相互作用,在我们之前的文章也有介绍,详见:
肠道微生物群通过酶修饰结构和生物活性或毒性的改变来影响药物的有效性和可接受性。肠道微生物群可以通过多种方式影响IVDR,包括以下:
1) 药物代谢的改变
微生物群可以影响体内代谢药物的酶的活性,从而影响药物的疗效和副作用。
2) 产生耐药性
随着时间的推移,微生物群会对药物产生耐药性,使其在治疗感染方面的效力降低。这种耐药性可能是由于微生物群DNA突变或从他人那里获得耐药性基因所致。
3) 药物靶点的修饰
微生物群可以修饰体内的药物靶点,使其不易受药物影响。如微生物群可以修饰氟喹诺酮类抗生素的靶位点,从而降低其结合和抑制酶的能力。
4) 与药代动力学相互作用
微生物群影响药代动力学,影响药物的疗效和安全性。例如,肠道微生物群可以改变药物的吸收、分布、代谢、排泄,从而改变其治疗效果和毒性。
5) 宿主微生物群的破坏
使用抗生素会干扰宿主微生物群中的自然生态系统,导致致病菌(如艰难梭菌)过度生长。这会导致感染和其他不良反应,从而影响药物安全。
6) 宿主免疫反应的调节
肠道微生物群可以调节宿主的免疫功能,这可能会影响靶向免疫系统的药物的活性和毒性。例如,肠道微生物群可以通过调节宿主免疫反应来调节免疫疗法在肿瘤治疗中的有效性。
7) 肠道屏障功能的调节
肠道微生物群可能影响肠道屏障的完整性,从而影响药物吸收和肠道-宿主相互作用。例如,肠道微生物群可以调节肠道中紧密连接蛋白的表达水平,从而影响药物的吸收。
肠道菌群编码的一些酶及其对药物的影响

Zhao Q, et al., Signal Transduct Target Ther. 2023
在一项重要全面的研究中,作者评估了1000多种药物的抗微生物特性,其中835种是影响人体细胞的靶向药物。其中,24%表现出抗菌作用,影响了至少50%的受试菌株的增殖。
药物影响肠道微生物群的机制有几个:
1) 直接抗生素效应
抗生素可以杀死包括有害菌和有益菌,可能导致肠道微生物群失衡,对人类健康产生负面影响。
2) 肠道运动能力改变
食物通过肠道的速度,会影响肠道微生物群的增殖和功能。某些药物,如阿片类止痛药,会减缓肠道运动,从而导致有害细菌过度生长。这可能会导致便秘和腹胀等胃肠道症状,在某些情况下还会导致感染(如艰难梭菌)。
3) 免疫功能的调节
肠道微生物群在调节肠道免疫方面具有关键功能。几种药物,如免疫检查点抑制剂,会影响肠道免疫,进而影响肠道微生物群。
4) pH值的变化
肠道的pH值会影响不同类型细菌的生长和存活。一些药物,如用于治疗胃酸倒流的质子泵抑制剂,可以改变肠道的pH值,从而影响不同微生物群的增殖,从而影响肠道微生物群的整体组成。
5) 干扰微生物代谢
肠道微生物群在代谢肠道中的化合物方面具有重要功能。一些药物,如非甾体抗炎药,会干扰微生物代谢,这可能会对肠道微生物群产生影响。特别是,非甾体抗炎药会干扰胆汁酸的肠道微生物群代谢,导致肠道微生物群的变化。
6) 饮食变化
某些药物,如泻药或抗腹泻药,会改变肠道的饮食环境。这可能会通过改变肠道微生物群生长和生存所需的营养素和其他化合物的可用性来影响肠道微生物群。
▸
药物对肠道微生物群的影响可能是积极的,也可能是消极的。例如,某些益生菌或益生元能够调节肠道微生物群,这可能对个体的健康产生积极影响。然而,服用对肠道微生物群产生负面影响的抗生素或其他药物可能导致微生态失调,对人类健康产生负面影响。
因此,必须仔细评估药物对肠道微生物群的潜在影响,并开发考虑个体肠道微生物群组成和功能的个性化药物治疗方法。
以上我们了解到微生物群和常见药物之间复杂的相互作用对药物效果的影响,肠道微生物群在药物治疗中的重要性意味着,肠道微生物群驱动的精准医疗,明确靶向肠道微生物群或将提高临床疗效。
未来多元化应用
通过测定肠道微生物群的组成、数量及代谢产物相对丰度,可以预测药物在体内的疗效和毒性。肠道微生物特征可作为非侵入性辅助诊断方法或提供预后评估。因此,开发能够预测药物疗效和毒性的改进生物标志物,对于成功实施精准医疗至关重要。
设计小分子抑制体内与药物生物转化为有毒代谢物相关的微生物代谢活性。
可以通过引入益生菌、益生元、粪菌移植等方式来调节微生物群的组成和比例,提高药物的生物利用度,减少不良反应。
药物微生物组学领域正在兴起
整合多个高通量多组学数据集,提供药物反应的个体差异的全面概况。这些将辅助全面揭示药物与微生物之间相互作用背后的决定因素,可以有效地满足对患者进行聚类和预测以及发现新生物标志物的需求。
多组学策略促进药物微生物组学走向人类精准医学

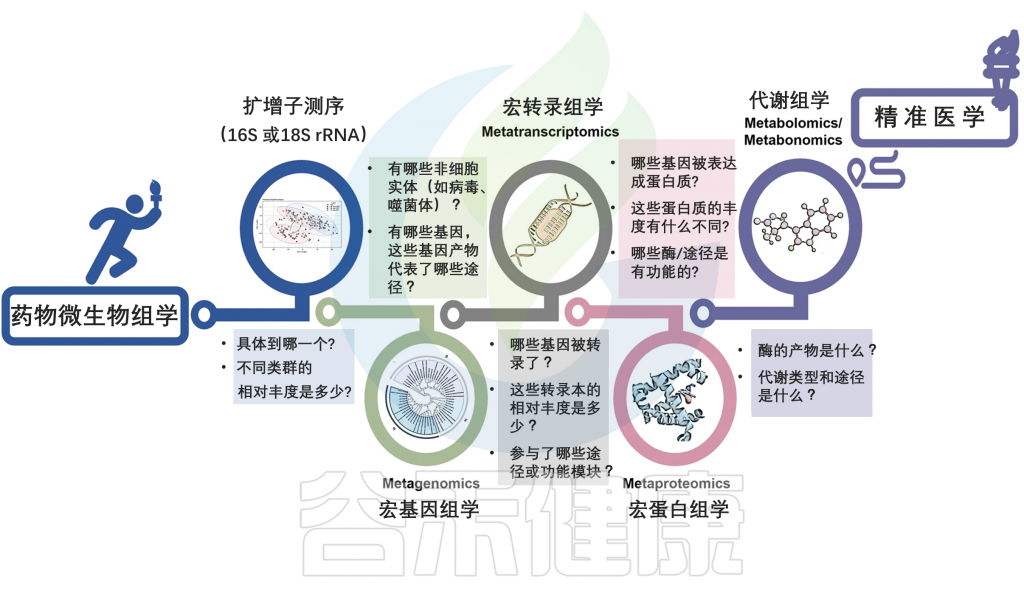
Zhao Q, et al., Signal Transduct Target Ther. 2023
高通量数据需要使用先进的计算技术通过人工智能算法进行建模。开发模拟药物与微生物相互作用的预测模型和软件对于减少研究时间和成本至关重要。
仍然存在一些挑战
——研究还需更加深入
对药物-微生物之间相互作用背后的机制仍然缺乏全面的了解。肠道菌群是一个复杂且不断变化的生态系统,受到饮食、年龄、性别、生活方式、宿主遗传学等多种因素的影响。很难将这些因素的影响与药物引起的微生物群变化分开。
——临床转化需要克服的障碍
例如,开发基于微生物群的药物反应生物标志物将需要大规模的验证研究和监管部门的批准。
许多药物微生物组学研究的样本量通常有限,可能限制其统计能力和概括研究结果的能力。需要更大规模的研究来确认和扩展初步结果。
应对这些挑战需要研究人员、临床医生和行业合作伙伴之间的合作,加深我们对药物-微生物相互作用机制的理解,并确保研究结果转化为安全有效的临床实践,为患者提供更好的治疗策略,共同推动精准医学领域的进步。
主要参考文献
Zhao Q, Chen Y, Huang W, Zhou H, Zhang W. Drug-microbiota interactions: an emerging priority for precision medicine. Signal Transduct Target Ther. 2023 Oct 9;8(1):386.
Rosell-Díaz M, Fernández-Real JM. Metformin, cognitive function, and changes in the gut microbiome. Endocr Rev. 2023 Aug 21:bnad029.
Weersma RK, Zhernakova A, Fu J. Interaction between drugs and the gut microbiome. Gut. 2020 Aug;69(8):1510-1519.
Schupack DA, Mars RAT, Voelker DH, Abeykoon JP, Kashyap PC. The promise of the gut microbiome as part of individualized treatment strategies. Nat Rev Gastroenterol Hepatol. 2022 Jan;19(1):7-25.
Chen HQ, Gong JY, Xing K, Liu MZ, Ren H, Luo JQ. Pharmacomicrobiomics: Exploiting the Drug-Microbiota Interactions in Antihypertensive Treatment. Front Med (Lausanne). 2022 Jan 19;8:742394.
Daisley BA, Chanyi RM, Abdur-Rashid K, Al KF, Gibbons S, Chmiel JA, Wilcox H, Reid G, Anderson A, Dewar M, Nair SM, Chin J, Burton JP. Abiraterone acetate preferentially enriches for the gut commensal Akkermansia muciniphila in castrate-resistant prostate cancer patients. Nat Commun. 2020 Sep 24;11(1):4822.
Jia L, Huang S, Sun B, Shang Y, Zhu C. Pharmacomicrobiomics and type 2 diabetes mellitus: A novel perspective towards possible treatment. Front Endocrinol (Lausanne). 2023 Mar 23;14:1149256.
Khan I. Drugs and gut microbiome interactions-an emerging field of tailored medicine. BMC Pharmacol Toxicol. 2023 Aug 30;24(1):43.
Pant A, Maiti TK, Mahajan D, Das B. Human Gut Microbiota and Drug Metabolism. Microb Ecol. 2023 Jul;86(1):97-111.

谷禾健康
疾病表现、进展和治疗反应的可变性一直是医学的核心挑战。尽管宿主因素和遗传学的变异性很重要,但很明显,在迈向个性化治疗的过程中,必须考虑肠道微生物组具有巨大的遗传和代谢多样性。
疾病表现、治疗反应和治疗不良反应的个体差异是有效管理疾病和患者安全的主要挑战。这种认知是精准医学的基础,其最简单的形式可以这么说,用个性化方法为合适的患者确定合适的治疗方法,无需反复试验。
将肠道微生物组与人类遗传学区分开来的一个方面是它代表了我们健康的动态组成部分,通过复杂的网络不断与宿主和环境因素相互作用。虽然存在潜在挑战,肠道微生物组的可塑性也提供了一个独特的机会,使其成为精准医学的一个有吸引力的目标。
本文支持使用肠道微生物组作为精准医学工具的当前证据,并建议未来需要将微生物组作为个体化治疗或干预工具的工作。
该研究团队选择了六个广泛的疾病组,这些组具有相对较强的证据表明肠道微生物组的作用。 尽管每个疾病组都有不错的发展,但在考虑临床影响时,不同疾病组的前景和成熟度各不相同(下图)。
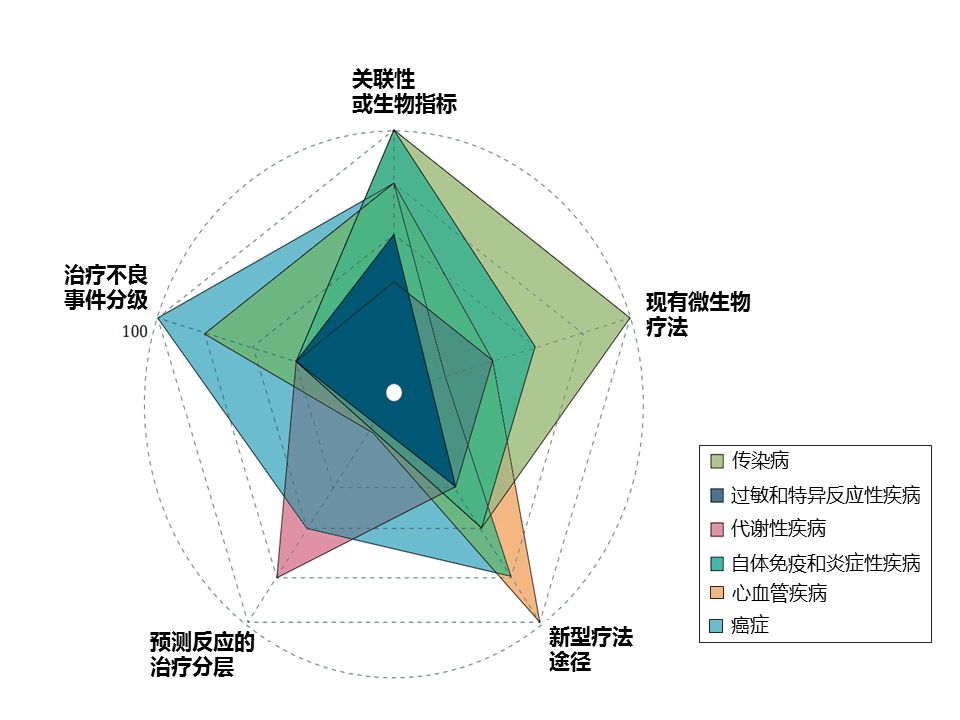
抗生素诱导的肠道微生物组破坏会促进机会性和医院感染的机制。最常见的院内腹泻感染艰难梭菌为例,强调可能解释临床结果的个体差异的微生物组和病原体特异性特征。
复发性艰难梭菌感染 (CDI) 一直是微生物组研究的中心焦点。CDI 出现最常见的原因是使用抗生素,但矛盾的是,CDI 的一线治疗也包括抗生素。
抗生素对一般人相当有效,但为什么部分患者出现治疗失败,或是成功治疗后复发?
这可能与宿主特征(例如高龄)或药物的使用(例如质子泵抑制剂)有关, 以及肠道微生物组中特定病原体的特征有关。
除了宿主因素外,肠道微生物群的破坏也是 CDI 的关键因素。
· 与健康对照个体相比,CDI患者的肠球菌、韦永氏菌、乳杆菌、γ-变形菌属的相对丰度较高,而拟杆菌属、毛螺菌科、瘤胃球菌科的含量较低。

谷禾健康
2型糖尿病是一种血糖水平升高(高血糖)的慢性代谢疾病,主要由胰岛素抵抗和胰岛素分泌不足引起。2型糖尿病全球患病率在不断上升。
截止到2020年,根据美国糖尿病学会评估标准,糖尿病患病率已达到12.8%。其实在我国成年人中,已经有将近一半的人存在血糖异常,未来极有可能发展为2型糖尿病。如果不加干预治疗,会引发许多不良后果。
很多研究表明,肠道菌群在宿主的代谢和疾病状态中起着重要的作用。特别是2型糖尿病,其病因复杂,包括肥胖、慢性低度炎症,受肠道微生物群和微生物代谢产物的调节。
本文将从肠道菌群的角度了解其与2型糖尿病的关系;肠道菌群及其代谢物对葡萄糖代谢、免疫系统的影响;
从影响肠道菌群变化的因素来了解各种干预措施,包括药物,饮食,益生菌/益生元,粪菌移植,间接性禁食等方式。
葡萄糖主要通过食用的食物和饮料进入人体。胰腺会产生一种叫做胰岛素的激素,以帮助血液中的葡萄糖进入肌肉、脂肪和肝脏,用作能量。
胰岛素通过血液循环进入不同组织。组织大多数细胞表面有一种结构,叫胰岛素受体。当胰岛素流过时,会附着在胰岛素受体上,就像钥匙打开锁一样,糖可以进入细胞内,细胞获得能量维持正常运作,血液中糖分就会回落到正常水平。
在2型糖尿病患者身上,细胞对胰岛素没有反应,这种情况就叫胰岛素抵抗。胰岛素没有了“钥匙”的作用,不能有效开启细胞上的“锁”,或者“锁”的数量也减少了,由此,糖分就不能进入细胞有效利用,被挡在了细胞外面,只好在血液中积累,血糖就升高了。
刚开始的时候,胰腺会觉得自己使不上力,于是不甘心开始拼命工作,产生更多的胰岛素来克服这种抵抗。
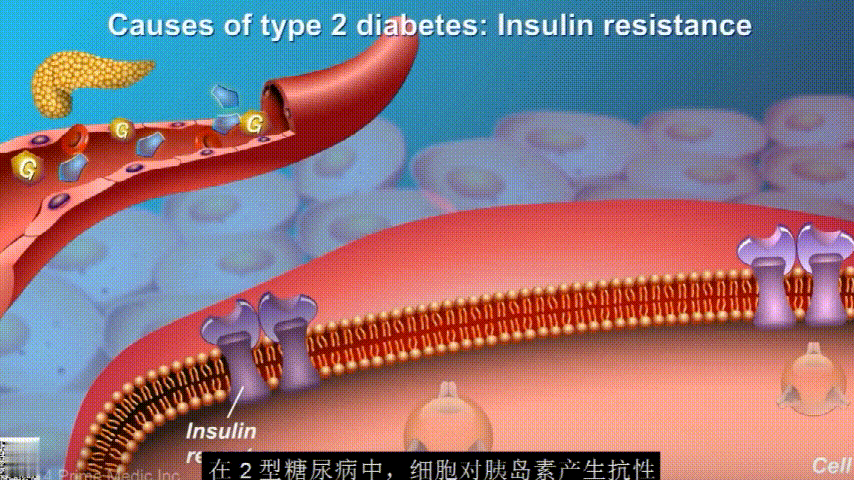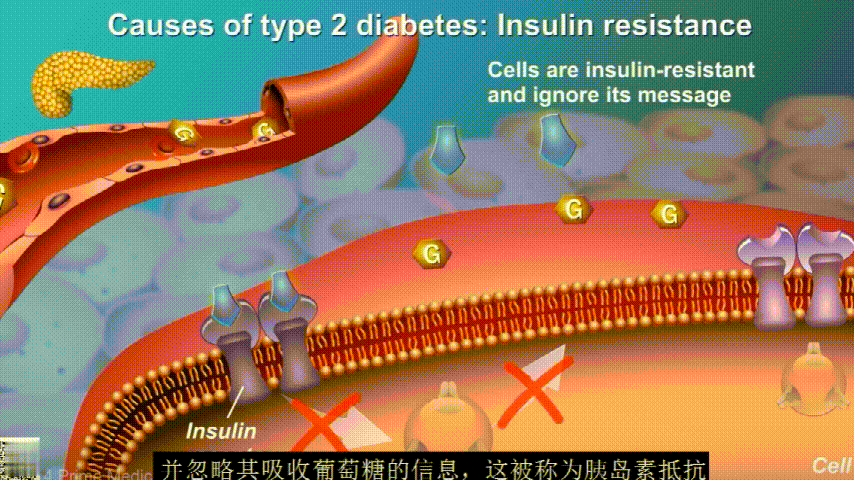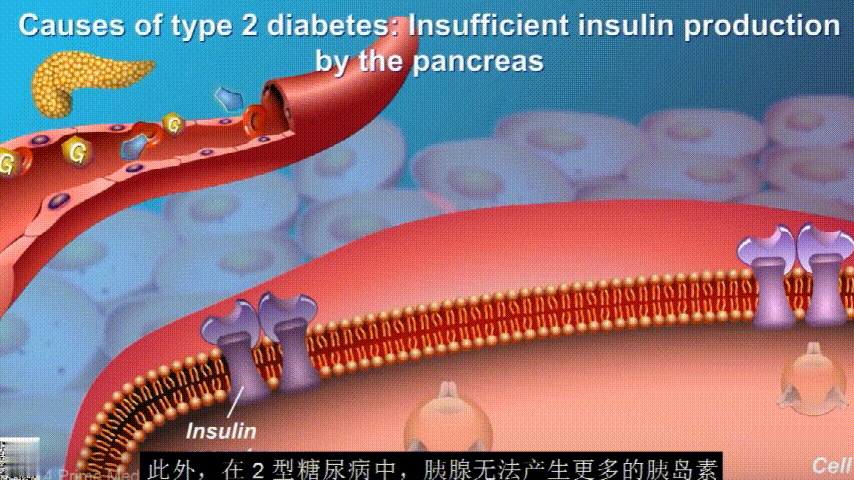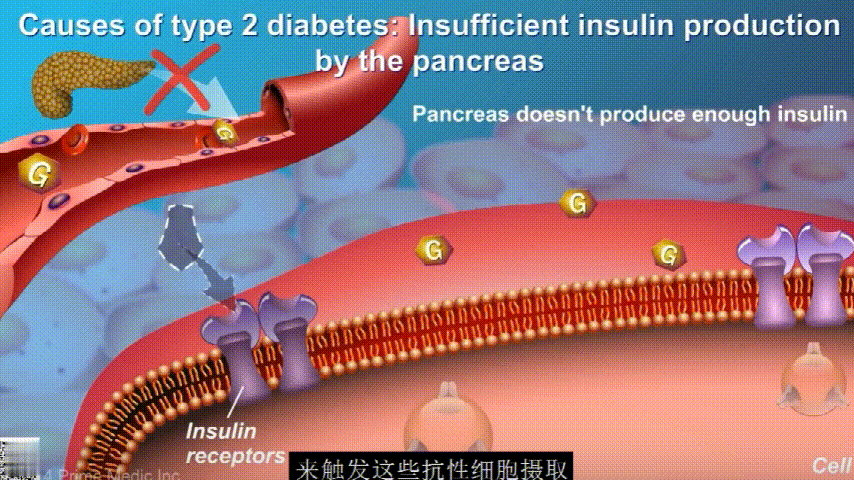
随着时间的推移,胰腺开始累了,力不从心,不能产生更多的胰岛素,这时候就是2型糖尿病开始了。
肠道微生物群可以直接或间接地影响人类健康,肠道微生物群失调可能会增加促炎疾病的患病率,如肥胖、炎症性肠病、2 型糖尿病、关节炎和癌症。
2型糖尿病人群中个体微生物群的差异
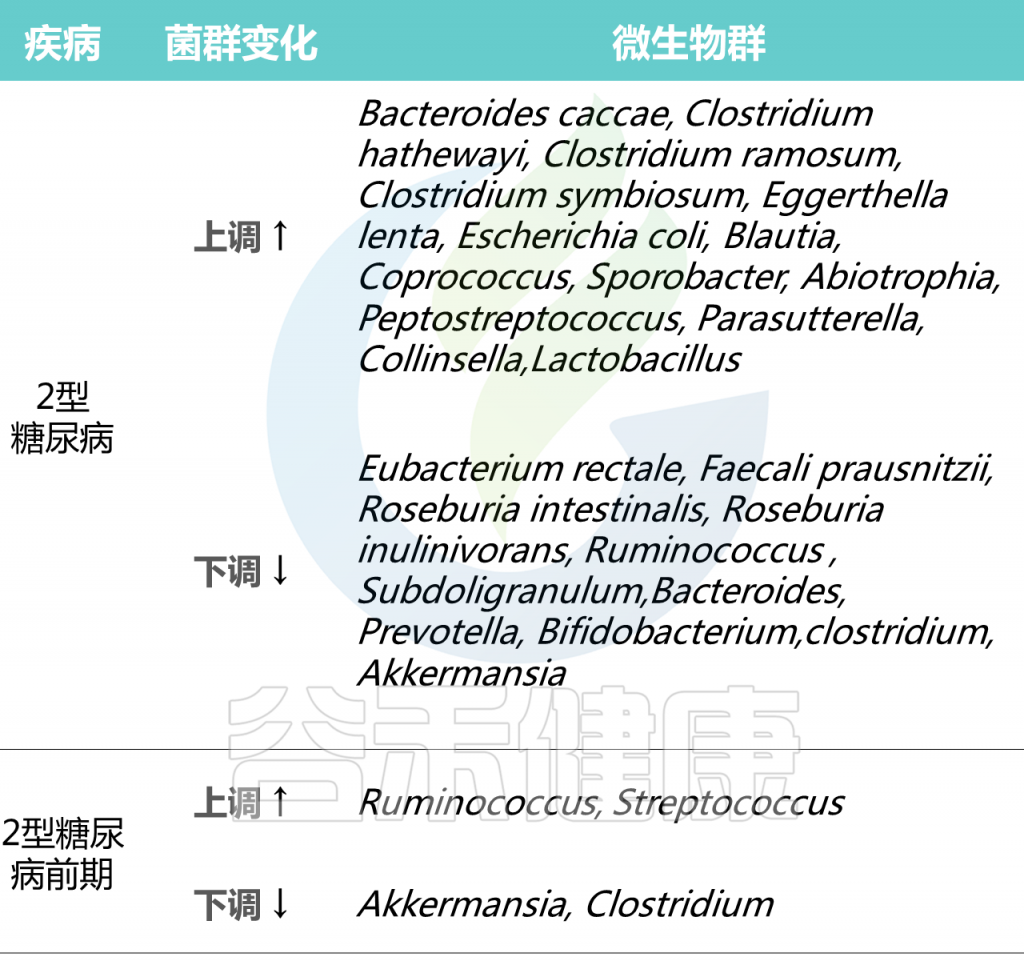

Cunningham A L et al., Gut Pathog, 2021
在2型糖尿病患者普遍具有相对高丰度的特定属:Blautia、Coprococcus、Sporobacter、Abiotrophia、Peptostreptococcus、Parasutterella、Collinsella。
2型糖尿病患者中,产生丁酸菌特别缺乏,特别是梭菌目,包括:
Ruminococcus、Subdoligranulum,Eubacterium rectale、Faecali prausnitzii、Roseburia intestinalis 、
Roseburia inulinivorans
2型糖尿病患者中,其他明显较少的菌属有:
拟杆菌属、普雷沃氏菌属、双歧杆菌属