-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

分娩标志着孩子和母亲的一个相当大的变化,对于母亲来说,分娩是一个转折点,过去我们常常将关注点集中在宝宝的成长发育上,却往往忽视了产后妈妈的身体恢复,如激素急剧变化、在营养补充和维持身材之间难以取舍、代谢异常、睡眠减少等困扰。
更隐秘的危机在精神领域悄然蔓延。世卫组织2023年的报告显示,全球每5位产妇就有1位陷入产后抑郁的泥沼,这些被激素风暴与育儿压力双重撕扯的母亲,往往在”为母则刚”的社会期待中被迫沉默。当一位母亲在产后面临身体不适时,对孩子的照料、家庭的和睦乃至整个社会都带来深远影响。
分娩后,女性体内发生着一系列显著的激素变化:雌激素和孕激素的急剧下降,催产素的波动,皮质醇等应激激素的起伏。激素变化会直接影响肠道菌群的组成和功能,而这些变化又与产后女性的代谢状态、食欲调节和营养吸收密切相关。
一方面,产妇需要充足的营养支持身体恢复和维持母乳喂养;另一方面,也希望逐渐恢复孕前体重。在这种情况下,找到产后营养补充与健康体重管理之间的平衡点变得尤为重要。理解肠道菌群与营养的双向互动关系,可以制定更有效的产后恢复策略,这一点在产后体重管理中尤为重要。
而当产后激素波动导致肠道菌群失衡时,不仅会影响营养物质的吸收和能量代谢,还可能通过炎症因子和神经递质的变化影响情绪,与产后抑郁等心理问题密切相关。
针对产后抑郁倾向的女性,菌群检测可与传统量表评估相结合,构建多模态评估体系,推动产后心理健康管理从单纯症状评估向生物标志物预警转变,提供更精准的个性化干预方案,有效支持产后女性的全面康复过程。
本文将重点探讨肠道菌群在产后女性健康中的关键作用,以及如何通过调节肠道菌群,为这群被忽视的重要人群提供更全面的关怀与支持。
疼痛修复期的身心挑战
产后女性经历着人类生物学中剧烈的生理重构,其变化涵盖内分泌、代谢、免疫等多个系统,并与肠道菌群形成复杂的双向调控网络。
生理层面——连锁效应
“肚子阵阵拧着疼”
很多女性在产后2-3天,下腹持续出现类似痛经的阵发性绞痛,哺乳时疼痛加剧,甚至需要咬牙忍耐。
子宫通过强烈收缩恢复孕前大小,宫底每日下降1-2厘米,约6周完成复旧。肌纤维缩短压迫血管止血。伴随这一过程,子宫内膜脱落形成恶露,初期为血性(持续3-4天),逐渐转为浆液性(持续约10天),最后为白色恶露(持续3周),全程4-6周。
哺乳时婴儿吸吮刺激催产素分泌,进一步强化宫缩。这种疼痛虽难熬,却是子宫复旧的积极信号。
“打个喷嚏就漏尿”
咳嗽、大笑时突然漏尿,尴尬又无奈。孕期增大的子宫压迫盆底肌长达数月,分娩时肌肉和神经被过度拉伸甚至断裂。松弛的盆底肌无法有效支撑尿道,导致腹压增加时尿液失控。
本文后面章节有介绍盆底肌修复的相关干预措施。
心理层面——从甜蜜到崩溃
“前一秒笑着哄娃,下一秒突然崩溃大哭”
分娩后24小时内,雌激素水平暴跌至孕前1/10,直接影响大脑5-羟色胺分泌,导致情绪调节功能紊乱。同时,睡眠剥夺(平均每天仅4小时碎片化睡眠)加剧前额叶皮层代谢异常。
“镜子里的我像个陌生人”——身材焦虑爆发
妊娠纹、松垮的肚皮、下垂的乳房引发强烈外貌焦虑。产后体内脂联素水平持续偏低,导致脂肪代谢减缓,而镜像神经元对体像改变的过度关注会激活杏仁核恐惧回路。
以上是产后康复涉及身体的方方面面,产后生理层面的变化是产后康复研究与实践的核心关注点。这些变化涉及多个系统,包括泌尿系统、体重管理、疼痛感知以及心理健康等方面,需要综合考虑各系统的代谢机制。
产后康复对于保障母婴健康、提升产妇生活质量具有关键意义。接下来们将聚焦于产后营养与体重管理这一关键领域,探讨如何通过科学的饮食策略来支持身体恢复并维持健康体重。
产后女性面临着双重挑战:一方面需要充足的营养来恢复体力、促进伤口愈合并支持母乳喂养;另一方面又期望逐渐恢复孕前体态。
产后超重一方面源于孕前超重或孕期增重过多,另一方面与产后体重滞留有关。
什么是产后体重滞留?
产后体重滞留(Postpartum Weight Retention, PPWR)是女性产后普遍面临的代谢失衡问题,定义为产后一年内体重较孕前增加≥5kg的状态。
主要以产后42天(产后6~8周)、产后6个月和产后12个月作为产后体重监测时点。
能量代谢重构与激素波动
脂肪储备与能量失衡
孕期母体脂肪储备量增加约3-4 kg,主要分布于腹部和臀部,用于支持胎儿发育及哺乳。
产后能量消耗模式改变:哺乳期基础代谢率较孕前提高15%-20%,但若能量摄入(尤其是高脂高糖饮食)超过哺乳消耗(约650 kcal/天),脂肪持续堆积。
激素与代谢调节紊乱
雌激素骤降:产后雌激素水平下降50%-70%,导致脂蛋白酶活性降低,脂肪分解受阻。
胰岛素抵抗:妊娠期胎盘分泌的激素(如胎盘催乳素)诱导胰岛素抵抗,产后恢复期若糖代谢未正常化,易引发脂肪合成亢进。
初始体重减轻幅度
分娩后,产妇体重平均减少约5-10斤(胎儿、胎盘、羊水等重量),但仍有60%-80%的增重需通过后续干预消除。
2013年中国不同产后时间和地区的乳母体重滞留量比较
产后女性的肠道菌群变化
门水平
厚壁菌门(Firmicutes)是产后早期(<6周)和晚期(6周至1年)的优势菌门,部分研究还发现放线菌门(Actinobacteria)在产后期间的比例显著增加。
属水平
拟杆菌属在产后早期具有主导地位,也有研究发现Clostridiales在分娩后和产后4-6周内占优势。研究中常见的丰富菌属还包括:
为什么产后有些人很容易瘦,有些不容易?
产后肠道菌群组成的变化不仅仅是微生物学现象,更是体重调节与代谢健康的关键因素。肠道微生物组直接参与能量提取、内分泌代谢与脂肪分解过程,充当产后女性代谢调节网络中的核心枢纽。
当然,体重也会涉及其他方面因素,这里我们从肠道菌群的角度来分析:
★ 基线菌群组成不同
每个产妇初始肠道菌群组成存在个体差异;不同菌群组成可影响从相同食物中提取的能量总量,具有特定微生物组特征的人在相同热量摄入条件下,体重变化轨迹可能完全不同。
那些具有”瘦菌群”特征的产妇(如双歧杆菌、阿克曼氏菌丰度高,F/B比值低)更容易恢复体重;菌群多样性高的产后女性通常代谢恢复更为理想。
妊娠期遗留的菌群变化
妊娠期激素水平和代谢变化会改变肠道菌群,这些变化可能在产后持续存在,影响能量提取效率和代谢调节;菌群变化的恢复速度存在个体差异,检测肠道菌群的变化可以了解其恢复程度。
菌群对能量平衡、激素的调节
基于菌群特征,有些产妇从相同食物中获取更多能量,肠道菌群影响短链脂肪酸产生,进而影响脂肪燃烧和储存。
短链脂肪酸通过多种机制影响脂肪组织代谢:
特定菌群可促进脂肪组织褐变,增加能量消耗。
某些肠道菌如Dysosmobacter welbionis产生的12,13-diHOME能促进脂肪酸转运至棕色脂肪组织,增加能量消耗。
阿克曼氏菌被证明能增加褐变、脂肪酸氧化和棕色脂肪组织(BAT)活性,这一转化对能量消耗和代谢健康至关重要。
肠道菌群还通过影响胆汁酸代谢,间接影响激素水平,菌群可能影响产后激素敏感性,进而影响脂肪分解和糖代谢。
肠道屏障与炎症
肠道屏障功能受损时,细菌内毒素LPS可进入循环系统,激活炎症途径;LPS暴露改变脂肪因子分泌,与脂肪组织中巨噬细胞积累和促炎状态相关。
总之,产后体重恢复的个体差异在很大程度上取决于肠道菌群的组成与代谢功能,这些因素通过影响能量提取、脂肪储存、激素调节和炎症状态等多种机制,共同决定了产后女性体重恢复的难易程度和速度。了解和调节个人肠道菌群可能是未来产后体重管理的关键策略。
基于这一认识,产后营养补充不再是简单的能量与宏量营养素摄入,而应转向”营养-微生物-代谢”的整体观念。
产后营养
合理的产后营养不仅关乎体重管理,更是整体康复过程的基石。适当的营养摄入能够提升免疫功能,加速产后恢复,调节激素平衡,甚至对缓解产后抑郁情绪也有积极作用。
产后体重管理的重要时间窗口
产后1年内是体重恢复的关键时期,产后6个月左右恢复到孕前体重的女性,其后续10年超重的风险会较低。
因此,理解产后身体的特殊需求,并据此制定个性化的饮食策略,是帮助产后妈妈顺利度过产后恢复期的重要支持手段。
首先,产后的营养需求有什么特点?
产后女性对食物的吸收利用率往往有所变化,激素波动会影响消化系统功能,影响营养素吸收。
◆ 能量需求增加哺乳期每天额外需要约500卡路里能量以支持乳汁分泌。
《美国膳食指南(2020-2025)》建议,与哺乳期的孕前需求相比,哺乳期妇女在产后前6个月额外摄入330卡路里,6-12个月额外摄入400卡路里。
我国传统月子餐文化源远流长,”坐月子”被视为产后恢复的关键。传统观念认为产后女性处于特殊”虚弱”状态,需通过特定食物”补”回元气。传统月子餐通常以高能量、高蛋白、温热食物为主,如猪蹄、鸡汤、鲫鱼汤等。这些食物含有丰富蛋白质和胶原蛋白,有助于伤口愈合和组织修复。
然而,传统月子餐也存在局限性:过度强调高油高糖食物,食用红糖、米酒等”温补”食物可能导致血糖波动;单一食谱导致营养素摄入不均衡等。
◆ 蛋白质需求提高 乳汁分泌和身体组织修复都需要优质蛋白质支持。膳食蛋白质不仅是宿主营养的来源,也是肠道微生物的关键营养底物。
肠道菌群在蛋白质代谢中发挥着重要作用,特定菌群如拟杆菌属、梭状芽胞杆菌属和乳酸杆菌属能有效分解未消化的蛋白质,生成短链脂肪酸和多种氨基酸。产后如果肠道菌群紊乱,可能导致菌群分解能力下降,从而引起蛋白质消化不良,影响营养吸收效率。
适量优质蛋白摄入可促进双歧杆菌和乳杆菌等有益菌生长,形成良性循环,而过高或过低的蛋白质摄入都可能导致菌群失衡,影响产后恢复。此外,一些肠道菌群还能从头合成赖氨酸等必需氨基酸,并将其整合到宿主蛋白质中,为产后女性提供额外的营养支持。
◆ 微量营养素需求钙、铁、锌等微量元素与多种维生素的需求量也显著增加,比如铁、钙流失和骨质疏松风险上升,微量营养素缺乏对产后女性健康恢复造成显著影响。单纯补充有时并不有效,甚至可能产生不良副作用(如补铁引起的消化问题)。
肠道菌群在微量营养素代谢中扮演着关键角色,它们能够合成、转化和影响多种微量营养素的吸收与利用。
例如,特定的乳杆菌如Latilactobacillus sakei能产生叶酸(维生素B9),帮助改善宿主叶酸状态,同时增加短链脂肪酸产生;研究发现,维生素A的摄入与肠道微生物多样性呈正相关,特别是在孕期和产后,类胡萝卜素摄入充足的女性肠道微生物α多样性更高。
铁是许多细菌生长必需的营养素,但铁补充不当可能导致条件致病菌增殖,产生肠道不适。同时,某些菌群可提高微量营养素的生物利用度,如乳酸乳球菌N8和布拉酵母菌可将发酵食品中的核黄素和叶酸浓度提高40%-90%。
在这其中,肠道菌群与微量营养素之间存在重要的双向相互作用,在营养补充策略中需要加以考虑。
母乳喂养
美国儿科学会 (American Academy of Pediatrics) 推荐前 6 个月进行纯母乳喂养,然后继续母乳喂养并辅食至少 2 年。哺乳是一种能量密集型状态,理论上可以引起净负平衡,从而使产后体重减轻。
《美国膳食指南(2020-2025)》建议,与哺乳期的孕前需求相比,哺乳期妇女在产后前6个月额外摄入330卡路里,6-12个月额外摄入400卡路里。有稳定乳汁且想减重的女性可每天减少500卡路里摄入(相当于哺乳消耗的能量),但每天至少保持1800卡路里。这样可以每周减重1磅,4个月后可恢复孕前体重而不影响婴儿生长。
在哺乳期,坚持均衡的饮食,包括所有类别的常量营养素,对于维持母乳的成分和产量至关重要。一些流行的几种时尚饮食(例如,极低碳水化合物、旧石器时代、极低脂肪)可能会导致哺乳期妇女营养缺乏,应该避免。
膳食计划应强调营养丰富的全食物,如水果、蔬菜、豆类、全谷物和健康脂肪。选择纯素饮食的患者应评估并补充叶酸、维生素B12、铁、锌、胆碱、碘和EPA/DHA。
运动干预
剖宫产后,建议早期下床活动作为促进剖宫产后恢复(ERAC)方案的一部分。早期行走可缩短肠功能恢复时间、血栓形成风险和产后住院时间。
NICE指南:建议所有产后女性在6-8周后进行体重管理。

分期渐进:产后0-6周以低强度恢复性训练为主(如凯格尔运动、腹式呼吸),6周后逐步增加有氧与抗阻训练强度。
产后2天起:产褥期保健操(每1-2天增加1节,每节8-16次)。
产后6周后:逐步引入有氧运动(如散步、瑜伽),每周≥150分钟中等强度运动,分4-5次完成。
力量训练:针对核心肌群,改善基础代谢率。
为了安全起见,避免过早负重或高强度运动,运动强度以心率<140次/分钟为宜。
个体化:剖宫产者需延迟腹部加压训练至伤口愈合(通常8-12周),重点关注多裂肌与膈肌协同。
有效运动模式:
高强度间歇训练(HIIT)
RCT显示,每周3次、每次20分钟的HIIT(如自行车+深蹲组合)在12周内显著降低体脂率(-3.2% vs对照组-1.1%),且不影响母乳产量。
抗阻-有氧联合训练
对比静态核心训练与瑞士球训练,发现两者均能改善腰围(平均减少4.3cm)和内脏脂肪面积,但需结合饮食控制才能实现体重下降。
注:以上需结合自身状况,避免盲目锻炼。
中药调理
中药调理通过使用具有健脾祛湿功效的中药材,改善体内湿气过重。产后体虚、气血不足时,可在医生指导下服用补血益气类中药。
产后体重管理与全面康复是产后女性身体健康的一个方面,心理健康同样不容忽视,而肠道菌群失衡不仅影响代谢和体重,也直接参与情绪调节。产后激素波动引起的菌群变化,可能形成生理-心理-微生物的复杂互动网络。
当产后女性面临身体恢复压力的同时,还可能经历产后抑郁的困扰。这种情绪障碍影响产后妈妈健康的同时,也有可能传递给婴儿,影响下一代发育。因此,我们需要将产后照护视角从单纯的体重恢复拓展至情绪健康领域,探索肠道菌群在产后抑郁中的关键作用。
神经系统
产后抑郁症(PPD)是女性分娩后的常见疾病,症状包括情绪低落、易怒、睡眠障碍,严重时还会出现自杀或自杀意念。与产后抑郁相关的自杀是产后妇女死亡的主要原因,仅次于其他原因。
产后抑郁的发生率因地理位置而异,在经济发达国家为6.9%~12.9%,在经济欠发达或发展中国家超过20%。
近年来,社会和生活压力的增加与产后抑郁发病率的上升有关,这对患者的生活质量和身心健康产生了负面影响。病理机制很复杂,目前还不完全清楚。大多数学者认为,产后抑郁的发展可能是多因素的,受遗传、生理、心理、社会和家庭因素的影响。

一项荟萃分析显示,以下危险因素与产后抑郁相关:
• 妊娠糖尿病(OR = 2.71, 95%CI 1.78-4.14, I2 = 0.0%)
• 妊娠期抑郁(OR = 2.40, 95%CI 1.96-2.93, I2 = 96.7%)
• 孕妇生男孩 (OR = 1.62;95% CI 1.28-2.05;I2 = 0.0%)
• 妊娠期抑郁病史 (OR = 4.82,95%CI 1.32-17.54,I2 = 74.9%)
• 抑郁病史 (OR = 3.09,95%CI 1.62-5.93,I2 = 86.5%)
• 分娩时硬膜外麻醉 (OR = .81,95%CI .13-4.87,I2 = 90.1%)
产后抑郁症不仅影响母亲的身心健康和家庭关系,还通过多种途径传递给宝宝,影响宝宝的大脑发育。
抑郁状态下的妈妈往往缺乏与宝宝的积极互动,减少了皮肤接触和情感交流,这也会影响婴儿的神经系统发育。
可能通过喂养习惯的改变和照料质量下降影响宝宝,也可能通过母乳微生物群影响宝宝的肠道菌群定植,进而影响宝宝的认知发展和情绪调节能力。
产后一个月的这段时期对婴儿肠道菌群建立至关重要,而这正是大多数婴儿完全依赖母乳的阶段。一项研究发现,产后母亲压力与母乳微生物组成之间存在关联,研究发现,高压力组母亲的乳汁中链球菌、Gemella、Veillonella含量显著降低,而葡萄球菌、棒状菌和不动杆菌的含量升高,这些部分是条件致病菌。母亲的压力状态会影响乳汁的微生物组成,这可能会进一步影响婴儿肠道菌群的定植和后续的健康发展。
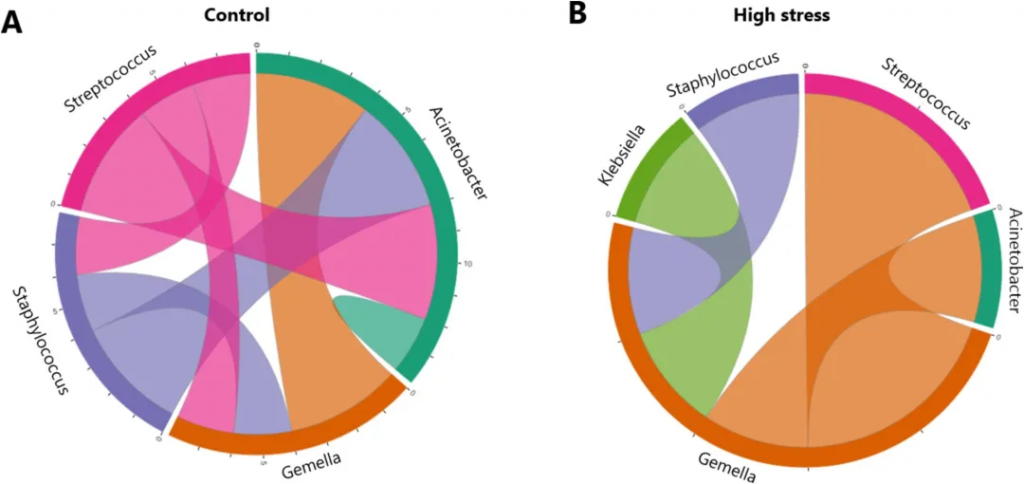
doi.org/10.1016/j.bbi.2024.11.020
链球菌和Veillonella的减少可能通过影响短链脂肪酸(SCFAs)的产生影响大脑发育,短链脂肪酸可穿过血脑屏障,对神经发育至关重要。
这种情况如果得不到及时干预,宝宝发育问题可能让产后妈妈的情绪雪上加霜,陷入恶性循环,导致抑郁症状加重,而对宝宝的影响也将长时间持续。
这种早期的微生物群失衡可能对宝宝的神经发育产生长期影响。研究发现,早期肠道菌群不健康与儿童期注意力缺陷、认知障碍、情绪调节问题甚至自闭症谱系障碍风险增加相关。由于大脑发育的关键期正是生命最初几年,这种影响可能会一直持续到青少年甚至成年期,形成跨代际的健康问题传递。
因此,针对产后抑郁的早期识别和干预至关重要。
产后抑郁治疗的困境
目前产后抑郁的治疗通常包括抗抑郁药、心理干预和激素补充。然而,这些方法经常出现副作用,表现出不一致的长期有效性,并可能在母乳中积聚,可能影响婴儿,从而限制其临床效用。
***
科学界开始逐渐认识到产后期女性不仅经历着激素的剧烈波动,也同时面临着肠道微生物生态的显著变化。这种变化并非独立存在,而是通过”肠-脑轴“与产后情绪密切相关。研究表明,肠道微生物通过产生多种神经递质和生物活性物质,如血清素(5-HT)、γ-氨基丁酸(GABA)、多巴胺等,直接影响中枢神经系统功能。
Sorboni SG, et al.,Clin Microbiol Rev. 2022
关于肠-脑轴详见我们之前的文章:
特别值得注意的是,血清素的合成受到肠道微生物群的显著调节,而血清素水平的异常与抑郁症状密切相关。肠道微生物还通过产生短链脂肪酸等代谢物,调节免疫系统功能,改善肠道屏障完整性,减少炎症反应。
这些发现为我们打开了理解产后抑郁的新视角——肠道微生物群的失衡可能是连接激素波动、免疫功能改变和情绪障碍的关键环节。
一项孟德尔随机化分析研究表明,产后抑郁患者的厚壁菌门与拟杆菌门之比(F/B)显著增加,这种菌群失衡与促炎状态相关。
α-变形杆菌属(属于变形杆菌门)、Clostridialesvadin BB60(属于拟杆菌属)和韦荣球菌科(属于厚壁菌门)与抑郁症风险的发展有关。
菌群“守护者”与“破坏者”的博弈
韦荣菌科(Veillonellaceae)通过代谢短链脂肪酸和脂多糖,增强肠道通透性,并激活Toll样受体通路,促进炎症因子释放,进而影响神经可塑性,这可能解释其在抑郁风险中的双重作用。
Clostridiales vadin BB60的保护作用可能通过调节F/B比值实现,与5-HT水平呈正相关,可能通过维持色氨酸代谢稳态发挥保护效应,但其具体机制需结合其对色氨酸代谢的影响进一步阐明。
RuminococcaceaeUCG011(保护性菌群)丰度下降会直接削弱其对5-HT的正向调节作用,5-羟色胺是一种与积极情绪相关的神经递质。
在产后抑郁大鼠模型中,该菌属的减少导致5-羟色胺合成酶(TPH)表达降低,从而引起5-羟色胺水平下降,可能导致情绪和行为调节障碍。
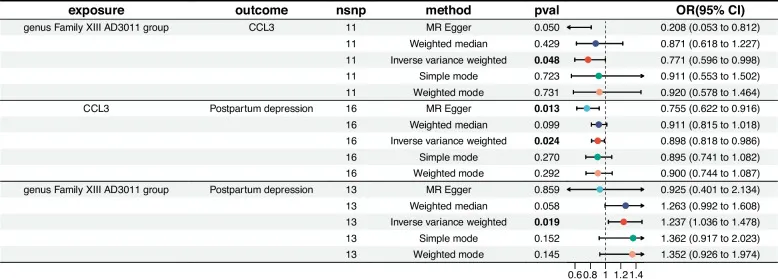
doi: 10.1186/s12884-025-07304-w
炎症——连接肠道菌群与产后抑郁的另一关键
血清趋化因子CCL5(OR=0.878)和CCL3(OR=0.898)水平升高与产后抑郁风险降低显著相关,但其作用机制独立于Family XIII AD3011属的致病效应。
动物实验证实,LPS诱导的神经炎症可导致海马神经元损伤和下丘脑-垂体-肾上腺(HPA)轴过度激活,最终引发皮质醇水平持续升高及突触可塑性受损。
通过对炎症介质的调节,可能能够降低产后抑郁的风险。这一理论为寻找新的干预手段提供了可能的方向。例如,益生菌或其他饮食干预策略被认为能够改善肠道菌群组成,并且有潜力减轻与产后相关的情绪障碍。
目前临床主要通过量表筛查进行初步判断,例如爱丁堡产后抑郁量表(EPDS),然而,量表评估依赖主观感受,可能存在漏诊或延迟干预的风险。近年来科研领域开始关注肠道菌群等相对客观生物标志物与产后抑郁的关联。
纵向研究表明,不同抑郁症状强度的孕产妇肠道菌群存在差异。
产后早期:在产后住院期间(产后1-3天)
中重度抑郁症中Enterobacteriaceae高
中重度抑郁症状组(MG组) Enterobacteriaceae细菌相对丰度显著高于轻度/无抑郁症状组(4.9%vs1.0%,p<0.05)。
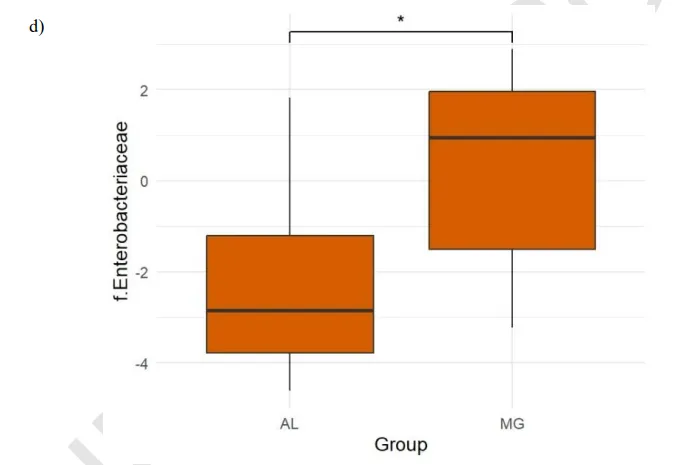
doi.org/10.47626/1516-4446-2024-3721
肠杆菌科细菌由革兰氏阴性菌组成,这些细菌可以转移到循环和淋巴系统,促进免疫反应的增加和炎性细胞因子的释放,如IL-1、IL-6等,这些细胞因子可以穿过血脑屏障并导致神经炎症,这是抑郁症女性的常见情况。
双歧杆菌属增加与抑郁症状评分(EPDS)降低存在相关趋势(p=0.2, cor= -0.19);Enterobacteriaceae与双歧杆菌属之间存在负相关趋势(cor:-0.14, p=0.2)。在接受精神治疗的中重度抑郁组中,双歧杆菌属的丰度随着时间的推移而增加。轻度/无症状组产后Faecalibacterium属丰度较高。
这项研究突显了将肠杆菌科(Enterobacteriaceae)视为妊娠晚期和产后恢复期间母体抑郁症状发作的合理生物标志物或促成因素的重要性。
识别出具有潜在预防或治疗意义的生物标志物,将有助于早期干预和个体化的治疗方案制定,最终减轻产后抑郁对母婴健康的影响。
临床应用思路
像上述研究证据,可以构建多模态评估体系:
通用益生菌、益生元等干预方式
编辑
——直接干预:产后母亲补充益生菌
鼠李糖乳杆菌HN001
针对438名孕妇的双盲试验显示,补充HN001组产后6个月抑郁评分(EPDS)降低(Slykerman et al., 2017)。结果显示,焦虑评分(STAI-6)降低34%,抑郁风险减少50%(p=0.037)。
复合菌株干预
超重孕妇补充鼠李糖乳杆菌HN001+动物双歧杆菌420,产后12个月抑郁症状减轻(Hulkkonen et al., 2021)。
局限性:需联合鱼油使用,单独益生菌效果未达统计学显著。
doi: 10.3390/healthcare10060970
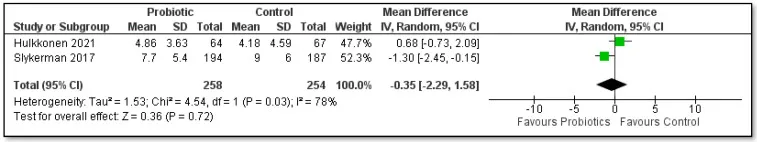
——间接干预:婴儿补充益生菌
罗伊氏乳杆菌DSM 17938
42名肠绞痛婴儿补充该菌株28天,母亲EPDS评分较安慰剂组降低2.3分(p<0.01)(Mi et al., 2015)。减少婴儿哭闹时长,缓解母亲育儿压力。
doi: 10.3390/healthcare10060970
个性化干预
基于上述纵向研究,如果产后女性情绪波动较大,量表评分趋于临界值,肠道菌群检测报告中有上述特征,肠杆菌较高,双歧杆菌较低,则可以针对性补充双歧杆菌来平衡肠道微生态,或者补充相关益生元为肠道有益菌提供养分,或者针对肠杆菌较高的情况进行饮食干预,吃西兰花、菠菜、胡萝卜等,具体情况因人而异。
有时候并不是简单地通过一个菌的高低来判别,而是要看个人肠道生态平衡状态,谷禾肠道菌群检测报告提供了更为精准的个体化干预方案。报告通常包含肠道菌群多样性评估、关键菌种分析以及代谢功能预测,尤其可以关注与情绪调节相关的微生物组成变化,如果偏高或者偏低,则有相关饮食、生活方式等干预措施,为产后女性提供个性化的调整建议。
产后女性可以在传统治疗方法之外,获得一种安全有效的补充干预途径,帮助她们更好地度过产后适应期,降低产后抑郁的风险。
维生素D
维生素D通过调节下丘脑-垂体-肾上腺轴(HPA轴)和促进神经递质合成发挥抗抑郁作用。
伊朗一项病例对照研究发现,维生素 D 水平低的妇女在分娩后 6-8 周患抑郁症的风险更大。
一项荟萃分析研究表明,低水平的维生素 D(低于 50 nmol/l)与产后抑郁的风险增加 3.67 倍相关。
从肠道菌群的角度,补充维生素D增加肠道菌群多样性,普氏菌属丰度增加,而嗜血杆菌和韦荣氏球菌丰度降低;促进双歧杆菌等益生菌生长,这些菌群参与血清素合成。维持肠道屏障完整性,减少促炎因子释放,调节免疫系统,改善Th17/Treg平衡。
一项研究发现,在怀孕的最后 2 周和分娩后的前 8 周每天服用 2,000 单位维生素 D 可以降低患产后抑郁的风险。
一项临床研究还发现,服用 2000 IU/d 的维生素 D 可以减轻抑郁症状。
B族维生素
维生素 B1 (硫胺素)
硫胺素是一种水溶性维生素,不会储存在体内,必须每天从牛肉、鸡肉、谷物、坚果和豆类等来源摄入。孕妇和哺乳期妇女每日需求量为 1.4 毫克。它对神经递质合成和能量产生至关重要,其缺乏会导致脑干变化和抑郁症状。补充硫胺素可以改善这些症状。
维生素 B2 (核黄素)
核黄素常见于乳制品、瘦肉、肝脏、绿叶蔬菜和酵母中,一项队列研究表明,适量摄入维生素 B2 有助于降低患产后抑郁的风险。
维生素 B6 (吡哆醇)
维生素 B6 或吡哆醇可以来自肉类、家禽、鱼、蛋、白土豆和淀粉类蔬菜。这种维生素对于血清素和多巴胺等必需神经递质的生物合成至关重要,这些神经递质可以改善情绪和认知功能。
抑郁症患者的同型半胱氨酸水平通常较高,而叶酸和维生素 B6 水平较低。同型半胱氨酸是一种非必需的硫氨基酸,对血管有毒并导致氧化应激和细胞死亡。 一项研究表明,服用维生素 B6 可以独立降低产后抑郁的发病率。
维生素 B12
血液中维生素B 的正常水平在147.6~664.2 pmol/L 之间。VB12 缺乏导致同型半胱氨酸水平增加以及叶酸和 VB12 效率降低,因为它被困在 5-甲基四氢叶酸循环中,而不是四氢叶酸的活性形式。
叶酸和VB12 在中枢神经系统的几种代谢途径中起着至关重要的作用。血清同型半胱氨酸水平升高表明VB12 和叶酸缺乏,见于抑郁症患者。
也有一项系统评价发现血清VB12、叶酸、铁蛋白水平与产后抑郁风险之间没有关联。
补充VB12 和叶酸可能在一定程度上提供保护作用,降低这些疾病的发病风险。
关于B族维生素和肠道菌群的关联,在我们之前的文章中有详细阐述:
铁
红肉、肝脏、种子、豆类和牡蛎等食物是铁的丰富来源。各种研究表明,与其他母亲相比,患有贫血的女性往往会经历更严重的产后抑郁。妊娠期贫血的诊断和治疗有助于降低患产后抑郁的风险。此外产后低铁蛋白水平也会导致产后抑郁。
中国一项涉及 1,592 名女性的队列研究表明,从怀孕期间开始摄入铁超过 6 个月有助于降低分娩后 6 个月和 12 个月患抑郁症的风险。
然而,另一项研究发现母体血清铁与产后抑郁症状之间没有关联。
一项对 649121 样本进行的 10 年高质量队列研究表明,在分娩后第一年,贫血和抑郁症之间存在显著关联。
维生素 C
维生素 C 在防止氧化应激方面起着至关重要的作用。它还充当一组酶的辅助因子,这些酶负责调节和合成整个身体的重要功能。
一项研究表明,高剂量的维生素 C(每天 3 克)可以降低 PPD 的严重程度。然而,另一项研究发现,压缩的橙皮滴剂对 PPD 或焦虑没有任何影响。
锌
锌是一种稀有金属离子,是人体中仅次于钙的第二大元素。它在免疫和内分泌系统中都起着至关重要的作用。锌负责刺激和抑制中枢神经系统中的化学介质。
根据一项全面的荟萃分析,抑郁症女性的血锌水平(1.85 μmoll/L)低于非抑郁症女性。
此外,一项系统评价发现,低锌水平与产后抑郁风险较高有关。然而,几项研究表明血清锌水平与产后忧郁综合征之间没有相关性。
此外,一项临床试验发现,锌对减轻产后焦虑和抑郁症状没有显着影响。
必需脂肪酸
必需不饱和脂肪酸,也称为多不饱和脂肪酸 (PUFA),分为两大类:n-6 和 n-3。
Omega-3 是一种亚麻酸,来自三个脂肪组,即 α-亚麻酸(ALA)、二十碳五烯酸(EPA)、二十二碳六烯酸(DHA)。n-3 多不饱和脂肪酸摄入量与产后抑郁之间的显著正相关。
研究表明,低水平的 omega-3 脂肪酸与产后抑郁高风险之间存在联系。其中,DHA 的作用更为明显。怀孕和哺乳自然会降低 DHA 水平。
然而,DHA 和产后抑郁之间的联系并不一致。在一项干预研究中,即使血清水平较低的女性每天摄入 200 毫克 DHA,产后前 4 个月内产后抑郁的患病率也没有变化。
一些研究发现鱼类摄入量或 omega-3 补充剂与产后抑郁之间没有相关性。一般来说,系统评价无法在omega-3脂肪酸和产后抑郁之间建立有效的关系。然而,素食中产后抑郁的患病率高于杂食性饮食。
碳水化合物
碳水化合物在能量产生中起着至关重要的作用,会影响情绪。研究表明,怀孕会导致胰岛素抵抗,这会使女性更容易患抑郁症和葡萄糖耐量受损。
一项队列研究发现,患有妊娠糖尿病的女性在怀孕和产后患抑郁的风险明显更高。此外,据推测,分娩后胰岛素水平降低,会降低血清素水平并导致抑郁症。血糖水平的波动也会导致炎症和脂肪因子标志物的分泌,例如白细胞介素IL-6,这些标志物与产后抑郁有关。
一项队列研究发现血糖指数与产后抑郁之间没有关联。
最后,低碳水化合物饮食往往会增加患抑郁症的风险,因为它们会减少大脑中血清素的产生。然而,富含碳水化合物的食物通过触发色氨酸的产生来促进幸福感。
临床实践中,产后女性补充维生素可以结合肠道菌群检测报告,针对个体差异制定个性化补充方案,以达到改善肠道菌群结构、提升情绪状态的最佳效果。
整合检测与干预
基线评估:产后进行首次肠道菌群检测与心理健康评估,建立个体基准数据。
分层干预:
动态监测:3个月左右复查肠道菌群和情绪状态,及时调整干预方案。
通过”检测-干预-评估-调整”的模式,产后女性可以获得高度个性化的维生素补充方案,靶向调节肠道菌群生态,有效支持情绪调节系统,实现身心健康的协同优化。
产后便秘、高血糖
产后便秘在新妈妈中较为常见,据相关研究显示,产后便秘的发生率在不同地区和人群中有所差异,但总体上可达到 20% – 40%。顺产和剖宫产的产妇均可能出现便秘问题,但剖宫产产妇由于手术和卧床休息等因素,便秘的发生率相对更高。长期便秘还可能增加患肠道疾病的风险。
分娩过程中抗生素使用、应激反应以及生理变化都会扰乱原有的肠道菌群平衡。特别是剖宫产女性,抗生素使用可能导致肠道菌群短期内显著改变,抗生素引起的生态失调会导致胆碱能神经元和整体肌间神经元减少,影响肠道蠕动。
产后盆底肌肉松弱或损伤会影响排便功能,而肠道运动减慢进一步导致粪便在肠道停留时间延长。关于盆底肌康复在下一章节介绍。
产后女性饮食习惯改变(如纤维摄入不足)、活动减少、水分摄入不足等因素,直接影响肠道菌群组成。
干预措施
饮食
增加膳食纤维的摄入是缓解产后便秘的重要方法。产妇应多吃蔬菜、水果、全麦面包等富含膳食纤维的食物,以增加粪便体积,促进肠道蠕动。同时,保持充足的水分摄入也很重要,每天至少饮用1500-2000毫升水,有助于软化粪便,使其更容易排出。
生活方式
适当运动可以促进肠道蠕动,缓解便秘症状。产后身体条件允许的情况下,新妈妈可以进行一些简单的运动,如散步、产后瑜伽等。
每天坚持 30 分钟左右的运动,有助于增强腹肌力量,促进排便。
定时排便训练
晨起或餐后2小时内尝试排便,利用生理性肠蠕动高峰(胃结肠反射)建立规律。
药物辅助
在医生指导下使用开塞露等药物,但不宜长期使用,以免形成依赖。乳果糖口服溶液也可在医生指导下使用,增加大便体积,缓解便秘。
中药如黄连上清丸、枳实导滞丸等,具有健脾消食、通腑泻下的作用,适用于产后气血虚弱所致的便秘。
腹部按摩
顺时针方向轻柔地按压下腹部,每次持续5-10分钟,有助于促进肠胃蠕动,缓解便秘症状。
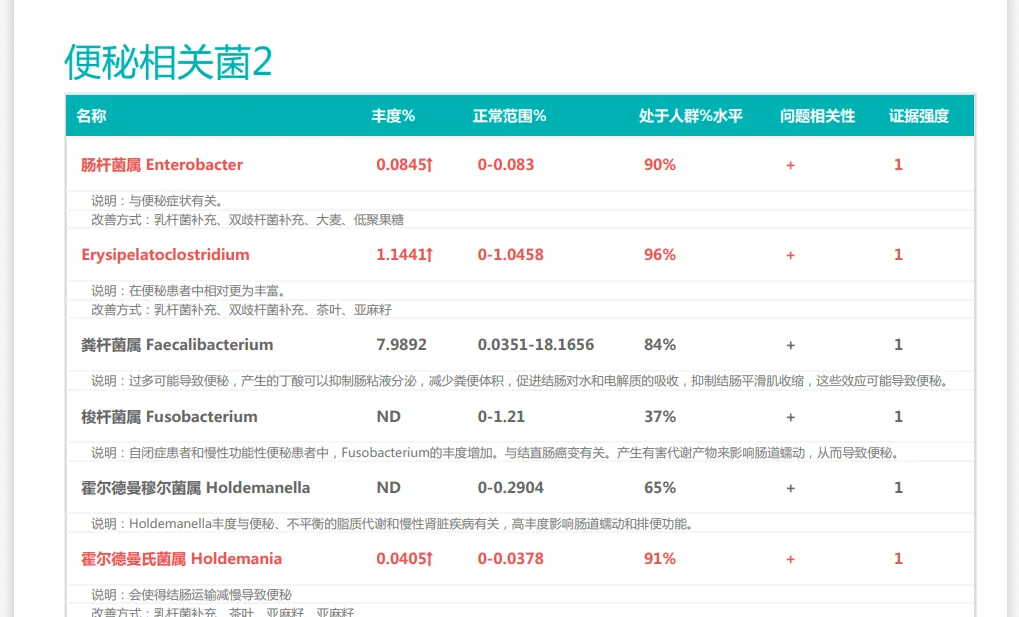
以上是普适性的干预方式,我们也了解到,产后便秘的发生与肠道菌群失调密切相关,每个人肠道菌群不一样,便秘的原因也可能不一样。通过专业的肠道菌群检测,可以了解产后女性肠道微生物组成的具体情况,比如产丁酸菌的丰度、双歧杆菌和乳杆菌等有益菌的数量,以及潜在致病菌如艰难梭菌的水平。
如果是菌群紊乱的原因,那么结合菌群检测结果进行精准干预效果会更为显著。例如,对双歧杆菌缺乏的产妇可重点补充特定双歧杆菌株;对产丁酸菌不足者,可增加膳食纤维和低聚果糖等益生元摄入。
谷禾肠道菌群检测报告有便秘相关菌群过多或过少的提示,根据个人菌群报告可以有针对性地干预。
<来源:谷禾健康肠道菌群检测数据库>
这种个性化的微生物干预策略,不仅能更有效缓解便秘症状,还能从根本上改善肠道微生态环境,促进产后整体健康恢复。
一小部分女性产后出现血糖调节能力异常的状况,更有甚者这些女性可能会在产后5-10年内发展为2型糖尿病。
产后高血糖的常见表现
餐后异常疲劳感、口渴增加、排尿频繁、视力模糊、伤口愈合缓慢,以及无法解释的体重变化。
为什么产后会出现血糖波动?
分娩后胎盘激素急剧下降,理论上有利于胰岛素敏感性恢复,但实际情况更为复杂。
产后激素变化剧烈,催乳素和皮质醇水平波动可直接影响血糖;激素变化也会改变肠道菌群组成。
研究表明妊娠期糖尿病患者的肠道菌群失调在产后8个月仍然存在,拟杆菌减少,厚壁菌增加,这种菌群失衡直接影响肠道产生的短链脂肪酸水平,进一步影响胰岛素敏感性。
睡眠不足和作息紊乱会增加应激激素分泌,干扰胰岛素功能;这些因素也会改变肠道微生态环境,导致肠道通透性增加,使细菌代谢产物和内毒素进入血液循环,引发低度炎症反应。
产后恢复期能量消耗模式变化,哺乳消耗增加而活动量可能减少;
产后子宫收缩、伤口愈合和组织修复过程会导致代谢状态波动。同时,身体组成变化如脂肪分布调整也会影响葡萄糖代谢。这些生理变化通过改变肠道微环境pH值、氧气含量和营养物质分布,进一步影响肠道微生物组成。
这些因素共同作用,使产后血糖波动大且不可预测,特别是在产后头三个月。
产后阶段是女性身体快速恢复和调整的关键期,尤其对于妊娠期糖尿病的新妈妈,这一时期的营养管理更为重要,直接关系到恢复质量和未来健康风险。
肠道菌群检测帮助早期风险预警,辅助干预
相比传统血糖检测,菌群变化可能是代谢异常的更早期信号,为高风险人群提供预防性干预的时间窗口。
通过肠道菌群检测识别个体特异性的菌群失衡模式,结合临床指标(如炎症因子IL-6、皮质醇水平)建立个人”菌群-代谢”关联模型。
跟踪干预措施对肠道菌群的调节效果,为调整干预方案提供客观依据。
相关产后康复中心或临床营养或健康管理机构,可以根据菌群结构设计低血糖指数的膳食模式,针对特定菌群不足,选择相应的益生元食物。基于个体菌群特性,调整蛋白质、脂肪和碳水化合物的比例。
这种微生态层面的干预不仅能帮助产妇更有效地管理血糖,还能从根本上改善代谢健康,降低未来发展为2型糖尿病的风险。
盆底肌损伤
产后盆底肌损伤是许多产妇面临的常见问题。盆底肌损伤会引发尿失禁、漏尿、性生活质量下降、盆腔器官脱垂、衰老等问题。研究表明,产后妇女盆底功能异常发生率为50-64%。
什么是盆底肌?
盆底肌是指位于骨盆底部的一组肌肉和筋膜组织,像一张“吊网”一样支撑着盆腔内的器官,包括膀胱、子宫、阴道和直肠等。盆底肌在维持盆腔器官正常位置、控制排尿和排便、支持性功能以及保持盆腔稳定等方面发挥着重要作用。
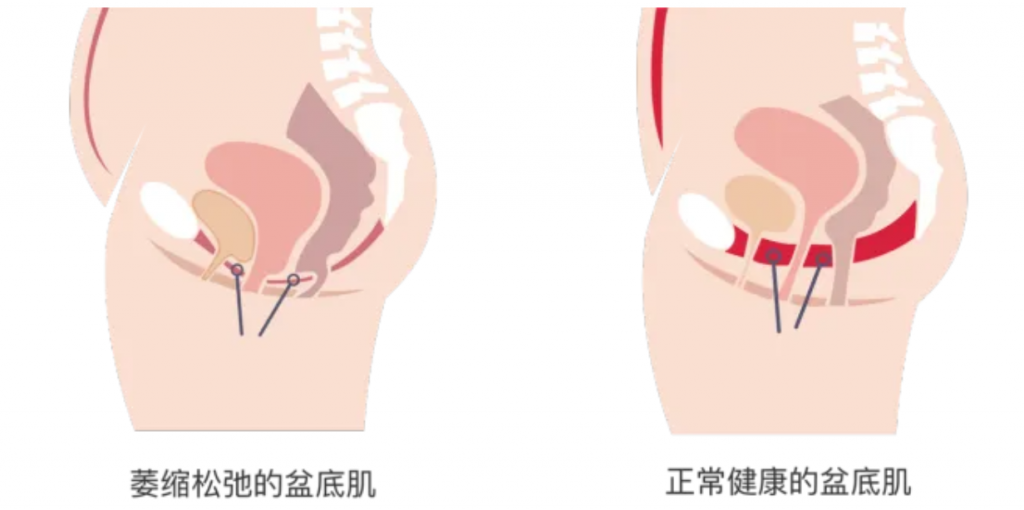
编辑
盆底肌损伤的原因
分娩压力:分娩过程中,胎儿通过产道时会对盆底肌肉施加巨大压力,导致肌肉损伤或拉伸,同时阴部神经牵拉导致神经传导功能下降,引发肌肉失用性萎缩。
激素变化:妊娠期孕激素和松弛素水平升高,抑制胶原蛋白合成,降低盆底肌的承托能力;产后雌激素骤降则延缓肌肉修复进程。
体重增加:怀孕期间体重的增加也会对盆底肌肉造成额外负担。
产后盆底肌修复
盆底肌训练(PFMT)
盆底肌训练是预防和治疗产后尿失禁的有效方法。训练通常包括收缩和放松盆底肌肉的动作,如凯格尔运动(Kegel exercises),并建议在专业理疗师或护理护士的指导下进行。
具体做法是找到盆底肌肉,在排尿时尝试中断尿流,然后收紧并上提盆底肌,保持5秒钟,然后放松10秒钟,每天进行3次,每次10-15分钟。
注:美国妇产科医生 Dr. Arnold Kegel 于 1948 年创建了盆底肌锻炼法,简称 Kegel 法,即指导患者做提肛运动。通过自主的、反复的盆底肌肉群的收缩和舒张,增强支持尿道、膀胱、子宫和直肠等脏器的盆底肌张力,恢复盆底肌功能。
生物反馈疗法
生物反馈疗法通过监测盆底肌肉的活动,让产妇直观了解自身肌肉收缩情况,帮助患者正确执行训练动作,提高康复效果。
电刺激疗法
电刺激疗法则通过特定频率和强度的电流刺激盆底肌肉或腹部肌肉,促进肌肉收缩,增强肌力。
一般来说,一周 3-5 次治疗,一疗程 10 次,每次 20-30 分钟,2-3 疗程。
但电刺激治疗需要专业设备和技术支持,且治疗过程可能会给产妇带来不适感。
中医调理
补肾固涩类方剂:如四神丸、金匮肾气丸等,用于调节内分泌系统,缓解压力性尿失禁。
健脾利水类中药:适用于气血虚弱导致的尿失禁及漏尿。
针灸疗法:通过在特定穴位如百会穴、关元穴等进行针刺,促进血液循环,帮助盆底肌修复。
手术治疗
对于严重的盆底肌损伤,如盆腔器官脱垂,严重尿失禁,影响日常生活,可能需要手术治疗。
尿道中段悬吊术(TVT/TOT):治愈率达85%-90%,但5年内复发率约10%-15%,且可能引发膀胱穿孔。
其他
使用盆底康复仪进行训练,可以帮助患者更有效地进行盆底肌锻炼。
针对性训练如腹式呼吸、脚趾叩击等也有助于增强盆底肌肉的力量。
多模式康复方法
多模式康复方法通过综合多种手段,以达到最佳康复效果。
Wang 等人的研究中,48 名产后腰骶骨盆疼痛女性参与随机对照试验,干预组接受为期 12 周的盆底肌训练结合腰背部肌肉神经肌肉电刺激,对照组仅接受神经肌肉电刺激。结果显示,干预组在 6 周和 12 周时疼痛、功能障碍和生活质量的身体领域均有显著改善。
进一步的研究由 Bhat 等人完成,比较了结合性唤起的凯格尔训练与单独凯格尔训练对产后盆底肌力和性功能的提升效果,涉及性活跃的初产阴道分娩女性。结果显示,结合性唤起的组别在每月评估中盆底肌力和性功能均有显著提升。这进一步证实了多模式康复方法的有效性,为产后康复提供了更多选择和可能性。
总的来说,骨盆底训练成为最常见的方法,躯干稳定练习和电刺激也强调恢复骨盆和核心力量。此外,创新技术,如脊椎按摩疗法,针灸等也是不断发展的产后护理方式。
这些产后康复方法不仅关乎生理恢复,更与产妇心理健康密切相关。研究表明,身体不适与心理健康之间存在双向互动关系。当产后女性遭受尿失禁、便秘或持续疼痛等困扰时,往往伴随着自尊心降低和社交回避倾向。
随着症状改善,产后女性对身体恢复的信心增强,减轻对永久性损伤的焦虑;其次,运动本身促进内啡肽分泌,天然调节情绪;运动通过影响肠道菌群组成间接改善了与情绪调节相关的神经递质平衡。
每一位母亲的产后康复都应被视为身心一体的整体康复过程。专业机构在设计产后康复方案时,如果超越传统的身体功能修复视角,整合肠道菌群调节的微生态方法,则能建立更全面、更有效的产后健康支持体系,帮助每位妈妈在迎接新生命的同时,也能守护自己的身心健康。
产后女性经历剧烈的生理重构,从激素波动到代谢变化,这些变化直接影响肠道微生态,而肠道菌群失衡又反过来影响产后恢复质量,形成复杂的双向调控网络。正是这种复杂的生理重构过程,使得产后康复面临独特挑战。
肠道菌群作为人体最大的微生态系统,不仅参与营养物质代谢和免疫调节,还通过肠-脑轴直接影响情绪和认知功能,是连接产后各种健康问题的核心纽带。通过解析产后女性独特的菌群变化特征,可以更精准地把握康复关键,从根本上促进身体各系统协调恢复。
目前,在临床应用中,肠道菌群检测不仅可辅助诊断产后抑郁、便秘和血糖异常等问题,更能通过”菌群-疾病”关联模型指导个性化治疗方案设计,减少药物依赖,缩短治疗周期。
月子中心可基于菌群检测结果定制营养餐,调节双歧杆菌、产丁酸菌等关键菌群,同时通过环境菌群优化降低感染风险,为母婴健康奠定微生态基础。
对健身机构而言,菌群检测结合训练能显著提升燃脂效率,使腰围减少更显著。健康管理机构通过菌群监测预警代谢风险,实施早期干预,避免产后5-10年内发展为2型糖尿病的风险。
未来,肠道菌群检测将与数字技术深度融合,推动产后康复服务从”经验型”向”精准型”转变。菌群检测+AI分析将实现健康异常早期预警;功能性菌株筛选与应用将催生新一代产后康复产品;母婴菌群联动管理将形成全新的家庭健康解决方案。
临床-科研-产业-政策四维联动机制,可以共同构建如”产后菌群健康分级评估指南”,制定产后菌群健康指导标准,推动产后菌群药物和营养品开发,为产后康复提供科学指导。
注:本账号内容仅供学习和交流,不构成任何形式的医疗建议。
主要参考文献
Mota AS, Sparvoli LG, Vanzele PAR, Naspolini NF, Tobaruela EC, Yoshizaki CT, Francisco RPV, Oliveira AMSS, Galletta MAK, Tess VLC, Taddei CR. Longitudinal Gut Microbiota Composition During Perinatal period in Women with Different Intensities of Depressive Symptoms. Braz J Psychiatry. 2024 Sep 21.
Wallace CJ, Audet MC. Diet and the gut microbiota-immune axis in the context of perinatal mental health: Protocol for a prospective cohort study. Womens Health (Lond). 2024 Jan-Dec;20:17455057241277072.
Wallace CJ, Audet MC. Diet and the gut microbiota-immune axis in the context of perinatal mental health: Protocol for a prospective cohort study. Womens Health (Lond). 2024 Jan-Dec;20:17455057241277072.
Macphail MG, Juul S, Wollny K, Negre JY, Metcalfe A, Chaput KH, Butalia S, Nerenberg KA. Nutrition Interventions for Lowering Cardiovascular Risk After Hypertensive Disorders of Pregnancy: A Systematic Review. CJC Open. 2023 Nov 4;6(2Part B):195-204.
Trifkovič KČ, Mičetić-Turk D, Kmetec S, Strauss M, Dahlen HG, Foster JP, Fijan S. Efficacy of Direct or Indirect Use of Probiotics for the Improvement of Maternal Depression during Pregnancy and in the Postnatal Period: A Systematic Review and Meta-Analysis. Healthcare (Basel). 2022 May 24;10(6):970.
Strobel KM, Juul SE, Hendrixson DT. Maternal Nutritional Status and the Microbiome across the Pregnancy and the Post-Partum Period. Microorganisms. 2023 Jun 13;11(6):1569.
Weerasuriya W, Saunders JE, Markel L, Ho TTB, Xu K, Lemas DJ, Groer MW, Louis-Jacques AF. Maternal gut microbiota in the postpartum Period: A Systematic review. Eur J Obstet Gynecol Reprod Biol. 2023 Jun;285:130-147.
Ghaedrahmati M, Alipour Z. The Association between Post-Partum Depression and Nutrition and Dietary Patterns: Systematic Review. Iran J Nurs Midwifery Res. 2024 Jul 2;29(3):280-289.
Neumann CJ, Pausan M-R, Haid V, Weiss E-C, Kolovetsiou-Kreiner V, Amtmann B, Winkler P, Mahnert A, Jantscher-Krenn E, Moissl-Eichinger C. The dynamics of the female microbiome: unveiling abrupt changes of microbial domains across body sites from prepartum to postpartum phases. Microbiol Spectr. 2024 Jun 25;12(8):e0014724.
Dellapiana, G., Nguyen, Q.T. & Naqvi, M. Navigating Postpartum Weight Loss: Evidence and Interventions. Curr Obstet Gynecol Rep 13, 207–212 (2024).
Ionescu RF, Enache RM, Cretoiu SM, Gaspar BS. Gut Microbiome Changes in Gestational Diabetes. Int J Mol Sci. 2022 Oct 25;23(21):12839.
Hasain Z, Mokhtar NM, Kamaruddin NA, Mohamed Ismail NA, Razalli NH, Gnanou JV, Raja Ali RA. Gut Microbiota and Gestational Diabetes Mellitus: A Review of Host-Gut Microbiota Interactions and Their Therapeutic Potential. Front Cell Infect Microbiol. 2020 May 15;10:188.
Hasain Z, Mokhtar NM, Kamaruddin NA, Mohamed Ismail NA, Razalli NH, Gnanou JV, Raja Ali RA. Gut Microbiota and Gestational Diabetes Mellitus: A Review of Host-Gut Microbiota Interactions and Their Therapeutic Potential. Front Cell Infect Microbiol. 2020 May 15;10:188.
Ohene-Agyei P, Iqbal A, Harding JE, Crowther CA, Lin L. Postnatal care after gestational diabetes – a systematic review of clinical practice guidelines. BMC Pregnancy Childbirth. 2024 Nov 4;24(1):720.
Xu H, Liu R. Comprehensive management of gestational diabetes mellitus: practical efficacy of exercise therapy and sustained intervention strategies. Front Endocrinol (Lausanne). 2024 Oct 3;15:1347754.
Gunabalasingam S, Kyrka A, Hopkins L, Lebrett R, Dyer E, Forde R, Heslehurst N, Meek CL, Schoenaker DAJM, Flynn AC, White SL. Interventions in women with type 2 diabetes mellitus in the pre-pregnancy, pregnancy and postpartum periods to optimise care and health outcomes: A systematic review. Diabet Med. 2025 Jan;42(1):e15474.
Juncker HG, Jakobsen RR, Naninck EFG, Davids M, Herrema H, van Goudoever JB, de Rooij SR, Korosi A. Maternal stress in the early postpartum period is associated with alterations in human milk microbiome composition. Brain Behav Immun. 2025 Feb;124:74-84.
谷禾健康

抑郁症和抑郁情绪是不一样的,如果说抑郁情绪是一阵悲伤或沮丧,那么抑郁症可以具有巨大的深度和持久力。抑郁症不只是沮丧发作,也不是性格弱点,无法以“快刀斩乱麻”的方式轻松摆脱。
世界卫生组织统计,全球约10亿人正在遭受精神障碍困扰,新冠疫情后,全球精神障碍疾病负担更加沉重,抑郁症患者激增 5300万,增幅高达 27.6%。受抑郁症影响的女性多于男性。
抑郁症患者通常会出现持续的压抑,兴趣减退,动力不足;除了在情绪上的悲观冷漠之外,很多抑郁症患者还常伴有食欲不振、便秘等胃肠道症状。

抑郁症是一种多因素,多重机制参与的复杂的疾病,病情绵长。它与神经递质表达异常、炎性因子分泌、神经细胞通路改变、下丘脑-垂体-肾上腺(HPA)轴持续紊乱、肠道菌群改变及线粒体结构异常等诸多因素有关。
抑郁症在中医中属于“郁证”的范畴,几千年前的书籍中就已有所记载。《黄帝内经》中所述 “心主血脉、心主神志” , 这里“神志之心”与现代医学脑的生理功能基本对应,中医学“心与小肠相表里”理论与现代医学提出的“脑-肠轴”理论相通,其部分内涵可以理解为中枢神经系统与肠道菌群的密切关系。
近年来,越来越多的中药、中药复方被证实可以发挥抗抑郁作用,人们开始认识到中医药通过调节肠道菌群而影响抑郁症发生发展,这为抑郁症的治疗提供新思路。
本文主要介绍肠道菌群和抑郁症之间的关联,窥探中医与肠道菌群之间的微妙关联,以及基于肠道菌群来探讨中医药改善抑郁症的相关机制。
本文主要内容如下:

抑郁症是一种常见的医学疾病,会对感受、思维方式和行为方式产生负面影响。它是一种复杂的疾病,有多种成因,包括各种生活方式、饮食、环境和遗传因素。
▼ 常见的抑郁症症状有哪些?
抑郁的人通常会出现以下几种症状:

▼ 抑郁症有哪些类型?
不同类型抑郁症的例子包括:
双相情感障碍、重度抑郁症(临床抑郁症)、持续性抑郁症和季节性情感障碍。
双相情感障碍的人会经历抑郁和躁狂(情绪异常升高)或轻躁狂(明显但不一定异常的情绪升高)交替状态。
重度抑郁症的特征是严重的症状会扰乱个人的日常生活,通常会影响食欲、睡眠、工作或享受生活的能力。
持续性抑郁症涉及持续两年或更长时间的症状,有时以严重抑郁症发作为特征。
其他类型的抑郁症包括产后抑郁症、精神病性抑郁症和季节性情感障碍,每一种都在特定情况下发生。
产后抑郁症发生在女性分娩后的时期。症状包括焦虑、对照顾婴儿缺乏兴趣,以及悲伤、绝望或无能为力的感觉。
精神病性抑郁症是在精神病的背景下出现的,精神病可能涉及妄想、幻觉或偏执的症状。
季节性情感障碍的特点是抑郁症状在秋季和冬季发作,随着春季和夏季暴露于自然光的增加而缓解。
▼ 哪些人群患抑郁症的风险相对较高?
▼ 有什么方法可以治抑郁症?
目前用的较多的是药物和心理疗法。
目前常用的药物包括:
抗抑郁药可能会在使用的第一周或两周内产生一些改善,但可能需要两到三个月才能看到效果。
心理疗法帮助一个人识别扭曲/消极的想法,以更积极的方式应对生活中的挑战。
例如与他人建立积极的互动关系,识别消极的信念和行为并改善,学习设定切实可行的人生目标等。
心理疗法或“谈话疗法”有时单独用于治疗轻度抑郁症;对于中度至重度抑郁症,心理治疗通常与抗抑郁药物一起使用。
其他疗法包括:
电惊厥疗法、经颅磁刺激、按摩疗法、音乐或艺术疗法、瑜珈(或太极或冥想)、时间疗法、针灸疗法、写作疗法、光疗、有氧运动、基于肠道菌群调节的补充剂非药物疗法(包括益生菌、益生元等)等。
▼ 什么原因可能导致抑郁症?
与抑郁症发生相关的因素可能有很多:
自尊心低、容易被压力压垮,对自己和世界产生消极想法,这样的人群似乎更容易患抑郁症。
持续暴露于暴力、忽视、虐待或贫困等不良环境,或不利的生活事件,会增加一个人患抑郁症的可能性或引发抑郁发作。
抑郁症可以在家族中遗传。例如,如果同卵双胞胎中的一个患有抑郁症,则另一个有 70% 的机会在一生中的某个时候患上抑郁症。
抑郁症的发病机制复杂且仍然难以摸透,目前已经提出了几种假说/理论来从不同的角度解释临床表现。
抑郁症的病理学
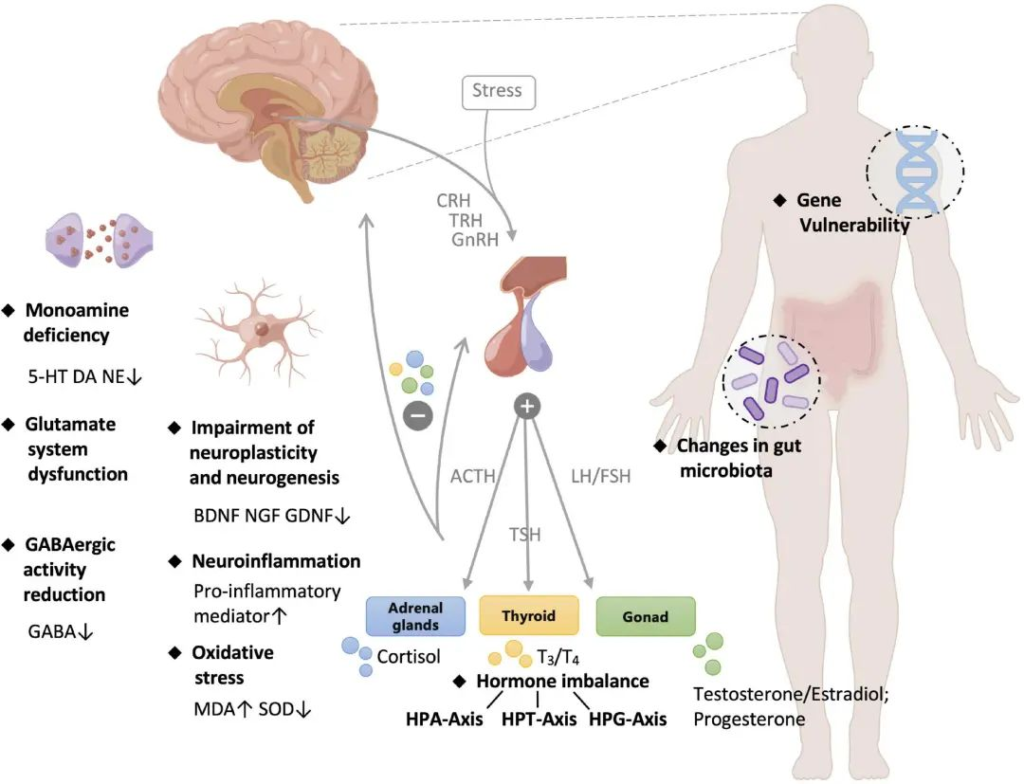
doi.org/10.3389/fpsyt.2022.1054726
单胺假说:
谷氨酸能假说和 GABA 能缺陷假说:
激素失调:
神经发生和神经可塑性假说:
肠道菌群理论:
关于肠道菌群如何通过微生物群-肠-脑轴影响抑郁症,我们在下一章节详细阐述。
肠道菌群与人体是共生互利密不可分的统一体, 又被称为人的 “ 第二大脑 ” ,它的作用不仅局限于胃肠道,还可以通过 “脑-肠轴” , 参与调控脑发育、应激反应、焦虑抑郁、认知功能等中枢神经系统的活动,从而对脑的功能和行为产生重大影响。肠道菌群、肠道、脑三者间密切的信息交流,共同影响人的喜怒哀乐。
抑郁患者常伴有胃肠功能障碍, 表现在食欲不振、代谢紊乱、胃肠功能紊乱及肠道菌群异常等方面的问题。即便不是抑郁症患者,我们回想一下,有时候对某些事件感到压抑,恐惧等情绪,或者一些状况感到焦虑的时候:是不是也会经历某种肠道不适,比如恶心、反胃、腹泻等。
胃肠道和大脑之间似乎有着某种联系,如果说大脑可以影响肠道,那么反过来肠道是不是也能影响大脑?这种联系究竟是怎么发生的?
本章节我们详细了解其中的故事。

近期发表在《自然通讯》杂志上的两项研究发现,肠道中的几种细菌与抑郁症状之间存在联系。
一 “抑郁症状的肠道微生物组关联研究” :

该研究调查了来自鹿特丹研究队列的 1,054 名参与者的粪便微生物组多样性和组成与抑郁症状的关系,并在 1,539 名受试者的阿姆斯特丹 HELIUS 队列中验证了这些发现。
研究人员确定了 13 个与抑郁相关菌群,包括:
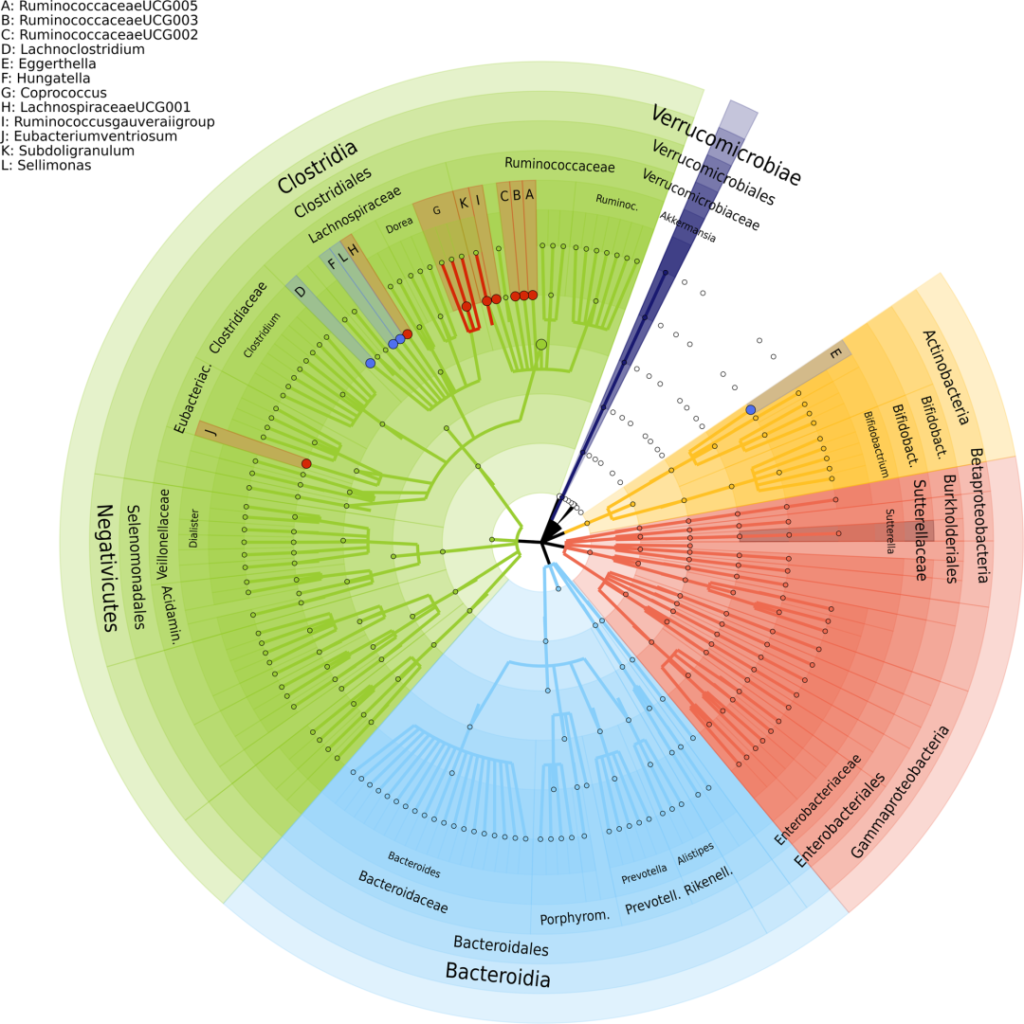
红点表示与抑郁症状负相关的属,蓝色点表示与抑郁症状正相关的属。最外层描述了门级,然后是纲、目、科和属级。
已知这些细菌参与谷氨酸、丁酸、血清素和γ-氨基丁酸 (GABA) 的合成,这些是抑郁症的关键神经递质。该研究表明,肠道微生物组成可能在抑郁症中发挥关键作用。
二 “跨种族的肠道菌群和抑郁症状”的研究:
不同种族群体的微生物组和抑郁症状水平差异很大。因此,任何针对微生物组的抑郁症干预都需要了解不同种族的微生物组抑郁症相关性。

通过分析HELIUS队列的数据,研究人员描述了生活在同一城市地区的6个种族群体(荷兰、南亚苏里南、非洲苏里南、加纳、土耳其、摩洛哥;N=3211)的肠道微生物群及其与抑郁症状的关联。
考虑到人口统计学、行为学和医学差异,肠道菌群在个体内部(α多样性)和个体之间(β多样性)可预测抑郁症状水平。
β多样性解释了29%-18%的抑郁症状的种族差异。与抑郁症状相关的细菌属属于多个科,主要包括:
该研究结果表明,肠道微生物群与抑郁症状水平相关,这种关联在不同种族群体中普遍存在。肠道微生物群的种族差异可能部分解释了抑郁症的平行差异。
以上我们了解到肠道菌群和抑郁症之间的关联。那么肠道菌群是如何影响抑郁症的?这就涉及到一个概念:
“ 微生物群-肠-脑轴 ”
1980 年,由于对神经元和脑细胞中胃肠内分泌系统的激素信号传导的研究发现,肠-脑轴的概念意外诞生。在接下来的几十年里,这一概念得到进一步加强和扩展,包括微生物群对肠-脑轴的贡献。
目前,微生物群-肠-脑轴更像一个复杂的循环而不是单向关系,它代表了宿主体内中枢神经系统、内分泌化学信号系统、免疫调节、微生物群和代谢效应,以及大脑和肠道的屏障功能之间的相互作用。
以上这些因素的协调对维持个体的健康状态起着重要作用。如果微生物群-肠-脑轴失衡,则会引起包括抑郁症等精神障碍。
我们前面的文章已经讨论过,肠道菌群可以通过许多潜在途径影响抑郁症,从大脑神经元到肠道小分子。
这里我们结合最新研究再了解一下,通常肠道菌群可以通过以下三种主要途径参与抑郁症,包括:
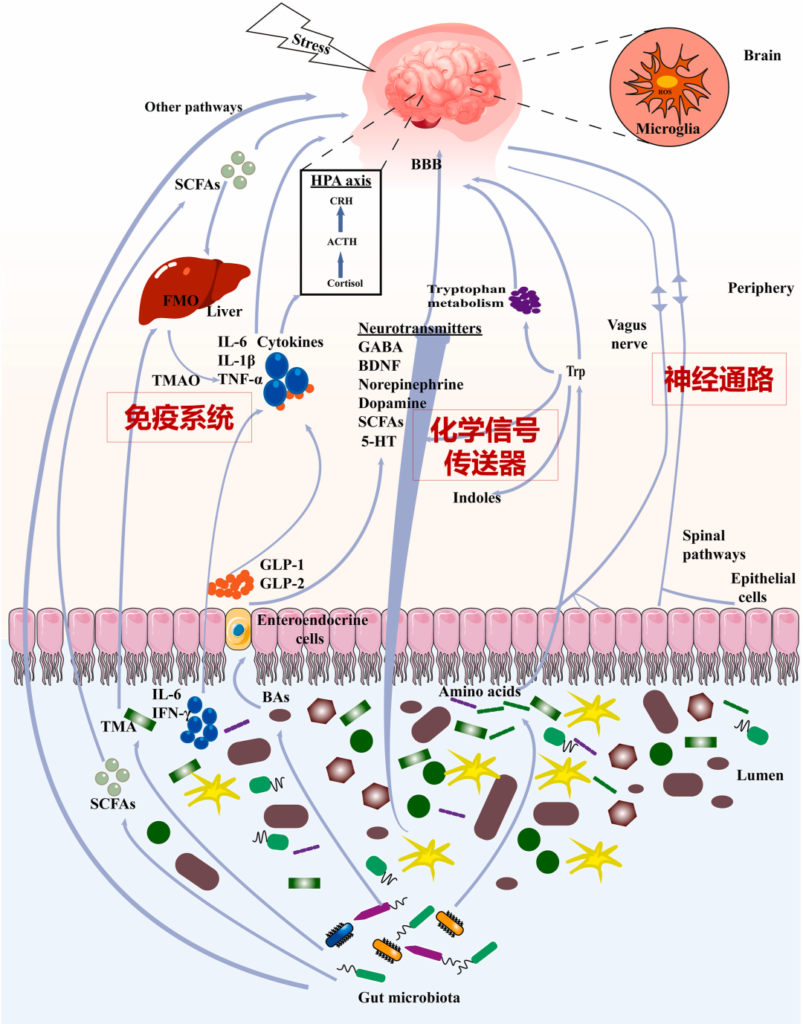
肠道微生物群和大脑之间的沟通途径
编辑
Li B, et al., J Ethnopharmacol. 2023
肠道菌群和大脑的沟通方式包括:
迷走神经、脊髓通路、短链脂肪酸(SCFA)、吲哚、色氨酸(Trp)、γ-氨基丁酸(GABA)、脑源性神经营养因子(BDNF)、去甲肾上腺素、多巴胺、5-羟色胺(5-HT)、细胞因子等。
接下来,我们就以上这些,逐一了解每个途径具体的运作方式。
Part 1 化学信号
▼
神 经 递 质 ——“信号兵”
神经递质是指脑内的化学物质,它们可以在神经元间的信息传递中起着重要作用,也就是充当“信号兵”的作用。根据其化学成分,神经递质分为:
神经递质——单胺
抑郁症的发病与单胺系统密切相关,多巴胺能、去甲肾上腺素能和血清素能神经元参与学习、记忆、行为、情绪和认知。
肠道微生物群影响单胺,包括多巴胺、去甲肾上腺素。例如,蜡样芽孢杆菌(Bacillus cereus)和蕈状芽孢杆(Bacillus mycoides)可以产生多巴胺。
神经递质——胆碱
胆碱是肠道、皮肤、神经系统和细胞中的必需营养素。胆碱水平会影响肠道菌群。如:胆碱缺乏可导致革兰氏阴性菌增加,并增强抑郁症患者的抑郁样行为。
肠道微生物群可以影响胆碱的生物利用度(如大肠杆菌可以抑制人体吸收胆碱的能力),从而导致胆碱缺乏和神经系统疾病的发生。
抑郁症患者的胆碱水平显著高于健康人。同时,抑郁症患者表现出肠道微生物群失衡。这表明影响胆碱代谢的肠道菌群可能参与中枢神经系统调节。
神经递质——谷氨酸
谷氨酸是大脑中的一种兴奋性神经递质,记忆、学习、行为、认知和发育与谷氨酸神经递质有关。突触传递通过谷氨酸受体实现,谷氨酸受体与神经递质释放和突触可塑性发育密切相关。
抑郁症患者的内侧前额叶皮质中谷氨酸水平降低。肠道细菌可影响谷氨酸代谢,如:
• 空肠弯曲杆菌 (Campylobacter jejuni)
• 谷氨酸棒状杆菌 (Corynebacterium glutamate)
• 乳酸发酵短杆菌 (Brevibacterium lactofermentum)
肠道微生物群将蛋白质分解为氨基酸,其中大部分被肠内肠细胞顶膜上的转运蛋白(如兴奋性氨基酸C1)吸收。因此,谷氨酸被肠道吸收并进入血液。谷氨酸转化为γ-氨基丁酸(GABA)。
部分肠道微生物群可以直接产生GABA。例如,双歧杆菌可以分泌大量GABA。
注:GABA作为大脑中的神经递质,促进神经系统的稳定。这些神经递质由肠道产生,通过肠脑轴进入中枢神经系统,发挥各种功能。
▼
胆 汁 酸
胆汁酸是胆汁的重要组成部分,在脂肪代谢中起着重要作用。胆汁酸在肝脏中产生,由肠道菌群产生的酶代谢,促进脂质的消化和吸收。
肠道微生物群介导的胆汁酸通过酶水解转化为次级胆汁酸,这会影响肠肝循环并导致中枢炎症。因此,胆汁酸代谢亢进与抑郁症的发展相关。
例如,Turicibacter 的相对丰度与抑郁症患者血液中的几种胆汁酸呈正相关,表明Turicibacter可能参与肠内胆汁酸的合成。
胆汁酸受体可以影响葡萄糖代谢,从而导致抑郁症的发生。肠道微生物群通过调节胆汁酸的变化,影响BA-TGR5-GLP-1途径,进而导致抑郁症的发作。
▼
短 链 脂 肪 酸
短链脂肪酸主要由乙酸、丙酸、丁酸和戊酸组成。可以通过肠道吸收并穿过血脑屏障,影响大脑功能。
短链脂肪酸可以改变血脑屏障的通透性,肠道菌群如如长双歧杆菌和短双歧杆菌产生的短链脂肪酸促进5-HT的合成和循环,从而实现抗抑郁作用。临床上没有针对短链脂肪酸的药物。外源性短链脂肪酸的补充还可能加重疾病。通过肠道微生物群调节短链脂肪酸可以改善抑郁症。
▼
三 甲 胺
三甲胺(TMA)是胃肠道化学递质的主要调节因子之一。肠道微生物群代谢肉类、高脂肪乳制品和其他食品中富含的胆碱和TMA。肠道微生物群产生的TMA由肝脏中的黄素单加氧酶3催化,生成三甲胺N-氧化物(TMAO),这会导致衰老、认知障碍、社会行为改变和脑部疾病。
TMA的产生可以通过调节肠道微生物群来抑制。
血清TMAO水平与心血管疾病和抑郁样行为相关。3,3-二甲基-1-丁醇(DMB)是人体中的一种重要神经递质,被证实可抑制肠道微生物群产生TMA,并降低高胆碱小鼠的TMAO水平。研究发现,DMB可以增加肠道中AKK菌的丰度。
TMA被肠道吸收,并穿过血脑屏障进入大脑,导致神经元兴奋性毒性、氧化应激和炎症。
TMA的结构与谷氨酸类似,谷氨酸是一种兴奋性神经递质。抑郁症患者表现出明显低于健康人的谷氨酸水平,TMA激活受体,导致分子损伤和氧化应激。因此,TMA影响抑郁症的发病机制。
通过抑制与TMA和TMAO相关的肠道微生物群,可以实现抗抑郁效果,并且可以减少药物直接作用引起的副作用。
▼
脑源性神经营养因子(BDNF)
BDNF是神经营养因子家族的一员,对海马和额叶皮层神经元的生长和存活至关重要。BDNF广泛分布于大脑中,与学习、记忆和神经发生密切相关。
BDNF——大脑和肠道细菌之间的重要纽带
肠道微生物群影响BDNF。例如,一些益生菌增加了血清BDNF水平,而补充真杆菌和梭状芽孢杆菌可降低BDNF的水平。肠道微生物群与BDNF密切相关,从而影响大脑功能。
肠道微生物群可以通过BDNF/TrkB信号通路实现双向肠道脑调节,这表明抑郁症的发病机制也与BDNF有关。
BDNF与抑郁症的发生和发展密切相关
肠道菌群失衡导致小鼠BDNF表达减少,导致认知功能和焦虑发生变化。同时,抑郁症患者大脑中BDNF和成熟BDNF的表达水平均降低。BDNF mRNA在海马和杏仁核(与抑郁症相关的区域)的表达显著降低。
在抑郁症模型中,发现将BDNF注射到中脑和海马的齿状回区域会产生类似抗抑郁的效果,通过注射TRK抑制剂可以逆转这种效果。
▼
色 氨 酸 代 谢
色氨酸是一种必需的氨基酸,可以影响人类的生长和健康。肠道微生物的变化可以通过调节色氨酸代谢来引起,而色氨酸代谢产物,如血清素、犬尿氨酸和吲哚,可以影响肠道微生物群和抑郁症之间的关系。
注:5-HT,5-羟色胺,又名血清素。
通过调节血清素的产生影响抑郁症
中枢神经系统中,色氨酸在酶的催化下生成血清素。血清素是参与控制睡眠、疼痛和情绪的关键神经递质。
肠道微生物群,例如乳球菌、乳杆菌、链球菌、大肠杆菌、克雷伯氏菌,通过表达色氨酸合酶来调节 5-HT 的产生, 脑肠轴进一步影响大脑中色氨酸的代谢。
通过肠道菌群代谢产物犬尿氨酸影响抑郁症
犬尿氨酸是色氨酸的代谢产物。犬尿氨酸具有抗氧化功能,可防止大脑皮层中的脂质氧化。肠道微生物群通过犬尿氨酸途径影响犬尿氨酸代谢。
抑郁症患者的血清 犬尿氨酸/喹啉酸 比率显着降低。犬尿氨酸和喹啉酸代谢之间的平衡与大脑结构和功能有关,尤其是在海马体中。
通过肠道菌群代谢产物吲哚影响抑郁症
吲哚是肠道菌群代谢的重要组成部分,与色氨酸代谢密切相关。
Part 2 神 经 通 路
▼
迷 走 神 经
迷走神经:脑-肠之间的一条高速公路,可以双向传递信息。
迷走神经是连接胃肠道和神经系统的最长神经之一,在肠道和大脑之间的主要沟通途径中起着重要作用。
一方面,肠道微生物群通过激活迷走神经来改变下游神经活动,如BDNF、GABA和催产素信号。肠道包含肠感觉上皮细胞,这些细胞与迷走神经神经元形成回路,使大脑能够直接感知肠道的变化。
另一方面,迷走神经可以通过刺激传出神经释放乙酰胆碱,从而影响巨噬细胞和α-7烟碱胆碱能神经受体,同时抑制炎症因子以实现抗抑郁作用。
补充乳酸杆菌JB-1菌株降低了前额叶皮层GABAα2受体的mRNA表达,从而降低了应激诱导的皮质酮水平和减轻抑郁。
▼
脊 髓
脊髓是自主神经系统的重要组成部分。脊髓连接大脑和肠道,肠道是中枢神经系统最重要的部分。脊髓损伤导致肠交感神经和自主神经张力失衡,导致胃肠道疾病。
肠道微生物群会影响脊髓
脊髓损伤会损害肠道神经系统,导致肠道运输功能障碍。脊髓损伤后的并发症,包括肠道功能障碍、焦虑和抑郁,可能是由于微生物群-肠-脑轴相互作用所致。
脊髓影响抑郁症的发病机制
脊髓中抑制性神经元的功能障碍导致脊髓层面传入感觉信息的放大,这是抑郁症患者疼痛的原因之一。疼痛和抑郁是密切相关的。事实上,前额叶和杏仁核与抑郁症密切相关。
Part 3 免 疫 系 统
免疫系统是肠脑轴的一部分,是从微生物到大脑的重要信号级联。肠道细菌失调导致肠道和血液之间的屏障变得可渗透,从而让“坏”细菌进入血液,可能引起炎症。
炎症可能是一个重要的免疫节点
免疫炎症反应机制:胃肠道系统是最大的免疫器官,抑郁症中存在一种慢性、低水平的炎症状态,肠道菌群可作用于免疫系统,降低外周血中促炎因子IL-1、IL-6、IL-8、IL-10、TNF-α、TGF-3等释放,并升高抗炎急性期蛋白、趋化因子、黏附分子、前列腺素等的表达,从而影响中枢神经系统,最终导致脑功能的改变。
临床上,抑郁症患者表现出细胞因子水平升高、神经发生减少和氧化应激水平升高。肠道菌群对免疫系统的调节是影响抑郁症的重要因素之一。
以上化学信号、神经通路、免疫系统三大途径,详细描述了微生物群-肠-脑轴之间的关联,以及肠道菌群是如何通过该轴影响抑郁症的发生发展。显而易见,肠道菌群其中扮演重要角色。
目前关于抑郁症的治疗,药物治疗是常见手段之一,化学合成药物因其疗效快、剂量低等优点被广泛使用,但容易引起耐药性,抑制质子泵,可能危害肠道健康。
药物对肠道菌群和肠道屏障的影响是药物安全性和有效性的重要评价指标。近年来,随着大众对肠道健康的日益重视,肠道已成为中药领域的研究热点。中药具有抗菌活性温和、修复作用以及人类不易对其产生耐药性等优点。
那么中药与肠道菌群有什么关联,与肠道菌群的相互作用及其肠道屏障的修复机制如何?下一章节我们来详细了解一下。
强调“整体性”
中医认为人与自然、社会环境具有整体性。自然界孕育人类的繁衍,人类活动顺应四时变化方能“精神乃治”,两者交互协作、对立统一,即通过“天人相应”实现“天人合一”。
作为人体内的微生态,肠道菌群与机体各项结构机能与内在环境共生共存,互根互用,构成一个有机整体。
“多因素”相关
中医提出体质是人体形态结构、功能活动的个体特征,与生命过程、遗传、后天环境等因素有关。
肠道菌群也受到饮食、生活方式、药物、社会环境、遗传、地理位置等多因素影响。
“个体化”防治
辨证论治作为中医基本原则之一,其核心目的是通过因人因时因地制宜辨证来更好地阐述个体疾病的易患因素和疾病发展的倾向性。
虽然人体肠道肠道菌群的核心菌群相似,但在不同宿主个体间,不同菌群的相对丰度和菌种存在很大差异。肠道菌群是健康的动态组成部分。个体化治疗计划的制定和实施与肠道菌群检测分析密切相关。
《黄帝内经》云:“胃足阳明之脉……是动则病洒洒振寒……心欲动,独闭户塞牖而处。甚则欲上高而歌,弃衣而走,贲响腹胀,是为骭厥。”
提示古人认为精神状态异常不仅与心失神明相关,亦与阳明胃病变关系密切。
中医学提出人体由“形”和“神” 构成,“形为神之宅”“神乃形之主”,即心理特征影响人的生理机能和形态结构,又同时受到机体生理病理情况反馈的影响。
现代医学提出心理压力或其他抑郁因素引起的饮食偏好、应激激素调节、炎症反应及自主神经反应可重塑肠道菌群,肠道菌群的代谢产物、毒素、神经激素等又能反过来调节宿主的饮食偏好或心情。
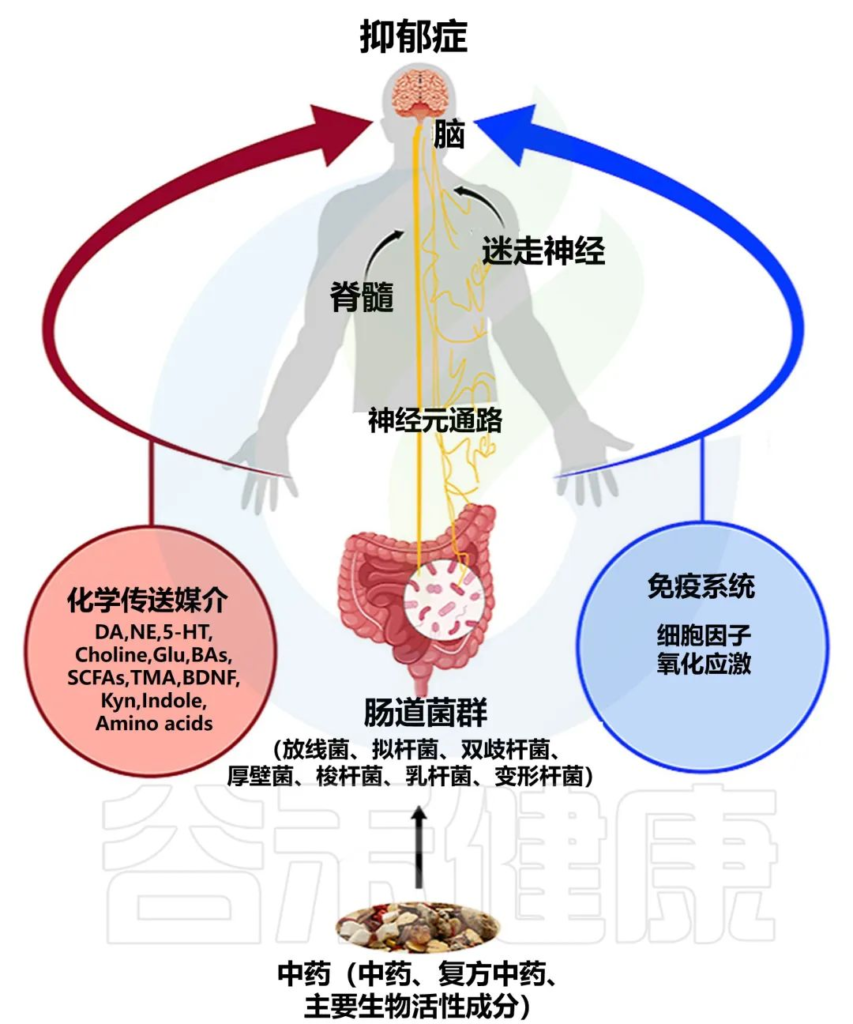
Li B, et al., J Ethnopharmacol. 2023
抑郁症可由“气”(生命能量)、血液循环障碍、“热”(炎症)、湿气和痰引起。
解气是抑郁症的常见治疗方法,从而促进血液循环、减少炎症和缓解疼痛。传统上,一些中药配方被用于治疗抑郁症,如逍遥散和小柴胡、甘麦大枣(GMDZD)和半夏厚朴汤。一些治疗胃肠道疾病的中药也具有抗抑郁类型的作用。
下面列一些常见的治疗抑郁症的复方中药配方:
逍遥散、解郁丸、四逆散、薯蓣散、小柴胡汤、柴胡温胆汤、柴胡桂枝汤
甘麦大枣汤、开心散、柴胡加龙骨牡蛎汤、酸枣仁汤
柴胡疏肝方、半夏厚朴汤、
补阳还五汤、血府逐瘀汤
百合地黄汤、小补心汤、归脾汤、桃红四物汤
栀子豉汤、栀子厚朴汤
大多数治疗抑郁症的中药都具有疏肝、益气、养血、活血、化痰的作用。
下表列出各种中药的主要生物活性成分:
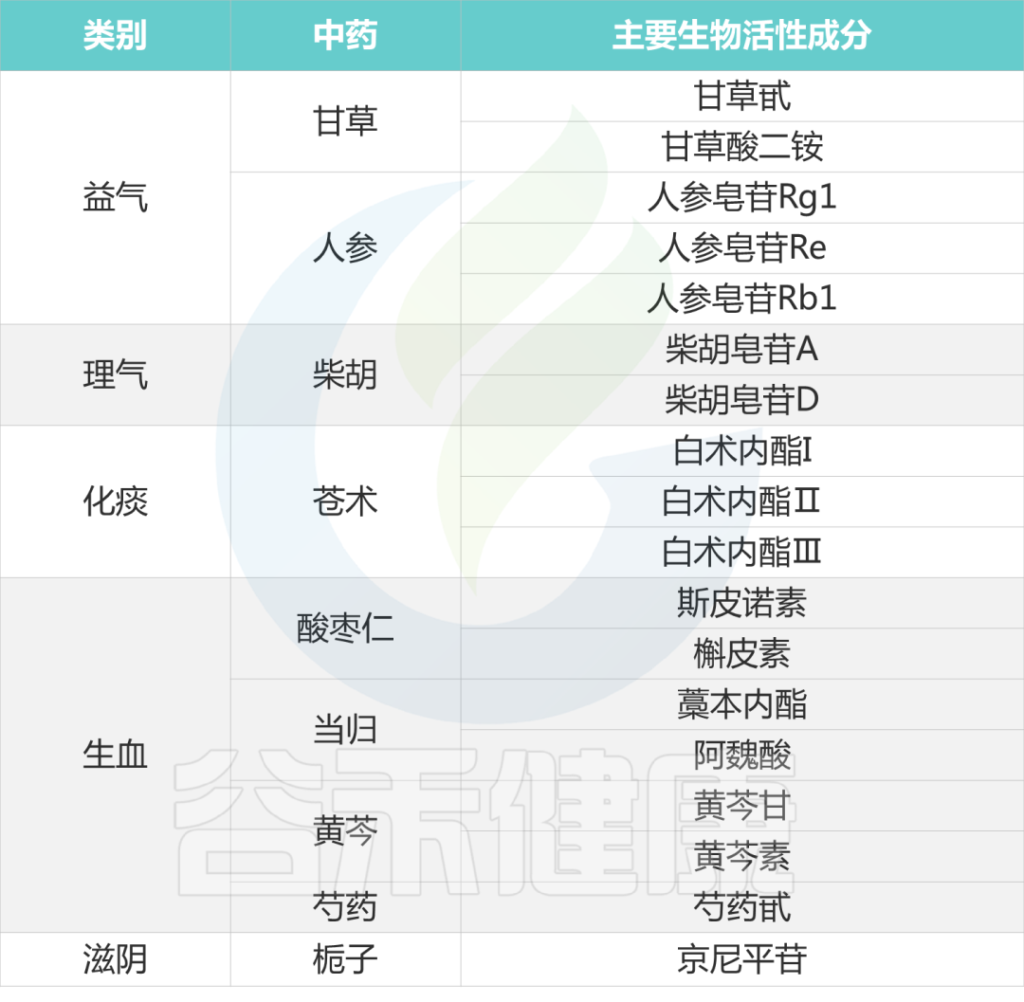
Li B, et al., J Ethnopharmacol. 2023
以上是中药与肠道菌群的整体关联,以及常见的一些具有抗抑郁作用的中药及其生物活性成分,这些中药是如何通过调节肠道菌群,从而达到抗抑郁的效果?下一章节我们继续。
虽然目前对于中医药抗抑郁作用的潜在机制相对模糊,但可能涉及多种机制,其中之一可能包括肠道微生物群的调节。本章节讨论了由调节肠道微生物群的化学递质和细胞介质诱导的中药抗抑郁作用。
传统中药配方,包括复方中药、中药和主要生物活性成分,它们影响肠道菌群改善抑郁症如下:
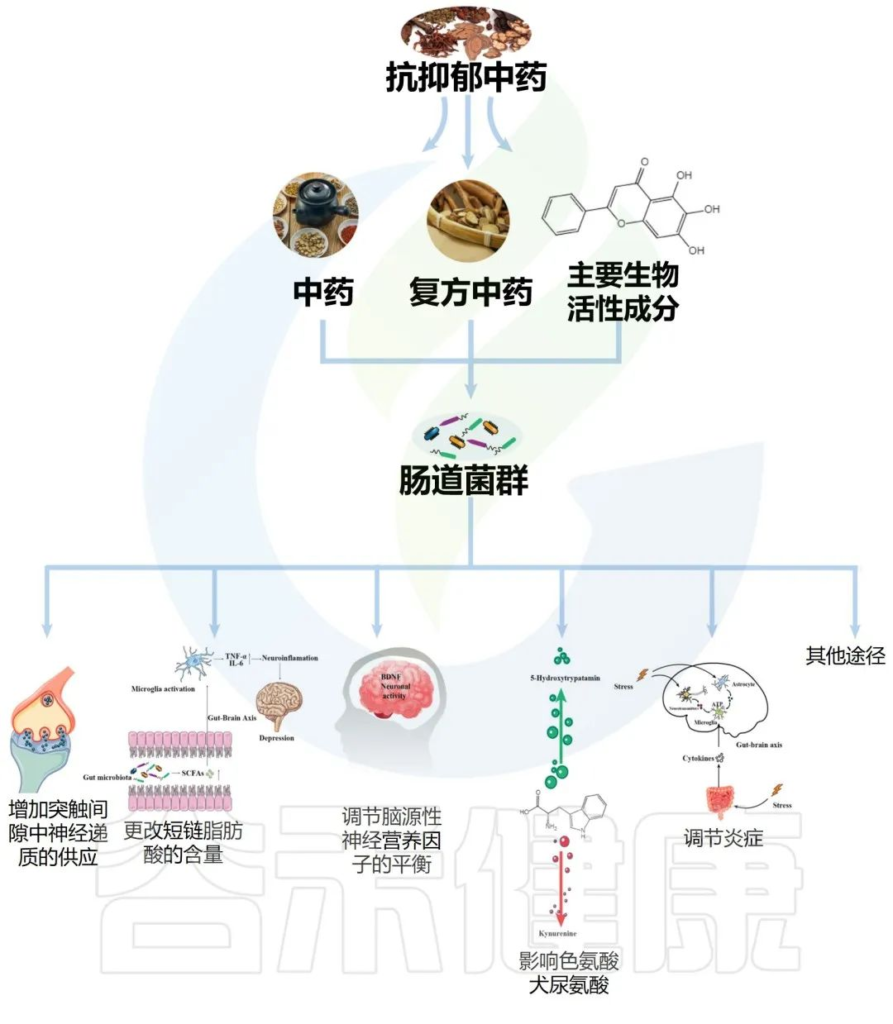
Li B, et al., J Ethnopharmacol. 2023
迄今为止,大多数抗抑郁药物都是神经递质再摄取抑制剂,通过抑制神经递质的再摄取和增加突触间隙的神经递质供应来改善神经传递。
中医药在中枢神经系统疾病的治疗方面有着丰富的历史。
开心散
开心散(KXS)、栀子豉汤(ZZCD)和甘麦大枣汤是用于治疗抑郁症的不同类型的中药。研究发现,这些物质参与调节肠道微生物群,最终缓解抑郁症状。
注:栀子豉汤(ZZCD)首载于《伤寒论》,在中国被广泛用于治疗抑郁症、发热性疾病和失眠症已有1000多年的历史。
开心散调节肠道和大脑功能的重要组成部分。开心散治疗改变了CUMS诱导抑郁症小鼠肠道微生物群的相对丰度,并通过增加Allobaculum、Turicibacter、双歧杆菌,改善了抑郁症症状。
栀子厚朴汤
相关的中药处方,如栀子厚朴汤,逆转了CUMS诱导抑郁症小鼠肠道神经递质(如5-HT、多巴胺和色氨酸)的抑制。
研究报告,栀子厚朴汤的抗抑郁类型效应由肠道微生物群介导,肠道微生物群影响神经递质的代谢。与未治疗组相比,栀子厚朴汤治疗组显著增加了Barnesiella和Lachnospiraceae的成分,但降低了链球菌。
总之,这些结果表明,栀子厚朴汤通过肠脑轴调节肠道微生物群以改善抑郁症,这影响了大脑中的相关神经递质。此外,在用栀子厚朴汤治疗后,CUMS诱导的齿状回中未成熟和新生神经元的丰度降低显著改善,抑郁样行为得到缓解。
潜在抗抑郁机制
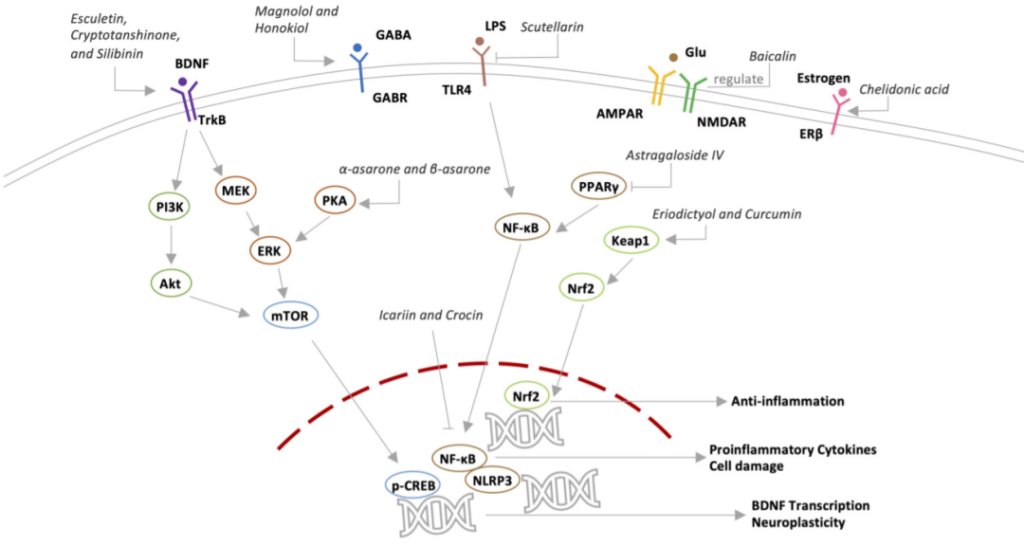
doi.org/10.3389/fpsyt.2022.1054726
甘麦大枣
甘麦大枣增加了大鼠肠道中的神经递质水平,缓解了抑郁症,这可能是由于活性成分甘草酸苷的作用。
其他
一些草药以 5-HT 受体为主要抗抑郁机制。
如来自葛根的葛根素不仅作为 5-HT2C 和 5-HT2A 受体的拮抗剂,而且作为 5-HT1A 受体的激动剂。
大量中药配方以及主要生物活性成分通过调节肠道微生物群中的神经递质发挥抗抑郁作用。如下表所示:
表 中药对抑郁症患者化学神经递质的影响
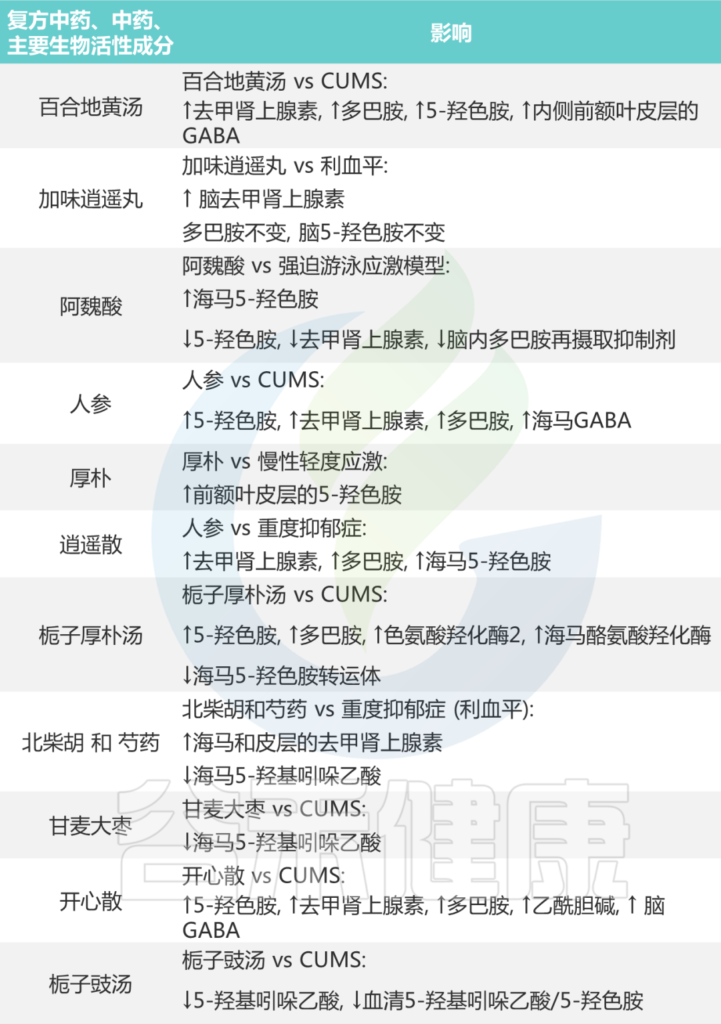
Li B, et al., J Ethnopharmacol. 2023
►⋙
总之,中药含有多种活性成分,这些成分旨在整合和调节人体内的多个环节、水平和靶点,通过调节肠道菌群和神经递质来实现抗抑郁效果。在临床实践中,除了用作抗抑郁药的补充外,它还为与神经递质紊乱相关的其他疾病提供治疗。
研究发现,短链脂肪酸作为肠脑轴的递质,会影响抑郁症。例如,患者体内可产生短链脂肪酸的Alloprevotella的相对丰度增加。一些中药配方及其活性成分可以通过改变肠道中的短链脂肪酸含量来诱导抑郁症样症状。
DOI: 10.16438/j.0513-4870.2022-0844
五味子素可以缓解抑郁小鼠肠道微生物群失衡,这与粪便短链脂肪酸水平的变化有关。
黄芩苷(BAI)是甘草的一种生物活性成分,通过促进肠道中产短链脂肪酸的细菌,影响抑郁症的发展。
栀子厚朴汤的抗抑郁类型效应通过调节肠道微生物群来促进丁酸分泌而发生。
用肉苁蓉(CTE)治疗CUMS模型大鼠显示,肠道微生物群的破坏与短链脂肪酸的产生之间存在强烈的相关性。
杏仁可以增加肠道微生物群的含量,如瘤胃球菌和真细菌。人参及其提取物通过改变肠道微生物群的代谢产物,从而影响血清短链脂肪酸水平和大脑中的神经递质,从而达到抗抑郁作用。
黄连素和淡豆豉通过调节短链脂肪酸达到抗抑郁作用。
总之,如下表所示,研究结果支持各种中药制剂可以通过介导肠道微生物群的短链脂肪酸来治疗抑郁症。
中药对抑郁症患者短链脂肪酸的影响
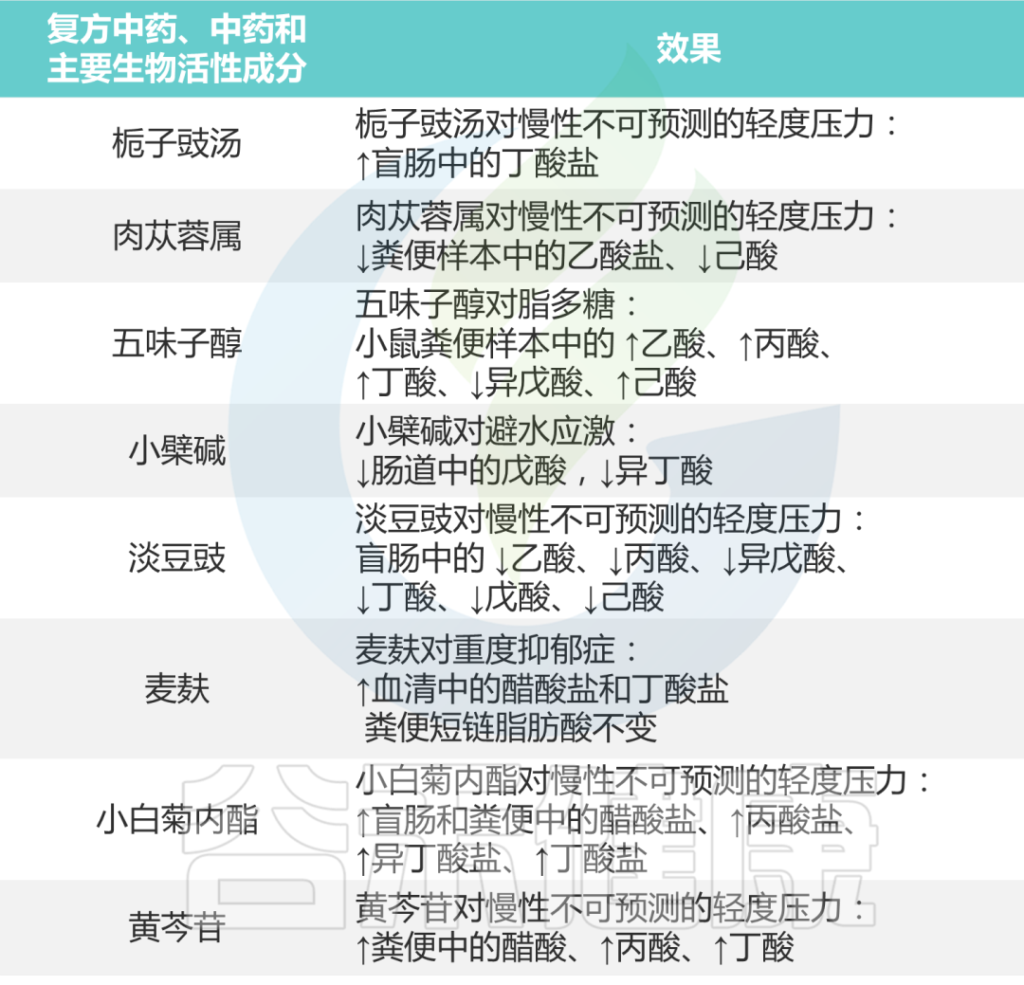
Li B, et al., J Ethnopharmacol. 2023
►⋙
目前,中医对短链脂肪酸的调节更广泛地用于治疗代谢性疾病,如肥胖症、糖尿病和高血脂,但通过中医调节肠道微生物组治疗抑郁症的研究相对较少。因此,将中医药作为深入研究抑郁症的切入点将有助于开发新药。
BDNF与抑郁症密切相关,是许多抑郁症中医治疗的目标,包括槲皮素、肉苁蓉、人参和柴胡。
槲皮素
槲皮素来源于多种植物多酚,据报道可以预防焦虑,缓解抑郁,提高记忆力。
值得注意的是,槲皮素已被证明可以改变肠道微生物群。例如,槲皮素处理增加了肠道微生物多样性以及下列菌群的相对丰度:
槲皮素的抗抑郁作用是通过调节BDNF相关蛋白CPNE6和TREM1之间的平衡实现的。
在一项研究中,槲皮素能够改善大鼠的抑郁样行为,同时降低肠道微生物群的含量,如Verrucomichobiae和脱硫弧菌。
此外,槲皮素改善了受损的结肠组织,增强了海马中BDNF的表达。
肉苁蓉
肉苁蓉可以改善抑郁大鼠肠道微生物群的含量,如拟杆菌的增加和瘤胃球菌的减少。此外,肉苁蓉增加了抑郁症患者的BDNF水平。这些发现支持BDNF可能影响抑郁症的治疗。
其他
据报道,其他复方中药和中药制剂和主要生物活性成分也通过调节BDNF实现抗抑郁作用,如下表所示:
表 中药对抑郁症患者BDNF的影响

Li B, et al., J Ethnopharmacol. 2023
►⋙
临床上,没有药物直接调节大脑中的BDNF,大脑中每天的BDNF含量只能通过添加一些蔬菜来维持。如果中医能调节肠道微生物群中的BDNF,它不仅能改善抑郁症,还能治疗BDNF相关疾病。
一些中药配方通过影响色氨酸-犬尿氨酸代谢平衡来改善抑郁症样症状。
人参皂苷
人参和相关的中药配方富含人参皂苷,已表明人参皂苷可改善大肠杆菌K1诱导的小鼠抑郁和肠道失调。此外,据报道,人参皂苷改善了肠色氨酸-犬尿氨酸代谢紊乱和血清犬尿氨酸水平,导致海马犬尿氨酸含量显著变化。
此外,人参皂苷治疗抑制小胶质细胞过度激活,以改善抑郁样行为。
天丝饮
天丝饮是一种中药,可以提高肠道微生物群(乳杆菌和毛螺菌科)的含量,然后调节色氨酸-犬尿氨酸途径的代谢产物,以改善抑郁症状。因此,色氨酸-犬尿氨酸代谢可能影响肠道微生物群。
其他
据报道,其他复方中药和中药制剂和主要生物活性成分通过调节犬尿氨酸水平实现抗抑郁作用,如下表所示。
中药治疗抑郁症对犬尿氨酸的影响

Li B, et al., J Ethnopharmacol. 2023
►⋙
临床上,已发现氯胺酮和右旋西帕明等抗抑郁药与犬尿氨酸密切相关,但尚未应用直接作用于犬尿氨酸的药物。因此,发现新的抗抑郁药或辅助药物作用于犬尿氨酸已成为一个悬而未决的问题。
中医药可以通过肠道微生物组调节犬尿氨酸来改善抑郁症状,具有安全性高、稳定性好的潜在优势。
与色氨酸-犬尿氨酸代谢相关的酶的调节,如QPRT(喹啉磷酸核糖转移酶)和IDO(吲哚胺2,3-二加氧酶),也是抑郁症治疗的理想靶点。因此,中药肠道微生物群对犬尿氨酸的调节将成为抗抑郁药物的新靶点。
越来越多的研究表明,改变肠道微生物群可以通过细胞因子调节影响抑郁症。
一些中药制剂通过影响血液和肠道中的细胞因子水平(如细胞因子IL-6和IL-1β)发挥抗抑郁作用,从而通过血脑屏障改变中枢神经系统的细胞因子,并影响脑小胶质细胞。作为中枢神经系统中最重要的免疫细胞之一,小胶质细胞与一系列神经退行性疾病有关,并与神经炎症密切相关。
秋葵
秋葵处理增加了Barnesiella、拟杆菌和乳杆菌的相对丰度。此外,秋葵抑制toll样受体4的表达、NF-κB的核易位、高水平的促炎细胞因子和增强的丝裂原活化蛋白激酶信号传导。最终,秋葵达到了抗抑郁类型的效果。
柴胡疏肝散
柴胡疏肝散的主要成分皂苷A和D,在CUMS模型大鼠中发挥抗抑郁作用,恢复HPA轴的平衡,并通过提高肠道和海马促炎因子(如IL-1β、IL-6和TNF-α)的水平,减少神经炎症。
这些研究进一步证明,肠道微生物群可以通过调节细胞因子来影响大脑的神经系统。
其他
据报道,其他复方中药和中药制剂和主要生物活性成分通过调节细胞因子发挥抗抑郁作用,如下表所示。
中药对抑郁症患者细胞因子的影响

Li B, et al., J Ethnopharmacol. 2023
►⋙
在临床实践中,抑郁症患者菌群的相对丰度与免疫力密切相关,这表明特定菌株有可能影响免疫力。因此,在未来,中医不仅可以治疗抑郁症,还可以通过肠道微生物群调节免疫系统,这可能对其他神经疾病具有良好的治疗效果。
临床上,有几种方法可以通过刺激神经通路来治疗抑郁症,如脑深部刺激(DBS)和迷走神经刺激(VNS)。然而,这些技术存在一些并发症,例如需要手术和术后恢复。
肠道微生物群通过迷走神经调节脑-肠轴信号。例如,长双歧杆菌NC3001通过迷走神经缓解焦虑样行为。柠檬酸杆菌(Citrobacter)通过调节迷走神经的活动产生焦虑-抑郁样行为。
▸中药通过调节迷走神经缓解抑郁症
因此,影响肠道的某些类型的中药,如四逆散(SNS)、柴胡温胆汤、柴胡桂枝方和桂皮方,通过调节迷走神经来影响抑郁样行为。
柴胡温胆汤通过调节迷走神经的活动来影响乙酰胆碱含量的变化,从而缓解抑郁症。
看起来,就缓解抑郁症而言,在调节迷走神经活动方面,使用中医药调理肠道微生物群,比直接使用药物更有效;这是一个值得进一步研究的研究方向。
▸中药通过调节脊髓损伤缓解抑郁症
抑郁症常伴有慢性疼痛,疼痛信号主要存在于脊髓通路;因此,脊髓在与抑郁症相关的神经通路中起着重要作用。研究发现,脊髓损伤可导致肠道生态紊乱;肠道菌群的重塑可能会恢复肠道功能。
在脊髓损伤中,益生菌复苏可以改善脊髓损伤。用抗生素治疗的小鼠表现出更严重的脊髓损伤。因此,中医可以通过调节脊髓通道的活动来调节肠道微生物群以缓解抑郁症。
中医作用于多种神经通路,并在多个层面治疗抑郁症。它们不仅在抑郁症的快速治疗中发挥作用,还可以缓解与抑郁症相关的并发症。因此,中医显示出巨大的潜力。然而,中医治疗的手段五花八门,以上主要是服用各种药剂,其他还有包括食疗、针灸、太极、按摩等。
● 针灸影响肠道菌群
研究表明,针灸可以通过对胃肠动力、分泌和免疫的调节影响肠道菌群。
研究人员通过针刺应激性胃溃疡模型大鼠的百会、中脘、足三里穴位,结果表明,针刺能够有效改善应激性胃溃疡引发的胃黏膜损伤,可能与增加的菌群多样性,促使紊乱的肠道菌群水平回调有关。
研究人员对实验组溃疡性结肠炎的患者应用益阳愈溃汤结合针刺治疗,对照组仅给予益阳愈溃汤,治疗后实验组双歧杆菌、乳酸杆菌等优势菌种均高于对照组。
另外有研究人员认为早期针刺对中风患者的干预不仅可以促进神经功能的恢复,并可以有效降低中风后抑郁症的发病率,说明中医针灸治疗与肠道菌群也有某种联系,更有利于对肠道菌群的研究,从而拓宽抑郁症治疗的新方法和思路。
很少有研究报道了中药制剂在抑郁症临床治疗中的毒性。
柴胡皂苷D是柴胡中的主要生物活性成分,具有抗抑郁、肝毒性、神经毒性、溶血性和心脏毒性作用。因此,应注意中药配方中柴胡的用量。
黄芩苷在肠道中作为黄芩素代谢。黄芩苷在HepG2细胞中显示出比黄芩素更高的毒性,但肠道微生物群产生的黄芩苷代谢产物的毒性低于黄芩苷本身。因此,黄芩苷生产工艺应进一步优化,以治疗抑郁症。
开心散导致白细胞和淋巴细胞以及血糖水平升高,尽管所有患者在治疗30天后均表现出正常水平。因此,口服开心散被认为是相对安全的。
甘麦大枣汤与治疗抑郁症的不良反应有关,如口干、便秘、失眠和易怒。
补骨脂及其主要生物活性成分具有抗抑郁作用,但临床前安全性研究揭示了未知化合物和机制对肝脏和生殖系统的毒性作用。
►⋙
一般来说,中药配方不会刺激肝脏或肾脏,也不会损害胃肠道。与西医使用的抗抑郁药物相比,中医药治疗抑郁症的副作用一般较少,不会产生依赖或成瘾,疗效稳定,从而防止治愈后复发。
人体大多数疾病都与肠道有关,肠道菌群调节越来越被认为是疾病的立足点和突破口。
从中医的角度来看,人的各个器官并不是独立存在的,而是相互联系的,共同影响着全身的生理机能。中医擅长于动态和整体上把握疾病的发生发展,这与肠道菌群反映人体健康动态的理念不谋而合。
通过监控肠道菌群的动态预测易感疾病,并运用其与人体自身的共生关系和个体化的生物学特征,使中医在疾病诊治中突出整体观和辨证论治的优势。
抑郁症的发病机制尚不确定,单胺、神经营养因子、神经递质和肠道菌群被认为参与了抑郁症的发展。抑郁症研究的重点已经从大脑转移到其他系统,微生物群-肠-脑轴可通过形成复杂的内分泌、神经、免疫炎症的生物学免疫机制,在影响抑郁症的发生发展中发挥重要作用。
中药通过非常复杂的机制调节肠道功能。虽然中药调节肠道菌群的机制没有完全摸透,但其显著疗效已经受到越来越多的关注。中医身心一体观的临床实践经验在防治抑郁症方面具有潜在优势。
中药与肠道菌群之间抗抑郁的关系不仅仅有中药对于肠道菌群的影响, 还有肠道菌群对中药成分代谢和促进吸收的作用等值得探索。
目前仍需进行大量的研究以探寻中药与肠道菌群之间的相互作用,这对于研究抑郁症的发病机制和抗抑郁新药研发有深远意义。结合中医药理论,以肠道菌群为靶点,开发中药新药研究,将为中医药防治抑郁症提供新的思路和治疗方案。
主要参考文献:
Radjabzadeh, D., Bosch, J.A., Uitterlinden, A.G. et al. Gut microbiome-wide association study of depressive symptoms. Nat Commun 13, 7128 (2022). https://doi.org/10.1038/s41467-022-34502-3
Sun Y, Zhao J, Rong J. Dissecting the molecular mechanisms underlying the antidepressant activities of herbal medicines through the comprehensive review of the recent literatures. Front Psychiatry. 2022 Dec 22;13:1054726. doi: 10.3389/fpsyt.2022.1054726. PMID: 36620687; PMCID: PMC9813794.
Li B, Xu M, Wang Y, Feng L, Xing H, Zhang K. Gut microbiota: A new target for traditional Chinese medicine in the treatment of depression. J Ethnopharmacol. 2023 Mar 1;303:116038. doi: 10.1016/j.jep.2022.116038. Epub 2022 Dec 15. PMID: 36529248.
Asim M, Wang H, Waris A. Altered neurotransmission in stress-induced depressive disorders: The underlying role of the amygdala in depression. Neuropeptides. 2023 Jan 20;98:102322. doi: 10.1016/j.npep.2023.102322. Epub ahead of print. PMID: 36702033.
Wilkowska A, Szałach ŁP, Cubała WJ. Gut Microbiota in Depression: A Focus on Ketamine. Front Behav Neurosci. 2021 Jun 23;15:693362. doi: 10.3389/fnbeh.2021.693362. PMID: 34248517; PMCID: PMC8261217.
Park LT, Zarate CA Jr. Depression in the Primary Care Setting. N Engl J Med. 2019 Feb 7;380(6):559-568. doi: 10.1056/NEJMcp1712493. PMID: 30726688; PMCID: PMC6727965.
王凯新, 董晓梦, 苏毅鹏,等. 肠道菌群与抑郁症关系的研究进展[J]. 吉林大学学报:医学版, 2022(004):048.
Xu J, Chen HB, Li SL. Understanding the Molecular Mechanisms of the Interplay Between Herbal Medicines and Gut Microbiota. Med Res Rev. 2017 Sep;37(5):1140-1185. doi: 10.1002/med.21431. Epub 2017 Jan 4. PMID: 28052344.
Bosch, J.A., Nieuwdorp, M., Zwinderman, A.H. et al. The gut microbiota and depressive symptoms across ethnic groups. Nat Commun 13, 7129 (2022). https://doi.org/10.1038/s41467-022-34504-1
Ashraf H, Salehi A, Sousani M, Sharifi MH. Use of Complementary Alternative Medicine and the Associated Factors among Patients with Depression. Evid Based Complement Alternat Med. 2021 Mar 26;2021:6626394. doi: 10.1155/2021/6626394. PMID: 33854557; PMCID: PMC8019377.
鲍婷婷, 杨凯麟, 龙治勇,等. 基于”心与小肠相表里”探讨肠道菌群与抑郁症[J]. 中国中西医结合杂志, 2021.
Barandouzi ZA, Starkweather AR, Henderson WA, Gyamfi A, Cong XS. Altered Composition of Gut Microbiota in Depression: A Systematic Review. Front Psychiatry. 2020 Jun 10;11:541. doi: 10.3389/fpsyt.2020.00541. PMID: 32587537; PMCID: PMC7299157.
Zhao Y, Luan H, Gao H, Wu X, Zhang Y, Li R. Gegen Qinlian decoction maintains colonic mucosal homeostasis in acute/chronic ulcerative colitis via bidirectionally modulating dysregulated Notch signaling. Phytomedicine. 2020 Mar;68:153182. doi: 10.1016/j.phymed.2020.153182. Epub 2020 Feb 7. PMID: 32065953.
袁霞红, 刘林. 肠道菌群调节抑郁症机制及中医药防治研究进展[J]. 中华中医药学刊, 2022, 40(9):4.
Aktar R, Parkar N, Stentz R, Baumard L, Parker A, Goldson A, Brion A, Carding S, Blackshaw A, Peiris M. Human resident gut microbe Bacteroides thetaiotaomicron regulates colonic neuronal innervation and neurogenic function. Gut Microbes. 2020 Nov 1;11(6):1745-1757. doi: 10.1080/19490976.2020.1766936. Epub 2020 Jun 9. PMID: 32515657; PMCID: PMC7524364.
Dinan TG, Cryan JF. Gut microbes and depression: Still waiting for Godot. Brain Behav Immun. 2019 Jul;79:1-2. doi: 10.1016/j.bbi.2019.02.007. Epub 2019 Feb 13. PMID: 30771453.
丁书凝, 贾心如, 阮善明,等. 中医思辨体系中肠道菌群的共性分析和诊疗应用[J]. 时珍国医国药, 2022(007):033.