-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

抗生素的诞生彻底改写了人类对抗微生物感染的历史,从远古先民偶然利用霉变物质疗伤,到现代医学精准调控分子机制,抗生素通过抑制细菌细胞壁合成、干扰蛋白质生成等机制,成为治疗感染的核心武器。
它们按来源可分为天然(如青霉素)、半合成(如阿莫西林)和全合成(如喹诺酮类);按作用谱分为广谱(覆盖革兰氏阳性与阴性菌)和窄谱(针对特定菌种)。
然而,抗生素的过度使用(如农业促生长、医疗误用)导致耐药性急速发展。细菌通过β-内酰胺酶分解青霉素、修饰核糖体靶点逃避大环内酯类药物、外排泵排出喹诺酮类等策略,使药物失效。
耐药基因通过质粒、噬菌体在环境中扩散,甚至存在于未接触抗生素的偏远人群肠道中。通过评估个体肠道菌群中耐药基因的分布特点(如喹诺酮耐药基因的丰度),临床可优先选择对特定菌株敏感的抗生素,减少盲目使用广谱药物带来的生态风险。
本文谷禾通过查阅文献以及指南等,带大家一起深入理解抗生素的分类体系和作用机制,以及如何根据来源、作用谱和效果来认识不同的抗生素,及其针对不同微生物的使用策略探讨,在理解和允许的情况下结合感染或致病菌合理选择抗生素,并知晓其可能的副作用和耐药防控。
“抗生素”一词源自希腊语“anti”(反对)和“bios”(生命),指通过特异性作用于细菌靶点来抑制或杀灭微生物的有机分子。
天然抗生素最初由微生物(如真菌、细菌)产生,例如青霉素由青霉菌合成,链霉素来自链霉菌。现代抗生素的定义已扩展至包括全合成或半合成化合物,如磺胺类、喹诺酮类等。
抗生素的发现是医学史上的里程碑。

图源:tansuo
抗生素的现代角色抗生素在治疗细菌感染(如肺炎、尿路感染、皮肤感染)、预防术后感染及控制流行病中不可或缺。例如,β-内酰胺类抗生素(如青霉素)至今仍是许多感染的一线药物。
回顾抗生素的发展历程,这些微观世界的”分子武器”究竟是如何发挥作用的?它们为何能在细菌的生命过程中制造如此精准的”障碍”?
按来源分类
■ 天然抗生素
抗生素的天然来源涉及从生物成分中生产抗生素,其中包括微生物作为主要来源。
天然来源可能包括从细菌、真菌或放线菌中提取抗生素。
■ 半合成抗生素
这包括使用微生物生产从发酵中获得的物质,然后通过添加官能团进行化学修饰,从而产生变异。
例如:青霉素-氨苄西林、阿莫西林、甲氧西林。
■ 合成抗生素
属于这一类的抗生素是通过化学合成获得的。
示例:磺胺类药物、喹诺酮类药物。
按活性谱分类
■ 广谱抗生素
这些对革兰氏阳性菌和革兰氏阴性菌均具有活性。
例子包括:四环素类、氟喹诺酮类、“第三代”和“第四代”头孢菌素类。
■ 窄谱抗生素
它们的活性有限,主要仅对特定种类的微生物(革兰氏阳性或革兰氏阴性)有用。
例如,糖肽和杆菌肽仅对革兰氏阳性菌有效,而多粘菌素通常仅对革兰氏阴性菌有效。
氨基糖苷类和磺胺类药物仅对需氧微生物有效,而硝基咪唑通常仅对厌氧菌有效。
按抗菌活性分类
■ 抑菌剂
指那些阻止或抑制细菌生长的抗生素,也就是说细菌不会繁殖或产生,但它们不会杀死细菌。
例如:四环素、氯霉素
■ 杀菌剂
指根据所使用的抗生素,通过任何机制杀死细菌的抗生素。
示例:氨基糖苷类
基于行为模式的分类
细胞壁抑制剂:β-内酰胺、杆菌肽
细胞膜抑制剂:聚霉素、唑类抗真菌药物
蛋白质合成抑制剂
核酸合成抑制剂:喹诺酮类、利福平、呋喃妥因
叶酸合成抑制剂:甲氧苄啶、磺胺类

Uddin TM, et al., J Infect Public Health. 2021
按化学成分分类
■ β-内酰胺类抗生素
在引入后的20年里,青霉素是唯一一类β-内酰胺类抗生素。20世纪60年代中期,青霉素类抗生素与头孢菌素类抗生素并列,20世纪末,碳青霉烯类抗生素和单杆菌类抗生素并列。
这些抗生素具有相同的抗菌作用机制,并且都具有β-内酰胺环作为其结构的组成部分,但它们在其他特征上存在很大差异。
这些抗生素的作用机制是抑制细胞壁。
如:青霉素、头孢菌素、碳青霉烯类、单巴坦
■ 四环素类抗生素
这些是一类具有四个环核的抗生素,都是从土壤放线菌中获得的。
四环素最早是在20世纪40年代和50年代开发的,有几种至今仍在使用,如四环素本身、土霉素和金霉素。
多西环素和米诺环素是分别于1966年和1972年发现的更有效的半合成类似物,此后直到2005年引入替加环素(一种甘氨酰甘氨酸衍生物)才有了重大进展,替加环蛋白通常比其他四环素更有效,并对一些对该组早期成员产生耐药性的生物体保持活性。
四环素在实验室浓度下可能具有杀菌性,但体内安全浓度下仅为抑菌剂。它们通过结合敏感生物的30S核糖体来抑制蛋白质合成。
■ 氨基糖苷类
这些是一组天然和半合成的抗生素,具有与两个或多个氨基糖残基糖苷连接的多元氨基。
氨基糖苷类抗生素具有杀菌作用,在碱性条件下活性更强。它们通过干扰细菌蛋白质合成发挥作用,主要针对需氧革兰阴性杆菌,但抗菌谱各异。
氨基糖苷类的所有成员都具有杀菌作用,在碱性pH值下更具活性。
它们通过干扰细菌蛋白质合成来发挥作用。
它们主要对需氧革兰阴性杆菌有活性,但光谱不同。
如:链霉素、新霉素、卡那霉素、阿米卡星、庆大霉素

■ 多肽
低分子量阳离子多肽抗生素,均为强效杀菌剂,但因毒性较高,极少全身使用。
■ 糖肽
目前仅有的两种重要糖肽抗生素是万古霉素和替考拉宁。
它具有复杂的三环糖肽结构,其大分子量意味着它不能穿透大多数革兰氏阴性菌的外膜,因此它的使用实际上仅限于治疗需氧或厌氧革兰氏阳性菌的感染。
万古霉素在接近其最低抑菌浓度(MIC)的浓度下对大多数易感细菌具有杀菌作用,并且是细菌细胞壁肽聚糖合成的抑制剂,其位置与β-内酰胺类抗生素不同。
■ 大环内酯类
如: 红霉素、克拉霉素、阿奇霉素
大环内酯类抗生素是由12-16碳内酯环组成的大分子,通过糖苷键与氨基糖连接。
红霉素于1952年首次发现,至今仍是重要抗生素。它常用于治疗呼吸道、皮肤及软组织感染。大环内酯类药物通过抑制细菌蛋白质合成发挥抗菌作用,通常为抑菌剂,但在高浓度下可能具有杀菌活性。红霉素的抗菌活性具有pH依赖性,随pH值升高而增强,最佳pH值约为8.5,该特性在其他大环内酯类药物中也不同程度地存在。
■ 利福霉素
利福平口服吸收良好,蛋白结合率高(80-90%),能穿透细胞壁作用于细胞内病原体(如结核杆菌)。利福昔明因肠道吸收率低,主要用于局部感染。
如:利福平、利福巴林
■ 链霉素
普利司他霉素、维吉尼亚霉素
奎奴普汀/达福普汀是以30:70比例混合的两种链阳霉素类抗生素。它们源自链霉菌,经化学修饰后,通过抑制蛋白质合成发挥作用。
■ 抗真菌药物
灰黄霉素、多烯类
■ 合成药物
喹诺酮类、咪唑类、硝基呋喃衍生物
■ 氯霉素
氯霉素最初于1947年从委内瑞拉链霉菌中分离得到,后经化学合成。它是一种黄白色结晶固体,可溶于水。其抗菌活性可能源于其硝基苯结构。氯霉素的作用机制是抑制蛋白质合成。
■ 夫西地酸
夫西地酸是一种类似类固醇的杀菌抗生素,主要用于对抗葡萄球菌。
它对青霉素耐药的金黄色葡萄球菌菌株有活性,包括MRSA,可以与红霉素或克林霉素联合使用,用于严重的葡萄球菌感染。
■ 克林霉素
克林霉素是另一种对革兰氏阳性球菌具有显著抑菌活性的抗生素,尽管对革兰氏阴性球菌的活性较低,对肠杆菌的活性完全没有。
克林霉素在结构上与大环内酯类无关,但具有相似的作用机制,因此它们之间可能会发生交叉耐药性。
■ 林可霉素
它是克林霉素的前身,具有类似的抗菌和毒性特性,但效力较弱。
以上,我们已基本了解了抗生素的分类体系及其作用机制,这些分子武器本应是人类对抗微生物感染的坚固屏障。然而,当这些强大的武器被不当使用时,细菌迅速发展出层出不穷的耐药策略,将医学奇迹逐渐转变为临床危机。
全球健康的紧迫威胁
许多与人类疾病流行相关的细菌病原体在抗生素使用后已演变成多重耐药(MDR)形式。例如,多重耐药结核分枝杆菌(MDR M. tuberculosis)是发展中国家和工业化国家都发现的主要病原体,成为20世纪版本的古老病原体。
其他严重感染包括医院相关感染,如:
“超级细菌”指那些因多重突变而具有增强致病性和死亡率的微生物。

超级细菌的崛起:抗生素滥用的致命代价
近十年来,结核病的治疗遭遇了重大危机,广泛耐药结核菌(XDR-TB)和完全耐药结核菌(TDR-TB) 接连出现,这些“超级结核菌”对至少四种一线抗生素完全失效,且在全球快速传播。更令人担忧的是,像大肠杆菌、肺炎克雷伯菌等常见致病菌,也因抗生素滥用纷纷进化出耐药性。其中,青霉素类抗生素(如阿莫西林)和头孢类抗生素的过度使用,直接促使细菌发展出“β-内酰胺酶”这种分解抗生素的酶,让药物彻底失效。
医院里的危险分子也在增加:
某些超级细菌的爆发竟是抗生素滥用的直接后果。例如,艰难梭菌引发的严重腹泻,高毒力产毒素菌株已被确认,作为一种革兰氏阳性孢子形成菌,很容易通过医院人员、设备和气溶胶传播。它的重新突出被认为是医院广泛使用抗生素的结果,如广谱头孢菌素,新的青霉素和氟喹诺酮类药物,导致革兰氏阴性肠道菌群的显著消耗,从而提高了艰难梭菌。
在感染数量和后果方面,霍乱弧菌仍是头号杀手。亚洲和南美洲的疫情仍因缺乏有效监测系统难以控制。这些案例无不警示:抗生素的每一次误用,都在加速催生更危险的敌人。
耐药机制:细菌的“生存绝招”
细菌对抗生素的耐药性,本质上是它们演化出的保命技能。科学家发现,这些技能涉及基因突变、酶分解药物、改变自身结构等多种手段,甚至能通过“共享基因”在细菌间传播耐药能力。
以下是几种典型的耐药策略:
1
分解抗生素的“盾牌”——β-内酰胺酶
β-内酰胺酶是一种酶,能像剪刀一样切断青霉素、头孢类抗生素的结构(β-内酰胺环),让药物失效。β-内酰胺酶基因可能是分布最广泛的耐药基因。
这种酶的基因广泛存在于细菌的质粒(可移动的基因片段)上,甚至能在不同细菌间“快递传播”。
例如,新的超广谱β-内酰胺酶(CTX-M酶)最初在土壤中的Kluyvera菌里被发现,并于20世纪90年代出现在临床上,后来传播到致病的大肠杆菌中,导致头孢类抗生素失效。
2
改变“药物靶点”——大环内酯类耐药
红霉素等药物,广泛用于革兰氏阳性感染治疗。
通过结合细菌的核糖体(蛋白质工厂)来杀菌。而耐药菌通过修改核糖体的RNA或蛋白质结构,让药物无法锁定目标。
结果:即使更换新型大环内酯类药物,细菌仍能通过类似机制抵抗,形成“交叉耐药”。
3
升级“防御系统”——喹诺酮类耐药
当这类高效抗生素在1987年首次推出时,一些专家过于乐观地认为:”这种新型抗生素几乎不可能产生耐药性,因为细菌需要同时发生至少两种基因突变才能对它产生明显的抵抗力。”
然而,现实很快就打破了这些预测:
科学家感叹,永远别低估细菌的适应能力。
4
天生的“耐药基因”——内在耐药性
内在耐药性指细菌基因组中存在可能产生耐药表型的基因,即原始或准耐药性。不同属、种、菌株等表现出不同范围的抗生素反应表型。例如,某些肠道菌天生对磺胺类药物不敏感。
潜在威胁:这些基因平时潜伏,一旦被其他致病菌获取,可能引发新的耐药危机。
科学家们开发了一种方法来预测潜在的耐药基因。通过系统性地敲除细菌基因组中的每一个基因,观察哪些基因缺失会使细菌对抗生素变得更敏感。
逻辑很简单:如果缺少某个基因会使细菌更容易被抗生素杀死,那么这个基因过度表达可能会使细菌更具抗药性。
这种前瞻性研究已在多种细菌中进行:
5
环境中的“耐药基因库”
长期以来,人们知道可以通过在实验室中将环境细菌培养在含抗生素的培养基上来分离耐抗生素的细菌菌株。
产抗生素细菌的自我保护机制
对于那些能够产生抗生素的细菌(如放线菌),它们拥有耐药性并不令人惊讶。这是一种自我保护机制,细菌必须有能力抵抗自己生产的”武器”。在许多情况下,科学家们已经确定这种耐药机制是通过特定的酶来修饰抗生素,使其失去活性。
链霉菌:β-内酰胺酶的重要来源
链霉菌(Streptomycetes)能产生多种β-内酰胺酶(一种能破坏青霉素类抗生素的酶)。这很可能是如今临床上出现的一些β-内酰胺类抗生素耐药性的源头。同样,环境中的Kluyvera菌已被证实是CTX-M基因(一种重要的耐药基因)的起源。
多重耐药机制的进化蓝图
在产抗生素的细菌中,多重耐药机制十分常见,如四环素生产者Streptomyces rimosus就具有这种特性。根据生化和遗传相似性分析,这些天然存在的耐药机制预示了后来在致病细菌中发现的耐药机制。换句话说,致病菌的耐药策略很可能是从环境细菌那里”借鉴“而来的。
启示:耐药性为何难以控制?
对其他产抗生素细菌的进一步研究,如芽孢杆菌科、假单胞菌、蓝藻和多种放线菌科(这是一个已知能产生许多生物活性小分子的细菌群体),将有助于我们更全面地了解自然界中存在的耐药基因的本质和多样性。这些知识对于预测和应对未来可能出现的临床耐药问题至关重要。
当我们越来越理解这场微生物与药物之间的分子博弈,便不得不直面一个问题:如何在保持抗生素治疗效力的同时,为抗生素的未来开辟一条可持续发展的道路?下一章节我们来继续了解。
常见感染与抗生素选择
1. 尿路感染 (UTI)
无并发症尿路感染
– 首选药物:甲氧苄啶/磺胺甲噁唑(Bactrim Ds)、呋喃妥因(硝基呋喃类)
– 替代方案:头孢氨卡(Keflex,第一代头孢菌素)、阿莫西林/克拉维酸(Augmentin)
复杂性或上尿路感染(如肾盂肾炎)
– 首选药物:氟喹诺酮类(如环丙沙星Cipro、左氧氟沙星Levaquin)
– 替代方案:第三代头孢菌素(如头孢曲松)、氨基糖苷类(庆大霉素)
用药注意事项
– 磺胺类药物可能引起结晶尿,需充分水化
– 氟喹诺酮类因肌腱损伤和神经毒性风险,禁用于儿童及孕妇
– 氨基糖苷类雲监测肾功能及耳毒性
2. 肺 炎
社区获得性肺炎(CAP)
– 非重症患者:阿奇霉素(Zithromax,大环内酯类)或多西环素(Vibramycin,四环素类)
– 合并基础疾病或耐药风险:阿莫西林/克拉维酸(Augmentin)联合大环内酯类
医院获得性肺炎(HAP)
– 首选药物:第三代头孢菌素(如头孢他啶)或碳青烯类(如美罗培南)联合氟喹诺酮类
用药注意事项
– 大环内酯类(如阿奇霉素)可能延长QT间期,禁用于心律失常患者
– 碳青霉烯类需螫惕超广谱β-内酰胺酶(ESBL)耐药菌感染
3. 皮肤及软组织感染
轻度感染(如蜂窝织炎)
– 首选药物:头孢氨苄(Keflex)或双氯西林(耐酶青霉素)
疑似耐甲氧西林金黄色葡萄球菌(MRSA)感染
– 首选药物:复方磺胺甲噁唑(Bactrim DS)、克林霉素(Cleocin)
– 替代方案:万古霉素(糖肽类)或达托霉素(环脂肽类)
用药注意事项
– 需警惕艰难梭菌感染克林霉素可能引起伪膜性肠炎
– 万古霉素需根据肾功能调整剂量,监测血药浓度
4. 链球菌性咽炎 (Strep Throat)
首选药物
– 青霉素V钾(Penicillin VK)或阿莫西林(Amoxil)
青霉素过敏患者
– 阿奇霉素(Zithromax)或克拉霉素(Biaxin)
用药禁忌
– 四环素类(如多西环素)对链球菌活性低,不推荐作为一线治疗
– 氟喹诺酮类对链球菌无效
禁忌症与用药原则
病毒性感染的绝对禁忌
流感、普通感冒、急性病毒性鼻窦炎等无需抗生素治疗
滥用抗生素将增加耐药风险:60%的急性支气管炎为病毒性,仅需对症处理
特殊人群剂量调整
肝肾功能不全者:氨基糖苷类需减少剂量;磺胺类慎用于肾功能减退患者
孕妇与哺乳期妇女:禁用四环素类(影响胎儿骨骼发育)、氟喹诺酮类(致畸风险)
药物相互作用风险
大环内酯类(如红霉素)抑制CYP3A4酶,可能升高华法林、他汀类药物浓度
复方磺胺甲噁唑(Bactrim)增强磺脲类降糖药作用,需监测血糖
不合理用药的后果
耐药性加速:如氟喹诺酮类滥用导致铜绿假单胞菌外排泵基因突变频发
生态失衡:广谱抗生素(如第三代头孢菌素)破坏肠道菌群,增加艰难梭菌感染风险
经济负担:非必要使用增加医疗成本
抗生素的选择需基于病原体敏感性、感染严重程度及患者个体化因素。
临床实践中应严格区分细菌性与病毒性感染,优先使用窄谱抗生素。通过规范用药,可最大限度延缓耐药性蔓延。
通过肠道菌群检测识别抗生素耐药基因
宏基因组测序可获得细菌群体的全部基因组信息,通过序列比对和功能注释,可鉴定出各种已知和新型耐药基因,全面评估耐药基因的种类和数量。
例如,在人体肠道宏基因组中发现了大量β-内酰胺酶等耐药基因。
2021年一项研究显示,印度某社区爆发的碳青霉烯耐药肺炎克雷伯菌感染,其耐药基因与当地养殖场废水中分离的菌株高度同源,证实耐药基因通过水源传播至人体。
数据驱动的防控策略:从预警到干预
基于宏基因组分析的耐药风险评估,可制定精准防控措施:
对畜牧从业人员、医护人员等暴露于耐药基因环境的人群定期检测肠道菌群,早期发现耐药定植。
临床用药指导:建立区域耐药基因数据库,实时更新病原体耐药谱,帮助医生相对个性化地选择的窄谱抗生素(如用头孢他啶替代广谱碳青霉烯类药物)。
谷禾宏基因组肠道菌群检测报告中,就有抗生素耐药基因检测相关内容。
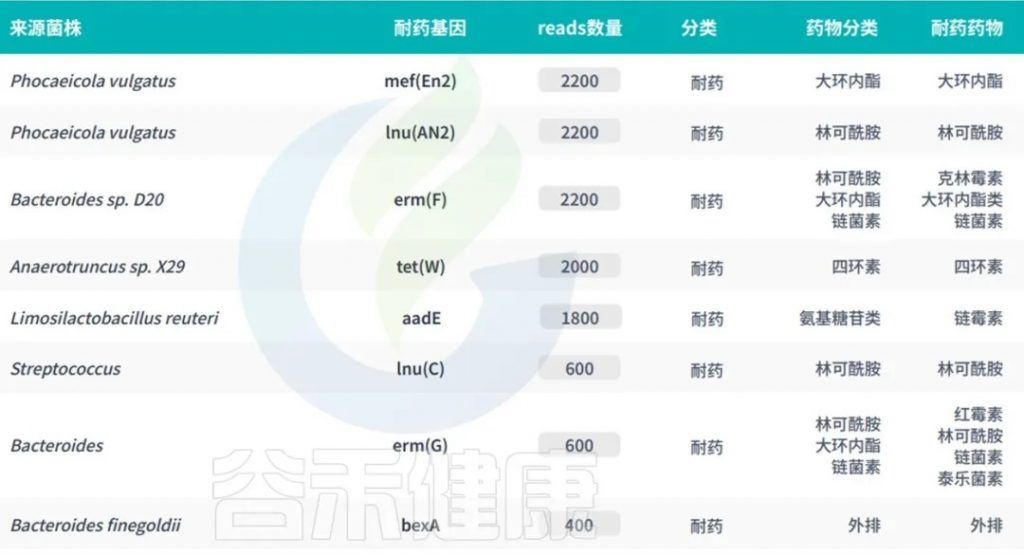
<来源:谷禾宏基因组肠道菌群健康检测数据库>
筛查应用:如对术前患者进行肠道耐药基因检测,若检出 vanA(万古霉素耐药基因),可优先选择替考拉宁或达托霉素替代万古霉素,降低术后感染风险。
用药方案优化:在复杂性尿路感染治疗中,若患者肠道中qnrS(氟喹诺酮耐药基因)丰度较高,应避免使用左氧氟沙星,转而选择磷霉素或呋喃妥因。
存在争议
支持证据
Cochrane综述表明,在抗生素后服用益生菌的儿童腹泻较少。
注:Cochrane综述是由国际非营利组织Cochrane协作网制作的系统性综述,被公认为循证医学领域的最高标准,旨在通过系统性方法评估医疗干预措施(如药物、手术、诊断测试)的有效性、安全性及适用性,为临床决策和政策制定提供可靠证据。
Cochrane对23项研究(3938名参与者)的综述调查了给予含有以下一种或多种的益生菌:
22/23项报告抗生素相关性腹泻发病率的试验结果显示,与活性、安慰剂或无治疗对照组相比,益生菌具有显著益处(益生菌组为8%,对照组为19%)。
报告副作用的16项试验(n=2455)均未记录任何可归因于益生菌的严重副作用,最常见的副作用是皮疹、恶心、胀气、肠胃气胀、腹胀、腹痛、呕吐、痰增、胸痛、便秘、味觉障碍和食欲低下。作者的结论是,益生菌对预防抗生素相关性腹泻具有保护作用。相对风险为0.46(95%CI 0.35至0.61),NNT为10。
作者认为,鼠李糖乳杆菌或布拉氏酵母菌的菌落形成单位为50亿~400亿个/天是最合适的选择。他们还评论,尽管在这些试验中,在其他健康儿童中没有观察到严重的不良事件,但在具有潜在风险因素(如中心静脉导管使用)的严重衰弱或免疫功能低下的儿童中观察到了严重的不良事件,并建议在进行进一步研究之前,应避免在有不良事件风险的儿科人群中使用益生菌。
反对观点
以色列魏茨曼科学研究所的科学家发现,当患者服用抗生素后,如果连续四周补充含11种菌株的复合益生菌,肠道菌群需要整整六个月才能恢复正常。尽管这些益生菌成功在肠道“安家落户”,但新引入的细菌和酵母菌株反而干扰了原有菌群的恢复。
对比发现:未服用益生菌的患者,停用抗生素后仅需三周,肠道菌群就自行恢复正常。
关键提示:
替代方案?
科学家正在探索其他恢复肠道的方法:
注:目前异体粪便移植目前是主流,但自体粪便移植可避免供受体不匹配的问题,部分研究仍处于早期阶段,需进一步验证长期安全性和有效性。
实用建议
如果你决定服用含有抗生素的益生菌,请在开始服用抗生素的同一天开始服用,但不要与抗生素完全同时服用。
选择高活性菌株,如鼠李糖乳杆菌GG、布拉氏酵母菌(每日5-400亿菌落单位)。
间隔服用时间,抗生素服用后2小时再服益生菌,避免活性被抑制。
抗生素的未来发展需在科学突破、临床实践与健康管理之间找到平衡点。面对耐药性危机,人类正通过多维度创新重塑感染治疗的格局。
1. 新型抗生素研发:从基因靶点到智能设计
宏基因组学驱动,通过分析环境样本(如深海沉积物、极端环境微生物)的宏基因组数据,挖掘新型抗生素合成基因簇。
合成生物学技术:利用CRISPR-Cas9基因编辑改造放线菌的代谢通路,定向生产改良抗生素。如改造链霉菌以高产泰斯巴汀(一种可靶向细胞壁脂质的广谱抗生素)。
噬菌体-抗生素联用,穿透生物膜杀灭耐药菌。例如,噬菌体搭载 β-内酰胺酶抑制剂,可恢复青霉素对产酶菌的活性。
缩短新药研发周期(从传统10-15年压缩至5-8年),降低开发成本,并为“无药可治”的超级细菌感染提供解决方案。
2. 精准医疗:从“一刀切”到个体化治疗
通过宏基因组测序分析患者肠道耐药基因谱(如 CTX-M、NDM-1),指导抗生素选择。例如,若检测到高丰度氟喹诺酮耐药基因(qnr),则优先选择磷霉素或呋喃妥因替代左氧氟沙星。
针对抗生素导致的菌群失衡,开发“益生菌-益生元-后生元”组合产品。例如,含 Akkermansia muciniphila 的微生态制剂可加速肠道屏障修复,减少艰难梭菌定植风险。
催生“感染精准医疗”细分市场,涵盖检测试剂、数据分析平台和微生态调节产品,预计2030年全球市场规模将突破520亿美元。
3. 耐药性防控:环境-医院-社区的联防联控
建立全球耐药基因数据库(如 ResistoMap),追踪耐药基因热点区域。例如,印度恒河流域因高浓度 blaNDM-1 基因被列为“耐药红色预警区”。
医院综合当地耐药数据、患者过敏史、肝肾功能、菌群检测报告等各类数据,个性化推荐窄谱抗生素。
设立“微生物学-药学-数据科学”交叉学科,开展耐药知识科普,提高公众对不当使用抗生素危害的认知,利用菌群检测手段辅助判别耐药情况,指导居民合理用药。
通过环境、医院、社区的协同联动,构建一个全方位的耐药性防控体系,减缓耐药菌的传播速度,保障公众健康。
抗生素的未来不仅是科学问题,更是社会命题。从基因编辑实验室到养殖场,从医院处方系统到家庭药箱,每个环节的革新都在重塑人类与微生物的关系。将技术创新、精准医疗和全球治理相结合,让抗生素这一“医学奇迹”持续守护生命,而非成为耐药危机的推手。
主要参考文献
Denyer S.P, Hodges N, Gorman S.P and Gilmore B.F. 2011. Hugo and Russell’s Pharmaceutical Microbiology. Eighth edition. A John Wiley & Sons, Ltd. Publication. Page no.169-193.
Antibiotics: Comprehensive Guide
Last updated: August 10, 2022 by Sagar Aryal
Davies J, Davies D. Origins and evolution of antibiotic resistance. Microbiol Mol Biol Rev. 2010 Sep;74(3):417-33.
Uddin TM, Chakraborty AJ, Khusro A, Zidan BRM, Mitra S, et al., Antibiotic resistance in microbes: History, mechanisms, therapeutic strategies and future prospects. J Infect Public Health. 2021 Dec;14(12):1750-1766.

谷禾健康

益生菌被世界卫生组织定义为“当摄入足够量时,可为宿主带来健康益处的活微生物”。近年来,随着人们发现其可用于预防、减轻或治疗特定疾病以及改善健康,益生菌在食品和临床治疗中的应用越来越广泛。
大量研究表明,益生菌有助于维持肠道菌群的平衡,促进消化和吸收营养物质;可以改善皮肤状况,减少皮肤问题如湿疹、痤疮等的发生;对治疗肠道疾病如腹泻、便秘、肠炎等有积极作用;此外,益生菌还可以减少细菌性阴道病,预防婴儿特应性皮炎,减少口腔病原体和龋齿,减少常见上呼吸道感染的发病率和持续时间。益生菌和益生元也被用于预防代谢综合征的一些表现,包括超重、2型糖尿病和血脂异常等。
然而,益生菌也不是什么“灵丹妙药”,盲目地补充益生菌也是不好的。谷禾曾检测发现一些人过量补充益生菌,导致肠道微生物群极度不平衡,这也是不利于健康的。
并且一些研究已证实了益生菌导致的不良事件是存在的。国际益生菌和益生元科学协会召开了一次会议,涉及益生菌潜在的急性和长期风险、对弱势群体的风险、益生菌产品质量满足弱势群体需求的重要性以及与益生菌使用相关的不良事件报告。
益生菌理论上可能会导致五种潜在风险:
1.微生物群组成或功能的改变;
2.入侵其他组织导致感染;
3.有害的代谢活动;影响药物功能;
4.易感个体的过度免疫刺激;
5.抗生素耐药基因转移。
此外,有大量证据表明益生菌的有效性针对菌株和疾病具有特异性。益生菌的效果因使用的菌株、给药周期和持续时间而异。并且对干预措施的反应也可能会因人而异,他们的健康状况、年龄和肠道微生物组的组成,都会影响使用益生菌的效果。
鉴于益生菌的使用日益广泛,必须全面了解其风险和益处,重新审视益生菌的安全问题。在本文中,我们回顾了益生菌所带来的一些健康益处,并讨论了其使用过程中存在的一些风险以及特别需要注意的人群。尽管益生菌在大多数时候是安全的,但在某些患者群体中应谨慎使用,尤其是早产儿或免疫缺陷的新生儿。
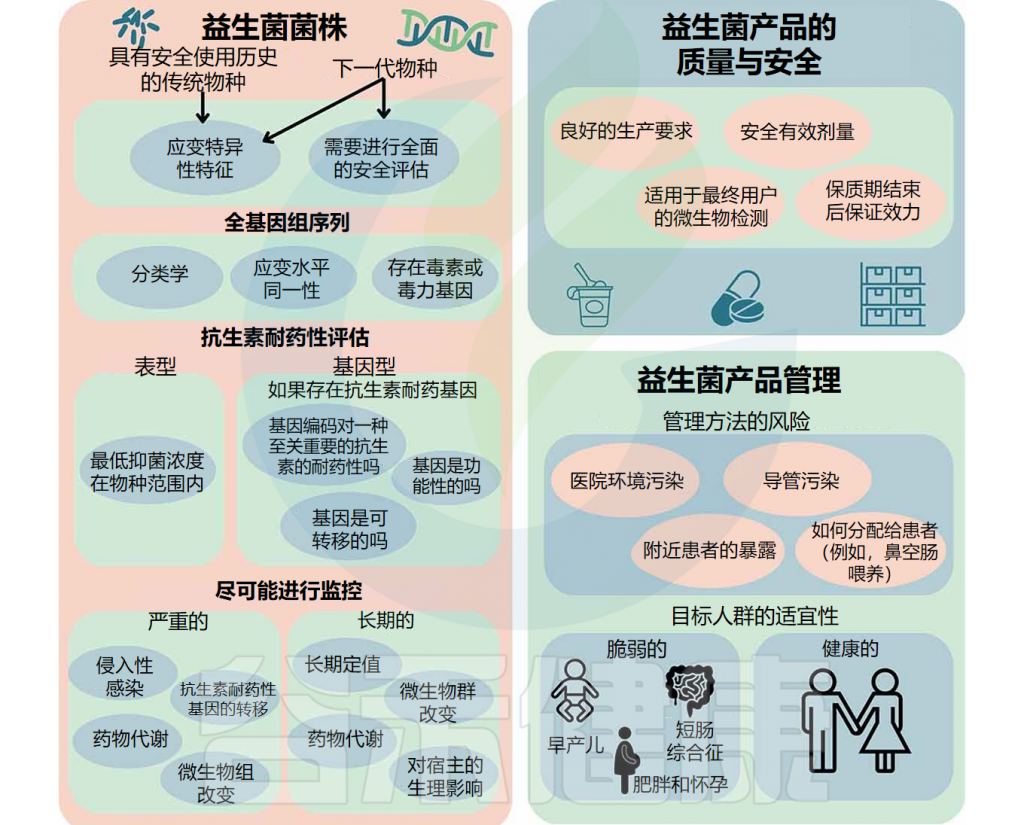
Merenstein D,et al.Gut Microbes.2023
益生菌一词源自拉丁语“pro”,意思是“为了”,希腊语“biotic”意思是“生命”。益生菌被广泛认为是促进健康的微生物。
联合国粮食及农业组织(FAO)和世界卫生组织(WHO)将益生菌定义为“在摄入足够量时可为宿主带来健康益处的活微生物”。
此外,国际奥委会(IOC)表示:“益生菌是活的微生物,口服几周后可以增加肠道中有益细菌的数量。这些与肠道健康的一系列潜在益处以及免疫功能的调节有关”。与其他膳食补充剂相比,益生菌制剂是独一无二的,它含有足够数量的活的、有活力的、明确的微生物,可以提供有益的健康效果。
乳杆菌和双歧杆菌是最常用的益生菌,但酵母菌和一些大肠杆菌和芽孢杆菌也被使用。新型益生菌还包括最近被批准的丁酸梭菌。
唾液乳杆菌UCC118的电镜照片
World Gastroenterology Organisation.2017
★ 益生菌用于改善健康已有悠久历史
益生菌的原理可以追溯到100多年前,早在1857年,法国微生物学家巴斯德就已经在酸奶中发现了益生菌。1908 年,乳酸菌之父 Elie Metchnikoff 提出,改变我们体内的微生物群并用有用的微生物取代有害的微生物是可能的。
在过去的几十年里,益生菌领域的研究取得了长足的进步,由于益生菌产品对健康有益,益生菌产品的使用和接受度在全球范围内不断增加。
迄今为止,人类对于益生菌的研究依然处在一个世界热门课题阶段,可见益生菌对于人类健康事业的重要意义。
★ 益生菌的作用机制
益生菌通常在胃肠道发挥作用,可能影响肠道微生物群。益生菌可以以高度个性化的模式短暂定植于人类肠道粘膜,具体取决于基线微生物群、益生菌菌株和胃肠道区域。
益生菌影响微生物群和疾病进程
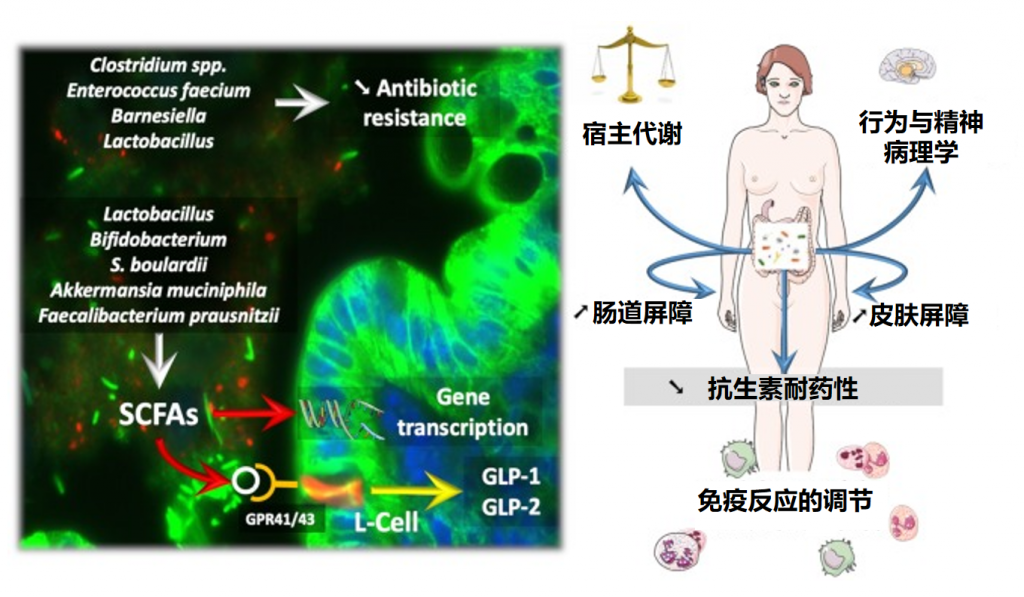
Wieërs G,et al.Front Cell Infect Microbiol.2020
益生菌还通过非特异性、物种特异性和菌株特异性机制发挥健康作用。常用益生菌补充剂的菌株、物种甚至属之间的非特异性机制差异很大。这些机制包括抑制胃肠道中病原微生物的生长(通过促进定植抵抗、改善肠道转运或帮助受干扰的微生物群正常化)、产生生物活性代谢物(例如短链脂肪酸)以及减少管腔结肠中的pH值。
物种特异性机制包括维生素合成、肠道屏障强化、胆汁盐代谢、酶活性和毒素中和。
菌株特异性机制非常罕见,并且仅被特定物种的少数菌株使用,包括细胞因子产生、免疫调节以及神经递质分子参与肠-脑轴通讯、对内分泌和神经系统的影响。通过所有这些机制,益生菌可能对人类健康和疾病产生广泛的影响。
微生物群和益生菌与宿主相互作用的机制
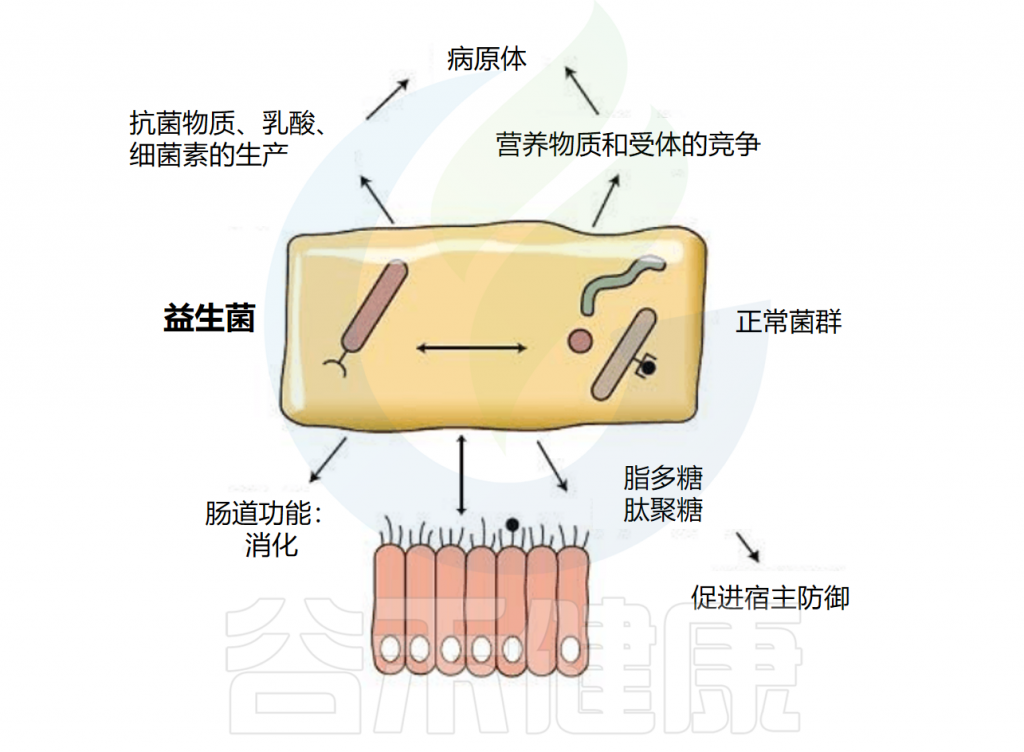
World Gastroenterology Organisation.2017
注:由于益生菌的作用可能特定于某些物种和菌株,因此其在临床或研究中使用的建议需要针对物种和菌株而定。此外,汇集不同类型益生菌研究的数据可能会导致关于其功效和安全性的误导性结论。
★ 益生菌的安全性也值得重视
尽管有潜在的好处,但益生菌对人类健康的有效性仍然存在不确定性,这主要是因为许多研究没有考虑到这些影响可能是针对菌株、剂量和条件的,并且对干预措施的反应可能会因人而异。独特的部分取决于他们的健康状况、年龄和肠道微生物组的组成。
重要的是,许多研究未能报告不良反应,或没有提供有关不良反应的具体细节,例如症状发生的时间、持续时间和严重程度。缺乏安全数据收集和报告可能会导致不良或意外的健康结果。
临床医生、研究人员和政策制定者已经提出了与益生菌安全性相关的担忧。这些问题可以广泛地分为与益生菌菌株、产品质量或益生菌管理相关的问题。
益生菌携带的抗生素抗性基因转移
一个令人担忧的问题是,益生菌携带的抗生素抗性基因可以转移到常驻的潜在病原体、宿主携带的其他微生物或环境微生物中,从而增加抗生素耐药性基因的生态库。
微生物污染物的存在
特别值得关注的是有害活微生物污染物的存在。由于益生菌被设计为活微生物形式施用,因此与经过有意灭菌过程的产品相比,被致病或潜在致病微生物污染的风险更大。最终产品的微生物污染以及过敏原或其他污染物的存在也令人担忧。
与益生菌产品配方安全相关的问题包括需要确定最终产品的纯度、效力(提供的活微生物的数量)和成分。此外,益生菌产品必须经过充分的测试(适合预期用途)以检测潜在污染物。
使用益生菌的方式也必须是安全的
给予或服用益生菌的方式也必须是安全的。安全给药包括对宿主的适当给药途径以及益生菌在现场的正确操作或制备。产品应以安全的剂量和最终配方交付。
例如,此类管理问题之一是一旦益生菌在现场打开并使用,医院环境和弱势患者可能会受到交叉污染。在医院病房内混合干燥的益生菌会导致静脉导管感染。
发酵食品
食用发酵食品是获取益生菌的一种重要方式,发酵食品是通过各种活微生物培养物的生长和代谢活动制成的。其中许多食物都含有丰富的活微生物和潜在有益微生物。
一些发酵食品,例如酵母面包和大多数商业泡菜,在发酵后进行加工,在食用时不含有活菌。而许多酸奶含有益生菌微生物,例如保加利亚乳杆菌(Lactobacillus bulgaricus)和嗜热链球菌(Streptococcus thermophilus)。
• 发酵食品中的部分活微生物无法到达远端肠道
用于制造许多发酵食品(包括酸奶)的活微生物通常在产品的整个保质期内都能很好地存活。然而,它们通常无法通过胃,并且可能无法抵抗小肠中水解酶和胆汁盐的降解,因此可能无法到达远端肠道。
然而,酸奶或其他食物中含有的部分益生菌菌株确实可以在肠道运输中存活下来。
含有活菌但不确定是否是益生菌微生物的发酵食品包括许多奶酪、泡菜(一种韩国发酵卷心菜)、普洱茶(一种发酵茶)、酸菜(发酵卷心菜)、味噌(一种发酵大豆酱),以及由发酵苹果糖制成的未经过滤的生苹果醋。
• 一些未发酵食品中也添加了微生物
某些未发酵食品,例如牛奶、果汁、冰沙、麦片、营养棒以及婴幼儿配方奶粉,都添加了微生物。这些食物是否是真正的益生菌取决于它们食用时所含的微生物水平、它们是否能在肠道运输中存活,以及它们的特定物种和菌株是否对健康有影响。
益生菌补充剂
益生菌也可以作为含有多种菌株和剂量的膳食补充剂(胶囊、粉末、液体和其他形式)提供。这些产品通常含有活微生物的混合培养物而不是单一菌株。
• 益生菌补充剂并不是含有的菌种数量越多带来的健康效果就越好
许多益生菌补充剂每剂含有1至100亿CFU,但有些产品含有高达500亿CFU或更多。然而,较高的CFU计数并不一定会改善产品的健康效果。
益生菌以菌落形成单位(CFU)为单位进行测量,它表示活细胞的数量。数量可以写在产品标签上,例如,1×10^9表示10亿CFU,或1×10^10表示100亿CFU。
由于益生菌必须活着食用才能对健康有益,而且益生菌可能在保质期内死亡,因此用户应寻找在产品保质期结束时(而不是在制造时)标有CFU数量的产品。
目前的法规仅要求制造商在益生菌产品的补充成分标签上列出微生物的总重量;该细胞团可由活微生物和死微生物组成,因此与产品中活微生物的数量无关。
益生菌的潜在健康益处是大量科学研究的焦点。本节介绍了使用益生菌在预防或治疗一些疾病中的作用,包括:特应性皮炎、小儿急性感染性腹泻、炎症性肠病、肠易激综合征、高胆固醇血症和肥胖。
1
特应性皮炎
特应性皮炎是最常见的湿疹形式,也是最常见的慢性炎症性皮肤病之一,影响全世界约15%至20%的儿童和1%至3%的成人。
许多益生菌研究评估了不同种类和菌株的细菌对预防特应性皮炎的作用,并且一些荟萃分析综合了这些研究的结果。
• 怀孕和婴儿早期接触益生菌可能降低儿童特应性皮炎的风险
研究和荟萃分析表明,在怀孕期间和婴儿早期接触益生菌可能会降低儿童患特应性皮炎的风险。例如,2018年的一项荟萃分析包括27项随机对照试验和一项对照队列研究,共有6907名婴儿和儿童在子宫内接触益生菌2周至7个月(通过母亲口服补充剂)或出生后2至13个月的婴儿口服给药。
在6个月至9岁之间,使用单一菌株或包括乳杆菌、双歧杆菌和丙酸杆菌菌株的混合物进行益生菌治疗可显著降低特应性皮炎的风险,从对照组的34.7%降至益生菌组的28.5%。
• 益生菌的治疗效果因菌株而异
此外,益生菌治疗的效果因益生菌菌株而异。例如,补充鼠李糖乳杆菌(Lactobacillus rhamnosus)或副干酪乳杆菌(Lactobacillus paracasei)可显著降低特应性皮炎的发病率,而补充罗伊氏乳杆菌或嗜酸乳杆菌则不会。
另一项荟萃分析包括8项随机临床试验,共有741名从出生到36个月大的参与者接受了乳酸菌或双歧杆菌治疗4至24周。结果表明,含有乳酸菌的益生菌可能会减轻婴儿和幼儿的特应性皮炎症状,但含有双歧杆菌的益生菌则不然。该治疗显著改善了患有中度至重度疾病的参与者的症状,但没有改善轻度疾病参与者的症状。
对2599名1至55岁参与者(大多数是儿童)使用单一益生菌和益生菌混合物治疗湿疹的39项随机对照试验进行了审查,发现益生菌治疗可能会略微降低 SCORAD评分。
SCORAD评分是一种用于评估湿疹严重程度的临床工具,它考虑了湿疹的病变严重程度、病变范围和瘙痒程度。
总体而言,现有证据表明,使用益生菌可能会降低患特应性皮炎的风险,并导致特应性皮炎SCORAD评分显著降低,但这些产品只能有限地缓解病情。
此外,益生菌的效果因使用的菌株、给药时间和患者年龄而异,因此很难提出建议。
2
小儿急性感染性腹泻
急性腹泻通常被定义为稀便或液状粪便或排便频率增加(通常24小时内至少3次)。急性腹泻可伴有发烧或呕吐,通常持续不超过7天。
• 使用益生菌缩短了腹泻的持续时间
对8014名参与者(主要是婴儿和儿童)进行了审查,发现单菌种和多菌种益生菌可显著缩短急性感染性腹泻的持续时间约25小时。这些补充剂还可以将腹泻持续4天或以上的风险降低59%,并且与未服用益生菌的患者相比,服用益生菌的患者第二天排便次数减少约1次。
对总共2444名参与者的11项随机临床试验的评估表明,鼠李糖乳杆菌(LGG)在治疗感染性腹泻方面最有效,每日剂量至少为10^10 CFU。布拉氏酵母菌(最常见的是10^9至10^10 CFU/天,持续5-10天)可减少腹泻持续时间和排便频率。
在这两项分析中,LGG和布拉氏酵母菌将急性感染性腹泻的持续时间缩短了大约1天。
然而,随后的两项临床试验发现,为期5天的LGG疗程(一项试验中每天两次单独服用1×10^10 CFU,另一项试验中每天两次总计4×10^9 CFU LGG 和瑞士乳杆菌R0052)没有效果。
然而,最近的研究表明,益生菌在急诊科可能并不有效,因为大多数急性感染性腹泻的发作都是自限性的,除了补液治疗外不需要其他治疗。
3
炎症性肠病
炎症性肠病(IBD)是一种慢性炎症疾病,包括溃疡性结肠炎和克罗恩病。IBD的确切原因尚不清楚,但可能是遗传因素和环境因素的结合,包括遗传改变和免疫系统功能障碍。IBD有多种治疗方法,包括口服类固醇和其他药物,但尚无治愈方法。
研究人员正在探索IBD患者的肠道微生物组是否发生改变,以及益生菌是否有助于控制炎症性肠病。研究得出了类似的结论——某些益生菌可能对溃疡性结肠炎有一定的有益作用,但对克罗恩病没有作用。
• 益生菌补充配合常规疗法可能使治疗效果更好
美国胃肠病学协会2020年的一项系统综述研究了益生菌在治疗胃肠道疾病中的作用。根据有限的证据,这些补充剂与常规疗法相结合可能会适度降低轻度至中度溃疡性结肠炎患者的疾病活动度。
但证据的局限性包括现有研究使用不同的患者群体、益生菌配方、治疗持续时间和伴随疗法。
2020年对865名溃疡性结肠炎参与者进行的14项研究也表明,益生菌可能有助于诱导缓解,并且益生菌与5-ASA(一种常用于治疗IBD的抗炎药物)联合使用可能优于单独使用5-ASA。
尽管益生菌可能对溃疡性结肠炎有一定的益处,但不常规使用。对于克罗恩病,还没有发现任何益处的证据。
还需要进行更多研究,包括强有力的随机对照试验,以确定哪些炎症性肠病患者可能受益于益生菌以及哪些益生菌菌株最有效。
4
肠易激综合症
肠易激综合征(IBS)是一种常见的胃肠道功能性疾病,其特征是反复出现腹部不适或疼痛、腹胀以及大便形式或频率的变化。尽管IBS的病因尚不完全清楚,但越来越多的证据表明肠道微生物群在其病理生理学和症状中具有潜在作用。
IBS患者体内含有丰富的促炎细菌,包括肠杆菌科细菌,而乳杆菌和双歧杆菌的数量通常也会相应减少。益生菌产品通常含有乳杆菌和双歧杆菌,因此有可能恢复一些缺失的微生物功能,从而帮助控制肠易激综合症症状。
• 益生菌对肠易激综合症患者具有一定积极作用
多项荟萃分析评估了益生菌对肠易激综合症患者的作用。大多数发现益生菌具有积极的、虽然有限的有益作用。例如,对总共2575名患者的23项 RCT 进行的荟萃分析发现,总体而言,益生菌可将IBS 症状持续或未改善的风险降低21%。
不同种类和菌株的益生菌对整体IBS症状、腹痛、腹胀和肠胃气胀具有有益作用,但研究质量较低。在此分析中,某些益生菌组合优于单个菌株,但没有特定组合优于其他组合。
对总共1793名IBS患者的15项RCT进行的第二次荟萃分析发现,治疗8至10周后,益生菌比安慰剂更能减轻总体症状和腹痛;在儿童中,这些补充剂还改善了粘膜屏障功能。
• 不同菌株对肠易激综合症的作用具有差异
不同菌株的益生菌对IBS的有益作用可能取决于所评估的IBS症状。在一项荟萃分析中,共有877名成人接受益生菌或安慰剂治疗4周至6个月,与安慰剂治疗相比,服用含有短双歧杆菌、长双歧杆菌或嗜酸乳杆菌的益生菌后疼痛评分显著改善。
相反,唾液链球菌嗜热亚种、动物双歧杆菌、婴儿双歧杆菌、干酪乳杆菌、植物乳杆菌、保加利亚乳杆菌和布拉酵母菌的益生菌无显著影响。
而使用含有短双歧杆菌、婴儿双歧杆菌、干酪乳杆菌或植物乳杆菌的益生菌可改善腹胀。使用所有测试的益生菌后,胀气现象有所减少。
总体而言,现有证据表明益生菌可能会减轻肠易激综合症的某些症状。然而,需要额外的高质量临床试验来确认所需的具体菌株、剂量和治疗持续时间,以及可以用益生菌有效治疗的肠易激综合症类型(例如腹泻或便秘)。
5
肥胖
肠道微生物群在从食物中提取营养和能量方面发挥着重要作用。研究表明,肠道微生物群不仅影响饮食中能量的使用,还影响宿主体内的能量消耗和储存。
评估益生菌对肥胖相关影响的临床试验结果不一致。例如,一项为期12周的临床试验,随机抽取210名年龄在35至60岁、内脏脂肪较多的健康成年人,每天饮用加氏乳杆菌的发酵奶。
• 益生菌对肥胖的影响可能并不显著
与对照组相比,接受10^7或10^6 CFU/g加氏乳杆菌牛奶的参与者的内脏脂肪面积(平均分别减少8.5%和8.2%)、体重指数、腰围和臀围以及身体脂肪量显著减少。
在另一项随机临床试验中,连续24周每日补充3.24x 10^8 CFU鼠李糖乳杆菌CGMCC1.3724,并在前12周进行能量限制饮食(比估计的卡路里需求少500kcal/天)并没有显著影响体重。然而,与安慰剂相比,77名女性参与者在12周(减轻1.8公斤)和24周(减轻2.6公斤),补充乳酸菌确实减轻了体重。
最近对957名超重或肥胖个体的15项随机对照试验进行的另一项系统回顾和荟萃分析发现,补充不同剂量和菌株的益生菌3至12周可导致体重(减少0.6公斤)、体重指数下降。比安慰剂低0.27kg/m2和脂肪百分比(低 0.6%)。然而,这些影响较小。
综上所述,这些结果表明,益生菌对体重和肥胖的影响可能取决于多种因素,包括益生菌菌株、剂量和持续时间以及使用者的某些特征,包括年龄、性别和基线体重。需要进行更多研究来了解益生菌对人体脂肪、体重和肥胖的潜在影响。
6
高胆固醇血症
血液中高水平的胆固醇或动脉壁中的胆固醇是心血管疾病的危险因素。低密度脂蛋白(LDL)将胆固醇携带至组织和动脉。LDL水平越高,患心血管疾病的风险就越大。高密度脂蛋白(HDL)将胆固醇从组织运送到肝脏并导致其排泄。高密度脂蛋白水平低会增加患心血管疾病的风险。
• 益生菌影响胆固醇水平的机制
研究人员研究了使用益生菌来改善血脂状况。它们对胆固醇浓度的影响机制包括通过增加胆固醇的分解代谢:
•影响胆盐水解酶活性,增加对新胆汁酸的需求,从而降低血清胆固醇水平;
•与小肠中的胆固醇结合,从而减少身体吸收的量;
•将胆固醇同化并掺入细菌中,从而降低血液中的胆固醇水平;
•乳杆菌和双歧杆菌产生短链脂肪酸,降低肝脏胆固醇合成并调节胆固醇代谢。
• 一些益生菌降低了总胆固醇和低密度脂蛋白水平
一项对30项随机对照试验的荟萃分析显示,与安慰剂组相比,接受益生菌治疗3至12周的受试者总胆固醇降低7.8mg/dL,低密度脂蛋白胆固醇浓度降低7.3mg/dL。
在亚组分析中,在持续8周或更长时间的研究中,以及在基线胆固醇水平高于240 mg/dL的参与者中,益生菌的益处略大。在三项以上研究中包括的菌株中,嗜酸乳杆菌、乳双歧杆菌以及植物乳杆菌的混合物与总胆固醇和低密度脂蛋白胆固醇浓度的显著降低有关,但瑞士乳杆菌和粪肠球菌则不然。
• 益生菌对高密度脂蛋白水平可能没有影响
在对602名胆固醇水平正常或高胆固醇成年人进行的11项随机对照试验中进行的一项小型荟萃分析显示,与安慰剂治疗组相比,接受益生菌治疗2至10周的患者总胆固醇水平降低了6.6mg/dL,低密度脂蛋白胆固醇水平降低了8.5mg/dL ,但益生菌治疗对高密度脂蛋白胆固醇水平没有显著影响。
另一项综述发现,使用含有多种菌株的益生菌可显著降低总胆固醇和低密度脂蛋白胆固醇水平(分别降低12.0和20.1mg/dL),而使用单一菌株的试验则没有这种效果。
总体而言,研究表明,组合使用多种益生菌菌株以及含有嗜酸乳杆菌和乳双歧杆菌的混合物或植物乳杆菌的益生菌可能会降低总胆固醇和低密度脂蛋白胆固醇水平。然而,需要更多的研究来证实这些发现。
尽管有潜在的好处,但益生菌人类健康的有效性仍然存在不确定性,这主要是因为许多研究没有考虑到这些影响可能是针对菌株、剂量和条件的,并且个人对干预措施的反应可能会因人而异。
独特的部分取决于他们的健康状况、年龄和肠道微生物的组成。在这节中我们会讲述当前使用益生菌还存在的一些安全隐患。
微生物群组成或功能改变
• 大多数口服益生菌不会长期定植
益生菌微生物的功效并不依赖于长期定殖于宿主的能力。长期定植通常意味着在停止给药后数周或数月仍可从宿主中检测到施用的微生物。
对于口服益生菌来说,这意味着微生物必须积极复制并且已经在宿主体内持续存在。迄今为止积累的关于从粪便中回收益生菌的证据表明,目前大多数益生菌不会定植。这几乎肯定是由于无法与常驻微生物群竞争造成的。
对于大多数人来说,仅仅遇到微生物并不会导致定植,但如果存在“开放生态位”,外来的微生物可能能够填补该生态位并进行定殖。
• 潜在风险有哪些?
有哪些安全隐患?在大多数情况下,来自常见共生微生物群的益生菌的低水平定植不会对宿主健康造成问题。即使没有明显毒力潜力的高水平微生物也不会对宿主健康产生负面影响。然而,可以想象的是,长期定植的益生菌所固有的暴露增加可能会带来以下风险:
(i) 益生菌可能会取代发挥重要功能的微生物;
(ii) 益生菌可能会对周围微生物群的结构和功能产生负面影响;
(iii) 如果正常的肠道屏障被破坏,益生菌可能会进入体循环,导致侵袭性感染。
• 潜在好处是什么?
有人可能会说,益生菌的长期存在(根据其定义可带来健康益处)可能是一种提供长期健康益处的有效方式。事实上,一种能够永久占据空缺生态位并提供缺失的代谢功能(例如代谢婴儿母乳寡糖的能力)的微生物,有助于宿主健康,可以代表一种优秀的益生菌候选者。
另一个考虑因素是,如果生态位注定要被占领,那么长期定殖的益生菌是否会比未知微生物更安全、更理想的占领者?这波新的菌株似乎更适合在人体中存在和生活,有可能实现独特和卓越的益处。例如,通过长期定植益生菌可以最好地实现赋予酶能力以补偿苯丙酮尿症等代谢紊乱。
• 建议:生物组分析有助于评估益生菌摄入后的健康作用
根据目前的理解,建议开发长期定植益生菌时,必须有一个明确的目标,即实现不易、可靠或经济上难以实现的效益,并权衡风险与这些明确定义的效益。建议仔细考虑确定哪些长期安全数据可能与宿主体内持续存在的益生菌菌株相关。应进行研究以确定有助于评估长期定植益生菌安全性的相关急性暴露试验和生物标志物。
生物组分析是评估基线微生物群组成和群落结构以及转录和代谢读数的过程。评估益生菌摄入前后的微生物组结果可能表明益生菌在塑造微生物组中的因果作用。
此类研究可能会为有关促进健康、引起安全问题或确定益生菌治疗反应者和非反应者特征的微生物机制和途径的假设提供信息。这种分析可能有助于解释或在一定程度上预测益生菌对特定宿主产生有益作用的能力。
抗生素抗性基因的转移
自从益生菌开始使用以来,人们担心抗生素耐药性可能从益生菌菌株转移到肠道微生物群中更多的致病菌。
例如许多乳杆菌菌株对万古霉素具有天然耐药性,这引发了人们对这种耐药性可能转移到更具致病性的生物体,特别是肠球菌和金黄色葡萄球菌的担忧。然而,乳杆菌的万古霉素抗性基因是存在于染色体的,因此不容易转移到其他物种。研究也尚未发现乳杆菌的万古霉素抗性基因转移到其他属。
• 评估益生菌中的抗生素抗性基因变得重要
评估益生菌基因组中现有抗生素抗性(AR)基因的风险需要基因型和表型方法。表型方法需要评估菌株表达的AR基因,通过最小抑制浓度技术确定。在某些情况下,AR 基因的表达是物种固有的,而不是由于可以获得的基因的表达。
常见益生菌种类的正常AR范围已经确定。然而,当开发信息未知的物种菌株(下一代菌株)时,需要进一步研究。
需要注意的是,即使不存在非内在AR基因的转移风险,也存在通过裸露DNA转化进行转移的可能性, 或通过噬菌体转导。
• 当考虑益生菌抗生素抗性基因的安全性时,应考虑几个问题:
(i)是与提供水平转移的可能机制的基因相关的基因;
(ii)如果转移至初始宿主,这些基因是否能够进行功能表达;
(iii)是该物种典型的抗生素耐药表型(内在耐药性);
(iv)耐药表型是否如此普遍,以至于益生菌不会对其在环境微生物中的存在产生实质性影响;
(v)是否对临床相关抗生素的耐药性。
这些问题必须作为严格分析的一部分来考虑,以平衡患者或消费者安全和公共卫生问题的利益。分析必须考虑益生菌是否被开发用于广泛分发给一般健康的消费者(食品或补充剂,其合理确定的无害性是一般标准)或限制分发给患者群体(药物)。
由于益生菌有可能加剧或减轻人类体内存在抗生素抗性基因库,因此可能需要采取具体情况具体分析的安全方法。
此外,基因修饰方法可用于改变或消除所关注的抗性元件。根据所采用的技术,该选项可能适用于食品应用的益生菌(例如质粒固化)或可通过药物途径的下一代益生菌。
侵袭性感染
在极少数情况下,益生菌可能会从胃肠道转移,导致侵袭性感染。
从心内膜炎、菌血症局部感染中分离出的菌株

Doron S,et al.Clin Infect Dis.2015
• 一小部分接受益生菌给药的患者曾出现过感染
对1995年至2021年间儿童中与益生菌给药相关的败血症、菌血症和真菌血症进行了系统回顾。大多数符合感染临床定义的儿童年龄在两岁以下,并且有早产或留置静脉导管等诱发因素,94%的儿童通过抗菌治疗成功治愈。
最常报告的单一事件是菌血症,至少有33份报告称,食用益生菌布拉氏酵母菌的患者的血培养物中存在酿酒酵母或布拉氏酵母菌(这些微生物在微生物学上无法区分)。
至少有8例与乳杆菌相关的菌血症已被报道,包括嗜酸乳杆菌(Lactobacillus acidophilus)、干酪乳杆菌(Lactobacillus casei)和鼠李糖乳杆菌(Lactobacillus rhamnosus GG)。
已报道了9例明显脓毒症病例,与布拉氏酵母菌(S.boulardii)、鼠李糖乳杆菌(Lactobacillus rhamnosus GG)、枯草芽孢杆菌(Bacillus subtilis)、短双歧杆菌(Bifidobacterium breve)或组合益生菌有关。
乳杆菌和链球菌益生菌引起的心内膜炎事件也有报道。与鼠李糖乳杆菌相关的脓肿的发展也被报道过两次。
人类使用益生菌相关的细菌性感染病例
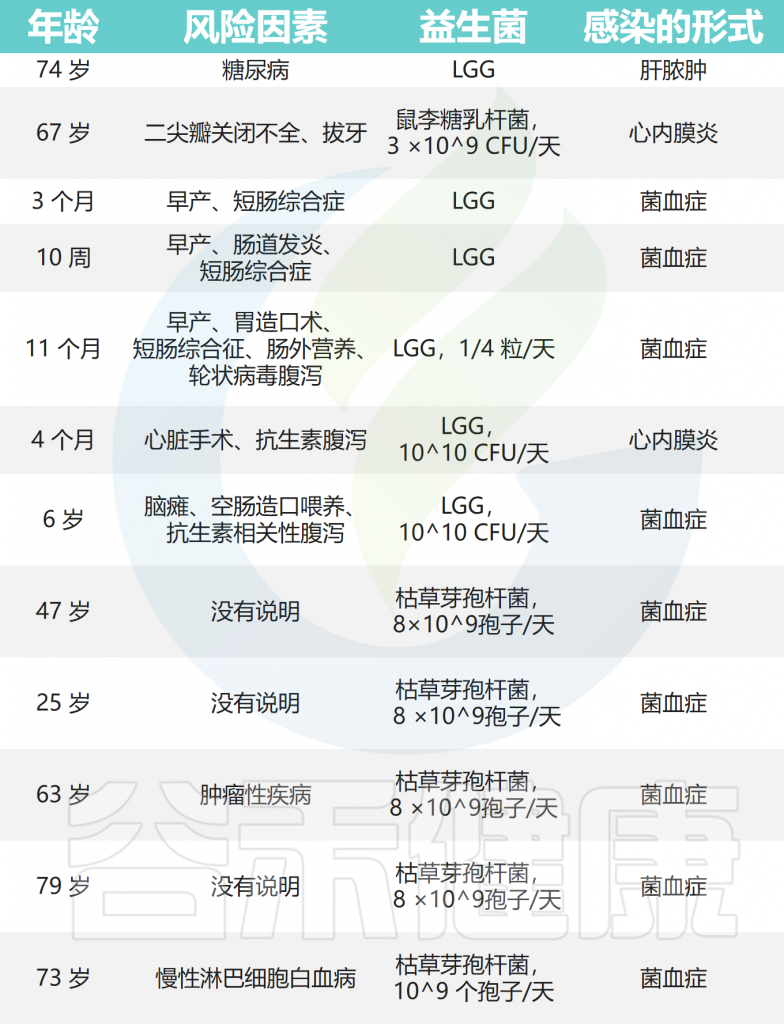
Boyle RJ,et al.Am J Clin Nutr.2006
• 在使用益生菌时,应考虑其感染风险和应对措施
由于多种原因,益生菌相关侵袭性感染的实际频率很难确定。大多数已发表的病例报告都发生在临床试验之外。并非所有临床实验室都会从血培养物中常规培养和鉴定益生菌,并且益生菌试验中的危害报告通常是不完整的。
尽管如此,在大多数对早产儿使用益生菌的试验中,经培养证明的侵袭性感染被作为主要或次要结果进行研究,荟萃分析表明,益生菌的使用不会增加这一弱势群体的败血症发生率。然而,益生菌相关脓毒症的真实发生率仍不确定。
我们认为,应在临床环境中认真监测侵袭性感染和菌血症,并在所有益生菌试验中充分报告。使用菌株水平分子技术,应将临床分离株与施用的益生菌进行比较。
补充益生菌微生物与侵入性临床分离株的分子匹配支持益生菌与全身感染之间的关联。在评估任何下一代益生菌的安全性时,应确定易位的可能性,并权衡风险与益处。
降解粘蛋白,影响肠道屏障
粘蛋白是一种蛋白质,是粘液的核心结构元素,粘液是整个消化道粘膜表面的重要组成部分。除其他作用外,粘蛋白还提供了保护宿主上皮免受微生物和化学入侵的屏障。
• 粘蛋白降解细菌过多可能不利于黏膜屏障稳定
当许多细菌将粘液用作碳源时,会发生一定程度的粘液降解。例如,Akkermansia muciniphila以粘蛋白为食,将其转化为短链脂肪酸。这些短链脂肪酸是胃肠道细胞的重要能量来源。
已鉴定出40多个与粘蛋白代谢相关的细菌基因。全基因组测序可用于鉴定与粘蛋白降解相关的细菌基因,并可通过评估细菌菌株在液体或含有粘蛋白作为唯一碳源的琼脂平板上生长的能力来体外分析其活性。
一些人认为,粘蛋白降解细菌的变化引起的生理平衡变化会导致人类疾病和感染,但据报道,这种特性在肠道微生物内受到非常严格的调节,并且受膳食多糖可用性的影响。
粘蛋白降解能力是益生菌综合安全性分析的一部分,因此,了解益生菌物种基因组中包含的粘蛋白降解基因的数量是益生菌菌株安全性整体审查的一部分,因为单独的粘蛋白降解潜力不应被视为毒力特征。
对药物功能的影响
• 微生物影响药物的代谢可能提高药效也可能产生毒性
肠道微生物群可以对药物的代谢产生直接和间接的影响,从而影响药效和毒性。例如,当大鼠接受抗生素治疗时,口服偶氮类药物Prontosil的大鼠中, 62%的总磺胺通过微生物偶氮还原酶的作用而减少,说明药物激活可以由微生物群介导。
微生物群也可以减少药物相关的毒性。一个众所周知的例子是葡萄糖醛酸化,结合物水解反应,通过 UDP-葡萄糖醛酸基转移酶将葡萄糖醛酸与底物连接成亲水性且带负电荷的葡萄糖醛酸苷。许多厌氧细菌可以诱导β-葡萄糖醛酸酶,这种酶能够解聚外源物质和之前通过葡萄糖醛酸化途径解毒的内源性化合物。这种解结合可以增强毒素、激素和各种药物的肠肝再循环以及局部致癌物的形成。因此,过量的β-葡萄糖醛酸酶可能会增加患结肠癌的风险。
然而,一定量的β-葡萄糖醛酸酶活性对于保证维生素D、甲状腺激素或雌激素等必需化合物的肠肝再循环非常重要。
• 益生菌影响药物的能力具有一定安全隐患
益生菌影响药物功能的能力可能会产生安全后果。毒物微生物组学或药物微生物组学是一门相对较新的学科,研究微生物群和外源化合物之间的相互作用。了解微生物群多样性、饮食和药物处置和反应之间的相互作用以及这如何影响未来的个性化医疗很重要。
过度的免疫刺激
研究还表明,肠道微生物群对于刺激正常免疫发育,特别是肠道相关淋巴组织的发育很重要。肠道微生物群的存在对于一系列免疫功能是必需的,包括抗体的产生、对食物抗原的口服耐受的发展和持续,以及淋巴滤泡内生发中心的形成。
由于益生菌已被证明会影响先天性和适应性免疫系统,包括对细胞因子分泌和树突状细胞功能的影响,因此人们担心益生菌可能会过度刺激某些个体的免疫反应。
• 新生儿和孕妇补充益生菌可能对免疫产生影响
肠道微生物群在正常免疫发育中的关键作用表明,旨在改变微生物群的操作可能具有显著的免疫调节作用。这些操作对宿主的长期影响很难预测,并且仍然有可能对免疫发育产生不利影响。
这在新生儿益生菌补充剂领域尤其重要,在该领域可能会实现微生物群的中长期改变或免疫反应的终生改变。
第二个可能面临不良免疫刺激风险增加的群体是孕妇。在怀孕期间,T细胞反应存在对Th2表型的偏向,这被认为对于维持胎儿活力很重要,因为Th1细胞因子与妊娠失败相关。
益生菌乳杆菌已被证明可以在体外抑制Th2细胞因子反应,并且在一些人体研究中发现可以增加Th1细胞因子干扰素γ的产生。这些影响可能不利于妊娠活力。
目前,实证研究很少支持益生菌导致免疫发育不良的假设,但这是一个值得进一步研究的领域。
尽管据报道益生菌对人群具有有益作用,但免疫功能低下的宿主由于抵御微生物入侵的能力降低,可能面临更高的不良事件风险。
益生菌在高危人群(例如免疫功能减弱/受损的个体、老年人、新生儿,特别是早产儿)中的安全性还有待研究。
√ 益生菌有时会变成机会性病原体
短期观察的证据表明,某些益生菌菌株可能在免疫功能低下、压力大、老龄或新生儿人群中充当机会病原体。
不良事件包括危及生命的肺炎、心内膜炎和败血症。一般来说,在弱势群体中,如果存在单一主要风险因素(例如免疫功能低下状态)或多个次要风险因素,则在使用益生菌时应谨慎。
然而,如果有令人信服的证据表明益生菌可以使一些弱势群体受益,则应考虑使用益生菌。根据现有数据,当对弱势目标人群施用益生菌时,需要进行额外监测。
益生菌对孕妇和哺乳期妇女的风险已得到审查。在100项妊娠期间服用益生菌的研究中,有28项报告了 不良事件。其中,只有11种报告的不良事件可能与治疗存在因果关系,包括胃肠道问题、恶心和头痛;但没有关于母亲或婴儿严重健康问题的报道。
一项研究报告称,施用鼠李糖乳杆菌GR-1和罗伊氏乳杆菌RC-14时,阴道分泌物风险增加,并且粪便稠度发生变化。
√ 一些疾病患者使用益生菌时应注意潜在风险
另一项研究结果显示,当对肥胖女性(先兆子痫风险增加)施用益生菌时,先兆子痫的风险增加(472名服用益生菌的女性中有31例先兆子痫,而安慰剂组中有17例)。尽管数据并不一定可靠,但我们仍然建议轻度至病态肥胖孕妇服用益生菌的同时监测先兆子痫的潜在风险。
而在非怀孕人群中,也有报道与使用益生菌相关的不良反应,包括胃肠道副作用,如腹部绞痛、恶心、软便、胀气和味觉障碍。
人们对一些人群中使用的某些益生菌的代谢活性表示担忧。D-乳酸性酸中毒可能发生在因手术改变肠道解剖结构的人身上,例如短肠或减肥手术,这是由常驻微生物的活动引起的。很少有公开报道将此与益生菌补充剂联系起来。由于缺乏早产儿数据,因此对该人群使用产生D-乳酸的益生菌持谨慎态度,尽管一项针对健康足月婴儿的对照试验表明,产生D-乳酸的罗伊氏乳杆菌DSM-17938不会导致酸中毒和含益生菌的婴儿配方奶粉与酸中毒无关。
√ 生命早期补充益生菌对发育可能有影响
鉴于在众多相互竞争的产前、围产期和产后因素中调节微生物群结构和功能的独特机会窗口,早产儿值得特别考虑。新生儿微生物群靶向疗法有可能影响宿主整个生命周期的生物学,可以通过在最有利于定殖的条件下引入异源微生物菌株,或者通过影响包括大脑在内的重要器官的早期发育轨迹。
迄今为止,几乎没有证据表明生命早期补充益生菌会对神经发育结果产生不利影响。在一项针对1099名极早产儿的后续研究中,接受益生菌治疗的存活婴儿与未接受益生菌治疗的婴儿相比,3-5岁时的主要神经发育结果没有差异。
有趣的是,接受益生菌治疗的儿童中耳聋的发生率较低,这不能归因于抗生素疗程数量或接受万古霉素或庆大霉素总天数的差异。
其他研究已经确定了生命早期微生物群的改变与肥胖之间的联系。一项针对美国333353名儿童的大型队列研究报告称,在生命的头两年内服用抗生素和抑酸药物与儿童后期的肥胖有关;这些改变微生物群的药物每增加一类,每增加30天的处方,这些关联就会得到加强。
现有的有限证据并不表明生命早期使用益生菌会增加儿童期不良后果的风险。没有足够的数据来确定围产期益生菌使用与成年期不良事件之间是否存在潜在关联。
因此,我们鼓励对围产期接受益生菌的早产儿进行至少2年的随访,以比较代谢、过敏、免疫和其他健康结果。
需谨慎使用益生菌的人群
然而使用益生菌时,一些特定人群需要格外注意:
• 免疫系统较弱的个体
如HIV感染者、正在接受化疗或免疫抑制治疗的患者,因为他们更容易受到感染。婴幼儿和老年人由于免疫系统不够成熟或衰弱,使用益生菌时也应谨慎。
• 患有消化系统问题的人
对于患有病毒性肠炎、细菌性胃肠炎等疾病的人群,为了避免益生菌的大量繁殖,导致病毒或细菌进一步增长,这类人群也需要慎重食用益生菌。
• 胃肠道屏障不完整的人
如消化道溃疡、胃肠道手术恢复期患者、胃出血等不建议服用,益生菌有随血液扩散至全身引起感染的风险。
• 身体过于虚弱者
因严重发热、感冒等导致的体能虚弱患者,摄入益生菌后,可能会加重身体负担,不利于身体恢复。
• 对益生菌成分过敏者
对益生菌成分过敏者吃了益生菌后,可能会出现皮肤起丘疹、腹泻次数增加、胃部不适等情况。
此外,怀孕和哺乳期妇女在使用益生菌前应咨询医生。总之,在使用益生菌补充剂前,最好先评估体内原有的肠道微生物群并咨询医疗专业人士是否需要额外补充益生菌。
益生菌的最佳剂量取决于菌株和产品。因此,建议患者使用益生菌的临床医生指定益生菌菌株、剂量和使用持续时间。
益生菌因其健康益处而被越来越多的消费者使用,并受到许多医疗保健专业人士的提倡。因此我们更需要了解使用益生菌的益处和一些潜在风险。
研究发现益生菌对于大部分健康的人来说是安全的,但由于存在感染的风险,因此对某些人群应谨慎使用。其中包括免疫功能低下的患者、早产儿、短肠综合征患者、使用中心静脉导管的患者以及心脏瓣膜疾病患者。
尽管关于益生菌的作用机制和施用还有很多东西有待了解,但很明显不同的菌株可以产生非常特定的效果。益生菌特异性取决于剂量、菌种、持续时间、给药途径和适应症等影响因素,此外还可能因施用对象的健康或疾病状况、不同年龄、肠道微生物组成而异。
因此,一个群体中一种益生菌菌株的临床试验结果不能自动推广到其他菌株或不同群体。需要进一步研究来探索益生菌的机制和对人体的作用。我们建议人们在使用益生菌之前了解自身具体的健康状况和微生物组成,以便能够“对症下药”。
主要参考文献
Merenstein D, Pot B, Leyer G, Ouwehand AC, Preidis GA, Elkins CA, Hill C, Lewis ZT, Shane AL, Zmora N, Petrova MI, Collado MC, Morelli L, Montoya GA, Szajewska H, Tancredi DJ, Sanders ME. Emerging issues in probiotic safety: 2023 perspectives. Gut Microbes. 2023 Jan-Dec;15(1):2185034.
Doron S, Snydman DR. Risk and safety of probiotics. Clin Infect Dis. 2015 May 15;60 Suppl 2(Suppl 2):S129-34.
Boyle RJ, Robins-Browne RM, Tang ML. Probiotic use in clinical practice: what are the risks? Am J Clin Nutr. 2006 Jun;83(6):1256-64; quiz 1446-7.
Sheyholislami H, Connor KL. Are Probiotics and Prebiotics Safe for Use during Pregnancy and Lactation? A Systematic Review and Meta-Analysis. Nutrients. 2021 Jul 13;13(7):2382.
Asha MZ, Khalil SFH. Efficacy and Safety of Probiotics, Prebiotics and Synbiotics in the Treatment of Irritable Bowel Syndrome: A systematic review and meta-analysis. Sultan Qaboos Univ Med J. 2020 Feb;20(1):e13-e24.
Jäger R, Mohr AE, Carpenter KC, Kerksick CM, Purpura M, Moussa A, Townsend JR, Lamprecht M, West NP, Black K, Gleeson M, Pyne DB, Wells SD, Arent SM, Smith-Ryan AE, Kreider RB, Campbell BI, Bannock L, Scheiman J, Wissent CJ, Pane M, Kalman DS, Pugh JN, Ter Haar JA, Antonio J. International Society of Sports Nutrition Position Stand: Probiotics. J Int Soc Sports Nutr. 2019 Dec 21;16(1):62.
Roe AL, Boyte ME, Elkins CA, Goldman VS, Heimbach J, Madden E, Oketch-Rabah H, Sanders ME, Sirois J, Smith A. Considerations for determining safety of probiotics: A USP perspective. Regul Toxicol Pharmacol. 2022 Dec;136:105266.

谷禾健康
发酵食品被定义为“通过受控微生物生长以及通过酶作用转化食品成分而生产的食品或饮料。许多食物历史上都经历过发酵,包括肉和鱼、乳制品、蔬菜、大豆、其他豆类、谷物和水果。

发酵过程中存在多种变量,包括微生物、营养成分和环境条件,从而产生了数千种不同的发酵食品。历史上,食品发酵被用作一种保存方法,因为抗菌代谢物(例如有机酸、乙醇和细菌素)的产生降低了病原微生物污染的风险。
发酵还用于增强感官特性(例如,味道和质地),一些食物,例如橄榄,如果不经过发酵去除苦味酚类化合物,就无法食用。
近年来,发酵食品越来越受欢迎,发酵食品在世界上几乎所有文化的美食中都占有一席之地。发酵食品越来越受欢迎,主要原因包括发酵食品对健康的益处以及人们对胃肠健康的兴趣高涨。发酵食品可以通过多种机制对健康和疾病发挥有益作用。
首先,在肠道中,发酵食品所含的共生微生物主要通过与病原菌竞争资源,以及产生具有调节免疫和神经功能的发酵副产物来发挥其生理作用。
其次,发酵产生的代谢物可能对健康有益。例如,乳酸菌(与乳制品和非乳制品发酵食品相关)产生生物活性肽和多胺,对心血管、免疫和代谢健康具有潜在影响。
第三,发酵可以将某些化合物转化为生物活性代谢物。例如,乳酸菌可以将酚类化合物(如类黄酮)转化为具有生物活性的代谢物。
第四,发酵食品中的食品成分,如益生元和维生素,也可能对健康产生益处。
最后,发酵可以减少毒素和抗营养物质,例如,大豆发酵可以降低植酸浓度,酸面团发酵可以减少可发酵碳水化合物(例如,可发酵低聚糖、二糖、单糖和多元醇、FODMAP)的含量,这可能会增加肠易激综合征等功能性肠道疾病患者对这些产品的耐受性。
本文带大家一起了解发酵食物/食品的来源,方法,种类,包括的微生物以及对人体健康的益处和作用机制。
虽然人们已经食用发酵食品有数千年,在公元前 7000 年的陶器中,发现了有意应用发酵的最早证据,这些陶器用于发酵大米、蜂蜜和水果。但最近在了解肠道微生物组(肠道中细菌、病毒和真菌的组成)方面取得的进展,重新燃起了人们对发酵食品消费的兴趣。传统上,食品被发酵作为一种保存手段,用来提高保质期、食品安全性和可及性。
发酵还用于改善食物的消化耐受性、味道和质地。发酵食品在文化饮食模式中的突出地位和悠久的使用历史,让消费者和研究人员想知道发酵食品如何适应当前的饮食建议、个人应该多久食用它们以及有什么好处。
为了更好地了解它们的健康益处,首先了解发酵食品的构成非常重要。国际益生菌和益生元科学协会(ISAPP)专家共识将发酵食品和饮料定义为“通过所需的微生物生长和食品成分的酶促转化而制成的食品”。
尽管微生物对于发酵过程至关重要,但由于加热和加工的原因,微生物在食用时可能存在也可能不存在(下表)。
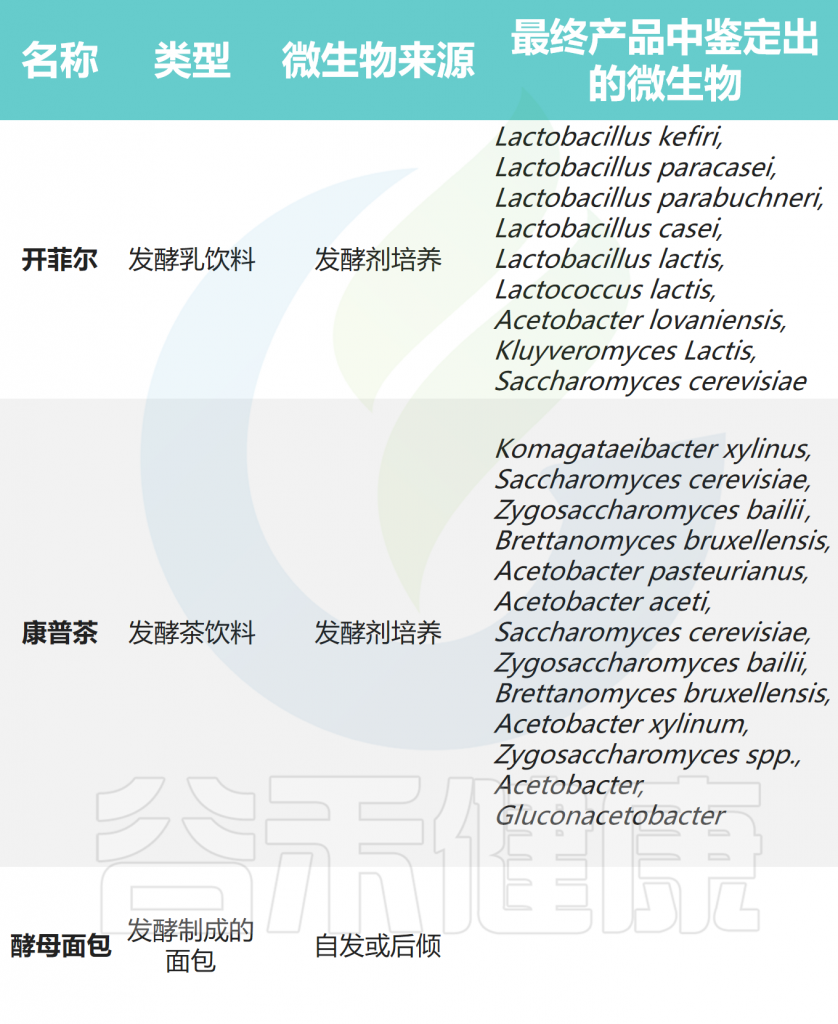


Dimidi E, et al., Nutrients. 2019
不是所有酸菜都是发酵食品
值得注意的是,一些食品需要发酵才能通过其通用名称来识别,例如酸奶;其他食品则可能不需要,例如,酸菜可以腌制或发酵,因此并非所有酸菜都是发酵食品。
注:腌制食品通常是通过浸泡制成的,不一定需要微生物或符合发酵食品的定义。
发酵食品和益生菌有什么区别?
发酵食品和饮料有时被定性或标记为“益生菌食品”或“含有益生菌”。然而:
由于以上这些原因,术语“发酵食品”和“益生菌”不能互换使用。
大多数发酵食品不符合益生菌的定义,因为它们的菌株尚未定义,并且不能保证在整个保质期内维持足够的菌落形成单位 (CFU)。
许多发酵食品含有具有益生菌潜力的细菌
这些细菌要么是在制造过程中添加的,要么是外来细菌,例如奶酪中发现的非发酵剂乳酸菌 (NSLAB),它们能够在发酵食品中生长和繁殖。
一般来说,大多数发酵产品含有足够多的微生物,其浓度根据产品的地区、年龄、消费时间等多个变量而变化。周围的食物基质似乎通过其针对肠道条件(例如低 pH 值、胆汁酸)的缓冲和保护作用,在益生菌菌株的存活中发挥着重要作用。
事实上,许多研究表明,发酵食品中的微生物可以到达胃肠道,这可能因产品而异。
发酵食品影响肠道微生物组的方式
食品发酵有两种主要方法
首先,食物可以自然发酵,通常被称为“野生发酵”或“自发发酵”,其中微生物天然存在于生食或加工环境中,例如酸菜、奶酪和某些发酵豆制品。
其次,食物可以通过添加发酵剂进行发酵,称为“依赖于培养物的发酵”,例如开菲尔、康普茶和纳豆。进行依赖于培养物的发酵的一种方法是“backslopping”,其中将少量先前发酵的批次添加到生食品中,例如酵母面包,用于启动发酵的发酵剂可以是天然的,也可以是精选的商业发酵剂,以标准化最终产品的感官特征。
注:backslopping是一种发酵过程中的一种方法,指的是将之前发酵批次中的一小部分加入到新的原始食物中,以启动新的发酵过程(有点类似于以前和面用的“醒子”)。
上面“野生发酵”或“自发发酵”利用空气中恰好存在的微生物或发酵原料上的微生物,而发酵剂则用于最初接种食物以启动发酵。在使用发酵剂时,微生物可能会经历产品标准化的选择过程。在研究发酵食品的健康益处时,由于生产方法而导致的食品成分和微生物的变化导致文献中存在显着的异质性。
发酵食品和饮料作为“功能性食品”的一部分,在传统和现代饮食中占有重要地位,对食物链价值有显著贡献,并具有额外的健康促进或疾病预防效果。
发酵过程及其与肠道健康的关联
发酵过程在无氧条件下将糖转化为有机酸、气体、醇和二氧化碳,带来多种益处,如新的口感和质地、营养增强、有毒或不良成分的去除、益生菌的传递以及食源性病原体的抑制。
发酵食品有助于提供益生菌,以维持健康的微生物群,对免疫系统和代谢功能影响显著。发酵食品的处理涉及人类、动物、环境、食品和微生物群之间的联系,这些联系影响食品的感官和理化特性以及人类健康。肠道控制并处理我们健康的各个方面,如消化方式、食物敏感性与情绪、行为、能量、体重、食欲、激素平衡和免疫力等均有关联。
营养与微生物群的协同效应
营养物质与微生物群的相互作用决定了整体健康。食用和饮用发酵食品和饮料,尤其是有机未削皮和未经巴氏消毒的水果和蔬菜,能提高食物生物活性成分的生物可及性和生物利用度,提供膳食纤维和必需的微量元素、植物化学物质以及酶、乳酸菌和有机酸,这些对健康至关重要。
发酵能增强各种食品的好处
包括乳制品、草药和饮料,影响它们次生代谢产物和化学元素的吸收和活性。尽管难以区分微生物内容和食物基质的潜在贡献,但消费者对发酵食品和饮料的健康益处有着明显的认知,这不仅仅是因为它们对胃肠功能障碍的影响,而且还与肠道微生物群、人类健康以及多种传染性、炎症性和肿瘤性疾病进程以及大脑功能有关。
发酵食品在精神健康和慢性疾病中扮演重要角色
尤其是与糖尿病和心血管疾病相关的肠道微生物组的变化。发酵和食物消化过程中产生的生理活性肽具有多种功能,能够作为促进健康的营养素配方。
尽管对于精神障碍的病因、分类和医疗护理存在分歧,但当前关于发酵食品、微生物组及其对人类健康影响的研究,特别是全球精神健康流行病,描述了与现代生活方式和高糖高饱和脂肪的西方饮食有关的问题。肠道黏膜的退化削弱了对有害物质入侵的紧密屏障,以及对无处不在的无害化合物的反应保护,是多种疾病的主要原因。
摄入活性益生菌,尤其是在发酵食品中,对平衡肠道通透性和屏障功能有显著积极改善,对代谢综合征、动脉粥样硬化、炎症性肠病和结肠癌有直接影响,并对抑郁、愤怒、焦虑和压力激素水平有间接影响。
酸奶与降低慢性疾病风险相关
酸奶是倍受认可的发酵食品之一。在流行病学研究中,饮用酸奶与降低 II 型糖尿病、心脏病和癌症的风险有关。此外,它还与改善骨骼健康和体重管理有关。
酸奶可提高乳糖不耐受者的乳糖消化率
牛奶发酵通过降低生产中的乳糖含量,以及通过活微生物表达 B-半乳糖苷酶的消化过程中的乳糖含量来提高乳糖的消化率。
虽然一些研究表明,饮用酸奶有助于减少抗生素相关性腹泻,但结果并不一致。虽然所有酸奶都是发酵的,但只有部分酸奶同时符合发酵食品和益生菌食品的标准,这意味着它们的菌株具有足够的特异性,具有治疗剂量,并且已针对特定的健康益处进行了研究。

酸奶可能含有特定的益生菌菌株,对身体有益处
这可以支持特定的治疗效果,包括改善便秘、减轻肠易激综合征 (IBS) 的症状,降低艰难梭菌 (C. difficile) 和抗生素相关性腹泻的发病率。值得注意的是,这些发现不能推广到酸奶本身,而是涉及到存在的益生菌菌株。除了乳糖消化不良和添加益生菌的酸奶具有特定菌株的治疗作用之外,支持饮用酸奶改善特定消化系统疾病的研究尚未阐明。
食用发酵牛奶、奶酪后对肠道菌群的影响
有八项研究分析了在食用发酵乳制品后的肠道菌群,包括发酵牛奶、酸奶和奶酪。发酵乳制品通常由乳酸菌(LAB)发酵,特别是嗜热链球菌(Streptococcus thermophilus)和乳杆菌属,此外还有双歧杆菌属。卡蒙贝尔奶酪还会使用明串珠菌属(Leuconostoc spp.)、Hafnia alvei、Geotrichum fungi 进行发酵。这些额外的奶酪发酵剂可能是导致其对肠道菌群影响多样化的原因。
食用酸奶对肠道菌群影响的研究
一项研究中,6名健康参与者连续6周食用酸奶,未发现与肠道细菌丰度存在任何统计学上显著的变化。
相反,也有报告显示,含有益生菌的酸奶进行4周干预,与对照组相比,能降低感染幽门螺杆菌儿童肠道大肠杆菌与双歧杆菌的比例(研究开始前1个月内使用抗生素为排除标准)。这种干预还降低了感染儿童体内的幽门螺杆菌,提高了血清IgA浓度,这为用酸奶治疗该感染提供了一条途径。
►
虽然测试的发酵乳和酸奶是用相似的细菌发酵的,但每种产品中特定的乳酸菌和乳酸菌的含量并不相同。这些差异可能是发酵奶和酸奶干预研究结果差异的原因。
为了进一步阐明食用酸奶产品的潜在益处,有必要开展更大样本量的研究,可能还需要开展干预时间更长的研究,来测试酸奶对肠道菌群的影响。
传统的开菲尔起源于高加索山脉,是一种具有奶油般质地、酸味和微妙气泡感的发酵乳饮料。通过向牛奶中添加一种名为“开菲尔粒”的发酵剂来生产开菲尔。
开菲尔粒由共生的乳糖发酵酵母(如Kluyveromyces marxianus)和非乳糖发酵酵母(如Saccharomyces cerevisiae、Saccharomyces unisporus),以及产乳酸和乙酸的细菌组成,它们位于称为开菲尔兰的多糖和蛋白质基质中。乳酸、风味生成成分(如乙醛)、乙醇和二氧化碳都是发酵的副产品,它们共同决定了开菲尔的感官特性。
在开菲尔粒中已经鉴定出多种微生物物种
常见的包括乳杆菌属:
链球菌属:
醋杆菌属:
酵母菌属:
假丝酵母菌属:
克鲁维酵母属:
乳杆菌科:
注: 如Leuconostoc mesenteroides 常见于蔬菜、乳制品和其他发酵食品中。它们在食品工业中扮演重要的角色,尤其是在发酵过程中,例如在制作泡菜、某些奶酪和腌制蔬菜等食品的过程中。这种细菌可以发酵糖类产生乳酸,有助于食品的保存和发酵过程中特定风味的形成。
它也能产生多种有益的代谢产物,如二乙酰(diacetyl),这是一种具有奶油味的化合物,常用于增强奶制品的风味。此外,这种细菌还能产生一种被称为白藜芦醇的多糖,这种物质具有良好的稳定剂和增稠剂特性,可以用于食品工业。
发酵过程中开菲尔的微生物组成可能会变化
例如,虽然在开菲尔粒的初级培养中L. kefiri并不是最主要的乳杆菌种类,但在最终发酵饮料中L. kefiri可以占所有乳杆菌种类的80%。
联合国粮食及农业组织(FAO)和世界卫生组织(WHO)建议开菲尔粒中至少应含有107个形成菌落单位(CFU)/克的微生物,最终产品中至少应含有10^4 CFU/克的酵母。
还有一种不含乳制品的开菲尔版本,称为水开菲尔,它是由水、糖和水开菲尔粒发酵而成的饮料,含有细菌和酵母,与传统开菲尔的发酵剂不同。

开菲尔抵抗病原菌,有益健康
多项体外研究已探究开菲尔的抗菌活性,这种活性归因于与病原体竞争可用营养物质,以及产生有机酸、细菌素、二氧化碳、过氧化氢、乙醇和乙酰乳酸等物质。
体外研究显示c对多种微生物如白色念珠菌、伤寒沙门氏菌、肠炎沙门氏菌、志贺氏菌、大肠杆菌、枯草杆菌、粪肠球菌和金黄色葡萄球菌表现出抗菌活性。
发酵衍生的生物活性肽已在动物模型中显示出刺激免疫系统的能力,而开菲兰则减少了小鼠哮喘模型中由卵清蛋白诱导的细胞因子产生。体外和动物研究还表明开菲尔可能具有抗氧化、降血压、抗癌以及降低胆固醇和血糖的潜在效果。
开菲尔有潜力在人类肠道中定植
多项体外、动物及人体研究已探讨开菲尔及其组成微生物对肠道菌群的影响。虽然尚未在体内得到证实,但从开菲尔中分离出的几种菌株已显示能够粘附于类人肠上皮Caco-2细胞,表明其有潜力在人类肠道中定植。
开菲尔或其组成菌株对肠道菌群有相当大影响
大量动物研究表明,它会增加乳杆菌、乳球菌和双歧杆菌的浓度,并降低变形菌和肠杆菌的浓度。此外,一项研究发现,与对照组相比,给予开菲尔乳杆菌(开菲尔乳杆菌本身不是开菲尔本身)(开菲尔谷物中常见的菌株)的小鼠体内,厚壁菌门、拟杆菌门和普雷沃氏菌浓度更高,粪便重量和粪便水分也更高。
食用开菲尔后,胃肠道中真菌丰度也会变化
一项针对高脂肪饮食诱导的肥胖小鼠模型的研究表明,与对照小鼠相比,摄入 0.2 mL 开菲尔的小鼠粪便总酵母菌和念珠菌随菲尔数量显着增加。
开菲尔在炎症性肠病中的应用
在人类中,一项针对 45 名炎症性肠病患者的研究表明,在每天摄入 800 毫升开菲尔的 4 周后,大多数参与者的粪便中都发现了一种开菲尔特有的菌株,即开菲尔乳杆菌,并且粪便中总乳酸杆菌丰度显着增加。与对照(无开菲尔)相比,克罗恩病患者发现了这一结果。
乳酸杆菌是一类益生菌,它们对维持肠道微生物平衡和促进肠道健康具有重要作用。这些菌株可以帮助改善肠道屏障功能,减少炎症,以及可能对免疫系统产生有益的调节效应。
在这项研究中,与未摄入开菲尔的对照组相比,克罗恩病患者在摄入开菲尔后的这些变化,可能表明开菲尔对改善他们的肠道微生物群和肠道健康有积极作用。这可能是由于开菲尔中的益生菌和发酵产物对肠道环境产生了积极影响。
开菲尔改善乳糖吸收不良
开菲尔对乳糖吸收不良的人具有良好的耐受性,因为它含有表达β-半乳糖苷酶的细菌(例如Kluyveromyces marxianus),可以水解乳糖,从而降低饮料中的乳糖浓度。
注:酵母全身是“宝”,无论酵母形式是农场生产的酵母醪糟,啤酒或白酒企业生产的酵母副产物,或专门生产用于饲喂动物的酵母产品。其中马克斯克鲁维酵母(Kluyveromyces marxianus)。这种酵母又叫“乳清酵母”,可以利用牛奶糖或乳糖作为底物,通过代谢过程将其分解,从而生长和繁殖。
这个特性使得Kluyveromyces marxianus特别适合用于乳制品工业的副产品,例如乳清。乳清含有乳糖和其他营养素,而乳清酵母可以将这些乳糖转化为酒精和二氧化碳(在发酵过程中),同时还能产生一些有益的副产品,如维生素和酶。
开菲尔含有比原味酸奶多 60% 的 β-半乳糖苷酶,而与未发酵奶相比,开菲尔的乳糖含量降低了 30% 。与牛奶相比,开菲尔还导致肠胃胀气严重程度显着降低,但肠胃气胀频率、腹痛和腹泻没有差异。总体而言,这项研究表明,对于乳糖吸收不良的人来说,食用开菲尔的胀气严重程度比牛奶低,并且与酸奶一样具有良好的耐受性。
开菲尔有助于根除幽门螺杆菌
另一项双盲随机对照试验研究了每天500毫升开菲尔与每天250毫升牛奶相比,在消化不良且幽门螺杆菌感染的患者中,对于配合2周三联抗生素疗法的幽门螺杆菌根除率的影响。研究发现:
这表明在治疗幽门螺杆菌感染期间,开菲尔可能是有益的辅助疗法。
然而,开菲尔研究的一个重要限制是每批可能包含不同的微生物。这可以解释一些异质性。需要进一步的高质量随机对照试验来确定开菲尔对肠道微生物群的影响及其对便秘等其他胃肠道疾病的影响。
开菲尔有助于改善便秘
几项非随机研究也探讨了开菲尔对便秘的影响。


doi: 10.3390/nu11081806
一项针对42名住院患者(这些患者有便秘问题以及精神和身体障碍)的非随机交叉研究显示,与对照组的粉状牛奶相比,6克冻干开菲尔对使用泻药的频率、大便的一致性和体积没有影响,然而在开菲尔干预12周后,不需要任何泻药的患者数量比基线时更高。
另一项小型非随机、无对照试验包括了20名功能性便秘患者,研究显示连续4周每天摄入500毫升开菲尔显著增加了大便频率,改善了肠道满意度评分,并且与基线相比,缩短了肠道传输时间。
考虑到样本小和研究设计的局限性(开菲尔的形式不同,没有随机化,无对照,验证程序的使用有限),需要进一步的高质量试验来确定开菲尔对便秘的影响。
康普茶(Kombucha) 是一种古老的发酵茶,康普茶距今已经有上千年的历史,起源于中国,后随丝绸之路引入亚洲和欧洲各国。
康普茶的发酵
传统的康普茶是通过细菌和酵母的组合对红茶(也可能使用绿茶)和白糖进行有氧发酵而生产的,称为细菌和酵母的共生培养物(SCOBY)。
酵母将蔗糖转化为乙醇(除了有机酸和二氧化碳),乙酸细菌将蔗糖转化为乙醛和乙酸。康普茶的微生物和代谢物组成根据 SCOBY 的具体组成、茶和糖的类型和浓度、氧气浓度、发酵时间、温度和储存时间而变化。

红茶菌的低pH值,主要是由于高浓度乙酸的产生,能够阻止幽门螺杆菌、大肠杆菌、鼠伤寒沙门氏菌和空肠弯曲菌等致病菌的生长。即使在中性pH值和经过热变性处理后,红茶菌在体外也能抑制病原体的生长,这表明除了乙酸以外的其他化合物也具有抗菌效果。
SCOBY是用于制作康普茶的一种共生菌群
它主要由乙酸细菌(例如乙酸杆菌属和葡萄糖酸杆菌属)、乳酸细菌(例如乳杆菌属和乳球菌属)以及酵母(例如酿酒酵母属Saccharomyces,和接合酵母属Zygosaccharomyces)组成。
高通量测序分析的研究表明,在康普茶发酵过程之后,假丝酵母属(Candida)和接合酵母属(Zygosaccharomyces)的酵母变得占主导地位,而在细菌中,则是酿酒酵母属(Komagataeibacter)、鱼腥藻属(Lyngbya)、葡萄糖酸杆菌属(Gluconobacter)、乳杆菌属和双歧杆菌属的数量最多。
在动物研究中:
康普茶对血糖水平、氧化应激、糖尿病引起的体重减轻、化学物质引发的肾脏毒性、高胆固醇血症、胃溃疡有影响。
研究假设在这些有益效果中起作用的化合物包括D-葡萄糖酸-1,4-内酯(DSL),这是在发酵过程中由葡萄糖酸杆菌产生的,在大鼠中它能够抑制氧化应激和糖尿病引起的肾损伤以及对乙酰氨基酚引起的肝损伤。尽管如此,目前还没有人类数据来证实这一作用机制。
茶中的多酚和黄酮类物质的含量会随着发酵的进行而增加。此外,康普茶发酵过程中,体外超氧阴离子清除能力、还原能力和总酚类化合物浓度也会增加。
虽然说康普茶是乙酸、乳酸菌和酵母的丰富来源,但目前还没有公开发表的研究探讨食用康普茶对动物或人类肠道微生物群落组成或功能的影响。有趣的是,康普茶在体外已显示出抗菌效果。
酸菜起源于中国,最早可以追溯到东汉,西周时期。酸菜是一种利用蔬菜经过发酵而制成的食品,可以延长保存时间并增加风味。酸菜在中国各地都有不同的制作方法和口味,是中国传统的发酵食品之一。
发酵酸菜的方法
古籍中记载的酸菜关于“酸菜”的形成历史。“请君伐菹薪,煮沸水为盐”;而《释名》中对“菹”的解释更为透彻,“菹,阻也。生酿之,遂使阻于寒温之闲,不得烂也”,这其实也写出了发酵酸菜的具体方法。

酸菜是最常见的腌制卷心菜形式之一,由切碎的卷心菜和2.3%至3.0%的盐混合制成的,然后让其自然发酵,通常涉及的菌种包括:
最终产品的低pH值使得卷心菜得以保存。
酸菜中的菌群
目前,通过培养依赖的技术,研究表明自制和商店购买的酸菜中含有多种细菌,一般包括:
当添加一种鼠李糖乳杆菌11MZ-5-1的启动培养物时,所制作的酸菜主要包含乳杆菌属和乳酸链球菌属(Lactococcus),这与自然发酵的酸菜相比,除了含有乳酸链球菌和乳杆菌外,自然发酵酸菜还含有显著数量的肠杆菌(Enterobacter)和假单胞菌(Pseudomonas),并且在微生物组成上更为多变。酸菜主要含有明串珠菌属和乳杆菌属。
从酸菜中分离出的某些乳杆菌种显示出益生菌潜力,它们能够耐受低pH环境,在Caco-2细胞上附着,并且在体外可以对抗病原体。常见于酸菜中的副干酪乳杆菌HD1.7(Lactobacillus paracasei HD1.7),能够产生一种广谱细菌素,这可能在酸菜的保存过程中发挥作用。
酸菜的健康益处,抗氧化,解毒,抗病原菌
在Wistar大鼠中口服酸菜汁导致谷胱甘肽S-转移酶(GST)、NAD(P)H:醌氧化还原酶1(NQO1)活性增加,这两种酶是肝脏和肾脏解毒过程中的关键酶。酸菜中含有的某些乳酸菌能够产生共轭亚油酸,关于共轭亚油酸,在动物实验中有证据表明它具有抗癌和抗动脉粥样硬化的活性。
从酸菜中分离出的植物乳杆菌P2(Lactobacillus plantarum P2)显著诱导TNF-α和IL-12的表达,并防止沙门氏菌肠炎亚种(Salmonella enteritidis)附着和侵入Caco-2细胞。
酸菜含有硫代葡萄糖苷分解产物,包括山奈酚(一种黄酮类化合物)、异硫氰酸酯、吲哚-3-甲醇、硫代甘蓝素、烯丙基腈和腈类化合物。尽管这些植物化学物质对人类健康的具体影响尚不明确,但山奈酚具有清除自由基的活性,能够保护机体免受氧化损伤,并在体外减轻细胞因子诱导的活性氧物种。
异硫氰酸酯已被证明具有抗菌特性,可以防止包括大肠杆菌、艰难梭菌、空肠弯曲菌(C. jejuni)和产气荚膜梭菌(C. perfringens)在内的多种物种的生长。
酸菜改善了肠易激综合征
酸菜是为数不多的几种发酵食品之一,其在功能性肠道疾病方面进行了临床试验。
一项随机双盲试验,比较了含有活性乳酸菌(LAB)的酸菜,对58名符合罗马III标准诊断的任何亚型肠易激综合症(IBS)患者的胃肠症状和微生物群的影响。
患者被随机分配每天食用75克的巴氏杀菌(对照)或未经巴氏杀菌(干预)含有LAB的酸菜,持续6周。在两个研究组中,从试验开始到结束,肠易激综合症严重性评分系统(IBS-SSS)得分都显著降低,但是饮食组之间的症状没有差异;
16S rRNA测序显示两个研究组之间或者在任一组的开始和结束时的微生物群组成没有差异。这可能表明,人们感知到的酸菜的健康益处与活微生物无关。这项研究的一个局限性是按方案分析,即只有完成研究的患者(n=34)被纳入主要结果的分析。此外,因为没有生卷心菜对照组,所以无法确定胃肠症状的改善是与发酵产物还是卷心菜本身有关。
酸菜可能与胃肠道癌症关联
在中国参与者中进行的另一项研究表明,大量食用酸菜实际上可能与胃肠癌症的不良健康结果有关。具体来说,这项病例对照研究显示,酸菜摄入量最高的人群与喉癌的风险增加有显著关联,比值比高达7.27。虽然这可能与酸菜中的高盐分有关,但在我国进行的另一项关于喉癌风险因素的研究并未发现与腌制蔬菜的摄入有关联。此外,酸菜中的高钾含量可能有助于抵消盐分可能引起的高血压效应。
尽管存在这些潜在的风险,一项试验发现,无论是经过巴氏杀菌处理的还是未经处理的酸菜,都能降低肠易激综合症(IBS)的严重程度,但这种效果似乎并非由改变胃肠道微生物群引起的。这意味着酸菜可能通过其他未知机制影响胃肠道症状。然而,目前关于酸菜对其他健康状况影响的证据还很有限。
最早已知的发酵大豆制品起源于中国和日本,包括发酵黑豆和腐乳。亚洲不同地区有许多发酵大豆制品,包括豆饼,豆豉(tempeh)、日本纳豆(natto)、日本味噌(miso)、中国腐乳(sufu)、豆腐乳(douche)、酱油以及韩国的豆瓣酱(doenjang)等。
豆 豉
豆豉是中国传统特色发酵豆制品调味料。豆豉(Glycine max)以黑豆或黄豆为主要原料,利用毛霉、曲霉或者细菌蛋白酶的作用,分解大豆蛋白质,达到一定程度时,用加盐、加酒、干燥等方法,抑制酶的活力,延缓发酵过程而制成。

在豆豉的制作过程中,主要的微生物包括:
豆豉霉(Aspergillus oryzae)或豆豉曲霉(Aspergillus sojae):这些霉菌负责初期的发酵过程,它们会分解大豆中的蛋白质和淀粉,产生一系列风味物质。
酵母:在发酵过程中,酵母也会参与作用,它们可以产生酒精和其他香气化合物。
乳酸菌:在某些豆豉的发酵过程中,乳酸菌可能会参与,有助于发酵过程的进行,并增加产品的酸味。
不同地区和不同生产商的豆豉可能会有所差异,微生物的种类和比例也可能会有所不同,这也是导致各种豆豉风味差异的原因之一。
豆 饼
豆饼是一种传统的印尼食品,通过在室温下用根霉Rhizopus oligoporus菌种发酵煮熟并去壳的大豆35-37小时来生产。这样可以制作出质地柔软、口感有嚼劲且带有类似蘑菇风味的白色豆饼。豆饼的微生物组成因生产工艺的不同而有所变化。
豆饼中含有乳酸菌、粪肠球菌,以及根霉属的丝状真菌(Rhizopus filamentous fungi)。研究表明,大豆的发酵能够降低蛋白酶抑制剂、植酸和酚类这些在生大豆中含量较高的抗营养因子,这可能与豆饼中根霉属表达的植酸酶有关。

在Sprague-Dawley大鼠中,与食用未发酵大豆的大鼠相比,补充豆饼后大鼠粪便中的拟杆菌门、厚壁菌门、艰难梭菌和脆弱拟杆菌的丰度增加。
在体外肠道模拟器模型中,应用大豆和豆饼对人类微生物群,可以增加双歧杆菌、乳酸杆菌、大肠杆菌和肠球菌的丰度。在一项对10名健康志愿者进行的开放标签非对照研究中,食用豆饼导致粪便中AKK菌的丰度和免疫球蛋白A浓度增加,这表明豆饼可能会影响人类的肠道微生物群。
在体外实验中,豆饼比未发酵的大豆显示出更强的自由基和超氧化物清除能,这可能与发酵后大豆中多酚含量和可消化性的变化有关。
但是迄今为止,关于豆饼消费对人类影响的随机对照试验(RCTs)还不存在。对人体的健康效果需要在人类试验中进行研究。
纳豆(Natto)
纳豆是一种传统的日本发酵大豆食品。纳豆是通过用枯草芽孢杆菌(一种益生菌)发酵煮熟的黄大豆制成的。这样制作出来的食品粘稠,有独特的风味和强烈的气味。
纳豆的特性根据大豆的蒸煮时间、相对湿度、发酵时间和温度而有所不同。纳豆发酵产生许多生物活性因子,包括纳豆激酶、杆菌肽酶F、维生素K2和吡啶二羧酸。
纳豆含槲皮素,对代谢、炎症、癌症预防有益
与未发酵的豆制品相比,纳豆中异黄酮槲皮素的含量更高,这些与代谢和炎症性疾病以及致癌预防有关。一种对肺炎链球菌和枯草芽孢杆菌具有抗菌活性的肽已从纳豆中分离出来,尽管尚未在人体中进行研究,但它在治疗肺炎链球菌感染方面具有潜在的临床重要性。
注:异黄酮类化合物是一类存在于豆类食物中的天然植物化学物质,具有类似于雌激素的生物活性,因此也被称为植物雌激素。
槲皮素(Genistein)是一种特定的异黄酮化合物,主要存在于大豆及其制品中。槲皮素因其多种生物学功能而受到关注,包括其抗氧化、抗炎、抗肿瘤的潜在效果,以及对骨密度和心血管健康的积极影响。

纳豆激酶由枯草芽孢杆菌变种产生。纳豆激酶除了增加组织纤溶酶原激活剂和减少血小板聚集外,还具有直接的体外和体内纤溶活性。纳豆激酶的抗血栓和抗高血压活性已在人体小型随机对照试验中得到证实。
食用含纳豆味噌汤:芽孢杆菌和双歧杆菌增加
关于纳豆对人类胃肠道微生物群影响的证据有限。关于纳豆对人类肠道微生物的影响,证据有限。有研究显示,8名健康志愿者连续两周食用含纳豆的味噌汤后,其粪便中的芽孢杆菌和双歧杆菌增加,而梭菌和肠杆菌科细菌减少。此外,粪便中的短链脂肪酸增加,氨和硫化物下降。然而,无法区分味噌汤(也是一种发酵大豆产品)的效应和纳豆的可能效应。
在每周排便3-5次的个体中,连续两周每天食用含有枯草芽孢杆菌K-2的50克纳豆,与每天食用50克煮豆相比,可以增加粪便频率和粪便中双歧杆菌的比例,尽管没有提供样本量。
味噌(Miso)
味噌是一种传统的日本发酵大豆酱,用于制作味噌汤。制作味噌的过程中,会用到一种名为“麴”的发酵剂,它是由霉菌Aspergillus oryzae(即麴菌)产生的,尽管有时也会使用酿酒酵母(Saccharomyces cerevisiae)和乳酸菌。与其他发酵大豆食品一样,味噌的生产在原料、温度和发酵时间、盐浓度以及使用的A. oryzae菌株方面都有很大差异。
味噌的微生物分析
对不同时间点的味噌进行微生物分析,发现在发酵过程中存在:
但在最终产品中只剩下枯草芽孢杆菌的细菌,关于枯草芽孢杆菌,详见:
此外,一系列味噌样本还含有乳球菌属的GM005菌株,它能产生一种具有强大抗菌活性的细菌素,能够抑制包括枯草芽孢杆菌、乳酸乳球菌(Pediococcus acidilactici)和植物乳杆菌在内的多种细菌的生长。
中国和日本的高大豆摄入量历史上一直被假设为相对较低的结肠癌和前列腺癌发病率的原因。支持这一假设的一个可能机制是在大豆中发现的异黄酮类化合物和大豆苷元的高浓度。异黄酮类在结构上与雌激素相似,可能通过与雌激素受体结合影响乳腺癌风险,这在体外实验中已得到证明。
进一步的体外研究表明,槲皮素可能通过促进细胞周期停滞、诱导凋亡和减少癌细胞迁移对癌症风险产生影响。如前面讨论过的,与未发酵的大豆制品如豆浆和豆腐相比,发酵大豆制品如味噌和纳豆中的槲皮素和大豆苷元含量可能更高。
味噌与癌症之间的关联,研究不一致
许多日本队列研究已经调查了味噌摄入量与癌症风险之间的关联。这些研究在饮食摄入评估(食物频率问卷,通常反应有限的摄入量)和可能存在的大量混杂因素方面是有限的。考虑到这些方法学局限性,队列研究观察到日本男性频繁摄入味噌汤与胃癌风险呈反向关联。相反,队列和病例对照研究显示频繁摄入味噌汤与日本成年人的单发和多发胃癌之间呈正相关。此外,一些队列研究显示味噌汤的摄入量与各种类型癌症的风险之间没有关联。
味噌对胃肠道疾病和肠道菌群的影响
目前还没有随机对照试验(RCTs)研究味噌对功能性肠道疾病的影响。因此,关于味噌对胃肠疾病和肠道菌群影响的证据是有限的。有几项观察性研究显示味噌的摄入与胃癌风险之间存在关联,然而这些关联的强度和方向仍然不明确。
酸菜、豆制品和泡菜对胃肠道健康和疾病影响的干预研究

doi: 10.3390/nu11081806
泡菜是一组腌制和发酵蔬菜的术语。它主要由大白菜或萝卜组成,并加入各种调味料(例如,辣椒、胡椒、大蒜、洋葱、生姜)、调味品(例如,盐、酱油、芝麻)以及其他辅助食材(例如,胡萝卜、苹果、梨、虾)。
泡菜的制作发酵
制作泡菜的过程中,首先将大白菜腌制并排水,然后添加剩余的调味品、香料和食品,与大白菜混合,最后进行发酵。发酵是由大白菜和混合物中食物自然存在的微生物发生的,尽管发酵剂培养物可用于泡菜的商业生产,但大白菜菜和混合物中天然存在的微生物会自发地进行发酵。
发酵前后的菌群变化
在发酵前,泡菜混合物中包含了来自明串珠菌属(Leuconostoc)、乳酸杆菌属(Lactobacillus)、假单胞菌属(Pseudomonas)、泛菌属(Pantoea)和魏斯氏菌属(Weissella)等多个不同细菌属的各种细菌物种。
然而,一旦开始发酵,细菌多样性就会下降,并在发酵后仅3天内迅速被明串珠菌属(Leuconostoc)主导。在这个属中,柠檬明串珠菌(Leuconostoc citreum)是发酵前最丰富的物种,但在发酵3天后其比例就很低,此时伴气明串珠菌(Leuconostoc gasicomitatum)和冷明串珠菌(Leuconostoc gelidum)变得占主导地位。
泡菜与其他食物的联合效应
由于泡菜可以包含各种各样的食材,其微生物组成会根据所含食物的类型和数量而有所不同。例如,当泡菜中含更多大蒜时,发现乳酸杆菌的浓度更高; 而添加红辣椒粉会导致魏斯氏菌(Weissella)比例增高,明串珠菌属和乳酸杆菌属比例降低。
一项动物研究显示,含有肠膜明串珠菌(Leuconostoc mesenteroides) DRC 0211的泡菜摄入可通过降低小鼠肝脏脂肪生成相关基因的mRNA表达和降低附睾脂肪组织中与炎症相关的单核细胞趋化蛋白-1和IL-6,展现出潜在的体重控制作用。
在大鼠身上,摄入由泡菜乳酸菌(Leuconostoc kimchi) GJ2发酵的泡菜后,血清总胆固醇、三酰甘油、低密度脂蛋白胆固醇水平以及动脉粥样硬化指数也显示出降低。
一项人体研究表明,摄入发酵8周的泡菜可导致与代谢途径和免疫相关的基因表达发生变化。在一种小鼠结肠炎模型中,从泡菜中分离出的嗜酸乳杆菌(Lactobacillus paracasei) LS2菌株可减少细胞因子产生、髓过氧化物酶活性以及固有层淋巴细胞中的巨噬细胞和中性粒细胞数量,提示其具有潜在的抗炎作用。

泡菜具有抗癌特性
一项体外研究显示泡菜可抑制胃癌细胞生长。值得注意的是,由于泡菜包含多种成分,其对肠道菌群和健康的影响被认为是其所含微生物以及食物制备过程中使用的食材营养成分(如植物化学物、纤维、维生素)的协同效应结果。例如,泡菜中的食物成分如红辣椒籽和大蒜也被认为具有抗菌和抗氧化效果。
小鼠实验:泡菜增加Adlercreutzia的比例
一项针对饮食诱导的肥胖小鼠模型的研究显示,从泡菜中分离出的植物乳杆菌(Lactobacillus plantarum) HAC01可以增加Adlercreutzia的比例,并降低拟杆菌属、Mucispirillum和瘤胃菌属(Ruminococcus)的比例,与对照组小鼠相比。
人体实验:泡菜增加乳杆菌,普雷沃氏菌属,明串珠菌,降低经黏液真杆菌属
在人体研究中,一项非随机对照研究纳入了6名韩国参与者,结果显示每天摄入300克泡菜4周,与每天摄入60克泡菜相比,可以增加粪便中的乳杆菌和明串珠菌的浓度,并降低粪便pH值。
其他几项非随机对照的人体研究也发现了类似的结果。在一项随机对照试验中,比较了24名肥胖女性摄入发酵泡菜和新鲜(未发酵)泡菜的影响,随机分配每天摄入180克发酵泡菜8周的女性显示,与基线相比,肠道核心菌属——经黏液真杆菌属(Blautia)的丰度降低,而普雷沃氏菌属(Prevotella)和拟杆菌属的丰度增加,但两组(发酵和未发酵泡菜)变形菌门和放线菌门的丰度都有所增加。
扩展阅读:
肠道核心菌属——经黏液真杆菌属(Blautia),炎症肥胖相关的潜力菌
不同成分的泡菜都增加产短链脂肪酸菌
另一项随机对照试验则比较了两种不同成分和数量制作的泡菜:
泡菜I 包含了白菜、萝卜、辣椒粉、大葱、大蒜、生姜、鳀鱼汁和糖;
而泡菜II 包含有机白菜、萝卜等多种成分,以及每克106个菌落形成单位的植物乳杆菌。
两组泡菜的摄入都导致产生短链脂肪酸的细菌,如粪肠球菌属(Faecalibacterium)、罗氏菌属(Roseburia)和考拉杆菌属(Phascolactobacterium)的丰度增加,同时降低了梭状芽孢杆菌属(Clostridium)和大肠杆菌(Escherichia coli)的丰度。
扩展阅读:
尽管没有直接比较两组泡菜的效果,但泡菜I被显示出与基线相比,放线菌门(Actinobacteria)的相对丰度增加,而变形菌门(Proteobacteria)的相对丰度减少。相比之下,泡菜II则产生了相反的效果,这表明泡菜中不同类型和数量的成分可能会以不同的方式影响肠道菌群。
酸面包发酵种是通过面粉中的乳酸菌和酵母发酵产生的,这些乳酸菌和酵母来源于面粉本身以及周围环境。
酸面包发酵
制作酸面包发酵种平均需要7天,过程中需要每天用新鲜面粉和水重新喂养微生物。一旦发酵种准备好,会取出一小部分加入酸面包的基本配料中,以启动酸面包的发酵过程——这种方法通常被称为“回种法”。与仅通过快速酵母发酵生产的标准面包不同,酸面包的共生发酵同时包含细菌和酵母,这被认为可以改善面包质量,包括质地、风味、营养含量和保质期,并且替代添加剂。
在发酵过程中,会发生微生物和酶引导的谷物碳水化合物、蛋白质、脂肪和酚类化合物的转化。微生物和酶的活性是相互关联的,例如,乳酸菌会导致pH值降低,调节谷物酶的活性和底物的溶解性(如麸质),反过来酶可以提供底物支持微生物的生长。

酵母发酵剂的微生物含量取决于所使用的传统做法,因此,最终产品的味道和质地以及营养成分都可能有很大差异。
酸面团发酵剂的微生物:乳杆菌常见
一般来说,酸面团发酵剂中已鉴定出乳杆菌属、明串珠菌属、魏斯氏菌属、片球菌属(Pediococcus)和链球菌属的几种菌种。
乳杆菌属是最常见的,而Lactobacillus sanfransiscensis是从大多数发酵剂中分离出来的关键细菌。酿酒酵母 (Saccharomyces cerevisiae)是最丰富的酵母菌种,其次是Candida milleri、 Candida humilis、小酒酵母 ( Saccharomyces exigious )和东方伊萨酵母 (Issatchenkia orientalis )。
酸面包带来健康益处,主要是通过其制作过程对面包营养成分的影响
例如,酸面团工艺可以降低面包中不可消化的低聚糖果聚糖和棉子糖(FODMAP 的类型)的含量,从而使 IBS 患者对面包的耐受性更好 。这种变化是由于酵母微生物,特别是如酿酒酵母和克鲁维酵母对寡糖的降解而发生的。
酸面团及其组成微生物也具有抗菌、抗高血压和降低胆固醇的特性,但这些都是基于体外研究,检查酸面团提取的细菌的影响,而不是烘烤的酸面团面包的影响。
酵母面包对肠道微生物群的影响:变形菌减少
与未发酵的面包相比,添加发酵 8 小时的酸面包后,健康对照样品中的双歧杆菌显着增加。与基线(接种前)相比,IBS 患者和健康捐赠者接种酵母面包发酵 8 小时后,δ-变形菌和 Gemmatimonadetes 显着减少。
此外,与未发酵面包和用酵母发酵16小时的面包相比,发酵8小时的酸面包在IBS样品接种15小时后产生的气体显着降低。作者认为这可能表明肠道微生物群发酵这种酵母面包的速度更慢。
然而,在体内,一项在20名健康成人中进行的随机交叉研究显示,每天摄入145克全麦酸面包1周,与每天摄入110克白小麦面包相比,在粪便微生物群组成上没有显著差异,整个两种面包干预期间,微生物群保持稳定。
酵母牛角面包:腹部不适、腹胀和恶心明显减轻
在一项双盲、交叉随机对照试验中,17 名健康成年人被随机分配吃一顿 2 个酵母牛角面包或 2 个啤酒酵母牛角面包,然后对胃排空进行磁共振成像分析。与啤酒酵母牛角面包相比,食用酵母牛角面包后胃总体积显着减少 11%,氢气产量显着减少 30%。腹部不适、腹胀和恶心明显减轻,表明酵母牛角面包比啤酒酵母牛角面包的耐受性更好。
此外,一项非常小的随机交叉试验包括7名报告轻微胃肠症状的参与者,结果显示食用酸面包黑麦面包后呼出的挥发性有机化合物(VOC)剖面与富含生物处理黑麦麸的小麦面包相比有显著不同,然而并未测量对胃肠症状的影响。这表明酸面包黑麦面包的潜在健康效果可能确实是通过肠道微生物群介导的。

编辑

doi: 10.3390/nu11081806
奶酪
奶酪的制作过程涉及到牛奶中的乳糖被乳酸菌等微生物发酵转化为乳酸的步骤。这个过程不仅使得奶酪产生独特的酸味,还有助于凝固奶蛋白,形成奶酪的固体结构。
在不同类型的奶酪生产中,可能会使用不同种类的发酵微生物,包括乳酸菌(如嗜热链球菌、乳酸乳球菌等)、霉菌(如青霉菌、白霉菌等)和其他发酵剂。
发酵橄榄
橄榄本身含有苦味物质,通常不能直接食用,需要通过发酵或其他处理方法来去除苦味并增加风味。
发酵橄榄的过程通常涉及将橄榄浸泡在盐水溶液中,有时还会添加其他调味料,如香料、柠檬酸、醋等。在这个环境中,有益的乳酸菌会繁殖并开始发酵过程,这些微生物会消耗橄榄中的糖分,产生乳酸,从而降低溶液的pH值。这个酸性环境有助于防止有害微生物的生长,并且随着发酵的进行,橄榄的苦味会逐渐减少,风味也会得到改善。

发酵橄榄的过程可能需要几周到几个月的时间,取决于所使用的具体方法和所需达到的风味强度。这个过程不仅增加了橄榄的可食性和风味,还提高了其保质期。发酵完成后的橄榄可以作为小吃、沙拉配料、披萨配料或其他菜肴的一部分来食用。
发酵辣酱
发酵辣酱是一种发酵食品。发酵辣酱的制作过程通常涉及将辣椒与盐混合,有时还会加入其他成分,如蒜、姜、蔬菜等。这些原料混合后会放置在适当的条件下进行自然发酵或控制发酵。这些是益生菌的良好来源。
在发酵过程中,盐水溶液(盐溶于辣椒释放的水分中)为乳酸菌等有益微生物提供了生长环境。这些微生物会消耗混合物中的糖分,产生乳酸,从而降低辣酱的pH值,形成酸性环境。这个环境有助于抑制有害微生物的生长,并且使辣酱具有独特的酸味和复杂的风味。
鱼露
鱼露是东亚和东南亚美食中的主食,是一种由发酵小鱼(通常是凤尾鱼)和盐制成的调味液,所得酱汁是咸鱼的液体副产品。在发酵过程中,鱼类和盐的混合物会自然分解,其中的蛋白质被酶和微生物分解成氨基酸,产生独特的强烈风味和鲜味。这个过程中产生的液体就是鱼露,它通常具有咸味和鱼的鲜味,是许多东南亚菜肴不可或缺的风味增强剂。鱼可以发酵几个月或长达几年,发酵过程中会出现活细菌,除非鱼露经过巴氏灭菌。
醋
醋是一种通过发酵过程制成的食品。醋的生产通常涉及两个基本的发酵步骤:

不同类型的醋使用不同的原料和发酵方法。例如,白醋通常由谷物酒精发酵而成,苹果醋来自苹果或苹果汁,而葡萄酒醋则是由葡萄酒发酵制成。每种醋都有独特的风味特点,这些特点取决于原料、发酵过程、成熟时间以及是否有其他调味成分的添加。
生姜啤酒
传统酿造生姜或根汁啤酒的制备方法与康普茶类似;酵母和乳酸菌的共生菌落有助于将生姜、糖和水发酵成美味的碳酸饮料。
生姜作为缓解消化不良的天然家庭疗法已经被世世代代使用,并且由于现代科学研究,我们现在知道生姜具有多种治疗作用。生姜含有抗氧化、抗炎和免疫支持化合物。
发酵啤酒的制作过程涉及到使用特定的微生物——酵母,来将麦芽中的糖分转化为酒精和二氧化碳。酵母是一种单细胞真菌,能够进行有氧或厌氧代谢。在啤酒的发酵过程中,酵母主要进行的是厌氧代谢,即酒精发酵。
因此,这种富含益生菌的饮料可能是比其他替代甜碳酸饮料更好的选择。话虽如此,需要知道即使是姜汁啤酒也可能含有多余的糖分。
客观的说,发酵食品的健康益处目前还是常常被夸大了。虽然发酵食品确实与健康益处有关,但是其他像治疗“渗漏性肠炎”或替代抗生素疗法的声明却缺乏足够的证据。
发酵食品确定的健康益处
包括:食品保存、提高营养的生物利用度、改善消化耐受性。利用发酵作为食品保存的手段可以提高食品安全性、可获得性,并保留营养成分。
通过发酵过程,食物成分的转化还可以通过降低抗营养因子(如植酸和单宁)的含量来提高营养的生物利用度。通过降低这些抗营养因子的含量,钙、铁和镁等微量元素的生物利用度就会提高。
发酵食品微生物的短暂性
当前的研究表明,来自发酵食品的微生物是短暂存在的。个体的微生物组已经建立并且对于定植有抵抗力;没有可以定植的生态位,因此它们的益处是可能短暂的。由于这些微生物的短暂性,我们可以推断,发酵食品的益处也可能只在个体食用的期间存在。
通常食用发酵食品的影响是短暂的,但某些影响,例如微生物群组成变化,可能会持续存在
活菌的摄入与肠道菌群和免疫系统积极互动,抑制病原菌,降低疾病风险
许多流行病学研究表明,随着发酵食品摄入量的增加,慢性疾病(如糖尿病和心血管疾病)的患病风险往往会降低。目前的理论是活菌的摄入会与我们自身的肠道微生物和先天免疫系统产生积极互动,有助于抑制病原菌的生长,并提供发酵代谢产物,从而对我们的健康有益。虽然一些益处已经被广泛研究,但其他一些益处更多是理论假设,还需要进一步的研究证实。
发酵食品摄入量逐步增加:炎症细胞因子下降,菌群多样性提高
一个最近的研究探讨了总体发酵食品摄入量对人体免疫系统的调节作用。该随机前瞻性研究纳入36名患者,要么接受高纤维饮食,要么增加发酵食品的摄入。研究监测了患者干预前3周的状况,然后进行为期4周的“逐步增加”阶段,参与者逐步增加高纤维或高发酵食品的饮食,维持6周饮食,以及4周的“自选饮食”,参与者在这期间根据自己的意愿维持饮食。
研究人员发现,在发酵食品组中,每天摄入约6份发酵食品的人(基线时每天仅摄入0.4份发酵食品)的炎症性细胞因子有所下降。
此外,随着发酵食品摄入量的增加,微生物多样性也有所提高。这是首个评估总体发酵食品摄入量及其对免疫功能影响的研究。虽然还需要进一步研究,但它开始探索膳食建议如何转变为包含总体发酵食品目标,以积极影响人类健康。
在世界各地,每种文化都有其独特的食品文化和传统,其中包括发酵食品。在发展中国家,生活在贫困中的人们的主要优先事项并非食品卫生、安全和营养因素,他们消费的食物中可能含有化学、微生物、人畜共患病以及其他危害,可能对健康构成风险。
非洲:大量食用乳酸发酵产品的地方,精神障碍和抑郁症的率比较低
非洲的传统发酵食品和饮料自古以来就被使用,整个大陆上有多种多样的发酵食品和饮料,主要是酸性粥和饮料。
在发展环境中,乳酸发酵和酒精发酵是最受欢迎的发酵类型,约80%的人口仍然寻求传统医治者的帮助,他们会开具本土产品。
在非洲,大量食用乳酸发酵产品的地方,精神障碍和抑郁症的率比较低,但疾病的发生率并不低于发达社会,除了饮食以外还有其他可能加剧疾病的因素,如社会经济变化、城市化、饮食习惯的改变,以及最近青年中的久坐行为。
撒哈拉以南非洲的人民常常遭受内战、干旱、洪水、饥荒和疾病的困扰,但拥有巨大的植物和草药生物多样性,他们倾向于依赖传统医治者,后者通常将精神疾病解释为附身或诅咒,并通过仪式以及推荐传统植物、草药、发酵食品和饮料来处理精神健康问题。
非洲的许多农村社区完全依赖传统发酵食品作为营养的主要来源
同时也用于文化传统实践。在莫桑比克和津巴布韦,传统发酵食品用于四个月大的婴儿断奶。最常见的发酵食品是mahewu,这是一种传统的、发酵的、麦芽的、酸的、非酒精性的玉米或木薯稀粥,酸奶和酸粥。
坦桑尼亚的发酵糊状食品togwa,可以在卫生条件较差的地区防止食源性疾病。但每个人在需求和营养上都是独一无二的。我们大多数人在想到过敏时只会想到组胺,但实际上作为潜在益生菌来源的本土发酵食品和饮料对一些人可能有治疗作用,而其他人可能对组胺不耐受,因为没有无组胺饮食,而这种胺在身体中有许多功能,自然发生,是中枢神经系统中的一种神经递质。
在非洲,水果和蔬菜由于其高水活性和营养价值而容易腐烂。这一现象在热带和亚热带国家更为严重,这些国家的气候有利于腐败微生物的生长。在非洲、亚洲和拉丁美洲的发展环境中,可能对益生菌和发酵食品的需求最大,因此许多发酵果蔬食品被开发出来。
食品发酵的主要目的是增加食品或饮料的保质期,并因此提高其安全性以供消费。发酵通过多种方式达到这个目的,包括通过产生有机酸来降低水分活性和pH值。
用于发酵的微生物是非致病性的,被认为是安全的。尽管对大多数人来说是安全的,但应该注意,发酵的一些副产品可能对健康产生负面影响,最值得注意的是酒精和生物胺。例如组胺和酪胺等生物胺的产生,可能对被诊断有肥大细胞疾病的患者或正在使用单胺氧化酶抑制剂(MAOIs)的患者产生负面影响。
通过发酵,氨基酸被脱羧释放出生物胺,这些生物胺在发酵的肉类和鱼类产品、奶酪、葡萄酒和啤酒中含量较高。对于那些服用单胺氧化酶抑制剂的人来说,限制生物胺和发酵食品的摄入可能是明智的,对于那些有组胺不耐症或肥大细胞激活症的人来说,这样做可能也有帮助。
发酵是一种古老的实践,用于保存食物和饮料,以提供更好的口味,改善营养和食品安全,有机保存食品,并促进健康属性。
食物和饮料的发酵可以改善产品的储存时间、安全性、功能性、感官品质和营养品质。发酵不仅有助于延长货架寿命,还可以安全有效地增强营养属性。
多种食物包括乳制品、蔬菜、豆类、谷物、淀粉根类和水果以及肉类和鱼类,都可以发酵。
在某些人群中,发酵食品和饮料可能占人类饮食的5-40%。
肠道微生物群可能会接触到多种逃避肠道消化的饮食成分,并可能受到植物化学物的影响。植物化学物质是存在于水果、蔬菜、全谷物、豆类、豆科植物、草药、香料、坚果和种子中的非营养性天然化学物,负责产生生理属性,并保护植物作物免受各种环境压力的侵害。
关于发酵食品和饮料与益生菌概念之间存在相当的混淆,重要的是要澄清发酵食品并不等同于益生菌的常见误解。尽管发酵食品可能包含益生菌,但它们的活性微生物含量是未定义的。
益生菌能够通过有益微生物更新、修复和生长消化道内衬组织,中和有害微生物。有用的活性微生物能够正确发酵我们的食物,从而改善我们的健康。尽管发酵食品和饮料对胃肠健康和疾病有影响,但它们的健康益处或推荐消费量尚未广泛纳入全球食品指南。
当发酵食品和饮料补充了益生菌细菌时,它们提供了许多额外的营养和健康特性。发酵食品和饮料比以往任何时候都更受欢迎,而对其健康益处的研究相对较新。并非所有发酵食品都含有活性微生物;例如,啤酒和葡萄酒在生产过程中经历了去除微生物的步骤,其他如面包的发酵食品则经过热处理,微生物被灭活。

目前消费者越来越频繁问到 “我应该食用发酵食品吗,或食用哪些发酵食物比较好?”或者遇到试图利用发酵食品来治疗他们消化症状的患者。
发酵食品通常被认为对健康有益,特别是对肠道健康。但是正如前面上面提到的,目前关于发酵食品对胃肠道健康有效性的科学证据仍然有限,且研究质量参差不齐。因此,当推荐消费者食用发酵食品时,应该提供以下建议:
逐量添加:如果消费者不习惯食用发酵食品,建议他们逐渐添加到饮食中。这样可以帮助肠道微生物群逐步适应,并减少可能出现的消化不适,如胀气或腹泻。
个体化选择:由于每个人的身体和健康状况不同,建议消费者选择适合自己的发酵食品。例如,乳糖不耐受的人可能需要避免含乳糖的发酵乳制品,转而选择非乳制的发酵食品,如泡菜或豆豉。
了解发酵食品:不同的发酵食品具有不同的营养和健康益处。例如,酸奶和开菲尔富含益生菌,有助于维持肠道微生物平衡;泡菜和酸菜含有丰富的维生素C和纤维,可以促进消化;而味噌和天然酿造的酱油则提供了丰富的氨基酸。
注意食品来源:推荐消费者选择自然发酵且未经高度加工的食品,这些食品更有可能含有活性的益生菌。选择未经过度加工和含有活性微生物的发酵食品。市场上的一些产品可能经过巴氏杀菌处理,这会杀死有益的微生物。因此,查看标签并选择含有“活性微生物”或“活性益生菌”的产品。
监测身体反应:建议消费者在尝试新的发酵食品时,留意身体的反应。如果发现消化不适或其他不良反应,应该减少摄入量或停止食用,并咨询医生。
谨慎治疗性使用:如果消费者试图通过食用发酵食品来治疗消化症状,应该提醒这种做法的证据基础不足。鼓励寻求专业医疗建议,并将发酵食品作为整体治疗计划的一部分,而不是唯一的治疗手段。
整体饮食模式:发酵食品应该作为均衡饮食的一部分。确保饮食中还包含了丰富的蔬菜、水果、全谷物、蛋白质和健康脂肪,以支持整体健康。
通过这些建议,可以更好地将发酵食品融入你的饮食中,同时确保这些食品对自己的健康带来积极的影响。
主要参考文献
Dimidi E, Cox SR, Rossi M, Whelan K. Fermented Foods: Definitions and Characteristics, Impact on the Gut Microbiota and Effects on Gastrointestinal Health and Disease. Nutrients. 2019 Aug 5;11(8):1806.
Leeuwendaal NK, Stanton C, O’Toole PW, Beresford TP. Fermented Foods, Health and the Gut Microbiome. Nutrients. 2022 Apr 6;14(7):1527.
Marco ML, Sanders ME, Gänzle M, et al. The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on fermented foods. Nature Reviews Gastroenterology & Hepatology. 2021;18(3):196-208.
Dimidi E, Cox SR, Rossi M, Whelan K. Fermented foods: definitions and characteristics, impact on the gut microbiota and effects on gastrointestinal health and disease. Nutrients. 2019;11(8):1806.
Rul F, Béra-Maillet C, Champomier-Vergès M, et al. Underlying evidence for the health benefits of fermented foods in humans. Food & Function. 2022;13(9):4804-4824.
Wastyk HC, Fragiadakis GK, Perelman D, et al. Gutmicrobiota-targeted diets modulate human immune status. Cell. 2021;184(16):4137-4153.
Gardini F, Özogul Y, Suzzi G, Tabanelli G, Özogul F. Technological factors affecting biogenic amine content in foods: A review. Frontiers in microbiology. 2016;7:1218.
Maintz L, Novak N. Histamine and histamine intolerance. The American journal of clinical nutrition. 2007;85(5):11851196.
Weinstock LB, Pace LA, Rezaie A, Afrin LB, Molderings GJ. Mast cell activation syndrome: a primer for the gastroenterologist. Digestive Diseases and Sciences. 2021;66(4):965982.
Savaiano DA, Hutkins RW. Yogurt, cultured fermented milk, and health: A systematic review. Nutrition reviews. 2021;79(5):599-614.
Patro-Golab B, Shamir R, Szajewska H. Yogurt for treating antibiotic-associated diarrhea: systematic review and metaanalysis. Nutrition. 2015;31(6):796-800.
Skokovic-Sunjic D. Clinical Guide to Probiotic Products Available in Canada. probioticchart.ca. Accessed September 14, 2022.
Turan İ, Dedeli O, Bor S, İlter T. Effects of a kefir supplement on symptoms, colonic transit, and bowel satisfaction score in patients with chronic constipation: a pilot study. Turk J Gastroenterol. 2014;25(6):650-656.
Bekar O, Yilmaz Y, Gulten M. Kefir improves the efficacy and tolerability of triple therapy in eradicating Helicobacter pylori. Journal of medicinal food. 2011;14(4):344-347.
Nielsen ES, Garnås E, Jensen KJ, et al. Lacto-fermented sauerkraut improves symptoms in IBS patients independent of product pasteurisation–a pilot study. Food & function. 2018;9(10):5323-5335.
Fujisawa T, Shinohara K, Kishimoto Y, Terada A. Effect of miso soup containing Natto on the composition and metabolic activity of the human faecal flora. Microbial ecology in health and disease. 2006;18(2):79-84.
Altobelli E, Del Negro V, Angeletti PM, Latella G. LowFODMAP diet improves irritable bowel syndrome symptoms: a meta-analysis. Nutrients. 2017;9(9):940.
Loponen J, Gänzle MG. Use of sourdough in low FODMAP baking. Foods. 2018;7(7):96.
谷禾健康

肠道微生物群之间编织了一个复杂的相互作用网络,影响人体的营养吸收和代谢,免疫功能等,对我们的健康状态有很大的影响。
我们知道,肠道微生物群具有多样性,平衡性,稳定性等特征,但同时也具有异质性,也就是说不同个体之间存在差异。不同人群对食物,膳食补充剂的健康需求不同。
特定的营养素、食物、整体饮食结构等诸多因素都会影响特定的肠道菌群,从而影响整体健康。
随着当前研究技术的不断进步,我们对肠道菌群和健康之间的关系认知不再停留在初级关联阶段,而是逐步走向精细化调节层面。
怎样通过这些看起来日常的饮食,益生菌补充剂等方式,去操纵肠道菌群以达到获得健康的目的,是一个值得深入探讨的话题。
本文,我们从肠道菌群的角度来了解一下,饮食模式、发酵食品、益生菌、益生元和其他相关化合物对我们健康的影响。
本文主要从五个方面讲述
●发酵食品对肠道菌群和健康的影响
●不同饮食模式与菌群及健康
●益生菌调节肠道微生物群和人体健康
●益生元化合物对肠道菌群的影响
●后生元和精神生物制剂与健康
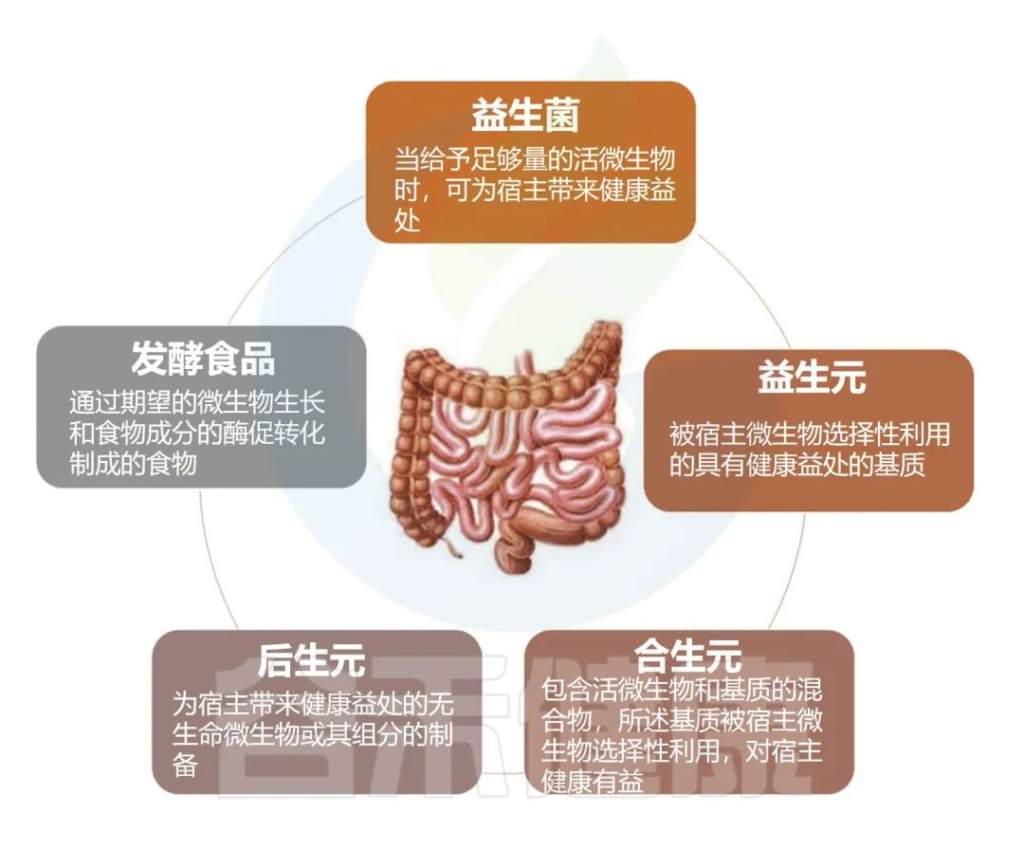
Nma B,et al.Elsevier Inc.2022
发酵食品被定义为“通过理想的微生物生长和食物成分的酶促转化制成的食品”。
许多发酵食品已被证明通过不同的方式对人体具有促进健康的作用,包括生物活性分子的合成、肠道微生物群的调节以及与免疫系统的相互作用。
✦发酵食品产生多种代谢物,促进有益作用
在食品发酵过程中,微生物进行酶促转化,提供多种具有不同生理活性的代谢产物(多肽、低聚糖、游离氨基酸、改性多酚、有机酸等)。
这些转化发生在食物摄入之前,发酵食品也是微生物进入我们肠道的绝佳载体,与我们的微生物群的其他成员一起,可以转化和代谢我们肠道中的食物成分,产生具有不同功能的微生物代谢物(短链脂肪酸、维生素、细菌素等)。
据报道,某些发酵食品或其成分能够以某种方式促进有益的效果,而这些效果有时与我们微生物群的变化有关。在本节中,我们将讨论发酵食品对微生物群的影响及其可能的有益作用。
发酵乳制品对健康的影响已经被深入研究了一个多世纪,但直到最近,随着新的组学技术和大规模测序方法的使用,我们才能够详细了解食用发酵乳制品对微生物群的影响。
1 酸奶

•酸奶有助于改善乳糖消化不良
酸奶是研究最多的发酵乳制品之一。它是通过两种乳酸菌(德氏乳杆菌保加利亚亚种和嗜热链球菌)在牛奶中的联合活性获得的。欧洲食品安全局已经认识到酸奶发酵剂的有益作用,认为活酸奶培养物可以改善乳糖消化不良患者的乳糖消化。
•饮用酸奶增加了嗜热链球菌,减少了拟杆菌丰度
一些动物模型的临床前研究表明,长期摄入酸奶改变了小鼠菌群中拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)之间的比例,并增加了链球菌科(Streptococcaceae)成员的数量,这可能是由于摄入了酸奶中存在的嗜热链球菌(S. thermophilus)。
此外,一些在人体中进行的干预试验表明,饮用酸奶会增加人体微生物群中的一些细菌数量:其中,乳酸菌的丰度较高,而拟杆菌(Bacteroides)的种类则相应减少。
2 奶酪

奶酪,也是一种发酵的牛奶制品,其性质与酸奶有相似之处,都是通过发酵过程来制作的,也都含有可以保健的乳酸菌,但是奶酪的浓度比酸奶更高,近似固体食物,营养价值也因此更加丰富。
•食用奶酪可以增加产丁酸盐细菌丰度,可能缓解特应性皮炎
研究了奶酪和乳制品引发肠道微生物群变化并促进相关健康影响的能力。最近进行了一项健康食品选择与肠道微生物群组成之间的广泛关联研究,表明α多样性与低脂奶酪之间存在强烈的正关联。
临床前研究报告称,给小鼠服用奶油奶酪后,产生丁酸盐的细菌水平增加,T细胞(Treg)介导的免疫反应和IgE水平降低,表明对缓解特应性皮炎有潜在的有益作用。
•奶酪中的发酵菌可以存在人体一段时间
在人类中,两项干预试验评估了食用卡门贝尔奶酪对不同肠道菌群成员的影响,结果表明,食用奶酪后粪肠球菌(Enterococcus faecalis)的丰度显著增加,并且卡门贝尔奶酪中存在的微生物,如乳酸乳球菌(Lactococcus lactis)、肠膜明串珠菌(Leuconostoc mesenteroides)和白地土菌(Geotricum candidum),在食用奶酪期间出现在个体的粪便中。在停止干预15天后,粪便样本中存在肠膜明串珠菌。
3 开菲尔
开菲尔是一种由微生物混合物发酵的产品,通常包括几种乳酸菌和酵母,其发酵和生产过程根据其生产的地理区域和传统的细化过程而显著变化。
因此,很难对开菲尔的效果得出一般性的结论,更谨慎的做法是根据所研究的开菲尔的类型来具体说明这些效果。
•改善机体代谢,抗肥胖
有证据表明,食用开菲尔可能有有益的代谢作用。开非尔能够调节啮齿动物体内的微生物群组成。向肥胖的人类微生物群相关大鼠喂食西藏开菲尔牛奶表明,微生物群变化与胆汁酸和氨基酸代谢有关。
此外,连续四周每天给小鼠服用克非尔显示了对厚壁菌门/拟杆菌门比率的影响,以及对性能和身体疲劳的改善。
另一项研究通过建立社区特征和几种生物标志物之间的相关性,证明了开菲尔在小鼠体内的抗肥胖作用,这表明食用开菲尔诱导的微生物群和真菌群调节可能与预防肥胖和脂肪酸代谢有关。
•改善炎症性肠病、代谢综合征
一项针对炎症性肠病患者的随机对照试验表明,定期食用开非尔可以改善生活质量,减少腹胀。
此外,一项平行组随机对照干预试验显示,代谢综合征患者接受开菲尔12周后,在开菲尔组中放线菌的相对丰度增加,对代谢综合征标志物有一些有利的影响。
•还可能影响宿主行为和免疫状态
对小鼠施用开非尔还被证明可以增加短乳杆菌(Lactobacillus brevis)的流行率和微生物群产生γ-氨基丁酸的能力,影响宿主行为和免疫状态。
这些临床前证据表明,开非尔对宿主的微生物群和代谢有影响,包括肥胖、糖尿病、肝脏和心血管疾病、免疫和神经系统变化。
除了发酵乳制品外,关于其他动物性发酵食品调节微生物群的信息较少。然而,有证据表明植物发酵食品对肠道微生物群的影响,以及其与健康影响的潜在关系。
在这方面,酸菜、泡菜、红茶菌和其他发酵的植物性食物已经被研究过,并显示出对肠道微生物群的不同影响,尽管需要更多的证据来建立它们对人类健康的明确联系。
1 酸面包
•低蛋白饮食相关细菌减少、影响升糖反应
酸面包是一种发酵食品,也显示出了显著的效果。采用元蛋白质基因组学方法分析了酸面包对大鼠微生物组的影响,结果显示低蛋白质饮食相关的细菌类群减少。
在另一项研究中,食用手工酸面包引起的升糖反应与食用工业白面包不同。这些反应是个体特异性的和微生物相关的。
每个人的血糖反应可以根据干预研究前确定的微生物组谱进行预测。
2 发酵豆制品
•促进脂肪酸分解代谢
关于发酵豆制品,一些临床研究显示了微生物群调节活性和各种生理效应。在啮齿动物中研究了大豆发酵产品对代谢过程的影响,表明发酵大豆能够促进小鼠脂肪酸分解代谢和主要细菌门的变化。
•影响其他代谢物水平
鼠李糖乳杆菌发酵的豆浆通过增加一些细菌类群,如拟杆菌(Bacteroides),对小鼠微生物群有影响,这是一种通过尿液排泄的异黄酮代谢物的来源。
此外,用解淀粉芽孢杆菌(Bacillus amyloliquefaciens)发酵的大豆降低了2型糖尿病大鼠模型中的高血糖,引起疣微菌(Verrucomicrobiales)种群的增加和肠杆菌(Enterobacteriales)的减少,以及其他微生物群的变化。
•改善认知功能
值得注意的是,在小鼠中摄入植物乳杆菌发酵的大豆后,观察到对认知功能的积极影响,以及乳酸菌和双歧杆菌种群的增加。
含有植物乳杆菌(L.plantarum C29)的发酵产品在一组轻度认知障碍患者中进行的为期12周的人类临床试验中显示出认知能力的改善。
•可能改善皮肤状况
最后,摄入含有干酪乳酸菌代田株(Lactobacillus casei Shirota)的发酵豆乳对健康绝经前日本女性的皮肤状况有显著影响,乳酸菌和双歧杆菌的数量有增加的趋势,而肠杆菌科和紫单胞菌科(Porphyromonadaceae) 的数量则有下降的趋势。
由于各种食物已经证明了调节特定细菌和肠道微生物群整体结构的能力,因此短期和长期的饮食模式可以影响肠道微生物组的构成和良好功能。
★ 饮食对肠道菌群的多样性至关重要
我们肠道菌群的多样性可能反映了我们饮食的多样性,因此,饮食可能是我们控制和平衡肠道菌群组成和代谢的最强大的武器。
以下部分旨在概述过去几年来产生的关于不同饮食和饮食习惯对调节肠道菌群的潜力的一些现有知识。
西式饮食、地中海饮食和素食这几种可能是世界上最常见的人类饮食模式,每一种都与一些特定的健康/疾病状况有关。
✦不同饮食模式的差异主要是碳水化合物和纤维的含量
宏量和微量营养素方面的显著差异决定了这些饮食模式,其中复合碳水化合物和纤维的含量可能是最显著的之一。
事实上,复杂的碳水化合物和纤维可能是产生最确凿证据的食物成分,它们是肠道菌群的有益调节器,在碳水化合物消耗仅24小时后就会发生快速转变。
西式饮食,是一种以高含量精加工糖和碳水化合物、高含量饱和脂肪酸、高含量动物蛋白以及低含量膳食纤维为特征的一种现代饮食方式,不能否认的是这种饮食好吃还容易上瘾。
✦西式饮食导致易患许多代谢疾病
这种饮食模式在人类历史上是最近才出现的,通常与城市生活方式有关,通常与炎症和代谢疾病有关,包括2型糖尿病和肥胖等。
✦西式饮食下的肠道微生物显著改变
此外,在将祖先生活方式和农业人口的饮食与西方化生活方式的饮食进行比较时,观察到肠道微生物群的组成发生了显著变化,总体特征是纤维降解细菌的减少和蛋白质代谢细菌的增加。
变形菌、拟杆菌等蛋白质代谢菌较丰富
最近的研究已经指出,与这些生活方式相关的一些疾病生物标志物可能是通过西方饮食对肠道微生物群的干扰作用介导的,其特点是多样性低。
蛋白质和胆汁代谢细菌占主导地位,包括产生三甲胺n-氧化物(TMAO)的物种,变形菌和拟杆菌通常更为丰富。
事实上,在动物模型中,西方化饮食的引入会迅速转化为微生物群的变化,并增加感染和代谢疾病的风险,在向新动物移植不良微生物群后,这些表型可以重现。
这表明,饮食模式影响人类健康的一些机制是通过调节肠道微生物群来实现的,并表明通过饮食调节肠道微生物群可能会降低一些疾病风险。
地中海饮食的特点是大量摄入新鲜水果、蔬菜、豆类和全谷物,同时摄入少量动物蛋白、加工食品和饱和脂肪。
✦地中海饮食改善代谢、降低慢性病患病率
长期以来,这种饮食习惯与改善代谢和心血管健康、健康老龄化、降低死亡率和慢性疾病患病率有关。
纤维降解细菌丰度增加、短链脂肪酸增加
其中一些影响与肠道菌群特征及其相关代谢组和免疫调节的特定变化有关。就地中海饮食对肠道菌群的具体影响而言,它通常与纤维降解物种的高度多样性和代表性有关,如普雷沃氏菌(Prevotella)和毛螺菌属(Lachnospira)。
其代谢导致短链脂肪酸的产生;以及一些瘤胃球菌的减少。事实上,严格坚持地中海饮食的人的短链脂肪酸水平似乎更高。
值得注意的是,与地中海饮食相关的有益肠道菌群调节并不完全与其长期食用有关,因为饮食习惯向这种模式转变,即使是相对较短的时间,通常也会改善微生物和健康生物标志物,这在各种炎症、代谢和认知障碍的动物模型以及人类临床试验中都得到了证明。
例如,对一组超重和肥胖的参与者进行了8周的地中海饮食干预,即使在保持能量摄入的情况下,也导致微生物群多样性显著增加,纤维降解细菌的表现包括普拉梭菌、一些拟杆菌属和一些罗氏菌属、颤螺菌属和毛螺菌,这些细菌负责短链脂肪酸的产生,包括丁酸盐生产者。其中一些还被认为具有抗炎特性。
✦有效改善炎症
此外,在饮食干预后,潜在的促炎细菌(如Ruminococcus gnavus)减少,胆固醇水平、炎症标志物和胰岛素抵抗全面改善。
地中海饮食对肠道菌群结构的好处也在其他健康受试者的队列中被揭示出来。在欧洲各国的老年人群中进行了一项大型饮食干预试验,表明在12个月的时间内坚持地中海饮食模式有利于调节微生物群中的关键物种,导致与较低虚弱和改善认知功能标志正相关的类群的丰富,并与炎症负相关,包括以下几种菌属:
普拉梭菌(Faecalibacterium);
罗氏菌属(Roseburia);
优杆菌属(Eubacterium);
多型拟杆菌(Bacteroides thetaiotaomicron);
普雷沃氏菌(Prevotella)。
素食
素食是一种不食肉等动物产品的饮食方式,有时也戒食奶制品和蜂蜜。在另一个极端,许多研究评估了长期素食和杂食饮食对微生物群、代谢组和疾病风险的影响。
✦素食对健康促进的具体作用暂不明确
长期以来,素食饮食一直被认为具有促进健康的作用,但与杂食性饮食相比,素食饮食也可以培养不同的肠道微生物群结构,总体上增加了多样性和丰富性;拟杆菌(Bacteroidetes)经常以较高的相对频率出现。
然而,报告了一些相互矛盾的结果,一些控制良好的喂养研究发现,生活在同一地理区域的杂食性和素食者之间的肠道微生物群只有适度的差异。不过两组在代谢组中都表现出很大的差异,这可能部分归因于微生物群产生的代谢物。
低FODMAP饮食
还有一种与潜在微生物群调节能力相关的饮食模式是低FODMAP饮食。
什么是FODMAP?
FODMAP是一组人体吸收较差的短链碳水化合物,包括果糖、果聚糖、乳糖、多元醇及半乳糖寡糖等。
其特点是可发酵低聚糖、双糖、单糖和多元醇的含量降低,虽然其中一些成分可能作为益生元对健康受试者的肠道菌群进行有益的调节,但它们也可能引发肠易激综合征(IBS)和其他肠道疾病患者的不良反应。
✦缓解肠易激综合征
低FODMAP饮食长期以来可以证明缓解了肠易激综合征患者的症状,但其有益效果似乎强烈依赖于患者的基础微生物群特征。
✦影响健康促进有关细菌的丰度
在微生物区系水平上,FODMAP消耗的减少通常会导致一些与健康促进有关细菌的肠道减少,如:
普拉梭菌(Faecalibacterium Prausnitzii)↓↓↓
双歧杆菌(Bifidobacterium)↓↓↓
嗜黏蛋白阿克曼菌(Akkermansia)↓↓↓
巨球型菌属(Megasphaera)↓↓↓
片球菌属(Pediococcus)↓↓↓
放线菌(Actinobacteria)↓↓↓
以及产生丁酸盐的细菌减少
同时伴随着其他气体消耗细菌的增加,如雌马酚产生者Adlercreutzia,甚至是Ruminococcus torques。细菌通常在肠易激综合征患者中检测到高丰度。
因此,低FODMAP饮食可以导致症状的改善,尽管所涉及的机制尚不清楚,但是同时,也可以诱导更明显的肠道菌群失调。
有趣的是,低FODMAP饲粮降低了结肠pH值和细菌总数,而短链脂肪酸浓度不受影响,这进一步支持了低FODMAP饮食下肠道菌群代谢中存在重要的重组。
注意
虽然人们普遍认为地中海和素食饮食可以改善肠道微生物群的多样性和纤维降解细菌的表现,但在不同的研究中,一些具体的类群有所不同,这阻碍了在饮食模式、微生物群变化和健康反映之间建立具体的因果关系。
这可以归因于不同食物组合的可变影响,以及对饮食干预的反应可能高度依赖于基础肠道微生物群组成,以及其他个体遗传和环境特征、宿主遗传、季节、地理和文化差异。
在考虑将饮食干预作为精确调节肠道微生物群的手段时,另一个需要考虑的关键方面不仅是宏观和微量营养素的具体组成,还包括摄入次数、饮食行为和饮食干预的持续时间。
一般来说,虽然相对短期的饮食干预足以对肠道菌群产生可测量的影响,但在恢复习惯性饮食后,这些变化会迅速恢复,甚至,根据基础菌群配置,可能需要更大的干预才能产生明显的效果;建议永久性的饮食适应,以确保提供持续的基质来源,为有益的肠道种群提供燃料及其相关的长期益处。
因此,虽然在该领域已经取得了重大进展,但为了建立旨在通过调节肠道微生物群来改善人类健康的个性化饮食策略,有必要进行进一步的研究。
益生菌被定义为“当施用足量时,对宿主的健康有益的活微生物”。
益生菌已被认为在不同水平上发挥其有益功能,包括:
•营养物质的代谢,以促进消化,产生维生素或具有全身作用的分子;
•神经系统信号的改变;
•免疫调节的诱导;
•对生理应激的保护;
•直接和间接的病原体拮抗;
•改善肠道上皮的屏障功能;
•调节微生物
益生菌可以在不同程度上对宿主产生有益作用
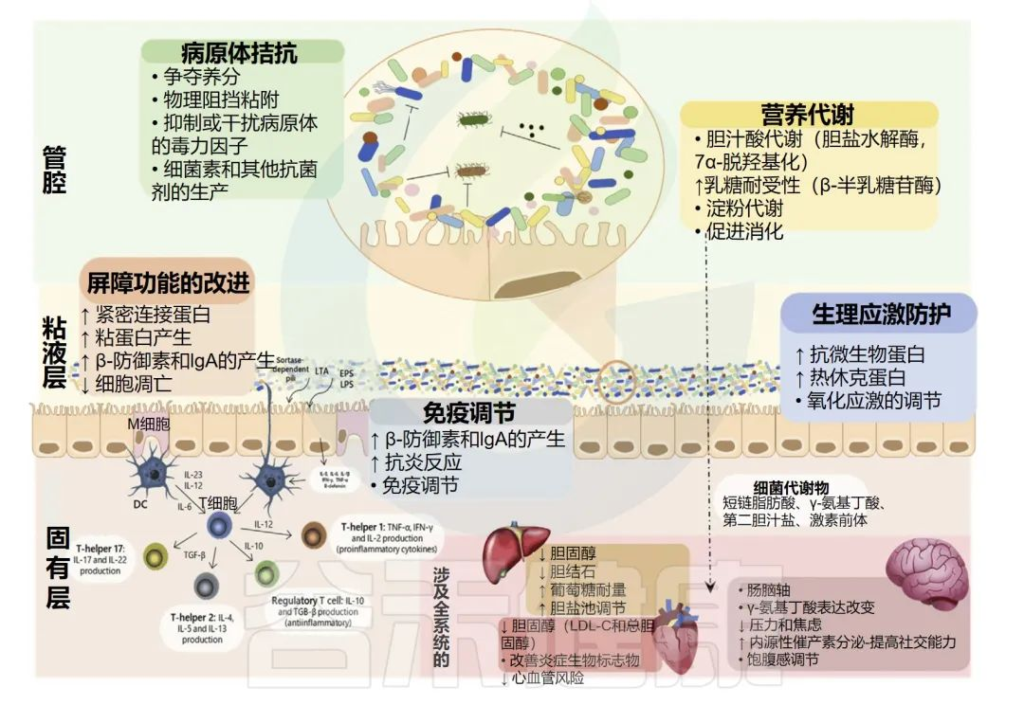
Nma B,et al.Elsevier Inc.2022
这些功能可以是接触依赖的或由表面分子介导的,如脂磷酸和梭酸依赖菌毛,或由分泌分子介导的,如短链脂肪酸和细菌素。
总的来说,突出了免疫调节和病原体拮抗活性,它们对于维持肠道微生物组中细菌群落与宿主之间的平衡至关重要。
一些研究,不仅在体外和动物模型中,而且在人类志愿者中,分析了益生菌对与人类疾病相关的特定细菌病原体或群体的抑制作用,如产气荚膜梭菌 (Clostridium perfringens)、肠炎沙门氏菌(Salmonella enteritidis)和大肠杆菌(Escherichia coli);以及其对生理或炎症标志物和免疫特征的影响。
益生菌也被认为能够调节整体肠道微生物群。事实上,有人提出所需的益生菌效果与肠道中的微生态变化有关。
✦益生菌治疗改变了肠道微生物组成
对动物模型的不同研究表明,用不同菌株的乳酸菌和双歧杆菌以及其他微生物(如布拉氏酵母菌)进行治疗,明显影响小鼠肠道的微生物群组成,促进微生物群落的结构和功能的变化。
注:这些研究大多使用细菌计数或qPCR分析来研究肠道微生物群分布的变化,只获得了生态系统的一小部分图像。在这方面,随着下一代测序技术和生物信息学工具的发展,我们可以对肠道微生物组进行更深入的研究,不仅可以从结构和组成层面,还可以从功能层面深入研究益生菌对微生物群落的影响。
缓解肥胖相关的肠道微生物失调
在动物模型上报道了鼠李糖乳杆菌、嗜酸乳杆菌、植物乳杆菌、两歧双歧杆菌、长双歧杆菌和粪肠球菌对饮食诱导的肥胖小鼠肠道微生物群的调节作用,缓解了饮食诱导的肥胖和相关的肠道微生物群失调。
此外一些益生菌,如茯砖茶中的冠突散囊菌(Eurotium cristatum),也显示出调节肠道真菌和细菌群落的能力,表现出与健康动物中观察到的情况更接近的特征,并减轻饮食引起的肥胖症状。
下面是益生菌调节肠道菌群的一些证据:
调节抑郁症的肠道生态失调
肠道生态失调
在抑郁症小鼠模型中,使用含有L.plantarum LP3、L.rhamnosus LR5、Bifidobacterium lactis BL3、Bifidobacterium breve BR3和Pediococcus pentosaceus PP1的益生菌配方进行干预,可对微生物组产生调节作用,使其与健康动物中观察到的情况相似,从而减少与疾病相关的肠道生态失调。
结肠炎生态失调得到改善
同样,在诱导结肠炎小鼠模型中,摄入布拉迪酵母菌(Saccharomyces boulardii)或两株发酵乳杆菌(Lactobacillus fermentum )已显示出能够调节肠道微生物组,增加生物多样性,并显著改善结肠炎动物的肠道生态失调特征。
结直肠癌的致病菌得到抑制,有益细菌增加
另外,在结直肠癌小鼠模型中,丁酸梭菌(Clostridium butyricum)的干预减弱了致病菌的增加,促进了有益菌的生长,并改变了次生胆盐和短链脂肪酸等微生物源性代谢产物。
在小鼠哮喘模型、抗生素诱导的生态失调小鼠和健康动物中也报道了这些调节作用,显示生物多样性和有益细菌丰度的增加。
益生菌对微生物群的调节在人类中并不明显,因为有的研究显示了相互矛盾的结果。可能还需一系列深入研究来了解益生菌对人体肠道微生物群的具体影响。
下面是存在争议的一些数据:
在最近的一项工作中,研究表明,以嗜酸乳杆菌(L. acidophilus)、乳酸乳杆菌(B. lactis)、长双歧杆菌(B. longum)、双歧双歧杆菌(B. bifidum)、和半乳糖低聚糖混合物组成的共生生物作为益生元进行干预,显示出在一组肥胖患者中调节肠道微生物群落的能力,观察到不同健康相关菌群(如双歧杆菌、毛螺菌和乳杆菌)的比例有所增加;以及与肥胖正相关的慢性炎症相关群体的减少,如瘤胃球菌科(Ruminococcaceae),普雷沃氏菌(Prevotella)和巨球型菌属(Megasphaera) 。
然而,先前对肥胖患者的研究显示了相互矛盾的结果,因此其中一些研究报告称,在益生菌干预后,肠道微生物群落没有变化,质疑这种对肠道微生物组的调节作用的存在。
与此同时,对影响全球数百万人的炎症性肠病患者的研究也显示出有争议的结果。尽管在动物模型中已经报道了对肠道微生物群落的调节作用,但在一组溃疡性结肠炎患者中,用含有短双歧杆菌(B. breve)的某品牌益生菌治疗,在研究过程中,两个治疗组之间没有显著差异。
另一方面,摄入含有L.acidophilus La-5和B. animalis亚种的益生菌酸奶。促进了一组炎症性肠病患者中乳酸菌、双歧杆菌和拟杆菌水平的增加,尽管这项工作没有从宏基因组的角度分析微生物组。
✦特定菌属水平增加,整体菌群组成变化不大
一些研究报道,益生菌不影响整体菌群组成,但可以改变特定属的比例。
例如,在高危特应性疾病婴儿中,在产前最后阶段和出生后第一年摄入益生菌混合物促进了双歧杆菌和乳酸杆菌水平的增加,但在肠道微生物组中没有检测到显著变化。
同样,在一组有功能性便秘症状的个体中,混合使用益生菌的干预促进了瘤胃球菌(Ruminococcus)水平的增加和丹毒丝菌科(Erysipelotrichaceae) 成员的减少,但α多样性指数和整体微生物组组成显示出与安慰剂组检测到的水平相似。
在一组HIV感染个体中,在使用鼠李糖酵母菌GG干预8周后,也描述了相同的趋势。
✦增加与健康相关共生细菌,减少病原体相关细菌
其他研究表明,益生菌可以引起肠道微生物种群的变化,增加与健康相关的共生细菌的水平,减少与病原体相关的群体,甚至恢复被改变的微生物群落的平衡。
在这方面,干酪乳杆菌(Lactobacillus casei Lcr35)在一组患有急性腹泻的儿童中,促进了拟杆菌、粪杆菌和瘤胃球菌属的增加,并降低了大肠杆菌和梭状芽孢杆菌的水平。
在一项针对乳糖不耐受患者的研究中,使用B.longum BB536和L.rhamnosus HN001进行30天的干预也导致肠道微生物组成发生积极变化。
在感染幽门螺旋杆菌的患者中也观察到了这种趋势。他们报告了多重耐抗生素的屎肠球菌LAB制剂与抗生素联合使用时,在正常肠道微生物群方面的有效效果,防止α多样性值的下降,并恢复受抗生素治疗影响的微生物群的水平。
同样,在一组患有早期败血症的成年人中,益生菌的干预导致α多样性的增加以及益生菌的增加,如不同种类的乳酸菌(Lactobacillus)和屎肠杆菌(E.faecium)。
此外,一些研究表明,益生菌不仅可以引起特定细菌种群的变化,还可以引起相关微生物群代谢物的变化。
✦肝硬化患者肠道失调得到改善
在肝硬化患者中,摄入8周鼠李糖乳杆菌GG不仅能调节肠道微生物组,降低肠杆菌科(Enterobacteriaceae)和紫单胞菌科(Porphyromonadaceae)的相对丰度,增加共生菌毛螺菌科(Lachnospiraceae)和瘤胃球菌科(Ruminococcaceae)的丰度,还能调节代谢物的分布,从而改善肠道生态失调和微生物-代谢组的联系。
在摄入增强结肠短链脂肪酸生成的发酵牛奶后,也有类似的趋势被报道;在乙型肝炎诱导的肝硬化患者中摄入含有丁酸梭菌(C.butyricum)和婴儿双歧杆菌(Bifidobacterium infantis)的益生菌混合物3个月后,促进了不同肠粘膜屏障完整性生物标志物的改善。
考虑到来自动物模型和人体试验的这一证据,最近有人提出将益生菌作为预防和治疗结直肠癌的新策略。
注:迄今为止,缺乏针对人类患者的研究,专注于分析益生菌对与CRC相关的肠道菌群紊乱的可能调节作用。
✦健康人群病原相关菌丰度下降
就健康人群而言,只有少数干预研究分析了益生菌摄入量对肠道微生物群的影响,而肠道微生物群可以根据参与者的年龄进行分类。
在一项对3至12个月大的婴儿的研究中,使用三种益生菌菌株进行干预(B.longum subsp. infantis R0033, Lactobacillus helveticus R0052和B. bifidum R0071)。8周后,一些病原相关类群如柯林斯菌属(Collinsella),肠球菌(Enterococcus)和克雷伯氏菌(Klebsiella),粪杆菌(Faecalibacterium)和瘤胃球菌(Ruminococcus)水平下降。
此外,在干预期间,一些细菌群保持稳定,而在安慰剂组中,它们增加了,如大肠杆菌志贺氏菌(Escherichia-shigella)和韦荣氏球菌属(Veillonella)的情况下
增加有益细菌,减少病原体相关菌的一些证据:
在另一项对健康婴儿的研究中,在生命的第一年摄入补充了4种双歧杆菌菌株的配方,促进了脆弱拟杆菌(Bacteroides fragilis)和经黏液真杆菌属(Blautia)水平的下降,以及代谢物谱的差异,尽管没有检测到整体微生物组的变化。
在成人人群中,有研究表明,益生菌摄入量对肠道微生物群落的影响与肠道菌群的基础组成密切相关。每天食用干酪乳杆菌(L.casei)14天,增加了某些有益细菌的相对丰度,如乳酸杆菌(Lactobacillus)、罗氏菌属(Roseburia)、粪球菌属(Coprococcus),而一些有害细菌的水平则降低了。
在用Lactobacillus kefiri LKF01治疗后,以及B.longum BB536和L.rhamnosus HN001进行干预后,也报告了类似的结果,显示出强大的调节肠道微生物群组成的能力,导致有益细菌的增加,并显著减少直接参与促炎反应和胃肠道疾病发作的潜在有害菌群。
✦产丁酸盐细菌增加
此外,每天食用两歧歧杆菌(B.bifidum strain Bb)4周会影响粪便微生物群中优势类群的相对丰度,并调节粪便丁酸盐水平,因此作者观察到普雷沃氏菌(Prevotellaceae)的数量减少,而瘤胃球菌(Ruminococcaceae)和Rikenellaceae的比例更高。
这些研究支持了之前的研究,即益生菌对肠道菌群的调节作用。有趣的是,最近有人提出了益生菌“ salami”的潜力,尽管微生物组的整体结构没有发现显著变化,但摄入益生菌萨拉米会促进产生丁酸盐的细菌的增加。
在益生菌摄入过程中检测到粘附相关基因的差异表达和大量参与细菌运动性的基因,提示益生菌干预可以通过调节其表达模式来调节肠道微生物组。
小结
总之,在过去的几十年里,大量的科学报告已经证实了益生菌对宿主健康的积极作用。然而,尽管存在不同的动物模型和人体研究,显示益生菌可能对肠道微生物群落及其功能具有调节作用,但在人体试验中报道的还存在一定的争议。
现有的研究使用了不同的益生菌菌株、广泛的年龄范围、疾病和疾病状态,以及摄入不同饮食和营养素的志愿者;因此,研究组表现出较高的个体内部和个体间的变异性,使得阅读结果变得困难。
另一方面,正如前面提到的,我们必须考虑到益生菌的作用不仅取决于菌株,还取决于基础微生物群,而最常用的益生菌(主要属于乳酸杆菌和双歧杆菌)不一定在肠道定植,并且可以在益生菌干预后释放,从而使确定益生菌调节宿主肠道微生物群的具体机制变得更加复杂。
为了阐明益生菌对肠道环境和微生物群影响的分子机制,我们应该进一步研究更大、更均匀的群体,也许还应该研究从人类肠道环境中分离出来的下一代益生菌,它们能够在肠道粘膜上定植,产生长期效应。
益生元概念首次定义为“不易消化的食物成分,通过选择性地刺激一种或少数已经存在于结肠中的细菌的生长或活性而有益地影响宿主”。
然而,这一概念多年来一直在发展。当前的国际益生菌和益生元协会共识小组提出了以下益生元的定义:“一种被宿主微生物选择性利用的对健康有益的底物”。
各种益生元
应该指出的是,目前确立的益生元是基于碳水化合物的,尽管其他物质如酚类化合物和多不饱和脂肪酸转化为各自的共轭脂肪酸可能符合这一定义。
几十年来,只有少数几类碳水化合物被认为是益生元,包括人乳寡糖(HMOs)、菊粉和低聚果糖(FOS)、低聚半乳糖(GOS)和乳果糖。
一些益生元及相关研究
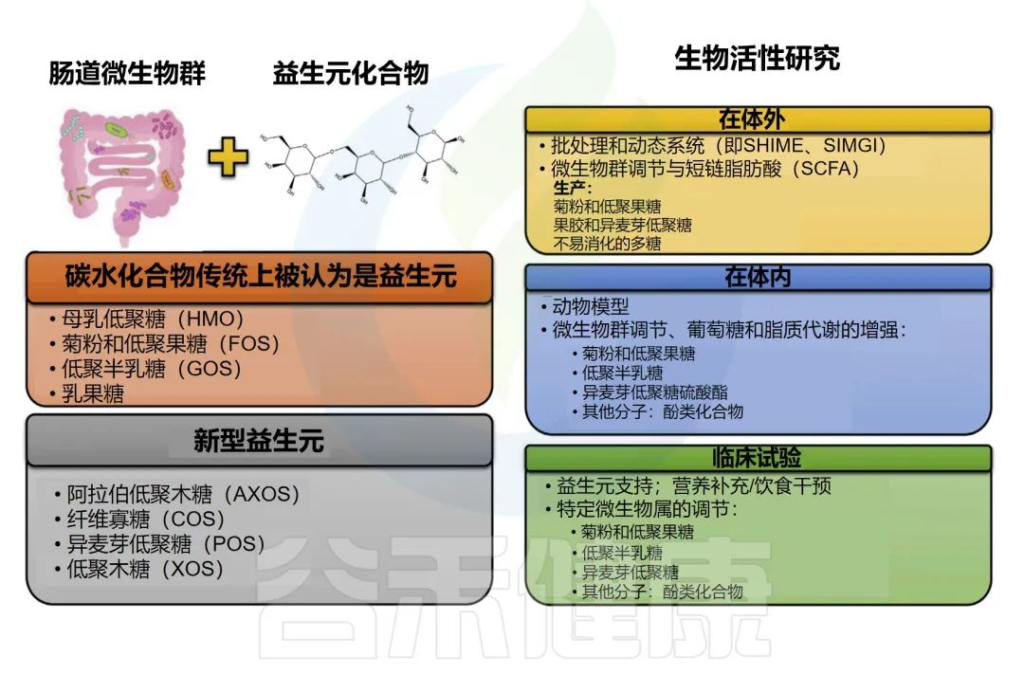
Nma B,et al.Elsevier Inc.2022
•人乳寡糖
人乳寡糖包括由5个单体(葡萄糖、半乳糖、n-乙酰葡萄糖胺、焦糖和唾液酸)通过多达12个不同的a-和b-糖苷键结合形成的广泛的低聚糖结构。
人乳寡糖对新生儿肠道菌群发育有很大影响,促进双歧杆菌(Bifidobacteriaceae)和拟杆菌(Bacteroidaceae)生长。
•低聚果糖
另一方面,低聚果糖是通过蔗糖的果糖转基化或菊粉的部分水解获得的,是唯一主要由果糖单位组成的碳水化合物。
•低聚半乳糖
相比之下,低聚半乳糖包括含有b键的b-GOS和来自乳糖延伸的b-GOS,以及存在于各种蔬菜来源中的a-GOS,如棉子糖和水苏糖。
•其他益生元
其他潜在的益生元低聚糖包括异麦芽糖-低聚糖(IMOS),由糖化植物淀粉中获得的由a键连接的葡萄糖单位形成的分支结构;
低聚木糖(XOS)和阿拉伯低聚糖(AXOS),由木聚糖和阿拉伯低聚木聚糖水解产生的含有阿拉伯糖酰和葡萄糖醛基分支的低聚木糖物组成;
纤维寡糖(COS),由木质纤维素生物质酶解获得,由b键连接的葡萄糖单位形成;
果胶寡糖(POS),由果胶部分水解产生,由半乳糖醛酸线性链形成,可能显示含有鼠李糖、阿拉伯糖、木糖和半乳糖等中性糖的分支结构域。
许多研究通过动物模型来评估体内益生元化合物的潜在生物活性。
✦增强代谢和生物利用度
通过16S rRNA基因测序和鸟枪法测序,大鼠给予低聚果糖和低聚半乳糖可导致普雷沃氏菌(Prevotella)水平升高,并由于普雷沃氏菌的代谢功能而增强了人参总苷的生物转化和生物利用度。
深度宏基因组测序实验已经报道了低聚果糖在高脂饮食喂养小鼠中促进了以下菌群的生长:
Allobaculum ↑↑↑
Oribacterium ↑↑↑
普雷沃氏菌(Prevotella) ↑↑↑
并降低了以下菌群:
嗜胆菌属(Bilophila) ↓↓↓
Butyrivibrio LE30 ↓↓↓
鸟枪测序分析还显示,菊粉处理的高脂饲料饲养的小鼠后代的葡萄糖和脂质代谢途径增强。
以下菌群水平增加:
B. breve ↑↑↑
B. acidifaciens ↑↑↑
Clostridium sp. CAG 343 ↑↑↑
Eubacterium sp. CAG 786 ↑↑↑
下列菌群水平下降:
B. massiliensis ↓↓↓
Oscillibacter sp. 1-3 ↓↓↓
Ruminococcus gnavus CAG 126 ↓↓↓
✦降低致病菌丰度
在肉鸡等其他动物模型中测试了低聚果糖补充剂作为抗生素的替代品,导致致病性脱硫弧菌属(Desulfovibrio)和幽门螺杆菌(Helicobacter)的丰度降低。
研究集中在其他寡糖家族,如异麦芽低聚糖,揭示了绿茶与异麦芽低聚糖联合使用,通过预防小鼠肠道生态失调来对抗高脂肪饮食诱导的代谢改变,显示了有益细菌(如Akkermansia muciniphilia,双歧杆菌,乳酸菌和罗氏菌属)丰度的增加。
✦非碳水化合物类益生元可以改善肥胖和肠道炎症
非碳水化合物的调节作用也在体内进行了研究,并通过元分类学评估了微生物种群的变化。已有研究证明,富含多酚的蔓越莓提取物可预防饮食诱导的肥胖、胰岛素抵抗和肠道炎症,并增加小鼠肠道微生物群中嗜黏蛋白阿克曼菌(Akkermansia muciniphila)丰度。
同样,槲皮素对高脂饮食诱导的非酒精性脂肪肝疾病的保护作用,以及类黄酮通过调节厚壁菌门/拟杆菌门比率来改善肥胖诱导的小鼠肠道生态失调的潜力已被描述。
临床试验
已经进行了几项临床试验,以测试不同益生元化合物的潜在作用。
✦增加新生儿双歧杆菌丰度
经荧光原位杂交测定,含有低聚半乳糖和低聚果糖混合物(比例为9:1)的配方可促进婴儿体内双歧杆菌的生长,而补充相同比例的短链低聚半乳糖和长链低聚果糖可导致丙型肝炎病毒感染母亲的新生儿粪便双歧杆菌和乳酸菌数量增加。
此外,肠内补充80%短链低聚半乳糖和长链低聚果糖(比例9:1)和20%酸性果胶寡糖的益生元混合物可导致早产儿双歧杆菌和出生后肠道定植增加。
✦抑制了艾滋病患者中一些有害菌的生长
在人类免疫缺陷病毒1型(HIV-1)感染的成人中,类似的益生元混合物促进了双歧杆菌的生长,并抑制了以下细菌的生长:
Clostridium coccoides ↓↓↓
直肠真杆菌(Eubacterium rectale) ↓↓↓
Clostridium lituseburense ↓↓↓
Clostridium histolyticum ↓↓↓
✦改善肥胖人群肠道菌群构成
同样,服用低聚半乳糖导致50岁以上男性和女性双歧杆菌丰度增加,并增加双歧杆菌数量,减少超重成人粪便样本中拟杆菌和Clostridium histolyticum的数量。
临床试验还报告了低聚果糖和果聚糖的益生元效应,结果表明菊粉型果聚糖导致双歧杆菌和普拉梭菌(F. prausnitzii)的增加;根据16S rRNA基因测序数据,这两种细菌都与血清脂多糖水平呈负相关,并且还降低了肥胖女性的肠道拟杆菌、Bacteroides vulgatus和丙酸杆菌(Propionibacterium)。
✦增加健康成年人体内双歧杆菌含量
此外,根据对健康成年人粪便微生物群的分析,菊粉给药增加了铁含量低的女性的粪便双歧杆菌,大豆寡糖、棉子糖和水苏糖可以被双歧杆菌选择性代谢。
✦其他益生元的作用
研究还评估其他益生元化合物的潜在效应。
食用聚葡萄糖可增加健康男性体内戴阿利斯特杆菌属 (Dialister)、普拉梭菌(Faecalibacterium)和考拉杆菌属(Phascolarctobacterium)的丰度。
这几类细菌的作用在谷禾之前的文章中有具体讲述
根据两项研究中获得的16S rRNA基因测序数据,B. animalis subsp. lactis 420促进了阿克曼菌、Christensenellaceae和Methanobrevibacter的生长,并降低了健康超重或肥胖个体中Paraprevotella的生长。
在健康个体中,部分水解瓜尔胶的饮食干预促进了拟杆菌、普拉梭菌、Fusicatenibacter和瘤胃球菌的生长,并减少了经黏液真杆菌属、毛螺菌科和罗氏菌属的生长。
值得注意的是,这些影响在男性参与者中更为明显。
同样,根据16S rRNA基因测序数据,女性不孕症患者口服部分水解瓜尔胶可导致双歧杆菌丰度增加,拟杆菌丰度降低,改善肠道生态失调和妊娠成功。
每日饮用红酒多酚可增加健康男性中的菌群数量,包括以下菌属:
拟杆菌属(Bacteroides) ↑↑↑
双歧杆菌属(Bifidobacterium) ↑↑↑
肠球菌属(Enterococcus) ↑↑↑
普雷沃氏菌属(Prevotella) ↑↑↑
Blautia coccoides ↑↑↑
Eggerthella lenta ↑↑↑
直肠真杆菌(E.rectale) ↑↑↑
益生菌定义中的关键词是“活的”,这意味着微生物必须是活的(在施用时)才能发挥有益的作用。
但是,在过去的几年里,越来越多的证据表明,不可活的细菌,它们的成分或它们分泌的代谢物,也可能在对健康的积极影响中发挥关键作用。
“后生元”一词于2011年首次提出,指的是摄入后对健康有益的灭活、不可存活的微生物细胞。
这一概念是基于观察到非活细菌或其提取物(破碎的细菌)具有调节宿主免疫反应的能力。
✦后生元相较益生菌的优势
将后生元与益生菌进行比较发现,后生元生产的复杂性较低,具有更好的长期稳定性。
对于某些高炎症状态的患者,使用后生元可能是更安全的替代方案,避免了使用活微生物时反应加剧。
在对术语进行分类的尝试中,提出了“true probiotics”(活的和活跃的细胞)、“pseudo-probiotic”(活的和不活跃的细胞,无论是营养细胞还是孢子细胞)和“ghost probiotics”(非活的或死亡的细胞,完整的或破裂的。
此外,活微生物对食物基质成分的活性也可能释放对健康有积极影响的副产物。例如,牛奶蛋白中加密的生物活性肽。
✦后生元的组成
后生元的组成可以是可变的。除了灭活的(无生命的)微生物生物量,细胞壁的成分(肽聚糖、蛋白质、糖蛋白、磷壁酸)、细胞质膜(磷脂、蛋白质)或细胞外成分,如胞外聚合物(EPS)。此外,分泌到培养基上清液或特定发酵食品的代谢物也可能存在。
后生元的成分示例及显微镜下图像
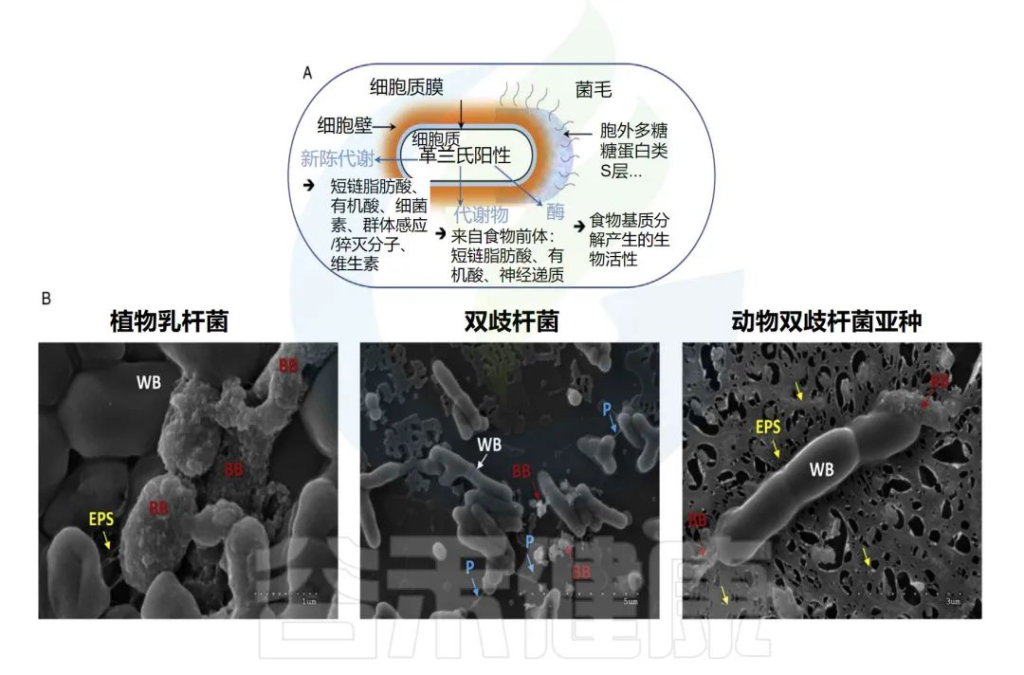
Nma B,et al.Elsevier Inc.2022
✦后生元的作用
后生元作用机制与益生菌的类似,即调节有益菌群的能力、对病原体的拮抗作用、增强肠上皮屏障功能的能力以及调节免疫反应或宿主的其他生理功能。
•刺激免疫反应
双歧杆菌产生的EPS,作为报道的对产生细菌有益作用的关键成分之一。无论是被聚合物包围的紫外线灭活双歧杆菌还是纯化的EPS本身,都能够以不同的方式刺激免疫反应,这取决于聚合物的物理化学特性。这些细菌EPS能够与肠上皮细胞的TLR4相互作用。
•促进脂质代谢和葡萄糖稳定
此外,双歧杆菌EPS是能够积极调节菌群组成的碳水化合物,因为它们被用作肠道某些细菌的选择性发酵底物。特异性EPS还促进饮食诱导的肥胖小鼠模型的脂质代谢和葡萄糖稳态的变化。
含有能够释放抗菌化合物的活益生菌,也可以被视为后生物制剂,可能有助于提高发酵产品的安全性。
将后生元应用于食品,虽然是改善我们健康的一种新方法,但仍然具有挑战性。
精神生物制剂
关于肠道菌群在维持我们生理系统(被称为微生物-肠道轴)方面的知识越来越多,这促使了与调节这种双向对话的饮食策略相关的新概念的发展。这些轴之一是研究的热点,即微生物-肠道-大脑轴。
这是基于对肠道微生物群活动可能参与神经疾病和随着年龄增长而维持认知功能。
▸ 精神生物制剂
针对这目标,提出了与益生菌相关的新定义:精神生物制剂是一种“活的有机体,当摄入足量时,会对患有精神疾病的患者产生健康益处”。
最近,这一定义扩大到包括能够调节肠-脑轴影响肠道微生物群的底物;因此,精神生物制剂是“有益的细菌(益生菌)或对影响细菌-大脑关系的细菌(益生元)的支持”。
研究强调,某些微生物代谢物可以作为某些代谢紊乱的调节因子。同样,在肠道-大脑相互作用的机制中,微生物代谢物也是关键角色。
✦改变行为
已经证明一些微生物来源的精神生物制剂能够有效地改变行为。在一种优雅的实验中,产生酪胺的Providencia能够以一种对共生和宿主都有益的方式操纵秀丽隐杆线虫(Caenorhabditis elegans)的“感官”决定;在食物选择测定中,被Providencia定植的线虫选择了含有这种细菌的食物。
然而,肠道微生物群代谢组的操纵非常复杂,因为肠道微生物的大量多样性之间存在着一种微生物代谢物生产者和消费者之间持续反馈的串扰。
例如,γ-氨基丁酸GABA——(中枢神经系统的主要抑制递质)可以由肠道微生物从饮食前体(如谷氨酸)合成,但它被用作支持该生态位中其他生物生长的营养素。
✦减轻疼痛
神经调节的精神生物学已经被提出,通过体外实验和在大鼠模型上的进一步验证,表明嗜酸乳杆菌菌株(Lactobacillusacidophilus NCFM)能够在肠道水平诱导鸦片样物质和大麻素受体的合成,从而作为一种镇痛药减轻疼痛。
✦调节焦虑
对无菌小鼠口服乳酸菌(Lactiplantibacillus plantarum PS128) 可增加小鼠大脑特定区域的多巴胺和血清素水平,并调节动物的焦虑样行为。
关于能够产生γ-氨基丁酸(中枢神经系统的主要抑制递质)的益生菌,已经在一些乳酸菌和双歧杆菌中描述了不同的代谢途径,其中Levilactobacillus是迄今为止量化产量最高的物种。
不同的策略,如优化培养基组成,可用于提高其他物种的γ-氨基丁酸产量。此外,其中一些乳酸菌也被用于发酵乳制品,以改善这种神经递质在食物中的合成。
//建议
通过γ-氨基丁酸前体的生物转化将食物与γ-氨基丁酸进行天然生物强化,以及使用食物或补充剂作为在肠道中输送能够合成γ-氨基丁酸的益生菌的载体,可能是调节大脑活动的一种策略。
上述的一些证据已经证明,发酵食品、健康的饮食模式、益生菌、益生元以及后生元等都是促进肠道健康的重要因素。通过食用这些食物和补充这些营养素,可以增加肠道内有益菌的数量和种类,并在一定程度上抑制病原相关菌群的丰度,维持肠道菌群的平衡,从而促进肠道健康。
饮食在塑造肠道微生物群的组成和活性方面起着重要作用,对营养饮食与健康肠道微生物组之间相互作用的深刻理解,将为我们理解其在疾病预防和治疗中的作用奠定基础。
任何饮食的好处都将在很大程度上取决于此人的微生物组,每个人根据自己独特的肠道微生物群摄入不同的饮食的方式,将会使我们迎来新时代的饮食模式。
除了肠道健康之外,针对多个健康维度例如提升免疫力,改善情绪,体重管理,皮肤管理等领域产品和食品的需求都在日益提升,这些与肠道微生物组之间又都存在密不可分的关联。因此基于肠道微生物组重要性的开创性研究,可能会从根本上改变消费者偏好及健康食品行业的走向。
主要参考文献
Nma B , Csa C , Ica C , et al. Mechanisms of Gut Microbiota Modulation by Food, Probiotics, Prebiotics and More – ScienceDirect.
Agus, A., Clément, K., Sokol, H., 2021. Gut microbiota-derived metabolites as central regulators in metabolic disorders.
Ali, A., Kamal, M., Rahman, H., Siddiqui, N., Haque, A., Saha, K.K., Rahman, A., 2021. Functional dairy products as a source of bioactive peptides and probiotics: current trends and future prospectives. J. Food Sci. Technol.
Barros, C.P., et al., 2020. Paraprobiotics and postbiotics: concepts and potential applications in dairy products. Curr. Opin. Food Sci. 32, 1–8.
Bellini, M., Tonarelli, S., Nagy, A.G., Pancetti, A., Costa, F., Ricchiuti, A., de Bortoli, N., Mosca, M., Marchi, S., Rossi, A., 2020. Low FODMAP diet: evidence, doubts, and hopes.Nutrients 12 (1), 148.
Cunningham, M., Acarate-Peril, M.A., Barnard, A., et al., 2021. Shaping the future of probiotics and prebiotics. Trends Microbiol.
Fiore, W., Arioli, S., Guglielmetti, S., 2020. The neglected microbial components of commercial probiotic formulations. Microorganisms 8, 1177.