-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

抗生素的诞生彻底改写了人类对抗微生物感染的历史,从远古先民偶然利用霉变物质疗伤,到现代医学精准调控分子机制,抗生素通过抑制细菌细胞壁合成、干扰蛋白质生成等机制,成为治疗感染的核心武器。
它们按来源可分为天然(如青霉素)、半合成(如阿莫西林)和全合成(如喹诺酮类);按作用谱分为广谱(覆盖革兰氏阳性与阴性菌)和窄谱(针对特定菌种)。
然而,抗生素的过度使用(如农业促生长、医疗误用)导致耐药性急速发展。细菌通过β-内酰胺酶分解青霉素、修饰核糖体靶点逃避大环内酯类药物、外排泵排出喹诺酮类等策略,使药物失效。
耐药基因通过质粒、噬菌体在环境中扩散,甚至存在于未接触抗生素的偏远人群肠道中。通过评估个体肠道菌群中耐药基因的分布特点(如喹诺酮耐药基因的丰度),临床可优先选择对特定菌株敏感的抗生素,减少盲目使用广谱药物带来的生态风险。
本文谷禾通过查阅文献以及指南等,带大家一起深入理解抗生素的分类体系和作用机制,以及如何根据来源、作用谱和效果来认识不同的抗生素,及其针对不同微生物的使用策略探讨,在理解和允许的情况下结合感染或致病菌合理选择抗生素,并知晓其可能的副作用和耐药防控。
“抗生素”一词源自希腊语“anti”(反对)和“bios”(生命),指通过特异性作用于细菌靶点来抑制或杀灭微生物的有机分子。
天然抗生素最初由微生物(如真菌、细菌)产生,例如青霉素由青霉菌合成,链霉素来自链霉菌。现代抗生素的定义已扩展至包括全合成或半合成化合物,如磺胺类、喹诺酮类等。
抗生素的发现是医学史上的里程碑。

图源:tansuo
抗生素的现代角色抗生素在治疗细菌感染(如肺炎、尿路感染、皮肤感染)、预防术后感染及控制流行病中不可或缺。例如,β-内酰胺类抗生素(如青霉素)至今仍是许多感染的一线药物。
回顾抗生素的发展历程,这些微观世界的”分子武器”究竟是如何发挥作用的?它们为何能在细菌的生命过程中制造如此精准的”障碍”?
按来源分类
■ 天然抗生素
抗生素的天然来源涉及从生物成分中生产抗生素,其中包括微生物作为主要来源。
天然来源可能包括从细菌、真菌或放线菌中提取抗生素。
■ 半合成抗生素
这包括使用微生物生产从发酵中获得的物质,然后通过添加官能团进行化学修饰,从而产生变异。
例如:青霉素-氨苄西林、阿莫西林、甲氧西林。
■ 合成抗生素
属于这一类的抗生素是通过化学合成获得的。
示例:磺胺类药物、喹诺酮类药物。
按活性谱分类
■ 广谱抗生素
这些对革兰氏阳性菌和革兰氏阴性菌均具有活性。
例子包括:四环素类、氟喹诺酮类、“第三代”和“第四代”头孢菌素类。
■ 窄谱抗生素
它们的活性有限,主要仅对特定种类的微生物(革兰氏阳性或革兰氏阴性)有用。
例如,糖肽和杆菌肽仅对革兰氏阳性菌有效,而多粘菌素通常仅对革兰氏阴性菌有效。
氨基糖苷类和磺胺类药物仅对需氧微生物有效,而硝基咪唑通常仅对厌氧菌有效。
按抗菌活性分类
■ 抑菌剂
指那些阻止或抑制细菌生长的抗生素,也就是说细菌不会繁殖或产生,但它们不会杀死细菌。
例如:四环素、氯霉素
■ 杀菌剂
指根据所使用的抗生素,通过任何机制杀死细菌的抗生素。
示例:氨基糖苷类
基于行为模式的分类
细胞壁抑制剂:β-内酰胺、杆菌肽
细胞膜抑制剂:聚霉素、唑类抗真菌药物
蛋白质合成抑制剂
核酸合成抑制剂:喹诺酮类、利福平、呋喃妥因
叶酸合成抑制剂:甲氧苄啶、磺胺类

Uddin TM, et al., J Infect Public Health. 2021
按化学成分分类
■ β-内酰胺类抗生素
在引入后的20年里,青霉素是唯一一类β-内酰胺类抗生素。20世纪60年代中期,青霉素类抗生素与头孢菌素类抗生素并列,20世纪末,碳青霉烯类抗生素和单杆菌类抗生素并列。
这些抗生素具有相同的抗菌作用机制,并且都具有β-内酰胺环作为其结构的组成部分,但它们在其他特征上存在很大差异。
这些抗生素的作用机制是抑制细胞壁。
如:青霉素、头孢菌素、碳青霉烯类、单巴坦
■ 四环素类抗生素
这些是一类具有四个环核的抗生素,都是从土壤放线菌中获得的。
四环素最早是在20世纪40年代和50年代开发的,有几种至今仍在使用,如四环素本身、土霉素和金霉素。
多西环素和米诺环素是分别于1966年和1972年发现的更有效的半合成类似物,此后直到2005年引入替加环素(一种甘氨酰甘氨酸衍生物)才有了重大进展,替加环蛋白通常比其他四环素更有效,并对一些对该组早期成员产生耐药性的生物体保持活性。
四环素在实验室浓度下可能具有杀菌性,但体内安全浓度下仅为抑菌剂。它们通过结合敏感生物的30S核糖体来抑制蛋白质合成。
■ 氨基糖苷类
这些是一组天然和半合成的抗生素,具有与两个或多个氨基糖残基糖苷连接的多元氨基。
氨基糖苷类抗生素具有杀菌作用,在碱性条件下活性更强。它们通过干扰细菌蛋白质合成发挥作用,主要针对需氧革兰阴性杆菌,但抗菌谱各异。
氨基糖苷类的所有成员都具有杀菌作用,在碱性pH值下更具活性。
它们通过干扰细菌蛋白质合成来发挥作用。
它们主要对需氧革兰阴性杆菌有活性,但光谱不同。
如:链霉素、新霉素、卡那霉素、阿米卡星、庆大霉素

■ 多肽
低分子量阳离子多肽抗生素,均为强效杀菌剂,但因毒性较高,极少全身使用。
■ 糖肽
目前仅有的两种重要糖肽抗生素是万古霉素和替考拉宁。
它具有复杂的三环糖肽结构,其大分子量意味着它不能穿透大多数革兰氏阴性菌的外膜,因此它的使用实际上仅限于治疗需氧或厌氧革兰氏阳性菌的感染。
万古霉素在接近其最低抑菌浓度(MIC)的浓度下对大多数易感细菌具有杀菌作用,并且是细菌细胞壁肽聚糖合成的抑制剂,其位置与β-内酰胺类抗生素不同。
■ 大环内酯类
如: 红霉素、克拉霉素、阿奇霉素
大环内酯类抗生素是由12-16碳内酯环组成的大分子,通过糖苷键与氨基糖连接。
红霉素于1952年首次发现,至今仍是重要抗生素。它常用于治疗呼吸道、皮肤及软组织感染。大环内酯类药物通过抑制细菌蛋白质合成发挥抗菌作用,通常为抑菌剂,但在高浓度下可能具有杀菌活性。红霉素的抗菌活性具有pH依赖性,随pH值升高而增强,最佳pH值约为8.5,该特性在其他大环内酯类药物中也不同程度地存在。
■ 利福霉素
利福平口服吸收良好,蛋白结合率高(80-90%),能穿透细胞壁作用于细胞内病原体(如结核杆菌)。利福昔明因肠道吸收率低,主要用于局部感染。
如:利福平、利福巴林
■ 链霉素
普利司他霉素、维吉尼亚霉素
奎奴普汀/达福普汀是以30:70比例混合的两种链阳霉素类抗生素。它们源自链霉菌,经化学修饰后,通过抑制蛋白质合成发挥作用。
■ 抗真菌药物
灰黄霉素、多烯类
■ 合成药物
喹诺酮类、咪唑类、硝基呋喃衍生物
■ 氯霉素
氯霉素最初于1947年从委内瑞拉链霉菌中分离得到,后经化学合成。它是一种黄白色结晶固体,可溶于水。其抗菌活性可能源于其硝基苯结构。氯霉素的作用机制是抑制蛋白质合成。
■ 夫西地酸
夫西地酸是一种类似类固醇的杀菌抗生素,主要用于对抗葡萄球菌。
它对青霉素耐药的金黄色葡萄球菌菌株有活性,包括MRSA,可以与红霉素或克林霉素联合使用,用于严重的葡萄球菌感染。
■ 克林霉素
克林霉素是另一种对革兰氏阳性球菌具有显著抑菌活性的抗生素,尽管对革兰氏阴性球菌的活性较低,对肠杆菌的活性完全没有。
克林霉素在结构上与大环内酯类无关,但具有相似的作用机制,因此它们之间可能会发生交叉耐药性。
■ 林可霉素
它是克林霉素的前身,具有类似的抗菌和毒性特性,但效力较弱。
以上,我们已基本了解了抗生素的分类体系及其作用机制,这些分子武器本应是人类对抗微生物感染的坚固屏障。然而,当这些强大的武器被不当使用时,细菌迅速发展出层出不穷的耐药策略,将医学奇迹逐渐转变为临床危机。
全球健康的紧迫威胁
许多与人类疾病流行相关的细菌病原体在抗生素使用后已演变成多重耐药(MDR)形式。例如,多重耐药结核分枝杆菌(MDR M. tuberculosis)是发展中国家和工业化国家都发现的主要病原体,成为20世纪版本的古老病原体。
其他严重感染包括医院相关感染,如:
“超级细菌”指那些因多重突变而具有增强致病性和死亡率的微生物。

超级细菌的崛起:抗生素滥用的致命代价
近十年来,结核病的治疗遭遇了重大危机,广泛耐药结核菌(XDR-TB)和完全耐药结核菌(TDR-TB) 接连出现,这些“超级结核菌”对至少四种一线抗生素完全失效,且在全球快速传播。更令人担忧的是,像大肠杆菌、肺炎克雷伯菌等常见致病菌,也因抗生素滥用纷纷进化出耐药性。其中,青霉素类抗生素(如阿莫西林)和头孢类抗生素的过度使用,直接促使细菌发展出“β-内酰胺酶”这种分解抗生素的酶,让药物彻底失效。
医院里的危险分子也在增加:
某些超级细菌的爆发竟是抗生素滥用的直接后果。例如,艰难梭菌引发的严重腹泻,高毒力产毒素菌株已被确认,作为一种革兰氏阳性孢子形成菌,很容易通过医院人员、设备和气溶胶传播。它的重新突出被认为是医院广泛使用抗生素的结果,如广谱头孢菌素,新的青霉素和氟喹诺酮类药物,导致革兰氏阴性肠道菌群的显著消耗,从而提高了艰难梭菌。
在感染数量和后果方面,霍乱弧菌仍是头号杀手。亚洲和南美洲的疫情仍因缺乏有效监测系统难以控制。这些案例无不警示:抗生素的每一次误用,都在加速催生更危险的敌人。
耐药机制:细菌的“生存绝招”
细菌对抗生素的耐药性,本质上是它们演化出的保命技能。科学家发现,这些技能涉及基因突变、酶分解药物、改变自身结构等多种手段,甚至能通过“共享基因”在细菌间传播耐药能力。
以下是几种典型的耐药策略:
1
分解抗生素的“盾牌”——β-内酰胺酶
β-内酰胺酶是一种酶,能像剪刀一样切断青霉素、头孢类抗生素的结构(β-内酰胺环),让药物失效。β-内酰胺酶基因可能是分布最广泛的耐药基因。
这种酶的基因广泛存在于细菌的质粒(可移动的基因片段)上,甚至能在不同细菌间“快递传播”。
例如,新的超广谱β-内酰胺酶(CTX-M酶)最初在土壤中的Kluyvera菌里被发现,并于20世纪90年代出现在临床上,后来传播到致病的大肠杆菌中,导致头孢类抗生素失效。
2
改变“药物靶点”——大环内酯类耐药
红霉素等药物,广泛用于革兰氏阳性感染治疗。
通过结合细菌的核糖体(蛋白质工厂)来杀菌。而耐药菌通过修改核糖体的RNA或蛋白质结构,让药物无法锁定目标。
结果:即使更换新型大环内酯类药物,细菌仍能通过类似机制抵抗,形成“交叉耐药”。
3
升级“防御系统”——喹诺酮类耐药
当这类高效抗生素在1987年首次推出时,一些专家过于乐观地认为:”这种新型抗生素几乎不可能产生耐药性,因为细菌需要同时发生至少两种基因突变才能对它产生明显的抵抗力。”
然而,现实很快就打破了这些预测:
科学家感叹,永远别低估细菌的适应能力。
4
天生的“耐药基因”——内在耐药性
内在耐药性指细菌基因组中存在可能产生耐药表型的基因,即原始或准耐药性。不同属、种、菌株等表现出不同范围的抗生素反应表型。例如,某些肠道菌天生对磺胺类药物不敏感。
潜在威胁:这些基因平时潜伏,一旦被其他致病菌获取,可能引发新的耐药危机。
科学家们开发了一种方法来预测潜在的耐药基因。通过系统性地敲除细菌基因组中的每一个基因,观察哪些基因缺失会使细菌对抗生素变得更敏感。
逻辑很简单:如果缺少某个基因会使细菌更容易被抗生素杀死,那么这个基因过度表达可能会使细菌更具抗药性。
这种前瞻性研究已在多种细菌中进行:
5
环境中的“耐药基因库”
长期以来,人们知道可以通过在实验室中将环境细菌培养在含抗生素的培养基上来分离耐抗生素的细菌菌株。
产抗生素细菌的自我保护机制
对于那些能够产生抗生素的细菌(如放线菌),它们拥有耐药性并不令人惊讶。这是一种自我保护机制,细菌必须有能力抵抗自己生产的”武器”。在许多情况下,科学家们已经确定这种耐药机制是通过特定的酶来修饰抗生素,使其失去活性。
链霉菌:β-内酰胺酶的重要来源
链霉菌(Streptomycetes)能产生多种β-内酰胺酶(一种能破坏青霉素类抗生素的酶)。这很可能是如今临床上出现的一些β-内酰胺类抗生素耐药性的源头。同样,环境中的Kluyvera菌已被证实是CTX-M基因(一种重要的耐药基因)的起源。
多重耐药机制的进化蓝图
在产抗生素的细菌中,多重耐药机制十分常见,如四环素生产者Streptomyces rimosus就具有这种特性。根据生化和遗传相似性分析,这些天然存在的耐药机制预示了后来在致病细菌中发现的耐药机制。换句话说,致病菌的耐药策略很可能是从环境细菌那里”借鉴“而来的。
启示:耐药性为何难以控制?
对其他产抗生素细菌的进一步研究,如芽孢杆菌科、假单胞菌、蓝藻和多种放线菌科(这是一个已知能产生许多生物活性小分子的细菌群体),将有助于我们更全面地了解自然界中存在的耐药基因的本质和多样性。这些知识对于预测和应对未来可能出现的临床耐药问题至关重要。
当我们越来越理解这场微生物与药物之间的分子博弈,便不得不直面一个问题:如何在保持抗生素治疗效力的同时,为抗生素的未来开辟一条可持续发展的道路?下一章节我们来继续了解。
常见感染与抗生素选择
1. 尿路感染 (UTI)
无并发症尿路感染
– 首选药物:甲氧苄啶/磺胺甲噁唑(Bactrim Ds)、呋喃妥因(硝基呋喃类)
– 替代方案:头孢氨卡(Keflex,第一代头孢菌素)、阿莫西林/克拉维酸(Augmentin)
复杂性或上尿路感染(如肾盂肾炎)
– 首选药物:氟喹诺酮类(如环丙沙星Cipro、左氧氟沙星Levaquin)
– 替代方案:第三代头孢菌素(如头孢曲松)、氨基糖苷类(庆大霉素)
用药注意事项
– 磺胺类药物可能引起结晶尿,需充分水化
– 氟喹诺酮类因肌腱损伤和神经毒性风险,禁用于儿童及孕妇
– 氨基糖苷类雲监测肾功能及耳毒性
2. 肺 炎
社区获得性肺炎(CAP)
– 非重症患者:阿奇霉素(Zithromax,大环内酯类)或多西环素(Vibramycin,四环素类)
– 合并基础疾病或耐药风险:阿莫西林/克拉维酸(Augmentin)联合大环内酯类
医院获得性肺炎(HAP)
– 首选药物:第三代头孢菌素(如头孢他啶)或碳青烯类(如美罗培南)联合氟喹诺酮类
用药注意事项
– 大环内酯类(如阿奇霉素)可能延长QT间期,禁用于心律失常患者
– 碳青霉烯类需螫惕超广谱β-内酰胺酶(ESBL)耐药菌感染
3. 皮肤及软组织感染
轻度感染(如蜂窝织炎)
– 首选药物:头孢氨苄(Keflex)或双氯西林(耐酶青霉素)
疑似耐甲氧西林金黄色葡萄球菌(MRSA)感染
– 首选药物:复方磺胺甲噁唑(Bactrim DS)、克林霉素(Cleocin)
– 替代方案:万古霉素(糖肽类)或达托霉素(环脂肽类)
用药注意事项
– 需警惕艰难梭菌感染克林霉素可能引起伪膜性肠炎
– 万古霉素需根据肾功能调整剂量,监测血药浓度
4. 链球菌性咽炎 (Strep Throat)
首选药物
– 青霉素V钾(Penicillin VK)或阿莫西林(Amoxil)
青霉素过敏患者
– 阿奇霉素(Zithromax)或克拉霉素(Biaxin)
用药禁忌
– 四环素类(如多西环素)对链球菌活性低,不推荐作为一线治疗
– 氟喹诺酮类对链球菌无效
禁忌症与用药原则
病毒性感染的绝对禁忌
流感、普通感冒、急性病毒性鼻窦炎等无需抗生素治疗
滥用抗生素将增加耐药风险:60%的急性支气管炎为病毒性,仅需对症处理
特殊人群剂量调整
肝肾功能不全者:氨基糖苷类需减少剂量;磺胺类慎用于肾功能减退患者
孕妇与哺乳期妇女:禁用四环素类(影响胎儿骨骼发育)、氟喹诺酮类(致畸风险)
药物相互作用风险
大环内酯类(如红霉素)抑制CYP3A4酶,可能升高华法林、他汀类药物浓度
复方磺胺甲噁唑(Bactrim)增强磺脲类降糖药作用,需监测血糖
不合理用药的后果
耐药性加速:如氟喹诺酮类滥用导致铜绿假单胞菌外排泵基因突变频发
生态失衡:广谱抗生素(如第三代头孢菌素)破坏肠道菌群,增加艰难梭菌感染风险
经济负担:非必要使用增加医疗成本
抗生素的选择需基于病原体敏感性、感染严重程度及患者个体化因素。
临床实践中应严格区分细菌性与病毒性感染,优先使用窄谱抗生素。通过规范用药,可最大限度延缓耐药性蔓延。
通过肠道菌群检测识别抗生素耐药基因
宏基因组测序可获得细菌群体的全部基因组信息,通过序列比对和功能注释,可鉴定出各种已知和新型耐药基因,全面评估耐药基因的种类和数量。
例如,在人体肠道宏基因组中发现了大量β-内酰胺酶等耐药基因。
2021年一项研究显示,印度某社区爆发的碳青霉烯耐药肺炎克雷伯菌感染,其耐药基因与当地养殖场废水中分离的菌株高度同源,证实耐药基因通过水源传播至人体。
数据驱动的防控策略:从预警到干预
基于宏基因组分析的耐药风险评估,可制定精准防控措施:
对畜牧从业人员、医护人员等暴露于耐药基因环境的人群定期检测肠道菌群,早期发现耐药定植。
临床用药指导:建立区域耐药基因数据库,实时更新病原体耐药谱,帮助医生相对个性化地选择的窄谱抗生素(如用头孢他啶替代广谱碳青霉烯类药物)。
谷禾宏基因组肠道菌群检测报告中,就有抗生素耐药基因检测相关内容。
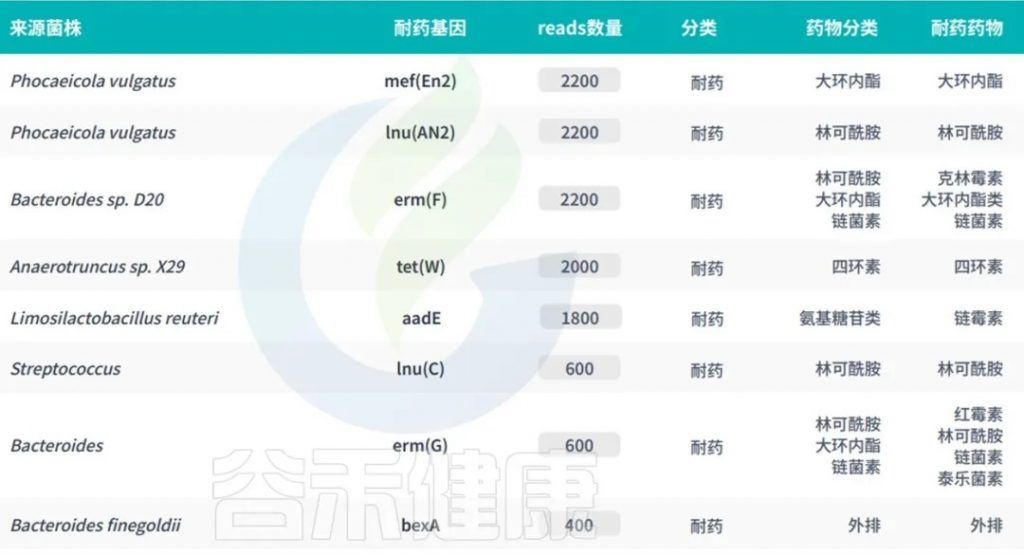
<来源:谷禾宏基因组肠道菌群健康检测数据库>
筛查应用:如对术前患者进行肠道耐药基因检测,若检出 vanA(万古霉素耐药基因),可优先选择替考拉宁或达托霉素替代万古霉素,降低术后感染风险。
用药方案优化:在复杂性尿路感染治疗中,若患者肠道中qnrS(氟喹诺酮耐药基因)丰度较高,应避免使用左氧氟沙星,转而选择磷霉素或呋喃妥因。
存在争议
支持证据
Cochrane综述表明,在抗生素后服用益生菌的儿童腹泻较少。
注:Cochrane综述是由国际非营利组织Cochrane协作网制作的系统性综述,被公认为循证医学领域的最高标准,旨在通过系统性方法评估医疗干预措施(如药物、手术、诊断测试)的有效性、安全性及适用性,为临床决策和政策制定提供可靠证据。
Cochrane对23项研究(3938名参与者)的综述调查了给予含有以下一种或多种的益生菌:
22/23项报告抗生素相关性腹泻发病率的试验结果显示,与活性、安慰剂或无治疗对照组相比,益生菌具有显著益处(益生菌组为8%,对照组为19%)。
报告副作用的16项试验(n=2455)均未记录任何可归因于益生菌的严重副作用,最常见的副作用是皮疹、恶心、胀气、肠胃气胀、腹胀、腹痛、呕吐、痰增、胸痛、便秘、味觉障碍和食欲低下。作者的结论是,益生菌对预防抗生素相关性腹泻具有保护作用。相对风险为0.46(95%CI 0.35至0.61),NNT为10。
作者认为,鼠李糖乳杆菌或布拉氏酵母菌的菌落形成单位为50亿~400亿个/天是最合适的选择。他们还评论,尽管在这些试验中,在其他健康儿童中没有观察到严重的不良事件,但在具有潜在风险因素(如中心静脉导管使用)的严重衰弱或免疫功能低下的儿童中观察到了严重的不良事件,并建议在进行进一步研究之前,应避免在有不良事件风险的儿科人群中使用益生菌。
反对观点
以色列魏茨曼科学研究所的科学家发现,当患者服用抗生素后,如果连续四周补充含11种菌株的复合益生菌,肠道菌群需要整整六个月才能恢复正常。尽管这些益生菌成功在肠道“安家落户”,但新引入的细菌和酵母菌株反而干扰了原有菌群的恢复。
对比发现:未服用益生菌的患者,停用抗生素后仅需三周,肠道菌群就自行恢复正常。
关键提示:
替代方案?
科学家正在探索其他恢复肠道的方法:
注:目前异体粪便移植目前是主流,但自体粪便移植可避免供受体不匹配的问题,部分研究仍处于早期阶段,需进一步验证长期安全性和有效性。
实用建议
如果你决定服用含有抗生素的益生菌,请在开始服用抗生素的同一天开始服用,但不要与抗生素完全同时服用。
选择高活性菌株,如鼠李糖乳杆菌GG、布拉氏酵母菌(每日5-400亿菌落单位)。
间隔服用时间,抗生素服用后2小时再服益生菌,避免活性被抑制。
抗生素的未来发展需在科学突破、临床实践与健康管理之间找到平衡点。面对耐药性危机,人类正通过多维度创新重塑感染治疗的格局。
1. 新型抗生素研发:从基因靶点到智能设计
宏基因组学驱动,通过分析环境样本(如深海沉积物、极端环境微生物)的宏基因组数据,挖掘新型抗生素合成基因簇。
合成生物学技术:利用CRISPR-Cas9基因编辑改造放线菌的代谢通路,定向生产改良抗生素。如改造链霉菌以高产泰斯巴汀(一种可靶向细胞壁脂质的广谱抗生素)。
噬菌体-抗生素联用,穿透生物膜杀灭耐药菌。例如,噬菌体搭载 β-内酰胺酶抑制剂,可恢复青霉素对产酶菌的活性。
缩短新药研发周期(从传统10-15年压缩至5-8年),降低开发成本,并为“无药可治”的超级细菌感染提供解决方案。
2. 精准医疗:从“一刀切”到个体化治疗
通过宏基因组测序分析患者肠道耐药基因谱(如 CTX-M、NDM-1),指导抗生素选择。例如,若检测到高丰度氟喹诺酮耐药基因(qnr),则优先选择磷霉素或呋喃妥因替代左氧氟沙星。
针对抗生素导致的菌群失衡,开发“益生菌-益生元-后生元”组合产品。例如,含 Akkermansia muciniphila 的微生态制剂可加速肠道屏障修复,减少艰难梭菌定植风险。
催生“感染精准医疗”细分市场,涵盖检测试剂、数据分析平台和微生态调节产品,预计2030年全球市场规模将突破520亿美元。
3. 耐药性防控:环境-医院-社区的联防联控
建立全球耐药基因数据库(如 ResistoMap),追踪耐药基因热点区域。例如,印度恒河流域因高浓度 blaNDM-1 基因被列为“耐药红色预警区”。
医院综合当地耐药数据、患者过敏史、肝肾功能、菌群检测报告等各类数据,个性化推荐窄谱抗生素。
设立“微生物学-药学-数据科学”交叉学科,开展耐药知识科普,提高公众对不当使用抗生素危害的认知,利用菌群检测手段辅助判别耐药情况,指导居民合理用药。
通过环境、医院、社区的协同联动,构建一个全方位的耐药性防控体系,减缓耐药菌的传播速度,保障公众健康。
抗生素的未来不仅是科学问题,更是社会命题。从基因编辑实验室到养殖场,从医院处方系统到家庭药箱,每个环节的革新都在重塑人类与微生物的关系。将技术创新、精准医疗和全球治理相结合,让抗生素这一“医学奇迹”持续守护生命,而非成为耐药危机的推手。
主要参考文献
Denyer S.P, Hodges N, Gorman S.P and Gilmore B.F. 2011. Hugo and Russell’s Pharmaceutical Microbiology. Eighth edition. A John Wiley & Sons, Ltd. Publication. Page no.169-193.
Antibiotics: Comprehensive Guide
Last updated: August 10, 2022 by Sagar Aryal
Davies J, Davies D. Origins and evolution of antibiotic resistance. Microbiol Mol Biol Rev. 2010 Sep;74(3):417-33.
Uddin TM, Chakraborty AJ, Khusro A, Zidan BRM, Mitra S, et al., Antibiotic resistance in microbes: History, mechanisms, therapeutic strategies and future prospects. J Infect Public Health. 2021 Dec;14(12):1750-1766.