-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康

恭喜 !2025年4月杭州谷禾信息技术有限公司检测实验室顺利通过中国合格评定国家认可委员(CNAS)认可评审,依据ISO/IEC 17025:2017《检测和校准实验室能力的通用要求》(CNAS-CL01《检测和校准实验室能力认可准则》)的要求,获得了由CNAS颁发的认可证书(注册号:CNAS L23010),正式成为了CNAS认可的检测实验室。
“CNAS”是“中国合格评定国家认可委员会”的英文缩写,是由国家认可监督管理委员会批准设立并确定的国家认可机构,统一负责对认可机构、实验室和检验机构等相关机构的认可工作。
在科技与健康深度融合的今天,精准科学公平的检测是后端精准干预的基础,其中实验室技术质量体系的建设则是确保检测结果可靠性的核心保障。
杭州谷禾检测实验室秉持“公正、科学、守信、高效”的准则,经过逐步的筹备和完善,全面优化和提升了实验室相关的人员、设备、环境、方法及管理流程等全方位实验室检测和管理体系,达到了CNAS认可的标准和要求。
质量之心,始于标准,成于责任。CNAS认可不仅是对谷禾检测技术能力与管理水平的肯定,更是一份责任,对客户、对行业、对社会的承诺。
CNAS认可:
不只是“通行证”,更是责任的镌刻
国际互认的硬核背书
CNAS作为权威的实验室能力认可体系,标志着实验室在技术能力、质量管理及国际互认性方面达到了国家及国际标准要求。

该认可不仅是对实验室技术能力的全面评价,更是对其实验室检测科学性、公平性和有效性的权威认可。通过认可的实验室所出具的检测报告,在全球100多个国家和地区得到认可,实现”一次认可,全球通行”。
肠道菌群检测行业的先行者
谷禾检测实验室成为国内领先通过CNAS认可的肠道菌群宏基因组检测机构,填补细分领域空白。
微生物检测和基因扩增检测具有高度专业性和技术敏感性,对实验室环境、人员资质、设备性能、实验过程控制等有严格的要求。
CNAS认可确保谷禾检测具备:

行业责任的担当
实验室声明“独立性与公正性”,建立相关程序文件,杜绝商业等其他利益干扰。
在生物检测领域,样本管理、方法验证、数据的准确性、真实性、可溯源性等至关重要。
CNAS认可要求实验室建立严格的数据控制和信息管理体系:
核心实力:专业、创新、严谨的三重奏
技术硬实力:环境、设备、专利等
实验室依据检测标准、设备需求和样品特性,建立病原微生物二级实验室,配备高通量测序仪、PCR仪、生物安全柜、高压灭菌锅、凝胶成像仪等设备。
通过温湿度监控、洁净度控制等方式,质量负责人定期监督环境合规性,发现偏离立即启动整改。
「 设备管理 」
通过技术负责人统筹、设备管理员执行及标准化流程,谷禾构建了科学高效的设备管理闭环,以全生命周期管控为核心,覆盖设备采购、验收、校准、使用、维护及报废全流程,确保检测设备的精准性与稳定性,为检测结果的可靠性提供硬件保障。
「 技术保障 」
实验室制定年度质量监控方案,结合内部核查(如使用有证标准物质、人员/方法/仪器比对)和外部验证(能力验证、实验室间比对),确保数据可靠性。针对宏基因组高通量测序项目,采用重复检测、盲样测试及统计分析方法识别潜在偏差。
异常数据触发不符合工作控制程序,通过根源分析实施纠正措施。监督员定期编制评估报告,纳入管理评审优化流程。
实验室强化设备校准、环境控制及人员能力评定,形成“方法-设备-环境-人员”闭环管理,确保结果溯源性。通过动态监控与持续改进,谷禾实验室为检测数据的科学性提供坚实保障。
管理软实力:用制度筑牢质量防线
谷禾的管理体系以“动态优化”为核心,通过制度迭代筑牢质量防线。
「 质量管理 」
数字化管控,建立“检测-分析-报告”全流程溯源系统。质量管理并非一蹴而就,而是持续改进的旅程。确保问题得到及时发现、有效解决,并转化为可推广的经验。定期的内部审核与外部评审相结合,进一步强化了质量体系的韧性。
「 样品管理 」
检测实验室的样品管理体系以全流程规范化、可追溯性为核心,确保检测结果的准确性与公正性。该体系覆盖样品接收、标识、流转、存储及处置全环节,严格遵循CNAS认可规范及生物安全要求。
样品采用唯一编码系统,
按类型差异执行差异化存储,
样品流转单及不合格样品
处理信息同步归档,
确保全流程可追溯。
「 安全管理 」
谷禾检测实验室安全管理体系以风险防控、规范操作和全员参与为核心,通过制度化管理与全流程管控,确保实验室活动的安全性与合规性。该体系涵盖危险废弃物处理、内务管理、环境控制及人员健康防护等模块,严格遵循生物安全法规及CNAS认可规范。
实验室严格执行分类收集、标签标识及专用容器暂存制度,确保不相容废弃物物理隔离。生物安全监督员全程监控收集、转运及处理流程,实现全程可追溯。

安全设施如灭火器、应急照明、洗眼装置全覆盖,质量负责人联合监督员不定期安全检查,发现隐患立即整改。
通过系统化的制度设计、严格的流程执行及全员责任落实,谷禾构建了高效可靠的安全管理闭环,为实验室人员健康、环境安全及检测质量提供坚实保障。
「 文件管理 」
谷禾文件管理体系以系统性、规范化和可追溯性为核心,确保管理体系文件的受控与合规性。该体系覆盖文件分类、编制审批、版本控制、发放回收及作废处理全流程,严格遵循CNAS认可规范与保密要求。
文件编制按权限分级管理,
相关人员负责审批,
定期组织文件评审,
评估体系文件的适宜性与有效性
重大修订触发换版流程
「 员工培训 」
谷禾重视员工培训,每一位员工都接受严格的岗位技能培训和质量意识教育,明确自身在质量控制中的角色与责任。鼓励员工积极参与质量改进活动,提出合理化建议,共同提升产品与服务的质量水平。
员工管理体系覆盖人员选择、培训、资格评定、监督及能力监控全流程,培训计划,涵盖岗前培训、资深指导及继续教育。
培训内容涉及检测方法、生物安全、数据分析软件操作等,并通过定期考核确保培训效果。新上岗或离职返岗人员需重新考核,确保岗位适配性。
「 供应链管理 」
谷禾实行严格的供应商准入制度和定期评估机制。采购产品和服务需经严格验证,如试剂类物资需检查有效期、成分及包装,设备维修后需重新校准并记录,确保所有供应商均符合质量标准和环保要求。
从规范走向责任,
从标准迈向担当。
质量不仅是管理的目标,
更是我们守护健康的使命。
社会责任:守护数据安全与生命健康
谷禾检测严格遵守国家法律法规,确保检测活动遵循客观独立、公平公正的原则。实验室独立运作,不参与可能影响检测结果的生产或商业活动,杜绝员工双重从业或利益关联。
肠道菌群检测涉及个人健康敏感信息,谷禾检测通过多层次保密措施保障数据安全,包括签署《保密规范协议》,对客户样品、检测结果及遗传信息等严格保密,实验室区域设置门禁与权限管控,禁止无关人员进入敏感区域;数据传输采用加密技术,严防未经授权访问。切实履行对客户隐私权和社会公共健康的责任。

每一次手册修订、每一台设备校准、每一份报告的诞生,都在诠释“公正、科学、守信、高效”的质量方针。实验室以技术实力与道德坚守,为社会提供可信赖的健康数据支持,助力疾病预防与精准医疗发展。
未来展望
以认可为新起点,开启“精准检测”新篇章
CNAS认可的获得不是终点,
而是谷禾检测新征程的起点。
未来,谷禾将始终以“公正、科学、守信、高效”为准则,严格贯彻和执行ISO/IEC 17025体系的质量标准。我们将继续秉承专业精神,不断提升技术水平和服务品质,凭借更严谨的检测能力和卓越的技术实力,结合业内领先的肠道微生物数据库以及人工智能分析平台,为客户提供更加优质的检测服务,助力精准医疗和个性化健康管理的发展。让每一份菌群检测数据成为连接科学与生命的桥梁。

谷禾健康
过去十余年,新一代测序(NGS)极大推动了人类微生物组研究,我们开始能以前所未有的分辨率,观察人体各生态位的细菌、古菌、真菌、病毒等。
研究发现,微生物组与肥胖代谢问题、消化道疾病、精神健康问题、癌症治疗响应、肝胆问题等健康状况都存在关联,这些前沿发现催生了如肠道菌群检测等专业服务,也推动学界提议将微生物组作为疾病辅助诊断、预后评估、治疗反应预测和监测、指导个性化的饮食方案的新工具。
但现实中,从科研发现到临床应用的转化之路并非坦途。样本差异很大、流程细节多、污染隐蔽、统计学和机器学习容易踩坑、不同实验室做法不一,导致可重复性与可比性不足,临床效用难以确认。
这场“从科研到临床”的转化难,其根源并非微生物本身潜力的匮乏,而在于我们缺乏一套能够驾驭其复杂性的严格“交通规则”。
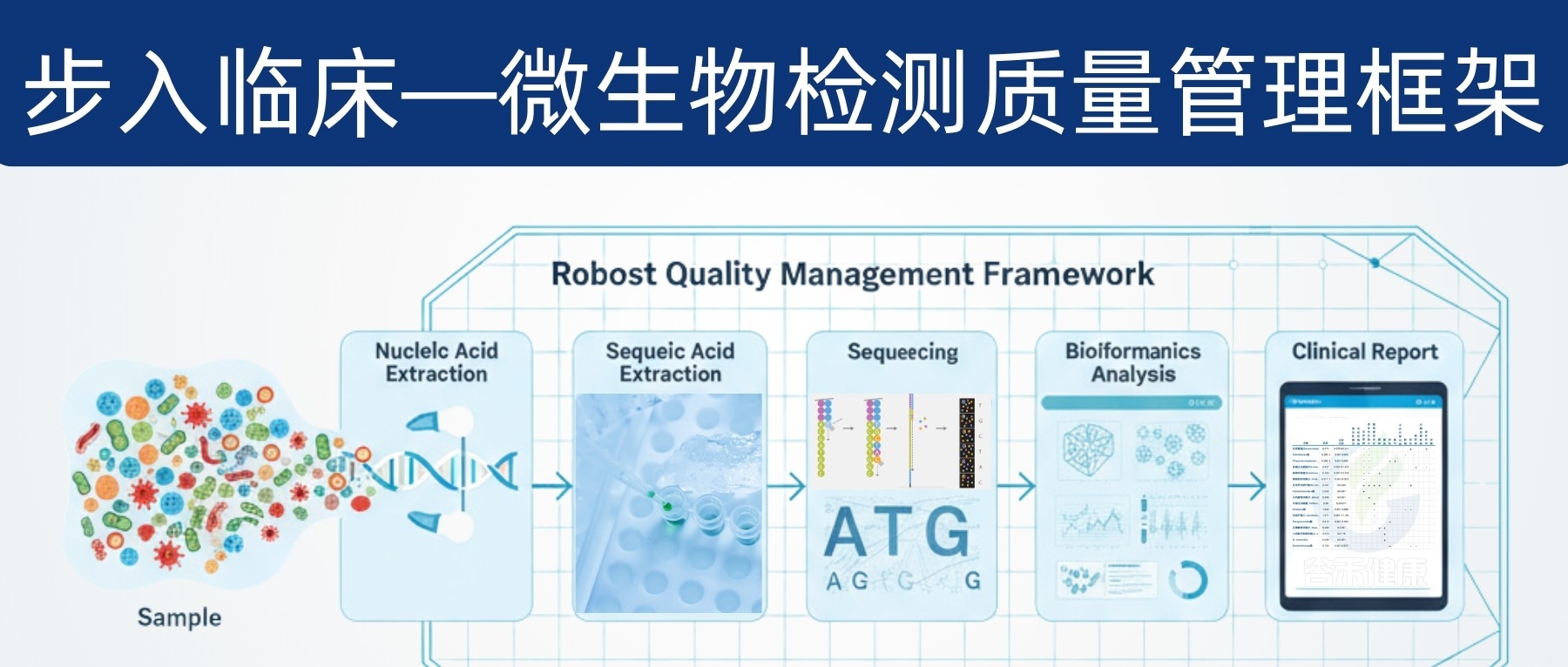
因此,微生物组要想真正服务临床,需要建立一套覆盖“分析前—分析中—分析后”的全流程质量管理,包含:标准操作程序(SOP)、质量控制(QC)、内部质量评估(IQA)、外部质量评估(EQA)与严格的分析/临床验证。
本文将为你揭示微生物组检测走向临床的关键挑战和解决方案,特别是质量管理框架的构建,为这一前沿领域的规范化发展提供路径。
从使用场景出发,理解“需要什么”远比“能做什么”更重要。微生物组数据可转化的临床用途,例如以下:
辅助筛查/诊断
识别疾病状态下的特征性菌群变化,例如肠道炎症、某些感染相关的菌群失衡。
指标示例:
特定物种丰度、菌群之间比值(如拟杆菌门/厚壁菌门)、功能通路、耐药/毒力基因等。
预后分层
用微生物组的“多样性与稳定性”预测疾病结局或加重风险,如囊性纤维化、消化系统或呼吸系统慢病的加重倾向。
比如说囊性纤维化患者:
菌群多样性下降 → 预测6个月内急性发作风险增加↑
指标示例:
α-多样性、β-多样性等。
微生物组分析指标作为生物标志物
预测治疗反应
典型案例:肿瘤免疫检查点抑制剂(ICIs)的疗效与基线肠道菌群结构相关;部分有益菌群富集与更好的应答有关。
具体来说,癌症治疗响应中,肠道菌群会通过调节免疫系统影响抗癌药物疗效。
指标示例:
响应者群体中特定属/种的富集模式、多样性高低、免疫调节相关功能基因与代谢产物等。
疗效监测/辅助治疗定制
动态随访微生物组,观察治疗(含饮食干预、FMT等)后的菌群变化轨迹;为供/受体匹配提供安全评估。
指标示例:
纵向β-多样性变化、特定功能通路恢复、致病菌负荷下降等。
注:这些指标不是金标准,可以认为是“窗口”,辅助筛查、分层或跟踪,但仍需在具体疾病与人群中完成临床验证与参考区间/阈值的建立。
正因如此,微生物群分析有望为疾病的早期诊断、个性化治疗以及健康管理提供全新的视角和方法,其作为生物标志物的潜力也备受关注。不过,微生物群分析的道路并非一帆风顺,诸多挑战横亘其中。
微生物组自身的善变与复杂性
微生物群本身具有高度的复杂性,它由数量庞大、种类繁多的微生物组成,包括细菌、真菌、病毒等,这些微生物之间以及它们与宿主之间存在着错综复杂的相互作用。
你的饮食、生活方式、服用的药物,都会引起肠道菌群的波动。这种看起来“牵一发而动全身”的特性,使得捕捉一个稳定且有代表性的快照变得困难。
数据分析的挑战
通过高通量测序(NGS)技术,我们能获得海量的微生物组数据。经过复杂的生物信息学处理,才能转化为可解读的分类、功能或多样性指标。
指标繁多:一个样本中可能包含成千上万种微生物或功能基因,为了简化,研究者会使用一些概括性指标,比如“α-多样性”(衡量菌群的丰富度和均匀度),但这可能会丢失关键信息。
统计陷阱:直接将成千上万个菌种与临床表型做关联分析,很容易因为数据本身的特点(高维度、稀疏性)而产生错误的、虚假的结论。
新工具的挑战:虽然机器学习等新工具很有前景,但它们也带来了新的复杂性,比如模型难以解释、验证困难等。
检测技术的细节
从样本离开人体到最终报告生成,整个流程遍布“雷区”,例如在样本储存条件、DNA 提取(方法、试剂盒品牌)、测序(引物的选择)等过程中,任何一个环节的细微差异,都可能对结果产生显著影响,从而导致研究结果的不一致性。
污染问题:尤其是在处理微生物含量低的样本时,实验中微量的污染物可能会导致错误的研究结论。
缺乏标准:目前没有统一的标准化实验流程。从样本处理到DNA提取,操作步骤的微小改动都会显著影响最终结果,导致不同研究之间的数据很难进行比较。
正是这些技术上的不统一和不可控,使得微生物组检测领域迫切需要一个标准化的质量管理体系,以确保未来临床检测的准确性和可靠性。
面对微生物群分析中的诸多挑战,建立一套完善的质量管理框架显得尤为重要。这个框架涵盖了从实验设计到结果解读的各个环节,旨在确保微生物群分析的准确性、可靠性和可重复性。它不仅为科研人员提供了标准化的操作流程,也为临床医生提供了更准确的诊断依据,有助于推动微生物群分析在精准医疗中的应用。
验 证:迈向精准医疗的基石
在微生物群分析中,新检测方法的引入如同打开一扇通往未知领域的门,但这扇门能否通向正确的方向,需要通过严格的验证来确保。
分析验证是对检测方法本身性能的评估,包括准确性、精密度、灵敏度、特异性等指标。
临床验证则是将检测方法应用于临床样本,验证其在实际临床环境中的有效性和可靠性。
临床效用评估是从临床实践的角度出发,评估检测方法对患者治疗决策和健康结果的影响。
临床效用——临床有效性,有用
微生物组检测必须同时满足两个条件:
这一验证阶段通常通过前瞻性临床试验进行,专门评估检测带来的实际改善。
虽然大型机构可能主导全面评估,但各临床实验室仍需验证自己的实施方案。
验证参考样本和数据的可用性对于充分评估任何新检测的实施至关重要。
目前微生物组分析还缺乏明确指导方针。现有的基因测序应用建议可作为基础,但验证过程必须根据特定方法和临床目的调整。尽管已提出许多潜在应用,但尚无一种完成正式临床验证。
标准操作程序:确保结果一致性的关键
严格标准流程的重要性
为整个微生物群分析工作流程定义严格的标准操作程序(SOPs)是确保结果一致性和可靠性的关键。
SOPs 好比一份详细的地图,为实验人员提供了清晰的操作指南,从样本采集到结果报告的每一个环节都有明确的规定和要求。
在湿实验室协议方面,任何细微的差异都可能对实验结果产生显著影响,因此需要严格控制实验条件,确保实验操作的一致性。
生物信息学工具的特殊需求
除了SOPs的基本要求(如书面文档和过程可追溯性)外,宏基因组学分析还特别需要生物信息学工具和参考数据库的稳定性。为了支持微生物组分析的各种应用,分析软件应具备可配置性和灵活性,同时保持易用、快速、稳定和可追溯的特点。
在宏基因组学分析的实际应用中,我们通过灵活组合构建定制化的数据分析脚本,满足不同分析需求的可配置性要求,确保分析工具既具备强大的统计分析能力,又保持了高效的数据处理性能。
谷禾所有生物信息学脚本的版本控制采用集中化管理策略,统一存储和备份于公司服务器中。对于分析所需的软件环境,本地统一部署管理,同时,建立了镜像作为备份方案,这种双重保障机制有效提升了分析环境的可靠性和可重现性。
这种基于官方资源的配置策略不仅保证了分析结果的标准化和可比较性,还为后续的方法验证和结果重现提供了坚实的技术基础。
质量控制:保障分析可靠性的支柱
质量控制(QCs)是质量管理的基石。它通过检查阴性和阳性对照样本,确保从采样到数据分析的全过程顺利完成。同时,设置“检查点”来监控关键步骤,只有满足标准才能继续。
核心原则
全流程把关:用阳性和阴性对照验证“采样→提取→建库→测序→分析”是否顺利完成。
检查点门槛:每个关键步骤设定接受标准,未达标则暂停或重做。
确保可重复与可比:严格执行标准,保证实验室内一致性和对外有效性。
内 部 质 量 控 制
阳性对照——验证能检出
最佳选择是标准化“细胞模拟”群落(已知组成),可覆盖提取到分析的全链条。
其他形式:DNA 模拟物、计算机模拟读段(不能覆盖湿实验室环节)。
平台特定补充,如 Illumina 常加 PhiX 作标定。
阴性对照——监测污染
污染物来源于实验室环境、试剂(“试剂盒”)或邻近样本(交叉污染),并在采样、DNA 提取、文库制备和测序(“索引跳跃”)过程中累积。
必备
提取空白、建库空白;必要时加“采样阴性”(例如清水、试剂空白)。
建议
所有阴性对照都进行测序,即便检测不到 DNA,也用于评估随机污染。
管理
建立污染物追踪库,长期记录与预警异常事件。
处理
策略
过滤阴性对照中出现的菌群(注意避免过度过滤导致假阴性)。
设阈值过滤或用专用工具(如 decontam、microDecon、Recentrifuge)识别并剔除污染;其中Recentrifuge能识别交叉污染。
注意
事项
低生物量样本(皮肤、下呼吸道)更易受污染影响;基于低丰度物种计数的指标更脆弱,像 α 多样性这类“更广义”的指标相对稳健。
关 键 检 查 点( 示 例 )
1
是否该做这个检测
核对临床指征、限制与必要咨询,避免无效或重复检测。
2
样本是否合适
采样部位要与临床问题匹配(肠道/皮肤/下呼吸道等生态位差异巨大)。
采样时机需控制(用药间隔、治疗/操作后多长时间、是否空腹/进食等),避免节律与饮食干扰。
采样质量判定(如直肠拭子是否有粪染、痰是否黏稠非唾液等)。
3
DNA 提取量与可用性
–工具:qPCR、荧光法(如 Qubit)、分光光度法(如 NanoDrop)。
–高生物量样本(粪便):若文库或测序读数异常偏低,提示提取/建库失败。
–低/中生物量样本(呼吸道、皮肤):常规前瞻性定量,关注污染风险。
–补充:靶向 qPCR(细菌 16S、真菌 ITS)可校正宿主 DNA 干扰,并将相对丰度换算为近似绝对量。
4
文库定量与标准化
–目的:测序前做等摩尔混合,也可侧面反映样本质量/微生物负荷。
–方法:荧光定量+片段长度分析。
5
测序质量
常用的测序数据指标:每样本读数、错误率、Q30 占比、读长等;
使用平台指标与 FastQC 辅助诊断问题。
6
生物信息学处理质量
流程:质控、过滤、修剪、聚类/ASV、组装、比对等;
检查各步骤的日志与评分,确认成功产出预期结果(分类、功能、耐药/毒力等)。
7
最终临床审核
由熟悉这方面的临床微生物学家把关,确认流程完整、报告恰当(必要时展示稀有但临床相关的菌群)。
早期需为临床医生提供解读支持;长期通过培训提升全科室对结果的理解与应用。
外部和内部质量评估:提升分析水平的助力
外部质量评估(EQA/能力验证)
核心做法是向多家实验室发放同一份参考材料,然后回收并比较各家的检测结果。可以理解为由权威第三方机构组织的 “全国统考”。
微生物组许多指标对流程细节非常敏感,因此需要定制化的 EQA 方案。
提出的两种解决方案:
结论导向 EQA:看不同实验室在临床结论上是否一致。
可能出现中间指标不一致(如多样性指数不同),但基于各自参考范围/阈值,最终临床判断一致(如粪菌移植失败风险高)。
举例:A、B两个实验室用了不同的方法,测出的多样性指数分别是3和5,数据不同。但他们根据各自的参考标准,可能都得出了“此患者粪菌移植失败风险高”的相同结论。这样就算通过。
局限:目前微生物组检测在临床上还没有太多公认的应用,所以这种考核很难开展。
方法导向 EQA:不讨论临床结论,只比对技术表现是否一致。看大家用同样的方法、同样的样本,能否得到同样的结果。
内 部 质 量 评 估(IQA)
简单来说,内部质量评估就是实验室内部的 “自我检查” 机制,用来确保自己的检测流程稳定可靠。
具体怎么做?
重复检测参考样本:定期把一个已知的、标准的参考样本拿出来重新检测一遍,看结果是不是和以前一样。这能保证实验流程长时间内没有发生偏移。
检测平行样本:把一份临床样本分成两份(或多份),当作两个独立的样本来检测。理论上,这两份得到的结果应该高度一致。这能检验操作的精密度和可重复性。
为什么要这么做?
因为目前针对微生物组分析的官方 “外部质量评估” (EQA)(也就是由权威机构组织的全国性或全球性大比对)还很缺乏。
解决方法:通过实验室内部的自我检查,以及组织几个本地或合作实验室之间搞 “比对测试”,可以很好地补充或弥补这个空缺,从而保证检测质量。
目前尚无充分验证的生物标志物可应用于常规实践,基于微生物组的生物标志物验证仍是一项持续而复杂的工作。下面的三个案例展示了常见挑战与可行做法。
案例一
Akkermansia muciniphila 预测免疫治疗反应
某些肠道菌与免疫检查点抑制剂疗效相关,Akkermansia muciniphila的存在被认为可能提示更好的应答。
► 分析验证(如何确保检测准确)
这个验证相对直接,因为目标很明确:只需要评估整个流程能否可靠地找到、识别并量化 A. muciniphila 这一种细菌。
具体做法是:
► 临床验证(这个指标在病人身上真的有用吗)
这需要通过设计良好的临床试验来证明。
可以这样做:
一个重要的提醒:
在做临床验证时,必须特别注意研究人群的构成。因为 种族、地理位置、饮食习惯 等因素都会显著影响肠道菌群。这些是混杂因素,如果不加考虑,可能会导致错误的结论。
案例二
用肠道菌群多样性指标,预测造血干细胞移植的预后
这个案例关注的是一个叫 “α-多样性”(Alpha-diversity) 的指标。简单来说,它衡量的是你肠道里微生物种类的“丰富程度”和“均匀程度”。就像一个生态系统,种类越多、分布越均匀,多样性就越高。
有研究发现,在接受造血干细胞移植前,如果患者肠道菌群的辛普森多样性指数的倒数(Inverse Simpson Diversity)越高,他们之后的总体生存率也越高。
► 分析验证(如何确保多样性算得准)
验证这类指标的难点在于,我们永远不知道样本里到底有多少种细菌(也就是说没有标准答案)。所以验证方法是直接看,我们测出的“多样性指数”和“病人的生存结果”之间有没有稳定的关联性。
► 临床应用与解读 (怎么用这个结果)
得到一个多样性指数后,怎么判断是高是低呢?
挑战:混杂因素
和上个案例一样,最大的挑战还是“混杂因素”。
人种、地区、饮食都极大地影响肠道菌群。
这个研究的优点是它的数据来自三大洲,说明结论可能具有普遍性。但反过来,这种大杂烩式的方法也可能掩盖了只针对某个特定人群的规律。
案例三
机器学习分析肠道菌群用于肝细胞癌筛查
这个案例探讨的是一个更前沿的方法:训练一个人工智能(AI)模型,让它通过分析一个人的肠道菌群数据,来判断他患上肝癌的风险。
核心思路
训练模型:先收集大量已知是“健康”或“肝癌患者”的肠道菌群数据。
让AI学习:把这些数据喂给AI模型,让它自己学习和总结出区分健康和患病人群的菌群模式。
预测:模型训练好后,当输入一个新人的菌群数据时,它就能根据学到的规律给出一个判断,这个人得肝癌的风险有多高。
如何验证这种AI模型?(这是最复杂的部分)
– 检查AI的学习方法
要确保AI不是过度训练得出的结论,比如,它可能学到了一些无关的线索或过度拟合部分线索,总的来说,AI需要比较大量的数据输入才可靠,此外对输入数据的准确性,描述等要求非常高。
– 严格的考试
绝对不能用训练过的数据来测试模型。这就像学生考试,不能用做过的练习题来当考卷。必须用一个全新的、独立的“验证数据集”来测试它的准确性。
– 在真实世界中检验
理想情况下,要把这个模型拿到一个更大、更多样化的人群中去检验,看它是否依然有效。
如何评价疾病预测模型的好坏?
评价一个疾病预测模型的精准性,远非一个“准确率”数字那么简单,其核心在于模型的性能是否与它的临床应用目的相匹配。我们必须综合评估一系列关键指标,并理解它们之间的内在权衡关系。
首先,要区分几个概念:
关键在于,这些指标的应用价值取决于场景:
对于疾病筛查(如早期癌症筛查):我们担心的是假阴性(把病人判为健康),这会延误宝贵的治疗时机。
因此,一个好的筛查模型必须追求灵敏度高,哪怕这会牺牲一部分特异度,导致一些假阳性(把健康人判为有病)。因为假阳性者可以通过后续更精确的检查(如CT、活检)来排除,只是虚惊一场,但漏诊的代价是巨大的。
对于疾病的确诊或指导重大治疗:此时,我们担心的是假阳性(误诊)。
给一个健康人施以不必要的、甚至有害的治疗是不可接受的。因此,一个用于确诊的模型必须拥有很高的特异度和阳性预测值(PPV),确保诊断的可靠性。
总的来说,一个模型的优劣是相对的。因此,最适合特定任务的模型,就是最佳模型。
评估微生物组的预测模型时,不能孤立地看某个指标,而应结合ROC曲线和AUC值来综合判断其区分能力,并根据其在临床路径中的具体角色(是用于大规模初筛,还是用于辅助诊断,辅助干预),来决定我们更看重哪个维度的性能。
关于这方面内容,详见谷禾之前的文章:
这套质量管理框架,为临床实验室未来如何开展微生物组检测指明了方向。
有些做法是现成的,比如必须使用“阴性对照”样本来监控污染。还有一些可以直接借鉴其他领域的经验,比如开展“内部质控”(IQA)和“外部质评”(EQA)。
因为如果科研人员在发表研究成果(比如发现一个新的生物标志物)时,就能提供详细的标准化操作流程(SOPs)和完整的质控数据,那么临床实验室就能更快、更容易地把这项新技术“接过去”并复现出来。
这将大大加快从基础研究成果,到病人能从中受益的诊断工具的转化过程。
编辑
目前,行业标准化已不再是纸上谈兵,本文所探讨的质量管理框架源自长期的实践与迭代。围绕实验室的人员、设备、环境、方法及管理流程等关键环节,谷禾进行了持续的系统化改进,建立并执行一套可追溯、可评估的质量管理体系,推动相关工作走向规范化。
在既有质量控制与验证基础上,谷禾将继续推进临床与微生物领域的转化应用,持续完善流程与方法,稳步提升落地能力与服务可用性。
主要参考文献
Scherz V, Greub G, Bertelli C. Building up a clinical microbiota profiling: a quality framework proposal. Crit Rev Microbiol. 2022 May;48(3):356-375.
Caminero A, Tropini C,et al., Credible inferences in microbiome research: ensuring rigour, reproducibility and relevance in the era of AI. Nat Rev Gastroenterol Hepatol. 2025 Jul 31.
Britton RA, Verdu EF, Di Rienzi SC, Reyes Muñoz A, Tarr PI, Preidis GA; Biotherapeutics Subcommittee of the AGA Center for Gut Microbiome Research and Education. Taking Microbiome Science to the Next Level: Recommendations to Advance the Emerging Field of Microbiome-Based Therapeutics and Diagnostics. Gastroenterology. 2024 Nov;167(6):1059-1064.

谷禾健康

人体肠道微生物群作为一个重要的“微生物器官”,在人类健康和疾病中发挥着至关重要的作用,影响着人体的代谢、免疫,甚至神经系统功能。随着测序技术和分析方法的进步,大规模人群队列研究已经成为理解肠道微生物群与宿主遗传、环境因素以及人类健康结局之间复杂相互作用的强有力工具。
这些人群队列研究,特别是那些样本量超过1,000名参与者的研究,为识别不同人群中一致的微生物组模式、建立与各种健康参数的关联,以及理解地理位置、饮食和文化因素对微生物群组成的影响提供了独特的机会。大样本量和使得研究能够进行稳健的统计分析,有助于控制混杂因素,并能够识别那些在小规模研究中可能被忽视的微弱但显著的关联。此外基于大规模人群队列的多组学数据也为我们了解肠道菌群与其他如代谢、蛋白、饮食和基因等关联提供了绝佳的材料。
与人类基因组相比,微生物组在治疗上更易于处理,它的可操控和可干预性显著支撑了微生物组的治疗进展和快速发展,因此具有良好的诊断和治疗前景。但实现这一愿景需要了解正常微生物组的构成。
建立正常微生物组参考一直是微生物组科学中的一大挑战。正常或健康微生物组的定义一直难以达成共识或一致。人类微生物组的惊人变化与地理位置,种族,生活方式,饮食,年龄,性别和药物等有关。并且由于迄今为止少数群体和全球主要地区在微生物组研究中的代表性不足。相比起来,我们国家人群的微生物研究数据是相对比较大的。
为什么需要特定人群的正常微生物参考?建立特定人群的正常微生物参考有助于精确诊断和个性化治疗;更好地评估健康状态和制定预防策略;深入了解人群差异并指导药物研发;辅助判断临床干预效果还能确定特定人群的疾病易感性。
在这篇文章中,我们主要关注肠道微生物组(最大和研究最广泛的微生物群落),从非患病人群中已知的微生物组开始,并简单分享不同人群中的正常肠道微生物组,分析与健康相关的微生物组特征变化的主要驱动因素,还概述了一些广泛研究的疾病微生物组相关治疗干预措施,同时探讨和关注这些偏差的来源以及与定义人群特异性微生物组参考基础相关的挑战。
1
利于精确诊断和治疗
每个人体内都有独特的微生物群落(微生物组),这些微生物组的构成受到个人年龄、性别、生理状态、生活方式及遗传背景等差异的影响,其正常的微生物群落组成存在特定特征。但同一个群体(如同一个家庭或地区)内的人们往往具有相似的微生物组构成。
同时,在健康人体内,微生物组会与人体形成一种平衡关系,这种平衡是适应了特定的宿主(人体)和环境条件的,这种状态被称为“稳态”,是维持健康的重要因素。
精确诊断:对于特定人群,有了正常微生物参考,可以更准确地判断其微生物群落是否偏离正常状态,从而为疾病的早期诊断提供依据。一些疾病如炎症性肠病与特定的促炎细菌(Fusobacterium nucleatum、Ruminococcus gnavus)异常增多或产短链脂肪酸细菌(Akkermansia Muciniphila、Lactobacillus)减少有关,通过与该人群的正常微生物参考对比,可以更敏锐地发现这些异常变化,提高诊断的准确性和及时性。
举个简单的例子:
如果一个人的多种菌都超过了正常范围,除了疾病和菌群紊乱,是不是还有一种可能,因为他的生活方式或地区不适用原有的菌群范围。比如纯素食者的菌群与肉食者的菌群无论在多样性和关键菌群特征上都有明显的不同,如果简单的将两类人群合并,按比例范围给出一个正常范围,结果就是两类人群差异的特征菌的范围异常宽泛,导致无法辨识是否存在异常。这就对于未来构建全面的肠道菌群数据库提出了要求和标准,也是谷禾致力于建立细分数据库的根据。
个性化治疗:在治疗疾病时,了解特定人群的正常微生物参考有助于制定个性化的治疗方案。由于微生物组具有群体特异性(不同群体有不同特点),在使用相同药物时可能会产生不同的反应。
例如在使用抗生素治疗感染性疾病时,不同人群的肠道菌群对不同抗生素的反应可能不同。如果知道特定人群的正常菌群组成,医生可以选择对其肠道菌群影响较小的抗生素,或者在治疗过程中同时采取措施保护肠道菌群,如补充益生菌等。
此外,对于一些与肠道菌群失调相关的疾病,如炎症性肠病、肠易激综合征等,通过恢复患者的肠道菌群至正常状态可以作为一种治疗策略。而特定人群的正常微生物参考可以为确定治疗目标和选择治疗方法提供重要参考。
2
健康管理和预防
评估健康状态:特定人群的正常微生物参考可以作为评估该人群健康状态的一个重要指标。通过检测个体的微生物群落组成,并与同人群的正常参考进行比较,可以了解个体的健康状况是否良好,是否存在潜在的健康风险。
例如,对于孕妇来说,孕期的肠道菌群变化可能与妊娠并发症的发生风险相关。如果能够监测孕妇的肠道菌群,并与正常孕妇的菌群参考进行对比,可以在早期发现潜在的风险因素。
制定预防策略:对于一些特定人群,如老年人、婴幼儿、患有慢性疾病的人群等,了解他们的正常微生物参考可以帮助制定针对性的健康管理和预防策略。
例如,对于老年人,可以通过调整饮食、补充益生菌等方式维持肠道菌群的平衡,预防肠道疾病和其他慢性疾病的发生。对于婴幼儿,建立健康的肠道菌群对于其免疫系统的发育和整体健康至关重要。
3
科学研究和药物研发
深入了解人群差异:特定人群的正常微生物参考为科学研究提供了重要的基础数据。通过比较不同人群的微生物群落组成,可以深入了解人群之间的差异及其背后的生物学机制。
例如,研究不同种族人群的肠道菌群差异,可能有助于揭示遗传和环境因素对肠道菌群的影响,以及这些差异与疾病易感性的关系。此外,特定人群的微生物参考还可以为研究微生物与宿主相互作用提供重要线索,推动微生物学、免疫学、营养学等多个领域的发展。
指导药物研发:在药物研发过程中,考虑特定人群的微生物特征非常重要。药物的疗效和安全性可能受到个体微生物群落的影响。某些药物的代谢可能依赖于肠道菌群中的特定酶。了解特定人群的正常微生物参考,可以帮助研发人员预测药物在不同人群中的代谢情况和疗效差异,从而优化药物设计和开发更具针对性的药物。
此外,针对特定人群的肠道菌群特点,还可以开发新型的益生菌、益生元或其他微生物相关的治疗方法,为疾病的治疗提供新途径。
4
判断临床干预效果
微生物组在人群之间存在差异,因此需要针对特定人群(如不同地区、文化或生活方式的人群)进行分析。通过这种人群特异性分析,可以识别出哪些微生物标志(特定的微生物或微生物群)与健康状态(非疾病状态)相关。这些标志可以用来定义健康人群中微生物的“正常范围”(即参考流行范围和丰度分布)。
如果对微生物组进行干预(比如通过饮食、益生菌、药物等),可以通过观察这些健康相关微生物标志在干预前后的变化来评估干预的效果。也就是说,干预是否有效,可以通过看这些标志是否恢复到健康人群的正常范围来判断。
目前已经有一些指数或统计方法被提出,用来衡量微生物组干预的效果。但这些方法大多是针对特定人群(比如某些研究中的特定群体)设计的,或者主要集中在少数地区的人群上。这意味着这些方法可能无法很好地适用于其他人群。
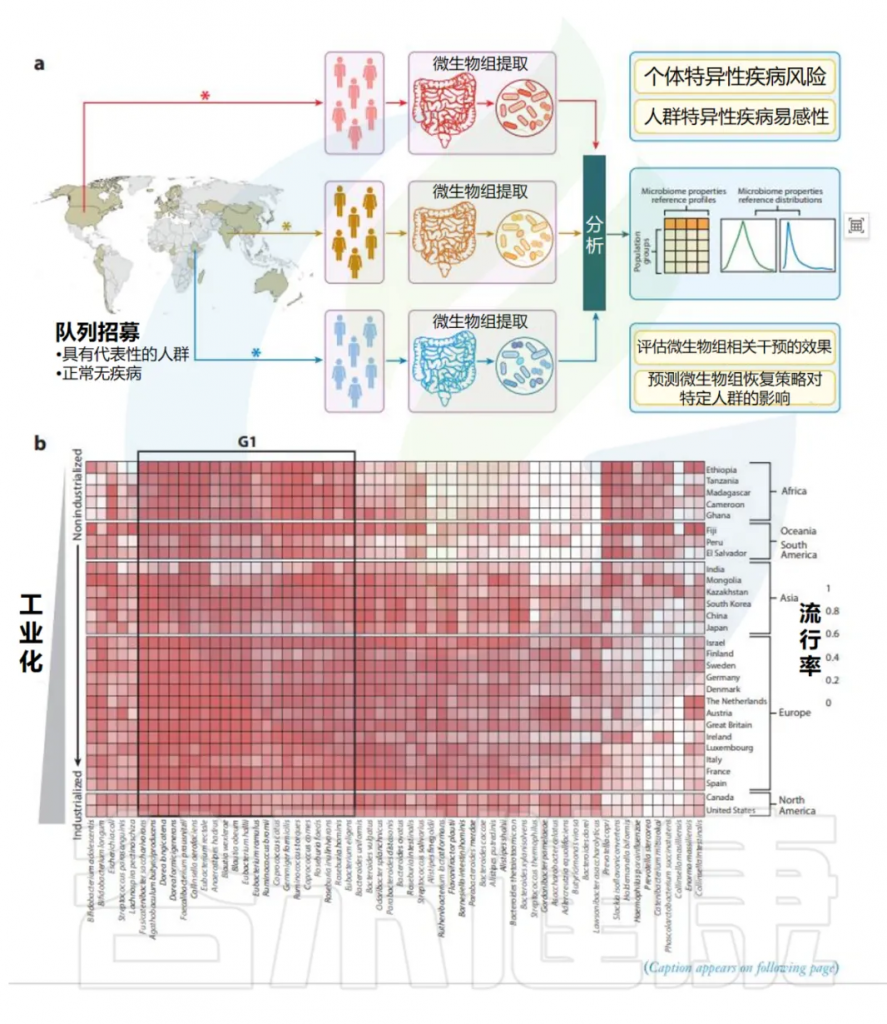
上图分析包括来自29个国家进行的65项研究的21117个明显健康个体的肠道微生物组(来自curatedMetagenomicData存储库)。这些优势物种是从至少两个民族的前30个流行分类群中选出的。除了捕获某些分类群的一些已知地理特异性流行模式(与工业化状况有关)外,该分析还揭示了存在一个共同的核心微生物组,由29个民族中流行的21个物种组成。
(a)该方法的模式和需要人群特异性正常微生物组参考的四个主要原因。
(b)热图显示了来自不同民族的肠道微生物组中优势微生物物种的流行率。
另外还需要通过以相同基准进行比较,比如同一个体的前后比较,并根据个体的人群特征分类对变化的菌的程度进行判定。
5
确定特定人群的疾病易感性
正常不等于健康。微生物组不仅可以反映当前的健康状况不佳,还可以反映疾病发展的风险。此外,虽然微生物组和疾病风险之间的一些联系在多项研究中得到了一致的再现,但有可能识别出那些处于特定风险中的人。例如,一项研究对坦桑尼亚城乡梯度人口的调查表明,城市化群体的微生物组结构在暴露于体外细菌刺激物时易患炎症状态。这也在实验小鼠中建模。
因此,在明显未患病的人群中存在特定微生物组“配置”的情况下,特定标志物的较高基线水平的组合可以预测某些疾病的易感性,并能够加强公共卫生监测的重点。
6
不同微生物组干预恢复策略对不同人群的有益和有害影响
研究表明,大多数微生物组干预策略是基于工业化或西方化人群的研究结果设计的,但对于农村人群或过着传统生活方式的人群,这些策略可能效果较差,甚至会带来负面影响(这也是谷禾一直花大力气构建本地区能覆盖全国的人群样本菌群数据库的主要原因)。
例如,在城市化、工业化人群中,嗜粘蛋白的阿克曼氏菌(AKK)被认为有多种益处,比如抗衰老和改善胰岛素抵抗。然而,由于它以粘蛋白为食,这种菌可能并非对所有人都有同样的好处。在一些粘蛋白层较薄、屏障完整性较差的人群中,它可能反而会带来有害影响。
同样,对于缺乏纤维降解细菌的人,如果直接补充β-果聚糖,可能会导致炎症增加。接下来,我们将总结不同人群中微生物组差异的相关研究。
多个大规模人群微生物组测序项目,包括LifeLinesDEEP、佛兰芒肠道微生物项目、荷兰微生物组项目、美国肠道、瑞典心脏病生物成像研究、芬兰慢性非传染性疾病风险因素人群调查(FINRISK)、广东项目、谷禾健康项目肠道微生物组和日本4D微生物组项目提供了不同人群中正常肠道微生物组的一些数据。
此外,小规模的研究已经描述了特定国籍,种族和偏远地理位置的焦点群体中具有不同生活方式或生活方式转变的非患病个体的微生物组,其他项目已经调查了患有各种疾病的匹配对照患者队列。
公开的微生物组数据存储库促进了对多个地理区域人群特异性正常微生物组特征的研究,并揭示了大致的模式。
首先肠道菌群与生长发育是相伴随的,婴幼儿和青少年以及老年人的菌群在不同阶段是跃迁式变化的,而且不同的年龄阶段,菌群的变化频率也不同。因此不能简单的将不同年龄阶段的人群合并给出菌群范围,需要针对不同年龄阶段计算相适应的年龄范围,这样才能准确的反映菌群的异常情况。
1
婴儿的微生物群落
婴儿的微生物群落已经被观察到,在不同的地理位置有相当大的相似性。它们以肠杆菌科(Enterobacteriaceae)、双歧杆菌科(Bifidobacteriaceae)、肠球菌科(Enterococcaceae)、韦荣氏球菌科(Veillonellaceae)和葡萄球菌科(Staphylococcaceae)的成员为主。
婴儿肠道微生物组似乎主要受饮食模式,城市化和环境暴露的影响(这反过来可能会推动间接的地理特异性关联)。
2
正常成人的肠道微生物组
肠道微生物组在成熟至成年后达到独特的组成。典型的正常成人肠道微生物组由拟杆菌门(例如普雷沃氏菌属(Prevotella)、拟杆菌属(Bacteroides)、Alistipes、Barnesiella、Odoribacter)和厚壁菌门(例如粪杆菌属、Roseburia、真杆菌属、粪球菌属、毛螺菌属),其次是变形菌门(埃希氏菌属)、线菌门(双歧杆菌属、Collinsella、Eggerthellaceae)和疣微菌门(Akkermansia),尽管这些成员在患病人群中存在相当大的差异。
一些研究强调了工业化对微生物组的独特影响,以及工业化和非工业化社会中城乡梯度的影响。 城市化与属于拟杆菌、Alistipes和Akkermansia等分支的微生物成员的增加有关,与属于Prevotella、Catenibacterium、Treponema和Succinatimonas分支的成员的减少有关,以及与瘤胃球菌科和真杆菌属分支的特定成员的减少有关。
为了进一步阐明不同国家正常微生物组中的这些差异,对从全球微生物组数据库curatedMetagenomicData获得的全球数据集(包括来自29个国家的65项研究的21117名正常,明显未患病受试者的肠道微生物组)进行了调查,结合谷禾的检测数据库,确定了正常成人肠道微生物组的共同核心菌属。(下图)
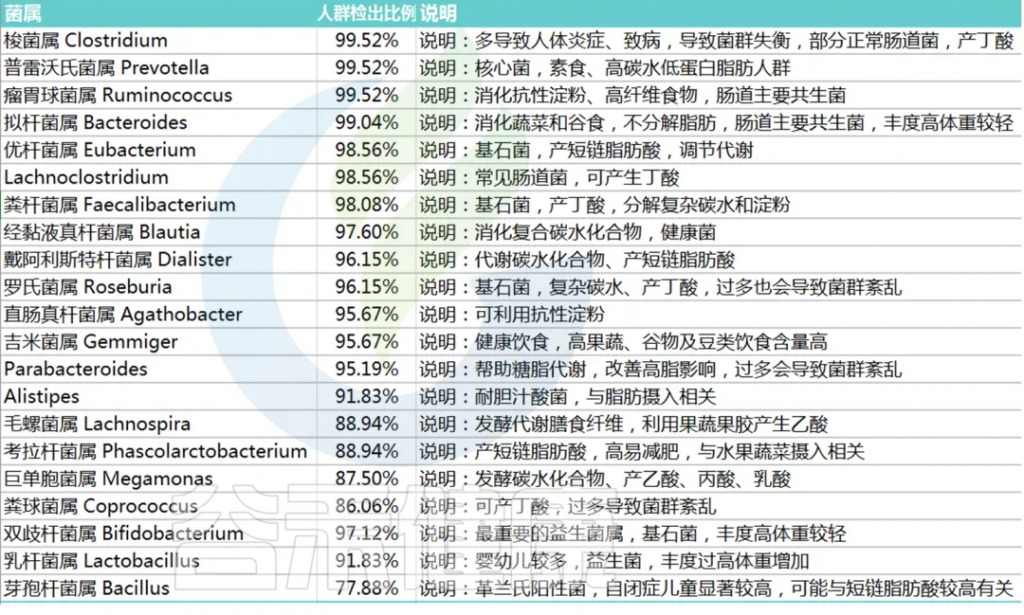
<来源:谷禾肠道菌群检测数据库>
♢除核心菌外的微生物与工业化程度及生活方式存在很大联系
其他微生物类群在不同程度上与国家的工业化程度相关。两种双歧杆菌(长双歧杆菌和青春双歧杆菌)在除非洲国家外的所有队列中普遍存在。与之前的观察相反,Prevotella copri——非工业化肠道微生物群的标志,在一些工业化国家仍然普遍存在,尽管出现了减少,以及其他与城市化负相关的成员,如Holdemanella biformis。
与工业化负相关程度最高的3个物种分别是Catenibacterium mitsuokai、
Phascolarctobacterium succinatutens、
Prevotella stercorea。
同样,虽然拟杆菌和另枝菌属(Alistipes)与工业化社会的肠道微生物群有关,但这些谱系的差异是明显的。虽然Bacteroides uniformis、B.vulgatus和Odoribacter在非工业化社会中也很普遍,但该分支的其他成员,如B.dorei、B.xylanisolvens、B.caccae、Barnesiella、Alistipes和Parabacteroides在欧洲、北美和亚洲国家普遍存在,但在其他国家却没有。
城市化生活方式的形成是多个因素的综合结果,包括卫生条件改善、药物摄入增加、久坐不动的生活方式、昼夜节律紊乱、饮食缺乏季节性变化、富含蛋白质或脂肪的饮食、家庭规模较小以及与宠物或其他动物接触较少。这些因素可能单独或共同影响肠道微生物组的组成变化。
♢特定的饮食习惯与肠道微生物也密切相关
某些肠道微生物通常与特定的饮食习惯有关。例如,耐胆汁的谱系如拟杆菌属和嗜胆汁菌属通常与肉类摄入有关,而产生丁酸盐的糖解谱系如罗氏菌属、瘤胃球菌属和粪杆菌属及普雷沃氏菌与富含植物和地中海饮食有关。
普雷沃氏菌属也与食用谷物(尤其是全谷物)有关。同样,虽然粪杆菌属和罗氏菌属与红酒摄入有关,但富含乳化剂的饮食(通常与加工食品有关)与有害的Ruminococcus gnavus增加有关。
详见: 活泼瘤胃球菌(Ruminococcus gnavus)——多种疾病风险的潜在标志物
♢衰老以特定的方式影响肠道微生物群
随着年龄的增长,与青年相关的、产生丁酸盐的微生物群减少,潜在有害分类群(致病菌)增加,以及替代核心成员(如阿克曼菌属、克里斯滕森菌属、颤杆菌属、丁酸弧菌属和丁酸单胞菌属)的比例增加。这些是肠道微生物组在未患病个体中适应与衰老相关的宿主生理变化的一部分种群。
奇怪的是,一些看似无关的因素与肠道微生物组组成也有着联系。例如,养宠物和更多的人际接触(如在大家庭中)与普雷沃氏菌属和脱硫弧菌属的增加以及有益的孢子形成、丁酸盐产生的厚壁菌门物种(如粪杆菌、真杆菌、罗氏菌属、粪球菌属)的增加有关,与富含谷物的植物性饮食相关的同一谱系的嗜酸乳杆菌和脆弱拟杆菌的减少有关。
同样,大多数通常与多药相关的微生物成员(如拟杆菌属、拟副杆菌属、爱格氏菌属、链球菌属)也与工业化人群有关。
3
真菌组成
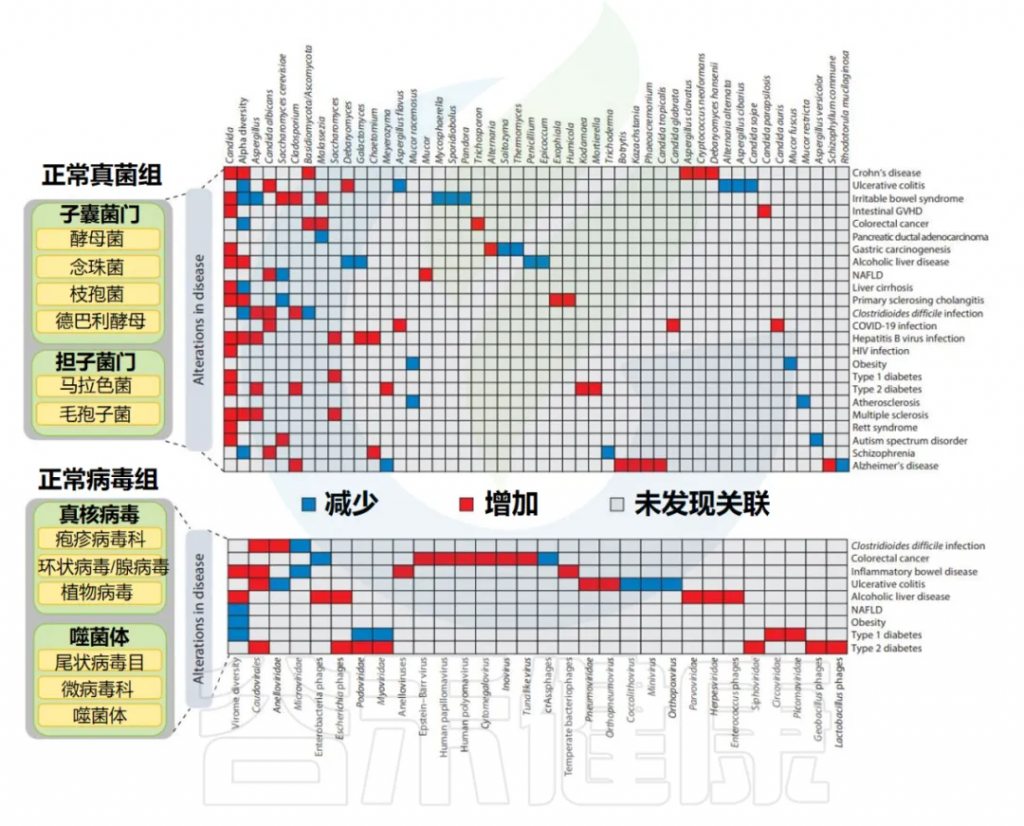
doi: 10.1146/annurev-med-051223-031809.
上图总结了目前对正常肠道真菌群落的了解以及多种疾病中一些变化。主要由子囊菌门和担子菌门两门组成。婴儿的肠道菌群主要包含子囊菌目(Ascomycota)和马拉色菌目(Malasseziales)(担子菌门)的成员。
与细菌组一样,真菌组也随着年龄的增长而变化。正常成人肠道真菌组由三个属占主导地位,即酵母菌属、假丝酵母菌属和枝孢属(均属于子囊菌门),其次是其他属,如德巴利酵母属和毕赤酵母属(均属于子囊菌门)以及马拉色菌属、汉纳酵母和隐球菌属(均属于担子菌门)。
♢不同人群真菌组成更加个性化
与细菌组/古菌组相比,真菌组在种或属水平上表现出较少的受试者内多样性和显著更高的受试者间变异性,表明真菌组更加个性化。尽管真菌生物群系受到城市化、饮食、出生模式、药物和种族等因素的影响,这些因素同样影响细菌组/古菌组,但与每个宿主相关因素的进化枝在队列中表现出一致性较小。与不同宿主生化标记相关的真菌分支也显示出高度个性化的群体特异性关联模式。
♢真菌生物群与宿主性状和疾病存在关联
真菌生物群与宿主性状和疾病之间存在一致的关联。例如,多项研究发现,曲霉菌和青霉菌在老年人中的流行率增加,除了念珠菌和酵母菌外。克罗恩病和溃疡性结肠炎中白色念珠菌和德巴利酵母菌增加;马拉色菌在肠易激综合征(IBS)、结直肠癌和胰腺癌中也有所增加;多种疾病中真菌生物群的α多样性显著提高。
过多的真菌谱系如念珠菌已被证明对细菌微生物组的多样性和组装产生负面影响,导致促炎微环境。
4
病毒组成
人体的病毒生物群也是个性化的,并受到地理,城市化和种族的影响。
尽管有这些影响,但多项研究就正常肠道病毒组的典型构成达成了共识。这包括真核病毒(感染人类宿主细胞以及膳食植物材料)和噬菌体(感染微生物组细菌/古菌成员的病毒)。
上图总结了目前关于正常肠道病毒组和某些疾病中的一致发现。主要的宿主感染真核病毒谱系,包括疱疹病毒、无核病毒和腺病毒,在正常个体中通常处于低丰度和休眠阶段,可能有助于启动免疫系统。
而人类肠道中的主要噬菌体谱系包括有尾噬菌体目、微小噬菌体科和交叉组装噬菌体(crAssphages)。crAssphage是一种粪便病毒谱系,是通过使用交叉组装方法对宏基因组数据集进行计算分析而发现的(因此得名)。
♢肠道病毒组以特定的变化影响着宿主健康
肠道微环境的变化,如炎症,pH值的变化,氧化应激或抗生素引起的变化,可能会触发噬菌体生命周期的变化。
噬菌体组还可以以不利的方式(即通过促进毒素产生、定殖/粘附、生物膜产生和抗生素抗性)或有益的方式(即通过使用免疫球蛋白样结构域粘附于宿主细胞并形成病原体防御层或调节宿主炎症状态)。
多项研究已确定肠道病毒组中特定的疾病相关变化,其中一些在临床前模型中得到了验证。常见模式包括肠道炎性疾病中病毒多样性的增加,以及多种疾病中微病毒科的减少和尾状病毒目的增加。然而,大多数关于宿主相关因素对正常肠道病毒组影响的研究仍局限于西方国家和东亚的特定亚群,缺乏来自全球其他地区的数据。
1
人群样本代表性可能不足
扩大我们对特定人群正常微生物组知识的主要障碍是缺乏来自非工业化发展中国家和低收入国家的微生物组数据。下图a突出了这一问题。我们将不同国家的全球人口份额与其在全球微生物组数据库中的代表性进行了关联,这些数据库包括MetagenomicData(v3)、Human Microbiome Compendium和GMrepo。与其全球人口代表性相比,肠道微生物组代表性显著较低的国家主要是最不发达和发展中国家。
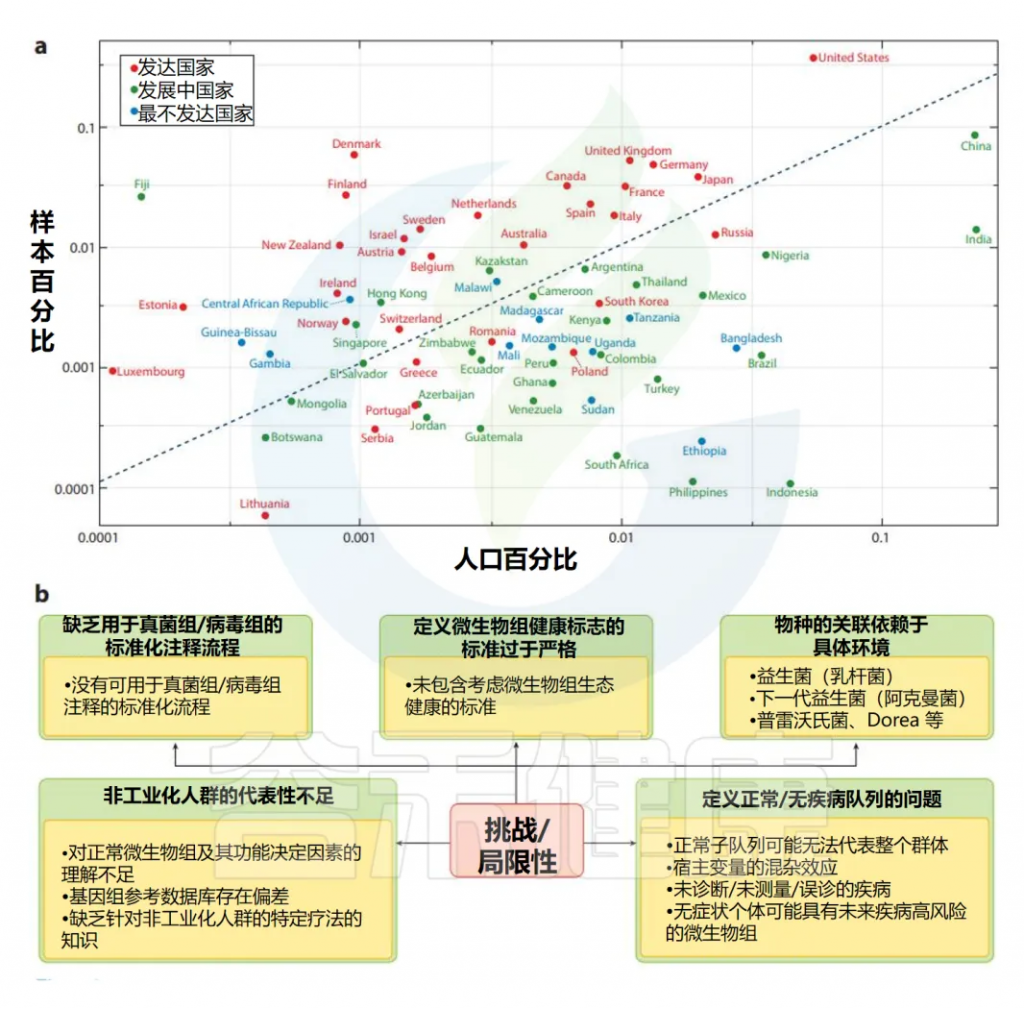
(a)在全球微生物组数据库中缺乏来自发展中国家/最不发达国家的肠道微生物组的代表性。散点图是通过结合来自三个主要微生物组数据库的肠道微生物组概况进行的全球数据分析的一部分,其中包括来自71个国家的221983个肠道微生物组。1y轴代表每个国家在微生物组计数方面的比例份额。x轴显示了全球人口在log 10尺度上的相同份额。
具体国家的人口来自联合国人口基金的世界人口仪表板(https://www. unfpa.org/data/world-population-dashboard)。根据经济状况(发达国家、发展中国家或最不发达国家)进行的国家分类取自联合国发布的《2023年最不发达国家报告》(https://unctad.org/publication/least-developed-countries-report-2023。
(b)界定特定人群正常人口范围的挑战和局限性的简要说明。
此外,相同国家也存在地域代表性差异,广东的研究队列显示即便是广东同省,不同地区的菌群特征也存在明显的差异。
♢代表性不足的后果
这种代表性不足有两个主要后果。首先,它限制了我们对大多数人口正常微生物组的理解。其次,它导致参考数据库的基因组表示主要偏向于工业化或西化城市人群的物种(或亚分支/菌株变体)。这不仅限制了来自非工业化发展中国家和最不发达国家的新数据集的分类和功能注释,还使得确定这些人群中与弹性和健康相关的微生物组功能决定因素变得困难。
事实上,这些传统种群中许多新的适应宿主的功能特征(包括识别随着城市化而丢失的新纤维素降解物种)已在少数高深度测序项目中出现,这些项目主要集中在尼泊尔部落、斐济人以及埃塞俄比亚、加纳和马达加斯加等的小型农村亚群。
我们之前已表明,健康和疾病相关的类群在工业化和非工业化人口中存在差异。因此,非工业化人口的健康功能决定因素可能与工业化人口不同,并可能适应相关的环境压力。这对基于工业化国家开发的微生物组治疗在非工业化和发展中国家的应用具有显著影响。此外,来自发展中国家的数据在真菌组和病毒组方面的代表性不足更为明显。
2
定义正常亚群的挑战
目前对正常微生物组的理解是基于人群水平的微生物组分析或比较患者和对照组的以疾病为重点的研究。有四个混杂因素需要考虑。
首先,在许多以疾病为中心的研究中,匹配的正常亚组由居住在同一地区的个体亚组组成。这大大限制了代表正常人群的数据。
其次,在许多以疾病为重点的研究中,正常对照组包括除试验组中感兴趣的疾病之外的一系列疾病的受试者。
第三,尽管人群水平的测序项目解决了以疾病为重点的报告的许多局限性,但它们经常包括自我宣称正常但患有未诊断或误报疾病的个体,这些疾病扭曲了正常微生物组特征的分析。
第四,最近的研究表明,微生物组的改变早在明显的疾病之前[例如,炎症性肠病(IBD)和阿尔茨海默氏症]是明显的。
3
基因型与表型的关系
肠道微生物与疾病之间的关系严重依赖于环境。在一个遭受饥荒的国家,微生物组可能适应于最大限度地提取卡路里和营养,而在肥胖环境中则可能产生负面影响。同样,单个微生物在健康和疾病中可能呈现相反的相关性。
♢大多数情况下有益的细菌可能在一些疾病中也丰度过高
例如,广泛用作益生菌的乳酸杆菌在炎症性肠病、2型糖尿病(T2D)和肝硬化等疾病中也显示出增加的丰度;目前用作下一代益生菌的嗜粘蛋白阿克曼氏菌也与帕金森病、阿尔茨海默病和多发性硬化等神经系统疾病有关;与改善宿主代谢和葡萄糖稳态正相关的Prevotella copri也在类风湿性关节炎和肝病等疾病中富集。
特定分类群的疾病相关性需要开发创新的评分指标,以选择用于治疗的分类群。
4
缺乏标准化的微生物组分析和注释
识别正常微生物组标志物的典型方法是探索在疾病中通常获得或失去的物种或分类群。然而,这种方法是有限的,无法解决微生物组的生态健康问题(即其随时间的稳定性和弹性)。事实上,一些广泛用于微生物组补充策略的分类群(如乳杆菌)已被证明缺乏这种特性。
正常微生物组参考应在不同人群中具可比性,这需要减少研究间的实验和测序变量,并标准化计算注释协议。然而,目前尚未建立标准化的注释,尤其是针对真菌组和病毒组。不同研究使用了多种非均质实验技术进行宏基因组DNA提取、测序文库制备和测序,导致生成的微生物组谱在不同研究中难以比较。
尽管识别正常(或未患病)肠道微生物组面临许多挑战(如在全球人群中定义正常微生物组的限制),微生物组相关的治疗干预在解决多种疾病方面取得了显著成功。然而,其成功程度依赖于疾病和干预的性质。为进一步阐明这些方面,我们将在下一节提供基于PubMed的文献调查总结,针对一些广泛研究的疾病的不同微生物组相关治疗干预措施。
与肠道微生物组相关的治疗干预措施可大致分为四类:
1.益生菌(具有推定治疗潜力的活微生物);
2.益生元(由宿主相关的、无害的有益肠道微生物选择性地利用以用于其生长的化合物,其可以赋予健康益处);
3.膳食干预(治疗性饮食方案或对个体常规饮食的改变,其可以直接或通过调节肠道微生物组赋予多种健康益处);
4.粪便微生物组移植(FMT;将粪便微生物从明显健康的供体转移到不健康的受体)。
此外,还有其他干预措施,如合生元(益生菌和益生元的组合)和后生元(postbiotics)(微生物细胞或热灭活微生物的成分,可以赋予健康益处)。
为了调查针对一些主要微生物组相关疾病的干预试验的情况,我们使用抽象检索字符串进行了PubMed文献检索,如下表所述。

下图a显示了410项针对一些广泛传播、广泛研究的疾病的微生物组相关干预措施人体试验的疾病病灶分布总结。
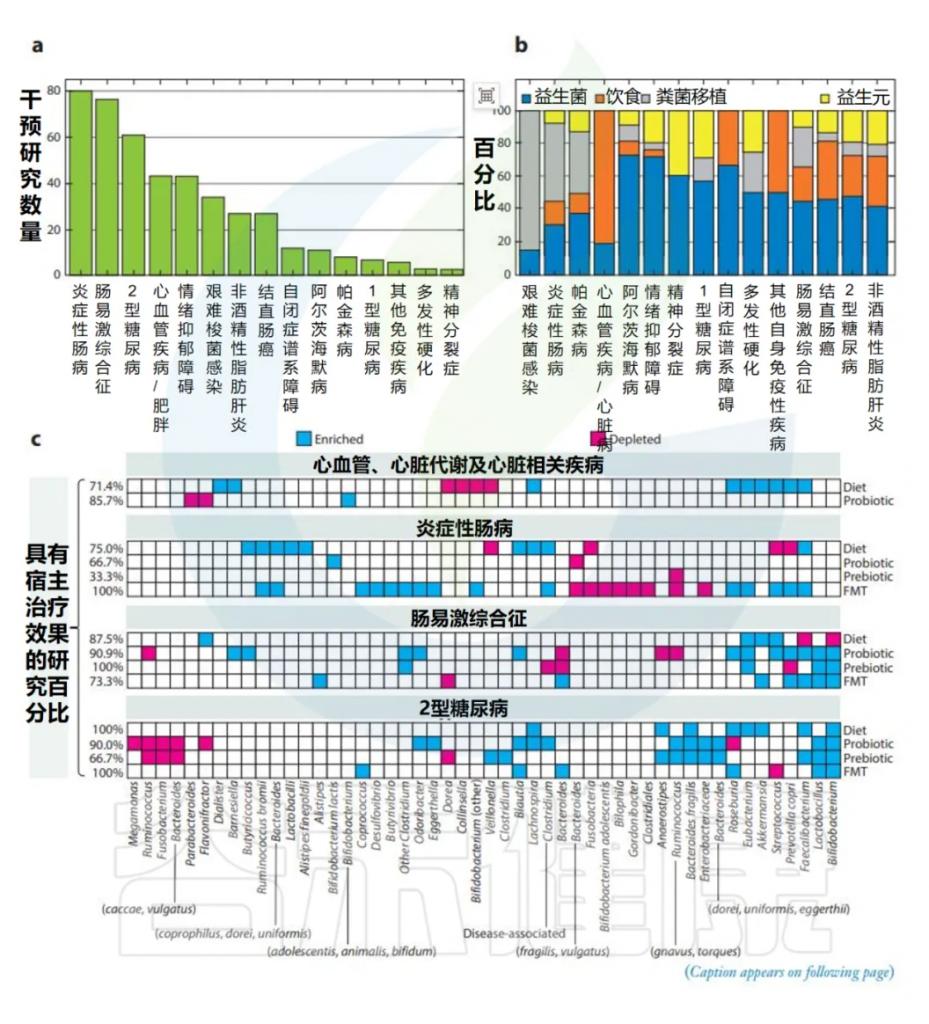
doi: 10.1146/annurev-med-051223-031809.
(a)使用条形图总结干预研究的疾病焦点。
(b)每种疾病的四种干预类型的相对代表性。根据干预措施的数量重点关注前四种疾病,仅选择随机安慰剂对照试验,并研究了宿主和微生物组的影响。还确定了一项显示至少一种宿主相关临床性状改善的研究。
(c)热图总结了针对前四种疾病的四种干预类型所观察到的微生物群相关影响。对于每种疾病干预组合,在至少两项研究中显示富集或耗尽的微生物谱系分别标记为富集或耗尽,并提到具有宿主相关有益作用的研究百分比。这些观察结果强调了启动大型基于微生物组的分析研究的必要性,以确定不同人群的正常微生物组参考,为人群定制的微生物治疗和诊断提供未来路线图。
肠道相关疾病如炎症性肠病(IBD)和肠易激综合征(IBS)占这些干预措施的最大比例(410例中的155例,或38%),其次是2型糖尿病和、心血管和心脏相关疾病(410例中的104例,或25.3%)。神经、心理和脑相关疾病,如抑郁症、自闭症谱系障碍、阿尔茨海默病、帕金森病和精神分裂症,共占19%(410人中的77人)。其他疾病包括艰难梭菌感染(CDI; 7.7%),结直肠癌(6%),肝脏相关疾病如非酒精性脂肪肝和非酒精性脂肪性肝炎(6%),以及其他自身免疫性疾病,包括1型糖尿病和多发性硬化症(累计占3.6%)。 因此,尽管优先关注某些疾病,但微生物相关干预的疾病焦点是多样化的。
1
不同疾病需要特定的干预措施更有效
干预措施的性质显示出疾病特有的趋势(图b)。针对CDI的干预主要是粪便微生物组移植(82.3%),FMT的第一个随机临床试验涉及复发性CDI患者,至今仍是最成功的干预措施,尤其在真正的生态失调环境中。
这与针对心血管、心脏代谢和心脏疾病的干预形成对比,这些干预主要是饮食(80.9%)。虽然肠道相关疾病(如IBS和IBD)主要使用粪菌移植和益生菌,但饮食干预和益生菌在2型糖尿病和非酒精性脂肪性肝病/非酒精性脂肪性肝炎的微生物组干预中占主导地位。
不同的神经、心理和大脑相关疾病也表现出不同的干预类型。阿尔茨海默病、抑郁症和精神分裂症主要针对益生菌干预,而帕金森病则有相当多的基于粪菌移植的干预试验。
对这些干预研究的深入调查(仅关注前四种主要疾病的安慰剂对照试验,即IBS,IBD,T2D以及心血管,心脏代谢和心脏疾病,这些疾病的干预研究数量最多)提供了对其影响的进一步见解(图c)。对于疾病干预型组合,至少三分之二的研究报告了宿主相关临床特征之一的显著改善。
许多与微生物组相关的影响也表现出合理的一致性。例如,除了益生菌如乳杆菌外,一些与消化道健康/正常肠道微生物组相关的谱系,如粪杆菌属、真杆菌属、阿克曼氏菌属、双歧杆菌属、紫单胞菌科和经黏液真杆菌属,显示出针对多种疾病的不同干预类型的富集。 这表明这些谱系可用作微生物组衍生的终点,以计算不同微生物组相关干预措施的有效性。
2
不同疾病和干预措施存在差异和冲突
不同疾病和不同干预措施的变化模式也存在差异和冲突。在特定情况下,这些变化可能与更广泛的干预类别的不同亚型有关。例如,粪杆菌属谱系在针对IBD、T2D和心血管、心脏代谢和心脏疾病的饮食干预后正富集,但在针对IBS的饮食干预后耗尽。
这可能是因为,虽然前三种疾病的大多数饮食干预是基于地中海/素食/素食主义者制度,但IBS的大多数饮食干预是基于低发酵寡糖,二糖,单糖和多元醇(FODMAP)饮食。
微生物组相关干预措施的反应在宿主或微生物组水平上与性别和年龄等人口统计学因素相关。先前研究发现,在缺乏特定应答分类群的情况下,微生物组干预可能对宿主产生有害影响。因此,对一个群体有效的干预措施可能对另一个群体有害。目前,我们尚不清楚这些针对特定人群的干预措施的效果,因为大多数研究是在工业化国家进行的,而在非工业化人口中的实施相对较少。
这些观察结果为启动大型基于微生物组的分析研究奠定了基础,以确定不同人群的正常微生物组参考。
提高对人群正常微生物组构成的理解需要在多个方面进行重点研究。
1
增强非工业化国家和不同地域的微生物组数据
这应包括整个非洲和特定的亚洲次区域的微生物组采样和测序。全世界范围来说,需要整个非洲和特定的亚洲次区域的微生物组采样和测序。国内的样本数据量,相对东部来说,西部地区人群的肠道样本量偏少,尤其青海,西藏或一些偏远的山区等。群体水平的微生物组测序项目应包括代表整个群体的不同个体亚群的数据。
2
促进前瞻性队列研究
微生物和疾病和其他相关健康指标的探索和确定需要更多的前瞻性队列研究。
前瞻性队列有两大优势。首先,确定了纵向微生物组稳定性和弹性的功能决定因素(换句话说,微生物组的生态健康)。其次,它们有助于识别疾病特异性风险相关的微生物组配置。
因此,纵向研究对于完善可能被认为是正常的微生物组至关重要。
3
整合宿主相关多组学、人口统计学和生活方式与微生物组的分析
将宿主相关的基本信息、健康数据(人口统计、饮食和药物使用)与微生物组分析相结合,确定相关的菌群特征分类群,将有助于研究宿主适应的机制基础,并进一步帮助识别与某些疾病未来发展相关的个体(和微生物组特征)。
4
改进鉴定微生物组和宿主健康功能决定因素的方法
将宿主相关的健康数据(人口统计、饮食和药物使用)与微生物组分析相结合,将有助于研究宿主适应的机制基础,并进一步帮助识别与某些疾病未来发展相关的个体(和微生物组特征)。
谷禾多年来一直从事微生物的研究和检测实践,我们收集和整理了世界范围内包含肠道微生物组数据的主要人群队列研究。我们特别关注了欧洲的大型研究计划(这些研究建立了广泛的生物样本库和详细的表型数据收集协议)、规模可观的中国人群研究(这些研究提供了亚洲人群肠道微生物群特征的见解),以及美国的目标性研究(这些研究结合了普通人群采样和特定疾病调查)。总结这些队列的关键特征,包括研究设计、人群统计学特征、数据收集方法和数据可及性,此外,每项队列还简要描述了每个队列的特点,突出了不同人群之间的共性和差异,为研究人员提供有价值的参考资源。理解这些现有资源可以促进未来的研究合作,实现跨队列的荟萃分析,并指导新的微生物组研究的设计。
谷禾长期专注于肠道菌群研究和临床转化,通过对全球肠道菌群队列数据以及谷禾数十万肠道菌群样本数据的整合,目前已清洗整理超200万例以肠道菌群数据为核心,涵盖临床病例、饮食调查、代谢指标以及蛋白和临床检测在内的超大规模样本队列数据。有效的整合和利用这些数据将能极大的推动肠道菌群在健康和医疗领域的落地和解析肠道菌群与全维度生物表征的内在关联。
例如,瑞典 SCAPIS 队列:
队列基本信息
来源和设计:
SCAPIS(The Swedish CArdioPulmonary BioImage Study)是一项前瞻性的人群基础观察研究,旨在改善心血管疾病、慢性阻塞性肺病和相关代谢紊乱的风险预测和理解。
研究在瑞典的六个市政区域进行,参与者为50至65岁的男性和女性。
人群数量:
总共招募了30,154名参与者。
本研究基于来自乌普萨拉和马尔默两个研究地点的11,287名参与者的子集。
数据收集:
参与者在家中收集粪便样本,并在研究中心进行血液样本采集。
粪便样本用于宏基因组分析,血浆样本用于代谢组学分析。
最终,8,583名参与者的数据被用于分析,这些参与者拥有高质量的宏基因组和代谢组学数据。
数据访问
数据存储和访问:
匿名化的宏基因组测序数据已存储在欧洲核苷酸档案中。
代谢组学分析由Metabolon公司在美国德克萨斯州进行,部分光谱数据存储在MetaboLights中。
由于数据包含敏感的个人信息,需通过瑞典伦理审查委员会和SCAPIS数据访问委员会的批准才能获取。
研究人员需获得伦理批准,并遵循SCAPIS数据访问委员会的申请程序和条件。
通过这些策略,可以帮忙我们更全面、更精准地理解人体微生物组与健康的复杂关系,为未来的精准医疗和个性化干预奠定坚实的数据库基础。

主要参考文献
Shete O, Ghosh TS. Normal Gut Microbiomes in Diverse Populations: Clinical Implications. Annu Rev Med. 2024 Nov 18.
Fan Y, Pedersen O. 2021. Gut microbiota in human metabolic health and disease. Nat. Rev. Microbiol.19:55–71
Mayer EA, Nance K, Chen S. 2022. The gut–brain axis. Annu. Rev. Med. 73:439–53
Ruff WE, Greiling TM, Kriegel MA. 2020. Host–microbiota interactions in immune-mediated diseases.Nat. Rev. Microbiol.18:521–38
Ghosh TS, Shanahan F, O’Toole PW. 2022. Toward an improved definition of a healthy microbiome for
healthy aging. Nat. Aging 2:1054–69
He Y, Wu W, Zheng HM, et al. 2018. Regional variation limits applications of healthy gut microbiome reference ranges and disease models. Nat. Med. 24:1532–35

谷禾健康
《中华人民共和国生物安全法》于2021年4月15日起正式施行。

《中华人民共和国生物安全法》是生物安全领域的一部基础性、综合性、系统性、统领性法律。其颁布和实施具有里程碑意义,标志着我国生物安全进入依法治理的新阶段。
生物安全风险防控体制
防控重大新发突发传染病、动植物疫情
生物技术研究、开发与应用安全
病原微生物实验室生物安全
人类遗传资源与生物资源安全
防范生物恐怖与生物武器威胁
生物安全能力建设
此次,关于病原微生物实验室生物安全管理章节,明确以下内容:
第四十二条 严格遵守生物安全标准
国家加强对病原微生物实验室生物安全的管理,制定统一的实验室生物安全标准。病原微生物实验室应当符合生物安全国家标准和要求。
从事病原微生物实验活动,应当严格遵守有关国家标准和实验室技术规范、操作规程,采取安全防范措施。
第四十三条 具备条件,符合规范
国家根据病原微生物的传染性、感染后对人和动物的个体或者群体的危害程度,对病原微生物实行分类管理。
从事高致病性或者疑似高致病性病原微生物样本采集、保藏、运输活动,应当具备相应条件,符合生物安全管理规范。具体办法由国务院卫生健康、农业农村主管部门制定。
第四十四条 依法批准或备案
设立病原微生物实验室,应当依法取得批准或者进行备案。
个人不得设立病原微生物实验室或者从事病原微生物实验活动。
第四十五条 实验室分等级管理
国家根据对病原微生物的生物安全防护水平,对病原微生物实验室实行分等级管理。
从事病原微生物实验活动应当在相应等级的实验室进行。低等级病原微生物实验室不得从事国家病原微生物目录规定应当在高等级病原微生物实验室进行的病原微生物实验活动。
第四十六条 高致病性经有关部门批准
高等级病原微生物实验室从事高致病性或者疑似高致病性病原微生物实验活动,应当经省级以上人民政府卫生健康或者农业农村主管部门批准,并将实验活动情况向批准部门报告。
对我国尚未发现或者已经宣布消灭的病原微生物,未经批准不得从事相关实验活动。
第四十七条 加强实验动物和废弃物管理
病原微生物实验室应当采取措施,加强对实验动物的管理,防止实验动物逃逸,对使用后的实验动物按照国家规定进行无害化处理,实现实验动物可追溯。禁止将使用后的实验动物流入市场。
病原微生物实验室应当加强对实验活动废弃物的管理,依法对废水、废气以及其他废弃物进行处置,采取措施防止污染。
第四十八条 定期检查、维护、更新
病原微生物实验室的设立单位负责实验室的生物安全管理,制定科学、严格的管理制度,定期对有关生物安全规定的落实情况进行检查,对实验室设施、设备、材料等进行检查、维护和更新,确保其符合国家标准。
病原微生物实验室设立单位的法定代表人和实验室负责人对实验室的生物安全负责。
第四十九条 建立完善安全保卫制度
病原微生物实验室的设立单位应当建立和完善安全保卫制度,采取安全保卫措施,保障实验室及其病原微生物的安全。
国家加强对高等级病原微生物实验室的安全保卫。高等级病原微生物实验室应当接受公安机关等部门有关实验室安全保卫工作的监督指导,严防高致病性病原微生物泄漏、丢失和被盗、被抢。
国家建立高等级病原微生物实验室人员进入审核制度。进入高等级病原微生物实验室的人员应当经实验室负责人批准。对可能影响实验室生物安全的,不予批准;对批准进入的,应当采取安全保障措施。
第五十条 制定安全应急预案
病原微生物实验室的设立单位应当制定生物安全事件应急预案,定期组织开展人员培训和应急演练。发生高致病性病原微生物泄漏、丢失和被盗、被抢或者其他生物安全风险的,应当按照应急预案的规定及时采取控制措施,并按照国家规定报告。
第五十一条 提高医疗救治能力
病原微生物实验室所在地省级人民政府及其卫生健康主管部门应当加强实验室所在地感染性疾病医疗资源配置,提高感染性疾病医疗救治能力。
第五十二条 企业微生物车间规范管理
企业对涉及病原微生物操作的生产车间的生物安全管理,依照有关病原微生物实验室的规定和其他生物安全管理规范进行。
涉及生物毒素、植物有害生物及其他生物因子操作的生物安全实验室的建设和管理,参照有关病原微生物实验室的规定执行。
生物安全实验室主要分为2类:
病原微生物生物安全实验室和动物生物安全实验室,前者主要用于研究病原微生物,后者用于开展病原微生物感染动物的实验。
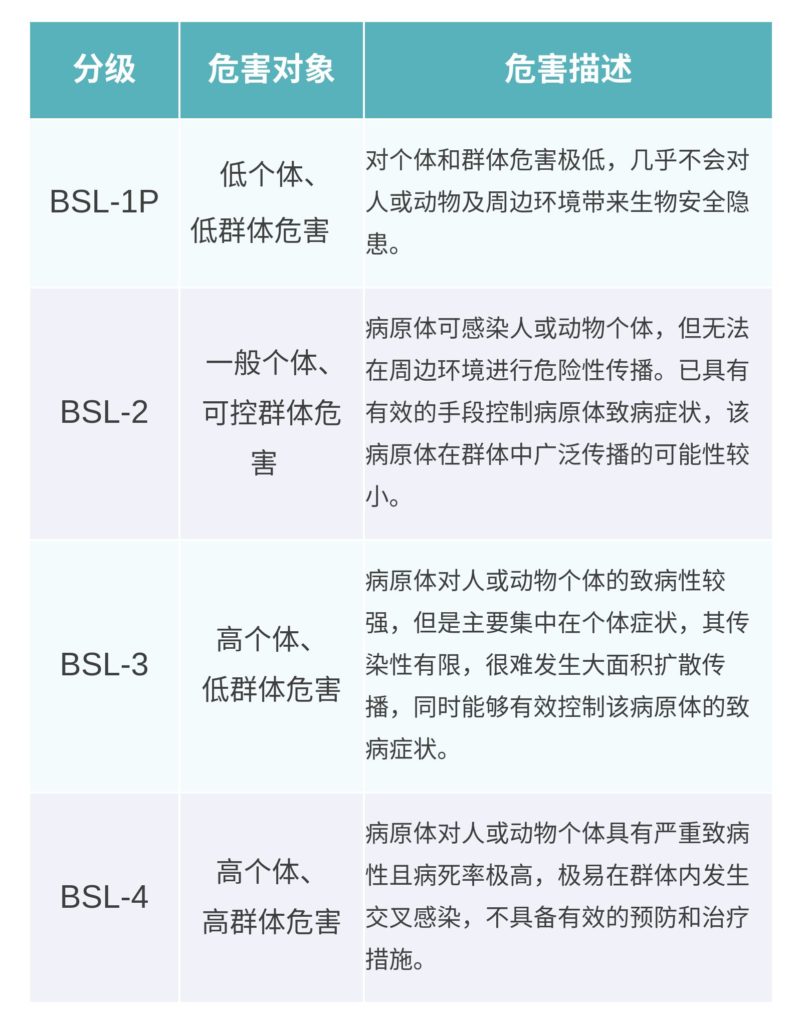
CHEN Jiejun.Journal of Biosafety.2018
6.2 BSL-1 实验室
6.2.1 应为实验室仪器设备的安装、清洁和维护、安全运行提供足够的空间。
6.2.2 实验室应有足够的空间和台柜等摆放实验室设备和物品。
6.2.3 在实验室的工作区外应当有存放外衣和私人物品的设施,应将个人服装与实验室工作服分开放置。
6.2.4 进食、饮水和休息的场所应设在实验室的工作区外。
6.2.5 实验室墙壁、顶板和地板应当光滑、易清洁、防渗漏并耐化学品和消毒剂的腐蚀。地面应防滑,不得在实验室内铺设地毯。
6.2.6 实验室台(桌)柜和座椅等应稳固和坚固,边角应圆滑。实验台面应防水,并能耐受中等程度的热、有机溶剂、酸碱、消毒剂及其他化学剂。
6.2.7 应根据工作性质和流程合理摆放实验室设备、台柜、物品等,避免相互干扰、交叉污染,并应不妨碍逃生和急救。台(桌)柜和设备之间应有足够的间距,以便于清洁。
6.2.8 实验室应设洗手池,水龙头开关宜为非手动式,宜设置在靠近出口处。
6.2.9 实验室的门应有可视窗并可锁闭,并达到适当的防火等级,门锁及门的开启方向应不妨碍室内人员逃生。
6.2.10 实验室可以利用自然通风,开启窗户应安装防蚊虫的纱窗。如果采用机械通风,应避免气流流向导致的污染和避免污染气流在实验室之间或与其他区域之间串通而造成交叉污染。
6.2.11 应保证实验室内有足够的照明,避免不必要的反光和闪光。
6.2.12 实验室涉及刺激性或腐蚀性物质的操作,应在 30 m 内设洗眼装置,风险较大时应设紧急喷淋装置。
6.2.13 若涉及使用有毒、刺激性、挥发性物质,应配备适当的排风柜(罩)。
6.2.14 若涉及使用高毒性、放射性等物质,应配备相应的安全设施设备和个体防护装备,应符合国家、地方的相关规定和要求。
6.2.15 若使用高压气体和可燃气体,应有安全措施,应符合国家、地方的相关规定和要求。
6.2.16 应有可靠和足够的电力供应,确保用电安全。
6.2.17 应设应急照明装置,同时考虑合适的安装位置,以保证人员安全离开实验室。
6.2.18 应配备足够的固定电源插座,避免多台设备使用共同的电源插座。应有可靠的接地系统,应在关键节点安装漏电保护装置或监测报警装置。
6.2.19 应满足实验室所需用水。
6.2.20 给水管道应设置倒流防止器或其他有效的防止回流污染的装置;给排水系统应不渗漏,下水应有防回流设计。
6.2.21 应配备适用的应急器材,如消防器材、意外事故处理器材、急救器材等。
6.2.22 应配备适用的通讯设备。
6.2.23 必要时,可配备适当的消毒、灭菌设备。
6.3 BSL-2 实验室
6.3.1 普通型 BSL-2 实验室
6.3.1.1 适用时,应符合 6.2 的要求。
6.3.1.2 实验室主入口的门、放置生物安全柜实验间的门应可自动关闭;实验室主入口的门应有进入控制措施。
6.3.1.3 实验室工作区域外应有存放备用物品的条件。
6.3.1.4 应在实验室或其所在的建筑内配备压力蒸汽灭菌器或其他适当的消毒、灭菌设备,所配备的消毒、灭菌设备应以风险评估为依据。
6.3.1.5 应在实验室工作区配备洗眼装置,必要时,应在每个工作间配备洗眼装置。
6.3.1.6 应在操作病原微生物及样本的实验区内配备二级生物安全柜。
6.3.1.7 应按产品的设计、使用说明书的要求安装和使用生物安全柜。
6.3.1.8 如果使用管道排风的生物安全柜,应通过独立于建筑物其他公共通风系统的管道排出。
6.3.1.9 实验室入口应有生物危害标识,出口应有逃生发光指示标识。
6.3.2 加强型 BSL-2 实验室
6.3.2.1 适用时,应符合 6.3.1 的要求。
6.3.2.2 加强型 BSL-2 实验室应包含缓冲间和核心工作间。
6.3.2.3 缓冲间可兼作防护服更换间。必要时,可设置准备间和洗消间等。
6.3.2.4 缓冲间的门宜能互锁。如果使用互锁门,应在互锁门的附近设置紧急手动互锁解除开关。
6.3.2.5 实验室应设洗手池;水龙头开关应为非手动式,宜设置在靠近出口处。
6.3.2.6 采用机械通风系统,送风口和排风口应采取防雨、防风、防杂物、防昆虫及其他动物的措施,送风口应远离污染源和排风口。排风系统应使用高效空气过滤器。
6.3.2.7 核心工作间内送风口和排风口的布置应符合定向气流的原则,利于减少房间内的涡流和气流死角。
6.3.2.8 核心工作间气压相对于相邻区域应为负压,压差宜不低于10Pa. 在核心工作间入口的显著位置,应安装显示房间负压状况的压力显示装置。
6.3.2.9 应通过自动控制措施保证实验室压力及压力梯度的稳定性,并可对异常情况报警。
6.3.2.10 实验室的排风应与送风连锁,排风先于送风开启,后于送风关闭。
6.3.2.11 实验室应有措施防止产生对人员有害的异常压力,围护结构应能承受送风机或排风机异常时导致的空气压力载荷。
6.3.2.12 核心工作间温度18 ℃~26 ℃,噪音应低于68 dB。
6.3.2.13 实验室内应配置压力蒸汽灭菌器,以及其他适用的消毒设备。

生物安全柜的排风系统中装有高效空气过滤器 (HEPA),它能有效地截留所有已知传染因子, 对于直径 0.3 μm 的颗粒它可以截留 99.97%, 对大于或小于直径0.3μm 颗粒它可以截留 99.99%,并确保从安全柜中排出的是不含微生物的空气。
因此正确使用生物安全柜可以有效地减少由于气溶胶暴露或溅出物所造成的实验室污染以及培养物等交叉污染,减少对环境和人身安全所造成的危害,有效地保护实验室人员的健康与安全,减少职业暴露的发生。
生物安全实验室的关键设备:

·生物安全柜安装位置应避开人流频繁处;
· 安全柜安装的周围和电源处要留出足够的空间;
· 操作人员要经过专业培训方可上岗;
· 操作者必须穿戴紧口长纤维易灭菌的洁净工作服、帽、口罩;
· 操作过程中,台面不能存放过多物品;
· 操作时,操作者的双臂以直线方向缓慢伸入生物安全柜,并至少静止1min,使柜内气流相对稳定后再进行操作;
· 操作者头部、身体严禁伸到操作区内,操作动作应控制在最小程度;
· 应该按照从清洁区、半污染区到污染区的方向进行,防止交叉污染;
·实验完成后,对所有从安全柜取出的器材和物品均要进行严格的消毒处理。
只有了解生物安全柜的性能、结构、防护级别及一些注意事项,正确使用生物安全柜,才能针对自己实验室选择适合本实验室使用生物安全柜,保护实验环境不受污染,有效地减少由于气溶胶暴露或有害气体扩散所造成实验室感染事件的发生,规避感染风险。


《生物安全法》为促进我国生物技术产业发展提供了法律保障,筑牢生物安全法治“防火墙”。
谷禾实验室作为二级病原微生物安全实验室,全面贯彻落实法律规定的重要制度,严格遵守管理规范,防止生物安全风险发生,做好《生物安全法》落地实施“主力军”,让用户更放心的同时,也为国家科研、健康产业的发展,人民幸福安康贡献自己的力量。
参考资料:
《中华人民共和国生物安全法》
病原微生物实验室生物安全通用准则. WS 233—2017
孟宪军, 史志旭. 加强生物安全柜正确使用规避感染风险[D]. , 2010.