-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
让食物成为你的药物,让药物成为你的食物
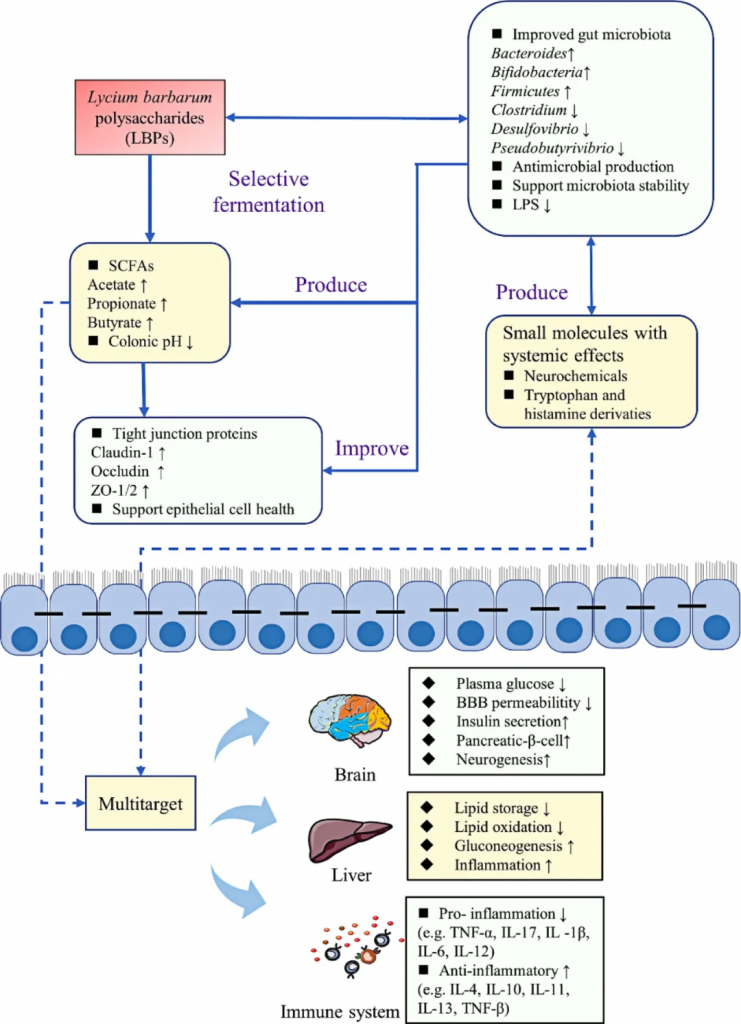
随着现代生活节奏的加快,疲劳、压力、不均衡的饮食,都在悄悄侵蚀着我们的健康。多糖,这些来自植物、真菌乃至海洋生物的天然赠礼,正以其独特的方式,为我们提供了一种全新的健康支持。
多糖由单糖通过糖苷键结合而成的高分子碳水化合物。研究表明,多糖具有多种生物活性,包括调节免疫功能、降低血脂和血糖、抗癌、抗病毒、抗肥胖、抗精神病、抗氧化、抗炎、抗凝血、止吐、抗辐射等作用。因此,多糖已成为最重要的天然成分之一,并引起了世界上越来越多研究者的关注。
虽然部分多糖如淀粉可以在人体胃和小肠中被消化吸收,但仍有许多特殊结构的多糖不能在这两个部位分解。对于那些不能被宿主消化的多糖,它们可以进入结肠,而结肠是大多数肠道菌群居住的地方。在结肠中,多糖可以与肠道菌群相互作用,从而发挥营养或药理作用。
多糖与肠道菌群之间相互作用可以影响健康,同时也通过肠道菌群的代谢作用,转化为有益的代谢产物,如短链脂肪酸,这些产物对维持肠道屏障的完整性、调节免疫反应发挥着至关重要的作用,甚至扩展到了全身的健康状况,可以影响我们的精力水平、情绪状态,对疾病的抵抗力等方方面面。
本文将深入探讨多糖,了解其在人体内的消化过程、与肠道菌群的相互作用,以及它们如何通过调节肠道菌群代谢物影响健康,如短链脂肪酸、三甲胺、色氨酸,还讨论了多糖在疾病预防和治疗中的应用,包括它们在改善代谢性疾病、炎症性肠病、缓解疲劳、改善肿瘤,神经系统疾病等方面的潜在效果。这为靶向肠道菌群开发新型的营养补充剂和药物提供了新的思路。

本文目录
01 多糖
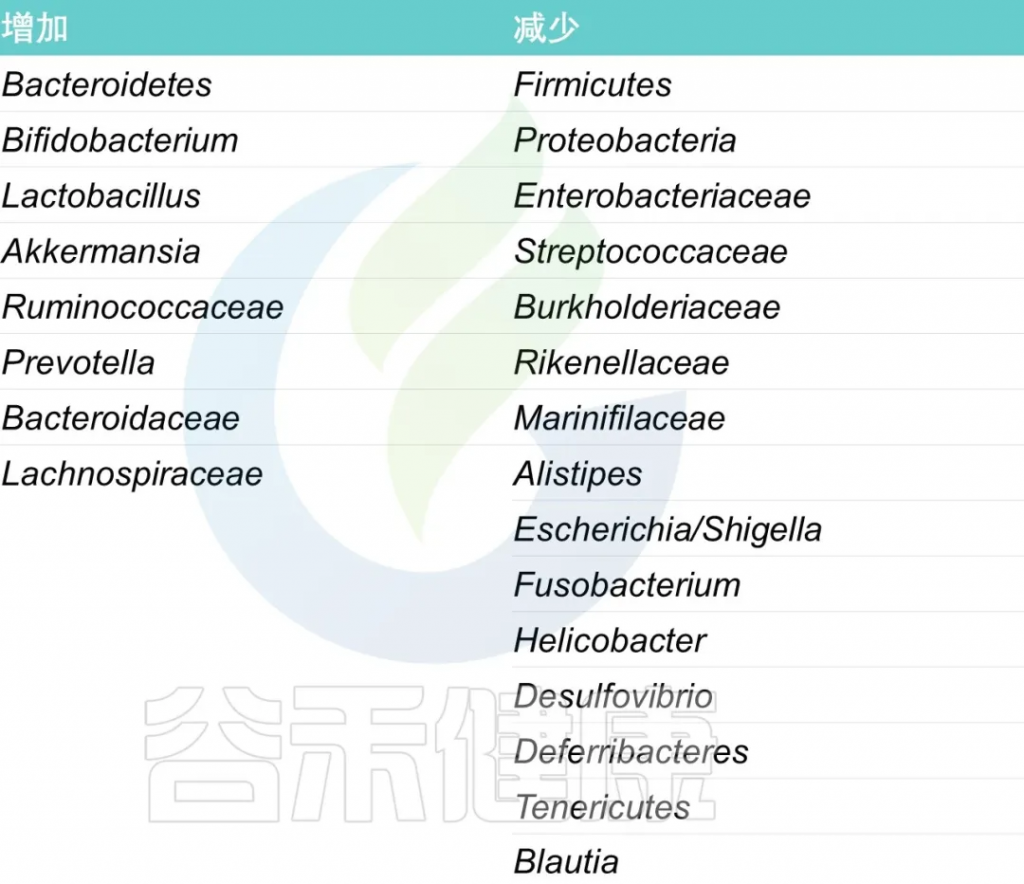
02 多糖调节肠道菌群的组成
为什么多糖可以调节肠道菌群的组成?
多糖促进或抑制肠道微生物群
多糖分子量、糖苷键影响其细菌调节活性
03 肠道微生物将多糖代谢为短链脂肪酸
短链脂肪酸的生物学效应
人体内的多糖代谢
多糖补充与短链脂肪酸的生成
04 多糖调节其他肠道微菌群代谢物
三甲胺和氧化三甲胺(TMAO)
色氨酸及其代谢产物
胆汁酸、脂多糖、胃肠道气体
05 多糖调节肠道菌群修复肠道屏障
06 多糖通过肠道菌群改善疾病
2型糖尿病、非酒精性脂肪肝、肥胖、高血脂症
炎症性肠病、其他肠胃疾病、肿瘤
疲劳、神经系统疾病(认知障碍、抑郁等)
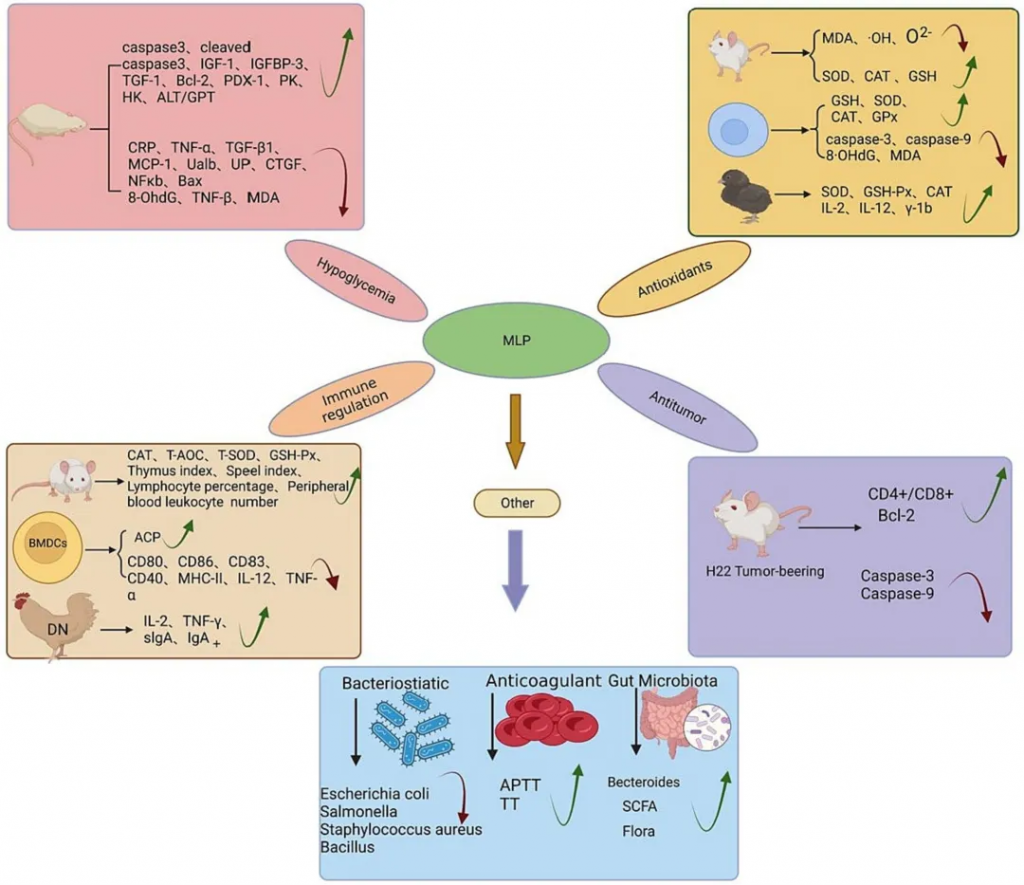
07 部分多糖营养与菌群调节
路易波士茶多糖、地黄多糖、五指毛桃根多糖
大蒜多糖、槐耳多糖、黄芩多糖、枸杞多糖
岩藻多糖、桑叶多糖、沙棘多糖、蘑菇多糖
08 结语
糖,这个小小的分子,是能量的源泉,是细胞的加油站。除了我们熟知的葡萄糖以外,还有一种叫做多糖,由许多糖分子手拉手组成,从植物的根茎到海洋生物的细胞壁,它们以复杂多样的形态存在。
根据糖单元的数量,碳水化合物可分为几类:
多糖是由多个单糖分子通过糖苷键连接而成的聚合物,属于高分子碳水化合物。它们广泛存在于自然界中,包括植物、真菌和海藻等生物体内。根据其来源和结构特性,多糖具有多种生物活性,如免疫调节、抗氧化、抗肿瘤等。
多糖是由10个以上相同或不同的单糖通过α或β糖苷键连接而成的大分子化合物,分子量从几万到数百万。
多糖的空间构象非常复杂,具有一级、二级、三级和四级结构。研究表明,多糖的活性与其结构密切相关。此外,通过分子修饰,如乙酰化、硫酸化、羧甲基化、硒化、磷酸化和磺化等可显著提高多糖的生物活性。
根据来源和结构的不同,多糖可以分为天然多糖和合成多糖,其中天然多糖又可根据其在自然界中的分布分为植物多糖、动物多糖、微生物多糖等。
例如,透明质酸和硫酸软骨素属于动物多糖,而纤维素、淀粉和糖原是常见的植物多糖。
淀粉
由大量葡萄糖分子通过α-1,4-糖苷键和α-1,6-糖苷键连接而成,形成直链淀粉和支链淀粉两种结构。广泛存在于谷物(如大米、小麦、玉米)、薯类(如土豆、红薯)等食物中。在人体消化过程中,被淀粉酶逐步分解为葡萄糖,为身体提供能量。
纤维素
由葡萄糖分子通过β-1,4-糖苷键连接而成,形成长而直的链状结构。是植物细胞壁的主要成分,在蔬菜(如芹菜、菠菜)、水果(如苹果)中含量丰富。由于人体缺乏分解β-1,4-糖苷键的酶,纤维素难以被人体消化吸收,但对促进肠道蠕动、预防便秘等具有重要作用。
果胶
是一种复杂的多糖,由半乳糖醛酸等组成。常见于水果(如柑橘、苹果)中。在食品工业中,常用于制作果酱、果冻等,增加其黏稠度和稳定性。
尽管功能性糖因其在健康和疾病预防中的潜在作用而受到越来越多的关注,但它们的天然可用性相对较小。这意味着,为了充分利用这些有益的分子,需要采用特定的提取方法来增加它们的可获得性,多糖提取常用的方法有热水提取、酸提取、碱提取和酶水解等。
近年来,一些新的方法,如超声波提取、微波提取、超滤、高压电场法、超临界流体萃取、亚临界水萃取等也用于多糖的提取。这些方法不仅能够提高多糖的提取率,还能够在一定程度上保护多糖的结构完整性,从而保留其生物活性。
通常,人体分泌的消化酶只能分解几种多糖,而纤维等许多多糖不能被吸收和直接使用。因此,多糖可以通过小肠进入结肠,这是大多数肠道细菌居住的地方,然后与肠道微生物群相互作用。
细菌在肠道中通过发酵降解多糖
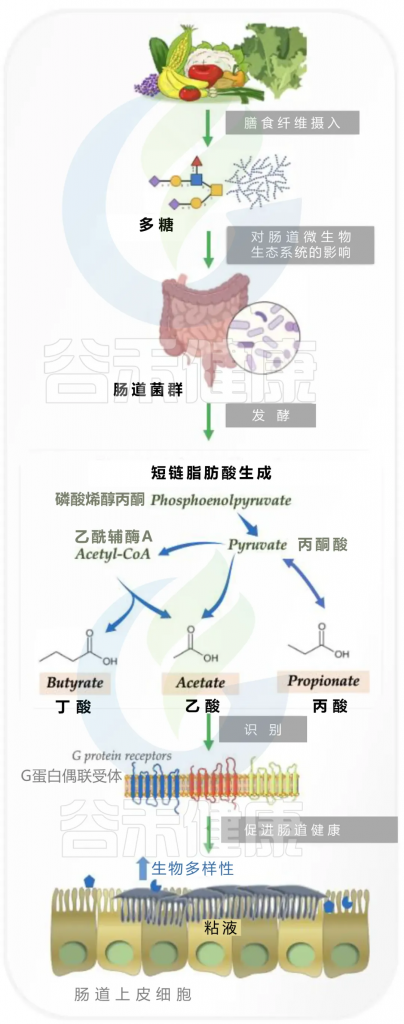
doi.org/10.3390/nu14194116
多糖转化为短链脂肪酸
首先与多糖能够发酵生成酸性的短链脂肪酸密切相关。未电离的短链脂肪酸能够穿过细菌细胞膜,对肠道细菌产生一系列影响,例如改变DNA合成和氨基酸摄取。
短链脂肪酸对肠道细菌的影响
例如,短链脂肪酸能够通过调节侵袭基因的表达,抑制沙门氏菌(一种常见的食源性病原体)的生长。因此,短链脂肪酸的增加可以改变肠道菌群的功能,进而影响其组成。
肠道pH值的变化
短链脂肪酸的增加还会导致肠道pH值下降,影响细菌的适应能力。每种细菌都有其适宜的pH范围,不同细菌在特定pH条件下的适应能力各异。
多糖的降解产物作为能量来源
多糖对肠道菌群组成的调节作用还与其降解产物有关。一些肠道细菌能够利用多糖的降解产物作为碳源和能量来源,而另一些细菌则不能。
综上所述,多糖通过影响肠道菌群的代谢功能,直接调节了肠道菌群的组成。这些发现为我们理解多糖如何通过肠道菌群影响宿主健康提供了新的视角。
多糖的益生元效应
具有选择性刺激有益微生物生长能力的多糖被称为益生元,例如果聚糖,它能丰富乳酸菌和/或双歧杆菌。这些有益细菌的减少与糖耐量受损密切相关。一些多糖能够丰富这些细菌,因此可以用来改善糖尿病表型。
多糖抑制病原菌
病原菌在胃肠道中的定植和增加会导致一系列疾病,而抑制它们可以控制疾病的严重程度。例如,致病性 Sutterella、Desulfovibrionaceae、Streptococcaceae 、Clostridium 的比例较高与肥胖发展呈正相关。
多糖的双向调节作用
疾病的发生是一个复杂的过程,涉及不同的微生物,包括有害细菌和有益细菌。例如:
多糖能够对肠道微生物发挥双向调节作用,即促进有益细菌的同时抑制有害细菌。
例如,口服灰树花多糖(GFHP)对非酒精性脂肪肝病的积极作用与调节肠道菌群有关。
在分子量方面,不同分子量的魔芋葡聚糖(KGM)对2型糖尿病(T2DM)大鼠的降血糖作用研究表明,中等分子量的KGM显著增加了Muribaculaceae,减少了Romboutsia和Klebsiella,但高分子量和低分子量的KGM对这些细菌的影响不显著。
灵芝的低分子量多糖(<10 kDa)具有更好的发酵和更高的产气能力,刺激肠道细菌快速生长。另一方面,高分子量多糖(>100 kDa)更难被肠道细菌发酵,并且在肠道中的停留时间更长,导致对肠道微生物群的影响更长。
高分子量的黄芪多糖具有一定的生物活性,但其相对分子量较大,溶解性差,生物利用度低,限制了其功效的发挥。低分子量的黄芪多糖具有较好的水溶性,能够在更大程度上刺激巨噬细胞摄取中性红、NK细胞增殖,发挥免疫活性。
多糖由各种通过糖苷键连接的单糖组成,糖苷键的类型和位置导致肠道微生物群的选择性发酵存在差异。
多糖的单糖组成越复杂,调节细菌的活性越强
一项关于龙眼多糖和燕麦多糖的研究表明,龙眼多糖能显著促进干酪乳杆菌、嗜酸乳杆菌、植物乳杆菌、粪肠球菌的增殖,但燕麦多糖的作用并不明显。原因是龙眼多糖由葡萄糖、甘露糖和阿拉伯糖组成,而燕麦多糖的单糖主要是葡萄糖。
短链脂肪酸(SCFA)是一组含有少于六个碳的脂肪酸,包括甲酸盐、乙酸盐、丙酸盐、丁酸盐、戊酸盐。
乙酸盐、丙酸盐和丁酸盐是肠道中的主要SCFA,约占所有SCFA的95%,三者的比例约为3:1:1。
作为肠道微生物群和宿主的重要能量来源,短链脂肪酸通过不同的作用模式在健康和疾病中发挥着重要作用。
作用机制
与GPRs的相互作用
抗炎作用
免疫调节
HDAC抑制作用
丁酸盐的作用
与疾病的关系
多糖对SCFA的调节及其对靶标的影响
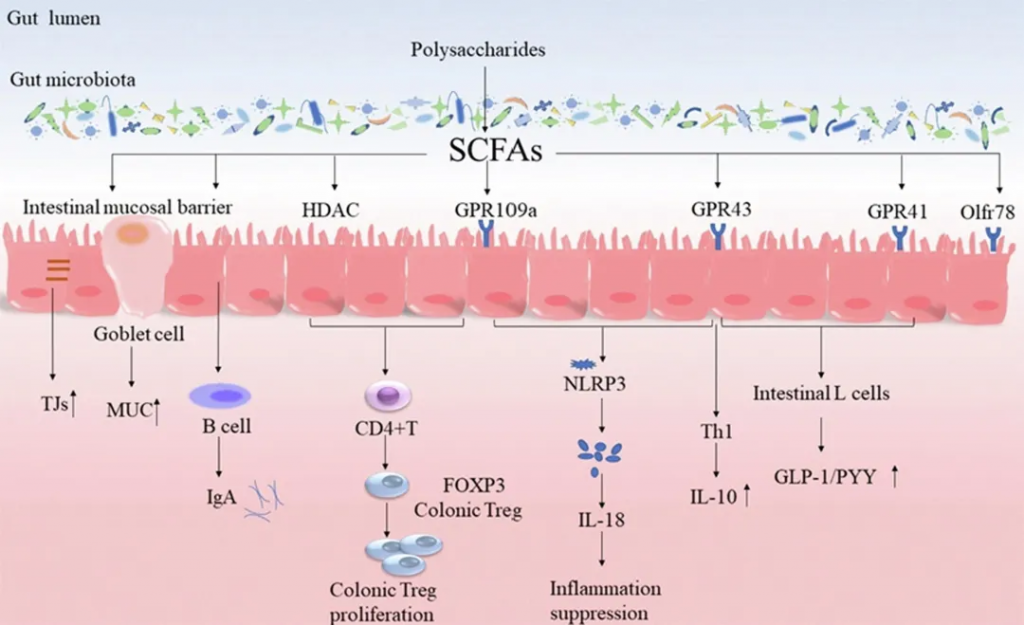
doi.org/10.1016/j.foodres.2022.111653
人体内消化酶的局限
在人体消化系统中,我们自身分泌的消化酶往往难以分解复杂的多糖。这些多糖分子,因其结构复杂,通常在我们体内无法被有效代谢。
肠道菌群的代谢作用
我们的肠道菌群拥有破解这些复杂多糖的秘密武器——一系列的酶,统称为碳水化合物酶(CAZymes)。这些酶能够分解多糖,将其转化为对人体健康有益的短链脂肪酸。
碳水化合物酶的种类
肠道菌群中的“专家”与“通才”
在肠道菌群中,拟杆菌门和厚壁菌门是编码CAZymes的两大主力。
多糖的初步降解
在属的水平上,多糖最初可以由某些微生物降解,例如双歧杆菌属、真杆菌属、梭菌属、罗氏菌属(Roseburia spp.)。
SCFAs的生成途径
尽管人体自身无法分解复杂的多糖,但我们的肠道菌群却具备了这一能力,它们通过一系列特殊的酶,将多糖转化为对人体健康有益的短链脂肪酸。
多糖对SCFAs生成的促进作用
饮食补充多糖可以为产生SCFAs的细菌提供有利的生长环境,从而促进SCFAs的生成。例如,沙棘多糖(CCPP)通过调节肠道菌群和SCFAs,能够缓解2型糖尿病。
沙棘多糖调节肠道菌群和SCFAs,缓解2型糖尿病
枸杞多糖调节肠道菌群,提高SCFAs
多糖结构对短链脂肪酸生成的影响
不同的多糖因其分子结构的不同,对SCFAs的调节作用也不尽相同。
多糖的疗效与SCFAs的非直接关联
尽管大多数多糖可以被代谢成SCFAs,但它们的疗效并不一定与SCFAs直接相关。
多糖通过调节肠道菌群和促进SCFAs的产生,对健康具有多方面的益处。然而,多糖的结构与它们对SCFAs生成的调节作用之间的关系仍需进一步研究。此外,多糖的疗效可能不仅限于SCFAs的产生,还可能涉及肠道菌群产生的其他分子。
在肠道微生物群的作用下,脂质和蛋白质等饮食成分可以代谢为一系列代谢产物,如三甲胺-N-氧化物(TMAO)、色氨酸、脂多糖(LPS)等。此外,肠道微生物群还可以与宿主合成和释放的化合物相互作用。例如,肠道微生物群可以将初级胆汁酸(BA)转化为次级胆汁酸。由于肠道微生物群的组成与肠道微生物群代谢物的产生直接相关,因此可以推断,除了SCFAs,多糖还可以调节其他肠道微生物群代谢产物,如BA。
三甲胺和TMAO的代谢过程
在肠道中,饮食中的四胺类物质如胆碱、L-肉碱和卵磷脂(来自红肉、鸡蛋、鱼、海鲜)首先被微生物胆碱三甲胺裂解酶分解成三甲胺(TMA)。随后,TMA被吸收进入门脉循环,并运输到肝脏,在黄素单加氧酶1和黄素单加氧酶3的作用下转化为三甲胺-N-氧化物(TMAO)。
TMAO的潜在危害
值得注意的是,TMAO是一种潜在的有害代谢产物。多项研究指出,TMAO水平的增加与多种疾病的发生和发展呈正相关。例如,TMAO可以直接增强血小板的反应性,促进血栓形成,并通过激活核因子κB(NF-κB)和NLRP3炎症体影响血管炎症。
多糖对TMA和TMAO代谢的影响
最近的研究表明,TMA和TMAO在理解多糖的作用机制中扮演重要角色。例如:
不同多糖对肠道菌群的调节作用
不同的多糖可以通过调节相同的肠道细菌来降低TMA和TMAO的代谢,例如变形菌门。研究表明,变形菌门负责TMA的转化,增加变形菌门可能导致TMA增加。然而,也有研究表明TMAO与变形菌门呈负相关,这表明多糖调节变形菌门与TMA产生的效应之间的关系需要进一步研究。
多糖通过调节肠道菌群,影响TMA和TMAO的代谢,从而可能对人体健康产生积极影响。然而,多糖与TMAO之间的关系复杂,需要更多的研究来阐明这些相互作用的确切机制。
色氨酸代谢的重要性
色氨酸(Trp)是人体必需的氨基酸。它的代谢可以分为内源性代谢和细菌性代谢。内源性代谢主要通过犬尿氨酸途径(KP)和5-羟色氨酸途径进行,前者产生犬尿氨酸(KYN)、犬尿酸(KA)、烟酸、黄嘌呤酸等,后者转化为5-羟色氨酸(5-HT)和褪黑素。
色氨酸代谢物的生理功能
增强免疫:色氨酸可加强免疫力,减少炎症。
神经保护:KA作为谷氨酸受体拮抗剂,具有神经保护和抗惊厥作用,还能调节能量代谢。
情绪调节:5-HT作为神经递质,可调节情绪、肠道通透性和肠道蠕动。
肠道菌群在色氨酸代谢中的作用
肠道细菌代谢色氨酸产生吲哚及其衍生物,如吲哚丙酸、吲哚乙酸等,这些物质可以缓解炎症,促进肠道上皮屏障功能。肠道菌群的色氨酸代谢异常与肠易激综合症、代谢综合症和结肠癌等疾病有关。例如,结肠癌患者常伴有色氨酸水平下降和KP代谢物水平升高。
多糖影响肠道微生物色氨酸代谢,从而改善疾病
吲哚是硫酸吲哚酚的前体,是一种蛋白结合尿毒症毒素,是心血管疾病的危险因素。对于患有终末期肾病心血管疾病的患者,吲哚水平升高,患者粪便中产吲哚细菌丰富。
总的来说,多糖可以通过调节肠道菌群来改变色氨酸代谢,最常见的是增加乳杆菌和阿克曼菌,从而缓解疾病。
胆汁酸的生物合成与功能
胆汁酸(BAs)是一类由肝脏产生的特殊类固醇分子,经过肠道菌群转化。肝脏中存在两种BA生物合成途径:
CA和CDCA是体内的主要胆汁酸。经过肠道菌群的改造,CA转化为脱氧胆酸(DCA),CDCA转化为鹅去氧胆酸(LCA)。
胆汁酸受体及其作用
胆汁酸受体包括细胞表面受体和细胞内受体。细胞表面受体包括TGR5,细胞内受体包括法尼酰X受体FXR、孕烷X受体、维生素D3受体(VDR)和组成型雄烷受体。胆汁酸通过激活相应的受体调节脂质、葡萄糖和能量代谢。例如,TGR5和VDR的激活导致GLP-1和FGF19分泌,GLP-1可以改善胰岛素敏感性,FGF19可以通过抑制脂肪生成减少肝脏脂肪变性。
多糖对胆汁酸代谢的调节作用
近年来的研究表明,多糖可以通过恢复胆汁酸的代谢来缓解疾病。
多糖对胆汁酸代谢影响的总结
多糖通过调节肠道菌群的组成,特别是Bacteroides、Lactobacillus、Clostridium、Ruminococcus、Bifidobacteria,影响胆汁酸的代谢。
某些多糖如岩藻聚糖和灰树花多糖减少了Clostridium的水平,这与文献报道的促进胆汁酸转化的作用似乎矛盾,需要进一步研究确认这些肠道细菌与多糖之间的关系。
脂多糖的危害
脂多糖(LPS)是由革兰氏阴性细菌(如大肠杆菌)产生的内毒素。持续暴露于LPS或LPS异常增加,可通过减少肠道上皮细胞活性、降低肠道细胞增殖、抑制肠道细胞迁移和诱导肠道细胞凋亡等方式,导致肠道损伤。
LPS的转移还能损伤肠道,并可能通过与多种受体的相互作用,如LPS结合蛋白、簇分化14、髓样分化2和Toll样受体4,引发糖尿病、非酒精性脂肪肝病、肥胖、动脉粥样硬化等一系列疾病。
多糖对LPS产生菌的抑制作用
许多多糖能够抑制产生LPS的细菌。例如,在链脲佐素(STZ)诱导的糖尿病肾病模型中:
多糖调节肠道菌群的矛盾效应
尽管多糖可以通过调节肠道细菌来抑制LPS,但对特定细菌的调节作用可能存在矛盾。例如,作为LPS产生菌的拟杆菌门,在多糖处理后的水平变化并不一致。有研究表明,黄精多糖和蝉花多糖增加了拟杆菌门的水平,而竹荪多糖却降低了它。这些研究表明,多糖对肠道菌群的调节效应有时可能相互矛盾,需要进一步研究以确认结果。
胃肠道气体的生成
胃肠道内通过细菌发酵食物,会产生一系列气体,包括氢气(H2)、甲烷(CH4)、二氧化碳(CO2)、硫化氢(H2S)和一氧化氮(NO)。这些气体在胃肠道中发挥着调节作用,例如影响结肠蠕动、神经通讯、血管功能和免疫反应等。
气体产生的部位和作用
CO2 主要在胃中产生,而其他气体如 H2、CH4、CO2 和 H2S 主要在小肠和结肠中产生。
这些气体对人体健康至关重要,它们可以调节肠道功能,影响营养物质的吸收和疾病的发生。
多糖对气体产生的调节
尽管多糖对 H2、CH4 和 CO2 的产生有明显影响,但关于多糖结构与气体产生之间具体关系的研究会相对较少。需要更多的研究来明确这些关系,以及多糖如何通过影响肠道菌群来调节气体的产生。
肠道菌群是一个复杂的微生物群落,具有显著的组成和功能多样性。不同的微生物可以介导相同或不同的代谢物的产生,相同的微生物也有助于不同代谢物的生产。
例如,持续的研究表明:
拟杆菌门(特别是Bacteroides thetaiotaomicron、Bacteroides fragilis)、厚壁菌门(如Clostridiaceae、Erysipelotrichia)、以及变形菌门可以促进TMA的产生。
放线菌门(如Bifidobacteria)、厚壁菌门(如Lactobacillus、Clostridium、Peptostreptococcus)、拟杆菌门(如Bacteroides)可以促进色氨酸(Trp)的转化。
双歧杆菌、乳酸菌、梭菌、Peptostreptococcus、拟杆菌也有助于次级胆汁酸(BAs)的产生。
因此,就像肠道菌群组成的调节一样,多糖对特定肠道菌群代谢物功能的调节作用不是孤立的。
肠道是我们抵御外界有害物质和病原体侵袭的第一道防线。它由多个层次的子屏障构成:
生物屏障:由肠道细菌和病毒组成;
化学屏障:包含免疫球蛋白A(IgA)、抗菌肽(AMPs)和粘液(MUC);
物理屏障:由肠道上皮细胞构成;
免疫屏障:含有T细胞、B细胞、巨噬细胞和树突细胞等免疫细胞。
这些子屏障协同工作,限制病原体与肠道的接触,维持肠道稳定。肠道屏障的损伤与多种疾病正相关,包括肠易激综合症(IBS)、代谢综合征、过敏、肝脏炎症等。
肠道菌群及其代谢物可以直接或间接影响肠道屏障:
越来越多的证据表明,多糖通过调节肠道菌群对肠道屏障有益。正常的肠道菌群组成可以通过竞争性排除,通过消耗营养源和占据附着位点,作为抵御外界病原体的屏障。
多糖→ 调节肠道菌群→ 修复肠道屏障
肠道菌群可以刺激宿主产生抗菌化合物,如IgA和AMPs,这些是化学屏障的关键组成部分。
例如,菊粉型果聚糖可以促进乳杆菌的丰度和IgA的分泌。在DSS诱导的溃疡性结肠炎小鼠模型中,金银花多糖通过增加双歧杆菌和乳杆菌,增加了分泌型IgA含量,从而调节肠道屏障。
在DSS诱导的结肠炎小鼠中,海蜇皮多糖增加Akkermansia,Akkermansia muciniphila作为粘液的降解者,可以增强肠道屏障的完整性,减少炎症。同时海蜇皮多糖增加结肠中TJs和MUC2的表达,保护了肠道屏障。
多糖→ 短链脂肪酸→ 修复肠道屏障
短链脂肪酸和胆汁酸等肠道菌群代谢物在调节肠道屏障功能中也扮演重要角色。
多糖→ 色氨酸和胆汁酸代谢→ 修复肠道屏障
这些研究表明,多糖可以通过调节肠道菌群及其代谢物,维护肠道屏障的完整性。
代谢性疾病包括一组因碳水化合物、脂质和蛋白质代谢错误而导致的疾病。2 型糖尿病 (T2DM)、非酒精性脂肪性肝病 (NAFLD) 和肥胖是常见的代谢性疾病。
生活方式干预、全身药物治疗和外科手术等多种方法被用于预防和治疗代谢性疾病。尽管代谢性疾病的药物治疗取得了最新进展,但潜在的不良反应仍然是关键挑战。
使用天然物质的药物治疗被认为是改善代谢疾病的一种有前途且可行的方法。
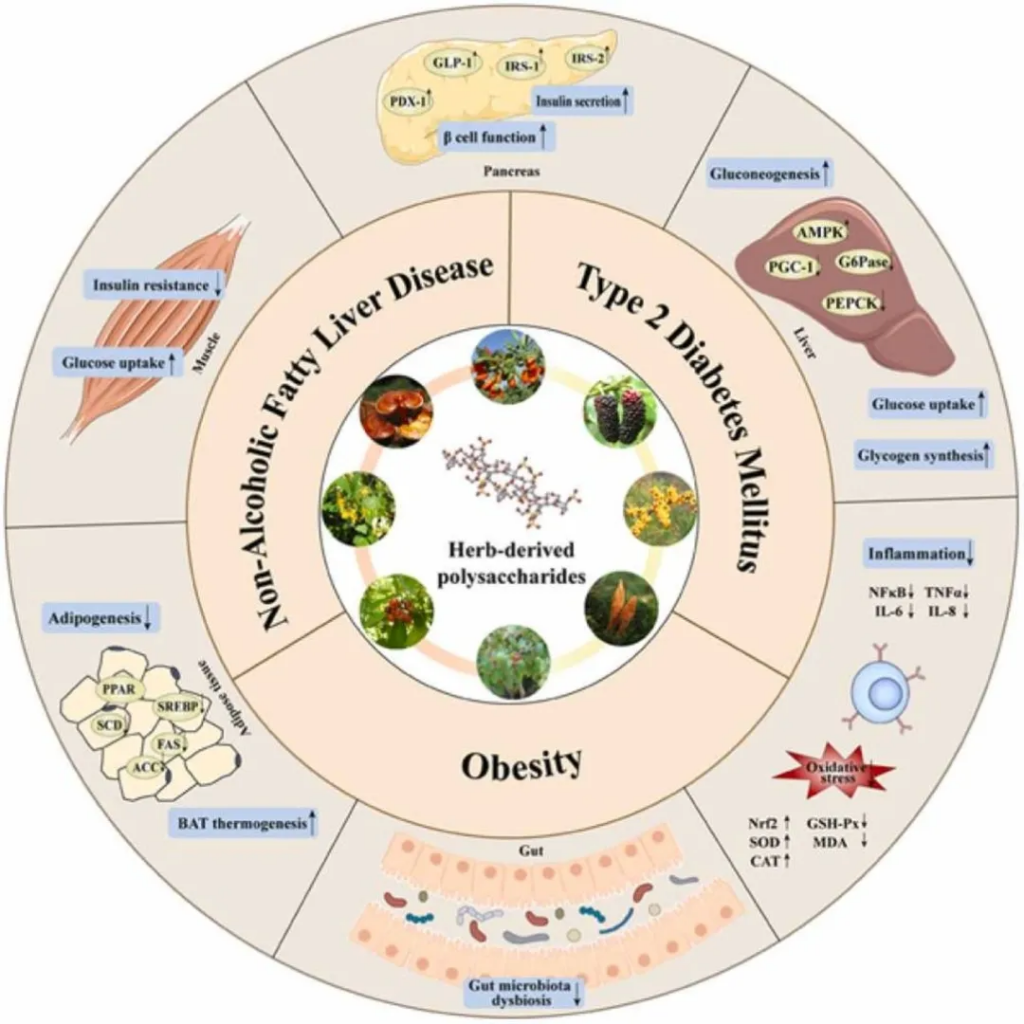
doi.org/10.1016/j.biopha.2023.114538
多糖通过多种机制在治疗2型糖尿病方面表现出良好的效果,比如:
肠道菌群在代谢紊乱,特别是 2 型糖尿病的发展中起着重要作用。
◤车前子多糖 对 STZ 诱导的 2 型糖尿病大鼠有抗糖尿病作用,这可能与其调节肠道菌群和增加短链脂肪酸水平有关。车前子多糖可显著增加糖尿病大鼠粪便中Bacteroides vulgatus、发酵乳杆菌、Prevotella loescheii、Bacteroides vulgates等结肠细菌的多样性和丰度,以及短链脂肪酸的浓度。
◤桑果多糖 可以丰富糖尿病小鼠的功能菌并调节微生物多样性。具体而言,该多糖显著富集了一些有益细菌(拟杆菌目、乳杆菌属、Allobaculum、拟杆菌属、阿克曼菌属),同时减少了一些致病菌(葡萄球菌、棒状杆菌属、Jeotgalicoccus、Aerococcus、Enterococcus、Facklamia)。
◤罗布麻叶的两种富含多糖的提取物改善了糖尿病小鼠的肠道微生物群失调,包括增加了Odoribacter、Anaeroplasma、Parasutterella、Muribaculum的丰度,并降低了肠球菌属、克雷伯菌属、Aerococcus的丰度。这可能有助于它们的抗糖尿病作用。
◤菊粉补充增加了双歧杆菌的丰度并增强了肠道屏障的完整性,这与2型糖尿病呈负相关。
◤青钱柳叶中分离的多糖通过增加 SCFAs 含量和有益的肠道细菌瘤胃球菌科来减轻 HFD/STZ 诱导的 2 型糖尿病大鼠的糖尿病症状。
◤苦瓜中的天然多糖通过增加 SCFAs 含量和Prevotella loescheii、Lactococcus laudensis 的丰度来改善 HFD/STZ 诱导的 2 型糖尿病大鼠的高血糖、高脂血症、高胰岛素血症。
◤天然南瓜多糖通过增加阿克曼氏菌和减少丹毒丝菌科(Erysipelotrichaceae)来显示出对 HFD/STZ 诱导的 2 型糖尿病的降血糖作用。此外,南瓜多糖还能增加 2 型糖尿病模型中肠道短链脂肪酸的产生。
◤灵芝多糖(GLP)通过恢复HFD/STZ诱导的肠道微生物群失调,特别是通过增加Blautia、拟杆菌、Dehalobacterium、Parabacteroides,以及减少有害的肠道细菌Aerococcus、Corynebacterium、Ruminococcus、Proteus,显示出抗糖尿病作用。
◤薏苡仁多糖通过降低厚壁菌门/拟杆菌门的比例和增加SCFAs的含量,在HFD/STZ诱导的T2DM小鼠模型中表现出降血糖活性。
◤葡甘聚糖作为铁皮石斛、芦荟和魔芋的天然多糖,通过增加厚壁菌门的丰度和减少拟杆菌门、变形杆菌的丰度,改善HFD/STZ喂养大鼠的T2DM代谢紊乱。
多糖对改善NAFLD具有有益作用,比如:
多糖可以改善肠道菌群失调并保护非酒精性脂肪性肝动物的肠道屏障完整性
◤枸杞多糖结合有氧运动通过改善肠道菌群失调改善 NAFLD,包括调节肠道菌群的丰度和多样性,增加微生物代谢产物 SCFA 的水平,减少变形菌和厚壁菌门/拟杆菌门的比例。厚壁菌门和拟杆菌门是参与宿主代谢和脂肪积累的关键细菌。
◤麦冬多糖可以通过调节肠-肝轴显著保护 NAFLD。具体来说,这种多糖显著降低了一些有害细菌的相对丰度,包括乳球菌、肠杆菌、Turicibacter、Clostridium- sensu-stricto -1、Tyzzerella、Oscillibacter,并增加一些有益菌的相对丰度,如Alistipes、Ruminiclostridium、Rikenella。这种多糖还显著增加了两种产SCFAs菌( Butyricimonas、Roseburia )的丰度以及乙酸和戊酸的水平,从而改善了炎症反应和肝脏脂质代谢。
◤灰树花杂多糖可通过调节肠道菌群来改善高脂饮食诱导的NAFLD,包括显著增加Allobaculum、拟杆菌属和双歧杆菌属丰度,减少Acetatifactor、Alistipes、Flavonifractor、Paraprevotella、Oscillibacter的丰度。
◤黄芪多糖可减轻HFD喂养小鼠的NAFLD,丰富了脱硫弧菌属,尤其是作为SCFAs、乙酸的产生者的Desulfovibrio vulgaris,减轻肝脂肪变性。
◤诺尼果多糖来源于辣木,通过促进短链脂肪酸的产生缓解HFD喂养小鼠的NAFLD,并通过改善肠道微生物群的多样性和组成逆转HFD诱导的肠道微生态失调。
◤核桃青皮多糖通过提高肠微生物群(包括普氏菌科、Allobaculum)的SCFAs含量和丰度,预防HFD喂养大鼠的肥胖和NAFLD。
◤从贻贝中提取的贻贝多糖,α-D-葡聚糖(MPA)可保护HFD喂养的大鼠的NAFLD,补充MPA可逆转HFD抑制的微生物微生态失调和SCFAs。
◤海带可溶性多糖通过降低厚壁菌门/拟杆菌门的比例,促进Verrucomirobia和丙酸盐产生菌拟杆菌和阿克曼菌,减轻高脂饮食喂养小鼠的NAFLD。
多糖通过多种机制表现出良好的抗肥胖作用,作用机制如:
◤枸杞多糖补充剂可降低厚壁菌门与拟杆菌门的比例,增加产短链脂肪酸菌,如Lacticigenium、Butyricicoccus、Lachnospiraceae_NK4A136_group数量,从而改善肥胖小鼠的肠道菌群失调。
◤桑叶多糖治疗可调节肥胖小鼠肠道菌群的组成和功能,这与增加Allobaculum、Parabacteroides、Porphyromonadaceae、Butyricimonas、Ruminococcus 的水平有关。
◤黄精多糖调节HFD喂养的肥胖大鼠的肠道微生物群结构,包括降低梭菌、肠球菌、Coprobacillus、乳球菌、Sutterella的相对丰度。
◤沙蒿多糖给药8周显著上调了屏障完整性的结肠基因,并通过增加有益细菌(双歧杆菌和Olsenella)和抑制有害细菌(Mucispirillum和幽门螺杆菌)改善了肥胖小鼠的肠道微生物微生态失调。同时,它显著富集了与促进SCFAs产生相关的碳水化合物代谢,同时显著抑制了与肥胖和肠道微生态失调相关的氨基酸代谢。
◤从海带中提取的天然多糖可通过使肠道菌群正常化来缓解小鼠HFD引起的肥胖,特别是通过增加拟杆菌目和Rikenellaceae的丰度。
◤从杏鲍菇中分离出的蘑菇多糖通过增加产生 SCFA 的肠道细菌Anaerostipes和Clostridium 的数量,在高脂饮食喂养的小鼠中表现出抗肥胖作用。
◤茶树菇多糖对HFD诱导的小鼠脂肪堆积和减肥的影响,发现脱硫弧菌减少,副拟杆菌增加,从而显著降低肥胖相关的TNF-α 和 IL-6 的水平。
◤从苦瓜中获得的多糖通过增加有益细菌(如放线菌、Coprococcus、乳酸杆菌)和减少有害细菌(变形菌和幽门螺杆菌)来改善HFD诱导的小鼠肥胖。
◤日本刺参的硫酸多糖通过富集益生菌Akkermansia、减少携带内毒素的变形杆菌和提高SCFAs含量来预防HFD诱导的小鼠肥胖。
◤ 破壁灵芝孢子多糖能逆转 HFD 喂养小鼠中许多细菌的相对丰度,特别是一些潜在的益生菌,包括Allobaculum、双歧杆菌,这与抗肥胖呈正相关。双歧杆菌、乳杆菌和阿克曼菌可促进SCFAs的产生,并抑制梭菌科、脱硫弧菌和肠球菌的丰度,这将有助于减少体重和脂质积累。
总的来说,多糖可通过作用于多个环节、调控多个疾病相关靶点来改善这三种代谢性疾病。
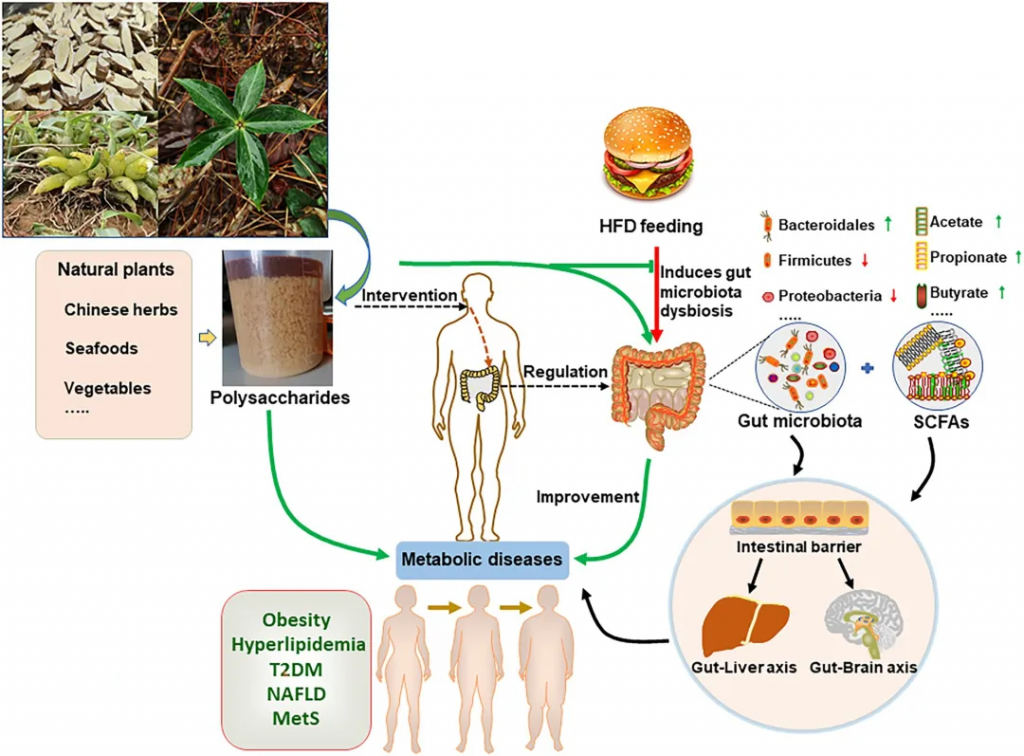
doi.org/10.3389/fmicb.2022.859206
高脂血症是指脂质代谢紊乱,其特征是甘油三酯 (TG)、总胆固醇 (TC) 和低密度脂蛋白浓度升高,同时高密度脂蛋白水平降低。
◤果胶多糖(高支链 RG-I,531.5 kDa)显著改善了 HFD 引起的脂质代谢异常,TG、TC、LDL-C 和游离脂肪酸水平降低。它还通过增加Roseburia、Clostridium等产生 SCFA 的细菌的数量来恢复肠道菌群失衡。
◤裙带菜多糖 ( Undaria pinnatifida )修复了高脂饮食引起的肠道微生物群改变,特别是Prevotellaceae_UCG-001,发现这与脂质代谢紊乱有关。
◤鲍鱼性腺多糖显著增加了丁酸水平,丁酸是一种重要的短链脂肪酸,它通过GPR依赖性途径抑制脂质相关基因的表达。
◤龙须菜多糖调节拟杆菌、瘤胃球菌_1和乳酸杆菌的相对丰度来增强胆固醇向BAs的转化。在遗传水平上,有人认为BA代谢的调节主要涉及CYP39A1和CYP7B1。
炎症性肠病 (IBD) 包括溃疡性结肠炎 (UC) 和克罗恩病 (CD),其特点是胃肠道持续炎症。IBD 的症状包括腹泻、腹胀、腹痛、便血、体重减轻和不适。
◤银耳多糖(TPs)通过多途径调节肠道菌群及其代谢物,改善了DSS诱导的溃疡性结肠炎。TPs可以增加Lactobacillus的丰度,从而改善色氨酸的分解代谢。这导致黄嘌呤酸、KA和吲哚衍生物(如5-羟吲哚、5-羟吲哚-3-乙酸、5-羟吲哚乙酰酸)的增加。
TPs还可以增加Romboutsia的水平,促进DCA的产生。因此,TPs可以通过影响色氨酸代谢和胆汁酸代谢来保护小鼠免受结肠炎的侵害。
◤金针菇多糖已被证明可以通过控制结肠微生物失调、增加短链脂肪酸和抑制 TLR4-NF-κB 信号通路来缓解结肠炎。能促进益生菌的生长,抑制致病菌的生长,恢复肠道稳态,缓解IBD症状。
◤竹荪多糖由59.84%的葡萄糖、23.55%的甘露糖和12.95%的半乳糖组成,已被证明可以通过增加粘蛋白和紧密连接蛋白的表达,抑制有害细菌(如γ-变形菌、变形菌、拟杆菌科、拟杆菌科和肠杆菌科)并增强有益细菌(如嗜酸乳杆菌)来改善肠道菌群组成和肠道屏障功能。
◤坛紫菜多糖通过上调紧密连接蛋白,增加粘液层及其分泌,调节肠道微生物群落,富集有益细菌,如拟杆菌、Muribaculum和乳酸杆菌,从而减轻DSS诱导的结肠损伤,从而改善结肠粘膜屏障的完整性。
◤白术多糖可以缓解在DSS诱导的溃疡性结肠炎小鼠模型炎症。白术多糖可以增加Butybacterium、Lactobacillus,同时减少Actinomyces、Akkermansia、Faecalibaculum、Verrucomicrobia、Bifidobacterium等。
肠道菌群的变化逆转了DSS引起的短链脂肪酸的减少以及色氨酸和色氨酸相关代谢物5-羟基-N-甲酰基犬尿氨酸和吲哚-3-乙酸的减少。白术多糖还剂量依赖性地逆转了LCA、DCA、缬氨酸、亮氨酸等的异常变化。
天然植物多糖治疗IBD的机制
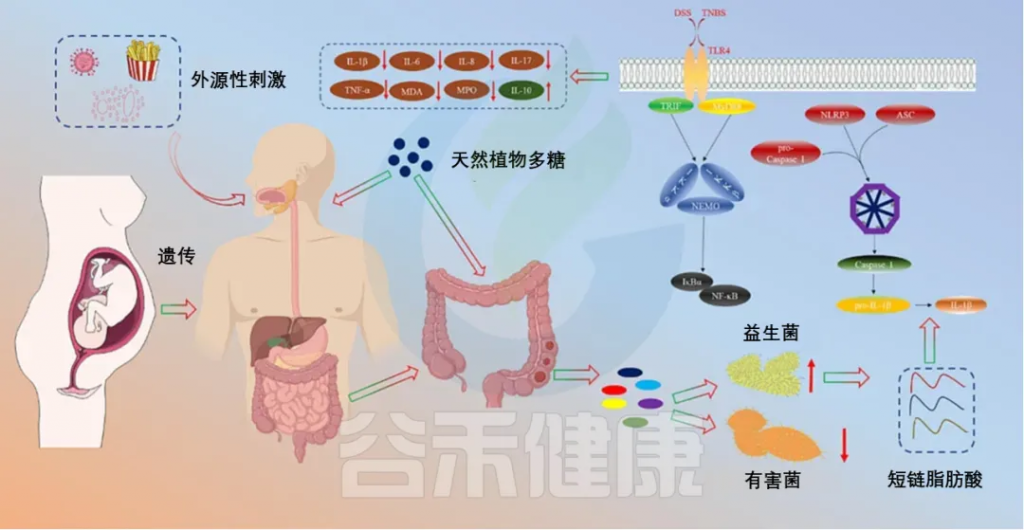
doi.org/10.1016/j.ijbiomac.2023.126799
◤甘草多糖GPS上调乳杆菌科、S24–7、Turicibacteraceae、Verrucomicrobiaceae和双歧杆菌科的丰度,下调脱硫弧菌科、瘤胃球菌科、毛螺菌科、肠杆菌科、丹毒丝菌科的丰度。GPS能促进乳杆菌、拟杆菌和产SCFAs菌的生长繁殖,起到减轻炎症、升高IL-10水平、抑制TLR4活化、降低血浆LPS水平的作用,从而保护肠道免受LPS诱导的炎症。
◤何首乌多糖(TSG)的给药显著增加了厚壁菌门和拟杆菌门的相对丰度,同时也降低了幽门螺杆菌和拟杆菌门的属水平,改善了肠道菌群,起到治疗IBD的作用。

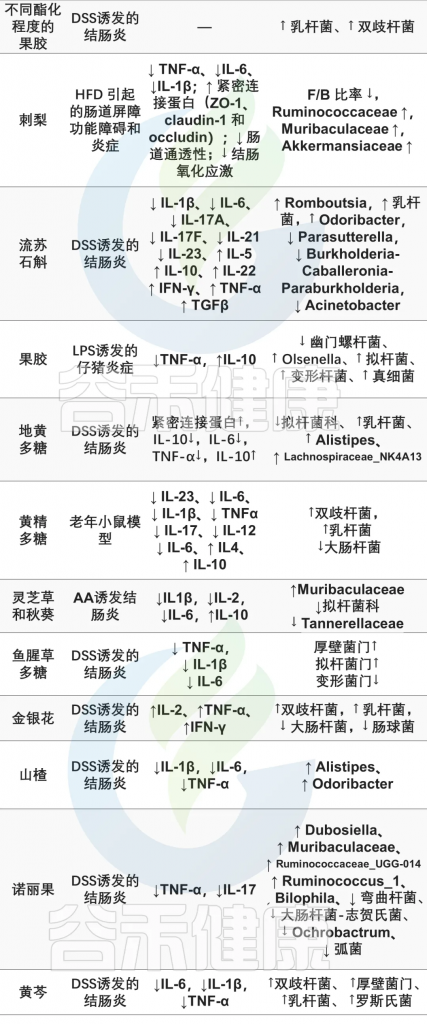
doi.org/10.3390/nu15153321
◤乳果糖通过重塑肠道菌群组成和代谢物,改善了由洛哌丁胺引起的便秘小鼠模型中的肠道水和盐代谢。具体来说,乳果糖上调了Bacteroides的丰度,并显著降低了厚壁菌门和Verrucomicrobia的水平。
此外,乳果糖减少了胆汁酸(包括CA、DCA等)、粪便中高浓度的吲哚(高浓度吲哚对细胞有毒)并增加了丙酸。
◤西洋参多糖(WQP) 可增强大鼠肠道结构的恢复,降低炎性细胞因子水平,改善短链脂肪酸 (SCFA) 水平,促进肠道菌群和肠黏膜屏障的恢复,并减轻盐酸林可霉素引起的腹泻和菌群失调等抗生素相关副作用。
◤葛根多糖( PPL )可缓解抗生素相关性腹泻引起的结肠病理改变和肠道菌群失调。
◤紫菜中提取的多糖(Nemacystus decipiens)能显著缓解小鼠抗生素相关性腹泻(AAD)的症状,并且显著增加了 Muribaculum、Lactobacillus 和 Bifidobacterium 的丰度,降低Enterobacter 、Clostridioides 的丰度。
◤茯苓多糖(PCP)通过恢复7种肠道菌菌缓解了抗生素相关性腹泻小鼠的症状,包括:Parabacteroides distasonis、Akkermansia muciniphila、Clostridium saccharolyticum、Ruminococcus gnavus、Lactobacillus salivarius、Salmonella enterica、Mucispirillum schaedleri.
适当调节免疫反应可以降低炎症反应引起的病原体入侵的风险。
结直肠癌
◤灵芝多糖在缓解结直肠癌症状方面比瓜尔胶更有效,因为它们能增加Akkermansia、结肠长度,并下调直肠癌相关基因。灵芝多糖通过动态调节肠道菌群和宿主免疫反应,已证明具有预防和治疗癌症的功能。
灵芝多糖通过调节乳酸杆菌、双歧杆菌等有益菌的相对丰度,诱导SCFAs的产生,改善肠道屏障损伤,抑制TLR4/MyD88/NF-κB信号通路,从而降低结肠炎和致癌风险。
◤绞股蓝与灵芝多糖联合使用显著提高了SCFAs产生菌的丰度,提高了丁酸和异丁酸水平,抑制了硫酸盐还原菌的丰度。
乳腺癌
◤来自灵芝破壁孢子(分子量为 3659 Da)的多糖可作为乳腺癌治疗的天然佐剂,增加细胞毒性 T 细胞和辅助性 T 细胞的数量。
灵芝孢子提取物(ESG)重塑了4T1荷瘤小鼠的肠道菌群:厚壁菌门和变形菌门的相对丰度增加,放线菌、拟杆菌门和蓝藻的相对丰度降低。
◤灵芝多糖联合紫杉醇对4T1乳腺荷瘤小鼠有抗肿瘤作用。联合治疗能显著富集拟杆菌、瘤胃球菌等5个菌属,降低脱硫弧菌和Odoribacter的丰度,平衡肠道菌群,抑制肿瘤代谢。
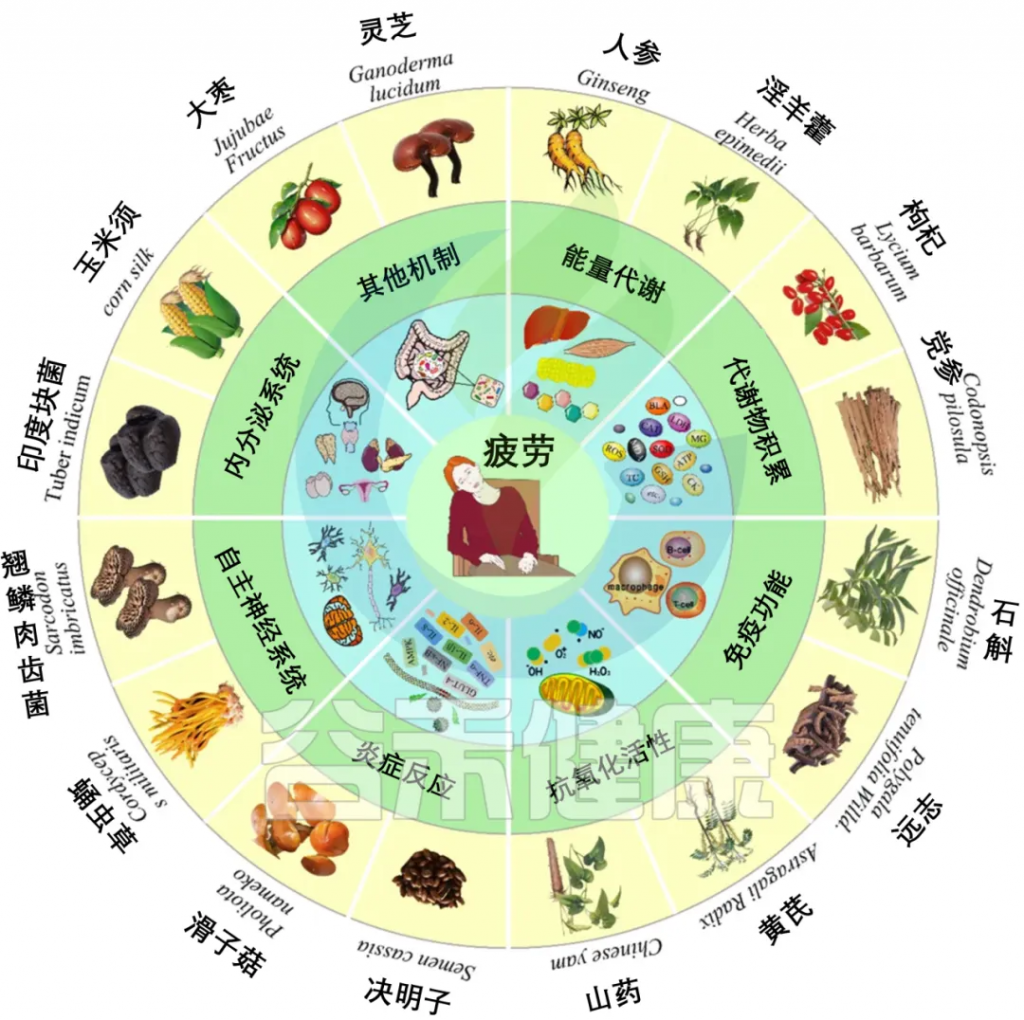
疲劳是一种普遍的不适感,表现为极度疲倦和力竭,通常在生理、病理或心理失衡时出现。体力劳动、心理压力、高原缺氧和长期疾病都可能引发疲劳。疲劳不仅影响日常生活,还可能导致内分泌、免疫、代谢等系统功能受损,甚至与癌症、糖尿病等严重疾病相关。此外,疲劳还与焦虑、抑郁和神经系统疾病有关。
近年来,天然多糖因其在缓解运动性疲劳中的潜在效果和较少的副作用而受到关注。研究表明,肌肉功能与肠道菌群的多样性和组成密切相关,而天然多糖如决明子、灵芝、枸杞和冬虫夏草等可通过不同机制发挥抗疲劳作用。
doi.org/10.3390/foods12163083
多糖抗疲劳机制如下:
抗疲劳多糖干预后肠道菌群的变化
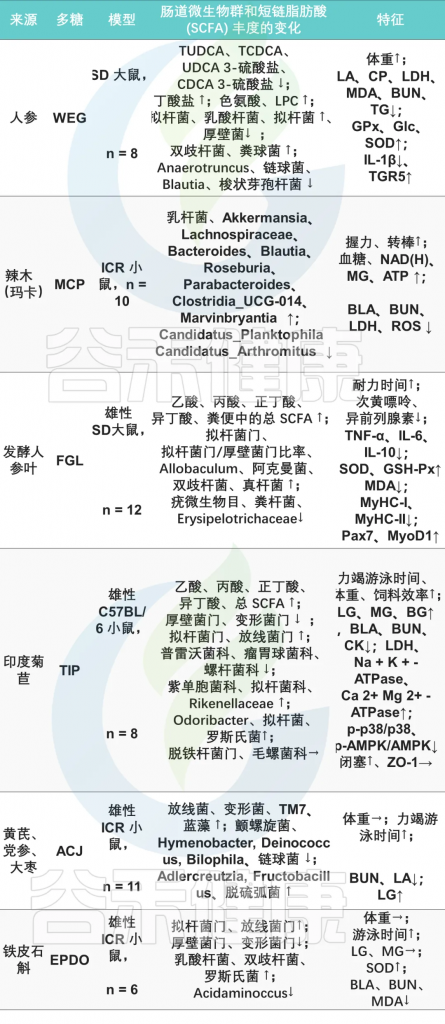
doi.org/10.3390/foods12163083
肠道-肌肉轴是肌肉与消化道之间的双向沟通,微生物可以通过微生物-肠道-肌肉轴作用于全身的肌肉。肠道微生物在膳食多糖的作用下,产生一些代谢产物(短链脂肪酸等),有些代谢产物会直接穿过肠道上皮细胞,通过血液循环直接或间接作用于肌肉组织和细胞,引起细胞发生生理生化反应,对疲劳产生一定的影响。
补充膳食多糖通过作用于肠道菌群及其代谢产物,间接激活AMPK/PGC-1α、PI3K/AKT、NF-κB、Nrf2/Keap1信号通路,调节能量代谢,降低炎症水平,增强线粒体功能和抗氧化能力,进一步维持肌肉质量和功能,从而缓解疲劳。
扩展阅读:
◤银杏叶中的一种水溶性多糖(GPS)可减轻压力引起的抑郁症并逆转肠道菌群失调。GPS 治疗可以缓解压力引起的血清素阳性和多巴胺阳性细胞密度降低。GPS 逆转了与抑郁相关的肠道菌群失调,并增加了乳杆菌的丰度,而乳杆菌已被证明是缓解抑郁的途径。
◤从秋葵中提取的多糖,发现它对抑郁小鼠的肠道菌群有明显的恢复作用,表现为厚壁菌门比例上调,拟杆菌门和放线菌门相对比例下调。这种调节有助于强化肠黏膜屏障,维持肠道免疫系统正常功能,减少肠道炎症反应,对抗抑郁有效,抑郁症小鼠的抑郁症状有所改善。用秋葵多糖治疗的小鼠体内的SCFAs显著增加,而SCFAs作为重要的通讯介质,对抗抑郁障碍有积极的影响。
◤接受金针菇多糖 (FVP)治疗的小鼠的肠道微生物组成发生显著改变,放线菌、丹毒菌和拟杆菌的丰度增加,梭菌的丰度降低,并且接受FVP治疗的小鼠的学习和记忆能力得到改善。
◤肉苁蓉多糖可以通过恢复小鼠模型中D-半乳糖诱导的衰老引起的肠道菌群稳态来抑制氧化应激和外周炎症,从而改善小鼠的认知功能。
◤从黄芪中提取的一种多糖已被证明可以通过改变糖尿病小鼠的肠道菌群来改善认知障碍。
扩展阅读:
以下是关于一些多糖的详细介绍,包括其功效,与肠道菌群的关联等,更深入地了解多糖在人体中的重要作用。
路易波士茶是什么?
路易波士茶(Rooibos)又名Aspalathus linearis,中文也有译作“路易博士茶”,取自原产于南非的一种豆科植物的茎叶。虽然带有一个茶字,但路易波士茶并不是传统意义上的茶叶。
路易波士茶因不含咖啡因、单宁含量低而受到南非人的喜爱,并在全球范围内进行商业化种植和销售。2014年,中国卫生和计划生育委员会批准路易波士茶作为新的食品原料,丰富了中国的食品和药物资源。
路易波士茶具有良好的抗氧化、抗过敏、解痉和降血糖作用。也可以预防心血管疾病、神经退行性疾病、各种癌症、骨质疏松症等。
路易波士茶多糖
一项研究从路易波士茶中分离得到均一酸性多糖(ALPs) ,水溶性多糖ALP由β-糖苷键连接,含有吡喃糖环,主要由岩藻糖、鼠李糖、阿拉伯糖和半乳糖组成。
结合RT-PCR结果推测,ALP可能通过降低Cyp2e1和Keap1的mRNA表达,增加Nrf2和HO-1的mRNA表达,激活Cyp2e1/Keap1-Nrf2-HO-1信号通路,调控下游抗氧化酶活性和炎症因子表达,减轻氧化应激损伤和炎症反应造成的损伤,从而改善急性酒精性肝损伤。
路易波士茶多糖对肠道菌群的影响
多样性
急性酒精性肝病模型对照组(MC)的物种多样性和丰富度显著降低(p≤0.05)。高剂量和低剂量ALP处理组的物种多样性和丰富度有所增加,其中高剂量组的增加更为显著。
干预后改善的菌群
ALP 干预后疣微菌丰度显著升高(p≤0.01),而脱硫杆菌丰度及F / B值均降低,但差异不显著。
肠道菌群中乳酸杆菌科的丰度与肝脏 AST 和 ALT 水平呈负相关。小鼠ALP干预后,乳酸杆菌科的丰度显著增加(p ≤ 0.05),而Rikenellaceae的丰度显著降低(p ≤ 0.05)。
ALP 显著改善了小鼠急性酒精性肝损伤中Alloprevotella和Alistipes丰度显著降低的情况( p ≤ 0.05)。
“肠-肝轴”途径
对属级别排名前20位的菌种进行了 Spearman 相关性分析。
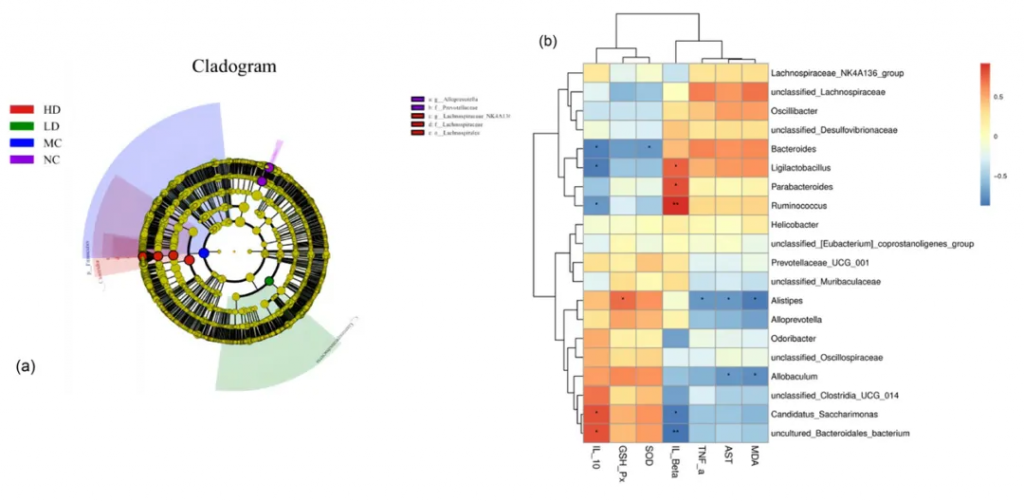
推测ALP可能通过“肠-肝轴”通路促进肠道菌群与抗氧化酶及炎症因子相互作用,从而减轻酒精性肝损伤,而上述菌群与酒精损伤标志物、抗氧化酶及炎症因子的表达均密切相关。
酒精及其代谢产物会影响肠道菌群的平衡和组成,导致肠道功能受损。这反过来又会影响肝脏健康,而肝脏健康与肠道菌群稳态密切相关。肠道和肝脏之间的相互作用被称为“肠-肝轴”通路。
地黄是玄参科地黄属植物,在我国拥有久远的药用历史,作为滋阴补肾的传统中药,也被《神农本草经》列为上品。
多糖是地黄中的主要活性成分之一。地黄多糖具有免疫调节、抗肿瘤、抗氧化、抗衰老等多种生物活性。
迄今为止,从地黄中分离纯化了20多种多糖,主要由阿拉伯糖、鼠李糖、半乳糖、葡萄糖、甘露糖、木糖、岩藻糖和半乳糖酸组成。
地黄多糖能增加DSS诱发小鼠的体质量指数和结肠长度、降低DAI评分,改善组织病理学损伤。同时,地黄多糖能阻断NF-κB信号通路,降低细胞内促炎因子表达,减轻炎症,增加紧密连接蛋白表达,维持肠道上皮屏障。
地黄多糖可能在肠道微生物作用下发酵转化为SCFAs,增加肠道中乙酸、丙酸和丁酸的含量,起到缓解IBD的作用。
拟杆菌属、乳酸杆菌属、Alistipes是导致DSS结肠炎组肠道微生物组失衡的关键细菌类型,而补充地黄多糖可以逆转这种有害变化。
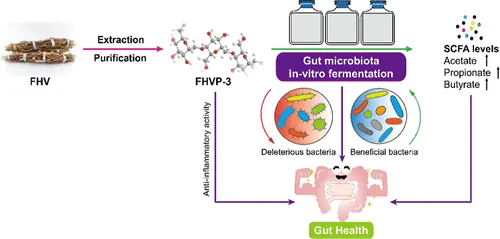
五指毛桃,又叫粗叶榕(Ficus hirta Vahl),常被用作滋补品的草药成分,以其丰富的多糖含量和生物活性而闻名。
一项研究发现,FHVP-3 对肠道微生物群产生影响:
下列菌群富集:
FHVP-3 抑制了下列机会性致病菌属的丰度:
作为可发酵底物,FHVP-3 还增加了短链脂肪酸的浓度,包括乙酸盐、丙酸盐和丁酸盐。FHVP-3 对脂多糖 (LPS) 诱导的 RAW 264.7 巨噬细胞表现出显着的抗氧化活性和显着的抗炎作用。
doi.org/10.1021/acsfoodscitech.3c00626
大蒜多糖 (GP) 占大蒜干重的 75% 以上。它们的特征是具有 2,1- β – d -Fruf 主链和 2,6- β – d -Fruf 分支的果聚糖。
研究表明,大蒜多糖在调节肠道微生物群方面发挥着作用,但它们是否具有维持肠道健康的全面功能并可作为有效的益生元仍不清楚。
为了探索这一点,通过管饲法给昆明小鼠施用不同剂量的大蒜多糖(1.25-5.0g/kg 体重)和菊粉(作为阳性对照),并评估它们对肠道上皮、化学和生物屏障的影响。还使用洛哌丁胺建立了便秘模型,以研究大蒜多糖对缓解便秘的潜在影响。
施用大蒜多糖显著上调昆明小鼠小肠组织中紧密连接蛋白和粘蛋白的表达。大蒜多糖提高了盲肠丁酸含量,降低了脱硫杆菌的丰度,并降低了厚壁菌门与拟杆菌门的比例(F/B)。大蒜多糖还促进了 Bacteroides acidifaciens、Clostridium saccharogumia的生长。
Tax4Fun 功能预测表明,大蒜多糖具有预防人类疾病的潜力,可降低胰岛素抵抗、传染病和耐药性的风险。
大蒜多糖还通过增强小肠转运、软化粪便稠度、加速排便和促进兴奋性神经递质的释放,在缓解洛哌丁胺引起的便秘症状方面表现出有益作用。
多年来,槐耳 (Trametes robiniophila Murr) 一直被用于药物治疗。槐耳含有多种成分,包括多糖、蛋白质、酮和生物碱,其中蛋白聚糖和多糖是主要的生物活性成分。
槐耳提取物具有免疫调节活性,并可通过激活自噬、抑制铁死亡、抑制内质网应激等过程对细胞发挥保护作用。研究表明,槐耳水提取物可通过抑制NLRP3炎症囊泡活化,减轻肠道屏障损伤和炎症反应,并抑制DSS和氧化偶氮甲烷 (AOM) 联合诱导的结肠肿瘤形成。
可缓解 DSS 引起的肠道菌群紊乱
一项小鼠研究显示,槐耳多糖干预显著逆转了 DSS 引起的Muribaculaceae_unclassified、Anaerotruncus、Ruminococcaceae_unclassified丰度的下降以及Escherichia-Shigella丰度的增加( p < 0.05)。
其中,Muribaculaceae_unclassified是健康人中发现的肠道微生物,参与丁酸代谢和色氨酸代谢,可产生对人体有益的短链脂肪酸。
相关性分析,Muribaculaceae_unclassified与结肠长度、SOD 和 T-AOC 呈正相关,而与 DAI 评分以及炎症和氧化指标呈负相关。
Anaerotruncus与结肠长度、SOD 和 T-AOC 呈正相关,但与炎症标志物 LPS、MDA 和 MPO 呈负相关。
黄芩的根通常用作药物,用于清热利湿、泻火解毒。多糖是黄芩的最重要成分之一。
一种来自黄芩的多糖通过抑制 NF-κB 信号传导和NLRP3 炎症小体活化来改善溃疡性结肠炎。在多糖的分离和纯化过程中,研究人员还获得了另一种名为 SP2-1 的均质多糖。SP2-1由甘露糖、核糖、鼠李糖、葡萄糖醛酸、葡萄糖、木糖、阿拉伯糖和岩藻糖组成。
研究人员发现其对肠道菌群紊乱、肠道屏障改善以及短链脂肪酸产生影响。
在UC患者中,SP2-1显著抑制了促炎性细胞因子IL-6,IL-1β和TNF-α。
溃疡性结肠炎患者的屏障完整性被破坏,TJ 蛋白的表达发生改变,SP2-1增加小鼠TJ蛋白的表达,修复肠道屏障。
SP2-1对肠道菌群的影响
SP2-1组的粪便微生物群多样性明显高于DSS组。
临床上,溃疡性结肠炎患者的双歧杆菌和乳酸杆菌的丰度降低。与模型组相比,SP2-1 组的双歧杆菌、乳酸杆菌和Roseburia的水平提高。
而拟杆菌和葡萄球菌的种群受到抑制。肠道菌群中存在过量的拟杆菌和葡萄球菌对肠道免疫系统有害。
Roseburia 通过调节调节性 T 细胞的发育和分化、增加抗炎细胞因子的分泌和抑制促炎细胞因子的产生来缓解UC。
枸杞多糖(简称LBPs)是从枸杞中提取的一类多糖物质。枸杞是一种多年生灌木,属于茄科,枸杞多糖因其多样的药理活性和生理功能而受到越来越多的关注。
枸杞多糖 (LBPs)作为最重要的生物活性分子,可通过肠道微生物参与有益作用,包括调节代谢、降血糖、神经保护、抗衰老、保护各种器官免受氧化应激相关疾病的侵害。
枸杞多糖对肠道菌群的影响
癌症
一般来说,抗癌化疗药物除了会诱导癌细胞凋亡外,还会对肠道菌群产生不利影响,主要表现在肠绒毛缩短,乳酸杆菌和肠球菌丰度下降,节段丝状菌丰度增加。而枸杞多糖治疗可通过增加有益菌相对丰度来改善肠道环境和免疫功能,逆转环磷酰胺引起的有害菌(瘤胃拟杆菌科、Longibraceae、脱硫弧菌和厌氧拟杆菌科)相对丰度的增加。
还发现毛螺菌科、瘤胃菌科、脱铁菌科、脱硫弧菌科、Aneoplasmataceae与细胞因子IL-2、IL-6、IL-1β、TNF-α、IFN呈负相关。因此,主要肠道菌群的相对丰度可能与免疫调节有关。
厚壁菌门与拟杆菌门(F/B)比例的变化与许多疾病状态有关,它被视为菌群失调的重要指标,有助于了解肝脏和代谢疾病的发展。枸杞多糖可降低高脂饮食大鼠的 F/B 比,表明补充枸杞多糖有助于调节肠道菌群失调。
doi.org/10.1080/10408398.2022.2128037
神经系统
枸杞多糖可通过调节肠道菌群-肠-脑轴的神经免疫通路,对中枢神经系统产生多方面的保护作用。枸杞多糖可改善菌群失调、肠道屏障受损等问题,并通过抑制细胞凋亡、促进自噬等机制发挥神经保护效应。
肝脏
枸杞多糖能够影响NAFLD患者的肠道菌群组成、肠道屏障及肝脏炎症。
代谢(肥胖、糖尿病)
肥胖个体的研究中,肠道内F/B比例较高,因此推测肠道内F/B比例与肥胖呈显著正相关。
后续研究发现,LBPs可通过调节肠道菌群组成和短链脂肪酸生成来改善肥胖。
枸杞多糖可作为2型糖尿病的潜在辅助药物。
LBPs能调节肠道菌群,激活大鼠肠黏膜TLR2+上皮细胞γδT细胞,增强肠道屏障功能,改善糖尿病。此外,LBPs能明显降低血浆中促炎性细胞因子IL-1β、IL-6、IL-17A和TNF-α,而抗炎性细胞因子IL-10水平在糖尿病大鼠中有所升高。
哮喘
枸杞多糖还可以通过直接或间接地改变肠道菌群,参与炎症介质的调控,从而改善肺功能和过敏性哮喘症状。
肠道菌群测序分析显示,LBPs能够促进哮喘小鼠肠道中乳酸杆菌和双歧杆菌增加,并降低厚壁菌门和放线菌水平,通过肠道介导缓解哮喘。
岩藻糖(Fucose),参与构成肠上皮细胞(IEC)顶端表达的聚糖,并介导肠道中的许多生物过程,尤其是宿主-微生物相互作用。
释放的岩藻糖可被微生物用作膳食聚糖、能量来源或合成结构蛋白。肠道中岩藻糖的变化影响微生物群的定植。
岩藻多糖
岩藻多糖是一种含有岩藻糖和硫酸基团的多糖,可改善糖尿病肾病。
一项小鼠研究发现,岩藻多糖可显著改善肾小球滤过率高滤过和肾纤维化,其机制与短链脂肪酸产生菌富集、增加盲肠内乙酸浓度、提高肾脏ATP水平以及改善线粒体功能障碍有关。此外,岩藻多糖还可通过抑制MAPKs通路来改善肾脏炎症和纤维化。总之,岩藻多糖可通过改善线粒体氧化应激和抑制MAPKs通路,靶向肠道菌群-线粒体轴,改善早期糖尿病肾病。
桑叶的药用功能最早在2000多年前的汉代被发现,并记载于《神农本草经》。明代李时珍在《本草纲目》中对桑叶的药用功效有更详细的描述,包括活血化瘀、祛风、清热解毒等功能。桑叶已被列入国家卫生健康委员会公布的食药同源资源名单。
桑叶多糖(Mulberry Leaves Polysaccharides,MLPs)是从桑树(Morus alba L.)叶片中提取的一种植物多糖。它们是桑叶中主要的活性成分之一,由多种单糖组成,主要包括木糖、阿拉伯糖、果糖、半乳糖、葡萄糖、甘露糖等。
桑叶多糖对人体的影响
桑叶多糖具有多种生物学活性,包括降低血糖、抗氧化、免疫调节、抗肿瘤、抗菌、抗凝和调节肠道菌群等。这些活性使得MLPs在医药和食品领域具有广泛的应用前景。并且安全、有效、低毒、副作用小。
doi.org/10.1016/j.ijbiomac.2023.128669
桑叶多糖对肠道菌群的影响
桑叶多糖通过调节肠道菌群的平衡,进而对人体的健康产生积极的影响。以下是桑叶多糖影响的肠道菌群及其变化情况:

桑叶多糖能够调节短链脂肪酸和肠道菌群的相对丰度,降低真细菌与过敏性细菌的比例,从而改善肠道屏障功能。
沙棘果实在藏族食品和药物中已有数千年的传统。沙棘多糖 (SP) 是沙棘果实中的主要功能成分之一。
对高脂饮食诱导的肥胖小鼠:沙棘多糖治疗提高了 p-AMPKα 和 PPARα 蛋白的表达,刺激了小鼠肝脏中 ACC1 的磷酸化,并抑制了 FAS、PPARγ 和 CD36 的蛋白表达。
沙棘多糖上调Muribaculaceae_unclassified、双歧杆菌、Rikenellaceae_RC9_gut_group、Alistipes、Bacteroides的比例,并下调Lactobacillus、 Firmicutes_unclassified 、Dubosiella Bilophila、 Streptococcus 的比例,重组了HFD诱导的肥胖小鼠的肠道微生物群。
此外,粪便中的微生物代谢物短链脂肪酸 (SCFAs) 的产生也有所增加。此外,相关性分析结果表明沙棘多糖的肥胖改善作用与粪便中的SCFAs水平高度相关。因此,沙棘多糖对肝脏脂质代谢的调节可能是由于肠道微生物群的变化和SCFAs产生量的增加。这些结果表明,沙棘多糖可以通过调节肠-肝轴发挥改善肥胖的潜在营养保健作用。
蘑菇多糖是一类存在于蘑菇中的生物活性多糖,它们包括但不限于几丁质、甘露聚糖、半乳糖聚糖、木聚糖、葡聚糖、云芝多糖、灵芝多糖、半纤维素。这些多糖在蘑菇细胞壁中含量丰富,赋予蘑菇独特的结构和生物活性。
蘑菇多糖的功效
蘑菇多糖对人体具有多种潜在的健康益处。它们可以增强免疫系统、具有抗肿瘤活性、调节肠道菌群、抗氧化、抗糖尿病、抗衰老作用。
蘑菇多糖对肠道菌群的影响
促进益生菌生长
蘑菇多糖通过选择性地促进益生菌的生长,增强肠道健康。例如,灵芝和茯苓中的多糖被发现可以增加有益细菌的数量,这些细菌可以对抗肥胖、产生短链脂肪酸和乳酸。香菇中的多糖也显示出对嗜酸乳杆菌(Lactobacillus acidophilus)有促进作用。
抑制病原菌
蘑菇多糖能够通过增强肠道屏障功能和促进益生菌的生长来间接抑制病原菌。双孢蘑菇中的多糖已被证明可以限制大肠杆菌的生长。
增强肠道屏障功能
蘑菇多糖通过增强肠道上皮细胞的功能,提高肠道屏障的完整性,减少有害物质的渗透。云芝(Trametes versicolor)中的多糖肽PSK和PSP能够调节肠道菌群,增加有益菌双歧杆菌和乳杆菌的数量,同时减少有害菌如梭状芽孢杆菌和金黄色葡萄球菌。在降低腹泻、艰难梭菌感染、炎症性肠病等方面发挥作用。
调节免疫反应
蘑菇多糖通过激活肠道相关淋巴组织,增强机体的免疫反应。灵芝多糖能刺激和增加免疫细胞如自然杀伤细胞、T淋巴细胞和巨噬细胞的数量。
产生短链脂肪酸
蘑菇多糖在肠道发酵过程中产生短链脂肪酸,这些物质对维持肠道健康和调节宿主代谢具有重要作用。蚝菇(Pleurotus ostreatus)中的β-葡聚糖衍生物能够诱导前列腺癌细胞的凋亡,并且显示出免疫调节、巨噬细胞激活、抗肿瘤和免疫刺激活性。

多糖的多样性和复杂性使其在人体内的作用千变万化,它们能够通过与肠道菌群的互动,从调节免疫功能到改善代谢性疾病等。
然而,利用天然多糖通过肠道菌群治疗疾病仍存在一些限制和挑战。对肠道菌群和多糖之间相互作用的全面了解需要进一步研究,由于大多数研究都是在动物身上进行的,因此开展研究多糖-微生物组-疾病相互作用的临床试验并实现临床转化至关重要。
幸运的是,随着生命科学领域新兴技术的发展,我们有了更多的工具来揭示这些复杂问题。高通量测序技术、多组学技术、人工智能和大数据分析的交叉融合,为研究多糖和肠道菌群的相互作用提供了强大的技术支持,推动了这一领域的快速发展。
此外,多糖与肠道菌群之间的相互作用不仅揭示了多糖的生物活性,也突显了肠道菌群对健康的重要贡献。多糖与肠道菌群的相互作用为我们提供了一个全新的视角,了解个体的肠道菌群组成,不仅有助于我们理解自身的健康状况,更为个性化的营养和健康管理提供了科学依据。肠道菌群检测可以揭示个体对多糖等营养成分的响应差异,从而为制定个性化的饮食和治疗计划提供指导。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
Xue H, Mei CF, Wang FY, Tang XD. Relationship among Chinese herb polysaccharide (CHP), gut microbiota, and chronic diarrhea and impact of CHP on chronic diarrhea. Food Sci Nutr. 2023 Aug 6;11(10):5837-5855.
Xu X, Wang L, Zhang K, Zhang Y, Fan G. Managing metabolic diseases: The roles and therapeutic prospects of herb-derived polysaccharides. Biomed Pharmacother. 2023 May;161:114538
Zhang D, Liu J, Cheng H, Wang H, Tan Y, Feng W, Peng C. Interactions between polysaccharides and gut microbiota: A metabolomic and microbial review. Food Res Int. 2022 Oct;160:111653.
Chen R, Zhou X, Deng Q, Yang M, Li S, Zhang Q, Sun Y, Chen H. Extraction, structural characterization and biological activities of polysaccharides from mulberry leaves: A review. Int J Biol Macromol. 2024 Feb;257(Pt 2):128669.
Lan Y, Sun Q, Ma Z, Peng J, Zhang M, Wang C, Zhang X, Yan X, Chang L, Hou X, Qiao R, Mulati A, Zhou Y, Zhang Q, Liu Z, Liu X. Seabuckthorn polysaccharide ameliorates high-fat diet-induced obesity by gut microbiota-SCFAs-liver axis. Food Funct. 2022 Mar 7;13(5):2925-2937.
Feng Y, Song Y, Zhou J, Duan Y, Kong T, Ma H, Zhang H. Recent progress of Lycium barbarum polysaccharides on intestinal microbiota, microbial metabolites and health: a review. Crit Rev Food Sci Nutr. 2024;64(10):2917-2940.
Cui L, Guan X, Ding W, Luo Y, Wang W, Bu W, Song J, Tan X, Sun E, Ning Q, Liu G, Jia X, Feng L. Scutellaria baicalensis Georgi polysaccharide ameliorates DSS-induced ulcerative colitis by improving intestinal barrier function and modulating gut microbiota. Int J Biol Macromol. 2021 Jan 1;166:1035-1045.
Tang YF, Xie WY, Wu HY, Guo HX, Wei FH, Ren WZ, Gao W, Yuan B. Huaier Polysaccharide Alleviates Dextran Sulphate Sodium Salt-Induced Colitis by Inhibiting Inflammation and Oxidative Stress, Maintaining the Intestinal Barrier, and Modulating Gut Microbiota. Nutrients. 2024 Apr 30;16(9):1368.
Zhao Q, Jiang Y, Zhao Q, Patrick Manzi H, Su L, Liu D, Huang X, Long D, Tang Z, Zhang Y. The benefits of edible mushroom polysaccharides for health and their influence on gut microbiota: a review. Front Nutr. 2023 Jul 6;10:1213010.
Álvarez-Mercado AI, Plaza-Diaz J. Dietary Polysaccharides as Modulators of the Gut Microbiota Ecosystem: An Update on Their Impact on Health. Nutrients. 2022 Oct 3;14(19):4116.
Tang M, Cheng L, Liu Y, Wu Z, Zhang X, Luo S. Plant Polysaccharides Modulate Immune Function via the Gut Microbiome and May Have Potential in COVID-19 Therapy. Molecules. 2022 Apr 26;27(9):2773.
Sun CY, Zheng ZL, Chen CW, Lu BW, Liu D. Targeting Gut Microbiota With Natural Polysaccharides: Effective Interventions Against High-Fat Diet-Induced Metabolic Diseases. Front Microbiol. 2022 Mar 15;13:859206.
Gan L, Wang J, Guo Y. Polysaccharides influence human health via microbiota-dependent and -independent pathways. Front Nutr. 2022 Nov 9;9:1030063.
Chen J, Gao Y, Zhang Y, Wang M. Research progress in the treatment of inflammatory bowel disease with natural polysaccharides and related structure-activity relationships. Food Funct. 2024 Jun 4;15(11):5680-5702.
Chen P , Hei M , Kong L , Liu Y , Yang Y , Mu H , Zhang X , Zhao S , Duan J . One water-soluble polysaccharide from Ginkgo biloba leaves with antidepressant activities via modulation of the gut microbiome. Food Funct. 2019 Dec 11;10(12):8161-8171.
Wang, A.; Liu, Y.; Zeng, S.; Liu, Y.; Li, W.; Wu, D.; Wu, X.; Zou, L.; Chen, H. Dietary Plant Polysaccharides for Cancer Prevention: Role of Immune Cells and Gut Microbiota, Challenges and Perspectives. Nutrients 2023, 15, 3019.
Zhou, Y.; Chu, Z.; Luo, Y.; Yang, F.; Cao, F.; Luo, F.; Lin, Q. Dietary Polysaccharides Exert Anti-Fatigue Functions via the Gut-Muscle Axis: Advances and Prospectives. Foods 2023, 12, 3083
Shen, Y.; Song, M.; Wu, S.; Zhao, H.; Zhang, Y. Plant-Based Dietary Fibers and Polysaccharides as Modulators of Gut Microbiota in Intestinal and Lung Inflammation: Current State and Challenges. Nutrients 2023, 15, 3321
Lv H, Jia H, Cai W, Cao R, Xue C, Dong N. Rehmannia glutinosa polysaccharides attenuates colitis via reshaping gut microbiota and short-chain fatty acid production. J Sci Food Agric. 2023 Jun;103(8):3926-3938.

谷禾健康

菌群.营养.炎症.免疫
营养在整个生命周期中对免疫和炎症以及最终的健康有深远影响。最新研究表明,饮食对肠道微生物组成和代谢产物具有显著影响,从而对宿主免疫和炎症产生重要影响。
研究发现,我们日常饮食中的特定食物成分和代谢产物在感染、慢性炎症和癌症过程中可能表现为促炎或抗炎,这突显了饮食与微生物代谢产物对免炎调节的重要影响。这将对精准营养和治疗干预方法产生重要影响。
小鼠研究表明,饮食-微生物轴对免疫介导性疾病(包括炎症性肠病和过敏)产生影响,同时在感染、疫苗接种和癌症免疫治疗等情况下优化免疫功能。例如,人类中,膳食纤维摄入量增加与黑色素瘤免疫检查点阻断治疗反应改善相关,而长期服用抗生素可能会损害微生物群,从而降低流感疫苗的效果。
这重新激发了科学界和公众的兴趣,健康饮食意味着什么,它到底如何通过微生物群影响健康免疫系统?
本文我们就来了解一下,饮食与微生物相互作用对免疫应答调节的影响,以及对感染、慢性炎症、代谢健康和抗肿瘤免疫背景下微生物代谢产物的机制作用的新见解。
膳食成分既有直接作用,又有依赖于微生物的影响,本文侧重于后者。这也为我们提供了一个“精准营养”的新视角,根据遗传、饮食习惯、社会经济地位、微生物群等多种因素为个体或人群提供营养建议,可作为传染性、炎症性、代谢性疾病和癌症整体治疗方法的一部分。
哺乳动物与驻留在屏障部位(包括肠道)的微生物群共同演化。宿主与微生物之间的相互作用塑造了多种生理过程,包括哺乳动物的免疫应答。屏障组织及其相关微生物群暴露于各种外部因素,包括膳食摄入、药物、感染和环境污染物,统称为“暴露组”。
人类饮食的历史变化
膳食是塑造我们进化、社会和文化的最具影响力的外部因素之一。值得注意的是,在过去一个世纪,人类饮食与历史上逐渐变化的膳食相比发生了急剧而显著的变化。
这些主要变化包括:
1)植物、蔬菜和复杂碳水化合物(包括未加工的全谷物)的减少;
2)精制碳水化合物、植物脂肪、简单糖、盐和加工食品摄入量的增加;
3)广泛使用人工甜味剂、乳化剂、增稠剂、胶凝剂、稳定剂以及色素和防腐剂等化学物质。
这些变化在工业化国家更为明显,并且在与全球化增长相关的较不工业化国家中迅速发展。
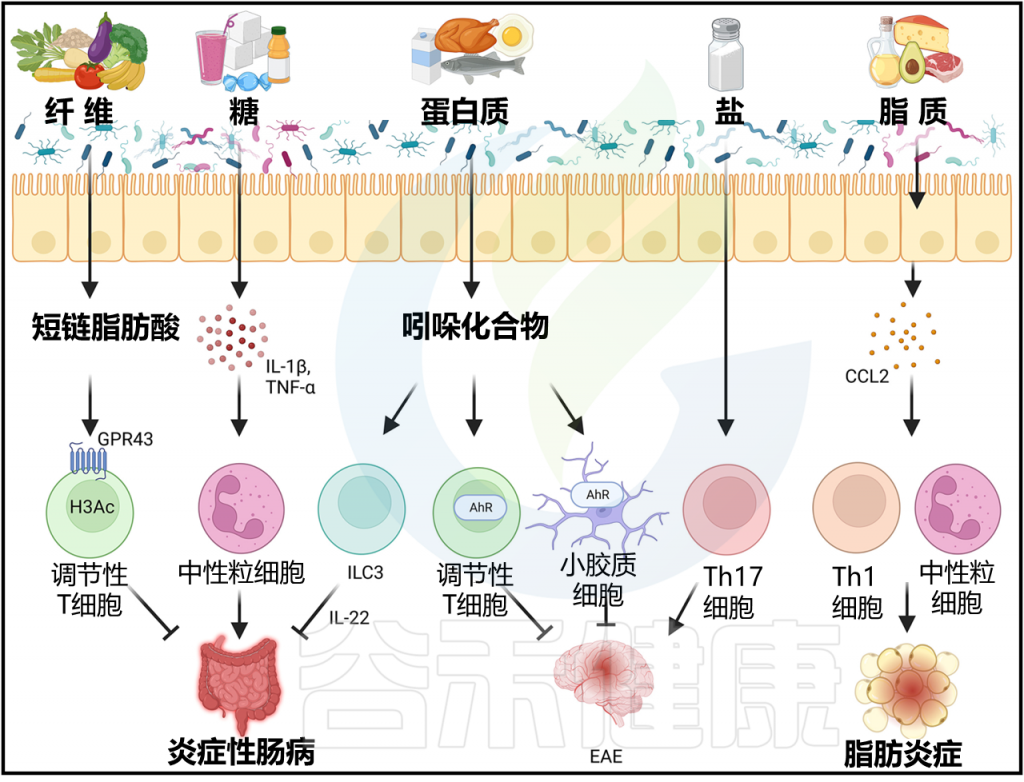
饮食与肠道菌群、炎症的关联
一系列比较了世界各地人群的饮食和微生物群的人口研究表明,我们的饮食模式深刻影响肠道微生物群。例如,西方饮食改变了细菌组成并降低了微生物群的多样性或丰富度。相反,微生物群也可以改变饮食对宿主生理的影响。
人类研究表明,膳食纤维干预可以降低血液中炎症标志物;然而,在微生物多样性降低的个体中,它却会增加炎症。值得注意的是,过去100年中,炎症性疾病,包括炎症性肠病、过敏和糖尿病也一直在增加,研究揭示了与饮食和炎症相关的多样免疫调节途径。
动物来源的食物是许多营养素的高效(有时是唯一的)来源,包括铁、钙、锌、牛磺酸、肌酸、肉碱、维生素A、维生素B12、维生素D3和包括 EPA 和 DHA 在内的omega-3 脂肪酸,农业的工业化提高了这些食物的全球可获得性。
不同饮食结构影响肠道微生物组成
然而,基于动物的西方饮食会促进一种与植物为基础的饮食所促进的微生物组成不同的肠道微生物群。在小鼠和人类中,拟杆菌门(Bacteroidota)和厚壁菌门(Firmicutes)是两大微生物门,往往覆盖总微生物组的90%以上。
传统植物为基础饮食:普雷沃氏菌属主导
西方动物为基础的高脂饮食:拟杆菌属主导
通过饮食干预或由于迁徙至西方风格国家而从植物为基础的饮食转变为动物为基础的饮食,会导致拟杆菌属取代普雷沃氏菌属成为主导。因此,普雷沃氏菌属和拟杆菌属被认为是传统植物为基础饮食高纤维和西方动物为基础饮食高脂肪的生物标志物。高脂肪、高糖饮食及与之相关的肥胖在小鼠和人类中已被证明会降低拟杆菌属的总体相对丰度并增加Bacillota的丰度。
肠道菌群及其代谢产物如何影响宿主免疫反应和生理过程
饮食中的组分可以直接调节小鼠的免疫系统,然而最近的研究表明,饮食引起的微生物群变化也深刻影响宿主的免疫反应。在屏障表面的免疫系统可以检测微生物群及其结构成分,这种直接的相互作用建立了一种免疫反应的耐受状态。
然而,肠道微生物群产生成千上万种代谢产物,这些产物被吸收到我们的体内,并通过血液循环。许多这些代谢产物是由微生物群特异性产生的,而不是宿主产生的。它们属于不同的化学类别,包括短链脂肪酸(SCFAs)、非结合和结合的胆酸、酚类化合物、吲哚、胺类、黄酮类和气态化合物。
迄今为止已经确定的许多代谢产物是通过微生物群对饮食组分的直接转化而生成的,这些微生物群表达了能够消化特定膳食物质的专门酶。例如,短链脂肪酸是由膳食纤维的微生物发酵产生的。因此,微生物群从我们的饮食中提取和产生必需营养素,包括宿主无法产生的维生素。微生物群产生的代谢产物也是通过微生物将宿主代谢产物转化而生成的。
例如,初级结合胆酸被微生物群转化为初级非结合胆酸,进一步转化为次级胆酸或额外的结合胆酸。这些代谢产物可以在宿主的整个身体中循环,作为细胞表面或胞核受体的配体,并调节多种生物过程,包括新陈代谢、认知、组织稳态和免疫反应。
饮食可以迅速改变微生物群的组成
已经证明,饮食变化,例如从植物为基础的饮食转向动物为基础的饮食,可以在暴露于新饮食后的第一天就改变人类微生物群的组成。小鼠研究表明,饮食变化也会影响微生物群的代谢活动,因此可能会改变微生物群产生的代谢产物的浓度。
虽然某些饮食成分,包括特定类型的膳食纤维,可以促进有益菌的扩张,但其他成分可能导致菌群失调,即微生物群组成异常或微生物群产生的代谢产物失调的状态。
对于饮食对一些微生物群依赖的免疫调节效应,微生物群物种、微生物组分和宿主受体尚未完全表征。未来,揭示这些元素对于开发基于饮食和微生物群的精准营养和个性化医学将至关重要。
小鼠研究表明,在稳态条件下,黏膜免疫系统建立了对肠道微生物的耐受状态。参与这种耐受性反应的免疫细胞包括调节性T细胞(Treg细胞)和第3组固有淋巴细胞(ILC3s)等。然而,微生物群失调或异常免疫激活可能会破坏耐受性并引发慢性炎症病症。在这里以炎症性肠病为例来讨论。
饮食和微生物群在膳食纤维和炎症性疾病的背景下的作用是最受关注的。
膳食纤维是一种复杂的碳水化合物,哺乳动物无法消化,而是被肠道微生物群发酵。微生物群利用膳食纤维作为营养源,并将其转化为包括乙酸、丙酸和丁酸在内的短链脂肪酸(SCFAs)。
短链脂肪酸激活几种G蛋白偶联受体,包括GPR41和GPR43,并抑制组蛋白去乙酰化酶(HDACs)。最近的研究表明,在各种炎症性疾病背景下,这些受体配体相互作用通过不同机制有助于抑制炎症。
短链脂肪酸对免疫细胞的影响
2009年一项开创性研究表明,乙酸能够通过GPR43依赖的方式促进小鼠肠道损伤和炎症模型中炎症的缓解。调节性T细胞在抑制炎症中起着关键作用,并且在维持免疫稳态和自身耐受性方面至关重要。Treg细胞对于控制自身免疫疾病和包括炎症性肠病在内的慢性炎症病症至关重要。
饮食对慢性炎症性疾病的影响
Arifuzzaman M et al., Immunity. 2024 57(1):14-27.
2013年,微生物群研究取得了重要里程碑,发现短链脂肪酸通过激活GPR43和抑制HDACs促进小鼠Treg细胞的分化和扩张。此外,无菌小鼠或饲养低纤维饮食的特定无特定病原体(SPF)小鼠显示短链脂肪酸和结肠Treg细胞减少。
最后,研究表明短链脂肪酸对小鼠T细胞转移结肠炎模型具有保护作用。这些研究是早期揭示微生物代谢产物直接调节免疫细胞的一些报告之一。从那时起,已经证明短链脂肪酸在小鼠各种炎症性疾病模型中具有抗炎作用,包括哮喘、关节炎和实验性自身免疫性脑脊髓炎(EAE)。
值得注意的是,短链脂肪酸介导的抑制HDACs的作用不仅限于促进Treg细胞,因为乙酸和丙酸也可以在适当细胞因子的预处理下促进Th1或Th17细胞的产生。
短链脂肪酸调节肠道微生物群
罗伊氏乳杆菌(Lactobacillus reuteri)是一种与人体共生的细菌物种,在系统性红斑狼疮(SLE)小鼠模型中,可以通过促进外周树突状细胞的聚集和在肠道和脾脏中提高Ⅰ型干扰素基因表达,来加重疾病结果。
通过饮食中的抗性淀粉,可以逆转罗伊氏乳杆菌(Lactobacillus reuteri)加重SLE的效应。从机制上讲,抗性淀粉诱导的短链脂肪酸通过直接抑制罗伊氏乳杆菌的生长来改善疾病。
注:抗性淀粉,一种被认为是膳食纤维的淀粉形式,因为它逃避了消化并被微生物群发酵。
膳食纤维还发挥着独立于短链脂肪酸的重要抗炎作用
膳食纤维可以保护肠壁的粘液层。如果小鼠缺乏膳食纤维,肠道微生物群就会利用宿主上皮细胞分泌的粘液糖蛋白,导致粘液层降解。这种保护性结肠粘液屏障的侵蚀,会导致肠道病原体Citrobacter rodentium(啮齿类柠檬酸杆菌)进入上皮的机会增加,从而促进结肠炎。
总的来说,这些研究突出了膳食纤维和短链脂肪酸通过多样化的免疫调节途径发挥抗炎作用。
值得注意的是,除了膳食纤维外,发酵食品(包括泡菜、酸菜、乳酪、开菲尔等)也改变了肠道微生物组成和代谢产物,这与人体中炎症标志物的降低相关。这些食物可以作为益生菌,通过提供特定的微生物种群(例如乳杆菌属)以及作为益生元,促进其他微生物种群(例如梭菌和拟杆菌属),从而改善微生物多样性。然而,发酵食品和涉及的微生物种群和代谢产物的抗炎作用机制尚未完全理解,需要进一步研究。
膳食蛋白质,特别是富含色氨酸的食物,如鸡肉、牛奶,也可以影响具有抗炎特性的微生物代谢产物。色氨酸是一种必需氨基酸,存在于富含蛋白质的食物中,人体利用它来产生神经递质5-羟色胺,稳定情绪,褪黑素,调节睡眠的激素,以及维生素B3,作为辅酶。
然而,微生物群也将色氨酸代谢为色胺和吲哚衍生物,包括吲哚-3-醛、吲哚乙酸、吲哚-3-丙酸和吲哚磺酸酯。这些代谢产物可以作为芳香烃受体(AhR)的激动剂,AhR是一个转录因子,在许多哺乳动物细胞类型中调节关键基因表达。
微生物来源的色氨酸代谢产物吲哚、吲哚-3-磺酸盐、吲哚-3-丙酸和吲哚-3-醛在小胶质细胞中的AhR信号传导改变了星形胶质细胞的免疫信号,并减轻了实验性自身免疫性脑脊髓炎的疾病严重程度。
值得注意的是,AhR还可以被各种植物来源、外源化合物和内源配体激活。通过芥蓝科蔬菜(例如西兰花和抱子甘蓝的代谢物)产生的一种代谢产物吲哚-3-甲醇(indole-3-carbinol)激活AhR已被证明促进ILC3s的扩增及其产生组织保护性IL-22,有助于增强多种结肠炎实验模型中的组织保护作用。
通过外源配体2,3,7,8-四氯二苯并二恶英(TCDD)激活AhR可以促进T调节细胞的扩增并抑制实验性自身免疫性脑脊髓炎。相反,内源配体6-甲醛吲哚[3,2-b]咔唑(FICZ)抑制T调节细胞的发育并促进T辅助17细胞的分化,导致实验性自身免疫性脑脊髓炎加重。这些研究表明,AhR在免疫细胞中的功能通常是配体特异的。
关于芳香烃受体(AhR)和色氨酸的详细代谢可以关注下谷禾以前发表的文章:
西方饮食逐渐缺乏膳食纤维,脂肪含量增加,添加盐和糖的浓度也增加,包括蔗糖和高果糖玉米糖浆。尽管西方饮食常常与动物脂肪摄入增加有关,但增加的脂肪含量主要来自全球范围内变得更加普遍的植物油和脂肪。
高脂饮食导致微生物群失调与炎症关联
与高脂饮食或肥胖相关的微生物群组成变化已与小鼠和人类的炎症联系在一起论。高脂饮食会导致小鼠和人类肠道微生物群失调,降低微生物多样性或“丰富度”。在小鼠中,这种微生物群失调已与肠道通透性增加相关联。这导致小鼠在四周内出现低级别肠道炎症。这种初始的炎症反应最终发展成涉及脂肪组织和肝脏炎症的全身性炎症状态,导致胰岛素抵抗。
Ccl2介导的炎症反应在代谢紊乱中的作用
肠道中增加上皮趋化因子Ccl2的表达引发了炎症反应,导致结肠粘膜下层的促炎性巨噬细胞的招募。随后CCL2的全身性升高导致促炎性巨噬细胞渗入脂肪组织,随后是其他炎症免疫细胞类型的积累,包括Th1细胞、CD8+T细胞、自然杀伤细胞(NK细胞)和中性粒细胞。
敲除Ccl2或其受体(Ccr2)可以改善脂肪组织炎症、肝脂肪变性和葡萄糖耐量。在人类肥胖的情况下,胰岛素抵抗主要是由肌肉内炎症驱动的,其特征是肌肉和肌周脂肪组织内免疫细胞的大量浸润。在肥胖的人类中,炎症和胰岛素抵抗与微生物群丰富度降低有关。
此外,减重会降低各种炎症标志物的浓度,包括肿瘤坏死因子α(TNF-α)、IL-6和C-反应蛋白。综上所述,这些数据突出了微生物群在促进炎症和相关代谢紊乱方面在高脂饮食和肥胖背景下的影响。
膳食脂肪促进硫还原致病菌增殖,导致慢性肠道炎症
除了微生物群失调和相关的低级别肠道炎症外,已经显示膳食脂肪可以促进特定微生物物种的积累,这些微生物可以直接导致慢性肠道炎症。例如,高脂饮食会促进牛磺胆酸(TCA)的产生,TCA被释放到肠道中溶解脂肪。研究表明,TCA的高浓度增加了肠道中有机硫的可用性,导致硫还原致病菌(Bilophila wadsworthia)的大量增殖,从而促进Il10−/−小鼠的结肠炎。这些研究需要进一步调查,以更好地表征膳食脂肪相关微生物群与炎症性肠病之间的关联。
扩展阅读:
肠道重要菌属——嗜胆菌属 (Bilophila)喜欢脂肪、耐胆汁的促炎菌
除了膳食脂肪外,添加的糖和盐也以微生物群依赖的方式促进肠道和其他器官的炎症。
高浓度简单糖改变肠道菌群,加重炎症
高浓度的简单糖(如葡萄糖、蔗糖和果糖)改变小鼠的微生物群组成,并与粘蛋白降解致病菌的增加、粘液层侵蚀和肠道通透性增加相关。这导致结肠中IL-1β、IL-6和TNF-α的表达增加,中性粒细胞浸润,并在多种实验性结肠炎模型中以微生物群依赖的方式加重疾病严重程度。
高量的食用食盐(氯化钠)也以微生物群依赖的方式加重化学诱导的结肠炎
高量的食用食盐还通过改变微生物群促进致病性Th17细胞的产生,并加重EAE中的炎症和疾病结果。此外,高量的食用食盐会减少人类和小鼠中的几种乳酸菌菌株。值得注意的是,补充乳酸菌菌株可以预防食盐诱导的EAE加重,表明乳酸菌在神经炎症中具有保护作用。
膳食成分对感染免疫力的影响
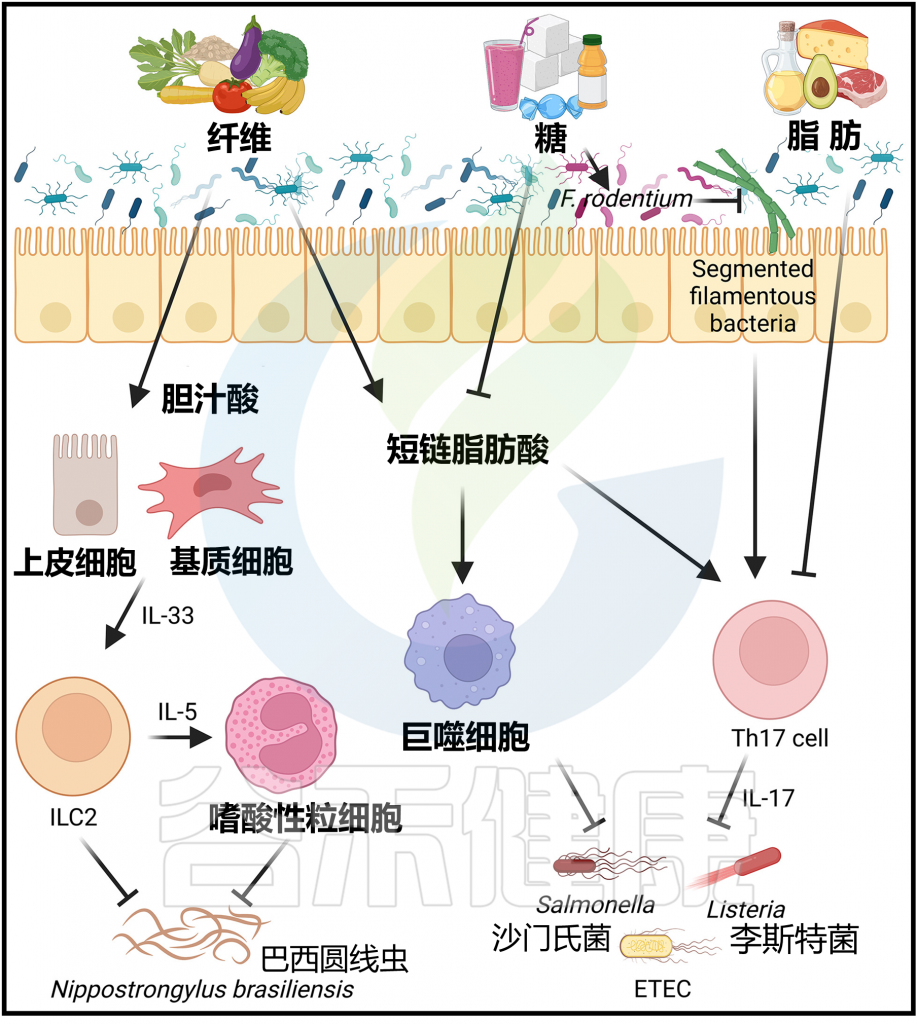
Arifuzzaman M et al., Immunity. 2024 57(1):14-27.
膳食纤维在结肠炎中的作用存在争议
尽管膳食纤维来源的短链脂肪酸(SCFAs)在多种结肠炎小鼠模型中减少肠道炎症,如前文所述,但使用各种高纤维饮食进行的类似研究报道了矛盾的结果。
例如,基于阿拉伯木聚糖的车前子、基于半乳糖的果胶和瓜尔胶具有抗炎或组织保护作用,而基于果糖的菊粉则加重炎症。已进行了多项临床试验来调节IBD患者的膳食纤维,尽管效果不一。此外,通常建议IBD患者避免富含纤维的饮食,因为膳食纤维可能加重疾病。然而,膳食纤维介导疾病恶化的机制尚不清楚。因此,在IBD背景下膳食纤维的作用仍存在争议。值得注意的是,最近的一项研究发现,低聚果糖,即菊粉纤维的结构单位,可以激活人类巨噬细胞产生与结肠炎相关的促炎细胞因子,包括IL-1β和IL-23。
此外,一项随机对照试验表明,给溃疡性结肠炎(UC)患者服用菊粉会增加结肠中的炎症细胞因子,包括IL-1β、IL-23和IL-5,并导致部分患者症状复发。在小鼠中,基于菊粉的高纤维饮食上调微生物群来源的胆酸代谢产物,促进IL-33的产生。这导致自然淋巴细胞群2(ILC2s)的激活和IL-5的产生,导致结肠中的嗜酸性粒细胞炎症。
菊粉纤维饮食还会触发肺部嗜酸性粒细胞增多,并加重小鼠过敏性气道炎症模型的疾病结果,而果胶纤维具有保护作用。
这些研究强调了假设膳食纤维的作用与SCFAs相同是误导性的。
但是以上数据表明饮食-微生物群轴对免疫细胞稳态和炎症性疾病具有深远影响。
除了影响各种炎症性疾病外,饮食和微生物群也被证明能够塑造对抗各种感染的免疫反应。尽管膳食纤维大多能够保护免受感染,但膳食脂肪和糖分却可能促成病原体发病过程。
正如前面所讨论的,膳食纤维通过维持肠道屏障完整性来保护免受肠道感染的影响,因为膳食纤维不足会促使以粘蛋白为食的微生物群破坏小鼠肠道的保护性黏液层。
丁酸对肠道病原体的多种抗菌机制
来源于纤维的丁酸盐有助于体外维持结肠上皮细胞的紧密连接完整性。丁酸也可以通过HDAC3抑制促进单核细胞向巨噬细胞的分化。因此,丁酸增强了小鼠巨噬细胞对一系列肠道病原体(包括沙门氏菌伤寒沙门氏菌和粘附侵袭性肠毒素产生大肠埃希菌)的抗菌活性,这与增强的抗菌肽产生和吞噬能力有关。丁酸还降低了上皮细胞的氧化程度,从而限制了沙门氏菌的需氧生长。
丙酸,另一种SCFA,可以通过破坏细胞内pH稳态直接抑制伤寒沙门氏菌的生长。最后,对口服感染的小鼠进行丁酸补充可以促进细菌清除,并防止这些病原体的全身传播。
微生物群对抗病毒免疫的重要性
微生物群在天然和适应性抗病毒免疫中也发挥着至关重要的作用。涉及微生物群消耗或改变的小鼠研究表明,微生物群对包括诺如病毒、黄病毒和流感病毒在内的病毒感染的保护性免疫反应至关重要。
已经证明微生物群对于最佳激活不同抗病毒机制是必不可少的,包括干扰素反应、CD4+和CD8+ T细胞反应以及抗体产生。虽然膳食纤维和SCFA通过增强效应细胞CD8+ T细胞功能在抗病毒免疫中发挥着关键作用,但饮食和微生物群来源的代谢产物在许多微生物群调节的抗病毒免疫机制中的作用仍需要进一步研究。
膳食纤维在蠕虫感染免疫中的保护作用
膳食纤维还通过其他代谢产物在小鼠中提供对蠕虫感染的保护性免疫。富含菊粉的高纤维饮食促进了细菌去共轭胆酸,提高了体内各种未共轭胆酸的浓度,包括胆酸。这些微生物群来源的胆酸增加了肺上皮细胞和肠间质基质细胞产生IL-33,导致ILC2s的激活。
当小鼠感染蠕虫寄生虫巴西圆线虫(Nippostrongylus brasiliensis),这种寄生虫会感染肺部,然后迁移到肠道,与对照组饮食喂养的小鼠相比,富含菊粉的饮食会增加肺部的杯状细胞和肠系膜淋巴结中的嗜酸性粒细胞。
这些由菊粉纤维诱导的2型免疫反应导致了肠道中蠕虫的加速排出,表明了膳食纤维在抵御寄生性蠕虫方面的益处。这些研究可能有助于增加全球对食物和补品的了解,特别是在那些细菌性肠道感染和蠕虫感染仍然地方性流行的地区。
肠道微生物群对传染性疾病疫苗效果的调节
肠道微生物群及其相关代谢产物在小鼠对传染性疾病疫苗的有效性中也发挥着重要作用。例如,小鼠巨噬细胞通过检测肠道微生物群菌株产生的鞭毛蛋白,促进巨噬细胞内固有产生浆细胞生长因子,直接促进浆细胞产生抗体。
此外,B淋巴细胞可以利用来源于膳食纤维衍生的SCFA产生的乙酰辅酶A作为细胞代谢的燃料,从而支持抗体的产生。
在人类中,许多研究将微生物群与对各种传染性疾病的疫苗反应联系起来。例如,已经证明抗生素介导的微生物群失调会损害那些预先抗体滴度较低的受试者对季节性流感的抗体反应,并且与抗生素治疗导致次生胆酸系统浓度降低有关。然而,各种饮食在微生物调节疫苗反应中的作用仍未得到充分探讨。
高脂饮食快速影响微生物群组成和免疫反应
正如前面讨论的那样,高脂饮食会增加小鼠肠道微生物群中Bacillota的数量,并以微生物群依赖的方式促进肠道通透性和炎症。尽管高脂饮食诱导的小鼠肥胖需要数月的膳食干预,但微生物群组成的转变和相关的免疫反应变化是迅速的,可以在几天内检测到。相关研究表明,进行为期两周的高脂饮食干预足以加重小鼠对病原细菌感染的情况。例如,口服李斯特菌单胞菌感染的小鼠,高脂饮食组的盲肠、肠系膜淋巴结和脾脏中细菌负荷增加,比饲喂常规饮食组高。
在人类中,饮食引起的微生物群变化也会在饮食发生重大改变后立即开始。一个典型的饮食变化例子是从以植物为基础的饮食转变为以动物为基础的饮食,这在社交活动期间的宴会中经常发生,比如参加宴会。这些宴会饮食通常富含脂肪和糖分,而纤维含量较低。
饮食改变对抗肿瘤免疫和癌症免疫疗法的影响
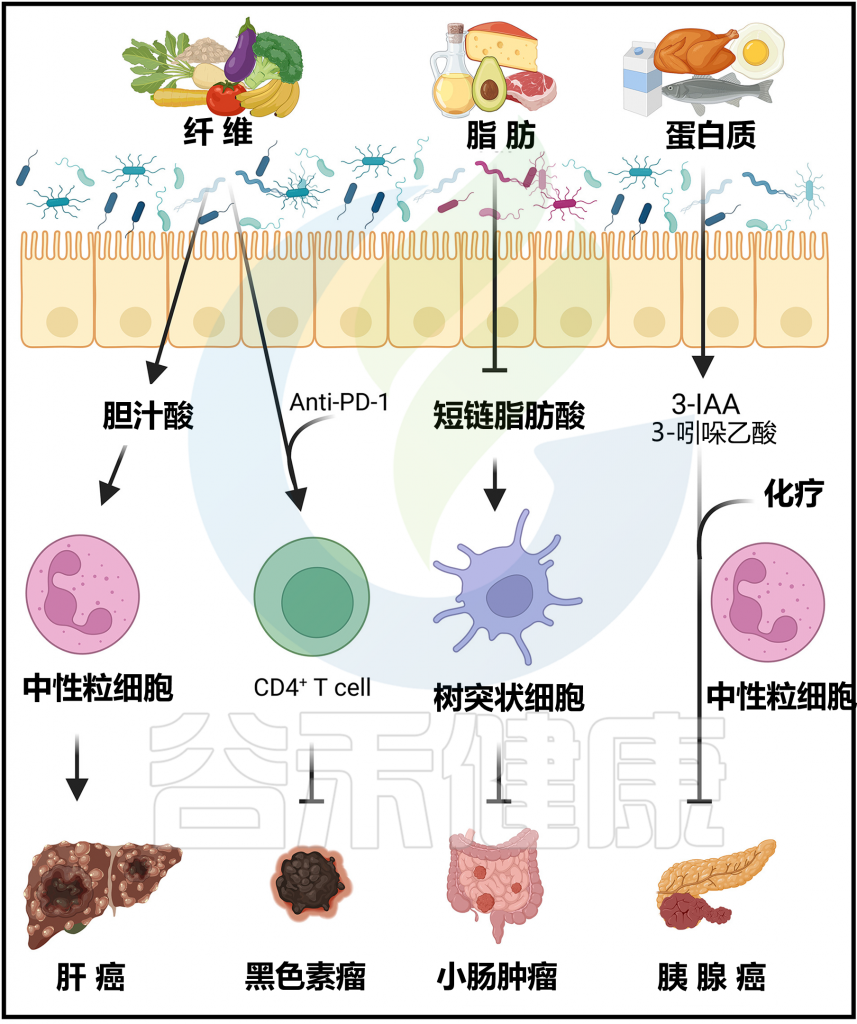
Arifuzzaman M et al., Immunity. 2024 57(1):14-27.
短期宴会饮食通过影响微生物群和Th17细胞抑制小鼠肠道免疫
一项研究使用了一种高脂肪、富含糖分(双糖和寡糖)、富含胆固醇、低纤维的饮食,因此模拟了“宴会饮食”。
研究发现,短暂接触这种宴会饮食会改变小鼠的微生物群组成,并抑制对细菌感染的黏膜免疫。在小鼠的回肠内容物中观察到了微生物群的快速和可逆性变化,宴会饮食3天后微生物群多样性减少,但在停止宴会饮食3天后迅速恢复到基线组成。
值得注意的是,这种为期3天的宴会饮食足以降低小肠Peyer氏板中Th17细胞的数量,降低回肠中Il17a、Il17f和Il22等3型细胞因 子的表达,这些细胞因子在维持肠道上皮屏障和抵御细菌病原体方面起着关键作用。
因此,这种饮食转变可能导致对沙门氏菌和李斯特菌感染的更高敏感性。与接受常规饮食小鼠回肠内容物的无菌小鼠相比,接受宴会饮食小鼠回肠内容物的无菌小鼠Il17a和Il17f的表达也减少,表明这种饮食介导的免疫抑制依赖于并可通过肠道微生物群传播。
高脂饮食(其中≥90%的热量来自脂肪)也会降低小鼠肠道中的Th17细胞,这与酮体介导的双歧杆菌耗竭有关。
值得注意的是,在不添加任何脂肪的低纤维、高糖饮食中,小鼠Th17细胞和细胞因子的减少情况也相似,这表明免疫表型的变化不取决于膳食脂肪,而是取决于饮食的能量密度和缺乏纤维。
宴会饮食降低SCFA,蔗糖促进Faecalibaculum rodentium 扩增,影响Th17细胞水平
宴会饮食会降低盲肠内容物中的乙酸和丁酸浓度,给予这两种短链脂肪酸(SCFA)的补充可以恢复Th17细胞数量并增强对沙门氏菌的保护。此外,另一项研究表明,向以普通饲料为基础的小鼠提供蔗糖饮水足以减少Th17细胞数量,这意味着小肠Th17细胞的减少也可能是由于高量的膳食糖引起的。
蔗糖会促使Faecalibaculum rodentium(该菌属于芽孢杆菌门下的Erysipelotrichaceae家族)的扩张。Faecalibaculum rodentium的扩增导致分段丝状细菌的替代,而后者已知能诱导和维持Th17细胞。
综合这些数据表明,虽然膳食纤维通过微生物群来源的短链脂肪酸和胆酸代谢产物对抗感染具有益处,但缺乏膳食纤维同时高量的脂肪和糖可能会削弱对各种肠道细菌病原体的肠道免疫力。
过去的十年里,许多临床前和临床研究报告指出,微生物群的组成在免疫系统对肿瘤的控制中起着重要作用,并可以促进对治疗的反应。
无菌小鼠或接受抗生素治疗的小鼠对化疗和免疫疗法表现出增强的抗药性。相比之下,口服具有益生菌Bacteroides fragilis有助于提高SPF小鼠对黑色素瘤的抗CTLA-4或抗PD-L1反应。
另外,缺乏膳食纤维的小鼠对黑色素瘤的抗PD1免疫检查点疗法没有反应,这与Ruminococcaceae的减少有关。这些小鼠中膳食纤维的抗肿瘤效果与CD4+T细胞增加有关。
在黑色素瘤和上皮癌患者中,对抗PD-1疗法的反应者和非反应者之间微生物组成存在显著差异。治疗反应与肿瘤中CD4+和CD8+T细胞的浸润增加有关,这与肠道微生物多样性高的几种菌,包括Akkermansia muciniphila、粪杆菌属(Faecalibacterium)、毛螺菌科(Lachnospiraceae) 等有关。这些菌谷禾专门科普过,详见:
肠道核心菌属——普拉梭菌(Faecalibacterium Prausnitzii),预防炎症的下一代益生菌
膳食纤维增强抗肿瘤效果,瘤胃球菌、粪杆菌属等与癌症免疫治疗反应有关
抗生素治疗可能降低上皮癌患者抗PD-1疗法的临床益处。黑色素瘤患者对免疫检查点抑制剂疗法的反应不佳与膳食纤维摄入不足(<20克/天)有关。
与无反应者相比,反应者的微生物群显示出瘤胃球菌科(Ruminococcaceae)和粪杆菌属(Faecalibacterium)的富集。值得注意的是,发挥抗肿瘤作用的有益微生物群是可传播的。
与无反应患者的粪便微生物群移植 (FMT) 相比,来自有反应患者的无菌或抗生素治疗小鼠,对抗 PD-1 和抗 PD-L1 治疗黑色素瘤和肉瘤的反应更好。
此外,来自应答患者的 FMT 可以促进免疫细胞(包括 CD8 + T 细胞)的数量和激活状态,并提高黑色素瘤患者抗 PD-1 治疗的临床获益。
这些发现表明,膳食纤维通过维持微生物群分类群(包括瘤胃球菌科和粪杆菌属)来促进癌症免疫治疗,从而改善治疗结果。然而,需要进一步的研究来确定微生物菌株和相关代谢物在这些疗法的有效性中的具体作用。
吲哚-3-乙酸增强胰腺癌化疗效果
微生物群来源的代谢产物已被证明可以调节多种癌症小鼠模型的临床结果。从膳食色氨酸的微生物代谢中产生的吲哚-3-乙酸可以以中性粒细胞依赖的方式增强小鼠对胰腺癌的化疗效果。从理论上讲,中性粒细胞来源的髓过氧化物酶氧化吲哚-3-乙酸,氧化产物可以阻止癌细胞的增殖。
除了上述关于饮食和微生物群在抗肿瘤疗法中的作用的研究外,还有几项研究强调了饮食和微生物群在肿瘤发生中的作用。
高脂饮食降低短链脂肪酸,促癌
高脂饮食会降低小鼠粪便中的短链脂肪酸浓度,并以微生物群依赖的方式促进易感基因小鼠肠道肿瘤的发展。通过丁酸的给药可以减轻高脂饮食介导的肿瘤进展,丁酸可以促进树突状细胞的招募。
菊粉纤维可能促癌
尽管膳食纤维通常被认为对抗肿瘤疗法有益,但特定类型的纤维可能会以依赖环境的方式发挥促肿瘤作用。例如,菊粉纤维通过改变与升高的胆酸代谢物和肝内中性粒细胞炎症相关的微生物群,促进小鼠肝细胞癌的发展。
综合这些研究表明,通过膳食调节微生物群来源的代谢产物影响肿瘤发生和治疗结果,这可以用于精准营养学以预防和治疗癌症。
肠道微生物群与免疫系统之间的相互作用形成了两者的组成和功能,从而在外周组织中维持稳态平衡。
关键是,饮食可以维持或扰乱这种平衡,导致有益或有害的影响。饮食可以调节微生物组成和菌群失调,取决于微生物群的状态和膳食暴露的类型。
挑战
剖析特定菌株与识别微生物来源代谢产物
虽然膳食纤维的抗炎作用以及膳食糖和脂肪的促炎后果已被充分确立,但我们对其他膳食成分如何影响免疫系统的了解仍然有限。此外,剖析调节这些过程的特定微生物菌株和代谢产物是具有挑战性的。基于代谢组学的最新进展已经允许在各种宿主组织部位检测和定量低丰度代谢产物。
最近可用的公共数据库和生物信息学工具有助于在质谱数据中识别微生物来源的代谢产物。此外,基于CRISPR的细菌遗传学正在使得难以培养或操作的微生物菌株的操纵成为可能。
新兴工具和技术
研究免疫介导性疾病中微生物群和代谢产物
通常,一个蛋白质的合成由一个基因介导,而一种代谢产物的合成涉及多个代谢酶(因此,多个基因),这增加了微生物群介导的宿主代谢产物生产的复杂性。据统计,在非靶向代谢组学分析中,只有不到2%的光谱被注释;即98%的光谱与现有数据库中的化合物不匹配。据推测,这些“暗物质”的相当一部分具有微生物起源。
额外的计算工具,如CSI:FingerID,将有助于通过质谱观察到的这些光谱的注释。
在微生物群的基因操纵中,可以确认微生物菌株及其代谢途径在微生物驱动的表型中的作用。然而,以往,由于许多非模式菌株的遗传可操作性存在限制,这种策略是难以实现的。
基于CRISPR-Cas9的技术的最新发展已经允许针对非模式微生物进行遗传研究。这些遗传工具还可以有助于因果关系或干预研究以及未来基于代谢产物的治疗。外部提供的代谢产物的剂量和数量可能无法准确模拟微生物来源的剂量和数量。因此,一种精确地探究微生物群衍生分子在其产生环境中的方法是通过删除负责基因,从而“切断”各种共生微生物来源的代谢产物的产生。这些额外的遗传和生物信息学工具将有助于推动机制研究,并确定特定微生物菌株和微生物来源的代谢产物在调节各种免疫途径中的不可替代作用。
潜力
微生物群与个性化治疗性饮食
我们目前对营养调节炎症的了解仅限于个别营养素或食物类别。饮食模式和摄食行为也可以影响肠道微生物群和人体健康。我们通过神经元和化学感受味觉受体感知饮食方式,可以影响与饮食相关疾病的病理生理学。
然而,对微生物群在这些过程中的作用的理解仍然不完整。通过个性化治疗性饮食和营养干预的精准营养的当前愿景需要更深入的机制理解饮食-微生物群相互作用和摄食行为,并将其与年龄、性别和疾病相关参数相结合。
对饮食-微生物群-代谢物三者之间关系的更好理解为在三个层面开发有针对性的治疗提供了潜力:
1)益生元,促进特定微生物群的饮食
2)益生菌,特定野生型或基因工程微生物群
3)后生元,特定微生物群衍生代谢产物或具有更好疗效的合成类似物。
结合我们对微生物代谢产物在基因、细胞、分子和化学生物学水平的了解,可以更好地理解它们在调节宿主炎症和免疫中的作用,并通过操纵饮食-微生物群轴促进健康。
主要参考文献:
Arifuzzaman M, Collins N, Guo CJ, Artis D. Nutritional regulation of microbiota-derived metabolites: Implications for immunity and inflammation. Immunity. 2024 Jan 9;57(1):14-27.
Akagbosu B, Tayyebi Z, Shibu G, et al. Novel antigen-presenting cell imparts Treg-dependent tolerance to gut microbiota[J]. Nature, 2022, 610(7933): 752-760.
Montrose D C, Nishiguchi R, Basu S, et al. Dietary fructose alters the composition, localization, and metabolism of gut microbiota in association with worsening colitis[J]. Cellular and molecular gastroenterology and hepatology, 2021, 11(2): 525-550.
Bisanz J E, Upadhyay V, Turnbaugh J A, et al. Meta-analysis reveals reproducible gut microbiome alterations in response to a high-fat diet[J]. Cell host & microbe, 2019, 26(2): 265-272. e4.
Alexander M, Turnbaugh P J. Deconstructing mechanisms of diet-microbiome-immune interactions[J]. Immunity, 2020, 53(2): 264-276.