-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
氨基酸(AA)稳态对人体健康至关重要,其紊乱与多种疾病的发生和进展密切相关,如2型糖尿病和炎症性肠病(IBD),并且常常是治疗结果的决定性因素。
肠道微生物群可能通过多种机制调节宿主氨基酸的可用性,例如影响消化酶(如胰蛋白酶)的活性。肠道微生物群定殖还可能改变肠道通透性,从而影响胃肠道中游离氨基酸的运输和吸收。此外,肠道微生物可能直接利用或代谢肠道中的氨基酸,或合成并向宿主提供氨基酸。以往研究表明,肠道微生物组的变化(或其存在)可能影响肠道氨基酸谱。然而,参与调控宿氨基酸稳态的关键菌株及代谢基因仍未完全明确。
今天分享的这一篇发表在《Cell Host & Microbe》期刊上的研究论文”Microbiota metabolism of intestinal amino acids impacts host nutrient homeostasis and physiology”,通过比较Met无菌(GF)小鼠与无特异病原体(SPF)小鼠的分解物谱已证明,肠道细菌定殖会影响胃肠道(GI)中游离氨基酸谱,还通过高效代谢肠道氨基酸来重塑宿主氨基酸的格局。为确定责任微生物/基因,该研究开发了基于代谢组学的检测法,筛查了104个共生菌,并识别出能高效利用氨基酸的候选基因,并发现这些基因调控了肠道和循环氨基酸的可用性。
结果显示,不同氨基酸具有特定的细菌消费者,消耗效率差异明显。例如,天冬酰胺和谷氨酸被拟杆菌和部分梭菌高效利用,而芳香族氨基酸(色氨酸、酪氨酸)及支链氨基酸(BCAAs)仅为部分厚壁菌门成员所代谢,效率较低。值得注意的是,支链氨基酸与色氨酸代谢相关的微生物基因还能通过调节外周血清素间接影响宿主葡萄糖平衡。
总体而言,该研究首次系统揭示了肠道微生物群编码的氨基酸代谢活动对宿主营养稳态的深远影响,为理解微生物介导的氨基酸利用及其对宿主代谢调控机制提供了关键分子依据。
氨基酸稳态对人类健康至关重要,其紊乱与2型糖尿病和炎症性肠病(IBD)等多种疾病的进展密切相关。虽然传统上认为肠道和肝脏是调控营养代谢的主要器官,但最新研究发现,肠道微生物群通过代谢氨基酸能够深刻重塑宿主的氨基酸谱。
★该研究的核心意义在于:
•揭示了肠道微生物群通过代谢肠道氨基酸影响宿主氨基酸稳态的分子机制;
•鉴定了高效消耗氨基酸的特定肠道微生物及其代谢基因;
•阐明了微生物群氨基酸代谢基因如何通过外周血清素调节宿主葡萄糖稳态;
•为通过调节肠道微生物群代谢活性改善人类健康提供了新的靶点和策略。
▸ 肠道微生物群对宿主氨基酸水平的影响
研究首先通过比较无菌(GF)小鼠、无特定病原体(SPF)小鼠以及接受SPF微生物群移植(FMT)的GF小鼠,证实了肠道微生物群定植显著降低了肠道和循环氨基酸水平。
靶向代谢组学分析显示,SPF小鼠或接受SPF微生物群的GF小鼠肠道和循环氨基酸浓度普遍降低,这与之前的研究结果一致,表明微生物对肠道氨基酸的利用可能是影响宿主氨基酸稳态的主要途径之一。
▸ 高效代谢氨基酸的肠道微生物筛选
为识别高效代谢肠道氨基酸的微生物,研究者建立了一种基于活细胞的高通量代谢组学筛选方法,对104种肠道共生菌进行了系统分析。该方法综合考虑多个因素:
•生长阶段差异:绘制各菌株生长曲线并进行参数拟合,确保在可比生长阶段进行筛选;
•时间动态分析:分别在15、30和60分钟测定氨基酸消耗量,以精确评估不同菌株对特定氨基酸的利用速率;
•营养条件优化:在测定缓冲液中除氨基酸外,补充无机氮源、微量矿物质、维生素及额外碳源(如葡萄糖),以避免因营养限制导致的氨基酸非特异性快速消耗。
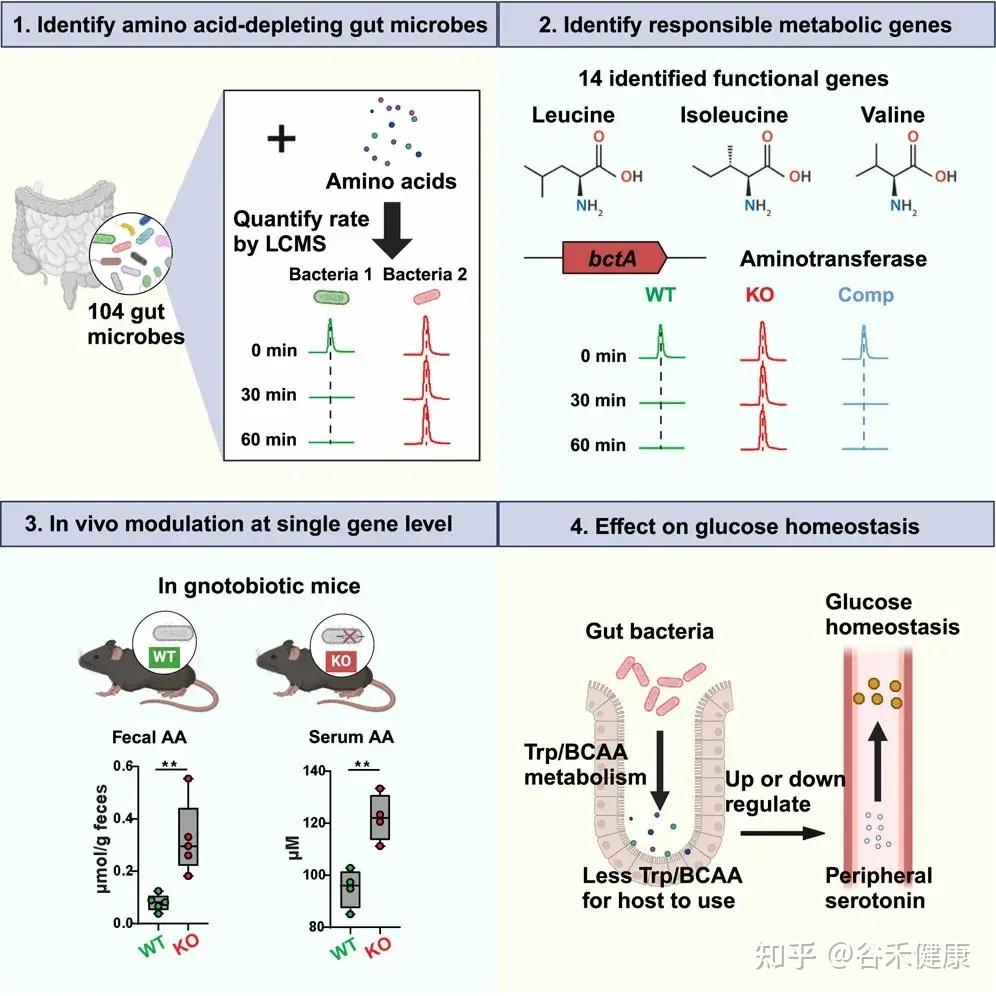
研究流程图展示了从识别消耗氨基酸的肠道微生物、鉴定负责的代谢基因、单基因水平的体内调节到对葡萄糖稳态影响的完整研究路径。
▸ 微生物代谢基因的鉴定与功能验证
研究利用CRISPR-Cas9和ClosTron等基因编辑技术,在系统发育多样的肠道微生物中开展大规模基因缺失分析,以鉴定氨基酸代谢的关键基因。筛选标准包括:
1.代谢基因编码的酶以氨基酸为直接底物;
2.这些基因存在于高效代谢氨基酸的肠道菌株中;
3.携带相关基因的菌株能稳定定植于无菌(GF)小鼠肠道,并降低宿主体内相应氨基酸水平。
通过构建基因敲除和互补菌株并结合代谢组学分析,研究识别出多种氨基酸代谢相关基因,并在单菌定植的GF小鼠模型中验证了其对肠道及血清氨基酸水平的调控作用。
▸ 高效代谢氨基酸的肠道微生物鉴定
通过大规模筛选,研究发现不同肠道微生物对氨基酸的代谢效率和偏好存在显著差异:
鉴定高效利用氨基酸的肠道微生物候选者
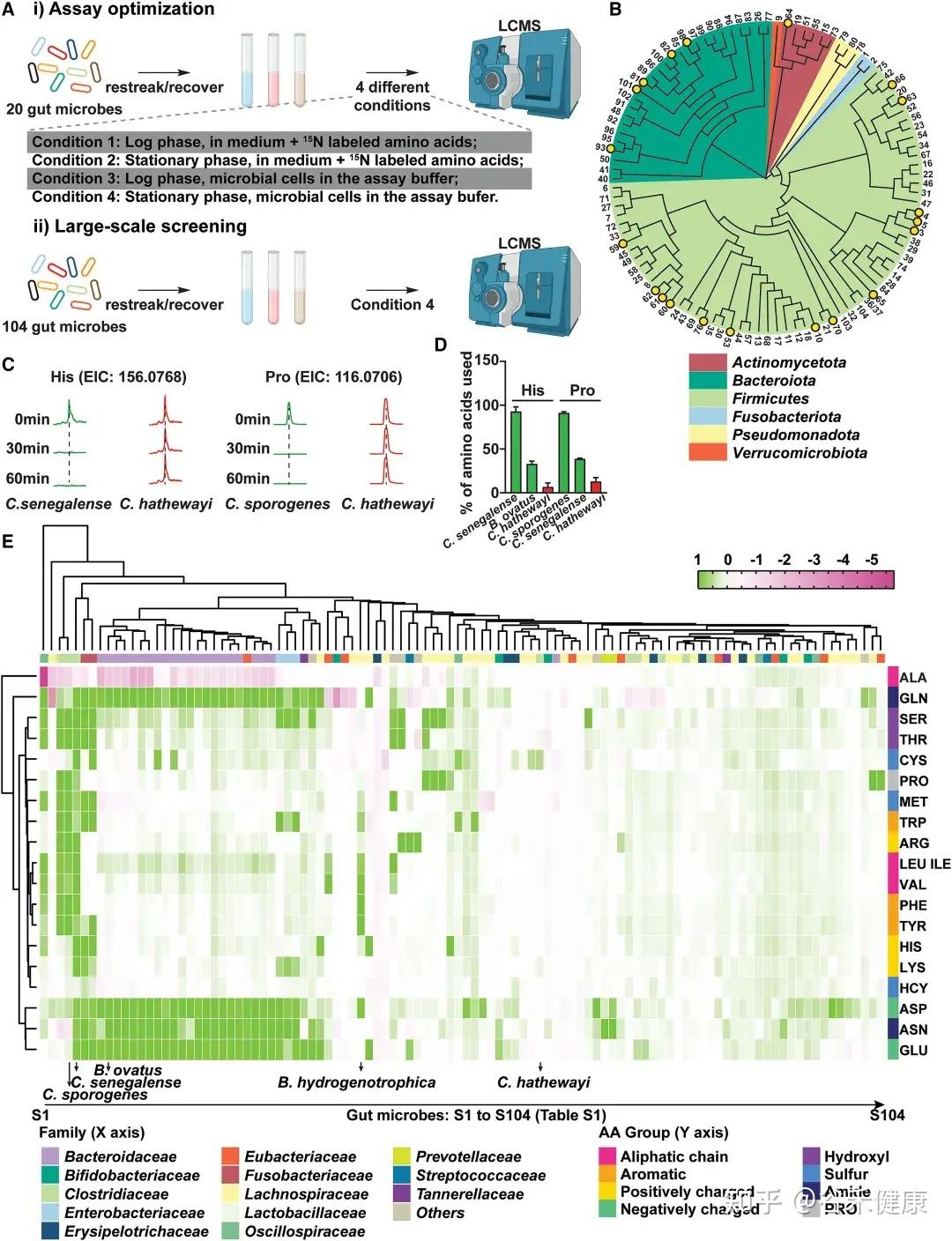
热图展示了104种肠道微生物对不同氨基酸的代谢情况,揭示了微生物系统发育与氨基酸代谢效率之间的复杂关系。
★ 关键发现包括:
•梭菌属微生物:如Clostridium sporogenes ATCC15579和Clostridium senegalense DSM25507,可高效代谢多种氨基酸,包括精氨酸、芳香族氨基酸、支链氨基酸、组氨酸、赖氨酸和脯氨酸等。
•拟杆菌属共生菌:作为肠道多糖的主要利用者,也能有效代谢天冬酰胺(Asn)、天冬氨酸(Asp)和谷氨酰胺(Gln)等氨基酸。
•氨基酸特异性代谢:不同氨基酸具有特定的细菌“消费者”,消耗效率差异明显。天冬酰胺和谷氨酸通常被拟杆菌和部分梭菌快速利用,而芳香族氨基酸(色氨酸、酪氨酸)及BCAA仅被部分厚壁菌门或梭菌较低效地代谢。
▸ 氨基酸代谢相关微生物基因的鉴定
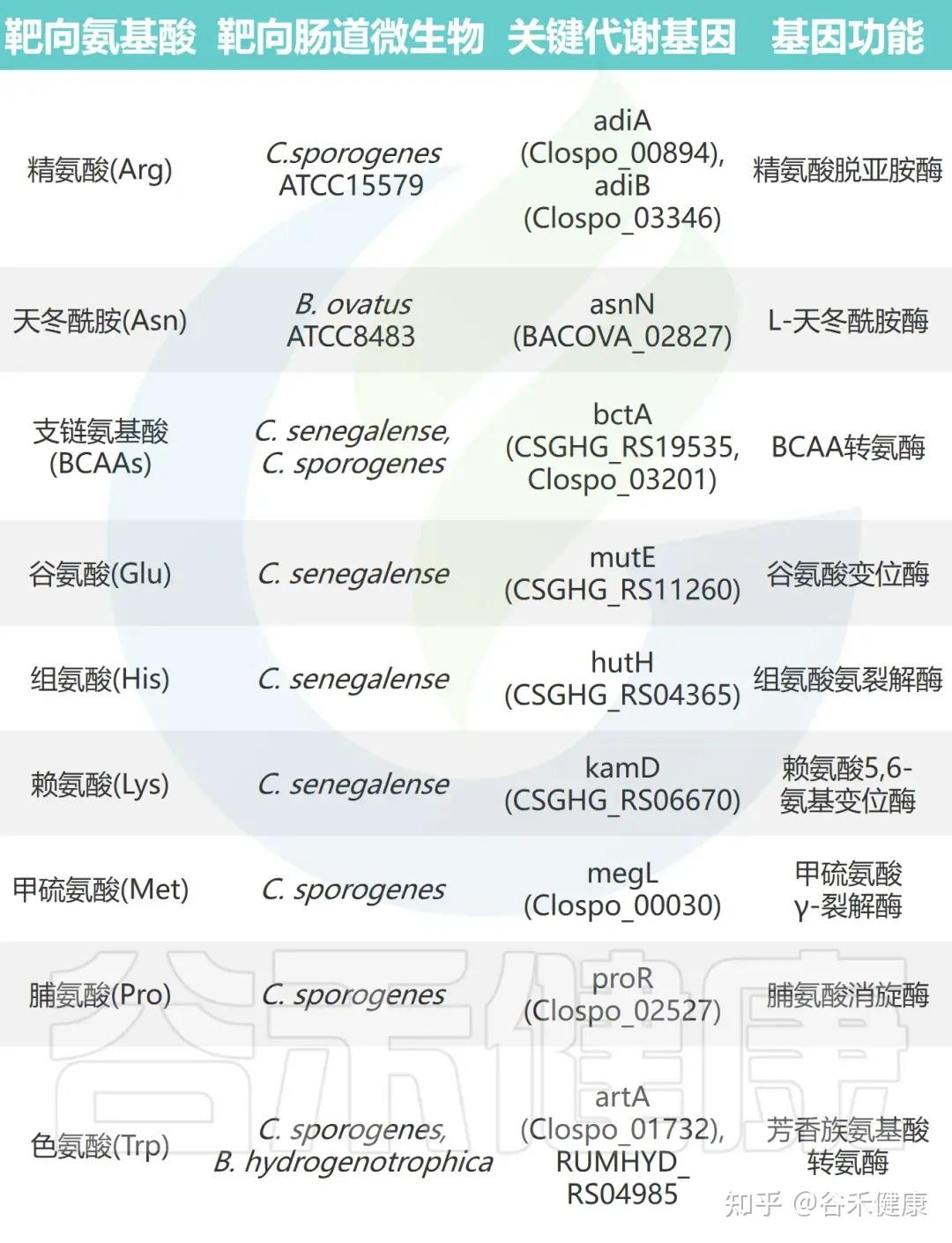
通过对高效代谢氨基酸的肠道微生物进行大规模基因缺失分析,研究鉴定出多种关键氨基酸代谢基因。这些基因编码的酶包括转氨酶、脱羧酶、消旋酶和氨裂解酶等,具有以下特征:
•功能冗余性:单株细菌常含多个具有相似功能的基因。例如,C. sporogenes 携带两种精氨酸脱亚胺酶基因(adiA 和 adiB),单基因敲除影响较小,而双敲除可完全消除其精氨酸代谢能力。
•底物特异性:代谢酶展现高度底物选择性。例如,C. sporogenes 的转氨酶 ArtA 特异作用于色氨酸和酪氨酸,但对苯丙氨酸代谢影响极小。
•催化多样性:不同类型的酶参与多条代谢途径。支链氨基酸和色氨酸经转氨途径代谢,脯氨酸通过还原反应被 C. sporogenes 利用,而谷氨酸、甲硫氨酸、丝氨酸和苏氨酸则由氨裂解酶快速分解。
•功能可转移性:这些酶的催化功能具有可转移性,在其他肠道共生菌中表达其编码基因可赋予相应氨基酸的消耗能力。
▸ 微生物代谢基因调控宿主氨基酸稳态
通过将野生型菌株及其代谢基因缺失突变体分别单菌定植于GF小鼠,研究发现这些基因显著影响宿主肠道及循环系统中的氨基酸水平:
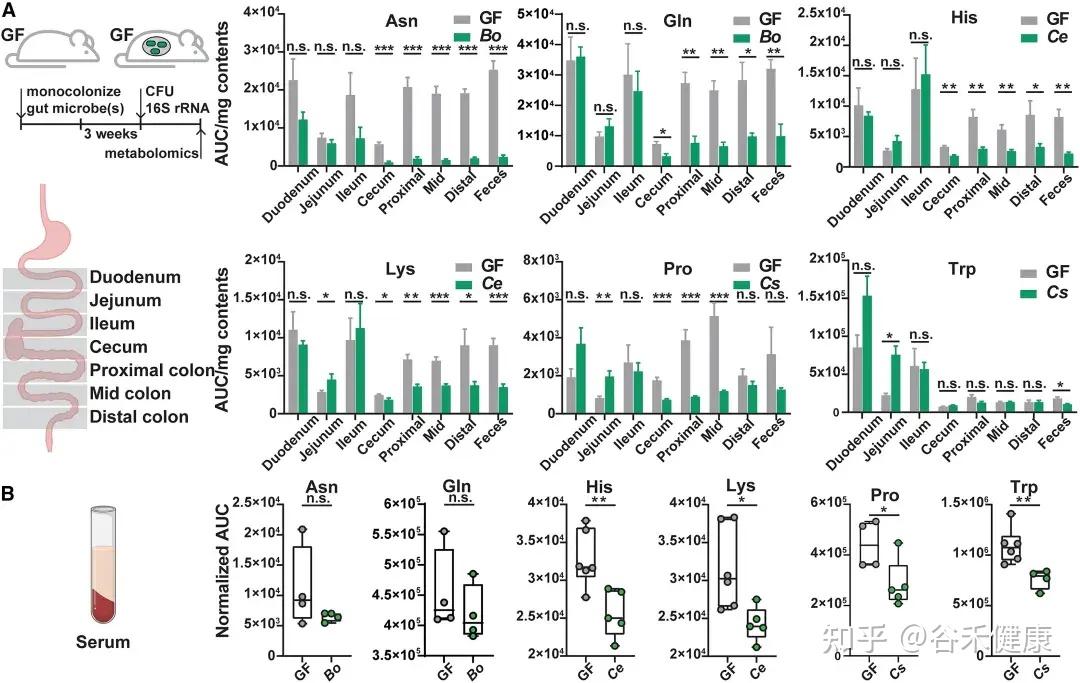
无菌小鼠单一定植B. ovatus、C. senegalense和C.sporogenes野生型菌株后,肠道和血清中特定氨基酸浓度显著降低。
★ 主要发现包括:
•肠道氨基酸稳态调控:多数鉴定出的微生物代谢基因或酶影响肠道氨基酸平衡。由于突变体的相应代谢途径被阻断,肠道内容物和粪便中相关氨基酸显著积累。
•循环氨基酸谱变化:部分代谢基因还影响宿主血清氨基酸水平。定植 Asn、Leu/Ile、Pro 和 His 利用缺陷突变体的无菌小鼠,其血清中对应氨基酸明显升高。
•系统性调节的复杂性:循环氨基酸水平的变化并不总与微生物在肠道中的代谢能力一致。例如,定植 C. sporogenes 精氨酸利用缺陷突变体可显著提高肠道精氨酸水平,但对循环精氨酸影响有限,提示肠上皮或肝脏代谢等额外机制亦参与精氨酸的全身稳态调控。
单基因水平的微生物群氨基酸代谢调控
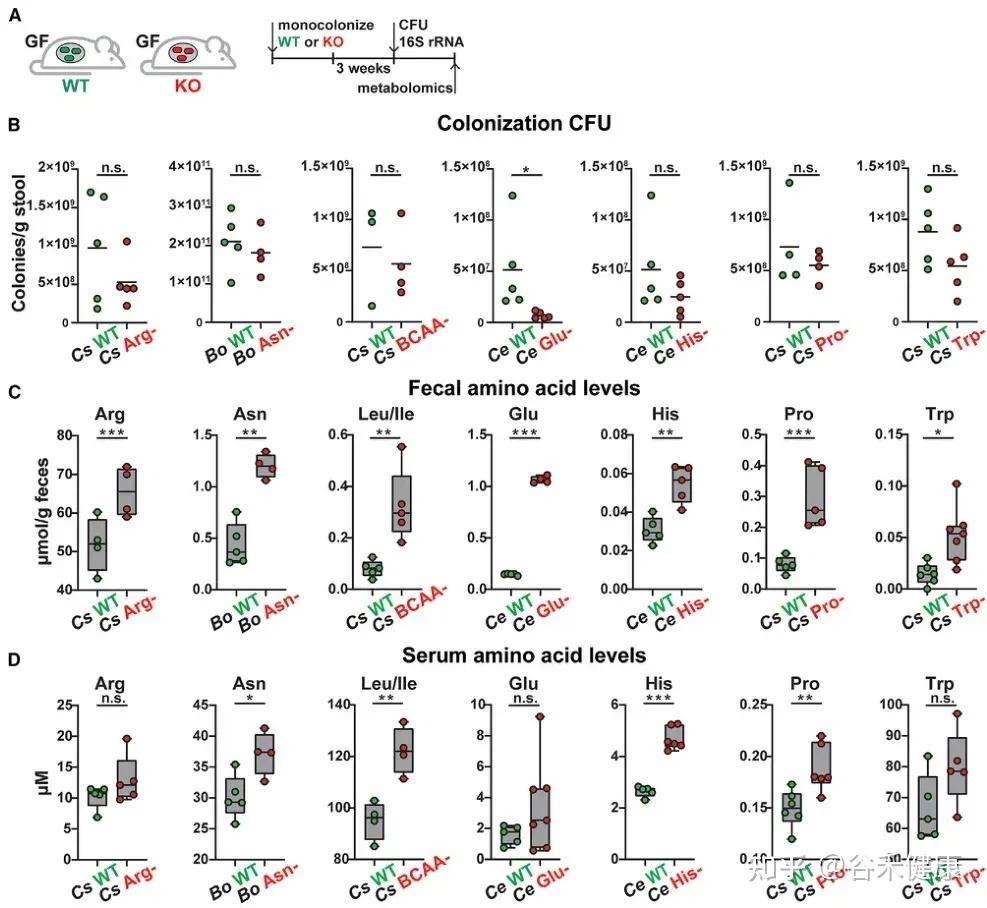
单基因水平的体内调节实验显示,氨基酸代谢基因缺陷突变体定植的无菌小鼠粪便和血清中相应氨基酸水平显著升高。
▸ 微生物氨基酸代谢通过外周血清素调控宿主葡萄糖稳态
研究发现,微生物中支链氨基酸(BCAAs)和色氨酸代谢相关基因可通过外周血清素间接调节宿主葡萄糖稳态。将 C. sporogenes 野生型、BCAA 缺陷型及色氨酸缺陷型突变体分别单菌定植于 GF 小鼠,并进行口服葡萄糖耐量试验(OGTT),结果显示以下关键发现:
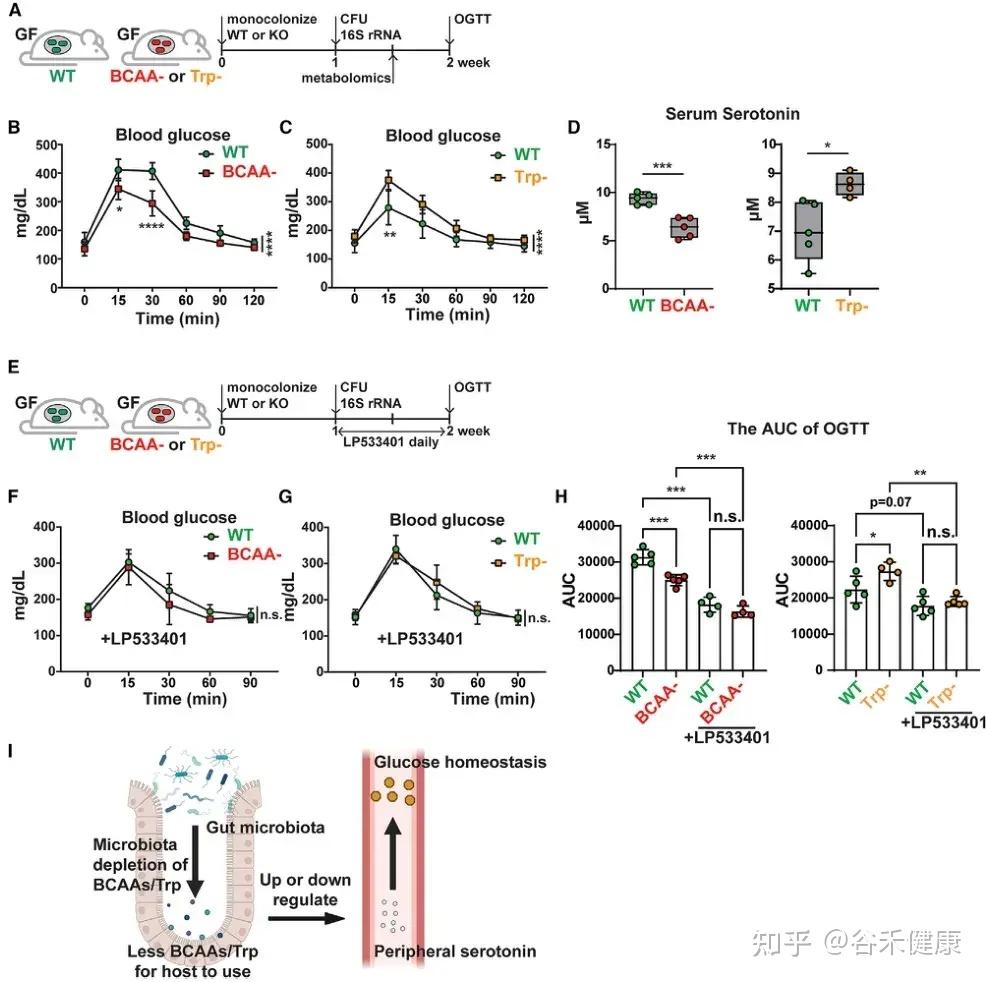
微生物支链氨基酸和色氨酸代谢通过调节外周血清素水平影响宿主葡萄糖稳态的机制示意图及实验验证。
•BCAA代谢与葡萄糖耐受性:定植 BCAA 缺陷突变体的小鼠葡萄糖耐受性显著增强,伴随血清素水平下降。
•色氨酸代谢与葡萄糖耐受性:定植色氨酸代谢缺陷突变体的小鼠表现相反,葡萄糖耐受性下降,血清素水平升高。
•血清素介导机制:应用 Tph1 抑制剂 LP533401 阻断外周血清素合成后,野生型与突变体定植小鼠间的葡萄糖处理差异显著减小,证实微生物氨基酸代谢通过调控外周血清素影响宿主葡萄糖稳态。
这一发现揭示了肠道微生物群、氨基酸代谢、外周血清素及葡萄糖稳态间的复杂关联,为理解代谢性疾病的机制提供了新思路。
!
研究局限性
尽管该研究取得了重要发现,但仍存在一些局限性:
1.微生物氨基酸代谢的多样性:研究主要关注肠道微生物对氨基酸的消耗,而其合成、转运等途径也可能影响宿主氨基酸稳态。体外测定仅反映特定条件下的代谢效率,难以全面代表其在宿主体内的作用。
2.模型简化的局限性:研究采用单菌定植的 GF 小鼠模型,未来应在更接近生理状态的模型(如定植简化微生物群的 GF 小鼠)中验证这些机制。
3.复杂微生物群中基因操作的挑战:虽然本研究成功在宿主定植背景下操纵单一氨基酸代谢途径,但在复杂微生物群中实现精确基因操作仍需进一步技术突破。
4.宿主响应机制研究不足:研究揭示了野生型与突变体共生菌定植小鼠间的生理差异,但尚需深入解析相关宿主细胞类型及信号通路的具体调控机制。
未来的研究在单基因分辨率下揭示了肠道微生物群如何通过代谢肠道氨基酸影响宿主氨基酸稳态。研究鉴定出多种积极代谢肠道氨基酸的细菌,并通过大规模基因缺失分析确定了其关键代谢基因。功能实验显示,这些代谢途径通过直接调控宿主肠道和循环氨基酸的生物利用度,或间接影响外周血清素合成,从而调节宿主的葡萄糖代谢和整体营养稳态。
研究表明,定植微生物群可能以“竞争”模式与宿主共同调控营养平衡,为理解其分子层面的调节机制提供了新视角。更值得关注的是它揭示了一个新的通路:微生物氨基酸利用 → 改变宿主血中氨基酸/代谢产物 → 改变激素/神经递质(如外周 5‑HT)→ 改变葡萄糖代谢等生理功能,所以这些菌在肠道里的存在,更可能是:微调宿主营养和代谢状态,而不是简单的“好/坏”。
参考文献:
Li TT, Chen X, Huo D, Arifuzzaman M, Qiao S, Jin WB, Shi H, Li XV; JRI Live Cell Bank Consortium; Iliev ID, Artis D, Guo CJ. Microbiota metabolism of intestinal amino acids impacts host nutrient homeostasis and physiology. Cell Host Microbe. 2024 May 8;32(5):661-675.e10.

谷禾健康
早晨闹钟响起时那瞬间的动力、完成任务后的成就感、写完最后一道题的如释重负、品尝美食时的愉悦…这些日常体验背后都有同一个幕后功臣——多巴胺。
它并非简单的“快乐信使”,也是我们大脑里最强的“动力引擎”,驱使我们启动任务、保持专注并最终享受完成目标的喜悦。
多巴胺这个拥有5亿年历史的古老分子,其水平竟会受到我们肠道里微生物的影响。这意味着,我们吃的食物或许能直接帮助我们战胜拖延症,更有精力地投入到下一次学习和工作中。
本文探讨多巴胺的作用,过多或者过少对我们身体有什么影响,它与肠道微生物群的关联,哪些饮食或生活方式可能有助于优化多巴胺系统等。
关于多巴胺的总结:
1 多巴胺是古老的
多巴胺作为神经递质在蠕虫到人类的进化中保持不变,有5亿年历史。它是自然界中古老且功能一致的模块,在所有有神经系统的生物中都执行学习、动力和运动调控功能。
2 多巴胺神经元很长
多巴胺神经元是大脑中最大且连接最广的细胞,主要在中脑腹侧被盖区和黑质。大鼠的单个神经元可产生1米长的轴突分支,形成3万个突触,人类可达数十万。
3 多巴胺是神经递质
多巴胺很少单独起作用。每当多巴胺被释放到大脑中时,其他神经递质,如谷氨酸和 GABA,可能会被多巴胺神经元共同释放。
4 多巴胺传递很快
多巴胺传递速度不同:神经元爆发时传输快速;神经元也稳定放电,维持基线水平,突发可应对重要事件。
5 多巴胺奖励回路异常
生存恐慌与压力不耐受:对压力的反应更为敏感和剧烈。
病态食物摄入:通过暴饮暴食来寻求短暂的快感,以弥补多巴胺的不足。
脂肪合成与储存增加:身体更容易囤积脂肪,导致肥胖。
消化系统紊乱:进一步加剧肠道问题。
6 多巴胺功能障碍
多巴胺传递功能障碍是各种精神神经障碍的特征,包括抑郁症、帕金森氏症、ADHD 和物质使用障碍。
多巴胺过量:躁狂或轻躁狂,精神病,物质使用障碍,多动和冲动,抽搐和图雷特综合征,睡眠障碍,亨廷顿病、过度寻求奖励行为。
多巴胺不足: 帕金森氏病、抑郁症、注意力缺陷/多动障碍(ADHD)、药物成瘾和物质使用障碍、不宁腿综合征、精神分裂症和亨廷顿氏病。
7 多巴胺与肠道菌群关系密切
肠道菌群可以通过多种方式积极影响和参与这两个神经系统的交流和对话,例如分泌信使物质:例如单形拟杆菌、双歧杆菌、乳杆菌、肠球菌属、普雷沃氏菌与梭菌属通过直接或间接方式影响多巴胺能或多巴胺转运运蛋白等,进而直接激活肠道内的神经末梢,将信号通过迷走神经上传至大脑。多巴胺水平遵循昼夜节律,清醒时高,睡眠时低。
8 多巴胺药物干预
许多药物通过改变或刺激多巴胺受体活性、合成和再摄取来发挥作用。
9 多巴胺调节
必需氨基酸如苯丙氨酸和酪氨酸是多巴胺的前体。食用富含这些氨基酸的食物可以增强多巴胺的合成。益生菌和发酵食品还可以通过促进肠道健康来影响多巴胺的产生。
有氧运动(跑步、骑自行车),力量训练以及瑜伽,听音乐等可以激活大脑的多巴胺并增强多巴胺奖励功能。
多巴胺的发现
多巴胺(化学名为 3,4-二羟基苯乙胺),于 1910 年由乔治·巴格和詹姆斯·尤恩斯在伦敦的惠康实验室首次合成。
但真正突破在近半个世纪后,1958 年,瑞典国家心脏研究所化学药理学实验室的阿维德·卡尔森和尼尔斯·希拉普才确定多巴胺是大脑中的一种神经递质。这一突破性的发现彻底改变了我们对大脑工作原理的认知,为现代神经科学的发展奠定了基础。卡尔森也因这项开创性贡献荣获了2000年诺贝尔生理学或医学奖。
多巴胺的关键证明:从实验室到临床的突破
在一项具有里程碑意义的实验中,研究人员阻断了兔子体内所有的多巴胺神经传递,使它们完全瘫痪,然后通过注射多巴胺前体左旋多巴(L-DOPA)完全恢复了它们的行为,证明多巴胺对自我启动的运动至关重要。
很快,奥列格·霍尼凯维奇和他的团队将这一发现应用到帕金森病患者身上,取得了同样惊人的效果。短短几年内,多巴胺从相对默默无闻一跃成为我们所知的生命的关键。
多巴胺的进化
多巴胺功能的惊人普适性
在鸟类身上,多巴胺展现出了惊人的精细调控能力。它不仅像哺乳动物一样处理基于奖励的学习信号,还能在鸟儿练习鸣唱时,通过”声音表现预测误差“来帮助它们完善歌声。
既关心有没有奖励,也关心这次唱得好不好。
这正是学习与动机功能的体现。
所有脊椎动物的基底神经节都保持着相似的基本架构,多巴胺在其中发挥着一致的作用:调控运动和学习。这种跨物种的功能稳定性表明,多巴胺系统的核心组件已经被进化完美保存了至少5亿年。
多巴胺功能在脊椎动物内部的家族相似性
DOI: 10.1016/j.cub.2022.06.060
多巴胺在不同生物中的类似功能
这种在不同物种中独立演化出相似结构和功能的现象,被称为“趋同演化”。
有力证明了多巴胺调控行为选择是一个极其高效的生物学解决方案。
多巴胺的演化之路清晰可见
多巴胺的化学结构
多巴胺的结构相对简单:一个带有两个羟基的苯环,连接着一条乙胺链。正是这种精巧的分子排列,让多巴胺能够与大脑中的各种受体和酶相互作用,进而影响我们的神经传导和行为表现。
作为大脑中的化学信使,多巴胺在神经元之间穿梭传递信息。但它的作用远不止于此,多巴胺深度参与调节我们的情绪状态、内在动机、奖赏感受、快乐体验、注意力集中、身体的运动控制。
从伸手拿杯水这样的简单动作,
到追求长远目标时的复杂决策,
多巴胺都在幕后发挥着关键作用
多巴胺合成和储存的复杂过程
▶ 多巴胺合成
从酪氨酸到神经递质是一个复杂的过程,涉及几个步骤和酶。
🧬 原材料:酪氨酸
多巴胺的前体是酪氨酸——一种我们可以从食物中获取,也可以在肝脏中由苯丙氨酸转化而来的氨基酸。当酪氨酸进入多巴胺神经元后,开始了它的转化之旅。
⚗️ 第一步:关键转化
第一步也是最关键的一步:酪氨酸羟化酶将酪氨酸转化为L-DOPA。这个步骤需要几种”助手”——四氢生物蝶呤、氧气和铁离子的协助。由于这一步控制着整个生产速度,因此受到严密监控。
⚡ 第二步:快速脱羧
接下来,芳香族氨基酸脱羧酶迅速将L-DOPA转化为多巴胺。这个反应很快完成,避免了L-DOPA的堆积,因为过多的L-DOPA可能会带来负面影响。
整个生物合成途径发生在神经元的细胞质中。
▶ 多巴胺储存
新鲜出炉的多巴胺并不会在神经元内四处游荡,而是被精心包装进一个叫”突触囊泡“的微型容器中。负责这项包装工作的是囊泡单胺转运蛋白(VMAT)。
这种包装有两大好处:
保护多巴胺不被细胞内的酶分解,
同时确保它能在需要时准确释放。
整个生产过程都有精密的调控机制。神经元会根据自身的活动状态和环境变化,灵活调节多巴胺的产量,确保大脑始终拥有合适的多巴胺供应。
多巴胺释放和再摄取的动力学
多巴胺从神经元的释放是由特定刺激触发的、高度调节的过程。
🌊 多巴胺的释放过程
当动作电位(电信号)到达多巴胺能神经元的轴突末端时,它会导致钙离子通过电压门控钙通道快速流入。细胞内钙离子浓度的突然增加触发了含有多巴胺的突触囊泡与细胞膜的融合,这一过程被称为胞吐作用。
🔄 突触间隙的扩散
当囊泡与膜融合时,它们将多巴胺释放到突触间隙中,突触间隙是突触前神经元和突触后细胞之间的狭窄空间。一旦进入突触间隙,多巴胺分子就会扩散到这个空间,可能与突触后神经元或附近细胞上的受体结合。
🎯 再摄取机制
多巴胺信号的持续时间和强度,通过一个称为再摄取的过程被仔细控制。
多巴胺细胞反应:神经生物学中的机制和意义在很大程度上取决于这种再摄取机制。
称为多巴胺转运蛋白(DAT)的特殊蛋白质负责这一过程。这些转运蛋白位于突触前神经元的膜上,积极地将多巴胺分子泵回释放它们的神经元。
再摄取过程有几个重要功能
多巴胺转运蛋白的活性可以受到各种因素的调节,包括其他神经递质和药物。例如,可卡因和安非他明通过干扰DAT的功能发挥其作用,导致突触中多巴胺浓度增加和多巴胺信号传导延长。
多巴胺受体和信号通路
多巴胺对靶细胞的作用是通过其与特定受体的相互作用来介导的。了解多巴胺受体的类型、功能和信号通路对于理解这种神经递质如何发挥其多种作用至关重要。
多巴胺受体有五种亚型,分为两个家族:
中脑多巴胺神经元的解剖连接
G蛋白偶联受体结构
所有多巴胺受体都属于G蛋白偶联受体(GPCR)超家族。这些受体跨越细胞膜七次,并与细胞内的G蛋白偶联。当多巴胺与这些受体结合时,它会引起构象变化,激活相关的G蛋白,引发细胞内信号级联事件。
不同受体的信号通路
D1
🔵 D1样受体通路(兴奋性)
偶联:与Gs蛋白偶联
效应:激活腺苷酸环化酶
结果:cAMP增加 → 激活PKA → 磷酸化细胞靶点
D2
🔵 D2样受体通路(抑制性)
偶联:与Gi蛋白偶联
效应:抑制腺苷酸环化酶
结果:cAMP降低
🧠 受体在大脑中的分布
多巴胺能受体:位置、功能和对脑化学的影响在不同的大脑区域各不相同,有助于多巴胺的不同作用。
纹状体:多巴胺作用的核心区域
在所有接收多巴胺信号的脑区中,纹状体(一个大型的皮层下区域,是基底神经节回路的核心)的神经支配最为密集。纹状体中高达95%的神经元是所谓的”纹状体投射神经元(SPNs)”,它们根据表达的多巴胺受体类型被清晰地分为两大类:
这种受体表达的差异意味着两类神经元对多巴胺信号的”聆听”方式截然不同,从而为多巴胺实现复杂的调控功能提供了基础。
多巴胺对神经回路和行为的影响
多巴胺的影响远远超出了单个神经元,塑造了整个神经回路的活动,从而影响了行为。
🎁 奖励与动机:大脑的激励系统
🧠 中脑边缘多巴胺通路
从腹侧被盖区投射到中脑背核,在奖赏加工和动机中起着至关重要的作用。
当我们经历一些有益的事情时,比如吃到美味的食物或受到表扬,这条通路上的多巴胺神经元就会被激活。这种多巴胺的释放加强了导致奖励的行为,增加了重复的可能性。这种机制是学习和习惯形成的基础。
重要提醒:
多巴胺不仅仅是一种”快乐化学物质”,
而是刺激的激励价值和显著性的信号。
🏃♂️ 运动控制:协调身体动作
🔗黑质纹状体多巴胺通路
连接黑质和纹状体的通路,对于启动和协调随意运动至关重要。
多巴胺调节基底神经节神经元的活动,基底神经节是一组参与运动控制的皮质下结构。这种调节有助于选择和启动适当的运动程序,同时抑制竞争性动作。
🧠 认知功能:思维与决策
除了奖励和运动,多巴胺还影响各种认知功能,包括注意力、工作记忆和决策。
📊 工作记忆
在前额叶皮层,多巴胺信号在维持和更新工作记忆中的信息方面起着至关重要的作用。
🎲 风险决策
多巴胺调节冒险行为和冲动,多巴胺水平较高通常与冒险和探索行为增加有关。
😊情绪调节:复杂的平衡艺术
多巴胺对情绪调节的影响是复杂的,并与其他神经递质系统相互作用。虽然多巴胺通常与积极的情绪状态有关,但它在情绪中的作用并不简单。
⚠️ 多巴胺信号过多和不足都可能导致情绪障碍。例如,精神分裂症的”多巴胺假说”表明,某些大脑区域的多巴胺活动过度可能导致精神病症状。
🕸️ 复杂的调控网络
多巴胺神经元的活动受到大脑内复杂网络的严密调控。它们接收来自局部及长距离投射的密集神经支配,其兴奋或抑制状态主要取决于两大类输入信号的动态平衡:
这种多层次、多维度的调控机制确保了多巴胺神经元能够精确响应机体内外环境的复杂变化,维持神经系统的动态平衡。
运动和动机
多巴胺在运动功能中的作用并非直接控制动作的精确性,而是作为一种“启动器”和“激励器”,负责激发和维持自主行为。
🚀 多巴胺是行为启动的关键
帕金森病就是个典型的例。患者虽然失去了自主行走的能力,但在外部刺激(如楼梯、音乐)的引导下,却能完成爬楼、跳舞等复杂的协调动作。
这表明多巴胺的核心作用在于:自我发起一个动作,而非执行动作本身。
⚡ 多巴胺调节行为活力与动机
现代研究发现,多巴胺的释放水平与动物执行动作的活力以及动机程度直接相关。
多巴胺越多,我们做事就越有劲头、越积极主动。
一个有影响力的假说认为,多巴胺的释放反映了某个特定行为的“价值”。也就是说多巴胺其实是在告诉我们某件事值不值得做。
当一个行为与重要结果相关联时,多巴胺会增强该行为,从而促进学习和激励。
比如你闻到了鸡腿香,大脑释放多巴胺让你更有动力去吃;当你发现不好了前方危险需要逃跑时,多巴胺也会激增,给你逃生的力量。
⏱️ 不同时间尺度的调控
多巴胺的这种激励作用体现在两个时间尺度上:
学 习
在过去的几十年里,科学家们发现,多巴胺除了是运动的启动器外,还在我们的大脑中扮演着一个更为深刻的角色——超级严格的学习教练。它不是简单地让你感到爽,而是通过一个精妙的机制,告诉我们什么值得学、什么需要改,从而塑造我们的行为。
学习的秘密:建立联系,预测未来
在神经科学看来,学习的本质就是建立关联。我们通过将一个中性线索与一个重要的结果联系起来,从而学会预测未来。也就是“条件反射”。
比如说:
这种能力让我们能提前预判,而不是被动挨打。
学习的核心动力:意外
什么时候我们学得最快?当现实和预期不一样的时候。举个生活中的例子:
🎉 意外惊喜时(正向误差):
😐 符合预期时(零误差):
😞 意外失望时(负向误差):
这个“现实与预期的差异”,在科学上被称为“奖励预测误差 (Reward Prediction Error, RPE)”。这正是学习发生的核心驱动力:
正向误差(Positive RPE): 现实 > 预期。
结果比想的要好,大脑发出“快学!”的信号,强化当前行为。
零误差(Zero RPE): 现实 = 预期。
一切尽在掌握,无需学习。
负向误差 (Negative RPE): 现实 < 预期。
结果比想的要糟,大脑发出“出错了,快改!”的信号,削弱当前行为。
经典例子:为什么”先入为主”这么难改?
一个经典的例子叫“阻断效应 (blocking)”。
如果狗已经学会了“铃声(A)=食物”,那么即便后来再给它“铃声+灯光(AB)=食物”的训练,它也学不会“灯光=食物”。因为食物的出现完全被铃声预测了,灯光的出现毫无意外可言,大脑就懒得学新东西了。
科学发现:多巴胺是意外探测器
神经科学家舒尔茨通过研究猴子发现:
从大脑到AI:跨界融合的典范
最神奇的是,科学家发现多巴胺的工作原理和人工智能的”强化学习“算法很像。
AI学习过程:
尝试一个动作 → 看结果如何 → 调整策略 → 再试再调整
大脑学习过程:
做一个行为 → 多巴胺评估意外程度 → 强化或削弱行为 → 下次做得更好
这就是为什么AI能学会下棋、打游戏的原理。
多巴胺是学习指导员:
它不会让你一直爽下去
它会根据”意外程度”给你反馈
它的目标是让你不断进步
该夸你时夸你,该推你时推你
让你变更聪明,更能适应这个世界
其他行为功能
前面我们说多巴胺是学习教练、动力开关,但其实它的功能远不止这些。多巴胺就像一个万能助手,在大脑不同区域有不同的工作职责。
🗺️ 多巴胺的工作岗位分布
– 腹侧纹状体
计算奖励预测误差,也就是评估这件事比我想的好还是差。
– 背侧纹状体
控制和协调身体运动, 指挥你的手脚如何动作。
– 纹状体后部
监测新鲜事物、重要信息、潜在危险。时刻警觉周围环境。
– 前额叶皮层
行为灵活性、工作记忆、控制冲动、区分不同刺激,也就是说负责规划和决策。
– 感觉皮层
帮助感知系统适应和改变,更好地适应环境。
– 海马体
帮助形成记忆,特别是新鲜事物的学习,专门负责把新信息存入大脑硬盘。
……
多巴胺参与了不同的行为过程,
它会根据所在位置和情况需要,
发挥不同的作用来帮助我们生存和适应。
科学家发现,肠道中的某些特定菌属,如普雷沃氏菌(Prevotella)、拟杆菌(Bacteroides)、乳杆菌(Lactobacillus)、双歧杆菌(Bifidobacterium)、肠球菌属(Enterococcus)和梭菌属(Clostridium)等,可以直接或间接地遥控大脑中的多巴胺系统。它们能够影响多巴胺受体和转运蛋白的表达水平,从而或增强、或削弱多巴胺信号的传递。
普雷沃氏菌与拟杆菌:多巴胺系统的精细调节师
在肠道菌群中,普雷沃氏菌属和拟杆菌属同属拟杆菌门,通过截然相反的方式,精妙地影响着我们大脑中多巴胺的活性。
它们主要作用于一个关键目标:多巴胺转运体 (DAT)。
什么是DAT?
多巴胺在神经元之间传递完信号后,就好比完成了任务的信使。DAT是一个高效的回收器,负责将这些信使从工作岗位上(突触间隙)回收,以便下次再用。DAT的效率直接决定了多巴胺的停留时间和信号强度。
✦ 拟杆菌:提高回收效率
以普通拟杆菌 (Bacteroides uniformis) 为代表,它的存在能增强DAT的回收效率。
当普通拟杆菌增多时,大脑纹状体中的DAT回收器会变得更加活跃,与多巴胺的结合能力增强。这意味着多巴胺会被更快地从工作岗位上回收。这是一种维持多巴胺系统稳态和效率的重要机制。
✦ 普雷沃氏菌:降低回收效率
以Prevotella copri为代表,它的作用则完全相反:它会降低DAT的回收效率。
当Prevotella copri增多时,DAT回收器的工作效率会下降。这使得多巴胺能在工作岗位上停留更长时间,其信号强度和作用时间都会被放大。
普雷沃氏菌的另一条通路:通过饥饿素间接发力
普雷沃氏菌能增加我们体内“饥饿素”(Ghrelin)的水平。饥饿素不仅让我们感到饥饿,它还能直接作用于大脑的奖赏中枢(VTA),在这里激活多巴胺神经元,促进多巴胺的释放。
总结来说,普雷沃氏菌和拟杆菌就像多巴胺系统的两个调节阀:
这两类细菌的平衡,对于维持我们大脑正常的奖赏、动机和运动功能至关重要。它们的失衡,可能与多种神经精神疾病的发生密切相关。
肠道菌群对多巴胺能突触间隙和多巴胺代谢的影响
doi: 10.3390/biomedicines10020436
(1) 单形拟杆菌上调 DAT/多巴胺结合效率。普雷沃氏菌Prevotella copri下调 DAT 结合效率。
(2) 粪肠球菌和屎肠球菌显示酪氨酸羟化酶和芳香族 L-氨基酸脱羧酶活性。口服黄连素合成辅因子 BH4,增强酪氨酸向多巴胺的转化。
(3) 植物乳杆菌 PS128 增加 DAT 表达。
(4) 瘤胃球菌下调 D2 R 表达。
(5) 瘤胃球菌与酪氨酸羟化酶活性降低相关。
乳杆菌与双歧杆菌:多巴胺系统的全能守护神
乳杆菌属(Lactobacillus)和 双歧杆菌属(Bifidobacterium) 是两大初代的益生菌,通过多种机制,保护和调节多巴胺系统,对抗压力与神经损伤。
✦ 直接保护神经,对抗损伤
其中植物乳杆菌PS128(Lactobacillus plantarum PS128) 的表现尤为突出:
补充PS128能够显著减少多巴胺神经元的死亡,并阻止纹状体中多巴胺水平的下降。其作用机制是减轻由神经毒素引发的氧化应激和神经炎症,从根源上保护了神经细胞。
✦ 提升多巴胺回收效率
除了直接保护,还能微调多巴胺的代谢通路,提升多巴胺回收效率。研究发现,植物乳杆菌PS128还能增加多巴胺转运体 (DAT) 的表达。这能优化多巴胺的回收和再利用,提高整个系统的运转效率。
✦ 调节关键代谢酶
植物乳杆菌DR7 (Lactobacillus plantarum DR7):在压力状态下,它能下调“多巴胺β-羟化酶”和“酪氨酸羟化酶”的水平。这两种是多巴胺合成与转化的关键酶,通过调节它们,DR7能有效缓解压力反应。
鼠李糖乳杆菌 (Lactobacillus rhamnosus):能下调单胺氧化酶 (MAO)的活性。MAO是分解多巴胺的酶,抑制它就等于延长了多巴胺的作用时间。
同样的多巴胺发挥更长时间的作用。
✦ 缓解压力与行为异常
益生菌对多巴胺系统的调节,最终体现在对情绪和行为的改善上:
双歧杆菌:能有效减轻身体过度的应激反应(HPA轴反应),帮助身体更好地应对压力。
婴儿双歧杆菌 (Bifidobacterium infantis):在经历过早期压力的动物中,补充该菌逆转其行为缺陷,并使其大脑中失衡的去甲肾上腺素水平恢复正常。
总结来说,乳杆菌和双歧杆菌部分菌株通过减少炎症、保护神经元、调节关键代谢酶、优化多巴胺回收等多种途径,支持多巴胺系统的健康。
在对抗压力、焦虑、抑郁
以及神经退行性疾病方面,
展现出巨大的应用潜力。
肠道菌群对多巴胺代谢副产物的影响
doi: 10.3390/biomedicines10020436
(1) 粪球菌属Coprococcus comes和Coprococcus catus 与 DOPAC合成潜力密切相关。
(2) 破伤风梭菌对多巴胺具有降解作用,通过 DOPAC 中间体促进降解为 HVA。
(3) 鼠李糖乳杆菌下调 MAO。
(4) 植物乳杆菌 DR7 下调多巴胺β-羟化酶。
(5) 梭菌属物种显示下调多巴胺β-羟化酶。
(6) 植物乳杆菌 PS128 给药可改善多巴胺代谢并增加去甲肾上腺素水平。
梭菌属:多巴胺的破坏者 / 守护者
梭菌属是一个拥有超过180个成员的大家族,它们对多巴胺的影响,展现了双重性。
😫 魔鬼的一面:多巴胺的破坏者与搅局者
一些梭菌属的成员,比如破伤风梭菌(Clostridium tetani),直接降解多巴胺。
它们能将多巴胺分解成无活性、甚至有害的代谢产物,直接导致多巴胺水平下降。
还能扰乱代谢通路,它们产生的代谢物会堵塞多巴胺的正常转化路径。比如,它们会阻止多巴胺转化为另一种重要的神经递质——去甲肾上腺素。这会导致多巴胺在细胞内异常堆积,产生毒性,引发氧化应激,最终伤害甚至杀死宝贵的多巴胺神经元。
😇 天使的一面:保护和提升多巴胺
幸运的是,梭菌属中也有许多英雄成员,它们通过具体机制保护和提升多巴胺:
丁酸的生产菌 (Clostridium butyricum):丁酸梭菌也是生产丁酸的重要菌种。丁酸能穿过血脑屏障,直接进入大脑,通过减轻神经炎症来保护皮层神经元,并被证实能提升下丘脑的多巴胺浓度。
此外,Clostridium coccoides为代表的成员,拥有一种名为β-葡萄糖醛酸酶的特殊工具。在肠道中,许多多巴胺与其它分子结合而处于休眠状态。这些梭菌能利用这种酶,切断结合,将多巴胺激活成自由的、有生物活性的形式。
肠道里有很多多巴胺被锁住了,梭菌用β-葡萄糖醛酸酶切断锁链,增加了肠道中可用的多巴胺总量。
研究还发现,梭菌能将多巴胺与脂肪酸结合,创造出全新的信号分子——脂肪酸酰胺。这些新分子可以与细胞受体结合,调节身体的生理过程,展现了梭菌影响我们健康的另一条复杂途径。
梭菌属不能被简单地归为好或坏。它既有破坏神经的物种,也有通过生产丁酸、激活多巴胺来守护大脑的友谊菌种。理解这些菌株和它们精确的作用机制,是未来精准调控肠道菌群以维护大脑健康的关键。
肠球菌属:多巴胺生产者 / 消耗者 / 条件益生菌
在肠道菌群的世界里,肠球菌属(Enterococcus) 是一个充满矛盾的角色。它既是我们肠道的正常居民,又可能在特定情况下变成“机会主义病原体”。然而,它最引人注目的,是其作为“多巴胺生产者”的巨大潜力,以及一个可能耗尽多巴胺原料的“坏习惯”。
😇 潜力所在:一个移动的多巴胺工厂
肠球菌属的两个主要成员——粪肠球菌(Enterococcus faecalis) 和屎肠球菌 (Enterococcus faecium), 展现了惊人的多巴胺生产能力。
它们拥有将左旋多巴 (L-dopa)(帕金森病常用药)直接转化为多巴胺的酶。当把这些细菌移植到帕金森病小鼠体内,能显著提升其大脑中的多巴胺水平。
更关键的是,研究发现它们自身就携带酪氨酸羟化酶的活性。这是从最基础的原料——酪氨酸,开始合成多巴胺的第一步关键酶。这意味着它们具备了从头开始构建多巴胺的潜力。
服用小檗碱(黄连素主要成分)能进一步激活生产过程,让这个工厂开足马力运转
😫 坏习惯:浪费原料
尽管肠球菌有生产多巴胺的潜力,但它更喜欢走另一条岔路——优先生产酪胺。
肠球菌会优先使用其酪氨酸脱羧酶,将多巴胺的两种核心前体物质——酪氨酸和左旋多巴,都转化为酪胺 (Tyramine)。
这是个大问题,因为会大量消耗本应用于生产多巴胺的宝贵原料,
反而可能导致多巴胺水平下降。
肠球菌属是一个极具潜力的条件性益生菌。 它天生拥有成为多巴胺工厂的所有工具,但默认设置却是浪费原料。未来的应用前景在于,如果能找到方法比如联合使用特定药物引导它生产多巴胺,有望成为治疗帕金森病等神经系统疾病的强大生物工具。
瘤胃球菌属:可能引发炎症并干扰多巴胺信号
瘤胃球菌属 (Ruminococcus) 虽然能生产有益的短链脂肪酸,但却也可能降解黏液,引发炎症。
💥 引发炎症,破坏多巴胺能神经元
研究发现,在帕金森病动物模型中,瘤胃球菌属的数量会增加,这与大脑黑质区域酪氨酸羟化酶阳性细胞(即多巴胺能神经元)的死亡直接相关。
使用红参或进行运动可减少瘤胃球菌数量,
从而保护多巴胺神经元
临床研究进一步证实了瘤胃球菌的负面影响。例如,在患有抽动障碍的儿童中,发现其肠道内的产乳糖瘤胃球菌(Ruminococcus lactaris) 和 活泼瘤胃球菌(Ruminococcus gnavus) 数量显著高于健康儿童。抽动障碍本身也与多巴胺系统失调密切相关。
💥 干扰多巴胺信号接收
除了引发炎症,瘤胃球菌属还可能通过一种更隐蔽的方式干扰多巴胺系统,影响多巴胺受体的表达。
下调D2受体:在酒精诱导的动物模型中,发现包括瘤胃球菌科 (Ruminococcaceae) 在内的菌群增多,与大脑纹状体中多巴胺D2受体的基因表达水平下降有关。
D2受体是多巴胺发挥作用的关键接收器之一
它的数量减少,意味着即便多巴胺水平正常,
其信号也无法被有效接收,这与帕金森病
运动障碍(如运动迟缓)等症状密切相关
总结来说,瘤胃球菌属对多巴胺系统的负面影响是多方面的: 它通过降解肠道黏液来引发炎症,间接损害多巴胺神经元;同时,它还可能通过下调关键的D2受体,直接削弱多巴胺信号的传递。这使其成为一个在研究神经系统疾病时需要特别关注的菌属。
在多巴胺方面,瘤胃球菌属: 坏的影响 >> 好的影响
多巴胺对众多重要神经功能的广泛影响,几乎所有脑部疾病在某个阶段都可能涉及多巴胺功能障碍。在这里,我们将重点介绍以下几种疾病,最具体的特点是,多巴胺能异常和/或多巴胺能药物治疗。
帕金森病
在涉及中脑多巴胺系统的疾病中,研究最深入的或许就是帕金森病 (Parkinson’s disease, PD)。
帕金森病的核心病理改变,是黑质纹状体通路多巴胺神经元的选择性死亡,尤其是位于黑质外侧部的那些神经元。这些神经元就像大脑深处的多巴胺工厂,专门生产控制运动的关键化学物质,这些多巴胺被送到大脑的运动控制中心,充当运动启动器的角色。当这些工厂停产,身体就无法流畅地执行运动指令。
治疗突破
研究人员使用左旋多巴 (L-DOPA) 作为半成品原料,L-DOPA可以轻松进入大脑,然后被大脑里残存的神经元加工成多巴胺,治疗帕金森病患者能高效缓解其运动症状,这一发现彻底革新了我们对帕金森病的认知,并且该疗法至今仍用于临床实践。
帕金森患者的肠道菌群变化
帕金森病患者的肠道菌群组成发生显著改变,比如普雷沃氏菌减少,这是帕金森病患者最显著的肠道菌群改变。普雷沃氏菌能产生硫化氢,对多巴胺神经元具有保护作用。
厚壁菌门 / 拟杆菌门比例升高,特别是梭菌属和瘤胃球菌科增多。
其他具体变化如下表所示:
微生物在帕金森病中的作用
doi: 10.3390/biomedicines10020436
仍有部分研究结果存在矛盾,提示帕金森病的肠道菌群变化可能具有时间和个体差异性。
肠道症状:帕金森病的早期信号
帕金森病的胃肠道症状(如便秘、胃排空延迟)通常比运动症状更早出现,这为疾病的早期诊断提供了重要线索。
便秘:外周多巴胺水平降低 → 下肠道蠕动减少 → 便秘加重。
普雷沃氏菌减少导致硫化氢分泌不足,
进一步加剧了这一过程。
研究表明,与厚壁菌门肠型相比,普雷沃氏菌肠型的帕金森病患者,便秘严重程度明显降低。
谷禾肠道菌群检测报告中的肠型这个指标:其中有一种肠型就是普雷沃氏菌肠型。
<来源:谷禾肠道菌群检测数据库>
如果帕金森患者的普雷沃氏菌少,后面有可能会出现便秘症状。
研究指出,将乳杆菌属和双歧杆菌属作为益生菌引入后,帕金森病患者的排便频率得到改善,平均肠道转运时间从135小时缩短至77小时。
注意力缺陷/多动障碍症
注意力缺陷/多动障碍(ADHD)是儿童期最普遍的行为和多因素精神障碍之一,具有复杂的病因和强大的遗传基础。全世界约 5%的儿童和 2.5%的成人患有 ADHD。在约 80%被诊断患有该疾病的儿童中,ADHD 的一些症状持续到青春期和成年期。
多动症的特征是注意力不集中、冲动、过度运动和多动症;情绪失调,表现为易怒加剧、耐受挫折能力低和情绪波动。
注意力像蝴蝶一样飞来飞去,很难专注,身体像装了小马达,停不下来,做事很冲动,想到什么就做什么。
🧠 多巴胺系统罢工了
还记得我们前面说多巴胺是学习教练和动力开关吗?在ADHD患者大脑里,这套系统出了故障:
“多巴胺假说”认为,ADHD的症状源于大脑中多巴胺系统的功能失调。就像城市交通系统瘫痪:
🚗 正常大脑: 多巴胺像交通警察,指挥着注意力和行为有序进行
🚧 ADHD大脑: 交通警察生病了,到处都是堵车和乱象
🔬 科学发现:关键零件有问题
在一项人类研究中,描述了特定基因显示出与 ADHD 的重要关联,并且这些基因与多巴胺系统的组分相关,例如:
在 ADHD 患者的脑中也检测到异常水平的 DAT,并且 DAT 是抗多动症药物如安非他明的靶标。
多巴胺系统的失调,特别是 D4 和 D5 受体功能的异常,会破坏奖赏处理和动机系统,这是 ADHD 核心症状的重要神经生物学基础。
D4 受体主要存在于与 ADHD 病因密切相关的关键脑区,特别是额叶区域。额叶区域在执行功能、注意力控制和行为调节中发挥核心作用,而这些正是 ADHD 患者表现出功能障碍的主要认知领域。
ADHD的发育、遗传和环境因素
doi: 10.12865/CHSJ.51.01.02
虽然ADHD可能有独特的风险基因,但相当一部分风险变异在昼夜节律和多巴胺系统中有作用。
注:在与环境因素的相互作用中,受基因驱动的多巴胺和昼夜节律病理机制会增加 ADHD 患者发展共病疾病的风险,即物质滥用障碍、抑郁症和肥胖症。
多巴胺不是唯一因素
多巴胺至关重要,但ADHD是一种复杂的神经发育障碍。去甲肾上腺素系统同样扮演着极其重要的角色(尤其在注意力和警觉性方面),且与多巴胺系统相互作用紧密。其他神经递质(如血清素、谷氨酸、GABA)和环境因素(如早产、低出生体重、铅暴露等)也可能参与其中。
精神分裂症
精神分裂症是一种相对常见(发病率约1%)、致残率极高的精神疾病,其症状繁多,包括幻觉、思维障碍、情感淡漠,以及学习和工作记忆的缺陷。精神分裂症患者的失业率很高(80-90%),且其平均预期寿命会缩短10-20年,这在很大程度上是由于自杀风险的增加。
多巴胺在精神分裂症中的作用
多巴胺的神经传递在精神分裂症的临床发展和症状表现中扮演着关键角色。关于精神分裂症的“多巴胺假说”是在20世纪60年代提出的。
根据修订的多巴胺假说,精神分裂症患者在大脑的两个关键区域——中脑边缘系统(这是负责情绪和奖励的部分)和前额叶(帮助思考和决策的部分)的多巴胺水平异常。
具体来说,在大脑的一个叫纹状体的区域,多巴胺释放得太多,这和阳性症状(如相信不真实的事)有关。研究发现,患者在联想纹状体(一种帮助连接想法的脑区)的前突触(神经信号传递的起点)多巴胺活动增加,这可能引发妄想和幻觉。
例如,像安非他明这样的药物能刺激多巴胺大量释放,会让健康人出现类似精神分裂的症状,这支持了多巴胺过度活跃的观点。
另一方面,前额叶的多巴胺太少,可能解释了阴性症状(如情绪麻木、没动力)和认知问题(如注意力不集中)。
治疗与其他影响因素
早期的抗精神病药物,如氟哌啶醇和氯丙嗪,都是强效的多巴胺D2受体(D2R)拮抗剂。
像氯丙嗪这样的第一代抗精神病药物,主要通过阻挡多巴胺的D2受体(多巴胺的“接收器”)来缓解阳性症状。但这些药有时会让阴性症状更糟,因为它们没针对多巴胺不足的地方。第二代药物,比如利培酮,不仅调控多巴胺,还调整血清素(另一种影响心情的化学物质)。
当然,多巴胺问题不是精神分裂症的唯一原因,它还会和其他大脑化学物质(如谷氨酸,GABA)相互影响。基因因素,比如COMT基因的变化,会影响多巴胺的分解过程,从而提高患病风险。
物质使用障碍
物质使用障碍(亦称药物成瘾)是一种慢性疾病,其特征在于强迫性地、或难以控制地寻求和使用药物,不顾其会带来有害后果。
明知有害后果,但无法控制
成瘾性物质共同特征——都能引起多巴胺释放的急剧增加
关于成瘾起源的经典理论认为,药物扮演了一种异常强大的原发性奖赏 ,它会强化与药物使用相关的行为,同时又绕开自然奖赏(如食物和水)消耗的饱足感过程,这被认为是促进(药量)逐步增加和强迫性使用的原因。
经典多巴胺理论:大脑被欺骗的过程
招数一:模拟超级奖赏
正常情况:
吃美食 → 适度多巴胺释放 → 感觉愉悦
完成目标 → 适度多巴胺释放 → 获得满足感
物质成瘾:
使用某类物质 → 超量多巴胺释放 → 极度愉悦感
问题: 这种奖赏比任何自然奖赏都强烈
招数二:打破饱足机制
自然奖赏有刹车:
物质成瘾没有刹车:
理论的局限性
它无法完全解释成瘾带来的长期认知损伤,也无法解释为何一些非药物的奖励性行为疗法同样有效。然而,无论存在何种争议,一个不可动摇的结论是:多巴胺系统功能紊乱,是药物成瘾发生和发展的关键生物学基础。
考虑到多巴胺功能的复杂性及其与几种疾病的发展的关系,有各种药物旨在通过直接或间接靶向多巴胺受体来治疗这些疾病也就不足为奇了。
传统药物
有广泛的选择性或非选择性多巴胺激动剂和拮抗剂,其已在临床上用于改善疾病的症状,例如:帕金森病、勃起功能障碍、高泌乳素血症、精神分裂症、双相抑郁症、恶心等。
一些实例是阿扑吗啡、伊潘立酮、多潘立酮、溴必利、氯氮平、鲁拉西酮、奥氮平。
共同特点:瞄准D2受体
这些药物中的大多数以 D2 受体为主要靶点,尽管也有化合物可作用于 D1 和 D3。 D2受体是多巴胺系统的主控开关。D4受体至今没有临床药物。
新一代药物
▪ 布雷哌唑,多功能
最近,美国食品药品监督管理局批准了一种新的药物,它是多巴胺 D2 受体部分激动剂,对 5-HT1A 受体也具有激动剂活性,对 5-HT2A 和α-肾上腺素能受体也具有拮抗剂活性:布雷哌唑。
治疗范围:
✅已获批准: 精神分裂症、重度抑郁症(辅助治疗)
🔬 研发中: 阿尔茨海默病相关、创伤后应激障碍
▪ 阿立哌唑,智能调节
另一种有趣的非典型抗精神病药物是 D2 受体的部分激动剂,是阿立哌唑。
浓度决定作用
高浓度的阿立哌唑降低多巴胺能神经元的放电,而低浓度的阿立哌唑增加放电,表明该药物作用于 cAMP/PKA 和 Akt/GSK 3 途径。
治疗应用:
新策略
策略一:绕过受体,直击信号通路
最近,有一种新的方法来开发作用于多巴胺能途径的药物,其中药物靶向受体后信号传导途径,而不是受体。
传统方法: 直接作用于多巴胺受体
新方法: 绕过受体,直接调节受体后的信号传导
策略二:变构调节剂- 侧门入口
这些药物可以通过结合到与内源性配体结合的位点在地形上不同的位点来潜在地减少不良副作用,并且它们还可以双向影响下游途径。已经提出,使用变构调节剂可以增加对 GPCR 亚基的选择性并改善治疗效果,而不破坏生理调节的基质。
不在多巴胺结合位点起作用
在受体的侧门位置结合
改变受体的形状和功能
策略三:偏向性配体- 选择性激活
另一类专注于多巴胺受体后受体信号传导的药物正在开发中,它们是偏向性配体(也称为功能性选择性配体)。这些化合物被设计为选择性地接合受体下游的一个信号传导途径,该受体响应其内源性配体调节多个途径。
传统药物激活所有通路
偏向性配体只激活特定有益通路
未来前景
非编码RNA疗法
未来多巴胺能信号药物发现的其他可能靶点可能是非编码 RNA,因为它们在维持神经元稳态及其在神经系统疾病中的失调中起作用。重新建立非编码 RNA 功能的药物的开发可以更新突触传递。
干细胞疗法
正在开发使用干细胞衍生的多巴胺神经元的疗法,特别是用于治疗帕金森病。
基于肠道菌群的疗法
前面我们了解到,肠道菌群能够直接影响多巴胺的合成、代谢和受体表达,为治疗策略提供了全新思路。
特定菌群超标或不足的干预
例如,肠球菌属(如粪肠球菌和屎肠球菌)具备将酪氨酸转化为多巴胺的完整酶系统,配合小檗碱等天然化合物可增强其多巴胺合成能力。
在肠道菌群检测报告中,如果看到这类菌群偏低,可以配合小檗碱补充进行相关干预。
肠道菌群检测报告相关指标
在谷禾肠道菌群检测报告中,也有多巴胺这个指标,这个指标并非直接检测多巴胺浓度,而是基于谷禾自有的“菌群-代谢-神经递质预测算法”得到的评估。
<来源:谷禾肠道菌群检测数据库>
如果测出来过多或者过少,谷禾肠道菌群检测报告也会给出相关的说明及建议,可以根据该指标结合自身症状进行干预。
值得注意的是,谷禾肠道菌群检测报告中除了多巴胺的指标外,也有血清素、GABA、谷氨酸、DOPAC等多种神经递质相关指标,有些症状可以结合多个指标一起分析来获得更全面的评估。例如,焦虑情绪可能不仅与GABA水平相关,还可能与血清素代谢异常有关。
比如说,DOPAC是多巴胺的代谢产物,参与神经递质的代谢循环。作为代谢产物,间接反映了多巴胺代谢的活动水平。
DOPAC这个指标低可能意味着多巴胺代谢减少或代谢过程受到抑制。这种情况可能出现在多巴胺能神经元活动降低时,比如在帕金森病患者中,由于多巴胺能神经元的退化,多巴胺及其代谢产物DOPAC的水平都会降低。DOPAC水平异常也可能与某些精神疾病如抑郁症相关,这反映了中枢神经系统中多巴胺能系统功能的改变。
在谷禾肠道菌群检测报告中一次检测列出众多指标,也可以结合分析,比如说,当多巴胺合成能力高但DOPAC水平低时,提示多巴胺降解酶活性不足,可能导致多巴胺积累;相反,如果多巴胺指标正常但DOPAC过高,则可能存在多巴胺过度代谢的问题。
大脑中的多巴胺水平受到多种因素的影响,包括日常习惯和医疗干预。这些因素会显著影响情绪、动机和认知功能。
营养和生活方式
饮食对多巴胺水平有很大影响。富含蛋白质食物中的必需氨基酸如苯丙氨酸和酪氨酸是多巴胺的前体。食用富含这些氨基酸的食物可以增强多巴胺的合成。苯丙氨酸和酪氨酸广泛存在于多种食物中,包括肉类、乳制品、豆类、蔬菜(如蘑菇)、水果(如猕猴桃、红树莓)等。
摄入美味食物(尤其是高糖、高脂肪的食物)会激活大脑的奖赏回路,促进多巴胺的释放,从而增强食物的愉悦感和进食行为。然而长期摄入高糖或高脂肪食物可能导致多巴胺系统的适应性变化,例如多巴胺反应的习惯化或敏感性改变。
益生菌和发酵食品还可以通过促进肠道健康来影响多巴胺的产生。某些研究表明,健康的肠道微生物组对包括多巴胺在内的神经递质水平有积极影响。
益 生 菌
益生菌和益生元改善宿主的健康。这是通过引入活微生物及其生长基质,影响肠道微生物生态,并积极改变宿主的生理学来实现的。一些研究表明益生菌作为治疗工具的潜力,对免疫系统甚至 中枢神经系统有益。
关于影响中枢神经系统的益生菌:
已经表明,鼠李糖乳杆菌 JB-1、 长双歧杆菌 NCC 3001 和瑞士乳杆菌 R 0052 和 长双歧杆菌 R 0175 可减少大鼠的焦虑样行为。
双歧杆菌和鼠李糖乳杆菌JB-1进行干预会影响 HPA 轴,降低皮质酮水平。
向无菌小鼠施用植物乳杆菌 PS128 可以减少焦虑样行为和过度运动。此外,这些变化伴随着 DA 和 HVA 的增加,以及纹状体中 5-HT 的增加。
特定的益生菌菌株能够:
降低应激激素:如假小链双歧杆菌 CECT 7765 能降低应激模型小鼠的皮质酮(CORT)水平。
调节神经递质:瑞士乳杆菌 NS 8 能恢复海马体中的去甲肾上腺素(NA)、5-HT水平,但另一些研究显示对下丘脑的神经递质无影响,表明其作用具有区域特异性。
改善情绪与行为:多种益生菌(如双歧杆菌、乳杆菌)显示出能够减少动物的焦虑和抑郁样行为,并改善认知功能。
支持大脑健康:能恢复神经营养因子(如BDNF)的水平,这对神经元的健康至关重要。
对人类有潜在益处:初步研究表明,益生菌可以降低健康女性大脑对情绪任务的反应,改善自闭症儿童的行为症状,并可能减少儿童患ADHD的风险。
然而,研究也强调了两个关键的复杂性:
菌株特异性:效果并非普适,不同的益生菌菌株(甚至是同一种类下的不同菌株)效果迥异。
并非绝对有益:一项研究指出,某种干酪乳杆菌反而增加了健康动物的焦虑样行为,提醒我们益生菌的作用是复杂的,并非多多益善。
益生菌并非万能药,其效果不仅取决于菌株,也取决于个体的身体状况。在健康状态下,不当补充某些益生菌甚至可能产生负面效果。
补充剂
一些补充剂被认为可以增强多巴胺功能:
注:刺毛黧豆也叫天鹅绒豆,是一种天然植物,其种子中富含左旋多巴(L-DOPA),这是多巴胺的前体物质,种子的提取物用于许多健美运动补剂。
将肠道健康视为心理健康的一部分。通过饮食(如发酵乳制品、高纤维食物)和生活方式来维护健康的肠道菌群,可能对情绪稳定和压力管理有积极作用。
睡眠和锻炼
有规律的身体活动已被证明可以提高多巴胺水平并增强受体敏感性。 这可以促进改善情绪,注意力和运动技能。
可能增加多巴胺的运动类型包括:
睡眠质量和持续时间也会影响多巴胺的功能。睡眠-觉醒周期的中断可以改变多巴胺信号,可能影响注意力,学习和压力管理。
建立健康的睡眠习惯可以支持最佳的多巴胺水平:
了解多巴胺,就是了解我们行动的底层逻辑。希望这份科普能给你带来启发,学会如何与自己的多巴胺系统合作,我们可以更好地管理自己的能量和动力,让工作变得更轻松高效,也让生活中的小确幸更加触手可及。
注:本账号发表的内容仅是用于信息的分享,在采取任何预防、治疗措施之前,请先咨询临床医生。
主要参考文献:
Hamamah S, Aghazarian A, Nazaryan A, Hajnal A, Covasa M. Role of Microbiota-Gut-Brain Axis in Regulating Dopaminergic Signaling. Biomedicines. 2022 Feb 13;10(2):436.
Grigore M, Ionică MV, Pătru L, Gheorman V, Wagner AP. Recent Advances in the Etiology and Neural Pathways Underlying Attention-Deficit and Hyperactivity Disorder. Curr Health Sci J. 2025 Jan-Mar;51(1):14-25.
Kollins SH, Adcock RA. ADHD, altered dopamine neurotransmission, and disrupted reinforcement processes: implications for smoking and nicotine dependence. Prog Neuropsychopharmacol Biol Psychiatry. 2014 Jul 3;52:70-8.
Loh JS, Mak WQ, Tan LKS, Ng CX, Chan HH, Yeow SH, Foo JB, Ong YS, How CW, Khaw KY. Microbiota-gut-brain axis and its therapeutic applications in neurodegenerative diseases. Signal Transduct Target Ther. 2024 Feb 16;9(1):37.
Beaulieu, J. M., & Gainetdinov, R. R. (2011). The physiology, signaling, and pharmacology of dopamine receptors. Pharmacological Reviews, 63(1), 182-217.
Wise, R. A. (2004). Dopamine, learning and motivation. Nature Reviews Neuroscience, 5(6), 483-494.
Grace, A. A. (2016). Dysregulation of the dopamine system in the pathophysiology of schizophrenia and depression. Nature Reviews Neuroscience, 17(8), 524-532.
Volkow, N. D., Wise, R. A., & Baler, R. (2017). The dopamine motive system: implications for drug and food addiction. Nature Reviews Neuroscience, 18(12), 741-752.
Tritsch, N. X., & Sabatini, B. L. (2012). Dopaminergic modulation of synaptic transmission in cortex and striatum. Neuron, 76(1), 33-50.
Berke, J. D. (2018). What does dopamine mean? Nature Neuroscience, 21(6), 787-793.
Sulzer, D., Cragg, S. J., & Rice, M. E. (2016). Striatal dopamine neurotransmission: regulation of release and uptake. Basal Ganglia, 6(3), 123-148.
González-Arancibia C, Urrutia-Piñones J, Illanes-González J, Martinez-Pinto J, Sotomayor-Zárate R, Julio-Pieper M, Bravo JA. Do your gut microbes affect your brain dopamine? Psychopharmacology (Berl). 2019 May;236(5):1611-1622.
Abela AR, Duan Y, Chudasama Y (2015) Hippocampal interplay with the nucleus accumbens is critical for decisions about time. Eur J Neurosci 42:2224–2233.
Arentsen T et al (2017) The bacterial peptidoglycan-sensing molecule Pglyrp2 modulates brain development and behavior. Mol Psychiatry 22:257–266.
Speranza L, di Porzio U, Viggiano D, de Donato A, Volpicelli F. Dopamine: The Neuromodulator of Long-Term Synaptic Plasticity, Reward and Movement Control. Cells. 2021 Mar 26;10(4):735.

谷禾健康

拟杆菌门细菌是革兰氏阴性菌的代表,具有外膜、肽聚糖层和细胞质膜。它们无氧呼吸的主要副产物是乙酸、异戊酸和琥珀酸。是最耐氧的厌氧菌之一。
参与人体结肠中许多重要的代谢活动包括碳水化合物的发酵、含氮物质的利用以及胆汁酸和其他类固醇的生物转化。大多数肠道细菌是糖酵解的,这意味着它们通过碳水化合物分子的水解获得碳和能量。
多糖而不是单糖是拟杆菌的主要能量来源,拟杆菌是肠道生态系统中非常成功的竞争者,表现出相当大的营养灵活性和对宿主和肠道环境施加的压力做出反应的能力。
很难说肠道拟杆菌是否对宿主产生负面或正面影响。拟杆菌能够通过预防可能定植和感染肠道的潜在病原体感染来使宿主受益。但是,拟杆菌衍生的代谢物——羧酸和单糖也可能对宿主产生损害。例如,肠出血性大肠杆菌(EHEC) 通过感觉拟杆菌属作为标志性生物体,沿着胃肠道寻找感染生态位。
特别是,对拟杆菌衍生的琥珀酸和岩藻糖的检测会启动转录级联,导致肠出血性大肠杆菌代谢的转录重编程和毒力因子的诱导。
在发炎的肠道中,拟杆菌衍生的短链脂肪酸(SCFA)不再发挥保护功能,而是可能被兼性厌氧病原体利用作为无氧呼吸的碳源。类似的,在抗生素引起的生态失调时,通过拟杆菌属的代谢活动从复杂多糖中释放出琥珀酸和单糖,交叉喂养肠杆菌和艰难梭菌。
本文再次聚焦拟杆菌门,拟杆菌属,及其代表菌种多形拟杆菌(B.thetaiotaomicron),以多形拟杆菌讲述了一个基于动态环境下共生菌群或菌种与其他菌互作及其生存进化的复杂故事范例。请注意拟杆菌,不仅交叉喂养病原体,而且在健康的肠道环境中交叉喂养益生菌物种,这有助于抵抗定植。
“
拟杆菌属细菌属于人类肠道微生物群中最普遍和最丰富的成员。虽然偶尔充当肠道外的病原体,但这些细菌被认为是结肠腔和粘膜层的共生定殖者,并且长期以来已知可提供针对肠道病原体的定殖抵抗力。然而,基于粪便微生物组学的相关性研究经常会得出关于它们对宿主健康与疾病的贡献相互矛盾的结果,尤其在肠道感染中的作用比预期的更加微妙。
我们结合谷禾大量检测实践,越来越认识到拟杆菌介导的定植抗性背后的复制和矛盾性,以及不同肠道病原体利用它们来建立感染的可能性。
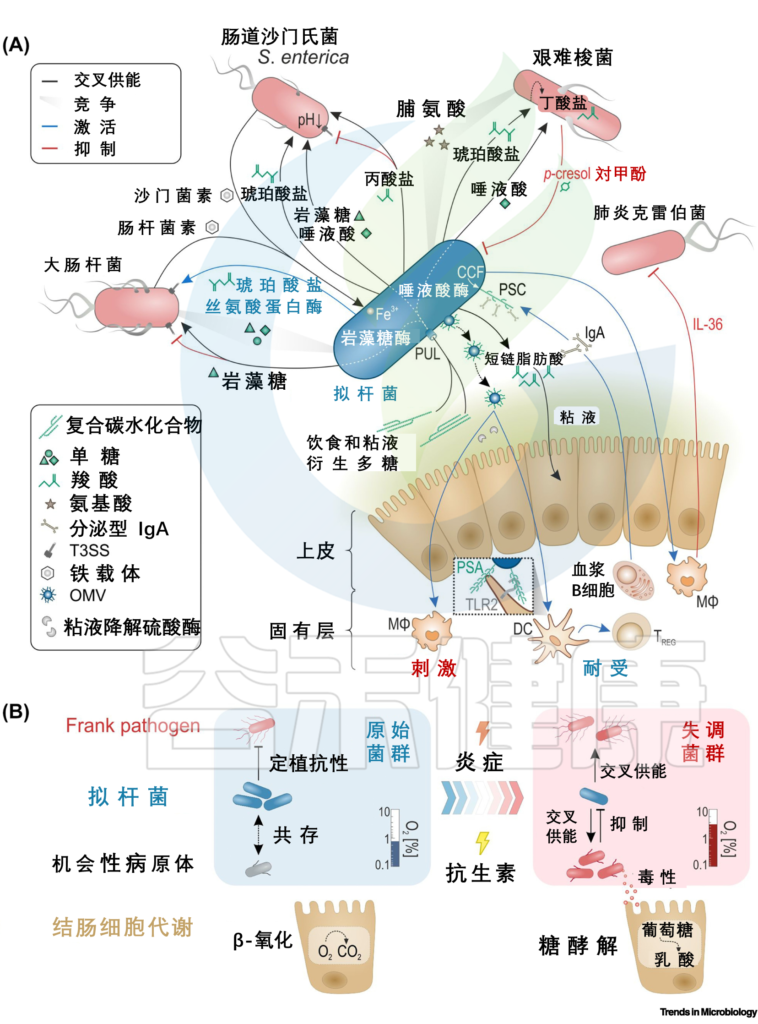
DOI: 10.1016/j.tim.2021.11.009
A) 互利拟杆菌属的相互作用。与肠粘膜以及与直接病原体肠出血性大肠杆菌(EHEC)和鼠伤寒沙门氏菌以及机会性病原体艰难梭菌和肺炎克雷伯菌有关。根据最近的文献汇编。肠道拟杆菌属也可能相互影响,例如,通过分泌的抗菌蛋白或通过某种“共享物”。
(B)通过病原体诱导(炎症)或治疗诱导(抗生素)破坏微生物群滋养免疫力,从原始微生物群向生态失调转变的简单化观点。
结肠细胞线粒体中的β-氧化会消耗氧气,造成管腔厌氧,而糖酵解则不消耗氧气,从而导致上皮氧合增加。拟杆菌属,不仅交叉喂养病原体,还在健康的肠道环境中交叉喂养益生菌物种,这有助于抵抗定植。
“
多形拟杆菌(Bacteroides thetaiotaomicron,B. thetaiotaomicron)是成人肠道的主要组成部分,已被用作研究人类细菌共生的有用模型。
降解植物多糖
它对人类的代谢不可忽缺功能是降解植物多糖,这是人类肠道非常重要的能力。此外,在产后母乳和富含植物淀粉的饮食之间的过渡过程中,这一点也有非常重要。
由于多形拟杆菌感应潘氏细胞发出微生物信号,它可以刺激肠道内的血管生成(从现有血管中生长出新血管)。B. thetaiotaomicron 通过为其他微生物帮助处理的营养物质提供足够的吸收能力来使其宿主受益。
塑造肠道粘膜屏障
多形拟杆菌介导的肠道内另一个出生后发育过程是肠粘膜屏障的形成,它通过调节物种特异性蛋白质抗生素的表达来帮助保护宿主免受病原体入侵。B. thetaiotaomicron 中存在的环境感知“调节装置”允许适应性食物寻找,从而稳定食物网,进而有利于群落的稳定和长寿。这种适应性“觅食”的能力是生物技术感兴趣的领域。
有异常大的“糖生物组”
多形拟杆菌是人类肠道远端的厌氧共生体,具有异常大的糖生物组,参与多糖获取和代谢的基因库。当膳食多糖受到限制时,这种糖生物组使 B. thetaiotaomicron 能够转向宿主多糖。B. thetaiotaomicron 不仅可以水解宿主衍生的聚糖,还可以主动确定肠道上皮细胞产生的聚糖的类型。
促进微生态系统稳定
B. thetaiotaomicron 诱导宿主衍生的聚糖可能具有适应性功能,为自身创造一个其他亲糖生物可以利用的生态位,从而促进生态系统的稳定性和功能多样性。这些独特的特征促使 B. thetaiotaomicron 被定性为关键物种。
B. thetaiotaomicron 可能稳定微生物生态以实现健康的宿主-微生物群关系的另一种机制涉及其能够诱导抗菌肽血管生成素,从而杀死机会性或致病性生物体,与此同时不能杀死 B. thetaiotaomicron 或其他共生体。
抵抗炎症变化
此外,B. thetaiotaomicron 通过过氧化物酶体增殖物激活受体-γ (PPARγ) 依赖性核因子-κB 亚基 p65 的核输出来抑制促炎基因的转录,从而潜在地抵抗可能破坏共生微生物群稳定的炎症变化。
例如,细胞毒性 T 淋巴细胞蛋白 4 (CTLA4) 阻断免疫疗法依赖于特定拟杆菌属物种(多形拟杆菌和脆弱拟杆菌)。这些结果表明,深入了解对拟杆菌类群的肠道微生物群特定成员的免疫反应,可能有助于为癌症治疗奠定基础。
“
根据微生物群滋养免疫概念,宿主应用栖息地过滤器来主动塑造其微生物群并维持互利共生状态。其中一种栖息地过滤器是上皮缺氧(关于这个详细的介绍我们在氧气与肠道共生菌那篇文章里讲过,详见:肠道漏氧会发生什么,健康的肠道是什么样?),这是成熟结肠细胞中线粒体β-氧化的结果。
粘膜表面的低氧浓度促进了专性厌氧细菌(包括拟杆菌属和一些产丁酸菌)的优势。反过来,这些细菌积极调节其肠道环境并影响宿主生理(例如,负责的免疫调节分子至少部分地通过外膜囊泡细菌表面衍生的双层球体,可以通过粘液屏障扩散)递送至真核靶细胞。
确保“正确的微生物”做“正确的事”
宿主栖息地过滤器不仅确保“正确”的微生物保留在肠道中,而且还确保它们做“正确的事情”。例如,血浆 B 细胞产生针对具有促炎潜力的拟杆菌表面结构的免疫球蛋白(主要是 IgA) ;这些免疫球蛋白减轻粘膜炎症,维持细菌分类群的多样性(关于IgA调节菌群多样性和菌定植的详细介绍可以参考我们以前的文章,详见对抗病原菌,帮助共生菌定植的“重要开关”),并调节拟杆菌代谢。
有趣的是,最近的发现表明某些拟杆菌属,增选 IgA 反应。例如,脆弱拟杆菌有意表达 IgA 反应性表面多糖C,使其被抗体修饰,从而改善粘液粘附,使细菌能够进入确定的空间生态位并促进与宿主的长期共生。
“
枢纽
拟杆菌属对宿主生态位的抢占、免疫系统的教育以及“益生菌”细菌的交叉喂养提供了针对病原入侵者的定植抵抗力。此外,拟杆菌与病原体竞争宿主来源的氨基酸(特别是脯氨酸和羟脯氨酸)和单糖(包括核糖、岩藻糖、阿拉伯糖、鼠李糖和果糖)并产生短链脂肪酸(SCFA),可以直接对抗发病机制。
从机制上讲,后者最好是丙酸盐,其质子化形式扩散到肠沙门氏菌(可能还有其他肠杆菌科)中,酸化受体的细胞质并减缓生长。此外,肠道拟杆菌属产生共生定植因子(CCF),即物种特异性碳水化合物利用系统,以强化肠道免疫屏障,保护宿主免受肺炎克雷伯菌定植和传播。
然而,拟杆菌衍生的代谢物——羧酸和单糖也可能对宿主产生损害。例如,肠出血性大肠杆菌(EHEC) 通过感觉拟杆菌属作为标志性生物体,沿着胃肠道寻找感染生态位。
特别是,对拟杆菌衍生的琥珀酸和岩藻糖的检测会启动转录级联,导致肠出血性大肠杆菌代谢的转录重编程和毒力因子的诱导。
肠出血性大肠杆菌(EHEC) 和其他病原体分泌的效应蛋白引起上皮炎症,在此过程中结肠细胞的能量代谢从β-氧化转向无氧糖酵解。这破坏了宿主栖息地过滤器,并开辟了新的生态位,这些生态位优先由肠杆菌科成员填充。
在发炎的肠道中,拟杆菌衍生的短链脂肪酸(SCFA)不再发挥保护功能,而是可能被兼性厌氧病原体利用作为无氧呼吸的碳源。类似的,在抗生素引起的生态失调时,通过拟杆菌属的代谢活动从复杂多糖中释放出琥珀酸和单糖,交叉喂养肠杆菌和艰难梭菌。
反过来,艰难梭菌释放抑菌化合物来抑制革兰氏阴性竞争者(包括拟杆菌属)的生长。然而,拟杆菌属已经进化出适应与肠道发炎、菌群失调相关的新环境的机制。例如,多形拟杆菌,利用其“异铁载体利用系统”(由xusABC_操纵子编码)来劫持沙门氏菌和大肠杆菌。大肠杆菌铁螯合剂,使其在结肠炎期间能够接触到这种必需的辅助因子。
拟杆菌属对于肠道感染来说是一把双刃剑
在提供针对病原体入侵的初始定植抵抗力的同时,它们可以被相同的病原体利用作为炎症和抗生素治疗期间的“利基”指标和资源提供者。
截至目前,我们还不完全了解除了感染剂量之外还有哪些因素会导致这些接触的结果对宿主有利或有害,但随着微生物分子组学发展包括转录组学领域的最新进展可能会成为这个任务中的改变者。
“
以多形拟杆菌为例,因为多形拟杆菌是研究最广泛的人类肠道共生体之一。2001有研究就使用与多形拟杆菌单一关联的无菌小鼠,并通过DNA 微阵列分析全局宿主转录反应。发现多形拟杆菌定植后上调的宿主基因包括:
这些基因共同证明共生细菌可以帮助强化宿主上皮屏障。受与多形拟杆菌单关联影响的其他宿主基因涉及出生后成熟(腺苷脱氨酶)、营养吸收和代谢(SGLT-1、辅脂肪酶和 L-FABP)以及血管生成处理(血管生成素-3)的调节。这项研究证明了单一物种的共生生物如何恢复以前无菌宿主的许多结构、代谢和发育缺陷。
随着B. thetaiotaomicron基因组被测序了解后,人们对驱动这种共生关系的分子机制有了更深入的了解。B. thetaiotaomicron含有 4,779 个成员的蛋白质组,缺乏与已知粘附素同源的蛋白质。然而,它已经进化出两种外膜多糖结合蛋白(SusC和SusD)的163个旁系同源物、226个预测的糖苷水解酶和15个多糖裂解酶。
B.thetaiotaomicron的全基因组转录分析揭示,与在由基本培养基组成的肉汤中生长相比,当把B.thetaiotaomicron引入无菌小鼠肠道时,B.thetaiotaomicron表达不同的碳水化合物和葡萄糖(MM-G)利用基因。
通过比较采用标准富含多糖的食物饮食或缺乏可发酵多糖的简单糖饮食的无菌小鼠的细菌基因表达,发现富含多糖的饮食诱导了碳水化合物利用基因(如木聚糖酶、阿拉伯糖苷酶和果胶酸裂合酶)的上调,而仅葡萄糖和蔗糖饮食则导致参与从粘液聚糖中回收碳水化合物的不同基因子集的表达增加,如己糖胺酶、α-岩藻糖苷酶和唾液酸酶。这些基因还可以介导细菌附着于粘液聚糖,以避免细菌从肠道中流失。
在荚膜多糖合成(CPS)位点中发现了体外与体内生长期间以及饮食控制过程中另一个值得注意的基因表达变化,这表明B. thetaiotaomicron能够改变其表面碳水化合物,作为宿主免疫逃避策略改变聚糖觅食行为。
B. thetaiotaomicron讲述了一个基于营养代谢的宿主-细菌互利共生的复杂故事范例。具有从宿主无法消化的营养物质回收能量的能力为细菌维持在宿主肠道中的驻留提供了进化驱动力。尽管缺乏粘附细胞器,B. thetaiotaomicron可以通过其外膜聚糖结合蛋白的全部介导将自身附着到营养支架(食物颗粒、粘液层和脱落的上皮细胞 )上。
由于其灵活的聚糖觅食能力,当膳食多糖变得稀缺时,B.thetaiotamicron通过转向宿主多糖来赋予肠道生态系统稳定性。这种非常成功的人类肠道共生体已经进化出一个复杂而庞大的基因组,可以针对不断变化的营养环境调动功能多样的适应性反应,从而保证与宿主的永久和互惠关系。
“
铁是许多生物体和细胞的必需营养素和生长限制元素,同时也是促炎剂。在人体内,大多数铁与原卟啉 IX (PPIX) (PPIX) 形成亚铁或三价铁络合物,此处简称为“血红素”,它在 O2和电子的运输和存储中发挥着多种作用,并且在催化作用中。
在检测到入侵病原体后,作为人类和动物先天免疫反应的一部分,促生长铁以血红素和非血红素形式被螯合。因此,环境微生物和病原微生物,包括经过充分研究的假单胞菌属、卟啉单胞菌属和葡萄球菌属成员,都进化出了多种机制来释放和同化血红素和非血红素铁的不同化学物质。
虽然许多兼性病原体大量产生和消耗血红素铁,但大多数胃肠道厌氧菌是血红素营养缺陷型微生物。拟杆菌是许多健康胃肠道菌群中的优势细菌群。其中B. thetaiotaomicron是一种共生血红素营养缺陷型,是该群体的代表,该菌优先使用并最终以血红素形式超积累铁,但是似乎不会从添加非血红素铁中获得进一步的生长益处。
胃肠道微生物组可能拥有足够的铁储备,足以替代人类几天的典型营养铁需求,构成大量的铁储存库和潜在的贫血缓冲剂。生物信息学分析表明,hmu操纵子编码拟杆菌门成员中血红素摄取和代谢的厌氧机制,在拟杆菌门中广泛存在,但仅限于拟杆菌门。
来自该操纵子的基因同样广泛存在于从健康人类收集的宏基因组样本中。因此,我们预计拟杆菌,特别是hmu介导的血红素代谢将构成代表微生物组和宿主从宿主饮食血红素中调动铁的主要机制。这种机制必须是稳健的,因为粪便中检测到的血红素通常归因于宿主衍生的潜血,可以诊断下消化道出血 。
营养研究表明,与典型的植物源性非血红素铁复合物相比,血红素是人类膳食铁的生物利用度更高的来源;然而,即使是血红素铁也不能被宿主完全吸收,这表明它必须与微生物组共享。
拟杆菌门对血红素的优先使用可能使它们在胃肠道环境中具有选择性优势。血红素促进拟杆菌的强劲生长。由于血红素依赖性富马酸还原酶增强了富马酸向琥珀酸的转化,从而发酵葡萄糖。反过来,相对于另一个优势门厚壁菌门的成员,复含血红素密集红肉的宿主饮食与结肠微生物组中更大比例的拟杆菌门相关。
拟杆菌密集的微生物群和红肉饮食都与结肠癌的诱发有关。目前尚不清楚这些宿主病理是否与血红素或卟啉本身的促炎特性有关,它们是否是由微生物组中受血红素刺激的部分的其他代谢活动引起的,还是两者的某种组合。
简而言之,拟杆菌门在共生环境中优先积累血红素,而不是直接促进发病机制,反而可能导致物种失衡(生态失调)以及随后对宿主生态系统的生化破坏。
这些例子说明了肠道病原菌和拟杆菌属之间从稳态到病理学之间复杂的种间相互作用。这也是谷禾健康不断积累和迭代不同人群样本库,以及长期纵向追踪不同人群疾病发生或症状改善以及与微生物群的潜在因果关系的价值所在。通过研究更大、更多样化的人群,检查不同疾病甚至同一疾病亚型内的微生物群组成,我们可以更全面、更准确地了解微生物群反馈及其对健康的影响。
分析肠道微生物群不仅仅涉及检测单个细菌种类或属。确定每种细菌的正常阈值需要全面了解大样本全局微生物群落以及种间互作等。
附录:
以下为本门当中比较著名的种属及其所属的纲目
主要参考文献:
Bornet E, Westermann AJ. The ambivalent role of Bacteroides in enteric infections. Trends Microbiol. 2022 Feb;30(2), pp.104-108.
A gut commensal-produced metabolite mediates colonization resistance to Salmonella infection. Cell Host Microbe, 24 (2018), pp. 296-307 e7
Commensal Bacteroidetes protect against Klebsiella pneumoniae colonization and transmission through IL-36 signalling. Nat. Microbiol., 5 (2020), pp. 304-313
Microbiota-liberated host sugars facilitate post-antibiotic expansion of enteric pathogens. Nature, 502 (2013), pp. 96-99

谷禾健康


什么是天然产物?
天然产物是指动物、植物、昆虫或微生物体内的组成成分或其代谢产物以及人和动物体内许多内源性的化学成分,是自然产生的小分子。值得注意的是,天然产物来源中,植物来源占85%以上。
谷禾在这里主要介绍植物来源的天然产物,包括营养素和药物。它们很容易与肠道微生物群相互作用,因为它们的成分复杂,在肠道中的停留时间长。通常,外源物质在小肠中的停留时间为1-6小时,在结肠中的停留时间为1-3天。特定的肠道微生物分解和转化天然产物,产生丰富的代谢物和功能化合物,具有宿主本身无法合成的生理活性。
天然产物在食品、药品、保健品领域均有运用。天然产物是极为重要的新药来源。近年来临床应用的药物,三分之二左右源自天然产物、天然产物衍生物以及天然的生物大分子,几乎涵盖了疾病治疗的各个方面。这在防治癌症及传染类疾病领域中的表现尤为明显。
天然产物在临床上得到了广泛的应用,其特点是多组分、多靶点、药效学物质多、作用机理复杂、生理活性多样。
对于口服天然产物,肠道菌群与临床疗效密切相关,但这种关系尚不明朗。肠道微生物在酶系统多样性引起的天然产物的转化和利用中起着重要作用。黄酮类化合物、生物碱、木酚素和酚类等有效成分不能通过人体消化酶直接代谢,但可以通过肠道微生物产生的酶转化,然后加以利用。因此,重点是通过肠道微生物群进行天然产物的代谢。
本文介绍了肠道微生物群及其对天然产物各组分生物转化的影响的研究,并强调了所涉及的常见菌群,反应类型,药理作用和研究方法。为临床疾病防治中的应用提供理论支持,以及日常的选择健康的药物提供一定的参考,并为基于肠道生物转化的天然产物研究提供新思路。
基于肠道微生物的天然产物的生物转化和代谢

Zhao Y,et al.Front Microbiol.2022
★人体肠道中的微生物
肠道微生物群由1000-1250种细菌组成,这些细菌以各种形式与人类相互作用,例如共生和寄生,这种相互作用通过微生物代谢物作为信号分子极大地影响人类健康。
肠道微生物构成了一个动态和多样化的微生态系统,这是抵抗致病细菌的天然屏障。肠道微生物具有丰富的酶系统,包括葡萄糖苷酶,还原酶,裂解酶,转移酶等,并大大扩展了人体内的代谢反应池。
✦肠道菌群影响口服给药的效果
口服给药是药物递送的首选途径,口服药物占市场最畅销药物的大部分。近年来,肠道微生物群对天然产物口服给药稳定性的影响受到广泛关注。
肠道具有丰富的细菌,有助于正常的消化功能,其中健康受试者中约98%的肠道微生物可分为四个门,厚壁菌门(Firmicutes),拟杆菌门(Bacteroidetes),变形菌门(Proteobacteria)和放线菌门(Actinobacteria)。
一些肠道微生物如大肠杆菌,双歧杆菌,真杆菌,乳酸杆菌,拟杆菌和链球菌参与天然产物的生物转化,其部分代谢物有利于肠道吸收并发挥显著的药理作用。
关键肠道微生物对天然产物的生物转化

Zhao Y,et al.Front Microbiol.2022
▸
大肠杆菌(Escherichia coli),又叫大肠埃希氏菌,是一种革兰氏阴性,无孢子,兼性厌氧细菌,主要栖息在脊椎动物的肠道中。
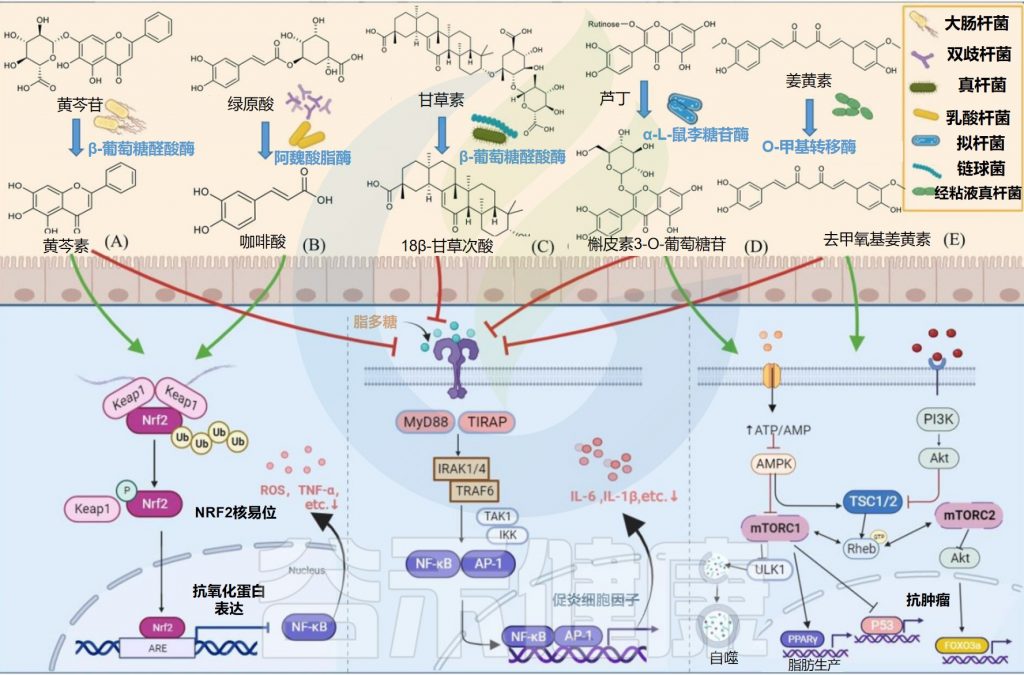
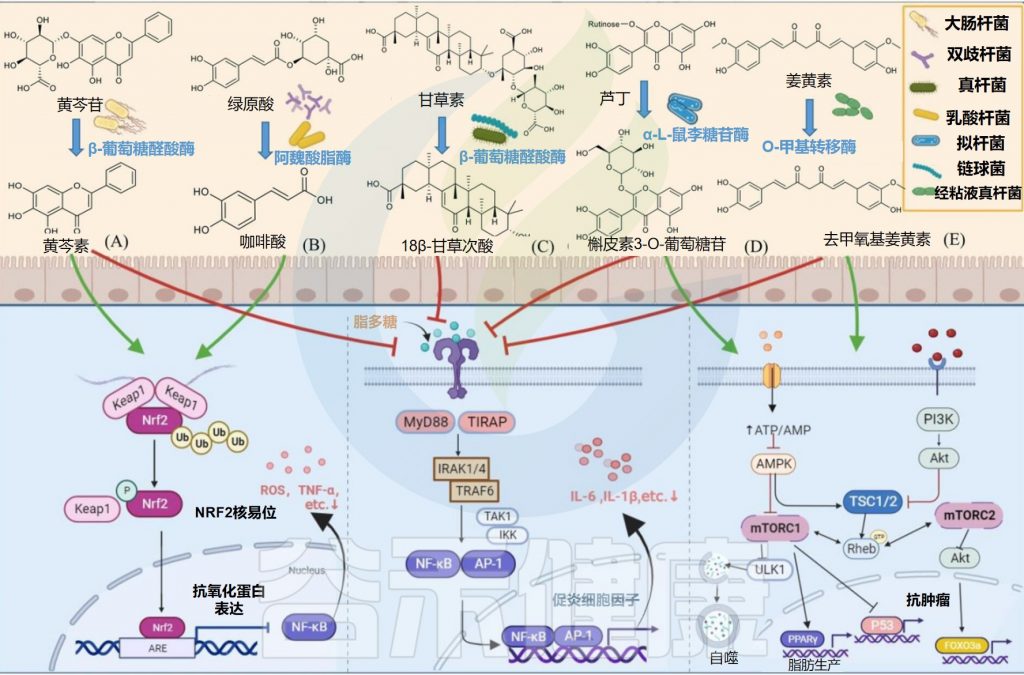
✦水解黄芩苷而具有抗炎抗氧化作用
部分大肠杆菌可以产生糖苷酶参与外源物质的转化,从而产生其有益作用。例如,E.coli HGU-3产生β-葡萄糖醛酸酶,水解黄芩苷中的糖苷键以产生黄芩素。
在相同剂量下,黄芩素比黄芩蒿素更有效地抑制组胺诱导的抓挠行为,并通过抑制Nrf2-ARE和NF-κB信号通路而具有抗炎和抗氧化作用。
✦在脂肪肝变性中有治疗益处
一些大肠杆菌菌株具有较高的姜黄素转化活性。E.coli DH10B的高表达NADPH依赖性姜黄素/二氢姜黄素还原酶(CurA)将姜黄素还原为二氢姜黄素(DHC)和四氢姜黄素(THC),其全基因组序列已经确定。
NADPH是一种辅酶,叫还原型辅酶Ⅱ,学名烟酰胺腺嘌呤二核苷酸,在很多生物体内的化学反应中起递氢体的作用,具有重要的意义。
二氢姜黄素和四氢姜黄素通过调节SREBP-1C和PPARα的mRNA和蛋白质表达水平来降低细胞中的甘油三酯水平,并以依赖性方式衰减肝脏脂肪生成;二氢姜黄素和四氢姜黄素在肝脂肪变性中比姜黄素具有新的治疗益处。
✦水解肉桂酸后有抗氧化和抗癌特性
E.coli Nu, E.coli MC和E.coli WC-1具有肉桂酰酯酶活性,可通过水解共轭羟基肉桂酸和游离羟基肉桂酸酯释放羟肉桂酸,在体外和体内均显示出抗氧化和抗癌特性。
目前,对大肠杆菌的遗传和生化特征的良好理解可能有助于在体外合成具有各种健康活性的天然产物衍生物。
▸
双歧杆菌(Bifidobacterium)是属于放线菌门的广泛而丰富的属,是人类肠道微生物群的首批定植者之一。人类肠道中最常见的双歧杆菌包括青春期双歧杆菌,B.angulatum, B.bifidum, B. breve, B.catenulatum, B.dentium, B.longum, B.pseudocatenulatum和B.pseudolongum,占成人微生物组的10%,它们与宿主健康有关。
✦预防急性肝损伤
某些种类的双歧杆菌可以通过表达阿魏酰酯酶产生酚酸。例如,动物双歧杆菌的阿魏酰酯酶可以将绿原酸(CHA)水解成咖啡酸(CAA)。咖啡酸可以通过增加Nrf2转录来预防对乙酰氨基酚诱导的小鼠急性肝损伤。
✦调节胆汁酸和降低胆固醇
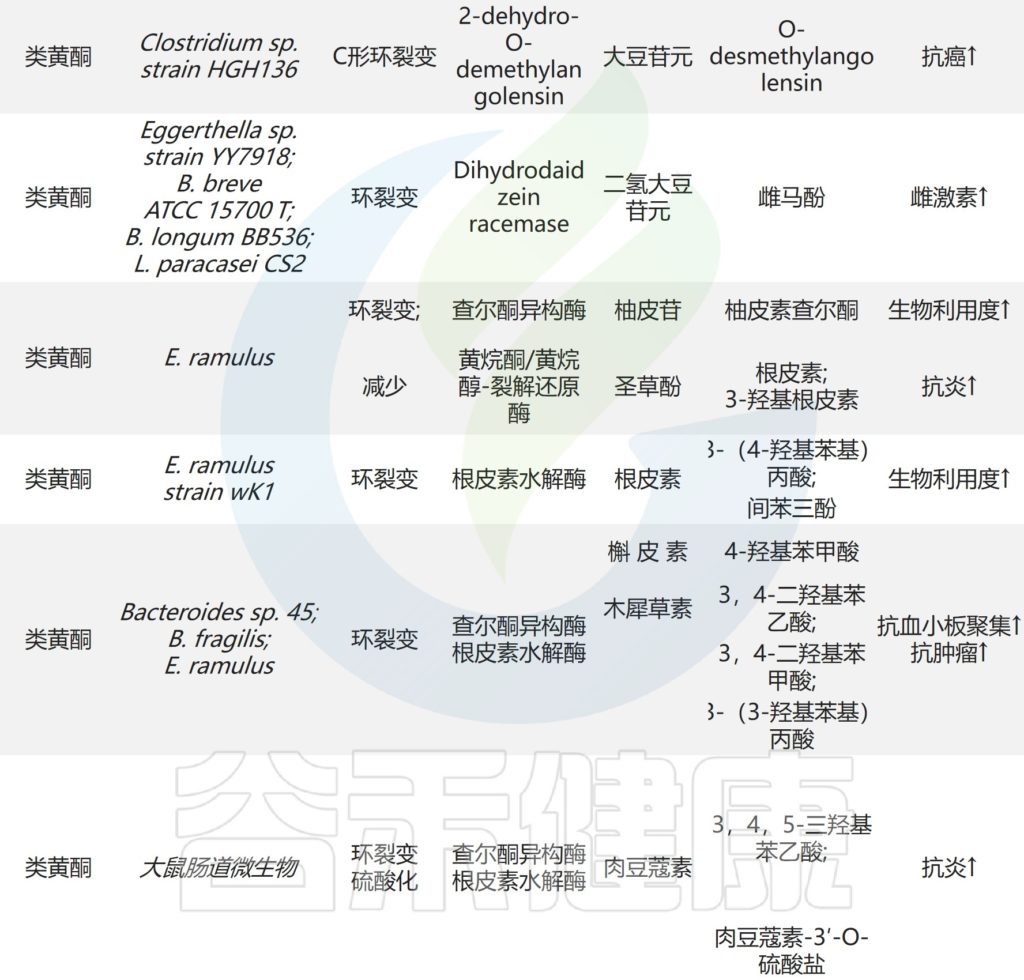
部分双歧杆菌的参与促进了黄烷酮,糖苷和皂苷在肠道中的代谢。B.longum R0175中的β-葡萄糖苷酶和去甲基化酶通过环裂解和脱甲基作用促进3-(3′-羟基苯基)丙酸和3-苯丙酸的产生。
B.longum SBT2928水解六种主要的人类和两种动物胆汁盐。因此,双歧杆菌可以调节胆汁酸代谢并降低体内胆固醇水平。
✦抗肿瘤和提高免疫
此外,B.breve ATCC 15700产生β-葡萄糖苷酶,在人参皂苷Rd的C-3和C-20位置裂解糖苷,生成脱糖基化的人参皂苷。
人参皂苷主要存在于人参和马铃薯药材中
人参皂甙的作用和功能是抑制肿瘤细胞的生长,诱导肿瘤细胞死亡,研究肿瘤的活性功能,肿瘤的异常逆行分化,提高人体免疫功能。
这些天然产物具有潜在的益处,代谢特征使双歧杆菌成为共生发展的主要候选者。
▸
真杆菌(Eubacterium)菌株的属是革兰氏阳性菌,它是人类肠道微生物群的核心属之一,并显示出在人类肠道的广泛定植。
一些真杆菌产生糖苷酶,还原酶等,并参与外源性物质的代谢。
✦抗炎抗氧化
E. ramulus是研究最广泛的类黄酮降解肠道细菌之一,它在人体肠道中很普遍。广泛存在于人体肠道中。来自E. ramulus的查尔酮异构酶和黄烷酮/黄烷醇裂解还原酶降解某些类黄酮产生查尔酮和二氢查尔酮。
二氢查尔酮及其代谢物具有抗炎和抗氧化作用,可以下调促炎细胞因子的分泌,并挽救脂多糖诱导的氧化磷酸化。
✦降解黄酮类化合物
研究了E.ramulus strain wK1对槲皮素和木犀草素的降解,发现静止细胞和酶制剂通过2,3位双键的还原和随后的环分裂将这些黄酮转化为3,4-二羟基苯基乙酸和3-(3,4-二羟基苯基)丙酸。
来自E.ramulus strain wK1的根皮素水解酶将邻近根皮素芳香A环的C-C键水解为3-(4-羟基苯基)丙酸和间苯三酚。
E.cellulosolvens ATCC 43171T可通过释放的葡萄糖部分的发酵促进类黄酮和葡萄糖苷的去糖基化。
注意:葡萄糖苷的去糖化仅由细菌酶催化。
✦预防气道过敏性炎症
Eubacterium L-8将甘草酸(GL)水解为18β-甘草次酸(18β-GA)。18β-甘草次酸通过抑制NF-κB磷酸化和增强Nrf2/HO-1通路来预防气道过敏性炎症。
NF-kB——核因子κB,参与细胞对外界刺激的响应,在细胞的炎症反应、免疫应答等过程中起到关键性作用
Nrf2/HO-1信号通路已成为细胞抗氧化应激的主要防御机制之一
这些代谢转化体现从真杆菌中获得的各种益处。然而,还需要进一步的体内研究,以最大限度地发挥真杆菌属的潜在益处。
▸
乳酸菌属(Lactobacillus)属于厚壁菌门,可以平衡微生物群落并保护胃肠粘膜。一些乳杆菌属富含代谢酶,如α-鼠李糖酶,单宁酶,没食子酸酯脱羧酶等,它们转化外源性物质。
✦抗炎、抗氧化作用
L. rhamnosus NCTC 10302具有β-葡糖苷酶和α-鼠李糖苷酶活性,通过水解,环裂变和脱氢将橙皮素7-O-葡萄糖苷和柚皮素-7-O-芸香糖苷转化为各自的糖苷元和3-(苯基)丙酸。
L. plantarum表达单宁酶水解没食子酸酯,具有短脂肪醇取代基的原儿茶酸酯和复杂的没食子单宁以产生没食子酸。没食子酸通过抑制MAPK/NF-κB途径并激活Akt/AMPK/ Nrf2途径,在脂多糖诱导的炎症和氧化应激中起保护作用。
MAPK是信号从细胞表面传导到细胞核内部的重要传递者。
Akt,蛋白激酶B,又称PKB或Rac,在细胞存活和凋亡中起重要作用。
✦预防代谢紊乱
观察到,没食子酸和邻苯三酚是由L.plantarum WCFS1中没食子甘氨酸代谢酶降解没食子甘肽而产生的。这项研究意味着益生元-益生菌相互作用在预防饮食诱导的代谢紊乱方面的潜在作用。
✦改善骨质疏松
具有大豆苷元还原酶活性的Lactobacillus sp. Niu-O16。二氢大豆苷元抑制NF-κB活化和MAPK磷酸化,从而改善骨质疏松症。
L.casei, L.plantarum和L.acidophilus影响白藜芦醇苷到白藜芦醇的去糖基化。这种转化对于提高白藜芦醇苷的生物利用度和生物活性非常重要。来自L.reuteri, L.helveticus和L.fermentum的阿魏酰酯酶水解绿原酸以释放咖啡酸。
这些发现为乳杆菌在促进健康的制药和食品应用中的作用开辟了新的视角。然而,潜在的转化机制值得进一步研究。
▸
拟杆菌属(Bacteroides)的成员是革兰氏阴性专性厌氧菌,占结肠中细菌总数的25%,在人类肠道细菌组中起着多种作用。在临床中经常检测到拟杆菌物种,例如脆弱拟杆菌,B.distasonis, B.ovatus和B.thetaiotaomicron。
✦抑制炎症反应
拟杆菌属拥有一系列水解酶,并通过转化外来物质参与与其微生物邻居的物种间关联。体外共孵育实验表明,某些拟杆菌物种参与类黄酮的生物转化。
Bacteroides sp. 45表达α-L-鼠李糖苷酶和β-芦丁糖苷酶,用于将芦丁水解成槲皮素3-O-葡萄糖苷,槲皮素和白花青素。
槲皮素3-O-葡萄糖苷比其他形式的槲皮素吸收得更好,并且可以通过抑制NF-κB和MAPK信号通路来抑制结肠炎小鼠的炎症反应。
Bacteroides sp. 54将槲皮苷代谢为羟基槲皮素和去甲基槲皮素。槲皮苷也被α-L-鼠李糖苷酶降解为槲皮素,并通过Bacteroides sp.45进行进一步的环裂解以产生3,4-二羟基苯甲酸。
β-葡萄糖醛酸酶由拟杆菌J-37表达,将甘草酸代谢为18β-甘草次酸。
天然产物在拟杆菌作用下进行生物转化,产生具有不同功能活性的代谢物。了解人体内天然产物的整个过程以评估其对人体健康的影响是很重要的。
▸
链球菌属(Streptococcus)是革兰氏阳性菌,呈球形或卵形,通常成链排列或成对排列,广泛存在于人类粪便和鼻咽中。
宏转录组学分析表明,磷酸转移酶系统主要由链球菌表达,这表明这些细菌是小肠中可用碳水化合物的主要利用者。
✦抗癌、抗过敏作用
Streptococcus LJ-22表达β-葡萄糖醛酸酶将甘草酸代谢为18β-甘草次酸-3-O-β-D-葡萄糖醛酸(GAMG)。GAMG对脂多糖诱导的RAW264.7细胞具有抗过敏活性。
甘草酸和甘草次酸均有一定的防癌和抗癌作用。甘草次酸可抑制原癌细胞的信息传递和基因表达.甘草酸对多种恶性肿瘤均有抑制作用。甘草次酸还具有抗病毒感染的作用,对致癌性的病毒如肝炎病毒,EB病毒及艾滋病毒的感染均有抑制作用。
此外,单宁酸被Streptococcus gallolyticus subsp.Gallolyticus(SGG)的单宁酶降解以产生邻苯三酚。SGG可能通过消除单宁酸对肿瘤细胞的毒性来促进结直肠癌的发展。因此,有必要进行进一步的体内研究,以确定消除这些单宁酸降解微生物是否可以支持结直肠癌的有效治疗。
✦降低血压,抗氧化
S.thermophilus GIM 1.321很高的β-葡萄糖苷酶生产能力,用于将果实花青素降解为绿原酸,咖啡酸和阿魏酸。
CAA和CHA(10/15毫克/千克/天)的施用可以降低血压并发挥抗氧化作用。
链球菌菌株可能是肠道中的共生、致病和机会性病原体,需要更多关于其对人类健康影响的信息。更好地了解链球菌如何代谢天然产物,可以调节肠道微生物组以提高治疗效果。
▸
经黏液真杆菌(Blautia)属物种严格无氧,不可移动,通常为球形或椭圆形,广泛存在于哺乳动物的肠道和粪便中。越来越多的证据表明,经黏液真杆菌的益生菌特性对天然产物的生物转化有影响。
✦影响生物转化
在类黄酮生物转化过程中,Blautia催化的反应包括去甲基化,去糖基化以及环裂解,其可能被相应的酶催化,例如O-糖苷酶和β-葡萄糖苷酶。
研究表明,Blautia sp. MRG-PMF1菌株分别将5,7-二甲氧基黄酮和5,7,4-三甲氧基黄酮转化为生物活性白杨素和芹菜素,对芳基甲基醚官能团具有水解能力。Blautia sp. MRG-PMF1还具有去糖基化活性,并且发现各种异黄酮,黄酮和黄酮被代谢成相应的糖苷元。
✦去甲基产物具有抗炎、抗癌、抗氧化能力
Blautia sp. MRG-PMF1在菌株进一步代谢具有雌激素作用的去甲基香菜素。该菌株还可以催化姜黄素以产生具有抗炎和抗癌特性的去甲氧基姜黄素。
此外,Blautia sp. AUH-JLD56能够单独生物转化牛蒡子苷或牛蒡子苷元,制成具有更好抗氧化能力的去甲基化产物。
最近,关于Blautia对草本植物和功能性食品的生物转化和代谢研究越来越多。探索Blautia的生物转化对于开发新的酶和生物活性代谢物具有重要意义。
复杂的微生物酶催化肠道中天然产物的代谢,产生有利于宿主利用/排泄的亲脂性和低分子量代谢物。与人类遗传学不同,肠道微生物组的特征是可改变的,使其成为优化治疗的潜在治疗靶点。
口服天然产品进入消化道后,首先会接触大量肠道微生物及其产生的活性酶。因此,天然产物的肠道生物转化可能发生在通过肝脏的第一次传递效应之前,也可以被运输到肝脏进行修饰/结合,然后排泄到肠道,与肠道微生物反应形成一系列代谢产物。
因此,与健康或疾病相关的特定菌株、特定代谢途径和特定酶的组合对于确定肠道微生物对宿主的影响非常重要。
✦水解提高生物活性和生物利用度
某些天然产物具有高分子量和低脂溶性,并且它们难以在肠道中被人体吸收并且具有低生物利用度。通过肠道微生物介导的水解,它们的物理性质发生了变化,它们的生物活性和生物利用度大大提高。
大多数糖苷具有低活性,被认为是“天然前体药物”。在与肠道微生物相互作用后,糖苷的糖基被去除,然后,糖苷部分被肠细胞吸收以发挥生理作用。水解反应是进一步转化所必需的,产物(例如糖)参与促进肠道微生物的生长和存活。
肠道微生物对天然产物的水解反应







Zhao Y,et al.Front Microbiol.2022
✦类黄酮
类黄酮是天然酚类化合物,大量存在于水果和蔬菜中。肠道微生物可能是黄酮类化合物(糖苷形式)功效的部分原因,由于存在水溶性糖成分,其生物利用度较低。
具有3羟基黄酮碱和平面环体系的黄烷醇构成了一类重要的黄酮类化合物。异鼠李素-3-O-新橙皮苷首先被Escherichia sp.23脱糖基化为异鼠李苷-3-O–葡糖苷,去糖基化成苷元异鼠李甙。
•肠道酶代谢比肠道微生物更快
肠道微生物和衍生酶共同控制通过体外测定确定的淫羊藿类黄酮的代谢。在目前的研究中,肠道酶代谢类黄酮的速度比肠道微生物更快。
来自Bacteroides thetaiotaomicron VPI-5482的α-L-鼠李糖苷酶可以水解淫羊藿定C的α-1,2糖苷键以产生芸香苷。
芸香苷,又叫芦丁。具有抗炎、抗氧化、抗过敏、抗病毒等功效。
•肠道酶在水解中起着重要作用
E. ramulus和Clostridium saccharogumia将花青素-氰苷3-葡萄糖苷转化为氰苷。人类肠道酶如β-葡糖苷酶在汉黄芩苷水解成汉黄苷素中起着关键作用。
茶氨酸菌素A是红茶中发现的一种生物活性儿茶素二聚体,通过人类粪便微生物群脱乙酰产生茶氨酸霉素C。
•空间位阻会限制酶降解
观察了黄烷醇的代谢差异,结果表明,在肠道微生物发酵过程中,空间位阻可能限制细菌酶降解部分黄烷醇环。
在肠道微生物的作用下,许多其他类黄酮也会发生水解反应。值得注意的是,考虑到类黄酮的结构差异,肠道微生物对类黄酮的降解程度差异很大,从而影响其生物可利用性。需要进一步研究肠道代谢在类黄酮生物利用度和吸收中的作用,以及可能的细菌类黄酮相互作用活性。
✦萜类化合物
萜类化合物是具有抗癌,抗炎和神经保护作用的最大一类天然产物。部分萜类化合物也可被肠道微生物水解。
萜类化合物广泛存在于自然界,是构成某些植物的香精、树脂、色素等的主要成分。如玫瑰油、桉叶油、松脂等都含有多种萜类化合物。另外,某些动物的激素、维生素等也属于萜类化合物。
肠道微生物也可以水解部分萜类化合物。京尼平苷在Eubacterium sp. A-44表达的β-葡萄糖苷酶的作用下产生京尼平。芍药苷在β-葡萄糖苷酶的作用下转化为PM-I,该酶由L. brevis和脆弱拟杆菌(B. fragilis)表达。通过与大鼠厌氧肠道微生物群孵育,芍药苷也被脱糖并脱苯基为小分子量的白花苷和酰基白花苷。
•肠道微生物中的酶促进水解作用
研究证明,几种具有酯酶的双歧杆菌物种可以在体外将白芍苷水解为苯甲酸。体外研究表明积雪草苷被糖苷键水解酶逐渐去糖基化,并产生相应的苷元。柴胡皂苷B1在β-葡萄糖苷酶和β-D-聚焦酶的作用下逐渐水解为原柴胡皂素和柴胡皂甙A,由Eubacterium sp. A-44表达。
除上述化合物外,萜类人参皂苷Rh2、阿迪普西洛苷I、罗汉果苷III和具栖冬青苷也可在肠道微生物的作用下发生水解反应。
肠道微生物在萜类化合物代谢中起着重要作用,其代谢产物对肠道微生物组和人体健康的影响有待进一步研究。
✦其他化合物
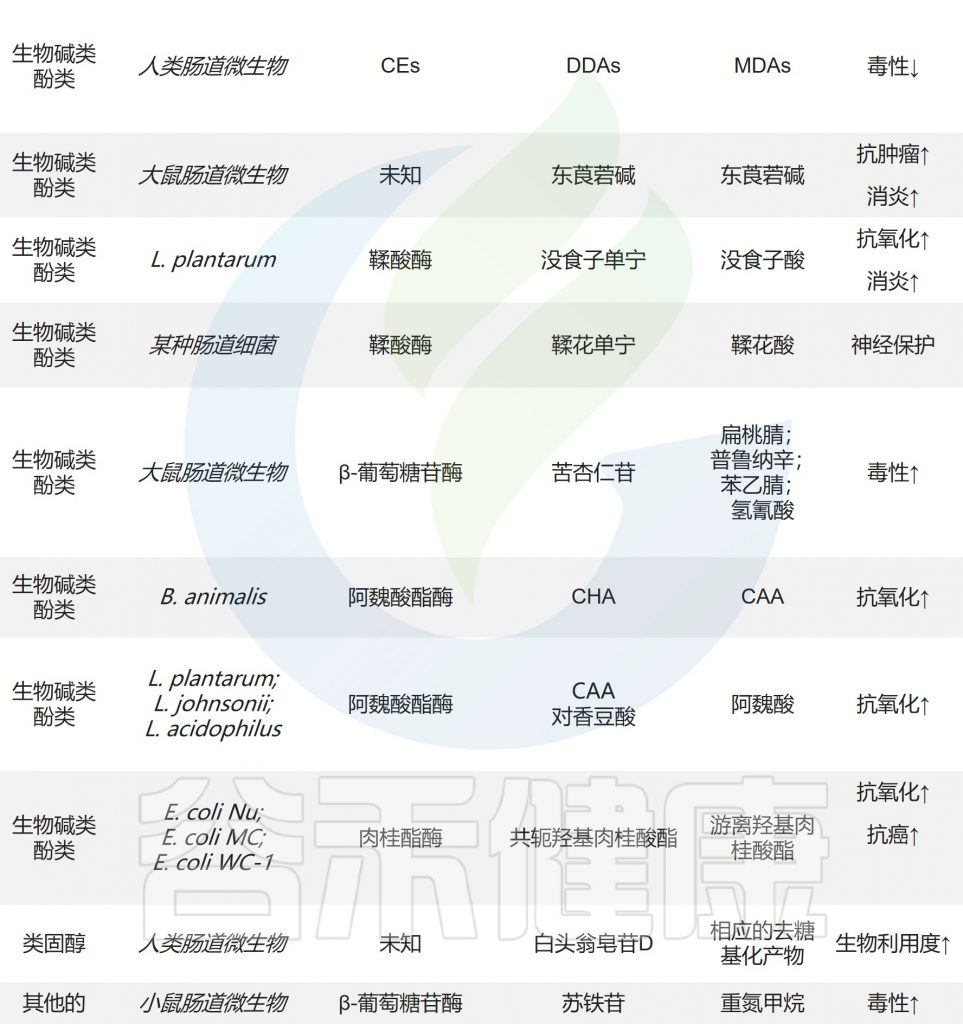
具有极低生物利用度的尿石素只有在来自Gordonibacter urolithinfaciens, Gordonibacter pamelaeae和Ellagibacter isourolithinifaciens的鞣酸酶作用下水解成鞣花酸和尿石等衍生物时才能发挥药理作用。
尿石素——存在于水果和坚果中的一类化合物鞣花单宁的天然代谢产物
从大黄中提取的蒽醌糖苷被肠道微生物水解为蒽醌苷元。Sennoside A是大黄提取物的主要成分,通过Bifidobacterium sp. strain SEN的β-葡萄糖苷酶代谢为大黄蒽酮。
大黄蒽酮具有泻下攻积、清热泻火、解毒、活血祛瘀、利胆退黄等功效。
在肠道微生物表达的羧酸酯酶(CE)的作用下,二酯二萜生物碱(DDAs,如乌头碱)水解C-8和C-14的酯键,产生毒性较小的单酯二萜生物碱。生物碱东莨菪碱、类固醇化合物白头翁皂苷D和半胱氨酸在肠道微生物的作用下也会发生水解反应。
小结
水解反应是肠道微生物代谢天然产物的重要步骤,是生物活性表达和进一步生物转化所必需的。
应重点关注参与该反应的特定微生物和酶,以充分了解天然产物的最终命运及其对人体健康的影响,并为个性化治疗提供依据。
肠道微生物可以通过亲核取代反应表达转移酶并在两种底物之间移动官能团。
肠道微生物将甲基添加到外源物质中需要化学活化的辅底物,如乙酰辅酶A、三磷酸腺苷或腺苷甲硫氨酸,而去甲基化需要可以进行亲核催化的辅因子。
甲基化修饰可以优化天然产物的生理活性,去甲基化可以释放极性基团以进一步结合和排出体外,并为肠道微生物的生长提供碳源。
下图显示了肠道微生物作用下天然产物的甲基化和去甲基化以及带来的影响。
肠道微生物对天然产物的甲基化和去甲基化



Zhao Y,et al.Front Microbiol.2022
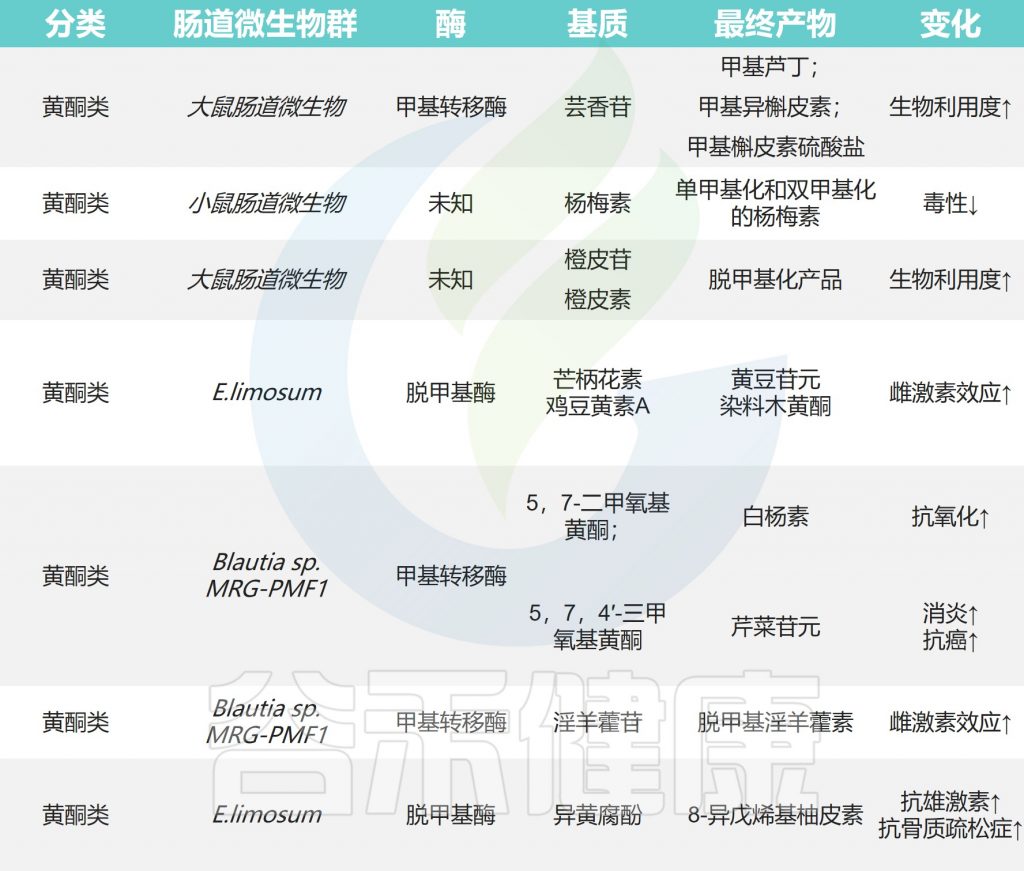
✦类黄酮甲基化后具有抗癌活性
类黄酮甲基化修饰可以在类黄酮结构中的C-2,C-3,C-4,C-5,C-6,C-7和C-8位置进行,甲基化类黄酮的生物利用度大大提高。
甲基化类黄酮具有显著的抗癌活性和对肝脏代谢的抵抗力。在大鼠口服芦丁后,在粪便样品中检测到许多甲基化代谢物,如甲基芦丁,甲基异槲皮素和甲基槲皮素硫酸盐。
作用过程
甲基化的异黄酮类化合物在E.limosum ATCC 8486的作用下进行去甲基化以产生大豆苷元和染料木黄酮。异氧杂环丁酚通过苌香产生去甲基化产物8-异辛基柚皮素。橙皮苷,5,7-二甲氧基黄酮,黄腐酚和5,7,4′-三甲氧基黄酮也可以在肠道微生物的作用下进行去甲基化反应。
✦生物碱具有抗癌性和抗病毒活性
生物碱是含氮化合物,由海洋和陆地生物生物合成,它们具有抗癌性和抗病毒活性。
绝大多数生物碱分布在高等植物,尤其是双子叶植物中,如毛茛科、罂粟科、防己科、茄科、夹竹桃科、芸香科、豆科、小檗科等。
在肠道微生物表达的酶的作用下,苦木中的主要生物碱成分准碳质酮被甲基化为准碳质碱丁基。异喹啉生物碱巴马汀通过体外厌氧培养产生去甲基产物,如哥伦比亚胺、药根碱、去甲基小檗碱和去甲基小蘖碱。通过离子阱电喷雾电离串联质谱法证明了肠道微生物对乌头碱的去甲基作用,并产生了去甲基乌头碱。
✦木酚素可以抗炎防心血管疾病
膳食木酚素是植物雌激素,主要存在于种子,坚果,豆类和蔬菜中。
木酚素在微生物作用下的一些转化
牛蒡苷可由Eubacterium sp. ARC-2菌株去甲基化为二羟基内酯和其他产物。从人类粪便细菌中分离出一种名为Lautia sp. AUH-JLD56的细菌,该物种可以有效地将牛蒡苷或牛蒡苷元转化为去甲基化代谢物3′-去甲基牛蒡苷(3′-DMAG)。
Secoisoolaricinol是亚麻籽中最常见的木脂素之一,可在Blautia producta、Gordonibacter和Lactonifactor longoviformis的存在下去甲基,形成肠内酯和肠二醇。
芝麻素通过甲基化、去甲基化和肠道微生物的其他反应代谢为哺乳动物木脂素内酯和肠二醇。罗汉松树脂酚和连翘脂素也可以去甲基化以产生内酯。水飞蓟宾A和B被人类粪便微生物群去甲基为去甲基水飞蓟宾A和脱甲基水飞蓟宾B。
✦其他化合物
多酚化合物姜黄素被Lautia sp. MRG-PMF1去甲基化,以产生代谢物去甲基姜黄素(DMC)和双去甲基姜黄素(bDMC)。二氢异铁酸的去甲基化产物,如二氢咖啡酸,也在粪便代谢物中获得。
研究发现,甲基化反应发生在甘草皂苷22β-乙酰氧基甘草酸糖链的内部和外部葡萄糖醛酸残基处,产生22β-乙氧基甘草酸甲酯。
丹参素,萜类化合物,二苯乙烯类化合物和类固醇化合物在肠道微生物的作用下经历甲基化和去甲基化。
小结
甲基化和去甲基化反应是肠道微生物代谢的重要途径。甲基化能引起染色质结构、稳定性及蛋白质相互作用方式的改变,从而控制基因表达。去甲基化则诱导了基因的重新活化和表达。
然而,介导这种反应的基因/酶尚未完全确定,还需要进一步的实验研究。
肠道微生物可以表达许多氧化还原酶并通过调节各种官能团转化天然化合物,如烯烃、羧酸衍生物、硝基、氧化物和a,b不饱和羧酸衍生物,这些官能团影响体内天然产物的活性。
下图显示了肠道微生物作用下天然产物的氧化和还原反应。
肠道微生物对天然产物的还原和氧化反应






Zhao Y,et al.Front Microbiol.2022
✦类黄酮
黄酮类化合物大豆苷元在Clostridium sp. strain HGH6和Lactobacillus. sp. Niu-O16的作用下还原为二氢大豆苷元和进一步的四氢大豆苷元。还原产物二氢染料木黄酮是由染料木黄酮在人类粪便细菌的作用下产生的。
通过分析,在厌氧条件下与槲皮素一起孵育,在大鼠肠液培养液中鉴定出脱氧代谢物山奈酚和双键氢化还原产物西叶素等化合物。
从Flavonifractor plautii ATCC 49531中发现了黄酮还原酶,该酶特异性催化黄酮/黄烷醇C环的C2-C3双结合的氢化作用,并在黄酮类化合物整个生物降解途径的初始步骤中起作用。
去甲黄腐酚,一种查尔酮化合物,被分枝杆菌还原为去甲-α,β-二氢黄腐酚
•药理作用
黄酮类化合物分布广泛,具有多种生物活性。
1.黄酮类化合物具有抗自由基和抗氧化作用;2.防治心血管疾病方面均具有良好的效果;3.抑菌抗免疫作用;4.对动物激素的调节作用。
✦生物碱
•小檗碱具有杀菌消炎的功效
由肠道微生物产生的硝酸还原酶催化生物碱中的醚和配位键反应。小檗碱(BBR)作为黄连的主要成分,可以通过肠道微生物表达的硝基还原酶还原为二氢小檗碱,这种还原产物具有很高的极性。
二氢小檗碱可以在肠道中被吸收,然后被氧化成原型小檗碱进入血液。二氢小檗碱在肠道中的吸收率是小檗碱的五倍。同时还发现,肠道微生物可以通过氧化将小檗碱转化为氧小檗碱。
小檗碱的功效和作用主要就是起到杀菌消炎的作用,抗菌谱比较广,主要用于治疗各种肠道感染和菌痢等。
•其他生物碱产物
血红素是小檗碱的一种新代谢产物,可能是一种值得探索的生物活性剂。黄连碱是一种天然的原小檗碱生物碱,具有与小檗碱相同的母体结构。口服黄连后,C-O键打开并断裂,随后发生还原反应,生成氢化小檗碱。阿南酰胺被小鼠和人类肠道微生物群还原为二氢阿南酰胺,生物利用度更高。
✦苯丙酸
•咖啡酸具有抑菌、抗病毒作用
咖啡酸(CAA)作为食品和饮料中的主要膳食多酚,在酯化后很容易进入结肠并与肠道微生物群发生反应。
苯丙酸通过C4双键还原和脱氢作用转化为3-羟基苯基丙酸,然后通过体外肠道微生物的β氧化迅速转化为3-苯基丙酸。苯丙酸也可以脱羟基化为间香豆酸或氢化为二氢咖啡酸。
咖啡酸片具有较普遍的抑菌效果,可用于抑菌、抗病毒。除此之外,还具有中枢兴奋、解毒凝血等作用。
丹参素是丹参的主要单体酚酸,通过肠道微生物群进行脱氢和脱氧,生成3-苯基-2-羟基丙酸、3-(3,4-二羟基苯基)-2-丙烯酸(咖啡酸)和3-(3,4-二羟基苯)丙酸。
✦其他化合物
甘草次酸通过盲肠中的Ruminococcus sp. po1-3的3β-羟基类固醇脱氢酶生成3-氧代甘草次甲酸。
•通便作用
番泻甙是一类天然蒽醌衍生物和二聚糖苷,首先被β-葡萄糖苷酶水解生成番泻甙-8-O-单糖苷,然后在体内被链球菌还原为具有通便作用的大黄蒽醌。
二萜类白藜芦醇被Slackia equolifaciens和Eggerthella lentaATCC 4305还原为二氢白藜芦醇。
此外,二酮姜黄,类固醇化合物地高辛和其他化合物马兜铃酸也可以在肠道微生物的存在下减少。肠道微生物黄酮还原酶和硝基还原酶具有特殊的催化选择性,填补了肠道微生物转化途径的关键空白。
然而,介导肠道微生物减少的特定基因和酶尚未完全确定。
肠道微生物对天然产物的其他反应
Zhao Y,et al.Front Microbiol.2022
如图中所示,肠道微生物也通过环分裂、硫化、芳构化和其他反应转化天然产物。
龙胆苦苷是一种天然的环烯醚萜苷,可通过肠道微生物β-葡萄糖苷酶水解为龙胆醛,然后通过N-杂环反应水解为含氮化合物。
京尼平丙酮醇的部分开环导致肠道微生物形成二醛。奎宁酸可以在肠道微生物存在下芳香化为马尿酸。
原花青素B2和A2与人类肠道微生物体外发酵,获得了主要的水解和环裂解代谢物,即苯甲酸、2-(3,4-二羟基苯基)乙酸和5-(3,4-二羟基苯)-γ-戊内酯。
口服木犀草素后,在大鼠粪便样品中检测到硫酸盐和氢还原代谢物。由肠道微生物促进的大豆苷元转化为雌马酚是另一个有趣的例子。
木犀草素,多以糖苷的形式存在于多种植物中,具有镇咳和祛痰作用。
雌马酚的作用:1.抗氧化,雌马酚属于多酚类物质,可作为氢/电子受体,清除自由基;2. 免疫调控,雌马酚的免疫保护作用可能是有其抗氧化作用所介导的,涂抹雌马酚对皮肤有免疫保护作用。
SesA是一种来自Sinomonas sp.no.22的芝麻素代谢酶,通过环裂解催化亚甲基从芝麻素或芝麻素单儿茶酚转移到四氢叶酸,产生芝麻素一儿茶酚或二儿茶酚和5,10-亚甲基四氢叶酸酯。
萜类化合物,类黄酮,苯酚,生物碱和脂肪酸都可以在肠道微生物的作用下进行生物转化反应,产生活性代谢物。
这些研究证明了各种肠道微生物组的巨大代谢潜力。天然产物的肠道微生物代谢及其在宿主健康中的作用应该是未来研究的重点。
小结
本节总结了来自单个反应的肠道微生物群介导的天然产物的生物转化。
但是,观察到一些限制。首先,考虑到肠道微生物的复杂性和肠道微生物酶的多样性,天然产物在肠道中经历复杂的转变。单个反应只能描述一定的新陈代谢过程。可以通过激活/抑制这一过程来优化治疗。
此外,考虑到肠道微生物含有各种潜在的多功能酶,可以预期肠道微生物会有更多的生物转化反应被天然产物所低估。
为了阐明肠道微生物代谢如何影响人类健康,研究人员应该将功能与基因和酶联系起来。
除了调节肠道微生物对天然产物的处置外,天然产物对肠道微生态学的调节作为潜在的功效机制也很重要。
越来越多的肠道微生物群研究逐渐揭示了大多数天然产品的高药理作用与低口服利用率之间的关系。大多数糖苷具有复杂的母体结构,很难被肠细胞吸收,从而限制了它们的组织特异性生物可及性。
这些化合物通过依赖于微生物/肠道微生物酶的降解反应转化为小分子代谢物/独特代谢物,从而对宿主产生广泛影响。肠道微生物还作用于膳食酚类物质,产生有助于宿主健康的功能代谢物。
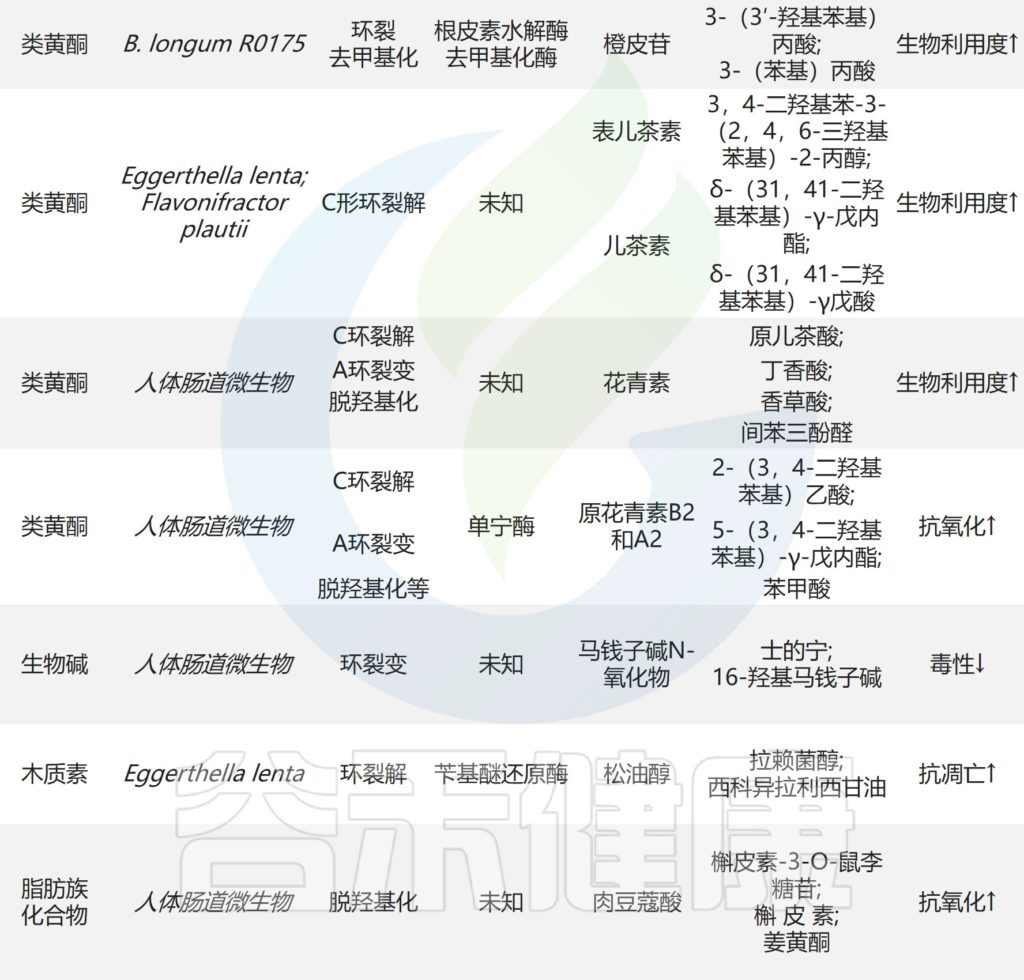
✦增强抗肿瘤、抗炎、降脂作用
肠道微生物的生物转化促进了天然产物的治疗效果。人参皂苷对化合物K(CK)的典型代谢模型已被广泛报道,具有增强的抗肿瘤,抗炎和降脂作用。
人参皂苷的生物转化和代谢物化合物k的功效
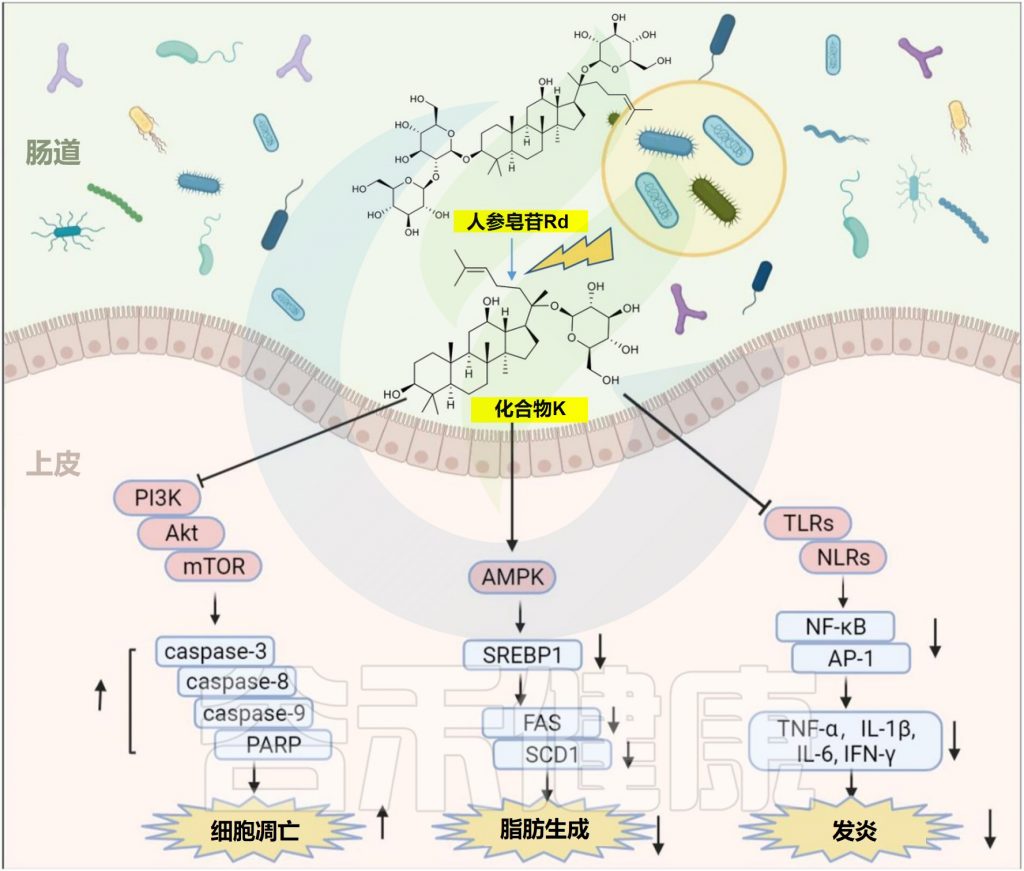

编辑
Zhao Y,et al.Front Microbiol.2022
1 —降脂
在20μM时,化合物K通过激活AMPK减少人肝细胞癌细胞中的肝脂堆积
2–抗癌
在50μM时,化合物K通过上调半胱天冬酶-3,半胱天冬酶-8,半胱天冬酶-9和环磷酸腺苷依赖性蛋白激酶来抑制胶质母细胞瘤细胞的生长。
3–减弱炎症
化合物K通过自噬诱导和调节NF-κB、p38蛋白和JNK/MAPK信号来减轻巨噬细胞炎症和泡沫细胞形成。
✦姜黄素可以抑制炎症
姜黄素代谢物的生物利用度取决于微生物群依赖性。例如,去甲基姜黄素增加PPARγ表达,导致自噬和核转录因子κB抑制,随后抑制脂多糖诱导的炎症。
PPARγ——是一种过氧化物酶体增殖物激活受体
MAPK——即AMP依赖的蛋白激酶,是生物能量代谢调节的关键分子
去甲基姜黄素通过抑制炎症因子的分泌和MAPK和NF-κB途径的激活来减轻体内和体外的炎症反应。由于在其原型苯环结构中不存在甲基,去甲基姜黄素的化学稳定性增加,从而解释了姜黄素的强大有益作用。
姜黄素来源:姜黄素是从植物根茎中提取,主要来源于生姜,然后就是那些植物中,胡萝卜、番茄以及辣椒,咖喱,芥末中也含有一些姜黄素。
✦尿石素具有抗炎和神经保护等作用
值得注意的是,尿石素A(UA)是一种天然化合物,由肠道微生物从摄入的鞣花单宁和鞣花酸中产生,具有显著的抗炎和神经保护作用。
在1μM时,尿石素A足以降低聚(I:C)诱导的RAW264.7细胞中肿瘤坏死因子和MCP-1的产生,并使TLR3/TRIF信号失活。尿石素A提高高脂饮食小鼠的全身胰岛素敏感性并降低肝脏白细胞介素1β水平。
MCP-1,是一种由星形胶质细胞分泌的促进炎症的蛋白质。
Toll样受体3(TLR3)是TLR家族的成员,介导I型干扰素、促炎细胞因子和趋化因子的转录诱导
尿石素A通过降低皮层和海马体中白细胞介素6、白细胞介素1β和肿瘤坏死因子的水平来改善小鼠的认知障碍,并抑制神经炎症。
小结
这些研究强调了鉴定天然产物微生物代谢的重要性。此外,许多体外药理活性测量应与微生物代谢产物一起进行,微生物代谢产物实际上与体内的生化受体相互作用。
肠道微生物的组成,结构,功能和代谢物已成为天然产物发挥有益作用和降低毒性的潜在目标。
例如,肠道微生物可以通过羧基酯酶催化双酯型二萜生物碱的C-8和C-14的酯键水解,或催化C-8的酯交换以产生毒性较小的单酯二萜烯生物碱。
大肠杆菌的地高辛还原型菌株含有强心苷还原酶,它可以还原地高辛环上的α和β-不饱和内酯,并将其代谢为活性较低的二氢地高辛,从而抑制其可能的心脏毒性。
地高辛,主要用于心脏类疾病的治疗,对心脏的作用表现为正性肌力作用,减慢心率,抑制心脏传导。
然而,这种能力是有限的,并且50%的地高辛可以通过肠道微生物转化而失活。强心苷还原酶可能是地高辛失活的有效生物标志物,其表达可以被精氨酸抑制。
•饮食可能调节微生物代谢活动
饮食可以解释地高辛还原的个体间差异,并可能调节体内微生物代谢活动。相比之下,有毒化合物可以由肠道微生物产生。桦木素在来自肠道微生物的β-葡萄糖苷酶的作用下水解成致癌性重氮甲烷。
建议
应开发微生物肠道酶的小分子抑制剂,以在这个复杂的栖息地的特定转化中发挥调节作用。肠道微生物群转化的代谢物与前体物质之间的毒性差异值得进一步研究。
此外,过量的药物可能导致肠道微生物失衡和不良反应,不同剂量的天然产物对肠道微生物和新陈代谢的影响也需进一步研究。
考虑到肠道微生物可以增加宿主对药物或天然产物的复杂和可变反应,这一过程值得研究。
生物转化的方法
(1)肠液转化。转化产物的大规模制备可以通过肠液生物转化来实现;
(2)与宿主微生物群的样品一起孵育。原型药物和代谢物的类型和数量可以使用该方法检测。它具有准确表示个体的整个肠道微生物组的优点;
(3)代表性菌株的孵育。该方法具有高通量潜力,这对于大规模药物研究很有价值,并有助于有益代谢物的工业生产。
✦模型分析有利于认识微生物代谢
器官微生理系统,胃肠道类器官的各种预测/计算工具可能有助于提高我们对未来微生物代谢的理解。
此外,在动物模型中已经研究了天然产物代谢与肠道微生物之间的关系,其结果可用于研究代谢物的分布和形式。无菌/抗生素处理的动物与传统动物进行了比较,以证明肠道微生物在天然产物代谢中的关键作用。
这种方法的局限性在于人类和啮齿动物之间存在固有的胃肠道和微生物差异。在临床试验中从受试者收集的粪便进行详细微生物群和代谢物分析可以全面反映天然产物在体内的代谢过程,并用于解释个体差异。
✦增加测序技术的应用
增加测序技术的应用,以研究微生物的转录活性和代谢谱。通过使用单细胞法,可以表征肠道微生物的生理结构,以确定其代谢活性。
转录组测序技术(RNA-Seq)可以直接分析人体肠道中具有强代谢活性的微生物的基因表达谱。
单细胞方法,宏转录组学和宏基因组学的组合已被用于鉴定和表征肠道微生物群的活性亚群,并确定它们对天然产物的代谢反应。
肠道微生物群是编码各种代谢酶的基因库。大多数天然产物的生物活性和潜在健康益处的激活极度依赖肠道微生物作为底物加工工厂。
了解微生物如何独特地调整天然产物以及这些代谢物对宿主健康的影响。已经得出以下结论:
(1)肠道微生物可以改变天然产物;
(2)天然产物可以调节肠道微生物的组成和丰度;
(3)肠道微生物可以介导天然产物的多组分协同作用。
此外,肠道微生物的巨大可塑性和个体间差异是值得注意的。因此,需要提高对肠道微生物对天然产物代谢的生理,化学和微生物贡献的理解,以帮助解释天然产物反应的个体差异,并为个性化治疗提供支持。
确认生物转化中极其参与的象征性功能及其物质基础将有助于探索天然产物与肠道微生物群之间相互作用的治疗模式。
主要参考文献
Zhao Y, Zhong X, Yan J, Sun C, Zhao X, Wang X. Potential roles of gut microbes in biotransformation of natural products: An overview. Front Microbiol. 2022 Sep 29;13:956378. doi: 10.3389/fmicb.2022.956378. PMID: 36246222; PMCID: PMC9560768.
Abookleesh F. L., Al-Anzi B. S., Ullah A. (2022). Potential antiviral action of alkaloids. Molecules 27:903. doi: 10.3390/molecules27030903.
Agatonovic-Kustrin S., Kustrin E., Gegechkori V., Morton D. W. (2020). Anxiolytic terpenoids and aromatherapy for anxiety and depression. Adv. Exp. Med. Biol. 1260, 283–296. doi: 10.1007/978-3-030-42667-5_11.
Al-Ishaq R. K., Liskova A., Kubatka P., Büsselberg D. (2021). Enzymatic metabolism of flavonoids by gut microbiota and its impact on gastrointestinal cancer. Cancers 13:3934. doi: 10.3390/cancers13163934.
Augusti P. R., Conterato G. M. M., Denardin C. C., Prazeres I. D., Serra A. T., Bronze M. R., et al.. (2021). Bioactivity, bioavailability, and gut microbiota transformations of dietary phenolic compounds: implications for COVID-19. J. Nutr. Biochem. 97:108787. doi: 10.1016/j.jnutbio.2021.108787.
Berlinberg A. J., Brar A., Stahly A., Gerich M. E., Fennimore B. P., Scott F. I., et al.. (2022). A novel approach toward less invasive multiomics gut analyses: a pilot study. Microbiol. Spectr. 10:e0244621. doi: 10.1128/spectrum.02446-21.
Bess E. N., Bisanz J. E., Yarza F., Bustion A., Rich B. E., Li X., et al.. (2020). Genetic basis for the cooperative bioactivation of plant lignans by Eggerthella lenta and other human gut bacteria. Nat. Microbiol. 5, 56–66. doi: 10.1038/s41564-019-0596-1.

谷禾健康

疫苗是公共卫生领域最伟大的成就之一,每年可预防数百万儿童疾病和死亡病例。然而,许多疫苗的功效在地理和社会经济不同地区的婴儿之间可能存在很大差异。
有研究发现,肠道微生物组组成的差异已成为解释免疫结果差异的主要因素之一。
在本篇文章中,谷禾总结了各位学者的研究。关于肠道微生物群对生命早期免疫的影响,重点关注微生物群中具有促进健康和免疫调节特性的两个重要成员:双歧杆菌和拟杆菌。
此外还罗列了一些具有免疫刺激特性的微生物产物、与宿主的相互作用以及它们对婴儿疫苗反应和功效的影响。
通过本文,可以让大家更好地了解肠道微生物对免疫接种的影响,让人们更有针对性地选择免疫接种,更好地保护我们的健康。
本文出现的专业名词
疫苗是指用各类病原微生物制作的用于预防接种的生物制品。其中用细菌或螺旋体制作的疫苗亦称为菌苗。疫苗分为活疫苗和死疫苗两种。
常用的疫苗:常用的活疫苗有卡介苗,脊髓灰质炎疫苗、麻疹疫苗、鼠疫菌苗等;常用的死疫苗有百日咳菌苗、伤寒菌苗、流脑菌苗、霍乱菌苗等。
免疫球蛋白(Ig)——指具有抗体活性或化学结构,与抗体分子相似的球蛋白
辅助T细胞(Th细胞)在免疫反应中扮演中间过程的角色:它可以增生扩散来激活其它类型的产生直接免疫反应的免疫细胞
调节性T细胞(Tregs)是维持机体免疫耐受的重要因素之一,通过主动调节的方式抑制存在于正常机体内潜在的自身反应性T细胞的活化与增殖,从而调节机体的免疫力
G蛋白偶联受体(GPCRs)是一大类膜蛋白受体的统称
Toll样受体(TLR)是参与非特异性免疫(天然免疫)的一类重要蛋白质分子,表达在巨噬细胞、树突状细胞和上皮细胞表面,可识别多种类型的病原体相关分子模式或损伤相关分子模式
人类胃肠道微生物群由细菌、病毒、古生菌和真菌组成的复杂群落,其组成沿胃肠道长度变化。
微生物定植在出生时开始,并在整个生命过程中不断变化,生命的前1000天是生态系统结构最脆弱和最不稳定的时期。
✦胃肠道微生物对健康至关重要
胃肠道微生物群有助于粘膜和全身免疫系统的成熟,抵抗病原体定植,消化膳食成分,并提供微量营养素。
胃肠道微生物群的结构和功能紊乱与各种疾病有关,包括代谢紊乱、神经退行性疾病,过敏,自身免疫性疾病,和癌症。
值得注意的是,影响微生物组的因素与影响疫苗免疫反应的因素相似,强调了免疫与胃肠道微生物群之间的相互关系。
在生命早期,影响胃肠道微生物群发育的其他因素是分娩方式,早产,营养(母乳与配方奶),早期使用抗生素或益生菌和卫生等。
✦ 分娩方式对早期微生物群的影响
在出生期间和出生后,婴儿会接触到促进免疫系统成熟的环境抗原和微生物,其性质取决于分娩方式。
●阴道分娩
阴道分娩的婴儿暴露于母体阴道和粪便微生物群中,导致微生物分布以埃希氏菌、乳酸杆菌、拟杆菌和双歧杆菌为主。
●剖宫产分娩
相比之下,剖宫产分娩的新生儿与母体皮肤和医院微生物的接触更多,并且经常被链球菌、葡萄球菌和肠球菌定植。
✦早期用抗生素对免疫系统发育有负面影响
早期使用抗生素治疗会对这种最初的定植和随后的免疫系统发育产生负面影响。这些早期生活障碍会在短期内导致感染风险增加。从长远来看,与免疫和代谢相关疾病(如特应性)的风险增加有关。
因此,在正确的时间由正确的微生物定殖对于有效建立免疫防御和稳态至关重要。
✦母乳喂养对肠道微生物群有益处
母乳喂养提供了抗菌肽、母体抗体和先天免疫因子,它们促进了对新生婴儿的被动保护,并提供了塑造婴儿微生物群的关键膳食成分。
人乳寡糖可增强双歧杆菌的定殖和持久性(占总微生物群落的80%),这在以配方奶喂养的婴儿中不太明显(5-30%)。
人乳寡糖(HMOs)是人类母乳中仅次于乳糖和脂肪的第三大固体成分,有助于预防人类细胞、组织和小鼠中的链球菌感染。
人乳寡糖的微生物代谢导致短链脂肪酸的产生,短链脂肪酸被与膜结合的特定G蛋白偶联受体识别,由免疫细胞在全身和胃肠道中表达,是关键用于发展免疫耐受性。母乳还直接通过母乳微生物组引入微生物,从而进一步播种婴儿肠道。
断奶和从母乳或以配方食品为基础的营养过渡到固体食物推动了胃肠道微生物群的重大变化,双歧杆菌种类减少,并引入了瘤胃球菌、阿克曼氏菌和普雷沃氏菌。
✦疫苗效果存在差异
许多许可疫苗的功效在人群之间存在差异,在某些情况下,转化为几乎没有效果。
许多内在因素导致疫苗反应的这种变异性,包括年龄、遗传(占受者之间变异的 20-40%)、贫血和性别。
此外,广泛的外部因素会极大地影响疫苗接种结果,包括疫苗成分和免疫方案,预先接触病原体和慢性炎症,暴露于母体抗体,营养状况和地理位置等。
✦肠道微生物有助于促进免疫
人们越来越认识到婴儿胃肠道微生物群在疫苗免疫中的作用。胃肠道微生物群已被证明可通过多种机制促进对疫苗的体液和细胞免疫反应的有效刺激。
肠道微生物群的免疫调节
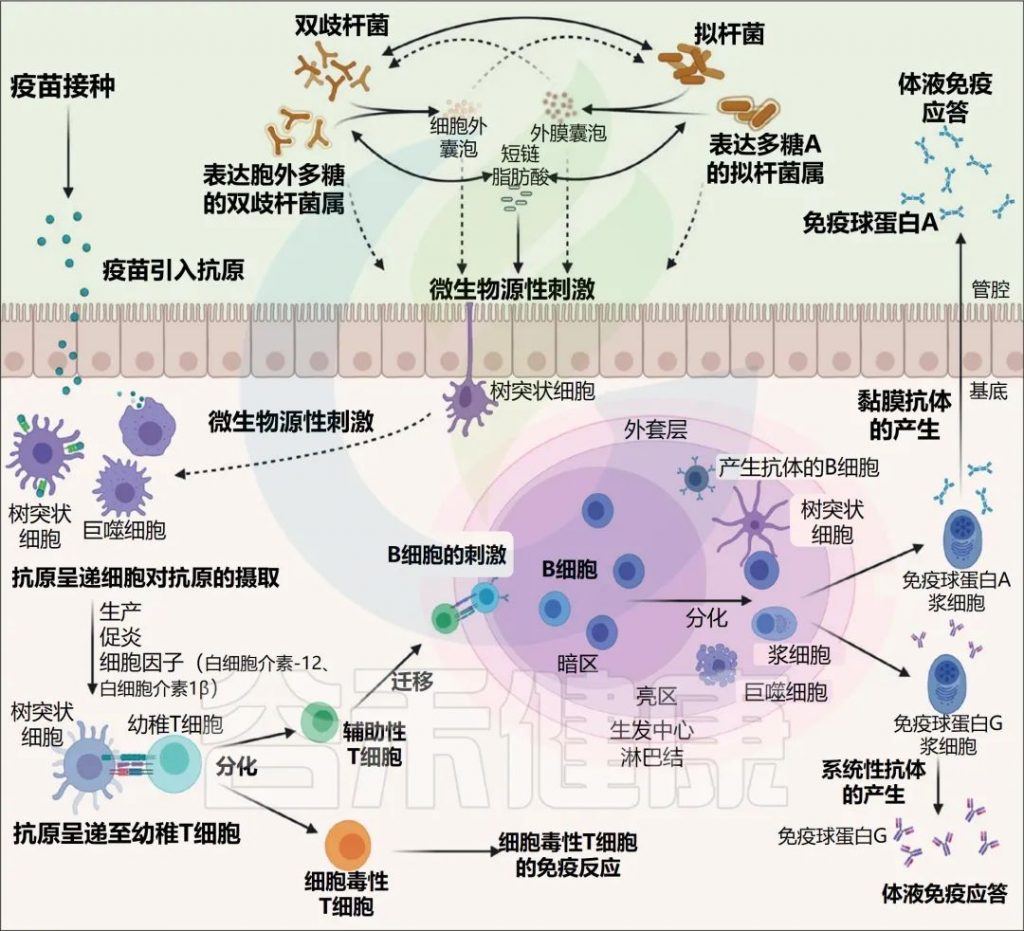

Jordan A,et al.Lancet Microbe.2022
微生物群刺激对于产生免疫球蛋白 (IgA) 的B细胞的发育和成熟、通过促进IgA类别转换的记忆浆细胞以及生发中心的发育至关重要。此外,通过介导浆细胞样树突状细胞产生I型干扰素,微生物群增强了抗原特异性T细胞反应。
肠道微生物群和免疫系统之间的共生关系,以及遗传和环境影响,可以解释个体对疫苗的免疫反应的可变性。
抗生素引起的新生小鼠微生物组紊乱,以及使用免疫缺陷的无菌幼崽,导致对不同佐剂和减毒活疫苗的体液反应受损,其特征是Th1和Th17反应降低,IgG和IgM生产。
注:辅助性T细胞1(Th1)主要为对抗细胞内细菌及原虫的免疫反应。
辅助性T细胞17(Th17)是一种新发现的能够分泌白介素17的T细胞亚群。
IgG是免疫球蛋白G,是免疫球蛋白中的一种,来源于浆细胞,具有抗病毒、抗菌和免疫调节的功能。
IgM是免疫球蛋白M,由于B淋巴细胞在抗原如病毒或细菌等病原微生物等的刺激下转化为浆细胞,产生能与相应抗原发生特异性结合的抗体,而形成免疫球蛋白。
值得注意的是,在通过施用特定的鞭毛大肠杆菌菌株或粪便微生物群转移来恢复微生物群后,这种损害是可逆的。
某些细菌科、属和物种的丰度与人类对疫苗的免疫反应差异有关,无论是正面的还是负面的。
// 不同地区间的研究
对来自加纳、巴基斯坦、孟加拉国和荷兰的接种轮状病毒疫苗的有反应和无反应儿童的微生物谱比较研究表明,与同一队列的无应答者相比,来自不同低收入和中等收入国家的应答者的微生物群组成与荷兰婴儿微生物群更为相似(即梭菌群XI和变形菌的丰度更高,拟杆菌门的数量更低)。
小结
由于胃肠道微生物组在激活和抑制免疫反应以及随后对疫苗免疫的影响方面具有多因素作用,因此研究不同的微生物群调节干预措施以最大限度地提高疫苗效力。
益生元、益生菌和抗生素
益生元——指一些不被宿主消化吸收却能够选择性地促进体内有益菌的代谢和增殖,从而改善宿主健康的有机物质。
益生菌——通过定殖在人体内,改变宿主某一部位菌群组成的一类对宿主有益的活性微生物。
✦益生元和益生菌对疫苗免疫有积极作用
对小鼠接种流感和霍乱疫苗的研究报告表明,不同的益生元与疫苗接种后的全身免疫反应之间存在正相关,与双歧杆菌和乳酸杆菌的丰度增加以及短链脂肪酸的产生有关。
已经研究了它们对疫苗接种反应的影响。系统评价总结了26项使用益生菌对人类进行干预研究的结果,以提高17种不同疫苗的功效,其中一半的研究显示出积极的结果。
婴幼儿使用益生菌效果更好
与成人相比,在新生儿和幼儿(0-16 周龄)中使用益生菌乳酸杆菌和双歧杆菌菌株的试验显示成功率更高,接种流感、白喉、轮状病毒和脊髓灰质炎疫苗后对体液免疫的影响最大。
然而,不同研究(包括使用的细菌菌株)的设计缺乏一致性,因此难以得出可靠的结论。
✦抗生素对疫苗的影响暂不明确
抗生素——指由微生物(包括细菌、真菌、放线菌属)或高等动植物在生活过程中所产生的具有抗病原体或其他活性的一类次级代谢产物,能干扰其他生活细胞发育功能的化学物质。
人体研究调查了抗生素介导的微生物耗竭对流感、脊髓灰质炎、轮状病毒、破伤风和卡介苗免疫反应的影响。没有观察到疫苗免疫原性改善或显著降低,这与抗生素使用、微生物群紊乱和免疫介导疾病的增加有关。
总之,某些细菌种类与婴儿疫苗应答者的体液或细胞免疫呈正相关或直接诱导增强。双歧杆菌是增强疫苗接种反应的良好候选者,也是健康早期肠道微生物群的关键成员。
其他可以刺激先天和适应性免疫反应的核心肠道微生物群成员,如拟杆菌属,也正在成为疫苗研究中的新型微生物群疗法。
扩展阅读:抗生素对微生物组及对人体健康的影响
双歧杆菌和拟杆菌的免疫调节
✦ 双歧杆菌减少炎症
在小鼠肥胖模型中,给予假链状双歧杆菌通过恢复调节性T细胞 (Treg) 和B淋巴细胞的平衡状态来减少全身炎症,并降低促炎细胞因子白细胞介素IL-17A和肿瘤坏死因子TNF的浓度。
白细胞介素——指在白细胞或免疫细胞间相互作用的淋巴因子,它和血细胞生长因子同属细胞因子。两者相互协调,相互作用,共同完成造血和免疫调节功能。
肿瘤坏死因子——血清中出现一种能使多种肿瘤发生出血性坏死的物质。
类似的免疫稳态特性已归因于双歧杆菌菌株,其通过体外刺激树突状细胞,诱导Th17谱并增强Treg细胞从幼稚淋巴细胞的分化。
双歧双歧杆菌DSM 20082裂解物刺激外周T细胞可增加CD8+ T细胞的细胞毒活性,而对CD4+ T细胞活性没有任何影响。
尽管支持这些免疫调节特性的机制尚不清楚,但已经提出了几个目标。
包括膳食发酵产物(例如,在人乳寡糖和其他复合碳水化合物代谢后),导致产生短链脂肪酸(即乙酸盐)和其他代谢副产物,这些副产物直接与宿主免疫细胞受体相互作用并促进其他共生体的交叉喂养细菌,如拟杆菌属和大肠杆菌。
长双歧杆菌亚种产生免疫调节化合物和蛋白质,如细胞外蛇毒蛋白,它不可逆地灭活促炎蛋白酶。
双歧杆菌MIMBb75之前已经证明其表面有肽聚糖水解酶TgaA,它通过启动白细胞介素-2生成和单核细胞衍生的树突状细胞激活,促进调节性T细胞扩增。
●双歧杆菌增强了免疫抗病毒反应
在新生仔猪中,长双歧杆菌AH1206菌株增强了肠道IL-10的产生,而动物双歧杆菌亚种乳酸Bb12、婴儿双歧杆菌MCC12和短双歧杆菌MCC1274促进了免疫成熟和免疫稳态。
更重要的是,MCC12和MCC1274 菌株在接种轮状病毒疫苗后增强了B细胞和抗病毒反应,表明双歧杆菌的免疫改变特征对某些菌株具有特异性。
●放线菌和双歧杆菌对人体免疫反应起促进作用
在人类中,几项研究强调了高丰度放线菌门和某些双歧杆菌菌株与对不同疫苗的免疫反应增加之间的正相关关系。
孟加拉婴儿胃肠道微生物组中高浓度的婴儿长双歧杆菌亚种与CD8+ T 细胞和CD4+ T 细胞反应增加以及接种卡介苗、破伤风和乙型肝炎疫苗后IgG滴度升高相关。
接种卡介苗、破伤风和乙型肝炎疫苗后,IgG滴度更高,在口服脊髓灰质炎疫苗接种后,双歧杆菌丰度高的中国婴儿表现出脊髓灰质特异性IgA应答增加。在疫苗补充研究中,B.longum BB536显示通过诱导干扰素-γ分泌来增强婴儿的Th1反应。
干扰素-γ——免疫干扰素,是由有丝分裂原刺激T淋巴细胞产生的。干扰素是一种高效的抗病毒生物活性物质,又是一种具有广泛免疫调节作用的淋巴因子。
扩展阅读:如何调节肠道菌群?常见天然物质、益生菌、益生元的介绍
✦拟杆菌影响疫苗免疫反应
拟杆菌属是婴儿期肠道定植的主要属,并且在整个成年生活中占主导地位。某些物种和菌株具有重要的互惠作用,从产生抗菌分子到通过分解不同聚糖提供营养。
关于拟杆菌和疫苗的反应性,存在相互矛盾的结果:
在加纳进行的轮状病毒试验发现,疫苗应答与拟杆菌门丰度呈负相关,而对巴基斯坦婴儿的一项类似研究显示,疫苗应答者中拟杆菌门的浓度增加。
观察到尼加拉瓜婴儿的疫苗反应者和无反应者中不同拟杆菌菌株的丰度存在差异。
注:由于样本量小,这些发现在多次调整后没有统计学意义,强调需要进行更大规模的研究来探索这些关联。
考虑到拟杆菌在诱导稳态免疫启动中的突出作用,可以预期拟杆菌和疫苗反应之间存在联系。
Bacteroides thetaiotaomicron中独特的寡糖结构具有佐剂特性,以依赖CD4+ T 细胞的方式诱导由乙型肝炎病毒疫苗引发的乙型肝炎病毒抗原特异性抗体浓度升高,这表明这种寡糖可作为大肠杆菌中毒性更大的脂多糖的替代佐剂。
短链脂肪酸是由肠道微生物群的不同成员通过发酵膳食复合碳水化合物(包括母乳或益生元中的碳水化合物)产生的。
短链脂肪酸在其一元羧酸碳链中含有少于六个碳原子,其中醋酸盐 (C2)、丙酸盐 (C3) 和丁酸盐 (C4) 最为普遍。它们是水溶性的,可以直接被不同的细胞吸收、转运或相互作用,包括肠上皮细胞、交感神经元和免疫细胞。
✦ 短链脂肪酸的多种益处
它们提供许多有益的健康影响,包括肠细胞的能量来源、加强上皮屏障、改变代谢过程、抑制肠道病原体生长、离子吸收的介质,以及作为肠道和全身免疫调节途径中的信号分子。
双歧杆菌和拟杆菌产生的乙酸,以及拟杆菌产生的丙酸盐,将在下面更详细地讲述。
●作为主要能源
乙酸盐可以酶促转化为乙酰辅酶A,并被许多不同的微生物群成员用来生产丁酸盐,并作为三羧酸循环中的主要能源。
●激活调节免疫细胞,增强疫苗反应
T细胞中细胞内乙酰辅酶A的增加会激活mTOR,从而驱动Th1和Th17 T细胞的分化。乙酸盐还可以激活B细胞、T细胞亚群、中性粒细胞、巨噬细胞、树突细胞和肠上皮细胞上表达的G蛋白偶联受体43(GPR43),导致固有层调节性T细胞增殖,和调节自身抗体的产生和边缘区B细胞。
mTOR是一种丝氨酸/苏氨酸蛋白激酶,对激素、生长因子、营养物质,能量和压力信号做出反应,是细胞代谢,生长和存货的中心调节因子。
GPR43的激活影响中性粒细胞趋化性和脱粒,以及脂肪组织中巨噬细胞产生肿瘤坏死因子。此外,缺乏GPR43的树突细胞无法诱导B细胞的类别转换。
没有产生短链脂肪酸的胃肠道细菌的小鼠的浆细胞分化减少,并且在稳态和病原体特异性抗体反应方面存在缺陷。乙酸盐可通过在体外增强针对霍乱毒素的抗原特异性IgA和IgG的产生以及刺激浆细胞分化所必需的树突状细胞中的信号分子来增强疫苗反应。
●改变巨噬细胞浓度
丙酸盐诱导小鼠调节性T细胞的分化和增殖以及白细胞介素10的表达。丙酸盐激活GPR15和GPR43还通过降低组蛋白去乙酰化酶6和9的表达以及抑制 NF-κB信号传导来增加结肠调节性T细胞的浓度。
丙酸盐激活GPR41会改变骨髓造血功能,导致巨噬细胞和树突状细胞前体浓度升高,并扭曲Th2分化。
✦短链脂肪酸是流感疫苗的潜在佐剂
一项调查短链脂肪酸对甲型流感病毒感染影响的研究揭示了短链脂肪酸(包括丙酸盐)通过激活GPR43来限制感染严重程度和伴随的肺炎球菌二重感染的重要作用。
GPR43被认为是甲型流感病毒进入的辅助受体
这意味着短链脂肪酸与该受体的结合抑制了病毒的进入和复制,这表明流感疫苗具有潜在的佐剂特性。
扩展阅读:你吃的膳食纤维对你有帮助吗?
胞外多糖是一些特殊微生物在生长代谢过程中分泌到细胞壁外、易与菌体分离、分泌到环境中的水溶性多糖,属于微生物的次级代谢产物。
胞外多糖是单糖或寡糖簇,包括形成同多糖或杂多糖的葡萄糖、果糖、半乳糖、岩藻糖和鼠李糖。
✦改变代谢物环境浓度,提供保护
这些可以分泌到肠道环境中或与亲本细菌的细胞壁有关。胞外多糖的表达增强了对宿主细胞的粘附,提供了对消化和环境压力的保护,并促进了生物膜的形成和胃肠道中的长期定植。
来自不同双歧杆菌菌株的胞外多糖可以被其他微生物发酵,从而改变代谢物环境和短链脂肪酸浓度。胞外多糖可以通过巨噬细胞和树突状细胞表面表达的特定模式识别受体(如TLR1、TLR2或TLR6)被识别为微生物相关的分子模式。
✦促进抗炎反应
受体的激活,取决于胞外多糖的化学物理特性(例如,分子量或电荷),导致产生不同的促炎和抗炎细胞因子谱,并以菌株特异性方式分别分化幼稚T细胞。
脆弱拟杆菌的表面多糖A可激活巨噬细胞上的Toll样受体2,并诱导调节性T细胞的扩增和抗炎白细胞介素10的产生,从而在病毒感染期间促进强烈的抗炎反应。
TLRs是一种模式识别受体家族,在先天免疫反应中起着重要作用。
✦增强对病毒的抵抗力
此外,多糖A激活结肠树突状细胞的Toll样受体2和肿瘤坏死因子分泌,增强了对病毒感染的天然抵抗力。
来自长双歧杆菌BCRC14634的胞外多糖被证明可增强巨噬细胞产生白细胞介素,与同基因的胞外多糖阴性突变体相比,来自B.longum亚种longum 35624的胞外多糖显示通过抑制促炎细胞因子产生来抑制促炎性Th17细胞的扩增。
在某些情况下,胞外多糖的存在与免疫沉默效应和逃避适应性B细胞反应有关,如在短双歧杆菌UCC2003中观察到的。
此外,这种双歧杆菌菌株和胞外多糖的存在也与较低丰度的促炎IFN-γ、肿瘤坏死因子和IL-12相关。
研究表明,青春双歧杆菌IF1-03通过增加巨噬细胞分泌IL-10来增加抗炎免疫反应,增加调节性T细胞浓度,这需要通过细胞外信号调节激酶或丝裂原活化蛋白激酶和NF-κB途径激活Toll样受体2和信号转导。
值得注意的是,在青春芽孢杆菌IF1-11产生的胞外多糖的情况下观察到相反的效果,它模拟巨噬细胞分泌高浓度的促炎性白细胞介素6、白细胞介素-17A 和转化生长因子-β,以及少量的白细胞介素10,随后将T细胞偏向Th17细胞。
转化生长因子-β(TGF-β)是属于一组新近发现的调节细胞生长和分化的TGF-β超家族
小结
这些研究展现了依赖于菌株的胞外多糖的免疫调节能力。以前使用乳酸杆菌的工作衍生的胞外多糖表明它们可以作为新型疫苗佐剂。因此,在特定疫苗接种后需要进一步测试关注拟杆菌和双歧杆菌相关胞外多糖的作用。
细菌细胞外囊泡是球形的膜衍生结构,大小从10纳米到 400 纳米不等,其中包含来自母细胞膜和周质的各种成分。
✦功能和分布
根据其膜组成和结构进行区分,其含量受环境因素(如培养条件或营养胁迫)的影响。这种影响可能导致DNA、RNA、脂多糖、酶、肽聚糖、毒素、信号分子、代谢物和毒力因子的数量和质量差异。
细菌细胞外囊泡并不局限于胃肠道,并且已在血液中检测到,它们可以从那里轻松进入不同的组织,包括大脑。
一项研究详细概述了不同的细菌膜外囊泡、它们的特性、功能和潜在应用。由共生细菌产生的细菌膜外囊泡有助于复杂微生物群落成员之间的合作和共养相互作用,并作为胃肠道微生物群成员与宿主之间跨界串扰的中介。
✦促进免疫反应
细菌细胞外囊泡可以激活免疫细胞并促进针对囊泡本身和亲代细胞的免疫反应。
膜脂、蛋白质(包括与微生物相关的分子模式)、危险信号和胞外多糖可以结合并激活模式识别受体和toll样受体,触发上皮细胞以外的不同免疫反应。
来自脆弱拟杆菌的囊泡携带荚膜多糖A,它激活黏膜下树突状细胞上的Toll样受体2,细胞外囊泡随后以肌动蛋白依赖性方式内化,导致白细胞介素10浓度增加和T细胞极化偏斜向调节性T细胞分化。
发现表明源于拟杆菌的胞外囊泡以物种特异性的方式在人类粘膜和血液树突状细胞中诱导白细胞介素10依赖性免疫调节反应。
✦为疫苗提供了多种可能性
细菌细胞外囊泡的非复制性及其内在的佐剂性、热稳定性以及对低pH值和酶降解的抵抗力,为疫苗设计和交付提供了多种可能性。
它们可以在不注射的情况下直接给药至粘膜部位(例如胃肠道和呼吸道),从而降低给药成本并降低与肠外分娩相关的潜在不良反应的风险。
此外,含有免疫原性成分的细菌细胞外囊泡可以促进强烈的先天性和适应性免疫反应,并提供大量针对传染病的保护。
✦呈递抗原,降低毒性
来自病原菌的细菌细胞外囊泡已成功用于疫苗制剂,一些针对霍乱弧菌和B Neisseria meningitidis的细胞外囊泡疫苗已获得许可,其中B Neisseria meningitidis疫苗显示出针对淋球菌的潜在跨物种保护作用。
其他研究表明,由微生物群成员产生的细菌细胞外囊泡,包括生物工程细菌细胞外囊泡,已被用于传递病原体的抗原。
源于拟杆菌的、表达不同鼠疫耶尔森菌抗原的细菌细胞外囊泡在体内诱导了特异性和强免疫反应,包括血清IgG和粘膜IgA,它们能够清除鼠疫感染。
来自突变的非致病性大肠杆菌的细菌细胞外囊泡对抗原特异性T细胞反应具有佐剂特性,并降低了毒性。
人类肠道微生物群正在成为疫苗反应性的重要决定因素,其中双歧杆菌和拟杆菌能够影响免疫和个体疫苗免疫反应。
这两个属是发育中的健康婴儿肠道微生物群的重要组成部分,但极易受到早期生活干扰的影响,例如剖腹产、配方奶与母乳以及抗生素的使用。
专注于这些促进健康的菌群,并利用它们的免疫调节特性,可能会导致更安全的方法来增强婴儿免疫力和疫苗效力。使用整个细菌或其产物和代谢物来调节免疫反应的新策略是可能的,例如在癌症中观察到对免疫检查点抑制剂的反应增强。
未来展望
对来自健康婴儿微生物组的关键菌株及其副产物和代谢物有更深入的了解和表征,可以催生新一代安全、无针和经济的疫苗促进疗法。关键特征,如剂量、疫苗设计和给药时间,将是重要的考虑因素。
主要参考文献:
Jordan A, Carding SR, Hall LJ. The early-life gut microbiome and vaccine efficacy. Lancet Microbe. 2022 Sep 8:S2666-5247(22)00185-9. doi:
10.1016/S2666-5247(22)00185-9. Epub ahead of print. PMID: 36088916.
Praharaj I, John SM, Bandyopadhyay R, Kang G.
Probiotics, antibiotics and the immune responses to vaccines.Philos Trans R Soc Lond B Biol Sci. 2015; 37020140144.
Ciabattini A, Olivieri R, Lazzeri E, Medaglini D.
Role of the microbiota in the modulation of vaccine immune responses.Front Microbiol. 2019; 101305.
Hill DL, Carr EJ, Rutishauser T, et al.Immune system development varies according to age, location, and anemia in African children.Sci Transl Med. 2020; 12eaaw9522.
Parker EPK, Bronowski C, Sindhu KNC, et al.Impact of maternal antibodies and microbiota development on the immunogenicity of oral rotavirus vaccine in African, Indian, and European infants.Nat Commun. 2021; 127288.
谷禾健康
Phascolarctobacterium,考拉杆菌属,专性厌氧和革兰氏阴性细菌,可产生短链脂肪酸,包括乙酸盐和丙酸盐,并可能与宿主的代谢状态和情绪有关,在人体胃肠道大量定植。
每个人都有可能具有与其他人不同的个体特异性微生物遗传成分,并且可能从童年到成年持续存在。Phascolarctobacterium属物种在较长的时间内显示出相对较高的个体内稳定性。一项调查中国南方1-80 岁健康个体研究发现,随着年龄的增长(1至60岁),该菌数量逐渐增加,维持在高水平,但随着年龄继续增加,老年人(> 60岁)的其数量反而减少)。
来自梅奥临床医学中心的研究人员研究发现比较容易减肥的人体肠道内考拉杆菌属水平较高。该菌除了减肥同时也是肠道菌群动态平衡的关键调节因素。
Phascolarctobacterium 多形棒状杆菌,0.5 × 2.0 µm 至 0.5 × 5 –20 µm。在琥珀酸的存在下,小棒会变成带有多个分支的细长和碎片状的棒。革兰氏染色阴性、不运动、不形成孢子的化学有机营养物。丙酸是琥珀酸发酵的主要终产物。富马酸盐抑制其生长。在 30–37°C 时生长最快。
系统发育上属于韦荣菌科,厚壁菌门。到目前为止, Succiniclasticum ruminis是最近的系统发育邻居。
DNA G + C 含量(mol %):41.4–42.3 ( Tm )
主要存在于人体肠道内,我们根据谷禾数据库认为其是基石核心菌。
目前报告的3个物种如下:
Phascolarctobacterium faecium
Phascolarctobacterium succinatutens
Phascolarctobacterium wakonense
其中,Phascolarctobacterium faecium (P. faecium)最早是从以有毒桉树叶为食的动物考拉中分离出来的,它可能与肠道菌群的解毒有关。因此,P. faecium可能在人体胃肠道中发挥有益作用。该菌种是一种专性厌氧和革兰氏阴性细菌,不形成孢子、不运动、分解酶,属于厚壁菌门。
它在普通琼脂上生长不良,但在培养基中添加琥珀酸盐可促进其生长。表明其利用生长需要琥珀酸。
虽然在人类胃肠道的样本中经常检测到与P. faecium密切相关的未培养菌落,但文献中尚未描述从人类胃肠道中分离出Phascolarctobacterium和扩大培养物,从而限制了Phascolarctobacterium faecium相关的功能研究和临床应用。
Phascolarctobacterium wakonense从普通狨猴 (Callithrixjacchus) 粪便中分离出,他们不仅利用了琥珀酸,还利用了丙酮酸。补充丙酮酸后,他们同时产生丙酸和乙酸,而琥珀酸仅产生丙酸。
肠道菌群的遗传特异性可用来做宿主的“微生物指纹”。
研究发现人体肠道菌群的遗传特征比其相对丰度更具有个体特异性。其中Phascolarctobacterium succinatutens 的鉴别准确率达到了88%。
饮食模式
一项调查中国南方1-80 岁健康个体研究发现,随着年龄的增长(1至60岁),该菌数量逐渐增加,维持在高水平,但随着年龄继续增加,老年人(> 60岁)的其数量反而减少。作者指出这种现象可能与饮食习惯有关。
考拉杆菌属专注于利用其他细菌产生的琥珀酸盐,同时,琥珀酸的主要生产者拟杆菌属和副拟杆菌属的丰度因高脂饮食而增加,并且与体重呈正相关。
老年人和1岁以下个体消耗的脂肪相对较少,体重相对较低,这可能导致拟杆菌属和副拟杆菌属减少,可用于考拉杆菌属的琥珀酸盐减少。
已发现体重和脂肪量与Phascolarctobacterium丰度呈负相关,因此可以帮助预测肥胖风险。
与年轻人相比,老年人群的体育锻炼较少,这可能是Phascolarctobacterium减少的另一个原因。
高脂饮食组富含拟杆菌属和Phascolarctobacterium,在人体肠道微生物群中,拟杆菌属产生乙酸和琥珀酸作为主要代谢产物。琥珀酸在肠道中的过量积累会导致腹泻,而利用琥珀酸的细菌的存在可能对人类有益。因此,Phascolarctobacterium可能和拟杆菌,尤其Bacteroides thetaiotaomicron(常栖息在人类肠道中,能够消化多糖)等菌存在共生。
此外,除了Phascolarctobacterium,研究发现高脂肪饮食更有可能导致大量产生丙酸和乙酸的细菌物种,如奇异变形杆菌(Proteus mirabilis)和韦荣氏球菌 (Veillonellaceae)。
含淀粉类食物、谷物和奶制品,与较高的Phascolarctobacterium 相对丰度。
一些小样本证据显示:
菊粉、岩藻多糖、中等剂量木糖醇可以增加Phascolarctobacterium 的丰度,但是低聚果糖的补充会降低Phascolarctobacterium。
此外,小檗碱和二甲双胍可以显着增加这种菌,这反过来可能有助于这两种药物对宿主的有益作用。
与其他菌互作
人体肠道中存在多种微生物,其中一些被认为是相互作用的。大多数这些相互作用涉及细菌代谢物。考拉杆菌属Phascolarctobacterium几乎不用碳水化合物进行生长,而是使用琥珀酸盐作为底物。研究发现Bacteroides thetaiotaomicron产生的琥珀酸支持Phascolarctobacterium菌的生长和伴随的通过琥珀酸途径产生丙酸。
丙酸生产的三种不同生化途径包括琥珀酸、丙烯酸酯和丙二醇途径。拟杆菌属拥有琥珀酸途径,该途径也存在于Phascolarctobacterium。然而,由于缺乏延胡索酸还原酶,推测P. faecium JCM 30894 无法产生琥珀酸,这是琥珀酸途径的关键代谢物。因此,与产生琥珀酸的细菌(如拟杆菌属)共存对于考拉杆菌属是必不可少的。
此外,从琥珀酸到丙酸的转化反应之一涉及甲基丙二酰辅酶 A 变位酶,它需要维生素 B12 。Bacteroides thetaiotaomicron 一些菌株缺乏维生素 B族 所需的上游基因12生物合成。
此外,发现Phascolarctobacterium与颤螺菌属一般呈正相关。
在一项对 314 名中国健康青年样本的队列研究中,9 个核心属中的 8 个,包括Blautia、Clostridium、Ruminococcus、Faecalibacterium、Subdoligranulum、Roseburia、Coprococcus、Bacteroides,彼此之间呈显著正相关,而核心属Phascolarctobacterium与其他八个核心属呈负相关。综合谷禾数据库和相关研究结果:

环境条件
考拉杆菌属(Phascolarctobacterium),这些细菌与他们的种族/地理和生活方式有关。通过对来自9个省份与自治区、7个民族的20个健康年轻人群的314名居民粪便进行16SrRNA测序,发现厚壁菌门、拟杆菌门、变形杆菌门和放线菌门是4种最主要的细菌门,其中,来自厚壁菌门的考拉杆菌属在人群中丰度占比较高。
人体肠道微生物群是可塑的,与周围环境密切相关。医务人员在日常工作中不断与患者接触,并暴露于医院环境中,这种高风险的接触与暴露使很多病原微生物成为医务人员手部微生物群的一部分而被携带。
万献尧教授团队2021年发表在《Clin Microbiol Infect》上的研究评估了医务人员与非医疗人员肠道微生物组的变化。与非ICU工作人员相比,ICU工作人员肠道内Phascolarctobacterium丰度显著增加。
疾病状态
而与健康人相比,早期肝癌患者中,考拉杆菌属(Phascolarctobacterium)和瘤胃球菌属(Ruminococcus) 明显减少。
在重度抑郁、阿尔茨海默病(AD)、自闭症等疾病中发现Phascolarctobacterium高富集,尽管疾病组内异质性也较高,因此,有必要开展大人群队列和临床验证该菌对于神经类疾病的发生和发展贡献情况。
在参与一项小型研究的复发缓解型多发性硬化症(RRMS) 患者中确定了肉类消费与其如何影响肠道细菌、免疫细胞谱和新陈代谢之间的关系。发现许多与多发性硬化症和多发性硬化症患者残疾严重程度与肠道4种细菌产气柯林氏菌、Coprococcus come、Phascolarctobacterium succinatutens、Sutterella wadsworthensis呈正相关。
Phascolarctobacterium属的减少与结肠炎症的存在有关。
阻止艰难梭菌定植
宿主免疫在肠道微生物群介导的对艰难梭菌感染 (CDI) 的定植抗性中发挥重要作用。研究发现人类微生物群相关小鼠中的 IL-22 信号传导调节宿主糖基化,这使得消耗琥珀酸的细菌Phascolarctobacterium 能够生长。在肠道微生物群中,Phascolarctobacterium降低了琥珀酸的可用性,这是艰难梭菌生长的关键代谢物,因此阻止了艰难梭菌的生长。
Phascolarctobacterium有助于肺癌的免疫治疗
免疫检查点阻断(ICB),特别是PD1/PDL1轴的阻断,为非小细胞肺癌(NSCLC)的治疗开辟了新的标准。然而,尽管临床护理取得了重大进展,但许多患者仍然对这些疗法无效。PD-L1 表达和肿瘤突变负荷等生物标志物与 ICB 疗效相关。Phascolarctobacterium在具有临床益处的患者中富集,并与延长的无进展生存期相关,而Dialister在进展性疾病患者中的代表性更高,其较高的相对丰度与无进展生存期和总生存期降低相关,具有独立的预后价值多变量分析。
有助于减肥
研究发现,比较容易减肥的人体肠道内考拉杆菌属(Phascolarctobacterium)水平较高,因此该菌也用来预测肥胖指标。而难以减肥的人体内则小类杆菌属(Dialister)水平较高。此外,在代谢综合征女性中观察到的Phascolarctobacterium属的丰度高于代谢综合征男性。
无论健康的核心细菌是如何定义的,以及群体研究中的鉴定结果有多么不同,可以肯定的是,普遍和优势的核心细菌对于宿主肠道稳态和健康至关重要。因此,重要的是发现一个全面的核心微生物群概况,以定义健康的肠道微生物群并指导它们对宿主健康的干预。
考拉杆菌属作为我们东方人肠道的核心菌属 ,其丰度高低对于维持健康和情绪等非常重要,后续期待更多关于该菌的深入研究信息。
主要参考文献:
Wu F, Guo X, Zhang J, Zhang M, Ou Z, Peng Y. Phascolarctobacterium faecium abundant colonization in human gastrointestinal tract. Exp Ther Med. 2017;14(4):3122-3126. doi:10.3892/etm.2017.4878
Watanabe Y, Nagai F, Morotomi M. Characterization of Phascolarctobacterium succinatutens sp. nov., an asaccharolytic, succinate-utilizing bacterium isolated from human feces. Appl Environ Microbiol. 2012 Jan;78(2):511-8. doi: 10.1128/AEM.06035-11. Epub 2011 Nov 11. PMID: 22081579; PMCID: PMC3255759.
Ogata Y, Suda W, Ikeyama N, Hattori M, Ohkuma M, Sakamoto M. Complete Genome Sequence of Phascolarctobacterium faecium JCM 30894, a Succinate-Utilizing Bacterium Isolated from Human Feces. Microbiol Resour Announc. 2019;8(3):e01487-18. Published 2019 Jan 17. doi:10.1128/MRA.01487-18
Bhandarkar NS, Mouatt P, Majzoub ME, Thomas T, Brown L, Panchal SK. Coffee Pulp, a By-Product of Coffee Production, Modulates Gut Microbiota and Improves Metabolic Syndrome in High-Carbohydrate, High-Fat Diet-Fed Rats. Pathogens. 2021 Oct 22;10(11):1369. doi: 10.3390/pathogens10111369. PMID: 34832525; PMCID: PMC8624503.
Zheng YH, Xu Y, Ma HX, Liang CJ, Yang T. Effect of High-Fat Diet on the Intestinal Flora in Letrozole-Induced Polycystic Ovary Syndrome Rats. Evid Based Complement Alternat Med. 2021 Jun 25;2021:6674965. doi: 10.1155/2021/6674965. PMID: 34257691; PMCID: PMC8257354.

谷禾健康


↑出现以上症状,可能是身体缺乏蛋白质的信号。
★ 蛋白质有多重要?
蛋白质不仅是构建人体组织的主要原料,而且对新陈代谢至关重要。膳食蛋白质及其代谢产物氨基酸是人类的必需营养素。
蛋白质提供能量,调节代谢;我们的皮肤、骨骼、毛发都有它的参与;当然免疫系统也少不了它。
★ 肠道菌群参与蛋白质代谢
肠道微生物群介导蛋白质代谢和宿主免疫反应之间的相互作用,在代谢过程中发挥重要作用。
小肠细菌能代谢部分氨基酸,进而影响宿主整体氨基酸的代谢。大肠拥有更丰富的菌群和更长的蠕动时间。
一方面,进入大肠的氮营养素会影响大肠菌群的代谢和群落结构;另一方面,大肠菌群也能广泛参与氮营养素的代谢与利用,生成许多代谢产物,进而影响人体健康。
因此,本文详细讨论蛋白质对人体的影响,肠道菌群与蛋白质的相互作用,肠道微生物群代谢产物的影响,文末有人体对蛋白质的需求量及相关食物补充说明。
我们先来看一下蛋白质的消化分解过程。
蛋白质的消化分解
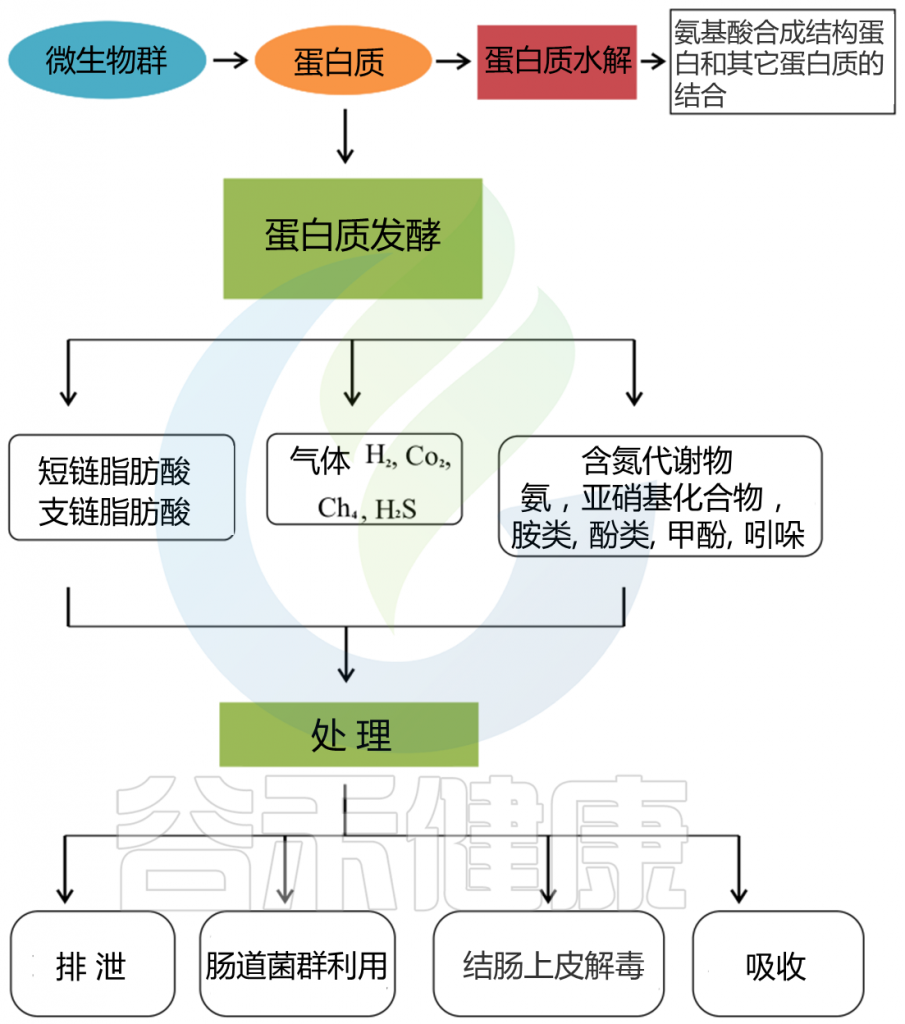
小肠上皮细胞消化膳食蛋白质,然后吸收氨基酸和肽是一个高效的过程。高可消化的蛋白质可能部分逃脱小肠的消化,大量的含氮物质可能从小肠转移到大肠。未消化的蛋白质和多肽通过肠道微生物和残留的胰腺蛋白酶进行蛋白水解,产生大量的微生物代谢物。
胃肠道中的蛋白质分解代谢物
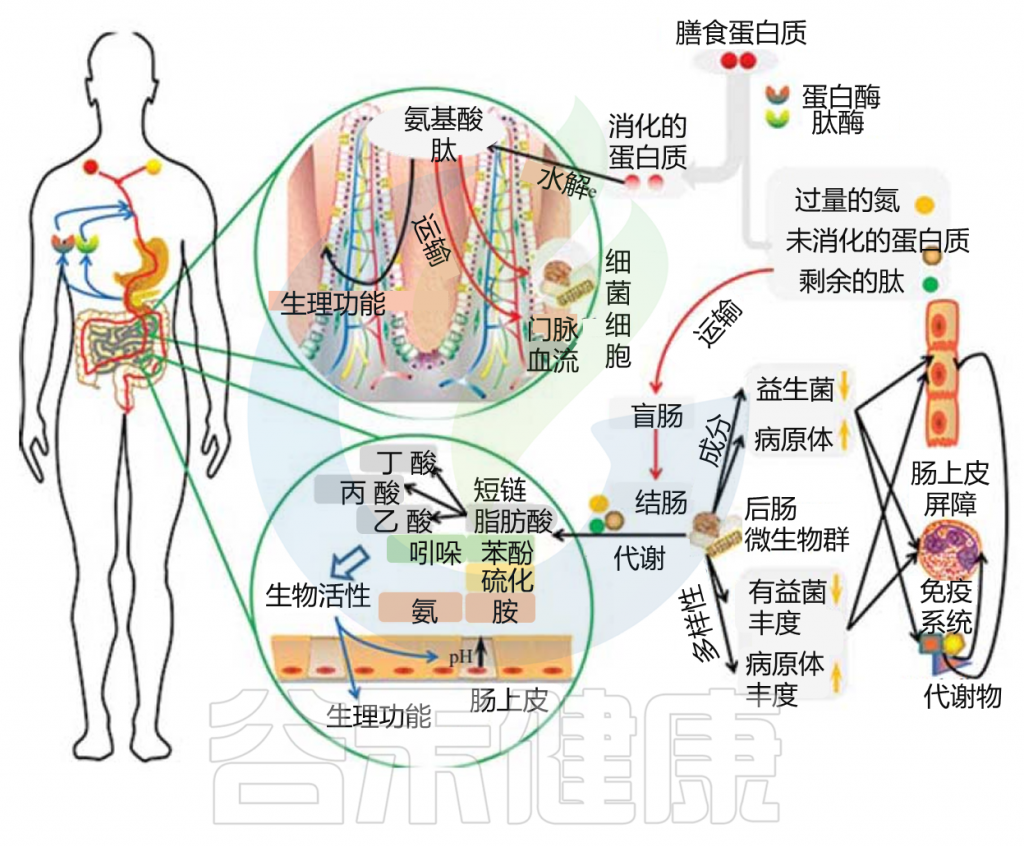

Zhao J, et al., Curr Protein Pept Sci. 2019
这些微生物代谢物中有些是中间产物,有些是最终产物。大量的最终产物主要是短链脂肪酸、氨、多胺、硫化氢、酚类和吲哚类化合物。
这些细菌代谢物中的一些可以被运输到结肠细胞,并根据其在腔内的浓度对这些上皮细胞产生有益或有害的影响。一些细菌代谢产物被输送到门脉血,对肝脏和周围器官组织产生各种生理作用(这些代谢物在健康中发挥的作用详见本文后面章节)。
肠道微生物群在膳食蛋白质分解代谢中作用
宿主饮食对肠道微生物群的分布和活性有很大影响。膳食蛋白质或氨基酸调节可作为调节发酵细菌的一种方法。
在研究不同动物蛋白质来源(牛肉、鸡肉和鱼类)对人类粪便微生物群的影响的研究中,与牛肉蛋白孵育2天后,产气荚膜梭菌的数量显著增加,双歧杆菌的数量显著减少。
微生物分泌的酶直接降解分解蛋白
肠道微生物群在促进氨基酸调节以及氨基酸消化和吸收过程中的分泌方面起着至关重要的作用。
蛋白质的转换主要发生在肠道中,结肠细菌降解内源性或外源性蛋白质的效率较高。
拟杆菌属(Bacteroides)、梭状芽胞杆菌属(Clostridium)、丙酸杆菌属(Propionibacterium)、梭杆菌属(Fusobacterium)、乳酸杆菌属(Lactobacillus)和链球菌属(Streptococcus)在蛋白质水解过程中发挥着重要作用。
粪便微生物群与结肠微生物群具有不同的蛋白水解活性。粪便微生物的活性仅在球状蛋白质的蛋白质水解方面较高。
发酵过程中,复杂蛋白质首先被各种细菌肽酶、蛋白酶和内肽酶切割,释放出游离氨基酸和短肽。氨基酸和短肽然后进行发酵。蛋白质发酵产生支链脂肪酸(2-甲基丁酸酯、异丁酸酯、异戊酸酯)、有机酸、气体(H2和CO2)以及微量酚、胺、吲哚和氨。
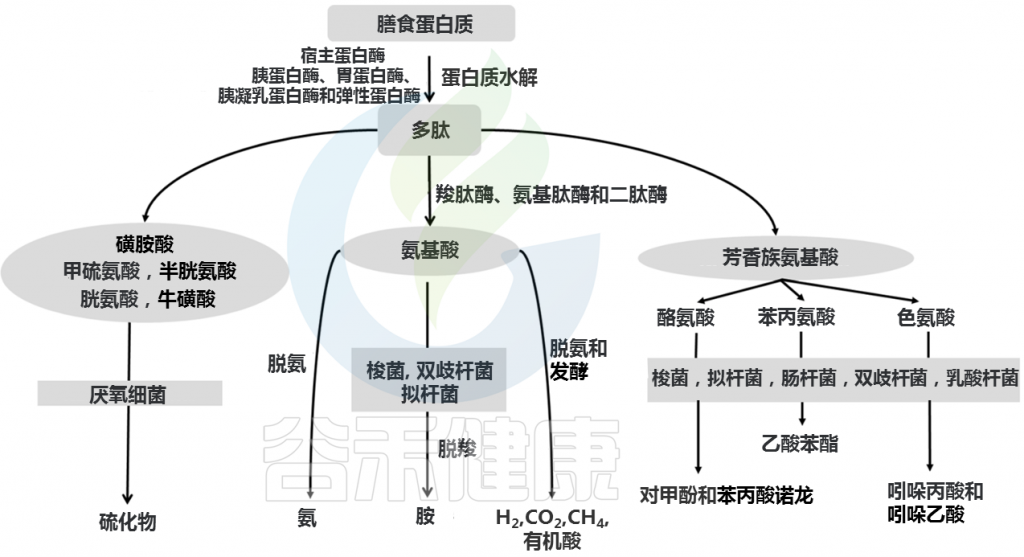

Yadav M, et al., Arch Microbiol. 2018
肠道微生物参与氨基酸代谢
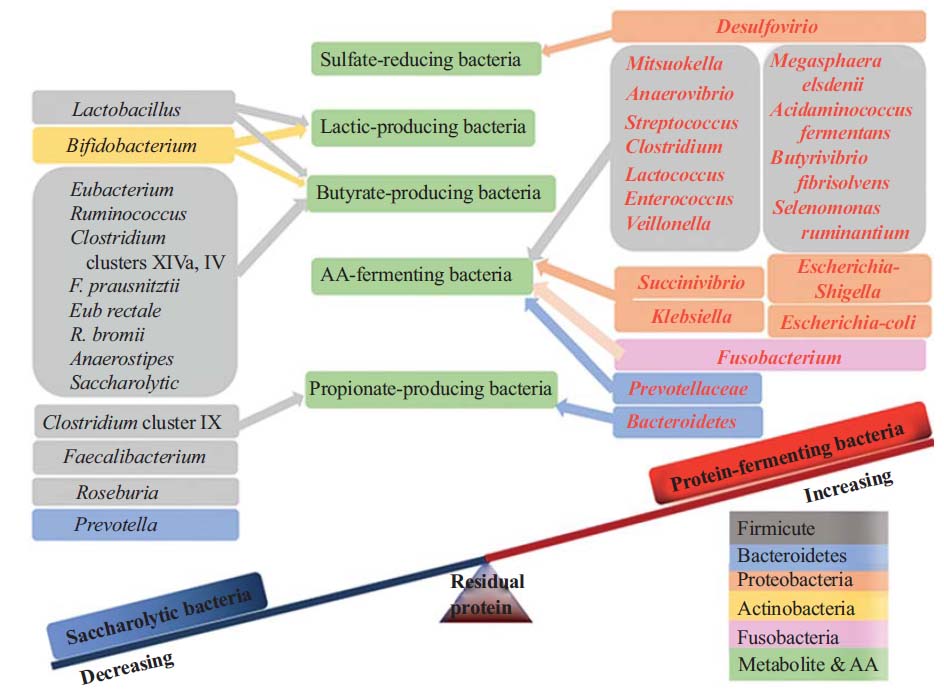
一些菌群可能在肠道中的氨基酸代谢中发挥重要作用,例如梭杆菌属、拟杆菌属和韦荣球菌,Megasphaera elsdenii, Selenomonas ruminantium.
肠道内的梭菌属细菌(赖氨酸或脯氨酸利用的基础细菌)是氨基酸发酵的关键驱动因素,而消化链球菌属细菌是谷氨酸或色氨酸利用的关键驱动因素。
其他例如瘤胃细菌,Selenomonas ruminantium, Megasphaera elsdenii, Prevotella ruminicola, Misuokella multiacidas, Butyrivibrio fibrisolvens, Streptococcus bovis等含有极为活跃的二肽基肽酶和二肽酶。
微生物从头合成氨基酸
肠道微生物群在产生氨基酸方面也起着关键作用,这包括从头生物合成。
例如,一些体外研究项目表明,瘤胃细菌种类,如Streptococcus bovis,Selenomonas ruminantium, Prevotella bryantii,在生理肽浓度存在的情况下参与氨基酸的从头合成。

Lin R, et al., Amino Acids. 2017
体内研究还表明,微生物衍生的赖氨酸(一种必需氨基酸)被吸收并并入宿主蛋白质。在无菌和常规化大鼠体内,将15NH4CL中的15N并入赖氨酸的比较表明,检测到的所有15N赖氨酸均来自微生物来源。在后续研究中,这些研究人员确定约75%的微生物15N标记的赖氨酸被小肠吸收。
此外,其他体内研究项目表明,微生物衍生的赖氨酸被吸收并整合到宿主蛋白质中。与动物研究相一致,六名健康男性的样本以15NH4Cl的形式口服15N与标记肠道微生物来源的微生物蛋白和苏氨酸有关,这些微生物来源存在于活体门静脉血流中。
对18岁以上的人样本进行了检查,这些人被提供了氮充足的饮食,并发现微生物衍生的赖氨酸和苏氨酸对游离血浆赖氨酸和苏氨酸库有显著贡献。
此外,Gill等人报告说,大肠中微生物群的富集是通过与必需氨基酸(EAA)生物合成相关的基因进行的,该生物合成基于人血浆池产生的前体。
蛋白质或氨基酸摄入对肠道微生物的影响
膳食蛋白质是均衡饮食的重要组成部分。人类无法合成多种氨基酸,因此这些氨基酸必须从食物中获取以维持健康。胃肠道微生物群组成和功能的差异可能是由于膳食蛋白质的变化。
进入结肠的蛋白质量和尿液中检测到的发酵代谢物量取决于蛋白质的消化率,蛋白质消化由蛋白质水平和来源的共同作用决定。
当进展到结肠的远端部分时,碳水化合物被消耗,pH值增加,蛋白质发酵变得更加有效。在消化过程中,蛋白质摄入量的增加总是与消化率的相对降低有关,通常会导致更多可发酵的大量营养物质进入结肠。
不同形式蛋白对肠道微生物群影响不同
蛋白质来源主要来自植物或动物来源,每种类型都具有独特的消化率和不同的降解模式,具体取决于所涉及的微生物。结肠中的细菌属参与蛋白质代谢,主要包括可能致病的拟杆菌属、大肠杆菌属和梭菌属。抑制这些潜在病原体通常与通过减少肠毒素和有害微生物代谢物的释放来恢复微生态系统平衡有关。
考虑到蛋白质来源在消化中的作用,动物来源的蛋白质,如乳品和动物蛋白的消化率普遍高于植物蛋白。然而,酪蛋白的热分解显著降低了蛋白质的消化率,增加了蛋白质的发酵程度。下面就详细来看蛋白质来源如何调节肠道微生物群。
植物蛋白
与动物蛋白相比,植物蛋白通常具有较低的蛋白质消化率,因为植物细胞壁不能消化。大豆和花生蛋白都在调节肠道有益细菌组成方面有积极的作用。
添加20%花生蛋白的饲粮改变了大鼠肠道菌群多样性,增加了双歧杆菌,降低了肠杆菌和产气荚膜梭菌的数量。增加的双歧杆菌有助于产生更多的微生物代谢物,包括乙酸和乳酸,导致肠道pH值降低,抑制有毒代谢物,如胺和苯并吡咯。
大豆已被广泛应用于人类和动物,它可以改变肠道微生物的组成,增加了埃希氏杆菌属和丙酸杆菌。系统发育分析显示,埃希氏杆菌属与志贺菌的同源性最高,两者都能在不损害肠道黏膜的情况下调节盐和水的代谢。但大豆中含有的抗营养因子会对生产性能产生负面影响,限制了其在非反刍动物中的应用。
植物蛋白被用于动物饲料行业,因为它的价格普遍低于动物蛋白,并且在食品安全方面具有一些优势。
动物蛋白
与植物蛋白相比,动物蛋白对于牲畜来说是高度易消化的。酪蛋白、脱脂奶粉和鱼粉通常用作猪的饲料,它们可以被消化成丰富的蛋白质底物并在到达大肠之前被吸收。这些动物蛋白的代谢特性有利于宿主健康,特别是,对环境应激导致仔猪断奶后腹泻的预防作用及一些植物蛋白中的抗营养因子。
酪蛋白可以被近端肠道中的宿主酶消化,从而减少大肠中细菌的降解。具体而言,酪蛋白可以增加乳杆菌和双歧杆菌,并减少粪便中葡萄球菌、大肠菌群和链球菌的数量。此外,酪蛋白可以调节直肠真杆菌和Marvinbryantia formatexigens的减少。
补充脱脂干牛奶可以增加总厌氧菌和需氧菌,而膳食鱼粉可以减少需氧菌,包括大肠菌群,并增加厌氧菌的数量,如乳酸杆菌属。
此外,动物蛋白的特点是 短链脂肪酸减少,肠道 pH 值和氨浓度增加。
显然,蛋白质来源对肠道微生物群的影响并不一致,需要更多的研究来评估不同蛋白质类型对蛋白质消化率和代谢以及肠道微生物群组成的影响。
蛋白质摄入量与肠道菌群
膳食蛋白质的浓度是影响蛋白质发酵和肠道微生物组成的主要因素。
更高的水平和未消化的蛋白质会导致致病微生物的增加,从而增加代谢疾病的风险。

Zhao J, et al., Curr Protein Pept Sci. 2019
未被小肠吸收的残留含氮化合物将被转移到远端肠道,并被该位置微生物代谢。微生物代谢物的数量和种类均受膳食蛋白质摄入量的影响。
有些微生物代谢物是有毒的,例如硫化氢、氨和吲哚化合物,并可能对宿主健康产生负面影响。有些代谢物是参与宿主各种生理过程的生物活性分子。
此外,由于肠道微生态系统的稳态破坏和有益菌的减少,高浓度的蛋白质补充会导致潜在病原体数量增加。膳食蛋白质改变的肠道微生物群,通过调节肠道屏障功能、肠道运动和免疫系统来影响宿主代谢。
结肠中过量蛋白质发酵影响肠道微生物群变化
未消化蛋白质的增加与蛋白质摄入水平高、蛋白质消化率相对降低和氨基酸组成不平衡有关。结肠中多余蛋白质的降解始于细菌蛋白酶和肽酶将蛋白质水解成较小的肽和氨基酸。这些含氮化合物会影响肠道微生物群,尤其是结肠。
-3.png)
稍低蛋白浓度有助于减少大肠杆菌,但蛋白浓度过低会增加潜在致病菌
相对低浓度的膳食蛋白质会减少致病菌增殖的底物量。例如,人类饮食中低浓度的蛋白质导致粘膜表面的大肠杆菌群落减少。在较低蛋白质条件下肠道微生物的变化会产生毒性较小的含氮细菌代谢物,例如多胺。
然而,当饮食中蛋白质的浓度过低而不能满足宿主的基本需要时,就会增加潜在病原体的丰度,减少有益菌的数量。
具体来看一项关于蛋白浓度变化对肠道菌群影响的研究。
断奶动物
蛋白水平适量:
当断奶动物饲喂100-200g/kg的膳食蛋白质时,粪便中需氧菌和厌氧菌的数量会增加,这些蛋白质水平会导致肠道中乳酸杆菌的增加以及大肠菌群和葡萄球菌的减少。
蛋白水平过高:
然而,当膳食蛋白质水平大于 200 g/kg 时,致病菌数量会增加,例如大肠菌群、链球菌和芽孢杆菌。
蛋白水平过低:
低浓度的膳食蛋白质会减少产丁酸菌(这些菌群是抗癌和其他肠道疾病的抗炎剂),包括乳酸杆菌、双歧杆菌、saccharolytic(糖酵解菌)。
成年动物
成年动物中,在蛋白质水平的微小变化下,肠道微生物群相对稳健。例如,当成年动物分别用 190 g/kg 和 150 g/kg 蛋白质喂养时,粪便样本中的细菌数量几乎没有差异。
在成年动物中,只有当蛋白质水平发生重大变化时,才能观察到微生物群的变化。
低蛋白饮食还与低浓度的氨、血浆尿素氮和回肠食糜中的短链脂肪酸含量有关。肠道中的氨不是来自宿主脲酶活性,而是来自蛋白水解和微生物活动。因此,回肠食糜中低浓度的氨可能表明蛋白质代谢降低。
蛋白质发酵产物对肠道微生物的影响
大部分膳食蛋白质在小肠中消化,但蛋白质摄入过多会导致结肠输入量增加。结肠中多余蛋白质的降解始于蛋白质被细菌蛋白酶和肽酶水解成更小的肽和AA,这些蛋白酶和肽酶在中性至碱性pH下更为活跃。这些残余蛋白质不仅提高了肠道pH值,而且还可供结肠微生物进一步代谢。
然而,碱性pH有利于病原体增殖,对肠道健康不利。此外,由于向肠道微生物群过量供应膳食蛋白质而导致的蛋白质发酵也被视为肠道疾病发展的一个因素。
虽然有报道称结肠蛋白输注过多会产生有害影响,仍有一些争议,但似乎较低量的蛋白到达远端肠道可能会降低腹泻的发生率,并抑制病原菌的增殖,特别是在应激情况下,如感染高压。
蛋白质的发酵通常与蛋白质发酵细菌以及潜在致病菌的生长有关。通过培养基分析,至少拟杆菌属和丙酸杆菌以及各种杆菌被鉴定为蛋白水解细菌,其中一些细菌的基因组中携带丝氨酸和其他蛋白酶的基因。
氨基酸为细菌提供代谢底物
饮食和内源性来源的蛋白质和氨基酸对于肠道微生物群的生长和存活是必要。
蛋白质水解后,释放的肽和氨基酸被宿主和胃肠道中的细菌用于各种代谢活动,虽然一些细菌缺乏使用细胞外氨基酸的特定转运体。
胃肠道中许多细菌的理想氮源是氨基酸和NH3,可能是因为它们缺乏必要的肽转运蛋白。然而,如瘤胃前置杆菌等细菌利用肽作为氮的唯一来源。这些肽最初被输送到瘤胃前置杆菌的细胞中,然后直接使用或水解成FAAs。通常,肽、氨基酸和NH3可用于细菌细胞成分的生产或通过各种途径分解代谢。这些过程可能对身体产生有利或不利的影响。
蛋白质摄入与肠道屏障
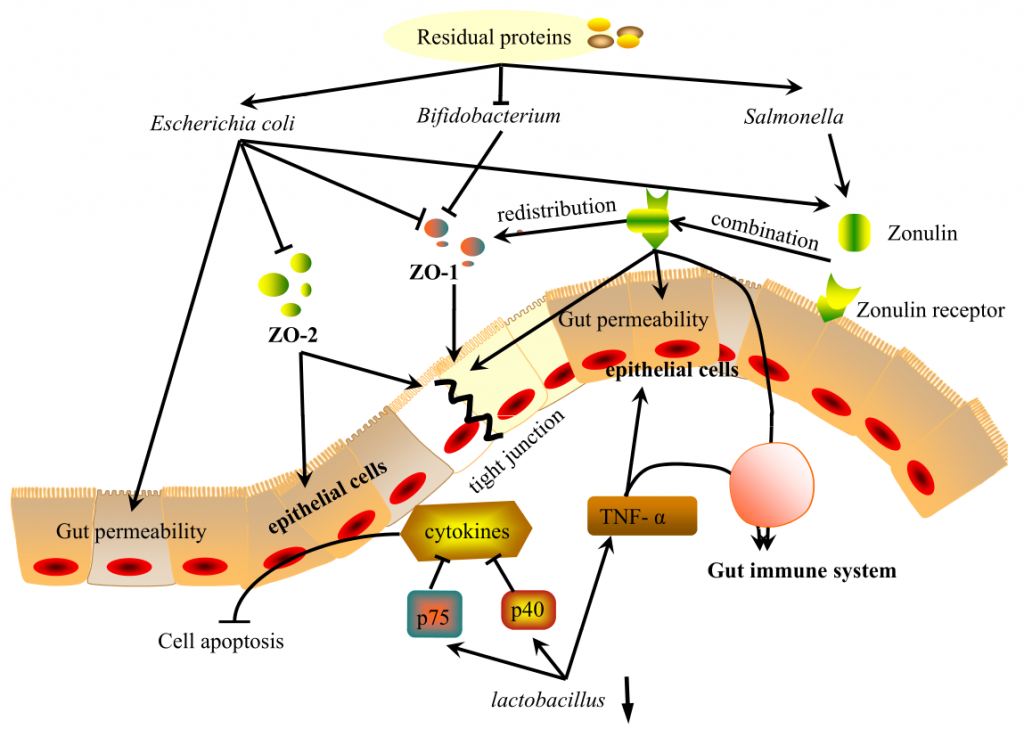
肠道是一个具有高度蛋白水解活性的部位,主要由微生物群介导。这些蛋白水解代谢物以及肠道微生物(可通过蛋白质水平改变)通过调节紧密连接蛋白和Zonulin在调节肠粘膜屏障中发挥重要作用。

Ma N, et al., Curr Protein Pept Sci. 2017
肠道微生物通过调节紧密连接蛋白ZO-1和ZO-2的表达来影响肠道上皮屏障。研究表明,在高蛋白饮食(HPD)中增加双歧杆菌可有效缓解结肠上皮细胞膜屈曲,上调ZO-1表达,有利于紧密连接修复。
相反,低蛋白饮食(low-protein diet, LPD)或正常蛋白饲粮(normalprotein diet, NPD)通过降低肠上皮通透性,降低大肠杆菌水平,从而上调ZO-1的表达。抑制大肠杆菌生长也可上调ZO-2的表达,从而保护肠上皮细胞,修复上皮屏障。
连蛋白Zonulin是唯一已知的细胞间紧密连接的生理调节剂,可能是微生物群和紧密连接蛋白之间的一种可能的调节剂。
Zonulin可逆且快速地调节肠道通透性,其在遗传易感个体中的上调可能导致免疫介导的疾病。其释放将由细菌数量的变化触发。
在上皮细胞中结合其受体后,该复合物导致紧密连接的开放并增加肠道通透性。
研究人员选择了4种细菌菌株作为兴奋剂,包括3种大肠杆菌菌株和1种沙门氏菌菌株,它们都是病原体,HPD增加。它们都释放了Zonulin并改变了细胞旁通透性。同时,观察到ZO-1从紧密连接复合物重新分布到细胞单层。
此外,不同的细菌会导致不同水平的Zonulin分泌,这会在不同程度上改变肠道屏障功能,反映微生物和肠道之间的急性调节。
氨基酸不均衡会诱发肠道问题
膳食蛋白质中的氨基酸可通过调节肠道微生物群组成间接影响肠道形态。此前有研究报道,低赖氨酸玉米蛋白会导致肠道绒毛高度降低,隐窝深度加深,提示肠道黏膜的损伤是由于饲粮中氨基酸比例失衡所致。
小肠上皮细胞可将氨基酸和其他营养物质吸收到血液和器官中,营养不良对肠道微生物群的干扰和影响可能导致肠道形态受损。
断奶时观察到的腹泻可以通过低蛋白质水平和平衡氨基酸组成来缓解。然而,饮食中氨基酸的不平衡可能损害肠道形态,增加腹泻风险。因此,饮食中氨基酸失衡会抑制蛋白质吸收,导致肠上皮增生。
注意蛋白过敏或不耐受诱发的肠道问题
大豆中的粗蛋白质相对较高,约为40%,主要由球蛋白组成,球蛋白由伴大豆球蛋白和大豆球蛋白组成。这些球蛋白具有免疫原性和热稳定性。
大豆蛋白补充剂中抗原复合物的形成,如大豆球蛋白、β-伴大豆球蛋白和免疫球蛋白抗体,可能是刺激过敏反应和腹泻的原因。大部分膳食蛋白质在消化后降解为肽和氨基酸。
然而,还有一种可能性是,其他分子如一种抗营养因子,可以通过肠上皮细胞进入血液和淋巴。大豆中具有抗原活性的抗营养因子可刺激宿主的免疫应答。
免疫反应由具有IgE分泌的T淋巴细胞介导,其对肠道形态具有负面影响,导致绒毛损伤和隐窝细胞增殖。
此外,上皮细胞中消化酶活性的降低可能与吸收功能失调和肠道微生物群组成多样性减少有关。
由于其抗原性,膳食大豆蛋白可能有利于病原体增殖,这些抗原也可能是对粪便微生物群一致性产生不利影响的因素。
对大豆蛋白的超敏反应可能导致对病原体过度生长的更高易感性,主要包括蛋白质代谢细菌以及肠致病性大肠杆菌。
大豆蛋白和其他植物蛋白通常含有抗营养因子,包括可溶性非淀粉多糖含量升高,可能增加断奶仔猪腹泻的发生率。
在大豆蛋白质代谢过程中,会产生各种毒素,如组胺、尸碱和腐胺,这些毒素会破坏肠壁,增加肠上皮细胞的通透性。当病原体在管腔内定植时,可能发生肠道微生态失调。
大豆蛋白被认为是一种相对健康的蛋白质来源。大豆经加工处理后,抗原活性有所降低,抗营养因子显著降低。Pepsin-hydrolysate conglycinin (PTC)是一种治疗后从球蛋白中提取的小肽,具有降低高血压、抗氧化和免疫刺激等药理和生理活性。
伴大豆球蛋白是大豆贮藏蛋白的组分之一,经消化和酶处理后以PTC的形式发挥作用。PTC可以抑制病理性大肠杆菌的生长,无时间依赖性,并且在 大肠杆菌E. coli O138激发后也被激活以预防疾病。
伴胰球蛋白-胃蛋白酶水解物参与调节肠道微生物群落平衡和维持肠道完整性。当肠道微生态系统的稳态受到干扰时,生物活性肽可在预防与肠道疾病相关的疾病中发挥重要作用。PTC还通过产生胃蛋白酶介导的双歧杆菌生长刺激肽促进双歧杆菌的生长。然而,PTC对E. coli O138的抑制作用的潜在机制尚不清楚,需要进一步的研究来阐明。
酪蛋白与肠道微生物群
酪蛋白具有特殊的氨基酸组成,可以诱导肠道氨基酸转运蛋白基因的转录水平。肠道微生物群的组成和功能也受到氨基酸平衡改变的影响。
CAT1
阳离子氨基酸转运蛋白(CAT1)参与赖氨酸和精氨酸的转运。研究表明,对十二指肠和回肠中的CAT1没有显著影响。相反,与空肠中的膳食玉米醇溶蛋白相比,补充酪蛋白的CAT1表达水平更高。
因此,可以合理地得出结论,酪蛋白可促进赖氨酸和精氨酸的积累,这与补充酪蛋白的赖氨酸含量高于膳食玉米醇溶蛋白的报告一致。
肠道中赖氨酸和精氨酸的变化可能有助于酪蛋白对肠道微生物群的影响。CAT1的表达随着饮食中赖氨酸水平的增加而上调。
EAAC1
兴奋性氨基酸载体1(EAAC1)参与天冬氨酸和谷氨酸的转运,其作用类似于CAT1。EAAC1在十二指肠中的表达水平被膳食玉米醇溶蛋白下调,而在空肠和回肠中,补充酪蛋白的EAAC1表达水平高于玉米醇溶蛋白或大豆蛋白。
PePT1
此外,肽转运蛋白1(PePT1)的表达也受到不同蛋白质来源的调控。与植物蛋白相比,膳食酪蛋白在所有肠段都有更高的PepT1表达。
因此,具有平衡氨基酸组成的膳食酪蛋白可以促进氨基酸和肽转运蛋白的表达。这种表达可以加速功能性氨基酸在肠道环境中的运输。
赖氨酸、天冬氨酸和谷氨酸在管腔中的浓度受不同蛋白质来源的不同处理的影响。这些变化可以影响特定代谢物的衍生和转化途径,改变生理功能,改变肠道内的微生态平衡。
氨基酸还通过合成细菌蛋白质以及与肠道微生物群的相互作用对微生物组成起重要作用。
菌群发酵蛋白质主要副产物
短链脂肪酸
短链脂肪酸(SCFA)是细菌在大肠内代谢的最终产物,主要成分为乙酸、丁酸和丙酸。短链脂肪酸的基质主要来自膳食纤维和抗性淀粉。
然而,未消化的蛋白质也是短链脂肪酸产物的底物。膳食蛋白质在大肠中释放的几种氨基酸是短链脂肪酸合成的前体。肠道微生物可以从甘氨酸、丙氨酸、苏氨酸、谷氨酸、赖氨酸和天冬氨酸中产生乙酸盐。
谷氨酸和赖氨酸可以合成丁酸,丙氨酸和苏氨酸可以合成丙酸。
短链脂肪酸产物的数量和形态主要取决于营养物质的底物可得性、肠道菌群组成和肠道传递时间。短链脂肪酸是已知的氧化和使用作为燃料的结肠上皮。
此外,SCFA可以靶向游离脂肪酸受体(FFAR)配体转运到结肠肠细胞,FFAR代谢感知的激活在调节肠道脂肪沉积和营养物质吸收中发挥重要作用。
短链脂肪酸与肠道血流相互作用,促进5-羟色胺的释放,这可能受到肠道-脑内分泌轴的调节。这有助于增加肠道运动和离子转运,从而改变肠道菌群组成和免疫防御。
SCFA参与多种生理过程,在维持肠道完整性、葡萄糖稳态和食欲调节中发挥重要作用。除了为结肠细胞提供能量外,丁酸盐也是SLC5A8的底物。该蛋白编码基因抑制组蛋白去乙酰化酶的活性,而组蛋白去乙酰化酶是一种表观遗传调节因子,在多种肿瘤中诱导细胞凋亡。丁酸可以通过上调宿主防御肽的表达来刺激中性粒细胞群体,有利于破坏病原体,增强抗病能力。
氨
氨在大肠中以毫摩尔浓度存在。与远端结肠相比,近端结肠的特点是pH值低,碳水化合物含量高。因此,从升结肠到降结肠,氨浓度升高,这与远端结肠的蛋白质代谢率高于近端结肠是一致的。
大肠中的氨浓度主要是与氨基酸脱氨和尿素水解有关的微生物代谢物。肠道菌群可利用氨,氨可被上皮细胞吸收。尿素在肠道内的水解是通过细菌脲酶活性进行的。
虽然幽门螺杆菌的脲酶活性已经得到了充分的研究,但关于其他大肠微生物的脲酶活性的信息却很少。最近的一项研究报道,部分氨被谷氨酰胺合成酶的活性与l -谷氨酸缩合,使谷氨酰胺合成。这是一种可能的机制,以控制氨细胞内浓度在结肠细胞。
硫化氢 (H2S)
硫化氢(H2S)是蛋氨酸、半胱氨酸等含硫氨基酸发酵产生的一种微生物代谢物。H2S也来源于无机硫酸盐和亚硫酸盐添加剂的还原,以及肠道磺胺类物质的分解代谢。
肠道微生物能够通过脱硫酶从半胱氨酸碳链中获得能量。甲硫氨酸可转化为α-酮丁酸酯、氨和甲硫醇。这些代谢物归因于一个特定的分类组的细菌,包括大肠杆菌、肠沙门氏菌、梭菌和产气肠杆菌,通常在大肠中发现。
肠杆菌、肠球菌、肠链球菌、梭杆菌和真细菌能够发酵含硫氨基酸。
多胺
多胺是由精氨酸、鸟氨酸和蛋氨酸等氨基酸前体的结肠细胞产生的聚阳离子分子。从结肠癌中分离出来的结肠上皮具有高的多胺合成能力,这可能是由于肿瘤细胞持续有丝分裂需要高的多胺。
肠道微生物可从鸟氨酸、精氨酸、赖氨酸、酪氨酸和组氨酸等氨基酸前体产生腐胺、胍胺、尸胺、酪胺和组胺等多种多胺。
多胺参与细菌细胞的生长、增殖、分泌和运输活动。大肠生态系统中能够产生多胺的大肠细菌有多种,包括拟杆菌属(Bacteroides)、乳杆菌属(Lactobacillus)、Veillonella、双歧杆菌属(Bifidobacterium)和梭状芽胞杆菌属(Clostridium)。因此,肠道菌群组成是影响结肠多胺分布和分配的因素之一。
苯酚和吲哚
结肠中苯丙氨酸、酪氨酸和色氨酸等芳香族氨基酸可被特定的肠道微生物代谢为酚类和吲哚类化合物。
然而,芳香氨基酸的代谢与结肠微生物群的特定组分之间的相互作用还没有充分的研究。一些代谢产物如酚和吲哚,被怀疑为共致癌物和结肠癌促进剂。
已知发酵芳香氨基酸的厌氧菌包括大肠中的拟杆菌、乳酸菌、双歧杆菌、梭状芽胞杆菌和胃链球菌。与结肠中的其他氨基酸相比,芳香氨基酸在细菌中代谢缓慢。它们可以生产一系列的酚类和吲哚类化合物作为最终产品,如对甲酚、吲哚、酚和粪臭酚。
据报道,酪氨酸可产生苯酚和对甲酚,而苯乙酸和色氨酸在人体浆发酵过程中分解为吲哚乙酸盐和吲哚。
在一项研究中,远端结肠中的酚类化合物浓度增加,表明大肠远端区域的氨基酸代谢较高。吲哚和酚类代谢物的浓度取决于细菌产生率和结肠吸收率之间的平衡。酚类化合物似乎大部分被结肠内容物吸收。它们在从管腔转移到血液和肝脏的过程中部分代谢,最后通过尿液排出。
对无菌和常规小鼠血浆代谢物的对比分析表明,无菌小鼠的色氨酸和酪氨酸水平至少增加了1.5倍。涉及这些芳香族氨基酸的细菌代谢产物包括硫酸吲哚氧基、硫酸苯酯、硫酸对甲酚和苯丙酰甘氨酸,仅在常规小鼠中发现。
关于酚类和吲哚类化合物对结肠上皮细胞的影响知之甚少。体外实验表明,苯酚会降低屏障功能的完整性。需要注意的是,当苯酚浓度高于1.25 mM时,它会损害结肠上皮细胞。
如果蛋白质摄入过量,或者肠道里消化蛋白质的菌群构成不理想,那么蛋白质发酵发生的胺,硫化氢,苯酚等肠道毒素过量积累,会诱发肠道炎症,便秘,腹胀等问题,因此正确摄入适量优质蛋白对于维持肠道菌群和身体健康很重要。
蛋白质摄入要因人而异
实际上,我们摄入的一些蛋白质可以转化为葡萄糖,特别是当蛋白质的消化速度快且人体糖原储存量低时,有些蛋白质可以被微生物群发酵,特别是当蛋白质的消化速度慢时。
每个人对蛋白质的需求量各不相同,比如经常运动人群和久坐人群对蛋白质的需求量不一样,孕妇、老人、儿童、肥胖等群体都有各自不同的需求。当然,每个人的不同状态对蛋白质的需求量也都不同,比如爬山的一天,和在家刷剧的一天,也是不一样的。
因此,我们说最佳每日蛋白质摄入量取决于你的身高体重、健康状况、目标、身体活动水平。

素食主义者对蛋白质的需求较高,因为植物蛋白在生物利用度上通常不如动物蛋白。植物蛋白消化率为 60-80%,而动物蛋白消化率超过90%.
注意植物蛋白的较难消化吸收
因为植物含有抑制蛋白质消化和吸收的抗营养物质,如胰蛋白酶抑制剂、植酸盐和单宁。虽然烧熟后确实降低了抗营养物质的浓度,但并不能完全消除它们。
另外,植物性蛋白质也含有限制性氨基酸,这些氨基酸是必须氨基酸但数量太少,以至于不够蛋白质的合成所需。
注:限制性氨基酸是指食物所含必需氨基酸的量与动物所需的蛋白质必需氨基酸的量相比,比值偏低的氨基酸。比如说一种食物里特别缺少某一种氨基酸,即使其它的氨基酸含量很高,因为这个氨基酸导致它的各个氨基酸比例不平衡。人体对这种食物的吸收依然不理想,这种氨基酸就叫限制性氨基酸。
结合不同的植物性蛋白质可以帮助弥补它们各自的不足。
摄入蛋白注意其氨基酸构成
比如说,赖氨酸是最常见的限制性氨基酸,特别是在谷类中,如小麦和水稻。坚果往往也含有赖氨酸作为限制性氨基酸。另一方面,豆类含有足够的赖氨酸,可以弥补,但缺乏硫氨基酸,如蛋氨酸和半胱氨酸。
蛋白质能否被人体吸收利用,还应该考虑蛋白质的氨基酸组成。
因此,了解一下评估蛋白质的另一个标准:氨基酸的组成。
氨基酸组成
蛋白质由氨基酸组成,身体可以合成其中一些氨基酸,而另一些则不能。
需要但不能合成、需要从食物中摄取的九种氨基酸被称为必需氨基酸(EAA)。
氨基酸:成人的需求和不同食物的含量
World Health Organization. Protein and Amino Acid Requirements in Human Nutrition
人群范围蛋白质摄入量如何?
使用谷禾检测人群,基于肠道菌群分析营养膳食摄入构成,图中给出了蛋白质占总能量摄入的占比,正常比例在10~20%范围。可以看出0~3岁蛋白质占比较高,3~15岁蛋白质占比较低,80~100岁比例又进一步下降。
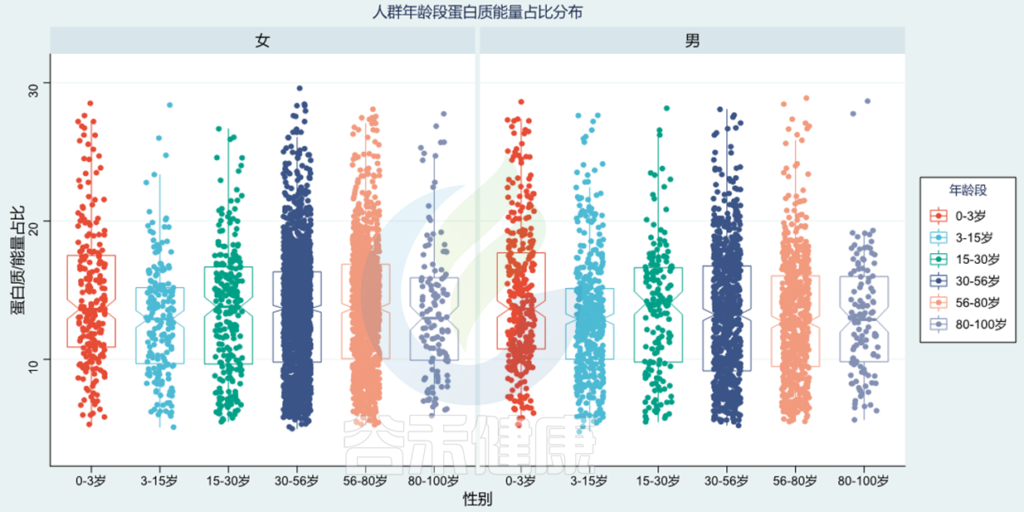
<谷禾健康肠道菌群检测数据库>
结 语
蛋白质代谢与肠道菌群密切相关。膳食蛋白质在小肠中被蛋白酶和众多肽酶代谢,膳食蛋白质释放的氨基酸可用于肠道微生物合成蛋白质。这反过来又促进了饮食、微生物群和宿主之间的氮循环和利用。
不同的细菌有不同的代谢能力,依靠我们摄入的营养物质繁殖生存,其中拟杆菌属(Bacteroides)、梭状芽胞杆菌属(Clostridium)、丙酸杆菌属(Propionibacterium)、梭杆菌属(Fusobacterium)、乳酸杆菌属(Lactobacillus)和链球菌属(Streptococcus)在蛋白质水解过程中发挥着重要作用。通过肠道菌群检测评估的蛋白质摄入水平显示不同人蛋白质摄入及营养占比差异很大,过高或者过低均伴随肠道菌群问题,包括过低导致潜在病原体数量增加,有益菌减少,同时导致部分氨基酸缺乏,过高又导致例如大肠菌群、链球菌和芽孢杆菌增殖,蛋白质发酵产生的副产物如,腐胺,苯酚,硫化氢等增诱发便秘,腹痛等健康问题。
除了蛋白质的摄入量,不同的蛋白形式,如植物蛋白,乳蛋白、动物蛋白以及蛋白质与其他营养摄入的相对比例构成,如膳食纤维、抗性淀粉、脂肪、微量元素等的比例都会影响肠道菌群进而反过来影响其消化降解,改变氨基酸的合成和代谢,最终影响宿主营养代谢健康。
总之,我们提倡膳食平衡,没有特殊情况不建议盲目补充蛋白粉等,建议从膳食结构调整保证营养均衡,从而使各种营养都能达到生长发育和身体健康的生理需要量,这同时要关注肠道菌群状况,因为他们是相辅相生。
常见食物中氨基酸含量见附录。
附录
供人类食用的植物性食品中总氨基酸的含量
(肽结合氨基酸加上游离氨基酸) mg/g
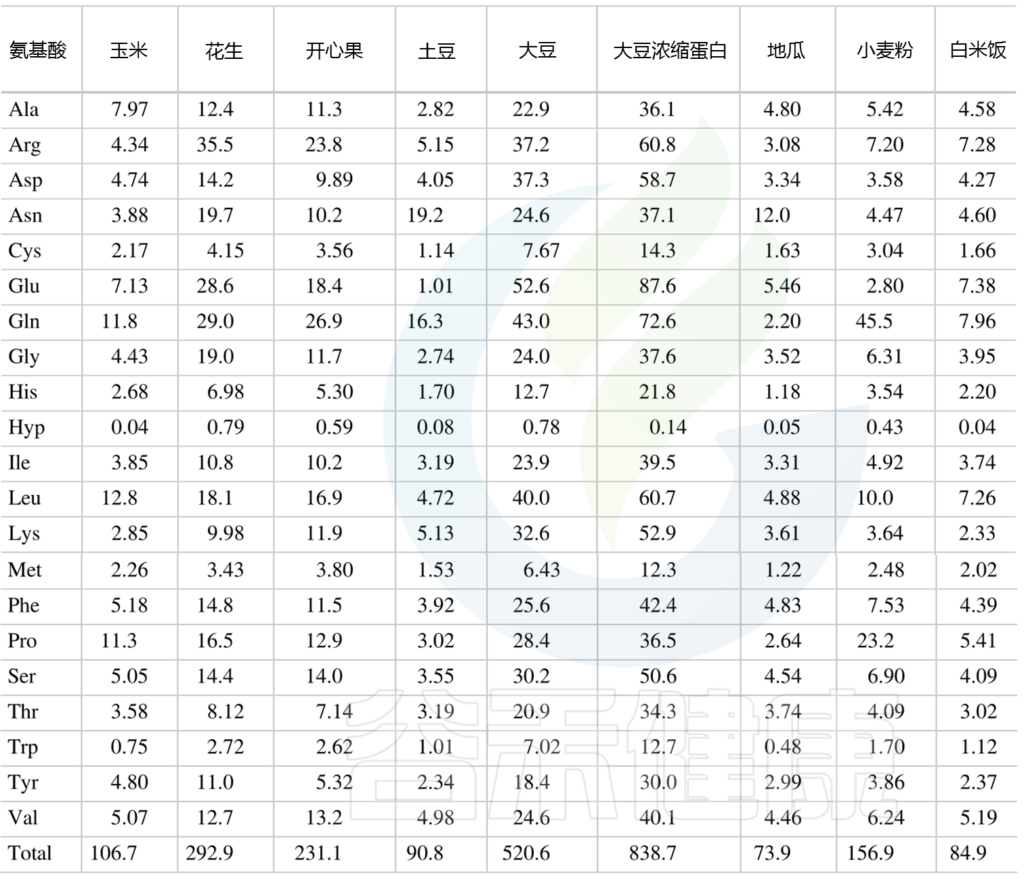
Amino Acids in Nutrition and Health, 2021
人类动物性食品中总氨基酸的含量
(肽结合氨基酸加上游离氨基酸)mg/g
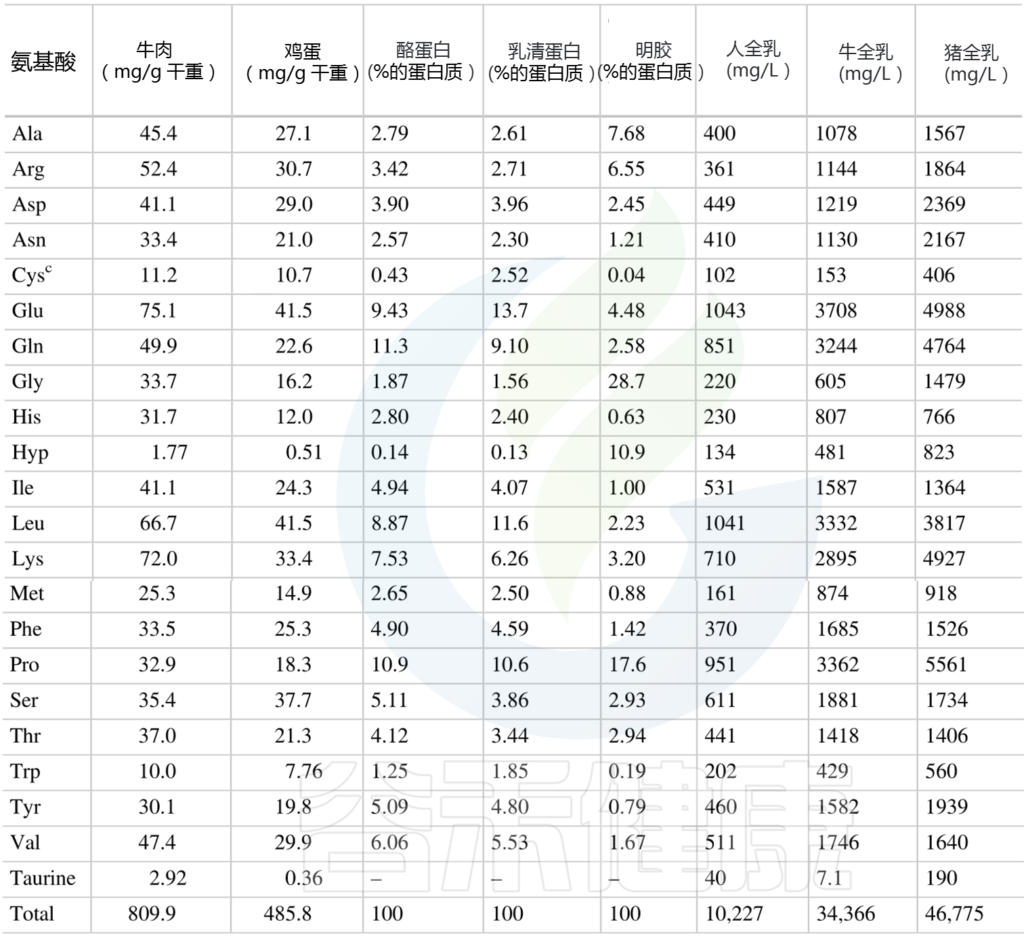
Amino Acids in Nutrition and Health, 2021
主要参考文献:
向上滑动阅览
Abdallah A, Elemba E, Zhong Q, Sun Z. Gastrointestinal Interaction between Dietary Amino Acids and Gut Microbiota: With Special Emphasis on Host Nutrition. Curr Protein Pept Sci. 2020;21(8):785-798.
doi: 10.2174/1389203721666200212095503. PMID: 32048965.
Ma N, Tian Y, Wu Y, Ma X. Contributions of the Interaction Between Dietary Protein and Gut Microbiota to Intestinal Health. Curr Protein Pept Sci. 2017;18(8):795-808.
Yadav M, Verma MK, Chauhan NS. A review of metabolic potential of human gut microbiome in human nutrition. Arch Microbiol. 2018 Mar;200(2):203-217. doi: 10.1007/s00203-017-1459-x. Epub 2017 Nov 29. PMID: 29188341.
Zhao J, Zhang X, Liu H, Brown MA, Qiao S. Dietary Protein and Gut Microbiota Composition and Function. Curr Protein Pept Sci. 2019;20(2):145-154.
Lin R, Liu W, Piao M, Zhu H. A review of the relationship between the gut microbiota and amino acid metabolism. Amino Acids. 2017 Dec;49(12):2083-2090. doi: 10.1007/s00726-017-2493-3. Epub 2017 Sep 20. PMID: 28932911.
谷禾健康
肺炎克雷伯菌(Klebsiella pneumoniae),也称弗里德兰氏杆菌,最早是由德国微生物学家和病理学家Edwin Klebs卡尔·弗里德兰德于1882年描述的。
肺炎克雷伯菌是一种革兰氏阴性,不运动的,包囊的杆状芽孢杆菌,存在于人类和非人类灵长类动物的鼻咽和胃肠道中。属于克雷伯氏菌属和肠杆菌科。是兼性厌氧的,氧化酶为阴性,并从乳糖产生酸和气体。它是一种肠内细菌,在5%的健康人的肠道中可见。也可以驻留在皮肤和口腔中。
肺炎克雷伯菌可以自然存在于健康个体的肠道和呼吸道中,具有健康免疫系统的人很少发生感染疾病。
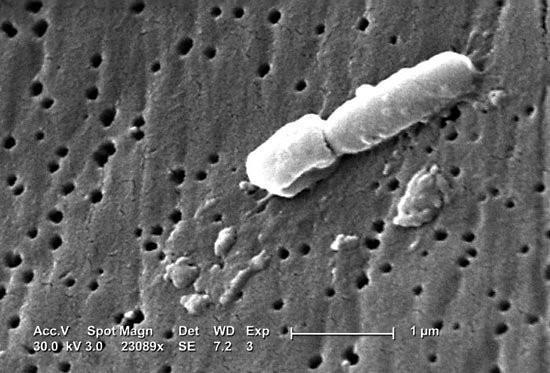
肺炎克雷伯菌的扫描电镜观察
图源:Janice Carr/Centers for Disease Control and Prevention (CDC)
肺炎克雷伯氏菌在人宿主中有两个主要的定植渠道:上呼吸道和肠道。肺炎克雷伯菌建立定植必须与这两个位置的微生物群和免疫系统建立的防御系统抗衡。
表达多种致病性因子,包括多种粘附素,荚膜多糖,铁载体和脂多糖,可逃避宿主防御。例如,荚膜多糖(K抗原)可防止吞噬作用;染色体上携带的多种抗生素抗性基因等。
科学分类
Trevisan 1885 emend. Drancourt et al. 2001
首先我们先来看看,肺炎克雷伯菌这种菌在人群中的分布情况究竟是怎样的?
我们从谷禾健康2019年近期检测人群肠道菌群样本抽取1.3万例样本,人群共计13358人,涵盖0~103岁人群。
其中肺炎克雷伯氏菌丰度占比超过1%的人群有3765例,占比28.2%。
谷禾健康肠道菌群数据库
肺炎克雷伯菌可以逃避人体的正常保护机制。除了攻击肺和膀胱等器官外,它还引发炎症反应,从而加剧发烧和发冷等症状。
接下来我们详细了解一下,克雷伯菌感染后会有哪些症状。
在新的和旧的灵长类动物中,这种细菌都与脑膜炎,腹膜炎,败血病和肺炎有关。肺炎克雷伯菌是引起肺炎的人类呼吸系统的主要病原体之一。
当细菌直接进入人体内时,通常会发生克雷伯菌感染。一旦它们进入体内并在免疫系统的防御中幸存下来,它们就会影响各种器官。疾病的症状通常取决于感染开始的位置。
感染包括泌尿道、血液、脑部等。克雷伯菌的感染迹象和症状会随感染部位的不同而不同。
肺部感染
这类肺炎的主要症状是发烧和发冷,由于咳嗽,可能还会感到胸部不适,呼吸急促,疲倦。如果疾病已经蔓延很多,那么可能还会遇到一些其他症状,例如咳嗽时痰液浓稠,带血,通常被称为“黑加仑果冻痰”。
像肺炎球菌一样,克雷伯菌属感染肺部一般会产生大叶性肺炎,有黏液状的“粘液样”外观,并且上叶的原因不明。感染会导致出血性坏死,微脓肿和空腔形成。部分克雷伯菌属还会产生慢性坏死性肺炎,并伴有疤痕和肺部解剖结构扭曲。
鼻部感染
感染克雷伯氏菌会导致鼻粘膜的恶臭消散(萎缩)。
克雷伯氏菌鼻硬膜炎可引起鼻硬化症,是鼻子和喉咙的破坏性结节性炎症。
眼部感染
如果肺炎克雷伯菌(K. Pneumonia)感染了血液,那么它有可能会传播到眼睛并引起严重的感染,称为眼内炎。它主要引起眼睛的白色部分发炎。
在较早阶段,这种感染会导致眼睛发红和轻度至重度疼痛。除了不适,还可能会从眼睛排出白色或黄色粘液。
当感染处于晚期时,会导致视力模糊和畏光。如果不加以治疗,细菌还会扩散到大脑中,并引起其他健康并发症。
血液感染
当肺炎克雷伯菌进入血液并对其进行感染时,通常会发生细菌血症。症状可能包括发冷,发烧,发抖,肌肉酸痛,疲劳和嗜睡。可能还会出现意识变化。败血症可作为反应发生。
脑膜炎
在某些由肺炎克雷伯菌引起的眼内炎中,微生物从患者的眼睛传播到大脑,并引起细菌性脑膜炎。但是,已知这种肺炎克雷伯菌很罕见,通常发生在老年人中。
当一个人患有这种类型的感染时,他们会突然发高烧,脑膜(大脑周围的保护层)感染可引起头痛,脖子僵硬,背部疼痛,疲劳。由于急性疼痛,许多人也会感到恶心和畏光的感觉。在极少数情况下,脑膜炎会引起癫痫发作。
如果不及时治疗,在某些情况下也可能导致患者死亡。
尿路感染
当肺炎克雷伯氏菌细菌进入人的尿道(包括肾脏,尿道和膀胱)时,会引起严重的尿路感染(UTI)。
起初由克雷伯菌引起的泌尿道感染通常不显示任何明显的体征。但是,随着感染的增加,开始出现许多严重的症状。
这可能会导致尿频,排尿灼热感,膀胱急迫和尿失禁。其中,尿频是最常见的一种。它还可能引起发烧、小腹和骨盆区域的疼痛或不适。
这种感染通常发生在使用导尿管一段时间的患者中。通常,它在老年妇女中更为常见。
伤口感染
如果肺炎克雷伯菌通过瘀伤进入,可导致伤口愈合延迟,发红,脓液和疼痛,发烧,疲劳。
那么它也可以感染身体或皮肤的软组织。这种类型的感染发生在那些因手术和受伤导致开放性伤口的人中。
可能会感到非常恶心,但是医生不一定能马上知道感染这种菌,肺炎克雷伯菌的感染通常以与其他感染相似的症状为特征。要经过诊断测试才能确认。
化脓性肝脓肿
肺炎克雷伯菌还可以感染肝脏,并在其中引起脓性病变,它被称为化脓性肝脓肿。这种类型的感染更常见于患有糖尿病一段时间或已经服用抗生素多年的人。
患有化脓性肝脓肿的人可能出现:
轻度至重度发烧、呕吐(有血或无血)、急性腹泻、经常感到恶心、右上腹部轻度疼痛。
克雷伯菌的其他种类包括产酸克雷伯氏菌和植物肺炎克雷伯菌与肺炎克雷伯菌一起可引起人尿道和伤口感染。肺炎克雷伯菌的罕见亚种会引起特别严重的疾病。
K. ozaenae
是一种罕见的人类病原体,很少引起严重感染,被认为是萎缩性鼻炎的病因(萎缩性鼻炎:以粘液脓性分泌物、粘膜结痂和恶臭为特征)。K. ozaenae菌血症是一种罕见的临床问题。在文献中,只有十二病例报告。
K. rhinoscleromatis
可导致缓慢进展的疾病,称为鼻硬化症。在首次临床表现时,患者最初可能处于疾病的第一阶段(鼻炎),伴有鼻塞、结痂和恶臭。随着疾病进展到肉芽肿阶段,患者开始出现更明显的鼻塞、畸形、鼻衄、嗅觉障碍。
K.oxytoca
与新生儿菌血症有关,尤其是在早产儿和新生儿重症监护病房中。从新生儿菌血症患者中分离出来。
K. planticola
已从诸如小麦,水稻和玉米(玉米)等植物的根中分离出了K. planticola和某些肺炎克雷伯氏菌菌株,它们在其中起着固氮细菌的作用。
K. variicola
变栖克雷伯菌K. variicola于2004年被发现,它也存在于多种植物中,包括水稻,香蕉和甘蔗。这种细菌还已经从医院环境中分离出来,在医院中它可能像其他克雷伯菌一样,是一种条件致病菌。
Alfred Pasieka/science Photo Library
肺炎克雷伯菌通常通过触摸,唾液交换和其他接触方式从一个人传给另一个人。没有被这种细菌感染的人也可以将其传播给另一个人。
它们还可以通过其他一些医疗设备传播,例如输尿管和静脉导管,呼吸机等。但是,肺炎克雷伯菌不能通过空气传播。
克雷伯菌肺炎通常发生在由于年龄,酒精滥用或糖尿病等导致免疫功能低下人群。常出现在酒精中毒或慢性肺部疾病等患者中,并且通常以医院感染的形式出现。
此外,易感因素包括营养不良,接触程度,不卫生的环境和遗传易感性等。
具体易感因素如下:
1.开放性伤口
克雷伯氏菌微生物可以通过开放性伤口从一个人传播到另一个人。因此,如果有开放性伤口,那么受到这些感染的风险增加近35%。
2.酒精
酒精除了会使人醉,还会影响人的免疫系统并降低其整体能力。如果一周中的每一天几乎都喝酒,那么免疫系统可能会弱,从而增加感染肺炎克雷伯菌的风险。
3.癌症药物
通常用来治疗癌症的药物会降低人体免疫力。因此,细菌更容易在体内生长并引起感染。
4.服用抗生素
抗生素药物会降低免疫力。如果长期服用抗生素,那么感染克雷伯菌的风险就会大大增加。
5.肾衰竭
如果患有肾脏方面的疾病,那么患克雷伯氏菌感染的风险也较高。肾脏衰竭是又一个可能增加感染克雷伯菌感染的机会的原因。
6.年龄
已知衰老是最主要的因素之一,它会降低我们的免疫系统的能力。因此,肺炎克雷伯菌引起的感染通常在65岁以上的人群中更为普遍。
7.慢性肝病
肝脏有助于清洁血液中的废物成分,从而使免疫系统保持健康有活力。但是,如果一个人患有慢性肝病,肝脏就不能很好地清除血液中的废物。会降低免疫力,更容易感染细菌。
以上原因是较为常见的,当然还有一些其他原因,比如:
长时间使用皮质类固醇; 器官移植; 慢性阻塞性肺疾病;糖尿病;
使用受感染的输尿管导管; 进行重大的手术; 使用被感染的呼吸机。
医生可能进行病史检查,也会使用影像学检查来诊断感染(例如肺炎等),但肺炎克雷伯菌的诊断主要基于实验室检查。
通常,由该菌引起的肺炎,脑膜炎,伤口感染和任何其他部位感染会感到恶心。医学评估通常着重于确定感染的原因并寻找并发症的征兆,例如脓肿。
病 史
医生会问是否发烧,恶心,咳嗽,呼吸困难,疼痛不适以及睡眠情况。可能还会问与患有类似疾病的人的接触情况。
体 检
检查将包括对体温,嗓子,呼吸音的评估,以及对腹部压痛的评估。将检查任何伤口或疼痛的皮肤区域是否发红,肿胀或发热。
影像学检查
这是最常见的检查之一,医生通常会要求患者进行这些检查以定位疾病的位置和传播。假如医生怀疑肝脏有病变,那么他会要求检查。
肺炎克雷伯菌通常会影响右上肺叶,并导致形成空腔以及引起脓液的组织死亡。这些会在胸部X射线上比较明显,这就是成像检查的原因。
根据症状可能还需要对腹部,膀胱,大脑或骨骼进行影像学检查。
诊断测试
医生可能还需要取样,包括血液,粪便,尿液并进行微生物检测,具体取决于怀疑的感染。
甲痰样品可以检测细菌性肺炎。
检测是否有败血症可能需要血液样本。
如果怀疑细菌性脑膜炎可能需要腰椎穿刺。
如果伤口被感染,需要对感染区域的一小部分样本进行检测。
如果是腹泻,可能会送检粪便样本。
以上样本会被送至实验室进行培养或测序,以便识别传染性细菌(及其对抗生素的敏感性)。
抗生素治疗
如果患者感染了非耐药性肺炎克雷伯菌,通常会用抗生素治疗。可以口服或静脉注射。
医生可能会考虑的抗生素包括:
阿扎坦(aztreonam);
喹诺酮类;
第三或第四代头孢菌素,例如罗芬(头孢曲松);
碳青霉烯类,例如Primaxin(亚胺培南/西司他丁);
青霉素,例如佐辛(哌拉西林-他唑巴坦)
治疗持续时间因抗生素而异,但大致范围可能是2-14天。
此外,一定要告诉医生是否对青霉素过敏,青霉素过敏者无法服用某些抗生素。
# 抗生素耐药性 #
肺炎克雷伯氏菌是革兰氏阴性杆菌,包裹在厚多糖胶囊中。
某些肺炎克雷伯菌已经进化,尽管可以通过单药治疗(包括青霉素或类似抗生素)有效地治疗某些克雷伯菌感染,但是对这些药物产生抗药性的生物的出现仍需要开发新的治疗方法。例如,肺炎克雷伯菌对β-内酰胺抗生素有抗性,β-内酰胺类抗生素包括碳青霉烯,青霉素和头孢菌素。
耐药性是由生物体合成称为碳青霉烯酶的酶的能力引起的,该酶会水解构成这些药物抗菌活性基础的β-内酰胺环。结果,耐药的肺炎克雷伯菌感染通常需要与结构多样的药物(例如β-内酰胺抗生素和氨基糖苷)联合治疗。
手 术
如果有脓肿,可能需要通过外科手术将其引流。根据脓肿的位置,这可能需要在诊所进行小手术,或者可能需要在医院进行外科手术。
通常,排脓后至少还需要几天的抗生素治疗。
其他治疗新方向——微生物群
肺炎克雷伯菌感染治疗有难度,因为大多数临床分离株均表现出对几种抗生素的抗性,从而导致治疗失败和全身性传播的可能性。
好消息是,国际顶级微生物学期刊《Nature microbiology》研究发现,成熟的微生物群推动了不同免疫防御程序的发展,从而在上呼吸道和肠道限制肺炎克雷伯氏菌在这些生态位内的定植。
肠道免疫保护取决于拟杆菌、白细胞介素IL-36信号和巨噬细胞的发育。拟杆菌的这种作用需要其保守的共生定植因子的多糖利用位点。相反,在上呼吸道,变形菌门通过IL-17A增强免疫力,但是肺炎克雷伯氏菌通过包囊IL-17A来克服这些防御进而有效定植。
最终发现肺炎克雷伯氏菌的宿主间传播主要发生在其肠道贮存器中,而产生共生定植因子的拟杆菌足以通过IL-36阻止宿主之间的传播。
点此了解更多:
附录:预防感染肺炎克雷伯菌
有必要遵循所有预防措施,尤其是手部卫生。克雷伯氏菌主要通过人与人之间的接触传播,保持手部清洁是防止细菌传播的最佳方法。
身体健康的人感染的几率较低,但是住院病人或免疫力低下者需要非常注意,勤洗手:
在准备食物或食用食物之前洗手;
使用浴室后洗手;
咳嗽、打喷嚏或擤鼻涕后洗手;
更换伤口敷料和绷带前后洗手;
在医院接触床头柜、床栏、门把手、遥控器和电话等表面后洗手。
早期诊断/治疗有助于降低发病率。
主要参考文献:
Sequeira, R.P., McDonald, J.A.K., Marchesi, J.R. et al. Commensal Bacteroidetes protect against Klebsiella pneumoniae colonization and transmission through IL-36 signalling. Nat Microbiol (2020)
Bryan Corrin MD FRCPath, Andrew G. Nicholson DM FRCPath, Klebsiella Pneumoniae Infection: Symptoms and Diagnostic Procedures. Pathology of the Lungs (Third Edition), 2011
Thea Brabb, Martha Hanes, in The Laboratory Rabbit, Guinea Pig, Hamster, and Other Rodents, 2012
Hanifa J. Abu Toamih Atamni, Fuad A. Iraqi, in Molecular-Genetic and Statistical Techniques for Behavioral and Neural Research, 2018
Nervous System Disorders of Nonhuman Primates and Research Models
MicheleA. Fahey, SusanV. Westmoreland, in Nonhuman Primates in Biomedical Research (Second Edition), Volume 2, 2012
Quereshi, Shahab. Klebsiella Infections. Medscape. December, 2018
Bush, Larry and Perez, Maria. Klebsiella, Enterobacter, and Serratia Infections. Merck Manual Professional Version. April, 2018
Clegg S, Murphy CN. Epidemiology and Virulence of Klebsiella pneumoniae. Microbiol Spectr. 2016 Feb;4(1). doi: 10.1128/microbiolspec.UTI-0005-2012. PMID: 26999397.