-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
艰难梭菌是一种革兰氏阳性、形成孢子的厌氧芽孢杆菌,是艰难梭菌感染(CDI)的病原体。该菌于1935年首次分离得到,1977年报道了第一例确诊的CDI病例。从那时起,CDI的发病率逐年上升,艰难梭菌感染现在是全世界医院腹泻的最常见原因。
艰难梭菌在我国健康成年人结肠的定植率约为4%-7%,而腹泻患者的检出率高达15%-40%。但为什么一些人群肠道中存在艰难梭菌,却没有出现任何症状?而另一些则会出现腹泻、腹痛,甚至发展为假膜性结肠炎?
这是因为艰难梭菌可分为产毒型和非产毒型,通常只有产毒型会引发临床症状,其感染的表现主要受多种毒力因子影响,这些毒力因子可能比艰难梭菌的存在更为重要。并且健康的肠道微生物组对艰难梭菌感染具有保护作用。平衡的微生物和宿主因子可抑制艰难梭菌的发芽和生长,同时微生物群与宿主免疫系统的相互作用调节免疫反应,刺激抗菌肽和分泌型IgA的产生,维持菌群平衡,通过营养竞争、生态竞争和生态位排斥等机制抵抗艰难梭菌的定植和感染。
例如一些有益菌通过产生短链脂肪酸降低管腔pH值(不利于艰难梭菌),并刺激粘蛋白和抗菌肽的生成以增强防御屏障。丁酸盐还能稳定缺氧诱导因子-1(HIF-1)、增强紧密连接,保护肠道上皮免受艰难梭菌毒素损害。
艰难梭菌的孢子和生长依赖特定胆汁酸,肠道共生细菌通过调节胆汁酸代谢产物,抑制其萌发和定植。例如,Clostridium scindens可催化胆汁酸7α-脱羟基化,生成次级胆汁酸,从而增强对艰难梭菌感染的抵抗力。
当肠道微生物组的平衡状态受到干扰或破坏时,艰难梭菌感染(CDI)的易感性会显著增加。例如由于使用抗生素,年龄增长、其他胃肠道疾病,营养状态不佳、肥胖、癌症化疗这些因素都会增加艰难梭菌感染的风险。
由于艰难梭菌的危害由毒力因子决定,检测产毒菌株或基因显得尤为重要。目前,一些检测方法只能识别艰难梭菌菌株,无法区分是否为产毒菌株,可能导致误诊或过度治疗。为提高诊断准确性,近年来开发了多种技术,包括检测毒素基因的分子诊断技术和直接检测毒素蛋白的免疫学方法。16S测序仅能分辨到物种层面,宏基因组测序(包括一些靶向的测序)则可识别毒力基因。这些技术能够较快速、准确地识别产毒菌株,帮助临床医生制定更有效的治疗方案,减少不必要的抗生素使用及相关并发症。
艰难梭菌感染的治疗和预防也是人们所关心的,其治疗方法包括针对细菌(抗生素)、针对毒素(抗体、结合剂)以及微生物群(保护或恢复)的方法,在暴发性病例或非手术治疗失败时,还可选择结肠切除术或其他微创手术。通过疫苗和益生菌预防艰难梭菌感染的研究逐渐显示出一定的临床效果。
希望通过本文的内容,能够帮助人们更加全面和清晰地了解艰难梭菌的相关知识,同时提高对其危害的认识,从而采取更加科学和有针对性的措施来预防和应对艰难梭菌感染。
艰难梭菌是一种革兰氏阳性、形成孢子的厌氧芽孢杆菌,近年来,由于抗生素的滥用导致肠道菌群失调,艰难梭菌感染(CDI)的发病率在中国和全球范围内不断上升,显示出这一公共卫生问题的严重性。
2022年,中国艰难梭菌感染治疗市场规模达34.14亿元,全球艰难梭菌感染治疗市场规模达到78.74亿元,预计全球艰难梭菌感染治疗市场规模将在2028年达到147.95亿元。
艰难梭菌的感染率不断上升,很多人可能想知道自己体内是否存在这种细菌,以及是否艰难梭菌存在于人体就会致病及造成危害?随着谷禾的视角一起往下看。
1
毒力因子影响艰难梭菌的致病性
首先要强调的一点是,艰难梭菌感染的临床表现受到多种毒力因子的影响,这些毒力因子可能比艰难梭菌的存在更为重要。艰难梭菌分为产毒型和非产毒型,通常只有产毒型会引发临床症状。
产毒艰难梭菌主要产生毒素A(肠毒素)和毒素B(细胞毒素),少部分仅产生毒素B。高毒力菌株(如027型)除了产生这两种毒素外,还产生二元毒素。
据国外综合医院统计,A(+)B(+)占艰难梭菌的57%,A(-)B(+)占34%,A(-)B(-)占9%。毒素A阳性,毒素B阴性的菌株尚未被发现,毒素B可以单独导致艰难梭菌致病。
◮ 艰难梭菌的毒力因子
毒素A:主要作用于肠道,导致肠道上皮细胞的损伤和炎症反应。它通过结合肠道细胞表面的受体,诱导细胞内信号转导,导致细胞凋亡和肠道通透性增加,从而引发腹泻。
毒素B:具有更强的细胞毒性,能够直接破坏细胞骨架,导致细胞死亡,破坏紧密连接并丧失肠道屏障功能。它在致病过程中,尤其是在高毒力菌株中,起着关键作用。
二元毒素:一种ADP-核糖基转移酶,导致肌动蛋白细胞骨架解聚(导致屏障功能丧失和紧密连接破坏)和微管突起(导致艰难梭菌粘附增加)。
致病性基因和毒素作用方式
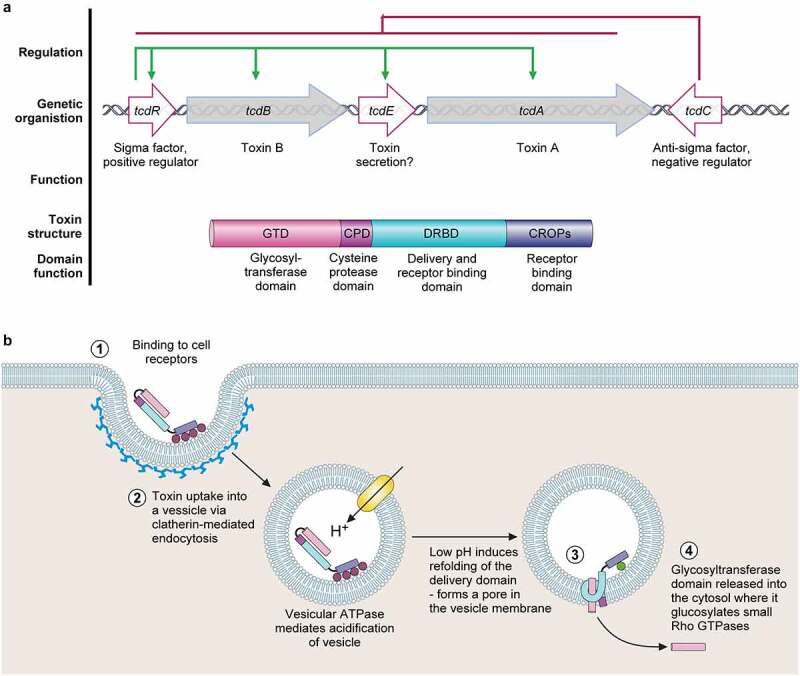
Buddle JE,et al.Virulence.2023
◮ 毒素诱导引发的免疫反应导致各种症状
这些毒素在致病性位点(PaLoc)内编码,能够与肠上皮细胞的受体结合并被内化。在细胞内,它们使小的Rho蛋白葡萄糖化,导致紧密连接破裂、上皮完整性降低,并增加细菌对宿主上皮的粘附。
毒素诱导的肠道屏障损伤会引发免疫反应,其特征是分泌促炎细胞因子和趋化因子,导致中性粒细胞、肥大细胞、单核细胞和先天性淋巴细胞的募集和激活;以及花生四烯酸代谢物的分泌、P物质和活性氧中间体的生产。这些细胞因子和免疫细胞的作用会引发艰难梭菌感染的临床症状。例如,肥大细胞脱颗粒刺激组胺释放,增加肠道屏障的通透性,导致大量液体流失到管腔中,从而引发严重的腹泻、痉挛、脱水和伪膜性肠炎等症状。
艰难梭菌的各种毒力因子

Buddle JE,et al.Virulence.2023
2
产毒艰难梭菌及我国的流行情况
目前已鉴定出几十种艰难梭菌菌株,其相对比例在过去几年中迅速变化,且毒力和感染能力可能存在差异。我们这里简单介绍几种高毒性艰难梭菌菌株以及我国的主要流行情况。
◮ 毒力较高的艰难梭菌
⑴027菌株
027菌株是近年来备受关注的高毒力菌株,部分027菌株在体外能够产生更多毒素,并且更容易与人类肠道上皮细胞结合,通常与严重腹泻和高死亡率相关。该菌株在北美和欧洲的医院中广泛传播,成为医院获得性腹泻的主要原因。
⑵017菌株
这种菌株在1990年代首次被识别,主要在亚洲地区流行。017菌株通常被认为是毒素A阴性、毒素B阳性的菌株。由于毒素A检测通常用于识别粪便样本中的艰难梭菌,因此可能会遗漏这种菌株。
⑶078菌株
078介导的艰难梭菌感染患者更常见于靠近农场的地区,078菌株是食用动物中最常见的类型,在牛和猪中都有发现,人可能通过食用动物导致感染。078菌株的毒力特征与027菌株相似,所有027和078菌株似乎都具有完整的肌动蛋白特异性ADP核糖基化毒素。
⑷其他菌株
除了027、017和078菌株,还有其他核糖型的艰难梭菌菌株,如001、106和053等。然而每种核糖型的相对比例在过去几年中迅速变化。核糖型001的比例从25.1%下降到7.8%,核糖型106的比例从26.2%下降到20.2%,且106几乎只在英国发现。
◮ 我国的艰难梭菌流行情况

一项荟萃分析统计了我国大陆部分省份的艰难梭菌感染发病率及主要流行和耐药的艰难梭菌。
艰难梭菌在健康成年人结肠的定植率约为4%-7%,而国内腹泻患者的检出率为15%-40%(共分析了15,313个样本)。在中国大陆,ST-37(017)和ST-3是最普遍的菌株;幸运的是,ST-1(027)和ST-11(078)等高毒力菌株迄今很少出现。
并且不同省份的阳性率存在差异显著:
湖北:23%
河北:19%
安徽:19%
四川:17%
宁夏:4%
河南:3%
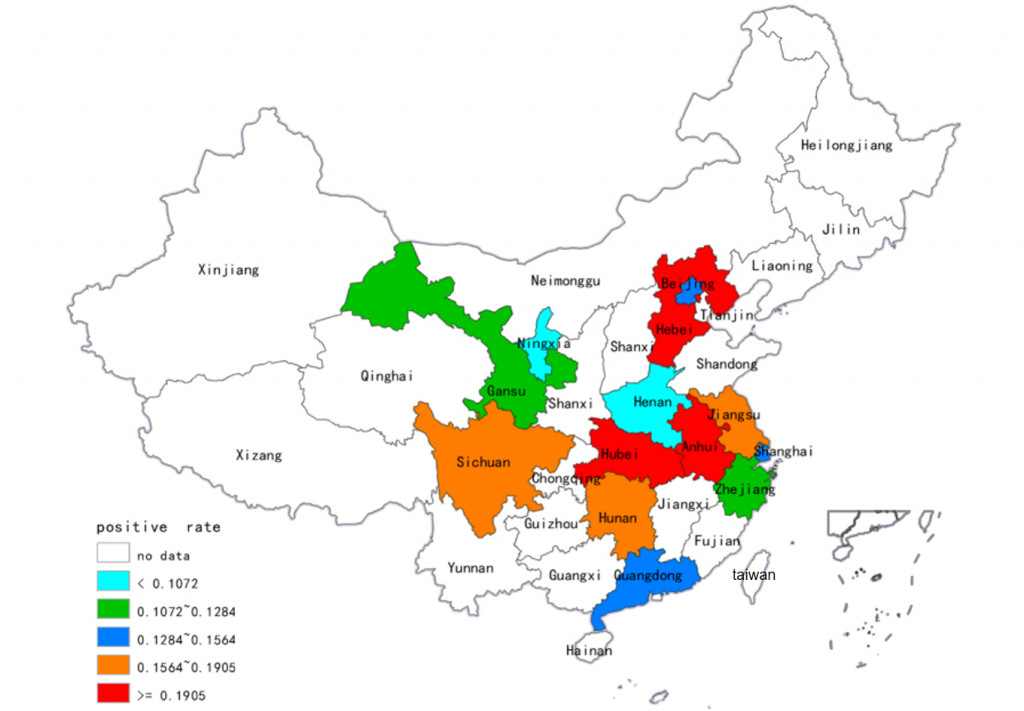
doi: 10.1038/srep37865.
中国临床艰难梭菌的分子特征
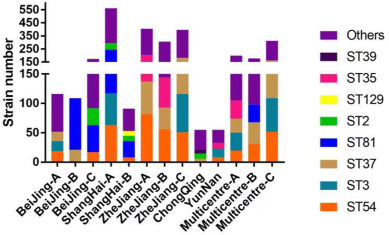
Wu Y,et al.Anaerobe.2022
中国大陆的流行艰难梭菌株并非高毒力类型,这可能是近年来没有艰难梭菌感染爆发的原因。此外,关于毒素A阴性和毒素B阳性菌株的报道逐渐增加,许多研究也发现了这一现象。在亚洲,毒素A阴性和毒素B阳性菌株的数量明显高于欧美国家。
◮ 我国的艰难梭菌耐药情况
我国的艰难梭菌对环丙沙星、克林霉素和红霉素的耐药率高于其他地区;然而,报道的艰难梭菌分离株均未对甲硝唑、万古霉素、替加环素或哌拉西林/他唑巴坦耐药。
3
非产毒艰难梭菌
◮ 菌株特性不同,不会致病
非产毒性艰难梭菌(NTCD)是指那些不产生致病毒素的艰难梭菌菌株。这些菌株能够在肠道中定殖,并且通常从无症状个体中分离出来。
非产毒性艰难梭菌菌株表现出与产毒性菌株不同的表型特征,如更高的甲硝唑耐药性和更高的孢子形成效率。
◮ 非产毒菌株定植可能具有保护作用
非产毒性艰难梭菌能够在肠道中定殖而不引起症状,并有研究发现其可能有助于降低由产毒性艰难梭菌引起的感染风险。研究表明,NTCD的定殖可以通过竞争性抑制机制,防止产毒性菌株的定殖和毒素产生。
临床应用与研究:在临床试验中,NTCD-M3等菌株已被用于预防艰难梭菌感染,通过诱导肠道和系统性免疫反应,从而减少产毒性艰难梭菌的附着和感染。
了解艰难梭菌感染的发病机制对于制定有效的疾病治疗和预防措施至关重要。让我们一起来看下人体是如何感染艰难梭菌以及感染后会出现的症状。
◮ 艰难梭菌主要通过孢子传播感染
艰难梭菌(C.difficile)作为一种专性厌氧菌,通常无法在大气中存活,那么它是如何传播到人体的呢?这是通过形成孢子来实现的,这些孢子即使在恶劣的环境条件下也能存活。除了提供对氧的抵抗力外,孢子还对紫外线、干燥、热、许多消毒剂和抗生素具有抵抗力。
注:艰难梭菌孢子已在各种环境来源中检测到,包括家畜、水源和土壤。
艰难梭菌感染的发病机制
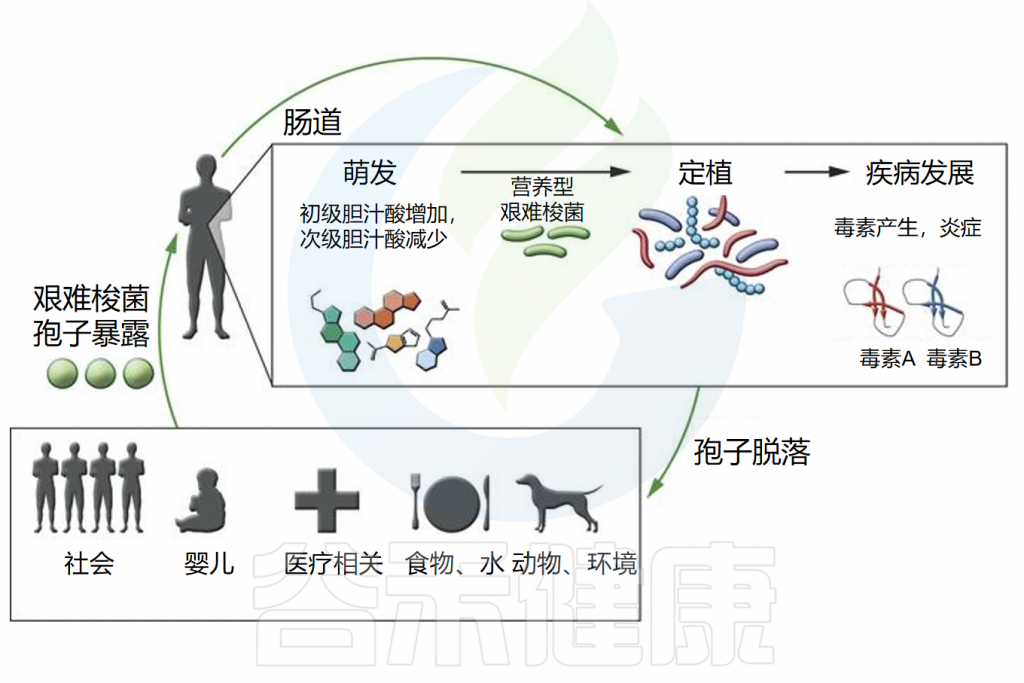
doi.org/10.1172/JCI72336.
1
感染过程
◮ 孢子生长必须依赖特定的胆汁酸
通过粪口途径摄入艰难梭菌孢子后,孢子需要发芽并生长为定植于胃肠道的营养细胞。然而,摄入孢子并不总是会导致定植,因为胃肠道环境必须适宜这一过程的发生。
体外研究表明,发芽和生长成营养形式取决于特定初级胆汁酸(如牛磺胆酸)的存在。相反,其他胆汁酸,如鹅去氧胆酸,可能会抑制艰难梭菌孢子的发芽。
胃肠道内的微生物在胆汁酸代谢中起关键作用,微生物群落的调节会影响代谢物的可用性。来自抗生素处理小鼠的盲肠提取物含有高水平的胆盐并促进孢子萌发,而来自未处理小鼠的盲肠提取物则没有。我们推测:抗生素的使用改变了肠道微生物群的代谢,导致胆汁酸种类更易促进艰难梭菌孢子的生长。
◮ 定植后毒素介导炎症和疾病
一旦定植,艰难梭菌会引发毒素介导的炎症和疾病。它产生两种主要毒素,即艰难梭菌毒素A和B(TcdA和TcdB),这些毒素在营养生长的静止期产生,主要导致粘膜上皮损伤和炎症反应。
另一种毒素,艰难梭菌二元毒素(CDT),会破坏肌动蛋白细胞骨架,研究表明其存在可能增加菌株的毒力。
由于孢子暴露和艰难梭菌定植不一定导致临床疾病,胃肠道微生物群和宿主在艰难梭菌的疾病发展中可能发挥重要作用。
2
艰难梭菌感染后的临床症状
产毒艰难梭菌菌株感染的临床表现通常从无症状携带到轻度或中度腹泻,或是暴发性,有时是致命的。症状在定植后不久开始,中位发病时间为2至3天。
◮ 常见的症状
腹泻:这是艰难梭菌感染最常见的症状,通常表现为水样腹泻,频率可达每天多次。腹泻可能伴有粘液或脓性分泌物。
腹痛和腹部不适:患者常感到腹部绞痛或不适,疼痛可能是间歇性的,且通常与腹泻发作相关。
发热:部分患者可能出现低热,体温通常在37.5°C至38.5°C之间。
恶心和食欲减退:患者可能会感到恶心,伴随食欲减退,进而导致体重下降。
脱水:由于频繁腹泻,患者可能出现脱水症状,如口干、尿量减少、皮肤弹性下降等。
腹胀:部分患者可能会感到腹部胀气或腹部膨胀。
◮ 严重并发症
在一些情况下,艰难梭菌感染可能导致更严重的并发症,包括:
伪膜性结肠炎:表现为严重的腹痛、腹泻和发热,肠道内形成伪膜。
肠穿孔:极少数情况下,感染可能导致肠道穿孔,表现为剧烈腹痛和急性腹膜炎。
中毒性巨结肠:具有全身中毒症状及全结肠或节段性结肠扩张的临床表现。是一种危及生命的并发症,表现为腹痛、腹胀、腹泻和全身症状加重,可能需要手术干预。
◮ 肠外表现
艰难梭菌感染不仅会导致肠道相关的症状,还可能引发一些肠道之外的表现,包括脱水、电解质紊乱、低白蛋白血症、低血压、肾功能衰竭、全身炎症反应综合征、关节炎、菌血症、败血症甚至死亡。
感染的核心是肠道菌群平衡被破坏
艰难梭菌感染发病机制的核心是微生物群的破坏。健康的肠道微生物群对于防止病原体定植(称为定植抗性)至关重要 。
未被破坏的微生物群能够抵抗病原体的定植,健康平衡的微生物和宿主因子均可抑制艰难梭菌的发芽和生长。同时微生物群和宿主免疫系统之间的串扰导致调节免疫反应。此外,微生物群可以刺激抗菌肽和分泌型IgA的产生,从而维持微生物群的组成。并且已经提出了多种机制来解释为什么微生物群被破坏会导致定植抗性丧失,包括营养竞争、生态竞争和生态位排斥。
而由于抗生素使用、药物、年龄变化、饮食或炎症等因素导致微生物群的破坏,可导致艰难梭菌感染的发展。由于结构或代谢环境的变化,菌群失调会导致定植抗性丧失。特定群落成员的损失可能会影响微生物和宿主产生的代谢物的水平,从而促进孢子萌发和艰难梭菌生长。菌群失调也可能通过免疫调节的丧失和促炎状态导致免疫反应失衡,这两者都会影响疾病的发展。营养型艰难梭菌产生的毒素可刺激炎性细胞因子、中性粒细胞和抗毒素抗体的生成。
微生物群对CDI期间病原体抗性和宿主的机制
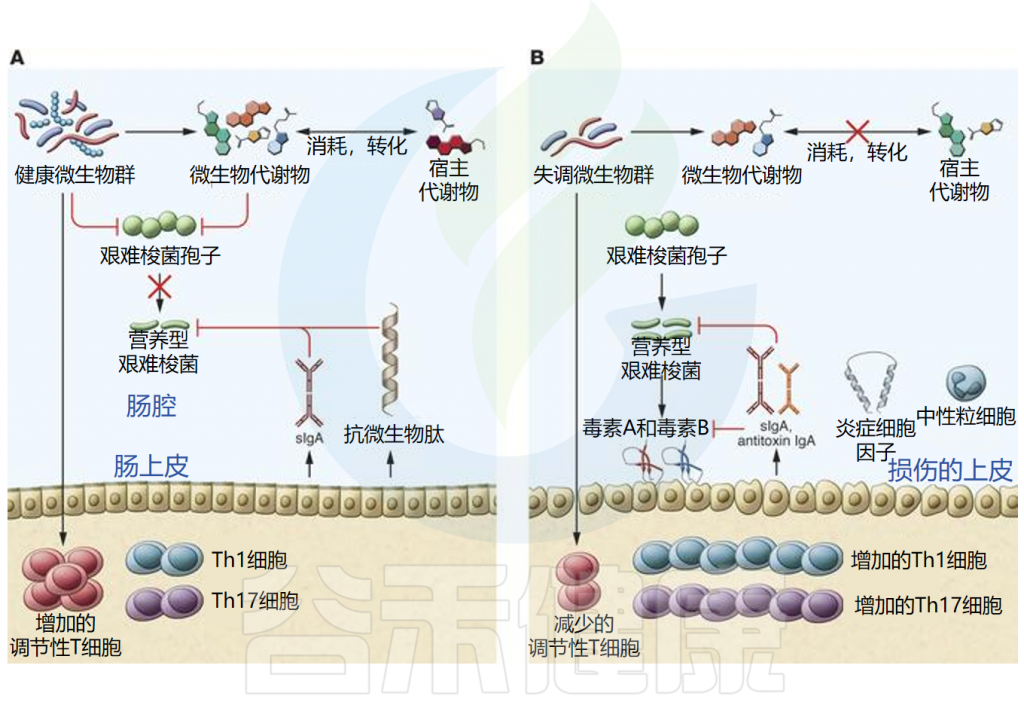
doi.org/10.1172/JCI72336.
据研究文献报道,以下这些因素会增加获得CDI的风险。
1
使用抗生素
◮ 使用过抗生素的人患病率更高
使用抗生素是艰难梭菌感染中最常见的诱发因素。一项大型回顾性研究分析了10154例艰难梭菌感染患者的数据,发现78%的患者在感染前3个月内使用过抗生素。
大多数抗生素都与艰难梭菌感染(CDI)发展相关,但最常见的药物包括青霉素、头孢菌素和氟喹诺酮类药物。在一项关于社区获得性CDI中抗生素使用情况的荟萃分析中,克林霉素发生社区获得性CDI的风险最高,然后依次是氟喹诺酮类药物、头孢菌素类、青霉素类、大环内酯类和磺胺类/甲氧苄啶类。
◮ 使用抗生素导致肠道微生物平衡被破坏增加艰难梭菌感染的风险
抗生素的使用,尤其是广谱抗生素,会显著改变肠道微生物群的组成和多样性,导致微生物群失调。这种失调主要表现为有益菌群(如双歧杆菌、乳酸菌等)数量减少,抑制艰难梭菌的生长和毒素产生的能力减弱,导致更易感染艰难梭菌。
艰难梭菌感染的发病机制
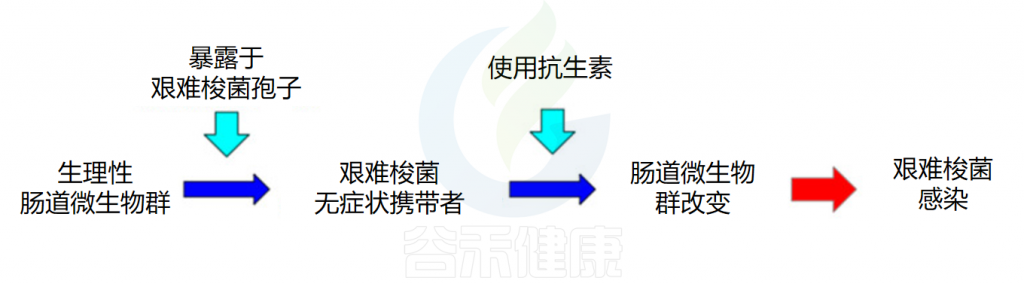
Piccioni A,et al.Int J Mol Sci.2022
2
高龄
◮ 高龄人群CDI的患病率和死亡率更高
正如多项研究所记录的那样,高龄是CDI的重要风险因素。65岁及以上的老人患病人数显著增加,人口发病率比其他年龄组高5倍以上。
并且还发现CDI的死亡率随着年龄的增长而显著升高。在2011年对美国CDI负担的最新研究中,发现65岁及以上的人大约占CDI病例总数的57%,但该年龄组的CDI死亡占CDI死亡总数的83%。
◮ 年龄增长免疫退化、微生物多样性下降
年龄增长会影响肠道微生物组结构。人类肠道微生物组在一生中经历显著变化,老年人群的微生物组多样性较低且不断变化。研究发现,老年人保护性物种(如双歧杆菌和部分厚壁菌门成员)减少,有害物种(如变形菌门)增加。这些变化与免疫系统退化(即免疫衰老)有关。
尽管年龄是CDI的独立危险因素,但其与抗生素使用增加、更频繁的医院就诊及疾病发展密切相关,这些因素共同提高了艰难梭菌的易感性。
新生儿与成人艰难梭菌感染的比较
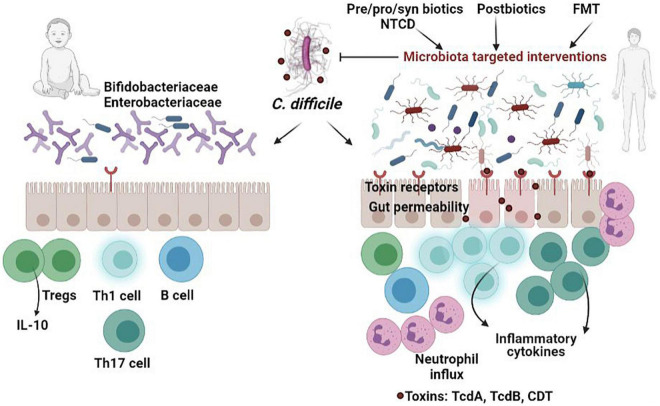
Vasilescu IM,et al.Front Microbiol.2022
3
其他胃肠道疾病
患有其他胃肠道疾病的患者也可能更容易感染艰难梭菌。炎症性肠病(IBD)已被证实是CDI的危险因素,并与更严重的疾病结果相关。IBD患者肠道菌群呈现多样性降低,同时存在以变形菌门为主的多种潜在致病菌。然而,这些微生物群落如何影响艰难梭菌易感性的具体机制较为复杂。
◮ 肠道炎症性疾病会促进艰难梭菌感染
宿主免疫反应能调节微生物群,而IBD加重CDI病情表明炎症可促进CDI发展。抗菌肽脂质运载蛋白-2和钙卫蛋白等炎症产物限制肠道环境中营养物质可用性,可能为艰难梭菌创造有利条件。肠道菌群类型影响粘膜IgA库,复发性CDI患者结肠活检中IgA产生细胞减少。
还观察到各种微生物会影响T细胞的亚群,例如梭菌属诱导Treg物种和分段丝状细菌诱导Th17细胞分化。这些微生物种群的调节,例如抗生素后,可能会影响艰难梭菌的定植。
4
其他风险因素
除此之外,还有一些因素也会增加艰难梭菌感染的风险。如:
医疗机构暴露:住院患者,特别是长期住院者,长期护理机构居住者容易艰难梭菌感染;
胃酸抑制剂使用:质子泵抑制剂(PPIs)和H2受体拮抗剂,降低胃酸可能导致艰难梭菌孢子存活率增加,长期使用与CDI风险增加相关。
手术和医疗操作:胃肠道手术、鼻胃管和胃肠营养管的使用、结肠镜检查会导致艰难梭菌感染风险升高;
营养状态不佳:低蛋白血症、营养不良的人群易感染艰难梭菌;
肥胖、癌症化疗也可能会增加艰难梭菌感染的风险。
肠道微生物群被破坏是艰难梭菌感染发病的关键机制。健康的肠道菌群对防止艰难梭菌定植和感染至关重要。那么,微生物群究竟如何在这一过程中发挥作用?那我们一起来看看。
艰难梭菌感染中的微生物群改变
正常的肠道菌群通过对艰难梭菌的定植抗性在预防 艰难梭菌感染中起着核心作用。这导致了一个问题,即是否存在一种微生物群紊乱模式,这种模式易导致艰难梭菌定植和感染。
◮ 菌群多样性降低,厚壁菌门增加
多项研究一致显示,与健康人群相比,艰难梭菌感染(CDI)患者的菌群复杂性和丰富度明显降低。这种多样性降低被认为是CDI发病和复发的关键因素。
厚壁菌门(Firmicutes)减少:CDI患者中厚壁菌门的丰度和多样性显著降低,尤其是瘤胃球菌科(Ruminococcaceae)和毛螺菌科(Lachnospiraceae)等保护性菌群。
拟杆菌门(Bacteroidetes)改变:CDI患者通常表现为拟杆菌门多样性降低,但有研究显示有症状患者中某些拟杆菌属(Bacteroides)可能增加。
变形菌门(Proteobacteria)增加:CDI患者体内变形菌门(特别是肠杆菌科)的比例明显增高。
◮ 产丁酸细菌减少,机会性病原体增加
接受多轮抗生素治疗的复发性CDI患者肠道微生物群组成遭受严重破坏。对比CDI患者、艰难梭菌阴性院内腹泻患者和健康对照受试者的远端肠道微生物群发现,艰难梭菌感染可能导致功能性菌群发生以下变化:
产丁酸盐细菌减少:包括罗氏菌属(Roseburia)、普拉梭菌(Faecalibacterium Prausnitzii)、假丁酸弧菌属等。
产乳酸细菌增加:特别是肠球菌属(Enterococcus)。
机会性病原体增加:研究发现,与健康者相比,白色念珠菌和光滑念珠菌在艰难梭菌阳性样本中更常见。
在艰难梭菌感染患者的肠道微生物群中,肠球菌、乳酸菌、大肠杆菌、肠杆菌、副拟杆菌、嗜粘蛋白阿克曼菌的相对丰度增加,以及粪杆菌、Roseburia、Blautia、Prevotella、链球菌的水平降低。
艰难梭菌感染相关的肠道微生物群失调

Vasilescu IM,et al.Front Microbiol.2022
生化和免疫紊乱影响感染
肠道菌群失调还引发多种生化和免疫紊乱:如短链脂肪酸(SCFA)水平降低、初级胆汁酸增多、碳水化合物可利用性提高、免疫功能受抑及竞争微生物缺乏。这些变化共同促进艰难梭菌的定植、孢子萌发和生长繁殖。
◮ 丁酸盐有助于减轻艰难梭菌毒素的损害
短链脂肪酸可以通过降低管腔pH值(对艰难梭菌不利)并通过产生粘蛋白和抗菌肽来刺激防御屏障。丁酸盐还可以通过稳定缺氧诱导因子-1(HIF-1)和增加紧密连接来保护肠道上皮免受艰难梭菌毒素的损害,抑制肠道炎症和细菌易位。
在小鼠的饮用水中添加丁酸盐,施用丁酸盐的前药、三丁酸甘油酯或富含菊粉的饮食(菊粉可以被肠道共生细菌发酵,产生短链脂肪酸,主要是乙酸盐、丙酸盐和丁酸盐)可使小鼠免受CDI的侵害。
◮ 胆汁酸会影响艰难梭菌的定植和生长
艰难梭菌孢子萌发由蛋白酶CspC和CspA感知胆汁盐和氨基酸复合物而调控。某些胆酸盐衍生物和甘氨酸可促进孢子萌发,而脱氧胆酸盐抑制艰难梭菌生长,鹅去氧胆酸盐则阻断牛磺胆酸盐介导的萌发过程。
共生肠道梭菌通过调节胆汁酸代谢产物,创造不利于艰难梭菌萌发和定植的环境。例如,Clostridium scindens能催化胆汁酸7α-脱羟基化,产生次级胆汁酸,增强对艰难梭菌感染的抵抗力。失去这类能将初级胆汁酸转化为具抗菌活性次级胆汁酸的微生物,将显著增加CDI风险。
◮ 艰难梭菌会刺激其他细菌产生吲哚造成不利肠道环境
最近的研究发现,CDI患者肠道腔中的吲哚水平增加(色氨酸代谢物参与微生物生长、毒力诱导、抗酸性、生物膜形成),艰难梭菌本身不能产生这种代谢物,但会刺激其他细菌产生吲哚,以阻止和抑制吲哚敏感菌株的生长和发展,包括保护性肠道微生物群代表, 从而确保有利于艰难梭菌生存的肠道环境。
微生物群介导艰难梭菌的定植和感染
一些人群中虽然有艰难梭菌定植,但并不会出现致病症状,这可能与肠道微生物群的保护作用相关。
◮ 婴儿艰难梭菌的定植率较高,但很少出现症状
由于婴儿肠道的不成熟和肠道微生物群的不稳定,其特别容易受到艰难梭菌定植的影响,但并不会出现症状和发展为疾病。
在<1个月大的婴儿中,艰难梭菌的平均定植率为 37%,范围在0到61%之间。在1到6个月大之间,定植率仍然很高,为30%,出生后第一年结束时下降到约10%。不同研究报告的12个月以下儿童的定植率从14%到71%不等,这个年龄组最常被艰难梭菌定植,并且他们没有症状。
无症状携带率在3岁左右下降至0-3%,接近成人水平。同时,出生至24个月间血清针对毒素A和B的IgG抗体浓度逐渐升高。3岁左右,儿童肠道微生物群趋于稳定并具备成人特征,这可能导致症状性CDI从该年龄开始增加。
注:新生儿微生物群以革兰氏阳性球菌、肠杆菌科或双歧杆菌科为主,逐渐过渡到以双歧杆菌科为主。双歧杆菌可通过上调肠道树突状细胞产生IL-10,解释了艰难梭菌定植婴儿无症状的原因。在剖宫产新生儿中,T细胞和CD4+辅助性T细胞水平降低,可能因未成熟的免疫系统无法激活炎症反应所致。
研究发现,配方奶喂养婴儿的艰难梭菌定植率高于母乳喂养婴儿,且母乳喂养婴儿的菌落计数明显更低,这可能与母乳中含有毒素A和B的抗体有关。
总之,新生儿艰难梭菌定植的高携带率可以用新生儿肠道的不成熟和肠道微生物群的存在来解释。然而,出生后的母乳喂养带有毒素抗体,加上艰难梭菌毒素受体的缺乏,可以帮助婴儿免受艰难梭菌毒素的有害影响。
◮ 肠道微生物多样性降低的人群和老年人更易受艰难梭菌影响
几项研究还比较了老年人群的肠道微生物样本,这些人群更容易受到艰难梭菌影响。
老年艰难梭菌感染患者的肠杆菌科、肠球菌属和乳酸杆菌的数量较高,而健康的老年人携带更多样化的拟杆菌属菌株。并且与任一老年人群相比,健康成年人也更有可能拥有更多的双歧杆菌和拟杆菌。最近使用16S rRNA 基因高通量测序的研究更深入地研究了艰难梭菌阳性人群的群落结构。观察到,与健康患者相比,活动性CDI患者的肠道微生物群多样性较低。
类似研究发现,与健康成人相比,CDI腹泻患者的肠道微生物群多样性显著降低,尤其是厚壁菌门的多样性较低。健康人群中以Lachnospiraceae、Ruminococcaceae和Bacteroidaceae为主导,而CDI和非CDI腹泻患者的微生物群落高度相似,表明腹泻或炎症可能与特定微生物群落相关。
在小鼠模型中进行了类似观察,与人类相似,抗生素降低了小鼠肠道微生物群多样性,使其更易患肠道疾病,包括CDI。研究发现,头孢哌酮、克林霉素或多种抗生素处理后,易感小鼠感染前以乳酸菌科和肠杆菌科为主,而对CDI具有保持抗性的动物以Lachnospiraceae为主。后续研究表明,被Lachnospiraceae定植的小鼠比被大肠杆菌定植的小鼠艰难梭菌定植减少且病情较轻。小鼠模型为识别CDI保护性成分提供了可测试的方法。
◮ 复发性CDI:微生物群恢复不完全
艰难梭菌感染(CDI)最常见的并发症是恢复不完全和反复感染。初次感染后复发率约为20-30%,3次感染后高达60%。研究发现,复发患者的微生物群多样性低于单次CDI患者,这表明可能可以根据感染期间存在的微生物群落预测复发。尽管一些研究在分析中包含了复发样本,但尚未确定复发性CDI患者特有的微生物特征。
另外有研究发现,复发性CDI患者体内初级胆汁酸浓度较高。粪菌移植后,次级胆汁酸浓度增加,接近健康供体水平,而这些酸在FMT前样本中未检测到。该结果与体外和小鼠研究一致,表明次级胆汁酸(如石胆酸和脱氧胆酸)可抑制艰难梭菌生长。尽管细菌群落决定代谢环境,但不同细菌群落可能通过相似功能实现相同代谢结果,仅靠群落结构可能不足以预测复发风险。
如何定义艰难梭菌感染病例?
只有产生毒素的产毒艰难梭菌菌株才具有致病性。根据欧洲临床微生物学和传染病学会(ESCMID)指南,CDI定义为:(i)符合CDI的临床表现,且粪便中检测到毒素A或毒素B的艰难梭菌,且无其他腹泻原因;或(ii)伪膜性结肠炎(PMC)患者。
美国医疗保健流行病学学会和美国传染病学会的定义类似:CDI病例需具备症状(通常为腹泻),且粪便检测产毒艰难梭菌或其毒素阳性,或结肠镜或组织病理学显示PMC。
那我们该如何检测艰难梭菌感染(CDI)?艰难梭菌感染检测通常包括以下方法:
1
临床评估
•症状:难梭菌感染病的主要症状包括腹泻(每天3次或以上稀便,持续2天以上)、腹痛、发热、恶心和脱水等。严重病例可能出现伪膜性结肠炎(PMC)、中毒性巨结肠或感染性休克。
•病史:重点关注患者的抗生素使用史(尤其是第三代头孢菌素、氟喹诺酮类等)、住院史、免疫抑制状态以及质子泵抑制剂(PPI)的使用。
2
实验室检测方法
◮ 细菌培养
用环丝氨酸头孢西丁果糖琼脂培养基(CCFA)等进行厌氧培养,需时72小时,灵敏度高且可获得菌株,但不能检测毒素不能区分非产毒株。
但分离菌株后,可以通过直接从菌落悬浮液或细菌生长的肉汤上清液中检测其体外毒素的产生来确定其致病潜力。
◮ 高通量测序
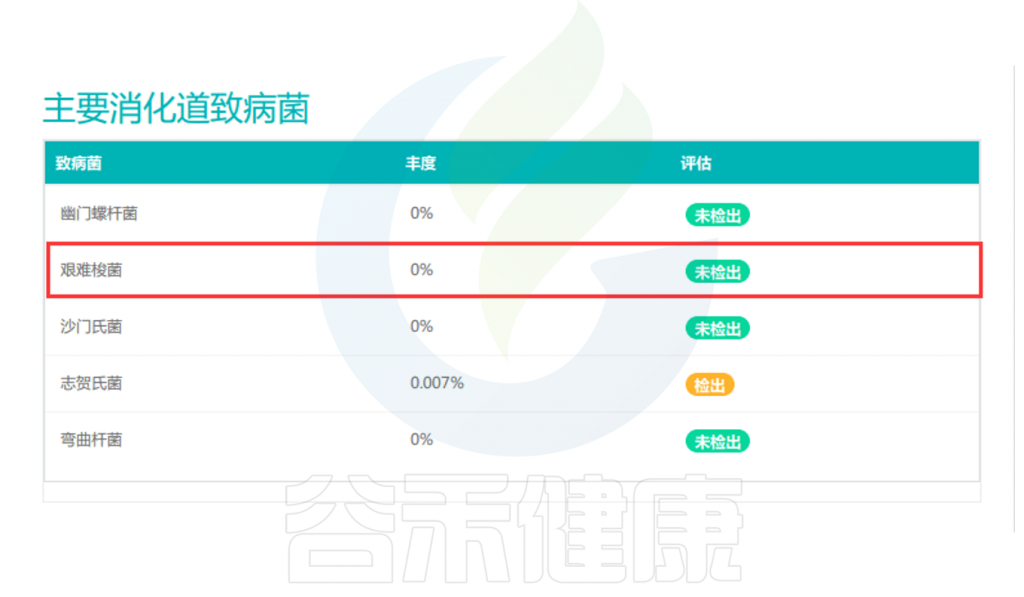
高通量测序可检测艰难梭菌菌株或毒力基因,16S测序仅能分辨到物种层面,可通过谷禾16S健康报告的解读,并结合自身有没有腹泻症状。然后进一步去判别是否存在产毒菌株。
与此同时,宏基因组测序(包括一些靶向的测序)则可识别毒力基因。
◮ 谷氨酸脱氢酶测定
谷氨酸脱氢酶(GDH)是所有艰难梭菌菌株表达的代谢酶,可通过ELISA或免疫层析法检测。阳性结果仅表明存在艰难梭菌,无法判断其是否产毒。由于其高阴性预测值(NPV,80.0%-100%),GDH阴性结果通常可排除感染,常用于初筛。
◮ 毒素检测
细胞毒性测定被认为是检测艰难梭菌的游离毒素(主要是毒素 B)的参考方法。
酶联免疫吸附试验(EIA):检测艰难梭菌毒素A或毒素B,快速但敏感性较低。
细胞毒素中和试验:检测毒素活性,敏感性和特异性较高,但耗时较长。
◮ 核酸扩增检测(NAATs)
实时PCR或环介导等温扩增法(LAMP) :检测艰难梭菌毒素基因,耗时短,敏感性高,但可能检测到无症状定植者,且成本高。
3
综合算法
根据欧洲临床微生物学和传染病学会(ESCMID)指南,推荐使用两步或三步算法:
初筛:谷氨酸脱氢酶(GDH)抗原检测或核酸扩增试验(NAAT)。
确认:毒素检测(EIA或细胞毒素试验)。
4
其他辅助检查
血常规:轻、中度感染者外周血白细胞可正常,严重感染者白细胞升高。
降钙素原(PCT):对诊断CDI意义不大,但PCT>0.2 ng/ml时,提示CDI有重症化趋势。
腹部CT:对重症CDI患者有辅助诊断意义,即结肠壁增厚、结节状结肠袋增厚、水肿厚度>4 cm,特别是炎症部位在升结肠。
内镜检查:内镜检查可作为辅助诊断,典型征象包括黏膜充血、水肿、糜烂、溃疡、直肠乙状结肠有多发性隆起的斑片或融合为大片的灰绿色、黄褐色伪膜覆盖黏膜表面。部分患者表现可不典型,尤其炎症性肠病合并艰难梭菌感染时多无特征性病变。伪膜性改变可能表明感染了产毒艰难梭菌。
艰难梭菌感染(CDI)的治疗包括针对细菌(抗生素)、针对毒素(抗体、结合剂)、宿主反应(调节炎症)或微生物群(保护或恢复)的方法,以及在暴发性病例或非手术方法失败的情况下,结肠切除术或其他侵入性较小的手术。选择取决于疾病严重程度、病史和宿主因素。
1
针对细菌——抗生素
停用有问题的抗生素以恢复正常肠道菌群是治疗CDI的理想方法。但在感染负担高或需持续抗生素治疗其他感染时,通常需要使用针对艰难梭菌的抗菌药物。
然而,几乎所有抗生素,包括针对艰难梭菌的药物,都可能进一步破坏肠道微生物群,延迟耐药性菌群的恢复,并增加再次感染的风险。目前用于治疗CDI的主要抗菌药物包括:
•万古霉素:万古霉素是美国食品药品监督管理局(FDA)批准的第一种CDI药物。最近的临床试验数据表明,万古霉素在治疗重症时优于甲硝唑。
•甲硝唑:与万古霉素的疗效相当,成本优势以及对万古霉素耐药肠球菌传播的担忧,甲硝唑成为CDI的推荐药物。但随着艰难梭菌流行菌株 BI/NAP1/027/III 的出现,甲硝唑治疗失败的报道越来越多。
•非达霉素:非达霉素也是获得FDA批准的其他治疗CDI药物。
•新型小分子抗菌剂:乳酸菌素3147是一种由乳酸乳球菌产生的双组分抗生素,它靶向细胞壁前体脂质II,抑制肽聚糖的生物合成,并在细胞膜上形成孔,实现细胞死亡。粪便发酵模型证明了乳酸素 3147 对一系列艰难梭菌分离株的强效细胞杀伤活性,在 30 分钟内完全消除艰难梭菌。
与传统药物相比,这种窄谱抗菌药物可能具有多种优势,包括减少对微生物组的影响、降低复发率、优于常规治疗以及改善药代动力学特征。然而,在保持非孢子形成厌氧菌和总革兰氏阴性厌氧菌完好无损的同时,这种抗菌剂对乳酸杆菌和双歧杆菌产生了负面影响。
2
针对毒素——阻断、中和毒素
CDI的发病机制以毒素介导为主,因此中和或阻断毒素是合理策略。但尽管抗毒素在动物模型中可改善疾病,但在人类中仅表现为减少复发性CDI。
•单克隆抗体:一项随机双盲安慰剂对照研究评估了针对艰难梭菌毒素A和B的两种中和单克隆抗体。在200名参与者中,治疗组的CDI复发率显著低于安慰剂组。然而,单克隆抗体未能缩短腹泻持续时间、降低严重程度或减少住院时间。住院、年龄较大、有严重潜在疾病或重症CDI的患者对治疗反应较差。
•Tolevamer:Tolevamer 是一种高分子量苯乙烯磺酸盐聚合物,可在体外中和艰难梭菌毒素。一项针对轻中度疾病的研究显示,6克剂量的Tolevamer与每日500毫克万古霉素疗效相当。
注:然而,Tolevamer的临床成功率低于甲硝唑和万古霉素。汇总分析显示,Tolevamer组的临床成功率为44.2%,显著低于甲硝唑组的72.7%和万古霉素组的81%。随着疾病严重程度增加,Tolevamer的疗效进一步下降。
•免疫球蛋白(IG):在人体研究中,针对毒素A和B的血清IgG抗体与保护相关,静脉注射IG治疗复发性或重症CDI的效果尚无系统研究支持,仅有少量病例报告和系列报道提供个案证据。剂量、给药次数和间隔存在较大差异。静脉注射IG对临床效果的差异可能与人群中抗毒素抗体水平的不可预测性有关。
3
微生物疗法
肠道微生物群的扰动是艰难梭菌感染(CDI)发生的关键因素。一些抗生素治疗无症状感染会导致艰难梭菌持续脱落和复发风险增加。通过特定微生物群恢复受损的肠道微生物群,已成为打破CDI-抗生素-CDI循环的策略。
• 粪菌移植的治疗效果优于仅用抗生素
粪菌移植(FMT)或微生物群替代疗法的原理是通过正常供体的粪便恢复CDI患者受损的肠道微生物群。系统评价显示,CDI患者接受FMT的腹泻消退率约为77%-90%。
一项随机对照试验比较了粪菌移植(FMT)与两种对照方案。FMT组在口服万古霉素(500mg,每天4次)4-5天后接受移植,对照组则接受14天相同剂量的万古霉素治疗。结果显示,FMT组3个月症状消退率为81%,显著高于万古霉素组(31%)和万古霉素加灌肠组(23%)。
尽管FMT已使用数十年,但其对严重复杂CDI的疗效、免疫功能低下患者的安全性及不明供体粪便长期安全性仍存疑。据报道,28.5%的患者出现FMT相关不良事件,最常见为腹部不适和排便异常,具体取决于给药途径。
• 口服微生物组疗法—SER-109
SER-109是一种由活性厚壁菌门细菌孢子组成的口服微生物组疗法,用于降低艰难梭菌感染复发风险。其机制可能通过与艰难梭菌竞争必需营养物质或调节胆汁酸谱来重建定植抵抗力,或两者兼具。
进行了一项3期、双盲、随机、安慰剂对照试验,其中艰难梭菌感染发作3次或以上(包括符合条件的急性发作)的患者在标准护理抗生素治疗后接受SER-109或安慰剂(每天4粒胶囊,持续3天)。
结果显示,在接受标准护理抗生素治疗后艰难梭菌感染症状消退的患者中,口服SER-109在降低复发感染风险方面优于安慰剂。
以微生物群为中心的治疗方法

Vasilescu IM,et al.Front Microbiol.2022
4
手术干预
艰难梭菌感染(CDI)的手术治疗通常用于严重或复杂病例,尤其是当药物治疗(如抗生素或粪便微生物群移植)无效,或患者出现危及生命的并发症时。以下是艰难梭菌感染的主要手术治疗方法:
• 全结肠切除术
适应症:严重的中毒性结肠炎、肠穿孔或肠坏死;严重的腹腔感染(腹膜炎),药物治疗无效且病情迅速恶化。
优点:快速去除感染源,降低死亡风险。
缺点:创伤较大,术后恢复时间长,可能影响生活质量。
• 分段结肠切除术
适应症:感染局限于结肠的某一部分。
优点:保留更多的肠道功能。
缺点:感染可能扩散,手术效果不如全结肠切除术稳定。
• 回肠造口术联合结肠灌洗
适应症:不适合全结肠切除的高危患者(如老年人或伴有多种合并症)。
优点:创伤较小,适合高危患者。
缺点:疗效可能不如全结肠切除术。
• 腹腔引流术
适应症:腹腔内脓肿或局部感染。
优点:辅助治疗,减轻感染负担。
缺点:仅适用于局部并发症,不能根治感染。
5
噬菌体疗法
噬菌体疗法利用天然噬菌体感染并裂解病原菌,是应对抗菌药物耐药性危机的潜在治疗方法。与抗生素不同,噬菌体具有进化能力,可持续克服细菌的抗性机制,从而避免疗法过时。
• 噬菌体可以降低艰难梭菌的生长和毒素水平
一些噬菌体在治疗艰难梭菌感染中表现出潜力。例如,ФCD27在CDI分批发酵模型中可显著降低艰难梭菌的生长和毒素水平。一种噬菌体组合已在体外完全裂解艰难梭菌,并在小鼠模型中减轻疾病症状和细菌定植。该组合进一步优化为4种噬菌体,成功在发酵容器中彻底根除艰难梭菌,显示出作为治疗选择的可行性。
总体而言,特异性以及对抗细菌耐药性的能力表明噬菌体治疗作为艰难梭菌治疗剂的巨大前景。
6
通过疫苗预防艰难梭菌感染
随着艰难梭菌感染(CDI)的发病率、死亡率和医疗成本不断上升,预防疾病的免疫接种成为理想选择。人类研究表明,对艰难梭菌毒素的强体液反应可减少复发和无症状定植。目前,多种候选疫苗正在开发中,包括基于类毒素、重组毒素肽、DNA和表面蛋白抗原的疫苗,但大多处于临床前阶段。
• 疫苗有助于减少复发和无症状定植
已发现部分纯化的类毒素A和B疫苗在30名健康成人中具有安全性和免疫原性,≥90%的受试者对两种毒素产生血清抗体反应。在一项试点研究中,3名多次复发CDI患者在第0、7、28和56天接受类毒素肌肉注射,其中2人对毒素A和B的IgG水平显著升高,且3人均在疫苗接种后停用万古霉素,随访6个月无复发。
两项2期试验已完成,测试疫苗在高危中老年人和首发CDI患者中的效果。一项3期试验正在17个国家中进行,计划评估疫苗在多达15,000名参与者中预防首发CDI的效果。其他候选疫苗包括基因和化学修饰的全长TcdA和B及重组融合蛋白IC84,其1期研究已完成,但结果尚未公布。
7
通过益生菌预防艰难梭菌感染
• 益生菌有助于预防艰难梭菌定植及相关腹泻
多项小型研究及荟萃分析表明,益生菌的使用可能与预防艰难梭菌相关腹泻有关。益生菌通常通过抑制艰难梭菌定植、调节肠道微生物群和胆汁酸代谢、破坏细胞壁和细胞膜、下调炎症反应、改善肠道屏障功能以及缓解病原性结肠炎来预防和治疗CDI。
最常研究的益生菌为嗜酸乳杆菌和双歧杆菌属。最近,一项多中心、随机、双盲、安慰剂对照研究测试了含嗜酸乳杆菌和双歧杆菌(双歧双歧杆菌和乳双歧杆菌)的高剂量益生菌制剂对≥65岁接受抗生素治疗患者的疗效。1,493名受试者接受益生菌,1,488名接受安慰剂。分析显示,益生菌组发生抗生素相关性腹泻和艰难梭菌感染的数量少于安慰剂组。
• 益生菌发挥抗菌活性抑制艰难梭菌定植
短双歧杆菌(YH68)通过抑制生长、孢子形成、毒力发生及毒力基因表达,展现出抗艰难梭菌活性,并增强抗艰难梭菌抗生素的体外效果或预防体内临床表现。
克劳氏芽孢杆菌和罗伊氏乳杆菌可分泌直接抑制艰难梭菌的可溶性化合物,而Clostridium scindens等产生次生胆汁酸的菌体可增强艰难梭菌的定植抗性。
此外,研究发现了一些可能有效的新型益生菌和制剂,如:
Bacteroides thetaiotaomicron,
E.thailandicus strain d5B,
B.amyloliquefaciens C-1,
B.longum JDM301,
Pediococcus pentosaceus LI05,
B.breve (YH68)
未来需要更大样本量的多中心双盲研究,以明确益生菌在CDI中的作用,同时考虑菌株和抗菌剂类型等因素。
艰难梭菌感染作为一种全球性公共卫生挑战,其发病率和医疗负担正不断攀升。通过本文的系统介绍,我们可以了解到,艰难梭菌感染的致病性主要取决于其产生的毒素,而非仅仅是菌株的存在。
健康的肠道微生物群在预防艰难梭菌感染中扮演着至关重要的角色,肠道微生物平衡的破坏是导致感染风险增加的关键因素。随着科学研究的深入,我们对艰难梭菌的检测、诊断、治疗和预防手段也在不断完善,从传统抗生素到粪菌移植、益生菌干预和疫苗开发等多元化策略均显示出积极成效。
了解艰难梭菌感染的本质和发病机制,对于临床医生制定合理治疗方案、减少不必要的抗生素使用以及患者接受适当预防措施至关重要。希望在未来研究的推动下,我们能够进一步降低艰难梭菌感染的发病率和复发率,减轻其对公共健康的威胁。
注:本账号内容仅供学习和交流,不构成任何形式的医疗建议。
主要参考文献
Buddle JE, Fagan RP. Pathogenicity and virulence of Clostridioides difficile. Virulence. 2023 Dec;14(1):2150452.
Piccioni A, Rosa F, Manca F, Pignataro G, Zanza C, Savioli G, Covino M, Ojetti V, Gasbarrini A, Franceschi F, Candelli M. Gut Microbiota and Clostridium difficile: What We Know and the New Frontiers. Int J Mol Sci. 2022 Nov 1;23(21):13323.
Wu Y, Wang YY, Bai LL, Zhang WZ, Li GW, Lu JX. A narrative review of Clostridioides difficile infection in China. Anaerobe. 2022 Apr;74:102540.
Arcay R, Barceló-Nicolau M, Suárez L, Martín L, Reigada R, Höring M, Liebisch G, Garrido C, Cabot G, Vílchez H, Cortés-Lara S, González de Herrero E, López-Causapé C, Oliver A, Barceló-Coblijn G, Mena A. Gut microbiome and plasma lipidome analysis reveals a specific impact of Clostridioides difficile infection on intestinal bacterial communities and sterol metabolism. mBio. 2024 Oct 16;15(10):e0134724.
Vasilescu IM, Chifiriuc MC, Pircalabioru GG, Filip R, Bolocan A, Lazăr V, Diţu LM, Bleotu C. Gut Dysbiosis and Clostridioides difficile Infection in Neonates and Adults. Front Microbiol. 2022 Jan 20;12:651081.
Maslanka JR, Gu CH, Zarin I, Denny JE, Broadaway S, Fett B, Mattei LM, Walk ST, Abt MC. Detection and elimination of a novel non-toxigenic Clostridioides difficile strain from the microbiota of a mouse colony. Gut Microbes. 2020 Nov 9;12(1):1-15.
Nibbering B, Gerding DN, Kuijper EJ, Zwittink RD, Smits WK. Host Immune Responses to Clostridioides difficile: Toxins and Beyond. Front Microbiol. 2021 Dec 21;12:804949.
Samarkos M, Mastrogianni E, Kampouropoulou O. The role of gut microbiota in Clostridium difficile infection. Eur J Intern Med. 2018 Apr;50:28-32.
Kelly CR, Fischer M, Allegretti JR, LaPlante K, Stewart DB, Limketkai BN, Stollman NH. ACG Clinical Guidelines: Prevention, Diagnosis, and Treatment of Clostridioides difficile Infections. Am J Gastroenterol. 2021 Jun 1;116(6):1124-1147.
Dawson LF, Valiente E, Wren BW. Clostridium difficile–a continually evolving and problematic pathogen. Infect Genet Evol. 2009 Dec;9(6):1410-7.

谷禾健康

群体感应(Quorum Sensing,QS)是一种细胞间的通讯机制,广泛存在于细菌、微生物以及某些多细胞生物中。通过这种机制,细胞能够感知周围环境中同类细胞的密度,并根据细胞数量变化调节基因表达和行为,这种现象在细菌中尤为显著。
在胃肠道等竞争激烈且不断变化的环境中,微生物群已经开发出独特的相互交流方法。肠道菌群产生的群体感应分子调节多种细胞功能,例如毒力基因的表达、生物膜的形成、能力和孢子形成,通常仅在细胞数量达到一定密度时启动这些过程。
肠道细菌产生的群体感应分子在肠道微生物组内建立物种和菌株水平结构方面很重要,但也用于与宿主交流。
微生物之间的对话各不相同,范围从种间交流、自我对话或种内交流到来自一个属的细胞对另一个属产生的信号做出反应。无法产生自身通信信号的细胞正在“监听”其他细胞产生的信号,这种现象类似于为“窃听”。
肠道微生物群使用某些代谢物作为群体感应分子与肠上皮细胞(IEC)进行通讯。例如,金黄色葡萄球菌分泌多种毒力因子,这些因子操纵宿主的免疫系统以保护自身的生存。这些生存策略对宿主的影响通常表现为:
虽然我们目前还不知道哪些群体感应分子与肠道和感觉神经元有最直接的相互作用,但很多证据显示它们会影响我们的生理和心理健康。
例如细菌产生的信号多种多样,包括自诱导剂 (AI)、高丝氨酸内酯(HSL)、喹啉、肽、毒素和蛋白酶。这些信号分子激活细菌细胞壁中的特定受体,并触发细胞质中调节基因表达的传感器。
注:自诱导剂(sAutoinducers)是细菌在群体中相互交流的一种信号分子。它们通过细菌的分泌进入环境,并在细菌密度达到一定水平时被其他细菌重新摄取。它使细菌能够协调其行为,例如生物膜的形成、毒素的产生和其他群体行为。
高丝氨酸内酯(Homoserine Lactones, HSL)是一类特定类型的自诱导剂,主要在革兰氏阴性细菌中发现。当HSL达到一定浓度时,它们会与细菌细胞内的特定受体结合,激活基因表达的调节机制。这种调节可以影响细菌的生长、代谢和致病性等多种生物学过程。
目前,研究很多研究已经建议可以将群体感应分子可用作辅助诊断的生物标志物:
未来,应该有可能使用 QS 生物标志物来诊断神经和精神疾病,例如:焦虑和抑郁、重度抑郁症、精神分裂症、双相情感障碍、自闭症、强迫症等。
微生物群体感应(QS)可以被视为微生物群之间的伙伴关系或协议,本文主要分享和讨论了QS在肠道细菌和肠壁中带来的变化,并探讨和总结这些通信可能对中枢神经系统和心理健康产生的影响。
Interbacterial Communication
革兰氏阴性菌(Gram-Negative Bacteria)
细菌是一类单细胞微生物,它们需要通过各种方式来感知周围环境,并协调自身的行为。革兰氏阴性细菌就利用一类称为自诱导剂 (Autoinducers, AI) 的小分子物质来实现这种细胞间通信。
AHL:细菌间的通用密码
其中最著名的自诱导剂是AHL(N-酰基-高丝氨酸内酯N-Acyl,Homoserine Lactones, AHL)。AHL是一种小的中性脂质分子,由高丝氨酸内酯(Homoserine Lactone, HSL) 部分和4到18个碳原子的酰基侧链组成。
不同细菌产生的AHL可能有不同的酰基侧链长度和取代基,这使得细菌能够区分彼此释放的信号分子。
AHL的合成
AHL的合成需要依赖于S-腺苷甲硫氨酸(S-Adenosyl Methionine,SAM)作为底物,由LuxI或LuxM等合成酶催化产生。有些细菌只有一种AHL合成酶,而另一些细菌则拥有多种AHL合成酶,能够产生多种形式的AHL。
AHL的产生水平受到严格调控,取决于底物的可用性
一些缺乏LuxI型合成酶的细菌会拥有”孤儿”的LuxR型受体,这些受体能够检测到同一环境中其他细菌释放的AHL信号。例如,大肠杆菌(Escherichia coli) 中的SdiA和铜绿假单胞菌(Pseudomonas aeruginosa)中的QscR就是这类孤儿受体的代表。
这些LuxR型受体在不同细菌中高度保守,序列同一性可达67%-84%。它们不仅存在于大肠杆菌,还广泛分布于其他肠道细菌,如肠杆菌(Enterobacter)、柠檬酸杆菌(Citrobacter)、克罗诺杆菌(Cronobacter)、克雷伯菌(Klebsiella)、沙门氏菌 (Salmonella) 、志贺氏菌(Shigella) 中。
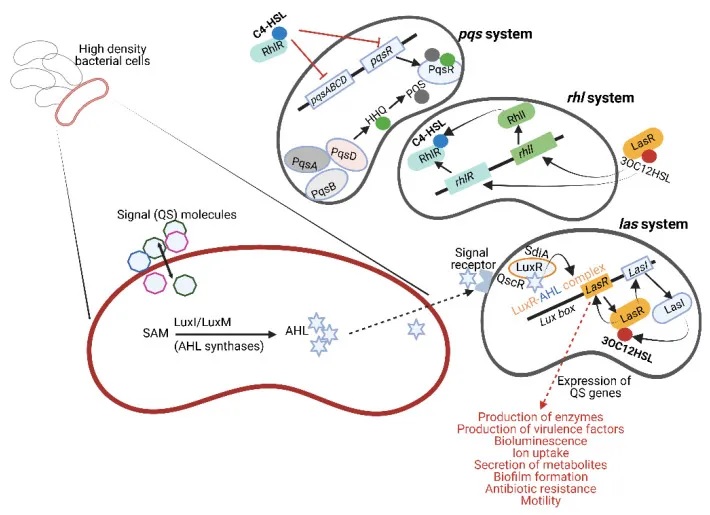
doi.org/10.3390/microorganisms10101969
大肠杆菌的多种群体感应系统及其生理调控
以致病性大肠杆菌(E. coli)为例,它利用多种QS系统来调控自身的生理过程:
其中,大肠杆菌的SdiA蛋白可以被铜绿假单胞菌产生的AHL信号分子激活。这种SdiA/AHL复合物能够增强大肠杆菌中与耐酸性相关基因的表达,对于肠出血性大肠杆菌(EHEC)在胃肠道低pH环境中存活至关重要。
此外,大肠杆菌还利用QS系统调控其毒力基因的表达、生物膜的形成、细菌运动性、III型分泌系统的活性,以及毒素和细菌纤毛的产生。
类似地,沙门氏菌的QS系统也参与调节其致病性,影响侵袭性基因的表达、鞭毛形成,以及与拉链侵袭机制相关的基因。
总之,细菌利用这些精细的群体感应系统,能够在复杂的环境中有效地感知周围情况,并协调自身的生理活动,从而增强其生存和致病能力。这种细菌间的通信机制对于理解细菌的生态和致病机制具有重要意义。
革兰氏阳性菌(Gram-Positive Bacteria)
除了革兰氏阴性菌使用自诱导剂(Autoinducer,AI)进行群体感应(Quorum Sensing, QS)外,革兰氏阳性菌也采用了一种独特的QS机制。
革兰氏阳性菌的独特群体感应机制
革兰氏阳性菌使用由5-17个氨基酸组成的小线性或环状寡肽(Quorum Sensing Peptide, QSP)进行细胞间通信。
其中,研究最多的是芽孢杆菌产生的QS系统,包括能力孢子形成因子(CSF)、五肽和七肽SDLPFEH(PapRIV)等。这些七肽是由48个氨基酸的前体肽经过NprB蛋白酶的裂解而形成的。
QSP在细胞膜上的ATP结合盒转运蛋白的帮助下被分泌到细胞外,并与膜结合的受体或细胞质传感器(如Rap、NprR、PlcR和PrgX蛋白)发生相互作用。
QSP系统在细菌中的实例
以金黄色葡萄球菌为例,其辅助基因调节因子(Agr)就是一个编码肽信号分子Agr的四基因操纵子,起到膜结合传感器的作用。Agr调节多种基因的表达,包括毒力因子、蛋白酶和成孔毒素等。
缺失agr基因(Δagr)的金黄色葡萄球菌菌株会形成生物膜,更容易引起慢性感染和菌血症。
另一种革兰氏阳性菌肠球菌也使用Fsr-QS系统,该系统由四个基因位点fsrABDC控制。一旦肽被裂解激活,就会通过跨膜激酶在细胞内进行磷酸化级联反应,从而诱导靶基因的表达。
总的来说,革兰氏阳性菌利用这种基于寡肽信号分子的QS系统,能够感知周围细菌的数量,并协调自身的生理活动,如毒力因子的表达、生物膜的形成等。这种细菌间的通信机制对于理解它们的生态和致病机制具有重要意义。
革兰氏阳性菌使用的群体感应的一般表示
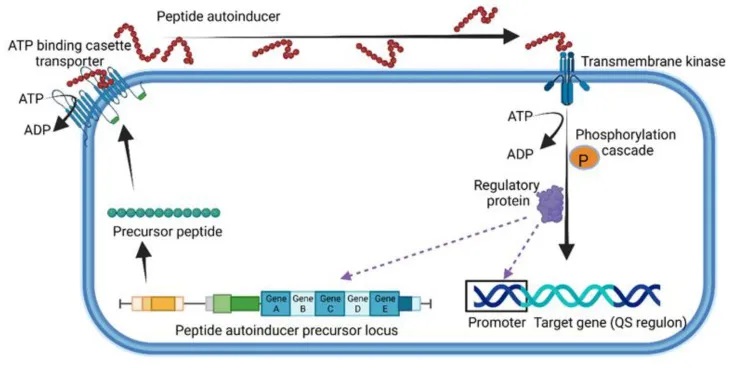
doi.org/10.3390/microorganisms10101969
Interspecies Communication
自身诱导剂-2 (Autoinducer-2, AI-2)是一种广泛存在于细菌中的信号分子,在细菌间的种间通讯和调节特定生物行为中起着关键作用。
AI-2的的合成途径
AI-2是一种呋喃硼酸酯二酯,既可以被革兰氏阴性菌,也可以被革兰氏阳性菌产生。它的合成受到luxS基因的调控。在这个过程中,首先S-腺苷同型半胱氨酸(SAH)被SAH水解酶(SahH)转化为同型半胱氨酸,然后经过Pfs和LuxS两步反应,形成中间体4,5-二羟基-2,3-戊二酮(DPD),最终重排成AI-2分子。
AI-2在细菌中的广泛分布
值得注意的是,在超过三分之一的细菌基因组中都能检测到编码luxS同源物的基因,包括大肠埃希菌(Escherichia coli)、粪肠球菌(Enterococcus faecalis)、空肠弯曲杆菌(Campylobacter jejuni)、金黄色葡萄球菌(S.aureus)、艰难梭菌(Clostridium difficile)、芽孢杆菌属(Bacillus)、链球菌属(Streptococcus)、福氏志贺氏菌(Shigella flexneri)、幽门螺杆菌(Helicobacter pylori)、鼠伤寒沙门氏菌血清型、伤寒沙门氏菌血清型、双歧杆菌属(Bifidobacterium)、乳酸菌属(Lactobacillus)、真杆菌属(Eubacterium)、罗氏菌属(Roseburia) 和瘤胃球菌属(Ruminococcus) 。
这表明:
AI-2系统在细菌的种间通讯中扮演重要角色
例如,大肠杆菌、肺炎链球菌等细菌就利用AI-2系统来调节编码细菌素产生的基因表达。
双歧杆菌也使用AI-2信号来对抗沙门氏菌的感染。此外,AI-2还可能参与调节细菌的运动性、生物膜形成等行为。
有趣的是,在肠道微生物群落中,AI-2信号也被用来帮助细菌应对胃肠道中的各种应激条件。研究发现,通过调控AI-2水平,可以在抗生素治疗后帮助恢复肠道微生物的平衡。但这需要谨慎控制,因为AI-2的细胞内水平受到LsrK激酶的调节。
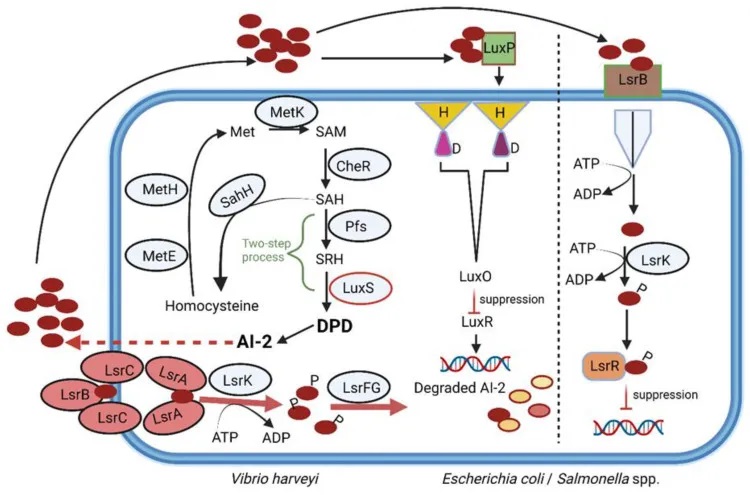
doi.org/10.3390/microorganisms10101969
AI-2在调节肠道微生物群中的应用
一种经改造的大肠杆菌菌株随着 AI-2 的产生增加,导致链霉素抑制的厚壁菌门恢复,并抑制拟杆菌门的生长。从这些发现可以推断,AI-2 可用于在抗生素治疗后恢复肠道微生物群的平衡。如果遵循这种策略,则必须仔细控制,因为 AI-2 的细胞质水平受 LsrK 激酶调节。
厚壁菌门和拟杆菌门种群的变化会改变 SCFA 的水平和组成,进而影响基因表达、细胞因子分泌和调节性 T 细胞诱导。所有这些变化都会影响炎症反应。因此,AI-2 水平的增加可以恢复厚壁菌门和拟杆菌门之间的平衡,并预防或逆转菌群失调、IBD、肥胖、自闭症和压力相关疾病。
利用AI-2来维持肠道微生物平衡,可以但需谨慎
一方面,AI-2确实可以帮助调节肠道细菌的行为,如影响细菌素的产生、生物膜的形成等。但另一方面,高浓度的AI-2也可能上调某些细菌的毒力因子,如增加粪肠球菌噬菌体的释放和基因转移。
在小鼠实验中,AI-2的给药虽然没有影响细胞因子的表达,但却加重了铜绿假单胞菌的肺部感染。这表明,单纯依赖AI-2来维持肠道稳态的做法可能会带来意想不到的后果。
AI-2受体的多样性及其生理影响
目前已经确定了两类AI-2受体,分别是LuxP和LsrB。这两种受体在结构上存在差异,序列相似性仅为11%。它们广泛分布于变形菌门、芽胞杆菌等细菌中。
其他肠道细菌可能也使用类似的受体来感知AI-2信号。有趣的是,有些细菌即使没有这些典型的AI-2受体,也能对AI-2产生反应,这可能涉及其他未知的感知机制。
此外,AI-2信号还可能影响细菌的耐药性等重要生理过程。同时,在结直肠癌相关肿瘤中也检测到AI-2水平的升高,这与肿瘤相关巨噬细胞中TNFSF9基因表达的增加相关。这提示AI-2可能是结直肠癌的一个重要生物标志物,值得进一步研究。
Interkingdom Communication
细菌利用复杂的群体感应系统来感知周围环境,并协调自身的生理活动。除了前面提到的自身诱导剂-2(AI-2)外,细菌还使用其他类型的信号分子进行细胞间通讯。
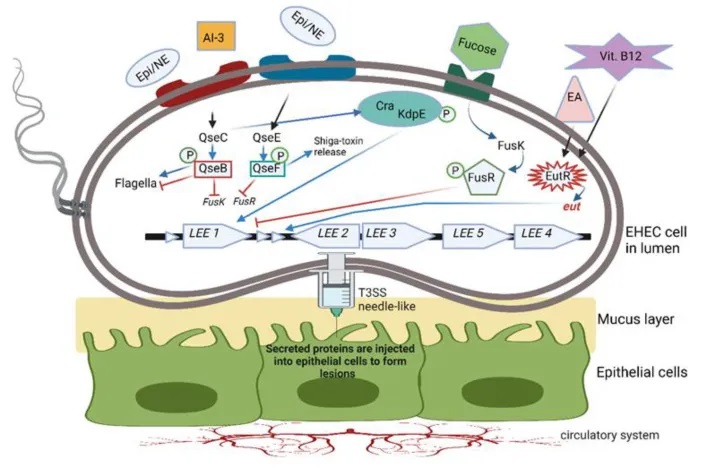
doi.org/10.3390/microorganisms10101969
AI-3信号系统在肠道病原体中的作用
其中,自身诱导剂-3(AI-3)/肾上腺素(Epi)/去甲肾上腺素(NE)界间信号系统在一些重要肠道病原体中发挥关键作用。这种信号系统可以促进鼠伤寒沙门氏菌、啮齿柠檬酸杆菌和肠出血性大肠杆菌(EHEC)等细菌的毒力基因表达。
以EHEC为例,它利用一种双组分QS系统(TCS)来感知和响应这些环境信号分子。该系统由QseBC和QseEF两个TCS组成。当EHEC感知到Epi、NE、AI-3、岩藻糖或乙醇胺等信号分子时,会激活跨膜组氨酸激酶受体,进而激活或抑制相应的反应调节因子。
例如,QseC组氨酸传感器可以激活QseB,QseB则调节鞭毛基因的表达,同时抑制参与岩藻糖代谢和毒力基因表达的fusK/-R基因。
QseC还可以磷酸化KdpE反应调节因子,与Cra蛋白一起刺激LEE操纵子中的基因,从而促进EHEC的黏附和毒力因子的注射。此外,QseC还可以激活QseF,进而诱导志贺毒素的产生。
细菌群体感应系统对宿主免疫的影响
另一方面,铜绿假单胞菌(P. aeruginosa)产生的 3-oxo-C12-HSL(下图)在上皮细胞和免疫细胞中积极转运,并通过抑制编码紧密连接蛋白(TJ)的基因表达来破坏肠壁的通透性。这导致occludin、tricellulin、ZO-1、ZO-3、JAM-A、E-cadherin、β-catenin的重新排列(错位),并阻止粘蛋白的产生。
这不仅使上皮细胞受到感染,还会激活粘膜免疫系统,导致白细胞增加和促炎细胞因子的积累。此外,3-oxo-C12-HSL 还抑制肿瘤坏死因子 TNF-α 和 IL-12 的产生,导致 T 辅助细胞-1(Th1)反应功能障碍,并刺激 Th2 产生免疫球蛋白 G1。
抑制 Th1 和 Th2 T 淋巴细胞分化会增加细胞因子的产生 ,加剧氧化应激,刺激细胞凋亡并灭活线粒体。这些细菌间通信机制的研究,有助于我们更好地理解和预防细菌性疾病的发生。
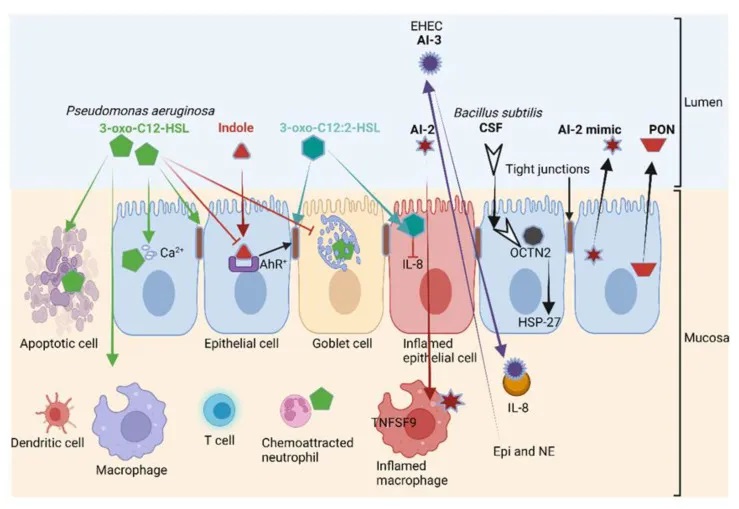
doi.org/10.3390/microorganisms10101969
铜绿假单胞菌产生的 3-oxo-C12-HSL诱导各种细胞类型(包括上皮细胞)的细胞凋亡;破坏紧密连接并减少粘蛋白的产生。
3-oxo-C12-HSL与3-氧代-C12:2-HSL对肠壁影响相反
结构相似的 3-oxo-C12-HSL、3-oxo-C12:2-HSL 对肠壁具有相反的作用。
3-oxo-C12:2-HSL不是破坏上皮细胞的稳定性,而是保护紧密连接蛋白occludin和tricellulin以及细胞质ZO-1免受促炎细胞因子(如干扰素-γ γ)、TNF-α和IL-8的侵害。
3-oxo-C12:2-HSL在肠道免疫细胞中的作用及对IBD的潜在影响
除了一些开创性研究外,3-oxo-C12:2-HSL 对人类肠道免疫细胞的影响在很大程度上仍然未知。
在诊断为IBD的患者中,3-oxo-C12:2-HSL的浓度要低得多。这表明 3-oxo-C12:2 HSL 在保护暴露于免疫冲击的上皮细胞中起重要作用。需要进一步的研究来确定 3-oxo-C12:2-HSL 是否可以用于治疗 IBD。这也需要更好地了解 3-oxo-C12:2-HSL 群体猝灭、AHL 裂解和高丝氨酸内酯(HSL)环水解所涉及的过程。
到目前为止,已在人类和其他哺乳动物的GIT中鉴定出三种参与HSL环水解的对氧磷酶(PON1、PON2和PON3)。其中,PON2 最活跃,主要在空肠中表达 。PON1 和 PON3 在诊断为克罗恩病和溃疡性结肠炎患者中的表达水平较低 。
因此,这些胃肠道疾病有可能通过恢复 PON1 和 PON3 水平来逆转。需要深入研究对氧磷酶在 GIT 不同领域中的作用,以及它们在治疗胃病中的可能应用。
肠道是人体与外界环境直接接触的重要器官,也是细菌与宿主细胞进行密切交流的场所。除了前面提到的自身诱导剂-2(AI-2)和自身诱导剂-3(AI-3)等细菌信号分子外,肠道细胞还能感知和响应其他细菌代谢产物。这些相互作用对维持肠道健康至关重要。
宿主对细菌信号的感知机制
首先,肠道细胞表达一些重要的受体,如:孕烷X受体(PXR)、过氧化物酶体增殖物激活受体(PPAR),这些受体能够感知细菌代谢物,并调节宿主细胞的基因表达,参与解毒、代谢和炎症反应的调控。
例如,PPARγ可以抑制巨噬细胞的活化,减少炎性细胞因子的产生,从而有助于缓解炎性肠病。
细菌-宿主信号相互作用网络
另一方面,细菌也能感知和利用宿主细胞的信号分子。例如,假单胞菌产生的PQS和HHQ信号分子,能够与淋巴细胞、树突状细胞和巨噬细胞相互作用,抑制宿主的先天性和适应性免疫反应。
作为应对,宿主细胞则通过激活芳烃受体(AhR)来感知这些细菌信号,并启动有益的免疫反应,如IL-22和IL-17的表达。
此外,枯草芽孢杆菌产生的CSF信号分子,能够与肠道上皮细胞表面的OCTN2转运蛋白结合,激活HSP-27,从而促进肠道屏障的完整性。一旦进入细胞,CSF还可以作为一种”报告器”,监测肠道微生物群的变化。
总结下,肠道细胞与细菌之间存在复杂的信号交流网络。宿主细胞通过感受细菌代谢物来调节自身的生理活动,而细菌也能利用宿主信号分子来调控自身的行为。这种跨界的“窃听”行为,体现了宿主-微生物之间精细的相互调控机制,对维持肠道健康至关重要。进一步研究这些相互作用过程,有助于我们更好地理解和调控肠道微生态平衡。
PapRIV
由芽孢杆菌产生的 PapRIV 穿过胃肠道,尽管速度很慢,并进入循环系统,大多数肽(87%)从那里以单向方式穿过 BBB(血脑屏障)。从体外研究中可以推断,PapRIV 激活小胶质细胞,因此可能在肠-脑相互作用中发挥作用。
氨基酸
根据2020比利时一项研究,氨基酸天冬氨酸和脯氨酸在小胶质细胞的激活中起关键作用。apRIV还诱导促炎细胞因子IL-6和TNFα的产生,增加细胞内ROS并刺激阿米巴样细胞的增加。丙酮丁醇梭菌(Clostridium acetobutylicum)产生的自体诱导肽(AIP)比肺炎链球菌产生的 AIP 更容易穿过(血脑屏障)。

自诱导肽 AIPs
自诱导肽(Autoinducer peptides, AIPs)是细菌用于细胞间通信的一类信号分子。它们在细菌群体感应中起重要作用。
革兰氏阳性菌穿过肠壁产生的AIPs已在Caco-2细胞的体内研究中得到证实。该研究表明,胃肠道中葡萄球菌(Staphylococcus)、链球菌(Streptococcus)、乳酸杆菌(Lactobacillus)和芽孢杆菌(Bacillus)产生的AIPs对肌肉细胞具有促炎和抗炎作用。
这些屏障的穿越似乎取决于肽的结构和大小。信号肽降解过程中产生的可扩散小分子,称为可扩散信号因子(DSF),也可能起到自诱导剂的作用。
肠道细菌产生的信号由肠壁中的特殊细胞记录(下图),导致身体或心理健康发生暂时或持久的变化。这些细胞通过使用模式识别受体 (PRR)区分本地(地方性)和外来、潜在致病性微生物群产生的信号。
AHL
细菌在生长过程中会产生各种化学信号分子,比如AHL(丙酰基-亮氨酸同系物)。这些信号分子可以被宿主细胞感知到,并引发一些生理反应。
比如,AHL可以增加中性粒细胞的活性,促进成纤维细胞向肌成纤维细胞的转化。这些变化对于组织的修复和再生非常重要。
宿主细胞有一些专门的受体,可以识别这些细菌信号分子。其中包括Toll样受体(TLR)和Nod样受体(NLR),它们可以感知细菌细胞壁的成分。还有一些G蛋白偶联受体(GPR),它们可以感知一些与激素相关的信号分子。
这些受体广泛存在于肠道的免疫细胞、上皮细胞和间质细胞等,在调节炎症反应和维护肠道屏障功能中起重要作用。
总的来说,细菌通过释放各种化学信号分子,可以与宿主细胞进行”对话”(下图),影响宿主的免疫反应和组织修复。这种细菌-宿主之间的相互作用,对于维持肠道健康非常关键。我们需要进一步研究这些复杂的交互机制,以更好地理解和调控肠道微生态平衡。
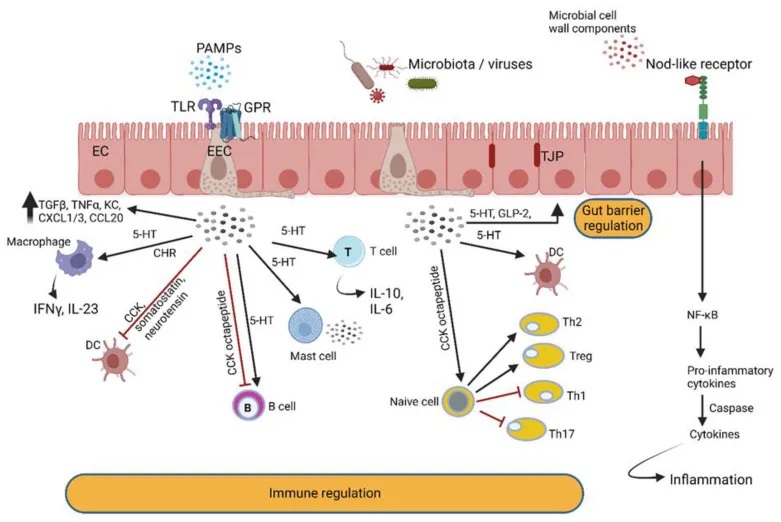
doi.org/10.3390/microorganisms10101969
肠壁中的肠内分泌细胞 (EEC) 检测肠道细菌和微生物代谢物,并通过分泌与免疫细胞反应的肽激素和细胞因子来做出反应。EEC 产生的激素调节肠道屏障功能并与肠神经反应。后者通过迷走神经与中枢神经系统进行交流。
芳香烃受体 AhRs
AhRs 调节免疫反应和发病机制(下图)。大量的AhR由肠上皮细胞和免疫细胞(如先天性淋巴细胞、上皮内淋巴细胞、TH17细胞和Treg细胞)表达,但也存在于肝脏、肺、膀胱和胎盘中。AhR 的关键功能之一是恢复屏障稳态,这是 IBD 中突出的现象。
芳烃受体(AhR) 通路总结
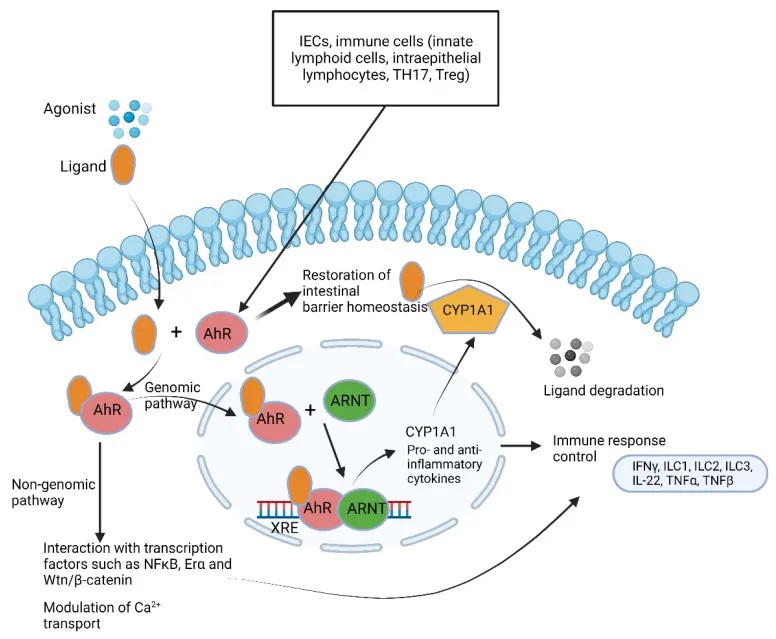
doi.org/10.3390/microorganisms10101969
AhR
芳香烃受体在维护肠道健康中的关键作用
芳香烃受体(Aryl hydrocarbon Receptor, AhR)是一种重要的细胞内受体蛋白,在人体内广泛分布,尤其集中于肝脏、肠道和免疫细胞等组织。
AhR的基本功能
AhR能够感知和结合各种芳香烃类化合物,包括细菌代谢产物、环境污染物等。
当AhR与这些化合物结合后,会进入细胞核内,调控一系列基因的表达,参与解毒代谢、免疫调节、细胞分化等重要生理过程。
AhR与疾病的关联
例如,AhR可以感知细菌产生的PQS信号分子,并激活一些有益的免疫反应,如促进IL-22和IL-17的表达,增强肠道屏障功能,维持肠道微生态平衡。
研究发现,在炎症性肠病(IBD)、代谢综合征或乳糜泻等疾病患者中,粪便中AhR配体的浓度较健康人明显降低,AhR活性也相应降低。而在艰难梭菌感染患者中,则检测到更高的吲哚浓度。
AhR可以被多种细菌代谢产物激活,包括色氨酸降解产物(吲哚、吲哚并[3,2-B]咔唑、吲哚乙酸等)以及假单胞菌产生的2,4-二羟基喹啉、喹诺酮衍生物等。
这些AhR配体的浓度在炎症性肠病、代谢综合征和乳糜泻患者中较健康人有所降低,提示AhR活性的降低可能与这些疾病的发生有关。
AhR在调节肠道屏障和免疫稳态中的作用
AhR参与调节肠道屏障完整性、免疫稳态、上皮内淋巴细胞的产生和存活、炎症反应以及肠道菌群密度等多个关键过程。
通过调节紧密连接蛋白的表达、促进IL-22和IL-10的产生、诱导抗菌肽分泌等,AhR在维持肠道健康中发挥重要作用。
在炎症性肠病患者中,AhR水平降低,尤其是在回肠部位,可能导致ILC1细胞增多,进而促进炎症因子IFN-γ和TNF-α的产生,破坏肠屏障。
AhR配体的来源与饮食影响
色氨酸是AhR配体的重要来源,但人体无法自行合成,需要从饮食中摄取。富含色氨酸的食物包括腰果、向日葵籽、奶酪、鸡胸肉和煮鸡蛋等。
因此,饮食中色氨酸的摄入量可能影响AhR配体的水平,进而影响肠道健康。
耐药菌与群体淬灭技术的兴起
五年前,世界卫生组织公布了一份对目前使用的抗菌剂最具耐药性的病原菌清单。下列物种在名单上名列前茅:
这促使许多科学家研究使用抗QS疗法(称为群体淬灭(quorum quenching,QQ)来预防或控制细菌感染的可能性。近年来,许多已发表的文章报道了有希望的结果,表明与抗生素共同处理时,可以降低微生物的致病性并且更容易根除。

2020年,天津大学的研究团队发现,可以利用QS信号分子丙酰基-亮氨酸同系物(AHL)来控制革兰氏阴性细菌引起的感染。这种方法的关键是要破坏QS对细菌毒力基因表达的调控作用。
群体淬灭的应用效果与风险
当应用群体淬灭时,粘膜相关病原体减少了约60%,主要是梭菌属(Clostridium)。尽管从感染管理的角度来看很有希望,但这种剧烈的变化可能导致促炎性疾病的发展,如囊性纤维化、硬化症和IBD,以及肠球菌(Enterococcus)和艰难梭菌(C. difficile)细胞数量的增加。
也许最令人担忧的是,在luxS QS系统功能失调或缺失的细菌中,细胞聚集和生物膜形成增加的证据,如幽门螺杆菌、霍乱弧菌(Vibrio cholerae)、放线菌集聚杆菌(Aggregatibacter actinomycetemcomitans)、胸膜肺炎放线杆菌(Actinobacillus pleuropneumoniae)、副猪嗜血杆菌(Haemophilus parasuis)、金黄色葡萄球菌(S. aureus)、表皮链球菌(S. epidermidis)、变形链球菌(Streptococcus mutans)、粪肠球菌(Enterococcus faecalis)、蜡样芽孢杆菌(Bacillus cereus)。美罗培南和左氧氟沙星刺激鲍曼不动杆菌(A. baumannii)外排泵的表达,促进AHL的释放,导致QS介导的生物膜形成增加。
群体淬灭技术的局限性与挑战
实际应用中也存在一些挑战。有研究报告,使用群体淬灭方法治疗铜绿假单胞菌和金黄色葡萄球菌感染的效果有限,特别是在生物膜相关感染中。这可能是因为QQ会导致细菌群落结构的剧烈变化,反而促进了一些致病菌的生长,如艰难梭菌等。
此外,一些细菌在缺失LuxS等QS系统时,反而表现出更强的细胞聚集和生物膜形成能力,这可能导致难以根除的持久性感染。一些抗生素如美罗培南和左氧氟沙星,也可能通过刺激细菌外排泵表达,促进AHL释放,增强QS介导的生物膜形成。
因此,单纯使用群体淬灭技术可能并不能完全解决细菌感染问题。研究人员建议,在使用群体淬灭疗法时,还需要结合具体的细菌感染情况,评估其与抗生素联合使用的效果。
此外,细菌也可能通过一些机制,如外排泵基因突变,对群体淬灭疗法产生耐药性。这可能导致难以根治的持久性感染。
群体感应分子对中枢神经系统的影响研究不足。几种QS peptides(群体感应肽分子,QSP)可通过肠粘膜扩散并进入循环系统,从那里它们可以穿透血脑屏障(BBB)。基于这些发现,QSP 可能在肠道微生物组和大脑之间的交流中发挥关键作用。如果是这种情况,QSP 可能会影响神经发育并引发神经退行性疾病。需要进一步的研究来证实这些发现。
金黄色葡萄球菌外毒素对神经系统的影响
金黄色葡萄球菌产生的外毒素激活转录因子辅助基因调节因子(Agr)A,该调节多种基因的表达,包括毒力因子、成孔毒素(PFT) 和细菌蛋白酶。这些毒素会增加细胞内的钙水平,导致感觉神经元的激活。
金黄色葡萄球菌产生的一种毒素叫做PSMS,它能特异性地结合到宿主细胞表面的一种受体叫做FPR(甲酰肽受体样蛋白)。
FPR与另外两种受体b-防御素和MRGPRX2(mas相关G蛋白偶联受体X2)的配体有结构相似性。这表明,MRGPRX2可能也参与了PSMS引起的皮肤过敏等症状。
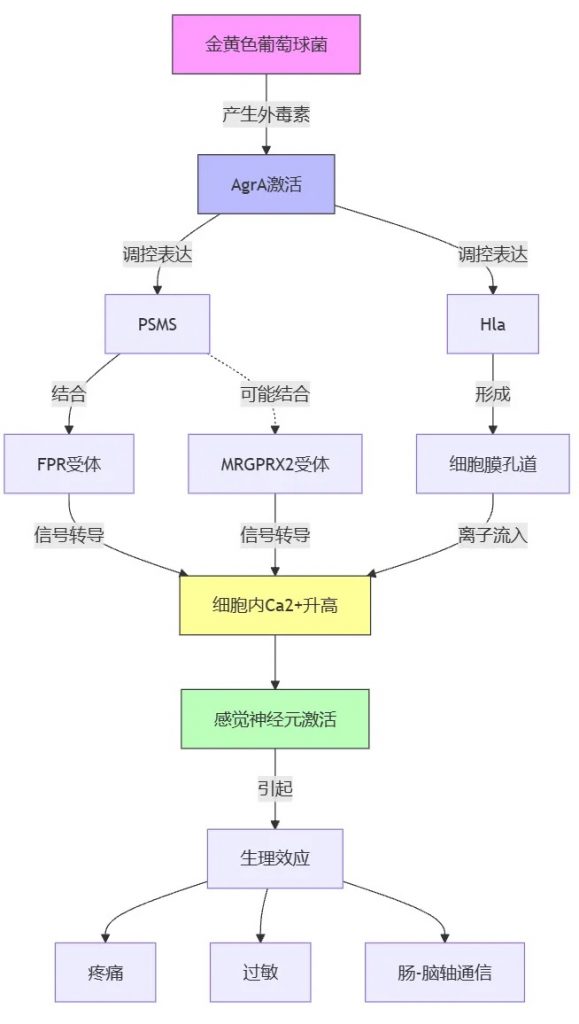
此外,FPR在肠道感觉神经节和背根神经节中有广泛表达,并与肠-脑轴(GBA)中涉及群体感应依赖性通路有关。
此外,金黄色葡萄球菌产生的毒素叫做α-溶血素(Hla),它也能通过增加细胞内钙的转移来激活神经元。与PSMS相比,Hla在细胞膜中形成的孔更小、破坏性也更小。
总之,肠道病原菌类似于金黄色葡萄球菌产生的这些毒素,通过作用于宿主细胞表面的不同受体,如FPR和MRGPRX2,从而引起神经元的激活,导致疼痛、过敏等症状。这些毒素在肠-脑轴通信中也可能发挥重要作用。

根据英国和澳大利亚联合的一项研究结果表明:与PSMS相比,Hla在细胞膜中产生更小、破坏性更小的孔。作者还观察到了 Adam10 的表达,Adam10 是一种在感觉神经元中产生的膜结合金属蛋白酶,Hla 与该酶结合。外毒素在肠脑轴通信中的重要性尚不清楚。
然而,由于金黄色葡萄球菌(S. aureus)与肠易激综合征和食物有关,这些QS分子有可能直接调节肠-脑通讯和肠道反射。

上面这篇研究在6种不同的神经元细胞系上筛选了85个群体感应肽,发现了22个可能对肠脑轴有影响的肽。其中,4 个肽诱导神经突生长,2 个肽抑制神经生长因子(NGF)诱导的神经突生长,8 个肽诱导人 SH-SY5Y 神经母细胞瘤细胞的神经突生长。2 个肽杀死 SH-SY5Y 细胞,6 个肽诱导 IL-6 表达或一氧化氮(NO)产生。
细胞壁成分在肠脑轴中的作用
已经发表了几篇关于细胞壁成分(如脂多糖、多糖和肽聚糖)在神经元激活和肠脑轴中的作用的报道。细胞壁成分还诱导神经肽、ATP 和细胞因子的释放。短链脂肪酸、色氨酸、微量胺和外毒素也具有神经调节剂特性。
5-羟色胺和组胺刺激神经末梢附近的肥大细胞。
阿尔茨海默病(AD)、自闭症谱系障碍(ASD)、多发性硬化症(MS)、帕金森病(PD) 和肌萎缩侧索硬化症(ALS)等神经元疾病与功能失调的小胶质细胞有关。
将患有注意力缺陷多动障碍(ADHD)、阿尔茨海默病和帕金森病的人类粪便移植到小鼠身上,激活了大脑中的小胶质细胞,并加剧了认知和身体损伤。
这些发现以及更多证据表明微生物群失调与神经发育、神经退行性和精神疾病(如自闭症谱系障碍、精神分裂症、阿尔茨海默病、重度抑郁症和帕金森病)之间存在明确联系,促使研究人员更仔细地研究肠脑轴。
有关肠道细菌和神经递质的更多信息,读者可关注谷禾健康以往其他分享文章。
扩展阅读:
肠道菌群检测报告解读——肠道菌群代谢产物包括激素,神经递质等
胃肠道特殊的环境下生存着海量的细菌微生物,因此它们已经开发出与宿主细胞交流的机制也就不足为奇了。
一些群体感应分子是属特异性的,但少数被革兰氏阴性菌和革兰氏阳性菌使用。Epi 和 NE 等激素以及某些碳水化合物(例如岩藻糖和 EA)激活细菌中的特定受体,进而触发细胞质中的传感器以调节基因表达。
在健康的胃肠道中,这些信号分子对于维持稳态状态很重要。一些 QS 分子,如 3-oxo-C12:2-HSL,保护紧密连接蛋白,在治疗肠漏综合征中可能很重要。
一些 QS 分子刺激肿瘤生长并与特定癌症的发展密切相关,而另一些则与神经系统疾病有关。穿透血脑屏障(BBB)的 QSP 构成了一个值得更多研究的领域,特别是因为肠道微生物组越来越被认为是神经精神病学的关键参与者。
通过更深入地了解肠道细菌产生的不同 QS 系统,未来可能能够开发可用于诊断神经和精神疾病的生物标志物,例如焦虑和抑郁、MDD、精神分裂症、双相情感障碍、自闭症和强迫症。
主要参考文献:
Dicks LMT. How does Quorum Sensing of Intestinal Bacteria Affect Our Health and Mental Status? Microorganisms. 2022 Oct 5;10(10):1969.
Janssens Y., Debunne N., De Spiegeleer A., Wynendaele E., Planas M., Feliu L., Quarta A., Claes C., Van Dam D., De Deyn P.P., et al. PapRIV, a BV-2 microglial cell acti-vating quorum sensing peptide. Sci. Rep. 2021;11:10723.
De Spiegeleer A., Elewaut D., Noortgate N.V.D., Janssens Y., Debunne N., Van Langenhove S., Govindarajan S., De Spiegeleer B., Wynendaele E. Quorum sensing molecules as a novel microbial factor impacting muscle cells. Biochim. Biophys. Acta (BBA) Mol. Basis Dis. 2019;1866:165646.
Miller M.B., Bassler B.L. Quorum Sensing in Bacteria. Annu. Rev. Microbiol. 2001;55:165–199.
Coquant G., Aguanno D., Pham S., Grellier N., Thenet S., Carrière V., Grill J.-P., Seksik P. Gossip in the gut: Quorum sensing, a new player in the host microbiota interactions. World J. Gastroenterol. 2021;27:7247–7270.
Yashiroda Y., Yoshida M. Intraspecies cell–cell communication in yeast. FEMS Yeast Res. 2019;19:foz071.
Prescott R., Decho A.W. Flexibility and Adaptability of Quorum Sensing in Nature. Trends Microbiol. 2020;28:436–444.
Tam K., Torres V.J. Staphylococcus aureus Secreted Toxins and Extracellular Enzymes. Microbiol. Spectr. 2018;7:GPP3-0039-2018.
Fülling C., Dinan T.G., Cryan J.F. Gut Microbe to Brain Signaling: What Happens in Vagus…. Neuron. 2019;101:998–1002.
Krasulova K., Illes P. Intestinal interplay of quorum sensing molecules and human receptors. Biochimie. 2021;189:108–119.
Galloway W.R.J.D., Hodgkinson J.T., Bowden S.D., Welch M., Spring D.R. Quorum Sensing in Gram-Negative Bacteria: Small-Molecule Modulation of AHL and AI-2 Quorum Sensing Pathways. Chem. Rev. 2010;111:28–67.
Wu S, Liu J, Liu C, Yang A, Qiao J. Quorum sensing for population-level control of bacteria and potential therapeutic applications. Cell Mol Life Sci. 2020 Apr;77(7):1319-1343.
Krzyżek P. Challenges and Limitations of Anti-quorum Sensing Therapies. Front. Microbiol. 2019;10:2473.
Wu S., Liu J., Liu C., Yang A., Qiao J. Quorum sensing for population-level control of bacteria and potential therapeutic applications. Cell. Mol. Life Sci. 2019;77:1319–1343.
Janssens Y, Wynendaele E, Verbeke F, Debunne N, Gevaert B, Audenaert K, Van DeWiele C, De Spiegeleer B. Screening of quorum sensing peptides for biological effects in neuronal cells. Peptides. 2018 Mar;101:150-156.

谷禾健康
谷禾以往在科研领域深耕十余年,积累了丰富的科研项目经验和数据分析能力,几年前,谷禾成功实现了从科研到大健康应用的技术转化,推出了谷禾宏基因组精准检测。
对于一些特定需要深度检测的应用场景,如健康管理机构的差异化服务需求,或者临床应用需求,宏基因组精准健康检测提供了另一种专业的技术选择。

宏基因组数据库的物种涵盖范围和菌株构成,直接影响着宏基因组物种鉴定分类的准确性和分类精度。
针对宏基因组数据库不完善的问题,谷禾整合了最新的NCBI refseq数据库,涵盖细菌、病毒、真菌和寄生虫,结合自研多元统计模型和机器学习算法,极大提升了物种鉴定和功能注释的准确性。
物种精准鉴定
分辨率更加精细,可达“种”和“菌株”水平,并对复杂的多菌种感染进行精细化解构。
肠道功能评估
肠道基础功能:包括蛋白质发酵能⼒、消化吸收效率、肠道产气情况、肠道屏障完整性、肠道炎症状态等,在菌群整体评估指标中也增加了包括菌群恢复力、革兰氏阴性菌、好氧菌等指标。
功能基因分析
– 全面评估菌群的基因功能潜力
如次生代谢产物合成通路、维生素合成能力、碳水化合物利用能力等,为个性化营养和精准干预提供科学证据。
耐药基因
– 分析耐药基因
不局限于已知靶点,可鉴定出各种已知和新型耐药基因,全面评估耐药基因的种类和数量,例如,在人体肠道宏基因组中发现了大量β-内酰胺酶等耐药基因。
– 追踪耐药基因的传播途径
通过比较不同环境(如土壤、水体、动物和人体)中耐药基因的分布情况,可推测耐药基因的来源和传播途径。
– 辅助指导耐药风险评估和防控策略
宏基因组学评估环境和宿主中耐药基因的分布特点,识别高风险区域和人群,为制定针对性监测和干预措施提供依据。
毒力基因
宏基因组检测技术在病原微生物毒力基因研究中具有独特优势,可在基因组水平系统分析其毒力基因组成及调控网络,加深对致病机理的理解。
免疫炎症分析
肠道菌群通过调控免疫平衡维持健康,⽽炎症标志物则作为评估机体炎症程度的关键指标。
宏基因组测序对测序深度要求较高,当数据量不足时,一些低丰度的真菌、寄生虫等病原体可能覆盖不到;然而,若要获得足够的测序深度来确保全面覆盖,则会显著增加测序成本,同时对分析能力和计算资源提出更高要求。
因此,宏基因组检测看似”简单粗暴”,只要更多数据量,实则真正的挑战在于,如何在成本与深度之间找到最优平衡。
谷禾持续迭代升级自有数据库
整合最新的NCBI refseq数据库
并结合十余年积累的临床样本数据
让相对较小的测序量
也能获得高精度的物种鉴定结果
同时,谷禾致力于深入挖掘
数据背后的生物学意义
通过专业团队的生物信息学分析
从宏基因组数据中构建
炎症状态、消化功能异常等关键健康指标
通过机器学习算法将海量基因信息
转化为实用的健康评估结果
通过这种”数据挖掘+算法迭代“
尽可能为大家控制成本的同时提供
媲美高深度测序的检测精度
极力追求技术创新与商业价值的完美结合

宏基因组报告中的解读更详细,还整理了一些评估指标,检测指标的总结等。
其他谷禾肠道菌群检测专业版的内容,宏基因组报告里面也都涵盖了,包括慢病风险、菌群代谢物及神经递质代谢、个性化营养等板块。
…
…
个性化饮食板块也在谷禾16S版本的基础上进行了迭代升级。
…
宏基因组检测并不常用于常规检测,其高昂的成本和复杂的数据分析决定了它更适用于关键时刻。
特定菌群感染的判别
对于一些复杂的多菌种感染,宏基因组能够更精细化鉴定感染菌群的构成,为临床辅助诊疗提供依据。
真菌与病毒感染的深度判别
相比传统培养,宏基因组学诊断真菌感染的敏感性和特异性更高,适用于一些真菌感染疾病。也可能鉴定出可疑的新病原体,为后续的病原学研究、药物和疫苗开发奠定基础。

<来源:谷禾宏基因组精准检测报告>
缺点:
总的来说,宏基因组测序仍存在技术瓶颈和生物学解释的局限性。然而,针对某些特殊情况研究需要,宏基因组测序也是一种有用的微生物组学研究工具。
特殊应用场景
对于一些复杂的多菌种感染,宏基因组能够更精细化鉴定感染菌群的构成,为临床辅助诊疗提供依据。
与传统方法相比,宏基因组学诊断真菌感染的敏感性和特异性更高,适用于一些真菌感染疾病。也可能鉴定出可疑的新病原体,为后续的病原学研究、药物和疫苗开发奠定基础。
以上是谷禾宏基因组精准检测报告的一些节选,其全面、精准、个性化分析肠道菌群的组成和功能,可帮助评估菌群失衡的风险和预后,为个性化诊疗和健康管理提供科学依据。
注:报告仅用于菌群科学研究和辅助参考,不直接用于临床诊断 。