-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
食源性微生物是影响食品安全的主要致病菌,因人类食用被致病菌或其毒素污染的食品(主要是动物制品)而引发全球范围的人类疾病。其中多数微生物具有人畜共患的特性,对公共卫生和经济领域产生重大影响。
细菌是全球三分之二人类食源性疾病的病原体。例如,金黄色葡萄球菌、沙门氏菌属、弯曲菌属、单核细胞增生李斯特菌和大肠杆菌是引发食源性疾病和死亡的主要人畜共患细菌性病原体,与食用受污染产品有关。
近年来,食源性病原体已成为全球重要的公共卫生问题,其对健康(显著的发病率和死亡率)和经济的影响日益受到重视。不同报告显示,每年全球约有6亿人(全球人口的十分之一)因食用受污染的食物而患病。由于未被发现或未被报告的爆发,食源性疾病的统计数据有所增加。
目前正值夏季,本文介绍食源性细菌性病原体的背景,并回顾常见的主要食源性人畜共患细菌性病原体。动物是许多食源性人畜共患细菌性病原体的主要储存宿主,动物源性食品是主要的传播载体。肉类、乳制品和蛋类是人类暴露于人畜共患细菌的主要途径。
由于人口快速增长,城市化,人均收入提高,全球化以及消费者习惯的改变(偏爱高蛋白饮食),肉类、牛奶和鸡蛋等动物产品的消费量有所增加。这种情况导致对动物源性食物的需求量大增,并导致集约化动物生产和产品加工,尤其是大规模生产和产品在全球范围内的流通。在此期间,从农场到餐桌的任何环节都可能出现有缺陷的加工实践,从而增加了污染和食源性病原体传播的机会。
人类肉源性疾病进展
doi: 10.3389/fpubh.2022.1045599.
★ 食品在不同阶段都可能受到污染
食品可能在食品链的不同阶段受到污染,包括生产、加工、分销、制备或最终消费过程中。食品被污染的风险很大程度上取决于食品处理者的健康状况、个人卫生、知识以及食品卫生的实践。
肉类供应链每一步都有污染风险
doi: 10.3389/fpubh.2022.1045599.
根据世界卫生组织(WHO)的定义,食源性疾病是指因食用食物或水引起的具有传染性或毒性的疾病。中毒(病原体产生的毒素引起食物中毒)、感染(摄入含有病原体的食物)和毒素感染(在人体肠道中生长时产生毒素)是食源性疾病的三种类型。
★ 动物食品是食源性感染的主要载体
大多数病原体具有人畜共患病的起源,动物源性食品被认为是食源性感染的主要载体。食用动物(牛、鸡、猪、鸭等)是许多食源性病原体的主要储存库。动物产品(肉、奶、蛋、鱼等)及其产品由于病原体含量、天然毒素、掺杂物和其他可能的污染物而具有高风险,当增加动物源性食品的消费时,人类患食源性疾病的风险也在增加。
编辑
doi: 10.3389/fpubh.2022.1045599.
图A描述了自1961年以来选定国家的个人肉类消费量。事实证明,人均收入较高的国家比人均收入较低的国家消费更多的肉类。世界每年生产近3.4亿公吨肉类,是50年前的三倍。图1B所示,到2050年,肉类消费量估计将增加至4.6亿-5.7亿公吨。病原性疾病,如狼疮性皮肤病,在主要畜牧国家越来越常见,对全球肉类和肉类产品的供应构成重大威胁。
在引起食源性中毒的细菌中,一些细菌在发病频率或疾病严重性方面尤为重要。各种细菌(包括革兰氏阳性和革兰氏阴性细菌)会产生引起食源性中毒的毒素,导致的症状从胃肠紊乱到瘫痪甚至死亡。据报道,革兰氏阴性细菌约占细菌性食源性疾病病例的69%。
虽然目前已确定有31种病原体可导致食源性疾病,但包括金黄色葡萄球菌(S.aureus)、非伤寒沙门氏菌、弯曲杆菌属、单核细胞增生李斯特菌(L.monocytogenes)和大肠杆菌(E.coli)在内的细菌性病原体,是全球食源性疾病和死亡的常见原因。下面我们就为大家一一介绍这些常见的食源性细菌病原体。
★ 沙门氏菌是最常见的食源性病原体
沙门氏菌广泛分布于自然界,是人类和动物的主要致病菌。它们是食源性疾病爆发中最常见的细菌来源,每年在全球范围内导致约9380万例食源性疾病和15.5万例死亡。
沙门氏菌已被认为是食源性疾病的主要原因,也是一个严重的公共卫生问题,人们越来越关注包括工业化国家在内的抗菌素耐药菌株的出现和传播。人类和动物的耐药沙门氏菌感染是普遍关注的问题,尤其是在发展中国家。
除了给人类和动物带来的发病率和死亡率成本外,贸易限制和丢弃受污染的食物也是该细菌造成的重要社会经济问题。
1
病原学特征 (Etiology)
分类: 沙门氏菌属包含超过2500种已识别的血清型,分属于肠道沙门氏菌 (Salmonella enterica) 和邦戈沙门氏菌 (Salmonella bongori) 两个种。其中,肠道沙门氏菌是人畜共患的主要病原体,又可细分为六个亚种。
常见致病菌株: 超过150种血清型可引起食源性沙门氏菌病,但鼠伤寒沙门氏菌 (S.typhimurium) 和肠炎沙门氏菌 (S.enteritidis) 是最常见的两种。
基本特性: 这类细菌属于肠杆菌科,是革兰氏阴性、兼性厌氧、不形成孢子、呈直杆状的细菌。在显微镜下或普通营养培养基上,它们与大肠杆菌无法区分。
2
流行病学特征 (Epidemiology)
全球公共卫生问题:沙门氏菌是全球主要的公共卫生问题之一,无论在发展中国家还是发达国家,它都是最常见的食源性疾病之一。
主要宿主与传染源
动物携带:动物是沙门氏菌食源性疾病的主要宿主,其在动物中的普遍携带是重要的流行病学因素。
自然栖息地:沙门氏菌的主要栖息地是动物(如农场动物、鸟类、爬行动物、昆虫)和人类的肠道。
导致暴发的因素:食用生或不安全的食物、交叉污染、不当的食品储存、不良的个人卫生习惯、食品冷却和再加热不充分,以及制备与食用间隔时间过长等,都是促使人类沙门氏菌病暴发的因素。
环境耐受性:它们能在典型的餐饮冷藏温度下存活,并在温度滥用(即不当的温度控制)的情况下繁殖。
高风险原因:不卫生的生活条件、人畜混居、以及食用生或未煮熟的动物源性食品,都增加了感染风险。
3
传播途径 (Transmission)
主要途径: 食源性传播被认为是沙门氏菌感染的主要原因。动物源性食品及其制品是沙门氏菌传播给人类的最常见载体。
其他途径: 传播也通过摄入被动物粪便污染的水、食物以及被污染的食品加工设备而发生。
主要污染食品: 禽类、猪、牛及其产品(如肉、蛋、奶)是导致人类沙门氏菌病暴发的最常见食品来源。尤其是鸡肉产品(包括鸡蛋)被公认为是沙门氏菌的重要宿主。
非伤寒沙门氏菌(NTS)的宿主和传播
doi: 10.3389/fpubh.2022.1045599.
污染过程
屠宰环节: 受污染的动物产品通常源于受感染的动物本身,或在屠宰过程中胴体或可食用器官被污染。
蛋类污染: 蛋壳和蛋内容物可能在母鸡生殖系统内形成时或从环境中(如粪便接触)被污染。
粪便污染: 胴体的粪便或肠道污染是人类食源性感染的主要来源。
特定菌株: 最近出现的多重耐药性鼠伤寒沙门氏菌DT104型,主要通过摄入受污染的牛肉传播。
4
致病机理 (Pathogenesis)
影响因素: 致病性受菌株毒力、感染剂量、感染途径和宿主易感性等因素影响。毒力质粒、毒素、菌毛和鞭毛等毒力因子有助于建立感染。
入侵过程
靶细胞: 微皱褶细胞(M细胞)是沙门氏菌致病性的靶细胞。
机制: 细菌首先利用菌毛(粘附结构)粘附于肠道上皮细胞,然后侵入上皮细胞引发肠胃炎。这一复杂的入侵过程由多种染色体基因产物介导。
宿主反应: 细菌入侵后,会诱导靶细胞膜起皱,将细菌内化到膜结合的液泡中。这个过程会引发一系列反应,包括中性粒细胞的募集和迁移、上皮细胞分泌细胞因子以及液体和电解质的分泌。
定植与生存: 肠道正常菌群可以抵抗沙门氏菌定植,因此口服抗生素会促进感染的建立。沙门氏菌能够避开胃部的宿主防御,到达肠道进行感染。
5
临床症状 (Symptoms)
潜伏期: 潜伏期为12至72小时。
临床表现严重程度不一,从自限性肠胃炎到败血症不等,这主要取决于宿主的易感性和菌株的毒力。
消化道症状: 通常为胃肠道症状,包括恶心、呕吐、腹部绞痛以及水样、绿色、有恶臭的腹泻或带粘液的血性腹泻。
其他症状: 还包括头痛、虚脱、疲劳(肌肉无力)和中度发烧。
预后与并发症: 该病通常是自限性的,不需要特殊治疗。但在幼儿、老人和免疫功能低下者中可能导致严重并发症。反应性关节炎、镰状细胞性贫血和骨髓炎等并发症在普通人群中也较为常见。
6
检测方法 (Detection)
常规方法: 通常的程序是使用选择性增菌培养基(如沙门氏菌-志贺氏菌琼脂)进行细菌的培养和分离。
血清分型: 血清分型是区分沙门氏菌菌株的公认方法,是公共卫生的重要工具。
快速方法: 市售的快速检测方法包括新型选择性培养基、改良的传统程序、免疫学检测法和核酸检测法。
免疫学检测: 包括ELISA、乳胶凝集试验、免疫扩散和免疫层析法(试纸条)。
分子检测: 主要技术是直接杂交(DNA探针)和扩增(PCR)方法。
7
预防与控制 (Prevention and Control)
综合策略:需要建立生物安全和生物防护措施,改进食品加工方法以及制备和储存实践。减毒的DNA重组活沙门氏菌疫苗,结合对动物、饲料和动物食品的综合控制策略,将有助于减少沙门氏菌病。
食品安全实践:应采取安全的食品制备方法,包括彻底煮熟、重新加热食物、牛奶的巴氏消毒(煮沸)、充分冷藏,并避免宠物和其他动物进入食品处理区域。
高危人群建议:建议易感人群避免食用未煮熟的肉和家禽、生牛奶、生鸡蛋以及含有生鸡蛋的食物。
二次污染控制:通过清洁消毒、人员卫生和适当的加工来防止二次污染。
金黄色葡萄球菌是全球最常见的食源性病原体之一,其高发生率仅次于沙门氏菌。
它可以作为一种共生菌存在于健康人和动物的皮肤、鼻子和粘膜上。然而,它也是一种众所周知的机会性食源性病原体,可引起多种严重程度不一的感染性疾病,在人和动物中引起广泛的疾病。
★ 金黄色葡萄球菌是食源性中毒的重要原因
金黄色葡萄球菌在人类消费品中的存在对食品工业至关重要,因为某些菌株是食源性中毒的原因。它们是导致食品腐败、降低食品安全和保质期以及引起食源性中毒的原因。
金黄色葡萄球菌是因食用被葡萄球菌肠毒素污染的食物而导致食物中毒的主要原因。
并且由于与多重耐药性相关的死亡率不断上升,它引起了公众的关注。抗生素的广泛使用以及细菌快速发展和获得抗菌素耐药性的能力促进了耐药菌株的出现,例如耐甲氧西林金黄色葡萄球菌(MRSA)。
注:MRSA最早于20世纪60年代初被报道,现在被认为是全球主要的医院获得性病原体。MRSA是人和兽医医学中常见的病原体。
1
病原学特征 (Etiology)
基本分类:金黄色葡萄球菌(S.aureus)是一种革兰氏阳性、过氧化氢酶阳性、凝固酶阳性、氧化酶通常为阴性的兼性厌氧球菌。
形态与生化特性: 这种细菌细胞呈球形,不运动,常形成葡萄状的菌落。它可以通过产生金色菌落、凝固酶、发酵甘露醇和海藻糖以及产生耐热核酸酶等特性,与其他葡萄球菌区分开来。
生存能力: S.aureus对环境有极强的适应能力,可在广泛的温度(7°C至48°C)、pH值(4.2至9.3)和高盐浓度(最高15% NaCl)下生长。这使其能够在多种食品中存活,尤其是在加工过程中需要较多人工操作的食品(如奶酪等发酵食品)。
2
流行病学特征 (Epidemiology)
重要性日益增加:由于其导致的感染增多(特别是MRSA菌株),在医学中的重要性,以及近年来发现其与动物相关的克隆谱系和人畜共患的潜力,该微生物在动物中的流行病学研究备受关注。
食源性疾病:S.aureus是全球食源性细菌性中毒的主要原因之一,也是全球报告的最常见的食源性疾病之一。
宿主与传播
人类携带:大约50%的健康人群在鼻腔、喉咙和皮肤中携带这种细菌。
动物来源:患有乳腺炎的奶牛是生牛奶中S.aureus的常见来源。该细菌广泛存在于多种宿主中,包括人类和猪、牛、山羊、鸡、鸭等食用动物。
污染途径:食品污染可能直接来自受感染的食用动物,也可能是由于食品生产、零售和储存过程中的卫生条件不佳所致。
耐甲氧西林金黄色葡萄球菌的风险因素:
免疫抑制
血液透析
外周灌注不良
高龄
长期住院
抗生素治疗不当
体内留置装置(如导管)
需要胰岛素治疗的糖尿病
褥疮溃疡等
3
传播途径 (Transmission)
主要来源:S.aureus主要通过受污染的动物源性食品传播。细菌有潜力在加工、制备、包装、切碎和储存过程中污染动物产品,从而进入食物链。
常见载体:污染可见于多种食品,如畜禽产品、海鲜以及烘焙产品。潮湿的、富含淀粉和蛋白质的食物特别容易被葡萄球菌肠毒素污染。牛奶、乳制品、猪肉、牛肉、羊肉、禽肉和鸡蛋是导致葡萄球菌食物中毒的常见载体。生肉也是S.aureus存活和耐药菌株在社区传播的良好媒介。
人为污染:携带S.aureus的食品处理者,其身体或手套也可能污染食物。
4
致病机理 (Pathogenesis)
毒力因子:S.aureus拥有多种毒力因子,这些因子单独或共同作用可导致严重感染。它能表达多种分泌性和细胞表面相关的毒力因子,以促进其粘附于宿主细胞外基质、破坏宿主细胞并对抗免疫系统。
关键致病物质:其产生的胞外活性物质被认为是致病的关键,包括凝固酶、溶血素、核酸酶、酸性磷酸酶、脂肪酶、蛋白酶、纤维蛋白溶酶、肠毒素和中毒性休克综合征毒素。
产生条件:如果食物在室温下存放一段时间,食物中的细菌就能产生毒素。
毒素稳定性:肠毒素能抵抗蛋白水解酶,且耐热。因此,即使食物中的S.aureus细菌已被杀死,毒素仍可能存在。
种类与作用:已分类出23种不同的葡萄球菌肠毒素(SEs)和SE样毒素。肠毒素会刺激中枢神经系统的呕吐中枢,并抑制小肠对水和钠的吸收,从而引起急性肠胃炎症状。
5
临床症状 (Symptoms)
疾病谱:该细菌可引起多种疾病,症状从简单的皮肤感染到更严重甚至危及生命的感染,如败血症、坏死性筋膜炎、感染性心内膜炎、坏死性肺炎和中毒性休克综合征。
潜伏期:潜伏期很短,通常在食用被污染食物后2-4小时内出现临床症状。
典型症状:特征为恶心、呕吐,体温多为偏低,伴有寒战、头痛和腹部绞痛,可有或无腹泻,但通常不发烧。最常见的症状是腹部绞痛、恶心和呕吐。
高危人群:在儿童和老年人等易感人群中,偶尔可能导致死亡。
MRSA感染症状:MRSA或多重耐药S.aureus菌株可引起院内感染,导致快速进展且可能致命的疾病,如威胁生命的肺炎、坏死性筋膜炎、心内膜炎、骨髓炎、严重败血症以及中毒性休克综合征等毒素病。
6
检测方法 (Detection)
常规检测
培养基: 使用一系列选择性和诊断性培养基(如甘露醇盐琼脂)来检测和计数食品中的葡萄球菌。
鉴定标准: 鉴定致病性葡萄球菌最广泛接受的标准是其产生凝固酶的能力。标准方法包括选择性增菌、分离具有典型形态的菌落,并通过微生物学和生化方法确认。
细菌检测:实时荧光定量PCR (RT-PCR) 和定量PCR越来越多地用于临床实验室,以快速检测和鉴定MRSA菌株。快速乳胶凝集试验也是一种常见的实验室测试。
肠毒素检测:检测食品中肠毒素最重要的方法是酶联免疫吸附试验(ELISA)。其他血清学测试如凝集试验和凝胶扩散法也可用于检测。近年来,核酸杂交、PCR和荧光免疫分析等分子生物学方法已成为最流行的检测手段。
7
预防与控制 (Prevention and Control)
基本原则: 葡萄球菌无处不在,无法从环境中根除。预防的关键在于切断其各种传播途径。
预防措施
食品安全: 彻底煮熟食物、防止污染和交叉污染、控制关键控制点是有效的预防方法。
公众教育: 提高公众关于安全处理肉类的意识以及其他公共卫生干预措施是预防疫情的基石。
控制方案
卫生实践: 改善医护人员和食品处理者的个人卫生习惯。
环境控制: 对设备、表面、衣物进行消毒。
医疗相关: 明智地使用抗生素,并实施筛查计划。对MRSA患者所在的区域应使用消毒剂进行彻底清洁。
弯曲杆菌属(Campylobacter)是全球人类细菌性食物传播腹泻病的主要原因,主要源于动物源性食品的污染。弯曲杆菌属可以在大多数温血动物和家禽中定殖。
弯曲菌病的人畜共患性质使其在全球范围内具有重要的临床和经济意义。它们导致了15%的食源性疾病相关住院和6%的食源性疾病相关死亡,据估计,每年有4亿例病例是由弯曲菌感染引起的。
1
病原学特征 (Etiology)
命名与形态:“Campylobacter”一词源于希腊语,意为“弯曲的杆菌”。这类细菌属于弯曲杆菌科,是微小(0.2–0.8μm×0.5–5μm)的革兰氏阴性、呈弯曲或螺旋状的微需氧菌。它们具有独特的“飞镖式”运动能力,过氧化氢酶和氧化酶呈阳性。当两个或多个细菌细胞聚集时,会形成“S”形或海鸥翅膀样的“V”形。
分类:弯曲杆菌属目前包含25个种和8个亚种。
主要致病菌:在众多弯曲杆菌中,空肠弯曲杆菌(C.jejuni)和结肠弯曲杆菌(C.coli),是重要的食源性病原体。其中,空肠弯曲杆菌是最常报告的种类(占80%至90%),其次是结肠弯曲杆菌(占5%至10%)。
2
流行病学特征 (Epidemiology)
动物宿主:它们广泛分布于自然界,被认为是人畜共患病原体,存在于众多动物宿主体内,尤其是鸟类。它们可以定植在野生和家养鸟类及哺乳动物(包括所有食用动物)的消化道中,也可存在于动物和人类的生殖器官、肠道和口腔中。
食品来源:散装牛奶、牛的组织标本和生碎牛肉中都可能发现这种细菌,但鸡蛋通常不被认为是该菌的重要来源。
暴发特点:弯曲杆菌病的暴发通常是散发性的,虽然不常导致死亡,但可能引起继发性并发症。
人类感染风险:旅行是导致人类感染弯曲杆菌病的最重要风险因素,其次是食用未煮熟的鸡肉、环境暴露以及与农场动物直接接触。
3
传播途径 (Transmission)
主要途径:人类感染弯曲杆菌的主要传播途径是处理、制备和食用受污染的食物,特别是禽肉产品。
其他途径:食品处理者在制备过程中对即食食品的交叉污染,以及与动物的直接接触也被确定为传播途径,或接触受污染的设备、水传播。
弯曲杆菌的储存库和传播
doi: 10.3389/fpubh.2022.1045599.
主要食品来源:感染主要来自食用受污染的家禽、牛肉、猪肉或其他动物肉类、肉制品、生(未经巴氏消毒)牛奶或奶酪等乳制品。
4
致病机理 (Pathogenesis)
关键毒力因子:细菌的运动能力、粘液定植、上皮细胞入侵、毒素产生、附着、内化和易位在疾病发展中起着重要作用。
入侵过程
运动与附着:鞭毛使细菌能够到达肠道内的附着位点。病原体对肠道上皮的附着对于定植和增加细菌毒素的分泌至关重要。
细胞入侵:空肠弯曲杆菌在被摄入后,会在肠道中繁殖并损害粘膜上皮,侵入上皮细胞和固有层内的细胞,导致自限性腹泻和腹痛。腹泻病可能由其产生的一种不耐热毒素引起。
防御机制:弯曲杆菌能产生超氧化物歧化酶,这种酶可以分解超氧自由基,是细菌对抗氧化损伤的主要防御机制之一。
5
临床症状 (Symptoms)
潜伏期:潜伏期为3至5天。
主要症状:人类弯曲杆菌病的特征是水样或血性腹泻、腹痛、痉挛、发烧、不适和呕吐。它也是“旅行者腹泻”的主要病原体。
高危人群: 这对幼儿尤其危险,因为腹泻会导致脱水和钠、蛋白质等营养物质的流失。在幼儿(<1岁)和免疫功能低下的患者中,可能会出现中毒性巨结肠、脱水和败血症。
感染后并发症:格林-巴利综合征(GBS)是最主要的感染后并发症,通常在感染后2-4周出现。其特征是周围神经的多发性神经炎,可能导致持续数周的肢体短期或长期麻痹。
其他并发症还可能包括脑膜炎、尿路感染和短期反应性关节炎。
6
检测方法 (Detection)
传统方法:传统上,鉴定方法包括使用选择性培养基(如Preston琼脂、木炭-头孢哌酮-脱氧胆酸盐琼脂等)结合生化测试。
分子技术:近年来,PCR已越来越多地应用于弯曲杆菌的检测和鉴定。
免疫学方法:作为替代方法,也可以使用免疫测定法等多种技术。
7
预防与控制 (Prevention and Control)
养殖场控制: 控制取决于畜舍的卫生设施和卫生状况,以减少动物环境中细菌的数量。
加工厂控制: 在肉类加工厂,可以通过实施HACCP体系,包括清洗、处理和冷冻胴体,来减少和控制细菌数量。
食品制备:提高餐馆和家庭厨房的食品处理技能将减少细菌的传播。 将家禽等生肉充分烹饪至内部温度达到82°C将能消灭该细菌。
新型干预: 精油、益生元、益生菌、细菌素、噬菌体和免疫措施在控制弯曲杆菌方面也具有重要作用。
它是一种主要的食源性人畜共患细菌,对公共卫生构成严重威胁,主要通过食用受污染的动物源性食品传播。单核细胞增生李斯特菌作为食源性病原体的出现可以追溯到1980年,当时发生了很多与食用受污染食品有关的李斯特菌病爆发和散发病例。
★ 李斯特菌感染病例死亡率较高
单核细胞增生李斯特菌是全球控制和监测机构一直试图控制的最具毒力的病原体之一,其病例死亡率约为30%,远高于其他常见的食源性病原体。
此外,食品中存在单核细胞增生李斯特菌还会造成重要的经济后果,例如产品从消费者市场撤回以及涉案产品销量下降。由于李斯特菌属无处不在的特性,以及它们在包括pH、温度和盐度在内的广泛环境压力下生存的独特能力,它们被认为是重要的食源性病原体。
1
病原学特征 (Etiology)
基本特性:李斯特菌属的生物是嗜冷、革兰氏阳性、可运动、兼性厌氧、不形成孢子的杆状细菌。
分类:李斯特菌属目前包含10个种,包括单核细胞增生李斯特菌 (L.monocytogenes)、伊万诺夫李斯特菌 (L.ivanovii) 等。
主要致病菌:尽管李斯特菌属有多个种,但由人类李斯特菌病引起的病例几乎全部是由单核细胞增生李斯特菌(L.monocytogenes)引起的。它是人类和动物的主要病原体。
生存能力:该细菌具有极强的环境适应能力,能够在冷藏条件、低pH值和高盐浓度下存活。它是一种兼性胞内菌,可在0°C至45°C的温度和4.4至9.4的pH值范围内生长。
2
流行病学特征 (Epidemiology)
地理分布:单核细胞增生李斯特菌在世界范围内广泛存在。李斯特菌病在全球以散发或流行的形式出现。
环境分布:李斯特菌属细菌无处不在,广泛分布于正常环境中。它们最常见于被土壤和水污染的蔬菜等生食,以及生的动物产品中。
主要污染食品:单核细胞增生李斯特菌经常从动物源性食品中分离出来,如即食肉制品、碎牛肉、香肠、鱼和鱼制品、牛奶以及经过巴氏消毒的乳制品(如软奶酪和冰淇淋)。
注:尽管巴氏杀菌可以消灭生奶中的单核细胞增生李斯特菌,但并不能消除乳制品后续被污染的风险。
职业与高危人群:人类可能因职业原因从动物源感染李斯特菌病,特别是农民、屠夫、家禽工人和兽医。
侵袭性李斯特菌病的主要风险人群是免疫功能低下者,如孕妇、未出生或新生婴儿、器官移植接受者、癌症和艾滋病患者以及老年人。
3
传播途径 (Transmission)
主要途径: 人类感染的最常见途径是食用被单核细胞增生李斯特菌污染的动物源性食品。
高危人群:孕妇、新生儿、老年人和免疫功能低下的人群感染风险更高。
单核细胞增生李斯特菌引起的宿主、传播和疾病
doi: 10.3389/fpubh.2022.1045599.
4
致病机理 (Pathogenesis)
独特毒力:李斯特菌拥有独特的毒力因子,使其能够侵入宿主、逃避免疫细胞并引起感染。
入侵过程
附着:L.monocytogenes 表面有D-半乳糖残基,可以附着到宿主细胞(通常是肠道粘膜的M细胞和派尔集合淋巴结)上的D-半乳糖受体。
穿透:附着后,细菌可以穿过肠道膜进入血液,成为血源性(败血性)病原体。
胞内生长:进入宿主的单核细胞、巨噬细胞或多形核白细胞后,细菌可以在其中生长。
跨越屏障: 作为一种胞内菌,它能够感染多种类型的细胞,并能穿过肠道、血脑和胎盘等生物屏障,引发感染。
5
临床症状 (Symptoms)
典型症状: L.monocytogenes通常表现为典型的“食物中毒”症状,包括流感样症状(如发烧、疲劳)和胃肠道症状(恶心、呕吐和腹泻)。
持续时间:李斯特菌病的症状通常持续7-10天。
严重感染:在高危人群中,它可能导致严重的、危及生命的感染,如败血症、脑膜炎、自然流产、死产或胎儿感染。
6
检测方法 (Detection)
传统方法:方法包括在选择性培养基中进行增菌,随后在琼脂平板上进行划线培养,并进行各种物种鉴定测试。
注:Christie–Atkinson–Munch–Peterson (CAMP) 试验有助于识别李斯特菌属的种类。
分子方法:由于其准确、灵敏和特异,PCR和RT-PCR等分子方法越来越多地用于从食品中鉴定L.monocytogenes。
免疫学方法:使用单克隆抗体的ELISA已被开发用于鉴定食品中的李斯特菌。
7
预防与控制 (Prevention and Control)
卫生措施
表面消毒:对食品接触表面进行有效的卫生处理可以预防李斯特菌病。
规范操作: 良好的卫生习惯、良好生产规范和卫生设施是操作程序中最合适的策略。
高危人群防护: 建议易感人群(孕妇、老年人和免疫抑制者)避免食用未经巴氏消毒的乳制品以降低风险。
法规与生产控制
法规:标准化的法律法规和对肉制品生产的控制应是保护食品免受L.monocytogenes污染的根本途径。
生产链控制:在食品生产链的不同阶段,防止细菌在加工厂传播是保护食品的最重要方法之一。
管理体系:实施HACCP方法并建立有效的关键控制点,可以显著降低许多加工食品中李斯特菌的污染水平。各国采用的冰淇淋/冷冻甜点巴氏杀菌标准对于减少李斯特菌病具有重要意义。
大肠杆菌是众多可进入动物源食品的病原微生物之一,被认为是粪便、土壤和水污染的可靠指标。一种新兴的克隆差异型大肠杆菌最早于1982年被确定为重要的食源性人畜共患病原体,当时它与美国爆发的严重血性腹泻有关,而这种腹泻的源头被追溯到食用未煮熟的汉堡包。
大多数大肠杆菌是动物和人类胃肠道(回肠下段和大肠)的正常居民,而另一些则对人类具有致病性。大肠杆菌具有人畜共患性质,构成公共卫生危害。产志贺毒素大肠杆菌与全球范围内多起危及生命的食源性疫情相关。
1
病原学特征 (Etiology)
基本特性:大肠杆菌是一种属于肠杆菌科的革兰氏阴性杆状细菌,长度可达3微米,能发酵葡萄糖和其他糖类,有周生鞭毛使其能够运动,并常有菌毛。
致病性分组:根据其毒力特征,可分为五个致病性组:肠道集聚性大肠杆菌(EAEC)、肠道出血性大肠杆菌(EHEC)、肠道侵袭性大肠杆菌(EIEC)、肠道致病性大肠杆菌(EPEC)和肠道产毒性大肠杆菌(ETEC)。
主要致病血清型:O157:H7是最著名的血清型之一,其致病型可引起人类食源性感染。它是一种广为人知的产志贺毒素细菌,也是主要的食源性和人畜共患病原体。
2
流行病学特征 (Epidemiology)
全球公共卫生问题:大肠杆菌O157:H7是最重要的食源性病原体之一,在世界各地报道日益增多,是导致全球暴发的新兴食源性病原体。据估计,仅在美国,每年就有约74000例病例和61例死亡归因于该菌。
主要宿主:牛是大肠杆菌O157:H7的主要宿主。其次是绵羊和山羊。一些研究报告称,小型反刍动物通过粪便排菌也是人类感染的来源之一。此外,也从马、狗和鹿中分离出该菌。
主要传染源:未煮熟的牛肉、受污染的碎牛肉以及其他牛源性食品被确定为暴发中的主要感染来源。牛奶和乳制品也是其来源之一。
促发因素:大肠杆菌O157:H7感染发病率上升的主要促成因素包括饮食习惯的改变、大规模餐饮、复杂且漫长的食品供应链(国际流动增加)以及不良的卫生习惯。
近期趋势:然而,最近关于该菌在牛肉和乳制品中出现水平的报告有增加的趋势。近年来已开展了一些研究来评估其在肉类和奶类等动物源性食品中的出现情况。
3
传播途径 (Transmission)
主要途径:人类感染大肠杆菌O157:H7最常见的传播方式是食用受污染的食物和水。它也可以通过人与人直接接触以及偶尔的职业暴露传播。
大肠杆菌O157:H7的储存库和传播
doi: 10.3389/fpubh.2022.1045599.
污染过程
屠宰环节:在加工厂的屠宰过程中,通过皮肤到胴体或粪便到胴体的转移导致胴体污染,这是人类感染的主要风险因素。
后续环节:交叉污染也可能在加工厂的后续加工、零售市场的牛肉分销和储存过程中发生。
4
致病机理 (Pathogenesis)
关键毒力因子:细菌的致病机制包括毒力因子、志贺样毒素和黏附因子。
黏附与损伤
黏附素基因(Intimin gene):该基因负责细菌与肠道细胞的紧密黏附,导致出现黏附/清除(A/E)病变,并擦除肠细胞刷状缘的微绒毛。
细胞结构改变:细菌黏附后会破坏微绒毛,并改变肠细胞的细胞骨架结构。
志贺毒素(Shiga toxin):志贺毒素的产生是导致出血性腹泻和溶血性尿毒综合征的核心。O157:H7菌株产生志贺毒素1(stx-1)和志贺毒素2(stx-2)。毒素会刺激细胞分泌并杀死结肠上皮细胞。
5
临床症状 (Symptoms)
潜伏期:潜伏期为2至10天。
主要症状:感染后出现腹泻、腹痛、呕吐。最初可能是伴有腹部绞痛的腹泻,几天内可能转为严重的血性腹泻,通常没有发烧。
严重并发症:可能导致出血性结肠炎、伴有急性肾衰竭的溶血性尿毒综合征(HUS)和血栓性血小板减少性紫癜(TTP)。
6
检测方法 (Detection)
金标准:大肠杆菌O157:H7的培养分离仍然是鉴定的金标准,并辅以生化测试。
选择性培养基:添加了头孢克肟和亚碲酸钾的山梨醇-麦康凯琼脂(SMAC)是分离O157:H7最灵敏和鉴别性的培养基之一。O157:H7不发酵山梨醇,因此在该培养基上会形成无色菌落。
免疫学方法:多种免疫测定技术和血清学技术可用于特异性诊断。
分子方法:PCR-ELISA、多种qPCR方法、环介导等温扩增(LAMP)等是检测志贺毒素的主要有效方法。
7
预防与控制 (Prevention and Control)
通用原则:预防由大肠杆菌引起的食源性疾病的方法与其他食源性细菌病相同,但由于其对幼儿的严重后果,需要特别注意。
养殖场策略:在养殖阶段采取干预措施,如使用益生菌、疫苗、抗菌剂、氯酸钠和噬菌体,以增加畜群对感染的抵抗力。
加工干预:开发了多种干预技术,如皮肤和胴体清洗、使用抗菌剂、蒸汽巴氏杀菌、伽马射线辐照等。
HACCP体系:在加工环节实施HACCP方法,该方法包括对产品进行微生物测试。
食品安全计划:证据表明,食品处理人员培训、食品经营场所检查以及旨在推广正确食品处理和制备技术的教育项目,是减少公众暴露于食源性病原体的有效组成部分。
人畜共患疾病是一个严重的公共卫生问题。大多数人类传染病都是由动物引起的。这些病原体不仅在动物中引起疾病,而且还对人类健康构成严重威胁。本文详细介绍了五种主要的食源性细菌性病原体——非伤寒沙门氏菌、金黄色葡萄球菌、弯曲杆菌、单核细胞增生李斯特菌和大肠杆菌O157:H7。这些病原体具有以下共同特点:
主要特征与危害:
-广泛分布于自然界,以动物为主要宿主;
-具有人畜共患特性,对公共卫生构成严重威胁;
-主要通过受污染的动物源性食品传播;
-可引起从轻微胃肠道症状到危及生命的严重并发症。
许多人畜共患病目前已得到控制,但我们对许多疾病的认识仍存在差距,特别是对疾病分布、病原学、病原体、宿主、媒介生物学、动力学、传播周期、易感因素和危险因素的认识。宿主、病原体和环境之间的平衡可能在任何时候受到人类活动和自然活动的干扰,从而引起人畜共患病的发生。
除前述针对不同病原菌(沙门氏菌、弯曲杆菌等)的传统培养、血清分型、免疫学检测及分子诊断等常规方法外,高通量测序技术正逐步成为重要补充工具。
以16S rRNA测序、宏基因组测序为代表的新型技术,无需依赖传统培养流程,可直接对粪便、食品或环境样本中的微生物群落进行全面解析。
未来预防与控制建议:
1.建立”从农场到餐桌”的全链条防控体系
-在养殖阶段加强生物安全措施,使用益生菌、疫苗等预防手段;
-在屠宰加工环节严格实施HACCP体系,加强胴体清洗和消毒;
-在零售和消费环节加强食品安全教育和监管。
2.强化多部门协作的”一体化健康”理念
-建立兽医、公共卫生、食品安全等部门的协调机制;
-完善动物疫病监测预警系统;
-加强抗菌药物合理使用,遏制耐药菌株传播。
3.推进科技创新与检测技术发展
-开发更快速、准确的分子检测方法;
-研发新型疫苗和生物防控技术;
-利用人工智能等技术提升风险预测能力。
4.加强公众教育与意识提升
-普及食品安全知识,提高消费者自我保护能力;
-加强食品从业人员培训;
-建立食品安全社会共治格局。
5.完善法律法规与标准体系
-制定和完善食品安全法律法规;
-建立严格的食品安全标准和检测体系;
-加大对违法行为的处罚力度。
面对人畜共患病的复杂挑战,我们需要以科学的态度、系统的思维和协作的精神,构建覆盖全社会、全过程的食品安全防控网络。消化道病原菌直接关系到我们的饮食和健康,尤其夏季食物易腐败或受污染,其检测更为重要。只有通过持续的努力和创新,才能有效预防和控制食源性人畜共患病的传播,保障人类健康和食品安全。
主要参考文献
Ali S, Alsayeqh AF. Review of major meat-borne zoonotic bacterial pathogens. Front Public Health. 2022 Dec 15;10:1045599.
Abebe E, Gugsa G, Ahmed M. Review on Major Food-Borne Zoonotic Bacterial Pathogens. J Trop Med. 2020 Jun 29;2020:4674235.
Rahman MT, Sobur MA, Islam MS, Ievy S, Hossain MJ, El Zowalaty ME, Rahman AT, Ashour HM. Zoonotic Diseases: Etiology, Impact, and Control. Microorganisms. 2020 Sep 12;8(9):1405.
Ed-Dra A, Giarratana F, White AP, Yue M. Editorial: Zoonotic bacteria: genomic evolution, antimicrobial resistance, pathogenicity, and prevention strategies. Front Vet Sci. 2024 Mar 8;11:1390732.
Ed-Dra A, Filali FR, Khayi S, Oulghazi S, Bouchrif B, El Allaoui A, Ouhmidou B, Moumni M. Antimicrobial Resistance, Virulence Genes, and Genetic Diversity of Salmonella enterica Isolated from Sausages. Eur J Microbiol Immunol (Bp). 2019 Apr 9;9(2):56-61.
Feng Y, Pan H, Zheng B, Li F, Teng L, Jiang Z, Feng M, Zhou X, Peng X, Xu X, Wang H, Wu B, Xiao Y, Baker S, Zhao G, Yue M. An integrated nationwide genomics study reveals transmission modes of typhoid fever in China. mBio. 2023 Oct 31;14(5):e0133323.
Mughini-Gras L, Kooh P, Augustin JC, David J, Fravalo P, Guillier L, Jourdan-Da-Silva N, Thébault A, Sanaa M, Watier L; Anses Working Group on Source Attribution of Foodborne Diseases. Source Attribution of Foodborne Diseases: Potentialities, Hurdles, and Future Expectations. Front Microbiol. 2018 Sep 3;9:1983.
Dhama K, Rajagunalan S, Chakraborty S, Verma AK, Kumar A, Tiwari R, Kapoor S. Food-borne pathogens of animal origin-diagnosis, prevention, control and their zoonotic significance: a review. Pak J Biol Sci. 2013 Oct 15;16(20):1076-85.

谷禾健康

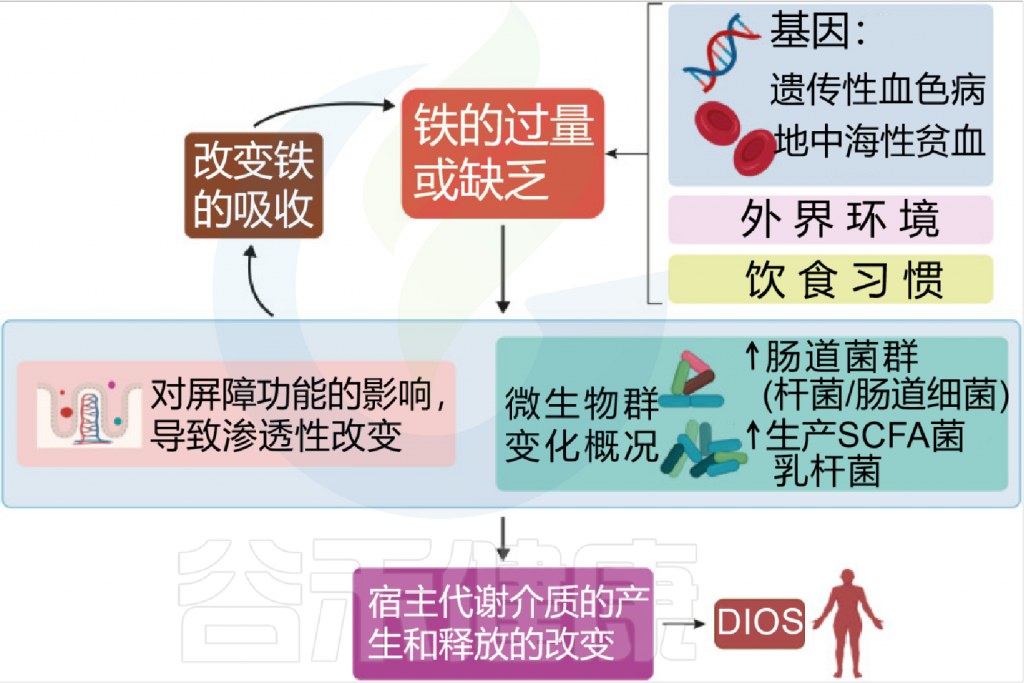
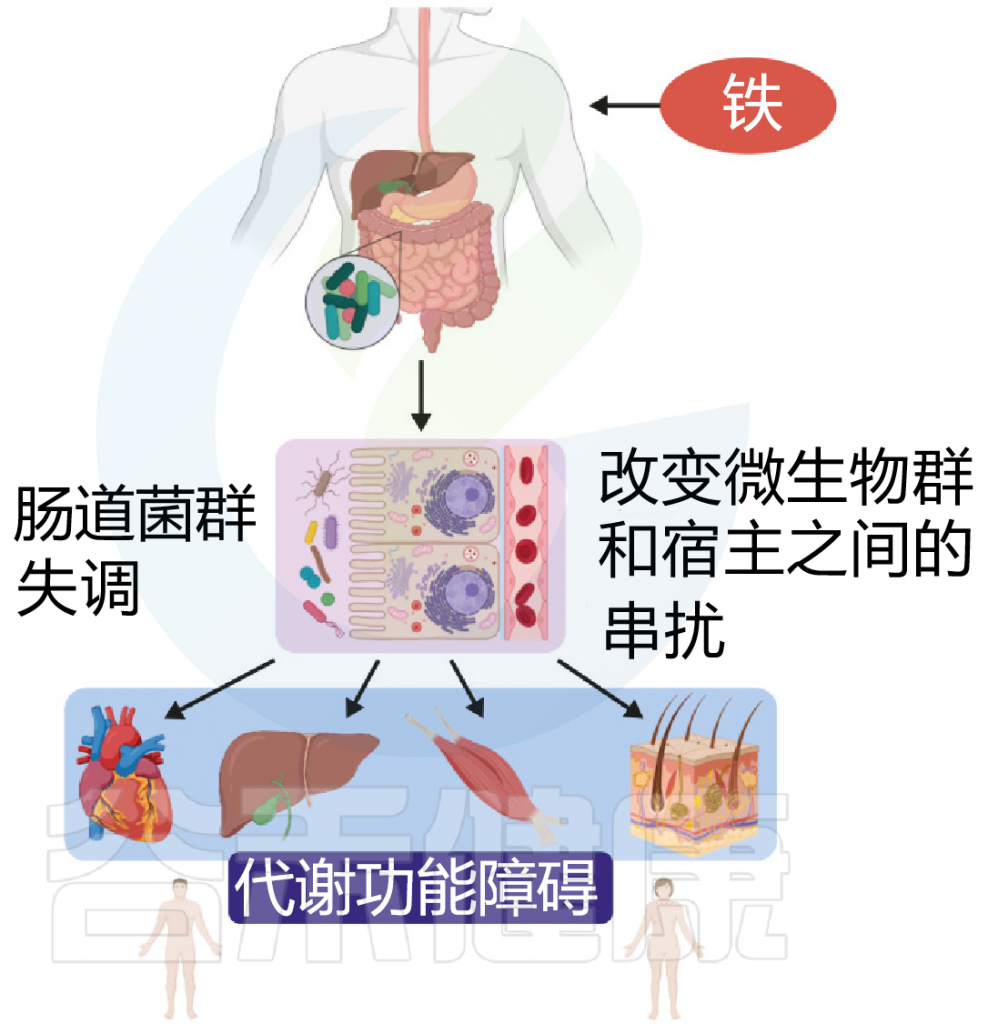
铁 (Iron)作为人体不可或缺的元素之一,在氧气运输,新陈代谢和免疫防御中起着基本作用。铁元素的良好调控是人体健康的保障,过多过少都会对人体产生不利影响。铁稳态的失调与各种疾病的发生和发展息息相关:铁缺乏会导致宿主发育迟缓,免疫低下,而铁过载更易引发炎性反应和代谢问题, 还可能与癌症的发生发展密切相关。
在人类中,小肠作为宿主体内铁的主要吸收场所,大约每天吸收2-3mg铁,但是在一些病理条件下,小肠并不能完全将食物中的铁吸收,而相当一部分铁进入结肠中与肠道菌群发生密切的交互作用,并影响肠道菌群的“生态系统”,从而进一步调节宿主的健康和代谢。
自法国国家农业研究院与法国国家健康与医学研究院(INSERM)的研究人员首次发现肠道菌群如何影响肠道内铁元素的转运与储备成果后,多项研究表明,铁失衡会导致肠道菌群的改变,进而改变微生物多样性,增加病原体丰度并诱导肠道炎症的发生发展。
谷禾在多年的肠道菌群研究和检测实践中,也发现饮食中的铁水平是导致肠道菌群改变的重要因素。我们基于机器学习算法,建立了预测模型,可以预测评估膳食摄入和铁的菌群代谢的总体水平,这有助于避免缺铁和铁过量引起的肠道菌群失调及其可能导致的宿主健康损害和疾病风险。
铁和微生物组之间相互作用

Botta A, et al., J Lipid Atheroscler. 2021
铁是人类必需的营养素,在环境中含量非常丰富,并参与了许多生物过程,如氢气的产生、呼吸和DNA 生物合成。它还在宿主细胞内的许多代谢途径中起到辅助因子的作用。
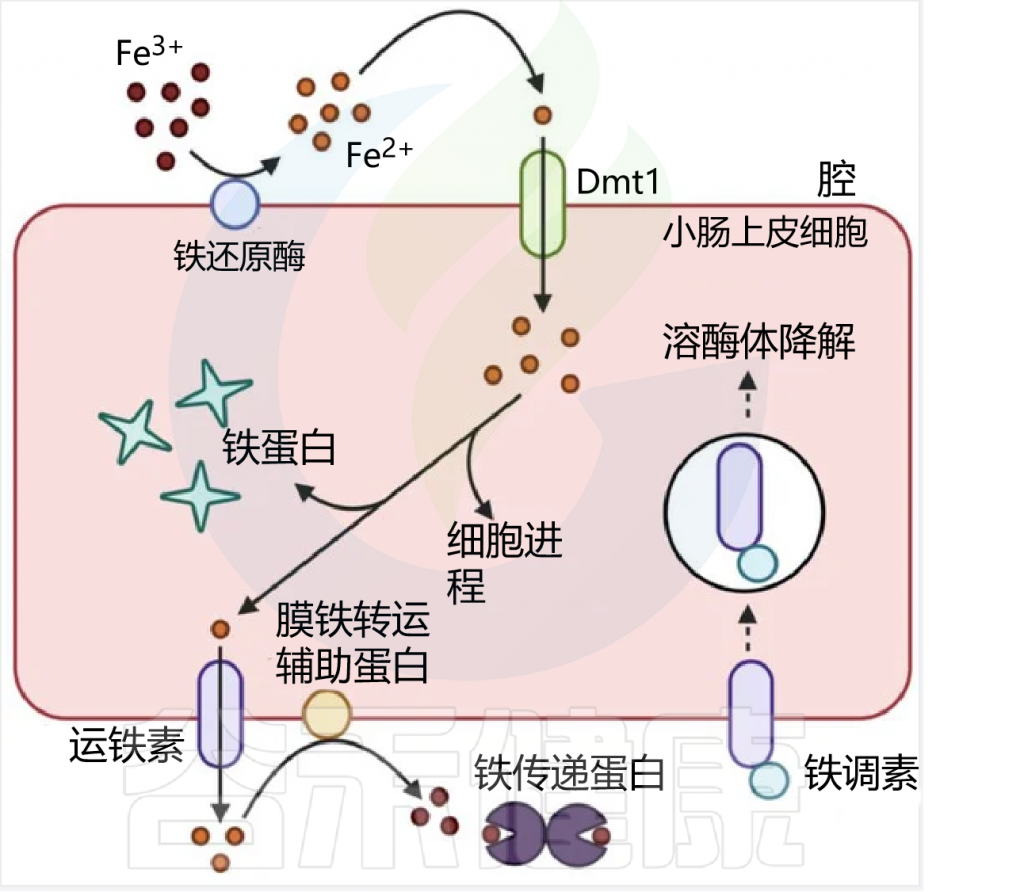
在人类中,由于没有排泄铁的途径,小肠上皮细胞对铁的吸收是一个非常严格的调节过程。
吸收效率取决于饮食中铁的潜在可用性,并受生理铁需求的调节,包括体内铁储存,铁调素在控制吸收中起核心作用。
膳食铁大致分为两种类型,非血红素铁和血红素铁。两种形式的膳食铁都有单独的肠细胞吸收途径:


这里主要关注的是非血红素铁(口服铁通常以非血红素铁的形式给予)。
肠上皮细胞对非血红素铁的吸收

日常生活中,缺铁的常见症状包括:
一般我们常见的缺铁,主要是以下几个原因:
这很好理解。我们的身体不能制造铁,需要从食物中获取。如果你每天摄入的铁量没有达到身体需要的量,就会出现缺铁。
快速生长会增加铁需求,因此儿童、孕妇和哺乳期女性更可能缺铁。此外,进行耐力锻炼的人更容易患低铁症。
出血和失血会增加铁的流失,包括:月经出血、分娩、溃疡、痔疮、因受伤或手术而出血、献血等。长期使用消炎药(布洛芬、萘普生、双氯芬酸)会增加肠道出血的可能性。
需要注意的是,缺铁性贫血的一个常见且常被忽视的原因是月经过多。随着时间的推移,这种缓慢的血液流失通常会导致铁流失过多。
在慢性炎症性疾病中也会出现缺铁,例如自身免疫性疾病、慢性感染、慢性肾病或癌症。这被称为慢性病性贫血。
因为铁对病原体和癌细胞的生长很重要,所以当发生感染或炎症时,身体会试图通过锁定铁来抑制病原体或恶性细胞的生长。
受感染或炎症影响的组织会释放降低铁血水平的细胞因子,从而导致贫血的发展。
消化系统的疾病会降低铁的吸收,包括:
乳糜泻、炎症性肠病、胃炎、幽门螺杆菌感染、小肠细菌生长过度等,此外,减肥手术也会减少营养吸收,包括铁。
铁吸收不足的其他原因包括大量摄入抑制铁吸收的食物或药物,包括:植酸盐(全谷物、豆类)、多酚(茶、咖啡、葡萄酒)、抗酸药、H2受体阻滞剂、四环素或消胆胺等药物等。还有一个很重要的我们可能会忽略的环节,就是菌群。
细胞铁浓度是感染性的关键决定因素之一。肠道病原体在宿主细胞中的存活可能部分取决于宿主铁的状态。铁也可以促进肠道病原体的复制和毒力,例如沙门氏菌属、志贺氏菌属和弯曲杆菌属。
利用铁载体获取铁的一些细菌还包括如:
大肠杆菌、铜绿假单胞菌、肺炎克雷伯菌、金黄色葡萄球菌和结核分枝杆菌。
这些病原菌的定植会与宿主进行铁的竞争吸收,同时诱发肠道炎症,改变肠腔环境,影响菌群构成,进一步导致缺铁加剧。


大多数细菌都依赖于铁的存在来进行呼吸和各种代谢过程。在细菌内部,铁在生长和增殖中起着至关重要的作用,例如,某些细菌蛋白质和酶的正常功能需要铁。此外,铁还可以调节某些毒力因子的表达。
铁浓度的波动会产生病理影响,对肠道微生物群组成产生负面影响。铁的波动有两种情况,过多或者缺乏,接下来我们逐一来看铁过量和缺乏会对菌群造成什么影响。
宿主铁稳态的改变可能会影响肠道的管腔铁含量,从而影响肠道菌群的组成。在无菌小鼠中,铁转运蛋白表达减少两倍,细胞铁含量较低,在移植肠道细菌定植后,上皮细胞利于铁的能力增加,细胞内铁含量增加。
铁过量
肠道中富含铁的环境有利于变形菌。对儿童的研究表明,过量的铁会导致炎症和病原菌的生长。这些病原菌可能会诱发炎症性肠病或结直肠癌。铁的强化增加了粪便钙卫蛋白的水平,显示了肠道的炎症。
患有铁过载综合征(包括血色素沉着症和难治性贫血)的人更容易受到细菌感染,包括:
耶尔森菌属Yersinia
单核细胞增生李斯特菌Listeria monocytogenes
创伤弧菌Vibrio vulnificus
膳食铁过量摄入可影响大鼠正常的生长发育,并引起小肠粘膜炎性损伤。过量铁摄入可引起大鼠肠道菌群失调,肠道菌群丰度有所降低,其中乳酸杆菌、双歧杆菌降低,血清中肿瘤坏死因子和内毒素水平升高可能与肠道菌群紊乱有关。
铁缺乏
当铁水平下降时,也会对肠道微生物群组成产生影响,诱发肠道感染。缺铁会抑制细菌细胞繁殖过程,从而损害细菌生长。
在啮齿类动物模型中,缺铁导致微生物群组成的显著重组,微生物多样性降低。
在铁含量非常低的条件下(0.9 mg Fe/L),Roseburia,肠杆菌减少,丁酸盐水平也降低,而Lactobacillus增加。此外,低铁条件下生长的Roseburia gutis优先产生乳酸而不是丁酸盐。
图 铁和炎症之间相互作用
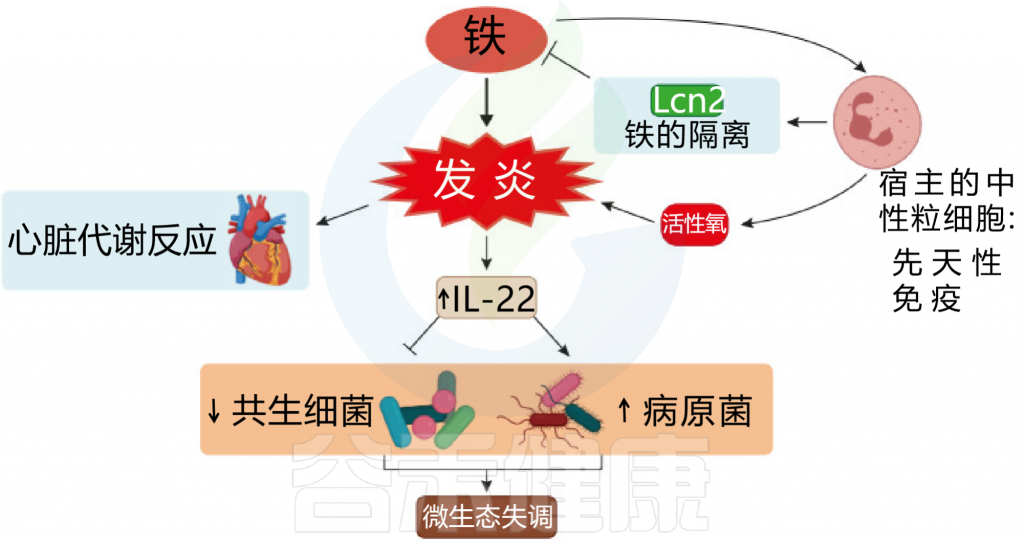

Botta A, et al., J Lipid Atheroscler. 2021
铁补充
铁的补充和强化对人体肠道细菌组成有不同的影响。
接受低剂量(0-10 mg Fe/天)或高剂量(大于60 mg Fe/天)铁补充剂的孕妇在肠道菌群任何分类水平上均没有显著差异。
接受含铁微量营养素粉(12.5 mg/天)的肯尼亚婴儿的病原体丰度增加。在健康、非贫血的瑞典婴儿中,食用高铁配方奶粉(6.6 mg Fe/天)45天不会增加病原菌的生长;然而,双歧杆菌的相对丰度降低。
但是,值得注意的是在同一项研究中,与服用高铁配方奶粉的婴儿相比,服用铁滴剂(6.6 mg Fe/天)的婴儿的乳酸菌种类相对丰度较低。尽管剂量相当,但这项研究表明,给药形式(即配方奶粉与滴剂)对肠道微生物组成的影响存在差异。
此外,由于铁滴剂会导致乳酸杆菌的减少,乳酸杆菌是重要的共生细菌,因此铁滴剂可能会增加感染的易感性。
在疟疾流行地区补充铁被证明会增加严重不良事件的发生率,包括因疟疾和其他感染而住院。疟疾感染恶化的潜在机制被认为是过量铁抑制铁转运蛋白(ferroportin,防止红细胞中铁过量,防止感染)。
口服铁补充剂和强化对 4-59 个月儿童腹泻发病率的影响。在19项研究中发现,12项研究中铁不会影响腹泻发病率,在其余的研究中,四项记录的腹泻发病率显着增加,三项记录在特定亚群中的增加。
为什么有些研究表明补铁导致腹泻增加?
有两个主要假设可以解释有时观察到的效果。
首先,铁可以在肠道内产生活性氧,从而导致肠道损伤,并导致炎症性腹泻。这一假设得到了体外实验的支持,在体外实验中,铁暴露后,肠上皮细胞失去了完整性。
其次,铁可以改变肠道细菌的组成,创造一个更具炎症性的环境。
口服铁剂后结肠腔内的微生物和代谢变化
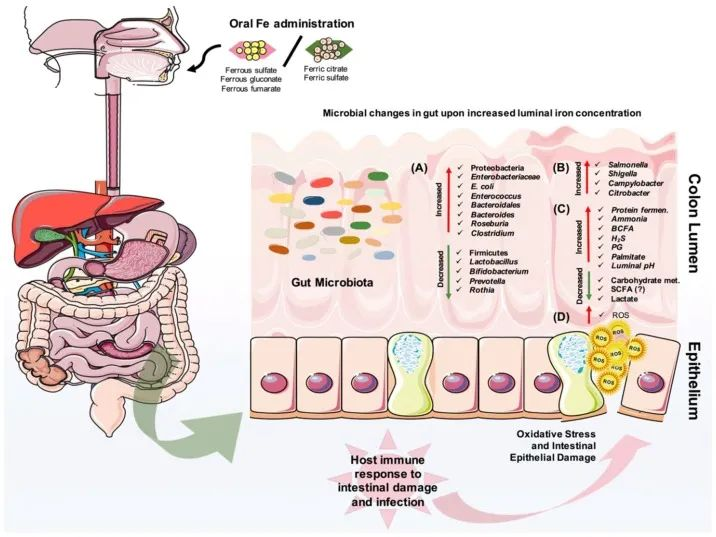
Yilmaz B, Li H. Pharmaceuticals (Basel). 2018
口服铁对肠道微生物组成的改变有直接影响。
(A)它可以导致有益微生物群的减少和致病菌的扩张,
(B)也可以为肠道病原体的扩张提供机会。
(C)此外,蛋白质发酵的增加和碳水化合物代谢的减少也会影响宿主的代谢。
(D)重要的是,铁可以在肠道中诱导活性氧(ROS)的产生,从而导致氧化应激,从而导致肠上皮损伤。
· 反过来,宿主的肠道免疫系统会对炎症、肠道损伤和可能的感染做出反应。
对于缺铁个体的补铁,可以改善肠道微生物的组成,降低致病菌的数量。但是在一些研究中,缺铁性贫血的个体口服补铁常会伴随胃肠道症状和肠道感染等副作用。在非洲的研究中,接受了铁强化剂饼干的儿童,铁补充并未改善机体贫血状况,反而增加了肠道致病菌肠杆菌数量,减少了乳酸菌和双歧杆菌数量,这些现象的发生可能与宿主的肠道高炎症水平密切相关,受到肠道内铁含量和微生物的影响。
当人体存在低肠道病原体负担时,补充铁剂对于肠道优势菌群或肠道炎症没有明显的影响;当人体不存在肠道病原负担的时候,补充铁剂可恢复肠道菌群,显著增加粪便中抗炎短链脂肪酸浓度并且降低肠道炎症,改善肠道微环境。
铁与病原菌
在哺乳动物中,大多数铁在血红素的卟啉结构中被螯合。由于病原菌生长需要铁,有的病原菌如霍乱包含的基因使霍乱弧菌能够从血红素中获取铁。霍乱毒素通过堵塞末端的毛细血管增加管腔血红素的生物利用度,导致宿主铁利用降低。
图 铁和代谢功能之间联系

Botta A, et al., J Lipid Atheroscler. 2021
此外,霍乱弧菌产生一种称为弧菌素的铁载体。与肠杆菌素等其他儿茶酚酸酯铁载体不同,这种独特的协同作用有助于逃避宿主免疫系统。霍乱毒素还会增加管腔内的长链脂肪酸和L-乳酸代谢产物,从而导致编码TCA循环含铁硫簇酶的霍乱弧菌基因上调。
因此,霍乱和霍乱毒素的产生在肠道中创造了一个缺铁代谢生态位,通过获得宿主来源的血红素和脂肪酸,选择性地促进霍乱弧菌的生长。
空肠弯曲菌也能捕获宿主铁并在宿主内引起感染。空肠弯曲菌感染是通过食用生的或未煮熟的家禽、海鲜、肉类和未经处理的饮用水发生的,当空肠弯曲菌通过胃时,它必须首先在极端酸性环境中存活。铁的存在增强了它在酸胁迫环境中的生存能力,因此它含有与铁介导的酸保护有关的基因,包括鞭毛生物发生基因、细胞膜生物发生基因、热休克蛋白(GroEL、GroES),这些基因有助于它的生存。
膳食铁可抑制肠道病原体柠檬酸杆菌的生长,并促使选择无症状的柠檬酸杆菌菌株;这些反应与胰岛素抵抗和抑制病原体毒力的葡萄糖水平升高有关。
除了促进胰岛素抵抗外,膳食铁还增加了肠道葡萄糖水平,这是抑制病原体毒力的关键肠道环境变化,并推动了无症状柠檬酸杆菌菌株的选择。然而,相比之下,其他研究表明,铁可用性的降低是有益的,因为它可以减少潜在致病性肠道细菌的生长。
铁对促、健康的 SCFAs 产生的影响
细菌代谢对我们的肠道健康很重要。短链脂肪酸是结肠中的主要代谢物,对肠道健康非常有益,并且是肠细胞和更远距离组织的能量来源。
铁与短链脂肪酸
两项研究首次描述了铁和短链脂肪酸产生之间的联系。
具体来说,体内大鼠管腔缺铁期间丁酸盐和丙酸盐水平较低,并通过补铁恢复。尽管不能排除饮食干预会改变肠道对短链脂肪酸的摄取,但这些结果表明,补铁可以通过增加短链脂肪酸的产生对肠道健康产生有益的影响。
然而,相比之下,高铁条件下似乎没有太大刺激体外短链脂肪酸的产生,而在极低铁条件下丁酸盐和丙酸盐的产生最明显受到损害。这种产量下降伴随着产生短链脂肪酸的菌Roseburia spp./ E. rectale和Clostridium Cluster IV 成员的减少。
体外发酵研究表明,补充铁会略微增加丙酸盐水平,但总短链脂肪酸水平没有显着变化。
与补充铁饮食的大鼠相比,缺铁饮食大鼠的盲肠乙酸盐、丙酸盐和丁酸盐水平降低。他们还表明,与对照组饮食(并且没有首先耗尽铁)的大鼠相比,补充铁饮食的大鼠的丙酸盐和丁酸盐水平更高。因此可以假设,缺铁饮食(与缺铁相结合)可能对肠道健康无益,因为在这些条件下,腔内短链脂肪酸水平会降低。相反,铁补充剂可能会增加促进健康的肠腔短链脂肪酸水平。
值得注意的是,短链脂肪酸可能会影响肠道病原体的毒力。丁酸盐的减少也可能会降低肠内 AMP 导管素的表达,从而削弱宿主的防御能力。
铁与支链氨基酸(BCFA)
与碳水化合物发酵相比,肠道细菌的蛋白质发酵会产生有毒或潜在有毒的代谢物,例如氨、H2S、BCFA(例如异丁酸和异戊酸)、吲哚和酚类化合物。
在体外,低铁条件下 BCFAs 的产生减少,也就是说:铁增加了成人粪便微生物群的 BCFA 的产生以及有毒氨的产生。
值得注意的是,BCFAs 和氨被认为是蛋白质发酵的指标。研究表明铁会刺激蛋白质发酵,这可能会导致更腐败、潜在有毒或致癌的环境。相比之下,在体外发酵研究中发现乳酸(主要来自碳水化合物)水平会随着铁的反应而降低。
虽然在多项体外研究中显示了源自蛋白质发酵的产品毒性的证据,但体内毒性是有限的,最近的一项试验不支持蛋白质发酵在人体肠道毒性中的作用。
另一方面,蛋白质发酵通常与病原菌的生长有关。因此,有必要在体内研究铁对蛋白质发酵和毒性的影响。
重要的是要认识到微生物代谢物的影响不仅限于肠道,因为它们被吸收,并且可能对远处部位和全身宿主代谢产生影响。目前我们还不知道这如何影响人类健康和疾病,但研究暗示铁诱导的肠道微生物活性变化也可能具有全身性影响。
在稳态条件下,肠道内的微生物必须相互竞争,并与宿主竞争可用铁。因此,细菌发展了不同的吸收系统,如铁运输系统和铁载体(铁螯合分子),以便在铁有限的环境中更有利地竞争。
前面我们知道,铁对于细菌的生长繁殖至关重要,但过量的铁也会产生毒性,因此,细菌对铁离子的摄取必须受到精确严格的调控。
细菌已经进化出了铁源的摄取系统。
细菌获取铁的机制
细菌可以通过分泌铁载体摄取Fe3+。铁载体是一种Fe3+特异性的螯合剂,对Fe3+具有超强的络合力。
铁载体能够与宿主体内的转铁蛋白、乳铁蛋白等铁结合蛋白竞争Fe3+,从而形成可溶性的Fe3+-铁载体复合体,这种复合体可以特异性地与细菌细胞外膜上的铁载体受体蛋白(OMRs)相结合,最终被转运至细胞周质中,转运过程通过TonB系统提供能量。
细胞周质中的Fe3+-铁载体复合体与周质结合蛋白(PBPs)相结合,形成Fe3+-铁载体-PBPs复合物。最后Fe3+-铁载体-PBPs复合物由ABC转运蛋白介导,通过内膜进入胞浆。进入细胞后,Fe3+-铁载体-PBPs复合物中的Fe3+被铁还原酶还原为Fe2+,Fe2+与铁载体的亲和力低,从而被释放。
除了分泌高亲和力的铁载体竞争Fe3+外,一些细菌还进化出直接利用转铁蛋白或乳铁蛋白中Fe3+的机制。
大多数革兰氏阳性菌存在直接吸收血红素而获得铁元素的转运系统。
细菌外膜上的血红素受体可以直接与血红素或血红蛋白结合,并将血红素或血红蛋白转运至周质,通过ABC转运蛋白转运至胞质降解或利用,整个过程由TonB系统提供能量。
金黄色葡萄球菌铁依赖性表面决定系统(Isd)可从血红蛋白中获取Fe2+。
除直接的血红素转运系统外,还存在间接的血红素转运系统。如革兰氏阴性菌中存在的Hemophore蛋白介导的血红素转运系统。
除此之外,细菌也可以产生分泌的或位于膜上的铁还原酶,将Fe3+还原成更容易溶解的Fe2+形式,并通过Feo、Yfe、Efe等转运系统来摄取Fe2+。其中Feo转运系统最为重要,大约80%的革兰氏阴性菌都存在Feo转运系统。
调节铁稳态
铁储存蛋白通过以可溶且无毒的形式储存细胞内游离铁来降低其浓度。在铁缺乏时,例如当存在于哺乳动物宿主细胞内或血液中时,铁可以从这些细菌储存中释放出来。
例如,大肠杆菌可以通过FieF输出铁,而且已经描述了一种用于伤寒杆菌的柠檬酸铁外排转运体(IceT);这些铁外流系统的目的是防止细胞内高水平的游离铁造成的压力。此外,血红素输出机制(HrtAB或同源蛋白)已被证明可以缓解某些细菌中血红素的铁胁迫。
最后,双歧杆菌科能够将铁结合到其表面,从而减少周围环境中自由基的形成,并可能在结肠腔中起到铁螯合的作用,以防止病原菌吸收铁。
铁的形态、可用性和结肠腔中的铁之争

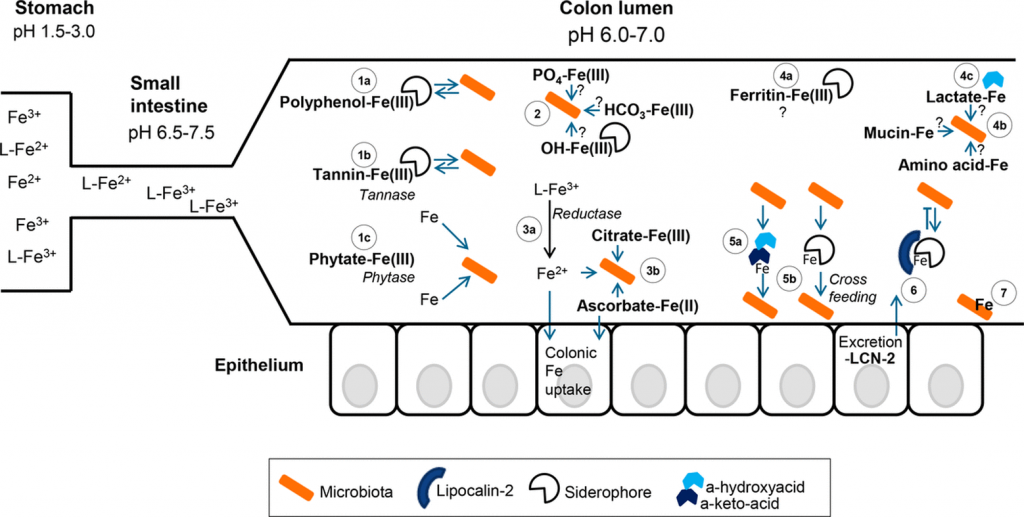
Kortman GA, et al., FEMS Microbiol Rev. 2014
胃肠道中的铁形态可能对肠道微生物群获取铁起着重要作用。
低pH值有利于铁和亚铁的溶解性,不一定需要配体(L)来溶解。
当小肠内的pH值升高时,主要是三价铁的溶解度降低,并与食物成分和宿主排泄物形成更多的络合物。
在结肠内,由于微生物群产生乳酸和短链脂肪酸等,pH值略有下降。图中结肠部分的微生物群以橙色表示(有益的)常驻物种和致病物种。
铁调素(Hepcidin)是一种由肝脏产生的肽激素,是全身铁稳态的主要调节剂。铁调素结合并降解铁转运蛋白,从而影响铁被巨噬细胞回收、被肠上皮细胞吸收以及被肝细胞储存的过程。
当体内缺铁时,铁调素浓度较低,从而有利于铁的吸收和从储存部位输送到血浆;
但当体内铁含量充足时,较高的铁调素浓度会降低铁的吸收,并损害铁的释放。
体内“铁稳态”
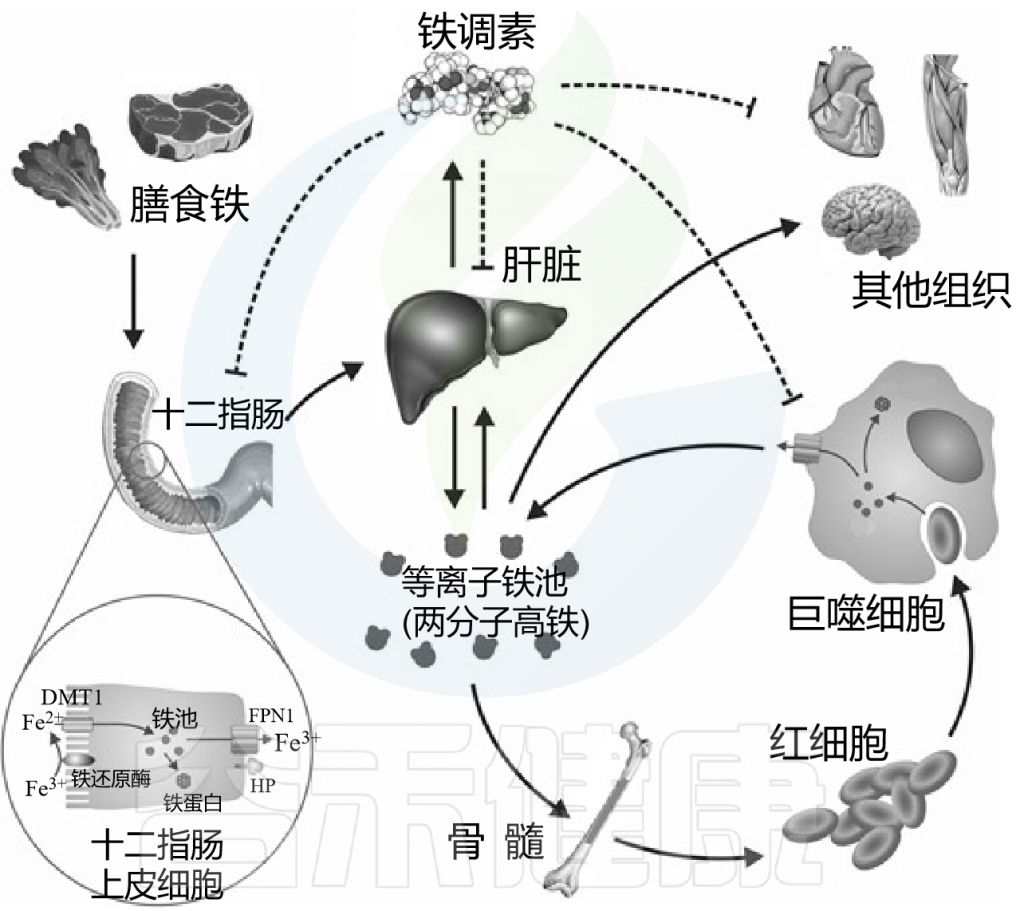

Anderson GJ, et al., Am J Clin Nutr. 2017
铁在饮食中以血红素和非血红素形式存在。非血红素铁通过DMT1穿过肠上皮细胞的根尖膜,通过FPN1穿过基底外侧膜后进入血液循环。铁与血浆TF结合,分布到全身组织。
菌群会通过代谢物信号传导途径调控系统铁稳态平衡。美国密西根大学研究人员在《Cell-Metabolism》上发表的研究证明了,细菌具有铁依赖性机制,可以抑制宿主铁的运输和储存。肠道菌群产生的代谢物能抑制肠道铁吸收主要转录因子低氧诱导因子 2α (HIF-2α),并增加铁存储蛋白铁蛋白 (Ferritin),从而抑制宿主的铁吸收。
两种菌群代谢物——1,3-二氨基丙烷 (DAP) 和 Reuterin,通过抑制异二聚化作用作为 HIF-2α 抑制剂,可以有效缓解全身铁超负荷。
与铁摄取相关的抗菌治疗
针对细菌生存繁殖对铁稳态的严重依赖,可将病原菌的铁获取系统作为抗菌治疗的靶点,开发针对病原菌铁稳态的化合物治疗细菌感染,同时可基于该系统研发疫苗。
大鼠和家兔服用抗生素后,铁的吸收也减少了。然而,小鼠研究发现,抗生素治疗后,铁的吸收增加了。这些发现表明,抗生素的使用可能改善铁缺乏症患者的铁吸收。
铁是饮食变化、微生物组改变和代谢功能障碍之间串扰的关键节点。
代谢综合征指的是一组异常,包括肥胖、血脂异常、胰岛素抵抗和2型糖尿病,这些疾病共同增加了心血管疾病的风险,包括心力衰竭(HF)和非酒精性脂肪性肝病。
通过血清中非转铁蛋白结合铁的存在、高铁蛋白血症、肝铁超载与胰岛素抵抗的相关性,明确了代谢综合征患者中轻度铁过量的患病率。
铁过量与胰岛素抵抗的结合通常被称为代谢异常铁过量综合征,15%-30%的代谢综合征患者会出现这种情况。因此,目前铁过量与代谢当量的关系已被充分认识,但导致代谢功能障碍的机制尚不完全清楚。
降低代谢疾病中铁的效果
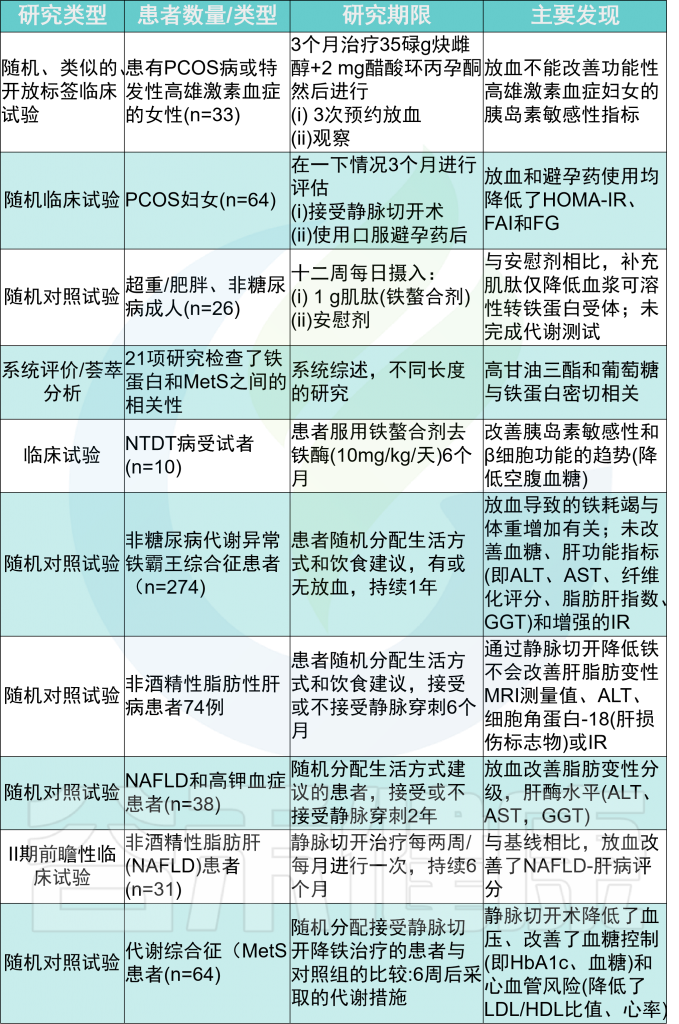

在铁储量较高的MetS患者中,男性对心脏和肝脏疾病的易感性较高。
通过静脉切开或使用螯合剂等降低铁含量的干预措施,在某些情况下可以提高胰岛素敏感性,延缓2型糖尿病(T2DM)和心力衰竭的发病,但并不总是成功的。
在长期病态肥胖后,缺铁是一种常见现象,同样也可导致2型糖尿病和心力衰竭。因此,之前的研究表明铁和葡萄糖稳态或心肌病之间存在双向关系,表明最佳铁水平的平衡至关重要。
可能铁在代谢综合征发病机制及其并发症中的作用仍未得到充分重视,而微生物群的修饰是铁代谢影响的一种重要且相对未被探索的中介物。特别是,肠道内饮食中的铁水平改变了微生物群的组成。预计随后会影响微生物组的代谢组谱功能,包括短链脂肪酸和支链氨基酸。这种改变的后果将是宿主的外周胰岛素抵抗和代谢功能障碍。
炎症性肠病 (IBD) 的特征是胃肠道的慢性炎症。炎症与溃疡性结肠炎 (UC) 和克罗恩病 (CD) 中的肠道溃疡有关。IBD 也可能出现出血和吸收不良,三分之一的患者会出现缺铁性贫血。
一项IBD小鼠模型的研究发现,铁含量的改变显着影响 DSS 在小鼠中诱导的结肠炎的严重程度,铁含量的过多或过少都会加剧结肠炎的严重程度。
DSS治疗的高铁饮食小鼠的体重减轻程度不如低铁饮食小鼠,但粪便钙卫蛋白测定的肠道炎症更严重。这些喂食高铁饮食的小鼠经历了变形菌的增加,同时厚壁菌和拟杆菌的减少。
膳食铁水平与结肠炎症的 DSS 治疗和粪便钙卫蛋白水平之间似乎存在协同作用。
摄入两倍于标准水平铁(400 ppm)的饮食会导致微生物组的关键变化,这意味着观察到的这些变化不仅仅是由炎症的严重程度驱动的,还有管腔游离铁也会导致导致IBD中经常观察到的异源状态发展的复杂因素相互作用。
还需要更多了解的是,管腔铁如何影响IBD。此外,还需要研究管腔铁的增加对肠道微生物群的生理影响,以及这可能如何影响菌群多样性。未来也需要更多人体干预研究,进一步确定不同剂量的治疗性口服铁对人体肠道微生物群的复杂影响,尤其是代谢后果。
研究表明,缺铁和铁过量都与结直肠癌的发病机制有关,这表明必须谨慎平衡最佳铁摄入量。
在 965 名 50-75 岁的人群研究中,发现铁摄入量与结直肠息肉之间存在 U 型关系,铁摄入量高(>27.3 毫克/天)或低量(<11.6 毫克/天)的人更容易患上结直肠息肉,这是结直肠癌的前兆病变。
缺铁
由于铁在维持免疫功能中至关重要,铁的可用性不足可能会通过削弱对肿瘤变化的免疫监测,并潜在地改变肿瘤免疫微环境而增强致癌性。来自临床研究的数据表明,在结直肠癌患者中,缺铁与较差的预后和较低的治疗反应相关。
铁过量
大多数强有力的研究证实,膳食铁和铁储存过量都会增加结直肠癌的风险。
五项前瞻性人类队列研究,包括566607名个体和4734例结肠癌患者的数据,表明高血红素铁摄入量与结肠癌风险增加有关(虽然有一个队列没有发现任何关联)。
在防御方面,长双歧杆菌和嗜酸乳杆菌是肠道保护性共生菌。它们形成了一道保护屏障,防止病原菌定植,并产生丁酸盐,作为一种抗癌剂。双歧杆菌科可通过将铁结合到其表面来影响自由基的形成,并促进结肠上皮的日常更新,而乳酸杆菌菌株可降低胆汁酸的诱变效应。
大多数致病菌都具有增强的铁获取机制,因此往往比保护性细菌更容易获得游离铁。也就是说,铁可以促进致病菌和肠道共生菌之间比例的变化,增加肠道中的特定代谢物和炎症。
研究显示,拟杆菌/普氏杆菌、梭状芽孢杆菌、牛链球菌和粪肠球菌可产生遗传毒性代谢物,如硫化氢和次生胆盐,这可能会促进炎症和致癌。
基于抗生素的肠道致病菌清除降低了结肠癌的发病率,并改变了小鼠的肠道微生物群。这些发现得到了人体研究的支持。
可见,针对肠道微生物群的饮食干预有望治疗结直肠癌,但这些方法仍需要进一步研究。
过量的铁对身体会带来不良影响,因此如果体内铁过量则需要采取相应措施。
多酚-铁:结合牢固,防止铁被吸收
饮食中通常含有单宁和儿茶酚等多酚,它们大量存在于茶和咖啡中。这些化合物可以非常牢固地结合铁,从而防止宿主吸收铁,但也防止细菌吸收铁。
然而,在铁缺乏的环境中,致病菌可以产生和/或占用含铁细胞可能受益于铁多酚提取机制,很可能通过清除铁绑定到多酚。
目前尚不清楚这种机制是否在肠腔中发挥重要作用,但可能与此有关,因为肠环境中可能同时存在多酚和铁载体。
此外,某些细菌,如甘蓝链球菌或卢格敦葡萄球菌,可以降解多酚鞣酸盐,并通过这种方式暂时将铁从这种有效的铁粘合剂中释放出来。
可以通过在用餐后一小时内饮用以下饮料来减少铁的吸收:


植酸盐-铁:结合物通过菌群降解,释放铁
另一种具有强铁结合活性的化合物是植酸盐,在食用谷物和豆类为主的饮食后,其肠道可利用性很高。
与单宁酸类似,某些肠道微生物(如大肠菌和双歧杆菌科)可以降解植酸盐,这可能是一种特殊的释放铁的方式,铁可能被降解生物体或其他细菌物种利用。因此,与植酸盐结合的铁可能是结肠肠道微生物群的相关铁源。
然而,应该注意的是,铁与植酸盐的复合物到达结肠时大多是不溶性的,因此不易被降解。然而,之前在常规大鼠的结肠中发现了只能通过微生物作用产生的植酸盐降解产物,但在无菌大鼠中却没有发现。这些发现表明微生物降解的植酸发生在结肠。
在每餐 2-10mg 植酸盐的极低浓度下,植酸盐会降低铁的吸收。
大豆蛋白(存在于豆腐、组织化植物蛋白和一些加工肉制品中)可以减少铁的吸收,因为它含有植酸盐。
钙
钙对骨骼很重要,但它也可能抑制铁的吸收。为了更好地吸收铁,避免在吃富含铁的食物的同时服用钙补充剂。
牛奶和鸡蛋中的蛋白质
虽然动物肉中的蛋白质会增加铁的吸收,但牛奶和鸡蛋中的蛋白质(卵清蛋白除外)在与低铁食物一起食用时会减少铁的吸收。
锌
过量摄入锌(由于过度使用锌补充剂)也会损害铁的吸收。
考虑到缺铁对人体健康影响重大,因此实施适当的策略来解决这一问题至关重要。
最常见的策略是食物中的铁补充、益生菌、益生元、铁药物补充剂等方法。
富含铁的食物
前面我们知道,膳食铁有两种形式:血红素和非血红素。血红素铁具有较高的生物利用度,膳食因素对其吸收的影响最小,而非血红素铁的吸收要低得多,并受到其他食物类型的强烈影响。
大多数对年轻女性的研究发现铁状态(铁蛋白和铁)与肉类和其他血红素铁的消耗量之间存在正相关关系。
增加富含铁的食物的摄入量,以补充铁储备,确保饮食健康均衡。
其中常见的富含铁元素的食物包括:
红肉、家禽(包括肝脏类)、鱼、豆类、扁豆、豆腐、豆豉、坚果、种子等
非血红素形式的铁含量高的植物性食物(但也可能含有高含量的阻止铁吸收的物质)包括:
● 豆类,包括鹰嘴豆、豆类、豌豆和小扁豆
● 种子,包括芝麻和南瓜子
● 绿叶蔬菜,包括西兰花和羽衣甘蓝
以上是富含铁元素的食物,同时其他富含维生素的食物也能辅助铁的吸收,例如,维生素A,维生素C.
维生素C:促进铁的吸收
如果膳食中含有大量维生素C,那么蔬菜膳食的吸收量可能会增加六倍。维生素C和柠檬酸以剂量依赖的方式促进铁的吸收,部分是通过充当弱螯合剂来帮助溶解小肠中的铁。
一项研究发现,维生素 C 的摄入量与女性的铁含量呈正相关。
在存在抑制铁吸收的物质(包括植酸盐、多酚、钙和蛋白质)的情况下,维生素 C 还有助于铁的吸收。
如果同时服用,维生素 C可将植物性食物中的非血红素铁的吸收提高 2 至 3 倍。因此,为了提高铁的摄入量,可以将富含铁的植物性食物与富含维生素 C 的食物结合起来。
水果或蔬菜中都会包含维生素 C,包括:
● 柑橘类水果
● 奇异果
● 草莓
● 番茄
● 辣椒
● 西兰花
● 卷心菜
● 菠菜


维生素A:克服植酸盐的影响促进铁的吸收
维生素 A直接影响铁转运和红细胞生成。
全谷物和豆类中的植酸盐会降低铁的吸收,但如果加入富含维生素A和β-胡萝卜素的食物可以增加铁的吸收,并可以克服植酸盐的影响。
维生素A(视黄醇)有助于治疗缺铁性贫血,并能改善儿童和孕妇的铁状况。
常见的富含维生素A和β-胡萝卜素的食物:
● 胡萝卜
● 红薯
● 鱼
● 哈密瓜
● 甜椒
● 南瓜
● 葡萄柚
益生菌
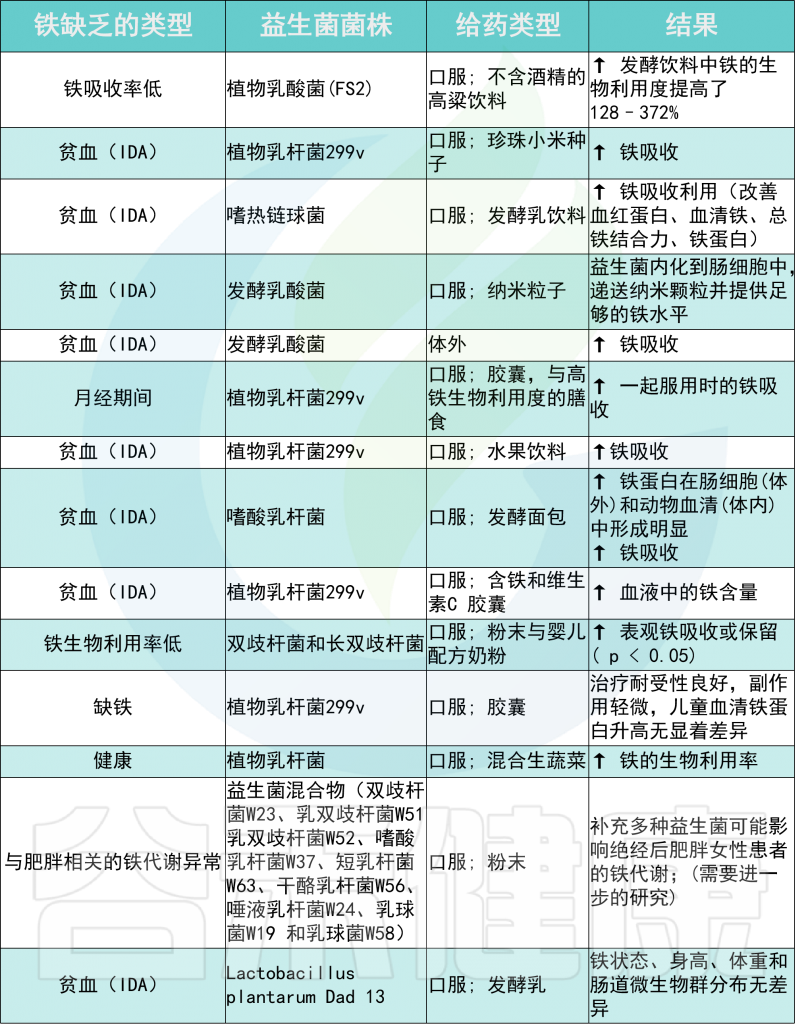
大多数益生菌产生乳酸,这可能会降低 pH 值,从而增加铁的溶解度,帮助其吸收。
例如,植物乳杆菌 299v 有助于预防缺铁性贫血。这种益生菌可以改善活跃的高加索欧洲人的膳食非血红素铁吸收。
发酵乳杆菌是人类微生物群中的一种主要益生菌,具有显著的铁还原活性。对羟基苯乳酸是该菌株产生的代谢物,通过DMT1转运体将Fe3+还原为Fe2+来增加肠细胞对铁的吸收。
与益生菌菌株给药相关的铁吸收

Rusu IG,et al., Nutrients. 2020
益生元
益生元是功能性食品成分,可刺激肠道中有益细菌的生长和定植,最终改善身体健康。肠道微生物群定植在肠道生理学中起着重要作用。
几项研究将益生元和/或合生元的摄入与铁可用性的增加联系起来,主要是通过将 Fe 3+转化为 Fe 2+(由于它们的铁还原活性),并促进肠细胞对铁的吸收。
例如,在肯尼亚儿童中进行的一项补铁试验报告称,在服用益生元期间铁吸收更高半乳糖寡糖 (GOS)底物。
不同类型铁缺乏症的益生元和合生元摄入量及其对机体铁水平的影响
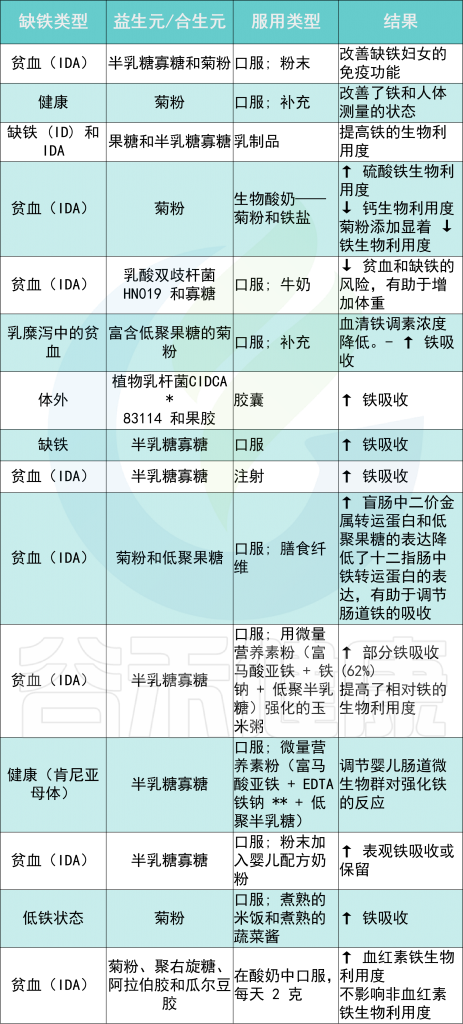

Rusu IG,et al., Nutrients. 2020
* CIDCA——食品冷冻技术研发中心
** EDTA——乙二胺四乙酸
补充剂
不同形式的铁补充剂补充铁以亚铁(+2)和铁(+3)的形式存在。由于铁形态必须在体内转化为亚铁形态以供吸收,因此亚铁形态更具生物利用度。
常用的口服亚铁补充剂包括:
● 柠檬酸亚铁
● 硫酸亚铁
● 葡萄糖酸亚铁
● 铁琥珀酸亚铁
● 氨基酸螯合物(如双甘氨酸铁、天冬氨酸铁)
● 血红素铁
虽然最常研究的铁补充剂是硫酸亚铁,但食品强化和补充剂研究表明,氨基酸螯合形式的铁(如甘氨酸)更好或同样好地被吸收。
例如,在一项针对孕妇的研究中,25mg甘氨酸亚铁能够将铁水平提高到与50mg硫酸亚铁相同的水平。
较新配方的铁补充剂可能比亚铁盐更容易耐受,胃肠道副作用更少,如:
然而,在提高产品螯合率、安全性,降低产品成本等方面有待进一步研究。
铁注射需要医疗监督。当口服铁补充剂不能耐受时,可以注射,这通常适用于患有腹腔疾病和炎症性肠病的患者。在手术或输血后血红蛋白必须迅速增加的情况下,也建议使用。注射铁剂比口服疗法更昂贵,而且不能在怀孕的前三个月用。
建议注射羧麦芽糖铁和异麦芽糖铁,因为它们能够以更大剂量给药,且安全性好。


另外,特殊人群对铁的需求量不同:
健身人群补铁
运动会加快铁在机体中的代谢,长期的运动使组织内储存铁的含量明显下降,是红细胞的更新速度加快,运动还导致机体对铁的吸收率降低,这些都增加了健身人群对铁的需要量。
我国对健身人群每日膳食的推荐的摄入量为:男性20毫克/天,女性25毫克/天。
妊娠期补铁
孕妇对铁的需求量比一般人群更高,每天 27 毫克。
妊娠期间,受母体铁状态调节的铁调素血清浓度极低。由于铁调素是肠道铁吸收的负调节剂,低水平表明对铁的需求高。
妊娠早期和中期缺铁与孕产妇发病率增加和不良妊娠结局风险增加有关,包括低出生体重、早产或宫内生长受限。
大多数产前维生素都含有足够的铁来弥补这种增加,但由于对血液产生的需求增加,缺铁性贫血在怀孕期间很常见。因此需要合理补铁。
具体补铁方式可参考上面列出的形式。
铁对于维持宿主肠道菌群稳态和肠道微生物的生长定植有重要作用。一些菌群,尤其是致病菌的生存,必须依靠铁的存在,因此形成了多种摄取铁的机制,并且参与调节宿主的肠道铁吸收。同时,铁与宿主的肠道微生物和微生物代谢产物共同作用,可对肠道乃至整体健康产生影响。
在补铁的同时,需要防止补铁带来的代谢紊乱和炎症损伤,也就是说铁的补充要在允许的条件下适度补充。那么怎么知道是否在合理范围内?目前对铁的监测以血液检测较常见,但血液检测波动较大。
此外,既已发现了铁与肠道菌群相关性,肠道菌群检测也是一个可行方向。谷禾肠道菌群健康检测报告中包含铁的水平,这是基于菌群代谢计算得到的,与血液检测有所不同,肠道菌群检测反映的是一段时间(2周左右)的长期状态。
未来需要更多的研究来证明铁、宿主与肠道菌群的相互作用机制,以及其与肠道炎症疾病等多种慢性疾病发生发展之间的因果关系,为铁补充的个性化策略提供更多支持。
各类人群的铁需求量


►►►
铁补充的副作用及相关禁忌
► 可能出现的副作用
► 禁忌症
铁补充剂不应用于以下人群:
声明:本账号发表的内容用于信息的分享,仅供学习参考使用。在采取任何预防、治疗措施之前,请先咨询临床医生。
主要参考文献:
Yilmaz B, Li H. Gut Microbiota and Iron: The Crucial Actors in Health and Disease. Pharmaceuticals (Basel). 2018;11(4):98. Published 2018 Oct 5. doi:10.3390/ph11040098
Botta A, Barra NG, Lam NH, et al. Iron Reshapes the Gut Microbiome and Host Metabolism. J Lipid Atheroscler. 2021;10(2):160-183. doi:10.12997/jla.2021.10.2.160
Finlaysontrick E C , Fischer J A , Goldfarb D M , et al. The Effects of Iron Supplementation and Fortification on the Gut Microbiota: A Review[J]. Gastrointestinal Disorders, 2020, 2(4):327-340.
Yilmaz B, Li H. Gut Microbiota and Iron: The Crucial Actors in Health and Disease. Pharmaceuticals (Basel). 2018 Oct 5;11(4):98. doi: 10.3390/ph11040098. PMID: 30301142; PMCID: PMC6315993.
Kortman GA, Raffatellu M, Swinkels DW, Tjalsma H. Nutritional iron turned inside out: intestinal stress from a gut microbial perspective. FEMS Microbiol Rev. 2014 Nov;38(6):1202-34. doi: 10.1111/1574-6976.12086. Epub 2014 Sep 29. PMID: 25205464.
Georgieff MK. Iron deficiency in pregnancy. Am J Obstet Gynecol. 2020;223(4):516-524. doi:10.1016/j.ajog.2020.03.006
Rusu IG, Suharoschi R, Vodnar DC, et al. Iron Supplementation Influence on the Gut Microbiota and Probiotic Intake Effect in Iron Deficiency-A Literature-Based Review. Nutrients. 2020;12(7):1993. Published 2020 Jul 4. doi:10.3390/nu12071993
Anderson GJ, Frazer DM. Current understanding of iron homeostasis. Am J Clin Nutr. 2017 Dec;106(Suppl 6):1559S-1566S. doi: 10.3945/ajcn.117.155804. Epub 2017 Oct 25. PMID: 29070551; PMCID: PMC5701707.
LIU Fang-Tong, FAN Hao-Nan, SHEN Li-Xin, LI Bo. Iron acquisition by bacterial and adaptive immune responses[J]. Microbiology China, 2019, 46(12): 3432-3439.
Tolkien Z, Stecher L, Mander AP, Pereira DI, Powell JJ. Ferrous sulfate supplementation causes significant gastrointestinal side-effects in adults: a systematic review and meta-analysis. PLoS One. 2015;10(2):e0117383. Published 2015 Feb 20. doi:10.1371/journal.pone.0117383
GUAN Lingjuan,CAO Congcong,TU Piaohan,et al. Research progress of the effect of iron deficiency on intestinal immune function and new iron supplements[J]. Food and Fermentation Industries,2020,46(19):264 -270
高鹤, 杨浕滢, 应晓玲,等. 铁,宿主和肠道菌群相互作用的研究进展[J]. 现代预防医学, 2020, 47(20):4.