-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
宝宝湿疹反复瘙痒总难根治,季节交替时喷嚏不断,擦不完的鼻涕,整晚咳嗽甚至发展为哮喘,到了学龄期孩子仍无法专注听讲…
如今约40%中国儿童在成长过程中会出现至少一种过敏症状(尤其是过敏性鼻炎),神经发育问题发生率也逐年上升。
多中心流行病学调查和系统综述显示:
神经发育障碍整体患病率呈上升趋势,已从 0.5 %‑1 % 逐步提升至约 5 %‑10 %,包括所有子类的累计比例。
中国儿童常见过敏性疾病的患病率总体呈上升趋势,哮喘约 3%–7%,过敏性鼻炎约 20%–25%,湿疹/特应性皮炎约 8%–20%,食物过敏约 3%–8%,且城市和经济发达地区患病率更高。
而这些看似独立的健康难题,都指向了肠道微生物群。
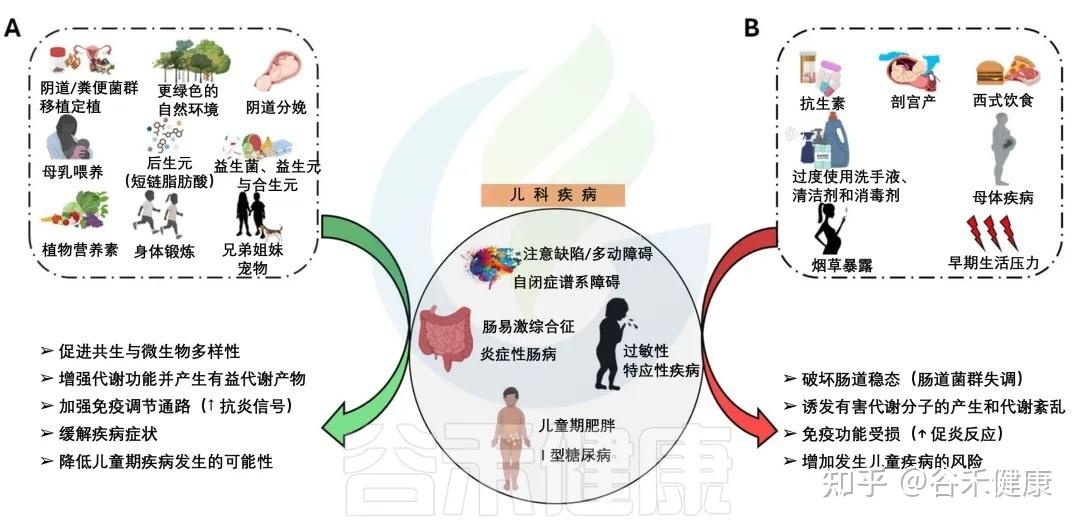
从出生开始,我们的肠道微生物群便陆续完成定植,在大约三年的时间里,从几乎一片空白,逐步演变为一个多样、稳定且高度复杂的微生态系统。这一阶段被认为是影响儿童健康的关键窗口期,而现代生活方式导致的环境污染、抗生素滥用、高加工食品摄入过多等问题,都在悄悄破坏着孩子娇嫩的肠道环境。
大量研究提示,生命早期一旦出现肠道菌群失衡,不仅会增加炎症性肠病、过敏性疾病(如哮喘、湿疹、过敏性鼻炎等)、自闭症、注意力缺陷多动障碍、儿童肥胖、糖尿病等多种儿科疾病的风险,其影响还可能延续至成年。相反,如果在这一时期通过合理的方式塑造一个平衡的肠道菌群,则有机会改善儿童免疫与代谢反应,甚至为一生的健康打下基础。
基于此,本文将围绕“早期肠道菌群与常见儿科疾病”这一主题,回顾当前研究进展,解析早期肠道菌群在疾病发生发展中的作用机制,并探讨可能的干预思路与临床应用前景。
我们知道肠道菌群不仅仅帮助我们消化食物,它还在免疫、营养吸收、抵御病菌、维护肠道屏障的完整性中扮演着关键角色。
尤其是在生命早期,肠道菌群会建立起连接大脑、肺、皮肤等远处器官的沟通轴线。这个关键发育窗口期建立的菌群平衡,就给未来打下了扎实的基础。如果这时候建立的菌群平衡被打破,就可能对儿童健康产生深远的不利影响,甚至引发多种疾病。
肠道与各大器官的交流
肠道菌群通过复杂的免疫、代谢和神经内分泌途径,与身体多个器官进行着持续的双向沟通。
这是最有名的这一条,大脑和肠道菌群,其实从宝宝还很小的时候就一起长大。
肠道菌群会产生影响情绪和行为的神经递质(如GABA),通过迷走神经和血液循环传递给大脑。
反过来,我们一紧张、焦虑,脑子里的压力信号会改变肠道里的环境,比如让酸碱度、激素水平发生变化,进而影响肠道菌群。这条轴线的失调与自闭症谱系障碍和注意力缺陷多动障碍有关。
再来看肠道和皮肤的关系。很多人都说“脸就是肠道的镜子”,其实还真有点道理。
肠道如果不太健康、菌群有点失衡,就很容易引发一些慢慢的、低度的炎症,还有一些代谢产物。这些东西会跟着血液到皮肤那儿去,影响皮肤表面的菌群平衡和局部免疫状态。
结果就是,像婴儿湿疹之类的问题,可能就会变得更严重或者更难治愈。
听起来好像肠道和肺离得挺远的,但它们之间也在悄悄互相影响。肠道菌群产生的代谢物,还有各种免疫信号,也可以通过血液到达肺部,帮忙调整呼吸道的免疫反应。肠道菌群失衡会增加儿童患哮喘和过敏的风险。
其他重要轴线: 研究还揭示了 肠-胰腺轴、肠-脂肪轴 等通路的存在。
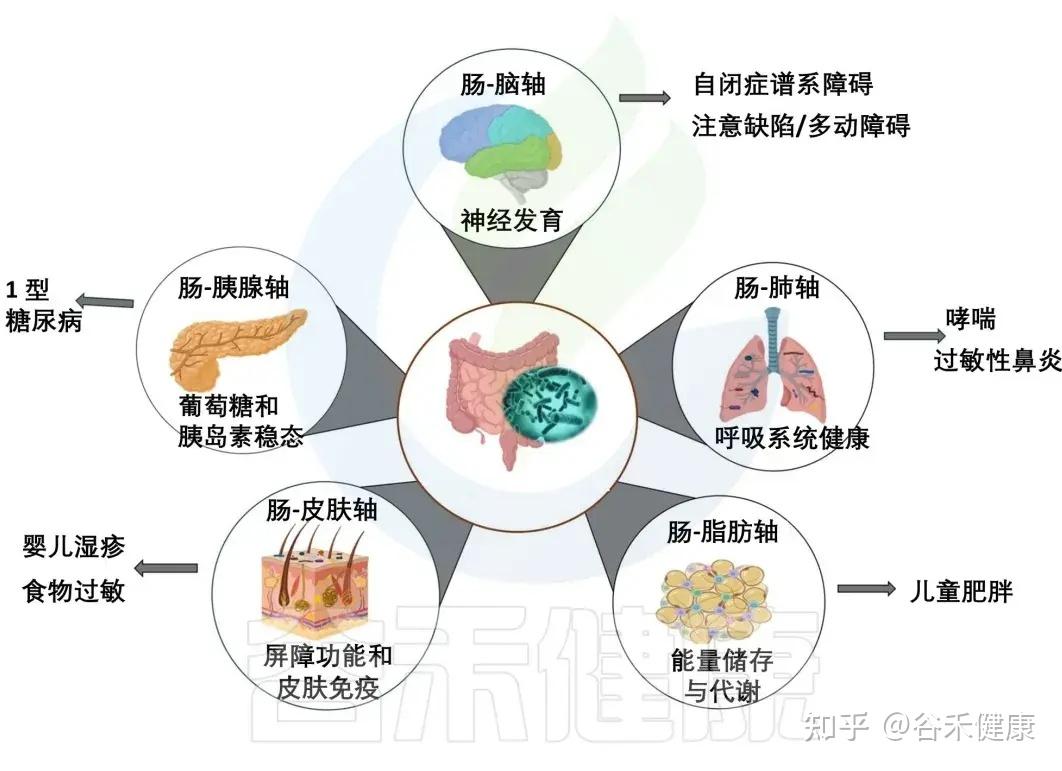
总之,肠道菌群通过这些复杂的代谢和信号通路,构建了一个覆盖全身的通讯网络,成为调节人体从免疫到神经系统等多个方面健康的核心枢纽。
母亲围产期营养状态
婴儿肠道菌群的初始状态,很大程度上继承自母亲。母亲在围产期保持均衡、健康的饮食,是为后代肠道菌群打下良好基础的第一步,也是至关重要的一步。
失衡的风险
如果母亲在孕期偏爱高热量、高脂肪的西式饮食,可能导致自身肠道菌群的失调。这种失调会通过胎盘、产道或母乳传递给婴儿,影响宝宝肠道健康。同样,营养不良也会导致菌群失调,可能增加如γ-变形菌门这类潜在致病菌群的出现。
▸细菌的入住,在出生前就开始了
与传统的“子宫无菌”理论不同,新的证据显示,细菌定植其实早在胎儿的宫内阶段便已开始。研究发现,非致病菌在妊娠期间能从母体肠道转移至胎儿,并存在于胎盘、羊水、脐带、胎儿组织及胎粪中。
而这个宫内微环境的菌群构成,又会受到母亲的健康状况、饮食习惯以及孕期菌群变化的影响,这为婴儿早期肠道菌群形成奠定了最初的基础。
分娩方式:顺产 or 剖腹产?
分娩方式,主要是顺产(即阴道分娩)与剖宫产,是显著影响新生儿肠道菌群组成和发育的关键因素。
▸出生方式决定了宝宝的第一批肠道居民
-顺产
顺产新生儿会接触到母体阴道与肠道来源的多样菌群,包括乳酸杆菌和双歧杆菌等优势菌株,这些菌群构成了初始肠道定植的核心。
顺产宝宝的菌群不仅更稳定、多样性也更高,而且他们的粪便菌群构成与母亲相似。
-剖宫产
与顺产儿相比,剖宫产儿的肠道菌群表现为双歧杆菌和乳酸杆菌的定植延迟、拟杆菌门的多样性较低,而主导菌群则通常是医院环境中常见的肠球菌属。
剖宫产宝宝的肠道里的菌群种类更少,而且这些菌群更像是来自妈妈皮肤和口腔里的。
注:
刚出生那段时间,两种分娩方式带来的菌群差别很大,这个差别会随着时间推移而慢慢变小。
有研究发现剖宫产宝宝的这种菌群特点,可能会让他们以后更容易得一些慢性病(比如哮喘、1型糖尿病、肥胖,但这个说法目前还有争议,不是所有研究结果都一样。
▸如何为剖腹产宝宝补回有益菌?
母体的阴道和粪便菌群是新生儿获得初始微生物的最主要、最丰富的来源。
——第一个办法:阴道菌群移植
为了弥补剖宫产宝宝在这方面的缺失,一些研究探索了“阴道菌群移植”的效果,就是说把母亲的阴道分泌物涂抹给新生儿。
部分研究显示,这种方法有助于部分恢复菌群定植;然而,另一些研究却得出相反结论,认为没什么影响。这种结果上的分歧,很可能是因为阴道菌群难以在婴儿肠道内实现长期定植。
——第二个办法:粪便菌群移植(仅科研探索阶段)
相对来说,母体消化道的菌群多样性要高得多,对宝宝肠道菌群定植的影响可能更深远。
基于这一理念,有些研究认为,母体粪便菌群移植是一种更有效的方法。它能近乎完全地恢复母婴间的微生物垂直传播,有效重塑新生儿的早期肠道菌群。
注:在我们看来,当前有关粪菌移植在儿童中的应用,仍主要停留在科研探索层面,且存在不少限制。成人与儿童的肠道菌群在组成和功能上存在显著差异,而目前临床检测和数据库中可用于精准匹配的儿童菌群数据仍相对有限。因此,现阶段粪便菌群移植更多作为研究工具和小范围、慎重的学术交流内容,并不适合作为常规干预手段。
喂养方式:母乳 or 配方奶?
▸母乳:不仅仅是食物
母乳 (HBM) 不仅为婴儿提供必需的营养,更在生命早期肠道菌群的成熟过程中扮演着至关重要的角色。
母乳富含多种生物活性成分,如免疫细胞、细胞因子、乳铁蛋白、抗菌蛋白和肽、抗体以及母乳低聚糖(HMOs)。这些成分能够对婴儿的肠道菌群进行正向调节,帮助宝宝抵抗感染。
与牛奶相比,母乳含有超过250种不同类型的母乳低聚糖。这些母乳低聚糖对于调节婴儿肠道微生物和影响免疫系统至关重要。
▸菌群差异:母乳 v.s. 配方奶
先前的研究已证实,母乳喂养和配方奶喂养的婴儿,其肠道菌群存在显著差异。
基于母乳喂养带来的整体健康益处,世界卫生组织推荐在婴儿出生后一小时内即开始母乳喂养,纯母乳喂养至六个月,并持续到至少一岁。
▸配方奶粉:添加母乳低聚糖
母乳喂养好处多多,但很多母亲会因乳腺炎、奶水不足或产后抑郁等原因而无法实现。为了弥补这一差距,现代高端婴幼儿配方奶粉开始添加在母乳中发现的关键成分——母乳低聚糖(HMOs),如2-岩藻糖基乳糖和乳糖-N-新四糖,这些有可能促进健康早期肠道微生物群的发展。
有研究发现,添加了HMOs的配方奶粉确实能带来积极效果:
▸生命早期,母婴间菌群如何传递?
母乳里的有益菌从何而来?研究人员认为,存在一个“肠道-乳腺通路”:
母亲肠道中的一些有益菌株可以被自身的免疫细胞(如树突状细胞)捕获。
这些免疫细胞随后通过淋巴系统,将这些细菌穿透肠上皮运送到乳腺。
最终,这些来自母亲肠道的有益菌就进入了母乳,并在喂养时传递给宝宝。
此外,母亲肠道细菌分泌的一些含有生物活性物质的小包裹(即细菌外囊泡,BEV),也可能通过同样的方式进入母乳,影响宝宝的肠道菌群建立。
总而言之,母亲自身的肠道健康状况,会直接影响母乳的微生物构成,进而深刻地影响着宝宝早期的肠道健康。
辅食添加:菌群发展的分水岭
当婴儿长到6个月左右开始添加辅食时,其肠道菌群会经历一次重大的转变。菌群会从以双歧杆菌为主的相对简单的状态,演变为一个相对更多样化的菌群。
-时机很关键
辅食添加太早或太晚,都会干扰菌群的正常成熟过程。因此,推荐在6个月左右开始添加营养丰富的辅食。
营养成分
不同的营养成分对肠道菌群有不同的影响。
▸宏量营养素(碳水、蛋白质等)
-碳水化合物
高纤维和低升糖指数的食物是肠道有益菌的“优质口粮”,有助于促进普雷沃氏菌属、双歧杆菌、毛螺菌属(Lachnoclostridium)和罗斯氏菌属(Roseburia)的生长。
一项研究表明,在婴儿的补充喂养阶段,食用来自各种全谷物、豆类、水果和蔬菜的膳食纤维会导致大量产丁细菌,如粪杆菌、粪球菌、Dorea、Oscillospira。
-蛋白质
相比动物蛋白,植物蛋白如扁豆,豆类,植物性饮食通常富含膳食纤维,含有足够量的多不饱和脂肪酸,通常更有利于结肠细菌的健康。
当然,为了维持肠道稳态,均衡摄入两种蛋白是最佳选择。
▸微量营养素(维生素与矿物质)
-维生素
多数维生素都能促进有益菌的生长,例如双歧杆菌和Akkermansia菌,同时抑制像艰难梭菌这样的致病菌。
例如,维生素A、B2、D、E、β-胡萝卜素可以增加有益共生菌的丰度。
维生素B2、E可以增加有益的SCFA产生菌。
-矿物质
它们的作用比较复杂。镁、钙、硒等有益于菌群。但需要特别注意的是,给婴儿补充铁剂可能是一把双刃剑,过量时可能会抑制双歧杆菌和乳杆菌科等有益菌,反而为一些有害菌的繁殖提供机会。
▸植物营养素(特别是多酚)
这是一类广泛存在于水果、蔬菜中的强大活性成分,能直接调节菌群。例如,生命早期服用葡萄多酚可以促进有益的Akkermansia和乳酸杆菌的生长。
更重要的是,母亲在孕期和哺乳期摄入的植物营养素可以传递益处。例如,母亲饮食中:
生命早期是一个塑造肠道菌群的黄金窗口期。在此期间,通过科学合理的营养干预来优化菌群构成,是预防多种儿童期乃至成年期疾病的有效策略。
运 动
除了我们吃什么,我们的“动与不动”也是影响肠道菌群的另一个关键因素。
▸运动如何优化肠道菌群?
规律的运动被证明可以从多个方面积极地重塑肠道微生态。
-增加有益菌和多样性
运动能显著增加肠道中有益菌的种类和数量,特别是那些能产生短链脂肪酸(SCFAs)的好菌。
宏基因组分析显示,运动量与罗斯氏菌属(Roseburia)和Akkermansia菌丰度呈正相关。
-久坐的危害
相反,久坐不动的生活方式则会破坏这种平衡。研究表明,久坐会导致肠道菌群多样性降低,并使得那些能更高效捕获食物能量的厚壁菌门增多,而放线菌门细菌减少。
▸生命早期的运动
在正确的时间运动,效果可能事半功倍,生命早期或许就是这样一个黄金窗口期。
-早期锻炼效果更佳
一项动物研究发现,如果在还很年幼的时候就开始运动,相比长大成年后才动起来,更能明显、积极地改变肠道菌群。
-具体的菌群变化
研究显示,幼年期的运动能显著增加拟杆菌门的比例,同时降低厚壁菌门的比例,这种菌群构成上的变化与增加瘦体重)直接相关。
基于这些益处,世界卫生组织建议,5岁以下的孩子,每天应累积进行至少180分钟的各类身体活动。
▸母亲的运动:给宝宝的第一份健康礼物
运动的影响力甚至可以追溯到生命开始之前。过去我们认为,父母传给孩子的是基因。现在我们知道母亲还可以传递一个健康的微生态系统。
-孕期运动的益处
母亲在孕前和孕期的规律运动,可以帮助宝宝的肠道减少有害菌,同时富集能产生短链脂肪酸的有益菌,从而改善宝宝整体的代谢健康。
-可能的机制
科学家推测,这其中的一个可能机制是,运动改变了母亲体内的代谢环境,如激素水平、血液循环和能量利用。这些生理变化信号传递到乳腺,影响了母乳的生产过程。
母乳中母乳低聚糖(HMOs)的种类和数量发生了改变。HMOs是母乳中仅次于乳糖和脂肪的第三大固体成分,但宝宝自己无法消化它。它不是给宝宝吃的,而是专门给宝宝肠道里的有益菌吃的。这样一来,宝宝的有益菌在菌群建立的早期就占据主导地位,抑制了有害菌的生长。
均衡的营养加上规律的身体活动,能最大程度地对早期肠道菌群的健康发展产生积极和深远的影响。
在生命早期操纵微生物发育的因素
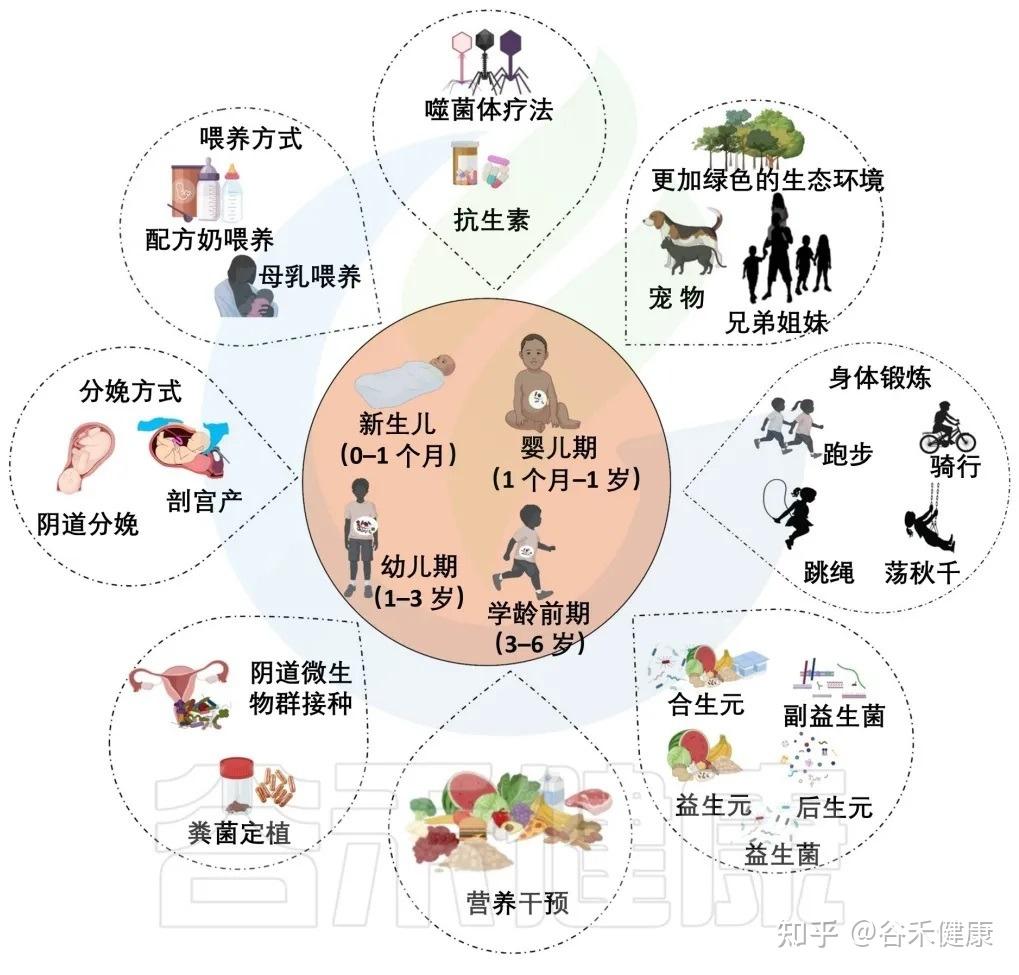
抗生素的使用:有利有弊
有些家长有过这种经历,带孩子看了一次病,用了抗生素,当时觉得病总算好了,松了口气,结果没过几天,新的问题又来了:孩子就开始拉肚子,或者突然吃一些东西开始食物不耐受了,甚至之前控制得好好的湿疹也加重了。这其实也跟肠道菌群有关。
关于抗生素,它确实对付细菌感染特别管用,不过呢,凡事都有两面,尤其是在生命早期,在宝宝身体各种系统都还在搭建的时候使用它,可能需要付出一些看不见的代价。
抗生素最大的问题在于其“不分敌我”的特性,它们不仅杀死了致病菌,也对肠道内大量的有益菌造成了连带伤害,导致肠道菌群失调。这种早期的菌群失调与日后的多种健康问题,如肥胖、哮喘以及抗生素耐药性等都有可能相关联。
婴儿接触到抗生素主要有两种途径:
▸母亲用药:穿越屏障的连锁反应
即使是母亲使用抗生素,其影响也能传递给宝宝。
-影响机制
在分娩期间,抗生素不仅会通过脐带传递给胎儿,还会改变母亲产道和粪便中的菌群,这些都是婴儿在出生时获得初始菌群的来源。
-对婴儿菌群的直接冲击
研究发现,经历过母亲产时抗生素暴露的婴儿,其粪便菌群表现出:
整体多样性降低;
放线菌门和拟杆菌门丰度显著减少;
变形菌门占据了主导地位。
-对母乳的影响
母亲使用的抗生素还会改变母乳中的微生物,这会直接阻碍双歧杆菌和乳酸杆菌等健康菌株在婴儿肠道的正常定植。
▸婴儿用药:艰难梭菌感染风险增高
当婴儿自己直接使用抗生素时,对肠道菌群的影响更为直接。
研究证实,这会导致婴儿肠道菌群构成发生剧变,主要表现为:有益的双歧杆菌数量锐减,而肠球菌属和克雷伯氏菌属等机会性致病菌的数量则会升高。
有些儿童在使用抗生素之后会发现,艰难梭菌(Clostridioides difficile)感染的风险会显著升高,艰难梭菌感染可能会引起严重的腹泻和结肠炎症。
除艰难梭菌外,抗生素使用还可能导致耐药菌株的选择性增长。例如,耐甲氧西林金黄色葡萄球菌(MRSA)和产超广谱β-内酰胺酶(ESBL)的肠杆菌科细菌,这些在抗生素治疗后更容易定植。
长远来看,可能会让宝宝更容易反复出现肠胃不适、拉肚子,或小病不断。因此,在抗生素用药之后,需要格外关注宝宝的饮食,排便,以及肠道菌群状态。
环 境
除了饮食和运动,我们生活于其中的物理和社会环境,也对生命早期的肠道菌群发展有着深刻而直接的影响。从家里的宠物到社区的公园,都在悄无声息地参与塑造这个微小的生态系统。
▸ “不干不净,吃了没病”
过度干净的环境,有时反而不利于建立一个强大的免疫系统和健康的肠道菌群。适度地接触来自外界的微生物,对婴儿来说是一种有益的早期训练。
-宠物带来的益处
宠物猫狗陪伴着孩子长大,像家人一般为孩子带来情感上的安慰与支持,也为孩子性格带来温暖的影响,让孩子感受更多无条件的爱与接纳。
从肠道菌群的角度来说,研究发现,与宠物(如猫狗)一起长大的婴儿,其肠道菌群的丰富度和多样性通常更高。具体来说,他们的肠道中比如双歧杆菌、颤螺菌属(Oscillospira)和瘤胃球菌属(Ruminococcus)这些有益菌的丰度会更丰富。

有趣的是,养猫的人肠道里的双歧杆菌水平也比不养猫的人要高。这就意味着,和猫咪一起生活,可能会通过菌群的交流,悄悄地帮我们补充有益菌,提升肠道健康水平。
注:然而也存在一些需要注意的潜在风险。研究指出,猫肠道里的抗生素耐药基因(ARG)丰度显著高于人类。这些耐药基因可能会通过猫咪在家里的活动(比如它走过地板、沙发),转移到环境中,进而有机会进入人体。简单说,就是猫可能会把它携带的耐药基因传递给主人,这增加了我们体内细菌变得耐药的可能性。
-兄弟姐妹的菌群共享
同样,有哥哥姐姐的孩子,其肠道菌群的多样性也更高。
道理其实很简单。宠物和哥哥姐姐会将更多来自室外(如土壤)或他们自身的微生物带入环境中,让婴儿有机会接触到更多样的细菌,这就像是给婴儿的肠道菌群进行了一次自然接种,有助于其发展得更加健全和有韧性。
▸新冠的意外发现:社交隔离对菌群的影响
新冠为我们提供了一个独特视角,观察环境剧变如何影响肠道菌群。
-菌群多样性下降
研究人员发现,在疫情期间出生的婴儿,其粪便样本中的微生物多样性显著低于疫情之前的同龄婴儿。
-可能的原因
这种变化被认为与疫情期间的特殊生活方式有关,包括:社交活动大幅减少,以及消毒剂、洗手液等清洁产品的使用频率急剧增加。这使得婴儿接触外界微生物的机会大大减少。
▸ 环境的力量:来自大自然的馈赠
我们与自然环境的接触,也能产生意想不到的健康关联。
-母亲接触绿色环境的益处
最近的一项研究指出,如果母亲在孕期更多地接触住宅区周围的公园、绿地等绿色环境,其母乳中母乳低聚糖(HMOs)的多样性和浓度都会更高。

我们已经知道,HMOs是婴儿肠道有益菌的超级食物。因此,通过提升母乳的质量,母亲接触绿色环境的益处最终能够传递给婴儿,积极地影响其肠道菌群的健康发育。
因此,生命早期丰富的环境暴露至关重要。一个不过分无菌、能适度接触来自他人、宠物和大自然的微生物的环境,是帮助孩子建立一个多样、稳定且有韧性的肠道菌群的关键因素之一。
生命从出生到3-6岁的这段时间,是肠道菌群发育的“关键窗口期”。这个阶段的任何干扰,都可能让菌群的健康发展偏离轨道,从而为日后儿童期的各种疾病埋下隐患。
儿童过敏
儿童过敏性疾病,包括湿疹、哮喘、过敏性鼻炎、食物过敏等,是一组以免疫系统对无害物质产生过度反应为特征的常见慢性病。它们的发病,往往与遗传和环境因素共同相关。
从临床分型上看,这些疾病都属于特应性疾病,其核心是身体产生了过度的IgE抗体来对抗那些本应无害的环境物质(如花粉、尘螨、某些食物等)。并且,患有其中一种过敏的孩子,往往更容易患上另一种,这被称为过敏进程。
▸肠道菌群:过敏病程中的关键调控者
这几年,无论是基础研究还是临床队列,都越来越一致地指向一个关键环节,肠道菌群在过敏的发生发展中扮演着关键的调控角色。
在我们对过敏儿童样本的菌群数据分析中,可以看到一种具有代表信的肠道菌群失调。
具体来说,过敏儿童的菌群通常具备几个共性:
更细分到食物过敏的时候会发现,不同食物过敏原(比如牛奶蛋白、鸡蛋蛋白、花生等)相关的菌群变化还可能各有其特异性的模式,不同分型这也是我们正在关注的方向。
▸失控的免疫反应:当前主流的菌群-免疫假说
那肠道菌群究竟是通过什么路径去影响免疫系统,进而推动过敏的呢?目前在学术界相对被广泛接受的,是围绕短链脂肪酸,尤其是丁酸盐的一条核心假说:
丁酸盐的缺失:菌群失调导致关键的代谢产物——丁酸盐浓度下降。
刹车失灵:丁酸盐是促进初始T细胞分化为调节性T细胞(Tregs)的关键信号。Tregs在免疫系统中可以理解为一个刹车装置,负责抑制过度的免疫反应,维持免疫平衡。
免疫过度激活:丁酸盐减少导致Tregs数量不足或功能受损,刹车失灵,免疫系统便会对无害物质反应过度。
典型免疫表型:在这种菌群失调的背景下,我们在过敏儿童身上通常可以看到这样一组特征性变化:
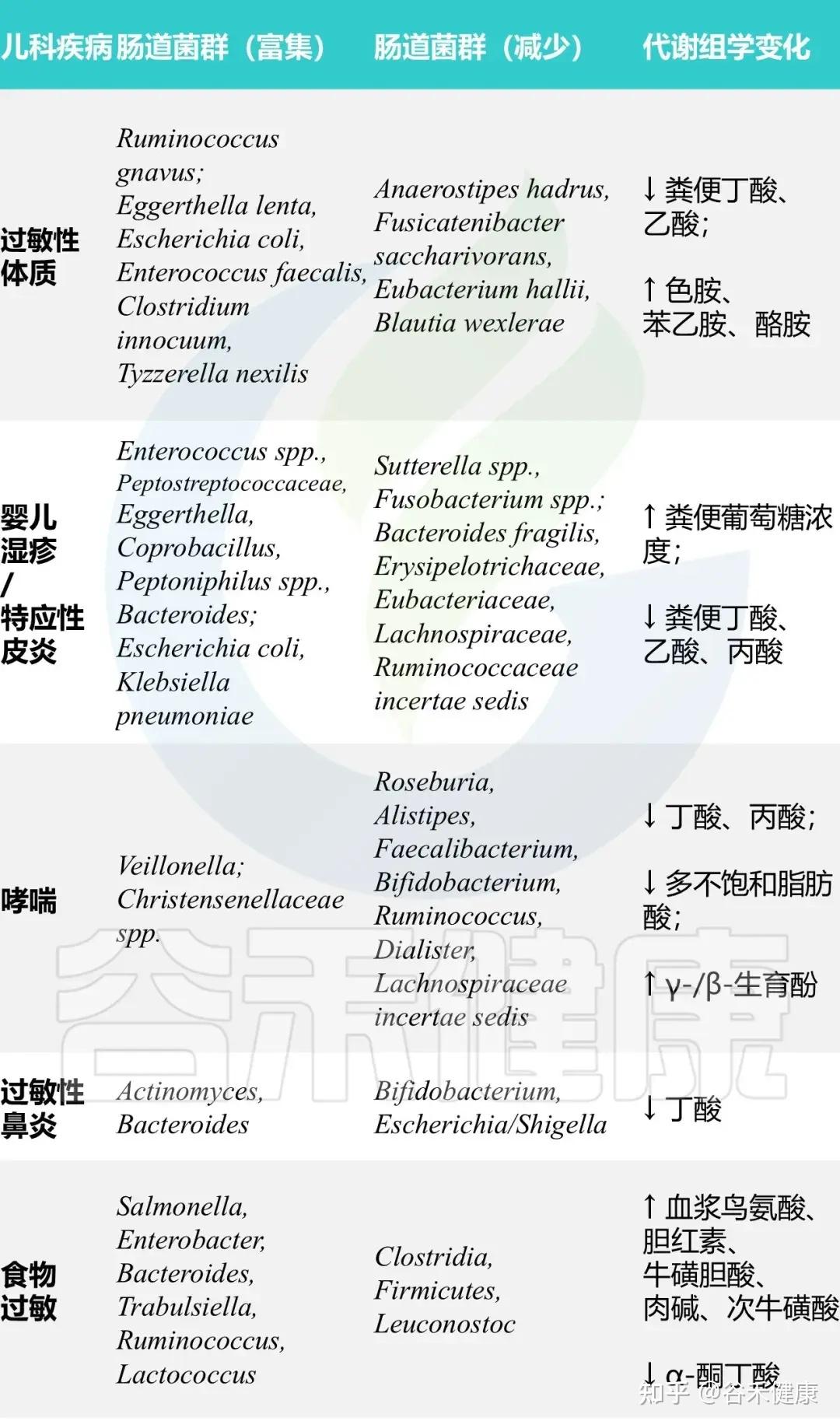
总而言之,生命早期的肠道菌群失调,通过影响免疫系统的正常教育过程,为日后一系列过敏性疾病的发生埋下了伏笔。而具体的菌群和代谢物变化,则在不同的过敏性疾病中呈现出各自的特征。
肠道菌群检测就是力求精准地捕捉到这些早期的菌群和代谢物特征,在实际应用中,我们并不会仅看哪个菌高了或者低了,而是会把菌群特征与已有的临床和免疫学指标放在一起综合判断。
例如,结合谷禾肠道菌群检测报告中的过敏相关菌群模块、肠道屏障评分,以及部分炎症相关因子和免疫调节指标(如 IL‑6 等),我们可以更准确地判断一个孩子的肠道生态,是不是已经处在一个更偏向炎症和过敏反应的状态,尽可能实现对高风险儿童的早期识别,从而为临床的早期预警和干预提供思路。
IBS 与 IBD
在儿童常见的胃肠道疾病中,炎症性肠病(IBD)和肠易激综合征(IBS)是两个重要的类别,它们都与肠道菌群的失衡密切相关。
虽然生命早期的肠道菌群构成与这两种疾病的确切因果关系仍在研究中,但科学家们已经在年龄较大的患病儿童中发现了明确的菌群改变。
▸失衡的菌群
IBS患儿的菌群特征:
IBD患儿的菌群特征:
▸代谢物的变化(化学信号的紊乱)
在IBD患儿体内,色氨酸、琥珀酸盐和3-羟基异丁酸等关键微生物代谢产物的水平较低。
在IBS患儿体内,则观察到葡萄糖、甾醇、乳酸水平升高,而有益的丁酸盐水平下降。
尽管如此,与生命早期相关的特定代谢组学特征,目前仍是一个有待深入探索的领域。
▸失控的免疫反应:炎症
在这两种疾病的背后,一个共同的核心病理机制是:由肠道屏障缺陷和微生物失调共同驱动的、失控的黏膜免疫反应。
IBD:
某些能够降解肠道黏液保护层的致病共生菌,例如黏附侵袭性大肠杆菌(adherent-invasive Escherichia coli),能够诱导巨噬细胞等免疫细胞分泌IL-1β,这会直接促进Th17细胞的分化,点燃肠道炎症。
从口腔跑到肠道的克雷伯氏菌属,也能促进树突状细胞和巨噬细胞产生促炎因子,从而推动初始T细胞分化为Th1和Th17细胞,加剧炎症。
此外,大量能产生IgG抗体的浆细胞被招募到肠道,也参与了IBD的疾病进展。
IBS:
虽然炎症程度不如IBD剧烈,但在IBS患儿的结肠黏膜和血液中,也观察到了先天免疫的过度活跃,特别是来自肥大细胞和单核细胞的活动增强。
适应性免疫同样参与其中,表现为肠道内T细胞数量增加、B细胞活性改变以及抗体的产生。
简而言之,IBD和IBS的发生,是肠道菌群失衡与免疫系统功能紊乱相互作用、相互放大的恶性循环。然而,上述这些复杂的免疫机制,在那些具有高患病风险的婴幼儿身上是如何运作的,仍需要更多未来的研究来进一步验证和阐明。
常见儿科疾病中的早期肠道生态失调
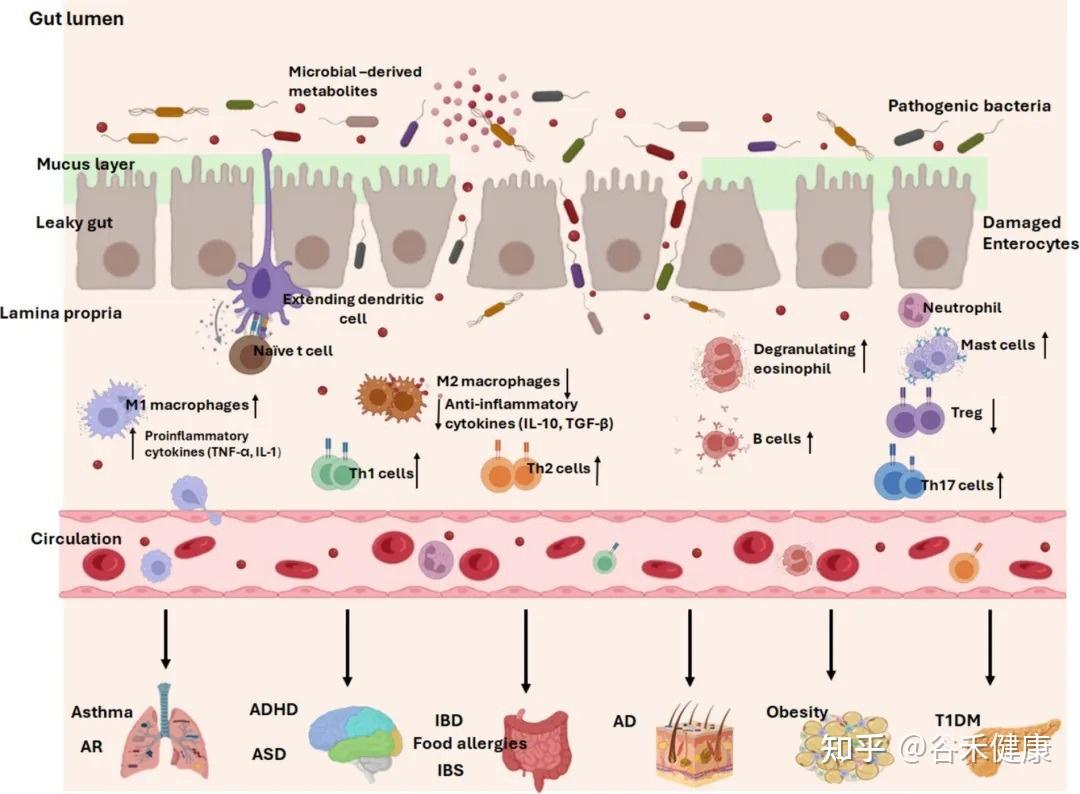
神 经 发 育
生命最初的几年,不仅是肠道菌群建立的关键窗口,也恰好与中枢神经系统发育的关键阶段,如神经突触的形成和髓鞘化高度重叠。这并非巧合。一条被称为肠-脑轴的复杂通讯网络,将肠道和大脑紧密地联系在一起,使得肠道菌群的状况能够深刻影响神经发育,甚至可能参与了自闭症谱系障碍(ASD)和注意力缺陷多动障碍(ADHD)等疾病的发生。
这两种情况有时会同时出现在一个孩子身上。
▸失衡的菌群,失调的化学信号
由于肠道微生物能通过其代谢产物和影响免疫通路来调控神经系统的发育和功能,科学家们将其视为自闭症和多动症发病的一个潜在贡献者。研究发现,与正常儿童相比,具有高患病风险的幼儿,其肠道菌群的构成和产生的生物活性代谢物均存在显著差异。
-菌群失衡
-关键神经递质的缺失
一个尤为引人注目的发现是,这些高风险儿童体内由细菌产生的、具有神经活性的分子——γ-氨基丁酸(GABA)的水平显著降低。
这些发现清晰地揭示了在生命早期,肠道菌群-代谢产物-神经系统之间存在的深刻联系。
▸从肠道炎症到大脑炎症
GABA的减少可能不仅仅是一个孤立的现象,它或许是连接肠道失衡与大脑功能异常的关键一环。GABA是大脑中主要的抑制性神经递质(负责让大脑冷静下来),它还在调节焦虑、改善睡眠、缓解疼痛以及帮助维持神经系统的整体平衡方面发挥着关键作用。
-连锁反应的启动
菌群失调导致GABA等代谢产物水平改变。
GABA水平的改变,加上菌群本身的失调,引发了不正常的免疫反应和全身性炎症(表现为血浆中细胞因子水平的异常)。
这种慢性的全身性炎症会逐渐破坏精密的血脑屏障的完整性。血脑屏障一旦受损,炎症细胞和炎症因子便更容易进入大脑,最终引发神经炎症,从而影响大脑的正常发育和功能。

简而言之,ASD和ADHD的发生,可能部分源于肠道开始,经由免疫系统,最终波及大脑。然而,这其中的具体机制非常复杂。尤其是在菌群发育的关键窗口期,究竟哪些早期的免疫学特征能够预示ASD和ADHD的发生,仍然是未来研究需要迫切解答的重要问题。
肥胖及1型糖尿病
在儿童期,最常见的代谢性疾病莫过于肥胖和1型糖尿病(T1DM),而这两者的发生,都与生命早期的肠道菌群失调有着千丝万缕的联系。
▸肠道菌群:调节新陈代谢
我们的肠道菌群在宿主的新陈代谢中扮演着至关重要的“总调度师”角色,其影响力涵盖了脂质与葡萄糖代谢、能量消耗与脂肪储存,乃至胰岛素信号的传导等多个方面。
更关键的是,T1DM的发病高峰期通常在生命最初的5-6年,这与肠道菌群发育的关键窗口期完全重合,这暗示了两者之间强烈的内在联系。
▸失衡的菌群
与健康儿童相比,患有或高风险患有这两种代谢病的儿童,其肠道菌群构成显示出特定的指纹。
-T1DM高风险儿童的预警信号
研究发现,在T1DM高风险儿童体内出现自身抗体(血清学转换)之前,他们的肠道中多形拟杆菌(Bacteroides dorei)和普通拟杆菌(B. vulgatus)的数量就已经显著增加。值得警惕的是,这两种拟杆菌属细菌均与肠道炎症有关。
-肥胖儿童的菌群
从婴儿早期开始,肥胖儿童的肠道中就表现出脆弱拟杆菌(Bacteroides fragilis)丰度更高,而有益的双歧杆菌属(Bifidobacteria)和柯林斯菌属(Collinsella)数量更少。这种菌群模式与日后过度的体重增加直接相关。
▸代谢紊乱:疾病发生前的信号
在疾病真正显现之前,身体的化学信号——代谢产物,可能已经发出了警报。
-肥胖儿童的代谢特征
他们的体内GABA(一种能调节食欲和体重的神经递质)水平显著较低。
同时,血液中对称性二甲基精氨酸和不对称性二甲基精氨酸的水平升高,这两种物质被认为与全身性炎症有关。
-代谢综合征儿童的发现
另一项研究观察到,在5岁的代谢综合征儿童体内,参与糖异生、氨基酸和脂肪酸代谢的循环代谢产物显著增加,这些代谢通路的变化与他们的BMI、腰围和空腹血糖水平密切相关。

▸免疫与炎症:连接菌群与疾病
早期肠道菌群与免疫系统之间的相互作用,是驱动这些代谢疾病的关键。
-肥胖与炎症
在3-5岁的重度肥胖儿童中,可以观察到C反应蛋白(一种全身性炎症标志物)的水平升高。
失调的肠道细菌及其代谢产物(分解代谢物)会损害脂肪组织的稳态,并诱发慢性低度炎症,从而助长儿童肥胖的发生。
-T1DM与炎症
儿童T1DM患者体内常常同时存在肠道菌群失调和全身性及组织特异性的炎症反应升高,这清晰地表明,肠道微生物在维持宿主代谢健康中扮演着不可或缺的角色。
因此,无论是儿童肥胖还是1型糖尿病,其背后都涉及生命早期的肠道菌群失调,通过扰乱宿主正常的新陈代谢通路和触发不当的免疫炎症反应,为这些慢性代谢疾病的发生和发展铺平了道路。
在生命早期干预和重塑肠道微生物群,是促进长期健康的有效方法。儿童的肠道菌群比成人更容易被环境因素改变,且该时期是免疫系统成熟的关键窗口,而免疫系统又受到肠道菌群的调节。
这里我们来了解一下在常见儿童疾病中,通过操纵早期肠道微生物组进行干预的前沿研究。
儿 童 过 敏
既然我们知道了肠道菌群失调是儿童过敏的关键推手,那么,我们是否能主动出击,通过调整菌群来拨乱反正,预防或缓解过敏呢?
答案是肯定的,现有研究已经为我们指明了几个有希望的方向。
▸抗生素的阴影与警示
在讨论干预之前,必须再次强调预防的重要性。大量证据表明,无论是母亲在孕期还是孩子在生命早期使用抗生素,都会增加儿童患过敏性疾病的风险。
剂量效应: 一项研究发现,母亲孕期使用抗生素的剂量越大,孩子日后患过敏病的风险就越高。
菌群变化: 生命早期使用大环内酯类抗生素,会导致肠道菌群发生剧烈变化,表现为放线菌门数量锐减,而拟杆菌门和变形菌门的数量则会增加。这种菌群的偏移,与哮喘风险和高BMI直接相关。
▸益生菌与益生元
直接补充益生菌及益生元,是最直接的干预手段之一,并且已经展现出不错的效果。
-针对湿疹
一项研究测试了一种含有两歧双歧杆菌(Bifidobacterium bifidum)和短双歧杆菌(B. breve)的特殊婴儿配方。结果显示,使用该配方的湿疹儿童肠道中,短双歧杆菌的丰度显著增加,同时 与乙酸盐合成相关的代谢通路被激活,这与湿疹症状的缓解显著相关。
-预防湿疹
另一项类似的研究也证明,补充益生菌和低聚半乳糖能够丰富肠道中的乳酸杆菌和双歧杆菌,从而有效预防了湿疹的发生。
-针对过敏性鼻炎
在一项芬兰的研究中,研究人员给孕晚期的母亲和她们出生后6个月内的婴儿补充四种益生菌菌株和低聚半乳糖(GOS)。在后来患上鼻炎的孩子组中,这种干预显著提升了双歧杆菌的数量,并减少了拟杆菌的数量。
▸母乳喂养与运动:有争议
-母乳喂养
理论上,母乳是建立婴儿免疫耐受的核心。但关于母乳喂养与预防过敏之间的关系,证据却并不完全一致。一些研究报告了其保护作用,而另一些则认为延长母乳喂养并没有预防效果。这说明其中的机制可能比我们想象的更为复杂。
-体育锻炼
在菌群可塑性最强的童年期,运动也可能扮演着重要角色。有研究显示,3-6岁时体育活动水平低的孩子,在儿童后期患哮喘的风险更高。然而,一个关键的不足是,这些研究并未分析运动究竟是如何影响肠道菌群的。
▸饮食:塑造菌群的日常选择
饮食是影响肠道菌群最基础、也最持久的因素。
PASTURE的一项研究发现,1岁时粪便中丁酸盐和丙酸盐水平高的婴儿,未来患上哮喘和发生过敏性致敏的风险更低。而这些短链脂肪酸的水平,又与婴儿饮食中摄入的酸奶、鱼、水果、蔬菜显著相关。
另一个代谢组学研究则指出,富含油炸和加工肉类的饮食习惯,与哮喘风险以及肠道中克里斯滕森菌科(Christensenellaceae)细菌的增多呈正相关。

「哮喘」最新研究已逐步渗透到更精细层面28 赞同 · 3 评论 文章
IBD 和 IBS
面对由菌群失调驱动的炎症性肠病(IBD)和肠易激综合征(IBS),研究人员正在积极探索一系列干预措施,试图通过调控肠道菌群,来调节肠道内的紊乱。
▸抗生素与噬菌体
越来越多的证据将矛头指向了抗生素。
一项涵盖22项研究的系统性回顾发现,生命最初两年内使用抗生素,与日后患上IBD的风险存在强烈关联。
另一项荟萃分析也指出,母亲在孕期接触抗生素和烟草烟雾,都会增加后代患IBD的风险。
噬菌体疗法:作为抗生素的潜在替代方案,噬菌体疗法(利用病毒去攻击特定的有害细菌)已在人体中显示出良好的安全性。它或许能成为治疗儿童胃肠道疾病的一种新方法,但要真正应用于临床,还需要大量深入的研究。
▸压力
早期生活压力的破坏力:肠道不仅感受生理刺激,也感受心理压力。一项动物研究利用母婴分离模型来模拟早期生活压力,结果发现,这种压力能够诱导小鼠从童年到成年持续出现类似IBS的症状,其肠道菌群也发生了改变,表现为乳酸杆菌、肠杆菌属等有益菌的减少。
▸饮食:塑造肠道的终极力量
在所有干预手段中,饮食调整可能是最基础、也最有效的方法之一。
-需要警惕的饮食
研究表明,高脂肪饮食以及富含可发酵寡糖、双糖、单糖和多元醇(FODMAPs)的饮食,会加剧IBD和IBS的症状。而在一项大型研究(斯堪的纳维亚出生队列的汇总研究数据)中,1岁时大量摄入含糖饮料也与日后更高的IBD风险相关。
-值得推荐的饮食
富含多酚、矿物质和高纤维的饮食则被证实有助于缓解症状。同一项研究发现,1岁时鱼类和蔬菜摄入量高的孩子,未来患IBD的风险更低。
-草本的力量
一些草本植物也显示出潜力。例如,在一项针对103名IBS患儿的随机双盲试验中,服用洋车前子(一种富含纤维的草本)长达6周的儿童,其腹痛发作的次数显著少于服用安慰剂的儿童。
但有趣的是,尽管症状得到了改善,两组儿童的肠道菌群构成却没有观察到显著差异,这提示其作用机制可能不仅仅是通过改变菌群。
肥胖和糖尿病
通过干预和调控生命早期的肠道菌群,我们或许能找到重置儿童新陈代谢的关键,从而预防这些疾病的发生。
▸抗生素
来自母亲的影响:现在的人群数据已经给了比较一致的信号。比如有研究发现,妈妈在备孕阶段频繁使用某些抗生素(像青霉素、喹诺酮类),和孩子日后T1DM 风险上升是相关的。
宫内暴露的后果:胎儿在子宫内接触到抗生素(如青霉素),与宝宝出生后的生长迟缓相关。这种暴露会导致婴儿肠道菌群多样性降低,并引发一系列菌群结构的改变:厚壁菌门和乳杆菌目减少,而变形菌门和拟杆菌门等则相对增多。
▸母乳喂养的黄金标准
在生命最初的几个月里,母乳是主要的营养来源,塑造早期肠道微生物群,促进双歧杆菌主导的肠道,这一点和我们日常检测到的健康婴幼儿菌群特征也是一致的。
明确的保护作用:来自两个基于人群的队列的数据显示,非母乳喂养的婴儿,其日后患T1DM的风险翻了一倍。同时,一项涵盖25项研究的荟萃分析也明确指出,母乳喂养是预防儿童肥胖的显著保护因素。
然而,大多数此类研究未能建立起从“母乳喂养”到“特定菌群改变”再到“代谢改善”之间的完整证据链。
▸益生菌
针对T1DM:研究显示,在生命最初的27天内进行益生菌干预,与T1DM高风险儿童的自身免疫风险降低相关。
针对肥胖:母亲在孕期及产后补充特定的益生菌(如鼠李糖乳杆菌HN001),能有效降低婴儿在2岁时过度肥胖的风险,这提示“母亲补充,婴儿受益”的策略或许能预防儿童肥胖。
▸运动的悖论:明确的效果与未解之谜
在肥胖儿童中的效果:研究证实,在肥胖儿童中,体育锻炼能够降低血糖和促炎通路,同时改善菌群(降低γ-变形杆菌,增加罗斯氏菌属Roseburia等),并提升有益的短链脂肪酸水平。
然而,这些研究几乎都是在年龄较大、菌群已趋于成熟的儿童或青少年中进行的。体育锻炼对于菌群可塑性最强的婴幼儿时期会产生怎样的影响,亟待未来的研究来解答。
▸营养:从母亲到孩子的饮食智慧
-母亲饮食的深远影响
母亲在孕期的饮食可以直接影响其自身的菌群,这种状态又能通过传递来重塑婴儿的早期菌群,从而为孩子未来的代谢健康打下基础。
-植物化学物质
多酚:如葡萄多酚,在动物实验中被证明能促进有益的Akkermansia菌和乳酸杆菌的定植,增加短链脂肪酸的产生。
实验室的研究也表明,无论是来自西兰花的萝卜硫苷,还是来自大豆的染料木黄酮,在生命早期摄入,都能有效减少后代的过度肥胖,改善其整体代谢健康。
这些发现揭示了巨大的潜力,但下一步需要通过转化研究来验证这些营养成分在人类儿童身上是否同样有效,以及它们是如何通过影响肠道菌群来发挥作用的。

膳食纤维对代谢健康和肥胖的影响8 赞同 · 1 评论 文章
儿 童 神 经 发 育
一切始于源头,生命最初的经历深刻地影响着大脑的发育轨迹。
-母乳喂养的保护
一项研究表明,更长时间的纯母乳喂养能够降低儿童患ASD和ADHD的风险。
-需要警惕的风险因素
相反,母亲吸烟、压力大、母乳喂养时间过短(< 4个月)则与更高的ADHD风险显著相关。而孕期感染和母亲患有自身免疫性疾病,也与ASD的发生呈正相关。
-补偿剖腹产的损失
对于剖腹产导致菌群未能正常传递的问题,一种名为阴道菌群移植(VMT)的新技术显示出潜力。研究发现,接受了VMT的新生儿,其肠道菌群和代谢物状况更优(如乳酸杆菌、双歧杆菌增多,克雷伯氏菌减少),并且在6个月大时,其神经发育评分也显著更高。
▸益生菌
直接补充特定的益生菌,为预防神经精神障碍提供了新的思路。
一项长达13年的里程碑式的研究中,科学家们给75名婴儿在生命最初的6个月里补充了鼠李糖乳杆菌GG。结果发现,这一干预引发了长期的、有益的菌群变化。更令人震撼的是,追踪到13岁时,这些接受了益生菌干预的孩子,其患上ADHD的风险显著降低了。
真实世界研究显示,植物乳杆菌PS128 服用者在注意力、沟通技能上有显著改善,且副作用小。
▸体育锻炼
体育锻炼不仅强健身体,更能健脑。
研究证实,让患有ASD的幼儿在进行课堂活动前进行体育锻炼(尤其是有氧运动),能够显著改善他们的学业反应能力。
▸母亲的饮食习惯
母亲通过塑造自身的肠道菌群,能将其影响传递给下一代,深刻影响孩子的行为和大脑功能。
母亲菌群多样性重要:一项大型队列研究发现,母亲孕期肠道菌群的α-多样性越高,其孩子在2岁时表现出的行为问题就越少。
有益菌的传承:在行为正常的孩子组中,他们的母亲肠道中富含能产生丁酸盐的菌科(如毛螺菌科Lachnospiraceae、瘤胃球菌科)。
健康的孕期饮食,与更高的母亲菌群多样性和更少的儿童内化行为问题直接相关,这清晰地表明,母亲的饮食是支持婴儿早期大脑发育的关键一环。
▸营养
研究报告称,ω-3脂肪酸、维生素、锌、镁、植物化学物质可能在管理与自闭症和多动症相关的生态失调方面发挥有益作用。
基于微生物的可改变因素对儿童疾病发展的影响

儿童神经发育异常的脑肠轴视角 – 自闭症早期风险判别和干预新路径6 赞同 · 0 评论 文章

探索大脑健康的宝藏:神经营养素、肠道菌群与我们的思维宇宙8 赞同 · 0 评论 文章
甲状腺功能障碍
甲状腺,这个位于颈部的蝴蝶状腺体,是身体新陈代谢的总开关。而它的功能状态与远在腹部的肠道菌群息息相关,形成了一条“肠道-甲状腺轴”。
肠道菌群失调和肠道屏障通透性增加(肠漏),与自身免疫性甲状腺疾病的风险增加有关,这是导致儿童甲状腺功能亢进或减退的主要原因。
▸肠道 ⇌ 甲状腺
肠道对甲状腺的影响:肠道细菌能影响甲状腺合成激素所必需的矿物质(如碘、硒、锌)的吸收和利用。同时,它们也参与甲状腺激素的代谢和激活。甲状腺免疫也受肠道微生物及其代谢产物的调节,从而导致自身免疫性甲状腺疾病的发病机制。
肠道对甲状腺的影响
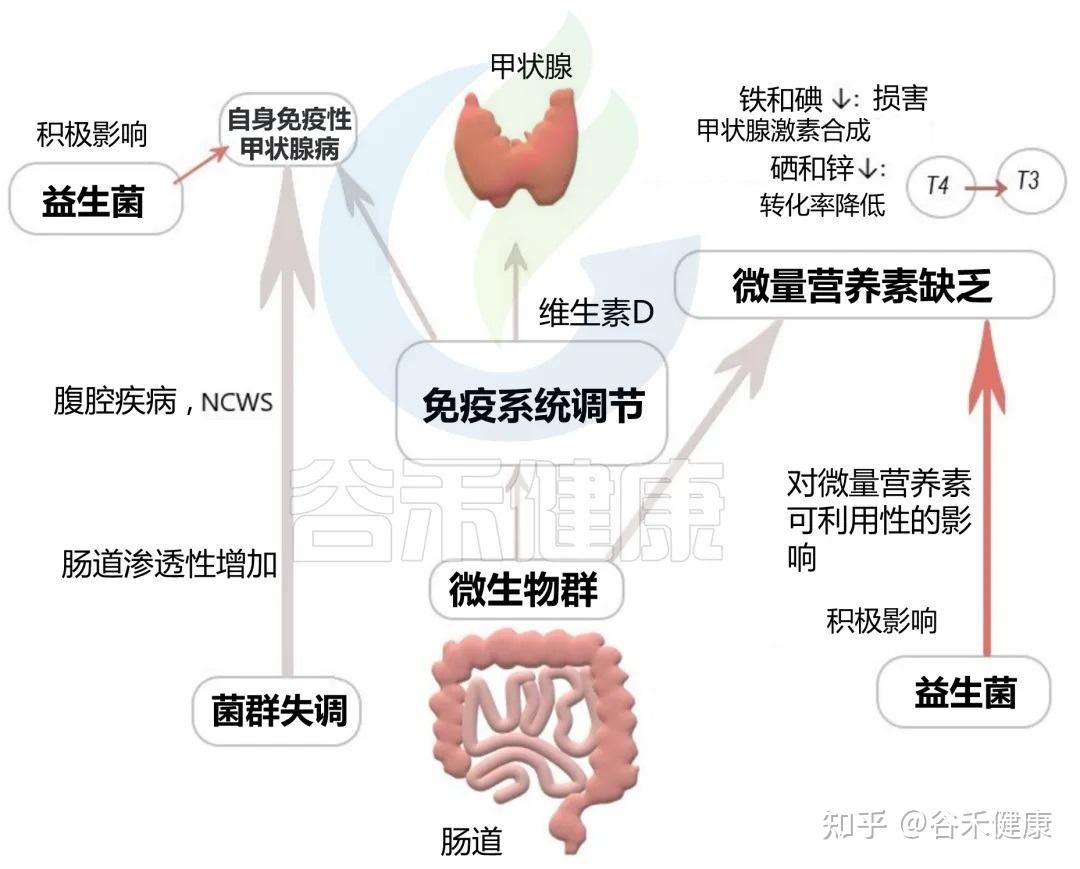
甲状腺对肠道的影响:甲状腺激素反过来也能影响胃肠道的蠕动,并可能直接调控肠道菌群的构成。
▸甲状腺相关疾病患者肠道菌群变化
在成人中:
甲亢患者的双歧杆菌和乳杆菌减少;
而桥本氏甲状腺炎患者则有Akkermansia菌和双歧杆菌的富集。
在儿童中,尤其是在菌群发育的关键窗口期,这方面的研究仍然非常稀少。
▸潜在的干预策略
研究提示,高纤维饮食、补充甲状腺相关的微量营养素、益生菌/益生元、体育锻炼甚至粪菌移植(FMT)都可能对保护甲状腺功能有益。相反,环境中的内分泌干扰物则是一个明确的风险因素。


慢性自身免疫性疾病——桥本甲状腺炎,改变认知和抓住关键16 赞同 · 1 评论 文章
性 早 熟
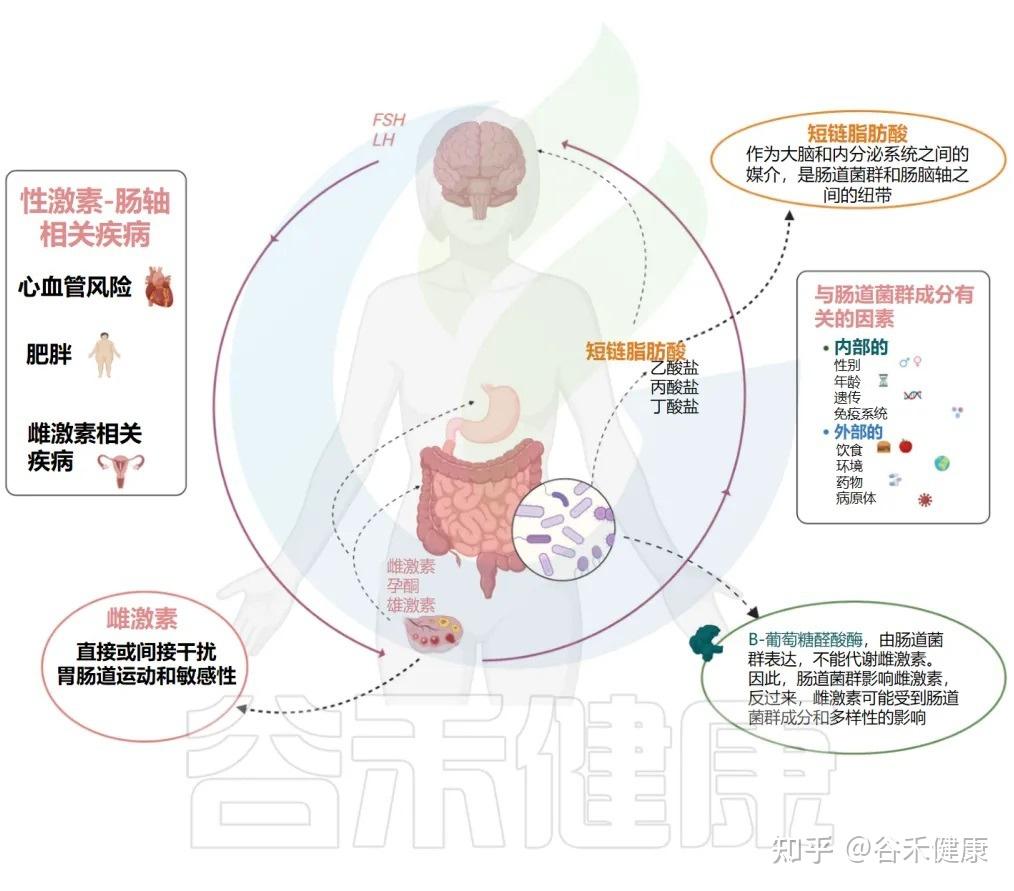
性早熟(PP),即第二性征过早出现,是儿童中一种日益普遍的内分泌紊乱,尤其在女孩中更为常见。最新的研究将目光投向了肠道菌群,认为它可能在“性激素-肠道菌群轴”上扮演了催化剂的角色。
▸菌群如何催熟?
影响雌激素代谢:某些肠道细菌,如瘤胃球菌属和拟杆菌属,能够通过产生β-葡萄糖醛酸酶来影响雌激素的代谢和循环,从而影响青春期的启动。
通过“肠-脑轴”通讯:菌群产生的短链脂肪酸(SCFAs)和神经递质,也能通过“肠-脑轴”向大脑发送信号,间接调控青春期的启动时机。
一项研究发现,与健康女孩相比,患有中枢性性早熟的女孩肠道中,多种特定细菌显著增加,如:
而这些细菌恰恰与肥胖、短链脂肪酸产生和雌激素代谢有关。
代谢组学分析进一步发现,这些女孩粪便中的代谢物发生了改变,与促进性腺激素分泌的通路(如类固醇生物合成)被激活有关。
性激素和肠道菌群之间的相互关系
▸干预与警示
有益的干预:动物实验表明,益生菌治疗可以逆转由早期压力或环境物质诱导的性早熟。在人类中,维生素D补充、复杂的碳水化合物和高蛋白饮食(如坚果、蔬菜、海鲜等)被认为可能对预防性早熟有益。
有害的暴露:生命早期接触内分泌干扰化学物质和环境污染物,会扰乱肠道菌群,从而增加性早熟的风险。
无论是甲状腺功能还是青春期的启动,这些看似与肠道无关的生命过程,都可能受到肠道菌群的深刻调控。这为我们理解和干预儿童内分泌疾病打开了一扇全新的大门。

性早熟和微生物群:性激素-肠道菌群轴的作用3 赞同 · 0 评论 文章
综上所述,我们看到许多儿童常见的健康问题,从反复过敏到体重管理,再到消化不适,似乎都与肠道这位“看不见的伙伴”——肠道菌群息息相关。生命早期是肠道菌群蓬勃发展并奠定基础的关键时期,它像一片微型森林,受到出生方式、母乳、饮食、环境等多种因素的影响。
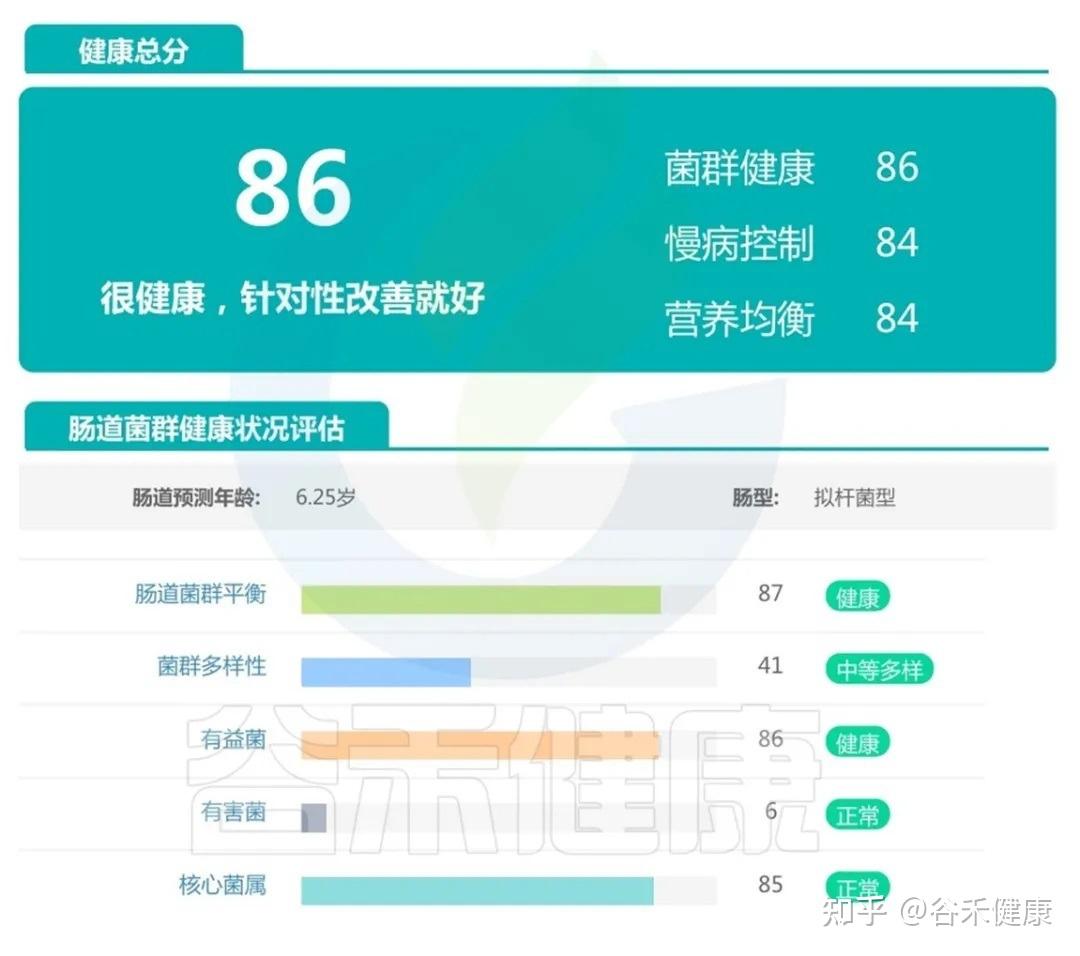
案例一:
肠道整体健康的宝宝,可以看到他的菌群健康、慢病控制、营养均衡三个维度都处在良好水平,有益菌充足、有害菌处于正常低水平,核心菌属完善。
案例二:
这个宝宝处于中等平衡状态,菌群健康指标较前一位儿童有所减弱,核心菌属开始出现缺乏,提示他可能已经携带了某些代谢问题的风险信号。
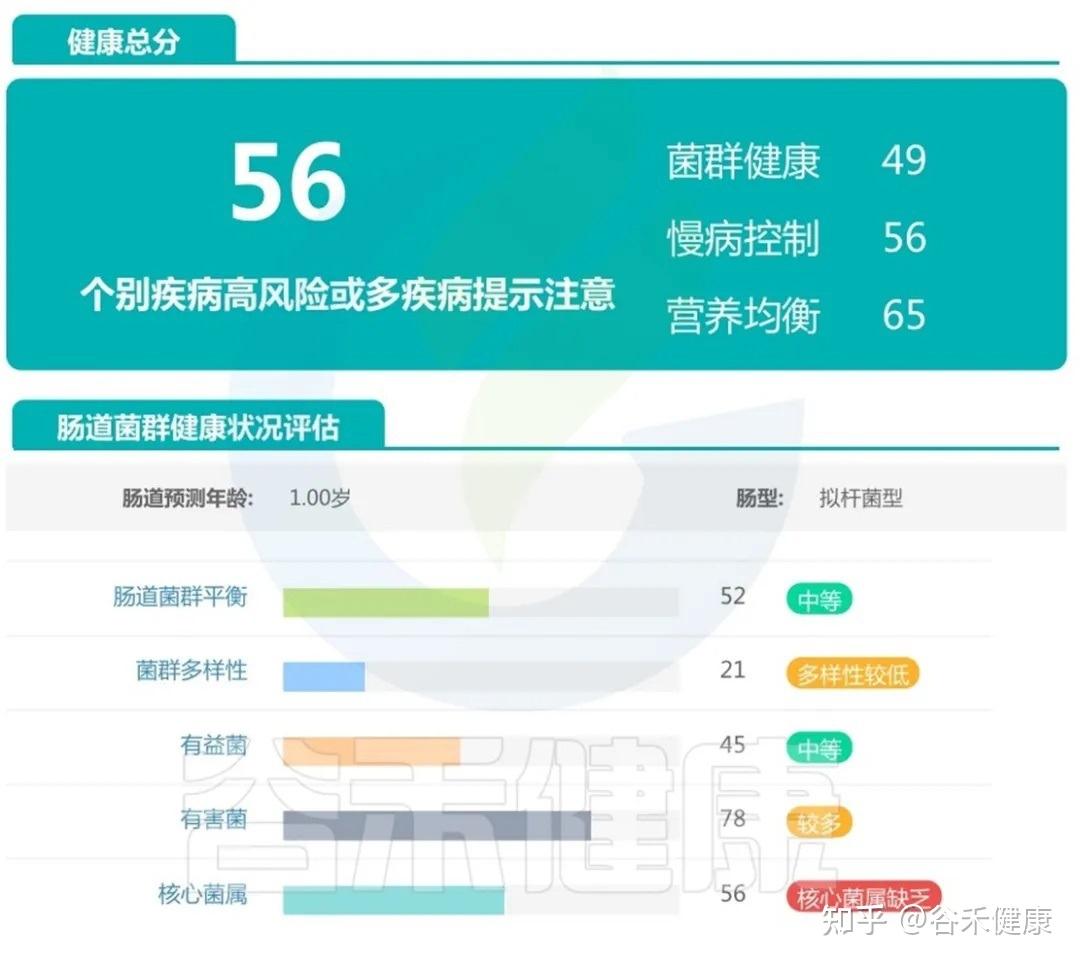
菌群多样性不足,有益菌占比下降,有害菌及产气相关菌群相对偏高。
这种菌群构成,容易让孩子陷入功能性消化不适的恶性循环:肠道动力紊乱、气体产生过多、肠腔内压波动增大,最终就表现为便秘与腹泻交替,夜间睡眠不安等问题。
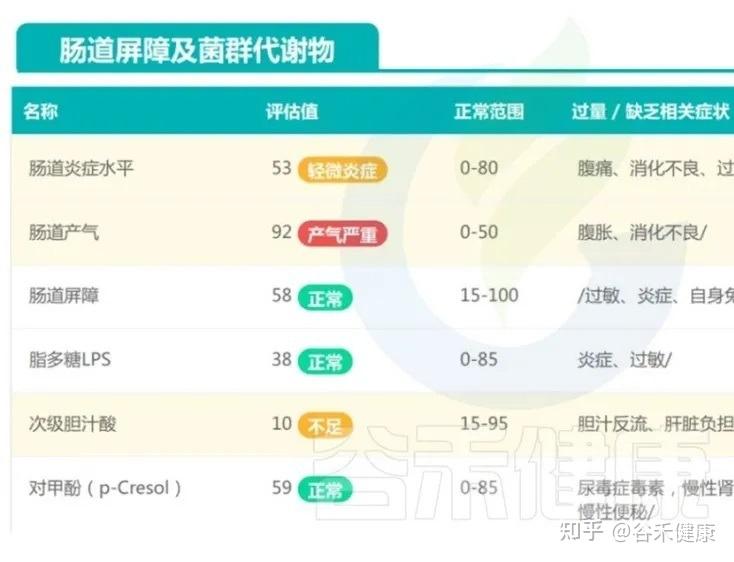
换句话说,这个孩子目前并不是存在明确器质性病变,更符合“肠道微生态已经出现早期失衡、但整体仍具有可逆性”的状态。
在这个阶段,如果能通过规范的饮食结构调整(例如逐步优化配方、增加优质膳食纤维、合理控制脂肪比例)、改善作息和生活方式,适当进行微生态干预(如针对性的益生菌/益生元支持),再配合后续的复查,就有较大机会把他的肠道环境拉回一个更平衡、更稳定的轨道。
案例三:
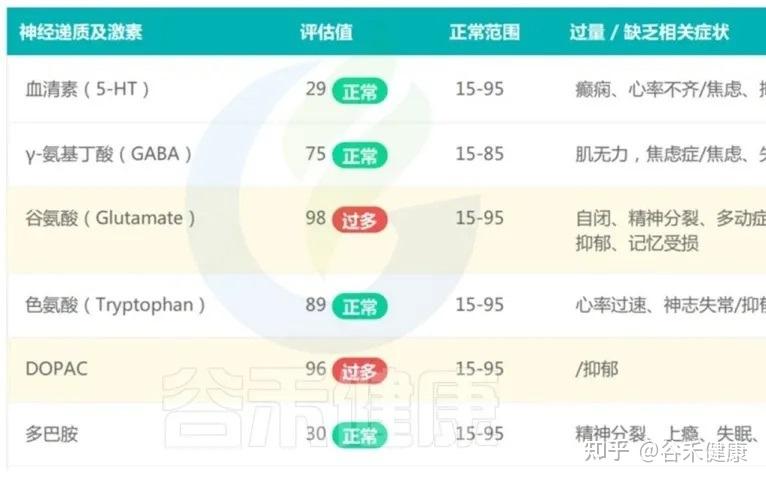
这个孩子目前看上去发育基本正常,仅社交能力稍不佳,从传统角度看,这样的孩子很容易被归为“现在没什么大问题”。但肠道菌群检测报告给出的信息却更加细腻:
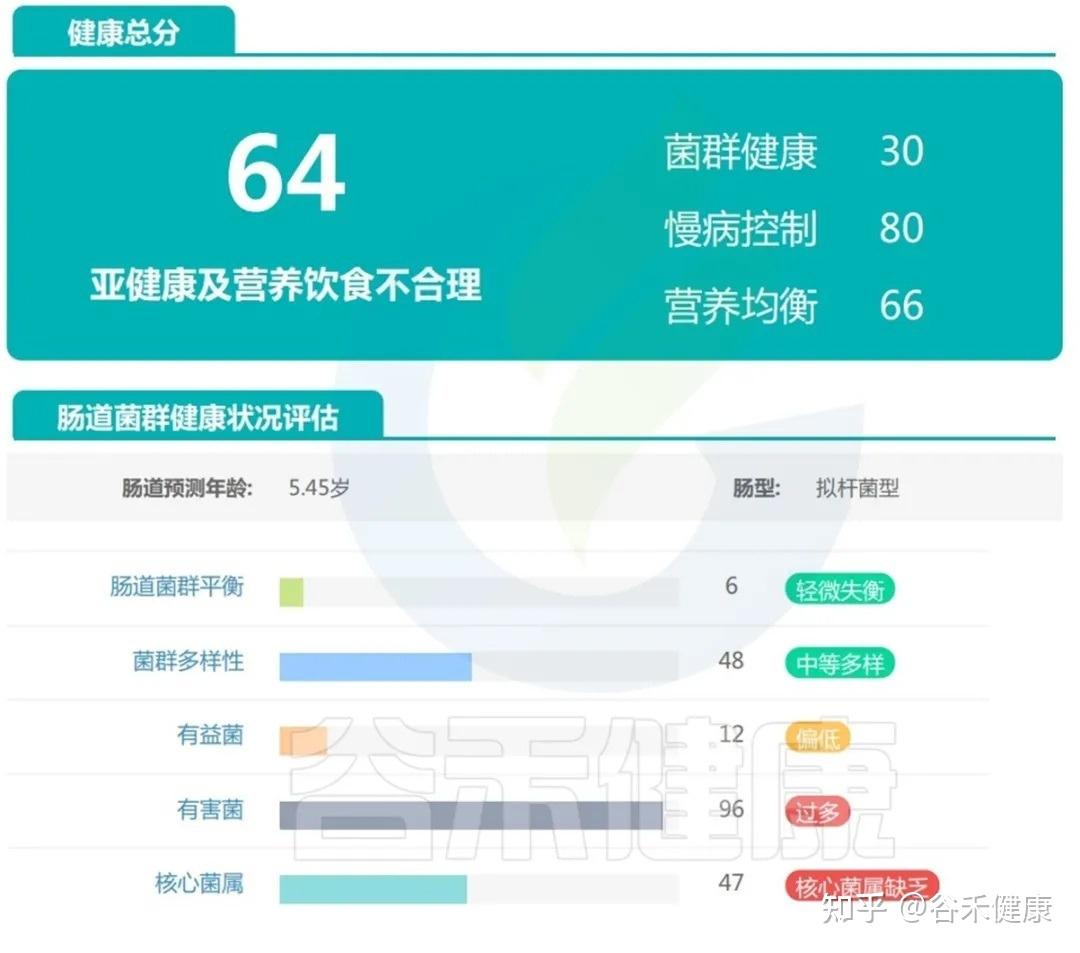
可以看到总体评分落在“轻微失衡”,已偏离理想健康状态。
有益菌丰度不足,有害菌比例偏高,核心菌属缺乏,这意味着肠道微生态的“稳定性”和“恢复力”都打了折扣。
结合该宝宝早期多次抗生素使用,很可能在肠道菌群发育的关键窗口期打断了原本的自然演化轨迹,走向一个“有益菌不足、有害菌偏多”的模式;这样的菌群背景,会让孩子在后续几年中更容易出现:反复上呼吸道感染、皮炎/湿疹、过敏性鼻炎等问题,这也与这与大量关于早期菌群失调和过敏性疾病风险上升的研究结果是吻合的。
同时,在肠–脑轴的影响下,肠道微生态的轻度失衡,过度增殖有害菌及超标代谢物(如对甲酚、硫化氢)会通过“肠脑轴”影响神经递质稳定性(如DOPAC升高提示多巴胺代谢素乱),影响孩子的情绪调节和社交意愿。
对于这种情况,肠道菌群检测不在于发现一个明确的器质性疾病,而是帮助家长在孩子看起来挺正常的当下,就开始有意识地保护和重建他的肠道微生态——包括减少不必要的抗生素使用、优化饮食结构、增加天然膳食纤维摄入、合理安排户外活动和环境暴露。

通过定期菌群监测,观察肠道菌群、有无新的过敏发作、呼吸道感染频次以及情绪和社交状态的变化,形成一个“早识别—早管理—可追踪”的长期支持路径。
因此,持续关注理解并监测儿童肠道菌群的发育与动态变化,不仅能帮助我们更全面地认识这些健康挑战,还能为未来的干预提供新的思路。通过科学的探索,我们期待能更好地守护儿童肠道微生态的健康成长,为他们一生的健康打下坚实而有力的根基。
主要参考文献
Bankole T, Li Y. The early-life gut microbiome in common pediatric diseases: roles and therapeutic implications. Front Nutr. 2025 May 29;12:1597206.
Shulhai AM, Rotondo R, Petraroli M, Patianna V, Predieri B, Iughetti L, Esposito S, Street ME. The Role of Nutrition on Thyroid Function. Nutrients. 2024 Jul 31;16(15):2496.
Yue M, Zhang L. Exploring the Mechanistic Interplay between Gut Microbiota and Precocious Puberty: A Narrative Review. Microorganisms. 2024 Feb 4;12(2):323.
Stokholm J, Blaser MJ, Thorsen J, Rasmussen MA, Waage J, Vinding RK, Schoos AM, Kunøe A, Fink NR, Chawes BL, Bønnelykke K, Brejnrod AD, Mortensen MS, Al-Soud WA, Sørensen SJ, Bisgaard H. Maturation of the gut microbiome and risk of asthma in childhood. Nat Commun. 2018 Jan 10;9(1):141.
Knezevic J, Starchl C, Tmava Berisha A, Amrein K. Thyroid-Gut-Axis: How Does the Microbiota Influence Thyroid Function? Nutrients. 2020 Jun 12;12(6):1769.
Ma T, Wu Z, Lin J, Shan C, Abasijiang A, Zhao J. Characterization of the oral and gut microbiome in children with obesity aged 3 to 5 years. Front Cell Infect Microbiol. 2023 Mar 29;13:1102650.
Tian X, Liu X, Wang Y, Liu Y, Ma J, Sun H, Li J, Tang X, Guo Z, Sun W, Zhang J, Song W. Urinary Metabolomic Study in a Healthy Children Population and Metabolic Biomarker Discovery of Attention-Deficit/Hyperactivity Disorder (ADHD). Front Psychiatry. 2022 May 20;13:819498.
Agrawal M, Sabino J, Frias-Gomes C, Hillenbrand CM, Soudant C, Axelrad JE, Shah SC, Ribeiro-Mourão F, Lambin T, Peter I, Colombel JF, Narula N, Torres J. Early life exposures and the risk of inflammatory bowel disease: Systematic review and meta-analyses. EClinicalMedicine. 2021 May 15;36:100884.

谷禾健康

春节假期期间,亲朋好友欢聚一堂,美食佳肴各种狂炫,然而当传统节日遭遇现代饮食文化,频繁的高脂高蛋白摄入、不规律的进食节奏,正不断冲击着肠道屏障的免疫调控网络,部分人群可能正被食物过敏困扰。
食物过敏(FA)是一个当今面临公共卫生问题。一个人可以在任何时候对任何食物过敏,但有引起过敏反应最普遍的食物包括:牛奶、鸡蛋、花生、坚果、大豆、小麦、鱼类和贝类。这些过敏反应范围从肿胀和荨麻疹到危及生命的过敏性休克。
更不乐观的是,食物过敏在当今全球工业化社会中的流行率呈现显著代际增长(一代比一代增强)。与此同时食物过敏率的上升与很多疾病的增加相呼应,包括肥胖、糖尿病、哮喘、自闭症和炎症性肠病(以及其他疾病)。我们如何解释这种代际变化?
食物过敏是过敏性疾病的一部分,被称为I型超敏反应,是由食物蛋白(抗原)通过肥大细胞和/或嗜碱性细胞表面上的免疫球蛋白同种型E(IgE)交联引起的,这与由食物成分引起的食物敏感性不同(例如,乳糖不耐症)。
与此同时,我们的肠道相关淋巴组织(GALT)每天都面临着相当大的挑战。它遇到的抗原估计来自1014微生物和每年超过约30公斤的食物蛋白质。这要求它必须将这些无害的抗原与潜在的病原体区分开来,并能同时引起适当的宿主免疫应答。
目前越来越明确的是,与先天免疫细胞和常驻微生物群密切相互作用的功能性上皮屏障对于建立和食物过敏以及口服耐受性至关重要。而口服耐受性的形成取决于年龄、遗传学、粘膜屏障状态、抗原的物理性质、暴露剂量和频率以及肠道微生物群。
是什么驱动了对食物抗原的过敏反应,近年来有关微生物群在调节抗原摄取和抗原呈递中的作用开始被解开。在4至6个月大的婴儿中早期引入致敏性食物已被证明有希望降低部分但并非所有儿童的IgE-食物过敏(IgE-FA)发病率。
IgE-FA尚无明确的治愈方法,金标准治疗是在发生过敏反应时避免使用对症治疗。幸运的是,疾病修饰疗法,包括免疫疗法,生物制剂等有希望。
本文汇总和依托这些文献结果,讨论了IgE-食物过敏在其自然史的背景下,发展的风险因素,免疫生物学,诊断和治疗,包括新兴疗法。同时,我们也将探讨肠道微生物群在食物过敏中的作用,以及如何通过调节肠道微生物群来预防和管理食物过敏。
食物过敏是一种由免疫球蛋白E(简称IgE)引起的过敏反应。这种病近几十年来越来越常见,可能会威胁生命。特别是对于那些难以完全避开的食物(比如牛奶或鸡蛋)过敏的人来说,生活质量会受到很大影响。
对牛奶、鸡蛋、小麦和大豆的过敏,随着年龄增长可能会慢慢好转。
对花生、坚果和海鲜的过敏,通常会伴随终身。
食物过敏常常和其他过敏性疾病一起出现,比如:
虽然理论上任何食物蛋白质都可能引起过敏,但最常见的是:
小麦过敏和乳糜泻是两种不同的病:
小麦过敏是对小麦蛋白的过敏反应;
但在乳糜泻中,部分水解的麦醇溶蛋白被小肠粘膜中的组织转氨酶脱酰胺。这种特异性和有序的脱酰胺作用增强了小肠固有层中CD4+T细胞对麦胶蛋白的识别,导致免疫应答。细胞因子的后续释放导致肠粘膜的组织学变化。
◆ 过敏疾病是如何发展的?
医生们发现,很多孩子的过敏疾病会按照一定规律逐步发展,这个过程被称为“过敏进行曲”。大约有30-50%的过敏儿童会经历这个过程。不过每个孩子的发展过程可能不太一样。
◆ 过敏疾病通常会按这个顺序出现:
湿疹(特应性皮炎):通常在出生后6个月内最先出现
食物过敏:在1岁前就可能出现
过敏性鼻炎和哮喘:在有湿疹的孩子中,差不多三分之二会在3岁前出现这些症状。
特别提醒:如果湿疹控制得不好,更容易得其他过敏病。
◆ 为什么会得食物过敏?
食物过敏的形成和很多因素有关:
个人因素:
严重的早期湿疹
父母有过敏病史
环境因素:
接触过敏物的时间
肠道中的菌群平衡情况
环境因素如何影响过敏?
新出现的数据表明,在免疫系统发育过程中暴露于非微生物环境因素,包括空气过敏原、清洁剂、污染物和微塑料,可能会导致屏障功能障碍。霉菌、蟑螂和尘螨等空气过敏原含有促进上皮蛋白分解的蛋白酶,导致上皮渗透性增加,例如,清洁剂破坏角质层内的紧密连接和脂质依赖性相互作用,从而增加细胞旁渗透性。
◆ 食物过敏的风险因素:
对过敏原蛋白的反应会受到多种因素的影响,包括:
个人的敏感程度:有些人对过敏原特别敏感,而有些人反应较轻。
过敏原的特性:不同食物中的过敏原性质不同,反应也会有所差异。
食物加工方式:加工过程可能会改变过敏原的性质,比如加热可能降低或增强过敏性。
有的加工对某些过敏原有帮助,比如鸡蛋中的卵清蛋白和卵粘蛋白在加热后过敏原性下降。
但对某些过敏原(如花生蛋白)可能起反作用,加热会使其形成更稳定的抗性结构,增加过敏原性。
◆ 胃肠道屏障与过敏风险
婴幼儿风险更高: 由于他们的胃肠道屏障和免疫系统尚未成熟,食物过敏更容易发生。
胃酸不足: 服用抗酸剂可能降低胃酸浓度,使更多未被分解的蛋白质进入肠道,增加过敏风险。
肠道通透性增加: 肠道屏障功能受损可能导致更多过敏原进入免疫系统,增加致敏和过敏反应的可能性。
食物成分的相互作用:食物中的其他成分可能会影响过敏原的作用。
◆ 过敏反应的严重程度
敏感人群的过敏反应可能从轻微到严重不等,严重时甚至可能危及生命(如过敏性休克)。因此,避免接触过敏原是目前最有效的预防方法。
◆ 为什么食物过敏难以治疗?
目前还没有针对食物过敏的有效治疗方法,因为科学家对引发过敏的分子机制还没有完全弄清楚。因此,过敏患者最好的办法就是避免食用含有过敏原的食物。但问题是,只有在明确知道食物中含有过敏原时,才能做到有效避免。
◆ 食品标签的重要性
食品标签是帮助消费者了解食物中是否含有过敏原的重要手段。然而,确保全球食品标签的准确性并不容易,主要有以下几个挑战:
◆ 哪些食物最容易引发问题?
牛奶是最常见的未标注过敏原,其次是小麦和大豆。这些食物经常出现在食品召回事件中,很大程度因为它们被意外添加或未正确标注。
对于过敏患者来说,了解食品标签和避免过敏原是保护自己的关键。但由于标签错误、交叉污染等问题,完全避免过敏原仍然具有挑战性。
食物过敏原主要是一类特殊的蛋白质(糖蛋白),它们通常能溶于水,而且比较”顽固”-不容易被热、酸和消化酶破坏。
不过,不同的过敏原特性会有很大差异。有的需要糖分子的修饰才能发挥作用,有的则不需要。
过敏原的结构特点:
大小不一:从小分子到大分子都有。
结构多样:有的是单个分子,有的会几个分子组合在一起。
稳定性强:通常含有特殊的化学键(二硫键),使它们不容易被破坏。
结合能力:能与金属、脂肪等物质结合,这种结合会让过敏原更稳定。
不同食物的过敏原如果结构相似,可能会导致交叉过敏。
常见的交叉过敏组合:
过敏原的识别位点(表位):
直线型表位:像一串珠子一样排列的氨基酸片段
立体型表位:蛋白质折叠形成的特殊立体结构
一般认为直线型表位更重要,因为它们更稳定,不容易被破坏。
但在某些情况下,立体型表位也能在食物中保持稳定,发挥作用。
了解这些特性有助于预测哪些食物可能会引起交叉过敏;改进食物加工方法,降低过敏风险;开发更好的过敏预防和治疗方案。
致敏是指免疫系统首次接触到某种过敏原后,开始产生针对它的特异性抗体(IgE),但此时不会引发过敏症状。
致敏的主要途径:
小麦过敏是一种IgE介导的I型过敏反应,部分人群对小麦中的某些蛋白质成分较为敏感,即使在护肤品中接触也可能出现过敏症状。
如果你已知对小麦过敏,或者属于敏感肌肤,建议谨慎使用含有水解小麦蛋白的护肤品。
花生过敏者可能因皮肤接触花生而致敏,尤其是皮肤屏障受损的人。
胃肠道致敏(1类食物过敏): 最常见的方式,食物过敏原通过消化道进入身体,导致过敏反应,尤其常见于婴幼儿,因为他们的肠道屏障和免疫系统尚未完全发育。常见过敏原包括牛奶、鸡蛋和豆类。
吸入性致敏(2类食物过敏): 通过呼吸道接触到空气中的过敏原(如花粉、动物毛发等),随后对相关食物产生过敏。
皮肤接触致敏: 通过皮肤接触到过敏原而致敏。例如:
蜱叮咬致敏: 蜱叮咬可能导致对红肉的过敏反应,这是一种特殊的皮内致敏途径。
子宫内暴露: 胎儿可能通过胎盘接触到母体食物中的过敏原(如牛奶、鸡蛋和花生),但目前没有确凿证据表明母亲的饮食会直接影响婴儿的食物过敏风险。
B细胞的双重角色 | 引起过敏/预防过敏
什么是B细胞?
B细胞是我们身体里的一种免疫细胞,它最重要的工作就是产生抗体(免疫球蛋白)。在食物过敏中,B细胞主要产生一种叫IgE的抗体。
食物过敏发生的过程:
第一步: 识别“入侵者”
B细胞会产生IgE抗体,这些IgE能够识别食物中的特定蛋白质(过敏原)。
第二步: 设置“警报器”
IgE会附着在特殊的免疫细胞(肥大细胞和嗜碱性粒细胞)表面,这些细胞就像身体的“警报器”。
第三步: 过敏反应的触发
当吃到过敏食物时,IgE认出并抓住过敏原
“警报器”被触发,免疫细胞释放出化学物质,这些化学物质引起过敏症状(如皮疹、呼吸困难等)。
关于IgE的特点:
IgE在所有抗体中数量最少,但它在过敏反应中起着关键作用。
B细胞的变化过程:
B细胞可以通过特殊方式转变,开始产生IgE,这个转变需要其他免疫细胞(T细胞)的帮助,还需要特定的信号分子(IL-4和IL-13)的参与。
对花生过敏的研究发现,科学家从花生过敏患者的血液中找到了产生IgE的B细胞。这些B细胞寿命较短。
不同过敏患者的IgE抗体可能会以相似的方式识别花生中的过敏原,这些发现帮助我们更好地理解食物过敏的发生机制,为开发新的治疗方法提供线索,从而可能帮助预防或减轻过敏反应。
图 控制对过敏原反应的免疫过程
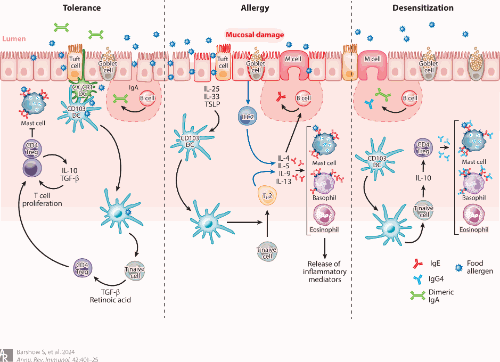
(左)耐受性:耐受性是一种主动免疫过程,在此过程中暴露于过敏原不会引发过敏性炎症。耐受性可涉及特异性抗原呈递细胞、TcB的诱导和活化以及B细胞同种型转换为伊加。
(中)过敏症:在过敏症中,上皮细胞功能障碍使抗原进入并触发alarmins IL-25、IL-33和TSLP的释放。幼稚T细胞分化成TH2细胞,其分泌促炎性TH2细胞因子IL-4、IL-5、IL-9和IL-13,其导致B细胞同种型类别转换为IgE。IgE通过高亲和力IgE受体(FcεR1)与肥大细胞和嗜碱性粒细胞结合,导致急性过敏性炎症。
(右)脱敏:过敏原免疫疗法的脱敏与IL-10的Treg产生相关。B细胞类别从IgE转变为IgG 4和伊加产生。IgG 4和伊加可通过分别与IgE竞争变应原结合位点和直接结合食物变应原而充当阻断抗体来抑制TH2适应性免疫应答。缩略语:DC,树突状细胞;TH2,2型辅助性T细胞; Treg,调节性T细胞; TSLP,胸腺基质淋巴细胞生成素。
不是所有抗体都会引起过敏;B细胞除了能产生引起过敏的IgE抗体,还能产生其他种类的保护性抗体,这些保护性抗体可以帮助预防食物过敏。
保护性抗体是如何工作的?
科学家通过小鼠实验发现粘膜中的IgA抗体能阻止过敏原被肠道吸收。
IgG抗体有两种保护作用:
直接捕获并中和过敏原;
通过FcγRIIb受体的作用抑制过敏反应。
此外,治疗食物过敏的新发现在口服免疫治疗(OIT)中观察到,保护性抗体IgG4会明显增加,IgG4与致敏抗体IgE的比值升高。这些变化与患者对食物的耐受性直接相关。
调节性B细胞的重要性
研究发现牛奶过敏患者与健康人对比,过敏患者的调节性B细胞明显减少,这些细胞产生的IL-10也较少。
IL-10的重要作用可以减少致敏抗体IgE的产生,促进保护性抗体IgG4的产生。
B细胞的信使功能:
B细胞也可通过IgE促进的抗原呈递作用作为T细胞的抗原呈递细胞(APC),其中IgE-过敏原复合物被低亲和力IgE受体CD 23(FcεRII)内化,后者在B细胞上表达。
值得注意的是,最近的一项研究表明,B细胞上CD 23的表面密度通过IgE促进的抗原呈递决定了过敏原特异性T细胞的活性,并与总血清IgE水平呈正相关。抗CD 23单克隆抗体鲁昔单抗通过靶向CD 23-IgE相互作用抑制IgE合成。
B细胞治疗方面潜力:
预防方面:
T细胞在食物过敏中的角色
1. TH2细胞:过敏反应的”指挥官”
研究发现,TH2细胞是引发食物过敏的核心细胞,它通过三种方式发挥作用:
2. 治疗的新发现
口服免疫治疗(OIT)的研究显示:能够抑制TH2细胞的活动,减少过敏相关物质的产生,帮助建立对食物的耐受性。
3. 新发现的重要T细胞类型
最新研究发现Tfh13细胞在食物过敏中的重要作用,动物实验证明,这种细胞对产生高效过敏抗体必不可少,能直接影响过敏反应的强度。
注:Tfh13(滤泡辅助性T细胞13)是一种特殊的免疫细胞亚型,属于CD4+ T细胞家族。它在免疫反应中起着重要作用,尤其是在过敏反应和IgE抗体的产生过程中。
此外,还有TH2A细胞,这是一种特殊的记忆性T细胞,该细胞只在过敏人群中发现,其表面有特定标记物(CD161、CRTH2、CD49d)。发现该细胞不仅与食物过敏有关,还与其他过敏病相关,例如,湿疹、过敏性鼻炎、哮喘和食管炎。
4. T细胞的共同识别标记
研究人员通过CD154标记发现:花生过敏患者的T细胞有特殊特征,17%的特定序列在不同花生过敏患者中相同。这说明花生过敏可能有共同的免疫机制。
5. 调节性T细胞(Treg):过敏的“刹车系统”
Treg细胞是免疫系统的调节者,有两种来源:
动物实验显示,牛奶过敏小鼠经过治疗后:Treg细胞数量增加,产生更多保护性物质(IL-10和TGF-β)。
人类研究发现,鸡蛋过敏儿童成功治疗后:特定类型Treg细胞增加。与此同时,花生过敏治疗后:Treg相关基因活性增加。
T细胞在诊断和治疗方面应用潜力:
肥大细胞:驻扎在“人体边防”的过敏触发器
主要在身体的”边界”位置:皮肤、呼吸道、消化道。
研究发现:对胃肠道过敏患儿的活检发现,他们的胃部和结肠中,肥大细胞数量比健康孩子多(通过CD117和类胰蛋白酶标记检测)。
临床观察:在食物过敏患者的肠道检查中发现,过敏相关物质明显增加:
特定条件下可能缓解过敏
小鼠实验发现,肥大细胞表面有个“刹车开关”(FcγRIIb),能接收IgG抗体的“停战指令”,抑制过敏反应,这可能是未来治疗的关键靶点。
嗜碱性粒细胞:血液中的哨兵
基本特征:在血液中数量很少(仅占白细胞的0.5-1%),但在过敏反应中作用重要。
临床应用:可以通过流式细胞术(BAT)检测,使用CD63和CD203c作为标记,帮助诊断食物过敏,监测治疗效果。
治疗相关发现:口服免疫治疗(OIT)研究显示,成功治疗后:
小鼠实验发现:在 IgE-FA 的小鼠模型中,嗜碱性粒细胞耗竭减轻了腹泻的发生率,临床过敏反应减弱。同一项研究表明,嗜碱性粒细胞来源的 IL-4 对于肥大细胞募集和/或增殖至关重要。
临床意义:可以通过检测这两种细胞,判断过敏严重程度,评估治疗效果。
治疗方向:可以破坏 IgE-FA 中肥大细胞和嗜碱性粒细胞反应性的新型干预措施,可能代表未来研究的有吸引力的治疗靶点。
抗原呈递细胞(APCs):免疫系统的“情报分析员”
主要包括三类细胞:
抗原呈递细胞是如何工作的?
➤ 发现并捕获食物过敏原 → 分解成小片段(肽段) → 用MHC II分子“举牌”展示
➤ 指挥CD4+ T细胞分化成不同细胞(TH1/TH2/Treg等)
不同派系的树突状细胞:过敏派 vs 和平派
◈ 过敏派(CD209+树突状细胞)
锁定目标:锁定致敏蛋白,如花生、坚果等。
煽风点火:释放信号诱导T细胞变身TH2(分泌IL-4/IL-5/IL-13)
研究证据:
◈ 和平派(CD103+树突状细胞)
维稳专家:在小鼠肠道训练T细胞成为Foxp3+ Treg(分泌IL-10),有助于预防过敏。
制衡机制:表达诱导性T细胞共刺激配体(ICOS-L),促进“调解员细胞”生成。
树突状细胞功能的其他重要考虑因素包括共刺激分子如 CD80 和 CD86 等表达,它们是 CD28 的天然配体;这些分子与 T 细胞表达的 CD28 的相互作用受损可能导致激活减少或缺失,并最终导致 T 细胞无反应。
花生口服免疫治疗降低了APC上CD86的表达,尽管这些变化可能是暂时的。
诊断方面:通过分析树突状细胞的亚型特征和活化状态,可评估个体过敏风险等级,并预测潜在的过敏反应发生概率。
治疗突破:为过敏治疗开辟了新路径。
1)精准调控不同功能亚型DC的比例平衡;
2)靶向干预DC表面关键分子(如共刺激分子)的表达;
3)特异性增强具有免疫调节功能的DC活性。
总之,免疫系统的多个部分协同作用。
正常耐受状态是B细胞生产保护性抗体(IgA),调节性T细胞(Treg)担任”指挥”角色,共同抑制过度反应,防止肥大细胞引发过敏症状。
过敏状态TH2细胞过度活跃,产生大量致敏物质,指导B细胞产生过敏抗体(IgE)。多种免疫细胞被激活,包括肥大细胞、嗜碱性粒细胞、嗜酸性粒细胞等。受损的肠道细胞会释放:IL-25、IL-33、TSLP,这些物质进一步加重过敏反应。
成功的脱敏治疗会带来以下变化:
T细胞方面,抑制致敏T细胞(TH2)、增加调节性T细胞;
B细胞方面,增加保护性抗体(IgA和IgG4)、减少致敏抗体(IgE)。
来自人类和动物研究的越来越多的证据支持肠道微生态失调在食物过敏发展中的关键作用。
基于16S rRNA测序的研究发现,与没有食物过敏的儿童相比,患有食物过敏的儿童具有独特的肠道微生物组结构。
表. 在有和没有FA的小儿患者之间主要的肠道微生物组差异(基于16S-rRNA测序的研究)
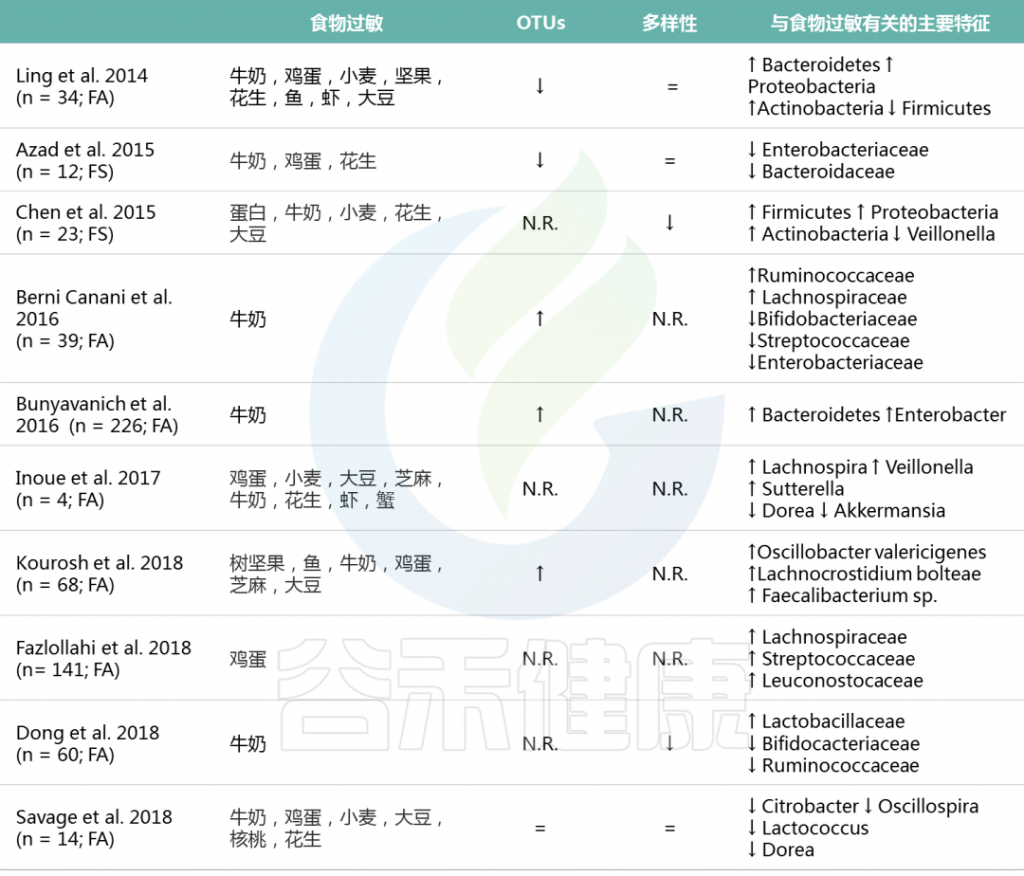
M.D.Costanzo et al, Int.J.Mol.Sci. 2020
FA:食物过敏; FS: 食物过敏; OTUs:操作分类单元; N.R.: 未报道过的; ↑ : 增加;↓: 减少; =: 不变.
表1中所有研究均调查了IgE介导的食物过敏。有趣的是,关于46例受非IgE介导的牛乳过敏(CMA)影响的患者的数据显示,与健康对照组相比,失调的菌群中拟杆菌Bacteroides (Bac 12) 和Alistipes丰富,IgE介导的CMA儿童的特征重叠,是从健康到IgE介导的CMA患者的拟杆菌逐渐增加。
在同一项研究中,患有非IgE介导的CMA的儿童的粪便中丁酸浓度明显低于健康人。
菌群失调先于食物过敏发作
来自人体研究的可用数据表明,菌群失调先于食物过敏发作。
Azad 等人研究发现,在婴儿早期肠道微生物组含量较低的情况下,肠杆菌科(Enterobacteriaceae) / 拟杆菌科(Bacteroidaceae)的比率增加和Ruminococcaceae的丰度较低与随后的食物敏感性相关,这表明早期肠道菌群失调对食物过敏的后续发展有促进作用。
此外,人类研究的可用数据表明,生命早期,尤其是生命的头6个月,微生物组构成与食物过敏的发展更为相关;
在出生后的前 6 个月内,在食物过敏儿童的肠道菌群中占比过高的菌如下:
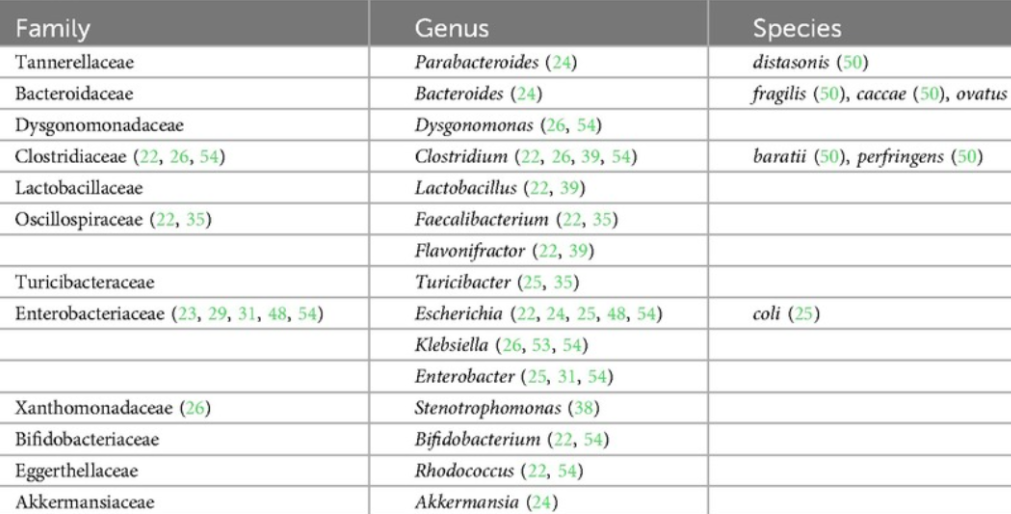
doi.org/10.3389/falgy.2024.1438252
在出生后的前 6 个月内,在食物过敏儿童的肠道菌群中缺乏的菌如下:
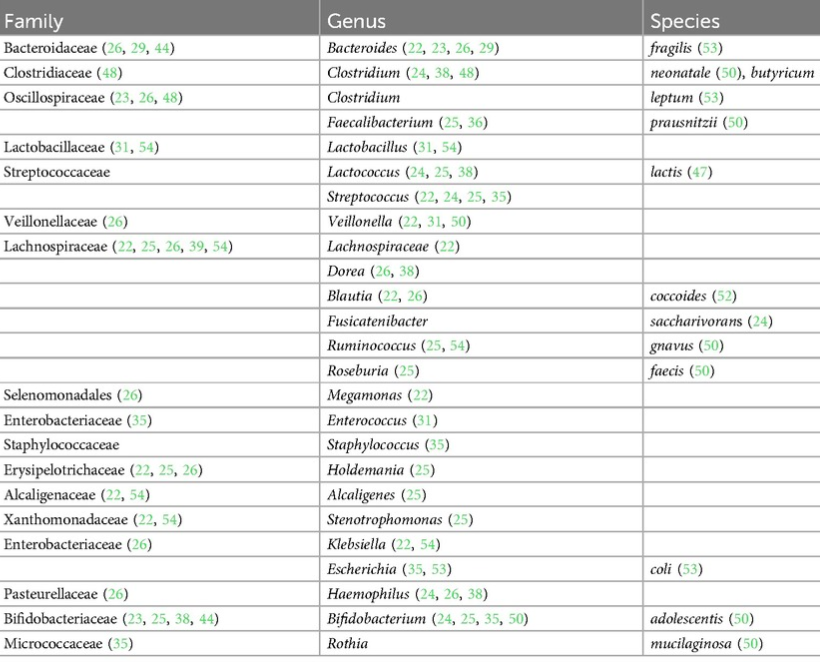
doi.org/10.3389/falgy.2024.1438252
▲ 有害菌增加:
肠杆菌等有害菌释放脂多糖(LPS)等毒素:
▼ 有益菌减少:
双歧杆菌、乳杆菌等能分解食物纤维,产生短链脂肪酸(如丁酸),这类物质:
调节免疫耐受
肠道菌群通过调节Tregs细胞的分化和功能,增强对食物抗原的耐受性。例如,梭菌和双歧杆菌能够通过其代谢产物(如SCFAs)和信号分子(如IL-10、TGF-β)促进Tregs的分化和增殖,从而抑制过敏反应。
肠道菌群还通过调节树突状细胞(DCs)的功能,影响免疫反应。例如,健康的肠道菌群能够使DCs产生TGF-β和视黄酸(RA),从而诱导Tregs的分化。
共生菌介导免疫耐受
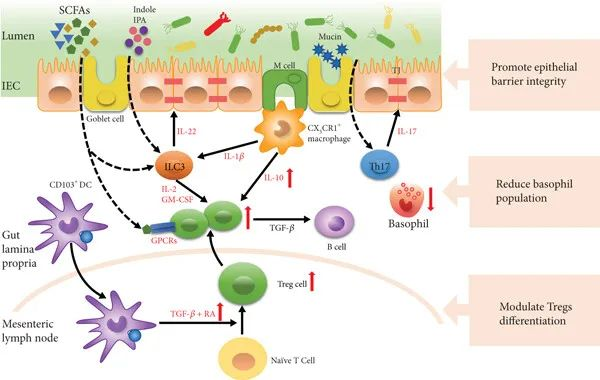
doi.org/10.1155/2023/9575410
增强肠道屏障功能
肠道菌群通过产生短链脂肪酸(如丁酸)和色氨酸代谢产物(如吲哚)来增强肠道上皮屏障的完整性。这些代谢产物能够促进黏液分泌和紧密连接蛋白的表达,从而防止食物抗原进入血液循环,减少过敏反应的发生。
例如,丁酸能够通过诱导IL-22的产生,增强肠道上皮细胞的屏障功能,减少过敏原的渗透。
调节过敏效应细胞
肠道菌群能够调节过敏效应细胞(如嗜碱性粒细胞)的数量和功能。例如,抗生素处理或无菌小鼠的嗜碱性粒细胞数量增加,而补充益生菌可以减少这些过敏效应细胞的数量,从而减轻过敏症状。
关于肠道菌群的干预措施,我们将在06章节详细阐述。
IgE-食物过敏的诊断依赖于临床病史和过敏试验的结合,如食物特异性IgE的存在。诊断指南和标准临床实践在国际上各不相同。这些差异主要是由于多种方法可用于评估IgE-FA;这些方法在灵敏度、特异性、成本、时间和可及性方面各不相同。准确的诊断对于防止不必要的食物避免和提供及时和适当的治疗建议至关重要。
金标准
双盲安慰剂对照食物激发试验(DBPCFC)是最可靠的确诊方法。由于12.9%的试验可能出现安慰剂反应,其准确性优于非盲法试验。
确定IgE对给定食物致敏的两种主要方法是:
体内皮肤点刺试验(SPT)
操作:将微量食物(新鲜的或更常见的作为提取物)刺入皮肤表层
判读标准:15-20分钟后,检查皮肤刺痛部位,若出现比阴性对照大3mm以上的红肿包块(因肥大细胞释放组胺所致)即为阳性。
编辑
血清特异性IgE(sIgE)
sIgE测定定量外周血中存在的过敏原特异性IgE的量。
传统标准:≥0.35 kU/L为阳性
新型检测:临界值可低至0.1 kU/L
注意:两项检测结果必须谨慎解释,均需结合症状分析,因可能出现”致敏但无过敏反应”的假阳性。
检测结果优化策略:
使用较大的SPT包块直径或较高的sIgE临界值可增加临床反应性的可能性,但这是以牺牲敏感性为代价的。
组合检测优势:
对1247例食物激发试验数据分析显示:
SPT+sIgE联合检测或sIgE/总IgE比值(sIgEr)
的阳性预测值显著优于单项检测。
应用价值:在临床试验等场景中可替代部分激发试验,但仍需更多验证。
现存挑战:许多具有临床相关IgE-FA的患者的SPT和/或sIgE值可能低于已发表的临界值,强调需要更稳健的诊断方法来取代口服食物激发试验。
食物过敏检测升级版:成分检测与表位检测有什么用?
除了常规的皮肤点刺、抽血验IgE,医生手里还有两把更精细的“放大镜”——成分检测和表位检测。它们能帮你区分“假警报”和“真危险”,甚至预测过敏反应有多严重。
成分检测:锁定过敏食物里的“关键蛋白质”
原理:
食物过敏其实是对其中某些蛋白质过敏。比如花生含有Ara h1、Ara h2等多种蛋白质,成分检测(CRD)可以单独测出你对哪一种蛋白质过敏。
实际用途:
区分“花粉过敏连带反应”和“真过敏”。
比如有人吃花生过敏,但检测发现只对Ara h8蛋白敏感,这通常是因为它和桦树花粉蛋白相似,属于“交叉反应”(可能症状轻微,比如口腔发痒)。
但如果对Ara h1/2/3敏感,则是真正的花生过敏,严重时可能引发全身反应。
预判过敏风险高低
研究证实:对花生中的Ara h2蛋白过敏的人,严重过敏风险更高;而另一种Ara h6蛋白(与Ara h2结构相似)阳性,也可能指向真实过敏。

表位检测: 看清IgE攻击的“精确靶点”
原理:如果把过敏蛋白比作一根长绳,表位就是绳子上被IgE抗体“咬住”的具体位置(分线性和构象两种结构)。表位检测能识别这些关键攻击点,帮助判断过敏是否会长期存在或容易引发严重反应。
在花生过敏的儿童和成人中,针对花生过敏的BBEA表位检测法(检测Ara h2蛋白的两个线性表位):灵敏度92%,特异性94%,准确度碾压常规检测:比皮肤点刺、普通IgE检测更准。
另一个相关的体液测试是 过敏原特异性IgG4
IgG4抗体通过充当阻断抗体而在IgE-FA中具有保护作用。一项研究发现,花生致敏但临床耐受或花生过敏并接受OIT治疗的儿童的血浆能够抑制花生诱导的肥大细胞活化。重要的是,当血浆中的IgG4耗尽时,肥大细胞的活化不能完全恢复。
但是目前需要进一步的研究来更全面地了解IgG4单独或与其他生物标志物结合在食物过敏诊断和/或预后中的作用。
编辑
诊断方法仍然主要限于研究环境,包括嗜碱性粒细胞活化试验(BAT)和肥大细胞活化试验(MAT)。
BAT与MAT的优劣对比:
BAT和MAT都是基于体外流式细胞术的实验室检测,用于测量过敏原刺激后活化标志物的表达。
BAT检测(嗜碱性粒细胞活化试验)
需要采集新鲜血液立即检测。
BAT在诊断IgE-食物过敏时的特异性高于SPT和sIgE水平,在花生过敏中的特异性为98%,灵敏度为75%。
但存在15%人群天生对检测无反应。
MAT检测(肥大细胞活化试验)
可用冷冻血清来激活培养的原代人血源性肥大细胞。
在花生过敏诊断中比BAT更准确。
重复检测结果高度一致(组内相关性:MAT 0.96 VS BAT0.43)。
新的诊断方法包括:
评估食物过敏原特异性B和T细胞
外周血中的过敏原特异性B和T细胞由于其稀缺性而历来难以分离。由于技术的进步,这些罕见的细胞现在可以通过几种方法来识别。
关于T细胞,这些方法包括:
a)用所选抗原或肽体外刺激PBMC,然后通过表达特异性活化标志物经由流式细胞术鉴定活化的T细胞;
b)用重组肽-MHC(pMHC)复合物离体染色T细胞。pMHC四聚体或多聚体技术也可用于鉴定变应原特异性B细胞。
多组学研究
包括基因组学、表观基因组学、转录组学、蛋白质组学、代谢组学、微生物组学和免疫组学在内的组学科学有望成为研究过敏性疾病(包括IgE-FA)的高通量方法。需要多组学方法来全面识别生物标志物,如基因,蛋白质和/或代谢产物,可以提高IgE-食物过敏诊断和预后的准确性。
此外,非常需要鉴定可预测IgE-食物过敏反应严重程度的生物标志物。特别令人感兴趣的是血小板活化因子乙酰水解酶(PAF-AH)。之前的研究已经证实,PAF-AH可以通过灭活PAF来预防过敏级联反应的进展。
肠道菌群检测
通过高通量测序技术获得菌群组成和功能数据,结合机器学习模型(如随机森林、神经网络)识别过敏相关特征。肠道菌群检测报告菌群失衡程度、关键菌群丰度及代谢物水平,提示过敏风险。
干预后复查菌群,观察过敏症状是否缓解,验证菌群与过敏的因果关系。
该方法是非侵入性的,且可以早期预警,因为很多时候菌群失衡可能早于过敏症状出现。通过个性化干预,指导益生菌、膳食调整等精准治疗。
肠道菌群检测可作为食物过敏的辅助诊断工具,为个性化治疗提供依据。可以结合临床传统方法(如食物激发试验)综合判断,通过连续检测评估过敏风险和干预效果,整合IgE检测、皮肤点刺试验和菌群数据,提高准确性。
1. 当前的食物过敏治疗方式
目前,食物过敏没有治愈方法,治疗的核心是避免接触过敏原。如果意外接触导致过敏反应,通常使用肾上腺素和抗组胺药进行处理。
由于食物过敏带来的严重健康和经济负担,科学界投入了大量资源研究新的治疗方法。
2. 预防的转变:从回避到早期接触
过去建议高过敏风险的婴儿(如父母有过敏史)避免接触过敏性食物,比如花生。
但后来研究发现,在婴儿早期引入过敏性食物(如花生)反而可以降低过敏风险。这项发现改变了过敏预防的建议,也激发了对免疫疗法的研究热情。
3. 免疫疗法的探索
免疫疗法的目标是通过逐步改变免疫系统的反应,让身体对过敏原“习惯”并耐受。方法包括:
其中,口服免疫疗法(OIT)效果最好,但也存在风险。比如,患者可能会出现轻微不适(如口痒、肚子痛),甚至更严重的过敏反应(如全身性过敏或嗜酸性食管炎)。
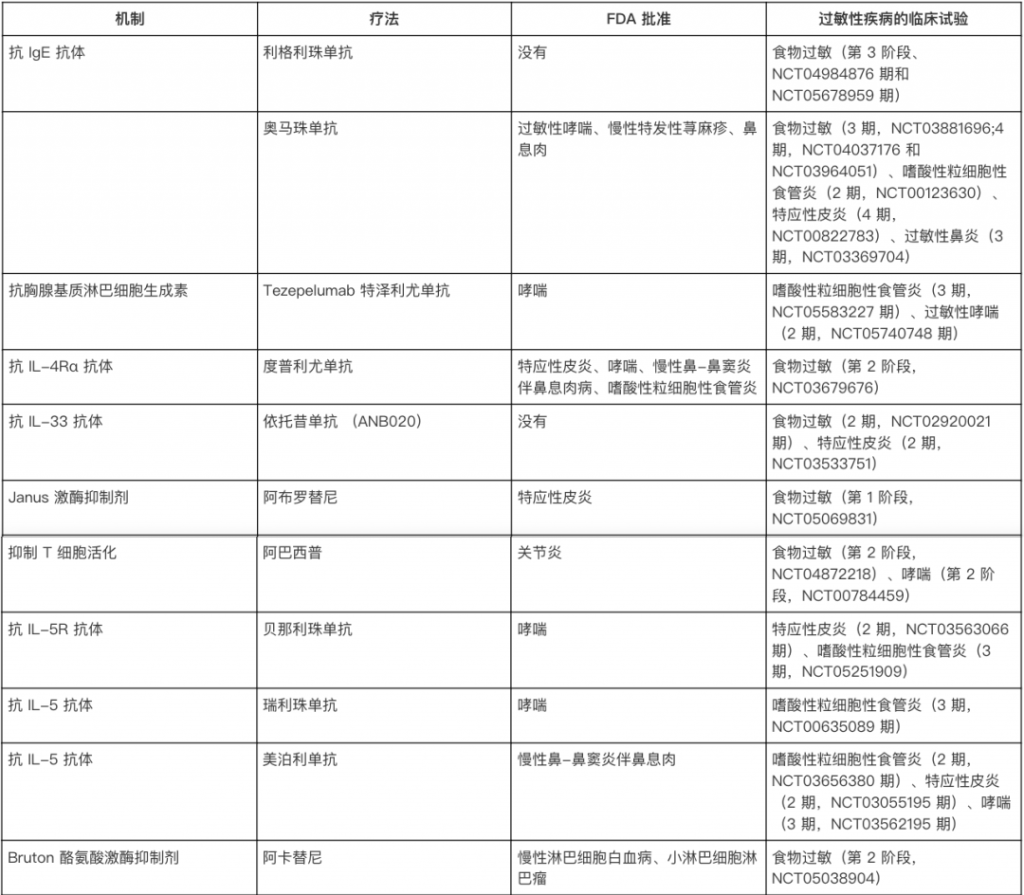
doi.org/10.1146/annurev-immunol-090122-043501
4. 辅助治疗:提高疗效,减少副作用
为了让免疫疗法更安全有效,科学家正在研究辅助治疗:
此外,新的治疗IgE-FA包括疫苗、纳米颗粒、Janus激酶(JAK)和布鲁顿的酪氨酸激酶抑制剂。
5. 基于微生物群的干预
研究发现,肠道中的某些细菌和它们的代谢产物(如丁酸盐)可以调节免疫系统,帮助身体更好地耐受过敏原。下列措施可以在调节肠道菌群的基础上干预食物过敏。
饮 食
增加膳食纤维
高纤维饮食(如全谷物、蔬菜、水果)可促进双歧杆菌、乳酸菌等有益菌增殖,增加短链脂肪酸的生成,抑制促过敏的Th2免疫反应。
举例:
菊粉(如洋葱、大蒜):增加双歧杆菌。
果胶(如苹果、柑橘):改变厚壁菌门与拟杆菌门的比例,增加血清和粪便中SCFA的含量,并通过损害树突状细胞功能来预防炎症的发展。
高纤维摄入通过重塑肠道微生物群和增加SCFA水平,特别是乙酸盐和丁酸盐水平,保护小鼠免受花生过敏。此外,这种保护作用取决于SCFA的受体GPR43和GRP109A,因为缺乏其中一种的小鼠表现出更严重的食物过敏。
减少高脂高蛋白饮食
过多动物蛋白和脂肪可能促进拟杆菌属等菌群占优,增加炎症风险,间接诱发过敏。建议适量摄入,平衡植物蛋白(如豆类)。
高脂饮食诱导的肠道菌群变化也被证实可以诱导食物过敏。
一项研究显示,高脂饮食通过增加Ruminococcaceae(梭菌目)、Desulfovibrionaceae(δ-变形菌纲)和Rikenellaceae(拟杆菌纲)的相对丰度,同时减少Muribaculaceae和Prevotellaceae的丰度来诱导食物过敏。
增加优质脂肪
ω-3脂肪酸,ω-3主要来自海洋来源(如鱼油、藻类)和某些植物(如亚麻籽):通过抑制树突状细胞(DCs)的激活、抑制CD4 T细胞的增殖和活化、减少促炎因子、降低IgE水平以及抑制肥大细胞脱颗粒,从而减轻食物过敏。
增加膳食多酚
多酚是次生植物代谢产物,富含水果、蔬菜、谷物、咖啡和茶。非结合多酚通过肠道菌群调节、紧密连接蛋白表达和 β-防御素分泌来缓解食物过敏。
可可多酚:
研究表明,富含可可多酚的饮食可以减少厚壁菌门和变形菌门,增加Tenericutes和蓝藻门(Cyanobacteria),从而抑制特定抗体和肠道IgA的合成,有助于减少过敏反应。
矢车菊素-3-O-葡萄糖苷(Cyanidin-3-O-glucoside):
通过增加有益菌(如乳酸杆菌和Odoribacter)和减少有害菌(如幽门螺杆菌和Turicibacter)来上调紧密连接蛋白的表达,促进分泌型IgA和β-防御素的分泌,并平衡Th1/Th2水平,有助于增强肠道屏障功能,减少过敏原的渗透,从而减轻食物过敏症状。
槲皮素(Quercetin):
槲皮素具有抗氧化、抗炎和抗癌活性。它可以通过与卵清蛋白(OVA)结合,减少OVA的致敏性,并降低特异性免疫球蛋白水平,从而减轻过敏反应。
咖啡酸和表儿茶素没食子酸酯(Epigallocatechin-3-gallate, EGCG):
与乳清蛋白结合后,可以减轻乳清蛋白引起的口服致敏反应,降低小鼠血清中特异性抗体和mMCP-1水平,并减少体外CD4 T细胞的增殖,有助于减少乳清蛋白引起的过敏反应。
益生菌
双歧杆菌(Bifidobacterium)
乳杆菌(Lactobacillus)
丁酸梭菌(Clostridium butyricum)
混合益生菌
注意:
益生元
通过特定益生元干预食物过敏的机制主要是调节肠道菌群,促进短链脂肪酸生成,抑制过敏相关炎症反应。以下为具体益生元及研究证据:
临床试验显示,补充该组合可显著降低高风险婴儿食物过敏发生率,可能与促进双歧杆菌生长有关。
2’-岩藻糖基乳糖(2’-FL)和乳糖-N-新四糖(LNnT):添加到配方奶粉中可缓解牛奶蛋白过敏(CMA),降低IgE水平和炎症因子(如IL-4、IL-6)。
乳-N-岩藻五糖III(LNFP III):摄入量高的婴儿CMA风险更低。
动物实验表明,母体补充可诱导免疫耐受,降低后代小麦过敏风险。
多不饱和脂肪酸(PUFA)等可能减少儿童食物致敏风险。
合生元
合生元是一种包含活菌(益生菌)和宿主微生物选择性利用的底物(益生元)的混合物,能够为宿主带来健康益处。
在一项多中心随机对照试验(RCT)中,研究了含有短双歧杆菌M-16V和低聚果糖(scGOS/lcFOS)的氨基酸配方(AAF-S)对IgE介导的牛奶过敏(CMA)婴儿的安全性。
结果显示,与普通氨基酸配方(AAF)相比,AAF-S在控制过敏症状和促进正常生长方面同样有效,但在减少感染、用药次数和住院率方面效果更好。具体数据如下:AAF-S组婴儿的感染发生率显著降低、使用的药物更少、住院率显著降低(8.8% vs. 20.2%,p = 0.036)。
粪便微生物组分析显示,AAF-S组婴儿的双歧杆菌丰度显著增加,而Eubacterium rectale和C. coccoides的丰度显著降低。
代谢产物变化:AAF-S组婴儿的粪便中乙酸和L-乳酸水平显著升高,粪便pH值显著降低。
粪菌移植
最近,一项小鼠模型研究表明,FMT抑制了特应性皮炎小鼠中OVA诱导的过敏反应。
除了恢复肠道微生物群外,FMT还降低了IgE水平;受监管的Tregs;肥大细胞、嗜酸性粒细胞和嗜碱性粒细胞减少;提高了SCFA的含量;恢复Th1/Th2平衡。
与其他方法相比,FMT是一种相对简单的治疗策略,可以改变人体肠道微生物群;然而,迄今为止,这项研究还不够充分,需要开展大量工作来提高我们对用FMT治疗食物过敏的理解。
中草药
中药因其低成本、高安全性以及高生物活性,近年来在食物过敏治疗中受到越来越多的关注。虽然传统中医中没有“食物过敏”的具体术语,但一些中药方剂在现代研究中显示出对食物过敏的潜在治疗效果。
食物过敏草药配方-2(FAHF-2):
来源:FAHF-2是从传统的“乌梅丸”(Wu Mei Wan)中开发而来的。
临床研究:在一项多中心、双盲、随机、二期临床试验中,68名12-45岁的食物过敏患者每天三次服用FAHF-2或安慰剂,持续六个月。结果显示,FAHF-2安全且耐受性良好。
免疫调节作用:FAHF-2能够显著抑制外周血单个核细胞(PBMCs)产生的IL-5,并增加IL-10和调节性T细胞(Tregs)的生成,显示出良好的免疫调节效果。
改进形式:由于FAHF-2的剂量较大,研究者开发了两种改进形式:丁醇纯化的FAHF-2(BF2)和乙酸乙酯及丁醇纯化的FAHF-2(EBF2)。在花生过敏的小鼠模型中,EBF2显示出很强的抑制IgE产生的能力,被认为是对花生过敏最有潜力的治疗药物。
尽管中药在治疗过敏性疾病中被广泛应用,但关于食物过敏的临床研究样本量小,且研究受限,需要进一步验证中药在食物过敏治疗中的效果。
从概念上讲,人类食物供应中的任何蛋白质都可能是潜在的过敏原,因此建立“无过敏原食品”体系不现实。由于不同个体的免疫系统对相同的过敏原可能会有不同的反应,因此很难对食物过敏做出普遍适用的定义。
现有诊断工具(如特异性IgE检测)可靠性有限,过敏原结构、加工方式及食物基质相互作用均影响致敏性。
引起个体过敏反应所需的最小量(阈值)也取决于个体的敏感性。大多数过敏性食物的阈值尚未确定,导致警示标签(如“可能含”)难以精准保护敏感人群。 需开发特异性强、灵敏度高的检测方法,并基于主要过敏食物(如牛奶)建立分级阈值标准——从鉴定关键过敏原及其表位入手,明确检测目标。
肠道菌群可能通过调节免疫耐受影响过敏风险。未来可探索菌群检测(如特定菌群丰度与过敏表型关联)作为辅助诊断工具,或通过益生菌等多种干预手段重塑菌群平衡,降低致敏性。
协同策略:
整合免疫学、微生物组学与食品加工技术,推动从“一刀切”警示转向动态风险评估,实现过敏防控的精准化与人性化。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献:
Iweala OI, Nagler CR. The Microbiome and Food Allergy. Annu Rev Immunol. 2019 Apr 26;37:377-403.
Januszkiewicz, Emilia, et al. “The importance of the gut microbiome in the development of allergic diseases.” Alergologia Polska-Polish Journal of Allergology 10.3 (2023): 202-209.
Venter, Carina. “Immunonutrition: Diet diversity, gut microbiome and prevention of allergic diseases.” Allergy, Asthma & Immunology Research 15.5 (2023): 545.
Jiachen Liang, Baodong Zheng, Yi Zhang, Hongliang Zeng, Food allergy and gut microbiota, Trends in Food Science & Technology, Volume 140, 2023, 104141, ISSN 0924-2244
Farnetano M, Carucci L, Coppola S, Oglio F, Masino A, Cozzolino M, Nocerino R, Berni Canani R. Gut microbiome features in pediatric food allergy: a scoping review. Front Allergy. 2024 Sep 25;5:1438252.

谷禾健康

粪球菌属(Coprococcus)
是厚壁菌门毛螺菌科重要成员,是肠道重要的菌属,菌种大部分从粪便中分离出来,积极发酵碳水化合物,是和Faecalibacterium prausnitzii 一样,丁酸的重要生产者之一。粪球菌可用作评估人体胃肠道健康状况的微生物生物标志物,Coprococcus属的细菌可能有助于抑制免疫反应,降低过敏反应的严重程度;Coprococcus的细菌有助于对 ACE 抑制剂产生耐药性,ACE 抑制剂是用于治疗高血压的主要药物类别之一。此外,该菌还与抑郁症,幼儿语言发育、便秘、睡眠以及慢性疲劳等相关。
细胞球状,直径0.8~1.5μm,有时椭圆形,成对或短链,革兰氏阳性,不运动,严格厌氧。最适生长温度37℃,多数物种分离于人的肠道和粪便,很少从人类临床标本中分离出来表明该菌主要定植于健康人的肠道。
需要注意的是,该菌需要与非常耐药且容易引起感染的肠球菌属(Enterococcus )区分开来,他们翻译的中文名虽然只差一个字,但是肠球菌能引发感染,以耐药性出名。
而粪球菌(Coprococcus)是厌氧球菌属,虽然它们都是人类粪便菌群的一部分。但是粪球菌积极发酵碳水化合物,产生丁酸和乙酸以及甲酸或丙酸和/或乳酸等。
在人类粪便中发现的最多产丁酸盐的细菌是属于梭菌簇 IV 和 XIVa 的对氧高度敏感的厌氧菌。其中包括许多以前未描述的与真杆菌属、罗斯氏菌属、普拉梭菌以及本文的粪球菌属。
该菌属主要至少包括以下物种:
Coprococcus catus (species)
Coprococcus comes (species)
Coprococcus eutactus (species)
Coprococcus sp. DJF_CR49 (species)
Coprococcus sp. L2-50
此属的模式种为(Coprococcus eutactus)
不同碳水化合物上的 Coprococcus 物种的生长不太一样,其中:
Coprococcus eutactus的丰度与肠道中更大的细菌基因丰富度有关,β-葡聚糖是与Coprococcus eutactus相关的人类肠道细菌的主要生长底物,其代谢产生丁酸盐和甲酸盐或乳酸。
此外,这两种菌可以利用广泛的碳水化合物底物:
Coprococcus. eutactus
Coprococcus sp. L2-50
但是,Coprococcus comes仅在葡萄糖上表现出良好的生长,而Coprococcus catus 仅在葡萄糖上表现出非常有限的生长,Coprococcus catus代谢产生丁酸盐和丙酸盐。
细菌互相作用或共同在一个生态位生存对整个菌群结构和宿主健康有很重要的影响,例如共现关系(例如,赋予抗生素耐药性)、共生关系(例如,交叉喂养其他成员产生的化合物)和协同作用。
研究报告Coprococcus和Roseburia之间的共现关系的支持,两者都属于Lachnospiraceae家族,表明系统发育密切相关的属也可能具有共现关系,而不是由于它们相似的栖息地偏好而总是相互竞争。然而,由于对人类肠道微生物群落的机理了解不足,因此应谨慎解释肠道细菌之间的生态联系。
此外还发现该菌属在生物化学上与瘤胃球菌密切相关。
值得注意的是,一项来自广东肠道微生物组计划的大规模队列数据,分析得出脱硫弧菌(DSV) 经常在人体肠道中发现,DSV的相对丰度与包括Oscillospira Coprococcus , Ruminococcus , Akkermansia,Roseburia , Faecalibacterium 和 Bacteroides呈正比。
人类肠道微生物群的物种组成对于弯曲杆菌感染的定植抗性很重要。相比于感染弯曲杆菌的人群,健康人群中Coprococcus丰度更好,表明高水平的Coprococcus有利于抵抗弯曲杆菌。
2019年比利时通过一项1070抑郁症病人的验证集小组发现,即使在控制了抗抑郁药的作用后,抑郁症患者的粪球菌属(Coprococcus)和小杆菌属(Dialister)细菌都已耗尽。
还发现Coprococcus具有与多巴胺相关的生物途径,多巴胺是一种会影响心理健康的神经递质。该研究的粪便宏基因组的肠脑模块分析确定,多巴胺代谢物 3,4-二羟基苯乙酸的微生物合成潜力与心理生活质量呈正相关,并表明微生物产生的γ-氨基丁酸在抑郁症中的潜在作用。
研究将重度抑郁症 (MDD) 患者的粪便微生物群移植 (FMT) 移植到大鼠体内,发现:相比较与移植健康粪便的大鼠, FMT-MDD大鼠瘤胃球菌科和毛螺菌属升高,而粪球菌属则被耗尽,从机理上表明粪球菌的缺乏会与抑郁症的关系。
另外一项对82 名抑郁的人随机分配接受多菌株益生菌加生物素治疗或生物素加安慰剂治疗 28 天。发现28天后,与接受安慰剂治疗的个体相比,精神症状的改善明显更高;同时粪便16s测试表明相比于安慰剂组,益生菌组的多样性高,Coprococcus 显著增加。
该研究的益生菌干预组为:包括九种菌株,双歧杆菌W23、乳酸双歧杆菌W51、乳酸双歧杆菌W52、嗜酸乳杆菌W22、干酪乳杆菌W56、副干酪乳杆菌W20、植物乳杆菌W62、唾液乳杆菌W24 和乳酸乳球菌W19。此外,益生菌产品中还添加了 125 毫克 D-生物素(维生素 B7)、30 毫克马尾草、30 毫克鱼胶原蛋白和 30 毫克角蛋白加基质。
帕金森病是一种神经退行性疾病,其特征是错误折叠的 α-突触核蛋白的细胞内聚集体沿脑轴聚集。一些研究报告了肠道菌群失调与帕金森病之间的关联,尽管因果关系仍有待确定。帕金森病组中最显著的变化突出了细菌类群的减少,特别是在毛螺菌科家庭和关键成员,例如丁酸弧菌属、粪球菌属(Coprococcus)和Blautia。
另外的研究发现帕金森病患者的结肠中有 α-突触核蛋白 (α-Syn) 聚集,并有结肠炎症的证据。PD患者的黏膜和粪便微生物群与对照组相比有显著差异,粪便样本比乙状结肠黏膜有更显著的差异。在属的分类水平上,来自 Blautia、Coprococcus和 Roseburia 属在对照组的粪便中明显多于 PD 患者。
此外,还有研究指出其他神经退行性疾病 (NDs)包括阿尔茨海默病 (AD)、多系统萎缩 (MSA)、多发性硬化症 (MS)、视神经脊髓炎(NMO) 和肌萎缩侧索硬化症 (ALS)中Faecalibacterium 、Coprococcus、Blautia 、 Prevotella减少。
一项针对136名3岁乌干达儿童粪便样本研究表明,产丁酸盐的肠道细菌Coprococcus eutactus可以作为乌干达农村三岁儿童语言发展的预测因子。
该研究模型指出3岁时语言发展高于平均水平的儿童,在其2岁时粪便中有相对较高水平的Coprococcus eutactus,语言发育低的儿童中Coprococcus 属平均丰度低,而且该研究表明早期获得产丁酸盐Coprococcus eutactus对语言发展的重要性,而在在语言发育受损的儿童中,耐氧物种的优势增加。
湿疹的严重程度一般与微生物群多样性和产生丁酸盐的细菌的丰度呈负相关,尤其产生丁酸盐的Coprococcus eutactus相关细菌的降低。我们数据库数据和案例也显示过敏和哮喘的儿童Coprococcus丰度很低或显著低于健康儿童。
自闭症谱系障碍 (ASD) 是世界范围内普遍存在的神经生物学疾病,原因复杂。多项研究表明自闭症儿童Coprococcus、Prevotella、Blautia 、Lachnospiraceae和Ruminococcaceae属的丰度较低。
睡眠在儿童的身心发展中发挥着重要作用。一项针对学龄前儿童(4.37 ±0.48 岁,n=143)的睡眠与肠道微生物群之间的关系研究表明拟杆菌中双歧杆菌的相对丰度较高,在睡眠效率较高和入睡后醒来时间较低(LDA 评分 >2)的儿童中较高。相比之下,包括 Blautia 和 Coprococcus 在内的一些毛螺菌科成员分别与较短的夜间睡眠时间和较低的效率相关。
慢性便秘是全球最常见的胃肠道疾病之一。然而,其发病机制在很大程度上仍不清楚。在便秘患者的肠道微生物组中,产生丁酸盐的 Roseburia、Coprococcus和 Faecalibacterium 属的丰度很低。不存在便秘状态的特定微生物生物标志物,整个肠道微生物群在都可能发挥作用。
此外,功能性便秘(FC)个体的肠道微生物群被证明缺乏属于拟杆菌属、罗斯氏菌属和 Coprococcus 的成员。与对照相比,FC 相对应的微生物组显示出高丰度的参与制氢、产甲烷和甘油降解的基因。
新出现的证据表明,肠道菌群失调与慢性肾脏病 (CKD) 的发病机制有关,其潜在机制涉及粘膜和/或系统免疫或代谢紊乱。
一项纳入1436 名慢性肾病的meta分析显示终末期肾病 (ESRD)患者中普氏菌属、粪球菌属、巨单胞菌属和粪杆菌属的丰度较低。
虚弱是一种常见的老年综合征,与不良健康后果的风险相关。从 176 名韩国老年人的粪便样本中获得的 16S rRNA 基因测序数据研究了虚弱测量与肠道微生物组的关联。发现在较虚弱的个体中,普氏菌和 Coprococcus eutactus的丰度减少。
先兆子痫是一种以高血压和多个器官功能障碍为特征的妊娠特异性疾病,与母体和胎儿并发症有关。
对 213 名孕妇的粪便样本进行 16S rRNA 基因扩增子测序,调查了妊娠 28 周时发生迟发性(>34 孕周)先兆子痫 (DPE) 的女性的肠道微生物群组成发现产丁酸的丰富粪球菌属在 DPE 中显著减少。产生丁酸盐的细菌特别是Coprococcus spp. 丰度的减少可能会增加孕妇患先兆子痫的风险。
此外,研究发现喹那普利在降低肠道菌群负荷较低的高血压大鼠的血压方面更有效。当他们分析肠道微生物群的组成时,Coprococcus 属成为一个重要的参与者。
早期乳腺癌 (BC) 患者和健康对照者的粪便微生物群分析对比表明早期 BC 的患者中微生物多样性的减少、Odoribacter、Butyricimonas和Coprococcus 的相对丰度降低的趋势。
慢性广泛性肌肉骨骼疼痛 (CWP) 是纤维肌痛的特征性症状,已被证明与肠道微生物组的改变有关。在 CWP 病例中,Coprococcus的物种显著减少 。
维生素 D 会增加瘤胃球菌科、阿克曼氏菌、粪杆菌和粪球菌的增加。
在整个人群中,Coprococcus 的变化与体重、总胆固醇和甘油三酯的变化呈正相关,与 HDL 胆固醇呈负相关。
银屑病是一种常见的慢性复发性皮炎。瘤胃球菌科、 Coprococcus_1属和Blautia属的丰度随着银屑病的改善而降低( p< 0.05),这已被证明在银屑病中显著增加。
但是也有研究指出观察到 Coprococcus属减少。这些研究队列都只有几十例,需要更大队列验证。
小檗碱和二甲双胍都是源自草药的成熟药剂,对包括糖尿病在内的多种疾病具有偶然的有益作用。使用二甲双胍或小檗碱干预 db/db 小鼠的肠道微生物群,增加产短链脂肪酸的细菌(例如,丁酸单胞菌属、粪球菌属、瘤胃球菌属)的数量。
补充维生素 D 对 26 种维生素 D 缺乏(25-羟基维生素 D (25(OH)D) ≤50 nmol/L)、超重或肥胖(BMI ≥25 kg/m 2) 其他健康的成年人。
一项研究是 2014 年至 2016 年间进行的基于社区的双盲随机临床试验的辅助研究。参与者在基线和 100,000 国际单位 (IU) 负荷剂量的胆钙化醇之后提供粪便样本,然后每天 4000 IU 或匹配安慰剂 16周。与25(OH)D <50 nmol/L的个体相比,25(OH)D >75 nmol/L 的个体的粪球菌属丰度增高。
关节和肠道炎症之间的密切关系早已为人所知。20 名受肠病性关节炎影响的患者,他们从未接受过生物药物治疗,在基线时和治疗 6 个月后接受了 TNFi 治疗。所有患者都遵循地中海饮食。治疗后6个月毛螺菌科和粪球菌属显著增加。
甘草甜素 (GL) 是一种三萜糖苷,在各种生物活性中发挥重要作用,包括抗病毒和抗肿瘤免疫反应。菌群分析表明 GL 降低Akkermansia、Sutterella、 Prevotella和Coprococcus 。
紫薯中提取的抗性淀粉 (RS) 有利于增加Coprococcus的丰度。
胞外多糖 (EPS) 是合成并存在于双歧杆菌表面的碳水化合物聚合物。由于其在食品、生物技术、化妆品和医药等多个领域的潜在应用,双歧杆菌 EPS 促进了 Coprococcus 属的生长。与淀粉组相比,EPS 还增加了丙酸的产生。
甘草甜素 (GL) 是一种三萜糖苷,在各种生物活性中发挥重要作用,包括抗病毒和抗肿瘤免疫反应。菌群分析表明 GL 降低Akkermansia、Sutterella、 Prevotella和Coprococcus 。
主要参考文献:
Valles-Colomer M, Falony G, Darzi Y, Tigchelaar EF, Wang J, Tito RY, Schiweck C, Kurilshikov A, Joossens M, Wijmenga C, Claes S, Van Oudenhove L, Zhernakova A, Vieira-Silva S, Raes J. The neuroactive potential of the human gut microbiota in quality of life and depression. Nat Microbiol. 2019 Apr;4(4):623-632. doi: 10.1038/s41564-018-0337-x. Epub 2019 Feb 4. PMID: 30718848.
Vascellari S, Palmas V, Melis M, Pisanu S, Cusano R, Uva P, Perra D, Madau V, Sarchioto M, Oppo V, Simola N, Morelli M, Santoru ML, Atzori L, Melis M, Cossu G, Manzin A. Gut Microbiota and Metabolome Alterations Associated with Parkinson’s Disease. mSystems. 2020 Sep 15;5(5):e00561-20. doi: 10.1128/mSystems.00561-20. PMID: 32934117; PMCID: PMC7498685.
Keshavarzian A, Green SJ, Engen PA, Voigt RM, Naqib A, Forsyth CB, Mutlu E, Shannon KM. Colonic bacterial composition in Parkinson’s disease. Mov Disord. 2015 Sep;30(10):1351-60. doi: 10.1002/mds.26307. Epub 2015 Jul 16. PMID: 26179554.
Naderpoor N, Mousa A, Fernanda Gomez Arango L, Barrett HL, Dekker Nitert M, de Courten B. Effect of Vitamin D Supplementation on Faecal Microbiota: A Randomised Clinical Trial. Nutrients. 2019 Nov 27;11(12):2888. doi: 10.3390/nu11122888. PMID: 31783602; PMCID: PMC6950585.
Arango L, Barrett HL, Dekker Nitert M, de Courten B. Effect of Vitamin D Supplementation on Faecal Microbiota: A Randomised Clinical Trial. Nutrients. 2019 Nov 27;11(12):2888. doi: 10.3390/nu11122888. PMID: 31783602; PMCID: PMC6950585.
Scher JU, Ubeda C, Artacho A, Attur M, Isaac S, Reddy SM, Marmon S, Neimann A, Brusca S, Patel T, Manasson J, Pamer EG, Littman DR, Abramson SB. Decreased bacterial diversity characterizes the altered gut microbiota in patients with psoriatic arthritis, resembling dysbiosis in inflammatory bowel disease. Arthritis Rheumatol. 2015 Jan;67(1):128-39. doi: 10.1002/art.38892. PMID: 25319745; PMCID: PMC4280348.
Sun C, Chen L, Yang H, Sun H, Xie Z, Zhao B, Jiang X, Qin B, Shen Z. Involvement of Gut Microbiota in the Development of Psoriasis Vulgaris. Front Nutr. 2021 Nov 22;8:761978. doi: 10.3389/fnut.2021.761978. PMID: 34881280; PMCID: PMC8646027.
Andreo-Martínez P, García-Martínez N, Sánchez-Samper EP, Martínez-González AE. An approach to gut microbiota profile in children with autism spectrum disorder. Environ Microbiol Rep. 2020 Apr;12(2):115-135. doi: 10.1111/1758-2229.12810. Epub 2019 Nov 27. PMID: 31713352.
Mancabelli L, Milani C, Lugli GA, Turroni F, Mangifesta M, Viappiani A, Ticinesi A, Nouvenne A, Meschi T, van Sinderen D, Ventura M. Unveiling the gut microbiota composition and functionality associated with constipation through metagenomic analyses. Sci Rep. 2017 Aug 29;7(1):9879. doi: 10.1038/s41598-017-10663-w. PMID: 28852182; PMCID: PMC5575163.
Yarullina DR, Shafigullin MU, Sakulin KA, Arzamastseva AA, Shaidullov IF, Markelova MI, Grigoryeva TV, Karpukhin OY, Sitdikova GF. Characterization of gut contractility and microbiota in patients with severe chronic constipation. PLoS One. 2020 Jul 17;15(7):e0235985. doi: 10.1371/journal.pone.0235985. PMID: 32678865; PMCID: PMC7367488.
Lim MY, Hong S, Kim JH, Nam YD. Association Between Gut Microbiome and Frailty in the Older Adult Population in Korea. J Gerontol A Biol Sci Med Sci. 2021 Jul 13;76(8):1362-1368. doi: 10.1093/gerona/glaa319. PMID: 33437992.

谷禾健康
乳酸菌属益生菌是使用最广泛的益生菌之一。罗伊氏乳杆菌( L. reuteri ) 是一种经过充分研究的益生菌,可以在大量哺乳动物中定殖。
罗伊氏乳杆菌是一种革兰氏阳性杆状细菌,已在各种食物中发现,尤其是肉类和奶制品。在人类中,罗伊氏乳杆菌存在于不同的身体部位,包括胃肠道、泌尿道、皮肤和母乳。罗伊氏乳杆菌的丰度因个体而异。
可能的优势
● 可能促进皮肤光泽和头发浓密
● 可能有助于对抗感染
● 可能减少炎症并加强免疫
● 可能会改善肠道健康(减少 IBS 和 IBD 症状)
● 可能降低胆固醇
可能的副作用
● 可能对组胺不耐受的人不利
● 可能导致某些人体重增加
● 缺乏大规模临床研究
● 长期补充的安全性未知
罗伊氏乳杆菌(Lactobacillus reuteri)名字来自德国微生物学家 Gerhard Reuter,他在1960 年代在人类肠道和粪便样本中发现了它。1960 年代被发现时,罗伊氏乳杆菌自然存在于 30-40% 的人体内,现在大约降至10-20%。科学研究者将这种下降与生活方式的改变联系起来。我们不像以前那样吃发酵食品,如酸菜,而是使用防腐剂,这会杀死食物和体内的细菌。
罗伊氏乳杆菌在发酵过程中能够产生葡聚糖和果聚糖。其中一种葡聚糖,α-1,4/1,6 葡聚糖,分子量为 40 MDa,支化度约为 16%,似乎是一种饱腹感诱导剂,对胰岛素和血糖水平有良好的影响在人类。葡聚糖不会在胃和空肠中降解,而是在结肠中完全降解。由于其慢淀粉特性,这种葡聚糖可能是烘焙应用中一种促进健康的成分。
不同菌株的Lactobacillus reuteri已被证明具有不同的生理作用。例如,Lactobacillus reuteri DSMZ 17648用于治疗幽门螺杆菌(H. pylori),而Lactobacillus reuteriNCIMB 30242 用于治疗高胆固醇。
但是,罗伊氏乳杆菌补充剂尚未获得批准用于医疗用途,而且有的益处和副作用缺乏可靠的临床研究。法规制定了补充剂的制造标准,但不保证它们是安全或有效的。
大多数关于Lactobacillus reuteri的研究是在动物或细胞中进行的。临床研究很少,而且大多数是低质量的、小规模的或可能存在偏见的。此外,使用的确切菌株因不同研究而异。
尽管罗伊氏乳杆菌在人类中是正常的,但并不是每个人的胃肠道中都有它。口服补充剂可以增加和补充胃肠道罗伊氏乳杆菌,然而它不一定会长期留在那里。
同样,罗伊氏乳杆菌的良好来源是乳制品和肉类,素食者和大多数素食者都避免食用这些食品,因此补充剂很重要。在母乳喂养时服用罗伊氏乳杆菌补充剂的女性更有可能将这些有益细菌转移给婴儿。
为消化和吸收而建,胃肠系统的某些部位已发展为对微生物定植不利。这方面的例子可以在由小肠上部胃酸和胆汁盐引起的低 pH 条件下看到。因此,在胃肠道定植的第一步就是在这样的环境中生存。幸运的是,罗伊氏乳杆菌对低 pH 值和胆汁盐具有抵抗力。这种抗性被认为至少部分取决于其形成生物膜的能力。
谷禾健康

现如今,有过敏症状的宝宝越来越多,如何防治孩子过敏成了颇受关注的公共健康问题之一。
过敏的原因除了遗传因素外,还与宝宝肠道菌群失调,自身的免疫系统发育不成熟,环境因素等息息相关。
本文列举的最新研究进展,从过敏早期识别干预,耐药基因,食物过敏及其因果关联等方面,展示了微生物群如何在其中发挥作用,为儿童过敏的防治提供新思路。
新生儿的第一次大便可能揭示发生过敏的风险
微生物群的成熟与免疫系统的发育同时发生,两者都与一系列疾病有关,包括过敏、花粉热、哮喘和湿疹。
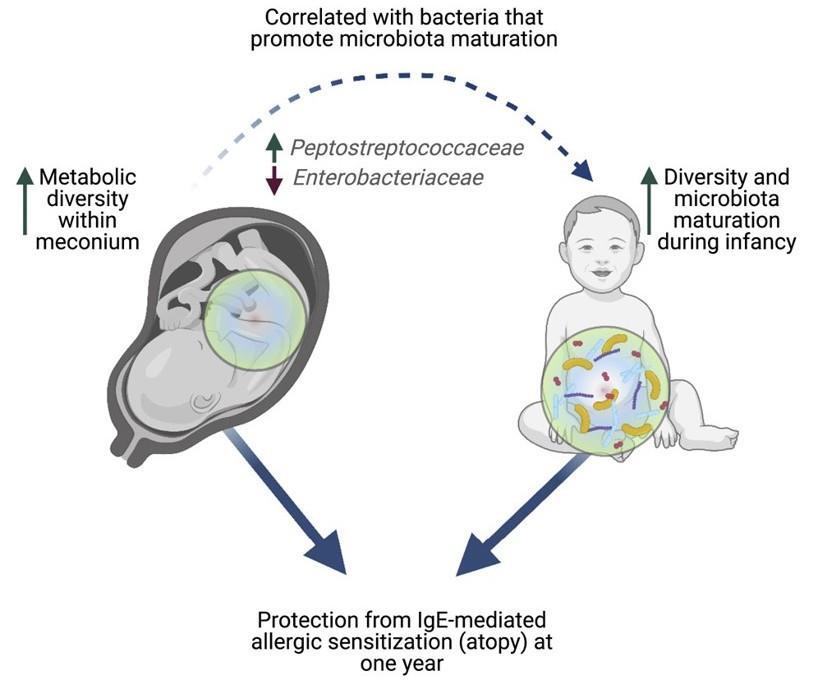
发表在Cell Reports Medicine 通过分析 100 名新生儿的粪便,研究人员发现婴儿第一次粪便的成分可以决定儿童在以后的生活中是否有可能患上过敏症和其他疾病。研究小组发现,缺乏特定分子与一年后过敏的风险增加有关。这些化学物质的减少与在微生物群成熟中起关键作用的细菌的变化有关。
Petersen Cet al., Cell Rep Med. 2021
新生儿的第一次粪便,称为胎粪。胎粪是一种粘稠的深绿色物质,在怀孕 16 周左右开始在胎儿肠道中形成,含有羊水、皮肤细胞以及婴儿摄入的其他物质和分子。
胎粪也是出生后在肠道中定殖的第一批微生物的最初“食物来源”。胎粪就像一个时间胶囊,揭示了婴儿在出生前接触过的东西。
过 敏
为了评估胎粪成分是否会影响以后发生过敏的风险,研究人员研究了新生儿第一次粪便中存在的代谢物。然后,当孩子们满一岁时,该团队进行了一项皮肤测试,以测量免疫系统的反应性。
分析表明,婴儿胎粪中不同类型的分子越少,孩子在出生后第一年内发生过敏的风险就越高。
一些代谢途径,包括那些涉及氨基酸代谢的途径,在后来出现过敏性疾病的婴儿的胎粪中最少。
与没有发生过敏反应的新生儿相比,在一岁时发生过敏反应的新生儿在出生时的胎粪代谢多样性降低。
早 期 干 预
接下来,研究人员分析了胎粪成分是否会影响肠道微生物群的成熟。胎粪“代谢组”较少的婴儿的细菌丰度平较水平低,如肠杆菌科,这在微生物群的成熟中起着关键作用。
最后,研究人员将有关胎粪和微生物群组成的信息与新生儿及其母亲的临床数据相结合,以准确预测婴儿是否会在 1 岁时出现过敏反应。
这项工作表明,健康的免疫系统和微生物群的发展实际上可能在孩子出生之前就开始了——这表明婴儿在子宫内接触的微小分子对未来的健康起着至关重要的作用。
研究人员说,调节子宫内关键代谢物的早期干预措施有助于促进微生物群和免疫系统的健康发育,从而预防过敏性疾病的症状。
这些发现可能有助于识别有患过敏症或哮喘风险的婴儿,并制定有助于预防这些疾病的早期干预措施。
参考文献:
Petersen C, Dai DLY, Boutin RCT, Sbihi H, Sears MR, Moraes TJ, Becker AB, Azad MB, Mandhane PJ, Subbarao P, Turvey SE, Finlay BB. A rich meconium metabolome in human infants is associated with early-life gut microbiota composition and reduced allergic sensitization. Cell Rep Med. 2021 Apr 29;2(5):100260.
婴儿的肠道微生物群包含数百个抗生素抗性基因
人类肠道微生物群已成为细菌的储存库,这些细菌含有帮助它们抵抗抗生素的基因。
发表在Cell Host & Microbe的一项研究通过分析丹麦 650 多名一岁儿童的粪便样本,发现婴儿的肠道细菌有数百个抗生素抗性基因。

谷禾健康
你知道吗?有一种菌群可改善人体免疫反应并有助于预防肠道疾病。还具有抑制过敏,降低胆固醇并改善皮肤健康的作用。它就是——长双歧杆菌Bifidobacterium longum。
接下来带你探索它的秘密……
定义发现
双歧杆菌是从六个不同的生态位中分离出来的,其中三个与人类和动物的肠道环境直接相关。例如:人、动物的肠道(牛,兔,鼠,鸡和昆虫)和口腔,而其他的则是污水,血液和食物,也可能是胃肠道污染的结果。
双歧杆菌广泛分布在为它们的后代提供有父母进行照料的活生物体中,例如:哺乳动物,鸟类和社交昆虫。到目前为止,尚未从其他动物(如爬行动物和鱼类)中分离出双歧杆菌。因此,它们的生态分布的重要原因可能是由亲代/照护者直接将双歧杆菌细胞传给后代。
长双歧杆菌是自然存在于人类胃肠道中的革兰氏阳性棒状细菌,是最早在婴儿通过产道时在肠道内定殖的细菌之一。这些细菌也被称为益生菌。婴儿双歧杆菌Bifidobacterium infantis和猪双歧杆菌Bifidobacterium suis 是长双歧杆菌的亚种。
结构代谢
双歧杆菌是革兰氏阳性,厌氧性和分支杆状细菌。它们也是非运动的和非孢子形成的。
双歧杆菌通过磷酸酮醇酶途径产生己糖代谢。果糖-6-磷酸磷酸酮醇酶(F6PPK)是其重要组成部分。
长双歧杆菌将糖发酵成乳酸,这有助于降低肠道的pH值。“它具有修复氧化损伤的酶的同系物,例如NADH氧化酶和NADH过氧化物酶。它还含有逆转氧化损伤的蛋白质和脂质,如:硫醇过氧化物酶,烷基过氧化氢还原酶(ahp C),肽甲硫氨酸亚砜还原酶。”
长双歧杆菌基因组存在编码各种专门用于分解寡糖的蛋白质。该菌在结肠中长期存在,是因为它能代谢宿主或其他肠道菌群吸收不良的底物。
1 增强免疫力
一项针对婴儿双歧杆菌的小型研究表明,婴儿双歧杆菌可起到预防脊髓灰质炎病毒的作用。婴儿双歧杆菌改善了实验志愿者的免疫反应。
我们知道从婴儿期开始肠道健康就关系到未来生活中与健康相关的状况和疾病危险因素。研究已将肠道菌群的改变与多种疾病联系起来,包括自身免疫性疾病,如腹腔疾病和1型糖尿病,代谢综合征,过敏,哮喘和炎症性肠病等。
多种因素可以促进肠道健康。健康的肠道菌群是支持肠道健康,改善免疫功能并可能降低某些疾病风险的因素之一。
研究人员认为,双歧杆菌对早期生命疾病的保护能力是通过产生短链脂肪酸(SCFA)和乳酸,通过特定的免疫刺激和肠道环境酸化来发挥作用。
长双歧杆菌还激发了45名接受过流感疫苗的住院的年迈患者的免疫功能。与其他知名的菌株相比,婴儿双歧杆菌在老年患者的血液中具有较强的免疫调节作用。
2 降低传染病
实验表明,长双歧杆菌通过微调炎症反应和加快肺恢复来保护小鼠免受肺炎诱发的死亡。婴儿双歧杆菌可以抑制小鼠轮状病毒感染,口服长双歧杆菌可以保护小鼠免受铜绿假单胞菌引起的肠道败血症的侵害,且大大提高了伤寒沙门氏菌感染小鼠的存活率。
用长双歧杆菌喂养的婴儿显示出呼吸道感染的比率较少。在27名接受流感疫苗的老年受试者中,长双歧杆菌补充剂减少了流感和发烧率。
3 减轻和治疗胃肠道感染
益生菌通常与抗生素结合使用,以降低胃肠道感染的风险并防止有益菌的死亡。此外,一些研究表明,用含有双歧杆菌的益生菌进行治疗可以通过减少腹泻来帮助治疗类似艰难梭菌的感染。
4 改善腹泻和便秘
肠易激综合征(IBS)通常以腹痛或不适为特征,并伴有大便次数和/或稠度变化,可能导致腹泻和/或便秘。
关于IBS的临床实践指南得出结论,根据一些随机临床对照试验,长双歧杆菌可以改善IBS患者的总体症状。
婴儿长双歧杆菌可以改善腹部疼痛/不适,腹胀,排便困难。
长双歧杆菌还降低了IBS小鼠的内脏超敏性,显著降低大鼠第一疼痛行为和总疼痛行为的内脏痛阈压。
美国家庭医师学会指出,“益生菌可减少抗生素相关性腹泻的发病率,减少所有因感染性腹泻的持续时间和疼痛的严重程度和患者腹胀。” 作用的有益程度取决于所使用的类型,配方和给定的量。
5 预防湿疹
许多研究表明,使用含有双歧杆菌菌株的益生菌在妊娠和哺乳期给予母亲以及婴儿,可以预防婴儿和儿童的湿疹。但当涉及湿疹治疗时,益生菌的有益用途是多样的,所以需要更多的研究来确定其益处。当给孩子进行任何补充之前,请应该先进行肠道菌群检测或咨询医生的建议。
6 减轻过敏
在柳杉花粉过敏患者中,摄入添加长双歧杆菌的酸奶或粉末可减轻主观症状并影响过敏的血液标志物。鼻症状,如瘙痒,鼻漏,堵塞以及喉咙症状往往可以得到缓解。

实验表明,双歧杆菌菌株减轻了小鼠的过敏性气道炎症和食物过敏症状。口服长双歧杆菌可抑制IgE水平并改善IgG2a / IgG1比例。它也增加了小鼠的Th1细胞因子并降低了Th2细胞因子的产生。长双歧杆菌平衡了Th1 / Th2反应并减轻了小鼠的β-乳球蛋白过敏性炎症。
7 减少胆固醇
长双歧杆菌降低了总胆固醇,特别是在中度高胆固醇血症患者中。长双歧杆菌补充剂可明显降低高胆固醇血症大鼠的总胆固醇,肝脂质沉积和脂肪细胞大小,并积极影响肝肾功能。
给大鼠喂食富含胆固醇的食物,并补充长双歧杆菌,结果发现,甘油三酯、低密度脂蛋白胆固醇(LDL-C)、超低密度脂蛋白(VLDL)胆固醇和丙二醛显著降低。
8 减轻精神分裂症
每天服用长双歧杆菌可减轻小鼠的精神分裂症饲养行为,降低静息时的血浆皮质酮水平以及犬尿氨酸与色氨酸的比率。
9 治疗焦虑和抑郁症
长双歧杆菌可以使感染性结肠炎小鼠焦虑样行为和海马脑源性神经营养因子(BDNF)正常化。
服用婴儿双歧杆菌可逆转抑郁症。长期服用婴儿双歧杆菌可保护大鼠免于因母体分离引起的压力而导致的抑郁症状。

目前已经有研究了长双歧杆菌对细胞水平的影响。这些可能反映长双歧杆菌在人体中的作用机制。
以下列举的均有研究文献支持。
炎性条件
● 降低的Th1相关的细胞因子(T-bet的,IL-2 ,和IFN-γ)和Th17相关的细胞因子(IL-12p40的,RORγt,IL-17A,IL-21,和IL-23),并增加了调节性T细胞-相关分子(Foxp3的,IL-10 ,和TGF-β)。
● 降低IL-1α,IL-1β,IL-6,IL-18,TNF-α的表达。
● IL-27升高。
● 降低CD80,CD40,CXCL1 ,CRP,iNOS的和抗微生物肽Reg3b和Reg3g 。
传染性条件
● 增加天然杀伤(NK)细胞活性。
● 血清IgA增加和IgG2a产生减少。
● IL-2,IL-1 2和IL-18升高。
● 降低IL-6和IL-8。
● TNF-α降低。
● 既增加了和减少IL-10,并降低和增加的IFN-γ
变态反应
● 减少IgE和改进了的IgG2a / IgG1的比。
● IgA增加。
● Th1细胞因子增加而Th2细胞因子产生减少。
● 降低IL-4和IL-5。
● 增加IL-10,IL-12和TGF-β。
● 增加或降低的IFN-γ。
● 抑制了MDC和TARC。
● CD4 + CD25 + Foxp3 + Treg细胞增加。
乳糜泻
● 降低TNF-α。
● NFκB增加。
● IL-10升高。
● 减少的CD3+ T,CD4+和CD4+ / Foxp3+细胞和增加的CD8+ T。
● MIP-1β升高。
下面具体以长双歧杆菌BB536为例,对长双歧杆菌的缓解过敏感染,调节代谢,调节免疫等作用进行详细阐述。
长双歧杆菌BB536与肠道微生物群协同作用,改善胃肠健康,调节宿主免疫稳态,缓解过敏性疾病和感染状况。
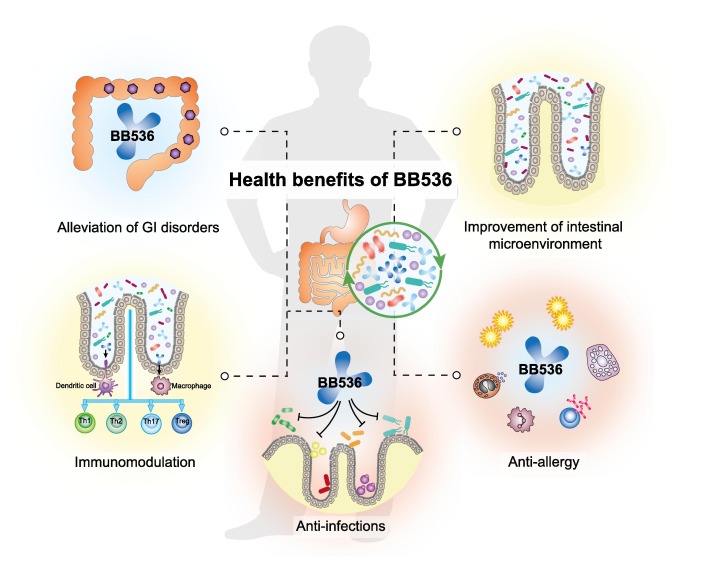
Wong C B, et al., Journal of Functional Foods, 2019
长双歧杆菌BB536通过与人体肠道微生物群串扰调节肠道代谢。
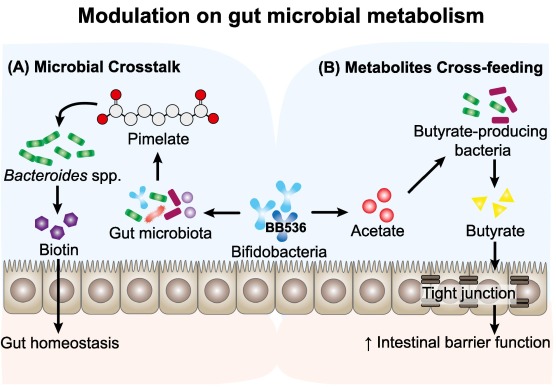
Wong C B, et al., Journal of Functional Foods, 2019
(A) BB536通过促进前体庚二酸的产生调节生物素的生物合成,并使Bacteroides caccae将其进一步代谢为生物素,从而促进宿主肠道内稳态。
(B) BB536通过交叉喂养机制影响共生丁酸生产菌(如直肠真杆菌)的代谢活性。BB536在碳水化合物发酵过程中产生的乙酸盐作为底物,维持Eu. rectale的生长,刺激丁酸盐的产生。
长双歧杆菌BB536的免疫调节作用
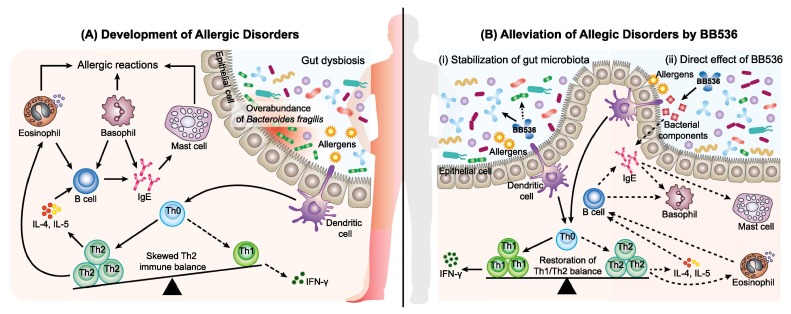
Wong C B, et al., Journal of Functional Foods, 2019
(A) 肠道微生物群的波动,特别是脆弱拟杆菌的过量,有助于干扰宿主免疫和发展过敏性疾病。在过敏反应中,一种过敏原被树突状细胞吸收,呈现给初始型T细胞(Th0),然后转化为辅助性T细胞2型(Th2)。Th2细胞分泌白细胞介素-4和白细胞介素-5,随后刺激记忆B细胞转换为过敏原特异性体液反应,主要由产生免疫球蛋白E(IgE)抗体。这些IgE抗体附着于肥大细胞和嗜碱性粒细胞,从而使它们对随后的暴露和过敏症状的发展敏感。
(B) BB536通过间接和直接机制调节宿主-微生物相互作用中的免疫稳态并减轻过敏性疾病。
(i) BB536通过纠正脆弱拟杆菌的流行,从而恢复Th1/Th2平衡,减轻过敏症状,促进肠道微生物群的稳定。
(ii)BB536通过其细菌成分直接影响抗原诱导的IgE介导的Th2倾斜免疫平衡。
1 剂量与特征
在使用双歧杆菌之前,请咨询医生。如果有某些慢病,可能无法使用双歧杆菌。
双歧杆菌有胶囊,片剂,散剂和咀嚼片形式。在没有医疗建议的情况下,请勿同时使用不同的配方。
以下情况需咨询是否可以安全使用该产品:
● 牛奶过敏或乳糖不耐症
● 正在服用抗生素药物期间
●孕妇或母乳喂养期间
应该如何判断益生菌的质量?
益生菌根据菌落形成单位(CFU)进行标记。这表明活细菌的密度或强度。益生菌中CFU的数量越高,就意味着它对肠道菌群中有益细菌的生长产生更大的影响。现在市面上很多产品把CFU的数量作为一种活菌标识。
有研究人员认为,关于CFU的特定剂量研究较少,可能不太重要。更重要的是找到一种经过适当加工和存储的高质量产品,这样就可以得到一种含有大量活细菌的产品。
未正确准备和存储的产品可能会导致细菌死亡,从而导致没有效果或者浪费。为了防止这种情况的发生,一些公司封装了他们的产品。
有效益生菌满足什么样的条件?
1. 它一定不能有毒或致病的。
2. 它必须保留已被证明对宿主(使用它的人)有益的特征。
3. 每单位必须包含足够数量的活微生物。
4. 它必须能够生长并在制造过程中存活,并能够通过胃和小肠运输。
5. 在存储和使用期间,它要保持活的状态。
如果需要开始补充,请尽量缓慢并逐渐增加。剂量范围很广,太高的剂量可能会引起胃部不适。
2 获取方法
每天食用富含有益菌的食物。发酵的食品和饮料,如酸菜,泡菜,开菲尔,康普茶,酸奶和人工培养的蔬菜,都是活益生菌和活性益生菌的绝佳来源。
* 开菲尔是一种发酵的乳制品,可以在酸奶和牛奶之间混合使用,可以作为早餐的不错选择。
如果想服用补充剂,请记住,益生菌菌株有很多不同的类型,每种类型的作用都略有不同。当寻找双歧杆菌时,请寻找完整的名称,包括属,种和菌株。
例如,在“Bifidobacterium adolescentis. 22L”中,“Bifidobacterium” 代表双歧杆菌属,种类是adolescentis,菌株为22L。
以正确的比例选择正确的活细菌类型非常重要。
冻干益生菌补充剂要特别小心。可以选择,但是,“它们暴露在湿气中会迅速降解,因此可能无法长期保持稳定” 。
3 如何储存
益生菌对光,热和水分敏感。优质的益生菌应保存在黑暗的玻璃瓶中,以防止细菌死亡。大多数类型的益生菌都需要冷藏。尽可能遵循厂商的说明进行最佳存储。
1 服用双歧杆菌时应避免什么?
请勿将口服粉与热液体或食物混合。
2 错过服用怎么办?
跳过错过的时间,并在常规时间使用下一个剂量。不要一下子服用两次的剂量。
3 服用过量怎么办?
咨询医生,寻求紧急医疗救护。
4 有可能出现的副作用?
如果你有过敏反应的迹象需就医:
荨麻疹; 呼吸困难;脸,嘴唇,舌头或喉咙肿胀。
常见的副作用可能包括:胃腹胀或不适。也可能会发生其他副作用。
5 是否一定要服用?
不一定。首先确定体内是否缺少益生菌,尤其是双歧杆菌。结合长双歧杆菌的健康益处和每个人的健康状况,可以在进行肠道菌群检测后,发现双歧杆菌(尤其长双歧杆菌)缺少的情况下进行服用,或遵医嘱。这样可以更加有针对性地改善某些症状,从而达到更好的效果。
附录:双歧杆菌的历史演变
自1900年,亨利·蒂西埃从新生婴儿的粪便中发现了双歧杆菌,蒂西埃便称他为革兰氏阳性弯曲和分叉(裂开,X形或Y形)杆状细胞双歧杆菌。现如今,蒂西埃的原始分离株被称为双歧双歧杆菌。
不久之后,作为诺贝尔奖获得者,蒂西埃研究所的同事——梅契尼科夫(Elie Metchnikoff)将蒂西埃的杆菌加入了他所研究的一份关于活力和长寿理论中。虽然早期有关于发酵乳的报道已经隐含说出关于发酵乳对于健康的益处,但梅契尼科夫是率先将其作为科学依据的。
梅契尼科夫的理论,从摄入的乳酸杆菌含量对健康和长寿的影响进行分析,目前酸奶是最有益的食品,其他如酸牛奶,纯牛奶等也含有。梅契尼科夫这一言论导致了20年以来公众对酸牛奶产品的需求逐增。梅契尼科夫不仅提出并延续了该理论——即肠道微生物群不仅可以控制肠道病原体感染的结果,还可以调节自然的慢性毒血症,这在降低衰老和死亡率中起着重要作用。
虽然由于第一次世界大战的爆发以及梅契尼科夫在71岁的时候去世,导致了人们对细菌疗法的兴趣大幅度降低。但是,关于在饮食中使用乳酸菌的研究一直持续了一个世纪,并在现今依然流行着。在健康的母乳所喂养的婴儿中发现了大量的双歧杆菌以及双歧杆菌的发酵/酸化性质,以此来暗示着双歧杆菌对人类营养方面和胃肠道健康有很大的益处。
如今,随着研究逐步扩大,双歧杆菌不仅通过食用益生菌培养物对人类进行了有益效果评估,还对家畜和其他动物进行了评估。
参考文献:
Wong C B, Odamaki T, Xiao J. Beneficial effects of Bifidobacterium longum subsp. longum BB536 on human health: Modulation of gut microbiome as the principal action[J]. Journal of Functional Foods, 2019, 54: 506-519.
Smecuol E, Hwang HJ, et al., Exploratory, randomized, double-blind, placebo-controlled study on the effects of Bifidobacterium infantis natren life start strain super strain in active celiac disease. J Clin Gastroenterol. 2013 Feb;47(2):139-47.
Smecuol E, Hwang HJ, et al., Exploratory, randomized, double-blind, placebo-controlled study on the effects of Bifidobacterium infantis natren life start strain super strain in active celiac disease. J Clin Gastroenterol. 2013 Feb;47(2):139-47.
Takahashi N, Kitazawa H, et al., Oral administration of an immunostimulatory DNA sequence from Bifidobacterium longum improves Th1/Th2 balance in a murine model. Biosci Biotechnol Biochem. 2006 Aug;70(8):2013-7.
Xiao JZ, Kondo S, et al., Effect of probiotic Bifidobacterium longum BB536 [corrected] in relieving clinical symptoms and modulating plasma cytokine levels of Japanese cedar pollinosis during the pollen season. A randomized double-blind, placebo-controlled trial. J Investig Allergol Clin Immunol. 2006;16(2):86-93.
Desbonnet L, Garrett L, et al., Effects of the probiotic Bifidobacterium infantis in the maternal separation model of depression. Neuroscience. 2010 Nov 10;170(4):1179-88.
Takahashi N, Kitazawa H, et al., An immunostimulatory DNA sequence from a probiotic strain of Bifidobacterium longum inhibits IgE production in vitro. FEMS Immunol Med Microbiol. 2006 Apr;46(3):461-9.
Namba K, Hatano M, et al., Effects of Bifidobacterium longum BB536 administration on influenza infection, influenza vaccine antibody titer, and cell-mediated immunity in the elderly. Biosci Biotechnol Biochem. 2010;74(5):939-45.
Jonathan Ritter, Puya Yazdi, Scientific Health Benefits of Bifidobacterium longum, 2020
Silva AM, Barbosa FH, et al., Effect of Bifidobacterium longum ingestion on experimental salmonellosis in mice. J Appl Microbiol. 2004;97(1):29-37.
Akatsu H, Iwabuchi N,et al.,Clinical effects of probiotic Bifidobacterium longum BB536 on immune function and intestinal microbiota in elderly patients receiving enteral tube feeding. JPEN J Parenter Enteral Nutr. 2013 Sep;37(5):631-40.

谷禾健康
痘痘,粉刺,酒渣鼻等皮肤问题,困扰着一些爱美的朋友。这关乎到个人形象,甚至有些朋友还会因为这个感到焦虑,社交尴尬,严重影响自信。
为了祛痘,盲目往脸上涂抹太多祛痘护肤产品,正所谓“过犹不及”,涂抹太多,过量,不断刺激皮肤,雪上加霜。


改善皮肤和整体健康的关键,从你的肠道开始。
我们常常说,一个人由内而外散发着美。其实是有科学依据的。
你的肠道和皮肤有很多共同点:
· 都在保护你,不受外界影响。
· 各自都有微生物群,彼此直接交流。
· 都富含肥大细胞,是免疫系统抗病第一线。
· 它们在早期发育过程中来自同一类细胞。
为什么吃的东西会影响你的皮肤?
皮肤与周围的世界相互作用,而胃肠道则处理你吃的、呼吸的和吞咽的一切。你吃的食物经过新陈代谢,食物分解后的副产物会直接进入到你的皮肤。
把皮肤看成是肠道健康的窗口
以下是11种皮肤状况,实际上是从肠道开始的:


看过我们文章的小伙伴都知道,人体肠道中有大量的微生物群。那肠道微生物群是怎么和皮肤进行交流的呢?
这就涉及一个:肠道-皮肤轴。
肠道-皮肤轴是连接肠道及其微生物与皮肤的信号分子网络,跟脑-肠轴类似。

免疫系统、皮肤和大脑之间的沟通是通过微生物来调节的。
炎症—— 大多数疾病的根本原因。
氧化应激—— 炎症的主要原因。
组织脂质水平—— 健康新陈代谢的重要因素。
血糖—— 控制平衡血糖的能力。
神经肽水平—— 一个与你的情绪、疼痛耐受力和身体内环境平衡有关的因素。
致病菌—— 使你生病或引起疾病的坏细菌。
神经递质—— 调节情绪,例如,大约90%的血清素(你的快乐神经递质)是由肠道微生物群产生的。
肠道微生物组与以上协调皮肤稳态的各个途径都有关联,最终影响皮肤健康。
研究发现,痤疮与其说是皮肤的问题,不如说是肠道的问题。
脂多糖(LPS)内毒素是有害的革兰氏阴性菌的组成成分,已被证明对肠道和皮肤造成严重破坏。研究发现,当体内有高水平的脂多糖内毒素时,它们会干扰伤口愈合,使疤痕更严重。
LPS还与寻常痤疮(也就是粉刺)有关,使你更可能对大肠杆菌脂多糖内毒素(E.coli LPS)产生强烈反应。对E.coli LPS有很强的反应性意味着你更可能有纤维蛋白微凝块,这会导致小而疼痛的组织疤痕。
更可怕的是,高水平的脂多糖和大肠杆菌脂多糖会导致肠漏,使细菌进入血液,身体就会出现炎症,表现在皮肤上就是痤疮、粉刺等问题。它还会使你更容易患上肠易激综合征和焦虑症、抑郁症等。
另外,肠道菌群失衡,有害菌大量繁殖,促进炎性物质释放,从而也会引起痤疮等皮肤问题。
特应性皮炎是最常见的慢性瘙痒性炎症性皮肤病。
西方饮食的低纤维和高脂肪含量特征从根本上改变了肠道菌群,导致免疫调节代谢产物特别是短链脂肪酸的产生不足。短链脂肪酸对上皮屏障完整性起重要作用。
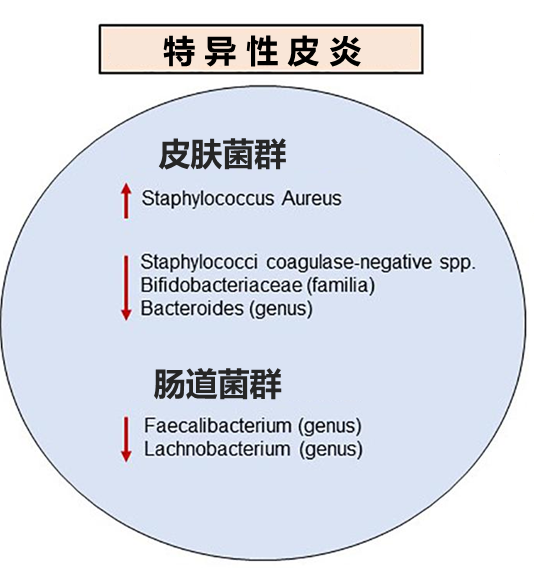
在两项韩国研究中,对特异性皮炎患者粪便样本的宏基因组分析显示,与对照组相比,普氏栖粪杆菌Faecalibacterium prausnitzii显著减少。
关于普氏栖粪杆菌的失调与上皮屏障破坏之间可能存在正反馈回路。肠屏障的破坏,允许消化不良的食物、微生物和毒素进入循环,到达目标组织包括皮肤,触发Th2免疫反应,导致进一步的组织损伤,从而促进该反馈回路。
关于特异性皮炎,更多详见:微生物群对三大过敏性疾病发展的影响
银屑病(俗称牛皮癣),是一种由免疫介导的慢性炎症性皮肤病,病程较长且易复发。
牛皮癣与胃肠道炎症的相关性特别强,7 – 11%的炎症性肠病(IBD)患者被诊断为牛皮癣。
某些共同的遗传和环境因素以及免疫途径在这两种疾病的发病机制中都有牵连。例如,Th17细胞及其细胞因子,已知在牛皮癣的发展中起主要作用,在IBD的病理生理学中也有牵连。
牛皮癣患者肠道菌群特征与IBD患者类似。与健康对照组相比,牛皮癣患者体内普氏栖粪杆菌Faecalibacterium prausnitzii的数量显著减少。
湿疹始于肠道。
当医生和皮肤科医生在寻找皮肤表面的解决方案时,他们忽略了湿疹是由免疫系统过度活跃引起的事实。这种过度活跃的免疫系统通常是肠道微生物群失调的结果。事实上,微生物多样性的下降会导致湿疹发作。
为了缓解湿疹症状,采取措施减少炎症和通过饮食增加微生物多样性是至关重要的。对抗湿疹的饮食需要针对你的微生物群和身体。
乳糜泻乳糜泻是一种常见的慢性疾病。它和皮肤状况密切相关。
患有乳糜泻的人更有可能有:
疱疹样皮炎、脱发、湿疹、
荨麻疹、白癜风、口腔黏膜病变
因为当患有乳糜泻的时候,免疫系统会释放出具有防御性质的抗体,也就是免疫球蛋白,它会在皮肤下面血管集中,导致皮疹的出现。
患有乳糜泻的人往往需要解决肠道的问题。他们有一个优势,就是他们会被引导去寻找与肠道有关的解决方案。
这就意味着,当他们进行无麸质或其他措施来减少乳糜泻的影响时,顺便在不经意间解决了皮肤状况。
至于其他的皮肤问题,往往需要比乳糜泻花更多的时间,才意识到原来肠道是问题的根源。
医生正在发现小肠细菌过度生长(SIBO)患者与酒渣鼻之间有着密切的联系。一些医生甚至报告说,当他们为患者治疗SIBO时,他们多年来的酒渣鼻会突然消失。
这对酒渣鼻患者来说绝对是个好消息。
SIBO是在2004年才被发现,许多人患有酒渣鼻,却不知道问题的根源可能是他们的肠道。现在可能许多人还不知道这一重要的联系。
每个人的肠道微生物组对他们来说都是独一无二的,因此每个人都有不同的适合自己的方法。
这里有些比较普适的建议。
减轻生活压力

持续的压力会对肠道菌群产生负面影响。减少压力时,进行规律饮食,保证良好睡眠,可以适当进行冥想、瑜伽、听音乐等方式,当然改善肠道健康也同样重要。
少吃糖

各种甜食虽然诱人,但还是尽量不要吃太多。糖分会刺激皮脂腺分泌,吃过多会导致皮肤爱出油、出油多自然容易长痘痘、粉刺等。另外,糖可以喂食许多有害菌,当你少吃糖时,提供给有害菌的能量少了,有害菌就会被饿死。
详见:深度解析 | 炎症,肠道菌群以及抗炎饮食 文中除了详细介绍机制外,还有相关的抗炎和促炎食物介绍。
均衡饮食
健康的饮食,最好由多种不同类型的食物组成,包含水果、蔬菜、谷物、肉类等。丰富的食物有利于肠道内不同类型细菌的生长,从而帮助肠道菌群多样性的增加。菌群多样性可能对恢复力起到积极作用,更能抵抗外界刺激引起的微生物群的扰动。
适量锻炼

适量锻炼,但不要太过 。锻炼对肠道微生物组有益,但如果锻炼过多,则无济于事。过度劳累又相当于形成了一种压力,并可能导致微生物失衡。
肠道菌群检测
每个人的肠道菌群都需要独特的饮食。对别人健康的食物可能对你来说并不理想。肠道菌群检测可以是一种工具,来帮你找到最适合你自己的健康食物。
其他方式,详见:
结 语
我们都知道分析问题要有整体观。面对疾病也一样,表面看是皮肤问题,实际可能是肠道的问题。
调理肠道健康,从根本上入手,一些皮肤问题也就迎刃而解了,而皮肤的改善提升颜值,带来的心情愉悦也可以进一步促进健康。
相关阅读:
参考文献:
Guo, Shuhong et al. “Lipopolysaccharide causes an increase in intestinal tight junction permeability in vitro and in vivo by inducing enterocyte membrane expression and localization of TLR-4 and CD14.” The American journal of pathology vol. 182,2 (2013): 375-87. doi:10.1016/j.ajpath.2012.10.014
O’Neill CA, Monteleone G, McLaughlin JT, Paus R. The gut-skin axis in health and disease: A paradigm with therapeutic implications. Bioessays. 2016 Nov;38(11):1167-1176.
Huang R, Wang K, Hu J. Effect of Probiotics on Depression: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Nutrients. 2016;8(8):483. Published 2016 Aug 6. doi:10.3390/nu8080483
Bowe WP, Logan AC. Acne vulgaris, probiotics and the gut-brain-skin axis – back to the future? Gut Pathog. 2011 Jan 31;3(1):1. doi: 10.1186/1757-4749-3-1. PMID: 21281494; PMCID: PMC3038963.
Caproni M, Bonciolini V, D’Errico A, Antiga E, Fabbri P. Celiac disease and dermatologic manifestations: many skin clue to unfold gluten-sensitive enteropathy. Gastroenterol Res Pract. 2012:952-753.
Parodi A, Paolino S, Greco A, Drago F, Mansi C, Rebora A, Parodi A, Savarino V. Small intestinal bacterial overgrowth in rosacea: clinical effectiveness of its eradication. Clin Gastroenterol Hepatol. 2008 Jul;6(7):759-64.
Wollina U. Microbiome in atopic dermatitis. Clin Cosmet Investig Dermatol. 2017;10:51-56.
Juhlin L, Michaëlsson G. Fibrin microclot formation in patients with acne. Acta Derm Venereol. 1983;63(6):538-40. PMID: 6198846
Yang H, Hu C, Li F, Liang L, Liu L. Effect of lipopolysaccharide on the biological characteristics of human skin fibroblasts and hypertrophic scar tissue formation. IUBMB Life. 2013 Jun;65(6):526-32. doi: 10.1002/iub.1159. Epub 2013 May 7. PMID: 23653386