-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
当我们的皮肤被轻微割伤或烧伤时,伤口周围区域可能会变得红肿、发热,甚至伴有疼痛;感冒时,喉咙痛、肿胀;不小心扭伤后,可能会肿胀、疼痛和僵硬…这些都与炎症相关。
炎症,作为身体对损伤或感染的自然防御机制,是一种复杂的生物学过程,涉及到免疫细胞和多种分子介质的相互作用。它可以帮助身体对抗病原体、清除死亡细胞和促进组织修复。然而,当炎症反应过度或持续时间过长时,它也可能成为许多疾病的驱动因素,包括心脏病、糖尿病、某些类型的癌症,自身免疫疾病等。因此,了解炎症及其相关症状对于早期识别和治疗炎症相关疾病至关重要。
你是否想过,在身体出现炎症之前,其实已经有一些潜在的信号出现?炎症这个过程看似简单,但背后却涉及复杂的免疫系统调控,以及多种炎症因子的参与。值得注意的是,在这些可见的炎症症状出现之前,我们体内的炎症因子可能已经悄然发生了改变。
研究表明,肠道菌群的失调往往是最早的预警信号之一。当肠道微生物群的平衡被打破时,会引发一系列连锁反应:有益菌群(如双歧杆菌、乳酸杆菌)数量减少,条件致病菌和致病菌的比例升高。这种失衡会导致肠道屏障功能受损,使得细菌产物(如脂多糖LPS)更容易进入血液循环。
早期的肠道菌群改变会引起炎症因子水平的显著变化。比如说:血清中促炎因子如TNF-α、IL-1β和IL-6的水平开始升高,而抗炎因子如IL-10的水平则呈现下降趋势。同时,由于有益菌群减少,短链脂肪酸等具有抗炎作用的代谢产物的产生也会减少。这些变化都可能发生在明显的炎症症状出现之前。
这种早期的炎症因子改变往往具有预警作用。例如,在动脉粥样硬化的发展过程中,即使尚未出现明显的斑块形成,血液中的炎症因子水平就已经开始发生变化。
本文将带大家了解炎症因子,具体怎么看,它的高低代表着什么,发挥什么作用,探讨炎症因子作为早期诊断生物标志物的价值,以及肠道菌群与炎症因子之间的复杂联系。通过监测肠道菌群的变化和炎症因子水平的波动,我们可以更早地发现潜在的健康问题,为疾病的预防和早期干预提供重要的时间窗口。

◑ 炎症
炎症是身体对外界损伤、感染或内部损伤的一种自然防御反应,旨在清除有害刺激因子、清除死亡细胞和组织碎片,并启动修复过程。它是免疫系统的一部分,涉及多种细胞类型和分子介质,包括白细胞、血管系统、补体系统和各种炎症因子。
日常可见的炎症反应可分为两类:
不健康的生活方式,如吸烟、不良饮食、过量饮酒、久坐不动、压力、体重增加等,都可能导致慢性炎症。
慢性低度炎症——疾病之源
慢性低度炎症是在没有明显感染的情况下,体内炎症介质水平持续升高。这种炎症状态往往不会引起明显的临床症状,但会长期影响人体健康。
慢性炎症可以攻击全身,并在此过程中增加特定区域某些类型疾病和紊乱的风险,如心脏、大脑、关节、胃肠道等。
炎症是如何被触发的?
炎症的触发是一个复杂的过程,感染、损伤、应激、自身免疫反应、坏死细胞、代谢紊乱…这些都可能是炎症触发的途径。
随着损伤信号的识别,免疫细胞如巨噬细胞和树突状细胞迅速响应,受体的激活促使免疫细胞分泌炎症因子,这些炎症因子是炎症反应中的关键分子。
炎症因子的释放不仅放大了炎症信号,还促进了血管的扩张和通透性增加,使得免疫细胞和分子能够更有效地到达受损部位。这些炎症因子的相互作用和级联反应构成了炎症反应的基础,它们共同协调了机体对损伤和感染的防御机制。
接下来我们来深入认识炎症过程中的核心”信使”——炎症因子。
◑ 炎症因子
炎症因子在疾病发展过程中扮演着关键角色,其水平变化不仅反映了疾病的发展态势,更为疾病的早期诊断和预后评估提供了重要依据。研究表明,炎症因子的变化往往早于临床症状的出现,这种特性使其成为疾病发展的重要生物标志物。
我们先看一下,炎症因子是什么?
炎症因子是一类由免疫细胞和其他细胞产生的特殊蛋白质分子,它们在体内发挥着”信使“的作用。也就是说,炎症因子就像是我们身体内的一支特殊”信号部队“,它们负责在炎症发生时传递各种指令,协调免疫系统的行动。
无论是急性炎症还是慢性炎症,炎症因子都扮演着不可或缺的角色,它们决定着炎症反应的强度、持续时间和最终结果。
炎症因子与细胞因子有什么区别?
炎症因子主要是指那些能够引起或加剧炎症反应的分子,而细胞因子则是一类更广泛的信号分子,包括炎症因子在内的多种类型,比如生长因子、趋化因子等,它们参与调节免疫细胞的功能和相互作用。
炎症因子可以被视为细胞因子的一个子集,也就是那些具有促进炎症反应功能的细胞因子。
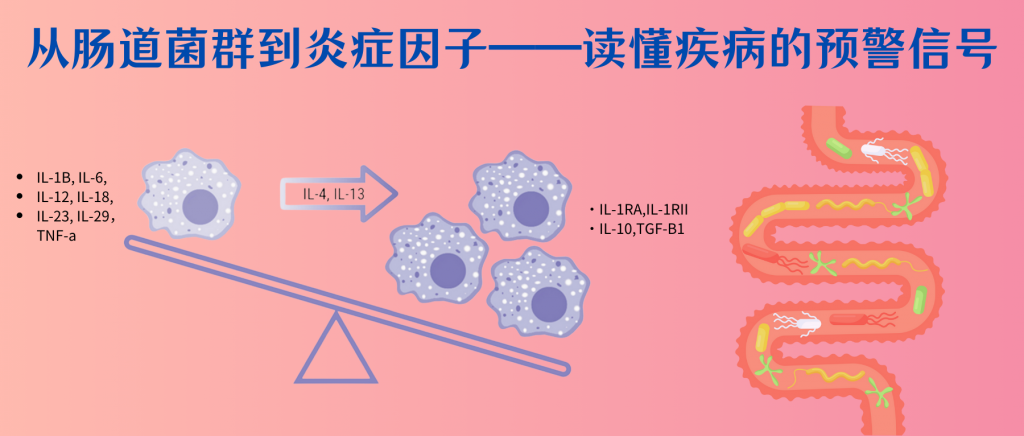
在疾病发展的早期阶段,即使尚未出现明显的临床表现,体内的炎症因子已经开始发生显著变化。
例如,促炎因子TNF-α和IL-6的水平会逐渐升高,而抗炎因子IL-10的水平则呈现下降趋势。这种变化具有明显的时序性和渐进性特征,为疾病的早期预警提供了可能。同时,C反应蛋白(CRP)等急性期蛋白的轻微升高,也常常预示着潜在的健康问题。
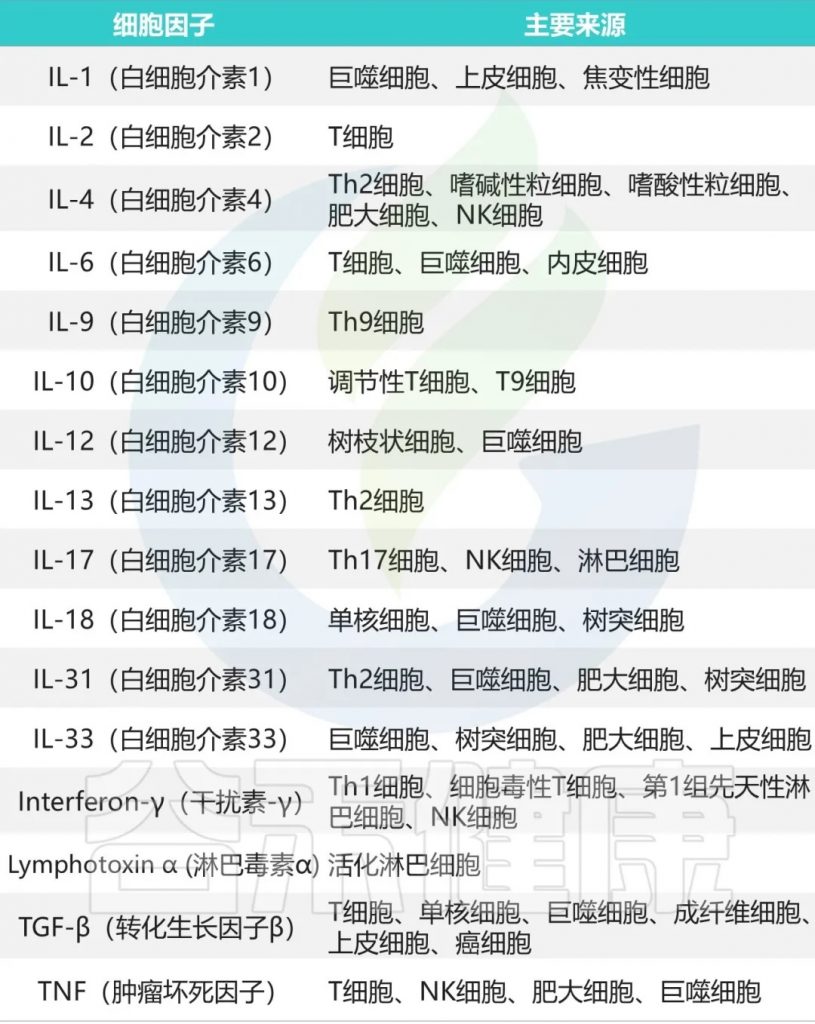
主要的促炎因子和抗炎因子有哪些?
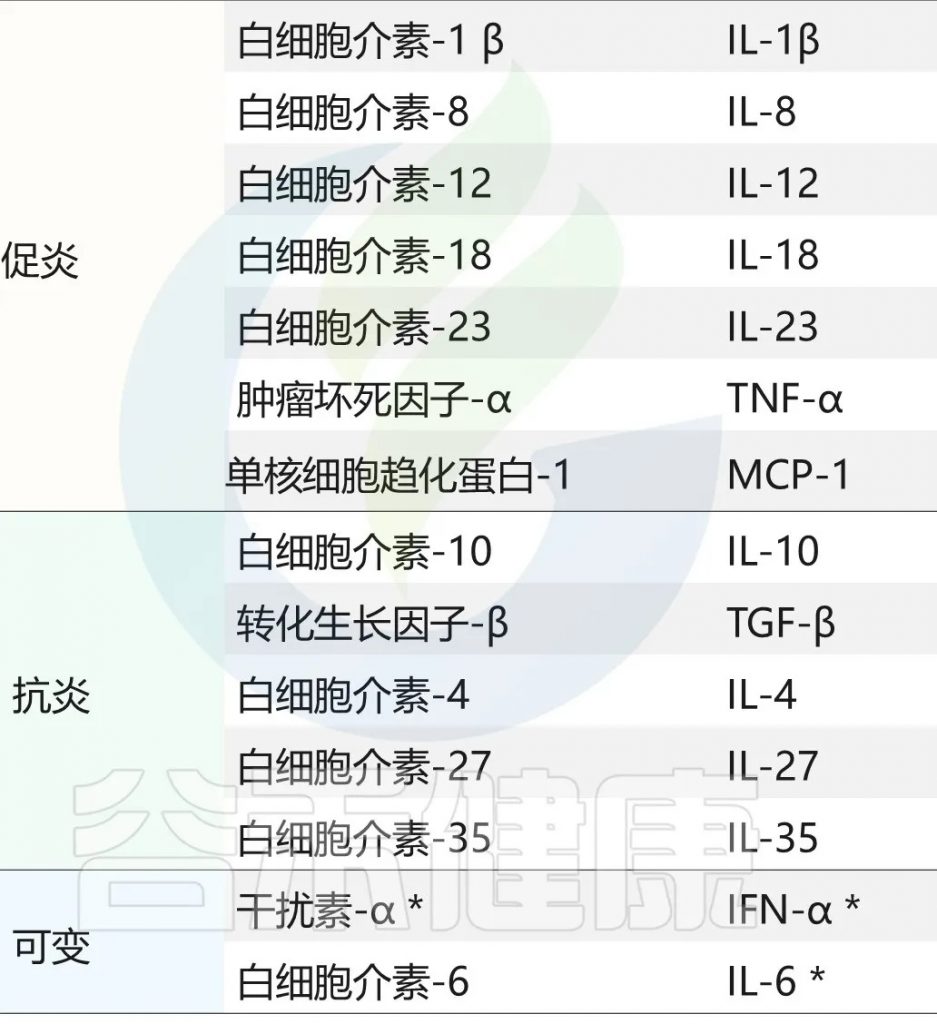
doi:10.3390/ijeph17207618
随着疾病的进展,炎症因子会呈现出不同的变化模式。在急性疾病中,IL-1β和TNF-α等促炎因子会快速升高,同时伴随着中性粒细胞趋化因子的显著增加。而在慢性疾病中,则常常表现为持续的低度炎症状态,多种炎症因子维持在较高水平,形成促炎和抗炎因子的失衡状态。
不同类型的疾病中,炎症因子往往表现出特征性的变化。以心血管疾病为例,患者体内的CRP和IL-6水平通常持续升高,同时伴有粘附分子表达的增加。在自身免疫性疾病中,TNF-α和IL-17的显著升高,以及特异性自身抗体的出现,往往是重要的诊断依据。而在代谢性疾病中,脂联素水平的改变和瘦素抵抗的出现,则与胰岛素抵抗密切相关。
炎症因子作为生物标志物在临床实践中有多重价值
在诊断方面,它可以用于疾病的早期筛查、鉴别诊断和病情评估;
在预后评估方面,能够预测疾病的进展趋势,评估并发症风险,并监测治疗效果;
在治疗指导方面,帮助医生选择合适的治疗方案,调整用药剂量,评价治疗效果。
了解炎症因子的作用机制不仅有助于我们更好地理解炎症过程,也为开发新的治疗策略提供了靶点,通过调节炎症因子的活性来治疗炎症性疾病,那么,如何有效地调节这些炎症因子的活性呢?近年来,越来越多的研究开始关注肠道菌群在调节炎症因子和免疫反应中的作用。
在疾病发展的早期阶段,即使在临床症状尚未显现时,身体内部可能已经发生了微妙的改变。肠道菌群作为人体最大的微生态系统,常常能够最早感知这些变化,并通过多种途径向身体发出预警信号。
我们以前的文章也有很多提及,肠道菌群不仅能影响局部的免疫反应,还能通过多种机制影响全身性的炎症状态,比如说:
代谢产物:
肠道菌群通过发酵膳食纤维产生短链脂肪酸(SCFAs),如乙酸、丙酸和丁酸,这些代谢产物能够调节免疫细胞的功能,特别是对调节性T细胞(Treg)的分化和功能具有重要作用,进而影响炎症因子的产生。
免疫细胞调节:
肠道菌群能够影响树突状细胞(DCs)和巨噬细胞的成熟和功能,这些免疫细胞在调节炎症因子的表达和释放中起着关键作用。
肠道屏障功能:
维持健康的肠道菌群有助于维持肠道屏障的完整性,防止病原体和有害物质的入侵,从而减少炎症因子的激活。
抗炎和促炎平衡:
某些肠道菌群成员能够促进抗炎细胞因子如IL-10的产生,而抑制促炎细胞因子如TNF-α和IFNγ的表达。
肠道菌群发出的预警信号,主要通过代谢产物、免疫细胞调节、肠道屏障功能维持以及抗炎促炎平衡等途径实现,而炎症因子则是传递这些预警信号的关键分子。
通过监测这些早期的分子标志物,我们可以在疾病发展的早期阶段进行干预,从而更有效地预防和控制炎症反应的发生发展。
接下来,我们将深入探讨常见的炎症因子(炎症标志物),包括C反应蛋白、粪便钙卫蛋白、TNF-α、IL-1、IL-6、IL-10、IL-17、IL-22等,这些炎症因子的具体功能,肠道菌群与这些炎症因子的关联等。
C反应蛋白(CRP)是一种重要的由肝脏产生的急性期反应蛋白,是临床上最常用的炎症标志物之一。比如,广泛使用于IBD筛查和评估疾病活动性、临床复发和治疗反应。
什么时候需要做CRP测试?
——急性
CRP水平在体内发生炎症或组织损伤时会急剧上升。比如说,感冒时身体的免疫系统会被激活,C反应蛋白的产生显著增加,反映了身体正在经历一种急性炎症反应,通常伴随着其他症状,如发热、 寒战、喉咙痛、全身乏力、呼吸急促、恶心呕吐等。一般出现这种情况的时候医生会要求抽血,看看CRP指标。
——慢性
除了感染性疾病的早期诊断外,CRP水平的升高还可用于判断疾病的严重程度和监测治疗效果。例如,在风湿性关节炎、狼疮、炎症性肠病、血管炎、哮喘等慢性疾病中,CRP常常作为一种重要的生物标志物,帮助医生评估病情进展及治疗反应。也可用于术后并发症监测。
例如,血液中高水平的hs-CRP与心脏病发作的风险增加有关。如果hs-CRP水平较高,心脏病发作的人更有可能再次心脏病发作。
CRP水平的高低意味着什么?
一般来说,健康人的血液中CRP含量很低。

CRP与肠道菌群有什么关联?
一项研究中,在CRP血浆水平升高的肥胖小鼠中,Akkermansia muciniphila的比例下降。
Phascolarctobacterium属成员的丰度与较低水平的CRP有关。这种关系可能会解释为什么该菌属比例的下降与结肠炎症有关:Phascolarctobacterium是丙酸的生产者,丙酸是一种短链脂肪酸,通过抑制促炎调节因子NFκB的活性来抑制促炎级联反应。同样,粪杆菌的丰度与CRP水平呈负相关。
因此,CRP是一种下游炎症标志物,可以通过特定肠道微生物的抗炎代谢产物的作用下调。
对BMI超过25的健康受试者的基线血清和微生物群数据的评估表明,CRP水平较高的受试者乳杆菌属和双歧杆菌属的细菌丰度明显较低,但大肠杆菌属和拟杆菌属的丰度较高。
钙卫蛋白是一种胞浆蛋白复合物,在中性粒细胞中组成性表达,并在肠道炎症期间迁移至肠粘膜时释放。
在健康状况下,钙卫蛋白具有免疫调节功能,对免疫防御至关重要;在慢性炎症性疾病中,钙卫蛋白可通过细胞因子受体结合和活性氧的产生来促进疾病进程。
钙卫蛋白——非侵入性生物标志物
自20世纪80年代钙卫蛋白的鉴定和表征以来,粪便钙卫蛋白成为一种经过显著验证的非侵入性生物标志物,可用于评估肠道炎症,是短期复发和IBD炎症活动的可靠预测指标。
举个例子:一个人去医院看病,主诉反复腹泻、腹痛、体重下降,有慢性腹泻的病史,过去几个月中症状有所加重,医生考虑他可能与肠道疾病相关,为了确诊,医生可能会开具粪便钙卫蛋白检测进行辅助诊断,帮助区分炎症性肠病和肠易激综合征。
钙卫蛋白水平高低意味着什么?
粪便钙卫蛋白与肠道菌群有什么关联?

一项来自TREND队列的大样本老年人研究发现,在高钙卫蛋白组与低钙卫蛋白组中,几种促炎肠道微生物属显著增加,而产短链脂肪酸菌减少。
在粪便钙卫蛋白升高的组中,几种产短链脂肪酸菌属(如梭菌属、Blautia、Turicibacter)的丰度降低与IBD、帕金森和心血管疾病中的许多发现一致。这些产生SCFA菌减少可能是几种疾病机制的关键,因为SCFA可以防止病原体,调节代谢,内分泌和免疫功能,并影响药物代谢和吸收。
发炎的肠道中较高水平的氧气可以允许肠杆菌科的有氧呼吸,同时抑制专性厌氧菌、拟杆菌和产生SCFA的梭菌的生长。此外,通过与富含脂肪的西方饮食的相互作用,含有促炎脂多糖作为膜成分的革兰氏阴性菌可能会引发炎症和粪便钙卫蛋白水平升高。
血清中,高粪便钙卫蛋白组IL-17 C、CCL 19和毒性代谢产物硫酸吲哚酚升高。这些变化部分由肠道微生物群介导。此外,高粪便钙卫蛋白组显示BMI增加,心脏病发作和肥胖的患病率较高。
在免疫疗法治疗肝细胞癌患者期间,粪便钙卫蛋白显示出与阿克曼氏菌与肠杆菌科比例和肠道微生物群α多样性相反的时间演变,但与zonulin-1和LBP相似。
肿瘤坏死因子-α(TNF-α)是驱动炎症的关键细胞因子。TNF-α在炎症级联反应的上游启动阶段,是Th1信号通路关键的细胞因子,在人体免疫系统中扮演着“紧急呼叫器”的角色。
该分子水平升高与胰岛素抵抗和葡萄糖耐受不良相关,因为TNF-α能够激活各种信号传导途径,包括mTOR途径,使其成为代谢疾病发展中的关键分子。
TNF的“好”
TNF诱导睡眠,并增加非快速眼动睡眠。因此,当我们晚上想入睡时,它提高一些是很好的。TNF在健康人中在夜间自然升高。
TNF是一种直接的脂肪克星,它导致脂肪细胞中的胰岛素抵抗,但也导致肌肉细胞中的胰岛素抵抗。这意味着葡萄糖不能进入这些细胞。
TNF通过抑制食欲素来抑制食欲。因此,高水平的TNF会使你吃得更少,并抑制葡萄糖进入脂肪细胞,从而使你变瘦。如果你减少TNF,会变得更饿,储存更多的脂肪。因此,抗TNF治疗导致体重增加并不奇怪。
TNF的“坏”
TNF通过抑制食欲素让人感到疲劳,降低情绪并降低认知和身体表现。
注:食欲素是一种非常重要的神经递质,对许多身体功能。食欲素在记忆获得和巩固以及长期记忆强化中起着许多关键作用。因此,如果你有炎症升高,它会损害你的认知能力。
TNF可以通过破坏线粒体造成持久的伤害。
TNF还可以降低甲状腺激素,导致“低T3综合征”。它也可以降低睾酮(趋势,但不显著)。
TNF会减缓伤口愈合,这意味着需要更多的时间从运动/受伤中恢复。
TNF可诱导“肠漏”。
长期升高的TNF-α也会扰乱昼夜节律并导致白天疲劳。
与TNF-α相关的疾病:炎症性肠病(IBD)、类风湿性关节炎(RA)、2型糖尿病、肥胖、系统性红斑狼疮、神经退行性疾病、精神分裂症等。
哪些肠道菌群与TNF-α呈负相关?
哪些肠道菌群与TNF-α呈正相关?
TNF-α在不同类型的感染中表现出不同的作用,例如在真菌感染中,TNF-α通过调节Th17/Th2和中性粒细胞/嗜酸性粒细胞的平衡来影响炎症反应。而在克罗恩病患者中,TNF-α的诱导活性与某些革兰阴性菌有关。
肠道菌群通过其代谢产物,如短链脂肪酸,可以影响TNF-α的水平。短链脂肪酸能激活AMPK,减少FIAF(诱导型脂肪因子)的产生,从而抑制脂多糖的活性,进而影响TNF-α的产生。
★ 如何减少TNF-α?
生活方式:运动(骑车)、瑜伽、太极拳、睡眠不足后的小睡、谈恋爱等。
饮食:沙丁鱼、蘑菇、大蒜、蜂蜜、大豆、苦瓜、十字花科蔬菜(西兰花、花菜)、水果(红树莓、蓝莓、黑醋栗果、李子、桃、荔枝、巴西莓)等。
其他补充剂:姜黄素、鱼油、肉桂、精氨酸、甘氨酸、组氨酸、铬、植物淄醇、黄芪、青蒿素、柠檬苷、辅酶Q10、紫锥菊、葡萄糖胺、小檗碱、黄芩、银杏、南非醉茄、槲皮素等。
IL-1是一种重要的促炎细胞因子。促进炎症细胞的招募和活化,增加血管通透性,吸引免疫细胞到达炎症部位。参与调节T细胞和B细胞的活化、增殖和分化,促进发热反应、疼痛、肿胀。同时也可以诱导某些细胞类型的凋亡,参与组织修复和再生。
与IL-1相关的疾病:自身免疫性疾病、感染性疾病、心血管疾病、代谢性疾病、神经退行性疾病等。
哪些肠道菌群与IL-1呈负相关?
哪些肠道菌群与IL-1呈正相关?
肠道菌群代谢产物,短链脂肪酸,通过激活AMPK和抑制PGC-1α,进而影响IL-1的产生。
◆ IL-1β
IL-1β是IL-1家族的重要成员之一,同属于促炎性细胞因子,IL-1β常作为特异性炎症标志物。
IL-1β的“好”
IL-1β是诱导睡眠机制的一部分,并增加非快速眼动睡眠,IL-1β具有昼夜节律,在睡觉前升高,但如果你是夜班工人,它会转移到白天。
IL-1在记忆功能中发挥作用,所以人需要一定水平的IL-1,但要“尽可能低”。
在啮齿动物中,IL-1β增加了催产素和加压素的释放。
IL-1β增加NGF。
NGF和NT-3在刺激神经突起生长方面有些独特,这是NGF、BDNF或NT-4无法单独完成的。IL-1β还会增加GDNF,这再次刺激神经突起的生长。
此外,它可以通过增加bFGF来增加多巴胺促进神经元。
IL-1β的“坏”
如果你的IL-1水平升高,那么这将影响你的情绪、认知功能、清醒程度和动力,需要关注降低慢性炎症。
IL-1与抑郁症有关,可能通过减少雌激素合成、增加黄体酮分解影响情绪,同时降低雄性激素水平。压力可通过IL-1b介导的途径导致抑郁,同时损害认知能力,影响学习和记忆,这可能与脑源性神经营养因子(BDNF)的减少有关。
IL-1通过抑制食欲素引起疲劳,并与焦虑、HPA轴激活、IBS、认知缺陷和多种慢性疾病相关。
IL-1β与低睾酮水平相关,可能通过影响甲状腺激素和皮质醇水平降低性能。它还抑制胰岛素释放,影响血糖水平,降低乙酰胆碱水平,并在肠道中抑制胃酸,可能导致幽门螺杆菌感染失控。
IL-1β与肠道菌群的关联
★ 如何减少IL-1β?
饮食:蔬菜和水果(花青素)、芹菜、生姜、十字花科蔬菜(西兰花、花菜)、燕麦鱼(虾青素)等。
益生菌:植物乳杆菌等
其他补充剂:维生素A、VB2、穿心莲、β-葡聚糖、葡萄籽提取物、水飞蓟素、红景天、黄连素、小檗碱、葡萄籽提取物、鱼油、茶多酚、蜂蜜、黄芩苷、迷迭香酸、丹参、锌(如果缺乏)、苜蓿、白术、紫苏等。
IL-6是与系统性炎症相关的炎症因子,调节免疫反应,参与激活和分化T细胞,促进B细胞分化和抗体产生,促进急性期蛋白的合成,促进中性粒细胞的募集,参与炎症性疾病的发生发展。
IL-6在中枢神经系统中也发挥作用,参与调节神经炎症和情绪反应。
IL-6可以通过两种方式激活细胞:
IL-6在你生病和运动后升高,特别是有氧运动。如果运动增加炎症标志物,那么怎么理解运动是健康的?
当你运动时,肌肉会释放IL-6,这是抗炎的。然而,当免疫细胞(巨噬细胞)释放它时,它是促炎性的。
IL-6还抑制Th1细胞,同时诱导Th2细胞,因此对Th2占主导地位的人来说情况更糟。它还增加了B细胞,这是产生抗体并导致过敏和自身免疫的原因。
不易患自身免疫性疾病的人也可能患有IL-6升高。这是与现代文明病有关的细胞因子。最常见的原因可能是肥胖。
IL-6升高的其他常见原因可能是慢性压力、睡眠太少、吃得太多(特别是吃太多糖或精制食品)、吸烟、过量酒精、运动过多。
IL-6的“坏”
IL-6水平在几乎所有疾病状态中都升高。
它减少了Treg细胞,这反过来又阻碍了我们对摄入的蛋白质产生耐受性的能力-引起过敏。它还增加了中性粒细胞的产生,这是炎症。
IL-6是中年后期认知能力下降的一个很好的预测因子。
IL-6可能会导致情绪恶化,绝望的感觉。IL-6还与暴力自杀、冲动和避免单调乏味相关。
IL-6导致血糖水平升高,增强了应激激素(CRH)对肠道粘膜的影响,导致IBS。IL-6可导致肠漏。
IL-6通过抑制(或超甲基化)对GABA正常工作重要的基因(GAD 67)而导致精神分裂症。
IL-6是CRP最有效的诱导剂,CRP就是我们前面讲的炎症标志物。
它可以通过增加IgG和IgM抗体产生和恶化食物敏感性和自身免疫问题。
IL-6也会导致皮肤问题。IL-6在患有皮肤真菌变色菌的人中升高。IL-6还增加了Th 22细胞,这破坏了皮肤微生物平衡。
IL-6的“好”
IL-6如果升高大多是不好的,但短暂的峰值可能是有益的。
TNF和IL-1β增加IL-6,但IL-6反过来抑制这两种细胞因子,其比IL-6本身更有害。在这种方式下,它是一种抗炎。抑制TNF,分解脂肪细胞并降低胰岛素抵抗。
IL-6在一些细菌、病毒和真菌感染中起保护作用。
IL-6的正常水平是什么?
在健康受试者中,IL-6血液水平几乎检测不到,范围在2-6 pg/ml之间。另一项研究提到,健康人的平均水平为0.5 pg/ml 。
抑郁症患者的IL-6水平比健康人高约1.78 pg/ml。
在患有风湿性关节炎的人中,水平可以增加到1000倍(不常见)。在败血症中,这是非常危险的,它可以增加到一百万倍。
IL-6与肠道菌群有什么关联?
高脂饮食会削弱粘液层的完整性,增加血液中LPS的水平,通过TLR-4传递,导致血液中TNF-α、IL-1、IL-6和PAI-1(纤溶酶原激活抑制剂-1)的水平升高,引起系统性炎症。
坏死的肠道粘膜细胞会刺激巨噬细胞产生IL-6。
★ 如何减少IL-6?
生活方式:情绪积极、睡眠不足后的小睡、听音乐等。
饮食:地中海饮食、燕麦、多酚、坚果(腰果)、豆类、橄榄油、蔬菜、蓝莓、红树莓、蜂蜜等。
其他补充剂:鱼油、植物甾醇、螺旋藻、维生素B2、VB12、VE、镁、铬、锌、精氨酸、组氨酸、甘氨酸、银杏、维生素E、黄芩苷、乳铁蛋白、葡萄籽提取物、黄芪、丹参、紫锥菊、迷迭香酸、牛至、鼠尾草等。
IL-10是一种重要的抗炎因子。
它能抑制促炎细胞因子的产生(如TNF-α、IL-1β、IL-6),降低抗原呈递细胞的活性,减少炎症细胞的募集,有助于炎症反应的消退。抑制Th1细胞的活化,从而调节Th1/Th2平衡。
IL-10的“好”
在自身免疫性疾病(如类风湿性关节炎、系统性红斑狼疮等)和移植免疫中,IL-10有助于防止自身反应性T细胞的活化,减少对移植器官的排斥反应。
IL-10抑制COX-2,这是参与偏头痛,疼痛和炎症。COX-2通常被非甾体抗炎药如阿司匹林和布洛芬阻断。
通过抑制肥大细胞,它抵消了这些细胞在过敏反应部位的炎症作用。
IL-10通过减少暴饮暴食并降低下丘脑(控制食欲的腺体)中的胰岛素和瘦素抵抗(通过抑制细胞因子、Nf-kB和ER应激)来减少肥胖。
IL-10的“坏”
IL-10可以阻断对病毒感染的反应,甚至直接增加病毒蛋白的产生,比如说,在慢性疲劳综合征中,IL-10增加;慢性感染的丙型肝炎患者在遗传上倾向于高IL-10产生,对治疗的积极反应较低。
平衡 IL-10 的“好”与“坏”
Th 1免疫系统,特别是CD 8 + T细胞和IFN γ,是人体对抗癌症的机制的一部分。阻断IL-10显示出作为癌症治疗的前景。然而,IL-10在某些情况下也通过促进细胞毒性T细胞活性和IFN-γ产生而发挥保护性抗癌作用。
重要的是认识到全身和癌组织中的IL-10水平之间存在差异。如果IL-10在正常组织中处于健康水平,在癌组织中处于低水平,那么这是比较理想健康的。
血液中IL-10的水平并不一定代表肠道或其他组织中的水平,但通常存在相关性。
在现代环境中,高IL-10水平可能比低IL-10水平更好,因为可以对抗细菌感染。
IL-10与肠道菌群有什么关联?
乳杆菌、双歧杆菌、普氏粪杆菌、某些产丁酸菌:能促进IL-10的产生,从而改善肠道炎症。
益生菌通过促进调节性T细胞(Treg)的分化来增加IL-10的产生。
★ 如何增加IL-10?
生活方式:运动、晒太阳、冥想等。
饮食:芝麻油、肉桂、大蒜、辣椒素、甘草、芥末等。
益生菌:植物乳杆菌、布拉氏酵母菌、干酪乳杆菌、枯草芽孢杆菌等。
益生元:阿拉伯半乳聚糖
其他补充剂:姜黄素、表儿茶素EGCG、Boswellia、橄榄苦苷、褪黑素、白藜芦醇、维生素D3、辅酶Q10、植物甾醇等。
IL-17(白细胞介素-17)是一种重要的促炎细胞因子,在自身免疫和炎症反应中发挥关键作用。IL-17能够促进多种细胞产生炎症因子,如IL-1β、TNF-α和IL-6,促进中性粒细胞募集,加剧炎症反应。
在肿瘤微环境中具有双重作用,既可以促进抗肿瘤免疫反应,也可能促进肿瘤的侵袭和转移。
与自身免疫性疾病、肿瘤、感染性疾病等相关。
IL-17水平的变化可以作为某些疾病预后的生物标志物。
IL-17 C属于IL-17细胞因子家族,由上皮细胞而不是免疫细胞产生。它作为对上皮损伤的快速局部自分泌反应,促进抗微生物保护反应和肠屏障维持。
分节丝状菌(SFB):通过其鞭毛蛋白促进其产生。
青春双歧杆菌(Bifidobacterium adolescentis):能够诱导肠道Th17细胞积累,从而促进IL-17的产生。
IL-22(白细胞介素-22)是IL-10家族的重要成员,主要参与组织修复和黏膜免疫。
具体来说,IL-22在组织损伤后的修复和再生过程中起着重要作用,特别是在肝脏和肠道等上皮组织中。
它是一种促炎细胞因子,但它也能发挥抗炎作用,特别是在抑制过度的炎症反应和促进组织稳态方面。
IL-22能够增强上皮细胞的抗菌肽表达,从而增强机体对细菌和病毒感染的防御能力。
在急性结肠炎中具有保护作用,但在慢性结肠炎中,IL-22与IL-17A协同介导致病性。
分节丝状菌(SFB):通过鞭毛蛋白参与调节其产生,诱导SAA产生来促进IL-22的分泌,刺激树突状细胞促进IL-22的产生。
IFNγ(干扰素-γ)是一种重要的细胞因子,它在免疫反应、抗感染、抗肿瘤和调节免疫应答中扮演着重要角色。
IFNγ是Th1细胞介导免疫反应的关键因子,它能够促进Th1细胞的分化,并抑制Th2细胞的分化,从而调节Th1/Th2平衡。
在某些自身免疫性疾病中,如多发性硬化症和类风湿性关节炎,IFNγ的过度产生与疾病的发生和发展有关。
肿瘤:IFNγ在肿瘤免疫监视中起关键作用,但其在肿瘤微环境中的作用可能更为复杂,包括促进肿瘤免疫逃逸。
TGF-β(转化生长因子-β)是一种多功能细胞因子,在调节免疫反应和促进Tregs细胞的增殖中起作用。
肠道菌群的变化可以影响TGF-β的产生,进而影响Tregs和Th17细胞的平衡。
丁酸梭菌,诱导树突状细胞中TGF-β信号传导,进而诱导调节性T细胞(Treg)的产生。
以上我们了解一些常见的炎症因子的功能,与肠道菌群的关联,基于这一认识,我们将进一步探讨这种异常变化如何表征不同疾病的风险,以及如何通过早期干预来预防和治疗相关疾病。
在探讨肠道菌群与炎症因子异常之间的关系时,我们不得不关注它们在多种慢性疾病中的作用,尤其是那些与炎症密切相关的疾病。
这里我们通过举例分析几种典型疾病(抑郁症、心血管疾病、炎症性皮肤病)中肠道菌群与炎症因子的动态变化特征,更深入地理解肠道菌群如何作为炎症反应的早期指标,为疾病的早期预防和个体化治疗提供科学依据。
抑郁症是一种常见的精神障碍,其特征为情绪低落、食欲不振和高自杀率。研究表明,炎症反应在抑郁症的发病中起着关键作用,炎症水平的紊乱可增加抑郁症的发病率。
调节炎症水平可能是肠道菌群影响宿主健康的途径之一。通过调节特异性肠道菌群和炎症反应,可以实现抑郁症的早期预测、预防和个性化治疗。
➤ 抑郁症
一项研究通过孟德尔随机化分析方法确定了15个与抑郁症相关的肠道菌群分类群和4种细胞因子,并证实了某些细胞因子在肠道菌群对抑郁症影响中的介导作用。
研究发现,Romboutsia、Intestinimonas、瘤胃球菌UCG 011等对抑郁症具有保护作用。
Romboutsia,Ruminococcaceae UCG 011,Intestinimonas都是产丁酸菌,临床研究发现,Romboutsia的丰度与帕金森病患者的抑郁状态呈负相关。同样,应激耐受性较差的小鼠含有较少的Romboutsia,导致对抑郁症的易感性更高。
Intestinimonas与IL-10水平呈正相关,与能够修复肠道损伤的促炎细胞因子DAO、D-LA呈负相关。
瘤胃球菌科UCG 011能够影响促炎细胞Th17的分化,减少促炎细胞因子IL-17的分泌,改善慢性炎症,缓解疼痛和焦虑抑郁症状。
毛螺菌FCS 020、链球菌、Marvinbryantia等被确定为抑郁症的危险因素。
毛螺菌科FCS 020能够诱导炎症反应,与血清脂多糖和细胞因子产生正相关,并且在自闭症儿童中丰度增加。
链球菌是一种与LPS密切相关的促炎性肠道菌群。
Marvinbryantia在慢性轻度应激大鼠中数量增加。
ADA 和 IL-18 R1是抗抑郁的保护性细胞因子。
VEGF_A和TNFSF 14是促进抑郁的危险因子。
抑郁症的严重程度与VEGF_A呈正相关。这可能与VEGF介导的血脑屏障功能障碍有关。许多抗抑郁药物通过调节VEGF_A发挥抗抑郁作用,因此VEGF_A对抑郁症的治疗效果具有预测作用。
TNFSF 14是TNF受体超家族的成员,其通过激活NF-κB信号通路促进促炎细胞因子的产生。TNF损害神经递质的合成并降低5-羟色胺的可用性,导致神经毒性代谢物的积累,这反过来会导致神经系统损伤并导致抑郁症。
循环细胞因子介导的肠道菌群对抑郁症的影响
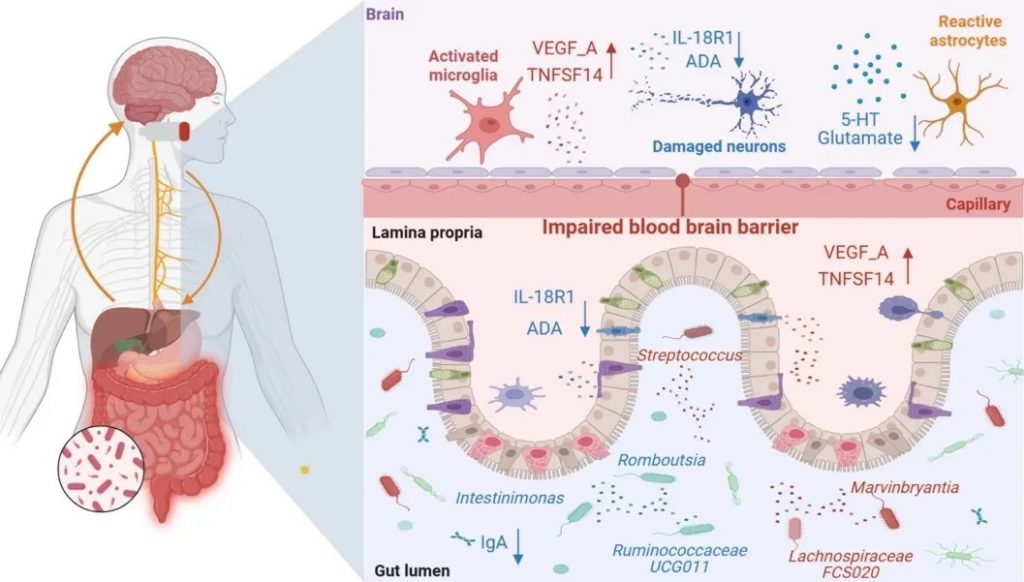
doi.org/10.1007/s13167-024-00379-z
➤ 重度抑郁症(MDD)
一项研究探讨了首发未经治疗的重度抑郁症(MDD)患者的肠道菌群组成与炎症因子和认知功能之间的关系。
研究发现MDD患者的肠道菌群多样性显著降低,某些菌群如拟杆菌属、Alistipes增加;一些菌群如梭菌科、Turicibacter减少。这些肠道菌群的改变与炎症因子(如IL-6、CRP)水平升高以及认知功能障碍(如执行功能、记忆力下降)显著相关。
在MDD患者中,拟杆菌科和拟杆菌属均与hsCRP、CCT1、CCT2呈正相关。
拟杆菌属是嗜酸性和革兰氏阴性的,是存在于人类胃肠道系统中非常丰富的细菌。拟杆菌属的某些菌株由于其许多能力对人类健康有利。然而,当人们经历压力,如休克,虐待,失去家庭成员等。拟杆菌属物种的某些菌株如脆弱拟杆菌可分泌脂多糖(LPS)、细菌淀粉样蛋白、内毒素(如脆弱溶素)和外毒素。这些神经毒素刺激各种细胞类型中TNF-α、IL-1β、IL-8、IFN-γ、CXCL 8和其他炎性细胞因子和趋化因子的释放,导致对这些细菌分子病原体的炎症反应。
活化的炎症反应可以破坏肠粘膜屏障以及血脑屏障,并且进一步地,它们可以活化CNS的小胶质细胞。发现活化的小胶质细胞参与促炎细胞因子的分泌,包括IL-1β、IL-6、TNF-α和TGF-β,从而有助于患有神经障碍的个体中认知障碍的发展。
Alistipes与IL-6呈正相关,与延迟记忆、总分和标准化评分呈负相关。
Alistipes也是促炎细菌,有研究表明,Alistipes属以IL-6依赖性方式参与促进炎症和肿瘤发生。本研究中Alistipes与IL-1、IL-6无显著相关性,与TNF-α呈负相关。因此,Alistipes可以通过炎症反应以外的其他方式加重认知障碍。
扩展阅读:
肠道重要菌属——另枝菌属(Alistipes),调节炎症情绪等的潜力菌
Clostridiaceae、Turicibacterae、Turicibacter与IL-1β和IL-6均呈负相关。
➤ 伴有厌食症的重度抑郁症
与健康个体相比,患有厌食症重度抑郁症患者具有不同的肠道微生物群,具有更高的CRP水平。伴厌食症的抑郁症患者中Blautia含量更丰富,并与CRP、HAMD评分和厌食症呈正相关。肠道菌群可能通过炎症因子CRP影响MDD和厌食症。
粪杆菌、拟杆菌、Roseburia和副拟杆菌与厌食、HAMD评分和CRP水平呈负相关。
短链脂肪酸通过干扰NF-κB通路发挥抗炎作用,补充短链脂肪酸可以减少炎症并缓解抑郁症状。
因此,MDD患者中产短链脂肪酸菌的减少可能会通过炎症反应引起抑郁症。这些炎症分子干扰食欲并促进厌食。下丘脑的炎症通过上调5-羟色胺的可用性,并刺激其在下丘脑中的信号传导途径而引起厌食症。
总的来说,由于肠道生态失调引起的免疫失衡是抑郁症发病的早期风险指标。这为利用无创肠道菌群检测对抑郁症进行早期筛查、及时预防和个性化治疗提供了依据。通过将非侵入性肠道菌群检测与现有方法(如心理问卷)相结合,可以共同预测和评估患抑郁症的风险。
心血管疾病(CVD)对人类健康构成了巨大的威胁。炎症是心血管疾病病理过程的普遍原因,包括免疫细胞的激活、积聚和炎症因子的释放。
➤ 动脉粥样硬化(AS)
动脉粥样硬化是CVD的病因之一。脂质沉积和持续性血管炎症被认为是动脉粥样硬化斑块进展的两个核心因素。
一项基于粪便宏基因组学、临床测量和流行病学的研究表明,日常饮食通过影响肠道微生物群促进动脉粥样硬化的形成,而抗炎反应功能障碍可能是核心过程。
脆弱拟杆菌的增加减少了乳酸杆菌的丰度,增加了脱硫弧菌科的丰度,导致葡萄糖或脂质代谢功能障碍,加重炎症反应。
循环中低密度脂蛋白含量显著增加,斑块中CD 36、F4/80增加,促进主动脉斑块的形成和动脉粥样硬化的进展。
衰老是动脉粥样硬化发展的另一个关键危险因素。
在炎症反应加重的衰老个体中,参与花生四烯酸(AA)代谢途径的组分(如20-HETE、PGF 2 α、花生四烯酸和LTB 4)显著增加。因此,建议肠道微生物群与动脉粥样硬化可能通过“肠道微生物群-代谢物-局部炎症-动脉粥样硬化”轴联系起来。
花生皮提取物(PSE)可降低动脉粥样硬化小鼠的血清TC和LDL-C含量,增加HDL-C含量,从而减缓动脉粥样硬化斑块的形成。
天麻素可以调节肠道微生物种类和丰度,降低促炎细胞因子TNF-α和IL-6的水平,增加抗炎因子IL-10的水平。
通心络干预是一种传统中药,通过增加肠道中益生菌的水平来改变斑块稳定性,从而增加有益代谢产物的含量,如反式阿魏酸,这可以抑制斑块中NLRP 3相关的炎症通路并稳定斑块。
乳酸杆菌的管理减少了来自受干扰的肠道微生物群的毒素,并增加了SCFA的水平,抑制了动脉粥样硬化的进展。
黄酮类化合物通过抑制TMA裂解酶而具有治疗冠心病的作用。
燕麦纤维可以防止动脉粥样硬化的恶化,阻断了TLR 4信号通路,降低了NF-κB p65的表达,并通过影响肠道微生物源性异丁酰-L-肉碱、戊酰肉碱、1-甲基鸟苷和2-甲基鸟苷来维持肠粘膜屏障的完整性。
鱼油衍生的长链单不饱和脂肪酸(LCMUFA),通过降低厚壁菌门和拟杆菌门的比例,增加肠道中阿克曼氏菌的丰度,上调SCFA以及SCFA诱导的一些胰高血糖素样物质来维持肠道微环境的平衡,降低了血清中炎性细胞因子的水平,抑制了动脉粥样硬化病变的进展。
支链氨基酸(BCAA)补充剂可以通过调节炎症来减轻动脉粥样硬化,包括减少巨噬细胞浸润、降低炎症因子的血清水平和抑制炎症相关信号通路。
➤ 慢性心力衰竭(CHF)
对53名慢性心力衰竭患者和41名对照成员的粪便宏基因组分析显示,慢性心力衰竭患者的肠道微生物群组成和代谢特征与对照组有显著差异,提示肠道微生物群功能障碍与慢性心力衰竭密切相关。
当肠道微生物群被破坏时分泌的LPS,以TLR4依赖性方式减少ZO-1紧密连接(TJ),并诱导肠上皮TJ的明显变形,导致肠屏障完整性的破坏。
心力衰竭患者会发生慢性全身炎症反应,血浆中几种促炎细胞因子的水平与疾病的严重程度和预后相关。肠道微生物群破坏和细菌产物(如LPS)易位到血液中是炎症过度状态的主要因素。
LPS是最强的促炎介质之一,可诱导心力衰竭患者血清中TNF-α、IL-1和IL 6的释放。另一方面,LPS通过TLR 4直接诱导心肌细胞损伤。
研究表明,晚期心力衰竭患者心脏中TLR 4的表达增加,与心脏炎性损伤高度相关,而抑制TLR 4可缓解心力衰竭的进展。
然而,一些研究表明,通过适当调节肠道微生物群,从而减轻或逆转心室重塑,可以减轻炎症。
目前有报道称,一些中药,如芪荔强心(QL),可稳定心力衰竭后的肠道菌群,通过减少炎症因子(如NLRP 3、IL-1β和TNF-α)的产生来抑制心肌纤维化和心脏重塑。
严重的心力衰竭总是伴随着肠道功能障碍。因此,重视肠功能的维持,可能会改善心力衰竭患者的预后。
肠道微生物群失衡会加重心血管疾病
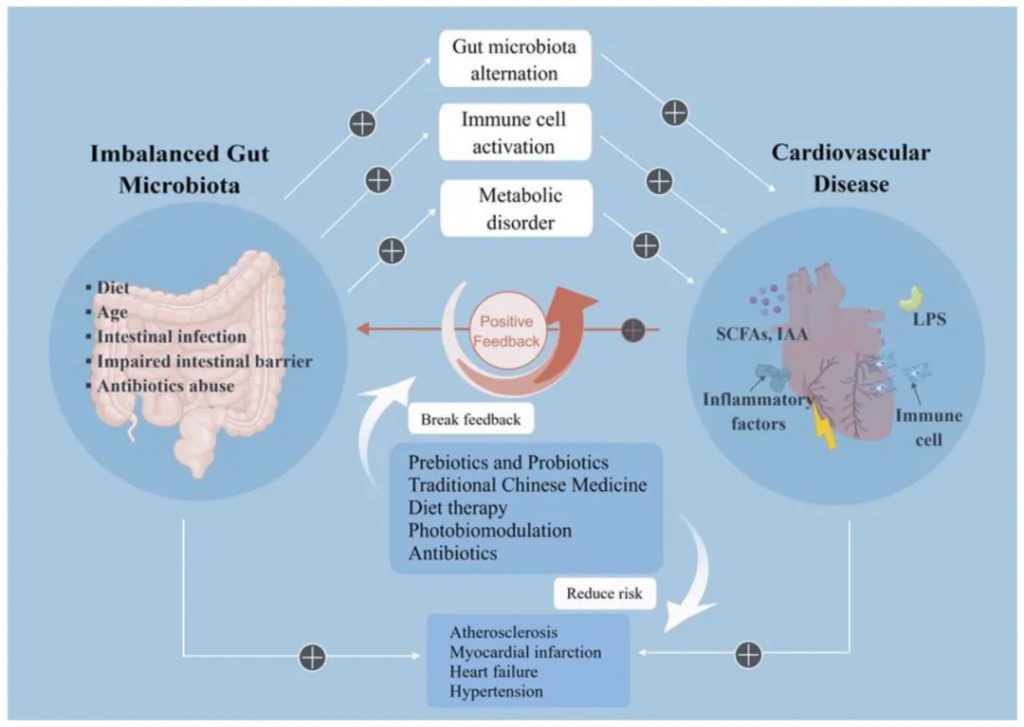
doi.org/10.3390/nu15030607
➤ 高血压
• 高盐饮食与肠道菌群失衡:
高盐饮食导致乳杆菌属减少,这些菌株能够产生肠道吲哚-3-乳酸,进而影响Th17细胞的活化。
• Th17细胞与炎症因子IL-17A:
Th17细胞的活化与IL-17A的产生增加有关,IL-17A通过上调肾脏中的钠转运蛋白(如钠氢交换蛋白3和氯化钠共转运蛋白)促进肾钠再吸收,这可能导致盐敏感性高血压。
• 益生菌治疗与血压调节:
用鼠乳杆菌(Lactobacillus murinus)进行的益生菌治疗可以预防小鼠的盐敏感性高血压,这表明通过调节肠道菌群可以影响血压。
• 高盐饮食与肠道菌群代谢物:
高盐饮食降低了肠道中脆弱拟杆菌和花生四烯酸的水平,这可能增加肠源性皮质酮的产生,进而提高血清和肠道中的皮质酮水平,促进血压升高。
• 饮食中钠的减少与SCFA:
减少饮食中的钠可以增加循环中的短链脂肪酸(SCFA),降低血压,这表明菌群代谢物SCFA可能在血压调节中发挥作用。
• 神经炎症与高血压:
肠道微生物群的紊乱及其代谢产物失调,会刺激巨噬细胞释放过量的炎症因子,加剧高血压的进展。
• 交感神经系统的激活与肠道菌群:
交感神经系统的激活增加了肠粘膜的渗透性,破坏了肠道微生物群的平衡,导致炎症细胞的动员和分化,这些炎性细胞返回大脑后加重神经炎症。
双歧杆菌能够增加eNOS的活性,降低血清过氧化氢酶的活性,这可能有助于维持血管的舒张和降低血压。
高纤维饮食增加了共生细菌的丰度,抑制了机会致病菌的繁殖,例如,产乙酸菌比例的增加有效降低了血压,减轻了心脏肥大和纤维化。
总的来说,维持肠道微生物群的稳定性对CVD的进展具有抑制作用。合适的饮食疗法,如益生菌和益生元补充剂,可以维持肠道微生物群的平衡,这已被证明可以有效降低血液中炎症因子的水平,改善心血管疾病的预后。
炎症性皮肤病代表了一组具有多种病因的疾病,包括遗传因素、感染和免疫失调,涉及先天性和适应性免疫系统中各种免疫细胞和炎症介质的激活。
一项研究首次使用双样本MR分析评估肠道微生物群与炎症性皮肤病之间的双向因果关系。
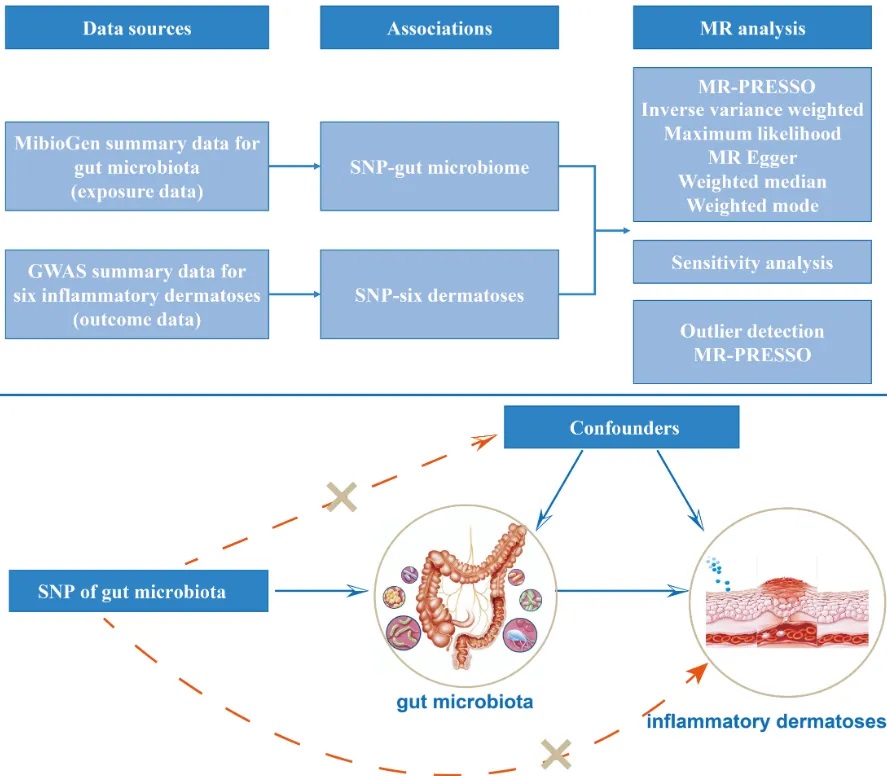
doi.org/10.3389/fimmu.2023.1231848
▸阿克曼氏菌属、瘤胃球菌属、双歧杆菌属、真杆菌属、粪球菌属等:
产生乙酸盐、丙酸盐和丁酸盐,通过GPCR和PPARγ受体调节免疫细胞,减少炎症因子释放,抑制组蛋白脱乙酰酶(HDAC),促进线粒体脂肪酸β-氧化。
▸乳酸杆菌和双歧杆菌:
增加色氨酸(Trp)和Trp代谢物,维持肠道屏障功能,减少痤疮炎症。
▸长双歧杆菌特殊作用:
将Trp代谢为吲哚-3-甲醛(I3C),通过AHR途径抑制Th2细胞,缓解特应性皮炎(AD)。
▸双歧杆菌、乳杆菌、Roseburia:
将多不饱和脂肪酸代谢为共轭亚油酸(CLA),抑制COX-2/5-LOX途径,抑制TLR4/NF-κB信号通路,减轻特应性皮炎皮肤病变。
▸硫酸盐还原菌(SRB):
如Desulfovibrionaceae,产生硫化氢(H2S),干扰丁酸盐氧化,损害肠道屏障,增加炎症因子释放。
以银屑病(牛皮癣)为例
银屑病是一种慢性复发性炎症性皮肤病,其特征是促炎细胞因子的释放增加。
Th-1、Th-17、Th-22细胞的扩增和活化, 一旦活化,这些细胞促进大量促炎介质的产生,包括但不限于来自角质形成细胞、淋巴细胞和其它免疫细胞的TNF-α、IL-6、IL-1、IL-17、IL-22、IL-23、VEGF、IFN-γ。此外,这些细胞促进皮肤病变的免疫发病机制,并在银屑病过程中驱动全身参与。
通过健康的饮食和运动获得的体重减轻能够改善银屑病的临床病程和治疗反应,甚至防止其发生,这种平衡的一个关键因素是肠道微生物群。(这在我们之前的文章中也详细阐述过)
肠道菌群在代谢综合征和银屑病中的多效性作用
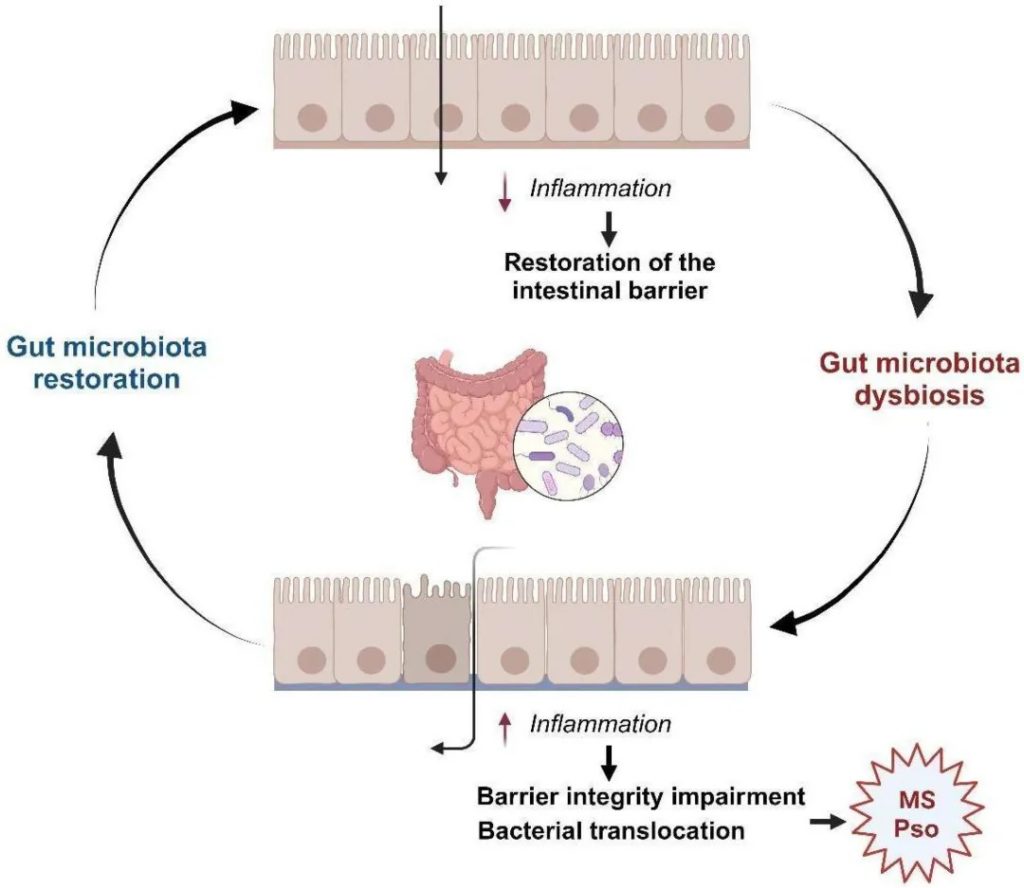
doi.org/10.3390/ijms25158098
哪些菌群产生炎症因子,影响银屑病发生发展?
厚壁菌门中,金黄色葡萄球菌(Staphylococcus aureus)产生超抗原如TSST-1,其刺激角质形成细胞和DC分别产生促炎细胞因子和IL-23。这导致Th17细胞活化和IL-17产生,促进银屑病特征。
放线菌门中,纹状体棒状杆菌(Corynebacterium striatum)直接刺激角质形成细胞和DC产生IL-1β、IL-6和IL-23,增强Th17细胞分化。
在变形菌门中,大肠杆菌和粘膜奈瑟氏菌(Neisseria mucosa)通过LPS激活巨噬细胞和DC,触发IL-23、IL-6和IL-1β的产生,从而稳定Th17细胞并促进IL-17的产生。
孢子形成细菌如梭菌和脆弱拟杆菌通过诱导结肠T淋巴细胞和平衡Th1/Th2/Th17细胞来调节免疫应答.
分节丝状细菌(SFB)诱导Th17细胞分化。
在标准治疗的协同作用下,可以建议采用适当的饮食或其他干预措施来调节肠道菌群,从而改善银屑病的临床表现,并降低合并症的发生率。
婴儿双歧杆菌35624和1:1:1的益生菌混合物(即长双歧杆菌CECT 7347、乳双歧杆菌CECT8145、鼠李糖乳杆菌CECT 8361)在8至12周的治疗过程后,要么降低促炎TNF-α和血浆C-反应蛋白,要么降低患者的银屑病面积和严重程度指数。
在用咪喹莫特治疗的BALB/c小鼠中,戊糖乳杆菌GMNL-77显著降低了红斑鳞屑病变和促炎细胞因子如IL-23和IL-27的mRNA水平。
有趣的是,补充短双歧杆菌CCFM683有效地下调了角蛋白16/17、IL-17和TNF-α的表达,通过调节FXR/NF-κB通路和角质形成细胞增殖来改善银屑病。
以上我们了解了炎症因子在多种疾病中的作用机制,以及肠道菌群如何通过影响这些因子的水平和功能来调节炎症反应。炎症因子不仅反映了炎症的状态,还可以作为疾病进展和治疗效果的生物标志物。
为了有效地评估炎症因子的变化,临床上采用了多种检测方法。这些方法能够提供准确的炎症因子水平信息,辅助医生做出及时的诊断和治疗决策。接下来,我们将详细介绍几种常用的检测技术。
检测体内炎症通常需要特定的血液检查,以测量指示炎症反应的各种标志物。
◉ ELISA(酶联免疫吸附测定)
原理:抗原-抗体特异性结合,通过酶标记检测
优点:
灵敏度高、特异性强、可批量检测
缺点:
检测时间较长、操作步骤多、成本较高
适用:
IL-1β、IL-6、TNF-α等细胞因子的定量检测
◉ 化学发光免疫分析
原理:利用化学发光物质标记抗体或抗原
优点:
检测速度快、灵敏度高、自动化程度高
缺点:
仪器要求高、试剂成本高
适用:CRP、PCT等急性期蛋白的快速检测
◉ 免疫比浊法
原理:
抗原抗体形成免疫复合物产生浊度
优点:
操作简单、成本低、检测快速
缺点:
灵敏度较低、易受干扰
适用:CRP、血清淀粉样蛋白等的常规检测
◉ 流式细胞术
原理:通过荧光标记检测细胞因子
优点:
可同时检测多个指标、特异性强、定量准确
缺点:
设备昂贵、要求技术人员专业水平高
适用:细胞内细胞因子和膜表面标志物检测
◉ PCR技术
原理:检测炎症因子的基因表达水平
优点:
灵敏度极高、特异性强、可检测微量样本
缺点:
操作复杂、成本高、易污染
适用:炎症因子基因表达研究
◉ 蛋白质芯片
原理:多种抗原抗体反应的微阵列分析
优点:
可同时检测多个指标、样本用量少、高通量
缺点:
成本高、技术要求高、标准化难度大
适用:多种炎症因子的同时检测
◉ 肠道菌群健康检测
原理:通过分析肠道菌群及其代谢产物的变化情况,间接反映人体的炎症状态
优点:
非侵入性、可重复采样、早期预警、利于干预、反映整体状态、长期监测
缺点:
成本高、技术要求高、数据分析复杂
适用:多种炎症因子的同时检测
通过肠道菌群监测炎症因子的方法虽然存在一些局限性,但其独特的预警价值和非侵入性特点使其成为传统炎症监测方法的重要补充。
随着技术的进步和研究的深入,这种检测方法的局限性正通过多种创新手段得到克服:
这些技术创新显著提升了肠道菌群检测在临床应用中的价值,特别是在精准医疗和预防医学领域,使其成为疾病预警和健康管理的重要工具。
饮食方式
地中海饮食(MD)包括水果、蔬菜、全谷物、橄榄油、红酒等,可能对IBD有益。有证据表明,地中海饮食后可降低IBD和炎症的发生率。地中海饮食有助于抗炎菌群的存活,并防止肠道微生物群的失调发展。
通过调节肠道微生物群,改变肠道微生物组成,增加SCFA水平,降低尿TMAO水平,地中海饮食可以成为阿尔茨海默的潜在治疗干预措施。此外,更严格地遵守地中海饮食会延缓阿尔茨海默的进展,并提供1.5-3.5年的阿尔茨海默防护。
更多抗炎饮食,详见我们之前的文章:
益生菌
益生菌引入人体后,不仅会产生抗炎代谢产物,下调IL-6、IL-12、TNF-α等炎症因子和NF-κB通路等相关信号通路,还有助于抑制病原体的生长,修复肠道屏障,调节初始淋巴细胞的分化和增殖。
在BALB/c小鼠中,引入干酪乳杆菌可以预防肠道和关节炎症,不仅在膝盖,还在肠系膜和腘淋巴结中下调IL-1β、IL-6、IL-17、IL-23、TNF-α。
在一项涉及18名活动性强直性脊柱炎患者的试点研究中,补充嗜酸乳杆菌和唾液酸乳杆菌4周后,巴斯强直性脊柱炎疾病活动指数和视觉模拟量表有所改善。
此外,干酪乳杆菌、嗜酸乳杆菌、罗伊氏乳杆菌、双歧杆菌和嗜热链球菌的组合成功降低了用光受体间类维生素A结合蛋白免疫的C57BL/6小鼠的视网膜组织学评分,这是一种自身免疫性葡萄膜炎的动物模型。
在牙周炎的背景下,引入乳双歧杆菌HN019或罗伊氏乳杆菌显著改善了牙周炎的临床指标,包括减少探诊深度、减少探诊出血和降低手术风险。上述临床试验或动物实验中没有报告严重不良事件。
下一代益生菌,如F.prausnitzii、A.muciniphila,它们对IBD的治疗效果已经得到证实。这些益生菌可以减少浸润的巨噬细胞,抑制NF-κB信号通路,减少IL-8的产生,最终降低结肠炎的严重程度。
考虑到IBD和常见肠易激综合征之间肠道生态失调的相似模式,下一代益生菌在肠易激综合症管理中的应用也可能很有前景。
益生元
益生元是指微生物选择性利用以带来健康益处的底物。菊粉和低聚果糖等益生元的微生物发酵会产生代谢物(如SCFA),进一步调节肠道微生态系统和免疫反应。
在SpA的背景下,据报道,口服长链菊粉和低聚果糖可显著降低HLA-B27转基因大鼠结肠炎和关节炎的发病率。
对于牙周炎的动物模型,口服甘露寡糖成功地防止了牙槽骨丢失,降低了IL-10和IFN-γ的表达,下调了TNF-α和IL-1β的水平,并显著恢复了肠绒毛和隐窝深度。
值得注意的是,益生元具有广泛可接受的安全性,报告的严重不良事件很少。
后生元
在国际益生菌和益生元科学协会的指导下,益生元是指死亡的微生物或其对宿主有益的成分,包括SCFA、SBA等。
在SpA的背景下,直接外源性补充短链脂肪酸可以减轻各种动物模型中的关节炎严重程度。此外,口服短链脂肪酸还可以防止效应T细胞的激活和免疫细胞向脾脏和颈部淋巴结的运输,最终降低C57BL/6J和Kaede转基因小鼠模型中葡萄膜炎的严重程度。
该领域对原发性硬化性胆管炎的研究相对丰富。已经启动了几项为期12-24周的II期临床试验,报告称,无论是去甲熊去氧胆酸(SBA的衍生物)、奥贝胆酸(FXR配体)还是西洛菲索(FXR激动剂),都能显著降低原发性硬化性胆管炎患者(有或没有IBD)血清中的碱性磷酸酶。
此外,在患有IBD相关肝损伤的C57BL/6J小鼠中,添加乳脂球膜(Milk Fat Globule Membrane)与促炎细胞因子减少、Faccalibacumum和Roseburia恢复、结肠炎和肝损伤减轻以及谷胱甘肽转移酶途径的重新激活有关。
对于牙周炎患者,口服热灭活植物乳杆菌L-137有效地减少了同时接受支持性牙周治疗且基线深度不小于4mm的患者的探诊深度。
此外,小檗碱促进丁酸盐的产生,改善肠道屏障,降低循环LPS和促炎细胞因子水平,下调牙槽骨中的促炎细胞,最终改善牙周炎动物模型中的牙槽骨损失。同样,在后生元中也没有报告严重的不良事件。
抗生素
临床上,抗生素用于杀死致病菌或抑制其增殖。
在SpA的背景下,口服美罗培南和万古霉素有效地抑制了BALB/c和SKG小鼠脾脏中Th1和Th17细胞减少的外周附着点炎的发展。
对于葡萄膜炎,甲硝唑或万古霉素已被证明可以缓解葡萄膜炎,并增加用光受体间维甲酸结合蛋白预处理的B10.RII小鼠肠外淋巴组织中Tregs的丰度。
对于原发性硬化性胆管炎患者,应用万古霉素、甲硝唑和米诺环素可改善肝酶和梅奥风险评分。
此外,阿莫西林联合甲硝唑、单独甲硝唑和阿奇霉素可有效改善牙周炎患者的临床结果,其中阿莫西林联合甲硝唑在减少探诊袋深度、探诊出血和提高临床附着水平方面表现最佳。
粪菌移植 (FMT)
FMT是指将健康人类粪便中的微生物群移植到患者消化道中,使肠道微生态系统快速恢复的疗法。FMT的效果受到各种因素的干扰,包括供体的粪便质量、粪便的制备程序、给药方法和频率、FMT前的个体化肠道微生物组成(包括细菌、真菌和病毒)以及操作员技术。
一项试点随机对照研究表明,FMT组的内镜严重程度指数降低,C反应蛋白水平降低,这证明了FMT在维持克罗恩病缓解方面的疗效。
FMT还可以通过改善肠道微生物群的失调来减少肝脏脂肪积聚,从而减少NAFLD。
对FMT在阿尔茨海默病治疗中的作用的系统综述表明,FMT可以恢复SCFA和健康的微生物组,从而破坏阿尔茨海默患者的Aβ寡聚体,从而减少阿尔茨海默的发病机制。进一步机制研究表明,FMT降低了结肠、血清和SN中的LPS水平,抑制了TLR4/MyD88/NF-κB信号通路,使肠道微生物群和SCFA正常化,增加了突触素I的表达,并改善了阿尔茨海默模型小鼠的认知缺陷和Aβ沉积。
在许多慢性疾病中,例如肥胖症、动脉粥样硬化、2型糖尿病、炎性肠病、多发性硬化、类风湿性关节炎等,炎症是主要原因。肠道菌群的结构成分可能引发炎症,这可能引发一系列涉及白细胞介素和其他细胞因子的炎症反应。同样,某些短链脂肪酸和细菌代谢的其他代谢副产物可能有助于抑制炎症反应。因此,肠道菌群改变往往可能是炎症的预警信号,更早于临床症状的出现,其在疾病防治中的价值正逐渐被认识和挖掘。
特别是在当今精准医疗时代,结合人工智能深度学习算法、多组学整合分析等创新技术,肠道菌群检测的准确性和临床应用价值将得到进一步提升。随着检测技术的不断优化、数据分析方法的持续改进,以及临床验证研究的深入开展,肠道菌群检测将在疾病预警、健康管理、个体化治疗,响应监测以及预后评估中发挥越来越重要的作用。
未来,深入了解肠道微生物诱导的炎症因子的信号机制,有助于为肠道微生物诱导的炎症性疾病开发更精确、更有效的治疗方案。
本文内容仅供学习和交流目的,不构成任何形式的医疗建议。
主要参考文献
Chaudhary S, Kaur P, Singh TA, Bano KS, Vyas A, Mishra AK, Singh P, Mehdi MM. The dynamic crosslinking between gut microbiota and inflammation during aging: reviewing the nutritional and hormetic approaches against dysbiosis and inflammaging. Biogerontology. 2024 Oct 23;26(1):1.
Bai S, Bai H, Li D, Zhong Q, Xie J, Chen JJ. Gut Microbiota-Related Inflammation Factors as a Potential Biomarker for Diagnosing Major Depressive Disorder. Front Cell Infect Microbiol. 2022 Mar 15;12:831186.
Wu, J., Ou, G., Wang, S. et al. The predictive, preventive, and personalized medicine of depression: gut microbiota and inflammation. EPMA Journal (2024).
Liu P, Gao M, Liu Z, Zhang Y, Tu H, Lei L, Wu P, Zhang A, Yang C, Li G, Sun N, Zhang K. Gut Microbiome Composition Linked to Inflammatory Factors and Cognitive Functions in First-Episode, Drug-Naive Major Depressive Disorder Patients. Front Neurosci. 2022 Jan 28;15:800764.
Secchiero, P.; Rimondi, E.; Marcuzzi, A.; Longo, G.; Papi, C.; Manfredini, M.; Fields, M.; Caruso, L.; Di Caprio, R.; Balato, A. Metabolic Syndrome and Psoriasis: Pivotal Roles of Chronic Inflammation and Gut Microbiota. Int. J. Mol. Sci. 2024, 25, 8098.
Wang, W.; Zhu, L.-J.; Leng, Y.-Q.; Wang, Y.-W.; Shi, T.; Wang, W.-Z.; Sun, J.-C. Inflammatory Response: A Crucial Way for Gut Microbes to Regulate Cardiovascular Diseases. Nutrients 2023, 15, 607.
Mao R, Yu Q, Li J. The causal relationship between gut microbiota and inflammatory dermatoses: a Mendelian randomization study. Front Immunol. 2023 Sep 27;14:1231848.
Heinzel, S., Jureczek, J., Kainulainen, V. et al. Elevated fecal calprotectin is associated with gut microbial dysbiosis, altered serum markers and clinical outcomes in older individuals. Sci Rep 14, 13513 (2024)
Saedi, S., Derakhshan, S., Hasani, A. et al. Recent Advances in Gut Microbiome Modulation: Effect of Probiotics, Prebiotics, Synbiotics, and Postbiotics in Inflammatory Bowel Disease Prevention and Treatment. Curr Microbiol 82, 12 (2025).
Jukic A, Bakiri L, Wagner EF, Tilg H, Adolph TE. Calprotectin: from biomarker to biological function. Gut. 2021 Oct;70(10):1978-1988.
Zhao M, Chu J, Feng S, Guo C, Xue B, He K, Li L. Immunological mechanisms of inflammatory diseases caused by gut microbiota dysbiosis: A review. Biomed Pharmacother. 2023 Aug;164:114985.
Tie Y, Huang Y, Chen R, Li L, Chen M, Zhang S. Current insights on the roles of gut microbiota in inflammatory bowel disease-associated extra-intestinal manifestations: pathophysiology and therapeutic targets. Gut Microbes. 2023 Dec;15(2):2265028.
Nigam M, Devi K, Coutinho HDM, Mishra AP. Exploration of gut microbiome and inflammation: A review on key signalling pathways. Cell Signal. 2024 Jun;118:111140.
Soares CLR, Wilairatana P, Silva LR, Moreira PS, Vilar Barbosa NMM, da Silva PR, Coutinho HDM, de Menezes IRA, Felipe CFB. Biochemical aspects of the inflammatory process: A narrative review. Biomed Pharmacother. 2023 Dec;168:115764.

谷禾健康

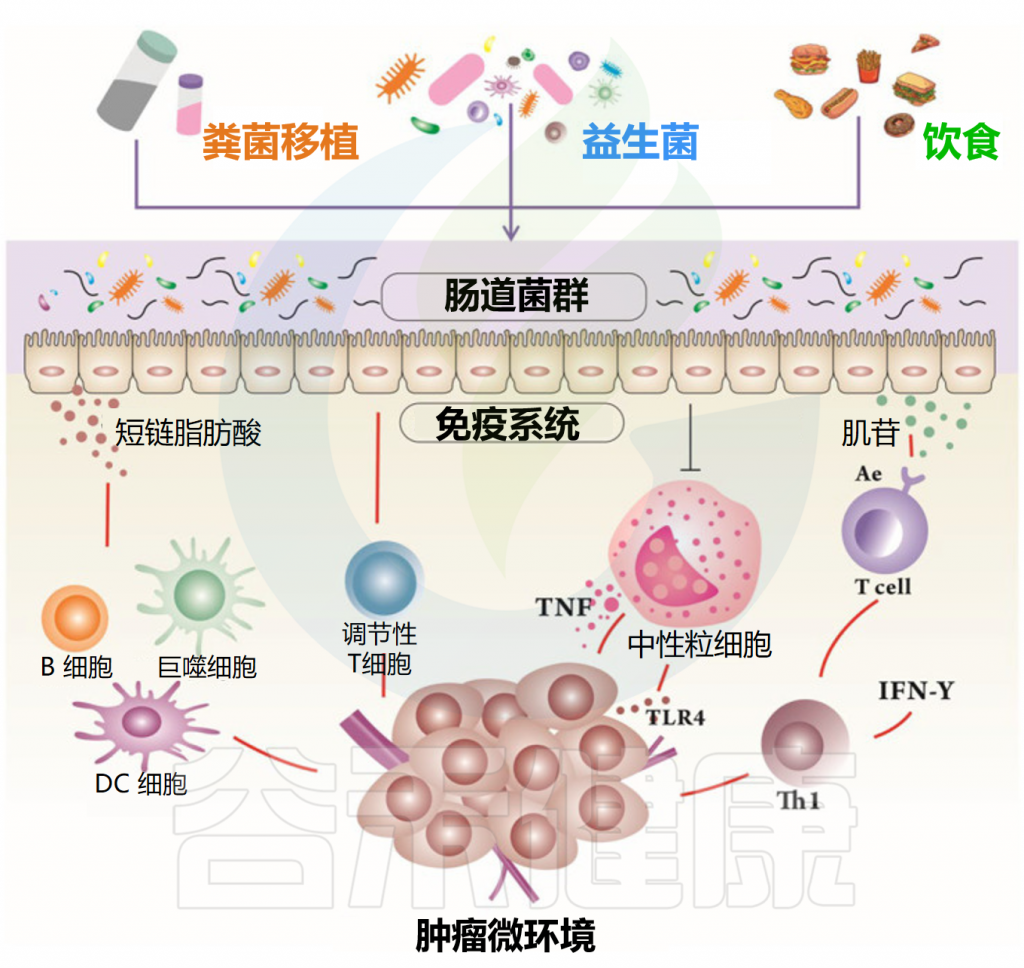
癌症是重要的死亡原因之一,影响着全球至少数百万人。据世界卫生组织统计,发现全球范围内癌症负担正在迅速增加。
癌症的发展不仅仅是癌细胞的生长和增殖,其肿瘤微环境(TME)也与之共同进化,主要参与肿瘤的发生、发展、转移和治疗反应。
肿瘤微环境包含肿瘤细胞、肿瘤浸润免疫细胞、肿瘤相关其他细胞、细胞外基质、非细胞成分和非癌性宿主细胞,微生物群也是肿瘤微环境中的细胞成分之一,发挥着重要且不可替代的作用,因为微生物群落可以调节各种生物过程,包括细胞代谢、生理学和免疫反应等。
谷禾以前的文章曾多次讲述,肠道菌群与肿瘤尤其是胃肠道肿瘤的发生、发展密切相关。肠道微生物群可以通过调节细菌的特定生物活性代谢物来影响肠道微环境。例如短链脂肪酸(SCFA)作为肠道细菌发酵产生的典型代谢物,在肠道稳态和人体健康中发挥着关键作用。
短链脂肪酸可以调节能量代谢、增强肠道屏障并发挥抗炎作用。短链脂肪酸作为免疫功能的关键调节剂,可以调节T细胞、B细胞、巨噬细胞和其他免疫细胞。短链脂肪酸由于与G蛋白偶联受体(GPCRs)的结合或对组蛋白脱乙酰酶(HDACs)的抑制,可以影响免疫反应的信号转导途径,调节免疫相关炎症介质的释放,从而调节肿瘤免疫微环境。
近年来,短链脂肪酸对肿瘤微环境的影响被广泛研究。在结直肠癌和胰腺癌实验模型中,已证明丁酸盐可以增强CD8+ T细胞的抗肿瘤作用。此外,独特组成的微生物群可能还有助于诊断和定位恶性肿瘤,全面了解肠道微生物群及其代谢物与肿瘤微环境之间的相互作用有望成为诊断、治疗和预防肿瘤的新方法。
在本文中,我们(1)讲述了微生物群及其代谢物短链脂肪酸对肿瘤微环境和宿主免疫的影响;(2)短链脂肪酸在癌症发生、发展和治疗方面的相互作用;(3)介绍基于微生物群的癌症诊断和预后;(4)讨论了靶向微生物-短链脂肪酸轴调整肿瘤微环境以最大限度地提高癌症治疗效果的各种方法,包括粪便微生物移植、饮食调整和施用益生菌。这将为未来基于肠道菌群和肿瘤微环境的癌症靶向治疗奠定基础。
什么是肿瘤微环境?
肿瘤微环境(TME)是指肿瘤细胞及其周围的局部环境,包括周围的血管、免疫细胞、细胞外基质、细胞间信号分子等。
肿瘤细胞和肿瘤微环境之间永久的相互关系不仅为肿瘤细胞提供了生长和扩散所需的物质和信息,还显著影响肿瘤的发生、进展、转移和治疗反应。
肿瘤微环境的组成部分
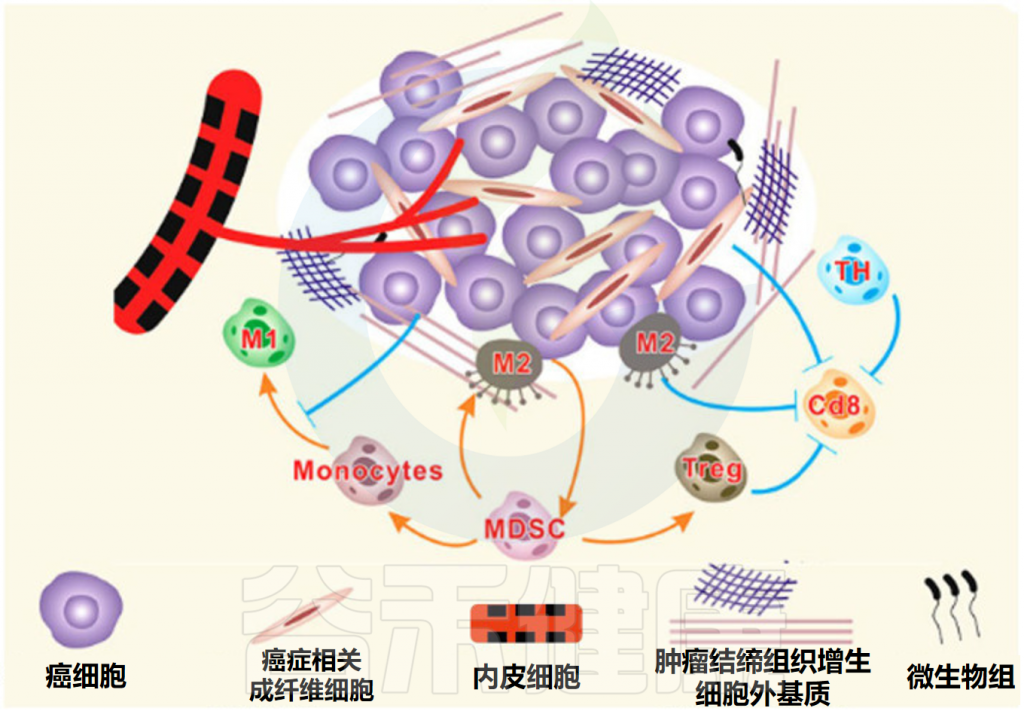
Feng P,et al.Front Microbiol.2024
▸ 前沿资料
最近,具有抗肿瘤能力的常规药物包括阿司匹林、塞来昔布、β-肾上腺素能拮抗剂、二甲双胍和他汀类药物,通过靶向肿瘤微环境成分显示出在联合治疗中的潜在用途。
★ 微生物群是肿瘤微环境的一个组成部分
肿瘤微环境是一个复杂的环境,其中微生物群被认为是一种新颖但必不可少的元素。微生物群在功能上减少肿瘤细胞代谢,例如炎症、基因毒素的产生以及具有各种特征的细菌代谢物的产生。
越来越多的证据表明,肿瘤微环境中微生物群及其代谢物之间的相互作用可以影响宿主免疫和肠上皮,最终驱动或抑制肿瘤生长。
研究报告称,肠道细菌可以调节人体免疫细胞的激活,使其迁移到肿瘤微环境来消除肿瘤细胞。此外,肠道微生物群和肿瘤微环境之间复杂的相互作用可能会使肿瘤细胞逃避免疫系统并增殖。了解这个系统将为癌症的预防、诊断和治疗带来希望。
肿瘤微环境在癌症免疫治疗中的作用
肿瘤微环境(TME)中肿瘤相关巨噬细胞(TAM)和其他免疫抑制细胞的大量积累对癌症的进展和治疗效果有重要影响。
★ 肿瘤微环境的免疫细胞影响癌症进展和治疗效果
CD163是一种标志物,主要表达在巨噬细胞表面,尤其是在肿瘤相关巨噬细胞(TAM)上。CD163阳性的TAM在肿瘤微环境中的高表达与免疫抑制环境的形成有关,这种环境可以促进肿瘤的生长和扩散,并且与病人的不良临床结果相关。
当CD163+ TAM的消耗导致免疫抑制减少,意味着通过减少这些免疫抑制性的巨噬细胞,可以增强细胞毒性T细胞(CTLs)的浸润和活性,从而有助于控制肿瘤的发展。这是当前癌症免疫治疗研究的一个重要方向,即通过调节肿瘤微环境中的免疫细胞组成来增强机体对肿瘤的免疫反应。
简而言之,CD163阳性的表达通常与肿瘤微环境中的免疫抑制状态相关,通过靶向这些细胞,可以改善免疫系统对肿瘤的攻击能力,为癌症治疗提供新的策略。
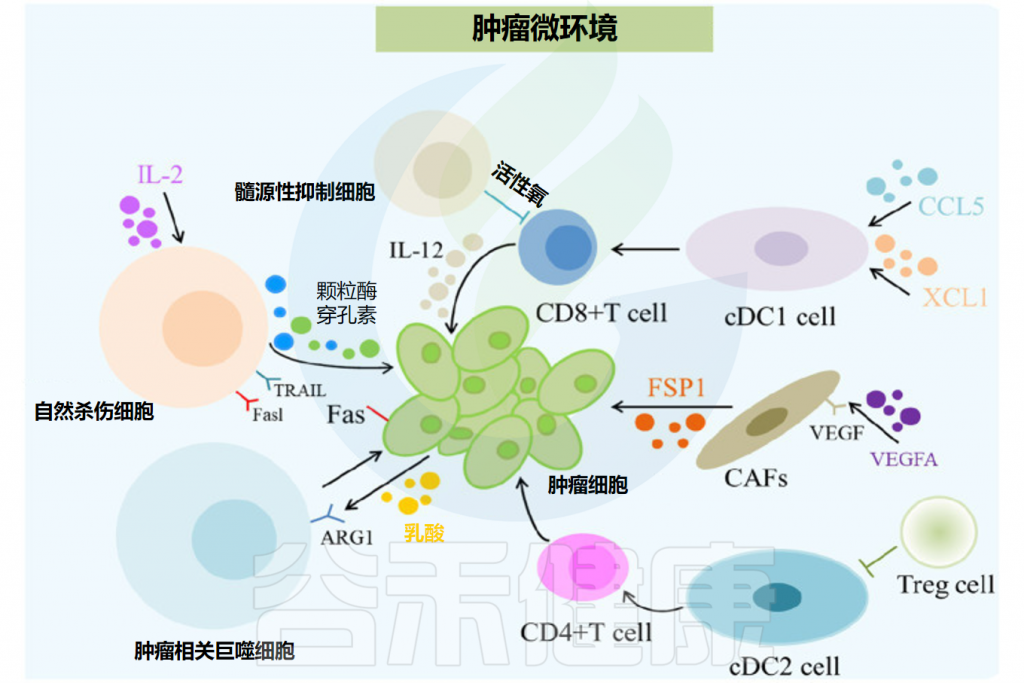
Feng P,et al.Front Microbiol.2024
★ 非细胞成分也调节癌细胞的增殖和治疗效果
肿瘤微环境的非细胞成分对于癌症进展、侵袭性和化疗耐药性也至关重要。细胞外基质的硬度促进肿瘤细胞存活和增殖,同时上调整合素信号传导。
透明质酸是一种CD44受体,在各种癌症的肿瘤微环境中含量丰富。它们的相互作用激活促癌信号通路并诱导非编码RNA种类的上调,例如miR-10b/miR-302/miR-21和lncRNA。在胰腺癌中,间质与不同的透明质酸高度反应,导致间质液压力升高,从而导致血管塌陷和化疗效果不佳。
注:使用重组透明质酸酶靶向胰腺肿瘤中的酶已被证明可以降解透明质酸并通过减少转移和提高生存率来增强治疗效果。
此外,肠道菌群的分泌成分也与肿瘤微环境有关。例如,外膜囊泡(OMV)可以将肿瘤微环境重新编程为pro-TH1模式,而代谢物(如丁酸盐和烟酸)可以介导结肠上皮中IL-18的Gpr109a依赖性诱导,抑制结肠炎和结肠癌症。
肠道微生物群对肿瘤微环境的影响
肠道微生物群对于宿主免疫系统的发育、维持和生长至关重要。肠道生态系统可以通过影响骨髓的流入、免疫环境、淋巴细胞以及炎症和代谢模式来影响局部和远处的肿瘤。
肠道微生物群参与多种细胞内信号通路的调节
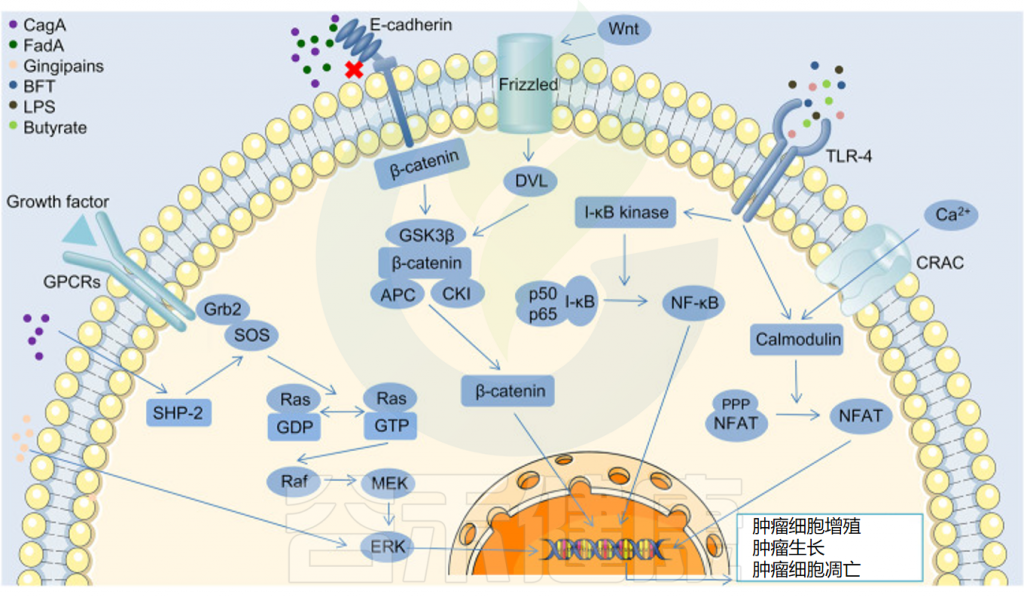
Sun J,et al.ISME J.2023
★ 肠道微生物群是肿瘤微环境的重要调节剂
肠道微生物群正在成为结直肠癌、胃癌和肝癌等各种癌症中肿瘤微环境的关键调节剂。例如,之前的一项研究报告称,具核梭杆菌(Fusobacterium nucleatum)等细菌可以通过抑制人类免疫反应来增强肿瘤生长。
此外,乳腺癌和卵巢癌与微生物群中的特定生物特征有关,例如卷曲乳杆菌(Lactobacillus crispatus)的丰度,它与癌症的发生呈负相关。
★ 肠道微生物群的代谢物影响肿瘤治疗
先前的研究发现,肠道微生物群代谢活动的产物显著影响与肥胖、血脂和能量稳态相关的宿主代谢途径。因此,揭示肠道微生物群的代谢物和亚代谢物如何影响免疫细胞并重塑肿瘤微环境可以极大地促进肿瘤治疗的发展。
肠道微生物群的代谢物进入宿主细胞并与人体免疫反应相互作用,促进各种肿瘤抑制和免疫调节分子的产生。它们还通过维持上皮屏障和肠道的完整性来抑制炎症。
肠道微生物代谢物,如短链脂肪酸和肌苷,直接或间接与肿瘤微环境相互作用,重塑它,从而影响癌症过程。短链脂肪酸有助于维持肠道稳态和调节肠道屏障功能。
肠道微生物代谢物影响抗癌免疫
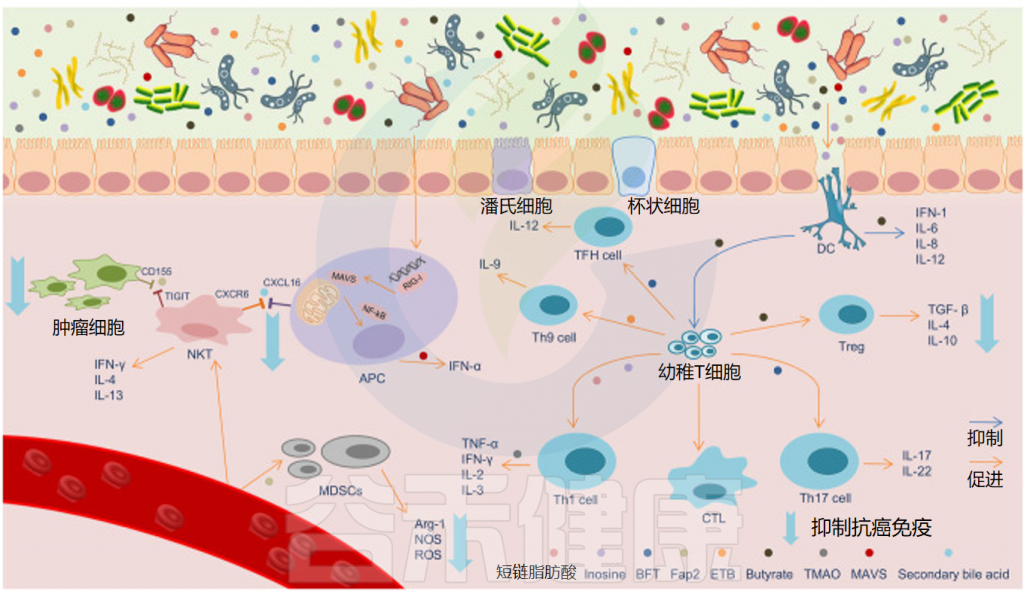
Sun J,et al.ISME J.2023
此外,一些脂肪酸和胆酸与炎症有关。丁酸盐等短链脂肪酸可由普拉梭菌(Faecalibacterium prausnitzii)产生,控制血管生成并减少促血管生成因子的表达。因此,增加丁酸盐浓度被认为可以减缓并阻止癌症的生长。
相反,脱氧胆酸和石胆酸可通过增加活性氧的产生而导致DNA损伤。最近的研究表明,肠道细菌假长双歧杆菌(B.pseudolongum)可以产生肌苷,在外源IFN-g存在的情况下驱动Th1细胞分化。
★ 影响免疫治疗的效果
此外,假长双歧杆菌(B.pseudolongum)通过与T细胞上的腺苷A2A受体相互作用,与免疫检查点治疗(例如抗CTLA-4和抗PD-L1)的反应相关。
CTLA-4和PD-L1是免疫检查点疗法的主要靶点,该疗法涉及膜结合分子,这些分子在初始刺激后会阻碍不受限制的T细胞反应。因此,癌细胞可以通过利用这种机制来逃避免疫监视。
然而,在重新激活低效T细胞的同时,免疫检查点抑制剂(ICIs)可以恢复对肿瘤抗原的反应。临床研究和临床前试验表明,肠道微生物群影响免疫检查点抑制剂的疗效,从而解释了患者对ICI反应的显著差异。因此,深入了解肠道微生物群、其代谢物和宿主免疫系统如何相互作用以重塑和调节肿瘤微环境,有望推动癌症免疫治疗的发展。
总体而言,肠道微生物群对肿瘤微环境的影响很复杂,目前尚未完全了解。然而研究表明,在控制肠道微生物以影响癌症治疗的有效性和改善患者预后方面具有潜在的应用前景。
近年来,微生物和微生物的代谢产物对宿主的影响越来越受到人们的关注。
短链脂肪酸由少于6个碳原子组成,是共生细菌通过膳食纤维在胃肠道中发酵产生的典型代谢产物,已被广泛研究。短链脂肪酸的产生是一个复杂的过程,由多种细菌在结肠中进行。在所有短链脂肪酸中,乙酸盐、丙酸盐和丁酸盐最具代表性。
短链脂肪酸对人体的基本作用
• 提供能量
当短链脂肪酸产生时,第一个功能是作为底物提供能量。大多数短链脂肪酸通过两种转运蛋白被结肠细胞吸收:单羧酸转运蛋白1(MCT-1)和钠偶联单羧酸转运蛋白1(SMCT-1)。
短链脂肪酸通过MCT-1以H+依赖性电中性方式转移,而短链脂肪酸阴离子通过SMCT-1运输。
• 调节生理反应
除了为结肠细胞提供能量外,短链脂肪酸还通过血液运输到全身的各个组织和器官,然后通过两种主要机制调节生物反应。
一方面,短链脂肪酸会降低组蛋白去乙酰化酶(HDAC)的活性或表达,从而导致组蛋白乙酰化增加。据报道,HDACs的异常激活存在于多种类型的癌症中。
另一方面,短链脂肪酸与G蛋白偶联受体(GPCR)结合,主要针对GPR41(更名为游离脂肪酸受体(FFAR)3)、GPR43(更名为FFAR2)和GPR109A,发挥相应的信号级联效应。一些研究表明GPCRs的异常表达或活性参与多种肿瘤进展。
短链脂肪酸调节炎症反应的机制
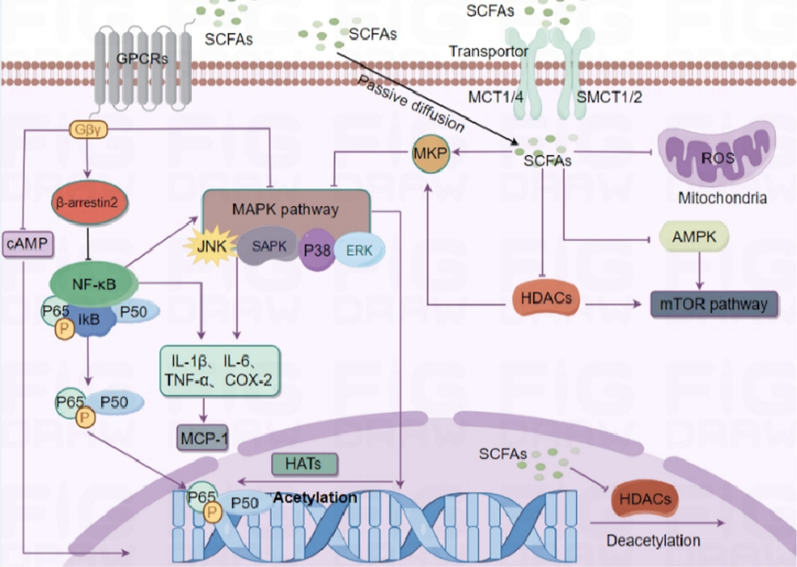
He M,et al.J Transl Med.2024
• 其他作用
既往研究总结了短链脂肪酸在调节能量代谢、保护肠道完整性、改善炎症反应等方面的作用,但短链脂肪酸对免疫系统的影响尚未引起足够的重视。一些作用罗列在下表中:


Dong Y,et al.Front Immunol.2023
短链脂肪酸对代谢稳态的影响
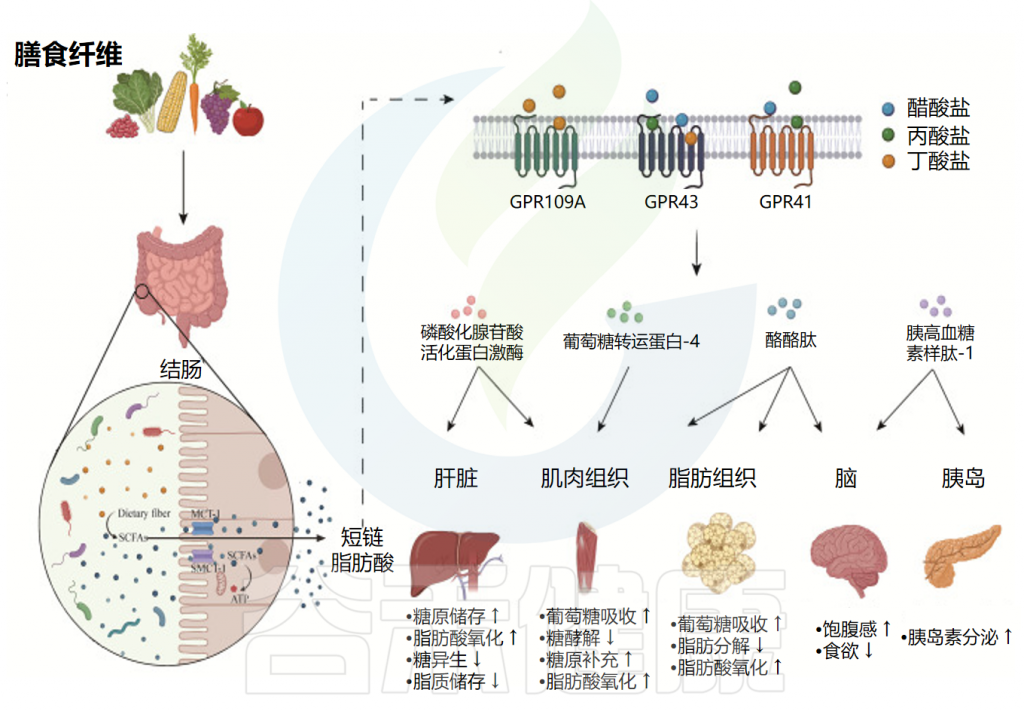
Dong Y,et al.Front Immunol.2023
在肿瘤免疫微环境中起重要作用
• 影响T细胞的分化
T细胞是肿瘤免疫微环境中的重要细胞,T细胞浸润减少或功能障碍会导致许多癌症治疗临床效果不佳。
由于幼稚T细胞在功能水平上表达时没有GPR41和GPR43,因此短链脂肪酸可以直接影响依赖于HDAC抑制剂活性的幼稚T细胞的分化。
通过这种方式,短链脂肪酸促进未成熟的CD4+ T细胞分化为不同的调节性T细胞和效应T细胞,这取决于不同的极化条件,比如细胞因子表型和免疫环境。
短链脂肪酸诱导mTOR-S6K和STAT3的激活,参与T细胞分化所需细胞因子的产生。无论极化条件如何,短链脂肪酸都会促进白细胞介素(IL)-10的表达,但只能在特定环境下促进IL-17或干扰素-γ (IFN-γ)的产生。
• 影响白细胞介素等细胞因子的含量
有趣的是,分化T细胞(例如辅助性T(Th)1细胞)中 IL-10的分泌取决于与GPR43的相互作用。此外,短链脂肪酸上调Blimp-1的表达,这与Th1细胞中IL-10的产生和T细胞功能的维持有关。
在高脂肪饮食治疗的小鼠中,IL-17和IFN-γ的水平升高,而转化生长因子-β(TGF-β)和IL-10的水平降低。这意味着T细胞向Th17和Th1细胞的分化程度较高,而向调节性T(Treg)细胞的分化程度较低,特别需要注意的是:短链脂肪酸可以扭转这种情况。
CD4+ T细胞和先天淋巴细胞中IL-22被发现可以通过短链脂肪酸进行调节。丁酸盐通过与GPR41结合增加转录因子HIF-1α和AhR的表达,同时伴随着STAT3和mTOR的激活。
同时,丁酸盐促进的HIF-1α与IL-22启动子的HRE结合涉及组蛋白乙酰化。CD4+ T细胞分化过程也受到表观遗传调控。不同的CD4+ T细胞亚群具有特定的转录因子,例如Th1细胞的T-bet、Th17细胞的RORγT和Treg细胞的FOXP3。丁酸盐通过乙酰化 H4K16增加分化的Th17细胞中RORγT的表达,但在Th17极化条件下对初始CD4+ T 细胞没有反应。
• 短链脂肪酸在抗肿瘤免疫中的其他作用
丁酸盐
低丁酸盐浓度以TGF-β1依赖性方式促进CD4+ T细胞向Foxp3+ Treg细胞分化,而高丁酸盐浓度无论在什么条件和亚群中都会诱导T-bet表达和IFN-γ释放。这似乎打破了我们对短链脂肪酸对粘膜免疫影响的传统认识。更重要的是,暴露于高浓度的短链脂肪酸,尤其是丁酸盐,可以抑制肠粘膜中CD4+ T细胞和其他CD4+ T细胞亚群的增殖和活化。这与组蛋白乙酰化和GPR43激活密切相关。
丁酸盐通过促进CD8+ T细胞作用参与抗肿瘤免疫。丁酸盐处理的细胞毒性T淋巴细胞(CTL)介导的抗肿瘤反应的促进作用依赖于一种称为ID2的转录调节因子,其水平在肿瘤微环境中的CD8+ T细胞中要高得多。丁酸通过抑制组蛋白脱乙酰酶(HDACs)的活性,诱导ID2表达并启动ID2-IL-12信号通路,从而提高奥沙利铂的化疗效果。
戊酸盐
戊酸通过抑制HDAC活性来增强CTL中IL-2、肿瘤坏死因子-α(TNF-α)、IFN-γ和其他效应分子的表达。
PVR/CD155 调节剂在恶性肿瘤中过度表达,并与具有Ig和ITIM结构域的T细胞免疫受体结合,介导免疫逃逸。
乙酸盐、丙酸盐
醋酸盐通过抑制PI3K/AKT通路抑制PVR/CD155水平,增强CD8+ T细胞的抗肿瘤能力。活化的γδ T细胞是IL-17的主要内源性来源。丙酸盐还通过抑制HDAC来抑制人γδ T细胞中IL-17、IL-22和其他细胞因子的分泌,从而防止癌症进展。
短链脂肪酸对肿瘤免疫微环境的影响
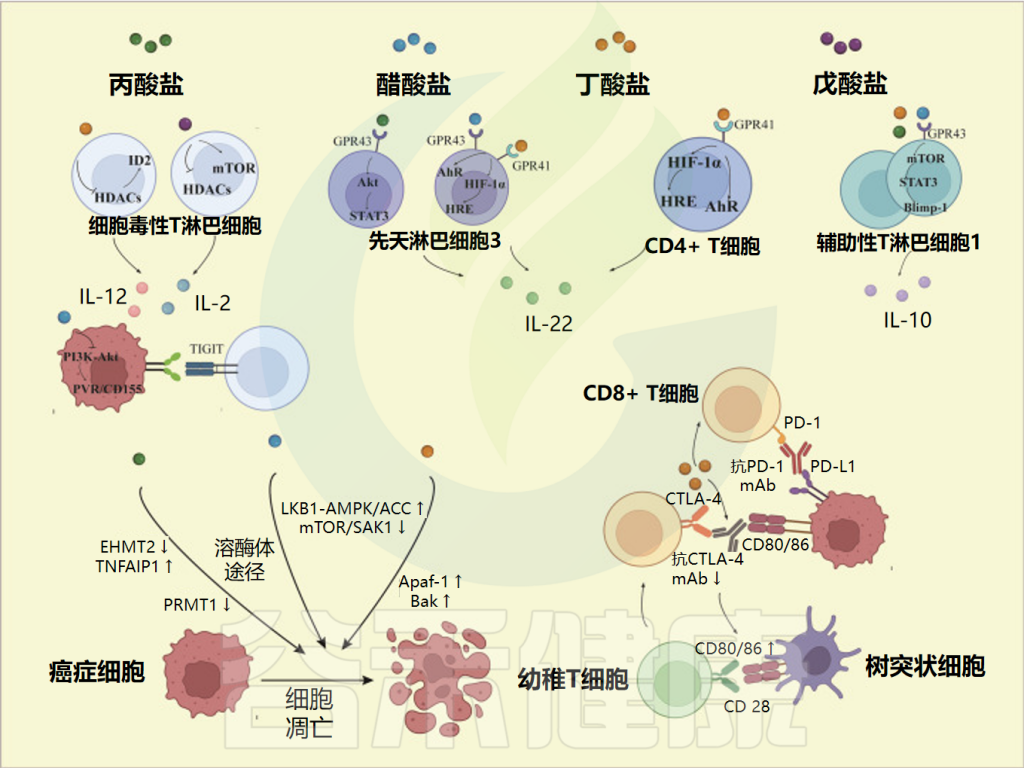
Dong Y,et al.Front Immunol.2023
密切相关的证据
实验研究和谷禾检测数据发现胃肠道肿瘤患者中短链脂肪酸和产生短链脂肪酸的细菌丰度明显较低,本节主要讲述短链脂肪酸可以通过多种机制影响胃肠道肿瘤的发展。而这也有助于未来将调节体内短链脂肪酸和肠道菌群的水平用作一种预防癌症或辅助治疗手段。
胃癌
• 短链脂肪酸可能用来评估胃癌的进展
在胃肠道化生或胃癌患者的血浆中检测到较低浓度的丙酸盐和丁酸盐。短链脂肪酸似乎可以用来评估胃癌的进展。
胃肠化生是指胃黏膜上皮转变为含有杯状细胞的肠黏膜上皮组织。肠上皮化生常见于慢性萎缩性胃炎,胃黏膜肠上皮化生属于胃的癌前病变。
此外,丁酸盐以剂量依赖性方式抑制KATO III细胞的增殖和迁移,这与其调节miRNA调控网络的作用有关。
• 影响胃癌治疗的效果
胃切除术后服用丁酸梭菌(C.butyricum)可以增加短链脂肪酸浓度,增强免疫力,减轻炎症,预防术后并发症。
体内实验证明,醋酸盐诱导胃癌细胞凋亡,随后体外实验证明氧化应激发挥了重要作用。大量摄入醋酸盐会增加胃癌细胞中活性氧的产生和MCT1的表达。
活性氧的过度表达上调了HCP1,两者均导致胃癌细胞对卟啉的摄入量增加。作为光动力疗法的光敏剂,卟啉的过度吸收增强了疗效。而作为HDAC抑制剂,丁酸盐修饰肿瘤抑制基因Per1和Per2并诱导它们在KATO III和NCI-N87中的表达。
与短链脂肪酸联合使用的传统疗法似乎具有更好的效果和更低的毒性。在裸鼠异种移植肿瘤模型中,丁酸盐-顺铂治疗抑制胃癌细胞的生长、迁移和侵袭,并依靠线粒体凋亡途径加速细胞凋亡。
此外,单独丁酸可以通过线粒体途径诱导胃癌细胞凋亡,这已在人细胞系BGC-823和SGC-7901中得到证实。
结直肠癌
先前的研究表明,结直肠癌高危人群中乙酸盐、丙酸盐和丁酸盐的浓度显著降低,并且短链脂肪酸水平较低的个体结直肠癌的发病率高于健康个体。各种短链脂肪酸均表现出抗癌行为。
注:与单独治疗相比,这些化合物具有叠加效应。
1
乙酸盐
•常规浓度下乙酸会增强癌细胞的凋亡并减少增殖
乙酸可以增强癌细胞的凋亡并减少增殖,已在不同的结直肠癌细胞系中得到证实,因此它已成为结直肠癌治疗的关键因素。
在结直肠癌患者中,短链脂肪酸减少,乙酸盐代谢转化为乙酰辅酶A。过去的研究表明,乙酸盐介导的细胞凋亡依赖于部分溶酶体膜透化触发的溶酶体途径。然而,溶酶体依赖性选择性死亡途径中随后释放的组织蛋白酶D降低了乙酸盐的敏感性。因此,组织蛋白酶D抑制剂与乙酸盐联合可能比单独使用乙酸盐效果更佳。
•注意:在缺乏氧气和葡萄糖的情况下乙酸盐可能导致癌细胞增加
然而,在没有氧气的情况下,乙酸盐会增加癌细胞的增殖,这依赖于ACSS2的上调和HIF-2的激活。
同时,在葡萄糖缺乏的情况下,乙酸盐通过激活 ACSS2/HIF-2 信号通路促进HCT-116(结肠癌细胞)和HT-29(结肠癌细胞)衍生肿瘤的生长。
因此,乙酸盐的抗癌作用可以根据环境和浓度的变化而改变。
此外,乙酸盐作为PI3K/AKT信号驱动的免疫检查点配体PVR/CD155的调节剂,可以增强肿瘤微环境中CD8+ T细胞的功能反应,促进IFN-γ的产生,有望成为促进肿瘤免疫的相关药物。基于上述讨论,免疫检查点抑制剂(ICIs)的功效可能受益于乙酸盐。
2
丙酸盐
研究发现结直肠癌组织中丙酸盐含量降低,并且向SW480细胞(人结肠腺癌细胞)中添加丙酸盐显著抑制癌细胞生长。
•丙酸盐调节免疫刺激来消灭癌细胞
短链脂肪酸调节免疫刺激和抑制配体,并参与免疫细胞介导的杀伤。丙酸盐诱导的NKG2D配体MICA/B的上调既不依赖于HDACs的抑制,也不依赖于GPR41/GPR43受体的组合,而是依赖于线粒体活性,而丁酸盐则取决于其HDACs抑制剂活性。丙酸盐的这种作用与介导肿瘤抑制蛋白p21表达的PEPCK-M酶和mTORC2/PDK1/AKT通路密切相关。
•丙酸盐通过调节表观遗传导致癌细胞凋亡
除了免疫调节之外,表观遗传调节也是短链脂肪酸发挥抗癌作用的一个有前景的靶点。丙酸盐通过阻止p70 S6激酶磷酸化导致PRMT1表达下调,从而导致结直肠癌细胞选择性死亡。
此外,丙酸盐诱导HECTD2上调,导致EHMT2降解,从而促进下游TNFAIP1的表达并最终促进癌细胞凋亡。
在丙酸盐介导的抗癌治疗中,表观遗传修饰是不可忽视的。然而,最新的孟德尔随机化分析发现,没有强有力的证据证明粪便中丙酸盐浓度与结直肠癌风险之间的相关性。可能有必要全面检测短链脂肪酸及其产生细菌。
3
丁酸盐
研究发现,丁酸盐抑制结直肠癌细胞的增殖,但滋养正常结肠细胞的生长。
•丁酸盐相比其他短链脂肪酸对癌细胞具有更强的抑制作用
与其他短链脂肪酸相比,丁酸盐对结直肠癌细胞系具有更强的抑制作用。
一方面,丁酸可以抑制促炎介质TNF-α、IL-1β、IL-6、IL-8,上调抗炎因子IL-10;另一方面,丁酸可以通过促进CD8+ T细胞发挥作用来促进抗肿瘤免疫。
此外,丁酸盐通过促进上皮细胞增殖、增加粘液层和改善紧密连接来维持肠道屏障的完整性。
在HCT 116细胞(人结肠癌细胞)中,丁酸介导的细胞凋亡与p300-Wnt信号传导密不可分。其中,致癌Wnt信号基因表达模式下的结肠癌细胞比受体介导的Wnt信号基因表达模式下对丁酸盐更敏感。
•丁酸盐影响结直肠癌细胞周期从而促进凋亡
结直肠癌中肠道微生物群的结构和稳定性发生显著改变,并与其进展密切相关。丁酸盐的施用改善了微生态紊乱,反映在病原体减少、厚壁菌门与拟杆菌门的比例减少以及益生菌丰度增加。
与乙酸盐和丙酸盐相比,丁酸盐对结直肠癌细胞周期至关重要的调节网络具有更强的影响。丁酸调节癌症相关miRNA的表达,其中miR-139和miR-542是众所周知的代表。具体来说,它们作为丁酸盐的协作对象来调节细胞周期中的EIF4G2和BIRC5基因。
丁酸盐调节c-Myc/p21通路,诱导细胞周期停滞在G2期,其中包含27个凋亡相关基因。此外,丁酸盐在G1期触发细胞周期阻滞,需要复杂的lncRNA-miRNA-mRNA调控网络。
补充丁酸盐可逆转CSE1L的过度表达,并似乎与p53表现出协同作用,最终将癌细胞抑制在G1和G2/M期。
同时,丁酸诱导的p21和γ-H2AX增加以及细胞周期蛋白B1减少导致细胞周期停滞在 G2/M 期。
•丁酸盐抑制癌细胞的迁移
不仅如此,丁酸盐还通过上调miR-200c并抑制其直接靶点BMI-1对癌细胞迁移产生抑制作用。
BMI-1是诱导依赖于AKT/GSK-3β/snail通路的上皮间质转化(EMT)驱动癌症转移的重要调节因子,丁酸盐阻止了BMI-1的作用。
丁酸盐处理还降低了结直肠癌细胞而非正常结肠细胞中Trx-1的表达。研究证明,Trx-1与S100P的相互作用通过AKT介导的S100A4上调促进EMT。通过施用丁酸盐,类器官证明细胞外基质-整合素/PI3K-Akt 轴参与结直肠癌细胞形态变化和细胞凋亡。
丁酸盐阻止结直肠癌细胞的迁移和侵袭,本质上是由于组蛋白脱乙酰酶(HDAC3)的抑制,从而阻断了AKT1和ERK1/2的激活。
•丁酸盐还改变表观遗传和代谢发挥抗癌特性
与其他短链脂肪酸不同,丁酸盐逆转前列腺素EP4受体的过度表达和环氧合酶2的产生,以减少从正常细胞到癌症的表型改变。
此外,丁酸盐通过激活LKB1-AMPK/ACC信号通路和降解β-catenin诱导结直肠癌细胞自噬。
丁酸盐致力于改变结直肠癌细胞的表观遗传学和代谢谱,发挥其抗癌特性。通过调节KEAP1的DNA甲基化,丁酸阻断NRF2-ARE信号传导,从而增强其抗癌潜力。
线粒体代谢和相关代谢物的变化参与了丁酸盐对表观遗传学的调节。丁酸激活三羧酸循环相关酶IDH1和PDH,从而下游产物α-KG水平升高。
作为一种信号分子,α-KG影响与细胞凋亡相关的MSH2和MLH1去甲基化。同时,α-KG减弱DNA和组蛋白H3K4me3的甲基化,导致结直肠癌中Wnt信号通路受到抑制。
丁酸盐通过促进PKM2的四聚化和去磷酸化来诱导有氧糖酵解的抑制,从而逆转癌细胞中的代谢优势。对于结直肠癌细胞,丁酸盐引起的代谢变化反映在促进氧化代谢而不是糖酵解。
此外,铁死亡是铁依赖性细胞程序性死亡的方式,丁酸盐通过CD44/SLC7A11信号通路诱导结直肠癌细胞中的铁死亡。
肝细胞癌
肝细胞癌是一种发生于肝脏的恶性肿瘤,它是全球范围内最常见的癌症类型之一。作为一个重要的危险因素,乙型肝炎病毒(HBV)会促进肝细胞癌(HCC)的进展。
• 丁酸盐促进肝癌细胞的凋亡和自噬
丁酸盐通过抑制SIRT-1从而促进p53乙酰化,显著抑制人肝癌细胞(Hep G2.2.15)的增殖和驻留乙型肝炎病毒的复制。
HBx是乙型肝炎病毒(HBV)编码的致癌蛋白,可能通过多种方式导致肝细胞癌的加速发生和发展。随着HBx相关途径的下调,短链脂肪酸导致肿瘤抑制因子DAB2的表达增加,从而延缓肝细胞癌的进展。
先前的研究表明,丁酸盐通过增加活性氧的产生来抑制AKT/mTOR通路,从而促进人肝癌细胞的凋亡和自噬。
• 短链脂肪酸延缓了肝癌进展
通过粪便罗伊氏乳杆菌(Lactobacillus reuteri)移植进行干预的肝细胞癌小鼠似乎也可以延缓癌症进展。相关机制是罗伊氏乳杆菌代谢产生的乙酸盐通过抑制HDAC和诱导Sox乙酰化,抑制先天淋巴细胞的效应分子IL-17A的产生。
另外,PD-1抑制剂与短链脂肪酸联合使用,在肝癌小鼠中显示出增强的抗肿瘤作用。Lachnospiracea具有减少肝纤维化的作用,部分原因是短链脂肪酸介导的。
已证明口服短链脂肪酸可以抑制万古霉素治疗的小鼠纤维化。
• 增强常规化疗药物的效果
此外,丙酸盐可以增强常规化疗药物在肝细胞癌中的化疗效果。研究表明,丙酸盐通过激活GPR41诱导TNF-α表达,并增加顺铂诱导的caspase-3激活,从而介导肝癌细胞凋亡。
肝细胞癌患者体内丁酸产生菌16s RNA表达降低,补充丁酸可促进肝癌细胞凋亡并抑制增殖。更重要的是,丁酸盐可以增强索拉非尼的治疗潜力,通过减少HK2对c-myc信号传导的依赖,丁酸盐可以抵抗糖酵解,从而增强索拉非尼的功效。
对于接受仑伐替尼治疗的肝细胞癌患者,无腹泻等不良反应的患者丁酸代谢相对丰富且活跃。最新研究表明,补充乙酸盐可以诱导人肝癌细胞中NAT2的水平,类似于葡萄糖和胰岛素,从而导致代谢相关基因的变化。
不仅如此,丁酸盐在胆管癌细胞中也表现出同样的抗癌作用。丁酸盐和HDAC6抑制剂在防止增殖、迁移和上皮间质转化方面具有协同作用。
• 短链脂肪酸改善一些癌前病变症状
酒精性脂肪肝病(AFLD)和非酒精性脂肪肝病(NAFLD)可进展为肝硬化,最终可能发展为肝癌。丁酸盐抑制gasdermin D 介导的细胞焦亡,改善肠道屏障破坏和内毒素血症,从而减轻AFLD中的肝脏脂肪变性和炎症。
此外,丁酸盐通过LKB1-AMPK-Insig信号通路的调节诱导肝脂质谱的改变并减轻肝脂肪变性来治疗 NAFLD 。
总而言之,短链脂肪酸限制了肝细胞癌前阶段的进展。
胰腺癌
研究发现,与对照组相比,胰腺癌患者的丙酸盐和丁酸盐水平降低,粪便微生物群的组成发生改变。
• 短链脂肪酸增强了对肿瘤细胞的杀伤能力
短链脂肪酸以肿瘤特异性免疫细胞为目标,无论单独使用还是与其他肿瘤疗法联合使用,都显示出强大的抗癌作用。
研究表明,与组蛋白脱乙酰酶(HDACs)抑制相关,丁酸和戊酸上调IL-2、CD25和mTOR的产生,这些物质参与T细胞激活的调节。通过触发增强的效应分子,丁酸盐和戊酸盐还增加了细胞毒性T淋巴细胞的肿瘤杀伤能力。
短链脂肪酸在过继性免疫治疗方面也显示出良好的前景。用丁酸盐或戊酸盐预处理的细胞在胰腺癌小鼠模型中显示出更好的治疗效果。
• 短链脂肪酸干扰胰腺癌的进展并减轻相关损伤
另一项研究表明,丁酸盐通过逆转胰腺腺癌患者的CD11b细胞的免疫抑制功能并增强CD8+ T细胞的免疫功能来延缓癌症的发展。
短链脂肪酸的影响不仅限于肿瘤微环境,还延伸至肿瘤相关基因。丁酸盐处理后,在AsPC-1细胞(人转移胰腺腺癌细胞)中可以观察到通过抑制组蛋白脱乙酰酶(HDACs)活性介导的p16INK4a、p14ARF和p15INK4b的上调。
在BxPC-3(人原位胰腺癌细胞)和PANC-1(胰腺癌细胞)细胞系中,丁酸盐单独或与吉西他滨联合使用可抑制增殖并诱导细胞凋亡。特别是联合用药减轻了吉西他滨引起的胃肠粘膜、肝、肾损伤。由于HDAC的抑制作用,丁酸盐还调节肿瘤微环境相关成分。
拓展:基于微生物群的癌症诊断和预后
癌症通常是在通过触诊或成像技术识别肿块后进行诊断,然后进行活检以确认细胞恶性肿瘤。断层扫描检测技术,包括PET-CT、MRI和CT,可以有效地识别体内的宏观病变。
基于微生物的癌症诊断
此外,研究已经证实,肠道微生物群动态可能有助于诊断和定位恶性肿瘤,例如根据胃肠道来源的解没食子链球菌菌血症。大多数基于微生物的癌症诊断侧重于对呼吸消化道内的肿瘤进行测序,包括结直肠癌、胰腺癌和肺癌。
有人提出,不同的癌症类型可能在呼吸消化道外具有独特组成的微生物群。一项研究了30多种癌症的瘤内微生物群,应用基于血液的诊断,并提供七种不同癌症中微生物瘤内空间分布和细胞内定位的视觉证据。
2017年的一项研究提出了结直肠癌粪便微生物组的宏基因组分析,以识别和验证不同种族群体中的细菌生物标志物。这项研究纳入了来自中国、丹麦、法国和奥地利的结直肠癌患者和对照样本,并强调了粪便宏基因组生物标志物在早期结直肠癌诊断中的潜力。
此后,更多的研究发现,粪便微生物DNA标记可以单独或与粪便免疫化学测试结合使用,作为新的测试来筛查无症状受试者的结直肠肿瘤。
此外,收集了41名肺癌患者和40名健康志愿者的粪便样本,并使用16S rRNA基因测序分析了肠道微生物群。他们发现, 肺癌患者中的放线菌属(Actinomyces)、韦荣球菌属(Veillonella)、巨球菌属(Megasphaera)、肠球菌属(Enterococcus)和梭菌属(Clostridioides)比健康个体更丰富。他们进一步证明肠道微生物及其相关代谢物是肺癌的潜在生物标志物和治疗靶点。
检查肠道微生物群的变化及其作为胰腺癌患者生物标志物的潜力。他们比较了患有癌前病变的胰腺癌患者、非酒精性脂肪肝患者和健康对照者的微生物群,发现了与胰腺癌相关的独特肠道微生物群特征。
主要特征是梭菌科、毛螺菌科的存在,瘤胃球菌科的缺乏,以及韦荣球菌科、阿克曼氏菌和Odoribacter的过度增加。
目前,已经开发了几种基于细菌的肿瘤检测策略,包括使用将肿瘤靶向细菌的特异性与生物标志物检测的敏感性相结合的工程细菌。使用远程诱导基因开关对减毒细菌进行工程改造,释放外源报告蛋白 ZsGreen。
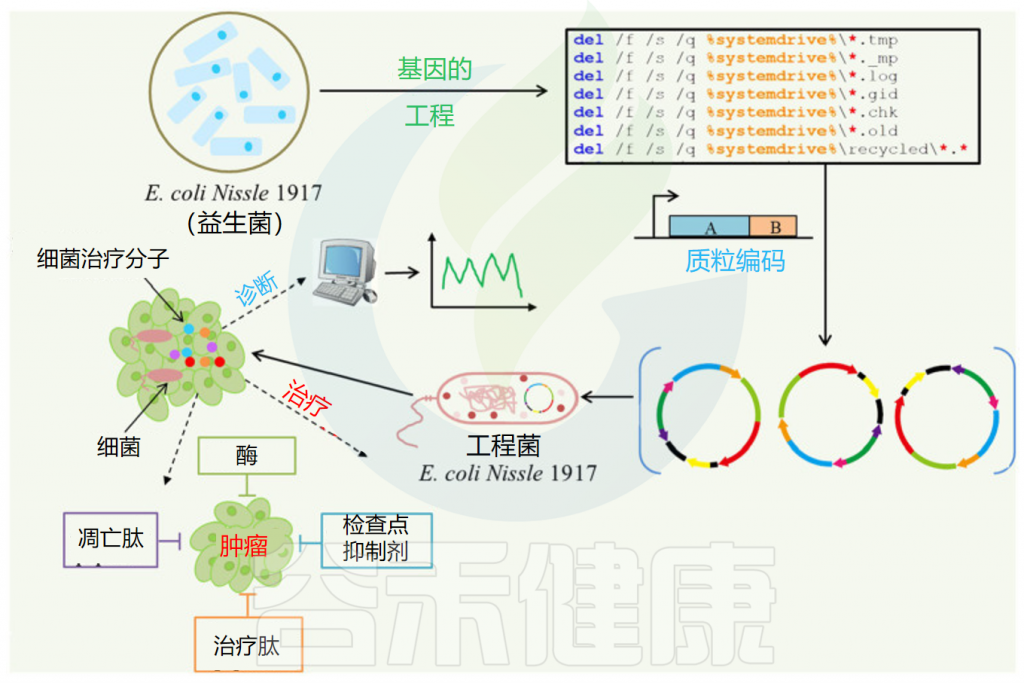
Feng P,et al.Front Microbiol.2024
体内和体外实验均表明,这些细菌可以通过对释放的ZsGreen的系统测量来识别肿瘤。尽管基于细菌的癌症诊断是一种有前景的策略,但它面临着一些挑战,例如相对于宿主的生物量较低以及试剂或环境污染物的干扰。因此,将基于肠道微生物群的方法与传统诊断技术(包括基因组测序、qPCR、免疫组织化学和电子显微镜)相结合,可以提供更准确、更有效的癌症诊断。
基于微生物的癌症诊断已成为一个新领域,专注于根据各种癌症或不同肿瘤阶段肠道微生物群的特定生物特征来设计或开发新策略。此外,深度学习和机器学习算法能够识别表明癌症的微生物特征,这是精准医学的基础。基于微生物的癌症诊断还具有改善癌症筛查和早期检测工作的潜力,有望为各种癌症开发更准确、更有效的诊断工具,并最终改善患者的治疗结果。
肠道微生物群作为潜在预后标志物
在预后方面,许多研究表明肠道微生物群可以作为癌症的潜在预后标志物。在一项结直肠癌患者预后模型的研究中,风险模型与结直肠癌患者的免疫状态和肠道微生物群相关,并且微生物组分析显示,高风险患者中拟杆菌(Bacteroidetes)和放线菌(Actinobacteria)的相对丰度低于低风险患者。
具核梭杆菌作为结直肠癌患者的预后标志物
研究发现肠道中高水平的具核梭杆菌(Fusobacterium nucleatum)和脆弱拟杆菌(Bacteroides fragilis)与结直肠癌患者术后预后不良相关。具核梭杆菌作为结直肠癌患者预后标志物的作用已被多次证明。
例如,收集了100个结直肠癌组织和72个正常粘膜组织,并确定具核梭杆菌水平有助于预测结直肠癌患者的临床结果,发现IV期结直肠癌患者具有较高水平的具核梭杆菌。
此外,研究证明特定的肠道微生物群与接受nabuliumab治疗的肝细胞癌患者的预后相关。具体而言,普雷沃氏菌/拟杆菌比率可用作纳武单抗治疗肝细胞癌的预后预测因子;该比率越高,疗效越好。
纳武单抗(nabuliumab)是一种人类免疫球蛋白G4单克隆抗体。纳武利尤单抗主要治疗三种疾病,包括非小细胞肺癌、头颈部鳞状细胞癌、胃或胃食管连接部腺癌。
治疗胃肠道肿瘤
微生物与抗癌疗法的结合早在19世纪就开始了,当时首次尝试将灭活的链球菌注射到人体肿瘤组织中来治愈癌症。此前的研究表明,微生物制剂直接注射到肿瘤组织或口服给药,可以对肿瘤细胞产生直接的细胞毒性作用或刺激机体局部抗肿瘤免疫反应。
最近的研究发现,传统的放疗、化疗和免疫疗法可以改变患者的肠道微生物群,而菌群的组成可以深刻影响这些治疗的疗效和副作用,包括癌症复发、耐药性和对肠道菌群的附带损害。
Feng P, et al.Front Microbiol.2024
施用益生菌
益生菌是一类存在于宿主体内并对宿主有益的细菌,给癌症患者服用益生菌的目的是重新激活患者受损的肠道微生物群,从而重建失败的共生微生物组的水平和功能。
益生菌在癌症辅助治疗中的作用


Sun J,et al.ISME J.2023
• 改善受损的肠道微生物群
益生菌还可以通过增加肠道微生物群的丰度、调节一些有助于产生致癌化合物的酶的活性以及改善肠道屏障来对抗胃肠道肿瘤。
23项随机对照试验表明,补充多种益生菌可改善结直肠癌患者的症状并提高生活质量,并减少传统治疗的不良反应。
• 增加短链脂肪酸的含量
增加短链脂肪酸的产量是一个关键途径。从人初乳中筛选出潜在益生菌唾液链球菌(Streptococcus salivarius),可抑制结直肠癌细胞增殖55%以上。唾液链球菌直接粘附并诱导癌细胞凋亡,促进短链脂肪酸的产生,并调节活化的B和T淋巴细胞。
丁酸梭菌(C.butyricum)依赖丁酸盐抑制胃肠道肿瘤的进展。C. butyricum调节Wnt/β-catenin的信号传导,减少高脂饮食诱导的结直肠癌,通过抑制NF-κB通路抑制结肠炎相关结肠癌,并增强免疫检查点抑制剂(ICIs)对肺癌的疗效。
一些产生短链脂肪酸的细菌有助于抗癌的例子
费氏丙酸杆菌(Propionibacterium freudenreichii)
通过产生作用于线粒体的丙酸和乙酸来诱导结直肠癌细胞的内在凋亡。
乳酸片球菌(Pediococcus acidilactici UAMS)是一种高产丁酸细菌,它能抑制人结肠癌细胞(HT29)和
SW480细胞(人结肠腺癌细胞)的增殖。
肠道Roseburia intestinalis、普拉梭菌(Faecalibacterium prausnitzii)、植物乳杆菌(Lactiplantibacillus plantarum)和Eubacterium callanderi也已被证明可增强结直肠癌中的抗癌免疫反应,同时产生丁酸盐。
用VSL#3益生菌治疗增加了丙酸盐和丁酸盐的水平,导致通过CCL20/CCR6轴募集Th17细胞,以减轻黑色素瘤的肺转移。鼠李糖乳杆菌GG ATCC 53103、罗伊氏乳杆菌DSM 17938、约氏乳杆菌LC1和其他益生菌不仅抑制结直肠癌细胞增殖,而且改善了化疗反应。
因此,补充益生菌可以在一定程度上增加短链脂肪酸,进而在癌症预防和治疗中发挥重要作用。
通过饮食成分改善
对于微生物群的组成和代谢功能,饮食可能是一种强大的调节剂。
• 摄入更多的膳食纤维可以降低结直肠癌等疾病的风险
膳食纤维作为短链脂肪酸的前体。研究证实,摄入更多膳食纤维可以降低患包括结直肠癌在内的多种疾病的风险。膳食纤维摄入量与患结直肠腺瘤和结直肠癌的几率之间存在统计学上显著且强烈的相关性。
作为代表性的膳食纤维,果胶显著增加了肠道微生物群的多样性,特别是产生丁酸的细菌,并促进肿瘤免疫微环境中的T细胞浸润,从而增强抗程序性死亡-1(抗PD-1)单克隆抗体(mAb)效果。
肥胖女性在一段时间内摄入富含菊粉和低聚果糖的混合物后,体内产生丁酸盐的细菌增多,还降低了餐后血糖水平。
• Omega-3等不饱和脂肪酸改善癌症治疗
Omega-3多不饱和脂肪酸(PUFA)人体不能合成,必须从食物中摄取,已被证明可以改善高脂血症、冠心病和动脉粥样硬化。每天服用更多的多不饱和脂肪酸时,可以观察到产生丁酸的细菌丰度增加。
与此同时,乳杆菌等益生菌增加,具核梭杆菌减少。研究表明,一些多不饱和脂肪酸可以辅助化疗药物5-氟尿嘧啶(5-FU)和奥沙利铂治疗结直肠癌并减少副作用。
• 益生元的摄入与结直肠癌呈负相关
益生元是不被宿主消化吸收、能选择性促进肠道内益生菌代谢和增殖的食物成分。常见的益生元包括菊粉、低聚果糖、半乳糖和一些藻类。益生元在癌症的发展中也发挥着重要作用。
最近进行的一项病例对照研究,包括1953名经组织学证实的结直肠癌患者和4154名对照者,发现结直肠癌风险与饮食中半乳糖摄入量呈负相关。
粪菌移植
除了补充益生菌、益生元外,粪菌移植也可能是增加短链脂肪酸、抵抗胃肠道肿瘤的一种选择。
• 粪菌移植有助于抗癌治疗的效果
在致癌物质诱导的常规小鼠或无菌小鼠中,来自结直肠癌患者的粪菌移植降低了肠道微生物群的丰富度并促进了胃肠道肿瘤的形成。
右旋糖酐硫酸钠或氧化偶氮甲烷的治疗可以在实验室小鼠中诱导结直肠癌,而从野生小鼠到实验小鼠的粪菌移植可以改善这一过程。
尽管没有临床证据表明粪菌移植可以直接治疗结直肠癌,但一项研究表明粪菌移植可以帮助提高化疗的疗效。将健康供体小鼠的粪便移植到FOLFOX治疗的小鼠体内,可以恢复FOLFOX治疗后破坏的肠道微生物群的组成,并减轻腹泻和肠粘膜炎症的严重程度。此外,粪菌移植通过增加微生物群多样性和调节免疫功能来增强抗PD-1治疗效果。
粪菌移植是塑造微生物组最直接的方式,通过粪菌移植直接增加产生短链脂肪酸的细菌,为胃肠道癌症的治疗提供了广阔的前景。
!
短链脂肪酸调节对化疗和免疫疗法的反应
短链脂肪酸还可以调节肿瘤对放化疗和免疫疗法的反应。临床研究发现,术前新辅助放化疗后,有反应的结直肠癌患者粪便中产生丁酸的细菌和短链脂肪酸水平比未接受治疗的患者更丰富。
• 丁酸盐协同增强抗癌作用
丁酸盐可作为奥沙利铂的增效剂,协同增强抗癌作用。丁酸盐通过调节CD8+ T细胞直接促进奥沙利铂的化疗疗效。
此外,与结直肠癌中无反应患者相比,有反应患者血清中的丁酸盐水平较高。与单独放疗相比,放疗-丁酸盐组合显著增强了抗癌效果。丁酸盐可以通过促进FOXO3A介导的转录来诱导细胞周期停滞,同时保护正常细胞免受辐射损伤。由于HDACs抑制剂已被证明可以增强放疗的敏感性,因此推测丁酸盐可能是因为抑制HDACs而增强了放疗的疗效。
丁酸盐还可以通过GPR109a-AKT信号通路增强5-氟尿嘧啶(5-FU)的功效。同时,短链脂肪酸降低了5-FU的促炎作用,并增加了粘膜中紧密连接蛋白的表达。
然而,产丁酸细菌的异常活性和患者体内过量的丁酸会导致对化疗药物的耐药性。结果表明,对丁酸盐具有抗性的结直肠癌细胞系表现出明显的化学抗性。
通过调节自身免疫细胞和免疫分子来靶向杀伤肿瘤细胞,同时减少对正常组织的损伤,已成为肿瘤免疫治疗的代表。
人类肠道微生物群在肿瘤生长、发展和治疗中发挥着关键作用。肠道菌群、宿主免疫系统和肿瘤之间的相互作用可以为调整肠道菌群以优化肿瘤微环境和增强癌症免疫治疗提供有价值的见解。
短链脂肪酸是肠道微生物群的重要产物,已被证明可以改变免疫细胞的分化和功能以及细胞因子的产生和释放,通过多种信号通路控制肿瘤的生长和转移并诱导细胞凋亡。此外,短链脂肪酸还有助于提高放疗和化疗的治疗效果,减少不良反应。
未来,个性化医疗可能会结合基于微生物组的诊断和治疗策略。以肿瘤免疫为目标,补充微生物源性 短链脂肪酸已成为诊断、治疗和预防肿瘤的新方法。可重点关注益生菌和粪便微生物移植以及合理的饮食,提高短链脂肪酸水平,调节胃肠道微生态,激活有效的抗癌作用。
主要参考文献
Feng P, Xue X, Bukhari I, Qiu C, Li Y, Zheng P, Mi Y. Gut microbiota and its therapeutic implications in tumor microenvironment interactions. Front Microbiol. 2024 Jan 23;15:1287077.
Dong Y, Zhang K, Wei J, Ding Y, Wang X, Hou H, Wu J, Liu T, Wang B, Cao H. Gut microbiota-derived short-chain fatty acids regulate gastrointestinal tumor immunity: a novel therapeutic strategy? Front Immunol. 2023 Apr 14;14:1158200.
Sun J, Chen F, Wu G. Potential effects of gut microbiota on host cancers: focus on immunity, DNA damage, cellular pathways, and anticancer therapy. ISME J. 2023 Oct;17(10):1535-1551.
He M, Wei W, Zhang Y, Xiang Z, Peng D, Kasimumali A, Rong S. Gut microbial metabolites SCFAs and chronic kidney disease. J Transl Med. 2024 Feb 18;22(1):172.
Hanus M, Parada-Venegas D, Landskron G, Wielandt AM, Hurtado C, Alvarez K, et al.. Immune system, microbiota, and microbial metabolites: The unresolved triad in colorectal cancer microenvironment. Front Immunol (2021) 12:612826.
Pansy K, Uhl B, Krstic J, Szmyra M, Fechter K, Santiso A, et al.. Immune regulatory processes of the tumor microenvironment under malignant conditions. Int J Mol Sci (2021) 22(24):13311.
Luu M, Riester Z, Baldrich A, Reichardt N, Yuille S, Busetti A, et al.. Microbial short-chain fatty acids modulate CD8(+) T cell responses and improve adoptive immunotherapy for cancer. Nat Commun (2021) 12(1):4077.
Kurokawa H, Ito H, Matano D, Terasaki M, Matsui H. Acetic acid enhances the effect of photodynamic therapy in gastric cancer cells via the production of reactive oxygen species. J Clin Biochem Nutr (2022) 71(3):206–11.
Marques C, Oliveira CS, Alves S, Chaves SR, Coutinho OP, Corte-Real M, et al.. Acetate-induced apoptosis in colorectal carcinoma cells involves lysosomal membrane permeabilization and cathepsin d release. Cell Death Dis (2013) 4:e507.