-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康

人体内的各个部位,如皮肤、口腔、肠道和阴道等,都是微生物的重要栖息地,这些微生物与人体健康紧密相关,并能反映人体的疾病状态。这些部位因受基因、环境和生活方式等影响,具有独特的菌群特征。
女性生殖系统包括卵巢、输卵管、子宫和阴道等主要器官,阴道微生态对女性生理健康、生殖健康和妊娠过程至关重要。随着高通量测序技术的进步,阴道微生物检测已被广泛应用于临床妇科感染的辅助诊断和治疗,以及科研。
阴道微生物群是维护阴道健康的关键,健康的阴道生态主要由乳杆菌组成,这些细菌通过产生乳酸、过氧化氢来保护阴道,并释放细菌素等化合物以防止有害细菌定植。
然而,阴道生态系统的失衡可能导致病原体过度生长,引发如细菌性阴道病(BV)、性传播感染(STI)和外阴阴道念珠菌病(VVC)等复杂的阴道感染。
阴道还可能受到多种病原体如人乳头瘤病毒(HPV)和人类免疫缺陷病毒(HIV)的感染。流行病学研究显示,这些因素与不良健康结果的风险增加有关。
本文旨在探讨阴道菌群的类型和阴道微生态的重要性,并探索如何通过微生物检测辅助妇科感染问题的诊断和治疗,从而为女性生殖系统健康提供更多精准的个性化方案。
阴道微生物群被定义为在阴道内定殖的共生和病原微生物群,阴道微生物群从女性出生的最初几个小时开始就开始定居,伴随女性一生。
随着测序技术的普及,近年来对女性阴道微生态结构有了更全面的了解并进一步做细分。
✦ 健康的阴道菌群以乳杆菌为主导
最主要的阴道种群是乳杆菌,在阴道中已检测出超过20种乳酸菌,占细菌群落的近70%。包括下列菌群等:
-Lactobacillus crispatus(卷曲乳杆菌)
-Lactobacillus gasseri(格氏乳杆菌)
–Lactobacillus rhamnosus(鼠李糖乳杆菌)
–Lactobacillus iners(惰性乳杆菌)
–Lactobacillus acidophilus(嗜酸乳杆菌)
–Lactobacillus jensenii(詹氏乳杆菌)
此外,其他细菌种群等也存在于健康个体的阴道中,例如下列几种:
–Prevotella bivia(普雷沃氏菌)
–Atopobium vaginae(阴道阿托波菌)
–Streptococcus aureus(金黄色链球菌)
–Bifidobacteriaceae(双歧杆菌科)
–Mobiluncus(里拉微球菌)
✦ 阴道菌群变化的影响因素
人类阴道微生物群组随着不同的年龄阶段发生变化,包括婴儿、青春期、怀孕和更年期等阶段。而其他方面包括激素水平、免疫力、细菌感染、抗生素治疗、月经、生活方式等是影响人类阴道微生物群构成变化的常见因素。
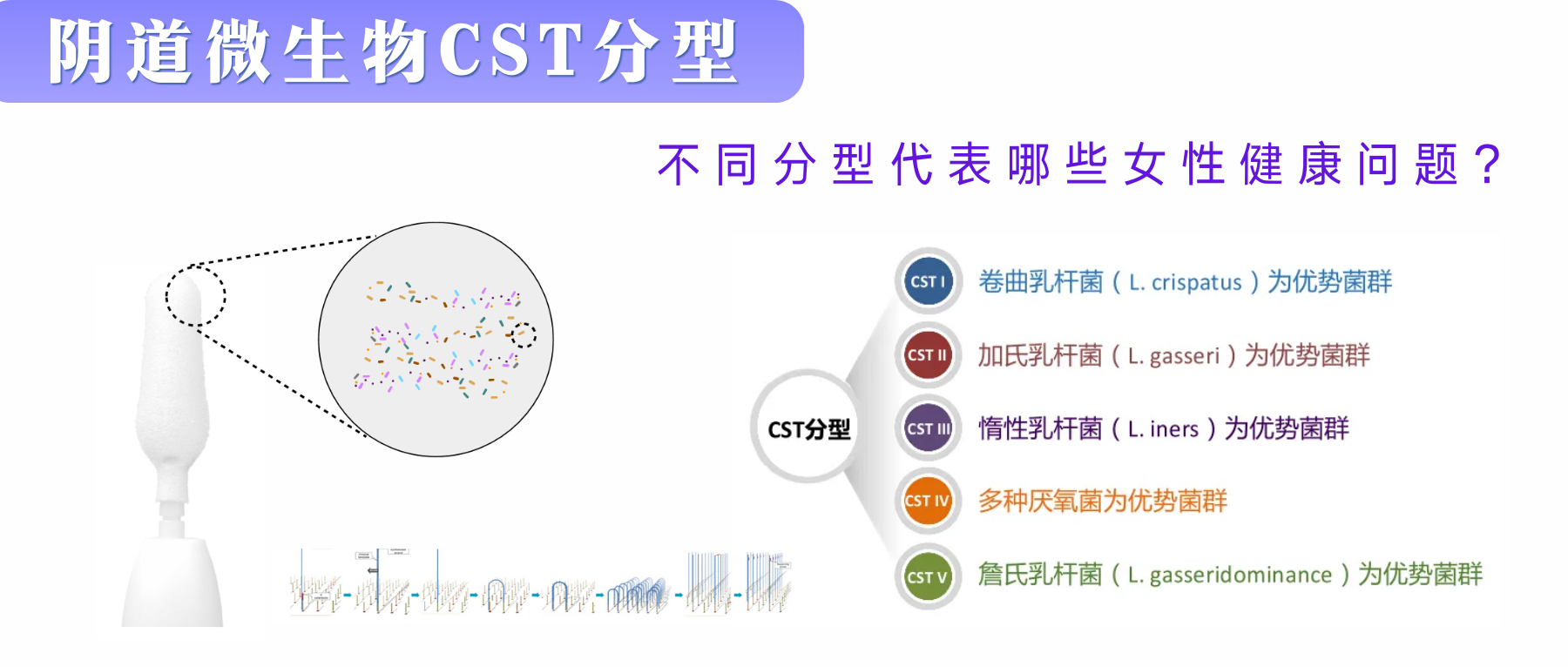
在2011年,美国Ravel教授首次通过16S rRNA基因的测序技术根据微生物组成和丰度的不同,将健康女性阴道微生物群落定义了5种不同的群落状态类型(community-state types, CSTs),并分别命名为CST I、II、III、IV、V。其中有四个以乳杆菌为主。

✦ CST-I、CST-II、CST-V——健康型
健康阴道中主要乳杆菌的相对丰度决定了细菌群落群的类型,绝大多数健康育龄女性的阴道菌群组成中以CST-I(卷曲乳酸杆菌)、CST-II(加氏乳酸杆菌)、CST-V(詹氏乳酸杆菌)这三种类型较为常见。
CST-I型:在所有的阴道菌型中,CST-I型被认为是最健康的一种类型,它表明阴道处于一个稳定的状态,抵制病原菌能力较强。
CST-I型以卷曲乳杆菌(L. Crispatus)为主。卷曲乳杆菌能产生大量的乳酸(D型和L型,但研究表明D-乳酸的抑菌效果更好)以及过氧化氢,有利于阴道维持弱酸性的环境。卷曲乳杆菌还可分泌抗菌化合物,如细菌素、类细菌素等,从而抑制病原菌的生长和繁殖。
此外,卷曲乳杆菌对阴道上皮细胞的黏附作用最强,与加氏乳杆菌相比,它更能竞争性抑制阴道加德纳菌等与阴道上皮细胞的黏附,最终维持阴道微生态的平衡。
注:CST I型又可细分为两个亚型,CST I-A型和CST I-B型。两者之间唯一明显的区别是I-A型中卷曲乳杆菌的比例高于CST I-B型。
虽然卷曲乳杆菌丰度更高可能更有益,但这两种亚型都表明阴道处于一个比较健康的状态。需要注意的是该种类型在月经期、孕期、性生活等影响下可能会转变为CST III型。
CST-II型:CST-II型也被认为是一种健康的阴道菌型,该种类型的阴道菌群以加氏乳杆菌(Lactobacillus gasseri)为主。与卷曲乳杆菌相似,加氏乳杆菌也能产生D-乳酸,使阴道维持弱酸性的环境,并生成过氧化氢抑制杂菌。
虽然它们产生的乳酸含量略低于卷曲乳杆菌,但CSTII型对病原体仍显示出较强的防御能力。CST-II型在围绝经期的女性中较为常见。当女性进入围绝经期,体内雌激素水平逐渐下降,阴道菌群结构容易发生变化,此时的加氏乳杆菌在维持阴道微生态平衡中可能发挥重要的作用。
注:CST-II型在某些情况下可转变为CST-I型(如妊娠期)。
CST-V型:被认为是一种健康的阴道菌型,以詹式乳杆菌(Lactobacillus jensenii)为主。与卷曲乳杆菌类似,詹式乳杆菌也能产生D-乳酸,降低阴道pH值,维持弱酸性环境,此外还可通过黏附于阴道上皮细胞和产生细菌素来维持一个阴道微生态的平衡。
相较其他CST类型,CST-V型较为少见,研究表明该种类型仅占不到10%。目前还未见该种类型能转变成其他CST型的报道。
✦CST-III 型——可能预示阴道免疫力下降
CST-III型:以惰性乳杆菌(Lactobacillus iners)为主。当惰性乳杆菌与其他乳杆菌在阴道内共存时,它可能参与维持阴道微生态的平衡;它也可能在阴道菌群失调后与多种厌氧菌共同参与细菌性阴道病的发展过程。
惰性乳杆菌具有较弱的过氧化氢产生能力,分泌的乳酸主要为L型,因此对阴道的保护作用不如其他几种乳杆菌(卷曲,加氏和詹式)强。研究发现,与其他种类的乳杆菌相比,惰性乳杆菌对性传播感染和妊娠并发症的防护能力较低。它有更复杂的营养需求,是阴道免疫力下降的标志,可能引发阴道感染。
注:CST III型又可细分为两个亚型,CST III-A型和CST III-B型。两者之间的区别是III-A型的惰性乳杆菌丰度比III-B型更高。CST III型代表了一种转变或者不稳定状态,容易收到宿主自身或者外界环境条件下的影响从而转变成病理状态。
✦CST-IV型——阴道生态失调
CST IV的特点是乳杆菌的相对丰度低,混合多种兼性厌氧菌,厌氧菌的多样性和丰富性增加,包括普雷沃菌属(Prevotella)、加德纳菌属(Gardnerella)、巨型球菌属(Megasphaera)、斯尼斯菌属(Sneathia)、气球菌属(Aerococcus)等。
CST IV型通常在细菌性阴道病患者中较为常见。该种类型与性传播疾病的感染风险增加、妊娠并发症、盆腔炎、早产、不孕不育等有较强的相关性。注:并不是所有的CST IV型阴道菌群都是由相同的细菌组成的。根据存在细菌比例不同,CST IV型可被分为A、B、C三个亚型。IV-A型的特点是阴道加德纳菌和细菌性阴道病相关细菌占比中等偏高。IV-B型的特点是阴道陌生菌(Atopobium vaginae)和阴道加德纳菌(Gardnerellavaginalis)占优势。A.vaginae可与G. vaginalis结合可形成生物膜,这也是BV发病及复发的主要原因。
IV-C又可细分为五个亚型(C0、C1、C2、C3、C4),IV-C0型菌群多样性最高,其中普雷沃菌较为常见。普雷沃菌也能形成生物膜,是另一种常与细菌性阴道病有关的微生物。Ⅳ-C1型以链球菌为优势菌,Ⅳ-C2型以肠球菌为优势菌,Ⅳ-C3型以双歧杆菌为优势菌,Ⅳ-C4型以葡萄球菌为优势菌。
与肠道微生物组相比,阴道微生物组的物种多样性相对较低,阴道微生物群通常由兼性和专性厌氧菌组成,以乳杆菌为主导的阴道微生物群是女性泌尿生殖系统健康的主要决定因素。
以乳杆菌为主导的健康人体阴道中通常有益细菌群落与人类宿主之间存在共存关系,通过保护宿主阴道环境免受病原微生物的定植,同时宿主为细菌生长提供营养。
✦ 阴道微生物的保护作用
阴道微生物群在保护阴道上皮免受病原微生物污染方面发挥着重要作用。这种保护机制基于三种机制:
1)天然微生物群与病原体的竞争
乳杆菌粘附到阴道上皮,通过竞争性占领过程形成抵抗病原微生物的保护层。
2)针对这些不良微生物的抗微生物物质的生产
生产三种不同类型的物质:乳酸、过氧化氢和细菌素。
•乳酸:维持阴道的pH值在酸性,抑制病原微生物的生长。
•过氧化氢:由于其氧化能力而具有抗菌作用。
•细菌素:是蛋白质来源的毒素,具有抗菌功能,它们的作用是通过在细菌的细胞质膜中产生孔来溶解或破坏细菌的细胞质膜。
3)病原物种的共聚集能力以提高抗微生物能力
病原微生物被来自天然阴道微生物群的细菌包围的机制。
✦ 阴道菌群失衡与一些疾病相关
乳杆菌的定植和优势是健康阴道微生物群的基本特征。正常情况下,二者处于动态平衡状态。当阴道环境、宿主等因素发生变化的时候,上述平衡状态改变,则为阴道微生态失调。
阴道细菌比例失衡被认为会导致生殖器官容易受到感染或并发症。阴道微生物的组成与感染和传播人类免疫缺陷病毒(HIV)的风险增加有关。并且感染其他性传播感染的风险增加,包括淋病、衣原体、滴虫、单纯疱疹病毒2(HSV-2)和梅毒。非最佳微生物群还与人乳头瘤病毒(HPV)的发病率和患病率以及宫颈上皮内瘤变的相关发展和进展以及宫颈癌风险增加有关。
阴道微生物群的组成还与尿路感染、外阴阴道念珠菌病和盆腔炎等疾病相关。有证据支持阴道微生物群的组成与生殖健康(包括早产、自发性早产和早产胎膜早破)之间存在关联。


细菌性阴道炎(BV)是一种在全球育龄妇女中非常普遍的阴道微生物群疾病。全世界23%–29%的女性患有此病。
✦ 细菌性阴道炎的微生物特征
乳杆菌总数的减少或急剧下降,同时兼性或专性厌氧微生物的浓度增加数倍,如Gardnerella、Prevotella、Atopobium、Mobiluncus、双歧杆菌、Sneahia、Leptotrichia,以及梭状芽胞杆菌目中的一些新细菌,称为BV相关细菌。
✦ 细菌性阴道炎的危害
细菌性阴道炎(BV)与不良生殖健康结果相关,例如性传播感染(STI)和盆腔炎(PID)。此外,早产(PTB)、低出生体重、流产以及其他不良产科结局也与BV相关。
✦ 需氧性阴道炎也存在生态失调
此外,另一种称为需氧性阴道炎(AV)的生态失调疾病经常与BV相混淆。这是因为,两者都与阴道微生物的CST-IV相似,即缺乏大量的乳杆菌,pH>4.5。
然而,根据微生物多样性对这两种情况进行了区分。 BV是指存在严格厌氧菌;而AV是指存在需氧肠道细菌,包括大肠杆菌、金黄色葡萄球菌、B族链球菌(无乳链球菌)或肠球菌。
需氧性阴道炎除了具有病原体复杂的特点外,还易合并其他阴道感染。AV不仅可导致患者外阴阴道不适,还与盆腔炎症性疾病、不孕症以及流产、早产、胎膜早破、绒毛膜羊膜炎、新生儿感染、产褥感染等不良妊娠结局有关。

越来越多的证据表明阴道微生物组与自发性早产风险有关。
阴道微生物群在妊娠健康和结局中起着重要作用,阴道菌群失调的增加(通常以CST IV菌群的丰度较高和乳酸杆菌的丰度较低为特征)导致妊娠并发症和早产风险增加。
✦ 足月分娩的妇女阴道微生物群稳定
足月分娩妇女的阴道微生物群落通常是稳定的,在怀孕早期以乳杆菌为主;而经历早产的女性通常阴道菌群以厌氧菌为主。
在大多数足月分娩中,阴道微生物群的特点是厚壁菌门成员占优势,放线菌门、变形菌门、拟杆菌门和梭杆菌门成员的丰度较低,而在早产的情况下,厚壁菌的数量减少。
✦ 低丰度的乳杆菌与早产风险增加相关
对至少三种不同CST中的阴道微生物组进行分类以评估早产风险的纵向研究。所有17项研究均在2014年至2021期间发表,包括38-539例妊娠和8-107例早产。与脆乳杆菌占优势的女性相比,具有“低乳杆菌”阴道微生物组的女性早产风险增加(OR 1.69,95%CI 1.15–2.49)。
网络荟萃分析支持微生物组可以预测早产,其中低丰度的乳酸菌与最高的风险相关,而L. crispatus优势菌群的早产风险最低。
越来越多的证据表明,每个女性独有的阴道微生物群在决定生殖健康许多方面起着重要作用。
✦ 与不孕相关的阴道菌群失调
研究表明,L. iners 、L . crispatus、L. gasseri可以区分特发性不孕女性与健康女性或阴道病患者。
乳杆菌主导的阴道菌群通常被视为正常的标志。然而,许多研究表明,并非所有类型的乳杆菌都是有益菌,例如,L.crispatus 似乎具有有益特性,而L.iners 则没有。
患有特发性不孕的女性似乎更容易出现阴道菌群失调。研究人员将阴道微生物群分为两类:低乳酸杆菌阴道微生物群(LL-VMB)和高乳酸杆菌阴道微生物群(HL-VMB)。研究人员开始评估女性不育与阴道微生物群之间的统计关联,结果如下:

DOI: 10.1007/s00404-020-05675-3
数据显示,细菌性阴道炎与女性不孕症呈正相关,并且细菌性阴道炎阳性者的影响大于细菌性阴道炎中间值者。
✦ 低乳酸杆菌阴道微生物群或细菌性阴道病 可能对受精过程产生影响
女性不孕症可根据不同的标准分为不同的类型,其中与阴道微生物群的关联可能有所不同。从病因学的角度来看,输卵管性不孕症是与阴道微生物群相关的最常见疾病。
由细菌性阴道炎引起的慢性炎症反应也可能是输卵管粘连的原因,至少是部分原因。
✦ 阴道微生物群对怀孕影响的其他研究

多囊卵巢综合征(PCOS)被广泛定义为一种内分泌和代谢紊乱,伴有雄激素过多(多毛症或高雄激素血症)和卵巢功能障碍(少排卵或多囊)的体征和症状,如今变得越来越常见。
由于健康女性的微生物群落处于动态平衡状态,因此不平衡的微生物群组成被认为与多囊卵巢综合症女性有关。许多研究人员已广泛证明,PCOS动物模型和患有PCOS的女性中会发生微生物群组成的变化和菌群失调。
✦ 多囊卵巢综合征患者的乳杆菌显著减少
据报道,青春期前女性和绝经后女性的阴道微生物组存在很大差异。这主要是由于下生殖道微生物组会受到年龄、性激素水平、生活习惯等的影响。
其中,月经不规律和激素水平异常被认为是导致PCOS女性阴道微生物组改变的两个主要原因。正常的月经伴随着雌激素和孕激素的规律变化,会带动生殖道表皮细胞的生理变化,维持微环境(包括平衡的微生物群落)的平衡。相反,PCOS女性的月经不调会导致下生殖道微生物组的组成发生变化。
通过 16S rRNA 基因测序分析的 194 个微生物样本的结果 表明,PCOS 和健康女性在阴道微生物组和宫颈管微生物组中的类群丰度存在显著差异。在多囊卵巢综合症女性中,结果发现乳杆菌的成分显著减少。
另一方面,其他一些微生物群,如阴道加德纳菌 (Gardnerella vaginalis)、沙眼衣原体 (Chlamydia trachomatis) 和普雷沃氏菌 (Prevotella) 同时增加。此外,这些增加的微生物群被认为是阴道和宫颈管中潜在的致病类群。
✦ PCOS中的微生物组和性激素
研究表明,性激素影响微生物组的组成,包括肠道微生物组和阴道微生物组。激素水平不平衡可能与多囊卵巢综合症的微生物组“失衡”有关。
越来越多的研究表明,雌激素对于建立女性平衡的微生物群落结构至关重要。众所周知,雌激素在增加阴道上皮细胞糖原的产生并随后促进乳杆菌的生长方面发挥着关键作用。尽管有研究表明高淀粉饮食是乳酸菌占主导地位的原因,但雌激素仍然被认为是这一过程的核心因素。
更重要的是,微生物组还调节多囊卵巢综合症的性激素。据报道,患有PCOS的女性体内雄激素水平较高与代谢失调有关。由于性激素受到微生物组的影响,因此可以合理地推测微生物失衡是导致多囊卵巢综合症的原因。多项研究报告称,多囊卵巢综合症与肠道微生物群组成的异常波动有关。这些波动可以概括为β多样性的异常变化和α多样性的下降,不仅包括物种丰富度,还包括系统发育多样性。
更重要的是,性激素、阴道以及肠道微生物群之间的相互作用是一个多步骤的过程。肠道微生物群调节雌激素水平,雌激素调节阴道微生物群。因此,异常的肠道微生物组或阴道微生物组可能在 PCOS 中相互影响,包括调节微生物组的组成和调节激素的变化。免疫稳态有利于女性建立健康的微环境。
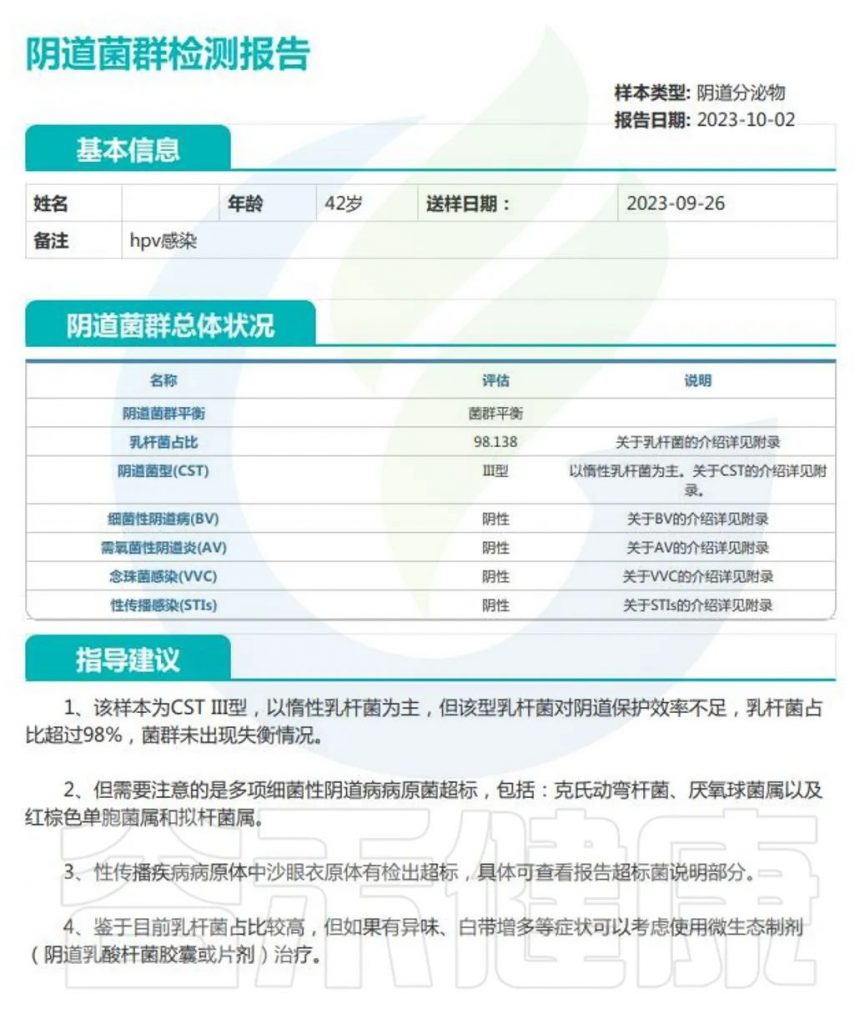
▸ 为什么要进行阴道菌群检测?
1. 全面了解菌群结构:高通量二代测序和 16S 测序能够更全面、精确地分析阴道菌群,提供更丰富的信息,有助于深入了解阴道微生态环境。
2. 早期发现异常:有助于早期发现潜在的菌群失衡,为细菌性阴道炎及不良妊娠结果的诊断和干预提供依据。
3. 个性化治疗:根据检测结果可以制定更有针对性的治疗方案,提高治疗效果。
以分子生物学和DNA测序技术的发展为生殖道微生态研究提供了可靠的技术支持,通常采用16S rRNA基因扩增子进行测序。
▸ 谷禾阴道菌群检测
谷禾健康运用高通量测序技术,得到阴道中大多数微生物的信息,并通过生信统计学对微生物菌群数据进行处理,通过分析阴道微生物的组成及相对丰度,对阴道微生物群落状态类型(CST)进行分型,可帮助监测和分析女性阴道的健康状况,并对不同疾病及条件的分组进行CST聚类,分析不同分组条件下的阴道菌群的特征差异,为临床科研分析做指导。
▸ 面向人群特点及解决问题
1. 面向有不良妊娠史或疑似细菌性阴道炎的人群:帮助这些人群更准确地评估阴道微生态状况,找出可能导致不良妊娠结果的原因。
2. 解决问题:明确菌群失衡情况,为治疗提供科学依据,提高妊娠成功率,改善女性生殖健康。
需要注意的是,在实际应用中,应结合临床症状、其他检查结果等进行综合分析和判断。
▸ 细菌性阴道炎极易复发
细菌性阴道炎是一种常见的妇科疾病,以阴道内细菌失衡为主要特征。尽管当前的治疗方法可以有效缓解症状,但该病症的复发率依然较高。复发的原因多种多样,包括但不限于抗生素治疗后的菌群失衡、个人卫生习惯、激素水平变化以及性行为等因素。
因此,对于细菌性阴道炎的管理,除了治疗初发感染外,更需重视疾病的长期预防和控制策略。阴道微生物的生态平衡对于治疗极为重要。
▸ 关注阴道微生物有助于提高治愈率

一项研究纳入了46名接受甲硝唑治疗的细菌性阴道炎患者,其中仅20名患者被治愈,在治疗前后检测阴道菌群后发现:在治愈的患者中,其在甲硝唑治疗前惰性乳杆菌富集,并且在治疗后保持较高的丰度。
惰性乳杆菌(L.iners)主导的阴道菌型与较差的抗细菌性阴道炎(BV)能力有关,且常规甲硝唑治疗并不会减少L.iners的丰度。而卷曲乳杆菌(L.crispatus)有较高抗BV的潜力。
与L.crispatus不同,L.iners的生长依赖于半胱氨酸;半胱氨酸抑制剂与甲硝唑联用,在体外通过可抑制L.iners,并促进L.crispatus的丰度。用最佳菌种进行补充治疗,或靶向治疗这些非最佳细菌,可能有助于减少细菌性阴道炎复发的概率。
▸ 针对不同的阴道微生物组成用药也不同
1.乳酸杆菌部分携带 (>5%)
口服或局部使用甲硝唑或替硝唑,因为乳杆菌对甲硝唑、替硝唑不敏感,且能杀灭其他厌氧菌。
2.乳酸杆菌几乎不携带 (<1%),厌氧型
口服或局部使用甲硝唑或替硝唑或克林霉素,因为
甲硝唑、替硝唑不敏感,且能杀灭其他厌氧菌。
3.乳酸杆菌几乎不携带 (<1%),需氧型
口服或局部克林霉素或卡那霉素为主,因为克林霉素对主要的好氧菌敏感。
▸ 阴道微生物移植

France M,et al.Nat Microbiol.2022
现有的治疗方法包括甲硝唑等抗生素、雌激素疗法、乳酸和硼酸以及阴道乳酸杆菌益生菌。然而,这些干预措施的成功率各不相同,并且不能有效预防复发性/顽固性 BV。
阴道微生物移植 (VMT) 是治疗BV的一种有前景的干预措施。确定了具有乳杆菌优势阴道微生物群的合适供体。从捐赠者处收集阴道分泌物,筛查各种性传播感染并进行处理。然后将处理后的阴道分泌物引入通常患有复发性/顽固性 BV 的接受者的阴道中。接受者在移植前可能会或可能不会接受抗生素治疗。成功的定义是受体细菌性阴道炎的持久解决以及其阴道微生物群向乳杆菌占主导地位的转变。
阴道微生物群的平衡对女性健康至关重要。因此,阴道菌群检测在评估女性健康状况方面具有重要意义。通过检测阴道微生物群的组成,可以及早发现潜在的问题,并采取相应的干预措施,以改善女性的生殖健康和妊娠成功率。这不仅有助于提高辅助生殖技术的效果,还可以降低早产、新生儿并发症等不良妊娠结局的风险,对于优化女性健康管理和具有重要意义。
主要参考文献
Gupta S, Kakkar V, Bhushan I. Crosstalk between Vaginal Microbiome and Female Health: A review. Microb Pathog. 2019 Nov;136:103696.
France M, Alizadeh M, Brown S, Ma B, Ravel J. Towards a deeper understanding of the vaginal microbiota. Nat Microbiol. 2022 Mar;7(3):367-378.
Chee WJY, Chew SY, Than LTL. Vaginal microbiota and the potential of Lactobacillus derivatives in maintaining vaginal health. Microb Cell Fact. 2020 Nov 7;19(1):203.
Shen L, Zhang W, Yuan Y, Zhu W, Shang A. Vaginal microecological characteristics of women in different physiological and pathological period. Front Cell Infect Microbiol. 2022 Jul 22;12:959793.
Chen X, Lu Y, Chen T, Li R. The Female Vaginal Microbiome in Health and Bacterial Vaginosis. Front Cell Infect Microbiol. 2021 Apr 7;11:631972.
Bayar E, Bennett PR, Chan D, Sykes L, MacIntyre DA. The pregnancy microbiome and preterm birth. Semin Immunopathol. 2020 Aug;42(4):487-499.
Chen T, Wu R, Cheng L, Liao Q, Chen Z. Editorial: Vaginal microecological disorder and gynecological diseases. Front Cell Infect Microbiol. 2023 Oct 18;13:1292815.
Gu Y, Zhou G, Zhou F, Li Y, Wu Q, He H, Zhang Y, Ma C, Ding J, Hua K. Gut and Vaginal Microbiomes in PCOS: Implications for Women’s Health. Front Endocrinol (Lausanne). 2022 Feb 23;13:808508.
Kalia N, Singh J, Kaur M. Microbiota in vaginal health and pathogenesis of recurrent vulvovaginal infections: a critical review. Ann Clin Microbiol Antimicrob. 2020 Jan 28;19(1):5.
Han Y, Liu Z, Chen T. Role of Vaginal Microbiota Dysbiosis in Gynecological Diseases and the Potential Interventions. Front Microbiol. 2021 Jun 18;12:643422.
Fettweis JM, Serrano MG, Brooks JP, Edwards DJ, Girerd PH, Parikh HI, Huang B, Arodz TJ, Edupuganti L, Glascock AL, Xu J, Jimenez NR, Vivadelli SC, Fong SS, Sheth NU, Jean S, Lee V, Bokhari YA, Lara AM, Mistry SD, Duckworth RA 3rd, Bradley SP, Koparde VN, Orenda XV, Milton SH, Rozycki SK, Matveyev AV, Wright ML, Huzurbazar SV, Jackson EM, Smirnova E, Korlach J, Tsai YC, Dickinson MR, Brooks JL, Drake JI, Chaffin DO, Sexton AL, Gravett MG, Rubens CE, Wijesooriya NR, Hendricks-Muñoz KD, Jefferson KK, Strauss JF 3rd, Buck GA. The vaginal microbiome and preterm birth. Nat Med. 2019 Jun;25(6):1012-1021.
谷禾健康
阴道微生物组是一个复杂而动态的微生态系统,在女性月经周期和女性的一生中不断发生波动。
在过去几年中,对阴道微生物群关注随着测序技术的发展和应用逐渐广泛和突出,有关以往传统正常和异常阴道微生物组的知识也发生了变化。培养技术可能不再适用于确定正常或异常的阴道微生物群。以非培养为基础的分析生物技术揭示了一个动态且主要由乳酸杆菌主导的复杂动态系统。
该生态系统受基因、种族背景、发育以及环境和行为因素的影响。每个个体都有几种乳酸杆菌在健康的阴道中占主导地位。它们与抗菌物质、细胞因子、防御素和其他物质一起支持防御系统,以对抗菌群失调、感染和早产以及不孕不育等问题。
在这里,我们主要讨论和介绍女性生命周期不同阶段阴道区域微生物群落的变化,哪些因素会影响阴道菌群,及阴道菌群对性健康和病理状况的影响。
育龄女性产生约 1 至 4 mL 的阴道液,每 mL 含有 108至 109 个细菌细胞。阴道微生物从女性出生的最初几个小时开始就开始定居,并伴随她的一生一直存在到死亡。
这些细菌群落在个体之间和随着时间的推移可能会有产生差异。
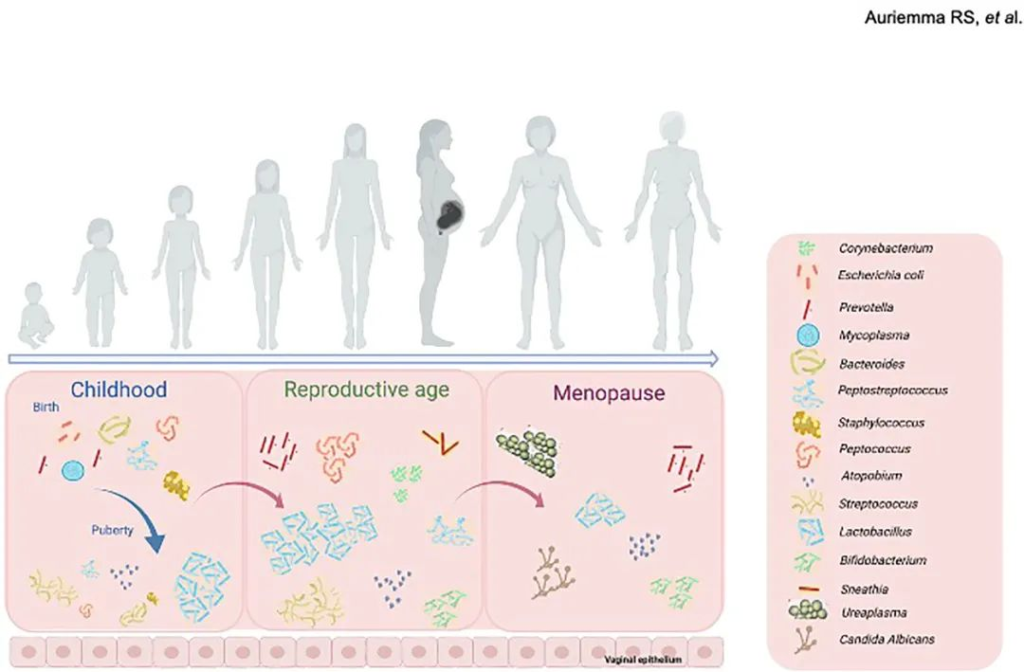
• 阴道微生物群被定义为在阴道内定殖的共生和病原微生物群;
• 阴道微生物群从女性出生的最初几个小时开始就开始定居,伴宿女性一生;
• 随着年龄的变化,从青春期前的厌氧微生物过渡到生殖年龄时富含乳酸杆菌的阴道。
• 在大多数健康育龄妇女中,阴道微生物群以乳酸杆菌为主。
+
阴道菌群中 70%是乳杆菌
阴道拥有自己的原生微生物群落,这是抵御病原体的主要防线。
最主要的阴道种群是乳酸菌,占细菌群落的近 70%。这些包括下列菌群等:
此外,其他细菌种类如下列菌群等也存在于健康个体的阴道中:
研究人员通过16s技术等在研究中将阴道微生物群分为编号为 I-V 的进化枝。其中,Clades I、II、III、V以乳酸杆菌为主,Clade IV无优势群,是微生物的混合体。
注:CST I、II、III 和 V 以L. crispatus 、L. gasseri、L. iners、L. jensenii 为主,而 CST IV 是指以专性厌氧菌为特征的微生物群落的高度多样性。
每个女性体内的原生微生物群数量因种族、地理、生活方式、卫生和冲洗方法而异。
注:已经发现,在疾病进展期间,乳杆菌种群发生了从L. crispatus 到 L. iners 的转变。这种转变的原因尚不清楚。有人提出,与L. iners 产生的L-乳酸相比, L . crispatus 产生的d-乳酸可能提供更好的保护,防止病原体定植。
因此,许多其他细菌在健康的阴道菌群中的浓度较低,例如消化链球菌(Peptostreptococcus)、拟杆菌(Bacteroides)、棒状杆菌(Corynebacterium)、链球菌(Streptococcus)和消化球菌(Peptococcus)。
阴道微生物群的组成在女性的一生中不断演变。在女性生命的这些不同阶段,阴道菌群会发生各种生理和荷尔蒙变化(下图)。
健康的阴道微生物群通常由乳杆菌属控制,乳杆菌属对阴道失调或感染具有保护作用。尽管这种保护作用的确切机制尚不清楚,但新出现的研究表明,阴道菌群产生多种分子来维持阴道内稳态并防止感染。
例如,健康的阴道环境的特征是阴道乳杆菌产生乳酸,这在消除入侵病原体方面发挥着重要作用。此外,Lactobacilius还产生许多化合物,如细菌素和H2O2,以选择性地抑制入侵病原体并保持阴道内稳态。
阴道微生物失调的特点是乳酸杆菌属的丰度较低,而CST IV微生物群的水平较高,如厌氧链球菌、阴道加德纳菌、阴道阿托波菌、莫比伦氏菌属、斯内氏菌属(Sneathia)、普雷沃氏菌属、支原体,这会对阴道和生殖健康产生不利影响,并导致对各种阴道感染(如细菌性阴道病和念珠菌病)的易感性,甚至可能导致不良妊娠结局,如早产、先兆子痫、妊娠高血压等。
世界范围内进行的大量研究已确定乳酸杆菌是育龄健康女性阴道微生物群的主要成分。阴道微生物组因种族和地区而异。目前尚不清楚种族因素是否单独或结合行为和环境变量可以解释这些差异。
▸ 不同地区的阴道菌群存在差异:
来自不同国家的女性在其阴道微生物群中有一定程度的差异,不过差异不大。
在中国育龄健康女性的生殖微生物群落中以 L. gasseri, L. crispatus 和 L. iners为主要。
欧洲女性有一个独特的阴道微生物群,包括L. crispatus, L. jensenii, L. gasseri, L. iners.
而非洲研究表明,植物乳杆菌是阴道微生物群中的主要物种,其次是:
L. gasseri
Lactobacillus rhamnosus
L. crispatus
Lactobacillus plantarum
上述发现表明,来自世界各地的健康女性的阴道微生物组存在物种水平的差异。这些差异也可以用所研究社区内的种族差异来解释。
▸ 同一地区不同种族的阴道菌群存在差异:
育龄妇女的阴道细菌群落在不同地区的妇女之间可能存在差异,但在生活在同一地理区域的不同种族的妇女之间也可能存在差异。
2011 年的一项研究对无症状北美女性的阴道微生物群进行表征,表明亚裔和美国白人女性的阴道菌群以乳酸杆菌为主,这与西班牙裔和非裔美国女性不同,后者只有 60% 的阴道菌群以乳酸菌为主。
此外,与非洲女性相比,白种人和亚洲女性的L. crispatus含量较高,而 L. iners 含量较低。
在另一项使用 16S rRNA 基因测序的研究中,表明欧洲血统女性的阴道微生物群以乳酸杆菌为主,而非裔美国女性则相反,后者呈现出混合的阴道群落,其中包括人型支原体、气球菌、惰性乳杆菌和许多严格的厌氧菌,包括:革兰氏-阳性厌氧球菌、细菌性阴道炎相关细菌、Sneathia、Prevotella amnii、Megasphaera、Atopobium、Gardnerella vaginalis。
阴道 pH 值也因种族而异。非裔美国人和西班牙裔女性的阴道 pH 值(分别为 4.7 和 5.0)高于标准值(<4.5)。
阴道及其微生物群形成了一个生态系统,随着时间的推移,从婴儿期到儿童期再到青春期和成年期,影响这些变化的主要力量是雌激素水平的波动和性活动的出现,卫生实践和药物,包括口服避孕药和抗菌剂,也会影响阴道中存在的各种菌群之间的复杂相互作用。
下面我们来看每个时期阴道菌群的特点及相关影响因素:
出生后或出生后不久,婴儿的阴道微生物群从母亲身上吸收细菌时开始繁殖。
许多研究表明,怀孕期间的母体微生物组对妊娠结局和分娩方式(阴道或剖宫产)有很大影响,这会显著影响婴儿的微生物组。
出生后,微生物群需要数年的时间才能充分发展和多样化,这是一个动态过程,并受到多种外部因素的严重影响。例如,早期喂养方式或接触抗生素会影响婴儿的微生物群。
▸分娩方式不同影响菌群定植
在阴道分娩时,新生儿暴露于母亲的阴道和粪便微生物群,这些微生物群中含有大量乳酸杆菌、普雷沃氏菌、斯奈氏菌和双歧杆菌;
然而,剖腹产婴儿从母亲的皮肤或周围医院环境中接受了不同的微生物接种物,这些接种物通常主要由棒状杆菌、葡萄球菌和丙酸杆菌居住,有时还含有传染性微生物制剂,如梭状芽孢杆菌、肠球菌和克雷伯菌。
胎盘和羊水的微生物组在成功分娩和新生儿微生物组发育中起着重要作用。最初的胎粪显示胎盘和羊水中的细菌占优势。
▸阴道菌群与激素调节相关
在怀孕和产后阶段,身体经历了许多变化,通常由雌激素等各种激素调节。
阴道雌激素水平高,有助于维持较高水平的阴道糖原,乳酸杆菌通常将其用作维持阴道酸性环境的食物。
此外,新生儿还通过母乳接触母体雌激素,这有助于维持健康的新生儿菌群。相反,阴道雌激素水平随着年龄的增长而降低,这反过来导致阴道乳杆菌和中性阴道pH值的降低。
▸乳酸杆菌是大多数女孩的主要菌群
在完成如厕训练之前,婴儿和学步儿童通常会遇到革兰氏阴性肠道细菌和肠球菌,但之后会较少遇到。
在儿童中,乳酸杆菌在 2 岁以下的女孩中比在青春期前年龄较大的女孩中更常见,并且可能在限制其他菌群过度生长方面发挥保护作用。
在儿童早期,阴道的 pH 值是中性或微碱性。
几个内在和外在因素可以显著影响女性一生中的阴道微生物群。
青少年时期的厌氧菌流行率更高。从青春期开始,有氧定植随着年龄、性活动的开始和胎次而增加。
在月经初潮前,低雌激素水平通常与由需氧、厌氧和肠道微生物组成的多种阴道微生物群落有关,微生物多样性增加的梭杆菌属、普雷沃氏菌属和Ezakiella属(普雷沃氏菌为主);在生命的这一阶段,阴道pH值呈微碱性(pH 7.5–8)或中性(pH 7.0)(下图)。
给父母的重要提示:
青春期前的儿童可能会出现阴道感染,这通常是由于高香味的沐浴产品造成的。鼓励孩子在上厕所时从前到后擦拭,洗澡时不要使用香皂等产品洗,尤其是直接进入阴道区域。
青少年时期对年轻人来说是一个充满挑战的时期,他们的身体在进入青春期时会发生变化。此时阴道微生物组也发生了很大变化。
从青春期初期到生殖阶段,阴道微生物组成不断变化:
青春期早期通常由Finegoldia、Anaerococcus、Prevotella、Dialister、Peptoniphilus和乳杆菌属组成,而后期主要由乳杆菌属和较低丰度的Sneathia、Prevotela、嗜血杆菌属、Atopobium、Gardnerella组成。
不断增加的雌激素水平导致高水平的糖原存在于阴道内膜中。乳酸杆菌家族的细菌发酵糖原,从而产生乳酸。这有助于保护阴道。
在这个阶段,乳酸杆菌的丰度降低会导致阴道生物失调和细菌性阴道病。
在生殖阶段的初始阶段,一系列因素有助于阴道微生物组的动态。青春期初期女性性腺激素水平的增加导致阴道微生物多样性的增加,这是通过诱导阴道壁中糖原沉积的增加,较低的阴道性腺水平和激素刺激的糖原支持乳酸杆菌的生长。
月经期的阴道微生物组成似乎与青春期早期观察到的相似:两个属(消化链球菌Peptostreptococcus和链球菌属Streptococcus)通常占主导地位,而不是乳杆菌属,这可以通过测定期间阴道pH值的变化来解释。
新的研究表明,在月经期间,月经液与阴道壁的相互作用中和了酸性阴道微环境,导致pH值升高(7.2–7.4)。乳杆菌属的下降导致许多其他厌氧菌上升。
尽管在月经周期中阴道菌群发生这些实质性变化的确切原因尚不清楚,但过去的结果表明,这一阶段的一些生理事件可能会影响阴道微环境。
例如,黄体期(月经前)被认为以子宫壁增厚为特征,特别是子宫内膜和阴道上皮增厚,导致阴道区域糖原沉积增加,而缺乏受精导致性激素水平突然下降,以及子宫内膜衬里脱落和中性pH,为许多微生物的增殖创造了理想的栖息地。
在随后的卵泡期,月经流量的减少再次降低了阴道pH值,增强了糖原降解和乳酸生产(通过乳酸杆菌),从而抑制了其他厌氧微生物的生长。
月经与阴道微生物群落的动态变化有关。一些女性有强健的阴道微生物群落,在月经期间群落状态之间有简单和可预测的过渡,而其他女性在整个月经期间表现出相对稳定的微生物群落。
在生殖阶段,阴道微生物群落通常以脆乳杆菌为主,而在月经期间观察到阴道微生物群失衡,其特征是脆乳杆菌减少,混合厌氧菌增加,如Gardnerella、Atopobium、Prevotella、Megasphaera sp.、L.iners、链球菌等。因此,CST从CST I转移到CST III或CST IV,有时在整个月经周期中,社区保持稳定和相同。
新的研究表明,阴道微生物环境是由宿主因素(种族、遗传和免疫介质)和微生物生物学在整个生殖周期中的微妙相互作用维持的。虽然在月经期间已描述了改变的阴道细胞因子模式,但其与阴道微生物群和生殖健康的关系尚未完全确定。此外,女性阴道微生物群落的个体间差异也很高。
一旦我们度过了青春期,我们就达到了生育年龄。性活动可能会随之而来,并伴随着怀孕的机会。在怀孕期间,阴道菌群会发生变化,并且在乳酸杆菌中变得更加占优势。人们认为,由于荷尔蒙的变化,乳酸杆菌的这种增加的优势是为了防止感染,这种感染可能在这个脆弱的时期被触发。
怀孕的特点是各种生理变化,这些变化有助于胎儿适应母亲身体的微生物群,反之亦然。这种多样化的状态受到激素和生理变化的调节,这些变化导致免疫调节、行为、粘膜理化、代谢和生殖道变化,从而导致微生物组的结构和功能被调节,这与非怀孕女性的不同。
怀孕是一个“形成期”,由各种相互关联的生理和分子过程控制,以支持胎儿的生长和发育。
在怀孕过程中,身体经历了大量的激素、免疫和微生物变化,以促进母体内稳态并支持胎儿生长。阴道菌群在怀孕过程中也会发生实质性变化,并随着怀孕的进行而变得更加均匀。在妊娠早期,胎盘为支持胎儿而增加的雌激素和孕激素分泌。
实际上触发了总体微生物多样性的丰富;然而,怀孕期间持续升高的激素水平和阴道乳杆菌的拮抗反应导致稳定和健康的阴道菌群。另一方面,不断变化的阴道环境也会导致几种氨基酸(例如,苯丙氨酸、丝氨酸、天冬氨酸、异亮氨酸、色氨酸、苏氨酸、甘氨酸、谷氨酸、亮氨酸)和乳酸水平升高,同时耗尽有机酸(乙酸盐、丙酸盐)、葡萄糖和生物胺(腐胺、酪胺、甲胺)以支持胎儿。
与怀孕期间阴道微生物的变化类似,母体免疫反应也发生了从促炎反应到抗炎细胞因子的实质性变化,以接受胎儿同种异体移植,同时性腺激素水平升高。阴道免疫系统在稳定阴道微生物群和防止上行生殖道感染中起着至关重要的作用。
产后阶段的阴道菌群显著不同,其特征通常是乳酸杆菌的丰度较低,而其他菌群的丰度相对较高,如阴道加德纳菌、无乳链球菌和普雷沃氏菌,导致阴道微生物群落更加多样。
怀孕后雌激素(雌二醇和雌二醇)水平的降低是一个显著影响阴道微环境的因素,包括菌群,这对于非怀孕阶段、恢复自然生理状态和为连续怀孕准备阴道微环境非常重要。未能在1年内恢复自然生理和免疫阴道微环境或随后的妊娠可能会严重影响妊娠结局。
产后抗生素预防是决定产后阴道微生物组成的另一个重要因素。与未经治疗的女性相比,分娩时使用抗生素预防的女性。
与雌激素水平降低同时,与分娩和分娩相关的自然生理变化会刺激炎症反应,以促进子宫收缩、宫颈扩张和胎膜破裂,这可能会显著导致阴道微生物成分的变化。
除雌激素外,其他分泌化合物如透明质酸和Hsp70在重塑阴道微环境中发挥着重要作用,因为它们在分娩期间的水平调节子宫颈并为分娩做好准备,而分娩后它们有助于重塑子宫颈,包括阴道上皮衬里和阴道液体成分。
更年期是女性停止月经周期的时候。在这个阶段,卵巢停止释放雌激素和卵子,这导致生殖周期结束,性腺激素和阴道壁糖原水平降低。随后,雌激素水平的降低也导致阴道微环境的变化,包括乳酸杆菌和乳酸的丰度降低以及中性pH值,这促进了潜在致病微生物的定植,并增加了对泌尿生殖道感染的易感性。
绝经后妇女不仅阴道感染风险增加,而且还会出现其他血管舒缩症状,如潮热、失眠、抑郁等。这些症状是更年期雌激素缺乏的结果,对女性的健康和生活质量产生负面影响。
阴道微生物组极其重要,对绝经后妇女的整体生活质量有重大影响,包括性健康、阴道干燥和外阴阴道萎缩等。不幸的是,新出现的结果表明,大约25-50%的女性在绝经后阶段经历了外阴阴道萎缩,这包括外阴阴道症状,如疼痛的性活动、性交后出血、小便时灼热、疼痛、瘙痒和带有难闻气味的阴道分泌物。
尽管医生已经尝试了不同的治疗方法来改善妇女的绝经后生活,包括使用雌激素的激素替代疗法,这种疗法导致乳酸杆菌数量和糖原水平的增加,从而导致泌尿生殖道感染的减少。
然而,这种疗法未能在不同人群中显示出一致的效果,特别是在有肝病、冠心病、心脏病或乳腺癌病史的患者中。在这些患者中,治疗会导致严重的不良反应,如乳房疼痛或持续阴道出血。
用益生菌鼠李糖乳杆菌GR-1和罗伊氏乳杆菌RC-14 进行的另一种阴道治疗已经证明,这显示出对阴道菌群的有益影响,有助于避免绝经后女性的阴道感染。有限的科学证据和不适当的数据阻止了此类益生菌的使用。
阴道微生物群在保护阴道上皮免受病原微生物污染方面发挥着重要作用。这种保护机制基于三种机制:
1)天然微生物群与病原体的竞争
乳酸杆菌粘附到阴道上皮,通过竞争性占领过程形成抵抗病原微生物的保护层。
2)针对这些不良微生物的抗微生物物质的生产
生产三种不同类型的物质:乳酸、过氧化氢和细菌素。
乳酸:维持阴道的 pH 值在酸性,抑制病原微生物的生长。
过氧化氢:由于其氧化能力而具有抗菌作用。
细菌素:是蛋白质来源的毒素,具有抗菌功能,因此它们可以抑制其他可能致病的微生物的生长。它们的作用是通过在细菌的细胞质膜中产生孔来溶解或破坏细菌的细胞质膜。
3)病原物种的共聚集能力以提高抗微生物能力
病原微生物被来自天然阴道微生物群的细菌包围的机制。
这些形成阴道菌群的微生物与其他微生物群在共生或稳态的情况下生活在一起,也就是说,在阴道中存在的所有物种之间保持平衡。
然而,当由于某种原因阴道中乳酸杆菌的浓度降低时,我们就会进入一种生态失调的情况,其中体内平衡被破坏,因此对粘膜的保护作用降低。
导致乳酸菌减少的原因是多种多样的:
在这种低保护的情况下,病原体会引起感染,包括细菌性阴道病、念珠菌属阴道炎(念珠菌病)、滴虫病或尿路感染等,其他包括早产,不孕不育等也与阴道菌群变化相关,接下来章节我们来详细了解一下相关妇科疾病。
早产(PTL)是指怀孕37周之前的分娩,影响15-30%的妊娠,是导致产前死亡的主要原因。尽管早产的确切病因仍不明确,但胎膜早破、阴道上升感染、羊膜内感染、压力、宫颈功能不全和血管疾病是关键的促成因素;其中,某些细菌引起的宫内感染或上行尿路感染是不良妊娠结局或PTL的影响关键因素。
越来越多的证据表明阴道微生物组与自发性早产风险有关。
阴道微生物群在妊娠健康和结局中起着重要作用,阴道失调的增加(通常以CST IV菌群的丰度较高和乳酸杆菌的丰度较低为特征)导致妊娠并发症和早产风险增加。
足月分娩中,阴道菌群以厚壁菌为主
足月分娩妇女的阴道微生物群落通常是稳定的,在怀孕早期以乳杆菌为主;而经历早产的女性通常阴道菌群以厌氧菌为主。
在大多数足月分娩中,阴道微生物群的特点是厚壁菌门成员占优势,放线菌门、变形菌门、拟杆菌门和细杆菌门成员的丰度较低,而在早产的情况下,厚壁菌的数量减少。
饮食对阴道微生物群有重要影响
在怀孕期间,几种维生素和小分子是必不可少的,每一种都在不同的代谢和生理变化以及胎儿的整体发育中发挥作用。
据指出,女性的饮食中缺乏铁、钙、叶酸、核黄素、钾和维生素D,更容易早产。
维生素D在怀孕期间会对阴道微生物群产生影响,因为它可以加强、保护和维持阴道的上皮衬里;诱导抗微生物肽(LL-37)的表达、增加胰岛素合成;并且通过抑制糖原合成酶激酶最显著地模拟糖原合成。
低丰度的乳酸菌与早产风险最高相关
对至少三种不同CST中的阴道微生物组进行分类以评估早产风险的纵向研究。所有17项研究均在2014年至2021期间发表,包括38-539例妊娠和8-107例早产。与脆乳杆菌占优势的女性相比,具有“低乳杆菌”阴道微生物组的女性早产风险增加(OR 1.69,95%CI 1.15–2.49).
网络荟萃分析支持微生物组可以预测早产,其中低丰度的乳酸菌与最高的风险相关,而L. crispatus优势菌群的早产风险最低。
不孕症对社会、经济以及夫妻双方的心理健康都有严重的不良影响。全球育龄夫妇的患病率为 8–12%.导致不孕的因素复杂且范围广泛。
年龄是导致女性生育力下降的关键影响因素,其他例如卵巢早衰、多囊卵巢综合征和子宫内膜异位症都是公认的导致女性不孕的原因。
越来越多的证据表明,每个女性独有的阴道微生物群在决定生殖健康许多方面起着重要作用。
之前的研究还表明, L. iners 、L . crispatus、L. gasseri可以区分特发性不孕女性与健康女性或阴道病患者。
乳杆菌主导的阴道菌群通常被视为正常的标志。然而,许多研究表明,并非所有类型的乳酸菌都是有益菌,例如,L . crispatus似乎具有有益特性,而L. iners 则没有。
患有特发性不孕的女性似乎更容易出现阴道菌群失调。
研究人员将阴道微生物群分为两类:低乳酸杆菌阴道微生物群 (LL-VMB) 和高乳酸杆菌阴道微生物群 (HL-VMB)。研究人员开始评估女性不育与阴道微生物群之间的统计关联,结果如下:
高乳酸菌阴道微生物群与不孕症之间呈负相关
DOI: 10.1007/s00404-020-05675-3
数据显示,细菌性阴道炎与女性不孕症呈正相关,并且细菌性阴道炎阳性者的影响大于细菌性阴道炎中间值者。
女性不孕症可根据不同的标准分为不同的类型,其中与阴道微生物群的关联可能有所不同。从病因学的角度来看,输卵管性不孕症是与阴道微生物群相关的最常见疾病。
由细菌性阴道炎引起的慢性炎症反应也可能是输卵管粘连的原因,至少是部分原因。
低乳酸杆菌阴道微生物群 或 细菌性阴道病 如何对受精过程产生影响?
通过回顾文献,研究人员确定了三种可能的途径。
第一个:慢性炎症假说
已知一部分女性不孕症可归因于亚临床盆腔炎。此外,细菌性阴道病常伴有 pH 值升高、粘膜细胞损伤和局部炎症反应。虽然阴道炎症不会直接影响卵子,但微生物群仍有可能发挥作用。
最近的一项研究还表明,女性生殖道存在微生物群连续体,包括宫颈管、子宫、输卵管和腹膜液。由于一些盆腔炎是慢性的,没有临床症状,许多女性在诊断出不孕症后才意识到这些问题。
第二个:对性传播感染 (STI) 的易感性
最近的一项荟萃分析提供了高乳酸杆菌阴道微生物群对 HPV 和沙眼衣原体的保护作用的证据。 此外,许多研究表明,细菌性阴道病是感染 STI/HIV 的危险因素。
第三个:指非因果关联
多囊卵巢综合征是女性不孕症的一个非常常见的原因,代表了以高雄激素血症、少排卵/无排卵和卵巢囊肿为特征的内分泌疾病综合症。
已知雌激素或下丘脑-垂体-卵巢轴的变化与 多囊卵巢综合征和阴道微生物群相关,但所涉及的机制仍不清楚。有一些证据表明肠道微生物群与多囊卵巢综合征有关。
需要进一步的研究来系统地探索阴道微生物群、不孕症和其他混杂/中介因素之间的因果关系。
总的来说研究结果表明,健康的阴道微生物群与较低的不孕风险相关。
健康的阴道微生物组以产生各种抗菌化合物的乳杆菌为主。细菌性阴道病(BV)的特征是乳酸杆菌总数的减少或急剧下降,以及相应的厌氧微生物浓度显着增加。
细菌性阴道病是一种在全球育龄妇女中非常普遍的阴道微生物群疾病。全世界23%–29%的女性患有此病。细菌性阴道病已被证实与妇科和产科不良结局有关,例如性传播感染、盆腔炎和早产。
BV的特征是:
乳酸杆菌总数的减少或急剧下降,同时兼性或专性厌氧微生物的浓度相应增加100–1000倍,如Gardnerella、Prevotella、Atopobium、Mobiluncus、双歧杆菌、Sneahia、Leptotrichia,以及梭状芽胞杆菌目中的一些新细菌,称为BV相关细菌(BVAB)1–3.
加德纳菌是从患有 BV 的女性阴道样本中鉴定出的最常见的微生物。
健康或无症状的女性也可能携带G. vaginalis. 这表明阴道中存在G. vaginalis并不一定导致 BV。因此,正确理解G. vaginalis的作用非常重要。
G. vaginalis 含有多种与致病潜力相关的毒力因子,其中唾液酸酶和阴道溶血素是研究最广泛的因子。唾液酸酶A基因与BV和生物膜的存在有关。
G. vaginalis 利用唾液酸酶水解阴道内粘液唾液聚糖中的唾液酸残基,然后分解代谢游离碳水化合物,从而促进阴道粘液屏障的降解。
至于阴道溶解素,它是一种属于胆固醇依赖性溶细胞素家族的成孔毒性化合物,有助于靶细胞(如阴道上皮细胞)的裂解。
细菌性阴道病的发病机制和益生菌对抗BV的作用机制
doi: 10.3390/antibiotics10060719
生物膜是一个附着在非生物或生物表面的结构化微生物群落,镶嵌在其自身分泌的聚合物基质中,包括碳水化合物、蛋白质和核酸。生物膜的形成是一个复杂、动态和相互作用的过程,与活动的浮游微生物和微生物聚集体有关。
多种细菌和真菌微生物,如加德纳菌属和念珠菌属,可以形成生物膜。
阴道上皮上形成的多微生物生物膜在BV的发病机制中起着关键作用。G. vaginalis是主要的定植体,它可以为其他BV相关微生物的附着建立支架,从而能够开发多微生物生物膜。
Atopobium vaginae 是多微生物生物膜的第二个定殖者之一,是一种严格的厌氧微生物,对BV具有很大的预测性。
G. vaginalis 生物膜对两种常见的健康阴道分泌物(即乳酸和H2O2)的耐受性高于浮游细胞。这可以保护阴道毛滴虫和其他BV相关微生物免受不利环境的影响。
BV被认为是一种生物失调,通常表现出临床症状,可由大量具有促炎特征的微生物以及宿主免疫反应引起。
据报道,BV女性的阴道样本中含有高水平的免疫介质,如白介素(IL)-8、IL-6、IL-1α、IL-1β、IL-12p70和TNFα。
不同物种可能采用不同的免疫因子。例如,脆乳杆菌与γ诱导蛋白10(IP-10)的显著增加以及IL-12(p70)、IL-8、IL-1β和IL-1α的显著下降相关。
然而,根据阴道拭子的分析,G. vaginalis与IP-10的下降和IL-12(p70)、IL-8、IL-1β和IL-1α的增加相关。G. vaginalis也与相同因素的增加和减少有关。
在携带大量Prevotella spp.的女性中观察到了更高水平的IL-1β、IL-8和干扰素(IFN-γ)。
IL-36G对BV女性的关键作用得到了验证。因此,BV患者阴道样本中IL-36G水平升高。IL-36G可能在BV和其他疾病的免疫应答中发挥重要作用。
通过阴道菌群的检测,可以了解更多相关疾病风险。
谷禾阴道菌群检测数据库
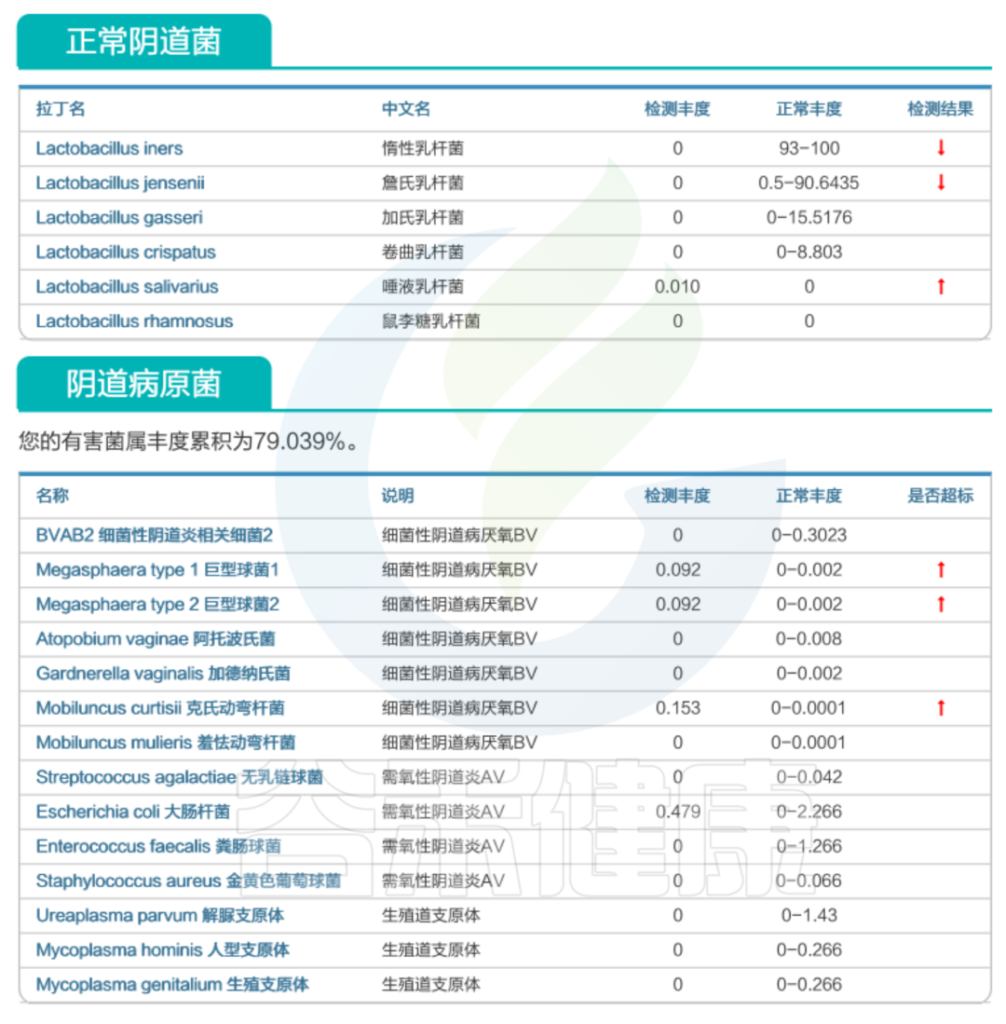
该案例选自谷禾阴道菌群检测数据库,相关菌群检测结果的异常对细菌性阴道病的风险具有提示作用。
盆腔炎是由上生殖道炎症引起的感染。细菌性阴道病被认为是盆腔炎的一个危险因素,可导致不良的生殖后遗症,如不孕、慢性骨盆疼痛和异位妊娠。
据报道,细菌性阴道病相关微生物与盆腔炎发病风险升高有关,而非细菌性阴道病相关微生物对盆腔炎发病风险没有影响。
急性子宫内膜炎患者更有可能细菌性阴道病,而携带乳酸杆菌的可能性较小。与阴道微生物群正常的女性相比,细菌性阴道病患者亚临床盆腔炎的检出率是正常女性的2.7倍。
A. vaginae, S. amnionii, BVAB1, S. sanguinegens的存在与盆腔炎及其后遗症相关,包括复发性盆腔炎和不孕。
在最近一项针对性传播感染高危女性的研究中,阴道中存在BV相关微生物,如A. vaginae, Megasphaera spp., Sneathia spp., Prevotella amnii, Eggerthella-like bacterium,可增加盆腔炎发生的可能性。
此外,BV相关微生物的更大细菌负荷预测了盆腔炎。盆腔炎中BV相关微生物的鉴定表明,生殖道上升的程度从低到高。
这一发现可能是由于BV相关微生物产生的酶。这些酶,如粘蛋白酶和唾液酸酶,可以降解粘蛋白屏障,促进上升感染,从而导致盆腔炎。
其他相关妇科疾病与阴道菌群详见:
阴道中有益和有害细菌之间的平衡非常脆弱,如果阴道 pH 值不够酸性,就会出现不平衡。阴道酸碱度应该在 3.8 到 4.5 之间,以保持健康的阴道酸度。
如果由于缺乏乳酸杆菌而导致阴道酸度不足,那么真菌和“坏”细菌的繁殖能力就会比平时更多。
可能增加阴道菌群失衡并因此感染的生理或外部风险因素包括:
帮助恢复阴道菌群平衡的措施:
益生菌是体内天然存在的细菌,通常被推荐用于治疗阴道菌群失衡。益生菌有助于恢复健康的乳酸杆菌水平。通过保持阴道菌群的健康平衡,身体对感染的防御能力得以恢复。
益生菌的开发和临床应用的最新进展为治疗开辟了新途径。极大地克服了因抗生素的适宜性、用量、给药方式等使用不当而导致病原体耐药性增强的现象。
有些益生菌例如鼠李糖乳杆菌、罗伊氏乳杆菌、植物乳杆菌、长双歧杆菌等,已被证明可以改善整体阴道健康。
每天口服一次或两次胶囊化鼠李糖乳杆菌GR-1和发酵乳杆菌RC-14菌株可将细菌性阴道病相关微生物群转化为以乳杆菌优势为标志的正常微生物群。
益生菌在外阴阴道念珠菌病(VVC)的阴道微生物组改变的治疗中也很有效。研究人员调查了7918名VVC孕妇阴道菌群的变化,发现外阴阴道念珠菌病阴道菌群可以在正常(以乳酸菌为主)和异常(乳酸菌减少)之间振荡。
临床试验表明,嗜酸乳杆菌、鼠李糖乳杆菌GR-1和发酵乳杆菌RC-14在恢复以乳酸杆菌为主的阴道菌群方面具有有效性。
它会对阴道健康产生负面影响。对于更容易受到阴道酵母菌感染的女性,建议采用均衡且高纤维的低糖饮食。摄入大量糖会促进肠道中致病性酵母菌的生长。如果这些在上厕所时进入阴道,可能会导致阴道酵母菌感染。
高热量和高脂肪消耗的女性患细菌性阴道病的风险增加。
一些研究已经确定微量营养素摄入不足,尤其是维生素 A、C、E 和 D 以及 β-胡萝卜素、叶酸、钙的不足,会增加细菌性阴道病的风险。
各种疾病所需的抗生素疗程会扰乱健康的阴道菌群。这使得病原体和酵母菌很容易传播。
有香味的卫生用品或其他物品,如用含有合成香料的洗衣粉洗涤的内衣,会破坏阴道微生物组。阴道有一种自然的气味。如果闻到比平时更刺鼻的气味,则可能表明阴道微生物组失衡。
冲洗会破坏阴道的天然微生物组,使其容易受到感染。肥皂和化学女性卫生用品会改变 pH 值的酸度,也可能杀死或去除有益细菌,还会引入新的细菌,从而降低抵御潜在感染的防御屏障。
有些女性认为所有的内衣都是一样的。但是紧贴生殖器区域皮肤穿的衣服会有所不同。“穿白色棉质内衣,不要染色”,研究人员表示,“而且阴道需要呼吸空间,所以不要穿紧身牛仔裤。”
膳食糖会滋养阴道中的酵母菌和其他有害细菌。“避免在饮食中加糖——不要吃小麦,不要吃甜食,”一些研究人员提倡“绿色”饮食,富含健康脂肪和低糖食物、富含微量营养素的植物性食物,如鳄梨、坚果、种子和十字花科蔬菜。
吸烟可以改变阴道内的雌激素和 pH 值;同时研究发现宫颈/阴道分泌物中含有微量尼古丁,可能会促进炎症。
如果低雌激素或阴道干燥影响阴道 pH 值,外用雌激素乳膏可能会有所帮助。 外用雌激素乳膏仅供处方使用,因此如果怀疑低雌激素(或雌激素波动不稳定)导致阴道生态系统失衡,请咨询医生。“如果女性处于围绝经期或绝经后,阴道雌激素治疗是降低阴道 pH 值的最有效方法。”
拥有健康的阴道菌群对孕妇尤为重要。怀孕对身体来说是一个非常特殊的条件。它还会改变荷尔蒙平衡。伴随的高水平雌激素也会影响阴道菌群。由于免疫系统更敏感,孕妇也更容易受到感染。
孕妇阴道菌群紊乱可能导致病原体传播。在细菌性阴道病的情况下,早产或流产的风险会增加。注意到阴道分泌物(外观和气味)发生变化的孕妇应咨询妇科医生。
阴道微生物组与人类宿主形成稳态和互惠关系,并在阴道健康和疾病中发挥重要作用。内部和/或外部因素的变化导致平衡的生态系统崩溃,这也称为生态失调。
乳酸杆菌似乎在维持健康的阴道微环境中起着核心作用。阴道菌群失调涉及微生物多样性或丰度的变化,特别是乳酸杆菌或某些厌氧细菌,这会导致炎症。这些相关微生物会影响免疫介质,而免疫介质可作为阴道环境中生态失调的预测性生物标志物。
基于调节阴道菌群平衡的研究,可用于了解阴道微生物组如何影响怀孕和分娩;同时可能成为细菌性阴道病、早产、不孕等疾病的新的靶点,深入了解相关作用机制,有助于更多改进的和准确的诊断和治疗策略的开发。

主要参考文献:
Gudnadottir U, Debelius JW, Du J, Hugerth LW, Danielsson H, Schuppe-Koistinen I, Fransson E, Brusselaers N. The vaginal microbiome and the risk of preterm birth: a systematic review and network meta-analysis. Sci Rep. 2022 May 13;12(1):7926. doi: 10.1038/s41598-022-12007-9. PMID: 35562576; PMCID: PMC9106729.
Hong X, Ma J, Yin J, Fang S, Geng J, Zhao H, Zhu M, Ye M, Zhu X, Xuan Y, Wang B. The association between vaginal microbiota and female infertility: a systematic review and meta-analysis. Arch Gynecol Obstet. 2020 Sep;302(3):569-578. doi: 10.1007/s00404-020-05675-3. Epub 2020 Jul 8. PMID: 32638096.
Joseph RJ, Ser HL, Kuai YH, Tan LT, Arasoo VJT, Letchumanan V, Wang L, Pusparajah P, Goh BH, Ab Mutalib NS, Chan KG, Lee LH. Finding a Balance in the Vaginal Microbiome: How Do We Treat and Prevent the Occurrence of Bacterial Vaginosis? Antibiotics (Basel). 2021 Jun 15;10(6):719. doi: 10.3390/antibiotics10060719. PMID: 34203908; PMCID: PMC8232816.
Chen X, Lu Y, Chen T, Li R. The Female Vaginal Microbiome in Health and Bacterial Vaginosis. Front Cell Infect Microbiol. 2021 Apr 7;11:631972. doi: 10.3389/fcimb.2021.631972. PMID: 33898328; PMCID: PMC8058480.
Zheng N, Guo R, Wang J, Zhou W, Ling Z. Contribution of Lactobacillus iners to Vaginal Health and Diseases: A Systematic Review. Front Cell Infect Microbiol. 2021 Nov 22;11:792787. doi: 10.3389/fcimb.2021.792787. PMID: 34881196; PMCID: PMC8645935.
Bastianelli C, Farris M, Bianchi P, Benagiano G. The effect of different contraceptive methods on the vaginal microbiome. Expert Rev Clin Pharmacol. 2021 Jul;14(7):821-836. doi: 10.1080/17512433.2021.1917373. Epub 2021 Apr 23. PMID: 33863265.
Saraf VS, Sheikh SA, Ahmad A, Gillevet PM, Bokhari H, Javed S. Vaginal microbiome: normalcy vs dysbiosis. Arch Microbiol. 2021 Sep;203(7):3793-3802. doi: 10.1007/s00203-021-02414-3. Epub 2021 Jun 13. PMID: 34120200.
Auriemma RS, Scairati R, Del Vecchio G, Liccardi A, Verde N, Pirchio R, Pivonello R, Ercolini D, Colao A. The Vaginal Microbiome: A Long Urogenital Colonization Throughout Woman Life. Front Cell Infect Microbiol. 2021 Jul 6;11:686167. doi: 10.3389/fcimb.2021.686167. PMID: 34295836; PMCID: PMC8290858.