-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康

随着生活方式的变化和环境压力的增加,慢性疾病的发病率正在全球范围内急剧上升。这些慢性疾病,包括心血管疾病、糖尿病、抑郁症和多种自身免疫性疾病,不仅对个人的健康和生活质量构成了严重威胁,也给全球卫生系统带来了前所未有的挑战。
我们知道抗生素对肠道菌群会产生很大影响,事实上,其他这些药物也被报告具有类似的改变肠道微生物群的效果。这引发了人们对药物通过影响肠道微生物群从而影响健康和疾病的关注。特别是,肠道微生物群与大脑之间的相互作用,也就是所谓的“肠-脑轴”,成为一个热点领域,这可能为一些神经系统疾病的新治疗方法提供线索。
另一方面,神经系统疾病的治疗面临着许多难点,其中包括疾病机制的复杂性、治疗效果的个体差异、长期药物治疗的副作用,缺乏针对疾病根本原因的治疗方法。这些难点突显了寻找新的治疗目标和策略的重要性。
本文我们来了解一下药物引起的生态失调,以及日常处方药包括二甲双胍、他汀类药物、质子泵抑制剂和非甾体抗炎药为什么以及如何可能通过微生物群改变肠脑轴,以抑郁症、多发性硬化症、帕金森病和阿尔茨海默病等神经系统疾病为例来说明。
关于药物和肠道菌群及其与神经系统疾病之间的关联研究,提供了一个全新的视角,对于开发新的神经系统疾病相关治疗方法具有重要意义。
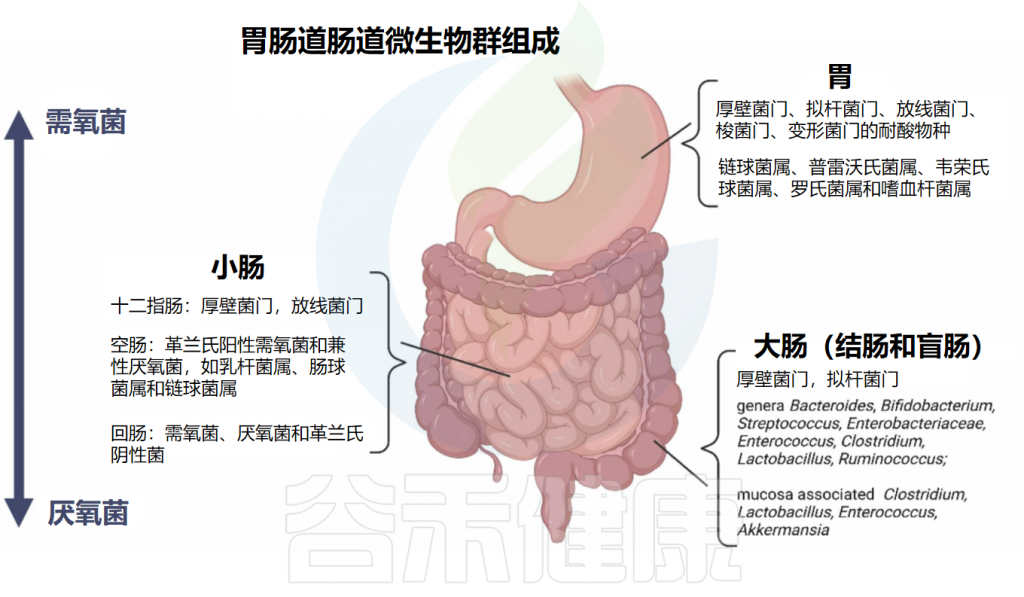
不同的细菌种群在消化道的不同部位繁殖,这是由于不同的微环境所致。关于居住在胃和肠道中的肠道细菌组成的总结见下图:
doi.org/10.1016/j.brainresbull.2024.110883
从上消化道到下消化道,细菌种类从需氧菌过渡到厌氧菌。
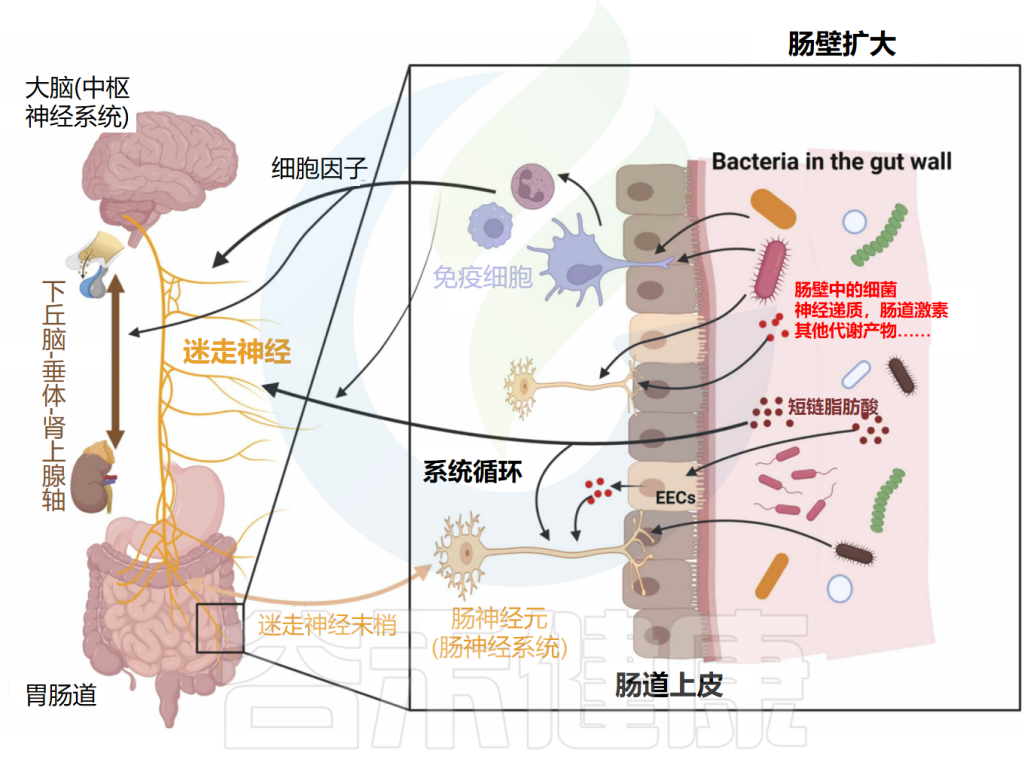
肠脑轴定义了肠神经系统(ENS)和中枢神经系统(CNS)之间的连接。随着研究的深入,微生物群在这一轴线中扮演着至关重要的角色。现已将肠脑轴扩展到了微生物群-肠-脑轴(MGBA)。
微生物群-肠-脑轴是肠道菌群和CNS之间的双向通信路径,肠道菌群可能通过细菌产生的神经递质和代谢物(所谓的化学信号)、迷走神经、免疫系统或包括下丘脑-垂体-肾上腺轴(HPAA)在内的神经内分泌系统影响大脑。
微生物群-肠-脑轴通信图
doi.org/10.1016/j.brainresbull.2024.110883
神经、免疫和内分泌介质,如神经递质、细胞因子和肠激素,是微生物群-肠-脑轴双向路径中的通信者。释放的细胞因子在免疫细胞识别细菌后可直接影响大脑。细胞因子和迷走神经也可以影响下丘脑-垂体-肾上腺轴(HPA轴)。细菌还可以通过其脂多糖(LPS)直接与肠神经元通信,触发肠神经元上的TLR4。
间接路径包括由肠道细菌产生的代谢物,如神经递质和短链脂肪酸(SCFAs)。这些代谢物可以进入全身血液循环,从而影响大脑。此外,这些代谢物可以刺激肠道中的肠内分泌细胞(EECs),然后它们在血液中释放肠激素。细菌代谢物和肠激素也可以通过属于迷走神经的肠神经元发送传入信号。
另一方面,大脑通过传出迷走神经纤维和其他肠神经系统(ENS)细胞进行通信。它因此在诸如粘液分泌和肠蠕动等重要方面影响肠生理。
关于微生物群-肠-脑轴在我们前面的文章已经详细阐述,详见:
最新研究速递 | 柳叶刀:肠道微生物群在神经系统疾病中的作用
抗糖尿病药物二甲双胍是 2 型糖尿病的一线治疗药物,已用于2 型糖尿病患者 60 多年。
口服后,二甲双胍在小肠吸收后的生物利用度约为40-60%。它在人肠道中的浓度比血浆中高 30-300 倍。
二甲双胍发挥什么作用?
二甲双胍通过改善胰岛素的作用、抑制肝脏糖异生、抑制肝脏中的胰高血糖素信号传导、增加骨骼肌中的葡萄糖摄取和降低体重来调节血糖水平,从而发挥其作用。新的研究表明,它通过抑制不同肿瘤类型的发作或进一步生长,具有抗癌作用。此外,二甲双胍已被证明通过与肠道菌群的相互作用降低葡萄糖水平。
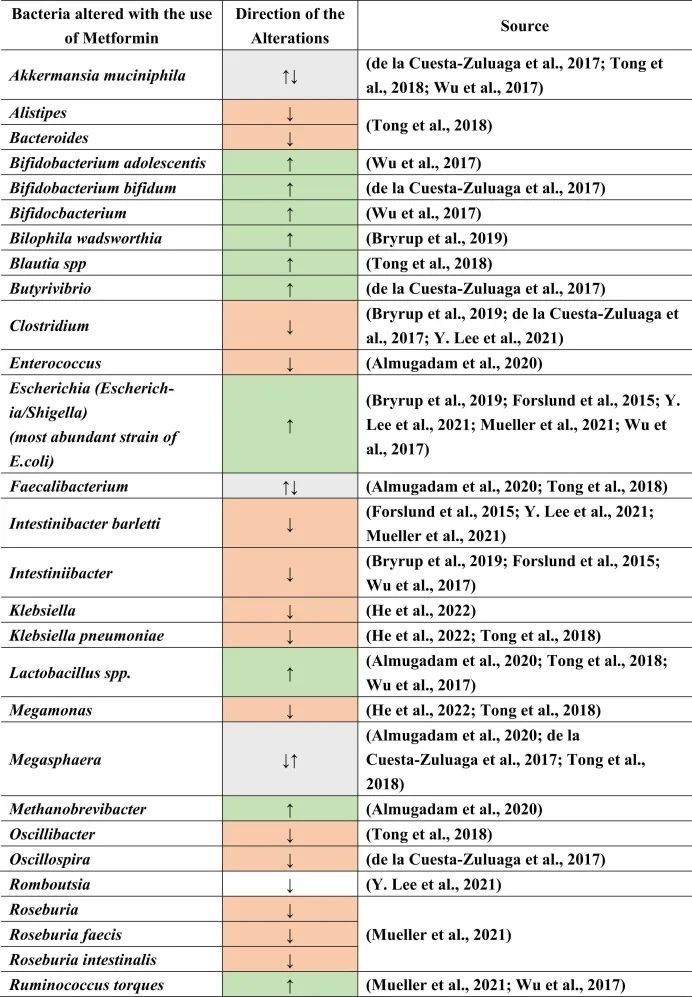
二甲双胍对肠道微生物的影响
二甲双胍的肠道改变作用可能是由于对肠道微生物组的直接作用和/或通过其他代谢物的间接作用。高胰岛素血症也会改变肠道微生物群。因此,通过二甲双胍降低胰岛素会引起肠道微生物群的间接变化。
在接受二甲双胍治疗的患者中肠道菌群变化
doi.org/10.1016/j.brainresbull.2024.110883
由于二甲双胍诱导的肠道菌群改变,该药物也正在研究用于治疗IBD、自身免疫病等,和/或用于恢复其他肠道改变药物的作用。
研究人员讨论了二甲双胍改善抗精神病药物引起的代谢功能障碍的可能性,代谢功能障碍主要通过各种途径引起体重增加,如胰岛素抵抗和高血糖,并影响神经活性物质(如神经递质和神经肽)。
二甲双胍→肠道菌群→改善抗精神病药物副作用
用抗精神病药物治疗的小鼠比微生物组耗尽的小鼠体重增加更大,这表明肠道菌群在体重管理中的作用。在抗精神病药物治疗的小鼠中,发现许多菌群减少,如乳酸杆菌和阿克曼菌。另一方面,大肠杆菌和双歧杆菌增加。特别是二甲双胍可以减少体重增加,A.muciniphila也显示了这一点。后者已被提议作为缓解全身炎症的益生菌治疗。因此,二甲双胍可以通过肠道微生物组改善抗精神病药物使用的副作用。
人体研究是在较小的队列规模(5-25名受试者)中进行的,还没有足够的数量。然而,对小鼠模型的研究充分证实了二甲双胍和肠道菌群之间的相互作用。
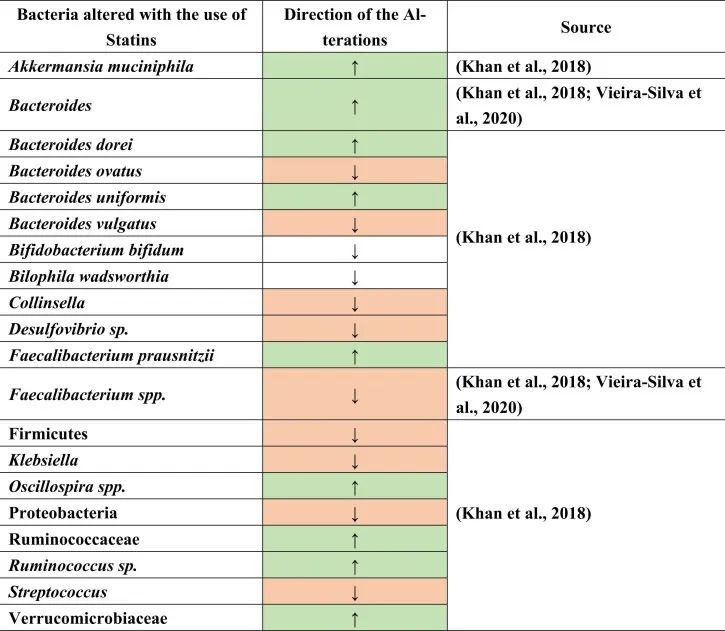
他汀类药物是预防心脏病和动脉粥样硬化最常用的心血管药物之一。超过2亿人单独或联合服用各种类型的他汀类药物。他汀类药物通过抑制HGM-CoA还原酶产生胆固醇的酶来降低低密度脂蛋白(LDL)。
在人类中进行的研究很少,以确定他汀类药物对肠道微生物群的影响,数据不一致。例如,瑞舒伐他汀在动力不足的人体试验中没有显示出显著变化。另一方面,它引起了肠道菌群功能潜力的显著改变,即细菌代谢物的水平。
他汀类药物治疗促炎菌降低
一项荟萃分析研究表明,他汀类药物通过降低Bact2肠型(Bacteroides 2)的发生率,而具有抗炎作用。
注:有研究人员根据在肠道占有优势地位的细菌种类将人的肠道微生物组成划分为4种“肠型”:拟杆菌1型(Bact1)、拟杆菌2型(Bact2)、瘤胃球菌型(Rum)和普氏菌型(Prev),其中拟杆菌2型可以被归类为“不健康肠型”,它与肥胖和系统性炎症水平高有关。
观察到接受他汀类药物治疗的患者Bact2较低,拟杆菌水平降低。这一结果可以进一步解释,在他汀类药物治疗下,粪杆菌属(Faecalibacterium)也可能增加,或者拟杆菌与粪杆菌属的比例较低,导致Bact2发生率降低。
他汀类药物治疗与产丁酸菌的增加有关
具体而言,与未治疗的高胆固醇血症患者相比,阿托伐他汀治疗的高胆固醇血症患者的下列菌群丰度增加:
促炎菌群减少,如:
与未经治疗的高胆固醇血症患者相比,在减少的共生菌中也测量到了Oscillospira(抗炎菌),Firmicutes,Proteobacteria,Desulfovibrio属和条件致病菌,包括克雷伯氏菌,链球菌和柯林斯菌属。
此外,在相同的比较中观察到Bilophila wadsworthia和双歧双歧杆菌(胆汁酸相关物种)的相对减少。他汀类药物治疗后,也观察到不同种类的拟杆菌如B.dorei和B.uniformis的丰度增加,同时B.vulgatus和B.ovatus的生长降低。这些结果表明他汀类药物引起的肠道菌群变化,可能通过肠道菌群进一步影响GBA。
doi.org/10.1016/j.brainresbull.2024.110883
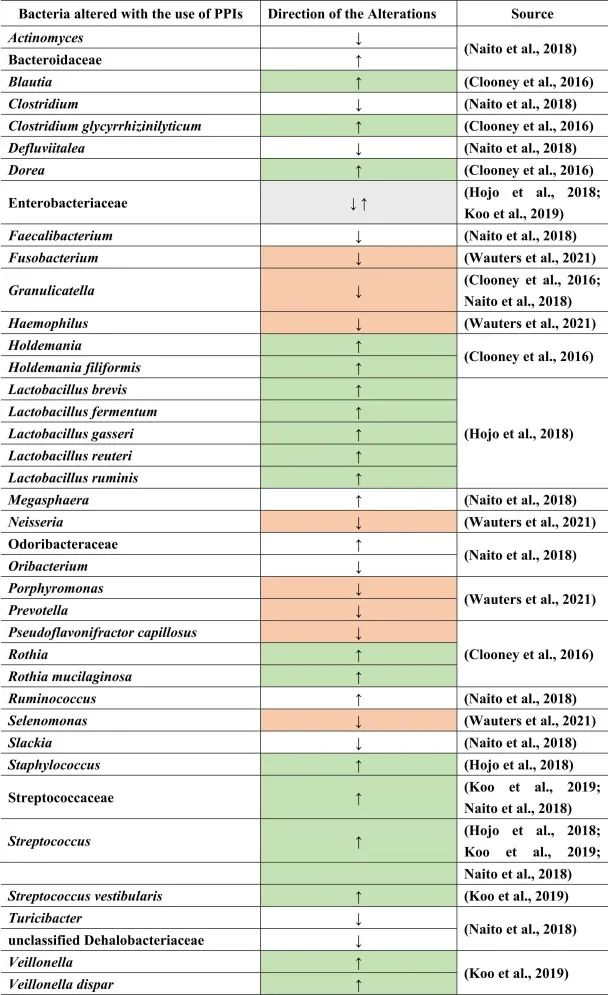
质子泵抑制剂(PPIs)用于预防胃病。很多患者尤其是老年人,会同时服用质子泵抑制剂和其他药物,如止痛药或抗抑郁药,以抵消后者对胃的副作用。
PPI对人体健康的影响
虽然说PPI的作用主要针对胃,但许多研究表明肠道微生物群发生了改变。PPI对微生物组诱导的人体代谢的影响还包括口腔,胃和小肠细菌过度生长(SIBO),肠道艰难梭菌的增加和沙门氏菌感染,肝性脑病,自发性细菌性腹膜炎,社区获得性肺炎,炎症性肠病的不良后果以及功能途径的变化。
PPI对肠道菌群的影响
许多这些疾病和改变是PPI使用后继发的生态失调的后果。一般来说,拟杆菌门丰度较低,厚壁菌门丰度较高。胃肠道中特定的菌群失调:
Naito等人总结了下列菌群丰度的相对增加:
而下列菌群减少:
功能性消化不良患者使用PPI的菌群变化
另一项研究得出结论,功能性消化不良与对照组相比,与粘液相关的细菌,如奈瑟氏菌(Neisseria)、卟啉单胞菌(Porphyromonas)、硒单胞菌(Selenomonas)、梭杆菌、嗜血杆菌(Haemophilus)的丰度较低。
使用PPI后对照组和功能性消化不良的普雷沃氏菌减少。停用PPI后,奈瑟氏菌仍然增加,表明药物使用后微生物变化持续存在。此外,其他细菌群如Holdemania和Blautia,Granulicatella,Rothia和Dorea,以及梭状芽孢杆菌簇XIVa和XIVb在PPI使用者中也有所增加。
在物种水平上:
反流性食管炎使用PPI治疗的菌群变化
由于PPI是给有胃病或反流问题的人服用的,因此一项研究仅检查了PPI治疗前后反流性食管炎患者的粪便微生物群组成。其中,在治疗的不同时间间隔中,乳杆菌(兼性厌氧菌)如加氏乳杆菌,罗伊氏乳杆菌和瘤胃乳杆菌,发酵乳杆菌,短乳杆菌的亚群在治疗后显著增加。
同样,对于链球菌属、肠杆菌科下的兼性厌氧菌计数以及葡萄球菌(也是兼性厌氧菌)也是如此。
有关于口服空肠弯曲菌或罗伊氏乳杆菌等研究显示,迷走神经传入信号发生变化,并在切除迷走神经的小鼠中恢复正常。
使用PPI后,细菌向下消化道区域的转移
在口腔,喉咙和鼻腔中发现了许多上述菌群,这表明由于使用PPI导致胃酸降低,细菌向下消化道区域的转移。通过PPI使用粪便样品显示远端肠道部分与上部胃肠道部分的定植,增加下列菌群:
减少下列菌群:
在一项健康双胞胎的研究中也观察到了同样的情况,结论是生态失调主要是由于咽部和口腔微生物群定殖到下肠道引起的,导致与上述文献相同的细菌改变。
PPI使用与肠道菌群多样性及SIBO相关影响
PPI的使用会导致细菌种群的进一步变化。例如,在PPI治疗后,远端肠道由上肠道的微生物群定殖。总体而言,微生物多样性较低,细菌种类减少,而上消化道中肠道共生菌的丰度较高。
小肠细菌过度生长(SIBO)是后一种情况的一个例子,导致链球菌,埃希氏菌,克雷伯菌,拟杆菌,乳酸杆菌,肠球菌,韦荣氏菌的丰度增加;双歧杆菌和放线菌科的减少。
与细菌转移相关联的是肠道的副交感神经刺激减少,如小肠细菌过度生长。下表总结了菌群的变化。
doi.org/10.1016/j.brainresbull.2024.110883
PPI使用增加链球菌,导致功能性消化不良等疾病患者消化不良症状持续
此外,在功能性消化不良,肝硬化,血液透析,类风湿性关节炎和癌症患者中观察到生态失调,这些患者表现出链球菌属的特异性增加。质子泵抑制剂用于缓解消化不良,尤其是幽门螺杆菌感染。然而,随着它增加链球菌的丰度,消化不良症状可能持续存在。来自胃窦胃炎患者的活检显示链球菌数量过多,证实了链球菌与消化不良的关系。
PPI引起肠道微生物失衡,增加肠道感染机会
总之,PPI用于预防其他药物(如NSAIDs)引起的消化不良,其作用是通过减少酸的产生。然而,它改变了肠道环境,使近端肠道细菌转移到肠道的远端。同时,它会导致一些菌群的丰度增加或减少。因此,这种生态失调导致更多的机会的肠道感染,涉及有害细菌,如艰难梭菌或沙门氏菌。
PPI治疗消化不良,影响肠道菌群,改变细菌丰度和细菌移位。主要影响链球菌丰度和艰难梭菌感染的高发病率。
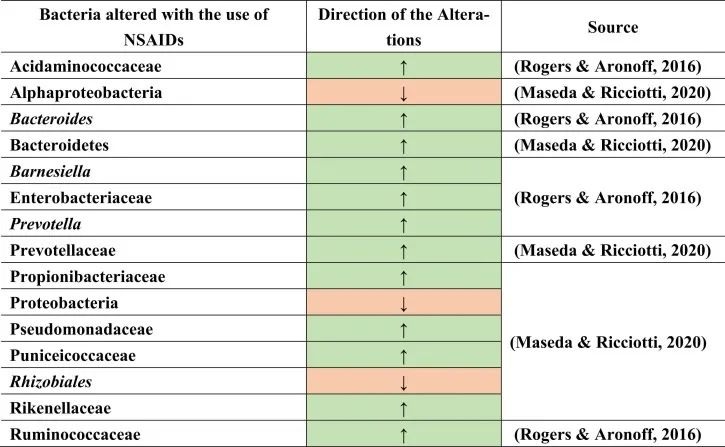
与上述其他药物组一样,非甾体抗炎药(NSAIDs)用于疼痛和抗炎,或低剂量阿司匹林作为心血管健康的血小板聚集抑制剂。NSAIDs也可能导致菌群失调及后果,如小肠细菌过度生长。大量使用NSAID诱导肠道病变。这是由于肠细胞死亡和免疫系统破坏导致肠道屏障受损的结果,从而导致革兰氏阴性细菌的增殖和革兰氏阳性细菌的减少。
PPIs和NSAIDs共同作用于肠道病变与微生物群失衡
PPIs和NSAIDs在由于生态失调引起的肠道肠病中发挥联合作用。NSAIDs可导致胃病,PPIs可减少其发生。NSAIDs和PPIs的联合摄入导致肠病,因为PPIs将微生物群从上胃肠道转移到远端肠道。
例如,用阿司匹林治疗会导致肠道微生物群组成的变化,增加普雷沃氏菌,拟杆菌,Ruminococcaceae,Barnesiella。
塞来昔布和布洛芬增加了酸性氨基球菌科(Acidaminococcaceae)和肠杆菌科的丰度。
与非使用者或萘普生使用者相比,布洛芬会导致丙酸杆菌科(Propionibacteriaceae),假单胞菌科,Puniciecoccaceae,Rikenellaceae的富集。
吲哚美辛诱导拟杆菌,普氏菌科的增加;变形菌门,α变形菌纲,根瘤目(Rhizobiales),假单胞菌科的减少。
同一项研究显示了性别特异性效应,因为女性肠道中的厚壁菌门较低,而男性肠道中的厚壁菌门较高。
一项比较研究表明,各种非甾体抗炎药诱导的生态失调增加了分类群,如肠杆菌科,酸性氨基球菌科,丙酸杆菌科,假单胞菌科,Punicecoccaceae,Rikenellaceae。
总结上述结果,在导致生态失调和NSAID肠病的不同细菌类群和物种中发现了明显的变化。
doi.org/10.1016/j.brainresbull.2024.110883
抗抑郁药(例如选择性5-羟色胺再摄取抑制剂SSRIs)是抑郁症的一线治疗方法。5-羟色胺是选择性5-羟色胺再摄取抑制剂(SSRIs)的靶标,增加了其在大脑中的可用性水平。
肠脑轴与抑郁症之间存在联系,但只有少数人体研究抗抑郁药对肠道菌群的影响。
抗抑郁药对肠道菌群的影响
艾司西酞普兰改变了肠道菌群,Christensenellaceae,Eubacterium ruminantium group,Fusobacterium显著增加,同时乳酸杆菌丰度相应降低,拟杆菌发生了显著变化。
注:艾司西酞普兰是一种用于治疗抑郁症和广泛性焦虑症的药物,通过增加大脑中神经递质5-羟色胺的水平来改善情绪。
Le Bastard等人的文章研究了非典型抗精神病药物治疗对双相情感障碍患者的影响,结果显示Lachnospiraceae的相对丰度增加(p=0.029),Akkermansia和Sutterella的相对丰度降低(p=0.0006)。
在荷兰队列的另一项研究中,B.dorei(p=0.051)和Coprococcus eutactus(p=0.041)与抗抑郁药呈正相关,而Eubacterium hallii与抗抑郁药呈负相关(p=0.055)。
在小鼠模型中存在许多关于SSRIs诱导的肠道改变的研究。常见的选择性5-羟色胺再摄取抑制剂(SSRI)舍曲林,氟西汀和帕罗西汀显示出对革兰氏阳性细菌如葡萄球菌和肠球菌的活性。
产毒肠杆菌随着SSRIs的使用而减少
其他潜在的产毒肠杆菌,如铜绿假单胞菌,肺炎克雷伯菌,柠檬酸杆菌属和摩根氏菌(M. morganii),产气荚膜梭菌和艰难梭菌也在一定程度上随着SSRIs的使用而减少。这些结果是在体外研究的基础上发现的。
服用某些抗抑郁药(如氟西汀)的抑郁成年人更容易发生艰难梭菌感染(CDI)。据报道,在小鼠中,艾司西酞普兰和锂在相似程度上增加了血清素水平。然而,这项研究没有讨论生态失调是根本原因。虽然SSRI对抑郁症的作用机制与这些药物的任何抗菌作用无关,但仍然可以看到微生物群落的潜在变化,并可能影响与情绪相关的其他炎症或生理参数。
抑郁症或重度抑郁症是最常见的神经精神疾病。它是导致残疾、发病率和死亡率的主要原因之一,导致生活质量低下。大约每五个人一生中就被诊断出一次。
抑郁症的基本症状
抑郁症是一种复杂的疾病,具有不同的症状和病理生理学。根据DSM-5,它被诊断出患有持续2周以上的一系列以下症状:持续的抑郁情绪,快感缺失,孤独感,动机降低,食欲和睡眠障碍,精神运动激动,注意力不集中,疲劳,内疚感或无价值感以及自杀念头。
抑郁症的病因
病因或病理生理学通过许多机制来解释,但整体上仍不清楚,可能有以下情况:
1) 血清素,去甲肾上腺素和多巴胺水平低,谷氨酸水平高;
2) HPA轴的改变;
3) 由于免疫介质的不平衡导致错误的免疫细胞通信,特别是微胶质细胞,引起系统性炎症;
4) 最后但同样重要的是与肠道微生物组-脑-肠轴有关的微生物群。
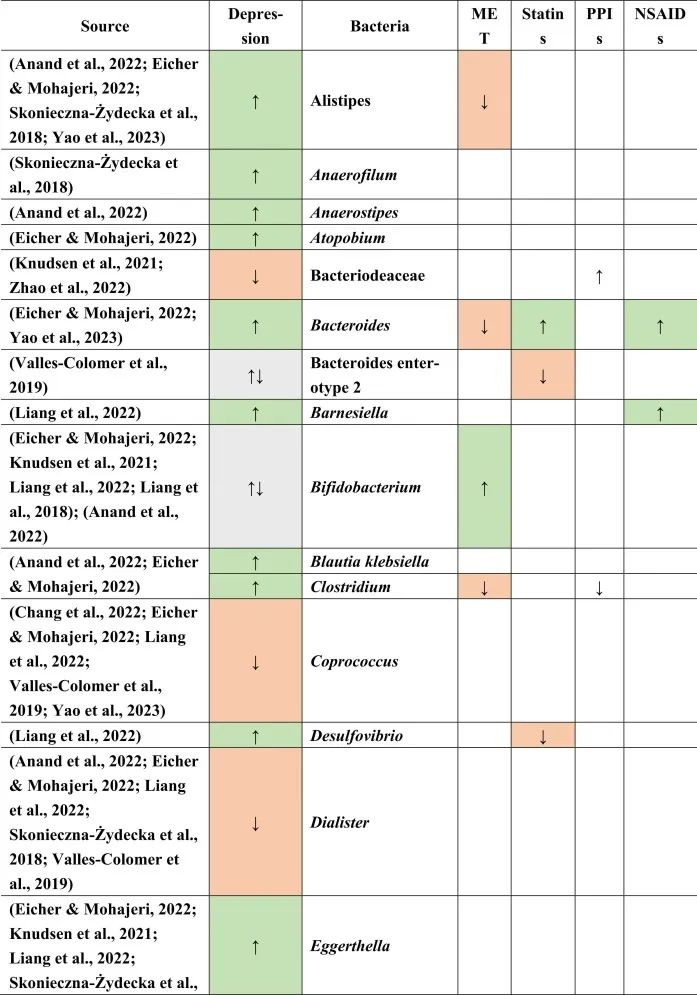
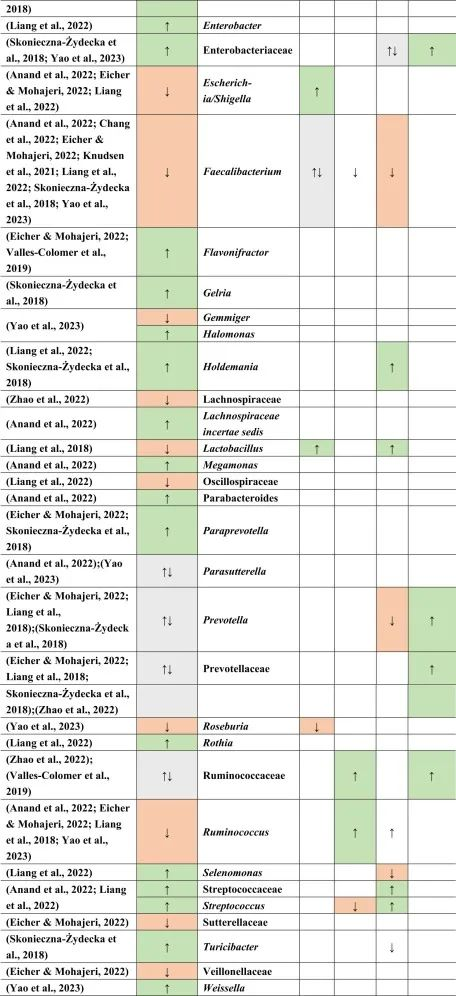
抑郁症的肠道菌群变化
迄今为止,研究发现,在门水平上,拟杆菌,变形杆菌,放线菌,放线菌增加,而抑郁症患者粪便中的厚壁菌减少。
在科的水平上,下列菌群有所增加:
下列菌群有所减少:
在属的层面上,提到了下列菌属减少:
下列菌属增加:
在少数细菌群体中,如Prevotellaceae,Prevotella,Bacteroides enterotype 2,双歧杆菌,Parasutterella,在不同的研究中发现了差异。
抑郁症患者菌群改变与二甲双胍,他汀类药物,
PPIs和NSAIDs使用者菌群改变有关
doi.org/10.1016/j.brainresbull.2024.110883
在比较抑郁症患者的肠道菌群与上述药物引起的生态失调时,可以观察到不同细菌分类群水平与一种或多种药物的相似性。
拟杆菌的增加可能对抑郁症有潜在益处
拟杆菌在使用他汀类药物和非甾体抗炎药(NSAIDs)以及抑郁症患者的肠道中都有所增加。拟杆菌是一种产生γ-氨基丁酸(GABA)的革兰氏阴性菌,具有免疫触发LPS和抗炎SCFAs,从而引发免疫反应。
抑郁症与血清素减少相关的系统性和神经炎症都有关联。然而,原本拟杆菌产生的短链脂肪酸和GABA在抑郁症患者体内的含量较低,那么拟杆菌的增加,也增加了GABA和短链脂肪酸,有助于缓解抑郁行为。
他汀类药物和PPIs → 瘤胃球菌↑
瘤胃球菌(Ruminococcus)是一种产短链脂肪酸菌,在他汀类药物和PPI的使用者中增加,再次抵消了短链脂肪酸的低含量。后者也可能是抑郁症患者在口服他汀类药物或PPIs后,粪杆菌属数量低下的原因,粪杆菌是已知的丁酸盐生产者,对肠道屏障稳态和抗炎作用很重要。
他汀类药物 → Bact2↓
特别是他汀类药物可以降低拟杆菌2型(Bact2),这反过来可能导致抑郁症状。
抑郁症可能与他汀类药物和PPI的使用呈负相关,因为抑郁症患者的瘤胃球菌较低,而他汀类药物和PPI使用者的瘤胃球菌较高。
二甲双胍和PPI → 梭菌↓
二甲双胍和PPI中可以降低梭菌丰度,但在抑郁症中没有,因此,二甲双胍和PPI可能有助于减少梭菌。
梭菌的过度生长可能带来的不利结果大于有利结果,例如,艰难梭菌具有毒性和传染性,而梭菌簇XIVa产生短链脂肪酸带来益处。
二甲双胍 → 大肠杆菌↑
血清素可能通过迷走神经影响体液肠-脑通路。大肠杆菌和链球菌与肠杆菌科物种参与血清素合成。在抑郁症患者中,大肠杆菌低丰度,链球菌高丰度,二甲双胍可以缓解低水平的大肠杆菌,因为在使用二甲双胍后大肠杆菌的丰度增加。
他汀类药物抵消PPIs
NSAIDs和PPIs可能分别对肠杆菌科和链球菌产生相同的作用,而他汀类药物可能抵消PPIs的作用,与链球菌数量减少呈正相关。
药物影响与谷氨酸途径的菌群
拟杆菌,乳酸杆菌,双歧杆菌,链球菌也可能参与谷氨酸途径。因此,它们的药物诱导影响可能在单独或通过彼此的相互作用提高谷氨酸能神经传递中发挥作用。
关于谷氨酸详见:兴奋神经递质——谷氨酸与大脑健康
因此,二甲双胍,他汀类药物,PPIs和NSAIDs药物诱导的菌群失调可能各自影响抑郁症的发展和进展,并且它们的作用可能相互抵消或加剧。
扩展阅读:
多发性硬化症是中枢神经系统中最丰富的自身免疫性疾病。全世界有250多万人受到影响,其中大多数是年轻人。它是一种慢性炎症性疾病,其特征是神经纤维脱髓鞘和轴突继发性破坏,表现为白质组织病变。
多发性硬化的症状
症状因受影响的组织区域而异。第一个最常见的症状是视神经炎引起的视觉障碍以及感觉障碍和疲劳。间歇性症状是运动障碍,疼痛,认知,心理和植物障碍,使疾病具有进行性或复发性。
多发性硬化的病因
炎症过程通过自身反应性外周T淋巴细胞侵入中枢神经系统来解释。然而,这种自身免疫反应的出现尚不清楚。脂肪因子和细胞因子水平之间的遗传不平衡,爱泼斯坦-巴尔病毒(EB病毒)感染引起的自身反应性,维生素D缺乏,吸烟以及改变微生物-肠-脑轴的细菌和病毒肠道生态失调,都与多发性硬化的病理生理学有关。
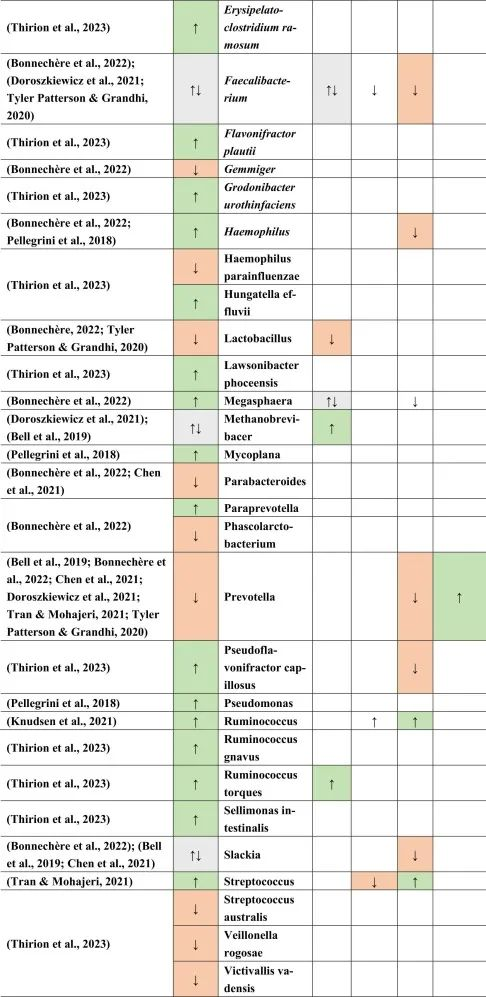
多发性硬化患者与健康对照组微生物群不同
移植了多发性硬化患者粪便物质的GF小鼠复制了自身免疫性脑脊髓炎(一种在动物中发现的脱髓鞘疾病)的表型。这些结果与具有健康对照粪便物质的GF小鼠形成对比。甚至疾病的严重程度和/或活动性似乎也与不同的微生物组成有关。一般来说,抗炎菌群丰度较低。
多发性硬化的微生物群特征
临床活跃的病例(即复发性发作)与临床非活跃的治疗前患者相比,具有更丰富的微生物组。
在比较细菌种类时,临床上不活跃的多发性硬化患者的普拉梭菌(Faecalibacterium prausnitzii)和Gordonibacter urolithinfaciens的丰度显著高于临床活跃的多发性硬化患者。
同一研究发现61种在微生物组成上有差异的物种。多发性硬化中富集的物种如下:
减少的菌群包括:
总体而言,多发性硬化患者的微生物组成丰富度低于健康对照组。这也与多发性硬化相关细菌物种相关的特定炎症生物标志物的丰度更高有关。
其他研究产生了类似的结果,下列菌群增加:
下列菌群减少:
总体而言,拟杆菌门减少,相应的物种也有所减少,例如B.coprocola,B.coprophilus,B.stercoris。
在Faecalibacterium,Slackia,Clostridium,Methanobrevibacter和Butyricimonas中观察到不一致的结果。
在所有引用的有关多发性硬化的文献中,阿克曼菌的增加和普雷沃氏菌的减少一直是菌群持续改变的原因之一。
doi.org/10.1016/j.brainresbull.2024.110883
他汀类药物,NSAID → 拟杆菌↑
与多发性硬化患者相比,他汀类药物和非甾体抗炎药使用者的拟杆菌(一种革兰氏阴性细菌属和SCFA和GABA生产者)增加。
多发性硬化、二甲双胍→Bilophila wadsworthia↑
另一种革兰氏阴性物种Bilophila wadsworthia 在多发性硬化和二甲双胍中增加,但在他汀类药物中减少,这表明二甲双胍可能对多发性硬化患者不利,而他汀类药物对多发性硬化患者有利。革兰氏阴性细菌由于其细胞壁中存在LPS而诱导宿主免疫应答。
多发性硬化、PPI→链球菌↑ 他汀类→ 链球菌↓
链球菌属也是如此,在多发性硬化患者和PPI使用者中发现链球菌数量增加,而在他汀类药物使用者中发现链球菌数量减少。链球菌是一种条件致病菌,可产生神经毒素,乙酸盐和5-羟色胺(5-HT)。
多发性硬化、二甲双胍、PPI → Blautia↑
另一方面,Blautia 在多发性硬化,二甲双胍和PPI中增加。Blautia是丁酸盐生产者,这对于肠道屏障和血脑屏障等完整性以及小胶质细胞成熟和活化很重要。
二甲双胍和PPIs → 梭菌↓
然而,在多发性硬化症患者中,二甲双胍和PPIs使用者的梭状芽孢杆菌数量减少。梭菌产生SCFA,这可能影响Treg细胞,影响多发性硬化患者的自身免疫。
产短链脂肪酸菌Ruminococcus在多发性硬化和他汀类药物和PPI使用后增加。
Prevotella是LPS携带者和GABA生产者和丙酸生产者,NSAIDs增加,多发性硬化和PPIs减少。
双歧杆菌和乳酸杆菌,GABA和乙酸盐生产者在多发性硬化和摄入MET后分别增加和减少,表明这两个属可能影响多发性硬化疾病和进展。
从结果来看,多发性硬化与药物引起的生态失调之间可能存在许多关联。然而,需要更明确的研究结果来证明这些假设的关联。
扩展阅读:
帕金森病(PD)主要症状是运动症状,伴有运动障碍,僵硬,静息性震颤和姿势不稳,由多巴胺缺乏引起,多发生在黑质。路易体聚集体由错误折叠的蛋白质聚集体组成,即淀粉样蛋白,主要是α-突触核蛋白淀粉样蛋白,是多巴胺能神经元破坏的主要原因。
帕金森病的非运动前驱症状及其对疾病进展的影响
帕金森患者在很大程度上受到非运动症状的影响,其中许多症状在运动功能缺失发生前数十年就已出现。胃肠功能障碍,抑郁情绪,睡眠障碍,肌肉和关节疼痛是这些前驱症状中的一些。前者最常见的是便秘或胃排空延迟,流涎,吞咽困难,胃轻瘫和SIBO。患有这些前驱胃肠道疾病的患者帕金森进展更为严重。在ENS神经元中也观察到淀粉样蛋白的形成,特别是在小鼠和帕金森患者的早期。最近的研究表明,大脑中路易体的形成是由小鼠胃肠道中的淀粉样蛋白纤维诱导的,并且通过迷走神经干切断术大大降低了路易体形成的风险。
淀粉样蛋白的交叉形成与肠道微生物的潜在关联
淀粉样蛋白的形成不一定仅限于一种蛋白质。产生淀粉样蛋白的蛋白质可以相互交叉形成淀粉样蛋白。分子过程仍然未知,但可能发生在人类之间以及人类和非人类淀粉样蛋白之间。肠道微生物群中的多个物种能产生包含淀粉样蛋白的生物膜。有人提出,肠道淀粉样蛋白理论上可以通过迷走神经路径传输到大脑,并与α-突触核蛋白交叉促使形成淀粉样蛋白。
大肠杆菌、假单胞菌、链球菌、葡萄球菌、沙门氏菌、分枝杆菌、克雷伯菌、柠檬酸杆菌和芽孢杆菌是肠道中产生这种胞外淀粉样蛋白的候选细菌。Nuzum等人还指出产短链脂肪酸菌的总体丰度较低。因此,肠道微生物群可能既能启动也能调节帕金森病的发起。
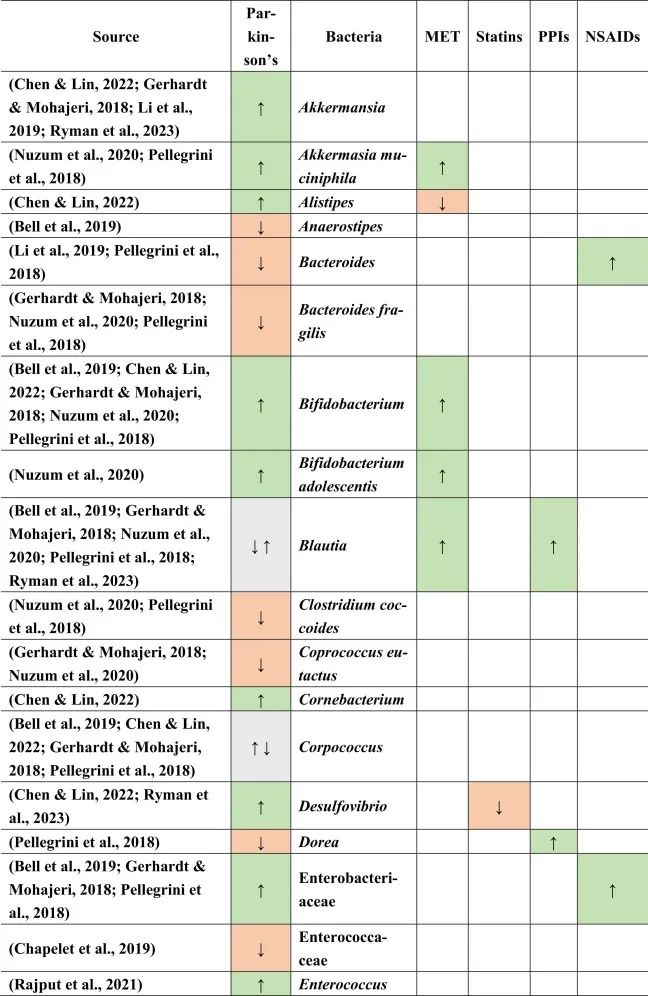
帕金森患者的肠道菌群特征
当比较帕金森患者与健康对照组的微生物组成时,在帕金森患者中主要是下列菌群增多:
下列菌群减少:
乳杆菌科不一致,显示出较高和较低的丰度。
doi.org/10.1016/j.brainresbull.2024.110883
在比较帕金森的生态失调和药物引起的生态失调时,假设如下:PPI诱导小肠细菌过度生长,并增加沙门氏菌感染的风险。两者都可能影响帕金森,因为小肠细菌过度生长也在帕金森病患者中发现,沙门氏菌是细胞外淀粉样蛋白的产生者。然而,在PPI和帕金森中没有观察到沙门氏菌作为一个共同因素。
与多发性硬化类似,瘤胃球菌科在帕金森,他汀类药物和NSAIDs中增加。然而,已知短链脂肪酸可以增强BBB的完整性,因此可以降低炎症因子通过大脑从而形成细胞外淀粉样蛋白的风险。
帕金森,他汀类药物,PPI → 粪杆菌↓
另一方面,粪杆菌(Faecalibacterium)是一种已知的丁酸盐生产者,对肠道和BBB完整性以及抗炎菌群具有重要意义,在帕金森,他汀类药物和PPI中减少,这表明粪便杆菌可能是帕金森病患者屏障减弱和炎症过程加剧的原因之一。
二甲双胍和PPIs可能有助于逆转粪杆菌的不利影响
因为二甲双胍和PPIs增加了Blautia的存在,而帕金森患者则减少了Blautia。同样,由于他汀类药物和非甾体抗炎药,瘤胃球菌科的丰度增加,也可以补偿粪杆菌和其他不利菌的影响。这也表明,没有一种药物会产生所有负面或正面影响,例如,PPI会增加Blautia(一种有利的短链脂肪酸生产菌)并同时增加小肠细菌过度生长,这是人体的负面过程。
菌群之间的相互作用力量不可忽视
总体而言,与本文提到的其他药物相比,二甲双胍对微生物组产生的影响与帕金森病中所见的影响最相似。在帕金森患者和二甲双胍使用者中均观察到Akk菌(短链脂肪酸生产者和LPS携带者),青春双歧杆菌(GABA生产者)和大肠埃希氏菌(LPS携带者,5-HT-metabolsier)的丰度增加,其中第一种和后一种细菌是革兰氏阴性,其细胞壁中存在LPS,但也分别产生短链脂肪酸和5-HT。
同样,它们都传达了有利和不利的影响,这表明没有一种细菌是某种疾病发病机制的主要决定因素。菌群之间的相互作用和相对丰度似乎对疾病发作和进展的总体影响很重要。
阿尔茨海默病(AD)是老年痴呆症最常见的形式,约占全球痴呆症病例的50-70%。由于其患病率随着年龄的增长而增加,并且世界人口正在老龄化,阿尔茨海默的发病率在未来几年将更高。在大多数情况下,它始于新形成的记忆的丧失,神经认知和执行功能(如语言和视觉空间取向)进一步下降。
阿尔茨海默病的病理生理学
病理生理学是多方面的,导致不可逆的神经元细胞和突触丢失。除年龄外,阿尔茨海默的其他标志是不溶性淀粉样β斑块的积累,其次是Tau蛋白的神经原纤维缠结,神经递质的失衡和神经炎症。随着年龄的增长,肠道微生物组会发生实质性变化,因此,有人认为与年龄相关的肠道菌群失调也可能导致阿尔茨海默的发病。
扩展阅读:
老年人肠道菌群失衡与阿尔茨海默病发病
在老年人中,随着促炎细菌与抗炎细菌比例的增加以及产短链脂肪酸菌的减少,导致肠漏,BBB紊乱和小胶质细胞活化。后者在清除Aβ斑块方面很重要,当其清除能力因Abeta的过度产生或由于炎症性结构变化导致的能力丧失而受阻时,淀粉样斑块可能会在阿尔茨海默病患者的大脑中积累。
淀粉样蛋白的细菌来源与神经炎症加剧
据推测,淀粉样蛋白也被推测可能来自细菌源,类似于帕金森,要么在大脑中与其他淀粉样结构交叉播种,要么由于肠漏引起的系统性炎症而加剧神经炎症。此外,据报道,通过显著阳性的SIBO呼吸试验(p=0.025)报告细菌移位。阿尔茨海默患者的细菌移位和LPS水平升高都会加剧神经炎症。
主要发现表明促炎细菌埃希氏菌/志贺氏菌水平升高,抗炎直肠真杆菌水平降低。它们失衡可能是认知障碍和淀粉样蛋白合成的主要原因之一,因为在促炎细胞因子和抗炎细胞因子之间发现了各自的相关性,而且大肠杆菌也属于产生淀粉样蛋白的细菌。
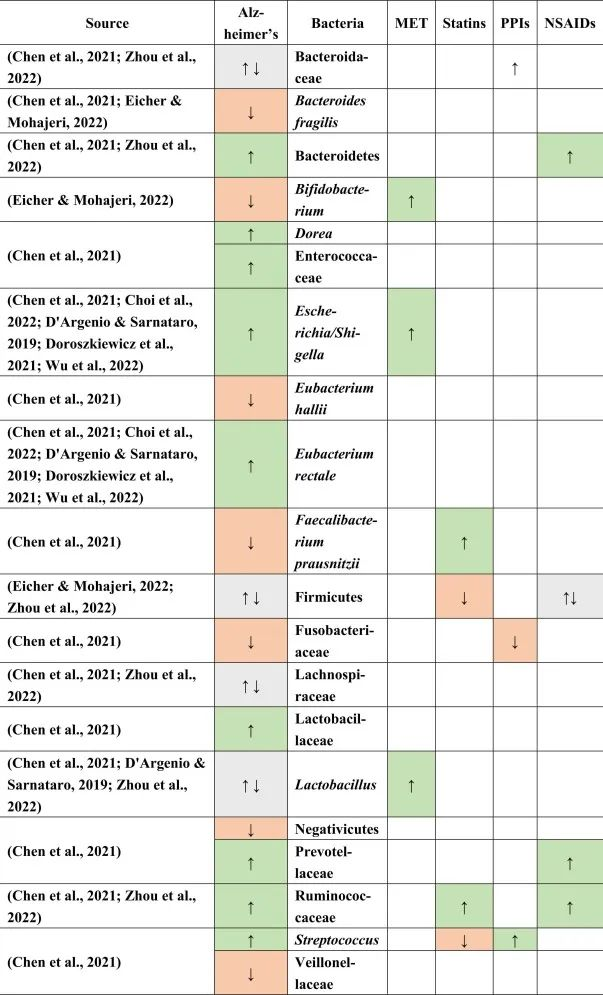
阿尔茨海默患者的肠道菌群特征
据报道,阿尔茨海默患者中下列菌群增加:
下列菌群减少:
在厚壁菌门,乳酸杆菌,Lachnospiraceaea和拟杆菌科中发现了不一致的结果。
doi.org/10.1016/j.brainresbull.2024.110883
他汀类药物 → 普拉梭菌↑ → 抗炎
在上述药物和阿尔茨海默病患者中,他汀类药物的使用与改变的微生物群的关联最强。特别是,产丁酸菌普拉梭菌在他汀类药物使用者中增加,这可能有助于维持血脑屏障,因为丁酸盐在抗炎过程和小胶质细胞活化和成熟中起主要作用。
他汀类药物联合PPI → 抵消链球菌富集
他汀类药物与PPI一起使用,可能有助于抵消由于PPI使用而导致的链球菌富集,因为链球菌被认为会产生细胞外淀粉样蛋白。
瘤胃菌科是一种短链脂肪酸生产者,在他汀类药物以及NSAID使用者和阿尔茨海默患者中升高,可能具有与帕金森病相同的补偿作用,因为在阿尔茨海默患者中观察到短链脂肪酸丰度较低。
与帕金森一样,在阿尔茨海默患者中观察到阳性小肠细菌过度生长结果,PPI可能是其主要贡献者,无论是否口服NSAIDs。
扩展阅读:
有力的证据表明药物使用与肠脑轴之间、肠脑轴与神经系统疾病之间分别存在联系。由于药物和神经系统疾病,菌群失调环境中存在共同的细菌菌株。少数药物可以在特定疾病情况下缓解菌群失调,但也可能引起菌群失调。菌群彼此之间及其相互作用将影响肠脑轴,药物在共病患者中通经常联合使用。因此,它们的效果可能相互抵消或加剧细菌种群的相应变化,并与神经系统疾病中的菌群失调呈正面或负面关联。
由于肠道微生物群会因食物、环境、生活方式等各种因素而发生变化,因此在这类研究中也应考虑伴有共病的老年人。当老年人同时服用多种药物且因食欲不振而饮食不佳时,可能会预期其肠道微生物群发生不同的变化。然而,药物引起菌群失调及其通过肠脑轴对神经系统疾病影响的相关性仍是一个新领域。
本文中有些数据也是有限的,没有考虑原发病情况、其他药物的合并使用、药物剂量、药物暴露和服药时间、年龄、性别、患者饮食、共病等混杂因素,缺乏大队列数据支持,目前还没有足够的数据来得出建议性的结论。因此,还需要更多的工作来克服现有的局限性并提供更加坚实的证据基础,包括设计大型的、多中心的、随机对照试验,以收集高质量的数据来验证这些初步发现。
主要参考文献
Garg K, Mohajeri MH. Potential effects of the most prescribed drugs on the microbiota-gut-brain-axis: A review. Brain Res Bull. 2024 Jan 18;207:110883.
Garg K, Mohajeri MH. Potential effects of the most prescribed drugs on the microbiota-gut-brain-axis: A review. Brain Res Bull. 2024 Jan 18;207:110883.
Deng X, Zhang C, Wang P, et al., Cardiovascular Benefits of Empagliflozin Are Associated With Gut Microbiota and Plasma Metabolites in Type 2 Diabetes. J Clin Endocrinol Metab. 2022 Jun 16;107(7):1888-1896.
Epishina IV, Budanova EV. Rol’ mikrobioty cheloveka v razvitii neirodegenerativnykh zabolevanii [A role of human microbiota in the development of neurodegenerative diseases]. Zh Nevrol Psikhiatr Im S S Korsakova. 2022;122(10):57-65.
He D, Han H, Fu X, Liu A, Zhan Y, Qiu H, Ma L, Zhang X, Wang X. Metformin Reduces Blood Glucose in Treatment-Naive Type 2 Diabetes by Altering the Gut Microbiome. Can J Diabetes. 2022 Mar;46(2):150-156.
Knudsen JK, Bundgaard-Nielsen C, Hjerrild S, Nielsen RE, Leutscher P, Sørensen S. Gut microbiota variations in patients diagnosed with major depressive disorder-A systematic review. Brain Behav. 2021 Jul;11(7):e02177.

谷禾健康
幽门螺杆菌(helicobacterpylori,H.pylori)是一种独特的,能持续定植于人类胃粘膜并能引起胃感染的细菌。
幽门螺杆菌是革兰氏阴性,螺旋形,微需氧细菌,定居于人类胃粘膜中。世界上有超过一半的人感染了幽门螺杆菌,但很多没有临床症状。幽门螺杆菌及其患病率在某些人群中高达80%。
据推测,幽门螺杆菌可能是人类土著微生物组的一部分,它与人类宿主之间有着很复杂的关系。
本文主要讨论幽门螺杆菌是如何与人类共同进化的,可能的机制可以解释基于人群的研究中幽门螺杆菌感染与几种疾病的发展之间的正相关性和负相关性,以及炎症和/或微生物组的变化是如何联系的各自的结果。
大多数幽门螺杆菌感染者并没有明显症状,但当症状出现时,一般是以下几种:
恶心,胃痛或胃灼热,空腹时腹部疼痛加剧。
怎样的情况有可能感染此菌?
幽门螺杆菌可能通过接触感染者的唾液、呕吐物或粪便传播,食用受污染的食物或水也会感染。
大多数感染幽门螺杆菌的人都是在儿童时期感染的。
有些因素可能会增加感染幽门螺杆菌的风险:
比如在拥挤的空间生活,没有干净的水,和患有幽门螺杆菌的人一起生活等。
什么情况下需要看医生?
当感觉有不寻常的胃痛或不适时,尤其是持续或反复发作的胃痛;
吞咽困难;
血腥,黑色或柏油样的粪便;
呕吐物带血或看起来像咖啡渣;
…
以上情况,最好去看医生。
( 如自行随意服用抗生素,效果不好的同时很可能带来抗生素耐药 )
如何诊断幽门螺杆菌?
目前最常见也实惠的方法是呼气检测,从分析到出结果只需数分钟,简单准确。
胃镜检查:做胃镜检查也包括幽门螺杆菌检测,因为可以取到胃里活性组织做病理切片检查。
抗体检查:通过抽血检查,以确定是否感染过幽门螺杆菌以及目前处于感染状态。
幽门螺杆菌会导致并发症?
包括溃疡,胃炎和胃癌。
溃疡约有10%的幽门螺杆菌患者会发展为胃溃疡(疼痛)。当幽门螺杆菌破坏保护胃和小肠内壁的粘膜时,就会发生这种情况,胃酸会渗透到衬里并造成伤害。
幽门螺杆菌可导致90%以上的肠道溃疡和80%的胃溃疡。
溃疡本身也会导致严重的并发症:
• 内部出血胃酸或溃疡渗入血管可能导致出血。
•阻塞溃疡会阻止食物离开您的胃。
•穿孔溃疡可能会深入并穿透胃或肠壁。
•腹膜炎 当溃疡引起感染或发炎时,可能发生腹膜炎症(腹膜)。
胃炎胃炎是胃黏膜炎症。幽门螺杆菌是处于患有这种病症的风险增加。
如果不治疗胃炎,可能会导致严重失血,并可能增加患胃癌的风险。胃癌是世界上与癌症相关的死亡的第二大最常见原因。
此外,幽门螺杆菌感染还与其他疾病有关,例如缺血性心脏病,2型糖尿病,贫血,肥胖受试者的不良代谢特征和胰岛素抵抗等。
幽门螺杆菌(Hp)感染会在胃微环境中产生剧烈变化,进而影响胃微生物群组成,并可能与肠道微生物群变化有关。可能会触发肠道共生稳态的重大改变,从而出现新的胃肠道平衡。
同时,用于根除幽门螺杆菌的治疗策略可以调节这种生理共生,但也可能相反,受到其特性的影响。感染,饮食,抗生素和/或生活方式会干扰这种共生关系。
幽门螺杆菌感染对胃微生物群的干扰
下一代测序对胃液和活检标本中的人体胃微生物群进行了研究,结果表明胃中存在多种细菌类群,主要由五个门组成,包括放线菌门、拟杆菌门、厚壁菌门、梭菌门和变形菌门。幽门螺杆菌感染极大地改变了胃微生物群的特征。
一项初步研究报道,幽门螺杆菌定植改变了胃微生物群,降低了微生物多样性,根除幽门螺杆菌可以恢复微生物多样性。
幽门螺杆菌可以利用几种机制来调节胃微环境。通过干扰质子泵的表达,幽门螺杆菌可以调节胃腔的酸度,从而使微环境与通常不能在胃中生长的微生物相容。
评估幽门螺杆菌感染对胃微生物群影响的研究
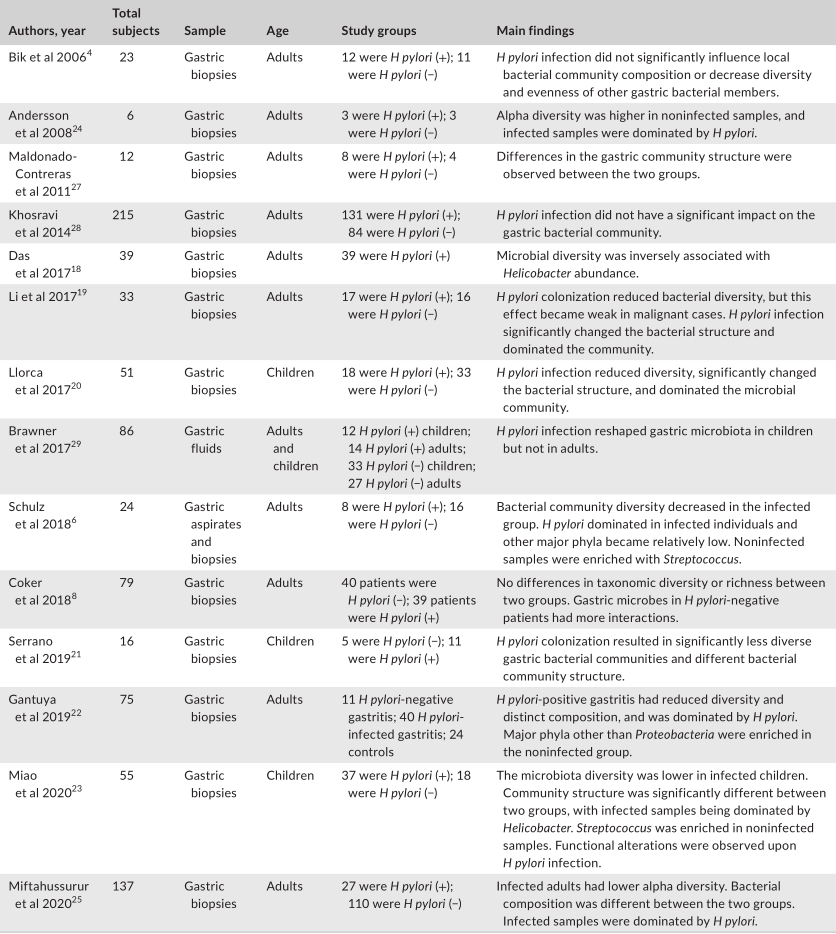
Tao et al., Helicobacter, 2020
此外,由于幽门螺杆菌的存在而改变的免疫反应可能会影响其他微生物群。幽门螺杆菌还可能通过动员抗菌肽或通过营养竞争来改变其他微生物群的生长。一般来说,研究人员表明,幽门螺杆菌的定植与α多样性的显著降低有关。微生物多样性和幽门螺杆菌丰度之间存在反比关系。
幽门螺杆菌感染对肠道微生物群的影响
与幽门螺杆菌阴性对照组相比,胃内有大量幽门螺杆菌的个体具有不同的肠道菌群,这表明胃肠段之间存在相互作用。
大多数研究表明,幽门螺杆菌感染与肠道微生物多样性之间的呈正相关。由于较高的微生物多样性通常与总体较好的健康状况有关,因此,探讨幽门螺杆菌感染后肠道微生物多样性的增加是否对宿主有一些有益的影响将是一个有趣的问题。
幽门螺杆菌感染对肠道微生物群影响的研究分析
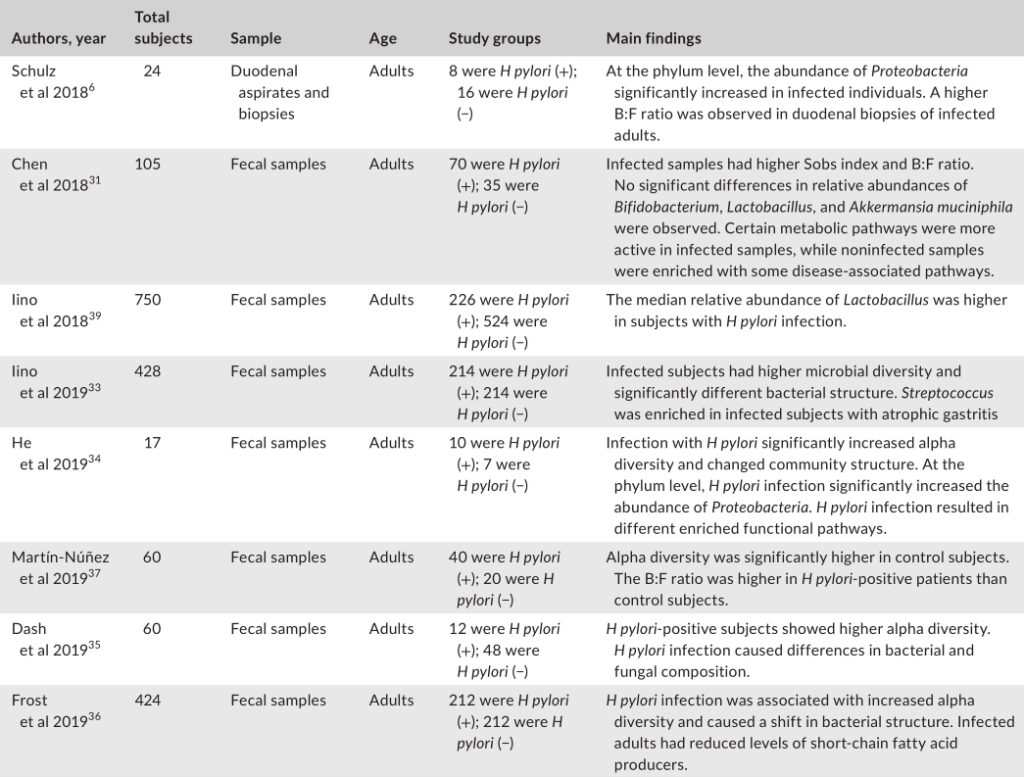
Tao et al., Helicobacter, 2020
幽门螺杆菌感染组和阴性对照组的微生物群落结构存在显著差异。
在门水平上的成分分析发现,受感染个体中变形菌的丰度显著增加,这可能是由于幽门螺杆菌从胃转移到肠腔所致。值得注意的是,拟杆菌与厚壁菌(B:F)的比率在幽门螺杆菌阳性组中更高。改变的B:F比值与临床相关,因为发现厚壁菌和拟杆菌与宿主的脂质代谢和能量平衡有关。
受感染与没感染组相比,双歧杆菌、乳酸杆菌和嗜粘液阿克曼菌的丰度没有显著差异。其他研究人员发现,幽门螺杆菌感染者体内乳酸杆菌的丰度更高。
一项研究发现,在幽门螺杆菌感染的患者中,萎缩性胃炎患者的肠道微生物群中链球菌更为丰富。
另一项研究发现,幽门螺杆菌感染的个体表现出短链脂肪酸(SCFA)产生者(如丁酸盐)水平的下降,SCFA对宿主产生有益的代谢作用。
此外,鉴于SCFAs受体在免疫细胞中的普遍表达,这些代谢物被认为在调节肠道内稳态中发挥重要作用。因此,幽门螺杆菌感染时抑制SCFAs的输出可能对人类健康有害。
有功能分析指出,在幽门螺杆菌阴性人群中,疾病相关途径更活跃。相比之下,许多代谢途径在感染的患者中的比例过高。因此,微生物群中的功能变化可能是特定于部位的,因为在肠道中观察到的变化与在胃中观察到的变化呈现不同的趋势。
根除疗法对胃微生物群的影响
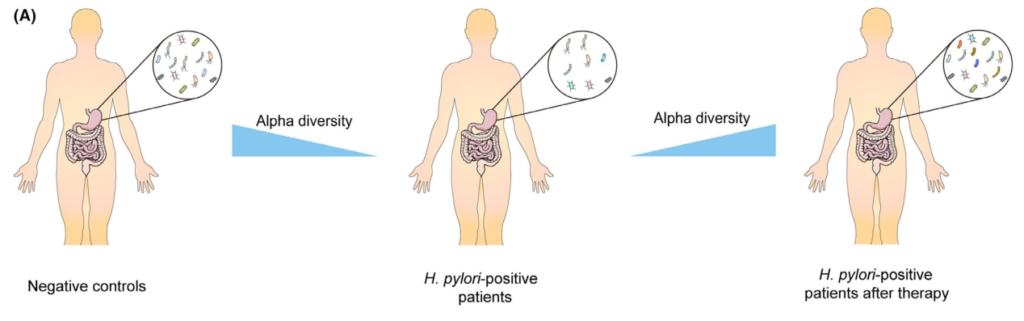
Tao et al., Helicobacter, 2020
充分的证据表明,成功清除幽门螺杆菌后,胃微生物多样性显著增加,但显示治疗失败后没有改善。研究人员认为恢复可能需要一定的时间,因为他们认为多样性从第0周到第6周和第26周逐渐增加。
此外,研究表明,成功根除幽门螺杆菌后,α多样性可以完全恢复到未感染对照组的水平。相反,尽管在清除幽门螺杆菌后,群落结构也可以部分恢复,但对于是否仍存在显著差异存在争议在根除后组和阴性对照组之间。
一些研究人员发现,接受抗幽门螺杆菌治疗的患者在治疗2个月后,胃微生物群落的组成恢复到未感染儿童的水平,然而,其他研究确定,成功治疗6个月后的成人样本仍显示出不同的菌群结构,阴性对照组则不同。
纳入分析的不同年龄组可能解释了相反的结论,因为另一项招募儿童的研究也发现根除组的菌群结构在治疗4周后与幽门螺杆菌阴性组的菌群结构接近。
根除治疗后评估胃微生物群变化的研究

Tao et al., Helicobacter, 2020
成分分析揭示了幽门螺杆菌的相对丰度治疗后幽门螺杆菌显著下降,而其他主要菌门,包括放线杆菌、拟杆菌、厚壁菌和梭杆菌,则增加。
在属水平上,治疗后乳酸杆菌和双歧杆菌(两种公认的益生菌)的数量显著增加。
两项研究的功能分析表明,成功治疗后,蛋白质和碳水化合物代谢途径上调。因此幽门螺杆菌感染期间,胃微生物群营养代谢功能受损,根除治疗可部分恢复。然而,预测的功能改变还需要进一步的验证。
根除治疗后肠道微生物群的变化
通过降低酸度,质子泵抑制剂(PPIs)已被证明对肠道微生物群产生显著影响。因此,抗幽门螺杆菌治疗对肠道微生物群的影响是PPIs、抗生素、铋联合应用的共同结果。总的趋势是,α多样性在根除后立即下降,随后又恢复。
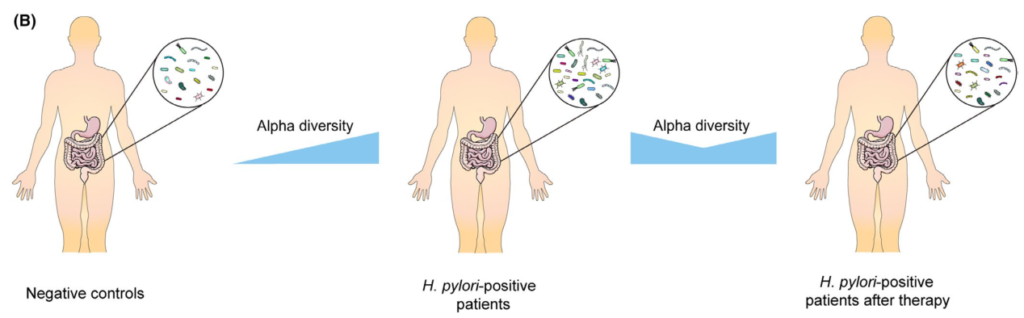

Tao et al., Helicobacter, 2020
具体来说,恢复需要多长时间仍有待阐明。大多数研究收集了随访2个月内的信息显示α多样性降低,而此后报告与基线无显著差异。
然而,一项研究报告,从第0周到第6周和第26周,Sobs指数和Chao指数都在下降没有达到统计学意义。值得注意的是,另一项研究发现,不同的治疗方案对肠道微生物群的影响可能不同。
在临床试验中,三种不同的治疗方案,包括三联疗法、联合疗法和铋四联疗法。结果表明,所有组的α多样性在第2周时都有所下降,但只有接受三联疗法的患者在第8周时才具有基本α多样性,而其他两组的α多样性在治疗后1年也无法恢复。
希望将来的研究验证根除疗法是否会导致肠道菌群的持续紊乱,以及不同的治疗方案如何影响可逆性。
分析根除疗法对肠道微生物群影响的研究
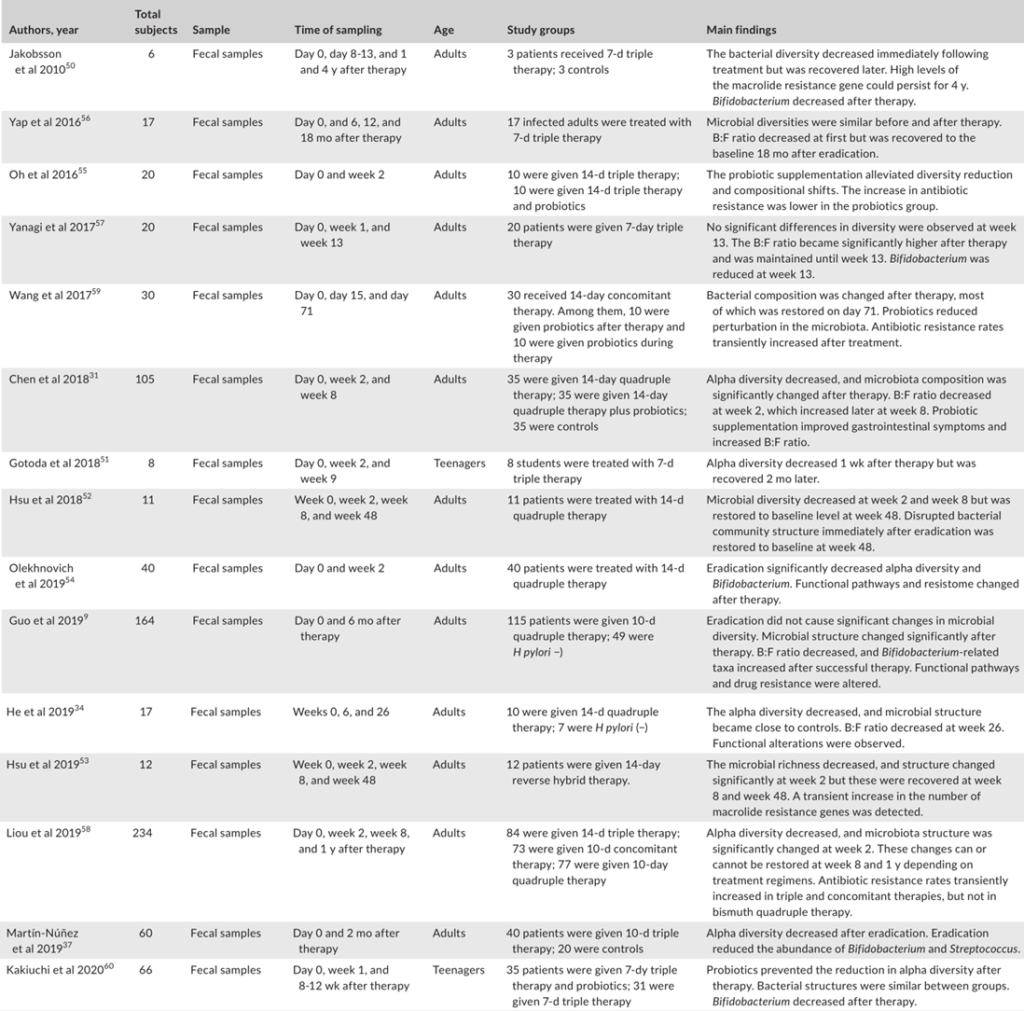

Tao et al., Helicobacter, 2020
益生菌的补充可以缓解抗生素引起的多样性和结构紊乱
益生菌,已被证明可稳定微生物群并改善胃肠道症状。在门水平上,治疗6个月后观察到厚壁菌群增加和拟杆菌减少,表明在幽门螺杆菌感染的个体中观察到的高B:F比率逆转。在另一项研究中报告了9个类似的结果。
临床证据支持肥胖与B:F比率降低相关。因此,这些研究中检测到的B:F比率降低可能为根除治疗后体重增加提供了一种可能的解释。然而,一些研究人员说明,在根除18个月后,降低的B:F比率可以逆转。有趣的是,益生菌补充被证明与根除治疗后较高的B:F比率相关。值得注意的是,报告的结果不一致。
一项研究表明,治疗后B:F比率立即增加,并在第13周保持高于基线水平。宏基因组研究的分类图谱显示,治疗后双歧杆菌的相对丰度下降。然而,另一项研究表明,双歧杆菌在成功根除6个月后增加。
在幽门螺杆菌阳性萎缩性胃炎的肠道微生物群中富集的链球菌在根除治疗后显著减少。
尽管不同研究中肠道微生物群的长期变化不同,但根除引起肠道内稳态的短期紊乱似乎是一致的。
根除疗法对肠道菌群抗生素耐药性的影响
随着根除疗法的广泛应用,抗生素耐药性的出现已成为临床实践中的一个重要问题。
根除幽门螺杆菌感染后,抗生素耐药性的上升以及根除治疗后的长期安全性是重要的问题。
通过药敏试验指导的个性化治疗可以在一线治疗中提供可靠的优异根除率,但贵且无法广泛获得。根据局部地区的抗生素耐药性,针对特定人群的经验疗法可能是一种替代策略。
已证明会改变幽门螺杆菌相关疾病风险的宿主因素包括宿主的年龄、在幽门螺杆菌的获得和幽门螺杆菌感染之间的持续时间,但更重要的是宿主免疫介质(多态性)和酸分泌状态。
除宿主因素外,吸烟和饮食等环境因素还会影响幽门螺杆菌定植的生态位,因此可能会影响疾病风险。

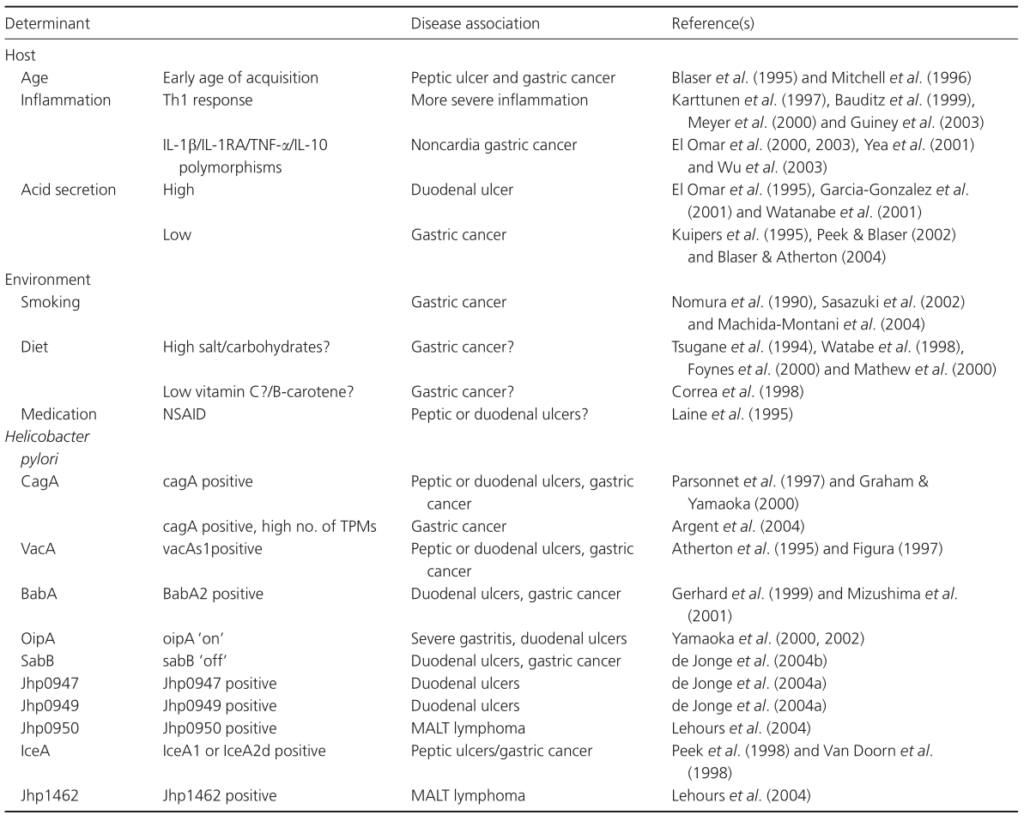
Karin et al., FEMS Microbiol Rev. 2006
在年幼时期感染幽门螺杆菌会增加患胃溃疡和胃癌的风险。 胃溃疡和胃癌的发展需要幽门螺杆菌的长期感染,因此,推测这些疾病是在慢性感染幽门螺杆菌的患者中更为常见。
此外,这种关联被认为是由不同年龄组的宿主免疫反应的差异所决定的。
感染幽门螺杆菌后,宿主胃上皮细胞释放细胞因子IL-8。这种细胞因子参与了巨噬细胞、中性粒细胞、肥大细胞、B细胞和T细胞募集到炎症部位。这些细胞通过分泌其他炎症介质,如干扰素(IFN-g)、肿瘤坏死因子(TNF-a)和白细胞介素(IL-1b),进一步增强免疫反应。
幽门螺杆菌相关发病机制的示意图

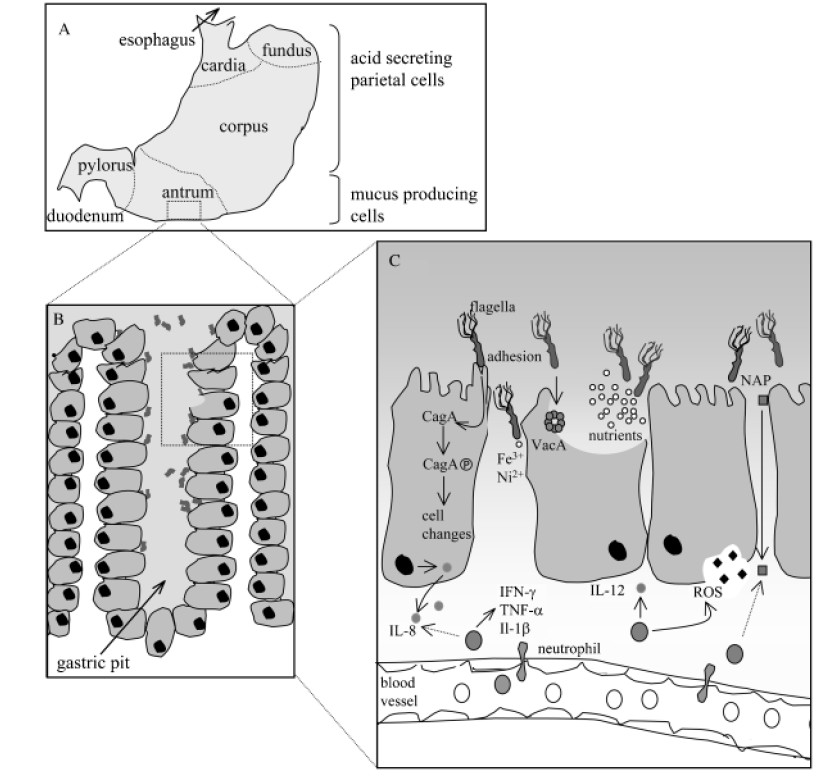
Karin et al., FEMS Microbiol Rev. 2006
A)在人类胃中,幽门螺杆菌主要定植于缺乏胃酸分泌壁细胞的胃窦中;
B)在胃小凹中,幽门螺杆菌尤其在上皮细胞紧密连接处附近增殖;
C)幽门螺杆菌对定植、持续和疾病发展具有重要作用的因子。
针对幽门螺杆菌的免疫反应进一步表现为活化的人类中性粒细胞中的氧化爆发。这种爆发会导致活性氧(ROS)的释放,活性氧是一种低分子量的代谢物,可破坏包括核酸在内的重要生物分。ROS可能损伤控制细胞生长的基因;并刺激癌症的发展。因此,免疫介质的存在会导致胃上皮的完整性受损。这种损伤是引起大多数与幽门螺杆菌感染相关的病理学,而不是直接的幽门螺杆菌活动。
幽门螺杆菌感染期间存在的免疫细胞主要是促炎细胞,而不是抗炎细胞。促炎介质由辅助性T细胞1(Th1)分泌。原始T细胞受多种因素驱动分化为Th1细胞,如TNF-a和IL-12。
在幽门螺杆菌刺激下,单核细胞大量产生细胞因子IL-12。因此,通过刺激IL-12的释放,幽门螺杆菌增强了促炎反应。这导致更多的损伤胃上皮,这容易发展胃萎缩。
一些编码免疫调节因子的宿主基因含有多态区域。这些基因的多态性将改变它们的转录,从而影响炎症过程。因此,幽门螺杆菌相关疾病的风险可能会改变。到目前为止,IL-1b、IL-1受体拮抗剂、IL-10和TNF-a基因的多态性已被证明与远端胃癌显著相关。
人类白细胞抗原(HLA)通过将病原体衍生的肽片段呈递给适当的T细胞,有助于消除病原体。HLA基因具有高度多态性,某些HLA等位基因与胃腺癌的发生有关。幽门螺杆菌感染也与胃腺癌的发生有关,但其存在与这些HLA等位基因的存在无关。因此,HLA等位基因在幽门螺杆菌介导的腺癌中的重要性仍然存在争议。
因此,遗传上预定的显性促炎性Th1反应与幽门螺旋杆菌疾病相关。
另一方面,Th1反应的强度可能受到抗炎Th2细胞因子IL10的产生的限制,从而延长感染时间。Th2型反应是由寄生虫引起的。因此,感染幽门螺杆菌的人的炎症反应和病理改变逐渐减弱。这可能导致这些个体慢性胃炎进展为胃癌的时间延迟。另外,不同的促炎反应可能直接导致幽门螺杆菌相关病理学的不同途径。
前面提到Th1反应导致胃壁细胞抑制其酸分泌。酸性较低的环境可能促进幽门螺杆菌的传播和持续。此外,当胃酸水平较低时,幽门螺杆菌以外的微生物可能在人体胃中生长,从而增强局部炎症反应。促炎细胞因子和胃酸分泌减少的联合作用增加了患消化性溃疡病和胃癌的风险。
另一方面,当酸的分泌减少时,十二指肠溃疡就不太可能发生。当酸的分泌增强时,十二指肠溃疡发生的风险增加。然而,同样在低酸性条件下,幽门螺杆菌感染后十二指肠溃疡的风险可能会增加。
胃壁细胞控制其产酸的能力在幽门螺杆菌相关疾病的发展中是重要的。幽门螺杆菌感染主要发生在人类胃中酸性较弱的部位,如胃窦。因此,胃酸分泌量高的宿主胃窦内幽门螺杆菌密度高,且主要发展为胃窦性胃炎。随后,胃体中完整的壁细胞被刺激分泌酸,从而诱导十二指肠的胃化生。幽门螺杆菌定植于这种胃化生,这可能导致十二指肠溃疡。
另一方面,胃酸分泌量低的宿主不仅胃窦易受幽门螺杆菌感染,而且胃体也易受幽门螺杆菌感染。感染的幽门螺杆菌可进一步抑制胃壁细胞的酸分泌。这可刺激胃上皮细胞持续增殖,导致胃腺进行性丧失,最终导致胃萎缩和癌症。
吸烟
一些环境因素与幽门螺杆菌相关的发病机制有关。吸烟是胃癌发展的主要因素。烟草烟雾含有致癌的亚硝胺,引发癌症的发展。
高盐饮食
一些饮食因素与幽门螺杆菌疾病有关。高盐饮食与幽门菌定植率、胃炎和胃癌风险增加。高盐浓度导致壁细胞萎缩,粘膜屏障破坏。然而,只有长期高盐摄入才会增加幽门螺杆菌相关疾病的风险。
高米饭摄入量
高米饭摄入量与胃癌之间存在正相关关系。米饭含有碳水化合物,可能会刺激胃粘膜。
水果和蔬菜摄入量低
水果和蔬菜摄入量低可能会增加胃癌的风险。水果和蔬菜含有抗氧化剂维生素C和β-胡萝卜素,通过中和活性氧来防止致癌。
因此,尽管有几个环境因素被认为与幽门螺杆菌相关疾病的发生有关,但它们的作用往往是有争议的。据推测,不同环境因素以及宿主和细菌因素之间的复杂相互作用妨碍了对研究结果的解释。
幽门螺杆菌因素在疾病发展中的总体影响是复杂的。到目前为止,已经描述了几种与幽门螺杆菌相关疾病的发生有关的幽门螺杆菌特异性蛋白。这些蛋白质被认为是导致幽门螺杆菌持续存在的原因。作为副作用,这些幽门螺杆菌蛋白诱导和改变炎症过程,损伤胃上皮,从而决定幽门螺杆菌感染后的结局。
CagA
与感染cagA阴性幽门螺杆菌分离株的患者相比,携带细胞毒素相关基因A(cagA)的幽门螺杆菌分离株的定植与严重胃炎、消化性溃疡病和远端胃腺癌的风险增加有关。
幽门螺杆菌cagA基因的存在或不存在经常被用作幽门螺杆菌中致病岛(PAI)存在或不存在的标记。 cag PAI由大约30个基因组成,并且在所有幽门螺杆菌分离株中占50%–70%。 位于cag PAI侧翼的两个31 bp重复序列之间的重组可能导致整个cag区域的缺失或获得。
cag PAI上的18个基因对于产生IV型分泌系统至关重要。 IV型分泌系统将细菌细胞中的蛋白(与毒力相关)转运到宿主细胞的胞质溶胶中。 这通常导致上皮细胞反应的级联反应的启动,例如细胞骨架的变化和细胞因子IL-8的分泌。
在幽门螺杆菌中,IV型分泌系统的成分将CagA蛋白转运到胃上皮细胞中。 随后,CagA蛋白被磷酸化。 然后,这种磷酸化的CagA与宿主磷酸酶SHP-2相互作用,引起细胞骨架的重排。 这导致宿主细胞形态发生变化,也称为“蜂鸟”表型。该表型的特征在于细胞扩散,上皮细胞的延长生长以及片状脂蛋白和丝状伪足的存在。
作为抵消事件,磷酸化的CagA与宿主Src激酶相互作用,从而减弱宿主SHP-2磷酸酶的信号传导。 这个过程减少了细胞骨架的重排,并阻止了CagA的进一步磷酸化。
最近,已经证明幽门螺杆菌菌株在体内诱导较高水平的CagA磷酸化。上皮细胞诱导更多的细胞骨架变化,并且更可能与胃癌有关。CagA磷酸化水平的差异是由cagA基因的30个区域内酪氨酸磷酸化基序(TPM)数量的差异引起的。
幽门螺杆菌人群,需要最低限度的免疫识别。因此,在萎缩的生态位中,这些TPM数量减少的亚克隆诱导了较弱的宿主免疫反应。
另一方面,较高水平的CagA磷酸化可引起强烈的炎症反应。 这种炎症会导致萎缩,并可能在限制高酸输出的生态位酸应激中发挥作用。
通过观察发现,缺乏cagA基因的幽门螺杆菌菌株是从消化性溃疡或胃癌患者中分离出来的,尽管其频率比cagA阳性幽门螺杆菌菌株的频率更低。
cagA和幽门螺杆菌相关疾病之间的关联在不同的地理区域中有所不同。 这种变异可能与CagA表达的差异有关。
然而,CagA并不是唯一的。幽门螺杆菌蛋白负责屏障功能障碍,而这一过程并没有随着CagA的清除而丢失。下一节讨论的VacA蛋白也很重要。
VacA
最初显示真核细胞在带有幽门螺杆菌的体外测试系统中经历空泡化和连续变性。 后来证明这种现象是由幽门螺杆菌毒素诱导的,现在被称为空泡细胞毒素A(VacA)。
VacA或CagA不能单独用作临床结果的决定因素。
VacA如何发挥作用,导致细胞死亡?
幽门螺杆菌VacA是一种高度免疫原性的95-kDa蛋白。VacA结合上皮细胞的顶端部分,形成阴离子选择性孔。
通过这些孔,碳酸氢盐,氯化物和尿素从细胞质中释放出来,然后,VacA被内吞进入晚期的内体区室,并改变这些区室的通透性。
在弱碱(例如氨)的存在下,这会导致水涌入,从而导致囊泡肿胀和液泡形成。 细胞内内吞途径的损伤最终导致细胞死亡。
这导致了上皮细胞抗性的降低,因此低分子量分子如Fe3+和Ni2+可以很容易地穿过上皮细胞层。Fe3+和Ni2+分子分别是幽门螺杆菌生长和脲酶活性的关键因子。
因此,推测通过降解上皮细胞屏障,幽门螺杆菌可以更容易地获得这些关键因子。
幽门螺杆菌VacA也与壁细胞的降解有关,这导致酸分泌减少,使宿主容易患上胃癌。 持续感染过程中VacA表达水平的差异导致毒性改变。 因此,溃疡的消长可以通过随时间变化的VacA表达变化来解释。
在体外在胃上皮细胞附近诱导vacA基因的转录。 这一发现证实了VacA与宿主细胞相互作用的重要性。 此外,VacA可以逃避适应性免疫反应,从而增强幽门螺杆菌在胃粘液层中的持久性。
幽门螺杆菌外膜蛋白(HOPs)
在革兰氏阴性细菌中,外膜介导与其周围环境的相互作用。 在感染期间,假定存在于幽门螺杆菌外膜上的蛋白质被改变,使得宿主免疫系统的识别作用降至最低。
幽门螺杆菌分离物含有约30种不同的外膜蛋白(HOP)。 其中几种是粘附素。 在革兰氏阴性细菌中,粘附素最常形成聚合菌毛结构。 但是,在幽门螺杆菌中,这些粘附素已经适应了胃环境,其中酸性条件可能会使这种聚合物菌毛结构解聚。
岩藻糖基化的糖蛋白和唾液酸化的糖脂都已被证明是胃上皮中幽门螺杆菌的结合位点。
与宿主细胞的粘附可保护幽门螺杆菌免受蠕动和粘膜脱落。
此外,推测粘附力可以使幽门螺杆菌更好地获取从胃上皮释放的营养物质,并更有效地将细菌毒素传递至宿主细胞。
另一方面,在剧烈炎症的部位,粘附特性的丧失可能使幽门螺杆菌逃脱宿主免疫细胞的杀伤。目前为止,一些HOP与疾病的发展有关。
幽门螺杆菌BabA (HopS)介导幽门螺杆菌粘附于人Leb血型抗原,这些抗原存在于胃上皮细胞上。BabA黏附促进幽门螺杆菌定植,增加上皮细胞分泌IL-8,导致粘膜炎症增强。
BabA调节的两种机制都有助于促进慢性感染的动态反应。
在慢性炎症期间,选择增加或减少粘附的周期可在所有血型的人群中获得所有类型的Leb结合。
宿主粘膜糖基化模式导致BabA进化,使幽门螺杆菌菌株适应其个体宿主,这有助于避免宿主反应,并在全世界范围内造成幽门螺杆菌感染的异常长期性。
幽门螺杆菌可塑性区域毒力因子
两个单独菌株基因组序列的比较表明,一个菌株中存在的幽门螺杆菌基因中约有6%-7%不存在于另一个菌株中,反之亦然。
大约一半的菌株特异性基因存在于高变区;可塑性区。 位于这种可塑性区域的基因通常与毒力增加相关。
在幽门螺杆菌中,可塑性区确实编码了与IV型分泌有关的Vir型ATP酶。 在幽门螺杆菌中,该分泌系统在例如分泌CagA细胞毒素中很重要。目前为止,一些位于可塑性区的幽门螺杆菌基因与幽门螺杆菌相关的疾病有关。
幽门螺杆菌Jhp0947和Jhp0949与十二指肠溃疡疾病相关。这两个基因均位于幽门螺杆菌菌株J99可塑性区,在幽门螺杆菌介导的IL-12释放中很重要。
在体外测试系统中从单核细胞中提取。 细胞因子IL-12对于使免疫反应偏向促炎性Th1应答是必不可少的,并且与十二指肠溃疡的形成密切相关。
由jhp0947和jhp0949编码的蛋白质的功能未知。 然而,已经假设这些蛋白通过与单核细胞的相互作用诱导促炎细胞因子IL-12的产生。
IL-12水平升高会导致幼稚T细胞分化为活化的Th1细胞,从而导致炎症反应增强和组织损伤增加。
幽门螺杆菌Jhp0950,编码一种未知功能的蛋白质,也是J99可塑性区的一部分。该基因的存在与cagA、cagE、vacA s1m1、babA2、hopQ T1、oipA有关。
在幽门螺杆菌J99基因组中,Jhp0950与Jhp0949相邻。与Jhp0949不同,Jhp0950与十二指肠溃疡风险增加无关。然而,它与疾病的关联支持了位于可塑性区域的幽门螺杆菌基因可能与毒性相关的观点。
其他幽门螺杆菌毒力因子
在美国和荷兰,幽门螺杆菌iceA1基因(iceA基因的两个等位基因变体之一)在幽门螺杆菌感染的消化性溃疡患者中比仅在幽门螺杆菌感染的胃炎患者中更为普遍。
与许多其他与毒力相关的基因相似,IceA表达与幽门螺杆菌相关疾病之间的联系是群体依赖性的。
在东南亚,未发现iceA1与幽门螺杆菌相关疾病之间的关联。 有趣的是,对iceA1呈阳性的南非幽门螺杆菌分离株在幽门螺杆菌感染的胃癌患者中比仅在幽门螺杆菌感染的胃炎患者中更普遍。
注:幽门螺杆菌iceA1最初是在与胃上皮细胞接触后转录上调后被鉴定的,iceA1基因编码的核酸内切酶与乳球菌中的限制性核酸内切酶NlaIIIR非常相似,伴随的高度保守的脱氧核糖核酸腺嘌呤甲基转移酶的活性,由幽门螺杆菌编码,似乎与控制幽门螺杆菌的基因表达有关。
幽门螺杆菌Jhp1462与MAL T淋巴瘤、十二指肠溃疡和胃腺癌的风险增加相关。由Jhp1462编码的蛋白质的功能是未知的,其在严重胃十二指肠疾病发展中的重要性仍有待阐明。
以上,我们看到幽门螺杆菌通过各种方式给人体带来种种不利影响,它似乎不应该在人体中长期生存,然而,幽门螺杆菌在人体内存在有着的悠久的历史,那么幽门螺杆菌是如何保护自己在人体中安稳生存下来?
幽门螺杆菌在疾病发生之前会长期感染人胃粘膜。 因此,导致幽门螺杆菌定植和持续存在的因素与幽门螺杆菌相关的发病机理具有内在联系。 在胃腔进入后,幽门螺杆菌必须应付胃酸。
幽门螺杆菌通过其耐酸性在这种酸性条件下得以生存:然后穿过粘液层到达其接近胃上皮细胞的位置。趋化性,运动性和粘附性是胃上皮细胞定殖的重要过程。
为了在人胃粘膜中长期持久存在,幽门螺杆菌还不断需要宿主提供营养。 这是通过降解粘液层和下面的胃上皮细胞的完整性来实现的。 此外,通过抑制宿主免疫系统,抗原变异和抗原拟态避免了幽门螺杆菌的清除。
耐酸性
幽门螺杆菌生长的下限pH值是5.0-5.5,具体取决于测试的分离物。在胃粘膜层中,pH也是酸性的,大约在4-6.5之间变化。而且,当粘液层被破坏时,pH值可能会偶尔下降。
酸冲击(pH<3)后幽门螺杆菌的存活取决于幽门螺杆菌蛋白脲酶的活性,该酶将尿素转化为氨和碳酸氢盐。这导致幽门螺杆菌的周质或细胞质被中和。幽门螺杆菌尿素酶活性对于在酸性pH下体外存活以及在动物模型中胃粘膜定植至关重要,这证明了尿素酶在幽门螺杆菌感染中的重要性。
在中性pH下高度活跃的脲酶和酸调节的尿素通道的结合解释了为什么幽门螺旋菌在人类胃部的生存能力是独特的。有效抑制UreI蛋白,将提供一种从正常的,分泌酸的胃中根除幽门螺杆菌的方法。
除耐酸性外,脲酶还具有与胃定植有关的其他基本功能
尽管尿素酶对于酸休克的生存是必不可少的,但是幽门螺杆菌尿素酶在处理胃上皮细胞附近的慢性酸性环境时还是不够的。 用酸抑制剂治疗不能恢复尿素酶阴性突变体定殖在生侏儒仔猪胃中的能力。
脲酶参与幽门螺杆菌的氮代谢,脲酶活性产生的氨和碳酸氢盐被认为会影响宿主的许多细胞过程,包括细胞裂解。
除脲酶外,非脲酶基因也有助于耐酸,并且在酸性pH下的存活和生长与脲酶无关。 在这些非脲酶基因中,已显示三种调节蛋白(Fur,NikR和HP0166)对幽门螺杆菌的适应性有贡献。 这表明严格调节耐酸机理的重要性。
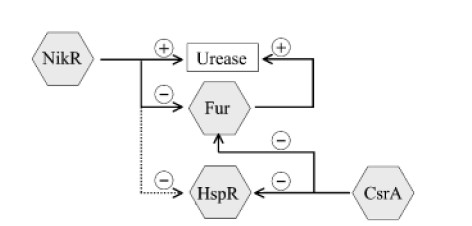
Karin et al., FEMS Microbiol Rev. 2006
NikR通过Fur调节系统直接和间接调节脲酶的表达。CsrA调节Fur和HspR调节系统的表达。通过不同基因调节蛋白的相互作用,幽门螺杆菌能够感知和响应多种信号。
细胞的趋化作用与运动
胃上皮细胞层覆盖着一层厚厚的粘液。假定该层甚至对于小分子也相对不可渗透。幽门螺杆菌的能动性和趋化性是有效穿透这一粘液层的关键。
在小鼠感染模型中,几乎任何运动和趋化性系统基因的诱变都消除了幽门螺杆菌感染胃粘膜的能力,强调了这些因素对定殖的重要性。
运动性
幽门螺杆菌的运动性是通过存在两到六个极性的带鞘鞭毛而实现的。鞭毛由三个结构元素组成:基体,钩子和细丝。迄今为止,超过50种蛋白质与鞭毛的结构或调控组织有关。
鞭毛丝由两个亚基FlaA和FlaB组成。幽门螺杆菌flaA和flaB突变体无法在感染仔猪的模型中定植,表明幽门螺杆菌鞭毛对定殖是必需的,幽门螺杆菌的毒力也因此而增加。
幽门螺杆菌motB基因编码鞭毛运动旋转蛋白。 幽门螺杆菌motB基因敲除突变体仍包含鞭毛,但不能运动。该突变体在小鼠中定植的能力降低,证实了运动性是完全传染性所必需的。
鞭毛基因转录的调控不同于许多其他细菌。与许多其他带鞭毛的革兰氏阴性细菌相反,幽门螺杆菌没有转录调控因子来调控鞭毛基因的转录。
据推测,幽门螺杆菌的运动不需要严格的调节,因为它在任何时候都是不可或缺的。然而,在幽门螺杆菌中仍然可以看到一些转录调控。例如,蛋白质FlhA和FlhF,基体的组成部分,需要在中后期鞭毛基因转录之前出现。
趋化性
除了运动性,趋化性对于幽门螺杆菌的定植也是必不可少的。趋化性允许幽门螺杆菌将其运动导向胃上皮细胞层。
由HP0099编码的幽门螺杆菌趋化性受体传感器识别碳酸氢盐和精氨酸作为引诱剂。幽门螺杆菌外膜上这种传感器蛋白与反应调节剂CheY偶联。
反应调节剂CheY调节鞭毛运动蛋白的表达,使幽门螺杆菌游向其生态位。
应答调节因子CheY的一个敲除突变体未能在非生物小猪体内定殖,强调了趋化性在最初定殖中的重要性。
反应调节因子CheY及其组氨酸激酶的敲除突变体显示出对粘蛋白的趋化性反应减弱。
免疫逃避
在长期的定殖过程中,宿主对多种幽门螺杆菌抗原产生强大的免疫反应。然而,这些抗原通常没有表面暴露。
另一方面,表面暴露的抗原通常高度多样化,使宿主清除幽门螺杆菌变得更加困难。幽门螺杆菌感染极少产生足够的免疫反应,能够清除细菌。 实际上,幽门螺杆菌能够有效规避先天性和适应性免疫反应。
先天的免疫反应不能实质上识别幽门螺杆菌。大肠杆菌脂多糖(LPS)通过TLR4激活先天免疫应答。然而,幽门螺杆菌LPS远不是TLR4介导的基因表达的有效诱导剂。
在幽门螺杆菌中,TLR5介导的免疫应答激活效率也较低。 与肠沙门氏菌血清型鼠伤寒鞭毛蛋白相比,幽门螺杆菌鞭毛蛋白没有被释放,并且在通过TLR5激活IL-8分泌中也没有那么强。
先天性免疫反应未能识别幽门螺杆菌可能导致适应性免疫反应失败以随后清除感染。
自适应免疫系统的逃避至少由两个重要机制介导:抗原模拟和免疫抑制。抗原模拟导致宿主免疫系统无法正确识别幽门螺杆菌。例如,幽门螺杆菌LPS上的Le血型抗原也在人类上皮细胞上表达。结果,幽门螺杆菌LPS免疫原性差,从而支持幽门螺杆菌的持久性。在其LPS上缺少O抗原的幽门螺杆菌菌株在小鼠中定殖的能力显着降低。因此,幽门螺杆菌LPS的典型结构在定植中很重要。
除了通过抗原模拟来逃避免疫外,免疫抑制也有助于幽门螺杆菌感染的慢性化。
免疫应答可能偏向更抗炎的应答,或者下调(VacA)。幽门螺杆菌VacA可以阻断巨噬细胞中的吞噬体-溶酶体融合,导致巨噬细胞无法杀死幽门螺杆菌。
此外,VacA表达阻断T细胞活化并因此增殖,活化T细胞凋亡,并抑制T细胞中的抗原呈递。
B淋巴细胞的抗原加工可能被阻止,可能是通过将内体的成熟限制在发生抗原加载的MHC II类区室中。因此,VacA限制了针对幽门螺杆菌的T细胞和B细胞应答。
幽门螺杆菌的存在可以预防某些疾病?
通过以上各种方式,幽门螺杆菌得以在人体中生存下来,从某种程度上来说,幽门螺杆菌并不总是对人类宿主有害。
研究表明,幽门螺杆菌的存在可能抑制引起结核的细菌(结核分枝杆菌),预防哮喘,克罗恩病,食管反流,腹泻病以及食道癌。 幽门螺杆菌的发病率下降与儿童过敏性疾病和自身免疫性疾病,多发性硬化,腹腔疾病的发病率上升相关。
因此,从某种程度上来说,幽门螺杆菌有其存在的价值。这引起了关于是否需要根除幽门螺杆菌的讨论。
需要明确的是,幽门螺杆菌感染后不会立即对人体产生致死性危害和严重后果,所导致的慢性胃炎、消化道溃疡和胃癌等疾病是长期存在并慢性与其他因素共同作用的结果。
第五次全国幽门螺杆菌感染处理共识报告中有如下陈述:
根除幽门螺杆菌的获益在不同个体之间存在差异
根除幽门螺杆菌促进消化性溃疡愈合和降低溃疡并发症发生率,根除幽门螺杆菌可使约80%早期胃 MALT 淋巴瘤获得缓解。与无症状和并发症的 幽门螺杆菌感染者相比,上述患者根除幽门螺杆菌的获益显然更大。胃癌发生高风险个体有胃癌家族史、早期胃癌内镜下切除术后和胃黏膜萎缩和(或)肠化生等。根除幽门螺杆菌预防胃癌的获益高于低风险个体。

在做出可靠的功能性消化不良诊断前,必须排除幽门螺杆菌相关消化不良。
幽门螺杆菌胃炎伴消化不良症状的患者,根除幽门螺杆菌后可使部分患者的症状获得长期缓解,是优选选择。
幽门螺杆菌感染是消化性溃疡主要病因,不管溃疡是否活动和是否有并发症史,均应该检测和根除幽门螺杆菌。
…
总的来说,对于无抗衡因素 ( 高龄、伴存疾病、社区再感染率、卫生经济因素等 ) 的个体,根除幽门螺杆菌治疗利大于弊。
儿童:
不推荐对 14 岁以下儿童行常规检测幽门螺杆菌。推荐对消化性溃疡儿童进行幽门螺杆菌检测和治疗,因消化不良行内镜检查的儿童建议行幽门螺杆菌检测与治疗。
与成人相比,儿童根除治疗不利因素较多,包括抗菌素选择余地小,对药物不良反应耐受性低。此外,儿童幽门螺杆菌感染有一定自发清除率,根除后再感染率也可能高于成人。
老年人:
老年人根除幽门螺杆菌治疗药物不良反应风险增加,因此对老年人根除幽门螺杆菌治疗应该进行获益-风险综合评估,个体化处理。
问卷调查显示,多数临床医生对老年人根除幽门螺杆菌治疗的态度趋向保守。一般而言,老年人(年龄>70 岁)对根除幽门螺杆菌治疗药物的耐受性和依从性降低,发生抗生素不良反应的风险增加;另一方面,非萎缩性胃炎或轻度萎缩性胃炎患者根除幽门螺杆菌预防胃癌的潜在获益下降。
合理看待幽门螺杆菌感染后果至关重要,对自然人群中幽门螺杆菌感染是否需要进行干预,需要综合权衡利弊。对于有根除治疗指征的患者,需要给予规范治疗,提高首次根除率,减少耐药性发生。
在慢性感染过程中,多株菌株同时定植于一个宿主,并且幽门螺杆菌分离株的遗传变异使幽门螺杆菌相关的发病机理难以从单个因素中预测。 幽门螺杆菌与其宿主的共同进化使它得以终生定居。
随着现代卫生环境改善及抗生素的大量使用,幽门螺杆菌的生长和传播越来越难,年轻一代中感染率较低,在未来几十年中幽门螺杆菌感染率将进一步下降。
更好地理解幽门螺杆菌和其他胃肠道微生物群之间的对话可能为预防或治疗其感染提供新的方向。如在肠道菌群健康检测报告中发现幽门螺杆菌感染,则应引起重视。当需要治疗时,应评估新的治疗策略和药物,或者应该制定替代策略来控制细菌的毒力,从而避免出现溃疡和胃癌而不消除其积极影响。
附录: 幽门螺杆菌的发现史
在1980年代初,幽门螺杆菌首次被发现是引起胃部疾病的原因。该发现帮助研究人员将幽门螺杆菌感染与胃炎,溃疡和胃癌等联系起来。
1982年,两名澳大利亚研究人员巴里·马歇尔和罗宾·沃伦描述了幽门螺杆菌感染的作用。
然而,沃伦和马歇尔关于幽门螺杆菌功能的理论并未立即被医学界接受。当时,大多数科学家都不相信细菌可以在人的胃中生活。
马歇尔无法在实验室小鼠中进一步测试他的工作,也不允许在人身上进行实验。马歇尔这位勇敢的科研工作者想到了一个办法。
他决定亲自吃下幽门螺杆菌。他从病人的肠道中提取该菌,将其放入肉汤中,然后饮用。
几天后,马歇尔出现了肠道症状,例如恶心,呕吐,口臭和疲劳。他做了胃活检,且能够培养幽门螺杆菌,证明是细菌引起了他的症状。
医学界最终接受了幽门螺杆菌引起溃疡和其他肠道问题的观念,但是接受的道阻且长。
1994年,美国国立卫生研究院共识发展会议正式承认幽门螺杆菌与溃疡之间的紧密联系。该小组建议对溃疡患者进行抗生素治疗。
1996年,FDA批准了首个针对幽门螺杆菌引起的溃疡的抗生素疗法。
一年后,疾控中心(CDC)与其他政府机构和学术机构合作发起了一项全国运动,为医患相关人员提供有关幽门螺杆菌与溃疡之间的联系。
2005年,马歇尔和沃伦获得了诺贝尔生理学或医学奖。溃疡不再被视为无法治愈的慢病,而是一种可以通过短期的抗生素和酸分泌抑制剂治疗的疾病。
【参考文献】
Burucoa C, Axon A. Epidemiology of Helicobacter pylori infection. Helicobacter. 2017 Sep;22 Suppl 1. doi: 10.1111/hel.12403. PMID: 28891138.
Camilo V, Sugiyama T, Touati E. Pathogenesis of Helicobacter pylori infection. Helicobacter. 2017 Sep;22 Suppl 1. doi: 10.1111/hel.12405. PMID: 28891130.
Eusebi LH, Zagari RM, Bazzoli F. Epidemiology of Helicobacter pylori infection. Helicobacter. 2014 Sep;19 Suppl 1:1-5. doi: 10.1111/hel.12165. PMID: 25167938.
Mentis A, Lehours P, Mégraud F. Epidemiology and Diagnosis of Helicobacter pylori infection. Helicobacter. 2015 Sep;20 Suppl 1:1-7. doi: 10.1111/hel.12250. PMID: 26372818.
Thorell K, Lehours P, Vale FF. Genomics of Helicobacter pylori. Helicobacter. 2017 Sep;22 Suppl 1. doi: 10.1111/hel.12409. PMID: 28891132.
Julie Marks.Robert Jasmer, MD What Is H. Pylori? Symptoms, Causes, Diagnosis, Treatment, and Prevention. 2020.9
History of H. Pylori: What We Do and Don’t Know Before the discovery of the bacterium, doctors thought stomach ulcers were due to stress and spicy foods.
Burucoa C, Axon A. Epidemiology of Helicobacter pylori infection. Helicobacter. 2017 Sep;22 Suppl 1. doi: 10.1111/hel.12403. PMID: 28891138.
Kamboj AK, Cotter TG, Oxentenko AS. Helicobacter pylori: The Past, Present, and Future in Management. Mayo Clin Proc. 2017 Apr;92(4):599-604. doi: 10.1016/j.mayocp.2016.11.017.
Eusebi LH, Zagari RM, Bazzoli F. Epidemiology of Helicobacter pylori infection. Helicobacter. 2014 Sep;19 Suppl 1:1-5. doi: 10.1111/hel.12165. PMID: 25167938.
Yang JC, Lu CW, Lin CJ. Treatment of Helicobacter pylori infection: current status and future concepts. World J Gastroenterol. 2014 May 14;20(18):5283-93. doi: 10.3748/wjg.v20.i18.5283.
Sun Y, Zhang J. Helicobacter pylori recrudescence and its influencing factors. J Cell Mol Med. 2019 Dec;23(12):7919-7925. doi: 10.1111/jcmm.14682. Epub 2019 Sep 19.
Tao Zhi-Hang,Han Ji-Xuan,Fang Jing-Yuan,Helicobacter pylori infection and eradication: Exploring their impacts on the gastrointestinal microbiota.[J] .Helicobacter, 2020, 25: e12754.
Algood HM, Cover TL. Helicobacter pylori persistence: an overview of interactions between H. pylori and host immune defenses. Clin Microbiol Rev. 2006 Oct;19(4):597-613. doi: 10.1128/CMR.00006-06.
Kori M, Daugule I, Urbonas V. Helicobacter pylori and some aspects of gut microbiota in children. Helicobacter. 2018 Sep;23 Suppl 1:e12524. doi: 10.1111/hel.12524. PMID: 30203591.
van Amsterdam K, van Vliet AH, Kusters JG, van der Ende A. Of microbe and man: determinants of Helicobacter pylori-related diseases. FEMS Microbiol Rev. 2006 Jan;30(1):131-56.
Waskito LA, Yamaoka Y. The Story of Helicobacter pylori: Depicting Human Migrations from the Phylogeography. Adv Exp Med Biol. 2019;1149:1-16. doi: 10.1007/5584_2019_356. PMID: 31016625.
Pereira-Marques J, Ferreira RM, Pinto-Ribeiro I, Figueiredo C. Helicobacter pylori Infection, the Gastric Microbiome and Gastric Cancer. Adv Exp Med Biol. 2019;1149:195-210.
RU Nan, DU Yi-qi, LI Zhao-shen. 幽门螺杆菌根除指征的演变[J]. 中国实用内科杂志, 2019, 39(006):515-519.
中华医学会消化病学分会幽门螺杆菌和消化性溃疡学组, 全国幽门螺杆菌研究协作组, 刘文忠,等. 第五次全国幽门螺杆菌感染处理共识报告[J]. 胃肠病学, 2017(6).