-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
肠道微生物群是居住在人类胃肠道中的复杂生态系统,由数万亿微生物(包括细菌、病毒、真菌和其他微生物)组成。通过代谢活动和与宿主相互作用,肠道微生物群在影响正常生理过程、代谢稳态和疾病易感性方面发挥重要作用,并影响健康的各个方面。
研究表明,肠道菌群失调或改变可通过影响葡萄糖代谢、胰岛素敏感性和炎症来促进2型糖尿病发展。此外,肠道菌群通过葡萄糖耐量受损和胰岛素抵抗增加等机制与2型糖尿病、肥胖、代谢综合征等疾病发作相关。
2型糖尿病患者通常表现出产丁酸盐的有益细菌(如罗氏菌属和普拉梭菌)减少,而有害细菌(如埃希菌属和扭链瘤胃球菌属)增加。
而平衡的肠道微生物群与葡萄糖代谢和胰岛素敏感性改善相关,有可能降低糖尿病相关并发症风险。最近的荟萃分析表明,微生物群衍生的干预措施可显著改善血清空腹胰岛素和糖化血红蛋白水平,这两者都是2型糖尿病患者疾病进展的关键标志物。调节肠道微生物群的策略包括使用益生菌、益生元和合生元。益生菌是摄入后对健康有益的活微生物,益生元是刺激有益肠道细菌生长的不可消化化合物,合生元是益生菌和益生元的组合,协同作用以增强肠道健康。
尽管关于益生菌在2型糖尿病中作用的研究正在迅速扩大,强调它们对血糖控制和代谢参数的积极影响,然而益生元作为细菌营养基质的重要作用经常被忽视。不同类型的益生元可直接影响血糖水平,并通过支持有益细菌生长间接影响糖尿病。菊粉、低聚果糖、低聚半乳糖、抗性淀粉、果胶低聚糖、多酚、β-葡聚糖和铁皮石斛等益生元已被证明可改善肠道微生物组成并支持2型糖尿病患者血糖控制。
本文将详细描述不同的益生元、它们建议的每日剂量、含有它们的食物、它们对2型糖尿病的直接影响,以及由此产生的肠道微生物群的变化。益生元还通过不同机制改善血糖指数,包括对短链脂肪酸的影响、抗炎作用、肠促胰岛素分泌优化、血脂水平改善和抗氧化特性。深入地了解如何利用益生元以及个性化饮食干预有望作为优化糖尿病管理和改善整体健康的治疗策略。
2型糖尿病(T2DM)是一种由胰岛素抵抗或分泌不足等导致血糖水平升高的慢性代谢性疾病,典型症状被称为”三多一少”:即多饮、多尿、多食和体重减轻。
2型糖尿病已成为21世纪最严重的全球性健康危机之一。据国际糖尿病联盟数据,全球糖尿病患者从2000年的1.51亿激增至2021年的5.37亿,预计2045年将达7.83亿,其中90-95%为2型糖尿病。并且在全球20-79岁成年患者中,中国占1.41亿人,超过总数的四分之一。
2型糖尿病的危害
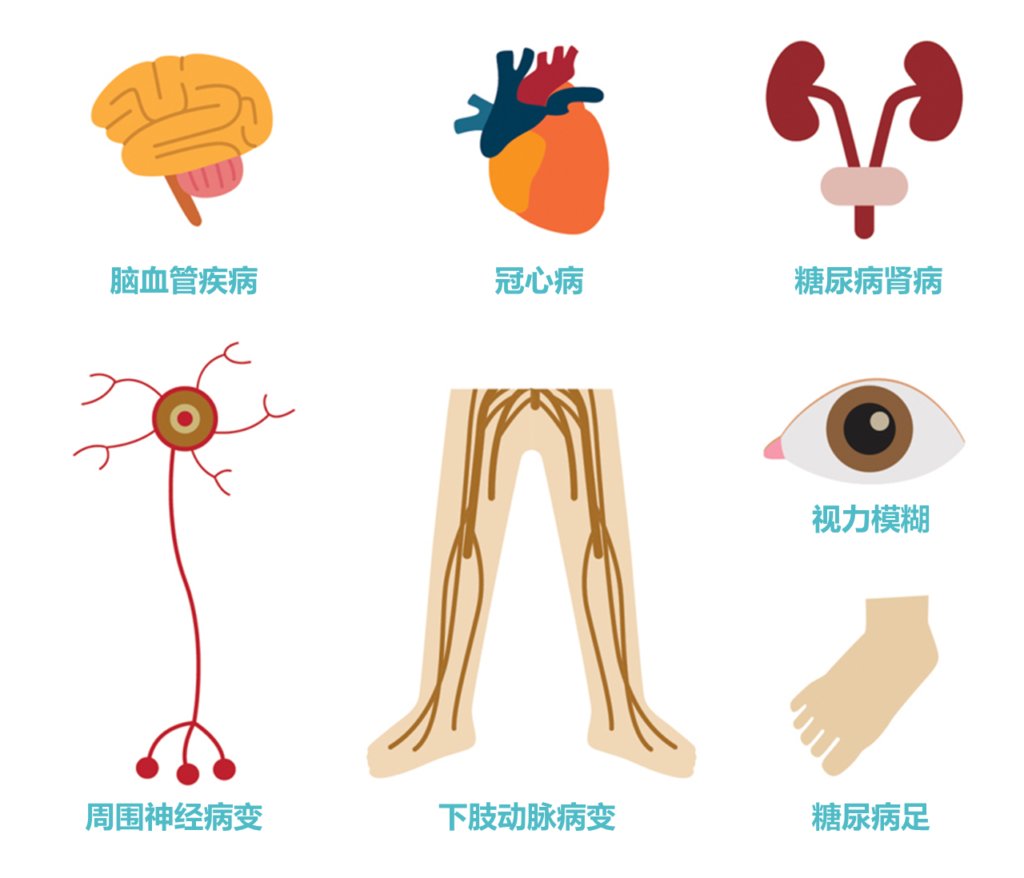
这一”现代流行病”不仅以惊人的速度蔓延,更以其广泛而深远的健康危害威胁着人类生存质量:它是导致失明、肾衰竭、糖尿病截肢的主要原因,还会使心血管疾病风险增加2-4倍,每年夺走超过400万人的生命。
2型糖尿病的危害包括以下几方面:
▸ 急性并发症
①糖尿病酮症酸中毒 (DKA)
发生率:2型糖尿病患者中约5-25%;
病理机制:胰岛素严重不足,脂肪分解增加,酮体生成过多;
临床表现:恶心、呕吐、腹痛、意识障碍;
死亡率:未治疗情况下可达5-10%。
②高血糖高渗状态 (HHS)
血糖通常>33.3 mmol/L,血浆渗透压>320 mOsm/kg;
脱水严重,可达体重的20-25%;
死亡率:10-50%。
③严重低血糖
血糖<2.8 mmol/L且伴有症状;
可导致认知功能损害、昏迷、死亡;
老年患者风险更高。
▸ 慢性微血管并发症
①糖尿病肾病
病理改变:肾小球基底膜增厚、系膜扩张、结节性硬化;
分子机制:高血糖激活蛋白激酶C,促进细胞外基质合成;
糖基化终末产物 (AGEs) 激活炎症反应;
肾素-血管紧张素系统激活;
患病率:30-40%的糖尿病患者发生肾病,是导致终末期肾病的主要原因。
②糖尿病视网膜病变
病理机制:视网膜毛细血管基底膜增厚;
周细胞丢失,血管通透性增加;
视网膜缺血,血管内皮生长因子 (VEGF) 释放;
新生血管形成,纤维增殖;
患病率:病程20年后约60%患者发生;
致盲率:糖尿病是工作年龄人群致盲的主要原因。
③糖尿病神经病变
远端对称性多发神经病变:
病理:轴突变性、脱髓鞘、神经纤维丢失;
症状:疼痛、麻木、感觉异常;
患病率:50-90%。
自主神经病变:
心血管自主神经病变:心率变异性降低,体位性低血压;
胃肠道自主神经病变:胃轻瘫,腹泻或便秘;
泌尿生殖系统病变:膀胱功能障碍,勃起功能障碍。
▸ 慢性大血管并发症
①冠心病
发病机制:动脉粥样硬化加速形成;
内皮功能障碍,一氧化氮生成减少;
血小板聚集性增加,凝血功能异常;
炎症反应激活,C反应蛋白升高;
发病风险:比非糖尿病患者高2-4倍;
预后:糖尿病患者心肌梗死后死亡率更高。
②脑血管病
缺血性脑卒中风险:增加2-3倍;
病理机制:大动脉粥样硬化、小血管病变、心源性栓塞;
认知障碍:血管性痴呆风险显著增加。
③外周动脉疾病
下肢动脉疾病:患病率15-20%。
糖尿病足:
发病机制:神经病变+血管病变+感染;
溃疡年发生率:2-10%;
截肢率:比非糖尿病患者高10-20倍。
▸ 代谢和内分泌影响
①脂代谢紊乱
糖尿病性血脂异常:甘油三酯升高(>1.7 mmol/L);
高密度脂蛋白胆固醇降低(<1.0 mmol/L男性,<1.3 mmol/L女性);
小而密的低密度脂蛋白增加。
非酒精性脂肪肝:患病率60-70%。
②电解质和酸碱平衡紊乱
高钾血症:肾功能不全时常见;
低钠血症:高血糖导致的稀释性低钠;
代谢性酸中毒:晚期肾病或酮症时。
▸ 免疫功能损害
①感染易感性增加
机制:中性粒细胞趋化性和吞噬功能下降;
细胞免疫功能减退;
组织愈合能力降低。
常见感染:
泌尿系统感染
皮肤软组织感染
肺部感染
真菌感染(如念珠菌病)
②疫苗应答减弱
流感疫苗、肺炎疫苗效果降低;
需要加强免疫策略。
▸ 心理和认知影响
①认知功能损害
2型糖尿病引起的脑血管病变、慢性炎症、胰岛素信号异常、高血糖毒性可能损害认知功能;
表现:执行功能、记忆力、注意力下降;
痴呆风险:增加1.5-2倍。
②心理健康问题
抑郁症:患病率25-30%,是一般人群的2倍;
焦虑障碍:患病率15-20%;
糖尿病痛苦:疾病管理负担导致的心理压力。
2型糖尿病是如何形成的?
葡萄糖通过食物和饮料进入人体,此时胰腺会分泌胰岛素激素帮助血液中的葡萄糖进入肌肉、脂肪和肝脏以提供能量。
▸ 胰岛素有助于控制正常血糖水平
胰岛素通过血液循环进入不同组织。组织大多数细胞表面有一种结构,叫胰岛素受体。当胰岛素流过时,会附着在胰岛素受体上,就像“钥匙打开锁”一样,糖可以进入细胞内,细胞获得能量维持正常运作,血液中糖分就会回落到正常水平。
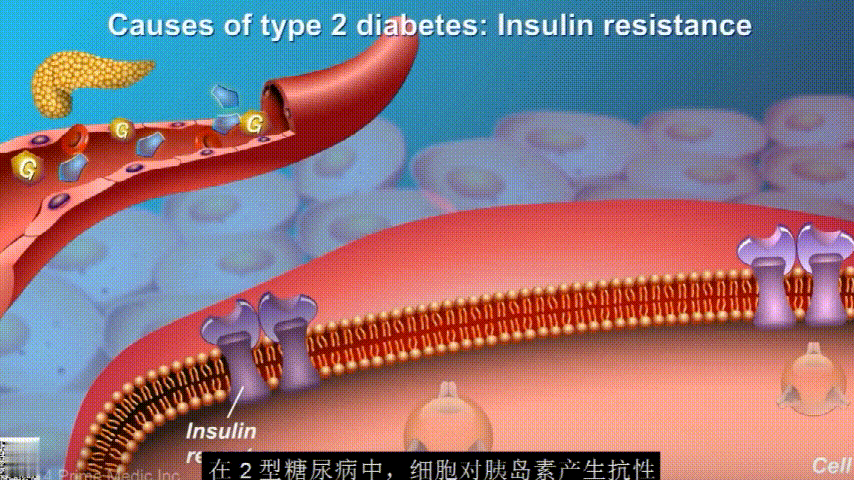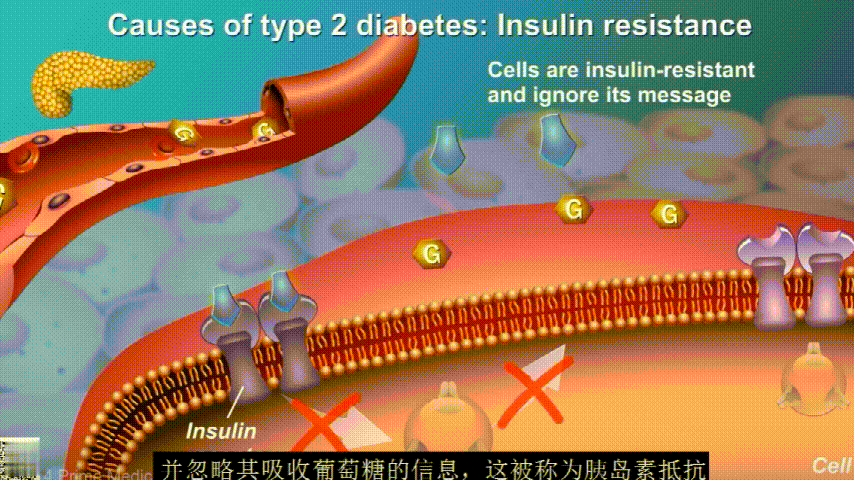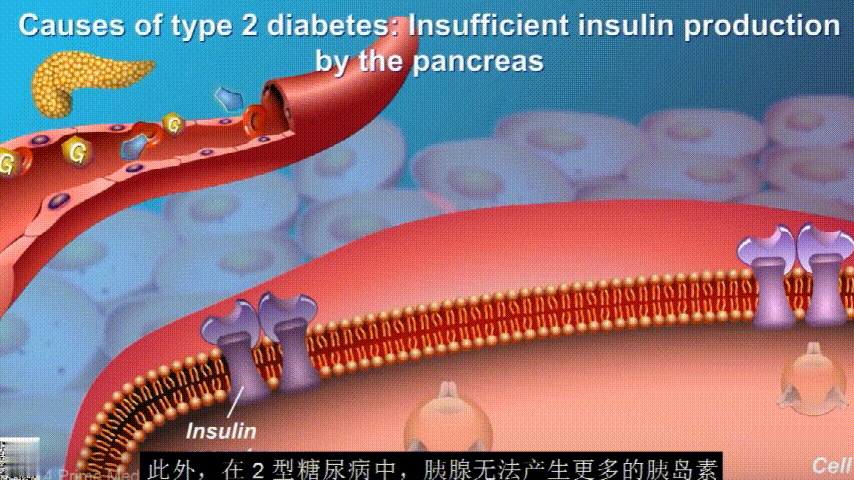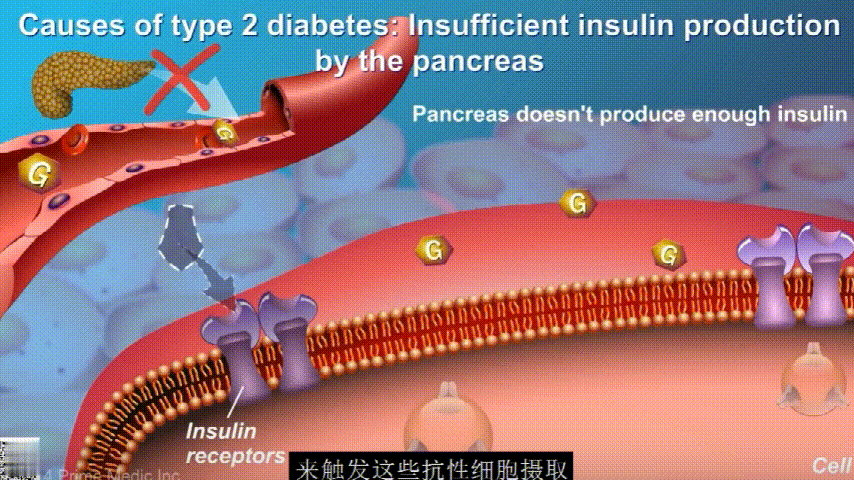
在2型糖尿病患者身上,细胞对胰岛素没有反应,这种情况就叫胰岛素抵抗。胰岛素没有了“钥匙”的作用,不能有效开启细胞上的“锁”,或者“锁”的数量也减少了,由此,糖分就不能进入细胞有效利用,被挡在了细胞外面,只好在血液中积累,血糖就升高了。
初期,胰腺会代偿性地分泌更多胰岛素来克服胰岛素抵抗。随着时间推移,胰腺功能逐渐衰竭,无法产生足够的胰岛素,2型糖尿病由此发生。
▸ 胰岛素抵抗的发生机制
细胞水平机制
胰岛素受体缺陷:受体数量减少或亲和力下降;
胰岛素受体底物-1 (IRS-1) 功能障碍:磷酸化异常,信号传导受阻;
PI3K-Akt通路受损:葡萄糖转运蛋白4 (GLUT4) 转位障碍;
线粒体功能异常:氧化磷酸化效率降低,ATP生成受限。
分子机制
蛋白激酶C (PKC) 激活:由二酰甘油 (DAG) 激活,抑制胰岛素信号;
c-Jun氨基末端激酶 (JNK) 激活:促进IRS-1丝氨酸磷酸化;
核因子κB (NF-κB) 激活:促进炎症因子释放;
过氧化物酶体增殖物激活受体γ (PPARγ) 功能减退。
▸ β细胞功能衰竭
早期阶段
β细胞代偿性增生:胰岛β细胞质量增加20-50%;
胰岛素分泌相位改变:第一相分泌减少,第二相延迟;
淀粉样蛋白沉积:胰岛淀粉样多肽 (IAPP) 在胰岛内沉积。
进展阶段
β细胞凋亡:氧化应激、内质网应激诱导细胞死亡;
β细胞去分化:失去成熟β细胞特征,分泌功能丧失;
胰岛纤维化:细胞外基质沉积,胰岛结构破坏。
▸ 遗传易感性
主要易感基因
TCF7L2:最强的2型糖尿病易感基因,影响胰岛素分泌;
PPARG:调节脂肪细胞分化和胰岛素敏感性;
KCNJ11和ABCC8:编码胰岛β细胞ATP敏感性钾通道;
IGF2BP2、CDKN2A/B、CDKAL1:影响β细胞功能。
遗传风险
一级亲属患病风险增加2-6倍;
同卵双胞胎一致性达90%;
不同种族遗传易感性存在差异。
▸ 环境和生活方式等因素
肥胖会增加患2型糖尿病的风险
内脏脂肪堆积:释放游离脂肪酸,诱发胰岛素抵抗;
脂肪因子异常:脂联素减少,瘦素抵抗,抵抗素增加;
慢性低度炎症:TNF-α、IL-6等促炎因子升高;
异位脂质沉积:肝脏、肌肉、胰腺脂肪浸润。
其他环境因素
久坐行为:肌肉胰岛素敏感性下降;
睡眠障碍:皮质醇分泌异常,葡萄糖稳态破坏;
慢性应激:下丘脑-垂体-肾上腺轴激活;
肠道菌群失调:短链脂肪酸减少,肠道屏障功能受损。(肠道菌群与2型糖尿病的关系将在后续章节详细描述,通过益生元和改善肠道微生物群可能成为治疗2型糖尿病的一种新方法)
研究表明,肠道菌群失调可通过影响葡萄糖代谢、胰岛素敏感性和炎症反应促进2型糖尿病(T2DM)的发生发展。
此外,肠道菌群还通过葡萄糖耐量受损和胰岛素抵抗等机制与肥胖、代谢综合征和2型糖尿病相关。最新荟萃分析显示,微生物群干预可显著改善空腹胰岛素和糖化血红蛋白水平,这两项均为2型糖尿病进展的关键指标。
2型糖尿病患者的肠道微生物群组成显示出明显的改变,提供了微生物分类群和相关代谢物之间的重要相关性,这些代谢物要么增加了对2型糖尿病发展的敏感性,要么防止了2型糖尿病的发展。
1
产丁酸盐细菌减少
具体而言,2型糖尿病(T2DM)患者表现出有益的产丁酸盐细菌减少,微生物多样性降低,包括普拉梭菌(Faecalibacterium prausnitzii)、罗氏菌属(Roseburia)和直肠真杆菌(Eubacterium rectale)。
丁酸盐是一种短链脂肪酸(SCFA),在调节食欲、体重和胰岛素抵抗方面起着关键作用。此外,在糖尿病患者中,另一种丁酸盐生产梭菌的减少已有记录。
• 与葡萄糖代谢相关的青春双歧杆菌等有益菌群减少
此外,2型糖尿病患者中另一种有益细菌Anaerostipes hadrus含量降低,这种减少与葡萄糖代谢受损和胰岛素抵抗增加有关。研究还显示,直肠真杆菌水平下降与加重胰岛素抵抗的菌群失调有关。
瘤胃球菌(Ruminococcus bromii)对葡萄糖代谢至关重要,但在糖尿病患者(尤其是慢性胰腺炎患者)中含量较低。2型糖尿病患者的青春双歧杆菌(Bifidobacterium adolescentis)和克里斯滕斯菌科(Christensenellaceae)水平均降低,后者与糖化血红蛋白水平呈负相关。糖尿病前期个体的梭菌显著减少,其降低与血糖水平、胰岛素抵抗和炎症反应改善相关。
2
对血糖有积极影响的菌群减少
放线菌门中的双歧杆菌与较低的2型糖尿病风险相关,厌氧菌门对空腹血糖有积极影响。其他研究表明,2型糖尿病患者的肠道拟杆菌(Bacteroides intestinalis)、拟杆菌(Bacteroides)和普通拟杆菌(Bacteroides vulgatus)水平降低。
早期研究显示,2型糖尿病患者的梭状芽胞杆菌和厚壁菌门水平显著下降,新诊断患者中球囊梭菌(Clostridium coccoides)和柔嫩梭菌属(Clostridium leptum)水平尤其降低。
青春双歧杆菌(Bifidobacterium adolescentis)和Bifidobacterium angulatum有助于改善血糖控制,Oscillospiraceae水平升高与胰岛素抵抗改善相关。巨单胞菌高水平与正常葡萄糖耐量相关。
• 双歧杆菌减少
双歧杆菌属具有显著的健康益处,包括改善肠道通透性,从而降低内毒素的循环水平并减少全身炎症。这与改善宿主的糖耐量和葡萄糖诱导的胰岛素分泌,并减少炎症有关。
• Akkermansia菌减少
Akkermansia muciniphila和Faecali prausnitzii这两种菌为2型糖尿病的发展提供了保护。
Akkermansia菌在维持粘蛋白层完整性和减少炎症方面发挥关键作用。粘蛋白作为高度糖基化的大分子蛋白质参与胃肠道保护,减少细菌移位,改善脂肪储存、脂肪组织代谢和葡萄糖稳态。
• Faecali prausnitzii 减少
2型糖尿病的Faecali prausnitzii丰度降低,而糖尿病治疗可导致了Faecali prausnitzii丰度的增加、全身炎症的二次减少和胰岛素抵抗的改善。
3
与糖尿病风险增加相关的有害菌丰度升高
临床前和临床试验的系统评价显示,双歧杆菌、拟杆菌、粪杆菌、阿克曼氏菌和罗氏菌属与2型糖尿病发展呈负相关,有助于改善代谢和肠道健康。相反,瘤胃球菌属、梭杆菌属和经黏液真杆菌属(Blautia)与糖尿病风险增加相关。
• 扭链瘤胃球菌与胰岛素抵抗和高血糖相关
并且2型糖尿病患者中潜在有害细菌显著增加,例如埃希氏菌和普雷沃氏菌。还观察到糖尿病患者变形菌门的显著增加。在T2DM 患者中经常观察到更高水平的 Collinsella,尤其是 Collinsella aerofaciens。此外,扭链瘤胃球菌(Ruminococcus torques)与胰岛素抵抗和高血糖有关,在减重手术和糖尿病缓解后水平下降。
2型糖尿病患者中高丰度的特定菌属还包括:Blautia、Coprococcus、Sporobacter、Abiotrophia、Peptostreptococcus、Parasutterella、Collinsella。
4
平衡的肠道菌群对改善2型糖尿病有益
• 双歧杆菌可能有助于改善2型糖尿病
多种双歧杆菌,包括青春双歧杆菌、两歧双歧杆菌、假链双歧杆菌、长双歧杆菌和齿双歧杆菌,与2型糖尿病呈负相关,尤其是在接受二甲双胍治疗的患者中。
产丁酸细菌如柔嫩梭菌属(Clostridium leptum)与糖化血红蛋白和空腹血糖呈负相关。2型糖尿病患者厚壁菌门水平普遍升高,但在糖尿病模型中与空腹血糖呈负相关。
• 阴沟肠杆菌与葡萄糖耐量受损相关
在2型糖尿病中观察到Desulfovibrio和Odoribacter水平升高。肥胖和糖尿病患者丹毒丝菌科(Erysipelotrichaceae)丰度较高,阴沟肠杆菌与葡萄糖耐量受损相关。
同时糖尿病患者免疫功能受损增加肺炎克雷伯菌感染风险。代谢综合征患者Odoribacter水平升高,产气荚膜梭菌可致糖尿病患者肝脓肿,体现其机会致病特性。
• 平衡的肠道菌群益于葡萄糖代谢和降低并发症
另一方面,平衡的肠道微生物群(共生状态)与2型糖尿病患者葡萄糖代谢改善和胰岛素敏感性增加相关。此外,共生状态有助于预防与2型糖尿病(T2DM)相关的并发症,因为健康的肠道微生物群可以降低糖尿病并发症的风险,如视网膜病变、肾病和其他相关疾病。
益生元选择性地刺激有益细菌的生长,增强微生物多样性。它们不会促进有害细菌,但可以影响某些细菌种类的生长,有时可能与在糖尿病等疾病中观察到的微生物变化重叠。
如上所述,某些细菌类型在糖尿病患者中可能更丰富。而服用益生元为2型糖尿病提供了双重好处,促进共生,同时改善血糖指数。
要被归类为益生元,食品成分必须满足特定标准:它必须抵抗胃酸,避免被消化酶水解,并能被胃肠道菌群发酵代谢,并增加促进健康的肠道细菌的丰度。
益生元本质上是不可消化的食物基质,绕过人体消化,最终到达肠道,为肠道微生物群提供能量来源。这种关系是共生的,因为益生元促进有益肠道微生物群的生长,如乳酸杆菌、阿克曼菌、双歧杆菌、粪杆菌和罗氏菌属,这有助于缓解与2型糖尿病相关的代谢过程。
碳水化合物被认为是最有效的益生元,可按分子大小或聚合程度分类。不可消化碳水化合物、特定蛋白质肽段及某些脂质也被确定为潜在益生元成分。菊粉、低聚果糖、低聚半乳糖、抗性淀粉、果胶低聚糖、β-葡聚糖、多酚和石斛属等益生元已被证实可通过优化肠道微生物组成对2型糖尿病患者血糖控制产生治疗作用。下面将讲述这些益生元的功能特性及其对肠道微生物组成和血糖指数的影响。
1
菊粉
菊粉是一种水溶性储存多糖,存在于36000多种植物中,属于果聚糖类不可消化碳水化合物。作为分类益生元,菊粉天然存在于多种食物中,建议每日摄入量为2-12克。
建议每天摄入菊粉量和最丰富的食物来源
Iatcu OC,et al.Nutrients.2024
菊粉表现出显著的益生元特性,长链菊粉型果聚糖对发酵活性和细菌群落组成的影响更强。菊粉的药理特性使其成为各种食品类别的多功能成分。它作为一种低热量甜味剂和不易消化的纤维,有助于提高食品的粘度、形成凝胶并改善食品的感官特性。菊粉能开发出具有理想质地和感官品质的低脂肉类和家禽产品,其脂肪替代和质地改性特性适用于各种食品。
注:菊粉广泛用于肉制品、乳制品、酱汁和糖果的脂肪替代品,还作为食品添加剂应用于面包、烘焙产品、乳制品、糖果和婴儿食品中,在食品工业中发挥重要作用。
• 菊粉对治疗2型糖尿病具有益处
多项研究表明菊粉对2型糖尿病的潜在益处。一项涉及49名BMI为25-35 kg/m²的2型糖尿病女性研究显示,每日服用10g菊粉2个月可降低空腹血糖和糖化血红蛋白水平,同时增加总抗氧化能力。
另一项52名2型糖尿病女性患者研究表明,补充10g富含低聚果糖的菊粉8周同样可降低空腹血糖和糖化血红蛋白水平。
• 菊粉改善了糖尿病患者的胰岛素敏感性
双盲交叉研究发现,糖尿病前期患者每日服用30g菊粉2周可改善胰岛素敏感性。每日补充15g菊粉6个月可降低糖尿病前期患者空腹胰岛素水平并改善胰岛素抵抗。
然而,一项随机双盲试验报告每日摄入10g菊粉12周对2型糖尿病患者胆固醇、血糖或糖化血红蛋白无显著影响。尽管如此,大量证据支持菊粉作为2型糖尿病治疗选择的潜力。
• 菊粉增加抗炎细菌丰度,改善厚壁菌门/拟杆菌门比率
关于肠道微生物群影响,糖尿病前期患者每日服用15g菊粉6个月可增加放线菌、双歧杆菌、乳酸菌等相对丰度,同时降低另枝菌属(Alistipes)丰度。
健康成人每日服用5-7.5g龙舌兰菊粉21天后,放线菌门和双歧杆菌丰度增加,脱硫弧菌丰度降低。双歧杆菌作用与较高粪便短链脂肪酸浓度相关,可能对2型糖尿病产生有益影响。
小鼠模型显示菊粉补充剂通过调节肠道神经胶质细胞产生显著抗炎作用,改善厚壁菌门/拟杆菌门比率。丁酸盐水平升高可抑制NF-κB通路,降低促炎因子表达。人体研究证实菊粉的抗炎益处,60例糖尿病患者补充菊粉后TLR4、NF-κB和IL-1表达降低。
• 菊粉可改善胰岛素抵抗
菊粉还被证明可以改善胰岛素抵抗的标志物,包括特定基因和胰岛素受体底物的表达。在一项针对67例2型糖尿病患者的纵向研究中,每日补充10g菊粉2个月可降低INS基因甲基化。有趣的是,据报道,胰岛细胞的胰岛素启动子中含有 INS 基因甲基化,这进一步揭示了菊粉干预人类后表观遗传修饰的作用。
此外,在小鼠模型中,菊苣菊粉补充8周后,IRS-1和MAPK信号通路受到影响。该研究表明,IRS活性上调并抑制丝裂原活化蛋白激酶(MAPK)通路,该通路对T2DM发病机制和糖尿病肾病等并发症有重大影响。
最后,在一项针对60名2型糖尿病患者的研究中,补充菊粉与丁酸盐联合使用,改善了血糖标志物、血脂谱和GLP-1分泌。
总体而言,有大量证据支持菊粉在改善血糖指数、减轻2型糖尿病发病机制相关分子过程和增强肠道微生物组成方面具有作用。
2
抗性淀粉
抗性淀粉在碳水化合物中具有独特特性,能抵抗小肠内源性淀粉酶消化,到达大肠作为肠道细菌营养。这一特性使抗性淀粉被归类为膳食纤维,具有多种潜在健康益处。抗性淀粉分为五种类型,天然存在于全谷物、豆类、煮熟冷却的马铃薯、大米和未成熟香蕉等食物中。
抗性淀粉包括物理难接近淀粉(RS1)、酶抗性淀粉(RS2)、逆降解淀粉(RS3)和化学改性淀粉(RS4),对人体葡萄糖反应影响不同。
抗性淀粉可通过发酵、挤压和化学处理等加工技术生产和改性,增强其结构、发酵特性和抗消化性。建议每日摄入量为10-15克。由于热量低,抗性淀粉适合添加到纤维和膨化谷物、零食、意大利面和烘焙食品中,不会显著增加卡路里。此外,它还能改善食品质地、稠度和稳定性。
建议每天摄入抗性淀粉量和最丰富的食物来源
Iatcu OC,et al.Nutrients.2024
• 补充抗性淀粉有助于血糖水平下降
2023年荟萃分析显示,2型糖尿病或糖尿病前期患者补充1型和2型抗性淀粉后餐后血糖降低,RS2的餐后胰岛素反应减少。另一荟萃分析发现,健康个体和糖尿病患者补充抗性淀粉后空腹胰岛素、HOMA-B、糖化血红蛋白降低,HOMA-S增加,糖尿病患者空腹血糖水平下降。
2020年的荟萃分析也表明,补充抗性淀粉可降低空腹血糖,摄入量超过28g/d或干预超过8周时改善更显著。
• 抗性淀粉具有抗炎抗氧化特性从而改善血糖
抗性淀粉改善血糖控制的机制涉及其抗氧化和抗炎特性。一项meta分析纳入了16项试验和706例2型糖尿病患者,结果显示,总抗氧化能力增加,炎症标志物(如CRP、IL-6和TNF浓度)降低。
这些发现一致强调了抗性淀粉在控制T2DM患者血糖水平和减少炎症方面的好处。除了这些荟萃分析外,个别临床试验还提供了强有力的证据,支持将抗性淀粉纳入2型糖尿病患者的饮食中,从而更详细地了解与食用相关的代谢改善。
例如,在60例T2DM女性患者中,补充10g/天的RS2持续8周,导致HgbA1c降低,甘油三酯降低,促炎性TNF-α减少,同时血清HDL水平升高。在另一项针对T2DM患者的研究中,补充RS2显示出对餐后GLP-1的有益影响,从而改善餐后胰岛素反应。
• 抗性淀粉饮食增加了罗氏菌属、阿克曼菌等
关于肠道菌群影响,富含抗性淀粉的饮食增加厚壁菌门与拟杆菌门比例,胰岛素敏感性低的个体中普拉梭菌、普雷沃氏菌科、瘤胃球菌、直肠真杆菌、罗氏菌属和嗜粘蛋白阿克曼菌增加。
不同类型抗性淀粉会引起不同反应:RS4可能促进拟杆菌门,RS2有利于厚壁菌门。研究显示,食用含RS4饼干的参与者放线菌门和拟杆菌门增加,厚壁菌门减少;食用含RS2饼干的个体瘤胃球菌和直肠真杆菌增加。但两种类型的抗性淀粉都与梭菌状芽胞杆菌比例的增加有关。
3
低聚果糖
低聚果糖(FOS)广泛用于生产功能性和低热量食品,作为甜味剂和生物防腐剂,以益生元作用著称。建议每日摄入量为12.5-20g,天然存在于洋葱、菊苣、大蒜、香蕉和朝鲜蓟等植物中。
建议每天摄入低聚果糖量和最丰富的食物来源
Iatcu OC,et al.Nutrients.2024
• 补充低聚果糖增加了双歧杆菌丰度,但会因年龄而异
与其他益生元结合使用时,低聚果糖显示出更好的代谢控制。与多酚类配对时,联合益生元效应可改善胰腺β细胞功能,降低肝脏胰岛素抵抗和低密度脂蛋白胆固醇水平,肠道菌群也发生显著变化,双歧杆菌属增加4倍,真杆菌属增加2倍。
2022年荟萃分析显示,低聚果糖给药后双歧杆菌浓度增加(每日7.5-15g,持续4周以上),乳杆菌属或肠杆菌科无显著变化。低聚果糖对肠道菌群的影响因年龄而异,成人和老年人Odoribacter显著减少,所有年龄组嗜胆菌属和毛螺菌属减少,年轻人和成人颤螺菌属(Oscillospira)减少。
• 低聚果糖对GLP-1分泌的影响还未确定
分子水平上,低聚果糖在小鼠模型中对肠促胰岛素激素(如GLP-1)分泌有积极影响。在2型糖尿病模型中,低聚果糖减轻肠道L细胞凋亡,增强GLP-1分泌。含低聚果糖饼干可在体外增加GLP-1浓度并降低血糖。
然而,人类急性摄入低聚果糖未产生类似结果,肠道激素水平或饱腹感无显著变化。富含低聚果糖的糖浆也不会显著改变餐后生长素释放肽或GLP-1水平。
4
低聚半乳糖
低聚半乳糖是天然功能性低聚糖,也是牛奶中的关键活性成分和广泛使用的益生元。它存在于α-低聚半乳糖和β-低聚半乳糖两种亚型,通过特定半乳糖键区分。
低聚半乳糖因双重功能在食品生产中受到关注:既能改善加工食品的感官品质(如味道、质地和稳定性),又能通过选择性刺激双歧杆菌和乳酸杆菌生长促进肠道健康。建议每日摄入量为2-20克。
建议每天摄入低聚半乳糖量和最丰富的食物来源
Iatcu OC,et al.Nutrients.2024
• 低聚半乳糖可能影响空腹胰岛素和血糖水平
关于低聚半乳糖对空腹胰岛素和血糖水平的影响,研究结果不一致,类似于低聚果糖。一项超重个体研究显示,每日补充5.5g低聚半乳糖84天后空腹胰岛素显著降低,同时总胆固醇、甘油三酯和炎症标志物(如CRP)也降低。
相反,另一项针对2型糖尿病患者的相同剂量和持续时间研究未观察到空腹血糖、糖化血红蛋白或空腹胰岛素水平的显著变化。荷兰一项针对超重或肥胖个体每日摄入15g低聚半乳糖84天的研究也未报告空腹血糖、胰岛素、肠道激素或炎症标志物的显著变化。
• 补充低聚半乳糖后双歧杆菌等有益菌丰度增加
虽然空腹胰岛素和血糖结果不一致,但低聚半乳糖对肠道微生物群的影响显示出更一致的结果。小鼠研究表明补充低聚半乳糖后双歧杆菌水平增加。人类研究同样显示低聚半乳糖增加双歧杆菌科,12周研究发现粪便双歧杆菌增加5倍。最近一项涉及53名糖尿病前期个体的研究显示,补充低聚半乳糖和短双歧杆菌12周后,糖化血红蛋白和空腹血糖显著降低。
除了增加双歧杆菌外,低聚半乳糖补充剂还与肠道微生物组成的其他有益变化有关。例如,在一项针对溃疡性结肠炎患者的研究中,每天服用2.8g低聚半乳糖,双歧杆菌属和克里斯滕森氏菌的丰度增加。还报道了几种有益细菌种类的增加,包括长双歧杆菌、青春双歧杆菌、乳酸菌科和瘤胃球菌属,以及补充低聚半乳糖后梭状芽胞杆菌、丹毒丝菌科、Odoribacteraceae和颤螺菌科(Oscillospiraceae)的减少。
总体而言,虽然低聚半乳糖在改善2型糖尿病血糖指数方面的功效仍无定论,但其对肠道微生物群的积极影响已得到充分证明。数据表明,与益生菌或其他有益剂结合使用时,低聚半乳糖可能增强疗效,尽管单独补充可能不会显著改变血糖结果。
5
果胶低聚糖
果胶是高等植物细胞壁中的必需多糖,对维持植物组织刚性和结构至关重要。水果和蔬菜中果胶含量为0.1%-2.5%,建议每日摄入30克可减少餐后血糖反应、维持正常胆固醇水平和增加饱腹感,从而减少热量摄入。
注:果胶含量因来源而异:橄榄渣34.4%,柑橘废料30%,洋葱皮27-34%,苹果浆20.9%,甜菜浆16.2%。果胶也是果胶低聚糖(POS)的来源,建议每日摄入10-20克,提供益生元益处并支持肠道健康。
• 果胶通过提高胰岛素敏感性等机制抗糖尿病
多项研究证实果胶的抗糖尿病特性。红辣椒果实提取的果胶可显著提高胰岛素敏感性并降低血糖水平。在含106g碳水化合物的膳食中添加16g瓜尔豆和10g果胶可显著降低胰岛素依赖型和非胰岛素依赖型糖尿病患者的餐后血糖和胰岛素水平。
健康成年人在含碳水化合物膳食中摄入10g果胶也可降低餐后血糖。一项涉及43名2型糖尿病志愿者的研究显示,补充果胶后空腹血糖和糖化血红蛋白水平显著降低,HOMA-IR指数降低表明胰岛素抵抗改善。
果胶还可以在胃肠道形成凝胶,减缓胃排空并减少葡萄糖吸收,调节血糖水平并增加饱腹感;对脂质代谢有积极影响,降低胆固醇水平;具有抗炎作用,可能通过减少炎症标志物改善整体代谢健康。
• 果胶促进有益菌生长并产生短链脂肪酸
果胶调节肠道菌群的能力是另一个关键因素,因为它促进有益细菌的生长,从而改善代谢健康和胰岛素敏感性。果胶经过缓慢发酵,并通过产生短链脂肪酸(SCFA)表现出益生元作用。
果胶低聚糖(POS)已显示出促进双歧杆菌的潜力,并提供各种健康益处,包括抗肥胖、抗癌和抗氧化特性。POS代表了一类新的益生元,它通过肠道微生物群的发酵产生SCFA。一项研究表明,甜菜中的POS具有最高的双歧杆菌生成促进作用和最高的SCFA浓度,而柑橘皮中的 POS 增加了乳酸菌种群。
2型糖尿病中响应益生元的肠道微生物组成变化
Iatcu OC,et al.Nutrients.2024
6
多酚类
酚类化合物是源自植物的具有生物活性的次生代谢产物,在蔬菜、水果、全谷物和其他植物来源中含量丰富。这些化合物因其抗炎、抗氧化和代谢调节特性而受到关注。每日定期摄入约1-2克多酚与预防慢性疾病相关,每日摄入超过650毫克可显著降低死亡风险。
• 酚类化合物具有控制糖尿病的潜力
膳食酚类化合物(如类黄酮、香豆素、醌、二苯乙烯和姜黄素类化合物)控制糖尿病的潜力受到关注。酚类已被证明能增强胰岛素分泌,调节血糖水平,并可能通过影响复杂分子过程帮助预防糖尿病相关并发症。
杨梅提取物通过增强肝细胞葡萄糖摄取和提高谷胱甘肽水平显示降糖活性。苹果多酚可刺激葡萄糖吸收,改善线粒体功能,减少氧化应激。牛至、黑莓提取物、白桑葚和发芽藜麦酸奶也显示出降血糖、抗氧化和抗炎作用。
• 2型糖尿病患者服用多酚后餐后血糖降低
临床试验进一步证实多酚的抗糖尿病潜力。一项涉及25名糖尿病风险男性的研究发现,早餐时食用250毫升芙蓉提取物可降低血糖、胰岛素、甘油三酯和C反应蛋白。
2型糖尿病患者每日两次补充160毫克纯化花青素24周后,低密度脂蛋白胆固醇、甘油三酯、空腹血糖和胰岛素抵抗降低,高密度脂蛋白胆固醇和抗氧化能力增加。对口服降糖药无反应的2型糖尿病患者每8小时补充350毫克越橘提取物2个月后,空腹血糖、餐后血糖和糖化血红蛋白显著降低,对肝肾功能无不良影响。
• 多酚可增加乳酸杆菌和双歧杆菌
生物活性酚类化合物,包括类黄酮和非类黄酮,在胃和小肠中部分吸收,其余部分到达大肠。在那里,它们要么被肠道微生物群利用以发挥益生元作用,要么转化为活性代谢物。大约90-95%的食用酚不会立即被吸收,而是到达大肠,在那里它们对人类健康起着保护作用。
各种研究表明,多酚可增加有益肠道细菌(如乳酸杆菌和双歧杆菌)的丰度,同时调节其他微生物群,包括拟杆菌、梭状芽胞杆菌和普拉梭菌。肠道微生物群的这些变化可能有助于酚类化合物的抗糖尿病、抗氧化和抗炎作用,进一步支持它们在代谢健康中的作用。
7
β-葡聚糖
β-葡聚糖是主要存在于燕麦和大麦中的可溶性膳食纤维,因其在糖尿病控制方面的健康益处而受到认可。这些化合物天然存在于植物细胞壁、谷物种子以及某些真菌、酵母、藻类和细菌中,高度集中在燕麦和大麦胚乳细胞壁中,占其含量的75%,在麸皮中占10.4%。
注:燕麦和大麦在谷物中β-葡聚糖浓度最高,燕麦每100克干重含3-8克(溶解度82%),大麦含2-20克(溶解度65%)。
• β-葡聚糖改善血糖控制,增加胰岛素敏感性
研究表明,β-葡聚糖可显著改善血糖控制,增加胰岛素敏感性,降低胆固醇水平。其主要作用机制是增加肠道粘度,减慢碳水化合物吸收,调节餐后血糖水平,防止血糖急剧飙升。
β-葡聚糖能在低浓度(1%)下形成高粘度溶液,在各种pH值下都具有稳定性,优于其他可溶性纤维。每日摄入约3克β-葡聚糖可显著改善2型糖尿病患者血糖控制,降低胰岛素抵抗,并与较低的糖化血红蛋白水平相关。
除改善血糖控制外,β-葡聚糖还对脂质代谢产生积极影响,有助于降低糖尿病患者心血管风险。它们通过与胆汁酸结合、促进胆汁排泄和减少肠道胆固醇吸收来降低总胆固醇和低密度脂蛋白胆固醇水平。这种降脂作用与其增加肠道粘度的能力相关,结合葡萄糖、胆汁酸和胆固醇,增强粪便排泄。β-葡聚糖通过肠道菌群发酵刺激短链脂肪酸产生,调节GLP-1和PYY等激素,增加胰岛素分泌并增强饱腹感。
• β-葡聚糖可增加肠道中阿克曼菌等产丁酸菌
β-葡聚糖发酵促进肠道菌群健康变化。糖尿病动物模型研究显示,酵母β-葡聚糖和面包酵母β-葡聚糖给药后阿克曼氏菌增加。燕麦β-葡聚糖增加梭菌和丁酸球菌,减少拟杆菌属、乳酸菌属、颤螺菌属和瘤胃球菌属。肥胖动物研究报道,大麦β-葡聚糖给药后双歧杆菌、拟杆菌属、乳酸菌属和Atopobium增加。
谷物β-葡聚糖对调节肠道微生物群的影响已得到广泛研究。有代谢综合征风险的患者食用富含β-葡聚糖的大麦粉面包后,双歧杆菌属和阿克曼菌属数量增加。动物研究表明,低分子量β-葡聚糖增加双歧杆菌和拟杆菌数量,促进短链脂肪酸(特别是乙酸盐和丁酸盐)产生。食用全麦大麦意大利面后,人罗氏菌属和瘤胃球菌属增加,梭菌门和厚壁菌门减少。
8
铁皮石斛
近年来,石斛属因其显著的益生元特性而受到关注,特别是在2型糖尿病动物模型中。它具有减少慢性炎症、防止胰腺β细胞功能障碍、刺激GLP-1分泌以及通过增强微生物多样性上调短链脂肪酸浓度等显著益处。这些作用改善多种代谢参数,包括葡萄糖耐量、胰岛素抵抗和血脂水平。
• 上调短链脂肪酸产生并改善胰岛素分泌
在糖尿病前期小鼠模型中,铁皮石斛通过调节炎症、修复胰岛损伤、增加肠促胰岛素释放和改善胰岛素分泌发挥作用,特别是通过减少脂多糖介导的TLR4激活。
补充铁皮石斛增加了Roseburia、Alloprevotella、拟杆菌、双歧杆菌和乳酸杆菌的相对丰度,同时上调短链脂肪酸产生和肠道GPR43表达。另一项研究发现类似的抗炎作用,铁皮石斛通过增加Allobaculum、双歧杆菌和乳酸杆菌丰度来增强代谢参数,通过下调LPS/TLR-4通路减少炎症,并加强肠道屏障。
• 铁皮石斛调节信号通路促进血糖控制
铁皮石斛多糖通过减少肝脏糖异生酶和调节AMP-PKA和Akt等信号通路促进血糖控制。在评估2型糖尿病小鼠模型脂质代谢的研究中,石斛补充剂通过激活PPAR信号通路改善肝功能,导致血脂水平降低和胰岛素敏感性提高。类似研究报道,石斛治疗4周后PPARγ激活导致炎症减轻。
尽管尚未在2型糖尿病患者中进行随机临床试验,但动物模型的有希望证据表明,石斛属的益生元作用可能需要进一步研究作为血糖控制的辅助治疗。
益生元和肠道菌群可以通过多种机制改善血糖参数,包括将食品发酵成生物活性短链脂肪酸 (SCFA)、减少炎症、增加降血糖激素水平、增强脂质代谢和提高抗氧化酶活性。
这些分子因素和途径的相互作用有助于2型糖尿病患者通过食用益生元改善健康状况。这些机制将在以下小节中具体讲述。
益生元对2型糖尿病患者血糖指数的影响
Iatcu OC,et al.Nutrients.2024
1
通过产生短链脂肪酸改善血糖指数
益生元主要由可溶性纤维组成,由肠道微生物群通过一系列反应发酵,产生短链脂肪酸(SCFA),即乙酸盐、丙酸盐和丁酸盐。
• 短链脂肪酸增强葡萄糖摄取,提高胰岛素敏感性
短链脂肪酸(特别是丁酸盐)作为结肠细胞关键能量来源,具有多种益处。研究表明,定期摄入纤维与人类短链脂肪酸浓度增加约4倍相关。各种益生元在微生物群组成和短链脂肪酸产生方面表现出相似反应。短链脂肪酸通过激活G蛋白偶联受体(GPR41/GPR43)和启动细胞能量稳态信号通路增强外周组织葡萄糖摄取,对提高胰岛素敏感性至关重要。
例如,小鼠模型中益生元纤维缺乏与GPR41和GPR43信号传导减少相关,导致心脏代谢健康状况下降。益生元补充剂通过增加产生短链脂肪酸的肠道微生物群,增强肝脏AMP活化蛋白激酶信号传导,从而降低胰岛素抵抗。AMPK激活通过促进葡萄糖和脂肪酸氧化、增强摄取、抑制脂肪合成和减少糖异生等能量消耗过程来提高胰岛素敏感性。丙酸盐通过GPR43/AMPK通路抑制肝脏糖异生,GPR43激活导致肝细胞钙依赖性AMPK激活,减少糖异生。
• 增加短链脂肪酸产生菌丰度并释放肠促胰素
此外,益生元通过增加短链脂肪酸产生和促进产生短链脂肪酸的细菌来增强抗炎作用、抗氧化特性、脂质代谢和肠促胰岛素激素释放。膳食纤维摄入通过增加短链脂肪酸产生改善2型糖尿病相关的各种参数,包括炎症、血脂水平和早期饱腹感。
2
抗炎作用改善血糖控制
2型糖尿病的特征是低度炎症,由脂肪组织释放促炎细胞因子、巨噬细胞浸润和有害肠道微生物及其代谢物驱动。这种炎症在临床上通常与C反应蛋白水平升高相关。
益生元干预措施的荟萃分析表明,2型糖尿病患者使用益生元后C反应蛋白水平显著降低,循环肿瘤坏死因子-α减少,抗氧化酶活性改善。另一项纳入27项研究的荟萃分析显示,抗性淀粉、抗性糊精和低聚果糖等益生元具有显著的降糖和抗炎益处。其中19项研究报告血糖指标改善,包括糖化血红蛋白、HOMA-IR评分和血糖,许多研究还显示抗炎作用增强。
• 益生元与肠道菌群通过抗炎作用改善2型糖尿病
脂多糖是革兰氏阴性菌外膜组成部分,通过与Toll样受体4结合,触发全身性促炎细胞因子释放,起到有效的炎症刺激作用。这些细胞因子(特别在脂肪组织和肝脏中)通过干扰胰岛素信号通路导致胰岛素抵抗。
白细胞介素-6和肿瘤坏死因子-α等细胞因子激活磷酸化胰岛素受体底物1的激酶,损害胰岛素信号传导。白细胞介素-6诱导细胞因子信号传导抑制因子3表达,降解胰岛素受体底物1,进一步恶化胰岛素抵抗。此外,白细胞介素激活核因子κβ,刺激细胞因子释放并产生反馈回路,加剧血糖失调。
肠道菌群和益生元通过发挥抗炎作用抵消这些炎症过程。多糖补充已被证明可减少2型糖尿病中脂多糖泄漏和代谢炎症。从机制上讲,益生元上调紧密连接蛋白,改善肠道屏障完整性,减轻脂多糖和核因子κβ介导的炎症损伤和氧化应激。
同时,有益的产生短链脂肪酸的双歧杆菌和乳酸杆菌种群增加两倍,有害的幽门螺杆菌种类受到抑制。研究表明,在脂多糖刺激的炎症细胞中进行短链脂肪酸治疗可降低血糖正常和控制不佳的2型糖尿病个体的肿瘤坏死因子-α和干扰素-γ。
注:异麦芽糖糊精是另一种潜在益生元,可抑制肿瘤坏死因子-α和白细胞介素-6,通过抑制脂肪组织中巨噬细胞浸润和恢复胰岛素受体底物1表达来调节免疫反应。它还提高拟杆菌-普雷沃氏菌浓度,改善微生物多样性,提高胰岛素敏感性。
总体而言,炎症是导致血糖控制不佳的重要因素,益生元和肠道菌群在减轻与2型糖尿病发作相关的炎症信号通路方面起着至关重要的作用。
3
影响激素水平从而调节血糖
肠促胰岛素激素(如胰高血糖素样肽1和胃抑制多肽)是众所周知的餐后胰岛素分泌增强剂,是目前流行的改善代谢健康的药物。
益生元摄入可通过改变肠道菌群组成及其代谢物自然刺激胰高血糖素样肽1、肽YY和胃抑制多肽的释放。例如,服用益生元2周与标准化膳食后血浆胰高血糖素样肽1和肽YY浓度升高及餐后血糖水平降低显著相关。
• 胰高血糖素样肽1和肽YY分泌增加
通过益生元增强胰高血糖素样肽1释放可部分归因于短链脂肪酸浓度增加。短链脂肪酸与分泌胰高血糖素样肽1的L细胞上的GPR41和GPR43受体结合,通过Gq信号传导促进胞质钙释放,刺激胰高血糖素样肽1分泌。低聚果糖和菊粉等益生元通过上调GPR43受体表达和增加结肠中分泌胰高血糖素样肽1的L细胞数量来促进这些作用。
例如康普茶作为富含多酚和益生元的茶,通过增加产生短链脂肪酸的细菌(如丁酸球菌、乳酸菌和毛螺菌科)水平来促进胰高血糖素样肽1和肽YY释放,对胰岛β细胞功能显示出有益作用。干预4周后,还观察到血糖控制的其他标志物改善,包括脂多糖水平降低、肠道屏障完整性改善,以及有害细菌属(如脱硫弧菌、大肠杆菌和志贺氏菌)减少。
总体而言,有强有力的证据支持益生元介导的肠促胰岛素激素释放增加,有助于改善血糖控制。
4
改善血脂水平进而增强血糖控制
益生元补充剂的另一个重要结果是改善血脂水平,从而直接或间接增强血糖控制。与其他有益机制类似,益生元通过促进产生短链脂肪酸的有益肠道微生物群生长来实现更好的脂质调节。
• 抑制肝脏胆固醇合成、减少异位脂肪沉积
丙酸盐通过下调参与胆固醇产生的关键酶(如乙酰辅酶A羧化酶和脂肪酸合酶)来抑制肝脏胆固醇合成,减少甘油三酯形成,降低极低密度脂蛋白分泌。
丁酸盐促进脂肪酸氧化,减少肝脏、肌肉和脂肪组织中的脂质积累。血糖控制改善主要由于异位脂肪沉积减少,因为无法抑制脂肪分解是导致2型糖尿病患者胰岛素抵抗的重要因素。
这些代谢益处通常同时发生,补充β-葡聚糖的益生元已被证明可减少胰岛素抵抗(AMPK信号传导)和脂肪酸储存(过氧化物酶体增殖物激活受体γ)的标志物。临床上,研究表明抵抗性糊精补充剂8周导致空腹血糖、糖化血红蛋白和低密度脂蛋白胆固醇水平降低,同时高密度脂蛋白浓度增加。
因此,益生元在控制脂质参数中的作用至关重要,因为脂质代谢与2型糖尿病的发生和发展有着密切关系。
5
益生元、抗氧化剂和血糖指数
氧化应激部分由有害微生物物种过度生长驱动,通过破坏胰岛素信号通路和促进胰腺β细胞功能障碍,在2型糖尿病发病机制和进展中起重要作用。
活性氧介导的通路触发胰岛细胞凋亡信号,导致细胞损伤和功能能力下降。在氧化应激状态下,胰岛素受体底物1磷酸化进一步损害胰岛素敏感性。
此外,促氧化剂损害内皮细胞,减少一氧化氮产生,而一氧化氮通过血管舒张作用将葡萄糖输送到细胞中是必不可少的。埃希菌属、梭状芽胞杆菌属和肠球菌属等细菌属,以及变形菌门和厚壁菌门与拟杆菌门比例增加,与2型糖尿病患者氧化应激增加相关。
• 减轻氧化应激、保护胰腺β细胞并改善葡萄糖稳态
益生元(特别是多酚)通过增加具有固有抗氧化能力的有益细菌相对丰度来减轻氧化应激,这些有益细菌可有效清除活性氧。多酚被肠道微生物群代谢产生酚酸,这是一种有效的抗氧化剂,已知可增强胰岛素信号传导、保护胰腺β细胞并改善葡萄糖稳态。
从机制上讲,酚酸通过下调NADPH氧化酶和上调核因子红细胞2相关因子2,后者是抗氧化酶的有效刺激剂。该研究还表明下游胰岛素信号传导增强,显著增加Akt磷酸化,表明胰岛素敏感性提高。
例如姜黄素是一种多酚,通过上调谷胱甘肽过氧化物酶和超氧化物歧化酶等抗氧化酶来促进胰岛细胞存活和功能,同时减少细胞凋亡。多酚已被证明可降低2型糖尿病患者脂质过氧化,通过降低低密度脂蛋白和增加高密度脂蛋白水平来优化血脂谱。这些改善与抗氧化防御机制增加相关,包括总谷胱甘肽水平升高,有助于防止糖尿病并发症进展。
因此,益生元的抗氧化特性在控制2型糖尿病氧化应激和控制血糖指数方面起着关键的治疗作用。
基于肠道微生物群的精准营养干预正成为功能食品和营养保健品行业的重要发展方向。随着个性化医疗的兴起,针对不同肠道菌群特征和代谢表型的定制化益生元产品将具有巨大的市场潜力。
肠道微生物群失调是2型糖尿病发生发展的重要机制,患者普遍存在产丁酸盐有益细菌(如双歧杆菌、罗氏菌属、普拉梭菌)减少,而有害细菌增加的现象。
研究表明,益生元在肠道菌群在2型糖尿病管理中的重要作用,本文深入分析菊粉、抗性淀粉、低聚果糖、低聚半乳糖、果胶低聚糖、多酚、β-葡聚糖和铁皮石斛等八种主要益生元,揭示了它们通过多重机制改善2型糖尿病的分子基础:促进短链脂肪酸产生、发挥抗炎作用、优化肠促胰岛素激素分泌、改善血脂代谢以及增强抗氧化特性。这些机制协同作用,显著改善血糖控制、胰岛素敏感性和代谢健康状况。
未来,应关注益生元与现有药物的协同作用,发展“药物+营养”的综合治疗模式。根据个体肠道微生物群特征和代谢特征定制益生元干预措施是一种策略。同时,这种“检测-分析-干预-监测”的精准营养循环,不仅能够实现血糖控制的显著改善,更能从根本上修复代谢紊乱的生物学基础。有望实现更好的血糖控制和整体健康改善。
主要参考文献
Iatcu OC, Hamamah S, Covasa M. Harnessing Prebiotics to Improve Type 2 Diabetes Outcomes. Nutrients. 2024 Oct 11;16(20):3447.
Zhou M., Zhao J. A Review on the Health Effects of Pesticides Based on Host Gut Microbiome and Metabolomics. Front. Mol. Biosci. 2021;8:632955.
Keivanlou M.H., Amini-Salehi E., Sattari N., Hashemi M., Saberian P., Prabhu S.V., Javid M., Mirdamadi A., Heidarzad F., Bakhshi A., et al. Gut microbiota interventions in type 2 diabetes mellitus: An umbrella review of glycemic indices. Diabetes Metab. Syndr. 2024;18:103110.
Quigley E.M.M. Prebiotics and Probiotics in Digestive Health. Clin. Gastroenterol. Hepatol. 2019;17:333–344.
Hamamah S., Iatcu O.C., Covasa M. Nutrition at the Intersection between Gut Microbiota Eubiosis and Effective Management of Type 2 Diabetes. Nutrients. 2024;16:269.
Megur A., Daliri E.B., Baltriukiene D., Burokas A. Prebiotics as a Tool for the Prevention and Treatment of Obesity and Diabetes: Classification and Ability to Modulate the Gut Microbiota. Int. J. Mol. Sci. 2022;23:6097.
Wu J., Yang K., Fan H., Wei M., Xiong Q. Targeting the gut microbiota and its metabolites for type 2 diabetes mellitus. Front. Endocrinol. 2023;14:1114424.
Gargari B.P., Dehghan P., Aliasgharzadeh A., Jafar-Abadi M.A. Effects of high performance inulin supplementation on glycemic control and antioxidant status in women with type 2 diabetes. Diabetes Metab. J. 2013;37:140–148.
谷禾健康
前几日,南方医科大学深圳医院院长周宏伟教授团队在国际顶尖医学期刊《Nature Medicine》上发表了一项重要研究。首次揭示一种名为活泼瘤胃球菌(Ruminococcus gnavus)的细菌产生的物质——苯乙胺,在肝性脑病发生中的关键作用。

同时谷禾的人群检测数据及相关研究也发现,活泼瘤胃球菌(R.gnavus)广泛存在于人体中,超过90%的人可以检测到。并且在例如肥胖、抑郁症、炎症性肠病、2型糖尿病等疾病患者中丰度偏高。
想必很多人对这个名字比较陌生,可能只知道瘤胃球菌属。虽然其名为活泼瘤胃球菌,但关于其的具体归属还有争议(有一段时间它被归类为Blautia属,但最近又被重新归为Mediterraneibacter属)。
活泼瘤胃球菌(Ruminococcus gnavus)是一种革兰氏阳性、严格厌氧的细菌,属于毛螺菌科,普遍存在于人类和动物的肠道中,是婴儿肠道的早期定植者,并在成年后也持续存在,占健康个体肠道微生物群丰度的0.1%至2%。
拉丁语gnavus的意思是忙碌,R.gnavus具有积极的碳水化合物发酵能力,可以将复杂的淀粉降解成更简单的分子。在淀粉、麦芽糖和岩藻糖基化聚糖等食物消化中具有重要功能。并产生乙酸盐、丙酸盐、甲酸盐和乙醇,但不产生丁酸盐。
虽然R.gnavus能有效利用植物性食物中的糖,但肠道中的糖并非全来自食物,人体自身也会生成糖类,如构成肠道内壁的粘蛋白聚糖。一些菌株依赖这些糖,并进化出策略以持续获取,可能破坏肠道屏障。
活泼瘤胃球菌(R.gnavus)生活在我们的肠道内壁,因此可以很好地感知肠道环境的变化并将其与身体的其他部分进行沟通。这在我们的免疫系统中发挥作用,也会对体内其他器官的功能产生影响。
研究发现R.gnavus能够产生一种炎性多糖,该分子诱导树突状细胞产生炎性细胞因子,如TNFα(肿瘤坏死因子),可能导致人体的炎症反应。并且越来越多的证据表明,R.gnavus的过度生长可能与某些肠道疾病有关,包括炎症性肠病(IBD)、肠易激综合征(IBS)和结直肠癌。
此外,研究还发现,患有影响身体其他部位的健康问题(包括感染、过敏、肥胖、代谢综合征、2型糖尿病、肝脏疾病和神经系统疾病)的人肠道中活泼瘤胃球菌(R.gnavus)的水平较高,说明R.gnavus与这些疾病之间存在相关性。
注:这种关联并不一定意味着R.gnavus是这些疾病的原因。相反,它可能只是表明这些疾病为R gnavus在肠道中的生长创造了有利条件。
活泼瘤胃球菌(Ruminococcus gnavus)到底是多种疾病的风险标志物还是正常的肠道共生菌?让我们来一探究竟。
活泼瘤胃球菌(Ruminococcus gnavus)是一种革兰氏阳性厌氧菌,属于厚壁菌门。R.gnavus于1974年首次从人类胃肠道的粪便和内容物中分离出来。当时它被描述为专性厌氧、非孢子形成、非运动或运动球菌,具有1-3个鞭毛,以链状或成对出现。
R.gnavus ATCC 35913 的扫描电子显微镜图像

拉丁语gnavus的意思是忙碌,指的是该物种的积极发酵能力。这种细菌具有特殊的酶,可以将复杂的淀粉降解成更简单的分子。在淀粉、麦芽糖和岩藻糖基化聚糖等食物消化中具有重要功能。可以产生乙酸盐和甲酸盐,但不产生丁酸盐。
R.gnavus的细胞壁由一种复杂的葡配甘露聚糖组成,它具有高度的免疫原性,可以在宿主中诱导特异性抗体。
R.gnavus的脂聚糖是一种附着在脂质上的聚糖,也是免疫原性的,可以调节宿主免疫系统。不同品系的R.gnavus具有不同的结构。
R.gnavus的基因组由一条约2.5Mb的圆形染色体和几个不同大小的质粒组成。它编码许多参与碳水化合物代谢的基因。其基因组DNA的G+C含量为43mol%。
虽然R.gnavus ATCC 29149无法在氧气存在下生长,但它确实表现出对大气氧气的一定耐受性,10%-15%的细胞在暴露于氧气1小时后仍保持活力,3小时后下降到0.05%-0.1%左右
该菌株对阿莫西林、替卡西林、头孢噻肟、亚胺培南、普那霉素、万古霉素、利奈唑胺、甲硝唑、利福平、甲氧苄啶/磺胺甲噁唑敏感,对林可霉素、红霉素、左氧氟沙星耐药。
▸ 在生命早期就定植于肠道
活泼瘤胃球菌(R.gnavus)是“正常”人类肠道微生物群的常见成员,多项证据表明其在生命早期就普遍存在。
生命第一年,分娩方式、饮食和遗传等因素都会影响微生物定植。一项针对25名1至24个月大婴儿样本的研究中,确定R.gnavus普遍存在;具体来说,在25个样本中的22个(88%)都检测到了活泼瘤胃球菌(R.gnavus)。
▸ 可能在婴儿消化与代谢中发挥作用
活泼瘤胃球菌(R.gnavus)可能是婴儿肠道的主要物种,其水平与双歧杆菌属相当。通过16S rRNA基因测序分析的研究强调了R.gnavus与母乳喂养或不同配方奶粉之间的饮食关联。
例如,在一项针对90名2个月大婴儿(每组30名)的比较研究中,与喂食牛奶的婴儿中更多样化的微生物特征相比,母乳或山羊奶喂养的婴儿中,毛螺菌科(Lachnospiraceae)的存在仅限于一种物种,即R.gnavus。
在另一项随机对照试验比较了喂食乳糖牛奶配方奶粉(CMF)与广泛水解蛋白配方奶粉(EHF,适用于牛奶蛋白不耐受婴儿)的婴儿粪便微生物群。结果显示,随着时间推移,EHF组中R.gnavus丰度增幅最大,成为区分不同食物喂养微生物组的显著特征。
这些数据表明,R.gnavus可能在肠道微生物群构建中发挥作用,并与婴儿正常体重增长和状态相关。
▸ 淀粉等固体食物会增加R.gnavus丰度
R.gnavus的相对丰度变化可能体现了婴幼儿微生物群的正常“成熟”。一些证据表明,R.gnavus在断奶后相对丰度增加,而其他物种,如双歧杆菌,已知相对丰度降低。
注:最近一项针对怀孕和分娩时婴儿肠道微生物群(脐带血)的研究显示,R.gnavus与产前血浆25-羟基维生素D(25[OH]D)呈正相关,但与脐带25[OH]D呈负相关。
一项研究调查了断奶对605名婴儿微生物群的影响,结果显示首次引入固体食物后,R.gnavus所属的比例显著增加。短链脂肪酸(SCFA)分析也反映了肠道微生物群的变化,数据显示断奶期间丁酸盐的产生发生变化。
对28名尼日利亚婴儿出生后第一年内粪便微生物群的分析显示,母乳喂养婴儿以R.gnavus、Collinsella和Sutterella为主。丁酸盐在断奶开始时(4-6个月大)首次检测到,引入固体食物后乙酸盐和乳酸仍然较高,12月龄时丁酸盐水平较低,与R.gnavus的已知发酵能力一致。
综上所述,这些研究支持R.gnavus在肠道早期定植中的作用。一些R.gnavus菌株能够代谢人乳低聚糖(HMO)和粘蛋白,其结构聚糖相似性进一步支持该物种在其他细菌定植过程中发挥重要作用的假设。
▸ R.gnavus在成年后也持续存在于肠道
R.gnavus在成年后也持续存在;根据对来自北美和欧洲的健康成年人的粪便样本的宏基因组测序,发现它是存在于≥90%的个体中的物种。
最近,在来自中国、埃塞俄比亚、西班牙、美国和瑞典的健康成年人的公开肠道微生物群宏基因组中发现了R.gnavus平均丰度为0.3%。
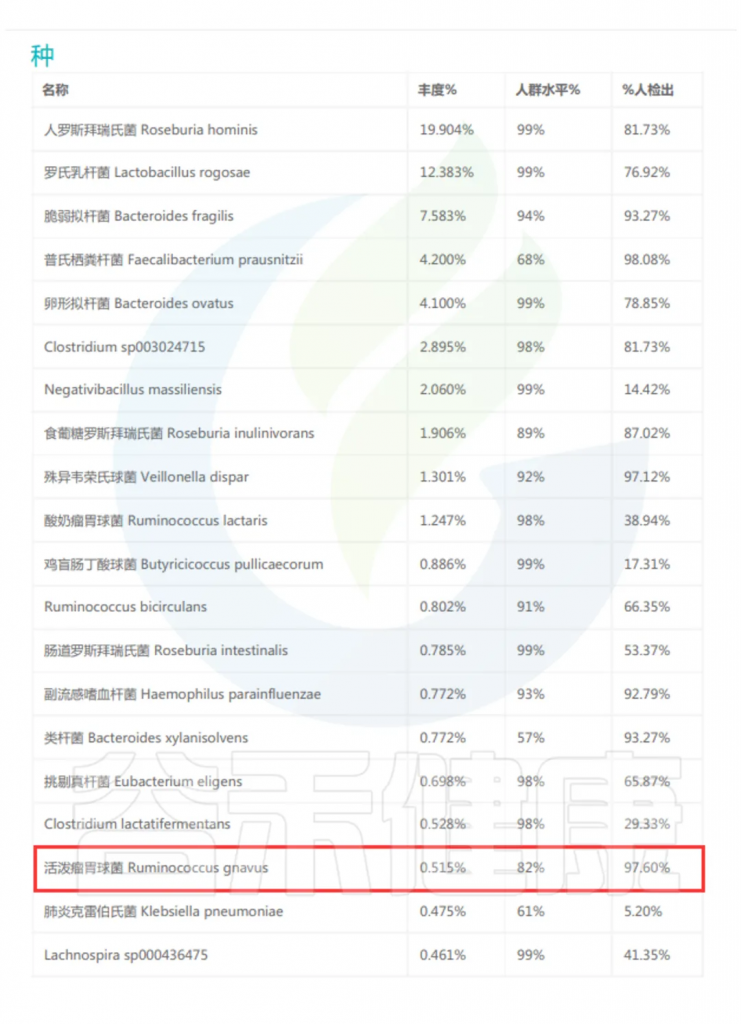
谷禾多年的检测数据显示,国人活泼瘤胃球菌(R.gnavus)检出率超过95%,表明其在人群中普遍存在,是肠道微生物群的基本组成部分。
▸ R.gnavus有助于消化复杂的碳水化合物
瘤胃球菌是分解碳水化合物最有效的细菌属之一。我们知道瘤胃球菌是“降解抗性淀粉的关键菌”。瘤胃球菌能有效地分解坚硬的植物物质,如细胞壁,这有助于人体消化水果蔬菜,不太可能引起胃痛。
注:抗性淀粉是在小扁豆、豆类和未加工的全谷物等高纤维食物中发现的复杂碳水化合物。
这种细菌具有特殊的酶,可以将这些复杂的淀粉降解成更简单的分子。这也与它利用一些母乳低聚糖和在粘蛋白聚糖表位上觅食的能力有关。值得注意的是,R.gnavus ATCC 29149具有一种独特的唾液酸代谢途径,专门用于2,7-脱水Neu5Ac。
R.gnavus碳水化合物的最终发酵产物包括乙酸盐、甲酸盐和乙醇,以及丙醇和丙酸盐,但不包括丁酸盐。
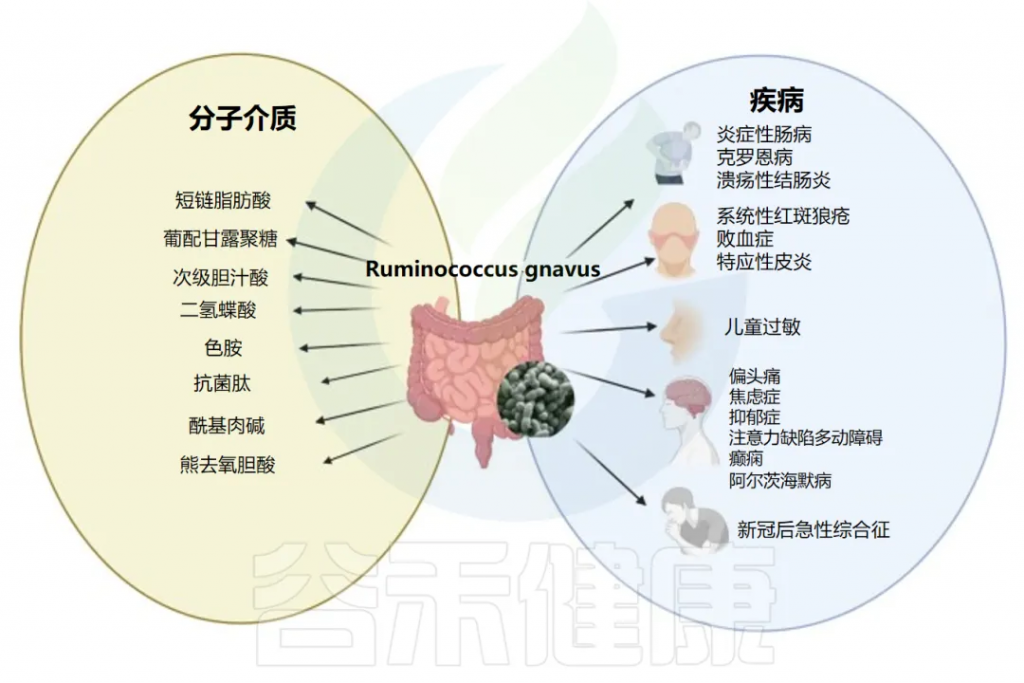
尽管活泼瘤胃球菌(R.gnavus)是人类肠道微生物群的组成部分,正常情况下在健康个体的肠道中普遍存在,但许多研究表明,当其丰度过高时,可能与多种疾病的发生发展存在密切关联。这些疾病不仅包括与肠道相关的疾病,如炎症性肠病(IBD)、肠易激综合征、结直肠癌,还涉及一些非肠道相关的疾病,如代谢性疾病和免疫系统紊乱等。
R.gnavus与疾病和潜在分子介质的关联
Crost EH,et al.FEMS Microbiol Rev.2023
1
炎症性肠病
克罗恩病(CD)和溃疡性结肠炎(UC)是多因素慢性炎症性肠病,一直与肠道微生物失调有关。越来越多的研究表明R.gnavus与炎症性肠病(IBD)之间存在正相关,尽管因果关系仍有待证明。
▸ R.gnavus在IBD患者中含量增加
分析了炎症性肠病(IBD)患者肠粘膜组织的早期研究表明,粘膜相关细菌的丰度增加。例如,与健康粘膜相比,R.gnavus和R.torques在CD和UC粘膜中含量更高,而主要的粘液降解细菌A.muciniphila在CD和UC粘膜中的含量明显较低。
在一项后续研究中,分析了68名CD患者、84名未受影响的亲属和55名匹配的对照者粪便样本,并使用实时PCR进行定量。结果显示,R.gnavus是五种与菌群失调相关的细菌中唯一在克罗恩病(CD)中丰度增加的物种。
通过内窥镜采集IBD患者粘膜表面样本(43名UC患者、26名CD患者和14名非IBD对照),利用16S rRNA 基因测序分析粘膜相关微生物群落。结果显示,与非IBD对照相比,CD患者变形菌门丰度显著增加,而厚壁菌门和拟杆菌门丰度显著降低。其中,埃希氏菌属、瘤胃球菌属(R.gnavus)、放线杆菌属和肠球菌属显著增加,而粪杆菌属、粪球菌属、普雷沃氏菌属和罗氏菌属显著减少。
▸ R.gnavus能够诱导产生炎性细胞因子

一项研究发现,肠道细菌R.gnavus产生了炎性多糖,其种群在克罗恩病患者的症状发作期间丰度增加。R.gnavus可以合成并分泌具有鼠李糖骨架和葡萄糖侧链的复杂多糖glucorhamnan,它有效诱导树突细胞分泌炎性细胞因子(TNFα),并可能导致R.gnavus与克罗恩病之间的关联。
另一项基于对40对双胞胎的肠道微生物群分析的研究显示,在回肠CD患者中,肠杆菌科和R.gnavus的丰度增加,而粪杆菌属(Faecalibacterium)和罗氏菌属(Roseburia)等核心细菌的消失。
▸ R.gnavus丰度与IBD疾病结果相关
R.gnavus是与克罗恩病相关的菌群,已被确定为导致克罗恩病症状的原因之一。在克罗恩病患者中活泼瘤胃球菌(R.gnavus)的相对丰度升高与症状严重相关。
通过Illumina MiSeq对IBD患者(70名UC,39名CD)及100名健康对照的粪便微生物群分析显示,它们在 IBD中表现出差异丰度。结合20名IBD患者和12名对照的宏基因组分析与R.gnavus分离株的全基因组测序,强调了R.gnavus菌株水平的重要性。
研究还揭示了IBD特异性、菌株特异性的基因,这些基因参与氧化应激反应、粘附、铁获取和粘蛋白利用,可能赋予R.gnavus在IBD患者肠道中的适应性优势。在小鼠模型中,提出了多种支持R.gnavus与 IBD关联的机制。
此外,分析了化疗后接受造血细胞移植和干细胞植入的癌症患者的>10000个纵向微生物群样本,发现R.gnavus的绝对丰度与淋巴细胞率负相关,与其生长速率正相关,表明R.gnavus可能驱动高中性粒细胞与淋巴细胞比率,这一特征与IBD不良预后密切相关。
注:R.gnavus的富集还与CD患者的心理评分呈正相关,与次级胆汁酸TDCA和TLCA呈负相关,进一步表明其与患者心理状态和疾病进展的关联。
综上所述,一些研究人员认为R.gnavus可以作为 炎症性肠病(IBD)的生物标志物,但因果关系仍有待证明。
2
肠易激综合征
肠易激综合征(IBS)是一种慢性异质性疾病,影响约6%的人口。IBS的病理生理学是多因素的,其中包括肠道微生物群的改变。
对IBS患者、健康个体粪便和结肠活检样本,以及小鼠模型样本的细菌测序分析表明,症状和炎症的严重程度可能与粘液相关细菌(如R.gnavus)的变化密切相关。
编辑
▸ 在腹泻型IBS患者中明显更丰富
对80名IBS患者(16-70岁)和65名无IBS对照的粪便进行鸟枪法和16S rRNA 测序显示,R.gnavus和毛螺菌科其他物种在 IBS 中显著更丰富,尤其在腹泻型IBS(IBS-D)患者中,与外周5-羟色胺(5-HT)水平和严重症状相关。
这一现象也在R.gnavus单定植小鼠中得到验证。代谢组学和宏基因组学研究表明,R.gnavus的富集与二氢蝶酸水平降低密切相关,二氢蝶酸是叶酸合成的重要中间体,其失调可能导致IBS病理变化。
此外,在新诊断的初治IBD或IBS患者(13UC、10CD和26IBS)与健康对照中,基于粪便和粘膜微生物群的16S rRNA 基因测序进一步证实了R.gnavus 作为区分疾病表型潜在生物标志物的作用。
3
结直肠癌
多项宏基因组学研究表明,结直肠癌(CRC)与肠粘膜相关微生物群的显著变化有关。
▸ 粘膜菌群失调与肿瘤形成存在关联
异常隐窝病灶(ACF)是CRC患者结肠中最早可识别的形态学病灶。对接受结肠镜筛查或监测个体的粘附细菌分析显示,与正常粘膜相比,ACF的细菌微生物组谱异质性显著更高;KRAS癌基因突变与R.gnavus呈正相关,提示特定结肠细菌与CRC相关突变之间可能存在联系。
这些结果表明,正常粘膜微生物群的扰动可能是早期肿瘤形成的危险因素,粘膜菌群失调可能影响ACF的组织微环境和行为,促进其向高级肿瘤发展。
此外,最近一项研究通过16S扩增子测序分析CRC患者治疗前后肠道微生物群,发现R.gnavus与脂肪细胞因子信号通路和过氧化物酶体通路相关。
4
过敏、免疫和炎症
▸ R.gnavus可能对特应性皮炎有一定保护作用
肠道微生物组失调与儿童过敏密切相关,R.gnavus 是儿童过敏的重要参与者。研究表明,患特应性皮炎(AD)的婴儿肠道微生物群与健康婴儿存在差异。通过对129名婴儿队列中随机选取的40名6个月大婴儿(20名对照组,20名AD患者)的肠道微生物组进行全宏基因组测序,发现与免疫发育相关的功能基因存在差异。AD组中A.muciniphila、R.gnavus和Lachnospiraceae bacterium 2_1_58FAA的定植减少,与免疫发育迟缓显著相关。临床前研究进一步支持了R.gnavus在特应性皮炎模型中的保护作用。
▸ 食物或呼吸道过敏儿童中R.gnavus升高
相比之下,在受食物或呼吸道过敏影响的儿童中观察到R.gnavus(和F.prausnitzii)的丰度更高。在一项前瞻性双胞胎队列的研究中,在过敏表现出现之前观察到粪便微生物群中R.gnavus的丰度增加,并且与呼吸道过敏或呼吸道过敏与特应性湿疹共存有关。
在小鼠模型中,添加R.gnavus ATCC 29149 导致气道高反应性和炎症(哮喘),表现为结肠和肺中辅助T细胞2的扩增,以及嗜酸性粒细胞和肥大细胞浸润结肠和肺实质。
▸ 一些炎症反应中R.gnavus增多
系统性红斑狼疮(SLE)患者中R.gnavus丰度显著增加,且与整体疾病活动呈正比,在狼疮性肾炎患者中尤为明显。狼疮性肾炎患者的粪便中sIgA包被的R.gnavus细菌更多,血清IgG水平升高,主要针对R.gnavus菌株特异性细胞壁脂聚糖抗原。
R.gnavus水平升高也与脊柱关节炎相关,这是一类炎症性风湿病,但其机制尚不明确。此外,COVID-19患者(未使用抗生素)及长期并发症患者的肠道微生物组中R.gnavus水平较高,可能与细菌的肠肺易位或免疫与炎症调节有关。
5
代谢综合征
▸ R.gnavus与体脂率、腰围、血清甘油三酯等指标相关
R.gnavus与代谢综合征的多个特征密切相关,包括体脂百分比增加。这一关联得到了以挪威20-94岁参与者为基础的大型发现队列(n=2875)及两个复制队列(n=999和n=1341)的分析支持。
编辑
在联合队列中,33.7%的参与者检测到R.gnavus,其存在与脂肪量、腰围、血清甘油三酯、C反应蛋白(CRP)、HbA1c增加及HDL降低相关。这些关联在调整混杂因素后依然显著,且在不同性别和年龄(以中位年龄 59.6 岁为界)分层分析中表现一致。
6
肥胖
▸ R.gnavus在肥胖者中更丰富
在一项横断面多种族肥胖表型研究(812 名男性,843名女性,60-77 岁)中,16S rRNA 基因测序显示 R.gnavus与能量调整饮食炎症指数(E-DII)和肥胖表型相关。
另一项研究发现,在41名BMI正常者中,R.gnavus 与内脏脂肪密切相关,并与代谢指标呈正相关。早期研究也表明,R.gnavus在肥胖者中明显更丰富,并在减重期间减少,且与高BMI呈正相关。此外,一项研究显示,R.gnavus在对减肥手术无反应的患者中更为丰富。
注:瘤胃球菌喜欢植物中的多糖。如果肠道中有过多的瘤胃球菌,可想而知细胞会吸收更多的糖,那就不可避免地导致体重增加。
▸ R.gnavus会影响脂质代谢及信号通路
最近的动物研究表明,R.gnavus影响宿主代谢物。在高脂肪饮食小鼠中,R.gnavus影响肝脏的信号通路和下游脂质代谢,特别是降低FGF21表达,增加肝脏甘油三酯水平、血清总胆固醇和低密度脂蛋白(LDL)水平,所有这些都会导致代谢紊乱。
7
冠状动脉和肝脏疾病
▸ 冠状动脉疾病晚期患者R.gnavus相对丰度增加
肠道微生物组的改变与心血管疾病相关。一项病例对照研究通过16S rRNA测序分析了53名晚期冠状动脉疾病(CAD)患者与53名年龄、性别、种族和BMI匹配的对照者的粪便微生物群,发现CAD患者的肠道微生物组丰富度和均匀度降低。R.gnavus是相对丰度增加超过数倍的五个分类群之一,并在调整糖尿病和血脂异常等风险因素后,与晚期CAD的存在显著相关。
▸ 在脂肪性肝病肝硬化中丰度显著增加
宏基因组测序显示,R.gnavus是脂肪性肝病(MASLD)肝硬化和脂肪性肝病-肝细胞癌(HCC)患者中最丰富的五种细菌之一,且在MASLD-HCC患者中丰度最高。
此外,R.gnavus与MASLD-HCC和MASLD肝硬化患者的细胞毒性CD8+ T细胞呈负相关,而在MASLD合并冠心病患者中,其丰度低于仅患冠心病的个体。然而,这些研究未包含MASLD对照组,限制了对MASLD肠道微生物组的理解。
已有研究表明,与健康对照和脂肪性肝病对照相比,脂肪性肝病肝硬化患者的R.gnavus丰度显著增加,暗示其可能与脂肪性肝病向肝硬化的进展有关。
▸ 驱动肝性脑病
高达50-70%的肝硬化患者会发展为肝性脑病(HE),这与肠道菌群失调密切相关,机制尚不清楚。通过构建肠脑模块评估宏基因组数据集中的细菌神经毒素,研究人员发现主要来自R.gnavus的苯丙氨酸脱羧酶(PDC)基因在肝硬化患者中增加了约10倍,在HE患者中更高。
用R.gnavus定植的肝硬化、不健康的小鼠表现出脑苯乙胺(PEA)积累,以及记忆障碍、对称性震颤和皮层特异性神经元丢失,通常见于肝性脑病患者。
8
2型糖尿病
▸ 2型糖尿病患者中R.gnavus较高,而抗炎细菌丰度较低
肠道菌群的变化和慢性低度炎症在2型糖尿病(T2D)发展中起关键作用。一项对T2D患者粪便样本的初步研究发现,R.gnavus、Lactobacillus ruminis、Bacteroides caccae、Butyricimonas 和 Collinsella aerofaciens丰度较高,而抗炎细菌F.prausnitzii和Butyrivibrio丰度较低。
在一项随访的人群队列研究中,R.gnavus被确定为与新发2型糖尿病(T2D)持续相关的四个物种之一。对134名糖尿病前期成年人的分析显示,梭菌目(Clostridiales)和阿克曼菌(A.muciniphila)丰度降低,而R.gnavus丰度增加。一项基于258名T2D患者的研究发现,富含R.gnavus的微生物簇与适中血糖、严重胰岛素抵抗、高胆固醇水平相关。
▸ 与妊娠晚期空腹血糖呈正相关
妊娠糖尿病(GDM)研究表明,R.gnavus与妊娠晚期空腹血糖呈正相关。此外,糖尿病周围神经病变(DPN)研究显示,甘氨酸熊去氧胆酸和牛磺熊去氧胆酸与R.gnavus和Phascolarctobacterium的丰度呈正相关。
9
感染与脓毒症
编辑
▸ R.gnavus可能导致外周感染及血液感染
R.gnavus感染病例包括血液恶性肿瘤和外周感染,如泌尿生殖系统感染。例如,一名患深部浸润性子宫内膜异位症和盆腔炎的女性在双侧输卵管卵巢脓肿中培养出R.gnavus。
R.gnavus血流感染还与憩室病、化脓性关节炎、胆囊穿孔、多发性骨髓瘤和乙状结肠癌化疗患者的肠穿孔以及小肠疝和穿孔引起的粪便腹膜炎相关。这些研究表明R.gnavus感染的致病性与胃肠道损伤密切相关。
10
神经系统疾病
新出现的证据表明,微生物失调可导致神经认知障碍的发生和发展,如精神分裂症、抑郁症、双相情感障碍、焦虑症和痴呆症。
有人认为,饮食、生活方式、遗传因素和外部压力源“合作”调节肠道微生物群组成,从而影响大脑的反应。越来越多的研究报告了患有神经系统疾病的患者R.gnavus水平的变化。
▸ 焦虑症、脑癫痫患者R.gnavus增加
尽管研究规模有限,但焦虑症患者的肠道微生物丰富度和多样性显著降低,同时R.gnavus丰度增加。一项为期8周的临床试验测试了益生菌对抑郁症的治疗效果,结果显示益生菌组和安慰剂组均有症状减轻,但肠道微生物群未发生显著变化。然而,重度抑郁患者的R.gnavus相对丰度显著增加,并与抑郁焦虑压力量表评分呈正相关。
另一项研究发现,R.gnavus与脑癫痫患者的癫痫发作显著正相关,这种神经系统疾病以癫痫发作易感性为特征,与健康对照组相比差异明显。
▸ 阿尔茨海默病和认知障碍患者中R.gnavus丰度增加
随着人口老龄化的加剧,微生物代谢物在神经退行性疾病如阿尔茨海默病(AD)和帕金森病(PD)进展中的作用受到越来越多关注。在AD患者中,主要特征是淀粉样蛋白β(Aβ)在记忆相关脑区的积累。一项基于AD小鼠模型的研究发现,Aβ蛋白的过表达显著影响肠道微生物群,其抗菌活性导致R.gnavus等物种的丰度变化。
另一项研究调查了PD患者的肠道微生物群,并根据疾病严重程度分组。结果显示,路易体痴呆患者中R.gnavus和粪杆菌的相对丰度更高。这与另一项研究的结果一致,该研究发现帕金森病(PD)患者肠道中R.gnavus的丰度显著高于健康对照组。
在易患神经认知障碍的老年人和患有心理症状的克罗恩病患者中观察到R.gnavus的富集。与健康对照相比,中风后认知障碍患者的R.gnavus丰度增加,且与认知测试结果呈负相关。对患偏头痛的老年妇女与健康对照(年龄和BMI匹配)的粪便样本进行宏基因组学分析显示,R.gnavus是偏头痛组中显著富集的物种之一。
综上所述,这些研究表明R.gnavus在神经系统疾病中的丰度增加,尽管因果关系尚未明确。文献倾向于将粘膜相关或粘液溶解细菌的存在与肠道屏障通透性增加或炎症相关联,导致细菌代谢物或分子泄漏,触发炎症并向大脑发出信号。例如R.gnavus ATCC 29149 能够将色氨酸脱羧形成色胺,提高了肠道和中枢神经系统互作的可能性。
然而,目前尚无证据表明R.gnavus能物理改变粘膜屏障。与多形拟杆菌(Bacteroides thetaiotaomicron)或A.muciniphila等物种因其广泛的粘蛋白-聚糖降解能力可分解完整的粘蛋白聚糖链不同,R.gnavus的粘蛋白聚糖降解能力具有菌株特异性,仅限于从上皮屏障外觅食聚糖表位。
R.gnavus与疾病关联的研究
编辑
Crost EH,et al.FEMS Microbiol Rev.2023
▸ 高糖高肉会增加R.gnavus
饮食是肠道微生物群的主要调节因素。在题为“满足欧洲老年人口健康老龄化特定需求的新饮食策略”(NU-AGE)的研究中,调查了饮食、肠道微生物群和认知之间的关联,结果表明R.gnavus和Collinsella spp.与富含动物产品的饮食有关,被称为“促炎物种”。
通过对多种族队列研究(5936名参与者)的粪便样本进行16S rRNA基因测序,确定了饮食质量与肠道微生物组的长期关联。结果显示,R.gnavus的存在与健康饮食指数呈负相关。
健康饮食指数(HEI)由13个组成部分组成,最高100分,包括9个充足性组成部分(总水果、全水果、总蔬菜、蔬菜和豆类、全谷物、乳制品、总蛋白质食品、海鲜和植物蛋白以及脂肪酸)以及四个适度成分(精制谷物、钠、添加糖和饱和脂肪)。大多数成分按每1000大卡摄入量的摄入量评分。2
以羊肉、猪肉等红肉为基础的饮食会增加活泼瘤胃球菌(Ruminococcus gnavus)的丰度。
此外,经常食用糖果、饮料、糕点等,也会导致Ruminococcus gnavus升高,并降低了肠道中某些有益菌。
▸ 富含多酚的食物有助于减少R.gnavus
针对R.gnavus的饮食干预研究较少。一项对23名健康个体的随机交叉试验发现,在高红肉饮食中添加高直链淀粉玉米可降低R.gnavus的比例;补充富含多酚的红树莓可减少糖尿病前期和胰岛素抵抗成人的R.gnavus。这表明针对活泼瘤胃球菌(R.gnavus)的饮食干预可作为促进健康的策略。
▸ 益生菌调节
唾液乳杆菌(Lactobacillus salivarius Ren)显著减少R.gnavus的数量。
Lactobacillus paracasei DG干预后,瘤胃球菌丰度下降55%(P = 0.016)
口服长双歧杆菌BB536 和鼠李糖乳杆菌HN001 1个月后,Ruminococcus gnavus丰度减少。
此外,我们推测多形拟杆菌(Bacteroides thetaiotaomicron)等能够降解碳水化合物的有益细菌可能会与R.gnavus竞争,从而抑制R.gnavus的丰度。
但在注射了乳杆菌的小鼠小肠微生物群中,瘤胃球菌过度生长。
以下的细菌也可能对R.gnavus具有抑制作用
Bifidobacterium
Coriobacteriales
Adlercreutzia
Collinsella
Bacteroidales
Bacteroides
Porphyromonadaceae
Odoribacter
Parabacteroides
Porphyromonas
Prevotella
Rikenellaceae
Alistipes
Turicibacter
Streptococcus
Clostridiales
Catabacteriaceae
Clostridium
Clostridiales incertae sedis
Peptoniphilus
Clostridiales Family XIII. Incertae Sedis
Lachnospiraceae
Blautia
Lachnospiraceae
Coprococcus
Dorea
Eubacterium
Lachnobacterium
Lachnospira
Roseburia
Lachnospiraceae
Peptococcaceae
Ruminococcaceae
Ruminiclostridium
Acetivibrio
Eubacterium
Faecalibacterium
Oscillospira
Ruminococcus
Acidaminococcus
Dialister
Phascolarctobacterium
Veillonella
Rubrivivax
Alcaligenaceae
Oxalobacter
Bilophila
Desulfovibrio
Campylobacteraceae
Enterobacteriaceae
Escherichia
Erysipelotrichaceae
Erysipelotrichaceae
Holdemania
Akkermansia
▸ 益生元调节
施用低聚半乳糖(GOS)后,R.gnavus丰度下降。
龙舌兰菊粉,3周,随机对照试验,交叉试验,R.gnavus减少。
玉米可溶性纤维21g/d, 3周,随机对照试验,交叉试验,R.gnavus减少。
尽管活泼瘤胃球菌(Ruminococcus gnavus)是人类肠道微生物群的重要组成部分,通常在健康个体的肠道中广泛存在,但研究表明,其丰度的异常升高可能与多种疾病的发生和发展密切相关。这些疾病不仅包括肠道相关疾病,如炎症性肠病(IBD)、肠易激综合征(IBS)和结直肠癌,还涉及非肠道相关疾病,如神经发育障碍、神经系统疾病、代谢性疾病以及免疫系统紊乱等。
例如,除了最近《Nature Medicine》揭示活泼瘤胃球菌可通过苯丙氨酸脱羧酶及其代谢产物苯乙胺驱动肝性脑病,为肝性脑病提供了潜在诊疗靶点。 今年江南大学王鸿超团队基于机器学习识别关键菌群,发现肥胖个体中肠道共生菌活泼瘤胃球菌的丰度增加,且与临床指标显著相关,且通过调节胆汁酸代谢(如促进次级胆汁酸的生成)对宿主代谢产生不利影响,间接阻碍了体重的下降;并可能导致肝脏损伤。
因此,监测和预防活泼瘤胃球菌丰度的异常升高对于维持肠道菌群平衡和降低疾病风险具有重要意义。然而,要实现这一目标,需要建立可靠的健康人群和疾病人群的肠道微生物数据库,以明确健康状态下该菌的正常丰度范围及其在疾病状态下的异常变化边界。这些数据库应包括不同年龄、性别、生活方式和地理区域的健康人群数据,同时结合疾病人群的微生物组特征,明确活泼瘤胃球菌的丰度变化与疾病的关联模式。通过这些数据的积累和分析,不仅可以更准确地识别活泼瘤胃球菌的异常丰度阈值,还能为个性化的肠道健康管理和疾病预防策略提供科学支持。
主要参考文献
Crost EH, Coletto E, Bell A, Juge N. Ruminococcus gnavus: friend or foe for human health. FEMS Microbiol Rev. 2023 Mar 10;47(2):fuad014.
Juge N. Microbe Profile: Ruminococcus gnavus: the yin and yang of human gut symbionts. Microbiology (Reading). 2023 Aug;169(8):001383.
Grahnemo L, Nethander M, Coward E, Gabrielsen ME, Sree S, Billod JM, Engstrand L, Abrahamsson S, Langhammer A, Hveem K, Ohlsson C. Cross-sectional associations between the gut microbe Ruminococcus gnavus and features of the metabolic syndrome. Lancet Diabetes Endocrinol. 2022 Jul;10(7):481-483.
Henke MT, Kenny DJ, Cassilly CD, Vlamakis H, Xavier RJ, Clardy J. Ruminococcus gnavus, a member of the human gut microbiome associated with Crohn’s disease, produces an inflammatory polysaccharide. Proc Natl Acad Sci U S A. 2019 Jun 25;116(26):12672-12677.
Titécat M, Wallet F, Vieillard MH, Courcol RJ, Loïez C. Ruminococcus gnavus: an unusual pathogen in septic arthritis. Anaerobe. 2014 Dec;30:159-60.
de la Fuente-Nunez C, Meneguetti BT, Franco OLet al. Neuromicrobiology: how microbes influence the brain. ACS Chem Neurosci. 2018;9:141–50.
Fan X, Chen Y, Liu Yet al. First case of bloodstream infection caused by Ruminococcus gnavus in an 85 year old man in China. Lab Med. 2022;53:e36–9.
Hall AB, Yassour M, Sauk Jet al. A novel Ruminococcus gnavus clade enriched in inflammatory bowel disease patients. Genome Med. 2017;9:103.

谷禾健康

副萨特氏菌属(Parasutterella)是一种革兰氏阴性,严格厌氧菌,在谷禾的人群肠道样本数据库中检出率为84.13%,说明这个菌在大部分人肠道存在,甚至长期定植共生。
Parasutterella属占据特定肠道生态位,影响宿主代谢:来自小鼠、大鼠和人的Parasutterella均不能降解糖,也无法还原硝酸盐或产生吲哚,但能合成琥珀酸盐,并且该菌可能参与人体胆汁酸稳态维持和胆固醇代谢。同时肠道内芳香族氨基酸、胆红素、嘌呤和胆汁酸衍生物等代谢物也受该菌的影响。
作为肠道共生菌成员之一,Parasutterella的相对丰度与不同的宿主健康结果有关,例如在肥胖、2型糖尿病、焦虑和抑郁、炎症性肠病患者中,Parasutterella的丰度增加;但是又有一些研究发现Parasutterella可以降低危重肺炎风险,并对肾上腺功能有一定的影响。副萨特氏菌属(Parasutterella)可能根据具体情况发挥二分作用。
在人体研究和动物试验中,发现Parasutterella对抗生素给药和其他饮食干预(如益生元和抗性淀粉补充剂)有反应。过量食用高脂、超加工食品,缺乏维生素A会导致Parasutterella丰度增加,而食用虫草素、小麦麸质、白藜芦醇、阿拉伯半乳聚糖、发酵豆乳等可以降低Parasutterella丰度。
副萨特氏菌属(Parasutterella)是β变形菌门下的一个属,与萨特氏菌属(Sutterella)相似但又有所不同。是一种革兰氏阴性,严格厌氧的球菌或球杆菌,不产生孢子,大小为0.5-0.8×1.0-1.5微米。
在37°C的GAM琼脂上培育72小时后,Parasutterella菌落呈完整、圆形、凸面、半透明,直径为0.5-0.7mm。
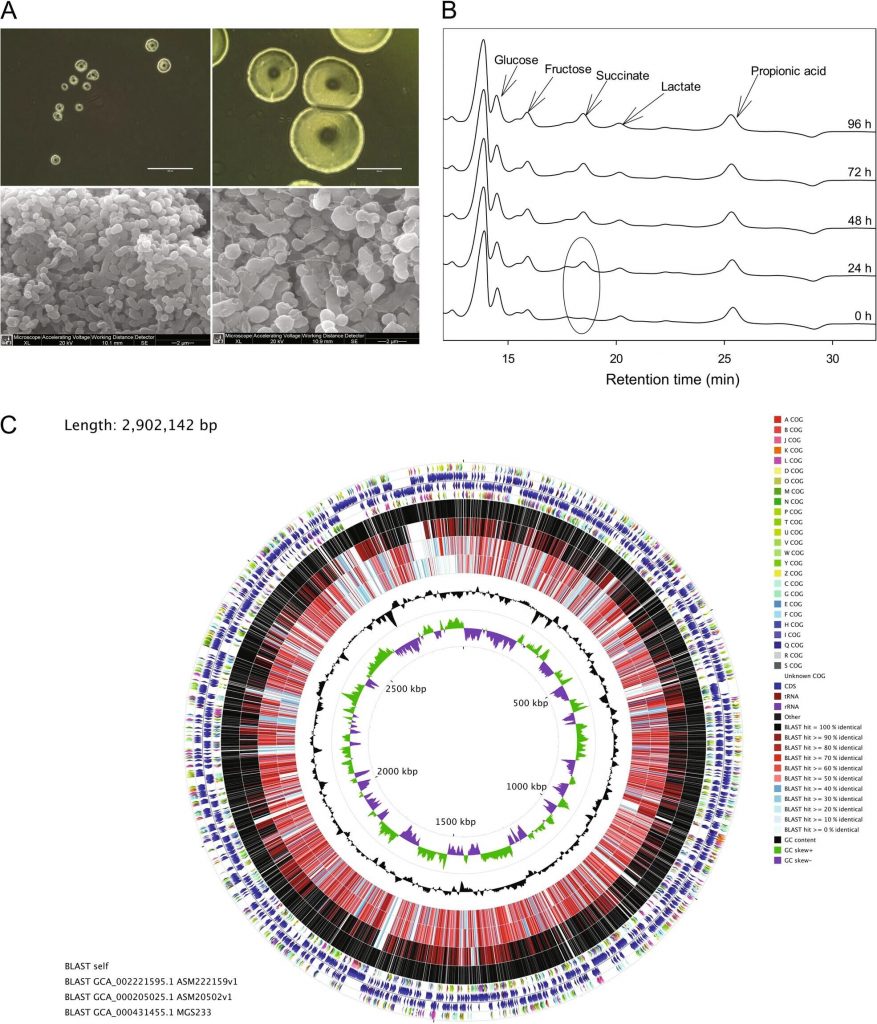
doi: 10.1038/s41396-019-0364-5.
物种与分布
Parasutterella属包含两种类型的菌株,Parasutterella excrementihominis YIT11859和Parasutterella secunda YIT12071,它们首先从人类粪便中分离出来。
Parasutterella excrementihominis是该菌属的模式物种。
Parasutterella属的成员也存在于其他物种中,包括小鼠、大鼠、狗、猪、鸡、火鸡和小牛。
生长与代谢
Parasutterella可在37°C厌氧环境下生长,这与人体肠道内的环境相似,并且在谷禾的检测报告中,Parasutterella有较高的检出率,说明Parasutterella是肠道菌群的共生成员。
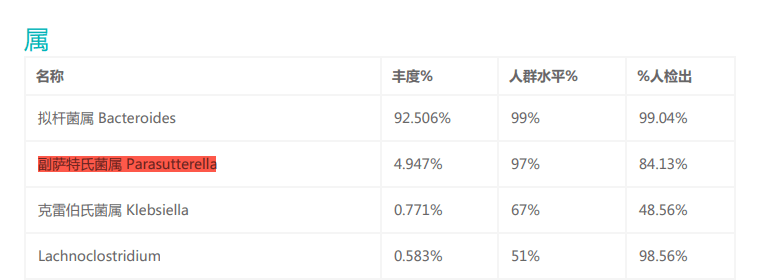
来自小鼠、大鼠和人的Parasutterella均不能降解糖(肉汤培养物中未检测到葡萄糖、果糖或乳酸的变化),并且未检测到短链脂肪酸作为代谢的最终产物,此外对硝酸盐还原、吲哚生成、过氧化氢酶、脲酶和氧化酶活性以及七叶苷和明胶水解呈阴性。
但该菌能合成琥珀酸盐,其的定植还可引起小鼠肠道内芳香族氨基酸、胆红素、嘌呤和胆汁酸衍生物等菌群代谢物的改变。
胆汁酸的变化伴随着回肠胆汁酸转运基因、肝脏胆汁酸合成基因表达的改变,证明该细菌可能参与胆汁酸稳态维持和胆固醇代谢。
注:Parasutterella的丰度在发酵过程中降低,与氨的产生呈正相关。天冬酰胺是GAM肉汤中Parasutterella代谢最迅速和首选的氨基酸。
基因组信息
Parasutterella的完整基因组大小为2.8 Mb,G+C含量为44.1mol%。预测包含2648个独特基因,缺乏转运和代谢外源糖的基因。
具有编码L-天冬酰胺酶、天冬氨酸氨裂解酶和天冬氨酸脱氢酶的基因,表明天冬酰胺是其最快速和首选的氨基酸代谢物。
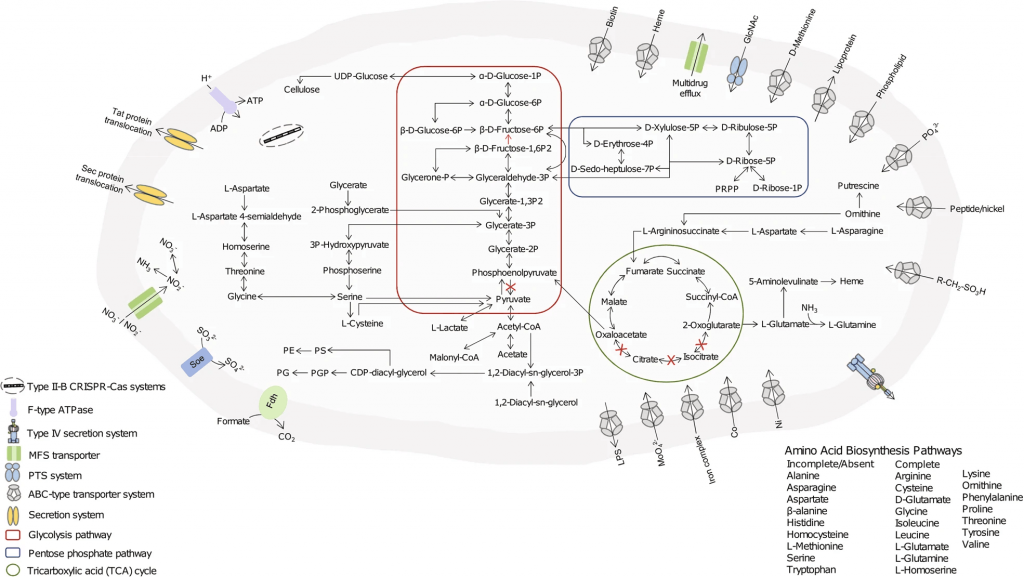
doi: 10.1038/s41396-019-0364-5.
此外,在Parasutterella mc1的基因组中没有鉴定出毒素毒力因子相关基因,这表明Parasutterella可能是肠道菌群的共生成员。但最近有许多研究和谷禾的检测报告中发现Parasutterella的丰度异常与一些疾病存在关联,让我们一起继续深入了解。
作为肠道微生物群中的一员,研究发现Parasutterella与炎症性肠病、肥胖、2型糖尿病、自闭症和肾结石等健康结果相关。
肥胖和2型糖尿病患者中增多 ↑↑
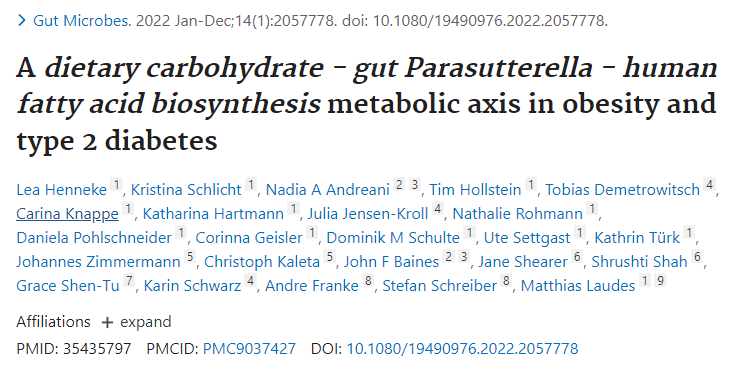
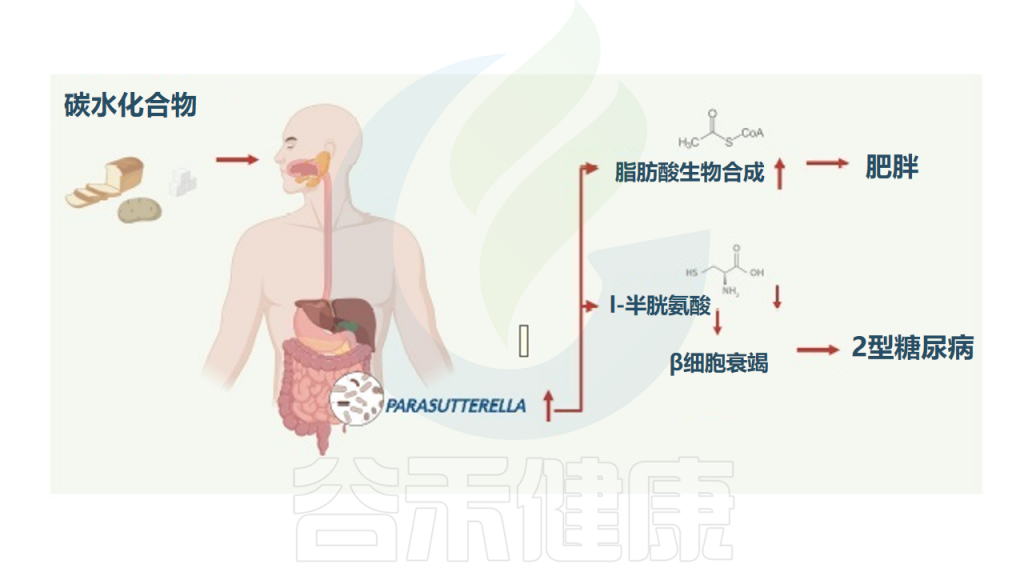
研究纳入了1544名受试者,分析肠道菌群组成,发现Parasutterella丰度与BMI以及2型糖尿病呈正相关,与膳食中碳水化合物摄入量呈正相关,但与肥胖中微生物组α/β多样性减少和低度炎症无关。
高丰度的Parasutterella与人体脂肪酸合成途径的激活有关,减肥干预试验中Parasutterella的丰度显著降低,Parasutterella增加或是影响体重增加的一个机制。
在代谢组学检测的126种血清代谢物中,L-半胱氨酸在Parasutterella丰度高的受试者中显著降低,因为Parasutterella是已知的高L-半胱氨酸消费者。
综上所述,Parasutterella在人类2型糖尿病和肥胖症中起一定作用,其中与L-半胱氨酸的联系可能与2型糖尿病的发展有关,并与肥胖症发展过程中富含碳水化合物的饮食导致体重增加的脂肪酸生物合成途径有关。
Henneke L,et al.Gut Microbes.2022
焦虑和抑郁人群中增加 ↑↑
与健康个体相比,社交焦虑症(SAD)患者体内的Parasutterella的丰度增加。

同时,16S rRNA分析发现,应激小鼠肠道中Bacteroides、Alistipes和Lactobacillus丰度降低,Parasutterella和Rikenellaceae_RC9_gut_group丰度升高。
KEGG通路分析表明,差异代谢物主要参与α-亚麻酸代谢、味觉传导、半乳糖代谢等下调通路。多种代谢物与Alistipes和Bacteroides呈正相关,而与Parasutterella呈负相关。
此外,Parasutterella的绝对丰度与身体不满意度呈正相关。
炎症性肠病患者中增加↑↑
在肠易激综合征(IBS)患者肠道菌群中,发现15个基因表达显著差异,Parasutterella的表达在筛选和验证实验中均显著不同,并与慢性肠道炎症相关,因此被认为与IBS的发生和发展有关。
Rnase4作为肠道抗菌蛋白在调节肠道微生物群和代谢物稳态中起关键作用,但在炎症性肠病(IBD)患者的肠道组织和粪便中观察到Rnase4水平降低,与Parasutterella的增加有关。
Parasutterella在小鼠体内定植虽然不会对整体微生物结构有明显影响,但会显著改变肠道代谢物,尤其是色氨酸代谢。
在肠上皮细胞和免疫细胞中表达的吲哚胺-2,3-双加氧酶1(IDO1)通过催化色氨酸转化为犬尿氨酸和其他下游代谢物,在肠道健康中发挥关键作用。这些代谢物具有免疫调节作用,并有助于维持肠道稳态,其产生失衡与IBD有关。
骨质疏松症患者中丰度改变
针对继发性骨质疏松症,研究发现酒精性骨质疏松大鼠厚壁菌门(Firmicutes)/拟杆菌门(Bacteroidetes)比例显著降低;高脂饮食诱导的骨质疏松小鼠肠道中双歧杆菌属(Bifidobacterium)、副萨特氏菌属(Parasutterella)和Odoribacter数量显著减少。
但最新的一项研究又发现了矛盾的结果,通过16S rDNA基因测序分析,发现骨质疏松症患者肠道微生物在属水平上的组成和结构明显不同。其中,uncultured_bacterium_f_Muribaculaceae,Allobaculum和Parasutterella丰度显著升高,Akkermansia显著降低,这可能对骨质疏松症(OP)的进展有显著影响。
其他疾病中的丰度变化
// 便秘患者中丰度增加
Parasutterella丰度与便秘大鼠中的炎症呈正相关。便秘是帕金森病患者常见的非运动症状,并在诊断为帕金森病的患者肠道内表现出升高的丰度,并与神经炎症和运动功能密切相关。
// 急性心肌缺血患者中丰度增加
与正常对照组相比,急性心肌缺血(AMI)患者中Parabacteroides、Butyricimonas、Odoribacter、Escherichia和Parasutterella的相对丰度显著增加。
// 酒精性肝病患者中丰度降低
研究也发现,酒精暴露导致小鼠肠道菌群结构显著改变,表现为Firmicutes丰度增加,Parasutterella丰度减少。这表明肠道菌群在酒精性肝病(ALD)的进程中起关键作用。
// 肾结石患者中丰度降低
肾结石患者中显著降低的菌群有:霍氏真杆菌、多尔氏菌属、啮齿杆菌、厌氧棒菌属、Ruminiclostridium_5、霍尔德曼氏菌属(Holdemania)、Fusicatenibacter、罕见小球菌属(Subdoligranulum)、戴阿利斯特菌属、Parasutterella、嗜胆菌属。
并且肾结石患者肠道中的Parasutterella菌属与血钠浓度呈负相关。
尽管Parasutterella丰度变化可能与某些疾病进展相关,但作为肠道共生菌,它也可能具有一些有益作用,如下所示。
可能降低危重肺炎风险 ↓↓

一项研究探讨了肠道菌群对危重肺炎的影响,分析了大规模肠道微生物群数据(n=18340)和危重肺炎基因组数据(病例n=2758和对照n=428607)。
结果显示,疣微菌科(Verrucomicrobiaceae)、嗜黏蛋白阿克曼菌属(Akkermansia)、Lachnospiraceae FCS020group、Parasutterella属、Prevotella7属和蓝细菌门与重症肺炎风险降低相关,而肠杆菌科、瘤胃球菌属UCG003和一些其他肠杆菌目则与风险增加相关。
影响肾上腺功能

研究表明Parasutterella与肾上腺球状带和束状带的功能之间存在因果关系,这会影响醛固酮和皮质醇水平。
Parasutterella生物学特性的研究发现,它显著调节胆汁酸和胆固醇。胆固醇是类固醇激素合成的主要底物,类固醇激素对肾上腺皮质激素的合成至关重要。胆汁酸还促进肠道对膳食胆固醇的吸收,肝脏中胆固醇的合成与胆汁酸的肠肝循环密切相关。
因此,Parasutterella对胆汁酸和胆固醇代谢的调节作用可能是影响肾上腺皮质激素(醛固酮和皮质醇)水平的重要途径。
对甲状腺疾病的保护作用
此外,还有研究发现Parasutterella对毒性单甲状腺结节(TSTN)的甲状腺毒症具有保护作用。
除了疾病外,其他生理状态或因素也会影响Parasutterella的丰度,我们在此列出了一些调节措施。
◮ 女婴中Parasutterella丰度更高
男婴肠道中的2种菌属——另枝菌属(Alistipes)和Anaeroglobus的平均相对丰度更高;而副萨特氏菌属(Parasutterella)、优杆菌属(Eubacterium)、Peptoniphilus和Anaerosporobacter在女婴肠道中的平均相对丰度更高。
◮ 孕妇肠道中Parasutterella增加
研究发现,在早孕期(孕10~15周),正常健康孕妇的肠道菌群拥有较高的α多样性,门水平主要由拟杆菌门、厚壁菌门和变形菌门组成,拟杆菌门为主要优势菌门;属水平上,主要由较多Parasutterella、Parabacteroides、Megasphaera、Dialister和Ruminococcaceae UCG 002/003/005组成。
◮ 缺乏维生素A会导致Parasutterela增加
维生素A缺乏使毛螺菌属_NK4A136组、颤杆菌的数量减少;然而,Parasutterela呈上升趋势。
◮ 高脂、超加工食品导致Parasutterella增加
与对照组相比,超加工食品组中Parasutterella的丰度更高,而Bacteroidetes和Rosebunia的丰度较低。
此外,与对照组相比,高脂高胆固醇饮食组小鼠Escherichia_shigella、Parasutterella和Allobaculum属相对丰度增加。这可能也是肥胖和2型糖尿病人群中Parasutterella较多的一个原因。
◮ 食用抗性马铃薯淀粉Parasutterella丰度增加

在食用抗性马铃薯淀粉(RPS) 的个体的肠道微生物组中,副萨特氏菌属(Parasutterella)的丰度趋于增加,并且副萨特氏菌的增加与服用RPS而不是安慰剂的参与者的低密度脂蛋白(LDL)水平降低相关。
将低密度脂蛋白(LDL)水平下降的RPS消费个体与没有降低的个体分开,发现低密度脂蛋白应答者在基线和服用RPS 12周后的Parashutterella水平明显较高。
▷ 黄莲解毒汤减少Parasutterella

传统中草药制剂黄莲解毒汤剂(HLJD)临床用于治疗腹泻和结肠炎。2和4g/kg剂量的HLJD通过抑制与集落刺激因子1受体(Csf1r)/Src通路相关的结肠组织中巨噬细胞活性受损来抑制炎症,从而缓解慢性结肠炎。
此外,黄莲解毒配方可以通过减少拟杆菌属、Odoribacter、Clostridium_sensu_stricto_1 和 Parasutterella 的丰度来改变肠道微生物群概况。
▷ 虫草素调节Parasutterella,改善肠道炎症

源自真菌的虫草素(CRD)具有抗炎和抗氧化特性,显示出对抗肥胖的潜力。CRD干预减轻了高脂饮食诱导的肠道炎症,改善了血糖水平,减少了脂肪堆积。
此外,冬虫夏草虫草素补充剂被证明能够通过调节关键代谢物的水平来调节内源性代谢紊乱,包括 DL-2-氨基辛酸、肌醇和6-脱氧法戈明。
虫草素影响了 Parasutterella、Alloprevotella、Prevotellaceae_NK3B31_group、Alistipes、unclassified_Clostridia_vadinBB60_group和 unclassified_Muribaculaceae等重要微生物群的丰度,最终导致内源性代谢的调节和肠道菌群紊乱的改善。
▷ 小麦麸油降低Parasutterella,改善脂肪堆积

麦麸是小麦的副产品,它含有膳食纤维、B族维生素、矿物质、酚类化合物和其他被认为对健康有益的植物化学物质。研究表明,麦麸对预防肥胖、心血管疾病、胃肠道疾病和一些癌症有积极作用
该研究发现小麦麸油(WBO)减少了体重增加、脂肪和脂质积累,并改善了肝脏脂肪变性和炎症。WBO处理增加了Romboutsia和 Allobaculum 的相对丰度,降低了Candidatus_Saccharimonas、Alloprevotella, Rikenellaceae_RC9_gut_group, Alistipes, Parabacteroides、Helicobacter、Colidextribacter 和 Parasutterella 的相对丰度。
▷ 世神丸调节肠道菌群,缓解肾阳虚腹泻
世神丸(SSP)是一种中药处方,通过调节肠道菌群、下调胆碱-三甲胺裂解酶(CutC)活性以及降低TMAO和炎症因子水平,显著缓解肾阳虚综合征腹泻症状。
相关性分析显示,CutC活性与粪杆菌属和Chryseobacterium呈正相关,与Prevotellaceae UCG-001、Rikenella、Acinetobacter、Parasutterella和Lacticaseibacillus呈显著负相关。
TNF-α 水平与Lacticaseibacillus、Prevotellaceae UCG-001、Parasutterella和Candidatus Saccharimonas呈显著负相关。
IL-6水平与Rikenella、Acinetobacter、Prevotellaceae UCG-001、Lacticaseibacillus和 Parasutterella呈显著负相关,并且与Faecalibaculum和Chryseobacterium呈显著正相关。
此外,还存在一些可以降低Parasutterella丰度的措施:
白藜芦醇
白藜芦醇(RSV)处理高脂饮食喂养的小鼠后,Parabacteroides 的丰度增加,而Parasutterella的丰度降低。
阿拉伯半乳聚糖
作为L-半胱氨酸的高消耗者,副萨特氏菌(Parasutterella)的定植可显著增加牛磺酸和N-乙酰蛋氨酸的水平。
而阿拉伯半乳聚糖(LBP-3)治疗显著降低了副萨特氏菌(Parasutterella)的相对丰度,从而降低了半胱氨酸、牛磺酸和炎性细胞因子(如TNF-α和IL-1β)的水平,从而有助于减轻溃疡性结肠炎(UC)的症状。
低FODMAP黑麦面包
一项随机临床试验比较低FODMAP黑麦面包与普通黑麦面包对肠易激综合征患者肠道菌群的影响,结果显示食用低FODMAP黑麦面包减少了拟杆菌、Flavonifractor、Holdemania、Parasutterella和克雷伯菌的丰度,并显示出双歧杆菌增加的趋势。
发酵豆乳
摄入发酵豆乳(FSM)可使Parasutterella、Turisibater和Bacteroide的相对丰度分别降低75%、62%和50%,而有益菌Akkermansiaceae、Lachnospiraceae、Alloprevotella和Dubosella的相对丰度分别增加28%、50%、80%和63%。
在动物实验中,经阿斯巴甜处理后,厚壁菌门和柔嫩梭菌属(Clostridiumleptum)的丰度较高,肠球菌和副萨特氏菌(Parasutterella)的丰度较低。
富含氢气的水(HRW)被发现减少了某些可能的致病性肠道微生物(Frisingicoccus和Parasutterella)。
主要参考文献
Ju T, Kong JY, Stothard P, Willing BP. Defining the role of Parasutterella, a previously uncharacterized member of the core gut microbiota. ISME J. 2019 Jun;13(6):1520-1534.
Henneke L, Schlicht K, Andreani NA, Hollstein T, Demetrowitsch T, Knappe C, Hartmann K, Jensen-Kroll J, Rohmann N, Pohlschneider D, Geisler C, Schulte DM, Settgast U, Türk K, Zimmermann J, Kaleta C, Baines JF, Shearer J, Shah S, Shen-Tu G, Schwarz K, Franke A, Schreiber S, Laudes M. A dietary carbohydrate – gut Parasutterella – human fatty acid biosynthesis metabolic axis in obesity and type 2 diabetes. Gut Microbes. 2022 Jan-Dec;14(1):2057778.
Yan H, Kuerbanjiang M, Muheyati D, Yang Z, Han J. Wheat bran oil ameliorates high-fat diet-induced obesity in rats with alterations in gut microbiota and liver metabolite profile. Nutr Metab (Lond). 2024 Oct 25;21(1):84.
Liu T, Ji H, Li Z, Luan Y, Zhu C, Li D, Gao Y, Yan Z. Gut microbiota causally impacts adrenal function: a two-sample mendelian randomization study. Sci Rep. 2024 Oct 7;14(1):23338.
Su S, Liu T, Zheng JY, Wu HC, Keng VW, Zhang SJ, Li XX. Huang Lian Jie Du decoction attenuated colitis via suppressing the macrophage Csf1r/Src pathway and modulating gut microbiota. Front Immunol. 2024 Sep 26;15:1375781.
Li Y, Fang M, Li D, Wu P, Wu X, Xu X, Ma H, Li Y, Zhang N. Association of gut microbiota with critical pneumonia: A two-sample Mendelian randomization study. Medicine (Baltimore). 2024 Oct 18;103(42):e39677.
Fu Y, Wang Q, Tang Z, Liu G, Guan G, Lyu J. Cordycepin Ameliorates High Fat Diet-Induced Obesity by Modulating Endogenous Metabolism and Gut Microbiota Dysbiosis. Nutrients. 2024 Aug 27;16(17):2859.
Xue S, Shi W, Shi T, Tuerxuntayi A, Abulaiti P, Liu Z, Remutula N, Nuermaimaiti K, Xing Y, Abdukelimu K, Liu W, Gao F. Resveratrol attenuates non-steroidal anti-inflammatory drug-induced intestinal injury in rats in a high-altitude hypoxic environment by modulating the TLR4/NFκB/IκB pathway and gut microbiota composition. PLoS One. 2024 Aug 12;19(8):e0305233.

谷禾健康

胃肠道除了在食物消化和吸收中发挥作用外,还是一个主要的内分泌器官,产生多种生物活性肽和胺类物质,作为肠道激素。
大多数肠道激素来源于肠内分泌细胞,但来源于其他肠上皮细胞类型的生物活性肽也与代谢调节有关。
为什么说肠道激素重要呢?我们在日常生活中胃口好不好都可能与它相关,它能影响食欲和食物摄入,通过影响大脑中的食欲中枢,减轻食欲或刺激饱腹感。
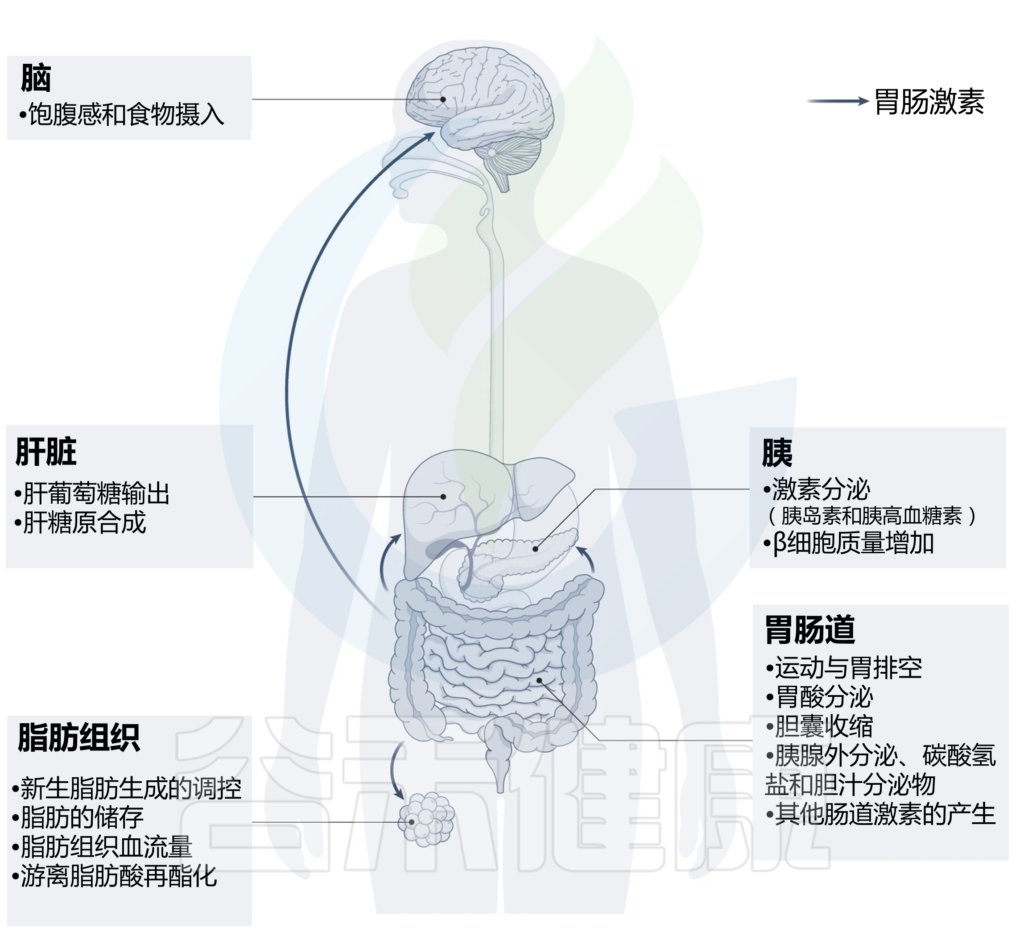
其实,肠道激素在多种器官的多种代谢活跃组织中协调关键的生理过程,包括胰腺、肝脏、脂肪组织、肠道和中枢神经系统等。从局部控制营养吸收和调节肠道生长、肠道运动和液体分泌,到远距离调节胰岛素释放、脂肪细胞功能。
近日,来自英国剑桥大学威康Trust-MRC代谢科学研究实验室团队发表了一篇文章在《Nature Reviews Gastroenterology & Hepatology》期刊,主要讲述了参与代谢调节的肠道激素,讨论了它们在胃肠系统内外的作用。

肠道激素由多种肠内分泌细胞和非肠内分泌细胞产生,它们对不同刺激的反应不同,并分泌特定的激素组合。
肠内分泌细胞通过一系列感觉转运蛋白、离子通道和受体感知各种营养和非营养刺激,使其成为营养吸收和肠道激素反应之间的有效联系。
这些肠道激素信号传导过程可以作为治疗靶点;例如,GLP2受体激动剂用于治疗短肠综合征,并且GLP1受体激动器用于治疗2型糖尿病和肥胖。此外,激素类药物的组合可用于最大限度地提高疗效,同时最大限度地减少不良反应。
因此,深入了解肠道内分泌系统介导的复杂器官间串扰,有助于设计基于或靶向肠道激素及其受体的更有效药物,并将其治疗潜力扩展到肥胖和糖尿病之外的疾病。
肠内分泌细胞沿着胃肠上皮的长度广泛分布。肠道内的一些细胞会分泌一些激素来应对不同的刺激。
■ 肠内分泌细胞可分为两大类:
以前我们认为这些肠内分泌细胞只会分泌单一类型的激素,但现在我们知道,实际上它们通常会同时分泌多种不同的激素,所以它们之间的分泌有一些重叠的部分。
■ 肠道中不同部位的激素表达也会有所不同,如:
肠道特定区域的激素产生与激素的功能作用及其反应的感觉输入有关。
决定肠道不同区域肠内分泌细胞激素特征的因素在很大程度上仍然未知。来自不同肠段的肠道类器官似乎保留了与起源相关的激素特征,这表明肠道干细胞的效力有限。
■ 肠道细胞功能受限的机制与激素分泌的发育演化
然而,随着细胞的发育成熟,肠内分泌细胞的激素特征会发生变化,并沿着隐窝-绒毛轴分化。
举个例子,回肠L细胞在肠隐窝中共表达GLP1和肽YY(PYY),但当这些细胞到达绒毛时,前胰高血糖素转录下调,分泌素转录上调。一旦这些激素分泌出来,它们有两条路:
■ 激素在肠道中的分泌调节及其影响
肠道激素控制多种代谢活性组织的广泛生理过程,包括胰腺、肝脏、脂肪组织、肠道和中枢神经系统。这些激素大多具有不止一种生理作用,许多生理作用由不止一种激素发挥。如下表:
调节新陈代谢的主要肠道激素的特征

Bany Bakar R, et al., Nat Rev Gastroenterol Hepatol. 2023
■ 肠内分泌细胞如何与营养物质密切接触
这就需要我们先来了解一下,肠内分泌细胞的结构特点,大多数肠内分泌细胞是开放型细胞,也就是说它们有一个顶端表面,带有向肠腔延伸的微绒毛,以及一个基底外侧表面,负责在刺激时通过胞吐释放分泌颗粒。
因此,这些细胞与消化和吸收的营养物质直接接触,把它们推向产生肠道激素反应的理想位置,将营养吸收的变化传达给身体其他部位。
它怎么传达呢?
肠内分泌细胞的化学感受能力归因于它们表达一系列感觉转运蛋白、离子通道和受体,这些受体解释了它们对各种营养刺激的反应能力,包括葡萄糖、消化脂质、碳水化合物和蛋白质,以及非营养刺激,如胆汁酸、肠道激素、肠道神经递质,微生物产物和炎性胞质分裂。
■ GPCR——肠内分泌细胞通过其检测营养物质吸收
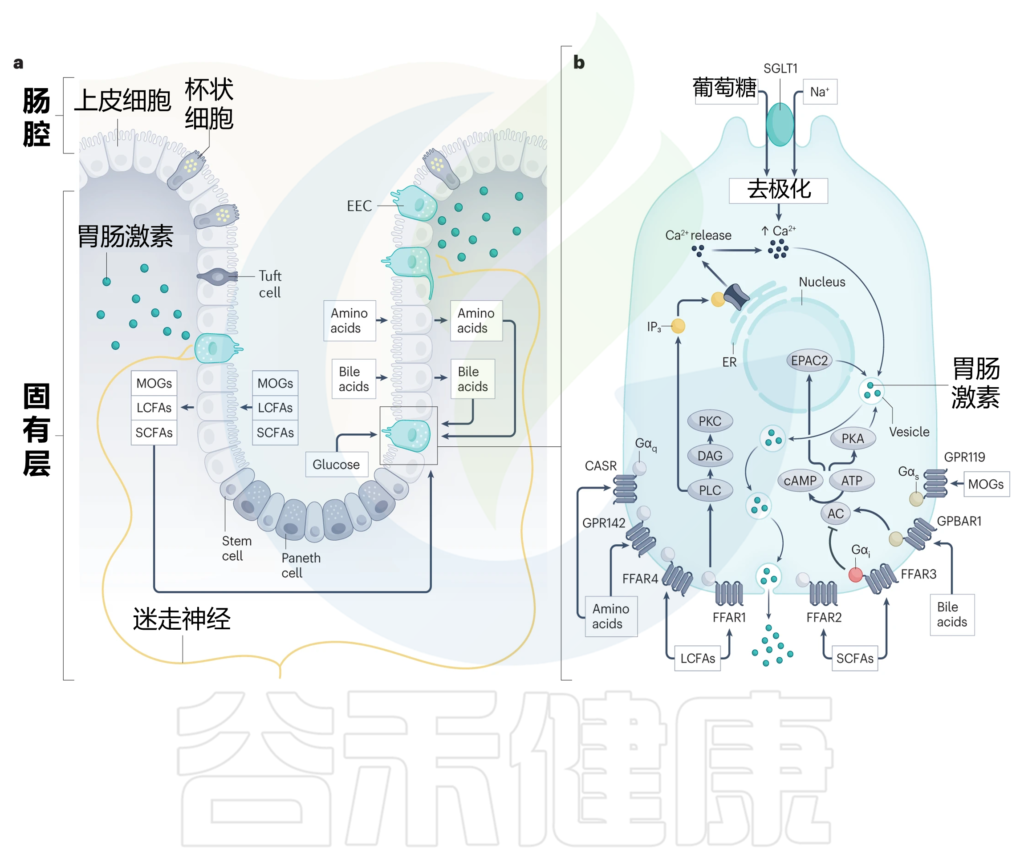
G蛋白偶联受体(GPCR)检测到广泛的营养和非营养刺激,肠内分泌细胞差异表达一系列GPCR,这些GPCR主要位于其基底外侧表面,能够检测出胆汁酸、游离脂肪酸(FFAs)和氨基酸在上皮层内的消化和吸收过程中的变化。
与肠道激素释放密切相关的GPCR包括:
各种脂质感应受体,包括:
相反,葡萄糖在通过顶端膜上的钠偶联葡萄糖转运蛋白SGLT1吸收时激活肠内分泌细胞。SGLT1对钠离子与葡萄糖的共转运直接触发质膜去极化,进而激活电压门控钙通道。由此产生的钙流入进一步使肠内分泌细胞质膜去极化,并启动分泌颗粒的释放(下图)。
调节肠内分泌细胞活性的营养诱导机制
Bany Bakar R, et al., Nat Rev Gastroenterol Hepatol. 2023
肠道激素GDF15、FGF19(小鼠中的FGF15)、鸟苷素和尿鸟苷素不是由肠内分泌细胞产生的,而是由肠细胞和其他上皮谱系产生的。对这些激素生物合成和释放的途径了解相对较少。
肠内分泌细胞衍生的肽激素是由激素原转化酶的活性产生的,这些酶共同储存在囊泡中,囊泡与细胞膜融合以响应分泌刺激;而其他细胞类型中激素的产生则不同,它们并不经过传统的囊泡激素原转化酶和调节的囊泡分泌机制。
■ 肠道激素与二甲双胍疗效的关联
这些激素的生物合成与它们的mRNA水平有关,mRNA对特定刺激有反应。举例来说,FGF19(小鼠中的FGF15)的表达仅限于回肠末端,并通过核法尼糖样受体FXR被胆汁酸上调。在人体中,饭后胆汁释放后90-120分钟内FGF19的循环水平上升。在小鼠中,GDF15在多个器官中表达,但其在肠道中的表达受到细胞应激途径的增加的影响,就像在二甲双胍治疗过程中观察到的那样。实际上,治疗2型糖尿病患者的二甲双胍可能导致循环GDF15水平升高,从而产生该药物减肥效果。
■ Proguanylin:胃切除后水平升高?
Proguanylin在成熟肠细胞、一些杯状细胞和Paneth细胞中表达,在接受胃切除术或肠移植的患者中检测到的循环水平高于健康人。
Proguanylin释放到肠腔中,在那里被切割形成成熟的生物活性鸟苷肽。鸟苷由两个分子内二硫键稳定,这两个键对消化酶提供了一些保护,并从顶端方向靶向上皮膜鸟苷环化酶受体。Proguanylin和 prouroguanylin 也进入血液,但这些形式是如何分泌和激活的尚不清楚。
肠道激素控制许多胃肠道功能,这些功能涉及协调对食物摄入的反应,并确保摄入的食物被有效消化和吸收。
肠内分泌细胞检测管腔内容物的化学成分和局部营养吸收率,以及它们释放的激素控制过程,如胃酸分泌的调节、胃排空、胆囊收缩、胰腺酶和电解质的分泌、肠道运动和上皮屏障功能。
▸ 胃酸分泌
胃中特殊的壁细胞分泌酸有助于食物的消化和矿物质的吸收,并降低胃肠道感染的风险。胃酸的产生受到严格调节,以确保有效的食物消化,而不会损害胃和十二指肠粘膜。
胃窦G细胞分泌的胃泌素作用于肠嗜铬细胞上的胃泌素受体(称为CCKB或CCK2受体),刺激组胺的释放,组胺是一种强效的盐酸促分泌剂。胃窦和胃底D细胞的生长抑素对该系统进行微调,除了直接抑制壁细胞的酸释放外,生长抑素还能抑制胃泌素和组胺的释放。
其他几种肠道激素,包括胆囊收缩素(CCK)、氧调素、PYY和分泌素,通过不完全表征的机制抑制胃酸分泌,并募集涉及生长抑素的旁分泌回路。
▸ 胃排空
胃排空的速度决定了胃内容物输送到十二指肠的速率,并受到各种因素的调节,包括食物特性、肠道神经信号、肠道激素和血糖水平。胃排空率与食物消化率和营养吸收率密切相关,并受到调节,使得胃排空率仅反映小肠消化和吸收所接收营养的能力。
如果胃排空速率超过十二指肠吸收能力,营养物质会进入小肠并触发回肠制动,从而导致胃排空的反馈抑制,从而恢复平衡。主要位于回肠和结肠的肠道激素GLP1和PYY在回肠制动中起主要作用。回肠制动导致食物滞留在胃中,导致胃胀,从而激活发出饱腹信号的机械敏感迷走神经传入神经元。
▸ 胰腺和胆囊功能
一旦胃内容物进入小肠,其他激素就会被吸收以促进消化。由十二指肠 I 细胞产生的CCK刺激胰腺酶分泌,并通过刺激胆囊神经节中传出迷走神经神经递质的释放来促进胆囊排空。
分泌素在各种成熟的肠内分泌细胞中产生,刺激胰腺碱性电解质分泌,也与餐后热遗传学有关。鸟苷激活肠细胞中的鸟苷酸环化酶-cGMP信号,从而触发上皮氯化物和液体分泌。
这种途径被热稳定肠毒素劫持,是它们引发分泌性腹泻的能力的基础。鸟苷素-cGMP信号通路也与结直肠癌的抑制有关。
▸ 肠道运动
幽门以外胃肠道的运动由协调纵向蠕动波的肠神经系统和几种肠道激素之间的相互作用调节。
其中一种激素是胃动素,它存在于人类十二指肠中(尽管啮齿类动物不存在),并在胃中启动迁移运动复合体,特别是在餐间状态。胃动素受体激动剂,如低剂量红霉素,对胃轻瘫有治疗作用,一项研究表明,胃动素接收器的功能缺失变体在胃轻瘫患者中富集。
与调节小肠和大肠运动有关的其他激素包括:
粘膜血清素对肠道运动和液体分泌的重要性受到质疑,因为缺乏产生粘膜血清素所需的色氨酸羟化酶1的小鼠没有强烈的表型。然而,在一个模型中,产生血清素的肠嗜铬细胞被有条件地切除,这一发现强调了这些细胞确实在肠道转运控制中发挥作用。
▸ 肠道功能
除了控制肠道通道外,肠道激素还调节其他重要的肠道过程。例如:
GLP2刺激上皮生长,从而增加给定肠段的吸收能力。这种作用可能有助于GLP2治疗短肠综合征的疗效,
GLP1–GLP2双激动剂更有效。与血清素和神经降压素等其他肠道激素一样,GLP1和GLP2也会影响屏障功能并调节免疫系统。分泌血清素的肠嗜铬细胞与内脏疼痛有关,对肠道炎症、肝脏病理生理学和焦虑具有重要意义。
内 分 泌 胰 腺
我们知道饭后一段时间,人体内胰岛素的分泌量会增加,这其实也跟肠道激素有关。GLP1和GIP是两种主要的肠促胰岛素,占餐后胰岛素分泌的70%。
肠促胰岛素对葡萄糖刺激的胰岛素释放的影响可以通过以下事实来证明:口服葡萄糖比静脉注射葡萄糖(不刺激肠促胰岛素释放)能引起更大的胰岛素分泌——这种效应被称为肠促胰岛素效应。从生理上讲,肠促胰岛素调节对碳水化合物摄入的反应,并确保餐后健康的葡萄糖耐受性,无论摄入的葡萄糖负荷如何。
GLP1和GIP如何增加胰岛素分泌?
GLP1和GIP分别通过直接作用于GLP1受体和GIP受体来增加胰岛素分泌,这两种受体在胰腺β细胞中高度表达。
在β细胞中,GLP1和GIP受体主要募集Gαs并触发cAMP的升高。cAMP影响通过激活蛋白激酶A(PKA)和由cAMP-2激活的交换蛋白(EPAC2)调节胰岛素释放的几种下游途径。这两种效应物都调节离子通道活性以及参与葡萄糖依赖性胰岛素分泌的囊泡运输和融合。
GLP1和GIP具有额外的促胰岛素作用,但两者对肠促胰岛素作用的贡献有争议
GLP1和GIP对β细胞的作用不仅限于调控胰岛素分泌,还包括上调PDX1,促进胰岛素基因转录,增加β细胞质量并通过细胞周期和MAPK的激活促进新生。
基于这些作用,GLP1受体激动剂的长期治疗被认为是2型糖尿病的一种疾病改良治疗方法,可以通过增加或保留功能性β细胞质量来减轻β细胞功能障碍的进展。
注:迄今为止还没有证据表明GLP1受体促动剂调节人类的β细胞质量。
虽然说GLP1和GIP都刺激胰岛素分泌,但它们对胰腺α细胞分泌胰高血糖素的作用相反。
GIP刺激胰高血糖素分泌,而GLP1抑制分泌。
有证据表明,GLP1对胰岛素和胰高血糖素分泌的相反作用都有助于降低血浆葡萄糖。
GLP1通过激活GLP1受体介导的内在(非旁分泌)途径抑制α细胞,从而减少了胰高血糖素的分泌。
然而,其他研究结果表明,GLP1通过涉及胰岛内生长抑素的旁分泌机制间接抑制胰高血糖素的释放,并且GLP1和GIP的不同作用可以通过GIP对α细胞具有强大的直接刺激作用来解释,该作用掩盖了局部生长抑素的抑制作用。
肠促胰岛素的作用通常在2型糖尿病中受损,这种作用是糖尿病的后果而非原因。
在这种情况下,即使GIP的水平是超生理的,其作用也会减弱或缺失,而GLP1的促胰岛素作用相对保留。然而,GIP在2型糖尿病中保留刺激胰高血糖素分泌的能力,这会导致餐后高血糖。在各种研究中,GIP对胰腺β细胞的作用减弱归因于GIP受体表达减少、GIP受体下调或细胞内信号机制的受体后缺陷。
值得注意的是,2型糖尿病患者的血糖正常化提高了对GIP和GLP1的敏感性,这也许解释了为什么在双激动剂药物中在GL1中添加GIP对胰岛素分泌有额外的有益作用。
2型糖尿病是否与GLP1或GIP分泌缺陷有关尚不清楚。对2型糖尿病患者循环GIP水平的研究产生了矛盾的结果——高、低和不变的水平都有报道。相比之下,几项研究表明,2型糖尿病患者在混合餐后GLP1的分泌减少。
总的来说,2型糖尿病对肠道激素分泌的影响显然相对较小,这可能反映了这样一个事实,即:
肠内分泌细胞从隐窝干细胞中不断更新,在不利的代谢条件下,细胞损伤几乎没有时间积累。
然而,2型糖尿病对肠道运动和营养吸收的影响可能通过改变营养和胆汁酸刺激的局部递送而间接影响肠内分泌细胞的释放。
GLP1对胰岛素释放的影响比GIP大,GLP1已被开发为2型糖尿病的主要治疗靶点,并改变了2型糖尿病和肥胖患者血糖控制和体重减轻的临床治疗。
肝 脏
来自动物研究和临床试验的数据强调了GLP1和GLP1受体激动剂对肝脏代谢的多种有益作用。
GLP1受体是否在肝脏中表达有争议:
因此,在将GLP1对肝脏病理和功能的任何观察到的影响归因于肽对肝脏本身的直接影响之前,必须谨慎。
GLP1和GLP1受体激动剂对肝功能的间接作用
GLP1和GLP1受体激动剂对肝功能的间接作用是预期的,因为它们能够刺激胰岛素释放、降低胰高血糖素水平、改善葡萄糖稳态、减少胃肠道中乳糜微粒的产生以及减少热量摄入和体重。GLP1对肝脏影响的复杂性体现在它可以抑制肝脏葡萄糖产生并刺激肝脏葡萄糖摄取的发现上。20世纪90年代发表的研究将这些观察结果归因于胰岛素水平改变的间接影响,但后来的研究表明,胰岛素不是关键因素。
GLP1对肝脏脂质代谢有几种有益作用:
肝脏脂质代谢的这些改善可能至少部分归因于食物摄入的减少和随之而来的体重减轻。然而,一些研究结果表明,GLP1在调节肝脏脂质代谢方面具有额外的直接作用。
GLP1是否具有与体重减轻、胰岛素和胰高血糖素相关的肝脏作用之外的肝脏作用是一个有趣的问题。一项研究令人惊讶地表明,GLP19-36是GLP1的主要循环代谢产物,它独立于胰岛素的变化而抑制肝葡萄糖的产生,当GLP1受体被阻断时,这种作用仍然存在。这种作用的机制尚不清楚。一些证据表明,它涉及一种未鉴定的膜受体的激活,而其他研究结果表明,GLP19–36的降解产物(GLP128–36和GLP132–36)靶向PKA–β-连环蛋白–Wnt信号通路;这些降解产物可以在不涉及特定受体的情况下穿透质膜。需要进一步调查,以澄清和验证所涉及的机制。
无论GLP1对肝脏的有益作用是直接的还是间接的,GLP1受体激动剂正在被研究用于治疗非酒精性脂肪肝(NAFLD),这是肝脂代谢紊乱的最常见的慢性肝病之一。
GLP1受体激动剂:治疗非酒精性脂肪肝的希望
GLP1受体激动剂可以通过多种途径的组合来改善与非酒精性脂肪肝的发作和进展相关的基本代谢变化。
对非酒精性脂肪肝和非酒精性脂肪性肝炎(NASH)小鼠模型的研究表明,GLP1受体激动剂可降低肝脏脂肪含量,逆转脂肪变性,发挥抗炎作用,并改善纤维化的组织学严重程度。
此外,GLP1受体激动剂治疗非酒精性脂肪肝的临床试验(主要包括T2DM患者)产生了有希望的结果。几项研究表明,用GLP1受体激动剂治疗可降低肝脏脂肪含量,导致非酒精性脂肪性肝炎的组织学消退,并减缓纤维化的进展。然而,在这些临床研究中观察到体重和血红蛋白A1c水平显著降低,因此GLP1受体激动剂的作用是否独立于体重减轻和血糖控制的改善仍不清楚。
双激动剂疗法:研究非酒精性脂肪肝的新选择
双激动剂疗法,其中GLP1受体激动剂与直接抑制脂肪酸合成或靶向纤维化的第二分子结合,正在作为非酒精性脂肪肝的治疗选择进行研究;一个例子是GLP1–胰高血糖素组合肽。
其他肠内分泌激素(包括胃饥饿素和胃肠肽)对肝脏的影响尚不清楚。几项研究表明,GIP调节肝脏脂质含量,并可能参与非酒精性脂肪肝的发病机制。然而,GIP是否独立于其对胰岛素和脂肪组织的影响而直接影响肝脏中的脂质积聚(见“脂肪组织”)仍存在争议,因为GIP受体在肝脏中的表达仍未得到证实。几项动物研究表明,GIP信号传导的遗传或药理学破坏可以减少肝脏脂质积聚,但这些干预措施也可以防止饮食诱导的体重增加,因此研究结果不能证明GIP对肝脏有直接作用。
FGF19的多重代谢作用
与肠内分泌细胞衍生的肽不同,FGF19(小鼠中的FGF15)在回肠末端上皮中对胆汁酸吸收产生反应,是调节肝胆汁酸生物合成的重要抑制性反馈回路的基础。它还通过激活肝糖原合成和抑制糖异生等途径具有更广泛的代谢作用。
在不同器官中由肠道激素调节的过程
Bany Bakar R, et al., Nat Rev Gastroenterol Hepatol. 2023
脂 肪 组 织
脂肪细胞是哺乳动物的主要燃料储存室,它们的调节可以产生重要的代谢后果。在肠内分泌激素中,GIP与脂肪细胞功能的关系最为密切。
GIP与脂肪细胞功能:代谢调节的关键
几项研究表明,GIP促进白色脂肪组织(WAT)中的脂质储存,包括在大鼠中观察到,GIP通过增加脂肪组织葡萄糖摄取、从葡萄糖重新生成脂肪和将FFAs重新酯化为甘油三酯来支持脂肪组织中的脂质存储,以及在小鼠中敲除GIP受体可以预防饮食诱导的肥胖。
几项研究表明,脂肪组织中的GIP受体激活与胰岛素协同作用,增加脂质积累、葡萄糖摄取、新生脂肪生成和FFA再酯化。
脂肪细胞中的GIP受体类型:研究争议与需解决的问题
然而,这些发现需要在脂肪组织中哪些细胞类型表达GIP受体的争议中进行解释。单核转录组学表明,GIP受体不在成熟脂肪细胞中表达,而是在周细胞和间充质细胞中表达。考虑到许多脂肪细胞模型是由可以表达GIP受体的未成熟细胞在体外产生的,这些模型中的GIP受体表达是否能概括天然成熟脂肪细胞中的表达值得怀疑。
另一个必须考虑的因素是,GIP受体与Gαs偶联,Gαs下游cAMP水平升高通常与脂解而非脂肪生成有关,例如β3-肾上腺素能受体激活的脂解作用。
GIP的脂肪生成作用有益,改善脂质储存,减少异位脂肪积聚
有趣的是,GIP受体在小鼠和人类脂肪组织周细胞中表达的发现与GIP在体内显著增加脂肪组织血流量的证据一致,这一过程可以间接促进胰岛素依赖性作用,比如:清除甘油三酯、摄取葡萄糖。
无论潜在机制如何,GIP的脂肪生成作用都是有益的,因为它改善了白色脂肪组织中健康的长期脂质储存,减少了肝脏、心脏和胰腺等外周组织中的脂质溢出和异位脂肪积聚。
在2型糖尿病和肥胖的GLP1受体激动剂上添加GIP受体激动剂的代谢益处
早期的研究表明,GIP纯粹是致肥胖的,因此有利于GIP拮抗作用的翻译策略来实现减肥,而自从2018年以来发表的研究表明双重GIP受体-GLP1受体激动剂,替西帕肽在2型糖尿病患者中实现血糖控制和减轻体重方面比单独使用任一受体的激动剂更有效,该治疗改善了白色脂肪组织健康。替西帕肽治疗显著降低了肝脏脂肪含量以及内脏和皮下脂肪组织的体积,因此可能成为非酒精性脂肪肝或非酒精性脂肪性肝炎的重要治疗选择,尤其是在同时患有2型糖尿病或肥胖的患者中。
然而,对于是激动还是拮抗GIP受体,仍存在不清晰性;强有力的证据表明,任何一种方式都可以减轻肥胖和体重。
注:已经提出了几个假设来调和这些自相矛盾的观察结果,但还需要更多的研究来澄清这一领域。
尽管GIP在肠道白色脂肪组织轴中的确切作用机制仍有争议,但GIP在脂肪组织中的生理作用是明确的。在啮齿类动物中,棕色脂肪细胞组织(BAT)中GIP受体的表达已得到充分证实,给予GIP或替西帕肽可促进产热;替西帕肽也与支链氨基酸分解代谢增加有关。
然而,小鼠棕色脂肪细胞组织中GIP受体的条件性敲除并不能像全局敲除GIP受体那样防止饮食诱导的肥胖,这表明GIP对棕色脂肪细胞组织的影响在生理上并不是主要的。那主要的会是什么呢?
其他激素在肠道棕色脂肪细胞组织轴中发挥重要作用
例如,血清素抑制棕色脂肪细胞组织活性,而缺乏血清素产生所需的色氨酸羟化酶1的小鼠可以免受饮食诱导的肥胖。然而,鉴于血浆5-羟色胺是由血栓细胞缓冲的,肠道来源的5-羟色胺的内分泌作用值得怀疑,而且关于血浆5-羟色胺水平相对于用餐时间的日变化的报道一直不一致。相反,分泌素激活棕色脂肪细胞组织,这种激活与食欲的改变有关。
脑
肠-脑轴是胃肠道和大脑之间传递信息的渠道,包括神经、激素和营养信号;下丘脑核团和后脑是检测和整合这些外周信号的主要中心。肠-脑轴的紊乱已在多种疾病中被发现,包括炎症和功能性胃肠道疾病以及饮食障碍。
肠道激素在大脑的作用可以解释一些饮食失调和进食障碍的发生?
肠道向大脑发送关于饮食营养摄入状态的实时信号,肠道激素是肠道和大脑之间复杂相互作用的主要介质,这些相互作用是饱腹感(两餐之间不饿的感觉)和饱足感(一餐结束时吃得足够的感觉)的基础。许多肠道肽及其受体也在中枢神经系统中表达,并调节中枢回路,包括与食欲有关的回路。这种在中枢神经系统中的表达可能会使涉及肠道激素受体的药理学或全局遗传操作的研究的解释复杂化,因为其结果可能归因于对中枢神经系统回路的影响,而与肠道分泌的激素无关。
传入迷走神经神经元的细胞体位于结节神经节,并投射到孤束核(NTS),是介导肠道激素对食物摄入影响的主要途径。肠内分泌细胞通过局部升高的肠道激素水平以及可能的突触连接与传入迷走神经和内脏神经末梢进行交流。到达心室周围器官(例如,脊后和正中隆起区)和邻近细胞核(分别为下丘脑的NTS和弓状核)的循环肠道激素与这些信号汇合,以调节进食行为。几种肠道激素对大脑有着重要而独特的影响,下文将对此进行讨论。
CCK是在食欲调节中发挥作用的肠道激素。餐后释放CCK通过与CCK1受体结合激活传入迷走神经,向大脑提供反馈信号,从而减少进食。然而,根据小鼠研究,反馈信号的性质仍不清楚,因为动物可能因各种原因停止进食。在人类中,输注生理浓度的CCK可以抑制能量摄入并增加幽门收缩,而不会引起恶心;食物摄入减少被认为是幽门收缩的结果。在小鼠中,CCK通过传入迷走神经发出信号,激活中枢奖赏通路,并增加脂肪和糖的消耗。
CCK似乎会触发相对短暂的饱腹信号,PYY与餐后食物摄入的长期抑制有关。已知PYY的两种不同形式:PYY1-36和PYY3-36。PYY1–36通过二肽基肽酶IV转化为PYY3–36。两种形式的PYY都参与调节食物摄入,但它们表现出不同的特性和受体偏好。
GLP1和GLP1受体激动剂可以抑制食欲
GLP1受体激动剂主要通过作用于中枢神经系统内的GLP1受体来抑制食物摄入,但肠道来源的GLP1在大脑中是否达到足够高的水平以在生理条件下激活GLP1受体仍不清楚。
几项研究表明,迷走神经传入神经元的末端暴露于胃肠道中高水平的局部生物活性GLP1,介导内源性肠道衍生的GLP1的饱腹作用。
肠道来源GLP1控制食物摄入——不是主要的
在小鼠中,迷走神经神经元表达GLP1受体,而且响应机械刺激,外源性GLP1也可以增强由胃和肠道拉伸引起的饱腹感。然而,敲除肠道来源的GLP1不会影响小鼠的食物摄入或体重,这表明肠道来源的GLP1对控制食物摄入并不重要。
脑源性GLP1控制食物摄入——明显作用
虽然去除后脑GLP1表达也不会影响自由进食行为,但当化学遗传学激活时,它确实削弱了表达GLP1的神经元减少进食的能力,证明了脑源性GLP1在控制食物摄入方面的明显作用。
GLP1受体与氧调素的互动:探索胰岛素类似物的潜力
GLP1受体也被氧调素激活,氧调素是一种由肠道L细胞分泌的37个氨基酸的略微延伸的胰高血糖素类似物,在胰岛素受体处也具有活性。氧调节蛋白在体重管理和葡萄糖稳态方面具有有益作用,这一作用正开始通过使用GLP1受体和胰岛素受体双激动剂而得到利用;鉴于目前还没有发现特异性的尿囊素受体,这些作用被认为是由其对这两种受体的双重作用介导的。
减肥手术后,餐后GLP1、氧调节蛋白和PYY水平显著升高;循环水平足以对食物摄入和葡萄糖耐受性产生有益影响。然而,在小鼠中,Roux-en-Y胃旁路术的减肥作用在缺乏神经肽Y受体2型和GLP1受体的动物中仍然存在,这表明这些激素作用之外的机制也有助于减肥手术的益处。
神经降压素也与减肥手术的效果有关
神经降压素(Neurotensin)是一种13个氨基酸的肽,主要存在于大脑和胃肠道中。在啮齿类动物中,神经降压素直接进入大脑时会减少食物摄入,这种作用主要由NTSR1(神经降压素受体1)介导。
在一些研究中,Ntsr1敲除小鼠食欲增加,体重增加,对神经降压素的食欲抑制作用没有反应。
然而,在其他研究中,Ntsr1敲除降低了进食量并增加了活性,但对体重或组成没有影响。
脑源性神经降压素抑制食欲,外周的神经降压素对代谢的影响尚不清楚
一些研究表明,神经降压素的外周给药会导致啮齿动物的食物摄入量暂时减少。一些证据表明,这种影响可能归因于肠道中脂肪吸收的减少,但减少进食的确切机制尚不清楚。
另一种与减肥手术结果有关的激素是分泌素,因为它在手术后的餐后水平也会升高,尽管它在这些患者中的生理重要性尚不清楚。
来自非肠道内分泌细胞的肠道激素(GDF15、FGF19、uroguanylin)似乎也通过中枢途径调节食欲的作用。
最有力的证据是GDF15,它靶向后脑中有限的神经元群体,并导致由一系列毒性刺激(如化疗剂)诱导的恶心,这种恶心发生在癌症恶病质和妊娠剧吐中。
GDF15反应神经元表达GDF15受体,即GFRAL,并与脑干GLP1受体和CCK回路密切相关。有趣的是,GIP可以通过表达GIP受体的海马后区GABA能神经元抑制GDF15(和其他肠道激素,包括GLP1和PYY)引起的恶心。
Ghrelin:非凡食欲刺激者
胃饥饿素(Ghrelin)是唯一被广泛接受的刺激食物摄入的肠道激素。根据这种生物活性,血液中胃饥饿素的水平在用餐前升高,在进食后下降。
其生物学效应是通过生长激素促分泌受体(GHSR)介导的,GHSR存在于全身,包括胰腺、迷走神经传入神经元和大脑。几项研究表明,Ghrelin通过在下丘脑弓状核的中央和迷走神经传入神经的外周发挥其食欲产生活性。
然而,后一种机制是有争议的,一些研究表明,胃饥饿素的食欲产生作用不需要迷走神经传入信号。一些研究表明,胃动素也能促进食物摄入,但胃动素的生理学特征很差,因为它不存在于啮齿类动物中。
注:胃动素是一种与胃饥饿素有关的肽,由十二指肠中重叠的肠内分泌细胞群体产生。
INSL5:微弱但可能的食欲促进者
INSL5由远端结肠和直肠L细胞的一个子集分泌,对小鼠的研究表明它它具有食欲促进作用。它通过RXFP4(松弛素-胰岛素样家族肽受体4)发挥作用,该受体在大脑的关键进食中心表达。
INSL5的增食欲作用远低于胃饥饿素,这在一些研究中没有观察到,并且可能在体内被PYY所淹没,PYY是从相同的肠内分泌细胞平行分泌的。这些观察结果让人怀疑外周释放的INSL5是否在控制食物摄入方面具有重要的生理作用。然而,一项研究已经确定了腹内侧下丘脑中表达RXFP4的神经元在调节食物摄入和偏好方面的潜在作用。
胃肠道和身体其他活跃的组织之间有着双向的信息传递,而这个信息传递的改变与多种代谢性疾病有关。目前对于胃肠激素如何与这个复杂的调节网络相互作用的理解正在逐渐加深,但仍需要进一步的研究来完全揭开这个谜团。
肠道菌群的异常变化可能影响肠道激素的正常分泌,从而导致代谢相关疾病发生。因此,肠道菌群的稳定和平衡对于保持肠道激素的正常分泌和代谢健康非常重要。这些发现为我们深入了解肠道菌群和肠道激素的相互作用、开发相关治疗方法提供了新的方向。通过调节肠道菌群的结构和功能,我们可能能够干预肠道激素的分泌,从而实现对代谢相关疾病的治疗和预防。
通过开发创新、微创且耐受性良好的治疗方法,我们可以利用胃肠激素受体的转化潜能。GLP-1双重和三重激动剂疗法的临床试验已经证明了这种方法的价值。这个领域研究进展迅速,很可能会进一步细化现有的认识,解决关键的机制问题。期待揭示出胃肠激素控制的多个信号通路,可以成功地用于治疗2型糖尿病和肥胖,并且将这些基于胃肠激素的药物在其他代谢性疾病中推广应用。
主要参考文献:
Bany Bakar R, Reimann F, Gribble FM. The intestine as an endocrine organ and the role of gut hormones in metabolic regulation. Nat Rev Gastroenterol Hepatol. 2023 Aug 25.

谷禾健康

Dorea菌属于厚壁菌门毛螺菌科,广泛存在于人体肠道内,谷禾数据显示该菌在人群的检出率超89%。该菌最早也是从人体粪便中分离出来。
“Dorea” 目前没有一个确定的译名,Dorea是以法国微生物学家 Joel Doré 的名字命名,以表彰他对肠道微生物学的诸多贡献。
该菌是一类革兰氏阳性厌氧菌,主要存在于人类和动物的肠道中,可以利用多种底物进行发酵代谢,包括葡萄糖、果糖、乳糖和芳香族化合物等。
它可能通过诱导Treg并抑制Th17细胞的分化和功能,从而调节肠道免疫反应,维持肠道黏膜屏障的完整性和稳定性。
编辑
图源:microbiomology
Dorea菌在肠道微生态系统中的丰度和分布受到多种因素的影响,如年龄、饮食、生活方式、疾病等。在不同年龄段、不同饮食类型和不同疾病状态下存在差异,这可能与其在肠道内的营养代谢、免疫调节和菌群相互作用等方面的作用有关。
在多发性硬化症、炎症性肠病患者,甚至结直肠癌、自闭症谱系障碍以及肥胖人群中的Dorea菌高丰度富集,被认为具有促炎作用。
多数研究证实Dorea与体重指数 (BMI)、腰围和舒张压呈正相关。基线肠道内富含高丰度的Dorea菌的人群,在减重方面更困难。
然而Dorea菌在抑郁患者和患有食物过敏人群中减少,研究还表明Dorea菌可以预防或治疗过敏性鼻炎。
相较于其他的肠道重要菌属,关于Dorea 的研究资料相对有限,本文将根据该菌相关的研究结果以及检测实践数据来综合分享该菌的相关信息和健康特性及其干预措施。
该菌是不形成孢子、革兰氏染色阳性、不运动、专性厌氧的菌。葡萄糖代谢的主要终产物是乙醇、甲酸盐、乙酸盐、H2 和 CO2。不产生丁酸盐。DNA G+C 含量 (mol%):40–45.6 (Tm)。
该属的代表菌种是Dorea formicigenerans,是肠道中主要的产气菌,能够利用碳水化合物,这也是一些肠病和部分肥胖患者会伴随腹胀气的原因之一。另外还有Dorea longicatena也比较常见。
该菌属包括目前已经鉴定的常见种包括以下:
Dorea菌与肠道微生态系统中的其他菌群之间也存在着复杂的相互作用。一些研究表明,Dorea菌与Bacteroides、Faecalibacterium等菌群之间存在着协同关系,可以相互促进代谢产物的生成和利用,从而维持肠道微生态系统的平衡和稳定性。
此外,青春双歧杆菌和长双歧杆菌可以降低或抑制Dorea的丰度。
该菌作为肠道重要菌属,其与其它肠道菌群互作如下,仅供参考:
<来源:谷禾健康数据库>
➩ 非酒精性脂肪型肝炎
患有脂肪变性或非酒精性脂肪型肝炎(NASH)的儿童伴随着更高丰度的Dorea和Ruminococcus 菌属。
线粒体功能障碍,连同氧化应激和肠道菌群改变据信能够促进非酒精性脂肪型肝炎的进展。
证据表明非酒精性脂肪性肝病(NAFLD)会破坏肠-肝轴,将野生型和甲基化控制的J蛋白敲除(MCJ-KO)小鼠喂食6周的高脂饮食 (CDA-HFD),小鼠的Dorea属及Oscillospira属较WT小鼠高;研究结果阐明了MCJ-KO的特定菌群谱,表现为Dorea和Oscillopira菌属的粪便相对丰度增加,以及Allboaculum和Ruminococcus菌属的减少。
这些菌通过增强短链脂肪酸、烟酰胺腺嘌呤二核苷酸(NAD+)代谢和sirtuin(长寿蛋白)的活性,增加了无菌小鼠的脂肪酸氧化来发挥肝脏保护作用。值得注意的是,该研究强调Dorea菌属及其相关代谢产物是这种菌群依赖性保护表型的主要调节剂。
研究者进一步利用公共数据库进行分析:通过一组肝硬化患者的数据,将患者根据体重指数(BMI)分为肥胖(BMI≥30;n=71)和非肥胖(BMI<30;n=121),有趣的是,在非肥胖受试者的子集中,粪便Dorea的丰度显著降低(p=0.026),而在肥胖患者中未观察到显著差异(p=0.636)。
这些发现可能表明瘦型非酒精性脂肪型肝炎患者的肠道菌群组成发生了特定变化,特征表现为Dorea菌属的减少。
➩ 超重和肥胖
肠道菌群被认为在超重和肥胖的发展中发挥重要作用,但能量限制(特别是长期)对超重和肥胖成年人肠道微生物群的影响。发表于Genome Medicine的一项研究发现,基线时Dorea菌属丰度较高可能与随后难以减掉体重有关。
宏基因组研究也表明,Blautia,Dorea和Mediterraneibacter属的增加可能促成宿主肥胖。
Dorea formicigenans 和 Dorea longicatena 在超重/肥胖人群中的丰度更高。
基线Dorea的丰富对随后的体重减轻有适度的预测作用。
Dorea丰度与肥胖呈正相关,在糖尿病前期患者中发现其丰度增加。Dorea丰度的变化与粪中戊酸水平的变化呈负相关。Dorea高丰度可以降低产短链脂肪酸菌的丰度,导致粪便中包括戊酸在内的短链脂肪酸水平降低。
➩ 2型糖尿病
2型糖尿病患者肠道菌群中产丁酸菌减少,而潜在致病菌增多。糖尿病前期患者肠道菌群也有相应的变化:梭菌属和黏蛋白降解菌AKKermansia显著减少。此外,Dorea菌属、瘤胃球菌属和链球菌属增多。
➩ 肠易激综合征
在肠易激综合征受试者中,与健康对照组相比,观察到肠道微生物群,肠杆菌科、瘤胃球菌、梭菌、Dorea物种增加。
➩ 肿瘤息肉
肠道微生态系统组成变化与大肠肿瘤密切相关:与无腺瘤性息肉患者相比,腺瘤性息肉患者肠道微生态中拟杆菌比例相对降低,而变形菌比例相对较高,Dorea菌属及志贺菌属比例升高。
➩ 结直肠癌
结直肠癌患者中Dorea和Porphyromonas增加同时Catenibacterium和Prevotella减少的细菌属被证明产生了最准确的预测效果。Dorea在结直肠癌患者的粪便样本中比在健康对照者的粪便样本中更丰富。Dorea菌具有粘附癌细胞的能力,这可能赋予Dorea在癌性结直肠环境中的竞争优势。Dorea菌的机会主义能力带来潜在致癌作用。
➩ 牛皮癣
牛皮癣患者肠道菌群中的Ruminoccocus gnavus, Dorea formicigenerans, Collinsella aerofaciens丰度显著增加。
➩ 自闭症
与健康对照组相比,自闭症孤独症谱系障碍儿童中毛螺菌科的数量有所增加。毛螺菌科由大约几十个异质属组成。
众所周知,毛螺菌科成员中的许多属甚至可以主宰肠道微生物群,包括Dorea、Blautia、Lachnospira、Coprococcus、Roseburia和Ruminococcus。毛螺菌科成员具有广泛的代谢功能,包括合成短链脂肪酸(包括丁酸盐)、粘蛋白降解以及糖和芳香族氨基酸代谢。他们的生态失调与许多其他慢性疾病有关,例如炎症性肠病、肾脏疾病、肝脏疾病和神经行为疾病等。
➩ 过敏性鼻炎
过敏性鼻炎 (Allergic rhinitis,AR)是特应性个体接触环境中变应原后,通过IgE介导的多种细胞因子及炎性介质参与的鼻腔黏膜慢性非感染性炎症。发现过敏性鼻炎患儿的粪便Dorea菌、Dialister菌和组氨酸水平显著降低,而其差异代谢物与差异菌群无明显关联。
进一步研究发现Dorea和Ralstonia与淋巴细胞模式(Th2/Treg 比率)密切相关。有趣的是,Dorea和Ralstonia与淋巴细胞模式呈负相关:Th2/Treg 比率与Dorea呈负相关, 但与Ralstonia呈正相关。
在儿童早期,Dorea菌与屋尘螨特异性 IgE 水平呈负相关,并且似乎对过敏性鼻炎更具特异性。由于Dorea属与过敏的持续关联,因此Dorea菌丰度的改变可能通过改变对屋尘螨的过敏性致敏作用的发展,来预防或治疗过敏性鼻炎。
➩ 食物过敏
厚壁菌门的Dorea属与婴儿期的食物致敏和食物过敏呈负相关。
研究表明提出婴儿双歧杆菌(Bifidobacterium Infantis)可能通过增加Dorea和减少Ralstonia来减轻 Tm 引起的过敏反应。Dorea可能有助于诱导 Treg 并抑制 Tm 诱导的过敏反应。
注:Tm 是指过敏原(allergen)或致敏物质(sensitizing agent)。
另外一项为期 3 年的后续研究表明,Dorea在后来发生食物致敏或食物过敏的婴儿的肠道微生物群中减少,因此表明Dorea可以防止食物致敏和食物过敏。
➩ 与肠道内肠道辅酶NAD正相关
Dorea相对丰度与肠道NAD总水平呈正相关。肠道NAD指的是肠道内的辅酶NAD(nicotinamide adenine dinucleotide)分子。NAD是一种重要的辅酶,在细胞中发挥着多种重要的生物学功能,包括能量代谢、DNA修复、信号转导等等。肠道内的NAD含量和代谢状态对肠道黏膜屏障的维护、肠道免疫和菌群平衡等方面都有着重要的影响。最近的研究表明,肠道NAD水平的改变可能与多种肠道相关疾病的发生和发展有关。
➩ 心力衰竭
此外,个别研究发现直肠真杆菌和Dorea longicatena在心力衰竭患者肠道微生物群中的含量低于健康受试者。
➩ 抑郁、睡眠
重度抑郁症是一种常见的精神疾病。研究结果显示属水平上,Dorea菌与抑郁和睡眠质量同时相关。压力诱导 Dorea, Coprococcus等菌群显著变化。
Dorea在抑郁症患者中减少,患有睡眠障碍的重度抑郁症患者的Dorea formicgenerans减少。
在属水平上,摄入 3 g/d HMW β-葡聚糖会增加拟杆菌,但会减少 Dorea (P < 0.1)。
大麦干预具有更高丰度的 Akkermansia、Blautia 和 Bilophila,同时减少 Parabacteroides和 Dorea。
属于厚壁菌门的 Dialister、 Dorea 、Pseudobutyrivibrio 和 Veillonella 在使用L-谷氨酰胺后显着减少。
补充维生素D,肠道内Dorea相对丰度降低。
补充硫酸铁(口服)导致 Dorea菌物种的丰度降低。
低聚半乳糖 (GOS) 补充显示Dorea减少。
补充益生元(低聚果糖FOS 和菊粉混合物)显示 Dorea 丰度较低。
Bifidobacterium longum 增加Dorea菌。
喂食鼠李糖乳杆菌hsryfm 1301或其发酵乳28天后,大鼠的肠道微生物群和血脂得到改善。血脂与瘤胃球菌、Dorea、Enterococcus呈正相关(P<0.05)。
刺梨(RRT)的果实可食用,被认为是具有降脂作用的药用果实。12 周刺梨降低 Dorea和Coprobacillus 丰度,并促进双歧杆菌和Roseburia 丰度,来逆转高脂饮食诱导的肠道生态失调。
芒果 ( Mangifera indica L.) 果皮是工业加工获取果汁和浓缩物的副产品,富含多酚和膳食纤维。将预先消化的芒果皮提交给人类结肠的动态体外模型。Dorea属在芒果果皮发酵中的含量为 6.69%。
在抗生素(阿莫西林、四环素和甲硝唑)治疗 2 周后,Dorea formicgenerans,Eubacterium rectale的丰度下降。
白藜芦醇有效降低了Akkermansia、Dorea、Sutterella和Bilophila菌属的丰度 。
在高蛋白饮食后,Dorea会随着 BMI 的降低而降低。
Dorea菌属可以利用多种底物进行发酵代谢,包括葡萄糖、果糖、乳糖和芳香族化合物等。因此,调节饮食结构可以影响Dorea菌属的生长和代谢。
摄入动物性饮食五天后,肠球菌科、肠球菌属和 Dorea属的细菌在蠕虫感染中表现出丰度增加的趋势。
高纤维、低脂肪的饮食有利于增加Dorea菌属的丰度和多样性。
富含可发酵碳水化合物的饮食支持相对丰富的双歧杆菌、普雷沃氏菌属、瘤胃球菌属、Dorea 、 Roseburia 等。
果胶是一种水果蔬菜中发现的复杂的膳食纤维和益生元。果胶摄入增加Lachnospira、Dorea和Clostridium,其中Lachnospira的增幅最大。
中等强度的运动干预持续 3 个月后,亚阈值抑郁症的年轻青少年的肠道菌群发生变化,在属水平上增加了Coprococcus、Blautia、Dorea、Tyzzerella 、Tyzzerella nexilis 的相对丰度。
注:中等强度的运动,包括每天跑步 30 分钟,每周 4 天。
结 语
当谈到Dorea菌时,虽然仍有许多未知的领域,但我们已经取得了一些重要的研究进展。Dorea菌在肠道微生物组中扮演着重要的角色,与人类健康密切相关。它们能够帮助维持肠道菌群的平衡,支持营养物质的吸收和消化,并且可能对肥胖、炎症性肠病、自身免疫疾病等疾病的发生和发展起到重要作用。
然而,关于Dorea菌的研究仍然处于起步阶段。我们需要研究更多的样本、更多的群体,并使用更多的技术手段来深入了解这些菌属的作用机制。相信随着微生物组研究的不断深入,我们将能够更好地理解Dorea菌和其他肠道菌属对人类健康的影响,并开发更加个性化的干预管理方案。
主要参考文献:
Chaput N,Lepage P,Coutzac C et al. Baseline gut microbiota predicts clinical response and colitis in metastatic melanoma patients treated with ipilimumab.[J] .Ann Oncol, 2019, 30: 2012.
Sowah SA, Milanese A, et al., Calorie restriction improves metabolic state independently of gut microbiome composition: a randomized dietary intervention trial. Genome Med. 2022 Mar 14;14(1):30
Juárez-Fernández M, Goikoetxea-Usandizaga N, Porras D, García-Mediavilla MV, Bravo M, Serrano-Maciá M, Simón J, Delgado TC, Lachiondo-Ortega S, Martínez-Flórez S, Lorenzo Ó, Rincón M, Varela-Rey M, Abecia L, Rodríguez H, Anguita J, Nistal E, Martínez-Chantar ML, Sánchez-Campos S. Enhanced mitochondrial activity reshapes a gut microbiota profile that delays NASH progression. Hepatology. 2023 May 1;77(5):1654-1669.
Zhang Q, Yun Y, An H, Zhao W, Ma T, Wang Z, Yang F. Gut Microbiome Composition Associated With Major Depressive Disorder and Sleep Quality. Front Psychiatry. 2021 May 21;12:645045.
Dahl WJ, Rivero Mendoza D, Lambert JM. Diet, nutrients and the microbiome. Prog Mol Biol Transl Sci. 2020;171:237-263.
Chen D, Yang Z, Chen X, Huang Y, Yin B, Guo F, Zhao H, Zhao T, Qu H, Huang J, Wu Y, Gu R. The effect of Lactobacillus rhamnosus hsryfm 1301 on the intestinal microbiota of a hyperlipidemic rat model. BMC Complement Altern Med. 2014 Oct 10;14:386.
Tangestani H, Boroujeni HK, Djafarian K, Emamat H, Shab-Bidar S. Vitamin D and The Gut Microbiota: a Narrative Literature Review. Clin Nutr Res. 2021 Jul 20;10(3):181-191.
Wang R, Cai Y, Lu W, Zhang R, Shao R, Yau SY, Stubbs B, McIntyre RS, Su KP, Xu G, Qi L, So KF, Lin K. Exercise effect on the gut microbiota in young adolescents with subthreshold depression: A randomized psychoeducation-controlled Trial. Psychiatry Res. 2023 Jan;319:115005.

谷禾健康
2型糖尿病是一种血糖水平升高(高血糖)的慢性代谢疾病,主要由胰岛素抵抗和胰岛素分泌不足引起。2型糖尿病全球患病率在不断上升。
截止到2020年,根据美国糖尿病学会评估标准,糖尿病患病率已达到12.8%。其实在我国成年人中,已经有将近一半的人存在血糖异常,未来极有可能发展为2型糖尿病。如果不加干预治疗,会引发许多不良后果。
很多研究表明,肠道菌群在宿主的代谢和疾病状态中起着重要的作用。特别是2型糖尿病,其病因复杂,包括肥胖、慢性低度炎症,受肠道微生物群和微生物代谢产物的调节。
本文将从肠道菌群的角度了解其与2型糖尿病的关系;肠道菌群及其代谢物对葡萄糖代谢、免疫系统的影响;
从影响肠道菌群变化的因素来了解各种干预措施,包括药物,饮食,益生菌/益生元,粪菌移植,间接性禁食等方式。
葡萄糖主要通过食用的食物和饮料进入人体。胰腺会产生一种叫做胰岛素的激素,以帮助血液中的葡萄糖进入肌肉、脂肪和肝脏,用作能量。
胰岛素通过血液循环进入不同组织。组织大多数细胞表面有一种结构,叫胰岛素受体。当胰岛素流过时,会附着在胰岛素受体上,就像钥匙打开锁一样,糖可以进入细胞内,细胞获得能量维持正常运作,血液中糖分就会回落到正常水平。
在2型糖尿病患者身上,细胞对胰岛素没有反应,这种情况就叫胰岛素抵抗。胰岛素没有了“钥匙”的作用,不能有效开启细胞上的“锁”,或者“锁”的数量也减少了,由此,糖分就不能进入细胞有效利用,被挡在了细胞外面,只好在血液中积累,血糖就升高了。
刚开始的时候,胰腺会觉得自己使不上力,于是不甘心开始拼命工作,产生更多的胰岛素来克服这种抵抗。
随着时间的推移,胰腺开始累了,力不从心,不能产生更多的胰岛素,这时候就是2型糖尿病开始了。
肠道微生物群可以直接或间接地影响人类健康,肠道微生物群失调可能会增加促炎疾病的患病率,如肥胖、炎症性肠病、2 型糖尿病、关节炎和癌症。
2型糖尿病人群中个体微生物群的差异
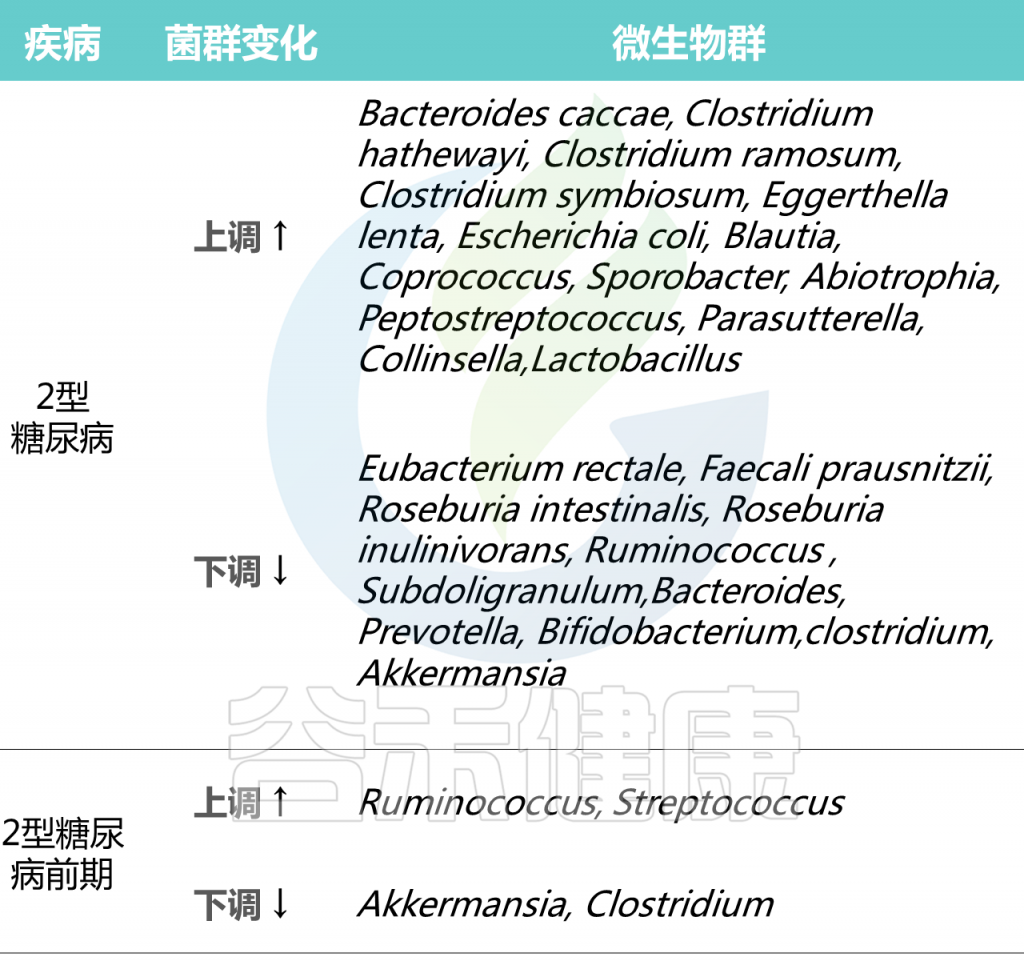

Cunningham A L et al., Gut Pathog, 2021
在2型糖尿病患者普遍具有相对高丰度的特定属:Blautia、Coprococcus、Sporobacter、Abiotrophia、Peptostreptococcus、Parasutterella、Collinsella。
2型糖尿病患者中,产生丁酸菌特别缺乏,特别是梭菌目,包括:
Ruminococcus、Subdoligranulum,Eubacterium rectale、Faecali prausnitzii、Roseburia intestinalis 、
Roseburia inulinivorans
2型糖尿病患者中,其他明显较少的菌属有:
拟杆菌属、普雷沃氏菌属、双歧杆菌属

谷禾健康
心血管疾病(CVD)已成为主要的健康问题,是导致发病率和死亡率高的主要原因,2型糖尿病(T2DM)患者发生CVD和重大心血管不良事件(MACE:心衰梗死、中风、死亡)风险更高,且预后较差。传统的CVD风险指标以及T2DM的血糖控制都不能很好地预测T2DM患者发生CVD的风险。

肠道菌群最近被认为是一种新型的内分泌器官,它通过产生生物活性代谢产物,在调节宿主的心脏代谢和肾脏功能中发挥关键作用。
肠道并不是第一个被用来研究心血管疾病病理生理学的器官。它不仅是处理食物消化吸收的器官,而且是体内最大的具有免疫活性的器官。
最近的研究表明,肠道菌群会产生并释放许多代谢产物和毒素,其中一些代谢产物和毒素会吸收到宿主的体循环中,作为微生物影响宿主的媒介。
我们整理汇总了这篇综述调查来自数项临床和实验研究的证据,这些证据表明肠道微生物群来源的毒素与CVD之间存在关联,包括脂多糖LPS、氧化三甲胺TMAO和苯乙酰谷氨酰胺PAGln。目前已经正在进行一些临床研究,旨在探索降低这些毒素水平以抑制心血管事件的有效性。
了解这些菌群相关代谢物是如何产生并如何影响心血管疾病有助于我们了解可能的风险和找到更好的生活方式来预防CVD。
缩略词:

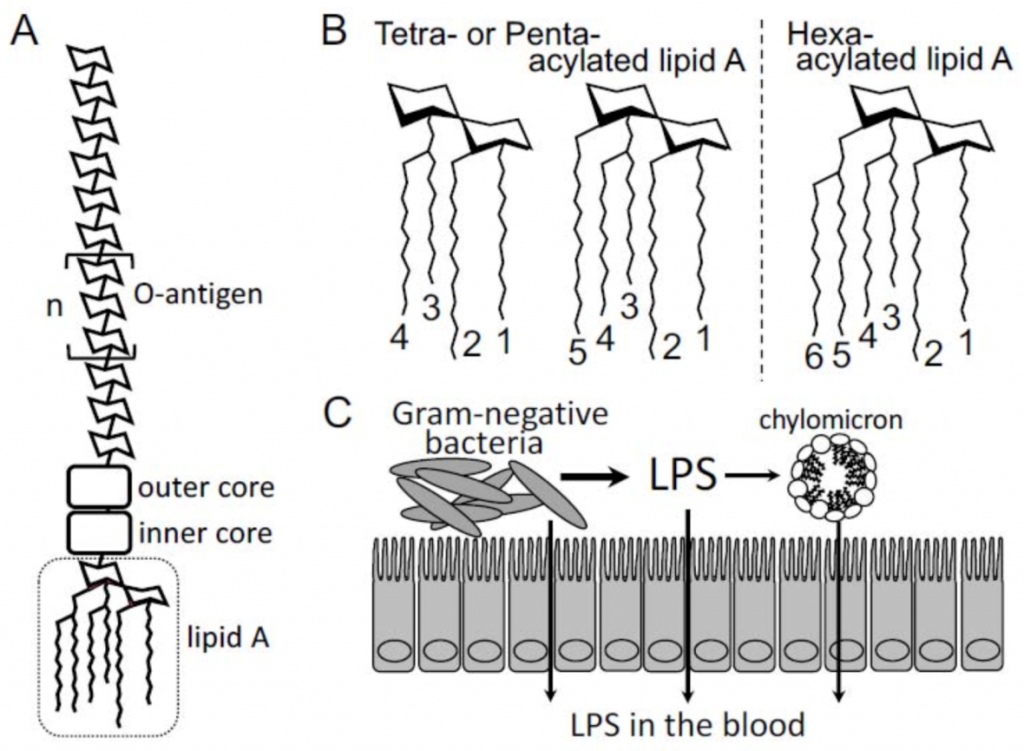

LPS的结构和特点
LPS,也称为内毒素,是革兰氏阴性细菌外膜的组成部分,主要存在于人体的肠道和口腔中。LPS的基本化学结构由亲水区和糖部分结合到疏水区组成,称为脂质A(下图A)。
LPS的亲水区域由内核和外部核以及O抗原(物种特异性重复寡糖亚基)组成,该区域对LPS的促炎活性影响最小(下图A)。
脂多糖(LPS)和脂质A的结构
Yamashita T,et al., Toxins,2021
疏水区脂质A在各种革兰氏阴性细菌中在结构上是保守的,由磷酸化的二葡萄糖胺主链组成,该主链具有4至7条相连的酰基链(上图B)。脂质A是Toll样受体4(TLR4)的配体和LPS的最关键“毒素”部分,它激活先天免疫系统,包括单核细胞和巨噬细胞,并引起宿主的炎症反应。
宿主血液中的 LPS 是从哪里来的?
——从肠道菌群中来
LPS是革兰氏阴性细菌外膜的主要成分,因此肠道微生物群可能是血液LPS的主要来源。人类胃肠道中存在数百万亿细菌,实际上,粪便LPS水平通常反映了肠道菌群衍生的LPS量,这个量因人的菌群构成和总量而异。
此外肠道通透性的提高会增强肠道菌群来源的LPS从肠道到血液的渗透。高脂饮食会增加肠道的通透性。
而Akkermansia菌可以加强肠道的紧密连接并防止代谢性内毒素血症,此外肠道菌群产生的短链脂肪酸可以保护肠屏障功能。
——从食物中来
除了肠道菌群以外,食物也是LPS的天然来源,因为食物和水总是含有少量LPS。饮食模式反映了血液中LPS的水平。
具体来说,选择健康的饮食食物(包括鱼,新鲜蔬菜和水果)可能会带来积极的健康结果,因为它们有助于减少内毒素血症。
CVD与几种传统的危险因素有关,例如高血压,血脂异常,糖尿病,吸烟和肥胖。
炎性过程已知在心血管病的发展中扮演至关重要的角色,而LPS是一种众所周知的炎症物质。LPS被认为是包括CVDs在内的炎性疾病的一种毒素,并参与CVDs发病和进展的病理生理过程。
由于LPS刺激TLR4诱导释放关键的促炎性细胞因子,而这些因子是激活有效免疫反应所必需的,大量的流行病学证据表明,内毒素血症的血液中LPS处于高水平,是动脉粥样硬化的重要危险因素,并且是LPS与动脉粥样硬化疾病之间联系的纽带。
不同的菌群,其LPS结构不同
虽然肠道菌群可以是粪便LPS的主要来源,但不同的菌群构成其LPS的炎症效应是不同的。LPS的脂质A部分的结构在不同菌群之间有所不同(上一小节图B)。这些结构差异可能是决定LPS活性的主要因素。
例如,已知拟杆菌属具有四酰基和五酰基酰化的脂质A部分,而大肠杆菌具有六酰化类脂A部分。通常,四和五酰化脂质A部分相比六酰化类脂A部分会减少TLR4反应。这表明如拟杆菌的LPS其诱导的促炎性细胞因子生成要远低于大肠杆菌的LPS。
因此肠道细菌组成和这些细菌所拥有的脂质A部分的类型可能是影响肠道微生物LPS与CVD之间关联的重要因素。
越来越多的证据表明,全身性内毒素血症和肠道菌群衍生LPS参与心血管病和许多其它流行疾病的发作和进展,如炎性肠疾病,肥胖和相关代谢性疾病,和非酒精性脂肪性肝炎。
2011年,Hazen博士和他的同事使用代谢组学方法在动脉粥样硬化研究中取得了显著发现,并揭示了肠道衍生的代谢产物TMAO是心血管疾病大型临床队列中心血管事件的独立预测因子。
TMAO是心血管疾病的危险因素
TMAO在伴有冠状动脉疾病、血栓形成、慢性肾病和心力衰竭的CVD患者中升高,并与不良心血管事件和全因死亡率相关。
据报道,TMAO水平升高与慢性肾病患者的肾功能程度和全身炎症增加密切相关,而TMAO可作为该组严重慢性肾病患者死亡率的独立预测因子。可以合理地得出结论,TMAO是肠道菌群来源的尿毒症或心血管毒素,可导致全身性炎症。
TMAO的产生
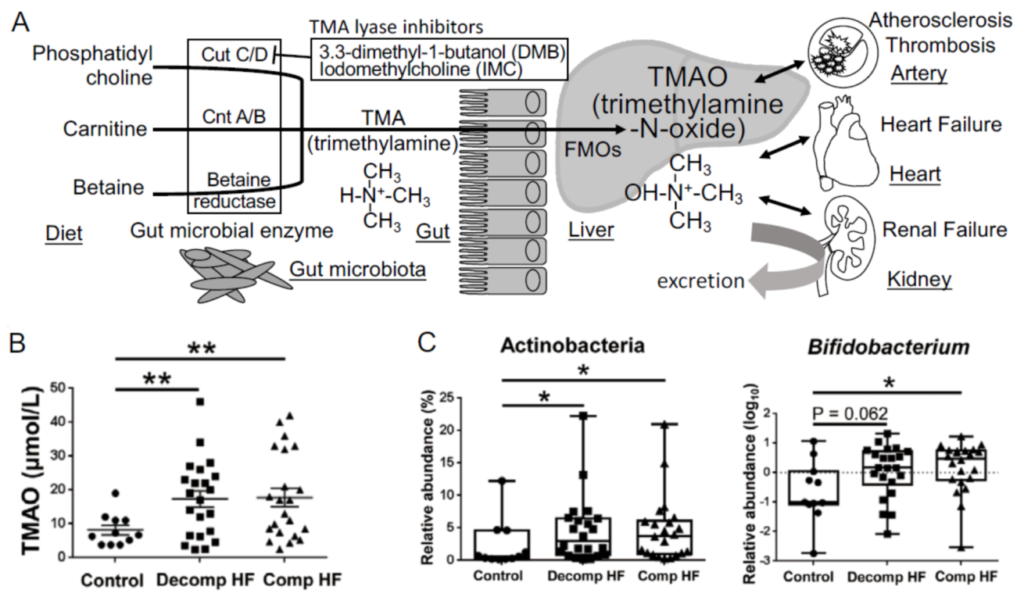
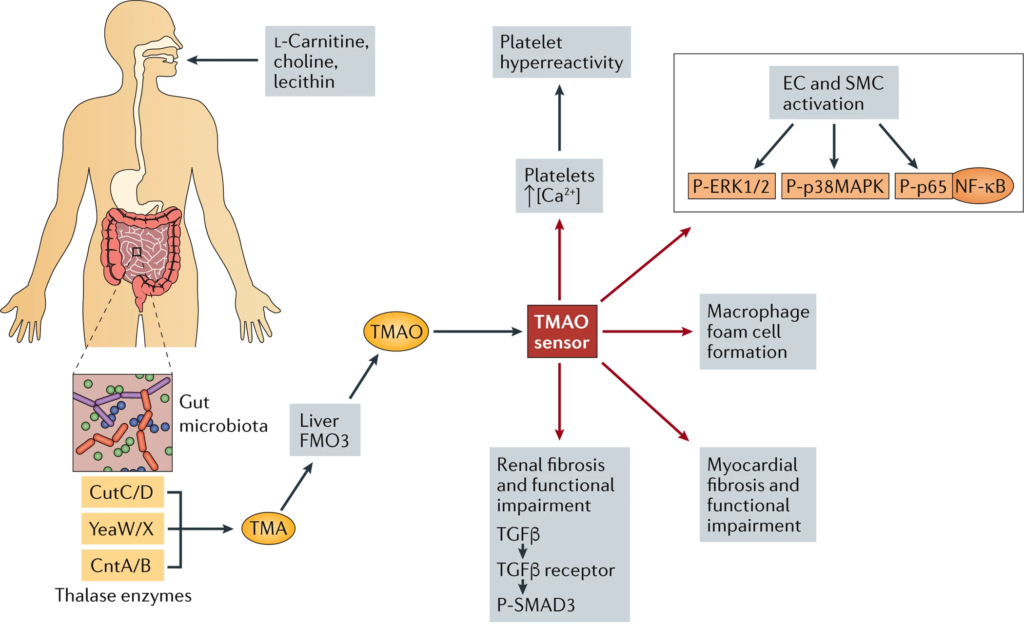
Brown J M, et al., Nature Reviews Microbiology, 2018
磷脂酰胆碱是一种在食品中发现的饮食成分,例如奶酪,蛋黄,肉和贝类,在肠道中被转化为胆碱,随后利用肠道微生物酶TMA裂解酶代谢为三甲胺(TMA)。TMA从肠道吸收进入门脉循环,然后通过肝脏中含黄素的单加氧酶(宿主酶)转化为TMAO 。
他们还证明,饮食中的左旋肉碱是红肉中的一种丰富营养物质,含有类似于胆碱的三甲胺结构,会促进血浆TMAO水平的升高并加速动脉粥样硬化。
肠道微生物衍生的TMAO代谢
Yamashita T,et al., Toxins,2021
与TMA产生有关的三个关键的微生物功能基因簇是胆碱TMA裂解酶(cutC)及其激活物(cutD)(cutC/D),一种糖基自由基酶和一种糖基自由基激活蛋白;肉碱加氧酶A/B(cntA/B),是一种由两部分组成的Riesketype加氧酶/还原酶复合物;甜菜碱还原酶途径(上图A)。
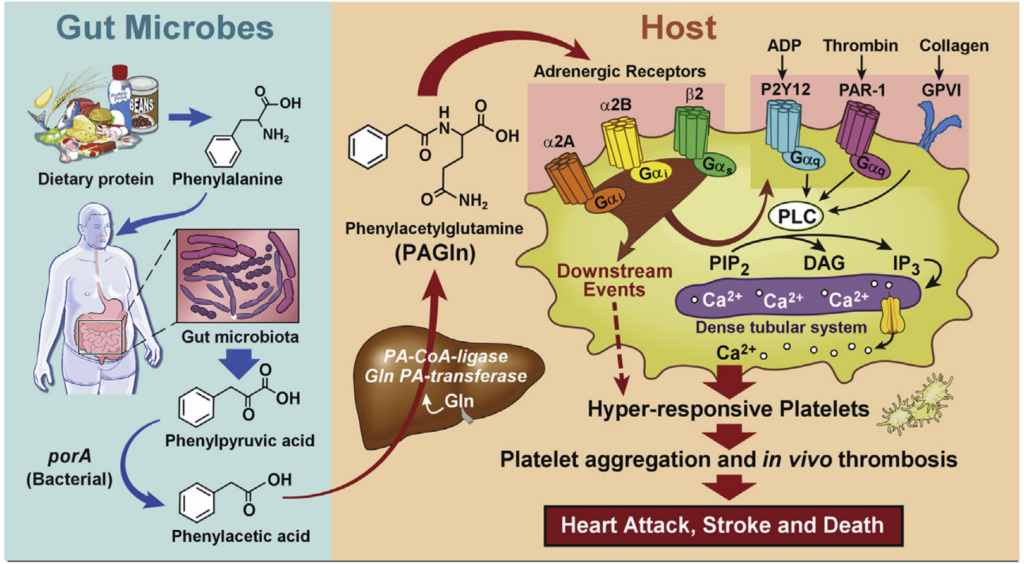
2020年Hazen团队通过代谢组学分析发现苯丙氨酸(Phe)与T2DM患者发生CVD风险升高有关,该物质被肠道微生物代谢生成苯乙酰谷氨酰胺(PAGln)。
对人群队列的代谢物检测发现,高PAGln水平与MACE高风险显著相关,较高的PAGln水平仍是MACE风险的独立预测因子。
肠道菌群影响PAGln水平
通过检测基线(Pre-Abx)、7天广谱复合抗生素处理(Abx)和3周清除期菌群重塑(Post-Abx)的血浆PAGln水平,发现PAGln水平受肠道微生物影响。
有研究表明,PAGln由苯乙酸(PAA)与谷氨酰胺(Gln)在肝酶的作用下形成,而PAA由苯丙氨酸(Phe)经菌群代谢产生。此外,PAA也可与甘氨酸(Gly)结合形成苯乙酰甘氨酸(PAGly)。
因此,在人类和小鼠体内,PAGln和PAGly都是通过肠道微生物群将饮食中的苯丙氨酸转化为PAA的元生物途径产生的,此时宿主与Gln(人类首选)或Gly(啮齿类动物首选)发生结合反应,分别产生PAGln和PAGly

Nemetet al. Cell , 2020
PAGln与血小板相互作用
根据人PAGln水平与血栓事件正相关性,提示PAGln可影响血小板功能和血管基质相互作用。研究结果显示,PAGln加速了胶原依赖性血小板粘附和扩散速度,并呈现剂量依赖性,表明PAGln可能与血小板直接相互作用,促进胞质内Ca2+浓度([Ca2+]i)呈现依赖性升高,并进行了相关验证。此外,在PAGly实验中也观察到类似结果。
因此,肠道菌群相关代谢产物PAGln和PAGly显著影响血小板功能,增强血小板与胶原基质的粘附,以及血小板刺激依赖性[Ca2+]i升高和对激动剂的聚集反应。
降低血栓形成
有研究报道Phe主要由生孢梭菌(Clostridium sporogenes)代谢为PAA(氧化途径)和苯丙酸(PPA)(还原途径),随后分别与Gln或Gly缩合形成PAGln或PAGly。其中参与反应的酶主要由porA或fldH基因编码。基因porA主要影响PAA产生,而fldH主要调节PPA产生,且敲除fldH会增加PAA水平继而影响PAGly水平从而显著降低血栓形成。
PAGln通过G蛋白偶联受体和ADRs介导细胞反应
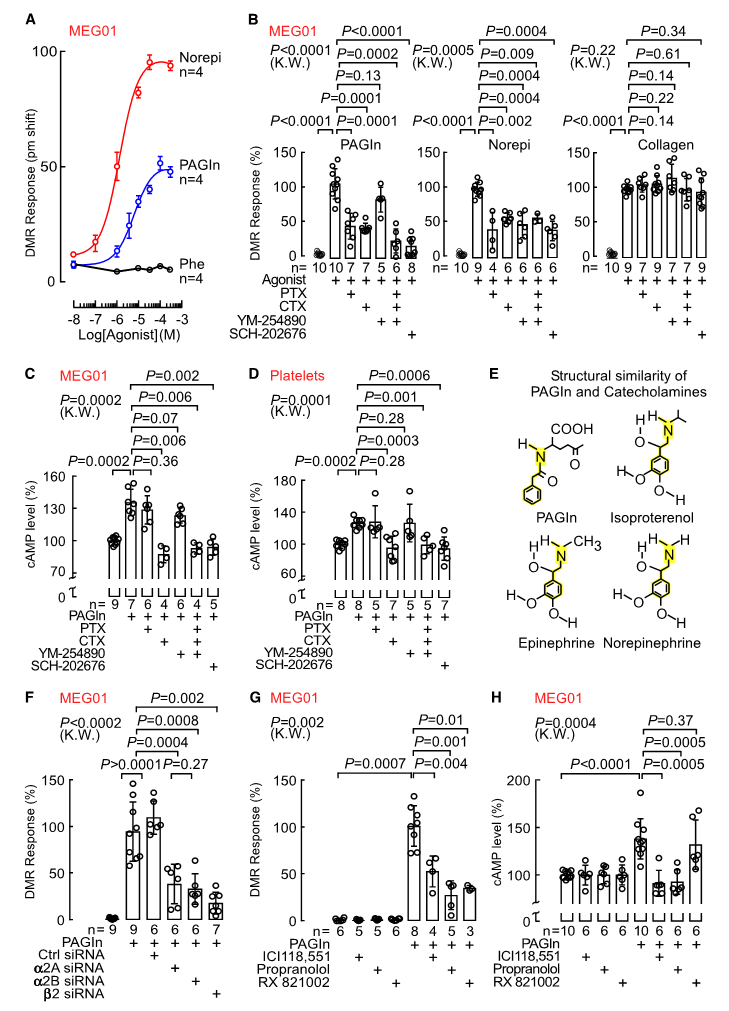
Nemetet al. Cell , 2020
研究人员发现PAGln与儿茶酚胺结构相似(上图E),暗示PAGln通过肾上腺素能受体(ADRs)发挥作用。遗传和药理学方法的功能丧失和功能获得研究证实,PAGln可通过G蛋白偶联受体(包括α2A,α2B和β2-ADRs)介导细胞反应。而β受体阻滞剂(卡维地洛)可显著降低PAGln诱导的高血栓风险。
微生物代谢产物可以调节宿主的生理和病理生理过程,这一发现开启了多种可能性,特别是证明了许多微生物途径可以作为抑制心血管病的治疗靶点。
LPS和TMAO可用于开发有效的治疗策略,然而目前还不能证明这些毒素水平是如何在宿主体内被确定和调节的。因此,需要进一步研究阐明肠道微生物源毒素与心血管疾病之间的因果关系,进一步探索肠道微生物及其代谢产物,包括毒素之间的关系,以确定心血管疾病治疗干预的最佳方法及患者的预后。
相关阅读:
主要参考文献:
Brown J M, Hazen S L. Microbial modulation of cardiovascular disease[J]. Nature Reviews Microbiology, 2018, 16(3): 171.
Yoshida, N.; Yamashita, T.; Kishino, S.; Watanabe, H.; Sasaki, K.; Sasaki, D.; Tabata, T.; Sugiyama, Y.; Kitamura, N.; Saito, Y.; et al. A possible beneficial effect of Bacteroides on faecal lipopolysaccharide activity and cardiovascular diseases. Sci. Rep. 2020, 10, 13009
Nemet et al. A Cardiovascular Disease-Linked Gut Microbial Metabolite Acts via Adrenergic Receptors. 2020, Cell 180, 862–877.
Yamashita T, Yoshida N, Emoto T, et al. Two Gut Microbiota-Derived Toxins Are Closely Associated with Cardiovascular Diseases: A Review[J]. Toxins, 2021, 13(5): 297.
Cui, X.; Ye, L.; Li, J.; Jin, L.; Wang, W.; Li, S.; Bao, M.; Wu, S.; Li, L.; Geng, B.; et al. Metagenomic and metabolomic analyses unveil dysbiosis of gut microbiota in chronic heart failure patients. Sci. Rep. 2018, 8, 635
Guo, C.J., Allen, B.M., Hiam, K.J., Dodd, D., Van Treuren, W., Higginbottom, S., Nagashima, K., Fischer, C.R., Sonnenburg, J.L., Spitzer, M.H., and Fisch-bach, M.A. (2019). Depletion of microbiome-derived molecules in the host using Clostridium genetics. Science 366, eaav1282