-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
孩子像有个停不下来的小马达,总是坐立不安、难以专注,对话像是没在听,还伴随着一些无法自控的小动作,比如频繁地挤眉弄眼、清嗓子或不自觉地耸动肩膀?…
这些常常被家长和老师贴上“不听话”、“坏习惯”标签的行为,背后可能隐藏着在儿童神经发育常见问题——注意缺陷多动障碍(ADHD,下文简称多动症)与抽动障碍(TD,下文简称抽动症)。
统计显示,全球学龄儿童中多动症的患病率约为3-7%,抽动障碍的患病率约为1-3%,且两者共病现象十分普遍。约50%-60%的抽动症患者同时患有多动症,男孩比女孩更常见。
注意力缺陷多动障碍(ADHD)和抽动障碍是儿童期常见的神经发育障碍,并不是很多家长以为的“学坏”或“故意捣乱”等行为问题。长期以来,医学界认为其病因主要与遗传、大脑结构发育及神经递质失衡有关。然而,近年来越来越多的研究发现,一个常被忽视的因素——肠道菌群。
例如,研究发现多动症儿童的肠道中,具有抗炎能力的普拉梭菌的丰度显著降低;而在抽动障碍的案例中,则观察到梭菌属和拟杆菌属等菌群的异常改变。
这些特定的菌群失衡,可以直接或间接地导致肠道通透性增加(即“肠漏”),引发低度炎症,甚至影响多巴胺等关键神经递质的合成与代谢。
肠道微生态的紊乱不仅影响消化吸收,更能通过神经、免疫及内分泌通路,远程影响大脑功能,从而可能加剧注意力缺陷、多动冲动以及不自主的抽动症状。
本文我们一起来深入了解一下多动症和抽动症,包括其症状、发病率、原因、共病现象等,重点探讨肠道菌群失调是如何影响这些神经发育障碍,并介绍肠道菌群检测在辅助诊断中的应用,以及如何通过调节肠道微生态进行相关干预,为管理这类神经发育障碍提供全新的视角与策略。
本文目录
一、认识多动症与抽动症
核心症状(多动症、抽动症症状、相似之处与不同之处)
患病率、共病现象
风险因素、原因
二、传统干预手段及其局限性
多动症的常用药物治疗
抽动障碍的常用药物治疗
传统药物治疗的共同困境
三、肠道菌群与抽动障碍和多动症的关联
多动症患者的肠道菌群特征
抽动障碍患者的肠道菌群特征
四、从菌群失调到神经炎症:发病机制新解
肠道屏障受损与全身性炎症
神经炎症与氧化应激
菌群代谢物的关键作用
菌群对神经递质的直接与间接调控
五、多动症与抽动症的诊断
多动症和抽动症的常规诊断流程
当前诊断的困境
整合肠道菌群检测:辅助诊断的新思路
肠道菌群检测如何为中西医结合提供桥梁
六、多动症与抽动症的干预新策略
饮食干预
– 地中海饮食、寡抗原饮食、人造食用色素去除
益生菌
– 双歧杆菌、植物乳杆菌PS128等
关键营养素补充
– Omega-3、维生素B6、B9、B12、D、锌、镁、铁等
粪菌移植(FMT)
中草药
– 健脾疏肝汤、菖麻熄风片、息风颗粒等
生活方式
– 运动、睡眠、行为干预等
核 心 症 状
▶ 注意缺陷多动障碍
注意缺陷多动障碍(ADHD,下文简称多动症)是一种复杂的神经发育障碍,其核心症状主要围绕三个方面:
😕 注意缺陷
– 难以持续集中注意力、容易分心、做事拖沓、经常丢失物品、在对话中似乎没有在听。
😖 多动
– 在座位上不停扭动、难以安静地坐着、话多、在不适当的场合跑来跑去或爬上爬下。
😡 冲动
– 难以等待、经常打断他人、不假思索地行动。
ADHD依据症状特点可分为三类:
患者常伴有执行功能缺陷、情绪失调和运动协调障碍等问题,这些都会严重影响其学习、社交能力和日常生活质量。
症状通常在 3~6 岁之间出现,平均诊断年龄为 7 岁。
成人多动症的多动表现可能不如儿童明显,更多体现在内心的躁动不安和精神层面的注意力不集中,体现在工作效率低下、人际关系处理困难、情绪波动大易发火、自我管理能力差等方面,而儿童则主要表现在学习障碍、行为问题上。
▶ 抽动障碍
抽动障碍(TD,下文简称抽动症)是一种神经发育障碍,以不自主、快速、重复、无节律的运动或发声为主要特征,即“抽动”。这些抽动在病程中的某个时间点出现,但不一定同时发生。
抽动障碍(TD)最严重的亚型是抽动秽语综合征(Tourette Syndrome, TS),其症状包括:
运动性抽动
– 简单的如眨眼、耸肩、摇头、皱眉等;
– 复杂的如模仿他人动作、做鬼脸、行走时的奇怪步态等。
发声性抽动
– 简单的如清嗓子、咳嗽、犬吠声;
– 复杂的如重复他人话语、说出不恰当的词语(秽语症,并非所有抽动患者都有)。
这些症状并非持续不变,其严重程度和频率会随时间波动,并受到压力、兴奋或疲劳等多种因素的影响。虽然大部分患者的症状在18岁前能够自行缓解,但仍有约三分之一的患者症状会持续到成年。
典型发病年龄在 6-7 岁左右,症状通常在 10-12 岁达到高峰。
▻ 两 者 相 似 之 处
▻ 不 同 之 处
抽动秽语综合征也会像多动症一样出现注意力不集中的情况,但这个注意力不集中可能是由抽动发生前令人分心的不适感(如压力、冲动感),以及抑制非自愿抽动本身所消耗的大量精力造成的。
流行病学与共病现象
► 多动症发病率
多动症是全球最普遍的儿童神经发育障碍之一,全球学龄儿童的患病率估计在3%~7%之间,男孩的诊断率是女孩的两倍以上。
18 岁以下患有多动症的儿童数量几乎是自闭症儿童的四倍。
儿童青少年多动症发病率主要统计数据
我国成人多动症的患病率约为4.4%,其中男性患病率高于女性。
柳叶刀的一项基于人群的研究显示:
疫情前,成人多动症的新增诊断平均为每月每10万人口8.8例。在疫情期间(2020年3月至2021年6月),这一数字上升至19.2例,每月增长率为4.9%(95%置信区间:[3.7, 6.2])。
疫情结束后,2021年7月的月度诊断率猛增107.3%[68.5, 155.0],此后每月继续以1.5%[0.4, 2.7]的速度增长,疫情后平均达到每10万人口34.8例。
► 抽动障碍发病率
《Pediatric Neurology》对 13 项儿童研究的荟萃分析显示,抽动秽语综合征的患病率为 0.77%(95%置信区间,0.39-1.51%)。男孩的患病率更高:1.06%的男孩受影响(95%置信区间,0.54-2.09%),而 0.25%的女孩受影响(95%置信区间,0.05-1.20%)。
全球抽动障碍流行病数据
► 多动和抽动共病现象
临床上一个巨大的挑战是这两种疾病的高度共病性。研究显示:
– 约50%-60%抽动症患者同时患有多动症
– 多动症往往在抽动症状出现之前就已存在
▻ 多动和抽动共病的影响
当两者共病时,多动症的症状通常在抽动症状出现之前出现。这就是为什么多年来抽动症状可能被错误地归因于兴奋剂药物的使用。
当孩子同时患有这两种疾病时,他们可能会消耗额外的精力和注意力,试图抑制抽动;这会加剧调节注意力和专注度的困难。
同时患有多动症和抽动症的儿童,往往比仅患有 多动症或仅患有抽动症的儿童面临更多的心理社会和行为问题,更容易受到欺凌,这些儿童还可能伴有认知和其他神经精神障碍。
▻ 共病强迫症
强迫症(OCD)也是常见的共病,约10%~35%的抽动症患者符合强迫症诊断标准。
注:多动症和抽动症儿童都容易患有焦虑症和强迫症。同时患有多动症和抽动症的儿童甚至比只患有其中一种疾病的儿童有更高的强迫症和广泛性焦虑症的发生率。更复杂的是,患有焦虑症的人还有额外的风险发展为抑郁症。因此,当孩子同时患有这两种疾病时,应常规监测情绪障碍和强迫症。
这种共病不仅使诊断复杂化,也严重影响患者的社会心理功能、自尊和生活质量,其背后可能隐藏着共同的病理生理机制。
风险因素
传统上,多动症和抽动症被认为是源于大脑的疾病,其病因复杂,涉及多种因素的相互作用。
► 遗 传 因 素
多动症和抽动障碍都具有明显的家族遗传性,家族史显著增加患病风险,遗传模式复杂,可能涉及多个基因的共同作用,相关基因如多巴胺受体基因(如DRD4)等可能参与其中。
► 产前 / 围产期因素
孕期吸烟、饮酒、接触有害物质等可能增加抽动和多动症的患病风险。
孕期感染也可能与神经发育障碍相关。
早产、低出生体重、缺氧等可能与抽动和多动症相关。
► 免 疫 因 素
免疫系统异常可能在抽动和多动症的发病中发挥作用。链球菌感染可能与部分抽动患者的发生有关。
► 营 养 因 素
铁、镁等微量元素缺乏可能与多动症的发生有关。
高糖、高脂肪饮食可能加重多动症症状。
► 早期生活环境
不良的家庭环境、虐待、忽视等可能增加抽动和多动症的患病风险。
► 屏幕时间
多动症患儿的屏幕使用时间(包括看电视、用平板/手机)显著高于正常儿童,并且过度的屏幕时间与多动症风险的升高有很强的统计学关联。
回归分析表明,屏幕时间增加与多动症风险升高相关(OR [95% CI] = 1.93 [1.28–4.27])。作者特别强调,由于研究是回顾性的病例对照设计,这个发现只能表明关联性,并不能证明是屏幕时间导致了多动症。
患有多动症或相关特质(如冲动、注意力不集中)的家长,可能更难为孩子设定和执行屏幕时间的规则,这本身就可能是一个混杂因素,同时也会影响他们报告的准确性。
什么原因引起的?
抽动和多动症的在遗传和神经学上存在相似的重叠,病因复杂,目前认为与神经递质失衡、脑结构和功能异常等因素有关,例如,涉及“去抑制”的相似神经回路。
这些因素可引发外周低度炎症(如细胞因子IL-6、TNF-α上调)和血脑屏障通透性增加,激活中枢小胶质细胞,干扰突触修剪和可塑性,最终导致额叶-纹状体/基底节环路的兴奋-抑制失衡,以及多巴胺、去甲肾上腺素和GABA等神经递质的调节异常,表现为注意缺陷、多动或抽动症状。这种机制并非单一,而是多通路交互的结果,后续章节将详述肠-脑轴的具体作用。
► 多动症
慢性低度神经炎症:风险因素(如早期营养/免疫失调)诱导外周炎症上行,激活小胶质细胞并干扰前额叶-纹状体环路的执行功能,导致注意缺陷和冲动控制问题。
多巴胺系统失调:遗传背景加剧多巴胺/去甲肾上腺素信号异常,与围产期因素交互,进一步放大行为症状。
代谢支持不足:营养相关失衡削弱神经保护,影响认知和情绪调节。
► 抽动症
感染触发与自身免疫:早期免疫因素(如链球菌感染)诱导异常自身免疫反应,错误靶向基底节,导致兴奋-抑制失衡和抽动发作。
基底节环路异常:遗传易感与环境应激放大多巴胺活性亢进和GABA抑制不足,阈值降低引发症状波动。
炎症-神经递质耦合:风险因素影响递质平衡,间接干扰运动控制。
根据美国儿科学会的最新指南,患有多动症的学龄前儿童(4~6岁)应首先接受家长培训的行为管理(PTBM)。若行为干预后功能障碍仍持续存在,可辅助使用哌甲酯治疗。
多动症的药物治疗:兴奋剂与非兴奋剂
▸中枢神经兴奋剂
这是最常用且被认为最有效的药物,代表药物是哌甲酯。这类药物通过抑制多巴胺和去甲肾上腺素的再摄取,提高突触间隙中这些关键神经递质的浓度,从而改善注意力和冲动控制。研究表明,治疗剂量的口服哌甲酯能显著增加人脑细胞外的多巴胺水平。
▸非兴奋剂
当患者对兴奋剂不耐受或效果不佳时,会考虑使用非兴奋剂。代表药物是托莫西汀,它是一种选择性去甲肾上腺素再摄取抑制剂,主要通过增加大脑中去甲肾上腺素的水平来发挥作用。
抽动障碍的药物治疗:多巴胺系统调节剂
对于抽动障碍,特别是症状严重影响生活的TS患者,药物治疗的目标是抑制多巴胺系统的过度活跃。根据美国神经病学学会(AAN)等权威指南,常用药物包括:
▸ α2-肾上腺素能激动剂
如可乐定和胍法辛,通常作为一线选择,尤其适用于伴有多动症的患者。它们副作用相对温和,但起效较慢。
▸ 抗精神病药(多巴胺受体拮抗剂)
典型抗精神病药:如氟哌啶醇和匹莫齐特,是FDA批准用于治疗抽动障碍的传统药物,效果显著但副作用风险较高。
非典型抗精神病药:如阿立哌唑和利培酮,因其对多巴胺和血清素系统的双重作用,被认为引发运动障碍的风险较低,已成为临床常用选择。此外,硫必利等药物也被广泛使用。
药物治疗的局限性
尽管上述药物在一定程度上有效,但其局限性同样显著,这也是驱动我们寻找新疗法的主要原因。
▸疗效的个体差异与不完全性
相当一部分患者对药物反应不佳或无效。即使有效,药物也通常只能控制症状,而不能根治疾病。对于许多患者来说,症状的改善是有限的,无法完全恢复正常功能。
▸可能带来副作用
ADHD药物:兴奋剂可能导致食欲不振、失眠、头痛、胃肠不适和情绪波动。长期使用还可能影响身高和体重发育。
抽动障碍药物:抗精神病药物的副作用尤为突出,包括镇静、头晕、嗜睡、体重增加和代谢综合征。更令人担忧的是,它们可能引发锥体外系症状,如肌肉震颤、僵硬和不自主运动(迟发性运动障碍),这些症状有时是不可逆的。
▸依从性挑战
由于副作用和疗效不确定性,患者(尤其是青少年)的治疗依从性往往较差。突然停药可能导致症状反弹或加重,给长期管理带来困难。
这种治疗上的困境促使科学界和医学界不得不将目光转向更深层次的病理生理学机制,以寻找新的干预靶点。在此背景下,“肠-脑轴”进入了研究者的视野。抽动障碍和多动症的神经系统功能紊乱,是否可能源于或受到肠道微生态失衡的影响?这为我们理解和治疗这些神经发育障碍开启了一个全新的视角,也正是我们下一章节将要探讨的内容。
肠-脑轴是指连接肠道和中枢神经系统(大脑)的一个复杂的双向通讯网络。它整合了神经、内分泌、免疫和代谢等多种信号通路,确保了大脑和肠道功能的协调。这个双向交流系统意味着,肠道的健康状况可以直接影响到我们的大脑,反之亦然。
既然肠-脑轴如此重要,那么我们来详细了解一下多动症和抽动障碍患者的肠道菌群。
多动症患者的肠道菌群
菌群多样性
β多样性(样本间物种组成的差异)分析通常能将多动症患者与健康对照区分开来,表明其菌群整体结构发生了改变。
特定菌群的变化
多项研究一致发现,多动症患者肠道中一些重要的有益菌丰度降低,特别是普拉梭菌(Faecalibacterium prausnitzii),这是一种主要的丁酸产生菌,具有强大的抗炎作用。此外,双歧杆菌属、粪球菌属(Coprococcus)和戴阿利斯特杆菌属(Dialister)的丰度也常被报道减少。
注:普拉梭菌在不同研究中结果矛盾。
一些研究观察到多动症患者肠道中拟杆菌属的某些种(如B. uniformis)、臭杆菌属(Odoribacter)、肠球菌属(Enterococcus)和链球菌属(Streptococcus)的某些种丰度增加。
与症状的关联
一项2025年的研究通过宏基因组和代谢组学分析发现,Lactobacillus sanfranciscensis的减少与多动症的三种核心症状注意缺陷、多动、冲动(p.adj = 1.04E–13; p.adj = 5.07E–07; p.adj = 2.61E–05)均显著相关。
多动症混合型菌群失调更严重
值得注意的是,多动症不同临床表现亚型(如ADHD-I和ADHD-C)可能对应着不同的菌群特征,这提示了疾病内部的异质性。例如,混合型(ADHD-C)患者的菌群失调程度通常比注意缺陷为主型(ADHD-I)更严重。
doi: 10.1080/19490976.2025.2537755
不同检测方法下儿童多动症的肠道菌群变化
doi: 10.3389/fpsyt.2025.1588135
抽动症患者的肠道菌群
针对抽动障碍(TD)和抽动秽语综合征(TS)的研究虽然起步较晚,但也揭示了相似的菌群失调模式。
门水平的变化
研究发现,与健康儿童相比,抽动障碍患儿粪便中厚壁菌门的相对丰度降低,而变形菌门和拟杆菌门的相对丰度升高。
属和种水平的特异性改变
一项研究发现,抽动障碍患儿肠道中普通拟杆菌(Bacteroides plebeius)、Ruminococcus lactaris的丰度显著高于健康儿童。这些细菌被认为与多种自身免疫性疾病有关。
另一项研究同样观察到TD患儿中双歧杆菌属和柯林斯菌属(Collinsella)丰度显著降低,而普雷沃氏菌属(Prevotella)和臭杆菌属(Odoribacter)丰度增加。
总的来说,多动症和抽动障碍患者的肠道菌群普遍呈现出促炎菌增多和有益菌减少的特征。这种失衡状态不仅是疾病的伴随现象,也可能是驱动疾病发展的关键因素之一。
肠道菌群的失调如何一步步影响到远端的大脑,并最终导致ADHD和抽动障碍的症状?科学家们提出了一个以“肠道菌群失调-神经炎症”为核心的通路。
肠道菌群失调如何通过炎症通路影响多动症
DOI: 10.1016/j.neuroscience.2025.01.031
1
肠道屏障受损与全身性炎症
肠道菌群失调被视为多动症和抽动症等神经发育障碍发病机制中的关键起点。
健康的肠道屏障能严格控制物质进入血液,但在菌群失调时,其通透性增加,即“肠漏”。
异常的肠道菌群组成可能激活肠道免疫系统,破坏屏障功能,也可能是有益菌群减少,对肠上皮细胞至关重要的“燃料”——短链脂肪酸生成不足,使得屏障细胞营养不良,细胞间的紧密连接蛋白松动,还有一些菌群降解肠道黏液层,削弱屏障保护。
屏障一旦受损,肠道内的细菌成分,如脂多糖(LPS)和有害代谢物便能渗入血液循环系统。这会触发强烈的免疫反应,因为免疫系统将这些物质识别为威胁。LPS会激活如TLR4(Toll样受体)等模式识别受体,刺激免疫细胞释放大量的促炎细胞因子,如IL-6(白细胞介素-6)、IL-1β(白细胞介素-1β)和TNF-α(肿瘤坏死因子-α)。
这些炎症因子在全身循环,形成了一种慢性的、低度的全身性炎症状态。这便是连接肠道与大脑问题的关键一步。
多动症和抽动症患者常常共患过敏性疾病(如哮喘、湿疹)和自身免疫性疾病,这从侧面印证了他们体内可能存在着异常的免疫激活状态。
肠道菌群通过肠-脑轴影响多动症的可能机制
doi: 10.3389/fpsyt.2025.1588135
2
神经炎症与氧化应激
上一节我们谈到,由肠道菌群失调引发的肠漏,引发了一场慢性的、低度的全身性炎症风暴,它的其中一个目标是突破人体的精密防线,也就是我们常说的血脑屏障。
一旦这道屏障因持续的炎症冲击而出现缝隙,炎症物质就直接去影响中枢神经系统,从而引发神经炎症与氧化应激,这是导致抽动症和多动症神经功能紊乱的核心病理环节。
一旦进入大脑,这些炎症物质会立即激活大脑内的免疫细胞——小胶质细胞和星形胶质细胞。这些细胞原本是大脑的管家,被激活的小胶质细胞会释放更多的炎症因子,将局部的火星煽动成燎原大火,形成一个恶性循环,导致持续的神经炎症。
神经炎症环境会产生大量的活性氧(ROS),引发氧化应激,损害神经元的线粒体功能、破坏细胞膜和DNA,最终导致神经元功能障碍甚至死亡,表现为多动症和抽动症的核心症状。
这一系列病理过程并非只是理论推测,在多动症患者身上已经找到了直接证据。多项研究发现:
从受孕到成年整个生命周期中,抽动和多动症接触免疫功能失调风险因素的时间、周围和中枢免疫炎症反应的变化、小胶质细胞激活的变化以及肠道菌群的改变如下图:
doi: 10.3389/fneur.2020.567407
这种由炎症和氧化应激共同驱动的神经毒性环境,会干扰正常的神经环路发育、突触可塑性和神经递质平衡,最终导致多动症的注意力不集中、多动冲动,以及抽动症的抽动、刻板行为等症状。
3
菌群代谢物(如短链脂肪酸)的关键作用
短链脂肪酸,主要包括丁酸、丙酸、乙酸,是肠道中的有益菌发酵膳食纤维后产生的重要代谢产物。
短链脂肪酸具有多重生理功能
Lactobacillus sanfranciscensis → 咪唑乙酸 → 注意力缺陷
在抽动和多动症中,短链脂肪酸的失调是一个核心环节。近日,一项针对多动症的队列研究明确指出,短链脂肪酸缺乏是其关键致病机制。
该研究发现,多动症患者体内普遍存在短链脂肪酸的缺乏,咪唑乙酸、4-氨基丁酸、4-胍基丁酸等多种SCFAs的水平显著降低。这种缺乏与我们前面提到的菌群失调有关,负责高效生产短链脂肪酸的有益菌减少。
研究通过因果中介分析发现,旧金山乳杆菌(Lactobacillus sanfranciscensis) 的减少,会引起肠道内咪唑乙酸水平的下降,而咪唑乙酸水平的下降,则直接导致了注意力不集中症状的加重。
注:Lactobacillus sanfranciscensis 对注意力不集中症状的总效应为−0.672,包括直接效应−0.535和中介效应−0.137,咪唑乙酸部分介导了这些效应,占总效应的 20.387%。
因此,这条病理链条变得清晰:
菌群失调 → 有益菌减少 → 短链脂肪酸产量不足 → 屏障失修,抗炎不力 → 肠道屏障和血脑屏障通透性增加→ 全身性炎症和神经炎症
总的来说,短链脂肪酸的缺乏,使得从肠道到大脑的整个防御体系变得脆弱。它为炎症的发展敞开了门,降低了身体抗炎能力,使神经系统遭受炎症和氧化损害,导致抽动症和多动症神经功能障碍。
4
菌群对神经递质的直接与间接调控
大脑的功能在很大程度上依赖于神经递质的精确平衡,它们是神经元之间传递信息的化学信使。
抽动症和多动症的核心病理之一,就是关键神经递质系统(尤其是多巴胺系统)的失衡。
菌群是神经递质及其前体的代谢工厂
如前所述,菌群可以合成GABA、5-HT等神经递质,或影响其前体物(如色氨酸、苯丙氨酸、酪氨酸)的代谢。
这里的关键在于,菌群的代谢活动能够直接决定这些原料的最终去向。
当多动症患者的肠道菌群异常地将大量色氨酸在外周(肠道内)就地转化为5-HT时,由于5-HT分子本身无法穿过血脑屏障,这实质上是一种“资源截留”。
这种外周的过度消耗,直接导致了能够进入大脑、用于合成中枢5-HT的色氨酸原料供给不足,最终引发中枢神经系统的5-HT缺乏。
菌群的功能缺陷会引发供应链中断
多巴胺和5-羟色胺等关键神经递质的合成,不仅需要前体原料,还需要维生素B6、叶酸等重要辅酶的参与才能顺利完成。
例如,多动症患者肠道菌群在维生素B6和叶酸代谢通路上的功能异常,可能影响到多巴胺、血清素等关键神经递质的合成,因为这些维生素是合成过程中的重要辅酶。肠道菌群是这些B族维生素的重要生产者,这在我们之前的文章可以详细了解,点击查看
当多动症患者的菌群失调时,相关维生素代谢异常,就像切断了神经递质合成的辅助工具供应,即使有足够原料,也会导致神经递质系统紊乱。
导致抽动秽语综合征的病理生理机制
doi: 10.2147/DDDT.S542423
多动症诊断
严格依据DSM-5或采用国际疾病分类第11版(ICD-11)作为诊断标准,强调症状需持续至少6个月,并在多个环境中可被观察到(如工作和家庭)都持续存在并造成影响。 必须有明确证据表明,这些症状已对社交、学业或职业功能造成实质性的负面影响。
确诊需通过临床访谈、评定量表等综合评估,并仔细排除焦虑、抑郁等其他可能引起相似症状的疾病。
为什么在儿童时期,诊断多动症的女孩少于男孩?
柳叶刀有一篇文章专门讲了这个问题:
症状表现不同:多动症的诊断标准更多基于男孩常见的、外显的多动-冲动行为。而女孩的症状更多是内化的、不易察觉,如健忘、分心、做事拖沓,这些安静的症状常被老师和家长忽视。
共病掩盖:女孩的多动症症状常被焦虑、抑郁等情绪问题所掩盖,导致她们被误诊为其他精神障碍。
社会因素与补偿行为:出于社会期望,女孩更倾向于通过加倍努力或发展补偿策略来伪装和隐藏自己的困难,这使得她们的内在挣扎更难被识别,从而错过了及时的诊断和干预。
抽动障碍诊断
由于该疾病的临床异质性、抽搐的可抑制性以及症状的时间可变性,抽动症的诊断和评估可能特别复杂。因此,在症状首次出现后,诊断可能会延迟 3~11 年,大约 73%患者会经历初次误诊。
目前,尚未发现任何早期诊断标志物,如影像学检查、血液检查或脑脊液生物标志物,可以在症状出现之前帮助诊断。
目前,关于多动症和抽动症的诊断在很大程度上依赖于“非客观性”的指标, 例如量表、临床晤谈与行为观察。
像康纳斯量表、SNAP-IV量表或耶鲁全球抽动严重程度量表(YGTSS)等工具,其本质并非客观检测,而是将主观的观察和感受进行结构化和量化的工具。
客观检查主要用于排除而非确诊: 医生可能会建议进行脑电图、头颅MRI、血液检查等医学检查。但这些检查的主要目的,是排除其他可能引起相似症状的神经系统疾病(如癫痫、脑损伤等)。
这也是为什么寻找可靠的方式,以实现更精准、客观的诊断,是该领域未来研究的重要方向。肠道菌群检测逐渐为多动症和抽动症的辅助诊断提供了新的思路和可能性。
整合肠道菌群检测
目前肠道菌群检测还不能作为诊断的独立标准,它是一种辅助性的、探索性的工具,旨在深化对个体病理状态的理解,从而指导更精准的个体化治疗。
► 肠道菌群检测结合病理生理机制
结合我们在前面提到的多动和抽动的多种病理生理机制,包括神经递质失衡(多巴胺、谷氨酸等)、神经炎症(小胶质细胞活化)和免疫功能障碍等,肠道菌群恰好在这些方面都扮演着关键角色。
肠道菌群能够合成或影响多种神经递质(如多巴胺、5-羟色胺、GABA)的代谢。谷禾肠道菌群检测通过构建基于大样本的数据库,能够评估关键神经递质指标,如多巴胺,血清素,GABA等。
通过分析特定菌群的丰度和代谢活性,谷禾肠道菌群检测能够推断个体神经递质的合成能力和代谢状态,例如,某些双歧杆菌和乳杆菌株能够产生GABA,对于多动症和抽动症患者而言,这些神经递质的失衡往往是核心病理机制之一。多巴胺系统异常与注意力缺陷和运动控制障碍密切相关,GABA不足则可能导致大脑过度兴奋和自控能力下降。
< 来源:谷禾肠道菌群检测数据库>
肠道菌群的代谢产物(如脂多糖LPS)是强烈的促炎物质,若肠道屏障受损(肠漏),LPS进入血液会引发全身性低度炎症,并可能通过血脑屏障影响大脑,激活小胶质细胞。
谷禾肠道菌群检测结果可以提示,患者是否存在由菌群失调导致的营养吸收障碍或炎症状态,例如肠道炎症水平、肠道屏障、脂多糖LPS等指标。
< 来源:谷禾肠道菌群检测数据库>
对于多动症和抽动症患者,这些炎症指标的异常往往提示存在”肠-脑轴“功能紊乱,慢性低度炎症可能正在影响大脑的神经发育和功能,导致注意力、情绪调节和运动控制等方面的问题加重。
► 肠道菌群检测结合中西医
中医诊断依赖于辨证论治,比如将患者分为“肝风内动”、“痰火扰心”、“脾虚肝亢”等不同证型。这种辨证主要依赖于医生的四诊(望、闻、问、切),缺乏现代生物学的客观指标。
菌群特征与中医“证”的关联
通过对不同证型的患者进行肠道菌群检测,可以探索特定菌群的构成模式是否与某种中医证型存在关联。例如我们可以去探索:
如果能建立这种关联,肠道菌群检测就能为中医的辨证提供客观的生物学证据,有了可以量化的数据支持。
如果肠道菌群检测发现患者有明显的菌群失调和炎症标志物升高,那么在常规治疗(如多巴胺受体拮抗剂)的基础上,结合具有抗炎作用的中药(如黄芩等),或者补充益生菌、调整饮食结构,可能效果更好。
医生还可以根据菌群偏好,推荐更具体的食疗方案(如富含多糖的山药、茯苓等药食同源的食物)。关于药食同源可详见谷禾之前的文章:
从药食同源到微生态健康:中华传统医学养生智慧在肠道菌群中的现代诠释
肠道菌群检测可以成为连接中医、西医理论和实践的桥梁。
饮 食 干 预
关于儿童注意力和饮食模式关系的研究强调,注意力问题的儿童零食和垃圾食品的摄入量更高,并且这些儿童可能表现出过度进食行为。此外,文献中有发现表明,有明显注意力缺陷特征的成年人由于比普通人更频繁地摄入零食和添加糖,因此肥胖的风险更高。
一项综述发现:
► 地中海饮食
对地中海饮食的更高依从性与短链脂肪酸产生菌种 Faecalibacterium prausnitzii、Eubacterium eligens、Bacteroides cellulosilyticus 的丰度增加以及纤维降解功能的增强相关,与Ruminococcus gnavus 和血液胆固醇水平的降低有关。
► 限制消除饮食(寡抗原饮食) 证据层级:强
食物过敏/超敏反应可能是导致部分儿童多动症症状的关键因素。寡抗原饮食通过在几周内只允许食用极少数低过敏性食物(如米、梨、多种蔬菜等),来完全移除可能引发症状的食物触发器。
Tips:这里可以记录饮食日记,以追踪饮食与症状严重程度之间的潜在关联,识别并消除潜在的食品诱因,考虑常见的诱因,比如咖啡因、人工添加剂、高糖食品、麸质、乳制品等。
以上效果堪比药物治疗,且无药物副作用。
► 人造食用色素去除 证据强度 中等
多项研究(包括著名的南安普顿研究)发现,去除饮食中的人造色素和防腐剂(如苯甲酸钠)可以小幅但显著地改善儿童的多动行为。然而,其效果远不如严格的寡抗原饮食。文章认为,单独去除人造食用色素可能只对一小部分儿童有效,或者改善程度有限,因为还可能存在其他未被识别的食物触发因素。
以上有益,但作用有限。
相关饮食的生理益处
doi: 10.3390/metabo15050335
益 生 菌
一项为期 12 周的随机双盲安慰剂对照试验,涉及 80 名 5-14 岁的儿童(39 名患有多动症,41 名患有自闭症)。益生菌补充剂显著改变了多动症和自闭症儿童的肠道菌群。多动症患者增加梭菌属 、瘤胃球菌科、毛螺菌科、Odoribacter等。
注:AB Biotics S.A.提供了安慰剂和益生菌。
► 多动症:双歧杆菌
一项针对75名儿童的研究使用了长双歧杆菌 (B. longum),但研究重点是评估其作为药物辅助治疗的可行性,而不是直接的治疗效果。在为期四周的研究中,研究人员观察到益生菌组的注意力不集中症状有所改善。但文章强调,这只是初步发现。
一项为期12周的随机双盲安慰剂对照试验显示,补充双歧杆菌Bf-688可显著改善多动症患者的注意力与反应速度。其机制在于,Bf-688能提高肠道厚壁菌门/拟杆菌门的比例,从而强化肠道屏障,改善神经递质(特别是多巴胺)的调节功能。同时,它还减轻了患者的胃痛、食欲不振等胃肠道问题。
儿童多动症益生菌治疗的临床研究
doi: 10.3389/fpsyt.2025.1588135
► 抽动症:植物乳杆菌PS128
一项研究发现,给抽动症模型大鼠喂食植物乳杆菌PS128后,大鼠的抽动行为得到显著改善。这可能与益生菌调节了肠道菌群(如增加了普氏菌科,降低了毛螺菌科),并增强了多巴胺系统的稳定性有关。
► 抽动症:益生菌+药物
一项涉及130名抽动症患儿的为期12周的随机对照试验显示,将益生菌与常规药物(泰必利)联合使用时,对改善抽动症状的效果最为显著。相比之下,单独使用益生菌的效果最不明显。
补充剂
一项研究发现,抽动秽语综合征儿童的钠摄入量显著更高,而维生素D和维生素K的摄入量显著更低。维生素 B3、维生素 B6 和维生素 C、微量元素磷和硒较少达到参考营养摄入量(这一趋势在自闭症儿童中也得到体现)。
► Omega-3 和 Omega-6 脂肪酸
理论基础是多动症患者体内可能存在这些脂肪酸水平较低的情况。这是研究最多的补充剂类型。
研究结果不一致。荟萃分析显示,补充Omega-3/6脂肪酸(特别是EPA和DHA的组合)后,在注意力、多动和冲动方面有微小但显著的改善。然而,许多其他研究未发现显著效果。效果可能受剂量、EPA/DHA比例以及个体差异的影响。
► 维生素D和镁
维生素 D 和镁补充剂在两项研究中显示出改善多动症症状的效果;然而,一项研究得出结论,维生素 D 补充剂仅在同时存在维生素 D 缺乏的多动症儿童中才有益。
在一项调查中,许多家长报告称,给孩子补充镁后,观察到抽动症状有所改善。镁是一种对身体的许多方面调节和功能起关键作用的矿物质,包括调节肌肉和神经功能、血压和血糖控制。
► 叶酸和维生素 B12
研究发现,多动症患者的叶酸和维生素 B12 水平较低,一项研究发现维生素 B12 水平与多动症症状呈负相关,而另一项研究则未发现这种关系。
► L-茶氨酸和维生素B6
一项初步研究表明,这两者联合使用能显著减轻抽动严重程度,并对缓解伴随的焦虑有积极作用。
► 锌
锌在神经递质多巴胺的代谢中起着关键作用,而多巴胺与多动症的核心症状密切相关。关于补充锌对多动症的治疗效果,目前的研究结论尚不一致。
► 铁
研究发现,多动症儿童体内的铁蛋白(ferritin)水平普遍较低,而铁蛋白是反映体内铁储存量的指标。补充铁剂已被证明可以改善多动症儿童的症状,其效果甚至可以与某些兴奋剂药物相媲美。但对于铁水平正常的儿童,效果不明确。
粪菌移植 (FMT)
粪菌移植(FMT)作为一种仍在探索中的疗法,已被尝试应用于多种伴有肠道菌群异常的难治性神经系统疾病,如自闭症等。
动物实验
动物实验发现,将健康小鼠的粪便移植给抽动模型小鼠后,小鼠的抽动症状得到缓解,同时其血清中的5-羟色胺水平升高。
儿童
2017 年报道了首例使用粪菌移植治疗的抽动症病例,9岁男孩服用中药和泰拉普丁2.5年后仍有症状。粪便来自14岁健康男孩,通过胃镜和肠镜送入患者肠道。治疗前YGTSS评分31,8周后降至5,抽搐行为几乎消失且注意力集中,表明FMT对抽动症有治疗效果。
随后用FMT治疗5名抽动症男童。4名儿童YGTSS评分降低超25%(7-35分),2名症状消失,1名评分增加4分。这表明FMT对部分抽动儿童有效,但其机制及适用性需进一步研究。
成人
2022年,一位 22 岁的女性因反复发作的艰难梭菌感染导致多次严重腹泻。接受 FMT 治疗后,共病 ADHD 和焦虑症状得到缓解,CGI–S 评分从治疗前的 5 分降至 2 分。
中 草 药
在抽动症的管理中,许多中药方剂被使用,包括天麻钩藤饮、柴胡疏肝散和六味地黄丸等。
抽动障碍治疗中 15 种高频中药的现代药理机制
doi: 10.2147/NDT.S543465
► 中医药联合治疗抽动秽语综合征的临床实践
▻ 健脾疏肝汤 + 盐酸泰必利
一项涉及98名抽动症儿童的随机对照试验,经过8周治疗,发现“健脾疏肝汤”与西药“盐酸泰必利”的联合使用疗效,在降低抽动严重程度、改善神经递质分泌方面效果显著,且复发率更低,安全性良好。
▻ 菖麻熄风片 + 氟哌啶醇片
一项随机对照试验(n=96),发现菖麻熄风片联合氟哌啶醇片治疗儿童抽动症,能有效改善抽动症患儿的临床症状、认知发育、脑电图结果和血清神经递质水平(多巴胺、去甲肾上腺素和血清素)。
▻ 息风颗粒 + 心理干预
一项随机对照试验(n=120)比较了“息风颗粒联合心理干预”与西药“硫必利”的疗效,息风颗粒与心理干预相结合,可显著改善抽动患儿的临床症状,有效缓解症状,安全性高。
▻ 针刺 + 安神颗粒
一项对118名“心肝火旺”型抽动症儿童的随机试验,比较了“针刺联合安神颗粒”与西药“盐酸替亚必利片”的疗效。结果表明,针刺与安神颗粒(Anshen Zhicheng Granule)的结合疗法在缓解抽动、改善神经递质和神经功能方面,效果优于单独使用西药,且不良反应更少。
▻ 耳穴贴压 + 益智宁神液
一项对90名抽动症儿童的随机对照试验,评估了“耳穴贴压”联合“益智宁神液”的疗效。结果显示,与单用药物相比,联合疗法的效果更优,且安全、无明显毒副作用。
▻ 小儿黄龙颗粒:改善多动症
中药复方“小儿黄龙颗粒”能有效改善多动症模型大鼠的多动、冲动和焦虑样行为。研究对比了胃溶、肠溶和结肠溶三种制剂,发现结肠靶向释放的治疗效果最为显著。
其作用机理涉及恢复肠道菌群稳态、减轻全身性炎症反应以及修复受损的肠道和血脑屏障。治疗后,多动症模型大鼠体内异常的氨基酸代谢、神经递质调控和短链脂肪酸生成得到纠正。
▻ 静安汤:改善多动症
静安汤是一种中药方剂,过去20年来,静安汤在临床、药理学和制药领域广泛研究。
注:静安汤是南京中医院研发的专有配方,已获江苏省医药产品管理局注册证书(苏药制字Z20100001)。
研究发现,静安汤能够增加肠道中产丁酸盐细菌(特别是毛螺菌科Lachnospiraceae NK4A136群)的丰度,从而提升结肠和纹状体中的丁酸盐水平。丁酸盐通过抑制TLR4/HDAC3/NF-κB信号通路,促进小胶质细胞向抗炎的M2型极化,进而减轻神经炎症,改善肠道屏障和血脑屏障的完整性,最终有效缓解抽动症相关的刻板行为、多动和认知障碍。
doi.org/10.1016/j.phymed.2025.157009
生 活 方 式
► 运动
运动可以帮助减轻压力、改善情绪,并可能减少抽搐的频率和严重程度。对于患有多动症的人来说,运动也有助于提高注意力并减少多动。
– 每天至少进行30分钟的中等强度运动
– 选择喜欢且可持续的活动
– 考虑参加团队运动或团体健身课程以进行社交互动
任何运动,包括骑自行车、跳舞、慢跑、滑冰、棒球、游泳等,都可能对抽动症孩子有所帮助。
▻ 运动的核心机制
▻ 不同运动类型的具体效果
急性有氧运动: 比如跑步、跳跃
– 改善执行功能,包括选择性注意、信息处理和任务规划。
慢性/长期有氧运动:
– 改善ADHD儿童普遍较弱的注意力和记忆能力。
开放性技能运动:如足球(环境多变,需要高度执行功能)
– 在改善执行功能,特别是抑制性控制方面,比封闭性技能运动更有效。长期参与有助于儿童形成定向行动模式,从而规范行为、减少冲动。
封闭性技能运动:比如跑步、骑行(环境稳定)
– 对改善工作记忆有显著效果,尤其是在长期训练后。
▻ 瑜伽的特殊作用:
一个例外研究显示,每周进行一次60分钟的瑜伽,持续20周后,儿童的多动和攻击性行为得到了改善。这表明对于以多动为主的ADHD个体,瑜伽可能是一种有重要意义的方法。
► 建立规律的睡眠习惯
充足的睡眠对于管理抽动秽语综合征和注意力缺陷多动障碍症状至关重要。睡眠不足会加剧抽动并增加注意力和冲动控制的难度。
– 设定固定的睡觉和起床时间
– 创建放松的睡前仪式
– 睡前限制屏幕使用时间
– 确保舒适的睡眠环境
► 解压练习
正念可以帮助个人更意识到他们的抽动冲动和注意力缺陷多动障碍症状,从而实现更好的管理。它还可以减轻整体压力和焦虑。研究显示,它对改善“注意力不集中”有中等效应。其最一致的积极效果是能显著减轻家长育儿压力、改善儿童情绪调节。
▻ 正念和冥想练习:
– 练习当下时刻的觉察
– 培养对思想和感觉的非评判性观察
– 在一天中穿插进行简短的正念练习
▻ 放松技巧和深呼吸练习:
– 练习膈式呼吸
– 尝试引导想象或视觉化练习
– 将渐进式肌肉放松融入日常生活
习惯逆转训练(HRT)已被证明在减少抽搐频率和严重程度方面具有显著效果。它使个人能够主动管理抽搐,而不是感到被抽搐所控制。
▻ 习惯逆转训练用于抽动管理:
– 增加对抽动欲望的意识
– 建立竞争性反应来替代抽动
– 练习放松技巧以减少整体紧张
以上这些技巧可以帮助减少整体紧张和焦虑,这可能导致抽动频率和严重程度的降低。它们还可以帮助患有注意力缺陷多动障碍的人平静快速的想法并提高注意力。
综上,我们了解到注意缺陷多动障碍与抽动障碍是与全身健康状态紧密相连的复杂病症。越来越多的科学证据揭示了肠道菌群通过“肠-脑轴”在其中的关键作用。从肠道通透性增加(“肠漏”)引发的低度炎症,到特定菌群失衡(如普拉梭菌或梭菌属)对神经递质代谢的直接影响,都为我们理解这两种疾病提供了全新的视角。
这一发现为我们开辟了全新的干预视角:从“头痛医头”的传统干预模式中跳脱出来,转向探寻并解决问题的根源。这种通过调理消化系统来改善大脑功能的思路,与中医“培土生金,调理脾胃以宁心神”的千年智慧不谋而合,也是中西医理论在更高维度上的融合与共鸣。
而要将这一整体观精准地应用于每个独特的个体,肠道菌群检测便扮演了关键的导航角色。当我们可以通过调整饮食、补充益生菌等方式来重塑肠道微生态时,就为改善这些多动症和抽动症等神经发育障碍提供了更加温和且可能更有效的干预手段。
主要参考文献
Martino D, Johnson I, Leckman JF. What Does Immunology Have to Do With Normal Brain Development and the Pathophysiology Underlying Tourette Syndrome and Related Neuropsychiatric Disorders? Front Neurol. 2020 Sep 16;11:567407.
Wang X, Wang N, Gao T, Zhang Y, Fu Z, Zhao Y, Huang Y, Zheng X, Gao X, Lu L, Yang L. Symptom-specific gut microbial and metabolic profiles in ADHD reveal SCFA deficiency as a Key pathogenic mechanism. Gut Microbes. 2025 Dec;17(1):2537755.
Wang Y, Xu H, Jing M, Hu X, Wang J, Hua Y. Gut Microbiome Composition Abnormalities Determined Using High-Throughput Sequencing in Children With Tic Disorder. Front Pediatr. 2022 May 4;10:831944.
You L, Peng H, Liu J, Sai N, Zhao W, Li X, Yang C, Guo P, Ni J. Xiaoer Huanglong pellets remodels the periphery microenvironment to improve attention deficit hyperactivity disorder based on the microbiota-gut-brain axis. Phytomedicine. 2025 Sep;145:157007.
Lewis N, Lagopoulos J, Villani A. Gut-Brain Inflammatory Pathways in Attention-Deficit/Hyperactivity Disorder: The Role and Therapeutic Potential of Diet. Metabolites. 2025 May 19;15(5):335.
Eder K, Schneider-Momm K, Puce TK, Tobergte M, Clement HW, Rauh R, Schulz E, Biscaldi M, Clement C, Fleischhaker C. The Acute and Long-Term Benefits of the Oligoantigenic Diet for Children and Adolescents on the Three Symptom Subdomains of ADHD: Inattention, Hyperactivity, and Impulsivity. Nutrients. 2025 Jun 3;17(11):1916.
Rizzo R, Prato A, Scerbo M, Saia F, Barone R, Curatolo P. Use of Nutritional Supplements Based on L-Theanine and Vitamin B6 in Children with Tourette Syndrome, with Anxiety Disorders: A Pilot Study. Nutrients. 2022 Feb 18;14(4):852.
Novau-Ferré N, Papandreou C, Rojo-Marticella M, Canals-Sans J, Bulló M. Gut microbiome differences in children with Attention Deficit Hyperactivity Disorder and Autism Spectrum Disorder and effects of probiotic supplementation: A randomized controlled trial. Res Dev Disabil. 2025 Jun;161:105003.
Smith BL, Vafeiadou K, Ludlow AK. Nutrient intake and food selectivity in children with Tourette syndrome. Nutr Neurosci. 2025 Jun;28(6):670-678.
Geng J, Liu C, Xu J, Wang X, Li X. Potential relationship between Tourette syndrome and gut microbiome. J Pediatr (Rio J). 2023 Jan-Feb;99(1):11-16.
Bai L, Jin M, Zhang Q, Sun S. Progress in research on nutrition, neuroinflammation and dopaminergic alterations in Tic disorders. Front Pediatr. 2025 May 20;13:1526117.
Teleanu RI, Moldoveanu ET, Niculescu AG, Predescu E, Roza E, Tincu IF, Grumezescu AM, Teleanu DM. Liposomal and Lipid-Based Drug Delivery Systems: Bridging Gut Microbiota and Pediatric Disorder Treatments. Pharmaceutics. 2025 May 28;17(6):707.
Li B, Zhu J, Zhang B, Ling Z, Zhao Y, Leng W, Zhang Q, Zhou X. Evidence Based Research on Medication Patterns in the Traditional Chinese Medicine Treatment of Tic Disorders: A Complete Review. Neuropsychiatr Dis Treat. 2025 Sep 10;21:2001-2016.
Yu X, Zhu M, Tang Q, An S, Tan H, Wang X, Zhang J, Tian J, Li J. Traditional Chinese Medicine in the Comprehensive Management of Tourette Syndrome: Insights from Genetics and Pathophysiology: A Review. Drug Des Devel Ther. 2025 Sep 11;19:8181-8194.
Navab F, Abbasi K, Heidari H, Ghiasvand R, Clark CCT, Bagherniya M, Hassanizadeh S, Rouhani MH. Associations between dietary inflammatory index (DII) scores and attention deficit hyperactivity disorder (ADHD) in children. Sci Rep. 2025 Aug 22;15(1):30884.
Kang X, Cheng E, Guo P, Xi L, Xiang C, Xu S, Zhang Y, Yang Y, Zhang J, Long H. Jing An decoction alleviates neuroinflammation in Tourette syndrome by regulating butyrate-mediated microbiota-gut-brain axis. Phytomedicine. 2025 Sep;145:157009.
Liu Y, Zhang P, Sun H. A narrative review of research advances in gut microbiota and microecological agents in children with attention deficit hyperactivity disorder (ADHD). Front Psychiatry. 2025 May 23;16:1588135.
Yu X, Zhu M, Tang Q, An S, Tan H, Wang X, Zhang J, Tian J, Li J. Traditional Chinese Medicine in the Comprehensive Management of Tourette Syndrome: Insights from Genetics and Pathophysiology: A Review. Drug Des Devel Ther. 2025 Sep 11;19:8181-8194.
Li B, Zhu J, Zhang B, Ling Z, Zhao Y, Leng W, Zhang Q, Zhou X. Evidence Based Research on Medication Patterns in the Traditional Chinese Medicine Treatment of Tic Disorders: A Complete Review. Neuropsychiatr Dis Treat. 2025 Sep 10;21:2001-2016.
Navab F, Abbasi K, Heidari H, Ghiasvand R, Clark CCT, Bagherniya M, Hassanizadeh S, Rouhani MH. Associations between dietary inflammatory index (DII) scores and attention deficit hyperactivity disorder (ADHD) in children. Sci Rep. 2025 Aug 22;15(1):30884.
Shah N, Nadella H, Williams S. Non-pharmacological Approaches to Managing Attention-Deficit Hyperactivity Disorder in Pediatric Populations: A Scoping Review. Cureus. 2025 Jul 13;17(7):e87810.
Di Salvo G, Filippo L, Perotti C, Pellegrini L, Rosso G, Maina G. Adult ADHD: associated medical conditions and related factors. Int J Psychiatry Clin Pract. 2025 Sep;29(3):125-129.
Chen L, Li Z, Fan Y. Neurodevelopmental disorders and gut-brain interactions: exploring the therapeutic potential of pycnogenol through microbial-metabolic-neural networks. Front Cell Infect Microbiol. 2025 Jun 11;15:1601888.
Wang N, Gao X, Zhang Z, Yang L. Composition of the Gut Microbiota in Attention Deficit Hyperactivity Disorder: A Systematic Review and Meta-Analysis. Front Endocrinol (Lausanne). 2022 Mar 18;13:838941.
Talat, A., Zuberi, A. & Khan, A.U. Unravelling the Gut–Microbiome–Brain Axis: Implications for Infant Neurodevelopment and Future Therapeutics. Curr Microbiol 82, 390 (2025).
Tas, E., Ulgen, K.O. Exploring the Integrated Gut-Brain Metabolic Model for ADHD. Biochem Genet (2025).
Sibley MH, Bruton AM, Zhao X, Johnstone JM, Mitchell J, Hatsu I, Arnold LE, Basu HH, Levy L, Vyas P, Macphee F, Gonzalez ES, Kelley M, Jusko ML, Bolden CR, Zulauf-McCurdy C, Manzano M, Torres G. Non-pharmacological interventions for attention-deficit hyperactivity disorder in children and adolescents. Lancet Child Adolesc Health. 2023 Jun;7(6):415-428.
Martin J. Why are females less likely to be diagnosed with ADHD in childhood than males? Lancet Psychiatry. 2024 Apr;11(4):303-310.
Trends of incident adult Attention-deficit/hyperactivity disorder diagnoses before, during and after the pandemic provincial state of emergency in British Columbia (2013–2023): a population-based study. Hu, Kevin et al.The Lancet Regional Health – Americas, Volume 0, Issue 0, 101223

谷禾健康

维生素对人体健康至关重要;它们是无数酶的辅助因子,包括促进脂肪和碳水化合物代谢的酶,并具有直接和间接的抗氧化特性。
由于人类自身无法产生足够量的维生素(维生素 D 除外),因此要从食物中获取维生素。然而,许多维生素对温度敏感,在食品加工和储存过程中容易降解。因此,维生素缺乏症在某些人群(例如,素食主义者或老年人)中很常见。
例如口角炎,脚气病,腿部容易抽筋,皮肤容易红肿,容易烦躁和疲倦等,都有可能与缺乏B族维生素有关。
B族维生素从哪里来?
曾经有人认为B族维生素只从饮食中获得;然而并非如此,肠道微生物群也是维生素的重要来源。
B 族维生素包括哪些?
常见的有维生素 B1 (硫胺素)、B2(核黄素)、B3(烟酸/烟酰胺)、B5(泛酸)、B6(吡哆醇)、B7(生物素)、B9(叶酸)和B12 (钴胺素)等。

B族维生素的吸收情况
B族维生素主要通过结肠产生和吸收,大多数B族维生素的吸收情况类似:在低浓度时,主动运输系统促进吸收,而在较高浓度时,被动扩散主要发生在小肠。过量摄入B族维生素会使B族维生素到达大肠。

B族维生素是多种代谢途径中普遍必需的辅助因子的生物合成前体,对宿主和肠道微生物群都是不可或缺的,它们在维持免疫稳态中也发挥着重要作用。
本文来详细了解一下B族维生素(8类)和肠道微生物群之间有什么联系,它们在免疫代谢中有哪些作用,缺乏会导致什么症状,如何补充B族维生素。
维生素B1是维持神经、心脏及消化系统正常机能的重要生物活性物质。
维生素B1参与肠道粘膜免疫系统的免疫防御,调节免疫细胞在肠道内发挥作用。维生素B1对巨噬细胞有调控作用,能够介导巨噬细胞的生长及其细胞因子的分泌,间接促进免疫细胞的增殖和分化。
维生素 B1(硫胺素)是几种酶的辅助因子,包括丙酮酸脱氢酶和 α-酮戊二酸脱氢酶,它们都参与三羧酸 (TCA) 循环,从而为人体提供能量。
维生素B1在体内是如何参与代谢的?
前面我们已经知道,维生素B的两种来源:
摄入食物和细菌代谢生成。
膳食和细菌维生素B1在宿主中有不同的作用。因此我们从这两个方面分别了解其吸收转化过程。
膳食维生素B1
维生素 B1 在肉类(尤其是猪肉和鸡肉)、鸡蛋、谷芽、米糠、豆类中以高浓度的焦磷酸硫胺素 (TPP) 形式存在。
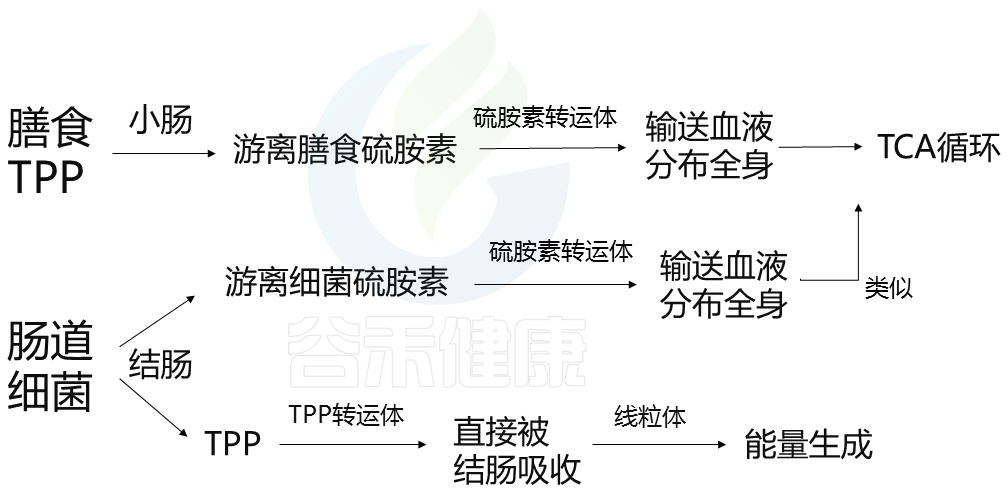
膳食TPP被碱性磷酸酶水解,并在小肠内转化为游离硫胺素。游离硫胺素通过硫胺素转运体(例如,THTR-1、THTR-2)被肠上皮吸收,并被输送到血液中以分布在全身。游离硫胺被转化回TPP,用于TCA循环中的能量代谢。
细菌维生素B1
结肠中各种类型的肠道细菌也会产生维生素B1作为游离硫胺素和TPP。在结肠中,游离细菌硫胺素主要被硫胺素转运体吸收,运输到血液中,并分布在全身;这一机制与小肠吸收游离膳食硫胺素的方式相似。
然而,肠道细菌产生的TPP不会转化为游离硫胺素,因为结肠中不会分泌碱性磷酸酶。相反,TPP通过在结肠顶膜上高度表达的TPP转运体(如TPPT-1)直接被结肠吸收。被吸收的TPP通过MTPP-1进入线粒体,MTPP-1是一种TPP转运体,在线粒体内膜中表达,用作ATP生成的辅助因子。这表明细菌TPP对结肠中的能量生成很重要。
这两者之间的区别在于:肠道细菌产生TPP这条途径,并不是通过游离硫氨酸,而是直接被结肠吸收。
哪些菌会产生维生素B1呢?
对人类肠道微生物群研究和谷禾数据库预测总结以下主要菌群:脆弱拟杆菌和普雷沃氏菌、艰难梭菌(Clostridium difficile)、一些乳杆菌属、Ruminococcus lactaris、双歧杆菌属、可变梭杆菌(Fusobacterium varium)是维生素B1的产生菌。

此外,比如干酪乳杆菌(Lactobacillus casei)在发酵乳饮料的生产过程中产生硫胺素,婴儿双歧杆菌和双歧双歧杆菌在培养上清液中产生硫胺素。
许多肠道细菌拥有完整的维生素B1合成途径,包括噻唑和嘧啶的合成途径。
维生素B1的结构由嘧啶环和噻唑环通过亚结合而成。
细菌从甘氨酸或酪氨酸和1-deoxy-d-xylulose-5-phosphate中获得噻唑部分;
嘧啶部分来自5-氨基咪唑核糖核苷酸,这是嘌呤途径的中间产物。
宿主和某些菌存在VB1竞争
在肠道微生物群中,并非所有细菌都产生 B 族维生素,一些细菌利用膳食 B 族维生素或其他肠道细菌产生的 B 族维生素来满足自己的需要;因此,宿主和肠道微生物群之间可能存在对 B 族维生素的竞争。
比如,粪杆菌属(Faecalibacterium)的生长虽然需要维生素B1,但它却缺乏维生素B1合成途径。因此,必须通过硫胺素转运体从其他细菌或宿主饮食中获得维生素B1,这表明宿主和某些肠道细菌之间存在维生素B1竞争。
建议摄入量
世界卫生组织 (WHO)/粮食及农业组织 (FAO) 建议成人每日维生素 B1 摄入量为 1.1-1.2 毫克。
缺乏导致
维生素 B1 缺乏会导致嗜睡,如果不及时治疗,可能会发展成脚气病,这是一种影响周围神经系统和心血管系统的疾病。
含量较高的食物
维生素B1 存在于全麦谷物、酵母、豆类、坚果和肉类(尤其是猪肉和鸡肉)等食物中。

维生素 B2(核黄素)及其活性形式(黄素腺嘌呤二核苷酸 [FAD] 和黄素单核苷酸 [FMN])是 TCA 循环和脂肪酸氧化(也称为 β-氧化)中酶促反应的辅助因子。
维生素B2通过调节脂肪酸氧化来控制免疫细胞的分化和功能。
除了产生能量外,维生素B2通过启动NADPH氧化酶2与免疫细胞中活性氧(ROS)的产生有关,ROS是炎症和免疫过程中重要的效应分子和信号分子。
维生素B1和B2介导肠道B细胞分化的免疫代谢
Yoshii K, et al., Front Nutr. 2019
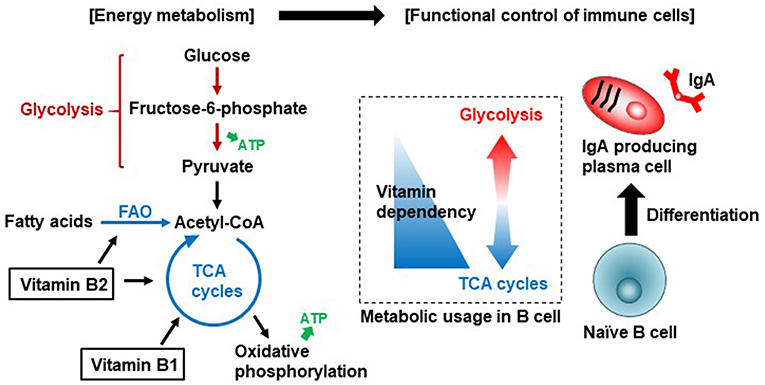
维生素B1是参与TCA循环的丙酮酸脱氢酶和α-酮戊二酸脱氢酶等酶的辅助因子。维生素B2是TCA循环中琥珀酸脱氢酶和脂肪酸氧化(FAO,也称为β-氧化)中酰基辅酶a脱氢酶等酶的辅助因子。初始B细胞优先使用TCA循环有效产生能量。一旦B细胞被激活,分化为产生IgA的浆细胞,它们就会利用糖酵解产生IgA抗体。
膳食维生素B2
膳食维生素 B2 以 FAD 或 FMN 形式存在,并在小肠中通过 FAD 焦磷酸酶和 FMN 磷酸酶转化为游离核黄素。游离核黄素通过小肠上皮上表达的核黄素转运蛋白被吸收,然后释放到血液中。在血液中,游离核黄素转化回 FAD 或 FMN 并分布在全身。
细菌维生素B2
细菌维生素B2是由三磷酸鸟苷(GTP)和5-磷酸核酮糖合成的。细菌维生素B2以游离核黄素的形式存在,可直接在大肠中吸收,转化为FAD或FMN,并如上所述分布在全身。
哪些菌会产生维生素B2呢?
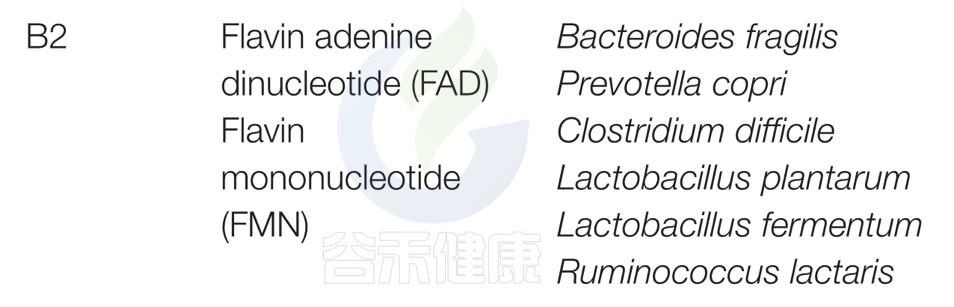
对人类肠道微生物群研究和谷禾数据库预测总结以下主要菌群:脆弱拟杆菌和普雷沃特菌属;艰难梭菌(Clostridium difficile)、植物乳杆菌(Lactobacillus plantarum)、发酵乳杆菌(L. fermentum)、Ruminococcus lacttaris表达合成维生素B2所必需的因子,表明这些细菌是大肠中维生素B2的重要来源。
从酸面团中分离出的发酵乳杆菌可以在体外合成维生素B2。
双歧杆菌和Collinsella缺乏维生素B2途径。
在缺乏维生素B2的小鼠中,添加含有植物乳杆菌的发酵豆浆可以促进维生素B2的产生,防止维生素B2缺乏。
宿主和共生细菌之间对VB2的竞争
拟杆菌门中的某些物种比放线菌门和厚壁菌门产生更多的VB2。然而,放线菌和厚壁菌门仍然表达核黄素转运蛋白以及从游离核黄素生成 FAD 和 FMN 所必需的酶(即 FAD 合酶和黄素激酶),这表明所有细菌,包括那些不能合成维生素的细菌B2 本身需要 FAD 和 FMN 才能生长和生存。因此,与维生素 B1 一样,宿主和共生细菌之间可能存在对维生素 B2的竞争。
某些菌产生维生素B2中间体,有助于防御病原体
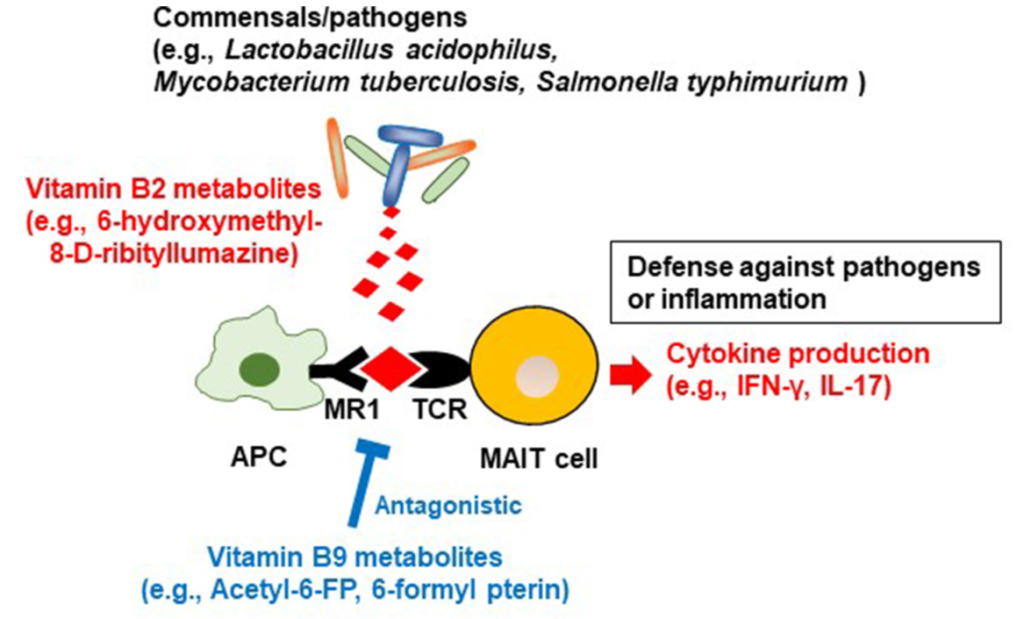
除了能够产生维生素 B2 之外,一些细菌(例如嗜酸乳杆菌等共生菌,结核分枝杆菌和鼠伤寒沙门氏菌等病原体)还产生维生素 B2 中间体(6-hydroxymethyl-8-d-ribityllumazine ),该中间体与抗原呈递细胞上的主要组织相容性复合物I类相关基因蛋白(MR1)结合;这会导致粘膜相关不变T细胞(MAIT)产生细胞因子,如干扰素γ和IL-17,这有助于宿主防御病原体(下图)。
来自维生素B2和B9的微生物代谢产物对MAIT细胞的调节
Yoshii K, et al., Front Nutr. 2019
有人认为,共生细菌的刺激有助于MAIT细胞的发育和激活,以便对病原体进行免疫监测。MAIT细胞还产生炎性细胞因子并具有组织归巢特性,表明这些细胞也参与自身免疫和炎症疾病的发展。
建议摄入量
世卫组织/粮农组织建议成人每日维生素 B2 摄入量为 1.0–1.3 毫克。
缺乏会导致
维生素 B2 缺乏会抑制参与脂肪酸氧化生成乙酰辅酶 A 的酰基辅酶 A 脱氢酶的活性,而乙酰辅酶 A 被线粒体用来通过 TCA 循环产生 ATP。
含量较高的食物
绿叶蔬菜、肝脏和鸡蛋中的维生素 B2 含量很高。

维生素 B3(烟酸)通常被称为烟酸和烟酰胺。这些化合物是烟酰胺腺嘌呤二核苷酸 (NAD) 的前体,NAD 是细胞氧化还原反应中的一种辅酶,在有氧呼吸中起核心作用。
免疫功能:抗炎,抑制结肠炎
维生素 B3 也是 GPR109a 的配体,GPR109a 是一种 G 蛋白偶联受体,在包括免疫细胞在内的多种细胞上表达。维生素 B3-GPR109a 信号传导诱导调节性 T 细胞分化并以 GPR109a 依赖性方式抑制结肠炎。维生素 B3 还抑制巨噬细胞和单核细胞产生促炎细胞因子 IL-1、IL-6 和肿瘤坏死因子 α (TNF-α)。
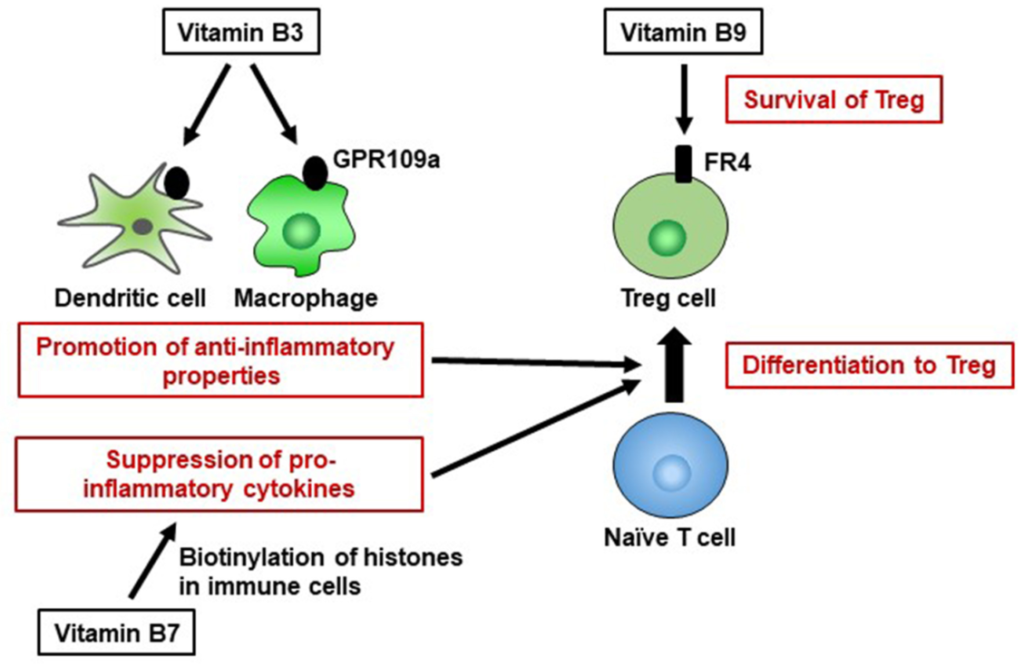
Yoshii K, et al., Front Nutr. 2019
因此,维生素B3通过调节宿主免疫细胞而具有抗炎特性,并在维持免疫稳态中发挥重要作用。
与其他B族维生素不同,维生素B3可由哺乳动物通过色氨酸的内源性酶途径生成,并储存在肝脏中,也可从饮食中获得。
膳食维生素B3
动物性食品如鱼和肉含有维生素B3作为烟酰胺,而植物性食品如豆类含有维生素B3作为烟酸。烟酰胺和烟酸都通过小肠直接吸收,烟酸在小肠转化为烟酰胺。
哪些菌会产生维生素B3呢?

维生素B3也是由肠道细菌从色氨酸合成的。可能参与B12合成和代谢的菌如:脆弱拟杆菌和普雷沃氏菌属、乳瘤胃球菌、艰难梭菌、婴儿双歧杆菌、幽门螺杆菌、可变梭杆菌。
因此,来自不同属的许多肠道细菌可以产生维生素B3,这表明饮食和共生细菌来源的维生素B3对宿主免疫都很重要。
缺乏会导致
在人类中,维生素B3缺乏会导致糙皮病,这是一种以肠道炎症、腹泻、皮炎和痴呆为特征的疾病。
建议摄入量
世卫组织/粮农组织建议成人每日维生素 B3 摄入量为 11-12 毫克。
含量较高的食物
全麦制品、糙米、绿豆、芝麻、花生、香菇、紫菜、无花果、乳制品、蛋、鸡肉、肝、瘦肉、鱼等。

维生素B5(泛酸)是辅酶a(CoA)的前体,辅酶a是TCA循环和脂肪酸氧化的必要辅助因子。
与维生素B1和B2一样,维生素B5通过免疫细胞的能量生成参与宿主免疫的控制。
缺乏导致
维生素B5缺乏会导致皮炎等免疫疾病,以及疲劳和失眠等非免疫相关疾病。
维生素B5缺乏如何引起炎症?
在一项针对成年人的随机、双盲、安慰剂对照研究中,膳食中补充维生素B5可改善面部痤疮,表明上皮屏障功能通过促进角质形成细胞增殖和分化为成纤维细胞而改善。
为了在缺乏维生素B5的时候保持维生素B5水平,辅酶A通过泛碱转化回维生素B5或半胱胺。然而,半胱胺抑制过氧化物酶体增殖物激活受体γ(PPARγ)信号,导致炎症。在泛碱产生酶基因敲除小鼠中,结肠炎已得到改善。因此,维生素B5缺乏通过上皮屏障功能障碍和促炎分子的产生引起炎症。
维生素B5通过激活免疫反应来促进宿主防御
在免疫反应方面,维生素B5通过促进先天免疫和适应性免疫,增强抗结核分枝杆菌感染的保护活性。在小鼠中,补充维生素B5可激活巨噬细胞的吞噬作用和细胞因子(包括IL-6和TNF-α)的产生,并随后促进Th1和Th17反应,以清除肺结核分枝杆菌。因此,维生素B5通过激活免疫反应来促进宿主防御,表明这种维生素作为一种天然佐剂具有重要作用。
膳食维生素B5
维生素B5在肝脏、鸡蛋、鸡肉和发酵大豆中以辅酶A或磷酸泛酰巯基乙胺pantetheinase的形式存在,浓度很高。辅酶A和磷酸泛乙烯通过小肠内的内源性酶(如磷酸酶和泛乙烯酶)转化为游离泛酸。游离泛酸通过小肠上皮上表达的钠依赖性复合维生素转运体(SMVT)被吸收,然后释放到血液中。最后,游离泛酸被转化回辅酶A并分布在全身,尤其是肝脏和肾脏。
细菌维生素B5
细菌维生素B5由2-二氢泛酸盐和β-丙氨酸通过从头合成途径合成。细菌维生素B5以游离泛酸的形式存在,其在大肠中直接吸收,转化为辅酶A,并以与膳食维生素B5相同的方式分布。
哪些菌会产生维生素B5呢?

对人类肠道微生物群研究和谷禾数据库预测总结:脆弱拟杆菌、普雷沃氏菌属、一些瘤胃球菌属(乳链球菌和扭链球菌)、肠道沙门氏菌、幽门螺杆菌具有维生素B5生物合成途径,表明肠道共生菌可以产生维生素B5。
细菌与宿主竞争维生素B5
相比之下,大多数梭杆菌和双歧杆菌属、艰难梭菌、粪杆菌属和乳酸杆菌属(厚壁菌属)的一些菌株缺乏这种途径,尽管其中一些菌株确实表达泛酸转运体以利用维生素B5产生能量,表明这些细菌与宿主竞争维生素B5。
摄入量
世卫组织/粮农组织建议成年人每天摄入5.0毫克维生素B5。
含量较高的食物
蔬菜中的卷心菜类,例如西兰花羽衣甘蓝,以及鳄梨、全麦谷物、土豆、乳制品、内脏等食物。

维生素B6以多种形式存在,包括吡哆醇、吡哆醛和吡哆胺。这些形式的维生素B6是辅酶磷酸吡哆醛(PLP)和磷酸吡哆胺(PMP)的前体,参与多种细胞代谢过程,包括氨基酸、脂质和碳水化合物代谢。
维生素B6在肠道免疫监测中起着重要作用
维生素B6调节炎症的机制目前尚不清楚。维生素B6通过脂质介质1-磷酸鞘氨醇(S1P)的代谢促进肠道免疫调节。
S1P调节淋巴细胞进入肠道,尤其是大肠。淋巴细胞转运依赖于S1P的产生及其降解产生的S1P梯度。S1P降解由S1P裂解酶介导,该裂解酶需要维生素B6作为辅助因子。服用维生素B6拮抗剂会损害S1P裂解酶活性,并产生不适当的S1P梯度,导致淋巴细胞从淋巴组织迁移受损,并减少肠道中淋巴细胞的数量。位于肠道上皮细胞之间的淋巴细胞被称为上皮内细胞(IEL),参与抵抗病原体的保护。
膳食维生素B6
膳食维生素B6以PLP或PMP的形式存在;它通过内源性酶(如吡哆醛磷酸酶)转化为游离维生素B6,然后被小肠吸收。虽然已经证明维生素B6通过酸性pH依赖和载体介导的转运被吸收,但尚未在任何哺乳动物物种中鉴定出肠吡哆醇转运体。在吸收游离维生素B6后,它进入血液,并转化回PLP或PMP。
细菌维生素B6
细菌维生素B6是由脱氧基果糖5-磷酸和4-磷酸羟基-L-苏氨酸或甘油醛-3-磷酸和d-核酮糖5-磷酸合成的PLP。在大肠中,细菌衍生的PLP转化为游离维生素B6,通过被动运输被吸收,运输到血液中,并分布在全身。
哪些菌会产生维生素B6呢?

可能参与B6合成和代谢的菌如:脆弱拟杆菌、普雷沃氏菌属、长双歧杆菌、产气柯林斯菌、幽门螺杆菌。
拟杆菌和变形杆菌可能从5-磷酸脱氧纤维素和4-磷酸羟基-l-苏氨酸开始产生维生素B6,而放线菌可能从甘油醛-3-磷酸和d-核酮糖5-磷酸开始产生。
相比之下,大多数厚壁菌属(韦荣球菌、瘤胃球菌、粪杆菌和乳杆菌属)都缺乏维生素B6生物合成途径,除了一些梭菌(C. bartlettii、C. leptum、C.methylpentosum和C. sporogenes)和乳杆菌(短乳杆菌和瘤胃乳酸杆菌)外。
摄入量
世卫组织/粮农组织建议成年人每天摄入1.3-1.7毫克维生素B6。青少年和怀孕或哺乳的女性每天需要更多的维生素 B6,大约 2 毫克。
缺乏导致
维生素B6缺乏与过敏和类风湿性关节炎等炎症性疾病的发展以及神经元功能障碍有关。维生素B6缺乏会破坏Th1-Th2平衡,导致过度的Th2反应,导致过敏。此外,在类风湿性关节炎患者中观察到血浆维生素B6水平较低,以及促炎细胞因子(如TNF-α和IL-6)水平升高。
其他还包括导致肌肉无力、抑郁、易怒、短期记忆丧失、紧张和注意力不集中等问题。
含量高的食物
鱼类、鸡肉、豆腐、红薯、鳄梨、扁豆、牛奶、三文鱼、虾、菠菜、葵花籽、金枪鱼、糙米等。

维生素B7(生物素)是葡萄糖、氨基酸和脂肪酸代谢所必需的几种羧化酶的辅助因子。例如,维生素B7是参与脂肪酸生物合成的乙酰辅酶A羧化酶和脂肪酸合成酶的必要辅助因子。因此,维生素B7可能会影响免疫代谢。
维生素B7的抗炎作用
维生素B7通过结合(生物素化)组蛋白抑制基因表达;这些基因包括编码NF-κB的基因,NF-κB是产生几种促炎细胞因子(例如,肿瘤坏死因子α、IL-1、IL-6、IL-8)的主要信号分子。NF-κB的核转录在维生素B7缺乏时被激活,表明组蛋白的生物素化抑制NF-κB信号中编码促炎细胞因子的基因的表达。
因此,维生素B7通过抑制NF-κB活化而具有抗炎作用,膳食维生素B7缺乏通过促进促炎细胞因子的分泌而引起炎症反应。
膳食维生素B7
膳食生物素以游离蛋白质结合形式或生物素形式存在。在小肠中,生物素酶从结合蛋白中释放游离生物素,游离生物素通过生物素转运体SMVT被吸收。
细菌维生素B7
维生素B7也是由肠道细菌产生的游离生物素,由丙二酰辅酶A或吡美乐酸通过吡美乐酰辅酶A合成。细菌游离生物素被结肠中表达的SMVT吸收。
哪些菌会产生维生素B7呢?

可能参与B7合成和代谢的菌如:脆弱拟杆菌、普雷沃氏菌属可变梭杆菌、大肠弯曲杆菌(campylobacteric coli)。
维生素B7的产生似乎在不同的肠道细菌之间以合作的方式进行;肠道中的长双歧杆菌产生吡美拉酸,它是维生素B7的前体,可增强其他肠道细菌产生维生素B7。
细菌与宿主竞争维生素B7
相比之下,普雷沃氏菌属、双歧杆菌属、梭菌属、瘤胃球菌属、粪杆菌属和乳酸杆菌属缺乏这种途径;然而,它们确实表达游离生物素转运体,这表明这些细菌也利用饮食和细菌维生素B7,因此可能与宿主竞争。
因此,游离生物素可能会影响肠道微生物群的组成,因为生物素是微生物群生长和存活所必需的。
缺乏导致
生物素缺乏会导致肠道失调和鼠乳杆菌过度生长,从而导致脱发。
什么情况会缺乏?
生蛋清中含有大量的抗生物素,它与维生素B7紧密结合,阻止维生素B7在肠道中被吸收。因此,维生素B7缺乏症不仅可能由维生素B7摄入不足引起,还可能由过量摄入生蛋清引起。
摄入量
世卫组织/粮农组织建议成年人每天摄入30微克。
含量较高的食物
维生素B7在坚果、豆类和油籽等食物中含量丰富。

维生素B9(叶酸)以四氢叶酸的形式存在,是包括DNA和氨基酸合成在内的多种代谢反应的辅助因子。
缺乏导致
由于红细胞对维生素B9的高需求,维生素B9缺乏会导致巨幼细胞性贫血。维生素B9缺乏症还通过将细胞周期阻滞在S期并增加DNA损伤的频率,在体外抑制人类CD8+T细胞的增殖。
维生素B9有助于维持免疫稳态
调节性T细胞(Treg)表达高水平的维生素B9受体(叶酸受体4[FR4])。服用抗FR4抗体会导致Treg细胞群的特异性减少,这表明维持Treg细胞需要维生素B9–FR4轴。
在维生素B9减少的条件下体外培养Treg细胞会导致细胞存活受损,抗凋亡Bcl2分子的表达减少,尽管幼稚T细胞仍保留分化为Treg细胞的能力;这表明维生素B9是Treg细胞的生存因子。
与这些发现一致,膳食维生素B9缺乏导致小肠中Treg细胞数量减少。由于Treg细胞在预防过度免疫反应中起着重要作用,喂食缺乏维生素B9饮食的小鼠对肠道炎症的易感性增加。
膳食维生素B9
维生素B9以单谷氨酸和多谷氨酸叶酸的形式存在于饮食中。叶酸-聚谷氨酸酯与谷氨酸单酯脱结合,然后通过叶酸转运体(如质子耦合叶酸转运体(PCFT))在小肠吸收。在肠上皮中,叶酸单谷氨酸盐在被输送到血液之前转化为四氢叶酸(THF),四氢叶酸是一种活性形式和辅助因子。
细菌维生素B9
肠道细菌从GTP、4-磷酸红糖和磷酸烯醇式丙酮酸合成维生素B9作为THF。细菌性THF通过PCFT在结肠中直接吸收,并通过血液分布到全身。
哪些菌会产生维生素B9呢?

对人类肠道微生物群研究和谷禾数据库预测总结:脆弱拟杆菌、普雷沃氏菌属、艰难梭菌、植物乳杆菌、罗氏乳杆菌、德氏乳杆菌、保加利亚和嗜热链球菌、双歧杆菌属中的一些物种、可变梭杆菌、肠道沙门氏菌具有维生素B9生物合成途径。这表明几乎所有门中的所有物种都会产生叶酸。
膳食中添加双歧杆菌益生菌菌株(青春期双歧杆菌和假链双歧杆菌)可提高叶酸缺乏大鼠和无叶酸培养基大肠中叶酸的生成。此外,植物乳杆菌、德氏乳杆菌、保加利亚乳杆菌和罗氏乳杆菌可提高缺乏叶酸合成所需成分的细菌培养上清液中叶酸的生成。
维生素B9代谢物防止过敏和炎症
在共生细菌中,维生素B9代谢产物6-甲酰蝶呤(6-FP)是通过光降解产生的。与维生素B2代谢物6-羟甲基-8-d-三嗪一样,6-FP与MR1结合,但与B2代谢物不同,它不能激活MAIT细胞。6-FP的类似物乙酰-6-FP是MR1的拮抗剂,可抑制MAIT细胞活化。
如关于维生素B2的章节所述,6-羟甲基-8-d-三硝基脲嗪可激活MAIT细胞,从而抵御病原体,因此维生素B9代谢物可抑制过度的MAIT细胞反应,并防止过度过敏和炎症反应。
膳食维生素B2和B9与微生物群的组成及其代谢这些维生素的能力之间的定量平衡,可能是理解肠内MAIT细胞介导的稳态的关键。
摄入量
世卫组织/粮农组织建议成年人每天摄入400微克维生素B9。美国国立卫生研究院建议母乳喂养的母亲每天需要 500 微克,青少年和怀孕女性每天应该摄入 600 微克。
较高含量的食物
牛肉肝、深绿叶蔬菜、芦笋、抱子甘蓝、橙子、坚果、豆类等食物含有高水平的维生素B9。

维生素B12(钴胺素)是一种含钴的维生素,以甲钴胺素和腺苷钴胺素的活性形式催化甲硫氨酸的合成。
维生素B12促进免疫反应
在宿主免疫方面,膳食维生素B12缺乏会减少小鼠体内CD8+T细胞的数量,并抑制自然杀伤T细胞的活性;补充甲钴胺可以改善这些状况,这表明维生素B12通过CD8+T细胞和自然杀伤T细胞促进免疫反应。
膳食维生素B12
膳食维生素B12与膳食蛋白质复合存在,胃蛋白酶将其分解为游离维生素B12。游离维生素B12通过胃糖蛋白内源性因子(IF)被小肠上皮细胞吸收。在上皮细胞内,如果维生素B12复合物被溶酶体分解为游离维生素B12,然后释放到血液中,在血液中转化为活性形式并分布在全身。
细菌维生素B12
细菌维生素B12由前甲胎蛋白-2合成,产生腺苷钴胺素,直接被大肠吸收并分布在全身;这种吸收的机制目前尚不清楚。
哪些菌会产生维生素B12呢?

可能参与B12合成和代谢的菌如:脆弱拟杆菌和普雷沃氏菌属、艰难梭菌、粪杆菌和乳瘤胃球菌、动物双歧杆菌、婴儿双歧杆菌和长双歧杆菌、可变梭杆菌。
从发酵食品中分离出的植物乳杆菌和棒状乳杆菌产生维生素B12,而动物双歧杆菌在牛奶发酵过程中合成维生素B12。
摄入量
世卫组织/粮农组织建议成年人每天摄入2.4μg维生素B12。青少年和怀孕或哺乳的女性需要更多:每天 2.6 至 2.8 μg。
缺乏导致
与维生素B6和B9一起,维生素B12在红细胞形成和核酸合成中起着重要作用,尤其是在神经元中。因此,维生素B12缺乏会导致巨幼细胞性贫血和神经系统症状,如手脚麻木,刺痛。
其他还会导致包括贫血、失智、沮丧、难以保持平衡、疲劳、虚弱、体重减轻、肠道问题、肌肉无力、口腔或舌头酸痛等症状,缺乏也会损害神经系统,并可能导致记忆力差、情绪障碍、抑郁、精神错乱和痴呆。
什么情况会缺乏?
除了饮食摄入量不足的原因之外,维生素 B-12 缺乏还可能是由于恶性贫血(一种影响壁细胞和内因子释放的自身免疫性疾病,维生素 B-12 吸收所必需的)导致的生物利用度低或吸收受损;随着年龄的增长,药物(例如质子泵抑制剂)的使用,胃肠道疾病(例如炎症性肠病)或胃肠道感染(例如幽门螺杆菌、肠道蠕虫)的发生,萎缩性胃炎、吸收不良和恶性贫血的风险增加。
含量较高的食物
牛肝、双壳类、鱼类、鸡肉和鸡蛋含有高水平的维生素B12。

微生物群失调和维生素缺乏是相互关联的,这种关系可能直接影响宿主健康。
对哺乳期女性进行的一项关联研究发现,增加维生素 B2、B5、B6 和 B12 的摄入量与120个粪便样本中普氏菌的相对丰度增加和拟杆菌的相对丰度降低有关。
炎症性肠病(IBD)患者会出现血浆维生素B2浓度较低。肠道慢性炎症包括促炎细胞因子浓度升高,已被证明会导致上皮吸收功能的改变。肠上皮细胞暴露于促炎细胞因子肿瘤坏死因子-α中会显著抑制维生素B2的摄取,这可能解释了IBD患者中维生素B2浓度显著较低的原因。
维生素B2和B3浓度可能是疾病状态的标志物。
克罗恩病恶化与参与抗炎的维生素B2、B1、B9生物合成相关的微生物基因减少有关。
此外,患有 2 型糖尿病的受试者在与微生物介导的维生素代谢相关的基因丰度方面表现出显着变化。
营养不良儿童的微生物组显示参与B 族维生素代谢的多种途径显着减少,包括烟酸/NADP 生物合成。
所有这些观察结果表明,微量营养素的缺乏会改变肠道微生物群。
因此,在某些条件下,针对肠道微生物群的维生素补充剂(直接和间接)可能对健康有益。
越来越多的证据表明,当大量服用以逃避完全吸收或以结肠靶向递送系统 (CTDS) 的形式服用时,维生素可以直接调节肠道微生物组。此外,维生素似乎通过体循环的间接机制影响肠道微生物群,与人类健康直接相关。
结肠靶向维生素补充剂可能通过三种相互关联的途径影响宿主健康
1) 对肠道免疫系统的直接影响(上左图)
2) 对肠道上皮屏障的直接影响(上右图)
3) 通过微生物代谢产物对肠道微生物群以及随后对肠道免疫和上皮屏障的影响(中)
在一个小型成人志愿者组中进行了一项试点研究,该组补充了过量的维生素B2(100 毫克),为期 14 天。他们发现,在补充过程中,每克粪便中的Faecalibacterium prausnitziip数量增加。作者还注意到厌氧罗氏菌属的增加和大肠杆菌减少。
关于维生素的结肠靶向性,最近的一项研究表明,通过缓释微囊结肠靶向补充烟碱酸有益于影响微生物组成和胰岛素敏感性。有趣的是,作者还观察到肥胖受试者群体中α多样性和拟杆菌丰度降低,并指出这种变化与膳食烟酸摄入量降低有关。
针对克罗恩病的研究发现发现,补充维生素 B2 可减少全身氧化应激、一些抗炎作用,降低 C 反应蛋白、红细胞沉降率、血小板和 IL-2,并减轻临床症状。粪便微生物群的荧光原位杂交分析显示 克罗恩病患者中粪便肠杆菌科细菌减少、粪便钙卫蛋白水平降低。
维生素可以调节微生物组、改变氧化还原电位,并且就维生素 B3而言,对全身胰岛素敏感性和代谢性炎症的生物标志物产生积极影响。虽然需要进行额外的临床研究以充分了解结肠靶向递送维生素的优势和潜在副作用,但在菌群失调的情况下,这种方法可能成为预防和治疗微生物组相关疾病的新的菌群调节途径。
该领域的研究很复杂,因为不仅肠道菌群的组成因人而异,饮食也会改变肠道菌群的组成和功能,维生素介导的免疫维持也因人而异。
补充结肠靶向维生素可能与基于个人健康状况和微生物组组成的个性化营养建议相关。
目前,对肠道微生物群的研究及其与多种 B族维生素的相互作用机制的理解正逐步深入,精准健康和营养新时代正在开启。
主要参考文献
Beane, K.E., Redding, M.C., Wang, X. et al. Effects of dietary fibers, micronutrients, and phytonutrients on gut microbiome: a review. Appl Biol Chem 64, 36 (2021). doi.org/10.1186/s13765-021-00605-6
Uebanso T, Shimohata T, Mawatari K, Takahashi A. Functional Roles of B-Vitamins in the Gut and Gut Microbiome. Mol Nutr Food Res. 2020 Sep;64(18):e2000426. doi: 10.1002/mnfr.202000426. Epub 2020 Aug 19. PMID: 32761878.
Yoshii K, Hosomi K, Sawane K, Kunisawa J. Metabolism of Dietary and Microbial Vitamin B Family in the Regulation of Host Immunity. Front Nutr. 2019 Apr 17;6:48. doi: 10.3389/fnut.2019.00048. PMID: 31058161; PMCID: PMC6478888.
Steinert RE, Lee YK, Sybesma W. Vitamins for the Gut Microbiome. Trends Mol Med. 2020 Feb;26(2):137-140. doi: 10.1016/j.molmed.2019.11.005. Epub 2019 Dec 17. PMID: 31862244.
Heather M Guetterman, Samantha L Huey, Rob Knight, Allison M Fox, Saurabh Mehta, Julia L Finkelstein, Vitamin B-12 and the Gastrointestinal Microbiome: A Systematic Review, Advances in Nutrition, 2021;nmab123, doi.org/10.1093/advances/nmab123
Putnam EE, Goodman AL. B vitamin acquisition by gut commensal bacteria. PLoS Pathog. 2020 Jan 23;16(1):e1008208. doi: 10.1371/journal.ppat.1008208. PMID: 31971969; PMCID: PMC6977713.