-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

写在前面
本文是谷禾健康微生物团队参考自英国大不列颠国家图书馆,美国微生物学会于 2003 年 在南卡罗来纳州查尔斯顿举办的一次微生物学座谈会,以及哈佛医学院微生物学系教授罗伯托·科尔特(Roberto Kolter)给Annual Review 期刊成立75 周撰写的微生物特刊等综合整理的,我们不是历史学家,更称不上微生物学专家,整理本文仅仅是向大家分享微生物学诞生和发展历程,以及全世界微生物学如何蓬勃发展、微生物相关技术给人类生命健康和生产生活等带来哪些影响和改变,我们相信未来微生物学的历史进程将会发生巨大的变化,因为从未见过像现在这样普遍的对微生物感兴趣。
我们应该思考随着技术的进步和人类对世界资源的压力越来越大,微生物科学正在发生怎样的变化?哪些主题值得探索,探索这些领域的障碍在哪里。
当我们站在基因组学、公众对生物恐怖主义、全球传染病爆发、前所未有的计算能力以及大规模生态灾难的可能性的交汇处,微生物学的最大机遇在哪里,什么是真正需要的,必须克服哪些障碍实现的机会?21世纪微生物学应该有哪些新方向?
总之,我们应该将此视为一个特殊的机会,致力于共同改善人们的生活和我们共同星球的健康。
前言
从当今科学飞速发展的角度来看,微生物学经历了漫长的发展。从安东尼·范·列文虎克(Antonie van Leeuwenhoek)对小动物的描述,到法国化学键路易斯·巴斯德(Louis Pasteur)创造的“微生物”一词已经过去了200多年。但是关于微生物学的累积知识和技术发展,大部分是在19世纪下半叶获得的,得益于多学科方法来研究地球上的各种微生物活动。
此时此刻,对于微生物学来说,是一个承上启下空前发展的阶段,尤其是2019 年冠状病毒病 (COVID-19) 大流后,我们越来越意识到微生物是生物圈的基础。它们是所有生物的祖先,也是所有其他生命形式的支持系统。
矛盾的是,某些微生物对人类健康以及植物和动物的健康构成威胁。作为生物圈的基础和人类健康的主要决定因素,微生物在地球上的生命中扮演着主要的、根本的角色。因此,研究微生物对于研究所有生物至关重要,而微生物学对于研究和理解这个星球上的所有生命至关重要。
微生物学研究正在迅速变化。该领域受到影响公众对微生物认知的事件的影响,例如全球大流行的新冠病毒出现和持续变异、生物恐怖主义的威胁、以前有效的抗生素和治疗微生物疾病的疗法越来越失败,以及大规模污染食物的事件。微生物研究正在利用开辟新研究领域的技术进步,特别是在基因组学方面。
微生物有着迷人的生活方式,许多生活在自然环境中的微生物会根据它们所处的环境发挥有益或有害的功能。微生物学从未像今天这样令人很多人感兴趣。强大的新技术,包括新颖的成像技术、基因组学、蛋白质组学、纳米技术、快速 DNA 测序和海量计算能力,已经融合在一起,使科学家能够深入研究以往认为无法或难以实现的研究。因此,几乎每一天都会有一项关于微生物的研究发表表明微生物具有核心重要性。
1
什么是微生物和微生物学?
微生物是在自然栖息地中共同生活的微生物群落,这些生物只能用显微镜才能看到,这些生命形式被称为微生物或微生物组。微生物包括细菌、古生菌、病毒、真菌、原生动物、朊病毒和酵母菌以及微观藻类。
微生物学是对肉眼无法看到的所有生物体的研究。微生物学研究涵盖了这些微生物的所有方面,例如它们的行为、进化、生态学、生物化学和生理学,以及它们引起的疾病的病理学。正如接下来的章节中所讨论的,微生物学在不同的流中扮演着非常重要的角色。
为什么微生物很重要?
在人类的发展史上,每个人都着延长寿命,1850年出生的婴儿只能指望活35年,然而目前的人类普遍的平均寿命都可以超过75年了。
那么人类是如何推翻掌握我们生命计算尺的预言,很大程度依赖过去,现在,未来在实验室战斗的无畏科学家们,尤其是微生物学家,比如,安东尼·飞利浦·范·列文虎克(发明显微镜,并观察到 “动物”(小动物)的微生物(细菌和原生动物)的人)、路易斯·巴斯德(他创造了“发酵”一词,是“现代微生物学之父/细菌学之父”)、罗伯特·科赫(提出科赫法则,验证了疾病的细菌理论,现代微生物的奠基人)、亚历山大·弗莱明安东(青霉素的发现者)、中国科学家伍连德(中国科学防疫第一人,世界鼠疫专家)、汤飞凡(著名微生物学家、沙眼衣原体发现人)等,他们抢救孕妇,拯救婴儿,对抗瘟疫,研制疫苗,发现抗生素等,大大扩展了人类对生命和微生物的认知,对延长人类寿命做出重要的贡献。
2
微生物和微生物学的核心作用
微生物影响着所有生命以及我们星球的物理和化学组成。从生命的起源开始,没有所有其他生物的生命是可能的,但没有微生物的生命是不可能的。
因此,科学家认为如果不考虑微生物的活动,就无法对生物学或地质学的任何分支进行深入研究。微生物是生物圈的主人,而我们存在的星球确实是微生物的星球。
微生物也是人类健康的决定因素,也是医疗和工业用途的关键材料的来源。因此,微生物学与生物化学、遗传学、进化或分子生物学一样,是生命研究的核心。
// 生命之树的根源
天体生物学中最大的问题之一是生命如何起源于地球。生命的基石和对生命至关重要的有机分子从原始地球开始就存在于地球上,在那里形成了生命的基本单位——细胞。这个过程是如何完成的,是天体生物学的主要研究领域之一。
微生物是现在地球上所有复杂多样的生物形式的祖先。植物和动物出现在微生物世界中,并与微生物保持着密切的联系和依赖。
作为生命之树的根,微生物是所有生命形成的原始模板,所有生命都与之密切相关。为了了解我们今天在生命之树的树枝顶端看到的生物的进化过程,有必要研究它们与祖先的关系以及这些祖先是什么样的。
通过研究当今生活的与第一批生命形式的特性相呼应的微生物,微生物学家试图了解创造我们全球生态系统的力量和过程。
此外,微生物是用于实验进化的卓越系统,因为它们为研究人员提供了快速的世代时间、遗传灵活性、无与伦比的实验规模和易于管理的研究系统。使用微生物的研究对所有物种的进化产生了开创性的见解。例如,对微生物相互关联性的研究首先揭示了地球上所有生命进化关联性的当前模型,即生命之树。
1970 年代发现了“生命的第三领域”。古生菌因其独特的生物学特性和大分子而被认为是非凡的研究对象。这一发现引发了许多关于生命起源和了解生物系统如何运作的潜力的问题,因为古细菌为研究提供了独特的资源,以揭示免疫系统的多样性和复杂性。
微生物学家开始拼凑生物系统如何从其组成部分工作,从而使科学家能够设计出执行定制功能的生物体。随着合成生物学领域的发展,现实世界的应用正在从思想领域和实验室范围内的研究转向产业化实践和产业。
最初,许多科学家的印象是深海通风口是生命起源的关键。在这里发现的化合物,可以在我们的海洋底部合成,尽管它是黑暗的,但有许多有机分子和微生物在那里发现了生命。这导致科学家们将他们的研究超越了我们的世界,对包括火星在内的行星进行了任务。鉴于我们知道微生物有能力在水中生存,他们一直在寻找确定“红色星球”过去是否有海洋。
// 维持地球上的生命
生命不仅始于微生物,地球上生命的持续存在完全依赖于不起眼的微生物。据估计,大约有5×10 31( 重达 50 万亿公吨)微生物细胞存在于这个星球上,它们对生物圈的重要性再怎么强调都不为过。
微生物负责循环生命中的关键元素,包括碳、氮、硫、氢和氧。通过在土壤中循环这些元素,微生物可以调节植物养分的可用性,从而控制土壤肥力并实现维持人类和动物生命的有效植物生长。
微生物在循环大气气体中也发挥着重要作用,包括造成“温室效应”的化合物,自相矛盾的是,它维持着我们星球上的生命,但通过全球变暖,对所有生物构成威胁。与绿色植物相比,微生物进行更多的光合作用。
事实证明,由于微生物可以吸收大型生物通常无法利用的营养物质和其他元素,因此微生物位于许多食物链的底部,在那里它们将以前惰性的无机材料转化到生物圈中。
微生物也是回收专家,它们降解生物废物并释放关键元素供其他生物使用。
目前,科学家才刚刚开始了解微生物如何适应环境,它们如何应对变化,以及它们如何与微生物群落的其他成员交流以执行维持生物圈的功能。了解这些现象将有助于我们更全面地了解我们的全球生态系统,并可能使科学家能够纠正人类对大大小小的生态系统的破坏。
// 对人类健康至关重要但危险
人类与微生物有着密切的关系。尽管它们对环境产生了很大的有益影响,但一小部分臭名昭著的细菌、真菌、寄生虫和病毒可能会导致疾病。
我们体内90%以上的细胞都是微生物;细菌和真菌遍布我们的皮肤、口腔、肠道和其他区域。微生物能够在我们的肠道中有效消化,合成必需的营养物质,并与身体器官保持良性甚至有益的关系。这些生物的存在会影响我们的身心健康。
微生物是如何引起疾病的?病原微生物和病毒具有各自的生态策略,该策略决定了它们攻击的位置以及它们对宿主的影响。
问题的根源之一是病原体在我们的免疫系统认为是“特权”的人体区域定殖。在进入这些地点或维持其菌落的过程中,微生物和病毒可能会对人体组织造成损害,产生疾病的迹象和症状。当免疫系统检测到微生物细胞或病毒时,疾病也可能开始。身体的免疫系统会对可能对身体本身造成伤害的外来生物进行攻击。在某些情况下,病原体在人体组织中造成的损害或对它们的免疫反应可以促进病原体向新宿主的传播。
因此,疾病的出现是一种新的致病微生物或病毒被识别或一种旧的微生物或病毒导致一种新的疾病——是当今的热门话题。从大肠杆菌O157 菌株到 SARS到COVID-19,每年都会发现新的疾病和新的病原体,这让公众感到恐惧。许多情况可能在疾病出现率的增加中起作用,包括各种宿主、环境和社会因素。
// 对工业和医学有用
工业和医学越来越依赖微生物来生产化学品、抗生素和酶,从而改善我们的世界并拯救生命。微生物正在被分子生物学工具驯化,以生产可生物降解的塑料和各种类型的新材料。
生物技术很快将成为各国工业基础的支柱,它以多种方式利用微生物和病毒,包括作物基因工程和基因治疗等不同应用。微生物学研究使这些成功的技术成为可能,而在工业和医学中使用微生物的未来进步依赖于今天进行有效的研究。
3
为什么微生物学研究很重要?
如上所述,微生物在我们的生活中起着至关重要的作用。事实上,我们不能没有他们,但他们可以没有我们。它们涉及许多过程,并且存在于多种环境中,其中一些是极端的。
由于它们的多功能性,微生物可以在许多方面发挥作用:疾病的原因和控制、制造救命药物、制造生物燃料、清理污染以及生产/加工食品和饮料,影响气候和生态环境。
// 医学微生物学的重要性
医学微生物学主要研究对人类和动物都有益和有害的微生物。医学微生物学的分支包括病毒学、细菌学、寄生虫学和真菌学等。
医学微生物学具有的一些重要特征,这些重要性在于它有助于病原微生物的鉴定、分离、诊断和治疗,还可以产生有益的生物体,如酵母菌和一些抗生素。
微生物学家研究微生物,而支撑现代社会的一些最重要的发现来自著名微生物学家的研究,例如詹纳和他的天花疫苗、弗莱明和青霉素的发现、马歇尔以及确定幽门螺杆菌之间的联系幽门螺杆菌感染和胃溃疡,以及 zur Hausen,他确定了乳头状瘤病毒与宫颈癌之间的联系。
生物医学研究源自生命和物理科学的许多领域,包括生物学。生物学家使用微生物学来开发预防疾病的新方法。微生物学提供的信息可进一步用于制造针对不同疾病的疫苗和治疗方法。
随着新细菌和感染的识别和分类,医学微生物学家的工作也在不断发展。生物学家在研究免疫系统时会使用从微生物学中获得的知识。
科学家在确定维生素补充剂对人类的影响时研究维生素效率。如果没有微生物学,科学家将无法看到细胞的内部结构并了解细菌、病毒和原生生物如何发育、生长和感染其他细胞。
微生物学在医疗设备中发挥着重要作用,例如荧光融合,用于快速准确地检测组织样本中的病原体。它是一种进行免疫荧光研究的技术,可用于在复杂的生物系统中寻找特定细胞。
医学微生物学的最大例子是给糖尿病患者注射从动物身上获得的胰岛素。但是由于大量需求以及由于它不是人类衍生的兼容性问题,因此需要一些其他来源的人胰岛素。然后采用涉及大肠杆菌的rDNA(Recombinant DNA)技术生产大量甚至安全的人胰岛素。
外科、医疗技术和药理学领域的发展促进了以前无法治愈的各种恶性和非恶性疾病的治疗。这些进步导致预期寿命和生活质量的提高。然而,也有不利的一面,包括因手术和其他侵入性手术、免疫抑制药物治疗或免疫系统老化而特别容易感染的患者数量激增。这些患者可能会感染多种微生物,包括那些通常不具致病性的微生物。
人们也越来越认识到感染的异常临床表现和病原体在它们通常不相关的身体区域中的存在。分子技术能够检测不可培养或难以培养的微生物,有望快速检测新的和不寻常的微生物。并非所有分子系统都是针对所有病原体设计的,但未来可检测微生物的范围可能会增加。
实验室检查是临床医生处理侵袭性感染患者的重要工具。脓毒症的发病率在世界某些地区有所增加,迫切需要快速识别致病微生物。与传统的培养和鉴定技术相比,多项研究已经确定现代分子方法的总体敏感性和特异性更高。检测时间也令人印象深刻,快速分子方法为 0.2-6 小时,而传统方法为 24-48 小时。
// 人体微生物学的重要性
人类胃肠道是极其密集的微生物群落的家园。这些微生物采用独特的策略在这种主要厌氧的环境中捕获能量。在分解源自饮食和宿主的底物的过程中,肠道微生物群会产生范围广泛的代谢产物,这些产物会在肠道中积累到高水平。越来越多的研究表明,这些化学物质通过作用于胃肠道内的细胞或进入循环并在体内远端部位发挥作用,从而影响宿主生物学。
鉴于肠道微生物群的高度功能多样性和多样化饮食,人体内微生物群衍生分子的组成部分因个体而异。因此,肠道中的微生物和它们产生的代谢终产物代表了一个表型杠杆,我们可以控制它来开发个性化医疗的新疗法。
越来越多的微生物组功能研究揭示了代谢物对人类健康和疾病的具体影响。随着对这些分子知识的扩展和生物学机制的阐明,将会出现一组新的治疗靶点。我们设想精确的健康策略将需要测量一个人的微生物组并将这些数据与代谢组以及蛋白组等分析相结合。然后,这些数据将指导利用微生物组的相对可塑性来调节微生物代谢物和促进健康的策略。
研究人员正在研发和推进控制微生物的个性化的策略,包括:
(a)改变微生物代谢的底物可用性
(b)通过饮食调节物种组成
(c)靶向微生物或代谢物的药物
(d)开发设计益生菌
(e)组装微生物群落
(f)进行粪便微生物群移植
….
这些策略存在于分子特异性的连续统一体上,从针对单个微生物中的单个酶的药物治疗方法到替代微生物组大部分代谢活动的粪便移植。
找到有效的策略将取决于对微生物和宿主新陈代谢的精确了解,同时需要足够大的人群数据库。这些与宿主修饰的化合物特别相关,在动物模型中控制代谢物通量的化合物可能不会在人体中这样做,因为 I 期和 II 期代谢不同。
// 环境微生物学的重要性
环境微生物学是对环境中微生物群落的组成和生理学的研究。在这种情况下,环境是指覆盖地球的土壤、水、空气和沉积物,还可以包括居住在这些区域上的动植物。
环境微生物学还包括对存在于人工环境(如生物反应器)中的微生物的研究。在这一领域工作的科学家通常强调微生物与植物生命和动物生命的相互作用,以及污染和季节变化等所有环境因素。
以下是微生物学的一些环境用途。它用于油的降解。
众所周知,石油是有毒的,石油造成的污染是一个重大的生态问题。沿海地区和公海的石油泄漏难以控制且难以缓解,但大部分石油可以通过微生物群落的碳氢化合物降解活动消除,特别是碳氢化合物细菌 (HCB)。这些生物可以帮助修复海洋栖息地石油污染造成的生态破坏。HCB 在生物塑料和生物催化领域也具有潜在的生物技术应用。
其次,它用于芳香族化合物的降解。从环境中分离出来的不动杆菌菌株能够降解多种芳香族化合物,也用于废物生物处理的分析。
分子生物学和基因组学在环境微生物学中的应用导致在自然微生物群落中发现了巨大的复杂性。在一系列分子和生物信息学技术的支持下,对自然种群的多样性调查、社区指纹识别和功能询问已经变得很普遍。
// 微生物学在食品工业中的重要性
微生物学也有助于保证我们的食品安全。微生物学帮助我们识别食物中存在的微生物。更好地了解这些微生物,帮助生物学家找出防止食物腐败变质和确保食物安全的方法。科学家使用好细菌对抗病原菌来防止食物污染。以下是微生物学在食品和农业工业中的优点。
专门研究食品细菌的微生物学家可以与食品和药物管理局合作,帮助识别可能对人类健康构成风险的食品。他们还调查食物中毒的爆发,旨在找出其原因,以防止再次发生。
微生物学也为我们提供了干净的水。这些活细菌有助于通过污水处理保持水的清洁。细菌分解污水中的有机物,在水释放回环境之前帮助净化水。
微生物学家研究微生物在土壤中的重要作用。一些专注于植物病虫害,开发控制它们的方法,甚至使用微生物来控制害虫和杂草。其他人则研究导致农场动物疾病的微生物。此外,微生物学帮助农民优化硝酸盐水平并最大限度地提高产量。
它有助于找出天然农药。很少有像细菌和病毒这样的微生物被用来对抗攻击农作物的害虫。因此,它们被称为天然农药。它们对害虫或昆虫如此特殊,不会对植物或动物和人类造成任何伤害。
帮助使用天然肥料。很少有像藻类和细菌这样的微生物通过固氮和保持土壤容量的水分来提高土壤肥力。因此,它们还保持适合植物生长的土壤微生物学。轮作是农民采用的一种技术,通过利用豆科植物根部的微生物来提高土壤肥力。
农业微生物学有助于分解废物。微生物分解农业土壤中的合成农药残留和其他有毒物质,从而保护农场免受毒素积累。
食品工业中微生物学应用的一个例子是乳酸链球菌素。它是一种抗菌剂,用于奶酪、肉类和饮料,通过抑制有害细菌的生长来延长保质期。
// 微生物学在日常生活中的重要性
微生物学在我们的日常生活中使用并在其中发挥着重要作用。这里讨论了我们日常生活中使用的微生物学的一些主要特征。日常生活中应用的微生物学,在食品生产、生物降解、商业产品生产、生物技术和基因工程方面。
有各种各样的菜肴需要微生物。例如,为了制作凝乳和奶酪,就需要微生物。一种叫做乳酸杆菌的细菌将牛奶中的乳糖转化为乳酸,从而将牛奶转化为凝乳。此外,酵母可以用来制作面包,在制作酸奶的过程中,细菌很重要。
此外,维生素K只能由人体内的微生物合成。除此之外,细菌用于合成具有商业价值的产品,例如用于制造一次性尿布和塑料的羟基丁酸。也在乙醇中,这是一种生物燃料,它们还合成氨基酸,这是非常常见的膳食补充剂。
因此,微生物学旨在通过研究微生物的形态、新陈代谢、生理学、繁殖和遗传学来获得和扩展我们对微生物的基本理解。这就是微生物学在不同领域发挥重要作用的方式。
在接下来的几年里,我们将看到微生物学的各种其他用途,这对我们在各个方面都非常有益。
1
诞生时代
▸微生物学一词是由法国化学家路易斯巴斯德 (Louis Pasteur, 1822-95) 提出的。
▸据说微生物学起源于 1850 年后生物科学的巨大扩展和发展。
▸Sedillot (1878) 首次使用微生物一词。
2
发展时代
▸17 世纪的英国科学家罗伯特·胡克是第一个使用镜头观察他称之为“细胞”的最小组织单位的人。不久之后,荷兰业余生物学家安东·范·列文虎克用他自制的显微镜观察了他所谓的“动物”。
▸荷兰代尔夫特的安东尼·范·列文虎克 (1632-1723)是第一个在 1676 年观察并准确描述称为“动物”(小动物)的微生物(细菌和原生动物)的人。他建造了 250 多台小型强大的显微镜,可以放大大约 50-300 倍。
▸列文虎克是第一个使用他自己制造的显微镜对细菌和原生动物进行精确和正确描述的人。由于对微生物学的这一非凡贡献,安东尼·范·列文虎克被认为是“微生物学之父”。
3
过渡时代
▸当已知微生物存在时,大多数科学家认为这种简单的生命形式肯定可以通过自发产生。也就是说,生命被认为是从泥泞、湖泊或任何营养充足的地方自发产生的。这个概念是如此引人注目,以至于它一直持续到 19 世纪后期。
▸Francesco Redi (1626-1697):自发产生的古老信念首先受到意大利医生 Redi 的挑战,他对腐肉及其自发产生蛆的能力进行了一系列实验。
▸John Needham (1713-1781):他可能是自发产生理论的最大支持者。他提出这种微生物是在他的羊肉汁中自发产生的。他像 Redi 那样用软木塞盖住烧瓶,甚至加热了一些烧瓶。微生物仍然出现在羊肉汤上。
▸拉扎罗·斯帕兰扎尼(Lazzaro Spallanzani,1729-1799):他是一位试图反驳李约瑟实验的意大利博物学家。他将牛肉汤煮了更长的时间,从烧瓶中抽出空气,然后密封容器。在温育之后,他在这些烧瓶中没有观察到生长。他表明,只要在脖子上开一个小裂缝,加热的营养物质在暴露在空气中时仍然可以生长出微生物。因此,斯帕兰扎尼反驳了自发产生的学说。
▸Nicolas Appert遵循了 Spallanzani 的工作理念。他是一位法国酿酒师,他证明了汤和液体可以通过在厚厚的香槟瓶中广泛加热来保存。
▸Ignaz Semmelweis和John Snow是对疾病传播方式的认识日益增强的两个人。
▸两位德国学者Schulze (1815-1873)和Theodor Schwan (1810-1882)认为空气是微生物的来源,并试图通过将空气通过热玻璃管或强化学物质进入烧瓶中煮沸的输液来证明这一点。两种情况下的输液都没有微生物。
▸George Schroeder和Theodor Von Dusch (1854)率先提出使用棉塞塞住微生物培养管的想法。
▸达尔文(1859 年)在他的著作《物种起源》中表明,人体可以被视为易受自然法则影响的生物。他认为疾病可能是一种生物学现象,而不是任何魔法。
4
黄金时代
▸微生物学的黄金时代始于路易斯巴斯德和罗伯特科赫的工作,他们拥有自己的研究所。更重要的是,全世界的科学界都接受了他们的工作,并愿意继续和扩展这项工作。在此期间,我们看到了微生物学作为生物学学科的真正开端。
▸法国化学家路易斯·巴斯德( Louis Pasteur)在一组涉及鹅颈烧瓶的启发性实验中最终搁置了自发产生的概念。当他在直颈烧瓶中煮肉汤并将其暴露在空气中时,有机体就会生长。当他用他的鹅颈烧瓶做这个时,什么都没有。第二个烧瓶的 S 形截留空气中的灰尘颗粒,防止它们到达肉汤。通过证明他可以让空气进入烧瓶而不是空气中的颗粒,巴斯德证明了在肉汤中生长的是灰尘中的有机体。
▸因此,巴斯德在 1858 年终于解决了自发产生与生物发生的争论,并证明微生物不是从无生命的物质自发产生的,而是从其他微生物产生的。
▸他还发现水果和谷物发酵产生酒精是由微生物引起的,并确定细菌是发酵过程中葡萄酒变质的原因。巴斯德在 1862 年提出,在 62.8°C (145°F) 温度下温和加热 30 分钟而不是煮沸足以在不破坏产品味道的情况下破坏有害生物,该过程称为巴氏杀菌。巴氏杀菌法于 1892 年在商业基础上引入美国。他的工作导致了疾病细菌理论的发展。
▸路易斯巴斯德被誉为“现代微生物学之父/细菌学之父”。
▸John Tyndall (1820 – 1893):一位英国物理学家,在 1877 年对自发产生进行了最后一击。他在一个无菌设计的盒子中进行了实验,以证明灰尘确实携带了细菌。他证明,如果不存在灰尘,无菌肉汤即使直接暴露在空气中,也可以无限期地保持没有微生物生长。他在干草的输液中发现了高度抗性的细菌结构,后来被称为内生孢子。需要长时间煮沸或间歇加热来杀死这些孢子,使输液完全灭菌,这一过程称为丁达尔化。
▸大约在巴斯德进行实验的同时,一位名叫罗伯特·科赫的医生正在努力寻找一些非常讨厌的动物疾病(首先是炭疽,然后是肺结核)的原因。他首次直接证明了细菌在引起疾病中的作用。他是一位德国医生,1876年首先分离出炭疽杆菌(Bacillus anthracis,引起炭疽病)。他完善了纯培养分离细菌的技术。他还在 1881 年通过使用明胶作为固化剂介绍了固体培养基的使用。1882年发现结核分枝杆菌. 他提出了科赫假设,该假设发表于 1884 年,是疾病细菌理论的基石,至今仍在用于证明传染病的病因(具体原因)。
科赫的四个假设是:
许多科学家的共同努力,最重要的是路易斯巴斯德和罗伯特科赫建立了疾病的细菌理论。看不见的微生物是疾病的原因的想法被称为细菌理论。
5
医学和外科的发展
▸一旦科学家们知道微生物会导致疾病,医疗实践的显着改善只是时间问题。手术曾经和不做任何事情一样危险,但一旦引入无菌(无菌)技术,康复率就会显着提高。洗手和对感染患者进行隔离减少了疾病的传播,并使医院成为接受治疗的地方,而不是死亡的地方。
▸约瑟夫·李斯特勋爵 (1827-1912):一位著名的英国外科医生,因其对预防和治疗伤口感染的抗菌治疗的显着贡献而闻名。Lister 得出结论,伤口感染也是由微生物引起的。
1867 年,他开发了一种消毒手术系统,旨在通过在手术敷料上使用苯酚来防止微生物进入伤口,有时还会喷洒在手术区域。
他还设计了一种方法,通过向空气中喷洒细小的石炭酸雾来破坏手术室中的微生物,从而产生消毒环境。因此,约瑟夫李斯特是第一个引入无菌技术,通过使用今天仍在使用的物理和化学试剂来控制微生物。由于这一显着的贡献,Joseph Lister 被称为防腐手术之父。
▸微生物的致病机理在很大程度上是环境微生物学的一部分。罗伯特·科赫的工作是世界观即将发生变化的主要驱动力。科赫证明细菌是重要传染病的病原体,这一观点的强大吸引力使微生物学的医学方面处于中心地位。知道细菌是传染病的病原体,长期以来一直是人类死亡的主要原因,意味着如果你能杀死负责的细菌,你就能治愈疾病。
▸到了20世纪初,微生物学主要集中在努力识别人类传染病背后的微生物。1918年流感大流行造成的可怕死亡人数只是加速了这些努力。由于直到20世纪30年代才发现流感病毒,在此之前,人们认为罪魁祸首是一种细菌,因此在大流行之后的几年里,许多致病细菌都得到了鉴定和深入研究。在这种情况下,关于微生物有益方面的研究基本上被搁置一旁。
▸在鉴定致病微生物的同时,许多微生物学家将注意力转向发现能够专门杀死这些微生物的化合物,这导致了20世纪人类医学史上最戏剧性的革命。
萨哈希罗·哈塔(Sahachiro Hata)和保罗·埃利希(Paul Ehrlich)的早期努力产生了第一种有机抗菌剂,即毒性较大的砷胂胺(Salvarsan),早在1910年就用于治疗梅毒。将染料用作抗菌灵丹妙药的长期努力导致了磺胺类药物的偶然发现,首先是磺胺嘧啶核苷(Prontosil),它在20世纪30年代进入临床使用。但毫无疑问,最有影响力的早期抗菌药物是青霉素。
从1928年亚历山大·弗莱明意外发现青霉素,到1942年霍华德·弗洛里、恩斯特·查恩、玛格丽特·詹宁斯等人在牛津大学的开创性工作,青霉素的纯化和有效注射使用,这种抗生素的开发仍然是人类最伟大的成就之一。
▸一种临床上有用的杀死其他微生物的微生物产品的发现对微生物学、医学和整个制药业的历史产生了持久的影响。为了发现更多的抗生素,出现了一场巨大而非常成功的热潮。
抗生素的临床成功导致其产量增加。这最初得益于20世纪40年代初的世界大战思维。由于青霉素被视为战争中的神奇药物,它的产量在很短的时间内急剧增加。1941年,全球的库存量只有几毫克,到1945年,每月生产近4000公斤。
由于与环境微生物学的分歧,医学微生物学很少关注生产和使用如此大量抗菌剂的生态后果。那些对根除病原菌的方法感兴趣的人和那些对微生物生态学感兴趣的人之间几乎没有什么合作和深入的交流对话。
6
疫苗开发
▸疫苗接种是在细菌理论之前发现的,但直到巴斯德时代才被完全理解。在 18 世纪后期,挤奶女工从他们挤奶的奶牛身上感染了非致命的牛痘病,而这些女工在周期性地肆虐英格兰的致命天花爆发中幸免于难。医生爱德华·詹纳(Edward Jenner)使用牛痘痂脓液为人们接种天花疫苗。
▸爱德华·詹纳(Edward Jenner,1749-1823)是第一个预防天花的英国医生。观察到农村挤奶女工在挤奶时接触了牛痘(牛痘是一种与天花密切相关的病毒引起的较轻的疾病),随后对天花产生了免疫力,这让他印象深刻。1796年 5 月 14日,他证明给人们接种牛痘病灶的脓液可以预防天花。
▸Jenner 于 1798 年发表了他对 23 名成功接种者的研究结果。最终这个过程被称为疫苗接种,基于拉丁词“Vacca”,意思是奶牛。
▸Jenner 的实验意义是由巴斯德实现的,他接下来将这一原理应用于预防炭疽病,并且奏效了。他将减毒培养疫苗(Vacca = 牛)和该过程称为疫苗接种。
受到通过疫苗接种成功预防炭疽热的鼓舞,巴斯德通过研制一种针对恐水症或狂犬病(一种通过狗和其他动物叮咬传播给人类的疾病)的疫苗,朝着为人类服务的方向前进。
与詹纳的天花疫苗接种一样,狂犬病的预防治疗原则也充分发挥了作用,为现代免疫计划奠定了针对白喉、破伤风、百日咳、脊髓灰质炎和麻疹等许多可怕疾病的免疫计划的基础。
▸Elie Metchnikoff (1845-1916)于 1883 年提出了免疫吞噬理论。他发现一些血液中的白细胞、白细胞 (WBC) 通过吞噬引起疾病的细菌来预防疾病。这些细胞被称为吞噬细胞和吞噬过程。因此,人体血细胞也具有免疫力,称为细胞免疫。
7
化疗药物、抗毒素和抗生素的开发
▸两位著名的法国细菌学家Emile Roux (1853-1933)和Alexandre Yersin证明了在白喉生物肉汤培养物的滤液中产生了毒素。
Emil von Behring (1854 -1917) 和 Shibasaburo Kitasato (1852-1931) 都是 Robert Koch 的同事,在 1890 年发现了破伤风(锁颚)抗毒素。在宣布发现破伤风抗毒素仅大约一周后,1890 年,冯·贝林 (Von Behring) 就用白喉抗毒素对白喉进行免疫治疗提出了反驳。毒素-抗毒素关系的发现对免疫学的发展具有重要意义。
▸Paul Ehrlich (1854-1915)在 1904 年发现染料台盼红对导致非洲昏睡病的锥虫具有活性,可用于治疗。这种具有抗菌活性的染料被称为“魔术子弹”。随后在 1910 年,埃利希与日本医生畑坂弘合作,推出了药物 Salvarsan(砷苯)作为治疗由梅毒螺旋体引起的梅毒。Ehrlich 的工作为未来的许多发展奠定了重要基础,Salvarsen 的使用标志着化学疗法的开端,以及选择性抑制或杀死病原体而不对患者造成伤害的化学物质的使用。
▸1935 年,德国的Gerhard Domagk用多种合成染料进行了实验,并报告说 Prontosil 是一种用于给皮革染色的红色染料,它对小鼠体内的病原体、链球菌和葡萄球菌具有活性,尽管它在试管中对相同的传染原没有作用。同年,两位法国科学家 Jacques 和 Therese Trefonel 表明,化合物 Prontosil 在动物体内被分解为真正的活性因子磺胺(磺胺药物)。Domagk 因发现第一种磺胺类药物而于 1939 年获得诺贝尔奖。
▸抗生素是在 1920 年代完全偶然发现的,当时在培养皿(称为盘子)中放置的固体培养物比平时更长。就像任何食物来源一样,它会发霉,长出一块毛茸茸的真菌。与平板其余部分的细菌相比,真菌菌落周围区域的菌落尺寸较小,并且似乎生长不良。被发现负责这种抗菌作用的化合物被命名为青霉素。第一种抗生素青霉素后来被用于治疗患有各种细菌感染的人,并预防烧伤患者的细菌感染,以及许多其他应用。就这样,亚历山大·弗莱明爵士在 1929 年发现了第一个抗生素青霉素。
▸美国罗格斯大学的瓦克斯曼在 1944年发现了另一种抗生素链霉素,它是由两种放线菌(灰色链霉菌)产生的。瓦克斯曼于 1952 年因发现用于治疗结核病的链霉素获得了诺贝尔奖,这是一种由结核分枝杆菌引起的细菌性疾病由 Robert Koch 于 1882 年发现。
▸到 1950 年,又鉴定出其他三种产生抗生素的微生物,例如Paul R. Burkholder 博士于 1947 年从委内瑞拉链霉菌中提取的氯霉素(氯霉素),以及BM 博士从金黄色葡萄球菌中提取的金霉素1948 年的挖掘机;Finlay、Hobby 和合作者于 1950 年从S. rimosus中提取土霉素。
▸1910 年罗伯特·科赫 (Robert Koch) 去世和第一次世界大战的到来标志着微生物学研究发生了巨大转变。巴斯德研究所关闭,德国实验室转而生产用于治疗战争感染的血液成分。许多人称之为微生物学的黄金时代就此结束。
8
20世纪:分子生物学时代
▸到 1900 年底,微生物学发展到青春期,并已成为更具包容性的生物学领域的一个分支。
晚年,微生物被作为研究各种生命过程的理想工具而被广泛采用,由此诞生了一个独立的微生物学学科——分子生物学。
微生物的相对简单性、它们的短寿命和遗传同质性为了解活生物体的生理、生化和遗传复杂性提供了一个真实的模拟模型。
分子生物学领域在理解遗传密码、如何调节 DNA 以及如何将 RNA 翻译成蛋白质方面取得了长足的进步。在此之前,研究主要集中在植物和动物细胞上,它们比细菌细胞复杂得多。当研究人员转而研究细菌中的这些过程时,基因和酶的许多秘密开始显露出来。
▸快速浏览一下从 1947 年到 1976 年分子生物学取得的进展,绝对会让人惊叹不已。科学从对基因性质的不确定状态转变为对复制、转录、翻译的分子基础以及如何调节这些过程的基础知识的相当完整的理解。大多数进展是细菌遗传学(Delbrück 和噬菌体小组的遗产)和生物化学(以 Avery 的纯化和表征方法为例)结合在一起的结果,生物物理学也做出了重要贡献。这一切的中心是大肠杆菌及其噬菌体。
很容易想象单看 DNA 结构就能揭示 DNA 复制和蛋白质合成的机制。但这种结构无疑提供了使用所有可用工具解决这些问题所需的所有动力。在不到十年的时间里,复制和蛋白质合成的一般机制被研究出来。
▸在提出 DNA 结构后不久,了解 DNA 中包含的信息如何被处理以产生蛋白质成为一个关键问题。1954 年,宇宙学家 George Gamow 提出了一种过程,即蛋白质合成通过钥匙锁机制在 DNA 表面发生,其中每个氨基酸都将作为一把钥匙,专门插入可能的 20 个孔或锁中的一个。
▸大部分关于 DNA 如何通过 RNA 聚合酶转录成 mRNA 以及 mRNA 如何在核糖体中翻译成蛋白质以及破译遗传密码的基础知识都发表于 1961 年,这是分子生物学非凡的一年。
▸核糖体于 1955 年被发现并被描述为真核细胞中蛋白质合成的场所。1958年报道了tRNA的存在。但到 1960 年底,几乎没有更多细节被公布。然后,在短暂的推进中,所有的拼图都慢慢凑齐了。基于对噬菌体突变体的遗传分析,Crick 与 Leslie Barnett、Sydney Brenner 和 Richard Watts-Tobin (23) 表明遗传密码是三联密码,三联密码不重叠,密码不包含逗号,每个基因序列都是从特定的起点读取的。
▸ 在基因活动调控这一主题上取得的进展使 1961 年发表的所有其他成就加冕。虽然研究了许多系统,但毫无疑问,在该主题上最有影响力的工作来自弗朗索瓦·雅各布和雅克·莫诺。通过应用遗传分析来研究大肠杆菌中β-半乳糖苷酶活性的诱导,他们开辟了一个关于基因如何关闭和开启的全新世界。
特别是,到 1961 年,他们发表了具有里程碑意义的论文,展示了他们积累的关于乳糖利用基因如何在大肠杆菌中受到调节的遗传证据。其中,他们提出了他们的操纵子模型,其中多个编码酶的基因由作用于操纵基因的阻遏基因调节。事实证明,他们的想法对分子生物学家如何进行基因调控研究产生了持久而极强的影响。
9
归为统一,21世纪微生物学
在 20 世纪的最后 20 年里,毫无疑问,研究宿主-病原体与模型系统和纯培养物相互作用的非常成功的方法使他们中的许多人专注于他们正在进行的研究。1999 年发表了使用非培养方法描述人类肠道微生物群高度多样性的最早报告之一。也许是因为它的资深作者 Joel Doré 曾接受过环境微生物学家的培训,这项开创性的工作几年来相对不为人所知。
在 Torsvik 描述土壤中的高细菌多样性 15 年后,Paul Eckburg、David Relman 及其同事在 2005 年发表了一篇广泛阅读的论文,描述了人类肠道中的高微生物多样性。这项工作让许多人大开眼界,它引发了人类微生物群研究的爆炸式增长。很快,几个实验室要么在纯培养中研究模型微生物,要么在动物模型中使用它们,转而使用独立于培养的方法研究人类微生物群的不同方面。这种转变恰逢测序方法的显着改进和计算能力的提高。
这个话题引起了科学家和公众的极大兴趣,因此美国国立卫生研究院于 2007 年启动了耗资 1.7 亿美元、为期 10 年的人类微生物组计划。尽管对因果关系有大量的夸张和广泛的不恰当解释,但将特定的微生物群落组成与功能联系起来有很多精彩的工作,这项新工作还包含生态学。
人类希望发展能够减轻与人类疾病相关的痛苦的医学实践,推动了继续进行基因研究的努力。世界各地的研究人员越来越多地以联盟和其他协作小组的形式聚集在一起,以完成生物学的重大成就。这些努力的第一个重大成功是人类基因组的测序,这是通过人类基因组计划(HGP) 完成的。
这种对理解人类与其相关微生物群落之间相互作用的兴趣的增加对整个微生物学产生了深远的,当然也是非常积极的影响。生态学家、进化生物学家、化学家、物理学家、计算生物学家和其他人已经进入该领域,因为他们的专业知识变得至关重要。现在,人们对微生物及其代谢途径的广泛多样性的研究重新引起了人们的关注,因为人们认识到所有生态系统都在其最基本的水平上存在微生物。生态和进化原理现在指导着微生物的研究。无论是研究人类肠道还是南极洲的冰冻湖泊,都是环境微生物学。
10
过去十年,微生物学发生了怎样的变化
在过去的 15 年里,这一统一的新微生物学出现了许多令人兴奋的新进展,因此不可能在此一一介绍。最近的历史仍在形成中,而且是最难评估的。
公众现在比历史上任何时候都更加了解微生物和病毒。不幸的是,这种公众意识通常伴随着焦虑和恐惧。过去十年的事件和媒体报道这些事件的基调助长了公众的恐惧,并产生了微生物世界风险增加的看法。这种“微生物恐惧症”导致消毒剂、抗菌肥皂和其他声称可以阻止疾病的产品的普及。
与传染病相关的话题对微生物学家来说当然不是什么新鲜事,但过去十年的发现和进步揭示了该领域的新视野,为提高人类生活质量提供了令人兴奋的机会。预测疾病出现的能力是一个特别关键的话题。对引发病原体出现的环境因素、驱动疾病迁移的因素以及疾病频率的季节性模式的研究可能会揭示影响新旧疾病如何在人群中出现和持续存在的因素。这些观察结果将使我们能够为新的和现有的病原体设计更好的治疗策略。
最近发现将人类疾病越来越多的与细菌或病毒原因联系起来,突出了其他具有神秘病因的慢性疾病也可能由微生物介导的可能性。候选药物包括炎症性肠病、糖尿病、类风湿性关节炎、结节病、系统性红斑狼疮和冠状动脉疾病。对这些疾病和其他疾病原因的研究将更加了解这些疾病及其诊断、预防和治疗。
生物恐怖主义以及炭疽或其他传染性微生物可能被用作对付无辜平民、农作物或牲畜的武器的明显可能性已经吓坏了全球人民。COVID-19、SARS、西尼罗河病等新型传染病的出现明显增加,也将微生物带入了公众视野。
最近,用于对抗某些传染病(包括艾滋病和肺结核)的常规健康疗法由于这些病原体的不断进化而失败,这加剧了公众对科学家和医生保护公众免受熟悉疾病侵害的能力的怀疑。一些曾经被认为是由遗传易感性或偶然性等因素引起的慢性疾病已被证明是由细菌或病毒引起的。而在很多国家,大规模食品污染事件呈上升趋势。
由于公众对生物战、传染病和食源性疾病的担忧,过去十年微生物学的进步经常被忽视。然而,过去十年的进步是不可否认的。药物研究现在严重依赖微生物和微生物学来进行药物发现和生产。2019年,美国科学家团队捕捉到细菌“间谍”:研究人员发现了一种有助于耐药细菌感知抗生素的蛋白质。肠道微生物作为隐藏的骑士:肠道微生物群被证明可以保护宿主免受轮状病毒感染。
使用微生物进行工业过程的绿色化学是解决化学相关行业安全性和可持续性问题的一种日益有效的策略。生物技术也依赖微生物技术和微生物基因来进行改良,以改善作物、牲畜品种和合成原料。
在农业中,微生物和微生物产品现在用于益生菌疗法、抗生素和害虫防治措施。
食品微生物学的进步提高了我们在超市和餐馆购买的食品的安全性,无疑每天都在挽救生命。
在危险废物处理场,微生物已经开始消化有毒化学物质——将它们代谢成无害物质,从而防止进一步污染土壤和水。
生物恐怖主义和疾病令人恐惧,但应牢记微生物学的进步和应用微生物正在解决看似棘手的人类问题。
在过去十年中,不仅公众对微生物学的看法发生了变化,微生物学研究的实践也发生了变化。过去十年的微生物学是充满活力和令人兴奋的,新的发现建立在过去非凡的工作之上。
1
更多的综合,更少的简化
微生物学曾经几乎只关注在人工条件下孤立生长的单个微生物,试图从实验室记录的微小观察中推断出对疾病或环境的理解。然而,今天,许多科学正在从还原论方法转向综合领域——将微生物、其环境以及其他生物体在许多尺度上的影响的测量和观察编织在一起,以创建一个综合图景的微生物活动。曾经不熟悉的细胞由相互作用的蛋白质网络组成的概念现在已经渗透到科学界。现在更加重视系统级研究,其中微生物在其栖息地被视为一系列相互关联的隔间、过程、和反馈。
将合成或系统镜头放在微生物学上可能具有很高的指导意义,并且与严格的还原论相比具有几个优点。希望在未来,综合方法将使微生物学家能够预测微生物结果,使他们能够查明人类健康或给定生态系统扰动的后果。
2
更加重视进化和生态
在过去的十年里,微生物学家越来越认识到生态和进化的重要性。实验生态学和进化论的研究提供了不仅适用于微生物的原理的证据,也可能适用于更大的生物体。生态思维已占主导地位,微生物学不再是过去的试管科学。一个例子是认识到微生物引起疾病的方式实际上是一个生态问题,需要了解微生物及其环境——疾病的宿主。
微生物学研究的调查方式也发生了变化。以前,由于技术限制或缺乏与微生物学相关的领域(如土壤科学、地质学或医学)的专业知识,许多调查潜力领域都被关闭了。在这些情况下,研究中的问题经常被重新定义以适应手头的技术和主要研究者的学术经验。今天,这些探究路线通常通过应用过去十年的技术进步进行正面探索,更重要的是,通常通过合作从其他学科招募专业知识和资源。
3
技术进步
技术进步改变了微生物学研究的格局,使长期存在的关于微生物的问题终于可以研究。在过去十年的重大进步中,最主要的是使基因组学成为可能的技术的发展,包括增强的计算能力、更快速的 DNA 测序和其他实验室技术。
基因组学利用基因组的全部或部分,即细胞的完整遗传体,来回答有关生物体的问题。尽管基因组学已经影响了大部分生命科学,并让人们对所有生命形式的功能和过程有了新的认识,但其最重要的影响还是对微生物学的影响,这一发展为微生物的生态学和进化开辟了新的认识。其他大规模研究,例如蛋白质组学或转录组学(基因表达的模式),也对微生物学研究的实践产生了很大影响。
信息技术的进步增加了所有领域研究人员之间的互动,使微生物学与其他学科之间的共同点得以持续对话。纳米技术和相关方法应该允许研究人员用单细胞进行实验,回答关于微生物生理学的长期问题。
最后,核磁共振成像 (NMR)、ESR 等高端成像技术允许对微生物细胞结构和微生物群落结构进行详细分析。信息技术的进步增加了所有领域研究人员之间的互动,使微生物学与其他学科之间的共同点得以持续对话。
纳米技术和相关方法应该允许研究人员用单细胞进行实验,回答关于微生物生理学的长期问题。最后,核磁共振成像 (NMR)、ESR 等高端成像技术允许对微生物细胞结构和微生物群落结构进行详细分析。
随着分子微生物学的出现,用于定义疾病微生物病因的传统方法(如科赫假设)已被发现不足,因为它们经常导致“假阴性”结论。研究人员一直在努力制定强有力的标准来识别超出科赫假设的微生物因果关系,并利用技术进步来识别因果关系,即使是无法在实验室培养的微生物也是如此。
本科阶段的培训
在本科阶段,微生物学教育有两个不同的方面:培养未来的微生物学家和培养其他领域的生物学家。关于培养未来的微生物学家,需要努力修改教科书,以反映关于微生物全球重要性的新知识,并克服可能仍然困扰一些微生物学课程的对记忆的强调。
很明显,所有生命科学家都应该接受微生物学培训,作为其核心课程的一部分。微生物生理学、进化、生物化学和遗传学等主题都应纳入生命科学本科生的课程。
幸运的是,有很多机会将适当的微生物学课程引入其他学科的课程。例如,几乎所有生物学学生都需要的有机化学课程将从微生物学和绿色化学的例子中受益,以证明从简单的前体合成复杂的化合物。即使是生命科学以外领域的学生也会从微生物学课程中受益,可能会在非专业的生物学探索课程中作为“微生物和你”部分进行介绍。
在许多大学中,微生物学被严格视为专业领域,而不是核心学科。鉴于微生物科学的根本意义,应该认识到拥有大量微生物科学教师的重要性。这样的教师不一定要设在微生物学系。地质学、化学、临床医学、工程学甚至历史学系都非常需要微生物学家的任命。这些教师可以跨越传统的部门障碍,在许多领域进行互动,有效地教育和培训下一代科学家。
提高微生物素养
回顾事实:微生物是最早的生命形式,它们是人类健康的重要决定因素,它们执行确保清洁饮用水和肥沃土壤的过程。它们是基因和生化最多样化的生命形式,也是地球上进化最快的生物。
微生物控制着世界营养物质和生命必需物质的环境循环。在每一个裂缝和每一个表面,从地壳深处,再到地球上每一种昆虫的肠道,微生物都在那里。
它们是所有生物系统的关键组成部分。鉴于这些事实,很明显微生物学家必须努力教育公众和政策制定者。然而,公共素养从事微生物学工作的人所经历的兴奋与公众的意识水平之间存在着严重的鸿沟。
然而,有证据表明,在艾滋病毒-艾滋病、西尼罗河病和 SARS 等重大公共卫生问题上对公共扫盲的支持水平提高会影响大学生对专业和研究项目的选择。换句话说,提高公共素养可能有助于引导学生进入最需要他们精力的领域。
此外,公众舆论可以通过提高对微生物学中未解决问题的认识来引导,从而影响领导者将资源投入到需要的领域。因此,旨在解决微生物学重大问题的培训计划应包括培养公众和政府意识的外展计划。
对公众进行微生物学教育的最佳方式是什么?迫切需要向公众宣传微生物学成功和紧迫的公共卫生问题的机制。
沟通问题
在向公众传达有关微生物学的信息时,首先要确定目标受众和适合传达给每个受众的信息类型是至关重要的。微生物外展的潜在目标受众包括一长串,包括商界领袖、各级学生和教师、公职人员、卫生专业人员(可能对微生物学不够熟悉)、农民、餐馆工作人员、联邦决策者机构等。
为了实现最有效的外展计划,教育公众的过程应该有明确的目标。具体的外展计划应该考虑到可以在指定时间段内实施的具体教育目标。这种方法将允许进行有针对性的评估,以确定外展计划在向公众传播微生物学方面是否有效。例如,一个项目的目标可能是在五到十年内对公众进行特定微生物学主题的教育,并且可以使用调查或其他指标来衡量目标受众的知识水平。
沟通的途径
向非科学家传达科学信息的最佳方式是什么?有许多途径可供外展。
例如,可以发起一项运动,向使用公共交通工具的人展示科学信息:公共汽车、火车、出租车或机场。
基于微生物主题的流行书籍的出版也将吸引大量读者。科学博物馆是教育年轻人的有力渠道,互动微生物展品可以以一种引人入胜的方式激发许多未来科学家的思想。也可以使用大众媒体。
以系统的方式研究目前用于向公众传播的与微生物学相关的材料的质量可能是有益的。目前缺乏公共知识可能是由于可用信息质量差,而不是可用性低。
改善向公众提供的知识需要让传播专业人士参与并通知他们。微生物组织应优先接触传播专业人士,并应帮助培训科学作家。
与决策者沟通
关于推进本报告中概述的目标,“决策者”一词包括联邦机构,例如国家科学基金会、卫生研究院、环境保护署、能源部、疾病控制和预防中心、农业部。其他包括地方教育委员会、国土安全部、食品和药物管理局、私人基金会等。
荧光显微镜、热循环仪、qPCR 机器、杂交炉、自动化专家系统、专用试剂——这些是现代微生物实验室更昂贵的要求。
在一些地区,新技术的吸收速度一直很慢。对于资源匮乏的地区,这些障碍似乎无法克服,因为必须为升级实验室基础设施和员工培训以及购买主要设备分配大量资金。同时,采购所需的设备、试剂供应和售后服务也很困难。
用于确认临床诊断、进行传染病监测和指导公共卫生保健政策的实验室拨款相对较少。获得良好实验室检测的机会有限导致对临床算法的依赖,但如果没有实验室确认,误诊可能很常见,导致治疗不充分、死亡率增加和缺乏对传染病真实流行率的了解。
受微生物科学进步影响但本身不是微生物学家的知情人士可能是微生物学的最佳倡导者之一。例子包括生物技术公司及其客户的代表、依赖训练有素的微生物学家技能的商业创始人、使用微生物修复财产的社区成员以及微生物疗法的受益者,包括细菌衍生的抗生素和其他药物。
建议
由于微生物对生命至关重要,并且在生物学研究中必须考虑到它们的活动,所有生物学家都必须具有扎实的微生物科学背景。微生物学课程应纳入生命和地球科学所有学生的核心课程。
在年轻学生中建立对微生物的了解,最终将提高公众对微生物对个人和地球日常健康重要性的认识。修改小学、初中和高中的学校科学课程,以包括微生物学课程和实验室练习。
通过与疾病相关的问题、生物技术、生物恐怖主义和食品安全,微生物和微生物学对公众产生了深远的影响。为了提高个人管理健康和对微生物科学做出明智判断的能力,与微生物学相关的专业协会应支持培养公共微生物素养的项目。
主要参考文献:
Microbiology in 20th Century. 2011. Link (accessed July 21, 2016).
Introduction to Microbiology. 2016. Link (accessed July 21, 2016).
Microbiology, American Society For. Significant Events in Microbiology 1861-1999. 2006. Link (accessed july 21, 2016).
Rhoads, Dan. History of Cell Biology. 2007. Link (accessed July 22, 2016).genbacteriology.
Bacterial Growth. 2015. Link (accessed July 22, 2016).
Utah.edu. PCR. 2016. Link (accessed July 22, 2016).
Innes, Centre John. Microscopy. 2016.
Mikell, Meredith. Understanding Cell Biology: History & Theories. 2003.
Pasteur, L. “”Animalcules infusoires vivant sans gaz oxygene libre et determinant des fermentations.”.” Compt. Rend. Acad. Sci., 1861: 344-347.
Pray, L. “Discovery of DNA Structure and Function: Watson and Crick.” Nature Education, 2009: 100-101
Microbiology in the 21st Century: Where Are We and Where Are We Going? This report is based on a colloquium sponsored by the American Academy of Microbiology held September 5–7, 2003, in Charleston, South Carolina. Washington (DC): American Society for Microbiology; 2004. PMID: 32809308.
Microbiology in the 21st Century: Where Are We and Where Are We Going?
American Academy of Microbiology held September 5–7, 2003, in Charleston, South Carolina.
Washington (DC): American Society for Microbiology; 2004.
Engelkirk, P. G., Duben-Engelkirk, J. L., & Burton, G. R. W. (2011). Burton’s microbiology for the health sciences. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins.
Levinson, W. (2014). Review of medical microbiology and immunology (Thirteenth edition.). New York: McGraw-Hill. Chicago
Cowan, M. Kelly.Herzog, Jennifer. (2013) Microbiology fundamentals :a clinical approach New York, NY : McGraw-Hill
Trivedi P.C., Pandey S, and Bhadauria S. (2010). Textbook of Microbiology. Pointer Publishers; First edition
Tortora, Gerard J., Funke, Berdell R.Case, Christine L.. (2013) Microbiology :an introduction Boston : Pearson.
Apurba Sankar Sastry and Sandhya Bhat K. 2018. Review of Microbiology and Immunology. 6th Edition. Jaypee Brothers Medical Publishers (P) Ltd.

谷禾健康

巨单胞菌属(Megamonas)
巨单胞菌属(Megamonas),厚壁菌门,梭状芽孢杆菌目的革兰氏阴性菌,发酵各种碳水化合物,终产物是乙酸、丙酸和乳酸。分离于人、动物和家禽的肠道。
巨单胞菌作为肠道核心种,可能是亚洲人种的特征。与炎症性肠病、结直肠癌、强制性脊柱炎(AS)、自闭症谱系障碍(ASD)、肥胖等疾病密切相关。
巨单胞菌属(Megamonas)革兰氏阴性,专性厌氧,嗜中温,亲糖,不产芽孢,杆状,不产芽孢,不运动。分离于人、动物和家禽的肠道。

doi.org/10.1099/ijs.0.65456-0
基于比较16S rRNA基因测序的系统发育分析表明,该菌种与“氨基酸球菌科(Acidaminococcaceae)” 的菌种聚为一类,故有研究者认为巨单胞菌属应归入厚壁菌门( Firmicutes )、巨单胞菌属的谱系中。
化能有机营养,发酵各种碳水化合物,终产物是乙酸、丙酸和乳酸。
属内成员有三个种:
Megamonas hypermegas(趋巨巨单胞菌)
Megamonas funiformis(单形巨单胞菌)
Megamonas rupellensis
此属的模式种为趋巨巨单胞菌 ( Megamonas hypermegale )。
目前该类型菌株M. funiformis JCM 14723、M. funiformis菌株1CBH44的完整基因组已被报道,从健康日本男性的人类粪便中分离出来。
Megamonas rupellensis sp. nov,一种从鸭子的盲肠中分离出来的厌氧菌。
结直肠癌
宏基因组和代谢组学揭示早期结直肠癌患者的肠道微生物群特征,对616名参与者进行了粪便宏基因组和代谢组学研究。在代谢组学研究中,他们发现:
在19.2%的患者(616名中的118名)中,巨单胞菌属(Megamonas)数量非常丰富。但在以往欧美受试者的肠道微生物群研究中,巨单胞菌没有被报道为优势属,只在中国个体的研究中发现,这表明该属可能是亚洲人群的特征;但在另外一篇研究中表明,炎症性肠病患者巨单胞菌属度显著降低。
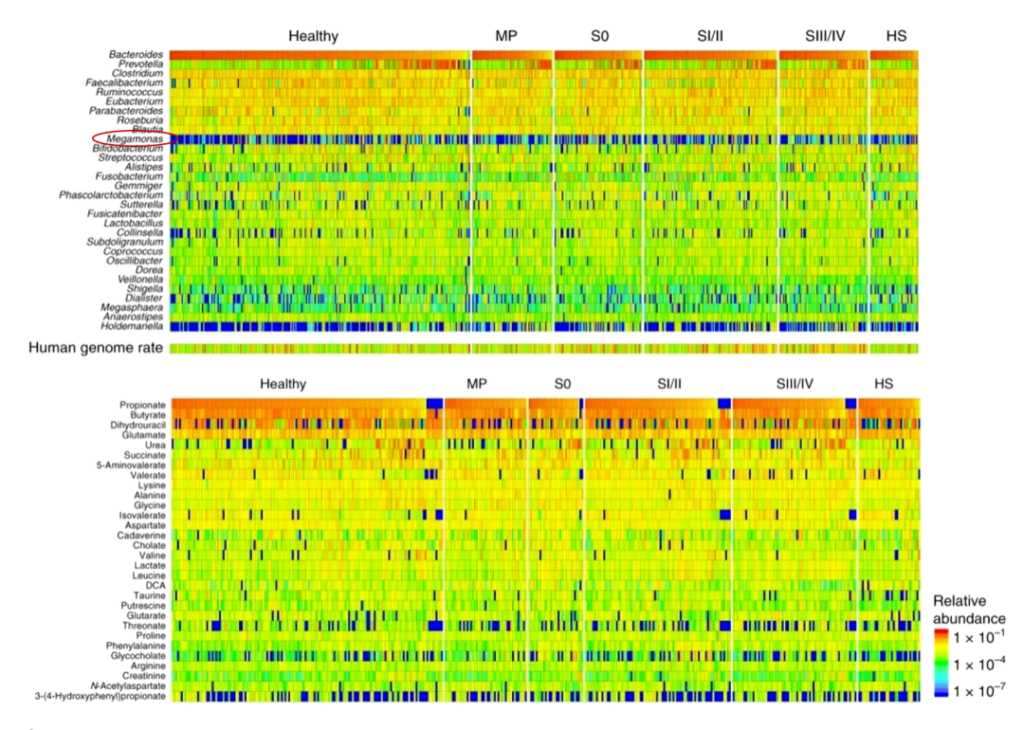
Yachida S, et al., Nat Med. 2019
Megamonas funiformis 可以作为区分胆囊切除术后病人与普通人的生物指标。其丰度与胆囊切除术后结直肠癌的发展有关。
没有癌前期病变或结直肠癌的胆囊切除术后病人比起有癌前期病变或结直肠癌的胆囊切除术后病人其Megamonas. funiformis丰度更高。
此外,研究发现巨单胞菌属(Megamonas)相对丰度与结直肠息肉发病风险增大呈负相关。
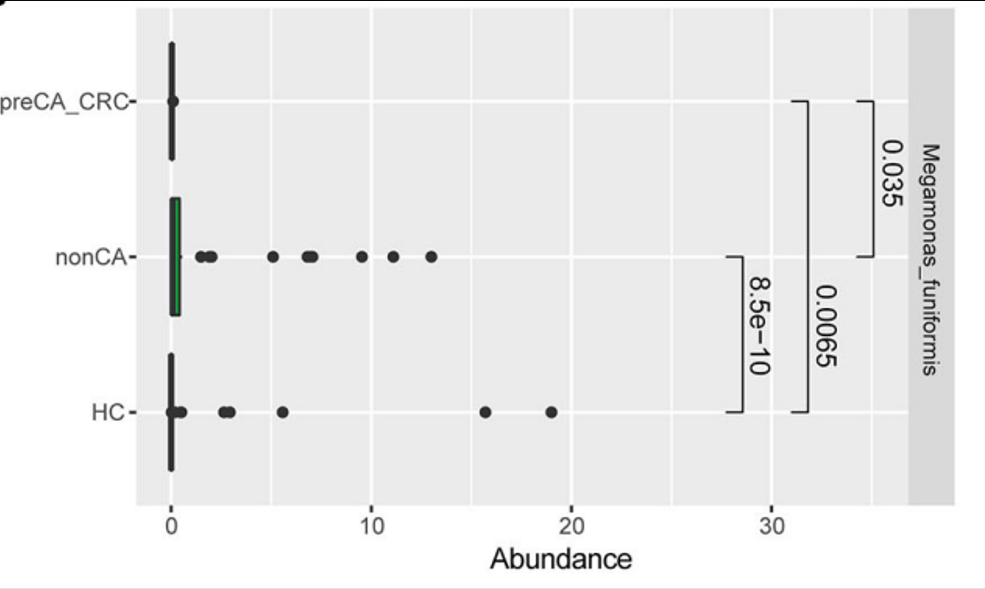
Ren, X et al., Frontiers in oncology. 2020
强制性脊柱炎(AS)
研究共纳入207名研究对象(包括103名AS患者和104名健康对照),结果显示巨单胞菌属(Megamonas)和链球菌属(Streptococcus)是强直性脊柱炎组中相对丰度增幅最大的2个属,通过聚类分析发现,巨单胞菌属的相对丰度在 AS、溃疡性结肠炎(ulcerative colitis,UC)、RA 及银屑病等病种组间的欧氏距离较近,而与Ⅱ型糖尿病及腺瘤较远。
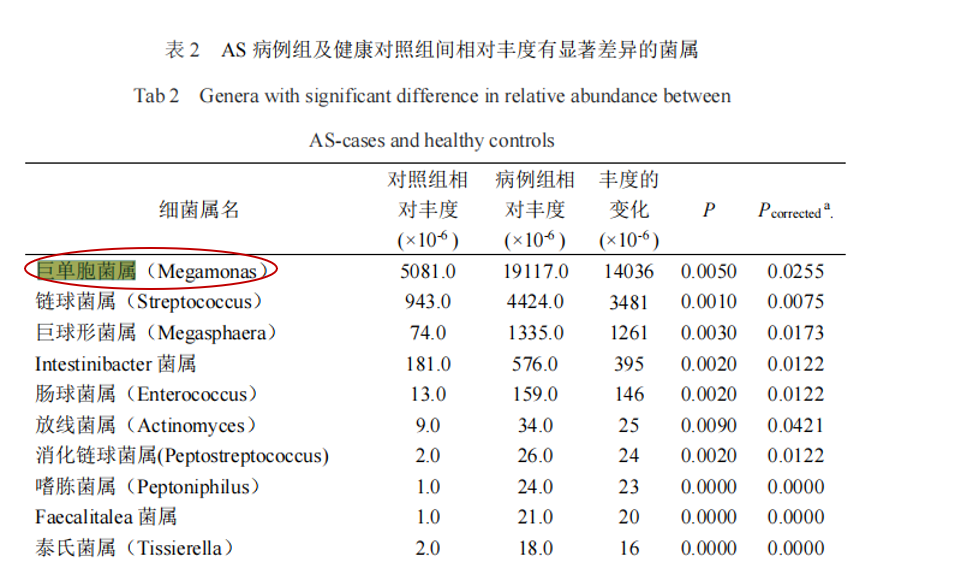
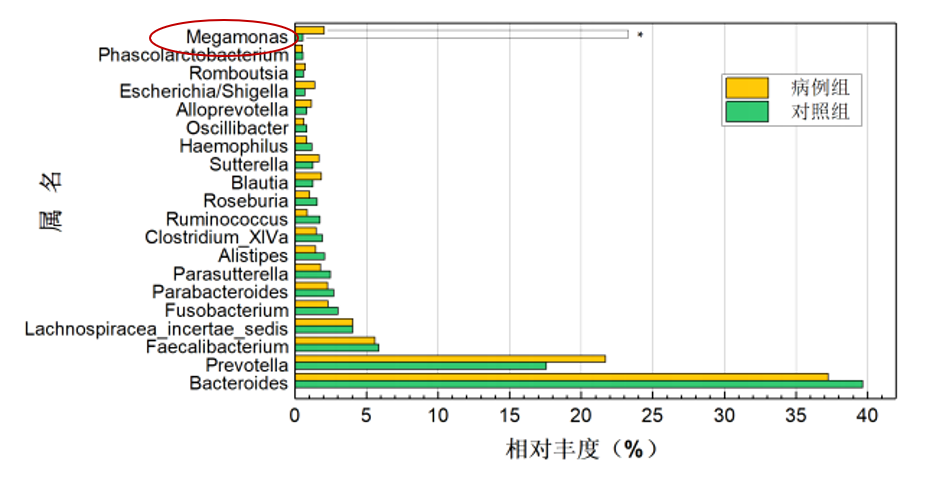
蒋光明,安徽医科大学,2021
自闭症谱系障碍(ASD)
肠道微生物群的改变可能会影响自闭症谱系障碍(ASD),患者中可能出现胃肠道(GI)生态失调。研究发现在自闭症儿童粪便中Megamonas丰度显著高于健康儿童。同时在矮身材儿童组的Megamonas丰度显著高于健康组,表明维持一定丰度在巨单胞菌属在儿童神经和体格生长发育方面的重要作用。

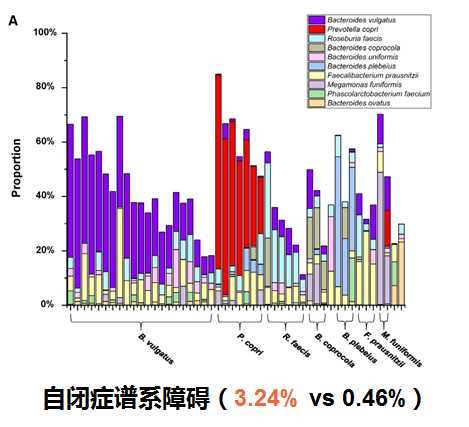
Zou R, et al., Autism Res. 2020
注意缺陷/多动障碍 (ADHD)
注意缺陷/多动障碍(ADHD)是一种神经发育障碍,其特征在于持续存在注意力不集中、多动和冲动的症状,导致个体生活两个或更多区域的功能(ADHD)组在属水平上显示出较高水平的Dialister和Megamonas以及较低的Anaerotaenia 和 Gracilibacter 丰度。
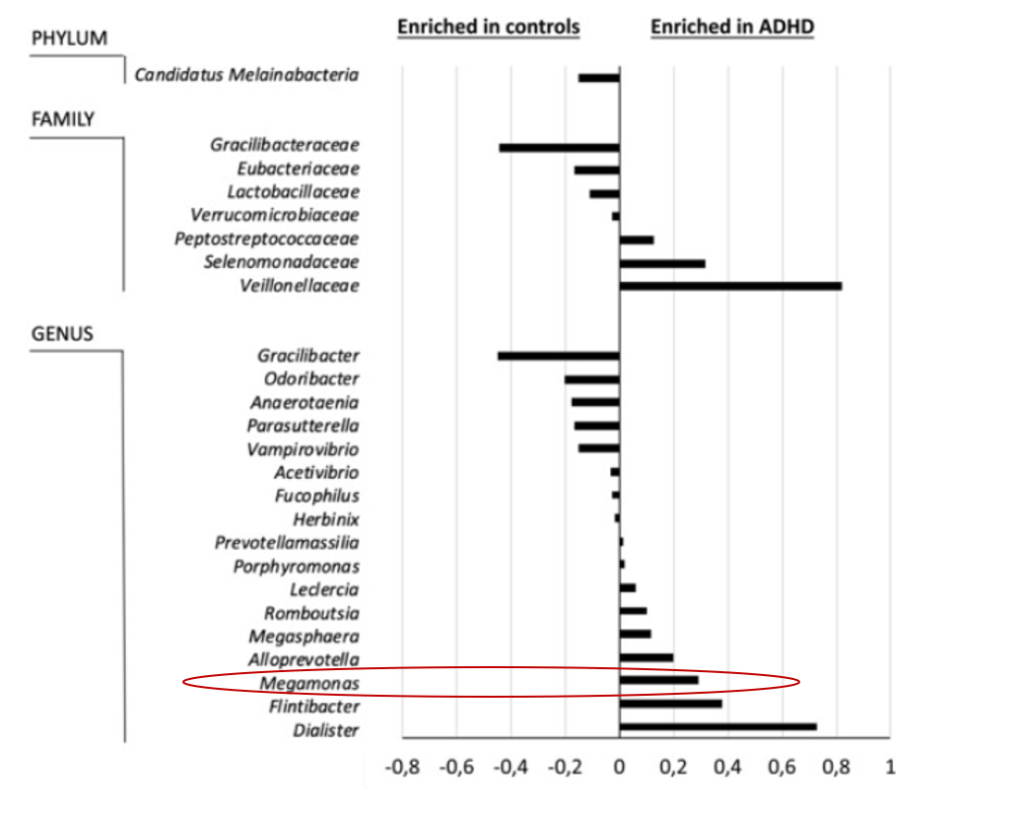
Richarte V, et al., Transl Psychiatry. 2021
注意缺陷多动障碍患者巨单胞菌丰度提高。同时作者还指出巨单胞菌可作为区分多动症患者与正常人的指标之一。
肥胖
研究发现在肥胖和对照受试者之间微生物群的显着差异。肥胖组的Prevotella、巨型单胞菌(Megamonas)、梭杆菌属和Blautia显著增加。
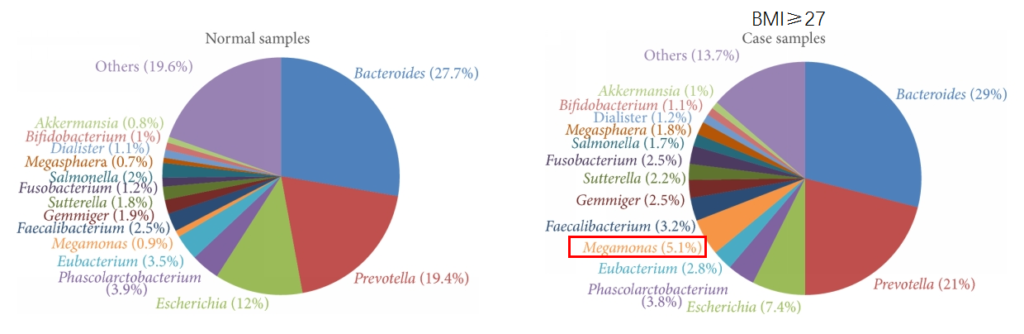
Chiu, C.M., et al., BioMed research international, 2014
另外一项研究表明体重降低或营养不良与巨单胞菌丰度减少有关联。巨单胞菌的丰度与体重减轻率呈负相关,Megamonas的丰度与肥胖犬减重的速度呈负相关。
急性缺血性脑卒中(AIS)
急性脑卒中(AIS)是一类脑部血液供应障碍引起局部组织缺血缺氧性坏死、相应神经功能出现缺损的不可逆性损害的临床综合征。同健康组比较,AIS组患者肠道中巨单胞菌属相对丰度上调,大肠杆菌属相对丰度下调。
通过将健康组和AIS患者肠道中巨单胞菌属和大肠杆菌属相对丰度进行分析,发现二者相对丰度及比值对潜在AIS具有一定诊断效能,可作为潜在的AIS诊断指标。
抑郁
部分研究报道巨单胞菌属的丰度在抑郁症患者中增加。脑卒中后抑郁患者巨单胞菌属水平上均显著高于对照组。巨单胞菌属与精神分裂症阳性和阴性症状量表(PANSS)总分呈正相关。
但也有个别文献检测到其丰度在抑郁症患者中下降。实际变化需要进一步研究。
其他
在最近的一项研究中,根据16S rRNA测序结果,发现Megamonas、放线杆菌属、Dorea和Ruminococcus与男性血清睾酮浓度呈正相关。
在另一项关于肠道微生物群性别差异的研究中,发现Megamonas、Prevotella、梭杆菌属和Megasphaera在男性中比在女性中更丰富。前列腺特异性抗原(PSA)水平高(G3)组的Megamonas丰度低于中等PSA水平(G2)组;此外,观察到PSA水平与先前报道的其他属之间没有关联。暗示Megamonas在雄激素代谢中具有潜在积极作用。
Kim HN, et al., J Pers Med. 2021
虚弱
虚弱是一种常见的老年综合征,主要根据症状进行诊断和分期。以确定这种综合征的微生物生物标志物收集了94名社区居住的老年人的血清和粪便样本,采用16SrRNA扩增子测序法测定粪便微生物群的粪便组成。
与对照组相比,来自虚弱组的粪便样本下列菌群具有较高的水平:
Akkermansia, Parabacteroides, Klebsiella
而共生属较低水平菌群如下:
Megamonas, Faecalibacterium, Prevotella, Roseburia, Blautia
推测其中Megamonas减少与老年人虚弱症状有关。
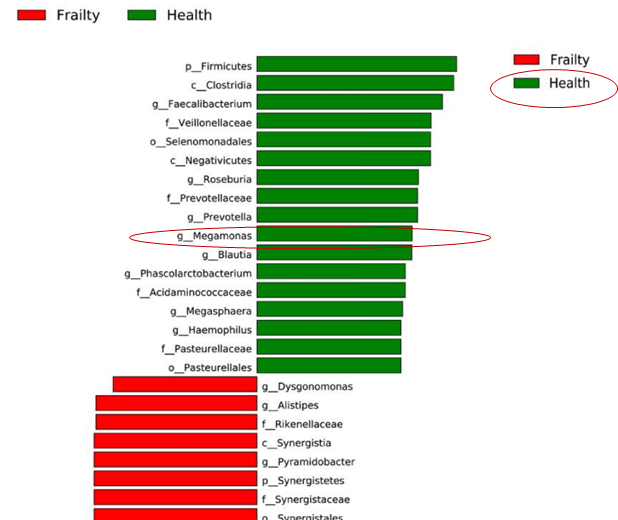
Xu Y, et al., Front Cell Infect Microbiol. 2021
炎症性肠病,白塞病,肝病等
IBD患者肠道中巨单胞菌属相对丰度显著降低。
与 正常个体相比,白塞病患者肠道中巨单胞菌物种的相对丰度显着降低。这可能与白塞病患者代谢物改变导致的 T 细胞畸变有关。
代偿期肝硬化患者巨单胞菌丰度下降。
老年血液透析(HD)患者巨单胞菌属减少。
血肌酐升高和血液透析可能影响肠道菌群的生存环境心力衰竭组与对照组相比,巨单胞菌属丰度降低。
▾ 该菌丰度较少相关:
动物脂肪摄入过多,肠道中产生短链脂肪酸(SCFAs) 的细菌(如Blautia、Megamonas)的丰度显着降低。
一项针对3500名加拿大儿童进行了从出生前直至青春期的持续追踪,其主要目标是为了发现过敏、哮喘、肥胖症及其它慢性疾病的根本原因。他们发现无论婴儿采用何种喂养方式(母乳喂养或配方奶喂养),直接补充维生素D滴剂的婴儿体内巨单胞菌属丰度都较低。
▴ 该菌丰度增加相关:
在体外发酵条件下,含牛肉蛋白和鸡肉蛋白组巨单胞菌属(Megamonas) 相对丰度显著增加,有益菌相对丰度增加。
饮食中豆类消费的高频率与Megamonas属呈正相关,但是目前该证据样本量太小,还需要进一步研究。
抗性淀粉(RS)在小肠中不能被酶解,大部分在结肠被肠道微生物发酵。研究显示玉米,马铃薯可以增加巨单胞菌属丰度。
岩藻糖基硫酸软骨素(fCS)是从海参中提取的一种独特的天然硫酸软骨素类似物,fCS-Sc显著增加了Megamonas(1.26倍)。
燕麦阿拉伯木聚糖 (AX) 刺激了鸭肠巨单胞菌和双歧杆菌的生长物种,其中巨单胞菌表现出最大的刺激。
在日粮中添加桑叶粉后,鸡肠道中的拟杆菌属、普氏菌和巨单胞菌属的相对丰度增加。
作为亚洲人肠道重要的菌属——巨单胞菌属,关于其与疾病的研究还处于开始阶段。部分数据能说明其与炎症性肠病、结直肠癌、强制性脊柱炎(AS)、肥胖、神经系统的相关性。但具体的因果关系与分子机制仍待研究,可能的研究方向有巨单胞菌的代谢产物短链脂肪酸在机体中的作用以及其与免疫反应互作反应。p.s. 本文感谢提供部分资料的各位同学。
主要参考文献:
Richarte V, Sánchez-Mora C, Corrales M, Fadeuilhe C, Vilar-Ribó L, Arribas L, Garcia E, Rosales-Ortiz SK, Arias-Vasquez A, Soler-Artigas M, Ribasés M, Ramos-Quiroga JA. Gut microbiota signature in treatment-naïve attention-deficit/hyperactivity disorder. Transl Psychiatry. 2021 Jul 8;11(1):382. doi: 10.1038/s41398-021-01504-6. PMID: 34238926; PMCID: PMC8266901.
Yachida S, Mizutani S, Shiroma H, Shiba S, Nakajima T, Sakamoto T, Watanabe H, Masuda K, Nishimoto Y, Kubo M, Hosoda F, Rokutan H, Matsumoto M, Takamaru H, Yamada M, Matsuda T, Iwasaki M, Yamaji T, Yachida T, Soga T, Kurokawa K, Toyoda A, Ogura Y, Hayashi T, Hatakeyama M, Nakagama H, Saito Y, Fukuda S, Shibata T, Yamada T. Metagenomic and metabolomic analyses reveal distinct stage-specific phenotypes of the gut microbiota in colorectal cancer. Nat Med. 2019 Jun;25(6):968-976. doi: 10.1038/s41591-019-0458-7. Epub 2019 Jun 6. PMID: 31171880.
Ren, X., Xu, J., Zhang, Y., Chen, G., Zhang, Y., Huang, Q., & Liu, Y. (2020). Bacterial Alterations in Post-Cholecystectomy Patients Are Associated With Colorectal Cancer. Frontiers in oncology, 10, 1418. https://doi.org/10.3389/fonc.2020.01418
Duan, M., Wang, Y., Zhang, Q., Zou, R., Guo, M., & Zheng, H. (2021). Characteristics of gut microbiota in people with obesity. PloS one, 16(8), e0255446.
Chiu, C. M., Huang, W. C., Weng, S. L., Tseng, H. C., Liang, C., Wang, W. C., Yang, T., Yang, T. L., Weng, C. T., Chang, T. H., & Huang, H. D. (2014). Systematic analysis of the association between gut flora and obesity through high-throughput sequencing and bioinformatics approaches. BioMed research international, 2014, 906168. https://doi.org/10.1155/2014/906168
Elizabeth P. Cato, Ella M. Barnes. Designation of the Neotype Strain of Bacteroides hypermegas Harrison and Hansen. https://doi.org/10.1099/00207713-26-4-494
Zou R, Xu F, Wang Y, Duan M, Guo M, Zhang Q, Zhao H, Zheng H. Changes in the Gut Microbiota of Children with Autism Spectrum Disorder. Autism Res. 2020 Sep;13(9):1614-1625. doi: 10.1002/aur.2358. Epub 2020 Aug 24. PMID: 32830918.
Morotomi M, Nagai F, Sakon H. Genus Megamonas should be placed in the lineage of Firmicutes; Clostridia; Clostridiales; ‘Acidaminococcaceae’; Megamonas. Int J Syst Evol Microbiol. 2007 Jul;57(Pt 7):1673-1674. doi: 10.1099/ijs.0.65150-0. PMID: 17625216.
Shimizu, J., Kubota, T., Takada, E., Takai, K., Fujiwara, N., Arimitsu, N., Ueda, Y., Wakisaka, S., Suzuki, T., & Suzuki, N. (2019). Relative abundance of Megamonas hypermegale and Butyrivibrio species decreased in the intestine and its possible association with the T cell aberration by metabolite alteration in patients with Behcet’s disease (210 characters). Clinical rheumatology, 38(5), 1437–1445. https://doi.org/10.1007/s10067-018-04419-8
Romain Chevrot, Arnaud Carlotti, Valérie Sopena, Pierre Marchand, Eric Rosenfeld. Megamonas rupellensis sp. nov., an anaerobe isolated from the caecum of a duck. https://doi.org/10.1099/ijs.0.2008/001297-0
Cheung, S. G., Goldenthal, A. R., Uhlemann, A. C., Mann, J. J., Miller, J. M., & Sublette, M. E. (2019). Systematic Review of Gut Microbiota and Major Depression. Frontiers in psychiatry, 10, 34. https://doi.org/10.3389/fpsyt.2019.00034
Kelly, J. R., Minuto, C., Cryan, J. F., Clarke, G., & Dinan, T. G. (2017). Cross Talk: The Microbiota and Neurodevelopmental Disorders. Frontiers in neuroscience, 11, 490.
Kim HN, Kim JH, Chang Y, Yang D, Kim HL, Ryu S. Gut Microbiota Composition across Normal Range Prostate-Specific Antigen Levels. J Pers Med. 2021 Dec 17;11(12):1381. doi: 10.3390/jpm11121381. PMID: 34945854; PMCID: PMC8703440.

谷禾健康
微生物群代表宿主肠道中存在的整个微生物群。肠道内细菌界的“贫富差距”非常大,和人类社会创造的大部分的财富都流向少部分人口的现实类似,只有少数几十种的细菌分布在近乎90%的人群中。换句话说,大部分细菌都只能在特定的环境中生存,只有少数细菌适应能力超强,这可能也是我们需要重点关注的对象。
如果把不同细菌品种看作互相竞争的国家,那么细菌界的“超级大国”就属拟杆菌门和厚壁菌门了。当然它们都不是单独某一种细菌,而是一大类细菌的统称。
然而近年来随着患有肠内外疾病的人群越来庞大,变形菌门也逐渐被关注和研究,变形菌门是含有最丰富细菌的门,麾下包括多种“著名的”病原菌,如大肠杆菌、幽门螺杆菌、克雷伯氏菌、沙门氏菌、志贺氏菌、绿脓杆菌、霍乱弧菌、空肠弯曲菌、鼠疫杆菌、脑膜炎双球菌、淋球菌等,让其备受关注。
事实上,越来越多的数据将变形菌确定为疾病的可能微生物特征。目前主要证据涉及代谢紊乱和炎症甚至癌症。然而,最近的研究表明,在哮喘和慢性阻塞性肺病等肺部疾病中也有作用,有些疾病中变形菌不受控制扩张导致疾病易感和发生。
变形菌(proteobacteria)是细菌中最大、种类最多的一个门,它们在系统发育、生态和致病方面具有广泛的重要性。所有变形菌都是革兰氏阴性菌,外膜主要由脂多糖组成。
图源:esacademic
变形菌门主要是由核糖体RNA序列定义的,名称取自希腊神话中能够变形的神普罗透斯(这同时也是变形菌门中变形杆菌属的名字),因为该门细菌具有极为多样的形状,代谢特征等。
△ 形状:杆状和球菌、弯曲的、螺旋状的、环状的、丝状的和带鞘的细菌都有。
△ 新陈代谢:新陈代谢类型也多种多样,一系列代谢特征包括化学自养(从无机化合物的氧化中获取能量)、化学有机营养(从有机化合物的氧化中获取能量)和光养(从光中获取能量)。
△ 氧气利用:从严格厌氧菌和严格需氧菌到兼性厌氧菌和微需氧菌株的都有,但是大多数变形菌门的成员是兼性厌氧菌。
△ 运动:许多使用鞭毛移动,但有些不能移动或依赖细菌滑动,而一些细菌是不运动的。
△ 生态分布:变形菌门的成员具有极大的可变形态和多才多艺的生理学,这使它们在各种生态位中生存具有竞争优势。已观察到变形菌在不同生境中无处不在。
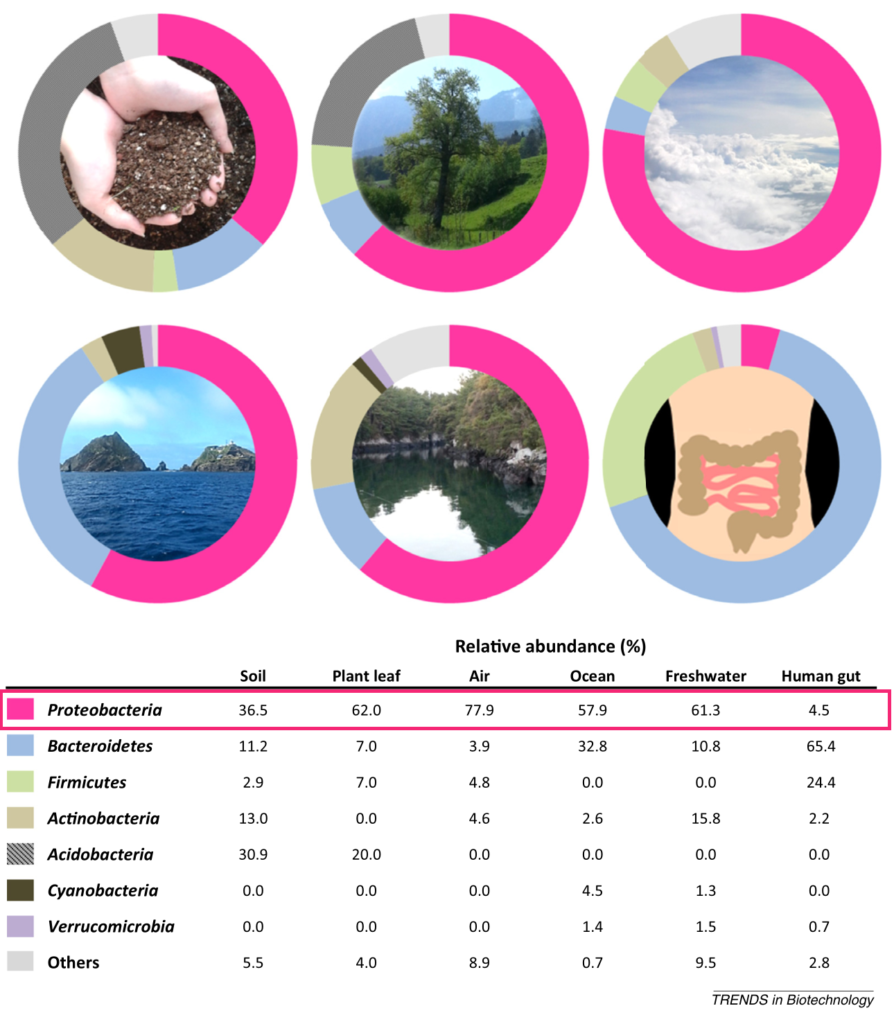
Shin NR, et al., Trends Biotechnol. 2015
植物 、海水、淡水 ,空气,以及人和动物的身体部位,包括肠道、口腔、皮肤、阴道。尽管存在研究间差异,但健康人口腔微生物群的变形菌相对丰度最高(17.2-36.8%),其次是皮肤(6.8-30.0%)、胃肠道(2.5-4.6%)和阴道(2.3%)。
在系统发育学上,变形菌是根据小核糖体亚单位RNA基因(16S rRNA)的测序定义的。这是一个巨大的革兰氏阴性原核生物门,原线粒体起源于此。
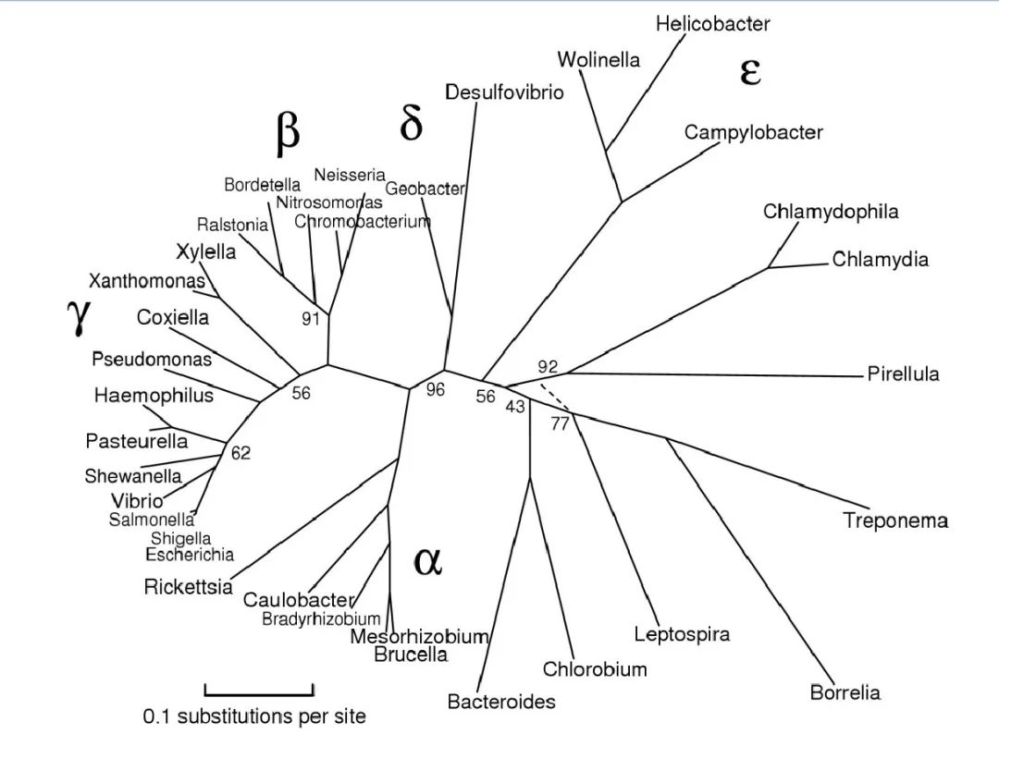
图片来源:Maria Lane,eportfolio
该门主要分为以下几大类:
最初,变形菌包括 α、β、γ 和 δ 四个亚类。ε变形菌 和 δ变形菌 通常被认为是最古老的变形菌群,因为它们包括利用硫化合物进行能量代谢的专性厌氧菌。
α变形菌(Alpha-proteobacteria)
第一类变形菌是α-变形菌。这一类的统一特征是它们是寡营养生物,能够生活在低营养环境中,如深海沉积物、冰川或深层地下土壤。同时α-变形菌是多样化的细菌分支之一,在生活方式、地理分布和基因组大小方面表现出极大的差异。
在 α-变形菌 中有两个重要分类群,衣原体和立克次体,它们是专性细胞内病原体,这意味着它们的部分生命周期必须发生宿主细胞内。由于它们无法合成自己的三磷酸腺苷 (ATP),因此,量需求依赖宿主于细胞。
立克次体属是人类很多严重疾病的病原体。例如,布鲁氏菌属、埃立克体属和立克次氏体。立克次氏杆菌会导致落基山斑疹热,这是一种威胁生命的脑膜炎(包裹大脑的膜发炎)。R. rickettsii 感染蜱,并可以通过被感染的蜱叮咬传播给人类。此外,布鲁氏菌科(Brucellaceae)和巴尔通氏菌科(Bartonellaceae)的细菌是人类病原体。
α-变形菌 还包括固氮细菌,例如固氮螺菌属和根瘤菌属。这两种细菌都使用一种称为固氮酶途径的复杂酶途径将大气中的氮 (N2) 转化为氨 (NH3)。此外,α变形菌还包括硝化细菌。这种类型的细菌将氨和铵 (NH4+) 还原为硝酸盐 (NO3–)。乙酸杆菌属和葡糖杆菌属的变形菌可用于生产乙酸。
β变形菌(Beta-proteobacteria)
与依靠最少量营养物质生存的 Alpha-proteobacteria 不同,Beta-proteobacteria 类是富营养生物,这意味着它们需要大量的有机营养物质。
Beta-proteobacteria 通常在需氧和厌氧区域之间生长(例如,在哺乳动物的肠道中)。一些属包括作为人类病原体的物种,能够引起严重的,甚至可能危及生命的疾病。例如,奈瑟球菌属包括淋病奈瑟菌( STI淋病的病原体)和脑膜炎奈瑟菌(细菌性脑膜炎的病原体)
β变形菌中的亚硝化单胞菌可以将亚硝酸盐还原为亚硝酸盐 (NO2–)。同时,硫杆菌属物种是将硫化氢 (H2S) 和元素硫氧化成硫酸盐 (SO42-) 的细菌,以及用于污水处理的菌胶团(Zoogloea)和Sphaerotilis 。
γ变形菌(Gamma-proteobacteria)
最多样化的革兰氏阴性细菌是γ-变形菌,它包括许多人类病原体。包括几个医学和科学上重要的细菌群,例如肠杆菌科、弧菌科和假单胞菌科。
此外,许多重要的病原体属于这一类,例如:
Richard B. Frankel
△ 铜绿假单胞菌
一个庞大而多样的科,假单胞菌科,包括假单胞菌属。铜绿假单胞菌在该属内,它是一种病原体,可以造成身体不同部位的各种感染。铜绿假单胞菌是一种严格需氧、不发酵、高度运动的细菌。
它通常可能造成伤口和烧伤感染,也可能是慢性尿路感染的原因,并且可能是囊性纤维化患者或机械呼吸机患者呼吸道感染的重要原因。
铜绿假单胞菌感染通常难以治疗,因为该细菌对许多抗生素具有抗性,并且具有形成生物膜的非凡能力。
△ 肠杆菌科
肠杆菌科是属于γ-变形菌 的一大类肠道细菌。它们是兼性厌氧菌,能够发酵碳水化合物。在这个家族中,微生物学家认识到两个不同的类别。
第一类,大肠杆菌,以其原型细菌种类大肠杆菌命名。大肠菌能够完全发酵乳糖(即产生酸和气体)。
第二类,非大肠杆菌,要么不能发酵乳糖,要么不能完全发酵(产生酸或气体,但两者不能同时产生)。
非大肠杆菌包括一些值得注意的人类病原体,例如沙门氏菌属,志贺氏菌,鼠疫耶尔森氏菌。
δ 变形菌(Delta-proteobacteria)
δ-变形菌(Delta-proteobacteria )包括基本好氧的形成子实体的粘细菌和严格厌氧的一些种类,如脱硫球菌属(Desulfococcus)、脱硫线菌属(Desulfonema)、硫酸盐还原菌(脱硫弧菌属(Desulfovibrio)、脱硫菌属(Desulfobacter)、和硫还原菌(如除硫单胞菌属Desulfuromonas),以及具有其它生理特征的厌氧细菌,如还原三价铁的Geobacter和互营菌属(Syntrophus)。
△ 蛭弧菌属:
δ-变形菌还包括蛭弧菌属,Bdellovibrio侵入宿主细菌的细胞,将自身定位在周质中,即质膜和细胞壁之间的空间,以宿主的蛋白质和多糖为食。这种感染对宿主细胞是致命的。
△粘细菌:
粘细菌(“粘液细菌”)是一组主要生活在土壤中并以不溶性有机物质为食的细菌。与其他细菌相比,粘细菌具有非常大的基因组,例如 9-1000 万个核苷酸。
Sorangium cellulosum 拥有最大的已知(截至 2008 年)细菌基因组,有 1300 万个核苷酸。
粘细菌产生许多在生物医学和工业上有用的化学品,例如抗生素。他们将这些化学物质输出到细胞外。
ε变形菌(Epsilon-proteobacteria )
ε-变形菌(Epsilon-proteobacteria) 是革兰氏阴性微需氧细菌(意味着它们在其环境中只需要少量氧气)。多数是弯曲或螺旋形的细菌,如沃林氏菌属(Wolinella)、螺杆菌属(Helicobacter)和弯曲菌属(Campylobacter)。它们都生活在动物或人的消化道中,为共生菌(沃林氏菌在牛中)或致病菌(螺杆菌在胃中或弯曲菌在十二指肠中)。
△ 弯曲杆菌:
变形菌门Epsilon-proteobacteria 中的两个临床相关属是弯曲杆菌属和螺杆菌属,它们都包括人类病原体。
弯曲杆菌可引起食物中毒,表现为严重的肠炎(小肠发炎)。这种由空肠弯曲杆菌引起的疾病在发达国家相当普遍,通常是因为食用了受污染的家禽产品。鸡通常携带空肠弯曲杆菌在胃肠道和粪便中,它们的肉在加工过程中可能会受到污染。
△螺杆菌:
螺杆菌是ε-变形菌的一个属,具有特征性的螺旋形状。它们最初被认为是弯曲杆菌属的成员,但自 1989 年以来,它们独立为自己的属。
螺杆菌属属于ε-变形菌,弯曲杆菌目,螺杆菌科,已经有超过 35 种。已经发现一些菌生活在上胃肠道的内壁,以及哺乳动物和一些鸟类的肝脏中。
该属中最广为人知的物种是幽门螺杆菌,它感染多达 50% 的人口。这种细菌的某些菌株对人类具有致病性,因为它与消化性溃疡、慢性胃炎、十二指肠炎和胃癌密切相关。它也作为该属的模式种。
幽门螺杆菌在胃的高酸性环境中存活的能力有些不同寻常。它产生脲酶和其他酶来改变其环境以降低其酸性。
幽门螺杆菌也有它存在的意义,可能抑制引起结核的细菌(结核分枝杆菌),预防哮喘,克罗恩病,食管反流,腹泻病以及食道癌。
❥ 识别微生物编码的基因,与特征相关联
栖息在哺乳动物肠道中的微生物编码了大量的蛋白质,这些蛋白质有助于广泛的生物功能,从调节免疫系统到参与新陈代谢。
我们从这些微生物中识别蛋白质编码基因并将基因水平与疾病、药物功效或副作用以及其他宿主特征相关联。
例如,与传统的高纤维农业饮食相关的人类肠道微生物群编码了参与纤维素和木聚糖水解的基因家族,而这些基因家族在吃典型西方饮食的人群(年龄匹配)中不存在。
一般编码适应肠道环境所必需的功能的微生物有很强的选择性,在不同宿主中具有大量冗余的基因库。然而,目前的研究和临床很容易忽略健康人类微生物组之间基因丰度的生理意义差异。
❥ 较少丰度的变形菌门,才是是跨宿主丰度变异性最大的基因的主要来源
人体肠道通常由拟杆菌门和厚壁菌门主宰,这些门内的进化枝(尤其是拟杆菌属、普氏菌属和瘤胃球菌科)是最常用于将个体聚集成“肠型”,因为它们解释了最多的分类变异。Bacteroidetes 与 Firmicutes 的比率也被推定为疾病或健康的潜在生物标志物。
有人提出,人类肠道微生物组中可能存在少量“肠型”,每一种都具有不同的分类组成。因此,虽然拟杆菌门和厚壁菌门可能对宿主之间的分类变异贡献最大,但变形菌门的丰度可能会捕获更多的功能变异。
与先前确定的肠型标记分类群相比,变形菌门的水平和可能的 Euryarchaeota 更好地解释了肠道微生物基因功能的人与人之间的差异。
在肠型研究中遗漏了这些不太丰富的门,可能是因为肠型是通过倾向于对高丰度分类群进行更多加权的方法鉴定的,并且肠型是从分类学而非功能数据中鉴定的。这对解释人类肠道微生物群的分类数据具有重要意义。
例如,变形菌门的过度生长与代谢综合征和炎症性肠病有关。通过 TLR5 敲除小鼠测试的肠道炎症关联到变形菌门(超过拟杆菌门和厚壁菌门),并且一些变形杆菌可以在这种背景下诱发结肠炎,可能导致反馈循环。因此,可变基因家族对解释人类肠道微生物群的分类数据具有重要意义。
备注:肠道受体蛋白TLR5参与积极地塑造新生小鼠肠道微生物群落的长期组成,敲除的Toll样受体(TLR5),是免疫系统识别鞭毛细菌(比如变形菌和梭状芽孢杆菌)的关键受体,缺乏它则机体可能不会在感知到细菌鞭毛时对细菌产生免疫应答。
肠道相关微生物群落组成的变化与许多人类疾病有关,但驱动这种不平衡(生态失调)的机制尚不完全清楚。
在肠道菌群失调期间观察到的最一致和最强大的生态模式是属于变形菌门的兼性厌氧细菌的扩张。
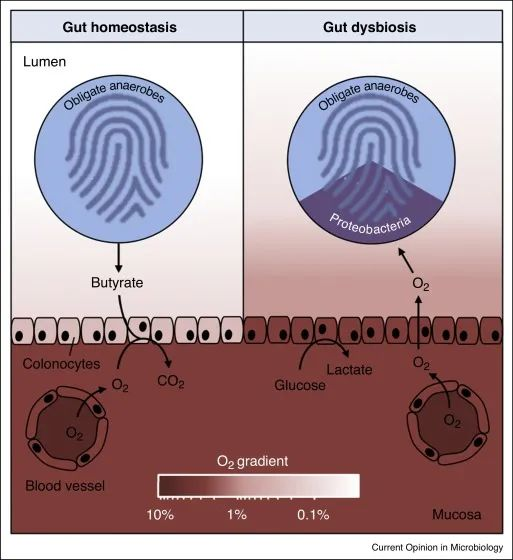
变形菌的菌群失调是上皮功能障碍的微生物特征
在肠道稳态期间(左),微生物群衍生的丁酸盐的 β 氧化导致上皮缺氧,从而维持大肠腔内的厌氧状态。反过来,腔内厌氧症导致肠道微生物群内专性厌氧菌占主导地位。
备注:丁酸(Butyrate acid,BA),俗称酪酸,是构成脂肪的一种脂肪酸,含有4个碳原子又称短链脂肪酸。人体的丁酸部分来自于食物中丁酸的吸收,主要的来自结肠厌氧菌的发酵产生。人体结肠产生的短链脂肪酸丁酸占比大部分)。
在肠道菌群失调期间(右),表面结肠细胞通过无氧糖酵解获得能量,从而导致上皮氧合增加,这种上皮功能障碍破坏了管腔中的厌氧菌,从而通过有氧呼吸推动兼性厌氧变形菌的扩张。
健康结肠的厌氧菌导致肠道微生物群的组成以专性厌氧菌为主,而菌群失调通常与兼性厌氧变形菌的丰度持续增加有关,这表明厌氧菌的破坏。
结肠上皮是缺氧的,但肠道炎症或抗生素治疗会增加结肠中的上皮氧合,从而破坏厌氧作用,通过有氧呼吸驱动兼性厌氧变形菌的菌群失调。
肠沙门氏菌(S. enterica)是一种食源性病原体,属于肠杆菌科,变形菌门,可引起小鼠结肠炎。在肠道沙门菌S. enterica诱导的结肠炎期间,肠腔内的氧气可用性增加,这表明结肠中病原体的氧气呼吸依赖性大量繁殖以及随之而来的专性厌氧梭状芽胞杆菌的丰度下降。
同样,结肠隐窝增生由鼠肠道病原体柠檬酸杆菌(肠杆菌科,变形菌门)引发,可提高肠腔内的氧气利用率,从而通过有氧呼吸推动变形菌病原体扩张。
这些观察结果表明,变形菌的菌群失调是上皮功能障碍的潜在诊断微生物特征,建议将变形菌负荷作为生态失调和疾病的潜在诊断标准,所以在谷禾即将更新的肠道菌群检测报告中,我们会加入变形菌门丰度和参考范围这一指标。
大肠中专性厌氧菌的优势可能是宿主环境的氧气限制严重的结果,这反过来又对用于营养物质的分解代谢途径产生重要影响。
避免被上消化道中的宿主酶降解的复合碳水化合物,可以被大肠中的专性厌氧细菌水解并发酵成更小的化合物。专性厌氧菌最终将许多发酵产物转化为短链脂肪酸,其中乙酸盐、丙酸盐和丁酸盐是最丰富的产物。宿主吸收了大约 95-99% 的微生物产生的短链脂肪酸,它到达血流以影响免疫发育。因此,大肠中专性厌氧菌的优势确保了维持肠道稳态的代谢物的产生。
变形菌是平衡的肠道相关微生物群落中的一个次要成分。然而,由遗传易感性、化学物质或肠道病原体感染引起的肠道炎症会导致小鼠模型中变形杆菌的管腔扩张不受控制。
同样,在患有严重肠道炎症的人类中,包括炎症性肠病、结直肠癌或坏死性小肠结肠炎的患者中观察到变形杆菌的丰度增加。此外,在包括肠易激综合征和代谢综合征在内的低水平肠道炎症条件下观察到大量变形菌。
肠道炎症增加了替代电子受体的可用性,这些电子受体通过厌氧呼吸支持兼性厌氧细菌的生长。肠道炎症过程中产生的活性氧可以将内源性硫化合物氧化为连四硫酸盐,这是一种电子受体,通过连四硫酸盐呼吸作用在鼠结肠中驱动类似肠沙门氏菌和Yersinia enterocolitica(一种属于肠杆菌科,变形菌门的病原体)的管腔扩张 。
一氧化氮由宿主酶产生化学诱导的结肠炎或由遗传易感性引发的结肠炎期间的诱导型一氧化氮合酶(iNOS) 。一氧化氮在肠腔内分解成硝酸盐,从而通过硝酸盐呼吸支持生长,从而增加小鼠结肠中共生大肠杆菌的丰度。类似,宿主衍生的硝酸盐的呼吸有助于在 S. enterica 诱导的小鼠结肠炎期间腔内病原体扩张。
有趣的是,即使在没有明显肠道炎症的情况下,例如在抗生素治疗期间,呼吸电子受体也有助于细菌群落从专性厌氧菌转变为兼性厌氧菌。为了支持这一观点,用链霉素治疗小鼠可将盲肠中的氧化还原电位提高到接近需氧培养液的水平。链霉素治疗通过硝酸盐呼吸和氧气呼吸的结合增加结肠中共生大肠杆菌或致病性肠杆菌的生长。
其他类似研究的结论也表明,氧气,单独或与其他呼吸电子受体结合,是广泛的胃肠道失衡中肠道菌群失调的常见驱动因素。因此,为了开发新的预防或治疗策略,必须了解在肠道菌群失调期间呼吸电子受体的可用性如何升高。
基于这些观察,有人提出变形菌的扩增是肠道菌群失调的微生物特征,而氧气、用药,遗传易感,肠炎驱动了变形菌的扩张,反过来加剧疾病的进展。
宿主遗传因素和外在环境因素,如饮食和生活环境,不断影响肠道微生物群的分类和功能组成。鉴于具有高度稳定性的平衡肠道微生物群与宿主的免疫系统具有共生相互作用,能够抑制变形杆菌失控的扩张,肠道中变形杆菌的大量繁殖可以反映肠道微生物群落结构的不稳定;这种不稳定的结构可以在非疾病状态下观察到(例如,新生儿期 和胃绕道手术后和疾病状态例如,代谢紊乱和肠道炎症)。
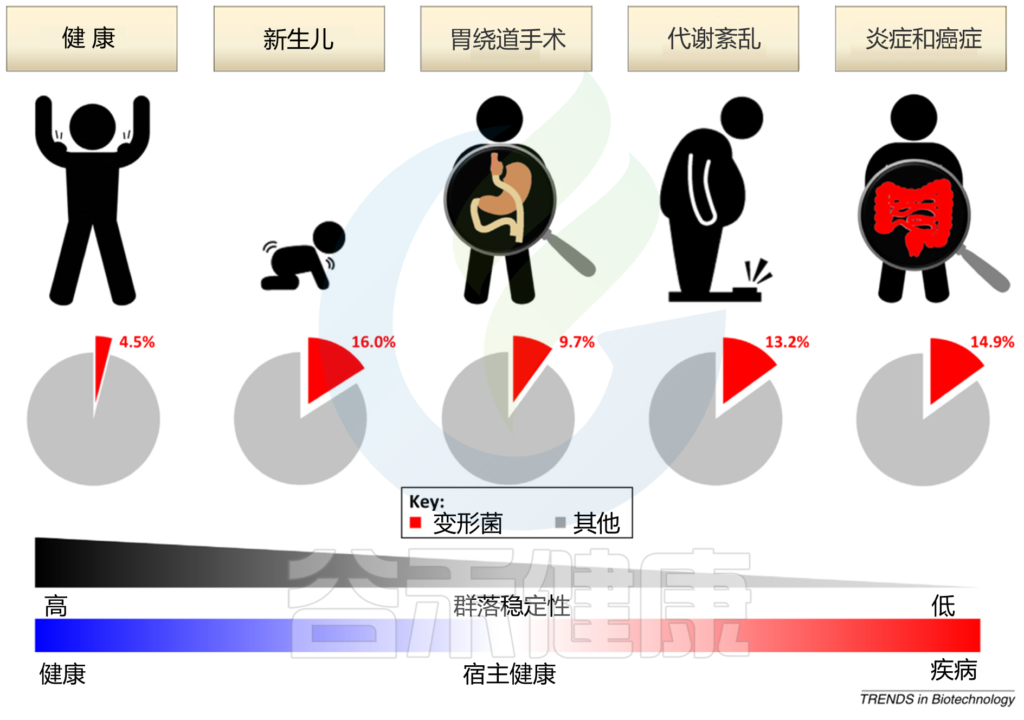
Shin NR, et al., Trends Biotechnol. 2015
在新生儿胃肠道的初始定植期间,兼性厌氧变形菌使肠道生态位有利于专性厌氧菌的定植;后者很快被专性厌氧的厚壁菌门和拟杆菌门所取代,它们在健康成年人的肠道微生物群中占主导地位。胃绕道手术导致的胃肠道重排可以改变 pH、胆汁流量和肠道激素,所有这些因素都会影响变形杆菌的丰度。
新生儿肠道中的变形菌
新生儿肠道中的微生物群备受关注,因为它不仅反映了细菌群落的脆弱结构,而且反映了哺乳动物肠道微生物群的真正起源。新生儿肠道中的细菌群落由于其快速的时间变化而不稳定。然而,这种脆弱性与更重要的肠道菌群定植有关,例如严格的厌氧菌。
具体来说,由于新生儿肠道中的氧气丰富,生命第一周的微生物群经常以兼性厌氧菌为主,主要是变形菌属(例如,埃希氏菌属、克雷伯氏菌属和肠杆菌属)。这些兼性厌氧菌通过消耗氧气、改变 pH 值、降低氧化还原电位并产生二氧化碳和营养物质,使栖息地适合严格的厌氧菌定殖。
因此,可以推测变形杆菌在为新生儿肠道准备好接受严格厌氧菌的连续定植方面发挥了作用,这些厌氧菌在健康成人的肠道中含量丰富。
最近对母体胎盘微生物组的一项研究描述了共生细菌群落的存在,其中大肠杆菌的丰度最高。尽管关于胎盘微生物群的活力和起源存在争议,但在母体胎盘中发现的这些有趣的细菌群落与来自母体羊水和新生儿胎粪的细菌群落重叠。
因此,新生儿肠道中的变形菌可能通过胎儿在子宫内吞咽羊水从母体胎盘传播。有趣的是,妊娠后期孕妇肠道中变形菌的比例增加。这意味着母亲微生物群中的这种特定细菌群转移到了新生儿身上。
在新生儿肠胃道中观察到的变形杆菌定植生长的持续时间很可能在母体控制之下。事实上,新生儿微生物群会受到各种母体因素的影响,例如分娩方式、饮食和怀孕期间接触抗生素。
最重要的是,新生儿肠道中变形菌的丰度受喂养类型的影响,这些细菌在配方奶喂养的婴儿中的频率更高,但在母乳喂养的婴儿中很少见。
人乳寡糖 和分泌型 IgA 的产生参与在最初的肠道定植过程中选择性抑制变形菌。因此,越来越多的人认为,及时减少变形菌的丰度是初始微生物定植的正常部分,而这种定植模式的紊乱与新生儿疾病的风险增加有关。
肠道中微生物群和宿主细胞之间的相互作用对于免疫系统的形成和调节至关重要,由于肠腔内有大量外源性抗原,免疫系统必须严格调节其反应以维持与共生菌的共生关系。共生体传递一种信号,诱导宿主免疫的耐受性反应。因此,宿主可以区分有益的本土微生物和有害病原体,并建立健康的微生物群。
变形杆菌的主要分类及其与IBD的关系

Mukhopadhya I, et al., Nat Rev Gastroenterol Hepatol. 2012
为了防止对共生细菌的炎症反应,肠道内的免疫细胞,如单核吞噬细胞(巨噬细胞和树突状细胞)和 CD4 + T 细胞,对微生物刺激反应迟钝或表现出共生反应。
同时,黏膜免疫系统负责清除病原体,这一过程需要积极的促炎信号级联反应。因此,不适当的免疫反应会破坏肠道稳态,引发生态失调,并导致局部和全身炎症和代谢功能障碍。
这种慢性进行性肠道炎症的状态在临床上被诊断为炎症性肠病 (IBD),其中包括溃疡性结肠炎 (UC) 和克罗恩病 (CD)。IBD 的确切病因仍然无法获得,但新出现的证据表明,肠道微生物群成为了这种疾病的主要嫌疑。
许多研究报告了动物和人类各种炎症持续条件下微生物群组成的改变。在这种情况下,通常发现变形菌在疾病中增加,变形菌在肠道炎症中的作用已在各种结肠炎小鼠模型中得到解决,与疾病呈正相关。
例如,使用易发炎症的小鼠模型,即鞭毛蛋白受体 TLR5 缺陷小鼠 (T5KO),发现,进展为结肠炎的小鼠表现出明确的微生物群特征,其特征是变形菌的水平增加,尤其是大肠杆菌属。并且一些作者已将其确定为微生物群不稳定性的潜在标志物,因此易诱发疾病发作。
与变形杆菌属大量繁殖的同时,结肠炎Tlr5-/- 小鼠表现出杂乱无章的结肠粘液层,与非结肠炎Tlr5-/- 同胞相比,感染性病原体的清除延迟。
这些结果表明,短暂不稳定的肠道微生物群,尤其是以变形菌为主的群落,会使遗传易感的小鼠易患慢性结肠炎。
先天免疫反应失调推动变形杆菌生长的假设这反过来又会促进肠道炎症,这一点得到了其他小鼠模型研究的支持,这些小鼠模型具有影响适应性免疫的突变,白细胞介素 (IL)-10 是对本地微生物群产生免疫耐受所需的主要免疫调节细胞因子。
IL-10 缺陷小鼠由于对肠道菌群不耐受而表现出自发性结肠炎。随着结肠炎症的发生和发展,在定植常规微生物群或缺乏特定病原体的微生物群的 IL-10-/- 小鼠中,变形杆菌和大肠杆菌比野生型小鼠多。
在另一项对 IL-10 缺陷小鼠的研究中,富含饱和乳脂的饮食扰乱了肠道微生物群,导致亚硫酸盐还原Delta-proteobacteriumBilophila wadsworthia 大量繁殖。这种病原菌在 IL-10 -/-小鼠中诱导促炎性黏膜免疫反应并促进自发性结肠炎的发生率和严重程度;它还在喂食高乳脂饮食的野生型小鼠中促进葡聚糖硫酸钠 (DSS) 诱导的结肠炎。
除了对结肠炎的易感性与肠道变形菌的相对丰度之间存在正相关性之外,对先天性和适应性免疫系统均缺陷的小鼠的研究提供了支持变形菌在肠道炎症中的致病作用的证据。
来源:谷禾健康肠道菌群数据库
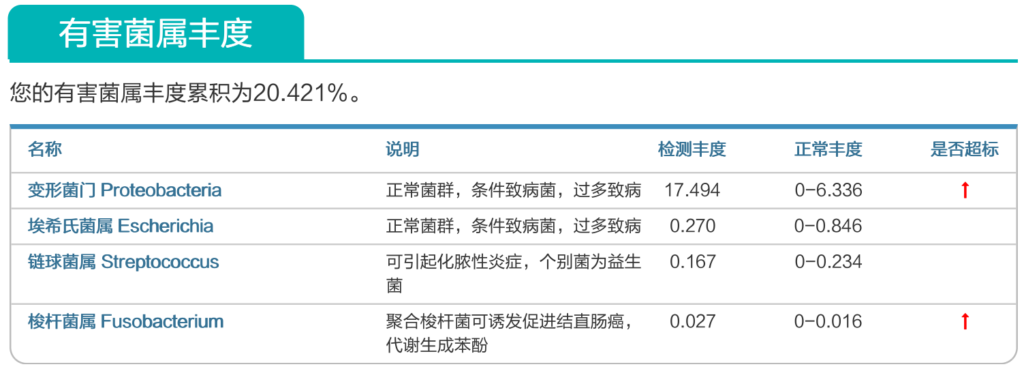
谷禾健康肠道菌群检测大数据也显示,在炎症性肠病,结直肠癌等患者的肠道菌群检测报告中,85%以上的患者显示变形菌门超标或多项变形菌门病原菌超标或占比丰度偏高。
在最近的一项研究中重现了,结肠炎中变形杆菌的显着扩增,该研究比较了患有活动性结肠炎的 TRUC 小鼠的肠道微生物组与因庆大霉素、甲硝唑或抗肿瘤坏死因子 (TNF)-α 治疗而缓解的小鼠的肠道微生物组。
值得注意的是,从 TRUC 小鼠的粪便中分离出的两种肠杆菌科细菌(肺炎克雷伯菌和奇异变形杆菌)即使在没有任何遗传免疫缺陷的受体小鼠中也足以引发结肠炎。
然而,这两种微生物的致结肠潜力并未在无菌 TRUC 小鼠中复制,这表明结肠炎的发病机制需要其他共生成员。口服伤寒杆菌,另一种富含 TRUC 小鼠的变形菌,也会在非结肠炎 TRUC 小鼠中引发结肠炎,这些小鼠具有大量的促炎细胞因子(例如,TNF-α)。
遗传易患结肠炎的小鼠的生态失调与人类 IBD 特别相关,因为与 IBD 相关的风险等位基因或多态性与先天性和适应性免疫成分有关。与小鼠研究相似,两项人类研究表明,与健康受试者相比,IBD 患者肠道微生物群落的特点是微生物多样性低、变形菌门(尤其是肠杆菌科)的产物以及厚壁菌门的减少。
一项人类队列研究发现,核苷酸结合寡聚化结构域 (NOD)-2 风险等位基因剂量与 IBD 患者肠道标本中肠杆菌科的相对丰度呈正相关。
在 UC 患者中,与炎症的中度和轻度阶段相比,在严重阶段观察到的变形杆菌水平显着升高。
在新发 CD 的初治儿科患者和非 IBD 对照受试者之间,回肠和直肠活检(但不在粪便样本中)的粘膜相关微生物组存在明显差异。变形菌的相对丰度增加,包括肠杆菌科、巴氏杆菌科和奈瑟菌科,将 CD 相关细菌群落与健康对照组区分开来。与慢性炎症一致,伴随变形杆菌属优势的肠道微生物群落改变不仅见于传染性病原菌或原生动物寄生虫引起的急性炎症,而且见于实验性和人类结肠炎相关的结肠直肠癌。
最有趣的生物体,通过一个孤立的病例报告与 IBD 有关,该病例报告一名感染这种细菌的小男孩在放射成像上出现回肠增厚,这是克罗恩病的典型表现。
血清学研究表明,与健康对照相比,克罗恩病患者的大肠杆菌抗体数量增加。具体地说,已发现37-55 % 的克罗恩病患者、2-11% 的溃疡性结肠炎患者和 <5% 对照组患者的百分比。
此外,克罗恩病患者中这些抗体的存在与更严重的表型相关,其特征是小肠受累、疾病进展频繁、病程更长和对手术的需求更大,这表明它们可以用作克罗恩病的预后标志物。
饮食被认为是塑造肠道微生物结构的最关键的环境因素之一。
△ 肥胖:丰富的变形菌为特征
累积证据表明,人类和啮齿动物的健康和肥胖个体的肠道微生物群的分类和功能组成存在差异。
此外,肥胖表型通过粪便移植的传播能力表明肠道微生物群落的改变,作为主要触发因素,是因果关系而不是结果。
肠道微生物群的分类组成失衡,称为生态失调,在代谢紊乱中得到充分证明,并被视为厚壁菌门相对于拟杆菌门的相对丰度增加(F:B 比率)。尽管一致的研究结果普遍支持这一概念,但代谢紊乱期间的生态失调通常包括变形菌的患病率增加。
例如,一项对儿童肠道微生物群的研究发现,与低脂肪、高纤维饮食儿童相比,食用高热量、高脂肪、低纤维饮食的欧洲儿童中的变形杆菌数量更多。
这种差异揭示了肠道微生物群落对非洲儿童饮食的适应性,这可以提高他们从难消化的多糖中获取能量的能力。此外,一些导致有害代谢影响的因素,例如食用无热量的人造甜味剂和乳化剂(通常用作加工食品中的添加剂),也会损害血糖控制并诱发变形杆菌繁殖。
特别是,人造甜味剂介导的肠杆菌科和Delta-proteobacteria类相对丰度的升高与 2 型糖尿病 (T2DM) 患者的结果一致,表明葡萄糖稳态和肠道变形菌之间存在联系。相比之下,证明变形菌的丰度与糖尿病表型呈负相关,挑战代谢疾病患者中高丰度变形菌的概念。
为支持代谢紊乱与变形菌属的扩张之间的关系,变形杆菌属的致肥胖潜力已在无菌小鼠的单关联研究中被确定。
在对一名病态肥胖志愿者进行的减肥试验中,肠杆菌科的相对丰度逐渐减少,假设肠杆菌在代谢恶化中具有致病作用。用从肥胖的人类肠道中分离出来的阴沟肠杆菌B29对无菌小鼠进行单菌定植足以诱导肥胖和胰岛素抵抗。
这一发现支持了这样一个假设,即以丰富的变形菌为特征的不稳定的肠道微生物群落可能代表代谢紊乱的主动特征,而不是被动后果。
△ 营养不良儿童:变形菌成为优势菌
营养不良会导致其他健康问题,例如消瘦和夸希奥科病。在发展中国家,营养不良是威胁 5 岁以下儿童生命的疾病。
营养不良的主要病因是在孕期或产后头 3 年由于大量营养素缺乏和微量营养素缺乏导致的慢性能量负平衡。
然而,最近的研究表明,孟加拉国和马拉维营养不良儿童的肠道微生物群落结构和基因含量与营养良好的儿童不同。在这些研究中,在营养不良的儿童中普遍观察到变形菌的优势和肠道微生物群的低多样性,并被认为是肠道微生物群成熟的障碍。
此外,最近的一项研究揭示了肠杆菌科细菌与营养不良下的肠道黏膜免疫球蛋白 A (IgA) 反应之间存在机制上的相互关系,这会引发肠病并中断黏膜免疫的发展和健康微生物群的组装。
鉴于生态失调驱动的选择压力似乎干扰了微生物群的稳定性,变形菌随后借此机会增加了它们的适应性。微生物群落在异常代谢条件下的不稳定性已被解释为对定植的抵抗力受损。
当接种来自肥胖人类供体的培养细菌(“肥胖受体小鼠”)的无菌小鼠与携带来自瘦肉供体的细菌物种(低脂肪、高纤维饮食)的小鼠共同饲养时,它们被瘦肉有效定殖供体来源的细菌菌株及其肥胖表型得到改善。相比之下,瘦小鼠没有被来自肥胖小鼠的外源或外源细菌菌株定殖。
这一发现表明,生态失调的特点是传播能力减弱和对定植的抵抗力。鉴于 kwashiorkor 儿童的肠道微生物不成熟且富含肠道病原体营养不良被认为与对殖民化的抵抗力有缺陷有关。
总的来说,这一间接证据导致了这样一种观点,即肠道变形菌的扩张反映了宿主的能量不平衡和不稳定的微生物群。有趣的是,在非疾病状态下,如新生儿期和胃绕道手术后也观察到肠道微生物群落的不稳定结构和高丰度的变形菌。
与大多数细菌一样,在细胞外环境中对变形菌的初步识别是通过病原体识别受体 (PRRs) 发生的,PRRs 识别微生物相关分子模式 (MAMPs)——一个包括病原体相关分子模式 (PAMPs) 和危险相关分子模式的统称分子模式(DAMP)。
这些信号受体可分为三个家族:
尽管至关重要的是,只有 TLR 家族参与识别肠细胞表面的细菌配体。
存在于变形菌细胞表面的主要 MAMP 是脂多糖 (LPS) 和鞭毛蛋白,它们分别被 TLR4 和 TLR5 识别。其他参与细菌识别的TLR包括检测细菌脂蛋白的TLR2和检测未甲基化 CpG DNA 的细胞内受体 TLR9。
LPS 的产生和鞭毛组装是在原核生物中观察到的两个最动态的过程,这些结构组成的巨大差异反映在不同变形菌家族成员中观察到的先天免疫反应的强度和方向上。例如,弯曲杆菌和螺杆菌属LPS 与大肠杆菌LPS 的不同之处在于具有更长的酰基链和增加的链连接和脂质 A 磷酸基团的修饰。
在许多病原生物体(例如百日咳杆菌和幽门螺杆菌)中观察到脂质 A 锚中的一个或两个磷酸基团丢失,并且已被证明可提供对抗菌肽的抗性。
参与细菌识别的 TLR 的遗传变异与 IBD 相关。2010 年发表的一项荟萃分析表明,TLR4 Asp299Gly 和 Thr399Ile 变体都赋予白人患克罗恩病和溃疡性结肠炎的统计学显着风险。有趣的是,这两种变体都位于 LPS 结合域内 TLR4 的胞外域,并且被认为会影响蛋白质的二级结构。
这些功能变体的存在已被证明会影响 LPS 反应性,并使个体更容易受到革兰氏阴性菌的感染。证据还表明,这些遗传变异的存在可能会影响基础免疫状态。
因此,有理由推测,在 TLR4 基因变异的携带者中,在营养不良事件之前或期间发生的免疫反应改变,可能足以驱动 IBD 发生不可挽回的免疫反应改变。TLR9 中的遗传变异也与 IBD 易感性增加有关。证据不如TLR4那样令人信服,尽管这一警告可能反映了 TLR9 处理来自所有细菌的配体而 TLR4 反映革兰氏阴性菌易感性的事实。
变形菌门是肠道菌群中四个主要门(厚壁菌门、拟杆菌门、变形菌门和放线菌门)中最不稳定变化最快的门。变形菌门作为一线反应者,对环境因素(如饮食)反应敏感。
总的来说,迄今为止的许多研究都支持这样一个概念,即肠道中大量变形菌反映了生态失调或不稳定的肠道微生物群落结构。除了外源性肠致病性变形杆菌外,健康的哺乳动物肠道还含有数种属于该门的共生细菌,作为其天然肠道菌群。
这些细菌在比例较小时似乎是良性的,而在某些肠道环境下,它们会变成可引发炎症反应甚至代谢障碍。
然而,肠道中变形菌的长期富集可能代表不平衡的不稳定微生物群落结构或宿主的疾病状态。因此,时间顺序监测,而不是横断面研究,可能是根据肠道中变形菌的比例确定疾病风险的更好方法。
在健康肠道中,免疫系统严格调节其反应以维持与共生菌的共生关系。这种可能性表明存在正反馈循环。环境或宿主因素(例如低纤维饮食和急性或慢性炎症)破坏体内平衡,具有选择性并导致肠道内大量变形菌的生态失调。由于宿主无法保持共生的变形菌而导致变形菌的不受控制的扩张,在一小部分和微生物群落对定植的抵抗力降低的情况下,可以进一步促进炎症或外源性病原体的入侵。
因此,切断反馈回路的策略可能包括优化肠道微生物群和宿主之间的伙伴关系。鉴于大多数研究已经在与宿主生理学相关的背景下描述了微生物群落状态,因此对于未来的炎症和代谢干预治疗,首先需要判别变形菌的丰度以及是其是否不受控制扩张,另外需要确定变形杆菌大量繁殖的原因以开发有效的治疗方法。
主要参考文献:
Rizzatti G, Lopetuso LR, Gibiino G, Binda C, Gasbarrini A. Proteobacteria: A Common Factor in Human Diseases. Biomed Res Int. 2017;2017:9351507. doi: 10.1155/2017/9351507. Epub 2017 Nov 2. PMID: 29230419; PMCID: PMC5688358.
Mukhopadhya I, Hansen R, El-Omar EM, Hold GL. IBD-what role do Proteobacteria play? Nat Rev Gastroenterol Hepatol. 2012 Feb 21;9(4):219-30. doi: 10.1038/nrgastro.2012.14. PMID: 22349170.
Litvak Y, Byndloss MX, Tsolis RM, Bäumler AJ. Dysbiotic Proteobacteria expansion: a microbial signature of epithelial dysfunction. Curr Opin Microbiol. 2017 Oct;39:1-6. doi: 10.1016/j.mib.2017.07.003. Epub 2017 Aug 4. PMID: 28783509.
Shin NR, Whon TW, Bae JW. Proteobacteria: microbial signature of dysbiosis in gut microbiota. Trends Biotechnol. 2015 Sep;33(9):496-503. doi: 10.1016/j.tibtech.2015.06.011. Epub 2015 Jul 22. PMID: 26210164.
Shin NR, Whon TW, Bae JW. Proteobacteria: microbial signature of dysbiosis in gut microbiota. Trends Biotechnol. 2015 Sep;33(9):496-503. doi: 10.1016/j.tibtech.2015.06.011. Epub 2015 Jul 22. PMID: 26210164.
Rigottier-Gois L. Dysbiosis in inflammatory bowel diseases: the oxygen hypothesis. ISME J. 2013 Jul;7(7):1256-61. doi: 10.1038/ismej.2013.80. Epub 2013 May 16. PMID: 23677008; PMCID: PMC3695303.

谷禾健康

粪球菌属(Coprococcus)
是厚壁菌门毛螺菌科重要成员,是肠道重要的菌属,菌种大部分从粪便中分离出来,积极发酵碳水化合物,是和Faecalibacterium prausnitzii 一样,丁酸的重要生产者之一。粪球菌可用作评估人体胃肠道健康状况的微生物生物标志物,Coprococcus属的细菌可能有助于抑制免疫反应,降低过敏反应的严重程度;Coprococcus的细菌有助于对 ACE 抑制剂产生耐药性,ACE 抑制剂是用于治疗高血压的主要药物类别之一。此外,该菌还与抑郁症,幼儿语言发育、便秘、睡眠以及慢性疲劳等相关。
细胞球状,直径0.8~1.5μm,有时椭圆形,成对或短链,革兰氏阳性,不运动,严格厌氧。最适生长温度37℃,多数物种分离于人的肠道和粪便,很少从人类临床标本中分离出来表明该菌主要定植于健康人的肠道。
需要注意的是,该菌需要与非常耐药且容易引起感染的肠球菌属(Enterococcus )区分开来,他们翻译的中文名虽然只差一个字,但是肠球菌能引发感染,以耐药性出名。
而粪球菌(Coprococcus)是厌氧球菌属,虽然它们都是人类粪便菌群的一部分。但是粪球菌积极发酵碳水化合物,产生丁酸和乙酸以及甲酸或丙酸和/或乳酸等。
在人类粪便中发现的最多产丁酸盐的细菌是属于梭菌簇 IV 和 XIVa 的对氧高度敏感的厌氧菌。其中包括许多以前未描述的与真杆菌属、罗斯氏菌属、普拉梭菌以及本文的粪球菌属。
该菌属主要至少包括以下物种:
Coprococcus catus (species)
Coprococcus comes (species)
Coprococcus eutactus (species)
Coprococcus sp. DJF_CR49 (species)
Coprococcus sp. L2-50
此属的模式种为(Coprococcus eutactus)
不同碳水化合物上的 Coprococcus 物种的生长不太一样,其中:
Coprococcus eutactus的丰度与肠道中更大的细菌基因丰富度有关,β-葡聚糖是与Coprococcus eutactus相关的人类肠道细菌的主要生长底物,其代谢产生丁酸盐和甲酸盐或乳酸。
此外,这两种菌可以利用广泛的碳水化合物底物:
Coprococcus. eutactus
Coprococcus sp. L2-50
但是,Coprococcus comes仅在葡萄糖上表现出良好的生长,而Coprococcus catus 仅在葡萄糖上表现出非常有限的生长,Coprococcus catus代谢产生丁酸盐和丙酸盐。
细菌互相作用或共同在一个生态位生存对整个菌群结构和宿主健康有很重要的影响,例如共现关系(例如,赋予抗生素耐药性)、共生关系(例如,交叉喂养其他成员产生的化合物)和协同作用。
研究报告Coprococcus和Roseburia之间的共现关系的支持,两者都属于Lachnospiraceae家族,表明系统发育密切相关的属也可能具有共现关系,而不是由于它们相似的栖息地偏好而总是相互竞争。然而,由于对人类肠道微生物群落的机理了解不足,因此应谨慎解释肠道细菌之间的生态联系。
此外还发现该菌属在生物化学上与瘤胃球菌密切相关。
值得注意的是,一项来自广东肠道微生物组计划的大规模队列数据,分析得出脱硫弧菌(DSV) 经常在人体肠道中发现,DSV的相对丰度与包括Oscillospira Coprococcus , Ruminococcus , Akkermansia,Roseburia , Faecalibacterium 和 Bacteroides呈正比。
人类肠道微生物群的物种组成对于弯曲杆菌感染的定植抗性很重要。相比于感染弯曲杆菌的人群,健康人群中Coprococcus丰度更好,表明高水平的Coprococcus有利于抵抗弯曲杆菌。
2019年比利时通过一项1070抑郁症病人的验证集小组发现,即使在控制了抗抑郁药的作用后,抑郁症患者的粪球菌属(Coprococcus)和小杆菌属(Dialister)细菌都已耗尽。
还发现Coprococcus具有与多巴胺相关的生物途径,多巴胺是一种会影响心理健康的神经递质。该研究的粪便宏基因组的肠脑模块分析确定,多巴胺代谢物 3,4-二羟基苯乙酸的微生物合成潜力与心理生活质量呈正相关,并表明微生物产生的γ-氨基丁酸在抑郁症中的潜在作用。
研究将重度抑郁症 (MDD) 患者的粪便微生物群移植 (FMT) 移植到大鼠体内,发现:相比较与移植健康粪便的大鼠, FMT-MDD大鼠瘤胃球菌科和毛螺菌属升高,而粪球菌属则被耗尽,从机理上表明粪球菌的缺乏会与抑郁症的关系。
另外一项对82 名抑郁的人随机分配接受多菌株益生菌加生物素治疗或生物素加安慰剂治疗 28 天。发现28天后,与接受安慰剂治疗的个体相比,精神症状的改善明显更高;同时粪便16s测试表明相比于安慰剂组,益生菌组的多样性高,Coprococcus 显著增加。
该研究的益生菌干预组为:包括九种菌株,双歧杆菌W23、乳酸双歧杆菌W51、乳酸双歧杆菌W52、嗜酸乳杆菌W22、干酪乳杆菌W56、副干酪乳杆菌W20、植物乳杆菌W62、唾液乳杆菌W24 和乳酸乳球菌W19。此外,益生菌产品中还添加了 125 毫克 D-生物素(维生素 B7)、30 毫克马尾草、30 毫克鱼胶原蛋白和 30 毫克角蛋白加基质。
帕金森病是一种神经退行性疾病,其特征是错误折叠的 α-突触核蛋白的细胞内聚集体沿脑轴聚集。一些研究报告了肠道菌群失调与帕金森病之间的关联,尽管因果关系仍有待确定。帕金森病组中最显著的变化突出了细菌类群的减少,特别是在毛螺菌科家庭和关键成员,例如丁酸弧菌属、粪球菌属(Coprococcus)和Blautia。
另外的研究发现帕金森病患者的结肠中有 α-突触核蛋白 (α-Syn) 聚集,并有结肠炎症的证据。PD患者的黏膜和粪便微生物群与对照组相比有显著差异,粪便样本比乙状结肠黏膜有更显著的差异。在属的分类水平上,来自 Blautia、Coprococcus和 Roseburia 属在对照组的粪便中明显多于 PD 患者。
此外,还有研究指出其他神经退行性疾病 (NDs)包括阿尔茨海默病 (AD)、多系统萎缩 (MSA)、多发性硬化症 (MS)、视神经脊髓炎(NMO) 和肌萎缩侧索硬化症 (ALS)中Faecalibacterium 、Coprococcus、Blautia 、 Prevotella减少。
一项针对136名3岁乌干达儿童粪便样本研究表明,产丁酸盐的肠道细菌Coprococcus eutactus可以作为乌干达农村三岁儿童语言发展的预测因子。
该研究模型指出3岁时语言发展高于平均水平的儿童,在其2岁时粪便中有相对较高水平的Coprococcus eutactus,语言发育低的儿童中Coprococcus 属平均丰度低,而且该研究表明早期获得产丁酸盐Coprococcus eutactus对语言发展的重要性,而在在语言发育受损的儿童中,耐氧物种的优势增加。
湿疹的严重程度一般与微生物群多样性和产生丁酸盐的细菌的丰度呈负相关,尤其产生丁酸盐的Coprococcus eutactus相关细菌的降低。我们数据库数据和案例也显示过敏和哮喘的儿童Coprococcus丰度很低或显著低于健康儿童。
自闭症谱系障碍 (ASD) 是世界范围内普遍存在的神经生物学疾病,原因复杂。多项研究表明自闭症儿童Coprococcus、Prevotella、Blautia 、Lachnospiraceae和Ruminococcaceae属的丰度较低。
睡眠在儿童的身心发展中发挥着重要作用。一项针对学龄前儿童(4.37 ±0.48 岁,n=143)的睡眠与肠道微生物群之间的关系研究表明拟杆菌中双歧杆菌的相对丰度较高,在睡眠效率较高和入睡后醒来时间较低(LDA 评分 >2)的儿童中较高。相比之下,包括 Blautia 和 Coprococcus 在内的一些毛螺菌科成员分别与较短的夜间睡眠时间和较低的效率相关。
慢性便秘是全球最常见的胃肠道疾病之一。然而,其发病机制在很大程度上仍不清楚。在便秘患者的肠道微生物组中,产生丁酸盐的 Roseburia、Coprococcus和 Faecalibacterium 属的丰度很低。不存在便秘状态的特定微生物生物标志物,整个肠道微生物群在都可能发挥作用。
此外,功能性便秘(FC)个体的肠道微生物群被证明缺乏属于拟杆菌属、罗斯氏菌属和 Coprococcus 的成员。与对照相比,FC 相对应的微生物组显示出高丰度的参与制氢、产甲烷和甘油降解的基因。
新出现的证据表明,肠道菌群失调与慢性肾脏病 (CKD) 的发病机制有关,其潜在机制涉及粘膜和/或系统免疫或代谢紊乱。
一项纳入1436 名慢性肾病的meta分析显示终末期肾病 (ESRD)患者中普氏菌属、粪球菌属、巨单胞菌属和粪杆菌属的丰度较低。
虚弱是一种常见的老年综合征,与不良健康后果的风险相关。从 176 名韩国老年人的粪便样本中获得的 16S rRNA 基因测序数据研究了虚弱测量与肠道微生物组的关联。发现在较虚弱的个体中,普氏菌和 Coprococcus eutactus的丰度减少。
先兆子痫是一种以高血压和多个器官功能障碍为特征的妊娠特异性疾病,与母体和胎儿并发症有关。
对 213 名孕妇的粪便样本进行 16S rRNA 基因扩增子测序,调查了妊娠 28 周时发生迟发性(>34 孕周)先兆子痫 (DPE) 的女性的肠道微生物群组成发现产丁酸的丰富粪球菌属在 DPE 中显著减少。产生丁酸盐的细菌特别是Coprococcus spp. 丰度的减少可能会增加孕妇患先兆子痫的风险。
此外,研究发现喹那普利在降低肠道菌群负荷较低的高血压大鼠的血压方面更有效。当他们分析肠道微生物群的组成时,Coprococcus 属成为一个重要的参与者。
早期乳腺癌 (BC) 患者和健康对照者的粪便微生物群分析对比表明早期 BC 的患者中微生物多样性的减少、Odoribacter、Butyricimonas和Coprococcus 的相对丰度降低的趋势。
慢性广泛性肌肉骨骼疼痛 (CWP) 是纤维肌痛的特征性症状,已被证明与肠道微生物组的改变有关。在 CWP 病例中,Coprococcus的物种显著减少 。
维生素 D 会增加瘤胃球菌科、阿克曼氏菌、粪杆菌和粪球菌的增加。
在整个人群中,Coprococcus 的变化与体重、总胆固醇和甘油三酯的变化呈正相关,与 HDL 胆固醇呈负相关。
银屑病是一种常见的慢性复发性皮炎。瘤胃球菌科、 Coprococcus_1属和Blautia属的丰度随着银屑病的改善而降低( p< 0.05),这已被证明在银屑病中显著增加。
但是也有研究指出观察到 Coprococcus属减少。这些研究队列都只有几十例,需要更大队列验证。
小檗碱和二甲双胍都是源自草药的成熟药剂,对包括糖尿病在内的多种疾病具有偶然的有益作用。使用二甲双胍或小檗碱干预 db/db 小鼠的肠道微生物群,增加产短链脂肪酸的细菌(例如,丁酸单胞菌属、粪球菌属、瘤胃球菌属)的数量。
补充维生素 D 对 26 种维生素 D 缺乏(25-羟基维生素 D (25(OH)D) ≤50 nmol/L)、超重或肥胖(BMI ≥25 kg/m 2) 其他健康的成年人。
一项研究是 2014 年至 2016 年间进行的基于社区的双盲随机临床试验的辅助研究。参与者在基线和 100,000 国际单位 (IU) 负荷剂量的胆钙化醇之后提供粪便样本,然后每天 4000 IU 或匹配安慰剂 16周。与25(OH)D <50 nmol/L的个体相比,25(OH)D >75 nmol/L 的个体的粪球菌属丰度增高。
关节和肠道炎症之间的密切关系早已为人所知。20 名受肠病性关节炎影响的患者,他们从未接受过生物药物治疗,在基线时和治疗 6 个月后接受了 TNFi 治疗。所有患者都遵循地中海饮食。治疗后6个月毛螺菌科和粪球菌属显著增加。
甘草甜素 (GL) 是一种三萜糖苷,在各种生物活性中发挥重要作用,包括抗病毒和抗肿瘤免疫反应。菌群分析表明 GL 降低Akkermansia、Sutterella、 Prevotella和Coprococcus 。
紫薯中提取的抗性淀粉 (RS) 有利于增加Coprococcus的丰度。
胞外多糖 (EPS) 是合成并存在于双歧杆菌表面的碳水化合物聚合物。由于其在食品、生物技术、化妆品和医药等多个领域的潜在应用,双歧杆菌 EPS 促进了 Coprococcus 属的生长。与淀粉组相比,EPS 还增加了丙酸的产生。
甘草甜素 (GL) 是一种三萜糖苷,在各种生物活性中发挥重要作用,包括抗病毒和抗肿瘤免疫反应。菌群分析表明 GL 降低Akkermansia、Sutterella、 Prevotella和Coprococcus 。
主要参考文献:
Valles-Colomer M, Falony G, Darzi Y, Tigchelaar EF, Wang J, Tito RY, Schiweck C, Kurilshikov A, Joossens M, Wijmenga C, Claes S, Van Oudenhove L, Zhernakova A, Vieira-Silva S, Raes J. The neuroactive potential of the human gut microbiota in quality of life and depression. Nat Microbiol. 2019 Apr;4(4):623-632. doi: 10.1038/s41564-018-0337-x. Epub 2019 Feb 4. PMID: 30718848.
Vascellari S, Palmas V, Melis M, Pisanu S, Cusano R, Uva P, Perra D, Madau V, Sarchioto M, Oppo V, Simola N, Morelli M, Santoru ML, Atzori L, Melis M, Cossu G, Manzin A. Gut Microbiota and Metabolome Alterations Associated with Parkinson’s Disease. mSystems. 2020 Sep 15;5(5):e00561-20. doi: 10.1128/mSystems.00561-20. PMID: 32934117; PMCID: PMC7498685.
Keshavarzian A, Green SJ, Engen PA, Voigt RM, Naqib A, Forsyth CB, Mutlu E, Shannon KM. Colonic bacterial composition in Parkinson’s disease. Mov Disord. 2015 Sep;30(10):1351-60. doi: 10.1002/mds.26307. Epub 2015 Jul 16. PMID: 26179554.
Naderpoor N, Mousa A, Fernanda Gomez Arango L, Barrett HL, Dekker Nitert M, de Courten B. Effect of Vitamin D Supplementation on Faecal Microbiota: A Randomised Clinical Trial. Nutrients. 2019 Nov 27;11(12):2888. doi: 10.3390/nu11122888. PMID: 31783602; PMCID: PMC6950585.
Arango L, Barrett HL, Dekker Nitert M, de Courten B. Effect of Vitamin D Supplementation on Faecal Microbiota: A Randomised Clinical Trial. Nutrients. 2019 Nov 27;11(12):2888. doi: 10.3390/nu11122888. PMID: 31783602; PMCID: PMC6950585.
Scher JU, Ubeda C, Artacho A, Attur M, Isaac S, Reddy SM, Marmon S, Neimann A, Brusca S, Patel T, Manasson J, Pamer EG, Littman DR, Abramson SB. Decreased bacterial diversity characterizes the altered gut microbiota in patients with psoriatic arthritis, resembling dysbiosis in inflammatory bowel disease. Arthritis Rheumatol. 2015 Jan;67(1):128-39. doi: 10.1002/art.38892. PMID: 25319745; PMCID: PMC4280348.
Sun C, Chen L, Yang H, Sun H, Xie Z, Zhao B, Jiang X, Qin B, Shen Z. Involvement of Gut Microbiota in the Development of Psoriasis Vulgaris. Front Nutr. 2021 Nov 22;8:761978. doi: 10.3389/fnut.2021.761978. PMID: 34881280; PMCID: PMC8646027.
Andreo-Martínez P, García-Martínez N, Sánchez-Samper EP, Martínez-González AE. An approach to gut microbiota profile in children with autism spectrum disorder. Environ Microbiol Rep. 2020 Apr;12(2):115-135. doi: 10.1111/1758-2229.12810. Epub 2019 Nov 27. PMID: 31713352.
Mancabelli L, Milani C, Lugli GA, Turroni F, Mangifesta M, Viappiani A, Ticinesi A, Nouvenne A, Meschi T, van Sinderen D, Ventura M. Unveiling the gut microbiota composition and functionality associated with constipation through metagenomic analyses. Sci Rep. 2017 Aug 29;7(1):9879. doi: 10.1038/s41598-017-10663-w. PMID: 28852182; PMCID: PMC5575163.
Yarullina DR, Shafigullin MU, Sakulin KA, Arzamastseva AA, Shaidullov IF, Markelova MI, Grigoryeva TV, Karpukhin OY, Sitdikova GF. Characterization of gut contractility and microbiota in patients with severe chronic constipation. PLoS One. 2020 Jul 17;15(7):e0235985. doi: 10.1371/journal.pone.0235985. PMID: 32678865; PMCID: PMC7367488.
Lim MY, Hong S, Kim JH, Nam YD. Association Between Gut Microbiome and Frailty in the Older Adult Population in Korea. J Gerontol A Biol Sci Med Sci. 2021 Jul 13;76(8):1362-1368. doi: 10.1093/gerona/glaa319. PMID: 33437992.

谷禾健康


最近关于“益生菌”的风很大,我们越来越容易从各种渠道听到关于补充益生菌的科普,但依然一知半解。
我们每个人都需要补充益生菌吗?
不同益生菌有什么不同,如何选择?
为什么有的人补充有效,有的人无效?
益生菌真的能定植吗?与什么因素有关?
…..

本文我们来逐一解答这些问题。
对于这个问题而言,我们要明确的是,补充益生菌的目的是为了通过改善菌群,从而达到更健康的状态。补充益生菌是改善菌群的一种方式。
并不是每个人都需要补充益生菌,也并不是每个人都适合补充益生菌,所以首先第一步是判断:
目前已有研究的,与菌群相关的疾病包括:
消化系统(腹泻、腹胀、便秘等);
神经系统(自闭症、精神障碍等);
免疫系统(哮喘等);
代谢系统(肥胖、糖尿病等);
心血管疾病(高血压、中风等);
癌症(胰腺癌、结肠癌等);
…
本号里有各类与菌群相关疾病的研究进展。
假如你本身非常健康,同时也一直遵循着健康的饮食和生活方式,那就不需要补充。
假如在你身上出现的症状和菌群完全没有关联,补充益生菌可能起不到太大的效果。
如果症状与菌群有关,或者正经历慢性压力、营养不良、药物、环境变动、衰老、疾病、旅行、肠道菌群紊乱等情况,可以通过补充益生菌的方式来改善菌群从而缓解症状。
然而,不同益生菌有不同的功效,并不是可以随意补充,究竟该如何选择?
下一章节我们来详细了解。
目前市面上的益生菌种类五花八门,要从这么多益生菌中选择适合自己的能发挥作用的,并不是一件容易的事儿,我们可以尝试从以下几个方面来了解益生菌。
最可靠的益生菌是那些经过双盲测试的益生菌。如果不进行双盲试验,益生菌测试可能会有偏差这些信息应该清楚地印在包装上。要检查包装确认益生菌厂家是否告知检测结果。
使用标准化流程的可追溯性确保了消费者安全和产品注册,尽可能选择严格规范的公司生产的益生菌。
对于无活菌标识、无菌株号、无任何文献数据支持的类型,则需谨慎。
益生菌每个属内都有很多种和菌株,益生菌的作用因这些种和菌株而不同。哪怕同属于乳酸杆菌,菌株不同效果也不同,比如:
嗜酸乳杆菌有助于血压、胆固醇、过敏和消化;鼠李糖乳杆菌可以帮助降低血糖、免疫功能和胆固醇;瑞士乳杆菌可以降低血压、改善睡眠质量和骨骼健康。
这里提供一些常见的益生菌及目前已知的功能作为参考。


-357x1024.png)
-1024x426.png)
-1024x615.png)
<来源:谷禾健康数据库>
研究表明最好空腹服用,通常是在早上。服用益生菌的是为了让它到达大肠,因为这是菌群存活率最高的地方。当有食物时,胃酸分泌较多,益生菌可能会被胃酸杀死,因此最好空腹服用。
一天中,最佳时间是早上空腹时,其余的话饭前或睡前也可以,饭后服用效果较差。
绝大多数人开始服用益生菌是安全的。在开始服用前几天,可能会出现胃部不适、胀气、腹泻或腹胀等症状。这些症状通常会在身体习惯后消失。
服用益生菌可能出现的副作用


如果是小肠细菌过度生长等疾病患者,则需要注意,可能会出现腹胀、便秘等消化疾病问题。
此外,它也可能会跟某些药物相互作用,如果长期服用药物,或有严重感染和近期做过手术的人群,使用益生菌前请遵医嘱。
如有牛奶过敏或乳糖不耐症、怀孕或哺乳等情况,请咨询医生是否适合服用。
在通过胃肠道的不利和波动条件的运输过程中,包埋可以为益生菌提供显著的保护。
微胶囊化对益生菌的贮藏稳定性和贮藏后性能有显著的影响。微胶囊化可以提高其在不利环境条件下的存活率,确保一定数量的益生菌进入人体并且在肠道中释放,提高益生菌的使用价值。
益生菌的种类不同,存储方式可能也有所不一,
益生菌产品的储藏方式一般可以分为常温,冷藏和冷冻三种,市场上的很多益生菌产品都需要冷藏。请检查包装去了解如何储存。对于干性益生菌补充剂,一般来说需要在干燥、黑暗的地方存储(潮湿条件会导致代谢发酵或降解)。
关于这部分详见《益生菌的靶向递送:研究和商业化前景》
跟其他食品一样,益生菌也要看生产日期或到期日期。随着时间的推移,CFU 的数量可能会下降。因此最好检查包装上的日期。
如果已经使用某种益生菌补充剂几周甚至几个月了,但没有发现消化系统健康状况有所改善,那么是时候尝试换一种新的益生菌了。
与药物不同,更换益生菌补充剂不会产生重大副作用。
此外,可以利用好肠道菌群检测这个工具。可以从两个方面入手:
益生菌抑制其他菌群生长
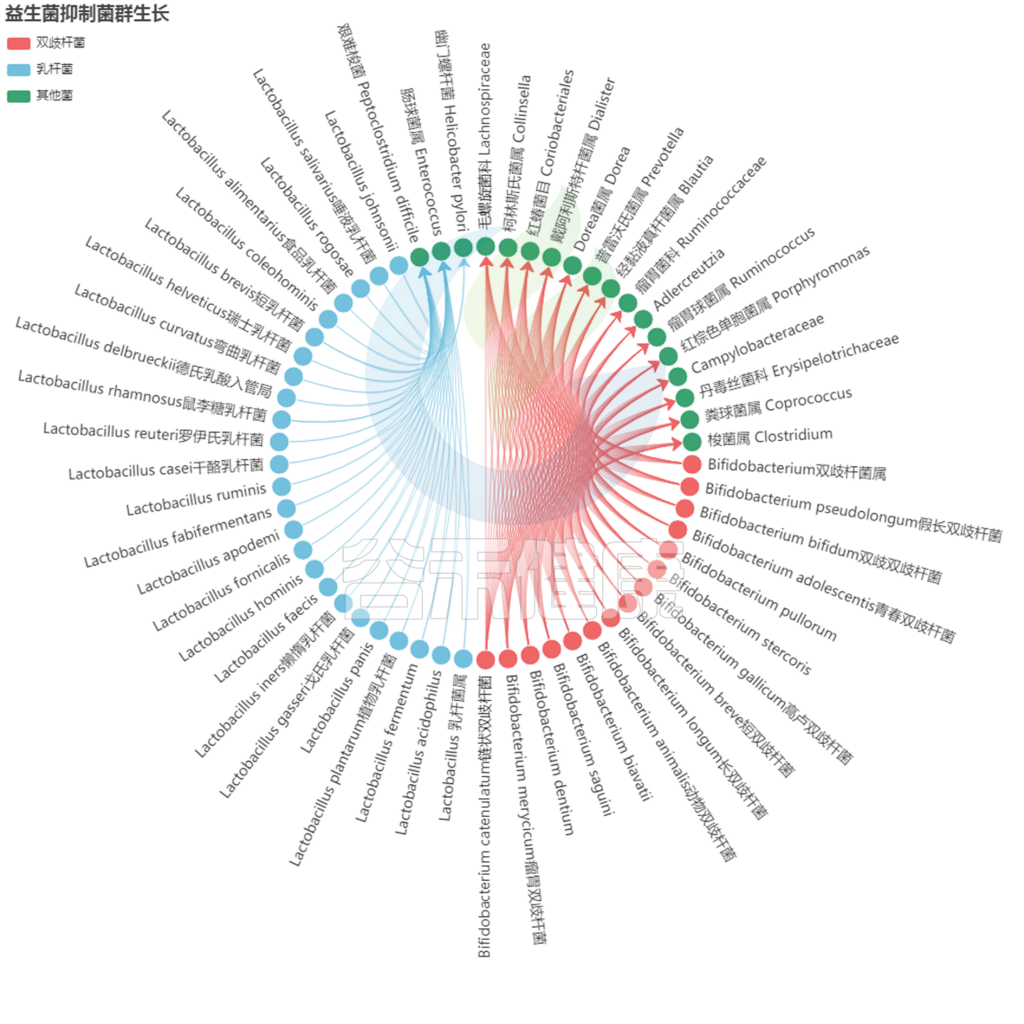

<来源:谷禾健康数据库>
注:以上红色代表双歧杆菌,蓝色代表乳杆菌,绿色则为其他菌群,箭头指向代表抑制的菌群。
我们知道,抗生素可以在杀死致病菌的同时,也会误伤体内的有益菌,破坏原有的菌群平衡状态。那能不能在抗生素使用的时候,补充一些益生菌使其恢复平衡?
目前针对益生菌和抗生素同时服用的研究,支持和不支持的都有。
√ 支持益生菌和抗生素同时服用的研究:效果显著
对给予益生菌的23项研究(3938名参与者)进行调查,22个试验报告了抗生素相关腹泻的发生率,结果显示,与活性、安慰剂或无治疗对照组相比,益生菌组显著受益(益生菌组8%,对照组19%)。
研究副作用的16项试验(n = 2455)中,没有一项记录了可归因于益生菌的任何严重副反应。作者认为益生菌对预防抗生素相关性腹泻具有保护作用。相对危险度为0.46 (95% CI为0.35 ~ 0.61),NNT为10。
作者认为鼠李糖乳杆菌或布氏酵母菌Saccharomyces boulardii 形成单位为每天50 – 400亿个是最合适的选择。
建议在进行进一步研究之前,应避免在有不良事件风险的儿童人群中使用益生菌。
× 反对益生菌和抗生素同时服用的研究:菌群恢复难
研究人员发现在服用抗生素4周后,接受11株益生菌治疗的人的肠道微生物群需要更长的时间才能恢复正常。这是在益生菌有效地在肠道定植的情况下。问题是新的细菌和酵母菌株的存在使肠道微生物群在整个6个月的研究期间无法恢复正常。
而那些没有服用益生菌的人的肠道菌群在停用抗生素三周后恢复正常。作者得出的结论是,这项研究只是检测了一种益生菌,不同的益生菌可能对服用不同抗生素的患者有帮助。不过他们也认为,在服用抗生素之后再服用益生菌可能是没有益处的。
还需要更多的研究来确定是否有其他方法来探索益生菌和抗生素的共存关系,如益生菌封装技术增强效果、自体粪菌移植等各种方式。
研究发现,封装的益生菌有一个由海藻酸钠或其他合适的生物相容性材料组成的保护壳,可以抵御抗生素;胶囊型益生菌对抗生素耐药病原体的治疗效果有所提高。这可能为益生菌和抗生素共同使用带来利好。
研究表明,自体粪便移植(在使用抗生素之前收集粪便样本并冷冻,在抗生素治疗后移植),8天内肠道菌群就恢复正常。未进行粪便移植的那一组的肠道菌群花了21天时间才恢复。
除了直接服用益生菌这种方式之外,有些食物中也富含益生菌,如:
还有其他方式也可以获取益生菌或者协助益生菌生长。
补充益生元,协助有益菌生长
益生元是一种可溶于水的可溶性纤维,可以作为益生菌的“食物”。
益生元可以通过小肠到达大肠和结肠,然后有益细菌会把它消化或发酵,形成乙酸盐、丙酸盐和丁酸盐等代谢物。
最广泛认可的益生元包括低聚果糖 (FOS)、菊粉和低聚半乳糖 (GOS) 等。
此外还包括抗性淀粉、果胶寡糖 (POS)、多酚等。
菊粉型果聚糖和阿拉伯木聚糖低聚糖等益生元表现出双歧化和产丁酸作用。产丁酸菌正需要这些益生元,例如直肠真杆菌、普拉氏粪杆菌和罗氏菌属。
有机酸的产生还可以形成对病原体的防御并增加矿物质的吸收。通过益生元和有益菌繁殖结合将导致较低的管腔 pH 值,阻止病原体在肠粘膜中的粘附和生长,并增加盲肠和结肠对矿物质,特别是钙和镁的吸收。
★ 哪些食物中含有益生元?
蒲公英嫩叶
蒲公英绿叶植物是菊粉和其他纤维的重要来源,每100克含有4克纤维。
蒲公英绿色植物也因其抗炎、抗氧化、降低胆固醇的功效而闻名,同时也有助于减轻便秘。
菊芋
每 100 克菊芋含有约 2 克膳食纤维,其中 3/4 由菊粉组成。它们还富含硫胺素和钾,可支持神经系统并促进适当的肌肉功能
青香蕉或青香蕉粉
未成熟的(绿色)香蕉富含抗性淀粉,绕过小肠的消化(可消化的淀粉转化为葡萄糖)并携带到结肠,被有益细菌发酵成代谢物。
香蕉中的纤维已被证明可以增加健康的肠道细菌并减少腹胀。
大麦和燕麦
大麦和燕麦由 3-8% 的 β-葡聚糖组成,这是一种益生元纤维,可促进肠道中有益细菌的生长。
还发现大麦和燕麦中的 β-葡聚糖可以降低 LDL 胆固醇(坏胆固醇)和血糖水平
大麦富含硒 – 支持甲状腺功能,抗氧化益处与预防多种癌症有关。
由于其酚酸含量,燕麦还提供抗氧化和抗炎保护。
魔芋根
魔芋根,也称为葡甘露聚糖,原产于亚洲部分地区,用于中药以及烹饪中作为增稠剂。它因其减肥益处和帮助降低低密度脂蛋白胆固醇而得到普遍认可。
除魔芋外,一项研究发现有助于减少粉刺并改善患者的整体皮肤健康。它还被发现有助于减少过敏。
菊苣根
菊苣根与蒲公英来自同一个家族,新鲜菊苣根由高达 70% 的菊粉组成,研究发现它有助于改善血糖控制,尤其是对糖尿病患者而言,并且还被发现有助于减轻体重。
菊苣根可以整个煮熟后与食物一起食用,也可以作为热饮冲泡,或者作为补充剂。
牛蒡根
通常作为茶饮用,具有广泛的益处,包括治疗癌症、糖尿病和炎症。其他好处包括帮助降低血糖水平和治疗糖尿病治疗和预防感染。
牛蒡可以作为茶服用,也可以作为补充剂的粉末服用。
亚麻籽
亚麻籽具有多种相关的健康益处。除了高纤维含量外,亚麻籽还富含蛋白质、omega-3 脂肪酸,以及一些维生素和矿物质的丰富来源。
一汤匙亚麻籽含有 3 克纤维,占每日推荐摄入量的 10%。亚麻籽有助于促进肠道中有益细菌菌株的生长,有助于降低血糖水平和治疗糖尿病、治疗和预防感染。
雪莲果根
雪莲果根的外观与甘薯相似,富含果糖(FOS),使其具有甜味。
豆薯根
豆薯根是一种可食用的根茎类蔬菜,原产于墨西哥,通常被称为墨西哥萝卜,由大约 5% 的膳食纤维组成。
海藻
海藻含有大量的生物活性化合物,如多糖和酚类物质,长期以来因其对健康的益处以及作为益生元的价值而得到认可。
海藻中发现的许多化合物对小肠的消化有抵抗力,但会刺激有益肠道细菌的生长及其发酵成短链脂肪酸。
土豆
土豆(以及土豆泥、薯条和炸薯条等土豆产品),一听就觉得是容易长胖的食物。确实,煮沸或油炸时,很容易在小肠中消化成葡萄糖。
然而,当土豆煮熟然后完全冷却至室温时,或者更好的是放在冰箱里,就会形成抗性淀粉。抗性淀粉属于膳食纤维的一种,抗性淀粉不被消化,进入结肠,作为菌群的营养源,菌群通过发酵,将碳水化合物代谢后生成丁酸等短链脂肪酸,促进肠道健康。
苹果
苹果含有丰富的纤维、维生素C、抗氧化剂和钾,具有显着的健康益处。它含有果胶,一种可溶性纤维,具有益生元作用并促进健康的肠道菌群。果胶会增加丁酸盐(短链脂肪酸),可以滋养有益的肠道细菌并减少有害细菌的数量。
其他协助益生菌的方式
▸ 适当锻炼
干预研究支持锻炼对肠道微生物群的有益影响。纵向研究表明,经常中等强度的耐力运动对肠道微生物产生最有益的影响,但是不同类型的运动训练方案(例如,阻力、间歇、伸展/柔韧性、耐力/有氧等)对肠道微生物群的影响存在差异。其他如训练状态,共享训练环境,自愿性,健康或疾病状况,年龄,性别等因素也是评估运动和肠道菌群的混杂因素。
关于运动锻炼对菌群的影响,详见:运动如何影响肠道微生物群,如何正确运动
▸ 足够睡眠
某些菌群会在睡觉时会大量繁殖,这些菌群在白天不会很好地繁殖。
如果你缩短睡眠时间,这些菌群可能会受到影响,没有机会增殖,从而影响肠道菌群的整体平衡。保持足够的睡眠对于健康的身体、肠道极为重要。
需要多少睡眠时间取决于年龄,并且因人而异。大多数成年人每晚至少需要七个或七个以上的睡眠时间。
新生儿(0到3个月):睡眠14到17个小时
婴儿(4至11个月):睡眠12至15小时
幼儿(1至2岁):睡眠11至14小时
学龄前儿童(3至5岁):睡眠10至13小时
学龄儿童(6至13岁):睡眠9至11小时
青少年(14至17岁):睡眠8至10小时
年轻人(18至25岁):睡眠7至9小时
成人(26至64岁):睡眠7至9小时
老年人(65岁或以上):睡眠7至8小时
当然以上只是参考,并不是所有人必须达到的标准,少数人的需要的睡眠时间本来就不多,且没有睡眠困扰或不适症状,则无需参考以上标准。
关于睡眠与肠道菌群详见:
肠道菌群与睡眠:双向调节
深度解析|睡眠健康与肠道健康之间的双向联系
有人说,益生菌在体内不能定植,很快就会被排出体外了…… 益生菌究竟能不能定植?


可以定植,但不容易。
首先,我们来看口服的益生菌在体内经历了什么?
▸口腔——唾液对益生菌的影响微乎其微
益生菌首先会接触到口腔中的唾液。唾液是一种透明且微酸性的黏液性外分泌物,由保护牙齿和黏膜表面的免疫和非免疫成分组成。
对多种乳酸杆菌、小球菌和双歧杆菌菌株进行的体外研究表明,与对照组相比,接触唾液时细胞计数没有显著损失。
▸胃——胃酸对大多数细菌都是极其致命的
通过食道后,益生菌到达胃部,转运需要5分钟到2小时,长时间暴露在酸性胃液中,对益生菌来说是一个巨大的挑战。
尤其是对不耐酸的细菌,会导致细菌细胞质pH降低。
氢离子(H+)的涌入导致糖酵解酶活性下降,进而影响F1F0 – ATP酶质子泵。低pH条件下F1F0 – ATP酶质子泵活性的降低,因此益生菌存活难。
胃中存在的其他不利条件:
包括离子强度、酶活性(胃蛋白酶)和机械搅拌对益生菌的生存能力有影响。例如,长双歧杆菌和短双歧杆菌的活细胞在模拟胃液中1小时内消失。


▸小肠——胆汁酸和消化酶影响益生菌生存
益生菌通过幽门到达小肠,那里有大量胰液和胆汁。在肠液的中和作用下,小肠内的pH约为6.0-7.0,比胃液温和得多。
然而,胆汁酸和消化酶(包括脂肪酶、蛋白酶和淀粉酶)也可以影响益生菌的生存能力,通过细胞膜破坏和DNA损伤等方式。
体外研究表明,在模拟肠液中唾液乳杆菌Lactobacillus salivarius Li01、Pediococcus pentosaceus Li05 的生存能力降低。
为了增强益生菌对胃液和胆汁的耐受性,可以将益生菌包裹在一层保护性外壳上,也就是前面说的微胶囊。近年来,微囊化技术在提高存活率和保证足够数量的活菌到达结肠方面取得了很大进展。
经历以上重重考验,益生菌的定植之路看起来并不容易。

而以上这些只是其中一部分原因。
等益生菌到了结肠之后,有更多的考验等着它。
共生菌的定植抗性,给益生菌的定植带来不利影响
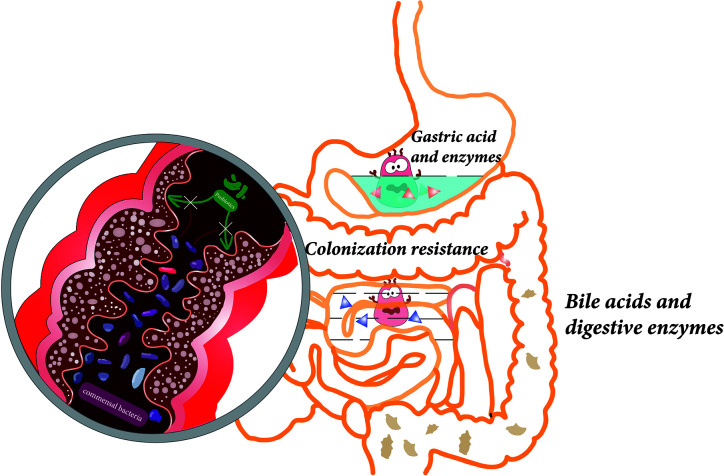
doi.org/10.3389/fcimb.2021.609722
由于定植抗性,大多数益生菌在口服后和消耗停止后不久随粪便排出结肠。
那么,什么是定植抗性?
通俗地说,在人类的菌群中,一个新的物种想要入侵并定居下来,也就是定植。但是本身存在的菌群会用各种方式,拒绝新的物种一起生活,就是所谓的“定植抗性”。
对于病原体而言,常驻微生物群的这种定植抗性,可以使其更难生长和繁殖,从而预防疾病的发生。
举个例子:
鼻腔微生物群的存在,可以保护人体免受呼吸道金黄色葡萄球菌感染,金黄色葡萄球菌想要入侵得过鼻腔微生物群这一关…
换句话说,益生菌如果想要定植,必须与宿主菌群竞争养分和粘附部位,争到了资源,活下来,才能繁衍后代。
具体的争抢资源的方式是什么?
包括以下各种方式:改变资源可用性、占领生态位、捕食、竞争等。
我们大致分成两种机制:直接和间接。
指严格通过与肠道菌群相关的因素,来限制外源微生物定植,独立于与宿主的任何相互作用。
这就涉及到菌群之间的相互作用。
一般这样的相互作用分为两种情况:
互利共生和竞争关系。
以拟杆菌为例。
▸ 互利共生(定植成功):
不同的拟杆菌种之间存在广泛的互利共生作用,也就说,拟杆菌群在肠道中团结友爱,稳定存在。
比如说,一些拟杆菌能够分解某种多糖,并释放出小分子物质,从而促进不能利用该多糖的拟杆菌生长。更有甚者,这种交互共生关系有时是以过量消耗某一种拟杆菌能量的前提下实现的。
延伸到其他菌群,可能会出现的情况:
里应外合:
准备入侵的菌与本地菌群偶然相互作用,促进定植;
抱团取暖:
两个非本地菌群之间的良好相互作用,可以使定植更加成功。
▸ 竞争关系(一争高下):
非病原菌与细菌竞争肠道上皮细胞刷状缘的结合位点,阻止病原菌的黏附、侵袭;
细菌竞争性利用营养素,消耗掉维持各自种群的生长原料。
有些菌群不直接和新来的菌群产生竞争,而是可以通过改变环境(改变pH值,胆汁酸浓度等)或释放抑制因子(如,代谢产物、细菌素等),从而决定另一个物种是否能成功定植。
结合肽聚糖抑制其他菌生长:
例如,拟杆菌的结构分子及代谢产物,能通过激活一系列的免疫细胞而参与宿主肠道免疫。
拟杆菌还能够更大量地刺激肠上皮细胞分泌RegIIIγ,它能够强力结合大部分革兰氏阳性菌表面的肽聚糖,抑制脂磷壁酸的合成从而抑制细菌的生长。
环境的改变如何影响其他菌群?
更高的营养浓度会导致微生物之间更多的负面相互作用
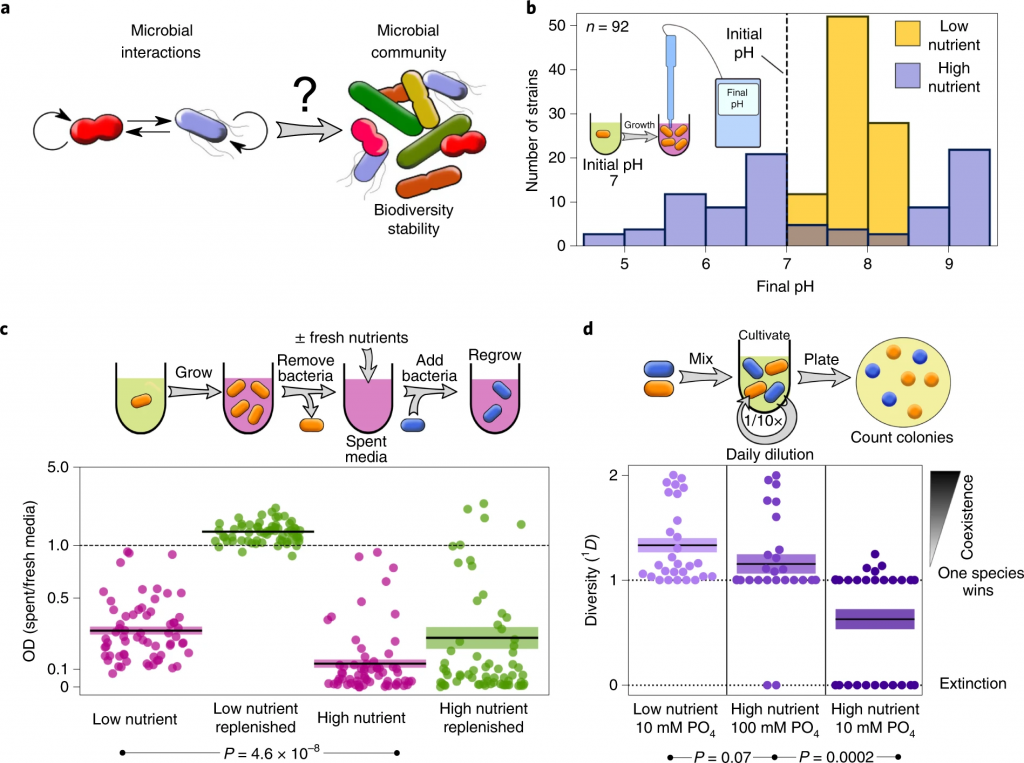

Ratzke C, et al., Nat Ecol Evol. 2020
在较高的营养浓度下,细菌会更强烈地改变环境pH值。
在较高的营养浓度下,细菌会产生更具生长抑制性的环境。
参考上图c,直接(紫色)或补充资源(绿色)后使用不同细菌的废培养基重新培养细菌。每个相互作用对的相对增长显示为散点图。
高营养浓度会减少相互作用对之间的共存。
低营养成分包括0.1%酵母抽提物和0.1%大豆酮。高营养的培养基与添加1%葡萄糖和0.8%尿素的培养基相同。所有28种共培养结果均显示为一个群体图。
微生物获得的营养浓度越高,它们生长的越多,它们代谢的底物就越多,因此它们可以改变环境的能力越强。
再看常见的益生菌,例如,乳酸杆菌和双歧杆菌:
乳酸杆菌和双歧杆菌在碳水化合物发酵过程中产生乙酸盐和乳酸,有机酸可以通过交叉喂养相互作用被其他细菌转化为丁酸盐。这些产生的有机酸降低了腔内的 pH 值,抑制了病原体的生长并增加了矿物质的吸收。
注:丁酸盐和其他短链脂肪酸对肠道健康至关重要,但也可能进入体循环并直接影响新陈代谢或外周组织的功能。短链脂肪酸在脂肪组织、骨骼肌中发挥重要作用和肝脏底物代谢和功能,有助于改善葡萄糖稳态和胰岛素敏感性。
以上,我们了解菌群之间相互作用机制。
可见菌群的定植并不容易,它们要面临的,可能是同伴的帮助,也可能是其他菌群的竞争或杀戮,又或者是受到环境的考验。
在经历此番折腾后,益生菌如果能顺利定植,它会在哪里,如何定植?
胃肠道的成功定植,是益生菌能够发挥足够的作用,是赋予健康益处的关键。粘膜粘附是益生菌定植的重要步骤。
在本小节中,我们将讨论肠道粘液层的组成和与益生菌粘附相关的特定蛋白质。
什么是肠粘膜和粘液层?
肠粘膜由上皮层、固有层和肌层组成。小肠绒毛由上皮细胞和伸入肠腔的固有层组成,覆盖在黏膜表面,负责肠内营养物质的吸收。
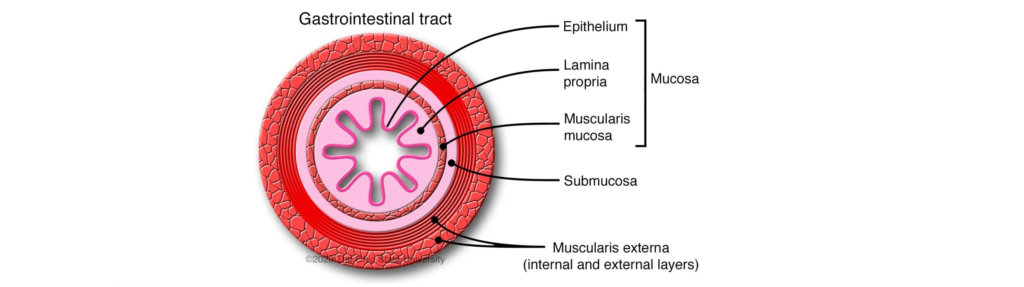
上皮细胞由吸收细胞、杯状细胞和内分泌细胞组成。杯状细胞分散在吸收细胞之间,分泌覆盖整个小肠腔的粘液,由碳水化合物、脂类、盐、蛋白质、细菌和细胞碎片组成。
粘液厚度约为 30 ~ 300 μm;从肠道到直肠的厚度都在增加。主要的蛋白质是粘蛋白,它聚合形成一个连续的凝胶基质,为粘膜层提供结构基础,保护肠道免受病原体、酶、毒素、脱水和磨损。
同时,肠道粘液中含有维生素、矿物质等外源性营养物质,为定植于肠道粘液中的细菌提供了巨大的生态生长优势。可以说,粘液是益生菌和病原体的绝佳生态位。
细菌粘附粘膜的过程包括可逆阶段和稳定阶段。
可逆阶段(初相识)
最初,益生菌通过非特异性的物理接触(包括空间和疏水识别)与粘膜结合,建立可逆的、弱的物理结合。
稳定阶段(如胶似漆)
随后,随着粘附素(通常是固定在细胞表面的蛋白)和互补受体之间的特异性相互作用,益生菌与粘液或肠上皮细胞(IECs)建立了稳定的结合,从而成功定植胃肠道。
益生菌可以编码大量的细胞表面因子,这些因子参与粘液蛋白或上皮细胞的粘附。
除蛋白质外,益生菌中还存在非蛋白分子,如磷壁酸和胞外多糖,它们可以与宿主细胞相互作用,影响粘附。
从目前的研究可以推断,没有固定的分子可以适用于所有菌株的益生菌。
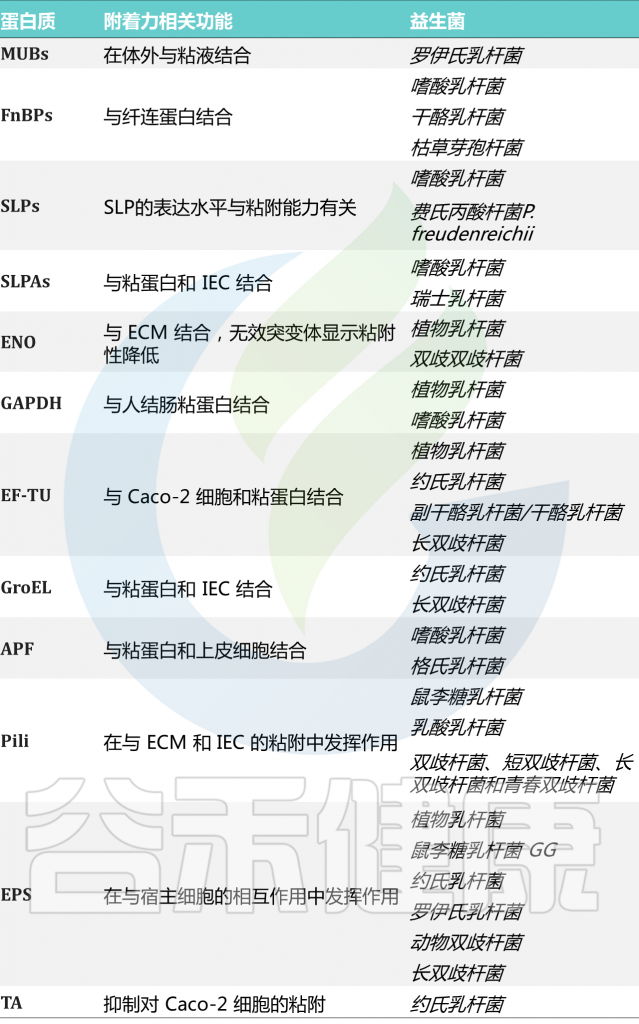
许多粘附素似乎是种或株依赖性的。这些与粘附相关的益生菌表面分子和粘附相关的机制将在下面详细讨论(下表)。
表 益生菌中的粘附相关分子

doi.org/10.3389/fcimb.2021.609722
粘液层的组成和与益生菌表面蛋白的结合
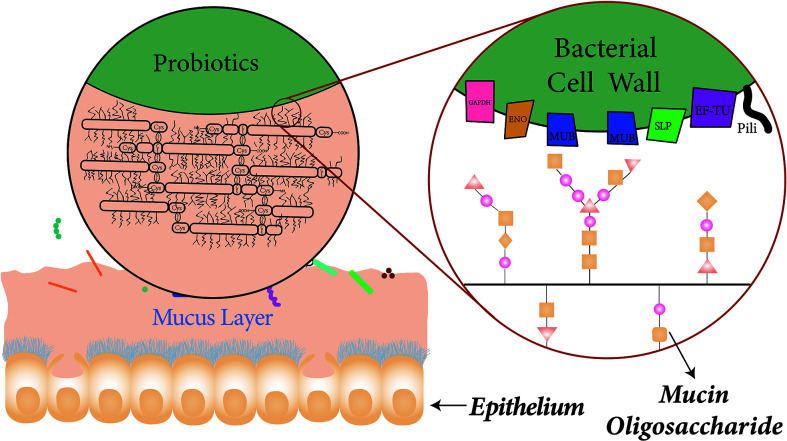
doi.org/10.3389/fcimb.2021.609722
杯状细胞分散在吸收细胞之间,吸收细胞可以分泌覆盖整个小肠的粘液。粘液主要由富含半胱氨酸的粘蛋白组成。粘液蛋白之间广泛的二硫键形成黏液特有的粘弹性。
益生菌表面的特异蛋白在益生菌粘附粘液中起着重要作用。例如,粘液结合蛋白可以通过与粘液蛋白的糖基修饰相互作用而与粘液层结合。
一旦粘附在肠道,益生菌通过将碳水化合物、蛋白质和其他次要化合物转化为能杀死病原菌的重要物质,如有机酸、酶、过氧化氢、细菌素和低分子量肽,可以产生细胞外抗菌成分。
以上是益生菌的定植给人体带来益处,当然这也不一定会发生在每个人身上。
益生菌定植的效果因人而异。
看一项有趣的研究,志愿者被分为两组,“允许型”和“抵抗型”。在允许组的人的肠道粘膜中益生菌菌株显著增加,而在抵抗组的人的肠道中没有检测到益生菌。
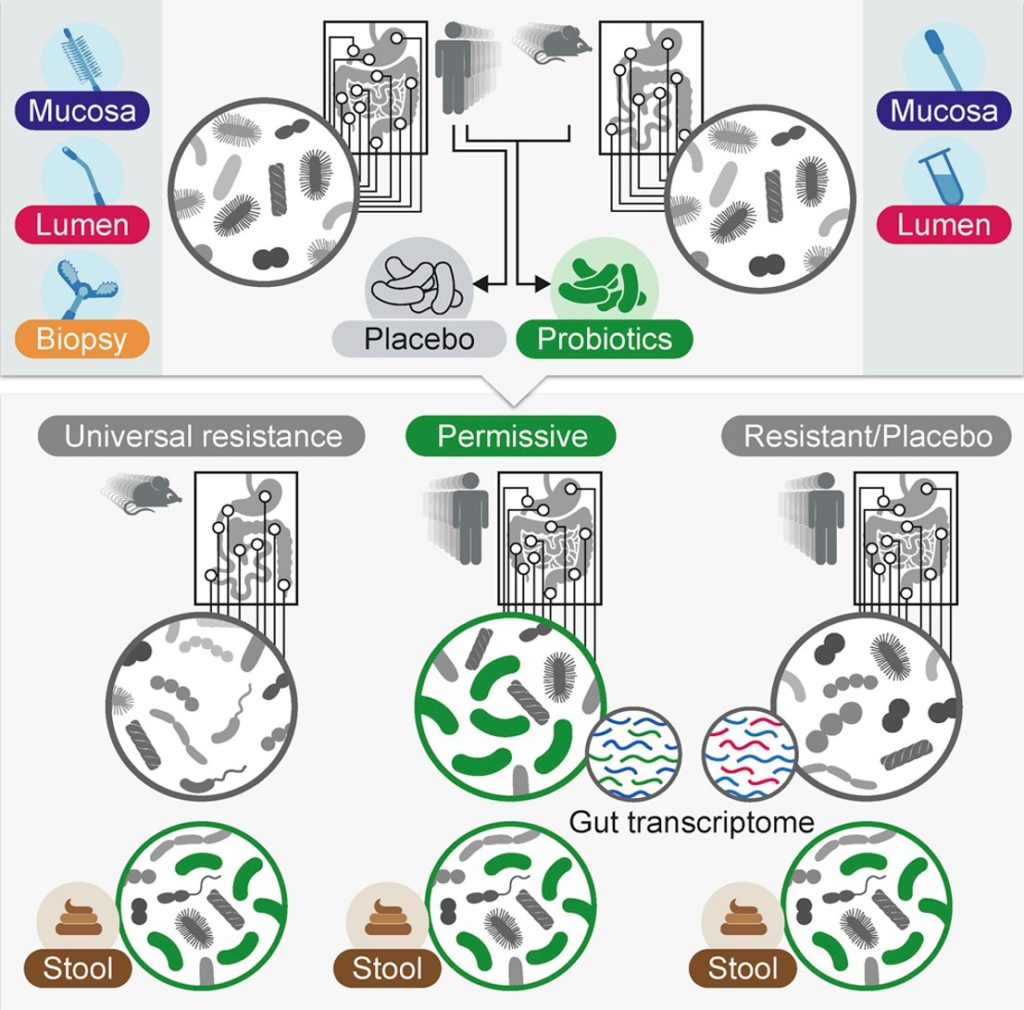
doi.org/10.1016/j.cell.2018.08.041
同样是补充益生菌,有些人身上可以看到非常明显的效果,而有些人的效果则不明显,这是为什么呢?
菌群都具有高度个体特异性,也就是人和人之间的菌群相差较大。
常驻微生物群对人类健康很重要,因为它们占据了可能被病原微生物占据的生态位。
就婴儿而言,影响初始菌群定植的因素包括:胎龄(足月or早产)、分娩方式(自然分娩or剖腹产)、喂养方式(母乳or配方奶)、药物使用(抗菌药物)、生长环境(城市or农村)等。
就成年人而言,年龄、饮食、生活方式、疾病状况、药物使用、环境等多因素都会影响肠道菌群多样性,这在前面的文章《菌群多样性是如何形成的,与健康的关系,如何改善?》已经详细阐述。
这些所有叠加后会形成一个具有高度特异性的个体菌群,构成的整体菌群环境会影响到其他新的菌群的定植。
那么,益生菌在什么样的菌群中更容易定植?
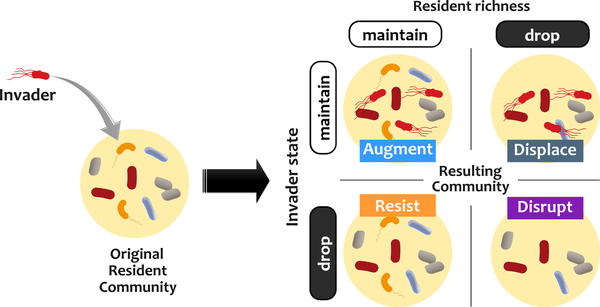
再来看一项研究,为了评估定植抗性,该研究建立了一种电子入侵分析方法,在该方法中,稳定的菌群受到不同种群规模的入侵者的挑战。
doi.org/10.1371/journal.pcbi.1008643(下同)
根据入侵者和常驻菌群的命运对结果进行分类。
有四种可能的结果:
增加入侵者的数量不会增加入侵者定植的概率。
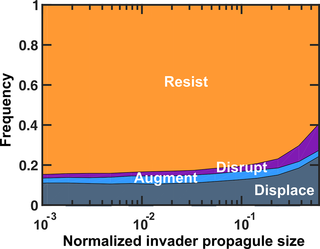
类比到益生菌,高剂量的益生菌可能并不会因此带来明显的定植效果。
基础增长率较高的入侵者更有可能取代常驻菌群,这可能是竞争潜力的主要指标。
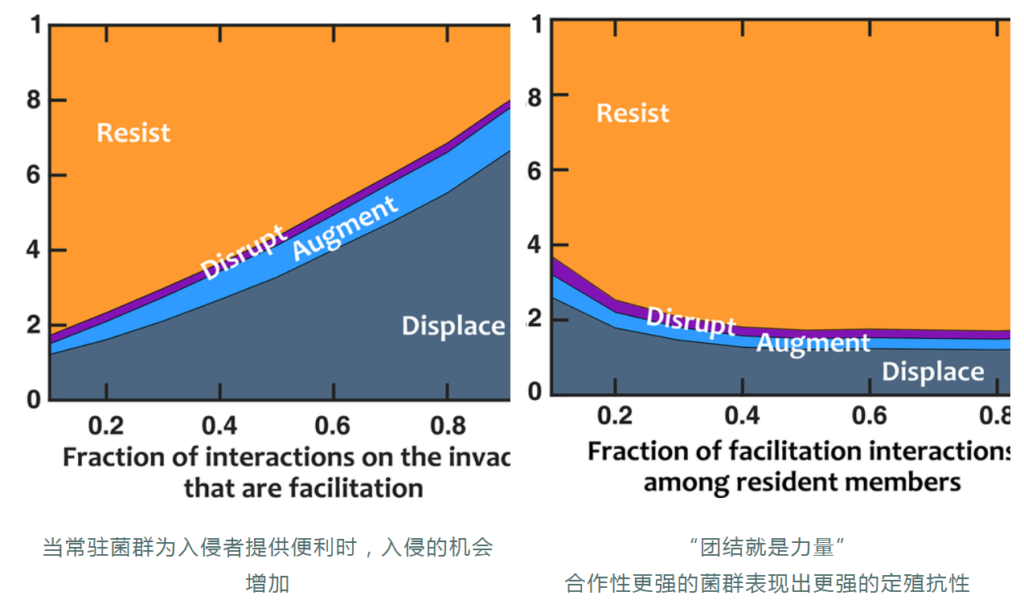

如果常驻菌群创造的化学环境有利于入侵者,入侵者会更成功。
这就说明,常驻菌群本身的结构特征也比较重要。益生菌带来的健康益处可能不仅是由单独补充的益生菌菌株引起的,而是与常驻肠道微生物群相互作用的结果。
研究人员在宏基因组和宏转录组学研究中表明,在 12 名健康老年人中食用鼠李糖乳杆菌GG益生菌菌株改变了常驻菌群的活性,而不会影响肠道微生物群组成本身。
益生菌虽然没有在菌群构成上带来改变,但是菌群的表达特征发生较大变化。尤其是益生菌服用后会大大促进双歧杆菌和主要丁酸产生菌:Roseburia和Eubacterium的鞭毛、运动,趋化性和粘附相关基因的表达。表明其能促进这些关键菌主动渗透进入肠粘膜的能力,提高宿主对于丁酸盐的利用度。
那么对于部分人群,益生菌不能有效定植,是否意味着益生菌无效?
有时候,益生菌并不是完全依靠在肠道的定植来产生影响。就算不能定植,它也有其他很多种方式来发挥优势。
益生菌:有助于维持宿主体内的动态平衡和防治疾病
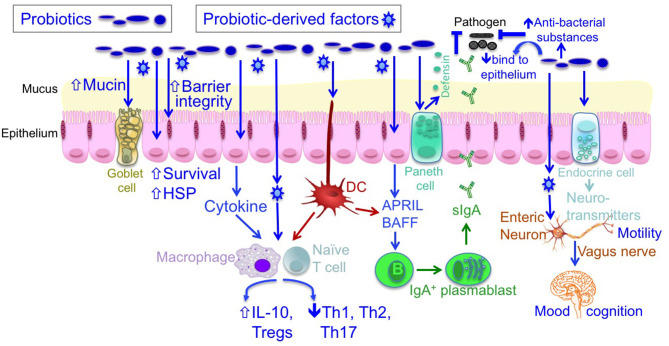
Yan F, Polk DB. Front Immunol. 2020
(1)通过产生抗菌物质和与病原体竞争结合上皮细胞来阻断致病细菌的作用
(2)通过增加屏障功能、粘液生成、存活和细胞保护反应来促进肠上皮细胞的稳态
(3)通过增加先天免疫,如IgA和防御素的产生,上调抗炎细胞因子的产生,抑制促炎细胞因子的产生,确定必要和过度防御免疫之间的平衡
(4)通过产生神经递质和迷走神经调节肠脑轴
益生菌衍生因子:有助于增强肠道屏障功能和刺激抗炎免疫反应
益生菌源因子对宿主反应的调控。一些益生菌衍生因子,包括产物和代谢物,对宿主发挥促进健康的作用。
益生菌的这些功能因子有助于增强肠道屏障功能,刺激抗炎免疫反应,从而改善肠道炎症紊乱。

Yan F, Polk DB. Front Immunol. 2020
益生菌混合物:减少成人肠道致病性或耐药性肠杆菌定植
益生菌补充剂可以减少肠道中潜在的耐药性或致病性肠杆菌,但有时候不能完全根除。
“如果益生菌单打独斗的力量不够,是不是可以寻求其他外援?”
比如多联益生菌,或者益生菌-益生元联合使用等方式。
多联益生菌减少肠杆菌:
为了根除潜在的肠杆菌,益生菌混合物(Bactiol duo ®:S. boulardii、L. acidophilus NCFM、L. paracasei Lpc-37、B. lactis Bl-04、B. lactis Bi-07 )的临床试验表明 ,在阿莫西林-克拉维酸治疗后,产 AmpC肠杆菌的定植会暂时增加,而在益生菌干预后会下降。
嗜酸乳杆菌CL1285、干酪乳杆菌LBC80R 和鼠李糖乳杆菌CLR2 (Bio-K+ ® )的混合物在预防成人抗生素相关性腹泻和初级预防艰难梭菌感染方面也表现出显着效果。
益生菌-益生元联合使用减少肠杆菌:
60名健康绝经前日本女性连续摄入发酵豆奶(含异黄酮)和干酪乳杆菌Shirota,能够降低肠道杆菌的粪便水平,并提高异黄酮的生物利用度。
当然以上只是小规模研究,还需进一步研究。
在人类中,一些临床干预可能会促进肠杆菌的肠道携带。益生菌可能有助于根除肠道携带的致病性或耐药性肠杆菌。
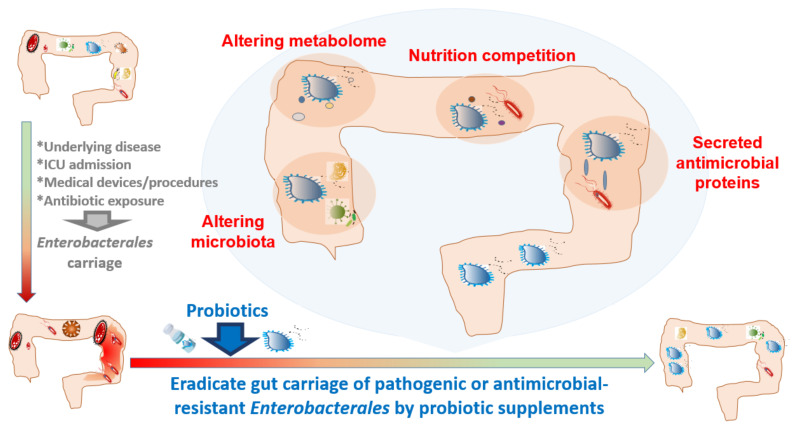
doi:10.3390/antibiotics10091086
综上,益生菌不能定植并不能说就是无效的,它有各种方式来影响人体健康。
“
广谱益生菌无论是否定植,在一定程度上都可以为我们的健康带来益处。当然每个人的菌群特征各不相同,结合肠道菌群检测结果,根据自身菌群特征,选择适合自己的益生菌,可以更加快速有效地帮助建立或恢复健康的菌群。
在服用益生菌的同时,如果能注意上述合理的饮食、健康的生活方式等,相当于开启了外挂,对于快速恢复菌群具有重要意义。主要参考文献:
Yan F, Polk DB. Probiotics and Probiotic-Derived Functional Factors-Mechanistic Insights Into Applications for Intestinal Homeostasis. Front Immunol. 2020;11:1428. Published 2020 Jul 3. doi:10.3389/fimmu.2020.01428
Hung, Yuan-Pin et al. “The Potential of Probiotics to Eradicate Gut Carriage of Pathogenic or Antimicrobial-Resistant Enterobacterales.” Antibiotics (Basel, Switzerland) vol. 10,9 1086. 8 Sep. 2021, doi:10.3390/antibiotics10091086
Wieërs G, Belkhir L, Enaud R, et al. How Probiotics Affect the Microbiota. Front Cell Infect Microbiol. 2020;9:454. Published 2020 Jan 15. doi:10.3389/fcimb.2019.00454
Pickard, Joseph M et al. “Gut microbiota: Role in pathogen colonization, immune responses, and inflammatory disease.” Immunological reviews vol. 279,1 (2017): 70-89. doi:10.1111/imr.12567
Zmora N, Zilberman-Schapira G, Suez J, Mor U, Dori-Bachash M, Bashiardes S, Kotler E, Zur M, Regev-Lehavi D, Brik RB, Federici S, Cohen Y, Linevsky R, Rothschild D, Moor AE, Ben-Moshe S, Harmelin A, Itzkovitz S, Maharshak N, Shibolet O, Shapiro H, Pevsner-Fischer M, Sharon I, Halpern Z, Segal E, Elinav E. Personalized Gut Mucosal Colonization Resistance to Empiric Probiotics Is Associated with Unique Host and Microbiome Features. Cell. 2018 Sep 6;174(6):1388-1405.e21. doi: 10.1016/j.cell.2018.08.041. PMID: 30193112.
Han S, Lu Y, Xie J, Fei Y, Zheng G, Wang Z, Liu J, Lv L, Ling Z, Berglund B, Yao M, Li L. Probiotic Gastrointestinal Transit and Colonization After Oral Administration: A Long Journey. Front Cell Infect Microbiol. 2021 Mar 10;11:609722. doi: 10.3389/fcimb.2021.609722. PMID: 33791234; PMCID: PMC8006270.
de Melo Pereira GV, de Oliveira Coelho B, Magalhães Júnior AI, Thomaz-Soccol V, Soccol CR. How to select a probiotic? A review and update of methods and criteria. Biotechnol Adv. 2018 Dec;36(8):2060-2076. doi: 10.1016/j.biotechadv.2018.09.003. Epub 2018 Sep 26. PMID: 30266342.
Eloe-Fadrosh, Emiley A et al. “Functional dynamics of the gut microbiome in elderly people during probiotic consumption.” mBio vol. 6,2 e00231-15. 14 Apr. 2015, doi:10.1128/mBio.00231-15

谷禾健康

毛螺菌属(Lachnospira),属于厚壁菌门,毛螺菌科(Lachnospiraceae),该菌属存在于大多数健康人的肠道里,可能是一种潜在的有益菌,参与多种碳水化合物的代谢,尤其水果蔬菜中的果胶(一种复杂的膳食纤维和益生元)的能力很强,发酵导致乙酸和丁酸的产生为宿主提供能量的主要来源。
图片来源:microbiomology
毛螺菌科(Lachnospiraceae)目前在NCBI中被描述为包括 58 个属和几个未分类的菌。毛螺菌属(Lachnospira)是毛螺菌科的一个重要组成成员。
认识毛螺菌属之间先了解下毛螺菌科。
人类结肠微生物群可以处理多种底物,包括蛋白质、寡肽、膳食多糖、内源性粘蛋白和逃避宿主消化的糖蛋白 。肠道菌群对碳水化合物的代谢是向宿主提供营养和能量的关键过程。
在厚壁菌门中,毛螺菌科、乳杆菌科和瘤胃球菌科水解淀粉和其他糖以产生丁酸盐和其他短链脂肪酸。
毛螺菌科(Lachnospiraceae)的基因组分析揭示了其组内成员利用饮食衍生的多糖(包括淀粉、菊粉和阿拉伯木聚糖)的相当大的能力,但是在菌种和菌株之间存在很大差异。
毛螺菌科是一个系统发育和形态异质的分类群,属于厚壁菌门的梭菌簇 XIVa,毛螺菌科的所有成员都是厌氧的、发酵的和化学有机营养的,并且一些表现出强水解活性,例如通过果胶甲酯酶、果胶酸裂合酶、木聚糖酶、α-L-阿拉伯呋喃糖苷酶、β-木糖苷酶α-和β-半乳糖苷酶的活性、α-和β-葡萄糖苷酶、N-乙酰-β-氨基葡萄糖苷酶或α-淀粉酶。
毛螺菌科存在于早期婴儿中,甚至在胎粪中也有发现。然而,毛螺菌科丰度的增加与衰老有关。毛螺菌科的丰度在患有不同疾病的受试者的肠腔中也增加了,尽管该科的分类群一再显示出它们为宿主产生有益代谢物的能力。
★ 形态和代谢
Lachnospira细胞形态呈直的或略微弯曲的棒状细胞,有的可能呈螺旋状。单细胞尺寸为 0.35–0.6×2.0–4.0 µm,DNA G + C 含量( mol %):38–45。细胞成对出现,有时呈长链状。细胞具有革兰氏阳性超微结构,严格厌氧。
在 30–45 °C 下生长,在含有瘤胃液或酵母提取物、无机盐、果胶或聚半乳糖醛酸的厌氧培养基中生长。
化能有机营养,发酵代谢;发酵果胶、聚半乳糖醛酸、果糖和纤维二糖等。乙酸盐、甲酸盐、乙醇和 CO2是聚半乳糖醛酸和果胶发酵的主要最终产物。也可能产生少量的H2 。果胶发酵时也会产生甲醇,不产生琥珀酸盐、丁酸盐和丙酸盐。
不产生吲哚、过氧化氢酶或 H2S,不还原硝酸盐。不水解明胶或淀粉。主要存在于哺乳动物肠道,从牛瘤胃内容物和猪粪便和盲肠内容物中分离。
在肠道中,抗性淀粉和低聚半乳糖可以通过结合胆盐直接降低胆汁酸的浓度。Lachnospira等产生丁酸盐细菌的增加都间接导致胆汁盐浓度降低。
★ 分类和物种
Lachnospira(毛螺菌属)主要有以下结果物种:
Lachnospira rogosae
Lachnospira eligens
Lachnospira multipara
Lachnospira multiparis
Lachnospira pectinoschiza
模式种是多对毛螺菌(Lachnospira multiparus)。
以前的16S 的测试,可能会错误地将Lachnospira rogosae识别为乳酸杆菌。后来纠正这一错误并更新了数据库,重新正确重命名为Lachnospira rogosae。
Lachnospira pectinoschiza 是从猪的结肠内容物中分离的能分解果胶的菌。但是该菌物种无法从羊的瘤胃内容物中分离出来,即使这些动物被喂食高果胶饮食。实验中果胶、聚半乳糖醛酸和葡萄糖酸盐是支持该菌快速生长的唯一底物。
不同的是,Lachnospira multiparus 是瘤胃内主要的果胶分解菌。它的碳水化合物代谢在实验室发酵罐的生长实验中进行的研究。
★ 哪些因素影响毛螺菌属
增加
食用富含纤维的植物性饮食与Roseburia、Lachnospira和Prevotella属的丰度增加以及短链脂肪酸产量增加相关。
用全谷物代替六周的饮食习惯精制谷物增加了 Lachnospira和Roseburia,减少了肠杆菌科的成员,总体上产生了更有利的微生物景观。
全谷物:是指完整、碾碎、破碎或压片的谷物,其基本组成包括淀粉质胚乳、胚芽与皮层,各组成部分的相对比例与完整颖果一样。
全谷物不仅含有丰富的B族维生素、镁、铁和膳食纤维,还含有多酚、维生素E、单宁、类胡萝卜素、植酸、木质素和木脂素等常见抗氧化成分,而且还含有一些果蔬食品中少见但具有很高营养价值的抗氧化成分,如γ-谷维素、烷基间苯二酚、燕麦蒽酰胺等。比如:全燕麦,荞麦,黑米,小米,全麦等。
果胶是一种水果蔬菜中发现的复杂的膳食纤维和益生元。研究表明水果中纤维的消耗与健康成人肠道中大量的果胶分解细菌属Lachnospira 密切相关。果胶摄入增加梭菌属簇 XIV(Lachnospira、Dorea和Clostridium),其中Lachnospira的增幅最大。
最近的一项研究发现Lachnospira与 β-胡萝卜素、维生素 E 和植物脂肪的摄入量呈正相关,而与肉类、总蛋白和胆固醇的摄入量呈负相关 。
洋车前子是一种广泛用于治疗便秘的药物。它将水分困在肠道中,增加粪便中的水分,缓解排便并改变结肠环境。研究显示洋车前子处理可以增加Lachnospira,Roseburia 和 Faecalibacterium.
茶多糖维持了肠道微生物群的多样性,恢复了一些因糖尿病而减少的细菌属(毛螺菌属、罗斯氏菌和Fluviicola)的相对丰度。
茶多糖主要由葡萄糖、阿拉伯糖、木糖、岩藻糖、核糖、半乳糖等组成。
葡萄不仅含有各种植物化学物质,如儿茶素,原花青素,花青素,亮氨酸花青素,槲皮素,山奈酚,二苯乙烯,鞣花酸和羟基肉桂酸酯,而且也是膳食纤维的良好来源。与基线相比,4周的葡萄粉摄入量显着增加三个属Akkermansia,Flavonifractor和毛螺菌属的相对丰度。
减少
将117名超重成年人随机均分为食用4次/周炸肉组和不食用炸肉组,干预4周,发现食用炸肉组的菌群多样性降低,Lachnospira和Flavonifractor丰度降低,Dialister、Dorea、韦荣球菌属丰度增加。
越来越多的证据表明,众所周知的致癌驱动因素吸烟会影响肠道微生物组。一项研究针对 803 名成年人子集的吸烟和肠道微生物组使用16s测序进行了分析。
发现以前和现在吸烟者的粪便微生物组的整体组成与从不吸烟者有显着差异。相对于从不吸烟者而言, Lachnospira 和Tenericutes菌则被耗尽。这些变化在种族和族裔亚群中是一致的,表明吸烟会导致Lachnospira消失或减少。
★ 与其他菌的相互作用(仅供参考)


睡眠(夜猫子)
海法大学和以色列理工学院的合作研究项目发现,“早起的人”和“夜猫子”的肠道微生物组(寄居在消化道的细菌群)彼此不同。该研究将人们分为三种不同的‘时型’:
“云雀”——早起的晨型人,在早晨活力最好;
“猫头鹰”——晚睡的夜猫子,在早晨运作困难;
“中间群体”——大部分人属于这种。
研究结果指出了“云雀”和“猫头鹰”的微生物组之间的差异;在“云雀”中,细菌属Alistipes 的百分比更高,而在“猫头鹰”中,属于Lachnospira属的细菌更高,该细菌为产生丁酸盐的细菌,是一种短链脂肪酸,是睡眠和觉醒相关信号的来源。
其他研究也陆续发现包括毛螺菌属Lachnospira、棒状杆菌属Corynebacterium 和 布劳特氏菌属Blautia 在内的几种微生物与睡眠质量呈负相关。
调节肠道菌群是改善睡眠的可行路径之一,好好睡觉也可以帮助我们维护肠道微生态健康,好眠养好菌,好菌助好眠。
肝病
非酒精性肝脂肪变性疾病中毛螺菌属的丰度相对对照较高,同样在非酒精性脂肪肝中也发现毛螺菌属的富集。
哮喘
哮喘是一种气道慢性疾病,尤其对于儿童。生命早期的特定细菌属与 1 岁儿童的特应性和喘息有关。越来越多的证据表明,其中一个原因可能是儿童在生命早期获得的健康微生物受到破坏。
加拿大健康婴儿纵向发育 (CHILD) 研究中发现,在生命的前 3 个月内,毛螺菌相对丰度的的下降与学龄前哮喘有关,并且 Lachnospira/Clostridium 比率可作为预测哮喘发展的潜在生命早期生物标志物。
《Science Translational Medicine》上刊登了加拿大温哥华的不列颠哥伦比亚大学(UBC)Brett Finlay 等科学家的文章,他们采集了300多个婴儿在3个月和1岁时的便便和尿液样本,结果显示,粪便样品中缺乏四种细菌(Lachnospira,Veillonella,Faecalibacterium,Rothia)的3个月的婴儿,后来在1岁时都显示出了早期哮喘的症状(喘息和皮肤过敏)。
而那些在1岁时没有这些症状的孩子,无一例外在其3个月的粪便样本中含有大量的这四种微生物。检测这些肠道微生物即可预测这些孩子日后患哮喘的风险,通过控制这些肠道细菌的组成还有可能找到预防儿童哮喘的方法。
抑郁症
研究发现,Lachnospira、Roseburia和Faecalibacterium与抑郁症状的严重程度呈负相关。
自闭症
南医大刘星吟团队揭示在属水平上,Lachnospira 和Megamonas 在对照组内的2-3岁和7-11岁亚组中丰度较高,而自闭症组不存在此趋势。
阿尔兹海默症
与健康对照组相比,阿尔茨海默病 (AD) 患者的肠道微生物组发生了改变。然而,以前的研究经常评估一直在服用药物或其他疾病干预措施的 AD 患者。此外,在一项研究中同时测定轻度认知障碍 (MCI) 或 AD 患者的肠道微生物组是罕见的。
与健康对照组相比,阿尔茨海默病患者的拟杆菌属、毛螺菌属和瘤胃梭菌减少,普氏菌属水平增加。而轻度认知障碍患者中这些属的变化方向与AD患者相同。然而,Lachnospira是唯一一个在轻度认知障碍患者中的丰度在统计学上显着低于健康对照组的属,表明该菌属的关键作用。
慢性肾病
研究表明,与健康人群相比,慢性肾脏病人群的肠道菌群组成不同,Lachnospira 和Ruminocococus gnavus 是很好的微生物标志物。
食管鳞状细胞癌
口腔健康以及口腔微生物不佳与食管鳞状细胞癌(ESCC)的发生有很大的关系。中国淮安市第一人民医院的 23 名食管癌患者身上采集的粪便样本中含有丰富的厚壁菌门和放线菌门。根据这项研究, Lachnospira可用作食管鳞状细胞癌潜在的生物标志物。
系统性红斑狼疮
肠道微生物组与系统性红斑狼疮 (SLE) 之间相关性被越来越多的研究关注。研究表明Lachnospira与SLE风险呈负相关。
慢性自发性荨麻疹
慢性自发性荨麻疹(CSU)是一种肥大细胞驱动的疾病,在过去几年中其病因和发病机制取得了许多进展。CSU的主要治疗方法是口服第二代抗组胺药。
然而,只有平均 50% 的 CSU 患者对常规或四倍剂量的非镇静抗组胺药有充分反应。同时,肠道菌群会影响药物的疗效。研究发现毛螺菌科及其下属分类群被发现是响应者和非响应者之间肠道微生物群的主要差异。而且Lachnospira是预测抗组胺药对 CSU 患者疗效的标志物。
格雷夫斯病(GD)
格雷夫斯病(GD)是一种以甲状腺功能亢进为特征的全身性自身免疫性疾病。有证据表明,肠道菌群的改变可能与自身免疫性疾病的发展有关。研究发现GD患者中Lachnospira 相较于对照减少。
肠癌
根据已有报道发现,两个丁酸盐生产者Lachnospira multipara和Eubacterium eligens在结直肠癌中含量降低,生成硫化物的细菌Desulfovibrio vietnamensis、D.longreachensis和Bilophila wadsworthia 增加。
大肠癌是由大肠息肉(腺瘤)和粘膜内癌一步步演变而来的(多阶段癌变)。研究表明,双歧杆菌属(Bifidobacterium)的细菌群会在粘膜内癌阶段减少。另外,作为丁酸产生菌的多毛毛螺菌(Lachnospira multipara)和挑剔真杆菌(Eubacterium eligens)从粘膜内癌阶段到晚期大肠癌阶段一直持续减少。
胃癌
胃癌患者肠道菌群的特点是物种丰富度增加,丁酸产生菌减少,以及其他共生细菌的富集,尤其是乳酸杆菌、埃希氏菌和克雷伯氏菌。据报道乳杆菌属和毛螺菌属是胃癌相关细菌属网络中的关键物种。毛螺菌属、乳杆菌属、链球菌属、韦荣氏菌属的组合在区分胃癌患者和健康对照方面表现出良好的表现。
2 型糖尿病 (T2D)
肠道微生物组可能在与 2 型糖尿病 (T2D) 发展相关的炎症中发挥作用。横断面研究发现 2 型糖尿病患者中毛螺菌属和消化链球菌科较少。
与对照大鼠相比,糖尿病大鼠肠道菌群中厚壁菌属的比例增加而拟杆菌属的丰度降低,菊粉治疗可使糖尿病大鼠的肠道菌群组成恢复正常。
与未治疗的糖尿病大鼠相比,接受菊粉治疗的糖尿病大鼠的益生菌乳杆菌及可产生短链脂肪酸的细菌(如毛螺菌属、考拉杆菌属及拟杆菌属)丰度会明显增加,可产生脂多糖的脱硫弧菌属丰度会降低。进一步分析发现,毛螺菌属的丰度与葡萄糖负荷后的血糖反应呈负相关。
白塞病
在白塞病 (BD) 中,一种自身炎症性血管炎,不平衡的肠道微生物群可导致促炎反应。与对照相比,Barnesiellaceae和Lachnospira属的显着减少与 BD 患者有关。

尽管毛螺菌属是一个重要的肠道菌属,但是目前关于该菌的研究和证据还不是很多,还仅限于关联性研究,在机制方面研究较少,以上文中主要的健康相关性证据支持还不充足,需要更大队列来探讨。
总的来说,该菌是一个对健康有益的菌,更深入地了解其与宿主相互作用的机制将有利于我们干预肠道菌群,最终目标是将其用于预防和治疗肠内外疾病。
主要参考文献:
Carasso S, Fishman B, Lask LS, Shochat T, Geva-Zatorsky N, Tauber E. Metagenomic analysis reveals the signature of gut microbiota associated with human chronotypes. FASEB J. 2021 Nov;35(11):e22011. doi: 10.1096/fj.202100857RR. PMID: 34695305.
Liu R, Peng C, Jing D, Xiao Y, Zhu W, Zhao S, Zhang J, Chen X, Li J. Lachnospira is a signature of antihistamine efficacy in chronic spontaneous urticaria. Exp Dermatol. 2022 Feb;31(2):242-247. doi: 10.1111/exd.14460. Epub 2021 Sep 30. PMID: 34558729.
Xiang K, Wang P, Xu Z, Hu YQ, He YS, Chen Y, Feng YT, Yin KJ, Huang JX, Wang J, Wu ZD, Yang XK, Wang DG, Ye DQ, Pan HF. Causal Effects of Gut Microbiome on Systemic Lupus Erythematosus: A Two-Sample Mendelian Randomization Study. Front Immunol. 2021 Sep 7;12:667097. doi: 10.3389/fimmu.2021.667097. PMID: 34557183; PMCID: PMC8453215.
Saladrigas-García M, D’Angelo M, Ko HL, Nolis P, Ramayo-Caldas Y, Folch JM, Llonch P, Solà-Oriol D, Pérez JF, Martín-Orúe SM. Understanding host-microbiota interactions in the commercial piglet around weaning. Sci Rep. 2021 Dec 6;11(1):23488. doi: 10.1038/s41598-021-02754-6. PMID: 34873196; PMCID: PMC8648723.
Maskarinec G, Raquinio P, Kristal BS, Setiawan VW, Wilkens LR, Franke AA, Lim U, Le Marchand L, Randolph TW, Lampe JW, Hullar MAJ. The gut microbiome and type 2 diabetes status in the Multiethnic Cohort. PLoS One. 2021 Jun 23;16(6):e0250855. doi: 10.1371/journal.pone.0250855. PMID: 34161346; PMCID: PMC8221508.
Prakash A, Peters BA, Cobbs E, Beggs D, Choi H, Li H, Hayes RB, Ahn J. Tobacco Smoking and the Fecal Microbiome in a Large, Multi-ethnic Cohort. Cancer Epidemiol Biomarkers Prev. 2021 Jul;30(7):1328-1335. doi: 10.1158/1055-9965.EPI-20-1417. Epub 2021 May 21. PMID: 34020999; PMCID: PMC8254769.
Ye X, Wang D, Zhu H, Wang D, Li J, Tang Y, Wu J. Gut Microbiota Changes in Patients With Major Depressive Disorder Treated With Vortioxetine. Front Psychiatry. 2021 May 7;12:641491. doi: 10.3389/fpsyt.2021.641491. PMID: 34025474; PMCID: PMC8138160.
Chen W, Bi Z, Zhu Q, Gao H, Fan Y, Zhang C, Liu X, Ye M. An analysis of the characteristics of the intestinal flora in patients with Parkinson’s disease complicated with constipation. Am J Transl Res. 2021 Dec 15;13(12):13710-13722. PMID: 35035709; PMCID: PMC8748098.

谷禾健康
菌群多样性
✦
关于菌群多样性,小伙伴们常会问到:
菌群多样性是如何形成的?
菌群多样性越高越好吗?
它与健康的关系如何?
该怎么去改善呢?
……
✦
✦
本期推文就为大家统一解答这类问题。
本文要点
在了解前面问题之前。我们首先要明确,菌群多样性是什么?
首先,我们知道肠道微生物群代表了一个不断变化的生态系统。
为了便于理解,我们可以把肠道菌群比作一块草地,健康的肠道菌群包含多种菌群,它们之间相对平衡,就好比一块生长完好的草地,生长各种类型的草,整体和谐 ↓↓

一旦遇到疾病,药物等干扰之后,一些菌群被杀死,也就是说少了很多种类型的草,这块“草地”会逐渐变秃,甚至部分沦为荒漠 ↓↓


之后如果不加任何看管,没有很好得到恢复的话,部分菌群可能会野蛮生长,破坏了原有的平衡 ↓↓


以上,我们可以看到关于多样性的几个特点。
一个是种类:
成年人群中肠道菌群的种类参考范围在100~2000种,种类数量越多多样性越高。类比图1那样。
一个是均匀性:
即各个菌种的含量丰度较为均一,如果出现单一菌种占据绝大部分的情况,类比以上图3,那么多样性也不理想。
多样性的评估一般通过一个叫做香农-维纳多样性指数的指标来进行评估,计算公式为:
H=-∑(Pi)(log2Pi)
其中Pi为每个菌的占比例,值越大代表物种种类越多,均匀性也更好相应的多样性也越高。正常人群中香浓指数在2~9之间,一般大于3以上表明具有一定多样性。
肠道菌群多样性表现在:
微生态系统的稳定性,以及面对外界致病菌等入侵的抵御能力。
这要追溯到生命早期。
在胎儿发育和婴儿期,菌群多样性通常很低。
由于在生命的早期阶段,肠道含有氧气,此时肠道内的微生物大多是耐氧的。
随着不断发育,这些菌群开始逐渐被厌氧菌取代。肠道菌群的这种进化是迅速的。
研究表明,婴儿在出生后第一周,肠道内发现的病毒序列有56%,在第二周后就不存在了。
这种多样性在生命的前3个月继续迅速扩大,其中约95%的微生物随着时间的推移而保存下来。
婴儿的微生物群组成具有特征丰富的Akkermansia muciniphila、拟杆菌属、韦荣氏菌属、球状梭菌属和肉毒梭菌属等。肠道微生物多样性延迟与过敏、哮喘和营养不良有关。
肠道菌群变得稳定,微生物群落多样性随着年龄的增长而增加,直到它成为一个稳定的成年微生物群,主要由三个细菌门组成:
厚壁菌门
(Lachnospiraceae和ruminococaceae)
拟杆菌门
(拟杆菌科、Prevotellaceae和Rikenellaceae)
放线菌门
(双歧杆菌科和Coriobacteriaceae)
从出生到2.5岁的微生物群发育期可能非常关键,婴儿早期肠道微生物群的破坏可能会严重影响人类健康。
大约三岁时,儿童肠道微生物群的组成和多样性与成人最为相似。
在个体的整个生命过程中,它继续以更稳定、更慢的速度进化。
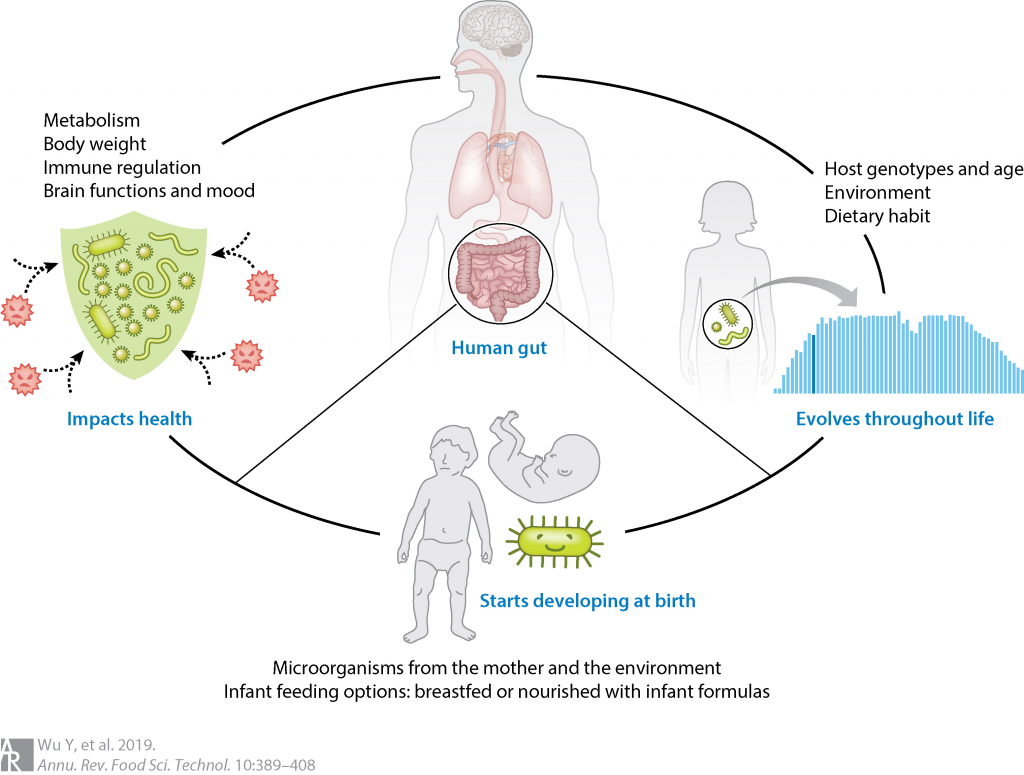

研究还发现,青春期之前儿童,肠道微生物群富含可能参与持续发育功能的菌群,如叶酸和维生素B12的合成方面也很丰富。
青少年微生物群,梭状芽胞杆菌属、双歧杆菌属的丰度显著高于成人。
健康成人肠道菌群以厚壁菌门和拟杆菌门为主,也包括较小比例的Verrucomicrobia、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)。
一般来说,老年微生物群的特点是微生物多样性下降,机会性病原体增多,双歧杆菌和拟杆菌显著减少,兼性厌氧菌、梭杆菌门、梭状芽胞杆菌和真细菌Eubacteria增加,产生短链脂肪酸菌群减少。衰老显著影响老年人微生物群的组成和功能。
是不是所有老人的肠道菌群多样性都会降低?
不是,长寿老人的肠道菌群多样性水平高。
研究人员检测了一群健康的长寿老人的肠道微生物组,来自中国四川都江堰市的长寿老人,包括“90-99岁”和“≥100岁”两个年龄段。
他们发现长寿人群的肠道菌群比年轻成年人的肠道菌群更多样化,这与传统观点相矛盾。
Kong F, et al., Gut Microbes, 2018
他们还发现了产短链脂肪酸菌在长寿老人中开始增加,例如梭状芽胞杆菌XIVa。
国内外研究结果一致
为了验证他们的发现,他们分析了来自一个意大利小组的独立数据集。
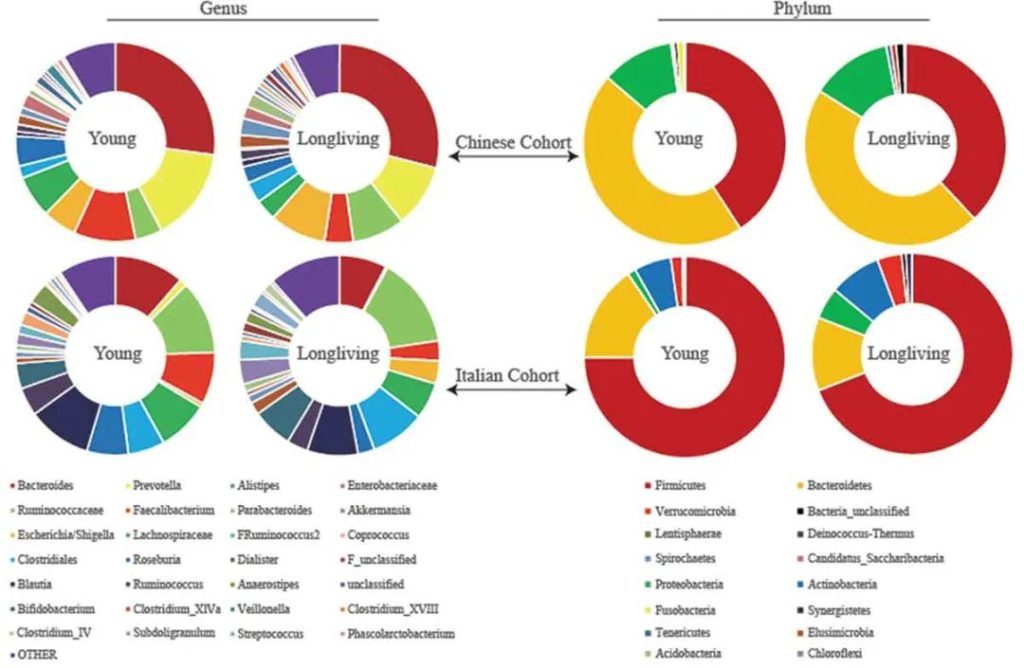
Kong F, et al., Gut Microbes, 2018
出现一致的结果:长寿的意大利人也比年轻的人群的肠道菌群多样化水平更高 。
庆幸的是,谷禾肠道菌群数据库中也有比较长寿的老人肠道菌群数据。
我们抽取其中一例相对较为健康的长寿老人的数据:
编号:083*****97 ,98岁(谷禾肠道菌群数据库)
可以看到肠道菌群多样性水平也是明显增高,与文献报道相符。大部分指标都处于正常水平。
那么,菌群多样性是不是仅随年龄的变化而变化呢?
不是的,我们会发现同一年龄层人群的多样性还是有差别的。也就是说除了年龄这个因素之外,肠道菌群变化与某些其他因素也存在关联。
下一章节我们逐一展开了解一下其他相关因素。
前一章节,我们发现年龄会影响菌群多样性变化,其他也可能是由遗传、饮食习惯、生活方式、生理变化、地理位置、药物等因素共同决定的。
▼ 遗传(双胞胎菌群特征相似)
研究发现,分开生活多年的同卵双胞胎在微生物特征上表现出高度的相似性,而生活在相同环境和饮食习惯相似的配偶则没有。


厚壁菌门、放线菌门、Tenericutes、Euryarchaeota的遗传性更强,而拟杆菌门的遗传性很低。
以上这些发现有力地证明,遗传因素在塑造肠道微生物群方面提供了强大的力量。
其他也有研究证实了猪、人和小鼠之间的遗传分类群和候选基因的功能类别的高度相似性,这表明宿主基因对哺乳动物肠道微生物群的影响机制相似。
▼ 地理位置(一方水土养一方人)
肠道菌群中每一个门的比例随着地理位置的变化而变化。这些可能是受到各种不同生活方式有关的大气、基因、饮食或其他因素影响。
在非洲农村布吉纳法索村的儿童(高纤维饮食,脂肪和动物蛋白含量低),马拉维和委内瑞拉的儿童和成人中富含普雷沃特菌,他们吃的主要是玉米、木薯和其他植物源性多糖。


研究表明,普氏杆菌与碳水化合物和单糖有关(在农业社会普遍存在)。
在西方国家,拟杆菌门与厚壁菌门的比例更高。
拟杆菌与长期饮食中,富含动物蛋白、几种氨基酸和饱和脂肪有关(在美国和欧洲普遍存在);


西方国家,肠道菌群多样性的普遍减少,引发了人们的思考,更广泛人群中重要共生菌该如何维持?全球饮食趋势是否会导致有益菌群永久消失?

在发展中国家保持个体菌群(特别是在农业文化中),可能有助于保存人类微生物群中潜在的重要组成部分。
此外,特殊环境,如医院的ICU病房、更衣室等消毒严格的地方,也可能导致环境菌群多样性下降。
▼ 饮食 (调节菌群怎么离得开吃?)
都知道饮食对肠道微生物群的调节起着至关重要的作用,这其中可能起到有益的作用,也可能是有害的。
为什么要把婴儿单独拎出来讲呢?因为对他们来说,人生重要事儿就是吃吃睡睡,那么吃就占了很重要的一块。饮食可以说是塑造肠道菌群的关键驱动力。
婴儿早期,肠道微生物群富含与母乳中低聚糖消化有关的基因,后来,随着其他辅食的引入,富含与多糖和维生素代谢相关的基因。
母乳喂养的婴儿表现出放线菌的过度生长以及厚壁菌和变形菌的抑制。母乳中含有可被这些细菌有效代谢的低聚糖,导致短链脂肪酸增加,从而使免疫系统增加免疫球蛋白G的表达。
配方奶粉喂养的婴儿表现出梭菌、链球菌、拟杆菌和肠杆菌的增加。婴儿期后,肠道微生物群继续发展,饮食成为组织肠道微生物群结构、形状和多样性的主要关键。
日常强调的水果和蔬菜,在决定α多样性方面发挥了最重要的作用。研究发现α多样性或微生物丰富度与长期水果和蔬菜摄入呈正相关(p<0.05)。

膳食纤维的摄入对于保持肠道粘膜屏障功能的完整性至关重要。高纤维饮食可以改善2型糖尿病患者的血糖控制和促进更健康的代谢状况。
素食与健康、肠道菌群多样性的变化以及厚壁菌和拟杆菌的优势有关。
高蛋白质和高脂肪的饮食与大量耐胆汁的菌群有关,如拟杆菌、嗜胆汁菌和厚壁菌,以及对厚壁菌的抑制。不过需要注意的是,这种饮食习惯,可能会导致免疫力降低、感染易感性增加和代谢性疾病的发展。因此,减肥人士也需谨慎。
具体如何选择可见后面章节。
▼ 季节 (果蔬也有属于它们的生长季节)
食物供应的季节性变化的影响菌群多样性。
首先,初步研究将坦桑尼亚的哈扎狩猎采集人与城市化人进行了比较,结果与意大利城市居民相比,哈扎人的饮食富含复杂的多糖,并表现出更高水平的微生物多样性,表现为拟杆菌的比例较高。
后续宏基因组分析显示碳水化合物活性酶的富集,这与觅食、富含多糖的饮食一致。肠道微生物组保留的代谢复杂碳水化合物和蛋白质的功能潜力,可能是由于食物供应的季节性变化。
哈扎人肠道菌群在组成上,经历了与湿季和旱季同时发生的季节性循环,其中 Prevotellaceae 、 Spirochaetaceae 是 2 个最具季节性变化的菌群。Prevotellaceae 的比例在雨季下降,这与宏基因组中存在的碳水化合物活性酶显着减少有关,特别是植物碳水化合物。
另一项研究针对北达科他州的社区哈特派人群,他们的夏季饮食富含高纤维的新鲜水果和蔬菜。与冬季相比,北达科他州的夏季肠道微生物群与拟杆菌门的丰度显着增加相关,而放线菌和厚壁菌门的丰度相应减少。
当然,在城市化人群中并没有这种现象。
总的来说,研究城市化程度、地理位置和特定食物供应的全球饮食模式,有助于在宏观层面上形成全球肠道微生物群的巨大异质性。
▼ 生活方式 (除了吃还有什么能改变菌群?动!)
——运动锻炼
在人类研究中,运动增加了肠道菌群的多样性,与蛋白质摄入量和肌酸激酶水平呈正相关。
与非运动员相比,运动员的拟杆菌水平较低,厚壁菌数量较多。
对运动产生反应的细菌种类包括乳酸杆菌、双歧杆菌和阿克曼菌,而其他种类则有所减少,如变形杆菌、Turicibacter、Rikenellaceae.
此外,在运动的反应中,产短链脂肪酸菌(尤其产丁酸菌),如梭菌Clostridiales、罗斯氏菌Roseburia、毛螺菌科Lachnospiraceae、Erysipelotrichaceae增加,并在调节运动对宿主肠道菌群的影响中发挥重要作用。

运动增强丰富菌群的机制是什么?
涉及内部和外部因素。
【内】对耐力训练的内在适应,如血流量减少、组织缺氧和转运增加,会导致胃肠道的变化。
【外】运动型个体暴露于他们的环境生物圈中,遵循整体健康的生活方式,促进更丰富的微生物群。
与对照组相比,运动员表现出较低的炎症和改善的代谢标志物,并且运动与较低的慢性炎症导致的发病率降低有关。
有研究人员提出,运动可以作为一种治疗支持,可用于治疗与失调相关的疾病,如肥胖和其他一些胃肠道疾病。
关于运动详见:《运动如何影响肠道微生物群,如何正确运动》
《肠道微生物组如何影响运动能力,所谓的“精英肠道微生物组”真的存在吗?》
——吸烟
在戒烟的健康个体的粪便微生物群中也观察到显著的变化,包括厚壁菌门和放线菌门相对丰度的增加,拟杆菌门和变形菌门的减少。
研究证实,吸烟者和非吸烟者的口腔菌群存在显著差异。特别是在吸烟者的口腔中,卟啉单胞菌和奈瑟菌的繁殖增加,Gemella减少。


▼ 药物
抗生素的使用是一把双刃剑:它摧毁致病菌的同时,可能也伤害了有益菌,导致肠道微生物群失调,多样性大幅下降,并且需要一段时间才能恢复。
广谱抗生素导致厚壁菌门和拟杆菌门之间的不平衡。在治疗过程中,菌群整体多样性降低,这些细菌的丰度也降低。
微生物组组成的改变取决于抗生素类别、剂量、暴露时间、药理作用和目标细菌等。例如,连续两年服用克林霉素会导致肠道微生物群发生变化,而拟杆菌种类不会恢复。
在幽门螺杆菌治疗中使用克拉霉素会导致放线菌数量减少,而环丙沙星会导致治疗半年后仍未恢复的瘤胃球菌数量减少。
研究表明,氨苄青霉素、万古霉素、甲硝唑和新霉素具有长期的负面影响,可引起肠道菌群多样性的不可逆变化,从而增加宿主疾病的风险。
关于抗生素对菌群的影响详见:
《抗生素对微生物组及对人体健康的影响》
《细菌感染和抗生素使用》
《细菌的天敌抗生素,如何用好这把救命的双刃剑?》
其他药物也会降低菌群多样性,如治疗胃溃疡和反酸的质子泵类药物也会导致菌群多样性降低。
以上是常见的菌群多样性的决定因素,那么菌群多样性是如何对身体产生影响的?下一章节我们探讨这部分内容。
微生物组的多样性和平衡在人类健康中发挥着重要作用。
▼ 消化系统疾病
以IBD为例。
在 IBD 患者中,肠道菌群的多样性减少,这主要是由于厚壁菌门的多样性减少。在厚壁菌中,梭菌减少,尤其是普拉梭菌,普拉梭菌是产丁酸盐的菌群之一。这些菌群少了,产出来的丁酸盐就少,丁酸有什么用呢?
它能对肠道防御机制具有多阶段调节作用,包括通过促进肠上皮中的紧密连接蛋白保护肠粘膜屏障,支持先天性和适应性免疫反应,刺激成熟的结肠细胞,抑制未分化的恶性细胞和干细胞,通过降低环氧合酶-2(COX-2)水平抑制氧化应激,并通过诱导过氧化氢酶,改善过氧化氢(H2O2)的解毒作用。
丁酸也能刺激芳香烃受体(AhR)、GPR41和GPR109A受体,并抑制不同细胞类型的HDAC,从而稳定肠道屏障功能并减少炎症过程。
丁酸少了,肠道屏障可能受损,炎症反应增加,就会出现IBD等肠道疾病。
在克罗恩病(CD)、肠易激综合征(IBS)等消化系统疾病中,无论是否伴有腹泻和结直肠癌,都会持续观察到多样性降低。
乳糜泻患者的十二指肠相关微生物群多样性也不太理想。
艰难梭菌结肠炎复发的危险因素之一就是多样性降低。
扩展阅读:
《深度解析 | 炎症,肠道菌群以及抗炎饮食》
《炎症性肠病中宿主与微生物群的相互作用》
▼ 神经系统疾病
目前越来越多的研究表明,在抑郁症、帕金森病 、阿尔茨海默病等神经系统疾病中,肠道菌群多样性减少。
抑郁症、帕金森病和AD患者肠道菌群的变化
MU Xin et al., Chinese Pharmacological Bulletin 2019
扩展阅读:《肠道微生物组在人类神经系统疾病中的作用》
《最新研究速递 | 柳叶刀:肠道微生物群在神经系统疾病中的作用》
《深度解读 | 肠道菌群和中枢神经系统的关系》
▼ 癌症
以乳腺癌为例。
乳腺癌患者多样性减少。一项基于人群的病例对照试验研究中,调查了绝经后妇女的粪便微生物群与乳腺癌之间的关系。发现与对照组患者相比,病例患者的微生物群组成显着改变(β-多样性,P = 0.006)和较低的α-多样性(P = 0.004)。
肠道菌群失调可诱发慢性炎症,因此有可能影响乳腺癌的发展。
扩展阅读:《肠道微生物群与五种癌症的相互作用:致癌 -> 治疗 -> 预后》
《结直肠癌防治新策略——微生物群》
《“隐藏高手” 胰腺癌的新出路——微生物》
《肺癌最新研究进展,与肠肺微生物息息相关》
《深度解析 | 肠道菌群与慢性肝病,肝癌》
▼ 代谢类疾病
肥胖
一般来说,肥胖个体的微生物多样性低于瘦的个体。饮食干预可以改善微生物的丰富度和相关的临床表型,例如改善代谢和炎症状态。
扩展阅读:《体重增长:目前为止我们所知道的一切(更新你的减肥工具箱)》
糖尿病
1 型糖尿病患者的肠道微生物群,高水平的拟杆菌,大量产生乳酸和丁酸的细菌以及细菌功能多样性降低。
2型糖尿病前期,菌群多样性就已经存在下降趋势。
扩展阅读:《2型糖尿病如何做到可防可控?肠道菌群发挥重要作用》
▼ 儿童发育
对来自孟加拉国的营养不良儿童和营养良好的健康儿童的肠道微生物群进行了横向比较研究,结果发现,营养不良儿童微生物群的多样性显著降低。
扩展阅读:《生命早期营养不良和微生物群影响大脑发育和行为》
《真实案例 | 儿童发育迟缓肠道菌群检测的应用》
《发育迟缓/营养不良不容忽视,问题很有可能在肠道》
▼ 心脑血管疾病
高血压个体的肠道微生物多样性减少,厚壁菌门/拟杆菌门比率增加。
扩展阅读:《认识肠道微生物及其与高血压的关系》
《饮食-肠道微生物群对心血管疾病的相互作用》
▼ 免疫系统疾病
以过敏为例。
在出生第一年甚至更早的时候,饮食多样性可能对预防过敏产生积极影响。早期接触多种食物抗原可能会促进免疫耐受的发展。
扩展阅读:《婴幼儿过敏有望改善,与肠道菌群密切相关》
《生命早期微生物接触和过敏风险:如何预防》
《微生物群对三大过敏性疾病发展的影响》
▼ 睡眠
人类肠道微生物群可以通过脑-肠道微生物群轴影响健康。
一项研究使用活动描记术量化睡眠测量,并结合肠道菌群采样,以确定肠道菌群与各种睡眠生理测量之间的相关性。测量了免疫系统生物标记物,并进行了神经行为评估,因为这些变量可能会改变睡眠和肠道菌群组成之间的关系。
总微生物组多样性与睡眠效率、总睡眠时间的增加呈正相关,睡眠越好,肠道菌群多样性越丰富,与睡眠开始后的觉醒呈负相关。
总微生物组多样性与IL-6之间存在正相关。微生物组分分析显示,拟杆菌和厚壁菌门内的丰富性与睡眠效率、IL-6浓度和抽象思维呈正相关。研究人员也发现了几个分类群(Lachnospiraceae, Corynebacterium, Blautia)与睡眠指标呈负相关。
肠道菌群多样性高有助于减轻压力,改善睡眠。
扩展阅读:
《肠道菌群与睡眠:双向调节》
《深度解析|睡眠健康与肠道健康之间的双向联系》
以上是菌群多样性与疾病的关联,了解这些我们可以有针对性地去改善菌群多样性。
我们在实际检测中会发现有这样一种情况:
多样性指标虽然很高,但是整体看起来健康总分并不理想。甚至还有很多慢性疾病风险,这是为什么呢?
这种情况可能是核心菌群丰度不够,核心菌群在代谢、免疫等方面都发挥重要作用,一旦核心菌群丰度下降,则可能造成外源物质侵入。感染、旅行等可能会出现这种情况。
如果发现肠道菌群检测报告中多样性很低,该如何判别具体情况,这要看以下几种情况:
✦
总的来说,在一定范围内,更高的多样性通常代表饮食更加丰富多样,同时也意味着更健康的身体状况。
✦
一个健康、有弹性的肠道微生物群依赖于高丰富性和生物多样性,也就是说,当你的肠道菌群多样性相对较高时,会更强大、更稳定。
就好比你拥有一支队伍,有很多不同类型的、不同专长的人可供你使用时,整体的能力就会很强大。


前面我们已经知道,菌群多样性的各种决定因素,例如,饮食、年龄、遗传、环境等。
多样性低不代表一定有疾病,但是更容易受到饮食,环境或疾病的影响,包括更易发生水土不服或更容易因饮食不洁导致腹泻等。菌群多样性低可能是肠道菌群不健康不稳定的一种表现形式。
当然,也不能过度追求菌群多样性高。
随着对饮食-微生物组-健康轴的理解逐渐加深,最近创造了个词叫“食品药学”,即“食品作为药物”的概念逐渐得到推广,基于个体微生物组特征的“食物疗法”的个性化得到越来越多的关注。
饮食干预引起的改变可能在几周甚至几天就会发生。对调节肠道菌群而言,饮食调节是一个非常重要且纯天然的方式。那到底该吃什么?如何吃?
我们可以从食物种类,饮食结构,饮食质量等多个角度去优化日常饮食,从而调节菌群。
✔ 食物种类:
膳食纤维是饮食中的重要组成部分,分为不溶性(抗发酵)或可溶性(可被肠道微生物群代谢),例如益生元纤维菊粉,在结肠中它被肠道微生物群发酵成短链脂肪酸:乙酸盐、丁酸盐、和丙酸盐。
食用膳食纤维时,各种菌群可以利用这些膳食纤维作为基质,扩大其种群,从而增加微生物组的总体多样性。
许多住在结肠和盲肠内的厌氧细菌,依赖于复杂碳水化合物的代谢来产生短链脂肪酸,短链脂肪酸是肠粘膜的重要能量来源,在宿主代谢、免疫功能和细胞增殖中发挥关键作用。
丁酸盐是肠道中一种丰富的短链脂肪酸,在结肠癌中起着复杂的作用,如最近的两项临床前研究所示,丁酸盐似乎是浓度和环境依赖性的。丁酸盐可以抑制肿瘤的发生,因为丁酸盐受体Grp109a缺乏的小鼠增加了炎症刺激或APC突变促进的肿瘤发生,并且通过Grp109a的信号传导抑制了这些刺激诱导的肿瘤发生。
▸ 富含膳食纤维的食物在哪里?
膳食纤维可以在各种水果、蔬菜、坚果、种子、豆类和谷类中找到。

吃洗过的生水果和蔬菜,这些水果和蔬菜含有环境微生物(如果难以消化生蔬菜,可以榨汁),包括益生元,以促进多样化的微生物群,不要只吃某一种蔬菜或水果。
▸ 足量的膳食纤维该吃多少?
推荐的纤维摄入量(充足摄入 克/天)
▸ 具体哪些水果蔬菜中的富含膳食纤维?
各类水果蔬菜中每标准份量膳食纤维的含量及热量

数据来源:U.S. Department of Agriculture, Agricultural Research Service. FoodData Central
同时,水果蔬菜里面一般富含多酚,多酚可以塑造肠道细菌的组成。
Vemana Gowd, et al.,Trends in Food Science & Technology, 2019
白藜芦醇
食用白藜芦醇可减轻结肠炎小鼠模型中的炎症状态并恢复微生物群多样性。
新的证据表明,红酒中的白藜芦醇能通过支持短链脂肪酸的产生来预防阿尔茨海默病 (AD),短链脂肪酸会干扰有毒的 β-淀粉样蛋白聚集体形成。在AD背景下,白藜芦醇的消耗与较高比例的有益菌有关,例如 F. prausnitzii、Akkermansia 物种和具有脑抗炎特性的产丁酸盐细菌。
姜黄素
姜黄素能够部分逆转多样性的变化 肠道微生物群,增加 F/B 比并降低 Anaerotruncus 和 Helicobacter 属的丰度。
已证明,姜黄素治疗降低了在癌症患者中发现的与癌症相关的菌群丰度(例如普氏菌属、冠状杆菌属和瘤胃球菌属)。
富含多酚的食物包括:


此外,饮食中添加全麦大麦、糙米或这两种的混合物会增加菌群多样性。
发酵食品是益生菌的另一个重要来源。
2021 年 7 月的《细胞》杂志上,健康成年人被分为两组,21人食用水果、全谷物、豆类、蔬菜、坚果和种子等高纤维食品,18人食用发酵食品。
在试验前的三周、指定饮食后的10周内,以及研究结束后的四周内,当参与者想吃什么就吃什么时,从受试者身上收集粪便样本。还采集了血液样本以测量炎症和免疫功能。
结果发现食用发酵食品的人,除了增加肠道微生物群的多样性外,同时对四种免疫细胞的激活程度较低,包括IL-6在内的几种炎症蛋白水平也降低。
然而,在大多数情况下,发酵食品对我们肠道微生物群的改变是暂时的,因此,持续摄入发酵食品更有利于对于维持高水平的有益菌。
▸ 发酵食物有哪些?
坚果(尤其是核桃)对健康有益,食用坚果可以降低血脂水平。核桃如何改变菌群?
在一项随机对照试验(交叉设计)中,96名健康参与者接受了为期8周的富含核桃的饮食,然后改用无坚果饮食。第二组98名参与者按相反顺序遵循饮食模式,收集粪便样本做16S rRNA测序分析。
在α多样性方面没有发现差异,但在β多样性方面,观察到核桃和对照组的明显聚集,也就是说,他们的菌群发生明显变化。
与对照饮食相比,核桃饮食仅解释了观察到的差异的5%左右。在核桃组,与对照组相比,瘤胃球菌Ruminococcaceae和双歧杆菌的丰度显著增加,同时梭状芽孢杆菌属簇XIVa物种的数量减少。
因此,摄入核桃可能会促进肠道微生物群向潜在的益生菌和产短链脂肪酸菌群的组成转变。核桃含有丰富的多酚和n-3 脂肪酸,这两种脂肪酸都具有益生元特性。
以上是各类食物对菌群多样性的影响。那么这些食物如何搭配在一起可以对菌群产生更好的影响?
这就涉及到日常饮食结构。
以现代地中海饮食金字塔为代表的高品质饮食,包括大量食用水果和蔬菜、豆类、坚果和全麦,适量橄榄油、鱼、家禽和酒,尽可能少吃红肉、糖果和加工肉类等食品。
坚持地中海饮食与降低疾病风险和改变微生物多样性有关。
地中海饮食评分与拟杆菌、普氏杆菌丰度较高呈正相关,与双歧杆菌/大肠杆菌的比例、粪便丙酸盐和丁酸盐浓度较高呈正相关。
地中海饮食中存在的典型食物成分与肠道微生物群中特定菌株的存在相关。
例如,全谷物与双歧杆菌、粪杆菌、 Tenericutes、Dorea的存在有关。橄榄油和红酒的食用量与Faecalibacterium的存在有关,蔬菜的食用量与Rikenellaceae, Dorea, Alistipes Ruminococcus存在有关,豆类与Coprococcus的存在有关。同一作者还观察到饮食中的多酚含量(通常在地中海饮食中较高)与特定梭菌(XIVa)和粪杆菌簇的存在之间存在相关性,这些梭菌簇能够合成丁酸,可能具有抗炎作用(如Akkermansia,也更多地与地中海饮食相关)。

doi: 10.3390/nu13010007
地中海饮食它没有指定份量大小或具体数量。由每个人根据自身情况设定每餐吃多少,大致比例参考以上金字塔。
目前认为的健康的饮食结构越来越偏向于,强调植物性食物和少吃红肉的饮食。
在地中海饮食结构中,我们可以看到,这类饮食结构的特点是:水果、蔬菜、高纤维食物类占比较多。
大多数研究表明,以植物为基础的饮食可以促进微生物的多样性。与杂食动物相比,纯素食者和素食者菌群具有显着更高的 α 多样性,也就是丰富度。
健康的植物性食物会影响肠道微生物的多样性和组成,包括产丁酸菌的富集,例如:
Roseburia hominis
Agathobaculum butyriciproducens
普氏粪杆菌Faecalibacterium prausnitzii
厌氧菌Anaerostipes hadrus
一些研究表明,高纤维饮食可以降低体重增加的风险。高纤维饮食随后有助于形成高度多样的微生物群。
高纤维饮食的摄入会降低饮食的能量密度,从而导致体内的短链脂肪酸促进体内更高水平的糖异生。这会导致肠促胰岛素的形成,从而使人更快、更长时间地拥有饱腹感。
地中海饮食与肠道菌群生长之间的相关性
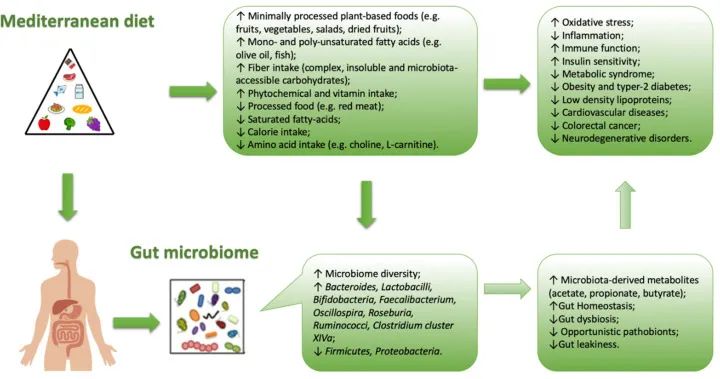
doi: 10.3390/nu13010007
此外,我们看到,地中海饮食结构中红肉类,加工肉类等是需要少吃,那么脂肪是否足够?能不能满足人体需求?
不必担心,地中海饮食中含有大量植物脂肪,这些脂肪来自橄榄油(主要是特级初榨橄榄油)和坚果,它们属于高脂肪能量密集型。
★ 地中海饮食中含有优质脂肪
榛子、 杏仁、夏威夷果、开心果、腰果等,都是单不饱和脂肪酸的重要来源。此外,核桃、碧根果和夏威夷果还富含植物性ω-3脂肪酸。核桃中的ω-3脂肪酸与ω-6脂肪酸的比例极好。
研究表明这些脂肪源与健康代谢状况直接相关,对改善大脑健康、消减炎症、降低各种原因的死亡风险和预防心脏病等有明显的作用,主要归因于它们的特定脂肪成分和生物活性分子含量。
ω-3脂肪酸,在肠道微生物群中的作用,可以调节炎症反应,改善结肠炎时的上皮屏障。
注:炎症反应是几种慢性非传染性退行性疾病的基础,如动脉粥样硬化、癌症、神经退行性疾病、慢性肾功能衰竭、糖尿病、男性肥胖、继发性性腺功能减退等。
地中海饮食中,除了坚果之外,鱼类、海鲜等食物都富含ω-3脂肪酸。显然优质的脂肪更有利于健康。
除了以上脂肪之外,地中海饮食中强调,“鱼和海鲜、鸡蛋、家禽类和高脂奶制品的摄入量每周几次;红肉每月只吃几次”,那么,蛋白质的量是否足够满足人体需求?
我们来看看地中海饮食中,蛋白质对菌群的影响。需要考虑多方面,比如蛋白质的数量、质量、加工方式和来源。
★ 高蛋白饮食可能不利于健康,地中海饮食中蛋白比例更合适
研究表明,与正常蛋白质饮食(20% 蛋白质,56% 碳水化合物)相比,喂给 Wistar 大鼠的高蛋白饮食(45% 蛋白质,30% 碳水化合物)对结肠微生物群有不利影响。
在高蛋白饮食中,链球菌、大肠杆菌/志贺菌和肠球菌分别增加了5.36倍、54.9倍和31.3倍,其丰度与与疾病发病相关的基因和代谢物(包括代谢物尸体)呈正相关,它来源于赖氨酸的脱羧作用,大量使用已被证明会引起氧化应激和DNA损伤。
有益菌在高蛋白饮食中大量减少,包括丁酸生产菌F.prausnitzii(减少3.5倍)、瘤胃球菌(减少8.04倍)和Akkermansia(在高蛋白饮食组中未检测到)。
慢性肾病下,长期低蛋白饮食更有利于改善健康。
研究表明,六个月的低蛋白饮食(0.6 g/kg/天)可以降低非透析慢性肾病患者的血清尿毒症毒素水平,包括对甲酚硫酸盐。低蛋白饮食也与肾功能改善、总胆固醇和低密度脂蛋白胆固醇降低有关。
★ 植物来源的蛋白比动物来源蛋白可能更有利于菌群和健康
在喂食大豆、猪肉、牛肉、鸡肉、鱼类和酪蛋白(后者作为对照)的大鼠中进行了为期14天的喂食试验,结果显示,到第2天,尤其是红肉(猪肉和牛肉)和白肉(鱼和鸡肉)之间的变化。主成分分析显示,在第7天和第14天有不同的微生物群,因此大豆蛋白组与肉类和对照组分开,也就说菌群特征显著变化。
在另一项类似的研究中,与喂食白肉、红肉或酪蛋白的大鼠相比,大豆蛋白与大鼠粪便短链脂肪酸增加有关。大豆组中拟杆菌和普氏杆菌的相对丰度也较高,它们是丙酸盐和其他短链脂肪酸的主要生产者。
另外研究发现,与接受牛奶分离蛋白的仓鼠相比,大豆喂养的仓鼠的血脂显著降低,至少部分原因是大豆蛋白引起的肠道微生物群变化。在高脂饮食制度下,大豆分离蛋白减少了高脂饮食诱导的小鼠体重增加和脂肪组织质量积累,并减轻了肝脏脂肪变性,而乳蛋白没有观察到这种情况。
荞麦蛋白抑制大肠杆菌的生长,促进乳酸杆菌、肠球菌和双歧杆菌的生长,后者与血脂密切相关。荞麦喂养的小鼠粪便中总胆汁酸和短链脂肪酸的排泄量显著增加。
绿豆蛋白在降低高脂饮食诱导的小鼠体重增加方面也优于酪蛋白。绿豆蛋白导致GLP-1分泌增加,盲肠和粪便胆汁酸池增加,次级和初级胆汁酸比率显著升高;在无菌小鼠中被消除的效应。就肠道微生物群而言,食用绿豆作为高脂肪饮食的一部分,导致了瘤胃菌科的扩张,并导致拟杆菌门分类群的增加和厚壁菌门丰度的减少。
乳清蛋白提取物和豌豆蛋白已被证明可以增加多样性、双歧杆菌和乳酸杆菌,其中,乳清蛋白提取物减少拟杆菌和梭菌。
以上这些研究清楚地表明,植物源性蛋白质在促进有益微生物群方面优于动物源性蛋白质,对宿主代谢具有积极影响。
蛋白质的加工(包括热加工)及其对蛋白质功能的影响(包括微生物组的调节)尚不完全清楚,需要进一步研究。
因此,在我们的饮食干预中,不能认为高蛋白饮食一定是健康的,还取决于其来源、加工方式等方面,对待“高蛋白饮食”需谨慎,尤其是在长期或反复饮食实践中。
我们可以看到,地中海饮食结构中,来源于动物蛋白只占金字塔上部(比例较小),无论是对慢病患者或者普通人群,都是一种更为安全、稳妥、健康的选择。
以上是地中海饮食结构对菌群多样性及健康的影响。那么知道吃什么,如何搭配之后,还需要注重什么?
✔ 饮食质量
同样是植物性饮食,有些高温下高油高盐等烹饪方式也会影响其营养。
为了防止破坏大量维生素、矿物质和纤维,加工烹饪的时候应尽量简化。天然食物的本味,对味蕾和身体是一种滋养。
在有条件的情况下,可以尽可能选用本地的、应季的新鲜蔬果作为食材。
高度加工的食物,富含脂肪、精制糖、盐等,与肠道微生物多样性降低有关,对宿主健康产生负面影响。
此外,各类添加剂比如,羧甲基纤维素 (CMC) 和聚山梨醇酯 80 (P80) 这两种乳化剂会降低肠道的微生物多样性并显着改变微生物群组成。
关于食品添加剂对菌群影响详见:《你的焦虑可能与食品添加剂有关,警惕食品添加剂引起的微生物群变化》
服用含有益生元的食物,乳糖不耐症的症状减轻。
低聚半乳糖是益生元,通过刺激肠道中的有益细菌对人体有益。对于乳糖不耐症患者,当低聚半乳糖诱导的微生物群变化增加了双歧杆菌、粪杆菌、乳酸杆菌、Roseburia等乳糖发酵物种的丰度时,它们会起到有益作用。
一项研究观察到,通过向参与者喂食高纯度低聚半乳糖(>95%),乳糖不耐受相关症状得到改善。在有反应的受试者中,观察到微生物组的组成发生了显著变化,但是,双歧杆菌、乳酸杆菌和粪杆菌,所有乳糖发酵菌均出现增加,50%的原本腹痛的受试者报告在使用低聚半乳糖治疗结束时没有腹痛。在将乳制品重新引入饮食后,喂低聚半乳糖的受试者在治疗后,乳糖耐受性的可能性也增加了六倍。
总的来说,以上这些研究强调了饮食对肠道菌群及其对人体的深远影响,具体取决于摄入的食物种类、饮食结构、饮食质量等。除了饮食之外,其他方式也能对菌群产生影响,具体如下:
益生菌
益生菌通过多种机制发挥作用,对肠道菌群的多样性产生积极影响,并改变人体的免疫反应,与改善多种慢性疾病密切相关。
研究发现,益生菌会抑制肠杆菌科(志贺氏菌和埃希氏菌)的生长,同时促进厚壁菌门的大量增殖,尤其是厌氧菌属。益生菌具有帮助从抗生素治疗中恢复个体菌群的显著能力。
益生菌可以直接作用于肠黏膜层和下层上皮,影响肠屏障功能和黏膜免疫;也可以通过调节常驻微生物种群结构或酶活性对宿主产生间接影响。
益生元
益生元本质上是一种肠道菌群的肥料,可以滋养有益菌群。例如,菊粉等益生元支持双歧杆菌的平衡。
益生元通过多种方式与潜在病原体、免疫系统的直接相互作用,调节肠道环境,从而有利于人体健康。
关于益生菌、益生元这部分内容由于在前面的文章中多次提到,此处就不详述了,详见:
《如何调节肠道菌群?常见天然物质、益生菌、益生元的介绍》
《益生菌的靶向递送:研究和商业化前景》
《益生菌的简单入门指南》
补充维生素D可显着增加肠道微生物多样性。具体而言,拟杆菌/厚壁菌的比例增加,益生菌类Akkermansia和双歧杆菌的丰度增加。拟杆菌属和普氏杆菌属显著变化,表明补充后肠型发生了变化。
详见:《维生素D与肠道菌群的互作》
缺铁可能导致微生物群组成的显著重组,微生物多样性降低。
详见:《人与菌对铁的竞争吸收 | 塑造并控制肠道潜在病原菌的生长》
如果从婴儿时期开始,住在农村或者养宠物,可能对儿童菌群多样性的建立比较有益。
另外,多去户外活动,亲近大自然。
一项研究对城市环境生物多样性进行人为干预试验,以检测其对儿童共生菌群和免疫调节的影响。在为期28天的生物多样性干预期间,对标准城市托儿所和自然托儿所的儿童进行对比分析,研究儿童皮肤和肠道微生物群以及血液免疫标记物的变化。
干预使环境和皮肤Gammaproteobacteria群落多样化,这反过来又与血浆TGF-β1水平和调节性T细胞比例的增加有关。
该研究发现,生物多样性干预增强了免疫调节途径,降低城市社会中免疫介导疾病的风险。
这可能为未来的预防方法提供了很大的参考价值。
写在最后
跟任何生态系统一样,我们的肠道菌群处于一种微妙的平衡。在不断变化的环境中,我们永远不知道自己会遇到什么新的威胁。
肠道菌群多样性高,能使整体菌群更有能力去抵抗外界的干扰,例如压力,抗生素药物等。
当然,对于“菌群多样性”这个指标,我们也应该理性看待,多样性出现异常高,如果是各类致病菌大量定植,核心菌群难以生存,那么也不利于健康…
肠道菌群检测报告可以帮助我们从更多角度去看待肠道菌群的整体状况,利用机器学习等最新技术,发现潜在的疾病风险,反映不同营养物质摄入比例,应该多吃什么、尽量少吃什么…
每个人对于要达到健康这个目的,可能有不同的路径,饮食需求不能一概而论,“个性化饮食建议”可以成为我们的健康指向标。我们可以利用好它,结合自身健康状态,有针对性地做出饮食或其他干预措施,从而达到更接近理想的健康状态。
主要参考文献:
Fatima Enam, Thomas J Mansell, Prebiotics: tools to manipulate the gut microbiome and metabolome, Journal of Industrial Microbiology and Biotechnology, Volume 46, Issue 9-10, 1 October 2019, Pages 1445–1459
Rinninella, Emanuele et al. “What is the Healthy Gut Microbiota Composition? A Changing Ecosystem across Age, Environment, Diet, and Diseases.” Microorganisms vol. 7,1 14. 10 Jan. 2019, doi:10.3390/microorganisms7010014
Wu Y, Wan J, Choe U, Pham Q, Schoene NW, He Q, Li B, Yu L, Wang TTY. Interactions Between Food and Gut Microbiota: Impact on Human Health. Annu Rev Food Sci Technol. 2019 Mar 25;10:389-408. doi: 10.1146/annurev-food-032818-121303. PMID: 30908952.
Muralidharan J, Galiè S, Hernández-Alonso P, Bulló M, Salas-Salvadó J. Plant-Based Fat, Dietary Patterns Rich in Vegetable Fat and Gut Microbiota Modulation. Front Nutr. 2019;6:157. Published 2019 Oct 11. doi:10.3389/fnut.2019.00157
Fitzgerald E, Lambert K, Stanford J, Neale EP. The effect of nut consumption (tree nuts and peanuts) on the gut microbiota of humans: a systematic review. Br J Nutr. 2021 Mar 14;125(5):508-520. doi: 10.1017/S0007114520002925. Epub 2020 Jul 27. PMID: 32713355.
Azcarate-Peril MA, Ritter AJ, Savaiano D, Monteagudo-Mera A, Anderson C, Magness ST, Klaenhammer TR. Impact of short-chain galactooligosaccharides on the gut microbiome of lactose-intolerant individuals. Proc Natl Acad Sci U S A. 2017 Jan 17;114(3):E367-E375. doi: 10.1073/pnas.1606722113. Epub 2017 Jan 3. PMID: 28049818; PMCID: PMC5255593.
Smith RP, Easson C, Lyle SM, et al. Gut microbiome diversity is associated with sleep physiology in humans. PLoS One. 2019;14(10):e0222394. Published 2019 Oct 7. doi:10.1371/journal.pone.0222394
Spolidoro GCI, Azzolino D, Cesari M, Agostoni C. Diet Diversity Through the Life-Course as an Opportunity Toward Food Allergy Prevention. Front Allergy. 2021;2:711945. Published 2021 Sep 24. doi:10.3389/falgy.2021.711945
Ecklu-Mensah G, Gilbert J, Devkota S. Dietary Selection Pressures and Their Impact on the Gut Microbiome. Cell Mol Gastroenterol Hepatol. 2022;13(1):7-18. doi:10.1016/j.jcmgh.2021.07.009
Merra G, Noce A, Marrone G, et al. Influence of Mediterranean Diet on Human Gut Microbiota. Nutrients. 2020;13(1):7. Published 2020 Dec 22. doi:10.3390/nu13010007
Elena Mengheri, Diet Quality Is Associated with Microbial Diversity and Host Health, The Journal of Nutrition, Volume 149, Issue 9, September 2019, Pages 1489–1490
Wilson, Annette S et al. “Diet and the Human Gut Microbiome: An International Review.” Digestive diseases and sciences vol. 65,3 (2020): 723-740. doi:10.1007/s10620-020-06112-w
Huang C, Feng S, Huo F, Liu H. Effects of Four Antibiotics on the Diversity of the Intestinal Microbiota. Microbiol Spectr. 2022 Mar 21:e0190421. doi: 10.1128/spectrum.01904-21. Epub ahead of print. PMID: 35311555.
Shreiner AB, Kao JY, Young VB. The gut microbiome in health and in disease. Curr Opin Gastroenterol. 2015;31(1):69-75. doi:10.1097/MOG.0000000000000139
Sakkas H, Bozidis P, Touzios C, Kolios D, Athanasiou G, Athanasopoulou E, Gerou I, Gartzonika C. Nutritional Status and the Influence of the Vegan Diet on the Gut Microbiota and Human Health. Medicina (Kaunas). 2020 Feb 22;56(2):88. doi: 10.3390/medicina56020088. PMID: 32098430; PMCID: PMC7073751.

谷禾健康
梭杆菌属(Fusobacterium),是梭菌门最主要的菌属,厌氧革兰氏阴性细菌,与拟杆菌属、普氏菌属、卟啉单胞菌属一样都是医学上重要的厌氧革兰氏阴性杆菌。
梭杆菌属是人类和动物的身体共生菌之一,主要定植在人类和动物的粘膜中,两个最主要的聚集地是口腔和结肠,某些类型物种属于机会性病原体,会引起菌血症和各种快速进展的感染。这些微生物比大多数正常的厌氧菌群更具毒性,产生重要的 脂多糖(LPS),内毒素和溶血素等,这可能是毒力的原因。
其中具核梭杆菌(Fusobacterium nucleatum, 简F. nucleatum)和坏死梭杆菌(Fusobacterium necrophorum,简F. necrophorum) 是可怕的厌氧病原体之一,最常存在于口腔、牙菌斑中,与牙周病、急性坏死性牙龈炎、口腔癌、溃疡性结肠炎、克罗恩病和结直肠癌有关。
此外,梭杆菌与大约一半的头颈部厌氧菌感染有关,包括牙龈和牙齿感染、慢性扁桃体炎、慢性鼻窦炎、中耳炎、咽旁感染以及口腔感染。它们不仅在这些组织中繁盛,而且很容易扩散,有时会引起肿瘤、息肉、囊肿和其他无害组织块的破坏。即使是局部炎症环境的变化也可能导致无功能组织过度生长,因此也称为“癌杆菌”。
梭杆菌属对粘菌素和卡那霉素敏感,这将它们与拟杆菌属和卟啉单胞菌区分开来。一些菌株产生β-内酰胺酶并对青霉素耐药。
梭杆菌
梭杆菌是一种独特的细菌门,是以前研究不足的分类群中的一个主要例子。该门下研究广泛的主要是梭杆菌属。
梭杆菌属细菌是革兰氏阴性、不形成孢子的厌氧菌,球状、多形性小球(坏死梭杆菌)到杆状的一系列细胞形态。当杆状时,梭杆菌细胞具有平行的壁,具有圆形或锥形末端,可分为运动和不运动。
梭杆菌属DNA(G + C)含量约为26~34mol%,正常存在于人或动物的口腔、消化道和土壤中,已知对人和动物致病的有十几种以上,其中主要代表为具核梭杆菌(F. nucleatum)和坏死梭杆菌(F. necrophorum).
在健康人的粪便中,发现以下数量的梭杆菌:
幼儿: 108-109 CFU/g
成人: 107-1010 CFU/g
老年人:108-109 CFU/g
通常,在成人的口腔中,含有 102 -104 CFU/g 的梭杆菌。
在血琼脂上,梭杆菌会形成圆形或不规则的针状菌落,一些物种,如具核梭杆菌,在孵化 3 至 5 天后会形成伞形“煎蛋”菌落。根据菌株的不同,它们可以是溶血的,并且一些菌株具有血凝作用。
临床感染中最常见的梭杆菌属有:
具核梭杆菌、坏死梭杆菌。
它们几乎存在于儿童的所有类型的感染中,包括菌血症,与耳科疾病相关的脑膜炎 ,内脏破裂后的腹膜炎,以及口腔或肛门口附近的皮下脓肿等。
致病梭杆菌在生物膜(特别是软组织)中粘附革兰氏阴性和革兰氏阳性菌斑微生物的卓越能力使其成为一种高度侵入性的病原体。
最常存在于口腔、牙菌斑中,与牙周病、急性坏死性牙龈炎、溃疡性结肠炎和克罗恩病有关。在免疫缺陷中,可引起继发性坏疽和化脓性坏疽过程。对于扁桃体炎,疱疹性口炎,儿童营养不良,免疫缺陷病,可能会发生梭菌病,扁桃体,口腔粘膜的坏死性炎症过程。
梭杆菌具有独特的代谢能力, 梭杆菌细胞通过发酵碳水化合物和蛋白获得能量。这种发酵产生丁酸盐,在某些情况下产生乙酸作为主要的代谢副产物。这是梭杆菌属物种与其他革兰氏阴性、非孢子杆状细菌的区别。
致病性
在革兰氏阴性厌氧菌中,梭杆菌作为主要病原体侵入人类宿主的能力很强。已经描述了许多毒力决定因素,包括白细胞毒素、蛋白水解酶、脂多糖(LPS)和血凝素的表达。
虽然是人体组织正常菌群的一部分,但梭杆菌可以在手术或意外创伤、水肿、缺氧和/或组织破坏后侵入组织。
★ 坏死梭杆菌 (F. necrophorum)
坏死梭杆菌在其细胞壁中含有特别强大的内毒素脂多糖,并产生一种促进凝块形成的凝固酶。此外,它还产生多种外毒素,包括杀白细胞素、溶血素、脂肪酶和细胞质毒素,所有这些都可能导致其致病。
坏死梭杆菌的粘附素和菌毛在宿主细胞附着中起关键作用。
白细胞毒素是已知的坏死梭菌的毒力因子,可能促进脓肿形成。内毒素和溶血素似乎也是脓肿形成和局部感染组织坏死增加的重要毒力因子。血凝素和尚未确定的导致血小板聚集的因素与Lemierre 综合征中发现的血栓形成后果相关性很大。
★ 具核梭杆菌 (F. nucleatum)
具核梭杆菌是少数利用氨基酸分解代谢来提供能量的非产孢厌氧物种之一,能使用谷氨酸、组氨酸和天冬氨酸。梭杆菌代谢通过消耗氨基酸和释放氨自然增加其局部环境的 pH 值,从而使酸敏感细菌(如牙龈卟啉单胞菌)生长。
但是,具核梭杆菌不使用葡萄糖作为其主要能源。现有数据表明,葡萄糖用于细胞内分子的生物合成,而不是能量代谢。具核梭杆菌也可以在低至 5 的 pH 值下存活。
——粘附各种细菌和细胞
具核梭杆菌是革兰氏阳性和革兰氏阴性物种之间物理相互作用的中心物种,可能对生物膜的形成很重要。
F. nucleatum具有外膜,于其细胞外表面上有大量蛋白质,可以发现细菌与宿主细胞表面上的各种互补结构具有特定的相互作用。这种粘附是由粘附素介导的。这种依从性对于易感宿主中感染的定植和建立非常重要。
它是附着在牙齿和上皮表面的共生体与真正的病原体。F. nucleatum有两种物质:菌毛和非菌毛粘附素,用于附着在其他细菌和细胞上。这些物质有助于定植以及细菌发病机制和感染。
——梭杆菌粘附 A (FadA)
梭杆菌粘附A (FadA) 是一种菌毛粘附蛋白,最近被证明是细菌附着和侵入牙龈上皮和内皮细胞所必需的。它在栖息于口腔黏膜的梭杆菌属中是保守的,并且对细胞结合很重要。
FadA 是一种含有 129 个氨基酸的蛋白质,具有 18 个氨基酸的信号肽。它具有一种分泌形式,可导致 β-连环蛋白途径和 Wnt 基因表达上调,这两种重要的发育途径在失调时都是致癌的主要原因。
FadA 的晶体结构揭示了一种独特的“亮氨酸链”结构,该结构在发生突变时会破坏宿主细胞的结合。尽管他们没有确定 FadA 的受体结合位点,但他们认为 FadA 作为细丝发挥作用,该区域的治疗靶点可能适用于未来的临床治疗。
梭杆菌多样性和生态位
从 1880 年代和 1890 年代开始,科学家们在各种人畜共患病和人类样本中发现了梭形杆状物,包括健康和患病的口腔。
以前梭杆菌属区分开来的特征主要是代谢与发酵和分泌的有机酸谱、吲哚和硫化氢的产生以及胆汁敏感性有关。尽管这些指标在区分梭杆菌中无法真正有效,从基因组上层面区分和鉴定梭杆菌属是在测序时代,而且还提高了对梭杆菌内部差异的理解。
目前梭杆菌属鉴定的有30 多个物种,包括:
通过对 16s rRNA 序列的系统发育分组分析,发现F. nucleatum与拟杆菌属和黄杆菌属密切相关。
比较基因组学研究表明,梭杆菌物种之间主要可以分为三个谱系。在这个模型中,F. nucleatum 进化为与牙周梭杆菌的谱系,这些物种不仅共享一个生态位,而且还具有与宿主细胞入侵相关的相似功能。
F. nucleatum本身可进一步划分为四个亚种:nucleatum、animalis、vincentii、polymorphum
虽然有人认为这些亚种在 DNA 水平上有足够的差异,可以被认为是独立的物种。
梭杆菌栖息在人类和动物的粘膜中,是两者的病原体。由于其致病性和寄生性,梭杆菌不会直接影响环境,但它可能会通过对受感染宿主动物菌群的影响来改变生态系统。
常见感染
一些梭杆菌菌株会导致多种人类疾病,包括牙周病、Lemierre 综合征和局部感染或溃疡。
较早的研究表明梭杆菌在人类口咽部很常见,但目前的共识是梭杆菌应始终被视为病原体。与拟杆菌属相比,梭杆菌属具有强效的脂多糖。
在与牙周病统计学相关的所有牙周菌群中,具核梭杆菌是在其他身体部位发现的临床感染中最常见的。
“具核梭杆菌心包炎”——一名疑似感染分枝杆菌的 49 岁男子胸部发现具核梭杆菌心包炎。被认为分枝杆菌是原因,因此对他使用了抗结核药物。然而,这是F. nucleatum导致的。这一发现使人们认识到,具核梭杆菌通过口咽入口进入是导致此类疾病的原因。这是较早的发现之一,即具核梭杆菌也可能影响除口腔以外的其他体腔。
一些身体感染包括:皮肤溃疡、扁桃体周围脓肿、脓肌炎和化脓性关节炎、菌血症、肝脓肿、宫内感染、细菌性阴道病、尿路感染、心包炎和心内膜炎、肺和胸膜肺感染。巧合的是,它更常见于儿童体内。
F. necrophorum 在某些类型的感染中可能具有很强的毒性。在心绞痛后脓毒症(Lemierre 综合征)中,感染始于膜感染,如扁桃体炎,然后发展为伴有转移性感染的败血症,包括肺脓肿、脓胸、肝脓肿、骨髓炎和化脓性关节炎。
梭杆菌属以多种方式与其他细菌相互作用。相对于人类口腔和胃肠道中同时存在的微生物,梭杆菌属可以是互惠者、促进者、拮抗者和/或协同者。
梭杆菌代谢的副产物可以促进其他细菌种类的生长。上面提到的梭杆菌粘附素库就允许与许多不同的菌属共聚集,甚至可以促进其他非侵入性细菌物种的入侵。
担当调解者——连接主要定植菌和厌氧菌——有益牙周健康
F. nucleatum在有助于牙周健康和疾病的生物膜中发挥不可或缺的有益作用。在牙菌斑生物膜中,具核梭菌作为桥梁生物在结构上起到支持作用,将主要定植菌(如链球菌属)与主要厌氧的次级定植菌(牙龈卟啉单胞菌和Aggregatibacter actinomycetemcomitans )连接起来。
许多口腔微生物,包括梭杆菌属是专性厌氧的,并且作为生物膜的一部分存在于口腔的富氧环境中。然而,溶解在唾液中的氧气可能会通过牙龈下生物膜中的通道深入渗透到牙龈下生物膜中。尽管在单一培养中,对氧气极为敏感的口腔菌斑衍生微生物(如牙龈卟啉单胞菌)无法在这种微通气条件下存活,但与更耐氧的具核梭菌共培养可以促进专性厌氧菌的生长,这可能是由于梭杆菌对局部还原条件的贡献。
能在酸性条件存活,增加pH值,促进其他菌生长
除了在低氧水平下生长的能力,F. nucleatum也可以在低至 5 的 pH 值下存活。梭杆菌代谢通过消耗氨基酸和释放氨自然增加其局部环境的 pH 值,从而使酸敏感细菌(如牙龈卟啉单胞菌)生长。除了促进其他细菌的生长,梭杆菌细胞可以将它们的 “同居者” 固定在适当的位置。
梭杆菌属,特别是具核梭杆菌,已显示与所有测试的口腔细菌属可以发生共聚集。然而,这种聚合并不是无差别的。在每个属中,梭杆菌分离物优先与特定的某些菌株而非其他菌株共聚集。由于这种相互作用,具核梭菌是口腔生物膜发育的重要贡献者,是早期和晚期定植者之间的桥梁。
接下来,我们了解一下,F. nucleatum可能与之共聚的细菌。
与肠源性细菌共聚集——协同作用
梭杆菌细菌素可以通过去除特定的口腔和/或肠道微生物来促进其他微生物的生长,从而促进互惠相互作用的选择性。
通过与具核梭菌的侵入性菌株共聚集,一种具有粘附和侵入哺乳动物细胞能力的梭杆菌分离物——非侵入性细菌“乘客”可以穿梭到哺乳动物细胞中。
例如,具核梭菌的侵入性菌株,促进一些源自口腔的非侵入性细菌能够侵入人类口腔细胞。有趣的是,尽管F. nucleatum原产于人类口腔已证明菌株但是能够与人类胃肠道结直肠区域的原生细菌共聚集。
细菌共聚集可能对人类健康产生的影响
这种共聚集能力可能通过协同相互作用在结直肠癌(CRC)的病因中发挥作用。
尽管大量研究调查了结肠微生物群与结直肠癌进展之间的联系,结直肠癌病例相关的细菌包括F. nucleatum、产肠毒素脆弱拟杆菌(ETBF)、致肠致病大肠杆菌(EPEC)、侵入性大肠杆菌(AIEC)、粪肠球菌、弯曲杆菌属和Leptotrichia spp 等。
已发现具核梭杆菌和以上菌可能协同加速结直肠癌进展和/或转移。
早在 1936 年,科学家就将梭杆菌感染与颈静脉血栓性静脉炎联系起来。
最近,梭杆菌感染的发病率有所增加。虽然这种增加的原因尚不清楚,但抗生素使用减少和检测技术改进有关的理论可能解释了这种变化。
临床医生能够发现梭杆菌属感染的早期迹象至关重要,这种感染会迅速出现一系列并发症,如 Lemierre 综合征(心绞痛后脓毒症)、菌血症、骨髓炎和感染性休克。
儿童发病 ↓↓↓
儿科人群中的梭杆菌感染主要影响头部和颈部区域,因为细菌主要存在于口腔内。急性中耳炎是最常见的感染部位,尤其是在 2 岁及以下的儿童中。
一项研究了 27 名中位年龄为 3.5 岁的儿童的梭杆菌感染的神经系统表现,发现其中 5 人出现意识水平下降,7 人在开始治疗前癫痫发作。
厌氧菌引起的中耳感染不到 1%;但是,如果不及时治疗,可能会出现严重的并发症,例如骨膜下和硬膜外脓肿。
菌血症是一种严重的并发症,常见于高达 77% 的儿童梭杆菌病例,可能是由于颅内窦靠近乳突骨所致。在 40% 的患者中也观察到骨髓炎,并且通常是多灶性的,需要长期静脉内抗生素治疗。
成年发病
在免疫功能正常的患者中,男性和女性的发病率相等。最初的症状包括发烧(38°C ~ 39°C)并伴有急性中耳炎,通常进展为乳突炎。实验室评估显示炎症标志物升高:C 反应蛋白水平、白细胞计数和中性粒细胞绝对计数。
梭杆菌引起的脑膜炎罕见且被描述少于 20 次;然而,人们经常注意到它会导致严重的发病率和死亡率。
Lemierre 综合征
有人提出,Lemierre 或 Lemierre 样综合征的发展通常发生在梭杆菌感染中耳之后。这是由于中耳感染延伸到静脉窦血栓形成。
Lemierre 综合征是梭杆菌感染的严重并发症。
在一项对 12 名感染患者的研究中,58% 的患者发展为 Lemierre 或 Lemierre 样综合征。该综合征以颈内静脉脓毒性血栓性静脉炎或血栓形成为特征,可在肺部或其他无菌部位引起脓毒性栓塞性病变。
坏死梭杆菌(F. necrophorum)是导致 Lemierre 综合征的梭杆菌属物种,是造成 10% 的急性咽喉痛和 21% 的复发性咽喉痛的原因,其余由引起由A 组链球菌或病毒引起。
F. necrophorum的其他并发症包括脑膜炎,并发脑静脉血栓形成, 以及泌尿生殖道和胃肠道感染。
菌血症
具核梭杆菌引起的菌血症不常见,但死亡率高
一些危险因素包括恶性肿瘤、年龄较大、酗酒、免疫抑制和透析;通常是通过医院感染。然而,F. nucleatum菌血症的死亡率可达 10%,并且与基础疾病的严重程度相关。
有一项研究调查了有梭杆菌属感染事件病例。研究期间的菌血症(每年 0.55 例/100,000 人),具核梭杆菌是最常见的物种(61%),其次是坏死梭杆菌(25%)。
许多具核梭杆菌菌血症发生在不同的疾病患者(糖尿病、肠道、肺部、肝脏或妇科疾病),其中口咽部、胃肠道、泌尿生殖道和呼吸道,通常是F. nucleatum定植,可能成为感染源。
在强化化疗后患有恶性肿瘤(白血病和淋巴瘤)的血液病患者中,发生了具核梭杆菌菌血症。在大多数情况下,发生在口腔粘膜炎患者中。值得注意的是,F. nucleatum菌血症的病程似乎比由F. necrophorum等梭杆菌属引起的其他菌血症更有利,后者通常会导致 Lemierre 综合征。
F. nucleatum 感染与新冠感染有关
比利时研究团队报告了2020 年 3 月和 2020 年 4 月,比利时布鲁塞尔的 2 家主要医院观察到 4例 具核梭菌感染病例,均与冠状病毒病(COVID-19)患者的严重急性呼吸综合征冠状病毒 2(SARS-CoV-2)感染有关。
在口腔中,细菌、真菌、病毒和古细菌在不同的栖息地自然定殖,包括牙齿、牙龈沟、舌头、脸颊、软硬腭和扁桃体。口腔微生物群是指这些生物的高度多样化和复杂的生态系统。超过 700 种细菌是口腔特有的,而本土口腔菌群则可以防止外来细菌的定居。
口腔菌群的两面性
口腔中的一些细菌是有害的,会导致严重的疾病,而同时也有许多口腔细菌上对预防疾病是有益的。
现在已经确定,许多慢性炎症状况是由宿主-微生物群相互作用之间的不平衡引起的。口腔共生菌在口腔疾病的发展中起着至关重要的作用,包括牙周病和牙齿脱落,以及维持正常的口腔生理环境。此外,已知口腔共生菌参与了肺炎、心血管疾病、糖尿病、痴呆等系统性疾病的发病和发展。
梭杆菌在口腔疾病中的作用
梭杆菌是口腔中常见的专性厌氧革兰氏阴性菌,可充当牙菌斑中早期和晚期定植细菌之间的桥梁,并在口腔和口腔外感染中发挥作用。
具核梭杆菌是一种常见于人类牙菌斑中的细菌。这种细菌已被证明在牙菌斑形成和牙龈炎等其他疾病中起着核心作用。
这是因为它能够粘附广泛的革兰氏阳性和革兰氏阴性菌斑微生物,例如牙龈卟啉单胞菌。与牙周炎以及头部和颈部、胸部、肺部、肝脏和腹部的侵入性人类感染密切相关。由于其粘附能力,它可以与病毒相关联,病毒粘附在宿主组织细胞上作为入侵并调节宿主的免疫反应。
口腔鳞状细胞癌中的梭杆菌
最近已经表明,在口腔鳞状细胞癌(OSCC)组织中检测到梭杆菌一种口腔共生细菌。OSCC 组织表面生物膜内需氧菌和厌氧菌的比例约为 1:2,而健康对照组为 2:1,表明 OSCC 表面为厌氧菌提供了重要的储存库。梭杆菌在 OSCC 组织中的分布可能与健康口腔粘膜组织中的分布不同。
具核梭杆菌侵入上皮细胞
与P. gingivalis相比,F. nucleatum 显着粘附并侵入人牙龈上皮细胞 (HGEC) 。具核梭菌的自发突变体无法侵入HGEC ,这表明它们的侵入需要细菌成分。
此外,葡萄糖抑制试验表明,凝集素样相互作用参与了具核梭菌与 OSCC 细胞的附着。
具核梭杆菌在上皮细胞促进细胞迁移
具核梭杆菌的感染在人类上皮细胞中促进细胞迁移,可能通过刺激 Etk/BMX、S6 激酶 p70 和 RhoA 激酶,并通过激活丝裂原活化蛋白激酶 p38 增加 MMP-13(胶原酶 3)的产生 。
然而,梭杆菌在 OSCC 细胞中的粘附以及具核梭杆菌介导的OSCC细胞侵袭的详细机制仍不清楚。但是,普遍共识认为在OSCC 患者的口腔中富含具核梭杆菌这一事实似乎在口腔癌的肿瘤发生和/或进展中很重要。
具核梭杆菌通过产生有毒代谢物成为牙周病原体
这些有毒成分具有杀死或阻止附近牙周正常细胞(成纤维细胞)增殖的能力。
F. nucleatum形成的硫化物可能为细菌提供了一种避开宿主免疫系统的方法。丁酸(以组织刺激性丁酸的形式)、丙酸和铵离子,由具核梭菌产生,抑制人牙龈成纤维细胞的增殖。
具核梭杆菌有穿透牙龈上皮的能力
且在与牙周炎相关的斑块中,以高水平存在。
因此,它们可能对产生牙龈炎等口腔疾病具有非常重要的作用。
毒素的作用对细胞来说不是致命的,但成纤维细胞增殖的抑制很严重,因为伤口快速愈合的潜力受到了损害。
通过对龈下菌斑样本进行聚类分析,发现牙菌斑中的细菌之间存在特定关联。如下图,如金字塔所示,存在各种细菌。具核梭杆菌在金字塔的中间。
梭杆菌属参与口腔癌发生和癌症进展的示意图
编辑
Fujiwara, Natsumi et al, INT J MOL SCI, 2020
在金字塔中部的物种中,具核梭菌在牙菌斑形成后期的牙齿生物膜中占优势。
如上所述,梭杆菌感染通过各种反应影响 OSCC 的肿瘤发生和发展。然而,梭杆菌的靶分子仍然未知。需要进一步的研究来阐明梭杆菌参与 OSCC 肿瘤发生和发展的证据。
梭杆菌属物种可能与炎症性肠病 (IBD) 有关,包括溃疡性结肠炎和克罗恩病。IBD 是一个已知的危险因素,它是结直肠癌的三个最高风险因素之一。
已报道了几种梭杆菌菌株与 IBD 相关。然而,大多数 (69%) 与F. nucleatum相关。
F. nucleatum和其他梭杆菌属物种可以引发宿主促炎反应,并具有促进它们与宿主上皮细胞粘附的毒力特征以及它们侵入上皮细胞的能力细胞。
因此,与正常邻近组织和健康对照中的水平相比,结直肠癌中的具核梭杆菌富集,这些微生物可能导致肿瘤发生的可能性,可能在有限的患者亚群中,最可能是通过炎症介导的机制。
具核梭杆菌在结直肠癌患者中丰度及作用
最近的一项荟萃分析表明,与邻近的健康组织和对照组的健康组织相比,结直肠肿瘤组织中检测到具核梭杆菌DNA 的几率更高。与对照组的健康组织相比,结直肠息肉组织中的具核梭杆菌DNA 也较高。
结直肠癌患者粪便样本中,具核梭杆菌高
研究表明,结直肠癌患者的粪便样本中F. nucleatum 含量丰富。Meta 分析发现,与健康对照组相比,结直肠癌患者粪便样本中具核梭菌阳性的综合几率更高;与结直肠息肉患者相比,结直肠癌患者更高;但与健康对照相比,结肠直肠息肉患者的情况并非如此。
F. nucleatum已从消化道其他部位的癌症中分离出来,即胰腺 、食道和胃。
肿瘤内具核梭杆菌可能起源于口腔
有趣的是,已经表明结直肠癌中的具核梭杆菌菌株与从口腔中分离的该物种的菌株相同,这表明肿瘤内具核梭杆菌可能起源于口腔。如果来自口腔的具核梭菌在口腔外部位的癌症发展中起作用,那么假设这种细菌可能导致口腔本身的致癌作用是合理的。
具核梭菌感染诱导特定的肿瘤分子事件
F. nucleatum曾经被认为是胃肠道中的被动细菌。然而,现在人们认识到,具核梭菌感染可以在结直肠癌中诱导一系列特定的肿瘤分子事件,包括 CpG 岛甲基化表型、微卫星不稳定性以及BRAF和TP53的基因突变。
肿瘤内有具核梭杆菌的存在,与较差生存率相关
此外,许多这些研究已经确定,肿瘤内有具核梭杆菌的存在与较差的生存率有关 。还观察到,具核梭杆菌感染与更差的临床病理学特征相关,例如更大的肿瘤、更差的分化、淋巴结和远处转移、晚期肿瘤分期和更深的肿瘤侵袭。
总之,结直肠癌微生物组的基因组分析揭示了这些癌症中梭杆菌属的显着富集,尤其是与具核梭杆菌、死亡梭菌和坏死梭杆菌具有最大相似性的种系型。这种富集通过肿瘤组织的组织学分析以及结肠肿瘤转移中梭杆菌DNA 的鉴定得到证实。
梭杆菌介导结直肠癌发生,随着肿瘤转移进肝脏
2017年发表在《Science》肠道细菌Fusobacterium介导结肠癌的发生及伴随肿瘤的转移。作者进行以下操作:
结果发现,10个患者里面,只有2个患者的原位病灶和肝转移病灶中Fusobacterium含量不一样,其他8个病人是高度吻合的(Fuso-qPCR)。
由以上结果我们可以得知:Fusobacterium阳性的患者中,原发灶和肝转移灶中的细菌谱是高度相似的。Fusobacterium很有可能能够随着结肠癌一起进入肝脏。
接下来,作者从病人体内分离出Fusobacterium,通过给小鼠口服Fusobacterium,发现可以诱导结肠癌的产生。同时再次分离小鼠结肠癌中的细菌,通过测序发现,小鼠结肠癌中的细菌谱跟之前病人结肠癌中的细菌谱也是高度一致的。
是否可通过抗生素消灭具核梭杆菌及其他细菌,能否抑制结肠癌的生长?
作者先使用了没有Fusobacterium的细胞系HT-29,通过皮下成瘤,发现甲硝唑并不能够抑制肿瘤的生长。然后使用了从结肠癌患者的肿瘤组织中分离出Fusobacterium,诱导产生结肠癌。发现甲硝唑能够显著抑制肿瘤的生长。
具核梭杆菌高与复发相关
此外,上海交通大学仁济医院房静远教授团队在《Cell》上发表了相关论文,发现在肿瘤复发患者中肠菌具核梭杆菌含量明显升高,并明确了该菌诱导癌细胞自噬而导致化疗耐药与肿瘤的术后复发机制,从而引起大肠癌患者五年生存率降低。
另外,2017年发表在《Gastroenterology》上复旦大学肿瘤研究所领衔完成和《Oncotarget》(由西南医科大学领衔完成)杂志上的两篇也从另外的角度阐述了具核梭杆菌促进肿瘤发生发展的分子机制。
总结一下梭杆菌与结肠癌的进展:
1)研究发现Fusobacterium在结肠癌组织中大量富集;
2)研究发现Fusobacterium能够抑制免疫,减少T细胞的在肿瘤组织中的浸润;
3)研究发现Fusobacterium能够促进结肠癌的发生和发展,通过给小鼠口服Fusobacterium可以诱导结肠癌的产生;
4)研究发现Fusobacterium在结肠癌原位和肝转移灶都能检测到,意味着Fusobacterium可能能够跟随肿瘤细胞一起转移到肝;
5)研究发现使用抗生素消灭Fusobacterium后可以抑制结肠癌细胞的生长(这里使用甲硝唑做实验并不代表今后治疗中可以直接使用,毕竟这是个广谱抗生素)。
那这些研究对我们临床有什么启示呢?
近些年来的很多研究都表明,Fusobacterium与结直肠癌的发生有很大的关联性。我们知道肿瘤防治重点在于防而不在于治。关于肿瘤跟细菌的相关研究,大家最熟悉的是幽门螺杆菌和胃癌的研究。
2017年8月《Nature》首度报道了幽门螺杆菌导致胃癌发生的机制。通过对幽门杆菌的清除可以将胃癌的患病风险降低65%,那么通过以后监测Fusobacterium以及清除Fusobacterium可能为以后结肠癌的预后提供新的思路。同时,为什么Fusobacterium能够介导结肠癌的发生也同样值得研究。
越来越多的证据表明,微生物会影响癌症治疗的效果。具核梭杆菌在具有不同微卫星不稳定性 (MSI) 状态的结直肠癌中,诱导不同的免疫反应。
增强PD-L1阻断剂疗效
高F. nucleatum水平与结直肠癌患者对 PD-1 阻断的治疗反应改善相关。此外,F. nucleatum增强了 PD-L1 阻断剂对小鼠结直肠癌的抗肿瘤作用并延长了生存期。结合F. nucleatum补充免疫疗法,挽救了 PD-L1 阻断的治疗效果。
激活信号,诱导 PD-L1 表达
此外,具核梭杆菌通过激活 STING 信号传导诱导 PD-L1 表达,并在 PD-L1 阻断治疗期间增加干扰素-γ (IFN-γ) + CD8 +肿瘤浸润淋巴细胞 (TIL) 的积累,从而增强肿瘤对PD-L1 阻断。
最后,源自患者的类器官模型表明,增加的具核梭菌水平与改善对 PD-L1 阻断的治疗反应相关。这些发现表明,F. nucleatum可能会调节结直肠癌的免疫检查点治疗。
1
与其他微生物共聚集
F. nucleatum是早期和晚期定植者之间的关键“桥梁”生物,其外膜粘附素 Fap2 部分负责促进多物种生物膜的形成 。当口腔生物膜中报告牙龈卟啉单胞菌(P. gingivalis)时,始终存在F. nucleatum,这表明它先于该物种,并且是其殖民化所必需的。
P. gingivalis是一种酸敏感细菌,但F. nucleatum可以通过发酵谷氨酸和天冬氨酸产生氨,从而为P. gingivalis定殖提供更中性的环境。
F. nucleatum和P. gingivalis可能协同工作,通过引发慢性炎症来促进肿瘤变化,刺激了人 OSCC 细胞的体外增殖 。
白色念珠菌是一种机会性致病酵母,常见于胃肠道和口腔。最近的真菌生物组研究表明,OSCC 中包括白色念珠菌在内的几种真菌种类的丰度增加 。众所周知,口腔中的念珠菌属具有乙醇脱氢酶,负责催化酒精产生乙醛,乙醛是一种有效的致癌物质 。已经表明,具核梭菌与念珠菌共聚集,这可以促进定殖。念珠菌口腔白斑的定植与F. nucleatum水平升高有关。F. nucleatum可能通过增加口腔黏膜与念珠菌产生的乙醛的接触而间接增加口腔癌的风险。
2
激活细胞增殖
最简单的癌症是不受控制的细胞生长,而有核梭菌已被证明通过与内皮钙粘蛋白(E-钙粘蛋白)相互作用来影响癌细胞的增殖。梭杆菌 FadA 与在宿主细胞膜表面表达的 E-钙粘蛋白结合。E-cadherin 是一种通过 β-catenin 发挥作用的肿瘤抑制因子。梭杆菌 FadA 与 E-cadherin 的相互作用激活 WNT/β-catenin 信号传导,导致细胞增殖并增加致癌和炎症基因的表达。
类似地,已显示F. nucleatum通过激活 Toll 样受体 4 (TLR4) 向 MYD88 发出信号来增加小鼠异种移植物中的 CRC 增殖,从而导致核因子 NFκB 的激活和 miR21 的表达增加;这种 miRNA 降低了负责控制细胞增殖和分化的 RAS GTPase RASA1 的水平 。
由细胞周期蛋白激活的细胞周期蛋白依赖性激酶促进细胞周期进程。F. nucleatum感染与细胞周期蛋白 D1 的激活有关,这促进了肠道肿瘤的发生 。在 OSCC 中,F. nucleatum和P. gingivalis均被证明能够通过上调 cyclin D1 和 c-Myc显着刺激 OSCC 细胞增殖。
TLR4 的细菌激活导致白细胞介素 6 (IL-6) 的表达增加,白细胞介素 6 (IL-6) 反过来又激活了 STAT3,这是一种负责调节细胞周期蛋白 D1 和 c-Myc 的关键信号分子 。而且,F. nucleatum通过降低 p27(一种细胞周期蛋白依赖性激酶抑制剂)的表达和加速细胞周期来引起 DNA 损伤并促进口腔癌细胞的细胞增殖 。此外,具核梭菌下调 DNA 修复蛋白 Ku70 和 p53,从而削弱细胞修复能力。
最近的一项研究发现,HNSCC 中具核梭菌的富集与宿主基因启动子甲基化有关,包括肿瘤抑制基因LXN和SMARCA2的高甲基化。SMARCA2是一种参与与 DNA 修复和复制相关的 ATP 依赖性染色质重塑的基因。这表明F. nucleatum感染可能通过表观遗传沉默导致细胞增殖。
3
炎症的诱导
F. nucleatum的促炎潜力已得到充分证明,因为它可以促进活性氧 (ROS) 的产生和细胞因子的产生 。慢性炎症在致癌过程中起着关键作用,并且可以解释牙周炎与 OSCC 高风险之间的密切关联。已发现具核梭菌与 CRC 和 OSCC 中的高细胞因子水平相关,从而产生支持肿瘤进展的炎症微环境 。LPS,存在于细胞外膜中F. nucleatum激活 TLR4 介导的 NF-κB 信号通路以产生促炎细胞因子,如 IL-6、IL-8 和肿瘤坏死因子 α 。
4
抗肿瘤免疫反应
F. nucleatum在 ApcMin/+ 小鼠模型中已显示将骨髓来源的抑制细胞募集到肿瘤微环境中。髓源性抑制细胞可抑制 T 细胞增殖并诱导 T 细胞凋亡 。
这与最近发现的F. nucleatum的数量与结肠直肠癌和乳腺癌组织中 CD3 和 CD4 T 细胞的密度之间的负相关的发现一致。
还观察到 OSCC 中具核梭菌负荷与 B 淋巴细胞、CD4 T 辅助淋巴细胞、M2 巨噬细胞和成纤维细胞的标志物之间存在显着负相关。
F. nucleatum抑制蛋白还可以通过将细胞阻滞在细胞周期的 G1 期来抑制人类 T 细胞活化 。梭杆菌 Fap2 粘附素结合并激活具有 Ig 和 ITIM 结构域 (TIGIT) 的 T 细胞免疫受体,TIGIT 是 T 细胞和自然杀伤 (NK) 细胞中的一种免疫调节信号受体。这种 Fap2-TIGIT 相互作用可保护具核梭菌和附近的肿瘤细胞免于被免疫细胞杀死。局部免疫抑制也可能发生,因为有核梭菌的Fap2和 RadD 外膜蛋白会诱导淋巴细胞中的细胞死亡。
F. nucleatum还通过促进有核梭菌相关 CRC中巨噬细胞的 M2 极化发挥免疫抑制作用,可能通过 TLR4/IL-6/p-STAT3/c-MYC 信号通路。
5
细胞迁移和侵袭
基质金属蛋白酶 (MMP) 是一个锌依赖性内肽酶家族,它们共同能够降解细胞外基质 (ECM) 的所有成分。MMP 在 ECM 过度降解的病理状况中发挥作用,包括肿瘤侵袭和转移。P. gingivalis和F. nucleatum都可以通过不同的机制产生 MMP,从而促进癌细胞的侵袭和转移。
在 OSCC 中,已观察到暴露于牙龈卟啉单胞菌和具核梭菌导致 MMP-1 和 MMP-9 的诱导。同样,与F. nucleatum一起孵育的 AT3 小鼠乳腺癌细胞也表现出 MMP-9 的过表达。
上皮-间质转化 (EMT) 定义为上皮细胞采用间充质表型的过程,是在癌症发展和进展中观察到的现象。
一般来说,进入 EMT 的细胞表现出上皮标志物(如 E-钙粘蛋白)的下调和间充质标志物的上调,包括神经钙粘蛋白(N-钙粘蛋白)和波形蛋白 。这种细胞分化行为的转变是由一组转录因子控制的,包括锌指 E-box 结合同源框 1 和 2 蛋白 (ZEB1/2)、SNAIL 和 TWIST。
CRC 中高水平的具核梭杆菌与 E-cadherin 表达呈负相关,但与 N-cadherin 表达呈正相关。同样,OSCC 细胞系暴露于F. nucleatum与 E-cadherin 转录的显着降低以及 N-cadherin、vimentin 和 Snail 的上调有关。
F. nucleatum可以上调ZEB1 在口腔癌细胞中诱导这种间充质状态,一种先前已在H. pylori感染的胃上皮细胞中发现的机制。
痛风
痛风患者中普氏杆菌(Prevotella)、梭杆菌(Fusobacterium)和拟杆菌(Bacteroides)的相对丰度增加,而肠杆菌科(Enterobacteriaceae)和产丁酸盐菌的相对丰度减少。
胃肠道肿瘤
梭杆菌属(Fusobacterium)在胃肠道肿瘤的发生和发展中起重要作用。与正常组织样本,尤其是正常血源性样本相比,原发肿瘤中梭杆菌较多。泛癌分析还显示,在原发肿瘤组织和邻近正常组织样本中,将所有胃肠道癌(n = 8)与非胃肠道癌(n = 24)进行比较时,梭杆菌丰富度都是较高的。
胰腺导管腺癌
与其他肿瘤相比,胰腺导管腺癌中的肿瘤相关细菌 Gammaproteobacteria较多,尤其是肠杆菌Enterobacterales,与胃癌和结肠癌不同的是,它们的梭杆菌fusobacteria 较少。
口腔和唾液微生物群组成的改变与PDAC(胰腺癌主要是指胰腺导管腺癌,简称PDAC)的风险相关。最近的研究表明,口腔中参与PDAC肿瘤发生的主要致病菌有:
在健康对照组和胰头癌患者中分别观察到嗜血杆菌、卟啉单胞菌、纤毛杆菌、梭杆菌的丰度有显著差异。
PDAC肿瘤内梭杆菌的定殖与PDAC患者的预后更差相关。这项研究的结果表明,梭杆菌属可以作为PDAC的预后生物标志物。
梭杆菌的严重程度和传播范围,决定了所需治疗程度
一般所有梭杆菌感染都必须用抗生素治疗,并且通常对 β-内酰胺类药物敏感,例如青霉素或头孢菌素或其衍生物。
一些梭杆菌菌株被发现含有 β-内酰胺酶,因此建议使用特定的厌氧抗生素,例如甲硝唑或克林霉素。
适当的抗生素治疗与手术清创相结合可预防并发症
抗生素治疗通常通过肠胃外给药 1 至 2 周,然后进行大约 10 天的口服治疗。有些孩子需要切除坏死组织或手术引流。
在一项对 7 名小于 2.2 岁的梭杆菌感染患者的监测研究中,除了乳突切除术外,所有患者都需要一根通气管。
在以色列对 22 名感染梭杆菌的儿童进行的一项为期 14 年的研究中,5 名出现 Lemierre 综合征的患者中有 3 名接受了低分子量肝素治疗以缓解脑窦静脉血栓形成的症状,但是该治疗仍存在争议。
一项 40 年文献回顾确定了, 12 例 2 岁以下儿童的梭杆菌感染病例;所有儿童都出现了乳突炎,并接受了乳突切除术和抗生素治疗,无论严重程度如何,都取得了成功。
早期发现和适当治疗,可以有效阻止和逆转感染的进展
梭杆菌感染在 2 岁及以下的儿童中,临床表现为急性中耳炎,但如果不及时治疗,则会发展为乳突炎和更严重的菌血症、骨髓炎症状,并可能出现 Lemierre 综合征和感染性休克。
使用适当的抗菌检测技术以及适当的成像程序应允许及时使用抗生素和手术参与,以防止感染的进一步传播。
虽然对梭杆菌感染的研究和分析有限,但对感染症状和严重程度的重要认识可以帮助临床医生发现感染的早期发作并将患者引导至适当的专科医生处。
口腔牙周病感染中,高达 90% 的菌群由专性厌氧菌组成,钙化合物已被证明是牙科中有价值的材料。钙与酯的配方在牙齿结构的愈合过程中表现出显着的特性。根据国外“Calcium Therapy Institute”研究所的介绍,他们长达16 年的时间里,发现使用钙化合物来开发治疗牙髓和牙周(牙龈和骨)感染的牙周治疗钙法 (CMPT)具有重要意义。
口腔厌氧菌分散的一个原因是梭杆菌在上颌骨中获得了稳定的立足点,以增殖并将其大量的毒素释放到多孔的上颌骨、上颚和下牙列中。这个过程与人体正常的进食、呼吸、说话和吸吮机制相联系,是梭杆菌对人体细胞异常失衡的完美寄生关系。
北美该研究人员最近报告了的一项突破,发现厌氧细菌被局部刺激或炎症所吸引,会开启“饥饿触发”信号,向侵袭性细菌发出信号,释放一种酶以减少抗生素的影响。
这种自我饥饿细菌的“饥饿信号”会产生一种冬眠状态,或者说是防御状态,直到不再使用抗菌药物。他们进入休眠状态,只是为了在更有利的条件下重新发动进攻。
该研究所实验人员发现舌下颌下腺唾液肽的生物学特性,以及用于根管和牙周治疗的钙材料有助于深入了解答案。
它们是具有解热、抗炎、定时释放特性的非类固醇。几项临床研究表明,长期摄入唾液腺分泌物和对组织有益的钙材料具有积极的全身作用。
——降低有害菌的复制率
在 1980 年代中期,一些的血清研究表明,某些钙质材料不会杀死细菌,而是“降低”它们的复制率,而流行的抗菌剂在几毫秒内杀死一切,包括健康的细胞和细菌。在那项研究中,根据对口腔组织钙治疗的多年临床观察,消除细菌需要十个小时。关键因素是时间。
鉴于饥饿细菌的发现,钙材料会发出警报,但不会造成伤害。
——饿死那些“自我饥饿的细菌”
几十年来,钙疗法已被证明对口腔或皮肤的任何正常健康细胞无害,同时它们还能维持环境“围攻”。不是直接杀死它们,而是逐渐将饥饿细菌饿死。
然后,由于几乎没有复制能力,它们开始消亡,而健康细胞迅速蓬勃发展并主导该领域,尤其是在定时释放钙离子的情况下。
如果厌氧梭杆菌最常存在于口腔、牙菌斑中,并且与牙周病和炎症性牙龈炎有关,那么梭杆菌的下一个最有利的栖息地是结肠,可以刺激溃疡性结肠炎、癌症和克罗恩病。
口腔和结肠这两个区域很容易受到异常水平的梭杆菌的影响,这会长时间造成炎症环境并增强细胞的扩散或分布,甚至会扩散到以厌氧微生物而臭名昭著的身体远处器官。众所周知,生物膜菌落容易引起囊性和脓肿感染。
梭杆菌的管理,中和它们的毒素仍然在控制厌氧微生物环境的范围内。同样,健康的一个主要考虑因素是限制侵入性病原体的局部和全身传播。
从用钙材料管理口腔环境可以明显看出,下颌前切牙上的斑块沉积快速愈合和减少。对口腔黏膜和牙周组织进行长期钙治疗的患者会显著减少牙菌斑和牙石。
考虑到梭杆菌的两个最主要的聚集地,口腔和结肠,那么未来继续研究钙材料应该是价值的。这种病原体比预期的更容易控制,至少在口腔和下消化道的炎症和感染的早期阶段是如此。
声明:关于药物、诊断和治疗方法的部分中提供的信息仅供医疗专业人员交流使用,并非使用说明。
主要参考文献:
Brennan CA, Garrett WS. Fusobacterium nucleatum – symbiont, opportunist and oncobacterium. Nat Rev Microbiol. 2019 Mar;17(3):156-166. doi: 10.1038/s41579-018-0129-6. PMID: 30546113; PMCID: PMC6589823.
Susan Bullman et al. Analysis ofFusobacteriumpersistence and antibiotic response in colorectal cancer, Science (2017). DOI: 10.1126/science.aal5240
Castellarin M, Warren RL, Freeman JD, Dreolini L, Krzywinski M, Strauss J, Barnes R, Watson P, Allen-Vercoe E, Moore RA, Holt RA. Fusobacterium nucleatum infection is prevalent in human colorectal carcinoma. Genome Res. 2012 Feb;22(2):299-306. doi: 10.1101/gr.126516.111. Epub 2011 Oct 18. PMID: 22009989; PMCID: PMC3266037.
Kostic AD, Gevers D, Pedamallu CS, Michaud M, Duke F, Earl AM, Ojesina AI, Jung J, Bass AJ, Tabernero J, Baselga J, Liu C, Shivdasani RA, Ogino S, Birren BW, Huttenhower C, Garrett WS, Meyerson M. Genomic analysis identifies association of Fusobacterium with colorectal carcinoma. Genome Res. 2012 Feb;22(2):292-8. doi: 10.1101/gr.126573.111. Epub 2011 Oct 18. PMID: 22009990; PMCID: PMC3266036.
Vidaurrazaga MM, McKinley GF, Camins BC. Postpartum Fusobacterium gonidiaformans bacteremia. Anaerobe. 2020 Apr;62:102168. doi: 10.1016/j.anaerobe.2020.102168. Epub 2020 Jan 28. PMID: 32045837.
Centor RM, Huddle TS. Should the risk of Fusobacterium necrophorum pharyngotonsillitis influence prescribing empiric antibiotics for sore throats in adolescents and young adults? Anaerobe. 2021 Oct;71:102388. doi: 10.1016/j.anaerobe.2021.102388. Epub 2021 Jun 2. PMID: 34089856.
Duncan SH, Hold GL, Harmsen HJM, Stewart CS, Flint HJ. Growth requirements and fermentation products of Fusobacterium prausnitzii, and a proposal to reclassify it as Faecalibacterium prausnitzii gen. nov., comb. nov. Int J Syst Evol Microbiol. 2002 Nov;52(Pt 6):2141-2146. doi: 10.1099/00207713-52-6-2141. PMID: 12508881.
Arane K, Goldman RD. Fusobacterium infections in children. Can Fam Physician. 2016 Oct;62(10):813-814. PMID: 27737977; PMCID: PMC5063768.
Peluso EA, Scheible M, Ton-That H, Wu C. Genetic Manipulation and Virulence Assessment of Fusobacterium nucleatum. Curr Protoc Microbiol. 2020 Jun;57(1):e104. doi: 10.1002/cpmc.104. PMID: 32539234; PMCID: PMC7398570.
Broadley M, Schweon SJ. Get the facts about Fusobacterium. Nursing. 2017 May;47(5):64-65. doi: 10.1097/01.NURSE.0000515524.23032.d5. PMID: 28445341.
Tadepalli S, Narayanan SK, Stewart GC, Chengappa MM, Nagaraja TG. Fusobacterium necrophorum: a ruminal bacterium that invades liver to cause abscesses in cattle. Anaerobe. 2009 Feb-Apr;15(1-2):36-43. doi: 10.1016/j.anaerobe.2008.05.005. Epub 2008 May 24. PMID: 18595747.
Mark J. Manhart DDS, Thomas B. Steg DDS,2011, Calcium Method of Fusobacteria Management. Alciumtherapy.com

谷禾健康


如果说前一篇文章《微生物组-神经免疫轴:心血管疾病的预防和治疗希望》更多的是借助心血管疾病(CVD),来宏观地阐述肠道-神经免疫-菌群之间的关联,那么这篇文章更多地是具体讨论肠道菌群及其代谢产物参与CVD疾病的发生发展,以及饮食和微生物群的串扰机制,基于上述理论,从更实际具体的角度来了解饮食相关的干预措施及其对健康的影响。
越来越多的研究表明,肠道菌群作为一个不可或缺的“隐形器官”,在人类新陈代谢和包括心血管疾病在内的疾病状态中发挥着至关重要的作用。
在可能影响肠道微生物群的许多内源性和外源性因素中,饮食成为宿主-微生物群关系的重要组成部分,可能与 CVD 易感性有关。
本文主要介绍肠道微生物群饮食调节的主要概念,及其参与心血管疾病发展。还讨论了调节 CVD 进展的饮食-微生物群串扰的机制,包括内毒素血症、炎症、肠道屏障功能障碍和脂质代谢功能障碍。也阐述了关于微生物群产生的代谢物,包括三甲胺-N-氧化物、次级胆汁酸、短链脂肪酸以及芳香族氨基酸衍生的代谢物如何在 CVD 发病机制中发挥作用。最后,列举了与肠道微生物群相互作用的潜在饮食干预措施,作为 CVD 管理的新型预防和治疗策略。
在了解CVD中基于菌群的饮食干预之前,首先我们来了解一下,饮食变化对肠道微生物群可能产生哪些影响?
主要可概括为三个方面:
(1) 快速/短期效应
对在植物性(高纤维)之间切换的人类受试者和以动物为基础的(高脂肪)饮食的研究表明:
所有受试者的微生物群组成在 1-2 天内发生变化,厚壁菌门在植物性饮食中代谢膳食纤维的丰度增加,在动物性饮食中耐胆汁微生物Alistipes和Bilophila增加。然而,即使经过 10 天的干预,短期饮食改变对肠型也没有影响。
(2) 长期影响
尽管微生物群落迅速调节,但长期的饮食干预不仅与成分改变有关,还与生理变化有关。
例如,用高脂肪饮食 (HFD) 喂养大鼠 8 周或 12 周会导致肠杆菌门(变形杆菌门)的丰度增加,这与全身炎症、肠道通透性和肥胖表型的升高相结合。相反,人类队列干预 3 个月的低碳水化合物或低脂肪健康饮食导致 14 或 12 种与体重减轻相关的菌群变化,这表明长期干预是必要的。此外,肠型主要与长期饮食影响而不是短期影响有关。
(3) 特定饮食引起的特定微生物变化
例如,膳食纤维的摄入促进了肠道微生物群的丰度或多样性以及厚壁菌门的增加。抗性淀粉饮食干预下 Ruminococcus bromii 增多。
有趣的是,不仅是微生物组成,还有特定的微生物代谢与特定的饮食和疾病模式相关。例如,富含红肉饮食的受试者血浆中的三甲胺-N-氧化物 (TMAO)(红肉中胆碱的肠道微生物代谢产物)比素食者多。已在人类受试者中发现 TMAO 水平升高,肠型普氏菌比例较高,并且与 CVD 风险增加有关。
人类队列中与心血管疾病相关的肠道微生物群的改变


Xufei Zhang,et al., Comput. Struct. Biotechnol. J. 2022
在健康状态下,适当的肠道屏障提供了抵御病原体的关键第一道防线,它由多种生理成分支持,包括粘液层、由紧密连接蛋白连接的上皮细胞和免疫细胞。
然而,心力衰竭或高血压的 CVD 患者经常观察到肠道屏障功能障碍,伴随全身微生物成分LPS和炎症的增加。
那么CVD过程中,引发肠道渗漏和炎症的风险因素是什么?
其中一个假设是,长期食用西方饮食或 HFD 会导致生态失调并损害肠道屏障,从而增强 LPS 易位和全身炎症,导致心血管疾病风险增加。
有鉴于此,富含饱和脂肪或反式脂肪酸的饮食摄入量较高与 CVD 风险的增加高度相关,而饮食中饱和脂肪的摄入量较低可使 CVD 降低约 30%。
在大型队列研究中,长期(6 个月)食用 HFD 会导致微生物菌群失调,其中革兰氏阴性菌(如Alistipes和Bacteroides)的比例增加,同时参与 LPS生物合成的基因水平更高。同时,已发现膳食脂肪通过激活促炎细胞因子(例如 TNF-α、IFNγ 和 IL-1β)的分泌来损害肠道屏障。促炎细胞因子的上调进一步激活 MLCK(肌球蛋白轻链激酶)信号通路,重组紧密连接蛋白,包括occludin、ZO-1(Zonula occludens-1)并导致肠漏。
当肠道屏障被破坏时,LPS或病原体可能转移到循环中,引起内毒素血症,从而刺激全身性促炎细胞因子的释放。一旦在血流中易位,内毒素可以通过与细胞表面的 TLR-4(Toll 样受体 4)相互作用来触发内皮细胞的损伤,并增强 ROS(活性氧)的产生,从而降低内皮细胞 NO(一氧化氮)的生物利用度导致形成斑块和动脉粥样硬化病变。
这一假设已在动物模型中得到证实,其中 ApoE-/-西方饮食下的小鼠动脉粥样硬化病变加重,变形菌(革兰氏阴性促炎细菌)和全身 LPS 水平显着增加。
此外,西方饮食促进炎症细胞因子(如 TNF-α 和 IL-1β)的上调,增加肠道通透性,同时修饰 ApoE-/- 小鼠中的紧密连接蛋白(如 occludin)。
然而,在人类队列中仍然缺乏数据来解释,由于西方饮食导致的肠道屏障受损和相关的内毒素血症增加在什么情况下会诱发CVD发病机制。
除了饮食-微生物群对炎症和肠道屏障功能的相互作用外,肠道微生物还通过宿主脂质代谢影响 CVD。
越来越多的动物和人类研究表明,肠道微生物群与脂质代谢紊乱有关,如血脂异常或高脂血症,它们是 CVD 发展的主要危险因素。
肠道微生物群将胆固醇转化为粪(甾)醇降低胆固醇
例如,GF 小鼠的胆固醇代谢发生了改变 ,而ApoE -/-小鼠肠道微生物群的消耗导致与传统的 ApoE -/-小鼠相比,血浆胆固醇伴有更大的主动脉病变。
此外,从高血浆胆固醇人类到小鼠的微生物群移植引发了上调循环胆固醇的表型以及肝脏胆固醇合成 的减少。
这可能是由于肠道微生物群将胆固醇转化为粪(甾)醇,这可以促进体内胆固醇的消除和降低胆固醇血症。
胆固醇代谢的数学模型已经证实了这一点,最近发现肠道菌群的胆汁盐代谢和胆固醇向粪(甾)醇的转化都会影响血液中的胆固醇水平。
此外,最近对人类队列进行的一项有趣的研究也证实了这一点,并确定了含有胆固醇代谢酶ismA的Eubacterium coprostanoligenes等粪(甾)醇形成菌的个体,粪便胆固醇水平显著降低,血清总胆固醇显著降低。
然而,在斑块面积较小的无菌 ApoE-/- 小鼠中也发现了有争议的结果,尽管血浆总胆固醇(TC)上调可能是由于缺乏与无菌状态相关的内毒素。
有趣的是,肠道微生物群的缺失似乎减弱了长期膳食脂质消耗的致动脉粥样硬化作用。
具体而言,与传统小鼠相比,HFD 喂养的无菌 Ldlr-/- 小鼠的血栓大小显着减小。尽管无菌和常规 Ldlr-/- 喂食 HFD 小鼠的血浆 TC 水平没有差异,但与喂食的无菌小鼠相比,富含脂质的饮食仍然诱导无菌小鼠的 TC 水平(TC≈1.6 mg/dlx103)约两倍配合食物(TC≈0.8 mg/dlx103)。
相比之下,HFD 诱导常规小鼠血浆 TC 增加约 8 倍(TC ≈1.6 mg/dlx103) 与以食物喂养的小鼠相比 (TC≈0.2 mg/dlx103 )。在这项研究中也发现了 VLDL 的类似发现。富含脂质的饮食还加剧了 Ldlr -/-小鼠的微生物群失调,梭菌科、葡萄球菌科、芽孢杆菌科的丰度增加,乳酸杆菌科的丰度降低。然而,最近的研究表明,在晚期主动脉粥样硬化方面,无菌Ldlr-/-与常规小鼠之间没有发现显着差异。
总之,不同的研究表明肠道微生物群对血脂代谢。这种影响对 CVD 发展是否具有保护作用或加重作用仍不清楚。这种差异可能取决于动物模型、动物年龄、饮食类型、喂养期以及住宿条件。未来的研究可以将这些因素纳入考虑范围,以便进行更好的调查。
TMAO,是一种饮食诱发的心血管疾病风险微生物生物标志物。
★ 饮食-肠道菌群代谢物TMAO(三甲胺-N-氧化物)
这是一种从饮食营养素衍生的肠道微生物共同代谢物,十年前首次被发现并被报道预测CVD的风险。饮食前体磷脂酰胆碱、胆碱和L-肉碱通常存在于奶酪、红肉、海鲜、蛋黄和其他西式营养素中,主要由特定的肠道微生物酶代谢,产生高水平的三甲胺(TMA)。
具体而言,含有功能性微生物CutC/D基因的TMA裂解酶负责胆碱相关TMA转化。TMA进一步被血液吸收,并在肝脏中被黄素单加氧酶(FMO,主要是FMO3)氧化,生成TMO。
在人类肠道中发现了七种不同的表达TMA裂解酶CutC/D的菌株,包括:
此外,TMA可以通过微生物里斯克型左旋肉碱加氧酶CntA/B从左旋肉碱合成。
虽然CntA/B编码基因已在变形杆菌中鉴定,但尚未证明共生肠道微生物群形成依赖于L-肉碱的TMA。然而,最近的一项研究发现,两种细菌菌株Emergencia timonensis和Ihubacter Massilensis的新组合在肉碱转化的TMA积累中具有潜在的重要作用。
有趣的是,最近发现的细菌E.timonensis通过L-肉碱促进TMAO的产生→ γ-BB(γ-丁基甜菜碱,肉碱的前体)→ TMA→ TMAO途径。然而,与肉碱TMA转化途径相关的特定共生微生物群仍需进一步发现。
★ 饮食-微生物群衍生的TMAO在CVD发病机制调节中的作用
最初的研究表明,高胆碱或肉碱饮食饲养的小鼠循环TMAO水平升高,巨噬细胞泡沫细胞形成的增加和主动脉粥样斑块形成的增强(图1)。
相反,在无菌或抗生素治疗的ApoE−/−小鼠中,TMAO产生能力和胆碱或肉碱饮食相关的动脉粥样硬化斑块负荷分别被消除或抑制 (C57BL/6株)。有趣的是,ApoE−/− 研究发现,当从高TMA/TMAO产生的供体C57BL/6小鼠接受盲肠微生物群移植时,小鼠比从低TMA/TMAO产生的供体NZW/LacJ小鼠产生更高的胆碱饮食依赖性主动脉病变聚集。
类似地,在无菌小鼠体内移植产生高TMA的微生物可诱导血小板高反应性,并增强与高血浆TMAO水平相关的血栓形成。
因此,微生物群对于TMAO的产生是必要的,TMAO通过以下几种机制参与动脉粥样硬化的进展:
1)泡沫细胞形成
微生物群衍生的TMAO可以激活应激诱导的热休克蛋白(HSP)HSP70或HSP60的表达,这可能触发巨噬细胞中清道夫受体(例如SR-A1)和CD36的激活,以刺激氧化低密度脂蛋白(ox-LDL)的摄取和泡沫细胞的形成。
2)炎症
TMAO通过激活Ldlr中的丝裂原活化蛋白激酶(MAPK)和NF-κB信号通路,诱导促动脉粥样硬化炎症标志物表达,包括IL-6、环氧合酶2(COX-2)和细胞内粘附分子 Ldlr−/− 小鼠吃富含胆碱的食物。
循环TMAO的增加与促炎细胞因子TNF-α和IL-1β的升高以及抗炎细胞因子IL-10的降低有关。
3) 脂质代谢
TMAO可抑制胆固醇逆向转运(RCT),导致动脉胆固醇沉积,加速动脉粥样硬化病变。
4) 血小板高反应性和血栓形成
饮食诱导的高水平微生物TMAO可刺激血小板激活次最大刺激物,包括凝血酶、二磷酸腺苷(ADP)和胶原,并诱导细胞内钙的释放,导致血小板高反应性。
然而,一些研究显示了相反的结果,表明饮食中的TMAO、胆碱或肉碱不会诱发ApoE−/− 的动脉粥样硬化或者Ldlr−/− 小鼠模型。这种差异可能是由于居住条件和小鼠模型造成的,但确切的原因仍有待进一步发现。
最近证明,TMA(而非TMAO)降低了心肌细胞和血管平滑肌细胞的活力。在大鼠体内静脉注射TMA时,平均动脉血压显著升高,表明TMA对CVD有有害影响。
进一步证实TMA在CVD发病机制中的作用并验证相关机制,还需要进行更多的体内和体外研究。
图1 肠道菌群产生的膳食代谢物在心血管疾病发病中的潜在机制

Xufei Zhang,et al., Comput. Struct. Biotechnol. J. 2022
★人体循环TMAO在心血管疾病预测和预后中的研究
大量人体研究已经证明肠道微生物衍生的TMAO在预测CVD风险中的作用。
最初的研究调查了1800多名受试者的人类队列,发现血浆TMAO升高与多种CVD亚型的发生有关,包括外周动脉疾病(PAD)、冠状动脉疾病和心肌梗死史。
在临床结果研究中,大量参与者表明,循环TMAO与主要不良心血管事件、事件死亡率和动脉梗死的风险增加呈正相关。在许多研究中,血浆TMAO的临界值超过6μM,以预测全因死亡率的风险,最近对10000多名受试者进行的荟萃分析提出,CVD预后的血浆TMAO临界值为5.1μM。
此外,已发现高水平的TMAO与人类队列中促炎性单核细胞和心血管风险的增加有关。
同样,一项系统回顾和剂量反应荟萃分析招募了13000多名参与者,发现血浆TMAO水平升高与炎症标志物C反应蛋白(CRP)升高之间存在非线性关联。然而,并非所有的人体研究都发现了类似的数据。例如,无症状动脉粥样硬化患者的肠道微生物群和血液TMAO水平没有明显变化。然而,中风和短暂性脑缺血发作患者表现出肠道微生物群的显著失调,但血浆TMAO水平降低。
相比之下,在一组35-55岁的参与者(n=817)中,在10年的随访中,TMAO浓度与动脉粥样硬化进展之间没有显著关系。
有趣的是,最近的一项研究发现,TMA而非TMAO与高血压负荷和CVD风险因素有关,并与早期慢性肾病(CKD)受试者中Akkermansia属、粪杆菌属、Ruminococcus、Subdoligranulum的丰度降低有关。
然而,仍需对人类队列进行进一步研究,以调查TMAO前体TMA是否是早期CVD发病机制调节中被遗忘的毒素或预测因子。
胆汁酸(BAs)是羟基化和饱和类固醇,有助于乳化和肠道吸收膳食脂肪和脂溶性分子。
在人类肝细胞中,初级胆汁酸(胆酸和鹅去氧胆酸)由胆固醇通过催化酶合成,如胆固醇7a羟化酶(CYP7A1)、甾醇27羟化酶(CYP27A1)、氧化甾醇7a羟化酶(CYP7B1),其表达受肠道微生物群的调节。
然后,初级胆汁酸与甘氨酸或牛磺酸结合,95%以上的初级胆汁酸被重新吸收并再循环回肝脏。非再吸收的胆汁酸可通过催化酶胆盐水解酶(BSH)解结合,该酶由几种共生肠道细菌表达,包括革兰氏阳性双歧杆菌、梭菌、肠球菌、乳酸杆菌和革兰氏阴性拟杆菌。
除了去结合,肠道微生物如梭菌和真杆菌也是7-脱氢酶的来源,以生成次级胆汁酸,包括来自CDCA的石胆酸(LCA)和来自CA的脱氧胆酸(DCA)。
此外,胆汁酸的氧化和差向异构化是通过羟类固醇脱氢酶(HSDHs)催化的,这种酶已在各种细菌中发现,包括放线杆菌、变形杆菌、梭菌和其他细菌。
一旦微生物代谢的胆汁酸进入循环血液,胆汁酸受体就可以介导信号通路来调节宿主代谢,有助于CVD的发展。
最重要的胆汁酸受体之一是FXR,它是肝脏初级胆汁酸和肠道次级胆汁酸的主要传感器。FXR在调节脂质和葡萄糖代谢方面已被证实。
有趣的是,在动脉粥样硬化易感小鼠中FXR的激活在动脉粥样硬化病变的形成中显示出保护作用。相应地,ApoE−/−中FXR的缺失导致脂质代谢缺陷的严重程度增加,主动脉斑块形成增强。相比之下,对FXR/ApoE或FXR/Ldlr双缺陷小鼠的其他研究显示主动脉病变和血浆LDL胆固醇降低。有趣的是,FXR还通过调节FMO3活性来调节TMAO途径。
另一个重要的胆汁酸受体是TGR5,通过继发性胆汁酸激活该受体,可通过减少斑块内炎症、斑块巨噬细胞含量和脂质负荷来减轻血管病变的形成。
PXR是另一种与胆汁酸代谢相关的核受体,由次级胆汁酸(如LCA)激活。
与其他受体相比,PXR的激活提高了脂蛋白VLDL、LDL和CD36的表达水平,从而聚集动脉粥样硬化形成中的ApoE−/− 小鼠,而PXR在载脂蛋白E中的抑制作用ApoE−/− 小鼠,通过减少巨噬细胞的脂质摄取和CD36表达减轻了主动脉病变区域。
尽管大多数关于胆汁酸在CVD发病机制中的研究都是在小鼠模型上进行的,但在临床队列中发现胆汁酸的循环水平与CVD表型相关。
例如,研究发现,人类受试者的初级和次级胆汁酸水平降低,慢性心力衰竭患者的总体生存率降低。此外,较低的空腹血浆总胆汁酸与冠状动脉疾病、MI和冠状动脉病变的严重程度显著相关。
总之,肠道微生物群衍生的胆汁酸通过多种类型的胆汁酸受体调节CVD的发展,而血浆胆汁酸可能是CVD发生的另一个重要预测因子,仍需进一步研究。
短链脂肪酸是膳食纤维(主要是多糖)发酵的主要微生物产物,主要由乙酸盐、丁酸盐和丙酸盐组成。肠道微生物群的特定成员参与短链脂肪酸合成的特定发酵途径。
肠道微生物群调节富含纤维的饮食与心血管疾病风险之间的保护性关联。具体而言,许多研究已经阐明了膳食纤维或短链脂肪酸在缓解高血压或其他CVD亚型中的功能作用(图1)。
其中一项研究发现,高纤维饮食和补充乙酸盐都可以降低收缩压和舒张压、心肌纤维化和左心室肥厚,这与改善肠道失调和增加拟杆菌的数量有关。
类似地,丙酸盐治疗可保护小鼠免受高血压心血管损伤,而产丁酸盐的细菌(如Roseburia intestinalis)可减少主动脉粥样硬化病变面积。
研究发现,Olfr78和GPR41参与调节宿主血压和内皮功能。具体而言,丙酸盐通过调节Olfr78和GPR41表达的中断,在野生型小鼠中诱导急性低血压反应。然而,抗生素治疗Olfr78−/− 小鼠(而非野生型小鼠)血压升高,GPR41升高,与野生型小鼠相比,小鼠也有收缩性高血压。
此外,最近的一项研究表明,乙酸盐和丁酸盐通过仅对丁酸盐进行GPR41/43激活,从而提高NO的生物利用度,从而改善大鼠主动脉内皮功能障碍。为了揭示短链脂肪酸在CVD发病机制中的机制作用,还需要进行进一步的研究。
★ 人类研究
在人类中,大多数关于CVD风险的研究都与短链脂肪酸相关的血压调节有关。早期临床干预研究发现,增加膳食纤维摄入量与高血压患者的血压降低有关。
在一项荟萃分析研究中也发现了粘性可溶性纤维对血压的类似保护作用。
相比之下,最近的一项干预研究报告称,高纤维高蛋白饮食可能通过上调循环短链脂肪酸水平增加CVD的风险。具体来说,高蛋白高纤维饮食诱导丙酸水平升高,这与LDL胆固醇和血压的上调有关;较高的丁酸水平与葡萄糖的上调和高密度脂蛋白胆固醇的下调有关。然而,它仍然局限于短链脂肪酸对人类CVD风险或保护作用的直接证明,需要进一步澄清。
芳香族氨基酸(AAA)是含有芳香环的氨基酸,包括苯丙氨酸(Phe)、色氨酸(Trp)和酪氨酸(Tyr)。
芳香族氨基酸的主要来源是膳食蛋白质,如牛肉、猪肉、鸡肉或鱼。有趣的是,研究人员发现了肠道微生物群产孢梭菌Clostridium sporogenes产生芳香族氨基酸代谢物的途径。
最近,几项研究发现,苯丙氨酸衍生的微生物代谢物苯乙酰谷氨酰胺(PAG)与主要心脏不良事件(如心肌梗死、急性缺血性中风或冠状动脉疾病)之间存在密切关系。
具体来说,膳食中的苯丙氨酸通过富含porA基因的肠道微生物群转化为苯乙酸,随后在肝脏中转化为PAG。PAG进一步激活G蛋白偶联受体,包括α2A、α2B和β2肾上腺素能受体,以促进动脉损伤动物模型中的血小板反应性和血栓形成潜能。
同样,来自Trp的肠道微生物衍生代谢物吲哚硫酸酯(IS)和来自Tyr的对甲酚硫酸酯(PCS)也被确定为预测CKD患者CVD事件的有价值标记物。
这可能是由于IS和PCS通过诱导尿毒症毒性和内皮功能障碍而产生的有害影响。
然而,一些研究发现IS、PCS或PAG与CVD结果无关。这种差异可能是由于不同研究的阈值效应造成的。这些肠道微生物代谢物在心血管疾病进展中的作用尚需进一步研究。
健康饮食模式已被建议预防 CVD 进展(图 2),包括地中海饮食(Med-diet)、阻止高血压的饮食方法(DASH)和间歇性禁食(IF)等喂养模式。
图2 针对肠道微生物群的饮食干预在预防心血管疾病方面的潜在疗法

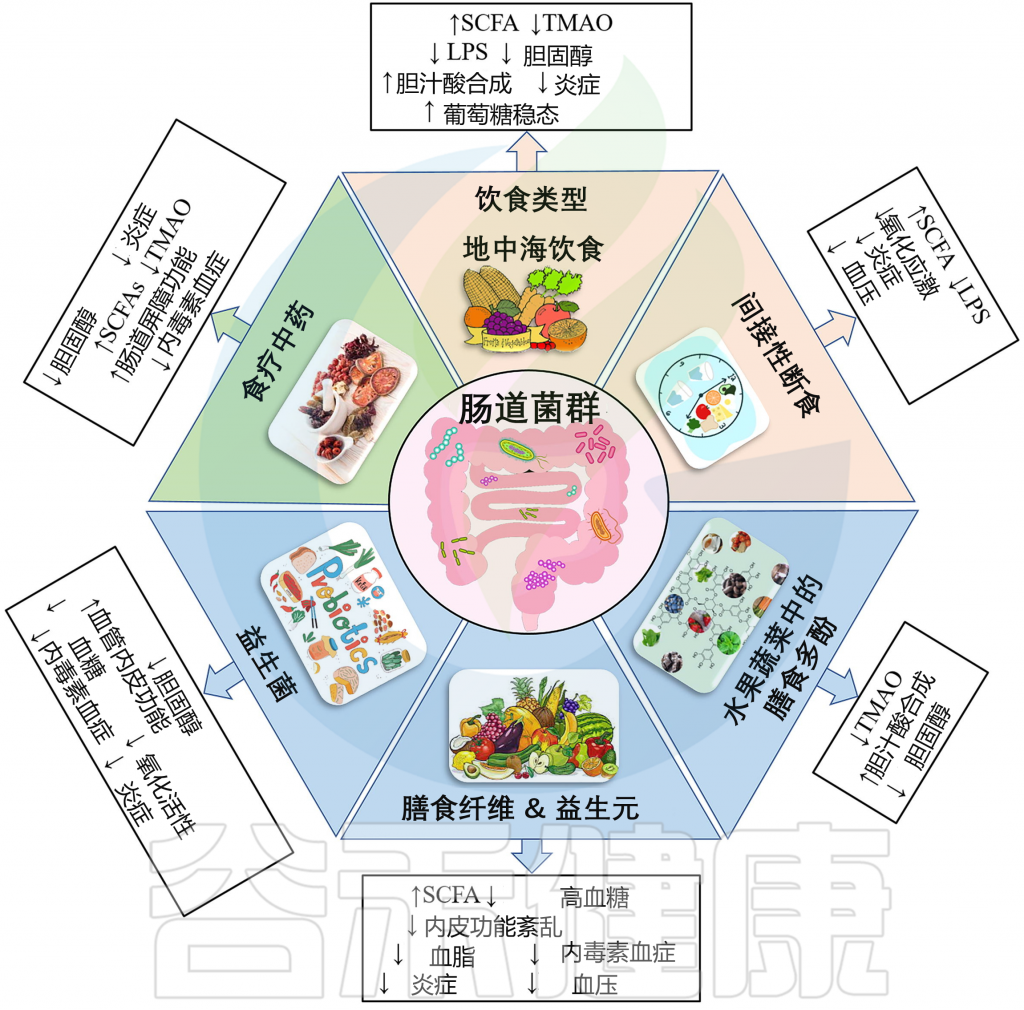
Xufei Zhang,et al., Comput. Struct. Biotechnol. J. 2022
★ 饮食类型
多项临床试验证实了地中海饮食对主要血管事件、冠状动脉事件、中风和心力衰竭的保护作用。这种效应与微生物群多样性和微生物代谢物短链脂肪酸的增加以及TMAO 和血浆LPS水平的降低有关。
然而直到最近,才发现地中海饮食的长期干预可以通过肠道微生物群调节来预防 CVD。
具体来说,地中海饮食的长期干预可以通过富含膳食纤维代谢物(如Faecalibacterium prausnitzii和Bacteroides cellulosilyticus )显着改变整体肠道微生物组。
特别是,在没有普氏菌的情况下,地中海饮食对 CVD 危险因素(包括脂质代谢、炎症和葡萄糖稳态)显示出强大的保护作用。
尽管多项数据表明 DASH 饮食可以通过降低血压和血脂异常来改善心脏危险因素,仍然缺乏关于 DASH 饮食与 CVD 预防中微生物群改变之间直接联系的数据。
★ 喂养模式
间歇性禁食(IF)是一种重要的饮食喂养模式,是一种周期性能量限制的做法,可以通过改变肠道微生物群来降低CVD风险。
具体而言,自发性高血压卒中易感大鼠在IF干预50天后,肠道微生物群β多样性发生显著变化,这与通过调节胆汁酸代谢降低血压有关。这些发现已通过对GF大鼠的粪便移植得到证实。
此外,在8周内对患有IF的人群进行临床干预,显著改善了血管舒张参数,减轻了氧化应激、与微生物群产生的短链脂肪酸增加相关的炎症,并降低了血浆LPS。有趣的是,短期禁食5天也可以降低血压和体重,调节微生物群,包括脱硫弧菌科、阿克曼菌和瘤胃菌科。
★水果和蔬菜中的多酚
多酚是一大类常见于植物产品中的有机化合物,尤其是水果和蔬菜。超过90%的总多酚在小肠中不可吸收,并被大肠中的肠道微生物群进一步代谢。
越来越多的研究支持膳食多酚对肠道微生物群的修饰和CVD保护的作用。
白藜芦醇(在葡萄、苹果和浆果等水果中发现)已被确定通过下调TMAO水平和上调BAs合成来减轻ApoE-/-小鼠的动脉粥样硬化,而BAs合成与有益菌拟杆菌、乳酸杆菌、双歧杆菌和阿克曼菌的丰度增加有关。
口服槲皮素(在洋葱、西兰花和西红柿等蔬菜中发现)可以抑制体重增加,改善动脉粥样硬化病变的程度,降低胆固醇水平、致动脉粥样硬化溶血磷脂酰胆碱水平,减少革兰氏阴性菌疣状芽胞菌的丰度,同时增加微生物多样性。
在人类受试者中,富含多酚的饮食干预发现,饮食多酚可以显著增加微生物多样性和Ruminococcaceae,这些与心脏代谢危险因素(如血浆甘油三酯和大 VLDL 中的胆固醇)的改善有关 。
总的来说,水果和蔬菜中的多酚可能是心血管疾病的潜在治疗干预措施,它们的部分保护作用可以通过肠道微生物群的修饰来介导。
关于多酚详见这篇文章:肠道微生物群与膳食多酚互作对人体健康的影响
★膳食纤维
膳食纤维是不易消化的碳水化合物,包括水溶性或不溶性形式,通常存在于水果、蔬菜、全谷物、坚果和豆类等中。
膳食纤维不能被小肠吸收,“喂养”健康的肠道微生物群,导致短链脂肪酸的多样性和产量增加。
如前所述,短链脂肪酸激活特异性受体,从而改善高血压和主动脉内皮细胞功能障碍。
最近的一项研究发现鹰嘴豆膳食纤维提高了微生物多样性,增加了拟杆菌和乳酸杆菌的相对丰度,并提高了丙酸水平。鹰嘴豆膳食纤维也可以通过对肠道微生物群进行类似的修饰来改善高血糖症。
全谷物燕麦还能降低血浆胆固醇水平,提高胰岛素敏感性,这与微生物群中有益乳酸杆菌的增加有关。同样,人类食用全谷物产品时,总胆固醇和低密度脂蛋白胆固醇水平较低,双歧杆菌含量较高。
关于膳食纤维详见这篇文章:你吃的膳食纤维对你有帮助吗?
益生元是植物源性或不易消化的食物成分,可刺激胃肠道中“友好”微生物的生长。
大多数益生元是膳食纤维,而不是所有膳食纤维都可以归类为益生元。常见的益生元包括低聚糖和多糖,如菊粉、低聚果糖、β-葡聚糖,它们通常能诱导肠道微生物群的特定修饰。
许多研究通过三个主要方面有趣地研究了益生元对宿主代谢的有益影响,以改善CVD状况(图2):
1)降低血脂
补充益生元纤维(例如菊粉)可以降低血浆胆固醇水平,并减少肝脏中的TAG积累;
2)减少内毒素血症和炎症
益生元低聚果糖可以增加双歧杆菌的数量,与血浆和脂肪组织中的内毒素血症和炎症呈负相关;
3)降低血压
补充富含益生元纤维的饮食可以通过GPR43信号通路降低收缩压和舒张压。
益生菌被定义为“活的微生物,当给予足够的量时,会给宿主带来健康益处”。人类饮食中的大量发酵食品,如酸奶、酸菜、开菲尔、泡菜,都含有益生菌菌株。
作为益生元,益生菌菌株也被确定在更多方面防止CVD进展(图2):
1) 改善血管内皮功能
服用植物乳杆菌299v可改善冠心病患者阻力动脉的内皮依赖性血管舒张功能。同样,发酵乳杆菌CECT5716治疗可降低大鼠的血管氧化应激并改善内皮功能。
2) 降低血糖和氧化活性
益生菌酸奶的干预显著降低血糖,提高总抗氧化状态。
3) 降低胆固醇
补充长双歧杆菌BB536对降低总胆固醇、肝脏脂质沉积和脂肪细胞大小有显著效果。
4) 减轻内毒素血症和炎症
通过恢复肠道屏障功能,通过改善系统性内毒素血症诱导的炎症,口服粘液阿克曼菌已被证明可减少动脉粥样硬化病变。此外,补充乳酸杆菌 L.reuteri V3401可降低炎症标志物水平,如TNF-α、IL-6、IL-8,这与降低CVD风险有关。
更多益生菌、益生元等介绍详见这篇文章:
如何调节肠道菌群?常见天然物质、益生菌、益生元的介绍
一些来自中药的天然成分也通过调节肠道微生物群被用作潜在的CVD疗法(图2)。
小檗碱(BBR),一种生物活性异喹啉生物碱,广泛存在于各种中草药中并从中提取,已被证明具有许多有益的作用。
最近发现,高剂量的小檗碱不仅通过降低总胆固醇和极低密度脂蛋白胆固醇水平来改善脂质代谢,还下调促炎细胞因子TNF-α、Il-1β、Il-6和上调的抗炎性Il-10水平,这些水平与参与短链脂肪酸产生的Alistipes和Roseburia的丰度增加有关。
Roseburia菌 详见: 肠道重要基石菌属——罗氏菌属(Roseburia)
此外,BBR可以通过重塑肠道微生物群成分来抑制TMAO的产生,从而减轻胆碱诱导的动脉粥样硬化。
红曲米(RYR)可以通过降低总胆固醇和低密度脂蛋白水平来缓解斑块的形成,而总胆固醇和低密度脂蛋白水平与厚壁菌/拟杆菌的比例降低有关,同时也降低了黄曲霉和黄酮类提取物的丰度。
RYR干预还能改善肠道屏障功能,并通过TLR信号通路减轻炎症。
灵芝是一种药用蘑菇,通过降低携带内毒素的变形菌水平和增加有益细菌(包括梭菌和真杆菌),来减少肥胖、内毒素血症、慢性炎症以及恢复肠屏障功能。
肠道微生物群与心血管疾病之间存在着重要而复杂的联系。作为肠道微生物群中重要的调节剂之一,膳食成分可改变与全身内毒素、炎症、肠道屏障功能障碍以及脂质代谢功能障碍相关的微生物成分,从而增加CVD风险。
然而,更多的研究数据表明,肠道微生物群对饮食代谢在调节CVD发病机制中的主要作用包括:
1) 代谢饮食胆碱或L-肉碱以诱导TMAO的释放,促进动脉粥样硬化的进展;
2) 调节胆汁酸代谢,可能通过多种受体途径调节动脉粥样硬化的形成;
3) 产生芳香族氨基酸代谢物PAG、IS、IPA或PCS,加速动脉粥样硬化形成;
4) 发酵膳食纤维以产生短链脂肪酸,这对CVD的进展起到了一些有益的作用。
这些发现为开发CVD的新型潜在预防和治疗方法提供了一些极好的支持,例如可以通过健康饮食和喂养模式、含有健康膳食成分的饮食等干预措施改善菌群,从而预防改善CVD。当然也包括:来自水果和蔬菜的膳食多酚、膳食纤维和益生元、益生菌以及饮食中药等干预措施。主要参考文献:
Xufei Zhang, PhilippeGérard. Diet-gut microbiota interactions on cardiovascular disease. Computational and Structural Biotechnology Journal. 2022,Mar: 1528-1540. doi: org/10.1016/j.csbj.2022.03.028
Safari Z, Gérard P. The links between the gut microbiome and non-alcoholic fatty liver disease (NAFLD). Cell Mol Life Sci. 2019 Apr;76(8):1541-1558. doi: 10.1007/s00018-019-03011-w. Epub 2019 Jan 25. PMID: 30683985.
Bapteste E, Gérard P, Larose C,et al., The Epistemic Revolution Induced by Microbiome Studies: An Interdisciplinary View. Biology (Basel). 2021 Jul 12;10(7):651. doi: 10.3390/biology10070651. PMID: 34356506; PMCID: PMC8301382.
Tang WHW, Li DY, Hazen SL. Dietary metabolism, the gut microbiome, and heart failure. Nat Rev Cardiol. 2019 Mar;16(3):137-154. doi: 10.1038/s41569-018-0108-7. PMID: 30410105; PMCID: PMC6377322.

谷禾健康
神经免疫,菌群,心血管疾病
最新的《中国心血管病健康和疾病报告2019》数据显示,中国居民心血管病现患人数已达3.30亿,拐点尚未到来,且7-17岁儿童青少年高血压患病率呈现上升趋势。
心血管疾病(CVD)仍然是全世界发达国家死亡和残疾的主要原因。此外,广泛存在的心血管危险因素,如代谢综合征、糖尿病、肥胖和性类固醇激素代谢紊乱,有效预防策略已成功减少急性心血管事件和死亡的影响。
大脑和其他器官系统之间的双向通信对于大脑健康和生物体的整体健康至关重要。曾经被认为具有免疫特权的大脑现在被认为是一个高度免疫特化的器官,拥有自己的大脑驻留免疫细胞。这些细胞形成神经元回路和淋巴系统,这些系统调节免疫细胞的复杂流出,以及从脑脊髓空间与循环的其余部分交换的液体。
而共生微生物群是个体间异质性的重要来源,可以通过调节宿主免疫来影响人类健康。人们越来越认识到 CVD 的许多潜在原因,包括免疫和肠道菌群失调可能是 CVD 的致病因素,提出了对新的免疫调节治疗策略的需求。
本文总结了免疫、炎症的神经调节以及肠道菌群如何参与 CVD 的发病和进展,并探索菌群-神经免疫通讯是否为 CVD 的潜在治疗靶点。
本文缩略词:
CVD: 心血管疾病 (cardiovascular disease )
心血管疾病,又称为循环系统疾病,是一系列涉及循环系统的疾病,循环系统指人体内运送血液的器官和组织,主要包括心脏、血管(动脉、静脉、微血管),可以细分为急性和慢性,一般指心脑血管疾病。
ANS: 自主神经系统 (autonomic nervous system)
自主神经系统是脊椎动物的末梢神经系统,由躯体神经分化、发展,形成机能上独立的神经系统,是外周传出神经系统的一部分,能调节内脏和血管平滑肌、心肌和腺体的活动,又称植物性神经系统、不随意神经系统,故名自主神经系统(参考自:百度百科)。
SFO: 穹窿下器神经元 (Neurons of the subfornical organ )
穹窿下器官,室周器官,位于第三脑室前背侧壁、海马连合腹侧穹窿柱分歧处、适平室间孑L平面。
OVLT: 下丘脑终板血管区(Organum vasculosum laminae terminalis)
终板就是第三脑室前缘的隔膜。下丘脑终板血管区,内生致热原作用于血脑屏障外的脑血管区,即下丘脑终板血管区,该区位于第三脑室壁的视上隐窝处。
PVN: 下丘脑室旁核 (paraventricular nucleus)
下丘脑室旁核 位于第三脑室下丘脑部的上端两侧,呈长楔形轮廓,是下丘脑前区最显著的核团之一,与神经内分泌活动和植物性功能等有关的复合体结构,参与体内电解质与体液平衡,心血管活动调节及其它多项生理功能的调控。
NTS: 孤束核 (nucleus tractus solitarius)
孤束核为延髓内重要内脏感觉性核团,为一般内脏感觉和味觉传导通路上的第一级中继站。随着神经解剖学和神经生理学研究方法的不断发展,人们对孤束核的认识日趋深入,近年来HRP和ARG技术有关孤束核的大量的研究证实了孤束核不但与低级中枢(脊髓、脑干)具有传入、传出神经联系,而且与高位中枢(前脑、小脑)也具有复杂的往返联系。
DMV:迷走神经运动背核 (dorsal nucleus of vagus nerve)
迷走神经背核是2014年经全国科学技术名词审定委员会审定发布的人体解剖学名词。位于延髓室底灰质内,迷走神经三角深面的神经核。属一般内脏运动核,支配颈部、胸部所有内脏器官和腹腔大部分内脏器官的平滑肌、心肌的活动和腺体的分泌。
神经和免疫系统通常通过特定的大脑区域、传入和传出周围神经以及神经激素通路进行交流(下图)。
大脑和周围器官之间的通讯途径
Carnevale D. Nat Rev Cardiol. 2022
大脑通过不同的途径与周围器官和组织相连。特定的大脑区域,统称为脑室周围器官,与周围形成自然的大脑界面,内衬有渗漏的血脑屏障。神经网络从脑室器官延伸到周围神经系统,并建立重要的神经解剖学连接。
穹窿下器官 (SFO) 和终板血管器官 (OVLT) 的神经元密集表达 1 型血管紧张素 II 受体和渗透压感受器,并为下丘脑的室旁核 (PVN) 提供神经支配。反过来,PVN 与延髓腹外侧 (RVLM) 的交感神经元相连,RVLM 具有调节外周交感神经活动的重要功能。
PVN 的其他神经元连接到孤束核 (NTS) 和迷走神经背运动核 (DMV) 的复合体,它们负责通过迷走神经传递的外周胆碱能神经支配。
所有主要的外周器官通常都有交感神经支配(包括心脏、脉管系统、肾脏和颈动脉体)和副交感神经支配(包括心脏、颈动脉体、肝脏、胃和肠)。
交感神经支配是免疫器官(以浅蓝色显示)和内脏组织的神经控制的主要途径。大脑、心血管系统和免疫器官之间的进一步整合轴是由神经内分泌系统通过下丘脑-垂体-肾上腺轴形成的。
循环物质,如细菌源性肽、宿主源性细胞因子和组织代谢物,向特定的大脑区域发出信号,这些区域的特点是存在渗漏的血脑屏障。
脑室周围器官由穹窿下器官(SFO)、终板血管器(OVLT)和末梢区组成,是监测周围组织并在神经免疫过程中发挥关键功能的大脑区域。同时,脑室周围器官在心血管疾病中起着至关重要的作用。
穹窿下器官富含血管紧张素II受体1型,它是肾素-血管紧张素-醛固酮系统的关键介质。
OVLT的神经元同时表达血管紧张素II受体1型和渗透压感受器,它们对感知细胞外钠/盐负荷浓度至关重要。
它们共同传递有关血容量、血压和细胞外液渗透压的外围信息。
有趣的是,从穹窿下器和OVLT投射到下丘脑室旁核(PVN)的神经元也被描述过,脑室旁核也接受后脑的投射,这表明它具有整合功能。虽然它们位于脑室周围器官之外,但孤束核(NTS)和迷走神经背侧运动核(DMV;心血管功能最有效的调节器之一)接收来自末梢区的输入。
大脑通过在脑室旁核和脊髓中间外侧细胞柱之间建立直接投射,或通过延髓头端腹外侧间接连接,来控制周围交感神经反射反应。外周的稳态扰动由延髓头端腹外侧感觉到,并通过蓝斑的去甲肾上腺素能神经元以反射反应传递。
作为补充,神经元表达细胞因子受体,这有助于神经免疫串扰和脑与身体的相互作用。
当细胞因子在各种生理和病理生理环境中的外周组织中分泌时,神经元活动就会改变。虽然神经元细胞因子受体的生理功能仍在研究中,但细胞因子在脑发育、外周组织损伤和动物行为方面的作用已被证明。这些观察表明存在由细胞因子介导的脑-体双向轴。
接下来进一步的讨论这些信号是如何在心血管疾病中启动、传播和转移到大脑的。
投射到中枢神经系统之外的神经被称为外周神经系统,它双向连接大脑和外周器官和组织。
外周神经系统分为两个部分:
躯体神经系统和自主神经系统(ANS)
躯体神经系统与中枢神经系统交换感觉和运动信息,而ANS调节非自愿功能,并在神经免疫和心血管相互作用中起决定作用。
ANS由传入和传出神经元组成,将大脑与周围内脏器官和组织连接起来。历史上,ANS被定义为平行的交感和副交感臂,分别负责所谓的“逃跑或战斗”和“休息和消化”反应。
ANS作为大脑与外周沟通的关键途径的概念不断发展,有证据表明,ANS也发挥了神经免疫调停者的作用。生理和心血管反应的改变都受到ANS的深度影响,ANS的失衡是许多心血管疾病的典型特征。
我们对ANS如何调节心血管功能的理解有了实质性的进步,这得益于实验方法的发展,使直接分析神经系统活动成为可能。
实验性和临床性的显微神经学被用来测量指向心血管系统的节后交感神经传出的电活动。例如,骨骼肌血管的显微神经造影术成为评估人类区域交感神经活动的金标准方法。
应用于动物实验的类似程序有助于确定ANS调节心血管功能的解剖路线和分子机制。在过去5年中,已经制定了直接评估调节免疫系统的ANS臂的实验方案,从而能够定义神经免疫机制如何促进心血管疾病的发病和进展。
神经系统和免疫系统之间的进一步相互作用是通过神经内分泌系统进行的,主要通过下丘脑-垂体-肾上腺轴进行调节。下丘脑-垂体-肾上腺轴通常对心理压力敏感,是免疫反应和心血管功能的有效调节剂。
神经元顺行和逆行追踪技术已被用于通过周围神经系统的传入和传出臂绘制大脑和免疫器官之间的连接(下图)。

Carnevale D. Nat Rev Cardiol. 2022
a |初级淋巴器官神经支配。胸腺主要由去甲肾上腺素能纤维支配。虽然不存在直接的胆碱能神经支配,但交感神经与下丘脑-垂体-肾上腺(HPA)轴之间的相互作用已被证实。相反,骨髓神经支配更为复杂,包括交感神经系统(SNS)、副交感神经系统(PNS)和与大脑建立双向通讯的感觉纤维。骨髓的造血和免疫功能受到这种神经网络的严格调节。
b |次级淋巴器官包括脾脏和淋巴结,由去甲肾上腺素能纤维密集支配,其起源于大脑,已通过神经调节研究确定。淋巴结也有一个明显的感觉神经网络,可以严密监测外周免疫状态。
c |三级淋巴器官是为了应对非淋巴器官的病理挑战而形成的,具有独特的组织特异性组织。控制第三淋巴器官神经支配的神经纤维仅在少数解剖部位被发现。
d |粘膜相关淋巴组织在粘膜组织(如支气管或肠道)中形成,以响应稳态的扰动,并由神经网络严格控制,包括SNS、PNS和肽能感觉纤维。
神经元追踪确定外周器官神经支配路线
神经元连接性的研究需要对轴突进行双向追踪,包括从神经元细胞体到轴突终末的顺行追踪,以及从终末到胞体的逆行追踪。神经解剖学追踪是一种通过追踪神经元在突触前或突触后水平的连接来识别神经元的常用方法。神经解剖学追踪技术在确定包括免疫器官在内的外周器官的神经支配途径方面变得特别有用。
原始追踪研究的基础是将氟金注射到免疫器官中,使研究人员能够逆行识别节前神经元,或注射生物素化葡聚糖胺以顺行识别神经元连接。几十年来,这些单独使用或联合使用的示踪剂使研究人员能够研究连接大脑和周围器官的神经回路。
随后的技术进步利用伪狂犬病病毒(一种高度传染性的神经营养性α疱疹病毒,Pseudorabies virus,PRV)的能力来定义中枢神经系统中的多突触回路。病毒的逆行扩散只发生在突触相连的神经元链中。在将伪狂犬病病毒注射到感兴趣的器官或组织后,更高阶的神经系统结构在稍后的时间点被标记。通过这种方式,可以定义神经元连接的精确路径,从外周器官开始,追溯到大脑。此外,伪狂犬病病毒在神经元细胞体中复制的过程具有自我放大的能力,这使得在受感染动物的大脑中识别二级、三级甚至四级神经元成为可能。
初级免疫器官包括胸腺和骨髓,它们参与淋巴细胞的产生和初始选择。胸腺在新生儿和青春期前发育阶段活跃,逐渐退化,只有残留的淋巴细胞生成持续到成年期。骨髓包含在骨腔中,从未成熟的造血祖细胞开始产生红细胞和免疫细胞。
胸腺神经支配和神经元调节
不同类型的细胞参与胸腺器官发生,这需要神经嵴细胞的协调相互作用。基于旧追踪技术的初步研究显示,交感神经纤维错综复杂,主要释放去甲肾上腺素,并在胸腺中形成血管周围神经网络。使用经典单突触逆行和顺行示踪剂的类似方法并没有识别胸腺的副交感神经支配。
后续的研究使用伪狂犬病病毒(PRV)的逆行跨神经元多突触追踪,来确定负责交感神经流出到胸腺的中枢神经系统区域。PRV感染的神经元分布在脊髓、延髓、脑桥、下丘脑室旁核、去甲肾上腺素能细胞A5组、延髓头端腹外侧核和中缝尾侧核。
值得注意的是,PRV感染的动物在DMV中没有PRV阳性细胞核,这与之前的观察结果一致,之前的观察排除了支配该区域胸腺的迷走神经纤维的存在。
虽然连接胸腺和大脑的硬连线路径的证明来自动物研究,追踪技术是可行的,但报告显示人类存在类似的胸腺神经支配模式,为这些发现提供了转化相关性。
神经样纤维和垂体激素通过人胸腺的免疫组织进行化学鉴定。胸腺糖皮质激素通过调节儿茶酚胺释放和肾上腺素受体表达,对胸腺细胞的存活和分化以及交感神经系统功能都很重要。相反,接受肾上腺切除术的动物胸腺去甲肾上腺素水平显著降低。
典型的感觉神经肽,如P物质和降钙素基因相关肽(CGRP),已在胸腺中被发现,但没有明确的报告表明,这些神经肽可以为大脑提供感觉通路,这意味着交感神经支配可能是调节胸腺免疫功能的唯一神经通路。
骨髓神经支配和神经元调节
骨髓神经支配沿着主动脉传导,并通过血管丛穿透骨髓。实质以神经纤维树枝状排列为特征,末端靠近造血细胞和淋巴细胞。大多数纤维支配骨髓血管系统,但其他一些神经末梢支配实质性和血窦元素以调节造血和细胞迁移。
酪氨酸羟化酶是去甲肾上腺素合成的限速酶,存在于大动脉周围的所有神经中,并延伸至骨髓实质。除了主要的去甲肾上腺素能神经支配外,还确定了神经肽Y的免疫反应性,从而表明骨髓的去甲肾上腺素能神经支配和肽能神经支配是混合的。
在很久以前发表的研究中也检测到对 P 物质和 CGRP 呈阳性的神经纤维,但感觉神经元的功能直到最近才被发现。CGRP感觉纤维与去甲肾上腺素能神经一起延伸到骨髓,在那里它们与酪氨酸羟化酶神经元合作,控制造血干细胞的动员。这些发现表明大脑通过硬连接的交感神经和感觉连接控制骨髓的免疫和稳态功能。
随后的研究还发现了支配骨骼和骨髓的副交感神经纤维。尽管在造血生态位附近检测到合成乙酰胆碱的胆碱乙酰转移酶的免疫反应性,但仅在骨中发现了明显的功能性副交感神经支配,其中胆碱乙酰转移酶调节骨重塑。
后来的研究表明,骨髓神经支配与昼夜节律密切相关。骨髓中去甲肾上腺素的释放依赖于昼夜振荡,进而调节与控制白细胞和造血干细胞的保留和排出过程相关的基因表达。尽管这种构成过程在生理上是相关的,但神经介导的白细胞和造血干细胞转运的节律过程在疾病背景下可能特别重要。
未来的研究将有必要澄清清晨急性心血管事件的高发病率是否与神经调节白细胞和造血干细胞运输的影响有关。
次级淋巴器官包括淋巴结、脾脏和与粘膜相关的淋巴组织,通常由交感神经和感觉神经支配。
淋巴结神经支配和神经调节
淋巴结的结构包括血管系统和淋巴管,它们穿透髓质实质,在 T 细胞区域中被复杂的去甲肾上腺素能纤维网络缠绕。相比之下,富含B细胞的生发中心缺乏神经支配。
在稳定状态下,去甲肾上腺素的释放依赖于昼夜节律的激活,进而通过β2-肾上腺素受体信号调节淋巴细胞的生理日常再循环。
通过使用各种技术,从整体免疫标记到逆行神经元追踪、单细胞基因组学和光遗传学,研究人员发现了支配淋巴结的独特感觉神经元阵列。将腺相关病毒注射到淋巴结后,四种类型的神经元被追溯到背根神经节。对这些不同的神经元群体进行的单细胞RNA测序确定了肽能伤害感受器的密集表达,形成了与大脑的双向通讯途径,并持续监测周围免疫环境。
脾神经支配和神经调节
脾脏是最大的次级淋巴器官,监测血液传播的物质和抗原。脾脏主要由去甲肾上腺素能脾神经支配,通常通过神经信号调节免疫功能。
脾神经从腹腔神经节分支,从脾门进入脾脏,沿着脾动脉外侧走行。去甲肾上腺素能神经分布穿过边缘区,伸入白髓,在白髓中,T细胞、B细胞和树突状细胞附近可以发现神经末梢。相反,红髓的神经支配似乎稀疏而分散。通过组织学和追踪的方法,在脾脏中没有发现直接的胆碱能神经支配。
白髓,位于脾脏内部,包含着一种特殊的白细胞,这些细胞聚集在血管周围,当血液流过脾脏的时候,白髓中的淋巴细胞辨认并吞噬掉任何侵入的细菌和病毒,以此方式过滤人体血液,防止机体被病菌感染。
红髓,动物体内最大的淋巴器官。位于左上腹胃的背面,胃与膈之间,呈内侧向内凹陷的扁椭圆形或条索状等。
一项使用完整全组织3D成像的研究提供了有关脾脏神经支配的额外信息。实质内交感神经支配的结构被揭示为圆锥状结构,这在其他免疫器官中是不存在的,这表明独特的神经调节功能发生在脾脏中。
在脾脏中发现了具有独特特征的神经胶质细胞,这又增加了复杂性。自主神经支配通常包含非髓鞘神经胶质细胞。虽然神经胶质细胞在由周围神经系统支配的内脏器官中的特定功能尚未得到充分研究,但它们在免疫器官中的存在可能在神经细胞和免疫细胞之间起着中介作用,这需要进一步研究。
使用逆行示踪剂和后来的跨神经元多突触PRV追踪的研究明确证明,脾脏神经支配完全是去甲肾上腺素能的,起源于腹腔神经节。
通过对脾脏注射PRV后较长时间点的分析,确定了脑干、桥脑和下丘脑的运动前脑核团。随后,光遗传学领域出现了一种追踪神经元回路的完全创新工具,它在功能上映射直接投射到腹腔神经节的DMV胆碱能神经元。
当DMV神经元被光激活时,会诱发脾神经放电,从而直接证明腹腔迷走神经和脾神经之间的解剖联系。
粘膜相关淋巴组织神经支配
身体内的粘膜,如呼吸道和胃肠道的粘膜,有分散的粘膜淋巴组织区域,这些区域共同构成了最广泛的淋巴组织,这些区域统称为粘膜相关淋巴组织,保护机体免受各种挑战。
虽然传统的次级淋巴器官是在胚胎发生过程中发育起来的,但淋巴滤泡,如支气管相关淋巴组织或肠道相关淋巴组织,在出生后会因炎症或感染而聚集。尽管如此,这些异位淋巴组织与传统淋巴组织在结构上有许多相似之处。
粘膜相关淋巴组织的一个典型特征是广泛的神经支配。早期研究描述了支气管相关淋巴组织和肠道相关淋巴组织的交感神经和肽能神经支配,这些淋巴组织含有大量神经肽,如P物质、血管活性肠肽和生长抑素。通常情况下,神经纤维沿着小血管排列,然后在与淋巴细胞接触的粘膜组织的实质中分支,在含有T细胞的区域,神经占优势。
随后的研究通过专门检测和解码各种有害外周刺激的伤害感受器,确定了粘膜相关淋巴组织神经支配的感觉通路。
支配肠道相关淋巴组织的伤害感受器感知胃肠道的扰动,并建立具有保护功能的神经反射。虽然肠道相关淋巴组织的感觉神经支配在抵御微生物方面的作用越来越明显,但对心血管疾病中肠道神经系统的影响仍不清楚。
支气管相关淋巴组织的神经支配作用研究较少,但交感神经、胆碱能神经和感觉神经纤维已被确定。
三级淋巴样器官是指在成年期由淋巴样新生在随机、典型的非淋巴样和非粘膜部位形成的淋巴样组织,以应对慢性炎症。这些组织在自身免疫性疾病、微生物感染、慢性同种异体移植排斥反应、癌症甚至动脉粥样硬化中都被观察到。
在几种转基因小鼠模型中诱导第三淋巴器官,可以表征炎症细胞因子和淋巴趋化因子的模式,这些细胞因子和趋化因子是其发育和调节所必需的。
虽然已经描述了三级淋巴器官的形态、细胞和血管成分,与第二淋巴器官(如B细胞和T细胞室的独特组织、含有滤泡树突状细胞的B细胞滤泡和生发中心)有相当大的相似性,他们在疾病进展中的参与是有争议的,并且仍然是研究的主题。
例如,在微生物感染期间,三级淋巴样器官会在局部保留病原体,从而阻碍它们进入生物体的其他部位。相反,自身免疫性疾病的进展可能因同时存在三级淋巴器官而加剧。通过选择性地去神经支配肠道交感神经或胆碱能神经,迷走神经在三级淋巴器官形成中的重要作用已在实验性结肠炎中得到证实。目前还尚不清楚ANS是否有助于其他器官中第三淋巴器官的发育、组织和功能。
神经免疫相互作用是对挑战体内平衡的应激源做出快速反应的基本适应机制。这一概念首次出现时,脾脏神经支配在细菌内毒素血症(对身体最危险的疾病之一)期间被观察到具有保护功能。
去甲肾上腺素能纤维和淋巴细胞之间的直接神经免疫相互作用被描述,同时确定在脾脏中引起去甲肾上腺素能放电的神经回路,该回路在抑制脂多糖诱导的细胞因子负荷和对抗感染性休克方面有效。
神经免疫相互作用已被确定为心血管危险因素和心血管疾病病理生理学的潜在机制。
神经免疫相互作用促进心血管危险因素的发生及进展
Carnevale D. Nat Rev Cardiol. 2022
大脑中的环室器官被心血管系统的挑战激活。通过一系列中枢和周围神经系统的解剖连接,大脑在免疫器官中建立神经反射来控制和调节免疫功能。心血管危险因素,如高血压、代谢紊乱和动脉粥样硬化,是常见的神经免疫机制改变的基础。心血管疾病,例如心肌缺血、压力过载心肌病、心力衰竭、肾脏疾病和神经血管功能障碍,其特征在于受影响的心血管组织中局部和免疫器官中的神经免疫改变。ARC,弓状核;DMV,迷走神经背运动核;MnPO,正中视前核;NTS,孤束核;OVLT, 终板的血管器官;PVN,下丘脑室旁核;SFO,穹窿下器官。
高血压
与高血压相关的炎症和免疫反应最早出现在20世纪70年代。然而,这些过程大多被认为是高血压导致靶器官损害的结果。
免疫系统在高血压中的机制作用的第一个证据,来自缺乏 T 细胞和 B 细胞且典型的高血压刺激不会增加血压的Rag1 -/-小鼠的研究。通过过继转移重建Rag1 -/-小鼠中的 B 细胞或 T 细胞池,这项研究表明,血管紧张素II或脱氧皮质酮醋酸盐(DOCA)仅在小鼠具有成熟 T 细胞时才会诱发高血压。
随后大量研究调查了特定的T细胞亚群是否对高血压的发展至关重要,发现血管紧张素II给药不会增加Cd8 -/-小鼠的血压,但会增加Cd4 -/-小鼠的血压。免疫系统在血压升高中所起作用的细胞和分子机制仍有待研究。
与血压稳态有关的基本生理变量,如血管张力和肾脏钠排泄,依赖于严格的神经控制。因此,神经调节系统、免疫器官和心血管功能之间建立的关系值得研究。
重要的研究揭示了大脑和免疫系统之间的联系可能对高血压至关重要。首先,在动物模型中,脑室内注射血管紧张素II可通过交感神经系统诱导外周细胞因子的释放。此外,选择性的脑室周围器官损伤阻碍了小鼠对血管紧张素II的典型血压升高反应。
有趣的是,脑室周围器官受损的小鼠无法激发T细胞并促进T细胞在血管系统中的浸润,这表明高血压患者的神经系统和免疫系统之间存在关系。
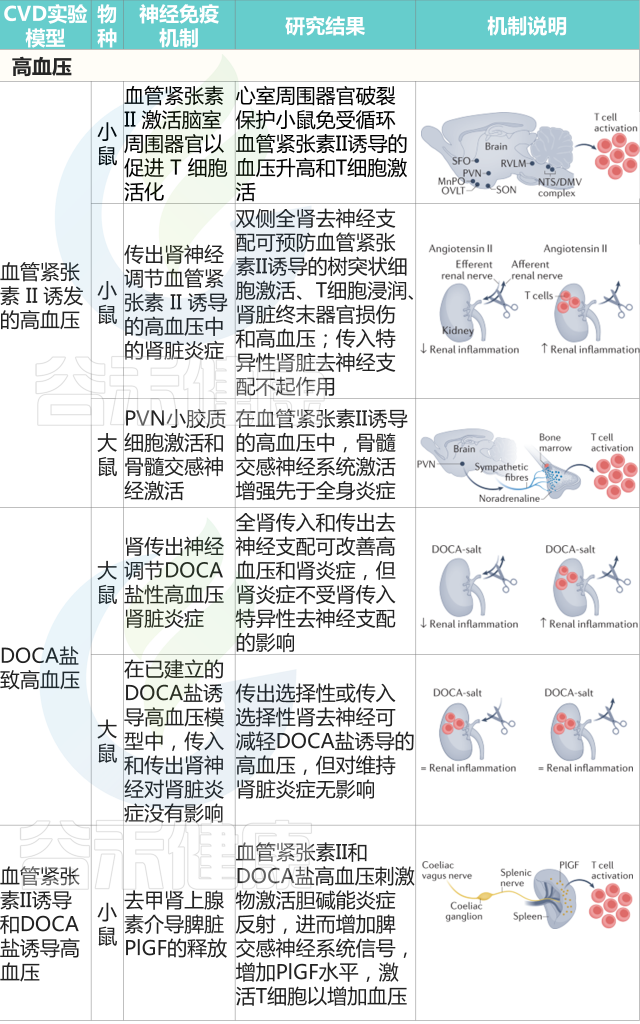

Carnevale D. Nat Rev Cardiol. 2022
高血压患者免疫系统的直接神经控制随后被证实。利用小鼠脾神经的显微神经学检查,血管紧张素II和DOCA盐均能增加神经放电,促进脾脏中去甲肾上腺素的释放。选择性脾脏去神经可防止血压升高以应对任何一种高血压刺激,脾切除术也重现了这一效应。
逆行追踪法,加上在测量脾神经放电时进行的选择性去神经手术,阐明了腹腔迷走神经输出是由高血压刺激激活的节前神经元。
在分子水平上,脾脏中的去甲肾上腺素释放是促进胎盘生长因子激活所必需的,胎盘生长因子是一种血管内皮生长因子家族的血管生成生长因子,也具有对血压升高至关重要的免疫调节功能。
高血压患者的神经免疫另一个相互作用的水平被称为双向脑-骨髓轴,即骨髓中交感神经流出增加先于全身炎症。
有关高血压患者肠道失调的证据正在迅速积累,来自小肠的激活免疫细胞已被证明与血压升高和大脑靶器官损伤有关。目前还不清楚是否存在相反的途径,即神经信号控制与高血压发病和进展相关的肠道和免疫机制。
动脉粥样硬化
脂质在动脉壁的积聚是动脉粥样硬化的一个典型特征,并伴随着免疫细胞的进行性浸润,导致斑块的形成。这一过程以慢性低度炎症为特征,逐渐增加动脉粥样硬化斑块的大小并导致动脉阻塞。
尽管有很多工作研究了导致斑块形成和决定斑块稳定性的机制,但神经免疫通讯的潜在作用才刚刚开始研究。
动脉粥样硬化斑块没有神经支配,但在斑块形成和进展过程中调节免疫反应的神经线索已被确定。Netrin 1首先被确定为指导轴突生长锥的神经信号,在人和小鼠动脉粥样硬化动脉的巨噬细胞中也发现了Netrin 1,它通过趋化因子驱动的迁移过程抑制巨噬细胞的排出。
巨噬细胞中的Ntn1缺失阻碍了小鼠的动脉粥样硬化过程,促进巨噬细胞从斑块中流出。
另一种蛋白质通常存在于神经元中,与胆碱能途径有关,可调节高胆固醇血症Ldlr–/–小鼠的动脉粥样硬化过程。在骨髓来源的细胞中,编码α7烟碱型乙酰胆碱受体(α7-nAChR)的Chrna7被切除会恶化小鼠动脉粥样硬化的进展。值得注意的是,人类动脉粥样硬化病变的特征是存在α7-nAChR+免疫细胞,表明该受体的通用相关性。
对受动脉粥样硬化影响的动脉周围三级淋巴器官的鉴定表明,神经机制可能与这些淋巴聚集相互作用,以控制和/或调节动脉粥样硬化疾病的进展。
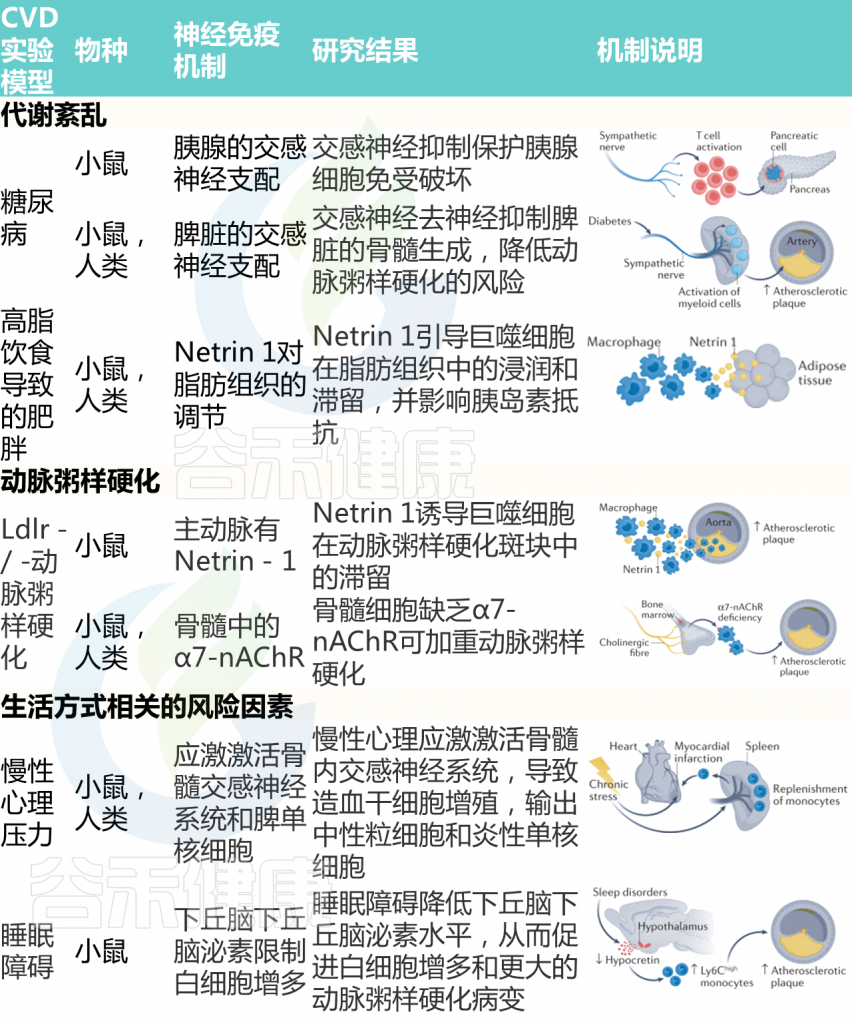

Carnevale D. Nat Rev Cardiol. 2022
代谢紊乱和肥胖
代谢综合征通常指可能单独或合并发生的一系列疾病,总体上增加了CVD的风险。除了血压升高,通常还包括高血糖和肥胖。
已知ANS失衡和免疫系统激活是代谢综合征的特征。在小鼠中发现了自身免疫性糖尿病的神经免疫机制。由CD8+T细胞介导的对胰腺β细胞的攻击诱导,糖尿病的发病取决于完整的胰腺神经支配的存在。
事实上,6-羟基多巴胺的化学消融或去甲肾上腺素能胰腺纤维的手术去神经支配阻碍了这些小鼠糖尿病的发病。在分子水平上,这种效应是由α1-肾上腺素能受体信号诱导的,因为使用哌唑嗪而不是普萘洛尔可以重现胰腺去神经支配的保护作用。
神经信号还可以控制与高脂饮食诱发的肥胖相关的糖尿病。患有肥胖症的小鼠和人类的脂肪组织被免疫细胞密集浸润,这些细胞导致脂肪组织炎症和胰岛素抵抗。
值得注意的是,脂肪组织中存在神经免疫指导线索netrin 1,这表明netrin 1可能调节巨噬细胞向脂肪组织的动员。此外,选择性缺失小鼠造血细胞中的Ntn1可有效促进巨噬细胞从脂肪组织中排出,减少炎症,并改善胰岛素敏感性。
这些发现确定了靶组织中的神经免疫相互作用,但免疫器官的神经控制也参与了疾病相关炎症状态的系统调节。例如,由脾交感神经驱动的神经通路已被确定为糖尿病的关键。通过手术或使用6-羟基多巴胺实现的选择性脾脏去神经支配,阻碍了糖尿病小鼠的过度脾脏骨髓生成。
一种连接大脑和脂肪组织的新型神经免疫途径已经被描述。在小鼠的脂肪间充质细胞附近发现了交感神经,交感神经控制着一个特定免疫细胞亚群的活动:2型固有淋巴细胞。
反过来,2型固有淋巴细胞通过释放神经营养因子来调节脂肪组织的稳态和肥胖。重要的是,通过在小鼠身上使用逆行追踪技术,结合外科手术和化学遗传学操作,定义了一个新的神经回路,通过交感主动脉-肾回路将脂肪组织中的2型固有淋巴细胞连接到高阶脑区,如室旁核。未来的研究应该调查这种新发现的神经免疫回路是否与肥胖和胰岛素抵抗的心血管并发症有关。
生活方式相关的危险因素
众所周知,生活方式相关的风险因素对CVD的发病率有着深远的影响,同时也对免疫系统构成挑战。此外,心理或身体上的应激状态与ANS的紊乱有关。对生活方式相关风险因素对心血管系统有害影响的潜在相关神经免疫相互作用的研究可以揭示创新的治疗机会。
正如在人类身上经常观察到的那样,慢性应激状态会增加小鼠的血压。值得注意的是,Rag1–/–小鼠对应激诱导的高血压具有抵抗力,并能减轻靶器官损伤。
除了血压升高,慢性应激还会增加动脉粥样硬化和心肌梗死的易感性。经过反复和各种应激性挑战的小鼠显示出造血干细胞增殖增加,导致产生高水平的促进疾病的炎性白细胞。这种效应是由骨髓交感神经纤维释放的去甲肾上腺素增加介导的,而去甲肾上腺素又反过来调节造血干细胞增殖、中性粒细胞和炎性单核细胞的排出。
睡眠障碍对心血管健康构成了重大挑战。小鼠正常睡眠节律的改变会增加动脉粥样硬化,与过度造血和促炎性单核细胞积聚有关。
在分子水平上,研究发现,睡眠碎片化可下调小鼠130的下视黄醇水平。下视黄醇是一种下丘脑神经激素,在控制睡眠、觉醒和觉醒方面具有重要功能。鉴于下视黄醇通过减少巨噬细胞集落刺激因子1的产生来限制骨髓生成,睡眠不良引起的下视黄醇水平降低与白细胞增多有关。
流行病学数据显示,健康的生活方式,如定期的体育活动,可以降低患CVD的风险。尽管许多观察分析都支持这种关联,但很少有机制研究调查这种有益关系的根本原因。有趣的是,习惯性自愿性跑步会降低小鼠的造血活动。在动脉粥样硬化小鼠中,运动抑制了慢性白细胞增多,但不影响紧急造血。通过降低脂肪-瘦素水平,这种效应促进造血生态位静止,改善心血管炎症和预后。
心肌缺血、心肌病和心力衰竭
ANS通过控制血管张力和各种心肌细胞特性,如收缩力、传导和频率,调节心脏功能。交感神经流出增加是慢性心力衰竭不良后果的最强预测因子之一。此外,非心肌细胞,尤其是常驻和非常驻免疫细胞,在应对各种挑战的心脏重塑中起着至关重要的作用。神经、免疫和心脏机制之间的相互作用值得研究。
急性缺血性心脏损伤通过增加骨髓中的交感神经信号与脾髓样细胞的生成增加有关。从脾脏部署的一部分单核细胞积聚在缺血心肌中,并参与心脏重塑。心-脾轴也被发现参与慢性心肌缺血的长期免疫反应,这总体上有助于不良的心脏重塑。脾脏的神经控制是否与这些表型有关仍有待阐明。
慢性高血压和肾功能衰竭会对心肌造成压力或容量过载,如果没有得到充分补偿,最终会导致心力衰竭。
在舒张功能不全的小鼠中,由于单核细胞募集和骨髓和脾脏造血增加,心脏巨噬细胞的数量增加。当巨噬细胞进入心肌时,会产生促纤维化细胞因子IL-10,进而促进胶原沉积和心肌僵硬,进一步加重舒张功能损害。
然而,其他巨噬细胞群体可以通过依赖于多器官相互作用的机制,促进慢性压力超负荷的适应性重塑。受到横向主动脉收缩以诱导心脏压力超负荷的小鼠增加了肾交感神经流出,由此去甲肾上腺素刺激粒细胞-巨噬细胞集落刺激因子的分泌,并对心脏巨噬细胞产生旁分泌作用。这项研究表明,心肌对慢性压力超负荷的适应取决于肾脏和心脏的神经和免疫反应之间的整合。
随后的研究阐明,心肌在稳定状态下含有大量不同的免疫细胞,对挑战的反应取决于常驻和招募的免疫细胞群体之间的整合。
鉴于ANS通过从颈上神经节、星状神经节和胸上神经节分支的纤维直接支配心肌,可以想象,参与心脏重塑的免疫反应的神经调节可能发生在心脏局部。
值得注意的是,尽管颈上神经节的去神经支配对心肌缺血引起的急性心脏重构没有影响,但从长远来看,这一过程减少了炎症浸润,减轻了心力衰竭。
肾脏疾病
肾钠处理、肾素分泌和肾血管张力受ANS的严格调节。肾传入和传出神经支配构成了最广为人知和研究最广泛的心血管反射系统之一。此外,炎症和免疫浸润通常伴随肾脏疾病。
急性肾损伤或慢性肾脏疾病均可导致肾功能衰竭,总的来说会增加心血管疾病的风险。促炎症环境和ANS平衡改变是肾病的特征,但神经系统和免疫系统之间的相互作用才刚刚开始澄清。
已经证实神经免疫调节在急性缺血再灌注反应中对肾损伤的重要作用。当用能引起胆碱能炎症反射的胆碱能激动剂进行预处理时,患有双侧肾缺血-再灌注或细菌内毒素血症的啮齿类动物对肾损伤的敏感性较低,这意味着神经反射调节由不同原因引起的肾损伤引起的炎症过程。
鉴于在类似的肾缺血再灌注损伤小鼠模型中,通过超声激活胆碱能炎症反射通过抑制炎症减轻了结构和功能损伤,该发现具有转化相关性。
2021发表的一项研究确定在小鼠急性肾损伤期间连接肾脏、大脑和脾脏的神经通路。通过光遗传学,迷走神经的传出或传入纤维被选择性地刺激,表明两者都对肾脏损伤有保护作用。通过激活传入的顺行感觉纤维,可以描绘出从肾脏追溯到延髓头端腹外侧的神经回路,以补充迷走神经-脾反射。
肾脏也是高血压损害的主要目标,这是心血管疾病不良后果的一个强有力的独立风险因素。浸润肾脏的活化免疫细胞和ANS失衡是高血压性慢性肾病的特征。
在动物模型中,肾脏去神经支配可有效对抗过度的肾交感神经流出和血压升高,并抑制T细胞聚集和由此引起的炎症反应、肾纤维化和蛋白尿。
在分析传入和传出肾神经支配的差异贡献时,在DOCA盐大鼠中,传入特异性肾去神经支配降低动脉血压和交感神经活动的程度与总(传入+传出)肾去神经支配的程度相同,但对血管紧张素II诱导的高血压没有影响。
有趣的是,在随后的一项研究中,同样的研究人员对已建立高血压和肾炎症的DOCA盐大鼠进行了传入特异性或全肾去神经支配。在这些动物中,虽然传入特异性和全肾去神经支配在降低血压方面仍然轻微有效,但两种治疗均未显着改变已确立的肾脏炎症。
总之,这些研究表明,肾神经(传入神经和传出神经)和炎症在高血压和肾脏炎症的发病机制中存在密切联系,但是,在确定高血压后,去肾神经支配不是抑制炎症过程的有效治疗,是通过其他机制维持的。
内脏器官炎症由ANS调节的观察可以追溯到之前研究肾传入和传出神经支配的作用。
一项初步研究表明,肾脏去神经支配可有效预防大鼠实验性肾小球肾炎,从而减少蛋白尿、系膜血管溶解、肾小球胶原沉积和转化生长因子-β的表达。这些数据表明,来自肾脏神经输入的信号分子可能在各种疾病环境下引发肾脏炎症和纤维化,进一步导致终末器官肾损伤。
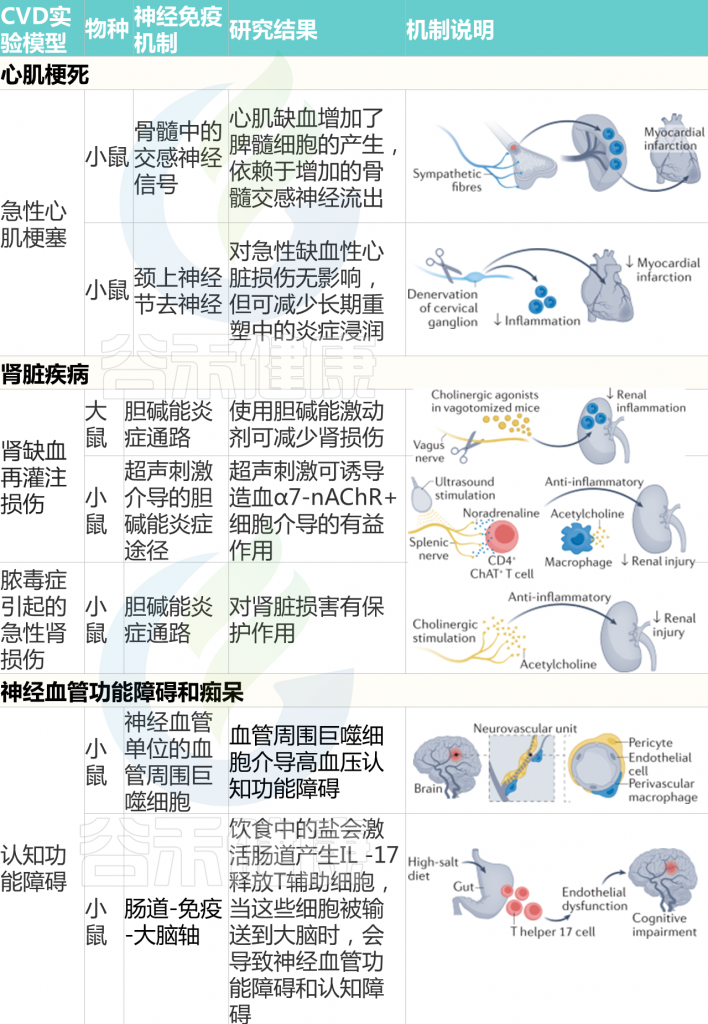

Carnevale D. Nat Rev Cardiol. 2022
神经血管功能障碍和痴呆
大脑由于没有能量储备,一直依赖于通过循环提供的营养,必须根据动态区域激活来适应其需求。因此,大脑对循环系统的改变特别敏感。
多种细胞类型构成脑实质和血管周围组织,包括免疫细胞。正如在其他器官和组织中观察到的那样,大脑中含有常驻免疫细胞(主要是小胶质细胞和血管周围巨噬细胞),当挑战干扰血脑屏障通透性时,这些细胞可以与招募的免疫细胞相互作用。
心血管风险因素会影响血脑屏障的完整性,改变脑血管内稳态,增加患痴呆症的风险。在小鼠和人类中,高血压会导致进行性脑血管损伤,并伴有典型的认知障碍症状。
免疫系统在高血压发病中的作用已得到明确证明,但免疫细胞如何参与高血压诱导的脑损伤才刚刚开始研究。
血管紧张素II诱导的高血压小鼠脑血管周围巨噬细胞的耗竭抵消了血管氧化应激和神经血管损伤,表明免疫的关键作用。
相反,在小鼠中,募集的免疫细胞会导致由血管危险因素(例如过度盐摄入)引起的脑损伤。脑血流、内皮功能和认知能力的损害取决于T淋巴细胞产生的IL-17,而IL-17是通过摄入肠道中的盐激活的。随后的一项研究还阐明了辅助性T淋巴细胞17对大脑有害影响的机制,表明肠道免疫轴对神经的调节非常关键。
外周神经系统的解剖结构和组织结构对轴突亚群的选择性和精确治疗提出了挑战,轴突亚群在特定器官中发挥独特的调节功能。因此,研究人员试图开发出越来越复杂的电极,以刺激更靠近目标组织的较小神经。这种方法有助于获得有关生理学和疾病中免疫神经调节的病理生理学基础的信息。
值得注意的是,靶向脾神经并直接测量其活性的技术的发展,使我们能够确定该免疫器官是神经系统和心血管系统之间串扰的中枢介质。相反,选择性去神经提供了有关该通路在CVD发病和进展中的相关性的机制信息。
研究表明,ANS调节免疫功能的功能障碍是心血管风险和CVD进展的重要组成部分。免疫器官自主神经外流的靶向调节是将这些发现转化为患者治疗的一种可能性。
值得注意的是,神经免疫通讯的机制研究被认为与一系列临床条件有关,如克罗恩病、类风湿性关节炎和原发性干燥综合征,所有这些都涉及免疫和炎症过程的失调。在临床前模型以及随后的炎症和自身免疫性疾病的人类临床试验中进行了探索,以非侵入性方式针对神经免疫机制的可能性也可能成为CVD的一种可能性。
对心血管疾病中调节免疫反应的神经通路的分子和电生理成分的临床前和临床研究为创新疗法提供了理论基础。能够对涉及心血管疾病的神经免疫反射进行精细调节的工具将有助于设计针对组织靶向免疫调节作用的策略,而不会增加感染风险或导致其他不良反应的普遍免疫抑制。根据特定疾病的特定背景和炎症环境,可以通过设计对腹腔迷走神经传出神经的生物电子刺激的选择性模式来微调脾脏的迷走交感神经激活。迄今为止,只有临床前工具已被开发并证明可有效调节免疫细胞从脾脏排出的过程。相反,通过手术切除腹腔神经节或热消融脾动脉周围的交感神经纤维,可以减弱脾交感神经流出的过度激活。
到目前为止,迷走神经刺激的研究主要集中在使用颈部植入装置,这些装置会触发传出和传入神经通路的混合,并产生潜在的不良影响。因此,尽管在自身免疫性疾病的临床试验中取得了有希望的结果,但迷走神经刺激方案具有引起脱靶刺激的局限性。
为了克服这一缺点,已经实施了改进的实验性迷走神经刺激方案,以选择性地刺激腹腔传出迷走神经并诱发脾神经流出。有趣的是,一系列研究提供了交感神经介导的脾神经控制的证据。特别是,通过腹腔神经节与脾神经相连的内脏神经已被证明可调节脾介导的炎症反应。具体作用是整合的还是单独作用的,取决于具体的病理生理学背景。
对腹腔迷走神经刺激后的脾脏免疫细胞的分析显示,特定的生物电子调节模式促进选择性T细胞亚型的排出,这表明可能会发展出靶向免疫调节。
使用活体和离体制剂对小鼠、大鼠、猪和人脾神经进行神经解剖学和功能比较,表明将临床前发现转化为临床相关工具的可行性。然而,尽管这种方法需要在实验模型中进行进一步研究,以揭示CVD中神经免疫通讯的病理生理学基础,但临床应用可能会受到该过程侵入性的限制。
肠道微生物群决定下丘脑-垂体系统的激活水平。特别是,肠道微生物群是心血管疾病发病机制中神经免疫介质的重要来源。
心肌缺血、心肌病和心力衰竭
与 CVD 相关的压力通过激活 ANS 的交感神经分裂来影响整个生物体,包括胃肠道。在 ANS 的影响下,肠道内微生物群的血液供应减少,从而降低了消化腺的活动,胃肠道的肠道蠕动减慢。上述机制决定了由于 CVD 相关应激导致的肠上皮细胞的进一步紊乱。
CVD相关应激期间肠道上皮损伤的机制

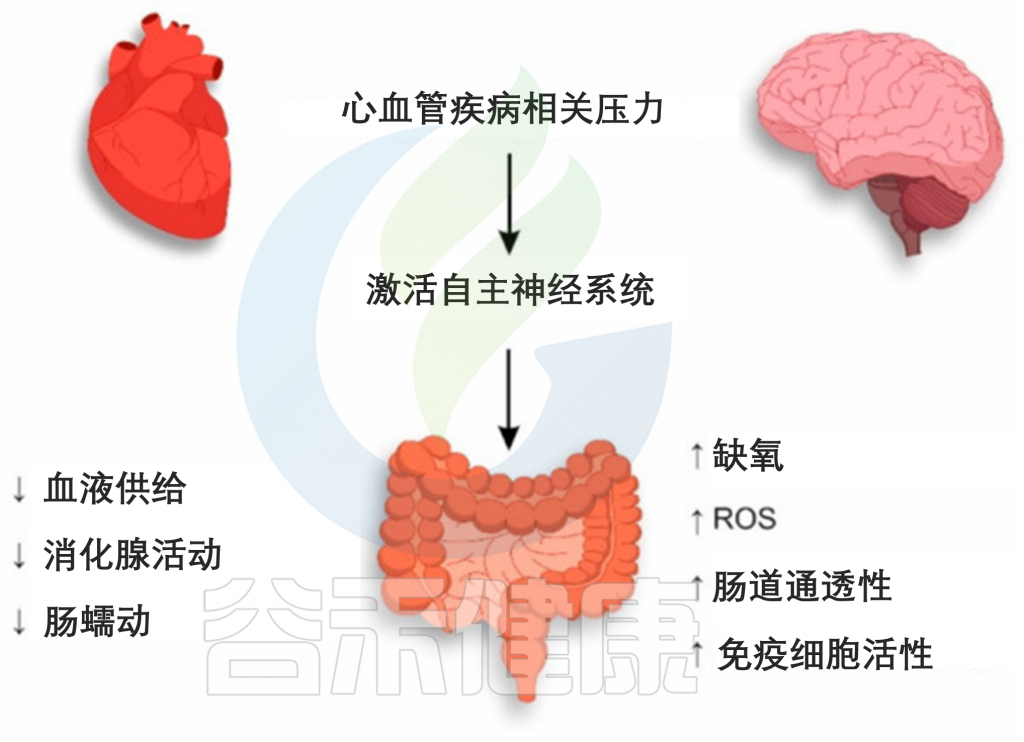
Suslov, Andrey V,, et al. J Clin Med. 2021
肠壁由肾上腺素能交感神经纤维支配,在刺激期间增加水和钠的吸收,伴随着肠道通透性的增加。同时,在大肠迷走神经的影响下,肠上皮杯状细胞产生的粘液减少。
值得注意的是,一方面,粘液为肠道上皮细胞提供保护,使其免受共生体及其代谢产物的影响,另一方面,粘液阻止免疫细胞的过早激活。因此,粘液层的减少和肠壁通透性的增加可导致肠道细菌的紊乱和肠上皮细胞的空间分离。
在Wistar大鼠中显示,出生后早期有限的筑巢压力会导致高皮质类固醇激素血症,增加肠道通透性,减少粪便微生物多样性,导致肠道微生物群组成失衡。肠道血供减少不仅是由于ANS交感分裂的影响,也是由于CVD的致病影响。
几项研究表明,肠道供血衰竭伴随着多种类型的CVD:心肌梗死、严重动脉粥样硬化、慢性心力衰竭、糖尿病和肥胖。因此,CVD期间肠道内的血供衰竭是由多种机制同时决定的。
肠血供减少伴有组织缺氧,而肠粘膜对缺氧最为敏感。
肠粘膜是一种支持粘液层以及微生物群与上皮下组织空间分离的解剖结构。在缺氧期间,有氧和无氧分解代谢循环中的葡萄糖转化会在中间阶段损害能量的生物合成。这导致活性氧(ROS)的释放。
由于活化免疫细胞的积累和 ROS 的产生,再灌注会增加缺血性损伤的破坏性影响。活性氧对蛋白质、脂质、碳水化合物和核酸具有高反应性,导致肠上皮完整性受损。至于肠道菌群与缺血性肠道损伤之间的关系,在大鼠模型中显示,肠道缺血-再灌注损伤导致肠道菌群发生显著变化,大肠杆菌和口腔普氏杆菌数量增加,随后在愈合阶段乳酸杆菌数量增加。
同时,在急性心肌梗死大鼠模型中证明,肠道微生物群的改变会导致肠道炎症和细胞凋亡的发展,也就是说,肠道缺血不仅会导致肠道微生物群失衡,反之亦然,肠道微生物群的变化会导致肠道损伤。
除粘液层外,肠上皮层在提供肠屏障功能方面也起着重要作用。肠上皮层由与紧密连接蛋白连接的上皮细胞组成,特别是紧密连接蛋白、封闭蛋白、钙粘蛋白和粘附分子。
紧密连接蛋白作为肠-脑轴结构中肠屏障的重要元素。研究表明,脑肠肽ghrelin可以减轻动物模型脑出血后激活紧密连接蛋白 zonula occludens-1 和 claudin-5 的肠道屏障功能障碍。
一些研究通过改变紧密连接蛋白证明了肠道微生物组变化与肠道屏障损伤的关系。例如,植物乳杆菌增强上皮屏障刺激基因的表达,这些基因参与紧密连接zonula occludens-1、zonula occludens-2 和 occludin 的信号通路。
在小鼠模型的另一项研究中也证明了相同的效果,其中用乳酸杆菌、双歧杆菌和链球菌的混合物治疗增加了紧密连接 zonula occludens-1 和紧密蛋白的表达。紧密连接完整性的改变可导致与代谢宿主状态受损相关的细菌或细菌代谢物的流入增加,表现为心脏代谢疾病。
肠上皮和粘液屏障位于肠道环境、肠道细菌和免疫系统之间。
众所周知,肠上皮层包括不同类型的细胞:
肠细胞
杯状细胞
肠内分泌细胞
潘氏细胞
簇状细胞
M细胞
以及多种专业免疫细胞,如
淋巴细胞
树突状细胞
巨噬细胞
均位于肠粘膜表面附近
上皮内淋巴细胞是第一个对致病因素做出反应的免疫细胞,它侵入上皮并传播树突以检测肠腔抗原。
其他细胞位于有组织的淋巴结构中,如派尔斑和隐斑,或分散在固有层内。
与巨噬细胞和树突状细胞等专业免疫细胞类似,肠上皮细胞表达先天免疫受体,如模式识别受体,包括 Toll 样受体 (TLR) 和核苷酸结合蛋白,含有寡聚化结构域 (NOD)。
潘氏细胞合成抗菌分子受 TLR4/MyD88 和 NOD2 信号传递的调节,这些信号传递受肠道微生物的控制。
TLR 通过激活促炎信号通路以响应微生物抗原,在先天免疫系统中发挥着重要作用。
肠道免疫细胞通过细胞因子或直接的细胞连接支持肠道黏膜的屏障功能。因此,由 Th17 细胞或 3 型先天性淋巴细胞 (ILC3) 产生的 IL-17 和 IL-22 会增加肠上皮细胞分泌的 AMP 和 Reg3 家族蛋白 。
此外,上皮内淋巴细胞产生的 IL-6 可增强肠上皮细胞增殖并促进损伤后黏膜的修复。然而,其他促炎细胞因子,如 TNF-α 和 IFN-γ,通过抑制 β-连环蛋白/T 细胞因子 (TCF) 信号传递来抑制上皮细胞增殖 。
肠上皮细胞还通过分泌细胞因子和趋化因子来调节宿主免疫反应。
在用革兰氏阴性细菌大肠杆菌和变形杆菌的鞭毛蛋白刺激肠内皮期间,TLR5 / MyD88 信号促进 IL-8 的产生,IL-8 将中性粒细胞募集到固有层中。
前面CVD中提到的胆囊收缩素、胰高血糖素样肽 (GLP) 和血清素由肠道内分泌细胞分泌,影响肠道免疫系统的活动。
胆囊收缩素通过 CD4+ 细胞和 B 细胞调节细胞因子的分化和产生。值得注意的是,交感神经系统调节的消化腺活性的降低间接影响免疫细胞的活性。
有趣的是,微生物群对上皮肠屏障的影响不仅取决于免疫成分,还取决于其他影响。特别是,由肠道微生物群合成的短链脂肪酸被用作上皮细胞的能量来源,并间接增强上皮屏障。微生物代谢产物吲哚通过激活孕烷-X 受体具有防御屏障作用,并增加胰高血糖素样肽-1 的分泌。
无法保存肠上皮的复杂解剖和功能特征会降低上皮屏障的抗菌、免疫调节和再生能力。粘膜的破坏导致共生细菌及其代谢物从肠腔转移到上皮下组织,导致促炎细胞因子的分泌。反过来,这会导致器官功能障碍,并伴有肠粘膜炎症。
现在越来越多的证据表明,肠道细菌的代谢物在炎症过程中通过被破坏的肠道屏障进入循环。
微生物组介导疾病的三个因素:
首先,肠道细菌的代谢物是慢性免疫反应的永久激活剂,会在肠道以及整个生物体中引起持续性炎症。
其次,先天免疫系统成熟期肠道微生态失调导致免疫耐受性受损,随后表现为自身免疫和自身炎症性疾病。
第三,微生物组可以影响控制肠道远处组织特异性免疫的免疫因素。
考虑到肠道微生物群在神经免疫网络形成中的作用。脑源性神经营养因子 (BDNF) 是一种应激蛋白,是神经营养因子家族的成员,可增加大脑中神经元对功能障碍的抵抗力,并提供神经系统的可塑性。
BDNF 控制了广泛的过程,包括微生物群-肠-脑轴参与心脏代谢疾病的发病机制。研究表明,BDNF 信号可能介导间歇性禁食对血糖调节和心血管功能的影响 。此外,研究表明,用高剂量益生菌治疗可以调节斑马鱼的行为,导致一些大脑相关基因的表达发生显着变化,例如 BDNF。因此,BDNF 可能代表了微生物-肠-脑轴的分子机制。
神经免疫轴:微生物群-肠-脑-CVD
肠道粘液膜的缺氧损伤、微生物群转移到上皮下组织、肠上皮屏障功能的破坏、肠道细菌代谢产物和炎症细胞因子的合成使肠道成为最大的内毒素源。炎症介质通过全身血液和淋巴循环到达神经系统中心。
血脑屏障
血脑屏障 (BBB) 在妊娠期间形成,充当大脑和血液循环系统之间的选择性过滤器。肠道微生物群和微生物代谢物在血脑屏障形成中的重要性已在不可知菌小鼠身上得到证实。在没有肠道微生物的情况下,与正常动物的血脑屏障相比,小鼠的血脑屏障变得具有渗透性。
研究发现,大脑的淋巴系统流入脑脊液,进入蛛网膜下腔,并进一步进入颈深淋巴结。脂质的溶解度、蛋白质的三级结构、浓度、分子质量和化合物的电荷决定了介质从外周血供应和淋巴系统到大脑的通道。
外周血中的细胞因子主要是亲水性的,可以调节神经系统的免疫功能。研究还表明,静脉注射吲哚(类似于色氨酸的细菌代谢产物)可以克服BBB。
LPS(脂多糖)的神经炎症效应通过外周组织中的TLR激活发挥作用,通过血脑屏障阳性的促炎细胞因子在神经系统中引起继发效应。
血脑屏障和淋巴血管系统被认为是信号进入大脑的入口。例如,循环免疫细胞和炎症介质(包括宿主和细菌的激素和神经递质)以及迷走神经刺激代表了有助于直接或间接微生物信号从肠道传输到大脑的机制 。
炎性细胞因子也是激活中枢神经系统的一个重要因素,作为对各种刺激的反应,包括在肠道病理过程中激活下丘脑-垂体-肾上腺轴的促炎性细胞因子。
肠易激综合征患者的皮质醇和促炎细胞因子白细胞介素IL-6和IL-8显著升高。IL-1α细胞因子在中枢神经系统水平上刺激机体的整个葡萄糖代谢;IL-6、IL-1、TNF-α和IFN细胞因子相互独立地刺激下丘脑-垂体-肾上腺轴(HPA轴)。
除了炎性细胞因子外,炎症期间环氧合酶系统合成的前列腺素也参与HPA轴的激活。多项研究发现炎性细胞因子(TNF-α、IL-1和IL-6)在HPA轴激活中的作用。任何炎性细胞因子的注射都会刺激HPA轴,并导致循环皮质酮水平升高。值得注意的是,在LPS穿透后,任何细胞因子的阻断都不会阻断HPA轴的激活,也就是说,如果肠上皮屏障功能停止,LPS进入血液,那么细胞因子激活HPA轴的复制效应就会实现。那么接下来就是神经免疫性疾病和靶器官损伤了。
因此,所有炎症介质都会促进HPA轴的激活,而阻断任何一种细胞因子都不能减少HPA轴的刺激,因为它们之间存在重复效应。
因此,下丘脑-垂体-肾上腺轴的激活是大脑介导的对疾病的基本反应之一。HPA 轴被认为是神经内分泌系统的基础,它在心理和生理压力(包括感染)的影响下调节机体的稳态,促进对压力的充分反应。
所考虑的机制在慢性应激中非常重要。由于情绪唤醒的阈值不足以在CVD期间形成压力,因此神经系统中形成全值压力反应,随后通过肠内炎症介质持续激活HPA,激活ANS的交感分裂。
值得注意的是,机体的整个复杂病理变化是通过急性应激途径发展起来的,而情绪成分(情绪刺激)与慢性应激阈值相对应或完全缺失。这个问题需要进一步研究。因此,综述的机制对神经系统中心(包括ANS中心)有激活作用,ANS中心反过来又支配内脏器官,包括微生物群居住的肠道。
结合有关肠道微生物群的机制及其与神经系统通过肠-脑轴发育紊乱的关系,可以初步得出结论,在CVD期间,来自肠道的介质通过血流和淋巴进入大脑,并激活下丘脑核团。然后,只要下丘脑是ANS的节段上整体中心,ANS的交感神经分裂就会被激活。
因此,来自肠道的介质到达ANS的节段上中心,并激活交感和副交感分裂的工作,从而关闭肠道微生物群参与CVD发病机制的病理循环。许多发表的研究报告表明,微生物群介导的炎症介质的增加会加重CVD的病程和预后。
研究还发现,恢复CVD患者的肠道菌群可以改善疾病的预后。使用增加阿克曼菌属、双歧杆菌、乳酸杆菌、拟杆菌和普氏杆菌的细菌数量的复合治疗制剂可改善CVD的病程。
众所周知,双歧杆菌和乳酸杆菌属的细菌对肠壁具有局部抗炎作用。肠上皮屏障功能的恢复是因为肠壁炎症的减少,这意味着炎症介质在体循环中的水平降低,因此它们对神经系统的激活作用降低。
尤其是,高血压与肠道微生物群紊乱和肠脑轴失调有关。在高血压大鼠模型中证明,长期开菲尔治疗可降低IL-6和TNF-α蛋白密度,并消除在下丘脑室旁核和延髓头端腹外侧区观察到的小胶质细胞激活,保护心脏调节核免受肠道介导炎症的影响,从而提供开菲尔的降压作用。在小鼠缺血性中风或脑缺血模型中进行的一些研究表明,缺血性中风脑损伤通过增加促炎反应和细胞因子、趋化因子和免疫细胞浸润大脑结构,促进肠道失调的发展,这与不良预后有关。
CVD患者肠道菌群与神经系统的相互作用
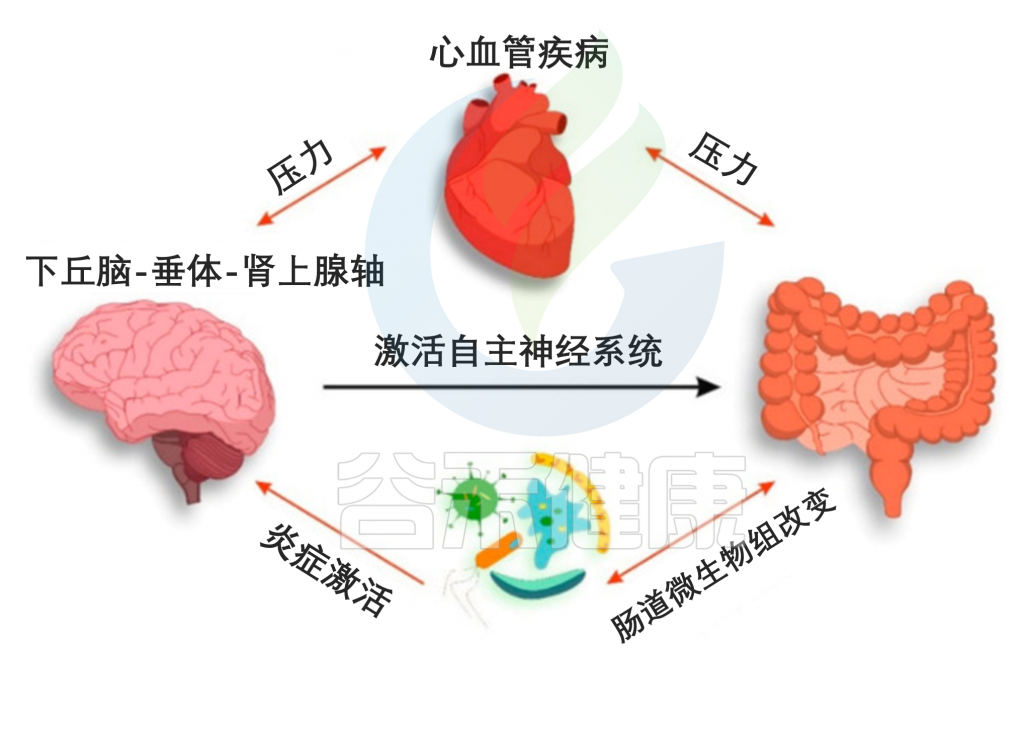

Suslov, Andrey V,, et al. J Clin Med. 2021
肠道微生物群参与了 CVD 的发病机制并决定了 HPA 轴的炎症激活。
一些研究调查了微生物组靶向制剂可改善 CVD 病程,减少动脉粥样硬化的进展和主要 CVD 并发症的风险 。
在这里,我们可以假设基于微生物组治疗的有益心脏保护机制是由于其对微生物组-肠道-脑轴的影响。
通过阻断左前冠状动脉诱发心肌梗死的大鼠中显示,与安慰剂组相比,使用基于瑞士乳杆菌和长双歧杆菌组合的益生菌可降低与心肌梗死相关的不同脑区的凋亡倾向。
另一项针对小鼠的研究表明,在实验性中风后,抗生素调节肠道微生物群可降低缺血脑内的LPS水平和神经炎症。一项针对冠心病患者的研究发现,益生菌鼠李糖乳杆菌与益生元菊糖复合物对抑郁、焦虑和炎症生物标志物具有有益作用。
建议所有成年人每周至少进行150-300分钟的中等强度或75-150分钟的高强度有氧运动,或两者的同等组合。当然要视身体状况而定,如果自身基础不太好,在能力和条件允许的情况下尽可能保持一些低强度活动。
减少久坐时间,适当进行轻度体力活动是有益的。
饮食对人类健康的多个方面都有重大影响,不健康的饮食模式(例如高脂肪的西式饮食)与动脉粥样硬化、代谢综合征和肥胖症等一系列慢性疾病的风险增加有关。免疫系统正在成为这种关系的关键中介,通过食物诱导调节与慢性炎症相关的促炎/抗炎因子以及增加/减少各种病理结果的风险。
支持这一观点的大型流行病学研究表明,以高摄入饱和脂肪和低纤维为特征的饮食模式与促炎生物标志物水平升高有关,例如 C 反应蛋白 (CRP) 和白细胞介素 IL- 6。相反,摄入大量水果和蔬菜和/或经常食用鱼类的饮食模式与较高的脂联素血清浓度相关,脂联素具有抗炎特性。
这些观察性研究得到了干预试验的进一步支持,干预试验表明饮食可能会影响血清炎症生物标志物谱。例如,高胆固醇食物的饮食干预增加了对胰岛素敏感的参与者的 CRP 和血清淀粉样蛋白 A 浓度。

Yu E, et al.,J Am Coll Cardiol. 2018
健康的饮食可以降低心血管疾病和其他慢性疾病的风险。从更多荤食(以动物为基础的)饮食模式转变为素食(以植物为基础的)饮食模式,可能会减少心血管疾病。
建议饮食中多吃水果、蔬菜、坚果等;少量食用低脂乳制品和海鲜;而且尽可能少摄入加工肉类、含糖饮料、精制谷物、盐等。
戒烟可迅速降低心血管疾病风险,是预防动脉粥样硬化性心血管疾病最具成本效益的策略。
建议限制饮酒或戒酒,每周最多饮酒100g。
通过改变生活方式来达到和保持健康体重,对这些指标可产生有利影响(如血压、血脂、血糖等),并降低CVD风险。
当饮食和体力活动改变以及其他常规的非侵入性干预措施效果不佳时,应考虑对高危人群行减重手术;也可以考虑使用具有心血管保护作用的抗肥胖药物。
新指南提出心理压力与动脉粥样硬化性心血管疾病风险相关,需要加强对心理障碍患者的关注和支持,对其进行生活方式和药物干预,方式包括呼吸练习、冥想、写日记、适当锻炼、与大自然接触、与他人建立联系等,尽可能改善压力症状和生活质量,可改善心血管疾病。
通过对血压,血糖,血脂等指标的日常监测来了解健康状况,也可以通过肠道菌群健康检测等方式来了解慢病风险,阻断这类慢病的进程,预防控制代谢紊乱,从根本上预防心血管疾病的发生。
本文主要基于研究阐述免疫、炎症的神经调节以及肠道菌群如何参与 CVD 的发病和进展。
在CVD的初始阶段,肠道微生物群在其发病机制中的作用是次要的,这意味着细菌的定性和定量变化不像在随后的阶段那么重要。
然而,后来,当肠道微生物群决定了下丘脑-垂体-肾上腺轴的炎症激活水平时,肠道微生物群的变化对CVD的发展具有重要意义。
在CVD进展过程中,肠道细菌与肠壁的病理过程密切相关,成为CVD发病机制中的关键因素之一。在这方面,试图确定与CVD进展过程最相关的肠道细菌,可能是开发CVD诊断、预防和治疗新相关方法的重要一步。
此外,注意通过饮食衍生的微生物代谢物、炎症反应转变、校准神经免疫从而影响CVD干预和治疗反应。
·
具体基于肠道菌群的饮食调节,以及CVD 进展中的饮食-微生物群串扰的机制,菌群代谢产物的作用等详见本次推文的第二篇:
《 饮食-肠道微生物群对心血管疾病的相互作用 》主要参考文献:
Carnevale D. Neuroimmune axis of cardiovascular control: mechanisms and therapeutic implications. Nat Rev Cardiol. 2022 Mar 17. doi: 10.1038/s41569-022-00678-w. Epub ahead of print. PMID: 35301456.
Yu E, Malik VS, Hu FB. Cardiovascular Disease Prevention by Diet Modification: JACC Health Promotion Series. J Am Coll Cardiol. 2018;72(8):914-926. doi:10.1016/j.jacc.2018.02.085
Suslov, Andrey V et al. “The Neuroimmune Role of Intestinal Microbiota in the Pathogenesis of Cardiovascular Disease.” Journal of clinical medicine vol. 10,9 1995. 6 May. 2021, doi:10.3390/jcm10091995
Thaiss CA, Zmora N, Levy M, Elinav E. The microbiome and innate immunity. Nature. 2016 Jul 7;535(7610):65-74. doi: 10.1038/nature18847. PMID: 27383981.
Huh JR, Veiga-Fernandes H. Neuroimmune circuits in inter-organ communication. Nat Rev Immunol. 2020 Apr;20(4):217-228. doi: 10.1038/s41577-019-0247-z. Epub 2019 Dec 17. PMID: 31848462.
Frank L J Visseren, François Mach, Bryan Williams,et al., ESC Scientific Document Group, 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice: Developed by the Task Force for cardiovascular disease prevention in clinical practice with representatives of the European Society of Cardiology and 12 medical societies With the special contribution of the European Association of Preventive Cardiology (EAPC), European Heart Journal, Volume 42, Issue 34, 7 September 2021, Pages 3227–3337