-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
氨基酸(AA)稳态对人体健康至关重要,其紊乱与多种疾病的发生和进展密切相关,如2型糖尿病和炎症性肠病(IBD),并且常常是治疗结果的决定性因素。
肠道微生物群可能通过多种机制调节宿主氨基酸的可用性,例如影响消化酶(如胰蛋白酶)的活性。肠道微生物群定殖还可能改变肠道通透性,从而影响胃肠道中游离氨基酸的运输和吸收。此外,肠道微生物可能直接利用或代谢肠道中的氨基酸,或合成并向宿主提供氨基酸。以往研究表明,肠道微生物组的变化(或其存在)可能影响肠道氨基酸谱。然而,参与调控宿氨基酸稳态的关键菌株及代谢基因仍未完全明确。
今天分享的这一篇发表在《Cell Host & Microbe》期刊上的研究论文”Microbiota metabolism of intestinal amino acids impacts host nutrient homeostasis and physiology”,通过比较Met无菌(GF)小鼠与无特异病原体(SPF)小鼠的分解物谱已证明,肠道细菌定殖会影响胃肠道(GI)中游离氨基酸谱,还通过高效代谢肠道氨基酸来重塑宿主氨基酸的格局。为确定责任微生物/基因,该研究开发了基于代谢组学的检测法,筛查了104个共生菌,并识别出能高效利用氨基酸的候选基因,并发现这些基因调控了肠道和循环氨基酸的可用性。
结果显示,不同氨基酸具有特定的细菌消费者,消耗效率差异明显。例如,天冬酰胺和谷氨酸被拟杆菌和部分梭菌高效利用,而芳香族氨基酸(色氨酸、酪氨酸)及支链氨基酸(BCAAs)仅为部分厚壁菌门成员所代谢,效率较低。值得注意的是,支链氨基酸与色氨酸代谢相关的微生物基因还能通过调节外周血清素间接影响宿主葡萄糖平衡。
总体而言,该研究首次系统揭示了肠道微生物群编码的氨基酸代谢活动对宿主营养稳态的深远影响,为理解微生物介导的氨基酸利用及其对宿主代谢调控机制提供了关键分子依据。
氨基酸稳态对人类健康至关重要,其紊乱与2型糖尿病和炎症性肠病(IBD)等多种疾病的进展密切相关。虽然传统上认为肠道和肝脏是调控营养代谢的主要器官,但最新研究发现,肠道微生物群通过代谢氨基酸能够深刻重塑宿主的氨基酸谱。
★该研究的核心意义在于:
•揭示了肠道微生物群通过代谢肠道氨基酸影响宿主氨基酸稳态的分子机制;
•鉴定了高效消耗氨基酸的特定肠道微生物及其代谢基因;
•阐明了微生物群氨基酸代谢基因如何通过外周血清素调节宿主葡萄糖稳态;
•为通过调节肠道微生物群代谢活性改善人类健康提供了新的靶点和策略。
▸ 肠道微生物群对宿主氨基酸水平的影响
研究首先通过比较无菌(GF)小鼠、无特定病原体(SPF)小鼠以及接受SPF微生物群移植(FMT)的GF小鼠,证实了肠道微生物群定植显著降低了肠道和循环氨基酸水平。
靶向代谢组学分析显示,SPF小鼠或接受SPF微生物群的GF小鼠肠道和循环氨基酸浓度普遍降低,这与之前的研究结果一致,表明微生物对肠道氨基酸的利用可能是影响宿主氨基酸稳态的主要途径之一。
▸ 高效代谢氨基酸的肠道微生物筛选
为识别高效代谢肠道氨基酸的微生物,研究者建立了一种基于活细胞的高通量代谢组学筛选方法,对104种肠道共生菌进行了系统分析。该方法综合考虑多个因素:
•生长阶段差异:绘制各菌株生长曲线并进行参数拟合,确保在可比生长阶段进行筛选;
•时间动态分析:分别在15、30和60分钟测定氨基酸消耗量,以精确评估不同菌株对特定氨基酸的利用速率;
•营养条件优化:在测定缓冲液中除氨基酸外,补充无机氮源、微量矿物质、维生素及额外碳源(如葡萄糖),以避免因营养限制导致的氨基酸非特异性快速消耗。
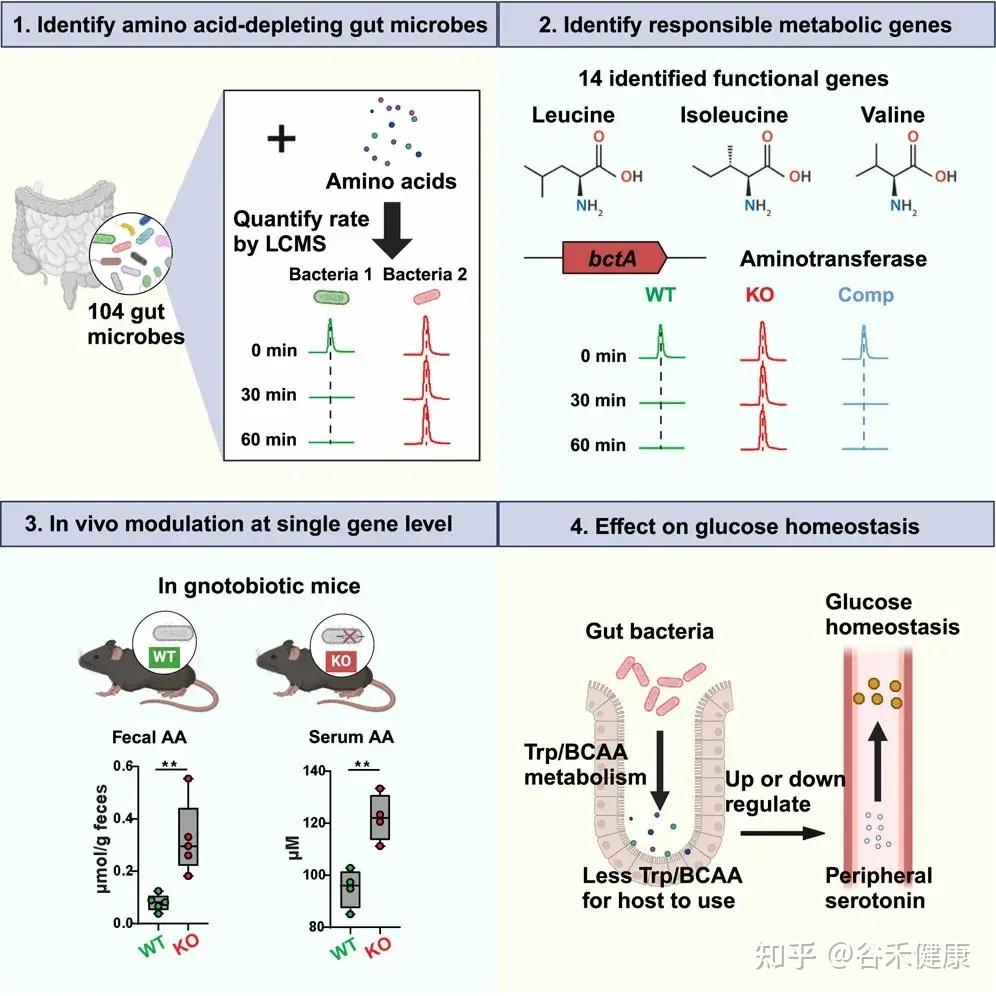
研究流程图展示了从识别消耗氨基酸的肠道微生物、鉴定负责的代谢基因、单基因水平的体内调节到对葡萄糖稳态影响的完整研究路径。
▸ 微生物代谢基因的鉴定与功能验证
研究利用CRISPR-Cas9和ClosTron等基因编辑技术,在系统发育多样的肠道微生物中开展大规模基因缺失分析,以鉴定氨基酸代谢的关键基因。筛选标准包括:
1.代谢基因编码的酶以氨基酸为直接底物;
2.这些基因存在于高效代谢氨基酸的肠道菌株中;
3.携带相关基因的菌株能稳定定植于无菌(GF)小鼠肠道,并降低宿主体内相应氨基酸水平。
通过构建基因敲除和互补菌株并结合代谢组学分析,研究识别出多种氨基酸代谢相关基因,并在单菌定植的GF小鼠模型中验证了其对肠道及血清氨基酸水平的调控作用。
▸ 高效代谢氨基酸的肠道微生物鉴定
通过大规模筛选,研究发现不同肠道微生物对氨基酸的代谢效率和偏好存在显著差异:
鉴定高效利用氨基酸的肠道微生物候选者
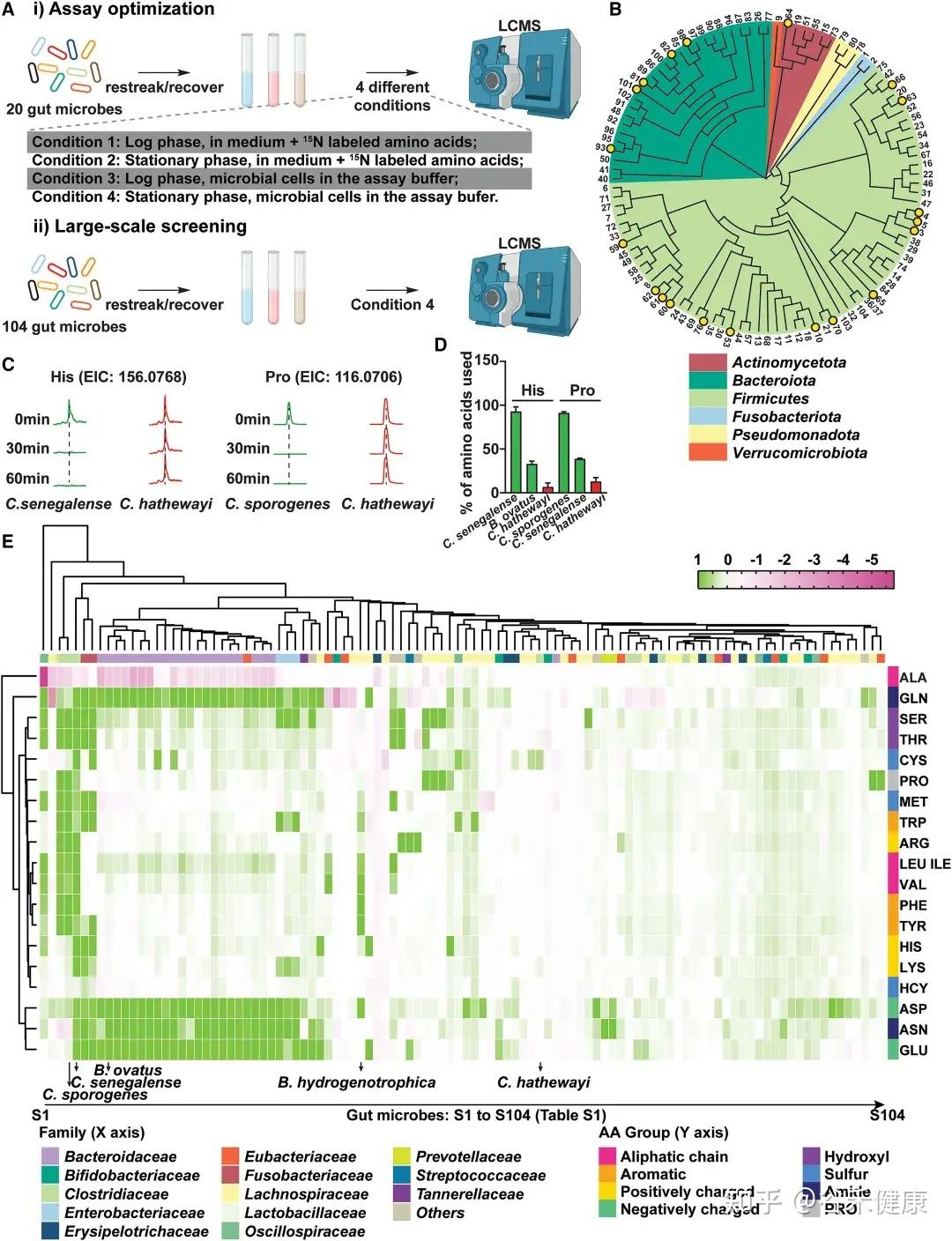
热图展示了104种肠道微生物对不同氨基酸的代谢情况,揭示了微生物系统发育与氨基酸代谢效率之间的复杂关系。
★ 关键发现包括:
•梭菌属微生物:如Clostridium sporogenes ATCC15579和Clostridium senegalense DSM25507,可高效代谢多种氨基酸,包括精氨酸、芳香族氨基酸、支链氨基酸、组氨酸、赖氨酸和脯氨酸等。
•拟杆菌属共生菌:作为肠道多糖的主要利用者,也能有效代谢天冬酰胺(Asn)、天冬氨酸(Asp)和谷氨酰胺(Gln)等氨基酸。
•氨基酸特异性代谢:不同氨基酸具有特定的细菌“消费者”,消耗效率差异明显。天冬酰胺和谷氨酸通常被拟杆菌和部分梭菌快速利用,而芳香族氨基酸(色氨酸、酪氨酸)及BCAA仅被部分厚壁菌门或梭菌较低效地代谢。
▸ 氨基酸代谢相关微生物基因的鉴定
通过对高效代谢氨基酸的肠道微生物进行大规模基因缺失分析,研究鉴定出多种关键氨基酸代谢基因。这些基因编码的酶包括转氨酶、脱羧酶、消旋酶和氨裂解酶等,具有以下特征:
•功能冗余性:单株细菌常含多个具有相似功能的基因。例如,C. sporogenes 携带两种精氨酸脱亚胺酶基因(adiA 和 adiB),单基因敲除影响较小,而双敲除可完全消除其精氨酸代谢能力。
•底物特异性:代谢酶展现高度底物选择性。例如,C. sporogenes 的转氨酶 ArtA 特异作用于色氨酸和酪氨酸,但对苯丙氨酸代谢影响极小。
•催化多样性:不同类型的酶参与多条代谢途径。支链氨基酸和色氨酸经转氨途径代谢,脯氨酸通过还原反应被 C. sporogenes 利用,而谷氨酸、甲硫氨酸、丝氨酸和苏氨酸则由氨裂解酶快速分解。
•功能可转移性:这些酶的催化功能具有可转移性,在其他肠道共生菌中表达其编码基因可赋予相应氨基酸的消耗能力。
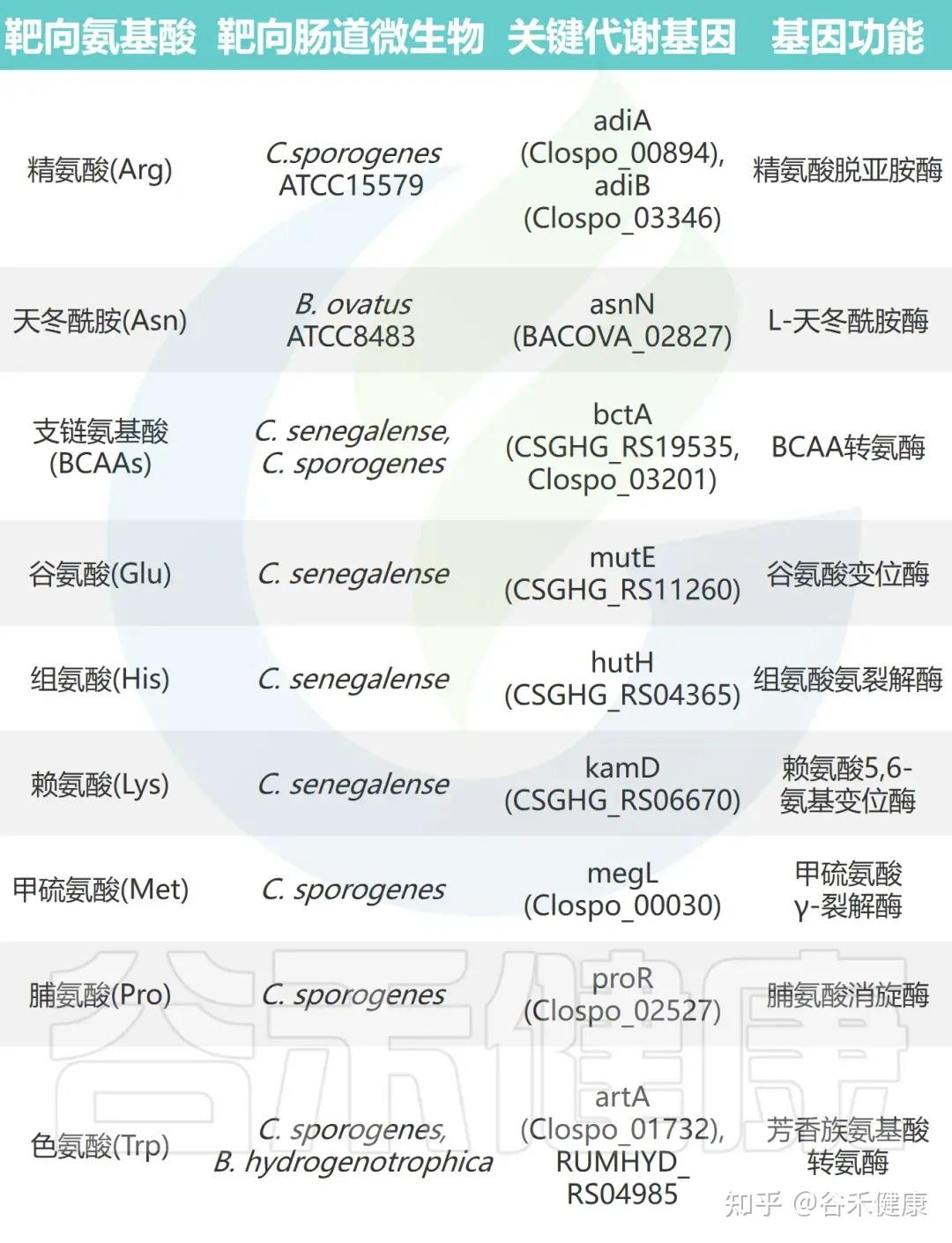
▸ 微生物代谢基因调控宿主氨基酸稳态
通过将野生型菌株及其代谢基因缺失突变体分别单菌定植于GF小鼠,研究发现这些基因显著影响宿主肠道及循环系统中的氨基酸水平:
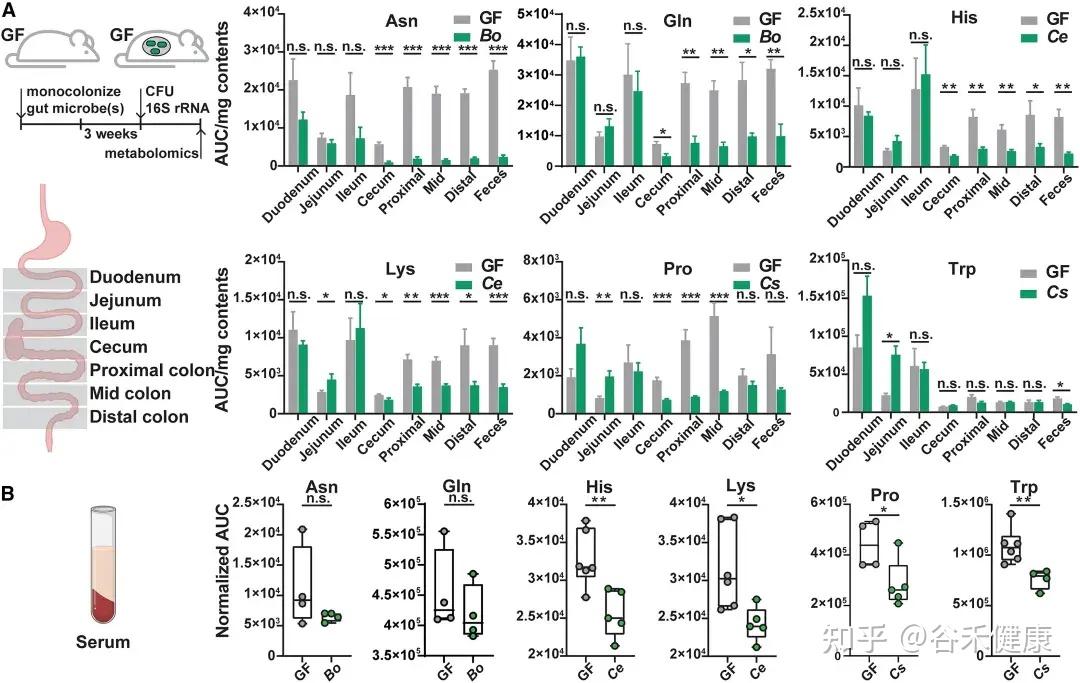
无菌小鼠单一定植B. ovatus、C. senegalense和C.sporogenes野生型菌株后,肠道和血清中特定氨基酸浓度显著降低。
★ 主要发现包括:
•肠道氨基酸稳态调控:多数鉴定出的微生物代谢基因或酶影响肠道氨基酸平衡。由于突变体的相应代谢途径被阻断,肠道内容物和粪便中相关氨基酸显著积累。
•循环氨基酸谱变化:部分代谢基因还影响宿主血清氨基酸水平。定植 Asn、Leu/Ile、Pro 和 His 利用缺陷突变体的无菌小鼠,其血清中对应氨基酸明显升高。
•系统性调节的复杂性:循环氨基酸水平的变化并不总与微生物在肠道中的代谢能力一致。例如,定植 C. sporogenes 精氨酸利用缺陷突变体可显著提高肠道精氨酸水平,但对循环精氨酸影响有限,提示肠上皮或肝脏代谢等额外机制亦参与精氨酸的全身稳态调控。
单基因水平的微生物群氨基酸代谢调控
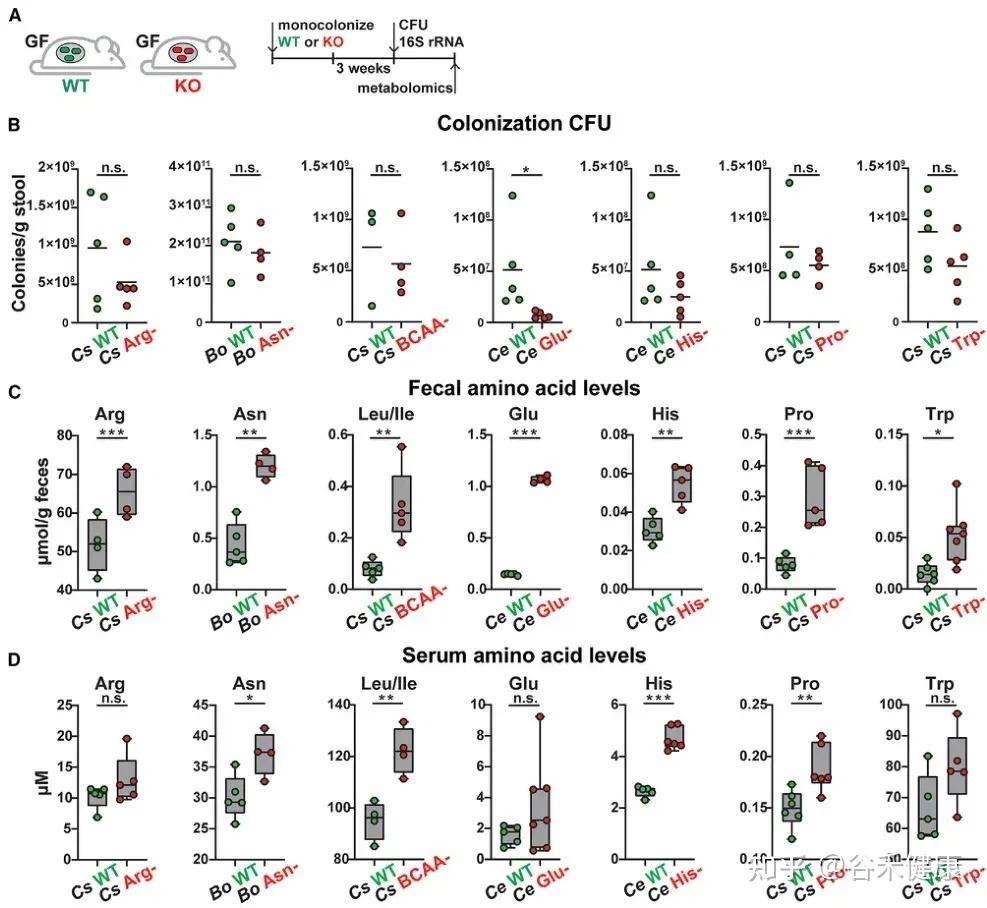
单基因水平的体内调节实验显示,氨基酸代谢基因缺陷突变体定植的无菌小鼠粪便和血清中相应氨基酸水平显著升高。
▸ 微生物氨基酸代谢通过外周血清素调控宿主葡萄糖稳态
研究发现,微生物中支链氨基酸(BCAAs)和色氨酸代谢相关基因可通过外周血清素间接调节宿主葡萄糖稳态。将 C. sporogenes 野生型、BCAA 缺陷型及色氨酸缺陷型突变体分别单菌定植于 GF 小鼠,并进行口服葡萄糖耐量试验(OGTT),结果显示以下关键发现:
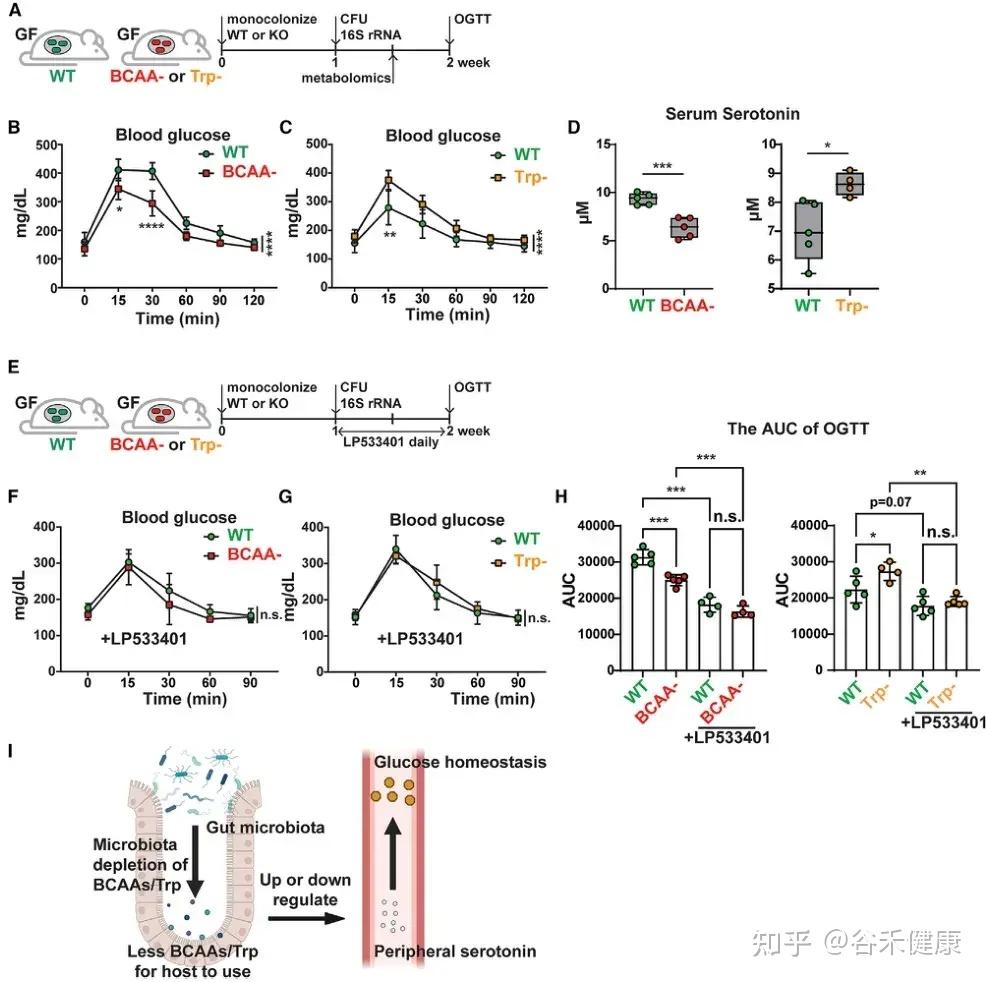
微生物支链氨基酸和色氨酸代谢通过调节外周血清素水平影响宿主葡萄糖稳态的机制示意图及实验验证。
•BCAA代谢与葡萄糖耐受性:定植 BCAA 缺陷突变体的小鼠葡萄糖耐受性显著增强,伴随血清素水平下降。
•色氨酸代谢与葡萄糖耐受性:定植色氨酸代谢缺陷突变体的小鼠表现相反,葡萄糖耐受性下降,血清素水平升高。
•血清素介导机制:应用 Tph1 抑制剂 LP533401 阻断外周血清素合成后,野生型与突变体定植小鼠间的葡萄糖处理差异显著减小,证实微生物氨基酸代谢通过调控外周血清素影响宿主葡萄糖稳态。
这一发现揭示了肠道微生物群、氨基酸代谢、外周血清素及葡萄糖稳态间的复杂关联,为理解代谢性疾病的机制提供了新思路。
!
研究局限性
尽管该研究取得了重要发现,但仍存在一些局限性:
1.微生物氨基酸代谢的多样性:研究主要关注肠道微生物对氨基酸的消耗,而其合成、转运等途径也可能影响宿主氨基酸稳态。体外测定仅反映特定条件下的代谢效率,难以全面代表其在宿主体内的作用。
2.模型简化的局限性:研究采用单菌定植的 GF 小鼠模型,未来应在更接近生理状态的模型(如定植简化微生物群的 GF 小鼠)中验证这些机制。
3.复杂微生物群中基因操作的挑战:虽然本研究成功在宿主定植背景下操纵单一氨基酸代谢途径,但在复杂微生物群中实现精确基因操作仍需进一步技术突破。
4.宿主响应机制研究不足:研究揭示了野生型与突变体共生菌定植小鼠间的生理差异,但尚需深入解析相关宿主细胞类型及信号通路的具体调控机制。
未来的研究在单基因分辨率下揭示了肠道微生物群如何通过代谢肠道氨基酸影响宿主氨基酸稳态。研究鉴定出多种积极代谢肠道氨基酸的细菌,并通过大规模基因缺失分析确定了其关键代谢基因。功能实验显示,这些代谢途径通过直接调控宿主肠道和循环氨基酸的生物利用度,或间接影响外周血清素合成,从而调节宿主的葡萄糖代谢和整体营养稳态。
研究表明,定植微生物群可能以“竞争”模式与宿主共同调控营养平衡,为理解其分子层面的调节机制提供了新视角。更值得关注的是它揭示了一个新的通路:微生物氨基酸利用 → 改变宿主血中氨基酸/代谢产物 → 改变激素/神经递质(如外周 5‑HT)→ 改变葡萄糖代谢等生理功能,所以这些菌在肠道里的存在,更可能是:微调宿主营养和代谢状态,而不是简单的“好/坏”。
参考文献:
Li TT, Chen X, Huo D, Arifuzzaman M, Qiao S, Jin WB, Shi H, Li XV; JRI Live Cell Bank Consortium; Iliev ID, Artis D, Guo CJ. Microbiota metabolism of intestinal amino acids impacts host nutrient homeostasis and physiology. Cell Host Microbe. 2024 May 8;32(5):661-675.e10.

谷禾健康
镁是人体中调节多种生理和病理过程的必需营养素。作为几百种酶促反应的辅因子,它参与能量合成、蛋白质与DNA稳定、神经传导、骨骼健康、肌肉收缩以及心律调节等多种生理过程。镁不仅是细胞能量代谢的核心元素,还在维持离子稳态、抗氧化防御和炎症调节中扮演着关键角色,被誉为“细胞代谢的守护元素”。
然而,现代社会中镁缺乏的现象正在快速上升,已成为全球范围内被低估的公共健康问题。许多国家人群的平均膳食镁摄入量远低于推荐标准。饮食结构改变和食物精制化是导致这一问题的主要原因。随着加工食品和高能量低营养饮食的普及,天然富镁食物(如全谷物、坚果、绿叶蔬菜)的摄入显著减少。此外,慢性压力、睡眠不足、过量咖啡因与酒精摄入,以及某些药物(如利尿剂和质子泵抑制剂)都会加速体内镁的流失。
镁缺乏对健康具有广泛而深远的影响。低镁状态会破坏细胞能量供应,削弱神经与肌肉系统的稳定性,易引发神经兴奋过度和心律失常。研究显示,血镁水平偏低与高血压、动脉硬化、心力衰竭、2型糖尿病、骨质疏松、抑郁症及认知障碍等多种慢性疾病密切相关。同时,镁不足还会增加炎症反应和氧化应激,成为多系统慢性损伤的重要激发因素。
改善镁缺乏除了常规的依赖膳食或补充剂外,更应从调节肠道微生态入手。研究表明,肠道微生物群在镁的吸收与代谢中发挥关键作用:肠道菌群通过发酵膳食纤维产生短链脂肪酸,可降低肠腔pH,促进镁盐溶解,并激活肠上皮细胞镁转运通道(TRPM6与TRPM7)的表达,从而增强镁吸收。健康菌群还能维护肠黏膜屏障,防止炎症性渗漏导致的镁流失;部分菌株则通过代谢产物调节肾脏镁重吸收,维持体内镁稳态。相反,菌群失衡会削弱这些机制,降低镁吸收效率并加剧缺镁,形成“低镁—炎症—菌群紊乱”的恶性循环。
镁缺乏的普遍化反映出现代生活方式与饮食结构下的系统性营养失衡。鉴于镁在多种疾病中的关键作用,深入探索肠道菌群对镁稳态的影响,并将其纳入营养干预策略,有望实现更精准、可持续的镁补充方式,从而在慢性疾病预防与代谢健康维护中发挥更积极的作用。

▸ 镁在人体的含量
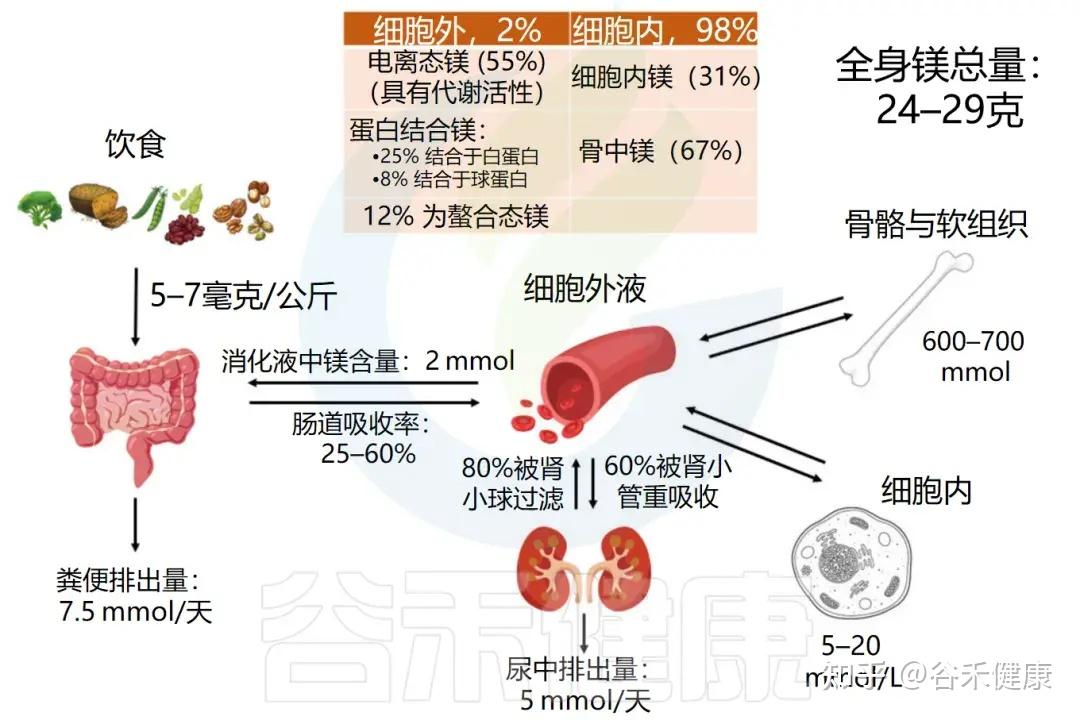
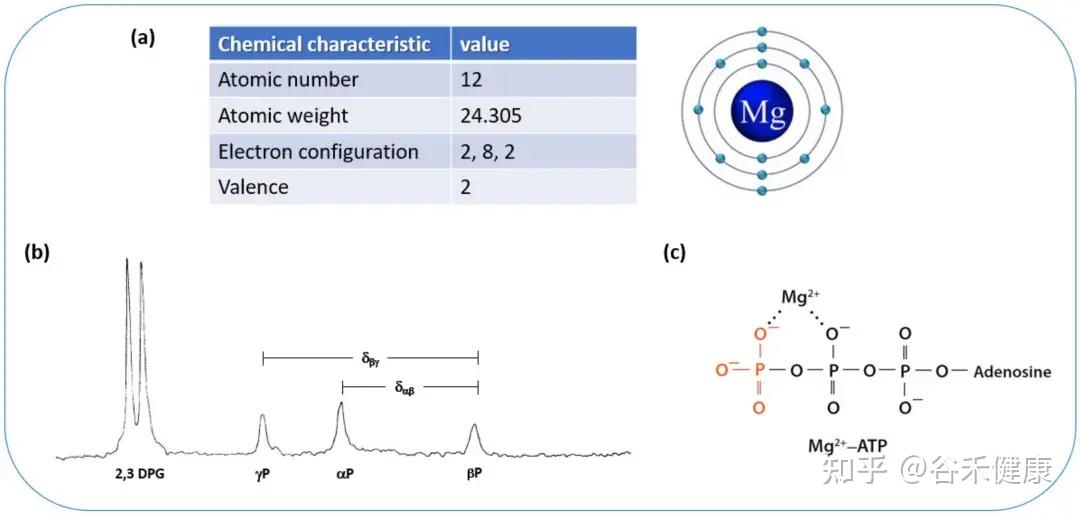
镁(Mg)是人体中调控多项生理功能的一种重要矿物质。是人体内第四丰富的金属元素(Ca²+ > K+ > Na+ > Mg²+),也是仅次于钾的细胞内第二丰富的阳离子。
人体镁含量约为24–29克,其中约2/3储存在骨骼,1/3分布于细胞内和肌肉组织,少于1%存在于细胞外其他组织及血液中(约100毫克)。血清镁浓度维持在0.75–0.95 mmol/L之间。
人体中镁的分布
▸ 镁的生理功能
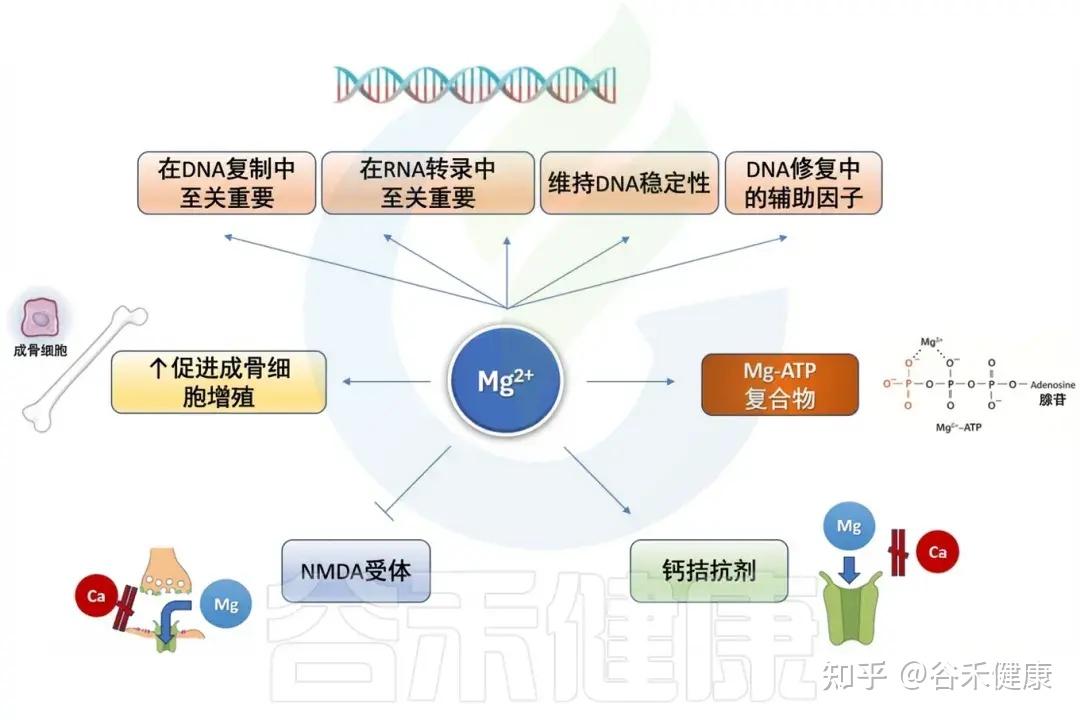
镁(Mg)是维持人体健康的必需矿物质,参与了许多对身体正常运作至关重要的生理过程。其重要性涵盖多个器官系统,包括细胞功能、心血管系统、肌肉骨骼系统和神经系统,突显了其在维持整体健康中不可或缺的作用。
镁在多个细胞过程中的参与
⑴影响能量代谢—是酶促反应核心因子
•镁是人体内超过600种酶的必需辅因子,参与能量代谢(在细胞中,ATP 以 MgATP²⁻ 复合物形式存在);
•促进糖酵解关键酶(己糖激酶、磷酸果糖激酶)的活性;
•调节线粒体氧化还原反应与电子传递链稳定性。
注:辅因子是与酶结合且在催化反应中必要的非蛋白质化合物。
镁离子和MgATP的化学结构
⑵稳定核酸与蛋白质等结构
镁参与骨骼(约储存体内60%镁)、线粒体、核酸及膜结构的稳定,对DNA修复、染色体完整性和细胞衰老的延迟具有重要作用。
⑶免疫调控与炎症反应
镁是免疫细胞(T/B淋巴细胞、巨噬细胞)正常功能所必需,调控细胞因子分泌、吞噬作用及抗原应答。
镁不足可促发慢性低度炎症,增加IL-6、TNF-α等炎性标志物。
⑷神经传导与兴奋调节
•镁稳定神经膜,抑制NMDA受体的过度激活 → 防止兴奋性毒性;
•促进GABA受体敏感性,具有一定镇静与抗焦虑作用;
•调节神经递质(乙酰胆碱、谷氨酸、血清素)的合成与释放;
•缺镁与中枢神经兴奋、偏头痛、抑郁和神经退行性疾病风险升高相关。
⑸调节肌肉兴奋与收缩
•与钙协同控制骨骼肌与心肌的收缩和舒张;
•Mg²⁺ 参与肌动蛋白‑肌球蛋白相互作用的能量供应;
•缺镁可导致肌肉痉挛、震颤、血管痉挛及心律失常。
⑹参与维持心血管功能
•镁可以调节血管平滑肌张力,维持血压稳定;
•抑制血小板聚集与血栓形成;
•增强心肌顺应性并降低心律失常发生;
•低镁水平与高血压、动脉粥样硬化、心律失常、猝死密切相关。
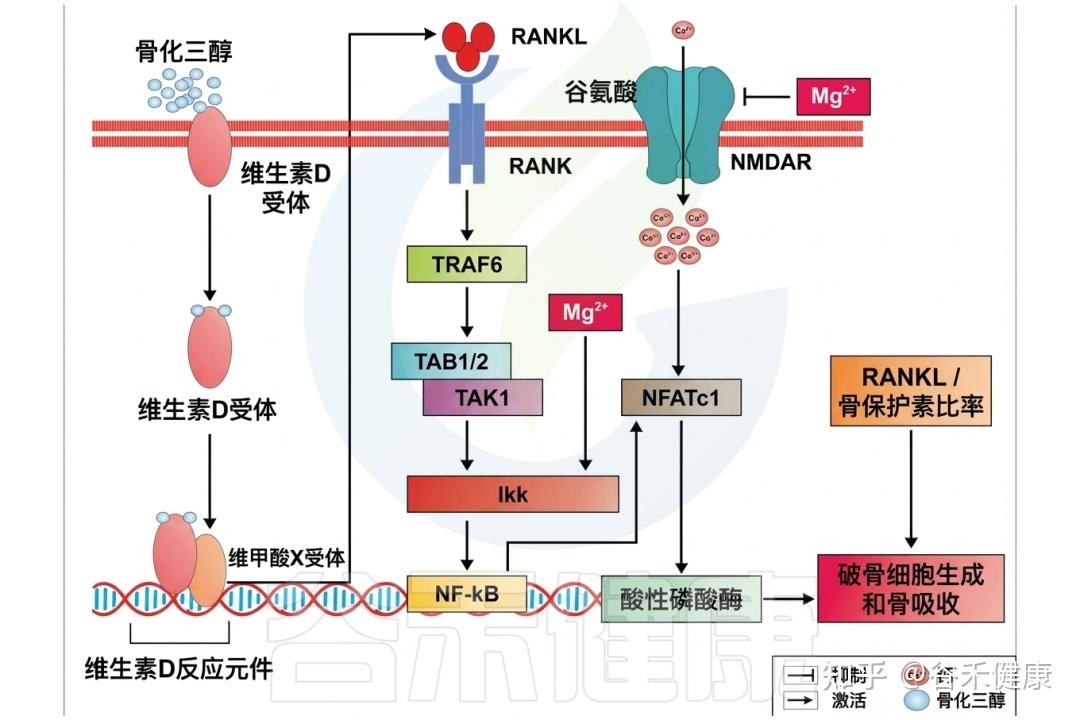
⑺骨骼健康与矿物代谢
•镁与钙、磷共同参与骨基质形成与矿化;
•是维生素D活化(25‑和1α‑羟化)过程中关键辅因子;
•缺镁会影响甲状旁腺激素(PTH)分泌,导致低钙血症与骨密度下降;
•充足镁水平有助于降低骨质疏松与骨折风险。
镁在骨代谢中的作用
⑻抗氧化、抗衰老
•镁有助于减少活性氧(ROS)生成,增强谷胱甘肽和抗氧化酶系统活性;
•稳定线粒体功能,降低氧化应激造成的细胞损伤;
•维持DNA修复与细胞代谢平衡,延缓组织功能退化与衰老进程;
•抑制炎症因子表达,减轻慢性炎症性衰老。
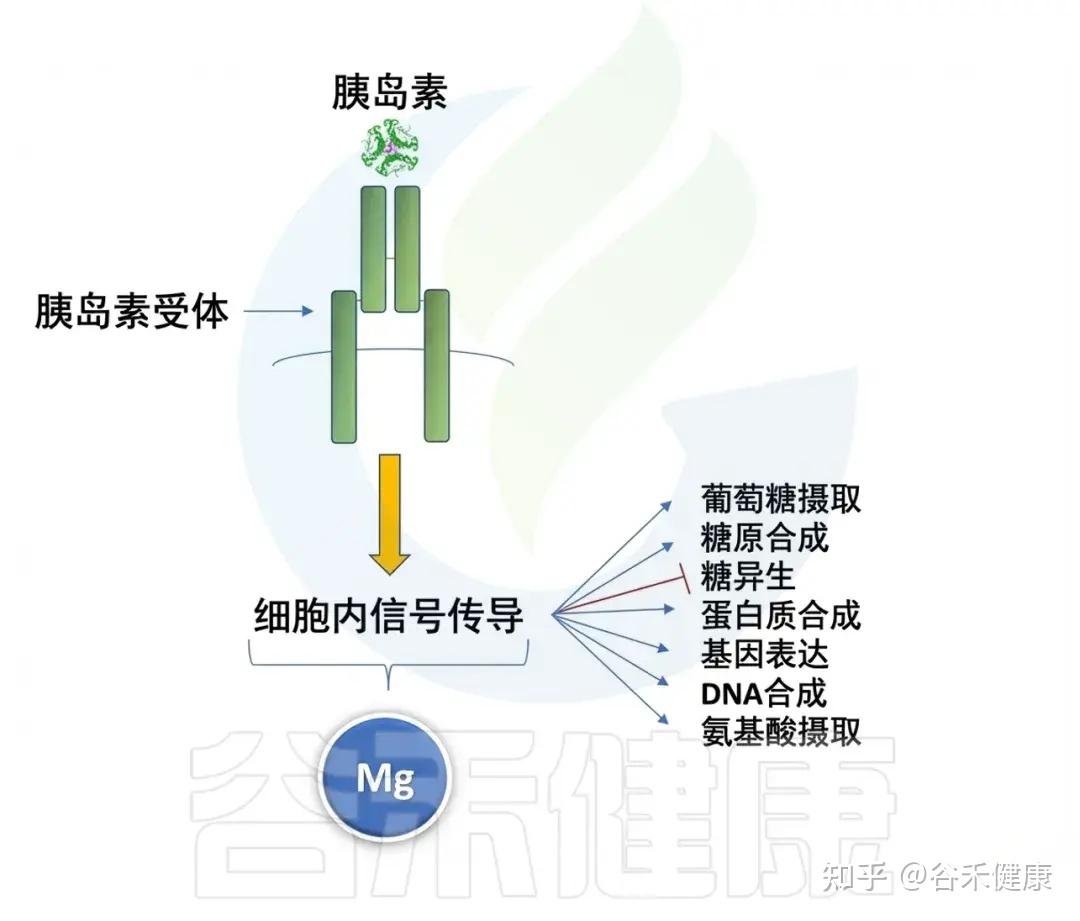
⑼调节内分泌与代谢稳态
•镁是胰岛素信号转导的关键因子:激活胰岛素受体酪氨酸激酶,增强葡萄糖摄取;低镁状态与胰岛素抵抗及2型糖尿病风险增加相关。
•还参与脂质合成、氧化及甲状腺激素代谢。
镁影响胰岛素信号传导
★ 不同人群对镁的需求存在差异
根据2015–2020年美国膳食指南,女性每日镁推荐摄入量为320 毫克,男性为420 毫克。在怀孕、衰老、运动或感染、2型糖尿病等情况下,机体对镁的需求可能进一步增加。
然而,许多因素可能改变Mg的平衡:饮食中高含量的Na、Ca、蛋白质、酒精或咖啡因,或某些药物的使用(利尿剂,如呋塞米;质子泵抑制剂,如奥美拉唑等)。
影响镁平衡的因素:
•胃肠道吸收能力;
•肾脏排泄;
•健康人群的饮食建议每天约5–7毫克/千克体重来保持平衡;
•细胞外的Mg与储存中的Mg处于平衡状态;
•骨头是Mg的主要储存点。
▸ 镁的吸收与代谢过程
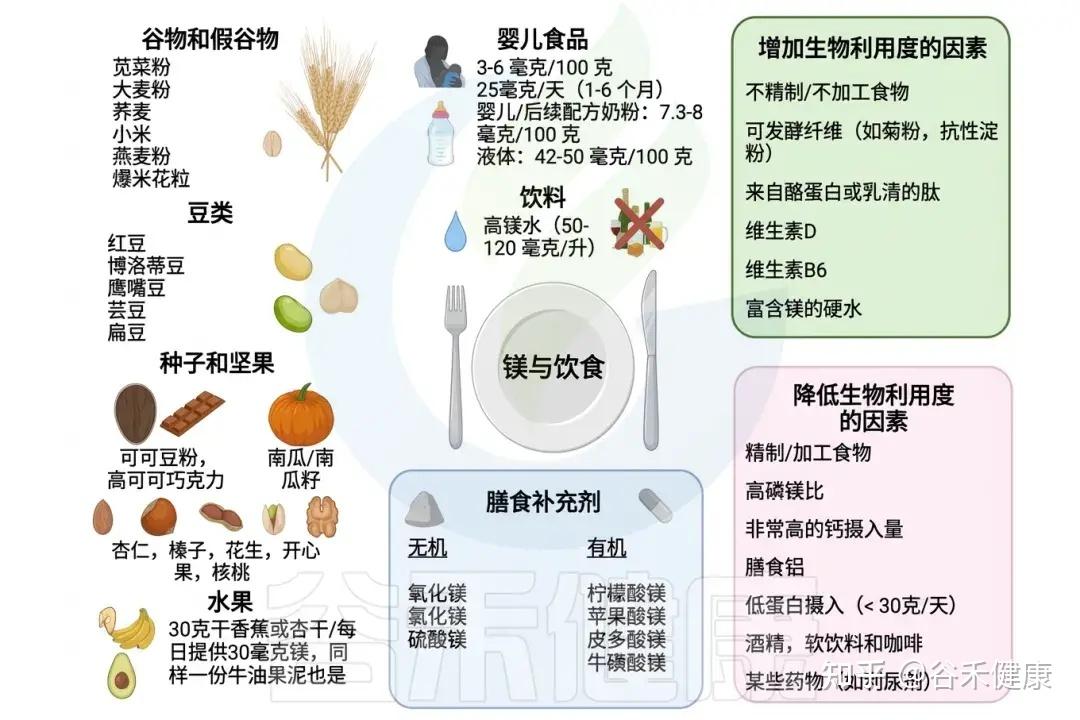
我们每天大约从食物和饮水中摄入约300–400毫克的镁,主要来源包括:
•深绿色蔬菜:如菠菜、羽衣甘蓝、甜菜叶等。
例如,100克煮熟的菠菜含约80毫克镁(占成人每日推荐量的20%)。
•坚果与种子:南瓜籽、杏仁、腰果、巴西坚果是镁的优质来源。
30克南瓜籽约含150毫克镁,接近成人每日需求量的37%。
•全谷物:糙米、燕麦、藜麦、荞麦等未经精制的谷物中,镁含量较高。
100克煮熟的藜麦约含65毫克镁。
•鱼类和豆制品:黑豆、鹰嘴豆等豆类每半杯煮熟的豆子含60-80毫克镁。三文鱼、鲭鱼等深海鱼也含镁(100克约含30-50毫克),同时提供Omega-3脂肪酸,建议每周食用2-3次。
•黑巧克力:可可含量70%以上的黑巧克力每30克约含65毫克镁,同时含抗氧化物质。
•硬水:(自来水或矿泉水中也含少量镁)。
①肠道吸收——“通往血液的第一道关口”
当镁随食物进入小肠后,约有30%~50%能被吸收进入血液。吸收主要发生在小肠(尤其是回肠和空肠),有两种途径:
被动扩散途径:当饮食中镁含量较高时,它通过肠壁间隙“自然渗透”进入血液。
主动转运途径:在镁摄入较低时,肠细胞会动用“镁专用通道”——TRPM6和TRPM7蛋白,把镁主动吸收入细胞。
影响吸收效率的因素包括:
促进吸收:维生素D、益生菌、乳酸盐、中等脂肪摄入。
抑制吸收:过多的钙、磷酸盐、酒精、咖啡因或高脂饮食。
维生素D:促进肠道镁吸收,而镁又是维生素D活化所必需。
甲状旁腺激素(PTH):促进肾脏与肠道吸收镁,调节骨中镁释放。
雌激素:通过上调TRPM6通道增强镁再吸收。
细胞内转运系统:TRPM6/7、MagT1以及SLC41家族是调节镁跨膜转运和细胞内稳态的关键通道;其功能异常与代谢紊乱、免疫及神经疾病均有关。
②进入血液——“镁流通的高速公路”
吸收后的镁进入血液循环。成人血浆中正常镁浓度约为 0.75–0.95 mmol/L;其中约1%的镁在血液中自由流动,剩下的99%存储在骨骼(约2/3)和肌肉、软组织(约1/3)中。
镁在血浆中有三种存在形式:
•离子态 Mg²⁺(有生理活性的形式)
•与蛋白结合的镁(主要结合白蛋白)
•与阴离子结合的复合物(如磷酸盐、柠檬酸盐)
血中的镁浓度受到肠道吸收、骨骼储备和肾脏排泄三方面的精密平衡控制。
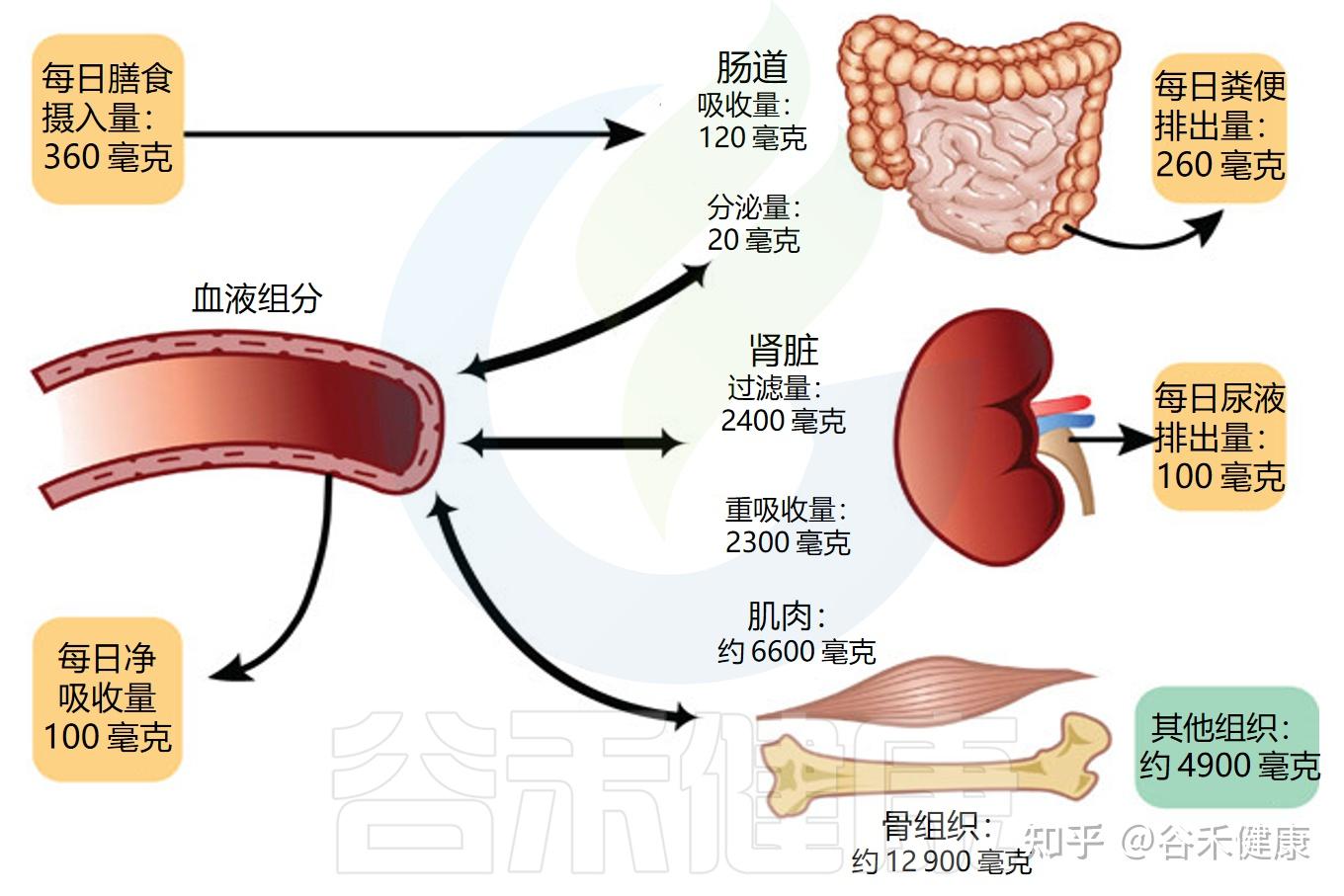
③肾脏的守护机制——排泄与调节
肾脏是镁平衡的核心调节器,肾小球对血浆反复滤过,每日滤过量可达约2.4g进入尿液;其中约95%(2300 毫克)在肾小管被重新吸收;实际仅约100 毫克以尿液形式排出体外。
肾脏可以调节排泄量,具体取决于血清镁的水平:当镁不足时,肾脏会提高重吸收率;当摄入过多时,则相应增加排泄量。
人体中的镁平衡
▸ 可能导致镁缺乏的因素
虽然日常饮食可提供一定量的镁,但现代饮食结构与生活方式的变化使许多人处于轻中度缺镁状态。长期摄入不足、吸收不良或排泄过多都可能扰乱体内镁平衡。以下列举了可能导致镁缺乏的因素:
导致低镁状态的原因及影响
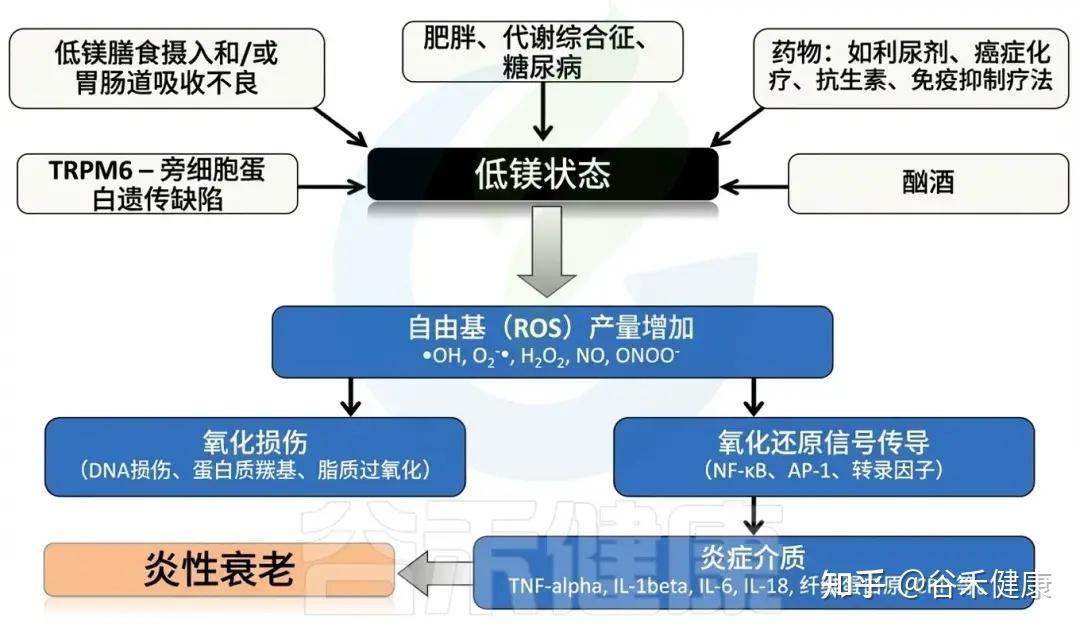
⑴摄入不足
饮食结构失衡
•过度精制(精米、精面、糖类食品)导致镁含量锐减 > 60%;
•现代“西式饮食”(高脂、高糖、高加工)普遍镁摄入不足;
•素食或高钙高磷饮食中钙/镁比例失衡(Ca:Mg > 3:1)抑制镁吸收;
•减肥、禁食及流质饮食者镁摄入低于推荐摄入量。
饮水镁含量降低
•现代净化/反渗透水镁浓度低于 10 mg/L(天然水约 20–50 mg/L);
•长期饮用低矿物质水可能导致血镁水平降低,有研究提示可达约10–15%,但不同研究差异较大。
食物生长环境贫镁
•现代农业中过度使用化肥、酸性土壤、除草剂(尤其草甘膦)导致土壤镁枯竭。植物镁含量相比1950年代平均下降 ≈ 25–30%。
⑵吸收障碍
胃肠疾病
•慢性腹泻、吸收不良综合征、克罗恩病、乳糜泻导致镁大量丢失;
•胆汁酸吸收障碍降低肠道对镁的电解质吸收能力;
•小肠细菌过度生长(SIBO)或肠黏膜萎缩破坏吸收通道(TRPM6 / TRPM7);
•胰腺外分泌障碍及脂肪泻减少脂溶性螯合离子的吸收。
手术相关
胃旁路手术/小肠切除术使吸收面积显著减少,短肠综合征患者吸收率下降 50% 以上。
药物相关吸收受阻
质子泵抑制剂(PPI,如奥美拉唑、泮托拉唑)抑制胃酸分泌,减少Mg²⁺离子溶解及TRPM6通道活性。
长期使用PPI > 1年可使低镁血症风险增加10–12 倍。
⑶肾性镁丢失
肾脏每日滤过≈2400 mg 镁,其中95% 被重吸收。任何影响肾小管Mg²⁺重吸收的因素都会导致缺镁。
药物诱导
某些药物的使用可能促进排泄而导致镁流失。具体作用机制和影响方式如下所示:

内分泌疾病
•高甲状旁腺功能 → 胃肠Ca²⁺升高→ 钙竞争性抑制Mg再吸收;
•抗利尿激素分泌异常会伴随低钠低镁症;
•糖尿病性肾病 → 高血糖引起渗透性利尿与电解质丢失。
酒精性肾损伤
•乙醇抑制肾小管再吸收并引发代谢性酸中毒,促使镁随尿排出。
•慢性酗酒者血镁常降低 20–30%。
⑷代谢与激素调控缺陷
甲状旁腺及维生素D轴异常
•Mg 是PTH(甲状旁腺激素)分泌与受体敏感性所必需的辅因子;
•缺镁→ PTH 分泌减少 + 靶器官抵抗 → 继发性低钙血症;
•维生素D活化需要Mg依赖性羟化酶(25‑和 1α‑羟化酶)。
遗传性离子通道缺陷
•TRPM6、CNNM2、SLC41A1 突变可致原发性家族性低镁血症;多合并癫痫、智力低下、低钙。
•Gitelman、Bartter 综合征:肾小管Mg‑Ca转运障碍。
⑸其他因素
应激与慢性炎症
•慢性应激激活下丘脑-垂体-肾上腺轴,升高皮质醇 → 增强镁排泄;
•炎性细胞因子(IL‑6、TNF‑α)会下调Mg转运体表达。
酒精与咖啡因
•酒精会促进尿镁排泄,抑制胃肠吸收;
•咖啡因增加肾小管滤过率,加速镁流失。
高钙补充剂及磷酸盐过量
•过高钙/磷摄入形成不溶性Mg盐,减少吸收。
⑹老龄化
吸收能力下降
随着年龄增长,小肠对镁的吸收效率降低。
肾功能减退
老年人肾脏重吸收镁的能力下降,排泄量增加。
饮食摄入不足
食欲减退、饮食单一或牙口问题常导致镁摄入不足。
药物干扰
老年人常用的利尿剂、质子泵抑制剂等药物会促进镁流失。
慢性疾病影响
糖尿病、胃肠疾病等常见老年病可进一步加重镁缺乏。
多项研究与临床证据表明,镁缺乏在全球范围内普遍存在且常被低估。
▸ 镁缺乏的患病率
大约10–25%的人群血镁浓度低于正常参考值(<0.75 mmol/L),并且不同人群镁缺乏的发生率不同。我们总结在下表中:

▸ 镁缺乏的主要症状
▸ 早期阶段(轻度缺乏)
镁水平轻度下降时,症状往往隐蔽而非特异性。常见表现包括:
•精力不足、易疲劳、注意力不集中;
•失眠或睡眠浅、焦虑、易怒、情绪波动;
•偶尔出现肌肉轻微抽搐、眼皮跳、手脚麻感;
•食欲减退或轻微便秘。
此阶段多数人并未意识到与镁有关,但代谢系统和神经功能已开始受到影响。
▸ 加重阶段(中至重度缺乏)
当缺镁持续或加重时,细胞功能紊乱导致全身性症状明显加剧:
•持续肌肉痉挛、抽筋或手足震颤;
•心悸、脉搏不齐、胸闷等心律异常表现;
•明显的神经兴奋性亢进,可出现焦虑、抑郁、甚至轻度意识障碍;
•持续疲劳、虚弱无力,运动耐力下降;
•骨骼变脆、骨痛或骨密度下降;
•代谢紊乱,如胰岛素抵抗、血糖波动、钙钾失衡。
▸ 严重阶段(临床性缺镁)
若缺乏未得到纠正,体内镁储备枯竭,可引发严重后果:
•明显心律失常、心肌功能障碍;
•痉挛性抽搐或癫痫样发作;
•电解质紊乱同时出现(低钙、低钾);
•严重者可能出现意识混乱、昏迷或猝死。
镁缺乏对人体健康的影响是全身性和多层面的。作为重要矿物质,镁在能量代谢、神经传导、心肌收缩、骨骼形成及免疫调节中均发挥关键作用。
当体内镁水平下降时,不仅会引起疲乏、肌肉痉挛、情绪不稳等早期症状,还会干扰糖代谢、增加心血管风险、促进慢性炎症及加速细胞老化。长期缺镁更与高血压、糖尿病、动脉硬化、骨质疏松以及神经退行性疾病等多种慢性病密切相关,显示出镁在维持机体整体稳态中的核心意义。
1
对神经系统与心理健康的影响
√神经兴奋性增强:
镁是调节神经膜电位和 NMDA 受体活性的重要离子,缺乏镁会使神经细胞过度兴奋,易导致焦虑、易怒、失眠及肌肉抽搐等症状。
√抑郁与焦虑关联:
镁缺乏可影响血清素和 GABA 的合成与受体功能,是抑郁症和焦虑症的重要生化基础。多项研究显示,低镁个体中抑郁风险增加20–40%。
√认知功能退化与神经退行性疾病:
•镁缺乏可促进 β‑淀粉样蛋白沉积、线粒体功能下降和突触丢失,与阿尔茨海默病病理密切相关。
•多项长期随访研究发现,血镁水平较低者认知下降速度更快,发生痴呆的风险增加约 20–40%。
注意:不同研究之间结果存在一定差异,上述数值多基于观测性研究,这里相关性而非严格因果。
2
对心血管系统的影响
√心律失常与电生理紊乱:
镁是维持心肌膜稳定性和钾钙平衡的关键元素。缺镁会导致室性早搏、房颤等心律失常发生率上升。
√高血压与动脉硬化:
镁具有血管舒张作用,可抑制钙离子内流、降低血管张力。缺镁使血管平滑肌收缩增强,从而促进高血压和动脉硬化的形成。
√心血管疾病事件风险上升:
大规模临床研究表明,血镁水平低于 0.75 mmol/L 的人群,其冠心病和突然心源性死亡风险增加 30–50%。
3
对骨骼和肌肉系统的影响
√骨质疏松与骨代谢障碍:
镁与钙、维生素 D 协同调控骨骼矿化。长期缺镁会降低成骨细胞活性并促进破骨。文献显示,低镁摄入可使骨密度下降约 5–8%。
√肌肉功能障碍:
缺镁常导致肌肉过度兴奋,表现为抽筋、痉挛、震颤、肌无力等症。严重时可引发横纹肌溶解。
4
对代谢与内分泌系统的影响
√胰岛素抵抗与糖尿病:
•镁是葡萄糖代谢关键酶的辅因子,缺镁会削弱胰岛素信号传导。
•部分研究显示,在低镁个体中,胰岛素敏感性可下降约 25–30%;2型糖尿病患者中约 1/3 存在血镁或细胞内镁下降。
√脂质代谢异常:
镁不足会增加甘油三酯与低密度脂蛋白(LDL)水平,降低高密度脂蛋白(HDL)水平,促进脂肪肝和动脉粥样硬化进程。
√内分泌紊乱:
镁参与皮质醇、甲状腺素及性激素的合成,其缺乏可导致应激反应过度、月经紊乱、骨质丢失加剧。
5
对免疫系统与炎症反应的影响
√慢性低度炎症:
•低镁状态会激活免疫细胞,升高 CRP、IL‑6、TNF‑α 等炎症标志物。
•长期炎症反应被认为是多种代谢性疾病和衰老过程的共同基础。
镁缺乏通过多种信号通路引发炎症
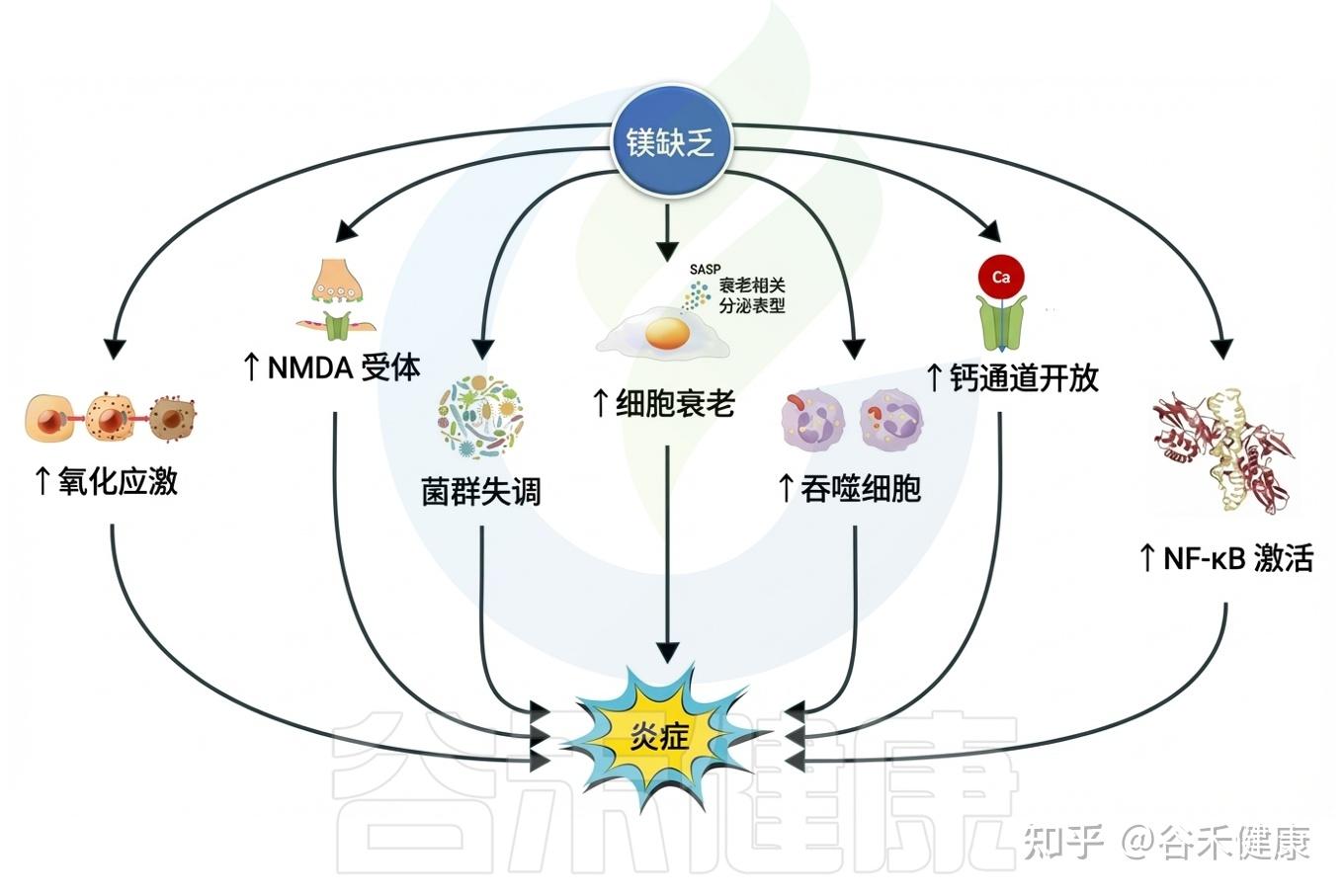
√免疫失衡与感染易感性:
镁缺乏削弱先天及获得性免疫反应,老年群体更易发生感染。
6
对呼吸系统的影响
√平滑肌功能紊乱与支气管高反应性:
镁能抑制钙离子进入平滑肌细胞,促进支气管舒张。缺镁时支气管平滑肌紧张度上升,气道收缩反应增强,易诱发或加重哮喘和慢性阻塞性肺疾病(COPD)。
多项研究发现,哮喘患者的血镁水平显著低于正常人群;在部分严重急性哮喘、对常规支气管扩张剂疗效欠佳的患者中,静脉硫酸镁可作为辅助治疗,有研究提示可改善肺功能与症状。
√呼吸衰竭与重症结局风险:
在重症监护人群中,低血镁与呼吸衰竭发生率及机械通气时间延长显著相关。有研究强调,老年COPD(慢性阻塞性肺疾病)患者中缺镁率可达 45–65%。
7
对衰老与细胞层面的影响
√线粒体功能下降:
镁是 ATP 合成复合物的重要组成部分,缺乏镁会直接影响能量代谢效率并促进氧化应激。
√DNA 稳定性与端粒退化:
镁是 DNA 聚合酶与修复酶的关键辅因子。缺乏镁导致 DNA 损伤积累与端粒缩短,加速细胞老化。
√细胞衰老信号激活:
镁缺乏可上调 p53、NF‑κB、MAPK 信号通路,促进细胞衰老及炎症反应。
8
对其他系统的影响
√电解质紊乱:
缺镁常伴随低钾血症和低钙血症,因为镁调节钙钾通道活性。若未及时纠正镁缺乏,补钾或补钙疗效有限。
√胃肠道与消化功能减退:
低镁可导致胃肠蠕动缓慢、食欲低下和长期便秘。
√妊娠期并发症风险增加:
妊娠缺镁与先兆子痫、胎儿生长受限及早产风险上升有关。
除了对神经、心血管、骨骼和代谢等系统具有广泛影响外,镁还在维持肠道微生态平衡中发挥关键作用。研究表明,镁不仅调节宿主代谢和免疫功能,还直接影响肠道微生物的组成与活性。
肠道微生态是人体健康的重要调控因素,参与营养吸收、代谢调节、免疫稳态及神经—肠轴信号传导,对整体生理平衡至关重要。
镁对肠道微生态的影响可分为两种情况:既包括镁缺乏状态下的不利变化,也涵盖过量摄入时的微环境干扰。但在实际人群中,镁缺乏更为常见且影响更显著。
肠道微生物与镁之间的联系

★ 镁主要通过三大途径调控肠道微生物
•直接离子效应:影响细菌膜电位、ATP合成酶及多种金属依赖酶的活性。
•间接宿主效应:通过上皮屏障、黏液层厚度、免疫细胞激活及pH变化改变菌群生态位。
•代谢共生效应:与短链脂肪酸、胆汁酸、氨基酸代谢互作,调节菌群能量网络结构。
▸ 镁缺乏对肠道微生态的影响
我们通过查阅和整理多篇相关研究文献,对镁缺乏与肠道微生态之间的关系进行了系统分析与比较,总结出镁缺乏对肠道微生态的主要影响如下:
▸ 总体特征
•α-多样性下降(Shannon 与 Chao1 指数显著降低);
•β-多样性结构偏移;
•微生物群表现出“致炎生态型”特征;
•Firmicutes/Bacteroidetes(F/B)比例上升,典型菌群表现为条件致病菌扩张。
▸ 主要菌属变化

▸ 代谢通路与产物变化
短链脂肪酸(SCFAs)水平下降:
•丁酸盐水平下降40–60%;
•丙酸盐水平下降;
•乙酸盐水平略降或不变。
氨基酸与氮代谢紊乱:
•蛋白质/氨基酸发酵菌扩张,支链脂肪酸升高;
•伴随氨、硫化氢(H₂S)和吲哚产物增加,引发局部上皮炎症。
胆汁酸代谢改变:
•Desulfovibrio 扩张促进次级胆汁酸(如脱氧胆酸、石胆酸)升高;
•抑制黏液层再生并促进炎症。
氧化还原平衡破坏:
•低镁降低过氧化氢酶与超氧化物歧化酶活性,造成还原应激环境,偏好肠杆菌科。
宿主相互代谢效应:
•降低肠道TRPM6/7表达(镁吸收能力进一步下降);
•形成“缺镁—菌群紊乱—炎症—吸收障碍”的恶性循环。
▸ 对肠道微生态和整体健康的影响
肠屏障受损与“肠漏”效应:
•缺镁小鼠肠道紧密连接蛋白(ZO‑1、Occludin)显著下降,肠道通透性增加,血浆脂多糖浓度升高;这促发系统性炎症及肝脏TNF‑α、IL‑6表达上升。
慢性炎症与免疫激活:
•镁缺乏促进单核细胞浸润、NF‑κB信号及细胞因子(TNF‑α、IL‑1β)上调,形成“肠—免疫炎症环”。
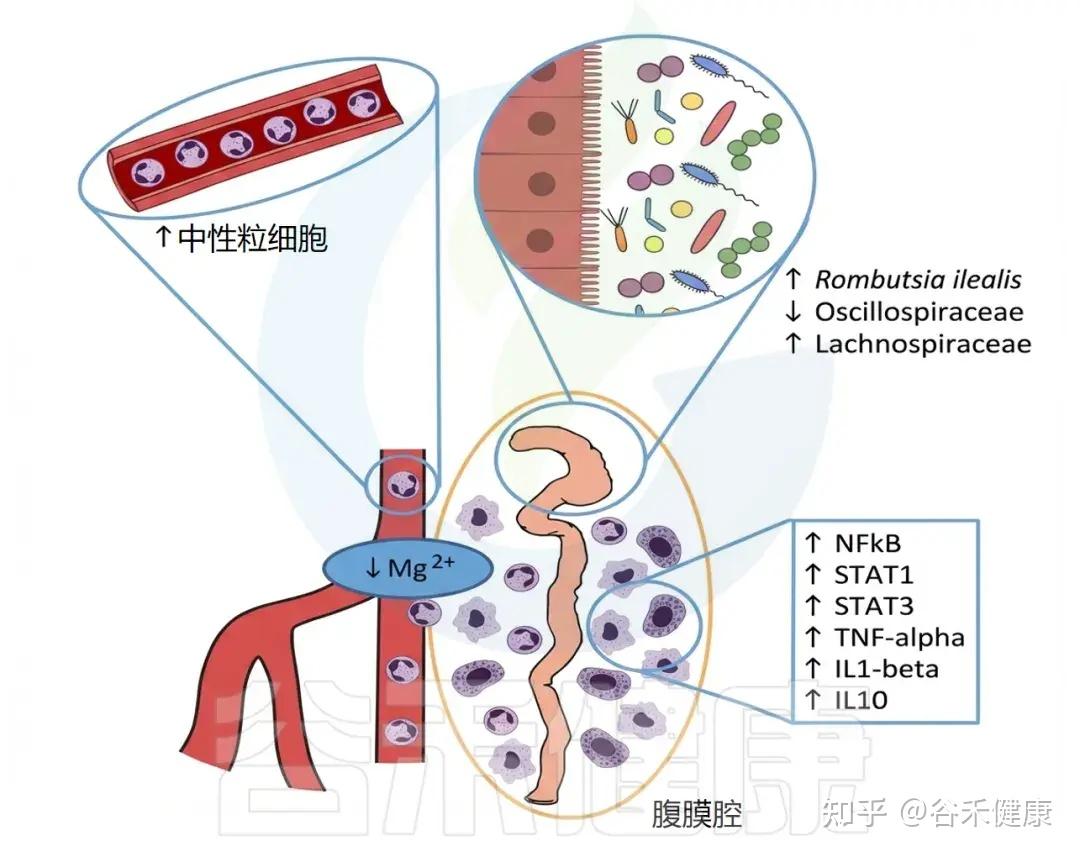
代谢与系统影响:
•长期缺镁相关菌群变化与胰岛素抵抗、肥胖有高度相关性(增多的 SMB53、Turicibacter 报告于低镁和肥胖模型中)。
•同时,产丁酸菌减少可能加剧代谢综合征风险,损害肠代谢稳态。
▸ 镁过量对肠道微生态的影响
通常,短期补充镁不会造成体内过量,因为机体具有良好的调节与排泄功能。然而,若长期高剂量摄入或肾功能受限,仍可能导致镁积累,进而扰乱肠道渗透压与离子平衡,影响微生物群的结构与代谢活动。
▸ 极高剂量会扰乱生态稳态
轻度镁富集(生理范围上限)可促进有益菌,但极高剂量可扰乱生态稳态。

▸ 高镁环境也改变了微生物的代谢
高镁环境重塑了肠道菌群的代谢谱,使代谢活动偏向能量储存与抗氧化代谢强化。
KEGG 与 PICRUSt2 功能预测显示,高镁饮食促进“糖代谢”(glycolysis)、“戊糖磷酸通路”(PPP)与“脂肪酸β氧化”相关基因丰度上升。与此同时,丙酮酸代谢和丁酸代谢略下降,提示产能途径更侧重于快速代谢而非发酵稳定性。
高镁显著上调谷胱甘肽代谢(glutathione metabolism)与嘌呤代谢,表明抗氧化能力增强。但同时,色氨酸→吲哚代谢途径增强,部分产物可调控免疫及神经—肠轴。
编者小结
总体而言,镁对肠道微生物群的影响取决于剂量与持续时间。
镁缺乏通常导致有益菌如双歧杆菌和产丁酸菌减少,而条件致病菌如肠杆菌科增多,引发短链脂肪酸生成下降、肠屏障受损及慢性炎症反应。
适度高镁摄入(生理上限范围内) 可促进益生菌如 Lactobacillus 和 AKK菌增殖,提升多样性,增强肠屏障与抗氧化防御。
长期或过高剂量则可能干扰渗透平衡,减少部分厌氧产丁酸菌,导致短暂微生态波动和通便反应。
因此,维持肠道内镁水平在适宜范围,是确保微生态稳态与代谢健康的关键条件:不足易致炎,过量则扰稳,唯有平衡方能良性共生。
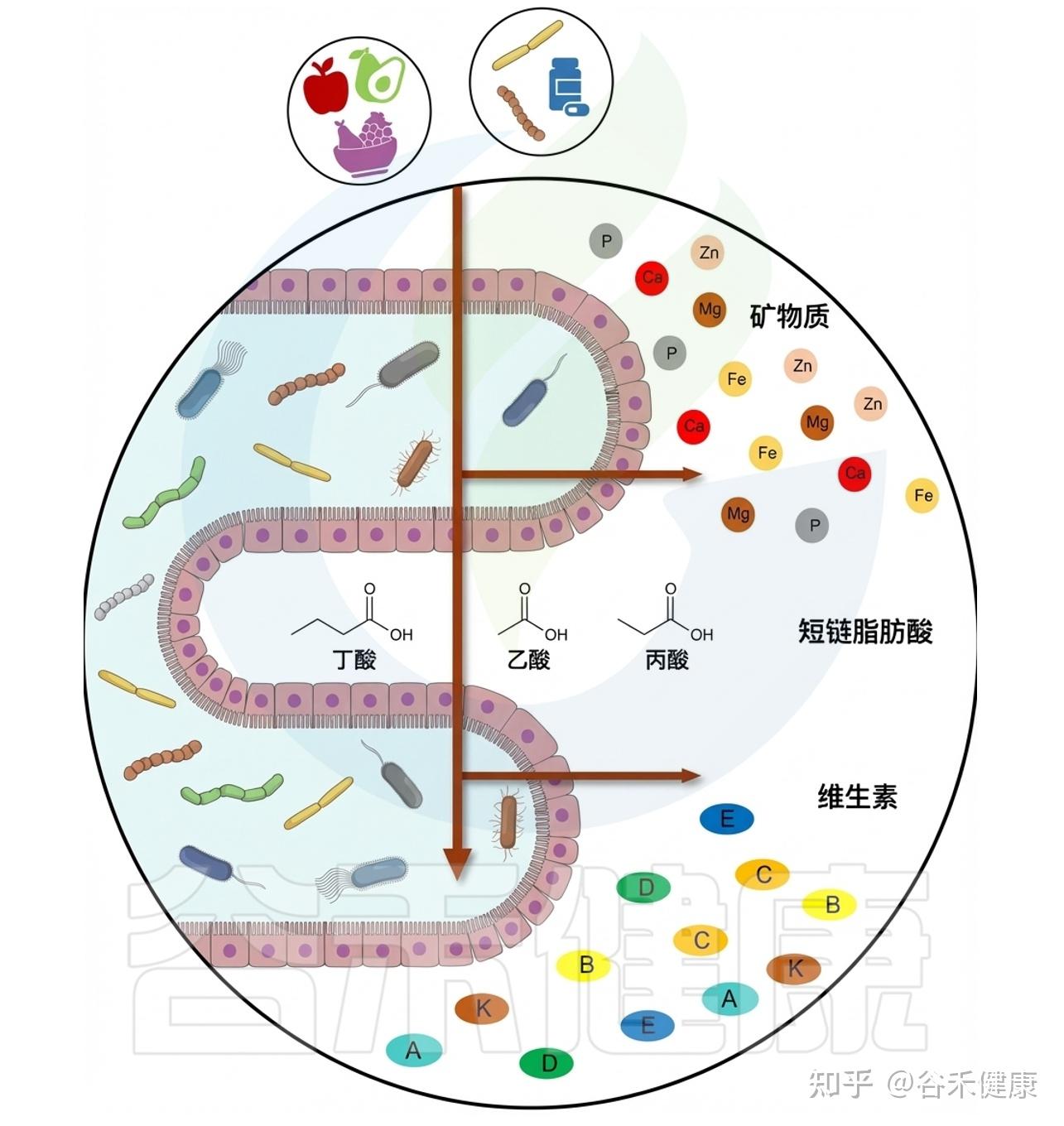
上文我们提到,镁不仅能够通过多种途径影响肠道微生态的平衡与整体健康状态,但这种关系并不是单向的。实际上,镁与肠道菌群之间存在一种紧密而动态的双向作用关系。肠道菌群的组成和代谢活动同样会反过来调节镁在体内的吸收与利用效率,从而共同维持机体的营养稳态与代谢平衡。
人体镁吸收主要发生在小肠(回肠和空肠)与结肠,包含两条途径:
被动扩散:依赖浓度梯度;约占吸收总量的 80–90%。
主动转运:由肠上皮细胞内的TRPM6、TRPM7通道调控,在低镁环境下尤为重要。
人体肠道矿物质吸收
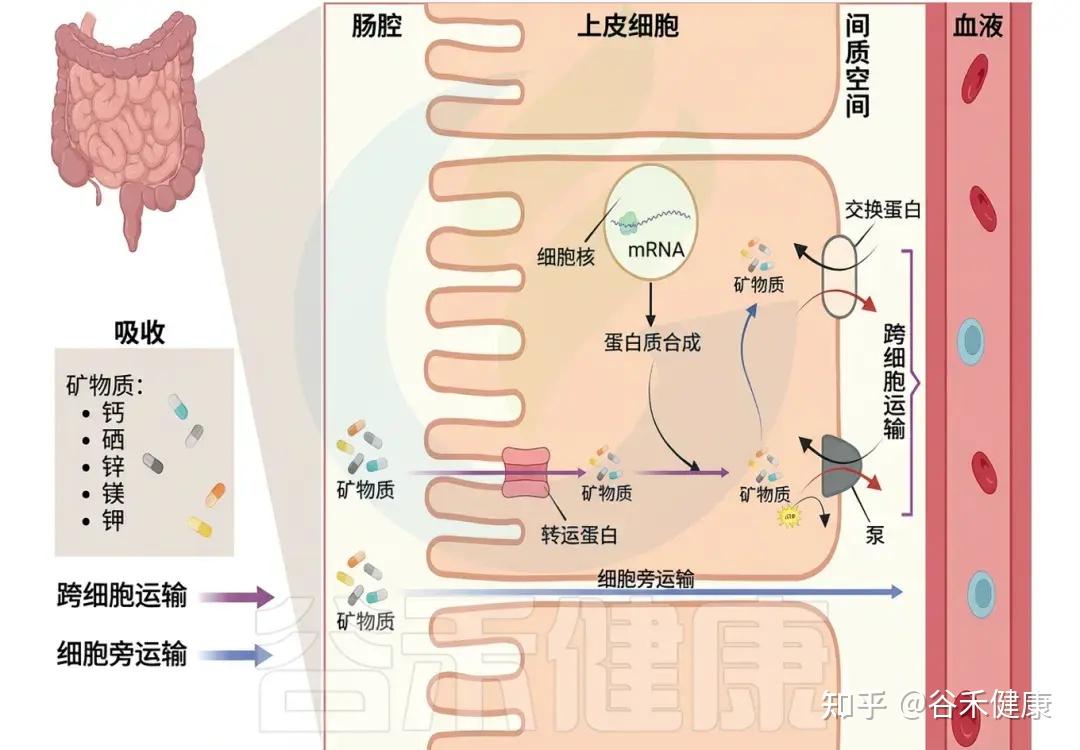
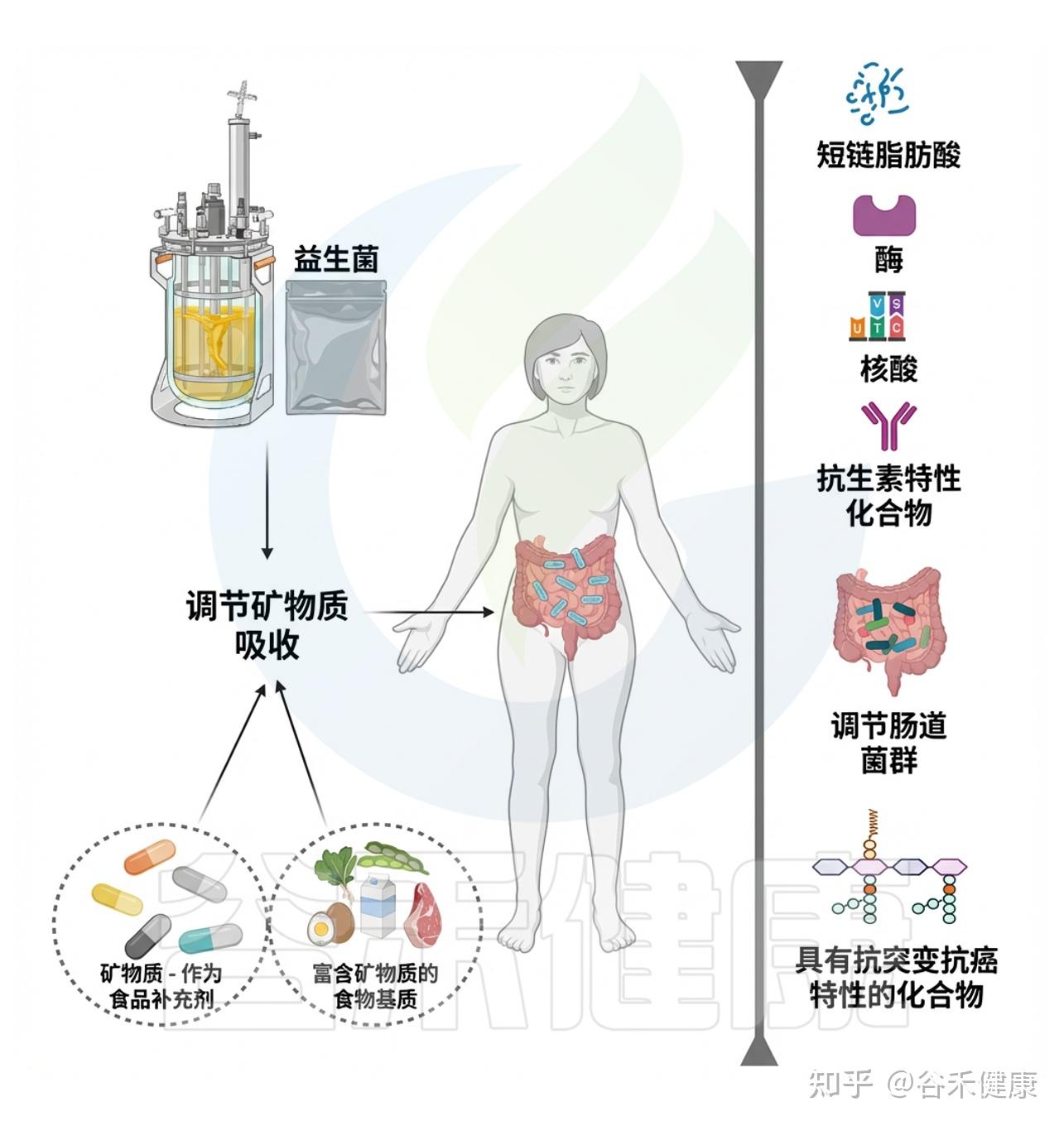
★ 肠道微生物群是影响镁吸收利用的重要因素
而近十年研究表明,肠道微生物群是第三个决定性因素,通过影响肠环境的理化条件、代谢产物和宿主转运通路,系统地调控镁的生物利用度。
▸ 肠道菌群影响镁吸收的主要机制
⑴调节肠腔环境(pH与溶解度)
•产酸菌(如 Lactobacillus、Bifidobacterium)通过发酵碳水化合物生成短链脂肪酸(SCFAs)——乙酸、丙酸、丁酸。
•SCFAs 降低肠腔 pH,使难溶性镁盐(如Mg(OH)₂、Mg₂PO₄)溶解度升高,从而促进镁离子化,提高吸收效率。
•酸性环境还刺激肠上皮表达钙/镁通道蛋白(TRPM6/7)及螯合肽转运体,从而增强主动摄取能力。
⑵短链脂肪酸促进上皮转运
短链脂肪酸可激活肠上皮 GPR43/GPR109A 受体,增强细胞紧密连接蛋白(ZO‑1、occludin)表达,改善屏障完整性,使镁离子有效跨膜转移。
乙酸与丙酸促进钠依赖型共转运(Na⁺/Mg²⁺ exchang),间接提升镁摄取。
注:有研究指出:丁酸在过高浓度条件下会通过抑制TRPM6通道电流,会降低Mg²⁺跨上皮细胞通量。该效应具有剂量依赖性双向调节特征——低浓度丁酸有利于吸收,而过高浓度则抑制。

因此,短链脂肪酸总体上促进镁吸收,但丁酸对TRPM6的局部抑制提示了菌群平衡对镁代谢的微妙调控关系。
⑶菌群代谢物与转运信号互作
•肠菌产物如多胺(腐胺、精胺)可通过调控AMPK和ERK信号通路促进TRPM6转录。
•粘蛋白降解菌 (Akkermansia muciniphila) 可增强上皮再生,维持适宜的吸收表面积与紧密连接。
•此外,一些细菌通过产生螯合有机酸(柠檬酸、乳酸)可形成可吸收镁螯合物,显著提高生物利用度。
⑷益生菌直接吸附与释放作用
•多种益生菌细胞壁富含带负电的羧基(COO⁻)与磷酸基(PO₄²⁻),能暂时结合Mg²⁺。
•在酸性环境中,结合的镁离子再被逐步释放,有助于维持小肠近端镁浓度梯度。
•Lactobacillus plantarum与Bifidobacterium longum 对镁的吸附容量尤高,故被视为“镁生物富集菌”。
⑸肠道微生物影响肠黏膜的吸收能力
有研究发现莲子抗性淀粉可增加Lactobacillus、Ruminococcus 丰度,SCFAs升高50–60%,并改善绒毛高度与微绒毛密度。
与对照组相比,小鼠肠道镁、钙吸收率分别提高约30%与25%。说明膳食诱导的菌群改善能通过结构性(形态学)重塑增强矿物吸收能力。
⑹肠—菌—宿主信号反馈调节
•微生物群通过信号环路调控肠上皮基因表达:提高 TRPM6、CLDN15(紧密连接蛋白)与 SLC41A1(镁排出转运体)转录水平,使吸收与细胞出口协调。同时通过产生代谢信号(如吲哚衍生物、丁酸)影响上皮AMPK和Nrf2通路,调节能量与氧化还原状态,从而间接优化镁吸收条件。
•微生物组成改变还能影响胆酸代谢与黏膜黏液厚度,这两者共同决定离子交换界面的有效面积与pH稳定性。
▸ 肠道菌群与镁利用的全身效应
⑴肝门循环途径调节
部分短链脂肪酸(SCFAs)被肠道上皮吸收后通过门静脉进入肝脏,在肝细胞内可上调镁稳态相关蛋白,即CNNM家族成员的表达,从而增强肝脏对镁离子的储存与调控功能。
这一过程在维持全身镁平衡中起着重要作用,有助于调节系统性储镁能力并保证体内镁稳态的稳定。
⑵肾脏再吸收作用
目前在动物模型和体外实验中观察到:肠道菌群产生的代谢产物,尤其是丙酸,在被吸收入血后能够激活宿主的PXR受体信号通路,从而促进肾脏中TRPM7通道蛋白的表达水平上升。通过这种分子途径,肠源代谢信号间接改变了肾脏对镁离子的再吸收与排泄能力,使镁的排泄率得到动态调节,进而参与维持全身镁稳态。
⑶免疫效应层面
健康的肠道菌群能够有效维持低炎症的内环境,抑制过度的免疫反应,从而减少由TNF‑α介导的TRPM6通道蛋白内化过程。通过保持TRPM6的稳定表达与功能活性,肠道上皮细胞得以持续高效地吸收镁离子,从整体上提升机体对镁的长期吸收效率与稳态维持能力。
▸ 肠道微生物紊乱与镁吸收障碍
当肠道菌群的平衡被打破时,例如在长期或不当使用抗生素、高脂饮食摄入过多、或发生炎症性肠病等情况下,肠道微生态的稳定性受到显著干扰,进而引发一系列连锁反应。
⑴Mg²⁺ 盐溶解性下降
首先,短链脂肪酸(SCFAs)的生成量明显下降,使得肠道内容物酸度降低,肠腔pH值常升高至7以上,从而导致镁盐溶解度下降并出现沉淀,削弱了可吸收镁离子的供给。
⑵TRPM6/7 下调,吸收效率降低
其次,肠上皮细胞中TRPM6通道的表达受到抑制,导致活性吸收途径效率降低,同时肠屏障的渗透性增强,离子外漏和炎性反应趋于加剧。
⑶长期失衡引发低镁血症
若这种失衡状态长期持续,则可能引发系统性低镁血症,进而影响机体的能量代谢与细胞信号传导,引起继发性代谢紊乱,如胰岛素抵抗的形成及炎症反应的持续增强,最终损害整体代谢健康。
肠道微生物群通过多层次机制深刻调控镁的吸收与利用,是维持机体镁稳态的关键生物学因素。健康的菌群结构可通过发酵产生短链脂肪酸,降低肠腔pH、增强镁盐溶解度,并上调肠上皮镁转运通道(如TRPM6/7)的表达,从而促进镁离子高效吸收。同时,益生菌的代谢活动改善肠屏障功能,抑制炎症介导的通道降解,维持镁吸收持续进行。
相反,当菌群失衡时,SCFA水平下降、肠道环境碱化以及通道表达受抑,会显著降低镁的生物利用度,甚至引发系统性低镁血症及代谢功能障碍。
因此,保持菌群多样性与代谢平衡,对优化镁吸收与全身代谢健康具有重要意义。
当前评估体内镁含量的方法可分为直接测定法与间接评估法两大类。每种方法在反映镁状态的敏感性、特异性及可行性方面各具优缺点。
1
血清(血浆)镁浓度测定
原理: 直接测定外周血清或血浆中的总镁离子含量,是临床常用的基础方法。
常用标准值:0.75–0.95 mmol/L(或1.8–2.3 mg/dL)。
优点:
•操作简便、成本低,可通过常规化学或光谱分析快速获得结果;
•适用于急性临床监测,如电解质紊乱、肾功能异常等情况。
缺点:
•仅反映体内总镁的约 1% ,对镁储备状态敏感性极低;
•血镁浓度受饮食、激素水平、肾功能和血液稀释度影响明显;
•在轻度缺镁或慢性低镁状态下常表现为“假正常”,容易漏诊。
2
红细胞镁(RBC Mg)测定
原理: 测量红细胞内镁离子浓度,更能反映细胞内镁水平。
优点:
•与组织镁含量和代谢活性状态相关性较强;
•适用于慢性缺镁、糖尿病、心血管疾病人群的研究。
缺点:
•样本分离流程复杂,需即时离心处理;
•红细胞寿命较长,难以反映短期动态变化;
•测定标准化程度低,不同实验室间的可比性较差。
3
离子镁(Mg²⁺)检测
原理: 直接测量血液中自由镁离子(生物活性形式)浓度,利用离子选择电极或离子色谱法。
优点:
•能准确反映生理活性镁水平,比总镁更具临床相关性;
•在重症监护、心律失常管理中应用价值高。
缺点:
•仪器昂贵,检测条件严格(需无空气暴露、控制pH和温度);
•样品保存与运输难度高,不适合集大样本研究。
4
尿镁排泄测定
原理: 通过24小时尿液或随机尿镁/肌酐比评估肾脏排镁功能。
优点:
•可判断低镁状态来源:分辨肾性镁丢失与摄入不足;
•利于药物(如利尿剂、铂类药物)诱导的电解质异常评估。
缺点:
•尿镁受肾小管功能、摄水量与饮食镁摄入影响大;
•单次检测波动性强,需与血镁水平联合判断。
5
骨骼或肌肉镁测定
原理:镁的大部分储存在骨骼和肌细胞中,采用骨活检或肌肉组织分析评估体内总储镁。
优点:
•最能代表全身镁储备量,是研究性“金标准”。
缺点:
•操作侵入性强、成本高,不适合常规临床使用;
•检测周期长,临床价值主要局限于科研应用。
6
非侵入性或间接评估方法
包括: 饮食问卷(FFQ)、头发镁、指甲镁或唾液镁检测。
优点:
•采样方便,可用于营养流行病学调查;
•能反映长期摄入趋势。
缺点:
•与生理有效镁缺乏相关性弱;
•易受环境污染、样品处理影响,数据可靠性不足。
综合来看,血清镁是初筛与临床常规监测的首选指标,而红细胞镁与离子化镁更适用于研究或特殊人群诊断。若需明确镁缺乏性质,应结合尿镁排泄、饮食摄入评估及必要的负荷试验,以全面评价机体镁稳态。
未来研究趋势正向多指标综合模型发展,结合代谢组学与离子组学数据,可更真实反映体内镁的动态分布及生理活性状态。
当我们了解到自身存在镁缺乏的情况时,就需要采取一些切实可行的方法来进行有效补充,以帮助身体恢复正常的镁平衡状态。
那么,在我们的日常饮食与生活习惯中,都有哪些常见且实用的途径能够帮助增加镁的摄入量、促进吸收与利用呢?接下来,让我们一起了解这些改善低镁状态的方法。
1
优化饮食结构提高镁摄入与吸收
√富镁食物摄入
•主要来源包括:深绿色叶菜(菠菜、羽衣甘蓝)、全谷物、豆类、坚果(杏仁、腰果)和种子(南瓜籽、亚麻籽)。
•海产品(三文鱼、海藻、贝类)和黑巧克力中亦含有高可溶性镁。
•膳食模式建议:遵循地中海式或DASH饮食可显著提升镁摄入并改善心代谢健康。
√避免阻碍吸收的膳食因素
•过量膳食脂肪、草酸(如菠菜、甜菜)、植酸(谷物外皮)和高磷饮食会与镁形成难溶盐,降低吸收率。
•过量钙、酒精、咖啡因及精制糖也会削弱肠镁吸收或加速排泄。
镁和饮食
2
调整肠道微生态
√益生菌补充:
部分菌株(如Lactobacillus plantarum、Bifidobacterium longum)具有生物螯合和离子交换能力,能直接结合或转运镁离子,并改善肠环境酸度、增强屏障功能并提高镁吸收。
√益生元摄入:
•菊粉、抗性淀粉、低聚半乳糖等促进有益菌生长与SCFA生成;与镁补充剂合用可产生“协同吸收效应”。
•天然食材包括菊苣根、洋葱、香蕉、燕麦、抗性玉米淀粉及豆类。
√合生元策略:
•将益生菌与益生元联合应用,持续重构菌群结构,稳定镁吸收体系。
•常见组合为 Lactobacillus rhamnosus+菊粉,或 Bifidobacterium bifidum+低聚果糖。
3
合理的镁补充剂
常用镁补充剂类型与吸收特征:

√与其他补充剂可能存在竞争或协同作用:
•维生素D与镁存在协同作用:D₃促进TRPM6表达并增强肠吸收。
•避免同时与高钙或铁补充剂同服,以减少竞争性吸收。
√特殊人群调节方案:
•老年人:胃酸分泌低、吸收率下降,应选择有机镁盐并配合益生菌。
•肾功能受损者:慎用高剂量补充,监测血镁。
•糖尿病与代谢综合征患者:镁可改善胰岛素敏感性,推荐持续低剂量补充。
4
促进镁利用减少体内丢失
√控制促镁排泄因素:
•减少长期使用袢利尿剂、质子泵抑制剂(PPI)和胰岛素过量。
•控制高醇饮用与慢性应激,因皮质醇及儿茶酚胺可显著促进镁排泄。
√维持酸碱平衡与肾功能健康:
•酸负荷饮食(高蛋白、高磷)会增加尿镁流失;适当碱化饮食(蔬果丰富)有助保镁。
•保证充足水合状态,稳定肾小管重吸收。
√协同营养素支持:
•维生素B₆:促进镁向细胞内转运。
•维生素D:增强肠镁吸收及骨镁沉积。
•钾水平充足也有助于稳定细胞内镁含量。
5
重视长期个性化健康
√联合评估与动态调整:
•定期监测血清镁、尿镁及相关代谢指标(葡萄糖、CRP、肾功能)。
•使用生物可利用性更高的镁盐并结合饮食优化,可在8–12周显著改善低镁状态。
√持续干预与个体化方案:
•长期追踪应以低剂量持续,而非短期高剂量“冲击补充”;
•根据个体肠道菌群、代谢状态及药物使用情况调整补充途径与剂型。
镁不仅是基础营养素,更是连接营养代谢、肠道微生态与整体健康的关键枢纽。鉴于其在人体代谢和系统调整中的诸多作用,镁有望作为代谢紊乱的潜在标志物。镁稳态的失衡可能预示心血管疾病、糖尿病、神经退行性疾病、胃肠道疾病或肾病、骨质疏松及慢性炎症等多种疾病风险的早期信号。
值得注意的是,近年来肠道微生物群在镁吸收、储存与代谢调控中的重要作用逐渐被揭示。菌群不仅影响了镁的生物利用效率,还通过其代谢产物影响宿主的免疫、炎症及能量代谢网络。
未来的健康干预方向应超越单纯的营养补充,转向以微生态调节为核心的“营养—菌群—代谢”综合模式。通过益生菌、益生元及合生元的个体化应用,可实现镁吸收效率的长期优化,并间接改善血糖、血压及炎症状态,从而强化整体健康管理。
深入研究镁与菌群互作的分子机制,将为精准营养学、代谢疾病防控及功能性食品研发提供新的理论支撑。构建以肠道生态平衡为基础的镁稳态干预体系,或将成为促进健康老龄化、预防慢性病及实现个体化营养治疗的发展方向。镁与菌群的协同作用,不仅代表了一种新的营养理念,更是未来健康科学从“补充”走向“调控”的关键转折点。

谷禾健康
宝宝湿疹反复瘙痒总难根治,季节交替时喷嚏不断,擦不完的鼻涕,整晚咳嗽甚至发展为哮喘,到了学龄期孩子仍无法专注听讲…
如今约40%中国儿童在成长过程中会出现至少一种过敏症状(尤其是过敏性鼻炎),神经发育问题发生率也逐年上升。
多中心流行病学调查和系统综述显示:
神经发育障碍整体患病率呈上升趋势,已从 0.5 %‑1 % 逐步提升至约 5 %‑10 %,包括所有子类的累计比例。
中国儿童常见过敏性疾病的患病率总体呈上升趋势,哮喘约 3%–7%,过敏性鼻炎约 20%–25%,湿疹/特应性皮炎约 8%–20%,食物过敏约 3%–8%,且城市和经济发达地区患病率更高。
而这些看似独立的健康难题,都指向了肠道微生物群。
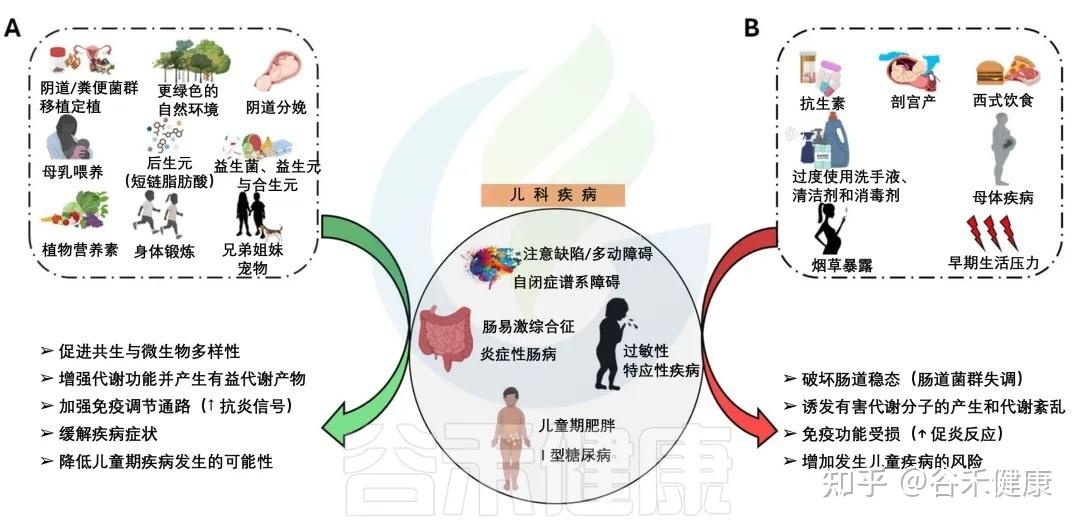
从出生开始,我们的肠道微生物群便陆续完成定植,在大约三年的时间里,从几乎一片空白,逐步演变为一个多样、稳定且高度复杂的微生态系统。这一阶段被认为是影响儿童健康的关键窗口期,而现代生活方式导致的环境污染、抗生素滥用、高加工食品摄入过多等问题,都在悄悄破坏着孩子娇嫩的肠道环境。
大量研究提示,生命早期一旦出现肠道菌群失衡,不仅会增加炎症性肠病、过敏性疾病(如哮喘、湿疹、过敏性鼻炎等)、自闭症、注意力缺陷多动障碍、儿童肥胖、糖尿病等多种儿科疾病的风险,其影响还可能延续至成年。相反,如果在这一时期通过合理的方式塑造一个平衡的肠道菌群,则有机会改善儿童免疫与代谢反应,甚至为一生的健康打下基础。
基于此,本文将围绕“早期肠道菌群与常见儿科疾病”这一主题,回顾当前研究进展,解析早期肠道菌群在疾病发生发展中的作用机制,并探讨可能的干预思路与临床应用前景。
我们知道肠道菌群不仅仅帮助我们消化食物,它还在免疫、营养吸收、抵御病菌、维护肠道屏障的完整性中扮演着关键角色。
尤其是在生命早期,肠道菌群会建立起连接大脑、肺、皮肤等远处器官的沟通轴线。这个关键发育窗口期建立的菌群平衡,就给未来打下了扎实的基础。如果这时候建立的菌群平衡被打破,就可能对儿童健康产生深远的不利影响,甚至引发多种疾病。
肠道与各大器官的交流
肠道菌群通过复杂的免疫、代谢和神经内分泌途径,与身体多个器官进行着持续的双向沟通。
这是最有名的这一条,大脑和肠道菌群,其实从宝宝还很小的时候就一起长大。
肠道菌群会产生影响情绪和行为的神经递质(如GABA),通过迷走神经和血液循环传递给大脑。
反过来,我们一紧张、焦虑,脑子里的压力信号会改变肠道里的环境,比如让酸碱度、激素水平发生变化,进而影响肠道菌群。这条轴线的失调与自闭症谱系障碍和注意力缺陷多动障碍有关。
再来看肠道和皮肤的关系。很多人都说“脸就是肠道的镜子”,其实还真有点道理。
肠道如果不太健康、菌群有点失衡,就很容易引发一些慢慢的、低度的炎症,还有一些代谢产物。这些东西会跟着血液到皮肤那儿去,影响皮肤表面的菌群平衡和局部免疫状态。
结果就是,像婴儿湿疹之类的问题,可能就会变得更严重或者更难治愈。
听起来好像肠道和肺离得挺远的,但它们之间也在悄悄互相影响。肠道菌群产生的代谢物,还有各种免疫信号,也可以通过血液到达肺部,帮忙调整呼吸道的免疫反应。肠道菌群失衡会增加儿童患哮喘和过敏的风险。
其他重要轴线: 研究还揭示了 肠-胰腺轴、肠-脂肪轴 等通路的存在。
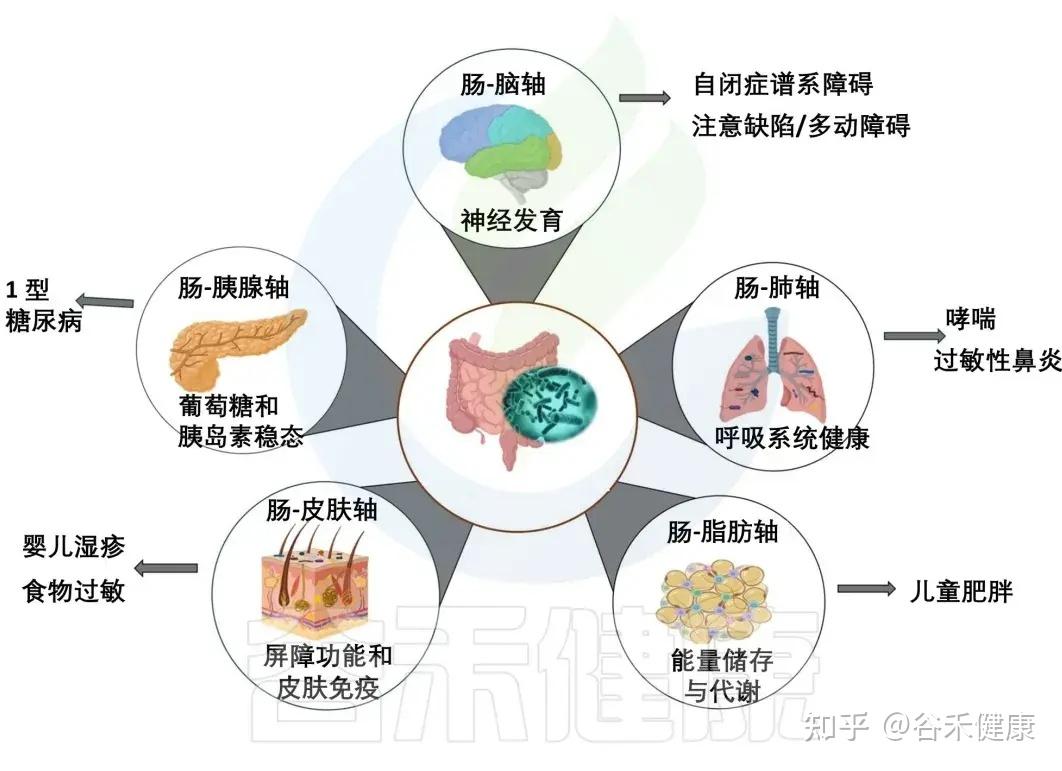
总之,肠道菌群通过这些复杂的代谢和信号通路,构建了一个覆盖全身的通讯网络,成为调节人体从免疫到神经系统等多个方面健康的核心枢纽。
母亲围产期营养状态
婴儿肠道菌群的初始状态,很大程度上继承自母亲。母亲在围产期保持均衡、健康的饮食,是为后代肠道菌群打下良好基础的第一步,也是至关重要的一步。
失衡的风险
如果母亲在孕期偏爱高热量、高脂肪的西式饮食,可能导致自身肠道菌群的失调。这种失调会通过胎盘、产道或母乳传递给婴儿,影响宝宝肠道健康。同样,营养不良也会导致菌群失调,可能增加如γ-变形菌门这类潜在致病菌群的出现。
▸细菌的入住,在出生前就开始了
与传统的“子宫无菌”理论不同,新的证据显示,细菌定植其实早在胎儿的宫内阶段便已开始。研究发现,非致病菌在妊娠期间能从母体肠道转移至胎儿,并存在于胎盘、羊水、脐带、胎儿组织及胎粪中。
而这个宫内微环境的菌群构成,又会受到母亲的健康状况、饮食习惯以及孕期菌群变化的影响,这为婴儿早期肠道菌群形成奠定了最初的基础。
分娩方式:顺产 or 剖腹产?
分娩方式,主要是顺产(即阴道分娩)与剖宫产,是显著影响新生儿肠道菌群组成和发育的关键因素。
▸出生方式决定了宝宝的第一批肠道居民
-顺产
顺产新生儿会接触到母体阴道与肠道来源的多样菌群,包括乳酸杆菌和双歧杆菌等优势菌株,这些菌群构成了初始肠道定植的核心。
顺产宝宝的菌群不仅更稳定、多样性也更高,而且他们的粪便菌群构成与母亲相似。
-剖宫产
与顺产儿相比,剖宫产儿的肠道菌群表现为双歧杆菌和乳酸杆菌的定植延迟、拟杆菌门的多样性较低,而主导菌群则通常是医院环境中常见的肠球菌属。
剖宫产宝宝的肠道里的菌群种类更少,而且这些菌群更像是来自妈妈皮肤和口腔里的。
注:
刚出生那段时间,两种分娩方式带来的菌群差别很大,这个差别会随着时间推移而慢慢变小。
有研究发现剖宫产宝宝的这种菌群特点,可能会让他们以后更容易得一些慢性病(比如哮喘、1型糖尿病、肥胖,但这个说法目前还有争议,不是所有研究结果都一样。
▸如何为剖腹产宝宝补回有益菌?
母体的阴道和粪便菌群是新生儿获得初始微生物的最主要、最丰富的来源。
——第一个办法:阴道菌群移植
为了弥补剖宫产宝宝在这方面的缺失,一些研究探索了“阴道菌群移植”的效果,就是说把母亲的阴道分泌物涂抹给新生儿。
部分研究显示,这种方法有助于部分恢复菌群定植;然而,另一些研究却得出相反结论,认为没什么影响。这种结果上的分歧,很可能是因为阴道菌群难以在婴儿肠道内实现长期定植。
——第二个办法:粪便菌群移植(仅科研探索阶段)
相对来说,母体消化道的菌群多样性要高得多,对宝宝肠道菌群定植的影响可能更深远。
基于这一理念,有些研究认为,母体粪便菌群移植是一种更有效的方法。它能近乎完全地恢复母婴间的微生物垂直传播,有效重塑新生儿的早期肠道菌群。
注:在我们看来,当前有关粪菌移植在儿童中的应用,仍主要停留在科研探索层面,且存在不少限制。成人与儿童的肠道菌群在组成和功能上存在显著差异,而目前临床检测和数据库中可用于精准匹配的儿童菌群数据仍相对有限。因此,现阶段粪便菌群移植更多作为研究工具和小范围、慎重的学术交流内容,并不适合作为常规干预手段。
喂养方式:母乳 or 配方奶?
▸母乳:不仅仅是食物
母乳 (HBM) 不仅为婴儿提供必需的营养,更在生命早期肠道菌群的成熟过程中扮演着至关重要的角色。
母乳富含多种生物活性成分,如免疫细胞、细胞因子、乳铁蛋白、抗菌蛋白和肽、抗体以及母乳低聚糖(HMOs)。这些成分能够对婴儿的肠道菌群进行正向调节,帮助宝宝抵抗感染。
与牛奶相比,母乳含有超过250种不同类型的母乳低聚糖。这些母乳低聚糖对于调节婴儿肠道微生物和影响免疫系统至关重要。
▸菌群差异:母乳 v.s. 配方奶
先前的研究已证实,母乳喂养和配方奶喂养的婴儿,其肠道菌群存在显著差异。
基于母乳喂养带来的整体健康益处,世界卫生组织推荐在婴儿出生后一小时内即开始母乳喂养,纯母乳喂养至六个月,并持续到至少一岁。
▸配方奶粉:添加母乳低聚糖
母乳喂养好处多多,但很多母亲会因乳腺炎、奶水不足或产后抑郁等原因而无法实现。为了弥补这一差距,现代高端婴幼儿配方奶粉开始添加在母乳中发现的关键成分——母乳低聚糖(HMOs),如2-岩藻糖基乳糖和乳糖-N-新四糖,这些有可能促进健康早期肠道微生物群的发展。
有研究发现,添加了HMOs的配方奶粉确实能带来积极效果:
▸生命早期,母婴间菌群如何传递?
母乳里的有益菌从何而来?研究人员认为,存在一个“肠道-乳腺通路”:
母亲肠道中的一些有益菌株可以被自身的免疫细胞(如树突状细胞)捕获。
这些免疫细胞随后通过淋巴系统,将这些细菌穿透肠上皮运送到乳腺。
最终,这些来自母亲肠道的有益菌就进入了母乳,并在喂养时传递给宝宝。
此外,母亲肠道细菌分泌的一些含有生物活性物质的小包裹(即细菌外囊泡,BEV),也可能通过同样的方式进入母乳,影响宝宝的肠道菌群建立。
总而言之,母亲自身的肠道健康状况,会直接影响母乳的微生物构成,进而深刻地影响着宝宝早期的肠道健康。
辅食添加:菌群发展的分水岭
当婴儿长到6个月左右开始添加辅食时,其肠道菌群会经历一次重大的转变。菌群会从以双歧杆菌为主的相对简单的状态,演变为一个相对更多样化的菌群。
-时机很关键
辅食添加太早或太晚,都会干扰菌群的正常成熟过程。因此,推荐在6个月左右开始添加营养丰富的辅食。
营养成分
不同的营养成分对肠道菌群有不同的影响。
▸宏量营养素(碳水、蛋白质等)
-碳水化合物
高纤维和低升糖指数的食物是肠道有益菌的“优质口粮”,有助于促进普雷沃氏菌属、双歧杆菌、毛螺菌属(Lachnoclostridium)和罗斯氏菌属(Roseburia)的生长。
一项研究表明,在婴儿的补充喂养阶段,食用来自各种全谷物、豆类、水果和蔬菜的膳食纤维会导致大量产丁细菌,如粪杆菌、粪球菌、Dorea、Oscillospira。
-蛋白质
相比动物蛋白,植物蛋白如扁豆,豆类,植物性饮食通常富含膳食纤维,含有足够量的多不饱和脂肪酸,通常更有利于结肠细菌的健康。
当然,为了维持肠道稳态,均衡摄入两种蛋白是最佳选择。
▸微量营养素(维生素与矿物质)
-维生素
多数维生素都能促进有益菌的生长,例如双歧杆菌和Akkermansia菌,同时抑制像艰难梭菌这样的致病菌。
例如,维生素A、B2、D、E、β-胡萝卜素可以增加有益共生菌的丰度。
维生素B2、E可以增加有益的SCFA产生菌。
-矿物质
它们的作用比较复杂。镁、钙、硒等有益于菌群。但需要特别注意的是,给婴儿补充铁剂可能是一把双刃剑,过量时可能会抑制双歧杆菌和乳杆菌科等有益菌,反而为一些有害菌的繁殖提供机会。
▸植物营养素(特别是多酚)
这是一类广泛存在于水果、蔬菜中的强大活性成分,能直接调节菌群。例如,生命早期服用葡萄多酚可以促进有益的Akkermansia和乳酸杆菌的生长。
更重要的是,母亲在孕期和哺乳期摄入的植物营养素可以传递益处。例如,母亲饮食中:
生命早期是一个塑造肠道菌群的黄金窗口期。在此期间,通过科学合理的营养干预来优化菌群构成,是预防多种儿童期乃至成年期疾病的有效策略。
运 动
除了我们吃什么,我们的“动与不动”也是影响肠道菌群的另一个关键因素。
▸运动如何优化肠道菌群?
规律的运动被证明可以从多个方面积极地重塑肠道微生态。
-增加有益菌和多样性
运动能显著增加肠道中有益菌的种类和数量,特别是那些能产生短链脂肪酸(SCFAs)的好菌。
宏基因组分析显示,运动量与罗斯氏菌属(Roseburia)和Akkermansia菌丰度呈正相关。
-久坐的危害
相反,久坐不动的生活方式则会破坏这种平衡。研究表明,久坐会导致肠道菌群多样性降低,并使得那些能更高效捕获食物能量的厚壁菌门增多,而放线菌门细菌减少。
▸生命早期的运动
在正确的时间运动,效果可能事半功倍,生命早期或许就是这样一个黄金窗口期。
-早期锻炼效果更佳
一项动物研究发现,如果在还很年幼的时候就开始运动,相比长大成年后才动起来,更能明显、积极地改变肠道菌群。
-具体的菌群变化
研究显示,幼年期的运动能显著增加拟杆菌门的比例,同时降低厚壁菌门的比例,这种菌群构成上的变化与增加瘦体重)直接相关。
基于这些益处,世界卫生组织建议,5岁以下的孩子,每天应累积进行至少180分钟的各类身体活动。
▸母亲的运动:给宝宝的第一份健康礼物
运动的影响力甚至可以追溯到生命开始之前。过去我们认为,父母传给孩子的是基因。现在我们知道母亲还可以传递一个健康的微生态系统。
-孕期运动的益处
母亲在孕前和孕期的规律运动,可以帮助宝宝的肠道减少有害菌,同时富集能产生短链脂肪酸的有益菌,从而改善宝宝整体的代谢健康。
-可能的机制
科学家推测,这其中的一个可能机制是,运动改变了母亲体内的代谢环境,如激素水平、血液循环和能量利用。这些生理变化信号传递到乳腺,影响了母乳的生产过程。
母乳中母乳低聚糖(HMOs)的种类和数量发生了改变。HMOs是母乳中仅次于乳糖和脂肪的第三大固体成分,但宝宝自己无法消化它。它不是给宝宝吃的,而是专门给宝宝肠道里的有益菌吃的。这样一来,宝宝的有益菌在菌群建立的早期就占据主导地位,抑制了有害菌的生长。
均衡的营养加上规律的身体活动,能最大程度地对早期肠道菌群的健康发展产生积极和深远的影响。
在生命早期操纵微生物发育的因素
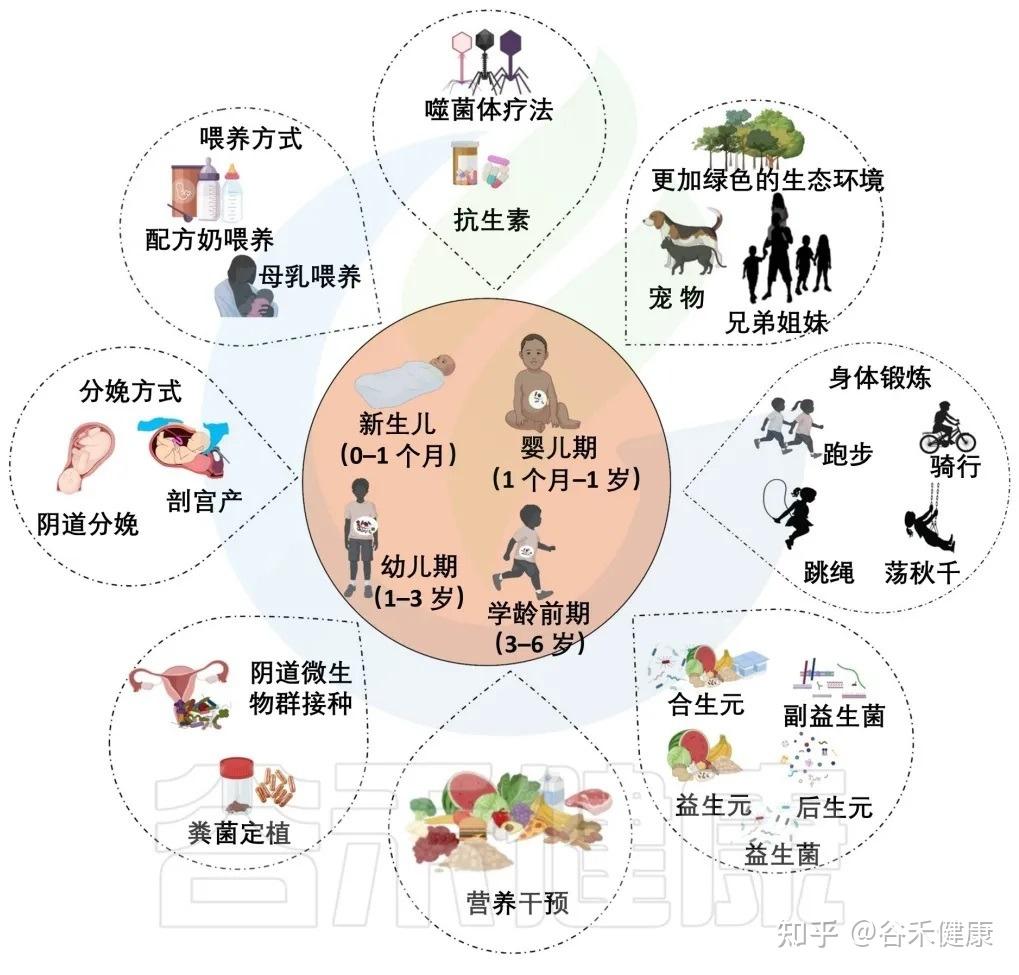
抗生素的使用:有利有弊
有些家长有过这种经历,带孩子看了一次病,用了抗生素,当时觉得病总算好了,松了口气,结果没过几天,新的问题又来了:孩子就开始拉肚子,或者突然吃一些东西开始食物不耐受了,甚至之前控制得好好的湿疹也加重了。这其实也跟肠道菌群有关。
关于抗生素,它确实对付细菌感染特别管用,不过呢,凡事都有两面,尤其是在生命早期,在宝宝身体各种系统都还在搭建的时候使用它,可能需要付出一些看不见的代价。
抗生素最大的问题在于其“不分敌我”的特性,它们不仅杀死了致病菌,也对肠道内大量的有益菌造成了连带伤害,导致肠道菌群失调。这种早期的菌群失调与日后的多种健康问题,如肥胖、哮喘以及抗生素耐药性等都有可能相关联。
婴儿接触到抗生素主要有两种途径:
▸母亲用药:穿越屏障的连锁反应
即使是母亲使用抗生素,其影响也能传递给宝宝。
-影响机制
在分娩期间,抗生素不仅会通过脐带传递给胎儿,还会改变母亲产道和粪便中的菌群,这些都是婴儿在出生时获得初始菌群的来源。
-对婴儿菌群的直接冲击
研究发现,经历过母亲产时抗生素暴露的婴儿,其粪便菌群表现出:
整体多样性降低;
放线菌门和拟杆菌门丰度显著减少;
变形菌门占据了主导地位。
-对母乳的影响
母亲使用的抗生素还会改变母乳中的微生物,这会直接阻碍双歧杆菌和乳酸杆菌等健康菌株在婴儿肠道的正常定植。
▸婴儿用药:艰难梭菌感染风险增高
当婴儿自己直接使用抗生素时,对肠道菌群的影响更为直接。
研究证实,这会导致婴儿肠道菌群构成发生剧变,主要表现为:有益的双歧杆菌数量锐减,而肠球菌属和克雷伯氏菌属等机会性致病菌的数量则会升高。
有些儿童在使用抗生素之后会发现,艰难梭菌(Clostridioides difficile)感染的风险会显著升高,艰难梭菌感染可能会引起严重的腹泻和结肠炎症。
除艰难梭菌外,抗生素使用还可能导致耐药菌株的选择性增长。例如,耐甲氧西林金黄色葡萄球菌(MRSA)和产超广谱β-内酰胺酶(ESBL)的肠杆菌科细菌,这些在抗生素治疗后更容易定植。
长远来看,可能会让宝宝更容易反复出现肠胃不适、拉肚子,或小病不断。因此,在抗生素用药之后,需要格外关注宝宝的饮食,排便,以及肠道菌群状态。
环 境
除了饮食和运动,我们生活于其中的物理和社会环境,也对生命早期的肠道菌群发展有着深刻而直接的影响。从家里的宠物到社区的公园,都在悄无声息地参与塑造这个微小的生态系统。
▸ “不干不净,吃了没病”
过度干净的环境,有时反而不利于建立一个强大的免疫系统和健康的肠道菌群。适度地接触来自外界的微生物,对婴儿来说是一种有益的早期训练。
-宠物带来的益处
宠物猫狗陪伴着孩子长大,像家人一般为孩子带来情感上的安慰与支持,也为孩子性格带来温暖的影响,让孩子感受更多无条件的爱与接纳。
从肠道菌群的角度来说,研究发现,与宠物(如猫狗)一起长大的婴儿,其肠道菌群的丰富度和多样性通常更高。具体来说,他们的肠道中比如双歧杆菌、颤螺菌属(Oscillospira)和瘤胃球菌属(Ruminococcus)这些有益菌的丰度会更丰富。

有趣的是,养猫的人肠道里的双歧杆菌水平也比不养猫的人要高。这就意味着,和猫咪一起生活,可能会通过菌群的交流,悄悄地帮我们补充有益菌,提升肠道健康水平。
注:然而也存在一些需要注意的潜在风险。研究指出,猫肠道里的抗生素耐药基因(ARG)丰度显著高于人类。这些耐药基因可能会通过猫咪在家里的活动(比如它走过地板、沙发),转移到环境中,进而有机会进入人体。简单说,就是猫可能会把它携带的耐药基因传递给主人,这增加了我们体内细菌变得耐药的可能性。
-兄弟姐妹的菌群共享
同样,有哥哥姐姐的孩子,其肠道菌群的多样性也更高。
道理其实很简单。宠物和哥哥姐姐会将更多来自室外(如土壤)或他们自身的微生物带入环境中,让婴儿有机会接触到更多样的细菌,这就像是给婴儿的肠道菌群进行了一次自然接种,有助于其发展得更加健全和有韧性。
▸新冠的意外发现:社交隔离对菌群的影响
新冠为我们提供了一个独特视角,观察环境剧变如何影响肠道菌群。
-菌群多样性下降
研究人员发现,在疫情期间出生的婴儿,其粪便样本中的微生物多样性显著低于疫情之前的同龄婴儿。
-可能的原因
这种变化被认为与疫情期间的特殊生活方式有关,包括:社交活动大幅减少,以及消毒剂、洗手液等清洁产品的使用频率急剧增加。这使得婴儿接触外界微生物的机会大大减少。
▸ 环境的力量:来自大自然的馈赠
我们与自然环境的接触,也能产生意想不到的健康关联。
-母亲接触绿色环境的益处
最近的一项研究指出,如果母亲在孕期更多地接触住宅区周围的公园、绿地等绿色环境,其母乳中母乳低聚糖(HMOs)的多样性和浓度都会更高。

我们已经知道,HMOs是婴儿肠道有益菌的超级食物。因此,通过提升母乳的质量,母亲接触绿色环境的益处最终能够传递给婴儿,积极地影响其肠道菌群的健康发育。
因此,生命早期丰富的环境暴露至关重要。一个不过分无菌、能适度接触来自他人、宠物和大自然的微生物的环境,是帮助孩子建立一个多样、稳定且有韧性的肠道菌群的关键因素之一。
生命从出生到3-6岁的这段时间,是肠道菌群发育的“关键窗口期”。这个阶段的任何干扰,都可能让菌群的健康发展偏离轨道,从而为日后儿童期的各种疾病埋下隐患。
儿童过敏
儿童过敏性疾病,包括湿疹、哮喘、过敏性鼻炎、食物过敏等,是一组以免疫系统对无害物质产生过度反应为特征的常见慢性病。它们的发病,往往与遗传和环境因素共同相关。
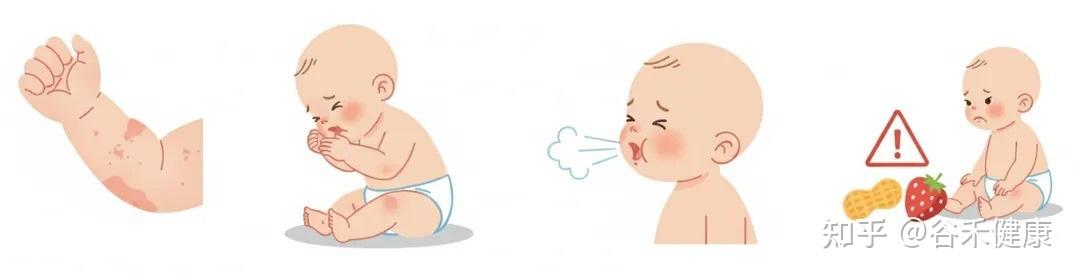
从临床分型上看,这些疾病都属于特应性疾病,其核心是身体产生了过度的IgE抗体来对抗那些本应无害的环境物质(如花粉、尘螨、某些食物等)。并且,患有其中一种过敏的孩子,往往更容易患上另一种,这被称为过敏进程。
▸肠道菌群:过敏病程中的关键调控者
这几年,无论是基础研究还是临床队列,都越来越一致地指向一个关键环节,肠道菌群在过敏的发生发展中扮演着关键的调控角色。
在我们对过敏儿童样本的菌群数据分析中,可以看到一种具有代表信的肠道菌群失调。
具体来说,过敏儿童的菌群通常具备几个共性:
更细分到食物过敏的时候会发现,不同食物过敏原(比如牛奶蛋白、鸡蛋蛋白、花生等)相关的菌群变化还可能各有其特异性的模式,不同分型这也是我们正在关注的方向。
▸失控的免疫反应:当前主流的菌群-免疫假说
那肠道菌群究竟是通过什么路径去影响免疫系统,进而推动过敏的呢?目前在学术界相对被广泛接受的,是围绕短链脂肪酸,尤其是丁酸盐的一条核心假说:
丁酸盐的缺失:菌群失调导致关键的代谢产物——丁酸盐浓度下降。
刹车失灵:丁酸盐是促进初始T细胞分化为调节性T细胞(Tregs)的关键信号。Tregs在免疫系统中可以理解为一个刹车装置,负责抑制过度的免疫反应,维持免疫平衡。
免疫过度激活:丁酸盐减少导致Tregs数量不足或功能受损,刹车失灵,免疫系统便会对无害物质反应过度。
典型免疫表型:在这种菌群失调的背景下,我们在过敏儿童身上通常可以看到这样一组特征性变化:
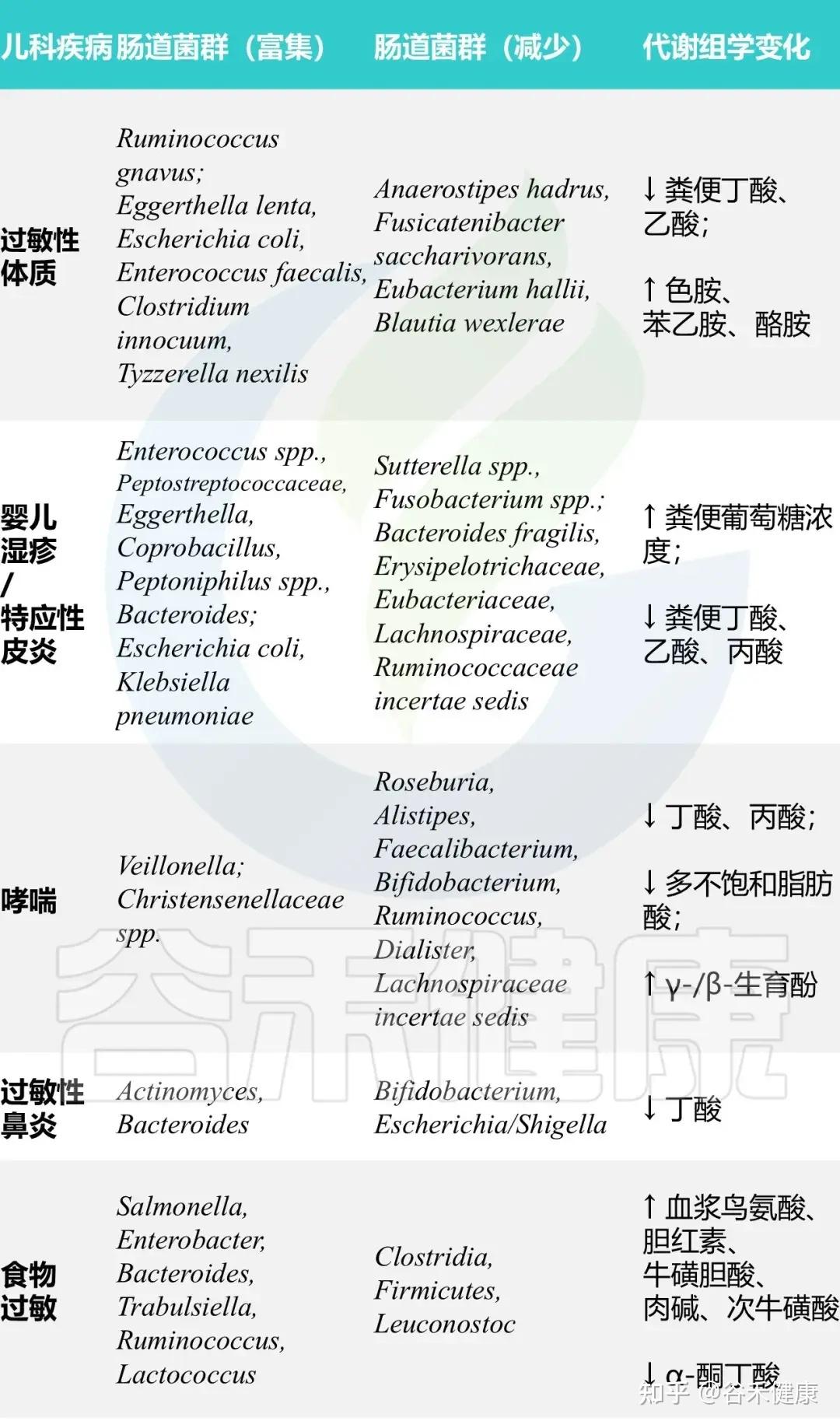
总而言之,生命早期的肠道菌群失调,通过影响免疫系统的正常教育过程,为日后一系列过敏性疾病的发生埋下了伏笔。而具体的菌群和代谢物变化,则在不同的过敏性疾病中呈现出各自的特征。
肠道菌群检测就是力求精准地捕捉到这些早期的菌群和代谢物特征,在实际应用中,我们并不会仅看哪个菌高了或者低了,而是会把菌群特征与已有的临床和免疫学指标放在一起综合判断。
例如,结合谷禾肠道菌群检测报告中的过敏相关菌群模块、肠道屏障评分,以及部分炎症相关因子和免疫调节指标(如 IL‑6 等),我们可以更准确地判断一个孩子的肠道生态,是不是已经处在一个更偏向炎症和过敏反应的状态,尽可能实现对高风险儿童的早期识别,从而为临床的早期预警和干预提供思路。
IBS 与 IBD
在儿童常见的胃肠道疾病中,炎症性肠病(IBD)和肠易激综合征(IBS)是两个重要的类别,它们都与肠道菌群的失衡密切相关。
虽然生命早期的肠道菌群构成与这两种疾病的确切因果关系仍在研究中,但科学家们已经在年龄较大的患病儿童中发现了明确的菌群改变。
▸失衡的菌群
IBS患儿的菌群特征:
IBD患儿的菌群特征:
▸代谢物的变化(化学信号的紊乱)
在IBD患儿体内,色氨酸、琥珀酸盐和3-羟基异丁酸等关键微生物代谢产物的水平较低。
在IBS患儿体内,则观察到葡萄糖、甾醇、乳酸水平升高,而有益的丁酸盐水平下降。
尽管如此,与生命早期相关的特定代谢组学特征,目前仍是一个有待深入探索的领域。
▸失控的免疫反应:炎症
在这两种疾病的背后,一个共同的核心病理机制是:由肠道屏障缺陷和微生物失调共同驱动的、失控的黏膜免疫反应。
IBD:
某些能够降解肠道黏液保护层的致病共生菌,例如黏附侵袭性大肠杆菌(adherent-invasive Escherichia coli),能够诱导巨噬细胞等免疫细胞分泌IL-1β,这会直接促进Th17细胞的分化,点燃肠道炎症。
从口腔跑到肠道的克雷伯氏菌属,也能促进树突状细胞和巨噬细胞产生促炎因子,从而推动初始T细胞分化为Th1和Th17细胞,加剧炎症。
此外,大量能产生IgG抗体的浆细胞被招募到肠道,也参与了IBD的疾病进展。
IBS:
虽然炎症程度不如IBD剧烈,但在IBS患儿的结肠黏膜和血液中,也观察到了先天免疫的过度活跃,特别是来自肥大细胞和单核细胞的活动增强。
适应性免疫同样参与其中,表现为肠道内T细胞数量增加、B细胞活性改变以及抗体的产生。
简而言之,IBD和IBS的发生,是肠道菌群失衡与免疫系统功能紊乱相互作用、相互放大的恶性循环。然而,上述这些复杂的免疫机制,在那些具有高患病风险的婴幼儿身上是如何运作的,仍需要更多未来的研究来进一步验证和阐明。
常见儿科疾病中的早期肠道生态失调
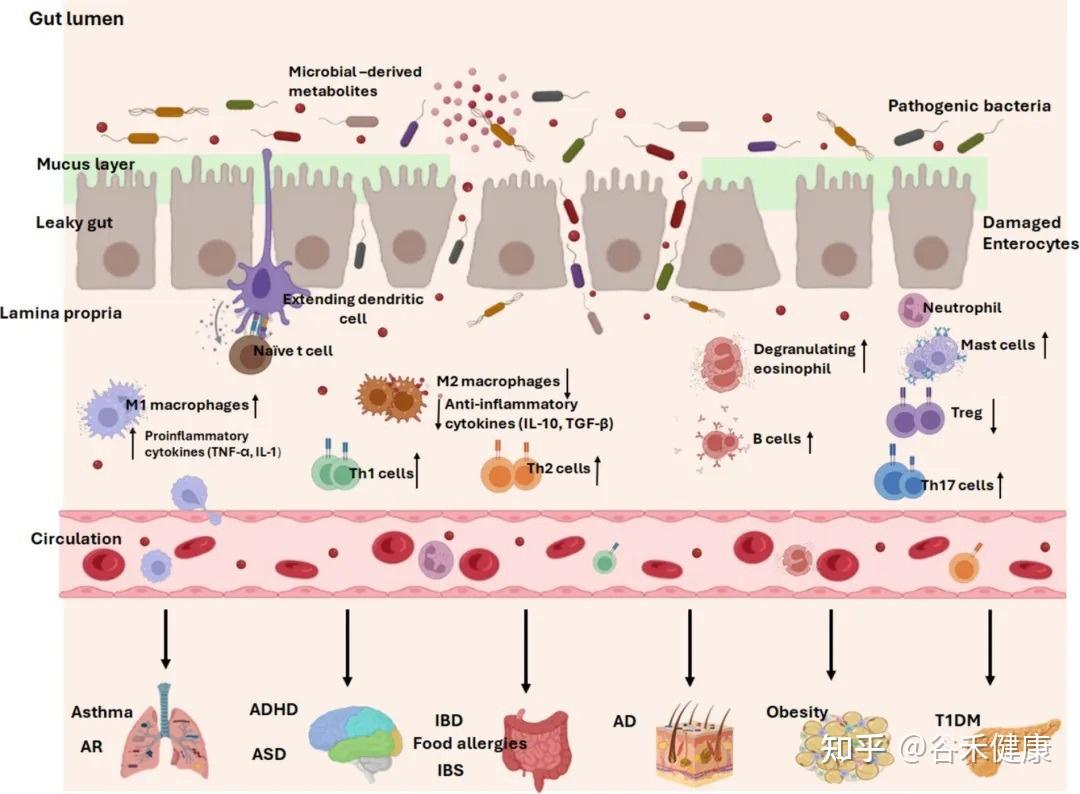
神 经 发 育
生命最初的几年,不仅是肠道菌群建立的关键窗口,也恰好与中枢神经系统发育的关键阶段,如神经突触的形成和髓鞘化高度重叠。这并非巧合。一条被称为肠-脑轴的复杂通讯网络,将肠道和大脑紧密地联系在一起,使得肠道菌群的状况能够深刻影响神经发育,甚至可能参与了自闭症谱系障碍(ASD)和注意力缺陷多动障碍(ADHD)等疾病的发生。
这两种情况有时会同时出现在一个孩子身上。
▸失衡的菌群,失调的化学信号
由于肠道微生物能通过其代谢产物和影响免疫通路来调控神经系统的发育和功能,科学家们将其视为自闭症和多动症发病的一个潜在贡献者。研究发现,与正常儿童相比,具有高患病风险的幼儿,其肠道菌群的构成和产生的生物活性代谢物均存在显著差异。
-菌群失衡
-关键神经递质的缺失
一个尤为引人注目的发现是,这些高风险儿童体内由细菌产生的、具有神经活性的分子——γ-氨基丁酸(GABA)的水平显著降低。
这些发现清晰地揭示了在生命早期,肠道菌群-代谢产物-神经系统之间存在的深刻联系。
▸从肠道炎症到大脑炎症
GABA的减少可能不仅仅是一个孤立的现象,它或许是连接肠道失衡与大脑功能异常的关键一环。GABA是大脑中主要的抑制性神经递质(负责让大脑冷静下来),它还在调节焦虑、改善睡眠、缓解疼痛以及帮助维持神经系统的整体平衡方面发挥着关键作用。
-连锁反应的启动
菌群失调导致GABA等代谢产物水平改变。
GABA水平的改变,加上菌群本身的失调,引发了不正常的免疫反应和全身性炎症(表现为血浆中细胞因子水平的异常)。
这种慢性的全身性炎症会逐渐破坏精密的血脑屏障的完整性。血脑屏障一旦受损,炎症细胞和炎症因子便更容易进入大脑,最终引发神经炎症,从而影响大脑的正常发育和功能。

简而言之,ASD和ADHD的发生,可能部分源于肠道开始,经由免疫系统,最终波及大脑。然而,这其中的具体机制非常复杂。尤其是在菌群发育的关键窗口期,究竟哪些早期的免疫学特征能够预示ASD和ADHD的发生,仍然是未来研究需要迫切解答的重要问题。
肥胖及1型糖尿病
在儿童期,最常见的代谢性疾病莫过于肥胖和1型糖尿病(T1DM),而这两者的发生,都与生命早期的肠道菌群失调有着千丝万缕的联系。
▸肠道菌群:调节新陈代谢
我们的肠道菌群在宿主的新陈代谢中扮演着至关重要的“总调度师”角色,其影响力涵盖了脂质与葡萄糖代谢、能量消耗与脂肪储存,乃至胰岛素信号的传导等多个方面。
更关键的是,T1DM的发病高峰期通常在生命最初的5-6年,这与肠道菌群发育的关键窗口期完全重合,这暗示了两者之间强烈的内在联系。
▸失衡的菌群
与健康儿童相比,患有或高风险患有这两种代谢病的儿童,其肠道菌群构成显示出特定的指纹。
-T1DM高风险儿童的预警信号
研究发现,在T1DM高风险儿童体内出现自身抗体(血清学转换)之前,他们的肠道中多形拟杆菌(Bacteroides dorei)和普通拟杆菌(B. vulgatus)的数量就已经显著增加。值得警惕的是,这两种拟杆菌属细菌均与肠道炎症有关。
-肥胖儿童的菌群
从婴儿早期开始,肥胖儿童的肠道中就表现出脆弱拟杆菌(Bacteroides fragilis)丰度更高,而有益的双歧杆菌属(Bifidobacteria)和柯林斯菌属(Collinsella)数量更少。这种菌群模式与日后过度的体重增加直接相关。
▸代谢紊乱:疾病发生前的信号
在疾病真正显现之前,身体的化学信号——代谢产物,可能已经发出了警报。
-肥胖儿童的代谢特征
他们的体内GABA(一种能调节食欲和体重的神经递质)水平显著较低。
同时,血液中对称性二甲基精氨酸和不对称性二甲基精氨酸的水平升高,这两种物质被认为与全身性炎症有关。
-代谢综合征儿童的发现
另一项研究观察到,在5岁的代谢综合征儿童体内,参与糖异生、氨基酸和脂肪酸代谢的循环代谢产物显著增加,这些代谢通路的变化与他们的BMI、腰围和空腹血糖水平密切相关。

▸免疫与炎症:连接菌群与疾病
早期肠道菌群与免疫系统之间的相互作用,是驱动这些代谢疾病的关键。
-肥胖与炎症
在3-5岁的重度肥胖儿童中,可以观察到C反应蛋白(一种全身性炎症标志物)的水平升高。
失调的肠道细菌及其代谢产物(分解代谢物)会损害脂肪组织的稳态,并诱发慢性低度炎症,从而助长儿童肥胖的发生。
-T1DM与炎症
儿童T1DM患者体内常常同时存在肠道菌群失调和全身性及组织特异性的炎症反应升高,这清晰地表明,肠道微生物在维持宿主代谢健康中扮演着不可或缺的角色。
因此,无论是儿童肥胖还是1型糖尿病,其背后都涉及生命早期的肠道菌群失调,通过扰乱宿主正常的新陈代谢通路和触发不当的免疫炎症反应,为这些慢性代谢疾病的发生和发展铺平了道路。
在生命早期干预和重塑肠道微生物群,是促进长期健康的有效方法。儿童的肠道菌群比成人更容易被环境因素改变,且该时期是免疫系统成熟的关键窗口,而免疫系统又受到肠道菌群的调节。
这里我们来了解一下在常见儿童疾病中,通过操纵早期肠道微生物组进行干预的前沿研究。
儿 童 过 敏
既然我们知道了肠道菌群失调是儿童过敏的关键推手,那么,我们是否能主动出击,通过调整菌群来拨乱反正,预防或缓解过敏呢?
答案是肯定的,现有研究已经为我们指明了几个有希望的方向。
▸抗生素的阴影与警示
在讨论干预之前,必须再次强调预防的重要性。大量证据表明,无论是母亲在孕期还是孩子在生命早期使用抗生素,都会增加儿童患过敏性疾病的风险。
剂量效应: 一项研究发现,母亲孕期使用抗生素的剂量越大,孩子日后患过敏病的风险就越高。
菌群变化: 生命早期使用大环内酯类抗生素,会导致肠道菌群发生剧烈变化,表现为放线菌门数量锐减,而拟杆菌门和变形菌门的数量则会增加。这种菌群的偏移,与哮喘风险和高BMI直接相关。
▸益生菌与益生元
直接补充益生菌及益生元,是最直接的干预手段之一,并且已经展现出不错的效果。
-针对湿疹
一项研究测试了一种含有两歧双歧杆菌(Bifidobacterium bifidum)和短双歧杆菌(B. breve)的特殊婴儿配方。结果显示,使用该配方的湿疹儿童肠道中,短双歧杆菌的丰度显著增加,同时 与乙酸盐合成相关的代谢通路被激活,这与湿疹症状的缓解显著相关。
-预防湿疹
另一项类似的研究也证明,补充益生菌和低聚半乳糖能够丰富肠道中的乳酸杆菌和双歧杆菌,从而有效预防了湿疹的发生。
-针对过敏性鼻炎
在一项芬兰的研究中,研究人员给孕晚期的母亲和她们出生后6个月内的婴儿补充四种益生菌菌株和低聚半乳糖(GOS)。在后来患上鼻炎的孩子组中,这种干预显著提升了双歧杆菌的数量,并减少了拟杆菌的数量。
▸母乳喂养与运动:有争议
-母乳喂养
理论上,母乳是建立婴儿免疫耐受的核心。但关于母乳喂养与预防过敏之间的关系,证据却并不完全一致。一些研究报告了其保护作用,而另一些则认为延长母乳喂养并没有预防效果。这说明其中的机制可能比我们想象的更为复杂。
-体育锻炼
在菌群可塑性最强的童年期,运动也可能扮演着重要角色。有研究显示,3-6岁时体育活动水平低的孩子,在儿童后期患哮喘的风险更高。然而,一个关键的不足是,这些研究并未分析运动究竟是如何影响肠道菌群的。
▸饮食:塑造菌群的日常选择
饮食是影响肠道菌群最基础、也最持久的因素。
PASTURE的一项研究发现,1岁时粪便中丁酸盐和丙酸盐水平高的婴儿,未来患上哮喘和发生过敏性致敏的风险更低。而这些短链脂肪酸的水平,又与婴儿饮食中摄入的酸奶、鱼、水果、蔬菜显著相关。
另一个代谢组学研究则指出,富含油炸和加工肉类的饮食习惯,与哮喘风险以及肠道中克里斯滕森菌科(Christensenellaceae)细菌的增多呈正相关。

「哮喘」最新研究已逐步渗透到更精细层面28 赞同 · 3 评论 文章
IBD 和 IBS
面对由菌群失调驱动的炎症性肠病(IBD)和肠易激综合征(IBS),研究人员正在积极探索一系列干预措施,试图通过调控肠道菌群,来调节肠道内的紊乱。
▸抗生素与噬菌体
越来越多的证据将矛头指向了抗生素。
一项涵盖22项研究的系统性回顾发现,生命最初两年内使用抗生素,与日后患上IBD的风险存在强烈关联。
另一项荟萃分析也指出,母亲在孕期接触抗生素和烟草烟雾,都会增加后代患IBD的风险。
噬菌体疗法:作为抗生素的潜在替代方案,噬菌体疗法(利用病毒去攻击特定的有害细菌)已在人体中显示出良好的安全性。它或许能成为治疗儿童胃肠道疾病的一种新方法,但要真正应用于临床,还需要大量深入的研究。
▸压力
早期生活压力的破坏力:肠道不仅感受生理刺激,也感受心理压力。一项动物研究利用母婴分离模型来模拟早期生活压力,结果发现,这种压力能够诱导小鼠从童年到成年持续出现类似IBS的症状,其肠道菌群也发生了改变,表现为乳酸杆菌、肠杆菌属等有益菌的减少。
▸饮食:塑造肠道的终极力量
在所有干预手段中,饮食调整可能是最基础、也最有效的方法之一。
-需要警惕的饮食
研究表明,高脂肪饮食以及富含可发酵寡糖、双糖、单糖和多元醇(FODMAPs)的饮食,会加剧IBD和IBS的症状。而在一项大型研究(斯堪的纳维亚出生队列的汇总研究数据)中,1岁时大量摄入含糖饮料也与日后更高的IBD风险相关。
-值得推荐的饮食
富含多酚、矿物质和高纤维的饮食则被证实有助于缓解症状。同一项研究发现,1岁时鱼类和蔬菜摄入量高的孩子,未来患IBD的风险更低。
-草本的力量
一些草本植物也显示出潜力。例如,在一项针对103名IBS患儿的随机双盲试验中,服用洋车前子(一种富含纤维的草本)长达6周的儿童,其腹痛发作的次数显著少于服用安慰剂的儿童。
但有趣的是,尽管症状得到了改善,两组儿童的肠道菌群构成却没有观察到显著差异,这提示其作用机制可能不仅仅是通过改变菌群。
肥胖和糖尿病
通过干预和调控生命早期的肠道菌群,我们或许能找到重置儿童新陈代谢的关键,从而预防这些疾病的发生。
▸抗生素
来自母亲的影响:现在的人群数据已经给了比较一致的信号。比如有研究发现,妈妈在备孕阶段频繁使用某些抗生素(像青霉素、喹诺酮类),和孩子日后T1DM 风险上升是相关的。
宫内暴露的后果:胎儿在子宫内接触到抗生素(如青霉素),与宝宝出生后的生长迟缓相关。这种暴露会导致婴儿肠道菌群多样性降低,并引发一系列菌群结构的改变:厚壁菌门和乳杆菌目减少,而变形菌门和拟杆菌门等则相对增多。
▸母乳喂养的黄金标准
在生命最初的几个月里,母乳是主要的营养来源,塑造早期肠道微生物群,促进双歧杆菌主导的肠道,这一点和我们日常检测到的健康婴幼儿菌群特征也是一致的。
明确的保护作用:来自两个基于人群的队列的数据显示,非母乳喂养的婴儿,其日后患T1DM的风险翻了一倍。同时,一项涵盖25项研究的荟萃分析也明确指出,母乳喂养是预防儿童肥胖的显著保护因素。
然而,大多数此类研究未能建立起从“母乳喂养”到“特定菌群改变”再到“代谢改善”之间的完整证据链。
▸益生菌
针对T1DM:研究显示,在生命最初的27天内进行益生菌干预,与T1DM高风险儿童的自身免疫风险降低相关。
针对肥胖:母亲在孕期及产后补充特定的益生菌(如鼠李糖乳杆菌HN001),能有效降低婴儿在2岁时过度肥胖的风险,这提示“母亲补充,婴儿受益”的策略或许能预防儿童肥胖。
▸运动的悖论:明确的效果与未解之谜
在肥胖儿童中的效果:研究证实,在肥胖儿童中,体育锻炼能够降低血糖和促炎通路,同时改善菌群(降低γ-变形杆菌,增加罗斯氏菌属Roseburia等),并提升有益的短链脂肪酸水平。
然而,这些研究几乎都是在年龄较大、菌群已趋于成熟的儿童或青少年中进行的。体育锻炼对于菌群可塑性最强的婴幼儿时期会产生怎样的影响,亟待未来的研究来解答。
▸营养:从母亲到孩子的饮食智慧
-母亲饮食的深远影响
母亲在孕期的饮食可以直接影响其自身的菌群,这种状态又能通过传递来重塑婴儿的早期菌群,从而为孩子未来的代谢健康打下基础。
-植物化学物质
多酚:如葡萄多酚,在动物实验中被证明能促进有益的Akkermansia菌和乳酸杆菌的定植,增加短链脂肪酸的产生。
实验室的研究也表明,无论是来自西兰花的萝卜硫苷,还是来自大豆的染料木黄酮,在生命早期摄入,都能有效减少后代的过度肥胖,改善其整体代谢健康。
这些发现揭示了巨大的潜力,但下一步需要通过转化研究来验证这些营养成分在人类儿童身上是否同样有效,以及它们是如何通过影响肠道菌群来发挥作用的。

膳食纤维对代谢健康和肥胖的影响8 赞同 · 1 评论 文章
儿 童 神 经 发 育
一切始于源头,生命最初的经历深刻地影响着大脑的发育轨迹。
-母乳喂养的保护
一项研究表明,更长时间的纯母乳喂养能够降低儿童患ASD和ADHD的风险。
-需要警惕的风险因素
相反,母亲吸烟、压力大、母乳喂养时间过短(< 4个月)则与更高的ADHD风险显著相关。而孕期感染和母亲患有自身免疫性疾病,也与ASD的发生呈正相关。
-补偿剖腹产的损失
对于剖腹产导致菌群未能正常传递的问题,一种名为阴道菌群移植(VMT)的新技术显示出潜力。研究发现,接受了VMT的新生儿,其肠道菌群和代谢物状况更优(如乳酸杆菌、双歧杆菌增多,克雷伯氏菌减少),并且在6个月大时,其神经发育评分也显著更高。
▸益生菌
直接补充特定的益生菌,为预防神经精神障碍提供了新的思路。
一项长达13年的里程碑式的研究中,科学家们给75名婴儿在生命最初的6个月里补充了鼠李糖乳杆菌GG。结果发现,这一干预引发了长期的、有益的菌群变化。更令人震撼的是,追踪到13岁时,这些接受了益生菌干预的孩子,其患上ADHD的风险显著降低了。
真实世界研究显示,植物乳杆菌PS128 服用者在注意力、沟通技能上有显著改善,且副作用小。
▸体育锻炼
体育锻炼不仅强健身体,更能健脑。
研究证实,让患有ASD的幼儿在进行课堂活动前进行体育锻炼(尤其是有氧运动),能够显著改善他们的学业反应能力。
▸母亲的饮食习惯
母亲通过塑造自身的肠道菌群,能将其影响传递给下一代,深刻影响孩子的行为和大脑功能。
母亲菌群多样性重要:一项大型队列研究发现,母亲孕期肠道菌群的α-多样性越高,其孩子在2岁时表现出的行为问题就越少。
有益菌的传承:在行为正常的孩子组中,他们的母亲肠道中富含能产生丁酸盐的菌科(如毛螺菌科Lachnospiraceae、瘤胃球菌科)。
健康的孕期饮食,与更高的母亲菌群多样性和更少的儿童内化行为问题直接相关,这清晰地表明,母亲的饮食是支持婴儿早期大脑发育的关键一环。
▸营养
研究报告称,ω-3脂肪酸、维生素、锌、镁、植物化学物质可能在管理与自闭症和多动症相关的生态失调方面发挥有益作用。
基于微生物的可改变因素对儿童疾病发展的影响

儿童神经发育异常的脑肠轴视角 – 自闭症早期风险判别和干预新路径6 赞同 · 0 评论 文章

探索大脑健康的宝藏:神经营养素、肠道菌群与我们的思维宇宙8 赞同 · 0 评论 文章
甲状腺功能障碍
甲状腺,这个位于颈部的蝴蝶状腺体,是身体新陈代谢的总开关。而它的功能状态与远在腹部的肠道菌群息息相关,形成了一条“肠道-甲状腺轴”。
肠道菌群失调和肠道屏障通透性增加(肠漏),与自身免疫性甲状腺疾病的风险增加有关,这是导致儿童甲状腺功能亢进或减退的主要原因。
▸肠道 ⇌ 甲状腺
肠道对甲状腺的影响:肠道细菌能影响甲状腺合成激素所必需的矿物质(如碘、硒、锌)的吸收和利用。同时,它们也参与甲状腺激素的代谢和激活。甲状腺免疫也受肠道微生物及其代谢产物的调节,从而导致自身免疫性甲状腺疾病的发病机制。
肠道对甲状腺的影响
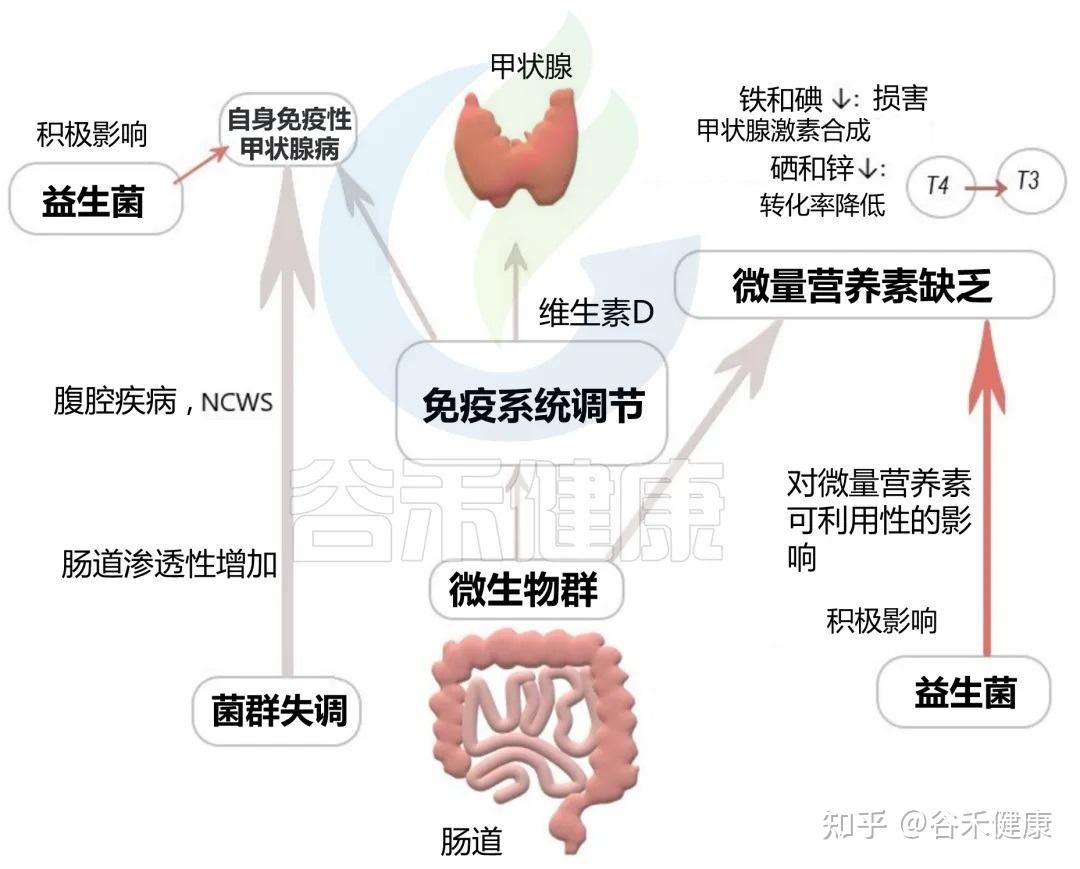
甲状腺对肠道的影响:甲状腺激素反过来也能影响胃肠道的蠕动,并可能直接调控肠道菌群的构成。
▸甲状腺相关疾病患者肠道菌群变化
在成人中:
甲亢患者的双歧杆菌和乳杆菌减少;
而桥本氏甲状腺炎患者则有Akkermansia菌和双歧杆菌的富集。
在儿童中,尤其是在菌群发育的关键窗口期,这方面的研究仍然非常稀少。
▸潜在的干预策略
研究提示,高纤维饮食、补充甲状腺相关的微量营养素、益生菌/益生元、体育锻炼甚至粪菌移植(FMT)都可能对保护甲状腺功能有益。相反,环境中的内分泌干扰物则是一个明确的风险因素。


慢性自身免疫性疾病——桥本甲状腺炎,改变认知和抓住关键16 赞同 · 1 评论 文章
性 早 熟
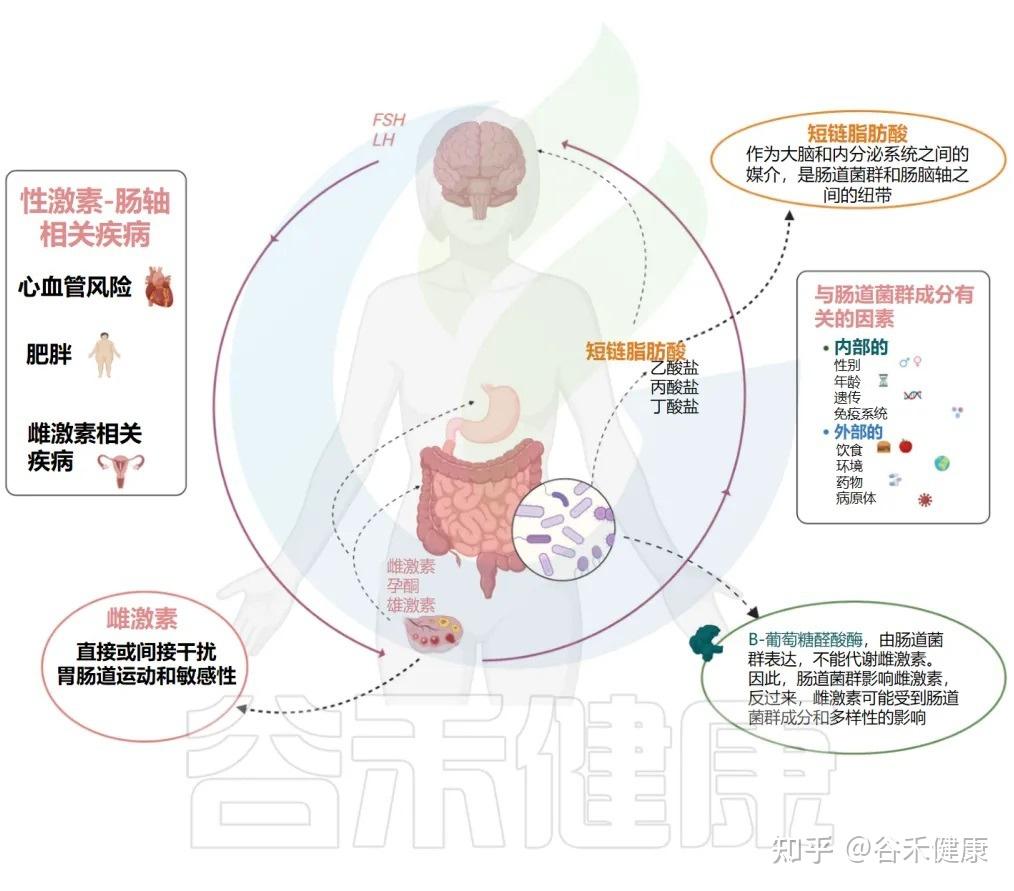
性早熟(PP),即第二性征过早出现,是儿童中一种日益普遍的内分泌紊乱,尤其在女孩中更为常见。最新的研究将目光投向了肠道菌群,认为它可能在“性激素-肠道菌群轴”上扮演了催化剂的角色。
▸菌群如何催熟?
影响雌激素代谢:某些肠道细菌,如瘤胃球菌属和拟杆菌属,能够通过产生β-葡萄糖醛酸酶来影响雌激素的代谢和循环,从而影响青春期的启动。
通过“肠-脑轴”通讯:菌群产生的短链脂肪酸(SCFAs)和神经递质,也能通过“肠-脑轴”向大脑发送信号,间接调控青春期的启动时机。
一项研究发现,与健康女孩相比,患有中枢性性早熟的女孩肠道中,多种特定细菌显著增加,如:
而这些细菌恰恰与肥胖、短链脂肪酸产生和雌激素代谢有关。
代谢组学分析进一步发现,这些女孩粪便中的代谢物发生了改变,与促进性腺激素分泌的通路(如类固醇生物合成)被激活有关。
性激素和肠道菌群之间的相互关系
▸干预与警示
有益的干预:动物实验表明,益生菌治疗可以逆转由早期压力或环境物质诱导的性早熟。在人类中,维生素D补充、复杂的碳水化合物和高蛋白饮食(如坚果、蔬菜、海鲜等)被认为可能对预防性早熟有益。
有害的暴露:生命早期接触内分泌干扰化学物质和环境污染物,会扰乱肠道菌群,从而增加性早熟的风险。
无论是甲状腺功能还是青春期的启动,这些看似与肠道无关的生命过程,都可能受到肠道菌群的深刻调控。这为我们理解和干预儿童内分泌疾病打开了一扇全新的大门。

性早熟和微生物群:性激素-肠道菌群轴的作用3 赞同 · 0 评论 文章
综上所述,我们看到许多儿童常见的健康问题,从反复过敏到体重管理,再到消化不适,似乎都与肠道这位“看不见的伙伴”——肠道菌群息息相关。生命早期是肠道菌群蓬勃发展并奠定基础的关键时期,它像一片微型森林,受到出生方式、母乳、饮食、环境等多种因素的影响。
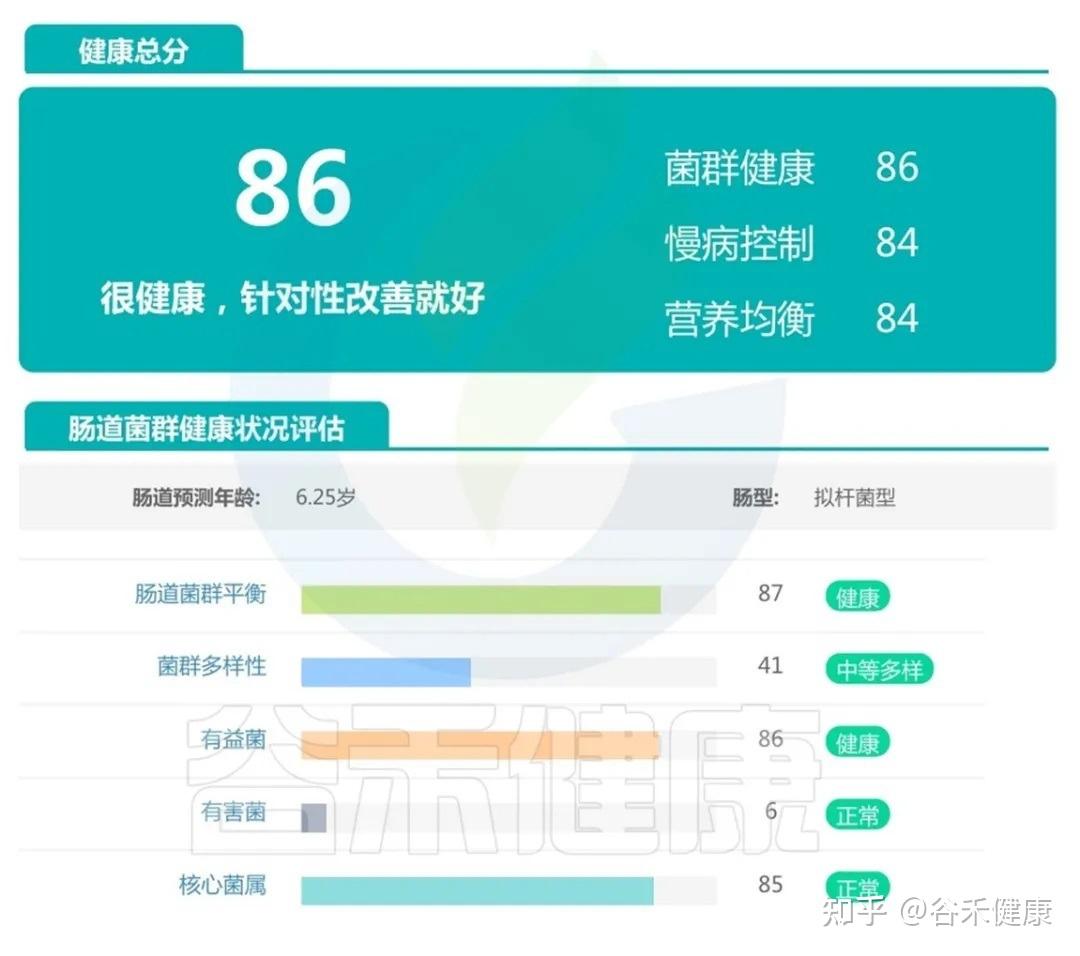
案例一:
肠道整体健康的宝宝,可以看到他的菌群健康、慢病控制、营养均衡三个维度都处在良好水平,有益菌充足、有害菌处于正常低水平,核心菌属完善。
案例二:
这个宝宝处于中等平衡状态,菌群健康指标较前一位儿童有所减弱,核心菌属开始出现缺乏,提示他可能已经携带了某些代谢问题的风险信号。
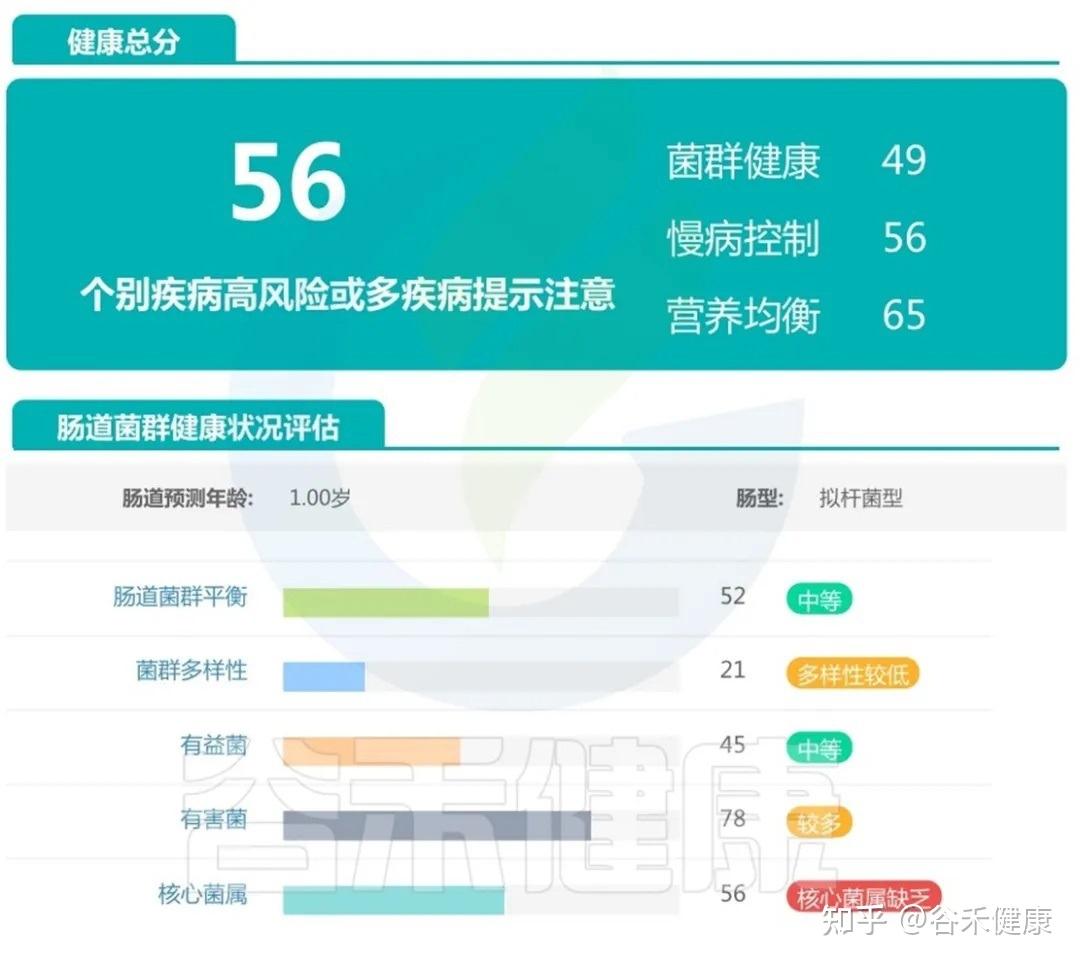
菌群多样性不足,有益菌占比下降,有害菌及产气相关菌群相对偏高。
这种菌群构成,容易让孩子陷入功能性消化不适的恶性循环:肠道动力紊乱、气体产生过多、肠腔内压波动增大,最终就表现为便秘与腹泻交替,夜间睡眠不安等问题。
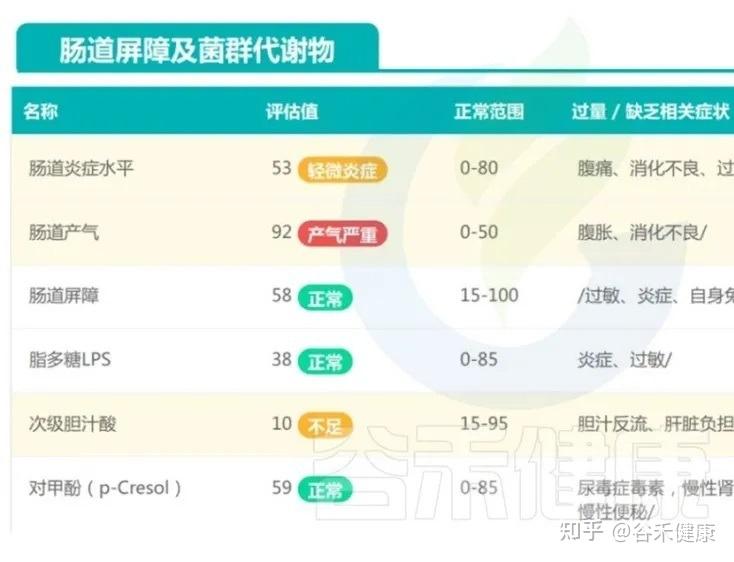
换句话说,这个孩子目前并不是存在明确器质性病变,更符合“肠道微生态已经出现早期失衡、但整体仍具有可逆性”的状态。
在这个阶段,如果能通过规范的饮食结构调整(例如逐步优化配方、增加优质膳食纤维、合理控制脂肪比例)、改善作息和生活方式,适当进行微生态干预(如针对性的益生菌/益生元支持),再配合后续的复查,就有较大机会把他的肠道环境拉回一个更平衡、更稳定的轨道。
案例三:
这个孩子目前看上去发育基本正常,仅社交能力稍不佳,从传统角度看,这样的孩子很容易被归为“现在没什么大问题”。但肠道菌群检测报告给出的信息却更加细腻:
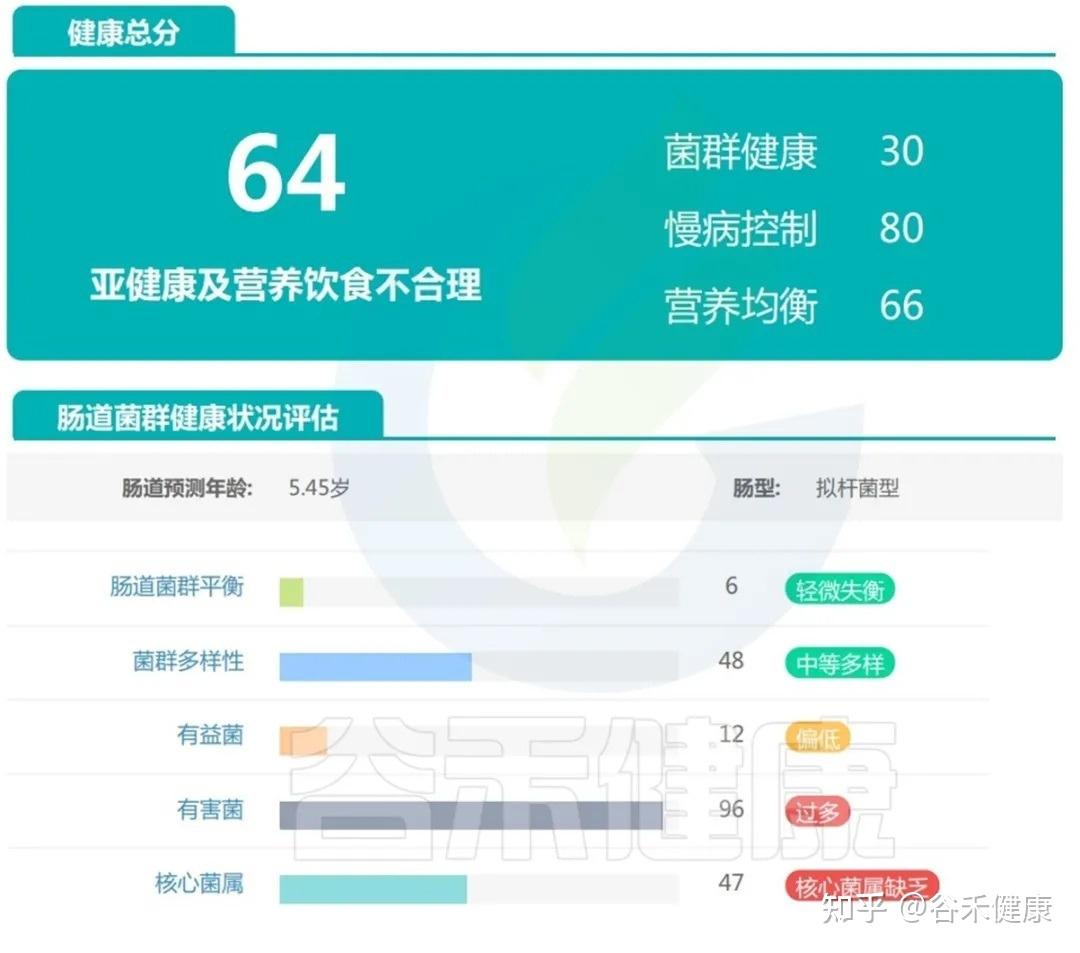
可以看到总体评分落在“轻微失衡”,已偏离理想健康状态。
有益菌丰度不足,有害菌比例偏高,核心菌属缺乏,这意味着肠道微生态的“稳定性”和“恢复力”都打了折扣。
结合该宝宝早期多次抗生素使用,很可能在肠道菌群发育的关键窗口期打断了原本的自然演化轨迹,走向一个“有益菌不足、有害菌偏多”的模式;这样的菌群背景,会让孩子在后续几年中更容易出现:反复上呼吸道感染、皮炎/湿疹、过敏性鼻炎等问题,这也与这与大量关于早期菌群失调和过敏性疾病风险上升的研究结果是吻合的。
同时,在肠–脑轴的影响下,肠道微生态的轻度失衡,过度增殖有害菌及超标代谢物(如对甲酚、硫化氢)会通过“肠脑轴”影响神经递质稳定性(如DOPAC升高提示多巴胺代谢素乱),影响孩子的情绪调节和社交意愿。
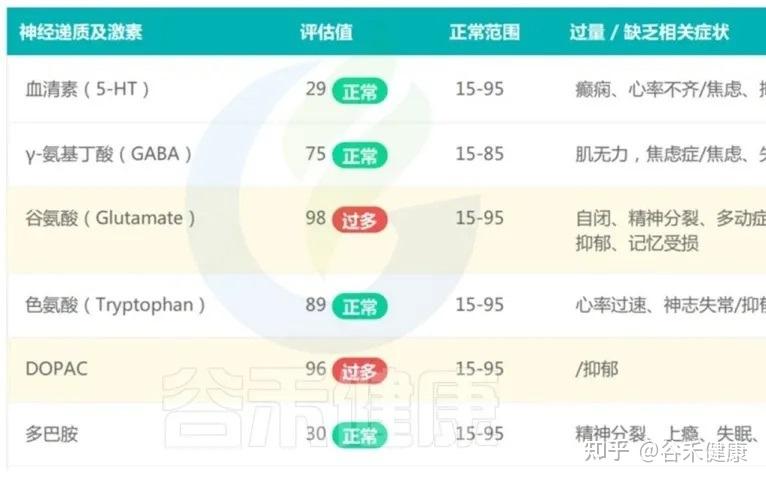
对于这种情况,肠道菌群检测不在于发现一个明确的器质性疾病,而是帮助家长在孩子看起来挺正常的当下,就开始有意识地保护和重建他的肠道微生态——包括减少不必要的抗生素使用、优化饮食结构、增加天然膳食纤维摄入、合理安排户外活动和环境暴露。

通过定期菌群监测,观察肠道菌群、有无新的过敏发作、呼吸道感染频次以及情绪和社交状态的变化,形成一个“早识别—早管理—可追踪”的长期支持路径。
因此,持续关注理解并监测儿童肠道菌群的发育与动态变化,不仅能帮助我们更全面地认识这些健康挑战,还能为未来的干预提供新的思路。通过科学的探索,我们期待能更好地守护儿童肠道微生态的健康成长,为他们一生的健康打下坚实而有力的根基。
主要参考文献
Bankole T, Li Y. The early-life gut microbiome in common pediatric diseases: roles and therapeutic implications. Front Nutr. 2025 May 29;12:1597206.
Shulhai AM, Rotondo R, Petraroli M, Patianna V, Predieri B, Iughetti L, Esposito S, Street ME. The Role of Nutrition on Thyroid Function. Nutrients. 2024 Jul 31;16(15):2496.
Yue M, Zhang L. Exploring the Mechanistic Interplay between Gut Microbiota and Precocious Puberty: A Narrative Review. Microorganisms. 2024 Feb 4;12(2):323.
Stokholm J, Blaser MJ, Thorsen J, Rasmussen MA, Waage J, Vinding RK, Schoos AM, Kunøe A, Fink NR, Chawes BL, Bønnelykke K, Brejnrod AD, Mortensen MS, Al-Soud WA, Sørensen SJ, Bisgaard H. Maturation of the gut microbiome and risk of asthma in childhood. Nat Commun. 2018 Jan 10;9(1):141.
Knezevic J, Starchl C, Tmava Berisha A, Amrein K. Thyroid-Gut-Axis: How Does the Microbiota Influence Thyroid Function? Nutrients. 2020 Jun 12;12(6):1769.
Ma T, Wu Z, Lin J, Shan C, Abasijiang A, Zhao J. Characterization of the oral and gut microbiome in children with obesity aged 3 to 5 years. Front Cell Infect Microbiol. 2023 Mar 29;13:1102650.
Tian X, Liu X, Wang Y, Liu Y, Ma J, Sun H, Li J, Tang X, Guo Z, Sun W, Zhang J, Song W. Urinary Metabolomic Study in a Healthy Children Population and Metabolic Biomarker Discovery of Attention-Deficit/Hyperactivity Disorder (ADHD). Front Psychiatry. 2022 May 20;13:819498.
Agrawal M, Sabino J, Frias-Gomes C, Hillenbrand CM, Soudant C, Axelrad JE, Shah SC, Ribeiro-Mourão F, Lambin T, Peter I, Colombel JF, Narula N, Torres J. Early life exposures and the risk of inflammatory bowel disease: Systematic review and meta-analyses. EClinicalMedicine. 2021 May 15;36:100884.

谷禾健康
宠物 营养 健康
在全球范围内,猫犬早已不再只是传统意义上的“宠物”,而成为许多家庭中重要的“毛孩子”。这种“宠物人性化”的趋势,极大地推动了宠物主人对爱猫爱犬健康的关注,促使他们寻求超越传统温饱的、更精细化、科学化的喂养方案。
如今,延长宠物寿命、提升健康福祉已成为宠物主人与兽医共同的目标。从过去仅满足基本能量与营养需求的狗粮,到如今注重护理、饮食与功能性食品的综合方案,宠物饲养理念正日益进步。
与人类相似,犬猫的健康同样受到饮食与肠道微生物组的深刻影响。肠道微生物组作为宿主体内重要的代谢与免疫调节中心,其稳态或失衡直接决定整体健康水平。
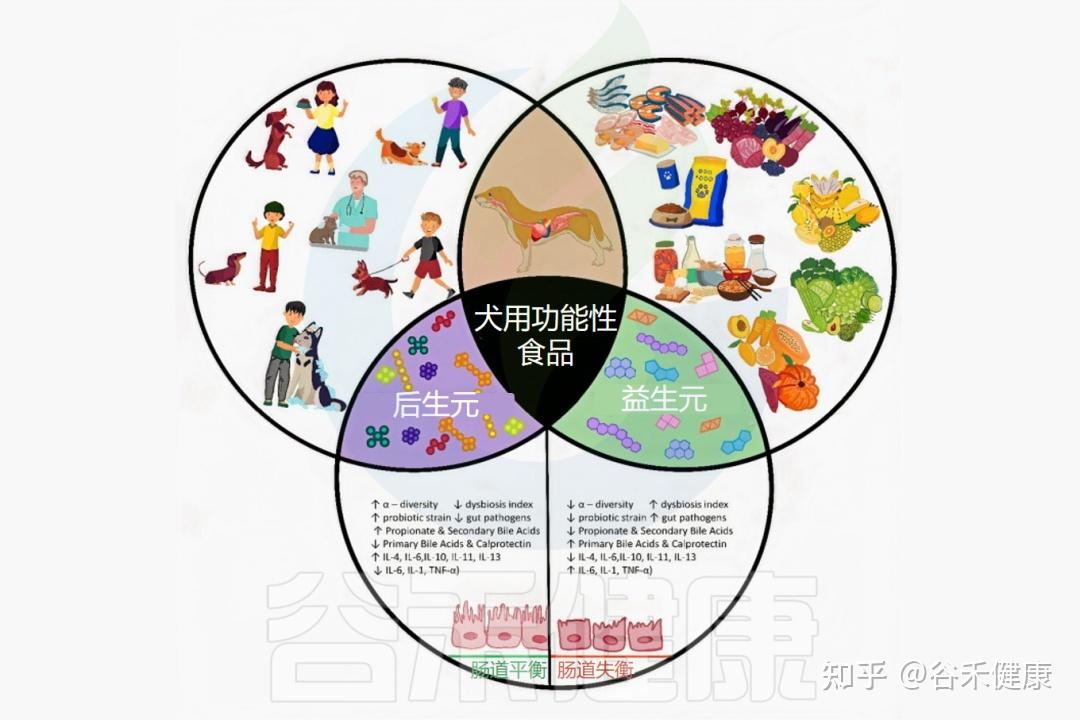
最近,宠物饮食中越来越多地引入功能性食品,以促进肠道微生物组的良性调节。这些食品包括益生菌、益生元、合生元、后生元,以及多不饱和脂肪酸和植物营养素等必需营养成分。
功能性食品虽非药物,却体现了“食疗同源”的理念,通过日常摄入实现主动健康干预。对犬类而言,这类食品可视作“第四餐”,在常规日粮之外帮助优化生理机能、增强免疫力、延缓衰老,并辅助疾病管理。

本文结合多篇核心研究,探讨了功能性营养干预在调节犬猫肠道微生物组及其在营养代谢、免疫成熟、神经行为调控等方面的作用,同时分析了肠道生态失调作为多种疾病(包括胃肠道、皮肤、代谢及神经系统疾病)共同病理基础的分子机制。
在此基础上,系统总结了各类功能性营养成分的关键特性:益生菌的菌株特异性免疫调节;益生元对特定菌群的选择性促进及短链脂肪酸(SCFAs)的生成;合生元的协同增效作用;后生元的创新应用潜力;多不饱和脂肪酸(PUFAs)尤其是EPA和DHA在炎症调控中的核心角色;以及植物营养素的多靶点抗氧化与抗炎效应等。

狗和猫与人类相伴已经超过一万年,作为伴侣动物,它们在人类社会中扮演着非常重要的角色。最近的一份报告估计,全球大约已经有4.77亿只狗和3.77亿只猫被当作宠物饲养。
★ 宠物有助于人身心健康
除了作为人类的伙伴,宠物还有助于个人身心的整体健康。根据一些证据,养宠物有助于减压、缓解抑郁、降低血压、预防心脏病,并提升自尊与幸福感。此外,哮喘、过敏和肥胖等疾病的发生风险也可能随之降低。
并且随着社会经济的发展与人文关怀的提升,犬猫在家庭中的地位发生了根本转变——它们被视为家庭成员,其健康与福祉备受关注。
这种“宠物人性化”趋势推动了宠物健康管理理念的革新。现代兽医学已从单纯的疾病治疗转向以预防、维护健康和提升生命质量为核心的主动健康管理,目标在于实现“健康老龄化”和延长健康寿命。
★ 肠道微生物组:一个多功能“超级器官”
在这一过程中,功能性营养学作为一种非侵入性、可持续的干预手段,其科学与临床价值日益凸显。功能性食品或营养品,是指除提供基础营养外,经科学验证能改善特定生理功能或降低疾病风险的食品或活性成分。其作用机制虽多样,但越来越多的研究表明,关键靶点在于寄居于宿主肠道内的复杂微生物生态系统——肠道微生物组。
作为身体的“隐形器官”,肠道微生物组深刻影响犬猫的营养吸收、免疫防御、新陈代谢及情绪行为。其平衡是健康的基石,而失调则被认为是多种犬猫常见疾病的关键驱动因素。
从急性腹泻、慢性肠病,到特应性皮炎、肥胖、糖尿病、骨关节炎及认知功能障碍,几乎都与菌群失衡密切相关。因此,通过精准营养干预调节肠道微生物组、恢复生态稳定,已成为现代兽医营养学中最具潜力的研究与应用方向之一。
1
营养代谢中心:发酵、合成与转化
犬猫的消化系统无法完全分解复杂碳水化合物,尤其是膳食纤维。这一过程主要由结肠中的厌氧菌群完成,它们通过发酵将纤维转化为短链脂肪酸(SCFAs),为宿主提供关键代谢产物。
• 产生丁酸盐:结肠上皮的重要能量,抗炎物质
丁酸盐(Butyrate)主要由厚壁菌门中的Clostridium簇IV和XIVa(如Faecalibacterium、Roseburia)合成,是结肠上皮细胞超70%的能量来源。
它还可以抑制组蛋白去乙酰化酶(HDACs),发挥抗炎和抗肿瘤作用,并上调紧密连接蛋白(Occludin、Claudin-1、ZO-1)表达,强化肠道屏障。
• 产生丙酸盐:调节脂质合成,影响血糖
丙酸盐(Propionate)主要由拟杆菌门产生,被吸收至肝脏后可抑制糖异生、调节脂质合成,从而改善血糖稳态与胰岛素敏感性。
• 产生乙酸盐:含量最高的短链脂肪酸
乙酸盐(Acetate)是含量最高的SCFA,可由多种菌群生成,既为外周组织供能,也是产丁酸菌合成丁酸的重要前体。
• 代谢胆汁酸,合成一些必需维生素
此外,肠道菌群还负责代谢胆汁酸,将肝脏合成的初级胆汁酸转化为次级胆汁酸(如脱氧胆酸LCA和石胆酸DCA)。这些次级胆汁酸作为信号分子,通过激活法尼醇X受体(FXR)和G蛋白偶联胆汁酸受体1(TGR5),调控宿主的脂质、葡萄糖代谢及炎症反应。
同时,菌群还能合成犬猫必需的维生素K、多种B族维生素(生物素、叶酸、核黄素)及氨基酸等,维持营养与代谢平衡。
2
免疫系统的“首席教官”
肠道相关淋巴组织(GALT)是机体最大的免疫器官,而肠道菌群在免疫系统的发育、成熟和调控中发挥着关键作用。
• 诱导免疫耐受
在新生期,肠道菌群的定植是建立口服耐受的关键,帮助免疫系统对食物抗原和共生菌保持耐受,从而预防过敏和自身免疫疾病。
• 塑造黏膜免疫
菌群及其代谢产物(尤其是短链脂肪酸)可刺激上皮细胞和浆细胞分泌大量sIgA,后者能中和毒素并阻止病原体附着,是黏膜免疫的第一道防线。
• 调节T细胞分化
菌群组成深刻影响辅助性T细胞(Th)亚群平衡。分段丝状菌(SFB)促进促炎性Th17细胞分化,提高对胞外菌的防御力;而产丁酸梭菌则诱导调节性T细胞(Treg)分化,Treg通过分泌IL-10与TGF-β抑制过度免疫反应,维持免疫稳态。肠道菌群失衡常伴随Treg/Th17比例紊乱,导致免疫异常。
3
“肠-脑轴”的核心信使
肠道与大脑之间通过“肠-脑轴”形成复杂的双向通讯网络,而肠道菌群是其中的核心信号调节者。
• 神经递质的合成与调控
肠道菌群可直接生成多种神经递质,如GABA、去甲肾上腺素和多巴胺,或通过代谢膳食前体物质(如色氨酸)影响中枢血清素水平。菌群代谢产物(如丁酸)还能调节肠嗜铬细胞产生血清素,占全身总量的90%以上。
• 迷走神经通路
菌群代谢物可促使肠上皮细胞释放信号分子,这些信号经迷走神经传递至大脑,进而影响情绪与行为。
• 调节HPA轴
肠道菌群稳态对下丘脑-垂体-肾上腺(HPA)轴的发育与应激反应至关重要。无菌动物常表现出过度应激反应,而补充特定益生菌可恢复其正常。研究还发现,具有攻击性或恐惧行为的犬只,其肠道菌群结构与健康犬存在显著差异。
功能性食品在犬猫营养中具有重要意义,它不仅提供基础能量与必需营养素,还能通过特定的生理活性成分,支持机体健康、延缓衰老并预防疾病。
近年来,越来越多研究证实,富含抗氧化剂、ω-3脂肪酸、植物营养素、益生元及功能性蛋白的配方,可改善犬猫的免疫功能、皮肤与毛发状况、肠道健康及认知能力。
1
功能性食品与犬类健康
多项研究探讨了功能性食品在犬中的作用,相关结果见下表。


• 低聚果糖等益生元改善整体健康
例如,成年雄性比格犬摄入富含低聚果糖(FOS)的饲粮后,粪便中氨及梭菌浓度降低,而需氧菌含量上升,改善整体健康。
以肉类为主的犬粮中,单独或联合添加FOS和甘露寡糖(MOS),可提高回肠免疫球蛋白A水平,降低粪便中吲哚和酚含量。
测试了一种含多种成分的维持性饲粮(包括多种植物提取物及抗氧化剂)对12只成年犬的影响。6个月后,犬只氧化应激显著下降,活性氧代谢物减少,而视黄醇及血浆抗氧化力(BAP)升高,提示氧化平衡得以恢复,说明均衡饮食对维持犬的抗氧化状态至关重要。相反,摄入高血糖指数食物后可能导致氧化失衡。
注:进一步研究表明,在测试4种复杂碳水化合物(大麦、玉米、豌豆、大米)及葡萄糖后,豌豆的血糖指数最低(29%),大麦和大米较高(分别为51%和55%),支持它们被纳入平衡膳食。
• 富含抗氧化剂的食物有助于提升代谢和繁殖能力
有研究评估了一种富含抗氧化剂和功能性成分的配方(含水解蛋白、维生素、酵母提取物和植物提取物)对不同年龄雄犬繁殖力的影响。
实验持续4个月,结果显示,在45天内犬的游离甲状腺素和睾酮水平升高,代谢和生育能力改善,特别是2–7岁组的精子活力显著提高,表明富含抗氧化剂的饮食可增强生殖表现与内分泌功能。
• 含抗氧化剂与植物化合物改善认知衰老和行为障碍
此外,犬类模型还用于研究认知衰老、脑源性神经营养因子(BDNF)及饮食之间的关系。研究发现,给予含抗氧化剂与植物化合物(如鱼油、甜菜浆、木瓜、石榴、芦荟、葡萄及迷迭香等)的日粮,可显著提高脑源性神经营养因子(BDNF)水平,降低氧化应激,并改善神经内分泌平衡。
另一系列实验显示,富含功能性植物提取物及色氨酸的饮食能减轻犬的行为障碍,改善相关临床症状。
综上所述,功能性食品通过抗氧化、抗炎及神经保护等多重机制,不仅能优化犬的代谢与免疫状态,还可能成为支持认知健康和行为管理的有效营养干预手段。
• 功能性饮食还有助于改善狗的口臭、皮肤健康
口臭是一种常见于犬及人类的疾病,影响彼此关系。一项双盲、安慰剂对照交叉研究评估了专用功能性饮食对16只不同品种和年龄犬慢性口臭的改善作用。
注:该饮食含米饭、鱼粉、植物脂肪、鱼油、甜菜浆、矿物质、脱水酵母、低聚果糖、丝兰提取物、溶菌酶、生物类黄酮、胸腺提取物与黑肋骨等成分。
经气相色谱测定,犬只口腔中关键挥发性硫化物(甲基硫醇、硫化氢、二甲硫化物)在30天内显著下降,且停用饮食20天后仍维持改善,显示其持久疗效。
有研究进一步发现,一种含水解蛋白、植物提取物(包括茶树、百里香、大蒜、玫瑰果)及矿物质的功能性饮食,可显著缓解犬慢性外耳炎症状,减少药物使用需求。15只患犬接受该饮食与局部药物治疗(前7天使用抗炎滴耳剂OTOMAX,后83天仅靠饮食干预),90天后耳道阻塞、红斑、分泌物与异味均明显减轻,体现出其抗炎与抗氧化双重功效,为抗生素替代方案提供了潜在方向。
此外,研究了免疫调节饮食(IMMD)在犬利什曼病(CL)治疗中的辅助作用。与标准饮食(SD)组相比,IMMD组犬在3、6、12个月内均恢复了因CL降低的调节性T细胞水平,并在后期阶段呈现T辅助细胞数量正常化,表明该饮食可在药物治疗期间调节免疫反应。
另一项研究证实,IMMD还能有效减轻犬角膜结膜炎的典型症状,包括泪液减少、结膜炎症、角膜角化与色素沉积过多等。
综上所述,针对犬的功能性饮食还能在口腔健康、皮肤炎症及免疫调节等方面发挥作用,为临床营养干预提供了有益证据。
2
功能性食品与猫类健康
与犬相比,猫为严格食肉动物,具有独特的营养需求。多项研究已探讨功能性食品在猫营养与健康中的作用(见下表)。
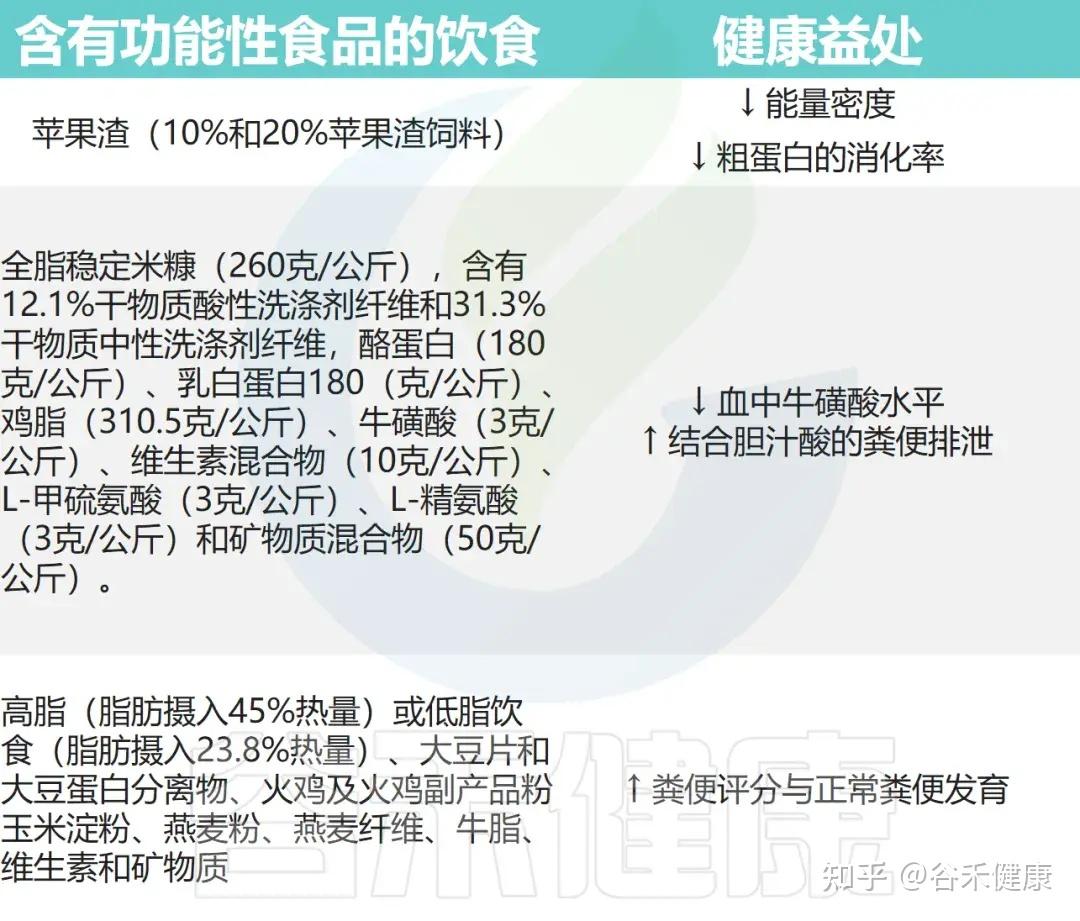
• 功能性食品改善了猫咪的腹泻
一项针对55只患慢性腹泻猫的随机、双盲、对照试验评估了高脂(23%)和低脂(10%)高消化性饮食的效果。该饮食由大豆片、大豆蛋白分离物、火鸡粉、玉米淀粉、燕麦粉、燕麦纤维、牛脂及维生素矿物质组成。结果显示,所有猫在第一周内粪便评分(FSa)均显著提高,3周后达到最佳改善,其中约三分之一的猫恢复正常排便。
• 含有纤维的饮食可能有助于猫咪减肥
苹果渣,即酿造苹果酒的剩余部分,可能是猫咪减肥饮食中的功能性食物。九只成年、绝育、肥胖的猫咪被喂食以肉类为主的饮食,并添加了不同程度的苹果渣。苹果渣分别用10%和20%,并未降低可口性,但确实降低了食物的能量密度。
因此,在肥胖猫的饮食中以有限的比例加入可入口纤维成分,是降低食物能量含量并维持生理食物摄入水平的好方法。
• 一些猫粮应适当提高牛磺酸含量
另一项研究显示,在纯化猫粮中添加26%全脂米糠后,猫的全血牛磺酸浓度显著低于含26%玉米淀粉的对照组。
这种降低与粪便中结合胆酸排泄增加及米糠中不可消化蛋白引发的后肠菌群变化有关,后者可导致牛磺酸降解。为避免缺乏,含米糠配方的猫粮应适当提高牛磺酸含量。
如前所述,调控肠道微生物组以维持或恢复生态平衡,是犬猫功能性食品的核心策略之一。根据作用机制与来源,目前应用最广的功能性成分主要包括:益生菌、益生元、合生元、后生元、多不饱和脂肪酸和植物营养素。它们各具优势,相互协同,共同守护宠物健康。
1
益生菌:直接补充“有益菌群
• 益生菌对狗的益处
研究表明,并非所有益生菌都适用于犬类。理想的菌株应具备宿主特异性,通常来源于犬只自身,以更好地适应其肠道环境。常见犬用益生菌包括:
乳杆菌属(Lactobacillus):
如嗜酸乳杆菌(L.acidophilus);
约氏乳杆菌(L.johnsonii);
发酵乳杆菌(L.fermentum);
鼠李糖乳杆菌(L.rhamnosus)。
双歧杆菌属(Bifidobacterium):如动物双歧杆菌(B.animalis)。
肠球菌属(Enterococcus):如屎肠球菌(E.faecium)的特定菌株(如SF68)。
注:但该属的使用需谨慎,因其部分菌株可能携带抗生素抗性基因。
多项研究表明,补充益生菌(如E. faecium SF68、B. animalis AHC7)可有效缩短犬急性腹泻的持续时间并改善粪便稠度。在慢性肠病(CE)中,它们可作为辅助疗法,帮助恢复菌群平衡、减轻炎症。
不同菌株的免疫作用各异。Lactobacillus casei 可诱导Th1型免疫反应(分泌IFN-γ),而Lactobacillus rhamnosus GG 更倾向促进Treg细胞分化。这种差异与细胞壁中不同的微生物相关分子模式(MAMPs)如肽聚糖、脂磷壁酸等有关。
多菌株组合制剂(如VSL#3)基于“菌种协同”理念。在犬炎症性肠病(IBD)研究中,使用VSL#3显著改善临床症状,降低肠道黏膜炎症评分,并增强Treg关键转录因子FoxP3的表达,证明其免疫调节作用。
• 益生菌对猫的益处
研究显示,健康成猫补充L.acidophilus DSM13241的膳食剂后,粪便中乳杆菌和嗜酸乳杆菌数量增加,而粪肠球菌和梭菌减少。
补充L.acidophilus CECT 4529能改善粪便质量。由S. boulardii和Pediococcus acidilactici组成的复合益生菌可提高粪便中丁酸和总短链脂肪酸含量,降低炎症标志物(髓过氧化物酶、钙卫蛋白)水平,并增强抗氧化酶活性(超氧化物歧化酶、谷胱甘肽)。
此外,口服地衣芽孢杆菌发酵产物可缓解腹泻,增加梭菌簇XIVa成员并减少慢性腹泻猫中C.perfringens数量。含八株乳酸菌的复合制剂可改善慢性便秘和特发性巨结肠猫的症状,并增加粪便中乳酸杆菌和链球菌。肠球菌E. faecium SF68在收容所猫中可显著降低腹泻率;另一粪源E. faecium菌株则改善肠道健康。
多种源自健康猫的菌株,如B.adolescentis、L.acidophilus、L.plantarum和L.rhamnosus,表现出对病原菌的益生活性和抗菌潜力。
• 益生菌的应用:
抗生素相关性腹泻:在犬只必须使用抗生素治疗时,同时或之后补充益生菌,有助于减少抗生素对肠道菌群的破坏,预防腹泻等副作用。
免疫调节:研究发现,给健康的犬只补充益生菌可以提高其免疫细胞(如白细胞)的吞噬活性,增强对病原体的防御能力。
压力引起的消化问题:对于寄养、旅行、更换环境等应激情况,提前补充益生菌有助于稳定肠道菌群,预防应激性腹泻。
!
注意事项
不同益生菌菌株的免疫效应存在差异。选择时,应优先考虑针对犬或猫、有随机对照临床试验(RCT)支持并经同行评审的特定产品,同时关注其活菌数量(CFU)及保质期内的稳定性。
2
益生元:为有益菌提供“超级口粮”
益生元是“可被宿主肠道微生物选择性利用、并对宿主健康产生益处的底物”,通俗地说,就是肠道有益菌喜爱的“食物”,可促进其生长和繁殖。
• 常见的益生元
低聚果糖(FOS):存在于菊苣、洋葱、香蕉等植物中。
菊粉(Inulin):FOS的一种长链形式,主要来源是菊苣根。
低聚果糖(FOS)和菊粉主要被双歧杆菌高效利用,因此被称为“双歧因子”。研究表明,在犬猫日粮中添加1–2%的FOS或菊粉,可显著提高粪便中双歧杆菌丰度,同时降低粪便pH值和氨含量。
甘露寡糖(MOS):通常提取自酵母细胞壁。甘露寡糖除具益生元作用外,还能吸附并清除部分病原菌,特别适用于幼年动物及预防应激性腹泻。MOS能与带I型菌毛的革兰氏阴性菌(如沙门氏菌、大肠杆菌)结合,而不影响有益菌。
注:不同类型和剂量的益生元会影响短链脂肪酸(SCFAs)的产量和构成,例如抗性淀粉更易生成丁酸,而果胶则倾向于产生乙酸和丙酸。
• 益生元的应用:
改善粪便质量:补充低聚果糖、菊粉等益生元能显著改善犬的粪便稠度,减少腹泻和便秘。
调节菌群结构:研究一致表明,饲喂益生元能显著提高犬粪便中双歧杆菌和乳杆菌的数量,同时降低梭菌等潜在有害菌的比例。
增强免疫:通过增加短链脂肪酸的产量,益生元能间接调节免疫系统,减轻炎症。有研究显示,给怀孕母犬补充FOS,能提高其初乳中的免疫球蛋白水平,从而使幼犬获得更好的被动免疫。
代谢健康:在超重犬的研究中,补充益生元有助于改善葡萄糖代谢和胰岛素敏感性。
3
合生元、后生元:下一代微生态调节剂
合生元是益生菌与益生元的复合产品,旨在通过益生元为益生菌提供特定营养来源,提高其在肠道内的存活率与定植效率,从而实现协同增效。
后生元则代表微生态干预的进阶方向,将关注点从“活菌”转向其“功能分子”,包括灭活菌体(如热灭活的Lactobacillus acidophilus)、细胞组分(如细胞壁碎片、胞外多糖)及发酵代谢产物(如短链脂肪酸、有机酸、酶和细菌素)。
系统综述与荟萃分析显示,健康犬的短链脂肪酸(SCFA)水平普遍高于患病犬(如IBD个体),说明SCFAs可作为反映健康状态的功能性标志物。其他研究同样发现,慢性肠病犬的粪便SCFA含量下降。
而肽聚糖(PTDG)和磷壁酸(TEIA)是细胞壁的重要组成成分,具有显著的免疫调节作用。TEIA分为脂质型(LTEIA)和壁连型(WTEIA):前者通过糖鞘脂附着在细菌膜上,后者与肽聚糖链形成共价键。乳酸杆菌属的肽聚糖可抑制炎症性细胞因子的释放,其中来自L. rhamnosus的PTDG能增强感染致病链球菌小鼠的先天免疫反应。LTEIA还能通过诱导防御素和猫地霉素的产生,有效治疗皮肤感染并预防细菌及病毒感染。
• 合生元、后生元的应用:
合生元在应对复杂肠道疾病方面展现出显著潜力。研究表明,在犬慢性肠病中,含多种益生菌菌株与益生元(FOS)的合生元产品能迅速缓解腹泻、呕吐等症状,改善肠道组织的炎症评分,并通过上调紧密连接蛋白表达修复受损肠道屏障。
另一项针对顽固性慢性结肠炎犬的研究显示,富含MOS与FOS的高纤维处方粮结合多菌株益生菌混合物,可在约8.5天内显著缓解症状并恢复肠道菌群平衡。
后生元的优势在于其高安全性与稳定性,适合用于免疫低下或危重动物。临床上,可直接补充丁酸钠或丁酸钙以促进急性肠炎和炎症性肠病犬的肠道修复,或利用特定发酵产物实现靶向免疫调节。
4
多不饱和脂肪酸:抗炎与细胞结构的关键
多不饱和脂肪酸(PUFAs)是分子中含有多个双键的脂肪酸。其中,Omega-3(ω-3)和Omega-6(ω-6)两大系列是犬只自身无法合成,必须从食物中获取的必需脂肪酸。
• 主要类型与来源
①ω-6脂肪酸:
亚油酸(LA):广泛存在于玉米油、葵花籽油等植物油中,是维持皮肤和毛发健康的关键营养素。
花生四烯酸(AA):可由犬体内的亚油酸转化而来。
②ω-3脂肪酸:
α-亚麻酸(ALA):来源于亚麻籽油、奇亚籽等植物,但犬体内转化为长链ω-3的效率低。
二十碳五烯酸(EPA)与二十二碳六烯酸(DHA):主要来自鱼油(如三文鱼、沙丁鱼)、磷虾油及海藻,是发挥主要生理作用的活性ω-3。
• 作用机制
抗炎调节:ω-6与ω-3是类花生酸的前体——前者(AA)产生的分子多促炎,后者(EPA)则具抗炎或弱促炎作用。通过提高饮食中ω-3比例(降低ω-6:ω-3比值),可改变细胞膜脂肪酸构成,促进抗炎介质生成,减少过度炎症反应。
炎症消退机制:EPA和DHA还能生成消退素、保护素与脂氧素等“促炎症消退介质”,它们通过抑制中性粒细胞浸润、促进巨噬细胞清除凋亡细胞,加速组织从炎症向修复转变。
结构与功能作用:DHA是脑和视网膜的重要组成成分,对幼犬神经及视觉发育至关重要,也有助于维持老年犬的认知功能。
其他生理效应:可改善血脂、增强心血管功能并调节免疫反应。
• 多不饱和脂肪酸的应用:
骨关节炎(OA):富含EPA+DHA(干物质基础>2.5%或50–100 mg/kg/日鱼油补充)的饮食可显著减轻狗的关节疼痛和跛行,提升活动能力,机制与其抗炎作用相关。
皮肤健康与过敏:提高ω-3摄入可缓解特应性皮炎的炎症、瘙痒与红肿。
心血管健康:ω-3补充可改善犬的心肌功能,降低心律失常风险。
认知与发育:DHA促进幼犬大脑发育,并有助于延缓老年犬的认知衰退,改善学习与记忆。
肾脏健康:ω-3的抗炎特性可能有助于减缓慢性肾病进展。
5
植物营养素:来自大自然的“抗氧化卫士”
植物营养素是植物中具有生物活性的天然化合物,虽非传统维生素或矿物质,但具显著的抗氧化和抗炎作用。
• 主要类别与来源
①多酚类:
类黄酮:如槲皮素(苹果、洋葱)、儿茶素(绿茶)、花青素(蓝莓、蔓越莓)。
其他多酚:如白藜芦醇(葡萄皮)、姜黄素(姜黄)。
②类胡萝卜素:
类胡萝卜素是脂溶性色素,存在于红色、橙色和黄色的蔬菜和水果中。常见于犬类和人类膳食补充剂及食品中的类胡萝卜素有:α-和β-胡萝卜素、番茄红素、玉米黄素、隐黄素和叶黄素。
例如如β-胡萝卜素(胡萝卜)、番茄红素(西红柿)、叶黄素(菠菜)。
③植物甾醇
植物甾醇存在于油、蔬菜、水果、坚果、种子和豆类中。植物甾醇在降低高脂血症犬只的高血浆三酸甘油酯和胆固醇水平中起着重要作用。
这其中尤为重要的两个:
姜黄素(Curcumin)其抗炎机制不仅限于抑制NF-κB,还包括抑制COX-2、LOX、诱导型一氧化氮合酶(iNOS)等多种炎症相关酶的活性和表达。其主要限制在于口服生物利用度低。现代制剂通过将其与磷脂结合(形成植物体)、使用纳米颗粒或与胡椒碱(能抑制其在肝脏的快速代谢)联用,同时调节肠道菌群来提高其吸收率。
白藜芦醇(Resveratrol):作为一种SIRT1激动剂,它能模拟热量限制带来的部分健康效应,如改善线粒体功能、提高胰岛素敏感性、减轻氧化应激。在犬模型中,白藜芦醇显示出心脏保护作用。
注:抗氧化剂“鸡尾酒”疗法:在犬认知功能障碍(CCD)的研究中,单独使用某一种抗氧化剂(如维生素E)的效果往往有限。而将多种抗氧化剂(维生素E, C, L-肉碱, α-硫辛酸)与富含多种植物营养素(来自菠菜、番茄、葡萄、胡萝卜、柑橘)的饮食相结合,则显示出强大的协同效应。这可能是因为不同抗氧化剂在细胞的不同区室(水溶性/脂溶性)起作用,并能相互再生,形成一个抗氧化网络。
• 作用机制
抗氧化:机体在新陈代谢过程中会产生自由基,过多的自由基会攻击细胞,导致氧化损伤,这是衰老和多种慢性疾病的根源。植物营养素能直接中和自由基,或激活机体自身的抗氧化酶系统,从而保护细胞免受损伤。
抗炎:许多植物营养素能抑制关键的炎症通路(如NF-κB),减少促炎细胞因子的产生。
其他:抗癌、调节免疫、保护心血管等。
• 植物营养素的应用:
认知功能与抗衰老:一项针对老年比格犬的著名研究发现,饲喂富含多种抗氧化剂(包括来自菠菜、番茄、葡萄的多酚)的食物,并结合行为丰富化训练,能显著改善犬只的学习和记忆能力,延缓认知衰退。蓝莓和葡萄提取物也被证明能改善老年犬的认知表现。
骨关节炎:姜黄素、鳄梨豆非皂化物(ASU)等被研究用于辅助治疗犬OA,它们通过抗炎和抗氧化作用减轻关节疼痛和炎症。
癌症:一些植物营养素在体外实验中显示出抑制犬肿瘤细胞(如骨肉瘤细胞)生长的能力,如番茄红素、黄芩素等。但这方面的体内研究仍需加强。
心血管保护:葡萄籽提取物、槲皮素等在犬模型中显示出保护血管、抗血小板聚集的作用。
编者小结
以上五类功能性成分从不同的作用途径出发,以各自独特的机制在细胞、组织及系统层面协同发挥效应,共同促进并维持犬猫的整体健康与生理平衡,帮助其保持良好的生命状态和长期活力。
要将上述功能性成分有效地整合到临床实践中,需要充分考虑不同疾病的病理生理学特征,并依据现有的循证研究结果进行科学应用。同时,应结合个体差异和具体健康状况,选择合适的配方与干预方式,以确保营养策略在临床实施中的安全性与有效性。
1
慢性肠病(CE)/炎症性肠病(IBD)
饮食试验:采用水解蛋白或新型蛋白饮食进行6–8周的严格试验,是诊断和治疗食物反应性肠病(FRE)的金标准。
微生态干预:对于确诊的炎症性肠病(IBD)或抗生素反应性肠病(ARE),在饮食管理基础上应联合使用经验证的多菌株、高剂量益生菌或合生元,以恢复肠道菌群平衡并调节免疫反应,从而抑制异常炎症。
抗炎支持:在饲粮中补充富含EPA的鱼油(50–100 mg/kg/天)可有效辅助抗炎治疗。
纤维调整:依据病情(如结肠炎或小肠性腹泻)适当调整可溶性与不可溶性纤维比例,其中低聚果糖、菊粉等益生元纤维为首选。
2
糖尿病与胰岛素敏感性
糖尿病(DM)在犬类中越来越常见,通常是1型糖尿病。自发性1型DM的犬只存在严重的胃肠道菌群失调和粪便中未结合胆汁酸水平的改变。此外,治疗DM的药物也会影响胃肠道微生物群。
个性化微生物治疗:益生菌在糖尿病治疗中具有潜力,可通过减少自身免疫反应、炎症及氧化应激来提高胰岛素敏感性,同时增强黏附蛋白表达以降低肠道通透性。例如,补充双歧杆菌已被证明可改善葡萄糖耐受性。由于个体间微生物组结构和功能差异显著,基于微生物组的糖尿病治疗需采取个体化策略以实现最佳效果。
饮食成分调整:部分植物活性物质具有调节胰岛素和血糖的潜力。例如,高脂饮食中以改性大豆蛋白代替牛肉可显著降低餐后胰岛素水平,可能与其碳水化合物和纤维特性相关。不同谷物、豆类及脂肪酸类型也会影响犬的胰岛素敏感性。
此外,多种植物可影响犬的糖代谢,如辣椒素、迷迭香、罗勒和绿茶提取物。研究表明,它们能降低血糖和胰岛素水平、增强胰岛素分泌,并通过多酚保护胰腺β细胞功能。
功能性食品开发流程
3
骨关节炎(OA)
骨关节炎的改善需要采用多模式的综合管理方法,通过多种干预手段协同作用以获得更好的治疗效果。
体重控制:是所有治疗方案中最重要的一环。减轻体重能直接降低关节负荷。
核心营养干预-高剂量EPA:应使用专门为关节健康设计的处方粮,或在现有日粮基础上添加足量的高品质鱼油,确保EPA+DHA的摄入量达到治疗水平。需告知主人,该干预起效较慢,需坚持8-12周。
辅助营养成分:可联合使用葡萄糖胺/软骨素和ASU作为软骨保护剂。高生物利用度的姜黄素、乳香提取物或新西兰绿唇贻贝提取物可作为额外的抗炎支持。
4
认知功能障碍(CCD)
核心:选择含有复合抗氧化剂(维生素E, C)和多种植物营养素(来自水果蔬菜提取物)的老年犬专用处方粮。
结构支持:DHA:确保日粮中DHA的含量充足。
能量支持:对于已有明显认知衰退症状的犬只,换用含有6-10% 中链脂肪酸(MCTs)的处方粮已被证明能显著改善其认知评分。
肠道支持:通过补充益生菌/益生元来维护老年犬的肠道健康,有助于减轻可能加剧神经炎症的“炎性衰老”。
针对肠道微生物组的功能性营养干预,将在未来犬猫的健康维护与疾病管理中扮演愈发关键的角色。从益生菌的菌株特异性免疫调节,到EPA对炎症通路的分子调控,再到抗氧化剂组合在延缓神经退行性病变中的协同作用,功能性营养已从一种辅助手段,发展成为现代循证兽医学中用于管理多种慢性疾病的、不可或缺的科学工具。
然而,我们必须清醒地认识到当前领域的挑战。最大的挑战来自于显著的个体差异性。不同品种、年龄、遗传背景和生活环境的动物,其基础微生物组构成和对营养干预的反应都可能截然不同。当前基于“群体平均值”的推荐方案,在个体应用中效果可能打折扣。
随着高通量测序成本的降低,多组学技术将使我们能够为每一只动物绘制出其独特的肠道微生态“指纹”。通过将这些个体化的多组学数据与临床表型、生活方式等信息相结合,并利用人工智能(AI)和机器学习算法进行深度分析,我们将能够:
实现疾病的早期预测与诊断:在临床症状出现前,通过识别特定的微生物组失调模式或代谢物谱异常,来预警疾病风险。
制定高度个性化的营养方案:根据动物特定的菌群缺陷(如缺乏某种产丁酸菌)或代谢异常,为其精准匹配最有效的益生菌菌株、益生元种类或后生元组合。
动态监测与方案优化:通过定期检测,评估干预效果,并对营养方案进行动态调整,形成一个“诊断-干预-监测-优化”的闭环管理。
综上所述,功能性营养学正引领着一场宠物健康管理的深刻变革——从“千篇一律”的传统模式迈向“量体裁衣”的精准时代。对临床工作者而言,这意味着需要将前沿的科学工具整合为个体化的诊疗方案。而对宠物主人来说,这更赋予了他们一种全新的能力:通过科学喂养,更主动、更深刻地参与到守护爱宠长期健康的责任中来。
主要参考文献:
https://www.sciencedirect.com/science/article/pii/S1756464623003444
Di Cerbo A, Morales-Medina JC, Palmieri B, Pezzuto F, Cocco R, Flores G, Iannitti T. Functional foods in pet nutrition: Focus on dogs and cats. Res Vet Sci. 2017 Jun;112:161-166.
Rindels JE, Loman BR. Gut microbiome – the key to our pets’ health and happiness? Anim Front. 2024 Jun 20;14(3):46-53.
Kates AE, Jarrett O, Skarlupka JH, Sethi A, Duster M, Watson L, Suen G, Poulsen K, Safdar N. Household Pet Ownership and the Microbial Diversity of the Human Gut Microbiota. Front Cell Infect Microbiol. 2020 Feb 28;10:73.
Yang, Q.; Wu, Z. Gut Probiotics and Health of Dogs and Cats: Benefits, Applications, and Underlying Mechanisms. Microorganisms 2023, 11, 2452. https://doi.org/10.3390/microorganisms11102452
Hernandez J, Rhimi S, Kriaa A, Mariaule V, Boudaya H, Drut A, Jablaoui A, Mkaouar H, Saidi A, Biourge V, Borgi MA, Rhimi M, Maguin E. Domestic Environment and Gut Microbiota: Lessons from Pet Dogs. Microorganisms. 2022 Apr 30;10(5):949.
Atuahene, D.; Mukarram, S.A.; Balouei, F.; Antwi, A. Gut Health Optimization in Canines and Felines: Exploring the Role of Probiotics and Nutraceuticals. Pets 2024, 1, 135-151.
Grześkowiak Ł, Endo A, Beasley S, Salminen S. Microbiota and probiotics in canine and feline welfare. Anaerobe. 2015 Aug;
Guo X, Wang Y, Zhu Z, Li L. The Role of Plant Extracts in Enhancing Nutrition and Health for Dogs and Cats: Safety, Benefits, and Applications. Vet Sci. 2024 Sep 12;11(9):426.
Caterino C, Aragosa F, Della Valle G, Costanza D, Lamagna F, Piscitelli A, Nieddu A, Fatone G. Clinical efficacy of Curcuvet and Boswellic acid combined with conventional nutraceutical product: An aid to canine osteoarthritis. PLoS One. 2021 May 28;16(5):e0252279.
Wernimont SM, Radosevich J, Jackson MI, Ephraim E, Badri DV, MacLeay JM, Jewell DE, Suchodolski JS. The Effects of Nutrition on the Gastrointestinal Microbiome of Cats and Dogs: Impact on Health and Disease. Front Microbiol. 2020 Jun 25;11:1266

谷禾健康
肌醇(Inositol,i-Inositol或myo-Inositol)
肌醇,它不仅是构成细胞膜的基础材料,更是一个连接新陈代谢、细胞信号和肠道微生态的核心枢纽。在其九种立体异构体中,主要以其特定形式(myo-inositol)参与广泛的生理过程,包括构成细胞膜磷脂、介导胰岛素信号、调节渗透压、基因表达等。
近年来,研究人员发现,肌醇代谢的紊乱正日益被视为多种疾病的促成因素,如代谢综合征、2型糖尿病、多囊卵巢综合征、神经退行性疾病如阿尔茨海默病乃至皮肤健康。
近期证据同时凸显,肠道菌群在塑造肌醇的生物可利用性和生物转化中扮演着决定性角色。有益的共生菌群(如Anaerostipes)能将膳食肌醇转化为促进健康的短链脂肪酸,而与肥胖相关的微生物则会过度降解肌醇,从而促进脂质吸收和脂肪堆积。
本文将一起整理讨论关于肌醇的以下方面知识:
1)肌醇:从化学结构到生理功能
2)肌醇缺乏或过量的影响
3)调控其合成、分解代谢与利用的机制
4)肌醇与肠道菌群的相互作用
5)影响肌醇代谢的因素
6)肌醇与代谢性疾病
7)肌醇与神经精神健康
8)肌醇与皮肤健康
9)诊断指标与临床相关性
10)恢复代谢稳态的循证营养与治疗策略
注:肌醇(Inositol) 是一个总称,它有多种异构体(分子式相同但结构不同)。
肌醇(myo-inositol) 是这些异构体中最常见、在自然界中分布最广、生物活性也最重要的一种形式。我们通常所说的“肌醇”,在文中没有特别指明的情况下,往往就是指这种形式。
游离myo-Ins 就是指不与其他分子结合、以独立形态存在的肌醇。
关于肌醇的研究发展
在过去二十年里,我们对肌醇的认识发生了深刻的转变。肌醇已从一个仅仅被视为“类维生素”的化合物,转变为一个深度参与葡萄糖和脂质调节的多功能信号分子。尽管有时被称为“维生素B8”,但肌醇并非必需维生素,因为人体自身就能以葡萄糖为原料(通过葡萄糖-6-磷酸经肌醇-3-磷酸合酶催化),实现内源性合成。
肌醇的重要性体现在其作为细胞信号的核心角色上。肌醇及其立体异构体D-手性肌醇(D-chiro-inositol, DCI)一起,充当着响应胰岛素的“第二信使”,负责传达葡萄糖摄取、糖原合成和脂肪代谢等关键指令。持续的研究发现,在糖尿病和胰岛素抵抗的状态下,这两种信使水平会显著下降。
与此同时,一个更前沿的发现是,肠道菌群对我们体内的肌醇水平有着深刻影响。肠道菌群不仅通过代谢膳食肌醇,还能将其转化为短链脂肪酸(SCFAs)。因此,理解肌醇、宿主代谢、肠道微生物群之间的这种三方互动,为个体化营养和精准医学提供了全新的视角。
肌醇的化学性质与合成
结构与立体化学
肌醇是一种结构类似于葡萄糖的天然多羟基环己六醇(C₆H₁₂O₆),形成一个稳定的六元环,每个碳原子上均带有一个羟基。
正是这些羟基在空间中朝向的不同,造就了肌醇的多种立体异构体。在其九种可能的立体异构体中,肌醇(myo-inositol)在哺乳动物组织中占比超过99%。每一种异构体都因其独特的空间结构,而具备了不同的生化活性和信号传导能力。
肌醇九种异构体的结构
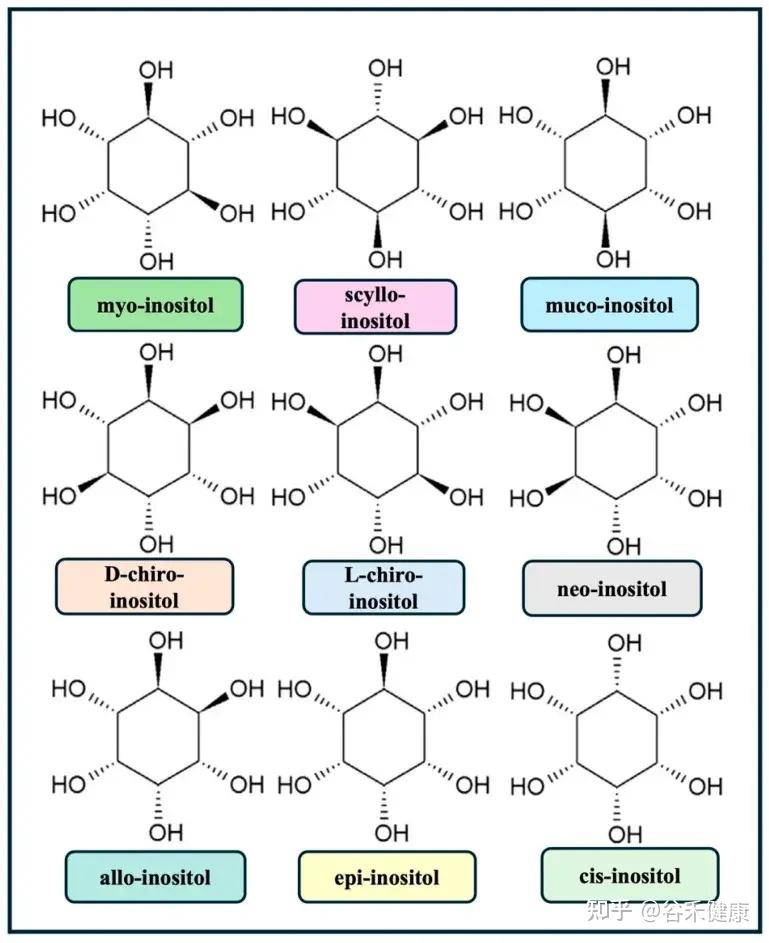
生物合成途径
人体能够自行合成肌醇,内源性生物合成主要发生在肾脏、肝脏和大脑,这个过程始于我们最熟悉的能量物质——葡萄糖,通过一个两步酶促转化过程完成:
该途径受到葡萄糖可利用性、胰岛素水平和渗透压应激的严密调控,确保按需生产。
膳食来源
肌醇以游离myo‑Ins 和其结合形式植酸(肌醇六磷酸, IP6)两种形式存在,后者在以下食物中含量丰富:
加工过程(如浸泡、发酵)会显著影响其生物可及性,因为植酸酶能将植酸降解为可吸收的形式。
肌醇的生理功能
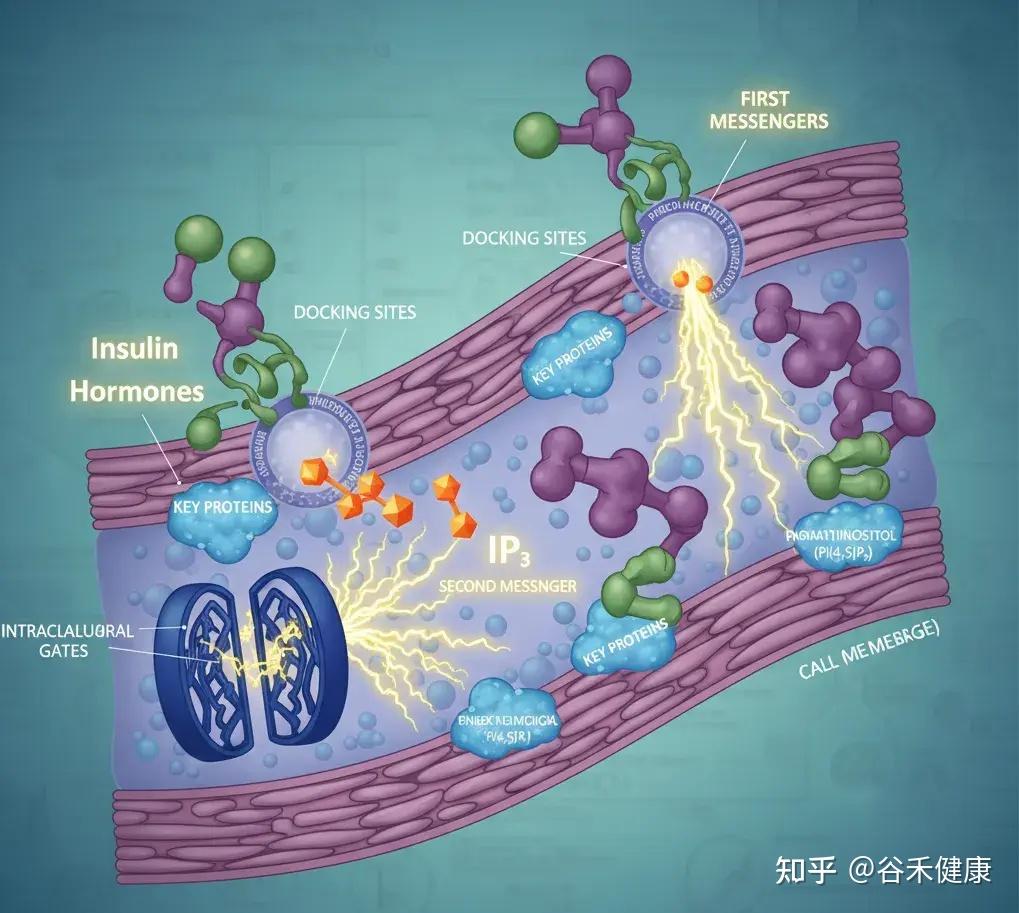
肌醇:细胞信号转导
肌醇是细胞信号传导通路中的关键一环。在细胞膜上,它的衍生物磷脂酰肌醇(如 PI(4,5)P₂)就像是为关键蛋白预留的停靠位点。
当胰岛素或激素(第一信使)敲响细胞的大门时,它自己不进去,而是派 IP₃(第二信使)在细胞内部跑腿传达命令。IP₃ 的一个重要任务就是去打开钙离子的阀门,而钙离子就像是启动细胞各种功能的电火花。
如果这个信号系统失灵会出现胰岛素抵抗,也就是说你吃了东西,胰岛素(第一信使)发出了指令,但细胞内部(第二信使)没反应过来,导致血糖降不下去,人会饭后特别困、容易饿、精力不济,并且脂肪更容易堆积。
渗透压调节:细胞的脱水危机与肌醇的救援
为了回收水分,我们的肾脏会创造一个盐分极高的“高渗环境”,普通细胞在这种环境下会像腌菜一样脱水。
肌醇(Myo-Ins)此时便作为一种有机渗透调节物,被 SMIT1 等转运蛋白大量泵入肾脏细胞内,提升细胞内部浓度,以对抗外界的高渗应激。这相当于给细胞喝足了保护液,防止其在极端环境下功能失常。
肌醇与脂肪肝:从源头阻断脂肪堆积
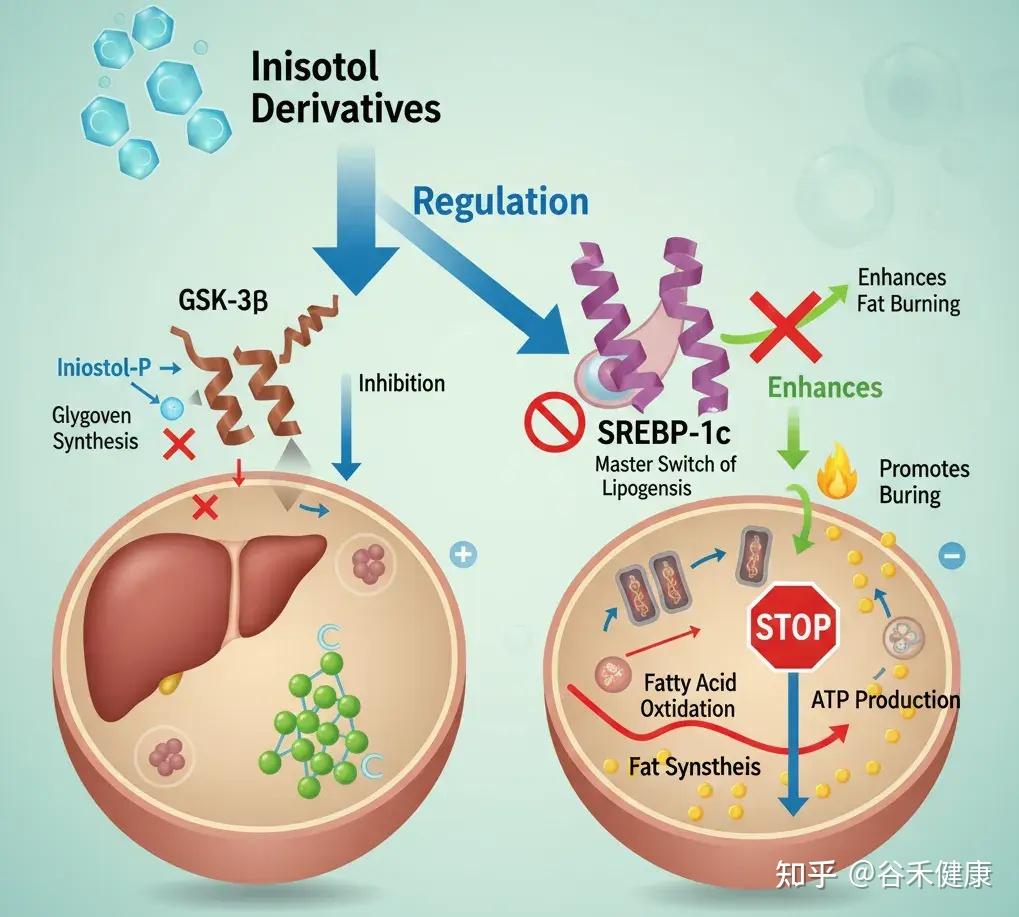
肌醇衍生物能精准调控肝脏和脂肪细胞内的关键酶,如糖原合酶激酶-3β(GSK-3β)和固醇调节元件结合蛋白-1c(SREBP-1c)。
例如,它能抑制 SREBP-1c 这个脂肪生成总开关的活性。当 SREBP-1c 过于活跃时,肝脏就会不停地合成脂肪。同时,肌醇还能增强脂肪酸氧化,也就是促进脂肪的燃烧。
当这个开关失控时,SREBP-1c 持续开启,会导致肝脏甘油三酯堆积,在体检报告上就表现为非酒精性脂肪肝。反映在体型上,就是腹部脂肪顽固、向心性肥胖。
肌醇:备孕路上的好助手
在女性体内,myo-肌醇调节卵泡刺激素(FSH),确保卵巢能准确接收指令,促进卵母细胞的正常成熟,这解释了为何补充肌醇能有效改善多囊患者的排卵状况和月经周期。
肌醇在男性精浆中的浓度非常高,它对精子的正常生理功能起着关键作用。补充肌醇,特别是肌醇(Myo-inositol),已被证明可以显著改善精子的活力、数量和形态。主要通过增强线粒体功能、提供能量和抗氧化作用。这使肌醇成为治疗男性不育的有效营养方案。
肌醇:如何稳定你的情绪?
在中枢神经系统中,肌醇衍生物参与磷脂酰肌醇循环,这与血清素受体活性、情绪稳定和神经保护有关。血清素是决定我们情绪的“快乐激素”。如果这个循环不畅,大脑就无法有效利用血清素,就会出现情绪波动大、容易焦虑、烦躁或感到莫名的情绪低落等问题。
平衡总是一体两面的。如果说缺乏肌醇会打破身体的稳定,那么,过量的肌醇就一定更好吗?接下来,我们就将深入探讨肌醇在体内的失衡状态——即缺乏与过量,分别会带来怎样的病理生理学后果。
缺乏机制
肌醇耗竭的产生途径包括:
临床表现
虽然不存在“经典的肌醇缺乏症”,但经验证据表明,组织中myo‑Ins水平低下与以下情况有关:
潜在毒性与过量
高达每日12克的剂量通常是安全的,仅有轻微的胃肠道不适报告。
当口服补充剂量很大时(通常指每日超过12克),肌醇可能无法被小肠完全吸收。未被吸收的肌醇在肠道内会产生渗透效应,像吸水海绵一样将水分吸入肠腔,从而导致轻微的胃肠道不适,如腹胀、排气和腹泻。
极高浓度可能扰乱渗透压平衡,尤其是在肾功能不全的患者中。
肌醇在人体内的转化与胰岛素信号
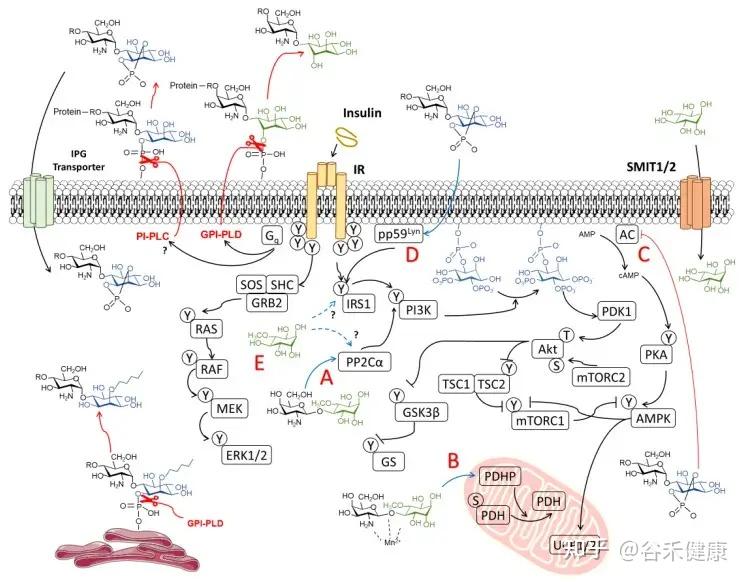
这里要介绍肌醇的两种异构体形式:
肌醇(Myo-Ins)和D-手性肌醇(DCI)。
生理转化(Myo ➜ DCI)
Myo‑Ins通过一种胰岛素依赖性的表异构酶(epimerase)转化为D-手性肌醇(DCI)。
myo/DCI的比例在不同组织中有所不同,例如:
这种差异化分布支持了组织特异性的胰岛素作用。
然而,在胰岛素抵抗的病理状态下,如在糖尿病和多囊卵巢综合征(PCOS)中,这种转化机制会受损。
胰岛素抵抗中的失衡
表异构酶活性的不足,导致myo‑Ins耗竭和DCI生成不足,损害了糖原合成和细胞葡萄糖摄取。
研究表明,补充肌醇(myo‑Ins)能有效恢复两种异构体的平衡,而单独补充DCI,则可能破坏生理比例,反而达不到理想的治疗效果。
肌醇在胰岛素信号传导中的作用机制
肠道菌群对肌醇的降解:诱发肥胖的关键机制
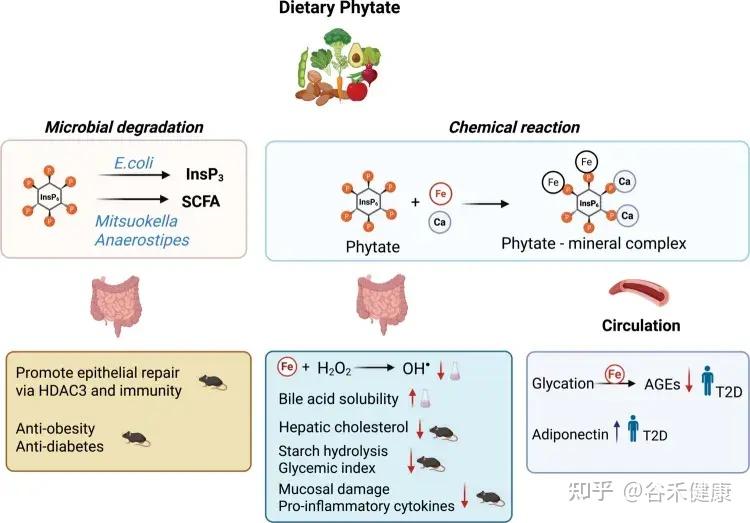
肠道菌群:肌醇代谢的隐形参与者
新兴证据正在引领我们对宿主-微生物协同代谢的理解。肠道菌群可以直接代谢膳食myo-肌醇,从而影响宿主的能量平衡。
Anaerostipes属等菌种能将肌醇转化为丙酸和乙酸,这两种主要的短链脂肪酸参与抑制肝脏糖异生和改善胰岛素敏感性。
相反,与肥胖相关的菌种(例如,高脂饮食下富集的某些厚壁菌门成员)表现出降解肌醇的活性,耗尽肠腔内的myo-Ins,并增强肠道对脂质的吸收。
肌醇缺乏,如何导致肥胖?
最新研究揭示了一个事实:肠道微生物可以降解肌醇,而这种降解与肥胖密切相关。
研究人员在肥胖人群中发现了一种名为Megamonas rupellensis(巨单胞菌代表物种)的细菌显著富集。这种细菌具有强大的肌醇降解能力,其降解途径(PWY-7237)及相关基因(iolG、iolI、iolE、iolD、iolB)在肥胖个体中丰度和表达水平均显著升高。
肌醇的抗肥胖作用
在正常情况下,肌醇能够通过下调几个基因表达,有效抑制小肠对脂肪的吸收。
肌醇下调的是三个关键脂肪酸转运蛋白基因:
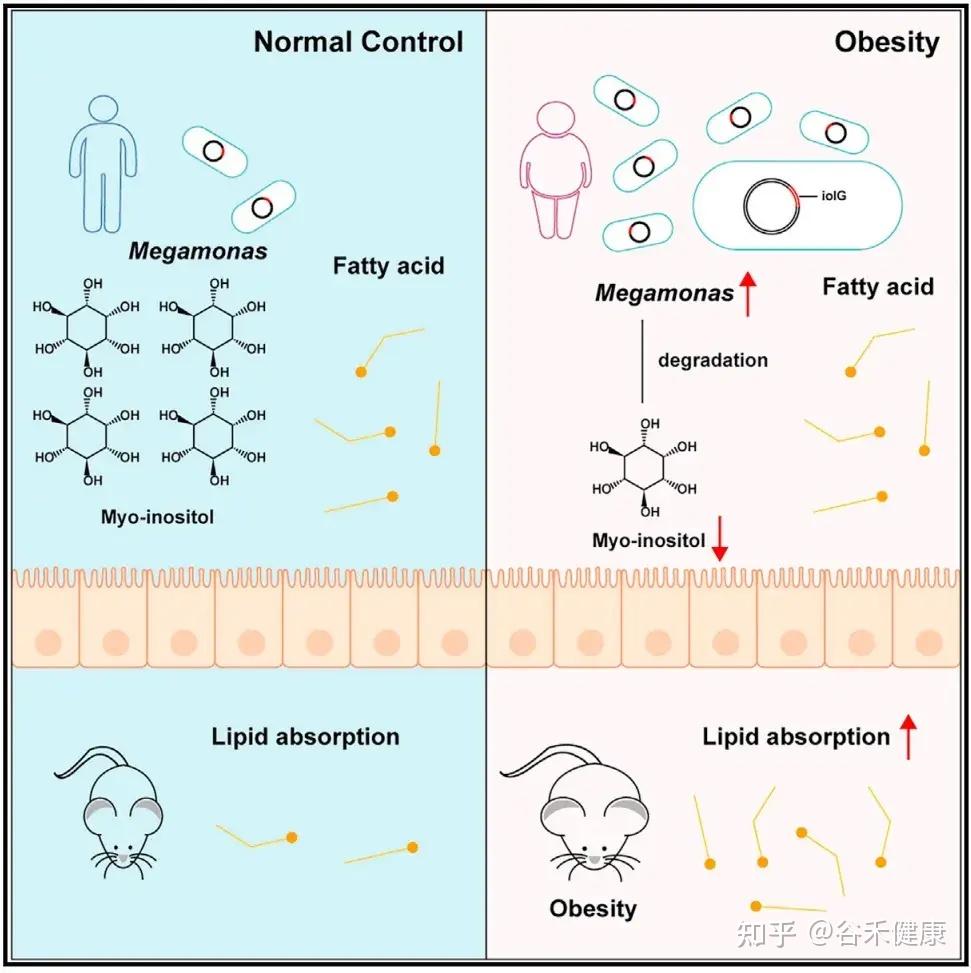
菌群降解肌醇的后果
当M. rupellensis 定植在小鼠肠道后,它会大量消耗肌醇,导致肠道内的myo-肌醇水平几乎耗尽。这直接削弱了肌醇抑制脂肪吸收的功能,最终引发一系列肥胖表型:肠道脂质吸收增加、体重与脂肪增加、肝脏脂肪堆积以及血糖升高等。
研究人员进一步进行了一项巧妙的实验:
仅将肌醇降解的第一个关键酶基因(iolG)转入原本不能降解肌醇的大肠杆菌中,就足以复现上述肥胖现象:体重增加、脂肪组织增多、肝脏脂肪堆积。这证明了:
肌醇降解本身(而非其他细菌因素),是导致肥胖的直接原因。
人体肠道内微生物肌醇及植酸降解推导途径
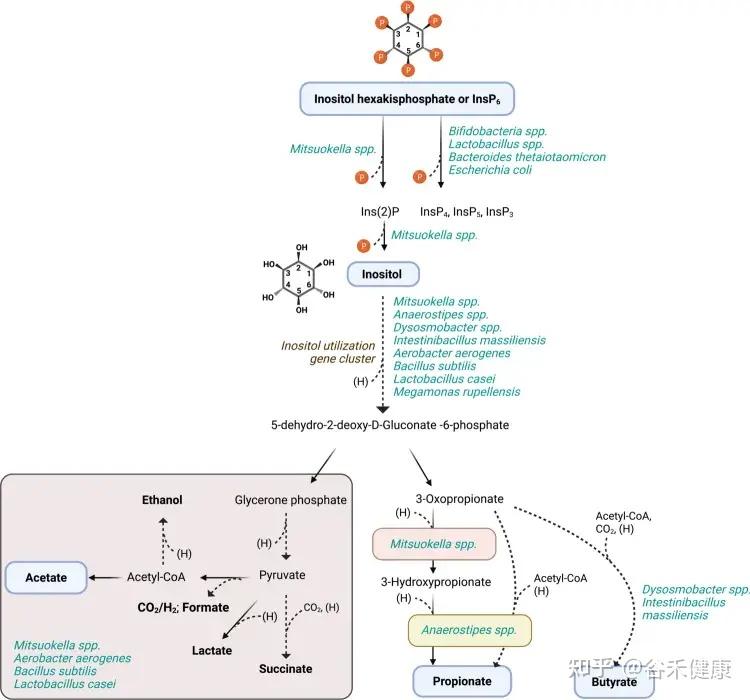
肠道菌群的另一面:合成有益的肌醇脂质
并非所有细菌都是反派。一些共生菌,特别是拟杆菌属,实际上能利用肌醇来合成对自身和宿主都有益的——肌醇脂质。
例如,人类肠道中的常驻菌多形拟杆菌(Bacteroides thetaiotaomicron)拥有完整的肌醇脂质合成基因簇。这些脂质能够帮助细菌抵抗宿主的抗菌肽,从而更好地在肠道中定植。
这体现在功能保护和结构支撑两方面:
然而,这个过程的影响远不止于细菌自身。研究发现,一旦细菌失去合成肌醇脂质的能力,会直接扰乱宿主的基因表达,特别是那些与碳水化合物降解和能量合成相关的关键代谢通路,这表明菌群的这一行为与宿主的能量平衡息息相关。
更重要的是,这背后还隐藏着一个精巧的生态循环系统。
我们摄入的食物中含有植酸(比如小麦、糙米、藜麦、玉米、花生、大豆、芝麻等),肠道中广泛存在的植酸酶,可以降解食物中的植酸,释放出肌醇。这些被释放的肌醇并不会被浪费,随后可被拟杆菌等细菌重新利用,作为原料去合成上述的肌醇脂质。
这一发现具有重要的临床意义:
不仅揭示了这种有益的合成能力在肠道菌群中远比我们想象的更为普遍,也展示了一个复杂的“宿主-微生物-肌醇”循环系统。
肌醇的降脂效果,要看肠道菌群的脸色
肌醇的代谢调控能力还体现在一个更宏观的战场上——直接对抗由现代不良饮食习惯(尤其是高糖饮食)引发的代谢紊乱。一个关键的动物研究,为我们深入揭示了肌醇是如何与我们的肠道菌群联手,共同调控肝脏脂肪代谢的。
高蔗糖饮食的影响
研究证实,高蔗糖饮食可触发一系列级联负面效应,涵盖肝脏代谢、基因转录及肠道微生态。
核心指标:肝脏甘油三酯水平显著升高(这是通往脂肪肝的快车道)。
伴随变化:肝脏总脂质、胆固醇含量及肝脏重量均呈现上升趋势,表明脂肪变性的发生。
上游通路激活:果糖代谢关键酶酮己糖激酶(KHK)与糖酵解关键酶丙酮酸激酶(PKLR)的表达被显著上调,为脂肪酸合成提供了充足的底物。
新生脂肪合成全面上调:涉及脂肪生成的全套关键基因表达均上调,包括:
核心转录因子激活:脂肪合成的主调控因子 SREBP1 与 ChREBP 的mRNA水平显著升高,从转录层面驱动了整个脂肪生成程序。
注:SREBP1(固醇调节元件结合蛋白1);
ChREBP(碳水化合物反应元件结合蛋白)。
肠道微生物组失调:
α-多样性显著降低:菌群的物种丰富度和系统发育多样性下降,生态系统稳定性减弱。
β-多样性显著变化:菌群的整体结构发生重组,偏离了健康状态。
特定菌属丰度改变:
削弱了有益菌(如Lactobacillus, Bifidobacterium),打击了负责肠道屏障的AKK菌,纵容了可能引发炎症或与代谢病相关的菌群(如 Desulfovibrio)的过度生长。
在这一片混乱中,肌醇的补充扮演了力挽狂澜的角色。
肌醇补充的干预效果
肌醇补充显著逆转了肝脏中甘油三酯和胆固醇的积累。
此作用具有选择性,因为肝脏的磷脂水平未发生变化,表明干预主要靶向异常的脂质沉积。
肌醇显著抑制了脂肪生成通路中的关键限速酶(尤其是FAS)的表达。
更重要的是,它显著降低了主转录因子 SREBP1 和 ChREBP 的mRNA水平,从源头上削弱了脂肪生成的转录驱动力。
同时,它减弱了糖酵解相关酶的上调趋势,减少了流向脂肪合成的碳水化合物底物。
肠道菌群:关键中介及潜在生物标志物
该研究最关键的发现之一,在于揭示了肌醇并非在孤军奋战,它的降脂效果,高度依赖肠道菌群这个关键盟友。
研究建立了一个重要的关联模型——乳杆菌属丰度的降低与拟杆菌属丰度的增加,这两项指标与血浆脂质升高及肝脏甘油三酯累积存在显著的正相关性。
这一结论提示,特定的肠道微生物特征可以作为评估宿主-微生物共代谢中肌醇代谢效率的有效生物标志物,为未来临床评估和干预提供了新的视角。
事实上,肌醇在体内的整个代谢网络,都受到一系列内在和外在因素的精密调控,任何一个环节的改变都可能影响其最终的生物学效应。接下来,我们将探讨哪些因素在影响着肌醇代谢。
肌醇的体内平衡受多种因素调控,失衡会导致功能性缺乏。以下是五个主要影响因素:
高糖与高脂饮食
这是最核心的干扰因素,通过四种方式产生负面影响:
– 竞争抑制
葡萄糖与肌醇结构相似,当血糖水平过高时,葡萄糖会抢占细胞为肌醇准备的转运通道,导致细胞内的肌醇供应不足。
– 加速流失
高血糖导致糖尿时,会顺带让大量肌醇从尿液中流失,造成体内总量下降。
– 抑制合成
长期高糖饮食会抑制体内合成肌醇的关键酶活性,减少内源性供应。
– 扰乱菌群
高糖高脂环境促使肠道中有害菌增殖,这些菌会过度消耗肌醇,或阻止其向有益的短链脂肪酸转化。
胰岛素抵抗
胰岛素抵抗既是肌醇失衡的结果,也是其恶化的推手。
– 转化障碍
胰岛素信号失灵,身体将“基础版”的肌醇(myo-肌醇)转化为其重要异构体“D-手性肌醇”(DCI)的能力会下降,影响糖原合成等功能。
– 组织失衡
在某些组织(如卵巢)中,身体为了代偿胰岛素抵抗而分泌更多胰岛素,造成“高胰岛素血症”。这反而会过度消耗myo-肌醇,导致两种异构体比例失调,这也是多囊卵巢综合征(PCOS)的核心病理机制之一。
肠道菌群失调
肠道菌群扮演着“双刃剑”的角色。
有益菌:像 Anaerostipes 属的细菌,能将肌醇转化为丙酸、乙酸等有益的短链脂肪酸,帮助改善整体代谢。
有害菌:与肥胖相关的菌群则会直接吞噬肌醇,减少其在体内的可用量,并可能促进脂肪吸收,进一步加剧代谢问题。
肾脏功能障碍
肾脏是回收肌醇、防止其流失的关键器官。在健康状态下,肾脏会重吸收超过99%被过滤的肌醇。然而,当患有慢性肾病或糖尿病肾病时,肾脏的重吸收功能受损,会导致大量肌醇随尿液排出,引起全身性的耗竭。
药物与生活方式
药物影响:例如,用于治疗双相情感障碍的锂盐,会抑制肌醇在细胞内的循环再生,导致功能性缺乏。
生活方式:长期饮酒和慢性压力会持续增加肌醇的代谢消耗,同时干扰其在肝脏和神经系统中的正常功能。
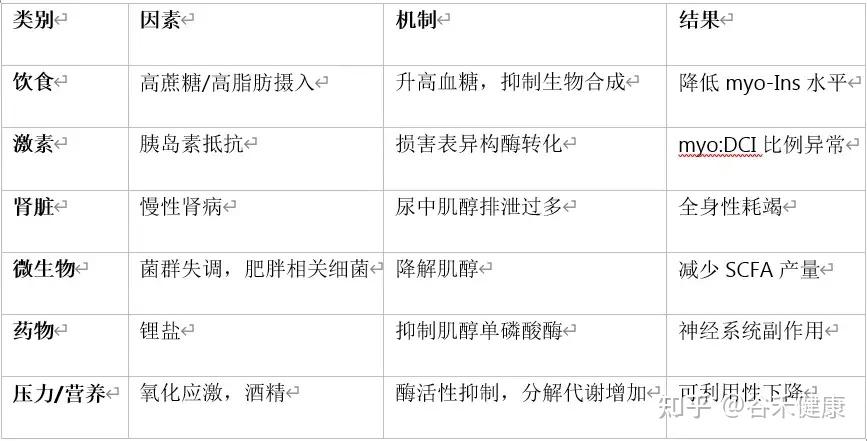
以上我们了解到肌醇的体内平衡,易受到现代生活方式和普遍健康问题的干扰。这种平衡的打破,绝非一个简单的营养素缺乏问题,它构成了多种复杂疾病发生与发展的核心病理生理基础。
多囊卵巢综合征
多囊卵巢综合征(PCOS)是育龄女性最常见的内分泌与代谢紊乱疾病。虽然其典型症状如月经不调、高雄激素、卵巢多囊样改变——都指向生殖系统,但其病理根源远不止于此。PCOS的本质,是一种与胰岛素抵抗及代偿性高胰岛素血症密切相关的全身性代谢失调。
在这一背景下,肌醇作为一种关键营养素,其代谢紊乱被发现是PCOS病程中的核心环节。这引出了一个重要概念:PCOS患者普遍存在一种“功能性肌醇耗竭”。这并非指吃得不够,而是细胞层面无法有效利用肌醇,尤其是其两种关键异构体——肌醇(myo-Ins)和D-手性肌醇(DCI)。
两种肌醇,两大职责
在健康人体内,胰岛素如同“总指挥”,精确调控着两种肌醇的转化与功能。它们分工明确:
肌醇失衡:与PCOS有重要关联
在PCOS患者中,普遍存在的胰岛素抵抗破坏了这个过程。
细胞对胰岛素不敏感(即胰岛素抵抗),导致将 myo-Ins 转化为 DCI 的酶活性不足。这使得细胞无法有效利用葡萄糖,进一步加剧高血糖和高胰岛素血症。
矛盾的是,卵巢对胰岛素依然高度敏感。全身循环中的高水平胰岛素在卵巢过度激活了转化酶,导致卵巢内的 myo-Ins 被大量、过早地消耗,转化为 DCI。
这就造成了卵巢微环境中灾难性的后果:myo-Ins 严重相对缺乏,而 DCI 严重相对过量。
肌醇失衡如何破坏生育力?
这种卵巢内的肌醇失衡直接导致了PCOS的两大核心生殖障碍:
作为FSH信号的关键信使,myo-Ins的耗竭损害了卵泡对FSH的反应。卵泡在募集后无法发育成优势卵泡,最终发育停滞,形成了一串“小囊泡”——即卵巢的多囊样改变。同时,myo-Ins的缺乏也直接影响卵母细胞的质量,导致受孕困难和流产风险增加。
卵巢内过量的DCI会反过来刺激卵泡膜细胞,使其对胰岛素和促黄体生成素(LH)的信号反应过度,从而过量合成雄激素。
治疗思路:补充肌醇,打破不良循环
理解了肌醇原因,那么外源性补充肌醇的逻辑便十分清晰了。其目的正是为了纠正卵巢内的营养失衡,打破恶性循环。
临床研究发现,单独补充大剂量DCI效果不佳甚至可能有害。因为它无法解决卵巢中真正耗竭的myo-Ins,反而可能加剧失衡比例。
直接喂养处于“饥饿”状态的卵巢,恢复其对FSH信号的敏感性,促进卵泡正常发育与排卵。
从根源改善:在全身层面改善胰岛素敏感性,降低血清胰岛素水平,从而减轻对卵巢转化酶的过度刺激。
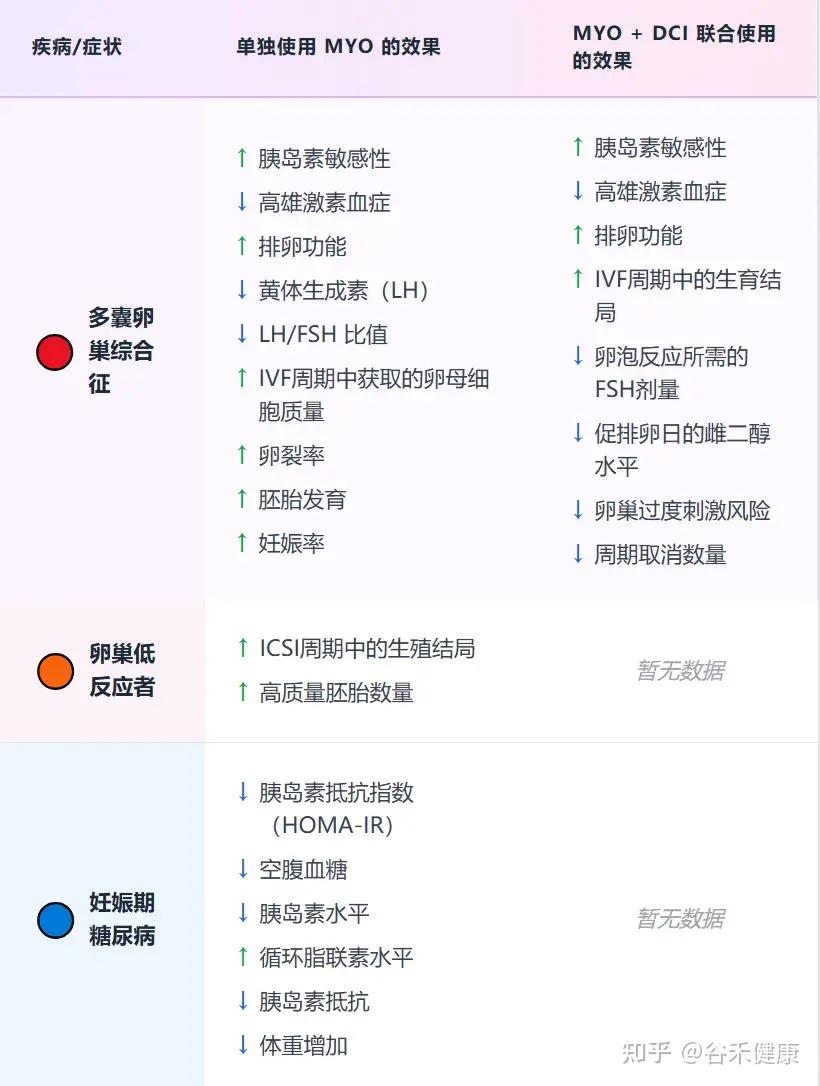
目前,大量高质量的临床研究证实,补充肌醇,特别是以生理比例40:1混合的myo-Ins和DCI,能够显著改善PCOS患者的内分泌和代谢指标,包括:
糖尿病
在糖尿病及其前驱状态(胰岛素抵抗)的复杂病理中,肌醇代谢的紊乱扮演着一个核心角色,它既是后果又是驱动因素,形成了一个自我强化的恶性循环。
高血糖如何耗尽肌醇?
高血糖通过“入口”和“出口”两个维度,造成了体内肌醇的严重耗竭。
葡萄糖与肌醇的化学结构高度相似,它们共享细胞膜上的部分转运通道,尤其是钠/myo-肌醇协同转运体(SMIT)。
当血糖持续升高时,血液中过量的葡萄糖霸占转运通道。这种竞争性抑制作用,极大地阻碍了细胞对肌醇的有效吸收。这就导致了一个矛盾的现象:即使血液中的肌醇浓度尚可,真正需要它的细胞(如神经、肝脏、肾脏细胞)内部却已处于饥饿状态,即功能性耗竭。
高血糖对肾脏也构成了巨大压力。当血糖超过肾脏的处理极限时,多余的葡萄糖会随尿液排出(即糖尿)。由于转运通道被葡萄糖占据,本应被肾脏回收的肌醇也同步受损,大量地随尿液流失。这直接削减了身体的肌醇总储备,是糖尿病患者体内肌醇水平显著偏低的关键原因。
肌醇耗竭如何反噬代谢?
当肌醇耗竭发生后,它会对糖尿病的病理产生关键的反噬作用,让情况变得更糟。
肌醇是胰岛素信号通路中不可或缺的第二信使。可以把它想象成信号传导链条上的一个关键齿轮。当细胞内肌醇水平下降,这个齿轮就脱落了,导致信号中断,加剧胰岛素抵抗。
也就是说,胰岛素虽然与细胞受体结合了,但信号无法有效向下游传递(无法有效激活下游的PI3K/Akt等关键激酶)。这使得负责将葡萄糖运入细胞的“大门”(GLUT4转运蛋白)无法正常打开,细胞摄取和利用葡萄糖的能力大幅下降。这直接加重了胰岛素抵抗。
恶性循环的闭环
至此,一个恶性循环正式形成:
高血糖 ➔ 抑制肌醇吸收 & 加速其流失 ➔ 细胞内肌醇耗竭 ➔ 胰岛素信号链中断 ➔ 胰岛素抵抗加剧 ➔ 血糖进一步升高
这个循环一旦启动,便会不断自我强化,使血糖控制变得愈发困难。
连锁反应:损害远不止于血糖
肌醇的缺乏会间接促进肝脏的脂肪生成,并导致血脂异常,从而显著增加糖尿病患者并发脂肪肝和心血管疾病的风险。
肌醇对维持神经细胞的渗透压平衡和正常信号传导至关重要。其长期耗竭是导致糖尿病周围神经病变(如手脚麻木、刺痛感)的核心原因之一。
因此,肌醇在糖尿病中的角色是一个从宏观器官功能(肾脏流失)到微观细胞信号(胰岛素抵抗)的系统性障碍。理解这一恶性循环,为通过补充肌醇来干预和改善糖尿病代谢状态提供了重要的理论依据。
脂质代谢(血脂异常)
代谢综合征(MetS)是一组以腹型肥胖、高血压、高血糖和血脂异常为核心特征的病理状态集合,其共同的病理生理基础是胰岛素抵抗。
研究表明,肌醇之所以能在改善血脂方面大有可为,是因为它能通过至少三条关键路径,协同作战,调控脂质代谢。

路径一:直击源头——为肝脏的脂肪工厂刹车
肝脏是全身的脂质代谢中心。在胰岛素抵抗和高糖负荷的状态下,肝脏的“新生脂肪合成”功能会失控,如同一个被过度激活的工厂,不停地将碳水化合物(糖)转化为脂肪。
肌醇的作用,就是为这个失控的工厂精准刹车。它通过抑制 SREBP-1c 和 ChREBP 这两个控制脂肪合成的总开关,直接从源头上减少了肝脏的脂肪产量。这不仅能降低血液中的甘油三酯(TG)水平,也是改善非酒精性脂肪肝(NAFLD)的关键一步。
路径二:切断原料——修复外周脂肪组织的失灵开关
胰岛素抵抗不仅会引发高血糖,还会导致另一个严重问题:脂肪组织中一个叫“激素敏感性脂肪酶(HSL)”的开关失灵了。
这些泛滥的原料被肝脏大量吸收,进一步加剧了甘油三酯和“坏胆固醇”(VLDL,极低密度脂蛋白)的生产。肌醇通过修复细胞内的胰岛素信号通路(如PI3K/Akt通路),重新恢复了对HSL的抑制作用。这相当于切断了肝脏过度生产脂肪的原料供应。
这个过程不仅能降低血脂,还能减少脂肪在肝脏、肌肉等不该堆积之处的沉积,从而进一步改善全身的胰岛素敏感性,形成一个宝贵的良性循环。
路径三:另辟蹊径——优化肠道菌群(肠-肝轴)
肌醇还通过一条全新的路径——调节肠道菌群,来间接实现降脂效果。
它扮演着益生元的角色,为特定的有益菌(如Anaerostipes属)提供食物。这些有益菌在代谢肌醇后,会产生丙酸和乙酸等短链脂肪酸。这些有益物质通过肠道进入肝脏,发挥重要作用,例如,丙酸可以抑制肝脏合成胆固醇。
更重要的是,一个健康的肠道菌群能够强化肠道屏障,防止脂多糖(LPS)等内毒素进入血液,从而减轻体内的低度炎症状态,而这种炎症正是驱动胰岛素抵抗和肝脏脂肪合成的关键推手。因此,肌醇通过优化肠道微生态,利用肠-肝轴,间接抑制了炎症和脂质生成。
其他潜在机制
除了上述三大路径,研究还提示肌醇可能通过以下方式发挥作用:
正是这种在多个层面、通过多种通路协同作用的综合效应,使肌醇成为一种极具潜力的天然营养干预策略,用以改善代谢综合征患者的血脂谱和整体健康。
肌醇是中枢神经系统中浓度第二高的有机小分子(仅次于谷氨酸),其重要性远不止于一个简单的结构单元。
它在维持神经精神健康中扮演着两大关键角色:既是细胞信号传导的基石,也是神经元功能的稳定器。肌醇代谢的紊乱,已与抑郁症、焦虑症、双相情感障碍等多种疾病的病理生理学紧密相连。其核心作用机制围绕着两个主要方面:
➷ 肌醇——信号传导的基石
肌醇是大脑最重要的信号传导系统,磷脂酰肌醇(PI)信号通路的绝对基石。
可以这样理解:几乎所有与情绪、认知相关的神经递质,包括血清素(5-HT)、去甲肾上腺素、多巴胺等,都好比是信使。但信使发出的信号要被细胞内部听到并执行,就需要一个高效的扩音系统,而PI通路就是这个系统。
细胞信号传导过程 – PI通路
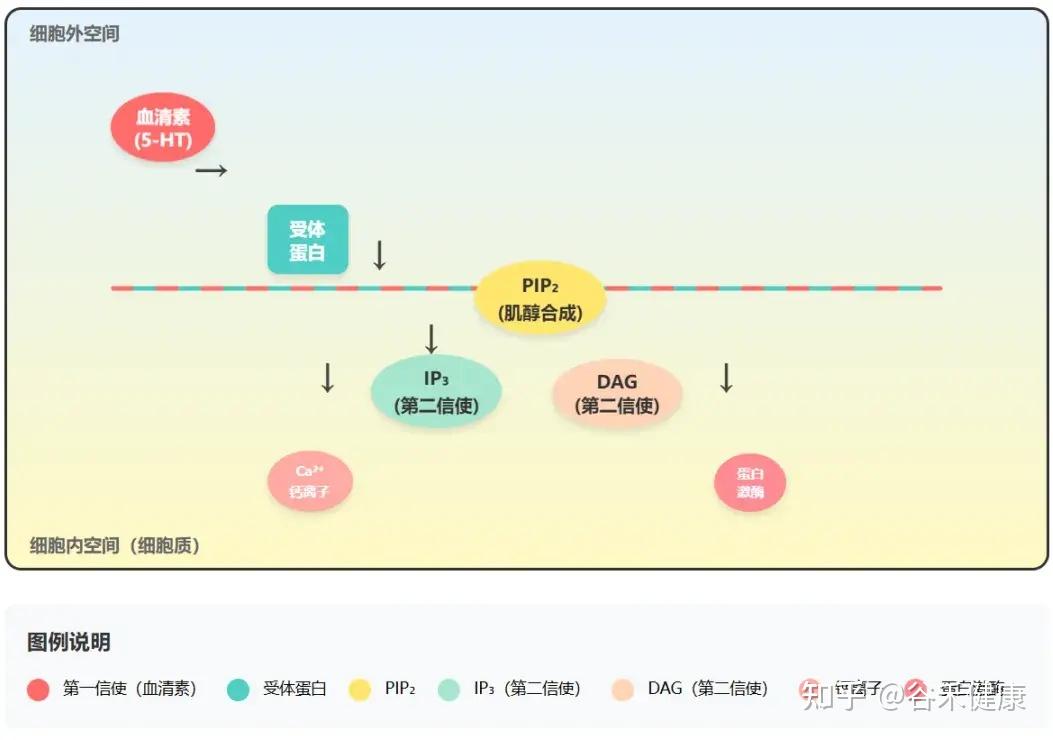
1.
“信使”(如血清素)与细胞外的受体结合。
2.
激活PI通路,将细胞膜上的PIP₂(由肌醇合成)分解为两个关键的“第二信使”——IP₃(肌醇三磷酸)和DAG(二酰甘油)。
3.
这两个第二信使在细胞内触发一系列反应,如IP₃调动钙离子、DAG激活蛋白激酶等,最终将“信使”的指令转化为实际的神经元活动。
因此,脑内充足的肌醇,是确保血清素等“快乐激素”的信号能被有效放大和传递的根本前提。
研究人员已反复在抑郁症和焦虑症患者的脑脊液中观察到,肌醇水平的显著降低。这强烈暗示,肌醇水平下降导致PI信号通路功率减弱,使得神经递质的信号无法被有效传导,从而引发情绪低落、快感缺失和焦虑。
这也解释了为何在多项临床试验中,补充大剂量肌醇(每日高达12-18克)显示出与标准抗抑郁药相当的疗效,它直接为这个“信号放大系统”补充了燃料。
➷ 肌醇——神经元功能的稳定器
大脑的细胞环境并非一成不变,脱水、高血糖等状态都可能引起渗透压的剧烈变化,威胁神经元的生存。
肌醇此时扮演着“渗透压稳定器”或“细胞海绵”的角色。它能在细胞内累积或释放,灵活调节细胞内外的水分平衡,防止神经元因过度肿胀或皱缩而受损。这种保护功能对于维持神经元的结构完整性和正常电生理活动至关重要。
来自临床与疾病的佐证
双相情感障碍的锂盐治疗
治疗双相情感障碍的经典药物——锂盐,其作用机制就从反面印证了肌醇的核心地位。锂盐通过抑制肌醇的再循环【锂盐抑制肌醇单磷酸酶(IMPase)和肌醇多磷酸-1-磷酸酶(IPPase)】,导致细胞内PI信号通路的信号减弱。这种信号抑制是锂盐平复躁狂心境的关键,这从反面印证了肌醇信号通路在情绪调节中的核心地位,但也可能因此产生副作用。
阿尔茨海默病的关联
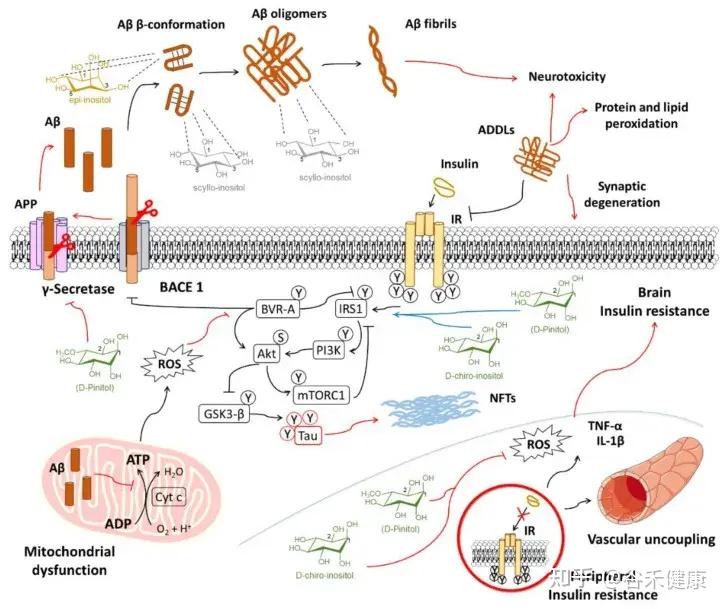
研究发现,肌醇有助于预防脑内胰岛素信号传导的早期损伤和血管功能障碍。这些功能障碍会促进氧化应激和炎症,最终在阿尔茨海默病的背景下,助长淀粉样蛋白的病理改变。
肌醇在导致阿尔茨海默病进展的机制中相互作用的示意图
综上所述,肌醇并非直接充当神经递质,而是作为神经信号传递系统的燃料和细胞环境的稳定器。当大脑的肌醇供应不足或代谢受阻时,整个神经系统的效率都会大打折扣,引发情绪和认知问题。
因此,维持充足的肌醇水平,是通过恢复最基础的细胞功能来支持整体神经精神状态的健康。这也使其成为现代营养精神病学中备受关注的干预策略之一。
尽管肌醇在皮肤健康领域的知名度远不及在代谢和神经科学中的应用,但它作为细胞功能的基础分子,通过调节细胞信号、脂质代谢和炎症,对维持皮肤的整体稳态发挥着不可或缺的幕后作用。
肌醇对皮肤的影响,主要通过以下三个层面实现:
1
强化皮肤屏障,构筑坚固屏障
肌醇是构成细胞膜关键成分——磷脂酰肌醇(PI)的核心原料。一个健康的细胞膜,是维持皮肤细胞功能和构建坚固皮肤屏障的基础。
可以把皮肤屏障想象成一道砖墙:角质细胞是砖块,细胞间的脂质(神经酰胺、胆固醇等)是水泥。肌醇参与的PI信号通路,深刻影响着砖块也就是角质细胞的增殖、分化和凋亡。
2
调节皮脂与炎症,从根源控痘
肌醇通过其在脂质代谢和胰岛素信号中的核心作用,直接影响着皮脂腺的活动——这与痤疮(也就是痘痘)的形成密切相关。
痤疮的形成与皮脂分泌过多、毛囊口角化异常、痤疮丙酸杆菌增殖和炎症反应四大因素相关。
这种状态会刺激皮脂腺过度活跃,分泌过多油脂,同时促进角化,为痤疮的爆发创造了土壤。
肌醇,特别是myo-肌醇,扮演着代谢调节器的角色:
这与它在治疗多囊卵巢综合征(常伴有痤疮的疾病)中观察到的效果一致:通过改善内部代谢,皮肤状况也随之显著好转。
3
改善全身代谢
皮肤是身体内部健康状况的一面镜子。代谢综合征(由胰岛素抵抗、血脂异常和慢性炎症引起)常常伴随着典型的皮肤问题,如黑棘皮病(皮肤皱褶处天鹅绒般的色素沉着)、皮赘以及更差的伤口愈合能力。
肌醇通过系统性地改善糖脂代谢、降低全身炎症水平,能够从根本上扭转这些病理状态,从而改善甚至消除这些皮肤表现。一个代谢平衡的身体,其皮肤的血液循环、营养供应和自我修复能力都会得到提升,自然会显得更有光泽和弹性。
综上肌醇并非一种传统意义上的护肤维生素,而是由内而外地改善,确保了皮肤细胞能够正常沟通、有序更新,并帮助控制那些由内部代谢失衡所驱动的皮肤问题(如过度出油和炎症)。因此,维持充足的肌醇水平,是实现由内而外的持久皮肤健康的重要一环。
评估体内的肌醇状态,通常需要结合临床表现和实验室检测。可以从以下几个方面,判断是否存在肌醇代谢紊乱的可能性。
症状信号
当患者出现以下看似不相关、但背后可能都与肌醇代谢紊乱有关的特定情况时,应引起警惕:
代谢:
尽管努力控制饮食,但血糖水平依然居高不下或难以控制。
肝脏:
体重正常,甚至偏瘦,但体检却发现存在脂肪肝。
生殖:
育龄女性出现无排卵或月经周期严重不规律(提示多囊卵巢综合征的可能)。
精神:
患有抑郁症或焦虑症,但对常规的血清素类药物(如SSRI)反应不佳。
生物标志物
使用气相色谱-质谱(GC-MS)或液相色谱-质谱(LC-MS)定量检测血清、尿液或组织中的myo‑Ins可提供直接测量。
这是最直接、最准确的评估方法。
辅助指标
胰岛素抵抗评估
检测空腹血清胰岛素和计算HOMA-IR指数,是评估胰岛素抵抗严重程度的核心指标。
血脂与肝功能检测
检查肝脏中的甘油三酯和胆固醇水平,以评估与肌醇代谢密切相关的脂肪肝状况。
肠道微生态分析
通过粪便样本分析,评估肠道菌群的构成,以及肌醇在肠道内的代谢产物,短链脂肪酸的水平,从而了解肠道在肌醇代谢通路中扮演的角色。
综合这些临床症状和辅助指标,可以为判断是否存在肌醇功能性缺乏以及是否需要进行营养干预提供有力的证据。
一般情况下, 以下建议可以帮助补充肌醇。
饮 食
富含天然肌醇来源的食物——全谷物、豆类、柑橘类水果、坚果、动物肝脏,可提供游离和结合形式的肌醇。发酵食物(如酸面包、酸奶发酵)能提高其生物利用度。
肌醇可以在以下食物来源中找到:
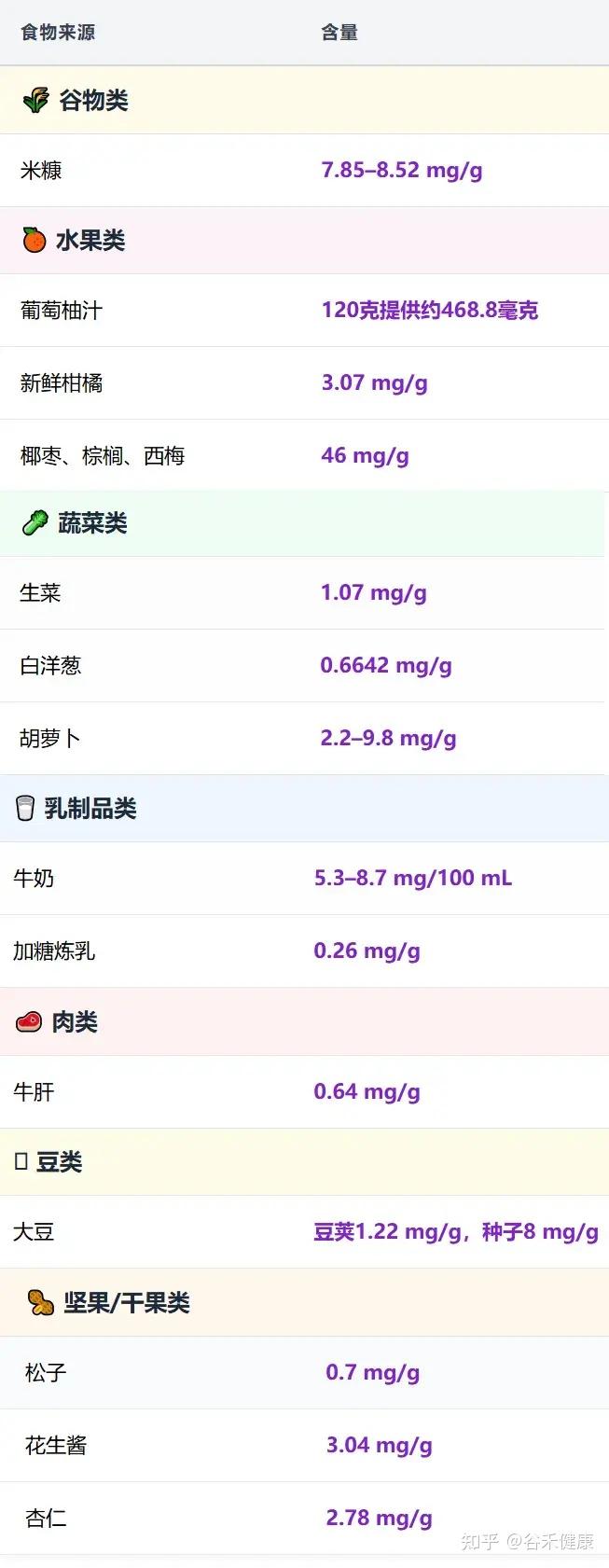
注:新鲜水果和蔬菜中的肌醇含量,远高于干燥或罐装水果和蔬菜。
磷脂酰肌醇也存在于卵磷脂中,因此以下所有富含卵磷脂的食物都是很好的来源:
注:动物来源通常比植物来源提供更大的卵磷脂来源。
D-手性肌醇(用作抗氧化剂,与肌醇结合用于多囊卵巢综合征)的最佳来源是荞麦。
肌醇食物来源含量表
补 充 剂 量
针对不同需求剂量有些差异
高剂量应用于神经与精神健康
对于抑郁症、焦虑症、强迫症及饮食失调等精神健康问题,临床研究倾向于使用每日12克甚至更多的剂量。研究人员认为需要如此高的剂量才能有效穿过血脑屏障,显著提升大脑中的肌醇与血清素水平,从而发挥稳定情绪的作用。
低剂量应用于代谢与生殖健康
相比之下,在处理代谢和生殖相关问题时,采用的剂量要温和得多。对于改善生育能力、调理多囊卵巢综合征、辅助减重以及提升胰岛素敏感性,每日2~4克的肌醇(Myo-inositol)已被证实是行之有效的。
在治疗PCOS时,一个关键的策略是将肌醇(Myo-inositol)与D-手性肌醇(D-chiro-inositol, DCI)联合使用,并遵循40:1的生理比例。一个典型的例子是:每日服用4克的肌醇,同时配以100毫克的D-手性肌醇,这种组合被证实能最有效地恢复代谢和卵巢功能。
也有单独的D-手性肌醇,每天500毫克~1.2克的剂量,改善激素状况并恢复排卵。每天1克改善了接受控制性卵巢过度刺激的女性的卵子质量。
注:联合补充剂可能比单独使用肌醇效果更好。
对于妊娠期糖尿病,每天服用1.75克肌醇和250毫克DCI,可以降低血糖和母婴健康风险。
补充形式
补充剂的形态对吸收率有显著影响。
研究表明,软胶囊的生物利用度远高于粉末,仅需约30%的剂量即可达到同等效果。例如,一项针对经前情绪障碍的研究发现,每日3.6克的软胶囊与12克的粉末效果相当。
增强效果的协同组合
为了最大化肌醇在生殖和代谢方面的益处,常常推荐将其与其他营养素协同使用。临床实践表明,将肌醇与叶酸或Omega-3脂肪酸联合补充,可以起到1+1>2的效果,进一步增强其对生殖和代谢健康的积极影响。
MYO或MYO + DCI给药对生育治疗和健康妊娠的影响
生 活 方 式
规律运动:有氧运动能增强体内将myo-肌醇转化为DCI的关键酶的活性。
优质睡眠:充足的睡眠有助于减少压力激素(皮质醇)对肌醇的降解。
限制不良习惯:减少精制糖的摄入和限制饮酒,能有效稳定血液中的肌醇水平。
调 节 肠 道 菌 群
益生元纤维(如菊粉、抗性淀粉)和益生菌(如鼠李糖乳杆菌、婴儿双歧杆菌)有助于培养有益的微生物群落,这些菌群能产生短链脂肪酸,支持肌醇介导的代谢健康。
根据肌醇缺乏机制定制
根据五大缺乏机制,可以针对性的策略:
1- 针对「膳食摄入不足」
策略:重点增加全谷物、豆类和坚果的摄入。如果饮食难以保证,应考虑直接补充。
2- 针对「内源合成障碍」(如基因缺陷)
风险人群:携带 ISYNA1 基因变异者;有唐氏综合征家族史的备孕人群。
策略:必须依赖外源性补充,且可能需要比常规更高的剂量。
3- 针对「肾脏过度清除」(如糖尿病状态)
风险人群:高血糖、糖尿病、肥胖及高血压患者。
策略:
-严格控制血糖是重中之重。
-补充 myo-肌醇以弥补流失。
-定期监测肾功能。
4- 针对「肠道吸收障碍或竞争」
A. 葡萄糖竞争
挑战:与高糖食物同服会降低吸收。
策略:选择在空腹或两餐之间服用肌醇。
B. 高剂量DCI的竞争
挑战:单独补充高剂量DCI会反过来抑制myo-肌醇的吸收。
策略:严格遵守40:1或更高的 myo-Ins/DCI 比例,避免使用高剂量DCI的单一配方。
C. 肠道菌群失调
策略:采用组合方案,myo-肌醇 (2-4g/天) + α-乳白蛋白 (作为益生元, 2-3g/天) + 乳杆菌/双歧杆菌益生菌,并配合高纤维饮食。
5- 针对「药物诱导的消耗」
A. 影响中枢神经的药物(锂盐、丙戊酸等)
策略:进行外周补充以缓解副作用。此时配比可能需要调整为 80:1 (myo:DCI)。需定期监测多尿、皮肤问题等代谢指标。
B. 影响肠道菌群的药物(PPI、他汀类、泻药等)
策略:联合补充益生元和益生菌,必要时临时增加myo-肌醇的补充。
特殊人群的注意事项
在为以下人群制定方案时,应格外谨慎,并从低剂量开始:
基于体外和体内模型以及人体研究肌醇肌醇六磷酸盐对健康影响
肌醇的研究正进入一个新纪元,其重要性已远远超越了传统的代谢调节范畴,延伸至癌症、神经保护和肠道健康等前沿领域,进一步巩固了它作为连接人体与微生物生态的核心分子的地位。
癌症代谢的新武器
研究发现,肌醇及其衍生物(如IP6)通过调节细胞内关键的 PI3K/AKT 信号通路并抑制肿瘤血管的生成,表现出显著的抗肿瘤增殖特性。这为开发基于营养的癌症辅助治疗策略提供了新思路。
神经保护的希望之星
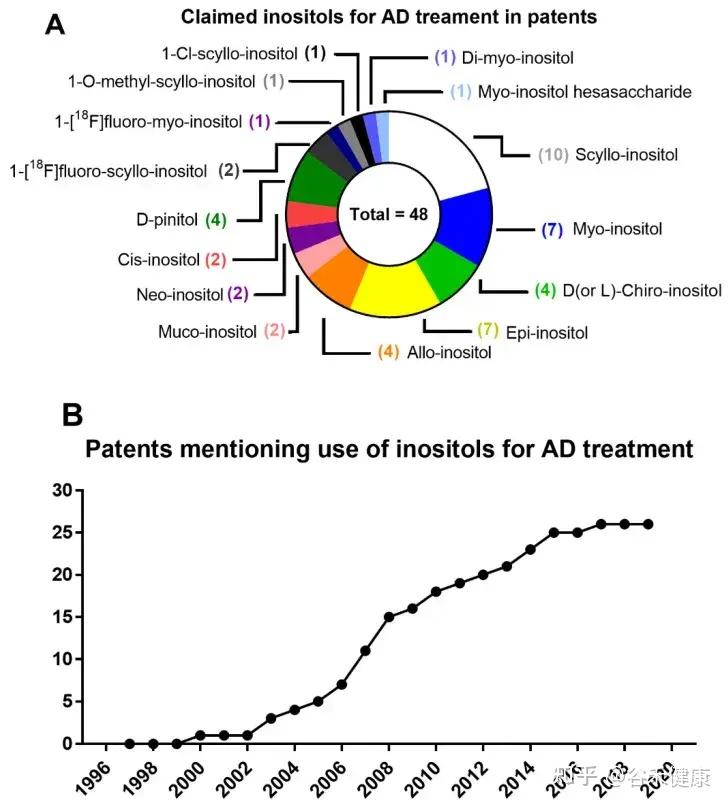
在阿尔茨海默病等神经退行性疾病的研究中,肌醇显示出巨大潜力。它被证实可以减少β-淀粉样蛋白的聚集和脑内的氧化应激,这是阿尔茨海默病的两大核心病理过程。事实上,已有大量专利被授予,用于探索和应用肌醇来治疗阿尔茨海默病,突显了其在该领域的应用前景。
提及和要求使用肌醇治疗阿尔茨海默的专利数量
肠-肝轴的协同调控
最新研究揭示,将肌醇与牛磺酸联合使用,能够有效重编程肝脏的基因表达,不仅能防止因高糖饮食诱导的脂肪肝,还能显著改善肠道内有益的短链脂肪酸。
这些发现共同描绘了:肌醇是一个卓越的整合分子,它能够巧妙地协调宿主自身的代谢节律与体内庞大的微生物生态系统。
肌醇深刻影响着全身的能量平衡与健康信号。过去,我们补充肌醇,期望它能在体内某个需要的地方恰好生效。现在,我们知道肌醇的效能并非孤立存在,它也同时取决于我们的肠道菌群。
基于此,“先养菌,再补剂”可能会成为新的黄金法则。我们可以先通过饮食、生活方式、益生元或益生菌来改造肠道环境,为肌醇补充铺平道路。未来可能将有更深入的研究,去识别究竟是哪些微生物基因簇在主导肌醇的转化;也许我们会找到那些由肌醇衍生出的、尚未被发现的新型健康信使。
主要参考文献:
Lepore E, Lauretta R, Bianchini M, Mormando M, Di Lorenzo C, Unfer V. Inositols Depletion and Resistance: Principal Mechanisms and Therapeutic Strategies. Int J Mol Sci. 2021 Jun 24;22(13):6796.
Jessen H, Bui TPN. Metabolism of inositol derivatives by the gut microbiome. Gut Microbes. 2025 Dec 31;17(1):2564765.
López-Gambero AJ, Sanjuan C, Serrano-Castro PJ, Suárez J, Rodríguez de Fonseca F. The Biomedical Uses of Inositols: A Nutraceutical Approach to Metabolic Dysfunction in Aging and Neurodegenerative Diseases. Biomedicines. 2020 Aug 20;8(9):295.
Wu C, Yang F, Zhong H, Hong J, Lin H, Zong M, Ren H, Zhao S, Chen Y, Shi Z, Wang X, Shen J, Wang Q, Ni M, Chen B, Cai Z, Zhang M, Cao Z, Wu K, Gao A, Li J, Liu C, Xiao M, Li Y, Shi J, Zhang Y, Xu X, Gu W, Bi Y, Ning G, Wang W, Wang J, Liu R. Obesity-enriched gut microbe degrades myo-inositol and promotes lipid absorption. Cell Host Microbe. 2024 Aug 14;32(8):1301-1314.e9.
Fazio A, Rosenstiel P. Language of a Long-Term Relationship: Bacterial Inositols and the Intestinal Epithelium. Cell Metab. 2020 Oct 6;32(4):509-511.
Caputo M, Bona E, Leone I, Samà MT, Nuzzo A, Ferrero A, Aimaretti G, Marzullo P, Prodam F. Inositols and metabolic disorders: From farm to bedside. J Tradit Complement Med. 2020 Mar 24;10(3):252-259.
Bui TPN, Mannerås-Holm L, Puschmann R, Wu H, Troise AD, Nijsse B, Boeren S, Bäckhed F, Fiedler D, deVos WM. Conversion of dietary inositol into propionate and acetate by commensal Anaerostipes associates with host health. Nat Commun. 2021 Aug 10;12(1):4798.
Lentini G, Querqui A, Monti N, Bizzarri M. PCOS and Inositols – Advances and Lessons We are Learning. A Narrative Review. Drug Des Devel Ther. 2025 May 21;19:4183-4199.
Min M, Afzal N, Maloh J, Dulai AS, Ahmad N, Pinzauti D, Sivamani RK. Prospective Comparative Study of an Oral Synbiotic and a Myoinositol-Based Herbal Supplement in Modifying Hormone Levels and the Gut Microbiome in Non-cystic Acne. Dermatol Ther (Heidelb). 2025 Jun;15(6):1331-1350.
Vitacolonna E, Masulli M, Palmisano L, Stuppia L, Franzago M. Inositols, Probiotics, and Gestational Diabetes: Clinical and Epigenetic Aspects. Nutrients. 2022 Apr 8;14(8):1543.
Placidi M, Casoli G, Tatone C, Di Emidio G, Bevilacqua A. Myo-Inositol and Its Derivatives: Their Roles in the Challenges of Infertility. Biology (Basel). 2024 Nov 16;13(11):936.

谷禾健康
厌氧棒状菌属(Anaerostipes)隶属于厚壁菌门下的毛螺菌科,是一类革兰氏阳性厌氧产丁酸菌,在维持宿主肠道稳态与代谢平衡中具有关键作用。
该菌属的显著特征是能够产生丁酸,并且其中的A.caccae与A.hadrus还能利用体内的乳酸与乙酸,将其转化为丁酸。一些菌株还拥有维生素B₁₂和E生物合成通路基因,或是将肌醇转化为丙酸与乙酸的代谢途径。
Anaerostipes与其他肠道内重要菌属还存在密切的相互作用。例如A.caccae可发酵由粘蛋白降解菌A.muciniphila生成的葡萄糖、甘露糖、半乳糖等粘蛋白衍生糖,产生丁酸盐、乙酸盐和乳酸盐。此外,A.hadrus通过分解低聚果糖生成的水解产物能够有效促进包括 Lactobacillus 在内的多种益生菌生长和繁殖,表现出其特有的“互利共代谢”特征。
厌氧棒状菌属中的A.hadrus被发现可代谢抗癌药5‑氟尿嘧啶(5‑FU),参与其降解或转化,这一代谢活动可能改变5‑FU在肠道中的稳定性与吸收效率,从而进一步影响其在体内的生物利用度及临床治疗效果。
Anaerostipes具有作为肠道健康和疾病生物标志物的重要潜力,其在儿童克罗恩病、胆汁淤积、结直肠癌、重度抑郁症、强迫症、食物过敏患者中丰度普遍下降,且与疾病进展、炎症及免疫调控密切相关。
深入研究Anaerostipes的生态特征及其在疾病中变化,不仅有助于揭示肠道菌群与宿主互作机制,还为微生态干预与疾病防治提供潜在的新靶点。
1
分类地位与主要菌种
厌氧棒状菌属(Anaerostipes)隶属于厚壁菌门(Firmicutes)、Clostridiales(梭菌目)下的毛螺菌科(Lachnospiraceae)。
毛螺菌科是人体肠道中重要的核心菌群,在碳水化合物代谢、短链脂肪酸(SCFAs)生成及宿主健康调控中发挥关键作用。
模式种为 :Anaerostipes caccae,其丰度受饮食膳食纤维与碳水组成显著影响;
–A. hadrus为主要优势种,呈泛基因组开放性,适应性强;
–A. rhamnosivorans:新从婴儿粪便中分离出来;
–A. butyraticus在禽类肠道中较为丰富。
DNA G+C 含量(mol%):45.5–46
Anaerostipes属的系统发育树
2
细胞及形态特征
细胞形态
–革兰氏阳性,杆状或略弯曲杆形,无运动性。
-多数为严格厌氧菌,部分可形成芽孢。
-尾端圆钝,长度约2–5μm。
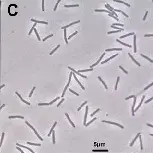
芽孢形成能力
-厌氧棒状菌属(Anaerostipes)中的A. caccae、A. hominis、A. rhamnosivorans能形成芽孢,观察到内生孢子结构。
-虽然A. hadrus、A. butyraticus、A. amylophilus 在实验所用条件下未形成可见孢子,但其基因组保留主要的孢子形成核心基因(spo0A 等)。
-芽孢具有较强的耐氧和耐热能力,部分菌株可在常温下存活数。
3
生长条件
-厌氧棒状菌属(Anaerostipes)为严格厌氧菌,最适生长温度约37°C,适宜pH为6.8–7.2。
– 代谢途径显示该属具极高适应能力,属于肠道生态系统中的“代谢枢纽”。
4
重要的代谢能力
关键丁酸生成菌
-厌氧棒状菌属(Anaerostipes)的一个显著特征是其能够产生丁酸(butyrate),这是一种短链脂肪酸(SCFA),对肠道健康至关重要。丁酸不仅为结肠细胞提供能量,还能促进肠道免疫稳态,并刺激有益菌群的生长。
-同时可生成少量乙酸(acetate)和丙酸(propionate)。
–A.caccae可利用乳酸与乙酸共生成丁酸,是肠道“乳酸清除者”。
–A.hadrus具有细胞外GH32类水解酶,可降解果寡糖(FOS)及菊粉,这种能力使其能与非 FOS 利用菌共代谢。
–A.rhamnosivorans和A.caccae具有独特的肌醇(inositol)转化途径,可将膳食肌醇厌氧代谢为丙酸和乙酸,其代谢活性与宿主血糖、胰岛素水平呈负相关。
–非溶血性,过氧化氢酶和氧化酶均为阴性。
维生素与胆汁酸代谢能力
-厌氧棒状菌属拥有胆汁盐水解酶(bsh)基因,能够去结合胆汁酸,影响宿主胆汁酸稳态。
-厌氧棒状菌属还具有维生素B₁₂和E生物合成通路基因。
5
生态学分布
-广泛存在于全球人群粪便样本中,也出现在部分哺乳动物及禽类(A.butyraticus在鸡盲肠中富集)。
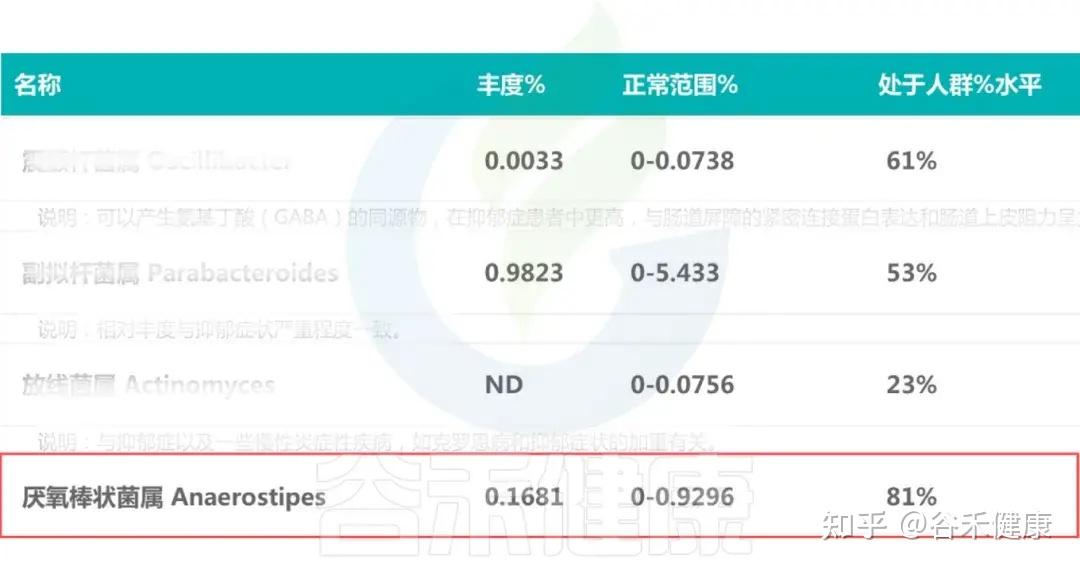
-A.hadrus为人群中优势种,具有开放泛基因组特征,表明其具较高的生态可塑性。
-A.caccae丰度与饮食成分(膳食纤维、寡糖)密切相关。
6
与其他细菌和宿主的互作
厌氧棒状菌属(Anaerostipes)通过代谢共生在肠道生态系统中发挥“碳转接”和“代谢桥梁”的重要作用。
利用乳酸菌产生的乳酸生成丁酸盐
A. caccae已被证明可利用双歧杆菌和乳杆菌等共生菌产生的乳酸盐和乙酸盐发酵产物生成丁酸盐,并能分别转化双歧杆菌的l-乳酸和乳酸杆菌的d-乳酸,从而在减少乳酸积累和维持肠道菌群平衡中发挥重要作用。
利用AKK菌的粘蛋白衍生产物
另一项实验研究发现,A.caccae 可发酵由粘蛋白降解菌 A.muciniphila 生成的葡萄糖、甘露糖、半乳糖和 N-乙酰半乳糖胺等粘蛋白衍生糖,产生丁酸盐、乙酸盐和乳酸盐。A.caccae 和 A.muciniphila 之间的肠粘液层似乎存在共生交叉摄养。
此外,A.hadrus通过分解低聚果糖(FOS)生成的水解产物能够有效促进包括 Lactobacillus 在内的多种益生菌生长和繁殖,表现出其特有的“互利共代谢”特征。
Anaerostipes还与其他细菌存在相互作用,如下所示:
增强
Bacteroidales
Bacteroides
Odoribacter
Peptococcaceae
抑制
Coriobacteriales
Adlercreutzia
Collinsella
Porphyromonas
Prevotella
Clostridium
Clostridiales incertae sedis
Clostridiales Family XIII. Incertae Sedis
Blautia
Coprococcus
Dorea
Lachnospiraceae
Ruminococcaceae
Ruminococcus
Dialister
Campylobacteraceae
Erysipelotrichaceae
此外,Anaerostipes的丁酸盐与丙酸盐产物不仅为结肠上皮提供能量来源,还可:
–促进调节性 T 细胞(Treg)分化;
–抑制 NF‑κB 介导的炎症通路,
–加强肠屏障紧密连接蛋白表达。
7
耐药性
对大多数抗生素都敏感
目前关于 Anaerostipes 的耐药性研究较少,但由于其严格的厌氧特性和对特定环境的依赖,它通常不会对抗生素产生广泛的耐药性。
A. hominis 和一些 A. hadrus 菌株仅表现出编码 β-内酰胺类和多粘菌素抗性的基因,而这些基因在所有 A.caccae 基因组中都不存在。在3个物种中零星观察到与其他抗生素(如四环素、氨基糖苷类和杆菌肽)耐药性相关的基因。
整体而言,A.caccae 与 A.hadrus 均未携带主要的抗生素耐药、毒性或耐胆酸基因。其耐受性主要源于对氧化应激和低pH的内源性适应,与抗生素无关。
厌氧棒状菌属(Anaerostipes)是典型的产丁酸厌氧菌,在人类肠道生态系统中扮演了“代谢枢纽”的角色。它通过能量代谢、基质转化、宿主营养协同、免疫调节和药物代谢等多层机制,对维持肠道与全身健康具有重要意义。
产丁酸、乙酸与丙酸——肠屏障修复、抗炎与能量供应核心驱动力
厌氧棒状菌属(Anaerostipes)的代表菌如A.caccae、A. hadrus、利用乳酸、乙酸及多糖降解产物,通过乙酰辅酶A途径生成丁酸和丙酸。
√ 主要生理作用
–肠上皮能量供给:丁酸是结肠上皮细胞主要能量来源(可达 70% )。
–肠道屏障修复与增强:丁酸刺激紧密连接蛋白(ZO‑1、occludin、claudin)的表达,修复屏障结构,减少肠漏。
-抗炎与免疫调节:丁酸通过抑制 NF‑κB 信号,促进调节性 T 细胞(Treg)分化,减少促炎细胞因子(IL‑6、TNF‑α)释放。
-能量代谢优化:丙酸参与肝糖异生、乙酸供其他益菌利用,共同维持肠内碳流平衡。
这一发酵体系在维持低炎症水平、促进黏膜修复与调节全身能量代谢方面具有核心作用。
分解乳酸、肌醇等底物——维持菌群生态平衡
A. caccae与A. hadrus能使用由双歧杆菌和乳酸杆菌等生成的乳酸与乙酸共代谢,转化为丁酸。这可以避免乳酸过度积累,防止肠腔过酸化,维持pH稳定。

利用低聚果糖和肌醇:A.hadrus可水解低聚果糖,产物反过来促进乳酸菌增殖;并具备将肌醇转化为丙酸与乙酸的代谢途径,有助于调节宿主能量与脂质代谢。
对微生态的意义:通过分解中间代谢物和益生元,Anaerostipes属增强了肠道代谢网络的互补性,是稳定微生态平衡的关键成员。
维生素B12合成——宿主营养代谢支持因子
除了短链脂肪酸的产生外,某些厌氧棒状菌属还可能有助于其他重要的次级代谢物,例如维生素B12。
√ 作用意义
-肠道维生素B12供应源:为需B12菌群如甲烷菌、部分脱硫弧菌提供前体;
–宿主营养参与:B12参与脂肪酸与氨基酸代谢,与能量稳态及神经系统功能密切相关;
–互利生态效应:在共生系统中,Anaerostipes的B12产能增强了菌群代谢互补性。
药物代谢——调节宿主药物应答
√ 可代谢影响抗癌药5‑氟尿嘧啶
A.hadrus被发现可代谢抗癌药5‑氟尿嘧啶(5‑FU),参与其降解或转化,可能影响药物的生物利用度与疗效。

其机制可能涉及脱氨酶或还原酶通路对5‑FU的结构修饰,从而调节肠腔中药物浓度和毒副作用。这表明Anaerostipes在肠道药物代谢群中具有潜在作用,为利用菌株优化药效、降低毒性、实现个体化药物治疗提供新方向。
产生丁酸盐的A.hadrus可能会干扰氟嘧啶药物的疗效或减少结直肠癌患者的不良反应,这可能取决于人类宿主二氢嘧啶脱氢酶(DPD)的水平。
在人体肠道微生态中,厌氧棒状菌属(Anaerostipes)是重要的丁酸生成菌之一,其丰度常被视为肠道健康与代谢稳态的重要指标。
近年来的多项研究发现,不同疾病状态——包括克罗恩病、胆汁淤积、结直肠癌、强迫症、抑郁症、食物过敏等——均伴随着 Anaerostipes 丰度的显著变化。这些波动不仅反映了宿主代谢和免疫环境的改变,也提示该菌属可能在多种疾病的发生与缓解过程中发挥关键调节作用。
1
儿童克罗恩病中Anaerostipes下降

研究显示,克罗恩病患者(尤其是活动期或有高应激水平者)粪便中Anaerostipes的丰度显著下降,与健康儿童对照相比差异明显。
同时,患者中促炎或条件致病菌(如Escherichia-Shigella、Enterococcus、Ruminococcus gnavus等)增加。
2
胆汁淤积患者中Anaerostipes减少

临床与动物模型研究显示,无论是肝胆疾病(如原发性胆汁性胆管炎、药物性胆汁淤积)还是肝外胆汁阻滞,Anaerostipes的相对丰度均呈下降趋势。
这可能是由于Anaerostipes拥有胆汁盐水解酶(bsh)基因,能够去结合胆汁酸,影响宿主胆汁酸稳态。
因此,Anerostipes丰度下降不仅是胆汁淤积相关肠道菌群失衡的标志之一:一方面反映宿主胆汁酸代谢环境的毒性压力;另一方面通过丁酸减少和屏障损伤途径,放大肝‑肠轴炎症与代谢紊乱。
3
Anaerostipes在结直肠癌中减少
√ Anaerostipes随着结直肠癌的发展逐渐减少

有研究显示,从健康个体 → 结直肠腺瘤(CRA) → 结直肠癌(CRC),Anaerostipes的丰度逐渐并显著下降。
在早期腺瘤阶段,该菌种相对丰度已明显低于健康对照;在癌症阶段,其丰度降至最低水平,几乎完全缺失于部分患者样本中。
Anerostipes是主要的丁酸盐生成菌之一。其减少会导致丁酸水平下降,损害上皮细胞线粒体功能,使能量代谢从稳态转向糖酵解。同时,丁酸缺乏削弱了免疫调控和细胞凋亡诱导,使异常增殖细胞逃避免疫清除。
丁酸还能通过抑制组蛋白去乙酰化酶(HDAC)调节基因表达,当产丁酸菌减少时,HDAC 活性增强,促进癌变相关基因(如 c‑Myc、Cyclin‑D1)上调。
综上所述,Anaerostipes既是结直肠肿瘤发生的重要微生态标志,也是肠道微生物干预与癌症预防的潜在靶点。
4
强迫症患者中Anaerostipes减少

有研究收集了21名非抑郁、无药物的强迫症患者和22名年龄和性别匹配的非精神病对照者的晨间粪便和血液样本。
√ 强迫症患者中Anaerostipes等丁酸盐生产菌减少
与对照组相比,强迫症组的物种丰富度/均匀度较低(α多样性,逆辛普森)和三个丁酸盐生产属(Oscillospira、Odoribacter和Anaerostipes)的相对丰度较低。同时,患者的平均CRP水平升高(而IL‑6和TNF‑α无显著变化),且CRP与精神症状呈中至强相关。
5
肾移植受者中Anaerostipes减少

多项肾移植后微生物组研究显示,Anaerostipes丰度在移植早期明显下降,并持续低于健康对照组。
√ 肾移植受者中Anaerostipes减少,并可能导致腹泻
在肾移植受者(KTRs)中,Anaerostipes丰度显著下降,尤其在伴有肠道菌群失调及抗生素或免疫抑制剂相关腹泻的患者中更为明显。
Anaerostipes丰度下降,导致丁酸缺乏削弱上皮细胞能量供应,降低紧密连接蛋白(ZO‑1、occludin)表达,使黏膜屏障完整性受损,从而诱发腹泻。
Anaerostipes缺失与丁酸水平下降呈正相关,提示代谢失衡可能是腹泻的重要机制。
6
重度抑郁症患者中Anaerostipes减少

一项研究探讨了肠道微生物群与重度抑郁症(MDD)的关系,共招募46名活动性MDD患者(a-MDD)及45名健康对照(HC)。
√ Anaerostipes在重度抑郁症患者中丰度较低
研究发现,与健康对照相比,重度抑郁症(MDD)患者中存在相对丰度改变的细菌属:Bilophila(2 倍)和Alistipes(1.5 倍)更高,而Anaerostipes和Dialister在 MDD 患者中较低。
在重度抑郁障碍患者中,Anaerostipes显著减少,伴随丁酸合成能力下降和免疫炎症失衡。这种改变可能通过破坏肠‑脑屏障、增强神经炎症及损害神经营养调控,参与抑郁症的发生与维持。
7
食品过敏婴儿中Anaerostipes减少

在食物过敏婴儿,尤其是牛奶过敏患者中,研究显示 Anaerostipes(特别是 Anaerostipes caccae)丰度显著下降。相反,在健康婴儿中,这一菌种丰富且与免疫耐受密切相关。
√ Anaerostipes减少可能作为食物过敏发生潜在指标
我们大胆推测Anerostipes的减少可作为婴幼儿食物过敏风险和肠道失衡的潜在标志;恢复A.caccae或其丁酸代谢活性(如补充丁酸菌、乳酸底物或膳食纤维)有望通过微生态干预促进免疫耐受并减轻过敏反应。
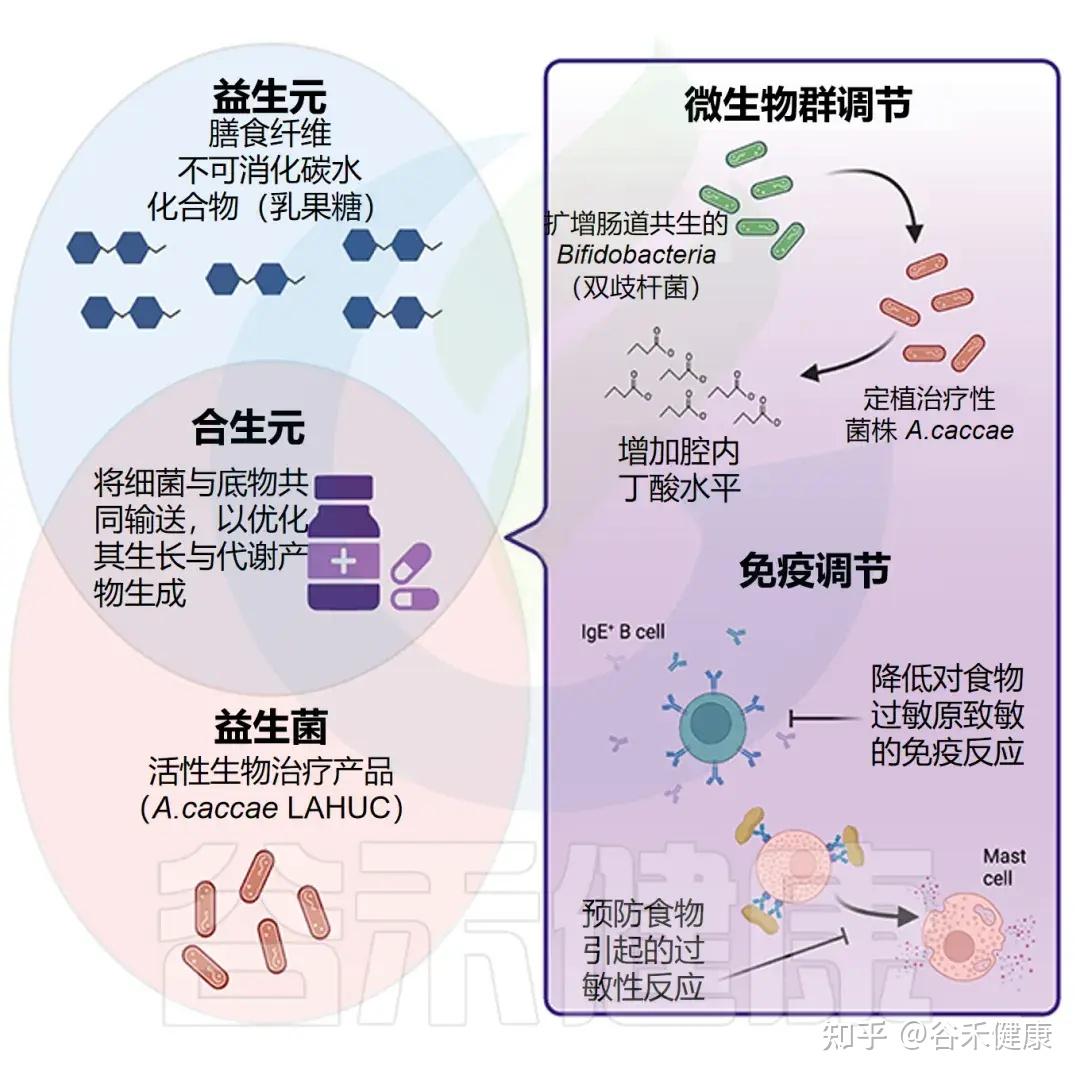
8
Anaerostipes在其他疾病中的丰度变化
√ 阿尔茨海默病患者中减少
研究结果显示,与健康对照相比,阿尔茨海默病患者(尤其是APOE‑ε4携带者)肠道中Anaerostipes的相对丰度显著下降。
注:APOE-ε4是载脂蛋白E(APOE)基因的一个等位基因,与阿尔茨海默病(老年痴呆症)风险显著相关。
√ 焦虑、创伤后应激人群中减少
具有焦虑、抑郁或创伤后应激特征(PTSD样表现)的人群中,Anaerostipes丰度显著下降。而在心理状态健康的对照组中,Anaerostipes 丰度明显较高,且与积极情绪和心理韧性评分呈正相关。
√ 儿童局灶性癫痫患者中减少
研究发现,儿童局灶性癫痫患者发病时肠道中Anaerostipes的丰度显著下降,与健康对照组相比明显减少。
在接受抗癫痫治疗后(尤其是病情稳定、发作频率下降者),Anaerostipes丰度明显回升,丁酸代谢通路相关活性亦随之增强。
这提示Anaerostipes的丰度与癫痫活动状态呈负相关,可能反映肠‑脑功能恢复与神经代谢平衡的改善。
√ 慢性疲劳综合征中减少
研究发现,慢性疲劳综合征(CFS)患者肠道中Anaerostipes相对丰度显著下降,与健康对照相比变化明显。
该菌的降低与患者的疲劳严重程度和认知功能障碍评分呈负相关,即Anaerostipes越少,临床症状越重。
与此同时,CFS患者中促炎或条件致病菌(如Enterobacteriaceae、Alistipes的某些菌株)相对增加,提示肠道生态由抗炎平衡型转向炎症型。
编者的话
厌氧棒状菌属(Anaerostipes)在多种疾病(尤其是慢性炎症、代谢疾病、心理疾病及肿瘤相关疾病)中丰度普遍下降,且与疾病进展、炎症及免疫调控密切相关。
其作为肠道健康和疾病生物标志物具有重要潜力,未来可通过饮食或微生态干预提升其丰度以改善健康。
多种方法可有效调节厌氧棒状菌属(Anaerostipes)丰度,主要包括膳食纤维、益生元、益生菌和生活方式干预。
1
膳食纤维补充
多项研究表明,高纤维饮食——包括菊粉、抗性淀粉及阿拉伯木聚糖等——能够显著提高厌氧棒状菌属(Anaerostipes)的丰度,并增强肠道丁酸盐的生成能力。
这些膳食纤维可作为产丁酸菌的发酵底物,为它们的生长提供能量来源,从而改善肠道微生态结构。该方法在健康成人及动物模型中均显示出良好的效果。
2
益生元与合生元干预
特定类型的益生元(如菊粉型果寡糖)以及合生元组合(如 Lactobacillus fermentum K73 联合高油酸棕榈油与乳清)对Anaerostipes的增殖具有促进作用。这些干预方式通过改变肠道内短链脂肪酸代谢路径与底物利用率,进而提升丁酸生成效率。该策略适用于儿童及成人人群。
3
益生菌联合干预
部分益生菌(如 Bifidobacterium animalis、Lactobacillus rhamnosus)在配合膳食纤维应用后,能间接提升 Anaerostipes的丰度。这种组合干预有助于改善肠道代谢环境和菌群多样性,常用于功能性便秘患者及儿童群体中。
4
饮食结构调整
研究指出,增加全谷物、蔬菜(大蒜、洋葱等)与水果的摄入,减少精制碳水化合物比例,可有效改善肠道微生态组成,并促进 Anaerostipes 的生长。这一健康饮食结构可长期维持肠道菌群稳定,对中国成年人及一般健康人群均有益。
5
运动干预
规律的有氧运动与抗阻训练被证实能够显著提升老年人肠道中 Anaerostipes 的丰度,同时增加粪便中丁酸盐的浓度。这一发现表明,运动干预不仅对维护机体代谢健康具有积极作用,还能通过改善肠道菌群结构,促进产丁酸菌的增长,从而增强能量代谢效率和抗炎能力。
此外,该研究结果进一步说明,长期坚持科学的运动方式能够在多层面维持肠道生态平衡,降低慢性炎症水平,对老年人整体健康状况的改善与代谢功能的恢复具有重要意义,体现了运动与肠道微生态之间的密切关联。
6
减少高盐饮食
研究发现,高盐饮食可显著降低Anaerostipes 丰度,从而削弱丁酸生成与肠道免疫平衡。降低盐摄入对维持肠道微生态多样性与代谢稳态具有重要意义,动物模型结果为该机制提供了有力证据。
主要参考文献
Bhattacharjee D, Millman LC, Seesengood ML, Seekatz AM. Diversity and prevalence of Anaerostipes in the human gut microbiota. bioRxiv [Preprint]. 2025 May 1:2025.05.01.651700.
Liu D, Xie L-S, Lian S, Li K, Yang Y, Wang W-Z, Hu S, Liu S-J, Liu C, He Z. Anaerostipes hadrus, a butyrate-producing bacterium capable of metabolizing 5-fluorouracil. mSphere. 2024 Apr 23;9(4):e0081623.
Hesser LA, Puente AA, Arnold J, Ionescu E, Mirmira A, Talasani N, Lopez J, Maccio-Maretto L, Mimee M, Nagler CR. A synbiotic of Anaerostipes caccae and lactulose prevents and treats food allergy in mice. Cell Host Microbe. 2024 Jul 10;32(7):1163-1176.e6.
Bui TPN, Mannerås-Holm L, Puschmann R, Wu H, Troise AD, Nijsse B, Boeren S, Bäckhed F, Fiedler D, deVos WM. Conversion of dietary inositol into propionate and acetate by commensal Anaerostipes associates with host health. Nat Commun. 2021 Aug 10;12(1):4798.
Caso JR, MacDowell KS, González-Pinto A, García S, de Diego-Adeliño J, Carceller-Sindreu M, Sarramea F, Caballero-Villarraso J, Gracia-García P, De la Cámara C, Agüera L, Gómez-Lus ML, Alba C, Rodríguez JM, Leza JC. Gut microbiota, innate immune pathways, and inflammatory control mechanisms in patients with major depressive disorder. Transl Psychiatry. 2021 Dec 21;11(1):645.
Endo A, Tanno H, Kadowaki R, Fujii T, Tochio T. Extracellular fructooligosaccharide degradation in Anaerostipes hadrus for co-metabolism with non-fructooligosaccharide utilizers. Biochem Biophys Res Commun. 2022 Jul 12;613:81-86.
Guo C, Li Y, Wang P, Li Y, Qiu C, Li M, Wang D, Zhao R, Li D, Wang Y, Li S, Dai W, Zhang L. Alterations of Gut Microbiota in Cholestatic Infants and Their Correlation With Hepatic Function. Front Microbiol. 2018 Nov 13;9:2682.
Turna J, Grosman Kaplan K, Anglin R, Patterson B, Soreni N, Bercik P, Surette MG, Van Ameringen M. The gut microbiome and inflammation in obsessive-compulsive disorder patients compared to age- and sex-matched controls: a pilot study. Acta Psychiatr Scand. 2020 Oct;142(4):337-347.
Singh V, Lee G, Son H, Koh H, Kim ES, Unno T, Shin JH. Butyrate producers, “The Sentinel of Gut”: Their intestinal significance with and beyond butyrate, and prospective use as microbial therapeutics. Front Microbiol. 2023 Jan 12;13:1103836.
Low A, Sheludchenko M, Cheng HE, Koh XQ, Lee JWJ. Complete genome sequences of butyrate producing Anaerostipes hadrus strains BA1 and GIF7 isolated from the terminal ileum of a healthy lean male. Microbiol Resour Announc. 2023 Oct 19;12(10):e0070123.
Modica V, Glávits R, Clewell A, Endres JR, Hirka G, Vértesi A, Béres E, Szakonyiné IP. A Comprehensive Toxicological Safety Evaluation of Anaerostipes caccae. Int J Toxicol. 2025 Nov-Dec;44(6):471-487.
Morinaga K, Kusada H, Watanabe M, Tamaki H. Complete Genome Sequence of Anaerostipes caccae Strain L1-92T, a Butyrate-Producing Bacterium Isolated from Human Feces. Microbiol Resour Announc. 2021 Apr 22;10(16):e00056-21.

谷禾健康
丹毒丝菌科(Erysipelotrichaceae)是厚壁菌门(Firmicutes)中的一类重要细菌,广泛存在于人体肠道中,因其在健康与疾病调控中的重要作用而备受关注。
丹毒丝菌科参与食物分解与能量代谢,并在脂质代谢、胆汁酸循环和免疫调控中发挥关键作用,对维持机体代谢稳态至关重要。
并且该家族的细菌具有较高的免疫原性,丹毒丝菌科的某些成员相比其他肠道菌群更易被IgA包被。研究表明,其相对丰度与肿瘤坏死因子α(TNF)水平呈正相关,并与多种免疫相关疾病密切相关。在炎症性肠病及其他免疫介导疾病(如多发性硬化、特应性皮炎和食物过敏)中,丹毒丝菌科的异常增减可能影响宿主免疫稳态,从而调节炎症反应。
丹毒丝菌科的一个显著特点是功能异质性与环境敏感性。在健康状态下,丹毒丝菌科可以促进短链脂肪酸生成、维持上皮屏障功能及调节免疫应答,有助于肠道稳态。然而,在高脂饮食、代谢紊乱或免疫异常等条件下,其丰度和代谢模式往往出现明显波动,可能促发低度炎症或代谢失衡。大量研究显示,丹毒丝菌科的丰度变化与肥胖、糖代谢异常、炎症性肠病、自闭症谱系障碍及神经退行性疾病等多种疾病密切相关。
深入探索丹毒丝菌科在宿主代谢中的作用机制,不仅有助于揭示肥胖与代谢疾病的微生态基础,也为通过微生物干预改善人体健康提供了潜在的新策略。
注:在生物分类学中,“科”(Family)是界、门、纲、目、科、属、种层级中的一级,科并不属于精细的分类层面,但是在人类健康、科学研究和生态系统中有些是公认且非常重要的细菌科,例如肠杆菌科(Enterobacteriaceae):这是医学上最重要的科之一,包含了非常常见的大肠杆菌(Escherichia coli)和沙门氏菌(Salmonella)。
葡萄球菌科(Staphylococcaceae):主要包括葡萄球菌属 (Staphylococcus),特别是金黄色葡萄球菌(Staphylococcus aureus),普遍存在于皮肤和黏膜上的机会性病原体等。
而丹毒丝菌科成员在脂质代谢、胆汁酸转化和炎症调节等方面具有相似生态功能,其丰度在疾病状态下往往整体升降,呈现更一致的变化趋势。
丹毒丝菌科(Erysipelotrichaceae)是一种革兰氏阳性菌,广泛分布于人体、哺乳动物、鸟类、鱼类和昆虫肠道中的细菌家族,属于厚壁菌门(Firmicutes),Erysipelotrichia纲、Erysipelotrichales目。在肠道微生态、宿主代谢和炎症反应中具有重要作用。
1
形态特征与分类
丹毒丝菌科成员多为革兰氏阳性、直的或稍微弯曲的细长杆状或丝状细胞,既有严格厌氧菌,也有兼性厌氧菌和微需氧菌。不运动,不产生内生孢子。
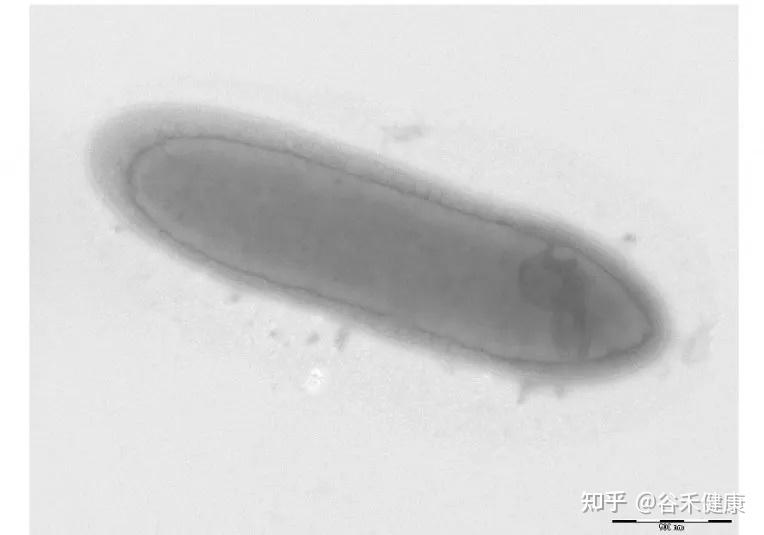
该家族的 G+C 含量较低(约36-40mol%),细胞壁结构独特。目前已鉴定出二十多个属,包括 Erysipelothrix、Allobaculum、Bulleidia、Faecalibaculum、Holdemania、Catenibacterium、Dubosiella等。
其模式菌属为丹毒丝菌属(Erysipelothrix)。
2
生态分布与功能
生长条件:温度范围5–42°C,最适30–37°C;不耐热(60°C 15分钟即可灭活)。
pH范围6.7–9.2,最适7.2–7.6。
丹毒丝菌科(Erysipelotrichaceae)广泛存在于人类和动物肠道,是常见的共生菌群之一。它们与宿主的脂质代谢密切相关,研究显示高脂饮食、肥胖、代谢紊乱等状态下该家族丰度常常升高。此外,丹毒丝菌科也与炎症性肠病、免疫反应、某些代谢疾病(如高胆固醇血症)相关。
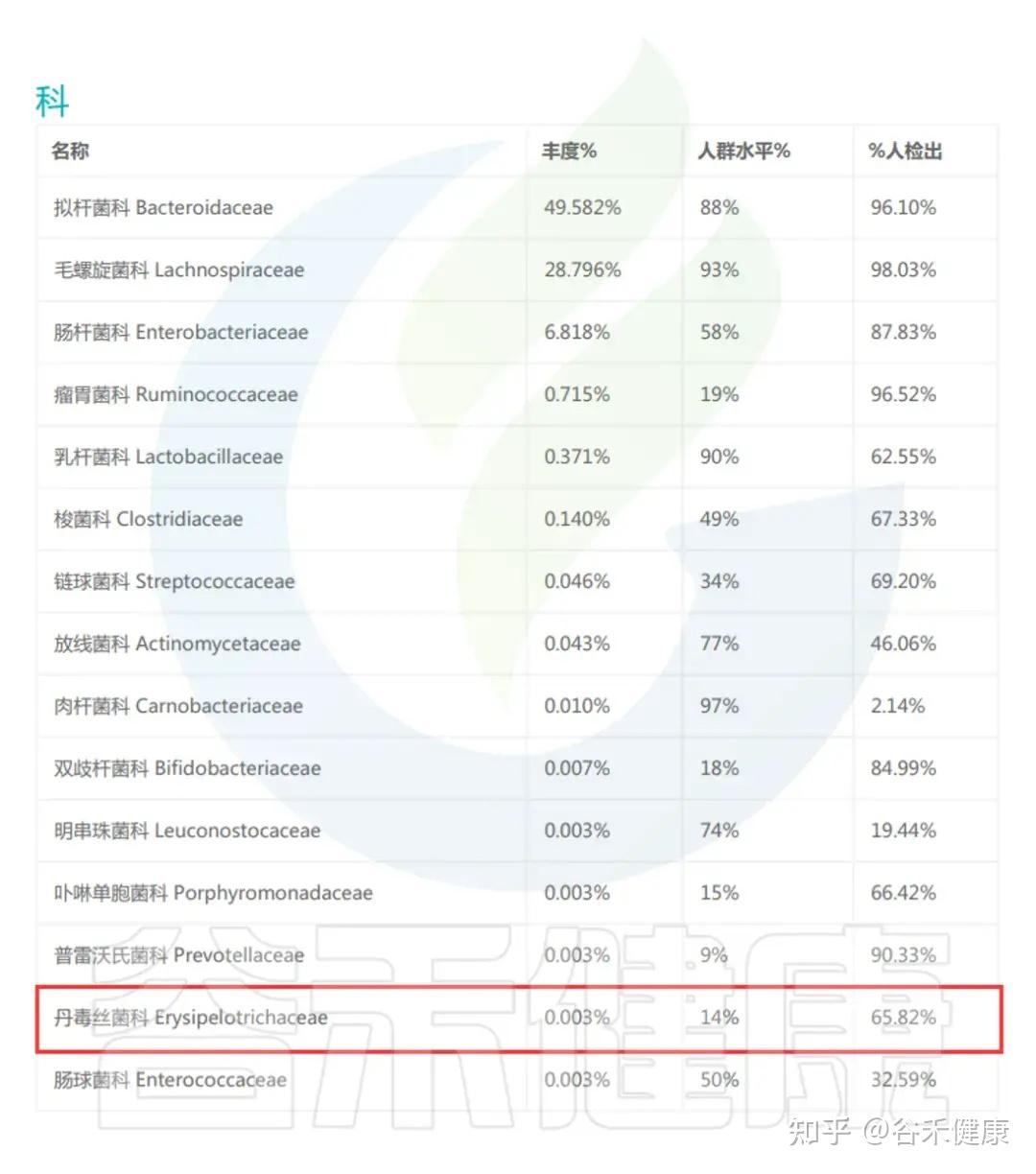
3
代谢特性
该家族的细菌具备较强的代谢多样性,能够发酵多种类型的碳水化合物,在这一过程中产生多种短链脂肪酸,例如乙酸、丙酸和丁酸等。部分菌株还具有利用植物多糖以及 N-乙酰半乳糖胺(GalNAc)的能力,这种代谢特性使它们在复杂碳源环境中能够持续生长和维持能量供应。
与此同时,这类细菌在宿主的蛋白质分解、脂肪代谢以及能量吸收过程中也发挥着一定的辅助作用,有助于食物成分的进一步消化与转化,从而在营养物质的利用中占据重要地位。
4
抗生素敏感性
目前关于整体的耐药性特征仍缺乏系统研究,因此其抗药机制和范围尚未完全明确。
然而,根据现有资料可知,该科下属的丹毒丝菌属(Erysipelothrix)在抗生素敏感性方面具有一定的特征表现。研究显示,这一属的细菌通常对磺胺类药物、多黏菌素、庆大霉素以及卡那霉素等抗生素具有明显的耐药性,表现出对这些药物的较强抵抗能力;而在另一方面,它们对青霉素、氯霉素和四环素等抗菌药物则较为敏感。
5
与其他细菌的相互作用
丹毒丝菌科与其他细菌之间存在一定程度的相互作用,能够与多种不同类型的细菌发生协同或竞争关系,包括:
增强:
Bacteroidales
Bacteroides
Odoribacter
Peptococcaceae
抑制:
Bifidobacterium
Coriobacteriales
Adlercreutzia
Collinsella
Porphyromonas
Prevotella
Clostridium
Clostridiales incertae sedis
Clostridiales Family XIII. Incertae Sedis
Blautia
Coprococcus
Dorea
Lachnospiraceae
Ruminococcaceae
Ruminococcus
Dialister
Campylobacteraceae
被抑制:
Bifidobacterium
Coriobacteriales
Adlercreutzia
Collinsella
Bacteroidales
Bacteroides
Porphyromonadaceae
Odoribacter
Parabacteroides
Porphyromonas
Prevotella
Rikenellaceae
Alistipes
Turicibacter
Streptococcus
Clostridiales
Catabacteriaceae
Clostridium
Clostridiales incertae sedis
Peptoniphilus
Clostridiales Family XIII. Incertae Sedis
Blautia
Lachnospiraceae
Coprococcus
Dorea
Eubacterium
Lachnobacterium
Lachnospira
Roseburia
Peptococcaceae
Ruminococcaceae
Ruminiclostridium
Acetivibrio
Faecalibacterium
Oscillospira
Ruminococcus
Acidaminococcus
Dialister
Phascolarctobacterium
Veillonella
Rubrivivax
Alcaligenaceae
Oxalobacter
Bilophila
Desulfovibrio
Campylobacteraceae
Enterobacteriaceae
Escherichia
Holdemania
Akkermansia
6
健康与疾病相关性
•代谢疾病方面:研究结果显示,丹毒丝菌科(Erysipelotrichaceae)的相对丰度与多种代谢性紊乱密切相关,包括肥胖、高脂血症以及肝脂肪变性等。其数量变化常被视为代谢异常的一种微生态特征,提示该菌群可能在宿主脂肪代谢、胆汁酸循环以及能量平衡调控中发挥一定作用。
•炎症与免疫方面:该家族的细菌具有较高的免疫原性,其丰度波动与多种免疫相关疾病密切联系。在炎症性肠病及其他免疫介导疾病(例如多发性硬化、特应性皮炎和食物过敏)中,丹毒丝菌科(Erysipelotrichaceae)的异常增减被认为可能影响宿主免疫反应的稳定性,从而参与炎症反应的调节过程。
丹毒丝菌科在宿主炎症中的潜在作用
有研究人员开发了一种基于免疫球蛋白 A(IgA)包被细菌进行分类和测序的技术——IgA-SEQ,发现丹毒丝菌科的某些成员相比其他肠道菌群被 IgA 高度包被。随后,在研究慢性 HIV 感染且接受抑制性抗逆转录病毒治疗的患者时发现,丹毒丝菌科的相对丰度与肿瘤坏死因子 α(TNF)水平呈正相关。
•其他疾病方面:部分研究还提示,该菌群的丰度变化与多种神经系统及精神类疾病有关。例如,在帕金森病和阿尔茨海默病等神经退行性疾病患者中,其比例与病情进展存在一定相关性;而在抑郁症与精神分裂症等精神障碍人群中也观察到类似现象。
这些发现表明,丹毒丝菌科(Erysipelotrichaceae)在多系统疾病中的潜在作用值得进一步深入探讨,后文将对此内容进行更为详细的阐述。
1
结直肠癌中水平增加
丹毒丝菌科在胃肠道相关疾病中的重要性,已经被多项研究证实。其在结直肠癌患者体内的富集现象凸显了该菌群与肿瘤发生之间的联系。
具体而言,与健康个体相比,结直肠癌患者肠腔中丹毒丝菌科的丰度显著升高,这种差异性被认为可能与肠道炎症环境的变化密切相关。
此外,在以1,2-二甲基肼诱导的结肠癌动物模型中,肿瘤组中该菌科的丰度水平也明显高于对照组,进一步支持了其在结肠肿瘤形成过程中的潜在作用。这些发现共同表明,丹毒丝菌科的变化可能是肠道微生态失衡与结直肠癌发病机制之间的重要连接环节。

2
炎症性肠病中丰度发生变化
在炎症性肠病(IBD)患者及动物模型中,丹毒丝菌科的丰度发生变化,但相关证据并不一致。
•小鼠肠道炎症中丹毒丝菌科增加
有研究发现,在感染弓形虫或贾第鞭毛虫的小鼠中,回肠处的菌群向丹毒丝菌科转变;另一项研究发现,丹毒菌科丰度显著增加时,小鼠发生了肿瘤坏死因子(TNF)驱动的克罗恩病 (CD) 样透壁炎症。
•也有研究发现克罗恩病中丹毒丝菌科丰度减少
相反,也有研究发现克罗恩病(CD)复发患者的丹毒丝菌科显著减少,另一项研究同样观察到新发 CD 患者中该菌科的丰度下降。他们分析了 IBD 患者和胆汁代谢基因对照的公开宏基因组数据集,发现源自厚壁菌门类群(包括丹毒科)的胆汁盐水解酶基因的丰度在 IBD 中与健康对照相比显著减少。

这些结果表明不同宿主间存在差异,炎症小鼠模型的丹毒科水平较高,而 IBD 患者的水平较低。对此的两种可能的解释包括小鼠和人类肠道微生物群的固有差异或它们在感知细菌配体时先天免疫反应的差异。
注:当以高IgA包被菌群(含丹毒丝菌科)定植无菌小鼠后,发现这些小鼠在葡聚糖硫酸钠处理后发生更严重的结肠炎。
3
丹毒丝菌科有望作为肠道疾病生物标志物
在对克罗恩病(CD)、溃疡性结肠炎(UC)、结直肠癌(CRC)及艰难梭菌感染(CDI)总计3048份肠道菌群 16S rRNA 数据的荟萃分析中,研究发现:

•肠道疾病患者普遍存在丹毒丝菌科的升高
与健康对照组相比,肠道疾病患者(包括CD、UC、CRC和CDI)普遍表现出丹毒丝菌科(Erysipelotrichaceae)丰度的升高。
该科群体的增加与肠道炎症和免疫反应异常密切相关,提示其可能参与肠道菌群失调(dysbiosis)的形成与维持。
在克罗恩病(CD)和艰难梭菌感染(CDI)中,丹毒丝菌科(Erysipelotrichaceae)尤其突出,其中的Erysipelatoclostridium属被鉴定为两种疾病的潜在微生物标志物。
关于丹毒丝菌科在人类疾病中作用的最有力证据来自其与代谢紊乱的关联研究。
1
肥胖个体中丰度升高
早期研究发现,在饮食诱导的肥胖动物中,丹毒丝菌科物种大量繁殖;肥胖个体也表现出该菌科丰度升高。

•参与脂质代谢,与肝脏脂肪含量正相关
后续研究进一步证实,该菌群与宿主体内脂质代谢密切相关。研究还发现丹毒丝菌科的四个谱系,对饮食及宿主健康表型的反应不同。观察到高脂饮食或西方饮食小鼠中该菌科的增加;并有研究发现其丰度与女性受试者肝脏脂肪含量呈正相关,且这一效应在控制胆碱摄入的条件下表现明显。
2
丹毒丝菌科与较高的代谢紊乱相关
对20名年龄在 58 至 71 岁之间、糖耐量正常、糖尿病前期或 2 型糖尿病的个体中,从粪便样本中扩增的 16S rRNA 基因的条形码测序,比较了肠道细菌群落发现:

•丹毒丝菌科丰度过高增加代谢紊乱风险
特定的微生物群在不同的代谢状态下相对富集或减少。例如,丹毒丝菌科(Erysipelotrichaceae)的丰度较高与代谢紊乱有关,而霍尔德曼氏菌属(Holdemania)与脂质和葡萄糖代谢受损的临床指标相关。与代谢性疾病临床表现的相关表明,这些微生物可能有助于代谢损伤或健康。
一项针对奥地利男女肠道菌群与糖代谢紊乱的研究也发现,丹毒丝菌科(Erysipelotrichaceae)和毛螺菌科(Lachnospiraceae)部分菌群与代谢异常相关。Lachnospiraceae科和瘤胃球菌科成员可将复杂多糖分解为短链脂肪酸,如丁酸、丙酸和乙酸。而丹毒丝菌科在肥胖患者接受胃旁路手术后,其丰度明显下降。
3
高脂肪摄入和抽烟会增加丹毒丝菌科丰度
营养学研究进一步表明,膳食脂肪对丹毒丝菌科的丰度具有显著影响。在肠外营养相关肝损伤的小鼠中发现,丹毒丝菌科中特定分类单元积累明显,而肝损伤的减轻则伴随着抗生素治疗后该菌群的下降。
研究还显示,丹毒丝菌科的变化与肠外营养液中大豆油基脂质乳剂的使用密切相关。
此外在进行多重比较校正后还发现,与从不吸烟者相比,丹毒丝菌科的细菌类群在吸烟者中显著富集。
•低脂饮食降低丹毒丝菌科水平及血脂或胆固醇
在接受低脂(约13.5g/1000 Kcal)排他性肠内营养(EEN)治疗的患者中观察到类似现象。结合关于 EEN 治疗可显著减少克罗恩病(CD)患者内脏脂肪面积的结果,进一步暗示脂肪摄入类型可能影响治疗效果。还有研究人员提出,膳食脂肪的组成对 CD 肠内营养疗法的疗效至关重要。
与健康人相比,炎症性肠病(IBD)患者常表现出不同的胆固醇水平,而针对 TNF 的英夫利昔单抗维持治疗则会导致血胆固醇升高及腹部脂肪显著增加。
综上所述,IBD患者丹毒丝菌科丰度的波动可能与血脂或胆固醇表型,以及饮食组成密切相关,并可能对疾病表现和活动程度产生重要影响。
1
自闭症儿童中丰度较高
研究发现,与健康对照组相比,自闭症谱系障碍(ASD)儿童的肠道菌群生物量、丰富度和多样性均显著增加,且微生物群落结构发生明显改变。在属水平上,未鉴定的 Lachnospiraceae、Clostridiales、Erysipelotrichaceae、Dorea、Collinsella 和 Lachnoclostridium 的相对丰度升高。未鉴定的丹毒丝菌科、粪杆菌及毛螺菌科的存在与 ASD 症状严重程度正相关。

•丹毒丝菌科可能有助于判断自闭症严重程度
进一步分析显示,重度 ASD 儿童中未鉴定的丹毒丝菌科丰度最高,而粪杆菌数量最低;其丹毒丝菌科水平也明显高于轻度ASD儿童,粪杆菌则相对更低。因此我们推测肠道微生物群落的结构与自闭症症状的严重程度相关,肠道微生物群分析可能有助于症状学,肠道菌群的调节可能是未来ASD治疗的新策略。
2
阿尔兹海默病中丹毒丝菌科UCG-003减少
在阿尔茨海默病(AD)患者中,肠道微生物群呈现出明显的紊乱特征。具体而言,与健康对照组相比,AD 患者体内的双歧杆菌、梭状芽孢杆菌、Castellaniella、丹毒丝菌科 UCG-003、罗氏菌属、Tuzzerella、乳杆菌科以及Monoglobus的丰度均显著减少。
这些细菌通常与维持肠道生态平衡、促进短链脂肪酸生成及调节免疫反应等功能密切相关,因此它们的减少可能反映出宿主体内代谢与炎症状态的异常。

丹毒丝菌科(Erysipelotrichaceae)是一类肠道常见菌群,广泛参与宿主的代谢、炎症及多种疾病过程。高脂饮食、抽烟等不良习惯会增加丹毒丝菌科水平。多项研究及谷禾数据库均显示,在肥胖和代谢紊乱人群中该菌科显著富集。
由于具备较高免疫原性,丹毒丝菌科在肠道疾病(克罗恩病、溃疡性结肠炎、结直肠癌及艰难梭菌感染)中丰度上升,未来有望成为反映肠道健康状况的潜在生物标志物。
富含膳食纤维或特定益生元(如阿拉伯木聚糖低聚糖、黄酮类槲皮素、菊粉、薏米)的饮食可调节丹毒丝菌科(Erysipelotrichaceae)丰度,说明饮食可以通过菌群进而影响人体代谢健康。
此外,太极拳和运动等生活方式干预也可影响丹毒丝菌科的丰度,提示其在心理与生理健康调节中的潜在作用。研究发现,肠道中未鉴定的丹毒丝菌科物种丰度越高,自闭症症状越严重,进一步证实该菌科在神经系统疾病中的参与,可能有助于辅助判断自闭症严重程度。
未来,应通过多组学分析和功能实验进一步揭示丹毒丝菌科不同成员的代谢特性及其与其他肠道菌群的互作机制。随着肠道菌群检测技术的发展,丹毒丝菌科有望成为评估代谢健康、监测炎症状态及指导微生态干预的重要生物标志物,为精准营养和疾病预防提供新的思路与工具。
主要参考文献
Kaakoush NO. Insights into the Role of Erysipelotrichaceae in the Human Host. Front Cell Infect Microbiol. 2015 Nov 20;5:84.
Ding X, Xu Y, Zhang X, Zhang L, Duan G, Song C, Li Z, Yang Y, Wang Y, Wang X, Zhu C. Gut microbiota changes in patients with autism spectrum disorders. J Psychiatr Res. 2020 Oct;129:149-159.
Lippert K, Kedenko L, Antonielli L, Kedenko I, Gemeier C, Leitner M, Kautzky-Willer A, Paulweber B, Hackl E. Gut microbiota dysbiosis associated with glucose metabolism disorders and the metabolic syndrome in older adults. Benef Microbes. 2017 Aug 24;8(4):545-556.
Teng D, Jia W, Wang W, Liao L, Xu B, Gong L, Dong H, Zhong L, Yang J. Causality of the gut microbiome and atherosclerosis-related lipids: a bidirectional Mendelian Randomization study. BMC Cardiovasc Disord. 2024 Mar 2;24(1):138.
Cox LM, Sohn J, Tyrrell KL, Citron DM, Lawson PA, Patel NB, Iizumi T, Perez-Perez GI, Goldstein EJC, Blaser MJ. Description of two novel members of the family Erysipelotrichaceae: Ileibacterium valens gen. nov., sp. nov. and Dubosiella newyorkensis, gen. nov., sp. nov., from the murine intestine, and emendation to the description of Faecalibaculum rodentium. Int J Syst Evol Microbiol. 2017 May;67(5):1247-1254.
Mancabelli L, Milani C, Lugli GA, Turroni F, Cocconi D, van Sinderen D, Ventura M. Identification of universal gut microbial biomarkers of common human intestinal diseases by meta-analysis. FEMS Microbiol Ecol. 2017 Dec 1;93(12).
Zhang H, DiBaise JK, Zuccolo A, Kudrna D, Braidotti M, Yu Y, Parameswaran P, Crowell MD, Wing R, Rittmann BE, Krajmalnik-Brown R. Human gut microbiota in obesity and after gastric bypass. Proc Natl Acad Sci U S A. 2009 Feb 17;106(7):2365-70.

谷禾健康
胆碱(2-羟基‑N,N,N‑三甲基乙铵),是我们身体正常运转不可或缺的一种必需营养素。它的角色至关重要:一方面,它是构成细胞膜的重要原料,参与合成磷脂酰胆碱等物质来维持细胞的完整结构;另一方面,它也是神经递质“乙酰胆碱”的前体物质,在大脑与神经功能中扮演着关键角色。
正因如此,乙酰胆碱的水平失衡已成为临床上监测阿尔茨海默病、帕金森病及重症肌无力等疾病的关键指标。在日常生活中,我们可以通过食用鸡蛋黄、动物内脏以及大豆等来获取较为丰富的胆碱。
然而,对于这样一种重要的营养素,并非多多益善,需要维持一个平衡,过高或过低都可能对健康构成威胁。
当胆碱摄入不足时,与婴儿大脑发育,中老年神经退行性疾病,代谢综合征以及癌症风险都密切相关。研究报道胆碱缺乏造成基因甲基化失衡,可能促发肝癌、乳腺癌及结直肠癌等的发生。
与此同时最近研究发现,一些肠道细菌例如拟杆菌和梭菌细菌能将胆碱转化三甲胺(TMA),然后再经由肝脏FMO3酶氧化生成氧化三甲胺(TMAO),而TMAO与动脉粥样硬化和血栓形成等心血管疾病密切相关,被视为心脑血管的潜在风险指标。
因此,本文带大家一起了解什么是胆碱,及其与肉碱区别,胆碱在人体的转化代谢和对健康的影响,胆碱不平衡引发的疾病以及饮食调整与健康防控的科学策略。
什么是胆碱?
胆碱(2-羟基-N,N,N-三甲基乙铵),是人类必需的营养素,对大脑、肝脏和全身代谢等都非常重要。它既是细胞膜的组成原料(主要参与合成磷脂,如磷脂酰胆碱),又是神经递质乙酰胆碱的前体,帮助大脑传递信号、维持记忆和注意力。同时,胆碱还能转化为甜菜碱(betaine),在体内甲基化反应中提供“甲基”,参与DNA和蛋白质的调控,是表观遗传调节的重要环节。
▸ 胆碱的生物学功能
★ 关键生理角色
结构作用:是细胞膜主要磷脂(PC、磷脂酰乙醇胺PE)的前体,维持膜的完整性与流动性。
神经递质合成:为乙酰胆碱(acetylcholine)合成提供原料,参与记忆、注意和肌肉控制。
甲基供体来源:通过转化为甜菜碱供给 S-腺苷甲硫氨酸(SAM)的甲基,参与DNA、蛋白和磷脂的甲基化,对基因表达和表观遗传调控至关重要。
脂质代谢与肝功能:促进脂肪从肝脏输出,预防脂肪肝。
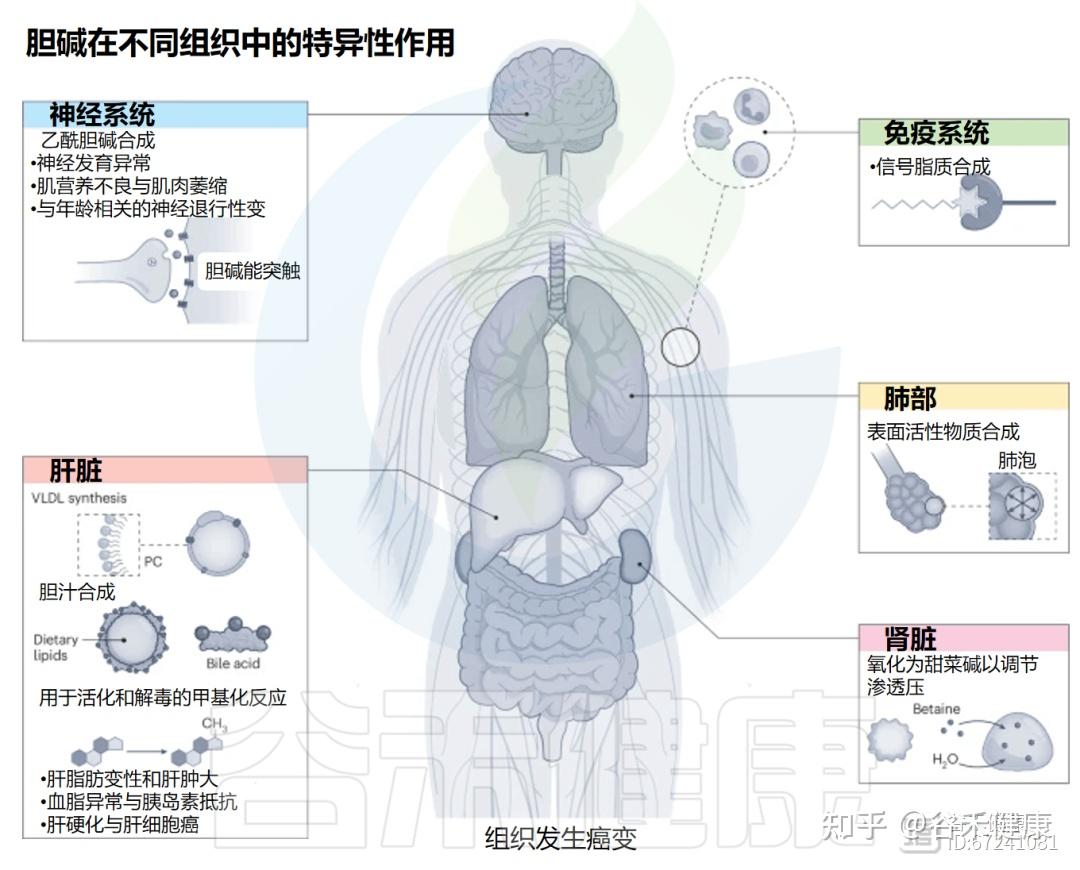
▸ 影响神经系统发育与功能维持
·胎儿期及早期生命阶段高胆碱摄入可增强大脑海马区的神经发生、突触可塑性与学习记忆能力。
·唐氏综合征模型(Ts65Dn小鼠)中改善注意与空间学习障碍,恢复海马神经发生。
·Rett综合征、小鼠精神分裂症模型(DBA/2小鼠):改善运动协调与感觉信息处理。
·阿尔茨海默病(AD)模型:减少Aβ斑块沉积、缓解胶质细胞活化、维持胆碱乙酰转移酶(CHAT)水平,保护胆碱能系统功能。
▸ 认知维护与老化防护
·成人摄入胆碱量与语言记忆、视觉记忆表现呈正相关。
·胆碱充足可降低白质高信号体积,后者是认知衰退与阿尔茨海默病的影像学标志。
·胆碱与omega-3脂肪酸共同维持脑内磷脂酰胆碱-DHA(PC-DHA)的正常水平。
·充足胆碱可促进血浆及红细胞PC-DHA含量,提高脑内DHA供给,从而改善或延缓认知衰退。
要充分发挥胆碱的这些健康益处,我们就必须确保它的稳定供给。那么,哪些食物才是胆碱的宝库呢?
尽管人体可以通过内源性途径合成一定量的胆碱,但这种合成能力十分有限,通常不足以满足身体需求。因此,还需要通过日常饮食获得,以弥补内源性合成的不足。
▸ 食物中的胆碱
▸ 母乳是婴幼儿重要的胆碱来源
母乳是纯母乳喂养婴儿在出生后6个月内唯一的胆碱来源,被世界卫生组织公认为婴儿的最佳营养来源。
新生儿和婴儿在快速生长阶段对胆碱需求量较高。研究显示,母乳中总胆碱含量从初乳到出生后两周明显上升,随后在6个月后趋于稳定,成熟母乳中总胆碱浓度约为125–166mg/L(1198–1600μmol/L)。
注:部分研究认为母亲的膳食胆碱摄入量可能影响乳汁中胆碱的浓度。补充胆碱可使成熟乳中游离胆碱、磷酸胆碱、甘油磷酸胆碱及总胆碱水平提高约20%–38%。
▸ 不同配方奶粉间胆碱含量差异显著
当无法母乳喂养时,婴儿配方奶粉是主要替代选择。目前建议婴儿配方奶中胆碱含量为7–50mg/100kcal,相当于每日37–265mg,总摄入量取决于婴儿每日约0.78L的奶量。
不同配方和品牌之间的胆碱形式与含量差异较大,大多以氯化胆碱为主要添加形式,部分含有少量大豆卵磷脂。分析显示,不同产品胆碱含量可相差两倍(52–104mg/L),各国市售配方平均在82–209mg/L之间。
研究表明,与大豆配方相比,牛奶配方中游离胆碱和磷脂酰胆碱含量较低,但磷酸胆碱、甘油磷酸胆碱及总胆碱水平更高;与母乳相比,牛奶配方中磷酸胆碱和鞘磷脂水平较低,而甘油磷酸胆碱较高,总胆碱接近。
▸ 鸡蛋、鱼、肝脏、牛奶是优质的胆碱来源
大量证据表明,动物性食物的总胆碱含量普遍高于植物性食物。肝脏、鸡蛋、牛肉、鱼类及海鲜、猪肉和鸡肉是最富含胆碱的代表,其中大部分以脂溶性的磷脂酰胆碱形式存在,是细胞膜的重要组成部分。牛奶因日常摄入频繁,也是良好的胆碱来源。
此外,豆类和坚果、谷物以及各类种子中也含有一定量的胆碱,这些植物性食物虽然胆碱含量较动物性食物低,但仍对日常摄入具有补充作用。同时,十字花科蔬菜如西兰花、花椰菜等也提供一定水平的胆碱,可作为均衡饮食中重要的植物来源。
下面列出了一些常见食物中胆碱和甜菜碱的含量:
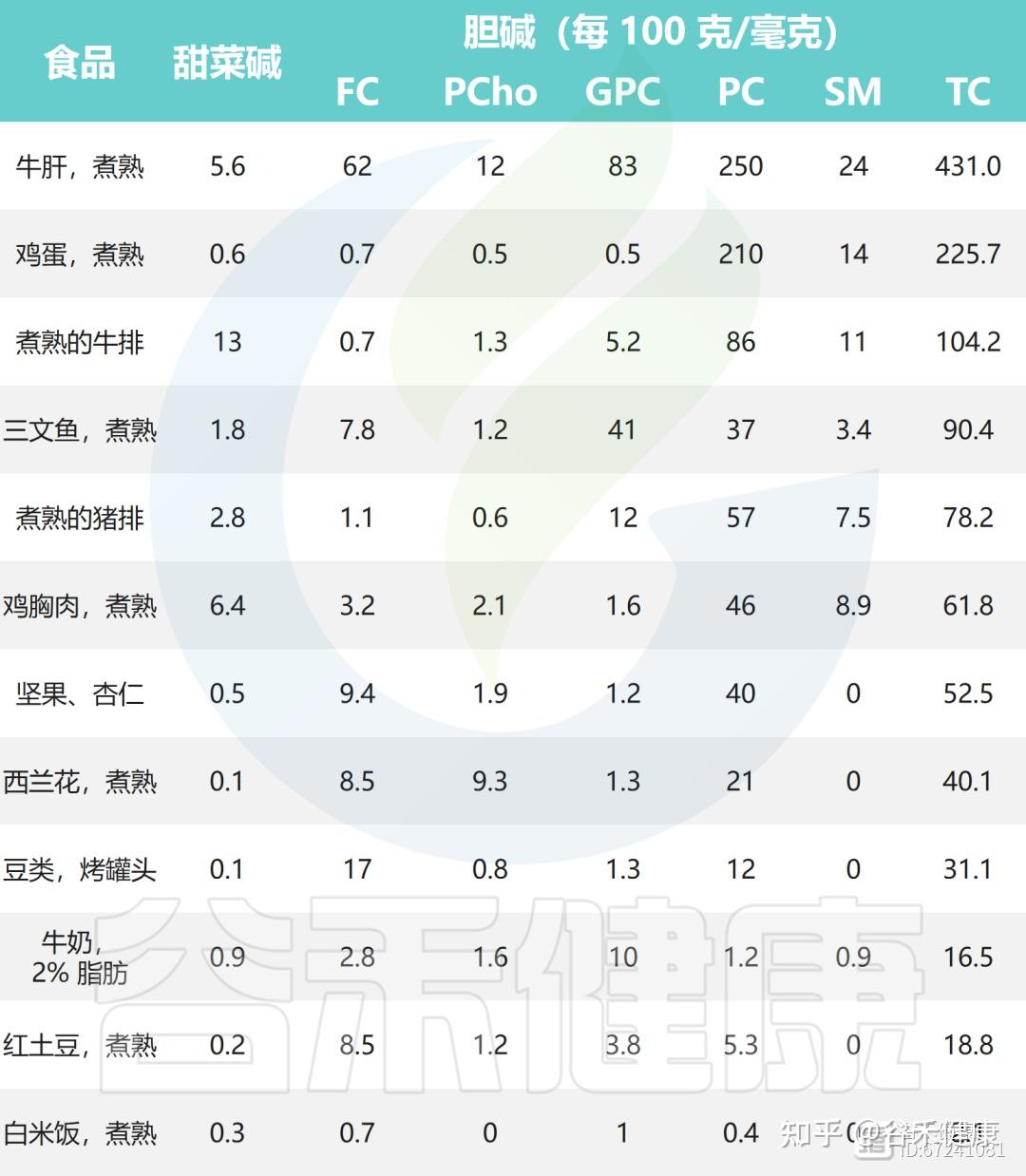
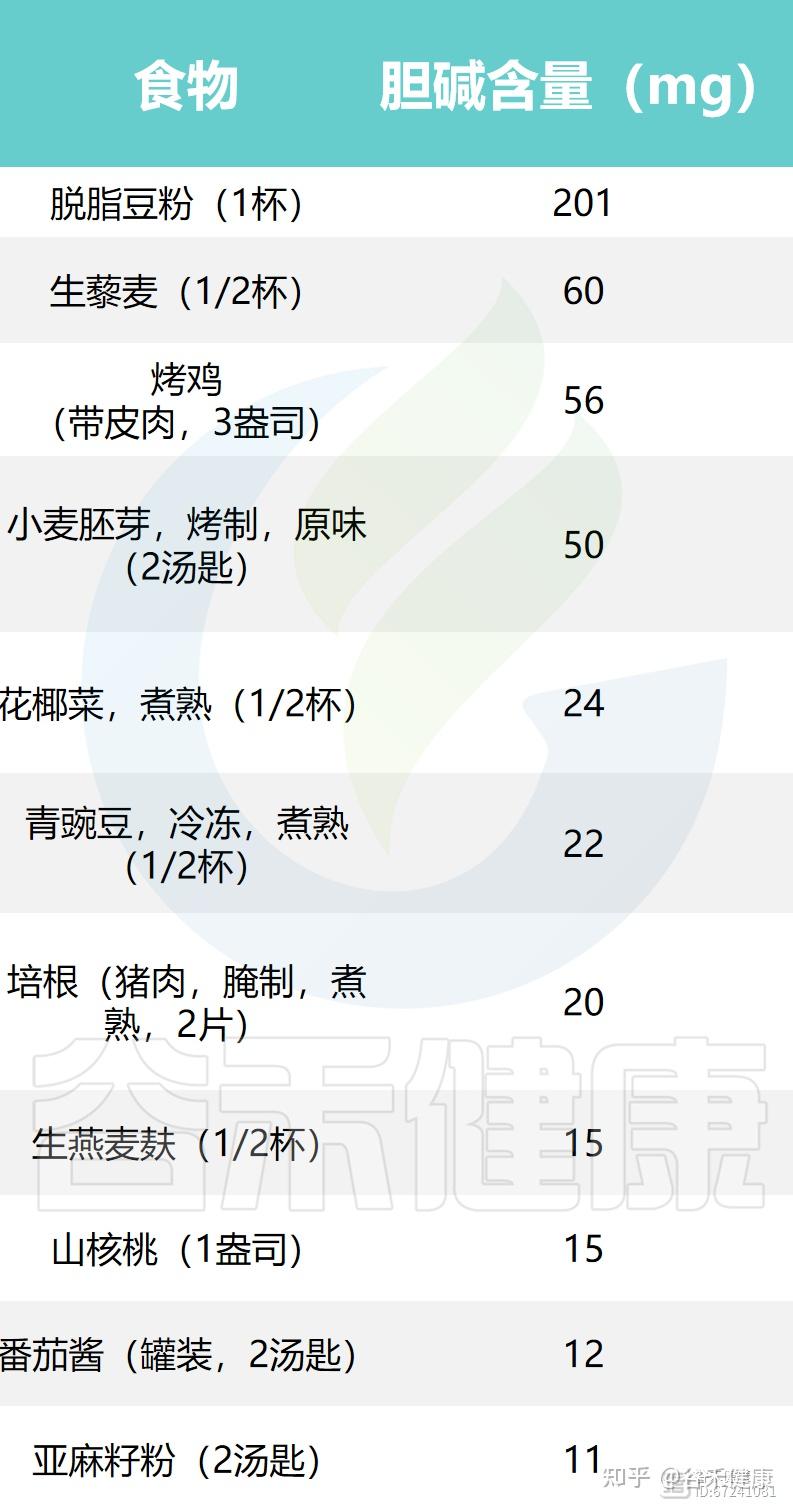
▸ 胆碱与肉碱的区别
虽然名称相似,但胆碱和肉碱是两种功能完全不同的物质,不可混淆。
胆碱是细胞膜,神经递质乙酰胆碱的前体,主要参与结构和信号;绝大部分必须从食物中获取,鸡蛋含量比较高。
肉碱是赖氨酸和蛋氨酸合成的氨基酸衍生物,脂肪代谢的关键物质;人体可以利用赖氨酸和蛋氨酸(两种氨基酸)在肝脏和肾脏中自行合成大部分所需的肉碱,同时也可以从食物中补充,主要来源是红肉(尤其是牛肉和羊肉)。

简单来说,胆碱负责搭建基础设施——细胞膜,又参与信号传导(神经),还参与到复杂的基因表达调控。而肉碱,代谢路径较专一,专门负责将燃料(脂肪酸)高效地运送到线粒体去燃烧供能。
以上我们可以看到,胆碱和肉碱虽然名称相似,但在生理功能上却截然不同,不可混淆。那么下一个更实际的问题是:我们吃下去的胆碱,身体是如何处理它的?这背后又隐藏着哪些与健康息息相关的秘密呢?
胆碱进入人体后,会经历一系列复杂的吸收和代谢过程。这一过程不仅涉及小肠和肝脏,还与我们肠道中的微生物群密切相关,最终决定了胆碱的生物利用度和其代谢产物对健康的影响。
▸ 胆碱的形式与吸收路径
在食品中,胆碱有水溶性(游离胆碱、磷酸胆碱和甘油磷酸胆碱)和脂溶性(磷脂酰胆碱和鞘磷脂)两种形式。
不同胆碱形式的结构
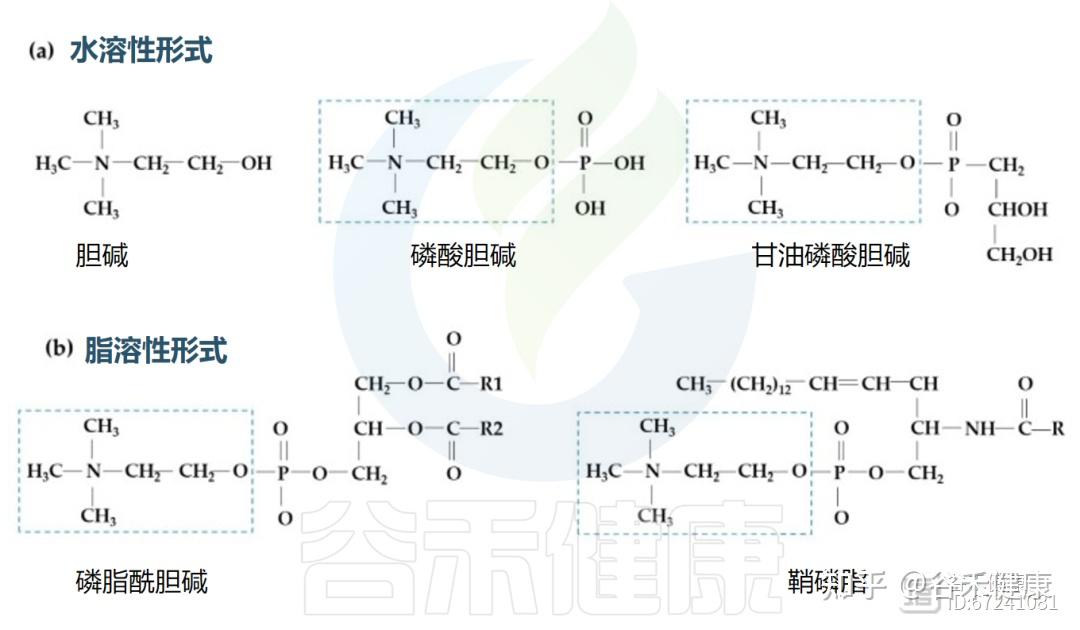
▸ 不同形式的胆碱吸收路径不同
不同形式的胆碱在吸收和代谢途径上存在差异。水溶性胆碱经门静脉输送至肝脏,而脂溶性胆碱在吸收后被封装成乳糜微粒,通过淋巴系统运输。
值得注意的是,婴儿期与成年期摄入的胆碱形式不同,这与食物来源有关。母乳中的胆碱主要为水溶性形式,而随着成长,膳食来源逐渐转向脂溶性胆碱。
▸ 不同形式胆碱在利用度和吸收效率等存在差异
有研究表明,不同形式膳食胆碱在生物利用度、吸收效率和组织分布方面存在差异,并可影响幼儿发育。与游离胆碱相比,膳食磷脂酰胆碱会改变乳汁中胆碱的组成形式,但不影响其总含量。
在人类中,乳汁中不同胆碱形式与婴儿发育的关系仍不清楚。仅有一项土耳其研究指出,纯母乳喂养婴儿的游离胆碱浓度高于配方奶喂养者。
动物研究的证据表明,牛奶中不同形式的胆碱会以不同的方式利用,母体和后代免疫系统对摄入各种形式的胆碱的反应不同就证明了这一点。因此,不同形式的胆碱的摄入应被认为与特定发育阶段相关。
▸ 胆碱在体内的四大代谢途径
进入体内的胆碱主要有四条代谢通路,分别参与不同的生理功能。包括乙酰胆碱、三甲胺(TMA)、甜菜碱、磷脂的合成。
①转化成重要的神经递质—乙酰胆碱
在突触前胆碱能神经元中,胆碱经胆碱乙酰转移酶转化为乙酰胆碱,并以囊泡形式释放至突触间隙,与中枢和外周神经系统的突触后受体结合。
也就是说,乙酰胆碱作为一种关键的神经递质,参与中枢和外周神经系统的信号传递,对记忆、学习和肌肉控制至关重要。
除神经系统外,乙酰胆碱的合成也存在于胎盘、肌肉、肠道及淋巴细胞中。
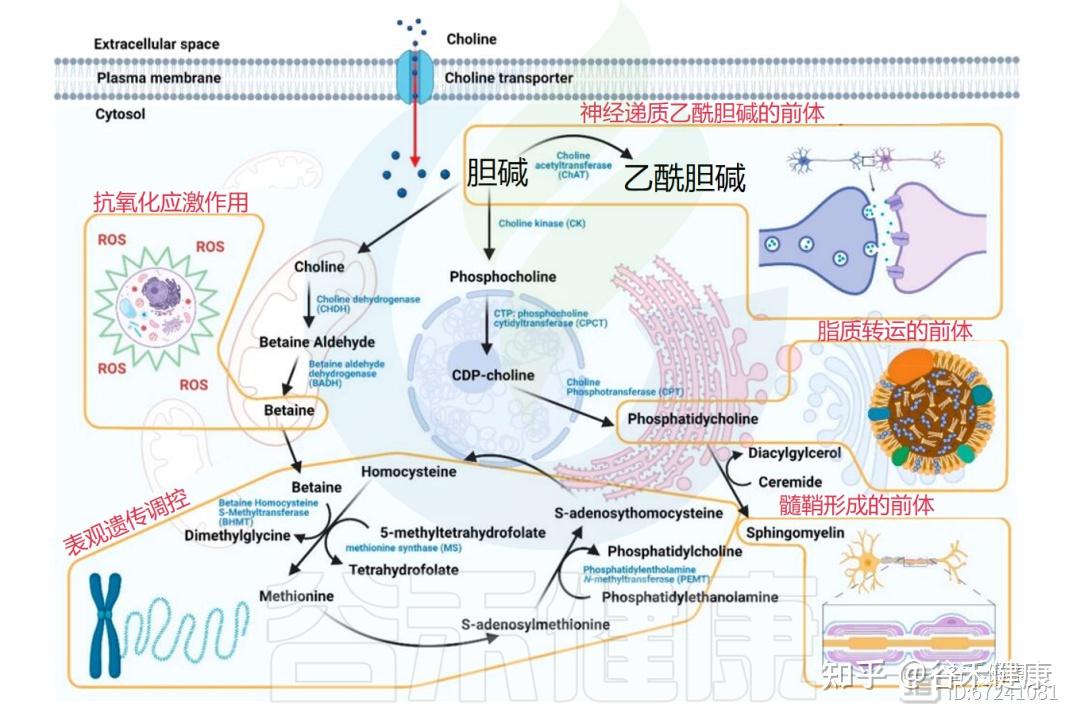
②经肠道菌群代谢为三甲胺及其氧化物
在大肠中,未被吸收的胆碱可被肠道菌群代谢为三甲胺(TMA),随后在肝脏中经黄素单加氧酶氧化为三甲胺氧化物(TMAO)。
饮食中胆碱代谢
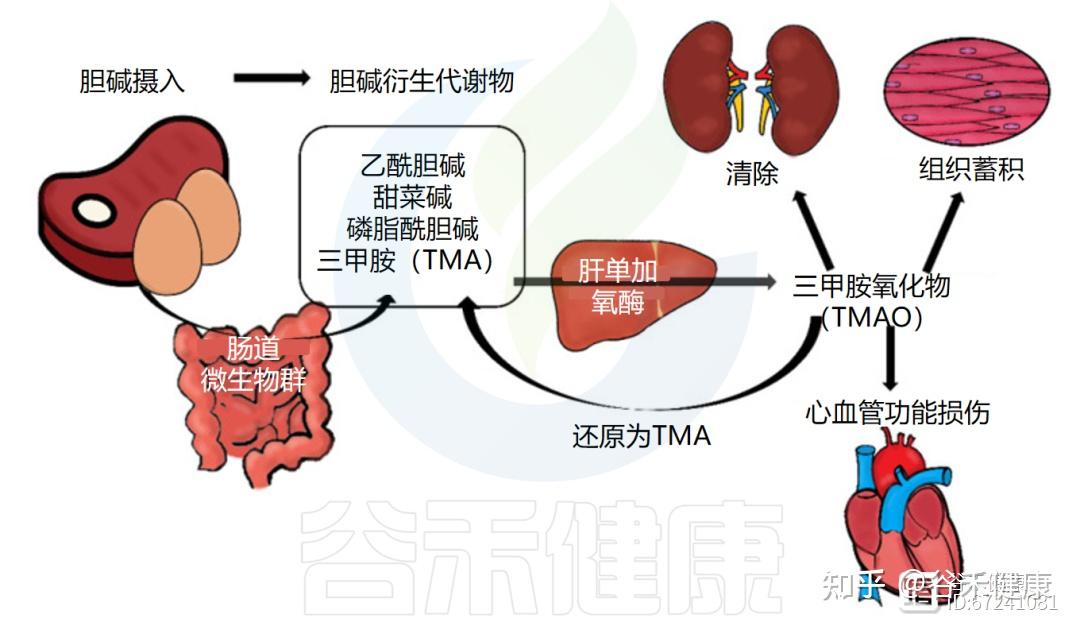
③生成重要的渗透调节剂—甜菜碱
胆碱还可在肝脏和肾脏中经两步氧化反应(胆碱脱氢酶和甜菜碱醛脱氢酶),不可逆氧化生成甜菜碱。甜菜碱既是重要的渗透调节剂,又是关键的甲基供体,可通过甜菜碱-同型半胱氨酸S-甲基转移酶(BHMT)将同型半胱氨酸再甲基化为蛋氨酸,同时生成二甲基甘氨酸。该途径与维生素B12/叶酸依赖型再甲基化途径平行,约占肝脏同型半胱氨酸再甲基化活性的一半。
④形成磷脂的前体—磷脂酰胆碱
胆碱是合成磷脂酰胆碱的前体,后者是机体最主要的磷脂形式。其合成主要通过胞苷二磷酸(CDP)-胆碱途径完成,存在于所有有核细胞中,约占肝脏中总磷脂酰胆碱的70%。
另一途径为磷脂酰乙醇胺N-甲基转移酶(PEMT)催化磷脂酰乙醇胺的三步甲基化反应,需消耗3分子SAM并生成3分子S-腺苷同型半胱氨酸(SAH),后者是同型半胱氨酸的前体。据估计,约50%的同型半胱氨酸来源于此反应,且肝脏为主要发生部位。
注:在人类中,PEMT路径是唯一已知的胆碱从头合成机制。近年研究表明,PEMT途径生成的磷脂酰胆碱在脂肪酸组成上不同于CDP-胆碱途径产物,前者富含长链多不饱和脂肪酸,如二十二碳六烯酸(DHA)。
▸ 肠道菌群:胆碱代谢的关键加工厂
摄入含胆碱的食物后,人体肠道微生物群一小部分微生物(不到1%)携带TMA产生所需的基因,可以将胆碱用于生成三甲胺(TMA)。三甲胺在宿主体内进一步氧化生成三甲氧化物(TMAO),与心血管疾病、肝脏疾病及代谢综合征等健康风险密切相关。
因此,肠道微生态组成与功能的差异,不仅影响胆碱及其衍生物的生物利用度,也决定了其代谢产物对宿主健康的双向调控效应。是连接膳食摄入与宿主生理反应的重要桥梁。
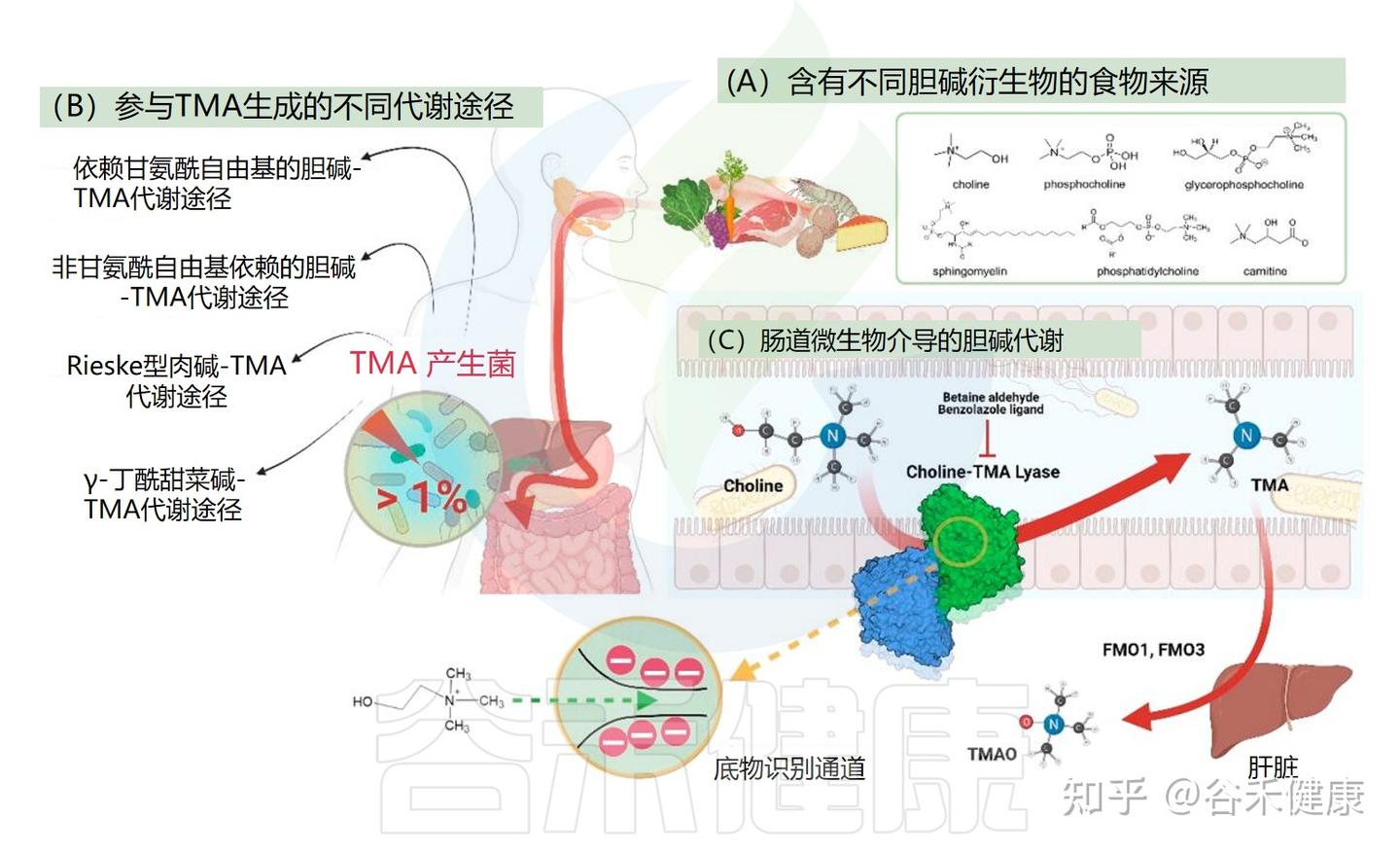
揭秘产TMA的关键菌群与基因
并非所有肠道细菌都能将胆碱转化为TMA。这一过程需要特定的酶系统。过去十年的研究已经鉴定出一些负责TMA生成的细菌基因簇:
研究发现,负责将胆碱转化为TMA的肠道细菌种类繁多,包括:Anaerococcus hydrogenalis、Clostridium asparagiformis、Clostridium hathewayi、Clostridium sporogenes、Desulfovibrio desulfuricans、Escherichia fergusonii、Klebsiella pneumoniae、Proteus penneri、Providencia rettgeri 等。
这些菌主要隶属于厚壁菌门和变形菌门。因此,血浆TMA和TMAO水平的升高,通常与这两类菌门的丰度增加以及厚壁菌门/拟杆菌门比值的增加有关。
可将胆碱降解为三甲胺的细菌菌株


▸ 三甲胺生产细菌与胆碱
▸ 三甲胺产生菌会降低胆碱的生物利用度
研究发现,即使仅有极少量三甲胺(TMA)产生菌(约占总菌群的0.15%),也能显著降低宿主的胆碱生物利用度,且丰度越高影响越显著。这表明肠道TMA生成菌的丰度与组成对胆碱代谢及相关疾病密切相关。
利用定量PCR和Illumina测序分析人类粪便样本发现,TMA产生菌占总菌群不足1%,所有样本均检测到CutC基因,而仅26%含有CntA基因。类似的模式也出现在不同饮食类型动物中:杂食和肉食动物CutC基因丰度较高,而草食动物几乎缺乏CntA基因。
▸ 梭状芽孢杆菌可能是胆碱转化的关键菌
在不同哺乳动物的肠道微生物组中,CutC基因主要分布于放线菌门、变形菌门和厚壁菌门,尤其与厚壁菌门中多个分类群相关,典型代表为梭状芽孢杆菌目成员。三甲氧化物(TMAO)水平与这些菌群丰度之间的一致性进一步支持这一关系。相比之下,CntA基因多样性较低,主要存在于变形菌中。
▸ 不同形式的胆碱与肠道菌群的相互作用
食物中的胆碱衍生物包括水溶性形式(如游离胆碱、磷酸胆碱、甘油磷酸胆碱)和脂溶性形式(如磷脂酰胆碱、鞘磷脂)。由于其化学性质和吸收效率不同,肠道微生物对这些形式的可利用性存在差异。
▸ 不同底物会影响胆碱的酶促转化效率
研究表明,与磷脂酰胆碱相比,酒石酸氢胆碱可使血浆TMAO水平提高约三倍,可能因其非酯结构更易被微生物利用,而磷脂酰胆碱需经额外水解步骤释放胆碱,延缓TMA生成。
另一项膳食干预研究发现,摄入富含磷脂酰胆碱的鸡蛋虽能提高血浆胆碱水平,但TMAO水平与补充游离胆碱者相似,进一步提示底物结构影响其酶促转化效率。近期研究也证实,食用鸡蛋不会像补充酒石酸氢胆碱那样显著升高TMAO水平。
胞苷二磷胆碱(CDP-胆碱)是一种新获欧盟批准的新型食品成分,主要用于中老年人以改善胆碱摄入。其焦磷酸基团可避免在肠腔中被水解,使其具有较高宿主生物利用度,但难以被富含CutC的菌群利用。并且其吸收、水解和去磷酸化机制尚未完全明确。
▸ 抑制胆碱向三甲胺的转化,提高胆碱利用率
对胆碱-TMA裂解酶(CutC)的结构研究揭示了底物识别的分子基础,为开发抑制TMA生成的微生物靶向分子提供了依据。X射线晶体学显示,CutC具有一个埋藏的催化位点,通过带负电残基构成的通道与带正电的胆碱结合,并在底物结合时发生贝壳式闭合反应。
基于这些结构特征,苯并恶唑配体和甜菜碱醛等已被鉴定为CutC的非竞争性抑制剂,可不可逆地抑制胆碱向TMA的转化,从而提高高危人群的胆碱利用率,并降低循环TMAO水平及其相关健康风险。
▸ 关于胆碱、三甲胺和氧化三甲胺
▸ 一些肠道细菌能将TMAO转化为TMA或甲烷
在胆碱代谢中,三甲胺(TMA)在肝脏中经FMO3酶氧化生成氧化三甲胺(TMAO)。值得注意的是,部分变形菌门细菌可利用TMAO还原酶将膳食TMAO逆向代谢为TMA。
此外,近期研究发现,某些肠道古细菌(如Methanomassiliicoccales)能够将TMAO还原为甲烷。当前研究正探索利用这些微生物作为潜在益生菌,以降低与心血管疾病风险相关的循环TMAO水平。
▸ 饮食会通过肠道菌群代谢影响氧化三甲胺含量
氧化三甲胺(TMAO)(由微生物生成的TMA氧化而来)与动脉粥样硬化和血栓形成等心血管疾病密切相关,因此常被视为预测主要不良心脏事件(MACE)的潜在风险指标。
一项关于短期高脂饮食对健康男性的研究发现,空腹血浆TMAO水平保持稳定,而餐后TMAO会随时间显著升高。由于TMAO低分子量和高溶解性,其可被肾脏快速滤过和排泄,使血浆TMAO升高仅为暂时现象。
此外,不同研究中膳食或血清胆碱水平与TMA/TMAO浓度的相关性不一致,也暗示肠—肝轴调控机制尚未明晰。这种差异可能源于肠道微生物群对胆碱生物利用度及TMA/TMAO生成平衡的调节作用。
这种复杂的调控机制,恰恰凸显了维持体内胆碱水平平衡的极端重要性。那么,当身体的胆碱天平发生倾斜时,具体会表现出哪些疾病信号或临床症状呢?下一章,我们将分别探讨胆碱“缺乏”与“过量”这两种失衡状态所引发的一系列身体信号。
胆碱作为一种必需营养素,其在体内的水平需要维持在一个动态平衡的范围内。无论是摄入不足导致的缺乏,还是因肠道菌群代谢异常导致的代谢物(如TMAO)过高,都可能通过一系列身体信号或临床指标发出警报。识别这些信号对于早期干预和预防相关疾病至关重要。
▸ 胆碱缺乏的信号与表现
当膳食胆碱摄入长期无法满足身体需求时,机体多个系统会受到影响,并表现出一系列症状和体征,这些可被视为胆碱缺乏的“信号”。由于胆碱是维持机体正常代谢功能和生理平衡的必需营养素,长期摄入不足不仅会干扰肝脂代谢过程,还可能导致肠道微生物群结构的显著改变,从而引发一系列健康问题。
▸肝脏功能受损与脂肪肝
这是最典型、最直接也是最早出现的表现。由于胆碱是合成磷脂酰胆碱(PC)的必需原料,而PC是肝脏输出脂肪(以VLDL形式)的关键组分,胆碱缺乏会直接导致肝脏脂肪堆积,形成非酒精性脂肪肝(NAFLD)。
临床上可能表现为肝功能检查中的转氨酶(ALT, AST)水平升高。在严格控制胆碱摄入的人体实验中,受试者很快就会出现肝脏脂肪变性的迹象。
事实上,一项严格控制胆碱摄入量的人体干预实验表明,肠道微生物群的组成会明显随膳食胆碱水平的变化而调整,其中包括γ变形菌门(Gammaproteobacteria)相关的特异性改变。此外,实验还发现,丹毒丝菌等群落成员与胆碱耗竭期间肝脏脂肪积聚变化密切相关,提示胆碱缺乏可通过微生物介导的机制影响肝脏脂质代谢。
▸认知功能障碍
虽然这一信号较为隐蔽,不易在短期内察觉,但长期胆碱不足会影响大脑中乙酰胆碱的合成,可能导致记忆力减退、注意力不集中、思维迟缓和学习能力下降。在孕期或婴幼儿期这一大脑发育的关键窗口期,胆碱缺乏的后果更为严重,可能导致成年后永久性的海马区结构改变和认知功能受损。
▸ 阿尔茨海默
一项于2023年发表的重要研究,为胆碱与阿尔茨海默病之间的关联提供了强有力的证据。该研究明确指出,较低的循环(血清)胆碱水平与阿尔茨海默病的病理进展显著相关。
在轻度认知障碍和阿尔茨海默病患者中,胆碱水平较低者脑内的神经炎性斑块密度更高,Braak分期更晚,并伴有更强的炎症反应。该关联在动物实验中得到进一步证实:饮食性胆碱缺乏会加剧阿尔茨海默病模型小鼠的神经病理变化,反之,补充胆碱则能有效减轻这些损伤。
然而,与循环胆碱水平降低的发现形成鲜明对比的是,一些研究(特别是较早期的研究)观察到,在神经退行性疾病患者的脑部,胆碱水平反而呈系统性升高趋势。
这种看似矛盾的现象,其根源并非胆碱的“供应过剩”,而恰恰是神经元膜加速降解,导致胆碱分解产物(如GPC)被释放出来。
这些看似矛盾的结果凸显了阿尔茨海默中胆碱代谢的极端复杂性,其检测水平高度依赖于疾病分期、脑区以及所测量的具体胆碱化合物。
▸ 肌肉损伤与功能下降
胆碱缺乏同样会影响肌肉健康。临床表现为血液中肌酸激酶(CK)水平的升高,这是肌肉细胞受损的标志物。长期来看,由于肌细胞内甘油三酯的积累以及作为甲基供体的胆碱缺乏导致肌肉蛋白合成减少、分解加速,可能引发肌肉无力、疲劳,甚至肌肉萎缩和功能下降。
▸ 代谢紊乱
胆碱缺乏会干扰全身的脂质和碳水化合物代谢。由于脂肪酸在肝脏的氧化能力下降,可能导致血浆中甘油三酯水平升高。同时,胆碱缺乏也与胰岛素抵抗的加重有关,增加了患2型糖尿病的风险。
▸ 遗传性胆碱代谢缺陷
一些罕见的遗传性疾病源于胆碱代谢通路中关键蛋白的功能缺陷。例如,胆碱转运蛋白、胆碱酯酶或磷脂合成相关酶的基因突变,可导致多种临床表型,包括先天性肌无力综合征、肌肉萎缩、癫痫、以及其他复杂的代谢异常。
▸ 发育异常
在胚胎发育过程中,胆碱扮演着至关重要的角色。研究表明,孕期胆碱缺乏与新生儿神经管缺陷的风险增加有关,这凸显了孕期充足胆碱供应对于胎儿正常神经系统发育的重要。
▸ 胆碱过量的信号与表现
胆碱是必需营养素,人体对其有较强的吸收控制与代谢平衡机制。当膳食胆碱摄入增加时,身体通常会通过减少内源合成或加快代谢(例如经氧化为甜菜碱)来维持稳态。因此,在健康人群中,即使日摄入量高于推荐量,也不会立刻造成毒性反应。
▸ 胆碱过量一般不会引起明显不良反应
胆碱过量的不良反应较为罕见,仅早期少数研究(1977年)报道,七名阿尔茨海默症患者服用后,会出现降压作用,并伴有恶心和腹泻。出现不良反应的情况(如血压下降、出汗、胃肠不适)往往是在极端剂量(比如每日7克以上的胆碱盐补充)。
▸ 胆碱代谢产物TMAO过量的隐形风险
胆碱真正应警惕的是代谢通路过载,而非营养素本身,尤其是当肠道菌群过度活跃或肝脏代谢调节失衡时,形成的代谢产物(如TMA 与 TMAO)才是隐藏的风险源。
胆碱的肠道菌群代谢产物TMA/TMAO的水平过高,本身通常不会引起明显的身体不适感。它的“信号”更多是通过体检发现的异常指标,以及一种特殊的体征,也预示着多种慢性疾病的风险正在悄然增加。
▸ 鱼腥体味综合征
这是TMA过高最直接、最尴尬的信号。当摄入极高剂量的胆碱(如每天超过7.5克)或肉碱时,或者在一些存在FMO3酶功能缺陷的遗传病患者中,肝脏无法将肠道菌群产生的大量TMA完全氧化为无味的TMAO。过量的TMA会进入血液循环,并通过汗液、尿液和呼吸排出体外,散发出类似腐烂鱼类的腥臭味。虽然这种情况在普通人群中是罕见的,但它明确地指向了TMA代谢通路的超负荷或障碍。
三项研究指出,当患者每天服用 8−20 克胆碱时,会出现胃肠道影响和鱼腥体味。基于约7.5 g/天的最低观察不良反应水平(LOAEL)并采用安全系数,将19岁及以上成人的可耐受最高摄入量(UL)设定为3.5 g/天。
▸ 心血管事件风险
大量的临床研究已证实,血浆TMAO水平升高是预测未来发生主要不良心血管事件的独立风险指标。对于心血管疾病患者来说,TMAO水平可以作为评估预后的重要参考。
▸ 肝脏疾病
TMAO不仅在非酒精性脂肪肝(NAFLD)患者中水平升高,它本身也能反过来加剧肝脏损伤。研究表明,TMAO能加剧肝脏的脂肪堆积、氧化应激和炎症反应,从而促进NAFLD向更严重的NASH阶段发展。
▸ 慢性肾病
TMAO主要通过肾脏滤过和排泄。TMAO与慢性肾病之间存在恶性循环。一方面,肾功能不全导致TMAO清除障碍,使其在体内大量蓄积;另一方面,高水平的TMAO本身就是一种尿毒症毒素,它能诱导肾小管间质纤维化,进一步损害肾功能,加速慢性肾病的进展。
▸ 代谢紊乱
高TMAO水平也常见于代谢综合征、肥胖和2型糖尿病患者,并与胰岛素抵抗的严重程度相关。
至此,从肝脏、心血管到神经系统,胆碱代谢失衡所引发的系统性风险已清晰可见。无论是胆碱缺乏导致的器官功能受损,还是其代谢产物TMAO过量所驱动的慢病进程,都凸显了维持胆碱稳态的极端重要性。
那么究竟是什么因素在幕后调控着我们每个人的胆碱水平,并决定了其代谢通路的效率与风险?下一章,我们将深入剖析这些决定胆碱“命运”的关键内外因素。
在前文我们已经看到,胆碱的缺乏与其代谢产物过高,都与多种慢性疾病的发生密切相关。但还有问题在于,不同个体对胆碱的需求与代谢反应并不一致,这种差异源于多种宿主和环境因素的综合作用,包括个体的遗传背景、性别与生理阶段、激素水平、饮食结构以及肠道微生物组成等。理解这些影响因素,是建立个体化胆碱营养策略、避免代谢失衡的关键前提。
胆碱摄入需求的个体差异
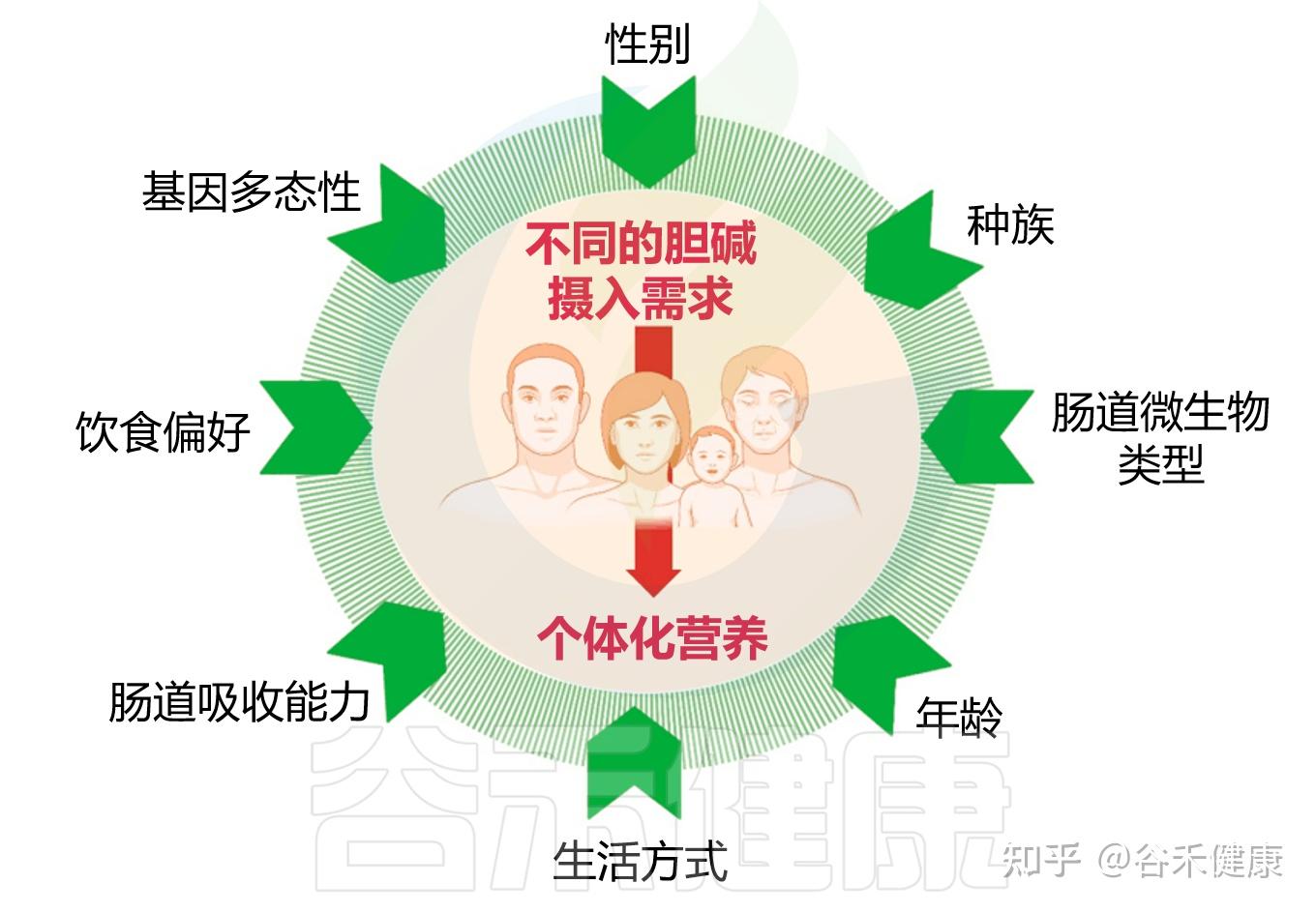
接下来,我们将逐一了解这些因素如何共同塑造个体胆碱代谢特征。
▸ 性别与激素水平
雌激素与PEMT活性:雌激素上调肝脏磷脂酰乙醇胺N-甲基转移酶(PEMT)基因的表达,促进磷脂酰胆碱的内源合成,从而减少对膳食胆碱的依赖。
因此,绝经前女性通常较为耐受低胆碱膳食,而绝经后女性因雌激素水平下降,PEMT活性降低,胆碱需求显著上升。
注:研究显示,在低胆碱膳食条件下,77%的男性和80%的绝经后女性出现缺乏症状,而绝经前女性仅为44%。
性别差异与酶活性:女性肝脏中黄素单加氧酶(FMO3)活性通常高于男性,会影响TMA→TMAO的转化速率及胆碱代谢终产物水平。
▸ 遗传与基因多态性
PEMT(rs12325817, G→C):该多态性位于雌激素反应元件附近,会削弱雌激素对PEMT的调控作用,使女性更易发生胆碱缺乏综合征(CDS)。携带者中约78%在低胆碱摄入下出现CDS症状。
MTHFD1(G1958A)突变:该突变影响叶酸介导的一碳代谢通路,降低甲基供体合成效率,从而增加对胆碱(作为甲基供体)的依赖。该突变与神经管缺陷风险增加相关。
CHDH与BHMT等基因变异:影响胆碱氧化及甜菜碱-同型半胱氨酸甲基转移过程,调节体内胆碱的利用率与甲基化能力。不同种族中相关等位基因分布差异显著,导致胆碱需求的群体差异性。
▸ 年龄与生命周期阶段
婴幼儿:婴儿阶段主要通过母乳摄入胆碱,母乳中胆碱以水溶性形式(磷酸胆碱、甘油磷酸胆碱)为主,易于吸收。早期胆碱摄入对神经发育和认知形成至关重要。早产儿胆碱需求更高,因为其肝脏合成能力尚未完善。
孕期与哺乳期:妊娠期母体需为胎儿及胎盘提供额外胆碱,用于细胞分裂、DNA甲基化及神经发育。哺乳期胆碱需求也升高,用以补充乳汁输出。
老年期:随年龄增长,内源性合成能力和饮食吸收效率下降,同时肝功能减退可能加重需求。老年人胆碱摄入不足已被关联至认知下降和非酒精性脂肪肝(NAFLD)风险。
▸ 饮食
饮食类型:动物性食物(如鸡蛋、肝、肉类、鱼、乳制品)是胆碱的主要来源。素食者或纯素饮食者胆碱摄入普遍低于标准需求。
烹饪与食物形式:高温烹饪会使游离胆碱减少。食物中胆碱的化学形式影响吸收效率——水溶性胆碱(如磷酸胆碱)易经门静脉吸收,而脂溶性形式(如磷脂酰胆碱)经乳糜微粒运输,更受脂质代谢状态影响。
营养互作:叶酸、维生素B12、B6、甜菜碱与胆碱共享甲基供体代谢通路,缺乏任一成分都会增加对胆碱的生理需求。
▸ 过量使用抗生素
长期或不当使用抗生素会对肠道微生物生态系统造成深远影响。广谱抗生素可同时抑制病原菌与共生菌的生长,引发菌群失调,削弱正常微生物竞争力,从而促使艰难梭菌等病原体过度繁殖。
总体而言,抗生素使用所引起的肠道微生物群结构变化,可能与机体代谢失衡以及糖尿病发病率的增加密切相关。这种由抗生素干扰导致的菌群改变会破坏肠道生态系统的稳定性,使益生菌数量减少、代谢功能受扰,从而使肠道逐渐倾向于形成促进TMA生成的代谢表型,进一步影响宿主的代谢健康和能量稳态。
▸ 肠道微生物组影响
微生物代谢胆碱为TMA/TMAO:特定菌群(如CutC/D阳性菌属——Desulfovibrio、Clostridium、Enterococcus等)可将胆碱降解为三甲胺(TMA),后被肝脏FMO3氧化为TMAO。
这一过程不仅影响胆碱的生物利用度,还与心血管疾病(CVD)、慢性肾病(CKD)、NASH等疾病风险相关。
个体间菌群差异:不同人群(年龄、饮食习惯、抗生素使用史)菌群组成各异,导致胆碱代谢途径及利用效率不同。这种差异在宿主遗传背景(如FMO3多态性)影响下进一步放大。
▸ 生理与病理状态
肝功能障碍:肝脏是胆碱代谢的核心器官。肝病患者(尤其是NAFLD/NASH)因磷脂合成与脂质输出受阻,其胆碱需求量显著增加。
代谢状态:胰岛素抵抗、高脂饮食、慢性炎症状态均影响胆碱的代谢与分配,使机体对胆碱的依赖度提升。
▸ 种族与地理差异
膳食习惯与基因共同决定胆碱供给与需求差异。研究显示,在相同叶酸摄入下,非裔美国女性血浆胆碱水平低于白人或墨西哥裔女性,提示胆碱代谢相关基因在不同种群中的分布不均。
以上我们了解到个体的胆碱需求受到遗传、性别、激素水平、生理状态以及肠道菌群等多重因素的综合影响。正因如此,找到一个既能满足身体需要,又不会造成代谢负担的摄入平衡,就成为维持健康胆碱状态的关键。
虽然胆碱的最佳摄入量因人而异,但权威机构仍基于大量流行病学与生化研究,制定了适宜的参考标准,以帮助公众更好地评估日常摄入量是否充足。
美国医学研究所(IOM)早年制定了不同人群的胆碱适宜摄入量(AI):女性425 mg/天,孕妇450 mg/天,哺乳期妇女和男性均为550 mg/天。
欧洲食品安全局(EFSA)在2016年更新建议值:成人400 mg/天,7–11个月婴儿160 mg/天,儿童140–400 mg/天(随年龄和体重变化),孕妇480 mg/天,哺乳期妇女520 mg/天。
目前对胆碱的摄入量建议
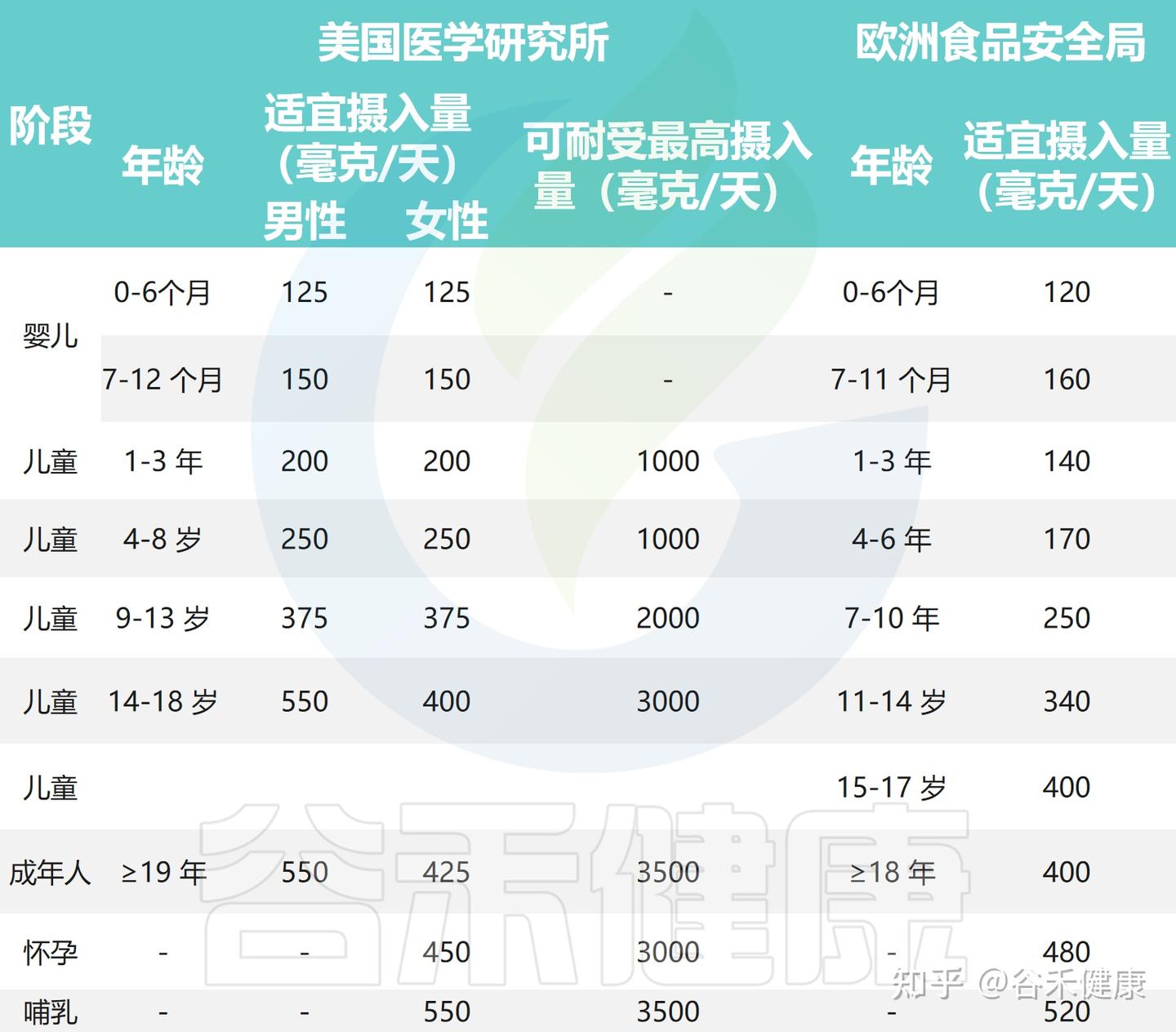
注意:这些推荐值反映的是“维持正常生理功能”的适宜摄入量(AI),并非“最低需求量(RDA)”。也就是说这是用来指导日常膳食的安全范围,而不是严格的个体化目标。
鉴于胆碱代谢的复杂性及其对健康的双重影响,我们的核心目标应该是:在确保摄入充足胆碱以满足机体生理需求的同时,最大限度地减少其在肠道内向有害代谢物TMAO的转化。这并非一个简单的“多吃”或“少吃”的问题,而是一个需要综合性的饮食调整、生活方式干预乃至个体化营养策略的系统工程。
▸ 饮食调整
饮食是影响肠道健康的关键因素,因此饮食调整成为控制三甲胺氧化物(TMAO)相关疾病风险的简便且安全的方式。
动物性来源:这类食物通常被认为是胆碱的最佳来源,含量尤为突出。
植物性来源:对于素食者或希望通过植物性饮食增加胆碱摄入的人群,以下食物是重要选择 。
地中海饮食富含多酚和膳食纤维,具有多重健康益处。流行病学数据表明,长期遵循地中海饮食与尿液、血浆TMAO水平呈负相关。
动物实验也发现,膳食影响肉食诱导的TMAO上升——高纤维饮食可显著减轻其增幅。
植物性或纯素饮食:抑制胆碱向TMA的转化
近年来,植物性或纯素饮食以其健康优势受到关注,这些优势与较低的厚壁菌门/拟杆菌门比例及短链脂肪酸的增加有关。素食和杂食性饮食在微生物群和TMAO水平方面存在差异。
有研究发现,纯素食者在左旋肉碱摄入后TMAO生成能力低于杂食者。膳食纤维可抵抗胃肠道消化并在结肠中被特定细菌发酵为短链脂肪酸(SCFA),进而影响肠道微生态平衡。
研究表明,膳食纤维可抑制胆碱向TMA的转化,从而提高高需求人群的胆碱生物利用度。其机制包括抑制糖酵解副产物甲基乙二醛的积累,减少甘氨酸代谢反馈,从而降低CutC依赖的TMA裂解酶表达;同时,纤维可激活AMPK信号通路以抑制ATP消耗过程,如TMA裂解酶合成。
尽管如此,纤维的效果存在个体差异,受基线微生物基因丰富度及普雷沃氏菌丰度等因素影响。这些发现表明,合理利用膳食纤维及其他饮食成分,有望促进功能性食品的开发,在满足胆碱需求的同时降低TMAO产生。
总体来看,膳食纤维在地中海饮食中的充足供应,以及其在西式饮食中的缺乏,是不同个体间肠道菌群组成和TMAO水平差异的关键因素。
西式饮食增加三甲胺生产者
西式饮食以高动物蛋白、饱和脂肪和低膳食纤维为特征,常摄入家禽、猪肉、牛肉和鸡蛋等动物性食品。这些食物中含有大量磷脂酰胆碱(PC)和左旋肉碱等可被微生物转化为三甲胺(TMA)的前体,随后在肝脏中进一步氧化生成三甲胺氧化物(TMAO)。
西式饮食通常与拟杆菌肠型相关。研究发现,某些微生物进化枝(如奈瑟氏菌科和脱硫弧菌属)与血浆TMAO水平呈正相关,并在冠心病患者及长期摄入动物性饮食者中观察到TMAO显著升高。进一步研究表明,摄入鸡蛋后TMAO水平升高的男性往往具有较高的厚壁菌门丰度,而TMAO水平较低者则表现出较高的拟杆菌门比例。
大部分PC在小肠上部被胰酶水解为1-lyso-PC并迅速吸收,其酶活性受胆盐与PC比例影响,而在空肠下段和回肠中逐渐失活,使部分未水解的PC进入结肠被肠道菌群利用。换言之,高肉食摄入为TMA合成菌提供了充足底物。肠道转运时间和消化酶活性等因素亦会影响未水解PC到达下消化道的量。
PC在小肠下部的积聚为表达CutC酶的细菌(如Proteus mirabilis)提供了有利生态位,使其能以胆碱为碳源进行生长和定植。此外,西方饮食脂肪和乳化剂含量高,易引起菌群失衡,并促进产TMA菌株(如梭状芽孢杆菌、埃希氏菌)的扩张。
研究不同人群中西式饮食的普及程度、肠道转运时间差异及胆汁盐水平,有助于揭示各人群间胆碱代谢差异的潜在机制。
▸ 补充益生菌
益生菌作为另一种干预手段,在动物模型中可有效重塑肠道菌群并降低TMAO水平。
▸ 副干酪乳杆菌F198
例如,膳食补充副干酪乳杆菌F198可恢复肠屏障功能,减少氧化应激性肝损伤;M. smithii定植可降低TMAO并减轻动脉粥样硬化;Enterobacter aerogenes通过调节菌群平衡显著降低血浆和盲肠TMAO。
然而,与人类相比,啮齿动物微生物组差异巨大,个体饮食和基因背景也会影响效果,因此应谨慎外推动物结果。
▸ 植物乳杆菌
植物乳杆菌,尤其是Lactobacillus plantarum ZDY04 菌株,在小鼠模型中被反复证明能显著降低因高胆碱饮食引起的血清TMAO和结肠TMA水平 。其机制可能涉及抑制肠道中TMA的生成菌群 。
▸ 双歧杆菌属
双歧杆菌Bifidobacterium breve 、Bifidobacterium longum的一些菌株在动物研究中也显示出降低血浆TMAO和TMA浓度的能力。
▸ 其他菌株
Akkermansia muciniphila、Enterobacter aerogenes ZDY01 以及一些 Lactobacillus reuteri 菌株在降低TMAO方面的潜力 。一项包含 Lactobacillus rhamnosus GG 的混合益生菌干预,在人体试验中也观察到能减弱胆碱负荷后TMAO的升高程度。
▸ 补充益生元
▸ 补充阿拉伯木聚糖等
“功能性食品”可超越基础营养调节健康。以益生元为例,这类可被特定肠菌利用的不可消化碳水化合物能促进有益菌生长并改善菌群多样性。
在人类研究中,超重者摄入富含阿拉伯木聚糖的益生元提取物后,普雷沃氏菌丰度和短链脂肪酸水平上升,血浆磷脂酰胆碱下降,提示TMA合成底物可用性降低并有助于代谢健康。
▸ 摄入多酚类化合物—如白藜芦醇
多酚类化合物作为另一类植物源膳食成分,具有重要的微生物群调节功能。补充白藜芦醇可增加乳酸杆菌、降低TMAO并缓解高胆碱饮食小鼠的动脉粥样硬化;乌龙茶提取物和柑橘类黄酮表现出相似效应。
临床试验表明,富含多酚的果渣提取物Taurisolo在4周内可显著降低TMAO水平(63.6% vs. 0.54%)。尽管结果积极,但仍需更多机制研究以阐明多酚与TMAO及人类疾病间的关系。
▸ 粪菌移植
粪菌移植(FMT)作为一种新兴手段,通过健康供体的菌群替换受体的失调微生物组,在临床前研究中展现疗效,但实际应用有限。
针对其他疾病的研究显示虽然可部分恢复菌群平衡,但并未显著降低TMAO或改善动脉粥样硬化。未来,结合精准医学的FMT策略或可实现个体化微生物重建,但仍依赖对细菌与疾病因果关系的深入理解。
▸ 针对TMAO生物合成的药物
针对TMAO生物合成的药物干预包括胆碱类似物3,3-二甲基-1-丁醇(DMB)和抗缺血药米屈肼。DMB通过非致死性抑制TMA裂解酶减少TMAO生成并减轻动脉粥样硬化,但尚未在人类中验证;米屈肼较安全,但其作用仅限于肉碱途径。
胆碱相关疾病的治疗方法


▸ 中医药
传统中医药(TCM)通过其独特的理论体系和复方用药,为调节与胆碱相关的功能紊乱提供了不同的视角,尤其是在神经系统和认知功能方面。
中医药研究更多关注的是胆碱的下游产物——神经递质乙酰胆碱(ACh)的功能。乙酰胆碱水平下降与阿尔茨海默病等认知障碍密切相关。一些中药或其活性成分被发现具有胆碱酯酶(AChE)抑制作用,能够减少乙酰胆碱的分解,从而提升其在突触间隙的浓度和作用。
具有乙酰胆碱酯酶抑制活性的中药及成分
研究发现,人参、五味子、远志、麦冬等传统补益药材,以及从石杉科植物中提取的石杉碱甲,均显示出显著的AChE抑制活性,被认为是改善认知功能的潜力药物。
也有研究认为,半夏、川芎、当归、人参等药材本身也含有胆碱成分,但其在复方煎煮后对人体系统性胆碱水平的实际贡献尚需进一步量化研究。
补肾益智汤(方)
一项针对记忆障碍模型的动物研究显示,中药复方“补肾益智汤”能够显著改善小鼠的学习记忆能力。其机制研究发现,该方剂能上调海马和皮层中胆碱乙酰转移酶(ChAT,合成乙酰胆碱的关键酶)的表达,并逆转乙酰胆碱(ACh)水平的下降和胆碱酯酶(ChE)活性的紊乱 。这表明该复方并非简单地补充胆碱,而是通过多靶点调节胆碱能神经系统的稳态。
目前中医药领域的研究主要集中在改善与胆碱能系统相关的病理状态(如认知障碍),而非直接“提高”或“降低”血浆胆碱水平本身。
▸ 运动
规律体育锻炼稳大脑胆碱水平,有益神经健康
研究表明,规律的体育锻炼(如每周三次的骑行训练,持续12周)可以防止大脑中胆碱浓度的异常升高。在阿尔茨海默病等神经退行性疾病中,神经元细胞的减少会导致胆碱浓度上升。规律运动组的大脑胆碱浓度保持稳定,而缺乏运动的对照组则出现升高。这表明规律运动可能通过保护神经元,有助于预防认知障碍和痴呆。
运动对胆碱能系统有积极调节作用
除了直接影响胆碱水平,运动还能对整个胆碱能神经系统功能产生积极影响:
小结
总体而言,饮食调整、益生元/益生菌补充、粪菌移植及药物治疗共同构成调控肠道微生态和降低TMAO水平的潜在策略。
然而,要实现临床转化,需要更系统的机制研究和设计完善的长期随机对照试验。同时,维持良好饮食习惯和健康生活方式仍是改善肠道生态与促进代谢健康的关键。
胆碱,曾经被简单地视为一种神经保护因子、细胞膜的核心组件,如今却被发现,它的命运在进入肠道那一刻便被改写。它的吸收效率、代谢方式、甚至健康效应,皆取决于你的肠道菌群。
未来,这条从认知到干预的路径将变得清晰,随着肠道菌群检测技术日益成熟,我们可以逐渐了解到自己肠道里,哪些菌群在控制胆碱的去向,哪些代谢通路可能与慢病风险相关…
基于这份独一无二的“身体地图”,我们便能采取更具针对性的行动,无论是调整饮食结构,补充特定的益生菌、益生元,还是接受个性化营养规划,最终目标都是主动引导胆碱走向有益的代谢路径,从源头上减少TMAO等风险分子的生成,修复与优化内环境。
主要参考文献
Kenny TC, Scharenberg S, Abu-Remaileh M, Birsoy K. Cellular and organismal function of choline metabolism. Nat Metab. 2025 Jan;7(1):35-52.
Goh YQ, Cheam G, Wang Y. Understanding Choline Bioavailability and Utilization: First Step Toward Personalizing Choline Nutrition. J Agric Food Chem. 2021 Sep 22;69(37):10774-10789.
Arias N, Arboleya S, Allison J, Kaliszewska A, Higarza SG, Gueimonde M, Arias JL. The Relationship between Choline Bioavailability from Diet, Intestinal Microbiota Composition, and Its Modulation of Human Diseases. Nutrients. 2020 Aug 5;12(8):2340.
Wiedeman AM, Barr SI, Green TJ, Xu Z, Innis SM, Kitts DD. Dietary Choline Intake: Current State of Knowledge Across the Life Cycle. Nutrients. 2018 Oct 16;10(10):1513.
Blusztajn JK, Slack BE, Mellott TJ. Neuroprotective Actions of Dietary Choline. Nutrients. 2017 Jul 28;9(8):815.
Dalla Via A., Gargari G., Taverniti V., Rondini G., Velardi I., Gambaro V., Visconti G.L., De Vitis V., Gardana C., Ragg E., et al. Urinary TMAO levels are associated with the taxonomic composition of the gut microbiota and with the choline TMA-lyase gene (cutC) harbored by enterobacteriaceae. Nutrients. 2020;12:62.
Bernhard W., Poets C.F., Franz A.R. Choline and choline-related nutrients in regular and preterm infant growth. Eur. J. Nutr. 2019;58:931–945.
Chan M.M., Yang X., Wang H., Saaoud F., Sun Y., Fong D. The microbial metabolite trimethylamine N-oxide links vascular dysfunctions and the autoimmune disease rheumatoid arthritis. Nutrients. 2019;11:1821.

谷禾健康
刚过去的九九重阳节,唤起了我们对“长长久久”的生命期盼,这是根植于我们文化深处的向往。而今我们期盼的,不再只是生命时钟的不断前行,更是那份长长久久的能够自由行走、清晰思考、感受生活美好的“生命质量”。
衰老,正是稀释生命质量、为晚年带来挑战的关键因素。因此,理解衰老、干预衰老,让每一段生命都充满活力,成为了比单纯追求“长久”更重要的时代课题。

为何同龄人中,有些人看起来精力充沛、容光焕发,而另一些人却似乎被岁月过早地刻上了痕迹?
当看到市面上琳琅满目的NMN、NAD+补充剂,或是主打“肠道健康”的益生菌时,是否也曾好奇:这些宣称能“逆转时光”的产品,其背后真正的科学逻辑是什么?
…
衰老是一个每个人都无法回避的自然的生物学过程,包括基本生理功能的逐渐衰退和进行性衰老。随着年龄的增长,衰老加速,导致细胞内损伤积累,增加年龄相关疾病的易感性。衰老影响每个人,但对每个人影响的程度不同。
近年来,科学界已经逐步确定了一系列导致细胞、组织和整个生物体衰老的生物学过程,这些被扩展到包括衰老的十四个关键标志。它们包括基因组不稳定性、端粒磨损、表观遗传改变、蛋白质稳态丧失、细胞自噬失能、营养感应失调、线粒体功能障碍、细胞衰老、细胞外基质变化、干细胞耗竭、细胞间通讯改变、慢性炎症、菌群失调、心理-社会隔离。
这些特征为理解衰老过程提供了一个基本框架,并且相互之间有着深刻的联系。其中,免疫力下降、肠道菌群失衡和慢性炎症这三个因素相互影响,形成了一个加速衰老的恶性循环。简单来说,肠道不健康会削弱免疫功能,免疫力差又会让肠道问题更严重,最终导致全身慢性炎症,而这种炎症正是心脏病、糖尿病、老年痴呆和癌症等多种年龄相关疾病的共同土壤。
在这个复杂系统中,饮食营养扮演了连接环境、肠道与宿主免疫的中心枢纽角色。因此,我们的餐盘实质上成为了调控自身衰老速度和健康轨迹的“遥控器”。饮食中的每一个选择,都在向这个复杂的“微生物-免疫-炎症”网络发送信号,或促进平衡与修复,或加剧失调与衰败。
传统的营养学常常聚焦于维生素、矿物质等已知营养素。然而,前沿科学发现,食物中还存在大量曾被忽视的“营养暗物质”,如植物化学物质、多酚等。它们虽非传统必需营养素,却在调节健康、对抗衰老中扮演着至关重要的角色。
例如,石榴中的鞣花单宁,需要经过特定肠道微生物的代谢,才能转化为近来在抗衰老市场备受追捧的尿石素A(Urolithin A),后者已被证明能有效清除衰老线粒体,恢复细胞活力。这完美诠释了饮食、微生物和抗衰老之间的精妙联系。
在这些复杂联系之外,现代AI技术正为我们提供了系统化解决方案。目前,人工智能驱动的精准饮食干预将海量的多组学数据转化为可操作的饮食建议,通过分析生物年龄较高或较低人群的数据,机器学习模型能够识别出哪些特定的饮食模式、食物来源的信号分子或肠道菌群特征是“减速”或“加速”衰老的关键驱动因素。最终,可以为个体量身定制饮食方案。
本文将带您深入这一前沿领域,探讨肠道菌群失调与免疫衰老之间如何形成恶性循环,并共同催生“炎症衰老”,我们将了解各种干预方式,是如何成为打破这一循环、调控我们衰老速度的强大工具。
随着年龄增长,我们常常感觉身体变得更脆弱了:更容易感冒,伤口愈合得更慢,恢复得也更吃力。这背后一个很重要的原因,就是我们身体内部的免疫系统发生了变化。免疫力的衰退,即免疫衰老,是衰老过程中的一个核心环节。
这种变化主要体现在两个方面:
衰老过程中先天与适应性免疫系统的变化共同导向炎症性衰老状态
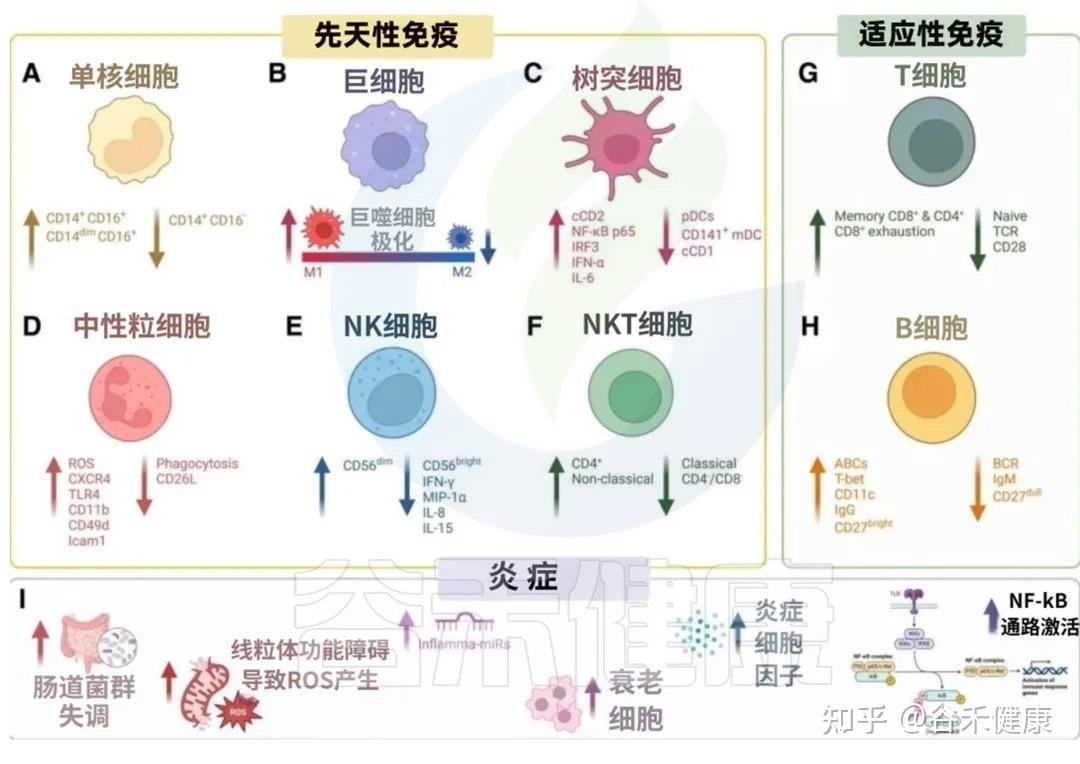
我们来看看衰老是如何影响我们免疫军队的两大核心分支的:先天免疫系统和后天免疫系统。
先天免疫是我们与生俱来的、快速反应的防御系统,是抵御病原体的第一道防线。但随着衰老,这支部队的效率和精确性都大打折扣。
这种功能失调的背后,涉及多种免疫细胞的变化。以下,我们将首先探讨先天免疫系统在衰老过程中的具体改变。
单核细胞:平衡 ➜ 促炎(经典型↓ 中间型、非经典型↑)
从单核细胞看炎症体质的形成:为什么你会感觉身体总在发炎?
在年轻健康时,单核细胞在血液中循环,一旦机体出现感染或损伤,便会迅速赶往炎症部位,并在此分化为巨噬细胞或树突状细胞。单核细胞还能吞噬病原体,并分泌信号分子,精细调控炎症反应。
根据细胞表面的蛋白标志物,人类单核细胞大致可分为三种主要表型:
▸ 衰老带来的失衡
研究表明,衰老导致:
值得注意的是,血液中单核细胞的总数通常保持稳定,这说明衰老的影响主要体现在细胞亚群的功能重塑上,而非数量变化。
▸ 这会带来什么后果?
这种细胞亚型的转变,意味着体内能高效分泌促炎因子的细胞群体增多,这直接助长了“炎症衰老”的慢性炎症状态,并削弱了机体有效修复损伤的能力。
你可能在体检报告上看到高敏C反应蛋白(hs-CRP)的指标,该指标升高往往与体内促炎单核细胞数量或活性增加、持续释放炎症因子有关。hs‑CRP 被视为心血管疾病等多种慢性病的风险预警信号。
巨噬细胞:平衡 ➜ 促炎( M1型↑ M2型↓ )
如果说单核细胞是血液中的巡逻兵,那么巨噬细胞就是驻扎在身体各组织(如皮肤、肝脏、大脑)里的多功能兵。巨噬细胞源自血液中的单核细胞,是处理局部问题的专家。
巨噬细胞的核心在于其“按需切换”的能力,主要有两种工作模式:
注:这里只是为了便于理解简化了,实际上巨噬细胞的极化是一个连续光谱(受多种细胞因子、代谢状态和组织微环境共同调控),往往呈现混合或中间表型,而非仅在两极之间来回切换。
在年轻健康的身体里,这两种模式的切换是及时且高效的。
▸ 衰老带来的失衡
衰老使巨噬细胞的平衡向促炎的M1型偏移。
▸ 这会带来什么后果?
伤口愈合变慢,组织修复能力下降
因为负责修复重建的M2型模式减少,所以在出现损伤(如割伤、手术后)时,组织的愈合过程会变得缓慢且不充分,更容易形成疤痕。
体内垃圾堆积,加速衰老进程
巨噬细胞的一个关键职责是吞噬并清除体内的“垃圾”,比如衰老的细胞和细胞碎片。尽管炎症信号增强,但吞噬与清理能力下降,功能失衡加剧。这导致衰老细胞无法被及时清除,它们在组织中不断累积,并释放更多炎症物质,形成一个“促炎-衰老细胞累积-更促炎”的恶性循环。
可能带来动脉粥样硬化
在血管壁中,功能失调的M1型巨噬细胞会疯狂吞噬胆固醇,但又无法有效代谢,最终变成充满脂质的泡沫细胞。这些泡沫细胞大量堆积,正是形成动脉粥样硬化斑块、导致血管堵塞的核心原因。
这削弱了它们有效召集其他免疫援军,并启动高效免疫反应的能力,进一步维持了体内的炎症状态。
树突状细胞:免疫反应启动效率下降
这些问题的答案,均指向了免疫系统中一个关键角色——树突状细胞(DCs) 的功能衰退。
树突状细胞是功能最强的抗原呈递细胞,重要职责是:
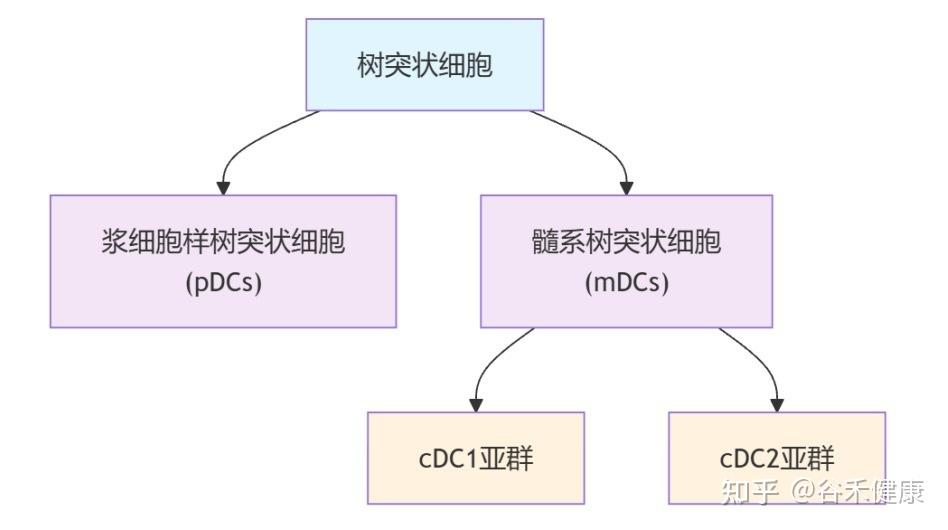
这其中,有一类名为 cDC1 的树突状细胞亚群,是专门负责激活T细胞的,T细胞是消灭病毒和肿瘤细胞的主力。
▸ 衰老影响这些DC亚群的组成和功能
关键指挥官cDC1 数量锐减:研究证实,体内负责激活抗病毒和抗肿瘤反应的 cDC1 细胞数量会显著减少。
剩余部队反应迟钝:剩下的树突状细胞,其呈报敌情的效率也大打折扣,激活T细胞的能力下降。
▸ 这会带来什么后果?
肿瘤和病毒的可乘之机
cDC1的减少,直接导致免疫系统的日常“巡逻监控”能力下降。体内的癌变细胞或潜伏的病毒(如导致带状疱疹的水痘-带状疱疹病毒)更不容易被及时发现和清除,从而大大增加了患癌和机会性感染的风险。
现代肿瘤治疗中的免疫疗法,其核心策略之一,就是想方设法重新激活这条“树突状细胞-T细胞”的攻击轴线。
加剧慢性炎症
这些功能失调的树突状细胞,在“消极怠工”的同时,还会错误地释放更多促炎信号,为身体的“炎症衰老”状态火上浇油。
树突状细胞功能的衰退,让我们在面对病毒和肿瘤时,免疫系统的启动速度和反应强度都打了折扣。
中性粒细胞:低效杀敌 + 高效自伤
中性粒细胞是免疫系统中的“快速反应部队”,一旦有病菌入侵,它们最先到达现场,通过吞噬、释放杀菌物质(如ROS,活性氧)等方式消灭病原体。
年轻时,它们是高效的杀手。但衰老后,它们的功能变得非常矛盾和具有破坏性。
▸ 衰老带来的变化
杀敌能力下降:它们吞噬病菌的效率变低了,用来捕捉病菌的“网”(NETs)也造得又少又差。这直接导致它们无法有效清除病原体,让小的感染迟迟不好,甚至恶化。
无差别攻击增强:虽然杀菌效率变差,但它们释放的化学武器——活性氧(ROS),却不减反增。ROS过度释放导致旁观细胞损伤和组织炎症,这正是“氧化应激”加剧的核心原因之一。
▸ 这对你的健康意味着什么?
这种“低效杀敌 + 高效自伤”的模式,让人在年老后,更容易发生组织损伤和慢性炎症,关节炎、血管损伤等都与这种失控的氧化应激有关。
这就是为什么“抗氧化”是抗衰老领域永恒的热点。市面上流行的维生素C、维生素E、富含多酚的食物等,其核心作用之一就是帮助身体中和这些过量的、由衰老免疫细胞产生ROS,从而减少对自身的伤害。
NK细胞:癌症巡逻减少
NK细胞,即“自然杀伤细胞”,是体内最警惕的“巡逻兵”,它们不需要预警,就能不停地识别并清除癌变细胞和病毒感染细胞。
▸ 衰老带来的变化
随着年龄增长,NK细胞的数量和组成都在变化:
“精锐”减少:NK细胞中功能最强、反应最迅速的“精锐亚群”(CD56亮细胞)数量下降。
“普通”功能下降:虽然细胞总数可能没变少,但整体战斗力和沟通能力都大幅下滑。它们在发现敌人后,释放的求援信号(如干扰素IFN-γ)显著减少,无法有效召集其他免疫细胞协同作战。
“后勤补给”被切断:维持NK细胞生长和活力的关键因子IL-15水平下降,相当于断了粮草,使其功能进一步衰退。
▸ 这对健康意味着什么?
是老年人健康最大的隐患之一。
癌症风险显著增加
免疫系统对早期癌细胞的监控和“清除”能力下降,给了癌细胞潜伏和发展的可乘之机。
病毒感染更易发生
对潜伏病毒(如引起带状疱疹的病毒)的压制力减弱,更容易导致病毒再激活和发病。
NK细胞因其在癌症预防和抗衰老中的巨大潜力,已成为再生医学和细胞治疗领域的绝对明星。
近年来,NK细胞疗法备受追捧,无论是通过体外扩增回输自体NK细胞,还是异体NK细胞产品,都旨在补充和激活这支重要的免疫力量。
据市场分析,全球NK细胞疗法市场预计在未来十年将以超过40%的年复合增长率高速发展,显示出巨大的市场潜力和消费者关注度。
我们的免疫系统分为两支主要部队:一支是反应迅速、指哪打哪的“特种部队”(后天免疫系统),另一支是冲锋在前、快速反应的“先锋部队”(先天免疫系统)。随着年龄增长,这两支部队都会出现不同程度的老化。
T细胞:精英特种兵 ➜ 疲惫老兵
T细胞是免疫系统中负责精准打击和长期记忆的核心战斗力。其中,
针对T细胞的免疫疗法是现代医学的重大突破,尤其是在癌症治疗领域(如CAR-T疗法)。在抗衰老领域,如何清除衰老的T细胞、恢复T细胞“新兵”的多样性,是前沿研究的核心。
▸ 新兵来源枯竭:免疫系统的“兵工厂”关闭了
T细胞的“训练营”是我们的胸腺。胸腺在年轻时非常活跃,源源不断地培养出充满活力、能识别各种新敌人的“新兵”(幼稚T细胞)。
但随着年龄增长,胸腺会严重萎缩,被脂肪取代。结果就是,“新兵”补充几乎断绝,我们识别和对抗全新病毒(比如新型流感病毒)的能力大幅下降。
▸ 老兵开始消极怠工
由于没有新兵补充,军队里只剩下了身经百战的老兵(记忆T细胞)。更糟糕的是,其中一部分老兵因常年作战而变得衰老和耗竭。它们不仅战斗力锐减,无法有效增殖去打仗,还会在体内释放大量“煽风点火”的炎症信号,成为慢性炎症的主要推手。
因此,“胸腺再生”已成为抗衰老领域的前沿探索方向之一。
再生思路:利用 iPSC(诱导多能干细胞)或胸腺组织工程技术,在体外或体内重建功能性胸腺,恢复或提升 T 细胞生成能力。
前沿:已有公司(如 Tolerance Bio)获得数千万美元融资,开展胸腺再生的临床前/临床研究;早期临床试验报告显示参与者的表观遗传年龄出现显著下降,提示胸腺再生可能对抗免疫衰老具有潜在价值。
B细胞:产能不足、武器型号单一
B细胞,是免疫系统的“抗体军工厂”,负责生产能够精准锁定并中和病原体的“导弹”——抗体,是我们获得长期免疫力的核心。
市场上的“抗体水平检测”服务,无论是针对新冠病毒还是其他病原体,其本质就是检测B细胞“军工厂”的工作成果。
随着年龄增长,这家军工厂不仅生产效率下降,更可怕的是,它开始生产出一批危险的“叛乱分子”。
▸ 衰老带来的变化
出现“叛乱分子”:危险的“年龄相关B细胞”(ABCs)崛起,具有极强的破坏性:
▸ 这对你的健康意味着什么?
自身免疫病风险剧增
许多自身免疫病,如类风湿性关节炎、干燥综合征、红斑狼疮,都在中老年时期高发或加重?这背后的一个关键推手,就是不断增多的ABCs细胞。它们产生的“错误抗体”攻击我们自身的关节、腺体乃至全身器官,导致了持续的疼痛和炎症。
抗体生产线僵化,难以应对新威胁
健康的免疫反应,在遇到新敌人时,会先迅速生产一批“通用型”的先锋抗体(IgM)来应急,然后再生产更精准、更持久的“定制型”主力抗体(IgG)。
衰老的B细胞系统彻底打乱了这个节奏:
这就是为何老年人接种流感或新冠疫苗后,产生的保护效果往往不如年轻人。他们的“抗体军工厂”已经失去了快速创新和应对新挑战的能力。
鉴于ABCs在自身免疫病和免疫衰老中的核心破坏作用,它们已成为药物研发的重点靶标。科学家们正在全力研究如何能精准地清除这些叛乱细胞,或抑制它们的活性,从而恢复免疫系统的正常秩序。
抗衰老前沿:研究者正探索通过 JAK‑STAT 抑制剂、代谢调控(如二甲双胍)或靶向 T‑bet/CD11c 等方式降低 ABCs 的频率或功能,以恢复更健康的 B 细胞谱系,提升老年免疫应答和疫苗效果。
如果说免疫系统是身体的“军队”,那么肠道菌群就是栖息在我们体内的、数量庞大的“盟友”与“潜在敌人”的复杂的生态系统,这对我们的健康至关重要,而它的构成也并非一成不变。随着年龄的增长,我们内在的微生物世界正在经历一场深刻的演替。
肠道菌群:随生命历程动态变化的生态系统
我们的肠道菌群从出生那一刻起就开始构建,并在3-4岁时基本成型,这个早期阶段的“地基”对一生影响深远。
婴儿期(奠定基础)
肠道菌群的“地基”搭建。新生儿的肠道以有益的双歧杆菌为主导,这对早期免疫系统的建立至关重要。
成年期(成熟稳定)
随着饮食日益多样化,细菌的种类和复杂性不断增加,而真菌的多样性则趋于减少。到成年时,菌群结构基本成型并进入一个相对稳定的阶段,主要由厚壁菌门和拟杆菌门两大类细菌主导。尽管宏观结构相似,但每个成年人的菌群构成都是独一无二的,如同指纹一般。
从婴儿到百岁老人,肠道微生物的组成和多样性在不同生命阶段呈现动态变化
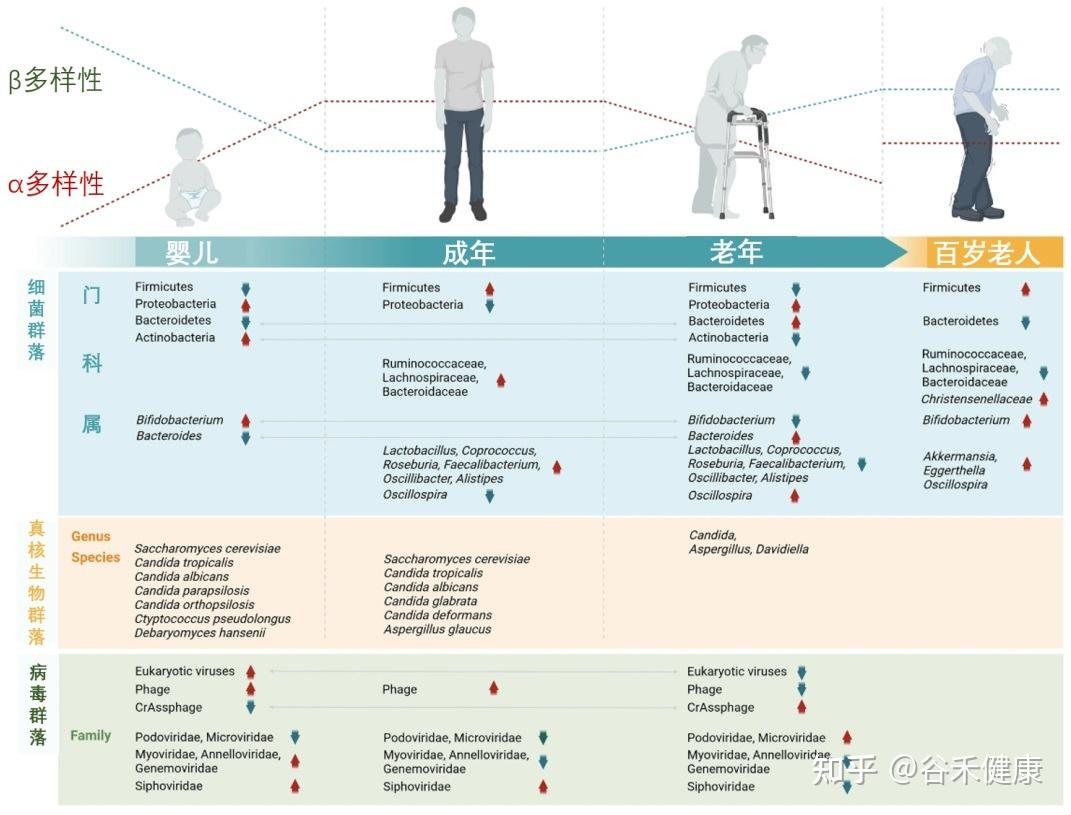
衰老带来的关键转变:生态系统的失衡
随着年龄增长,这个稳定的生态系统开始出现显著的、通常是负面的变化,这一过程被称为“微生物群落老化”。
有益菌的流失,有害菌的增多
多样性降低:如同一个健康的森林退化成单一树种的林场,肠道菌群的总多样性下降,使其变得更加脆弱。
有益菌减少:对我们有益的细菌,如双歧杆菌 和乳杆菌属,数量显著下降。
有害菌增多:与此同时,一些具有促炎特性的“机会致病菌”开始占据优势,如变形菌门等,它们会持续地刺激免疫系统,导致全身性的低度炎症。
从青壮年(22-48岁)到准超级百岁老人(105-109岁)的进程中,一个显著的标志是:
关键功能的丧失:短链脂肪酸的减产
衰老菌群最核心的变化之一,是能够发酵膳食纤维并产短链脂肪酸的细菌大幅减少。
短链脂肪酸(如丁酸盐)是维持肠道健康和调节免疫的基石:它们为肠道壁细胞提供能量,维持肠道屏障的完整性,并能直接向免疫细胞发送“保持冷静”的信号。它们的减少,是肠道功能衰退的关键标志。
长寿的线索:从百岁老人的菌群中学习
随着全球老龄化的加速,研究越来越集中于理解生命晚期的微生物演替,以预测与衰老相关的疾病特征并促进健康老龄化。
有趣的是,研究发现健康长寿的老人(如百岁老人)的肠道菌群并未完全遵循上述的衰退轨迹。相反,它们展现出一些独特的“年轻化”特征:
与老年人(66-85岁)相比,他们的肠道菌群保留了更高的多样性,生态依然丰富。
在他们的肠道中富含长寿菌群,几种被认为与健康和长寿相关的细菌丰度更高,例如:
这些传统的有益菌在他们体内依然维持着高水平。

解密|肠道菌群与健康长寿7 赞同 · 0 评论 文章
“生物群落老化”:衰弱与菌群失调的关联
身体衰弱表现为精力差、活动少、体重减轻、肌肉流失的老年人,与特定的菌群失调模式相关。
研究发现,高衰弱评分的老年人,其肠道中特定的共生菌群,如Coprococcus eutactus、Prevotella copri等耗尽,而一些潜在有害菌,如Clostridium hathewayi,脆弱拟杆菌Bacteroides fragilis等则占据优势。
以下肠道菌群数量增加与衰老相关,并被认为是高衰弱评分的特征,包括:
这些微生物的转变与代谢改变密切相关,包括短链脂肪酸和色氨酸减少,以及苏氨酸、疏水性次级胆汁酸(石胆酸和脱氧胆酸)、三甲胺氧化物(TMAO)、对甲酚、乙醇和氨的增加。同时,依赖于果糖和木寡糖的关键纤维发酵菌群趋于减少。
总之,这些发现支持了“生物群落老化”机制,即微生物多样性减少,其特征是机会性/促炎微生物的增加和共生/有益成员的减少,与加速衰老和增加的衰弱有关。
肠道-免疫轴:菌群如何影响全身衰老
肠道菌群并非孤立地影响健康,它通过“肠道-免疫轴”与我们的免疫系统进行着持续而复杂的对话,直接影响着全身的衰老进程。
衰老的一个核心特征是炎症性衰老(Inflammaging)——一种长期、低度的全身性炎症状态。而肠道菌群失调,是点燃和助推炎症的关键因素之一,从而加剧炎症性衰老。
短链脂肪酸
众所周知,肠道菌群产生的短链脂肪酸(SCFAs)是重要的信号分子,能调节免疫细胞的分化和功能。
饮食中纤维缺乏会导致SCFA合成减少,进而导致黏蛋白降解菌增多,肠道黏液层变薄,屏障功能受损,促炎细胞因子(IL-33和IL-25)增多,最终引发更强的炎症反应。
色氨酸
另一个例子是色氨酸,它是一种由微生物衍生的代谢物,也是一种必需氨基酸。它的代谢产物对于维持肠道稳态至关重要。
在临床前的老年小鼠模型中,缺乏色氨酸的饮食会诱发肠道菌群失调并促进炎症性衰老。
这些机制表明,一个“健康”或“年轻”的微生物组,能够通过抑制慢性炎症和维持肠道屏障,在抵抗细胞衰老和炎症性衰老中发挥关键的抗衰老作用。
我们已经知道,衰老的肠道菌群呈现出多样性降低和功能失调的特征。但一个关键问题是:这种菌群失调究竟是衰老过程的果,还是驱动衰老的因?
越来越多的证据表明,这很可能是一个双向的恶性循环,而多种与年龄相关的因素共同推动了这个循环的加速。
以炎症性衰老为核心,这种系统性的低度慢性炎症状态,通过与宿主免疫系统的紧密互动,导致肠道微生物组的失调。反之,失调的菌群又会加剧炎症。而多种外部和内部因素,则像催化剂一样,不断加剧这个循环。

外部:生活方式与医疗因素的冲击
多种药物的使用
老年人常因多种慢性病而服用多种药物。许多非抗生素药物,如质子泵抑制剂、二甲双胍、非甾体抗炎药等,都会严重影响肠道菌群的组成和多样性。
它们可能引起食欲变化、口干(导致唾液酶分泌减少)和特定营养素吸收不良,共同塑造了一个不利于有益菌生长的环境。
营养不良与饮食改变
随着年龄增长,味觉和嗅觉减退、牙口问题、食欲下降等因素,常导致老年人饮食结构单一,特别是膳食纤维摄入量锐减。
纤维是许多有益肠道细菌(尤其是产短链脂肪酸的细菌)的主要“食粮”。纤维摄入不足,直接导致这些有益菌“挨饿”甚至消失,从而削弱了肠道屏障功能和抗炎能力。
缺乏体育锻炼与社交孤立
这些因素也被证明与肠道菌群多样性降低和不良健康状况相关,它们通过影响激素水平、应激反应和整体代谢,间接塑造了肠道微生态。
内部:消化系统自身的生理性衰退
随着年龄增长,我们消化系统本身的衰老,也在悄然改变着肠道菌群的生存环境。
胃肠道动力减弱
随着年龄增长,肠道蠕动和结肠转运功能减慢,容易导致便秘、腹胀等问题。食物残渣在肠道内停留时间过长,会改变发酵模式,可能有利于腐败菌的生长。
此外,肠神经系统(ENS)中神经元的退化也加剧了这一问题。
消化液分泌减少
注:胆囊逐渐对介导饱腹感的肽类激素——胆囊收缩素变得不敏感,导致其在血浆中的水平升高。这种被抑制的胆囊收缩素功能会逐渐导致食欲/饥饿感下降和食物摄入量减少,并促进老年人的营养不良,所有这些都会逐渐减少对维生素合成、能量代谢和免疫功能至关重要的有益肠道微生物。
有趣的是,百岁老人能产生独特的具有抗菌特性的次级胆汁酸(例如,石胆酸的独特异构体),是一种正向适应,这可能是他们维持肠道稳态的秘诀之一。
而在普通老年人中,失调的次级胆汁酸(如脱氧胆酸及其甘氨酸或牛磺酸结合形式)则与阿尔茨海默病等衰老相关疾病有关。

什么是胆汁酸,其与肠道微生物互作如何影响人体健康18 赞同 · 0 评论 文章

肠道微生物群对胆汁酸代谢和信号传导影响的最新研究成果20 赞同 · 1 评论 文章
肠道自身的衰老
肠上皮细胞(IECs)的更新能力随着年龄增长而下降。肠道干细胞耗竭,导致组织再生和愈合能力减弱。
衰老的肠上皮细胞和杯状细胞(负责分泌黏液)功能下降,导致保护性的黏液层变薄,肠道通透性增加(即“肠漏”),使得细菌及其产物(如LPS)更容易进入血液,引发全身性炎症。
最终后果:“肠道-器官轴”通讯中断
肠道并非一个孤岛,它通过免疫、神经、内分泌和代谢等多种途径,与我们全身所有器官(包括大脑、心脏、肝脏等)构成了一个复杂的双向通信网络。
肠道菌群正是这个网络中的关键,它们合成和调节着无数的信号分子,如:
当肠道菌群失调时,这个通信网络便会中断或充满错误信号。有益减少,有害增多,这种混乱的沟通状态,最终会体现在全身性的功能障碍上,包括免疫失调、心血管问题和认知能力下降等。
总结来说,肠道菌群的健康与否,直接关系到整个身体的衰老轨迹。它既是衰老过程的反映,也是一个可以主动干预、用以延缓衰老和促进老年健康的潜在靶点。
既然我们已经认识到肠道菌群在衰老过程中的重要地位,那么我们能否通过主动干预肠道菌群,来延缓衰老、促进健康长寿?答案是肯定的。
靶向肠道微生态的治疗干预措施,从生态失调中恢复生态平衡(稳态),不仅有望改善肠道健康,而且有望通过减轻年龄相关疾病促进整体健康和健康衰老和长寿。
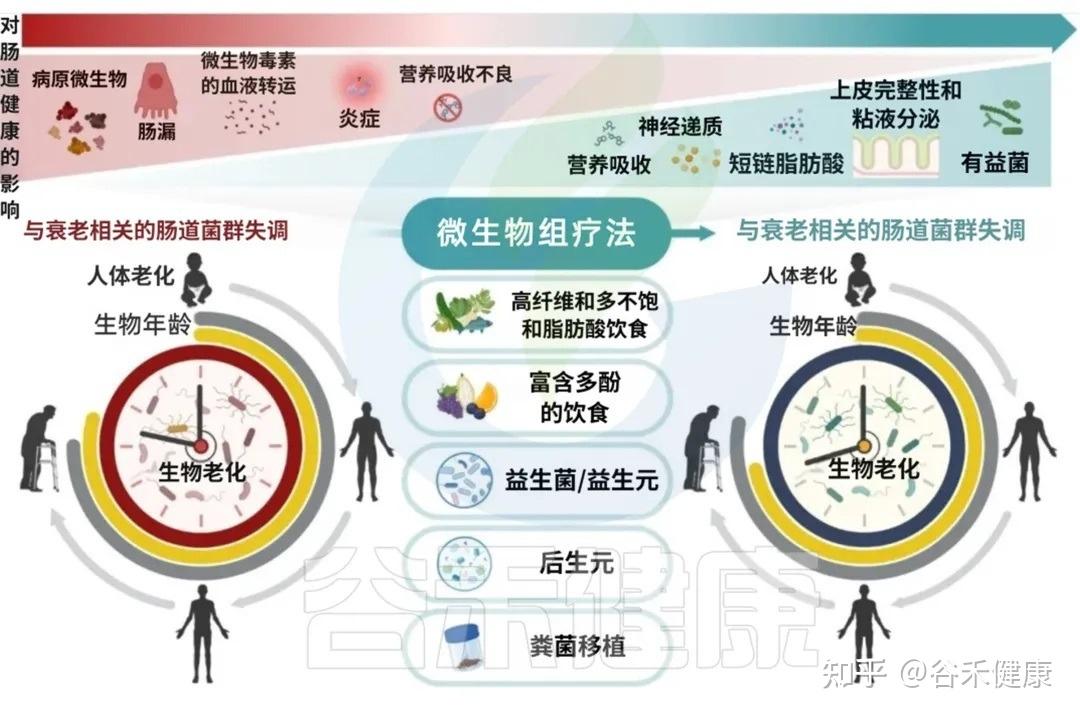
在所有影响肠道菌群的因素中,饮食是核心角色之一。尽管生理性的衰老不可避免,但大量短期、长期的饮食干预研究已证明,通过调整饮食,我们拥有巨大的潜力来延缓衰老的进程。
饮食如何塑造我们的衰老轨迹?
工业革命以来,人类的饮食结构发生了剧变,这种变化的速度远远超过了我们基因的适应速度。然而,我们的肠道微生物凭借其极短的代际时间迅速适应,从而演化出了由饮食、年龄、地理和健康状况共同塑造的高度个体化菌群。
下图清晰地展示了饮食对衰老轨迹的深远影响
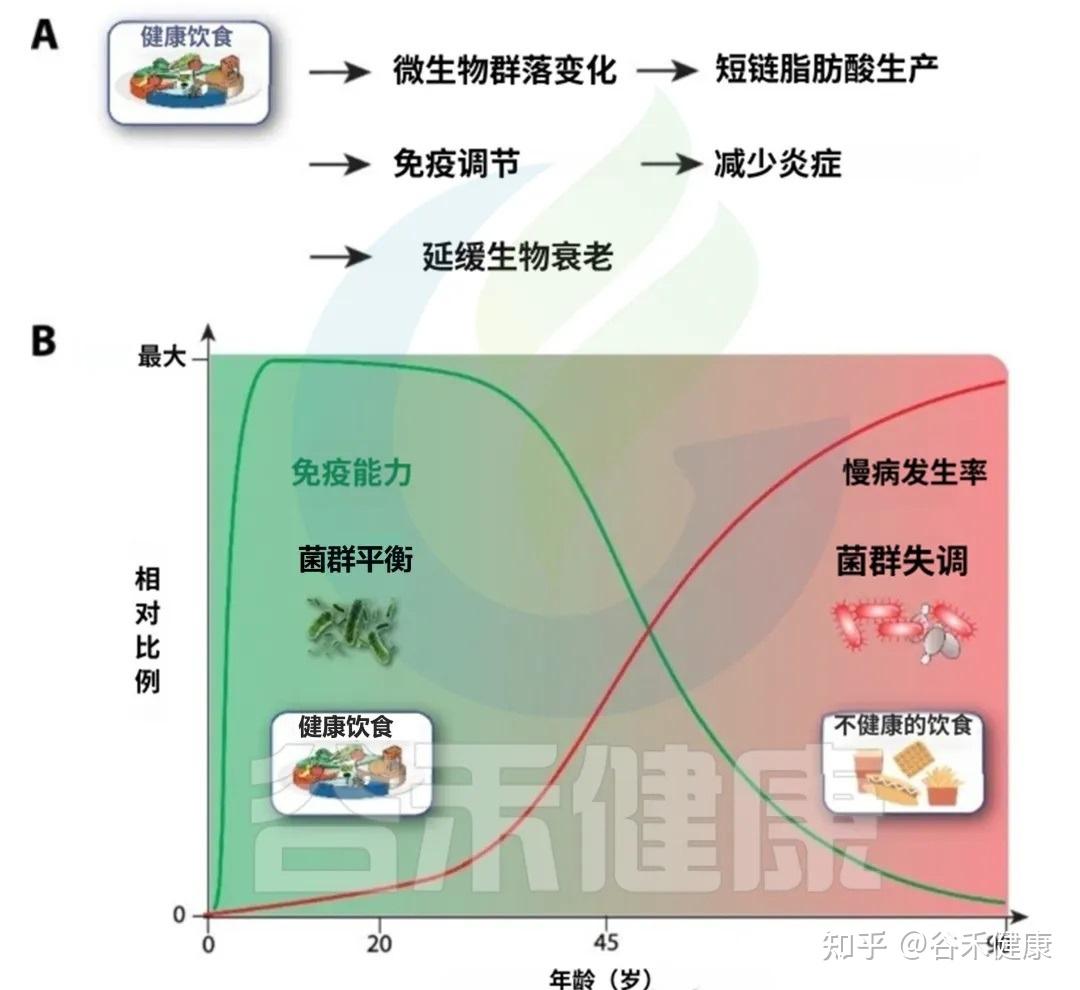
A健康的饮食促进有益的微生物群转变,增强短链脂肪酸的产生,调节免疫反应,并减少慢性低度炎症。这些效应共同导致生物衰老的延迟。
B免疫能力和非传染性疾病发病率与饮食质量的年龄相关轨迹示意图。早期坚持健康的饮食支持生态良好和强大的免疫功能(绿色曲线),而不健康的饮食与生态失调,炎症增加、随着时间的推移慢性病(NCD)负担增加有关(红色曲线)。
中年时期是一个关键的“十字路口”,此时的饮食选择将在很大程度上决定你未来,是走向健康的A路径,还是加速衰老的B路径。
地中海饮食:经过验证的减轻老年衰弱
一项长期、大规模的长期临床研究发现(注册号 NCT01754012),遵循地中海饮食模式与显著降低老年人的衰弱风险密切相关。
其背后的机制正是通过调节肠道菌群:这种饮食模式能有效增加有益菌的丰度,例如:
同时抑制与2型糖尿病、结直肠癌等疾病相关的潜在有害菌,例如:
改良地中海-生酮饮食(MkD):保护大脑功能
在针对轻度认知障碍老年人的研究中,改良的地中海-生酮饮食展现出显著的神经保护效果。其作用路径同样是通过肠道菌群:
高脂饮食:警惕坏脂肪,加剧炎症与菌群失调
近年来,老年人的饮食模式趋向于减少纤维、增加脂肪摄入。这会对衰老产生显著的负面影响。
促炎效应
高脂饮食会显著增加脂肪组织中的促炎因子(如TNF-α)和单核细胞趋化蛋白-1(MCP-1)的水平,并促使免疫细胞(巨噬细胞)向更具攻击性的M1型极化,加剧肝脏等器官的炎症。
破坏肠道菌群
高脂饮食会增加厚壁菌门的丰度(与炎症正相关),同时减少产丁酸菌,如瘤胃球菌科等。这会削弱肠道屏障的紧密连接,增加“肠漏”风险。
关键区别:并非所有脂肪都是有害的。
Omega-6多不饱和脂肪酸:通常具有促炎作用。
Omega-3多不饱和脂肪酸:如鱼油、亚麻籽油中的ALA,则具有明确的抗炎作用。
Omega-3能增加菌群多样性,促进双歧杆菌等有益菌的生长,减少肠杆菌,帮助改善肠道屏障功能,并增加有益的SCFA(富集产短链脂肪酸的毛螺菌科Lachnospiraceae)、减少有害的TMAO的产生。
控制总脂肪摄入并优化脂肪酸来源(尤其是增加Omega-3的比例),对于维护老年人的免疫健康和肠道稳态具有重要意义。
高蛋白饮食:复杂且需谨慎对待
高蛋白饮食对衰老的影响是复杂的,其效果因蛋白质的来源、数量以及个体的健康状况而异。
潜在益处:特定情境下的抗炎
在某些特定条件下,增加蛋白质摄入可能有助于抑制炎症。
例如,一项针对进行阻力训练的百名老年女性(60-90 岁)的研究发现,通过增加瘦红肉消费来提高蛋白质摄入的群体,其血浆中由运动引发的炎症标志物IL-6水平有所降低。这表明,在高蛋白饮食与规律运动相结合时,可能对控制炎症有积极作用。
潜在风险:促炎、免疫失衡、肠道菌群紊乱
——引发促炎反应与免疫失衡
多项研究将高蛋白饮食与促炎因子的升高联系起来。
在老年小鼠中,摄入全蛋白的高蛋白饮食会提高血浆中LPS、IL-6和IL-10的水平,而摄入水解蛋白则会额外增加TNF-α。表明高蛋白饮食,特别是当蛋白质未水解时,可能会在老年小鼠中引发更强烈的促炎反应。
此外,高蛋白、低碳水化合物的组合在老年大鼠中甚至表现出免疫抑制作用。
更为复杂的是,在一项结合了运动干预的研究中,富含Omega-3的高蛋白饮食反而导致了老年人体內具有抗炎作用的IL-10和IL-1Ra水平下降,这可能暗示着免疫调节机制的潜在紊乱。
——破坏肠道微生态与屏障功能
在老年女性中,高蛋白饮食与产丁酸菌的减少相关,而丁酸盐是维持肠道屏障功能和抑制炎症的关键短链脂肪酸,其减少可能导致肠道屏障受损。
动物实验也证实,摄入全蛋白的高蛋白饮食会破坏小鼠小肠的组织结构,减少保护性的杯状细胞数量,并导致链球菌(Streptococcus)等潜在有害菌增多,同时减少有益的双歧杆菌。
——产生有害代谢物
当蛋白质摄入过高(>1.6 g/kg体重/天)时,可能会导致肠道菌群发酵未被消化的蛋白质,产生有害代谢物。
例如,在老年男性中观察到,这种饮食模式与心血管疾病风险标志物——三甲胺氧化物(TMAO)的水平升高有关。虽然在大鼠中也观察到粪便乙酸盐水平的增加,但这同样可能源于蛋白质的异常发酵。
关键调节因素:蛋白质的“质”与“量”
蛋白质的类型(质)是决定其效果的关键。在上述破坏肠道结构的小鼠研究中,水解蛋白相较于全蛋白,显示出了截然不同的保护作用:它改善了小肠结构,增加了杯状细胞和有益的双歧杆菌,并减少了致病菌。这提示我们,蛋白质的消化吸收效率可能直接影响其对肠道健康的作用。
►▷
虽然高蛋白饮食近年来越发流行,但现有数据提示我们需谨慎对待,尤其是在老年群体中。当前的饮食指南建议将蛋白质摄入量限制在1.0-1.2 g/kg体重/天,并保证充足的碳水化合物摄入,这或许是避免潜在风险、维持免疫和肠道稳态的更为稳妥的策略。未来的研究需进一步阐明这些复杂的相互作用,以制定更精准的老年营养建议。
高纤维饮食:抗衰老,滋养有益菌,抑制炎症
高纤维饮食对免疫系统和肠道菌群的有益影响是明确且显著的。然而,大多数老年人的纤维摄入量远低于推荐标准(女性 21 g/天;男性 30 g/天)。
抗炎作用
膳食纤维(特别是可溶性纤维,如菊粉)是肠道益生菌的“首选食物”。它们通过发酵纤维产生大量丁酸盐等短链脂肪酸,这些物质能有效抑制全身和大脑中的炎症反应。
减轻神经炎症
高纤维饮食带来的丁酸盐水平增加,已被证明能有效减少中枢神经系统中“小胶质细胞”的促炎细胞因子表达,从而改善与衰老相关的神经炎症。
在人类研究中,食用富含纤维的谷物与多种炎症标志物水平降低相关,特别是C反应蛋白(CRP)和IL-1Ra。然而,有趣的是,来自水果和蔬菜的纤维并未显示出同样的效果。这提示我们,纤维的来源(如可溶性 vs. 不溶性)、是否存在其他生物活性化合物、以及加工方式都可能影响其最终的生物学效应,亟需进一步研究。
改善肠道菌群
高纤维饮食对肠道菌群的组成有着显著的积极影响,能够促进有益菌群的生长。
一项针对中国老年群体的研究显示,高纤维饮食者的肠道中瘤胃球菌科的丰度更高,而拟杆菌目和毛螺菌科的丰度较低。该变化可能与地理或膳食差异有关,并非绝对不良。
另一项针对55-80岁人群的研究,增加菊粉摄入量与更高的微生物多样性相关,显著提升了以下菌群的丰度:双歧杆菌、Alistipes shahii、Anaerostipes hadrus、Parabacteroides distasonis。
影响的复杂性:纤维类型、宿主年龄与性别的交互作用
尽管高纤维饮食益处明确,但其具体效果并非一成不变,而是受到多种因素的复杂调节。
效果的非普遍性
一项老龄小鼠研究发现,虽然含2.5%菊粉的饮食通过增加双歧杆菌和粪杆菌属(Faecalibacterium),并增强丁酸盐产量来改变了肠道微生物组,但它并未减少不同年龄组间的菌群总体差异,也未能改善全身性炎症或肠道生理指标。这表明纤维的干预效果是特定的,而非全局性的。
年龄特异性
在另一项小鼠研究中,菊粉能够有效降低厚壁菌门与拟杆菌门的比例,但其对特定菌属的影响具有年龄特异性——在老年小鼠中,菊粉显著增加了双歧杆菌和拟杆菌属 的数量。
性别依赖性
近期一项利用人源化小鼠模型的研究,更清晰地揭示了菊粉作用的性别差异。
对两性的共同影响:
对雌性小鼠的更强影响:
对雄性小鼠的特定影响:
高纤维饮食是维持老年健康的关键策略,它能有效抑制炎症并优化肠道菌群。然而,其效果并非“一刀切”。纤维的来源、类型(如菊粉)、宿主的年龄乃至性别,都会影响其最终的生物学功能。在制定未来营养策略时,需考虑个体化因素,以便实现更精准、高效的健康干预。
这提示我们,餐桌或许是最日常却最深远的抗衰老实验场。
色氨酸
讲究最佳剂量
色氨酸,一种必需氨基酸,在人体的应激反应、心理健康及炎症调节中扮演着核心角色。
色氨酸有几种饮食来源,包括:燕麦,香蕉,干梅子,牛奶,金枪鱼,奶酪,面包,鸡肉,花生等。
在衰老背景下,色氨酸对免疫系统和肠道微生物组的影响尤为复杂,呈现出显著的“剂量依赖性”,即适量摄入是关键。
核心机制:犬尿氨酸途径与免疫衰老
色氨酸的免疫调节功能主要通过犬尿氨酸途径实现。在衰老过程中,体内的慢性炎症会激活此通路中的关键酶(IDO),导致一系列的连锁反应,最终可能加速免疫系统的衰老。
具体而言,在该途径中,超过95%的游离色氨酸被关键的限速酶——吲哚胺-2,3-双加氧酶(IDO)所降解,产生犬尿氨酸及其下游代谢物。这些代谢物不仅参与调节免疫功能,还是合成烟酰胺腺嘌呤二核苷酸(NAD+)的前体。
衰老过程本身伴随着慢性低度炎症,这会提高IDO酶的活性。IDO活性增强导致犬尿氨酸/色氨酸比率升高,进而激活芳烃受体(AhR)信号通路。该通路通过上调Foxp3,增加Treg的活化,最终促进胸腺退化和细胞衰老,这一过程被称为免疫衰老。
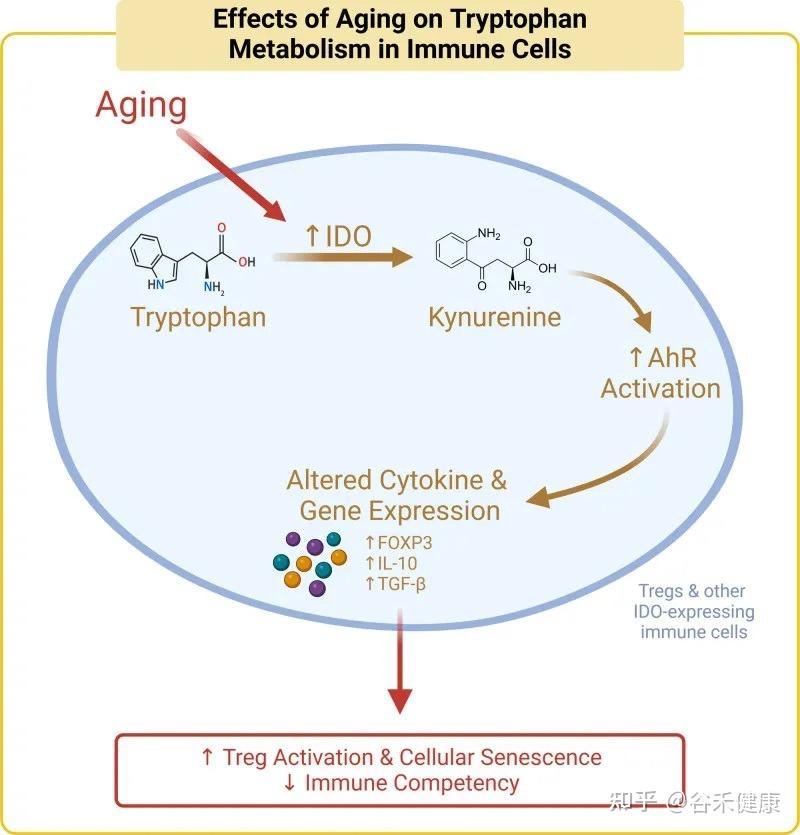
剂量决定效果:色氨酸摄入量的三重效应
关于色氨酸的摄入,研究揭示了一个非常关键的原则:并非越多越好,而是存在一个最佳窗口。
➦ 摄入过少(缺乏):加剧炎症与菌群失调
衰老本身就与小鼠体内色氨酸及其关键代谢物——吲哚的水平下降有关。在此基础上,色氨酸缺乏会进一步恶化健康状况。
一项针对老年小鼠的研究显示,与正常补充(0.2%)相比,缺乏色氨酸的饮食会导致促炎细胞因子IL-6、IL-17A和IL-1α显著增加,同时抗炎因子IL-27水平降低。
肠道微生物组也发生剧烈变化,包括下列菌群丰度均发生改变:
➦ 摄入适中,带来显著益处(最佳窗口)
一项老年小鼠研究中,摄入中等水平的色氨酸(占饮食的0.4%)显示出多重益处。这种饮食模式显著降低了潜在有害菌群的相对丰度,如丹毒丝菌属 (Erysipelatoclostridium)、肠球菌属(Enterococcus) 、Dubosiella菌属。
与此同时,它促进了有益菌的生长:
➦ 摄入过量,产生毒性,弊大于利
“越多越好”的原则在这里并不适用。摄入更高水平的色氨酸(占饮食的0.8%)则会加剧肠道黏膜屏障的损伤、氧化应激、炎症反应、严重的肠道菌群失调。
►▷
综上所述,色氨酸在衰老中的作用极为精准,呈现“剂量依赖性”。它不仅通过犬尿氨酸途径调控免疫,其摄入量还深刻影响肠道菌群与全身炎症。研究表明,存在一个有益的“最佳窗口”(如0.4%的补充),而缺乏或过量摄入均可能损害老年机体。这凸显了对色氨酸等营养素采取精准营养策略的必要性,未来的研究也应扩展至蛋氨酸、支链氨基酸等,以构建更全面的老年营养支持体系。

色氨酸代谢与肠内外健康稳态37 赞同 · 2 评论 文章
Omega-3 脂肪酸:强大的抗炎剂
Omega-3脂肪酸作为一类重要的多不饱和脂肪酸(PUFA),主要来源于鱼类、海鲜、坚果、种子和某些植物油。然而老年人群的Omega-3摄入量却常常低于最佳水平。大量研究证实,Omega-3脂肪酸具有强大的抗炎潜力,是维持衰老过程中免疫稳态的关键。
调节炎症介质产生
Omega-3脂肪酸(包括其前体α-亚麻酸ALA,以及EPA和DHA)能够显著减少促炎性类二十烷酸(如前列腺素E2、白三烯B4和LTC4)的合成。
在一项针对老年大鼠的研究中,补充Omega-3同时降低了IL-1β、MCP-1和TNF-α等多种细胞因子的浓度。
平衡脂肪酸比例
炎症状态不仅取决于Omega-3的绝对量,也取决于其与Omega-6脂肪酸的比例。体内Omega-6与Omega-3的比例过高,会直接导致TNF-α和IL-6等促炎细胞因子水平升高。
影响细胞功能与信号通路
Omega-3能直接影响免疫细胞的功能,包括调节白细胞活性和T细胞的发育。
在老年人的骨骼肌中,富含Omega-3的饮食被证明可以减少促炎细胞因子IL-1β的表达,并抑制mTOR(哺乳动物雷帕霉素靶蛋白)信号通路,从而减轻局部炎症和调节细胞代谢。
通过肠道微生物组介导
在人类中,Omega-3摄入被证实能通过改善肠道微生物组来抵消由肥胖引起的炎症和代谢紊乱。这种菌群改变有助于减少促炎性的循环脂多糖(LPS)水平,并抑制下游的NF-κB炎症信号通路。
协同效应:与生活方式干预结合效果更佳
Omega-3的抗炎效果可以与其他健康干预措施产生协同效应。
研究表明,在肥胖的绝经后女性中,虽然单独补充Omega-3或进行减肥都能降低体内的促炎因子水平,但当Omega-3补充剂与超过10%的体重减轻相结合时,其抗炎效果最为显著。
►▷
提高老年人Omega-3的摄入量,并将其与健康的生活方式(如体重管理)相结合,是抑制慢性低度炎症、维持免疫稳态的有效策略。

探索Omega-3脂肪酸:健康益处与营养补充12 赞同 · 0 评论 文章
膳食多酚:与菌群合作
膳食多酚:与菌群合作
多酚广泛存在于植物性食物中,如蓝莓、葡萄、可可、绿茶、苹果等。它们以强大的抗氧化和抗炎能力而闻名。在预防多种慢性疾病中显示出巨大潜力。
然而,其真正的抗衰老潜力并非通过直接吸收,而是通过与肠道菌群的复杂互动来“解锁”的。
核心机制:肠道菌群是多酚发挥作用的关键中介
由于其化学结构复杂且常常被糖基化,它们在小肠中的直接吸收率非常有限。但这恰恰成为了它们发挥更深远作用的起点。
大量未被吸收的多酚会到达大肠,成为肠道菌群的理想底物,并在此引发双重有益效应。
——直接作为养料,促进有益菌的生长
例如,研究证实,富含花青素和原花青素B2的饮食能够在衰老啮齿动物模型中,显著增加对肠道健康至关重要的产丁酸菌的丰度。
——代谢活化与菌群重塑
肠道菌群在享用多酚的同时,会将其分解代谢为一系列生物活性更强、更易被人体吸收的小分子代谢物。这个过程不仅激活了多酚的抗炎和抗氧化潜力,同时代谢过程本身及其产物还能温和地抑制有害菌,从而优化整个肠道菌群的结构。
多酚与益生菌的协同抗衰老效应
多项研究为肠道介导这一机制提供了有力证据,并揭示了多酚与益生菌之间的协同作用。
——减轻炎症性衰老
一项针对50岁及以上成年人的研究发现,在富含多酚的饮食基础上额外补充特定的益生菌,能够有效减轻慢性低度炎症,同时受试者肠道中的有益菌和短链脂肪酸水平也得到显著提升。
——传统补品的现代诠释
富含抗氧化物的传统草药——红参,其抗衰老效果同样与肠道菌群密切相关。它不仅能直接对抗氧化应激,还能促进有益菌的生长,并通过菌群代谢活动来强化肠道屏障功能。
更值得注意的是,当红参经过特定益生菌发酵后,其抗衰老特性得到显著增强。这归因于抗氧化相关基因的上调和对肠道菌群更有效的积极调节。
我们吃的食物不仅仅是在填饱肚子,更是在喂养体内的亿万微生物。通过多吃富含多酚的彩色果蔬和选择红参等天然补品,我们就能和肠道菌群打好配合,让它们帮我们把食物中的营养变成抗衰老的利器,实现从肠道到全身的健康。

肠道微生物群与膳食多酚互作对人体健康的影响30 赞同 · 3 评论 文章

多酚等膳食成分与肠道菌群协同作用可以更好地改善骨质疏松症3 赞同 · 1 评论 文章
益生菌干预的核心是直接向肠道输送特定的有益微生物,以实现靶向健康效益。
——改善大脑健康与情绪(调节肠-脑轴)
临床研究也证实,通过益生菌干预提高肠道中普拉梭菌(Faecalibacterium prausnitzii) 的水平,与焦虑、抑郁等神经精神症状的改善密切相关。
——强化肠道屏障,抑制全身性炎症
下一代益生菌:巨大潜力
研究的焦点正从传统的乳杆菌属和双歧杆菌属,扩展到一些新发现的、潜力巨大的肠道共生菌,它们被称为“下一代益生菌”。
其他潜力菌株也备受关注:

AKK菌——下一代有益菌21 赞同 · 0 评论 文章
通过精准干预肠道,我们可以恢复其稳态,进而增强免疫、改善代谢,并有效对抗衰老。益生元和合生元构成了这一策略的核心工具箱,它们在衰老的肠道环境中展现出显著的积极作用。
益生元:喂养有益菌
益生元是为有益肠道菌群提供营养的“食物”(如膳食纤维、低聚半乳糖GOS),为整个生态系统的健康奠定基础。
低聚半乳糖 (GOS) 是其中的典型代表,它来源于豆类、乳制品等。研究证实,补充GOS能够:
研究发现,补充GOS可以通过增强食糖细菌及其相关酶(β-半乳糖苷酶)的丰度,来改善肠道上皮完整性和粘液产生,从而调节衰老肠道的稳态。
合生元:益生菌与益生元的“强强联合”
一项临床研究报告称,老年女性在摄入名为MPRO3的合生元产品(由多种益生菌和膳食纤维组成)后,其血液代谢物谱、肠道菌群和整体肠道健康均得到积极调节。
后生元:更安全、更精准的有益物质
后生元是一个新兴且极具潜力的领域。它指的是“源自微生物的有益物质”,包括无活性的菌体、菌体碎片(如细胞壁)或细菌的代谢产物。
后生元的优势在于更稳定、更安全,因为它不涉及活菌的定植问题,而是直接提供发挥功效的“最终产物”。
——菌体成分
热灭活的益生菌(如副干酪乳杆菌)的细胞壁成分脂磷壁酸 (LTA),被证实能直接抑制炎症信号(NF-κB),同时促进黏液分泌,修复肠漏。
——代谢产物
这是指由微生物产生或将膳食成分转化而来的、具有健康效益的小分子物质。
在衰老模型中,它能通过下调 HMGB1-TLR4-NF-κB 炎症通路、减轻氧化应激并积极调节肠道菌群,来全面改善肠道功能。
——无活性的菌体
即便是完整但无活性的微生物,也能通过其细胞结构与人体免疫系统等发生互作,产生健康效益,这种方式被称为“幽灵效应”。
经过间歇灭菌(也称为廷德尔灭菌法)(一种温和加热灭活法)处理的长双歧杆菌(B.longum) 和嗜酸乳杆菌 (L. acidophilus) 菌株,在与运动干预相结合时,展现出改善阿尔茨海默病(AD)病理的潜力。其机制包括:
最终效果:减少大脑中淀粉样蛋白-β的聚集。
►▷
微生物的健康效应,并非完全依赖于其活性。
后生元绕开了活菌在储存、运输和定植中的不确定性,为开发更安全、更稳定、靶点更明确的新型疗法或辅助保健品铺平了道路。未来,后生元也将成为防治衰老疾病的重要途径。
许多我们熟知的药物和膳食补充剂,其作用并非仅仅是简单的化学分子与人体细胞的直接互动。它们的抗衰老等多效性作用,在很大程度上是通过与肠道菌群的复杂“对话”和“合作”来实现的。
药物干预:从直接靶点到微生物介导
案例一:二甲双胍—— 经典的生物转化
作为一线降糖药,二甲双胍的益处远超血糖控制。最近的研究证明,肠道微生物组对其进行了关键的生物转化。
在老年小鼠中,二甲双胍治疗通过抑制Wnt信号通路,增强了肠道粘蛋白的产生,这一由菌群介导的过程最终对神经认知功能产生了积极影响。这表明,没有微生物组的参与,二甲双胍的某些重要功效可能无法完全发挥。
案例二:衰老细胞清除药物—— 协同调节
特定的“衰老细胞清除”药物(如达沙替尼和槲皮素),其作用也不再是单一的。研究表明,它们在清除体内衰老细胞的同时,还能主动调节肠道菌群——即促进抗炎微生物的生长,并抑制促炎微生物。
这一发现强烈暗示,这些前沿抗衰老药物的整体效果,至少部分是通过与肠道菌群的协同作用介导的,共同减少了肠道乃至全身的衰老和炎症。
膳食补充剂:菌群是关键中介
案例一:α-亚麻酸 (ALA) —— 清晰的微生物依赖途径
植物来源的ALA(一种Omega-3脂肪酸)的抗血栓效应,就是一个完美的例证。其作用并非直接,而是遵循一个清晰的微生物依赖路径:
案例二:NAD+抗衰老:肠道菌群的关键一环
补充烟酰胺单核苷酸(NMN)或烟酸(维生素B3)是目前流行的抗衰老策略,其核心机制是提升细胞内的NAD+水平。
研究发现,NMN也能通过调节肠道菌群来维持肠道稳态。鉴于肠道菌群拥有独特的酶来参与NAD+代谢,有理由推测,这类补充剂的抗衰老效果可能直接或间接地与肠道菌群的变化有关。

关于长寿因子(NAD+)你了解多少?——健康益处及如何提高补充效果6 赞同 · 1 评论 文章
粪便微生物群移植(FMT)不再是补充单一菌株或代谢物,而是通过移植一个完整的、健康的微生物生态系统,来彻底重置和改造宿主的肠道环境。
这一新兴策略正从治疗特定肠道疾病(如复发性艰难梭菌感染、IBS、克罗恩病等)的成功案例中,迈向一个更宏大的目标:促进健康衰老与延长寿命。
核心证据:从肠道到大脑的系统性年轻化
大量的临床前和临床研究表明,FMT的益处远不止于肠道本身,它能沿着“肠-脑轴”向上影响,实现系统性的抗衰老效果。
未来展望:建立“长寿菌群”生物样本库
FMT的潜力上限,取决于捐赠者菌群的质量。
关键发现:研究已证实,将长寿老年捐赠者(如百岁老人)的粪菌移植到小鼠体内,可以通过引入有益的细菌及其代谢物,有效改善受体的各项衰老相关指标。
基于这些证据,系统性地探索使用健康、长寿的捐赠者来建立一个特征明确的FMT生物样本库,可能为减轻与衰老相关的健康损害,提供一条有效的治疗途径。

粪菌移植——一种治疗人体疾病的新型疗法7 赞同 · 2 评论 文章
力量训练
中到高强度的抗阻训练,建议每周2-3次。训练强度通常设定在个人最大重复次数(1-RM)的60-85%之间,每个动作进行1-3组,每组重复8-12次。
例如,使用壶铃(一种具有特殊形状握把的重量,配有专门的训练方案)进行 8 周训练,可以改善与肌肉减少症和低度炎症相关的指标。
这种训练能够有效调节体内的微小核糖核酸(miRNAs)。它能抑制促进肌肉萎缩的miRNA,同时激活促进肌肉合成与生长的miRNA,从而打破肌肉流失的恶性循环,实现肌肉质量和力量的维持与增长,有效延缓衰老过程中的身体功能衰退。
高强度间歇训练 (HIIT) vs. 中等强度持续训练(MICT)
研究发现:两者对老年人的肠道菌群和肌肉功能有不同的调节效果。微生物组分析显示,HIIT组α多样性增加,并富集了产短链脂肪酸菌(如 Faecalibacterium prausnitzii),MICT组与多样性稳定和双歧杆菌适度增加相关。
HIIT在提升心肺功能和认知控制能力方面更优;而MICT则对改善情绪(心理健康)和帮助坚持运动更有利。
注:HIIT-涉及短时间高强度运动和短暂休息或低强度运动交替进行。MICT-中等强度持续一段时间的运动(如慢跑、骑行)。
瑜伽
一个为期12周的瑜伽项目,结合了体式、呼吸技巧和冥想,证实了其对阿尔茨海默病患者和其照护者的双重益处。
瑜伽是一种实用、经济的辅助方法,其成功也暗示了其他身心活动在延缓衰老相关疾病方面的潜力。
太极、有氧运动、八段锦
对于膝骨关节炎患者,这几种运动在减轻疼痛和改善身体功能方面的效果相当。
研究发现,太极能在12周内显著改善患者的疼痛管理(依据WOMAC量表评估)、姿势稳定性及功能性活动能力。
►▷
总的来说,老年人保持规律的活动总量(不一定要某种特定类型的运动或强度),能有效改善血管健康。 核心在于“动起来”,任何形式的规律运动都有益于心血管健康,不必过分纠结于某一种特定的运动方式。
要真正运用好肠道菌群来调节或延缓衰者,我们需要更强大、更智能的工具来指引方向。
从海量数据到精准洞察:AI与多组学的力量
我们的身体是一个极其复杂的系统。基因(基因组学)、代谢产物(代谢组学)、肠道菌群(微生物组学)……这些“多组学”数据共同交织,决定了我们的健康轨迹。在过去,我们很难看清这背后的规律。
而现在通过大数据可以整合分析这些不同维度的数据,帮助我们回答那个最核心的问题:在衰老过程中,究竟是哪些菌群、哪些营养分子,起到关键作用。
精准干预的前提:找到一把好的“衰老标尺”
要想知道我们的干预措施是否有效,首先需要一把能够精确测量“生物学年龄”的标尺。这个“标尺”就是衰老生物标志物。
根据国际性的衰老生物标志物联盟提出的全面框架,一把理想的“衰老标尺”必须满足六个关键维度:
可行性、有效性、懂机制、
适用广、反应灵敏、成本可控
换言之,一把好的“衰老标尺”,必须用得起、测得准、看得懂机制、适用广…幸运的是,最新的技术进展,特别是肠道菌群和免疫衰老的生物标志物,正为我们提供了构建这把“标尺”的强大工具。
精准营养时代:告别“一刀切”的健康建议
“精准营养”的最终目标,是根据每个人的独特性,提供量身定制的健康方案。
这意味着,通过对你个人的基因、代谢和肠道菌群进行综合检测,我们能知道,为什么对你有效的维生素D₃,对他来说可能Omega-3脂肪酸更重要。
一句话总结:我们已经推开了“通过调节菌群来抗衰老”这扇大门,但门后的世界依然充满未知。未来的研究方向很明确:通过更大规模的全球合作和更长时间的跟踪研究,全面揭示不同肠道菌群模式与健康衰老之间的内在联系,从而找到最精准、最个性化的方法,让每个人都能通过管理好自己的肠道菌群,实现更长久、更健康的生命。
抗衰老不应被视为与自然规律的对抗
而是一种与生命节奏的和谐共舞。
人间万事,生命最为宝贵;
生命长短,质量至关重要。
掌握科学的抗衰老智慧,
倾听肠道菌群等身体信号,
活出自己生命的最佳状态。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。