-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
胆碱(2-羟基‑N,N,N‑三甲基乙铵),是我们身体正常运转不可或缺的一种必需营养素。它的角色至关重要:一方面,它是构成细胞膜的重要原料,参与合成磷脂酰胆碱等物质来维持细胞的完整结构;另一方面,它也是神经递质“乙酰胆碱”的前体物质,在大脑与神经功能中扮演着关键角色。
正因如此,乙酰胆碱的水平失衡已成为临床上监测阿尔茨海默病、帕金森病及重症肌无力等疾病的关键指标。在日常生活中,我们可以通过食用鸡蛋黄、动物内脏以及大豆等来获取较为丰富的胆碱。
然而,对于这样一种重要的营养素,并非多多益善,需要维持一个平衡,过高或过低都可能对健康构成威胁。
当胆碱摄入不足时,与婴儿大脑发育,中老年神经退行性疾病,代谢综合征以及癌症风险都密切相关。研究报道胆碱缺乏造成基因甲基化失衡,可能促发肝癌、乳腺癌及结直肠癌等的发生。
与此同时最近研究发现,一些肠道细菌例如拟杆菌和梭菌细菌能将胆碱转化三甲胺(TMA),然后再经由肝脏FMO3酶氧化生成氧化三甲胺(TMAO),而TMAO与动脉粥样硬化和血栓形成等心血管疾病密切相关,被视为心脑血管的潜在风险指标。
因此,本文带大家一起了解什么是胆碱,及其与肉碱区别,胆碱在人体的转化代谢和对健康的影响,胆碱不平衡引发的疾病以及饮食调整与健康防控的科学策略。
什么是胆碱?
胆碱(2-羟基-N,N,N-三甲基乙铵),是人类必需的营养素,对大脑、肝脏和全身代谢等都非常重要。它既是细胞膜的组成原料(主要参与合成磷脂,如磷脂酰胆碱),又是神经递质乙酰胆碱的前体,帮助大脑传递信号、维持记忆和注意力。同时,胆碱还能转化为甜菜碱(betaine),在体内甲基化反应中提供“甲基”,参与DNA和蛋白质的调控,是表观遗传调节的重要环节。
▸ 胆碱的生物学功能
★ 关键生理角色
结构作用:是细胞膜主要磷脂(PC、磷脂酰乙醇胺PE)的前体,维持膜的完整性与流动性。
神经递质合成:为乙酰胆碱(acetylcholine)合成提供原料,参与记忆、注意和肌肉控制。
甲基供体来源:通过转化为甜菜碱供给 S-腺苷甲硫氨酸(SAM)的甲基,参与DNA、蛋白和磷脂的甲基化,对基因表达和表观遗传调控至关重要。
脂质代谢与肝功能:促进脂肪从肝脏输出,预防脂肪肝。
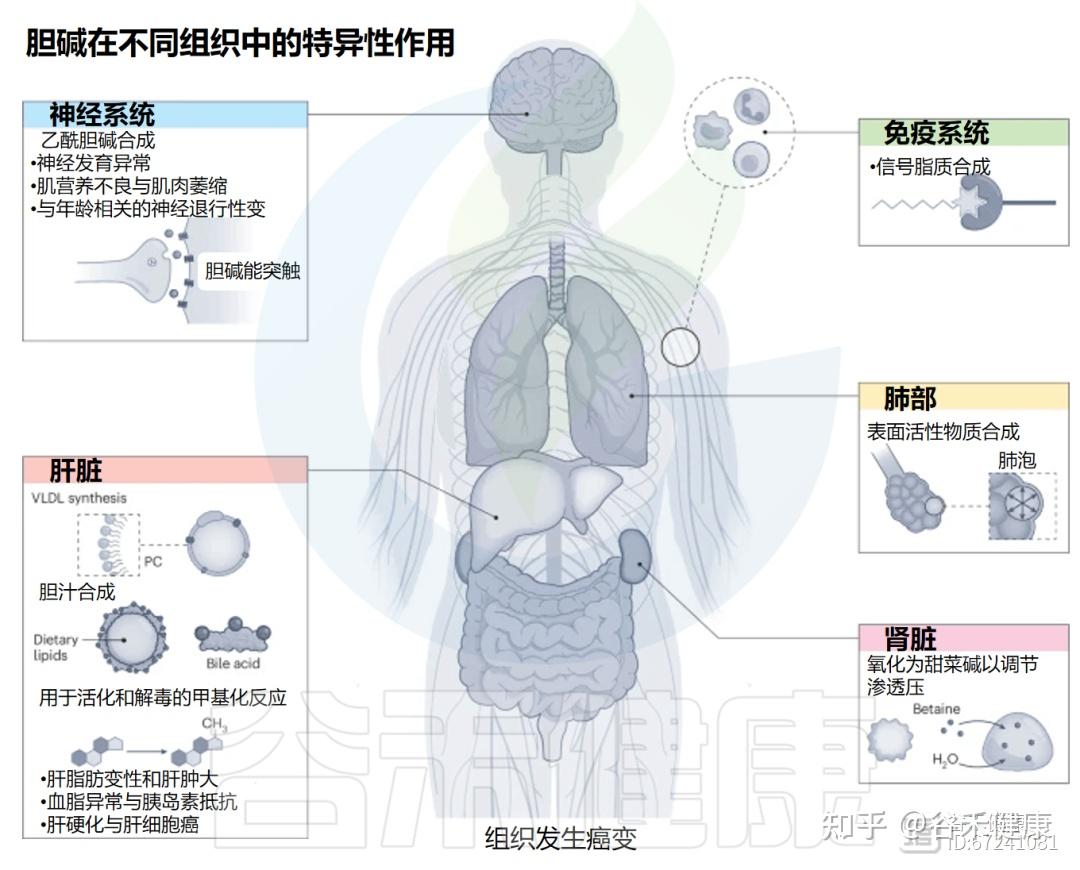
▸ 影响神经系统发育与功能维持
·胎儿期及早期生命阶段高胆碱摄入可增强大脑海马区的神经发生、突触可塑性与学习记忆能力。
·唐氏综合征模型(Ts65Dn小鼠)中改善注意与空间学习障碍,恢复海马神经发生。
·Rett综合征、小鼠精神分裂症模型(DBA/2小鼠):改善运动协调与感觉信息处理。
·阿尔茨海默病(AD)模型:减少Aβ斑块沉积、缓解胶质细胞活化、维持胆碱乙酰转移酶(CHAT)水平,保护胆碱能系统功能。
▸ 认知维护与老化防护
·成人摄入胆碱量与语言记忆、视觉记忆表现呈正相关。
·胆碱充足可降低白质高信号体积,后者是认知衰退与阿尔茨海默病的影像学标志。
·胆碱与omega-3脂肪酸共同维持脑内磷脂酰胆碱-DHA(PC-DHA)的正常水平。
·充足胆碱可促进血浆及红细胞PC-DHA含量,提高脑内DHA供给,从而改善或延缓认知衰退。
要充分发挥胆碱的这些健康益处,我们就必须确保它的稳定供给。那么,哪些食物才是胆碱的宝库呢?
尽管人体可以通过内源性途径合成一定量的胆碱,但这种合成能力十分有限,通常不足以满足身体需求。因此,还需要通过日常饮食获得,以弥补内源性合成的不足。
▸ 食物中的胆碱
▸ 母乳是婴幼儿重要的胆碱来源
母乳是纯母乳喂养婴儿在出生后6个月内唯一的胆碱来源,被世界卫生组织公认为婴儿的最佳营养来源。
新生儿和婴儿在快速生长阶段对胆碱需求量较高。研究显示,母乳中总胆碱含量从初乳到出生后两周明显上升,随后在6个月后趋于稳定,成熟母乳中总胆碱浓度约为125–166mg/L(1198–1600μmol/L)。
注:部分研究认为母亲的膳食胆碱摄入量可能影响乳汁中胆碱的浓度。补充胆碱可使成熟乳中游离胆碱、磷酸胆碱、甘油磷酸胆碱及总胆碱水平提高约20%–38%。
▸ 不同配方奶粉间胆碱含量差异显著
当无法母乳喂养时,婴儿配方奶粉是主要替代选择。目前建议婴儿配方奶中胆碱含量为7–50mg/100kcal,相当于每日37–265mg,总摄入量取决于婴儿每日约0.78L的奶量。
不同配方和品牌之间的胆碱形式与含量差异较大,大多以氯化胆碱为主要添加形式,部分含有少量大豆卵磷脂。分析显示,不同产品胆碱含量可相差两倍(52–104mg/L),各国市售配方平均在82–209mg/L之间。
研究表明,与大豆配方相比,牛奶配方中游离胆碱和磷脂酰胆碱含量较低,但磷酸胆碱、甘油磷酸胆碱及总胆碱水平更高;与母乳相比,牛奶配方中磷酸胆碱和鞘磷脂水平较低,而甘油磷酸胆碱较高,总胆碱接近。
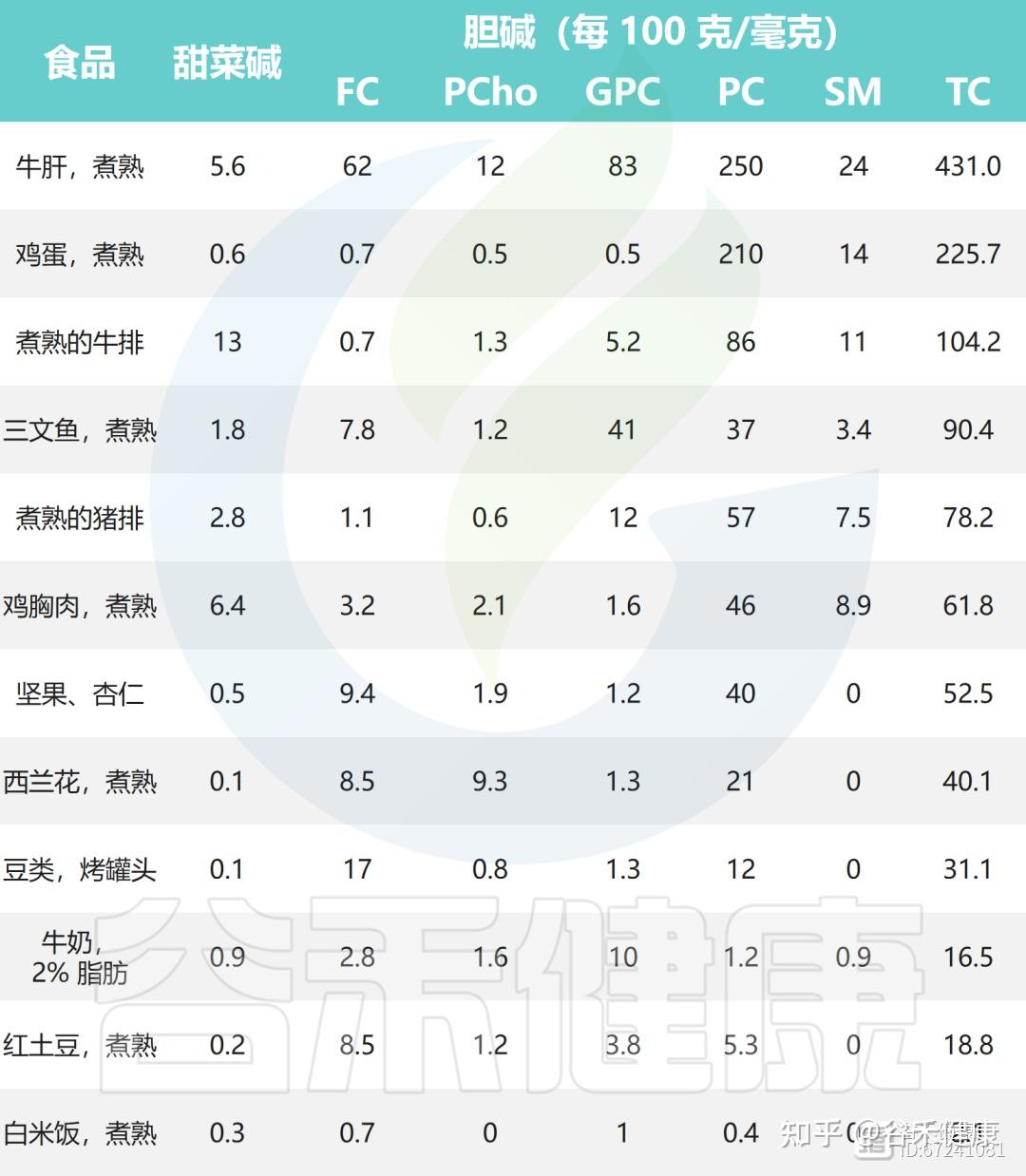
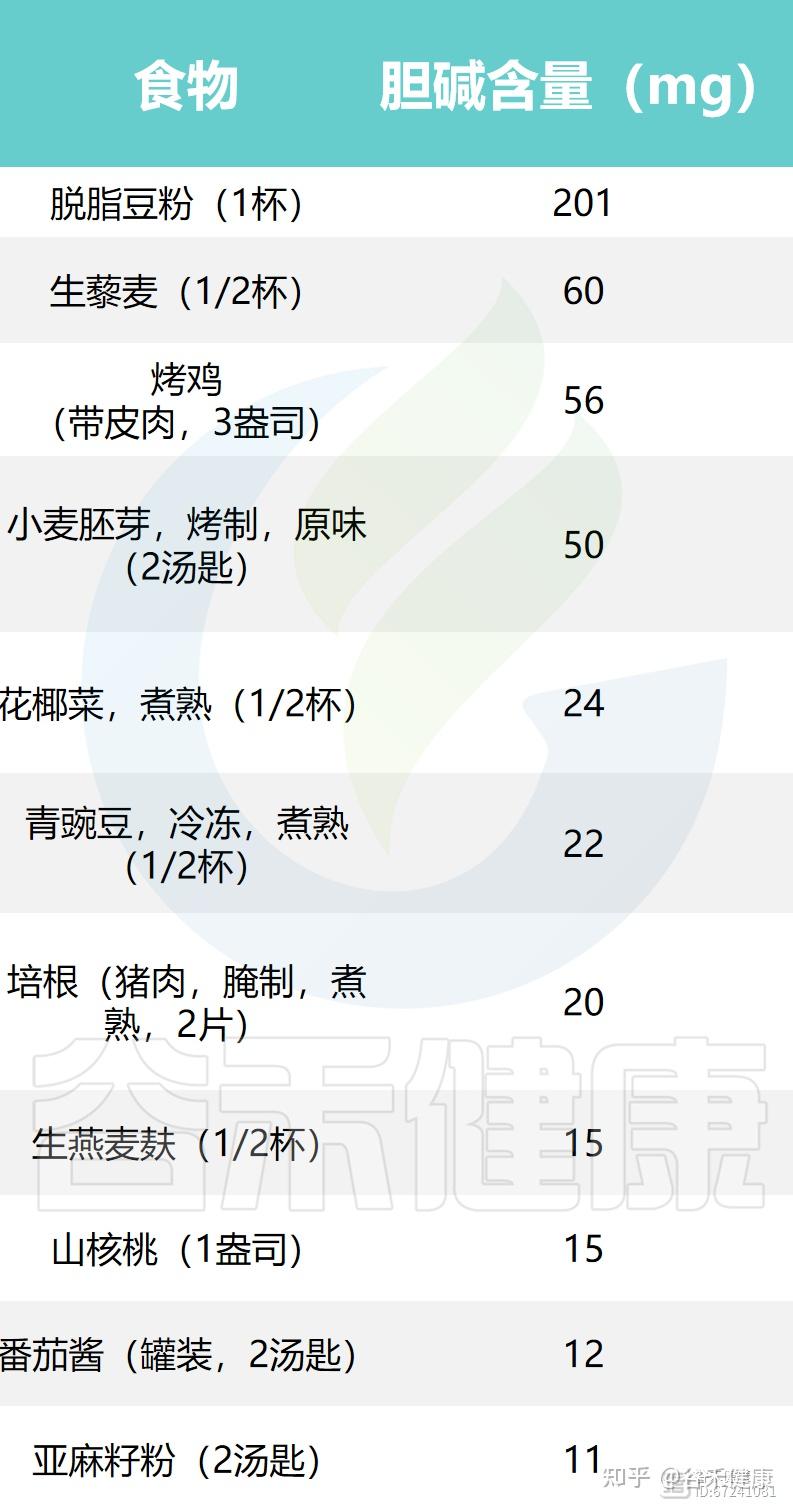
▸ 鸡蛋、鱼、肝脏、牛奶是优质的胆碱来源
大量证据表明,动物性食物的总胆碱含量普遍高于植物性食物。肝脏、鸡蛋、牛肉、鱼类及海鲜、猪肉和鸡肉是最富含胆碱的代表,其中大部分以脂溶性的磷脂酰胆碱形式存在,是细胞膜的重要组成部分。牛奶因日常摄入频繁,也是良好的胆碱来源。
此外,豆类和坚果、谷物以及各类种子中也含有一定量的胆碱,这些植物性食物虽然胆碱含量较动物性食物低,但仍对日常摄入具有补充作用。同时,十字花科蔬菜如西兰花、花椰菜等也提供一定水平的胆碱,可作为均衡饮食中重要的植物来源。
下面列出了一些常见食物中胆碱和甜菜碱的含量:
▸ 胆碱与肉碱的区别
虽然名称相似,但胆碱和肉碱是两种功能完全不同的物质,不可混淆。
胆碱是细胞膜,神经递质乙酰胆碱的前体,主要参与结构和信号;绝大部分必须从食物中获取,鸡蛋含量比较高。
肉碱是赖氨酸和蛋氨酸合成的氨基酸衍生物,脂肪代谢的关键物质;人体可以利用赖氨酸和蛋氨酸(两种氨基酸)在肝脏和肾脏中自行合成大部分所需的肉碱,同时也可以从食物中补充,主要来源是红肉(尤其是牛肉和羊肉)。

简单来说,胆碱负责搭建基础设施——细胞膜,又参与信号传导(神经),还参与到复杂的基因表达调控。而肉碱,代谢路径较专一,专门负责将燃料(脂肪酸)高效地运送到线粒体去燃烧供能。
以上我们可以看到,胆碱和肉碱虽然名称相似,但在生理功能上却截然不同,不可混淆。那么下一个更实际的问题是:我们吃下去的胆碱,身体是如何处理它的?这背后又隐藏着哪些与健康息息相关的秘密呢?
胆碱进入人体后,会经历一系列复杂的吸收和代谢过程。这一过程不仅涉及小肠和肝脏,还与我们肠道中的微生物群密切相关,最终决定了胆碱的生物利用度和其代谢产物对健康的影响。
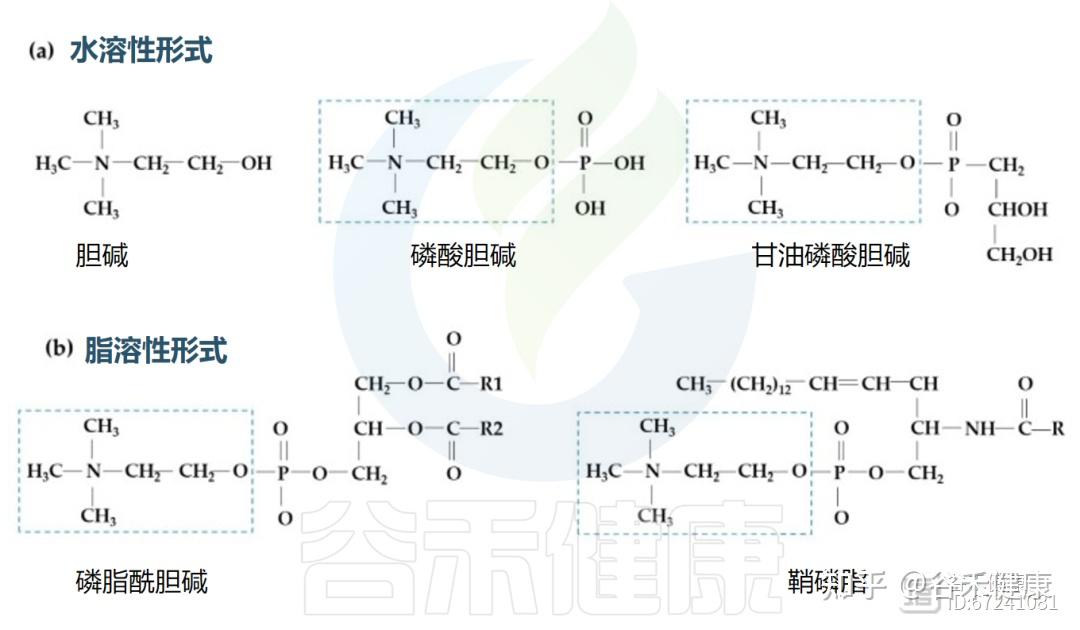
▸ 胆碱的形式与吸收路径
在食品中,胆碱有水溶性(游离胆碱、磷酸胆碱和甘油磷酸胆碱)和脂溶性(磷脂酰胆碱和鞘磷脂)两种形式。
不同胆碱形式的结构
▸ 不同形式的胆碱吸收路径不同
不同形式的胆碱在吸收和代谢途径上存在差异。水溶性胆碱经门静脉输送至肝脏,而脂溶性胆碱在吸收后被封装成乳糜微粒,通过淋巴系统运输。
值得注意的是,婴儿期与成年期摄入的胆碱形式不同,这与食物来源有关。母乳中的胆碱主要为水溶性形式,而随着成长,膳食来源逐渐转向脂溶性胆碱。
▸ 不同形式胆碱在利用度和吸收效率等存在差异
有研究表明,不同形式膳食胆碱在生物利用度、吸收效率和组织分布方面存在差异,并可影响幼儿发育。与游离胆碱相比,膳食磷脂酰胆碱会改变乳汁中胆碱的组成形式,但不影响其总含量。
在人类中,乳汁中不同胆碱形式与婴儿发育的关系仍不清楚。仅有一项土耳其研究指出,纯母乳喂养婴儿的游离胆碱浓度高于配方奶喂养者。
动物研究的证据表明,牛奶中不同形式的胆碱会以不同的方式利用,母体和后代免疫系统对摄入各种形式的胆碱的反应不同就证明了这一点。因此,不同形式的胆碱的摄入应被认为与特定发育阶段相关。
▸ 胆碱在体内的四大代谢途径
进入体内的胆碱主要有四条代谢通路,分别参与不同的生理功能。包括乙酰胆碱、三甲胺(TMA)、甜菜碱、磷脂的合成。
①转化成重要的神经递质—乙酰胆碱
在突触前胆碱能神经元中,胆碱经胆碱乙酰转移酶转化为乙酰胆碱,并以囊泡形式释放至突触间隙,与中枢和外周神经系统的突触后受体结合。
也就是说,乙酰胆碱作为一种关键的神经递质,参与中枢和外周神经系统的信号传递,对记忆、学习和肌肉控制至关重要。
除神经系统外,乙酰胆碱的合成也存在于胎盘、肌肉、肠道及淋巴细胞中。
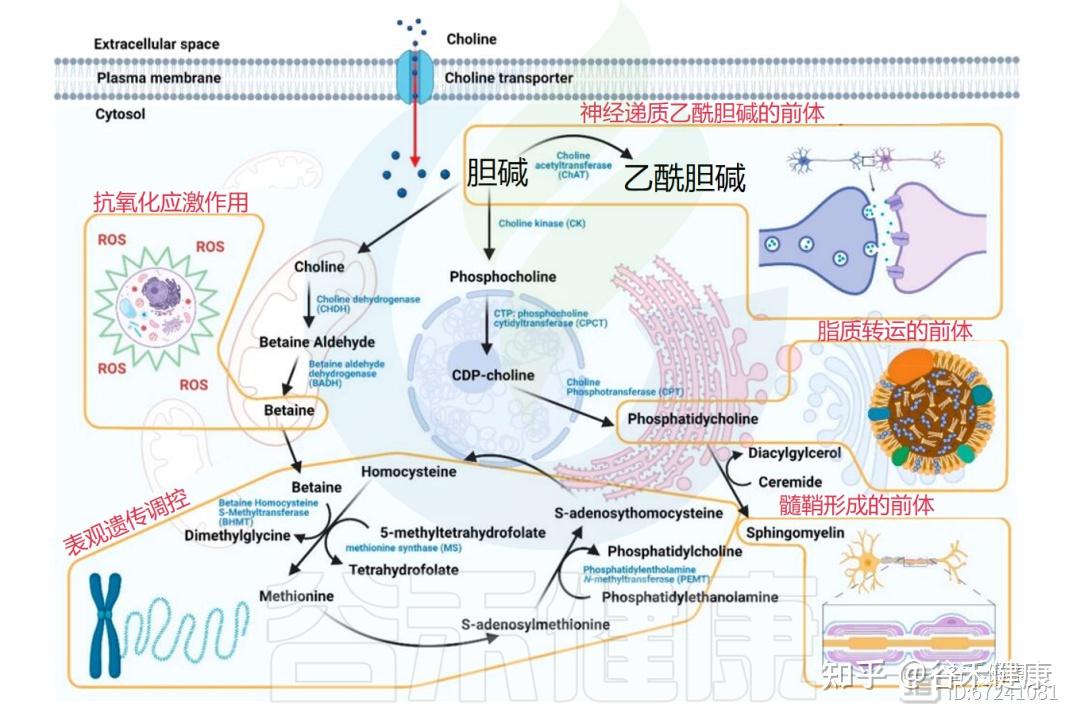
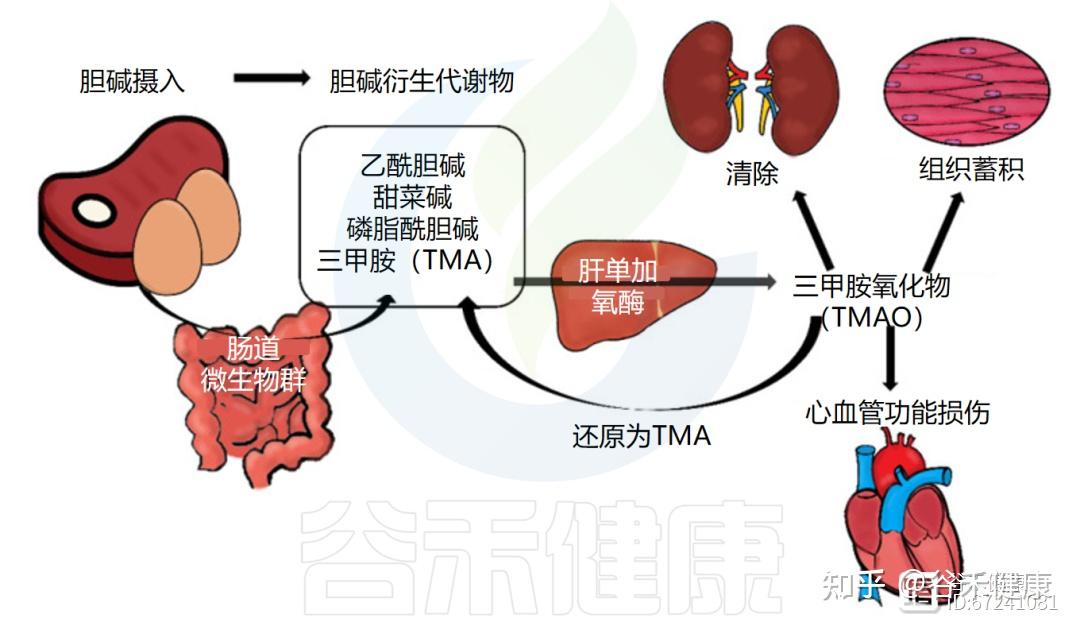
②经肠道菌群代谢为三甲胺及其氧化物
在大肠中,未被吸收的胆碱可被肠道菌群代谢为三甲胺(TMA),随后在肝脏中经黄素单加氧酶氧化为三甲胺氧化物(TMAO)。
饮食中胆碱代谢
③生成重要的渗透调节剂—甜菜碱
胆碱还可在肝脏和肾脏中经两步氧化反应(胆碱脱氢酶和甜菜碱醛脱氢酶),不可逆氧化生成甜菜碱。甜菜碱既是重要的渗透调节剂,又是关键的甲基供体,可通过甜菜碱-同型半胱氨酸S-甲基转移酶(BHMT)将同型半胱氨酸再甲基化为蛋氨酸,同时生成二甲基甘氨酸。该途径与维生素B12/叶酸依赖型再甲基化途径平行,约占肝脏同型半胱氨酸再甲基化活性的一半。
④形成磷脂的前体—磷脂酰胆碱
胆碱是合成磷脂酰胆碱的前体,后者是机体最主要的磷脂形式。其合成主要通过胞苷二磷酸(CDP)-胆碱途径完成,存在于所有有核细胞中,约占肝脏中总磷脂酰胆碱的70%。
另一途径为磷脂酰乙醇胺N-甲基转移酶(PEMT)催化磷脂酰乙醇胺的三步甲基化反应,需消耗3分子SAM并生成3分子S-腺苷同型半胱氨酸(SAH),后者是同型半胱氨酸的前体。据估计,约50%的同型半胱氨酸来源于此反应,且肝脏为主要发生部位。
注:在人类中,PEMT路径是唯一已知的胆碱从头合成机制。近年研究表明,PEMT途径生成的磷脂酰胆碱在脂肪酸组成上不同于CDP-胆碱途径产物,前者富含长链多不饱和脂肪酸,如二十二碳六烯酸(DHA)。
▸ 肠道菌群:胆碱代谢的关键加工厂
摄入含胆碱的食物后,人体肠道微生物群一小部分微生物(不到1%)携带TMA产生所需的基因,可以将胆碱用于生成三甲胺(TMA)。三甲胺在宿主体内进一步氧化生成三甲氧化物(TMAO),与心血管疾病、肝脏疾病及代谢综合征等健康风险密切相关。
因此,肠道微生态组成与功能的差异,不仅影响胆碱及其衍生物的生物利用度,也决定了其代谢产物对宿主健康的双向调控效应。是连接膳食摄入与宿主生理反应的重要桥梁。
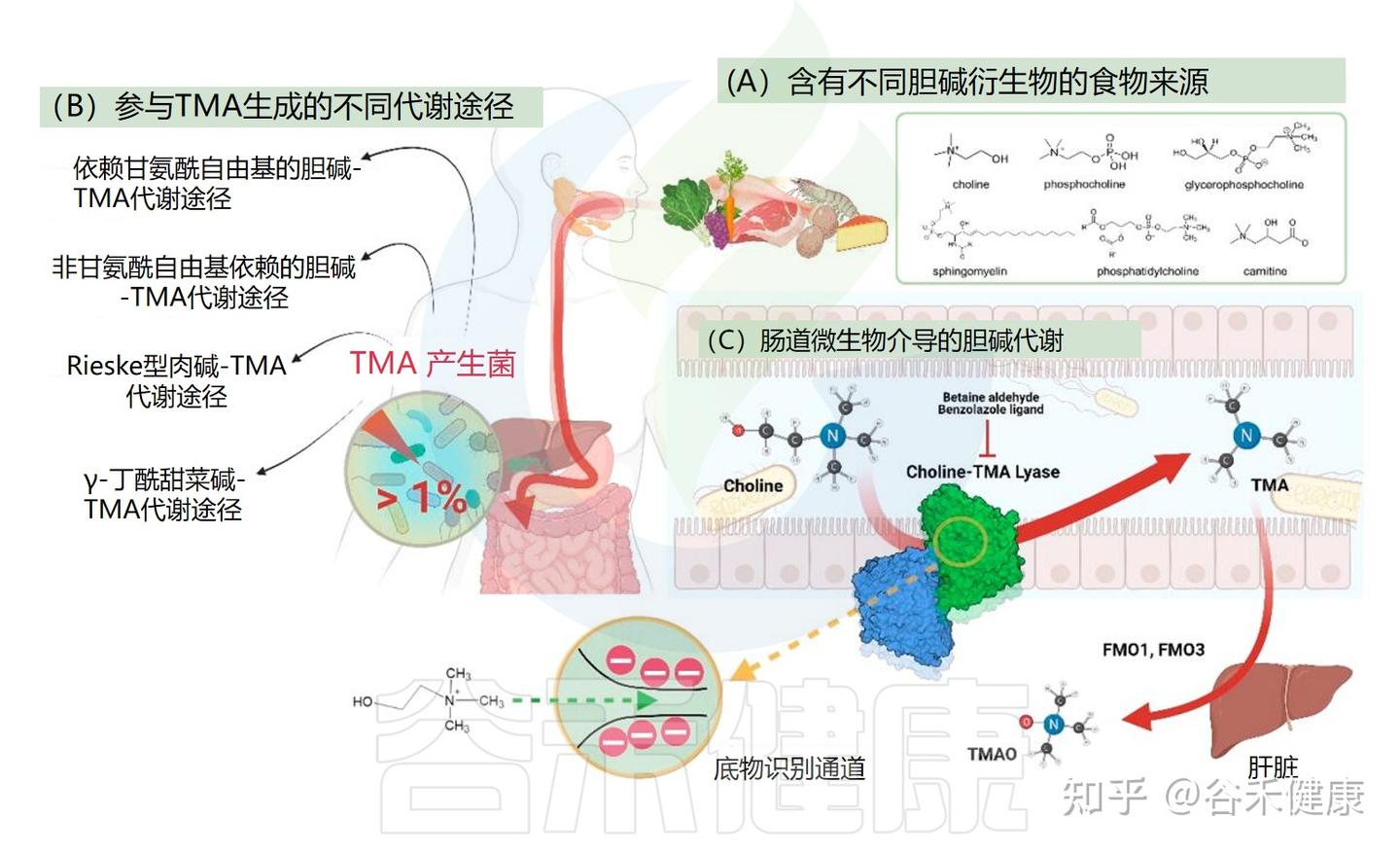
揭秘产TMA的关键菌群与基因
并非所有肠道细菌都能将胆碱转化为TMA。这一过程需要特定的酶系统。过去十年的研究已经鉴定出一些负责TMA生成的细菌基因簇:
研究发现,负责将胆碱转化为TMA的肠道细菌种类繁多,包括:Anaerococcus hydrogenalis、Clostridium asparagiformis、Clostridium hathewayi、Clostridium sporogenes、Desulfovibrio desulfuricans、Escherichia fergusonii、Klebsiella pneumoniae、Proteus penneri、Providencia rettgeri 等。
这些菌主要隶属于厚壁菌门和变形菌门。因此,血浆TMA和TMAO水平的升高,通常与这两类菌门的丰度增加以及厚壁菌门/拟杆菌门比值的增加有关。
可将胆碱降解为三甲胺的细菌菌株


▸ 三甲胺生产细菌与胆碱
▸ 三甲胺产生菌会降低胆碱的生物利用度
研究发现,即使仅有极少量三甲胺(TMA)产生菌(约占总菌群的0.15%),也能显著降低宿主的胆碱生物利用度,且丰度越高影响越显著。这表明肠道TMA生成菌的丰度与组成对胆碱代谢及相关疾病密切相关。
利用定量PCR和Illumina测序分析人类粪便样本发现,TMA产生菌占总菌群不足1%,所有样本均检测到CutC基因,而仅26%含有CntA基因。类似的模式也出现在不同饮食类型动物中:杂食和肉食动物CutC基因丰度较高,而草食动物几乎缺乏CntA基因。
▸ 梭状芽孢杆菌可能是胆碱转化的关键菌
在不同哺乳动物的肠道微生物组中,CutC基因主要分布于放线菌门、变形菌门和厚壁菌门,尤其与厚壁菌门中多个分类群相关,典型代表为梭状芽孢杆菌目成员。三甲氧化物(TMAO)水平与这些菌群丰度之间的一致性进一步支持这一关系。相比之下,CntA基因多样性较低,主要存在于变形菌中。
▸ 不同形式的胆碱与肠道菌群的相互作用
食物中的胆碱衍生物包括水溶性形式(如游离胆碱、磷酸胆碱、甘油磷酸胆碱)和脂溶性形式(如磷脂酰胆碱、鞘磷脂)。由于其化学性质和吸收效率不同,肠道微生物对这些形式的可利用性存在差异。
▸ 不同底物会影响胆碱的酶促转化效率
研究表明,与磷脂酰胆碱相比,酒石酸氢胆碱可使血浆TMAO水平提高约三倍,可能因其非酯结构更易被微生物利用,而磷脂酰胆碱需经额外水解步骤释放胆碱,延缓TMA生成。
另一项膳食干预研究发现,摄入富含磷脂酰胆碱的鸡蛋虽能提高血浆胆碱水平,但TMAO水平与补充游离胆碱者相似,进一步提示底物结构影响其酶促转化效率。近期研究也证实,食用鸡蛋不会像补充酒石酸氢胆碱那样显著升高TMAO水平。
胞苷二磷胆碱(CDP-胆碱)是一种新获欧盟批准的新型食品成分,主要用于中老年人以改善胆碱摄入。其焦磷酸基团可避免在肠腔中被水解,使其具有较高宿主生物利用度,但难以被富含CutC的菌群利用。并且其吸收、水解和去磷酸化机制尚未完全明确。
▸ 抑制胆碱向三甲胺的转化,提高胆碱利用率
对胆碱-TMA裂解酶(CutC)的结构研究揭示了底物识别的分子基础,为开发抑制TMA生成的微生物靶向分子提供了依据。X射线晶体学显示,CutC具有一个埋藏的催化位点,通过带负电残基构成的通道与带正电的胆碱结合,并在底物结合时发生贝壳式闭合反应。
基于这些结构特征,苯并恶唑配体和甜菜碱醛等已被鉴定为CutC的非竞争性抑制剂,可不可逆地抑制胆碱向TMA的转化,从而提高高危人群的胆碱利用率,并降低循环TMAO水平及其相关健康风险。
▸ 关于胆碱、三甲胺和氧化三甲胺
▸ 一些肠道细菌能将TMAO转化为TMA或甲烷
在胆碱代谢中,三甲胺(TMA)在肝脏中经FMO3酶氧化生成氧化三甲胺(TMAO)。值得注意的是,部分变形菌门细菌可利用TMAO还原酶将膳食TMAO逆向代谢为TMA。
此外,近期研究发现,某些肠道古细菌(如Methanomassiliicoccales)能够将TMAO还原为甲烷。当前研究正探索利用这些微生物作为潜在益生菌,以降低与心血管疾病风险相关的循环TMAO水平。
▸ 饮食会通过肠道菌群代谢影响氧化三甲胺含量
氧化三甲胺(TMAO)(由微生物生成的TMA氧化而来)与动脉粥样硬化和血栓形成等心血管疾病密切相关,因此常被视为预测主要不良心脏事件(MACE)的潜在风险指标。
一项关于短期高脂饮食对健康男性的研究发现,空腹血浆TMAO水平保持稳定,而餐后TMAO会随时间显著升高。由于TMAO低分子量和高溶解性,其可被肾脏快速滤过和排泄,使血浆TMAO升高仅为暂时现象。
此外,不同研究中膳食或血清胆碱水平与TMA/TMAO浓度的相关性不一致,也暗示肠—肝轴调控机制尚未明晰。这种差异可能源于肠道微生物群对胆碱生物利用度及TMA/TMAO生成平衡的调节作用。
这种复杂的调控机制,恰恰凸显了维持体内胆碱水平平衡的极端重要性。那么,当身体的胆碱天平发生倾斜时,具体会表现出哪些疾病信号或临床症状呢?下一章,我们将分别探讨胆碱“缺乏”与“过量”这两种失衡状态所引发的一系列身体信号。
胆碱作为一种必需营养素,其在体内的水平需要维持在一个动态平衡的范围内。无论是摄入不足导致的缺乏,还是因肠道菌群代谢异常导致的代谢物(如TMAO)过高,都可能通过一系列身体信号或临床指标发出警报。识别这些信号对于早期干预和预防相关疾病至关重要。
▸ 胆碱缺乏的信号与表现
当膳食胆碱摄入长期无法满足身体需求时,机体多个系统会受到影响,并表现出一系列症状和体征,这些可被视为胆碱缺乏的“信号”。由于胆碱是维持机体正常代谢功能和生理平衡的必需营养素,长期摄入不足不仅会干扰肝脂代谢过程,还可能导致肠道微生物群结构的显著改变,从而引发一系列健康问题。
▸肝脏功能受损与脂肪肝
这是最典型、最直接也是最早出现的表现。由于胆碱是合成磷脂酰胆碱(PC)的必需原料,而PC是肝脏输出脂肪(以VLDL形式)的关键组分,胆碱缺乏会直接导致肝脏脂肪堆积,形成非酒精性脂肪肝(NAFLD)。
临床上可能表现为肝功能检查中的转氨酶(ALT, AST)水平升高。在严格控制胆碱摄入的人体实验中,受试者很快就会出现肝脏脂肪变性的迹象。
事实上,一项严格控制胆碱摄入量的人体干预实验表明,肠道微生物群的组成会明显随膳食胆碱水平的变化而调整,其中包括γ变形菌门(Gammaproteobacteria)相关的特异性改变。此外,实验还发现,丹毒丝菌等群落成员与胆碱耗竭期间肝脏脂肪积聚变化密切相关,提示胆碱缺乏可通过微生物介导的机制影响肝脏脂质代谢。
▸认知功能障碍
虽然这一信号较为隐蔽,不易在短期内察觉,但长期胆碱不足会影响大脑中乙酰胆碱的合成,可能导致记忆力减退、注意力不集中、思维迟缓和学习能力下降。在孕期或婴幼儿期这一大脑发育的关键窗口期,胆碱缺乏的后果更为严重,可能导致成年后永久性的海马区结构改变和认知功能受损。
▸ 阿尔茨海默
一项于2023年发表的重要研究,为胆碱与阿尔茨海默病之间的关联提供了强有力的证据。该研究明确指出,较低的循环(血清)胆碱水平与阿尔茨海默病的病理进展显著相关。
在轻度认知障碍和阿尔茨海默病患者中,胆碱水平较低者脑内的神经炎性斑块密度更高,Braak分期更晚,并伴有更强的炎症反应。该关联在动物实验中得到进一步证实:饮食性胆碱缺乏会加剧阿尔茨海默病模型小鼠的神经病理变化,反之,补充胆碱则能有效减轻这些损伤。
然而,与循环胆碱水平降低的发现形成鲜明对比的是,一些研究(特别是较早期的研究)观察到,在神经退行性疾病患者的脑部,胆碱水平反而呈系统性升高趋势。
这种看似矛盾的现象,其根源并非胆碱的“供应过剩”,而恰恰是神经元膜加速降解,导致胆碱分解产物(如GPC)被释放出来。
这些看似矛盾的结果凸显了阿尔茨海默中胆碱代谢的极端复杂性,其检测水平高度依赖于疾病分期、脑区以及所测量的具体胆碱化合物。
▸ 肌肉损伤与功能下降
胆碱缺乏同样会影响肌肉健康。临床表现为血液中肌酸激酶(CK)水平的升高,这是肌肉细胞受损的标志物。长期来看,由于肌细胞内甘油三酯的积累以及作为甲基供体的胆碱缺乏导致肌肉蛋白合成减少、分解加速,可能引发肌肉无力、疲劳,甚至肌肉萎缩和功能下降。
▸ 代谢紊乱
胆碱缺乏会干扰全身的脂质和碳水化合物代谢。由于脂肪酸在肝脏的氧化能力下降,可能导致血浆中甘油三酯水平升高。同时,胆碱缺乏也与胰岛素抵抗的加重有关,增加了患2型糖尿病的风险。
▸ 遗传性胆碱代谢缺陷
一些罕见的遗传性疾病源于胆碱代谢通路中关键蛋白的功能缺陷。例如,胆碱转运蛋白、胆碱酯酶或磷脂合成相关酶的基因突变,可导致多种临床表型,包括先天性肌无力综合征、肌肉萎缩、癫痫、以及其他复杂的代谢异常。
▸ 发育异常
在胚胎发育过程中,胆碱扮演着至关重要的角色。研究表明,孕期胆碱缺乏与新生儿神经管缺陷的风险增加有关,这凸显了孕期充足胆碱供应对于胎儿正常神经系统发育的重要。
▸ 胆碱过量的信号与表现
胆碱是必需营养素,人体对其有较强的吸收控制与代谢平衡机制。当膳食胆碱摄入增加时,身体通常会通过减少内源合成或加快代谢(例如经氧化为甜菜碱)来维持稳态。因此,在健康人群中,即使日摄入量高于推荐量,也不会立刻造成毒性反应。
▸ 胆碱过量一般不会引起明显不良反应
胆碱过量的不良反应较为罕见,仅早期少数研究(1977年)报道,七名阿尔茨海默症患者服用后,会出现降压作用,并伴有恶心和腹泻。出现不良反应的情况(如血压下降、出汗、胃肠不适)往往是在极端剂量(比如每日7克以上的胆碱盐补充)。
▸ 胆碱代谢产物TMAO过量的隐形风险
胆碱真正应警惕的是代谢通路过载,而非营养素本身,尤其是当肠道菌群过度活跃或肝脏代谢调节失衡时,形成的代谢产物(如TMA 与 TMAO)才是隐藏的风险源。
胆碱的肠道菌群代谢产物TMA/TMAO的水平过高,本身通常不会引起明显的身体不适感。它的“信号”更多是通过体检发现的异常指标,以及一种特殊的体征,也预示着多种慢性疾病的风险正在悄然增加。
▸ 鱼腥体味综合征
这是TMA过高最直接、最尴尬的信号。当摄入极高剂量的胆碱(如每天超过7.5克)或肉碱时,或者在一些存在FMO3酶功能缺陷的遗传病患者中,肝脏无法将肠道菌群产生的大量TMA完全氧化为无味的TMAO。过量的TMA会进入血液循环,并通过汗液、尿液和呼吸排出体外,散发出类似腐烂鱼类的腥臭味。虽然这种情况在普通人群中是罕见的,但它明确地指向了TMA代谢通路的超负荷或障碍。
三项研究指出,当患者每天服用 8−20 克胆碱时,会出现胃肠道影响和鱼腥体味。基于约7.5 g/天的最低观察不良反应水平(LOAEL)并采用安全系数,将19岁及以上成人的可耐受最高摄入量(UL)设定为3.5 g/天。
▸ 心血管事件风险
大量的临床研究已证实,血浆TMAO水平升高是预测未来发生主要不良心血管事件的独立风险指标。对于心血管疾病患者来说,TMAO水平可以作为评估预后的重要参考。
▸ 肝脏疾病
TMAO不仅在非酒精性脂肪肝(NAFLD)患者中水平升高,它本身也能反过来加剧肝脏损伤。研究表明,TMAO能加剧肝脏的脂肪堆积、氧化应激和炎症反应,从而促进NAFLD向更严重的NASH阶段发展。
▸ 慢性肾病
TMAO主要通过肾脏滤过和排泄。TMAO与慢性肾病之间存在恶性循环。一方面,肾功能不全导致TMAO清除障碍,使其在体内大量蓄积;另一方面,高水平的TMAO本身就是一种尿毒症毒素,它能诱导肾小管间质纤维化,进一步损害肾功能,加速慢性肾病的进展。
▸ 代谢紊乱
高TMAO水平也常见于代谢综合征、肥胖和2型糖尿病患者,并与胰岛素抵抗的严重程度相关。
至此,从肝脏、心血管到神经系统,胆碱代谢失衡所引发的系统性风险已清晰可见。无论是胆碱缺乏导致的器官功能受损,还是其代谢产物TMAO过量所驱动的慢病进程,都凸显了维持胆碱稳态的极端重要性。
那么究竟是什么因素在幕后调控着我们每个人的胆碱水平,并决定了其代谢通路的效率与风险?下一章,我们将深入剖析这些决定胆碱“命运”的关键内外因素。
在前文我们已经看到,胆碱的缺乏与其代谢产物过高,都与多种慢性疾病的发生密切相关。但还有问题在于,不同个体对胆碱的需求与代谢反应并不一致,这种差异源于多种宿主和环境因素的综合作用,包括个体的遗传背景、性别与生理阶段、激素水平、饮食结构以及肠道微生物组成等。理解这些影响因素,是建立个体化胆碱营养策略、避免代谢失衡的关键前提。
胆碱摄入需求的个体差异
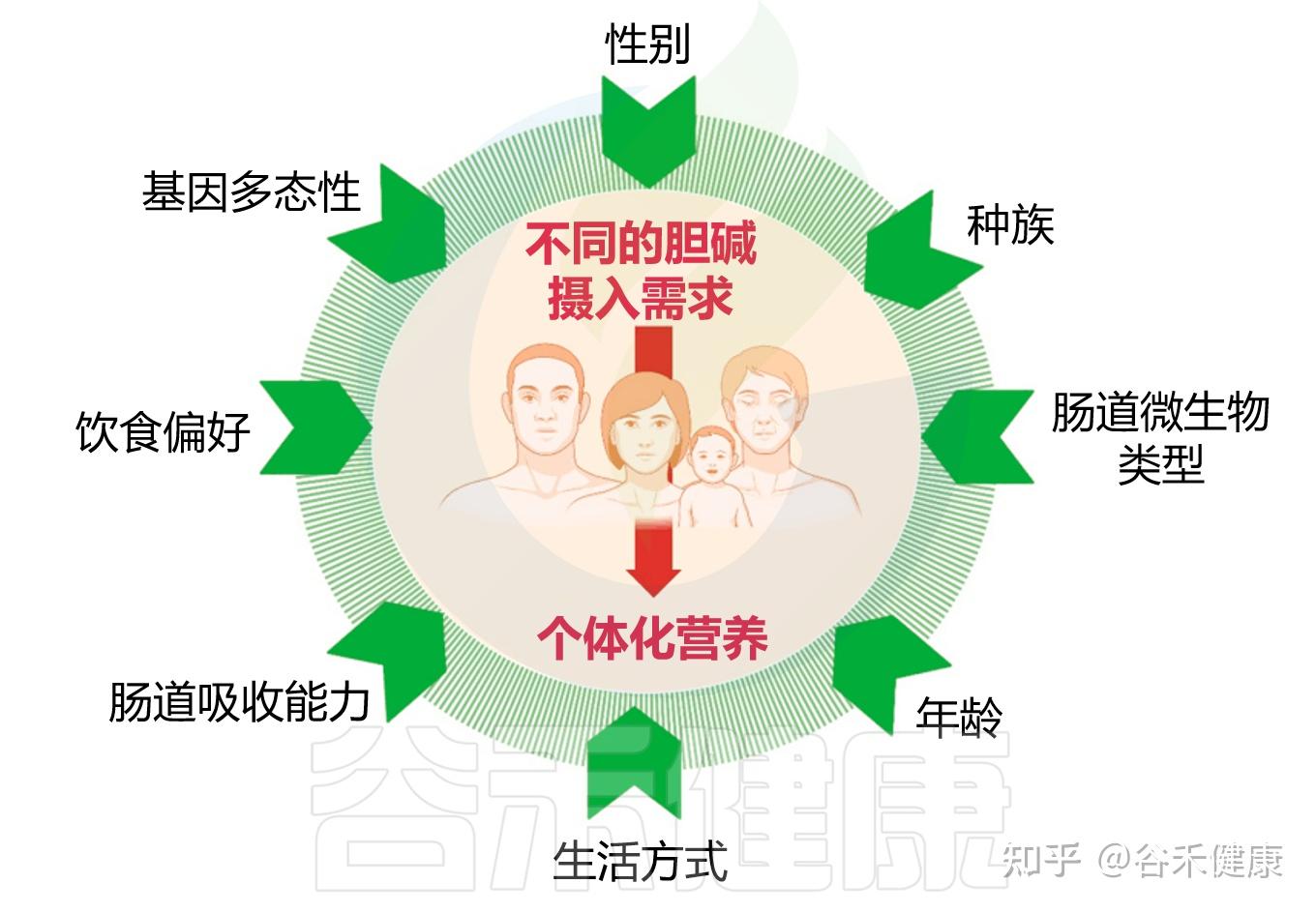
接下来,我们将逐一了解这些因素如何共同塑造个体胆碱代谢特征。
▸ 性别与激素水平
雌激素与PEMT活性:雌激素上调肝脏磷脂酰乙醇胺N-甲基转移酶(PEMT)基因的表达,促进磷脂酰胆碱的内源合成,从而减少对膳食胆碱的依赖。
因此,绝经前女性通常较为耐受低胆碱膳食,而绝经后女性因雌激素水平下降,PEMT活性降低,胆碱需求显著上升。
注:研究显示,在低胆碱膳食条件下,77%的男性和80%的绝经后女性出现缺乏症状,而绝经前女性仅为44%。
性别差异与酶活性:女性肝脏中黄素单加氧酶(FMO3)活性通常高于男性,会影响TMA→TMAO的转化速率及胆碱代谢终产物水平。
▸ 遗传与基因多态性
PEMT(rs12325817, G→C):该多态性位于雌激素反应元件附近,会削弱雌激素对PEMT的调控作用,使女性更易发生胆碱缺乏综合征(CDS)。携带者中约78%在低胆碱摄入下出现CDS症状。
MTHFD1(G1958A)突变:该突变影响叶酸介导的一碳代谢通路,降低甲基供体合成效率,从而增加对胆碱(作为甲基供体)的依赖。该突变与神经管缺陷风险增加相关。
CHDH与BHMT等基因变异:影响胆碱氧化及甜菜碱-同型半胱氨酸甲基转移过程,调节体内胆碱的利用率与甲基化能力。不同种族中相关等位基因分布差异显著,导致胆碱需求的群体差异性。
▸ 年龄与生命周期阶段
婴幼儿:婴儿阶段主要通过母乳摄入胆碱,母乳中胆碱以水溶性形式(磷酸胆碱、甘油磷酸胆碱)为主,易于吸收。早期胆碱摄入对神经发育和认知形成至关重要。早产儿胆碱需求更高,因为其肝脏合成能力尚未完善。
孕期与哺乳期:妊娠期母体需为胎儿及胎盘提供额外胆碱,用于细胞分裂、DNA甲基化及神经发育。哺乳期胆碱需求也升高,用以补充乳汁输出。
老年期:随年龄增长,内源性合成能力和饮食吸收效率下降,同时肝功能减退可能加重需求。老年人胆碱摄入不足已被关联至认知下降和非酒精性脂肪肝(NAFLD)风险。
▸ 饮食
饮食类型:动物性食物(如鸡蛋、肝、肉类、鱼、乳制品)是胆碱的主要来源。素食者或纯素饮食者胆碱摄入普遍低于标准需求。
烹饪与食物形式:高温烹饪会使游离胆碱减少。食物中胆碱的化学形式影响吸收效率——水溶性胆碱(如磷酸胆碱)易经门静脉吸收,而脂溶性形式(如磷脂酰胆碱)经乳糜微粒运输,更受脂质代谢状态影响。
营养互作:叶酸、维生素B12、B6、甜菜碱与胆碱共享甲基供体代谢通路,缺乏任一成分都会增加对胆碱的生理需求。
▸ 过量使用抗生素
长期或不当使用抗生素会对肠道微生物生态系统造成深远影响。广谱抗生素可同时抑制病原菌与共生菌的生长,引发菌群失调,削弱正常微生物竞争力,从而促使艰难梭菌等病原体过度繁殖。
总体而言,抗生素使用所引起的肠道微生物群结构变化,可能与机体代谢失衡以及糖尿病发病率的增加密切相关。这种由抗生素干扰导致的菌群改变会破坏肠道生态系统的稳定性,使益生菌数量减少、代谢功能受扰,从而使肠道逐渐倾向于形成促进TMA生成的代谢表型,进一步影响宿主的代谢健康和能量稳态。
▸ 肠道微生物组影响
微生物代谢胆碱为TMA/TMAO:特定菌群(如CutC/D阳性菌属——Desulfovibrio、Clostridium、Enterococcus等)可将胆碱降解为三甲胺(TMA),后被肝脏FMO3氧化为TMAO。
这一过程不仅影响胆碱的生物利用度,还与心血管疾病(CVD)、慢性肾病(CKD)、NASH等疾病风险相关。
个体间菌群差异:不同人群(年龄、饮食习惯、抗生素使用史)菌群组成各异,导致胆碱代谢途径及利用效率不同。这种差异在宿主遗传背景(如FMO3多态性)影响下进一步放大。
▸ 生理与病理状态
肝功能障碍:肝脏是胆碱代谢的核心器官。肝病患者(尤其是NAFLD/NASH)因磷脂合成与脂质输出受阻,其胆碱需求量显著增加。
代谢状态:胰岛素抵抗、高脂饮食、慢性炎症状态均影响胆碱的代谢与分配,使机体对胆碱的依赖度提升。
▸ 种族与地理差异
膳食习惯与基因共同决定胆碱供给与需求差异。研究显示,在相同叶酸摄入下,非裔美国女性血浆胆碱水平低于白人或墨西哥裔女性,提示胆碱代谢相关基因在不同种群中的分布不均。
以上我们了解到个体的胆碱需求受到遗传、性别、激素水平、生理状态以及肠道菌群等多重因素的综合影响。正因如此,找到一个既能满足身体需要,又不会造成代谢负担的摄入平衡,就成为维持健康胆碱状态的关键。
虽然胆碱的最佳摄入量因人而异,但权威机构仍基于大量流行病学与生化研究,制定了适宜的参考标准,以帮助公众更好地评估日常摄入量是否充足。
美国医学研究所(IOM)早年制定了不同人群的胆碱适宜摄入量(AI):女性425 mg/天,孕妇450 mg/天,哺乳期妇女和男性均为550 mg/天。
欧洲食品安全局(EFSA)在2016年更新建议值:成人400 mg/天,7–11个月婴儿160 mg/天,儿童140–400 mg/天(随年龄和体重变化),孕妇480 mg/天,哺乳期妇女520 mg/天。
目前对胆碱的摄入量建议
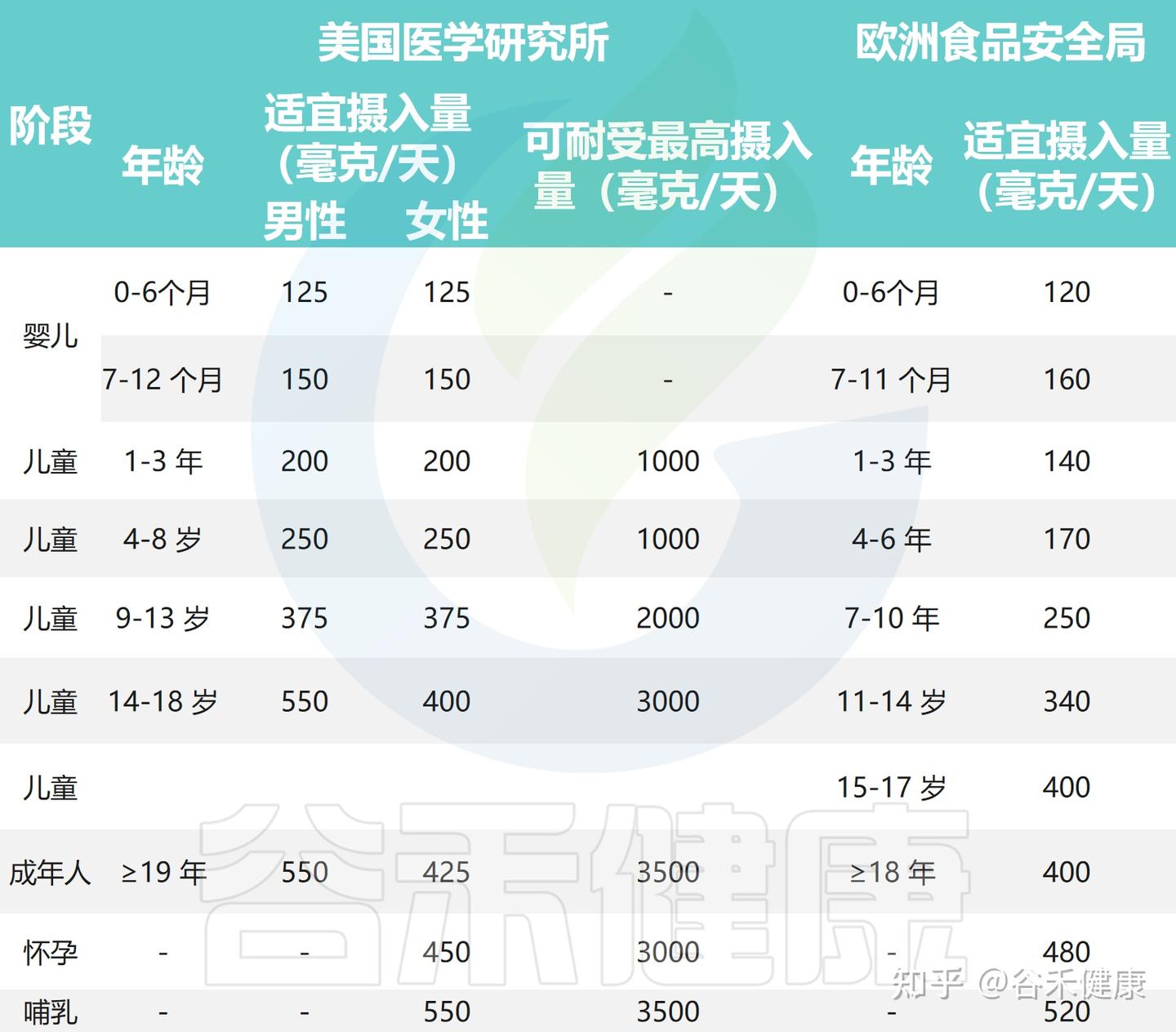
注意:这些推荐值反映的是“维持正常生理功能”的适宜摄入量(AI),并非“最低需求量(RDA)”。也就是说这是用来指导日常膳食的安全范围,而不是严格的个体化目标。
鉴于胆碱代谢的复杂性及其对健康的双重影响,我们的核心目标应该是:在确保摄入充足胆碱以满足机体生理需求的同时,最大限度地减少其在肠道内向有害代谢物TMAO的转化。这并非一个简单的“多吃”或“少吃”的问题,而是一个需要综合性的饮食调整、生活方式干预乃至个体化营养策略的系统工程。
▸ 饮食调整
饮食是影响肠道健康的关键因素,因此饮食调整成为控制三甲胺氧化物(TMAO)相关疾病风险的简便且安全的方式。
动物性来源:这类食物通常被认为是胆碱的最佳来源,含量尤为突出。
植物性来源:对于素食者或希望通过植物性饮食增加胆碱摄入的人群,以下食物是重要选择 。
地中海饮食富含多酚和膳食纤维,具有多重健康益处。流行病学数据表明,长期遵循地中海饮食与尿液、血浆TMAO水平呈负相关。
动物实验也发现,膳食影响肉食诱导的TMAO上升——高纤维饮食可显著减轻其增幅。
植物性或纯素饮食:抑制胆碱向TMA的转化
近年来,植物性或纯素饮食以其健康优势受到关注,这些优势与较低的厚壁菌门/拟杆菌门比例及短链脂肪酸的增加有关。素食和杂食性饮食在微生物群和TMAO水平方面存在差异。
有研究发现,纯素食者在左旋肉碱摄入后TMAO生成能力低于杂食者。膳食纤维可抵抗胃肠道消化并在结肠中被特定细菌发酵为短链脂肪酸(SCFA),进而影响肠道微生态平衡。
研究表明,膳食纤维可抑制胆碱向TMA的转化,从而提高高需求人群的胆碱生物利用度。其机制包括抑制糖酵解副产物甲基乙二醛的积累,减少甘氨酸代谢反馈,从而降低CutC依赖的TMA裂解酶表达;同时,纤维可激活AMPK信号通路以抑制ATP消耗过程,如TMA裂解酶合成。
尽管如此,纤维的效果存在个体差异,受基线微生物基因丰富度及普雷沃氏菌丰度等因素影响。这些发现表明,合理利用膳食纤维及其他饮食成分,有望促进功能性食品的开发,在满足胆碱需求的同时降低TMAO产生。
总体来看,膳食纤维在地中海饮食中的充足供应,以及其在西式饮食中的缺乏,是不同个体间肠道菌群组成和TMAO水平差异的关键因素。
西式饮食增加三甲胺生产者
西式饮食以高动物蛋白、饱和脂肪和低膳食纤维为特征,常摄入家禽、猪肉、牛肉和鸡蛋等动物性食品。这些食物中含有大量磷脂酰胆碱(PC)和左旋肉碱等可被微生物转化为三甲胺(TMA)的前体,随后在肝脏中进一步氧化生成三甲胺氧化物(TMAO)。
西式饮食通常与拟杆菌肠型相关。研究发现,某些微生物进化枝(如奈瑟氏菌科和脱硫弧菌属)与血浆TMAO水平呈正相关,并在冠心病患者及长期摄入动物性饮食者中观察到TMAO显著升高。进一步研究表明,摄入鸡蛋后TMAO水平升高的男性往往具有较高的厚壁菌门丰度,而TMAO水平较低者则表现出较高的拟杆菌门比例。
大部分PC在小肠上部被胰酶水解为1-lyso-PC并迅速吸收,其酶活性受胆盐与PC比例影响,而在空肠下段和回肠中逐渐失活,使部分未水解的PC进入结肠被肠道菌群利用。换言之,高肉食摄入为TMA合成菌提供了充足底物。肠道转运时间和消化酶活性等因素亦会影响未水解PC到达下消化道的量。
PC在小肠下部的积聚为表达CutC酶的细菌(如Proteus mirabilis)提供了有利生态位,使其能以胆碱为碳源进行生长和定植。此外,西方饮食脂肪和乳化剂含量高,易引起菌群失衡,并促进产TMA菌株(如梭状芽孢杆菌、埃希氏菌)的扩张。
研究不同人群中西式饮食的普及程度、肠道转运时间差异及胆汁盐水平,有助于揭示各人群间胆碱代谢差异的潜在机制。
▸ 补充益生菌
益生菌作为另一种干预手段,在动物模型中可有效重塑肠道菌群并降低TMAO水平。
▸ 副干酪乳杆菌F198
例如,膳食补充副干酪乳杆菌F198可恢复肠屏障功能,减少氧化应激性肝损伤;M. smithii定植可降低TMAO并减轻动脉粥样硬化;Enterobacter aerogenes通过调节菌群平衡显著降低血浆和盲肠TMAO。
然而,与人类相比,啮齿动物微生物组差异巨大,个体饮食和基因背景也会影响效果,因此应谨慎外推动物结果。
▸ 植物乳杆菌
植物乳杆菌,尤其是Lactobacillus plantarum ZDY04 菌株,在小鼠模型中被反复证明能显著降低因高胆碱饮食引起的血清TMAO和结肠TMA水平 。其机制可能涉及抑制肠道中TMA的生成菌群 。
▸ 双歧杆菌属
双歧杆菌Bifidobacterium breve 、Bifidobacterium longum的一些菌株在动物研究中也显示出降低血浆TMAO和TMA浓度的能力。
▸ 其他菌株
Akkermansia muciniphila、Enterobacter aerogenes ZDY01 以及一些 Lactobacillus reuteri 菌株在降低TMAO方面的潜力 。一项包含 Lactobacillus rhamnosus GG 的混合益生菌干预,在人体试验中也观察到能减弱胆碱负荷后TMAO的升高程度。
▸ 补充益生元
▸ 补充阿拉伯木聚糖等
“功能性食品”可超越基础营养调节健康。以益生元为例,这类可被特定肠菌利用的不可消化碳水化合物能促进有益菌生长并改善菌群多样性。
在人类研究中,超重者摄入富含阿拉伯木聚糖的益生元提取物后,普雷沃氏菌丰度和短链脂肪酸水平上升,血浆磷脂酰胆碱下降,提示TMA合成底物可用性降低并有助于代谢健康。
▸ 摄入多酚类化合物—如白藜芦醇
多酚类化合物作为另一类植物源膳食成分,具有重要的微生物群调节功能。补充白藜芦醇可增加乳酸杆菌、降低TMAO并缓解高胆碱饮食小鼠的动脉粥样硬化;乌龙茶提取物和柑橘类黄酮表现出相似效应。
临床试验表明,富含多酚的果渣提取物Taurisolo在4周内可显著降低TMAO水平(63.6% vs. 0.54%)。尽管结果积极,但仍需更多机制研究以阐明多酚与TMAO及人类疾病间的关系。
▸ 粪菌移植
粪菌移植(FMT)作为一种新兴手段,通过健康供体的菌群替换受体的失调微生物组,在临床前研究中展现疗效,但实际应用有限。
针对其他疾病的研究显示虽然可部分恢复菌群平衡,但并未显著降低TMAO或改善动脉粥样硬化。未来,结合精准医学的FMT策略或可实现个体化微生物重建,但仍依赖对细菌与疾病因果关系的深入理解。
▸ 针对TMAO生物合成的药物
针对TMAO生物合成的药物干预包括胆碱类似物3,3-二甲基-1-丁醇(DMB)和抗缺血药米屈肼。DMB通过非致死性抑制TMA裂解酶减少TMAO生成并减轻动脉粥样硬化,但尚未在人类中验证;米屈肼较安全,但其作用仅限于肉碱途径。
胆碱相关疾病的治疗方法


▸ 中医药
传统中医药(TCM)通过其独特的理论体系和复方用药,为调节与胆碱相关的功能紊乱提供了不同的视角,尤其是在神经系统和认知功能方面。
中医药研究更多关注的是胆碱的下游产物——神经递质乙酰胆碱(ACh)的功能。乙酰胆碱水平下降与阿尔茨海默病等认知障碍密切相关。一些中药或其活性成分被发现具有胆碱酯酶(AChE)抑制作用,能够减少乙酰胆碱的分解,从而提升其在突触间隙的浓度和作用。
具有乙酰胆碱酯酶抑制活性的中药及成分
研究发现,人参、五味子、远志、麦冬等传统补益药材,以及从石杉科植物中提取的石杉碱甲,均显示出显著的AChE抑制活性,被认为是改善认知功能的潜力药物。
也有研究认为,半夏、川芎、当归、人参等药材本身也含有胆碱成分,但其在复方煎煮后对人体系统性胆碱水平的实际贡献尚需进一步量化研究。
补肾益智汤(方)
一项针对记忆障碍模型的动物研究显示,中药复方“补肾益智汤”能够显著改善小鼠的学习记忆能力。其机制研究发现,该方剂能上调海马和皮层中胆碱乙酰转移酶(ChAT,合成乙酰胆碱的关键酶)的表达,并逆转乙酰胆碱(ACh)水平的下降和胆碱酯酶(ChE)活性的紊乱 。这表明该复方并非简单地补充胆碱,而是通过多靶点调节胆碱能神经系统的稳态。
目前中医药领域的研究主要集中在改善与胆碱能系统相关的病理状态(如认知障碍),而非直接“提高”或“降低”血浆胆碱水平本身。
▸ 运动
规律体育锻炼稳大脑胆碱水平,有益神经健康
研究表明,规律的体育锻炼(如每周三次的骑行训练,持续12周)可以防止大脑中胆碱浓度的异常升高。在阿尔茨海默病等神经退行性疾病中,神经元细胞的减少会导致胆碱浓度上升。规律运动组的大脑胆碱浓度保持稳定,而缺乏运动的对照组则出现升高。这表明规律运动可能通过保护神经元,有助于预防认知障碍和痴呆。
运动对胆碱能系统有积极调节作用
除了直接影响胆碱水平,运动还能对整个胆碱能神经系统功能产生积极影响:
小结
总体而言,饮食调整、益生元/益生菌补充、粪菌移植及药物治疗共同构成调控肠道微生态和降低TMAO水平的潜在策略。
然而,要实现临床转化,需要更系统的机制研究和设计完善的长期随机对照试验。同时,维持良好饮食习惯和健康生活方式仍是改善肠道生态与促进代谢健康的关键。
胆碱,曾经被简单地视为一种神经保护因子、细胞膜的核心组件,如今却被发现,它的命运在进入肠道那一刻便被改写。它的吸收效率、代谢方式、甚至健康效应,皆取决于你的肠道菌群。
未来,这条从认知到干预的路径将变得清晰,随着肠道菌群检测技术日益成熟,我们可以逐渐了解到自己肠道里,哪些菌群在控制胆碱的去向,哪些代谢通路可能与慢病风险相关…
基于这份独一无二的“身体地图”,我们便能采取更具针对性的行动,无论是调整饮食结构,补充特定的益生菌、益生元,还是接受个性化营养规划,最终目标都是主动引导胆碱走向有益的代谢路径,从源头上减少TMAO等风险分子的生成,修复与优化内环境。
主要参考文献
Kenny TC, Scharenberg S, Abu-Remaileh M, Birsoy K. Cellular and organismal function of choline metabolism. Nat Metab. 2025 Jan;7(1):35-52.
Goh YQ, Cheam G, Wang Y. Understanding Choline Bioavailability and Utilization: First Step Toward Personalizing Choline Nutrition. J Agric Food Chem. 2021 Sep 22;69(37):10774-10789.
Arias N, Arboleya S, Allison J, Kaliszewska A, Higarza SG, Gueimonde M, Arias JL. The Relationship between Choline Bioavailability from Diet, Intestinal Microbiota Composition, and Its Modulation of Human Diseases. Nutrients. 2020 Aug 5;12(8):2340.
Wiedeman AM, Barr SI, Green TJ, Xu Z, Innis SM, Kitts DD. Dietary Choline Intake: Current State of Knowledge Across the Life Cycle. Nutrients. 2018 Oct 16;10(10):1513.
Blusztajn JK, Slack BE, Mellott TJ. Neuroprotective Actions of Dietary Choline. Nutrients. 2017 Jul 28;9(8):815.
Dalla Via A., Gargari G., Taverniti V., Rondini G., Velardi I., Gambaro V., Visconti G.L., De Vitis V., Gardana C., Ragg E., et al. Urinary TMAO levels are associated with the taxonomic composition of the gut microbiota and with the choline TMA-lyase gene (cutC) harbored by enterobacteriaceae. Nutrients. 2020;12:62.
Bernhard W., Poets C.F., Franz A.R. Choline and choline-related nutrients in regular and preterm infant growth. Eur. J. Nutr. 2019;58:931–945.
Chan M.M., Yang X., Wang H., Saaoud F., Sun Y., Fong D. The microbial metabolite trimethylamine N-oxide links vascular dysfunctions and the autoimmune disease rheumatoid arthritis. Nutrients. 2019;11:1821.