-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
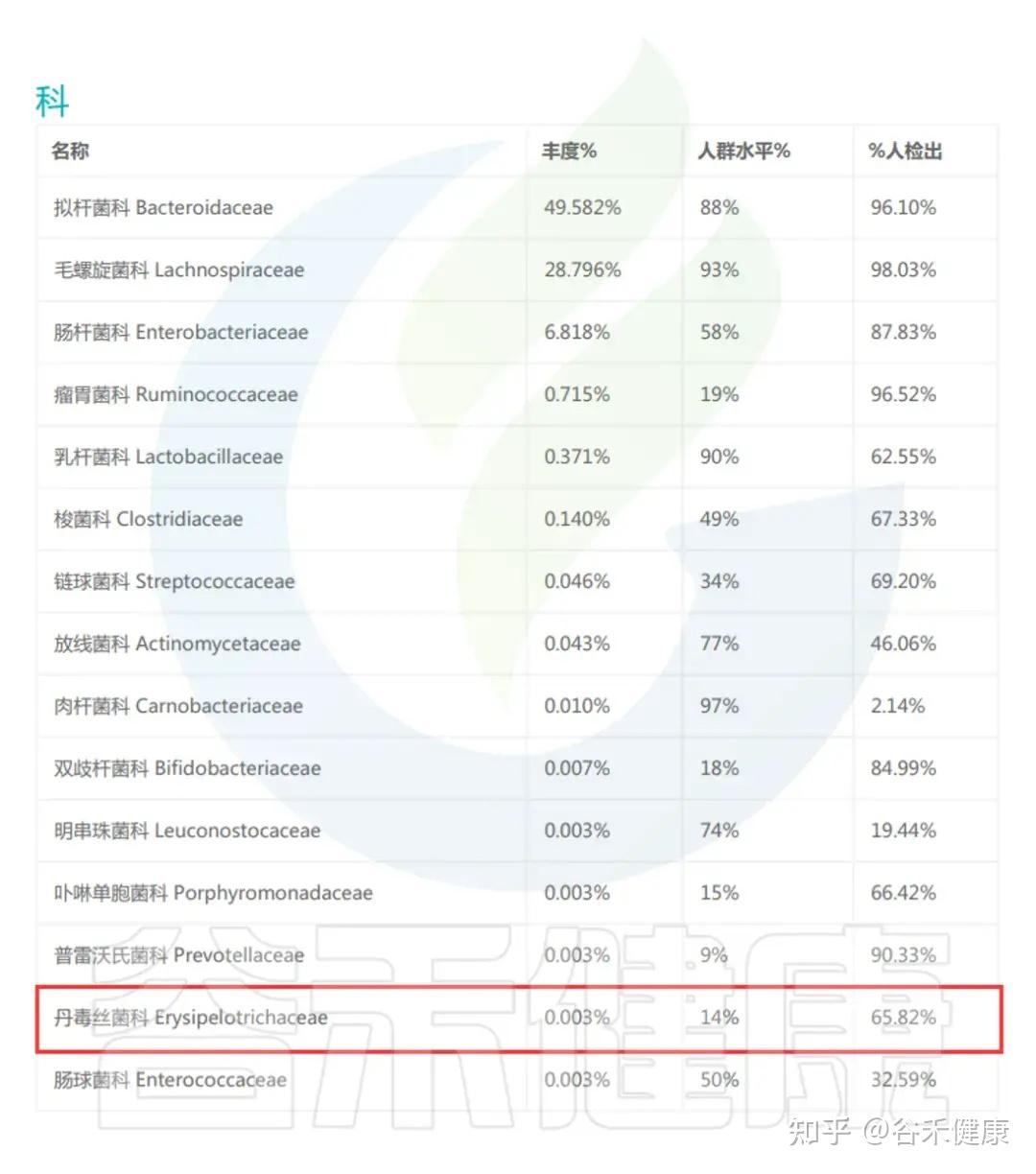
丹毒丝菌科(Erysipelotrichaceae)是厚壁菌门(Firmicutes)中的一类重要细菌,广泛存在于人体肠道中,因其在健康与疾病调控中的重要作用而备受关注。
丹毒丝菌科参与食物分解与能量代谢,并在脂质代谢、胆汁酸循环和免疫调控中发挥关键作用,对维持机体代谢稳态至关重要。
并且该家族的细菌具有较高的免疫原性,丹毒丝菌科的某些成员相比其他肠道菌群更易被IgA包被。研究表明,其相对丰度与肿瘤坏死因子α(TNF)水平呈正相关,并与多种免疫相关疾病密切相关。在炎症性肠病及其他免疫介导疾病(如多发性硬化、特应性皮炎和食物过敏)中,丹毒丝菌科的异常增减可能影响宿主免疫稳态,从而调节炎症反应。
丹毒丝菌科的一个显著特点是功能异质性与环境敏感性。在健康状态下,丹毒丝菌科可以促进短链脂肪酸生成、维持上皮屏障功能及调节免疫应答,有助于肠道稳态。然而,在高脂饮食、代谢紊乱或免疫异常等条件下,其丰度和代谢模式往往出现明显波动,可能促发低度炎症或代谢失衡。大量研究显示,丹毒丝菌科的丰度变化与肥胖、糖代谢异常、炎症性肠病、自闭症谱系障碍及神经退行性疾病等多种疾病密切相关。
深入探索丹毒丝菌科在宿主代谢中的作用机制,不仅有助于揭示肥胖与代谢疾病的微生态基础,也为通过微生物干预改善人体健康提供了潜在的新策略。
注:在生物分类学中,“科”(Family)是界、门、纲、目、科、属、种层级中的一级,科并不属于精细的分类层面,但是在人类健康、科学研究和生态系统中有些是公认且非常重要的细菌科,例如肠杆菌科(Enterobacteriaceae):这是医学上最重要的科之一,包含了非常常见的大肠杆菌(Escherichia coli)和沙门氏菌(Salmonella)。
葡萄球菌科(Staphylococcaceae):主要包括葡萄球菌属 (Staphylococcus),特别是金黄色葡萄球菌(Staphylococcus aureus),普遍存在于皮肤和黏膜上的机会性病原体等。
而丹毒丝菌科成员在脂质代谢、胆汁酸转化和炎症调节等方面具有相似生态功能,其丰度在疾病状态下往往整体升降,呈现更一致的变化趋势。
丹毒丝菌科(Erysipelotrichaceae)是一种革兰氏阳性菌,广泛分布于人体、哺乳动物、鸟类、鱼类和昆虫肠道中的细菌家族,属于厚壁菌门(Firmicutes),Erysipelotrichia纲、Erysipelotrichales目。在肠道微生态、宿主代谢和炎症反应中具有重要作用。
1
形态特征与分类
丹毒丝菌科成员多为革兰氏阳性、直的或稍微弯曲的细长杆状或丝状细胞,既有严格厌氧菌,也有兼性厌氧菌和微需氧菌。不运动,不产生内生孢子。
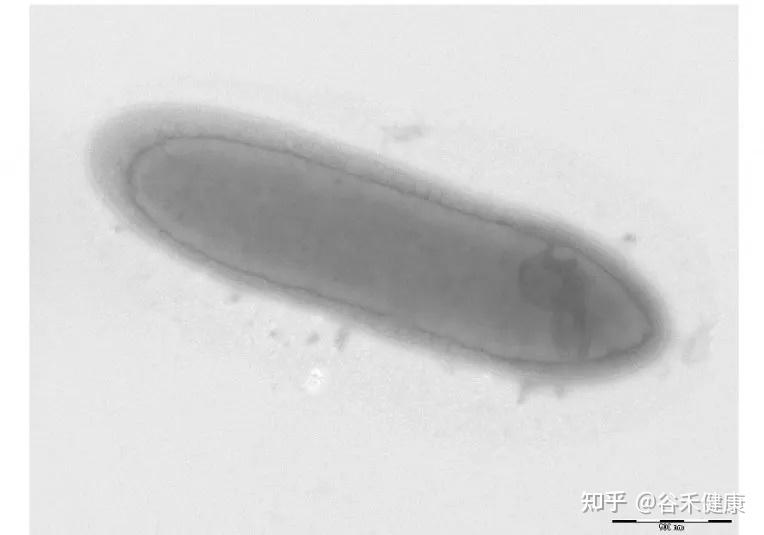
该家族的 G+C 含量较低(约36-40mol%),细胞壁结构独特。目前已鉴定出二十多个属,包括 Erysipelothrix、Allobaculum、Bulleidia、Faecalibaculum、Holdemania、Catenibacterium、Dubosiella等。
其模式菌属为丹毒丝菌属(Erysipelothrix)。
2
生态分布与功能
生长条件:温度范围5–42°C,最适30–37°C;不耐热(60°C 15分钟即可灭活)。
pH范围6.7–9.2,最适7.2–7.6。
丹毒丝菌科(Erysipelotrichaceae)广泛存在于人类和动物肠道,是常见的共生菌群之一。它们与宿主的脂质代谢密切相关,研究显示高脂饮食、肥胖、代谢紊乱等状态下该家族丰度常常升高。此外,丹毒丝菌科也与炎症性肠病、免疫反应、某些代谢疾病(如高胆固醇血症)相关。
3
代谢特性
该家族的细菌具备较强的代谢多样性,能够发酵多种类型的碳水化合物,在这一过程中产生多种短链脂肪酸,例如乙酸、丙酸和丁酸等。部分菌株还具有利用植物多糖以及 N-乙酰半乳糖胺(GalNAc)的能力,这种代谢特性使它们在复杂碳源环境中能够持续生长和维持能量供应。
与此同时,这类细菌在宿主的蛋白质分解、脂肪代谢以及能量吸收过程中也发挥着一定的辅助作用,有助于食物成分的进一步消化与转化,从而在营养物质的利用中占据重要地位。
4
抗生素敏感性
目前关于整体的耐药性特征仍缺乏系统研究,因此其抗药机制和范围尚未完全明确。
然而,根据现有资料可知,该科下属的丹毒丝菌属(Erysipelothrix)在抗生素敏感性方面具有一定的特征表现。研究显示,这一属的细菌通常对磺胺类药物、多黏菌素、庆大霉素以及卡那霉素等抗生素具有明显的耐药性,表现出对这些药物的较强抵抗能力;而在另一方面,它们对青霉素、氯霉素和四环素等抗菌药物则较为敏感。
5
与其他细菌的相互作用
丹毒丝菌科与其他细菌之间存在一定程度的相互作用,能够与多种不同类型的细菌发生协同或竞争关系,包括:
增强:
Bacteroidales
Bacteroides
Odoribacter
Peptococcaceae
抑制:
Bifidobacterium
Coriobacteriales
Adlercreutzia
Collinsella
Porphyromonas
Prevotella
Clostridium
Clostridiales incertae sedis
Clostridiales Family XIII. Incertae Sedis
Blautia
Coprococcus
Dorea
Lachnospiraceae
Ruminococcaceae
Ruminococcus
Dialister
Campylobacteraceae
被抑制:
Bifidobacterium
Coriobacteriales
Adlercreutzia
Collinsella
Bacteroidales
Bacteroides
Porphyromonadaceae
Odoribacter
Parabacteroides
Porphyromonas
Prevotella
Rikenellaceae
Alistipes
Turicibacter
Streptococcus
Clostridiales
Catabacteriaceae
Clostridium
Clostridiales incertae sedis
Peptoniphilus
Clostridiales Family XIII. Incertae Sedis
Blautia
Lachnospiraceae
Coprococcus
Dorea
Eubacterium
Lachnobacterium
Lachnospira
Roseburia
Peptococcaceae
Ruminococcaceae
Ruminiclostridium
Acetivibrio
Faecalibacterium
Oscillospira
Ruminococcus
Acidaminococcus
Dialister
Phascolarctobacterium
Veillonella
Rubrivivax
Alcaligenaceae
Oxalobacter
Bilophila
Desulfovibrio
Campylobacteraceae
Enterobacteriaceae
Escherichia
Holdemania
Akkermansia
6
健康与疾病相关性
•代谢疾病方面:研究结果显示,丹毒丝菌科(Erysipelotrichaceae)的相对丰度与多种代谢性紊乱密切相关,包括肥胖、高脂血症以及肝脂肪变性等。其数量变化常被视为代谢异常的一种微生态特征,提示该菌群可能在宿主脂肪代谢、胆汁酸循环以及能量平衡调控中发挥一定作用。
•炎症与免疫方面:该家族的细菌具有较高的免疫原性,其丰度波动与多种免疫相关疾病密切联系。在炎症性肠病及其他免疫介导疾病(例如多发性硬化、特应性皮炎和食物过敏)中,丹毒丝菌科(Erysipelotrichaceae)的异常增减被认为可能影响宿主免疫反应的稳定性,从而参与炎症反应的调节过程。
丹毒丝菌科在宿主炎症中的潜在作用
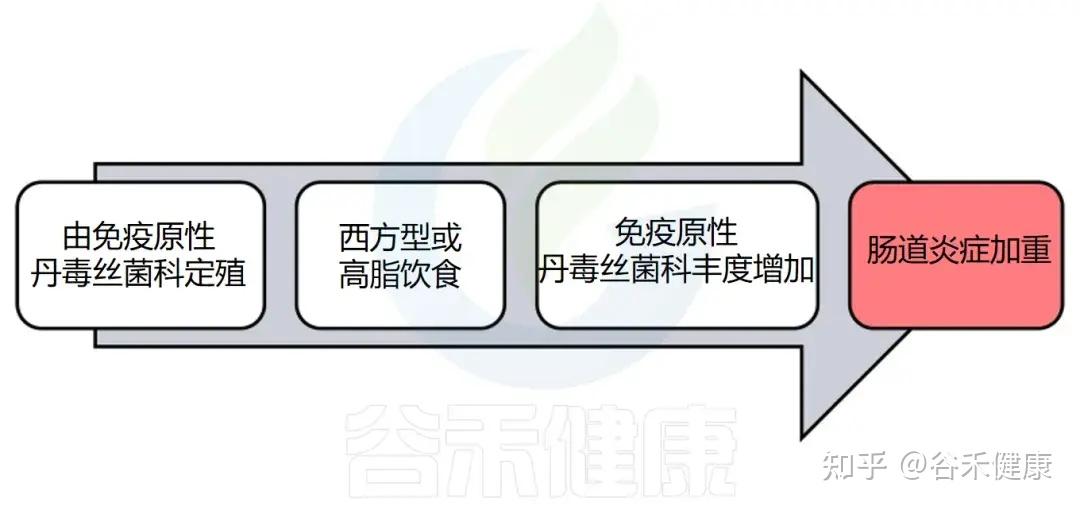
有研究人员开发了一种基于免疫球蛋白 A(IgA)包被细菌进行分类和测序的技术——IgA-SEQ,发现丹毒丝菌科的某些成员相比其他肠道菌群被 IgA 高度包被。随后,在研究慢性 HIV 感染且接受抑制性抗逆转录病毒治疗的患者时发现,丹毒丝菌科的相对丰度与肿瘤坏死因子 α(TNF)水平呈正相关。
•其他疾病方面:部分研究还提示,该菌群的丰度变化与多种神经系统及精神类疾病有关。例如,在帕金森病和阿尔茨海默病等神经退行性疾病患者中,其比例与病情进展存在一定相关性;而在抑郁症与精神分裂症等精神障碍人群中也观察到类似现象。
这些发现表明,丹毒丝菌科(Erysipelotrichaceae)在多系统疾病中的潜在作用值得进一步深入探讨,后文将对此内容进行更为详细的阐述。
1
结直肠癌中水平增加
丹毒丝菌科在胃肠道相关疾病中的重要性,已经被多项研究证实。其在结直肠癌患者体内的富集现象凸显了该菌群与肿瘤发生之间的联系。
具体而言,与健康个体相比,结直肠癌患者肠腔中丹毒丝菌科的丰度显著升高,这种差异性被认为可能与肠道炎症环境的变化密切相关。
此外,在以1,2-二甲基肼诱导的结肠癌动物模型中,肿瘤组中该菌科的丰度水平也明显高于对照组,进一步支持了其在结肠肿瘤形成过程中的潜在作用。这些发现共同表明,丹毒丝菌科的变化可能是肠道微生态失衡与结直肠癌发病机制之间的重要连接环节。

2
炎症性肠病中丰度发生变化
在炎症性肠病(IBD)患者及动物模型中,丹毒丝菌科的丰度发生变化,但相关证据并不一致。
•小鼠肠道炎症中丹毒丝菌科增加
有研究发现,在感染弓形虫或贾第鞭毛虫的小鼠中,回肠处的菌群向丹毒丝菌科转变;另一项研究发现,丹毒菌科丰度显著增加时,小鼠发生了肿瘤坏死因子(TNF)驱动的克罗恩病 (CD) 样透壁炎症。
•也有研究发现克罗恩病中丹毒丝菌科丰度减少
相反,也有研究发现克罗恩病(CD)复发患者的丹毒丝菌科显著减少,另一项研究同样观察到新发 CD 患者中该菌科的丰度下降。他们分析了 IBD 患者和胆汁代谢基因对照的公开宏基因组数据集,发现源自厚壁菌门类群(包括丹毒科)的胆汁盐水解酶基因的丰度在 IBD 中与健康对照相比显著减少。

这些结果表明不同宿主间存在差异,炎症小鼠模型的丹毒科水平较高,而 IBD 患者的水平较低。对此的两种可能的解释包括小鼠和人类肠道微生物群的固有差异或它们在感知细菌配体时先天免疫反应的差异。
注:当以高IgA包被菌群(含丹毒丝菌科)定植无菌小鼠后,发现这些小鼠在葡聚糖硫酸钠处理后发生更严重的结肠炎。
3
丹毒丝菌科有望作为肠道疾病生物标志物
在对克罗恩病(CD)、溃疡性结肠炎(UC)、结直肠癌(CRC)及艰难梭菌感染(CDI)总计3048份肠道菌群 16S rRNA 数据的荟萃分析中,研究发现:

•肠道疾病患者普遍存在丹毒丝菌科的升高
与健康对照组相比,肠道疾病患者(包括CD、UC、CRC和CDI)普遍表现出丹毒丝菌科(Erysipelotrichaceae)丰度的升高。
该科群体的增加与肠道炎症和免疫反应异常密切相关,提示其可能参与肠道菌群失调(dysbiosis)的形成与维持。
在克罗恩病(CD)和艰难梭菌感染(CDI)中,丹毒丝菌科(Erysipelotrichaceae)尤其突出,其中的Erysipelatoclostridium属被鉴定为两种疾病的潜在微生物标志物。
关于丹毒丝菌科在人类疾病中作用的最有力证据来自其与代谢紊乱的关联研究。
1
肥胖个体中丰度升高
早期研究发现,在饮食诱导的肥胖动物中,丹毒丝菌科物种大量繁殖;肥胖个体也表现出该菌科丰度升高。

•参与脂质代谢,与肝脏脂肪含量正相关
后续研究进一步证实,该菌群与宿主体内脂质代谢密切相关。研究还发现丹毒丝菌科的四个谱系,对饮食及宿主健康表型的反应不同。观察到高脂饮食或西方饮食小鼠中该菌科的增加;并有研究发现其丰度与女性受试者肝脏脂肪含量呈正相关,且这一效应在控制胆碱摄入的条件下表现明显。
2
丹毒丝菌科与较高的代谢紊乱相关
对20名年龄在 58 至 71 岁之间、糖耐量正常、糖尿病前期或 2 型糖尿病的个体中,从粪便样本中扩增的 16S rRNA 基因的条形码测序,比较了肠道细菌群落发现:

•丹毒丝菌科丰度过高增加代谢紊乱风险
特定的微生物群在不同的代谢状态下相对富集或减少。例如,丹毒丝菌科(Erysipelotrichaceae)的丰度较高与代谢紊乱有关,而霍尔德曼氏菌属(Holdemania)与脂质和葡萄糖代谢受损的临床指标相关。与代谢性疾病临床表现的相关表明,这些微生物可能有助于代谢损伤或健康。
一项针对奥地利男女肠道菌群与糖代谢紊乱的研究也发现,丹毒丝菌科(Erysipelotrichaceae)和毛螺菌科(Lachnospiraceae)部分菌群与代谢异常相关。Lachnospiraceae科和瘤胃球菌科成员可将复杂多糖分解为短链脂肪酸,如丁酸、丙酸和乙酸。而丹毒丝菌科在肥胖患者接受胃旁路手术后,其丰度明显下降。
3
高脂肪摄入和抽烟会增加丹毒丝菌科丰度
营养学研究进一步表明,膳食脂肪对丹毒丝菌科的丰度具有显著影响。在肠外营养相关肝损伤的小鼠中发现,丹毒丝菌科中特定分类单元积累明显,而肝损伤的减轻则伴随着抗生素治疗后该菌群的下降。
研究还显示,丹毒丝菌科的变化与肠外营养液中大豆油基脂质乳剂的使用密切相关。
此外在进行多重比较校正后还发现,与从不吸烟者相比,丹毒丝菌科的细菌类群在吸烟者中显著富集。
•低脂饮食降低丹毒丝菌科水平及血脂或胆固醇
在接受低脂(约13.5g/1000 Kcal)排他性肠内营养(EEN)治疗的患者中观察到类似现象。结合关于 EEN 治疗可显著减少克罗恩病(CD)患者内脏脂肪面积的结果,进一步暗示脂肪摄入类型可能影响治疗效果。还有研究人员提出,膳食脂肪的组成对 CD 肠内营养疗法的疗效至关重要。
与健康人相比,炎症性肠病(IBD)患者常表现出不同的胆固醇水平,而针对 TNF 的英夫利昔单抗维持治疗则会导致血胆固醇升高及腹部脂肪显著增加。
综上所述,IBD患者丹毒丝菌科丰度的波动可能与血脂或胆固醇表型,以及饮食组成密切相关,并可能对疾病表现和活动程度产生重要影响。
1
自闭症儿童中丰度较高
研究发现,与健康对照组相比,自闭症谱系障碍(ASD)儿童的肠道菌群生物量、丰富度和多样性均显著增加,且微生物群落结构发生明显改变。在属水平上,未鉴定的 Lachnospiraceae、Clostridiales、Erysipelotrichaceae、Dorea、Collinsella 和 Lachnoclostridium 的相对丰度升高。未鉴定的丹毒丝菌科、粪杆菌及毛螺菌科的存在与 ASD 症状严重程度正相关。

•丹毒丝菌科可能有助于判断自闭症严重程度
进一步分析显示,重度 ASD 儿童中未鉴定的丹毒丝菌科丰度最高,而粪杆菌数量最低;其丹毒丝菌科水平也明显高于轻度ASD儿童,粪杆菌则相对更低。因此我们推测肠道微生物群落的结构与自闭症症状的严重程度相关,肠道微生物群分析可能有助于症状学,肠道菌群的调节可能是未来ASD治疗的新策略。
2
阿尔兹海默病中丹毒丝菌科UCG-003减少
在阿尔茨海默病(AD)患者中,肠道微生物群呈现出明显的紊乱特征。具体而言,与健康对照组相比,AD 患者体内的双歧杆菌、梭状芽孢杆菌、Castellaniella、丹毒丝菌科 UCG-003、罗氏菌属、Tuzzerella、乳杆菌科以及Monoglobus的丰度均显著减少。
这些细菌通常与维持肠道生态平衡、促进短链脂肪酸生成及调节免疫反应等功能密切相关,因此它们的减少可能反映出宿主体内代谢与炎症状态的异常。

丹毒丝菌科(Erysipelotrichaceae)是一类肠道常见菌群,广泛参与宿主的代谢、炎症及多种疾病过程。高脂饮食、抽烟等不良习惯会增加丹毒丝菌科水平。多项研究及谷禾数据库均显示,在肥胖和代谢紊乱人群中该菌科显著富集。
由于具备较高免疫原性,丹毒丝菌科在肠道疾病(克罗恩病、溃疡性结肠炎、结直肠癌及艰难梭菌感染)中丰度上升,未来有望成为反映肠道健康状况的潜在生物标志物。
富含膳食纤维或特定益生元(如阿拉伯木聚糖低聚糖、黄酮类槲皮素、菊粉、薏米)的饮食可调节丹毒丝菌科(Erysipelotrichaceae)丰度,说明饮食可以通过菌群进而影响人体代谢健康。
此外,太极拳和运动等生活方式干预也可影响丹毒丝菌科的丰度,提示其在心理与生理健康调节中的潜在作用。研究发现,肠道中未鉴定的丹毒丝菌科物种丰度越高,自闭症症状越严重,进一步证实该菌科在神经系统疾病中的参与,可能有助于辅助判断自闭症严重程度。
未来,应通过多组学分析和功能实验进一步揭示丹毒丝菌科不同成员的代谢特性及其与其他肠道菌群的互作机制。随着肠道菌群检测技术的发展,丹毒丝菌科有望成为评估代谢健康、监测炎症状态及指导微生态干预的重要生物标志物,为精准营养和疾病预防提供新的思路与工具。
主要参考文献
Kaakoush NO. Insights into the Role of Erysipelotrichaceae in the Human Host. Front Cell Infect Microbiol. 2015 Nov 20;5:84.
Ding X, Xu Y, Zhang X, Zhang L, Duan G, Song C, Li Z, Yang Y, Wang Y, Wang X, Zhu C. Gut microbiota changes in patients with autism spectrum disorders. J Psychiatr Res. 2020 Oct;129:149-159.
Lippert K, Kedenko L, Antonielli L, Kedenko I, Gemeier C, Leitner M, Kautzky-Willer A, Paulweber B, Hackl E. Gut microbiota dysbiosis associated with glucose metabolism disorders and the metabolic syndrome in older adults. Benef Microbes. 2017 Aug 24;8(4):545-556.
Teng D, Jia W, Wang W, Liao L, Xu B, Gong L, Dong H, Zhong L, Yang J. Causality of the gut microbiome and atherosclerosis-related lipids: a bidirectional Mendelian Randomization study. BMC Cardiovasc Disord. 2024 Mar 2;24(1):138.
Cox LM, Sohn J, Tyrrell KL, Citron DM, Lawson PA, Patel NB, Iizumi T, Perez-Perez GI, Goldstein EJC, Blaser MJ. Description of two novel members of the family Erysipelotrichaceae: Ileibacterium valens gen. nov., sp. nov. and Dubosiella newyorkensis, gen. nov., sp. nov., from the murine intestine, and emendation to the description of Faecalibaculum rodentium. Int J Syst Evol Microbiol. 2017 May;67(5):1247-1254.
Mancabelli L, Milani C, Lugli GA, Turroni F, Cocconi D, van Sinderen D, Ventura M. Identification of universal gut microbial biomarkers of common human intestinal diseases by meta-analysis. FEMS Microbiol Ecol. 2017 Dec 1;93(12).
Zhang H, DiBaise JK, Zuccolo A, Kudrna D, Braidotti M, Yu Y, Parameswaran P, Crowell MD, Wing R, Rittmann BE, Krajmalnik-Brown R. Human gut microbiota in obesity and after gastric bypass. Proc Natl Acad Sci U S A. 2009 Feb 17;106(7):2365-70.