-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
厌氧棒状菌属(Anaerostipes)隶属于厚壁菌门下的毛螺菌科,是一类革兰氏阳性厌氧产丁酸菌,在维持宿主肠道稳态与代谢平衡中具有关键作用。
该菌属的显著特征是能够产生丁酸,并且其中的A.caccae与A.hadrus还能利用体内的乳酸与乙酸,将其转化为丁酸。一些菌株还拥有维生素B₁₂和E生物合成通路基因,或是将肌醇转化为丙酸与乙酸的代谢途径。
Anaerostipes与其他肠道内重要菌属还存在密切的相互作用。例如A.caccae可发酵由粘蛋白降解菌A.muciniphila生成的葡萄糖、甘露糖、半乳糖等粘蛋白衍生糖,产生丁酸盐、乙酸盐和乳酸盐。此外,A.hadrus通过分解低聚果糖生成的水解产物能够有效促进包括 Lactobacillus 在内的多种益生菌生长和繁殖,表现出其特有的“互利共代谢”特征。
厌氧棒状菌属中的A.hadrus被发现可代谢抗癌药5‑氟尿嘧啶(5‑FU),参与其降解或转化,这一代谢活动可能改变5‑FU在肠道中的稳定性与吸收效率,从而进一步影响其在体内的生物利用度及临床治疗效果。
Anaerostipes具有作为肠道健康和疾病生物标志物的重要潜力,其在儿童克罗恩病、胆汁淤积、结直肠癌、重度抑郁症、强迫症、食物过敏患者中丰度普遍下降,且与疾病进展、炎症及免疫调控密切相关。
深入研究Anaerostipes的生态特征及其在疾病中变化,不仅有助于揭示肠道菌群与宿主互作机制,还为微生态干预与疾病防治提供潜在的新靶点。
1
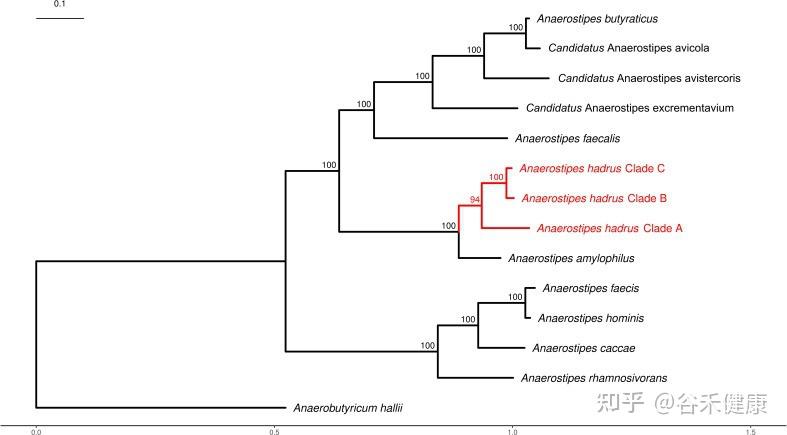
分类地位与主要菌种
厌氧棒状菌属(Anaerostipes)隶属于厚壁菌门(Firmicutes)、Clostridiales(梭菌目)下的毛螺菌科(Lachnospiraceae)。
毛螺菌科是人体肠道中重要的核心菌群,在碳水化合物代谢、短链脂肪酸(SCFAs)生成及宿主健康调控中发挥关键作用。
模式种为 :Anaerostipes caccae,其丰度受饮食膳食纤维与碳水组成显著影响;
–A. hadrus为主要优势种,呈泛基因组开放性,适应性强;
–A. rhamnosivorans:新从婴儿粪便中分离出来;
–A. butyraticus在禽类肠道中较为丰富。
DNA G+C 含量(mol%):45.5–46
Anaerostipes属的系统发育树
2
细胞及形态特征
细胞形态
–革兰氏阳性,杆状或略弯曲杆形,无运动性。
-多数为严格厌氧菌,部分可形成芽孢。
-尾端圆钝,长度约2–5μm。
芽孢形成能力
-厌氧棒状菌属(Anaerostipes)中的A. caccae、A. hominis、A. rhamnosivorans能形成芽孢,观察到内生孢子结构。
-虽然A. hadrus、A. butyraticus、A. amylophilus 在实验所用条件下未形成可见孢子,但其基因组保留主要的孢子形成核心基因(spo0A 等)。
-芽孢具有较强的耐氧和耐热能力,部分菌株可在常温下存活数。
3
生长条件
-厌氧棒状菌属(Anaerostipes)为严格厌氧菌,最适生长温度约37°C,适宜pH为6.8–7.2。
– 代谢途径显示该属具极高适应能力,属于肠道生态系统中的“代谢枢纽”。
4
重要的代谢能力
关键丁酸生成菌
-厌氧棒状菌属(Anaerostipes)的一个显著特征是其能够产生丁酸(butyrate),这是一种短链脂肪酸(SCFA),对肠道健康至关重要。丁酸不仅为结肠细胞提供能量,还能促进肠道免疫稳态,并刺激有益菌群的生长。
-同时可生成少量乙酸(acetate)和丙酸(propionate)。
–A.caccae可利用乳酸与乙酸共生成丁酸,是肠道“乳酸清除者”。
–A.hadrus具有细胞外GH32类水解酶,可降解果寡糖(FOS)及菊粉,这种能力使其能与非 FOS 利用菌共代谢。
–A.rhamnosivorans和A.caccae具有独特的肌醇(inositol)转化途径,可将膳食肌醇厌氧代谢为丙酸和乙酸,其代谢活性与宿主血糖、胰岛素水平呈负相关。
–非溶血性,过氧化氢酶和氧化酶均为阴性。
维生素与胆汁酸代谢能力
-厌氧棒状菌属拥有胆汁盐水解酶(bsh)基因,能够去结合胆汁酸,影响宿主胆汁酸稳态。
-厌氧棒状菌属还具有维生素B₁₂和E生物合成通路基因。
5
生态学分布
-广泛存在于全球人群粪便样本中,也出现在部分哺乳动物及禽类(A.butyraticus在鸡盲肠中富集)。
-A.hadrus为人群中优势种,具有开放泛基因组特征,表明其具较高的生态可塑性。
-A.caccae丰度与饮食成分(膳食纤维、寡糖)密切相关。
6
与其他细菌和宿主的互作
厌氧棒状菌属(Anaerostipes)通过代谢共生在肠道生态系统中发挥“碳转接”和“代谢桥梁”的重要作用。
利用乳酸菌产生的乳酸生成丁酸盐
A. caccae已被证明可利用双歧杆菌和乳杆菌等共生菌产生的乳酸盐和乙酸盐发酵产物生成丁酸盐,并能分别转化双歧杆菌的l-乳酸和乳酸杆菌的d-乳酸,从而在减少乳酸积累和维持肠道菌群平衡中发挥重要作用。
利用AKK菌的粘蛋白衍生产物
另一项实验研究发现,A.caccae 可发酵由粘蛋白降解菌 A.muciniphila 生成的葡萄糖、甘露糖、半乳糖和 N-乙酰半乳糖胺等粘蛋白衍生糖,产生丁酸盐、乙酸盐和乳酸盐。A.caccae 和 A.muciniphila 之间的肠粘液层似乎存在共生交叉摄养。
此外,A.hadrus通过分解低聚果糖(FOS)生成的水解产物能够有效促进包括 Lactobacillus 在内的多种益生菌生长和繁殖,表现出其特有的“互利共代谢”特征。
Anaerostipes还与其他细菌存在相互作用,如下所示:
增强
Bacteroidales
Bacteroides
Odoribacter
Peptococcaceae
抑制
Coriobacteriales
Adlercreutzia
Collinsella
Porphyromonas
Prevotella
Clostridium
Clostridiales incertae sedis
Clostridiales Family XIII. Incertae Sedis
Blautia
Coprococcus
Dorea
Lachnospiraceae
Ruminococcaceae
Ruminococcus
Dialister
Campylobacteraceae
Erysipelotrichaceae
此外,Anaerostipes的丁酸盐与丙酸盐产物不仅为结肠上皮提供能量来源,还可:
–促进调节性 T 细胞(Treg)分化;
–抑制 NF‑κB 介导的炎症通路,
–加强肠屏障紧密连接蛋白表达。
7
耐药性
对大多数抗生素都敏感
目前关于 Anaerostipes 的耐药性研究较少,但由于其严格的厌氧特性和对特定环境的依赖,它通常不会对抗生素产生广泛的耐药性。
A. hominis 和一些 A. hadrus 菌株仅表现出编码 β-内酰胺类和多粘菌素抗性的基因,而这些基因在所有 A.caccae 基因组中都不存在。在3个物种中零星观察到与其他抗生素(如四环素、氨基糖苷类和杆菌肽)耐药性相关的基因。
整体而言,A.caccae 与 A.hadrus 均未携带主要的抗生素耐药、毒性或耐胆酸基因。其耐受性主要源于对氧化应激和低pH的内源性适应,与抗生素无关。
厌氧棒状菌属(Anaerostipes)是典型的产丁酸厌氧菌,在人类肠道生态系统中扮演了“代谢枢纽”的角色。它通过能量代谢、基质转化、宿主营养协同、免疫调节和药物代谢等多层机制,对维持肠道与全身健康具有重要意义。
产丁酸、乙酸与丙酸——肠屏障修复、抗炎与能量供应核心驱动力
厌氧棒状菌属(Anaerostipes)的代表菌如A.caccae、A. hadrus、利用乳酸、乙酸及多糖降解产物,通过乙酰辅酶A途径生成丁酸和丙酸。
√ 主要生理作用
–肠上皮能量供给:丁酸是结肠上皮细胞主要能量来源(可达 70% )。
–肠道屏障修复与增强:丁酸刺激紧密连接蛋白(ZO‑1、occludin、claudin)的表达,修复屏障结构,减少肠漏。
-抗炎与免疫调节:丁酸通过抑制 NF‑κB 信号,促进调节性 T 细胞(Treg)分化,减少促炎细胞因子(IL‑6、TNF‑α)释放。
-能量代谢优化:丙酸参与肝糖异生、乙酸供其他益菌利用,共同维持肠内碳流平衡。
这一发酵体系在维持低炎症水平、促进黏膜修复与调节全身能量代谢方面具有核心作用。
分解乳酸、肌醇等底物——维持菌群生态平衡
A. caccae与A. hadrus能使用由双歧杆菌和乳酸杆菌等生成的乳酸与乙酸共代谢,转化为丁酸。这可以避免乳酸过度积累,防止肠腔过酸化,维持pH稳定。

利用低聚果糖和肌醇:A.hadrus可水解低聚果糖,产物反过来促进乳酸菌增殖;并具备将肌醇转化为丙酸与乙酸的代谢途径,有助于调节宿主能量与脂质代谢。
对微生态的意义:通过分解中间代谢物和益生元,Anaerostipes属增强了肠道代谢网络的互补性,是稳定微生态平衡的关键成员。
维生素B12合成——宿主营养代谢支持因子
除了短链脂肪酸的产生外,某些厌氧棒状菌属还可能有助于其他重要的次级代谢物,例如维生素B12。
√ 作用意义
-肠道维生素B12供应源:为需B12菌群如甲烷菌、部分脱硫弧菌提供前体;
–宿主营养参与:B12参与脂肪酸与氨基酸代谢,与能量稳态及神经系统功能密切相关;
–互利生态效应:在共生系统中,Anaerostipes的B12产能增强了菌群代谢互补性。
药物代谢——调节宿主药物应答
√ 可代谢影响抗癌药5‑氟尿嘧啶
A.hadrus被发现可代谢抗癌药5‑氟尿嘧啶(5‑FU),参与其降解或转化,可能影响药物的生物利用度与疗效。

其机制可能涉及脱氨酶或还原酶通路对5‑FU的结构修饰,从而调节肠腔中药物浓度和毒副作用。这表明Anaerostipes在肠道药物代谢群中具有潜在作用,为利用菌株优化药效、降低毒性、实现个体化药物治疗提供新方向。
产生丁酸盐的A.hadrus可能会干扰氟嘧啶药物的疗效或减少结直肠癌患者的不良反应,这可能取决于人类宿主二氢嘧啶脱氢酶(DPD)的水平。
在人体肠道微生态中,厌氧棒状菌属(Anaerostipes)是重要的丁酸生成菌之一,其丰度常被视为肠道健康与代谢稳态的重要指标。
近年来的多项研究发现,不同疾病状态——包括克罗恩病、胆汁淤积、结直肠癌、强迫症、抑郁症、食物过敏等——均伴随着 Anaerostipes 丰度的显著变化。这些波动不仅反映了宿主代谢和免疫环境的改变,也提示该菌属可能在多种疾病的发生与缓解过程中发挥关键调节作用。
1
儿童克罗恩病中Anaerostipes下降

研究显示,克罗恩病患者(尤其是活动期或有高应激水平者)粪便中Anaerostipes的丰度显著下降,与健康儿童对照相比差异明显。
同时,患者中促炎或条件致病菌(如Escherichia-Shigella、Enterococcus、Ruminococcus gnavus等)增加。
2
胆汁淤积患者中Anaerostipes减少

临床与动物模型研究显示,无论是肝胆疾病(如原发性胆汁性胆管炎、药物性胆汁淤积)还是肝外胆汁阻滞,Anaerostipes的相对丰度均呈下降趋势。
这可能是由于Anaerostipes拥有胆汁盐水解酶(bsh)基因,能够去结合胆汁酸,影响宿主胆汁酸稳态。
因此,Anerostipes丰度下降不仅是胆汁淤积相关肠道菌群失衡的标志之一:一方面反映宿主胆汁酸代谢环境的毒性压力;另一方面通过丁酸减少和屏障损伤途径,放大肝‑肠轴炎症与代谢紊乱。
3
Anaerostipes在结直肠癌中减少
√ Anaerostipes随着结直肠癌的发展逐渐减少

有研究显示,从健康个体 → 结直肠腺瘤(CRA) → 结直肠癌(CRC),Anaerostipes的丰度逐渐并显著下降。
在早期腺瘤阶段,该菌种相对丰度已明显低于健康对照;在癌症阶段,其丰度降至最低水平,几乎完全缺失于部分患者样本中。
Anerostipes是主要的丁酸盐生成菌之一。其减少会导致丁酸水平下降,损害上皮细胞线粒体功能,使能量代谢从稳态转向糖酵解。同时,丁酸缺乏削弱了免疫调控和细胞凋亡诱导,使异常增殖细胞逃避免疫清除。
丁酸还能通过抑制组蛋白去乙酰化酶(HDAC)调节基因表达,当产丁酸菌减少时,HDAC 活性增强,促进癌变相关基因(如 c‑Myc、Cyclin‑D1)上调。
综上所述,Anaerostipes既是结直肠肿瘤发生的重要微生态标志,也是肠道微生物干预与癌症预防的潜在靶点。
4
强迫症患者中Anaerostipes减少

有研究收集了21名非抑郁、无药物的强迫症患者和22名年龄和性别匹配的非精神病对照者的晨间粪便和血液样本。
√ 强迫症患者中Anaerostipes等丁酸盐生产菌减少
与对照组相比,强迫症组的物种丰富度/均匀度较低(α多样性,逆辛普森)和三个丁酸盐生产属(Oscillospira、Odoribacter和Anaerostipes)的相对丰度较低。同时,患者的平均CRP水平升高(而IL‑6和TNF‑α无显著变化),且CRP与精神症状呈中至强相关。
5
肾移植受者中Anaerostipes减少

多项肾移植后微生物组研究显示,Anaerostipes丰度在移植早期明显下降,并持续低于健康对照组。
√ 肾移植受者中Anaerostipes减少,并可能导致腹泻
在肾移植受者(KTRs)中,Anaerostipes丰度显著下降,尤其在伴有肠道菌群失调及抗生素或免疫抑制剂相关腹泻的患者中更为明显。
Anaerostipes丰度下降,导致丁酸缺乏削弱上皮细胞能量供应,降低紧密连接蛋白(ZO‑1、occludin)表达,使黏膜屏障完整性受损,从而诱发腹泻。
Anaerostipes缺失与丁酸水平下降呈正相关,提示代谢失衡可能是腹泻的重要机制。
6
重度抑郁症患者中Anaerostipes减少

一项研究探讨了肠道微生物群与重度抑郁症(MDD)的关系,共招募46名活动性MDD患者(a-MDD)及45名健康对照(HC)。
√ Anaerostipes在重度抑郁症患者中丰度较低
研究发现,与健康对照相比,重度抑郁症(MDD)患者中存在相对丰度改变的细菌属:Bilophila(2 倍)和Alistipes(1.5 倍)更高,而Anaerostipes和Dialister在 MDD 患者中较低。
在重度抑郁障碍患者中,Anaerostipes显著减少,伴随丁酸合成能力下降和免疫炎症失衡。这种改变可能通过破坏肠‑脑屏障、增强神经炎症及损害神经营养调控,参与抑郁症的发生与维持。
7
食品过敏婴儿中Anaerostipes减少

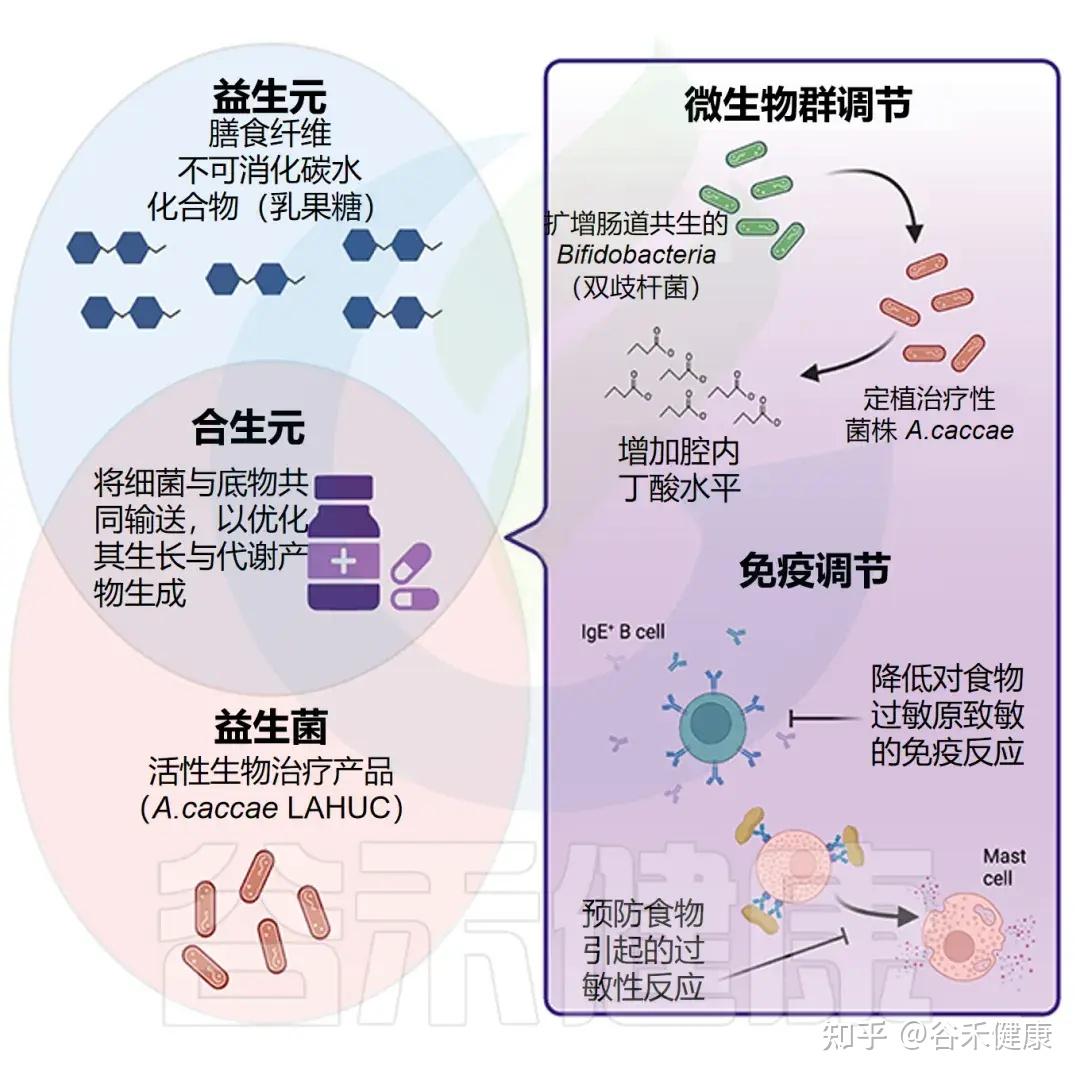
在食物过敏婴儿,尤其是牛奶过敏患者中,研究显示 Anaerostipes(特别是 Anaerostipes caccae)丰度显著下降。相反,在健康婴儿中,这一菌种丰富且与免疫耐受密切相关。
√ Anaerostipes减少可能作为食物过敏发生潜在指标
我们大胆推测Anerostipes的减少可作为婴幼儿食物过敏风险和肠道失衡的潜在标志;恢复A.caccae或其丁酸代谢活性(如补充丁酸菌、乳酸底物或膳食纤维)有望通过微生态干预促进免疫耐受并减轻过敏反应。
8
Anaerostipes在其他疾病中的丰度变化
√ 阿尔茨海默病患者中减少
研究结果显示,与健康对照相比,阿尔茨海默病患者(尤其是APOE‑ε4携带者)肠道中Anaerostipes的相对丰度显著下降。
注:APOE-ε4是载脂蛋白E(APOE)基因的一个等位基因,与阿尔茨海默病(老年痴呆症)风险显著相关。
√ 焦虑、创伤后应激人群中减少
具有焦虑、抑郁或创伤后应激特征(PTSD样表现)的人群中,Anaerostipes丰度显著下降。而在心理状态健康的对照组中,Anaerostipes 丰度明显较高,且与积极情绪和心理韧性评分呈正相关。
√ 儿童局灶性癫痫患者中减少
研究发现,儿童局灶性癫痫患者发病时肠道中Anaerostipes的丰度显著下降,与健康对照组相比明显减少。
在接受抗癫痫治疗后(尤其是病情稳定、发作频率下降者),Anaerostipes丰度明显回升,丁酸代谢通路相关活性亦随之增强。
这提示Anaerostipes的丰度与癫痫活动状态呈负相关,可能反映肠‑脑功能恢复与神经代谢平衡的改善。
√ 慢性疲劳综合征中减少
研究发现,慢性疲劳综合征(CFS)患者肠道中Anaerostipes相对丰度显著下降,与健康对照相比变化明显。
该菌的降低与患者的疲劳严重程度和认知功能障碍评分呈负相关,即Anaerostipes越少,临床症状越重。
与此同时,CFS患者中促炎或条件致病菌(如Enterobacteriaceae、Alistipes的某些菌株)相对增加,提示肠道生态由抗炎平衡型转向炎症型。
编者的话
厌氧棒状菌属(Anaerostipes)在多种疾病(尤其是慢性炎症、代谢疾病、心理疾病及肿瘤相关疾病)中丰度普遍下降,且与疾病进展、炎症及免疫调控密切相关。
其作为肠道健康和疾病生物标志物具有重要潜力,未来可通过饮食或微生态干预提升其丰度以改善健康。
多种方法可有效调节厌氧棒状菌属(Anaerostipes)丰度,主要包括膳食纤维、益生元、益生菌和生活方式干预。
1
膳食纤维补充
多项研究表明,高纤维饮食——包括菊粉、抗性淀粉及阿拉伯木聚糖等——能够显著提高厌氧棒状菌属(Anaerostipes)的丰度,并增强肠道丁酸盐的生成能力。
这些膳食纤维可作为产丁酸菌的发酵底物,为它们的生长提供能量来源,从而改善肠道微生态结构。该方法在健康成人及动物模型中均显示出良好的效果。
2
益生元与合生元干预
特定类型的益生元(如菊粉型果寡糖)以及合生元组合(如 Lactobacillus fermentum K73 联合高油酸棕榈油与乳清)对Anaerostipes的增殖具有促进作用。这些干预方式通过改变肠道内短链脂肪酸代谢路径与底物利用率,进而提升丁酸生成效率。该策略适用于儿童及成人人群。
3
益生菌联合干预
部分益生菌(如 Bifidobacterium animalis、Lactobacillus rhamnosus)在配合膳食纤维应用后,能间接提升 Anaerostipes的丰度。这种组合干预有助于改善肠道代谢环境和菌群多样性,常用于功能性便秘患者及儿童群体中。
4
饮食结构调整
研究指出,增加全谷物、蔬菜(大蒜、洋葱等)与水果的摄入,减少精制碳水化合物比例,可有效改善肠道微生态组成,并促进 Anaerostipes 的生长。这一健康饮食结构可长期维持肠道菌群稳定,对中国成年人及一般健康人群均有益。
5
运动干预
规律的有氧运动与抗阻训练被证实能够显著提升老年人肠道中 Anaerostipes 的丰度,同时增加粪便中丁酸盐的浓度。这一发现表明,运动干预不仅对维护机体代谢健康具有积极作用,还能通过改善肠道菌群结构,促进产丁酸菌的增长,从而增强能量代谢效率和抗炎能力。
此外,该研究结果进一步说明,长期坚持科学的运动方式能够在多层面维持肠道生态平衡,降低慢性炎症水平,对老年人整体健康状况的改善与代谢功能的恢复具有重要意义,体现了运动与肠道微生态之间的密切关联。
6
减少高盐饮食
研究发现,高盐饮食可显著降低Anaerostipes 丰度,从而削弱丁酸生成与肠道免疫平衡。降低盐摄入对维持肠道微生态多样性与代谢稳态具有重要意义,动物模型结果为该机制提供了有力证据。
主要参考文献
Bhattacharjee D, Millman LC, Seesengood ML, Seekatz AM. Diversity and prevalence of Anaerostipes in the human gut microbiota. bioRxiv [Preprint]. 2025 May 1:2025.05.01.651700.
Liu D, Xie L-S, Lian S, Li K, Yang Y, Wang W-Z, Hu S, Liu S-J, Liu C, He Z. Anaerostipes hadrus, a butyrate-producing bacterium capable of metabolizing 5-fluorouracil. mSphere. 2024 Apr 23;9(4):e0081623.
Hesser LA, Puente AA, Arnold J, Ionescu E, Mirmira A, Talasani N, Lopez J, Maccio-Maretto L, Mimee M, Nagler CR. A synbiotic of Anaerostipes caccae and lactulose prevents and treats food allergy in mice. Cell Host Microbe. 2024 Jul 10;32(7):1163-1176.e6.
Bui TPN, Mannerås-Holm L, Puschmann R, Wu H, Troise AD, Nijsse B, Boeren S, Bäckhed F, Fiedler D, deVos WM. Conversion of dietary inositol into propionate and acetate by commensal Anaerostipes associates with host health. Nat Commun. 2021 Aug 10;12(1):4798.
Caso JR, MacDowell KS, González-Pinto A, García S, de Diego-Adeliño J, Carceller-Sindreu M, Sarramea F, Caballero-Villarraso J, Gracia-García P, De la Cámara C, Agüera L, Gómez-Lus ML, Alba C, Rodríguez JM, Leza JC. Gut microbiota, innate immune pathways, and inflammatory control mechanisms in patients with major depressive disorder. Transl Psychiatry. 2021 Dec 21;11(1):645.
Endo A, Tanno H, Kadowaki R, Fujii T, Tochio T. Extracellular fructooligosaccharide degradation in Anaerostipes hadrus for co-metabolism with non-fructooligosaccharide utilizers. Biochem Biophys Res Commun. 2022 Jul 12;613:81-86.
Guo C, Li Y, Wang P, Li Y, Qiu C, Li M, Wang D, Zhao R, Li D, Wang Y, Li S, Dai W, Zhang L. Alterations of Gut Microbiota in Cholestatic Infants and Their Correlation With Hepatic Function. Front Microbiol. 2018 Nov 13;9:2682.
Turna J, Grosman Kaplan K, Anglin R, Patterson B, Soreni N, Bercik P, Surette MG, Van Ameringen M. The gut microbiome and inflammation in obsessive-compulsive disorder patients compared to age- and sex-matched controls: a pilot study. Acta Psychiatr Scand. 2020 Oct;142(4):337-347.
Singh V, Lee G, Son H, Koh H, Kim ES, Unno T, Shin JH. Butyrate producers, “The Sentinel of Gut”: Their intestinal significance with and beyond butyrate, and prospective use as microbial therapeutics. Front Microbiol. 2023 Jan 12;13:1103836.
Low A, Sheludchenko M, Cheng HE, Koh XQ, Lee JWJ. Complete genome sequences of butyrate producing Anaerostipes hadrus strains BA1 and GIF7 isolated from the terminal ileum of a healthy lean male. Microbiol Resour Announc. 2023 Oct 19;12(10):e0070123.
Modica V, Glávits R, Clewell A, Endres JR, Hirka G, Vértesi A, Béres E, Szakonyiné IP. A Comprehensive Toxicological Safety Evaluation of Anaerostipes caccae. Int J Toxicol. 2025 Nov-Dec;44(6):471-487.
Morinaga K, Kusada H, Watanabe M, Tamaki H. Complete Genome Sequence of Anaerostipes caccae Strain L1-92T, a Butyrate-Producing Bacterium Isolated from Human Feces. Microbiol Resour Announc. 2021 Apr 22;10(16):e00056-21.