-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
氨基酸(AA)稳态对人体健康至关重要,其紊乱与多种疾病的发生和进展密切相关,如2型糖尿病和炎症性肠病(IBD),并且常常是治疗结果的决定性因素。
肠道微生物群可能通过多种机制调节宿主氨基酸的可用性,例如影响消化酶(如胰蛋白酶)的活性。肠道微生物群定殖还可能改变肠道通透性,从而影响胃肠道中游离氨基酸的运输和吸收。此外,肠道微生物可能直接利用或代谢肠道中的氨基酸,或合成并向宿主提供氨基酸。以往研究表明,肠道微生物组的变化(或其存在)可能影响肠道氨基酸谱。然而,参与调控宿氨基酸稳态的关键菌株及代谢基因仍未完全明确。
今天分享的这一篇发表在《Cell Host & Microbe》期刊上的研究论文”Microbiota metabolism of intestinal amino acids impacts host nutrient homeostasis and physiology”,通过比较Met无菌(GF)小鼠与无特异病原体(SPF)小鼠的分解物谱已证明,肠道细菌定殖会影响胃肠道(GI)中游离氨基酸谱,还通过高效代谢肠道氨基酸来重塑宿主氨基酸的格局。为确定责任微生物/基因,该研究开发了基于代谢组学的检测法,筛查了104个共生菌,并识别出能高效利用氨基酸的候选基因,并发现这些基因调控了肠道和循环氨基酸的可用性。
结果显示,不同氨基酸具有特定的细菌消费者,消耗效率差异明显。例如,天冬酰胺和谷氨酸被拟杆菌和部分梭菌高效利用,而芳香族氨基酸(色氨酸、酪氨酸)及支链氨基酸(BCAAs)仅为部分厚壁菌门成员所代谢,效率较低。值得注意的是,支链氨基酸与色氨酸代谢相关的微生物基因还能通过调节外周血清素间接影响宿主葡萄糖平衡。
总体而言,该研究首次系统揭示了肠道微生物群编码的氨基酸代谢活动对宿主营养稳态的深远影响,为理解微生物介导的氨基酸利用及其对宿主代谢调控机制提供了关键分子依据。
氨基酸稳态对人类健康至关重要,其紊乱与2型糖尿病和炎症性肠病(IBD)等多种疾病的进展密切相关。虽然传统上认为肠道和肝脏是调控营养代谢的主要器官,但最新研究发现,肠道微生物群通过代谢氨基酸能够深刻重塑宿主的氨基酸谱。
★该研究的核心意义在于:
•揭示了肠道微生物群通过代谢肠道氨基酸影响宿主氨基酸稳态的分子机制;
•鉴定了高效消耗氨基酸的特定肠道微生物及其代谢基因;
•阐明了微生物群氨基酸代谢基因如何通过外周血清素调节宿主葡萄糖稳态;
•为通过调节肠道微生物群代谢活性改善人类健康提供了新的靶点和策略。
▸ 肠道微生物群对宿主氨基酸水平的影响
研究首先通过比较无菌(GF)小鼠、无特定病原体(SPF)小鼠以及接受SPF微生物群移植(FMT)的GF小鼠,证实了肠道微生物群定植显著降低了肠道和循环氨基酸水平。
靶向代谢组学分析显示,SPF小鼠或接受SPF微生物群的GF小鼠肠道和循环氨基酸浓度普遍降低,这与之前的研究结果一致,表明微生物对肠道氨基酸的利用可能是影响宿主氨基酸稳态的主要途径之一。
▸ 高效代谢氨基酸的肠道微生物筛选
为识别高效代谢肠道氨基酸的微生物,研究者建立了一种基于活细胞的高通量代谢组学筛选方法,对104种肠道共生菌进行了系统分析。该方法综合考虑多个因素:
•生长阶段差异:绘制各菌株生长曲线并进行参数拟合,确保在可比生长阶段进行筛选;
•时间动态分析:分别在15、30和60分钟测定氨基酸消耗量,以精确评估不同菌株对特定氨基酸的利用速率;
•营养条件优化:在测定缓冲液中除氨基酸外,补充无机氮源、微量矿物质、维生素及额外碳源(如葡萄糖),以避免因营养限制导致的氨基酸非特异性快速消耗。
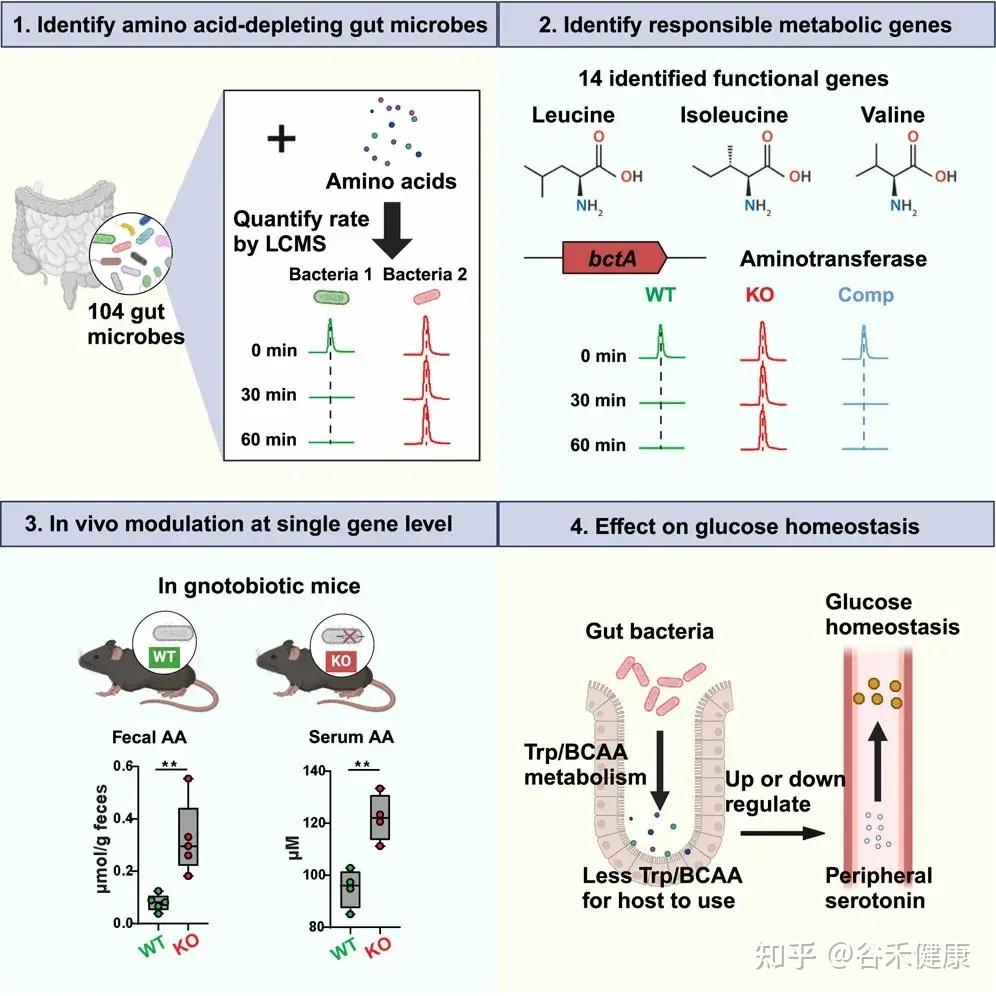
研究流程图展示了从识别消耗氨基酸的肠道微生物、鉴定负责的代谢基因、单基因水平的体内调节到对葡萄糖稳态影响的完整研究路径。
▸ 微生物代谢基因的鉴定与功能验证
研究利用CRISPR-Cas9和ClosTron等基因编辑技术,在系统发育多样的肠道微生物中开展大规模基因缺失分析,以鉴定氨基酸代谢的关键基因。筛选标准包括:
1.代谢基因编码的酶以氨基酸为直接底物;
2.这些基因存在于高效代谢氨基酸的肠道菌株中;
3.携带相关基因的菌株能稳定定植于无菌(GF)小鼠肠道,并降低宿主体内相应氨基酸水平。
通过构建基因敲除和互补菌株并结合代谢组学分析,研究识别出多种氨基酸代谢相关基因,并在单菌定植的GF小鼠模型中验证了其对肠道及血清氨基酸水平的调控作用。
▸ 高效代谢氨基酸的肠道微生物鉴定
通过大规模筛选,研究发现不同肠道微生物对氨基酸的代谢效率和偏好存在显著差异:
鉴定高效利用氨基酸的肠道微生物候选者
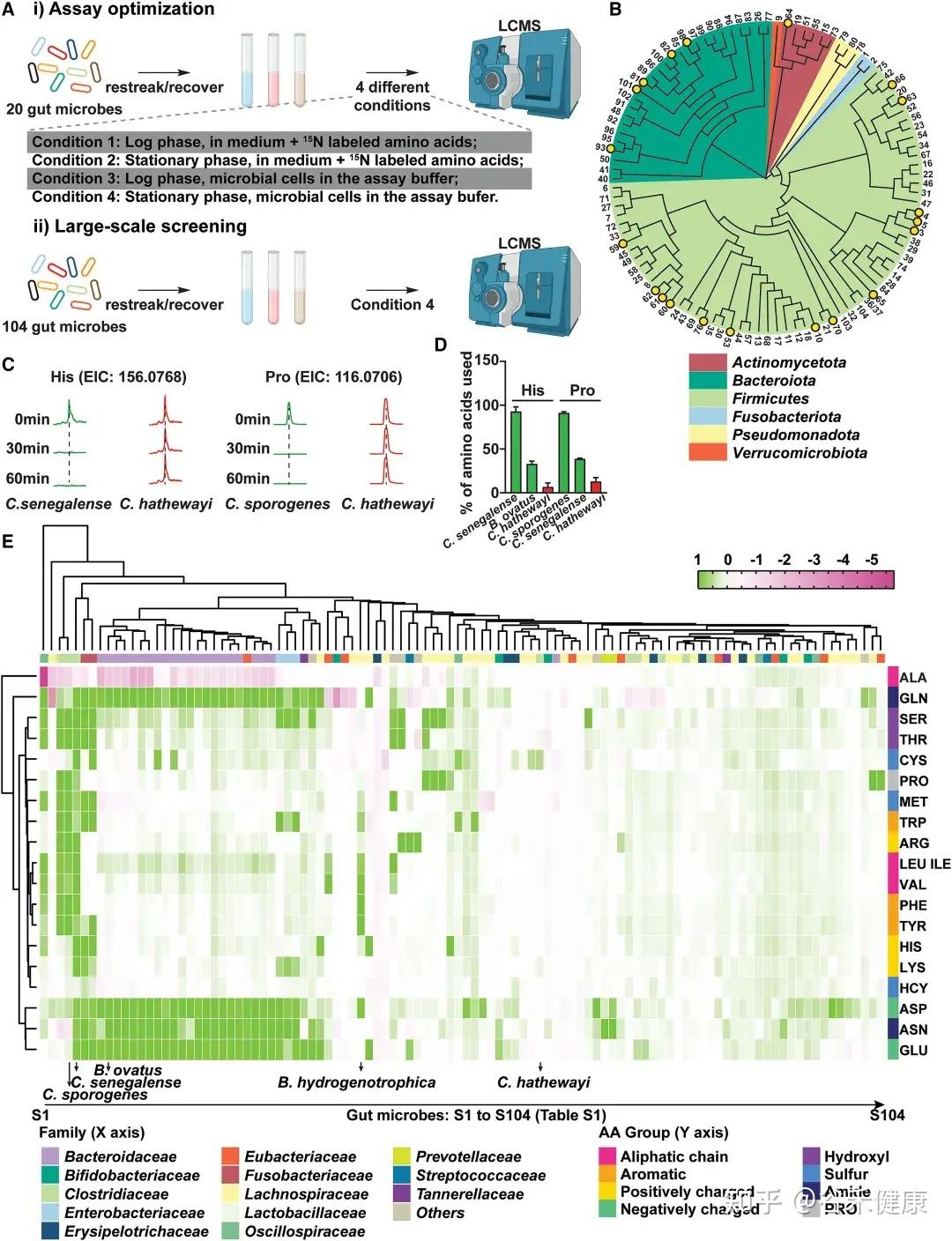
热图展示了104种肠道微生物对不同氨基酸的代谢情况,揭示了微生物系统发育与氨基酸代谢效率之间的复杂关系。
★ 关键发现包括:
•梭菌属微生物:如Clostridium sporogenes ATCC15579和Clostridium senegalense DSM25507,可高效代谢多种氨基酸,包括精氨酸、芳香族氨基酸、支链氨基酸、组氨酸、赖氨酸和脯氨酸等。
•拟杆菌属共生菌:作为肠道多糖的主要利用者,也能有效代谢天冬酰胺(Asn)、天冬氨酸(Asp)和谷氨酰胺(Gln)等氨基酸。
•氨基酸特异性代谢:不同氨基酸具有特定的细菌“消费者”,消耗效率差异明显。天冬酰胺和谷氨酸通常被拟杆菌和部分梭菌快速利用,而芳香族氨基酸(色氨酸、酪氨酸)及BCAA仅被部分厚壁菌门或梭菌较低效地代谢。
▸ 氨基酸代谢相关微生物基因的鉴定
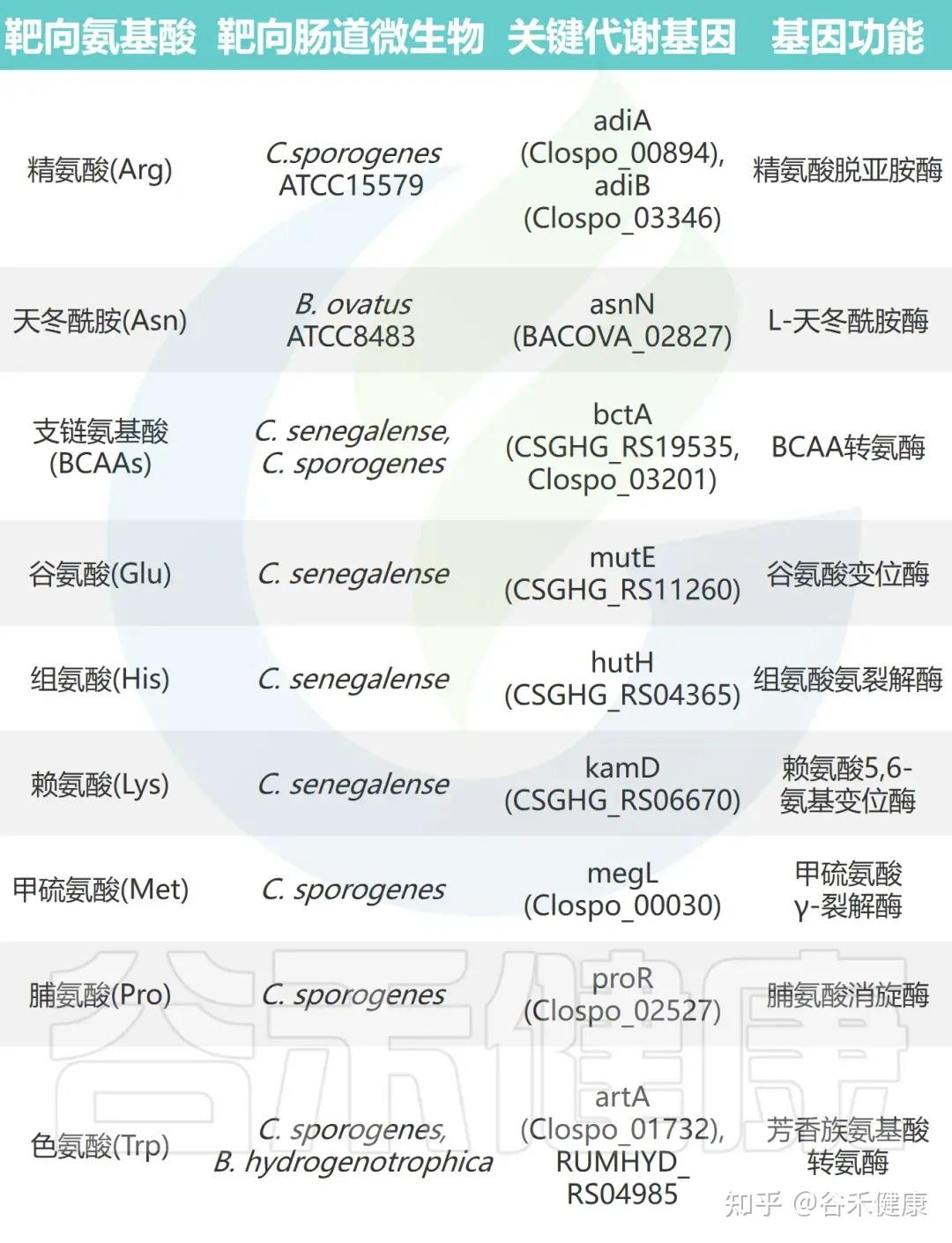
通过对高效代谢氨基酸的肠道微生物进行大规模基因缺失分析,研究鉴定出多种关键氨基酸代谢基因。这些基因编码的酶包括转氨酶、脱羧酶、消旋酶和氨裂解酶等,具有以下特征:
•功能冗余性:单株细菌常含多个具有相似功能的基因。例如,C. sporogenes 携带两种精氨酸脱亚胺酶基因(adiA 和 adiB),单基因敲除影响较小,而双敲除可完全消除其精氨酸代谢能力。
•底物特异性:代谢酶展现高度底物选择性。例如,C. sporogenes 的转氨酶 ArtA 特异作用于色氨酸和酪氨酸,但对苯丙氨酸代谢影响极小。
•催化多样性:不同类型的酶参与多条代谢途径。支链氨基酸和色氨酸经转氨途径代谢,脯氨酸通过还原反应被 C. sporogenes 利用,而谷氨酸、甲硫氨酸、丝氨酸和苏氨酸则由氨裂解酶快速分解。
•功能可转移性:这些酶的催化功能具有可转移性,在其他肠道共生菌中表达其编码基因可赋予相应氨基酸的消耗能力。
▸ 微生物代谢基因调控宿主氨基酸稳态
通过将野生型菌株及其代谢基因缺失突变体分别单菌定植于GF小鼠,研究发现这些基因显著影响宿主肠道及循环系统中的氨基酸水平:
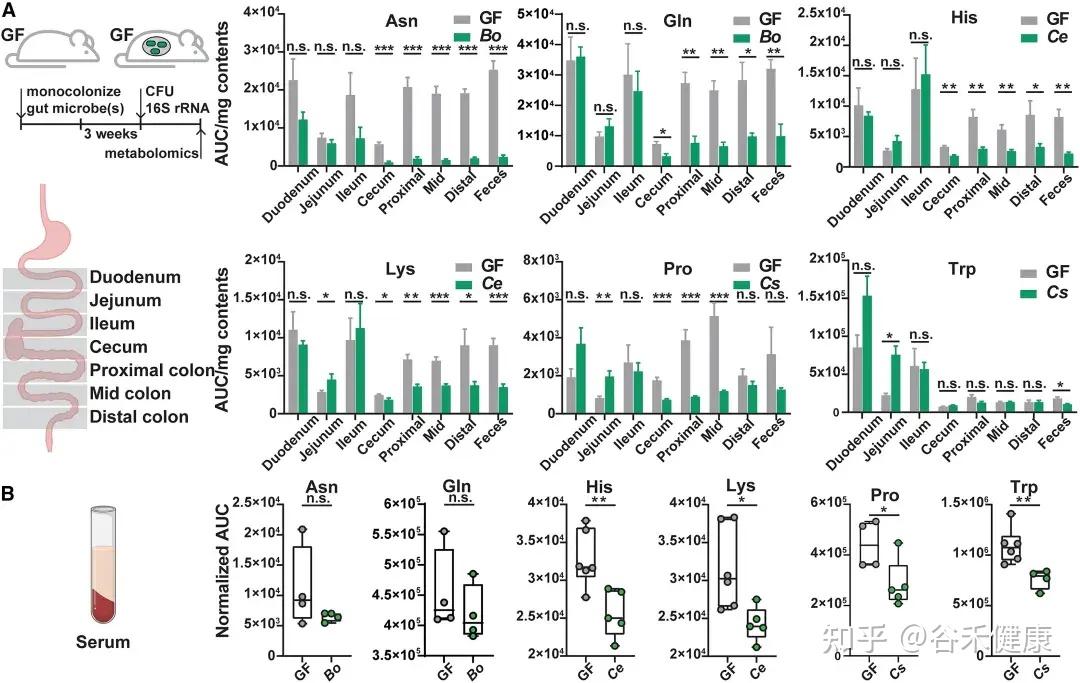
无菌小鼠单一定植B. ovatus、C. senegalense和C.sporogenes野生型菌株后,肠道和血清中特定氨基酸浓度显著降低。
★ 主要发现包括:
•肠道氨基酸稳态调控:多数鉴定出的微生物代谢基因或酶影响肠道氨基酸平衡。由于突变体的相应代谢途径被阻断,肠道内容物和粪便中相关氨基酸显著积累。
•循环氨基酸谱变化:部分代谢基因还影响宿主血清氨基酸水平。定植 Asn、Leu/Ile、Pro 和 His 利用缺陷突变体的无菌小鼠,其血清中对应氨基酸明显升高。
•系统性调节的复杂性:循环氨基酸水平的变化并不总与微生物在肠道中的代谢能力一致。例如,定植 C. sporogenes 精氨酸利用缺陷突变体可显著提高肠道精氨酸水平,但对循环精氨酸影响有限,提示肠上皮或肝脏代谢等额外机制亦参与精氨酸的全身稳态调控。
单基因水平的微生物群氨基酸代谢调控
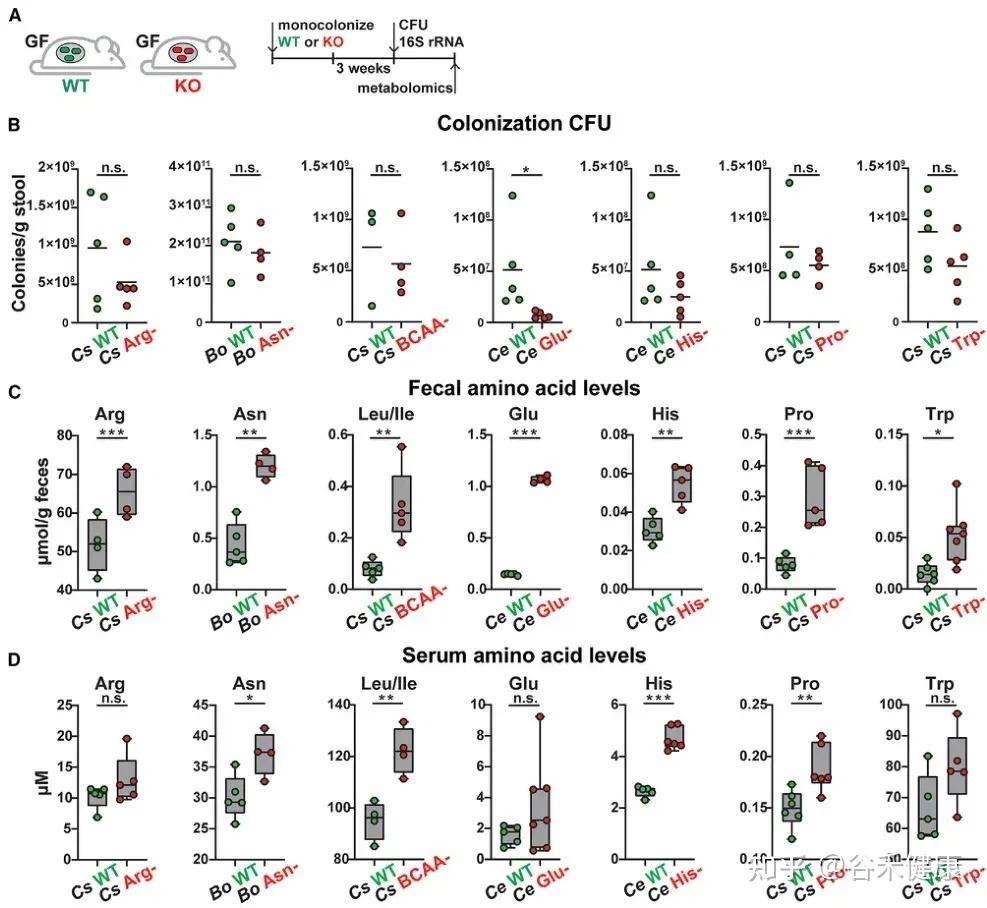
单基因水平的体内调节实验显示,氨基酸代谢基因缺陷突变体定植的无菌小鼠粪便和血清中相应氨基酸水平显著升高。
▸ 微生物氨基酸代谢通过外周血清素调控宿主葡萄糖稳态
研究发现,微生物中支链氨基酸(BCAAs)和色氨酸代谢相关基因可通过外周血清素间接调节宿主葡萄糖稳态。将 C. sporogenes 野生型、BCAA 缺陷型及色氨酸缺陷型突变体分别单菌定植于 GF 小鼠,并进行口服葡萄糖耐量试验(OGTT),结果显示以下关键发现:
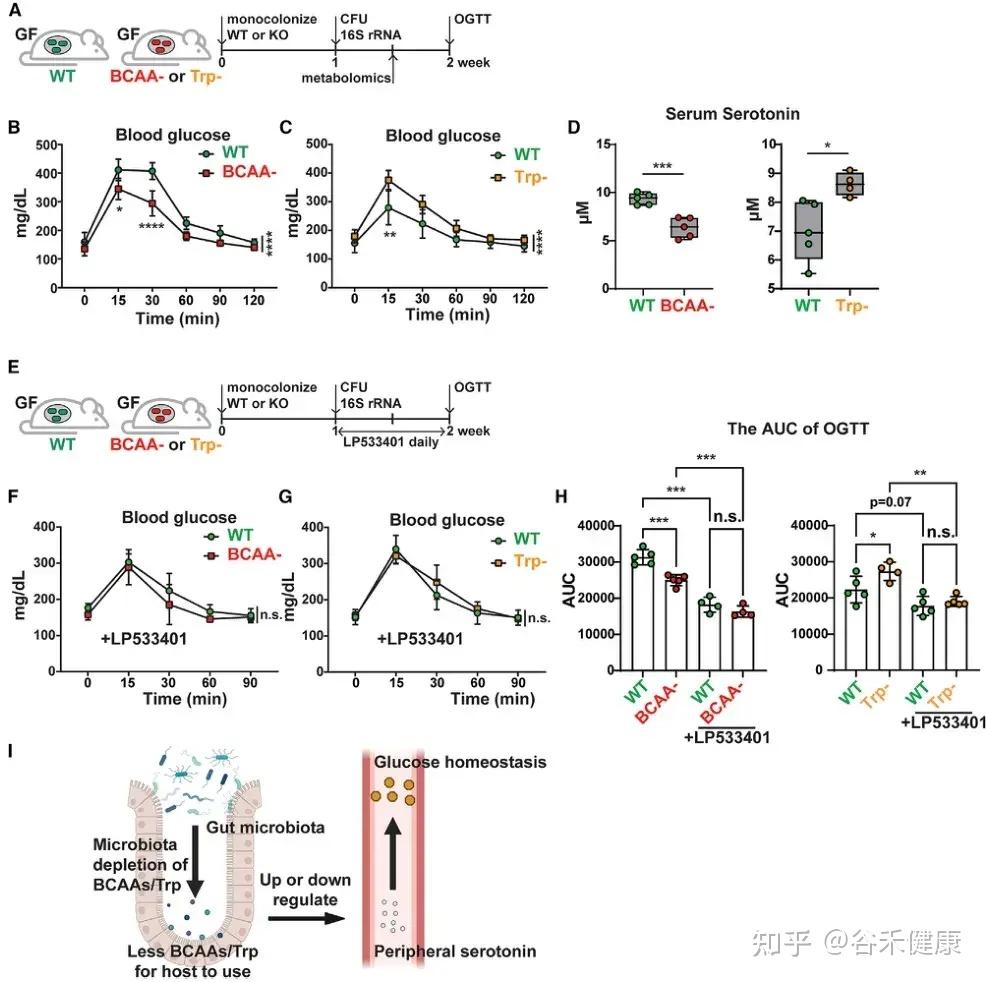
微生物支链氨基酸和色氨酸代谢通过调节外周血清素水平影响宿主葡萄糖稳态的机制示意图及实验验证。
•BCAA代谢与葡萄糖耐受性:定植 BCAA 缺陷突变体的小鼠葡萄糖耐受性显著增强,伴随血清素水平下降。
•色氨酸代谢与葡萄糖耐受性:定植色氨酸代谢缺陷突变体的小鼠表现相反,葡萄糖耐受性下降,血清素水平升高。
•血清素介导机制:应用 Tph1 抑制剂 LP533401 阻断外周血清素合成后,野生型与突变体定植小鼠间的葡萄糖处理差异显著减小,证实微生物氨基酸代谢通过调控外周血清素影响宿主葡萄糖稳态。
这一发现揭示了肠道微生物群、氨基酸代谢、外周血清素及葡萄糖稳态间的复杂关联,为理解代谢性疾病的机制提供了新思路。
!
研究局限性
尽管该研究取得了重要发现,但仍存在一些局限性:
1.微生物氨基酸代谢的多样性:研究主要关注肠道微生物对氨基酸的消耗,而其合成、转运等途径也可能影响宿主氨基酸稳态。体外测定仅反映特定条件下的代谢效率,难以全面代表其在宿主体内的作用。
2.模型简化的局限性:研究采用单菌定植的 GF 小鼠模型,未来应在更接近生理状态的模型(如定植简化微生物群的 GF 小鼠)中验证这些机制。
3.复杂微生物群中基因操作的挑战:虽然本研究成功在宿主定植背景下操纵单一氨基酸代谢途径,但在复杂微生物群中实现精确基因操作仍需进一步技术突破。
4.宿主响应机制研究不足:研究揭示了野生型与突变体共生菌定植小鼠间的生理差异,但尚需深入解析相关宿主细胞类型及信号通路的具体调控机制。
未来的研究在单基因分辨率下揭示了肠道微生物群如何通过代谢肠道氨基酸影响宿主氨基酸稳态。研究鉴定出多种积极代谢肠道氨基酸的细菌,并通过大规模基因缺失分析确定了其关键代谢基因。功能实验显示,这些代谢途径通过直接调控宿主肠道和循环氨基酸的生物利用度,或间接影响外周血清素合成,从而调节宿主的葡萄糖代谢和整体营养稳态。
研究表明,定植微生物群可能以“竞争”模式与宿主共同调控营养平衡,为理解其分子层面的调节机制提供了新视角。更值得关注的是它揭示了一个新的通路:微生物氨基酸利用 → 改变宿主血中氨基酸/代谢产物 → 改变激素/神经递质(如外周 5‑HT)→ 改变葡萄糖代谢等生理功能,所以这些菌在肠道里的存在,更可能是:微调宿主营养和代谢状态,而不是简单的“好/坏”。
参考文献:
Li TT, Chen X, Huo D, Arifuzzaman M, Qiao S, Jin WB, Shi H, Li XV; JRI Live Cell Bank Consortium; Iliev ID, Artis D, Guo CJ. Microbiota metabolism of intestinal amino acids impacts host nutrient homeostasis and physiology. Cell Host Microbe. 2024 May 8;32(5):661-675.e10.