-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
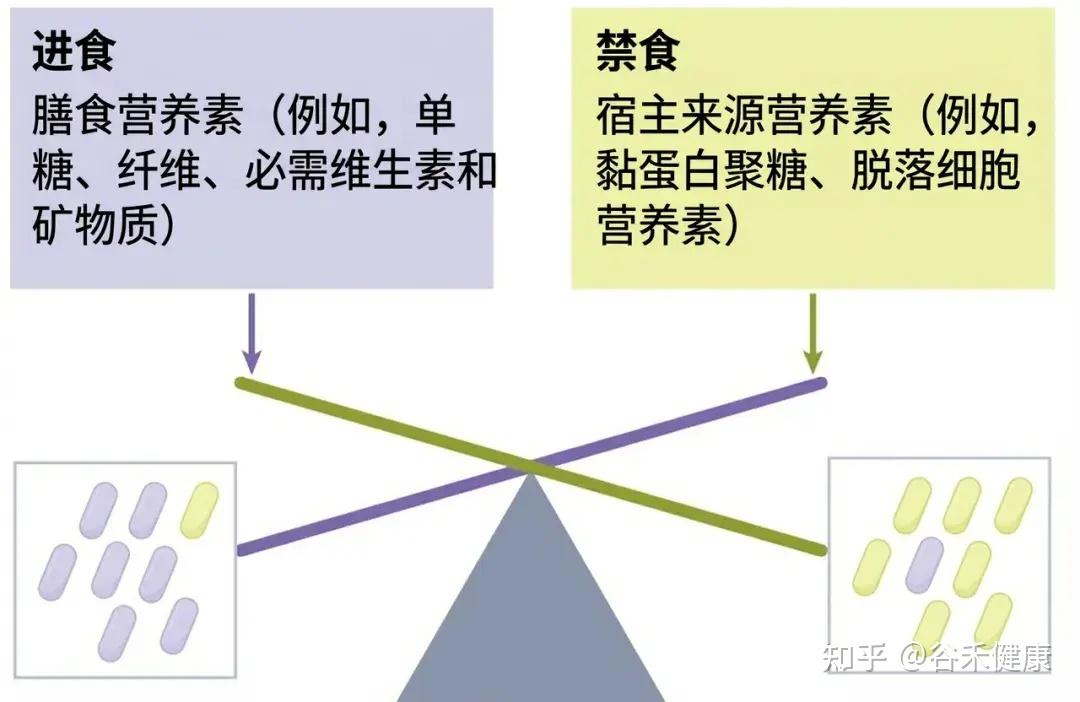
在当代营养流行病学的视野中,我们长期致力于寻找一种最佳饮食模式。无论是地中海饮食、生酮饮食还是植物基饮食,焦点往往集中在吃什么。然而,这种静态的视角忽略了人类饮食行为中最显著的一个特征:时间上的波动性。
举个例子,工作日与周末的割裂,很多人在周一至周五严格控制热量,吃高纤维的健康沙拉;而一旦到了周五晚上或周末,各种吃大餐,高脂、高糖食物轮流上,或者饮食时间变得极不规律。

如果我们将时间跨度拉长,计算其营养摄入的平均值,这些人的数据可能依然显示为健康。这就带来了一个问题:
如果平均营养摄入达标,为什么代谢紊乱和肠道微生态失调的问题依然普遍存在?
近期《Nature》几个子刊的研究,揭示了被长期忽视的真相:
饮食的规律性与营养供给的精准度,可能比单一的追求饮食质量,更能影响肠道微生态的健康。

Singh 等人发表的最新研究(Nat Commun, 2025),通过分析“Food & You”数字队列中近1000名参与者长达两周的高分辨率饮食记录与微生物组数据,饮食质量的时间波动性是破坏肠道菌群多样性的独立风险因素。
Estrela等人的研究(Nat Micro, 2025)深入微观层面,告诉我们肠道菌群挨饿的时候到底会发生什么。
随机休眠-唤醒,可能会让细菌本应用于繁殖的能量储备耗尽,共生菌因无法快速复苏而被淘汰。细菌一旦应激,可能啃食肠壁,使屏障功能变薄;若饥荒持续,则启动终极生存策略——同类相食。这种层层升级的生存博弈,最终将肠道生态系统推向从共生到对抗的危险边缘。
那么,如何才能让肠道菌群真正吃饱吃好,避免生存博弈演变成对宿主的反噬?
膳食纤维与脂肪、蛋白质之间又存在怎样的微妙平衡,才能既满足人体需求又不伤害有益菌?
那些看似不起眼的微量元素,又是如何在这场微观战争中决定菌群的站队?
…
本文将综合这些前沿成果,详细了解菌群喂养的底层逻辑,从关注宏观层面饮食营养的平均达标,转向整合多维度包括时间层面的规律饮食与微观层面的精准喂养。我们将探讨如何通过消除隐性饥饿、维持微量元素平衡以及建立稳定的饮食节律,从而为预防代谢性疾病和构建深层免疫防线提供可落地的精准营养行动指南。
在既往的营养学研究中,我们习惯于通过平均值来评估一个人的饮食质量。例如,如果一个人在一个月内摄入了足够总量的膳食纤维,无论他是每天均匀摄入,还是集中在几天内突击摄入,他在传统的营养评估中得到的得分往往是相似的。
然而,Singh等人的研究通过高分辨率的时间序列分析,彻底打破了这一平均值的说法,揭示了饮食规律性作为独立健康维度的决定性作用。

突破传统的方法论:从回忆问卷到动态观测
该研究依托于“Food & You”数字队列(http://clinicaltrials.gov NCT03848299),这是一个极具前瞻性的研究项目。不同于传统流行病学依赖参与者回忆过去一年饮食习惯的食物频率问卷,这种方法类似一张模糊的静态快照,Singh 等人利用智能手机应用程序辅助的实时追踪技术,记录了近 1000 名参与者在两周内每一餐的详细构成。
这种方法论的革新使得研究者能够计算出一个全新的指标:每日健康饮食指数(Daily HEI)。传统的平均健康饮食指数掩盖了每日的波动,而每日健康饮食指数则像一部动态电影,捕捉了饮食质量在时间轴上的每一次震荡。
研究人员进一步引入了个体内变异系数(Intra-individual Coefficient of Variation, CV),专门用于量化这种震荡的幅度。通过将微生物组测序数据(16S rRNA gene sequencing)与这些高频饮食数据进行关联分析,一个隐藏在平均值背后的规律浮出水面。
每天吃沙拉,健康饮食的人,菌群多样性反而不如饮食普通但规律的人?
数据的统计分析揭示了一个单调且稳健的负相关关系:
饮食质量的变异性越高,肠道微生物群的 α-多样性越低(尤其是 Shannon 指数)。
不同生理和饮食因素与香农多样性之间的相关性
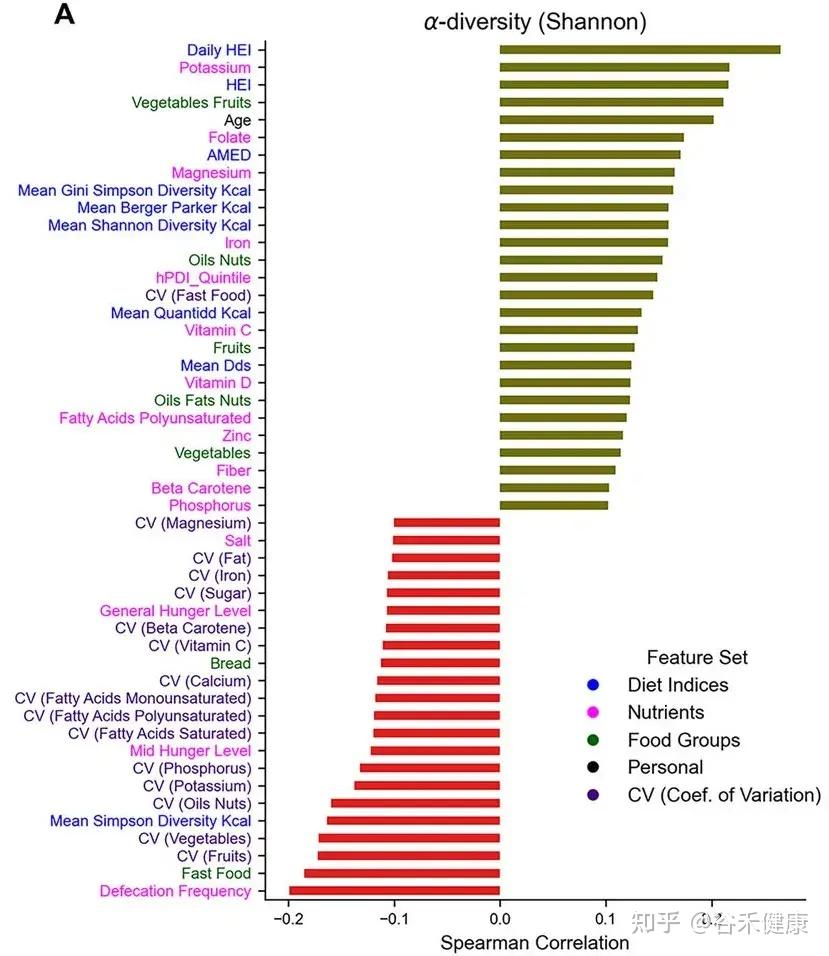
这一发现具有极高的临床意义。Shannon 指数反映了群落中物种的丰富度和均匀度,通常被视为生态系统健康和韧性的标志。
研究数据显示,即使在那些平均饮食质量较高的参与者中,如果他们的饮食习惯呈现出高波动性(例如:周一吃素,周二高脂,周三断食),其微生物多样性依然显著低于那些饮食质量中等但非常规律的个体。
这意味着,肠道微生态系统对于“不确定性”忍耐度有限。 剧烈的饮食波动相当于在肠道内制造了不稳定的生态位,导致只有少数菌能够快速适应环境变化的,能够存活,从而降低了整体生态系统的复杂度和稳定性。
具体菌群的响应
Singh 等人的研究并未止步于宏观的多样性指标,而是深入到了分类学(Taxonomy)层面,明确指出了哪些细菌是饮食规律性的受益者,哪些则是波动的获益者。
规律饮食滋养:毛螺菌科、粪球菌属
数据表明,属于厚壁菌门下的毛螺菌科(Lachnospiraceae),尤其是粪球菌属(Coprococcus),与饮食的规律性呈现最强的正相关。
毛螺菌科,如真杆菌属(Eubacterium)、毛螺菌属(Lachnospira)和丁酸杆菌属(Butyribacter),均是预测高健康饮食指数、蔬菜、水果、坚果及膳食纤维摄入的关键特征菌。
粪球菌属是肠道内重要的产丁酸者。丁酸盐不仅是结肠上皮细胞的主要能量来源,还具有强大的抗炎功能。
研究发现,粪球菌属的丰度对于蔬菜、水果和全谷物摄入的稳定性高度敏感。当这些富含纤维的食物来源在几天内忽高忽低时,粪球菌属的种群数量会迅速崩塌。
这表明这类有益菌需要持续、稳定的底物供应,来维持其在竞争激烈的肠道环境中的生态位。
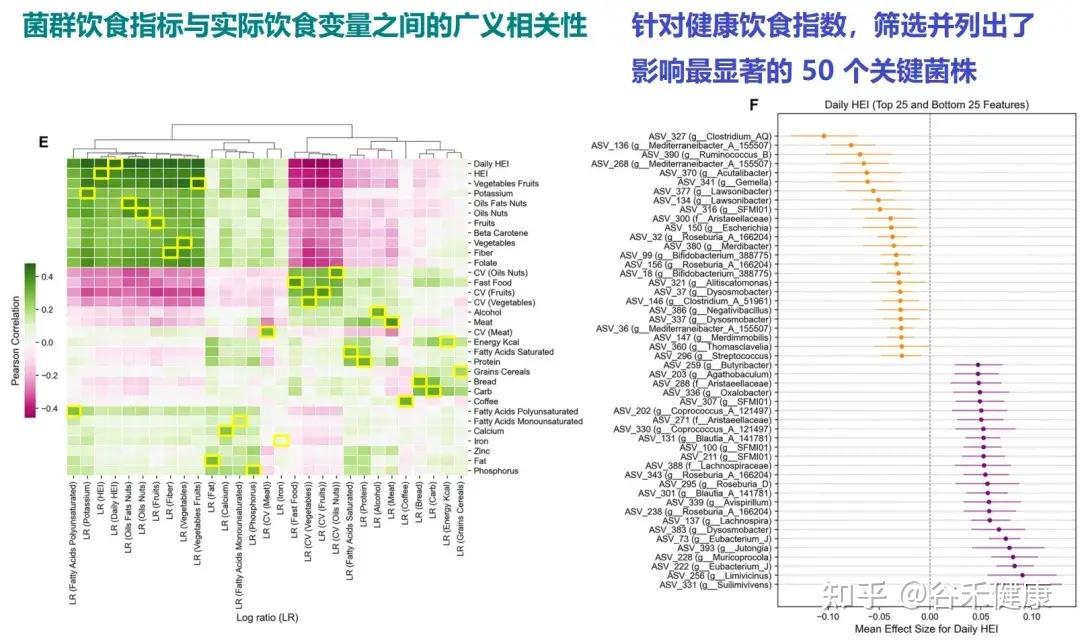
趁乱反噬:活泼瘤胃球菌
与之形成鲜明对比的是,饮食质量的高变异性与活泼瘤胃球菌(Ruminococcus gnavus)的富集显著相关。
研究还发现,Mediterraneibacter、Lawsonibacter、Dysosmobacter等,与肉类摄入、快餐消费以及蔬菜、水果、坚果摄入的不规律性(高 CV)呈正相关,并与腹泻比例增加显著相关。
活泼瘤胃球菌是一种典型的病原共生菌。在健康肠道中,它可能以低丰度存在,但在炎症性肠病、克罗恩病患者体内,常观察到该菌的过度生长。
该菌具有分解含有唾液酸的宿主黏蛋白的能力。当饮食中的外源性营养(如膳食纤维)波动剧烈导致供应中断时,活泼瘤胃球菌能够迅速切换代谢模式,利用宿主的黏液层作为备用能源。
数据暗示,饮食的不规律性实际上是在为活泼瘤胃球菌、Mediterraneibacter、Lawsonibacter这类具有高度适应性的机会主义者创造竞争优势,从而增加了肠道促炎环境的风险。
蔬果摄入波动大,是菌群失衡的关键推手
研究进一步细化了不同食物类别的波动影响。结果显示,蔬菜、水果、坚果摄入量的变异性,即吃得忽多忽少,对微生物组的影响最为显著。相比之下,精制谷物或乳制品的摄入波动对菌群多样性的冲击较小。
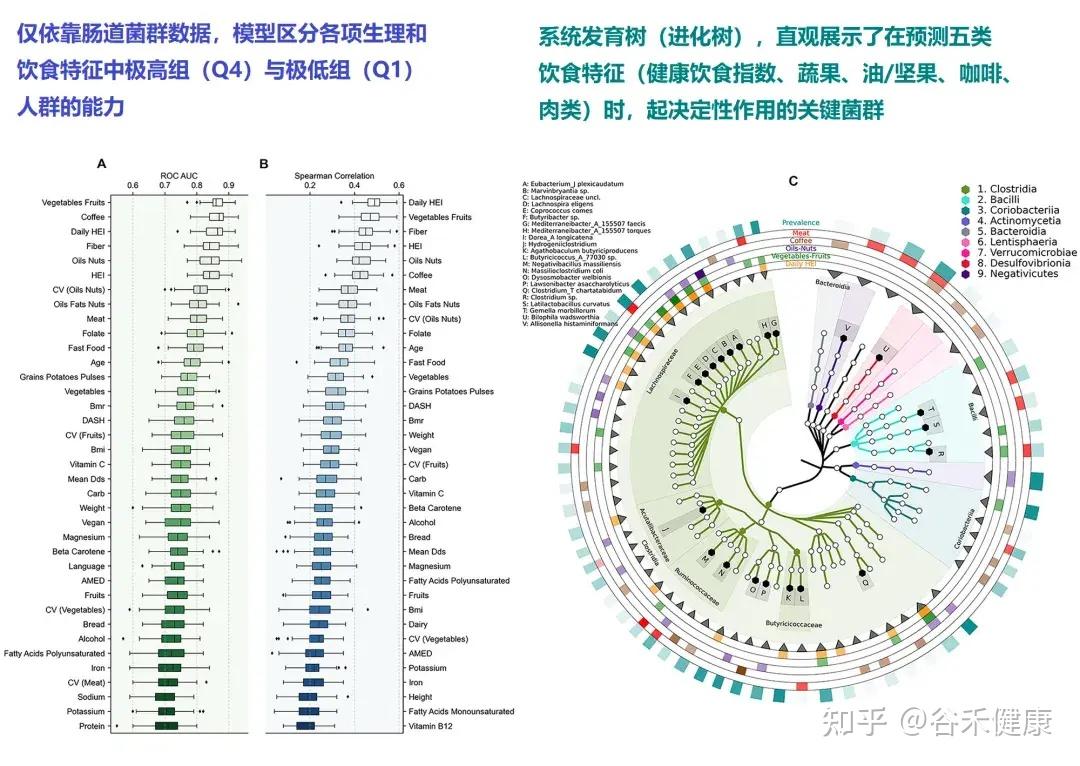
这背后的逻辑在于:蔬菜和水果是膳食纤维的主要来源,对于肠道细菌而言,这些纤维是赖以生存的“口粮”。
如果这些纤维的供应不稳定(高变异性),那些专性依赖纤维发酵的细菌(如前述的毛螺菌科)就会面临周期性的饥饿压力,无法建立稳定的种群;而那些代谢灵活、能吃“杂食”甚至能“吃人”(降解黏液)的细菌则会占据主导地位。
小结:规律性是独立的健康参数
上述研究确立了一个新的营养学范式:规律性本身就是一个独立的、关键的健康参数。
我们不能再单纯地建议人们多吃蔬菜,而应该建议每天稳定地吃蔬菜。因为从微生态的视角来看,三天吃一次大量的沙拉,其生态效益远不如每天吃一小份沙拉。
不规律的饮食习惯,实际上是在肠道内进行着一场持续的、负面的自然选择,逐渐淘汰了那些维护健康的共生菌,而筛选出了潜在的致病菌。
那么,为什么细菌对波动如此敏感?在微观层面上,当营养供应中断的那几个小时或几天里,细菌究竟经历了什么?
下一章节,我们接着来看Estrela等人的一篇文章,有详细的机制解析,深入到细菌的细胞内部,去洞察微观世界的隐形饥荒。
如果说上述研究从宏观层面来告诉我们,饮食波动会导致多样性下降和机会病原菌滋生。但要真正理解这场危机的根源,我们需要深入到细菌的视角,去体验它们在面对“断粮”时的生死抉择。
Estrela等人发表在《Nature Microbiology》的文章为我们揭开了这场微观“饥饿游戏”的规则。

研究表明,细菌并不只是被动地等待死亡,它们演化出了一套极其复杂的策略来应对营养匮乏。对于肠道细菌而言,宿主少吃一顿,或者饮食结构的一次剧烈跳变,就意味着它们必须在毫秒级的时间内启动应急预案。
肠道里的“盛宴与饥荒”循环
尽管现代人往往处于营养过剩的状态,但这并不意味着肠道细菌总能吃饱。相反,细菌生活在一种“盛宴与饥荒”交替的极端环境中。
盛宴期
当宿主进食后,膳食成分进入结肠,营养物质瞬间激增。此时,那些生长速度快、擅长降解复杂膳食多糖的厚壁菌门细菌占据绝对优势。例如,罗氏菌属(Roseburia)、真杆菌属(Eubacterium)和瘤胃球菌属(Ruminococcus),它们在有食物时不仅自身快速增殖,还通过交叉喂养滋养其他菌群。
饥荒期
在宿主睡眠期间、餐间空隙,或者当宿主摄入缺乏纤维的精细饮食时,肠道内的可发酵膳食纤维会迅速耗尽。此时,群落结构发生变化:厚壁菌门的丰度下降,而拟杆菌门、变形菌门以及疣微菌门开始主导局面。
研究人员指出,正是这种不可预测的饥荒期长度,决定了群落的最终结构。不规律的饮食习惯,本质上是在人为地延长或随机化“饥荒期”,迫使细菌长期处于应激状态。
策略一:蛰伏以求生——休眠与生长停滞
面对饥饿,细菌的第一反应往往是节能。
许多细菌会进入一种被称为生长停滞或休眠的状态。它们关闭大部分代谢活动,停止细胞分裂,将原本用于繁殖的能量,转用于维持细胞结构的完整性。
断臂求生:细菌的饥饿应对机制
细菌会通过复杂的分子机制(如 (p)ppGpp 介导的严谨反应)下调核糖体的合成,这是细胞内最耗能的过程,所以立刻叫停这个耗能的事。
对于大肠杆菌和其他变形菌来说,它们会依赖 Sigma因子 RpoS 来重新编程基因表达,将原本用于繁殖的能量转用于维持细胞结构的完整性,甚至不惜降解自身的核糖体,以回收氨基酸和核苷酸作为应急储备。
持久细胞:极度不活跃,却能保生存
文章还提到了一种“两面下注策略”(bet-hedging),即细菌分化出一小部分代谢极度不活跃的持久细胞。它们虽然不生长,但能耐受极端的压力(包括抗生素),确保存活。
内生孢子的形成
某些厚壁菌门的成员,如艰难梭菌或枯草芽孢杆菌,能够形成高度耐受的内生孢子。这就像是把自己锁进一个时间胶囊里,以此度过长达数天甚至数年的饥荒。
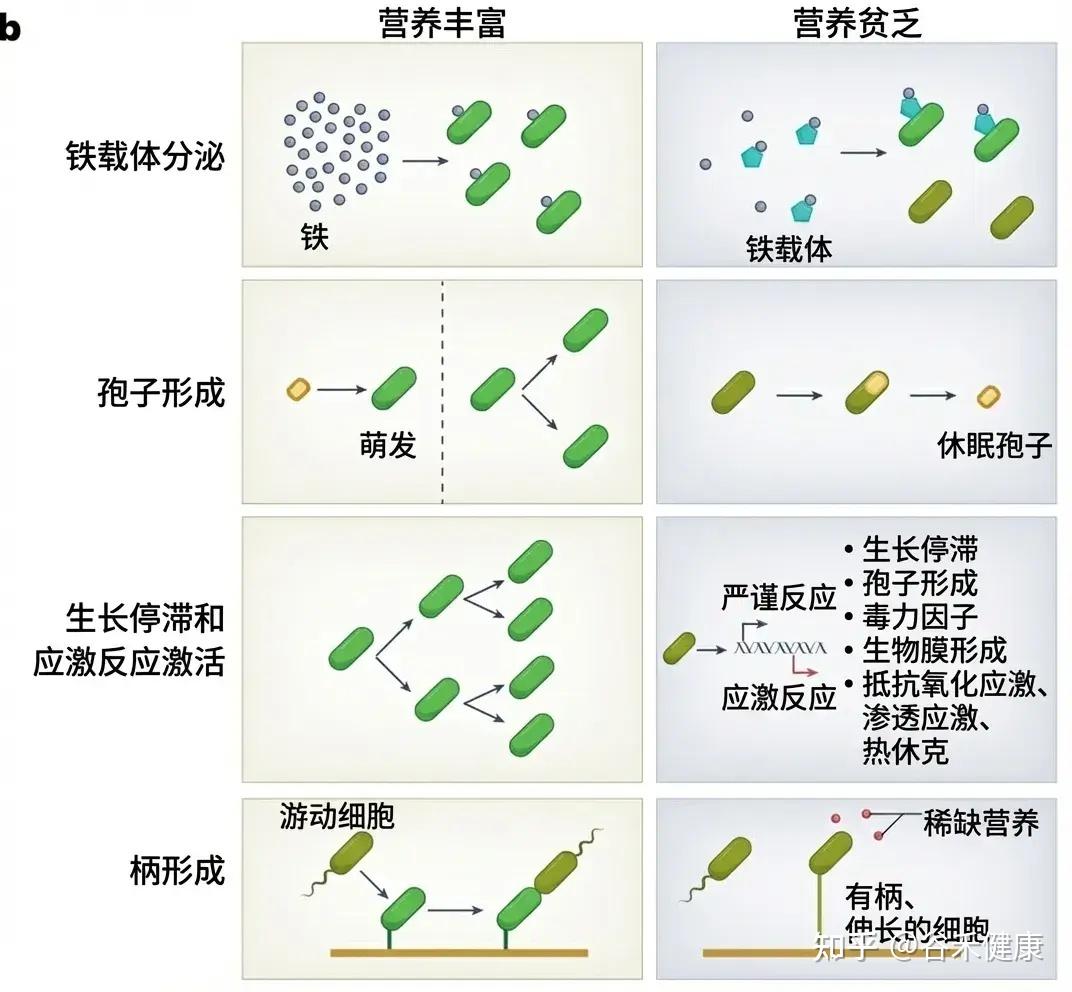
然而,这种策略是有代价的。进入休眠意味着放弃了繁殖的机会。如果饮食波动过于频繁,细菌反复在“唤醒”和“休眠”之间切换,会消耗巨大的能量储备。那些无法快速从休眠中复苏的菌种,就会在下一轮盛宴来临时因为起步太慢而被竞争对手淘汰。这也解释了前面的研究提到的饮食高变异性会导致微生物多样性的丧失——许多脆弱的共生菌因为经不起反复折腾而灭绝了。
策略二:吃宿主——营养毒力与黏液降解
如果说休眠是一种被动的防御,那么另一种策略则显得极具侵略性:当外源性食物(膳食纤维)断供时,去找内源性的替代品——宿主自己。
这就是研究人员强调的“营养毒力”概念。
我们的肠道内壁覆盖着一层厚厚的黏液层,主要由高度糖基化的黏蛋白组成。对于细菌来说,这层黏液不仅是屏障,更是一个巨大的、全天候供应的备用糖库。
黏液降解菌的崛起
正常情况下,像AKK菌(Akkermansia muciniphila)和多形拟杆菌(Bacteroides thetaiotaomicron)这样的细菌,会以受控的方式降解少量陈旧的黏液,这有助于黏液的更新。
但在饥饿状态下,当膳食纤维严重缺乏或供应中断时,多形拟杆菌会通过转录调控,迅速上调分解宿主聚糖的酶系表达。而AKK菌更依赖宿主黏蛋白上的糖链作为能量来源,在别的菌饿得不行的时候还能活得不错,数量甚至上升。
这种代谢切换使它们能够生存下来,但代价是过度啃食保护肠壁的黏液层。
黏液层变薄:病原菌的入侵
更危险的是,这种黏液层的变薄为病原菌打开了缺口。例如,肠出血性大肠杆菌(EHEC)在饥饿状态下会感知这种环境信号,上调其毒力因子的表达,利用这一机会粘附并侵袭肠上皮细胞。
这就是为什么饮食不规律(尤其是纤维摄入的波动)不仅影响菌群结构,更直接威胁肠道屏障功能。你的细菌饿急了,是真的会“吃”你的。
游离糖:病原菌的扩张燃料
此外,拟杆菌在降解黏液时,会释放出岩藻糖、唾液酸等游离糖。在盛宴期,这些糖滋养共生菌;但在饥荒期,它们成了病原菌的“救命粮”。
鼠伤寒沙门氏菌(Salmonella Typhimurium)和艰难梭菌能够利用这些游离的唾液酸和岩藻糖迅速扩增。
策略三:GASP表型——长期饥饿,同类相食
如果饥荒持续的时间足够长(例如极端的节食或长期的饮食紊乱),细菌就不会仅仅满足于生理调节,而是会开启基因层面的进化。
强者通吃:残酷的 GASP 现象
文中提到了一个经典的微生物学现象:
在长期的营养限制下,细菌会发生基因突变,产生“长期静止期生长优势”表型(简称GASP)。
如果将已经饿了10天的大肠杆菌培养物,与仅培养了1天(刚进入静止期)的同种细菌混合,那些饿了10天的老细菌反而会竞争过并取代那些年轻的细菌。
激进策略:弃守为攻与同类相食
老细菌并不是单纯地在等死,而是通过 RpoS 基因突变采取了激进策略。它们主动放弃了原本用于防御(如耐热、耐酸)的盾牌以节省能量,转而全力强化进食能力。这让它们能掠夺环境中仅存的资源,比如说,大肠杆菌被证明能够利用死细胞释放的天冬氨酸、谷氨酸、甘氨酸、丝氨酸、苏氨酸来维持生存,从而在同类相食的竞争中,把那些还在老实防守的同伴彻底淘汰。
生态隐患
虽然这保证了某个物种的延续,但这种突变往往伴随着功能的丧失或毒力的增强。这意味着,经过长期饥饿筛选后的肠道菌群,可能在遗传上已经发生了漂变,肠道菌群变成了一个由一群“生存狂”组成的群落:它们为了活命可能丧失了原有的有益功能,甚至增强了毒力,对宿主不再那么友好。
人类不同的饮食习惯(如长期断食、热量限制、饮食结构改变)对菌群产生的共同影响
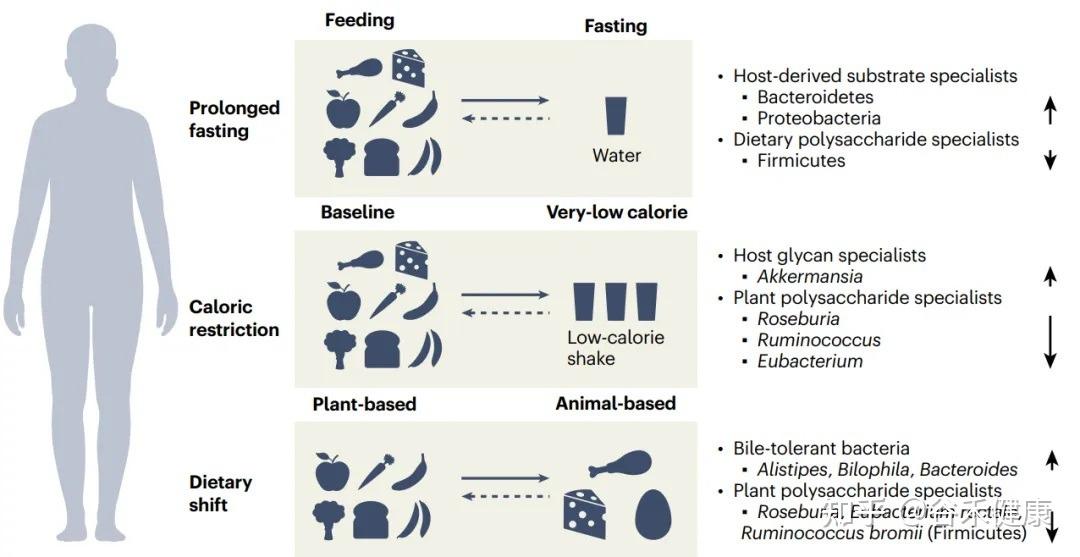
例如,当饮食结构从植物基转向动物基(素食转向肉食)时,会导致耐胆汁细菌的增加,同时那些专门负责分解植物多糖的细菌则会减少。
小结:微观机制的宏观映射
多样性下降是因为许多菌种无法承受反复的“休眠-复苏”能量损耗,或在竞争中落败。
病原菌(如沙门氏菌)的泛滥,是因为它们具备更灵活的代谢切换能力,能在纤维断供时迅速利用宿主黏液糖、琥珀酸等替代营养源。
饮食的规律性,本质上就是为肠道微生物提供一份安全感。消除了对迫近饥荒的恐惧,那些对宿主有益但相对脆弱的专性共生菌才能安心定植,繁衍生息,而不是被迫进入生存模式去啃食宿主的肠壁。
在解决了‘不饿着它们’这一基础问题后,我们需要深入探讨更深层的问题:如何通过特定的饮食成分,将肠道菌群从一个仅仅是活着的群体,引导为一个能为宿主提供健康的共生群落。
一旦细菌脱离了饥饿造成的极端环境,它们的功能重点就会从生存转向代谢。最新的综述研究指出,此时底物的类型(即你吃了什么)将决定菌群的代谢产出。

饮食习惯是肠道微生物群变异的主要决定因素,其影响力远超宿主遗传背景。换句话说,你每天吃进嘴里的食物,才是你肠道微生态的“总设计师”。
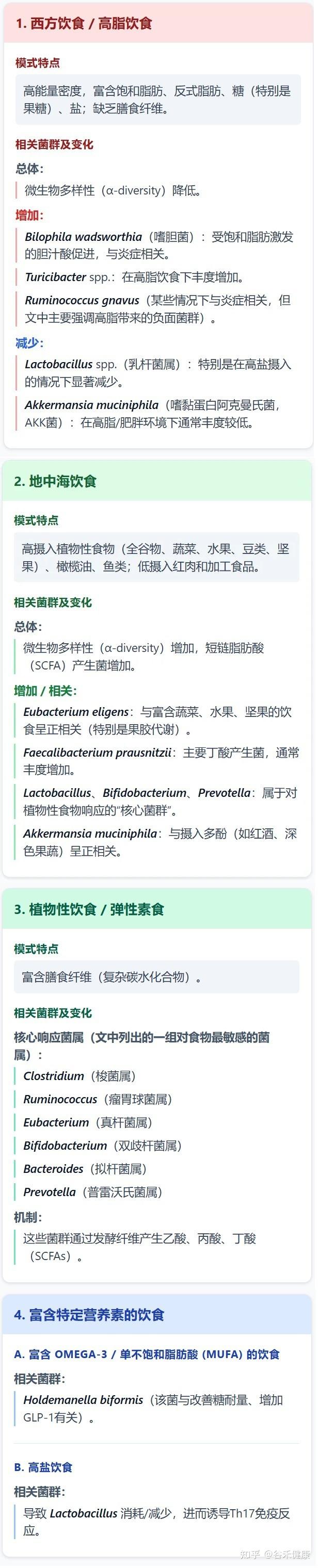
★ 一般性饮食模式
我们先来说一些的日常饮食习惯。
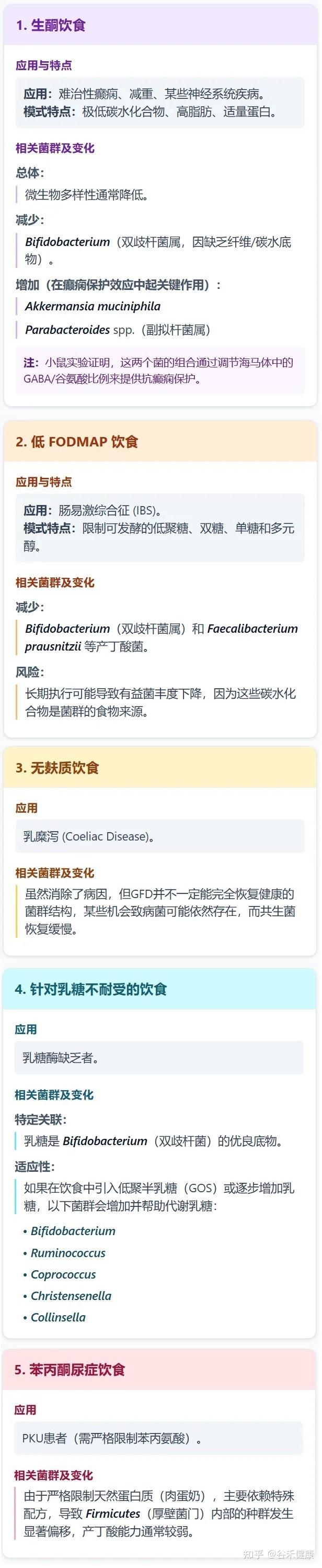
★ 治疗性/医学饮食模式
接下来我们来说一些饮食,通常用于特定疾病的干预。
膳 食 纤 维
在传统的营养学认知中,膳食纤维往往被简化为帮助通便的工具。但在微生物组的视角下,它的定义远不止于此。这是肠道共生菌最主要、甚至是赖以生存的能量来源。
从纤维到短链脂肪酸:点石成金的转化
膳食纤维进入结肠后,并不会像在小肠里那样被简单吸收,未被消化的膳食纤维被细菌发酵后,会产生一系列具有强大生物活性的代谢产物——短链脂肪酸(SCFAs),乙酸、丙酸和丁酸。
膳食纤维代谢产物在维护肠道屏障中的核心作用
-加固屏障,紧密连接
细菌产生的丁酸具有组蛋白去乙酰化酶(HDAC)抑制剂的功能。它能直接作用于肠上皮细胞的基因表达,上调紧密连接蛋白(如 Occludin 和 Claudin)的合成,好比给肠道细胞之间的缝隙抹上了强力胶水,防止细菌内毒素渗入血液。
-筑牢免疫防线(Treg 和 IL-22)
纤维发酵产物能与免疫细胞表面的G蛋白偶联受体(如 GPR43/GPR109A)结合。这种结合会向免疫系统发送和平信号,促进调节性T细胞(Treg)的分化,并刺激IL-22的分泌。IL-22 被称为屏障守护因子,它能加速上皮细胞的修复,并诱导细胞分泌抗菌肽(AMPs),将病原体拒之门外。
-降低环境 pH 值
发酵产生的酸性环境(低 pH)能有效抑制许多对酸敏感的致病菌(如沙门氏菌、大肠杆菌)的生长,这是一种最原始但有效的生态位竞争策略。
吃多少才够?
上一章节我们已经了解到,膳食纤维如果喂不饱菌群,那么菌群就会吃你的粘液层,肠道屏障就会随之薄弱,可能出现肠漏,低度慢性炎症等情况,那么吃多少才够呢?
目前的膳食指南通常建议每日摄入 25-30g 的膳食纤维。然而,Sanz 等人在综述中提出一个观点:这个标准可能仅仅是维持基本功能的底线,而非优化健康的理想值。
研究人员指出,为了达到预防非传染性慢性病(如心血管疾病、代谢综合征)的最佳效果,膳食纤维的摄入量可能需要提高到 35-50g/日。这个数字更接近人类祖先(狩猎采集时期)的摄入水平。
但这里有一个关键的注意事项:
对于肠道已经处于高度敏感或炎症状态(如 IBD 或 IBS 患者)的人群,突然摄入大量粗纤维可能会导致耐受不良。这也引出了精准营养的概念——不同人的菌群对纤维的处理能力是不同的。
因此,策略不是盲目地吃草,而是循序渐进,并注重纤维种类的多样性(可溶性与不可溶性纤维的搭配),以喂养更广泛的共生菌群。

蛋 白 质
在健身房里,蛋白质是增肌的必需品;但在结肠深处,蛋白质的命运却充满了变数。
与膳食纤维的健康益处不同,蛋白质对肠道微生物组的影响是双向的。这取决于两个关键因素:蛋白质的来源,以及你是否同时摄入了足够的碳水化合物。
当有益菌遇到色氨酸:免疫系统的调停者
首先,我们来看看蛋白质天使的一面。
蛋白质由氨基酸组成,比如说,色氨酸(Tryptophan),是连接饮食、微生物和宿主免疫的关键桥梁。
肠道细菌(如乳杆菌属和部分梭菌属)能够将未消化的色氨酸代谢为吲哚(Indole)及其衍生物(如吲哚-3-丙酸 IPA、吲哚-3-乙醛等)。这些吲哚类物质并非废料,而是高级的生化信使,它们可以:
从这个角度看,适量的蛋白质摄入,特别是富含色氨酸的食物,是维持肠道免疫稳态的重要一环。

黑暗面:当发酵转向“腐败”
当膳食纤维摄入不足,或者蛋白质摄入过量导致大量未消化的蛋白质进入结肠(尤其是远端结肠)时,微生物的代谢模式会发生危险的逆转。
在这个过程中,细菌会产生一系列具有细胞毒性的代谢产物:
这种“腐败发酵”主要发生在远端结肠,那里是碳水化合物最先被耗尽的地方,也是结直肠癌的高发部位。这非巧合。
关键在于“碳氮比”:别让细菌只吃肉
那么,我们该如何避免蛋白质的“黑化”?
研究人员认为,碳水化合物(纤维)的存在可以抑制蛋白质的腐败发酵。
这是一种名为分解代谢抑制的生存策略:只要有容易发酵的碳水化合物存在,细菌就会优先利用它们,而此时产生的酸性环境会进一步抑制蛋白水解酶的活性。
因此,问题的核心往往不在于肉吃多了,而在于菜吃少了。
植物蛋白 vs 动物蛋白
相比于红肉(富含血红素铁,可能催化致癌物 N-亚硝基化合物的形成),植物蛋白通常自带膳食纤维。这种自带解药的属性,使得植物蛋白在被细菌分解时,往往伴随着更有益的代谢环境。

肠道菌群与蛋白质代谢14 赞同 · 3 评论 文章

动物蛋白与植物蛋白对肠道微生态的不同“改造”与健康风险”6 赞同 · 2 评论 文章
脂 肪
与纤维(作为食物)不同,脂肪更多是通过改变肠道环境(特别是胆汁酸代谢)来间接筛选微生物。
长期以来,我们对脂肪的恐惧主要集中在变胖和心血管堵塞。但在微观视角下,高脂饮食对健康的打击是从肠道屏障的崩塌开始的。
这其中牵涉到两个核心机制:
胆汁酸的改变 与 内毒素的易位。
高脂饮食的代价:当助消化的胆汁变成致癌毒素
当你吃下一块肥美的五花肉,肝脏会立刻分泌胆汁酸(Bile Acids)来乳化这些油脂,帮助消化吸收。这本是正常的生理过程。
然而,问题在于量。
长期摄入高脂肪饮食,会迫使肝脏源源不断地向肠道泵入大量的初级胆汁酸。当这些胆汁酸流经小肠未被完全回收,进入结肠后,它们就落入了微生物的手中。

肠道细菌(如梭菌属)通过7α-脱羟基作用会将初级胆汁酸进行二次加工,转化为次级胆汁酸,如脱氧胆酸(DCA)和石胆酸(LCA)。
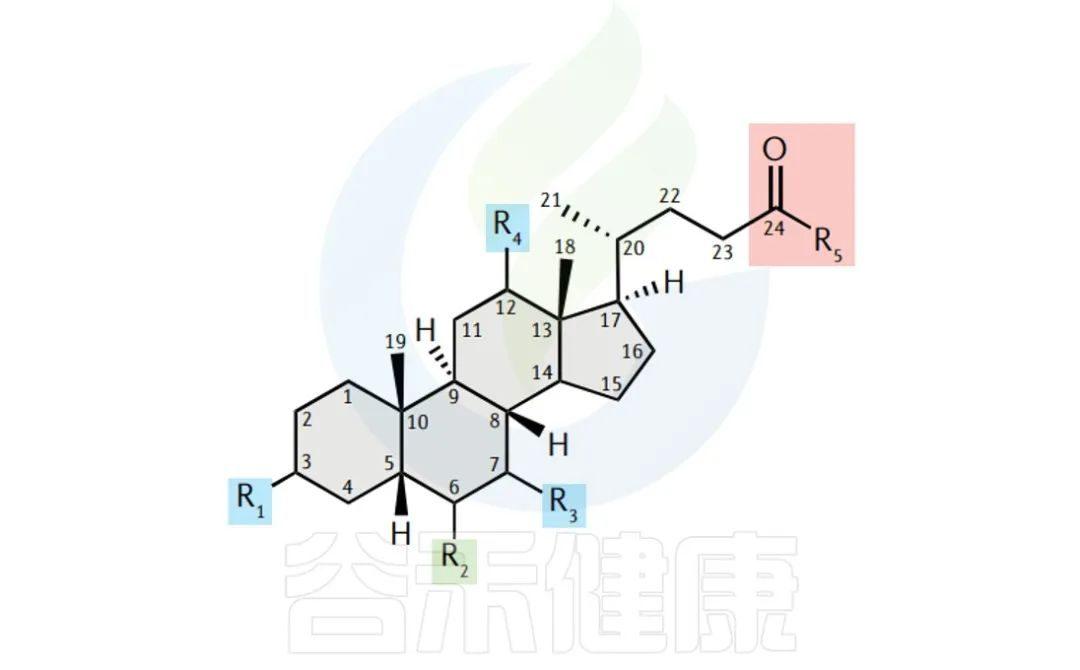
什么是胆汁酸,其与肠道微生物互作如何影响人体健康18 赞同 · 0 评论 文章
次级胆汁酸的蓄积,是一个危险的信号:
当然,次级胆汁酸也有另一面——某些特定的衍生物(如 isoalloLCA)能特异性地抑制艰难梭菌等病原体。
但在典型的高脂“西方饮食”模式下,负面效应往往占据了主导地位。
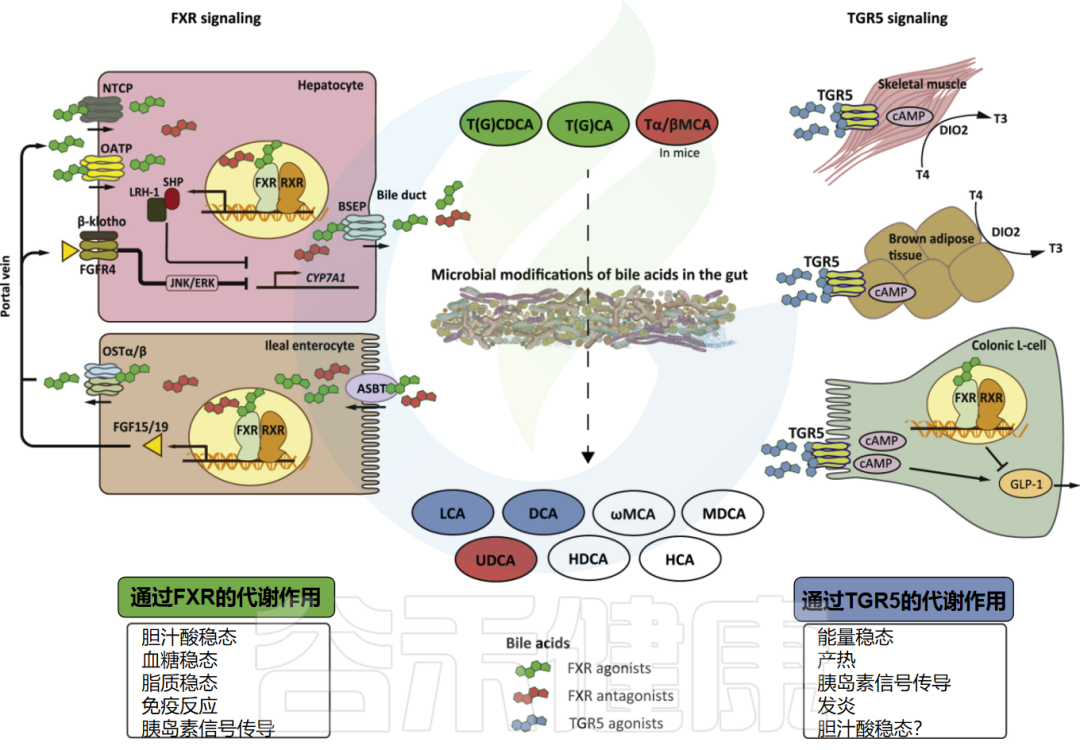
肠道微生物群对胆汁酸代谢和信号传导影响的最新研究成果20 赞同 · 1 评论 文章
脂肪的类型(质量)远比数量重要
研究对比了饱和脂肪酸(如猪油、棕榈油)与多不饱和脂肪酸(PUFAs,如鱼油、亚麻籽油):
-饱和脂肪:代谢性内毒素血症
摄入过多的饱和脂肪,不仅会降低微生物的多样性,更关键的是它充当了细菌毒素的载体。
革兰氏阴性菌的细胞壁成分——脂多糖(LPS,即内毒素),极易溶解在脂肪微粒(乳糜微粒)中。当饱和脂肪穿过肠壁进入血液时,它会顺手把 LPS 也带进去。
这就是著名的代谢性内毒素血症。血液中微量的 LPS 升高,会触发全身性的低度慢性炎症,诱导胰岛素抵抗,成为肥胖和糖尿病的隐形推手。
-Omega-3
相反,富含 Omega-3 的多不饱和脂肪酸,被证明能够增加产丁酸菌丰度,逆转由饱和脂肪引起的菌群失调,并有助于维护肠道屏障的完整性。
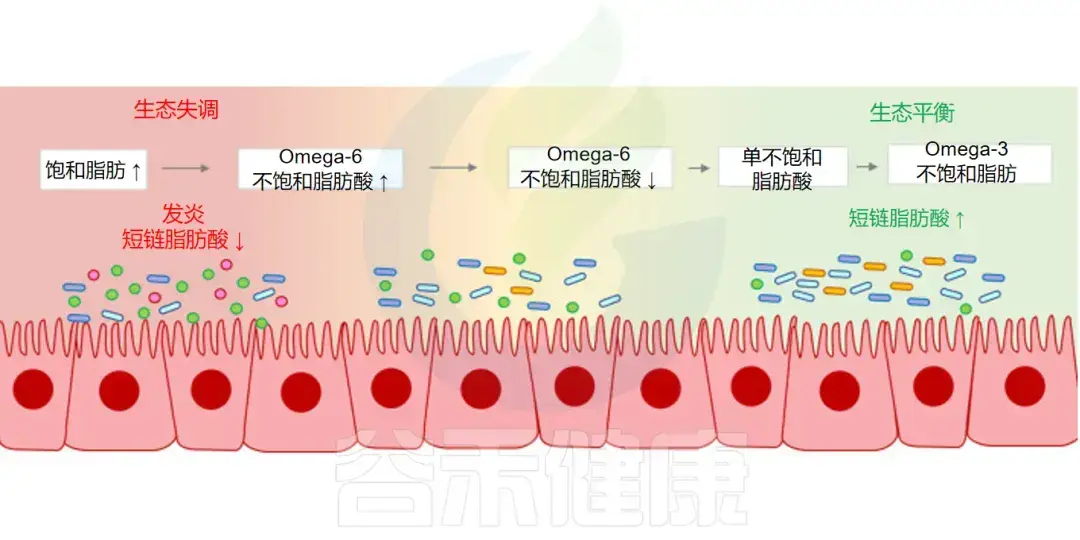
探索Omega-3脂肪酸:健康益处与营养补充12 赞同 · 0 评论 文章
维 生 素
我们常以为维生素只是为了身体好,其实肠道里的细菌也是维生素大户。
许多有益菌(如双歧杆菌)虽然能为我们合成维生素K和部分B族维生素,但它们自身往往无法从头合成生长所需的全部维生素(尤其是B族),必须依赖我们的饮食摄入或原本的交叉喂养网络。
B2(核黄素)
当饮食中缺乏维生素B2(核黄素)时,肠道中产丁酸菌(如普拉梭菌)就会因缺乏口粮而减少,而这可能间接给大肠杆菌等潜在有害菌腾出生存空间。
B9(叶酸)与 B12(钴胺素)
乳杆菌和双歧杆菌通常缺乏从头合成叶酸和钴胺素的完整酶系,属于维生素营养缺陷型微生物。必须依赖宿主摄入。如果叶酸摄入不足,这些益生菌的生长就会受限,进而削弱其对肠道微生态的调节功能。
B3(烟酸)
烟酸不仅是细胞能量代谢(NAD+合成)的关键前体,还是结肠上皮及免疫细胞表面 GPR109A 受体的特异性配体。烟酸通过激活该受体发挥抗炎作用,抑制促炎因子的释放。
缺乏烟酸会导致肠道免疫耐受性降低,增加结肠炎易感性,并伴随微生物群落Alpha 多样性的显著下降及微生态结构的崩塌。严重缺乏会导致糙皮病。
B7(生物素)
生物素是细菌羧化酶不可或缺的辅助因子,在菌群的种间竞争中起着关键作用。研究显示,在生物素缺乏的环境下,某些机会性致病菌(如鼠乳杆菌Lactobacillus murinus)会利用代谢优势发生异常增殖,导致严重的菌群失调;而恢复生物素水平则能有效遏制这种过度扩张,通过生态位竞争维持肠道微生态的稳态。

B族维生素与肠道菌群互作52 赞同 · 1 评论 文章
维生素A
维生素 A 的代谢产物(视黄酸)是调节肠道黏膜免疫的关键信号。它能直接促进 B 细胞分化,上调分泌型免疫球蛋白 A (sIgA) 的合成与分泌。sIgA 能够特异性地包裹细菌,在阻止致病菌黏附上皮组织的同时,协助乳杆菌(Lactobacillus) 等共生菌在黏膜表面的稳定定植,防止菌群易位。
维生素D
维生素 D 通过激活肠上皮细胞中的维生素 D 受体 (VDR),上调紧密连接蛋白(如 Occludin 和 Zonulin)的表达,从而维持肠道屏障的物理完整性。
此外,维生素D还能发起主动进攻,它能诱导宿主分泌防御素和组织蛋白酶等抗菌肽。这种选择性压力有助于重塑菌群结构,研究显示其可显著促进Akkermansia muciniphila的生长,并抑制变形菌门等潜在致病菌。
维生素 C & E:调节氧化还原电位
肠道核心菌群(如厚壁菌门和拟杆菌门)多为专性厌氧菌,对氧气极为敏感。维生素 C 和 E 具有显著的抗氧化作用,能够清除肠腔内的活性氧 (ROS),维持肠道较低的氧化还原电位。这种厌氧环境有利于核心有益菌的代谢与生存,同时限制肠杆菌科(多为兼性厌氧菌)等机会性致病菌的过度增殖。
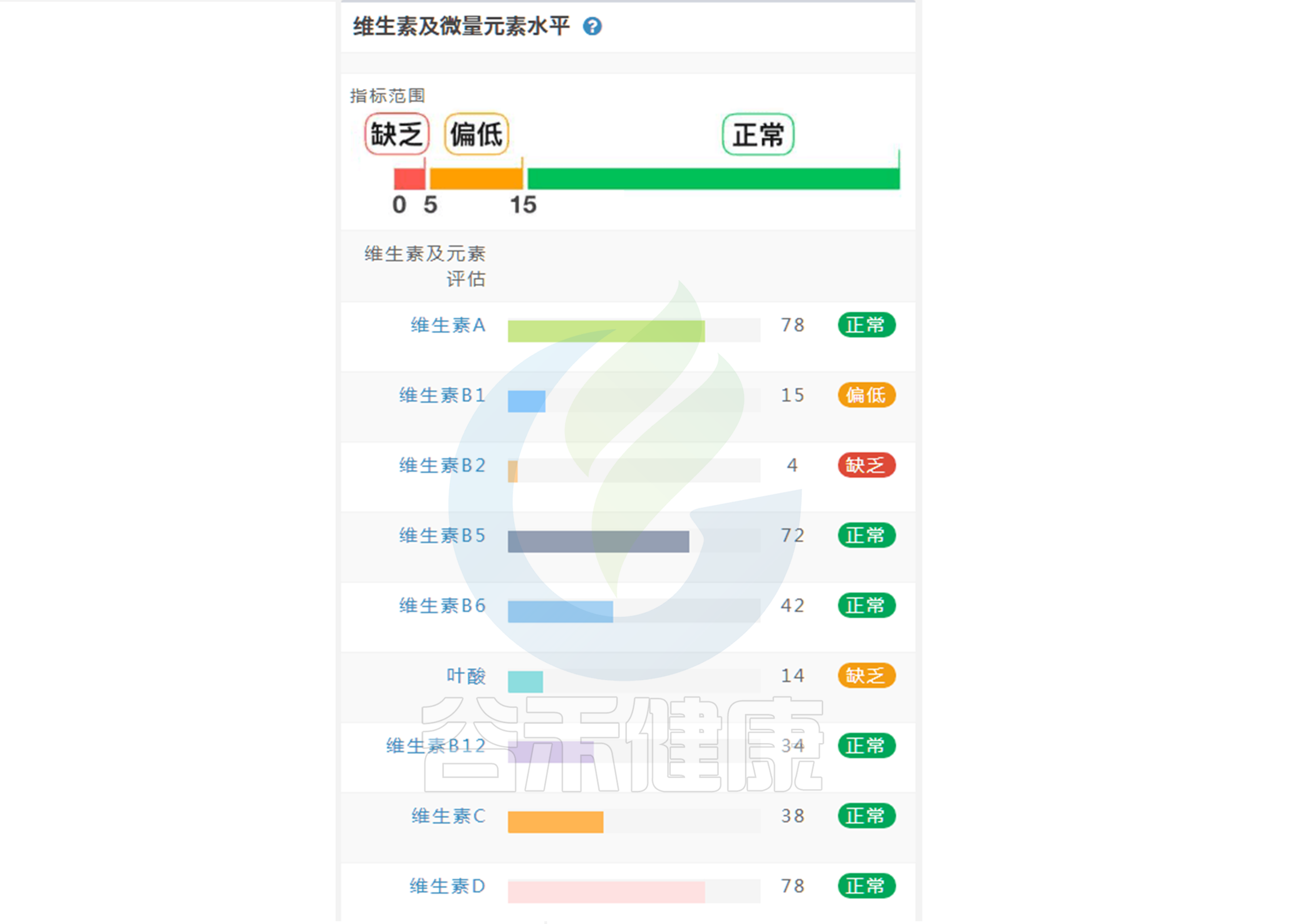
维生素摄入水平肠道菌群可以告诉你14 赞同 · 0 评论 文章
下表列出了常见的维生素的食物来源,可供参考。

矿 物 质
铁
铁是细菌界的稀缺资源。正常情况下,人体会限制肠道内的游离铁(营养免疫),防止细菌疯长。
但问题在于,沙门氏菌和致病性大肠杆菌等肠杆菌科细菌,进化出了极强的“抢铁工具”——铁载体(Siderophores)。相比之下,乳杆菌等有益菌抢夺铁的能力很弱。
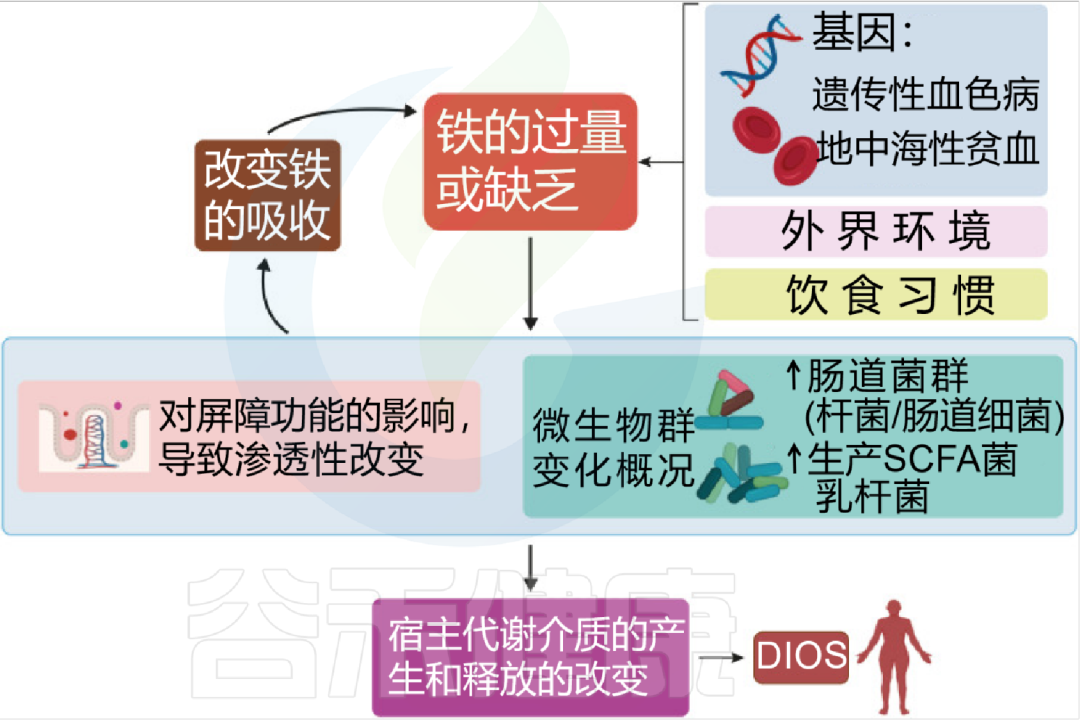
人与菌对铁的竞争吸收 | 塑造并控制肠道潜在病原菌的生长15 赞同 · 0 评论 文章
因此,一旦结肠中出现未被吸收的游离铁(比如吃太多红肉或过量补铁),这些铁就会优先被致病菌抢走,助长它们爆发性繁殖,从而压制有益菌并引发炎症。

锌
锌不仅能加固肠道屏障,更是维持菌群结构稳定的关键。
研究发现,缺锌会直接导致肠道中的主力军——厚壁菌门的数量大幅下降。这种多样性的丧失,意味着肠道的定植抵抗力被削弱了。

膳食锌缺乏或过量对人体肠道菌群及健康的影响11 赞同 · 1 评论 文章
这就好比城墙上的守卫变少了,原本被压制的艰难梭菌就会趁虚而入,利用空出来的生态位大量繁殖并分泌毒素,引发生严重的肠道感染。

这种微观层面的营养不良,往往是导致菌群失调和系统性炎症的隐蔽开端,也进一步凸显了通过高质量饮食纠正营养短板的紧迫性。
前面关注了“吃什么”,“吃多少”,接下来我们来看第三个维度:进食时机。
人体内存在两套主要的生物钟系统:
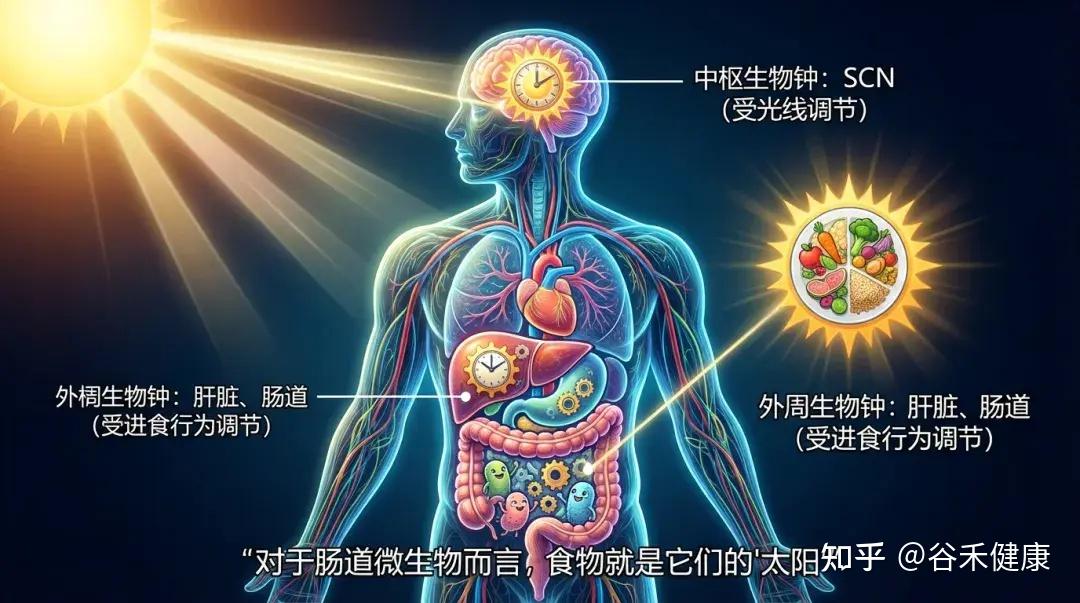
微生物也会“倒时差”
你可能不知道,肠道菌群也是分早班和晚班的。肠道微生物的组成和功能会呈现出显著的昼夜震荡。
这种节律性波动是如此重要,以至于产生的代谢物(如我们前面提到的短链脂肪酸、胆汁酸衍生物)在一天中的浓度也是波动的。这种波动指导着宿主的肝脏何时储存脂肪、何时释放葡萄糖。
现代生活方式:“光”与“食”错位
当我们在深夜(大脑认为是休息时间)吃一顿宵夜(肠道接收到工作信号)时,中枢生物钟和外周生物钟就发生了脱钩。
这种时钟错位会导致肠道微生物节律的丧失。原本应该在休息期清理毒素的细菌被迫加班处理食物,不仅效率低下,还会引发代谢混乱。这被认为是倒班工作者更容易患肥胖、糖尿病和肠道炎症的核心机制之一。
限时进食(TRE):重启肠道节律
限时进食(Time-Restricted Eating, TRE)——即把每天的进食窗口限制在 8-10 小时内,其余时间禁食。
这不仅仅是减少热量摄入的手段,更是一种微生物重塑策略。
–恢复昼夜节律
TRE 能够强力恢复微生物群落的昼夜节律震荡。让不同的细菌在正确的时间做正确的事,重建宿主代谢通路与微生物活动的同步性。
-特定功能菌群的富集
延长的禁食窗口为特定共生菌提供了生态位优势。
研究显示,禁食期间,以AKK菌(Akkermansia muciniphila)为代表的黏液降解菌丰度显著增加。这类菌群利用内源性黏蛋白进行增殖,反向刺激杯状细胞分泌黏液,从而强化肠道屏障功能,减少内毒素血症风险。
-代谢保护
动物模型和人类研究,表明 TRE 可以预防由高脂饮食引起的肥胖和代谢综合征。哪怕摄入的总热量没有改变,仅仅是改变进食的时间窗口,就能显著改善血糖稳态。
对于现代人来说,最糟糕的饮食习惯可能是进食时间的不规律。今天不吃早饭,明天半夜撸串,这种行为让肠道微生物始终处于“倒时差”的应激状态中。

因此,为了维护肠道健康,除了多吃膳食纤维、少吃加工食品外,我们还需要给微生物一个明确的作息表:在白天的活跃期进食,在夜晚的休息期禁食。这不仅是对身体的尊重,也是对居住在你体内的万亿微生物生命的尊重。
小结:从填饱肚子到精准滋养微生态
热量达标不代表菌群吃饱。必须保证膳食纤维的充足供应。这是防止菌群因底物匮乏而倒戈吞噬肠道黏膜的第一道防线。
蛋白质与脂肪对菌群的影响,可能取决于纤维的在场。控制饱和脂肪摄入,选择优质脂肪,能减少次级胆汁酸对有益菌的杀伤,避免内毒素血症。
均衡的微量营养素摄入,比如维生素和矿物质,能精准强化共生菌的竞争优势,助其在生态位争夺战中抢占先机,从而有效压制机会致病菌的野蛮生长。
当我们站在微生物生态学的前沿回望,传统的“金字塔式”饮食建议显得过于粗糙且缺乏维度。Singh等人的数据警示了“饮食大波动有风险”,Estrela等人的机制揭示了“细菌怕长期挨饿”,而Sanz等人的综述则描绘了通过饮食调节菌群的多维度健康蓝图。
这就要求我们必须升级我们的营养系统,从单纯关注成分转向关注生态稳定性与精准化。
新时代的营养观
对于普通大众而言,建立一个基线饮食节奏至关重要。
建立核心菜单
不要让每一顿饭都成为随机事件。尝试确立每天固定的核心食物,例如早餐固定的全谷物燕麦,或晚餐固定的深色蔬菜。这能确保护肠道内的核心共生菌每天都能获得稳定的底物供应,避免其因“断粮”而进入休眠或衰退。
平滑过渡
当你试图改变饮食习惯(比如从高碳水转向低碳水,或者开始吃地中海饮食)时,切忌急刹车或急转弯。根据 Estrela等人的理论,剧烈变换的底物会诱发细菌的饥饿应激和黏液降解。更合适的做法是循序渐进,给微生物群落留出数周的适应期,让代谢网络慢慢重塑。
精准营养 2.0:整合微生物组
每个人的肠道菌群构成都是独一无二的,这意味着同样的食物在不同人体内会引发截然不同的微生物反应(例如,不同人吃同样的香蕉,血糖反应可能截然不同)。未来的营养干预将不再是千篇一律的指南,而是根据人群的代谢表型或微生物特征,提供分层建议。
肠道菌群监测
比如说核心菌群,如厚壁菌门/拟杆菌门比值、产丁酸菌比例等指标,建立个人化菌群基线。
长期的饮食习惯会在菌群上留下印记。例如,长期缺乏膳食纤维的人,其肠道内负责降解植物多糖的酶系可能已经退化。此时若盲目大量补充纤维,不仅无法被利用,反而可能导致腹胀不适。这时肠道菌群数据能提示我们,可能需要采用缓慢饮食过渡方案,给菌群以适应和重建的时间。
靶向性补充
针对特定的功能缺失进行干预。例如,如果发现黏液降解菌(如 Akkermansia)异常升高,这往往是肠道缺乏膳食纤维、菌群正在吃内源性黏液的信号。可能不仅要补充益生菌,更需精准增加抗性淀粉、菊粉等摄入,以提供替代碳源,保护肠道屏障。
拥抱时间营养学
我们不仅要问吃什么,还要问什么时候吃。微生物组具有自身的昼夜节律,这种节律受宿主进食时间的强烈驯化。
保持规律的进食时间,避免深夜进食
这能让微生物群的代谢活动与宿主的生理时钟同步,优化代谢产物的分泌时机,使其在宿主最需要的时候(如日间活动时)发挥作用。
避免长期的随机断食
间歇性断食在某些情况下有益,但无序的、饥一顿饱一顿的“随机断食”是细菌的噩梦。如果你选择断食,请保持断食窗口的规律性,让细菌能够建立起预期的代谢循环。
保持饮食的节奏,不仅仅是一种自律的生活态度,更是一种对生命的敬畏。维护肠道内的和平与稳定,我们实际上是在守护自身健康的根基。正如研究所示,每日稳定摄入蔬菜、水果等富含纤维的食物,远比间断性大量食用更能维持菌群多样性。
在这个充满不确定性的世界里,科学的节奏与精准的滋养,或许就是你能给身体最好的确定性。
主要参考文献
Estrela S, Long JZ, Huang KC. How nutrient starvation impacts the gut microbiome. Nat Microbiol. 2025 Nov;10(11):2663-2672. doi: 10.1038/s41564-025-02139-9. Epub 2025 Sep 30. PMID: 41028229.
Singh R, McDonald D, Hernandez AR, Song SJ, Bartko A, Knight R, Salathé M. Temporal nutrition analysis associates dietary regularity and quality with gut microbiome diversity: insights from the Food & You digital cohort. Nat Commun. 2025 Sep 30;16(1):8635. doi: 10.1038/s41467-025-63799-z. PMID: 41028733; PMCID: PMC12484809.
Sanz Y, Cryan JF, Deschasaux-Tanguy M, Elinav E, Lambrecht R, Veiga P. The gut microbiome connects nutrition and human health. Nat Rev Gastroenterol Hepatol. 2025 Aug;22(8):534-555. doi: 10.1038/s41575-025-01077-5. Epub 2025 Jun 4. PMID: 40468006.