-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
在人类与微生物的共生世界中,新的发现正在不断刷新我们对健康与疾病的认知。肠道、呼吸道、生殖道——这些看似熟悉的环境中,栖息着数量庞大却性质各异的细菌,它们有的温和共生,有的在特定条件下摇身一变成为病原菌。
本次谷禾报告更新,新增了多种具有代表性的潜在致病菌和机会性感染菌——从龋齿放线菌到医院相关耐药菌,从新生儿高危感染的GBS到隐秘的粘质沙雷氏菌——这些微生物不仅展示了复杂的生态角色,也折射出人体微环境的脆弱平衡。
我们希望通过科学、系统的解读,帮助读者理解这些菌群在健康和疾病之中的真实意义:哪些只是短暂停留的“旁观者”,哪些则可能成为引发炎症、感染乃至系统性疾病的“潜在危险信号”。这既是一次对微生物多样性的探索,也是一场关于精准健康管理的知识升级。
龋齿放线菌(Actinomyces odontolyticus)是一种革兰氏阳性、厌氧、非产孢、非运动性杆菌,最早于1958年从口腔龋齿中分离。它通常作为口腔、上消化道和泌尿生殖道的正常菌群存在,但在特定条件下可成为机会致病菌,导致多种感染。
1
基本信息
•形态特征:革兰氏阳性,细长分枝杆菌样,呈丝状。
•需氧情况:严格或微需氧厌氧菌。
•人体分布:人类口腔、咽部、胃肠道和泌尿生殖道的常驻菌群之一。
•特点:与其他放线菌(如A. israelii)类似,可形成肉芽肿样、慢性脓肿,有“硫磺颗粒”。当黏膜屏障受损(如牙科操作、外伤、免疫抑制)时,易由定植转为致病。
2
可能导致的疾病
我们在下表中系统整理了由Actinomyces odontolyticus可能引起的各类疾病:

3
典型症状
•全身症状:患者可出现发热、乏力、体重减轻。局部出现慢性硬结,逐渐形成波动性脓肿,并可伴多发瘘管。脓液中常见黄白色“硫磺样颗粒”,实为菌落团。起病缓慢,虽少见明显全身中毒症状,但可长期低热、消耗,局部愈合不良。
•口腔/颈面部:牙痛、牙龈红肿、口腔脓肿、颈部肿胀。
•胸部/肺部:咳嗽、咳痰、呼吸困难、胸痛、胸腔积液。
•腹部/盆腔:腹痛、肝区压痛、腹部包块、女性可见盆腔炎症。
•中枢神经系统:头痛、意识障碍、神经功能缺损。
•皮肤/导管:脓性分泌物。
4
致病机理要点
•机会致病菌:Actinomyces odontolyticus通常在宿主免疫力下降或局部组织受损时,通过黏附并侵入受损的黏膜或牙龈组织,借此获得感染机会并逐步定植。
•在缺氧或厌氧条件下,该菌可迅速繁殖,形成致密的丝状菌丝团块。这些菌团被机体的肉芽组织所包绕,逐渐构成类似肉芽肿的慢性炎性病灶,使局部组织结构被破坏并持续扩展。
•随着感染进展,病原体可沿组织间隙缓慢向周围扩散,通过连续性扩展和瘘道形成进一步蔓延。由于这种蔓延方式不遵循正常的解剖间隙,病灶范围常远超出皮肤或黏膜表面肉眼可见的受累区域,导致诊断和治疗更加复杂。
5
在肠道里的意义
•这类放线菌本身就可以是口腔和消化道的共生菌之一,在粪便或肠道菌群中检出,并不罕见。多数情况下,仅仅检出不代表有病。
•还有部分研究显示,A.odontolyticus具备硝酸盐还原能力,可能影响口腔及肠道的亚硝酸盐水平,间接参与宿主的抗菌和血管舒张等生理过程 。
6
可能提示或潜在问题
•若在有腹腔感染、慢性脓肿、术后持续不愈的病例中,从腹腔脓液或病灶同时检出放线菌,才需要考虑:是否存在腹部放线菌病(如阑尾穿孔、肠穿孔后形成的慢性肉芽肿性炎症、瘘管等)。
•单纯在“肠道菌群报告”中出现,多半只是共生/或短暂存在,不必单独处理。
总结
A.odontolyticus虽为常见口腔定植菌,但在免疫低下或黏膜损伤时可引发多系统感染,临床表现多样,需高度警惕并结合多种检测手段早期诊断与干预。
摩氏摩根氏菌(Morganella morganii)是一种革兰氏阴性菌,兼性厌氧、杆状细菌,属于肠杆菌科,广泛存在于人类、哺乳动物、爬行动物肠道及环境中。
它通常作为肠道正常菌群存在,但在免疫力低下或特定条件下可成为机会致病菌,引发多种感染,且近年来耐药性和毒力增强,临床关注度显著提升。
1
基本信息
•分类:肠杆菌科,Morganella属,主要有M.morganii subsp. morganii和M.morganii subsp. sibonii 两个亚种。
•生物学特点:无芽孢、运动性强、杆状、兼性厌氧,具强尿素酶活性,能分解尿素。
•生态分布:广泛分布于水体、土壤、动物及人类肠道。
•重要性:常为医院获得性感染的机会致病菌。
2
可能导致的疾病
M. morganii作为机会致病菌,能引发多种感染,常见于以下疾病:
•尿路感染(UTI):常见于留置导尿、结构异常者或免疫低下、老年人、儿童中。
•伤口及软组织感染:包括手术后伤口感染、蜂窝织炎、坏死性筋膜炎等。
•败血症/菌血症:可导致高死亡率,尤其在老年及有基础疾病患者中。
•腹腔及肝胆系统感染:如腹膜炎、肝脓肿、胆道感染。
•其他:脑脓肿、心内膜炎、骨髓炎、关节炎、绒毛膜羊膜炎、食物中毒(组胺中毒)等。
3
典型症状
M. morganii感染的临床表现多样,取决于感染部位和宿主状况,常见症状包括:
•尿路感染:尿频、尿急、尿痛、血尿、发热。
•伤口/软组织感染:局部红肿、疼痛、化脓、坏死、发热,严重时可进展为坏死性筋膜炎。
•败血症:高热、寒战、低血压、意识障碍,严重时可致多器官功能衰竭。
•腹腔感染:腹痛、腹胀、发热、黄疸等。
•其他部位感染:如脑脓肿可表现为头痛、神经功能障碍,心内膜炎可有心脏杂音、心衰表现。
4
致病机理要点
•多重耐药性:M.morganii具备多种耐药基因(如 blaNDM-1、qnrD1、blaKPC-2),对多类抗生素(包括碳青霉烯类、氨基糖苷类等)表现耐药,治疗难度大。
•毒力因子:包括溶血素、尿素酶、IgA 蛋白酶、鞭毛、黏附素等,增强其致病性和组织侵袭能力。
•高危人群:老年人、免疫抑制者、慢性基础病患者、住院及手术后患者感染风险更高,且病死率较高
5
健康风险
•基因毒性与肿瘤风险:
M. morganii 可产生新型基因毒素“indolimines”,能直接损伤肠上皮细胞DNA,增加肠道通透性,并在动物模型中加重结肠肿瘤负担,提示其可能促进结直肠癌的发生与进展。
•炎症与免疫失调
该菌与炎症因子(如IL-6、IL-8、TNF-α)表达升高相关,且与短链脂肪酸水平降低有关,可能加剧肠道炎症和免疫功能障碍。在HIV感染者中,M.morganii丰度升高与抗逆转录病毒治疗后免疫重建不全密切相关。
•精神健康影响
研究发现M. morganii产生的特殊磷脂可激活免疫反应,诱导炎症,且其丰度与抑郁症发病风险增加有关。
6
在肠道里的意义
•属于肠杆菌科,本来就可以是肠道正常菌群的一部分。
•但它也是典型的机会致病菌+容易耐药的医院相关菌。
7
可能提示或潜在问题
•菌群失衡/抗生素压力下(特别是住院、用广谱抗生素的人):Morganella 可能扩增,成为潜在的感染源,例如尿路感染(尤其有导尿管者)、伤口感染、腹腔感染、菌血症、败血症(免疫抑制或重症患者)。
•从菌群学角度:此类条件致病菌大量增多,常提示肠道菌群多样性下降、共生菌被压制。
•什么时候要警惕:在ICU、肿瘤或老年患者中,若粪便或直肠拭子多次检出且丰度较高,并伴发热而无明确感染灶,应警惕其作为潜在的“肠源性血流或尿路感染”病原库,对经验性抗生素选择具有重要参考意义。
总结
M. morganii 虽为肠道常见菌,但其基因毒性、炎症促进、耐药性及与多种疾病的关联,使其成为值得高度警惕的潜在健康威胁。
无乳链球菌(Streptococcus agalactiae)(又称B群链球菌,GBS)是一种革兰氏阳性球菌,广泛存在于人类肠道和泌尿生殖道的正常菌群中,但在特定条件下可转变为重要的人类和动物病原体,导致多种严重感染。
1
基本信息
•革兰染色:革兰阳性球菌,成链状排列。
•溶血性:多为β溶血。
•分类:Lancefield B 群 → 常称“B 族链球菌(GBS)”目前已鉴定出10种血清型(Ia、Ib、II-IX),不同地区和宿主的流行型别有所差异。
•自然栖息地:成人肠道和女性阴道、下生殖道常见定植菌。
2
可能导致的疾病
•新生儿感染(核心重点):
-早发型:新生儿早期败血症、肺炎;
-晚发型:脑膜炎、败血症。
•妇产科感染:
产褥感染、绒毛膜羊膜炎、尿路感染。
•成人侵袭性感染:
皮肤软组织感染、尿路感染、菌血症、肺炎、骨髓炎等,尤其是糖尿病、老年或免疫低下者。
3
典型症状
•新生儿早发型:出生后数小时~数天内出现:呼吸急促、发绀、喂养困难、发热或体温不稳、嗜睡,可进展为呼吸窘迫、休克。
•新生儿脑膜炎:惊厥、反应差、长期可遗留神经系统后遗症。
•妇女:发热、下腹痛、恶露异常、尿频尿急尿痛等。
•成人/老年人:发热、意识障碍、关节炎、皮肤软组织感染、尿路感染、心内膜炎、脑膜炎等,重症可致死亡。
4
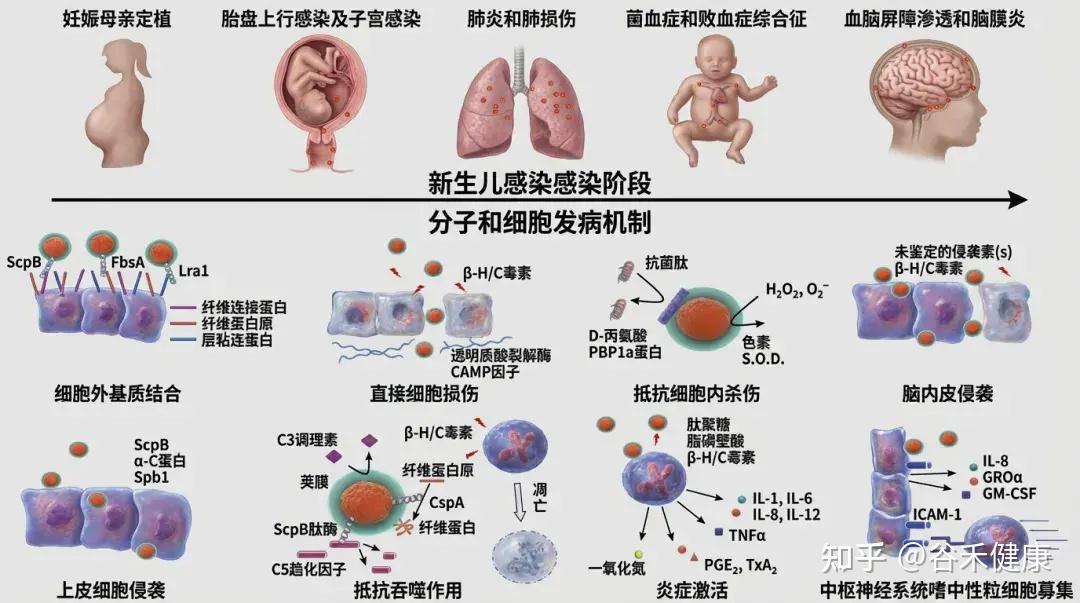
致病机理要点
GBS定植依赖多种黏附因子(如Fbs、Lmb、SfbA、HvgA等)和生物膜形成能力,这些机制增强其在肠道黏膜的持久性和侵袭性。
•荚膜多糖(CPS):抗吞噬作用,是主要毒力因子。
•表面蛋白(如C蛋白):有助黏附与免疫逃逸。
•妊娠晚期母体阴道/直肠定植 → 围产期经产道传播给新生儿。
•新生儿免疫系统未成熟,补体及吞噬功能不足,易进展为侵袭性败血症和脑膜炎。
5
在肠道里的意义
•GBS 本身就可定植在肠道和阴道,成人特别是健康人群中检出并不少见。
•对普通非孕成人,大多是良性定植。
6
可能提示或潜在问题
•孕妇:
肠道是阴道定植的“菌库”,肠道检出 GBS,说明机体有GBS 定植风险。
阴道/直肠 GBS 定植 → 分娩时可传给新生儿 → 新生儿早发型败血症/肺炎/脑膜炎。
实务上,真正决定产时预防用药的,还是孕晚期阴道+直肠拭子筛查结果,而不是单纯一份“肠道菌群报告”。
•老年/慢病/免疫抑制人群:
肠道是 GBS 侵袭性感染的潜在来源(菌血症、软组织感染),但总体风险仍属相对低,要结合临床症状。
总结
GBS作为肠道定植菌,既是正常微生态的一部分,也具有转化为致病菌的潜力。其在肠道的存在与新生儿、孕妇及免疫低下人群的感染密切相关。
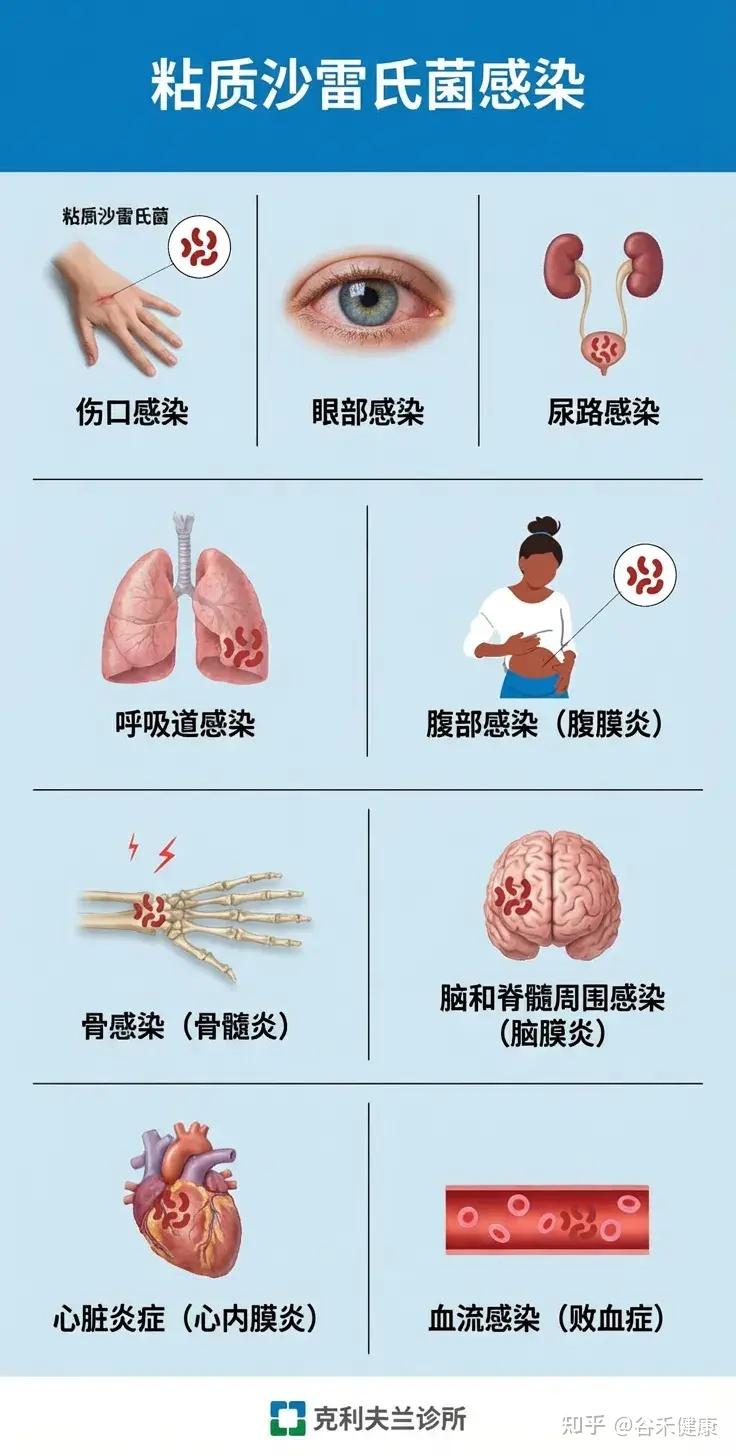
粘质沙雷氏菌(Serratia marcescens)是一种广泛分布于环境中的革兰氏阴性杆菌,近年来作为机会致病菌在医院获得性感染中日益受到关注,尤其威胁免疫功能低下者和新生儿。
1
基本信息
•革兰染色:革兰阴性杆菌。
•特点:部分菌株产生红色色素,肉眼可见“红色菌落”但临床分离株中无色素菌株更为常见。
具备多种耐药机制,对多类抗生素(如青霉素、头孢菌素、四环素等)有固有或获得性耐药。
•自然栖息地:水、土壤、植物以及医院潮湿环境(洗手池、呼吸机管路等)。
•重要性:典型的医院获得性感染和器械相关感染病原菌。
2
可能导致的疾病
S. marcescens可引发多种感染,尤其在医院环境和免疫低下人群中高发:
•血流感染(菌血症):常见于中心静脉导管相关感染。
•肺炎:包括医院获得性肺炎和重症肺炎。
•尿路感染:尤其在留置导尿管患者中。
•脑膜炎:多见于新生儿或免疫低下者。
•伤口和手术部位感染。
•罕见病例:可见于皮肤软组织感染、心内膜炎、骨髓炎等、角膜炎、结膜炎。
3
典型症状
S.marcescens与其他革兰阴性杆菌感染类似:发热、局部红肿热痛、脓性分泌物,重症可出现败血症、脓毒性休克。具体取决于感染部位和宿主状况:

4
致病机理要点
•黏附与生物被膜形成:在导尿管、静脉导管、呼吸机管路表面形成生物膜,增加持久定植与耐药。
•产生多种水解酶和毒力因子:如蛋白酶、脂酶等,这些物质能够分解宿主组织成分,破坏细胞结构,削弱局部屏障功能,从而进一步导致组织损伤和感染扩散。
•常携带产β-内酰胺酶和多药外排泵:导致多重耐药 → 治疗困难。
•医院潮湿环境的储存与反复污染:是暴发院感的重要原因。
5
在肠道里的意义
•本身不是典型稳定的“常驻共生菌”,更常见为医院环境相关的机会致病菌。
•健康人群肠道中较少见,但在住院患者,尤其是ICU或长期使用抗生素者中检出率显著升高。
•新生儿与免疫低下:肠道定植可导致院内感染暴发,易扩散至血流、呼吸道等部位,致病率和死亡率高。
•抗生素耐药:具多重耐药性,易获得广谱抗生素耐药基因,增加治疗难度。
6
可能提示或潜在问题
•表明患者已被多重耐药医院菌群定植:肠道成为储存库,增加导尿管相关尿路感染、呼吸机相关肺炎及静脉导管相关菌血症的风险。
•肠道菌群失衡:定植后抑制益菌生长,降低菌群多样性,影响宿主免疫与发育。
•公共卫生与院感防控角度:若大量患者肠道定植 Serratia,病区院感暴发风险显著上升。并且可经医院环境、医护人员手部及医疗器械传播,且难以根除。
7
需要关注的人群
•ICU、血液肿瘤科、器官移植患者:如果粪便/直肠拭子筛查提示有 Serratia marcescens(尤其是已知多重耐药株):通常会在经验性抗生素选择、隔离防护上额外注意。
总结
Serratia marcescens是重要的机会致病菌,在肠道中不仅可引发局部和全身性感染,还会扰乱肠道微生态,促进耐药性传播,尤其对新生儿和免疫低下人群威胁极大。加强监测、感染控制和合理用药,是降低其危害的核心措施。
索氏志贺氏菌(Shigella sonnei),也叫宋内志贺菌,是全球重要的肠道致病菌,近年来在发达国家和部分发展中国家发病率持续上升,且耐药性问题日益突出。
1
基本信息
•革兰染色:革兰阴性短杆菌。
•生物学:不运动、不产H2S,极少发酵糖类。
•分类与流行病学:Shigella sonnei属于肠杆菌科、志贺菌属的四个主要种之一,在发达地区更常见(与 S. flexneri 相对),但随着全球卫生条件改善,其在中低收入国家的比例也在上升。
•传播途径:主要通过粪-口途径传播,包括被污染的水、食物、接触受污染物品等。人是其主要宿主,极低的感染剂量(1-100个细胞)即可引发疾病,极易造成暴发流行。
•耐药性:S.sonnei对多种抗生素(如氟喹诺酮、头孢菌素、阿奇霉素等)耐药性显著增强,已成为全球公共卫生关注的多重耐药菌株。
2
可能导致的疾病
•主要疾病:S.sonnei是细菌性痢疾(志贺菌病,shigellosis)的主要致病菌之一,尤其在发达国家占主导地位。
•特殊人群风险:儿童、免疫力低下者、男男性行为者(MSM)、流浪者等为高风险人群,部分病例可出现菌血症、重症结肠炎甚至败血症。
•暴发场景:可引起食源性、饮水型、性传播及机构内(如学校、收容所)暴发。
3
典型症状
•常见症状:水样腹泻、腹痛、发热、恶心、呕吐。部分病例可出现血便(即“痢疾”),严重者可有脱水、休克等并发症。
•潜伏期:通常为1-4天,部分个体可无症状但仍具传染性。
•重症:脱水、电解质紊乱、毒血症,少数可出现中毒性肠麻痹或中毒性脑病(儿童)。
•特殊表现:免疫力低下者、儿童及老年人更易发展为菌血症和全身感染。
4
致病机理要点
•极低的感染剂量(10~100个菌即可致病),因此高度传染性。
•S.sonnei通过多种毒力因子(如III型和VI型分泌系统、O抗原胶囊、群体感应信号4-HBA等)侵袭肠上皮细胞,破坏肠黏膜屏障,诱发炎症反应。
S.sonnei的毒力因子
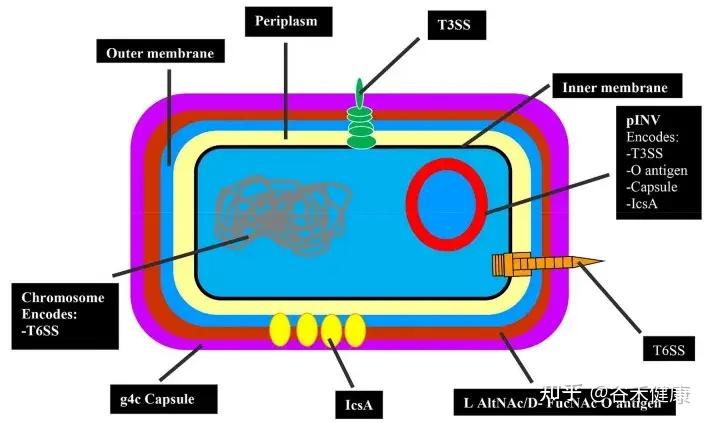
•其VI型分泌系统和细菌素(colicins)赋予其在肠道内与其他菌群竞争、占据生态位的能力,促进其流行。
•通过M细胞入侵肠上皮 → 细胞内增殖 → 从细胞侧面传播,造成上皮细胞坏死、溃疡。
•产生志贺毒素(Shiga toxin,一些菌株):抑制蛋白合成,导致黏膜细胞死亡,也可引起全身毒性反应
•粘膜受损导致渗出性炎症和溃疡 → 典型的黏液脓血便与里急后重。
•感染可显著扰乱肠道菌群多样性,部分患者即使临床恢复后,肠道微生态仍长期异常。
5
在肠道里的意义
•志贺菌是典型肠道致病菌,不是共生菌。
在粪便或肠道菌群中检出,尤其丰度不低时,通常意味着:
•正在感染期;
•或刚经历过感染,处于带菌/恢复期排菌状态。
6
可能提示或潜在问题
•急性期:细菌性痢疾 → 腹痛、里急后重、黏液脓血便、发热。
•恢复/带菌期:人本身症状可能已好转或无症状,但仍有:继续向他人传播的风险(粪–口),公共场所/托幼机构尤其要警惕。
•少数患者可发展为:
脱水、电解质紊乱;
中毒性肠炎/中毒性脑病(多见儿童);
感染后肠易激综合征等后遗症。
•耐药基因发展
S.sonnei对多种一线和二线抗生素(包括氟喹诺酮、头孢菌素、阿奇霉素等)耐药株迅速扩散,导致治疗选择受限。耐药基因可通过质粒在肠道内水平转移,增加耐药性在肠道微生物群中的传播风险。
7
检出后的处理思路
•若伴随腹泻、发热等症状 → 需要按细菌性痢疾评估和管理。
•即使暂时无症状,但粪便志贺菌阳性,尤其在托幼机构、食品从业人员等,应当从传染病防控角度处理。
总结
Shigella sonnei在肠道中不仅引发急性腹泻,还因其强竞争力、复杂致病机制和多重耐药性,带来持续的公共卫生威胁。加强监测、合理用药、疫苗研发及肠道微生态修复是未来防控的关键方向。
化脓性链球菌(Streptococcus pyogenes,简称GAS)是A群β溶血性链球菌。是全球重要的人体病原体,能引发从轻微到危及生命的多种疾病。
1
基本信息
•分类与特性:S. pyogenes 属于A群β溶血性链球菌,革兰阳性球菌,常呈链状排列。该菌能在富血培养基上生长并产生完全溶血。
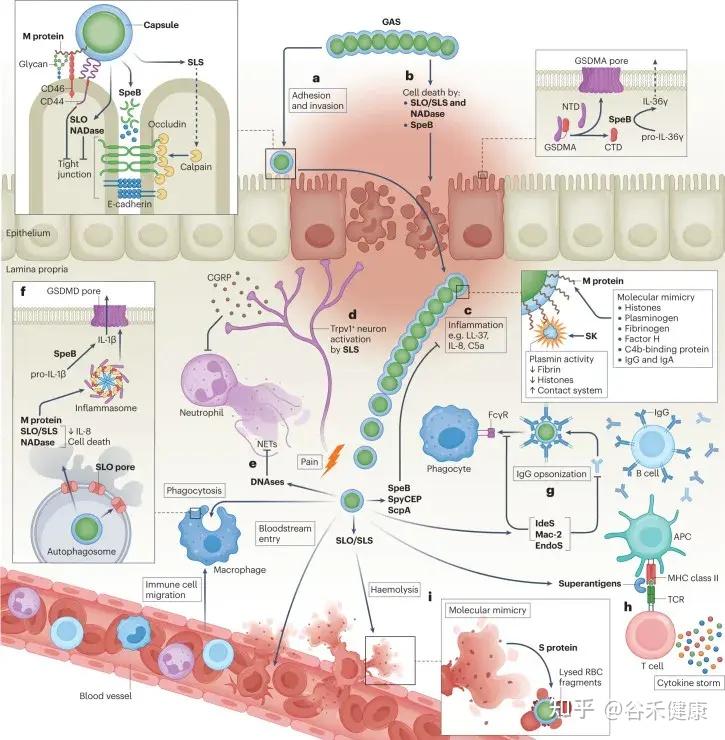
•重要特点:多种毒力因子,可致急性感染及免疫后遗症。
GAS的毒力因子
•传播途径:主要通过呼吸道飞沫、密切接触传播。上呼吸道和皮肤是主要的感染部位。
•流行病学:全球每年导致约50万例死亡,尤其在卫生条件较差地区危害更大。
2
可能导致的疾病
Streptococcus pyogenes感染后可能引发多种类型的疾病,如下:

3
典型症状
•咽炎/扁桃体炎:喉咙痛、发热、咽部充血、扁桃体肿大、化脓、软腭点状出血、颈部淋巴结肿大。
•猩红热:皮疹(常为沙粒状)、“草莓舌”、高热、咽痛、腺体肿大。
•皮肤感染:局部红肿、疼痛、脓疱、溃烂,严重时可发展为坏死性筋膜炎。
•侵袭性疾病:高热、休克、意识障碍、器官功能障碍(如肺炎、脑膜炎、败血症等)。
•免疫并发症:风湿热表现为关节炎、心脏炎、皮下结节等;急性肾小球肾炎表现为血尿、水肿、高血压,多在皮肤或咽部感染后1–3周出现。
4
致病机理要点
•M蛋白:抗吞噬、促进黏附,是关键毒力因子,也与风湿热的分子模拟相关。
•外毒素(SPE:streptococcal pyrogenic exotoxins):可作为超抗原 → 引起大量细胞因子释放 → 毒性休克、猩红热皮疹。
•溶血素(SLO、SLS):溶血、损伤组织。
•透明质酸荚膜:抗吞噬作用。
•免疫后遗症(风湿热、肾炎):多是免疫交叉反应与免疫复合物沉积所致,而非细菌直接侵袭。
5
在肠道里的意义
•主要定植于咽部和皮肤,并非典型肠道菌。
•在肠道菌群检测中检出,多见几种情况:
1.咽部分泌物被吞咽→通过粪便短暂排出;
2.可能存在上呼吸道感染;
3.极少数真正的肠道/腹腔感染(如坏死性小肠结肠炎等极罕见情形)。
6
可能提示或潜在问题
一般来说,单在菌群检测里偶然检出意义有限。真正需要警惕A组链球菌的,是:
•侵袭性疾病风险
GAS可通过肠道引发罕见但严重的腹膜炎,常被误诊为阑尾炎,延误治疗可能危及生命。女性、免疫抑制者及有水痘史者为高危人群,早期识别和抗生素治疗至关重要。
•免疫相关并发症
反复或持续感染可诱发免疫介导的疾病,如急性风湿热、风湿性心脏病和急性肾小球肾炎,尤其在发展中国家致死率高。
•功能性消化不良与肠道功能障碍
最新动物研究显示,GAS定植可通过皮肤-肠道轴影响胃肠动力,抑制RhoA/ROCK1信号通路,导致食欲下降、体重减轻和胃肠蠕动障碍,提示其可能加重功能性消化不良。
•抗生素耐药性与公共卫生挑战
GAS对青霉素的敏感性下降及大环内酯类耐药的增加,威胁一线治疗手段,需密切监测和合理用药。
总结
S.pyogenes是一种高度多样且致病力强的细菌,既可引发常见的咽炎、皮肤感染,也可导致危及生命的侵袭性疾病和免疫相关并发症。典型症状因疾病类型而异,需临床高度警惕并及时治疗。
解脲支原体(U.urealyticum,Uu),又称为溶脲脲原体。主要寄居于泌尿生殖道,在特定条件下可致病。
1
基本信息
•归类于支原体类,无细胞壁(对β-内酰胺类天然耐药)
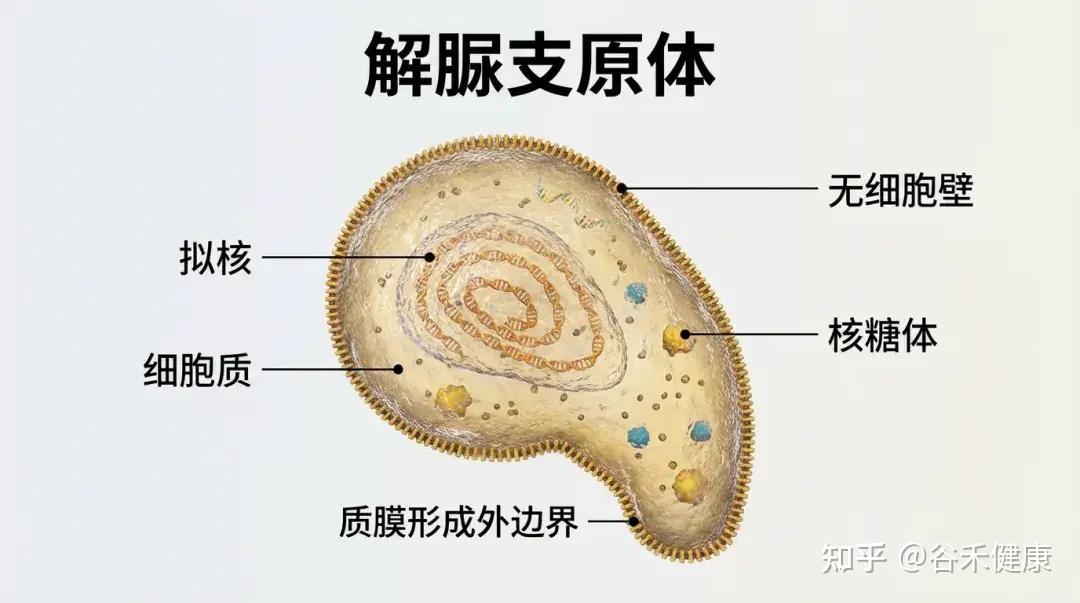
•极小型(“类原核生物”),通过固着于黏膜表面生存。
•自然栖息地:男女泌尿生殖道黏膜正常菌群之一,常为性传播。
2
可能导致的疾病
•男性:非淋菌性尿道炎(NGU),精囊炎、附睾炎等。
•女性:宫颈炎、盆腔炎、输卵管炎、不孕风险增加。
•妊娠相关:绒毛膜羊膜炎、羊水感染、早产、胎膜早破。
•新生儿:肺炎、菌血症、脑膜炎,尤其极低出生体重儿。
•免疫低下者:机会性感染。
3
典型症状
•男性非淋菌性尿道炎:尿道刺痛、瘙痒、轻度分泌物,症状可较轻、反复发作。
•女性宫颈炎/盆腔炎:下腹痛、白带增多、性交痛、不规则出血。
•妊娠并发症:发热、下腹痛、胎动异常、早产征象。
•新生儿:呼吸窘迫、发热或体温不稳、反应差等。
4
致病机理要点
•黏附因子:附着于泌尿生殖道上皮细胞表面,干扰纤毛功能。
•尿素酶:分解尿素→生成氨和二氧化碳:
过量氨对上皮细胞有毒性作用,引发局部炎症;
改变局部pH,影响黏膜屏障。
•诱导宿主产生多种炎症因子(如IL-6、IL-8),使局部出现慢性炎症与微环境改变,影响孕囊稳定和胎膜完整性。
5
在肠道里的意义
•其典型定植部位主要位于泌尿生殖道黏膜,包括尿道、宫颈及阴道等区域,在这些部位最易形成稳定的定植状态并长期存在。
•在粪便或肠道菌群中也可检出该菌,但多数情况下为采样过程中会阴部污染所致,尤其在女性样本中这一情况更为常见。
6
可能提示或潜在问题
•对肠道本身的影响:目前尚缺乏充分而有力的科学证据,尚不能明确证明其在肠道内具有直接的致病作用,更多情况下可能仅为暂时定植或伴随现象。
•需要重点关注的情况是:如果在生殖道相关样本(如尿道拭子、宫颈分泌物)中检测到该菌丰度较高,同时伴随出现尿道炎、不孕或妊娠相关并发症等临床表现,此时检测结果才真正具有临床意义和诊断参考价值。
注:若仅在肠道菌群中偶然检出该菌,而未见相应的临床症状或体征,通常不建议仅依据此结果进行疾病诊断或启动抗菌治疗。
Mycoplasma pneumoniae(肺炎支原体)是一种无细胞壁、体积极小的专性寄生细菌,是全球社区获得性肺炎(CAP)尤其是儿童和青少年中最常见的病原体之一。其感染可导致多种呼吸道及肺外疾病,临床表现多样,部分病例可进展为重症甚至危及生命。
1
基本信息
•肺炎支原体为最小的自由生活原核生物之一,缺乏细胞壁,对β-内酰胺类抗生素天然耐药。
•主要通过飞沫传播,潜伏期为2-3周。
•该菌主要寄生于呼吸道上皮细胞,通过特殊的终末附着器实现黏附、侵袭和免疫逃逸。
•近年来,耐大环内酯类(如红霉素)菌株比例显著上升,尤其在中国和亚洲地区。
2
可能导致的疾病

3
典型症状
•呼吸道症状:持续性干咳(最常见,85-96%)、发热(86-96%)、咽痛、头痛、乏力、气促、胸痛、喘息等。
•肺外症状:皮疹、恶心/呕吐、关节痛、神经系统症状(如头痛、意识障碍)、心肌损伤、肝肾功能异常等,约1/4患者可见。
•儿童表现:咳嗽、哮喘样症状、低热,部分伴有皮肤表现(25%)、消化道症状(33%)。
•影像学:单侧或多叶浸润、实变、胸腔积液等,部分病例可见肺不张或大面积病变。
4
致病机理要点
•P1黏附蛋白:结合呼吸道上皮细胞表面的纤毛,牢固黏附 → 破坏纤毛运动,干扰黏液清除。
•产生CARDS toxin(Community-Acquired Respiratory Distress Syndrome toxin)等毒素,损伤上皮细胞,引发炎症。
•诱发宿主细胞免疫和体液免疫反应,其中部分交叉反应导致肺外免疫并发症(如溶血性贫血、皮疹、神经系统损害等)。
•由于细胞壁缺失,细菌形态柔软、易穿行于黏膜表面间隙,且对多种抗生素类别不敏感(需用大环内酯、四环素或氟喹诺酮类)。
5
在肠道里的意义
•是典型的呼吸道病原体(气道黏附),不属于肠道定植菌。
•在肠道菌群测序中检出,通常是吞咽气道分泌物中的菌体/DNA,短暂通过消化道。
6
可能提示或潜在问题
•一般不直接导致肠道疾病,更多表明可能存在呼吸道感染。但M. pneumoniae感染可显著改变肠道菌群结构,降低有益菌如乳酸杆菌和双歧杆菌的丰度。这种菌群失衡与炎症因子升高密切相关,尤其在伴喘息的患儿中更为明显。同时肠道菌群的变化会加剧免疫失调,促进炎症反应,增加哮喘等并发症风险。
•肺炎支原体真正的危害仍在:非典型肺炎、持续干咳、肺外免疫并发症(皮疹、溶血性贫血、中枢神经系统累及等)。
总结
M.pneumoniae不仅影响呼吸系统,还可通过肠道微生态紊乱和免疫调节,导致肠道损伤和多系统炎症反应。关注其肠道影响有助于早期识别非典型病例,并为综合治疗提供新思路。
Clostridium symbiosum(共生梭菌)是一种严格厌氧、具鞭毛、可运动、不产毒素的芽孢杆菌,属于厚壁菌门,在人体肠道中可作为正常菌群存在,但近年来被认为是新兴的致病菌,临床分离较为罕见。
1
基本信息
•形态与生理特征:C. symbiosum为芽孢形成、鞭毛运动、革兰氏阳性杆菌,但因其对氧的敏感性,常表现为革兰氏阴性染色。它不产毒素,能发酵多种糖类。
•生态分布:主要存在于人类肠道正常菌群中,也可在动物肠道及环境中发现。
•致病性:与其他梭菌如 C.perfringens、C.difficile 相比,其致病性报道较少。多在严重基础病或免疫抑制、肠道屏障破坏时成为机会致病菌。
2
可能导致的疾病
目前临床报道不多,可见于:
•腹腔内感染:如穿孔性腹膜炎、腹腔脓肿(与肠道穿孔/手术有关)。
•菌血症/败血症:多为重症患者、肿瘤患者、长期住院或使用广谱抗生素者。
•结直肠癌:C. symbiosum在结直肠癌患者肿瘤组织中显著富集,并与腺瘤复发风险增加相关。动物实验显示其可促进肠道干细胞增殖和癌变,机制涉及支链氨基酸代谢和胆固醇合成通路激活。
•可能参与某些肠道菌群失衡相关疾病(如代谢性疾病、肠炎)中的“共病菌”,但具体因果尚在研究中。
3
典型症状
•无特异性,通常与原发病及感染部位相关:
-腹痛、发热、白细胞升高、腹膜刺激征(腹腔感染);
–寒战、高热、低血压、脓毒性休克表现(菌血症)。
•其他:如合并腹腔脓肿、手术部位感染等,表现为局部红肿、疼痛、化脓等。
•多数为混合感染:与其他肠道厌氧和需氧菌同在,单独分离报道较少。
4
致病机理要点
•作为梭菌,可形成芽孢,在不利环境中长期存活;进入厌氧环境(如坏死组织、闭合脓腔)后即可迅速繁殖。
•当肠道屏障受损(如穿孔、手术、肿瘤浸润)时,可随肠内容物移位至无菌体腔或血流,引发机会性感染。
•可能分泌组织降解酶和毒力因子,但其毒力谱较艰难梭菌(C. difficile )等梭菌研究尚不充分。
5
在肠道里的意义
这是典型的肠道厌氧共生菌之一,在健康人粪便中检出是常见且正常的。
•能量代谢与交互喂养:C. symbiosum 能分解膳食抗氧化剂(如麦角硫因),产生可被其他菌(如 Bacteroides xylanisolvens)利用的电子受体,促进厌氧能量代谢和菌群协同生长。这种交互喂养机制有助于维持肠道微生态稳定,并可能影响个体疾病风险。
•短链脂肪酸(SCFA)合成:C. symbiosum 参与乙酸等 SCFA 的合成,SCFA 对维持肠道屏障、调节免疫和抑制肿瘤细胞增殖具有重要作用。
6
可能提示或潜在问题
•菌群失衡的“标志菌”之一(研究层面):
一些研究发现,在某些疾病(如结直肠癌、代谢性疾病、肠道炎症状态)中,某些梭菌(包括C.symbiosum在内)丰度升高或降低,可作为潜在“生物标志物”。但这些更多是统计学相关性,并不能简单说“检出/增多 = 一定有某种病”。
•机会致病菌:
当肠道屏障严重破坏(穿孔、手术、肿瘤浸润)或极度免疫抑制时,共生梭菌可随肠内容物进入腹腔或血流,引起腹腔感染或厌氧菌败血症。真正发生时,往往是与其他肠道菌“混合感染”,而不是它单独“作恶”。
•抗药性:
C. symbiosum中携带多种环境来源的抗生素抗性基因,提示其在抗药性传播中的重要角色。
总结
Clostridium symbiosum 在肠道生态、能量代谢、疾病发生及抗药性传播中扮演着双刃剑角色。其作为结直肠癌等疾病的潜在生物标志物和微生态调节靶点,具有重要研究和临床应用前景,但也需警惕其条件致病性和抗药性扩散风险。