-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
噬菌体(bacteriophages,phages)是专一感染细菌的病毒,它曾长期被视为抗生素时代之前的“旧疗法”,但在多重耐药(multidrug resistance, MDR)日益严峻和微生物组医学兴起的背景下,噬菌体疗法被重新定位为一种“可编程的微生物群编辑工具”。
噬菌体这一名称源于“吃细菌”之意。它广泛存在于一切有细菌的环境中,包括土壤、地壳深处、动植物体内以及海洋等,其中海洋是全球噬菌体最密集的天然库之一。
本文系统梳理噬菌体的生物学基础、肠道噬菌体组的生态学规律,以及噬菌体疗法在胃肠疾病与肝病中的证据链与关键瓶颈。
同时顺便讨论了噬菌体相较抗生素的优势:高度靶向特异性、可在靶点原位扩增、具备穿透和降解生物膜的潜力,以及与抗生素耐药机制的不交叉性;并分析其临床转化面临的核心挑战,如宿主谱狭窄、耐噬菌体进化、免疫反应与微生物组外溢效应、疗效评价体系与监管标准的不完善,以及高质量公共噬菌体库的匮乏。
更重要的是,肠道与肝病领域正在形成“从感染到菌群失衡相关疾病”的范式迁移:噬菌体不再仅是“杀菌药”,而是用于选择性削减致病共栖菌以恢复肠道稳态、影响免疫与代谢表型的精准干预手段。
噬菌体是一种感染细菌细胞并在其内部繁殖的病毒,它们形态和遗传物质类型多样。噬菌体由称为衣壳的蛋白质外壳包裹内部的DNA或RNA。噬菌体通常只识别特定细菌物种或菌株,在多种环境中对细菌种群的调控起着关键作用。
噬菌体疗法最大的优点之一是不会攻击其他细菌,只攻击特定类型或群体,我们的身体习惯了它们,因为我们被它们包围着。
噬菌体的发现历史
噬菌体实际上存在的时间比我们还长。
1915-1940年——发现与发展时期
1910年:噬菌体的发现;
1920年:噬菌体用于细菌感染治疗。
1940-2000年——停滞时期
抗生素的使用压制了西方国家的噬菌体疗法研究,但在苏联及其盟友中蓬勃发展,特别是在冷战期间。
1940年:难以重现,缺乏基本科学数据;
1970年:噬菌体与抗生素治疗比较。
2000年-至今——复兴时期
抗生素耐药性威胁加剧,结合现代生物技术和基因工程的进步,重新激发了对噬菌体疗法的兴趣。相关研究论文、临床试验及成功临床应用案例的数量均不断增加。
2005年:首次安全性测试;
2007年:人类微生物组计划;
2014年:CRISPR-Cas系统武装的噬菌体;
2019年:噬菌体可在肠道中特异性靶向细胞溶解性E.faecalis;
2020年:肠道微生物基因水平的原位调节;
2021年:口服噬菌体疗法BX002的I期药代动力学研究取得积极成果;
2023年:首个CRISPR噬菌体药物候选者进入临床试验。
2024年:小鼠肠道中细菌的原位靶向编辑。

噬菌体结构
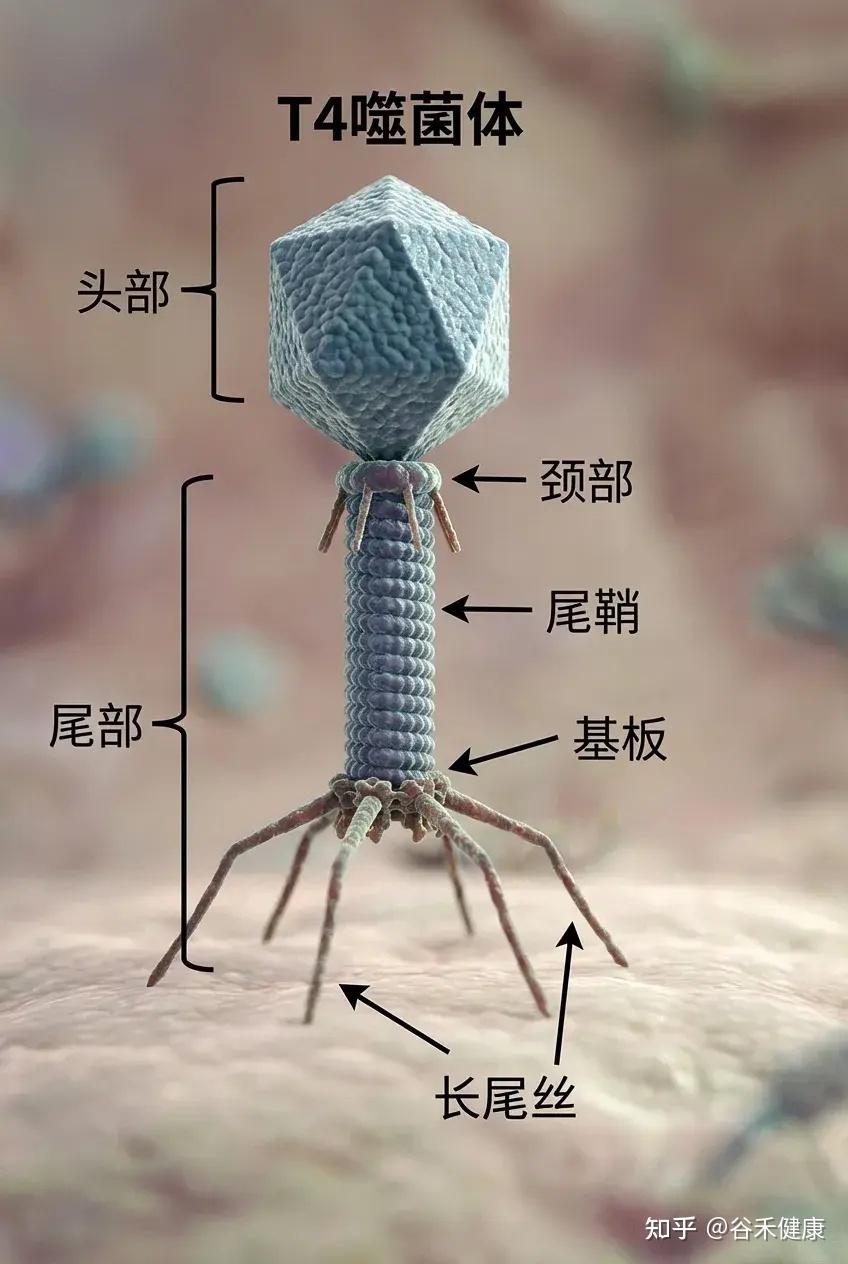
噬菌体由三部分构成:一个多面体的头部,一个短短的领口,以及一个螺旋形的尾部。
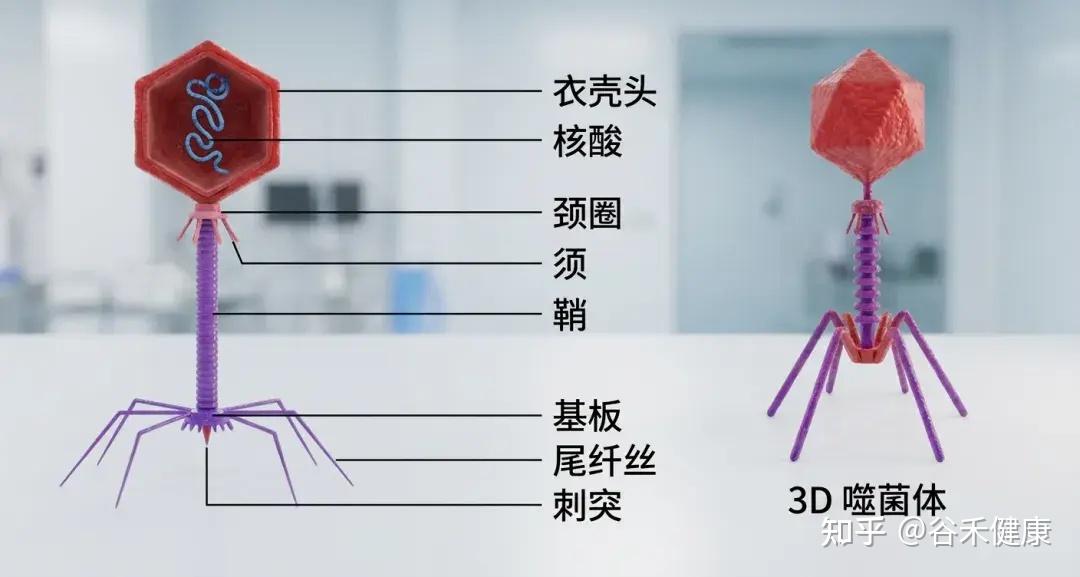
①头部
形状:多面体(就像一个有很多面的几何体)。
结构:由大约2000个囊聚体(capsomere)组成,囊聚体是构成头部外壳的基本单元。
内部:包含双链DNA,也就是噬菌体的遗传物质。
简单来说: 头部的作用就是保护噬菌体的DNA。
②项圈
位置位于头部和尾部之间,提供结构支撑,促进头部与尾部的连接。
③尾部
尾鞘:一种收缩结构,见于某些噬菌体(如T4噬菌体),有助于将遗传物质注入宿主体内。感染期间,鞘收缩并推动尾管穿过细菌细胞壁。
尾管:一种中空的管道,遗传物质通过它进入宿主细菌体内。
底板位于尾部末端,是连接细菌表面的关键。它通常包含受体结合蛋白、分解细菌细胞壁的酶以及其他有助于附着和穿透的特征。
尾纤维丝:长而灵活的延伸部分,使噬菌体能够识别并连接细菌细胞表面的特定受体。这些纤维非常特殊,决定噬菌体的宿主范围。
简单来说: 尾部的作用是像一根“注射器”,将噬菌体的DNA注入细菌体内。尾丝用来“抓住”细菌。
例如,T4噬菌体(如下图)是一种感染大肠杆菌的病毒,大肠杆菌是分子生物学领域研究最为深入的细菌类型之一。由于T4噬菌体感染大肠杆菌,科研人员得以结合对细菌的既有认知,借助T4噬菌体研究病毒在细胞内的感染与复制机制。
噬菌体的生命周期
噬菌体是感染细菌的病毒,它们有两种主要的生命周期:裂解循环和溶原循环。
•裂解循环或致病循环
裂解循环是指噬菌体感染细菌后,在细菌体内复制自身,最终导致细菌破裂(裂解)并释放出大量新的噬菌体,从而感染更多细菌。可以理解为“快速杀灭”的模式。这个过程包含以下几个步骤:
吸附 (Adsorption): 噬菌体利用其尾部的纤维,结合到细菌表面的特定受体上,就像钥匙插入锁一样。
穿透 (Penetration): 噬菌体的尾鞘收缩,并利用一种酶削弱细菌的细胞壁。然后,噬菌体将自身的DNA注入到细菌细胞内。
噬菌体组分的合成: 噬菌体的DNA进入细菌后,会“劫持”细菌的代谢系统,开始合成新的噬菌体所需的各种部件,例如头部、尾部以及各种蛋白质。这些蛋白质分为早期蛋白和晚期蛋白,早期蛋白负责复制DNA和合成其他蛋白质,晚期蛋白主要用于组装病毒颗粒。
成熟与组装: 噬菌体的头部、尾部等各个部件组装在一起,形成完整的病毒颗粒,称为病毒体。 噬菌体DNA会被装入头部中。
释放:最终,大量新形成的噬菌体会产生一些酶来破坏细菌的细胞壁,导致细菌裂解。 细菌破裂后,这些噬菌体就被释放出来,可以去感染其他细菌。
•溶原循环
噬菌体的生命周期要么是裂解性,要么是溶原性。
溶原循环是指噬菌体感染细菌后,并不立即导致细菌裂解,而是将自身的DNA整合到细菌的染色体中,成为前噬菌体。前噬菌体随着细菌的复制而复制,并传递给细菌的后代。可以理解为“潜伏”的模式。
当细菌分裂繁殖时,携带前噬菌体的细菌(称为溶原细菌)也随之分裂,将前噬菌体传递给所有后代。这样,噬菌体就可以在不杀死细菌的情况下进行繁殖。
但是,前噬菌体并非永久地潜伏在细菌体内。在某些条件下(例如紫外线照射),前噬菌体可能会从细菌的染色体上切除下来,并进入裂解循环,导致细菌裂解。
溶原细菌在繁殖过程中,也有可能因为切除作用而失去前噬菌体。
•裂解循环与溶原循环的区别
总而言之,裂解循环相当于“快攻”:迅速杀死宿主并大量产生子代,方式激进;溶原循环则类似“潜伏”:先藏入宿主基因组,随宿主繁殖扩增,在需要时再转入裂解。噬菌体选择哪种模式取决于细菌的生理状态和环境条件等多种因素。
噬菌体的类型
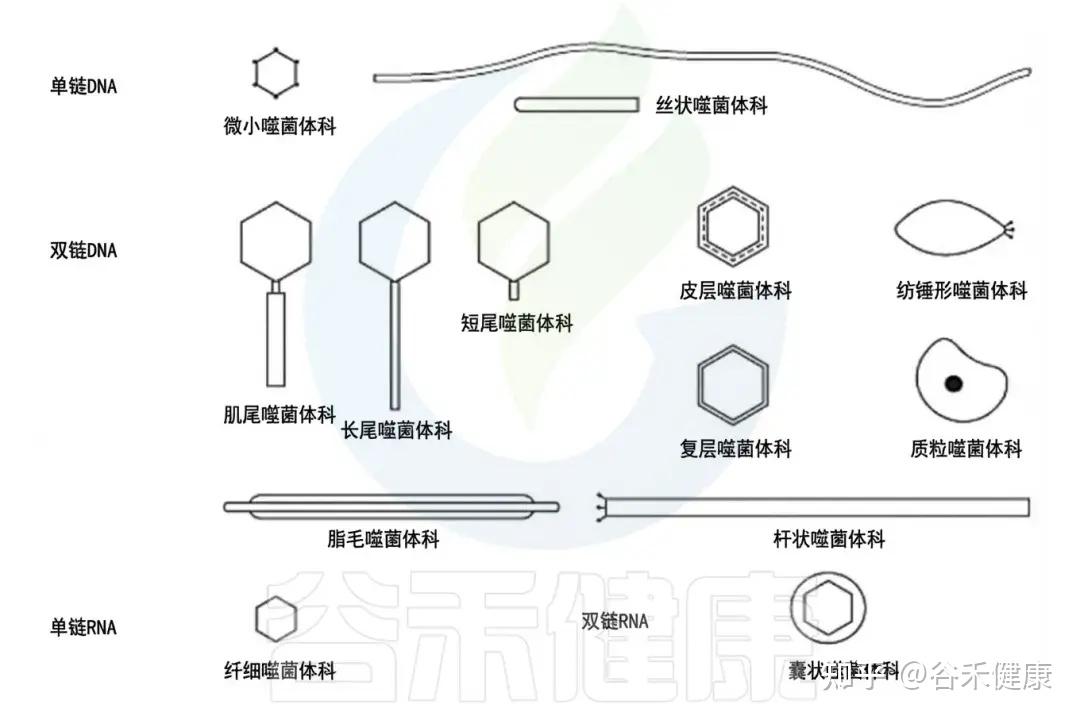
•按基因组分:
根据基因组,噬菌体可分为以下四种类型:
1.dsDNA 噬菌体(双链 DNA);
2.ssDNA 噬菌体(单链 DNA);
3.dsRNA 噬菌体(双链 RNA);
4.ssRNA 噬菌体(单链 RNA)。
噬菌体主要类群的示意图
•按照生活史/复制策略分:
裂解性噬菌体: 这些噬菌体感染细菌细胞并在体内繁殖,最终使细胞裂解(破裂)并释放新形成的噬菌体。T4噬菌体是一种常见的裂解性噬菌体。
溶原噬菌体: 这些噬菌体将 DNA 整合进细菌染色体,并能长时间保持潜伏状态。在某些情况下,噬菌体 DNA 可以在复制过程中传递给子细胞,从而实现稳定感染。λ噬菌体是一种著名的溶原噬菌体。
•按形态结构分:
有尾噬菌体: 这些噬菌体具有独特的尾部结构,有助于附着在宿主细胞细菌表面 。偶T噬菌体(T2、T4、T6)是有尾噬菌体的例子。
丝状噬菌体: 这些噬菌体具有细长的丝状结构,有助于感染细菌细胞。它们通常感染革兰阴性菌,且没有尾巴。M13是一种著名的丝状噬菌体。
长尾噬菌体科(Siphoviridae):是国际病毒分类委员会确认的噬菌体主要科系,具有长而无收缩性的尾部结构,头部呈正多面体或扁形衣壳。其基因组为线型双链DNA,通过尾部吸附宿主细菌细胞壁实现感染,主要侵染大肠杆菌等革兰氏阴性菌。
该科成员以λ噬菌体和T5噬菌体为典型代表,能够在宿主基因组中整合并进行温和性复制。作为天然抗菌剂,其裂解酶特性被应用于绿脓杆菌感染治疗及工业发酵污染防控。
短尾噬菌体科(Podoviridae):这类噬菌体具有短尾、一般不可收缩;宿主范围因种而异,很多感染革兰氏阴性菌,代表如T7噬菌体。
噬菌体的分布
噬菌体无处不在;水、空气、土壤,几乎任何地方都能找到细菌。有人甚至认为,正因为噬菌体的存在和独特功能,我们的环境才没有被细菌完全占据。他们认为噬菌体是被允许控制自然界细菌水平的生物体。
噬菌体疗法已有近百年历史,但在抗生素广泛应用后迅速被边缘化。随着抗生素效果下降以及测序和微生物组研究的推进,噬菌体疗法重新受到关注,并被视为在缺乏有效手段时“恢复肠道微生物群”的潜在临床策略,其依据包括对靶菌的杀灭作用和免疫调节功能。
在胃肠—肝病领域,噬菌体疗法的应用已从霍乱、腹泻等感染扩展至多种与特定菌群相关的非传染性疾病,如克罗恩病中的黏附侵袭性大肠杆菌(AIEC)、溃疡性结肠炎中的艰难梭菌、结直肠癌相关的聚合梭杆菌、NAFLD 中的“产酒精”肺炎克雷伯菌以及酒精相关肝炎中的粪肠球菌等。
另一方面,从微生物组视角出发,噬菌体是人体最小且广泛存在的微生物之一,对细菌群体施加选择压力并塑造微生物组;噬菌体可与黏膜表面相互作用并跨越上皮层,同时还能调节免疫系统。这种“生态—免疫—代谢”的三重效应,使噬菌体疗法天然适配“精准编辑肠道菌群”的医学目标。
噬菌体的潜在应用
治疗为何偏好裂解噬菌体?
噬菌体的复制策略包括裂解型、温带型(溶原/可裂解)和慢性型。临床应用时,出于监管和安全性考虑,通常优先选择“严格裂解型噬菌体”。
温带噬菌体可整合为前噬菌体并介导基因转移,因而监管接受度较低;但在人类微生物群中却普遍存在,其受饮食、生活方式、化疗等因素诱导激活,可能导致群落扰动和菌群失调。
因此,“理解并可控诱导前噬菌体”正被视为新一代微生物群调控的重要方向。
机制性优势:为何噬菌体常被视为抗生素的互补/替代
•特异性靶向:噬菌体仅攻击被识别的细菌,避免广谱抗生素造成的微生物群破坏和继发感染风险;抗生素易诱发菌群失调,而噬菌体可选择性清除致病共栖菌。
•原位增殖与“自放大药代学”:在存在靶菌时,噬菌体可在局部扩增,呈现近似“单次击中”的动力学特征,其剂量—时间关系不同于需反复给药的抗生素。
•生物膜清除潜力:噬菌体及其脱聚合酶、裂解酶可穿透或降解生物膜胞外基质,提高对耐药生物膜相关感染的控制能力。
•耐药机制不交叉:细菌对抗生素和噬菌体的耐受机制不同,抗生素耐药菌仍可作为噬菌体靶标,反之亦然,因此噬菌体与抗生素的联合和协同应用成为可行策略。
•适应度权衡与表型重塑:噬菌体受体突变可在“噬菌体感染—细菌毒力—抗生素敏感性”之间形成适应度权衡。例如,当外排泵为噬菌体受体时,其突变虽可带来噬菌体耐受,却可能削弱外排泵功能,从而恢复对抗生素的敏感性。
★肠道噬菌体组是菌群稳态的重要调控层
肠道微生物组除细菌外还包括以噬菌体为主的病毒组(virome)。肠道病毒组中约90%为原核病毒、10%为真核病毒,其组成受饮食、生活方式和年龄等因素影响,呈现显著个体差异。
在生态学层面,噬菌体通过对细菌施加选择压力重塑菌群结构,可与黏膜表面互作并跨越上皮屏障,同时调节免疫系统。因此,噬菌体并非单纯的“外源抗菌剂”,而是长期参与“微生物—黏膜—免疫”互作的常驻调控因子。
在生命周期层面,噬菌体可表现为裂解、溶原(前噬菌体)或慢性感染。溶原噬菌体可整合入细菌染色体并在特定触发因素下被诱导进入裂解周期;伪溶原性则允许噬菌体DNA在不利环境中以外染色体形式“待机”,在条件适宜时再进入裂解或溶原通路。
这些机制表明:肠道噬菌体组对菌群稳态的作用既可能体现为“抑制性捕食”(裂解),也可能表现为“功能性重塑”(溶原带来的基因与适应度效应)。这为噬菌体疗法用于肠道疾病提供了理论基础:通过引入特定裂解噬菌体,对关键病原体或致病共栖菌施加定点压力,从而实现菌群结构与功能的可控回调。

噬菌体疗法的“靶向层级”
将噬菌体疗法用于“肠道菌群精准编辑”时,靶点的定义通常可分为三个层级:物种—菌株—功能表型。
•物种层级(species-level):对已知致病或与疾病密切相关的物种进行清除或抑制;
•菌株/群体层级(strain-/pathotype-level):针对同一物种内部与疾病相关的特定致病群体(例如具黏附侵袭表型的菌株群);
•功能表型层级(function-level):以“代谢/毒力功能”定义靶点(例如“产酒精”或“细胞溶解型”表型),强调并非该物种的所有成员均为治疗对象。
★噬菌体选择性靶向并清除特定菌株
通过选择性靶向并清除特定菌株来调节肠道菌群平衡的思路是一致的,也更有助于解释胃肠及肠—肝轴相关疾病机制。
噬菌体的核心优势在于高度特异性,但这也带来宿主谱受限的问题。其宿主范围受感染过程和受体识别等多重因素限制,在临床应用中,宿主谱过窄是公认的主要挑战之一。多数感染或菌群失衡涉及多菌株甚至多菌种,因此往往需要多噬菌体组合(鸡尾酒或联合)以扩大覆盖范围。在治疗设计上,可区分三类“覆盖策略”:
窄谱噬菌体(多为菌株水平):适用于“精准编辑”,最大限度减少对非靶向共栖菌的影响;
相对宽谱噬菌体(同种多株或同属多成员):可降低匹配难度,但并非“广谱抗生素式”全面覆盖;
噬菌体鸡尾酒/联盟(phage cocktails/consortia):通过组合实现更大覆盖并降低耐受风险,实践中常用于应对肠道靶菌的菌株多样性及耐噬菌体进化。
需强调的是,在“微生物群治疗”的语境下,真正意义上的“广谱杀菌”通常并非目标;更契合这一领域价值主张的,是“定点削减关键致病共栖菌、保留有益群落”,以减少菌群失调和继发问题的风险。
基于噬菌体的肠道微生物组生态与基因工程

从感染性腹泻到IBD与CRC相关菌
噬菌体疗法在胃肠领域的研究正由传统感染治疗拓展至与慢病相关的菌群失衡。早期研究主要针对霍乱等感染,而现阶段已开始在溃疡性结肠炎(UC)的艰难梭菌相关结肠炎,以及克罗恩病(CD)中黏附侵袭性大肠杆菌(AIEC)的清除方面开展探索。
•噬菌体定点清除靶菌而不破坏整体菌群
该方向的共同逻辑是:以裂解噬菌体定点清除加重炎症或与复发相关的关键靶菌,从而在不显著破坏整体菌群的前提下恢复微生态平衡。
此外,胃肠领域的综述也将噬菌体疗法延伸至肿瘤相关菌,如将结直肠癌(CRC)相关的具核梭杆菌(Fusobacterium nucleatum)视为潜在靶点。在“菌群—肿瘤微环境”框架下,噬菌体的特异性为“削减疾病相关菌而非整体抑菌”提供了方法学基础,但目前人体临床试验仍然有限。
炎症性肠病和肝病被视为“精准编辑”应用的代表性场景,在这些疾病中通过精确调控微生物或相关因子实现有针对性的干预尤为重要。
炎症性肠病(IBD)的治疗
原则:选择性抑制病原体/致病共栖菌,尽量保留有益菌群。
IBD(包括CD和UC)与菌群失调密切相关。当前调节菌群的手段主要是饮食干预和抗生素治疗,但多重耐药的上升削弱了抗生素的效果,并突显出对新策略的需求。
在此背景下,噬菌体疗法被视为可行替代方案:通过选择性靶向并清除致病细菌来重塑肠道菌群,从而影响炎症进程及临床结局。
(1)UC相关:艰难梭菌(Clostridioides difficile)
艰难梭菌过度生长常由抗生素诱发,可加重UC症状;裂解噬菌体治疗被认为可能帮助恢复微生物平衡。其临床意义在于:在“抗生素引发或加重菌群失调”的情境下,噬菌体的定点作用有潜力降低“治疗—再失衡”的循环风险。
(2)CD相关:黏附侵袭性大肠杆菌(AIEC)
AIEC在CD中被视为重要致病相关群体。综述明确指出,裂解噬菌体疗法正用于探索根除CD中的AIEC,并可能通过清除该致病群体减少炎症与复发。
这一靶点体现了“菌株/致病表型层级靶向”的典型特征:同为E.coli,但治疗目标锁定为与疾病表型相关的特定群体而非全部大肠杆菌。
肝病的治疗
肠道菌群改变与多种肝病密切相关,肠道病毒组的变化也被报道与疾病发生有关。在此背景下,噬菌体疗法的定位正由单纯“抗感染”转向“通过定点清除关键靶菌来编辑肠道菌群”,为肝病干预提供新的路径。
•靶向Enterococcus在治疗肝硬化中有效
近期一项RCT显示,靶向特定Enterococcus物种的噬菌体治疗在肝硬化患者中“非常有效”。研究指出,噬菌体可特异性靶向细胞溶解型(cytolytic)E.faecalis,从而实现对肠道微生物群的精确编辑。其重要意义在于:治疗靶点从“属/种”进一步下沉至“功能/毒力表型”(如细胞溶解型),与前文所述的“功能表型层级靶向”概念相契合。
在肠—肝轴相关肝病中,目前明确的代表性靶点包括:
酒精相关肝炎/肝硬化:肠球菌属(Enterococcus)及E.faecalis(尤其细胞溶解型);
非酒精性脂肪性肝病:Klebsiella pneumoniae(产酒精克雷伯氏菌),是以“功能表型”界定治疗对象的典型例子。
这些靶点共同体现了肝病领域噬菌体治疗的主线逻辑:并非追求“广谱清菌”,而是针对与病理表型高度相关、且具可解释机制链的关键菌群成员实施定点干预,并观察肠道生态与肝脏结局能否实现同步改善。
噬菌体疗法开发的核心在于确保所用噬菌体的安全性与有效性,当前研究主要依赖体内动物模型或合适的体外系统进行评估。同时,宿主谱狭窄与噬菌体耐受进化是公认难题,实践中往往需采用鸡尾酒策略以扩大覆盖并降低耐受风险。
因此,在炎症性肠病(IBD)情境下,研究重点不仅是“找到能裂解靶菌的噬菌体”,还包括:如何应对患者间菌株差异、如何设计组合以抑制耐受出现,以及如何量化其对整体菌群结构与功能的外溢影响。
转化层面上,由于人体试验数量有限,标准化方案和可比终点仍明显不足。尽管噬菌体在胃肠领域已展现出“较为理想的安全性特征”并进入临床评估,但用于胃肠疾病治疗的人体试验仍偏少。
因此,要在肠—肝轴方向开展“可发表、可转化”的研究,需要:
1.明确靶点定义(物种/菌株/功能表型)、患者分层及菌株匹配策略;
2.采用可比较的疗效终点(如靶菌负荷、菌群结构与功能指标、炎症与肝功能指标等);
3.系统评估耐噬菌体出现及菌群外溢效应风险,并据此论证鸡尾酒策略的必要性。
监管与安全性关注点
多个综述一致强调:西方主流监管机构尚未全面批准噬菌体用于常规人用治疗,主要担忧包括噬菌体耐药、对细菌基因组进化的影响、对人体微生物群的影响等;目前更多是在“同情用药”框架下开展个案或探索。
2019年人类微生物群焦点综述进一步把监管审批的科学问题具象化为三问:
•外源噬菌体治疗是否影响微生物群?
•是否影响非靶向共生菌?
•是否出现耐噬菌体突变体,其对微生物群平衡的影响是什么?
并指出现有文献稀缺且结论不一致。
•要注意肠道环境带来的“药物递送”问题
肠道环境的酸度与离子条件可显著影响噬菌体稳定性与滴度;例如空腹人胃pH中位数约1.7,而消化道部分区域pH可>6。因此口服噬菌体疗法常需抗酸策略(抗酸剂、包埋/包衣保护基质)。
这一点对“肠道微生物群编辑”的临床可重复性尤为关键:疗效的不确定性可能来自递送失败而非生物学无效。
主要争议与关键科学问题
需要从“仅仅证明治疗有效”进一步走向“疗效可预测、过程可监管”,实现从单点结果到全程可控的升级。
•宿主谱狭窄与鸡尾酒策略
噬菌体宿主谱狭窄既是优势也是临床障碍;多数感染或失衡为多菌种/多亚型并存,需多噬菌体组合扩大谱系。但鸡尾酒带来配方复杂性、生产一致性、批间稳定性与监管评估难度。
•耐噬菌体进化与共进化外溢
噬菌体—细菌呈捕食—猎物系统并持续共进化,细菌可快速产生耐受突变,噬菌体也可反适应。
鸡尾酒可通过叠加选择压力限制细菌对单一噬菌体的耐受进化。然而,在肠道这样高度异质且多物种互作的生态位中,耐受突变体与原菌株、其他共栖菌的竞争关系可能改变群落结构与功能,导致结果偏离体外培养预测。
•免疫反应与炎症风险
裂解噬菌体可能造成快速大量细菌裂解释放细胞壁成分与噬菌体蛋白,可能触发宿主免疫反应并诱导抗体,影响安全性与重复给药有效性。这也是需要系统研究“噬菌体—免疫”相互作用与合理剂量方案的原因。
•噬菌体选择标准不清与公共库缺乏
几篇权威研究一致指出:治疗性噬菌体选择不能只看宿主谱,还应考虑感染静止期细菌能力、酶活性、血清失活稳定性、突变率等指标;同时公共噬菌体库匮乏导致研发重复、共享不足、难以快速匹配患者菌株。这直接限制了“个体化噬菌体疗法”的规模化与规范化。
★ 什么是噬菌体?
噬菌体是一种感染细菌的病毒。
★ 噬菌体是如何工作的?
噬菌体附着在细菌细胞表面,并将其遗传物质注入细胞内。这些物质随后接管细胞,利用其资源制造更多病毒拷贝。
★ 噬菌体是如何感染细菌的?
噬菌体基因组接管宿主的代谢机制,利用它来生产新的噬菌体。最终,宿主细胞被裂解(破裂)以释放新的噬菌体,这些噬菌体随后可以感染其他细菌。
★ 噬菌体在生物学中有什么重要意义?
噬菌体在控制细菌数量方面发挥着关键作用,防止细菌过度繁殖并对其他生物造成危害。
★ 噬菌体在医学中是如何被利用的?
为抗生素耐药感染的替代治疗方法。它们可以外用或口服,在某些情况下已被证明能有效减少感染中的细菌数量。
将噬菌体送达胃肠道环境
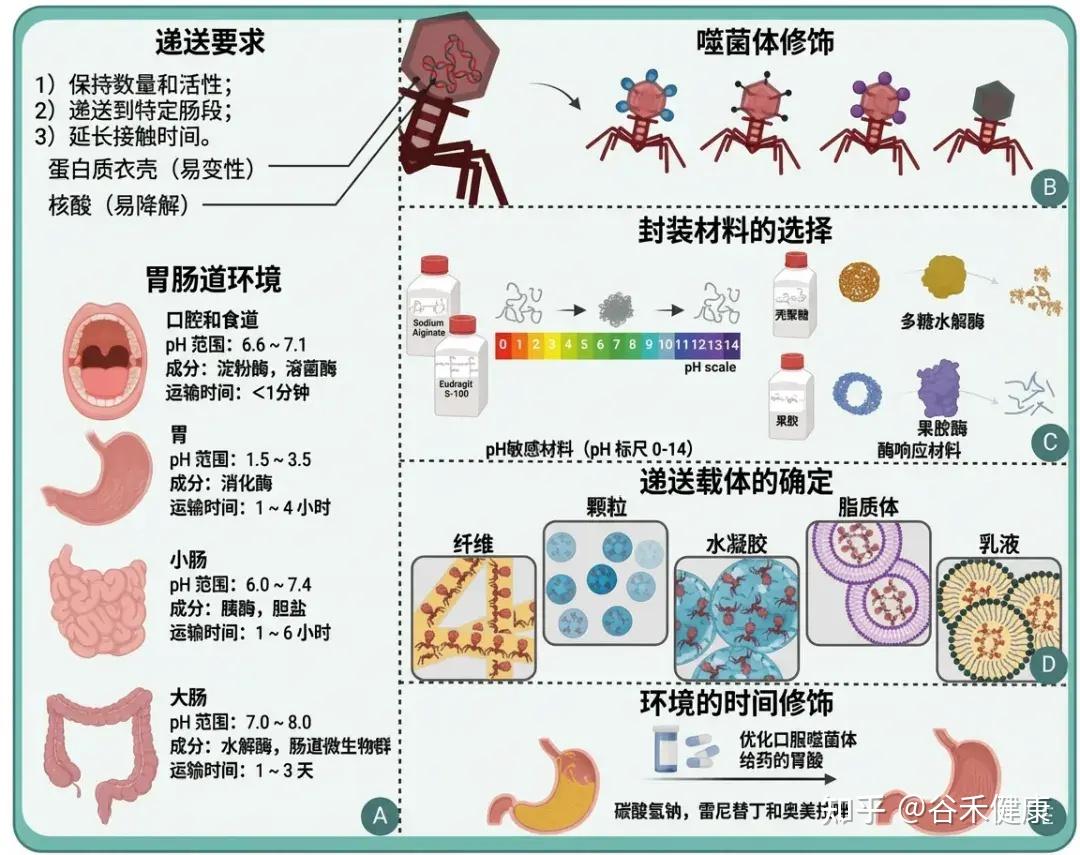
(A)噬菌体给药背景;(B)噬菌体的修饰;(C)封装材料的选择;(D)确定投递承运人;(E)环境的时间性变化。
★ 噬菌体是抗生素更好的替代品吗?
在某些情况下,噬菌体可能是抗生素的有用替代品,尤其是在导致感染的细菌具有抗生素耐药性时。
★ 使用噬菌体有哪些好处?
噬菌体可用于对抗细菌感染,因为它们具有高度特异性,能够针对特定类型的细菌。这常被用作抗生素的替代方案,因为它更具针对性,且对患者产生不良反应的可能性较低。
★ 使用噬菌体会有风险吗?
一个潜在风险是细菌耐药性的发展,因为病毒可能变异并对噬菌体产生抗药性。负责任地使用噬菌体并监测任何抗药性迹象非常重要。
主要参考文献:
Kuang X, Shen J, Zheng L, Duan Y, Ma Y, Leung EL, Dai L. Applications of bacteriophages in precision engineering of the human gut microbiome. Eng Microbiol. 2025 Jan 6;5(1):100189.
Sheraz, M., Shi, H. & Banerjee, S. Human Microbiome and Bacteriophages: Impacts on Health and Disease. Curr Clin Micro Rpt 12, 7 (2025). https://doi.org/10.1007/s40588-025-00243-2
Divya Ganeshan S, Hosseinidoust Z. Phage Therapy with a Focus on the Human Microbiota. Antibiotics (Basel). 2019 Aug 27;8(3):131.
De P, Bhat VG, Kamath V, Kolathur KK, Mazumder N. Insight into Bacteriophage Therapy for Bacterial Infections and Cancer. Mol Biotechnol. 2025 Jul 9.
Bozidis P, Markou E, Gouni A, Gartzonika K. Does Phage Therapy Need a Pan-Phage? Pathogens. 2024 Jun 20;13(6):522. doi: 10.3390/pathogens13060522.
Chen X, Mendes BG, Alves BS, Duan Y. Phage therapy in gut microbiome. Prog Mol Biol Transl Sci. 2023;201:93-118.doi: 10.1016/bs.pmbts.2023.04.005.