-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
粪菌移植(FMT)这几年很热,表面看,它的逻辑很直白:将健康人的肠道菌群移植到患病者体内,期望借此改善肠道微生态,帮助缓解疾病症状。但是,同样是 FMT,为什么有些人效果明显,甚至症状得到了长期缓解,而有些人却反应并没有达到预期?
其关键在于供体菌群能否在受体肠道定植并长期维持。
定植并不只是看移植后肠道菌群更像供体,而是看供体菌株是否能在受体体内站稳脚跟、稳定下来,并在长期的群落动态中维持。这个过程背后,涉及到很多因素——包括供体和受体肠道环境的相似度、供体菌群的多样性、移植方式等等。
目前,越来越多的研究开始聚焦于供体菌株的定植效率。换句话说,供体菌群是否真的能够在受体肠道环境中稳定生长,功能性地替代或补充原有群落。这是 FMT 成功的一个关键因素。
而定植的成败又受到多方面因素的共同影响,包括微生物物种之间的兼容性、菌株之间的互补性,以及肠道环境本身的特性。在不同的疾病状态下,影响定植效率的因素可能截然不同。
近期的两项大型随机对照试验(FOCUS Trial 和 Gut Bugs Trial)对这两种疾病背景下 FMT 的效果进行了深入分析,其研究结果发表在《Gut Microbes》期刊上。

研究表明,在溃疡性结肠炎的队列中,供体和受体菌群的相似性越高,定植效果越好;而在肥胖的队列中,更大的相似性反而可能降低定植效率,反而更互补的供体-受体匹配可能更有利。
本文我们将通过这两项试验的数据,探讨影响 FMT 定植效率的关键因素,并分析其如何在不同的疾病背景下产生不同的效果。随着对 FMT 机制的深入了解,未来我们也许能在个性化医疗的框架下,根据患者的疾病背景和微生物特点,更精确地选择供体和设计治疗方案,从而提高 FMT 的疗效。
许多FMT 研究会先用群落层面的指标(如 PCoA、α 多样性)说明受体菌群是否更像供体。但这类指标回答的仍是整体相似性问题。尤其在单供体 FMT 中,供体来源相对明确。
在多供体 FMT 设计的实际应用中,还有更棘手更具体的问题:
后面所有“哪些因素影响定植”的统计分析,都是围绕这个问题展开的。本章先把作者怎么定义与计算定植效率讲清楚。
多供体FMT第一道坎:究竟谁给了谁?
单供体 FMT 比较直观:受体出现一个新菌株,大概率来自那位供体。
但在溃疡性结肠炎(UC) 的 FOCUS 试验里,每次用的是 4–7 位供体混合。于是会出现两个麻烦:
所以作者先做了一个基础动作(逻辑很简单):
把受体治疗后样本里的菌株,拿去和每位供体的菌株做DNA 相似度比对,足够像就可以算供体匹配菌株(donor-matching strain)。
再统计一个受体样本里,能匹配上的供体菌株有多少——这就是后面要用到的定植相关指标的基础。
怎么“用菌株匹配”拼出每个受体的供体来源
这一步相当于在反向破案。
先定一条线——多像才算同一菌株
作者用 StrainPhlAn3 估计每个样本在每个物种里的“主导菌株”,再算菌株间 DNA 距离,并做了归一化(不同物种的菌株差异天生不一样,不能直接比)。
下图对比了两类距离:
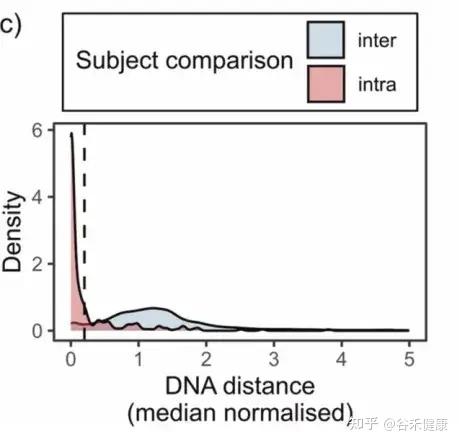
然后画了一条阈值线:0.2。
作者把距离 ≤0.2 当成是“同一菌株/高度匹配”的层级。
注:这条线很重要,因为后续所有“某受体匹配到某供体菌株”的判断,都建立在这个阈值上。
不同队列/测序条件下最优阈值不同,且优化阈值能显著提升配对预测的整体表现
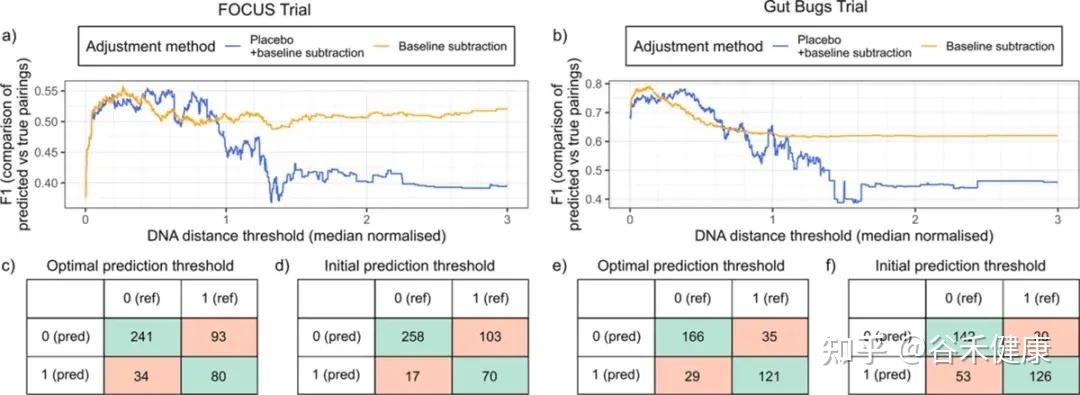
你可以把它理解成:作者先用数据告诉你,同一个人的前后样本(或者同来源)通常会落在怎样的距离范围,再在这个分布上划一个相对保守的界限,用它来决定是不是同一株。
安慰剂组里也会出现看似匹配的噪音,所以要剔除模糊供体菌株
你会注意到一个事实:安慰剂组里也可能出现一些供体匹配菌株 ——这显然不能被解释为真的做了 FMT。这类匹配可能来自背景噪音、算法阈值的误差、或某些菌株本来就在群体里很常见导致碰巧接近。

所以作者在 Figure 1b 做了关键一步:
把安慰剂组里出现的这些模糊供体菌株(ambiguous donor strains)当作噪音来源,从 FMT 组数据里移除,再重新画热图。这样就尽量避免把“背景共有菌株”误判成“FMT 导致的定植”。
这也是多供体、菌株匹配分析里比较严谨的一点:不是匹配上了就算,而是还要问一句,在没有 FMT 的情况下,这种匹配会不会也出现?
反推每个受体可能接到了哪些供体
剔噪后,下图统计每个受体匹配到的菌株分别来自哪些供体,用不同颜色表示不同供体贡献。
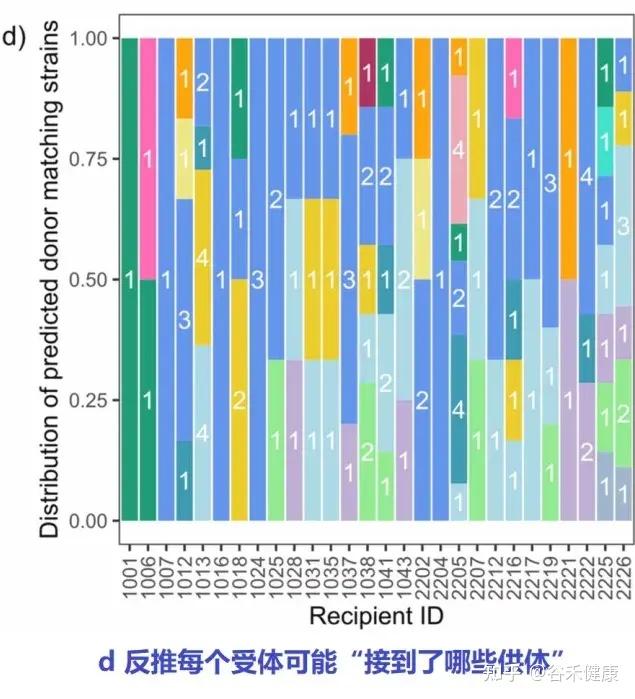
FOCUS 的 FMT 组里,28/32 名受体在 8 周能检测到“只在 FMT 组出现且基线不存在”的供体匹配菌株。
也就是说:大多数人确实能看到来自供体的新菌株信号。
在结果里把定植拆成了两类:新增与替换
同样叫“定植”,机制可能不同。
对每个发生定植的物种—菌株事件,看受体基线有没有这个物种:
注: 这两类在生态学上差别很大:
替换意味着同物种内的菌株竞争、基因型差异、以及原有菌株的生态位被重新占据;
新增更像是受体原来缺失的成员被补齐,或者说受体生态系统里存在可被填补的空位。
这一步很必要,因为它会影响你怎么理解后面供受体相似/不相似:
这也解释了为什么后面在不同疾病队列里,相似性指标的方向可能不一样。
那么,“定植效率”在本文里到底是什么
把“能住下来多少菌”变成一个数字。
当研究人员能数清,受体里到底出现了多少个“可追踪的供体匹配菌株事件”后,就能把它汇总成一个可建模的因变量:
供体的定植效率(engraftment efficiency)。
注:可以粗略地理解为供体带来的、能被追踪到的菌株,在受体体内“留下来”的程度。
后面所有模型(相关性、线性模型、线性混合模型)基本都是:用 定植效率 当结果,看看它和哪些因素有关。
到这里,作者先解决了“没配对表也能继续分析”的卡点。接下来进入论文真正想回答的核心:
哪些因素决定菌株能不能定植?
这种规律在不同疾病人群里是不是完全不同?
两个队列:UC vs 肥胖
作者选了两项双盲、随机、安慰剂对照的多供体 FMT 临床试验:
为什么要用两项试验来说?
这里研究人员认为,如果“哪些因素决定定植”是一条普遍规律,那么换一个疾病队列也应该差不多;如果规律会变,那说明定植机制是队列/疾病特异的。
FOCUS:强干预、长疗程、但测序相对浅
FOCUS试验对象:患有溃疡性结肠炎(UC)的成年人。
FOCUS(UC)试验采用多供体粪菌制备的灌肠剂及胶囊,给UC患者的治疗方案很猛:
采样与数据方面,作者为了让前后对比简单且可比,主要选了:
受体:基线 + 8 周(FMT 组与安慰剂组)
供体:个人供体样本 + 混合供体批次样本
对菌株来说,这是一个供体数量可变、竞争更复杂的输入环境。
Gut Bugs:供体数固定、胶囊给药、测序深
Gut Bugs Trial是另一种更标准化的多供体:
采样时间点:基线与6周(尽量对齐“即时干预后”)。
这些结构差异会怎么影响定植效率?
两项试验虽然都叫多供体,但 FOCUS 的结构更像供体数量可变的混合生态输入,Gut Bugs 更像供体数量固定的标准化输入。
在 FOCUS 里,受体面对的是 4–7 个供体生态位的竞争,而且批次大小(batch size,即每位受体的供体数量)在模型里被作者作为固定效应单独纳入(因为它会影响每个供体成分能否留下来)。
在 Gut Bugs 里,供体数恒定为 4,所以作者明确说明:不把 batch size 当作固定效应。
这会让后面的相关性(比如β多样性与定植效率的方向)更可能呈现队列差异。
再看分析结构:为什么FOCUS能盲法预测配对,而Gut Bugs更多是验证
Methods 里还特别强调了一个分析流程上的差异:
FOCUS 试验:作者在一开始不知道真实供体—受体配对的前提下,先用供体菌株匹配去反推每个受体可能用了哪些供体(盲分析)。之后才从原试验作者处拿到真实配对,用于验证与后续分析。
Gut Bugs 试验:真实配对关系在此前已发表,因此无法再做同样的盲法预测;它在该文章中的角色更像是验证集,验证这套菌株匹配框架在另一种疾病队列里是否还能工作、结论是否一致。
FOCUS更偏向从0推断供体贡献,Gut Bugs更偏在已知答案下验证规律是否可迁移。
FMT的定植不是供体越强越好,也不是受体越空越好,而是供体携带的菌株库、受体基线生态位,以及两者的匹配关系共同决定。
同样是健康供体,有的人就是更容易送进去
很多人会以为:多供体混在一起,最后效果应该差不多“平均掉”。但原文首先用数据把这个想法打破:供体之间的平均定植效率差异显著(p<0.001)。
更直观的是 FOCUS(UC)队列里两个常见供体的对比:
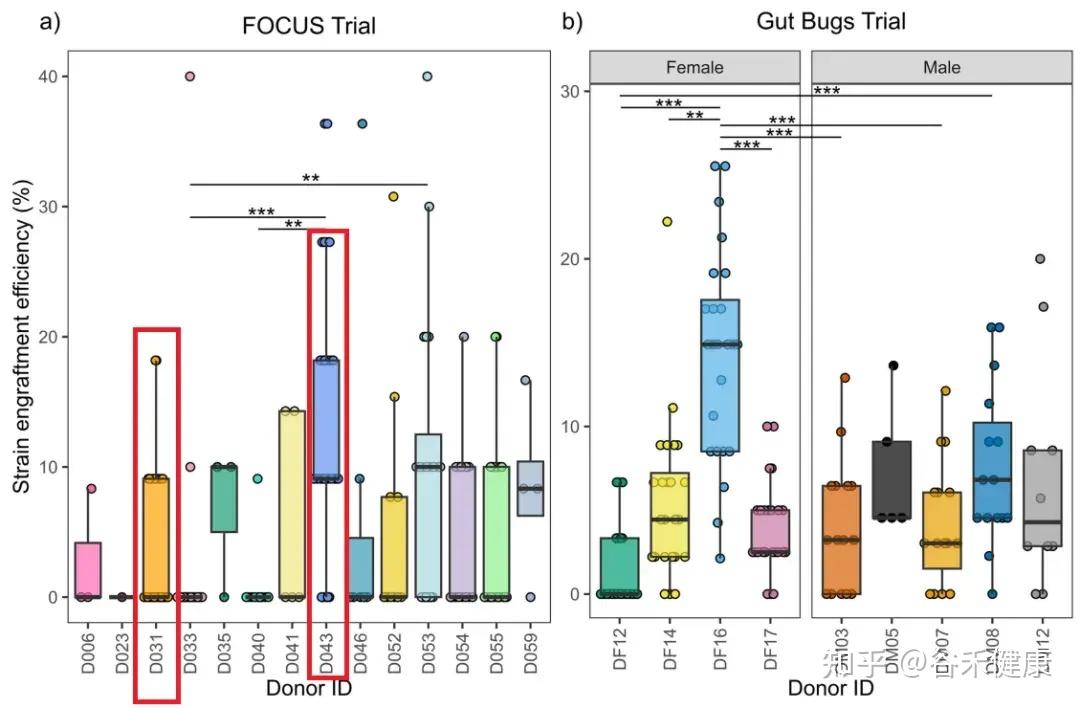
可以看到供体之间差异显著,比如说FOCUS里面:D043、D053 高,D033、D040 低;Gut Bugs里面:DF16 高、DF12 低。
而且这两位供体都被大量使用(分别对应 n=29、n=26 个受体)。这意味着:不是谁用得多谁就看起来强,而是供体本身确实存在可重复的可定植性差异 。
反转:用“匹配度”量化后,两队列规律不同
这个供体适不适合这个受体,它不靠主观印象,在这里研究人员用β 多样性把匹配变成可计算、可检验的量,并发现两队列的关键信号落在不同层面。
在 FOCUS(UC)队列中,供受体的功能谱越接近,供体菌株越容易留下来:
研究人员还进一步做了“按单个 COG 类别差异”去解释的线性模型,但没有找到某一个功能单独驱动的证据,因此提出更合理的解释:这更可能反映的是整体功能的互补性/匹配,而不是某一个功能类别单打独斗。
在 Gut Bugs(肥胖)队列中,功能 β 多样性并没有显著影响定植效率(下图显示相关性不显著)。也就是说,至少在这个队列与这套数据里,“功能越像越好”并不是主导信号。
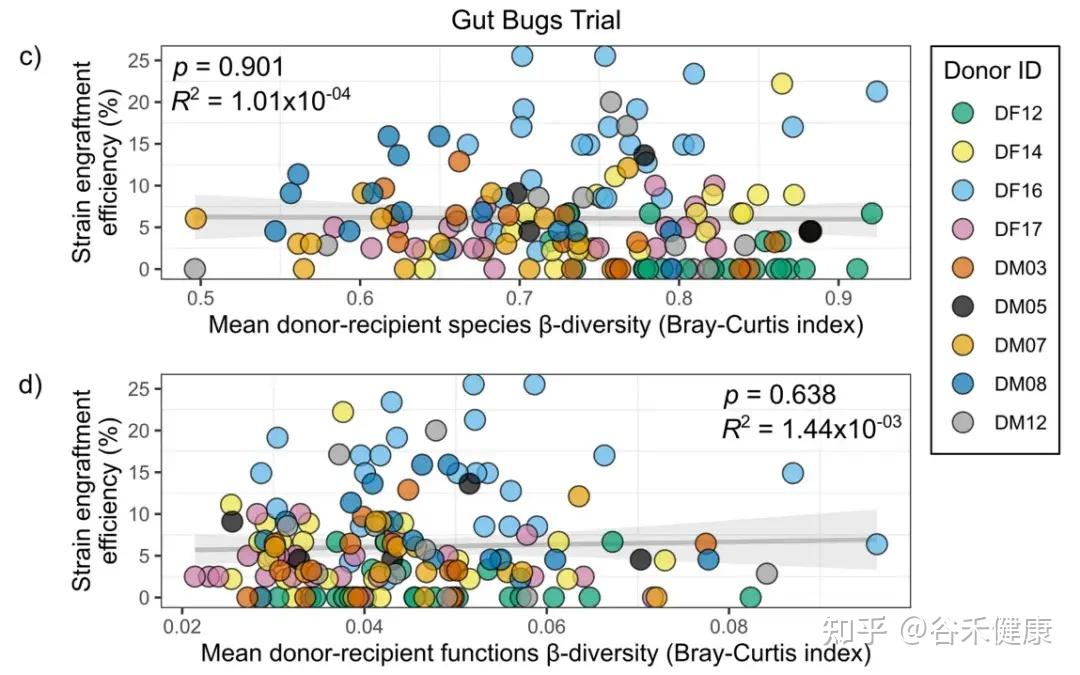
但 Gut Bugs 的匹配信号并不是不存在,而是体现在更接近缺口的指标上:
Jaccard更像在问:受体缺不缺这个物种席位。缺得越多,供体带来的成员越容易补进去。
简单来说,就是UC 队列更像功能上别差太远更容易留下(兼容性/匹配);肥胖队列更像物种上更不一样反而更容易留下(互补性/空位)。
这不是一句话能简化的供体筛选公式
到这里你已经知道为什么会被概括成相反规律:FOCUS(UC)更强调兼容性/匹配(尤其功能层面),Gut Bugs(肥胖)更像互补性/空位(物种有无层面的缺口)。
但这不等于能把它简化成一个选供体公式。下一章节的P/B模型会提示:供体强弱不仅是供体自身属性,还会受受体本身的影响(存在交互项)。换句话说,匹配本身就是关键变量。
原文还提到 D043 有一个很醒目的特征:
它是所有供体里面唯一的一个,平均 Prevotella/Bacteroides(P/B)比 > 1(也就是 Prevotella 更占优势)的供体,这个特征在一些研究里被联系到所谓“超级供体”现象。作者在这里比较谨慎:他们并不武断地说D043 就是超级供体,而是提醒你,它被用得多,也可能本身更容易定植。
α多样性不是越高越好,更像一个最低门槛
很多 FMT 文章都喜欢讲多样性,但这篇文章的结论更接近真实世界:多样性有用,但不是线性万能解释。
在 UC 的 FOCUS 队列里,作者观察到一个挺像门槛的现象:当供体 α 多样性(Shannon)比较低(大约 < 2.5)时,供体—受体配对更容易出现 0% 定植效率。
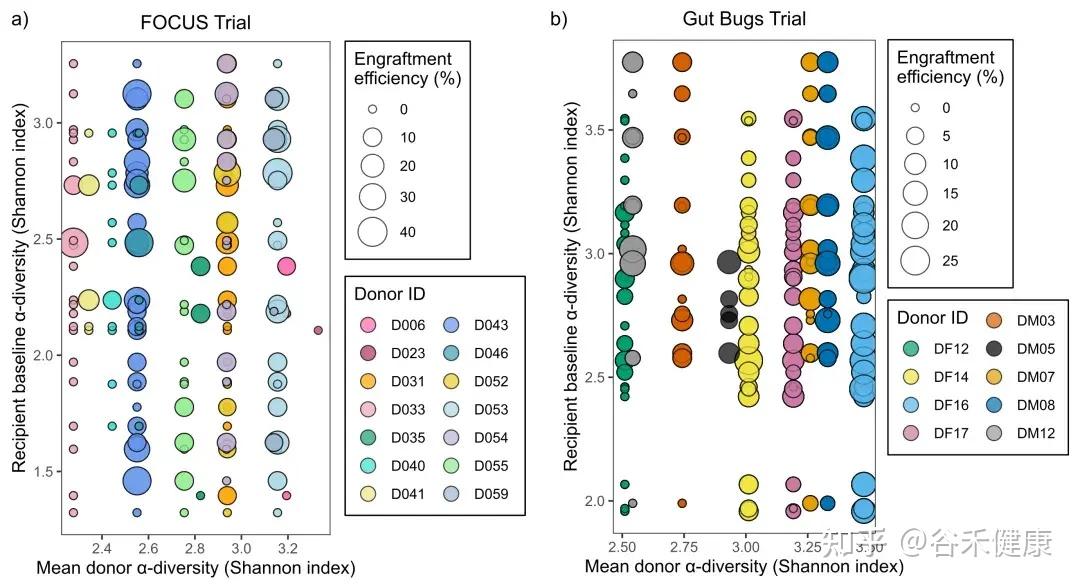
图中比例差异很明显:低于 2.5 时 86.5% 配对为 0%,高于 2.5 时下降到 44.9%.
也可以这样理解,供体群落太单薄,可输出的菌株本来就少,想在受体里留下来更难。
关键是:当供体多样性在常见范围内时,供体多样性与定植效率并没有稳定线性相关(FOCUS:p = 0.955;Gut Bugs 也未显著)。研究人员还强调,两项试验里都出现过“受体 α 多样性反而高于供体”的情况。于是,简单用“供体更丰富→就更能定植”来解释就站不住了。
P/B 比:一个很能用的群落标签(供体端与受体端)
作者用了一个相对好理解、也常用于描述群落结构的指标:Prevotella/Bacteroides 比例(P/B 比) 。有的人肠道菌群里 Prevotella 占优势,有的人 Bacteroides 占优势。
在两项试验的线性混合模型(Figure 6)里,P/B 比给出了比较稳定的信号:
供体 P/B 比越高,定植效率越高 FOCUS(b = 6.28, p = 0.023),Gut Bugs(b = 3.83, p = 0.036)。
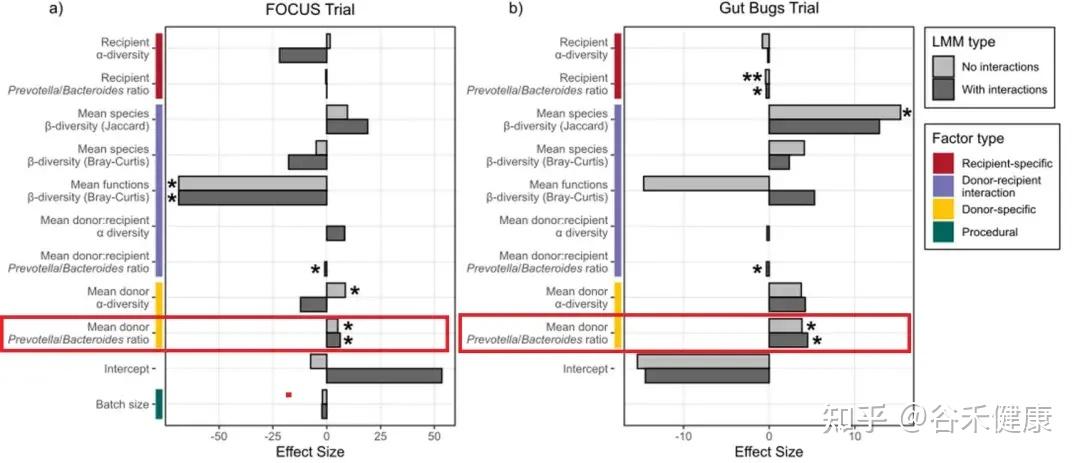
但 P/B 比并不是说,供体越偏 Prevotella 越好这么简单。
受体端与交互:同一供体,在不同受体身上不一定一样
模型同时显示:受体端的 P/B 比、以及供受体之间的组合关系,会显著改变这种供体优势的作用方式。
首先看 Gut Bugs(肥胖)队列:受体 P/B 比对定植效率是显著负向的(b = -0.424, p = 3.77×10^-3)。这意味着在这个队列里,受体本身越偏 Prevotella(P/B 越高),总体上越不利于供体菌株定植。可以理解为:当受体群落已经更偏向某一类“Prevotella 型结构”时,可被外来菌株占据的生态位更少(或同类竞争更强),因此总体定植更难发生。
再看 FOCUS(UC)队列:作者不仅看到供体 P/B 的正向主效应,还看到了一个显著的供体×受体 P/B 交互项(b = -0.899, p = 0.017)。
交互项为负的意思是:偏 Prevotella 的供体并非对所有受体都同样有效;当受体本身也偏Prevotella 时,供体的这种优势更可能被抵消,甚至变成同生态位的竞争。
可以这样理解:供体端的某些群落结构会加分,但受体端也会把关,而且不同疾病背景下,把关方式不一样。
总体思路:对的人 + 对的生态位规则
肠道菌群检测报告可以作为个性化 FMT 的入门级决策与随访工具:一方面用于治疗前分层与配对,另一方面用于治疗后量化是否定植、改了什么,并将结果回收为下一轮配对的证据。
该研究作者甚至强调应建立针对每种疾病的特异方法学,并提出 FMT 的真正潜力应以个体化医学实现:根据疾病/亚型,把受体与一个或多个最可能带来有益菌定植的供体进行配对。
这意味着:
同一份菌群报告,在不同疾病里“怎么解读、怎么用来配对”,规则不应相同。
个性化 FMT 的核心是两件事:
这里的落地流程(四步闭环):
筛受体 → 筛供体 → 做匹配 → 评估与复盘
治疗前——患者分层(用哪套匹配方案)
一份肠道菌群检测用于分病种策略选择,同时缩小供体候选池:
把菌群平衡指标作为受体“微生态脆弱程度”的一个粗筛维度,用于确定是否需要更强的干预(如多次给药、路线选择、随访更密集等),以及作为后续是否改善的评估指标之一。
把多样性作为“受体可被改造程度/生态位可用性”的基础变量。前面的研究也讨论到,跨疾病的 Meta分析中受体 α 多样性与定植常存在关系,但在不同队列呈现不同交互与权重,所以不能只用一个阈值做所有病种的决策,更合理的是在某病种人群里建立自己的判读边界。
哪些常见核心菌群、产丁酸相关菌、黏液层相关菌、有益菌等缺位,决定了后续更偏向新增还是替换。
简单来说,先别急着挑供体,用检测回答:这个受体的底盘是缺位型还是紊乱型,以及属于哪种疾病队列的生态规则。
供体筛选:从安全合格走向微生态特征可量化
传统供体筛选主要是安全(病原体/寄生虫等),而该研究认为,供体的物种组成、功能结构,以及与受体的互补/相似关系,会影响定植效率。
因此供体筛选至少要增加两层可量化标准:
基础质量指标:供体的 α 多样性、关键结构特征(例如 P/B 比在研究里被作为指标之一,也可以同时用其他的相关指标)。
报告列出多种有益菌(如 Lactobacillus、Bifidobacterium等)的丰度与检出情况,可作为供体是否具备可提供的功能模块的证据(例如 产丁酸相关菌群)。
有害菌总体是否过高、以及抗生素耐药风险评估等,可作为长期可用供体库管理的一部分。
供体稳定性:如果供体多次采样,观察其菌群波动(稳定供体更利于可复现)。
供体受体匹配:建立按疾病分轨的匹配规则
该研究给出的最重要启示,是同样的供受体差异度指标,在不同疾病队列里方向可能相反:
炎症性肠病类疾病(更强调功能兼容)
匹配优先级:供受体在功能维度不要差太远(避免来者水土不服),同时供体能补足受体缺失的关键菌群。
可以用谷禾检测报告里的菌群平衡、多样性等指标先做受体分层。炎症类可考虑供体中抗炎/屏障模块相关指标更好的(例如肠道屏障、LPS等指标),并避免在受体本已存在风险提示的方向上进一步加重。
屏障不足者在方案上更强调先稳环境再引入,并把屏障改善作为疗效评估的一部分,而不只追求菌的变化。
如果条件允许,可以用宏基因组做供受体功能匹配。
代谢类疾病(更强调生态位空缺)
匹配优先级:在安全与稳定的前提下,供体应能提供受体缺失的菌群模块;供受体在物种组成上适度拉开差异,可能更利于新菌株进入。
对多供体方案,可进一步用供体间互补减少内耗,避免多个供体在同一生态位高度重叠、彼此竞争导致有效输出下降。
匹配不是一个公式,而是一个分病种的规则库。
当疾病队列的生态位规则复杂、且个体差异大时,多供体更像提高覆盖率的工程策略;但最终仍需靠检测把贡献拆开、把有效组合沉淀下来。
治疗后评估——用同一套指标呈现是否定植
随访时不只看整体更像谁,还可以拓展一些:
这一步形成反馈:把这位患者用什么供体组合更容易定植沉淀为可复用规则,推动下一次配对更精确。
注:做前后评估要尽量保持同一检测平台与标准化流程。
这项研究真正的价值,不只是告诉我们某个供体更强,而是把FMT推进到更精细的层面: 从看群落像不像推进到追踪菌株能不能留下来,并提示不同疾病人群的肠道微生态规则不同。
当我们开始用整个肠道微生态的思路去理解FMT, 就不仅是找一个最强供体,未来更可行的路径是:分病种建立可验证的匹配策略,把治疗做成一套可测量、可比较、可迭代的闭环:治疗前的受体分层,治疗中的供受体匹配,治疗后的定植追踪与反馈,从而让 FMT 更接近可计算的精准干预。
主要参考文献
Behling, Anna H., et al. “Cohort-specific determinants of donor strain engraftment following multi-donor faecal microbiota transplantation in two randomised clinical trials.” Gut Microbes 17.1 (2025): 2597628.