-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
刚过去的九九重阳节,唤起了我们对“长长久久”的生命期盼,这是根植于我们文化深处的向往。而今我们期盼的,不再只是生命时钟的不断前行,更是那份长长久久的能够自由行走、清晰思考、感受生活美好的“生命质量”。
衰老,正是稀释生命质量、为晚年带来挑战的关键因素。因此,理解衰老、干预衰老,让每一段生命都充满活力,成为了比单纯追求“长久”更重要的时代课题。

为何同龄人中,有些人看起来精力充沛、容光焕发,而另一些人却似乎被岁月过早地刻上了痕迹?
当看到市面上琳琅满目的NMN、NAD+补充剂,或是主打“肠道健康”的益生菌时,是否也曾好奇:这些宣称能“逆转时光”的产品,其背后真正的科学逻辑是什么?
…
衰老是一个每个人都无法回避的自然的生物学过程,包括基本生理功能的逐渐衰退和进行性衰老。随着年龄的增长,衰老加速,导致细胞内损伤积累,增加年龄相关疾病的易感性。衰老影响每个人,但对每个人影响的程度不同。
近年来,科学界已经逐步确定了一系列导致细胞、组织和整个生物体衰老的生物学过程,这些被扩展到包括衰老的十四个关键标志。它们包括基因组不稳定性、端粒磨损、表观遗传改变、蛋白质稳态丧失、细胞自噬失能、营养感应失调、线粒体功能障碍、细胞衰老、细胞外基质变化、干细胞耗竭、细胞间通讯改变、慢性炎症、菌群失调、心理-社会隔离。
这些特征为理解衰老过程提供了一个基本框架,并且相互之间有着深刻的联系。其中,免疫力下降、肠道菌群失衡和慢性炎症这三个因素相互影响,形成了一个加速衰老的恶性循环。简单来说,肠道不健康会削弱免疫功能,免疫力差又会让肠道问题更严重,最终导致全身慢性炎症,而这种炎症正是心脏病、糖尿病、老年痴呆和癌症等多种年龄相关疾病的共同土壤。
在这个复杂系统中,饮食营养扮演了连接环境、肠道与宿主免疫的中心枢纽角色。因此,我们的餐盘实质上成为了调控自身衰老速度和健康轨迹的“遥控器”。饮食中的每一个选择,都在向这个复杂的“微生物-免疫-炎症”网络发送信号,或促进平衡与修复,或加剧失调与衰败。
传统的营养学常常聚焦于维生素、矿物质等已知营养素。然而,前沿科学发现,食物中还存在大量曾被忽视的“营养暗物质”,如植物化学物质、多酚等。它们虽非传统必需营养素,却在调节健康、对抗衰老中扮演着至关重要的角色。
例如,石榴中的鞣花单宁,需要经过特定肠道微生物的代谢,才能转化为近来在抗衰老市场备受追捧的尿石素A(Urolithin A),后者已被证明能有效清除衰老线粒体,恢复细胞活力。这完美诠释了饮食、微生物和抗衰老之间的精妙联系。
在这些复杂联系之外,现代AI技术正为我们提供了系统化解决方案。目前,人工智能驱动的精准饮食干预将海量的多组学数据转化为可操作的饮食建议,通过分析生物年龄较高或较低人群的数据,机器学习模型能够识别出哪些特定的饮食模式、食物来源的信号分子或肠道菌群特征是“减速”或“加速”衰老的关键驱动因素。最终,可以为个体量身定制饮食方案。
本文将带您深入这一前沿领域,探讨肠道菌群失调与免疫衰老之间如何形成恶性循环,并共同催生“炎症衰老”,我们将了解各种干预方式,是如何成为打破这一循环、调控我们衰老速度的强大工具。
随着年龄增长,我们常常感觉身体变得更脆弱了:更容易感冒,伤口愈合得更慢,恢复得也更吃力。这背后一个很重要的原因,就是我们身体内部的免疫系统发生了变化。免疫力的衰退,即免疫衰老,是衰老过程中的一个核心环节。
这种变化主要体现在两个方面:
衰老过程中先天与适应性免疫系统的变化共同导向炎症性衰老状态
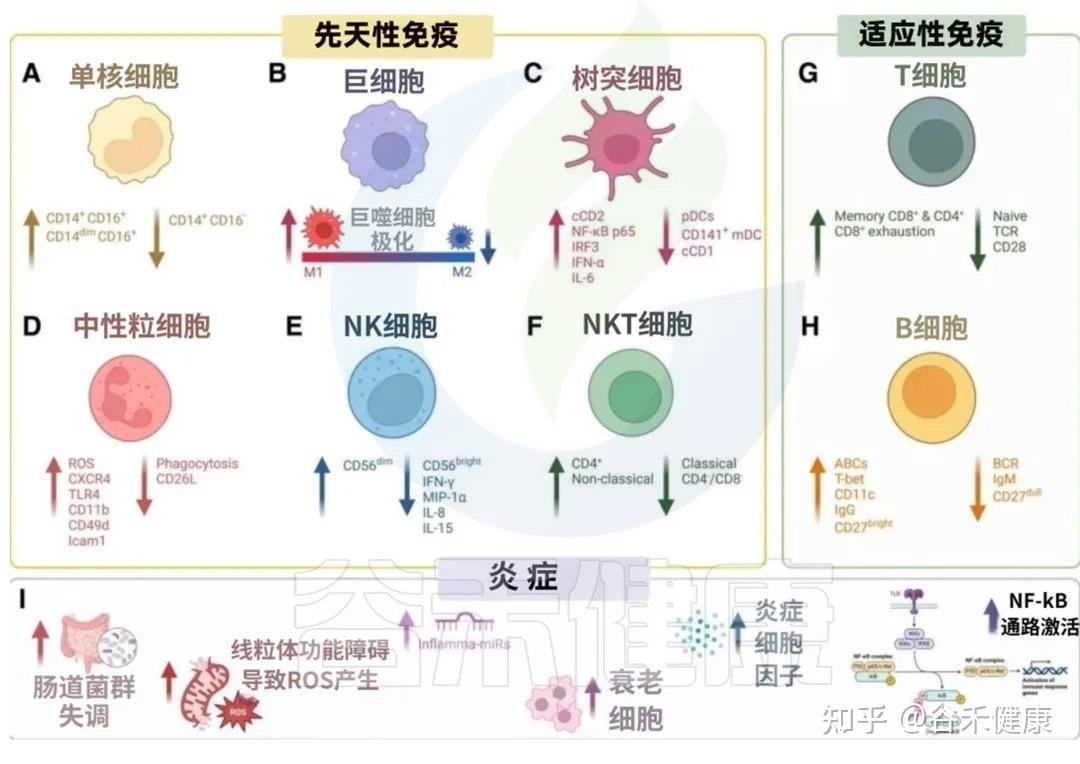
我们来看看衰老是如何影响我们免疫军队的两大核心分支的:先天免疫系统和后天免疫系统。
先天免疫是我们与生俱来的、快速反应的防御系统,是抵御病原体的第一道防线。但随着衰老,这支部队的效率和精确性都大打折扣。
这种功能失调的背后,涉及多种免疫细胞的变化。以下,我们将首先探讨先天免疫系统在衰老过程中的具体改变。
单核细胞:平衡 ➜ 促炎(经典型↓ 中间型、非经典型↑)
从单核细胞看炎症体质的形成:为什么你会感觉身体总在发炎?
在年轻健康时,单核细胞在血液中循环,一旦机体出现感染或损伤,便会迅速赶往炎症部位,并在此分化为巨噬细胞或树突状细胞。单核细胞还能吞噬病原体,并分泌信号分子,精细调控炎症反应。
根据细胞表面的蛋白标志物,人类单核细胞大致可分为三种主要表型:
▸ 衰老带来的失衡
研究表明,衰老导致:
值得注意的是,血液中单核细胞的总数通常保持稳定,这说明衰老的影响主要体现在细胞亚群的功能重塑上,而非数量变化。
▸ 这会带来什么后果?
这种细胞亚型的转变,意味着体内能高效分泌促炎因子的细胞群体增多,这直接助长了“炎症衰老”的慢性炎症状态,并削弱了机体有效修复损伤的能力。
你可能在体检报告上看到高敏C反应蛋白(hs-CRP)的指标,该指标升高往往与体内促炎单核细胞数量或活性增加、持续释放炎症因子有关。hs‑CRP 被视为心血管疾病等多种慢性病的风险预警信号。
巨噬细胞:平衡 ➜ 促炎( M1型↑ M2型↓ )
如果说单核细胞是血液中的巡逻兵,那么巨噬细胞就是驻扎在身体各组织(如皮肤、肝脏、大脑)里的多功能兵。巨噬细胞源自血液中的单核细胞,是处理局部问题的专家。
巨噬细胞的核心在于其“按需切换”的能力,主要有两种工作模式:
注:这里只是为了便于理解简化了,实际上巨噬细胞的极化是一个连续光谱(受多种细胞因子、代谢状态和组织微环境共同调控),往往呈现混合或中间表型,而非仅在两极之间来回切换。
在年轻健康的身体里,这两种模式的切换是及时且高效的。
▸ 衰老带来的失衡
衰老使巨噬细胞的平衡向促炎的M1型偏移。
▸ 这会带来什么后果?
伤口愈合变慢,组织修复能力下降
因为负责修复重建的M2型模式减少,所以在出现损伤(如割伤、手术后)时,组织的愈合过程会变得缓慢且不充分,更容易形成疤痕。
体内垃圾堆积,加速衰老进程
巨噬细胞的一个关键职责是吞噬并清除体内的“垃圾”,比如衰老的细胞和细胞碎片。尽管炎症信号增强,但吞噬与清理能力下降,功能失衡加剧。这导致衰老细胞无法被及时清除,它们在组织中不断累积,并释放更多炎症物质,形成一个“促炎-衰老细胞累积-更促炎”的恶性循环。
可能带来动脉粥样硬化
在血管壁中,功能失调的M1型巨噬细胞会疯狂吞噬胆固醇,但又无法有效代谢,最终变成充满脂质的泡沫细胞。这些泡沫细胞大量堆积,正是形成动脉粥样硬化斑块、导致血管堵塞的核心原因。
这削弱了它们有效召集其他免疫援军,并启动高效免疫反应的能力,进一步维持了体内的炎症状态。
树突状细胞:免疫反应启动效率下降
这些问题的答案,均指向了免疫系统中一个关键角色——树突状细胞(DCs) 的功能衰退。
树突状细胞是功能最强的抗原呈递细胞,重要职责是:
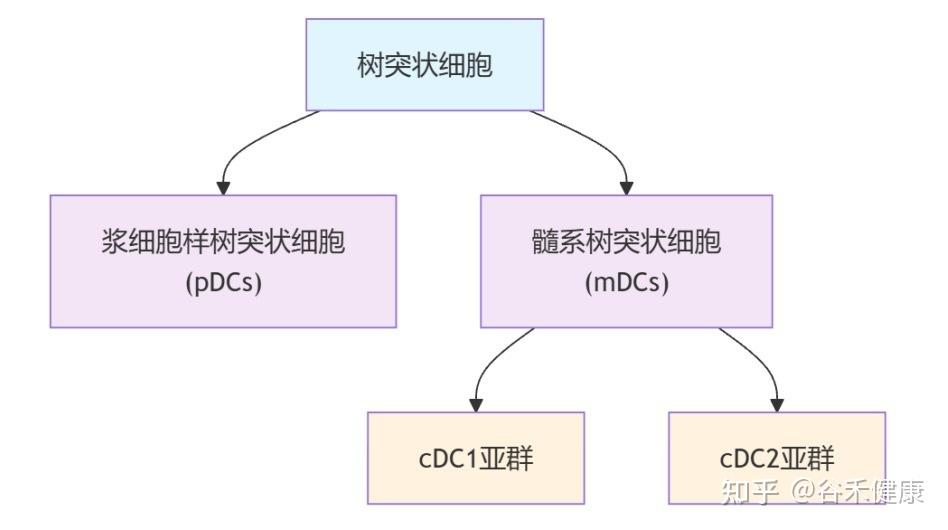
这其中,有一类名为 cDC1 的树突状细胞亚群,是专门负责激活T细胞的,T细胞是消灭病毒和肿瘤细胞的主力。
▸ 衰老影响这些DC亚群的组成和功能
关键指挥官cDC1 数量锐减:研究证实,体内负责激活抗病毒和抗肿瘤反应的 cDC1 细胞数量会显著减少。
剩余部队反应迟钝:剩下的树突状细胞,其呈报敌情的效率也大打折扣,激活T细胞的能力下降。
▸ 这会带来什么后果?
肿瘤和病毒的可乘之机
cDC1的减少,直接导致免疫系统的日常“巡逻监控”能力下降。体内的癌变细胞或潜伏的病毒(如导致带状疱疹的水痘-带状疱疹病毒)更不容易被及时发现和清除,从而大大增加了患癌和机会性感染的风险。
现代肿瘤治疗中的免疫疗法,其核心策略之一,就是想方设法重新激活这条“树突状细胞-T细胞”的攻击轴线。
加剧慢性炎症
这些功能失调的树突状细胞,在“消极怠工”的同时,还会错误地释放更多促炎信号,为身体的“炎症衰老”状态火上浇油。
树突状细胞功能的衰退,让我们在面对病毒和肿瘤时,免疫系统的启动速度和反应强度都打了折扣。
中性粒细胞:低效杀敌 + 高效自伤
中性粒细胞是免疫系统中的“快速反应部队”,一旦有病菌入侵,它们最先到达现场,通过吞噬、释放杀菌物质(如ROS,活性氧)等方式消灭病原体。
年轻时,它们是高效的杀手。但衰老后,它们的功能变得非常矛盾和具有破坏性。
▸ 衰老带来的变化
杀敌能力下降:它们吞噬病菌的效率变低了,用来捕捉病菌的“网”(NETs)也造得又少又差。这直接导致它们无法有效清除病原体,让小的感染迟迟不好,甚至恶化。
无差别攻击增强:虽然杀菌效率变差,但它们释放的化学武器——活性氧(ROS),却不减反增。ROS过度释放导致旁观细胞损伤和组织炎症,这正是“氧化应激”加剧的核心原因之一。
▸ 这对你的健康意味着什么?
这种“低效杀敌 + 高效自伤”的模式,让人在年老后,更容易发生组织损伤和慢性炎症,关节炎、血管损伤等都与这种失控的氧化应激有关。
这就是为什么“抗氧化”是抗衰老领域永恒的热点。市面上流行的维生素C、维生素E、富含多酚的食物等,其核心作用之一就是帮助身体中和这些过量的、由衰老免疫细胞产生ROS,从而减少对自身的伤害。
NK细胞:癌症巡逻减少
NK细胞,即“自然杀伤细胞”,是体内最警惕的“巡逻兵”,它们不需要预警,就能不停地识别并清除癌变细胞和病毒感染细胞。
▸ 衰老带来的变化
随着年龄增长,NK细胞的数量和组成都在变化:
“精锐”减少:NK细胞中功能最强、反应最迅速的“精锐亚群”(CD56亮细胞)数量下降。
“普通”功能下降:虽然细胞总数可能没变少,但整体战斗力和沟通能力都大幅下滑。它们在发现敌人后,释放的求援信号(如干扰素IFN-γ)显著减少,无法有效召集其他免疫细胞协同作战。
“后勤补给”被切断:维持NK细胞生长和活力的关键因子IL-15水平下降,相当于断了粮草,使其功能进一步衰退。
▸ 这对健康意味着什么?
是老年人健康最大的隐患之一。
癌症风险显著增加
免疫系统对早期癌细胞的监控和“清除”能力下降,给了癌细胞潜伏和发展的可乘之机。
病毒感染更易发生
对潜伏病毒(如引起带状疱疹的病毒)的压制力减弱,更容易导致病毒再激活和发病。
NK细胞因其在癌症预防和抗衰老中的巨大潜力,已成为再生医学和细胞治疗领域的绝对明星。
近年来,NK细胞疗法备受追捧,无论是通过体外扩增回输自体NK细胞,还是异体NK细胞产品,都旨在补充和激活这支重要的免疫力量。
据市场分析,全球NK细胞疗法市场预计在未来十年将以超过40%的年复合增长率高速发展,显示出巨大的市场潜力和消费者关注度。
我们的免疫系统分为两支主要部队:一支是反应迅速、指哪打哪的“特种部队”(后天免疫系统),另一支是冲锋在前、快速反应的“先锋部队”(先天免疫系统)。随着年龄增长,这两支部队都会出现不同程度的老化。
T细胞:精英特种兵 ➜ 疲惫老兵
T细胞是免疫系统中负责精准打击和长期记忆的核心战斗力。其中,
针对T细胞的免疫疗法是现代医学的重大突破,尤其是在癌症治疗领域(如CAR-T疗法)。在抗衰老领域,如何清除衰老的T细胞、恢复T细胞“新兵”的多样性,是前沿研究的核心。
▸ 新兵来源枯竭:免疫系统的“兵工厂”关闭了
T细胞的“训练营”是我们的胸腺。胸腺在年轻时非常活跃,源源不断地培养出充满活力、能识别各种新敌人的“新兵”(幼稚T细胞)。
但随着年龄增长,胸腺会严重萎缩,被脂肪取代。结果就是,“新兵”补充几乎断绝,我们识别和对抗全新病毒(比如新型流感病毒)的能力大幅下降。
▸ 老兵开始消极怠工
由于没有新兵补充,军队里只剩下了身经百战的老兵(记忆T细胞)。更糟糕的是,其中一部分老兵因常年作战而变得衰老和耗竭。它们不仅战斗力锐减,无法有效增殖去打仗,还会在体内释放大量“煽风点火”的炎症信号,成为慢性炎症的主要推手。
因此,“胸腺再生”已成为抗衰老领域的前沿探索方向之一。
再生思路:利用 iPSC(诱导多能干细胞)或胸腺组织工程技术,在体外或体内重建功能性胸腺,恢复或提升 T 细胞生成能力。
前沿:已有公司(如 Tolerance Bio)获得数千万美元融资,开展胸腺再生的临床前/临床研究;早期临床试验报告显示参与者的表观遗传年龄出现显著下降,提示胸腺再生可能对抗免疫衰老具有潜在价值。
B细胞:产能不足、武器型号单一
B细胞,是免疫系统的“抗体军工厂”,负责生产能够精准锁定并中和病原体的“导弹”——抗体,是我们获得长期免疫力的核心。
市场上的“抗体水平检测”服务,无论是针对新冠病毒还是其他病原体,其本质就是检测B细胞“军工厂”的工作成果。
随着年龄增长,这家军工厂不仅生产效率下降,更可怕的是,它开始生产出一批危险的“叛乱分子”。
▸ 衰老带来的变化
出现“叛乱分子”:危险的“年龄相关B细胞”(ABCs)崛起,具有极强的破坏性:
▸ 这对你的健康意味着什么?
自身免疫病风险剧增
许多自身免疫病,如类风湿性关节炎、干燥综合征、红斑狼疮,都在中老年时期高发或加重?这背后的一个关键推手,就是不断增多的ABCs细胞。它们产生的“错误抗体”攻击我们自身的关节、腺体乃至全身器官,导致了持续的疼痛和炎症。
抗体生产线僵化,难以应对新威胁
健康的免疫反应,在遇到新敌人时,会先迅速生产一批“通用型”的先锋抗体(IgM)来应急,然后再生产更精准、更持久的“定制型”主力抗体(IgG)。
衰老的B细胞系统彻底打乱了这个节奏:
这就是为何老年人接种流感或新冠疫苗后,产生的保护效果往往不如年轻人。他们的“抗体军工厂”已经失去了快速创新和应对新挑战的能力。
鉴于ABCs在自身免疫病和免疫衰老中的核心破坏作用,它们已成为药物研发的重点靶标。科学家们正在全力研究如何能精准地清除这些叛乱细胞,或抑制它们的活性,从而恢复免疫系统的正常秩序。
抗衰老前沿:研究者正探索通过 JAK‑STAT 抑制剂、代谢调控(如二甲双胍)或靶向 T‑bet/CD11c 等方式降低 ABCs 的频率或功能,以恢复更健康的 B 细胞谱系,提升老年免疫应答和疫苗效果。
如果说免疫系统是身体的“军队”,那么肠道菌群就是栖息在我们体内的、数量庞大的“盟友”与“潜在敌人”的复杂的生态系统,这对我们的健康至关重要,而它的构成也并非一成不变。随着年龄的增长,我们内在的微生物世界正在经历一场深刻的演替。
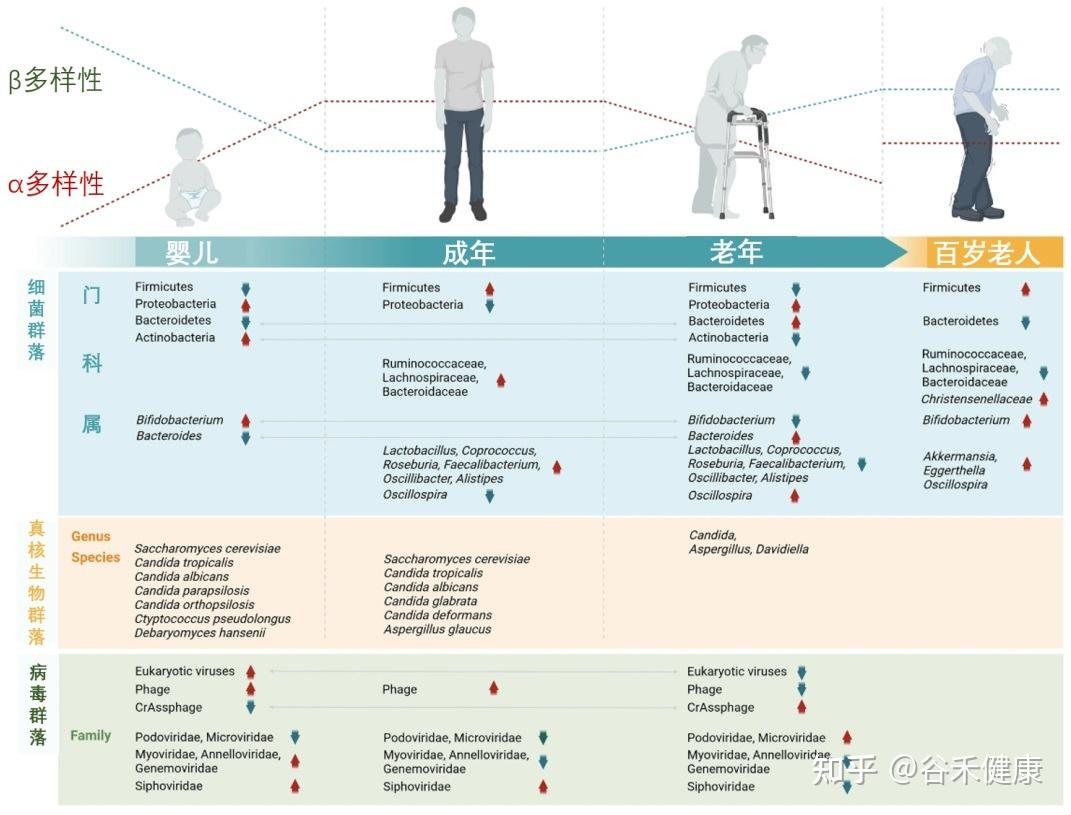
肠道菌群:随生命历程动态变化的生态系统
我们的肠道菌群从出生那一刻起就开始构建,并在3-4岁时基本成型,这个早期阶段的“地基”对一生影响深远。
婴儿期(奠定基础)
肠道菌群的“地基”搭建。新生儿的肠道以有益的双歧杆菌为主导,这对早期免疫系统的建立至关重要。
成年期(成熟稳定)
随着饮食日益多样化,细菌的种类和复杂性不断增加,而真菌的多样性则趋于减少。到成年时,菌群结构基本成型并进入一个相对稳定的阶段,主要由厚壁菌门和拟杆菌门两大类细菌主导。尽管宏观结构相似,但每个成年人的菌群构成都是独一无二的,如同指纹一般。
从婴儿到百岁老人,肠道微生物的组成和多样性在不同生命阶段呈现动态变化
衰老带来的关键转变:生态系统的失衡
随着年龄增长,这个稳定的生态系统开始出现显著的、通常是负面的变化,这一过程被称为“微生物群落老化”。
有益菌的流失,有害菌的增多
多样性降低:如同一个健康的森林退化成单一树种的林场,肠道菌群的总多样性下降,使其变得更加脆弱。
有益菌减少:对我们有益的细菌,如双歧杆菌 和乳杆菌属,数量显著下降。
有害菌增多:与此同时,一些具有促炎特性的“机会致病菌”开始占据优势,如变形菌门等,它们会持续地刺激免疫系统,导致全身性的低度炎症。
从青壮年(22-48岁)到准超级百岁老人(105-109岁)的进程中,一个显著的标志是:
关键功能的丧失:短链脂肪酸的减产
衰老菌群最核心的变化之一,是能够发酵膳食纤维并产短链脂肪酸的细菌大幅减少。
短链脂肪酸(如丁酸盐)是维持肠道健康和调节免疫的基石:它们为肠道壁细胞提供能量,维持肠道屏障的完整性,并能直接向免疫细胞发送“保持冷静”的信号。它们的减少,是肠道功能衰退的关键标志。
长寿的线索:从百岁老人的菌群中学习
随着全球老龄化的加速,研究越来越集中于理解生命晚期的微生物演替,以预测与衰老相关的疾病特征并促进健康老龄化。
有趣的是,研究发现健康长寿的老人(如百岁老人)的肠道菌群并未完全遵循上述的衰退轨迹。相反,它们展现出一些独特的“年轻化”特征:
与老年人(66-85岁)相比,他们的肠道菌群保留了更高的多样性,生态依然丰富。
在他们的肠道中富含长寿菌群,几种被认为与健康和长寿相关的细菌丰度更高,例如:
这些传统的有益菌在他们体内依然维持着高水平。

解密|肠道菌群与健康长寿7 赞同 · 0 评论 文章
“生物群落老化”:衰弱与菌群失调的关联
身体衰弱表现为精力差、活动少、体重减轻、肌肉流失的老年人,与特定的菌群失调模式相关。
研究发现,高衰弱评分的老年人,其肠道中特定的共生菌群,如Coprococcus eutactus、Prevotella copri等耗尽,而一些潜在有害菌,如Clostridium hathewayi,脆弱拟杆菌Bacteroides fragilis等则占据优势。
以下肠道菌群数量增加与衰老相关,并被认为是高衰弱评分的特征,包括:
这些微生物的转变与代谢改变密切相关,包括短链脂肪酸和色氨酸减少,以及苏氨酸、疏水性次级胆汁酸(石胆酸和脱氧胆酸)、三甲胺氧化物(TMAO)、对甲酚、乙醇和氨的增加。同时,依赖于果糖和木寡糖的关键纤维发酵菌群趋于减少。
总之,这些发现支持了“生物群落老化”机制,即微生物多样性减少,其特征是机会性/促炎微生物的增加和共生/有益成员的减少,与加速衰老和增加的衰弱有关。
肠道-免疫轴:菌群如何影响全身衰老
肠道菌群并非孤立地影响健康,它通过“肠道-免疫轴”与我们的免疫系统进行着持续而复杂的对话,直接影响着全身的衰老进程。
衰老的一个核心特征是炎症性衰老(Inflammaging)——一种长期、低度的全身性炎症状态。而肠道菌群失调,是点燃和助推炎症的关键因素之一,从而加剧炎症性衰老。
短链脂肪酸
众所周知,肠道菌群产生的短链脂肪酸(SCFAs)是重要的信号分子,能调节免疫细胞的分化和功能。
饮食中纤维缺乏会导致SCFA合成减少,进而导致黏蛋白降解菌增多,肠道黏液层变薄,屏障功能受损,促炎细胞因子(IL-33和IL-25)增多,最终引发更强的炎症反应。
色氨酸
另一个例子是色氨酸,它是一种由微生物衍生的代谢物,也是一种必需氨基酸。它的代谢产物对于维持肠道稳态至关重要。
在临床前的老年小鼠模型中,缺乏色氨酸的饮食会诱发肠道菌群失调并促进炎症性衰老。
这些机制表明,一个“健康”或“年轻”的微生物组,能够通过抑制慢性炎症和维持肠道屏障,在抵抗细胞衰老和炎症性衰老中发挥关键的抗衰老作用。
我们已经知道,衰老的肠道菌群呈现出多样性降低和功能失调的特征。但一个关键问题是:这种菌群失调究竟是衰老过程的果,还是驱动衰老的因?
越来越多的证据表明,这很可能是一个双向的恶性循环,而多种与年龄相关的因素共同推动了这个循环的加速。
以炎症性衰老为核心,这种系统性的低度慢性炎症状态,通过与宿主免疫系统的紧密互动,导致肠道微生物组的失调。反之,失调的菌群又会加剧炎症。而多种外部和内部因素,则像催化剂一样,不断加剧这个循环。

外部:生活方式与医疗因素的冲击
多种药物的使用
老年人常因多种慢性病而服用多种药物。许多非抗生素药物,如质子泵抑制剂、二甲双胍、非甾体抗炎药等,都会严重影响肠道菌群的组成和多样性。
它们可能引起食欲变化、口干(导致唾液酶分泌减少)和特定营养素吸收不良,共同塑造了一个不利于有益菌生长的环境。
营养不良与饮食改变
随着年龄增长,味觉和嗅觉减退、牙口问题、食欲下降等因素,常导致老年人饮食结构单一,特别是膳食纤维摄入量锐减。
纤维是许多有益肠道细菌(尤其是产短链脂肪酸的细菌)的主要“食粮”。纤维摄入不足,直接导致这些有益菌“挨饿”甚至消失,从而削弱了肠道屏障功能和抗炎能力。
缺乏体育锻炼与社交孤立
这些因素也被证明与肠道菌群多样性降低和不良健康状况相关,它们通过影响激素水平、应激反应和整体代谢,间接塑造了肠道微生态。
内部:消化系统自身的生理性衰退
随着年龄增长,我们消化系统本身的衰老,也在悄然改变着肠道菌群的生存环境。
胃肠道动力减弱
随着年龄增长,肠道蠕动和结肠转运功能减慢,容易导致便秘、腹胀等问题。食物残渣在肠道内停留时间过长,会改变发酵模式,可能有利于腐败菌的生长。
此外,肠神经系统(ENS)中神经元的退化也加剧了这一问题。
消化液分泌减少
注:胆囊逐渐对介导饱腹感的肽类激素——胆囊收缩素变得不敏感,导致其在血浆中的水平升高。这种被抑制的胆囊收缩素功能会逐渐导致食欲/饥饿感下降和食物摄入量减少,并促进老年人的营养不良,所有这些都会逐渐减少对维生素合成、能量代谢和免疫功能至关重要的有益肠道微生物。
有趣的是,百岁老人能产生独特的具有抗菌特性的次级胆汁酸(例如,石胆酸的独特异构体),是一种正向适应,这可能是他们维持肠道稳态的秘诀之一。
而在普通老年人中,失调的次级胆汁酸(如脱氧胆酸及其甘氨酸或牛磺酸结合形式)则与阿尔茨海默病等衰老相关疾病有关。

什么是胆汁酸,其与肠道微生物互作如何影响人体健康18 赞同 · 0 评论 文章

肠道微生物群对胆汁酸代谢和信号传导影响的最新研究成果20 赞同 · 1 评论 文章
肠道自身的衰老
肠上皮细胞(IECs)的更新能力随着年龄增长而下降。肠道干细胞耗竭,导致组织再生和愈合能力减弱。
衰老的肠上皮细胞和杯状细胞(负责分泌黏液)功能下降,导致保护性的黏液层变薄,肠道通透性增加(即“肠漏”),使得细菌及其产物(如LPS)更容易进入血液,引发全身性炎症。
最终后果:“肠道-器官轴”通讯中断
肠道并非一个孤岛,它通过免疫、神经、内分泌和代谢等多种途径,与我们全身所有器官(包括大脑、心脏、肝脏等)构成了一个复杂的双向通信网络。
肠道菌群正是这个网络中的关键,它们合成和调节着无数的信号分子,如:
当肠道菌群失调时,这个通信网络便会中断或充满错误信号。有益减少,有害增多,这种混乱的沟通状态,最终会体现在全身性的功能障碍上,包括免疫失调、心血管问题和认知能力下降等。
总结来说,肠道菌群的健康与否,直接关系到整个身体的衰老轨迹。它既是衰老过程的反映,也是一个可以主动干预、用以延缓衰老和促进老年健康的潜在靶点。
既然我们已经认识到肠道菌群在衰老过程中的重要地位,那么我们能否通过主动干预肠道菌群,来延缓衰老、促进健康长寿?答案是肯定的。
靶向肠道微生态的治疗干预措施,从生态失调中恢复生态平衡(稳态),不仅有望改善肠道健康,而且有望通过减轻年龄相关疾病促进整体健康和健康衰老和长寿。
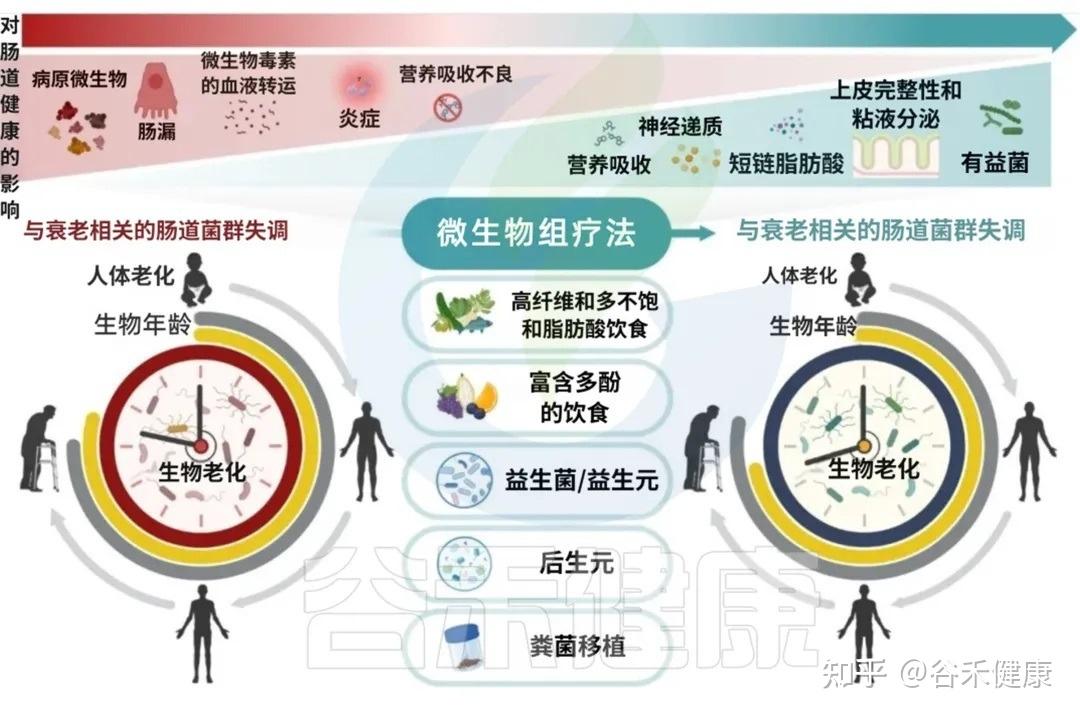
在所有影响肠道菌群的因素中,饮食是核心角色之一。尽管生理性的衰老不可避免,但大量短期、长期的饮食干预研究已证明,通过调整饮食,我们拥有巨大的潜力来延缓衰老的进程。
饮食如何塑造我们的衰老轨迹?
工业革命以来,人类的饮食结构发生了剧变,这种变化的速度远远超过了我们基因的适应速度。然而,我们的肠道微生物凭借其极短的代际时间迅速适应,从而演化出了由饮食、年龄、地理和健康状况共同塑造的高度个体化菌群。
下图清晰地展示了饮食对衰老轨迹的深远影响
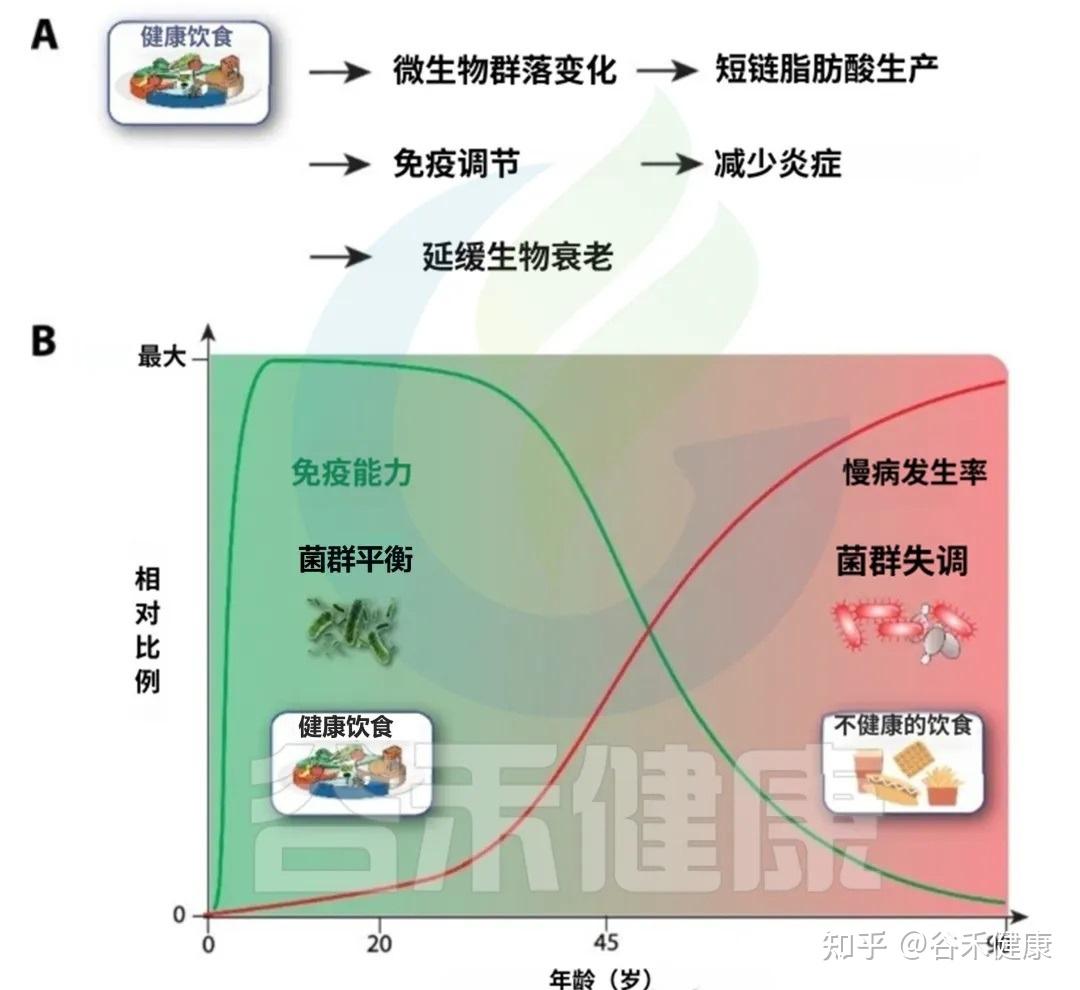
A健康的饮食促进有益的微生物群转变,增强短链脂肪酸的产生,调节免疫反应,并减少慢性低度炎症。这些效应共同导致生物衰老的延迟。
B免疫能力和非传染性疾病发病率与饮食质量的年龄相关轨迹示意图。早期坚持健康的饮食支持生态良好和强大的免疫功能(绿色曲线),而不健康的饮食与生态失调,炎症增加、随着时间的推移慢性病(NCD)负担增加有关(红色曲线)。
中年时期是一个关键的“十字路口”,此时的饮食选择将在很大程度上决定你未来,是走向健康的A路径,还是加速衰老的B路径。
地中海饮食:经过验证的减轻老年衰弱
一项长期、大规模的长期临床研究发现(注册号 NCT01754012),遵循地中海饮食模式与显著降低老年人的衰弱风险密切相关。
其背后的机制正是通过调节肠道菌群:这种饮食模式能有效增加有益菌的丰度,例如:
同时抑制与2型糖尿病、结直肠癌等疾病相关的潜在有害菌,例如:
改良地中海-生酮饮食(MkD):保护大脑功能
在针对轻度认知障碍老年人的研究中,改良的地中海-生酮饮食展现出显著的神经保护效果。其作用路径同样是通过肠道菌群:
高脂饮食:警惕坏脂肪,加剧炎症与菌群失调
近年来,老年人的饮食模式趋向于减少纤维、增加脂肪摄入。这会对衰老产生显著的负面影响。
促炎效应
高脂饮食会显著增加脂肪组织中的促炎因子(如TNF-α)和单核细胞趋化蛋白-1(MCP-1)的水平,并促使免疫细胞(巨噬细胞)向更具攻击性的M1型极化,加剧肝脏等器官的炎症。
破坏肠道菌群
高脂饮食会增加厚壁菌门的丰度(与炎症正相关),同时减少产丁酸菌,如瘤胃球菌科等。这会削弱肠道屏障的紧密连接,增加“肠漏”风险。
关键区别:并非所有脂肪都是有害的。
Omega-6多不饱和脂肪酸:通常具有促炎作用。
Omega-3多不饱和脂肪酸:如鱼油、亚麻籽油中的ALA,则具有明确的抗炎作用。
Omega-3能增加菌群多样性,促进双歧杆菌等有益菌的生长,减少肠杆菌,帮助改善肠道屏障功能,并增加有益的SCFA(富集产短链脂肪酸的毛螺菌科Lachnospiraceae)、减少有害的TMAO的产生。
控制总脂肪摄入并优化脂肪酸来源(尤其是增加Omega-3的比例),对于维护老年人的免疫健康和肠道稳态具有重要意义。
高蛋白饮食:复杂且需谨慎对待
高蛋白饮食对衰老的影响是复杂的,其效果因蛋白质的来源、数量以及个体的健康状况而异。
潜在益处:特定情境下的抗炎
在某些特定条件下,增加蛋白质摄入可能有助于抑制炎症。
例如,一项针对进行阻力训练的百名老年女性(60-90 岁)的研究发现,通过增加瘦红肉消费来提高蛋白质摄入的群体,其血浆中由运动引发的炎症标志物IL-6水平有所降低。这表明,在高蛋白饮食与规律运动相结合时,可能对控制炎症有积极作用。
潜在风险:促炎、免疫失衡、肠道菌群紊乱
——引发促炎反应与免疫失衡
多项研究将高蛋白饮食与促炎因子的升高联系起来。
在老年小鼠中,摄入全蛋白的高蛋白饮食会提高血浆中LPS、IL-6和IL-10的水平,而摄入水解蛋白则会额外增加TNF-α。表明高蛋白饮食,特别是当蛋白质未水解时,可能会在老年小鼠中引发更强烈的促炎反应。
此外,高蛋白、低碳水化合物的组合在老年大鼠中甚至表现出免疫抑制作用。
更为复杂的是,在一项结合了运动干预的研究中,富含Omega-3的高蛋白饮食反而导致了老年人体內具有抗炎作用的IL-10和IL-1Ra水平下降,这可能暗示着免疫调节机制的潜在紊乱。
——破坏肠道微生态与屏障功能
在老年女性中,高蛋白饮食与产丁酸菌的减少相关,而丁酸盐是维持肠道屏障功能和抑制炎症的关键短链脂肪酸,其减少可能导致肠道屏障受损。
动物实验也证实,摄入全蛋白的高蛋白饮食会破坏小鼠小肠的组织结构,减少保护性的杯状细胞数量,并导致链球菌(Streptococcus)等潜在有害菌增多,同时减少有益的双歧杆菌。
——产生有害代谢物
当蛋白质摄入过高(>1.6 g/kg体重/天)时,可能会导致肠道菌群发酵未被消化的蛋白质,产生有害代谢物。
例如,在老年男性中观察到,这种饮食模式与心血管疾病风险标志物——三甲胺氧化物(TMAO)的水平升高有关。虽然在大鼠中也观察到粪便乙酸盐水平的增加,但这同样可能源于蛋白质的异常发酵。
关键调节因素:蛋白质的“质”与“量”
蛋白质的类型(质)是决定其效果的关键。在上述破坏肠道结构的小鼠研究中,水解蛋白相较于全蛋白,显示出了截然不同的保护作用:它改善了小肠结构,增加了杯状细胞和有益的双歧杆菌,并减少了致病菌。这提示我们,蛋白质的消化吸收效率可能直接影响其对肠道健康的作用。
►▷
虽然高蛋白饮食近年来越发流行,但现有数据提示我们需谨慎对待,尤其是在老年群体中。当前的饮食指南建议将蛋白质摄入量限制在1.0-1.2 g/kg体重/天,并保证充足的碳水化合物摄入,这或许是避免潜在风险、维持免疫和肠道稳态的更为稳妥的策略。未来的研究需进一步阐明这些复杂的相互作用,以制定更精准的老年营养建议。
高纤维饮食:抗衰老,滋养有益菌,抑制炎症
高纤维饮食对免疫系统和肠道菌群的有益影响是明确且显著的。然而,大多数老年人的纤维摄入量远低于推荐标准(女性 21 g/天;男性 30 g/天)。
抗炎作用
膳食纤维(特别是可溶性纤维,如菊粉)是肠道益生菌的“首选食物”。它们通过发酵纤维产生大量丁酸盐等短链脂肪酸,这些物质能有效抑制全身和大脑中的炎症反应。
减轻神经炎症
高纤维饮食带来的丁酸盐水平增加,已被证明能有效减少中枢神经系统中“小胶质细胞”的促炎细胞因子表达,从而改善与衰老相关的神经炎症。
在人类研究中,食用富含纤维的谷物与多种炎症标志物水平降低相关,特别是C反应蛋白(CRP)和IL-1Ra。然而,有趣的是,来自水果和蔬菜的纤维并未显示出同样的效果。这提示我们,纤维的来源(如可溶性 vs. 不溶性)、是否存在其他生物活性化合物、以及加工方式都可能影响其最终的生物学效应,亟需进一步研究。
改善肠道菌群
高纤维饮食对肠道菌群的组成有着显著的积极影响,能够促进有益菌群的生长。
一项针对中国老年群体的研究显示,高纤维饮食者的肠道中瘤胃球菌科的丰度更高,而拟杆菌目和毛螺菌科的丰度较低。该变化可能与地理或膳食差异有关,并非绝对不良。
另一项针对55-80岁人群的研究,增加菊粉摄入量与更高的微生物多样性相关,显著提升了以下菌群的丰度:双歧杆菌、Alistipes shahii、Anaerostipes hadrus、Parabacteroides distasonis。
影响的复杂性:纤维类型、宿主年龄与性别的交互作用
尽管高纤维饮食益处明确,但其具体效果并非一成不变,而是受到多种因素的复杂调节。
效果的非普遍性
一项老龄小鼠研究发现,虽然含2.5%菊粉的饮食通过增加双歧杆菌和粪杆菌属(Faecalibacterium),并增强丁酸盐产量来改变了肠道微生物组,但它并未减少不同年龄组间的菌群总体差异,也未能改善全身性炎症或肠道生理指标。这表明纤维的干预效果是特定的,而非全局性的。
年龄特异性
在另一项小鼠研究中,菊粉能够有效降低厚壁菌门与拟杆菌门的比例,但其对特定菌属的影响具有年龄特异性——在老年小鼠中,菊粉显著增加了双歧杆菌和拟杆菌属 的数量。
性别依赖性
近期一项利用人源化小鼠模型的研究,更清晰地揭示了菊粉作用的性别差异。
对两性的共同影响:
对雌性小鼠的更强影响:
对雄性小鼠的特定影响:
高纤维饮食是维持老年健康的关键策略,它能有效抑制炎症并优化肠道菌群。然而,其效果并非“一刀切”。纤维的来源、类型(如菊粉)、宿主的年龄乃至性别,都会影响其最终的生物学功能。在制定未来营养策略时,需考虑个体化因素,以便实现更精准、高效的健康干预。
这提示我们,餐桌或许是最日常却最深远的抗衰老实验场。
色氨酸
讲究最佳剂量
色氨酸,一种必需氨基酸,在人体的应激反应、心理健康及炎症调节中扮演着核心角色。
色氨酸有几种饮食来源,包括:燕麦,香蕉,干梅子,牛奶,金枪鱼,奶酪,面包,鸡肉,花生等。
在衰老背景下,色氨酸对免疫系统和肠道微生物组的影响尤为复杂,呈现出显著的“剂量依赖性”,即适量摄入是关键。
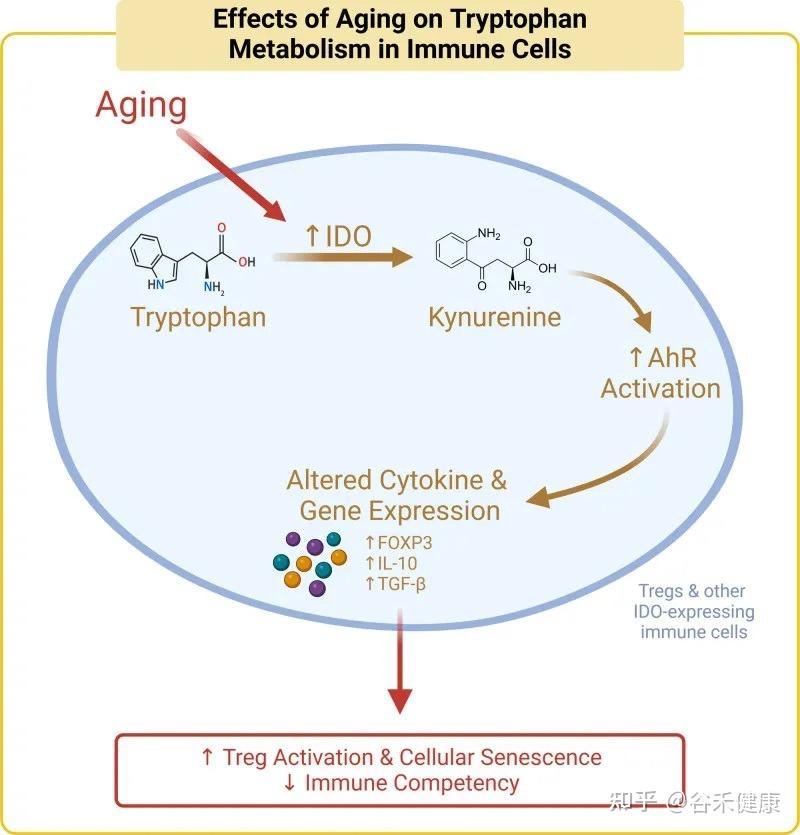
核心机制:犬尿氨酸途径与免疫衰老
色氨酸的免疫调节功能主要通过犬尿氨酸途径实现。在衰老过程中,体内的慢性炎症会激活此通路中的关键酶(IDO),导致一系列的连锁反应,最终可能加速免疫系统的衰老。
具体而言,在该途径中,超过95%的游离色氨酸被关键的限速酶——吲哚胺-2,3-双加氧酶(IDO)所降解,产生犬尿氨酸及其下游代谢物。这些代谢物不仅参与调节免疫功能,还是合成烟酰胺腺嘌呤二核苷酸(NAD+)的前体。
衰老过程本身伴随着慢性低度炎症,这会提高IDO酶的活性。IDO活性增强导致犬尿氨酸/色氨酸比率升高,进而激活芳烃受体(AhR)信号通路。该通路通过上调Foxp3,增加Treg的活化,最终促进胸腺退化和细胞衰老,这一过程被称为免疫衰老。
剂量决定效果:色氨酸摄入量的三重效应
关于色氨酸的摄入,研究揭示了一个非常关键的原则:并非越多越好,而是存在一个最佳窗口。
➦ 摄入过少(缺乏):加剧炎症与菌群失调
衰老本身就与小鼠体内色氨酸及其关键代谢物——吲哚的水平下降有关。在此基础上,色氨酸缺乏会进一步恶化健康状况。
一项针对老年小鼠的研究显示,与正常补充(0.2%)相比,缺乏色氨酸的饮食会导致促炎细胞因子IL-6、IL-17A和IL-1α显著增加,同时抗炎因子IL-27水平降低。
肠道微生物组也发生剧烈变化,包括下列菌群丰度均发生改变:
➦ 摄入适中,带来显著益处(最佳窗口)
一项老年小鼠研究中,摄入中等水平的色氨酸(占饮食的0.4%)显示出多重益处。这种饮食模式显著降低了潜在有害菌群的相对丰度,如丹毒丝菌属 (Erysipelatoclostridium)、肠球菌属(Enterococcus) 、Dubosiella菌属。
与此同时,它促进了有益菌的生长:
➦ 摄入过量,产生毒性,弊大于利
“越多越好”的原则在这里并不适用。摄入更高水平的色氨酸(占饮食的0.8%)则会加剧肠道黏膜屏障的损伤、氧化应激、炎症反应、严重的肠道菌群失调。
►▷
综上所述,色氨酸在衰老中的作用极为精准,呈现“剂量依赖性”。它不仅通过犬尿氨酸途径调控免疫,其摄入量还深刻影响肠道菌群与全身炎症。研究表明,存在一个有益的“最佳窗口”(如0.4%的补充),而缺乏或过量摄入均可能损害老年机体。这凸显了对色氨酸等营养素采取精准营养策略的必要性,未来的研究也应扩展至蛋氨酸、支链氨基酸等,以构建更全面的老年营养支持体系。

色氨酸代谢与肠内外健康稳态37 赞同 · 2 评论 文章
Omega-3 脂肪酸:强大的抗炎剂
Omega-3脂肪酸作为一类重要的多不饱和脂肪酸(PUFA),主要来源于鱼类、海鲜、坚果、种子和某些植物油。然而老年人群的Omega-3摄入量却常常低于最佳水平。大量研究证实,Omega-3脂肪酸具有强大的抗炎潜力,是维持衰老过程中免疫稳态的关键。
调节炎症介质产生
Omega-3脂肪酸(包括其前体α-亚麻酸ALA,以及EPA和DHA)能够显著减少促炎性类二十烷酸(如前列腺素E2、白三烯B4和LTC4)的合成。
在一项针对老年大鼠的研究中,补充Omega-3同时降低了IL-1β、MCP-1和TNF-α等多种细胞因子的浓度。
平衡脂肪酸比例
炎症状态不仅取决于Omega-3的绝对量,也取决于其与Omega-6脂肪酸的比例。体内Omega-6与Omega-3的比例过高,会直接导致TNF-α和IL-6等促炎细胞因子水平升高。
影响细胞功能与信号通路
Omega-3能直接影响免疫细胞的功能,包括调节白细胞活性和T细胞的发育。
在老年人的骨骼肌中,富含Omega-3的饮食被证明可以减少促炎细胞因子IL-1β的表达,并抑制mTOR(哺乳动物雷帕霉素靶蛋白)信号通路,从而减轻局部炎症和调节细胞代谢。
通过肠道微生物组介导
在人类中,Omega-3摄入被证实能通过改善肠道微生物组来抵消由肥胖引起的炎症和代谢紊乱。这种菌群改变有助于减少促炎性的循环脂多糖(LPS)水平,并抑制下游的NF-κB炎症信号通路。
协同效应:与生活方式干预结合效果更佳
Omega-3的抗炎效果可以与其他健康干预措施产生协同效应。
研究表明,在肥胖的绝经后女性中,虽然单独补充Omega-3或进行减肥都能降低体内的促炎因子水平,但当Omega-3补充剂与超过10%的体重减轻相结合时,其抗炎效果最为显著。
►▷
提高老年人Omega-3的摄入量,并将其与健康的生活方式(如体重管理)相结合,是抑制慢性低度炎症、维持免疫稳态的有效策略。

探索Omega-3脂肪酸:健康益处与营养补充12 赞同 · 0 评论 文章
膳食多酚:与菌群合作
膳食多酚:与菌群合作
多酚广泛存在于植物性食物中,如蓝莓、葡萄、可可、绿茶、苹果等。它们以强大的抗氧化和抗炎能力而闻名。在预防多种慢性疾病中显示出巨大潜力。
然而,其真正的抗衰老潜力并非通过直接吸收,而是通过与肠道菌群的复杂互动来“解锁”的。
核心机制:肠道菌群是多酚发挥作用的关键中介
由于其化学结构复杂且常常被糖基化,它们在小肠中的直接吸收率非常有限。但这恰恰成为了它们发挥更深远作用的起点。
大量未被吸收的多酚会到达大肠,成为肠道菌群的理想底物,并在此引发双重有益效应。
——直接作为养料,促进有益菌的生长
例如,研究证实,富含花青素和原花青素B2的饮食能够在衰老啮齿动物模型中,显著增加对肠道健康至关重要的产丁酸菌的丰度。
——代谢活化与菌群重塑
肠道菌群在享用多酚的同时,会将其分解代谢为一系列生物活性更强、更易被人体吸收的小分子代谢物。这个过程不仅激活了多酚的抗炎和抗氧化潜力,同时代谢过程本身及其产物还能温和地抑制有害菌,从而优化整个肠道菌群的结构。
多酚与益生菌的协同抗衰老效应
多项研究为肠道介导这一机制提供了有力证据,并揭示了多酚与益生菌之间的协同作用。
——减轻炎症性衰老
一项针对50岁及以上成年人的研究发现,在富含多酚的饮食基础上额外补充特定的益生菌,能够有效减轻慢性低度炎症,同时受试者肠道中的有益菌和短链脂肪酸水平也得到显著提升。
——传统补品的现代诠释
富含抗氧化物的传统草药——红参,其抗衰老效果同样与肠道菌群密切相关。它不仅能直接对抗氧化应激,还能促进有益菌的生长,并通过菌群代谢活动来强化肠道屏障功能。
更值得注意的是,当红参经过特定益生菌发酵后,其抗衰老特性得到显著增强。这归因于抗氧化相关基因的上调和对肠道菌群更有效的积极调节。
我们吃的食物不仅仅是在填饱肚子,更是在喂养体内的亿万微生物。通过多吃富含多酚的彩色果蔬和选择红参等天然补品,我们就能和肠道菌群打好配合,让它们帮我们把食物中的营养变成抗衰老的利器,实现从肠道到全身的健康。

肠道微生物群与膳食多酚互作对人体健康的影响30 赞同 · 3 评论 文章

多酚等膳食成分与肠道菌群协同作用可以更好地改善骨质疏松症3 赞同 · 1 评论 文章
益生菌干预的核心是直接向肠道输送特定的有益微生物,以实现靶向健康效益。
——改善大脑健康与情绪(调节肠-脑轴)
临床研究也证实,通过益生菌干预提高肠道中普拉梭菌(Faecalibacterium prausnitzii) 的水平,与焦虑、抑郁等神经精神症状的改善密切相关。
——强化肠道屏障,抑制全身性炎症
下一代益生菌:巨大潜力
研究的焦点正从传统的乳杆菌属和双歧杆菌属,扩展到一些新发现的、潜力巨大的肠道共生菌,它们被称为“下一代益生菌”。
其他潜力菌株也备受关注:

AKK菌——下一代有益菌21 赞同 · 0 评论 文章
通过精准干预肠道,我们可以恢复其稳态,进而增强免疫、改善代谢,并有效对抗衰老。益生元和合生元构成了这一策略的核心工具箱,它们在衰老的肠道环境中展现出显著的积极作用。
益生元:喂养有益菌
益生元是为有益肠道菌群提供营养的“食物”(如膳食纤维、低聚半乳糖GOS),为整个生态系统的健康奠定基础。
低聚半乳糖 (GOS) 是其中的典型代表,它来源于豆类、乳制品等。研究证实,补充GOS能够:
研究发现,补充GOS可以通过增强食糖细菌及其相关酶(β-半乳糖苷酶)的丰度,来改善肠道上皮完整性和粘液产生,从而调节衰老肠道的稳态。
合生元:益生菌与益生元的“强强联合”
一项临床研究报告称,老年女性在摄入名为MPRO3的合生元产品(由多种益生菌和膳食纤维组成)后,其血液代谢物谱、肠道菌群和整体肠道健康均得到积极调节。
后生元:更安全、更精准的有益物质
后生元是一个新兴且极具潜力的领域。它指的是“源自微生物的有益物质”,包括无活性的菌体、菌体碎片(如细胞壁)或细菌的代谢产物。
后生元的优势在于更稳定、更安全,因为它不涉及活菌的定植问题,而是直接提供发挥功效的“最终产物”。
——菌体成分
热灭活的益生菌(如副干酪乳杆菌)的细胞壁成分脂磷壁酸 (LTA),被证实能直接抑制炎症信号(NF-κB),同时促进黏液分泌,修复肠漏。
——代谢产物
这是指由微生物产生或将膳食成分转化而来的、具有健康效益的小分子物质。
在衰老模型中,它能通过下调 HMGB1-TLR4-NF-κB 炎症通路、减轻氧化应激并积极调节肠道菌群,来全面改善肠道功能。
——无活性的菌体
即便是完整但无活性的微生物,也能通过其细胞结构与人体免疫系统等发生互作,产生健康效益,这种方式被称为“幽灵效应”。
经过间歇灭菌(也称为廷德尔灭菌法)(一种温和加热灭活法)处理的长双歧杆菌(B.longum) 和嗜酸乳杆菌 (L. acidophilus) 菌株,在与运动干预相结合时,展现出改善阿尔茨海默病(AD)病理的潜力。其机制包括:
最终效果:减少大脑中淀粉样蛋白-β的聚集。
►▷
微生物的健康效应,并非完全依赖于其活性。
后生元绕开了活菌在储存、运输和定植中的不确定性,为开发更安全、更稳定、靶点更明确的新型疗法或辅助保健品铺平了道路。未来,后生元也将成为防治衰老疾病的重要途径。
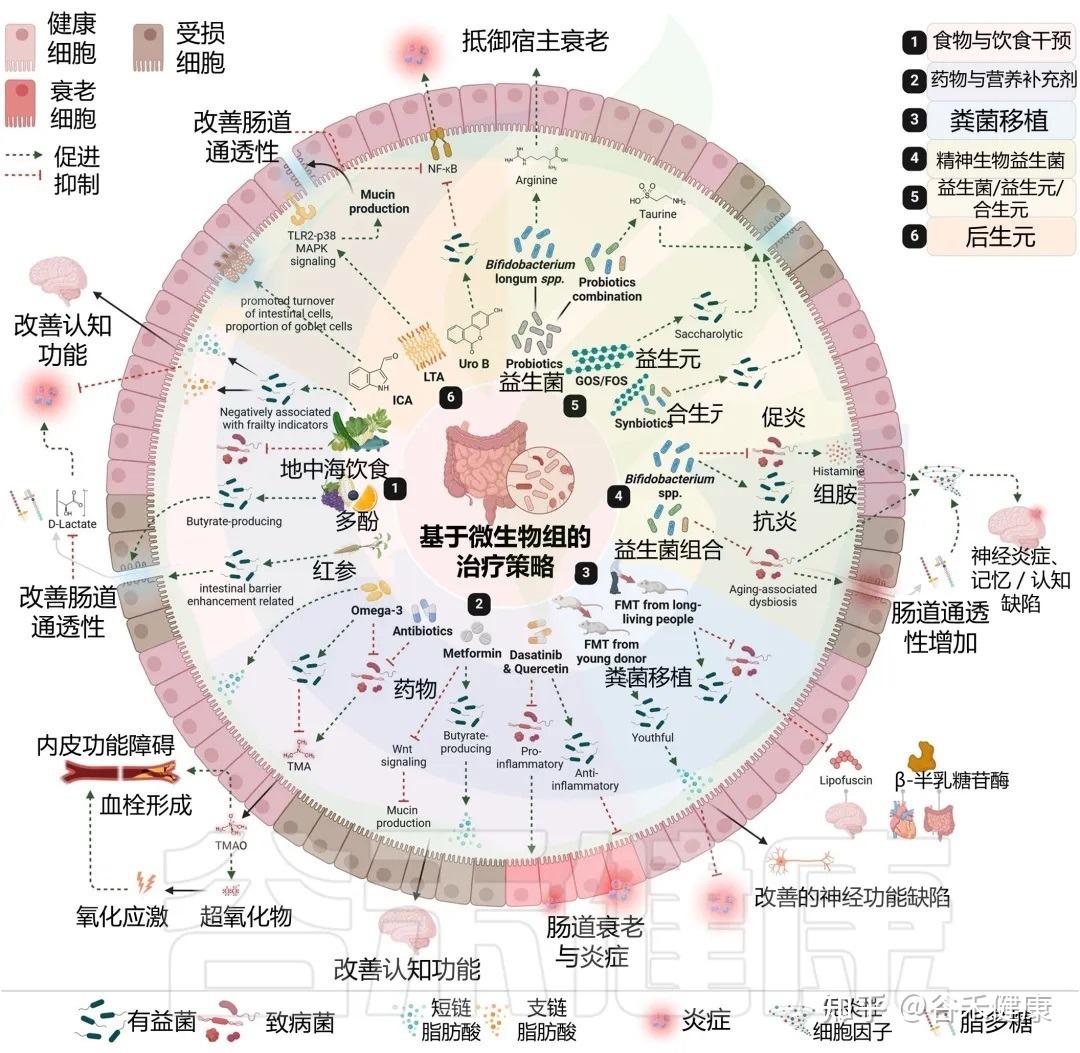
许多我们熟知的药物和膳食补充剂,其作用并非仅仅是简单的化学分子与人体细胞的直接互动。它们的抗衰老等多效性作用,在很大程度上是通过与肠道菌群的复杂“对话”和“合作”来实现的。
药物干预:从直接靶点到微生物介导
案例一:二甲双胍—— 经典的生物转化
作为一线降糖药,二甲双胍的益处远超血糖控制。最近的研究证明,肠道微生物组对其进行了关键的生物转化。
在老年小鼠中,二甲双胍治疗通过抑制Wnt信号通路,增强了肠道粘蛋白的产生,这一由菌群介导的过程最终对神经认知功能产生了积极影响。这表明,没有微生物组的参与,二甲双胍的某些重要功效可能无法完全发挥。
案例二:衰老细胞清除药物—— 协同调节
特定的“衰老细胞清除”药物(如达沙替尼和槲皮素),其作用也不再是单一的。研究表明,它们在清除体内衰老细胞的同时,还能主动调节肠道菌群——即促进抗炎微生物的生长,并抑制促炎微生物。
这一发现强烈暗示,这些前沿抗衰老药物的整体效果,至少部分是通过与肠道菌群的协同作用介导的,共同减少了肠道乃至全身的衰老和炎症。
膳食补充剂:菌群是关键中介
案例一:α-亚麻酸 (ALA) —— 清晰的微生物依赖途径
植物来源的ALA(一种Omega-3脂肪酸)的抗血栓效应,就是一个完美的例证。其作用并非直接,而是遵循一个清晰的微生物依赖路径:
案例二:NAD+抗衰老:肠道菌群的关键一环
补充烟酰胺单核苷酸(NMN)或烟酸(维生素B3)是目前流行的抗衰老策略,其核心机制是提升细胞内的NAD+水平。
研究发现,NMN也能通过调节肠道菌群来维持肠道稳态。鉴于肠道菌群拥有独特的酶来参与NAD+代谢,有理由推测,这类补充剂的抗衰老效果可能直接或间接地与肠道菌群的变化有关。

关于长寿因子(NAD+)你了解多少?——健康益处及如何提高补充效果6 赞同 · 1 评论 文章
粪便微生物群移植(FMT)不再是补充单一菌株或代谢物,而是通过移植一个完整的、健康的微生物生态系统,来彻底重置和改造宿主的肠道环境。
这一新兴策略正从治疗特定肠道疾病(如复发性艰难梭菌感染、IBS、克罗恩病等)的成功案例中,迈向一个更宏大的目标:促进健康衰老与延长寿命。
核心证据:从肠道到大脑的系统性年轻化
大量的临床前和临床研究表明,FMT的益处远不止于肠道本身,它能沿着“肠-脑轴”向上影响,实现系统性的抗衰老效果。
未来展望:建立“长寿菌群”生物样本库
FMT的潜力上限,取决于捐赠者菌群的质量。
关键发现:研究已证实,将长寿老年捐赠者(如百岁老人)的粪菌移植到小鼠体内,可以通过引入有益的细菌及其代谢物,有效改善受体的各项衰老相关指标。
基于这些证据,系统性地探索使用健康、长寿的捐赠者来建立一个特征明确的FMT生物样本库,可能为减轻与衰老相关的健康损害,提供一条有效的治疗途径。

粪菌移植——一种治疗人体疾病的新型疗法7 赞同 · 2 评论 文章
力量训练
中到高强度的抗阻训练,建议每周2-3次。训练强度通常设定在个人最大重复次数(1-RM)的60-85%之间,每个动作进行1-3组,每组重复8-12次。
例如,使用壶铃(一种具有特殊形状握把的重量,配有专门的训练方案)进行 8 周训练,可以改善与肌肉减少症和低度炎症相关的指标。
这种训练能够有效调节体内的微小核糖核酸(miRNAs)。它能抑制促进肌肉萎缩的miRNA,同时激活促进肌肉合成与生长的miRNA,从而打破肌肉流失的恶性循环,实现肌肉质量和力量的维持与增长,有效延缓衰老过程中的身体功能衰退。
高强度间歇训练 (HIIT) vs. 中等强度持续训练(MICT)
研究发现:两者对老年人的肠道菌群和肌肉功能有不同的调节效果。微生物组分析显示,HIIT组α多样性增加,并富集了产短链脂肪酸菌(如 Faecalibacterium prausnitzii),MICT组与多样性稳定和双歧杆菌适度增加相关。
HIIT在提升心肺功能和认知控制能力方面更优;而MICT则对改善情绪(心理健康)和帮助坚持运动更有利。
注:HIIT-涉及短时间高强度运动和短暂休息或低强度运动交替进行。MICT-中等强度持续一段时间的运动(如慢跑、骑行)。
瑜伽
一个为期12周的瑜伽项目,结合了体式、呼吸技巧和冥想,证实了其对阿尔茨海默病患者和其照护者的双重益处。
瑜伽是一种实用、经济的辅助方法,其成功也暗示了其他身心活动在延缓衰老相关疾病方面的潜力。
太极、有氧运动、八段锦
对于膝骨关节炎患者,这几种运动在减轻疼痛和改善身体功能方面的效果相当。
研究发现,太极能在12周内显著改善患者的疼痛管理(依据WOMAC量表评估)、姿势稳定性及功能性活动能力。
►▷
总的来说,老年人保持规律的活动总量(不一定要某种特定类型的运动或强度),能有效改善血管健康。 核心在于“动起来”,任何形式的规律运动都有益于心血管健康,不必过分纠结于某一种特定的运动方式。
要真正运用好肠道菌群来调节或延缓衰者,我们需要更强大、更智能的工具来指引方向。
从海量数据到精准洞察:AI与多组学的力量
我们的身体是一个极其复杂的系统。基因(基因组学)、代谢产物(代谢组学)、肠道菌群(微生物组学)……这些“多组学”数据共同交织,决定了我们的健康轨迹。在过去,我们很难看清这背后的规律。
而现在通过大数据可以整合分析这些不同维度的数据,帮助我们回答那个最核心的问题:在衰老过程中,究竟是哪些菌群、哪些营养分子,起到关键作用。
精准干预的前提:找到一把好的“衰老标尺”
要想知道我们的干预措施是否有效,首先需要一把能够精确测量“生物学年龄”的标尺。这个“标尺”就是衰老生物标志物。
根据国际性的衰老生物标志物联盟提出的全面框架,一把理想的“衰老标尺”必须满足六个关键维度:
可行性、有效性、懂机制、
适用广、反应灵敏、成本可控
换言之,一把好的“衰老标尺”,必须用得起、测得准、看得懂机制、适用广…幸运的是,最新的技术进展,特别是肠道菌群和免疫衰老的生物标志物,正为我们提供了构建这把“标尺”的强大工具。
精准营养时代:告别“一刀切”的健康建议
“精准营养”的最终目标,是根据每个人的独特性,提供量身定制的健康方案。
这意味着,通过对你个人的基因、代谢和肠道菌群进行综合检测,我们能知道,为什么对你有效的维生素D₃,对他来说可能Omega-3脂肪酸更重要。
一句话总结:我们已经推开了“通过调节菌群来抗衰老”这扇大门,但门后的世界依然充满未知。未来的研究方向很明确:通过更大规模的全球合作和更长时间的跟踪研究,全面揭示不同肠道菌群模式与健康衰老之间的内在联系,从而找到最精准、最个性化的方法,让每个人都能通过管理好自己的肠道菌群,实现更长久、更健康的生命。
抗衰老不应被视为与自然规律的对抗
而是一种与生命节奏的和谐共舞。
人间万事,生命最为宝贵;
生命长短,质量至关重要。
掌握科学的抗衰老智慧,
倾听肠道菌群等身体信号,
活出自己生命的最佳状态。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。

谷禾健康
虽然每个人都会老去,但是衰老的速度却不一定相同。生理年龄是每个人的遗传,环境和生活方式的影响。
人的一生,从出生到成年到老年,微生物组在免疫系统成熟,功能和调节中起着基本作用。免疫系统和微生物组形成一种互惠关系。
随着年龄的增长,免疫系统和肠道微生物组的组成和功能都会发生重大变化,这与对传染病的易感性增加有关。
导读
01)免疫衰老的一般标志
02)衰老和肠道微生物组
03)微生物老化的衡量指标
04)微生物老化加快免疫衰老和虚弱
05)肠道微生物组对疫苗反应的影响
06)对抗与年龄相关宿主免疫力下降的营养策略
07)恢复肠道微生物稳态、减少炎症和免疫衰老
08)健康长寿的普适方式
免疫衰老
“免疫衰老”是指在老年人中观察到的功能障碍,免疫反应有缺陷或异常。
与年龄相关的免疫反应的质量和数量的变化导致触发有效抗体和细胞反应抵御感染和疫苗的能力逐渐下降。
衰老的T淋巴细胞生物学研究十分突出,但所有造血源性细胞都显示出衰老的特征,包括功能失调的抗体产生B细胞、抗原呈递细胞、自然杀伤细胞和中性粒细胞。最早的造血祖细胞中也报告了表观遗传学改变,这可能解释了观察到的年龄相关的髓样细胞偏斜。
主要淋巴器官的老化(骨髓和胸腺磨损)、慢性抗原过载(如CMV)、肠道失调或炎症是免疫衰老的驱动因素,这些因素与遗传缺陷、细胞应激和/或细胞衰竭的累积一起,会导致免疫适应度随着年龄的增长而下降。
炎症
炎症是一种高度控制的生理过程,对对抗病原体、清除碎屑和愈合损伤至关重要。
随着年龄的增长,由于基因、环境和生活方式因素的复杂和不断变化的相互作用,促炎和抗炎之间的动态平衡下降。
慢性炎症状态是发病和死亡的一个重要危险因素。包括慢性感染、缺乏运动、内脏肥胖、饮食、心理压力、睡眠不足或肠道失调等多种因素都会引发和维持炎症。
长期暴露于应激源会加速细胞衰老和先天免疫失调,这是炎症的一个主要特征,反映在局部和全身炎症介质与白细胞介素-6(IL-6)、肿瘤坏死因子TNF-α 水平持续升高,IL-1β,C-反应蛋白(CRP)在老年人中普遍存在。
尽管先天性单核-巨噬细胞网络的失调可能是炎症的中心,但新的证据表明衰老细胞(包括T细胞和B细胞)通过其衰老相关的分泌表型参与慢性低度炎症的关键作用。
而慢性表达或暴露于炎症刺激可能使预先激活的免疫细胞对进一步的刺激难以耐受,从而导致观察到的老年人感染性疾病的频率和严重程度增加。
因此,先前存在的炎症已被证明是疫苗反应性的一个重要决定因素。
此外,炎症可能通过助长年龄相关疾病(包括代谢综合征、心血管疾病、肌细胞减少症、癌症和神经退行性疾病)而产生多种健康后果,因为大多数(如果不是所有)年龄相关疾病都具有炎症特征。
尽管衰老、炎症和慢性病之间存在着共同性,但生物医学研究继续巨额花费来单独解决这些疾病状态。这就提出了一个具有挑战性的问题,即:
针对慢性低度炎症或引起炎症的机制是否可能减缓衰老及其相关疾病?
虽然临床前研究表明炎症是导致年龄相关疾病和免疫反应性降低的一个因素,但证实这一假设的人类数据在很大程度上是缺失的。
而最近一项CANTOS的研究(Canakinumab Anti-inflammatory Thrombosis Outcomes Study)为老年人带来了巨大的希望。
对10000多名既往有心肌梗死史的稳定患者进行卡那单抗(Canakinumab,一种针对白细胞介素-1β的人单克隆抗体)治疗,可显著降低参与者的全身低度炎症。
重要的是,治疗方案可以预防复发性血管事件和肺癌的发生。虽然这些研究唤起了人们对有效抗衰老疗法的希望,但通过靶向阻断关键炎症介质来减少全身炎症需要在对传染病的易感性方面谨慎平衡。
这些免疫指标包括基于炎症年龄评分的iAGE、依赖于免疫球蛋白糖基化的聚糖生长或南丁格尔健康指数,其中糖蛋白乙酰化的全身炎症预测呼吸道感染、心血管疾病和全因死亡率的长期风险。
随着老龄化社会的健康管理成为一个日益增长的经济负担,这种免疫指标代表了有希望的工具,以确定风险个人的早期药物或营养干预。
为了应对不断变化的环境,肠道微生物通过菌种组成和代谢功能的变化动态响应。这个过程受到宿主免疫系统的严格调控,想象宿主免疫系统是一位建筑师,通过允许共生细菌生长和占据粘膜生态位,同时选择性地消除或中和有害微生物,从而塑造肠道微生物群。
随着年龄的增长,免疫适应度逐渐下降,宿主与微生物动态信号交换的监测受到损害,从而对宿主健康和免疫造成广泛的功能后果(图1)。
图1 模型:微生物老化及其对宿主免疫的相关影响
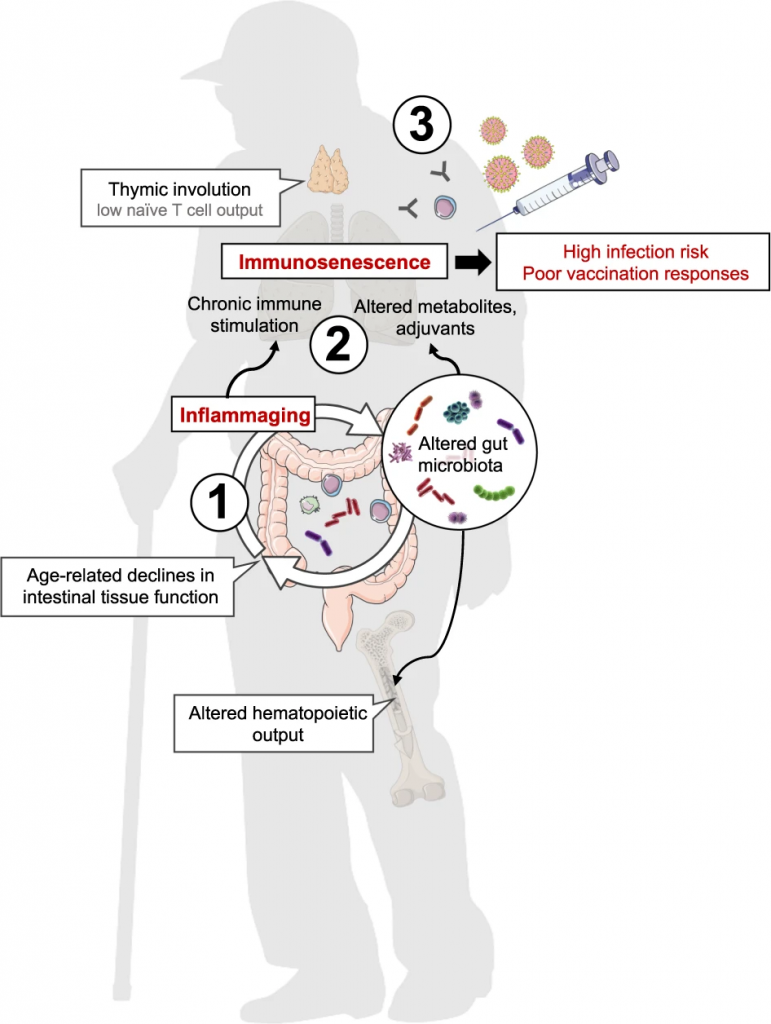

Nabil Bosco & Mario Noti,Genes & Immunity, 2021
(1) 年龄相关的肠道微生物群落变化和相关的肠道组织功能下降可能加剧炎症
(2) 由全身低度炎症引起的慢性免疫刺激、代谢组和微生物刺激的变化导致免疫衰老
(3) 免疫功能受损(如胸腺退化、造血功能改变),导致老年人感染风险增加,老年人接种疫苗反应差
在人类中,年龄相关的菌群失调(微生物老化)特征是梭状芽孢杆菌和双歧杆菌数量减少,变形菌门以及肠杆菌科等病原菌数量过多。
肠道微生物群落结构的组装也可能取决于宿主器官的功能。考虑到肠道的组织功能和完整性受到与年龄相关的显著变化,如再生能力、上皮屏障形成、黏液层组成和蠕动的改变,随着我们年龄的增长,粘膜生态位的变化很可能导致了失调状态。
这种肠道完整性的亚临床改变可能会促进微生物向全身部位渗出,全身性低度炎症,慢性炎症的发生和过早死亡。然而,确定人类的因果关系仍然具有挑战性,下文将进行讨论。
虽然,我们已经开始了解细菌的分类组成和多样性是如何随着年龄的变化而变化的,但我们对细菌进化和与宿主适应性相关的功能后果的了解仍然有限。有两种可能的情况:
1 肠道微生物群落结构中与年龄相关的变化是宿主衰老过程中发生的生理组织适应的简单结果
2 与年龄相关的失调是细菌进化的产物,通过使特定菌群逃避免疫监视,直接触发宿主衰老
因此,更好地了解老化的宿主微生物群,对于推进以微生物组为基础的治疗方法来对抗老化和与年龄相关的疾病至关重要。
我们需要先了解这样的概念。
生理年龄:指人达到某一时序年龄时生理和其功能所反映出来的水平,是从医学、生物学角度来衡量的。
肠道年龄:是基于健康人群每个年龄段样本的菌群构成使用深度神经网络模型提取特征菌属并构建的预测模型。
谷禾健康-肠道年龄预测模型图

注: 谷禾报告中的肠道年龄是基于超过6万人群队列的深度学习模型构建的,伴随年龄的变化肠道菌群也会相应的改变。对于0~2岁的儿童,肠道年龄通常偏差小于3个月,3~5岁偏差在6个月以内,6~15岁偏差在1岁左右,16~50岁人群正常肠道年龄的偏差在3岁以内,50岁以上正常偏差在5岁以内。在正常偏差内年龄差异可以理解为年轻或衰老,超出正常偏差的年龄无论是超过或低于都可能是菌群异常或健康状况不佳。
真实年龄与肠道预测年龄在范围内的差异可以反映其肠道菌群的发育和衰老状况。
以下情况可能会导致肠道预测年龄完全偏离真实年龄,包括:肠道菌群紊乱,菌群结构过于单一,近期服用包括抗生素等可能严重干扰肠道菌群的药物,病原菌感染或者处于疾病状态。
肠道菌群失调可以触发先天性免疫反应和慢性低度炎症,导致许多与年龄有关的退化性疾病和不健康的衰老。肠道菌群通过各种生物分子,营养素信号独立途径和表观遗传机制与宿主进行交流。与年龄有关的肠道菌群失调会干扰这些交流,从而影响宿主的健康和寿命。
与年龄相关的肠道微生物组成的改变不仅发生在人类身上,也发生在实验室模型生物身上。这些控制遗传、年龄、饮食和微生物组本身的模型系统提供了强有力的科学证据,表明宿主生理或微生物进化的内在改变足以促进一种失调状态。
这些模式生物已经证明肠道微生物群有潜力有益地调节衰老过程,以促进宿主的健康和寿命。
黑腹果蝇
对黑腹果蝇的研究(一个经常被用来研究微生物动力学、肠道生理中与年龄相关的变化和生物体健康之间相互作用的衰老模型)——已经完美地证明了肠道生态失调不仅是年龄相关肠道屏障功能障碍、系统免疫激活和机体死亡的前兆,而且还预测了这些疾病的发生。
结果表明,在整个生命过程中保持在无菌条件下的果蝇显示出较低的衰老率,这表明在这些模型设置中防止与年龄相关的菌群失调可以限制炎症,改善免疫稳态,促进健康。
非洲绿松石鳉鱼
利用自然短命的脊椎动物非洲绿松石鳉鱼(Nothobranchius furzeri)进一步证实了肠道微生物群在调节衰老过程中的影响。年轻的微生物群的慢性定植在中年鱼,诱导了长期有益的系统效应,导致脊椎动物的寿命延长。将年轻的供体微生物群定植在年老的鱼,与已知产生代谢产物的关键细菌属的存在有关,这些代谢产物既能维持免疫系统健康,又有抗炎作用。
小鼠
年轻小鼠菌群 → 早衰小鼠:特定菌发挥作用
将年轻供体的粪便微生物群移植到早衰小鼠中,可改善后者的健康状况和寿命,并将疣微菌门verrucomicrobia,Akkermansia muciniphila移植到早衰小鼠中,从而充分发挥有益作用。
此外,与年龄相关的Akkermansia muciniphila缺失与肠道完整性受损和胰岛素抵抗相关——这是一个通过微生物组-单核细胞-B细胞轴介导的过程。
除了对宿主代谢的影响,Akkermansia muciniphila还参与了调节抗原特异性T细胞反应和抗体产生来调节宿主免疫功能。
小鼠菌群 → 无菌小鼠:T细胞活化增加
用年轻或年老小鼠的肠道微生物群定植无菌(GF)小鼠。将老年供体微生物组移植给年轻小鼠足以促进肠道炎症、微生物产物向循环的渗漏和慢性低级别炎症的发生。作为全身低度炎症的结果,全身免疫区的T细胞活化增加。
年老菌群→年轻小鼠:巨噬细胞功能失调
另一项研究报告了类似的发现,在年轻的GF接受者中,移植一种老年微生物组可促进全身低度炎症。这些情况下的炎症进一步与巨噬细胞功能失调相关,巨噬细胞是炎症细胞因子的有力来源,其细菌杀灭活性较差。此外,基因或抗体介导的肿瘤坏死因子α(低度炎症的标志性细胞因子)的减少,可以预防年龄相关的肠道失调和相关的全身低度炎症。
年龄相关肠道免疫力下降:增加M细胞可恢复
最近的一项研究强调,年龄相关肠道免疫力下降可以通过操纵肠道微生物组增加M细胞数量来恢复。年老小鼠暴露于年轻的微生物群或鞭毛蛋白刺激都足以观察到这种效应:Peyer’s补丁中的M细胞成熟恢复,增强抗原摄取,年老小鼠肠道IgA反应增加。基于微生物组干预的M细胞修复确实依赖于肠道干细胞功能的改善,这表明修复老年肠道的再生能力可能对提高肠道免疫力有额外的好处。这些发现可能与改善口服疫苗应答或预防老年人胃肠道感染有关。
年龄相关肠道菌群改变影响造血
除了局部免疫调节外,年龄相关的肠道群落结构变化也可能对造血产生直接影响。对小鼠的研究表明,肠道微生物组的改变与造血系统的多谱系改变和多能祖细胞的抑制有关。
鉴于肠道微生物群通过促进造血功能密切参与了细菌感染的控制,与年龄相关的肠道微生物群平衡和多样性的变化可能导致老年人造血功能受损、更易感染和减少疫苗接种应答。然而,为了更好地理解年龄相关的生态失调对造血系统调节的影响,还需要更多的研究来支持这一假设。
总的来说,这些临床前模型系统的发现表明,校正与年龄相关的肠道菌群失调是有益的,为基于微生物组的治疗方法改善免疫系统功能、对抗衰老及相关疾病提供了理论依据。
虽然粪便微生物群移植(FMT)在动物模型中具有抗衰老特性(见上文),并且FMT已成功用于治疗男性复发性艰难梭菌感染,但在临床环境中提出FMT作为抗衰老策略仍存在一些障碍。更好地了解健康微生物组的特征(包括病毒组和真菌组)对于确保接受者的长期安全至关重要。
尽管我们对整个生命中肠道微生物群的理解取得了很大进步,但在疫苗学上的潜力尚未实现。鉴于微生物组严格调控免疫细胞的发育和功能,它可能最终影响疫苗的疗效。因此,由环境、社会经济、营养或卫生条件引起的肠道微生物群落结构的变化可以解释疫苗应答中的地理异质性。
对微生物群如何促进疫苗应答的机制更好地理解,可能有助于制定新的策略,以减少老年人感染性死亡。
直到最近,表明肠道微生物组影响疫苗接种反应的最佳证据来自使用无菌或缺乏微生物的小鼠的临床前模型系统。
研究人员探讨不同抗生素方案对抗原特异性体液免疫应答的影响,研究了克拉霉素、强力霉素和氨苄西林对小鼠破伤风类毒素(TT)、肺炎球菌多糖疫苗(PPV)、乙型肝炎病毒表面抗原(HBsAg)疫苗和减毒沙门氏菌活疫苗(Ty21a)的一级和二级抗体应答的影响。
有趣的是,抗原和抗生素的特异性反应都受到了影响。
克拉霉素和强力霉素抑制典型的T细胞依赖性和T细胞非依赖性抗体反应,而氨苄西林的效果较差或无效果。
此外,所有三种抗生素,特别是氨苄西林增强了对Ty21a-a减毒细菌粘膜疫苗模型的体液反应。在GF小鼠中进行疫苗接种实验的进一步工作证实了这些初步发现。
到目前为止,现有的研究主要集中在细菌,以及包括病毒、真菌、原生动物和古生菌在内的微生物群的其他组成部分。然而,仍然存在两个重要问题:
(一) 微生物群参与宿主免疫反应(特别是疫苗反应)的机制是什么?
(二) 这些发现对人类的影响是什么?
迄今为止,最令人信服的数据表明,肠道微生物群提供了佐剂的天然来源,能够调节宿主的系统和黏膜疫苗反应。
这一观点最初是在Nakaya等人的系统生物学报告中提出的,他们描述了在非佐剂流感疫苗接种三价灭活疫苗(TIV)后,人类toll样受体-5 (TLR5)的早期(第3天)和瞬时基因上调。TLR5的表达与TIV诱导的血凝抑制(HAI)滴度(滴度是稀释度的倒数)呈正相关。
随后,该研究小组证实TLR5对小鼠肠道微生物分泌的鞭毛蛋白的感应与TIV介导的应答有关。虽然直接给予鞭毛蛋白或有鞭毛的细菌移植可以提供天然佐剂来改善非佐剂流感疫苗的应答,但它不能与其他佐剂或活疫苗如破伤风-白喉-百日咳(Tdap)、黄热病(YF-17D)或重组乙型肝炎抗原(Recombivax HB)配合使用。
除TLR5外,另一种模式识别受体核苷酸结合寡聚结构域2 (NOD2)的特异性贡献,人血清白蛋白(HSA)抗原和霍乱毒素(CTX)佐剂鼻内刺激诱导的粘膜疫苗应答小鼠模型。在GF小鼠、抗生素处理小鼠或基因修饰缺乏NOD2信号的突变小鼠中,HSA特异性IgG反应持续下降。当这些动物接受一种被NOD2或表达MDP的细菌识别的肽聚糖MDP(muramyl dipeptide, MDP)时,HSA特异性IgG反应恢复。
虽然尚未使用人体相关疫苗,但这第二项工作表明,常驻微生物也可以增强用于粘膜疫苗接种方案的CTX的佐剂效果。需要进一步研究揭示肠道微生物群、其细胞壁成分或代谢物作为内源性疫苗佐剂的免疫能力,以放大对特定病原体的适应性免疫应答。
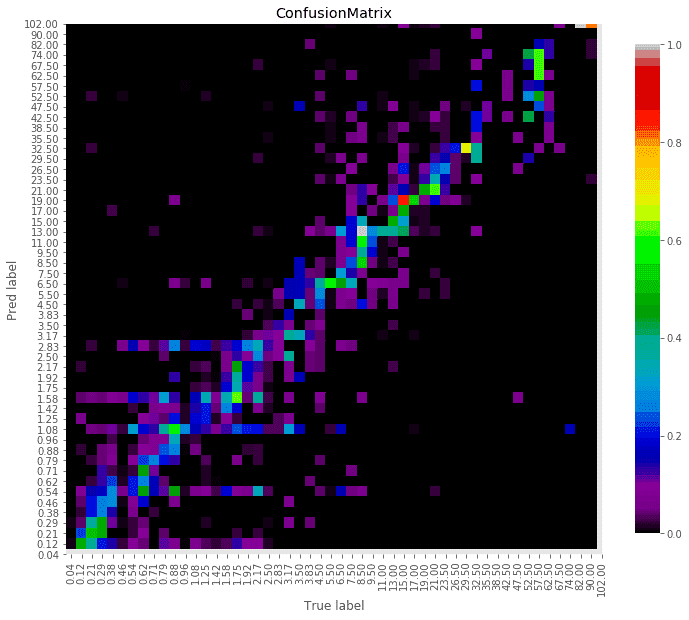
临床前和临床报告均观察到膳食纤维对功能免疫参数的积极影响,包括疫苗应答(表1),进一步支持基于其组成(细菌的性质)和或活性(分泌的代谢物的性质)的肠道微生物群的重要免疫调节潜力。
表1 益生元和/或益生菌临床干预试验探讨老年人免疫相关结果


Nabil Bosco & Mario Noti,Genes & Immunity, 2021
关于纤维消化产生的短链脂肪酸(SCFAs)免疫调节活性的大量文献证明了这一点。这些代谢物在局部或全身释放,参与宿主的一般生理过程。
肠道微生物组组成和功能的动态变化也可以解释疫苗应答中观察到的地理异质性。研究人员还报道了成人和老年人接种流感疫苗后体液免疫反应的显著差异(超过100倍)。
宿主遗传、营养状况、母乳喂养习惯以及卫生条件和/或之前接触过病原体,被提出用来解释疫苗免疫原性的差异。然而,近年来研究宿主微生物群的技术进步为这一领域提供了新的思路。
粪便微生物群特征研究表明,肠道菌群组成可能影响口服脊髓灰质炎、卡介苗、破伤风类毒素和乙肝病毒的疫苗接种效果。
此外,在某些国家的儿童中,小肠细菌过度生长(SIBO)的流行率高。SIBO还可能限制疫苗的性能,因为相关的吸收不良、肠道微生物群和宿主免疫细胞之间争夺关键营养物质以及或通过渗漏的肠道系统释放微生物分子。从南非收集的样本中观察到反应迟钝的全血细胞(标准TLR刺激试验),并将来自北美和欧洲儿童的年龄匹配样本进行了比较。
上述人体研究仅存在相关性。
最近进行了三项研究,以确定婴儿和成人肠道微生物群失调和疫苗应答之间的因果关系。
在第一个大型(n = 754)和良好对照的研究中,广谱抗生素治疗(阿奇霉素)减少了致病性肠道细菌的流行,但没有改善印度婴儿的口服脊髓灰质炎疫苗接种。
接下来,Harris等人在开放标签试验中使用广谱抗生素(万古霉素)或广谱抗生素(万古霉素、环丙沙星和甲硝唑)治疗66名荷兰健康成人,并研究TT、口服轮状病毒(RV)和多糖肺炎球菌(Pneumo23)疫苗的应答。虽然RV疫苗观察到一些积极的效果,抗生素治疗没有改善TT或肺炎23价反应。
最后,Hagan和他的同事进行了一项研究,22名年轻的成年人接受广谱抗生素(万古霉素、新霉素和甲硝唑)治疗,然后接受TIV疫苗。虽然这种治疗对以前接种过流感疫苗的成年人影响有限,但在11名以前没有接触过流感(接种疫苗或自然感染)的健康个体中进行的第二次试验提供了突破性的发现。那些首次接受抗生素治疗的人的体液免疫反应,特别是对H1N1流感毒株的免疫反应大大减弱。
这些数据证实了早期的小鼠研究,并证明抗生素驱动的生态失调导致了非佐剂TIV引起的疫苗应答的显著改变。用系统生物学方法进行的更深层次的分子图谱也揭示了一种特定的炎症基因特征,即与抗生素治疗相关的更活化的髓系树突状细胞。
合理设计以微生物为内源性佐剂的疫苗在疫苗学领域具有广阔前景。这些方法可能需要个性化和工程可逆性来管理脆弱个体的疗效和潜在并发症。鉴于饮食是塑造肠道微生物群的最有力因素之一,营养干预与益生菌和益生元促进多样化的微生物群来维持健康受到了相当大的关注。
食品的发展是为了促进健康或减少疾病风险,1980年代中期,出现了“功能食品”一词:希望支持以营养为基础的预防性方法,以提高生活质量,减少与老龄化人口相关的医疗成本。
由于肠道微生物与宿主免疫系统的密切相互作用,临床试验研究的提高老年人免疫力的功能食品主要包括益生元(如纤维)、益生菌、两者的结合(即共生)或分泌可溶性代谢物(也称为后生元,如短链脂肪酸)。
随着年龄的增长,免疫适应能力下降,老年人无力抵抗感染,无力对抗原挑战作出反应,大多数这些试验探讨了感染流行程度、严重程度和持续时间或特定的疫苗接种结果。
在已确定的400项临床研究中,研究人员根据其相关性(免疫读数和目标人群为60岁的老年人)保留了31项研究,并将其总结在表1中。
这些研究是在社区居民、疗养院居民或住院患者中进行,这些患者可以服用口服补充剂或需要管饲。
大多数研究(20项研究)是随机双盲安慰剂对照组,考虑经典的混杂因素,如年龄、性别,有时还有医疗条件、营养状况、感染史或疫苗接种史。
预防感染性并发症,特别是危重症或选择性手术患者中艰难梭菌相关腹泻是第二个有意思的领域。
在对老年人进行的13项研究中,6项呈阳性。它们积极的性质也可能表明,疾病预防可以通过人体免疫系统的不同方面来实现。
疫苗挑战研究通常测试适应性免疫系统的功能,但没有解决某些细菌感染中与年龄相关的先天免疫下降的后果。然而,最近在英国23家养老院进行的规模最大的研究,即“益生菌减少养老院居民感染”试验,LGG和BB12胶囊每天服用长达1年,对预防感染没有效果。在感染症状、抗生素使用、住院或死亡率方面没有发现差异。
总的来说,可能有多种原因,研究之间缺乏一致性,如菌株特定差异或剂量,以及益生元性质和数量,或受试者的年龄和医疗条件。
这些研究中没有一项对干预前和干预后的患者微生物群进行了广泛的分析。虽然这些数据可能作为独立报告存在,以描述成分的特性,在未来,对干预前后的人体微生物群和免疫参数进行系统的平行评估是至关重要的,以揭示相关的相互作用或因果关系。
虽然实际年龄是不可逆转的,但随着年龄的增长,与肠道微生物群、炎症和免疫衰老相关的衰老变化是免疫介导的慢性疾病的共同帮凶,这可能是维持免疫和健康的目标。
当消炎药和衰老疗法选择性地消除衰老细胞(衰老抑制剂)或抑制衰老相关分泌表型(衰老表型)时,作为抗衰老疗法的临床试验正在迅速发展(图2),它们的长期使用需要谨慎地平衡对传染病的易感性和潜在的其他副作用。
为什么减少全身低度炎症可以促进疫苗应答,而疫苗学的主流观点是佐剂通过促进局部炎症来改善疫苗应答,这一悖论还需要进一步的研究来解释。
图2 恢复肠道微生物稳态、减少炎症和免疫衰老以支持老年人免疫功能的方法
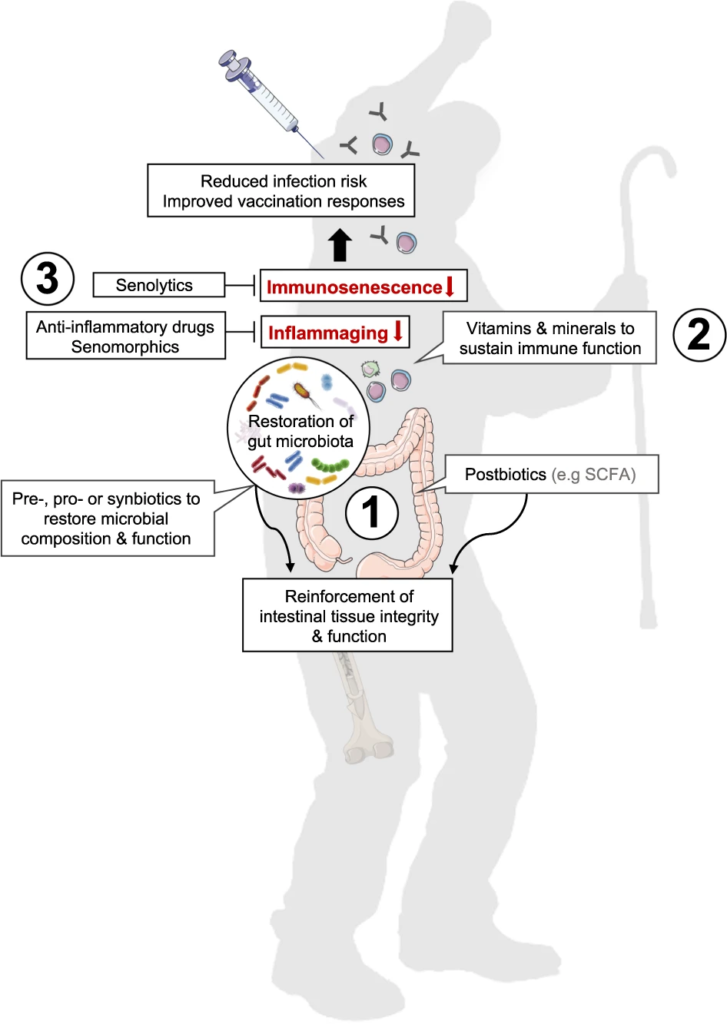
Nabil Bosco & Mario Noti,Genes & Immunity, 2021
(1)益生菌或益生元或合生元、后生元(如SCFAs)等进行干预可能有助于恢复与年龄相关的肠道微生物组成和功能下降
(2) 补充维生素和矿物质有助于正常的免疫细胞功能。
(3) 消炎药或老年药可能有助于减少炎症,而老年药直接消除老化细胞,燃料炎症。
单独或联合使用可能有助于增强宿主免疫,更好地控制感染,并随着我们年龄的增长产生适当的疫苗接种反应。
鉴于肠道微生物对宿主免疫系统的影响越来越大,可以合理推测,通过个性化营养或补充,恢复与年龄相关的肠道微生物丰富度和功能的下降,可能是一种对抗免疫适应性功能下降的预防措施。
在这种情况下,已在临床环境中测试了能够通过支持肠道屏障完整性或调节炎症过程来增强免疫力的益生菌、益生元、后生元或合生元(表1)。
然而,由于研究、菌株特异性差异或剂量、益生元的性质和数量或受试者的年龄和医疗条件之间缺乏一致性,因此很难验证这种方法在增强与年龄相关的宿主免疫适应性下降方面的有效性。
肠道微生物群是一个有待挖掘的宝藏,衰老学也不例外。正如许多临床前研究所证明的那样,恢复年轻的微生物群可以通过维持免疫和健康跨度来恢复老年宿主的活力。
因此,更好地了解肠道微生物群落结构和相关代谢组的动态变化,这些改变如何影响细胞免疫网络,以及这些通路如何被治疗靶向,将对未来加强甚至恢复老化免疫系统的策略产生广泛的影响。随着人口老龄化的加剧,迫切需要这样的解决方案来支持健康老龄化,减缓不断增长的医疗费用。
健康饮食
Omega-3脂肪酸
随着年龄的增长,神经细胞萎缩,向大脑提供的营养丰富的血液供应减少,Omega-3脂肪酸,尤其是二十二碳六烯酸(DHA)可以促进神经细胞之间的有效电信号传递,减少炎症,甚至可以改善精神集中度并与记忆力丧失作斗争。
较小的脑体积与阿尔茨海默氏症以及正常衰老有关。研究人员发现,血液中omega-3脂肪酸EPA和DHA水平较高的绝经后妇女的脑体积也更大。
富含Omega-3脂肪酸的食物:
鱼类:鲱鱼,沙丁鱼,鲭鱼,鲑鱼,大比目鱼,鳟鱼
绿叶蔬菜: 抱子甘蓝,菠菜,芝麻菜,薄荷,羽衣甘蓝和豆瓣菜
油: 亚麻籽油,正大籽油,鳕鱼肝油和磷虾油
其他:蛋、核桃等
黄酮类化合物
几乎所有的水果,蔬菜都含有类黄酮,具有许多健康益处,包括减少炎症,降低心脏病风险和湿疹症状,对衰老的大脑有益。有研究发现,食用大量浆果(类黄酮含量较高)的老年妇女将记忆力下降的时间推迟了两年以上。
类黄酮含量高的食物:
浆果: 蓝莓,草莓和黑莓
绿叶蔬菜: 菠菜,羽衣甘蓝和豆瓣菜
彩色农产品:胡桃南瓜,牛油果,李子,红葡萄
其他:咖啡,黑巧克力,红酒
维生素E
防止细胞损伤。已有几项研究发现,维生素E可以延缓轻度到中度阿尔茨海默病的进展
富含维生素E的食物:
坚果和种子:杏仁,山核桃,花生酱,花生,榛子,松子和葵花籽
油:小麦胚芽油,葵花籽油,红花油,玉米油,大豆油
绿叶蔬菜:菠菜,蒲公英嫩叶,唐莴苣,萝卜叶
运动
走楼梯:
瑞士一项研究发现,久坐不动的人把乘电梯换成走楼梯,过早死亡的风险可以降低15%。哈佛早期的研究显示,与每周爬楼梯少于10层的人相比,每周能爬35层或更多的楼梯能显著提高寿命。
骑车:
骑自行车上班是一种环保又健康的方式,在一天中挤出锻炼时间在户外,还能节省点油钱。
游泳:
一项数据发现,经常游泳的男性比久坐不动的男性死亡率低50%,游泳者的死亡率也比运动时走路或跑步的男性低。
每天锻炼15分钟:
2011年的一项研究发现,与久坐不动的人相比,每天15分钟锻炼可以平均延长3年的寿命。
保护牙齿
如果牙齿一直很敏感,那么随着年龄的增长,牙齿会越来越容易脱落,这会影响老年生活品质。请保持日常牙科护理的最佳状态,防止蛀牙。
保持良好的生活习惯
保证充足的睡眠:
NIH的数据显示,每晚持续睡眠少于7个小时的成年人患高血压,心脏病,肥胖,糖尿病和抑郁症的风险更高。另外,晚上睡不好会抑制重要激素的释放,这些激素可以修复细胞和组织,抵抗疾病和感染,睡不好会使身体无法自然康复。
尽可能避免吸烟:
戒烟可以减少许多疾病风险。
适当缓解压力:
压力容易让人变老。尝试放弃明显的压力源,适当安排休息时间,
经常锻炼记忆力
记忆就像肌肉一样可以训练;如果充分利用自己的记忆并定期使用它,记忆力可以磨练到老。比如每天尝试做一个填字游戏,以帮助建立和维护词汇量和记忆力。
《阿尔茨海默氏病杂志》上的一项研究显示,吃蓝莓可以增强记忆力和学习能力,喝苹果汁可以通过防止重要的神经递质的衰退来改善记忆力。
选择适宜的养老居住地
可以选择气候宜人的地方居住,良好的空气质量有助于保持健康,环境条件佳也有利于保持好心情。此外尽量选择拥有良好的经济和医疗体系的地方,帮助维持积极长寿的生活。
做好健康管理
定期进行肠道菌群健康检测或其他检查,及时了解自身健康状况,包括哪些风险,需要注意事项等,做好健康管理,享受健康幸福的晚年生活。
相关阅读:
主要参考文献:
Hägg S, Jylhävä J, Wang Y, Xu H, Metzner C, Annetorp M, et al. Age, frailty, and comorbidity as prognostic factors for short-term outcomes in patients with coronavirus disease 2019 in geriatric care. J Am Med Dir Assoc. 2020;21:1555–9.e2.
Khan SS, Singer BD, Vaughan DE. Molecular and physiological manifestations and measurement of aging in humans. Aging Cell. 2017;16:624–33.
Crooke SN, Ovsyannikova IG, Poland GA, Kennedy RB. Immunosenescence and human vaccine immune responses. Immun Ageing. 2019;16:25–16.
Butler CC, Lau M, Gillespie D, Owen-Jones E, Lown M, Wootton M, et al. Effect of probiotic use on antibiotic administration among care home residents: a randomized clinical trial. Jama. 2020;324:47–56.
Bosco Nabil,Noti Mario,The aging gut microbiome and its impact on host immunity.[J] .Genes Immun, 2021
Book: Mayo Clinic Family Health Book, 5th Edition
Wang J, Varghese M, Ono K, Yamada M, Levine S, Tzavaras N, Gong B, Hurst WJ, Blitzer RD, Pasinetti GM. Cocoa extracts reduce oligomerization of amyloid-β: implications for cognitive improvement in Alzheimer’s disease. J Alzheimers Dis. 2014;41(2):643-50.
James V. Pottala, Kristine Yaffe, Jennifer G. Robinson, Mark A. Espeland, Robert Wallace, William S. Harris Neurology Feb 2014, 82 (5) 435-442
Dysken MW, Sano M, Asthana S, et al. Effect of Vitamin E and Memantine on Functional Decline in Alzheimer Disease: The TEAM-AD VA Cooperative Randomized Trial. JAMA. 2014;311(1):33–44.
Berryman CE, West SG, Fleming JA, et al. Effects of Daily Almond Consumption on Cardiometabolic Risk and Abdominal Adiposity in Healthy Adults With Elevated LDL-Cholesterol: A Randomized Controlled Trial. Journal of the American Heart Association. January 2015.