-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

群体感应(Quorum Sensing,QS)是一种细胞间的通讯机制,广泛存在于细菌、微生物以及某些多细胞生物中。通过这种机制,细胞能够感知周围环境中同类细胞的密度,并根据细胞数量变化调节基因表达和行为,这种现象在细菌中尤为显著。
在胃肠道等竞争激烈且不断变化的环境中,微生物群已经开发出独特的相互交流方法。肠道菌群产生的群体感应分子调节多种细胞功能,例如毒力基因的表达、生物膜的形成、能力和孢子形成,通常仅在细胞数量达到一定密度时启动这些过程。
肠道细菌产生的群体感应分子在肠道微生物组内建立物种和菌株水平结构方面很重要,但也用于与宿主交流。
微生物之间的对话各不相同,范围从种间交流、自我对话或种内交流到来自一个属的细胞对另一个属产生的信号做出反应。无法产生自身通信信号的细胞正在“监听”其他细胞产生的信号,这种现象类似于为“窃听”。
肠道微生物群使用某些代谢物作为群体感应分子与肠上皮细胞(IEC)进行通讯。例如,金黄色葡萄球菌分泌多种毒力因子,这些因子操纵宿主的免疫系统以保护自身的生存。这些生存策略对宿主的影响通常表现为:
虽然我们目前还不知道哪些群体感应分子与肠道和感觉神经元有最直接的相互作用,但很多证据显示它们会影响我们的生理和心理健康。
例如细菌产生的信号多种多样,包括自诱导剂 (AI)、高丝氨酸内酯(HSL)、喹啉、肽、毒素和蛋白酶。这些信号分子激活细菌细胞壁中的特定受体,并触发细胞质中调节基因表达的传感器。
注:自诱导剂(sAutoinducers)是细菌在群体中相互交流的一种信号分子。它们通过细菌的分泌进入环境,并在细菌密度达到一定水平时被其他细菌重新摄取。它使细菌能够协调其行为,例如生物膜的形成、毒素的产生和其他群体行为。
高丝氨酸内酯(Homoserine Lactones, HSL)是一类特定类型的自诱导剂,主要在革兰氏阴性细菌中发现。当HSL达到一定浓度时,它们会与细菌细胞内的特定受体结合,激活基因表达的调节机制。这种调节可以影响细菌的生长、代谢和致病性等多种生物学过程。
目前,研究很多研究已经建议可以将群体感应分子可用作辅助诊断的生物标志物:
未来,应该有可能使用 QS 生物标志物来诊断神经和精神疾病,例如:焦虑和抑郁、重度抑郁症、精神分裂症、双相情感障碍、自闭症、强迫症等。
微生物群体感应(QS)可以被视为微生物群之间的伙伴关系或协议,本文主要分享和讨论了QS在肠道细菌和肠壁中带来的变化,并探讨和总结这些通信可能对中枢神经系统和心理健康产生的影响。
Interbacterial Communication
革兰氏阴性菌(Gram-Negative Bacteria)
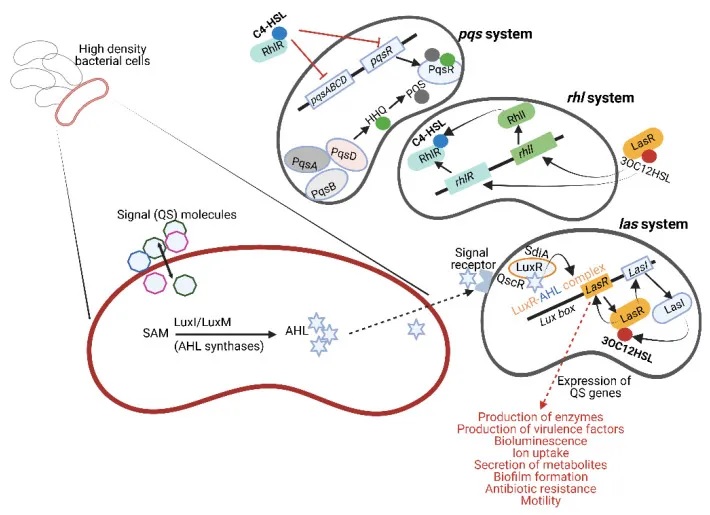
细菌是一类单细胞微生物,它们需要通过各种方式来感知周围环境,并协调自身的行为。革兰氏阴性细菌就利用一类称为自诱导剂 (Autoinducers, AI) 的小分子物质来实现这种细胞间通信。
AHL:细菌间的通用密码
其中最著名的自诱导剂是AHL(N-酰基-高丝氨酸内酯N-Acyl,Homoserine Lactones, AHL)。AHL是一种小的中性脂质分子,由高丝氨酸内酯(Homoserine Lactone, HSL) 部分和4到18个碳原子的酰基侧链组成。
不同细菌产生的AHL可能有不同的酰基侧链长度和取代基,这使得细菌能够区分彼此释放的信号分子。
AHL的合成
AHL的合成需要依赖于S-腺苷甲硫氨酸(S-Adenosyl Methionine,SAM)作为底物,由LuxI或LuxM等合成酶催化产生。有些细菌只有一种AHL合成酶,而另一些细菌则拥有多种AHL合成酶,能够产生多种形式的AHL。
AHL的产生水平受到严格调控,取决于底物的可用性
一些缺乏LuxI型合成酶的细菌会拥有”孤儿”的LuxR型受体,这些受体能够检测到同一环境中其他细菌释放的AHL信号。例如,大肠杆菌(Escherichia coli) 中的SdiA和铜绿假单胞菌(Pseudomonas aeruginosa)中的QscR就是这类孤儿受体的代表。
这些LuxR型受体在不同细菌中高度保守,序列同一性可达67%-84%。它们不仅存在于大肠杆菌,还广泛分布于其他肠道细菌,如肠杆菌(Enterobacter)、柠檬酸杆菌(Citrobacter)、克罗诺杆菌(Cronobacter)、克雷伯菌(Klebsiella)、沙门氏菌 (Salmonella) 、志贺氏菌(Shigella) 中。
doi.org/10.3390/microorganisms10101969
大肠杆菌的多种群体感应系统及其生理调控
以致病性大肠杆菌(E. coli)为例,它利用多种QS系统来调控自身的生理过程:
其中,大肠杆菌的SdiA蛋白可以被铜绿假单胞菌产生的AHL信号分子激活。这种SdiA/AHL复合物能够增强大肠杆菌中与耐酸性相关基因的表达,对于肠出血性大肠杆菌(EHEC)在胃肠道低pH环境中存活至关重要。
此外,大肠杆菌还利用QS系统调控其毒力基因的表达、生物膜的形成、细菌运动性、III型分泌系统的活性,以及毒素和细菌纤毛的产生。
类似地,沙门氏菌的QS系统也参与调节其致病性,影响侵袭性基因的表达、鞭毛形成,以及与拉链侵袭机制相关的基因。
总之,细菌利用这些精细的群体感应系统,能够在复杂的环境中有效地感知周围情况,并协调自身的生理活动,从而增强其生存和致病能力。这种细菌间的通信机制对于理解细菌的生态和致病机制具有重要意义。
革兰氏阳性菌(Gram-Positive Bacteria)
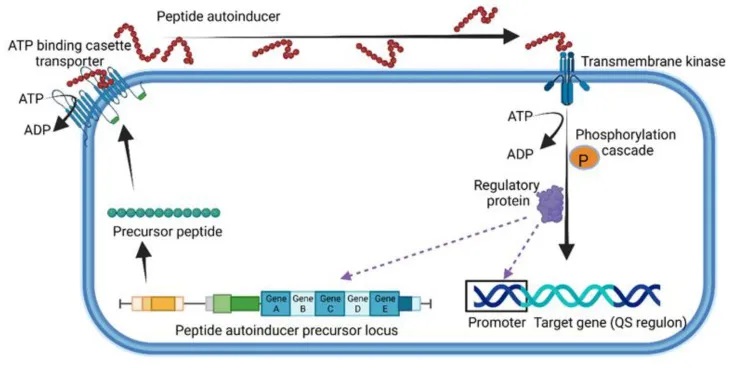
除了革兰氏阴性菌使用自诱导剂(Autoinducer,AI)进行群体感应(Quorum Sensing, QS)外,革兰氏阳性菌也采用了一种独特的QS机制。
革兰氏阳性菌的独特群体感应机制
革兰氏阳性菌使用由5-17个氨基酸组成的小线性或环状寡肽(Quorum Sensing Peptide, QSP)进行细胞间通信。
其中,研究最多的是芽孢杆菌产生的QS系统,包括能力孢子形成因子(CSF)、五肽和七肽SDLPFEH(PapRIV)等。这些七肽是由48个氨基酸的前体肽经过NprB蛋白酶的裂解而形成的。
QSP在细胞膜上的ATP结合盒转运蛋白的帮助下被分泌到细胞外,并与膜结合的受体或细胞质传感器(如Rap、NprR、PlcR和PrgX蛋白)发生相互作用。
QSP系统在细菌中的实例
以金黄色葡萄球菌为例,其辅助基因调节因子(Agr)就是一个编码肽信号分子Agr的四基因操纵子,起到膜结合传感器的作用。Agr调节多种基因的表达,包括毒力因子、蛋白酶和成孔毒素等。
缺失agr基因(Δagr)的金黄色葡萄球菌菌株会形成生物膜,更容易引起慢性感染和菌血症。
另一种革兰氏阳性菌肠球菌也使用Fsr-QS系统,该系统由四个基因位点fsrABDC控制。一旦肽被裂解激活,就会通过跨膜激酶在细胞内进行磷酸化级联反应,从而诱导靶基因的表达。
总的来说,革兰氏阳性菌利用这种基于寡肽信号分子的QS系统,能够感知周围细菌的数量,并协调自身的生理活动,如毒力因子的表达、生物膜的形成等。这种细菌间的通信机制对于理解它们的生态和致病机制具有重要意义。
革兰氏阳性菌使用的群体感应的一般表示
doi.org/10.3390/microorganisms10101969
Interspecies Communication
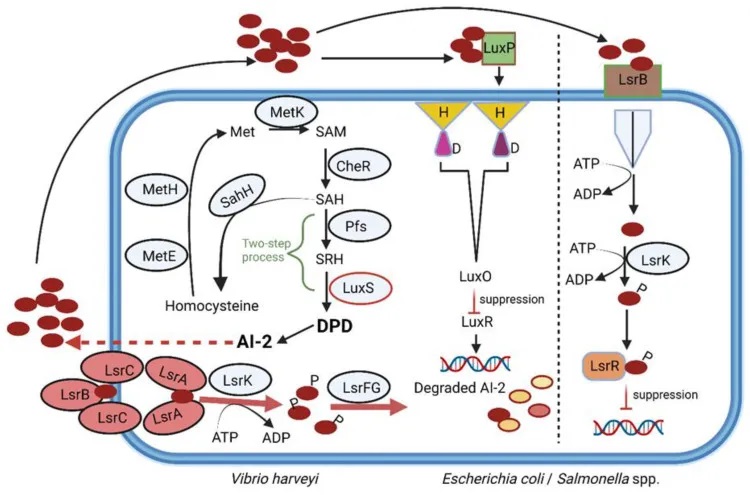
自身诱导剂-2 (Autoinducer-2, AI-2)是一种广泛存在于细菌中的信号分子,在细菌间的种间通讯和调节特定生物行为中起着关键作用。
AI-2的的合成途径
AI-2是一种呋喃硼酸酯二酯,既可以被革兰氏阴性菌,也可以被革兰氏阳性菌产生。它的合成受到luxS基因的调控。在这个过程中,首先S-腺苷同型半胱氨酸(SAH)被SAH水解酶(SahH)转化为同型半胱氨酸,然后经过Pfs和LuxS两步反应,形成中间体4,5-二羟基-2,3-戊二酮(DPD),最终重排成AI-2分子。
AI-2在细菌中的广泛分布
值得注意的是,在超过三分之一的细菌基因组中都能检测到编码luxS同源物的基因,包括大肠埃希菌(Escherichia coli)、粪肠球菌(Enterococcus faecalis)、空肠弯曲杆菌(Campylobacter jejuni)、金黄色葡萄球菌(S.aureus)、艰难梭菌(Clostridium difficile)、芽孢杆菌属(Bacillus)、链球菌属(Streptococcus)、福氏志贺氏菌(Shigella flexneri)、幽门螺杆菌(Helicobacter pylori)、鼠伤寒沙门氏菌血清型、伤寒沙门氏菌血清型、双歧杆菌属(Bifidobacterium)、乳酸菌属(Lactobacillus)、真杆菌属(Eubacterium)、罗氏菌属(Roseburia) 和瘤胃球菌属(Ruminococcus) 。
这表明:
AI-2系统在细菌的种间通讯中扮演重要角色
例如,大肠杆菌、肺炎链球菌等细菌就利用AI-2系统来调节编码细菌素产生的基因表达。
双歧杆菌也使用AI-2信号来对抗沙门氏菌的感染。此外,AI-2还可能参与调节细菌的运动性、生物膜形成等行为。
有趣的是,在肠道微生物群落中,AI-2信号也被用来帮助细菌应对胃肠道中的各种应激条件。研究发现,通过调控AI-2水平,可以在抗生素治疗后帮助恢复肠道微生物的平衡。但这需要谨慎控制,因为AI-2的细胞内水平受到LsrK激酶的调节。
doi.org/10.3390/microorganisms10101969
AI-2在调节肠道微生物群中的应用
一种经改造的大肠杆菌菌株随着 AI-2 的产生增加,导致链霉素抑制的厚壁菌门恢复,并抑制拟杆菌门的生长。从这些发现可以推断,AI-2 可用于在抗生素治疗后恢复肠道微生物群的平衡。如果遵循这种策略,则必须仔细控制,因为 AI-2 的细胞质水平受 LsrK 激酶调节。
厚壁菌门和拟杆菌门种群的变化会改变 SCFA 的水平和组成,进而影响基因表达、细胞因子分泌和调节性 T 细胞诱导。所有这些变化都会影响炎症反应。因此,AI-2 水平的增加可以恢复厚壁菌门和拟杆菌门之间的平衡,并预防或逆转菌群失调、IBD、肥胖、自闭症和压力相关疾病。
利用AI-2来维持肠道微生物平衡,可以但需谨慎
一方面,AI-2确实可以帮助调节肠道细菌的行为,如影响细菌素的产生、生物膜的形成等。但另一方面,高浓度的AI-2也可能上调某些细菌的毒力因子,如增加粪肠球菌噬菌体的释放和基因转移。
在小鼠实验中,AI-2的给药虽然没有影响细胞因子的表达,但却加重了铜绿假单胞菌的肺部感染。这表明,单纯依赖AI-2来维持肠道稳态的做法可能会带来意想不到的后果。
AI-2受体的多样性及其生理影响
目前已经确定了两类AI-2受体,分别是LuxP和LsrB。这两种受体在结构上存在差异,序列相似性仅为11%。它们广泛分布于变形菌门、芽胞杆菌等细菌中。
其他肠道细菌可能也使用类似的受体来感知AI-2信号。有趣的是,有些细菌即使没有这些典型的AI-2受体,也能对AI-2产生反应,这可能涉及其他未知的感知机制。
此外,AI-2信号还可能影响细菌的耐药性等重要生理过程。同时,在结直肠癌相关肿瘤中也检测到AI-2水平的升高,这与肿瘤相关巨噬细胞中TNFSF9基因表达的增加相关。这提示AI-2可能是结直肠癌的一个重要生物标志物,值得进一步研究。
Interkingdom Communication
细菌利用复杂的群体感应系统来感知周围环境,并协调自身的生理活动。除了前面提到的自身诱导剂-2(AI-2)外,细菌还使用其他类型的信号分子进行细胞间通讯。
doi.org/10.3390/microorganisms10101969
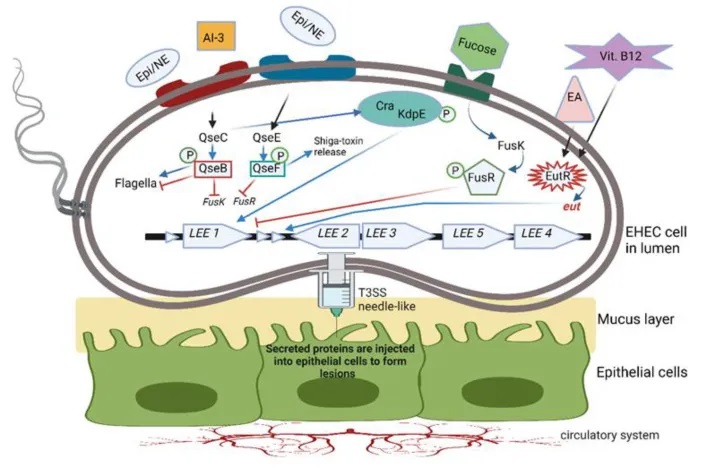
AI-3信号系统在肠道病原体中的作用
其中,自身诱导剂-3(AI-3)/肾上腺素(Epi)/去甲肾上腺素(NE)界间信号系统在一些重要肠道病原体中发挥关键作用。这种信号系统可以促进鼠伤寒沙门氏菌、啮齿柠檬酸杆菌和肠出血性大肠杆菌(EHEC)等细菌的毒力基因表达。
以EHEC为例,它利用一种双组分QS系统(TCS)来感知和响应这些环境信号分子。该系统由QseBC和QseEF两个TCS组成。当EHEC感知到Epi、NE、AI-3、岩藻糖或乙醇胺等信号分子时,会激活跨膜组氨酸激酶受体,进而激活或抑制相应的反应调节因子。
例如,QseC组氨酸传感器可以激活QseB,QseB则调节鞭毛基因的表达,同时抑制参与岩藻糖代谢和毒力基因表达的fusK/-R基因。
QseC还可以磷酸化KdpE反应调节因子,与Cra蛋白一起刺激LEE操纵子中的基因,从而促进EHEC的黏附和毒力因子的注射。此外,QseC还可以激活QseF,进而诱导志贺毒素的产生。
细菌群体感应系统对宿主免疫的影响
另一方面,铜绿假单胞菌(P. aeruginosa)产生的 3-oxo-C12-HSL(下图)在上皮细胞和免疫细胞中积极转运,并通过抑制编码紧密连接蛋白(TJ)的基因表达来破坏肠壁的通透性。这导致occludin、tricellulin、ZO-1、ZO-3、JAM-A、E-cadherin、β-catenin的重新排列(错位),并阻止粘蛋白的产生。
这不仅使上皮细胞受到感染,还会激活粘膜免疫系统,导致白细胞增加和促炎细胞因子的积累。此外,3-oxo-C12-HSL 还抑制肿瘤坏死因子 TNF-α 和 IL-12 的产生,导致 T 辅助细胞-1(Th1)反应功能障碍,并刺激 Th2 产生免疫球蛋白 G1。
抑制 Th1 和 Th2 T 淋巴细胞分化会增加细胞因子的产生 ,加剧氧化应激,刺激细胞凋亡并灭活线粒体。这些细菌间通信机制的研究,有助于我们更好地理解和预防细菌性疾病的发生。
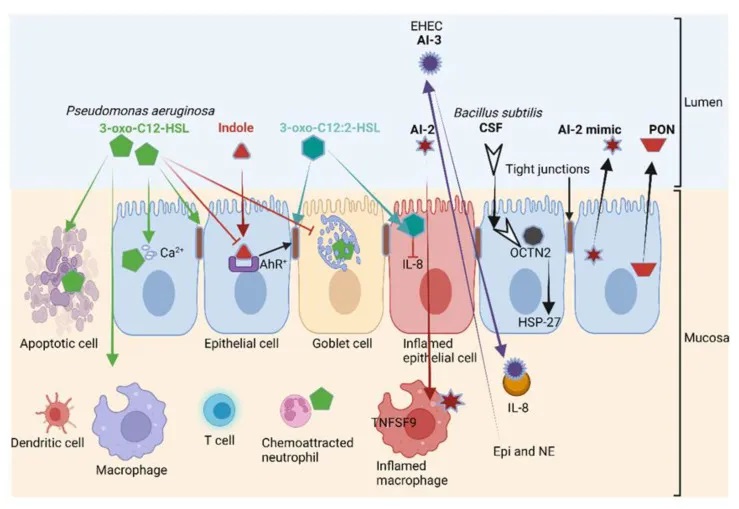
doi.org/10.3390/microorganisms10101969
铜绿假单胞菌产生的 3-oxo-C12-HSL诱导各种细胞类型(包括上皮细胞)的细胞凋亡;破坏紧密连接并减少粘蛋白的产生。
3-oxo-C12-HSL与3-氧代-C12:2-HSL对肠壁影响相反
结构相似的 3-oxo-C12-HSL、3-oxo-C12:2-HSL 对肠壁具有相反的作用。
3-oxo-C12:2-HSL不是破坏上皮细胞的稳定性,而是保护紧密连接蛋白occludin和tricellulin以及细胞质ZO-1免受促炎细胞因子(如干扰素-γ γ)、TNF-α和IL-8的侵害。
3-oxo-C12:2-HSL在肠道免疫细胞中的作用及对IBD的潜在影响
除了一些开创性研究外,3-oxo-C12:2-HSL 对人类肠道免疫细胞的影响在很大程度上仍然未知。
在诊断为IBD的患者中,3-oxo-C12:2-HSL的浓度要低得多。这表明 3-oxo-C12:2 HSL 在保护暴露于免疫冲击的上皮细胞中起重要作用。需要进一步的研究来确定 3-oxo-C12:2-HSL 是否可以用于治疗 IBD。这也需要更好地了解 3-oxo-C12:2-HSL 群体猝灭、AHL 裂解和高丝氨酸内酯(HSL)环水解所涉及的过程。
到目前为止,已在人类和其他哺乳动物的GIT中鉴定出三种参与HSL环水解的对氧磷酶(PON1、PON2和PON3)。其中,PON2 最活跃,主要在空肠中表达 。PON1 和 PON3 在诊断为克罗恩病和溃疡性结肠炎患者中的表达水平较低 。
因此,这些胃肠道疾病有可能通过恢复 PON1 和 PON3 水平来逆转。需要深入研究对氧磷酶在 GIT 不同领域中的作用,以及它们在治疗胃病中的可能应用。
肠道是人体与外界环境直接接触的重要器官,也是细菌与宿主细胞进行密切交流的场所。除了前面提到的自身诱导剂-2(AI-2)和自身诱导剂-3(AI-3)等细菌信号分子外,肠道细胞还能感知和响应其他细菌代谢产物。这些相互作用对维持肠道健康至关重要。
宿主对细菌信号的感知机制
首先,肠道细胞表达一些重要的受体,如:孕烷X受体(PXR)、过氧化物酶体增殖物激活受体(PPAR),这些受体能够感知细菌代谢物,并调节宿主细胞的基因表达,参与解毒、代谢和炎症反应的调控。
例如,PPARγ可以抑制巨噬细胞的活化,减少炎性细胞因子的产生,从而有助于缓解炎性肠病。
细菌-宿主信号相互作用网络
另一方面,细菌也能感知和利用宿主细胞的信号分子。例如,假单胞菌产生的PQS和HHQ信号分子,能够与淋巴细胞、树突状细胞和巨噬细胞相互作用,抑制宿主的先天性和适应性免疫反应。
作为应对,宿主细胞则通过激活芳烃受体(AhR)来感知这些细菌信号,并启动有益的免疫反应,如IL-22和IL-17的表达。
此外,枯草芽孢杆菌产生的CSF信号分子,能够与肠道上皮细胞表面的OCTN2转运蛋白结合,激活HSP-27,从而促进肠道屏障的完整性。一旦进入细胞,CSF还可以作为一种”报告器”,监测肠道微生物群的变化。
总结下,肠道细胞与细菌之间存在复杂的信号交流网络。宿主细胞通过感受细菌代谢物来调节自身的生理活动,而细菌也能利用宿主信号分子来调控自身的行为。这种跨界的“窃听”行为,体现了宿主-微生物之间精细的相互调控机制,对维持肠道健康至关重要。进一步研究这些相互作用过程,有助于我们更好地理解和调控肠道微生态平衡。
PapRIV
由芽孢杆菌产生的 PapRIV 穿过胃肠道,尽管速度很慢,并进入循环系统,大多数肽(87%)从那里以单向方式穿过 BBB(血脑屏障)。从体外研究中可以推断,PapRIV 激活小胶质细胞,因此可能在肠-脑相互作用中发挥作用。
氨基酸
根据2020比利时一项研究,氨基酸天冬氨酸和脯氨酸在小胶质细胞的激活中起关键作用。apRIV还诱导促炎细胞因子IL-6和TNFα的产生,增加细胞内ROS并刺激阿米巴样细胞的增加。丙酮丁醇梭菌(Clostridium acetobutylicum)产生的自体诱导肽(AIP)比肺炎链球菌产生的 AIP 更容易穿过(血脑屏障)。

自诱导肽 AIPs
自诱导肽(Autoinducer peptides, AIPs)是细菌用于细胞间通信的一类信号分子。它们在细菌群体感应中起重要作用。
革兰氏阳性菌穿过肠壁产生的AIPs已在Caco-2细胞的体内研究中得到证实。该研究表明,胃肠道中葡萄球菌(Staphylococcus)、链球菌(Streptococcus)、乳酸杆菌(Lactobacillus)和芽孢杆菌(Bacillus)产生的AIPs对肌肉细胞具有促炎和抗炎作用。
这些屏障的穿越似乎取决于肽的结构和大小。信号肽降解过程中产生的可扩散小分子,称为可扩散信号因子(DSF),也可能起到自诱导剂的作用。
肠道细菌产生的信号由肠壁中的特殊细胞记录(下图),导致身体或心理健康发生暂时或持久的变化。这些细胞通过使用模式识别受体 (PRR)区分本地(地方性)和外来、潜在致病性微生物群产生的信号。
AHL
细菌在生长过程中会产生各种化学信号分子,比如AHL(丙酰基-亮氨酸同系物)。这些信号分子可以被宿主细胞感知到,并引发一些生理反应。
比如,AHL可以增加中性粒细胞的活性,促进成纤维细胞向肌成纤维细胞的转化。这些变化对于组织的修复和再生非常重要。
宿主细胞有一些专门的受体,可以识别这些细菌信号分子。其中包括Toll样受体(TLR)和Nod样受体(NLR),它们可以感知细菌细胞壁的成分。还有一些G蛋白偶联受体(GPR),它们可以感知一些与激素相关的信号分子。
这些受体广泛存在于肠道的免疫细胞、上皮细胞和间质细胞等,在调节炎症反应和维护肠道屏障功能中起重要作用。
总的来说,细菌通过释放各种化学信号分子,可以与宿主细胞进行”对话”(下图),影响宿主的免疫反应和组织修复。这种细菌-宿主之间的相互作用,对于维持肠道健康非常关键。我们需要进一步研究这些复杂的交互机制,以更好地理解和调控肠道微生态平衡。
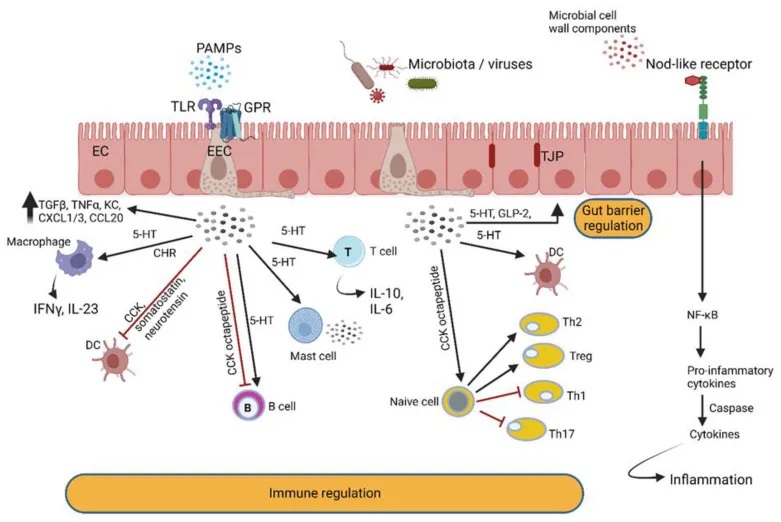
doi.org/10.3390/microorganisms10101969
肠壁中的肠内分泌细胞 (EEC) 检测肠道细菌和微生物代谢物,并通过分泌与免疫细胞反应的肽激素和细胞因子来做出反应。EEC 产生的激素调节肠道屏障功能并与肠神经反应。后者通过迷走神经与中枢神经系统进行交流。
芳香烃受体 AhRs
AhRs 调节免疫反应和发病机制(下图)。大量的AhR由肠上皮细胞和免疫细胞(如先天性淋巴细胞、上皮内淋巴细胞、TH17细胞和Treg细胞)表达,但也存在于肝脏、肺、膀胱和胎盘中。AhR 的关键功能之一是恢复屏障稳态,这是 IBD 中突出的现象。
芳烃受体(AhR) 通路总结
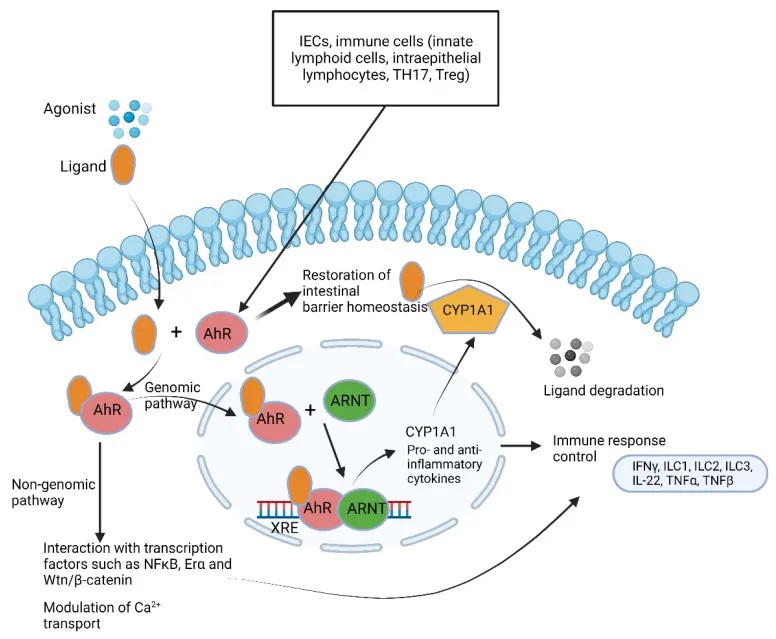
doi.org/10.3390/microorganisms10101969
AhR
芳香烃受体在维护肠道健康中的关键作用
芳香烃受体(Aryl hydrocarbon Receptor, AhR)是一种重要的细胞内受体蛋白,在人体内广泛分布,尤其集中于肝脏、肠道和免疫细胞等组织。
AhR的基本功能
AhR能够感知和结合各种芳香烃类化合物,包括细菌代谢产物、环境污染物等。
当AhR与这些化合物结合后,会进入细胞核内,调控一系列基因的表达,参与解毒代谢、免疫调节、细胞分化等重要生理过程。
AhR与疾病的关联
例如,AhR可以感知细菌产生的PQS信号分子,并激活一些有益的免疫反应,如促进IL-22和IL-17的表达,增强肠道屏障功能,维持肠道微生态平衡。
研究发现,在炎症性肠病(IBD)、代谢综合征或乳糜泻等疾病患者中,粪便中AhR配体的浓度较健康人明显降低,AhR活性也相应降低。而在艰难梭菌感染患者中,则检测到更高的吲哚浓度。
AhR可以被多种细菌代谢产物激活,包括色氨酸降解产物(吲哚、吲哚并[3,2-B]咔唑、吲哚乙酸等)以及假单胞菌产生的2,4-二羟基喹啉、喹诺酮衍生物等。
这些AhR配体的浓度在炎症性肠病、代谢综合征和乳糜泻患者中较健康人有所降低,提示AhR活性的降低可能与这些疾病的发生有关。
AhR在调节肠道屏障和免疫稳态中的作用
AhR参与调节肠道屏障完整性、免疫稳态、上皮内淋巴细胞的产生和存活、炎症反应以及肠道菌群密度等多个关键过程。
通过调节紧密连接蛋白的表达、促进IL-22和IL-10的产生、诱导抗菌肽分泌等,AhR在维持肠道健康中发挥重要作用。
在炎症性肠病患者中,AhR水平降低,尤其是在回肠部位,可能导致ILC1细胞增多,进而促进炎症因子IFN-γ和TNF-α的产生,破坏肠屏障。
AhR配体的来源与饮食影响
色氨酸是AhR配体的重要来源,但人体无法自行合成,需要从饮食中摄取。富含色氨酸的食物包括腰果、向日葵籽、奶酪、鸡胸肉和煮鸡蛋等。
因此,饮食中色氨酸的摄入量可能影响AhR配体的水平,进而影响肠道健康。
耐药菌与群体淬灭技术的兴起
五年前,世界卫生组织公布了一份对目前使用的抗菌剂最具耐药性的病原菌清单。下列物种在名单上名列前茅:
这促使许多科学家研究使用抗QS疗法(称为群体淬灭(quorum quenching,QQ)来预防或控制细菌感染的可能性。近年来,许多已发表的文章报道了有希望的结果,表明与抗生素共同处理时,可以降低微生物的致病性并且更容易根除。

2020年,天津大学的研究团队发现,可以利用QS信号分子丙酰基-亮氨酸同系物(AHL)来控制革兰氏阴性细菌引起的感染。这种方法的关键是要破坏QS对细菌毒力基因表达的调控作用。
群体淬灭的应用效果与风险
当应用群体淬灭时,粘膜相关病原体减少了约60%,主要是梭菌属(Clostridium)。尽管从感染管理的角度来看很有希望,但这种剧烈的变化可能导致促炎性疾病的发展,如囊性纤维化、硬化症和IBD,以及肠球菌(Enterococcus)和艰难梭菌(C. difficile)细胞数量的增加。
也许最令人担忧的是,在luxS QS系统功能失调或缺失的细菌中,细胞聚集和生物膜形成增加的证据,如幽门螺杆菌、霍乱弧菌(Vibrio cholerae)、放线菌集聚杆菌(Aggregatibacter actinomycetemcomitans)、胸膜肺炎放线杆菌(Actinobacillus pleuropneumoniae)、副猪嗜血杆菌(Haemophilus parasuis)、金黄色葡萄球菌(S. aureus)、表皮链球菌(S. epidermidis)、变形链球菌(Streptococcus mutans)、粪肠球菌(Enterococcus faecalis)、蜡样芽孢杆菌(Bacillus cereus)。美罗培南和左氧氟沙星刺激鲍曼不动杆菌(A. baumannii)外排泵的表达,促进AHL的释放,导致QS介导的生物膜形成增加。
群体淬灭技术的局限性与挑战
实际应用中也存在一些挑战。有研究报告,使用群体淬灭方法治疗铜绿假单胞菌和金黄色葡萄球菌感染的效果有限,特别是在生物膜相关感染中。这可能是因为QQ会导致细菌群落结构的剧烈变化,反而促进了一些致病菌的生长,如艰难梭菌等。
此外,一些细菌在缺失LuxS等QS系统时,反而表现出更强的细胞聚集和生物膜形成能力,这可能导致难以根除的持久性感染。一些抗生素如美罗培南和左氧氟沙星,也可能通过刺激细菌外排泵表达,促进AHL释放,增强QS介导的生物膜形成。
因此,单纯使用群体淬灭技术可能并不能完全解决细菌感染问题。研究人员建议,在使用群体淬灭疗法时,还需要结合具体的细菌感染情况,评估其与抗生素联合使用的效果。
此外,细菌也可能通过一些机制,如外排泵基因突变,对群体淬灭疗法产生耐药性。这可能导致难以根治的持久性感染。
群体感应分子对中枢神经系统的影响研究不足。几种QS peptides(群体感应肽分子,QSP)可通过肠粘膜扩散并进入循环系统,从那里它们可以穿透血脑屏障(BBB)。基于这些发现,QSP 可能在肠道微生物组和大脑之间的交流中发挥关键作用。如果是这种情况,QSP 可能会影响神经发育并引发神经退行性疾病。需要进一步的研究来证实这些发现。
金黄色葡萄球菌外毒素对神经系统的影响
金黄色葡萄球菌产生的外毒素激活转录因子辅助基因调节因子(Agr)A,该调节多种基因的表达,包括毒力因子、成孔毒素(PFT) 和细菌蛋白酶。这些毒素会增加细胞内的钙水平,导致感觉神经元的激活。
金黄色葡萄球菌产生的一种毒素叫做PSMS,它能特异性地结合到宿主细胞表面的一种受体叫做FPR(甲酰肽受体样蛋白)。
FPR与另外两种受体b-防御素和MRGPRX2(mas相关G蛋白偶联受体X2)的配体有结构相似性。这表明,MRGPRX2可能也参与了PSMS引起的皮肤过敏等症状。
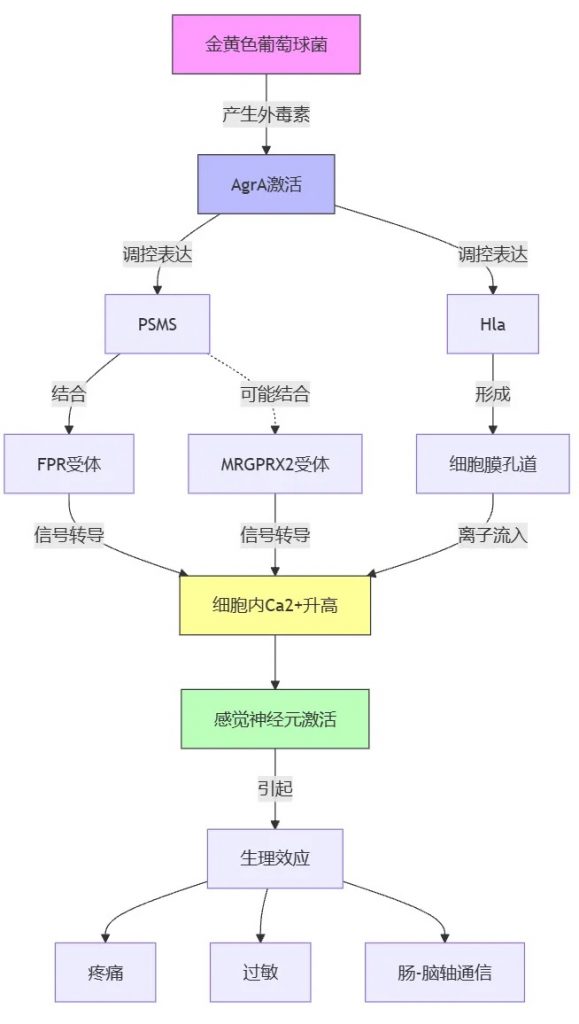
此外,FPR在肠道感觉神经节和背根神经节中有广泛表达,并与肠-脑轴(GBA)中涉及群体感应依赖性通路有关。
此外,金黄色葡萄球菌产生的毒素叫做α-溶血素(Hla),它也能通过增加细胞内钙的转移来激活神经元。与PSMS相比,Hla在细胞膜中形成的孔更小、破坏性也更小。
总之,肠道病原菌类似于金黄色葡萄球菌产生的这些毒素,通过作用于宿主细胞表面的不同受体,如FPR和MRGPRX2,从而引起神经元的激活,导致疼痛、过敏等症状。这些毒素在肠-脑轴通信中也可能发挥重要作用。

根据英国和澳大利亚联合的一项研究结果表明:与PSMS相比,Hla在细胞膜中产生更小、破坏性更小的孔。作者还观察到了 Adam10 的表达,Adam10 是一种在感觉神经元中产生的膜结合金属蛋白酶,Hla 与该酶结合。外毒素在肠脑轴通信中的重要性尚不清楚。
然而,由于金黄色葡萄球菌(S. aureus)与肠易激综合征和食物有关,这些QS分子有可能直接调节肠-脑通讯和肠道反射。

上面这篇研究在6种不同的神经元细胞系上筛选了85个群体感应肽,发现了22个可能对肠脑轴有影响的肽。其中,4 个肽诱导神经突生长,2 个肽抑制神经生长因子(NGF)诱导的神经突生长,8 个肽诱导人 SH-SY5Y 神经母细胞瘤细胞的神经突生长。2 个肽杀死 SH-SY5Y 细胞,6 个肽诱导 IL-6 表达或一氧化氮(NO)产生。
细胞壁成分在肠脑轴中的作用
已经发表了几篇关于细胞壁成分(如脂多糖、多糖和肽聚糖)在神经元激活和肠脑轴中的作用的报道。细胞壁成分还诱导神经肽、ATP 和细胞因子的释放。短链脂肪酸、色氨酸、微量胺和外毒素也具有神经调节剂特性。
5-羟色胺和组胺刺激神经末梢附近的肥大细胞。
阿尔茨海默病(AD)、自闭症谱系障碍(ASD)、多发性硬化症(MS)、帕金森病(PD) 和肌萎缩侧索硬化症(ALS)等神经元疾病与功能失调的小胶质细胞有关。
将患有注意力缺陷多动障碍(ADHD)、阿尔茨海默病和帕金森病的人类粪便移植到小鼠身上,激活了大脑中的小胶质细胞,并加剧了认知和身体损伤。
这些发现以及更多证据表明微生物群失调与神经发育、神经退行性和精神疾病(如自闭症谱系障碍、精神分裂症、阿尔茨海默病、重度抑郁症和帕金森病)之间存在明确联系,促使研究人员更仔细地研究肠脑轴。
有关肠道细菌和神经递质的更多信息,读者可关注谷禾健康以往其他分享文章。
扩展阅读:
肠道菌群检测报告解读——肠道菌群代谢产物包括激素,神经递质等
胃肠道特殊的环境下生存着海量的细菌微生物,因此它们已经开发出与宿主细胞交流的机制也就不足为奇了。
一些群体感应分子是属特异性的,但少数被革兰氏阴性菌和革兰氏阳性菌使用。Epi 和 NE 等激素以及某些碳水化合物(例如岩藻糖和 EA)激活细菌中的特定受体,进而触发细胞质中的传感器以调节基因表达。
在健康的胃肠道中,这些信号分子对于维持稳态状态很重要。一些 QS 分子,如 3-oxo-C12:2-HSL,保护紧密连接蛋白,在治疗肠漏综合征中可能很重要。
一些 QS 分子刺激肿瘤生长并与特定癌症的发展密切相关,而另一些则与神经系统疾病有关。穿透血脑屏障(BBB)的 QSP 构成了一个值得更多研究的领域,特别是因为肠道微生物组越来越被认为是神经精神病学的关键参与者。
通过更深入地了解肠道细菌产生的不同 QS 系统,未来可能能够开发可用于诊断神经和精神疾病的生物标志物,例如焦虑和抑郁、MDD、精神分裂症、双相情感障碍、自闭症和强迫症。
主要参考文献:
Dicks LMT. How does Quorum Sensing of Intestinal Bacteria Affect Our Health and Mental Status? Microorganisms. 2022 Oct 5;10(10):1969.
Janssens Y., Debunne N., De Spiegeleer A., Wynendaele E., Planas M., Feliu L., Quarta A., Claes C., Van Dam D., De Deyn P.P., et al. PapRIV, a BV-2 microglial cell acti-vating quorum sensing peptide. Sci. Rep. 2021;11:10723.
De Spiegeleer A., Elewaut D., Noortgate N.V.D., Janssens Y., Debunne N., Van Langenhove S., Govindarajan S., De Spiegeleer B., Wynendaele E. Quorum sensing molecules as a novel microbial factor impacting muscle cells. Biochim. Biophys. Acta (BBA) Mol. Basis Dis. 2019;1866:165646.
Miller M.B., Bassler B.L. Quorum Sensing in Bacteria. Annu. Rev. Microbiol. 2001;55:165–199.
Coquant G., Aguanno D., Pham S., Grellier N., Thenet S., Carrière V., Grill J.-P., Seksik P. Gossip in the gut: Quorum sensing, a new player in the host microbiota interactions. World J. Gastroenterol. 2021;27:7247–7270.
Yashiroda Y., Yoshida M. Intraspecies cell–cell communication in yeast. FEMS Yeast Res. 2019;19:foz071.
Prescott R., Decho A.W. Flexibility and Adaptability of Quorum Sensing in Nature. Trends Microbiol. 2020;28:436–444.
Tam K., Torres V.J. Staphylococcus aureus Secreted Toxins and Extracellular Enzymes. Microbiol. Spectr. 2018;7:GPP3-0039-2018.
Fülling C., Dinan T.G., Cryan J.F. Gut Microbe to Brain Signaling: What Happens in Vagus…. Neuron. 2019;101:998–1002.
Krasulova K., Illes P. Intestinal interplay of quorum sensing molecules and human receptors. Biochimie. 2021;189:108–119.
Galloway W.R.J.D., Hodgkinson J.T., Bowden S.D., Welch M., Spring D.R. Quorum Sensing in Gram-Negative Bacteria: Small-Molecule Modulation of AHL and AI-2 Quorum Sensing Pathways. Chem. Rev. 2010;111:28–67.
Wu S, Liu J, Liu C, Yang A, Qiao J. Quorum sensing for population-level control of bacteria and potential therapeutic applications. Cell Mol Life Sci. 2020 Apr;77(7):1319-1343.
Krzyżek P. Challenges and Limitations of Anti-quorum Sensing Therapies. Front. Microbiol. 2019;10:2473.
Wu S., Liu J., Liu C., Yang A., Qiao J. Quorum sensing for population-level control of bacteria and potential therapeutic applications. Cell. Mol. Life Sci. 2019;77:1319–1343.
Janssens Y, Wynendaele E, Verbeke F, Debunne N, Gevaert B, Audenaert K, Van DeWiele C, De Spiegeleer B. Screening of quorum sensing peptides for biological effects in neuronal cells. Peptides. 2018 Mar;101:150-156.
谷禾健康

抑郁症和抑郁情绪是不一样的,如果说抑郁情绪是一阵悲伤或沮丧,那么抑郁症可以具有巨大的深度和持久力。抑郁症不只是沮丧发作,也不是性格弱点,无法以“快刀斩乱麻”的方式轻松摆脱。
世界卫生组织统计,全球约10亿人正在遭受精神障碍困扰,新冠疫情后,全球精神障碍疾病负担更加沉重,抑郁症患者激增 5300万,增幅高达 27.6%。受抑郁症影响的女性多于男性。
抑郁症患者通常会出现持续的压抑,兴趣减退,动力不足;除了在情绪上的悲观冷漠之外,很多抑郁症患者还常伴有食欲不振、便秘等胃肠道症状。

抑郁症是一种多因素,多重机制参与的复杂的疾病,病情绵长。它与神经递质表达异常、炎性因子分泌、神经细胞通路改变、下丘脑-垂体-肾上腺(HPA)轴持续紊乱、肠道菌群改变及线粒体结构异常等诸多因素有关。
抑郁症在中医中属于“郁证”的范畴,几千年前的书籍中就已有所记载。《黄帝内经》中所述 “心主血脉、心主神志” , 这里“神志之心”与现代医学脑的生理功能基本对应,中医学“心与小肠相表里”理论与现代医学提出的“脑-肠轴”理论相通,其部分内涵可以理解为中枢神经系统与肠道菌群的密切关系。
近年来,越来越多的中药、中药复方被证实可以发挥抗抑郁作用,人们开始认识到中医药通过调节肠道菌群而影响抑郁症发生发展,这为抑郁症的治疗提供新思路。
本文主要介绍肠道菌群和抑郁症之间的关联,窥探中医与肠道菌群之间的微妙关联,以及基于肠道菌群来探讨中医药改善抑郁症的相关机制。
本文主要内容如下:

抑郁症是一种常见的医学疾病,会对感受、思维方式和行为方式产生负面影响。它是一种复杂的疾病,有多种成因,包括各种生活方式、饮食、环境和遗传因素。
▼ 常见的抑郁症症状有哪些?
抑郁的人通常会出现以下几种症状:

▼ 抑郁症有哪些类型?
不同类型抑郁症的例子包括:
双相情感障碍、重度抑郁症(临床抑郁症)、持续性抑郁症和季节性情感障碍。
双相情感障碍的人会经历抑郁和躁狂(情绪异常升高)或轻躁狂(明显但不一定异常的情绪升高)交替状态。
重度抑郁症的特征是严重的症状会扰乱个人的日常生活,通常会影响食欲、睡眠、工作或享受生活的能力。
持续性抑郁症涉及持续两年或更长时间的症状,有时以严重抑郁症发作为特征。
其他类型的抑郁症包括产后抑郁症、精神病性抑郁症和季节性情感障碍,每一种都在特定情况下发生。
产后抑郁症发生在女性分娩后的时期。症状包括焦虑、对照顾婴儿缺乏兴趣,以及悲伤、绝望或无能为力的感觉。
精神病性抑郁症是在精神病的背景下出现的,精神病可能涉及妄想、幻觉或偏执的症状。
季节性情感障碍的特点是抑郁症状在秋季和冬季发作,随着春季和夏季暴露于自然光的增加而缓解。
▼ 哪些人群患抑郁症的风险相对较高?
▼ 有什么方法可以治抑郁症?
目前用的较多的是药物和心理疗法。
目前常用的药物包括:
抗抑郁药可能会在使用的第一周或两周内产生一些改善,但可能需要两到三个月才能看到效果。
心理疗法帮助一个人识别扭曲/消极的想法,以更积极的方式应对生活中的挑战。
例如与他人建立积极的互动关系,识别消极的信念和行为并改善,学习设定切实可行的人生目标等。
心理疗法或“谈话疗法”有时单独用于治疗轻度抑郁症;对于中度至重度抑郁症,心理治疗通常与抗抑郁药物一起使用。
其他疗法包括:
电惊厥疗法、经颅磁刺激、按摩疗法、音乐或艺术疗法、瑜珈(或太极或冥想)、时间疗法、针灸疗法、写作疗法、光疗、有氧运动、基于肠道菌群调节的补充剂非药物疗法(包括益生菌、益生元等)等。
▼ 什么原因可能导致抑郁症?
与抑郁症发生相关的因素可能有很多:
自尊心低、容易被压力压垮,对自己和世界产生消极想法,这样的人群似乎更容易患抑郁症。
持续暴露于暴力、忽视、虐待或贫困等不良环境,或不利的生活事件,会增加一个人患抑郁症的可能性或引发抑郁发作。
抑郁症可以在家族中遗传。例如,如果同卵双胞胎中的一个患有抑郁症,则另一个有 70% 的机会在一生中的某个时候患上抑郁症。
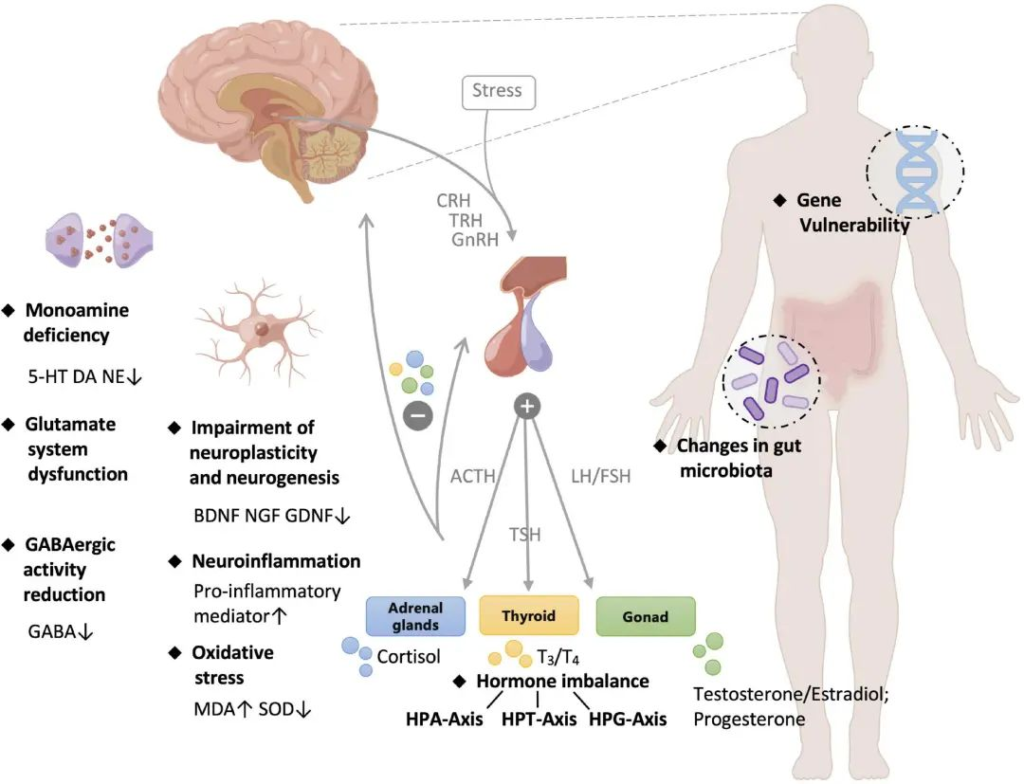
抑郁症的发病机制复杂且仍然难以摸透,目前已经提出了几种假说/理论来从不同的角度解释临床表现。
抑郁症的病理学
doi.org/10.3389/fpsyt.2022.1054726
单胺假说:
谷氨酸能假说和 GABA 能缺陷假说:
激素失调:
神经发生和神经可塑性假说:
肠道菌群理论:
关于肠道菌群如何通过微生物群-肠-脑轴影响抑郁症,我们在下一章节详细阐述。
肠道菌群与人体是共生互利密不可分的统一体, 又被称为人的 “ 第二大脑 ” ,它的作用不仅局限于胃肠道,还可以通过 “脑-肠轴” , 参与调控脑发育、应激反应、焦虑抑郁、认知功能等中枢神经系统的活动,从而对脑的功能和行为产生重大影响。肠道菌群、肠道、脑三者间密切的信息交流,共同影响人的喜怒哀乐。
抑郁患者常伴有胃肠功能障碍, 表现在食欲不振、代谢紊乱、胃肠功能紊乱及肠道菌群异常等方面的问题。即便不是抑郁症患者,我们回想一下,有时候对某些事件感到压抑,恐惧等情绪,或者一些状况感到焦虑的时候:是不是也会经历某种肠道不适,比如恶心、反胃、腹泻等。
胃肠道和大脑之间似乎有着某种联系,如果说大脑可以影响肠道,那么反过来肠道是不是也能影响大脑?这种联系究竟是怎么发生的?
本章节我们详细了解其中的故事。

近期发表在《自然通讯》杂志上的两项研究发现,肠道中的几种细菌与抑郁症状之间存在联系。
一 “抑郁症状的肠道微生物组关联研究” :

该研究调查了来自鹿特丹研究队列的 1,054 名参与者的粪便微生物组多样性和组成与抑郁症状的关系,并在 1,539 名受试者的阿姆斯特丹 HELIUS 队列中验证了这些发现。
研究人员确定了 13 个与抑郁相关菌群,包括:
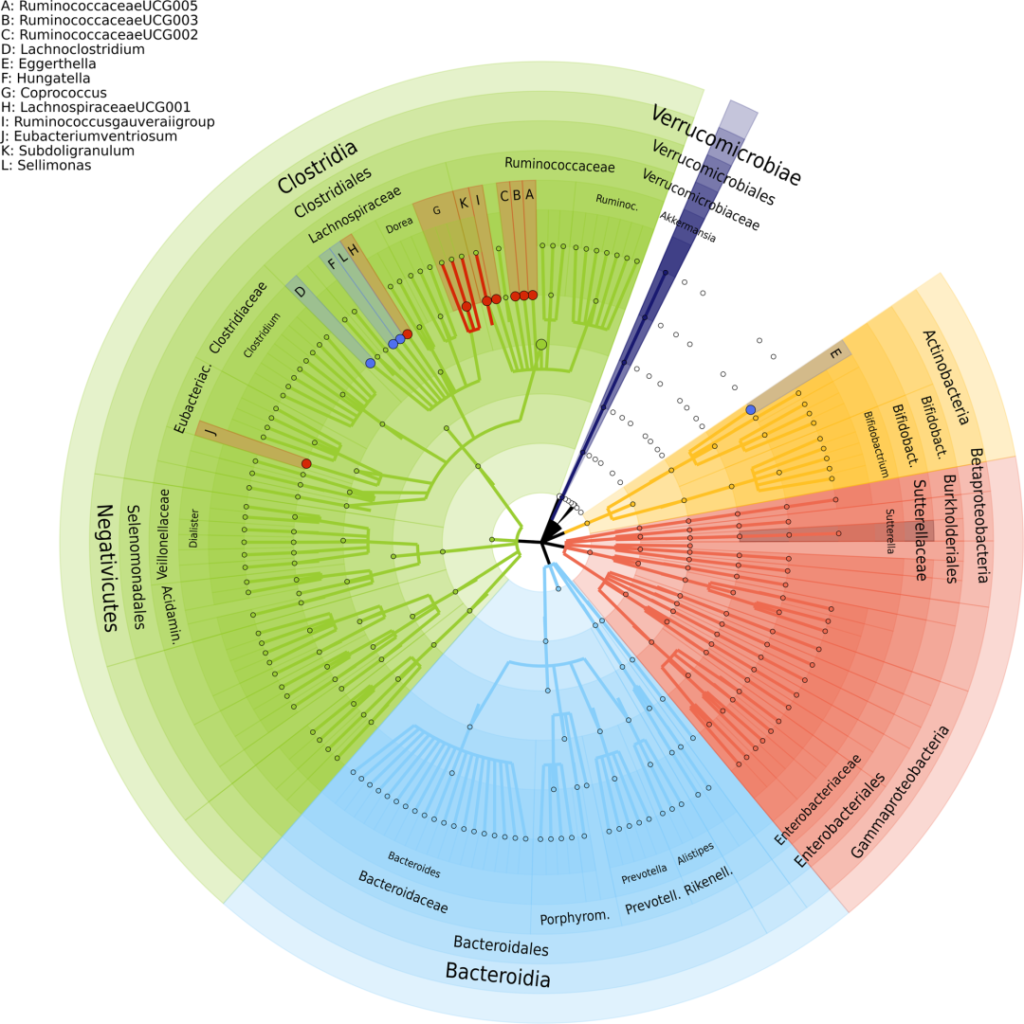
红点表示与抑郁症状负相关的属,蓝色点表示与抑郁症状正相关的属。最外层描述了门级,然后是纲、目、科和属级。
已知这些细菌参与谷氨酸、丁酸、血清素和γ-氨基丁酸 (GABA) 的合成,这些是抑郁症的关键神经递质。该研究表明,肠道微生物组成可能在抑郁症中发挥关键作用。
二 “跨种族的肠道菌群和抑郁症状”的研究:
不同种族群体的微生物组和抑郁症状水平差异很大。因此,任何针对微生物组的抑郁症干预都需要了解不同种族的微生物组抑郁症相关性。

通过分析HELIUS队列的数据,研究人员描述了生活在同一城市地区的6个种族群体(荷兰、南亚苏里南、非洲苏里南、加纳、土耳其、摩洛哥;N=3211)的肠道微生物群及其与抑郁症状的关联。
考虑到人口统计学、行为学和医学差异,肠道菌群在个体内部(α多样性)和个体之间(β多样性)可预测抑郁症状水平。
β多样性解释了29%-18%的抑郁症状的种族差异。与抑郁症状相关的细菌属属于多个科,主要包括:
该研究结果表明,肠道微生物群与抑郁症状水平相关,这种关联在不同种族群体中普遍存在。肠道微生物群的种族差异可能部分解释了抑郁症的平行差异。
以上我们了解到肠道菌群和抑郁症之间的关联。那么肠道菌群是如何影响抑郁症的?这就涉及到一个概念:
“ 微生物群-肠-脑轴 ”
1980 年,由于对神经元和脑细胞中胃肠内分泌系统的激素信号传导的研究发现,肠-脑轴的概念意外诞生。在接下来的几十年里,这一概念得到进一步加强和扩展,包括微生物群对肠-脑轴的贡献。
目前,微生物群-肠-脑轴更像一个复杂的循环而不是单向关系,它代表了宿主体内中枢神经系统、内分泌化学信号系统、免疫调节、微生物群和代谢效应,以及大脑和肠道的屏障功能之间的相互作用。
以上这些因素的协调对维持个体的健康状态起着重要作用。如果微生物群-肠-脑轴失衡,则会引起包括抑郁症等精神障碍。
我们前面的文章已经讨论过,肠道菌群可以通过许多潜在途径影响抑郁症,从大脑神经元到肠道小分子。
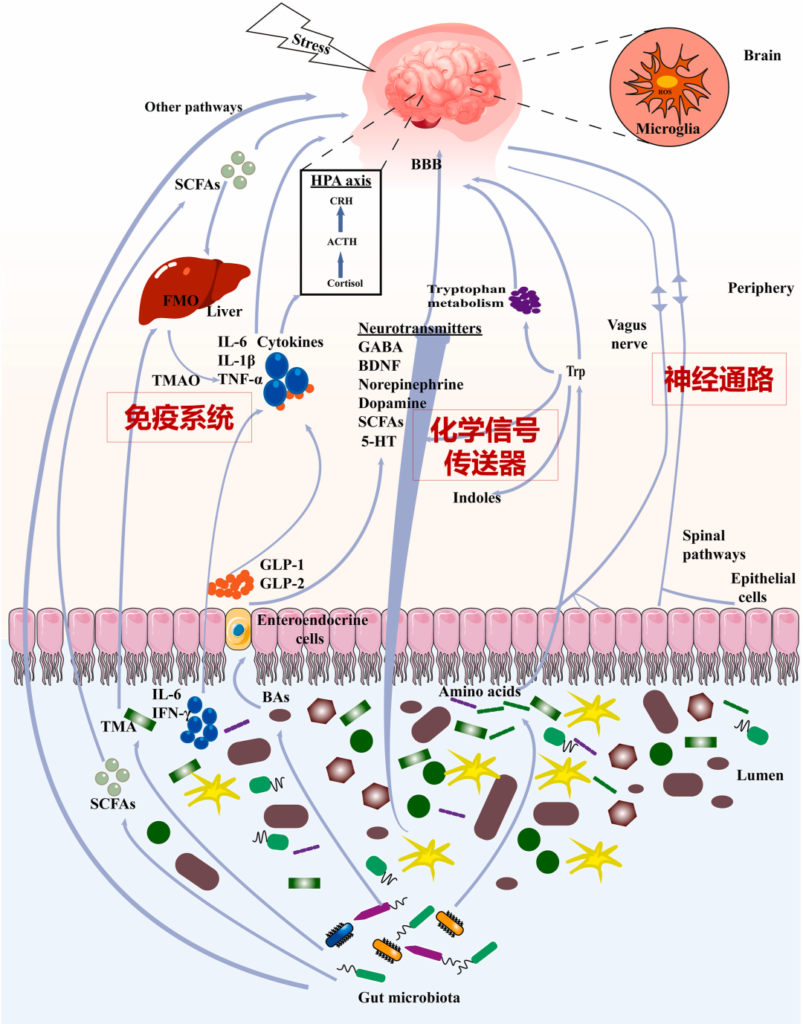
这里我们结合最新研究再了解一下,通常肠道菌群可以通过以下三种主要途径参与抑郁症,包括:
肠道微生物群和大脑之间的沟通途径
编辑
Li B, et al., J Ethnopharmacol. 2023
肠道菌群和大脑的沟通方式包括:
迷走神经、脊髓通路、短链脂肪酸(SCFA)、吲哚、色氨酸(Trp)、γ-氨基丁酸(GABA)、脑源性神经营养因子(BDNF)、去甲肾上腺素、多巴胺、5-羟色胺(5-HT)、细胞因子等。
接下来,我们就以上这些,逐一了解每个途径具体的运作方式。
Part 1 化学信号
▼
神 经 递 质 ——“信号兵”
神经递质是指脑内的化学物质,它们可以在神经元间的信息传递中起着重要作用,也就是充当“信号兵”的作用。根据其化学成分,神经递质分为:
神经递质——单胺
抑郁症的发病与单胺系统密切相关,多巴胺能、去甲肾上腺素能和血清素能神经元参与学习、记忆、行为、情绪和认知。
肠道微生物群影响单胺,包括多巴胺、去甲肾上腺素。例如,蜡样芽孢杆菌(Bacillus cereus)和蕈状芽孢杆(Bacillus mycoides)可以产生多巴胺。
神经递质——胆碱
胆碱是肠道、皮肤、神经系统和细胞中的必需营养素。胆碱水平会影响肠道菌群。如:胆碱缺乏可导致革兰氏阴性菌增加,并增强抑郁症患者的抑郁样行为。
肠道微生物群可以影响胆碱的生物利用度(如大肠杆菌可以抑制人体吸收胆碱的能力),从而导致胆碱缺乏和神经系统疾病的发生。
抑郁症患者的胆碱水平显著高于健康人。同时,抑郁症患者表现出肠道微生物群失衡。这表明影响胆碱代谢的肠道菌群可能参与中枢神经系统调节。
神经递质——谷氨酸
谷氨酸是大脑中的一种兴奋性神经递质,记忆、学习、行为、认知和发育与谷氨酸神经递质有关。突触传递通过谷氨酸受体实现,谷氨酸受体与神经递质释放和突触可塑性发育密切相关。
抑郁症患者的内侧前额叶皮质中谷氨酸水平降低。肠道细菌可影响谷氨酸代谢,如:
• 空肠弯曲杆菌 (Campylobacter jejuni)
• 谷氨酸棒状杆菌 (Corynebacterium glutamate)
• 乳酸发酵短杆菌 (Brevibacterium lactofermentum)
肠道微生物群将蛋白质分解为氨基酸,其中大部分被肠内肠细胞顶膜上的转运蛋白(如兴奋性氨基酸C1)吸收。因此,谷氨酸被肠道吸收并进入血液。谷氨酸转化为γ-氨基丁酸(GABA)。
部分肠道微生物群可以直接产生GABA。例如,双歧杆菌可以分泌大量GABA。
注:GABA作为大脑中的神经递质,促进神经系统的稳定。这些神经递质由肠道产生,通过肠脑轴进入中枢神经系统,发挥各种功能。
▼
胆 汁 酸
胆汁酸是胆汁的重要组成部分,在脂肪代谢中起着重要作用。胆汁酸在肝脏中产生,由肠道菌群产生的酶代谢,促进脂质的消化和吸收。
肠道微生物群介导的胆汁酸通过酶水解转化为次级胆汁酸,这会影响肠肝循环并导致中枢炎症。因此,胆汁酸代谢亢进与抑郁症的发展相关。
例如,Turicibacter 的相对丰度与抑郁症患者血液中的几种胆汁酸呈正相关,表明Turicibacter可能参与肠内胆汁酸的合成。
胆汁酸受体可以影响葡萄糖代谢,从而导致抑郁症的发生。肠道微生物群通过调节胆汁酸的变化,影响BA-TGR5-GLP-1途径,进而导致抑郁症的发作。
▼
短 链 脂 肪 酸
短链脂肪酸主要由乙酸、丙酸、丁酸和戊酸组成。可以通过肠道吸收并穿过血脑屏障,影响大脑功能。
短链脂肪酸可以改变血脑屏障的通透性,肠道菌群如如长双歧杆菌和短双歧杆菌产生的短链脂肪酸促进5-HT的合成和循环,从而实现抗抑郁作用。临床上没有针对短链脂肪酸的药物。外源性短链脂肪酸的补充还可能加重疾病。通过肠道微生物群调节短链脂肪酸可以改善抑郁症。
▼
三 甲 胺
三甲胺(TMA)是胃肠道化学递质的主要调节因子之一。肠道微生物群代谢肉类、高脂肪乳制品和其他食品中富含的胆碱和TMA。肠道微生物群产生的TMA由肝脏中的黄素单加氧酶3催化,生成三甲胺N-氧化物(TMAO),这会导致衰老、认知障碍、社会行为改变和脑部疾病。
TMA的产生可以通过调节肠道微生物群来抑制。
血清TMAO水平与心血管疾病和抑郁样行为相关。3,3-二甲基-1-丁醇(DMB)是人体中的一种重要神经递质,被证实可抑制肠道微生物群产生TMA,并降低高胆碱小鼠的TMAO水平。研究发现,DMB可以增加肠道中AKK菌的丰度。
TMA被肠道吸收,并穿过血脑屏障进入大脑,导致神经元兴奋性毒性、氧化应激和炎症。
TMA的结构与谷氨酸类似,谷氨酸是一种兴奋性神经递质。抑郁症患者表现出明显低于健康人的谷氨酸水平,TMA激活受体,导致分子损伤和氧化应激。因此,TMA影响抑郁症的发病机制。
通过抑制与TMA和TMAO相关的肠道微生物群,可以实现抗抑郁效果,并且可以减少药物直接作用引起的副作用。
▼
脑源性神经营养因子(BDNF)
BDNF是神经营养因子家族的一员,对海马和额叶皮层神经元的生长和存活至关重要。BDNF广泛分布于大脑中,与学习、记忆和神经发生密切相关。
BDNF——大脑和肠道细菌之间的重要纽带
肠道微生物群影响BDNF。例如,一些益生菌增加了血清BDNF水平,而补充真杆菌和梭状芽孢杆菌可降低BDNF的水平。肠道微生物群与BDNF密切相关,从而影响大脑功能。
肠道微生物群可以通过BDNF/TrkB信号通路实现双向肠道脑调节,这表明抑郁症的发病机制也与BDNF有关。
BDNF与抑郁症的发生和发展密切相关
肠道菌群失衡导致小鼠BDNF表达减少,导致认知功能和焦虑发生变化。同时,抑郁症患者大脑中BDNF和成熟BDNF的表达水平均降低。BDNF mRNA在海马和杏仁核(与抑郁症相关的区域)的表达显著降低。
在抑郁症模型中,发现将BDNF注射到中脑和海马的齿状回区域会产生类似抗抑郁的效果,通过注射TRK抑制剂可以逆转这种效果。
▼
色 氨 酸 代 谢
色氨酸是一种必需的氨基酸,可以影响人类的生长和健康。肠道微生物的变化可以通过调节色氨酸代谢来引起,而色氨酸代谢产物,如血清素、犬尿氨酸和吲哚,可以影响肠道微生物群和抑郁症之间的关系。
注:5-HT,5-羟色胺,又名血清素。
通过调节血清素的产生影响抑郁症
中枢神经系统中,色氨酸在酶的催化下生成血清素。血清素是参与控制睡眠、疼痛和情绪的关键神经递质。
肠道微生物群,例如乳球菌、乳杆菌、链球菌、大肠杆菌、克雷伯氏菌,通过表达色氨酸合酶来调节 5-HT 的产生, 脑肠轴进一步影响大脑中色氨酸的代谢。
通过肠道菌群代谢产物犬尿氨酸影响抑郁症
犬尿氨酸是色氨酸的代谢产物。犬尿氨酸具有抗氧化功能,可防止大脑皮层中的脂质氧化。肠道微生物群通过犬尿氨酸途径影响犬尿氨酸代谢。
抑郁症患者的血清 犬尿氨酸/喹啉酸 比率显着降低。犬尿氨酸和喹啉酸代谢之间的平衡与大脑结构和功能有关,尤其是在海马体中。
通过肠道菌群代谢产物吲哚影响抑郁症
吲哚是肠道菌群代谢的重要组成部分,与色氨酸代谢密切相关。
Part 2 神 经 通 路
▼
迷 走 神 经
迷走神经:脑-肠之间的一条高速公路,可以双向传递信息。
迷走神经是连接胃肠道和神经系统的最长神经之一,在肠道和大脑之间的主要沟通途径中起着重要作用。
一方面,肠道微生物群通过激活迷走神经来改变下游神经活动,如BDNF、GABA和催产素信号。肠道包含肠感觉上皮细胞,这些细胞与迷走神经神经元形成回路,使大脑能够直接感知肠道的变化。
另一方面,迷走神经可以通过刺激传出神经释放乙酰胆碱,从而影响巨噬细胞和α-7烟碱胆碱能神经受体,同时抑制炎症因子以实现抗抑郁作用。
补充乳酸杆菌JB-1菌株降低了前额叶皮层GABAα2受体的mRNA表达,从而降低了应激诱导的皮质酮水平和减轻抑郁。
▼
脊 髓
脊髓是自主神经系统的重要组成部分。脊髓连接大脑和肠道,肠道是中枢神经系统最重要的部分。脊髓损伤导致肠交感神经和自主神经张力失衡,导致胃肠道疾病。
肠道微生物群会影响脊髓
脊髓损伤会损害肠道神经系统,导致肠道运输功能障碍。脊髓损伤后的并发症,包括肠道功能障碍、焦虑和抑郁,可能是由于微生物群-肠-脑轴相互作用所致。
脊髓影响抑郁症的发病机制
脊髓中抑制性神经元的功能障碍导致脊髓层面传入感觉信息的放大,这是抑郁症患者疼痛的原因之一。疼痛和抑郁是密切相关的。事实上,前额叶和杏仁核与抑郁症密切相关。
Part 3 免 疫 系 统
免疫系统是肠脑轴的一部分,是从微生物到大脑的重要信号级联。肠道细菌失调导致肠道和血液之间的屏障变得可渗透,从而让“坏”细菌进入血液,可能引起炎症。
炎症可能是一个重要的免疫节点
免疫炎症反应机制:胃肠道系统是最大的免疫器官,抑郁症中存在一种慢性、低水平的炎症状态,肠道菌群可作用于免疫系统,降低外周血中促炎因子IL-1、IL-6、IL-8、IL-10、TNF-α、TGF-3等释放,并升高抗炎急性期蛋白、趋化因子、黏附分子、前列腺素等的表达,从而影响中枢神经系统,最终导致脑功能的改变。
临床上,抑郁症患者表现出细胞因子水平升高、神经发生减少和氧化应激水平升高。肠道菌群对免疫系统的调节是影响抑郁症的重要因素之一。
以上化学信号、神经通路、免疫系统三大途径,详细描述了微生物群-肠-脑轴之间的关联,以及肠道菌群是如何通过该轴影响抑郁症的发生发展。显而易见,肠道菌群其中扮演重要角色。
目前关于抑郁症的治疗,药物治疗是常见手段之一,化学合成药物因其疗效快、剂量低等优点被广泛使用,但容易引起耐药性,抑制质子泵,可能危害肠道健康。
药物对肠道菌群和肠道屏障的影响是药物安全性和有效性的重要评价指标。近年来,随着大众对肠道健康的日益重视,肠道已成为中药领域的研究热点。中药具有抗菌活性温和、修复作用以及人类不易对其产生耐药性等优点。
那么中药与肠道菌群有什么关联,与肠道菌群的相互作用及其肠道屏障的修复机制如何?下一章节我们来详细了解一下。
强调“整体性”
中医认为人与自然、社会环境具有整体性。自然界孕育人类的繁衍,人类活动顺应四时变化方能“精神乃治”,两者交互协作、对立统一,即通过“天人相应”实现“天人合一”。
作为人体内的微生态,肠道菌群与机体各项结构机能与内在环境共生共存,互根互用,构成一个有机整体。
“多因素”相关
中医提出体质是人体形态结构、功能活动的个体特征,与生命过程、遗传、后天环境等因素有关。
肠道菌群也受到饮食、生活方式、药物、社会环境、遗传、地理位置等多因素影响。
“个体化”防治
辨证论治作为中医基本原则之一,其核心目的是通过因人因时因地制宜辨证来更好地阐述个体疾病的易患因素和疾病发展的倾向性。
虽然人体肠道肠道菌群的核心菌群相似,但在不同宿主个体间,不同菌群的相对丰度和菌种存在很大差异。肠道菌群是健康的动态组成部分。个体化治疗计划的制定和实施与肠道菌群检测分析密切相关。
《黄帝内经》云:“胃足阳明之脉……是动则病洒洒振寒……心欲动,独闭户塞牖而处。甚则欲上高而歌,弃衣而走,贲响腹胀,是为骭厥。”
提示古人认为精神状态异常不仅与心失神明相关,亦与阳明胃病变关系密切。
中医学提出人体由“形”和“神” 构成,“形为神之宅”“神乃形之主”,即心理特征影响人的生理机能和形态结构,又同时受到机体生理病理情况反馈的影响。
现代医学提出心理压力或其他抑郁因素引起的饮食偏好、应激激素调节、炎症反应及自主神经反应可重塑肠道菌群,肠道菌群的代谢产物、毒素、神经激素等又能反过来调节宿主的饮食偏好或心情。
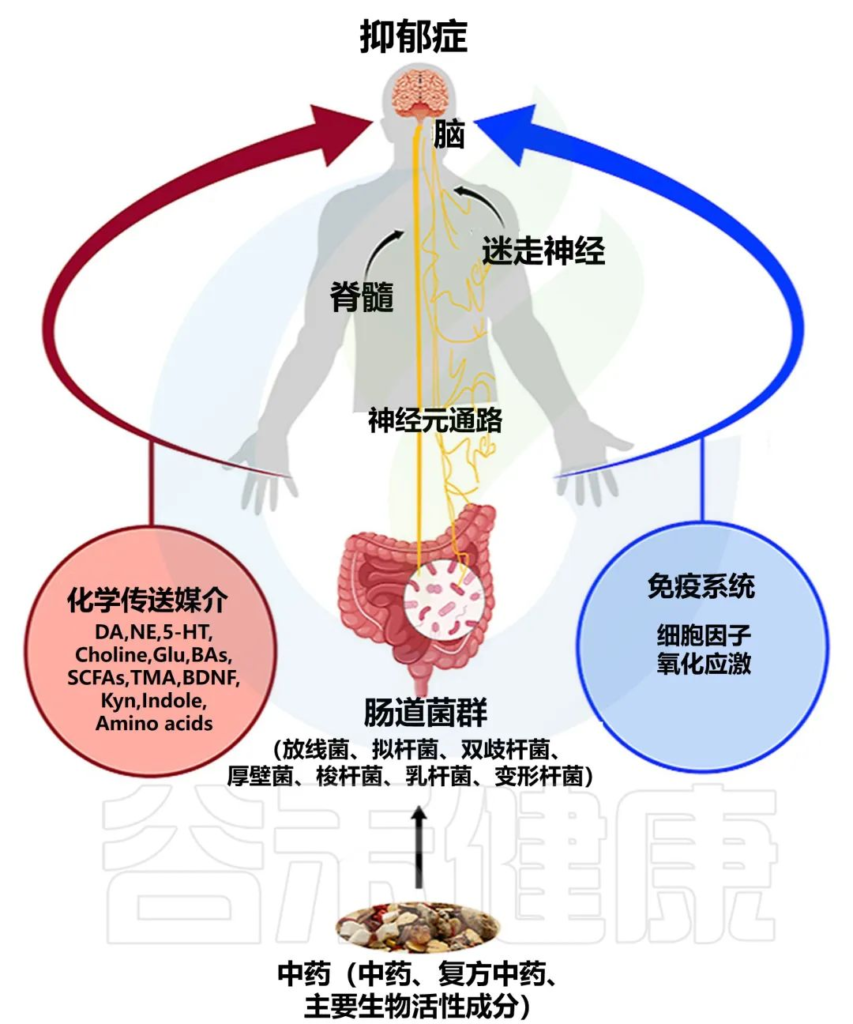
Li B, et al., J Ethnopharmacol. 2023
抑郁症可由“气”(生命能量)、血液循环障碍、“热”(炎症)、湿气和痰引起。
解气是抑郁症的常见治疗方法,从而促进血液循环、减少炎症和缓解疼痛。传统上,一些中药配方被用于治疗抑郁症,如逍遥散和小柴胡、甘麦大枣(GMDZD)和半夏厚朴汤。一些治疗胃肠道疾病的中药也具有抗抑郁类型的作用。
下面列一些常见的治疗抑郁症的复方中药配方:
逍遥散、解郁丸、四逆散、薯蓣散、小柴胡汤、柴胡温胆汤、柴胡桂枝汤
甘麦大枣汤、开心散、柴胡加龙骨牡蛎汤、酸枣仁汤
柴胡疏肝方、半夏厚朴汤、
补阳还五汤、血府逐瘀汤
百合地黄汤、小补心汤、归脾汤、桃红四物汤
栀子豉汤、栀子厚朴汤
大多数治疗抑郁症的中药都具有疏肝、益气、养血、活血、化痰的作用。
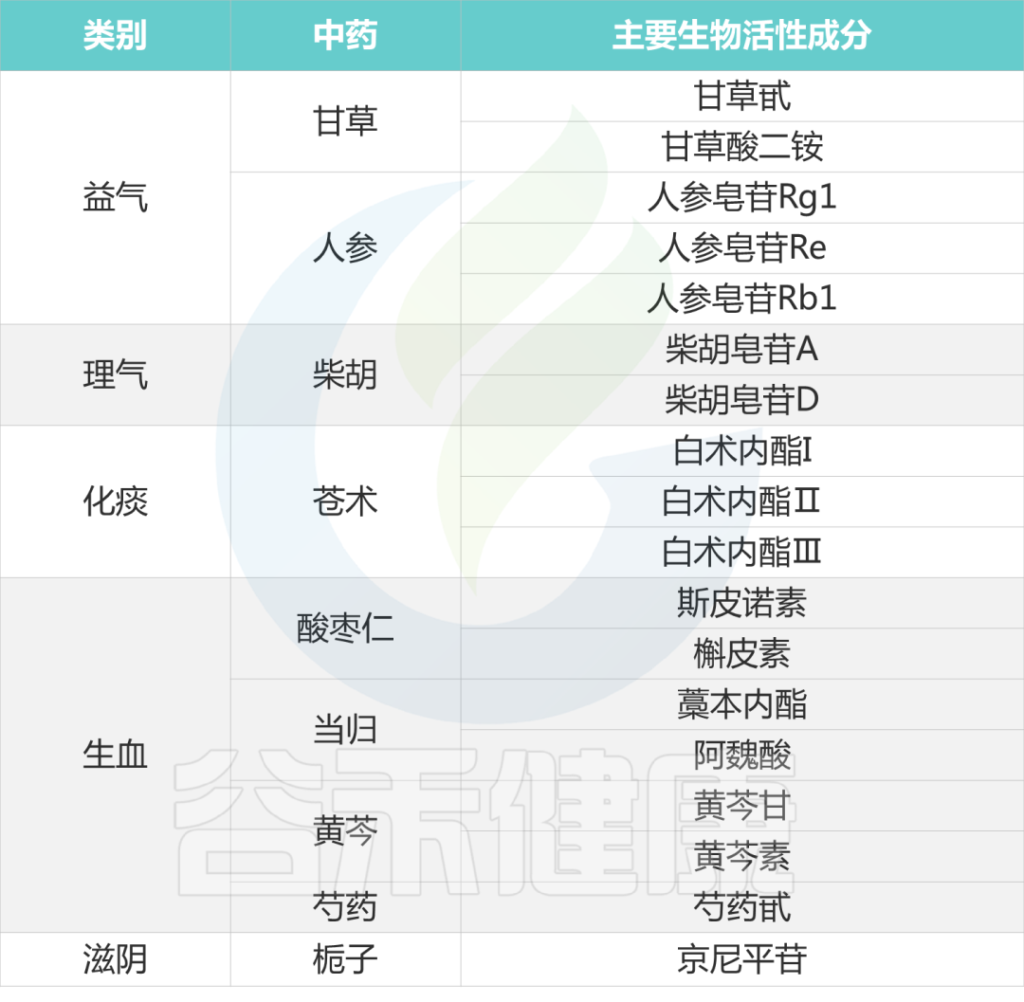
下表列出各种中药的主要生物活性成分:
Li B, et al., J Ethnopharmacol. 2023
以上是中药与肠道菌群的整体关联,以及常见的一些具有抗抑郁作用的中药及其生物活性成分,这些中药是如何通过调节肠道菌群,从而达到抗抑郁的效果?下一章节我们继续。
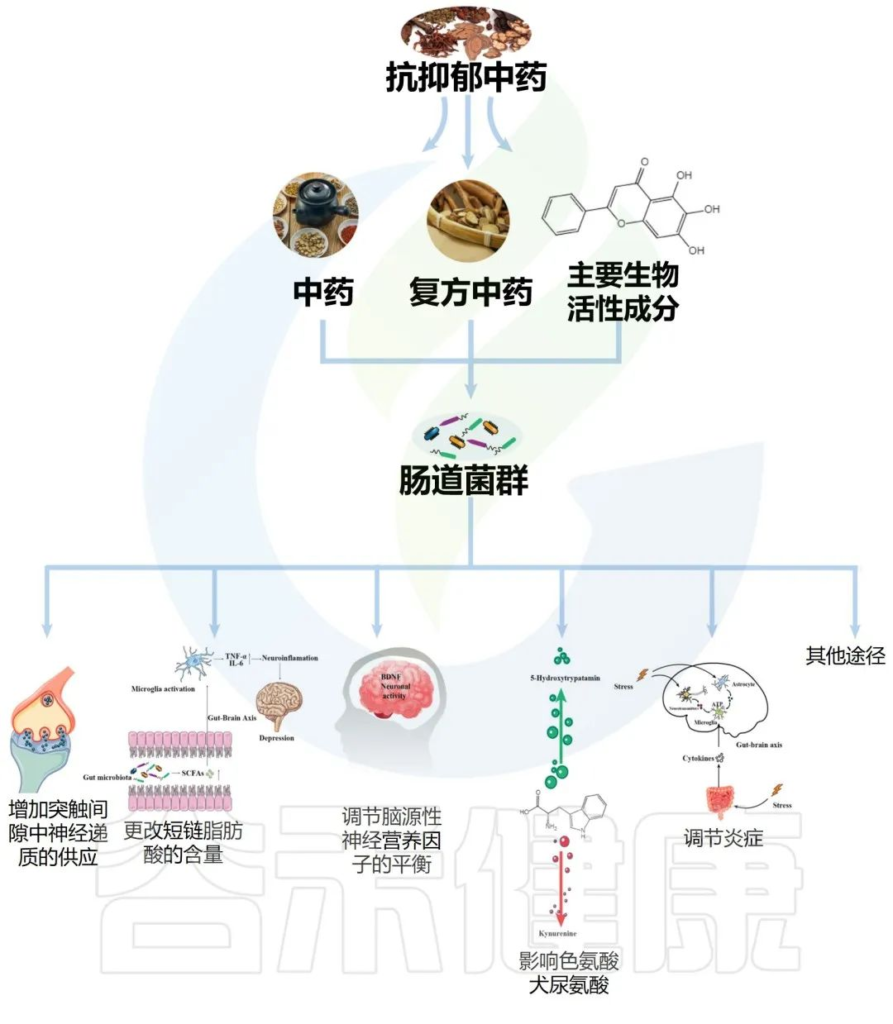
虽然目前对于中医药抗抑郁作用的潜在机制相对模糊,但可能涉及多种机制,其中之一可能包括肠道微生物群的调节。本章节讨论了由调节肠道微生物群的化学递质和细胞介质诱导的中药抗抑郁作用。
传统中药配方,包括复方中药、中药和主要生物活性成分,它们影响肠道菌群改善抑郁症如下:
Li B, et al., J Ethnopharmacol. 2023
迄今为止,大多数抗抑郁药物都是神经递质再摄取抑制剂,通过抑制神经递质的再摄取和增加突触间隙的神经递质供应来改善神经传递。
中医药在中枢神经系统疾病的治疗方面有着丰富的历史。
开心散
开心散(KXS)、栀子豉汤(ZZCD)和甘麦大枣汤是用于治疗抑郁症的不同类型的中药。研究发现,这些物质参与调节肠道微生物群,最终缓解抑郁症状。
注:栀子豉汤(ZZCD)首载于《伤寒论》,在中国被广泛用于治疗抑郁症、发热性疾病和失眠症已有1000多年的历史。
开心散调节肠道和大脑功能的重要组成部分。开心散治疗改变了CUMS诱导抑郁症小鼠肠道微生物群的相对丰度,并通过增加Allobaculum、Turicibacter、双歧杆菌,改善了抑郁症症状。
栀子厚朴汤
相关的中药处方,如栀子厚朴汤,逆转了CUMS诱导抑郁症小鼠肠道神经递质(如5-HT、多巴胺和色氨酸)的抑制。
研究报告,栀子厚朴汤的抗抑郁类型效应由肠道微生物群介导,肠道微生物群影响神经递质的代谢。与未治疗组相比,栀子厚朴汤治疗组显著增加了Barnesiella和Lachnospiraceae的成分,但降低了链球菌。
总之,这些结果表明,栀子厚朴汤通过肠脑轴调节肠道微生物群以改善抑郁症,这影响了大脑中的相关神经递质。此外,在用栀子厚朴汤治疗后,CUMS诱导的齿状回中未成熟和新生神经元的丰度降低显著改善,抑郁样行为得到缓解。
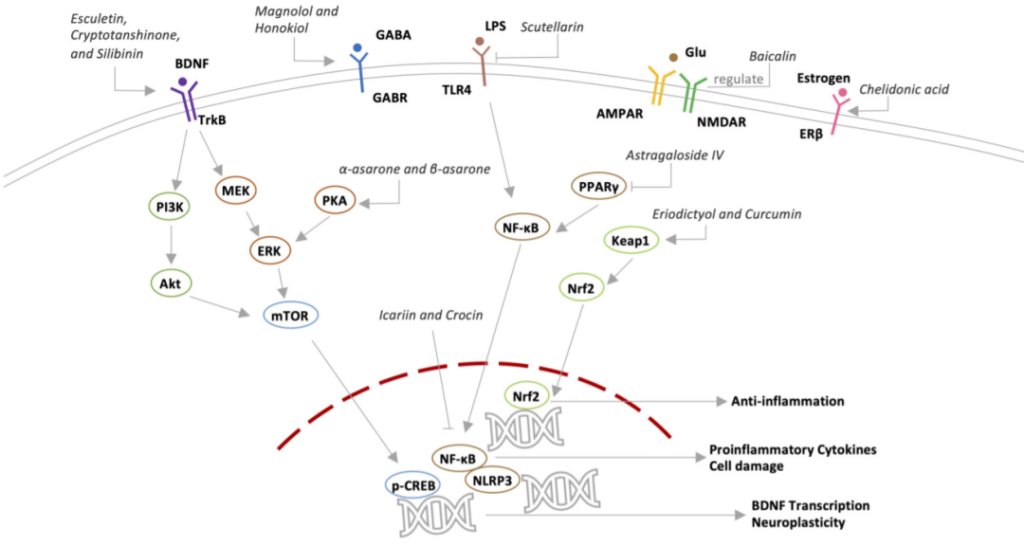
潜在抗抑郁机制
doi.org/10.3389/fpsyt.2022.1054726
甘麦大枣
甘麦大枣增加了大鼠肠道中的神经递质水平,缓解了抑郁症,这可能是由于活性成分甘草酸苷的作用。
其他
一些草药以 5-HT 受体为主要抗抑郁机制。
如来自葛根的葛根素不仅作为 5-HT2C 和 5-HT2A 受体的拮抗剂,而且作为 5-HT1A 受体的激动剂。
大量中药配方以及主要生物活性成分通过调节肠道微生物群中的神经递质发挥抗抑郁作用。如下表所示:
表 中药对抑郁症患者化学神经递质的影响
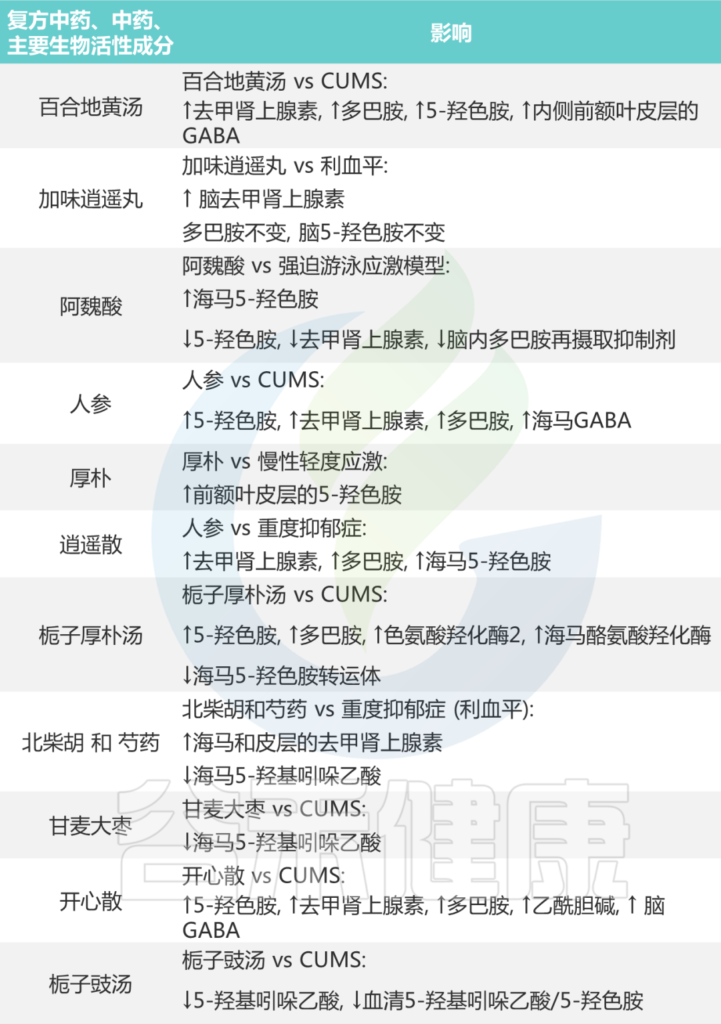
Li B, et al., J Ethnopharmacol. 2023
►⋙
总之,中药含有多种活性成分,这些成分旨在整合和调节人体内的多个环节、水平和靶点,通过调节肠道菌群和神经递质来实现抗抑郁效果。在临床实践中,除了用作抗抑郁药的补充外,它还为与神经递质紊乱相关的其他疾病提供治疗。
研究发现,短链脂肪酸作为肠脑轴的递质,会影响抑郁症。例如,患者体内可产生短链脂肪酸的Alloprevotella的相对丰度增加。一些中药配方及其活性成分可以通过改变肠道中的短链脂肪酸含量来诱导抑郁症样症状。
DOI: 10.16438/j.0513-4870.2022-0844
五味子素可以缓解抑郁小鼠肠道微生物群失衡,这与粪便短链脂肪酸水平的变化有关。
黄芩苷(BAI)是甘草的一种生物活性成分,通过促进肠道中产短链脂肪酸的细菌,影响抑郁症的发展。
栀子厚朴汤的抗抑郁类型效应通过调节肠道微生物群来促进丁酸分泌而发生。
用肉苁蓉(CTE)治疗CUMS模型大鼠显示,肠道微生物群的破坏与短链脂肪酸的产生之间存在强烈的相关性。
杏仁可以增加肠道微生物群的含量,如瘤胃球菌和真细菌。人参及其提取物通过改变肠道微生物群的代谢产物,从而影响血清短链脂肪酸水平和大脑中的神经递质,从而达到抗抑郁作用。
黄连素和淡豆豉通过调节短链脂肪酸达到抗抑郁作用。
总之,如下表所示,研究结果支持各种中药制剂可以通过介导肠道微生物群的短链脂肪酸来治疗抑郁症。
中药对抑郁症患者短链脂肪酸的影响
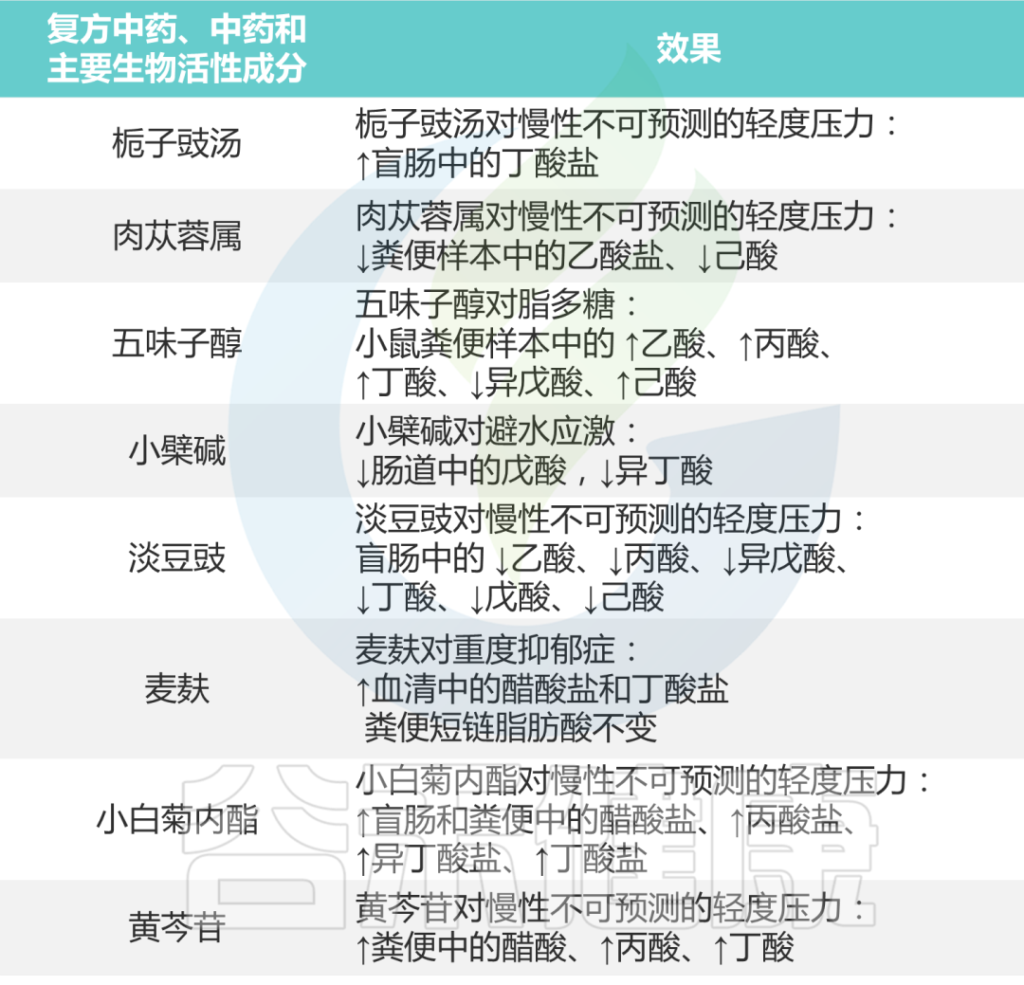
Li B, et al., J Ethnopharmacol. 2023
►⋙
目前,中医对短链脂肪酸的调节更广泛地用于治疗代谢性疾病,如肥胖症、糖尿病和高血脂,但通过中医调节肠道微生物组治疗抑郁症的研究相对较少。因此,将中医药作为深入研究抑郁症的切入点将有助于开发新药。
BDNF与抑郁症密切相关,是许多抑郁症中医治疗的目标,包括槲皮素、肉苁蓉、人参和柴胡。
槲皮素
槲皮素来源于多种植物多酚,据报道可以预防焦虑,缓解抑郁,提高记忆力。
值得注意的是,槲皮素已被证明可以改变肠道微生物群。例如,槲皮素处理增加了肠道微生物多样性以及下列菌群的相对丰度:
槲皮素的抗抑郁作用是通过调节BDNF相关蛋白CPNE6和TREM1之间的平衡实现的。
在一项研究中,槲皮素能够改善大鼠的抑郁样行为,同时降低肠道微生物群的含量,如Verrucomichobiae和脱硫弧菌。
此外,槲皮素改善了受损的结肠组织,增强了海马中BDNF的表达。
肉苁蓉
肉苁蓉可以改善抑郁大鼠肠道微生物群的含量,如拟杆菌的增加和瘤胃球菌的减少。此外,肉苁蓉增加了抑郁症患者的BDNF水平。这些发现支持BDNF可能影响抑郁症的治疗。
其他
据报道,其他复方中药和中药制剂和主要生物活性成分也通过调节BDNF实现抗抑郁作用,如下表所示:
表 中药对抑郁症患者BDNF的影响

Li B, et al., J Ethnopharmacol. 2023
►⋙
临床上,没有药物直接调节大脑中的BDNF,大脑中每天的BDNF含量只能通过添加一些蔬菜来维持。如果中医能调节肠道微生物群中的BDNF,它不仅能改善抑郁症,还能治疗BDNF相关疾病。
一些中药配方通过影响色氨酸-犬尿氨酸代谢平衡来改善抑郁症样症状。
人参皂苷
人参和相关的中药配方富含人参皂苷,已表明人参皂苷可改善大肠杆菌K1诱导的小鼠抑郁和肠道失调。此外,据报道,人参皂苷改善了肠色氨酸-犬尿氨酸代谢紊乱和血清犬尿氨酸水平,导致海马犬尿氨酸含量显著变化。
此外,人参皂苷治疗抑制小胶质细胞过度激活,以改善抑郁样行为。
天丝饮
天丝饮是一种中药,可以提高肠道微生物群(乳杆菌和毛螺菌科)的含量,然后调节色氨酸-犬尿氨酸途径的代谢产物,以改善抑郁症状。因此,色氨酸-犬尿氨酸代谢可能影响肠道微生物群。
其他
据报道,其他复方中药和中药制剂和主要生物活性成分通过调节犬尿氨酸水平实现抗抑郁作用,如下表所示。
中药治疗抑郁症对犬尿氨酸的影响

Li B, et al., J Ethnopharmacol. 2023
►⋙
临床上,已发现氯胺酮和右旋西帕明等抗抑郁药与犬尿氨酸密切相关,但尚未应用直接作用于犬尿氨酸的药物。因此,发现新的抗抑郁药或辅助药物作用于犬尿氨酸已成为一个悬而未决的问题。
中医药可以通过肠道微生物组调节犬尿氨酸来改善抑郁症状,具有安全性高、稳定性好的潜在优势。
与色氨酸-犬尿氨酸代谢相关的酶的调节,如QPRT(喹啉磷酸核糖转移酶)和IDO(吲哚胺2,3-二加氧酶),也是抑郁症治疗的理想靶点。因此,中药肠道微生物群对犬尿氨酸的调节将成为抗抑郁药物的新靶点。
越来越多的研究表明,改变肠道微生物群可以通过细胞因子调节影响抑郁症。
一些中药制剂通过影响血液和肠道中的细胞因子水平(如细胞因子IL-6和IL-1β)发挥抗抑郁作用,从而通过血脑屏障改变中枢神经系统的细胞因子,并影响脑小胶质细胞。作为中枢神经系统中最重要的免疫细胞之一,小胶质细胞与一系列神经退行性疾病有关,并与神经炎症密切相关。
秋葵
秋葵处理增加了Barnesiella、拟杆菌和乳杆菌的相对丰度。此外,秋葵抑制toll样受体4的表达、NF-κB的核易位、高水平的促炎细胞因子和增强的丝裂原活化蛋白激酶信号传导。最终,秋葵达到了抗抑郁类型的效果。
柴胡疏肝散
柴胡疏肝散的主要成分皂苷A和D,在CUMS模型大鼠中发挥抗抑郁作用,恢复HPA轴的平衡,并通过提高肠道和海马促炎因子(如IL-1β、IL-6和TNF-α)的水平,减少神经炎症。
这些研究进一步证明,肠道微生物群可以通过调节细胞因子来影响大脑的神经系统。
其他
据报道,其他复方中药和中药制剂和主要生物活性成分通过调节细胞因子发挥抗抑郁作用,如下表所示。
中药对抑郁症患者细胞因子的影响

Li B, et al., J Ethnopharmacol. 2023
►⋙
在临床实践中,抑郁症患者菌群的相对丰度与免疫力密切相关,这表明特定菌株有可能影响免疫力。因此,在未来,中医不仅可以治疗抑郁症,还可以通过肠道微生物群调节免疫系统,这可能对其他神经疾病具有良好的治疗效果。
临床上,有几种方法可以通过刺激神经通路来治疗抑郁症,如脑深部刺激(DBS)和迷走神经刺激(VNS)。然而,这些技术存在一些并发症,例如需要手术和术后恢复。
肠道微生物群通过迷走神经调节脑-肠轴信号。例如,长双歧杆菌NC3001通过迷走神经缓解焦虑样行为。柠檬酸杆菌(Citrobacter)通过调节迷走神经的活动产生焦虑-抑郁样行为。
▸中药通过调节迷走神经缓解抑郁症
因此,影响肠道的某些类型的中药,如四逆散(SNS)、柴胡温胆汤、柴胡桂枝方和桂皮方,通过调节迷走神经来影响抑郁样行为。
柴胡温胆汤通过调节迷走神经的活动来影响乙酰胆碱含量的变化,从而缓解抑郁症。
看起来,就缓解抑郁症而言,在调节迷走神经活动方面,使用中医药调理肠道微生物群,比直接使用药物更有效;这是一个值得进一步研究的研究方向。
▸中药通过调节脊髓损伤缓解抑郁症
抑郁症常伴有慢性疼痛,疼痛信号主要存在于脊髓通路;因此,脊髓在与抑郁症相关的神经通路中起着重要作用。研究发现,脊髓损伤可导致肠道生态紊乱;肠道菌群的重塑可能会恢复肠道功能。
在脊髓损伤中,益生菌复苏可以改善脊髓损伤。用抗生素治疗的小鼠表现出更严重的脊髓损伤。因此,中医可以通过调节脊髓通道的活动来调节肠道微生物群以缓解抑郁症。
中医作用于多种神经通路,并在多个层面治疗抑郁症。它们不仅在抑郁症的快速治疗中发挥作用,还可以缓解与抑郁症相关的并发症。因此,中医显示出巨大的潜力。然而,中医治疗的手段五花八门,以上主要是服用各种药剂,其他还有包括食疗、针灸、太极、按摩等。
● 针灸影响肠道菌群
研究表明,针灸可以通过对胃肠动力、分泌和免疫的调节影响肠道菌群。
研究人员通过针刺应激性胃溃疡模型大鼠的百会、中脘、足三里穴位,结果表明,针刺能够有效改善应激性胃溃疡引发的胃黏膜损伤,可能与增加的菌群多样性,促使紊乱的肠道菌群水平回调有关。
研究人员对实验组溃疡性结肠炎的患者应用益阳愈溃汤结合针刺治疗,对照组仅给予益阳愈溃汤,治疗后实验组双歧杆菌、乳酸杆菌等优势菌种均高于对照组。
另外有研究人员认为早期针刺对中风患者的干预不仅可以促进神经功能的恢复,并可以有效降低中风后抑郁症的发病率,说明中医针灸治疗与肠道菌群也有某种联系,更有利于对肠道菌群的研究,从而拓宽抑郁症治疗的新方法和思路。
很少有研究报道了中药制剂在抑郁症临床治疗中的毒性。
柴胡皂苷D是柴胡中的主要生物活性成分,具有抗抑郁、肝毒性、神经毒性、溶血性和心脏毒性作用。因此,应注意中药配方中柴胡的用量。
黄芩苷在肠道中作为黄芩素代谢。黄芩苷在HepG2细胞中显示出比黄芩素更高的毒性,但肠道微生物群产生的黄芩苷代谢产物的毒性低于黄芩苷本身。因此,黄芩苷生产工艺应进一步优化,以治疗抑郁症。
开心散导致白细胞和淋巴细胞以及血糖水平升高,尽管所有患者在治疗30天后均表现出正常水平。因此,口服开心散被认为是相对安全的。
甘麦大枣汤与治疗抑郁症的不良反应有关,如口干、便秘、失眠和易怒。
补骨脂及其主要生物活性成分具有抗抑郁作用,但临床前安全性研究揭示了未知化合物和机制对肝脏和生殖系统的毒性作用。
►⋙
一般来说,中药配方不会刺激肝脏或肾脏,也不会损害胃肠道。与西医使用的抗抑郁药物相比,中医药治疗抑郁症的副作用一般较少,不会产生依赖或成瘾,疗效稳定,从而防止治愈后复发。
人体大多数疾病都与肠道有关,肠道菌群调节越来越被认为是疾病的立足点和突破口。
从中医的角度来看,人的各个器官并不是独立存在的,而是相互联系的,共同影响着全身的生理机能。中医擅长于动态和整体上把握疾病的发生发展,这与肠道菌群反映人体健康动态的理念不谋而合。
通过监控肠道菌群的动态预测易感疾病,并运用其与人体自身的共生关系和个体化的生物学特征,使中医在疾病诊治中突出整体观和辨证论治的优势。
抑郁症的发病机制尚不确定,单胺、神经营养因子、神经递质和肠道菌群被认为参与了抑郁症的发展。抑郁症研究的重点已经从大脑转移到其他系统,微生物群-肠-脑轴可通过形成复杂的内分泌、神经、免疫炎症的生物学免疫机制,在影响抑郁症的发生发展中发挥重要作用。
中药通过非常复杂的机制调节肠道功能。虽然中药调节肠道菌群的机制没有完全摸透,但其显著疗效已经受到越来越多的关注。中医身心一体观的临床实践经验在防治抑郁症方面具有潜在优势。
中药与肠道菌群之间抗抑郁的关系不仅仅有中药对于肠道菌群的影响, 还有肠道菌群对中药成分代谢和促进吸收的作用等值得探索。
目前仍需进行大量的研究以探寻中药与肠道菌群之间的相互作用,这对于研究抑郁症的发病机制和抗抑郁新药研发有深远意义。结合中医药理论,以肠道菌群为靶点,开发中药新药研究,将为中医药防治抑郁症提供新的思路和治疗方案。
主要参考文献:
Radjabzadeh, D., Bosch, J.A., Uitterlinden, A.G. et al. Gut microbiome-wide association study of depressive symptoms. Nat Commun 13, 7128 (2022). https://doi.org/10.1038/s41467-022-34502-3
Sun Y, Zhao J, Rong J. Dissecting the molecular mechanisms underlying the antidepressant activities of herbal medicines through the comprehensive review of the recent literatures. Front Psychiatry. 2022 Dec 22;13:1054726. doi: 10.3389/fpsyt.2022.1054726. PMID: 36620687; PMCID: PMC9813794.
Li B, Xu M, Wang Y, Feng L, Xing H, Zhang K. Gut microbiota: A new target for traditional Chinese medicine in the treatment of depression. J Ethnopharmacol. 2023 Mar 1;303:116038. doi: 10.1016/j.jep.2022.116038. Epub 2022 Dec 15. PMID: 36529248.
Asim M, Wang H, Waris A. Altered neurotransmission in stress-induced depressive disorders: The underlying role of the amygdala in depression. Neuropeptides. 2023 Jan 20;98:102322. doi: 10.1016/j.npep.2023.102322. Epub ahead of print. PMID: 36702033.
Wilkowska A, Szałach ŁP, Cubała WJ. Gut Microbiota in Depression: A Focus on Ketamine. Front Behav Neurosci. 2021 Jun 23;15:693362. doi: 10.3389/fnbeh.2021.693362. PMID: 34248517; PMCID: PMC8261217.
Park LT, Zarate CA Jr. Depression in the Primary Care Setting. N Engl J Med. 2019 Feb 7;380(6):559-568. doi: 10.1056/NEJMcp1712493. PMID: 30726688; PMCID: PMC6727965.
王凯新, 董晓梦, 苏毅鹏,等. 肠道菌群与抑郁症关系的研究进展[J]. 吉林大学学报:医学版, 2022(004):048.
Xu J, Chen HB, Li SL. Understanding the Molecular Mechanisms of the Interplay Between Herbal Medicines and Gut Microbiota. Med Res Rev. 2017 Sep;37(5):1140-1185. doi: 10.1002/med.21431. Epub 2017 Jan 4. PMID: 28052344.
Bosch, J.A., Nieuwdorp, M., Zwinderman, A.H. et al. The gut microbiota and depressive symptoms across ethnic groups. Nat Commun 13, 7129 (2022). https://doi.org/10.1038/s41467-022-34504-1
Ashraf H, Salehi A, Sousani M, Sharifi MH. Use of Complementary Alternative Medicine and the Associated Factors among Patients with Depression. Evid Based Complement Alternat Med. 2021 Mar 26;2021:6626394. doi: 10.1155/2021/6626394. PMID: 33854557; PMCID: PMC8019377.
鲍婷婷, 杨凯麟, 龙治勇,等. 基于”心与小肠相表里”探讨肠道菌群与抑郁症[J]. 中国中西医结合杂志, 2021.
Barandouzi ZA, Starkweather AR, Henderson WA, Gyamfi A, Cong XS. Altered Composition of Gut Microbiota in Depression: A Systematic Review. Front Psychiatry. 2020 Jun 10;11:541. doi: 10.3389/fpsyt.2020.00541. PMID: 32587537; PMCID: PMC7299157.
Zhao Y, Luan H, Gao H, Wu X, Zhang Y, Li R. Gegen Qinlian decoction maintains colonic mucosal homeostasis in acute/chronic ulcerative colitis via bidirectionally modulating dysregulated Notch signaling. Phytomedicine. 2020 Mar;68:153182. doi: 10.1016/j.phymed.2020.153182. Epub 2020 Feb 7. PMID: 32065953.
袁霞红, 刘林. 肠道菌群调节抑郁症机制及中医药防治研究进展[J]. 中华中医药学刊, 2022, 40(9):4.
Aktar R, Parkar N, Stentz R, Baumard L, Parker A, Goldson A, Brion A, Carding S, Blackshaw A, Peiris M. Human resident gut microbe Bacteroides thetaiotaomicron regulates colonic neuronal innervation and neurogenic function. Gut Microbes. 2020 Nov 1;11(6):1745-1757. doi: 10.1080/19490976.2020.1766936. Epub 2020 Jun 9. PMID: 32515657; PMCID: PMC7524364.
Dinan TG, Cryan JF. Gut microbes and depression: Still waiting for Godot. Brain Behav Immun. 2019 Jul;79:1-2. doi: 10.1016/j.bbi.2019.02.007. Epub 2019 Feb 13. PMID: 30771453.
丁书凝, 贾心如, 阮善明,等. 中医思辨体系中肠道菌群的共性分析和诊疗应用[J]. 时珍国医国药, 2022(007):033.