-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
孩子像有个停不下来的小马达,总是坐立不安、难以专注,对话像是没在听,还伴随着一些无法自控的小动作,比如频繁地挤眉弄眼、清嗓子或不自觉地耸动肩膀?…
这些常常被家长和老师贴上“不听话”、“坏习惯”标签的行为,背后可能隐藏着在儿童神经发育常见问题——注意缺陷多动障碍(ADHD,下文简称多动症)与抽动障碍(TD,下文简称抽动症)。
统计显示,全球学龄儿童中多动症的患病率约为3-7%,抽动障碍的患病率约为1-3%,且两者共病现象十分普遍。约50%-60%的抽动症患者同时患有多动症,男孩比女孩更常见。
注意力缺陷多动障碍(ADHD)和抽动障碍是儿童期常见的神经发育障碍,并不是很多家长以为的“学坏”或“故意捣乱”等行为问题。长期以来,医学界认为其病因主要与遗传、大脑结构发育及神经递质失衡有关。然而,近年来越来越多的研究发现,一个常被忽视的因素——肠道菌群。
例如,研究发现多动症儿童的肠道中,具有抗炎能力的普拉梭菌的丰度显著降低;而在抽动障碍的案例中,则观察到梭菌属和拟杆菌属等菌群的异常改变。
这些特定的菌群失衡,可以直接或间接地导致肠道通透性增加(即“肠漏”),引发低度炎症,甚至影响多巴胺等关键神经递质的合成与代谢。
肠道微生态的紊乱不仅影响消化吸收,更能通过神经、免疫及内分泌通路,远程影响大脑功能,从而可能加剧注意力缺陷、多动冲动以及不自主的抽动症状。
本文我们一起来深入了解一下多动症和抽动症,包括其症状、发病率、原因、共病现象等,重点探讨肠道菌群失调是如何影响这些神经发育障碍,并介绍肠道菌群检测在辅助诊断中的应用,以及如何通过调节肠道微生态进行相关干预,为管理这类神经发育障碍提供全新的视角与策略。
本文目录
一、认识多动症与抽动症
核心症状(多动症、抽动症症状、相似之处与不同之处)
患病率、共病现象
风险因素、原因
二、传统干预手段及其局限性
多动症的常用药物治疗
抽动障碍的常用药物治疗
传统药物治疗的共同困境
三、肠道菌群与抽动障碍和多动症的关联
多动症患者的肠道菌群特征
抽动障碍患者的肠道菌群特征
四、从菌群失调到神经炎症:发病机制新解
肠道屏障受损与全身性炎症
神经炎症与氧化应激
菌群代谢物的关键作用
菌群对神经递质的直接与间接调控
五、多动症与抽动症的诊断
多动症和抽动症的常规诊断流程
当前诊断的困境
整合肠道菌群检测:辅助诊断的新思路
肠道菌群检测如何为中西医结合提供桥梁
六、多动症与抽动症的干预新策略
饮食干预
– 地中海饮食、寡抗原饮食、人造食用色素去除
益生菌
– 双歧杆菌、植物乳杆菌PS128等
关键营养素补充
– Omega-3、维生素B6、B9、B12、D、锌、镁、铁等
粪菌移植(FMT)
中草药
– 健脾疏肝汤、菖麻熄风片、息风颗粒等
生活方式
– 运动、睡眠、行为干预等
核 心 症 状
▶ 注意缺陷多动障碍
注意缺陷多动障碍(ADHD,下文简称多动症)是一种复杂的神经发育障碍,其核心症状主要围绕三个方面:
😕 注意缺陷
– 难以持续集中注意力、容易分心、做事拖沓、经常丢失物品、在对话中似乎没有在听。
😖 多动
– 在座位上不停扭动、难以安静地坐着、话多、在不适当的场合跑来跑去或爬上爬下。
😡 冲动
– 难以等待、经常打断他人、不假思索地行动。
ADHD依据症状特点可分为三类:
患者常伴有执行功能缺陷、情绪失调和运动协调障碍等问题,这些都会严重影响其学习、社交能力和日常生活质量。
症状通常在 3~6 岁之间出现,平均诊断年龄为 7 岁。
成人多动症的多动表现可能不如儿童明显,更多体现在内心的躁动不安和精神层面的注意力不集中,体现在工作效率低下、人际关系处理困难、情绪波动大易发火、自我管理能力差等方面,而儿童则主要表现在学习障碍、行为问题上。
▶ 抽动障碍
抽动障碍(TD,下文简称抽动症)是一种神经发育障碍,以不自主、快速、重复、无节律的运动或发声为主要特征,即“抽动”。这些抽动在病程中的某个时间点出现,但不一定同时发生。
抽动障碍(TD)最严重的亚型是抽动秽语综合征(Tourette Syndrome, TS),其症状包括:
运动性抽动
– 简单的如眨眼、耸肩、摇头、皱眉等;
– 复杂的如模仿他人动作、做鬼脸、行走时的奇怪步态等。
发声性抽动
– 简单的如清嗓子、咳嗽、犬吠声;
– 复杂的如重复他人话语、说出不恰当的词语(秽语症,并非所有抽动患者都有)。
这些症状并非持续不变,其严重程度和频率会随时间波动,并受到压力、兴奋或疲劳等多种因素的影响。虽然大部分患者的症状在18岁前能够自行缓解,但仍有约三分之一的患者症状会持续到成年。
典型发病年龄在 6-7 岁左右,症状通常在 10-12 岁达到高峰。
▻ 两 者 相 似 之 处
▻ 不 同 之 处
抽动秽语综合征也会像多动症一样出现注意力不集中的情况,但这个注意力不集中可能是由抽动发生前令人分心的不适感(如压力、冲动感),以及抑制非自愿抽动本身所消耗的大量精力造成的。
流行病学与共病现象
► 多动症发病率
多动症是全球最普遍的儿童神经发育障碍之一,全球学龄儿童的患病率估计在3%~7%之间,男孩的诊断率是女孩的两倍以上。
18 岁以下患有多动症的儿童数量几乎是自闭症儿童的四倍。
儿童青少年多动症发病率主要统计数据
我国成人多动症的患病率约为4.4%,其中男性患病率高于女性。
柳叶刀的一项基于人群的研究显示:
疫情前,成人多动症的新增诊断平均为每月每10万人口8.8例。在疫情期间(2020年3月至2021年6月),这一数字上升至19.2例,每月增长率为4.9%(95%置信区间:[3.7, 6.2])。
疫情结束后,2021年7月的月度诊断率猛增107.3%[68.5, 155.0],此后每月继续以1.5%[0.4, 2.7]的速度增长,疫情后平均达到每10万人口34.8例。
► 抽动障碍发病率
《Pediatric Neurology》对 13 项儿童研究的荟萃分析显示,抽动秽语综合征的患病率为 0.77%(95%置信区间,0.39-1.51%)。男孩的患病率更高:1.06%的男孩受影响(95%置信区间,0.54-2.09%),而 0.25%的女孩受影响(95%置信区间,0.05-1.20%)。
全球抽动障碍流行病数据
► 多动和抽动共病现象
临床上一个巨大的挑战是这两种疾病的高度共病性。研究显示:
– 约50%-60%抽动症患者同时患有多动症
– 多动症往往在抽动症状出现之前就已存在
▻ 多动和抽动共病的影响
当两者共病时,多动症的症状通常在抽动症状出现之前出现。这就是为什么多年来抽动症状可能被错误地归因于兴奋剂药物的使用。
当孩子同时患有这两种疾病时,他们可能会消耗额外的精力和注意力,试图抑制抽动;这会加剧调节注意力和专注度的困难。
同时患有多动症和抽动症的儿童,往往比仅患有 多动症或仅患有抽动症的儿童面临更多的心理社会和行为问题,更容易受到欺凌,这些儿童还可能伴有认知和其他神经精神障碍。
▻ 共病强迫症
强迫症(OCD)也是常见的共病,约10%~35%的抽动症患者符合强迫症诊断标准。
注:多动症和抽动症儿童都容易患有焦虑症和强迫症。同时患有多动症和抽动症的儿童甚至比只患有其中一种疾病的儿童有更高的强迫症和广泛性焦虑症的发生率。更复杂的是,患有焦虑症的人还有额外的风险发展为抑郁症。因此,当孩子同时患有这两种疾病时,应常规监测情绪障碍和强迫症。
这种共病不仅使诊断复杂化,也严重影响患者的社会心理功能、自尊和生活质量,其背后可能隐藏着共同的病理生理机制。
风险因素
传统上,多动症和抽动症被认为是源于大脑的疾病,其病因复杂,涉及多种因素的相互作用。
► 遗 传 因 素
多动症和抽动障碍都具有明显的家族遗传性,家族史显著增加患病风险,遗传模式复杂,可能涉及多个基因的共同作用,相关基因如多巴胺受体基因(如DRD4)等可能参与其中。
► 产前 / 围产期因素
孕期吸烟、饮酒、接触有害物质等可能增加抽动和多动症的患病风险。
孕期感染也可能与神经发育障碍相关。
早产、低出生体重、缺氧等可能与抽动和多动症相关。
► 免 疫 因 素
免疫系统异常可能在抽动和多动症的发病中发挥作用。链球菌感染可能与部分抽动患者的发生有关。
► 营 养 因 素
铁、镁等微量元素缺乏可能与多动症的发生有关。
高糖、高脂肪饮食可能加重多动症症状。
► 早期生活环境
不良的家庭环境、虐待、忽视等可能增加抽动和多动症的患病风险。
► 屏幕时间
多动症患儿的屏幕使用时间(包括看电视、用平板/手机)显著高于正常儿童,并且过度的屏幕时间与多动症风险的升高有很强的统计学关联。
回归分析表明,屏幕时间增加与多动症风险升高相关(OR [95% CI] = 1.93 [1.28–4.27])。作者特别强调,由于研究是回顾性的病例对照设计,这个发现只能表明关联性,并不能证明是屏幕时间导致了多动症。
患有多动症或相关特质(如冲动、注意力不集中)的家长,可能更难为孩子设定和执行屏幕时间的规则,这本身就可能是一个混杂因素,同时也会影响他们报告的准确性。
什么原因引起的?
抽动和多动症的在遗传和神经学上存在相似的重叠,病因复杂,目前认为与神经递质失衡、脑结构和功能异常等因素有关,例如,涉及“去抑制”的相似神经回路。
这些因素可引发外周低度炎症(如细胞因子IL-6、TNF-α上调)和血脑屏障通透性增加,激活中枢小胶质细胞,干扰突触修剪和可塑性,最终导致额叶-纹状体/基底节环路的兴奋-抑制失衡,以及多巴胺、去甲肾上腺素和GABA等神经递质的调节异常,表现为注意缺陷、多动或抽动症状。这种机制并非单一,而是多通路交互的结果,后续章节将详述肠-脑轴的具体作用。
► 多动症
慢性低度神经炎症:风险因素(如早期营养/免疫失调)诱导外周炎症上行,激活小胶质细胞并干扰前额叶-纹状体环路的执行功能,导致注意缺陷和冲动控制问题。
多巴胺系统失调:遗传背景加剧多巴胺/去甲肾上腺素信号异常,与围产期因素交互,进一步放大行为症状。
代谢支持不足:营养相关失衡削弱神经保护,影响认知和情绪调节。
► 抽动症
感染触发与自身免疫:早期免疫因素(如链球菌感染)诱导异常自身免疫反应,错误靶向基底节,导致兴奋-抑制失衡和抽动发作。
基底节环路异常:遗传易感与环境应激放大多巴胺活性亢进和GABA抑制不足,阈值降低引发症状波动。
炎症-神经递质耦合:风险因素影响递质平衡,间接干扰运动控制。
根据美国儿科学会的最新指南,患有多动症的学龄前儿童(4~6岁)应首先接受家长培训的行为管理(PTBM)。若行为干预后功能障碍仍持续存在,可辅助使用哌甲酯治疗。
多动症的药物治疗:兴奋剂与非兴奋剂
▸中枢神经兴奋剂
这是最常用且被认为最有效的药物,代表药物是哌甲酯。这类药物通过抑制多巴胺和去甲肾上腺素的再摄取,提高突触间隙中这些关键神经递质的浓度,从而改善注意力和冲动控制。研究表明,治疗剂量的口服哌甲酯能显著增加人脑细胞外的多巴胺水平。
▸非兴奋剂
当患者对兴奋剂不耐受或效果不佳时,会考虑使用非兴奋剂。代表药物是托莫西汀,它是一种选择性去甲肾上腺素再摄取抑制剂,主要通过增加大脑中去甲肾上腺素的水平来发挥作用。
抽动障碍的药物治疗:多巴胺系统调节剂
对于抽动障碍,特别是症状严重影响生活的TS患者,药物治疗的目标是抑制多巴胺系统的过度活跃。根据美国神经病学学会(AAN)等权威指南,常用药物包括:
▸ α2-肾上腺素能激动剂
如可乐定和胍法辛,通常作为一线选择,尤其适用于伴有多动症的患者。它们副作用相对温和,但起效较慢。
▸ 抗精神病药(多巴胺受体拮抗剂)
典型抗精神病药:如氟哌啶醇和匹莫齐特,是FDA批准用于治疗抽动障碍的传统药物,效果显著但副作用风险较高。
非典型抗精神病药:如阿立哌唑和利培酮,因其对多巴胺和血清素系统的双重作用,被认为引发运动障碍的风险较低,已成为临床常用选择。此外,硫必利等药物也被广泛使用。
药物治疗的局限性
尽管上述药物在一定程度上有效,但其局限性同样显著,这也是驱动我们寻找新疗法的主要原因。
▸疗效的个体差异与不完全性
相当一部分患者对药物反应不佳或无效。即使有效,药物也通常只能控制症状,而不能根治疾病。对于许多患者来说,症状的改善是有限的,无法完全恢复正常功能。
▸可能带来副作用
ADHD药物:兴奋剂可能导致食欲不振、失眠、头痛、胃肠不适和情绪波动。长期使用还可能影响身高和体重发育。
抽动障碍药物:抗精神病药物的副作用尤为突出,包括镇静、头晕、嗜睡、体重增加和代谢综合征。更令人担忧的是,它们可能引发锥体外系症状,如肌肉震颤、僵硬和不自主运动(迟发性运动障碍),这些症状有时是不可逆的。
▸依从性挑战
由于副作用和疗效不确定性,患者(尤其是青少年)的治疗依从性往往较差。突然停药可能导致症状反弹或加重,给长期管理带来困难。
这种治疗上的困境促使科学界和医学界不得不将目光转向更深层次的病理生理学机制,以寻找新的干预靶点。在此背景下,“肠-脑轴”进入了研究者的视野。抽动障碍和多动症的神经系统功能紊乱,是否可能源于或受到肠道微生态失衡的影响?这为我们理解和治疗这些神经发育障碍开启了一个全新的视角,也正是我们下一章节将要探讨的内容。
肠-脑轴是指连接肠道和中枢神经系统(大脑)的一个复杂的双向通讯网络。它整合了神经、内分泌、免疫和代谢等多种信号通路,确保了大脑和肠道功能的协调。这个双向交流系统意味着,肠道的健康状况可以直接影响到我们的大脑,反之亦然。
既然肠-脑轴如此重要,那么我们来详细了解一下多动症和抽动障碍患者的肠道菌群。
多动症患者的肠道菌群
菌群多样性
β多样性(样本间物种组成的差异)分析通常能将多动症患者与健康对照区分开来,表明其菌群整体结构发生了改变。
特定菌群的变化
多项研究一致发现,多动症患者肠道中一些重要的有益菌丰度降低,特别是普拉梭菌(Faecalibacterium prausnitzii),这是一种主要的丁酸产生菌,具有强大的抗炎作用。此外,双歧杆菌属、粪球菌属(Coprococcus)和戴阿利斯特杆菌属(Dialister)的丰度也常被报道减少。
注:普拉梭菌在不同研究中结果矛盾。
一些研究观察到多动症患者肠道中拟杆菌属的某些种(如B. uniformis)、臭杆菌属(Odoribacter)、肠球菌属(Enterococcus)和链球菌属(Streptococcus)的某些种丰度增加。
与症状的关联
一项2025年的研究通过宏基因组和代谢组学分析发现,Lactobacillus sanfranciscensis的减少与多动症的三种核心症状注意缺陷、多动、冲动(p.adj = 1.04E–13; p.adj = 5.07E–07; p.adj = 2.61E–05)均显著相关。
多动症混合型菌群失调更严重
值得注意的是,多动症不同临床表现亚型(如ADHD-I和ADHD-C)可能对应着不同的菌群特征,这提示了疾病内部的异质性。例如,混合型(ADHD-C)患者的菌群失调程度通常比注意缺陷为主型(ADHD-I)更严重。
doi: 10.1080/19490976.2025.2537755
不同检测方法下儿童多动症的肠道菌群变化
doi: 10.3389/fpsyt.2025.1588135
抽动症患者的肠道菌群
针对抽动障碍(TD)和抽动秽语综合征(TS)的研究虽然起步较晚,但也揭示了相似的菌群失调模式。
门水平的变化
研究发现,与健康儿童相比,抽动障碍患儿粪便中厚壁菌门的相对丰度降低,而变形菌门和拟杆菌门的相对丰度升高。
属和种水平的特异性改变
一项研究发现,抽动障碍患儿肠道中普通拟杆菌(Bacteroides plebeius)、Ruminococcus lactaris的丰度显著高于健康儿童。这些细菌被认为与多种自身免疫性疾病有关。
另一项研究同样观察到TD患儿中双歧杆菌属和柯林斯菌属(Collinsella)丰度显著降低,而普雷沃氏菌属(Prevotella)和臭杆菌属(Odoribacter)丰度增加。
总的来说,多动症和抽动障碍患者的肠道菌群普遍呈现出促炎菌增多和有益菌减少的特征。这种失衡状态不仅是疾病的伴随现象,也可能是驱动疾病发展的关键因素之一。
肠道菌群的失调如何一步步影响到远端的大脑,并最终导致ADHD和抽动障碍的症状?科学家们提出了一个以“肠道菌群失调-神经炎症”为核心的通路。
肠道菌群失调如何通过炎症通路影响多动症
DOI: 10.1016/j.neuroscience.2025.01.031
1
肠道屏障受损与全身性炎症
肠道菌群失调被视为多动症和抽动症等神经发育障碍发病机制中的关键起点。
健康的肠道屏障能严格控制物质进入血液,但在菌群失调时,其通透性增加,即“肠漏”。
异常的肠道菌群组成可能激活肠道免疫系统,破坏屏障功能,也可能是有益菌群减少,对肠上皮细胞至关重要的“燃料”——短链脂肪酸生成不足,使得屏障细胞营养不良,细胞间的紧密连接蛋白松动,还有一些菌群降解肠道黏液层,削弱屏障保护。
屏障一旦受损,肠道内的细菌成分,如脂多糖(LPS)和有害代谢物便能渗入血液循环系统。这会触发强烈的免疫反应,因为免疫系统将这些物质识别为威胁。LPS会激活如TLR4(Toll样受体)等模式识别受体,刺激免疫细胞释放大量的促炎细胞因子,如IL-6(白细胞介素-6)、IL-1β(白细胞介素-1β)和TNF-α(肿瘤坏死因子-α)。
这些炎症因子在全身循环,形成了一种慢性的、低度的全身性炎症状态。这便是连接肠道与大脑问题的关键一步。
多动症和抽动症患者常常共患过敏性疾病(如哮喘、湿疹)和自身免疫性疾病,这从侧面印证了他们体内可能存在着异常的免疫激活状态。
肠道菌群通过肠-脑轴影响多动症的可能机制
doi: 10.3389/fpsyt.2025.1588135
2
神经炎症与氧化应激
上一节我们谈到,由肠道菌群失调引发的肠漏,引发了一场慢性的、低度的全身性炎症风暴,它的其中一个目标是突破人体的精密防线,也就是我们常说的血脑屏障。
一旦这道屏障因持续的炎症冲击而出现缝隙,炎症物质就直接去影响中枢神经系统,从而引发神经炎症与氧化应激,这是导致抽动症和多动症神经功能紊乱的核心病理环节。
一旦进入大脑,这些炎症物质会立即激活大脑内的免疫细胞——小胶质细胞和星形胶质细胞。这些细胞原本是大脑的管家,被激活的小胶质细胞会释放更多的炎症因子,将局部的火星煽动成燎原大火,形成一个恶性循环,导致持续的神经炎症。
神经炎症环境会产生大量的活性氧(ROS),引发氧化应激,损害神经元的线粒体功能、破坏细胞膜和DNA,最终导致神经元功能障碍甚至死亡,表现为多动症和抽动症的核心症状。
这一系列病理过程并非只是理论推测,在多动症患者身上已经找到了直接证据。多项研究发现:
从受孕到成年整个生命周期中,抽动和多动症接触免疫功能失调风险因素的时间、周围和中枢免疫炎症反应的变化、小胶质细胞激活的变化以及肠道菌群的改变如下图:
doi: 10.3389/fneur.2020.567407
这种由炎症和氧化应激共同驱动的神经毒性环境,会干扰正常的神经环路发育、突触可塑性和神经递质平衡,最终导致多动症的注意力不集中、多动冲动,以及抽动症的抽动、刻板行为等症状。
3
菌群代谢物(如短链脂肪酸)的关键作用
短链脂肪酸,主要包括丁酸、丙酸、乙酸,是肠道中的有益菌发酵膳食纤维后产生的重要代谢产物。
短链脂肪酸具有多重生理功能
Lactobacillus sanfranciscensis → 咪唑乙酸 → 注意力缺陷
在抽动和多动症中,短链脂肪酸的失调是一个核心环节。近日,一项针对多动症的队列研究明确指出,短链脂肪酸缺乏是其关键致病机制。
该研究发现,多动症患者体内普遍存在短链脂肪酸的缺乏,咪唑乙酸、4-氨基丁酸、4-胍基丁酸等多种SCFAs的水平显著降低。这种缺乏与我们前面提到的菌群失调有关,负责高效生产短链脂肪酸的有益菌减少。
研究通过因果中介分析发现,旧金山乳杆菌(Lactobacillus sanfranciscensis) 的减少,会引起肠道内咪唑乙酸水平的下降,而咪唑乙酸水平的下降,则直接导致了注意力不集中症状的加重。
注:Lactobacillus sanfranciscensis 对注意力不集中症状的总效应为−0.672,包括直接效应−0.535和中介效应−0.137,咪唑乙酸部分介导了这些效应,占总效应的 20.387%。
因此,这条病理链条变得清晰:
菌群失调 → 有益菌减少 → 短链脂肪酸产量不足 → 屏障失修,抗炎不力 → 肠道屏障和血脑屏障通透性增加→ 全身性炎症和神经炎症
总的来说,短链脂肪酸的缺乏,使得从肠道到大脑的整个防御体系变得脆弱。它为炎症的发展敞开了门,降低了身体抗炎能力,使神经系统遭受炎症和氧化损害,导致抽动症和多动症神经功能障碍。
4
菌群对神经递质的直接与间接调控
大脑的功能在很大程度上依赖于神经递质的精确平衡,它们是神经元之间传递信息的化学信使。
抽动症和多动症的核心病理之一,就是关键神经递质系统(尤其是多巴胺系统)的失衡。
菌群是神经递质及其前体的代谢工厂
如前所述,菌群可以合成GABA、5-HT等神经递质,或影响其前体物(如色氨酸、苯丙氨酸、酪氨酸)的代谢。
这里的关键在于,菌群的代谢活动能够直接决定这些原料的最终去向。
当多动症患者的肠道菌群异常地将大量色氨酸在外周(肠道内)就地转化为5-HT时,由于5-HT分子本身无法穿过血脑屏障,这实质上是一种“资源截留”。
这种外周的过度消耗,直接导致了能够进入大脑、用于合成中枢5-HT的色氨酸原料供给不足,最终引发中枢神经系统的5-HT缺乏。
菌群的功能缺陷会引发供应链中断
多巴胺和5-羟色胺等关键神经递质的合成,不仅需要前体原料,还需要维生素B6、叶酸等重要辅酶的参与才能顺利完成。
例如,多动症患者肠道菌群在维生素B6和叶酸代谢通路上的功能异常,可能影响到多巴胺、血清素等关键神经递质的合成,因为这些维生素是合成过程中的重要辅酶。肠道菌群是这些B族维生素的重要生产者,这在我们之前的文章可以详细了解,点击查看
当多动症患者的菌群失调时,相关维生素代谢异常,就像切断了神经递质合成的辅助工具供应,即使有足够原料,也会导致神经递质系统紊乱。
导致抽动秽语综合征的病理生理机制
doi: 10.2147/DDDT.S542423
多动症诊断
严格依据DSM-5或采用国际疾病分类第11版(ICD-11)作为诊断标准,强调症状需持续至少6个月,并在多个环境中可被观察到(如工作和家庭)都持续存在并造成影响。 必须有明确证据表明,这些症状已对社交、学业或职业功能造成实质性的负面影响。
确诊需通过临床访谈、评定量表等综合评估,并仔细排除焦虑、抑郁等其他可能引起相似症状的疾病。
为什么在儿童时期,诊断多动症的女孩少于男孩?
柳叶刀有一篇文章专门讲了这个问题:
症状表现不同:多动症的诊断标准更多基于男孩常见的、外显的多动-冲动行为。而女孩的症状更多是内化的、不易察觉,如健忘、分心、做事拖沓,这些安静的症状常被老师和家长忽视。
共病掩盖:女孩的多动症症状常被焦虑、抑郁等情绪问题所掩盖,导致她们被误诊为其他精神障碍。
社会因素与补偿行为:出于社会期望,女孩更倾向于通过加倍努力或发展补偿策略来伪装和隐藏自己的困难,这使得她们的内在挣扎更难被识别,从而错过了及时的诊断和干预。
抽动障碍诊断
由于该疾病的临床异质性、抽搐的可抑制性以及症状的时间可变性,抽动症的诊断和评估可能特别复杂。因此,在症状首次出现后,诊断可能会延迟 3~11 年,大约 73%患者会经历初次误诊。
目前,尚未发现任何早期诊断标志物,如影像学检查、血液检查或脑脊液生物标志物,可以在症状出现之前帮助诊断。
目前,关于多动症和抽动症的诊断在很大程度上依赖于“非客观性”的指标, 例如量表、临床晤谈与行为观察。
像康纳斯量表、SNAP-IV量表或耶鲁全球抽动严重程度量表(YGTSS)等工具,其本质并非客观检测,而是将主观的观察和感受进行结构化和量化的工具。
客观检查主要用于排除而非确诊: 医生可能会建议进行脑电图、头颅MRI、血液检查等医学检查。但这些检查的主要目的,是排除其他可能引起相似症状的神经系统疾病(如癫痫、脑损伤等)。
这也是为什么寻找可靠的方式,以实现更精准、客观的诊断,是该领域未来研究的重要方向。肠道菌群检测逐渐为多动症和抽动症的辅助诊断提供了新的思路和可能性。
整合肠道菌群检测
目前肠道菌群检测还不能作为诊断的独立标准,它是一种辅助性的、探索性的工具,旨在深化对个体病理状态的理解,从而指导更精准的个体化治疗。
► 肠道菌群检测结合病理生理机制
结合我们在前面提到的多动和抽动的多种病理生理机制,包括神经递质失衡(多巴胺、谷氨酸等)、神经炎症(小胶质细胞活化)和免疫功能障碍等,肠道菌群恰好在这些方面都扮演着关键角色。
肠道菌群能够合成或影响多种神经递质(如多巴胺、5-羟色胺、GABA)的代谢。谷禾肠道菌群检测通过构建基于大样本的数据库,能够评估关键神经递质指标,如多巴胺,血清素,GABA等。
通过分析特定菌群的丰度和代谢活性,谷禾肠道菌群检测能够推断个体神经递质的合成能力和代谢状态,例如,某些双歧杆菌和乳杆菌株能够产生GABA,对于多动症和抽动症患者而言,这些神经递质的失衡往往是核心病理机制之一。多巴胺系统异常与注意力缺陷和运动控制障碍密切相关,GABA不足则可能导致大脑过度兴奋和自控能力下降。
< 来源:谷禾肠道菌群检测数据库>
肠道菌群的代谢产物(如脂多糖LPS)是强烈的促炎物质,若肠道屏障受损(肠漏),LPS进入血液会引发全身性低度炎症,并可能通过血脑屏障影响大脑,激活小胶质细胞。
谷禾肠道菌群检测结果可以提示,患者是否存在由菌群失调导致的营养吸收障碍或炎症状态,例如肠道炎症水平、肠道屏障、脂多糖LPS等指标。
< 来源:谷禾肠道菌群检测数据库>
对于多动症和抽动症患者,这些炎症指标的异常往往提示存在”肠-脑轴“功能紊乱,慢性低度炎症可能正在影响大脑的神经发育和功能,导致注意力、情绪调节和运动控制等方面的问题加重。
► 肠道菌群检测结合中西医
中医诊断依赖于辨证论治,比如将患者分为“肝风内动”、“痰火扰心”、“脾虚肝亢”等不同证型。这种辨证主要依赖于医生的四诊(望、闻、问、切),缺乏现代生物学的客观指标。
菌群特征与中医“证”的关联
通过对不同证型的患者进行肠道菌群检测,可以探索特定菌群的构成模式是否与某种中医证型存在关联。例如我们可以去探索:
如果能建立这种关联,肠道菌群检测就能为中医的辨证提供客观的生物学证据,有了可以量化的数据支持。
如果肠道菌群检测发现患者有明显的菌群失调和炎症标志物升高,那么在常规治疗(如多巴胺受体拮抗剂)的基础上,结合具有抗炎作用的中药(如黄芩等),或者补充益生菌、调整饮食结构,可能效果更好。
医生还可以根据菌群偏好,推荐更具体的食疗方案(如富含多糖的山药、茯苓等药食同源的食物)。关于药食同源可详见谷禾之前的文章:
从药食同源到微生态健康:中华传统医学养生智慧在肠道菌群中的现代诠释
肠道菌群检测可以成为连接中医、西医理论和实践的桥梁。
饮 食 干 预
关于儿童注意力和饮食模式关系的研究强调,注意力问题的儿童零食和垃圾食品的摄入量更高,并且这些儿童可能表现出过度进食行为。此外,文献中有发现表明,有明显注意力缺陷特征的成年人由于比普通人更频繁地摄入零食和添加糖,因此肥胖的风险更高。
一项综述发现:
► 地中海饮食
对地中海饮食的更高依从性与短链脂肪酸产生菌种 Faecalibacterium prausnitzii、Eubacterium eligens、Bacteroides cellulosilyticus 的丰度增加以及纤维降解功能的增强相关,与Ruminococcus gnavus 和血液胆固醇水平的降低有关。
► 限制消除饮食(寡抗原饮食) 证据层级:强
食物过敏/超敏反应可能是导致部分儿童多动症症状的关键因素。寡抗原饮食通过在几周内只允许食用极少数低过敏性食物(如米、梨、多种蔬菜等),来完全移除可能引发症状的食物触发器。
Tips:这里可以记录饮食日记,以追踪饮食与症状严重程度之间的潜在关联,识别并消除潜在的食品诱因,考虑常见的诱因,比如咖啡因、人工添加剂、高糖食品、麸质、乳制品等。
以上效果堪比药物治疗,且无药物副作用。
► 人造食用色素去除 证据强度 中等
多项研究(包括著名的南安普顿研究)发现,去除饮食中的人造色素和防腐剂(如苯甲酸钠)可以小幅但显著地改善儿童的多动行为。然而,其效果远不如严格的寡抗原饮食。文章认为,单独去除人造食用色素可能只对一小部分儿童有效,或者改善程度有限,因为还可能存在其他未被识别的食物触发因素。
以上有益,但作用有限。
相关饮食的生理益处
doi: 10.3390/metabo15050335
益 生 菌
一项为期 12 周的随机双盲安慰剂对照试验,涉及 80 名 5-14 岁的儿童(39 名患有多动症,41 名患有自闭症)。益生菌补充剂显著改变了多动症和自闭症儿童的肠道菌群。多动症患者增加梭菌属 、瘤胃球菌科、毛螺菌科、Odoribacter等。
注:AB Biotics S.A.提供了安慰剂和益生菌。
► 多动症:双歧杆菌
一项针对75名儿童的研究使用了长双歧杆菌 (B. longum),但研究重点是评估其作为药物辅助治疗的可行性,而不是直接的治疗效果。在为期四周的研究中,研究人员观察到益生菌组的注意力不集中症状有所改善。但文章强调,这只是初步发现。
一项为期12周的随机双盲安慰剂对照试验显示,补充双歧杆菌Bf-688可显著改善多动症患者的注意力与反应速度。其机制在于,Bf-688能提高肠道厚壁菌门/拟杆菌门的比例,从而强化肠道屏障,改善神经递质(特别是多巴胺)的调节功能。同时,它还减轻了患者的胃痛、食欲不振等胃肠道问题。
儿童多动症益生菌治疗的临床研究
doi: 10.3389/fpsyt.2025.1588135
► 抽动症:植物乳杆菌PS128
一项研究发现,给抽动症模型大鼠喂食植物乳杆菌PS128后,大鼠的抽动行为得到显著改善。这可能与益生菌调节了肠道菌群(如增加了普氏菌科,降低了毛螺菌科),并增强了多巴胺系统的稳定性有关。
► 抽动症:益生菌+药物
一项涉及130名抽动症患儿的为期12周的随机对照试验显示,将益生菌与常规药物(泰必利)联合使用时,对改善抽动症状的效果最为显著。相比之下,单独使用益生菌的效果最不明显。
补充剂
一项研究发现,抽动秽语综合征儿童的钠摄入量显著更高,而维生素D和维生素K的摄入量显著更低。维生素 B3、维生素 B6 和维生素 C、微量元素磷和硒较少达到参考营养摄入量(这一趋势在自闭症儿童中也得到体现)。
► Omega-3 和 Omega-6 脂肪酸
理论基础是多动症患者体内可能存在这些脂肪酸水平较低的情况。这是研究最多的补充剂类型。
研究结果不一致。荟萃分析显示,补充Omega-3/6脂肪酸(特别是EPA和DHA的组合)后,在注意力、多动和冲动方面有微小但显著的改善。然而,许多其他研究未发现显著效果。效果可能受剂量、EPA/DHA比例以及个体差异的影响。
► 维生素D和镁
维生素 D 和镁补充剂在两项研究中显示出改善多动症症状的效果;然而,一项研究得出结论,维生素 D 补充剂仅在同时存在维生素 D 缺乏的多动症儿童中才有益。
在一项调查中,许多家长报告称,给孩子补充镁后,观察到抽动症状有所改善。镁是一种对身体的许多方面调节和功能起关键作用的矿物质,包括调节肌肉和神经功能、血压和血糖控制。
► 叶酸和维生素 B12
研究发现,多动症患者的叶酸和维生素 B12 水平较低,一项研究发现维生素 B12 水平与多动症症状呈负相关,而另一项研究则未发现这种关系。
► L-茶氨酸和维生素B6
一项初步研究表明,这两者联合使用能显著减轻抽动严重程度,并对缓解伴随的焦虑有积极作用。
► 锌
锌在神经递质多巴胺的代谢中起着关键作用,而多巴胺与多动症的核心症状密切相关。关于补充锌对多动症的治疗效果,目前的研究结论尚不一致。
► 铁
研究发现,多动症儿童体内的铁蛋白(ferritin)水平普遍较低,而铁蛋白是反映体内铁储存量的指标。补充铁剂已被证明可以改善多动症儿童的症状,其效果甚至可以与某些兴奋剂药物相媲美。但对于铁水平正常的儿童,效果不明确。
粪菌移植 (FMT)
粪菌移植(FMT)作为一种仍在探索中的疗法,已被尝试应用于多种伴有肠道菌群异常的难治性神经系统疾病,如自闭症等。
动物实验
动物实验发现,将健康小鼠的粪便移植给抽动模型小鼠后,小鼠的抽动症状得到缓解,同时其血清中的5-羟色胺水平升高。
儿童
2017 年报道了首例使用粪菌移植治疗的抽动症病例,9岁男孩服用中药和泰拉普丁2.5年后仍有症状。粪便来自14岁健康男孩,通过胃镜和肠镜送入患者肠道。治疗前YGTSS评分31,8周后降至5,抽搐行为几乎消失且注意力集中,表明FMT对抽动症有治疗效果。
随后用FMT治疗5名抽动症男童。4名儿童YGTSS评分降低超25%(7-35分),2名症状消失,1名评分增加4分。这表明FMT对部分抽动儿童有效,但其机制及适用性需进一步研究。
成人
2022年,一位 22 岁的女性因反复发作的艰难梭菌感染导致多次严重腹泻。接受 FMT 治疗后,共病 ADHD 和焦虑症状得到缓解,CGI–S 评分从治疗前的 5 分降至 2 分。
中 草 药
在抽动症的管理中,许多中药方剂被使用,包括天麻钩藤饮、柴胡疏肝散和六味地黄丸等。
抽动障碍治疗中 15 种高频中药的现代药理机制
doi: 10.2147/NDT.S543465
► 中医药联合治疗抽动秽语综合征的临床实践
▻ 健脾疏肝汤 + 盐酸泰必利
一项涉及98名抽动症儿童的随机对照试验,经过8周治疗,发现“健脾疏肝汤”与西药“盐酸泰必利”的联合使用疗效,在降低抽动严重程度、改善神经递质分泌方面效果显著,且复发率更低,安全性良好。
▻ 菖麻熄风片 + 氟哌啶醇片
一项随机对照试验(n=96),发现菖麻熄风片联合氟哌啶醇片治疗儿童抽动症,能有效改善抽动症患儿的临床症状、认知发育、脑电图结果和血清神经递质水平(多巴胺、去甲肾上腺素和血清素)。
▻ 息风颗粒 + 心理干预
一项随机对照试验(n=120)比较了“息风颗粒联合心理干预”与西药“硫必利”的疗效,息风颗粒与心理干预相结合,可显著改善抽动患儿的临床症状,有效缓解症状,安全性高。
▻ 针刺 + 安神颗粒
一项对118名“心肝火旺”型抽动症儿童的随机试验,比较了“针刺联合安神颗粒”与西药“盐酸替亚必利片”的疗效。结果表明,针刺与安神颗粒(Anshen Zhicheng Granule)的结合疗法在缓解抽动、改善神经递质和神经功能方面,效果优于单独使用西药,且不良反应更少。
▻ 耳穴贴压 + 益智宁神液
一项对90名抽动症儿童的随机对照试验,评估了“耳穴贴压”联合“益智宁神液”的疗效。结果显示,与单用药物相比,联合疗法的效果更优,且安全、无明显毒副作用。
▻ 小儿黄龙颗粒:改善多动症
中药复方“小儿黄龙颗粒”能有效改善多动症模型大鼠的多动、冲动和焦虑样行为。研究对比了胃溶、肠溶和结肠溶三种制剂,发现结肠靶向释放的治疗效果最为显著。
其作用机理涉及恢复肠道菌群稳态、减轻全身性炎症反应以及修复受损的肠道和血脑屏障。治疗后,多动症模型大鼠体内异常的氨基酸代谢、神经递质调控和短链脂肪酸生成得到纠正。
▻ 静安汤:改善多动症
静安汤是一种中药方剂,过去20年来,静安汤在临床、药理学和制药领域广泛研究。
注:静安汤是南京中医院研发的专有配方,已获江苏省医药产品管理局注册证书(苏药制字Z20100001)。
研究发现,静安汤能够增加肠道中产丁酸盐细菌(特别是毛螺菌科Lachnospiraceae NK4A136群)的丰度,从而提升结肠和纹状体中的丁酸盐水平。丁酸盐通过抑制TLR4/HDAC3/NF-κB信号通路,促进小胶质细胞向抗炎的M2型极化,进而减轻神经炎症,改善肠道屏障和血脑屏障的完整性,最终有效缓解抽动症相关的刻板行为、多动和认知障碍。
doi.org/10.1016/j.phymed.2025.157009
生 活 方 式
► 运动
运动可以帮助减轻压力、改善情绪,并可能减少抽搐的频率和严重程度。对于患有多动症的人来说,运动也有助于提高注意力并减少多动。
– 每天至少进行30分钟的中等强度运动
– 选择喜欢且可持续的活动
– 考虑参加团队运动或团体健身课程以进行社交互动
任何运动,包括骑自行车、跳舞、慢跑、滑冰、棒球、游泳等,都可能对抽动症孩子有所帮助。
▻ 运动的核心机制
▻ 不同运动类型的具体效果
急性有氧运动: 比如跑步、跳跃
– 改善执行功能,包括选择性注意、信息处理和任务规划。
慢性/长期有氧运动:
– 改善ADHD儿童普遍较弱的注意力和记忆能力。
开放性技能运动:如足球(环境多变,需要高度执行功能)
– 在改善执行功能,特别是抑制性控制方面,比封闭性技能运动更有效。长期参与有助于儿童形成定向行动模式,从而规范行为、减少冲动。
封闭性技能运动:比如跑步、骑行(环境稳定)
– 对改善工作记忆有显著效果,尤其是在长期训练后。
▻ 瑜伽的特殊作用:
一个例外研究显示,每周进行一次60分钟的瑜伽,持续20周后,儿童的多动和攻击性行为得到了改善。这表明对于以多动为主的ADHD个体,瑜伽可能是一种有重要意义的方法。
► 建立规律的睡眠习惯
充足的睡眠对于管理抽动秽语综合征和注意力缺陷多动障碍症状至关重要。睡眠不足会加剧抽动并增加注意力和冲动控制的难度。
– 设定固定的睡觉和起床时间
– 创建放松的睡前仪式
– 睡前限制屏幕使用时间
– 确保舒适的睡眠环境
► 解压练习
正念可以帮助个人更意识到他们的抽动冲动和注意力缺陷多动障碍症状,从而实现更好的管理。它还可以减轻整体压力和焦虑。研究显示,它对改善“注意力不集中”有中等效应。其最一致的积极效果是能显著减轻家长育儿压力、改善儿童情绪调节。
▻ 正念和冥想练习:
– 练习当下时刻的觉察
– 培养对思想和感觉的非评判性观察
– 在一天中穿插进行简短的正念练习
▻ 放松技巧和深呼吸练习:
– 练习膈式呼吸
– 尝试引导想象或视觉化练习
– 将渐进式肌肉放松融入日常生活
习惯逆转训练(HRT)已被证明在减少抽搐频率和严重程度方面具有显著效果。它使个人能够主动管理抽搐,而不是感到被抽搐所控制。
▻ 习惯逆转训练用于抽动管理:
– 增加对抽动欲望的意识
– 建立竞争性反应来替代抽动
– 练习放松技巧以减少整体紧张
以上这些技巧可以帮助减少整体紧张和焦虑,这可能导致抽动频率和严重程度的降低。它们还可以帮助患有注意力缺陷多动障碍的人平静快速的想法并提高注意力。
综上,我们了解到注意缺陷多动障碍与抽动障碍是与全身健康状态紧密相连的复杂病症。越来越多的科学证据揭示了肠道菌群通过“肠-脑轴”在其中的关键作用。从肠道通透性增加(“肠漏”)引发的低度炎症,到特定菌群失衡(如普拉梭菌或梭菌属)对神经递质代谢的直接影响,都为我们理解这两种疾病提供了全新的视角。
这一发现为我们开辟了全新的干预视角:从“头痛医头”的传统干预模式中跳脱出来,转向探寻并解决问题的根源。这种通过调理消化系统来改善大脑功能的思路,与中医“培土生金,调理脾胃以宁心神”的千年智慧不谋而合,也是中西医理论在更高维度上的融合与共鸣。
而要将这一整体观精准地应用于每个独特的个体,肠道菌群检测便扮演了关键的导航角色。当我们可以通过调整饮食、补充益生菌等方式来重塑肠道微生态时,就为改善这些多动症和抽动症等神经发育障碍提供了更加温和且可能更有效的干预手段。
主要参考文献
Martino D, Johnson I, Leckman JF. What Does Immunology Have to Do With Normal Brain Development and the Pathophysiology Underlying Tourette Syndrome and Related Neuropsychiatric Disorders? Front Neurol. 2020 Sep 16;11:567407.
Wang X, Wang N, Gao T, Zhang Y, Fu Z, Zhao Y, Huang Y, Zheng X, Gao X, Lu L, Yang L. Symptom-specific gut microbial and metabolic profiles in ADHD reveal SCFA deficiency as a Key pathogenic mechanism. Gut Microbes. 2025 Dec;17(1):2537755.
Wang Y, Xu H, Jing M, Hu X, Wang J, Hua Y. Gut Microbiome Composition Abnormalities Determined Using High-Throughput Sequencing in Children With Tic Disorder. Front Pediatr. 2022 May 4;10:831944.
You L, Peng H, Liu J, Sai N, Zhao W, Li X, Yang C, Guo P, Ni J. Xiaoer Huanglong pellets remodels the periphery microenvironment to improve attention deficit hyperactivity disorder based on the microbiota-gut-brain axis. Phytomedicine. 2025 Sep;145:157007.
Lewis N, Lagopoulos J, Villani A. Gut-Brain Inflammatory Pathways in Attention-Deficit/Hyperactivity Disorder: The Role and Therapeutic Potential of Diet. Metabolites. 2025 May 19;15(5):335.
Eder K, Schneider-Momm K, Puce TK, Tobergte M, Clement HW, Rauh R, Schulz E, Biscaldi M, Clement C, Fleischhaker C. The Acute and Long-Term Benefits of the Oligoantigenic Diet for Children and Adolescents on the Three Symptom Subdomains of ADHD: Inattention, Hyperactivity, and Impulsivity. Nutrients. 2025 Jun 3;17(11):1916.
Rizzo R, Prato A, Scerbo M, Saia F, Barone R, Curatolo P. Use of Nutritional Supplements Based on L-Theanine and Vitamin B6 in Children with Tourette Syndrome, with Anxiety Disorders: A Pilot Study. Nutrients. 2022 Feb 18;14(4):852.
Novau-Ferré N, Papandreou C, Rojo-Marticella M, Canals-Sans J, Bulló M. Gut microbiome differences in children with Attention Deficit Hyperactivity Disorder and Autism Spectrum Disorder and effects of probiotic supplementation: A randomized controlled trial. Res Dev Disabil. 2025 Jun;161:105003.
Smith BL, Vafeiadou K, Ludlow AK. Nutrient intake and food selectivity in children with Tourette syndrome. Nutr Neurosci. 2025 Jun;28(6):670-678.
Geng J, Liu C, Xu J, Wang X, Li X. Potential relationship between Tourette syndrome and gut microbiome. J Pediatr (Rio J). 2023 Jan-Feb;99(1):11-16.
Bai L, Jin M, Zhang Q, Sun S. Progress in research on nutrition, neuroinflammation and dopaminergic alterations in Tic disorders. Front Pediatr. 2025 May 20;13:1526117.
Teleanu RI, Moldoveanu ET, Niculescu AG, Predescu E, Roza E, Tincu IF, Grumezescu AM, Teleanu DM. Liposomal and Lipid-Based Drug Delivery Systems: Bridging Gut Microbiota and Pediatric Disorder Treatments. Pharmaceutics. 2025 May 28;17(6):707.
Li B, Zhu J, Zhang B, Ling Z, Zhao Y, Leng W, Zhang Q, Zhou X. Evidence Based Research on Medication Patterns in the Traditional Chinese Medicine Treatment of Tic Disorders: A Complete Review. Neuropsychiatr Dis Treat. 2025 Sep 10;21:2001-2016.
Yu X, Zhu M, Tang Q, An S, Tan H, Wang X, Zhang J, Tian J, Li J. Traditional Chinese Medicine in the Comprehensive Management of Tourette Syndrome: Insights from Genetics and Pathophysiology: A Review. Drug Des Devel Ther. 2025 Sep 11;19:8181-8194.
Navab F, Abbasi K, Heidari H, Ghiasvand R, Clark CCT, Bagherniya M, Hassanizadeh S, Rouhani MH. Associations between dietary inflammatory index (DII) scores and attention deficit hyperactivity disorder (ADHD) in children. Sci Rep. 2025 Aug 22;15(1):30884.
Kang X, Cheng E, Guo P, Xi L, Xiang C, Xu S, Zhang Y, Yang Y, Zhang J, Long H. Jing An decoction alleviates neuroinflammation in Tourette syndrome by regulating butyrate-mediated microbiota-gut-brain axis. Phytomedicine. 2025 Sep;145:157009.
Liu Y, Zhang P, Sun H. A narrative review of research advances in gut microbiota and microecological agents in children with attention deficit hyperactivity disorder (ADHD). Front Psychiatry. 2025 May 23;16:1588135.
Yu X, Zhu M, Tang Q, An S, Tan H, Wang X, Zhang J, Tian J, Li J. Traditional Chinese Medicine in the Comprehensive Management of Tourette Syndrome: Insights from Genetics and Pathophysiology: A Review. Drug Des Devel Ther. 2025 Sep 11;19:8181-8194.
Li B, Zhu J, Zhang B, Ling Z, Zhao Y, Leng W, Zhang Q, Zhou X. Evidence Based Research on Medication Patterns in the Traditional Chinese Medicine Treatment of Tic Disorders: A Complete Review. Neuropsychiatr Dis Treat. 2025 Sep 10;21:2001-2016.
Navab F, Abbasi K, Heidari H, Ghiasvand R, Clark CCT, Bagherniya M, Hassanizadeh S, Rouhani MH. Associations between dietary inflammatory index (DII) scores and attention deficit hyperactivity disorder (ADHD) in children. Sci Rep. 2025 Aug 22;15(1):30884.
Shah N, Nadella H, Williams S. Non-pharmacological Approaches to Managing Attention-Deficit Hyperactivity Disorder in Pediatric Populations: A Scoping Review. Cureus. 2025 Jul 13;17(7):e87810.
Di Salvo G, Filippo L, Perotti C, Pellegrini L, Rosso G, Maina G. Adult ADHD: associated medical conditions and related factors. Int J Psychiatry Clin Pract. 2025 Sep;29(3):125-129.
Chen L, Li Z, Fan Y. Neurodevelopmental disorders and gut-brain interactions: exploring the therapeutic potential of pycnogenol through microbial-metabolic-neural networks. Front Cell Infect Microbiol. 2025 Jun 11;15:1601888.
Wang N, Gao X, Zhang Z, Yang L. Composition of the Gut Microbiota in Attention Deficit Hyperactivity Disorder: A Systematic Review and Meta-Analysis. Front Endocrinol (Lausanne). 2022 Mar 18;13:838941.
Talat, A., Zuberi, A. & Khan, A.U. Unravelling the Gut–Microbiome–Brain Axis: Implications for Infant Neurodevelopment and Future Therapeutics. Curr Microbiol 82, 390 (2025).
Tas, E., Ulgen, K.O. Exploring the Integrated Gut-Brain Metabolic Model for ADHD. Biochem Genet (2025).
Sibley MH, Bruton AM, Zhao X, Johnstone JM, Mitchell J, Hatsu I, Arnold LE, Basu HH, Levy L, Vyas P, Macphee F, Gonzalez ES, Kelley M, Jusko ML, Bolden CR, Zulauf-McCurdy C, Manzano M, Torres G. Non-pharmacological interventions for attention-deficit hyperactivity disorder in children and adolescents. Lancet Child Adolesc Health. 2023 Jun;7(6):415-428.
Martin J. Why are females less likely to be diagnosed with ADHD in childhood than males? Lancet Psychiatry. 2024 Apr;11(4):303-310.
Trends of incident adult Attention-deficit/hyperactivity disorder diagnoses before, during and after the pandemic provincial state of emergency in British Columbia (2013–2023): a population-based study. Hu, Kevin et al.The Lancet Regional Health – Americas, Volume 0, Issue 0, 101223

谷禾健康
早晨闹钟响起时那瞬间的动力、完成任务后的成就感、写完最后一道题的如释重负、品尝美食时的愉悦…这些日常体验背后都有同一个幕后功臣——多巴胺。
它并非简单的“快乐信使”,也是我们大脑里最强的“动力引擎”,驱使我们启动任务、保持专注并最终享受完成目标的喜悦。
多巴胺这个拥有5亿年历史的古老分子,其水平竟会受到我们肠道里微生物的影响。这意味着,我们吃的食物或许能直接帮助我们战胜拖延症,更有精力地投入到下一次学习和工作中。
本文探讨多巴胺的作用,过多或者过少对我们身体有什么影响,它与肠道微生物群的关联,哪些饮食或生活方式可能有助于优化多巴胺系统等。
关于多巴胺的总结:
1 多巴胺是古老的
多巴胺作为神经递质在蠕虫到人类的进化中保持不变,有5亿年历史。它是自然界中古老且功能一致的模块,在所有有神经系统的生物中都执行学习、动力和运动调控功能。
2 多巴胺神经元很长
多巴胺神经元是大脑中最大且连接最广的细胞,主要在中脑腹侧被盖区和黑质。大鼠的单个神经元可产生1米长的轴突分支,形成3万个突触,人类可达数十万。
3 多巴胺是神经递质
多巴胺很少单独起作用。每当多巴胺被释放到大脑中时,其他神经递质,如谷氨酸和 GABA,可能会被多巴胺神经元共同释放。
4 多巴胺传递很快
多巴胺传递速度不同:神经元爆发时传输快速;神经元也稳定放电,维持基线水平,突发可应对重要事件。
5 多巴胺奖励回路异常
生存恐慌与压力不耐受:对压力的反应更为敏感和剧烈。
病态食物摄入:通过暴饮暴食来寻求短暂的快感,以弥补多巴胺的不足。
脂肪合成与储存增加:身体更容易囤积脂肪,导致肥胖。
消化系统紊乱:进一步加剧肠道问题。
6 多巴胺功能障碍
多巴胺传递功能障碍是各种精神神经障碍的特征,包括抑郁症、帕金森氏症、ADHD 和物质使用障碍。
多巴胺过量:躁狂或轻躁狂,精神病,物质使用障碍,多动和冲动,抽搐和图雷特综合征,睡眠障碍,亨廷顿病、过度寻求奖励行为。
多巴胺不足: 帕金森氏病、抑郁症、注意力缺陷/多动障碍(ADHD)、药物成瘾和物质使用障碍、不宁腿综合征、精神分裂症和亨廷顿氏病。
7 多巴胺与肠道菌群关系密切
肠道菌群可以通过多种方式积极影响和参与这两个神经系统的交流和对话,例如分泌信使物质:例如单形拟杆菌、双歧杆菌、乳杆菌、肠球菌属、普雷沃氏菌与梭菌属通过直接或间接方式影响多巴胺能或多巴胺转运运蛋白等,进而直接激活肠道内的神经末梢,将信号通过迷走神经上传至大脑。多巴胺水平遵循昼夜节律,清醒时高,睡眠时低。
8 多巴胺药物干预
许多药物通过改变或刺激多巴胺受体活性、合成和再摄取来发挥作用。
9 多巴胺调节
必需氨基酸如苯丙氨酸和酪氨酸是多巴胺的前体。食用富含这些氨基酸的食物可以增强多巴胺的合成。益生菌和发酵食品还可以通过促进肠道健康来影响多巴胺的产生。
有氧运动(跑步、骑自行车),力量训练以及瑜伽,听音乐等可以激活大脑的多巴胺并增强多巴胺奖励功能。
多巴胺的发现
多巴胺(化学名为 3,4-二羟基苯乙胺),于 1910 年由乔治·巴格和詹姆斯·尤恩斯在伦敦的惠康实验室首次合成。
但真正突破在近半个世纪后,1958 年,瑞典国家心脏研究所化学药理学实验室的阿维德·卡尔森和尼尔斯·希拉普才确定多巴胺是大脑中的一种神经递质。这一突破性的发现彻底改变了我们对大脑工作原理的认知,为现代神经科学的发展奠定了基础。卡尔森也因这项开创性贡献荣获了2000年诺贝尔生理学或医学奖。
多巴胺的关键证明:从实验室到临床的突破
在一项具有里程碑意义的实验中,研究人员阻断了兔子体内所有的多巴胺神经传递,使它们完全瘫痪,然后通过注射多巴胺前体左旋多巴(L-DOPA)完全恢复了它们的行为,证明多巴胺对自我启动的运动至关重要。
很快,奥列格·霍尼凯维奇和他的团队将这一发现应用到帕金森病患者身上,取得了同样惊人的效果。短短几年内,多巴胺从相对默默无闻一跃成为我们所知的生命的关键。
多巴胺的进化
多巴胺功能的惊人普适性
在鸟类身上,多巴胺展现出了惊人的精细调控能力。它不仅像哺乳动物一样处理基于奖励的学习信号,还能在鸟儿练习鸣唱时,通过”声音表现预测误差“来帮助它们完善歌声。
既关心有没有奖励,也关心这次唱得好不好。
这正是学习与动机功能的体现。
所有脊椎动物的基底神经节都保持着相似的基本架构,多巴胺在其中发挥着一致的作用:调控运动和学习。这种跨物种的功能稳定性表明,多巴胺系统的核心组件已经被进化完美保存了至少5亿年。
多巴胺功能在脊椎动物内部的家族相似性
DOI: 10.1016/j.cub.2022.06.060
多巴胺在不同生物中的类似功能
这种在不同物种中独立演化出相似结构和功能的现象,被称为“趋同演化”。
有力证明了多巴胺调控行为选择是一个极其高效的生物学解决方案。
多巴胺的演化之路清晰可见
多巴胺的化学结构
多巴胺的结构相对简单:一个带有两个羟基的苯环,连接着一条乙胺链。正是这种精巧的分子排列,让多巴胺能够与大脑中的各种受体和酶相互作用,进而影响我们的神经传导和行为表现。
作为大脑中的化学信使,多巴胺在神经元之间穿梭传递信息。但它的作用远不止于此,多巴胺深度参与调节我们的情绪状态、内在动机、奖赏感受、快乐体验、注意力集中、身体的运动控制。
从伸手拿杯水这样的简单动作,
到追求长远目标时的复杂决策,
多巴胺都在幕后发挥着关键作用
多巴胺合成和储存的复杂过程
▶ 多巴胺合成
从酪氨酸到神经递质是一个复杂的过程,涉及几个步骤和酶。
🧬 原材料:酪氨酸
多巴胺的前体是酪氨酸——一种我们可以从食物中获取,也可以在肝脏中由苯丙氨酸转化而来的氨基酸。当酪氨酸进入多巴胺神经元后,开始了它的转化之旅。
⚗️ 第一步:关键转化
第一步也是最关键的一步:酪氨酸羟化酶将酪氨酸转化为L-DOPA。这个步骤需要几种”助手”——四氢生物蝶呤、氧气和铁离子的协助。由于这一步控制着整个生产速度,因此受到严密监控。
⚡ 第二步:快速脱羧
接下来,芳香族氨基酸脱羧酶迅速将L-DOPA转化为多巴胺。这个反应很快完成,避免了L-DOPA的堆积,因为过多的L-DOPA可能会带来负面影响。
整个生物合成途径发生在神经元的细胞质中。
▶ 多巴胺储存
新鲜出炉的多巴胺并不会在神经元内四处游荡,而是被精心包装进一个叫”突触囊泡“的微型容器中。负责这项包装工作的是囊泡单胺转运蛋白(VMAT)。
这种包装有两大好处:
保护多巴胺不被细胞内的酶分解,
同时确保它能在需要时准确释放。
整个生产过程都有精密的调控机制。神经元会根据自身的活动状态和环境变化,灵活调节多巴胺的产量,确保大脑始终拥有合适的多巴胺供应。
多巴胺释放和再摄取的动力学
多巴胺从神经元的释放是由特定刺激触发的、高度调节的过程。
🌊 多巴胺的释放过程
当动作电位(电信号)到达多巴胺能神经元的轴突末端时,它会导致钙离子通过电压门控钙通道快速流入。细胞内钙离子浓度的突然增加触发了含有多巴胺的突触囊泡与细胞膜的融合,这一过程被称为胞吐作用。
🔄 突触间隙的扩散
当囊泡与膜融合时,它们将多巴胺释放到突触间隙中,突触间隙是突触前神经元和突触后细胞之间的狭窄空间。一旦进入突触间隙,多巴胺分子就会扩散到这个空间,可能与突触后神经元或附近细胞上的受体结合。
🎯 再摄取机制
多巴胺信号的持续时间和强度,通过一个称为再摄取的过程被仔细控制。
多巴胺细胞反应:神经生物学中的机制和意义在很大程度上取决于这种再摄取机制。
称为多巴胺转运蛋白(DAT)的特殊蛋白质负责这一过程。这些转运蛋白位于突触前神经元的膜上,积极地将多巴胺分子泵回释放它们的神经元。
再摄取过程有几个重要功能
多巴胺转运蛋白的活性可以受到各种因素的调节,包括其他神经递质和药物。例如,可卡因和安非他明通过干扰DAT的功能发挥其作用,导致突触中多巴胺浓度增加和多巴胺信号传导延长。
多巴胺受体和信号通路
多巴胺对靶细胞的作用是通过其与特定受体的相互作用来介导的。了解多巴胺受体的类型、功能和信号通路对于理解这种神经递质如何发挥其多种作用至关重要。
多巴胺受体有五种亚型,分为两个家族:
中脑多巴胺神经元的解剖连接
G蛋白偶联受体结构
所有多巴胺受体都属于G蛋白偶联受体(GPCR)超家族。这些受体跨越细胞膜七次,并与细胞内的G蛋白偶联。当多巴胺与这些受体结合时,它会引起构象变化,激活相关的G蛋白,引发细胞内信号级联事件。
不同受体的信号通路
D1
🔵 D1样受体通路(兴奋性)
偶联:与Gs蛋白偶联
效应:激活腺苷酸环化酶
结果:cAMP增加 → 激活PKA → 磷酸化细胞靶点
D2
🔵 D2样受体通路(抑制性)
偶联:与Gi蛋白偶联
效应:抑制腺苷酸环化酶
结果:cAMP降低
🧠 受体在大脑中的分布
多巴胺能受体:位置、功能和对脑化学的影响在不同的大脑区域各不相同,有助于多巴胺的不同作用。
纹状体:多巴胺作用的核心区域
在所有接收多巴胺信号的脑区中,纹状体(一个大型的皮层下区域,是基底神经节回路的核心)的神经支配最为密集。纹状体中高达95%的神经元是所谓的”纹状体投射神经元(SPNs)”,它们根据表达的多巴胺受体类型被清晰地分为两大类:
这种受体表达的差异意味着两类神经元对多巴胺信号的”聆听”方式截然不同,从而为多巴胺实现复杂的调控功能提供了基础。
多巴胺对神经回路和行为的影响
多巴胺的影响远远超出了单个神经元,塑造了整个神经回路的活动,从而影响了行为。
🎁 奖励与动机:大脑的激励系统
🧠 中脑边缘多巴胺通路
从腹侧被盖区投射到中脑背核,在奖赏加工和动机中起着至关重要的作用。
当我们经历一些有益的事情时,比如吃到美味的食物或受到表扬,这条通路上的多巴胺神经元就会被激活。这种多巴胺的释放加强了导致奖励的行为,增加了重复的可能性。这种机制是学习和习惯形成的基础。
重要提醒:
多巴胺不仅仅是一种”快乐化学物质”,
而是刺激的激励价值和显著性的信号。
🏃♂️ 运动控制:协调身体动作
🔗黑质纹状体多巴胺通路
连接黑质和纹状体的通路,对于启动和协调随意运动至关重要。
多巴胺调节基底神经节神经元的活动,基底神经节是一组参与运动控制的皮质下结构。这种调节有助于选择和启动适当的运动程序,同时抑制竞争性动作。
🧠 认知功能:思维与决策
除了奖励和运动,多巴胺还影响各种认知功能,包括注意力、工作记忆和决策。
📊 工作记忆
在前额叶皮层,多巴胺信号在维持和更新工作记忆中的信息方面起着至关重要的作用。
🎲 风险决策
多巴胺调节冒险行为和冲动,多巴胺水平较高通常与冒险和探索行为增加有关。
😊情绪调节:复杂的平衡艺术
多巴胺对情绪调节的影响是复杂的,并与其他神经递质系统相互作用。虽然多巴胺通常与积极的情绪状态有关,但它在情绪中的作用并不简单。
⚠️ 多巴胺信号过多和不足都可能导致情绪障碍。例如,精神分裂症的”多巴胺假说”表明,某些大脑区域的多巴胺活动过度可能导致精神病症状。
🕸️ 复杂的调控网络
多巴胺神经元的活动受到大脑内复杂网络的严密调控。它们接收来自局部及长距离投射的密集神经支配,其兴奋或抑制状态主要取决于两大类输入信号的动态平衡:
这种多层次、多维度的调控机制确保了多巴胺神经元能够精确响应机体内外环境的复杂变化,维持神经系统的动态平衡。
运动和动机
多巴胺在运动功能中的作用并非直接控制动作的精确性,而是作为一种“启动器”和“激励器”,负责激发和维持自主行为。
🚀 多巴胺是行为启动的关键
帕金森病就是个典型的例。患者虽然失去了自主行走的能力,但在外部刺激(如楼梯、音乐)的引导下,却能完成爬楼、跳舞等复杂的协调动作。
这表明多巴胺的核心作用在于:自我发起一个动作,而非执行动作本身。
⚡ 多巴胺调节行为活力与动机
现代研究发现,多巴胺的释放水平与动物执行动作的活力以及动机程度直接相关。
多巴胺越多,我们做事就越有劲头、越积极主动。
一个有影响力的假说认为,多巴胺的释放反映了某个特定行为的“价值”。也就是说多巴胺其实是在告诉我们某件事值不值得做。
当一个行为与重要结果相关联时,多巴胺会增强该行为,从而促进学习和激励。
比如你闻到了鸡腿香,大脑释放多巴胺让你更有动力去吃;当你发现不好了前方危险需要逃跑时,多巴胺也会激增,给你逃生的力量。
⏱️ 不同时间尺度的调控
多巴胺的这种激励作用体现在两个时间尺度上:
学 习
在过去的几十年里,科学家们发现,多巴胺除了是运动的启动器外,还在我们的大脑中扮演着一个更为深刻的角色——超级严格的学习教练。它不是简单地让你感到爽,而是通过一个精妙的机制,告诉我们什么值得学、什么需要改,从而塑造我们的行为。
学习的秘密:建立联系,预测未来
在神经科学看来,学习的本质就是建立关联。我们通过将一个中性线索与一个重要的结果联系起来,从而学会预测未来。也就是“条件反射”。
比如说:
这种能力让我们能提前预判,而不是被动挨打。
学习的核心动力:意外
什么时候我们学得最快?当现实和预期不一样的时候。举个生活中的例子:
🎉 意外惊喜时(正向误差):
😐 符合预期时(零误差):
😞 意外失望时(负向误差):
这个“现实与预期的差异”,在科学上被称为“奖励预测误差 (Reward Prediction Error, RPE)”。这正是学习发生的核心驱动力:
正向误差(Positive RPE): 现实 > 预期。
结果比想的要好,大脑发出“快学!”的信号,强化当前行为。
零误差(Zero RPE): 现实 = 预期。
一切尽在掌握,无需学习。
负向误差 (Negative RPE): 现实 < 预期。
结果比想的要糟,大脑发出“出错了,快改!”的信号,削弱当前行为。
经典例子:为什么”先入为主”这么难改?
一个经典的例子叫“阻断效应 (blocking)”。
如果狗已经学会了“铃声(A)=食物”,那么即便后来再给它“铃声+灯光(AB)=食物”的训练,它也学不会“灯光=食物”。因为食物的出现完全被铃声预测了,灯光的出现毫无意外可言,大脑就懒得学新东西了。
科学发现:多巴胺是意外探测器
神经科学家舒尔茨通过研究猴子发现:
从大脑到AI:跨界融合的典范
最神奇的是,科学家发现多巴胺的工作原理和人工智能的”强化学习“算法很像。
AI学习过程:
尝试一个动作 → 看结果如何 → 调整策略 → 再试再调整
大脑学习过程:
做一个行为 → 多巴胺评估意外程度 → 强化或削弱行为 → 下次做得更好
这就是为什么AI能学会下棋、打游戏的原理。
多巴胺是学习指导员:
它不会让你一直爽下去
它会根据”意外程度”给你反馈
它的目标是让你不断进步
该夸你时夸你,该推你时推你
让你变更聪明,更能适应这个世界
其他行为功能
前面我们说多巴胺是学习教练、动力开关,但其实它的功能远不止这些。多巴胺就像一个万能助手,在大脑不同区域有不同的工作职责。
🗺️ 多巴胺的工作岗位分布
– 腹侧纹状体
计算奖励预测误差,也就是评估这件事比我想的好还是差。
– 背侧纹状体
控制和协调身体运动, 指挥你的手脚如何动作。
– 纹状体后部
监测新鲜事物、重要信息、潜在危险。时刻警觉周围环境。
– 前额叶皮层
行为灵活性、工作记忆、控制冲动、区分不同刺激,也就是说负责规划和决策。
– 感觉皮层
帮助感知系统适应和改变,更好地适应环境。
– 海马体
帮助形成记忆,特别是新鲜事物的学习,专门负责把新信息存入大脑硬盘。
……
多巴胺参与了不同的行为过程,
它会根据所在位置和情况需要,
发挥不同的作用来帮助我们生存和适应。
科学家发现,肠道中的某些特定菌属,如普雷沃氏菌(Prevotella)、拟杆菌(Bacteroides)、乳杆菌(Lactobacillus)、双歧杆菌(Bifidobacterium)、肠球菌属(Enterococcus)和梭菌属(Clostridium)等,可以直接或间接地遥控大脑中的多巴胺系统。它们能够影响多巴胺受体和转运蛋白的表达水平,从而或增强、或削弱多巴胺信号的传递。
普雷沃氏菌与拟杆菌:多巴胺系统的精细调节师
在肠道菌群中,普雷沃氏菌属和拟杆菌属同属拟杆菌门,通过截然相反的方式,精妙地影响着我们大脑中多巴胺的活性。
它们主要作用于一个关键目标:多巴胺转运体 (DAT)。
什么是DAT?
多巴胺在神经元之间传递完信号后,就好比完成了任务的信使。DAT是一个高效的回收器,负责将这些信使从工作岗位上(突触间隙)回收,以便下次再用。DAT的效率直接决定了多巴胺的停留时间和信号强度。
✦ 拟杆菌:提高回收效率
以普通拟杆菌 (Bacteroides uniformis) 为代表,它的存在能增强DAT的回收效率。
当普通拟杆菌增多时,大脑纹状体中的DAT回收器会变得更加活跃,与多巴胺的结合能力增强。这意味着多巴胺会被更快地从工作岗位上回收。这是一种维持多巴胺系统稳态和效率的重要机制。
✦ 普雷沃氏菌:降低回收效率
以Prevotella copri为代表,它的作用则完全相反:它会降低DAT的回收效率。
当Prevotella copri增多时,DAT回收器的工作效率会下降。这使得多巴胺能在工作岗位上停留更长时间,其信号强度和作用时间都会被放大。
普雷沃氏菌的另一条通路:通过饥饿素间接发力
普雷沃氏菌能增加我们体内“饥饿素”(Ghrelin)的水平。饥饿素不仅让我们感到饥饿,它还能直接作用于大脑的奖赏中枢(VTA),在这里激活多巴胺神经元,促进多巴胺的释放。
总结来说,普雷沃氏菌和拟杆菌就像多巴胺系统的两个调节阀:
这两类细菌的平衡,对于维持我们大脑正常的奖赏、动机和运动功能至关重要。它们的失衡,可能与多种神经精神疾病的发生密切相关。
肠道菌群对多巴胺能突触间隙和多巴胺代谢的影响
doi: 10.3390/biomedicines10020436
(1) 单形拟杆菌上调 DAT/多巴胺结合效率。普雷沃氏菌Prevotella copri下调 DAT 结合效率。
(2) 粪肠球菌和屎肠球菌显示酪氨酸羟化酶和芳香族 L-氨基酸脱羧酶活性。口服黄连素合成辅因子 BH4,增强酪氨酸向多巴胺的转化。
(3) 植物乳杆菌 PS128 增加 DAT 表达。
(4) 瘤胃球菌下调 D2 R 表达。
(5) 瘤胃球菌与酪氨酸羟化酶活性降低相关。
乳杆菌与双歧杆菌:多巴胺系统的全能守护神
乳杆菌属(Lactobacillus)和 双歧杆菌属(Bifidobacterium) 是两大初代的益生菌,通过多种机制,保护和调节多巴胺系统,对抗压力与神经损伤。
✦ 直接保护神经,对抗损伤
其中植物乳杆菌PS128(Lactobacillus plantarum PS128) 的表现尤为突出:
补充PS128能够显著减少多巴胺神经元的死亡,并阻止纹状体中多巴胺水平的下降。其作用机制是减轻由神经毒素引发的氧化应激和神经炎症,从根源上保护了神经细胞。
✦ 提升多巴胺回收效率
除了直接保护,还能微调多巴胺的代谢通路,提升多巴胺回收效率。研究发现,植物乳杆菌PS128还能增加多巴胺转运体 (DAT) 的表达。这能优化多巴胺的回收和再利用,提高整个系统的运转效率。
✦ 调节关键代谢酶
植物乳杆菌DR7 (Lactobacillus plantarum DR7):在压力状态下,它能下调“多巴胺β-羟化酶”和“酪氨酸羟化酶”的水平。这两种是多巴胺合成与转化的关键酶,通过调节它们,DR7能有效缓解压力反应。
鼠李糖乳杆菌 (Lactobacillus rhamnosus):能下调单胺氧化酶 (MAO)的活性。MAO是分解多巴胺的酶,抑制它就等于延长了多巴胺的作用时间。
同样的多巴胺发挥更长时间的作用。
✦ 缓解压力与行为异常
益生菌对多巴胺系统的调节,最终体现在对情绪和行为的改善上:
双歧杆菌:能有效减轻身体过度的应激反应(HPA轴反应),帮助身体更好地应对压力。
婴儿双歧杆菌 (Bifidobacterium infantis):在经历过早期压力的动物中,补充该菌逆转其行为缺陷,并使其大脑中失衡的去甲肾上腺素水平恢复正常。
总结来说,乳杆菌和双歧杆菌部分菌株通过减少炎症、保护神经元、调节关键代谢酶、优化多巴胺回收等多种途径,支持多巴胺系统的健康。
在对抗压力、焦虑、抑郁
以及神经退行性疾病方面,
展现出巨大的应用潜力。
肠道菌群对多巴胺代谢副产物的影响
doi: 10.3390/biomedicines10020436
(1) 粪球菌属Coprococcus comes和Coprococcus catus 与 DOPAC合成潜力密切相关。
(2) 破伤风梭菌对多巴胺具有降解作用,通过 DOPAC 中间体促进降解为 HVA。
(3) 鼠李糖乳杆菌下调 MAO。
(4) 植物乳杆菌 DR7 下调多巴胺β-羟化酶。
(5) 梭菌属物种显示下调多巴胺β-羟化酶。
(6) 植物乳杆菌 PS128 给药可改善多巴胺代谢并增加去甲肾上腺素水平。
梭菌属:多巴胺的破坏者 / 守护者
梭菌属是一个拥有超过180个成员的大家族,它们对多巴胺的影响,展现了双重性。
😫 魔鬼的一面:多巴胺的破坏者与搅局者
一些梭菌属的成员,比如破伤风梭菌(Clostridium tetani),直接降解多巴胺。
它们能将多巴胺分解成无活性、甚至有害的代谢产物,直接导致多巴胺水平下降。
还能扰乱代谢通路,它们产生的代谢物会堵塞多巴胺的正常转化路径。比如,它们会阻止多巴胺转化为另一种重要的神经递质——去甲肾上腺素。这会导致多巴胺在细胞内异常堆积,产生毒性,引发氧化应激,最终伤害甚至杀死宝贵的多巴胺神经元。
😇 天使的一面:保护和提升多巴胺
幸运的是,梭菌属中也有许多英雄成员,它们通过具体机制保护和提升多巴胺:
丁酸的生产菌 (Clostridium butyricum):丁酸梭菌也是生产丁酸的重要菌种。丁酸能穿过血脑屏障,直接进入大脑,通过减轻神经炎症来保护皮层神经元,并被证实能提升下丘脑的多巴胺浓度。
此外,Clostridium coccoides为代表的成员,拥有一种名为β-葡萄糖醛酸酶的特殊工具。在肠道中,许多多巴胺与其它分子结合而处于休眠状态。这些梭菌能利用这种酶,切断结合,将多巴胺激活成自由的、有生物活性的形式。
肠道里有很多多巴胺被锁住了,梭菌用β-葡萄糖醛酸酶切断锁链,增加了肠道中可用的多巴胺总量。
研究还发现,梭菌能将多巴胺与脂肪酸结合,创造出全新的信号分子——脂肪酸酰胺。这些新分子可以与细胞受体结合,调节身体的生理过程,展现了梭菌影响我们健康的另一条复杂途径。
梭菌属不能被简单地归为好或坏。它既有破坏神经的物种,也有通过生产丁酸、激活多巴胺来守护大脑的友谊菌种。理解这些菌株和它们精确的作用机制,是未来精准调控肠道菌群以维护大脑健康的关键。
肠球菌属:多巴胺生产者 / 消耗者 / 条件益生菌
在肠道菌群的世界里,肠球菌属(Enterococcus) 是一个充满矛盾的角色。它既是我们肠道的正常居民,又可能在特定情况下变成“机会主义病原体”。然而,它最引人注目的,是其作为“多巴胺生产者”的巨大潜力,以及一个可能耗尽多巴胺原料的“坏习惯”。
😇 潜力所在:一个移动的多巴胺工厂
肠球菌属的两个主要成员——粪肠球菌(Enterococcus faecalis) 和屎肠球菌 (Enterococcus faecium), 展现了惊人的多巴胺生产能力。
它们拥有将左旋多巴 (L-dopa)(帕金森病常用药)直接转化为多巴胺的酶。当把这些细菌移植到帕金森病小鼠体内,能显著提升其大脑中的多巴胺水平。
更关键的是,研究发现它们自身就携带酪氨酸羟化酶的活性。这是从最基础的原料——酪氨酸,开始合成多巴胺的第一步关键酶。这意味着它们具备了从头开始构建多巴胺的潜力。
服用小檗碱(黄连素主要成分)能进一步激活生产过程,让这个工厂开足马力运转
😫 坏习惯:浪费原料
尽管肠球菌有生产多巴胺的潜力,但它更喜欢走另一条岔路——优先生产酪胺。
肠球菌会优先使用其酪氨酸脱羧酶,将多巴胺的两种核心前体物质——酪氨酸和左旋多巴,都转化为酪胺 (Tyramine)。
这是个大问题,因为会大量消耗本应用于生产多巴胺的宝贵原料,
反而可能导致多巴胺水平下降。
肠球菌属是一个极具潜力的条件性益生菌。 它天生拥有成为多巴胺工厂的所有工具,但默认设置却是浪费原料。未来的应用前景在于,如果能找到方法比如联合使用特定药物引导它生产多巴胺,有望成为治疗帕金森病等神经系统疾病的强大生物工具。
瘤胃球菌属:可能引发炎症并干扰多巴胺信号
瘤胃球菌属 (Ruminococcus) 虽然能生产有益的短链脂肪酸,但却也可能降解黏液,引发炎症。
💥 引发炎症,破坏多巴胺能神经元
研究发现,在帕金森病动物模型中,瘤胃球菌属的数量会增加,这与大脑黑质区域酪氨酸羟化酶阳性细胞(即多巴胺能神经元)的死亡直接相关。
使用红参或进行运动可减少瘤胃球菌数量,
从而保护多巴胺神经元
临床研究进一步证实了瘤胃球菌的负面影响。例如,在患有抽动障碍的儿童中,发现其肠道内的产乳糖瘤胃球菌(Ruminococcus lactaris) 和 活泼瘤胃球菌(Ruminococcus gnavus) 数量显著高于健康儿童。抽动障碍本身也与多巴胺系统失调密切相关。
💥 干扰多巴胺信号接收
除了引发炎症,瘤胃球菌属还可能通过一种更隐蔽的方式干扰多巴胺系统,影响多巴胺受体的表达。
下调D2受体:在酒精诱导的动物模型中,发现包括瘤胃球菌科 (Ruminococcaceae) 在内的菌群增多,与大脑纹状体中多巴胺D2受体的基因表达水平下降有关。
D2受体是多巴胺发挥作用的关键接收器之一
它的数量减少,意味着即便多巴胺水平正常,
其信号也无法被有效接收,这与帕金森病
运动障碍(如运动迟缓)等症状密切相关
总结来说,瘤胃球菌属对多巴胺系统的负面影响是多方面的: 它通过降解肠道黏液来引发炎症,间接损害多巴胺神经元;同时,它还可能通过下调关键的D2受体,直接削弱多巴胺信号的传递。这使其成为一个在研究神经系统疾病时需要特别关注的菌属。
在多巴胺方面,瘤胃球菌属: 坏的影响 >> 好的影响
多巴胺对众多重要神经功能的广泛影响,几乎所有脑部疾病在某个阶段都可能涉及多巴胺功能障碍。在这里,我们将重点介绍以下几种疾病,最具体的特点是,多巴胺能异常和/或多巴胺能药物治疗。
帕金森病
在涉及中脑多巴胺系统的疾病中,研究最深入的或许就是帕金森病 (Parkinson’s disease, PD)。
帕金森病的核心病理改变,是黑质纹状体通路多巴胺神经元的选择性死亡,尤其是位于黑质外侧部的那些神经元。这些神经元就像大脑深处的多巴胺工厂,专门生产控制运动的关键化学物质,这些多巴胺被送到大脑的运动控制中心,充当运动启动器的角色。当这些工厂停产,身体就无法流畅地执行运动指令。
治疗突破
研究人员使用左旋多巴 (L-DOPA) 作为半成品原料,L-DOPA可以轻松进入大脑,然后被大脑里残存的神经元加工成多巴胺,治疗帕金森病患者能高效缓解其运动症状,这一发现彻底革新了我们对帕金森病的认知,并且该疗法至今仍用于临床实践。
帕金森患者的肠道菌群变化
帕金森病患者的肠道菌群组成发生显著改变,比如普雷沃氏菌减少,这是帕金森病患者最显著的肠道菌群改变。普雷沃氏菌能产生硫化氢,对多巴胺神经元具有保护作用。
厚壁菌门 / 拟杆菌门比例升高,特别是梭菌属和瘤胃球菌科增多。
其他具体变化如下表所示:
微生物在帕金森病中的作用
doi: 10.3390/biomedicines10020436
仍有部分研究结果存在矛盾,提示帕金森病的肠道菌群变化可能具有时间和个体差异性。
肠道症状:帕金森病的早期信号
帕金森病的胃肠道症状(如便秘、胃排空延迟)通常比运动症状更早出现,这为疾病的早期诊断提供了重要线索。
便秘:外周多巴胺水平降低 → 下肠道蠕动减少 → 便秘加重。
普雷沃氏菌减少导致硫化氢分泌不足,
进一步加剧了这一过程。
研究表明,与厚壁菌门肠型相比,普雷沃氏菌肠型的帕金森病患者,便秘严重程度明显降低。
谷禾肠道菌群检测报告中的肠型这个指标:其中有一种肠型就是普雷沃氏菌肠型。
<来源:谷禾肠道菌群检测数据库>
如果帕金森患者的普雷沃氏菌少,后面有可能会出现便秘症状。
研究指出,将乳杆菌属和双歧杆菌属作为益生菌引入后,帕金森病患者的排便频率得到改善,平均肠道转运时间从135小时缩短至77小时。
注意力缺陷/多动障碍症
注意力缺陷/多动障碍(ADHD)是儿童期最普遍的行为和多因素精神障碍之一,具有复杂的病因和强大的遗传基础。全世界约 5%的儿童和 2.5%的成人患有 ADHD。在约 80%被诊断患有该疾病的儿童中,ADHD 的一些症状持续到青春期和成年期。
多动症的特征是注意力不集中、冲动、过度运动和多动症;情绪失调,表现为易怒加剧、耐受挫折能力低和情绪波动。
注意力像蝴蝶一样飞来飞去,很难专注,身体像装了小马达,停不下来,做事很冲动,想到什么就做什么。
🧠 多巴胺系统罢工了
还记得我们前面说多巴胺是学习教练和动力开关吗?在ADHD患者大脑里,这套系统出了故障:
“多巴胺假说”认为,ADHD的症状源于大脑中多巴胺系统的功能失调。就像城市交通系统瘫痪:
🚗 正常大脑: 多巴胺像交通警察,指挥着注意力和行为有序进行
🚧 ADHD大脑: 交通警察生病了,到处都是堵车和乱象
🔬 科学发现:关键零件有问题
在一项人类研究中,描述了特定基因显示出与 ADHD 的重要关联,并且这些基因与多巴胺系统的组分相关,例如:
在 ADHD 患者的脑中也检测到异常水平的 DAT,并且 DAT 是抗多动症药物如安非他明的靶标。
多巴胺系统的失调,特别是 D4 和 D5 受体功能的异常,会破坏奖赏处理和动机系统,这是 ADHD 核心症状的重要神经生物学基础。
D4 受体主要存在于与 ADHD 病因密切相关的关键脑区,特别是额叶区域。额叶区域在执行功能、注意力控制和行为调节中发挥核心作用,而这些正是 ADHD 患者表现出功能障碍的主要认知领域。
ADHD的发育、遗传和环境因素
doi: 10.12865/CHSJ.51.01.02
虽然ADHD可能有独特的风险基因,但相当一部分风险变异在昼夜节律和多巴胺系统中有作用。
注:在与环境因素的相互作用中,受基因驱动的多巴胺和昼夜节律病理机制会增加 ADHD 患者发展共病疾病的风险,即物质滥用障碍、抑郁症和肥胖症。
多巴胺不是唯一因素
多巴胺至关重要,但ADHD是一种复杂的神经发育障碍。去甲肾上腺素系统同样扮演着极其重要的角色(尤其在注意力和警觉性方面),且与多巴胺系统相互作用紧密。其他神经递质(如血清素、谷氨酸、GABA)和环境因素(如早产、低出生体重、铅暴露等)也可能参与其中。
精神分裂症
精神分裂症是一种相对常见(发病率约1%)、致残率极高的精神疾病,其症状繁多,包括幻觉、思维障碍、情感淡漠,以及学习和工作记忆的缺陷。精神分裂症患者的失业率很高(80-90%),且其平均预期寿命会缩短10-20年,这在很大程度上是由于自杀风险的增加。
多巴胺在精神分裂症中的作用
多巴胺的神经传递在精神分裂症的临床发展和症状表现中扮演着关键角色。关于精神分裂症的“多巴胺假说”是在20世纪60年代提出的。
根据修订的多巴胺假说,精神分裂症患者在大脑的两个关键区域——中脑边缘系统(这是负责情绪和奖励的部分)和前额叶(帮助思考和决策的部分)的多巴胺水平异常。
具体来说,在大脑的一个叫纹状体的区域,多巴胺释放得太多,这和阳性症状(如相信不真实的事)有关。研究发现,患者在联想纹状体(一种帮助连接想法的脑区)的前突触(神经信号传递的起点)多巴胺活动增加,这可能引发妄想和幻觉。
例如,像安非他明这样的药物能刺激多巴胺大量释放,会让健康人出现类似精神分裂的症状,这支持了多巴胺过度活跃的观点。
另一方面,前额叶的多巴胺太少,可能解释了阴性症状(如情绪麻木、没动力)和认知问题(如注意力不集中)。
治疗与其他影响因素
早期的抗精神病药物,如氟哌啶醇和氯丙嗪,都是强效的多巴胺D2受体(D2R)拮抗剂。
像氯丙嗪这样的第一代抗精神病药物,主要通过阻挡多巴胺的D2受体(多巴胺的“接收器”)来缓解阳性症状。但这些药有时会让阴性症状更糟,因为它们没针对多巴胺不足的地方。第二代药物,比如利培酮,不仅调控多巴胺,还调整血清素(另一种影响心情的化学物质)。
当然,多巴胺问题不是精神分裂症的唯一原因,它还会和其他大脑化学物质(如谷氨酸,GABA)相互影响。基因因素,比如COMT基因的变化,会影响多巴胺的分解过程,从而提高患病风险。
物质使用障碍
物质使用障碍(亦称药物成瘾)是一种慢性疾病,其特征在于强迫性地、或难以控制地寻求和使用药物,不顾其会带来有害后果。
明知有害后果,但无法控制
成瘾性物质共同特征——都能引起多巴胺释放的急剧增加
关于成瘾起源的经典理论认为,药物扮演了一种异常强大的原发性奖赏 ,它会强化与药物使用相关的行为,同时又绕开自然奖赏(如食物和水)消耗的饱足感过程,这被认为是促进(药量)逐步增加和强迫性使用的原因。
经典多巴胺理论:大脑被欺骗的过程
招数一:模拟超级奖赏
正常情况:
吃美食 → 适度多巴胺释放 → 感觉愉悦
完成目标 → 适度多巴胺释放 → 获得满足感
物质成瘾:
使用某类物质 → 超量多巴胺释放 → 极度愉悦感
问题: 这种奖赏比任何自然奖赏都强烈
招数二:打破饱足机制
自然奖赏有刹车:
物质成瘾没有刹车:
理论的局限性
它无法完全解释成瘾带来的长期认知损伤,也无法解释为何一些非药物的奖励性行为疗法同样有效。然而,无论存在何种争议,一个不可动摇的结论是:多巴胺系统功能紊乱,是药物成瘾发生和发展的关键生物学基础。
考虑到多巴胺功能的复杂性及其与几种疾病的发展的关系,有各种药物旨在通过直接或间接靶向多巴胺受体来治疗这些疾病也就不足为奇了。
传统药物
有广泛的选择性或非选择性多巴胺激动剂和拮抗剂,其已在临床上用于改善疾病的症状,例如:帕金森病、勃起功能障碍、高泌乳素血症、精神分裂症、双相抑郁症、恶心等。
一些实例是阿扑吗啡、伊潘立酮、多潘立酮、溴必利、氯氮平、鲁拉西酮、奥氮平。
共同特点:瞄准D2受体
这些药物中的大多数以 D2 受体为主要靶点,尽管也有化合物可作用于 D1 和 D3。 D2受体是多巴胺系统的主控开关。D4受体至今没有临床药物。
新一代药物
▪ 布雷哌唑,多功能
最近,美国食品药品监督管理局批准了一种新的药物,它是多巴胺 D2 受体部分激动剂,对 5-HT1A 受体也具有激动剂活性,对 5-HT2A 和α-肾上腺素能受体也具有拮抗剂活性:布雷哌唑。
治疗范围:
✅已获批准: 精神分裂症、重度抑郁症(辅助治疗)
🔬 研发中: 阿尔茨海默病相关、创伤后应激障碍
▪ 阿立哌唑,智能调节
另一种有趣的非典型抗精神病药物是 D2 受体的部分激动剂,是阿立哌唑。
浓度决定作用
高浓度的阿立哌唑降低多巴胺能神经元的放电,而低浓度的阿立哌唑增加放电,表明该药物作用于 cAMP/PKA 和 Akt/GSK 3 途径。
治疗应用:
新策略
策略一:绕过受体,直击信号通路
最近,有一种新的方法来开发作用于多巴胺能途径的药物,其中药物靶向受体后信号传导途径,而不是受体。
传统方法: 直接作用于多巴胺受体
新方法: 绕过受体,直接调节受体后的信号传导
策略二:变构调节剂- 侧门入口
这些药物可以通过结合到与内源性配体结合的位点在地形上不同的位点来潜在地减少不良副作用,并且它们还可以双向影响下游途径。已经提出,使用变构调节剂可以增加对 GPCR 亚基的选择性并改善治疗效果,而不破坏生理调节的基质。
不在多巴胺结合位点起作用
在受体的侧门位置结合
改变受体的形状和功能
策略三:偏向性配体- 选择性激活
另一类专注于多巴胺受体后受体信号传导的药物正在开发中,它们是偏向性配体(也称为功能性选择性配体)。这些化合物被设计为选择性地接合受体下游的一个信号传导途径,该受体响应其内源性配体调节多个途径。
传统药物激活所有通路
偏向性配体只激活特定有益通路
未来前景
非编码RNA疗法
未来多巴胺能信号药物发现的其他可能靶点可能是非编码 RNA,因为它们在维持神经元稳态及其在神经系统疾病中的失调中起作用。重新建立非编码 RNA 功能的药物的开发可以更新突触传递。
干细胞疗法
正在开发使用干细胞衍生的多巴胺神经元的疗法,特别是用于治疗帕金森病。
基于肠道菌群的疗法
前面我们了解到,肠道菌群能够直接影响多巴胺的合成、代谢和受体表达,为治疗策略提供了全新思路。
特定菌群超标或不足的干预
例如,肠球菌属(如粪肠球菌和屎肠球菌)具备将酪氨酸转化为多巴胺的完整酶系统,配合小檗碱等天然化合物可增强其多巴胺合成能力。
在肠道菌群检测报告中,如果看到这类菌群偏低,可以配合小檗碱补充进行相关干预。
肠道菌群检测报告相关指标
在谷禾肠道菌群检测报告中,也有多巴胺这个指标,这个指标并非直接检测多巴胺浓度,而是基于谷禾自有的“菌群-代谢-神经递质预测算法”得到的评估。
<来源:谷禾肠道菌群检测数据库>
如果测出来过多或者过少,谷禾肠道菌群检测报告也会给出相关的说明及建议,可以根据该指标结合自身症状进行干预。
值得注意的是,谷禾肠道菌群检测报告中除了多巴胺的指标外,也有血清素、GABA、谷氨酸、DOPAC等多种神经递质相关指标,有些症状可以结合多个指标一起分析来获得更全面的评估。例如,焦虑情绪可能不仅与GABA水平相关,还可能与血清素代谢异常有关。
比如说,DOPAC是多巴胺的代谢产物,参与神经递质的代谢循环。作为代谢产物,间接反映了多巴胺代谢的活动水平。
DOPAC这个指标低可能意味着多巴胺代谢减少或代谢过程受到抑制。这种情况可能出现在多巴胺能神经元活动降低时,比如在帕金森病患者中,由于多巴胺能神经元的退化,多巴胺及其代谢产物DOPAC的水平都会降低。DOPAC水平异常也可能与某些精神疾病如抑郁症相关,这反映了中枢神经系统中多巴胺能系统功能的改变。
在谷禾肠道菌群检测报告中一次检测列出众多指标,也可以结合分析,比如说,当多巴胺合成能力高但DOPAC水平低时,提示多巴胺降解酶活性不足,可能导致多巴胺积累;相反,如果多巴胺指标正常但DOPAC过高,则可能存在多巴胺过度代谢的问题。
大脑中的多巴胺水平受到多种因素的影响,包括日常习惯和医疗干预。这些因素会显著影响情绪、动机和认知功能。
营养和生活方式
饮食对多巴胺水平有很大影响。富含蛋白质食物中的必需氨基酸如苯丙氨酸和酪氨酸是多巴胺的前体。食用富含这些氨基酸的食物可以增强多巴胺的合成。苯丙氨酸和酪氨酸广泛存在于多种食物中,包括肉类、乳制品、豆类、蔬菜(如蘑菇)、水果(如猕猴桃、红树莓)等。
摄入美味食物(尤其是高糖、高脂肪的食物)会激活大脑的奖赏回路,促进多巴胺的释放,从而增强食物的愉悦感和进食行为。然而长期摄入高糖或高脂肪食物可能导致多巴胺系统的适应性变化,例如多巴胺反应的习惯化或敏感性改变。
益生菌和发酵食品还可以通过促进肠道健康来影响多巴胺的产生。某些研究表明,健康的肠道微生物组对包括多巴胺在内的神经递质水平有积极影响。
益 生 菌
益生菌和益生元改善宿主的健康。这是通过引入活微生物及其生长基质,影响肠道微生物生态,并积极改变宿主的生理学来实现的。一些研究表明益生菌作为治疗工具的潜力,对免疫系统甚至 中枢神经系统有益。
关于影响中枢神经系统的益生菌:
已经表明,鼠李糖乳杆菌 JB-1、 长双歧杆菌 NCC 3001 和瑞士乳杆菌 R 0052 和 长双歧杆菌 R 0175 可减少大鼠的焦虑样行为。
双歧杆菌和鼠李糖乳杆菌JB-1进行干预会影响 HPA 轴,降低皮质酮水平。
向无菌小鼠施用植物乳杆菌 PS128 可以减少焦虑样行为和过度运动。此外,这些变化伴随着 DA 和 HVA 的增加,以及纹状体中 5-HT 的增加。
特定的益生菌菌株能够:
降低应激激素:如假小链双歧杆菌 CECT 7765 能降低应激模型小鼠的皮质酮(CORT)水平。
调节神经递质:瑞士乳杆菌 NS 8 能恢复海马体中的去甲肾上腺素(NA)、5-HT水平,但另一些研究显示对下丘脑的神经递质无影响,表明其作用具有区域特异性。
改善情绪与行为:多种益生菌(如双歧杆菌、乳杆菌)显示出能够减少动物的焦虑和抑郁样行为,并改善认知功能。
支持大脑健康:能恢复神经营养因子(如BDNF)的水平,这对神经元的健康至关重要。
对人类有潜在益处:初步研究表明,益生菌可以降低健康女性大脑对情绪任务的反应,改善自闭症儿童的行为症状,并可能减少儿童患ADHD的风险。
然而,研究也强调了两个关键的复杂性:
菌株特异性:效果并非普适,不同的益生菌菌株(甚至是同一种类下的不同菌株)效果迥异。
并非绝对有益:一项研究指出,某种干酪乳杆菌反而增加了健康动物的焦虑样行为,提醒我们益生菌的作用是复杂的,并非多多益善。
益生菌并非万能药,其效果不仅取决于菌株,也取决于个体的身体状况。在健康状态下,不当补充某些益生菌甚至可能产生负面效果。
补充剂
一些补充剂被认为可以增强多巴胺功能:
注:刺毛黧豆也叫天鹅绒豆,是一种天然植物,其种子中富含左旋多巴(L-DOPA),这是多巴胺的前体物质,种子的提取物用于许多健美运动补剂。
将肠道健康视为心理健康的一部分。通过饮食(如发酵乳制品、高纤维食物)和生活方式来维护健康的肠道菌群,可能对情绪稳定和压力管理有积极作用。
睡眠和锻炼
有规律的身体活动已被证明可以提高多巴胺水平并增强受体敏感性。 这可以促进改善情绪,注意力和运动技能。
可能增加多巴胺的运动类型包括:
睡眠质量和持续时间也会影响多巴胺的功能。睡眠-觉醒周期的中断可以改变多巴胺信号,可能影响注意力,学习和压力管理。
建立健康的睡眠习惯可以支持最佳的多巴胺水平:
了解多巴胺,就是了解我们行动的底层逻辑。希望这份科普能给你带来启发,学会如何与自己的多巴胺系统合作,我们可以更好地管理自己的能量和动力,让工作变得更轻松高效,也让生活中的小确幸更加触手可及。
注:本账号发表的内容仅是用于信息的分享,在采取任何预防、治疗措施之前,请先咨询临床医生。
主要参考文献:
Hamamah S, Aghazarian A, Nazaryan A, Hajnal A, Covasa M. Role of Microbiota-Gut-Brain Axis in Regulating Dopaminergic Signaling. Biomedicines. 2022 Feb 13;10(2):436.
Grigore M, Ionică MV, Pătru L, Gheorman V, Wagner AP. Recent Advances in the Etiology and Neural Pathways Underlying Attention-Deficit and Hyperactivity Disorder. Curr Health Sci J. 2025 Jan-Mar;51(1):14-25.
Kollins SH, Adcock RA. ADHD, altered dopamine neurotransmission, and disrupted reinforcement processes: implications for smoking and nicotine dependence. Prog Neuropsychopharmacol Biol Psychiatry. 2014 Jul 3;52:70-8.
Loh JS, Mak WQ, Tan LKS, Ng CX, Chan HH, Yeow SH, Foo JB, Ong YS, How CW, Khaw KY. Microbiota-gut-brain axis and its therapeutic applications in neurodegenerative diseases. Signal Transduct Target Ther. 2024 Feb 16;9(1):37.
Beaulieu, J. M., & Gainetdinov, R. R. (2011). The physiology, signaling, and pharmacology of dopamine receptors. Pharmacological Reviews, 63(1), 182-217.
Wise, R. A. (2004). Dopamine, learning and motivation. Nature Reviews Neuroscience, 5(6), 483-494.
Grace, A. A. (2016). Dysregulation of the dopamine system in the pathophysiology of schizophrenia and depression. Nature Reviews Neuroscience, 17(8), 524-532.
Volkow, N. D., Wise, R. A., & Baler, R. (2017). The dopamine motive system: implications for drug and food addiction. Nature Reviews Neuroscience, 18(12), 741-752.
Tritsch, N. X., & Sabatini, B. L. (2012). Dopaminergic modulation of synaptic transmission in cortex and striatum. Neuron, 76(1), 33-50.
Berke, J. D. (2018). What does dopamine mean? Nature Neuroscience, 21(6), 787-793.
Sulzer, D., Cragg, S. J., & Rice, M. E. (2016). Striatal dopamine neurotransmission: regulation of release and uptake. Basal Ganglia, 6(3), 123-148.
González-Arancibia C, Urrutia-Piñones J, Illanes-González J, Martinez-Pinto J, Sotomayor-Zárate R, Julio-Pieper M, Bravo JA. Do your gut microbes affect your brain dopamine? Psychopharmacology (Berl). 2019 May;236(5):1611-1622.
Abela AR, Duan Y, Chudasama Y (2015) Hippocampal interplay with the nucleus accumbens is critical for decisions about time. Eur J Neurosci 42:2224–2233.
Arentsen T et al (2017) The bacterial peptidoglycan-sensing molecule Pglyrp2 modulates brain development and behavior. Mol Psychiatry 22:257–266.
Speranza L, di Porzio U, Viggiano D, de Donato A, Volpicelli F. Dopamine: The Neuromodulator of Long-Term Synaptic Plasticity, Reward and Movement Control. Cells. 2021 Mar 26;10(4):735.
谷禾健康
随着现代医学的不断进步,人类对于肠道微生态的研究正逐渐深入,粪菌移植(FMT)作为一种新兴的、生物学意义深远的治疗手段,在临床实践中展现出了革命性潜力。FMT广泛用于治疗艰难梭菌感染等复杂疾病,并逐渐延伸至免疫功能调节、代谢紊乱等领域,尤其是在儿童人群中的应用引发了广泛关注。
然而,在这项技术日益普及的同时,其在特殊人群中的安全性问题始终是临床医生和产业从业者关注的焦点。大多数关于FMT安全性的研究主要集中在成人人群中,而对儿科人群的了解较少,目前所有儿科FMT数据均来自小型病例系列和病例报告。
近日,一项来自上海儿童医院的大规模单中心回顾性研究,揭示了FMT在儿童人群中的长期安全性数据。这项跨越十年(2013-2023年)、涵盖813名儿童患者的研究,不仅是目前样本量最大的儿科FMT安全性评估,更是首次系统性地呈现了中国儿童接受FMT后的长期随访结果。

研究发现,FMT在儿科人群中总体表现安全,短期不良事件(AE)发生率仅为5.8%,且大多为轻微自限性症状;在长达122个月的随访期内未观察到长期不良事件。
这些珍贵的临床数据将为技术优化、产品研发和临床应用提供重要参考,并为拓展儿科FMT市场提供有力支撑。
本文我们来详细了解一下这项研究。

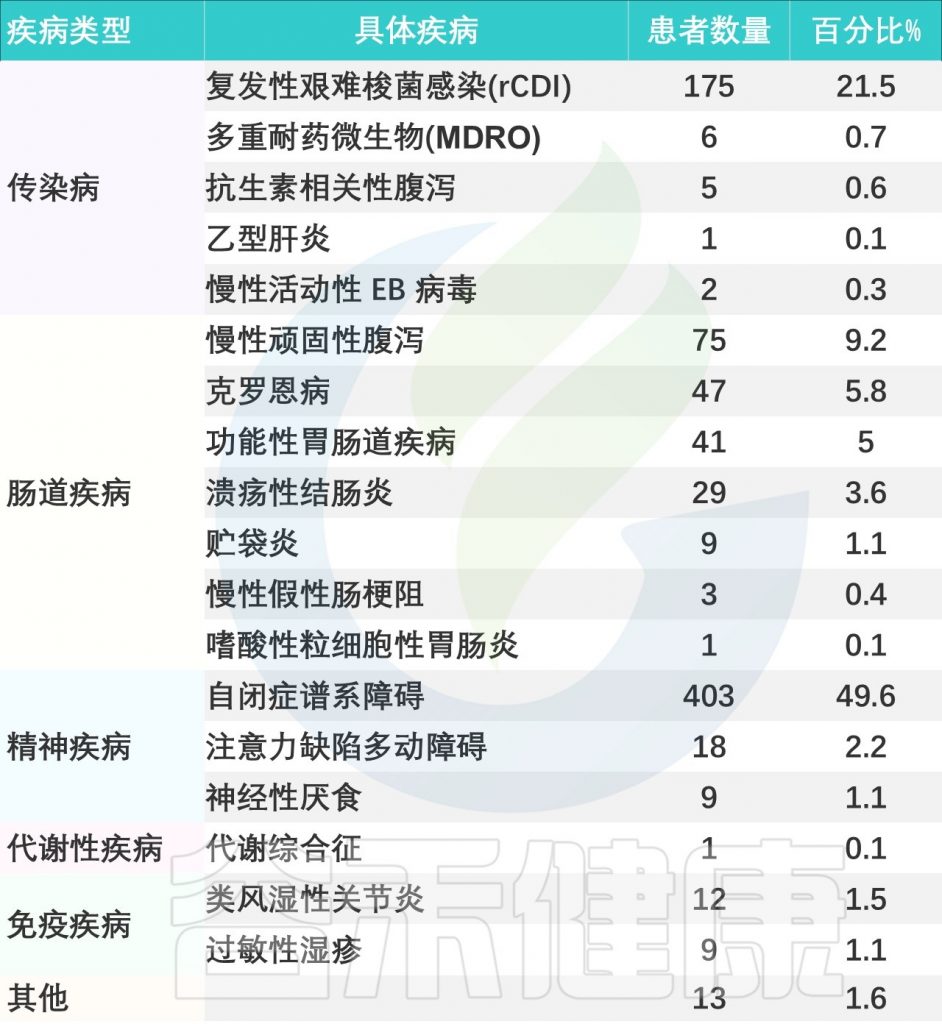
该研究回顾性分析了2013年12月~2023年12月在上海儿童医院接受 FMT 治疗的儿科患者,例如复发性艰难梭菌感染、抗生素腹泻、乙肝、慢性顽固性腹泻、炎症性、慢性肠假性梗阻、自闭症、多动症、神经性厌食症等,详见下表。
doi.org/10.1186/s12866-025-03858-z
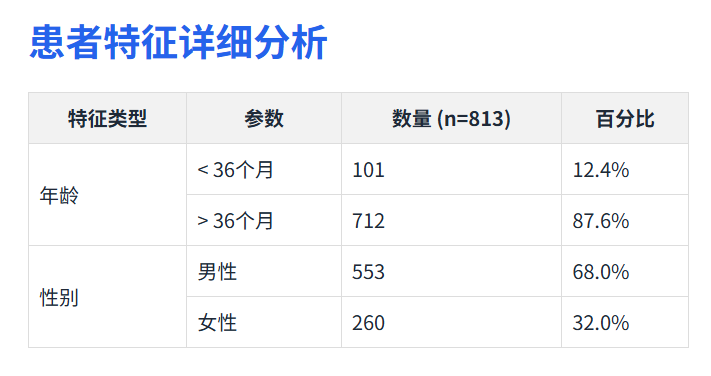
患者特征详细分析

1. FMT相关不良事件
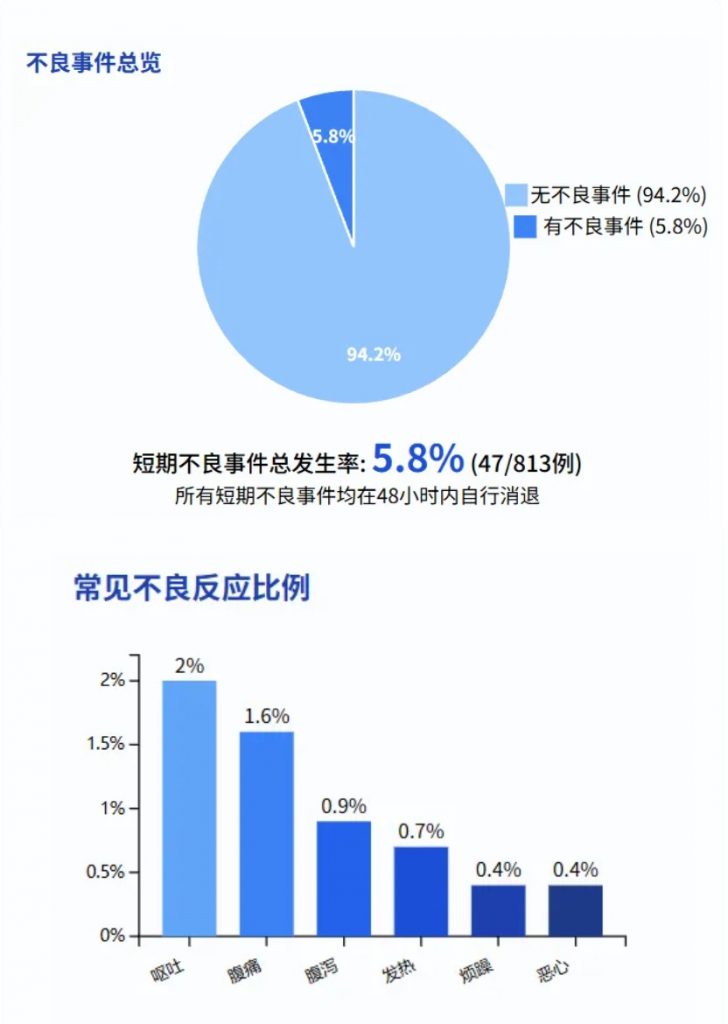
短期不良事件总发生率为5.8%(47/813例)
最常见的短期不良反应包括:
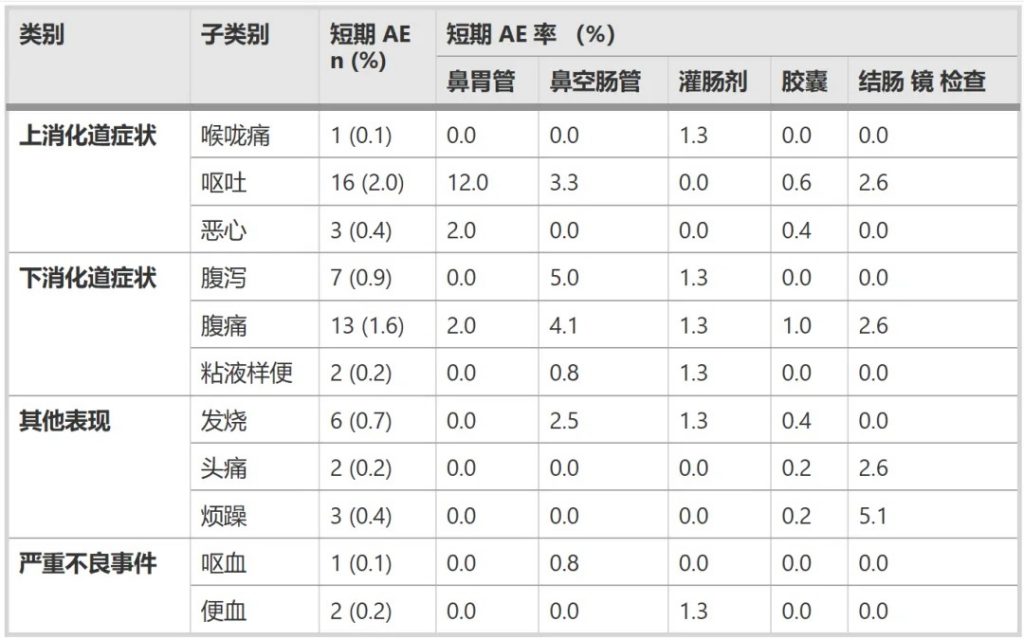
doi.org/10.1186/s12866-025-03858-z
2. 给药途径与不良事件关联
FMT 的给药途径在短期不良事件的发生中起着重要作用。
给药选择包括上消化道(UGI),例如使用鼻胃管或鼻空肠管、内窥镜检查、胶囊,以及下消化道途径(LGI),如保留灌肠、乙状结肠镜检查或结肠镜检查。
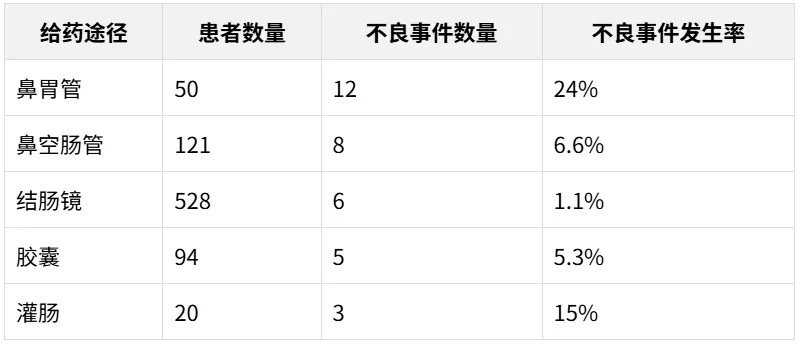
与其他途径相比,胶囊的短期不良事件发生率较低;鼻胃管(16.0%,8/50) 和鼻空肠管(14.0%,17/121) 的短期不良事件发生率更高。
FMT不同给药方式下的短期不良事件发生率(%)
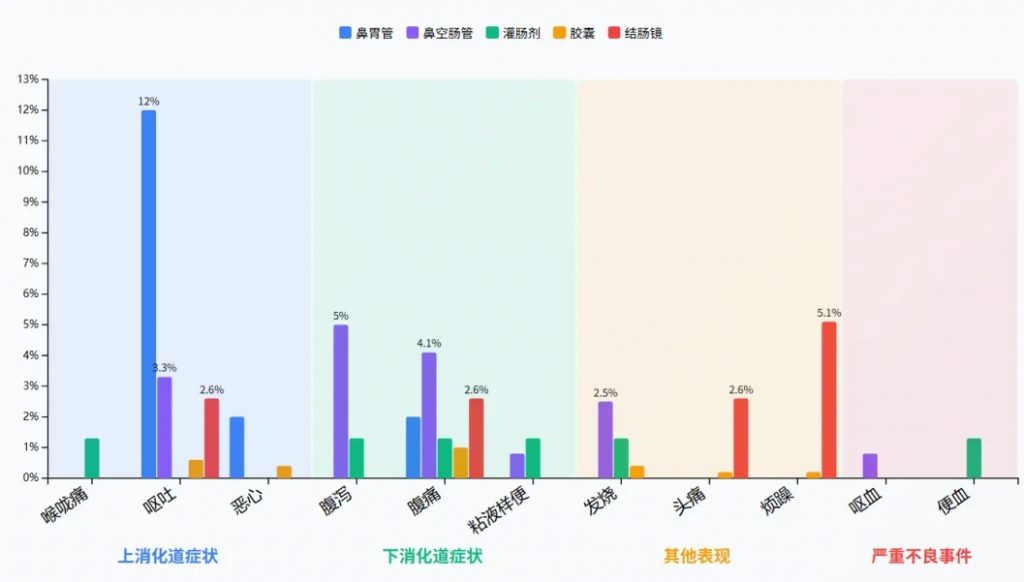
鼻胃管给药方式下,呕吐的发生率最高(12.0%),是所有给药方式中单一不良事件最高的发生率。
鼻空肠管给药方式下,腹痛(4.1%)和腹泻(5.0%)的发生率较高。
严重不良事件(呕血、便血)总体发生率极低(0.1%-0.2%)。

胶囊形式安全也更易于标准化生产、储存和运输,有利于FMT治疗的普及和推广。
3. 疾病类型与不良事件关联
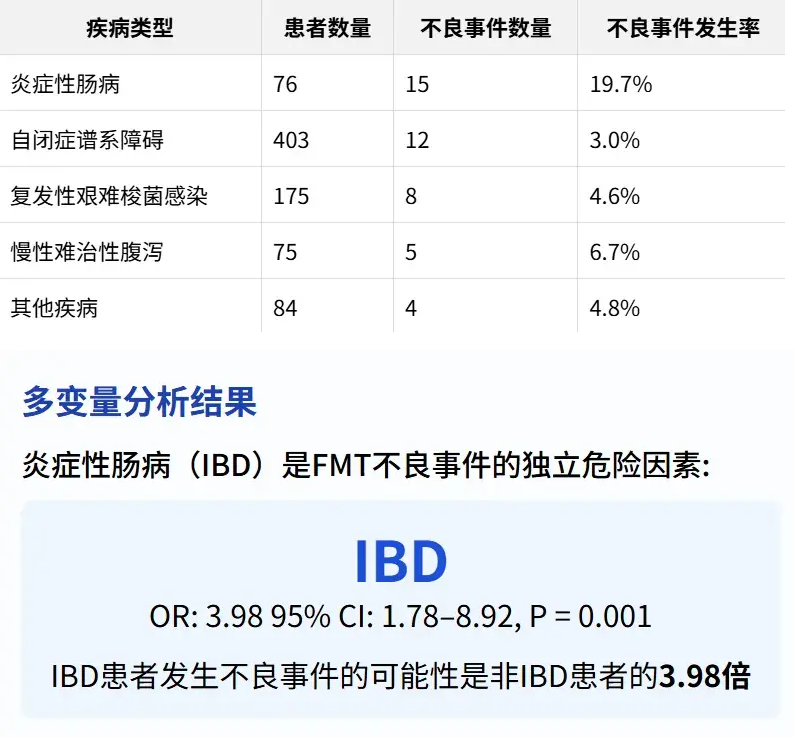
提示在产品开发中需针对IBD患者群体设计更安全的给药方案。
4. 长期随访结果
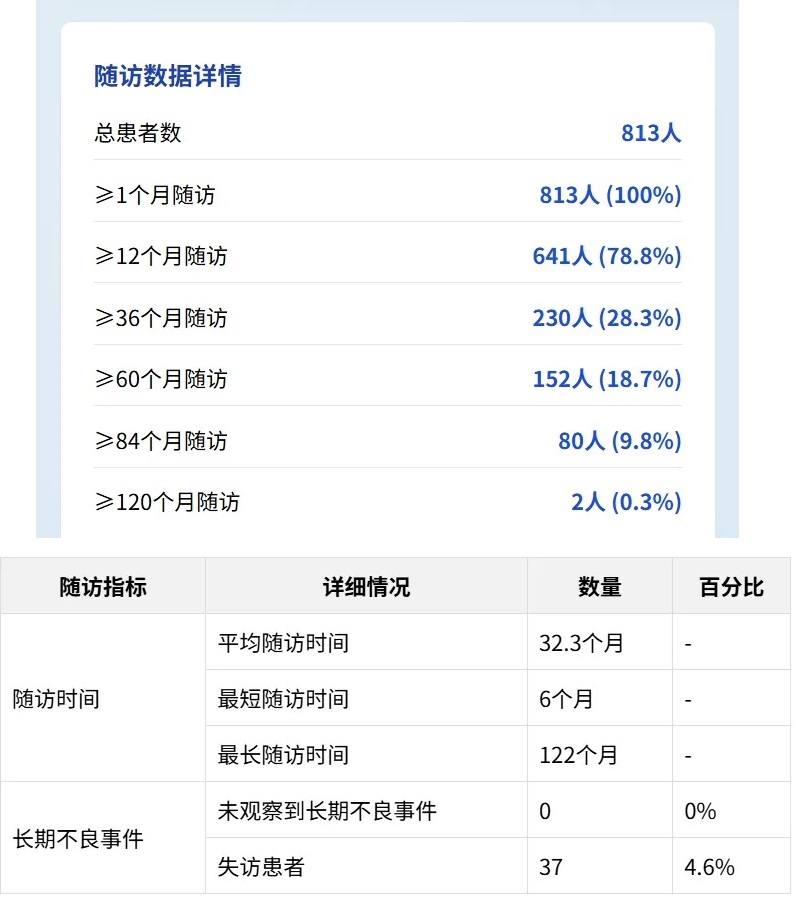
研究纳入813名患者,平均随访时间达32.3个月,最长随访期达122个月,形成了一个极具代表性的儿科FMT安全性数据库。
该研究作为迄今为止中国儿科领域样本量最大、随访时间最长的粪菌移植(FMT)安全性评估,具有较大的科学价值和临床指导意义。
这种大样本、长随访的队列设计克服了以往研究样本量小、随访时间短的局限性,为FMT安全性评估提供了更为可靠的证据。
且该研究覆盖了多种疾病类型和给药途径,包括感染性疾病、肠道疾病、精神疾病、代谢性疾病等多种适应症,以及鼻胃管、鼻空肠管、灌肠剂、胶囊和结肠镜等多种给药方式,能够指导不同疾病和不同情况下FMT的应用策略。
该研究提供的长期安全性数据将增强医患对FMT的接受度,促进其临床应用的规范化,也为微生物组治疗领域的产业化发展奠定了基础。未来,FMT产业有望通过以下方向发展:
未来需要加强微生物组移植后的菌群定植与功能研究,深入探索宿主-菌群互作机制,开发更加精准的微生物组干预策略。
随着高通量测序技术和人工智能技术的发展,FMT治疗前后的连续性菌群数据采集成为可能。这种基于海量微生物组动态变化数据的安全性评估,将远超传统的症状观察方法,能够在潜在安全问题出现前就发出预警,大幅提升FMT的安全性保障水平