-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
夜幕落下,一场疲惫的战斗即将开始
翻来覆去,时间在无情地流逝
盯着天花板,期待天亮的时刻
却又害怕那一刻的真正到来
这意味着又一个疲惫的早晨
从整个歌单的催眠音乐到数了一万只羊
最终都只是让自己在煎熬中更加清醒

在快节奏的现代生活中,良好的睡眠已成为许多人难以实现的奢望。随着压力的增加,睡眠障碍,如失眠、睡眠呼吸暂停和不宁腿综合症等,成为越来越普遍问题。这些睡眠障碍不仅影响人的生活质量,还常伴随其他共病,如焦虑症、抑郁症、心血管疾病甚至癌症等。
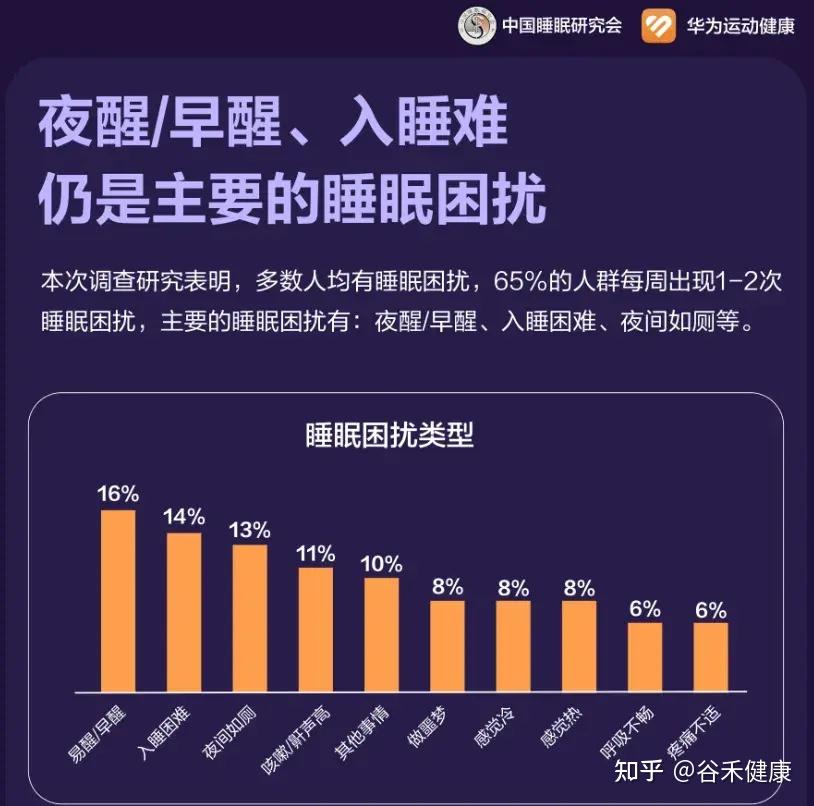
当前,失眠的治疗方法主要有药物治疗和心理疗法。例如,苯二氮䓬类药物虽然能快速缓解失眠症状,但常常伴随神经毒性、成瘾和耐受性等副作用。而认知行为疗法作为一种有效的心理治疗方式,依然缺乏熟练的治疗师,还有高昂的费用,令人望而却步。
当药物的副作用让人却步,心理疗法的门槛又难以触及,我们是否还有更安全、更普适的选择?
答案或许就藏在我们日常的饮食中。饮食不仅能通过营养成分直接作用于神经系统,还能通过调节肠道菌群这个第二大脑,间接影响我们的睡眠质量和昼夜节律。
例如,富含色氨酸的食物(如坚果和牛奶)有助于促进血清素及褪黑素的合成,而神经递质和激素对调节睡眠周期至关重要。
健康的肠道菌群能够通过调节神经递质和激素,促进更好的睡眠。例如,乳杆菌和双歧杆菌,能够产生GABA等神经递质;进而帮助改善睡眠深度和质量。
然而,饮食与睡眠的关联并不是千篇一律的,因为我们每个人体内都有一套独特的生物钟。对于习惯早起的晨型人来说,他们的进食节奏通常与肠道菌群的活跃周期保持一致,而“夜猫子”们往往习惯晚睡晚起,甚至在深夜进食。
那么,晨型人与夜猫子不同的进食时间和作息习惯,会对肠道菌群的昼夜节律产生怎样的影响?
饮食作为连接两者的关键桥梁,怎样才能更好地帮助我们协调自身节律与肠道菌群的作息,从而改善睡眠呢?
本文我们将探讨饮食中关键的食物成分与睡眠之间的关系,分析饮食如何通过调节昼夜节律和肠道菌群来影响我们的睡眠状态,列举各类改善睡眠质量的营养干预措施,为大家提供切实可行的饮食建议,为您的轻松入睡增添更多选择。
本文目录
01 睡眠调节中的关键营养素及生物活性化合物
氨基酸:色氨酸、甘氨酸
微量元素:镁、锌、铁
维生素:维生素 D、B 族维生素
多酚:芹菜素、槲皮素、白藜芦醇等
02 饮食模式对睡眠质量的影响
地中海饮食、生酮饮食、植物性饮食
饮食时间
03 肠道菌群与睡眠的关系
肠道菌群如何影响睡眠
神经递质合成(GABA等)
昼夜节律与肠道菌群的双向关系
早鸟型or夜猫子型?不同睡眠类型的肠道菌群
饮食与微生物干预措施
04 增强睡眠的功能性食品
酸樱桃汁和褪黑素
猕猴桃和血清素
草本茶与镇静植物化合物
甘氨酸、L-茶氨酸和CBD
05 营养睡眠干预的实际应用与个性化营养方法
睡眠健康的一般饮食建议
场景化食谱与搭配建议
饮水与睡眠(补水节奏、起夜、微醺)
饮食与生活方式的协同作用(正念饮食、光照)
睡眠障碍:个性化营养方案

氨基酸:色氨酸、甘氨酸
✦ 色 氨 酸
色氨酸是一种必需氨基酸,意味着我们的身体无法自行合成它,而必须通过食物获得。色氨酸是合成血清素和褪黑素的重要前体,这两种神经递质对于调节我们的睡眠周期至关重要。特别是,褪黑素帮助信号传递,让我们的身体准备入睡。
无论是通过富含蛋白质的食物还是补充剂摄入色氨酸,都与缩短睡眠潜伏期和改善主观睡眠质量有关。
然而,色氨酸在经过血脑屏障进入大脑时,会与其他大型中性氨基酸(LNAAs)争夺运输通道。因此,膳食中碳水化合物与蛋白质的比例也会影响色氨酸在大脑中的可用性。如果你的饮食中碳水化合物的比例适当,就能更好地促进色氨酸的有效运输,有助于改善睡眠。
注:目前的共识倾向于高碳水、低蛋白的组合最有利于色氨酸进入大脑。研究显示,高升糖指数(高Gl)碳水化合物可能比低Gl碳水化合物更能显著提升Trp/LNAA比率。
来源
小贴士
早餐搭配全麦面包或燕麦粥食用富含色氨酸的食物(如鸡蛋、牛奶)。
下午茶喝一杯牛奶或吃一片全麦饼干,配合少量坚果。
睡前仪式一杯温牛奶,不仅含色氨酸,更重要的是其舒缓的温度也有助于褪黑素分泌。
在摄入色氨酸补充剂或富含色氨酸的食物时,避免吃入大量肉类或乳制品。
✦ 甘 氨 酸
甘氨酸是一种非必需氨基酸,通过在中枢神经系统中作为抑制性神经递质发挥促进睡眠的作用。
研究表明,口服甘氨酸补充剂可以改善主观睡眠质量并缩短入睡潜伏期。这种效果可能与甘氨酸降低核心体温有关,而降低体温是身体准备入睡的重要生理信号。
来源
小贴士
避免空腹大剂量:甘氨酸在高浓度下可能刺激胃黏膜,建议随餐或餐后服用。
搭配富含维C食物:维生素C能促进胶原蛋白合成,间接支持甘氨酸的代谢循环。
适量饮水:甘氨酸是水溶性的,充足的水分有助于维持体内代谢平衡。
在严重失眠时,甘氨酸(负责降温/放松)与褪黑素(负责启动睡眠)联合使用可能效果更佳。
微量元素:镁、锌、铁
✦ 镁
镁在睡眠调节中发挥着关键作用,它通过调节N-甲基-D-天冬氨酸(NMDA)受体和GABA系统的活性帮助我们入睡,这两个系统对催眠至关重要。
研究发现,镁缺乏与夜间觉醒次数增加和慢波睡眠减少相关,因此,确保摄入足够的镁对获得高质量的睡眠至关重要。
✦ 锌
锌是一种微量矿物质,具有抗氧化和神经调节特性,参与调节睡眠结构。
针对婴儿和学龄前儿童的研究表明,血清锌水平与睡眠时长之间存在正相关关系。这意味着锌的摄入可能与更长的睡眠时间有关。
锌可能通过影响突触可塑性和调节谷氨酸能神经递质来改善睡眠。
✦ 铁
铁是大脑健康的另一重要元素,尤其是在调节睡眠-清醒周期时起着关键作用。
铁缺乏与不宁腿综合症(RLS)有关,这是一种在休息时会感觉到不适并有强烈想抖腿的冲动的疾病。补充铁可以帮助缓解这些症状,同时改善睡眠质量。因此,获得足够的铁对维持良好的睡眠也是非常重要的。
来源

小贴士
吃富含铁/锌的植物食物(如菠菜、豆类)时,搭配富含维C的食物(如橙子、番茄),可显著提高吸收率。
避免过量咖啡/茶:咖啡因和鞣酸会抑制铁和锌的吸收,建议在餐后1小时再饮用。
动物性食物中的血红素铁(来自肉类)比植物性非血红素铁更容易被人体直接吸收。
维生素:维生素D、B族维生素
✦ 维生素D
维生素D在多种与睡眠调节相关的脑区中存在受体,包括下丘脑。
观察性研究发现,维生素D水平低与睡眠障碍的风险增加有关,特别是短睡时间和睡眠效率差。这可能与维生素D在调节炎症反应和促进褪黑素合成中的作用有关,褪黑素是调节睡眠的重要激素。
来源
维生素 D 是唯一一种人体可以通过皮肤在阳光下自行合成的脂溶性维生素。虽然食物是重要补充,比如蘑菇、香菇、三文鱼、燕麦奶、杏仁露等,但更重要的维生素 D 来源于晒太阳。
小贴士
晒背:每天中午前后(10:00-14:00)暴露手臂和腿部皮肤 15-30分钟,无需涂抹防晒霜。
注意吸收:维生素D是脂溶性的,建议随餐食用以提高吸收率。
避免过量:长期过量摄入可能中毒,每日上限通常为4000 lU。
✦ B族维生素
B族维生素,尤其是B6(吡哆醇)、B9(叶酸)和B12(钴胺素),在神经递质代谢中发挥着重要作用。维生素B6对于将色氨酸转化为血清素至关重要,而叶酸和维生素B12则参与支持褪黑素合成的甲基化过程。缺乏这些维生素可能导致睡眠问题,如失眠和睡眠片段化。
来源

小贴士
B12 是唯一一种几乎只存在于动物性食物中的 B 族维生素。素食者需通过强化食品或补充剂获取。
B族维生素属于水溶性,容易随尿液排出,因此需要每日通过饮食规律补充。
多酚:芹菜素、槲皮素、白藜芦醇…
多酚,尤其是存在于水果、蔬菜、茶和可可中的类黄酮,因其神经保护和促进睡眠的特性而备受关注。
类黄酮如芹菜素(在洋甘菊中发现)和槲皮素通过与GABA_A受体的相互作用,展现出抗焦虑和镇静效果。
其他多酚化合物,如白藜芦醇(存在于葡萄和浆果中)和表没食子酸没食子酸酯(EGCG)(来自绿茶),具有抗炎和抗氧化效果。
这些化合物可能通过降低全身性炎症和氧化应激间接促进睡眠。这些作用至关重要,因为慢性炎症和氧化应激的升高与失眠以及其他睡眠障碍密切相关。
来源
芹菜素:芹菜(尤其西芹含量极高)、洋葱、大蒜、欧芹、香菜、罗勒;苹果、梨、葡萄等。
槲皮素:苹果(果皮含量极高)、覆盆子、桑葚、樱桃、葡萄;洋葱、菠菜、羽衣甘蓝、番茄;小麦、大麦、燕麦等。
白藜芦醇:葡萄(果皮)、红酒(发酵过程产生)、桑葚、蓝莓;花生、核桃等。
小贴士
芹菜素和槲皮素属于脂溶性或半脂溶性物质,与橄榄油、坚果或牛油果同食可促进吸收。
槲皮素主要集中在苹果的果皮中,吃苹果记得连皮一起吃。
肠道菌群能将多酚转化为活性代谢物(如阿魏酸),因此富含膳食纤维的食物有助于提高利用率。
褪黑素和L-茶氨酸
褪黑素是主要由松果体分泌的内源性激素,是调节昼夜睡眠-清醒节律的关键因素。而外源性褪黑素(可以通过补充剂或一些食品如酸樱桃获取)越来越多地被用于改善睡眠,特别是对那些有昼夜节律障碍的人群。研究表明,褪黑素补充剂可以有效缩短入睡所需时间,增加总睡眠时间,并改善整体睡眠质量。
L-茶氨酸是一种主要存在于绿茶中的氨基酸,它展现出促进放松而不引起镇静的潜力。临床试验证实,L-茶氨酸补充可以改善睡眠质量,减少睡眠干扰,并通过调节大脑α波活动和GABA水平增强睡眠的恢复阶段。

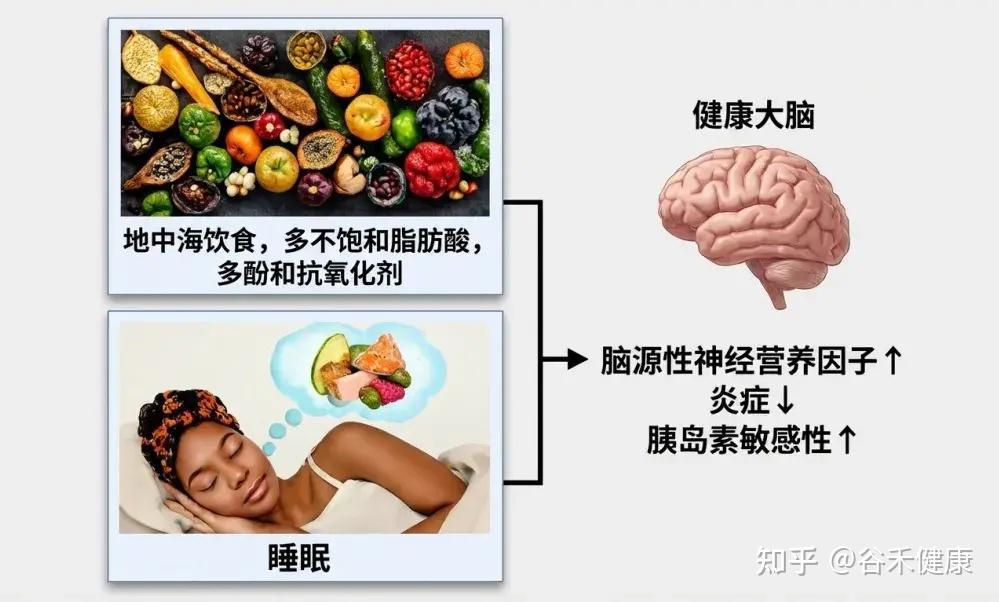
地中海饮食
地中海饮食(MD) 特点
研究表明,遵循这种饮食模式与更好的睡眠效果密切相关。许多研究发现,地中海饮食能够提高睡眠持续时间、效率和主观睡眠质量,这可能与其抗炎和抗氧化特性有关。
关键营养成分
这种饮食富含多酚、ω-3脂肪酸和复杂碳水化合物,这些成分有助于合成褪黑素,减少氧化压力,并增强血清素的传递,这些都是调节睡眠所需的关键途径。此外,地中海饮食中的镁丰富食物,也可能通过调节NMDA和GABA受体来促进睡眠。
Li Rang等人的一项大型横断面研究报告称,对地中海饮食的更高依从性与老年人失眠症状风险的降低相关。地中海饮食中普遍存在的复合碳水化合物通过增加色氨酸在大脑中的可用性,可能有助于睡眠的开始和持续。
地中海饮食对睡眠的影响
生酮饮食
生酮饮食的特点
生酮饮食(KD)是一种高脂肪、极低碳水化合物的饮食模式,因其在治疗癫痫、肥胖和代谢疾病方面的疗效而受到关注。近期研究表明,生酮饮食可能还会影响睡眠结构。
对睡眠结构的影响
研究发现,处于生酮状态时,慢波睡眠(SWS)的比例增加,而快速眼动睡眠(REM)减少。这种变化可能与腺苷信号传导和能量代谢的改变有关。
一项关于癫痫儿童的临床试验显示,生酮饮食能改善睡眠质量,通过减少夜间觉醒和提高睡眠效率。同时,酮体本身可能具有神经保护和抗炎作用,有助于稳定与睡眠调节相关的神经网络。
复杂的影响
然而,生酮饮食对睡眠的影响并非一成不变。饮食的初期阶段常伴随生酮适应症状,这可能暂时干扰睡眠,因此饮食的坚持时间和个人的代谢反应是影响睡眠的重要因素。
植物性饮食
植物性饮食的特点
植物性饮食,强调以水果、蔬菜、豆类、全谷物、坚果和种子等植物来源的食物为主,同时尽量减少或不摄入动物产品。流行病学数据表明,植物性饮食者往往报告的睡眠质量优于杂食者。
对睡眠的积极影响
植物性饮食中的高纤维含量有助于改善肠道微生物组成,增强肠-脑轴信号,这可能有助于改善睡眠。此外,植物性饮食丰富的植物营养素和抗氧化剂形成的抗炎特性,可能有助于降低全身性炎症,而炎症与睡眠质量差有关。
营养素的关注
然而,植物性饮食需要仔细规划,以防止维生素B12、铁和ω-3脂肪酸等营养素的缺乏,这些营养素对良好的睡眠调节至关重要。有研究表明,这些微量营养素的低水平可能会影响睡眠质量。
饮食时间
新兴研究表明,在饮食中,不仅食物的选择很重要,饮食的时间也对睡眠健康有显著影响。不规律的就餐时间、夜间进食、跳过早餐与昼夜节律失调、入睡延迟和睡眠质量降低相关。
饮食时间对睡眠的影响
晚间食用高脂肪或高能量餐食可能会通过干扰昼夜节律激素的分泌(包括褪黑激素)来影响入睡和睡眠深度。相反,建议在睡前约4小时摄入高升糖指数的食物,这可能有助于减少入睡的延迟,表明餐食的合理时间安排能够改善睡眠。
限时饮食的益处
限时饮食(TRE)要求在一天中的特定时间窗口内进食。这种饮食方式已经显示出增强昼夜节律,从而提高睡眠效率和持续时间的潜力。

肠道菌群如何影响睡眠
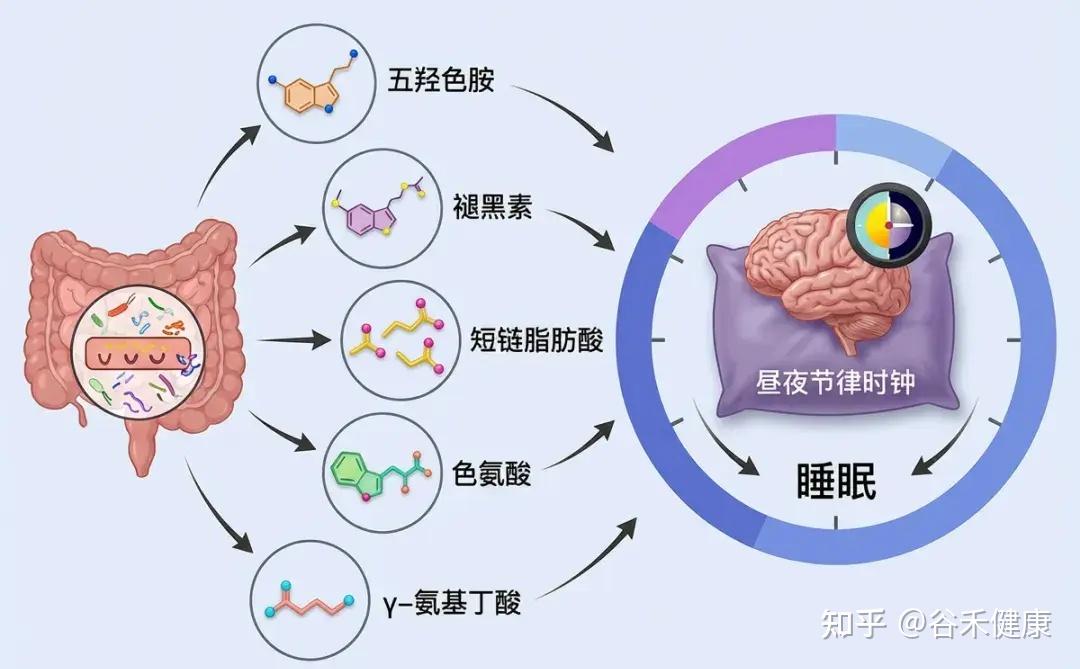
新兴研究表明,肠道微生物群可以通过多种机制影响睡眠,包括调节免疫系统、调节代谢途径、产生神经递质以及与昼夜节律系统的相互作用。
神经递质合成
部分肠道细菌能够合成关键的神经递质,如GABA(γ-氨基丁酸)、血清素和多巴胺。人体约90%的血清素(睡眠激素褪黑素的前体)产生于肠道。这些神经递质的水平直接影响睡眠-觉醒周期的调节。
GABA
GABA(γ-氨基丁酸)是一种非蛋白质氨基酸,是大脑中主要的抑制性神经递质,主要负责抑制神经活动。它在缓解压力和调节睡眠方面起着重要作用。GABA通过引导突触后神经元的超极化过程,帮助产生抑制性的电信号。这导致细胞内负电荷增加,使神经细胞更难以被激活,从而减少神经冲动的产生。
一些研究表明GABA补充可能有助于睡眠质量。
一项研究显示,每天给失眠患者提供300毫克GABA,连续四周,与提高睡眠效率和降低睡眠潜伏期相关。
另一项研究,用含GABA和L-茶氨酸的混合物可减少睡眠潜伏期,并增加快速眼动和非快速眼动期。
GABA的饮食来源:
普通豆类和豌豆芽、大米、燕麦、小麦、菠菜、土豆以及许多蔬菜。
通过饮食摄入GABA有助于提高体内的水平,但食物中含量相对还是较少。研究表明,特定的肠道微生物能够有效地合成GABA,增加其生物利用度。
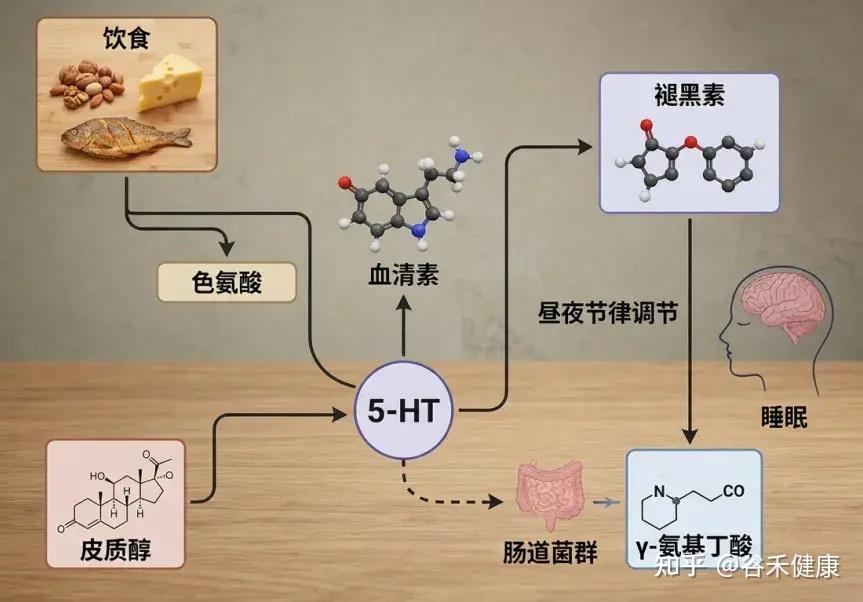
乳杆菌和双歧杆菌是GABA产生的关键成员
双歧杆菌在肠道粘液层定植:具有将谷氨酸、谷氨酰胺和琥珀酸转化为GABA的酶机制。
乳杆菌 :多个菌株都具备GABA合成能力
– Limosilactobacillus fermentum L18:
高效分泌GABA的专业户,通过增加连接蛋白的浓度和有益肠道细菌的丰度来增强肠道屏障。
– 鼠李糖乳杆菌GG:
除了保护肠道屏障外,还可以通过调节肠脑轴来提高海马和杏仁核中的脑源性神经营养因子(BDNF)和GABA受体水平。
– 短乳杆菌:
通过发酵产生高剂量GABA,可以提高肠道中有益细菌的相对丰度和SCFA的水平,进而可以上调GABA能和5-羟色胺能神经递质的mRNA和蛋白质表达水平。这将导致θ和δ波以及非快速眼动睡眠的显著增加。
免疫系统调节
肠道微生物通过调节炎症细胞因子(如IL-6和TNF-α)来影响睡眠结构。健康的肠道菌群能促进短链脂肪酸(SCFA)等抗炎代谢物的产生,从而改善睡眠连续性;反之,慢性低度炎症通常与肠道菌群失调有关,这也是导致失眠和睡眠碎片化的重要因素。
代谢途径与屏障功能
微生物发酵产生的短链脂肪酸(乙酸盐、丙酸盐、丁酸盐)已被证实能穿过血脑屏障,通过调节神经炎症和神经可塑性来优化睡眠调节。
注意:慢性或周期性纤维缺乏可能导致黏膜糖蛋白作为营养来源分泌,进而侵蚀结肠黏膜屏障。这反过来可能导致肠道屏障功能障碍,进而升级为致命的结肠炎。
研究表明,某些细菌菌株,包括Lachnospiraceae UCG004 ,Odoribacter,参与短链脂肪酸的产生,有助于延长睡眠时间。短链脂肪酸可能通过调节GABA和血清素的合成来影响睡眠。GABA是神经系统中的主要抑制性神经递质,通过抑制唤醒通路在促进睡眠中发挥重要作用。
昼夜节律与肠道菌群的双向关系
光是负责人类昼夜节律最佳功能和精准调节的主要因素,该时钟位于下丘脑的视交叉上核。然而,许多其他刺激和环境信号也可能显著影响昼夜节律,包括用餐时间、食物类型、运动、体温,甚至社交互动。
肠-脑轴是一个复杂的生物系统,促进大脑与肠道之间的双向通信。肠道微生物群在调节这种相互作用中发挥了关键作用,影响着多种信号通路。
微生物群的多样性和组成会发生变化,这些变化受到一天中的时间、所摄入食物的类型和禁食习惯等影响。因此,异常或单一的饮食习惯可能对生物钟的正常功能产生负面影响。此外,肠道微生物群与昼夜节律之间是一种双向关系,彼此的干扰和紊乱会相互影响。
一方面,宿主昼夜节律的紊乱(如轮班工作、时差或不规律饮食)会导致微生物生态失调,进而加剧睡眠问题。
昼夜节律紊乱对肠道菌群的具体表现:α‑多样性显著降低;有害菌如 Ruminococcus torques、Streptococcus、Alloprevotella增多,益生菌如 Lactobacillus johnsonii、Lactobacillus、Bifidobacterium减少。
菌群失调与睡眠障碍
肠道菌群失调与多种睡眠障碍的病理生理学密切相关,包括失眠、阻塞性睡眠呼吸暂停(OSA)和不宁腿综合征(RLS)。
例如,阻塞性睡眠呼吸暂停患者常表现出特征性的肠道菌群改变,具体为微生物多样性降低及促炎细菌丰度增加。这种失调引发的全身性炎症可能通过肠-脑轴反馈至中枢神经系统,进一步恶化睡眠病理。
另一方面,通过规律的作息维持同步的昼夜节律,可促进健康的微生物群,进而反哺睡眠质量。
固定进食窗口产生 “餐后高峰‑空腹低谷” 的碳源波动。
产短链脂肪酸的菌(如Faecalibacterium, Roseburia)在餐后 2‑4 h 达到丰度峰值;胆汁酸代谢菌(如Clostridium spp., Bacteroides)在胆汁分泌高峰时活跃。
规律作息降低全身 IL‑6、TNF‑α,使肠道屏障更完整(ZO‑1、occludin 表达↑),阻止致炎菌(如Enterobacteriaceae)越过黏膜进入血液。低炎症环境进一步促进产短链脂肪酸的菌代谢活性,形成正反馈。
规律作息通过同步中枢与外周时钟、固定进食窗口、调节激素与免疫状态,形成一个“时间‑营养‑免疫”三位一体的生态网络,从而塑造更为多样、功能更完整的肠道菌群。
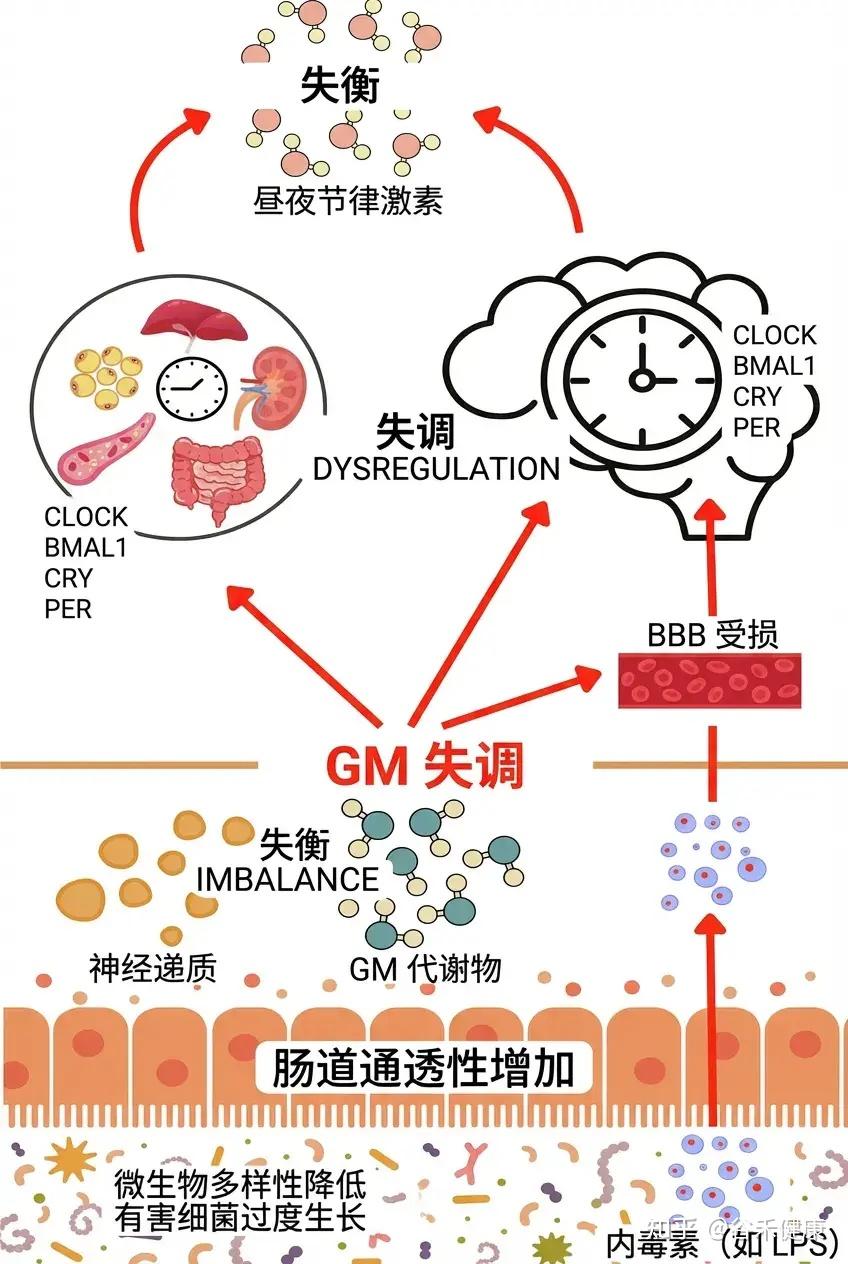
然而,这种双向调节在每个个体身上的表现并非千篇一律。要真正理解微生物组与生物钟的深层联系,我们不仅要看作息是否规律,还要看每个人独特的生物钟设定,你是早鸟型还是夜猫子型,本身就不一样。
早鸟型or夜猫子型?不同睡眠类型的肠道菌群
什么是睡眠类型,有哪几种常见的?
所谓睡眠类型,指的是一个人的昼夜节律表型,通俗来说,就是你在何时醒来、何时活跃以及何时入睡的天然偏好。
根据人体内部的昼夜节律,我们通常将人分为“晨型人”和“夜型人”(这两类又可细分为极端型和温和型)。此外,研究还确认了第三种类型:中间型(Neither-types)。
有趣的是,只有约40%的成年人属于典型的晨型或夜型,其余约60%都属于中间型。这类人群的作息往往更具弹性,能够根据具体情况或个人喜好灵活调整睡眠和活动时间。
早起鸟 和 夜猫子 在日常生活中有何不同?
这两类人的表现截然不同。晨型人倾向于早睡早起,他们的作息与日出日落的时间紧密同步,通常在一天中的早些时候达到身心状态的巅峰。
相反,夜型人倾向于晚睡晚起,他们的身心最佳状态通常出现在一天的后半段。然而,这也带来了一个问题:如果在不得不早起的情况下,他们更有可能面临精神不振的困难。
当夜型人被迫在他们生物钟认为的“深夜”(比如早上 7 点)进食早餐时,肠道代谢系统尚未完全苏醒(胰岛素敏感性低、消化酶分泌少)。
我们的肠道细菌与这种睡眠生物钟有关吗?
早起时的不适感可能不仅仅是大脑的问题,还可能与肠道有关。
研究发现,不同睡眠类型的人群拥有不同的肠道微生物群。例如,与晨型人相比,夜猫子人体内的 肠杆菌目(Enterobacteriales) 和 肠杆菌科(Enterobacteriaceae) 数量往往更高。
可能与延长睡眠时间相关的菌群包括:
微生物群-肠道-大脑轴如何影响昼夜节律
例如,硒单胞菌目(Selenomonadales)和Negativicutes 丰度较高的个体可能面临更高的失眠风险。相反,像Anaerofilum和肠杆菌目这样的细菌可以影响肠道上皮的时钟基因,从而增加成为夜猫子的概率,而夜猫子人与较高的体重相关。
给晨型人(早鸟型)的建议
利用早餐优势: 你的胰岛素敏感性在早晨极高。把一天中大部分的碳水化合物(全谷物、水果)放在早餐吃,不仅代谢快,还能为一整天提供能量。
警惕晚上能量透支: 晨型人容易在傍晚感到能量崩溃。
晚餐摄入适量的复合碳水化合物(如红薯、糙米),这有助于血清素的合成,不仅能维持情绪稳定,还能为入睡提供充足的褪黑素原料,防止“睡太早、半夜醒”的情况。
给夜型人(夜猫子)的策略
“时间限制进食法(TRE)”是关键:对夜型人来说,最危险的不是晚睡,而是晚吃。
在睡前 3-4小时 坚决停止进食。这给肠道留出了宝贵的清洗时间,防止细菌在不该繁殖的小肠内过度生长。
既然体内时钟慢,如果觉得需要,可以靠光来校准。早起第一件事接触阳光,这是告诉肠道菌群,新的一天开始了。
补给策略: 夜型人往往缺乏维生素D(晒太阳少)和B族维生素。结合肠道菌群检测相关的营养指标,如有缺乏则针对性补充这些营养素,有助于稳定生物钟基因的表达。
饮食与微生物干预策略
基于“饮食-微生物-睡眠”的调节路径,利用益生菌、益生元及膳食纤维进行干预,为管理睡眠障碍提供了有前景的新途径。
膳食纤维与益生元
膳食纤维(富含于水果、蔬菜、全谷物)作为微生物发酵的底物,能显著促进SCFA的产生。
对照喂养研究发现,较高的纤维摄入量与更长的慢波睡眠(深睡眠)时间相关,而高饱和脂肪摄入则导致睡眠质量下降。
益生元(如菊粉、FOS、GOS)被证明能增加非快速眼动睡眠(NREM),并提高机体对压力诱导的睡眠中断的抵抗力。
益生菌(精神益生菌)
益生菌在改善睡眠、缓解压力方面的潜力已在多项临床及临床前研究中得到证实。特定的益生菌菌株(有时被称为“精神益生菌”)通过调节神经递质途径和下丘脑-垂体-肾上腺(HPA)轴发挥作用。
临床证据
Nishida等人的随机对照试验表明,每日摄入
加氏乳杆菌CP2305 可显著提高轻度睡眠障碍成人的睡眠效率并缩短入睡潜伏期,这归因于其降低唾液皮质醇水平的能力。
机制研究
最近的研究进一步明确了特定菌株的神经化学机制。例如,鼠李糖乳杆菌GG被证明能增强海马和杏仁核中GABA受体的表达,通过迷走神经信号传导发挥抗焦虑和促睡眠作用。
代谢调节
长双歧杆菌1714和植物乳杆菌P8显示出降低皮质醇水平、改善主观睡眠质量的效果。这些菌株通过增加色氨酸的可用性并调节犬尿氨酸途径,增强中枢血清素的合成,从而巩固睡眠结构。
-只改睡眠时间而不管饮食,菌群会恢复吗?
部分恢复(尤其是夜间褪黑素对 Akkermansia 有正向作用),但若进食时间仍散乱,底物供给的节律仍缺失,恢复幅度有限。
-是否有推荐的作息模式?
目前证据最稳妥的模式是 “早起早睡 + 8‑10 h 进食窗口 + 早晨强光+ 低GI/高纤维饮食”,这套组合在多项研究中均能提升 α‑多样性、短链脂肪酸产生和睡眠质量。
注:作息干预的效果往往在 2‑4 周 开始出现可检测的菌群变化(α‑多样性、特定属丰度),完整的 功能恢复(SCFA 产量、炎症标记下降) 通常需要 8‑12 周 的持续坚持。
小 结
肠道微生物组通过产生神经活性代谢物(如短链脂肪酸、血清素前体)、调节炎症及与昼夜节律的交互,成为睡眠调节的关键一环。未来仍需更多临床试验来确立具体的因果关系及主要效果。
近年来,功能性食品和(提供基本营养以外的健康益处的食品)在睡眠健康方面的作用引起了人们的关注。几种富含生物活性化合物的天然产物已被证明可以通过多种生物机制调节睡眠质量、潜伏期和持续时间,包括抗氧化活性、抗炎作用和神经递质调节。
酸樱桃汁和褪黑素
酸樱桃(如蒙特莫伦西品种)是褪黑素的自然来源,这种荷尔蒙对调节我们的睡眠-觉醒周期至关重要。研究表明,喝酸樱桃汁可以改善睡眠的持续时间和质量,这主要得益于其中的褪黑素含量和抗氧化特性。
在一项随机、双盲、安慰剂对照的研究中,研究人员发现,患有慢性失眠的成年人每天喝两次酸樱桃汁后,睡眠持续性有所改善。这一结果表明,酸樱桃汁可能有助于提升睡眠的稳定性。
另一项研究发现,健康成年人饮用蒙特莫伦西酸樱桃浓缩汁后,平均睡眠时间增加了约34分钟,且睡眠效率也有所提高。这种改善可能与酸樱桃中增加的褪黑素有关。

猕猴桃和血清素
猕猴桃富含抗氧化剂、维生素(特别是维生素C和E)、叶酸以及血清素前体,这使其成为促进睡眠的理想食物。
临床研究显示,睡前1小时食用两个猕猴桃能够显著改善睡眠的开始时间、持续时间和效率,尤其对有睡眠问题的人群效果明显。
注:老年人缺乏直接的临床试验数据;基于生理差异,推测同样的摄入方案可能仍有助于改善睡眠(通过抗氧化、纤维促进肠道健康、提供血清素前体),但效果幅度可能低于年轻人。
这种积极的效果可能与猕猴桃中丰富的血清素含量有关,因为血清素能促进褪黑素的合成,从而调节睡眠周期。此外,猕猴桃的抗氧化特性可能有助于减少氧化应激,而氧化压力与睡眠障碍的发生有一定关系。
草本茶与镇静植物化合物
多种草本茶因其镇静和抗焦虑的效果而被传统使用,其中洋甘菊、缬草、薰衣草、百香果花是较常研究的几种。
洋甘菊茶富含一种叫芹菜素的类黄酮,它能与大脑中的苯二氮卓受体结合,有助于促进困倦感并减少夜间醒来的次数。
缬草根中含有缬草酸,这种成分可以调节GABA活性,从而产生镇静效果。
有系统评估的研究发现,缬草制剂与安慰剂相比显著改善了睡眠质量,尽管不同研究之间的结果存在一定的差异。
薰衣草和百香果花茶(西番莲茶)也具有抗焦虑特性,可能通过调节中枢神经系统中与压力和警觉性相关的通路来促进睡眠。
Omega-3脂肪酸与睡眠
Omega-3多不饱和脂肪酸,尤其是二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),因其抗炎和神经保护特性而受到关注。近期的研究表明,Omega-3的补充可能与改善睡眠模式有关。
在一项随机对照试验中,研究发现儿童体内DHA水平较高与睡眠干扰显著减少相关。此外,补充富含DHA的鱼油也显示出能延长睡眠时间,并减少夜间觉醒的次数。
注意:儿童研究中常使用的剂量(如 600mg DHA/天)在成人身上可能产生不同的代谢反应。此外,成人的睡眠问题往往由压力、焦虑或环境因素主导,单纯补充 DHA 的效果可能不如在发育期大脑中显著。
这些潜在机制包括调节褪黑素的分泌、减少促炎细胞因子的水平,以及稳定神经元膜,而这些都是维持健康睡眠结构所必需的因素。

EPA 和 DHA 在改善睡眠中的作用是否存在协同或拮抗效应?
多项研究同时使用 DHA 与 EPA(常以鱼油形式)进行干预,均报告了睡眠质量的改善。例如,针对 2 型糖尿病患者的 14 个月随机对照试验显示,鱼油(DHA + EPA)显著降低睡眠障碍风险、提升睡眠时长,并与血浆 DHA + EPA 水平呈正相关。
日本的研究把 DHA + EPA(约 860 mg/天)与单独 EPA(约 1260 mg/天)或单独 DHA(约 1170 mg/天)进行比较,结果显示,高剂量的 DHA + EPA 组合在提升睡眠效率和主观评价方面优于单一成分,提示两者可能产生加和或协同效应。
现有证据倾向于 EPA 与 DHA 共同补充对睡眠具有协同或至少加和的正向作用,而非拮抗。两者在调节褪黑素合成、炎症抑制以及生物钟分子(如 RORα、BMAL1)表达方面可能互补,从而共同改善睡眠质量。
甘氨酸、L-茶氨酸和CBD
新兴的营养药物作为改善睡眠的辅助疗法越来越受到重视:
甘氨酸是一种非必需氨基酸,研究表明,在睡前服用甘氨酸可以改善睡眠的主观质量并减少疲劳。甘氨酸可能通过降低体温和增强血管扩张来发挥作用,这些生理变化对于入睡至关重要。
L-茶氨酸是一种独特的氨基酸,存在于绿茶中,能够促进放松而不引起嗜睡,主要是通过增加GABA、多巴胺和血清素的水平。临床研究报告显示,L-茶氨酸补充能够提高有广泛性焦虑症的个体的睡眠质量。
CBD(大麻二酚)是一种来源于大麻植物的非精神活性成分,显示出通过抗焦虑和镇痛的作用改善睡眠的潜力。尽管初步证据支持CBD在减轻特别是与焦虑相关的失眠中的作用,但仍需进行更为严谨的长期临床试验来验证其效果。

将科学研究成果转化为可操作的饮食策略,对改善睡眠健康至关重要。随着关于特定营养素、饮食模式和生物活性化合物影响睡眠的证据日益增强,临床实践和个体健康管理中应用这些见解的机会也在增加。
睡眠健康的一般饮食建议
研究表明了一些可以推荐给大众的饮食策略,以促进更好的睡眠。
增加有助于睡眠的营养素摄入
通过均衡饮食确保摄入如镁、锌、Omega-3脂肪酸和色氨酸等关键营养素,有助于神经递质合成和昼夜节律调节。
采用抗炎饮食模式
强调地中海饮食或植物性饮食,这些饮食富含抗氧化剂、纤维和抗炎化合物,能通过减少系统性炎症和氧化应激来提高睡眠质量。
注意用餐时间
调整饮食模式与昼夜节律相吻合,例如在白天吃大餐,避免临睡前吃重餐,以优化入睡效率。
限制干扰睡眠的食物
减少晚间咖啡因、酒精和高升糖指数食物的摄入,有助于预防睡眠碎片化和干扰。
这些一般建议作为基础,但“放之四海而皆准”的方法可能无法满足个体在睡眠需求和饮食干预反应上的差异。
场景化食谱与搭配建议(仅供参考)


饮水与睡眠
在饮食干预中,液体摄入同样扮演着重要角色。水分的补给不仅影响身体的整体健康,也对睡眠质量有显著的影响。确保身体在白天的充分水分补给,对于身体性能和睡眠质量都至关重要。
补水节奏
白天补水:成年人通常需要每天摄入大约2-3升水(包括食物中的液体)。通过均匀分配全日饮水量,确保在工作和活动期间补充足够的水分。
睡前限制:在睡前2小时限制摄入液体,尤其是咖啡因和酒精饮料,以减少夜间起夜的可能性,从而保持更好的睡眠连续性。
平衡口渴与起夜的矛盾
饮水的时机和量的把控也很关键。为了平衡口渴与夜间起床的矛盾,可以采取以下策略:
-早上喝水
在一天开始时,补充70%甚至更多的日需水分,有助于唤醒身体,并提高白天的精神状态。
-定时小口喝水
可以考虑将白天的饮水分成多个小量,避免一次大量饮水。
-适当的液体选择
在喝水的同时,适当选择含电解质的液体(如椰子水、运动饮料)来补水,尤其是在炎热的天气或剧烈活动后,有助于更快速恢复水分和电解质平衡。
酒精的微醺更助眠?
很多人习惯,睡前喝上几杯更容易入眠。
这里要说明的是,虽然酒精确实能缩短入睡时间,但它可能会严重破坏快速眼动睡眠,也许并不是优质睡眠。
取而代之,睡前选择温和的茶类(如洋甘菊茶、洛神花茶、薄荷茶等无咖啡因饮品)将更有利于放松和准备入睡。
饮食与生活方式的协同作用
正念饮食
正念饮食是一种基于“正念”理念的饮食方式,强调在吃饭时保持全神贯注,关注食物的色香味,聆听身体的饥饿和饱腹信号。研究表明,进食时的情绪和心理状态不仅影响用餐体验,还会影响消化、吸收,最终影响睡眠质量。
饮食与情绪的关系
情绪状态不佳,比如焦虑、压力大或分心时,会导致以下影响:
建议
在用餐时,尽量保持放松的状态,可以采取以下措施促进正念饮食:
光照与饮食的配合
研究表明,光照与饮食的结合对维生素D的合成及身体生物钟的调节都有显著影响。
“早餐 + 晨光”的最佳组合
在早晨接触自然光可以帮助重置身体的昼夜节律,促进褪黑素和皮质醇的分泌,增强清醒状态,进而有助于晚上入睡的质量。

在早餐时,尽早接触自然光,可以进行以下实践:
睡眠障碍:个性化营养方案
个性化营养的概念是将饮食建议根据个体的生物学、遗传和生活方式因素进行调整,这为管理睡眠障碍提供了很大潜力。
遗传因素
参与昼夜节律调节(如CLOCK和PER3基因)、褪黑素生成(如MTNR1B基因)和营养代谢(如FADS1基因与Omega-3脂肪酸合成)等基因的多态性可能影响睡眠模式及对饮食干预的反应。营养基因检测可帮助识别适合特定营养素或时钟营养策略的个体。
代谢健康状况
肥胖、胰岛素抵抗和代谢综合症与睡眠呼吸暂停等睡眠障碍密切相关。针对减重和血糖控制的个性化干预可显著改善睡眠结果。
肠道菌群分析
越来越多的研究表明,肠道菌群的组成与睡眠质量之间存在显著关联。健康的肠道菌群不仅能促进消化,还通过调节神经递质的合成,影响情绪和睡眠模式。肠道菌群检测可以帮助识别个体特有的微生物特征,从而为优化干预方案提供依据。基于检测结果,个性化的益生菌或益生元治疗可以针对特定菌群进行设计,旨在改善整体睡眠质量与健康。因此,加强对肠道菌群的关注,可能是提升睡眠质量的重要策略。
生活方式和行为因素
睡眠习惯(如规律的作息、优化睡眠环境和减少临睡前的刺激性活动)、身体活动水平、压力管理和工作时间(如轮班工作)与饮食模式相互影响。个性化计划应整合这些行为因素以最大化效果。
生物钟类型(晨型人与夜猫子型)也会改变对用餐时间的代谢反应。个性化方法结合遗传、肠道菌群、代谢分析和生活方式因素,可以为特定睡眠障碍(如失眠、睡眠呼吸暂停和延迟睡眠相位综合征)提供精准的饮食推荐。
未来个性化工具:可穿戴设备和数字健康
技术进步使得可穿戴睡眠追踪器、数字饮食日志和基于机器学习的预测模型得以应用于高度个性化和动态的营养-睡眠程序。可穿戴设备能够实时监测睡眠指标,为饮食调整提供即时反馈。数字健康平台也可以整合遗传、代谢和生活方式数据,生成个性化、适应性的营养推荐。
在改善睡眠质量的过程中,饮食调整是一种有效的干预方式。同时,借助肠道菌群检测,可以更深入地了解自身状态,从而在营养干预上做出更加明智的决策。
将个性化营养与肠道菌群的研究相结合应用于睡眠医学,不仅有助于提高个体效果,也有助于通过尽早识别高风险人群并积极干预,为广泛人群制定有效策略。
本文内容主要集中在睡眠问题的营养干预措施,此外,还有中草药方面的介入措施,详细信息请参见我们之前撰写的文章。
主要参考文献
Abou-Khalil R. Nutritional Interventions for Enhancing Sleep Quality: The Role of Diet and Key Nutrients in Regulating Sleep Patterns and Disorders. Food Sci Nutr. 2025 Dec 4;13(12):e71309.
Sejbuk M, Siebieszuk A, Witkowska AM. The Role of Gut Microbiome in Sleep Quality and Health: Dietary Strategies for Microbiota Support. Nutrients. 2024 Jul 13;16(14):2259.
Bautista J, Hidalgo-Tinoco C, Di Capua Delgado M, Viteri-Recalde J, Guerra-Guerrero A, López-Cortés A. The gut-brain-circadian axis in anxiety and depression: a critical review. Front Psychiatry. 2025 Oct 30;16:1697200.
Minari TP, Pisani LP. Unraveling the connection between the Mediterranean diet and sleep health: from biological mechanisms to clinical implications. Sleep Breath. 2025 Nov 28;29(6):369.
Zhao D, Zou B, Do QL, Wu SK, Shen Y, Yang Y, Kang JX, Su KP, Wang B. Circadian rhythms and gut microbiota Dysbiosis: emerging gut-brain axis pathways in insomnia pathophysiology and Therapeutics. Brain Behav Immun. 2025 Nov 30;132:106203.
BaHammam AS, Pirzada A. Timing Matters: The Interplay between Early Mealtime, Circadian Rhythms, Gene Expression, Circadian Hormones, and Metabolism-A Narrative Review. Clocks Sleep. 2023 Sep 6;5(3):507-535.
Chaput JP, McHill AW, Cox RC, Broussard JL, Dutil C, da Costa BGG, Sampasa-Kanyinga H, Wright KP Jr. The role of insufficient sleep and circadian misalignment in obesity. Nat Rev Endocrinol. 2023 Feb;19(2):82-97.

谷禾健康
失眠是一种常见的睡眠障碍,近 40%的成年人表现出失眠症状,10.8%的成年人患有慢性失眠症。
失眠主要表现为睡眠质量差、入睡困难、睡眠时间不足等,并与认知能力下降、焦虑、慢性疲劳、注意力不集中和记忆力减退等身心后果相关。睡眠不足也会增加慢病风险(如心血管疾病、糖尿病和肥胖),形成恶性循环,进一步威胁患者的整体健康状况。
目前的失眠疗法主要包括药物治疗和心理治疗。然而,像苯二氮䓬类药物有不良影响,如过度的神经毒性、成瘾性和耐受性。心理疗法,如认知行为疗法,已显示出长期的有效性。然而,由于缺乏训练有素的理疗师和高昂的成本,其可用性有限。
近年来,随着微生物群-肠-脑轴理论的深入发展,研究人员发现了肠道微生物不仅参与消化代谢过程,还能通过多种途径影响脑功能和行为,为失眠的发病机制研究提供了全新的视角。
在这一背景下,中草药及其活性成分作为独特的益生元,展现出巨大的治疗潜力。它们不仅为肠道菌群的活动提供能量,还通过调节肠道菌群改善肠道微环境,从而影响身体的多种生理功能,特别是睡眠调节功能。例如:
本文阐述了肠道菌群如何通过肠道-脑轴的复杂通信网络调节睡眠质量,也介绍了利用中药及其活性成分调节肠道微生物群来改善睡眠质量的潜力,同时探讨了基于肠道菌群的其他针对失眠的干预措施,为失眠治疗开辟了一条融合传统智慧与现代科学的创新路径。
失眠意味着晚上难以入睡、难以保持睡眠,或两者都有,它是最常见的睡眠障碍之一。
仅数天的失眠发作称为短期(急性)失眠。当持续存在睡眠问题时,通常会被诊断为长期(慢性)失眠。
注:慢性失眠有许多不同的定义。一个普遍接受的定义是:每周超过3晚,持续至少3个月,或持续一个月或更长时间的失眠。
急性和慢性失眠都非常普遍。大约每3个成年人中有1个有可能出现失眠症状。
症 状
失眠症状可能包括:
哪些人群更容易失眠?
几乎每个人偶尔都会有失眠的夜晚。但下列人群更可能出现失眠的情况:
月经周期和更年期期间激素变化可能起作用。更年期时,夜间盗汗和潮热常常会扰乱睡眠。失眠在怀孕期间也很常见。
由于睡眠模式和健康状况的变化,随着年龄的增长,更有可能患有失眠。
可能是什么原因?
慢性失眠通常是由压力、生活事件或破坏睡眠的习惯引起的。慢性失眠的常见原因包括:
对工作、学校、健康、金钱或家庭的担忧会使思绪在夜间保持活跃,难以入睡。压力性生活事件,如亲人的去世或疾病、离婚或失业或搬家,也可能导致失眠。
身体的“内部时钟”,即昼夜节律,指导着诸如睡眠-觉醒周期、新陈代谢和体温等。破坏这些节律可能导致失眠。比如跨越多个时区的旅行导致的时差反应、上晚班或早班、频繁轮班或三班倒等都可能引发失眠。
包括每天上床睡觉和起床的时间不同、午睡、睡前过于活跃以及睡眠区域不舒服。
其他不良的睡眠习惯包括在床上工作、吃饭或看电视。在睡前使用电脑或智能手机、玩电子游戏或看电视可能会破坏睡眠周期。
睡前吃点清淡的小零食是可以的。但如果吃太多,可能会在躺下时感到不舒服。很多人还会出现胃灼热的情况。这是指胃酸反流到从口腔到胃的食物管道中。胃灼热可能会让人无法入睡。
焦虑症,如创伤后应激障碍,可能会扰乱你的睡眠。过早醒来可能是抑郁的迹象。失眠常常与其他心理健康问题同时发生。
许多处方药会影响睡眠,例如某些抗抑郁药和用于治疗哮喘或高血压的药物。许多非处方药,如一些止痛药、过敏和感冒药以及减肥产品,含有咖啡因和其他兴奋剂,这些物质会干扰睡眠。
与失眠相关的状况包括慢性疼痛、癌症、糖尿病、心脏病、哮喘、胃食管反流病(GERD)、甲状腺功能亢进、帕金森病和阿尔茨海默病。
睡眠呼吸暂停症会导致在夜间有时停止呼吸,从而扰乱睡眠。不安腿综合征会在你试图入睡时引起强烈的、不适的移动双腿的欲望,这可能无法入睡难以再次入睡。
咖啡、茶、可乐和其他含有咖啡因的饮料让人兴奋。在下午或晚上饮用会难以入睡。烟草产品中的尼古丁是另一种会破坏睡眠的兴奋剂。酒精可能会让你入睡,但它会阻止更深睡眠阶段,在半夜醒来。
肠道菌群可以通过肠-脑轴直接或间接地参与调节大脑的睡眠功能。肠道菌群的失调,通过减少肠道屏障完整性和短链脂肪酸含量以及增加触发炎症反应的炎症介质等机制,影响宿主的睡眠行为。详见下一章节。
失眠会影响肠道菌群的丰富度和多样性
与正常组相比,睡眠缺乏小鼠的Akkermansia muciniphila、拟杆菌和粪杆菌(Faecalibacterium)丰度显著降低,气单胞菌(Aeromonas)丰度显著增加。
临床研究中的失眠或其他睡眠障碍菌群特征
与对照组相比,失眠患者的Collinsella、Adlercreutzia、Clostridiales、Pediococcus、Erysipeltrichaceae、拟杆菌属、葡萄球菌属、Carnobacterium、Odoribacter、假单胞菌属、长双歧杆菌属、Phascolarctobacterium的丰度存在显著差异。
同样,阻塞性睡眠呼吸暂停患者在下列菌群丰度存在显著差异:乳杆菌属、瘤胃球菌科、 变形杆菌科、梭菌科(Clostridiaceae)、 颤螺菌科(Oscillospiraceae)、 克雷伯氏菌(Klebsiella)、脱硫弧菌科(Desulfovibrionaceae)、脆弱拟杆菌(Bacteroides fragilis)、普拉梭菌(Faecalibacterium prausnitzii)。
无论是与炎症相关的菌株的改变,如变形杆菌科、梭菌科、Oscillospiraceae、克雷伯氏菌,还是与肠道屏障完整性相关的菌株,如脱硫弧菌科、脆弱拟杆菌、F. prausnitzii,这些变化都与睡眠质量相关的参数显著相关。
失眠不仅会降低肠道的抗氧化能力、抗炎细胞因子水平、粘蛋白2(MUC2)和紧密连接蛋白表达,还会增加促炎细胞因子的水平,导致肠道黏膜损伤和屏障通透性增加。
实验证据:睡眠剥夺通过肠道菌群影响大脑功能
当睡眠剥夺动物的肠道微生物群移植到正常小鼠体内时,供体动物的肠道菌群发生了变化,导致脂多糖(LPS)和气单胞菌水平升高,丁酸盐和Lachnospiraceae_NK4A136水平降低,海马小胶质细胞活化和神经元死亡增加。
然而,用植物乳杆菌124或A.muciniphila预处理可以恢复被破坏的肠道微生物群,减少肠道中的氧化应激、炎症和屏障损伤,增加乙酸和丁酸水平,并防止LPS刺激的小胶质细胞-神经元共培养中的突触损失。
因此,肠道微生物群的破坏通过降低肠道屏障完整性和短链脂肪酸含量,增加引发炎症反应的炎症介质等机制,影响宿主的睡眠行为。
下面章节我们就来详细看一下肠道菌群参与失眠症调节的相关机制。
下丘脑-垂体-肾上腺轴
失眠激活并导致HPA轴功能障碍。微生物可能通过神经信号传导、短链脂肪酸、表观遗传学、肠道屏障完整性或血脑屏障(BBB)通透性影响HPA轴活性。因此,失眠引起的肠道微生物群失调可能与HPA轴的激活有关。
HPA轴的破坏与致病菌(包括肠杆菌科、链球菌科、韦荣球菌科)的增加和有益细菌(包括双歧杆菌和毛螺菌科)的减少有关。
某些特定的肠道微生物群可以抑制HPA轴的激活,并介导相关的脑功能。大肠杆菌(Escherichia coli)和粪肠球菌(Enterococcus faecalis)可以降低小鼠血清中的皮质醇水平,从而缓解压力和抑郁焦虑行为。
分析表明,粪便中的羟甲睾酮(Oxymesterone)可以介导皮质醇对副拟杆菌属(Parabacteroides)的负面影响,而3-(2,4-环戊二烯-1-基)-5α-雄甾烷-17β-醇可以介导皮质类固醇对气球菌(Aerococcus)的负面影响;洛伐他汀酸(Mevinolinic acid)还可以介导气球菌对皮质醇的负面影响。这表明肠道微生物群和HPA轴之间的信号传导是双向的。
doi: 10.3389/fphar.2025.1572007
微生物内分泌产物和代谢物
★ 褪 黑 素
什么是褪黑素?
褪黑素(Melatonin,MT)又称为”暗激素”,因为它主要在黑暗环境中分泌,是我们身体内重要的睡眠调节激素。夜幕降临,褪黑素水平开始上升,告诉我们的身体该睡觉了;当太阳升起时,它的分泌减少,帮助我们保持清醒。可以说,褪黑素就像是身体内部的生物钟管家,维持着我们正常的睡眠-觉醒周期。
色氨酸的”三岔路口”
要理解肠道微生物与褪黑素的关系,我们首先需要了解一个关键的氨基酸——色氨酸(Trp)。色氨酸是合成褪黑素的重要原料,但在正常情况下,人体内仅有不到5%的色氨酸用于合成血清素(5-HT)和褪黑素,而高达95%都通过肝脏中的犬尿氨酸(Kyn)途径进行代谢。
这就像是一个”三岔路口”:
压力→肠道菌群失调→褪黑素下降
长期压力会破坏肠道菌群平衡,导致失调,失调的微生物刺激犬尿氨酸通路过度活跃,本应用于合成褪黑素的色氨酸被大量转移到犬尿氨酸途径,最终导致循环中的褪黑素水平下降,影响睡眠质量。
有益菌的助眠作用
令人惊喜的是,肠道中的某些微生物也能够主动促进其合成。研究发现,罗伊氏乳杆菌和大肠杆菌这两种微生物激活TLR2/4/MyD88/NF-κB信号通路,促进关键酶AANAT(芳烷基胺N-乙酰基转移酶)的表达,推动褪黑素的合成。
微生物代谢产物的协同效应
除了直接合成,肠道微生物的代谢产物——短链脂肪酸(SCFA)也发挥着重要作用:
外源性褪黑素补充
不仅能直接改善睡眠,还能帮助生物钟恢复正常运转,改善肠道菌群的组成和功能,增加短链脂肪酸水平,改善肠脑交流,优化肠道与大脑之间的信息传递。
研究表明,褪黑素补充能够通过多个途径改善睡眠剥夺引起的认知障碍:
最后,这些在肠道中产生的褪黑素分子会通过血液循环系统到大脑,与大脑中的MT1或MT2受体结合,最终调节我们的睡眠行为。这就形成了一个完整的”肠道-血液-大脑“调节环路。
★ γ- 氨 基 丁 酸
什么是GABA?为什么它能帮助睡眠?
γ-氨基丁酸(GABA)是一种众所周知的促进睡眠的氨基酸,是一种天然的抑制性神经递质。当我们感到焦虑、紧张或难以入睡时,GABA帮助我们的神经系统冷静下来,促进放松和睡眠。
简单来说,GABA的作用就像给过度活跃的神经系统踩了一脚”刹车“,让我们从兴奋状态转向平静状态,为优质睡眠创造条件。
肠道:GABA的”第二生产基地”
许多人以为GABA只能在大脑中产生,但实际上,我们的肠道也是一个重要的GABA生产基地。在肠黏膜中,存在着一系列特殊的细胞——肠神经内分泌细胞(如STC-1和STC-2),它们就像是内置的”GABA工厂“,它们可以表达GABAA受体及其受体亚型(α1、α3、α5、β1、β3、δ)的mRNA。
除了胃肠神经内分泌细胞合成、储存和分泌GABA的能力外,肠道微生物群的某些成员也可以产生GABA。
乳酸菌和双歧杆菌是GABA产生的关键成员
– Limosilactobacillus fermentum L18:
高效分泌GABA的专业户,通过增加连接蛋白的浓度和有益肠道细菌的丰度来增强肠道屏障
– 鼠李糖乳杆菌GG:
除了保护肠道屏障外,还可以通过调节肠脑轴来提高海马和杏仁核中的脑源性神经营养因子(BDNF)和GABA受体水平。
– 短乳杆菌:
通过发酵产生高剂量GABA,可以提高肠道中有益细菌的相对丰度和SCFA的水平,进而可以上调GABA能和5-羟色胺能神经递质的mRNA和蛋白质表达水平。这将导致θ和δ波以及非快速眼动(NREM)睡眠的显著增加。
GABA如何在肠道中发挥多重功效?
– 维护肠道屏障:构建健康防线
刺激Ca²⁺信号传导;增加MUC2释放,强化肠道黏膜屏障;促进肠道干细胞增殖,维持肠道健康。
– 调节肠脑轴:远程遥控大脑
增加海马和杏仁核中的BDNF水平,促进神经元健康;上调大脑中GABA受体水平,增强镇静效果;拟杆菌丰度与GABA受体蛋白表达呈正相关。
GABA很难穿过血脑屏障直接作用于中枢神经系统,那么肠道产生的GABA是如何影响大脑和睡眠的呢?
肠神经系统:另辟蹊径的”高速公路”
有研究人员认为,肠道内分泌细胞中存在大量GABA受体,通过肠神经系统这个”第二大脑”发挥作用,不需要直接穿过血脑屏障,而是通过肠-脑轴的复杂网络影响大脑功能。
★ 血 清 素
什么是血清素?
血清素(5-羟色胺,5-HT),有时候被称为”快乐激素”,因为它不仅能让我们感到愉悦和放松,还是调节睡眠-觉醒周期的重要神经递质。当血清素水平充足时,我们更容易感到心情平静、思维清晰,也更容易获得优质的睡眠。
作为肠脑轴中的关键神经递质,血清素(5-HT,血清素)是肠道微生物群和大脑之间进行交流的重要介质,将肠道的信息准确传递给大脑,告诉大脑什么时候工作,什么时候该休息了。
肠道:血清素的主要生产基地
体内约95%的血清素来源于肠道,而大脑反而只是小作坊。
一般生产路径:
非经典调控途径:
肠道菌群如何助力血清素的生产?
肠道菌群代谢产生短链脂肪酸,短链脂肪酸通过调节血清素转运体(SERT);调节5-HT受体的敏感性;抑制色氨酸转化为犬尿氨酸,确保更多原料用于血清素合成来促进合成。
肠道菌群多样性影响血清素
肠道微生物群的多样性会影响5-HT水平,进而影响人体的睡眠模式。补充色氨酸和血清素已被证明可以改善肠道微生物群的多样性,增加肠道中短链脂肪酸的量,提高血清素的血液水平,所有这些都可以改善老年人和新生儿的睡眠质量。
血清素代谢失衡与睡眠障碍的病理关联
在用抗生素耗尽微生物群后,5-HT的表达水平降低,导致REM睡眠的发作频率增加,NREM和REM睡眠之间的频繁转换,最终对睡眠产生负面影响。
如何通过调节血清素改善睡眠?
例如,灵芝可以调节肠道微生物群和5-羟色胺相关途径,增加5-羟色胺和GABA的血清水平,同时降低HPA轴激素水平,有效缓解焦虑小鼠的失眠行为。显然,微生物群可以通过影响肠道中5-羟色胺的合成和释放来调节大脑中的睡眠行为。
影响睡眠的微生物群-肠道-大脑轴交流模式
Sen P, et al.,Trends Mol Med. 2021
★ 短 链 脂 肪 酸
短链脂肪酸(SCFA)是肠道细菌通过发酵我们吃下去的膳食纤维产生的主要代谢产物,被认为是神经调节物质,对肠道微生物群控制睡眠至关重要。通过免疫、神经、内分泌途径,微生物群与大脑睡眠过程形成密切联系;“肠-脑轴”是两者之间的纽带,SCFA起着信使的作用。
失眠会减少产短链脂肪酸的菌的数量
产短链脂肪的菌如粪杆菌(Faecalibacterium)、Roseburia、Ruminococacaceae,这反过来又降低了肠道中SCFA的数量,而SCFA的缺乏又会进一步影响睡眠质量,形成一个难以打破的恶性循环。
肠道短链脂肪酸水平升高可提高睡眠质量
相关研究表明,短链脂肪酸水平的升高可以通过穿越血脑屏障和调节大脑中血清素和多巴胺(DA)的产生来影响大脑发育。
短链脂肪酸不仅能直达大脑,在肠道局部也发挥着重要的睡眠调节作用。
增强睡眠相关物质:
调节压力系统:
调节免疫功能
SCFA调节HPA轴:缓解压力促进睡眠
通过显著增加SCFA含量,可以带来一系列积极变化:
短双歧杆菌207-1可以通过显著增加SCFA和GABA水平,整体抑制HPA轴相关激素来改善睡眠质量。
不同SCFA的作用
乙酸盐、丁酸盐、戊酸盐与HPA轴相关激素水平呈负相关;丙酸盐显示出相反的模式。
因此,微生物群产生的SCFA可以通过改善肠道屏障和肠道免疫环境来影响神经系统。它们通过增加肠道中SCFA的多样性和水平、刺激睡眠相关细胞因子的分泌和抑制炎症反应等机制,改善失眠。
★ 多 巴 胺
多巴胺(DA)被称为大脑中的”奖励分子”和”动力激素”,但在睡眠调节中,它是”人间清醒”。作为一种促进警觉性的强效神经递质,多巴胺对于控制我们的睡眠-觉醒周期至关重要。
当多巴胺水平充足时,我们会感到精神饱满、注意力集中、反应敏捷;而当多巴胺不足时,我们可能会感到昏昏欲睡、缺乏动力、思维迟钝。
多巴胺:肠道保护功能
多巴胺在肠道中并不仅仅是一个”过客”,它还承担着重要的肠道保护功能:
通过D5受体的作用:
通过D2受体的作用:
肠道菌群失调:多巴胺代谢的破坏者
肠道菌群可以影响多巴胺的水平,相关研究表明,肠道菌群失调导致多巴胺代谢紊乱(以高香草酸减少为特征),从而影响大脑的清醒和认知功能。
注:高香草酸是多巴胺代谢的重要产物,它的减少就像是”多巴胺工厂”生产效率下降的信号。
补充益生菌可以有效逆转这些紊乱
补充益生菌已被证明可以恢复Blautia、Dialister、F.prausnitzii、Ruminococcus、拟杆菌属,这些菌群与高香草酸水平呈显著正相关。这意味着它们能够有效修复多巴胺代谢通路,恢复正常的觉醒调节功能。
两种特别的”多巴胺生产专家”
粪肠球菌(Enterococcus faecalis)和屎肠球菌(Enterococcus faecium) 具有酪氨酸羟化酶和多巴脱羧酶活性,使其能够将酪氨酸转化为L-dopa(多巴胺的前体)。进一步的研究表明,粪肠球菌和屎肠球菌的移植增加了PGF小鼠肠道内多巴/多巴胺的合成,促进了多巴/多巴胺从肠道进入血液,从而提高了大脑中的多巴胺水平。
这表明,调节肠道微生物群中苯丙氨酸酪氨酸多巴多巴胺的生物合成途径可能会改善脑功能。
短链脂肪酸的协同作用
研究表明,肠道微生物群代谢产生的短链脂肪酸可以直接穿透血脑屏障,控制5-羟色胺和多巴胺的合成,进而影响大脑发育。因此,肠道细菌可以通过多种途径调节大脑的多巴胺能系统,从而影响大脑的唤醒能力和功能。
微生物群-迷走神经通路
迷走神经就像是连接肠道和大脑之间的一条专线电话,肠壁中富含迷走神经纤维,这些神经纤维就像是密布在肠道中的信号接收器,能够从肠道接收各种信号并将其精确地传递到大脑。可以说,迷走神经是肠道微生物群影响大脑功能、调节睡眠的重要通路之一。
肠道微生物如何启动迷走神经?
通过这条”迷走神经专线”,肠道细菌能够:
粪菌移植和罗伊氏乳杆菌
粪菌移植可以触发肠道的迷走神经系统,从而导致脑干和海马体的5-HT和DA神经传递途径的长期改变。
通过迷走神经依赖机制,罗伊氏乳杆菌还可以改变催产素和多巴胺能信号在腹侧被盖区(VTA)的传递方式。值得注意的是,海马体和VTA中的多巴胺能回路在维持睡眠-觉醒相关行为方面都起着至关重要的作用。
证据:迷走神经切断实验
为了证实迷走神经参与肠道和大脑之间的信息传递,研究人员进行了一个实验:膈下迷走神经切断术。就像是切断电话线,看看肠道和大脑之间的通讯是否会中断。
治疗效果消失:
注:选择性5-HT再摄取抑制剂是一类通过抑制突触前膜5-HT再摄取、增强突触间隙5-HT浓度的抗抑郁药物。
信号传递的机制
当肠道内的5-HT与迷走神经纤维上密集分布的5-HT受体结合时,迷走神经被激活。然后,神经元通过特定的投射对5-HT信号做出反应并进行分类,然后将其传递到大脑。
迷走神经刺激:治疗睡眠障碍的新策略
研究表明,迷走神经刺激可通过降低外周血和海马中IL-1β和IL-6的水平,以及防止星形胶质细胞和小胶质细胞激活,从而改善由睡眠剥夺引起的抑郁样行为。
微生物-免疫炎症通路
免疫炎症通路就像是身体内部的警报系统,当有危险信号出现时,它会迅速启动防御机制。在肠道微生物调节睡眠的过程中,它也扮演着至关重要的角色。这套系统运行正常时,我们能享受优质睡眠;而当系统失调时,就可能出现失眠、睡眠质量下降等问题。
微生物通过免疫炎症途径与大脑的睡眠调节功能建立复杂的相互作用。简单来说,肠道微生物可以通过调节免疫系统的炎症反应,间接影响大脑的睡眠中枢,就像是通过免疫语言与大脑进行对话。
睡眠剥夺:引发免疫炎症风暴的导火索
睡眠剥夺破坏肠道屏障和血脑屏障通透性,增加NLRP3水平,并激活肠道中的TLR4/NF-κB信号通路,导致炎症信号传递到大脑,从而加剧大脑中的神经炎症和小胶质细胞激活。
恢复被破坏的肠道微生物群可以缓解肠道氧化应激、炎症反应和屏障损伤,从而改善睡眠质量。
肠道微生物代谢物:TMAO的双面性
某些肠道微生物可以通过其代谢产物介导宿主的炎症反应来调节大脑的睡眠功能。例如,三甲胺N-氧化物(TMAO)是肠道微生物群的代谢产物,可以通过调节膜联蛋白A1信号传导来增强血脑屏障的完整性,保护大脑免受炎症损伤,还可以通过NF-κB信号通路促进NLRP3激活来影响睡眠。
特定菌群与炎症因子
睡眠剥夺会引发肠道微生物群失调,导致炎症因子如IL-1β、IL-6、TNF-α的表达失衡。
相关分析表明,IL-1β和TNF-α与肠道中的Ruminococcus_1和Ruminococcoccus e_UCG-005呈正相关。
– NLRP3炎症体:睡眠调节的关键开关
NLRP3是参与IL-1β调控睡眠的关键介质之一。NLRP3的组装可以激活caspase-1,激活的caspase-1随后将pro-IL-1β切割成成熟的IL-1β,然后调节中枢神经系统对生理睡眠的控制。
TNF-α和IL-1β受体通过配体激活介导NF-κB转录,触发参与睡眠调节和影响睡眠的炎症相关分子的转录。
这个指挥系统一旦启动,就会产生级联放大效应,小小的炎症信号最终可能对睡眠产生显著影响。
尽管睡眠剥夺对血脑屏障的影响在某种程度上是可逆的,但修复过程并不简单,即使在恢复正常睡眠模式后,恢复正常的血脑屏障功能仍然是一个漫长的过程。
这些发现为失眠的免疫治疗提供了新的思路,通过调节肠道微生物群来优化免疫炎症反应,进而改善睡眠质量。
源自中草药的药用食品及其生物活性化合物是独特的“益生元”,具有以下优点:副作用小、安全性高、提高患者依从性、适合长期食用。这些特性突显了这些草药在营养和治疗应用中的双重价值。此外,它们具有调节肠道微生物群稳定性的潜力,为通过调节肠道微生物组预防和治疗失眠提供了新的视角。
酸 枣 仁
酸枣仁(Ziziphi spinosae semen,SZR)是指鼠李科植物枣属种类中,中国枣(Ziziphus jujuba Mill. var. spinosa (Bunge) Hu ex H. F. Chou)的干燥成熟种子。
酸枣仁以其酸甜口味和中性特性为特征,靶向肝、胆囊、心经。它以“滋阴养心、补血养肝、安神安神”的功效而闻名,对治疗虚证和慢性失眠特别有效。正是因为其卓越的安神助眠功效,酸枣仁被誉为”东方睡眠果实“,在临床上广泛用于治疗失眠。
注:从历史角度看,酸枣仁在中医中一直受到高度重视,无论是作为单一草药还是复方制剂,都展现出了令人瞩目的疗效。
酸枣仁的”睡眠密码”:三大活性成分
皂苷、黄酮、生物碱是酸枣仁镇静和催眠作用的主要活性成分。先前的研究表明,酸枣仁可以调节氨基酸代谢、神经递质释放、炎症因子平衡和HPA轴稳态等生理过程,从而调节神经活动,实现神经系统的平衡,改善睡眠。
最近的研究表明,酸枣仁可以恢复失眠引起的肠道菌群失衡,增加大鼠体内有益菌的相对丰度,如乳杆菌、双歧杆菌、乳球菌、真杆菌,同时减少普雷沃氏菌的相对丰度。
菌群代谢产物——短链脂肪酸(SCFA)
梭菌和乳杆菌丰度的增加导致其代谢产物丁酸盐含量的增加,这进一步影响了体内的氨基酸代谢途径,从而显著恢复了患有睡眠-觉醒节律紊乱的小鼠的睡眠-觉醒节奏。
SCFA可以间接调节肠道和大脑中的5-HT水平。
研究表明,通过酸枣仁的微生物代谢增加的SCFA,可以调节结肠中TLR4/NF-κB/NLRP3相关信号通路中代表性因子的表达,从而调节微生物群-肠-脑轴,改善小鼠的失眠和抑郁行为。
注: TLR4:控制肠道免疫系统的”警报器”;NF-κB:调节炎症反应的”总开关”;NLRP3:影响炎症体的活化程度。
酸枣仁调节肠道菌群,而不是直接作用于大脑
显然,酸枣仁可以通过微生物群神经通路和微生物群免疫通路调节微生物群肠脑轴,从而实现对生物体睡眠行为的控制。这可能解释了酸枣仁的活性成分不能穿过血脑屏障,但仍然能改善睡眠质量。
卷 丹 百 合
在中医传统中,百合类植物一直被认为具有”润肺止咳、清心安神“的功效,而现代科学研究正在揭示其改善睡眠的深层机制。
卷丹百合(LB)可以通过降低血清中HPA轴激素的水平、增加5-HT和MT的水平、降低下丘脑中去甲肾上腺素(NE)的水平以及上调GABAA受体和5-HT1A受体的表达,来改善大鼠的下丘脑病理并缓解失眠行为。
肠道菌群调节:失眠改善的核心机制
卷丹百合调节肠道菌群的方式可能直接关系到它缓解失眠的效果。除了逆转失眠对肠道微生物群的多样性、丰度和粪便代谢表型的不利影响外,卷丹百合还控制花生四烯酸和色氨酸的代谢,从而降低与心理健康问题相关的化学物质犬尿氨酸的表达水平。
卷丹百合显著调节肠道内乳杆菌、埃希氏菌、Porphyromonadaceae的相对丰度,并积极调节下丘脑中的5-羟基-L-色氨酸,后者参与5-HT的代谢。通过卷丹百合干预,最重要和最基本的途径被认为是5-羟色胺能系统和花生四烯酸代谢途径。
复方协同:卷丹百合与地黄汤的联合
卷丹百合和地黄汤(LBRD)可以通过纠正肠道微生物群失调和避免肠道屏障受损或血脑屏障泄漏引起的炎症,来减轻与抑郁行为相关的神经元损伤。根据粪便微生物群移植和肠道微生物群组成研究,通过肠道-脑轴,乳杆菌、双歧杆菌、乳球菌(Lactococcus)被证明是地黄汤抗抑郁作用的重要因素。
灵 芝
灵芝的镇静作用与肠道菌群密切相关
当灵芝与罗伊氏乳杆菌发酵时,它可以增加血清中5-HT和GABA的水平,降低HPA轴激素的水平,有效缓解焦虑小鼠的失眠症状。
灵芝的乙醇提取物也对微生物组的结构产生了显著影响。
下丘脑的5-HT浓度与双歧杆菌和动物双歧杆菌呈正相关,这不仅提高了那里的5-HT水平,还增加了包括Tph2、Iptr3、Gng13在内的重要转录因子的产生。在用抗生素耗尽肠道微生物群后,灵芝乙醇提取物的促进睡眠作用以及与睡眠行为相关的粪便代谢物的变化完全消失。这表明肠道微生物群在灵芝的促睡眠作用中起着不可或缺的作用。
多糖成分的免疫调节与神经保护作用
来自灵芝的多糖已被证明可以提高小鼠大脑中的GABA和5-HT水平,并通过延长NREMS期间的δ波来提高其睡眠质量。
此外,灵芝多糖及其水解产物,即灵芝肽,通过各种途径表现出免疫调节活性。具体而言,灵芝多糖不仅降低了肠道中的F/B比值,而且显著上调了回肠中NF-κBp65、IL-2、IL-4的表达水平;它们还显著增强BDNF的表达,抑制促炎细胞因子的表达,并抑制小胶质细胞和星形胶质细胞的激活,从而发挥抗抑郁作用。
灵芝肽参与关键途径,如叶酸循环、脂肪酸的生物合成和代谢以及cAMP代谢。灵芝多糖在调节肠道微生物群稳态和提供神经保护方面具有巨大潜力。
茯 苓
茯苓(P.cocos)自古以来就被誉为”四时神药”,茯苓性平味甘,具有健脾利湿、宁心安神的功效,是古代人治疗失眠的首选核心药物之一,
传统核心药物的现代机制:多糖和三萜
茯苓含有多糖和三萜类化合物,是其镇静和诱导宁静的主要活性成分。研究表明,茯苓中的酸性多糖可以通过干预肠道微生物群和调节相关途径发挥镇静作用。
这些多糖不仅增加了肠道微生物群的丰度,如厚壁菌门、杆菌门、乳杆菌门、Fusicatenibacter、Prevotellaceae_UCG-001;它们还上调下丘脑中关键神经递质5-HT、DA、NE、GABA的水平,增加神经元细胞的数量,同时降低炎症因子的表达水平。
此外,来自茯苓的水提取物和水溶性多糖可以通过改善肠道微生物群失衡、缓解代谢紊乱、调节肠道神经肽和神经递质水平以及抑制TNF-α/NF-κB信号通路来有效预防焦虑的发作。
增加短链脂肪酸、促进色氨酸代谢
茯苓多糖可以通过增加肠道中的短链脂肪酸水平和促进色氨酸代谢来增强肠道屏障。它们不仅通过增加吲哚乳酸盐和吲哚-3-醛的水平来促进色氨酸代谢;还通过增加肠道中短链脂肪酸的水平、调节IL-2、IL-4、IL-6、IL-10、TGF-β、IFN-γ等关键免疫因子的表达,激活Wnt/β-Catenin信号通路来维持肠道屏障的完整性和功能。
色氨酸和短链脂肪酸的水平以及肠道屏障的健康稳态与肠道微生物群密切相关,对改善睡眠质量有重大影响。
人 参
人参被誉为”百草之王”,是中药中最珍贵的滋补品之一。作为五加科植物,人参含有丰富的活性成分,具有补元气、复脉固脱、补脾益肺、生津养血、安神益智等功效。现代研究发现,人参不仅能直接作用于大脑,还能通过调节肠道微生物群来改善睡眠质量。
多重活性成分的协同作用:跨越血脑屏障
人参中发现的肽、多糖、皂苷具有穿过血脑屏障并调节神经内分泌平衡和大脑代谢环境的能力。人参多糖通过增强肠道吸收和影响肠道微生物代谢来增强人参皂苷Rb1和微生物代谢产物的暴露。Rb1通过调节瑞士乳杆菌丰度和GABAA受体表达发挥神经保护作用。
人参皂苷Rg1(Rg1)对神经系统具有潜在的健康促进作用。Rg1可以改善吗啡诱导的肠道微生物群失调(特别是拟杆菌),抑制肠道微生物群衍生的色氨酸代谢,调节异常升高的血清素、5-羟色胺受体1B和5-羟色胺受体2A水平,使其回归正常范围。
人参皂苷的多途径神经保护机制
人参皂苷Rg可能影响肠道微生物群,并通过多种不同途径提供神经保护。
Rg1可以通过调节5-HT神经递质系统、阻止肠道微生物群产生的色氨酸代谢和改善肠道微生物群失调(特别是拟杆菌)来防止小鼠产生吗啡依赖。
Rg5不仅可以纠正不平衡的肠道微生物群,恢复肠道屏障的功能,还可以通过控制脂肪和葡萄糖的代谢,提高GABA/Glu比值,上调GABAA、GABAB和5-HT受体1A的表达,改变时钟相关蛋白质的节律特征,改善睡眠质量,进而影响GABA和5-HT神经递质系统。
复方协同与代谢循环优化
人参和酸枣仁的联合使用,可以改善肠道微生物群的结构,促进Glu/GBA-Gln代谢循环的正常运作,增加海马中GABA的合成和释放,从而显著改善失眠大鼠的睡眠状态。这表明人参可以通过多种途径干预肠道微生物群并调节大脑睡眠功能。
doi: 10.3389/fphar.2025.1572007
天 麻
天麻(G.Blume)是兰科植物天麻的干燥块茎,素有”定风草”之称,是著名的息风止痉、平抑肝阳的中药材。
天麻素的多重神经保护机制:从炎症调控到信号通路调节
从天麻中提取和分离天麻素(GAS)已被证明对中枢神经系统疾病有显著影响,包括但不限于失眠、焦虑、抑郁、认知障碍、缺血性中风。
天麻素通过控制IL-6、IL-1β等炎性因子的表达、B细胞淋巴瘤-2(Bcl-2)蛋白的活性以及p-ERK与ERK的比值,不仅改善了失眠小鼠的睡眠质量,而且通过调节TLR4/NF-κB和Wnt/β-catenin信号通路,改善了快速眼动睡眠剥夺引起的睡眠障碍。因此,天麻素在提高睡眠质量方面具有很大的潜力。
肠道微生物群调节
已经进行的研究表明,天麻素可以通过调节微生物群-肠-脑轴来抑制神经元凋亡,从而改善阿尔茨海默病小鼠的认知障碍和神经变性。
在抑郁的小鼠中,天麻的水提取物可以通过促进潜在有益菌(Alloprevotella、双歧杆菌、Defluviitaleaceae UCG-011、Akkermansia、Parabifidobacter)和粪便SCFA水平的增加和平衡,使结肠中5-羟吲哚乙酸与5-HT的比例正常化,并降低犬尿氨酸与色氨酸的比例来重塑肠道微生物组结构。抗生素混合物的给药部分消除了天麻素对阿尔茨海默小鼠的神经保护作用。
天麻及其活性成分对大脑功能的影响是显而易见的,因为它们部分针对微生物群-肠道-大脑轴。然而,支持天麻素可以通过这种微生物群-肠-脑轴调节大脑睡眠功能这一观点的确凿实验证据仍有待观察。需进一步研究来确定天麻素通过改变肠道微生物群来改善睡眠质量的确切过程,以便更谨慎地开发和使用天麻。
蒙 古 黄 芪
蒙古黄芪是豆科植物蒙古黄芪的干燥根,被誉为”补气圣药”,在中医药学中具有重要地位。黄芪性温味甘,具有补气固表、托毒排脓、利水消肿的功效,是临床上最常用的补气药之一。
现代研究发现,蒙古黄芪富含黄酮类化合物、多糖、皂苷,通过控制肠道微生物群的组成、代谢和活性,有助于保持肠道微环境的稳定。
黄芪多糖的免疫调节机制:特异性菌群调控的双向作用
研究发现,不同浓度的黄芪多糖(APS)对睡眠剥夺小鼠的脾脏和身体损伤具有缓解和保护作用。
进一步的研究表明,黄芪多糖可以通过调节与炎症和免疫反应、短链脂肪酸合成和TLR4/NF-κB通路有关的某些微生物来改善免疫功能障碍。
例如,黄芪多糖可以改善免疫功能低下的小鼠和大鼠的免疫功能,这是由于减少了Pseudoflavonifractor、Oscillibacter、Tyzzerealla、Paraprevotella、Lachnoclostridium的丰度,并增加了乳杆菌、双歧杆菌、Roseburia、脱硫原体、Paracoccus、副拟杆菌、Clostridium XIVb、Butyricicoccus的丰度。
然而,在肠道微生物群减少的免疫功能低下小鼠中,黄芪多糖并没有改善免疫功能。
肠脑轴的积极调控:从代谢产物到神经递质的全面优化
为了积极控制肠-脑轴,黄芪多糖不仅增加了肠道中乳杆菌和芽孢杆菌的相对丰度,还增加了粪便中短链脂肪酸和GABA的含量,提高了虾的免疫力。
此外,黄芪多糖可以显著减轻与年龄相关的肠道屏障破坏、胃肠酸碱平衡丧失、肠道长度缩短、肠道干细胞过度增殖以及衰老后的睡眠障碍。
因此,肠道微生物群不仅积极帮助身体吸收黄芪多糖,而且通过提高肠道SCFA水平来改善免疫功能障碍,并通过促进神经递质的释放来积极调节肠道脑轴。
龙 眼
龙眼肉,又称桂圆肉,自古以来就被誉为”智慧果”。在中医理论中,龙眼肉性温味甘,具有补益心脾、养血安神的功效,《神农本草经》将其列为上品药材。龙眼肉是中国传统医学中常用的治疗失眠的草药之一,但关于其改善睡眠质量的潜力的药理活性研究很少。
龙眼含有GABA,可以用作天然膳食补充剂。龙眼中富含多种氨基酸,如GABA和Glu,并且随着果实年龄的增长,其浓度也会增加。成熟后在冷藏温度下储存可以增加水果中的GABA含量。
此外,通过增加胃中Lactobacilli、Pediococci、 Bifidobacteria的数量,肠道微生物群对龙眼多糖的代谢可以提高琥珀酸和SCFA(乙酸、丙酸和丁酸)的水平,增强肠道免疫力。
无论是作为富含GABA的膳食补充剂还是通过调节肠道内的微生物代谢产物,龙眼肉都有可能通过影响肠道中GABA、MT、5-HT等睡眠相关神经递质的合成和释放来调节肠道微生物群-肠脑轴。这可以直接或间接地调节身体的睡眠-觉醒周期,从而发挥强大的睡眠促进作用。
其他中草药及其成分
中医药宝库中蕴藏着众多具有安神功效的珍贵药材,这些草药在千百年的临床实践中积累了丰富的应用经验。
除了前述的经典药材外,栀子、三七、莲子等传统药材同样具有改善睡眠的潜力,但它们通过肠道微生物群调节睡眠机制的研究相对较少。这里讨论了其他一些草药及其活性成分如何影响肠道菌群,从而提高睡眠质量的能力。
栀子、三七
研究表明,栀子可以通过调节肠道微生物群和降低TNF-α和IL-7β水平来改善睡眠质量和缓解焦虑症状。
由肠道微生物群代谢的三七总皂苷转化为人参皂苷Rg,其保护海马神经元并调节大脑中的神经递质水平,从而改善失眠、抑郁和认知障碍。
莲子、荷叶
莲子和荷叶都可以通过调节肠道微生物群的丰度和结构来调节GABA能系统,从而促进睡眠。然而,它们调节肠道微生物群的方式存在显著差异。具体而言:
枣、谷芽
枣具有改善睡眠质量和通过调节GABA能系统提供神经保护的潜力。具体而言,它可以上调Lachnoclosdium、Marvinbryantia的丰度,同时下调Alistipes、Akkermansia的丰度。
谷芽[Setaria italica(L.)Beauv]可能会增加肠道中普雷沃氏菌、乳酸菌、Ruminococcus的丰度,从而通过调节神经递质和炎症因子水平来提高SCFA水平并改善睡眠质量。
山茶、枸杞
山茶[(L.)Kuntze]可能通过改善肠道微生物群来影响神经内分泌途径和免疫系统,从而调节睡眠-觉醒周期。
枸杞可能通过改善肠道屏障和抑制TLR4信号通路来保护神经系统。
交泰丸
由黄连根茎和肉桂皮组成的交泰丸可以改善睡眠,并减轻慢性睡眠剥夺引起的炎症和胰岛素抵抗。组学结果表明,交泰丸治疗显著增加了小鼠中毛螺菌科、拟杆菌属、AKK菌属的相对丰度。
黄连温胆汤对失眠的机制可能与它抑制 5-羟色胺含量的降低和γ-氨基丁酸水平的升高有关。同样,研究发现甘麦大枣汤可以增加 NE 和 5-羟色胺的含量,改善睡眠,在一定程度上缓解抑郁,柴胡加龙骨牡蛎汤主要通过调节下丘脑-垂体-肾上腺轴(ACTH、CORT等)和脑单胺神经递质(NE、DA、5-羟色胺等)的水平来治疗失眠。
草药及其活性成分在改变肠道微生物群和提高睡眠质量方面的巨大潜力已经得到证实,尽管这一研究领域仍处于早期阶段。更多的研究不仅可以为治疗失眠提供坚实的支持,还可以通过阐明这些草药与微生物群-肠道-大脑轴相互作用的机制来调节与睡眠相关的大脑功能,从而帮助我们更明智地开发和使用这些草药。
针 灸
针灸治疗注重根据辨证选择穴位,基于辨证的针灸疗法可以取得良好效果并改善胃肠功能,针灸结合腹部环形按摩可以改善下丘脑和海马旁回的功能,从而达到改善失眠症状的效果。
此外,研究发现针灸可以抑制 HPA 轴的活性,从而改善失眠症状。
有研究在微生物-肠-脑轴理论指导下总结了针灸的原则:
可以直观地发现,这些针灸穴位与微生物-肠-脑轴的解剖部位有许多重叠。从健脾和胃治疗失眠的角度来看,主要穴位有中脘、关元、天枢、气海等。
这些针灸疗法可以通过调节神经递质和某些激素的分泌,以及下调 HPA 轴来抑制交感神经并改善内分泌,从而改善失眠症状,这些症状是微生物-肠-脑轴相同调节机制的一部分。
doi: 10.12998/wjcc.v12.i18.3314
饮 食 调 整
不良饮食模式的负面影响
长期高糖摄入会刺激免疫系统,诱发过度炎症反应,导致睡眠片段化。
肥胖人群中Faecalibacterium丰度显著下降,这在慢性失眠患者中同样存在。
健康饮食模式的积极作用
富含植物性食物、抗氧化剂和不饱和脂肪酸;促进产丁酸菌丰度增加,显著改变肠道微生物代谢活性,与更好的睡眠质量和更长的睡眠时间相关。
适用人群:肥胖青少年、结合增加体力活动
增加肠道中乳杆菌的丰度,乳杆菌以其促进睡眠的有益作用而闻名。
其他,如习惯性饮茶,可能通过肠道菌群-胆汁酸轴减轻慢性失眠引起的肠道菌群失衡和胆汁酸代谢紊乱。
益 生 菌
接受发酵益生菌 Lactobacillus brevis DL1-11 牛奶的小鼠表现出更短的睡眠潜伏期和更长的睡眠时间。因为 DL1-11 可以产生大量的 GABA,GABA 可以促进放松并增强睡眠。
Lactobacillus fermentum PS150TM通过增加下丘脑腺苷 A1 受体的表达,有效地促进了正常小鼠的睡眠,并缓解了咖啡因诱导失眠小鼠的失眠症状。PS150TM 能够恢复因首夜效应导致睡眠障碍的小鼠的非快速眼动睡眠,这可能是由于其重塑肠道菌群组成的能力,改变血清素能通路,减少慢性轻度压力大鼠的抑郁和焦虑。
Bifidobacterium breve CCFM1025 通过抑制 HPA 轴活性,改善了睡眠并缓解了压力水平。
Bifidobacterium adolescentis SBT2786 可以通过增加快速眼动睡眠时间来延长总睡眠时间,白天疲劳减少。
Lactobacillus plantarum PS128 显著增强了深度睡眠,并减少了疲劳和抑郁症状。
Lactobacillus gasseri CP2305 也已可以改善肠道微生物群组成,并降低唾液皮质醇浓度,从而减轻压力并增强睡眠 。
Lactobacillus casei Shirota 牛奶通过延长睡眠时间和减少觉醒时的嗜睡感,帮助面临考试压力的个体 。
Lactococcus lactis subsp. cremoris YRC3780 也显示出改善睡眠和缓解压力的潜力,这一点由日本进行的一项双盲、安慰剂对照的临床试验所证实,接受 YRC3780 干预的参与者主观睡眠质量和心理健康均有显著改善。
doi: 10.3390/ijms252313208
益 生 元
益生元饮食(由半乳寡糖、聚葡萄糖、乳铁蛋白和乳清蛋白浓缩牛奶脂肪球膜蛋白-10 组成)通过在正常情况下增强非快速眼动睡眠,并在压力情况下延长快速眼动睡眠,对小鼠的睡眠模式产生了积极影响。
接受益生元饮食(由半乳寡糖和聚葡萄糖组成)的大鼠在睡眠紊乱情况下表现出更长的非快速眼动睡眠和快速眼动睡眠。菌群分析发现,在益生组中,Parabacteroides distasonis 的相对丰度增加,这与促进睡眠和恢复昼夜节律有关。
在一项人体研究中,45 名参与者被随机分为三组,分别接受低聚果糖(FOS)、低聚半乳糖(GOS)或安慰剂。结果表明,低聚半乳糖组的参与者睡眠质量得到改善,唾液皮质醇觉醒反应显著降低。这种皮质醇的减少与肠道菌群中 Bifidobacteria 的相对丰度增加有关,这些菌具有代谢低聚半乳糖的能力,并对心理健康有积极作用。
抗性淀粉是另一种已被证明能通过减少炎症和 HPA 轴活性来改善 2 型糖尿病患者睡眠质量的益生元。
一项随机、双盲、安慰剂对照的研究也报道了益生元酵母甘露聚糖的改善睡眠效果。酵母甘露聚糖组的非快速眼动睡眠第 3 阶段睡眠时间和总睡眠时间均显著长于安慰剂组。
粪菌移植 (FMT)
目前,越来越多的研究将粪菌移植作为精神健康疾病的一种潜在治疗方法,因为肠道微生物群可以通过微生物群-大脑轴影响中枢神经系统。
临床研究表明,洗涤微生物群移植增加了有益细菌(如 Bifidobacterium、Ruminococcus gnavus 、Prevotella 7、Faecalibacterium)的相对丰度,并减少了有害细菌(如 Escherichia-Shigella 、 Streptococcus)的相对丰度,显著改善了患有各种潜在疾病的患者睡眠障碍。睡眠质量得到改善的患者在抑郁程度和 IBS 症状严重程度上也表现出更大的减少。
另一项开放标签的观察性研究发现,在患有胃肠道疾病且出现睡眠障碍的患者中,结果相似,作者认为整体改善归因于FMT治疗后菌群多样性的增加。
一项真实世界研究发现,粪菌移植显著改善了失眠患者的睡眠质量,缩短了睡眠潜伏期,并提高了睡眠效率。通过比较肠道菌群组成,研究人员发现,粪菌移植显著增加了产短链脂肪酸菌的相对丰度,包括 Lactobacillus、Bifidobacterium 、 Turicibacter。
注:所有这些研究都将失眠视为与其他疾病相关的共病,这表明睡眠的改善也可能归因于疾病症状的缓解,粪菌移植对睡眠障碍的有效性需要进一步研究。
随着现代医学对肠-脑轴研究的深入,传统中医药”治未病“的理念与现代微生态学理论完美融合,为失眠治疗开辟了全新视角。
未来研究应重点关注个体化精准治疗策略的制定。肠道菌群检测技术的应用将为临床实践提供重要指导,通过分析患者特异性的菌群结构,识别关键的失调菌群如拟杆菌、双歧杆菌、乳杆菌等,可为选择最适宜的中药配方提供科学依据。
同时,肠道菌群代谢产物如短链脂肪酸、GABA、血清素等关键代谢产物水平,这些在谷禾肠道菌群检测报告中也都有相应指标,结合肠道菌群检测报告有助于辅助评估治疗效果并优化用药方案。
<来源:谷禾肠道菌群检测数据库>
在中医药现代化进程中,应深入挖掘经典方剂如甘麦大枣汤、安神定志丸等复方的菌群调节机制,探索经典方剂与菌群协同效应的内在规律。同时,结合中医体质辨识与肠道菌群分型,建立”体质-菌群-证候“三位一体的诊疗模式。
通过构建中药-菌群相互作用数据库,为临床医师提供相对精准的用药指导,最终实现传统中医智慧与现代精准医学的深度融合,为失眠患者带来更加安全、有效的个性化治疗方案。
注:本账号内容仅供学习和交流,不构成任何形式的医疗建议。
主要参考文献
Wu C, Dou J, Song X, Yang F, Liu X, Song W, Zhang X. Gut microbiota: a new target for the prevention and treatment of insomnia using Chinese herbal medicines and their active components. Front Pharmacol. 2025 May 6;16:1572007.
Li C, Chen S, Wang Y, Su Q. Microbiome-Based Therapeutics for Insomnia. Int J Mol Sci. 2024 Dec 9;25(23):13208.
Ito H, Tomura Y, Kitagawa Y, Nakashima T, Kobanawa S, Uki K, Oshida J, Kodama T, Fukui S, Kobayashi D. Effects of probiotics on sleep parameters: A systematic review and meta-analysis. Clin Nutr ESPEN. 2024 Oct;63:623-630.
Patterson E, Tan HTT, Groeger D, Andrews M, Buckley M, Murphy EF, Groeger JA. Bifidobacterium longum 1714 improves sleep quality and aspects of well-being in healthy adults: a randomized, double-blind, placebo-controlled clinical trial. Sci Rep. 2024 Feb 14;14(1):3725.
Liwinski T, Lang UE, Brühl AB, Schneider E. Exploring the Therapeutic Potential of Gamma-Aminobutyric Acid in Stress and Depressive Disorders through the Gut-Brain Axis. Biomedicines. 2023 Nov 24;11(12):3128.
Li L, Wu L, Jiang T, Liang T, Yang L, Li Y, Gao H, Zhang J, Xie X, Wu Q. Lactiplantibacillus plantarum 124 Modulates Sleep Deprivation-Associated Markers of Intestinal Barrier Dysfunction in Mice in Conjunction with the Regulation of Gut Microbiota. Nutrients. 2023 Sep 15;15(18):4002.
Pan LM, Hong ZB, Guan RQ. Research progress on insomnia treated by traditional Chinese medicine and acupuncture based on microbial-gut-brain axis theory. World J Clin Cases. 2024 Jun 26;12(18):3314-3320.

谷禾健康
人一生中平均有三分之一的时间在睡觉。睡眠对于我们是必不可少的存在,它能够促进我们的幸福感。

然而目前,睡眠障碍已经成为了一种流行病。尤其是在新冠肺炎流行之后,进一步加剧了睡眠问题。
随着睡眠障碍的患病率越来越高,人们开始深入研究——是什么因素决定了睡眠的质量?
众所周知,各种环境因素和其他因素(如心理压力和饮食)的共同作用会影响睡眠质量和睡眠持续时间(下图)。
图1 各种因素的相互作用影响睡眠质量和持续时间
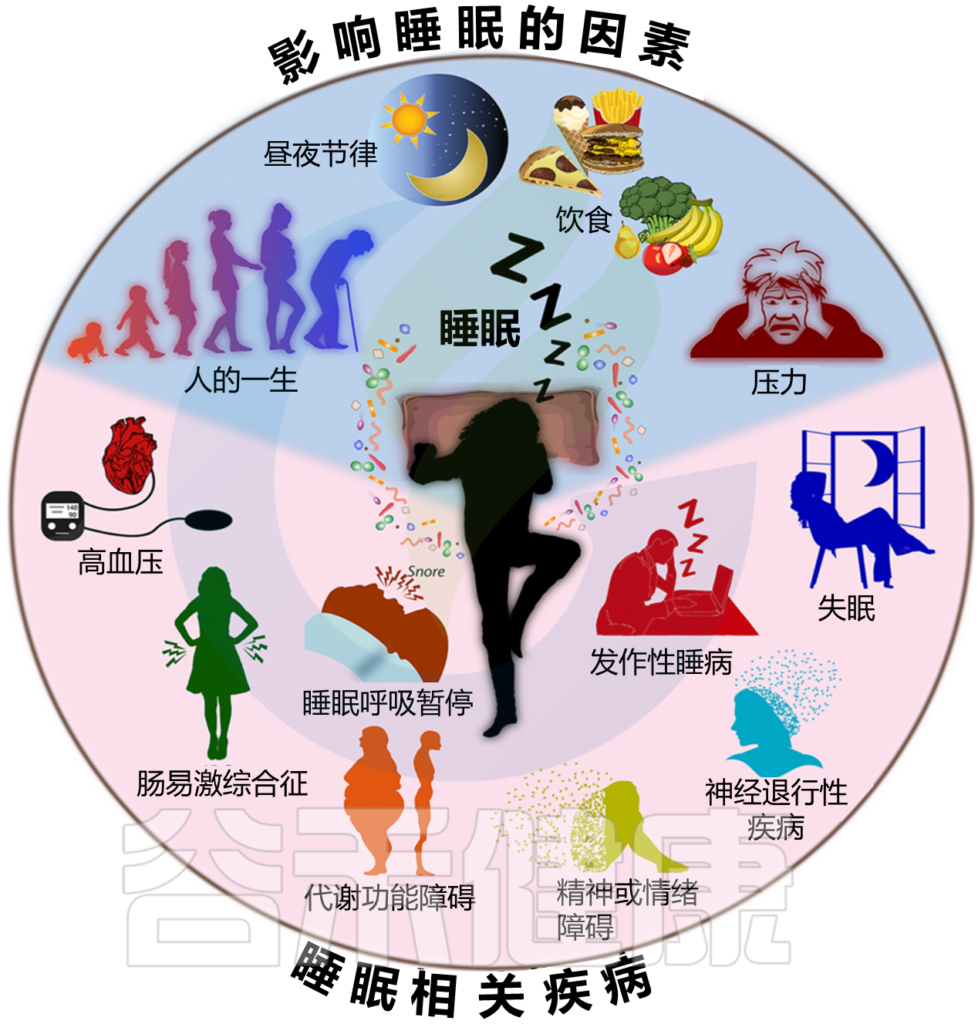
Sen P, et al.,Trends Mol Med. 2021
各种因素对睡眠质量和持续时间的相互作用影响。已知各种不同的因素会影响睡眠。其中包括饮食、压力、昼夜节律调整以及整个生命周期的各个阶段(上图,蓝色背景)。最近的研究表明,这些因素与肠道微生物群相互作用,影响睡眠。
反过来,睡眠质量和持续时间也影响各种因素。睡眠质量差或睡眠不足可导致免疫、代谢功能障碍、血压升高,并可发展为肠易激综合征、各种神经退行性疾病和精神障碍、睡眠呼吸暂停和发作性睡病(下窗格,粉红色背景)。睡眠不足可能通过影响肠道菌群组成而导致这些疾病的发展。
本文从微生物群的角度探讨各种因素如何与肠道微生物群相互作用影响睡眠。包括睡眠与微生物群具有相互作用的可能机制。
此外,还提出了常见的伴随睡眠障碍的疾病以及针对各种睡眠障碍时微生物群对肠道和大脑进行调节改变的现有证据。
睡眠质量与肠道菌群组成之间存在双向关系。使用抗生素干扰肠道微生物群会导致更大的非快速眼动(NREM)睡眠碎片化,从而降低睡眠质量,睡眠中断也会导致肠道微生物群组成的变化。不过,关于睡眠障碍和微生物组成之间关系的结果缺乏一致性。
此外,大多数睡眠研究只关注单一时间点的肠道微生物群。由于肠道菌群每天动态变化,睡眠和肠道菌群之间的关系可能在一天的不同时间有所不同。
尽管如此,越来越多的研究表明,微生物-肠道-大脑轴与睡眠生理和行为有关。
表1 探索肠道微生物如何影响睡眠的各种研究

Sen P, et al.,Trends Mol Med. 2021
睡眠和微生物群组成:交流机制
肠道微生物群通过微生物群-肠道-大脑轴与大脑沟通的各种可能机制。
图2 影响睡眠的微生物群-肠道-大脑轴交流模式