-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
夜幕落下,一场疲惫的战斗即将开始
翻来覆去,时间在无情地流逝
盯着天花板,期待天亮的时刻
却又害怕那一刻的真正到来
这意味着又一个疲惫的早晨
从整个歌单的催眠音乐到数了一万只羊
最终都只是让自己在煎熬中更加清醒

在快节奏的现代生活中,良好的睡眠已成为许多人难以实现的奢望。随着压力的增加,睡眠障碍,如失眠、睡眠呼吸暂停和不宁腿综合症等,成为越来越普遍问题。这些睡眠障碍不仅影响人的生活质量,还常伴随其他共病,如焦虑症、抑郁症、心血管疾病甚至癌症等。
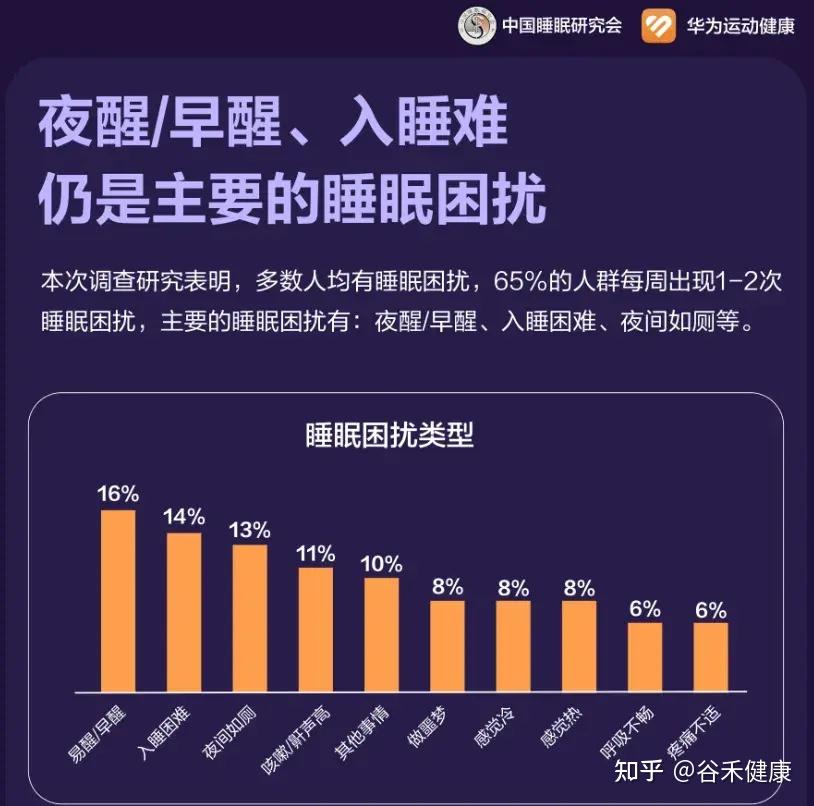
当前,失眠的治疗方法主要有药物治疗和心理疗法。例如,苯二氮䓬类药物虽然能快速缓解失眠症状,但常常伴随神经毒性、成瘾和耐受性等副作用。而认知行为疗法作为一种有效的心理治疗方式,依然缺乏熟练的治疗师,还有高昂的费用,令人望而却步。
当药物的副作用让人却步,心理疗法的门槛又难以触及,我们是否还有更安全、更普适的选择?
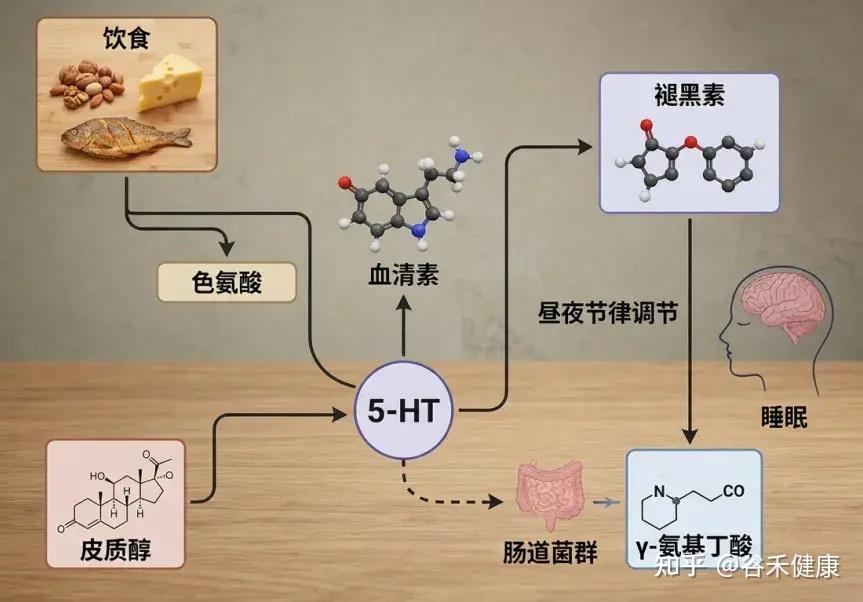
答案或许就藏在我们日常的饮食中。饮食不仅能通过营养成分直接作用于神经系统,还能通过调节肠道菌群这个第二大脑,间接影响我们的睡眠质量和昼夜节律。
例如,富含色氨酸的食物(如坚果和牛奶)有助于促进血清素及褪黑素的合成,而神经递质和激素对调节睡眠周期至关重要。
健康的肠道菌群能够通过调节神经递质和激素,促进更好的睡眠。例如,乳杆菌和双歧杆菌,能够产生GABA等神经递质;进而帮助改善睡眠深度和质量。
然而,饮食与睡眠的关联并不是千篇一律的,因为我们每个人体内都有一套独特的生物钟。对于习惯早起的晨型人来说,他们的进食节奏通常与肠道菌群的活跃周期保持一致,而“夜猫子”们往往习惯晚睡晚起,甚至在深夜进食。
那么,晨型人与夜猫子不同的进食时间和作息习惯,会对肠道菌群的昼夜节律产生怎样的影响?
饮食作为连接两者的关键桥梁,怎样才能更好地帮助我们协调自身节律与肠道菌群的作息,从而改善睡眠呢?
本文我们将探讨饮食中关键的食物成分与睡眠之间的关系,分析饮食如何通过调节昼夜节律和肠道菌群来影响我们的睡眠状态,列举各类改善睡眠质量的营养干预措施,为大家提供切实可行的饮食建议,为您的轻松入睡增添更多选择。
本文目录
01 睡眠调节中的关键营养素及生物活性化合物
氨基酸:色氨酸、甘氨酸
微量元素:镁、锌、铁
维生素:维生素 D、B 族维生素
多酚:芹菜素、槲皮素、白藜芦醇等
02 饮食模式对睡眠质量的影响
地中海饮食、生酮饮食、植物性饮食
饮食时间
03 肠道菌群与睡眠的关系
肠道菌群如何影响睡眠
神经递质合成(GABA等)
昼夜节律与肠道菌群的双向关系
早鸟型or夜猫子型?不同睡眠类型的肠道菌群
饮食与微生物干预措施
04 增强睡眠的功能性食品
酸樱桃汁和褪黑素
猕猴桃和血清素
草本茶与镇静植物化合物
甘氨酸、L-茶氨酸和CBD
05 营养睡眠干预的实际应用与个性化营养方法
睡眠健康的一般饮食建议
场景化食谱与搭配建议
饮水与睡眠(补水节奏、起夜、微醺)
饮食与生活方式的协同作用(正念饮食、光照)
睡眠障碍:个性化营养方案

氨基酸:色氨酸、甘氨酸
✦ 色 氨 酸
色氨酸是一种必需氨基酸,意味着我们的身体无法自行合成它,而必须通过食物获得。色氨酸是合成血清素和褪黑素的重要前体,这两种神经递质对于调节我们的睡眠周期至关重要。特别是,褪黑素帮助信号传递,让我们的身体准备入睡。
无论是通过富含蛋白质的食物还是补充剂摄入色氨酸,都与缩短睡眠潜伏期和改善主观睡眠质量有关。
然而,色氨酸在经过血脑屏障进入大脑时,会与其他大型中性氨基酸(LNAAs)争夺运输通道。因此,膳食中碳水化合物与蛋白质的比例也会影响色氨酸在大脑中的可用性。如果你的饮食中碳水化合物的比例适当,就能更好地促进色氨酸的有效运输,有助于改善睡眠。
注:目前的共识倾向于高碳水、低蛋白的组合最有利于色氨酸进入大脑。研究显示,高升糖指数(高Gl)碳水化合物可能比低Gl碳水化合物更能显著提升Trp/LNAA比率。
来源
小贴士
早餐搭配全麦面包或燕麦粥食用富含色氨酸的食物(如鸡蛋、牛奶)。
下午茶喝一杯牛奶或吃一片全麦饼干,配合少量坚果。
睡前仪式一杯温牛奶,不仅含色氨酸,更重要的是其舒缓的温度也有助于褪黑素分泌。
在摄入色氨酸补充剂或富含色氨酸的食物时,避免吃入大量肉类或乳制品。
✦ 甘 氨 酸
甘氨酸是一种非必需氨基酸,通过在中枢神经系统中作为抑制性神经递质发挥促进睡眠的作用。
研究表明,口服甘氨酸补充剂可以改善主观睡眠质量并缩短入睡潜伏期。这种效果可能与甘氨酸降低核心体温有关,而降低体温是身体准备入睡的重要生理信号。
来源
小贴士
避免空腹大剂量:甘氨酸在高浓度下可能刺激胃黏膜,建议随餐或餐后服用。
搭配富含维C食物:维生素C能促进胶原蛋白合成,间接支持甘氨酸的代谢循环。
适量饮水:甘氨酸是水溶性的,充足的水分有助于维持体内代谢平衡。
在严重失眠时,甘氨酸(负责降温/放松)与褪黑素(负责启动睡眠)联合使用可能效果更佳。
微量元素:镁、锌、铁
✦ 镁
镁在睡眠调节中发挥着关键作用,它通过调节N-甲基-D-天冬氨酸(NMDA)受体和GABA系统的活性帮助我们入睡,这两个系统对催眠至关重要。
研究发现,镁缺乏与夜间觉醒次数增加和慢波睡眠减少相关,因此,确保摄入足够的镁对获得高质量的睡眠至关重要。
✦ 锌
锌是一种微量矿物质,具有抗氧化和神经调节特性,参与调节睡眠结构。
针对婴儿和学龄前儿童的研究表明,血清锌水平与睡眠时长之间存在正相关关系。这意味着锌的摄入可能与更长的睡眠时间有关。
锌可能通过影响突触可塑性和调节谷氨酸能神经递质来改善睡眠。
✦ 铁
铁是大脑健康的另一重要元素,尤其是在调节睡眠-清醒周期时起着关键作用。
铁缺乏与不宁腿综合症(RLS)有关,这是一种在休息时会感觉到不适并有强烈想抖腿的冲动的疾病。补充铁可以帮助缓解这些症状,同时改善睡眠质量。因此,获得足够的铁对维持良好的睡眠也是非常重要的。
来源

小贴士
吃富含铁/锌的植物食物(如菠菜、豆类)时,搭配富含维C的食物(如橙子、番茄),可显著提高吸收率。
避免过量咖啡/茶:咖啡因和鞣酸会抑制铁和锌的吸收,建议在餐后1小时再饮用。
动物性食物中的血红素铁(来自肉类)比植物性非血红素铁更容易被人体直接吸收。
维生素:维生素D、B族维生素
✦ 维生素D
维生素D在多种与睡眠调节相关的脑区中存在受体,包括下丘脑。
观察性研究发现,维生素D水平低与睡眠障碍的风险增加有关,特别是短睡时间和睡眠效率差。这可能与维生素D在调节炎症反应和促进褪黑素合成中的作用有关,褪黑素是调节睡眠的重要激素。
来源
维生素 D 是唯一一种人体可以通过皮肤在阳光下自行合成的脂溶性维生素。虽然食物是重要补充,比如蘑菇、香菇、三文鱼、燕麦奶、杏仁露等,但更重要的维生素 D 来源于晒太阳。
小贴士
晒背:每天中午前后(10:00-14:00)暴露手臂和腿部皮肤 15-30分钟,无需涂抹防晒霜。
注意吸收:维生素D是脂溶性的,建议随餐食用以提高吸收率。
避免过量:长期过量摄入可能中毒,每日上限通常为4000 lU。
✦ B族维生素
B族维生素,尤其是B6(吡哆醇)、B9(叶酸)和B12(钴胺素),在神经递质代谢中发挥着重要作用。维生素B6对于将色氨酸转化为血清素至关重要,而叶酸和维生素B12则参与支持褪黑素合成的甲基化过程。缺乏这些维生素可能导致睡眠问题,如失眠和睡眠片段化。
来源

小贴士
B12 是唯一一种几乎只存在于动物性食物中的 B 族维生素。素食者需通过强化食品或补充剂获取。
B族维生素属于水溶性,容易随尿液排出,因此需要每日通过饮食规律补充。
多酚:芹菜素、槲皮素、白藜芦醇…
多酚,尤其是存在于水果、蔬菜、茶和可可中的类黄酮,因其神经保护和促进睡眠的特性而备受关注。
类黄酮如芹菜素(在洋甘菊中发现)和槲皮素通过与GABA_A受体的相互作用,展现出抗焦虑和镇静效果。
其他多酚化合物,如白藜芦醇(存在于葡萄和浆果中)和表没食子酸没食子酸酯(EGCG)(来自绿茶),具有抗炎和抗氧化效果。
这些化合物可能通过降低全身性炎症和氧化应激间接促进睡眠。这些作用至关重要,因为慢性炎症和氧化应激的升高与失眠以及其他睡眠障碍密切相关。
来源
芹菜素:芹菜(尤其西芹含量极高)、洋葱、大蒜、欧芹、香菜、罗勒;苹果、梨、葡萄等。
槲皮素:苹果(果皮含量极高)、覆盆子、桑葚、樱桃、葡萄;洋葱、菠菜、羽衣甘蓝、番茄;小麦、大麦、燕麦等。
白藜芦醇:葡萄(果皮)、红酒(发酵过程产生)、桑葚、蓝莓;花生、核桃等。
小贴士
芹菜素和槲皮素属于脂溶性或半脂溶性物质,与橄榄油、坚果或牛油果同食可促进吸收。
槲皮素主要集中在苹果的果皮中,吃苹果记得连皮一起吃。
肠道菌群能将多酚转化为活性代谢物(如阿魏酸),因此富含膳食纤维的食物有助于提高利用率。
褪黑素和L-茶氨酸
褪黑素是主要由松果体分泌的内源性激素,是调节昼夜睡眠-清醒节律的关键因素。而外源性褪黑素(可以通过补充剂或一些食品如酸樱桃获取)越来越多地被用于改善睡眠,特别是对那些有昼夜节律障碍的人群。研究表明,褪黑素补充剂可以有效缩短入睡所需时间,增加总睡眠时间,并改善整体睡眠质量。
L-茶氨酸是一种主要存在于绿茶中的氨基酸,它展现出促进放松而不引起镇静的潜力。临床试验证实,L-茶氨酸补充可以改善睡眠质量,减少睡眠干扰,并通过调节大脑α波活动和GABA水平增强睡眠的恢复阶段。

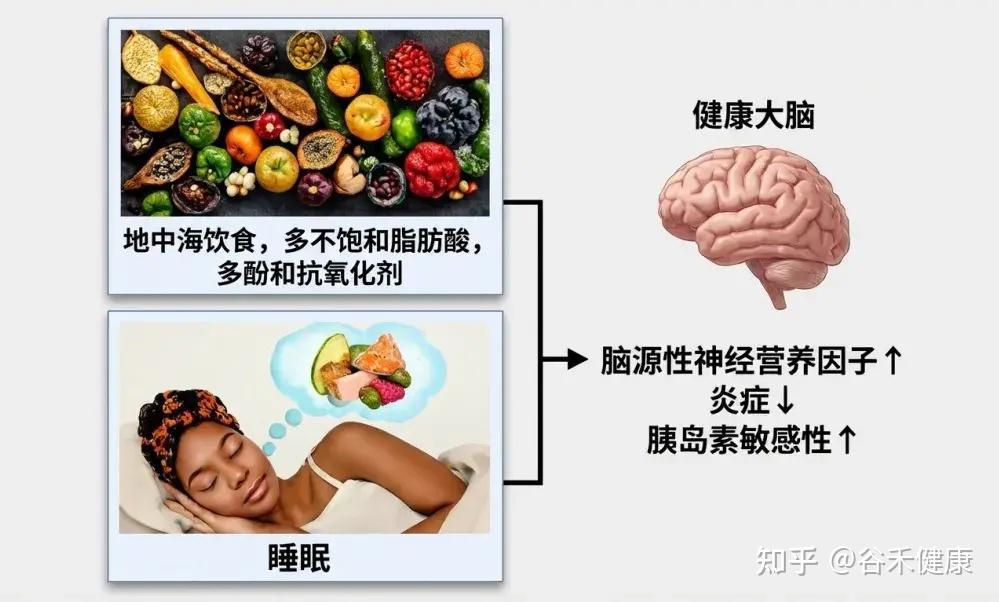
地中海饮食
地中海饮食(MD) 特点
研究表明,遵循这种饮食模式与更好的睡眠效果密切相关。许多研究发现,地中海饮食能够提高睡眠持续时间、效率和主观睡眠质量,这可能与其抗炎和抗氧化特性有关。
关键营养成分
这种饮食富含多酚、ω-3脂肪酸和复杂碳水化合物,这些成分有助于合成褪黑素,减少氧化压力,并增强血清素的传递,这些都是调节睡眠所需的关键途径。此外,地中海饮食中的镁丰富食物,也可能通过调节NMDA和GABA受体来促进睡眠。
Li Rang等人的一项大型横断面研究报告称,对地中海饮食的更高依从性与老年人失眠症状风险的降低相关。地中海饮食中普遍存在的复合碳水化合物通过增加色氨酸在大脑中的可用性,可能有助于睡眠的开始和持续。
地中海饮食对睡眠的影响
生酮饮食
生酮饮食的特点
生酮饮食(KD)是一种高脂肪、极低碳水化合物的饮食模式,因其在治疗癫痫、肥胖和代谢疾病方面的疗效而受到关注。近期研究表明,生酮饮食可能还会影响睡眠结构。
对睡眠结构的影响
研究发现,处于生酮状态时,慢波睡眠(SWS)的比例增加,而快速眼动睡眠(REM)减少。这种变化可能与腺苷信号传导和能量代谢的改变有关。
一项关于癫痫儿童的临床试验显示,生酮饮食能改善睡眠质量,通过减少夜间觉醒和提高睡眠效率。同时,酮体本身可能具有神经保护和抗炎作用,有助于稳定与睡眠调节相关的神经网络。
复杂的影响
然而,生酮饮食对睡眠的影响并非一成不变。饮食的初期阶段常伴随生酮适应症状,这可能暂时干扰睡眠,因此饮食的坚持时间和个人的代谢反应是影响睡眠的重要因素。
植物性饮食
植物性饮食的特点
植物性饮食,强调以水果、蔬菜、豆类、全谷物、坚果和种子等植物来源的食物为主,同时尽量减少或不摄入动物产品。流行病学数据表明,植物性饮食者往往报告的睡眠质量优于杂食者。
对睡眠的积极影响
植物性饮食中的高纤维含量有助于改善肠道微生物组成,增强肠-脑轴信号,这可能有助于改善睡眠。此外,植物性饮食丰富的植物营养素和抗氧化剂形成的抗炎特性,可能有助于降低全身性炎症,而炎症与睡眠质量差有关。
营养素的关注
然而,植物性饮食需要仔细规划,以防止维生素B12、铁和ω-3脂肪酸等营养素的缺乏,这些营养素对良好的睡眠调节至关重要。有研究表明,这些微量营养素的低水平可能会影响睡眠质量。
饮食时间
新兴研究表明,在饮食中,不仅食物的选择很重要,饮食的时间也对睡眠健康有显著影响。不规律的就餐时间、夜间进食、跳过早餐与昼夜节律失调、入睡延迟和睡眠质量降低相关。
饮食时间对睡眠的影响
晚间食用高脂肪或高能量餐食可能会通过干扰昼夜节律激素的分泌(包括褪黑激素)来影响入睡和睡眠深度。相反,建议在睡前约4小时摄入高升糖指数的食物,这可能有助于减少入睡的延迟,表明餐食的合理时间安排能够改善睡眠。
限时饮食的益处
限时饮食(TRE)要求在一天中的特定时间窗口内进食。这种饮食方式已经显示出增强昼夜节律,从而提高睡眠效率和持续时间的潜力。

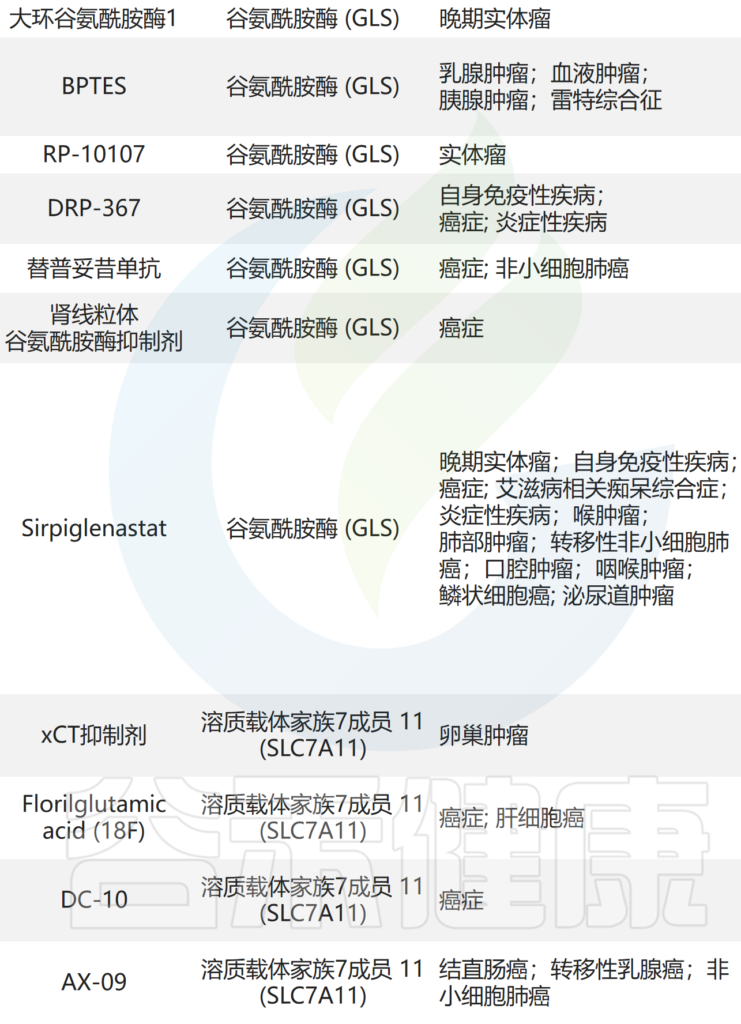
肠道菌群如何影响睡眠
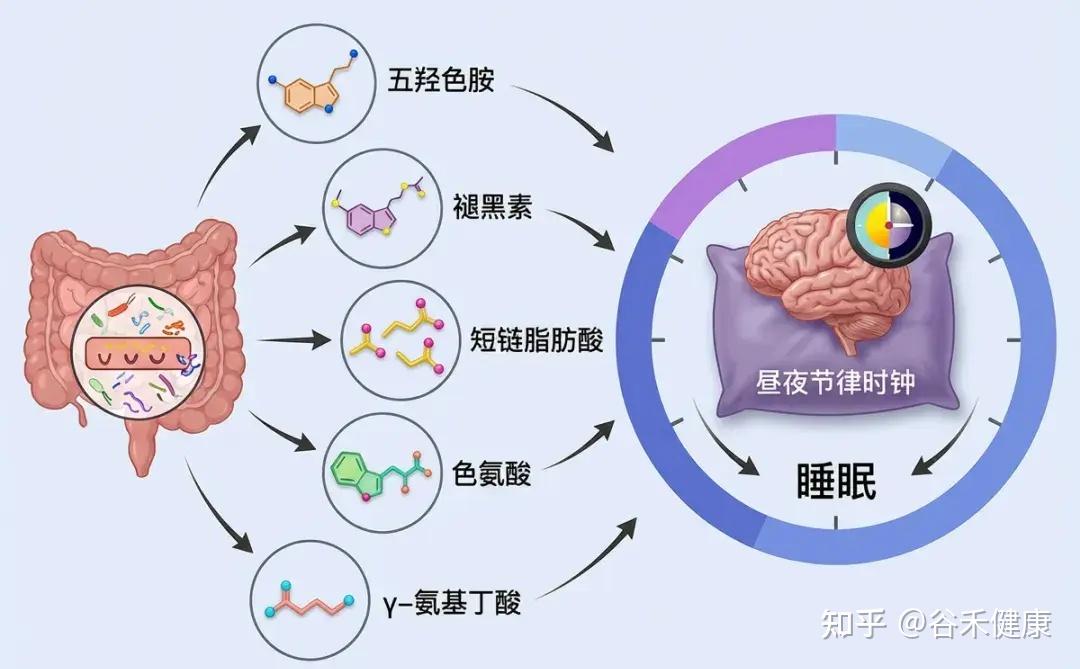
新兴研究表明,肠道微生物群可以通过多种机制影响睡眠,包括调节免疫系统、调节代谢途径、产生神经递质以及与昼夜节律系统的相互作用。
神经递质合成
部分肠道细菌能够合成关键的神经递质,如GABA(γ-氨基丁酸)、血清素和多巴胺。人体约90%的血清素(睡眠激素褪黑素的前体)产生于肠道。这些神经递质的水平直接影响睡眠-觉醒周期的调节。
GABA
GABA(γ-氨基丁酸)是一种非蛋白质氨基酸,是大脑中主要的抑制性神经递质,主要负责抑制神经活动。它在缓解压力和调节睡眠方面起着重要作用。GABA通过引导突触后神经元的超极化过程,帮助产生抑制性的电信号。这导致细胞内负电荷增加,使神经细胞更难以被激活,从而减少神经冲动的产生。
一些研究表明GABA补充可能有助于睡眠质量。
一项研究显示,每天给失眠患者提供300毫克GABA,连续四周,与提高睡眠效率和降低睡眠潜伏期相关。
另一项研究,用含GABA和L-茶氨酸的混合物可减少睡眠潜伏期,并增加快速眼动和非快速眼动期。
GABA的饮食来源:
普通豆类和豌豆芽、大米、燕麦、小麦、菠菜、土豆以及许多蔬菜。
通过饮食摄入GABA有助于提高体内的水平,但食物中含量相对还是较少。研究表明,特定的肠道微生物能够有效地合成GABA,增加其生物利用度。
乳杆菌和双歧杆菌是GABA产生的关键成员
双歧杆菌在肠道粘液层定植:具有将谷氨酸、谷氨酰胺和琥珀酸转化为GABA的酶机制。
乳杆菌 :多个菌株都具备GABA合成能力
– Limosilactobacillus fermentum L18:
高效分泌GABA的专业户,通过增加连接蛋白的浓度和有益肠道细菌的丰度来增强肠道屏障。
– 鼠李糖乳杆菌GG:
除了保护肠道屏障外,还可以通过调节肠脑轴来提高海马和杏仁核中的脑源性神经营养因子(BDNF)和GABA受体水平。
– 短乳杆菌:
通过发酵产生高剂量GABA,可以提高肠道中有益细菌的相对丰度和SCFA的水平,进而可以上调GABA能和5-羟色胺能神经递质的mRNA和蛋白质表达水平。这将导致θ和δ波以及非快速眼动睡眠的显著增加。
免疫系统调节
肠道微生物通过调节炎症细胞因子(如IL-6和TNF-α)来影响睡眠结构。健康的肠道菌群能促进短链脂肪酸(SCFA)等抗炎代谢物的产生,从而改善睡眠连续性;反之,慢性低度炎症通常与肠道菌群失调有关,这也是导致失眠和睡眠碎片化的重要因素。
代谢途径与屏障功能
微生物发酵产生的短链脂肪酸(乙酸盐、丙酸盐、丁酸盐)已被证实能穿过血脑屏障,通过调节神经炎症和神经可塑性来优化睡眠调节。
注意:慢性或周期性纤维缺乏可能导致黏膜糖蛋白作为营养来源分泌,进而侵蚀结肠黏膜屏障。这反过来可能导致肠道屏障功能障碍,进而升级为致命的结肠炎。
研究表明,某些细菌菌株,包括Lachnospiraceae UCG004 ,Odoribacter,参与短链脂肪酸的产生,有助于延长睡眠时间。短链脂肪酸可能通过调节GABA和血清素的合成来影响睡眠。GABA是神经系统中的主要抑制性神经递质,通过抑制唤醒通路在促进睡眠中发挥重要作用。
昼夜节律与肠道菌群的双向关系
光是负责人类昼夜节律最佳功能和精准调节的主要因素,该时钟位于下丘脑的视交叉上核。然而,许多其他刺激和环境信号也可能显著影响昼夜节律,包括用餐时间、食物类型、运动、体温,甚至社交互动。
肠-脑轴是一个复杂的生物系统,促进大脑与肠道之间的双向通信。肠道微生物群在调节这种相互作用中发挥了关键作用,影响着多种信号通路。
微生物群的多样性和组成会发生变化,这些变化受到一天中的时间、所摄入食物的类型和禁食习惯等影响。因此,异常或单一的饮食习惯可能对生物钟的正常功能产生负面影响。此外,肠道微生物群与昼夜节律之间是一种双向关系,彼此的干扰和紊乱会相互影响。
一方面,宿主昼夜节律的紊乱(如轮班工作、时差或不规律饮食)会导致微生物生态失调,进而加剧睡眠问题。
昼夜节律紊乱对肠道菌群的具体表现:α‑多样性显著降低;有害菌如 Ruminococcus torques、Streptococcus、Alloprevotella增多,益生菌如 Lactobacillus johnsonii、Lactobacillus、Bifidobacterium减少。
菌群失调与睡眠障碍
肠道菌群失调与多种睡眠障碍的病理生理学密切相关,包括失眠、阻塞性睡眠呼吸暂停(OSA)和不宁腿综合征(RLS)。
例如,阻塞性睡眠呼吸暂停患者常表现出特征性的肠道菌群改变,具体为微生物多样性降低及促炎细菌丰度增加。这种失调引发的全身性炎症可能通过肠-脑轴反馈至中枢神经系统,进一步恶化睡眠病理。
另一方面,通过规律的作息维持同步的昼夜节律,可促进健康的微生物群,进而反哺睡眠质量。
固定进食窗口产生 “餐后高峰‑空腹低谷” 的碳源波动。
产短链脂肪酸的菌(如Faecalibacterium, Roseburia)在餐后 2‑4 h 达到丰度峰值;胆汁酸代谢菌(如Clostridium spp., Bacteroides)在胆汁分泌高峰时活跃。
规律作息降低全身 IL‑6、TNF‑α,使肠道屏障更完整(ZO‑1、occludin 表达↑),阻止致炎菌(如Enterobacteriaceae)越过黏膜进入血液。低炎症环境进一步促进产短链脂肪酸的菌代谢活性,形成正反馈。
规律作息通过同步中枢与外周时钟、固定进食窗口、调节激素与免疫状态,形成一个“时间‑营养‑免疫”三位一体的生态网络,从而塑造更为多样、功能更完整的肠道菌群。
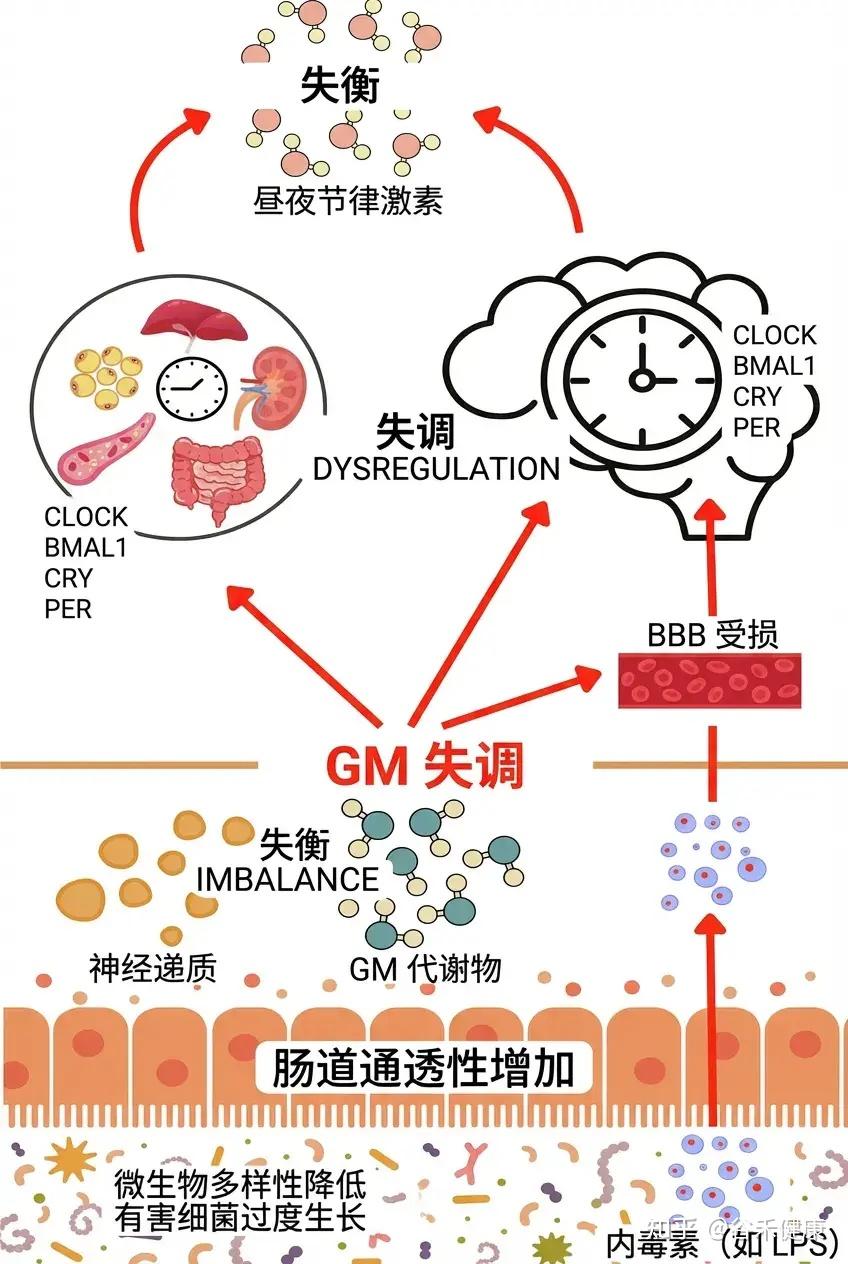
然而,这种双向调节在每个个体身上的表现并非千篇一律。要真正理解微生物组与生物钟的深层联系,我们不仅要看作息是否规律,还要看每个人独特的生物钟设定,你是早鸟型还是夜猫子型,本身就不一样。
早鸟型or夜猫子型?不同睡眠类型的肠道菌群
什么是睡眠类型,有哪几种常见的?
所谓睡眠类型,指的是一个人的昼夜节律表型,通俗来说,就是你在何时醒来、何时活跃以及何时入睡的天然偏好。
根据人体内部的昼夜节律,我们通常将人分为“晨型人”和“夜型人”(这两类又可细分为极端型和温和型)。此外,研究还确认了第三种类型:中间型(Neither-types)。
有趣的是,只有约40%的成年人属于典型的晨型或夜型,其余约60%都属于中间型。这类人群的作息往往更具弹性,能够根据具体情况或个人喜好灵活调整睡眠和活动时间。
早起鸟 和 夜猫子 在日常生活中有何不同?
这两类人的表现截然不同。晨型人倾向于早睡早起,他们的作息与日出日落的时间紧密同步,通常在一天中的早些时候达到身心状态的巅峰。
相反,夜型人倾向于晚睡晚起,他们的身心最佳状态通常出现在一天的后半段。然而,这也带来了一个问题:如果在不得不早起的情况下,他们更有可能面临精神不振的困难。
当夜型人被迫在他们生物钟认为的“深夜”(比如早上 7 点)进食早餐时,肠道代谢系统尚未完全苏醒(胰岛素敏感性低、消化酶分泌少)。
我们的肠道细菌与这种睡眠生物钟有关吗?
早起时的不适感可能不仅仅是大脑的问题,还可能与肠道有关。
研究发现,不同睡眠类型的人群拥有不同的肠道微生物群。例如,与晨型人相比,夜猫子人体内的 肠杆菌目(Enterobacteriales) 和 肠杆菌科(Enterobacteriaceae) 数量往往更高。
可能与延长睡眠时间相关的菌群包括:
微生物群-肠道-大脑轴如何影响昼夜节律
例如,硒单胞菌目(Selenomonadales)和Negativicutes 丰度较高的个体可能面临更高的失眠风险。相反,像Anaerofilum和肠杆菌目这样的细菌可以影响肠道上皮的时钟基因,从而增加成为夜猫子的概率,而夜猫子人与较高的体重相关。
给晨型人(早鸟型)的建议
利用早餐优势: 你的胰岛素敏感性在早晨极高。把一天中大部分的碳水化合物(全谷物、水果)放在早餐吃,不仅代谢快,还能为一整天提供能量。
警惕晚上能量透支: 晨型人容易在傍晚感到能量崩溃。
晚餐摄入适量的复合碳水化合物(如红薯、糙米),这有助于血清素的合成,不仅能维持情绪稳定,还能为入睡提供充足的褪黑素原料,防止“睡太早、半夜醒”的情况。
给夜型人(夜猫子)的策略
“时间限制进食法(TRE)”是关键:对夜型人来说,最危险的不是晚睡,而是晚吃。
在睡前 3-4小时 坚决停止进食。这给肠道留出了宝贵的清洗时间,防止细菌在不该繁殖的小肠内过度生长。
既然体内时钟慢,如果觉得需要,可以靠光来校准。早起第一件事接触阳光,这是告诉肠道菌群,新的一天开始了。
补给策略: 夜型人往往缺乏维生素D(晒太阳少)和B族维生素。结合肠道菌群检测相关的营养指标,如有缺乏则针对性补充这些营养素,有助于稳定生物钟基因的表达。
饮食与微生物干预策略
基于“饮食-微生物-睡眠”的调节路径,利用益生菌、益生元及膳食纤维进行干预,为管理睡眠障碍提供了有前景的新途径。
膳食纤维与益生元
膳食纤维(富含于水果、蔬菜、全谷物)作为微生物发酵的底物,能显著促进SCFA的产生。
对照喂养研究发现,较高的纤维摄入量与更长的慢波睡眠(深睡眠)时间相关,而高饱和脂肪摄入则导致睡眠质量下降。
益生元(如菊粉、FOS、GOS)被证明能增加非快速眼动睡眠(NREM),并提高机体对压力诱导的睡眠中断的抵抗力。
益生菌(精神益生菌)
益生菌在改善睡眠、缓解压力方面的潜力已在多项临床及临床前研究中得到证实。特定的益生菌菌株(有时被称为“精神益生菌”)通过调节神经递质途径和下丘脑-垂体-肾上腺(HPA)轴发挥作用。
临床证据
Nishida等人的随机对照试验表明,每日摄入
加氏乳杆菌CP2305 可显著提高轻度睡眠障碍成人的睡眠效率并缩短入睡潜伏期,这归因于其降低唾液皮质醇水平的能力。
机制研究
最近的研究进一步明确了特定菌株的神经化学机制。例如,鼠李糖乳杆菌GG被证明能增强海马和杏仁核中GABA受体的表达,通过迷走神经信号传导发挥抗焦虑和促睡眠作用。
代谢调节
长双歧杆菌1714和植物乳杆菌P8显示出降低皮质醇水平、改善主观睡眠质量的效果。这些菌株通过增加色氨酸的可用性并调节犬尿氨酸途径,增强中枢血清素的合成,从而巩固睡眠结构。
-只改睡眠时间而不管饮食,菌群会恢复吗?
部分恢复(尤其是夜间褪黑素对 Akkermansia 有正向作用),但若进食时间仍散乱,底物供给的节律仍缺失,恢复幅度有限。
-是否有推荐的作息模式?
目前证据最稳妥的模式是 “早起早睡 + 8‑10 h 进食窗口 + 早晨强光+ 低GI/高纤维饮食”,这套组合在多项研究中均能提升 α‑多样性、短链脂肪酸产生和睡眠质量。
注:作息干预的效果往往在 2‑4 周 开始出现可检测的菌群变化(α‑多样性、特定属丰度),完整的 功能恢复(SCFA 产量、炎症标记下降) 通常需要 8‑12 周 的持续坚持。
小 结
肠道微生物组通过产生神经活性代谢物(如短链脂肪酸、血清素前体)、调节炎症及与昼夜节律的交互,成为睡眠调节的关键一环。未来仍需更多临床试验来确立具体的因果关系及主要效果。
近年来,功能性食品和(提供基本营养以外的健康益处的食品)在睡眠健康方面的作用引起了人们的关注。几种富含生物活性化合物的天然产物已被证明可以通过多种生物机制调节睡眠质量、潜伏期和持续时间,包括抗氧化活性、抗炎作用和神经递质调节。
酸樱桃汁和褪黑素
酸樱桃(如蒙特莫伦西品种)是褪黑素的自然来源,这种荷尔蒙对调节我们的睡眠-觉醒周期至关重要。研究表明,喝酸樱桃汁可以改善睡眠的持续时间和质量,这主要得益于其中的褪黑素含量和抗氧化特性。
在一项随机、双盲、安慰剂对照的研究中,研究人员发现,患有慢性失眠的成年人每天喝两次酸樱桃汁后,睡眠持续性有所改善。这一结果表明,酸樱桃汁可能有助于提升睡眠的稳定性。
另一项研究发现,健康成年人饮用蒙特莫伦西酸樱桃浓缩汁后,平均睡眠时间增加了约34分钟,且睡眠效率也有所提高。这种改善可能与酸樱桃中增加的褪黑素有关。

猕猴桃和血清素
猕猴桃富含抗氧化剂、维生素(特别是维生素C和E)、叶酸以及血清素前体,这使其成为促进睡眠的理想食物。
临床研究显示,睡前1小时食用两个猕猴桃能够显著改善睡眠的开始时间、持续时间和效率,尤其对有睡眠问题的人群效果明显。
注:老年人缺乏直接的临床试验数据;基于生理差异,推测同样的摄入方案可能仍有助于改善睡眠(通过抗氧化、纤维促进肠道健康、提供血清素前体),但效果幅度可能低于年轻人。
这种积极的效果可能与猕猴桃中丰富的血清素含量有关,因为血清素能促进褪黑素的合成,从而调节睡眠周期。此外,猕猴桃的抗氧化特性可能有助于减少氧化应激,而氧化压力与睡眠障碍的发生有一定关系。
草本茶与镇静植物化合物
多种草本茶因其镇静和抗焦虑的效果而被传统使用,其中洋甘菊、缬草、薰衣草、百香果花是较常研究的几种。
洋甘菊茶富含一种叫芹菜素的类黄酮,它能与大脑中的苯二氮卓受体结合,有助于促进困倦感并减少夜间醒来的次数。
缬草根中含有缬草酸,这种成分可以调节GABA活性,从而产生镇静效果。
有系统评估的研究发现,缬草制剂与安慰剂相比显著改善了睡眠质量,尽管不同研究之间的结果存在一定的差异。
薰衣草和百香果花茶(西番莲茶)也具有抗焦虑特性,可能通过调节中枢神经系统中与压力和警觉性相关的通路来促进睡眠。
Omega-3脂肪酸与睡眠
Omega-3多不饱和脂肪酸,尤其是二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),因其抗炎和神经保护特性而受到关注。近期的研究表明,Omega-3的补充可能与改善睡眠模式有关。
在一项随机对照试验中,研究发现儿童体内DHA水平较高与睡眠干扰显著减少相关。此外,补充富含DHA的鱼油也显示出能延长睡眠时间,并减少夜间觉醒的次数。
注意:儿童研究中常使用的剂量(如 600mg DHA/天)在成人身上可能产生不同的代谢反应。此外,成人的睡眠问题往往由压力、焦虑或环境因素主导,单纯补充 DHA 的效果可能不如在发育期大脑中显著。
这些潜在机制包括调节褪黑素的分泌、减少促炎细胞因子的水平,以及稳定神经元膜,而这些都是维持健康睡眠结构所必需的因素。

EPA 和 DHA 在改善睡眠中的作用是否存在协同或拮抗效应?
多项研究同时使用 DHA 与 EPA(常以鱼油形式)进行干预,均报告了睡眠质量的改善。例如,针对 2 型糖尿病患者的 14 个月随机对照试验显示,鱼油(DHA + EPA)显著降低睡眠障碍风险、提升睡眠时长,并与血浆 DHA + EPA 水平呈正相关。
日本的研究把 DHA + EPA(约 860 mg/天)与单独 EPA(约 1260 mg/天)或单独 DHA(约 1170 mg/天)进行比较,结果显示,高剂量的 DHA + EPA 组合在提升睡眠效率和主观评价方面优于单一成分,提示两者可能产生加和或协同效应。
现有证据倾向于 EPA 与 DHA 共同补充对睡眠具有协同或至少加和的正向作用,而非拮抗。两者在调节褪黑素合成、炎症抑制以及生物钟分子(如 RORα、BMAL1)表达方面可能互补,从而共同改善睡眠质量。
甘氨酸、L-茶氨酸和CBD
新兴的营养药物作为改善睡眠的辅助疗法越来越受到重视:
甘氨酸是一种非必需氨基酸,研究表明,在睡前服用甘氨酸可以改善睡眠的主观质量并减少疲劳。甘氨酸可能通过降低体温和增强血管扩张来发挥作用,这些生理变化对于入睡至关重要。
L-茶氨酸是一种独特的氨基酸,存在于绿茶中,能够促进放松而不引起嗜睡,主要是通过增加GABA、多巴胺和血清素的水平。临床研究报告显示,L-茶氨酸补充能够提高有广泛性焦虑症的个体的睡眠质量。
CBD(大麻二酚)是一种来源于大麻植物的非精神活性成分,显示出通过抗焦虑和镇痛的作用改善睡眠的潜力。尽管初步证据支持CBD在减轻特别是与焦虑相关的失眠中的作用,但仍需进行更为严谨的长期临床试验来验证其效果。

将科学研究成果转化为可操作的饮食策略,对改善睡眠健康至关重要。随着关于特定营养素、饮食模式和生物活性化合物影响睡眠的证据日益增强,临床实践和个体健康管理中应用这些见解的机会也在增加。
睡眠健康的一般饮食建议
研究表明了一些可以推荐给大众的饮食策略,以促进更好的睡眠。
增加有助于睡眠的营养素摄入
通过均衡饮食确保摄入如镁、锌、Omega-3脂肪酸和色氨酸等关键营养素,有助于神经递质合成和昼夜节律调节。
采用抗炎饮食模式
强调地中海饮食或植物性饮食,这些饮食富含抗氧化剂、纤维和抗炎化合物,能通过减少系统性炎症和氧化应激来提高睡眠质量。
注意用餐时间
调整饮食模式与昼夜节律相吻合,例如在白天吃大餐,避免临睡前吃重餐,以优化入睡效率。
限制干扰睡眠的食物
减少晚间咖啡因、酒精和高升糖指数食物的摄入,有助于预防睡眠碎片化和干扰。
这些一般建议作为基础,但“放之四海而皆准”的方法可能无法满足个体在睡眠需求和饮食干预反应上的差异。
场景化食谱与搭配建议(仅供参考)


饮水与睡眠
在饮食干预中,液体摄入同样扮演着重要角色。水分的补给不仅影响身体的整体健康,也对睡眠质量有显著的影响。确保身体在白天的充分水分补给,对于身体性能和睡眠质量都至关重要。
补水节奏
白天补水:成年人通常需要每天摄入大约2-3升水(包括食物中的液体)。通过均匀分配全日饮水量,确保在工作和活动期间补充足够的水分。
睡前限制:在睡前2小时限制摄入液体,尤其是咖啡因和酒精饮料,以减少夜间起夜的可能性,从而保持更好的睡眠连续性。
平衡口渴与起夜的矛盾
饮水的时机和量的把控也很关键。为了平衡口渴与夜间起床的矛盾,可以采取以下策略:
-早上喝水
在一天开始时,补充70%甚至更多的日需水分,有助于唤醒身体,并提高白天的精神状态。
-定时小口喝水
可以考虑将白天的饮水分成多个小量,避免一次大量饮水。
-适当的液体选择
在喝水的同时,适当选择含电解质的液体(如椰子水、运动饮料)来补水,尤其是在炎热的天气或剧烈活动后,有助于更快速恢复水分和电解质平衡。
酒精的微醺更助眠?
很多人习惯,睡前喝上几杯更容易入眠。
这里要说明的是,虽然酒精确实能缩短入睡时间,但它可能会严重破坏快速眼动睡眠,也许并不是优质睡眠。
取而代之,睡前选择温和的茶类(如洋甘菊茶、洛神花茶、薄荷茶等无咖啡因饮品)将更有利于放松和准备入睡。
饮食与生活方式的协同作用
正念饮食
正念饮食是一种基于“正念”理念的饮食方式,强调在吃饭时保持全神贯注,关注食物的色香味,聆听身体的饥饿和饱腹信号。研究表明,进食时的情绪和心理状态不仅影响用餐体验,还会影响消化、吸收,最终影响睡眠质量。
饮食与情绪的关系
情绪状态不佳,比如焦虑、压力大或分心时,会导致以下影响:
建议
在用餐时,尽量保持放松的状态,可以采取以下措施促进正念饮食:
光照与饮食的配合
研究表明,光照与饮食的结合对维生素D的合成及身体生物钟的调节都有显著影响。
“早餐 + 晨光”的最佳组合
在早晨接触自然光可以帮助重置身体的昼夜节律,促进褪黑素和皮质醇的分泌,增强清醒状态,进而有助于晚上入睡的质量。

在早餐时,尽早接触自然光,可以进行以下实践:
睡眠障碍:个性化营养方案
个性化营养的概念是将饮食建议根据个体的生物学、遗传和生活方式因素进行调整,这为管理睡眠障碍提供了很大潜力。
遗传因素
参与昼夜节律调节(如CLOCK和PER3基因)、褪黑素生成(如MTNR1B基因)和营养代谢(如FADS1基因与Omega-3脂肪酸合成)等基因的多态性可能影响睡眠模式及对饮食干预的反应。营养基因检测可帮助识别适合特定营养素或时钟营养策略的个体。
代谢健康状况
肥胖、胰岛素抵抗和代谢综合症与睡眠呼吸暂停等睡眠障碍密切相关。针对减重和血糖控制的个性化干预可显著改善睡眠结果。
肠道菌群分析
越来越多的研究表明,肠道菌群的组成与睡眠质量之间存在显著关联。健康的肠道菌群不仅能促进消化,还通过调节神经递质的合成,影响情绪和睡眠模式。肠道菌群检测可以帮助识别个体特有的微生物特征,从而为优化干预方案提供依据。基于检测结果,个性化的益生菌或益生元治疗可以针对特定菌群进行设计,旨在改善整体睡眠质量与健康。因此,加强对肠道菌群的关注,可能是提升睡眠质量的重要策略。
生活方式和行为因素
睡眠习惯(如规律的作息、优化睡眠环境和减少临睡前的刺激性活动)、身体活动水平、压力管理和工作时间(如轮班工作)与饮食模式相互影响。个性化计划应整合这些行为因素以最大化效果。
生物钟类型(晨型人与夜猫子型)也会改变对用餐时间的代谢反应。个性化方法结合遗传、肠道菌群、代谢分析和生活方式因素,可以为特定睡眠障碍(如失眠、睡眠呼吸暂停和延迟睡眠相位综合征)提供精准的饮食推荐。
未来个性化工具:可穿戴设备和数字健康
技术进步使得可穿戴睡眠追踪器、数字饮食日志和基于机器学习的预测模型得以应用于高度个性化和动态的营养-睡眠程序。可穿戴设备能够实时监测睡眠指标,为饮食调整提供即时反馈。数字健康平台也可以整合遗传、代谢和生活方式数据,生成个性化、适应性的营养推荐。
在改善睡眠质量的过程中,饮食调整是一种有效的干预方式。同时,借助肠道菌群检测,可以更深入地了解自身状态,从而在营养干预上做出更加明智的决策。
将个性化营养与肠道菌群的研究相结合应用于睡眠医学,不仅有助于提高个体效果,也有助于通过尽早识别高风险人群并积极干预,为广泛人群制定有效策略。
本文内容主要集中在睡眠问题的营养干预措施,此外,还有中草药方面的介入措施,详细信息请参见我们之前撰写的文章。
主要参考文献
Abou-Khalil R. Nutritional Interventions for Enhancing Sleep Quality: The Role of Diet and Key Nutrients in Regulating Sleep Patterns and Disorders. Food Sci Nutr. 2025 Dec 4;13(12):e71309.
Sejbuk M, Siebieszuk A, Witkowska AM. The Role of Gut Microbiome in Sleep Quality and Health: Dietary Strategies for Microbiota Support. Nutrients. 2024 Jul 13;16(14):2259.
Bautista J, Hidalgo-Tinoco C, Di Capua Delgado M, Viteri-Recalde J, Guerra-Guerrero A, López-Cortés A. The gut-brain-circadian axis in anxiety and depression: a critical review. Front Psychiatry. 2025 Oct 30;16:1697200.
Minari TP, Pisani LP. Unraveling the connection between the Mediterranean diet and sleep health: from biological mechanisms to clinical implications. Sleep Breath. 2025 Nov 28;29(6):369.
Zhao D, Zou B, Do QL, Wu SK, Shen Y, Yang Y, Kang JX, Su KP, Wang B. Circadian rhythms and gut microbiota Dysbiosis: emerging gut-brain axis pathways in insomnia pathophysiology and Therapeutics. Brain Behav Immun. 2025 Nov 30;132:106203.
BaHammam AS, Pirzada A. Timing Matters: The Interplay between Early Mealtime, Circadian Rhythms, Gene Expression, Circadian Hormones, and Metabolism-A Narrative Review. Clocks Sleep. 2023 Sep 6;5(3):507-535.
Chaput JP, McHill AW, Cox RC, Broussard JL, Dutil C, da Costa BGG, Sampasa-Kanyinga H, Wright KP Jr. The role of insufficient sleep and circadian misalignment in obesity. Nat Rev Endocrinol. 2023 Feb;19(2):82-97.

谷禾健康

氨基酸(Amino Acid, 简称AA ) 是蛋白质合成的基石。它们是正常细胞生长、分化和功能所必需的细胞结构元素和能量来源。
蛋白质是长链氨基酸。人的身体有数千种不同的蛋白质,每种蛋白质都有重要的作用。每种蛋白质都有自己的氨基酸序列。该序列使蛋白质呈现不同的形状并在体内具有不同的功能。
可以将氨基酸视为字母表中的字母。当你以不同的方式组合字母时,会组成不同的单词。氨基酸也是如此——当以不同的方式组合它们时,就会产生不同的蛋白质。
氨基酸代谢紊乱与许多病理状况有关,包括代谢疾病、心血管疾病、免疫疾病和癌症。就肿瘤而言,氨基酸代谢的改变不仅可以用作癌症进展的临床指标,还可以用作治疗策略。
由于肿瘤的生长发育依赖于外来氨基酸的摄入,因此越来越多的研究针对肿瘤相关氨基酸的代谢来选择性杀伤肿瘤细胞。此外,免疫相关研究证实,氨基酸代谢调节效应T细胞和调节性T细胞的功能,影响免疫细胞的功能。因此,确定氨基酸代谢途径中的靶点可能有助于疾病的治疗。
近日,浙江大学医学院附属第一医院,国家卫健委多器官联合移植重点实验室,中国医学科学院器官移植诊治重点实验室,以及器官移植重点实验室联合发表在《Signal Transduct Target Ther》综述成果详细阐述和讨论氨基酸代谢相关的代谢性疾病、心血管疾病和免疫相关疾病的研究及临床研究进展。
本文就该篇文章为主要参考,分享围绕肿瘤相关疾病中的氨基酸代谢研究,结合讨论肠道微生物群在蛋白质和氨基酸代谢中的作用,以期为靶向氨基酸代谢管理治疗提供理论依据。
官方氨基酸定义包括任何同时含有羧基和氨基的有机化合物(如下图)。它们都具有共同的结构特征氨基 (-NH3+)、羧酸根 (-COO–) 基团和与同一碳原子键合的氢键。
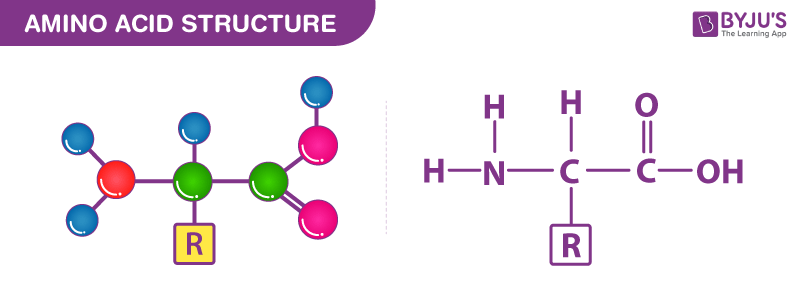
氨基酸有多少种?
氨基酸一共有20种,每种氨基酸在体内都发挥着非常特殊的作用,并通过其各自的氨基酸侧链来区分。从细菌到人类,都是由同一组 20 种氨基酸构成。
每个氨基酸都有 4 个不同的基团连接到 α-碳。它们的不同之处在于称为 R 基团的侧链。如下氨基酸的R基团不同:
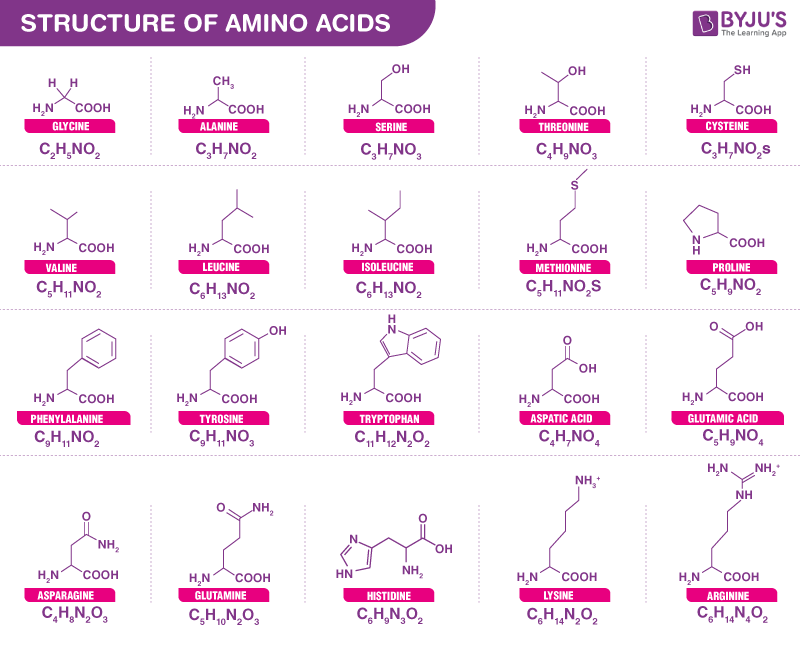
来源:byjus
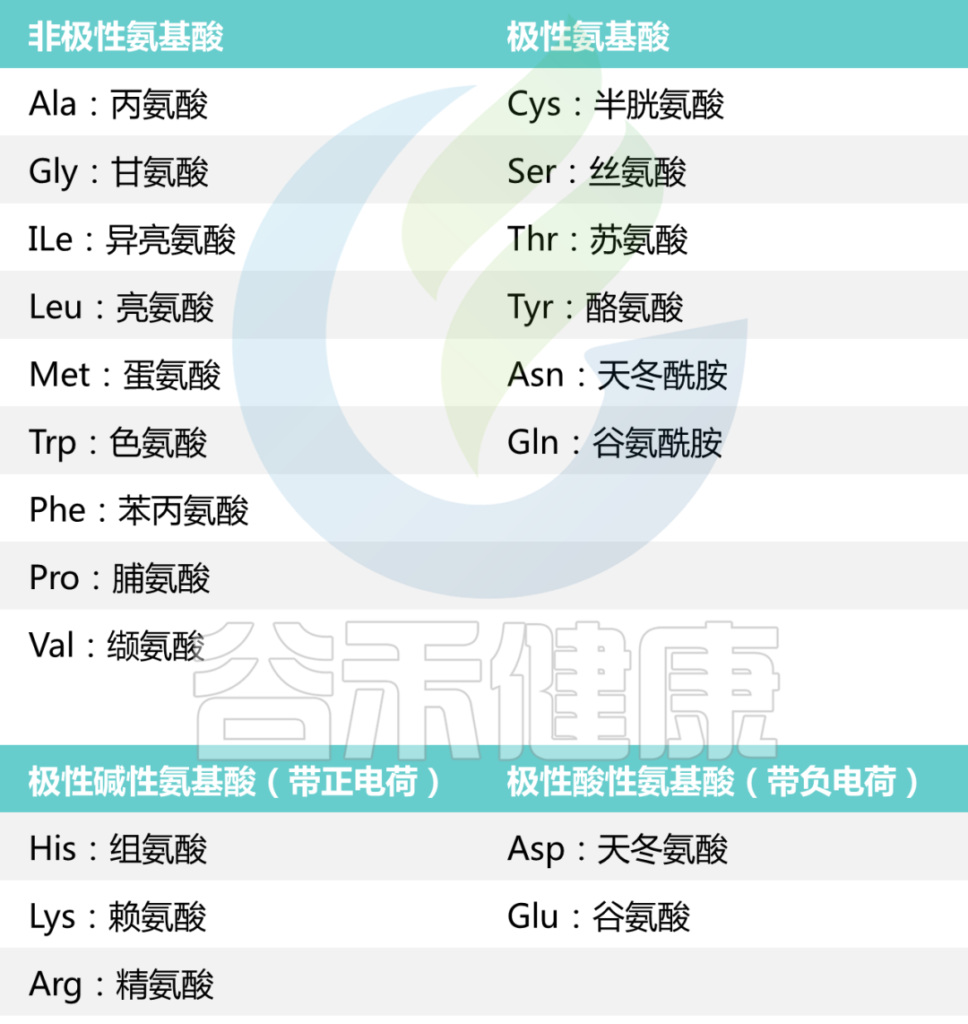
氨基酸还可以根据其结构和侧链分为其他组,
包括:
根据每种氨基酸中“R”基团的性质,氨基酸可以分为四个大类。
氨基酸可以是极性的、非极性的、带正电的或带负电的。
氨基酸是作为蛋白质构建块的基本分子。蛋白质由一条或多条氨基酸链(称为多肽)组成,其序列由基因编码。
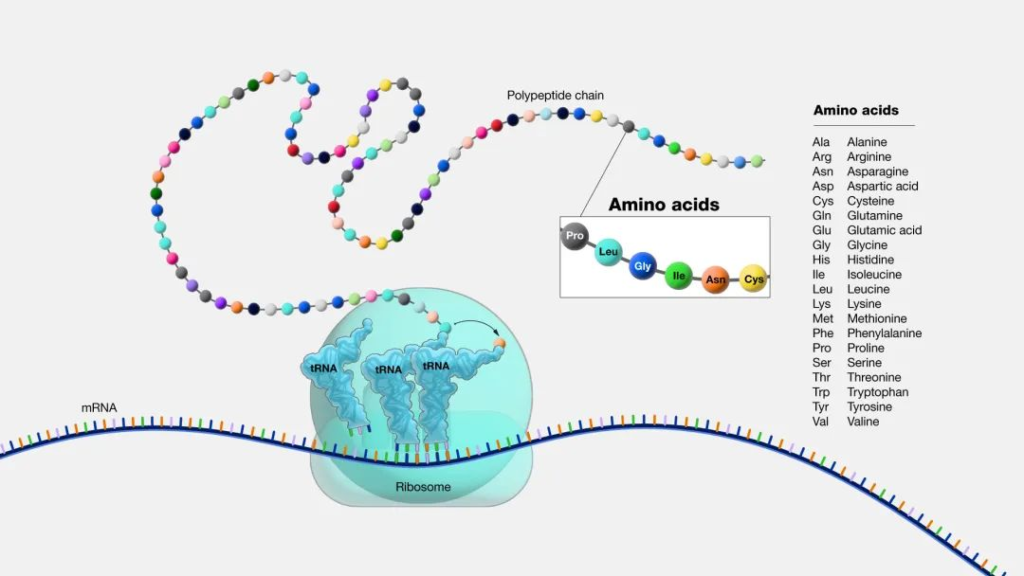
图源:National Human Genome Research Institute
这些氨基酸参与几乎所有生物过程并有助于:
伤口愈合、激素产生、免疫功能、肌肉生长、能源生产等。
身体需要所有氨基酸才能发挥作用并茁壮成长。有些可以在体内产生,而另一些则需要从食物中获取。
氨基酸有着有趣而悠久的历史。天冬酰胺是第一个被发现的氨基酸,由法国化学家 Louis Nicolas Vauquelin 和 Pierre Jean Robiquet 于 1806 年从芦笋营养中分离出来。
身体所需的 20 种氨基酸可进一步分为两个不同的类别:必需氨基酸和非必需氨基酸。
人体无法合成必需氨基酸,这意味着必须从食物中获取它们才能满足需求。
必需氨基酸有多少种?
必须通过饮食获得九种必需氨基酸,包括:
赖 氨 酸
赖氨酸是生长和组织修复以及多种激素、蛋白质和酶的产生所必需的。赖氨酸对于促进抗体、激素和酶的形成以及骨骼中钙的形成和固定是必需的。
亮 氨 酸
这种必需氨基酸参与蛋白质合成、伤口愈合、血糖控制、生长激素和新陈代谢。
异 亮 氨 酸
研究表明异亮氨酸有助于解毒、免疫功能和激素排泄。此外,在血红蛋白的形成、刺激胰腺合成胰岛素以及将氧气从肺部输送到各个部位方面起着至关重要的作用。
色 氨 酸
色氨酸是最著名的氨基酸之一,也是功能性氨基酸,参与维生素 B3 和血清素激素的产生。血清素是调节情绪、疼痛、食欲和睡眠的神经递质。
苯 丙 氨 酸
这种氨基酸有助于产生其他氨基酸以及多巴胺和去甲肾上腺素等神经递质,有助于维持健康的神经系统和增强记忆力。
苏 氨 酸
研究表明苏氨酸是胶原蛋白和弹性蛋白等结缔组织的基础,这些蛋白质为皮肤和结缔组织提供结构。它们还有助于形成血凝块,从而有助于防止出血。苏氨酸在脂肪代谢和免疫功能中也发挥着重要作用。
缬 氨 酸
缬氨酸支持大脑功能、肌肉协调和平静。缬氨酸参与肌肉生长、组织再生和产生能量。
组 氨 酸
这种氨基酸维持人体内髓鞘的健康,保护神经细胞免受损伤。参与许多酶促过程以及红细胞和白细胞的合成。组氨酸有助于制造一种称为组胺的大脑化学物质(神经递质)。组胺在身体的免疫功能、消化、睡眠和性功能中发挥着重要作用。
蛋 氨 酸
研究表明蛋氨酸可以保持皮肤弹性,并有助于强化头发和指甲。还用于治疗肾结石、保持皮肤健康,还用于控制病原菌的入侵。蛋氨酸有助于身体的组织生长、新陈代谢和解毒。蛋氨酸还有助于吸收必需矿物质,包括锌和硒。
在饮食中摄入多种氨基酸对于维持整体健康至关重要。任何这些关键必需氨基酸的缺乏都会导致严重的副作用,影响健康的几乎各个方面,包括免疫功能、肌肉质量、食欲等。
相比之下,非必需氨基酸可以由身体产生,这意味着通过吃的食物获取它们并不那么重要。
非必需氨基酸列表中共有 11 种氨基酸,包括:
精 氨 酸
精氨酸可刺激免疫功能、抗疲劳并优化心脏健康。一水肌酸在肝脏、胰腺和肾脏中形成,主要是在精氨酸、甘氨酸和蛋氨酸的帮助下形成的。有助于促进蛋白质和激素的合成、肾脏解毒、愈合伤口和维持健康的免疫系统。
丙 氨 酸
研究表明丙氨酸有助于新陈代谢,为肌肉、大脑和中枢神经系统提供能量。此外可以帮助清除体内毒素并参与葡萄糖和其他氨基酸的生产。
半 胱 氨 酸
半胱氨酸是头发、皮肤和指甲中发现的主要蛋白质类型,作为一种抗氧化剂,对于胶原蛋白的产生和皮肤健康至关重要。
谷 氨 酸
这种非必需氨基酸在中枢神经系统中充当神经递质,主要参与人脑的发育和功能。
天 冬 氨 酸
天冬氨酸有助于产生其他几种氨基酸,包括天冬酰胺、精氨酸和赖氨酸。主要参与将氮输送到身体细胞中、形成嘌呤和嘧啶以合成DNA、神经系统的发育和提高我们的身体耐力。
甘 氨 酸
甘氨酸有助于维持适当的细胞生长及其功能,并且在愈合伤口方面也起着至关重要的作用。此外,甘氨酸作为神经递质支持大脑健康。
脯 氨 酸
脯氨酸存在于胶原蛋白中,有助于促进关节健康、新陈代谢和皮肤弹性。主要参与胶原蛋白形成过程中的组织修复,防止动脉壁增厚和硬化(动脉硬化)以及新皮肤的再生。
丝 氨 酸
丝氨酸是脂肪代谢、免疫功能和肌肉生长所必需的。
酪 氨 酸
甲状腺激素-T3 和 T4 的产生以及合成一类神经递质和黑色素(我们的眼睛、头发和皮肤中发现的天然色素)方面发挥着至关重要的作用。
谷 氨 酰 胺
研究表明,谷氨酰胺支持许多代谢过程并为体内细胞提供能量。促进健康的大脑功能,是合成核酸(DNA 和 RNA)所必需的。
天 冬 酰 胺
天冬酰胺起到利尿剂的作用,可以优化大脑和神经细胞的功能。
氨基酸列表中的一些化合物也被认为是“有条件必需的”。这意味着它们通常不是身体所需要的,但在某些情况下可能变得必不可少,例如极端疾病或压力。
氨基酸缺乏的一些主要症状可能包括:
蛋白质缺乏症会影响任何饮食中氨基酸摄入不足的人。老年人和患有癌症等慢性病的人缺乏蛋白质的风险特别高,因为他们通常对蛋白质的需求增加而食物摄入量减少。
那些遵循纯素或素食饮食的人还应该仔细计划他们的饮食,以确保通过食用各种植物性蛋白质食物来满足他们的蛋白质需求。
富含氨基酸的食物包括植物性产品,如西兰花、豆类、甜菜根、南瓜、卷心菜、坚果、干果、奇亚籽、燕麦、豌豆、胡萝卜、黄瓜、绿叶蔬菜、洋葱、大豆、全谷物、花生豆类、扁豆等。
富含氨基酸的水果有苹果、香蕉、浆果、无花果、葡萄、甜瓜、橙子、木瓜、菠萝、石榴等。
其他动物产品包括乳制品、鸡蛋、海鲜、鸡肉、肉类、猪肉等。
从富含蛋白质的食物中摄入大量蛋白质不太可能引起任何负面影响。然而,有可能过量摄入蛋白质,尤其是蛋白质补充剂。
摄入过多蛋白质可能产生的一些副作用包括体重增加、肾脏问题、便秘和口臭,炎症以及肠道菌群的失调。
氨基酸是含有氨基和羧基的有机化合物,根据核心结构官能团的位置可分为α-、β-、γ-、δ-氨基酸,其中大部分参与蛋白质合成的是 α-氨基酸。
氨基酸参与生物合成、神经传递和其他生命过程。肽键连接氨基酸形成多肽链,多肽链经过翻译后修饰,有时与其他多肽链结合形成蛋白质。
九种氨基酸不能由其他化合物合成,必须从食物中获取,这些氨基酸从食物中被人体摄入后,除了用于蛋白质等生物分子的合成外,还可以通过氧化途径氧化为尿素和二氧化碳作为能量来源。
氧化途径以转氨酶介导的脱氨作用开始,将氨基转移至α-酮戊二酸,形成谷氨酸进入尿素循环。另一种产物酮酸进入柠檬酸循环,为生命活动提供能量(下图)。该循环提供某些氨基酸的前体,以及还原剂NADH,用于许多其他反应。
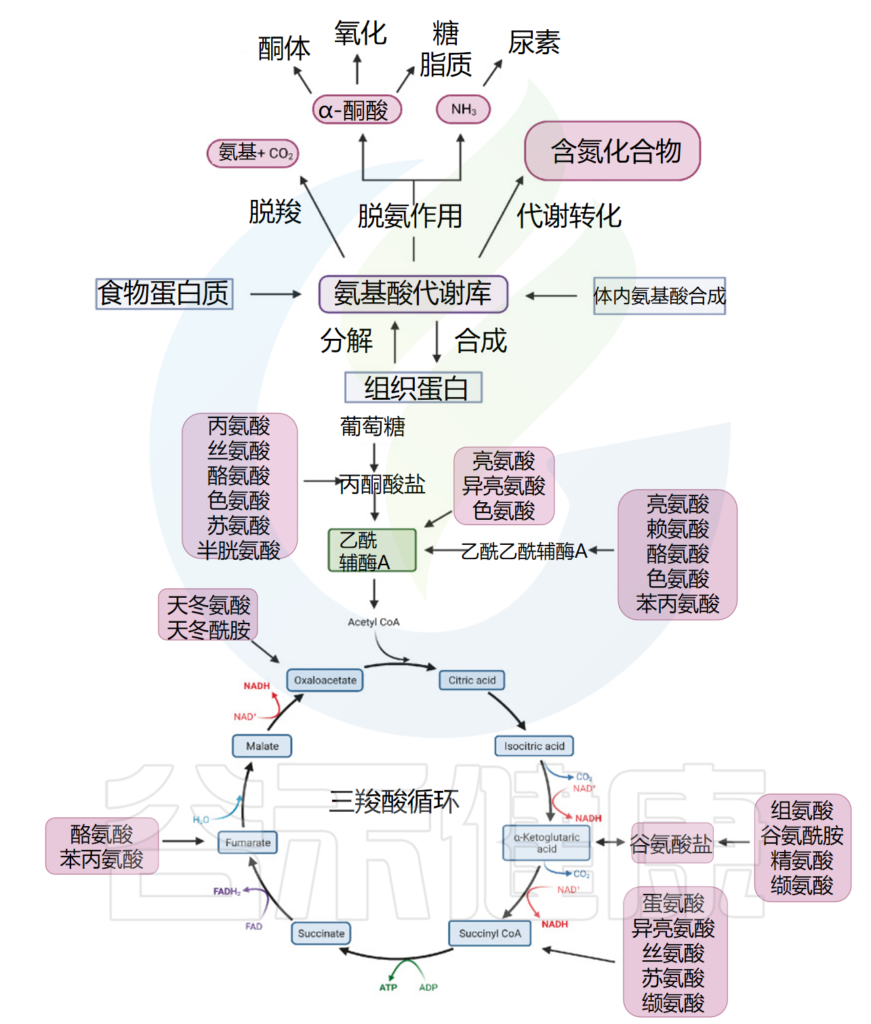
doi: 10.1038/s41392-023-01569-3
人体可以通过食物消化吸收、组织分解、内部合成三种途径获得氨基酸。
氨基酸代谢库中的氨基酸可脱酸,产生氨基酸和二氧化碳,或在代谢产物的转化中参与嘌呤、嘧啶等含氮化合物的合成;或者脱氨基产生α-酮酸和NH3。
根据不同的酶和途径,α-酮酸可以产生酮体,或参与氧化供能或糖和脂质的合成;NH3进入尿素循环。
细胞或细胞器对氨基酸的摄取需要氨基酸转运蛋白(AAT)的参与。不同的氨基酸依赖于特定的AAT,但氨基酸和转运蛋白并不是一一匹配的。多个AAT可以转运一个氨基酸,同一个转运蛋白也可以转运多个底物。AAT 除了充当氨基酸进出细胞的通道外,还充当感测氨基酸水平的探针和营养信号的引发剂。
根据结构和功能的多样性,AAT可分为不同的家族,其中溶质载体(SLC)超家族约占人类基因组编码的所有膜蛋白的20%,是最大的膜转运蛋白超家族。
根据底物特异性,AAT可分为中性、碱性和酸性类别,以及进一步的子类别,包括钠依赖性和钠非依赖性类型。从机制上讲,由于哺乳动物细胞(包括人类)细胞内液中的氨基酸浓度通常高于细胞外液中的氨基酸浓度,因此 AAT 通过离子共轭或氨基酸交换转运氨基酸以产生钠离子。
氨基酸除了是肽和蛋白质的组成部分外,还参与维持细胞生长、代谢和免疫的关键途径。
例如,哺乳动物雷帕霉素靶蛋白 (mTOR) 信号通路是调节蛋白质合成的主要机制。mTOR 系统包含雷帕霉素敏感复合物 1 (mTORC1) 和雷帕霉素不敏感复合物 2 (mTORC2)。mTORC1 被谷氨酰胺 (Gln)、精氨酸 (Arg) 和亮氨酸 (Leu) 激活,并通过 eIF4E 结合蛋白 1 (4E-BP1) 和核糖体蛋白 S6 激酶 1 (S6K1) 的磷酸化激活蛋白质合成。
此外,丙氨酸(Ala)可以通过抑制丙氨酸激酶来调节糖异生和糖酵解,从而维持饥饿肝脏产生的葡萄糖量。
TIPs:
糖异生是指非糖物质(如某些氨基酸、乳酸、丙酮酸和甘油等)在人体的肝脏和肾脏等器官中某些酶的催化下转变成糖原或葡萄糖的过程。简单说来,就是非糖物质转化为糖的过程。
糖分解是生物体取得能量的主要方式。生物体中糖的氧化分解主要有3条途径:糖的无氧氧化、糖的有氧氧化和磷酸戊糖途径。其中,糖的无氧氧化又称糖酵解(glycolysis)。生物在无氧条件下,从糖的降解代谢中获得能量的途径,也是大多数生物进行葡萄糖有氧氧化的一个准备途径。
糖酵解/糖原异生的差异比较
在某种程度上,糖异生可能被认为是糖酵解的逆过程,因为糖酵解将葡萄糖分解成两个丙酮酸分子以获得能量并供给三羧酸循环,而糖异生将两个丙酮酸分子构建成一个葡萄糖分子。然而,仅仅把糖异生看作糖酵解是不太正确的,因为这两者之间有一些重要的区别。
糖酵解是一种古老的代谢途径,为所有形式的细胞生命所共有,并且可以由所有细胞进行以获得能量(每个葡萄糖净2个三磷酸腺苷)。
相比之下,糖异生更具特异性:在人类中,它主要在肝细胞中进行,在某种程度上也在肾上腺皮质中进行。它还有一个更具体的目标:当血糖水平较低时,产生葡萄糖分泌到血液中。
在免疫方面,氨基酸参与免疫细胞增殖、分化和功能激活。例如,T细胞激活会上调多种氨基酸转运蛋白,包括SLC7A5,而SLC7A5的缺失会导致mTOR信号通路的激活和转录因子MYC的上调,从而抑制T细胞增殖。
当T细胞缺乏色氨酸(Trp)和 精氨酸 (Arg)时,活化的T细胞无法进入S期,这证明Trp和Arg是T细胞进入细胞周期的关键物质。此外,亮氨酸(Leu) 和异亮氨酸 (ILe) 的消耗会诱导 T 细胞进入 S-G1 期,然后停止分裂并死亡。
综上所述,氨基酸是维持生命所必需的有机化合物,是生物合成的原料,也是生命活动的能量来源。
接下来,我们针对支链氨基酸、天冬氨酸、谷氨酰胺、精氨酸、蛋氨酸五种氨基酸的代谢展开详细讨论,包括它们在癌症或其他疾病中的作用,希望给大家呈现一个更全面的视角,为疾病的发生发展和临床治疗方向带来更多的启示。
★
支链氨基酸(BCAA)是一类具有一个分支的脂肪侧链氨基酸,包括亮氨酸、异亮氨酸和缬氨酸。三种支链氨基酸占人体必需氨基酸肌肉中必需氨基酸的35%。
所有物种中支链氨基酸的分解过程都是相似的,最初通过支链氨基酸转移酶(BCAT)形成支链α-酮酸(BCKA),并将氮转移到氮受体(最常见的氮受体是α-酮戊二酸) (α-KG) 形成谷氨酸)。
第二步是支链α-酮酸脱氢酶(BCKDH)催化的不可逆限速反应,该反应被特定激酶BCKDH激酶(BCKDK)磷酸化并失活,并被蛋白磷酸酶1K(PPM1K)去磷酸化和激活。然后产物通过进一步氧化参与不同的生理活动。
促进肝脏和其他组织中的蛋白质合成
支链氨基酸参与多种生理过程。在代谢和信号通路研究方面,支链氨基酸尤其是亮氨酸,是mTOR信号通路的有效激活剂。亮氨酸可以与 Sestrin2(mTORC1 活性的负调节因子)结合,促进 mTORC1 激活,从而促进肝脏和其他组织中的蛋白质合成。
促进肝脏和骨骼肌对糖原的吸收,淋巴细胞增殖
支链氨基酸还可以促进肝脏和骨骼肌对糖原的吸收,并增强糖原的合成。
支链氨基酸对于免疫系统中免疫细胞的正常功能至关重要,通过氧化分解免疫细胞表达的脱氢酶和脱羧酶,促进淋巴细胞增殖和细胞毒性 T 细胞活化。
癌症患者的支链氨基酸循环水平发生了变化。
胰腺导管腺癌
最近的代谢组学回顾性研究表明,血浆支链氨基酸水平升高与胰腺癌风险增加相关,这一点在胰腺导管腺癌 (PDAC) 基因工程小鼠模型中得到了验证。可能是由于系统性蛋白质分解以满足致瘤期生长所需的支链氨基酸所致。
非小细胞肺癌 v.s. 胰腺导管腺癌
一项研究表明KRAS突变可以促进支链氨基酸代谢。尽管非小细胞肺癌 (NSCLC) 和 胰腺导管腺癌 (PDAC) 中存在 KRAS 激活和 P53 缺失,这两种肿瘤尽管初始事件相同,但对支链氨基酸的利用却不同。胰腺导管腺癌细胞倾向于分解并利用细胞外蛋白质获取氨基酸,而非小细胞肺癌细胞则通过分解循环支链氨基酸来提取氮。
为什么胰腺导管腺癌的支链氨基酸代谢低于周围正常组织?
胰腺导管腺癌细胞中的CBP和SIRT4结合BCAT2的K44位点,使该位点乙酰化,从而进一步促进BCAT2通过泛素蛋白途径降解,降低代谢胰腺导管腺癌中支链氨基酸的比例,进而抑制肿瘤细胞的生长。
注:CBP——cAMP反应元件结合(CREB)结合蛋白
KRAS和USP1也可以通过泛素-蛋白酶途径调控PDAC中BCAT2的表达:KRAS通过抑制脾酪氨酸激酶(SYK)和E3泛素化连接酶TRIM21对BCAT2的泛素化来稳定PDAC中BCAT2的表达;而USP1则通过去泛素化BCAT2的K229位点,并通过GCN2-eIF2a途径促进USP1蛋白的翻译水平,促进支链氨基酸表达。
另一项研究发现,USP1 和 BCAT2 的表达水平在基因编辑小鼠和临床样本中一致呈正相关,阐明了为什么胰腺导管腺癌的支链氨基酸代谢低于周围正常组织,进而转向其他途径获取氮。
癌症中的支链氨基酸代谢
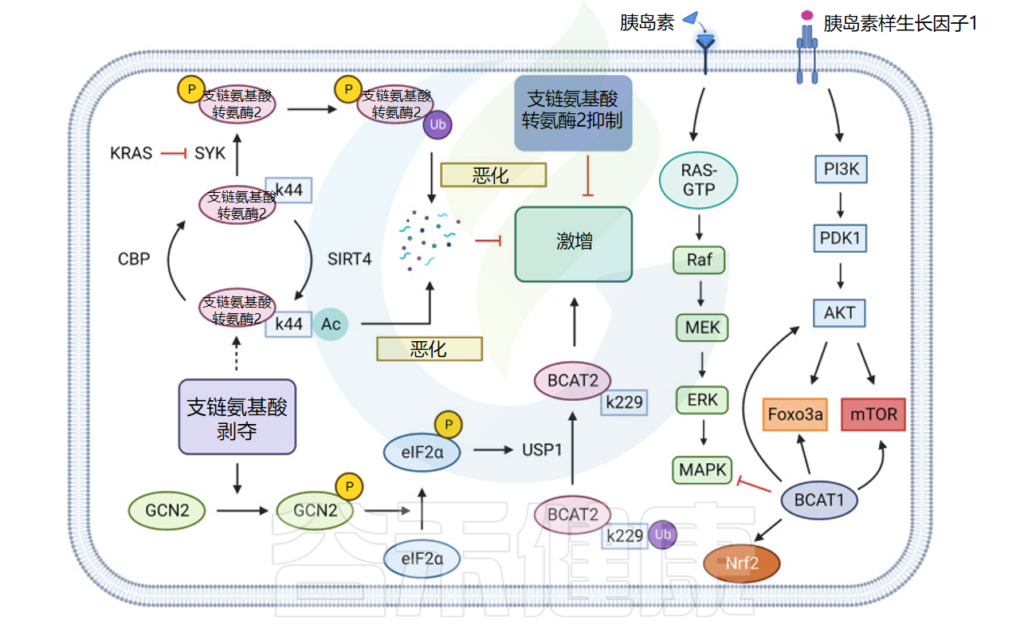
doi: 10.1038/s41392-023-01569-3
血浆支链氨基酸升高是胰腺癌的危险因素
在胰腺癌进展的早期阶段,在人类和小鼠胰腺癌模型中观察到循环支链氨基酸升高,并且由于胰腺癌周围组织中蛋白质过度分解,血液中支链氨基酸水平升高。
肿瘤微环境中的支链氨基酸代谢
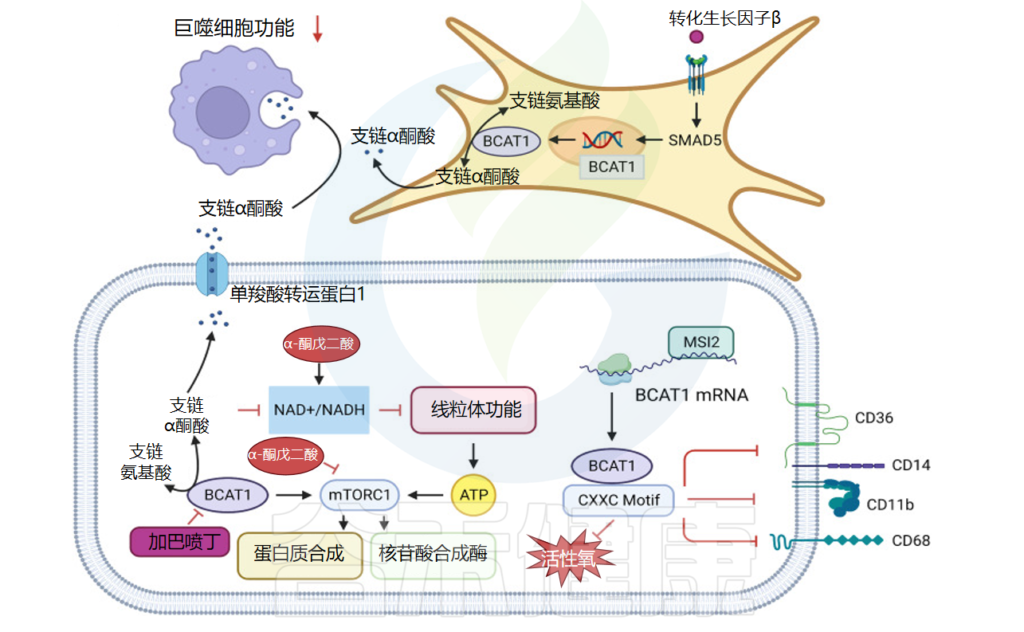
doi: 10.1038/s41392-023-01569-3
肺部肿瘤支链氨基酸摄取量高于胰腺导管腺癌
对标记的支链氨基酸代谢物的分析显示,非小细胞肺癌细胞中标记的 α-酮异己酸 (α-KIC) 和亮氨酸衍生的支链α-酮酸(BCKA)较多。同时BCKDK在非小细胞肺癌中高表达并调节细胞内ROS的产生,影响细胞存活。
代谢性疾病
支链氨基酸及其代谢物是肥胖、胰岛素抵抗和 2 型糖尿病等代谢性疾病的最强生物标志物。支链氨基酸及其代谢物升高是2型糖尿病等代谢性疾病早期进展的关键。
每种支链氨基酸都有独特的代谢作用
低异亮氨酸饮食→快速恢复肥胖小鼠代谢健康
异亮氨酸可以作为代谢健康的调节剂,低异亮氨酸饮食可以改善肥胖对代谢的不利影响。
肥胖可通过增加肝细胞中BCKDK(BCKDH激酶)/ PPM1K(BCKDH去磷酸化酶)的比例,抑制肝脏对支链氨基酸的利用,导致BCKDH失活。在肥胖和胰岛素抵抗的小鼠模型中,通过限制支链氨基酸饮食或调节 BCKDK/PPM1K 比率可以逆转这种现象。
肝脏和肾脏疾病
肝硬化:循环支链氨基酸降低 ↓↓
非酒精性脂肪肝:循环支链氨基酸升高↑↑
肝硬化患者中,高氨血症环境中支链氨基酸分解代谢增强、谷氨酸合成增加以及循环支链氨基酸水平降低被认为是该疾病的标志,并与肝性脑病风险增加相关。
在非酒精性脂肪肝 (NAFLD) 中检测到循环支链氨基酸升高。
此外,这种支链氨基酸代谢紊乱与 2 型糖尿病的发展具有协同作用。其他研究表明,补充支链氨基酸有助于恢复慢性肝病患者的葡萄糖稳态并增强免疫系统功能。
慢性肾病:循环支链氨基酸降低 ↓↓
在肾脏疾病中,慢性肾功能衰竭患者的循环支链氨基酸水平显著降低。这种现象在慢性肾脏病 (CKD) 患者中已观察到,一项 II 期慢性肾病队列研究发现,与正常对照相比,慢性肾病患者血浆亮氨酸 和缬氨酸显著降低。
这可能是由于慢性肾病患者长期营养不良和血液透析导致支链氨基酸水平下降。代谢性酸中毒还会增强支链氨基酸脱氢酶 (BCKD) 活性并加速蛋白质分解。然而,给慢性肾功能衰竭患者补充支链氨基酸和其他必需氨基酸,有助于维持蛋白质平衡,减少尿毒症毒性。
★
天冬氨酸(Asp)是一种用于蛋白质合成的 α-氨基酸,具有 α-氨基、α-羧酸基和侧链甲酰胺。它是一种非必需氨基酸,因为人体可以合成它。
草酰乙酸——天冬氨酸的前体
转氨酶将氨基从谷氨酸转移到草酰乙酸,产生 α-酮戊二酸和天冬氨酸。在天冬酰胺合成酶介导的酶反应中,谷氨酰胺提供氨基,与 β-天冬氨酸-AMP 结合形成天冬酰胺 (Asn) 和 AMP。
天冬酰胺——大脑发育必需的氨基酸
由于血液中的天冬氨酸不能直接通过血脑屏障,神经细胞的发育依赖于其在大脑中的合成。
当脑内天冬氨酸合成酶水平不足时,脑细胞的增殖就会受到限制,甚至导致细胞死亡。
反过来,在分解代谢过程中,天冬酰胺被天冬氨酸酶水解为天冬氨酸,然后用 α-酮戊二酸胺化,形成谷氨酸和草酰乙酸。然后草酰乙酸进入柠檬酸循环(下图)。
天冬氨酸、精氨酸和蛋氨酸代谢
doi: 10.1038/s41392-023-01569-3
天冬氨酸也是尿素循环的代谢物
在苹果酸-天冬氨酸穿梭中携带还原当量,在肌苷合成中提供氮原子,并在 ATP 合成中充当氢受体。
天冬氨酸也是四种必需氨基酸(蛋氨酸、苏氨酸、赖氨酸和异亮氨酸)的前体。天冬氨酸还可以作为氨基酸交换因子,成为氨基酸进出细胞的介质,特别是组氨酸、精氨酸和丝氨酸。天冬氨酸通过氨基酸交换因子功能调节丝氨酸代谢、核苷酸合成和 mTORC1 活性。
TP53是人类癌症中突变频率最高的基因。该基因编码的蛋白p53通过调节细胞周期、细胞凋亡、基因组稳定性等途径抑制肿瘤的发展。
结肠癌
结肠癌细胞系中的天冬氨酸(Asp)和 天冬酰胺 (Asn) 可通过与 LKB1(编码丝、苏氨酸激酶,并直接磷酸化蛋白质产物以激活 AMPK)来抑制其活性,从而抑制 AMPK 介导的 p53 激活。
淋巴瘤和结直肠肿瘤
在淋巴瘤和结直肠肿瘤模型中,p53 的激活会破坏 天冬氨酸-天冬酰胺 稳态,并促使细胞衰老和周期停滞。缺氧条件下,天冬氨酸是肿瘤生长的限制因素。
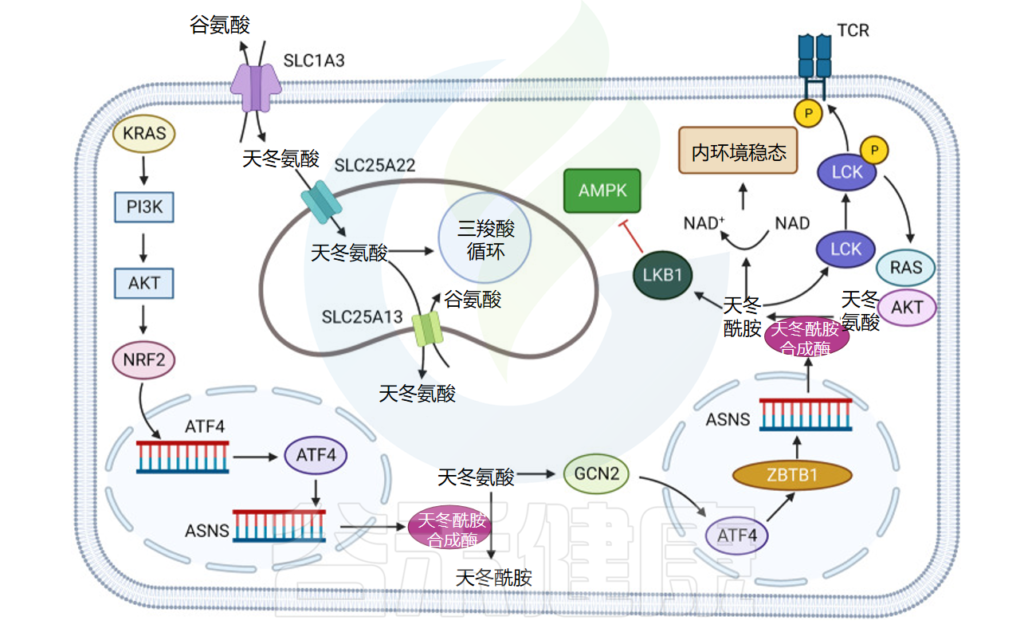
缺氧会抑制电子传递链 (ETC),影响能量和天冬氨酸的合成。研究了肿瘤细胞对线粒体 ETC 抑制剂的敏感性,发现对 ETC 抑制不敏感的肿瘤细胞通过 Asp/谷氨酸转运蛋白 SLC1A3 维持细胞内的Asp 浓度,这使肿瘤细胞具有生存优势。
膀胱癌
在另一项关于肿瘤代谢的研究中,发现当环境中缺乏氧气时,天冬氨酸合成是膀胱癌生长的限制因素。在膀胱癌细胞中,天冬氨酸细胞的渗透性差,阻碍了肿瘤细胞从环境中摄取天冬氨酸。虽然细胞对天冬酰胺的通透性高于天冬氨酸,但膀胱癌细胞中天冬酰胺酶的活性不足,无法将天冬酰胺转化为天冬氨酸。
使用豚鼠天冬酰胺酶 1 (gpASNase1) 促进肿瘤细胞中天冬酰胺转化为 Asp 后,肿瘤细胞的生长速度显著增加,表明 Asp 获取是 Asp 获取困难的肿瘤的内源性代谢限制。有人提出,Asp是体内某些肿瘤生长的内在限制,突破这一限制将促进肿瘤生长。
天冬氨酸-谷氨酸转运蛋白 SLC1A3 与 ETC 抑制剂的作用密切相关,并且 SLC1A3 位点在非神经胶质上皮肿瘤亚簇中扩增,从而对抗天冬氨酸限制。
乳腺癌
发现SLC1A3促进乳腺癌细胞对L-天冬酰胺酶(ASNase)的抵抗。而且,SLC1A3可以补充ASNase对天冬氨酸和谷氨酸的消耗,从而消除ASNase的抑制作用,促进肿瘤的发展。
此外,另一种氨基酸转运蛋白SLC25A22可以促进KRAS突变结直肠癌(CRC)细胞中天冬氨酸的合成,激活AMPK通路并减少氧化应激。
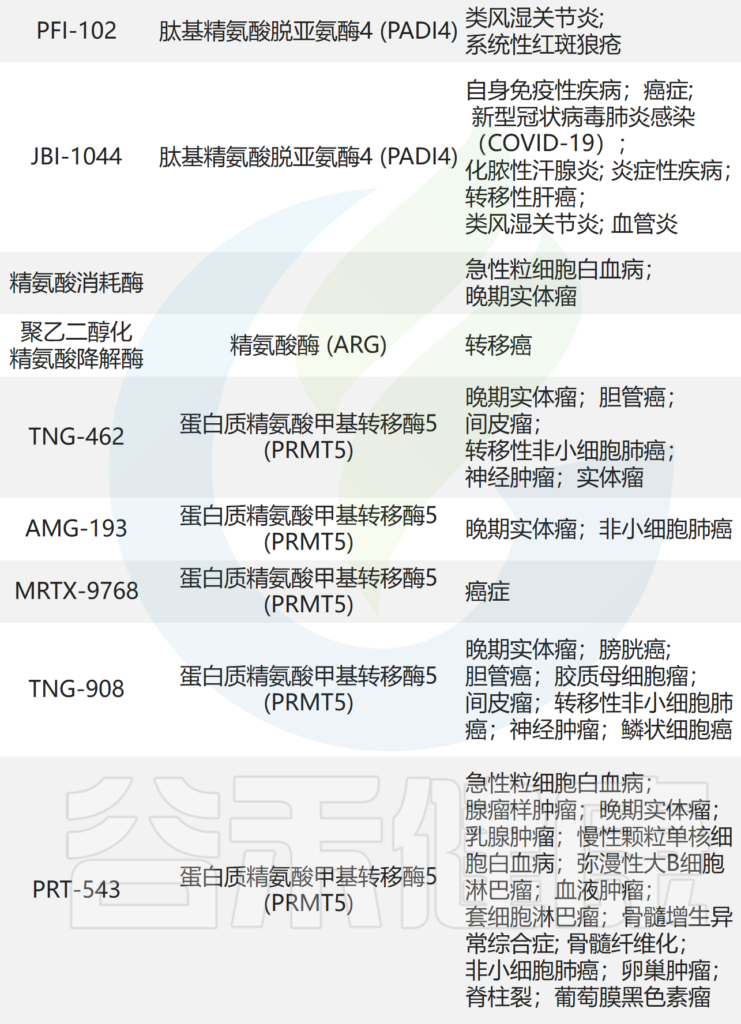
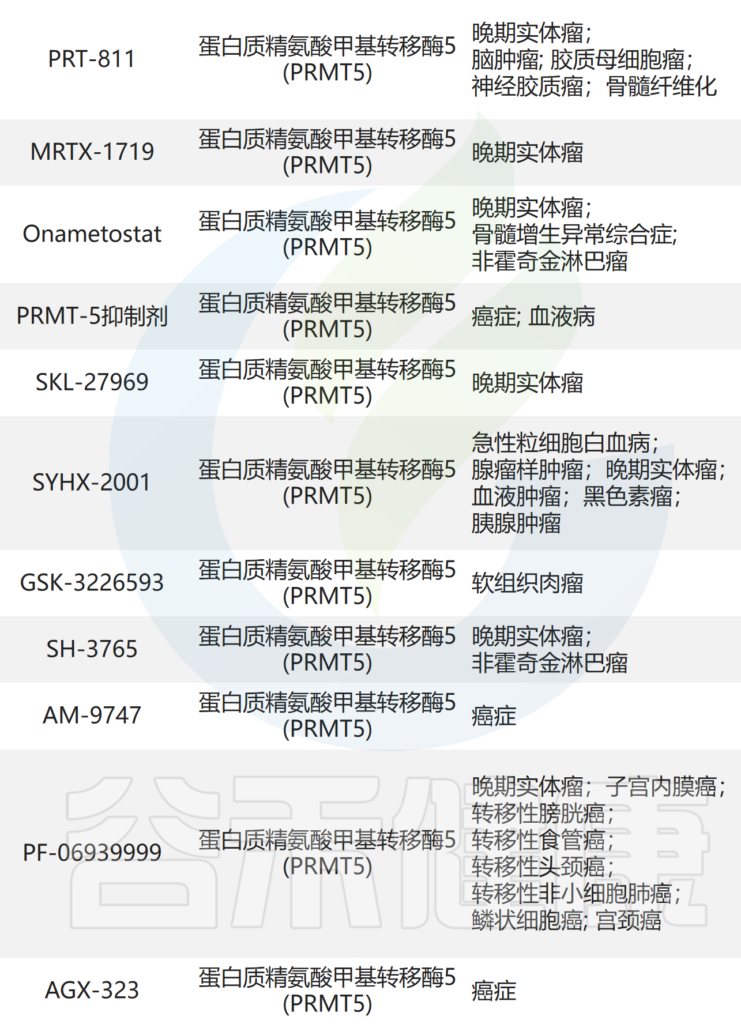
这些研究表明,AAT 是肿瘤代谢重编程的潜在靶标。目前正在测试的针对 AAT 的药物见(见后面的表格)。
实体瘤中的天冬氨酸代谢
doi: 10.1038/s41392-023-01569-3
天冬酰胺作为癌症治疗的新靶点受到广泛关注
报道指出乳腺癌中天冬酰胺合成酶(ASNS)的表达水平与转移复发密切相关,抑制ASNS或限制饮食天冬酰胺可以减少肿瘤转移。
非小细胞肺癌
在非小细胞肺癌中,激活转录因子 4 (ATF4) 可以通过 KRAS 下游的 AKT 和 NRF2 改变氨基酸摄取并增加天冬酰胺合成。此外,将AKT抑制剂与细胞外天冬酰胺(ASN)消耗结合使用可以显著抑制肿瘤生长。
天冬酰胺在免疫细胞的生长和功能中发挥关键作用
发现CD8 + T细胞在CD8 + T细胞激活的早期阶段几乎不表达天冬酰胺合酶(ASNS),并且CD8 + T细胞的生长、激活和代谢重编程在天冬酰胺剥夺的情况下被破坏。
还证明,活化的 CD8 + T 细胞中的天冬酰胺水平增加,并与 SRC 家族酪氨酸激酶 LCK 结合,协助 LCK 在 Tyr394 和 505 处磷酸化,增强 LCK 活性和 T 细胞受体信号传导。
血液恶性肿瘤
天冬酰胺在血液恶性肿瘤中也发挥着关键作用。目前,细菌源性 L-天冬酰胺酶 (ASNase) 在儿童急性淋巴细胞白血病 (ALL) 中的应用已显著提高了治愈率。然而,在实体瘤中,多项临床试验表明会出现药物相关的毒副作用,如胰腺炎、中性粒细胞减少和低蛋白血症。
这些毒副作用至少部分是由L-天冬酰胺酶中谷氨酰胺酶的协同活性引起的。基于提高L-天冬酰胺酶在血液恶性肿瘤中的疗效、扩大L-天冬酰胺酶的用途、减少副作用的目的,新一代L-天冬酰胺酶正在开发中。
临床试验中靶向氨基酸代谢的药物



doi: 10.1038/s41392-023-01569-3
免疫疾病
自身免疫性疾病中免疫细胞代谢异常可促进炎症细胞的趋化性和炎症因子的产生。
类风湿性关节炎:T细胞天冬氨酸的丰度降低↓↓
在类风湿性关节炎 (RA) 中,细胞因子肿瘤坏死因子 (TNF) 的过量产生是发病机制中的一个核心事件,而富含内质网 (ER) 的 T 细胞是发炎关节中 TNF 的主要释放者。
发现类风湿性关节炎(RA)T细胞中线粒体天冬氨酸(Asp)的丰度降低,从而抑制NAD +周转,导致NAD +/NADH 比值降低以及NAD+蛋白质的ADP核糖基化减少依赖。
类风湿性关节炎和其他自身免疫性疾病的治疗策略是使用抗体来阻断细胞因子或其受体。最新的小分子抑制剂是靶向 Janus 激酶 (JAK) 抑制剂。这些治疗策略旨在阻断炎症途径的下游实践。然而,这些下游信号通路广泛分布在免疫细胞以外的细胞类型中,这会导致血栓形成等不良事件。因此,对自身免疫性疾病上游炎症的研究有助于从源头上预防疾病的发展。
神经系统疾病
天冬酰胺合成障碍是一种新发现的神经系统疾病,与染色体 7q2 上的 ASNS 基因突变有关。
自闭症:血清和脑脊液中天冬酰胺降低↓↓
自闭症谱系障碍(ASD)严重影响早期神经发育,导致智力障碍、发育迟缓、顽固性癫痫发作、进行性脑萎缩和呼吸系统缺陷。目前,该疾病中有一小部分人的血清和脑脊液中天冬酰胺水平可检测到降低,这阻碍了该测试用于初步筛查。由于血脑屏障的存在,天冬酰胺不会在大脑中积极积聚,因此大脑中 ASNS 活性的降低被认为是导致这种疾病的原因。
迄今为止,已报道了15种与ASD相关的突变,其中一些突变破坏了蛋白质结构,降低了ASNS的底物结合能力和催化效率。
例如,R49Q是位于N端结构域的谷氨酰胺 (Gln)结合袋中的突变,该突变不仅导致第二个β-折叠的氢键丢失,而且导致Gln的氢键丢失。此外,G289A和T337I突变位于C端结构域的ATP结合袋附近,G289A会引起与Ser293的空间冲突,而T337I会在蛋白质表面引起疏水斑并降低蛋白质溶解度。
补充天冬氨酸部分有效,需进一步研究
在治疗方面,膳食补充天冬氨酸并没有想象中那么有效,人为升高血液天冬氨酸可能会因竞争共转运蛋白而影响其他氨基酸的吸收。目前的治疗方法仅部分有效,需要进一步了解该疾病的机制来开发有效的药物。
★
谷氨酰胺(Gln)是一种用于蛋白质合成的 α-氨基酸。它的结构与谷氨酸类似,但侧链的羧酸基团被酰胺取代。谷氨酰胺是从食物中获取的非必需氨基酸,也是消耗最多的氨基酸,参与合成所有非必需氨基酸 (NEAA) 和蛋白质。
哪里产生谷氨酰胺?
肌肉组织在人体内产生最多的谷氨酰胺,约占全部合成谷氨酰胺的90%。
大脑和肺部也能释放少量的谷氨酰胺。肝脏虽然也能合成谷氨酰胺,但其主要功能是调节从肠道吸收的大量谷氨酰胺。
哪里消耗谷氨酰胺?
肠道细胞、肾细胞、激活的免疫细胞和各种肿瘤细胞是谷氨酰胺最迫切的消耗者。
具体通路
谷氨酰胺通过氨基酸转运蛋白 ASCT2/SLC1A5 进入细胞,并通过涉及谷氨酰胺酶 (GLS) 的脱氨反应在线粒体中转化为谷氨酸。然后谷氨酸在谷氨酸脱氢酶(GDH)或谷氨酸转氨酶或天冬氨酸转氨酶(TAs)的催化下产生α-酮戊二酸(α-KG)。α-KG是TCA循环的中间产物。
在缺氧或线粒体功能障碍下,α-KG可通过异柠檬酸脱氢酶(IDH2)催化的羧化反应转化为柠檬酸,用于氨基酸和脂肪酸的合成以及还原剂NADPH的生产。
肿瘤细胞是谷氨酰胺的紧急消耗者。信号分子Akt、Ras和AMPK可以通过激活糖酵解引起Warburg效应来诱导乳酸产生,促使肿瘤细胞通过谷氨酰胺代谢来满足能量需求。
在各种肿瘤中,谷氨酰胺代谢受癌基因/抑癌基因(例如 c-Myc 和 p53)的调节。癌基因 c-Myc 通过 GLS 和 SLC1A5 基因的转录激活上调谷氨酰胺代谢。
GLS 驱动的谷氨酰胺代谢是前列腺癌 (PCa) 放疗耐受性的调节因子,并且 GLS 1 和 c-MYC(谷氨酰胺的关键调节因子)的高表达与接受治疗的前列腺癌患者的无进展生存期缩短显著相关与放射治疗。
谷氨酰胺代谢可以通过α-KG依赖性染色质双加氧酶维持前列腺癌干细胞(CSC)。抑制谷氨酰胺代谢可降低体内 CSC 群体的频率以及小鼠模型中肿瘤生长的速率。
结肠癌
在结肠癌中,谷氨酰胺剥夺刺激p53激活,促进天冬氨酸/谷氨酸转运蛋白SLC1A3的表达,从而促进谷氨酸、谷氨酰胺和核苷酸合成,维持电子传递链和三羧酸循环活性。
SLC1A3 的缺失会降低肿瘤细胞对谷氨酰胺饥饿的抵抗力并抑制肿瘤细胞的生长。此外,研究表明,高表达胱氨酸/谷氨酸抗转运蛋白SLC7A11/xCT的肿瘤细胞高度依赖谷氨酰胺代谢。
在缺乏胱氨酸等氨基酸的情况下,细胞通过通用控制非阻遏物 2 (GCN2) -真核起始因子 (eIF2a) 信号通路促进 ATF4 的翻译,从而促进参与氨基酸代谢和应激反应的基因转录,包括 SLC7A11,使细胞能够应对氨基酸饥饿。
肿瘤中的谷氨酰胺代谢
doi: 10.1038/s41392-023-01569-3
由于肿瘤细胞通过 SLC7A11 将细胞内的谷氨酸交换为细胞外的胱氨酸,细胞内的谷氨酸被消耗,导致细胞吸收更多的谷氨酰胺,并激活谷氨酰胺酶来补充细胞内的谷氨酸,使得 SLC7A11 高表达的细胞成为谷氨酰胺依赖型。
SLC7A11在三阴性乳腺癌、肺癌、胰腺导管腺癌、肾癌和肝癌中高表达
在三阴性乳腺癌 (TNBC) 中,与其他乳腺癌细胞相比,SLC7A11 高表达的细胞消耗更多的谷氨酰胺,并且对谷氨酰胺饥饿更敏感。
研究发现,SLC7A11 的缺失对小鼠正常胰腺组织的发育没有影响,但会严重损害 KRAS 驱动的胰腺导管腺癌生长。
生理条件下 SLC7A11 的非必需性以及 SLC7A11 在肿瘤中的高表达使 SLC7A11 成为癌症治疗的有希望的靶标。
谷氨酰胺酶可将谷氨酰胺水解为谷氨酸,是谷氨酰胺代谢中的关键酶。
谷氨酰胺酶的表达具有组织特异性。谷氨酰胺酶在汇管周围肝细胞、肾上皮细胞和中枢神经系统中活跃表达,用于合成尿素和神经递质。
人类谷氨酰胺酶的四种异构体分为两种由 GLS1 编码的高活性肾谷氨酰胺酶类型和两种由 GLS2 编码的低活性肝谷氨酰胺酶类型。
不同肿瘤中GLS1和GLS2表达的异质性表明恶性肿瘤细胞对谷氨酰胺代谢的需求不同。发现肝癌细胞线粒体中氨基酸合成5样1(GCN5L1)的通用控制可以促进GLS1和GLS2异构体的乙酰化和失活,从而抑制mTORC1激活和细胞增殖。
卵巢透明细胞癌
在卵巢透明细胞癌 (OCCC) 中,谷氨酰胺酶抑制剂 CB-839 抑制 ARID1A(富含 AT 的相互作用结构域蛋白 1A)突变的 PDX 肿瘤生长。
肾细胞癌
一项针对晚期肾细胞癌 (RCC) 的随机、双盲、对照 II 期试验证明,谷氨酰胺酶抑制剂 telaglenastat (CB-839) 和 mTOR 抑制剂依维莫司 (TelaE) 联合使用具有协同抗癌作用,且患者耐受性良好既往接受过 TKI 治疗的患者。此外,与安慰剂加依维莫司 (PboE) 相比,TelaE 可以改善无进展生存期 (PFS)。
另一项 Ib 期临床试验也显示 TelaE 或 telaglenastat 联合卡博替尼 (TelaC) 治疗 RCC 具有良好的耐受性和临床活性。
胰腺炎
补充谷氨酰胺降低重症死亡率,改善IBS,利于伤口愈合
谷氨酰胺可作为多种疾病的营养补充剂。多项荟萃分析发现,补充谷氨酰胺可以降低重症胰腺炎患者的死亡率、并发症发生率和总住院时间。
一项随机、双盲、安慰剂对照临床研究表明,在低发酵低聚单糖和多元醇 (FODMAP) 饮食中补充谷氨酰胺可改善肠易激综合征 (IBS) 症状。
在促进伤口愈合方面,研究发现,补充精氨酸和谷氨酰胺对伤口愈合有积极影响,补充谷氨酰胺显著影响患者的氮平衡,减少住院时间和死亡率。
补充谷氨酰胺并没有显著影响烧伤患者的预后
在一项招募 1200 名患者的双盲、随机、安慰剂对照试验中,谷氨酰胺补充剂组的出院生存期为 40 天,而安慰剂组为 38 天。谷氨酰胺组的死亡率为 17.2%,与安慰剂组的 16.2% 没有显著差异,并且补充谷氨酰胺并没有减少住院时间。
在他们的研究中,表明了补充谷氨酰胺的益处和风险,而烧伤和其他疾病的临床试验却显示出相互矛盾的结果。
补充谷氨酰胺对各种疾病的益处和风险仍需要更多临床试验数据。
心血管疾病
在心血管疾病中,Myc 和 Myc 相关因子 X (Max) 上调肺动脉高压中的谷氨酰胺转运蛋白 SLC1A5 和 SLC7A5 以及线粒体苹果酸,从而促进谷氨酰胺分解诱导的右心室肥厚。
氧化应激下,谷氨酰胺显著下降
在氧化应激下,心肌细胞中的谷胱甘肽(GSH)水平下降 60-70%,谷氨酰胺、谷氨酸和 α-酮戊二酸(α-KG)水平也显著下降,同时将谷胱甘肽转化为谷胱甘肽的 GLS 酶活性显著降低。
调节葡萄糖稳定性的关键氨基酸
2 型糖尿病是心血管疾病发生的主要危险因素。糖尿病患者骨骼肌代谢失调会影响胰岛素敏感性和葡萄糖稳态。研究发现,谷氨酰胺是调节葡萄糖稳定性和胰岛素敏感性的关键氨基酸,谷氨酰胺水平影响骨骼肌的炎症反应并调节胰岛素信号抑制剂适应性蛋白GRB10的表达。此外,谷氨酰胺的全身升高可改善肥胖小鼠模型中的胰岛素敏感性并恢复葡萄糖稳态。
补充谷氨酰胺——心脏保护的新希望
蒽环类抗生素阿霉素(DOX)是一种广泛应用于实体恶性肿瘤的抗肿瘤药物;然而,这种疗法可能因自由基和氧化应激而导致严重的心脏毒性。补充谷氨酰胺显著降低心脏脂质过氧化物水平,增加过氧化物酶和谷胱甘肽水平,保护 DOX 治疗的大鼠模型的心脏功能。
针对心脏谷氨酰胺代谢的药物正在开发中。冬凌农 (Ori) 是一种从植物冬凌草 (Hemsl.) 中提取的天然萜类化合物,在大鼠心肌损伤模型中,可提高心脏谷氨酰胺水平并抑制 ATP/ADP 比值下降,保护心肌细胞并减少梗塞面积。
严重急性呼吸道综合症
严重急性呼吸综合征冠状病毒 2 (SARS-CoV-2) 是 2019 年冠状病毒病 (COVID-19) 的病因。该疾病通过人与人之间的密切接触或感染者的呼吸道分泌物传播。
COVID-19:谷氨酰胺降低↓↓
COVID-19的危险因素包括心血管疾病和糖尿病,此类高危人群表现出谷氨酰胺、NAD +水平低和透明质酸(HA)过量产生的共同代谢特征。
谷氨酰胺和 NAD +水平会导致 SIRT1 失调
SIRT1 是透明质酸合酶 2 (HAS2) 基因的关键负调节因子。这些代谢改变最终导致 HA 和纤溶酶原激活剂抑制剂 1 (PAI-1) 的过量产生以及 Tregs 和骨髓源性抑制细胞 (MDSC) 群体的扩张。因此,谷氨酰胺缺乏导致了 COVID-19 高危人群的免疫功能障碍和 HA 过量产生。
HA可以通过PAI-1激活STAT3。由于 SIRT1、STAT3 和 O-GlcNacylation 失调,通过激活 HAS2 诱发透明质酸风暴。
谷氨酰胺消耗加剧
此外,尽管SARS-CoV-2疫苗显著减少了COVID-19病例,但SARS-CoV-2感染后细胞处于强烈的氧化应激条件下,从而促进谷氨酰胺的消耗以合成谷胱甘肽。这一过程加剧了高危人群的谷氨酰胺缺乏,并可能诱发代谢功能障碍。同时,它还能引起STAT3通路失活和PAI-1激活,导致部分人出现严重的COVID-19并发症。
补充谷氨酰胺降低患者严重程度
小型临床试验表明,补充谷氨酰胺可以降低 COVID-19 患者感染后的严重程度。然而,这部分研究需要扩大,以更准确地评估谷氨酰胺在治疗 COVID-19 中的价值。
★
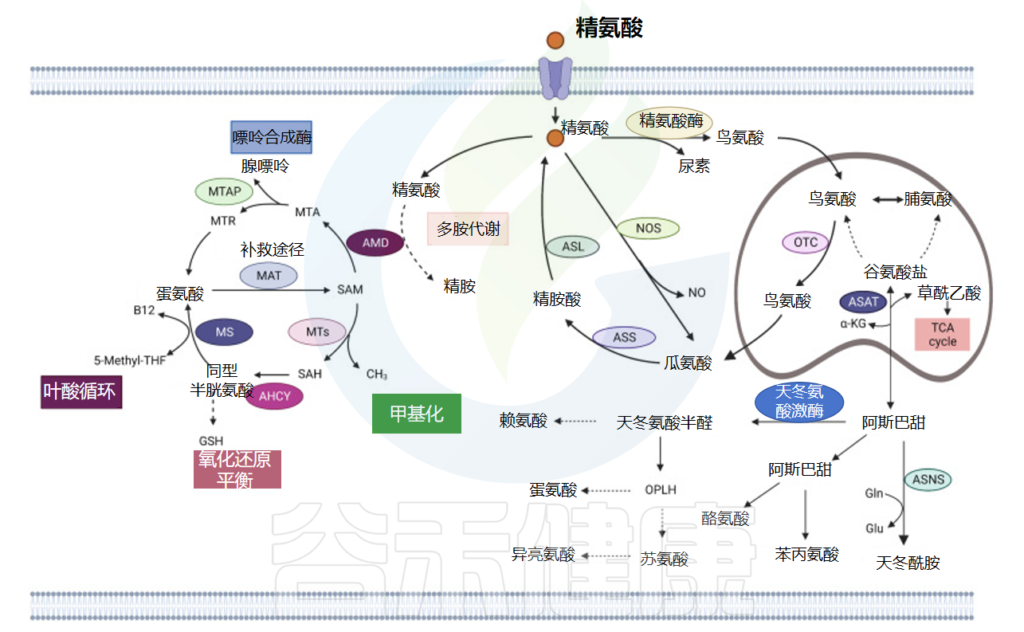
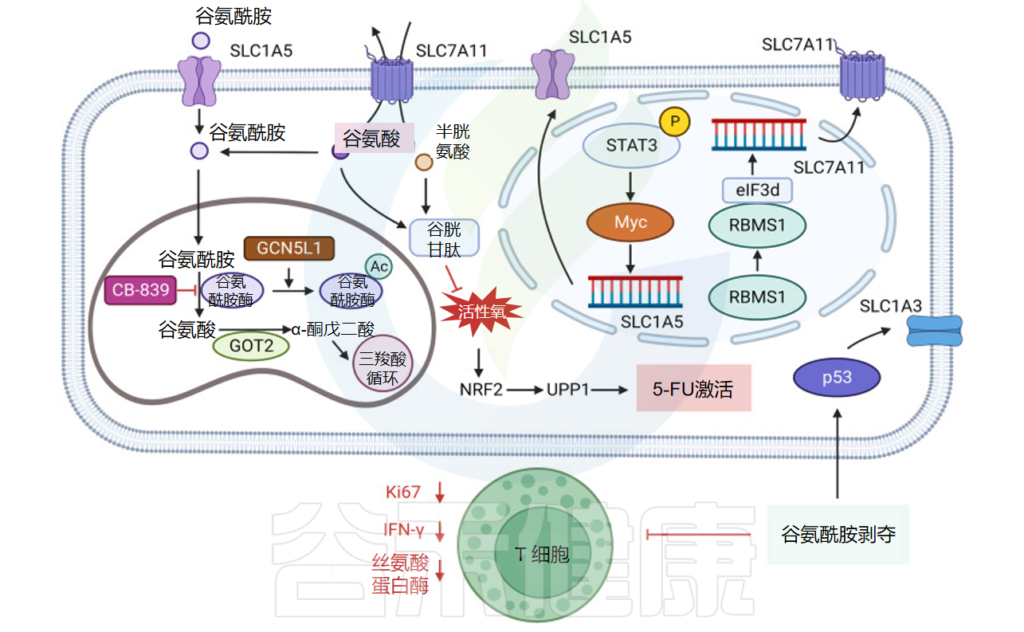
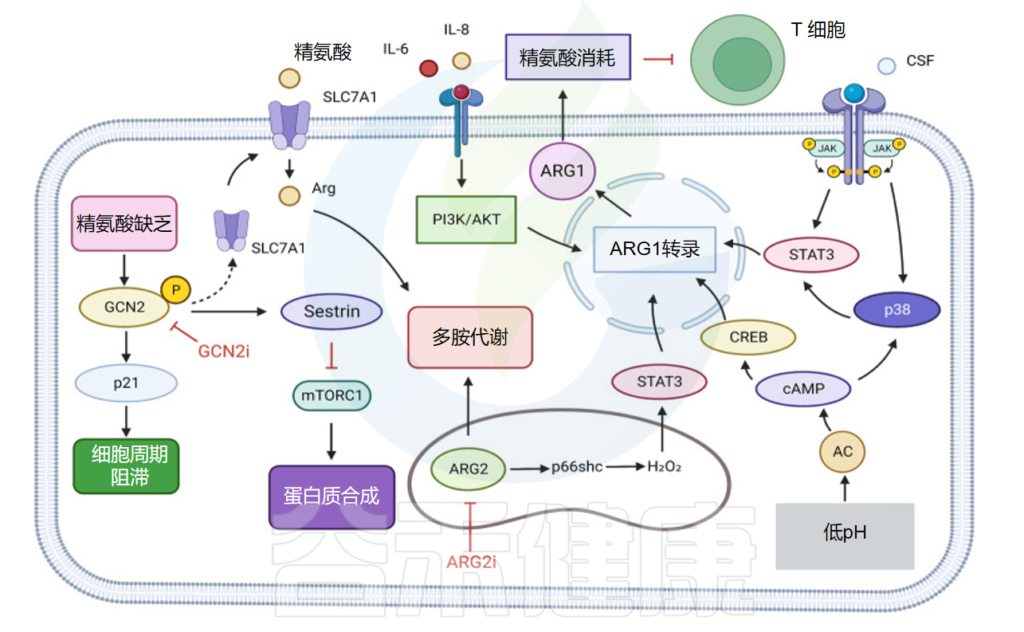
精氨酸,又称L-精氨酸,是蛋白质合成的原料,也是尿素和一氧化氮循环的中间产物。精氨酸被归类为条件必需氨基酸,其需求量取决于发育阶段和健康状况。
在人类中,小肠上皮细胞将谷氨酰胺和谷氨酸转化为瓜氨酸,然后通过循环系统转运至肾近端肾小管细胞,其中精氨酸由尿素循环中的精氨酸-琥珀酸合成酶和精氨酸-琥珀酸裂合酶合成。
当小肠和肾功能受损时,精氨酸合成就会受损,从而产生对精氨酸的饮食需求。在其他细胞类型中,瓜氨酸合成的精氨酸非常低,但当诱导型一氧化氮合酶 (NOS) 增加时,精氨酸合成会急剧增加。
在这些条件下,一氧化氮合成的副产物瓜氨酸可以通过精氨酸-瓜氨酸途径回收精氨酸。精氨酸对于细胞分裂、伤口愈合和免疫功能很重要。
蛋白质中的精氨酸可被 PAD 酶催化为瓜氨酸,这一过程称为瓜氨酸化,是正常免疫过程的一部分。另一种类型的翻译后修饰是精氨酸甲基转移酶 (PRMT) 的甲基化,其中精氨酸可以甲基化为单甲基化精氨酸或二甲基化精氨酸。
精氨酸甲基转移酶可分为以下三类:
精氨酸甲基化通常发生在富含甘氨酸和精氨酸的“GAR基序”中。许多精氨酸甲基化蛋白质已被证明可以与 DNA 或 RNA 相互作用,并且精氨酸残基充当磷酸主链的重要氢供体。
此外,精氨酸甲基化还会影响各种细胞过程中涉及的蛋白质-蛋白质相互作用,例如蛋白质运输、信号转导和转录调节。
正常细胞中的瓜氨酸和天冬氨酸可通过尿素循环中的精氨酸-琥珀酸合成酶 1 (ASS1) 和精氨酸-琥珀酸裂解酶 (ASL) 转化为精氨酸。
精氨酸琥珀酸合成酶 1 (ASS1) 转录抑制发生在各种肿瘤中,产生对外部精氨酸的依赖,并实现精氨酸剥夺疗法。
在GBM中使用精氨酸消耗剂聚乙二醇化精氨酸脱亚胺酶ADI-PEG20可以增加一氧化氮(NO)合成并产生细胞毒性过亚硝酸盐,增加肿瘤细胞对电离辐射的敏感性,显著增强放疗对GBM的效果。
精氨酸剥夺促进HCC细胞中GCN2依赖性周期停滞,而精氨酸剥夺HCC细胞中GCN2的抑制促进细胞衰老并增加衰老化合物的功效。
Ass 缺陷的前列腺癌和胰腺癌也被证明对 ADI-PEG20 敏感,而 ADI-PEG20 通过诱导自噬和细胞凋亡来促进细胞死亡。
肿瘤细胞中的精氨酸代谢
doi: 10.1038/s41392-023-01569-3
精氨酸耗竭可以增加肝细胞癌细胞中GCN2的磷酸化水平,激活GCN,增加SLC7A11的表达水平,增加精氨酸的摄取。
伤口愈合
在伤口愈合过程中,精氨酸通过精氨酸-NO途径参与炎症因子的反应。此外,精氨酸酶降解精氨酸产生的鸟氨酸和尿素在此过程中是必需的,并且在胶原蛋白和多胺的合成中具有关键作用。
精氨酸可以通过 GPRC6A-ERK1/2 和 PI3K/Akt 信号通路促进成纤维细胞增殖。
精氨酸调节免疫
精氨酸可以在炎症早期阶段增加单核细胞迁移和外周血中促炎因子的产生;在炎症后期,精氨酸还可以抑制免疫细胞的活性,调节免疫状态。总之,精氨酸及其代谢物对于伤口愈合至关重要,并参与伤口愈合的多个阶段,包括胶原蛋白形成、细胞增殖和免疫调节。
补充精氨酸有助于各种伤口愈合
膳食补充精氨酸是最方便的方法,对伤口愈合有多种好处。补充精氨酸可以增强人体 DNA 的合成。在结肠炎模型中,精氨酸补充剂可抑制炎症因子和趋化因子的表达,抑制炎症反应,促进受损组织的修复。
遭受创伤/失血性休克的患者由于胶原蛋白合成减少而难以实现伤口愈合。相反,补充精氨酸可以显著缓解上述问题并增加伤口强度。
糖尿病伤口愈合过程中,补充精氨酸可以逆转NO合成不足的情况,恢复受损组织中NO的浓度,促进伤口愈合。精氨酸也被用来降低压疮的风险,在压疮(褥疮)高风险患者中补充精氨酸可以显著加速压疮愈合。
阿尔茨海默病(AD)
阿尔茨海默病 (AD) 的特征是由淀粉样蛋白-β 和磷酸化 tau 沉积引起的老年斑和神经原纤维缠结 (NFT)。
精氨酸治疗改善阿尔茨海默病
晚期糖基化终末产物 (AGE) 会修饰蛋白质,导致其功能障碍。AMPK-γ 亚基的糖基化会抑制 AMPK 功能,精氨酸治疗可保护 AMPK-γ 免受糖基化并增加阿尔茨海默病小鼠模型中的 AMPK 磷酸化,从而改善阿尔茨海默病。
与其他药物联合使用,改善认知
在轻度阿尔茨海默病 /认知障碍 (MCI) 患者中,联合使用 L-精氨酸、HMG-CoA 抑制剂辛伐他汀和四氢生物蝶呤可增强内皮一氧化氮合酶 (eNOS) 通路,从而适度增加脑血流量并改善认知。
此外,据报道PRMT4催化的不对称二甲基精氨酸(ADMA)作为配体与NOS结合,导致NOS功能障碍,导致脑血流量减少,加重阿尔茨海默病,通过抑制PRMT4可以逆转这种情况。
肺部疾病
哮喘是一种多变的、反复发作的、长期的呼吸道炎症性疾病。精氨酸和一氧化氮代谢失衡与哮喘的病理生理学有关。
哮喘:精氨酸水平显著降低↓↓
对哮喘儿童血浆代谢质谱分析显示,与非哮喘易感组相比,哮喘易感组的精氨酸(Arg)、赖氨酸(Lys)和蛋氨酸(Met)水平显著降低。
还显示,哮喘和阻塞性睡眠患者的血清不对称二甲基精氨酸 (ADMA) 浓度显著增加,一氧化氮合酶 (NOS) 抑制增强,精氨酸分解代谢增强,鸟氨酸 (Orn) 和脯氨酸 (Pro) 水平增加,以及精氨酸/鸟氨酸比值降低呼吸暂停(OSA)。
在标记的哮喘药物中添加 L-精氨酸并不能显著减少哮喘发作
这可能是由于 IL-4 和 IL-13 诱导的精氨酸酶活性显著增加,以及过敏原刺激的肺部下游产物腐胺显著增加。
在肥胖哮喘患者的药物中添加 L-瓜氨酸(L-精氨酸循环和 NO 合成的前体),可能有助于控制哮喘并改善 NO 排泄分数 (FeNO) 水平。
心血管疾病
不对称二甲基精氨酸 (ADMA) 升高↑↑
患有高胆固醇血症和血管疾病的患者通常会出现不对称二甲基精氨酸 (ADMA) 升高,这与 NO 合成受损和内皮功能障碍的早期标志物有关。
ADMA 是一种内源性一氧化氮合酶 (NOS) 抑制剂,可显著减少血管舒张剂 NO 的合成,导致心血管疾病的发生。
PRMT1是催化ADMA的主要酶。它通过调节心肌肌动蛋白启动子区域的组蛋白甲基化修饰来调节基因激活。PRMT1的消融可以下调心肌素等收缩基因的表达,并显著降低主动脉的收缩力和血管平滑肌细胞(VSMC)的牵引力。
PRMTs的异常活性导致ADMA和MMA增加,从而增加心血管疾病的风险。
针对 PRMT 的抑制剂正在开发和实验测试中。精氨酸(Arg)甲基化酶抑制剂 (AMI) 是对称磺化尿素,可特异性抑制 PRMT 活性,并在大鼠模型中抑制环氧合酶 2 (COX-2) 表达并抑制炎症。
★
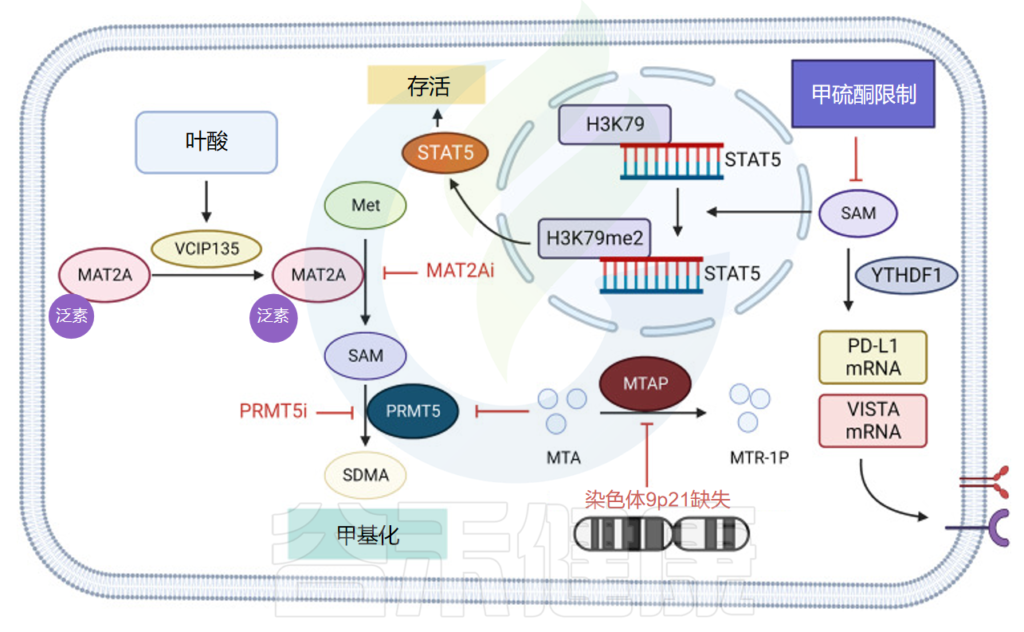
蛋氨酸(Met)是一种必需氨基酸,也是其他氨基酸的前体,例如半胱氨酸 (Cys) 和牛磺酸,以及 S-腺苷-L-甲硫氨酸 (SAM) 和谷胱甘肽 (GSH)。蛋氨酸生物合成的骨架主要来自天冬氨酸。
在分解代谢中,蛋氨酸被蛋氨酸腺苷转移酶 (MAT) 催化为 SAM。作为甲基供体,SAM 参与各种甲基转移反应,并在反应中转化为 S-腺苷高半胱氨酸 (SAH)。蛋氨酸可以增加细胞内谷胱甘肽的浓度,促进细胞氧化还原调节,并通过与氧化代谢物结合来保护细胞。
蛋氨酸作为一种必需氨基酸,在肿瘤的生长和代谢中具有重要作用。除外源供应外,蛋氨酸补救途径是唯一的蛋氨酸来源。该途径需要甲基腺苷磷酸化酶 (MTAP) 和 蛋氨酸合酶 (MS) 的活性。
MTAP 位于肿瘤抑制因子细胞周期蛋白依赖性激酶抑制剂 2 A (CDNK2A) 的外围,这两个基因的共同缺失发生在约 15% 的癌症中,导致高度侵袭性肿瘤且预后不良。这些酶在恶性肿瘤中常常下调,导致细胞对外部环境中蛋氨酸摄入的强烈依赖。
肿瘤细胞中的蛋氨酸代谢
doi: 10.1038/s41392-023-01569-3
肿瘤细胞竞争消耗蛋氨酸→T细胞蛋氨酸缺乏
肿瘤细胞可以通过SLC43A2的高表达来增加蛋氨酸的摄入,竞争性消耗环境中的蛋氨酸,导致T细胞蛋氨酸缺乏。T细胞蛋氨酸限制可抑制细胞内正常甲基化,导致STAT5基因转录受阻,影响T细胞存活和功能。另一方面,蛋氨酸代谢抑制 PD-L1 和 T 细胞激活的 V 结构域 Ig 抑制因子 (VISTA) 免疫检查点翻译。
由于其在甲基化中的核心作用,蛋氨酸被认为是由 10-11 易位 (TET)、异柠檬酸脱氢酶 (IDH) 蛋白、甲基转移酶和其他表型修饰剂驱动的肿瘤治疗的候选靶点。
无蛋氨酸饮食的抗肿瘤作用,抑制肿瘤免疫逃逸
无蛋氨酸饮食的抗肿瘤作用首次在患有 Walker-256 肉瘤的 Sprague-Dawley 大鼠中被报道。
Met限制饮食可以减少肿瘤细胞中的N6-甲基腺苷(m6A)甲基化和免疫检查点翻译,例如PD-L1和T细胞激活的V域Ig抑制因子(VISTA)。
此外,它还能增加肿瘤浸润CD8 + T细胞的数量,从而抑制肿瘤免疫逃逸。补充蛋氨酸或抑制肿瘤细胞中SLC43A2的表达可以逆转上述T细胞功能抑制,激活肿瘤免疫。
这些研究表明,蛋氨酸限制不仅抑制肿瘤细胞代谢,还涉及免疫细胞,并且肿瘤细胞本身具有复杂的优先途径来调节蛋氨酸代谢。因此,应针对肿瘤细胞蛋氨酸代谢开发更精准、更有针对性的治疗方法。
脂肪肝疾病
非酒精性脂肪性肝病(NAFLD)是一种由于代谢途径异常导致甘油三酯(TG)在肝脏积聚而引起的疾病。肥胖和2 型糖尿病是 NAFLD 的重要危险因素。
高脂饮食、蛋氨酸和胆碱缺乏饮食(MCD)可以模拟人类疾病的组织学和代谢异常,通常用于建立NAFLD小鼠模型。
非酒精性脂肪性肝病早期,蛋氨酸水平降低↓↓
在评估两种方法构建NALFD/NASH模型的差异时发现,MCD饮食可在2-4周内自发导致肝纤维化,并显著影响肝纤维化途径相关基因的表达。高脂饮食的这种作用直到胰岛素抵抗后 24 周才观察到,从而减少了肝纤维化。
临床数据显示,NAFLD 早期阶段蛋氨酸水平降低,且较高的蛋氨酸摄入量与纤维化风险呈负相关。甲基供体补充通过激活 AMPK 信号通路增加脂肪酸消耗来减少肝脏脂肪积累。
肾脏疾病
常染色体显性多囊肾病:蛋氨酸水平升高↑↑
常染色体显性多囊肾病(ADPKD)是一种常见的单基因疾病,其特征是肾囊肿增大。在ADPKD模型中,蛋氨酸(Met)和SAM的水平升高,从而诱导Mettl3的表达。
Mettl3 可以增加 c-Myc 和 Avpr2 mRNA 修饰,激活 c-Myc 和 cAMP 通路,并加速囊肿生长。限制蛋氨酸饮食可能会减缓常染色体显性多囊肾病的进展。
在蛋氨酸限制 (MR) 小鼠损伤模型中,肾损伤标志物簇蛋白和胱抑素 c 显著下降。与正常喂养模型相比,MR模型中Emr1、Nos2、Tnfa等肾脏炎症基因下调,嗜碱性粒细胞聚集程度较低。
糖尿病
2 型糖尿病:循环蛋氨酸水平升高 ↑↑
糖尿病肾病:循环蛋氨酸水平升高 ↑↑
在2 型糖尿病和糖尿病肾病 (DKD) 中可以检测到循环蛋氨酸、乙酰天冬氨酸和天冬酰胺水平升高。此外,循环蛋氨酸(Met)水平升高可用于预测患糖尿病的风险。
蛋氨酸代谢调节 Cys 和内源性硫化氢 (H2S) 水平。H2S 抑制胰腺 β 细胞中葡萄糖诱导的胰岛素释放和脂肪组织中胰岛素刺激的葡萄糖摄取。
胱硫醚γ-裂解酶(CSE)是H2S合成中的关键酶,CSE抑制剂的使用会增加脂肪细胞对葡萄糖的摄取。
总之,蛋氨酸限制 (MR) 可以通过干扰葡萄糖稳态、增加胰岛素敏感性和炎症反应来缓解糖尿病。
氨基酸水平和代谢影响多个层面的细胞代谢和许多细胞过程,从蛋白质合成到表观遗传调控。这些生理过程与维持细胞稳态和正常功能密切相关。因此,氨基酸代谢异常可能导致疾病的发展。
综上,一些肿瘤病人比如,肝硬化、肺癌、乳腺癌、食管癌、肾癌、胃癌、甲状腺癌、头颈部肿瘤等病人血浆中氨基酸浓度与健康人血浆中氨基酸浓度相比表现出异常,对氨基酸代谢变化的分析可以用来辅助诊断疾病。氨基酸代谢的改变对肿瘤细胞及肿瘤免疫微环境有着显著影响。肿瘤细胞通常依赖于外源氨基酸的供应,相对于肿瘤细胞,正常细胞对氨基酸的需求较低,干扰氨基酸的可获得性,通过氨基酸消耗疗法来诱导癌细胞凋亡也是近年来备受瞩目的研究热点之一。
支链氨基酸在肿瘤和代谢疾病中起重要作用,但不同肿瘤之间对支链氨基酸的需求存在差异。支链氨基酸代谢对促炎CD4+和CD8+T细胞以及免疫抑制调节性Treg细胞的功能同样重要,Treg细胞在代谢性疾病、肝脏和肾脏疾病中发挥着关键作用。
天冬氨酸在某些肿瘤生长中是一个内在的限制因素,其转化依赖于天冬酰胺酶的活性。转氨产物天冬酰胺比天冬氨酸更具渗透性。然而,膀胱癌细胞缺乏天冬酰胺酶,导致转化为天冬氨酸的功能障碍。SLC1A3在某些实体瘤中高表达,可能为解决天冬氨酸酶耐药提供解决方案。
谷氨酰胺在肠、肾、免疫和肿瘤细胞中广泛消耗,与癌基因c-Myc和STAT3有关。SLC7A11在多种癌症中显著高表达,可作为有前景的靶标。GLS是肾小管氨基酰胺代谢的关键酶,CB-839是其抑制剂,显示出良好的抗肿瘤活性。
精氨酸调节免疫,缺乏ASS1的细胞对精氨酸具有依赖性。精氨酸甲基转移酶(PRMT)在肿瘤发生发展中的调节作用也受到广泛关注,多种 PRMT 抑制剂表现出良好的抗肿瘤活性。
蛋氨酸作为必需氨基酸的地位及其在转甲基化过程中的作用注定了细胞对蛋氨酸代谢的依赖。甲硫腺苷磷酸化酶 (MTAP) 基因缺失在一些实体瘤中发生,针对缺乏MTAP的肿瘤细胞的治疗策略是抑制蛋氨酸代谢途径中的关键酶MAT2A。蛋氨酸限制饮食可以抑制肿瘤免疫逃逸。
但是,氨基酸代谢靶向治疗面临挑战,血液氨基酸代谢是一个复杂的生物过程,涉及多个代谢途径和相互作用。因此,准确评估血清氨基酸水平对于疾病筛查和治疗有主要的意义。同时,目前血清各类氨基酸测定方法,一般是空腹抽取这增加了检测的复杂性。而且检查前一周熬夜、饮酒、劳累、服药、情绪抑郁以及进食油腻食物等都会影响氨基酸的评估。
肠道菌群在蛋白质和氨基酸代谢中扮演着重要的角色。通过评估肠道菌群的组成和功能,可以更从另外一个维度了解氨基酸代谢的状态。
一些研究发现,通过调节肠道菌群可以影响氨基酸代谢和相关疾病的进展。通过了解个体的肠道菌群状态,可以针对性地选择合适的综合治疗方法,如益生菌、益生元和饮食干预,以优化氨基酸代谢和减少治疗的不良副作用,比如抗体来阻断细胞因子或其受体导致的血栓形成等不良事件。
除本文常见的20种蛋白质氨基酸外,还包括在各个代谢途径中较为重要的氨基酸及短肽,比如牛磺酸、γ-氨基丁酸(GABA)、肌酸、肌肽等。它们在某些方面对人体的重要作用一样不比蛋白质氨基酸逊色,后续我们再和大家分享。
主要参考文献:
Ling ZN, Jiang YF, Ru JN, Lu JH, Ding B, Wu J. Amino acid metabolism in health and disease. Signal Transduct Target Ther. 2023 Sep 13;8(1):345.