-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
粪菌移植(FMT)这几年很热,表面看,它的逻辑很直白:将健康人的肠道菌群移植到患病者体内,期望借此改善肠道微生态,帮助缓解疾病症状。但是,同样是 FMT,为什么有些人效果明显,甚至症状得到了长期缓解,而有些人却反应并没有达到预期?
其关键在于供体菌群能否在受体肠道定植并长期维持。
定植并不只是看移植后肠道菌群更像供体,而是看供体菌株是否能在受体体内站稳脚跟、稳定下来,并在长期的群落动态中维持。这个过程背后,涉及到很多因素——包括供体和受体肠道环境的相似度、供体菌群的多样性、移植方式等等。
目前,越来越多的研究开始聚焦于供体菌株的定植效率。换句话说,供体菌群是否真的能够在受体肠道环境中稳定生长,功能性地替代或补充原有群落。这是 FMT 成功的一个关键因素。
而定植的成败又受到多方面因素的共同影响,包括微生物物种之间的兼容性、菌株之间的互补性,以及肠道环境本身的特性。在不同的疾病状态下,影响定植效率的因素可能截然不同。
近期的两项大型随机对照试验(FOCUS Trial 和 Gut Bugs Trial)对这两种疾病背景下 FMT 的效果进行了深入分析,其研究结果发表在《Gut Microbes》期刊上。

研究表明,在溃疡性结肠炎的队列中,供体和受体菌群的相似性越高,定植效果越好;而在肥胖的队列中,更大的相似性反而可能降低定植效率,反而更互补的供体-受体匹配可能更有利。
本文我们将通过这两项试验的数据,探讨影响 FMT 定植效率的关键因素,并分析其如何在不同的疾病背景下产生不同的效果。随着对 FMT 机制的深入了解,未来我们也许能在个性化医疗的框架下,根据患者的疾病背景和微生物特点,更精确地选择供体和设计治疗方案,从而提高 FMT 的疗效。
许多FMT 研究会先用群落层面的指标(如 PCoA、α 多样性)说明受体菌群是否更像供体。但这类指标回答的仍是整体相似性问题。尤其在单供体 FMT 中,供体来源相对明确。
在多供体 FMT 设计的实际应用中,还有更棘手更具体的问题:
后面所有“哪些因素影响定植”的统计分析,都是围绕这个问题展开的。本章先把作者怎么定义与计算定植效率讲清楚。
多供体FMT第一道坎:究竟谁给了谁?
单供体 FMT 比较直观:受体出现一个新菌株,大概率来自那位供体。
但在溃疡性结肠炎(UC) 的 FOCUS 试验里,每次用的是 4–7 位供体混合。于是会出现两个麻烦:
所以作者先做了一个基础动作(逻辑很简单):
把受体治疗后样本里的菌株,拿去和每位供体的菌株做DNA 相似度比对,足够像就可以算供体匹配菌株(donor-matching strain)。
再统计一个受体样本里,能匹配上的供体菌株有多少——这就是后面要用到的定植相关指标的基础。
怎么“用菌株匹配”拼出每个受体的供体来源
这一步相当于在反向破案。
先定一条线——多像才算同一菌株
作者用 StrainPhlAn3 估计每个样本在每个物种里的“主导菌株”,再算菌株间 DNA 距离,并做了归一化(不同物种的菌株差异天生不一样,不能直接比)。
下图对比了两类距离:
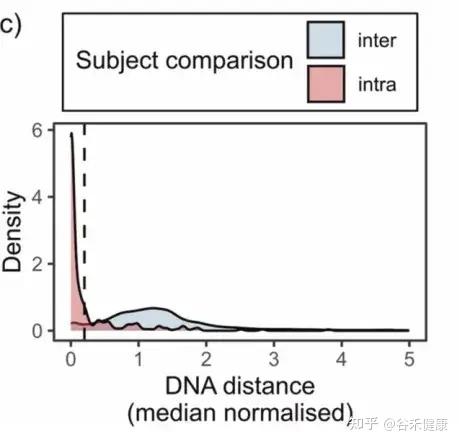
然后画了一条阈值线:0.2。
作者把距离 ≤0.2 当成是“同一菌株/高度匹配”的层级。
注:这条线很重要,因为后续所有“某受体匹配到某供体菌株”的判断,都建立在这个阈值上。
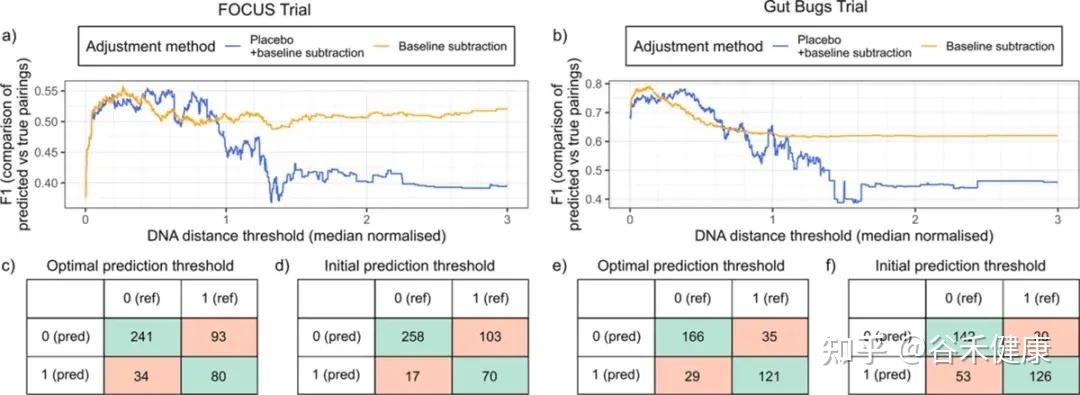
不同队列/测序条件下最优阈值不同,且优化阈值能显著提升配对预测的整体表现
你可以把它理解成:作者先用数据告诉你,同一个人的前后样本(或者同来源)通常会落在怎样的距离范围,再在这个分布上划一个相对保守的界限,用它来决定是不是同一株。
安慰剂组里也会出现看似匹配的噪音,所以要剔除模糊供体菌株
你会注意到一个事实:安慰剂组里也可能出现一些供体匹配菌株 ——这显然不能被解释为真的做了 FMT。这类匹配可能来自背景噪音、算法阈值的误差、或某些菌株本来就在群体里很常见导致碰巧接近。

所以作者在 Figure 1b 做了关键一步:
把安慰剂组里出现的这些模糊供体菌株(ambiguous donor strains)当作噪音来源,从 FMT 组数据里移除,再重新画热图。这样就尽量避免把“背景共有菌株”误判成“FMT 导致的定植”。
这也是多供体、菌株匹配分析里比较严谨的一点:不是匹配上了就算,而是还要问一句,在没有 FMT 的情况下,这种匹配会不会也出现?
反推每个受体可能接到了哪些供体
剔噪后,下图统计每个受体匹配到的菌株分别来自哪些供体,用不同颜色表示不同供体贡献。
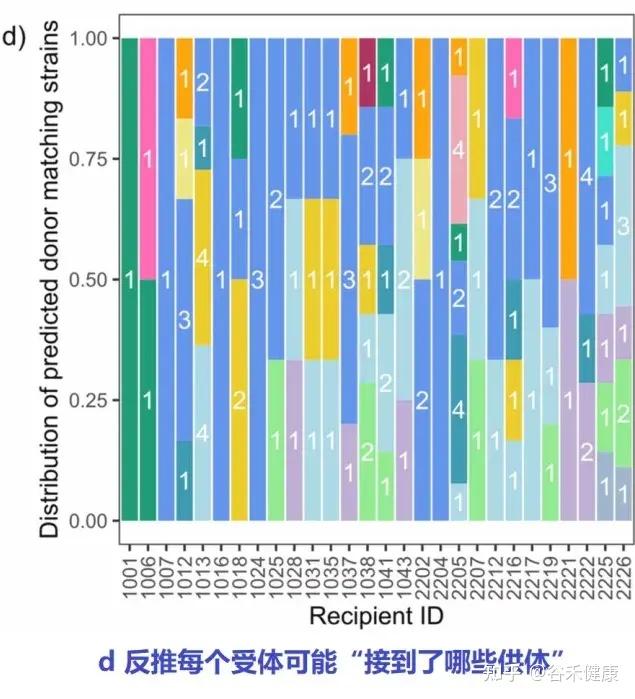
FOCUS 的 FMT 组里,28/32 名受体在 8 周能检测到“只在 FMT 组出现且基线不存在”的供体匹配菌株。
也就是说:大多数人确实能看到来自供体的新菌株信号。
在结果里把定植拆成了两类:新增与替换
同样叫“定植”,机制可能不同。
对每个发生定植的物种—菌株事件,看受体基线有没有这个物种:
注: 这两类在生态学上差别很大:
替换意味着同物种内的菌株竞争、基因型差异、以及原有菌株的生态位被重新占据;
新增更像是受体原来缺失的成员被补齐,或者说受体生态系统里存在可被填补的空位。
这一步很必要,因为它会影响你怎么理解后面供受体相似/不相似:
这也解释了为什么后面在不同疾病队列里,相似性指标的方向可能不一样。
那么,“定植效率”在本文里到底是什么
把“能住下来多少菌”变成一个数字。
当研究人员能数清,受体里到底出现了多少个“可追踪的供体匹配菌株事件”后,就能把它汇总成一个可建模的因变量:
供体的定植效率(engraftment efficiency)。
注:可以粗略地理解为供体带来的、能被追踪到的菌株,在受体体内“留下来”的程度。
后面所有模型(相关性、线性模型、线性混合模型)基本都是:用 定植效率 当结果,看看它和哪些因素有关。
到这里,作者先解决了“没配对表也能继续分析”的卡点。接下来进入论文真正想回答的核心:
哪些因素决定菌株能不能定植?
这种规律在不同疾病人群里是不是完全不同?
两个队列:UC vs 肥胖
作者选了两项双盲、随机、安慰剂对照的多供体 FMT 临床试验:
为什么要用两项试验来说?
这里研究人员认为,如果“哪些因素决定定植”是一条普遍规律,那么换一个疾病队列也应该差不多;如果规律会变,那说明定植机制是队列/疾病特异的。
FOCUS:强干预、长疗程、但测序相对浅
FOCUS试验对象:患有溃疡性结肠炎(UC)的成年人。
FOCUS(UC)试验采用多供体粪菌制备的灌肠剂及胶囊,给UC患者的治疗方案很猛:
采样与数据方面,作者为了让前后对比简单且可比,主要选了:
受体:基线 + 8 周(FMT 组与安慰剂组)
供体:个人供体样本 + 混合供体批次样本
对菌株来说,这是一个供体数量可变、竞争更复杂的输入环境。
Gut Bugs:供体数固定、胶囊给药、测序深
Gut Bugs Trial是另一种更标准化的多供体:
采样时间点:基线与6周(尽量对齐“即时干预后”)。
这些结构差异会怎么影响定植效率?
两项试验虽然都叫多供体,但 FOCUS 的结构更像供体数量可变的混合生态输入,Gut Bugs 更像供体数量固定的标准化输入。
在 FOCUS 里,受体面对的是 4–7 个供体生态位的竞争,而且批次大小(batch size,即每位受体的供体数量)在模型里被作者作为固定效应单独纳入(因为它会影响每个供体成分能否留下来)。
在 Gut Bugs 里,供体数恒定为 4,所以作者明确说明:不把 batch size 当作固定效应。
这会让后面的相关性(比如β多样性与定植效率的方向)更可能呈现队列差异。
再看分析结构:为什么FOCUS能盲法预测配对,而Gut Bugs更多是验证
Methods 里还特别强调了一个分析流程上的差异:
FOCUS 试验:作者在一开始不知道真实供体—受体配对的前提下,先用供体菌株匹配去反推每个受体可能用了哪些供体(盲分析)。之后才从原试验作者处拿到真实配对,用于验证与后续分析。
Gut Bugs 试验:真实配对关系在此前已发表,因此无法再做同样的盲法预测;它在该文章中的角色更像是验证集,验证这套菌株匹配框架在另一种疾病队列里是否还能工作、结论是否一致。
FOCUS更偏向从0推断供体贡献,Gut Bugs更偏在已知答案下验证规律是否可迁移。
FMT的定植不是供体越强越好,也不是受体越空越好,而是供体携带的菌株库、受体基线生态位,以及两者的匹配关系共同决定。
同样是健康供体,有的人就是更容易送进去
很多人会以为:多供体混在一起,最后效果应该差不多“平均掉”。但原文首先用数据把这个想法打破:供体之间的平均定植效率差异显著(p<0.001)。
更直观的是 FOCUS(UC)队列里两个常见供体的对比:
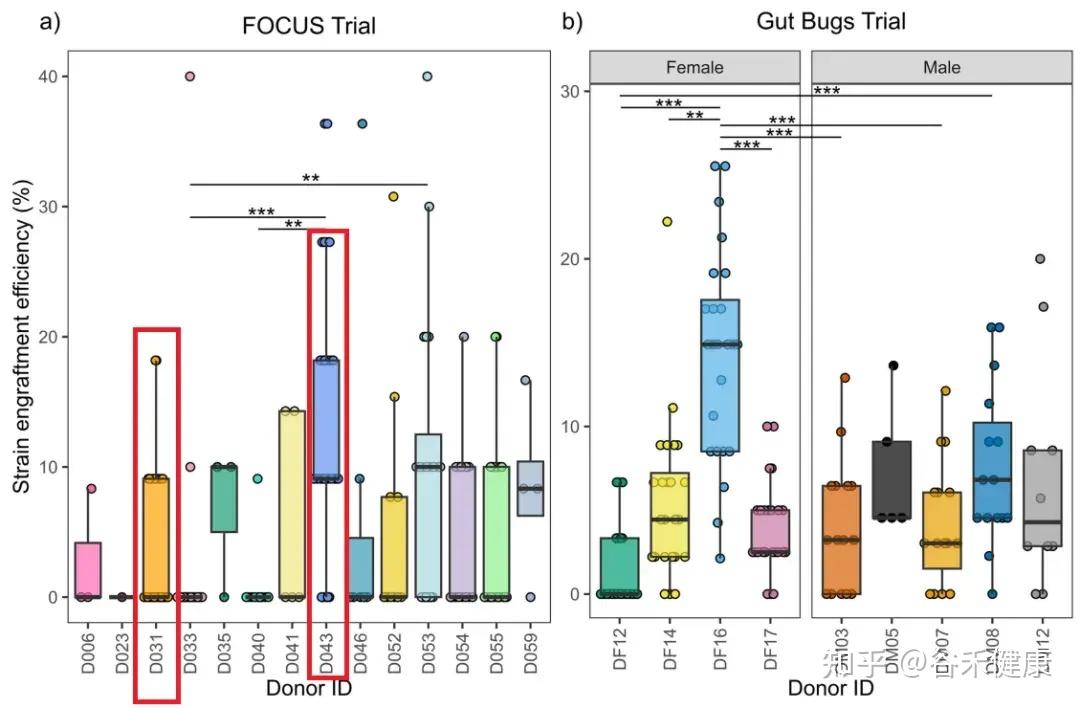
可以看到供体之间差异显著,比如说FOCUS里面:D043、D053 高,D033、D040 低;Gut Bugs里面:DF16 高、DF12 低。
而且这两位供体都被大量使用(分别对应 n=29、n=26 个受体)。这意味着:不是谁用得多谁就看起来强,而是供体本身确实存在可重复的可定植性差异 。
反转:用“匹配度”量化后,两队列规律不同
这个供体适不适合这个受体,它不靠主观印象,在这里研究人员用β 多样性把匹配变成可计算、可检验的量,并发现两队列的关键信号落在不同层面。
在 FOCUS(UC)队列中,供受体的功能谱越接近,供体菌株越容易留下来:
研究人员还进一步做了“按单个 COG 类别差异”去解释的线性模型,但没有找到某一个功能单独驱动的证据,因此提出更合理的解释:这更可能反映的是整体功能的互补性/匹配,而不是某一个功能类别单打独斗。
在 Gut Bugs(肥胖)队列中,功能 β 多样性并没有显著影响定植效率(下图显示相关性不显著)。也就是说,至少在这个队列与这套数据里,“功能越像越好”并不是主导信号。
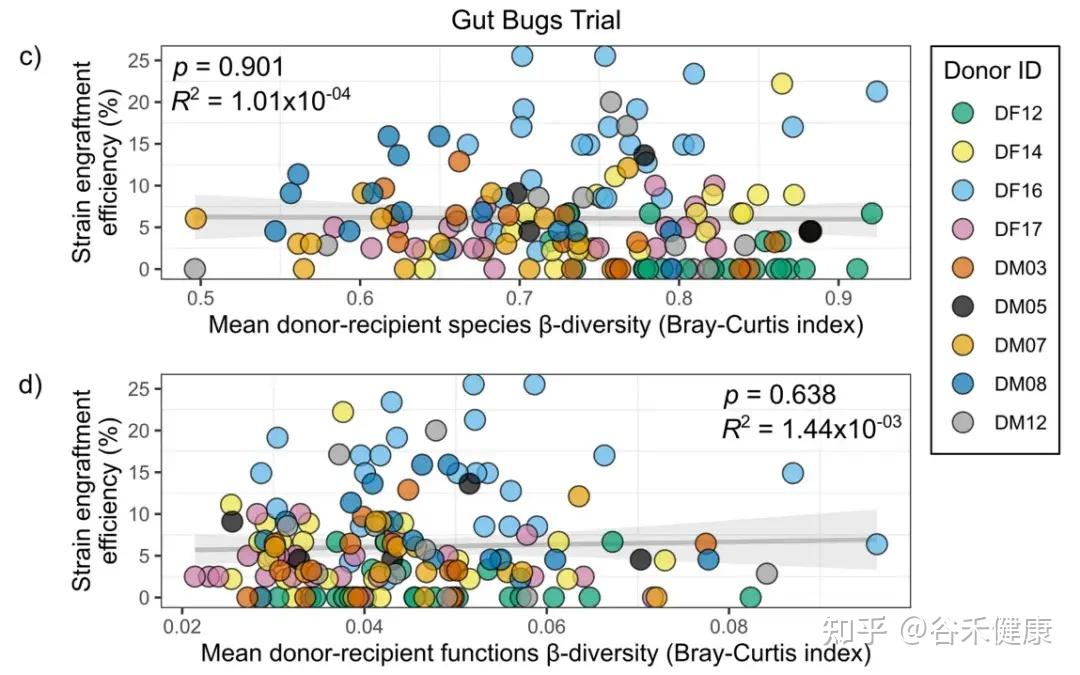
但 Gut Bugs 的匹配信号并不是不存在,而是体现在更接近缺口的指标上:
Jaccard更像在问:受体缺不缺这个物种席位。缺得越多,供体带来的成员越容易补进去。
简单来说,就是UC 队列更像功能上别差太远更容易留下(兼容性/匹配);肥胖队列更像物种上更不一样反而更容易留下(互补性/空位)。
这不是一句话能简化的供体筛选公式
到这里你已经知道为什么会被概括成相反规律:FOCUS(UC)更强调兼容性/匹配(尤其功能层面),Gut Bugs(肥胖)更像互补性/空位(物种有无层面的缺口)。
但这不等于能把它简化成一个选供体公式。下一章节的P/B模型会提示:供体强弱不仅是供体自身属性,还会受受体本身的影响(存在交互项)。换句话说,匹配本身就是关键变量。
原文还提到 D043 有一个很醒目的特征:
它是所有供体里面唯一的一个,平均 Prevotella/Bacteroides(P/B)比 > 1(也就是 Prevotella 更占优势)的供体,这个特征在一些研究里被联系到所谓“超级供体”现象。作者在这里比较谨慎:他们并不武断地说D043 就是超级供体,而是提醒你,它被用得多,也可能本身更容易定植。
α多样性不是越高越好,更像一个最低门槛
很多 FMT 文章都喜欢讲多样性,但这篇文章的结论更接近真实世界:多样性有用,但不是线性万能解释。
在 UC 的 FOCUS 队列里,作者观察到一个挺像门槛的现象:当供体 α 多样性(Shannon)比较低(大约 < 2.5)时,供体—受体配对更容易出现 0% 定植效率。
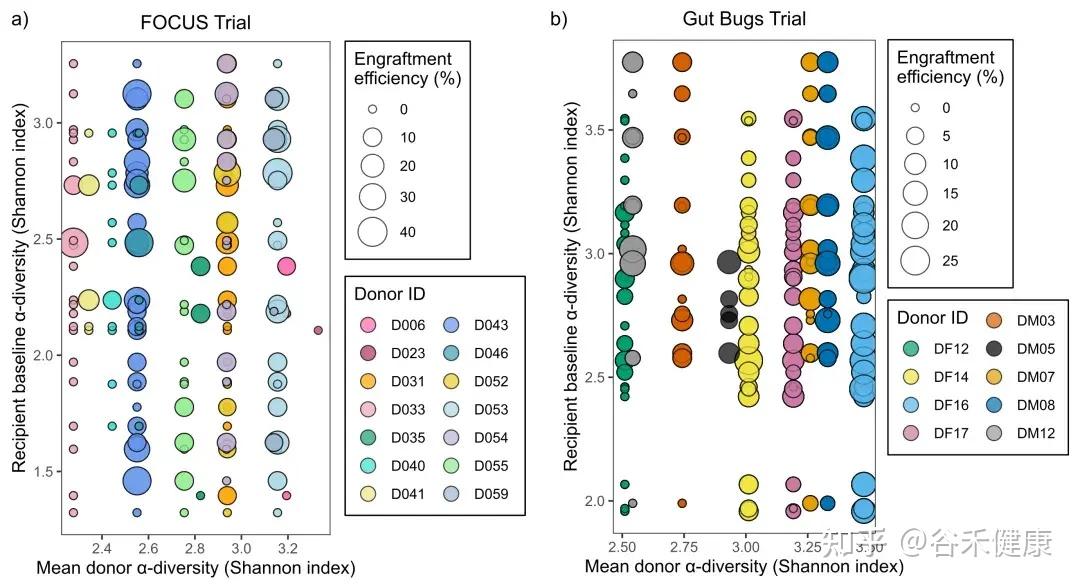
图中比例差异很明显:低于 2.5 时 86.5% 配对为 0%,高于 2.5 时下降到 44.9%.
也可以这样理解,供体群落太单薄,可输出的菌株本来就少,想在受体里留下来更难。
关键是:当供体多样性在常见范围内时,供体多样性与定植效率并没有稳定线性相关(FOCUS:p = 0.955;Gut Bugs 也未显著)。研究人员还强调,两项试验里都出现过“受体 α 多样性反而高于供体”的情况。于是,简单用“供体更丰富→就更能定植”来解释就站不住了。
P/B 比:一个很能用的群落标签(供体端与受体端)
作者用了一个相对好理解、也常用于描述群落结构的指标:Prevotella/Bacteroides 比例(P/B 比) 。有的人肠道菌群里 Prevotella 占优势,有的人 Bacteroides 占优势。
在两项试验的线性混合模型(Figure 6)里,P/B 比给出了比较稳定的信号:
供体 P/B 比越高,定植效率越高 FOCUS(b = 6.28, p = 0.023),Gut Bugs(b = 3.83, p = 0.036)。
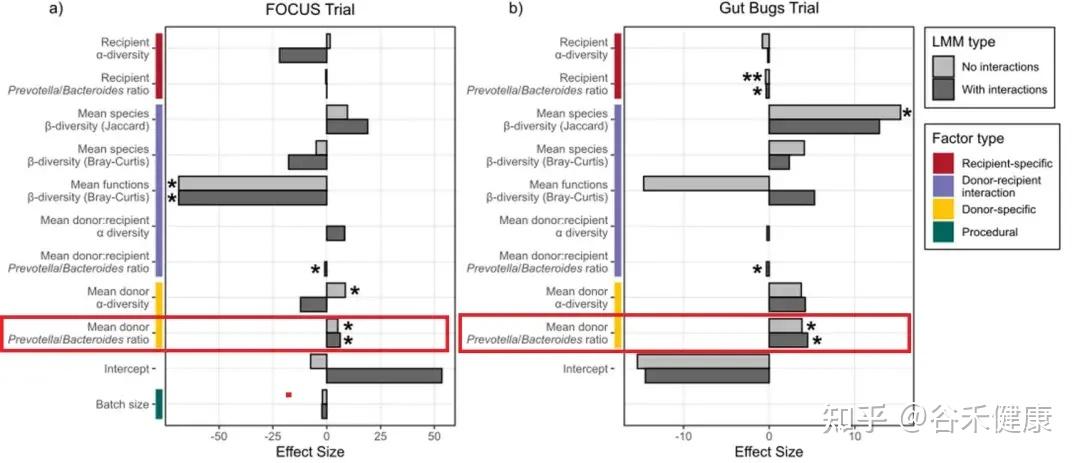
但 P/B 比并不是说,供体越偏 Prevotella 越好这么简单。
受体端与交互:同一供体,在不同受体身上不一定一样
模型同时显示:受体端的 P/B 比、以及供受体之间的组合关系,会显著改变这种供体优势的作用方式。
首先看 Gut Bugs(肥胖)队列:受体 P/B 比对定植效率是显著负向的(b = -0.424, p = 3.77×10^-3)。这意味着在这个队列里,受体本身越偏 Prevotella(P/B 越高),总体上越不利于供体菌株定植。可以理解为:当受体群落已经更偏向某一类“Prevotella 型结构”时,可被外来菌株占据的生态位更少(或同类竞争更强),因此总体定植更难发生。
再看 FOCUS(UC)队列:作者不仅看到供体 P/B 的正向主效应,还看到了一个显著的供体×受体 P/B 交互项(b = -0.899, p = 0.017)。
交互项为负的意思是:偏 Prevotella 的供体并非对所有受体都同样有效;当受体本身也偏Prevotella 时,供体的这种优势更可能被抵消,甚至变成同生态位的竞争。
可以这样理解:供体端的某些群落结构会加分,但受体端也会把关,而且不同疾病背景下,把关方式不一样。
总体思路:对的人 + 对的生态位规则
肠道菌群检测报告可以作为个性化 FMT 的入门级决策与随访工具:一方面用于治疗前分层与配对,另一方面用于治疗后量化是否定植、改了什么,并将结果回收为下一轮配对的证据。
该研究作者甚至强调应建立针对每种疾病的特异方法学,并提出 FMT 的真正潜力应以个体化医学实现:根据疾病/亚型,把受体与一个或多个最可能带来有益菌定植的供体进行配对。
这意味着:
同一份菌群报告,在不同疾病里“怎么解读、怎么用来配对”,规则不应相同。
个性化 FMT 的核心是两件事:
这里的落地流程(四步闭环):
筛受体 → 筛供体 → 做匹配 → 评估与复盘
治疗前——患者分层(用哪套匹配方案)
一份肠道菌群检测用于分病种策略选择,同时缩小供体候选池:
把菌群平衡指标作为受体“微生态脆弱程度”的一个粗筛维度,用于确定是否需要更强的干预(如多次给药、路线选择、随访更密集等),以及作为后续是否改善的评估指标之一。
把多样性作为“受体可被改造程度/生态位可用性”的基础变量。前面的研究也讨论到,跨疾病的 Meta分析中受体 α 多样性与定植常存在关系,但在不同队列呈现不同交互与权重,所以不能只用一个阈值做所有病种的决策,更合理的是在某病种人群里建立自己的判读边界。
哪些常见核心菌群、产丁酸相关菌、黏液层相关菌、有益菌等缺位,决定了后续更偏向新增还是替换。
简单来说,先别急着挑供体,用检测回答:这个受体的底盘是缺位型还是紊乱型,以及属于哪种疾病队列的生态规则。
供体筛选:从安全合格走向微生态特征可量化
传统供体筛选主要是安全(病原体/寄生虫等),而该研究认为,供体的物种组成、功能结构,以及与受体的互补/相似关系,会影响定植效率。
因此供体筛选至少要增加两层可量化标准:
基础质量指标:供体的 α 多样性、关键结构特征(例如 P/B 比在研究里被作为指标之一,也可以同时用其他的相关指标)。
报告列出多种有益菌(如 Lactobacillus、Bifidobacterium等)的丰度与检出情况,可作为供体是否具备可提供的功能模块的证据(例如 产丁酸相关菌群)。
有害菌总体是否过高、以及抗生素耐药风险评估等,可作为长期可用供体库管理的一部分。
供体稳定性:如果供体多次采样,观察其菌群波动(稳定供体更利于可复现)。
供体受体匹配:建立按疾病分轨的匹配规则
该研究给出的最重要启示,是同样的供受体差异度指标,在不同疾病队列里方向可能相反:
炎症性肠病类疾病(更强调功能兼容)
匹配优先级:供受体在功能维度不要差太远(避免来者水土不服),同时供体能补足受体缺失的关键菌群。
可以用谷禾检测报告里的菌群平衡、多样性等指标先做受体分层。炎症类可考虑供体中抗炎/屏障模块相关指标更好的(例如肠道屏障、LPS等指标),并避免在受体本已存在风险提示的方向上进一步加重。
屏障不足者在方案上更强调先稳环境再引入,并把屏障改善作为疗效评估的一部分,而不只追求菌的变化。
如果条件允许,可以用宏基因组做供受体功能匹配。
代谢类疾病(更强调生态位空缺)
匹配优先级:在安全与稳定的前提下,供体应能提供受体缺失的菌群模块;供受体在物种组成上适度拉开差异,可能更利于新菌株进入。
对多供体方案,可进一步用供体间互补减少内耗,避免多个供体在同一生态位高度重叠、彼此竞争导致有效输出下降。
匹配不是一个公式,而是一个分病种的规则库。
当疾病队列的生态位规则复杂、且个体差异大时,多供体更像提高覆盖率的工程策略;但最终仍需靠检测把贡献拆开、把有效组合沉淀下来。
治疗后评估——用同一套指标呈现是否定植
随访时不只看整体更像谁,还可以拓展一些:
这一步形成反馈:把这位患者用什么供体组合更容易定植沉淀为可复用规则,推动下一次配对更精确。
注:做前后评估要尽量保持同一检测平台与标准化流程。
这项研究真正的价值,不只是告诉我们某个供体更强,而是把FMT推进到更精细的层面: 从看群落像不像推进到追踪菌株能不能留下来,并提示不同疾病人群的肠道微生态规则不同。
当我们开始用整个肠道微生态的思路去理解FMT, 就不仅是找一个最强供体,未来更可行的路径是:分病种建立可验证的匹配策略,把治疗做成一套可测量、可比较、可迭代的闭环:治疗前的受体分层,治疗中的供受体匹配,治疗后的定植追踪与反馈,从而让 FMT 更接近可计算的精准干预。
主要参考文献
Behling, Anna H., et al. “Cohort-specific determinants of donor strain engraftment following multi-donor faecal microbiota transplantation in two randomised clinical trials.” Gut Microbes 17.1 (2025): 2597628.

谷禾健康

人类微生物组包含约 1000多 个常见物种,微生物细胞数量达 10-100 万亿个。微生物大多数遗传库分布在人类胃肠道内,与许多生理过程的发育和功能有内在联系,例如,肠道屏障完整性和稳态、营养、免疫和神经心理行为等。
人类肠道的菌群失调(即共生肠道微生物群的变化对宿主健康产生影响)通常与一系列疾病相关,其中许多疾病无法使用完善的医疗方案进行治疗。
在这种情况下,将健康捐赠者的粪便物质直接移植到受体的胃肠道中(称为粪便微生物群移植,简称粪菌移植,FMT)代表了一种操纵受体微生物群并赋予健康益处的治疗方法。许多国家食品和药物管理局最近的批准表明,粪菌移植和治疗性益生菌鸡尾酒疗法目前正在扩大研究和应用领域。
这种方法成功的关键是能够在患病患者的胃肠道内重建并将肠道微生物群恢复到理想的健康状态。据报道,粪菌移植在临床中治疗艰难梭菌感染成功率接近 90%。
最近发表了几项通过粪便微生物移植(FMT)来治疗炎症性肠病(IBD),特别是溃疡性结肠炎的随机临床试验,但是研究设计存在重大差异。这些包括给药剂量、给药途径和频率、安慰剂类型和评估终点的差异。总体结果看起来很有前景,但它们高度依赖于捐赠者和接受者因素。
近日,来自意大利、法国、英国、美国等 25 名IBD、免疫学和微生物学领域专家多次召开会议,通过对当前可用和/或已发布的数据进行深入评估来制定基于IBD 中与 FMT 相关证据的指南。所有成员对声明进行评估和投票,最终形成全体共识会议并生成拟议指南。
声明包括:
这份共识目的是为使用 FMT 评估、管理和潜在治疗 IBD 制定基于共识的声明和建议,以实现标准化实践。
今天谷禾与大家分享该共识或指南内容,并结合以往研究结果和相关经验阐述说明。我们也相信,在临床研究中明确考虑供体和受体的原有肠道微生物生态原则可以更好地指导FMT试验的设计并有助于提高 FMT 的疗效。
★
生态学是一门核心学科,研究集中构建生物群落的过程和机制,并调节其在空间和时间上的变化。
虽然说,生态学和微生物学在研究复杂群落的方向经常会有交叉部分,但两者在历史上都是作为独立的科学学科发展起来的,在概念、术语、综合和理论的使用上往往有所不同。
临床研究中的 FMT,个体之间粪便物质的移植符合社区合并的概念。这个概念指的是:
整个生物群落及其环境的大规模混合
虽然在宏观生物生态学(即植物和动物)中构成罕见事件,但群落合并在微生物系统中很常见,实际上,群落经常作为一个单元迁移。
这一原则与 FMT 治疗相一致,尽管该术语似乎尚未在临床研究中得到很好的确立。然而,合并后群落重新排列的结果(即植入)更常用于跟踪 FMT 功效。
基于来自供体、FMT前、FMT后接受者的粪便微生物组的微生物菌群监测,才能更好的确定与较高供体菌株植入相关的最重要的临床变量,通过不同的上消化道和下消化道引入的混合途径(即通过胶囊、肠镜检查、鼻胃管、鼻十二指肠管或上内窥镜检查和结肠镜检查),单独或结合进行 FMT 给药,会导致 FMT 后供体菌株植入率更高。
这一发现支持了繁殖压力(即引入的个体数量与独立引入的数量的组合)对于在新环境中成功引入非本地物种的重要性。
发生这种情况主要是因为:
i)初始微生物物种种群的大小可以直接影响其在非本地环境中持续存在的能力
ii)即使是短暂的入侵者也会对微生物组产生影响,有时会促进其在后续环境中的引入入侵尝试(例如,重复入侵尝试的重要性)
其次,在 FMT 给药前接受抗生素的患者中,可能供体菌株植入率更高。已知抗生素的使用会导致肠道微生物群失衡(即非生物紊乱)。这种干扰降低了受体胃肠道微生物群的生物抗性,有利于随后的供体群落植入。重要的是,这个个别研究结果,在推广这一原则时需要谨慎,因为 FMT 之前的抗生素剂量、类型和时间都会导致与 FMT 最终结果的差异。
第三,患有传染病的患者在接受单途径 FMT 给药后,微生物组植入量更大。这与以下观点一致:驻留微生物组的先前不稳定(即,在这种情况下,生物干扰)也会对肠道生物抵抗力产生负面影响。特别是,胃肠道中非本地物种(例如感染期间的致病菌)的存在可以促进其他非本地物种的后续入侵。
★
粪便微生物群移植(FMT)被定义为将健康捐赠者的粪便输注到受体的胃肠道中,以治疗与疾病相关的肠道菌群失调。
根据几项随机对照试验和荟萃分析的报告,FMT是治疗复发性艰难梭菌感染的一种既定且高效的治疗选择,最终制定了国际指南,以标准化其使用艰难梭菌感染的可行治疗方式。
继成功治疗艰难梭菌感染后,FMT 也在炎症性肠病 (IBD) 患者中进行了研究,首先是在非随机研究中,随后在随机对照试验中,尽管 FMT 方案和程序存在显着差异,但两者均显示出有希望的结果。
然而,采用 FMT 治疗 IBD 受到一些限制,包括招募捐赠者、准备粪便材料、确定最佳给药途径以及缺乏明确和既定的监管框架。
解决这些问题的潜在策略包括识别和使用可持续、可重复和标准化的方案,最终目标是改变肠道微生物组的组成。因此,建立最佳的FMT整体框架对于IBD的未来管理具有重要意义。
▼
共识过程是按照以下步骤制定的:
确定成员
确定了 25 名共识成员,他们在微生物学、免疫学、FMT 和 IBD 领域拥有公认的专业知识,并全部参加了专家小组。
注:德尔菲法是在20世纪40年代由O.赫尔姆和N.达尔克首创,经过T.J.戈尔登和兰德公司进一步发展而成的。
德尔菲法作为一种主观、定性的方法,不仅可以用于预测领域,而且可以广泛应用于各种评价指标体系的建立和具体指标的确定过程。
分工作小组
根据个人专业知识,每位成员被分配到四个工作组之一:
每个工作组提出了一份关键问题清单,并制定了与指定主题相关的声明。对于每个关键问题,最佳现有证据是通过对相关文献进行系统审查而获得的。声明以专家意见 (EO) 的形式发布。
详细陈述已上传至在线投票系统(http://scott.armstrong.delphi.stlouisintegration.com/delphi2/),并分发给专家组。
专家评分
每轮审查后,都会收集、处理并与专家小组分享专家的答复。
对于每项陈述,专家们被要求对他们的同意程度进行评分:
如果至少 80% 的受访者对每项陈述表示强烈同意或同意保留意见,则达成共识。
未通过此门槛的声明将在后续轮次投票中进行修改和再次评级,直至达成共识。小组专家于 2022 年 6 月 25 日齐聚罗马,对总体声明进行完善和最终批准。
最终达成共识
经过三轮投票,最终的累积声明达成共识。第一轮和第二轮后,分别有67%和79%的陈述通过了80%的同意门槛,而第三轮后100%的陈述达到了目标水平。
★
声明 A1
IBD 的确切病因目前尚不清楚;然而,其发病机制是多因素的,受遗传易感性、宿主粘膜免疫反应和环境(包括饮食和肠道微生物群)的影响。
评论:
IBD,如克罗恩病 (CD) 和溃疡性结肠炎 (UC),是一种慢性、复发性消化道炎症性疾病,是由于遗传易感个体肠道免疫系统和肠道微生物群之间失去稳态而导致的。由于对肠道微生物群的耐受性失调或将微生物与底层组织分开的上皮屏障破坏,导致不适当的粘膜免疫反应,可能会导致 IBD 的发展或持续。
声明 A2
肠道微生物群的组成、相对丰度、多样性和功能的改变(即菌群失调)促进IBD的发生和进展。
评论:
越来越多的证据表明,肠道微生物组组成的不平衡或“生态失调”是促进 IBD 发展影响最大的环境因素之一,因为改变的微生物群与宿主的相互作用可以触发和促进免疫与 IBD 相关的改变。大量证据表明,IBD 患者肠道微生物组存在特定的共同改变,这些改变与许多功能受损相关,包括短链脂肪酸代谢、氨基酸生物合成、氧化应激调节和毒素,可以单独或共同促进 IBD 的发展。
声明 A3
溃疡性结肠炎和克罗恩病患者的肠道微生物组特别缺乏普拉梭菌,这种细菌因其潜在的抗炎特性而被认可。
关于普拉梭菌详见:
肠道核心菌属——普拉梭菌(F. Prausnitzii),预防炎症的下一代益生菌
评论:
越来越多的临床和实验数据表明,共生微生物群在维持人类和实验性 IBD 的炎症过程中发挥着关键作用。
一些报告显示,IBD 期间微生物多样性下降,尤其是厚壁菌门和拟杆菌门。有趣的是,厚壁菌门的成员普拉梭菌显着减少,并且具有公认的抗炎活性。
相反,活动性 IBD 中的变形菌和放线菌通常升高,以及特定的大肠杆菌菌株也如此。在这种情况下,肠道微生物组的成分在炎症性肠病中发挥着至关重要的作用,这可能代表了一种与细菌加工相关的疾病。因此,肠道微生物组和宿主免疫反应之间存在功能失调的关系,从而引发和维持 IBD 的慢性炎症。
声明 A4
IBD 患者感染艰难梭菌的风险高于一般人群。
评论:
IBD 特异性危险因素,例如免疫抑制、炎症的严重程度和扩展以及 IBD 中观察到的肠道菌群失调,被认为是IBD 患者艰难梭菌感染高风险的主要原因。
IBD 患者并发艰难梭菌感染会导致住院时间延长以及结肠切除率和死亡率增加。鉴于这种情况可能会危及生命的并发症,建议在 IBD 发作期间和早期治疗干预期间筛查艰难梭菌。
艰难梭菌的选择较高毒力、抗生素耐药性和反复感染率增加的菌株使得IBD 中艰难梭菌感染的治疗更具挑战性。因此,建议采用个体化治疗方法来控制IBD 发作期间的艰难梭菌感染。
★
声明 B1
适合 IBD 实验性 FMT 的供体应接受血液和粪便检测,测试符合目前通过 FMT 治疗艰难梭菌感染的国家和国际指南,并且一般用于临床实践。
评论:
以 FMT 为目的的供体筛查的主要原则是避免潜在的传染病传播。用于筛查艰难梭菌感染 FMT 的指定血液和粪便参数已在溃疡性结肠炎患者的多项随机对照试验中被证明是安全的。应提供包含待测试的强制性国际参数的列表,而其他参数则应取决于地理区域(例如,热带地区)、患者的医疗状况或捐赠者的病史(例如,粪便钙卫蛋白增加史)。
除了血液和粪便检测外,还应通过多项调查问卷监测总体健康状况、饮食和心理状态,以避免任何潜在的非传染性不良事件。
声明 B2
粪便捐赠应该是自愿的,并且应告知捐赠者捐赠的潜在风险和/或好处。此外,每位患者必须提供书面知情同意书。
评论:
由于粪便采集程序是非侵入性的,并且可以在不受控制的环境中进行,因此不应允许捐赠者直接从粪便捐赠中受益,以避免样本欺诈。然而,根据国家规定,捐赠者可以获得时间和旅行费用的补偿。此外,捐赠者应了解捐赠的风险和益处,因为筛查过程可能会发现以前未知的疾病(例如艾滋病毒、结直肠癌)的诊断结果或其他疾病的易感性(例如与微生物群改变相关的疾病) 。此外,捐赠者应该知道他们可以随时撤回同意。
声明 B3
可以通过粪便库对供体进行管理,以供实验使用,符合适用于艰难梭菌感染的国家和国际指南和法规,并且一般用于临床实践。
评论:
粪便库能够以标准化方式处理粪便捐赠,这适合 IBD 的进一步临床和实验程序。在粪便库中,捐献者在给患者施用粪便之前经过严格筛选,FMT 制备是标准化的,与临床环境相比,制备 FMT 样本所需的成本和时间都可能减少。此外,粪便库拥有专业知识,因此总体上可能有助于优化 FMT 样本的质量。最后,粪便库可以为无法提供此项服务的 IBD 中心提供 FMT 样本。
声明 B4
捐赠者的粪便最好在粪便库现场或进行实验程序的地点收集,遵循国家和国际指南和法规。
评论:
捐赠者应收到有关如何收集粪便的明确说明,最好是在现场或粪便库收集。如果无法做到这一点,收集的粪便应储存在 4°C 下,并在收集后 6 小时内运送到临床地点或粪便库,由经过培训的人员进行处理。
声明 B5
根据实验方案,每个捐赠者都可以参与捐赠不同的 FMT 制剂。
评论:
供体粪便可用于制备不同的 FMT 制剂(例如,新鲜样品与冷冻样品,以及每个制剂的单个供体与多个供体)。到目前为止,建议使用冷冻 FMT 样品而不是新鲜制剂,主要是因为安全性。冷冻 FMT 样本可以被隔离,直到捐赠期结束时完成全面的捐赠者筛查。对于新鲜的 FMT,在完成完整的筛选过程之前对材料进行管理。因此,对于新鲜的 FMT,建议进行更定期的供体常规筛查和菌群评估。
声明 B6
应根据国家和国际准则和法规维护和存储捐助者信息登记册。
评论:
与 FMT 流程相关的捐赠者信息登记应由国家和国际医疗保健机构监管。来自捐赠者和接受者的信息应保存至少 10 年,或符合国家和国际法规。这些数据应提供给粪便库以获得长期安全数据。
声明 B7
患者不应直接使用粪便库来治疗 IBD。FMT 样本的提供应始终在治疗医疗保健提供者的指导下进行,并符合国家和国际指南和法规。
评论:
粪便库的使用应仅限于医疗保健提供者,因为 FMT 管理需要记录和适当的后续行动,以应对任何潜在的不良事件,而这些不良事件只能在医生的监督下安全地发生。因此,患者直接使用粪便库是不合适的。
声明 B8
FMT 的整个过程(从捐赠者筛选到粪便收集和 FMT 样本管理)应具有清晰的可追溯性。因此,应保留每个 FMT 样品的等分试样以进行测试,以防发生意外的不良事件。
评论:
FMT 过程的所有步骤都应进行登记,捐赠者样本的等分试样应保留并储存在 -80°C 下,以便在发生任何意外不良事件(例如病原体感染)时进行回溯。
据报道,FMT 后出现耐药大肠杆菌传播,这表明保留供体粪便以便在可能的不良事件发生后进行进一步分析的重要性,并保证在此类情况下及时干预。
声明 B9
关于供体 FMT 制备技术方面的共同协议,将有助于在全球范围内提供程序标准化和优化,从而促进结果的解释。
评论:
尽管研究设计不同,FMT 已显示出有希望的结果,尤其是在溃疡性结肠炎中。方案的变化包括不同的 FMT 输注途径(例如,鼻十二指肠、直肠、口服)、给药频率、对照安慰剂(例如,水、自体粪便材料)和终点测量。关于冷冻粪便材料制备、储存和给药量的剂量标准化将有助于未来 FMT 研究的解释和比较,包括结果。
声明 B10
需要进行研究,来确定与粪菌移植作为治疗炎症性肠病选择的临床疗效和整体治疗效果更好相关联的供体特征。
评论:
必须进行研究来确定供体标志物,以实现 FMT 在 IBD 中的最佳治疗效果和总体成功。因此,应该对微生物群、饮食模式(问卷)和其他方面(如药物使用、家族病史、心理状态和遗传背景)进行表征,以确定改善临床结果的潜在趋势。除了特定的供体标记外,还应该研究供体-受体的植入情况。
★
声明 C1
以前进行的随机对照试验一般规模较小,且方法学上存在异质性;因此,目前还不能得出明确的结论。
评论:
在成功用于治疗艰难梭菌感染后,FMT 也在溃疡性结肠炎患者中进行了研究,首先是在非随机研究中,然后在随机对照试验中,均取得了有希望的结果,尽管存在FMT 程序和测量结果存在显着差异。事实上,尽管这些研究和随后的荟萃分析强调供体 FMT 施用后令人满意的缓解率,已发表和/或可用的随机临床试验通常规模较小且方法学上异质,因为它们在粪便输注的时间、数量和途径、FMT 供体粪便与对照(假冒)的特征方面存在差异,使得结果难以从整体上解释结果,无法得出明确的结论。
声明 C2
对于患有IBD的轻度和重度复发或难治性难免性艰难梭菌感染,建议采用FMT作为治疗选择。
评论:
FMT 对于治疗无 IBD 患者的复发性艰难梭菌感染有效, 以及患有溃疡性结肠炎和克罗恩病的患者。然而,针对溃疡性结肠炎患者的研究报告称,单剂量 FMT 无法预防溃疡性结肠炎发作。没有足够的证据推荐 FMT 作为IBD首次艰难梭菌感染的治疗方法。
声明C3
FMT 可有效诱导轻度至中度溃疡性结肠炎的缓解;然而,没有足够的证据推荐 FMT 作为常规临床实践中溃疡性结肠炎的治疗方法,其使用通常应仅限于研究环境。
评论:
迄今为止,FMT 在诱导轻度至中度溃疡性结肠炎患者缓解方面显示出有希望的结果。然而,这些研究是在溃疡性结肠炎患者队列中进行的,样本量相对较小,而且研究设计之间存在差异,使得研究之间的比较难以协调。因此,没有足够的数据支持临床常规使用 FMT 来诱导溃疡性结肠炎患者缓解。但专家们一致认为,FMT可在特定情况下使用,应具体情况具体考虑,并与有关各方详细讨论。
声明C4
随机对照试验表明,在 FMT 后获得缓解的溃疡性结肠炎患者通常在 FMT 治疗后不会持续缓解超过 1 年。
评论:
溃疡性结肠炎中的 FMT 研究缺乏有关治疗效果和持久性的长期随访数据。因此,需要对治疗后的时间进行更持续的疾病监测随访。现有数据表明,复发是可能的,为了实现长期疗效,维持治疗可能是强制性的。然而,诱导治疗和维持治疗的输注次数和剂量均应进一步研究。
声明C5
反复输注和供体-受体移植可能对于 FMT 治疗溃疡性结肠炎的成功非常重要。
评论:
来自对溃疡性结肠炎进行 FMT 的现有随机对照试验的数据表明,重复输注很重要;然而,目前对于 FMT 成功所需的最少管理次数尚未达成共识。此外,FMT 在溃疡性结肠炎中的疗效似乎也依赖于受体,表明供体-受体移植至关重要。除了鉴定对 FMT 成功可能重要的供体标记外,还应研究受体标记及其与供体粪便物质/粪便抗原相互作用的重要性。
声明C6
FMT 后肠道微生物组组成多样性的增加,可能是 溃疡性结肠炎反应的标志。
评论:
除了临床和内镜缓解等临床结果外,还应评估微生物标志物,包括微生物组多样性的改变(即增加),并将其与未来研究中 FMT 的成功或失败相关联。这些标记物可用于预测患者的反应,这有可能实现精准医疗方法的个性化治疗。
声明C7
现有数据表明,FMT 对于轻度至中度溃疡性结肠炎诱导缓解的风险较低;然而,在使用 FMT 治疗 IBD 时已有严重不良事件的报道,包括疾病恶化。
评论:
已进行的随机对照试验中对患者安全性的评估显示出良好的结果,不良事件非常有限,其中大部分与给药方式有关。一般来说,鼻十二指肠给药比直肠给药灌肠产生的不良事件相对较多;因此,后者已被普遍认为是更安全的递送途径。然而,迄今为止,尚缺乏溃疡性结肠炎患者的长期 FMT 安全性数据。
事实上,在随机对照试验中,在有限数量的患者(<10%)中观察到了严重的不良事件。这些包括当通过上消化道给药进行 FMT 时误吸和疑似小肠穿孔。与 FMT 手术相关的最常见的严重不良事件是疾病恶化,需要住院治疗,在少数情况下需要结肠切除术。
在 Costello等人的试验中,观察到 43 名接受自体 FMT 的患者中有 2 名病情恶化,而 38 名接受捐赠者 FMT 的患者中有 1 名病情恶化。
在 Moayyedi 的试验中,38 名患者中有 2 名出现斑片状炎症和脓肿。其他显着的严重不良事件包括肺炎、艰难梭菌感染或其他形式的小肠结肠炎。
声明C8
随机对照试验尚未证明 FMT 和对照组在疾病恶化或轻微或严重不良事件引起的症状方面存在显着差异。
评论:
溃疡性结肠炎中的 FMT 试验对不良事件进行了评论;然而,由于对照组和治疗组之间没有发现显着差异,因此这些不良事件被认为是给药程序的结果,而不是加工后的供体粪便材料本身。
声明 C9
溃疡性结肠炎中 FMT 后,常见的不良事件是短暂的轻微胃肠道症状,如腹胀、腹泻和肠胃气胀。
评论:
FMT 试验中高达 83% 的患者观察到轻微不良事件,包括胃肠道症状,如短暂性腹泻、肠鸣、腹痛、腹胀和肠胃气胀。也有短暂发烧的报道。大多数不良事件在手术后几天内自然消失。
声明 C10
在临床实践中,没有足够的证据推荐 FMT 作为克罗恩病的治疗方法。迄今为止,其使用应仅限于研究环境。
评论:
克罗恩病中 FMT 的可用数据非常有限,主要包括病例报告和试点研究,而不是大型随机对照试验。这些研究显示不良事件,主要包括胃肠道症状,疾病发作报告为与 FMT 相关的严重不良事件。
Vermeire等人的一项初步研究显示,六名难治性 克罗恩病患者在 FMT 后第 8 周没有差异。
在评估 FMT 在维持克罗恩病缓解方面的效果时,Sokol等人报告称,与假手术组相比,FMT 组的急性发作发生率没有显着降低。
进一步的研究应包括优化该患者群体的缓解诱导和维持。大型随机对照试验必须推荐 FMT 作为克罗恩病患者的可行治疗方法。
声明 C11
在临床实践中,没有足够的证据推荐 FMT 作为贮袋炎(Pouchitis)的治疗方法。迄今为止,其使用应仅限于研究环境。
注:贮袋炎(Pouchitis)是保留肛门的大肠全切除术(或次全切除术)术后发生在患者回肠贮袋的非特异性炎症,是溃疡性结肠炎行回肠贮袋-肛管吻合术后最为常见的并发症。
本病病因不明。大约有1/3的患者在术后5年内可能出现这种难以解释的炎症,其中2/3的患者有复发的可能性。
评论:
据信,患有贮袋炎的患者也会出现菌群失调。目前,只有有限的研究使用 FMT 来治疗贮袋炎。然而,在已发表的文献和病例报告中,该手术大多被报道是安全的,但并不有效。
与溃疡性结肠炎中 FMT 的随机对照试验类似,所进行的研究也具有异质性,并评估了不同的结果测量。因此,需要进一步研究和优化方案来确定 FMT 在贮袋炎中的潜在用途。
声明 C12
关于 FMT 在克罗恩病和贮袋炎中的安全性数据不足。
评论:
基于缺乏大型随机对照试验和长期随访数据,目前无法得出FMT治疗克罗恩病和储袋炎的安全性结论。
声明 C13
需要进一步的研究来确定 FMT 在克罗恩病和贮袋炎中的有效性和安全性。
评论:
需要对克罗恩病和储袋炎的 FMT 进行进一步研究和优化,以评估疗效并生成(长期)安全性数据,以便将 FMT 引入临床环境。
★
展望D1
未来的研究需要确定精准的 FMT 供体和受体用于治疗 IBD 的最佳特征。
评论:
FMT 已被证明是一种有前景的溃疡性结肠炎治疗策略。然而,有效率似乎受到供体特异性、受体特异性和手术特异性特征的影响。此外,供体-患者移植获得了更多支持,有利于确定通用的“超级供体”。因此,需要进一步的研究来定义理想的患者和捐赠者特征及其最佳移植。
展望D2
有必要进行对照FMT试验,以优化IBD特定表型的疗效。
评论:
未来的研究在考虑 IBD 中 FMT 的结果时应考虑严格定义的患者表型。这些研究有可能确定 FMT 给药后与阳性反应或缺乏反应相关的特定表型。
展望D3
需要确定预测 IBD 中 FMT 反应的生物标志物。
评论:
除了确定供体和受体以及患者表型可能的最佳特征外,还需要确定免疫学和微生物生物标志物来预测对治疗的反应,以避免因 FMT 治疗无反应而造成时间、成本和不良事件的损失。
此类生物标志物可以通过 16S rRNA 扩增子测序、鸟枪法宏基因组测序、蛋白质组学和/或转录组分析来检测。通过识别此类生物标志物,有可能为 IBD 的 FMT 治疗设计更有针对性的策略,从而朝着更加精确、个性化的医疗方法发展。
展望D4
未来的研究需要确定基于 FMT 的 IBD 治疗的最佳配方和给药途径。
评论:
提高 FMT 功效的最佳剂量尚未确定。迄今为止,鼻十二指肠管输送以及通过结肠镜检查或直肠灌肠进行 FMT 输注已成为 IBD 研究最多的给药途径。
然而,最近的一项研究利用含有冻干粪便微生物群的口服胶囊作为其递送系统。这种给药途径侵入性较小,因此可能更受患者青睐。需要更多的随机对照试验来优化剂量和给药途径。
展望D5
需要进行研究来积累有关使用补充策略来提高 FMT 疗效的循证信息。
评论:
通过 FMT 调节肠道微生物组成的成功率可以通过补充策略来提高,例如捐赠者和接受者的支持性抗炎饮食, 通过优化FMT前的肠道准备,也可以通过抗生素预处理。如益生菌、益生元、合生元和后生元补充。
扩展阅读:
展望 D6
需要进行研究来评估 FMT 作为 IBD 的独立治疗方法或与当前可用的治疗方式相结合的作用。
评论:
除了评估补充策略(D5)之外,还需要进一步研究 FMT 与目前使用的 IBD 联合疗法(从皮质类固醇到生物制剂和 JAK 抑制剂)的组合。
这种针对免疫反应和肠道微生物组成的组合方法可能比单独的每种策略带来更高的缓解率。此外,应研究预防发病和/或术后复发,以及 FMT 对癌症治疗的影响,反之亦然。
★
本手稿的作者代表 IBD 各个方面的国际专家组,他们一致认为,在将 FMT 推广为公认的 IBD 治疗策略之前,有必要进行进一步的研究。人们普遍认为 FMT对于 IBD 患者是安全的,特别是对于溃疡性结肠炎患者。
文献中报道的大多数并发症主要与粪便输注的给药途径有关,而不是与感染传播有关。然而,为了避免不良事件的负担,应遵循针对艰难梭菌感染的 FMT 治疗现有的国际指南,来严格筛选捐赠者。
IBD 中的粪便微生物群移植 (FMT) 途径:从健康供体到恢复疾病患者的肠道微生物群
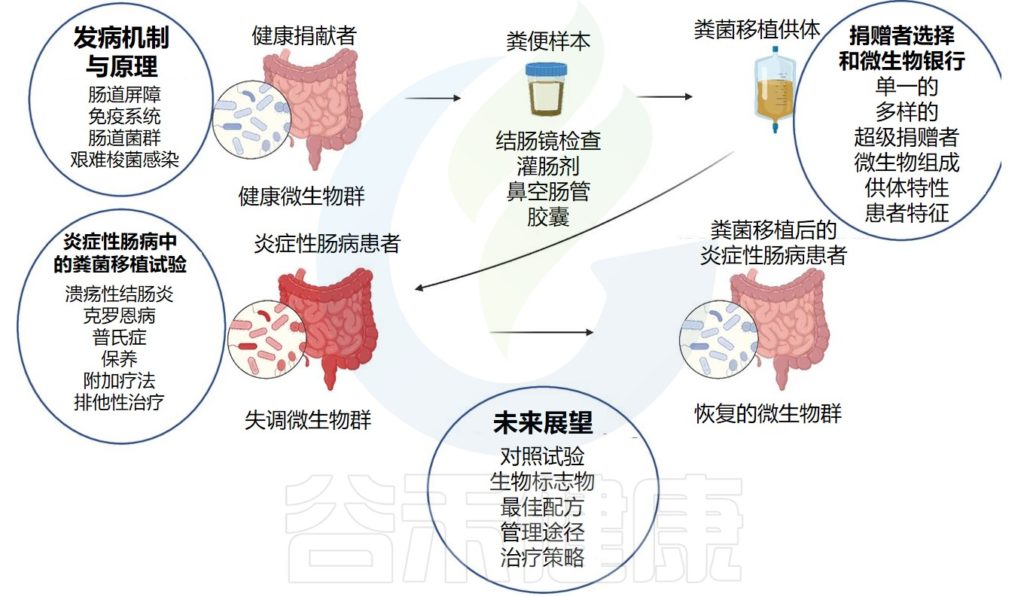
doi: 10.1136/gutjnl-2023-329948.
应投入粪便库以促进FMT研究,并应考虑通过实施永久捐赠者登记、通过微生物群特征和捐赠者健康状况筛选捐赠者粪便材料以及优化捐赠者粪便材料、粪便样本的储存,来治疗IBD的可能性。
粪便库应登记所有捐献者和患者数据,以便有效追踪并监测 FMT 施用后健康状况的变化(例如缓解/发作、心理状态)。
已经进行了几项 FMT 试点研究和随机对照试验来治疗 IBD,但使用的是异质研究设计。现有的结果,特别是在溃疡性结肠炎方面,是有希望的,但似乎依赖于供体和患者。然而,要将 FMT 纳入日常胃肠道实践中,还需要进一步研究来优化短期和长期成功率,并进一步评估安全性。
该方法应确定:最佳给药途径、剂量、频率、供体-受体植入、患者表型,以及 FMT 反应的免疫学和微生物组生物标志物的识别。
总而言之,这样将有助于 FMT 的标准化及其治疗溃疡性结肠炎的临床应用。对于克罗恩病和储袋炎,必须进行进一步的研究来评估其使用的(长期)安全性和有效性。尽管如此,这一系列研究可能会从优化其在溃疡性结肠炎中的使用所采取的措施中受益匪浅。
未来的工作包括对供体微生物群进行严格表征,以及调查 FMT 前后对 IBD 接受者的影响,这可用于最大限度地提高 FMT 功效并阐明作用机制。
通过研究供者和受者的支持性饮食、肠道准备、抗生素预处理、益生菌、益生元、合生元和生元后支持,以及与 IBD 治疗同时进行的联合治疗,进一步提高 FMT 的疗效至关重要。此外,识别与 FMT 成功预测相关的特定微生物菌株,可能会开发出明确的单菌株或多菌株益生菌。
参考文献:
Dini-Andreote F, Custer GF. Ecological principles of fecal microbiota transplantation. Trends Microbiol. 2023 Jun 8:S0966-842X(23)00162-2.
Lopetuso LR, Deleu S, Godny L, Petito V, Puca P, Facciotti F, Sokol H, Ianiro G, Masucci L, Abreu M, Dotan I, Costello SP, Hart A, Iqbal TH, Paramsothy S, Sanguinetti M, Danese S, Tilg H, Cominelli F, Pizarro TT, Armuzzi A, Cammarota G, Gasbarrini A, Vermeire S, Scaldaferri F. The first international Rome consensus conference on gut microbiota and faecal microbiota transplantation in inflammatory bowel disease. Gut. 2023 Jun 20:gutjnl-2023-329948.