-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
在当代营养流行病学的视野中,我们长期致力于寻找一种最佳饮食模式。无论是地中海饮食、生酮饮食还是植物基饮食,焦点往往集中在吃什么。然而,这种静态的视角忽略了人类饮食行为中最显著的一个特征:时间上的波动性。
举个例子,工作日与周末的割裂,很多人在周一至周五严格控制热量,吃高纤维的健康沙拉;而一旦到了周五晚上或周末,各种吃大餐,高脂、高糖食物轮流上,或者饮食时间变得极不规律。

如果我们将时间跨度拉长,计算其营养摄入的平均值,这些人的数据可能依然显示为健康。这就带来了一个问题:
如果平均营养摄入达标,为什么代谢紊乱和肠道微生态失调的问题依然普遍存在?
近期《Nature》几个子刊的研究,揭示了被长期忽视的真相:
饮食的规律性与营养供给的精准度,可能比单一的追求饮食质量,更能影响肠道微生态的健康。

Singh 等人发表的最新研究(Nat Commun, 2025),通过分析“Food & You”数字队列中近1000名参与者长达两周的高分辨率饮食记录与微生物组数据,饮食质量的时间波动性是破坏肠道菌群多样性的独立风险因素。
Estrela等人的研究(Nat Micro, 2025)深入微观层面,告诉我们肠道菌群挨饿的时候到底会发生什么。
随机休眠-唤醒,可能会让细菌本应用于繁殖的能量储备耗尽,共生菌因无法快速复苏而被淘汰。细菌一旦应激,可能啃食肠壁,使屏障功能变薄;若饥荒持续,则启动终极生存策略——同类相食。这种层层升级的生存博弈,最终将肠道生态系统推向从共生到对抗的危险边缘。
那么,如何才能让肠道菌群真正吃饱吃好,避免生存博弈演变成对宿主的反噬?
膳食纤维与脂肪、蛋白质之间又存在怎样的微妙平衡,才能既满足人体需求又不伤害有益菌?
那些看似不起眼的微量元素,又是如何在这场微观战争中决定菌群的站队?
…
本文将综合这些前沿成果,详细了解菌群喂养的底层逻辑,从关注宏观层面饮食营养的平均达标,转向整合多维度包括时间层面的规律饮食与微观层面的精准喂养。我们将探讨如何通过消除隐性饥饿、维持微量元素平衡以及建立稳定的饮食节律,从而为预防代谢性疾病和构建深层免疫防线提供可落地的精准营养行动指南。
在既往的营养学研究中,我们习惯于通过平均值来评估一个人的饮食质量。例如,如果一个人在一个月内摄入了足够总量的膳食纤维,无论他是每天均匀摄入,还是集中在几天内突击摄入,他在传统的营养评估中得到的得分往往是相似的。
然而,Singh等人的研究通过高分辨率的时间序列分析,彻底打破了这一平均值的说法,揭示了饮食规律性作为独立健康维度的决定性作用。

突破传统的方法论:从回忆问卷到动态观测
该研究依托于“Food & You”数字队列(http://clinicaltrials.gov NCT03848299),这是一个极具前瞻性的研究项目。不同于传统流行病学依赖参与者回忆过去一年饮食习惯的食物频率问卷,这种方法类似一张模糊的静态快照,Singh 等人利用智能手机应用程序辅助的实时追踪技术,记录了近 1000 名参与者在两周内每一餐的详细构成。
这种方法论的革新使得研究者能够计算出一个全新的指标:每日健康饮食指数(Daily HEI)。传统的平均健康饮食指数掩盖了每日的波动,而每日健康饮食指数则像一部动态电影,捕捉了饮食质量在时间轴上的每一次震荡。
研究人员进一步引入了个体内变异系数(Intra-individual Coefficient of Variation, CV),专门用于量化这种震荡的幅度。通过将微生物组测序数据(16S rRNA gene sequencing)与这些高频饮食数据进行关联分析,一个隐藏在平均值背后的规律浮出水面。
每天吃沙拉,健康饮食的人,菌群多样性反而不如饮食普通但规律的人?
数据的统计分析揭示了一个单调且稳健的负相关关系:
饮食质量的变异性越高,肠道微生物群的 α-多样性越低(尤其是 Shannon 指数)。
不同生理和饮食因素与香农多样性之间的相关性
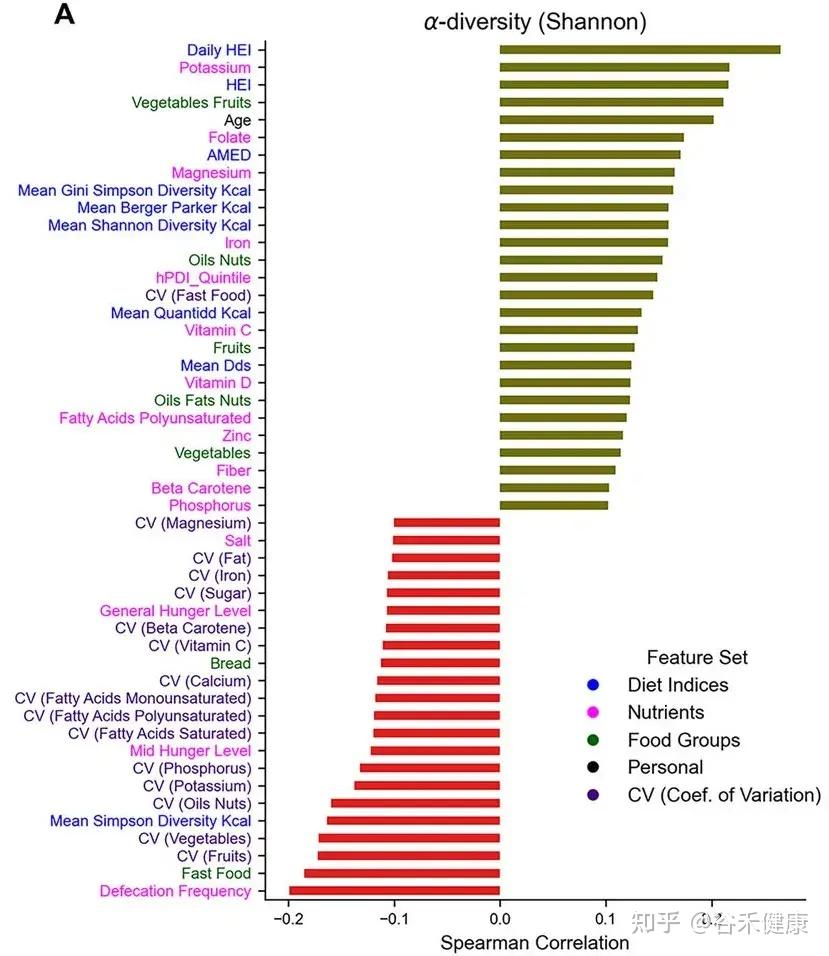
这一发现具有极高的临床意义。Shannon 指数反映了群落中物种的丰富度和均匀度,通常被视为生态系统健康和韧性的标志。
研究数据显示,即使在那些平均饮食质量较高的参与者中,如果他们的饮食习惯呈现出高波动性(例如:周一吃素,周二高脂,周三断食),其微生物多样性依然显著低于那些饮食质量中等但非常规律的个体。
这意味着,肠道微生态系统对于“不确定性”忍耐度有限。 剧烈的饮食波动相当于在肠道内制造了不稳定的生态位,导致只有少数菌能够快速适应环境变化的,能够存活,从而降低了整体生态系统的复杂度和稳定性。
具体菌群的响应
Singh 等人的研究并未止步于宏观的多样性指标,而是深入到了分类学(Taxonomy)层面,明确指出了哪些细菌是饮食规律性的受益者,哪些则是波动的获益者。
规律饮食滋养:毛螺菌科、粪球菌属
数据表明,属于厚壁菌门下的毛螺菌科(Lachnospiraceae),尤其是粪球菌属(Coprococcus),与饮食的规律性呈现最强的正相关。
毛螺菌科,如真杆菌属(Eubacterium)、毛螺菌属(Lachnospira)和丁酸杆菌属(Butyribacter),均是预测高健康饮食指数、蔬菜、水果、坚果及膳食纤维摄入的关键特征菌。
粪球菌属是肠道内重要的产丁酸者。丁酸盐不仅是结肠上皮细胞的主要能量来源,还具有强大的抗炎功能。
研究发现,粪球菌属的丰度对于蔬菜、水果和全谷物摄入的稳定性高度敏感。当这些富含纤维的食物来源在几天内忽高忽低时,粪球菌属的种群数量会迅速崩塌。
这表明这类有益菌需要持续、稳定的底物供应,来维持其在竞争激烈的肠道环境中的生态位。
趁乱反噬:活泼瘤胃球菌
与之形成鲜明对比的是,饮食质量的高变异性与活泼瘤胃球菌(Ruminococcus gnavus)的富集显著相关。
研究还发现,Mediterraneibacter、Lawsonibacter、Dysosmobacter等,与肉类摄入、快餐消费以及蔬菜、水果、坚果摄入的不规律性(高 CV)呈正相关,并与腹泻比例增加显著相关。
活泼瘤胃球菌是一种典型的病原共生菌。在健康肠道中,它可能以低丰度存在,但在炎症性肠病、克罗恩病患者体内,常观察到该菌的过度生长。
该菌具有分解含有唾液酸的宿主黏蛋白的能力。当饮食中的外源性营养(如膳食纤维)波动剧烈导致供应中断时,活泼瘤胃球菌能够迅速切换代谢模式,利用宿主的黏液层作为备用能源。
数据暗示,饮食的不规律性实际上是在为活泼瘤胃球菌、Mediterraneibacter、Lawsonibacter这类具有高度适应性的机会主义者创造竞争优势,从而增加了肠道促炎环境的风险。
蔬果摄入波动大,是菌群失衡的关键推手
研究进一步细化了不同食物类别的波动影响。结果显示,蔬菜、水果、坚果摄入量的变异性,即吃得忽多忽少,对微生物组的影响最为显著。相比之下,精制谷物或乳制品的摄入波动对菌群多样性的冲击较小。
这背后的逻辑在于:蔬菜和水果是膳食纤维的主要来源,对于肠道细菌而言,这些纤维是赖以生存的“口粮”。
如果这些纤维的供应不稳定(高变异性),那些专性依赖纤维发酵的细菌(如前述的毛螺菌科)就会面临周期性的饥饿压力,无法建立稳定的种群;而那些代谢灵活、能吃“杂食”甚至能“吃人”(降解黏液)的细菌则会占据主导地位。
小结:规律性是独立的健康参数
上述研究确立了一个新的营养学范式:规律性本身就是一个独立的、关键的健康参数。
我们不能再单纯地建议人们多吃蔬菜,而应该建议每天稳定地吃蔬菜。因为从微生态的视角来看,三天吃一次大量的沙拉,其生态效益远不如每天吃一小份沙拉。
不规律的饮食习惯,实际上是在肠道内进行着一场持续的、负面的自然选择,逐渐淘汰了那些维护健康的共生菌,而筛选出了潜在的致病菌。
那么,为什么细菌对波动如此敏感?在微观层面上,当营养供应中断的那几个小时或几天里,细菌究竟经历了什么?
下一章节,我们接着来看Estrela等人的一篇文章,有详细的机制解析,深入到细菌的细胞内部,去洞察微观世界的隐形饥荒。
如果说上述研究从宏观层面来告诉我们,饮食波动会导致多样性下降和机会病原菌滋生。但要真正理解这场危机的根源,我们需要深入到细菌的视角,去体验它们在面对“断粮”时的生死抉择。
Estrela等人发表在《Nature Microbiology》的文章为我们揭开了这场微观“饥饿游戏”的规则。

研究表明,细菌并不只是被动地等待死亡,它们演化出了一套极其复杂的策略来应对营养匮乏。对于肠道细菌而言,宿主少吃一顿,或者饮食结构的一次剧烈跳变,就意味着它们必须在毫秒级的时间内启动应急预案。
肠道里的“盛宴与饥荒”循环
尽管现代人往往处于营养过剩的状态,但这并不意味着肠道细菌总能吃饱。相反,细菌生活在一种“盛宴与饥荒”交替的极端环境中。
盛宴期
当宿主进食后,膳食成分进入结肠,营养物质瞬间激增。此时,那些生长速度快、擅长降解复杂膳食多糖的厚壁菌门细菌占据绝对优势。例如,罗氏菌属(Roseburia)、真杆菌属(Eubacterium)和瘤胃球菌属(Ruminococcus),它们在有食物时不仅自身快速增殖,还通过交叉喂养滋养其他菌群。
饥荒期
在宿主睡眠期间、餐间空隙,或者当宿主摄入缺乏纤维的精细饮食时,肠道内的可发酵膳食纤维会迅速耗尽。此时,群落结构发生变化:厚壁菌门的丰度下降,而拟杆菌门、变形菌门以及疣微菌门开始主导局面。
研究人员指出,正是这种不可预测的饥荒期长度,决定了群落的最终结构。不规律的饮食习惯,本质上是在人为地延长或随机化“饥荒期”,迫使细菌长期处于应激状态。
策略一:蛰伏以求生——休眠与生长停滞
面对饥饿,细菌的第一反应往往是节能。
许多细菌会进入一种被称为生长停滞或休眠的状态。它们关闭大部分代谢活动,停止细胞分裂,将原本用于繁殖的能量,转用于维持细胞结构的完整性。
断臂求生:细菌的饥饿应对机制
细菌会通过复杂的分子机制(如 (p)ppGpp 介导的严谨反应)下调核糖体的合成,这是细胞内最耗能的过程,所以立刻叫停这个耗能的事。
对于大肠杆菌和其他变形菌来说,它们会依赖 Sigma因子 RpoS 来重新编程基因表达,将原本用于繁殖的能量转用于维持细胞结构的完整性,甚至不惜降解自身的核糖体,以回收氨基酸和核苷酸作为应急储备。
持久细胞:极度不活跃,却能保生存
文章还提到了一种“两面下注策略”(bet-hedging),即细菌分化出一小部分代谢极度不活跃的持久细胞。它们虽然不生长,但能耐受极端的压力(包括抗生素),确保存活。
内生孢子的形成
某些厚壁菌门的成员,如艰难梭菌或枯草芽孢杆菌,能够形成高度耐受的内生孢子。这就像是把自己锁进一个时间胶囊里,以此度过长达数天甚至数年的饥荒。
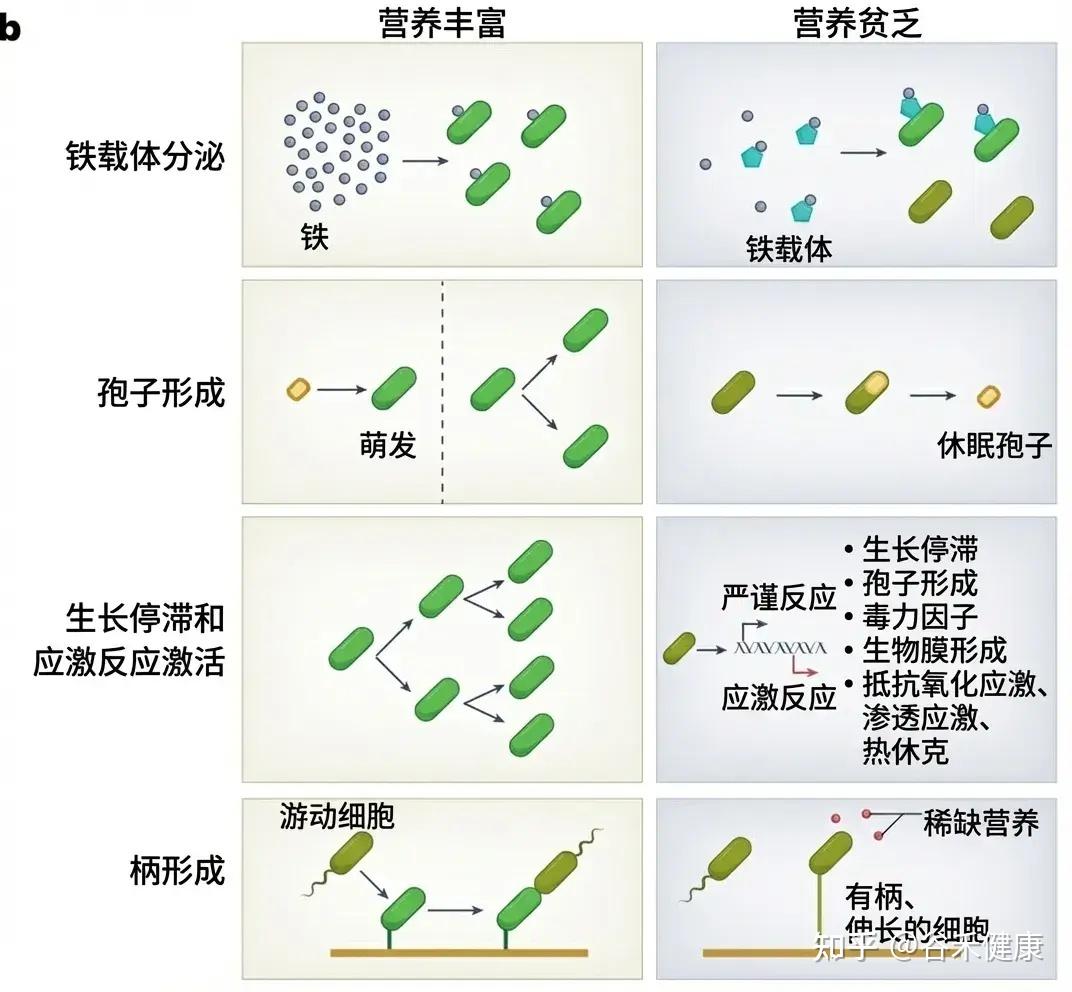
然而,这种策略是有代价的。进入休眠意味着放弃了繁殖的机会。如果饮食波动过于频繁,细菌反复在“唤醒”和“休眠”之间切换,会消耗巨大的能量储备。那些无法快速从休眠中复苏的菌种,就会在下一轮盛宴来临时因为起步太慢而被竞争对手淘汰。这也解释了前面的研究提到的饮食高变异性会导致微生物多样性的丧失——许多脆弱的共生菌因为经不起反复折腾而灭绝了。
策略二:吃宿主——营养毒力与黏液降解
如果说休眠是一种被动的防御,那么另一种策略则显得极具侵略性:当外源性食物(膳食纤维)断供时,去找内源性的替代品——宿主自己。
这就是研究人员强调的“营养毒力”概念。
我们的肠道内壁覆盖着一层厚厚的黏液层,主要由高度糖基化的黏蛋白组成。对于细菌来说,这层黏液不仅是屏障,更是一个巨大的、全天候供应的备用糖库。
黏液降解菌的崛起
正常情况下,像AKK菌(Akkermansia muciniphila)和多形拟杆菌(Bacteroides thetaiotaomicron)这样的细菌,会以受控的方式降解少量陈旧的黏液,这有助于黏液的更新。
但在饥饿状态下,当膳食纤维严重缺乏或供应中断时,多形拟杆菌会通过转录调控,迅速上调分解宿主聚糖的酶系表达。而AKK菌更依赖宿主黏蛋白上的糖链作为能量来源,在别的菌饿得不行的时候还能活得不错,数量甚至上升。
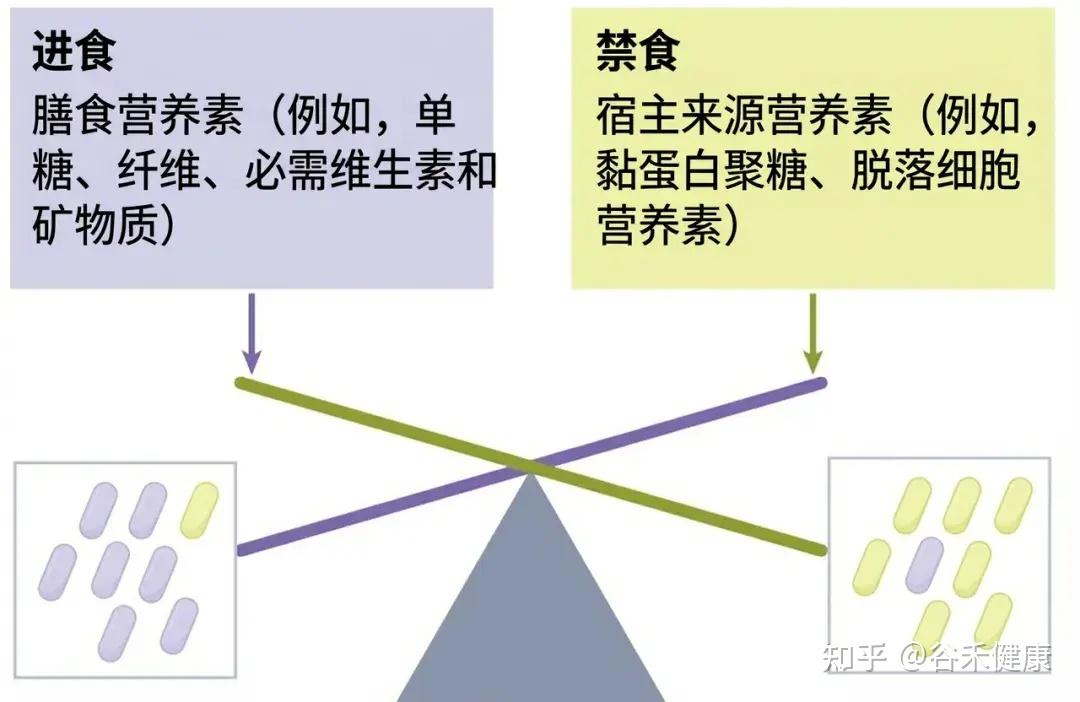
这种代谢切换使它们能够生存下来,但代价是过度啃食保护肠壁的黏液层。
黏液层变薄:病原菌的入侵
更危险的是,这种黏液层的变薄为病原菌打开了缺口。例如,肠出血性大肠杆菌(EHEC)在饥饿状态下会感知这种环境信号,上调其毒力因子的表达,利用这一机会粘附并侵袭肠上皮细胞。
这就是为什么饮食不规律(尤其是纤维摄入的波动)不仅影响菌群结构,更直接威胁肠道屏障功能。你的细菌饿急了,是真的会“吃”你的。
游离糖:病原菌的扩张燃料
此外,拟杆菌在降解黏液时,会释放出岩藻糖、唾液酸等游离糖。在盛宴期,这些糖滋养共生菌;但在饥荒期,它们成了病原菌的“救命粮”。
鼠伤寒沙门氏菌(Salmonella Typhimurium)和艰难梭菌能够利用这些游离的唾液酸和岩藻糖迅速扩增。
策略三:GASP表型——长期饥饿,同类相食
如果饥荒持续的时间足够长(例如极端的节食或长期的饮食紊乱),细菌就不会仅仅满足于生理调节,而是会开启基因层面的进化。
强者通吃:残酷的 GASP 现象
文中提到了一个经典的微生物学现象:
在长期的营养限制下,细菌会发生基因突变,产生“长期静止期生长优势”表型(简称GASP)。
如果将已经饿了10天的大肠杆菌培养物,与仅培养了1天(刚进入静止期)的同种细菌混合,那些饿了10天的老细菌反而会竞争过并取代那些年轻的细菌。
激进策略:弃守为攻与同类相食
老细菌并不是单纯地在等死,而是通过 RpoS 基因突变采取了激进策略。它们主动放弃了原本用于防御(如耐热、耐酸)的盾牌以节省能量,转而全力强化进食能力。这让它们能掠夺环境中仅存的资源,比如说,大肠杆菌被证明能够利用死细胞释放的天冬氨酸、谷氨酸、甘氨酸、丝氨酸、苏氨酸来维持生存,从而在同类相食的竞争中,把那些还在老实防守的同伴彻底淘汰。
生态隐患
虽然这保证了某个物种的延续,但这种突变往往伴随着功能的丧失或毒力的增强。这意味着,经过长期饥饿筛选后的肠道菌群,可能在遗传上已经发生了漂变,肠道菌群变成了一个由一群“生存狂”组成的群落:它们为了活命可能丧失了原有的有益功能,甚至增强了毒力,对宿主不再那么友好。
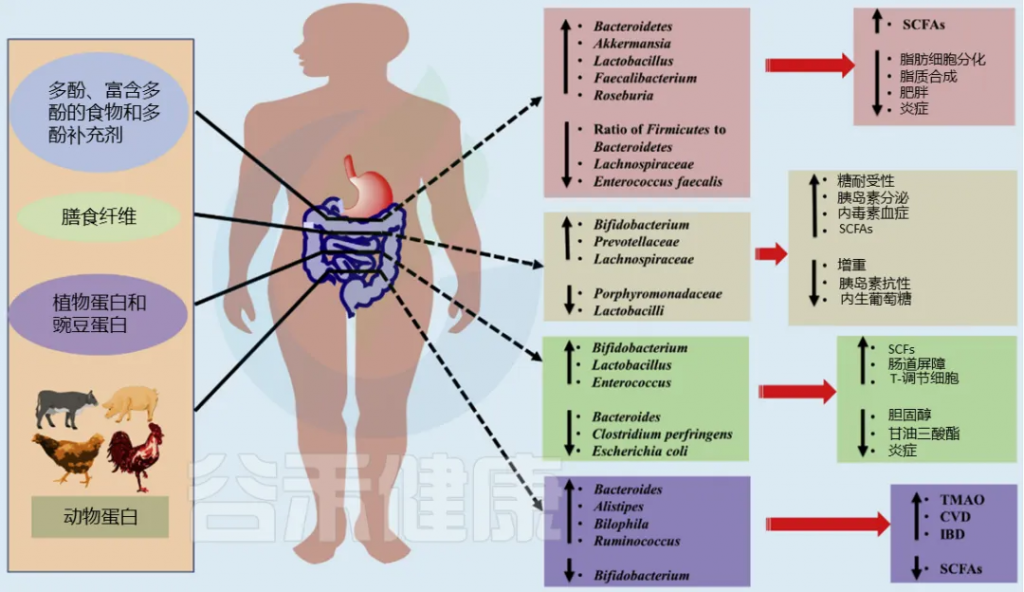
人类不同的饮食习惯(如长期断食、热量限制、饮食结构改变)对菌群产生的共同影响
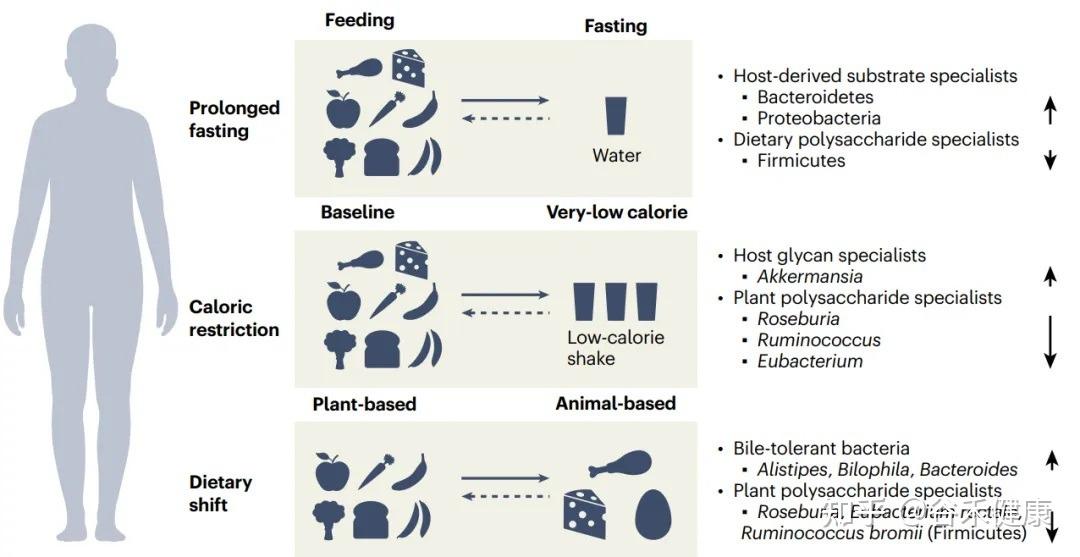
例如,当饮食结构从植物基转向动物基(素食转向肉食)时,会导致耐胆汁细菌的增加,同时那些专门负责分解植物多糖的细菌则会减少。
小结:微观机制的宏观映射
多样性下降是因为许多菌种无法承受反复的“休眠-复苏”能量损耗,或在竞争中落败。
病原菌(如沙门氏菌)的泛滥,是因为它们具备更灵活的代谢切换能力,能在纤维断供时迅速利用宿主黏液糖、琥珀酸等替代营养源。
饮食的规律性,本质上就是为肠道微生物提供一份安全感。消除了对迫近饥荒的恐惧,那些对宿主有益但相对脆弱的专性共生菌才能安心定植,繁衍生息,而不是被迫进入生存模式去啃食宿主的肠壁。
在解决了‘不饿着它们’这一基础问题后,我们需要深入探讨更深层的问题:如何通过特定的饮食成分,将肠道菌群从一个仅仅是活着的群体,引导为一个能为宿主提供健康的共生群落。
一旦细菌脱离了饥饿造成的极端环境,它们的功能重点就会从生存转向代谢。最新的综述研究指出,此时底物的类型(即你吃了什么)将决定菌群的代谢产出。

饮食习惯是肠道微生物群变异的主要决定因素,其影响力远超宿主遗传背景。换句话说,你每天吃进嘴里的食物,才是你肠道微生态的“总设计师”。
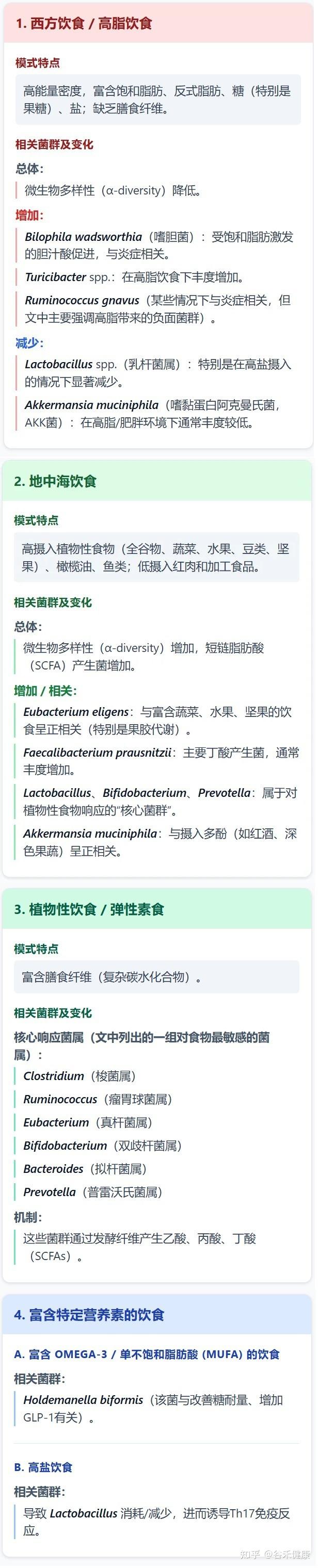
★ 一般性饮食模式
我们先来说一些的日常饮食习惯。
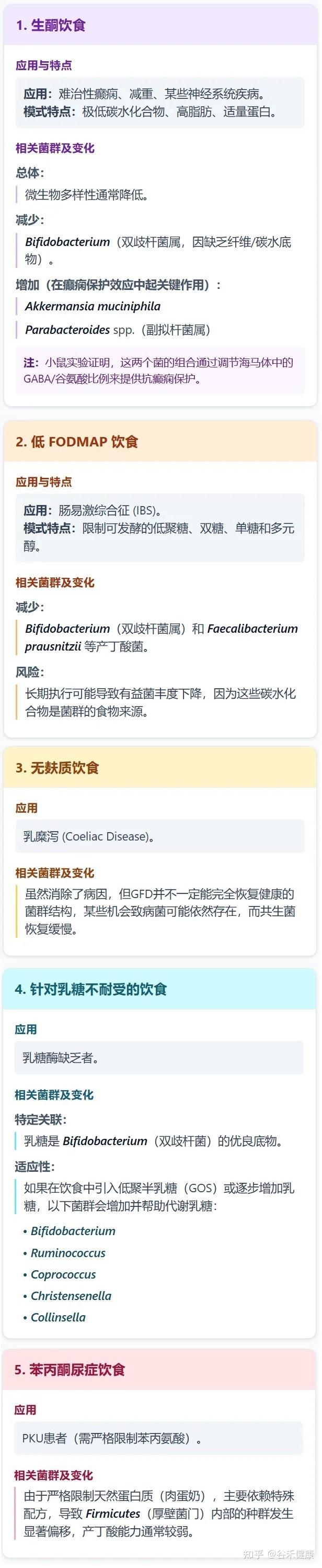
★ 治疗性/医学饮食模式
接下来我们来说一些饮食,通常用于特定疾病的干预。
膳 食 纤 维
在传统的营养学认知中,膳食纤维往往被简化为帮助通便的工具。但在微生物组的视角下,它的定义远不止于此。这是肠道共生菌最主要、甚至是赖以生存的能量来源。
从纤维到短链脂肪酸:点石成金的转化
膳食纤维进入结肠后,并不会像在小肠里那样被简单吸收,未被消化的膳食纤维被细菌发酵后,会产生一系列具有强大生物活性的代谢产物——短链脂肪酸(SCFAs),乙酸、丙酸和丁酸。
膳食纤维代谢产物在维护肠道屏障中的核心作用
-加固屏障,紧密连接
细菌产生的丁酸具有组蛋白去乙酰化酶(HDAC)抑制剂的功能。它能直接作用于肠上皮细胞的基因表达,上调紧密连接蛋白(如 Occludin 和 Claudin)的合成,好比给肠道细胞之间的缝隙抹上了强力胶水,防止细菌内毒素渗入血液。
-筑牢免疫防线(Treg 和 IL-22)
纤维发酵产物能与免疫细胞表面的G蛋白偶联受体(如 GPR43/GPR109A)结合。这种结合会向免疫系统发送和平信号,促进调节性T细胞(Treg)的分化,并刺激IL-22的分泌。IL-22 被称为屏障守护因子,它能加速上皮细胞的修复,并诱导细胞分泌抗菌肽(AMPs),将病原体拒之门外。
-降低环境 pH 值
发酵产生的酸性环境(低 pH)能有效抑制许多对酸敏感的致病菌(如沙门氏菌、大肠杆菌)的生长,这是一种最原始但有效的生态位竞争策略。
吃多少才够?
上一章节我们已经了解到,膳食纤维如果喂不饱菌群,那么菌群就会吃你的粘液层,肠道屏障就会随之薄弱,可能出现肠漏,低度慢性炎症等情况,那么吃多少才够呢?
目前的膳食指南通常建议每日摄入 25-30g 的膳食纤维。然而,Sanz 等人在综述中提出一个观点:这个标准可能仅仅是维持基本功能的底线,而非优化健康的理想值。
研究人员指出,为了达到预防非传染性慢性病(如心血管疾病、代谢综合征)的最佳效果,膳食纤维的摄入量可能需要提高到 35-50g/日。这个数字更接近人类祖先(狩猎采集时期)的摄入水平。
但这里有一个关键的注意事项:
对于肠道已经处于高度敏感或炎症状态(如 IBD 或 IBS 患者)的人群,突然摄入大量粗纤维可能会导致耐受不良。这也引出了精准营养的概念——不同人的菌群对纤维的处理能力是不同的。
因此,策略不是盲目地吃草,而是循序渐进,并注重纤维种类的多样性(可溶性与不可溶性纤维的搭配),以喂养更广泛的共生菌群。

蛋 白 质
在健身房里,蛋白质是增肌的必需品;但在结肠深处,蛋白质的命运却充满了变数。
与膳食纤维的健康益处不同,蛋白质对肠道微生物组的影响是双向的。这取决于两个关键因素:蛋白质的来源,以及你是否同时摄入了足够的碳水化合物。
当有益菌遇到色氨酸:免疫系统的调停者
首先,我们来看看蛋白质天使的一面。
蛋白质由氨基酸组成,比如说,色氨酸(Tryptophan),是连接饮食、微生物和宿主免疫的关键桥梁。
肠道细菌(如乳杆菌属和部分梭菌属)能够将未消化的色氨酸代谢为吲哚(Indole)及其衍生物(如吲哚-3-丙酸 IPA、吲哚-3-乙醛等)。这些吲哚类物质并非废料,而是高级的生化信使,它们可以:
从这个角度看,适量的蛋白质摄入,特别是富含色氨酸的食物,是维持肠道免疫稳态的重要一环。

黑暗面:当发酵转向“腐败”
当膳食纤维摄入不足,或者蛋白质摄入过量导致大量未消化的蛋白质进入结肠(尤其是远端结肠)时,微生物的代谢模式会发生危险的逆转。
在这个过程中,细菌会产生一系列具有细胞毒性的代谢产物:
这种“腐败发酵”主要发生在远端结肠,那里是碳水化合物最先被耗尽的地方,也是结直肠癌的高发部位。这非巧合。
关键在于“碳氮比”:别让细菌只吃肉
那么,我们该如何避免蛋白质的“黑化”?
研究人员认为,碳水化合物(纤维)的存在可以抑制蛋白质的腐败发酵。
这是一种名为分解代谢抑制的生存策略:只要有容易发酵的碳水化合物存在,细菌就会优先利用它们,而此时产生的酸性环境会进一步抑制蛋白水解酶的活性。
因此,问题的核心往往不在于肉吃多了,而在于菜吃少了。
植物蛋白 vs 动物蛋白
相比于红肉(富含血红素铁,可能催化致癌物 N-亚硝基化合物的形成),植物蛋白通常自带膳食纤维。这种自带解药的属性,使得植物蛋白在被细菌分解时,往往伴随着更有益的代谢环境。

肠道菌群与蛋白质代谢14 赞同 · 3 评论 文章

动物蛋白与植物蛋白对肠道微生态的不同“改造”与健康风险”6 赞同 · 2 评论 文章
脂 肪
与纤维(作为食物)不同,脂肪更多是通过改变肠道环境(特别是胆汁酸代谢)来间接筛选微生物。
长期以来,我们对脂肪的恐惧主要集中在变胖和心血管堵塞。但在微观视角下,高脂饮食对健康的打击是从肠道屏障的崩塌开始的。
这其中牵涉到两个核心机制:
胆汁酸的改变 与 内毒素的易位。
高脂饮食的代价:当助消化的胆汁变成致癌毒素
当你吃下一块肥美的五花肉,肝脏会立刻分泌胆汁酸(Bile Acids)来乳化这些油脂,帮助消化吸收。这本是正常的生理过程。
然而,问题在于量。
长期摄入高脂肪饮食,会迫使肝脏源源不断地向肠道泵入大量的初级胆汁酸。当这些胆汁酸流经小肠未被完全回收,进入结肠后,它们就落入了微生物的手中。

肠道细菌(如梭菌属)通过7α-脱羟基作用会将初级胆汁酸进行二次加工,转化为次级胆汁酸,如脱氧胆酸(DCA)和石胆酸(LCA)。
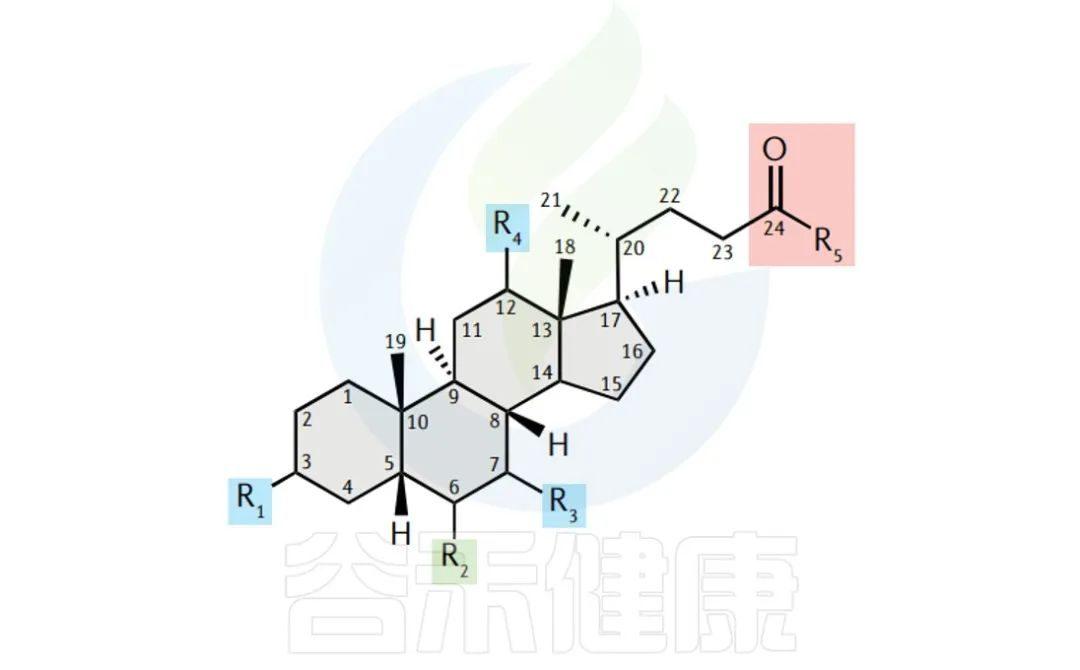
什么是胆汁酸,其与肠道微生物互作如何影响人体健康18 赞同 · 0 评论 文章
次级胆汁酸的蓄积,是一个危险的信号:
当然,次级胆汁酸也有另一面——某些特定的衍生物(如 isoalloLCA)能特异性地抑制艰难梭菌等病原体。
但在典型的高脂“西方饮食”模式下,负面效应往往占据了主导地位。
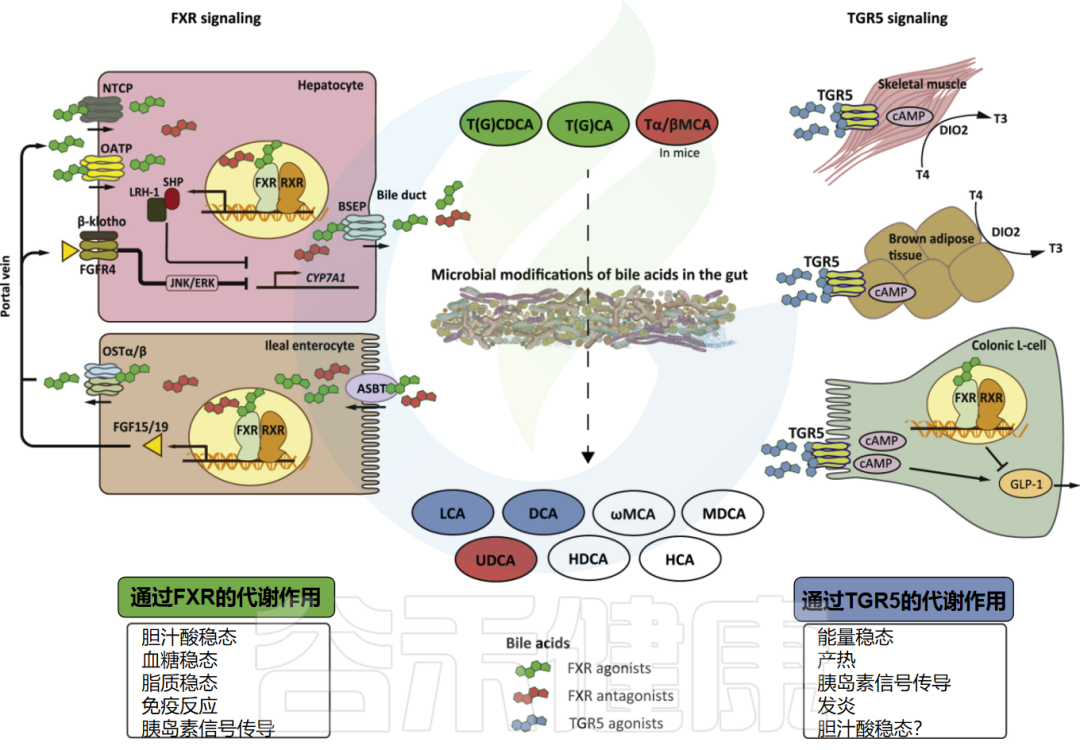
肠道微生物群对胆汁酸代谢和信号传导影响的最新研究成果20 赞同 · 1 评论 文章
脂肪的类型(质量)远比数量重要
研究对比了饱和脂肪酸(如猪油、棕榈油)与多不饱和脂肪酸(PUFAs,如鱼油、亚麻籽油):
-饱和脂肪:代谢性内毒素血症
摄入过多的饱和脂肪,不仅会降低微生物的多样性,更关键的是它充当了细菌毒素的载体。
革兰氏阴性菌的细胞壁成分——脂多糖(LPS,即内毒素),极易溶解在脂肪微粒(乳糜微粒)中。当饱和脂肪穿过肠壁进入血液时,它会顺手把 LPS 也带进去。
这就是著名的代谢性内毒素血症。血液中微量的 LPS 升高,会触发全身性的低度慢性炎症,诱导胰岛素抵抗,成为肥胖和糖尿病的隐形推手。
-Omega-3
相反,富含 Omega-3 的多不饱和脂肪酸,被证明能够增加产丁酸菌丰度,逆转由饱和脂肪引起的菌群失调,并有助于维护肠道屏障的完整性。
探索Omega-3脂肪酸:健康益处与营养补充12 赞同 · 0 评论 文章
维 生 素
我们常以为维生素只是为了身体好,其实肠道里的细菌也是维生素大户。
许多有益菌(如双歧杆菌)虽然能为我们合成维生素K和部分B族维生素,但它们自身往往无法从头合成生长所需的全部维生素(尤其是B族),必须依赖我们的饮食摄入或原本的交叉喂养网络。
B2(核黄素)
当饮食中缺乏维生素B2(核黄素)时,肠道中产丁酸菌(如普拉梭菌)就会因缺乏口粮而减少,而这可能间接给大肠杆菌等潜在有害菌腾出生存空间。
B9(叶酸)与 B12(钴胺素)
乳杆菌和双歧杆菌通常缺乏从头合成叶酸和钴胺素的完整酶系,属于维生素营养缺陷型微生物。必须依赖宿主摄入。如果叶酸摄入不足,这些益生菌的生长就会受限,进而削弱其对肠道微生态的调节功能。
B3(烟酸)
烟酸不仅是细胞能量代谢(NAD+合成)的关键前体,还是结肠上皮及免疫细胞表面 GPR109A 受体的特异性配体。烟酸通过激活该受体发挥抗炎作用,抑制促炎因子的释放。
缺乏烟酸会导致肠道免疫耐受性降低,增加结肠炎易感性,并伴随微生物群落Alpha 多样性的显著下降及微生态结构的崩塌。严重缺乏会导致糙皮病。
B7(生物素)
生物素是细菌羧化酶不可或缺的辅助因子,在菌群的种间竞争中起着关键作用。研究显示,在生物素缺乏的环境下,某些机会性致病菌(如鼠乳杆菌Lactobacillus murinus)会利用代谢优势发生异常增殖,导致严重的菌群失调;而恢复生物素水平则能有效遏制这种过度扩张,通过生态位竞争维持肠道微生态的稳态。

B族维生素与肠道菌群互作52 赞同 · 1 评论 文章
维生素A
维生素 A 的代谢产物(视黄酸)是调节肠道黏膜免疫的关键信号。它能直接促进 B 细胞分化,上调分泌型免疫球蛋白 A (sIgA) 的合成与分泌。sIgA 能够特异性地包裹细菌,在阻止致病菌黏附上皮组织的同时,协助乳杆菌(Lactobacillus) 等共生菌在黏膜表面的稳定定植,防止菌群易位。
维生素D
维生素 D 通过激活肠上皮细胞中的维生素 D 受体 (VDR),上调紧密连接蛋白(如 Occludin 和 Zonulin)的表达,从而维持肠道屏障的物理完整性。
此外,维生素D还能发起主动进攻,它能诱导宿主分泌防御素和组织蛋白酶等抗菌肽。这种选择性压力有助于重塑菌群结构,研究显示其可显著促进Akkermansia muciniphila的生长,并抑制变形菌门等潜在致病菌。
维生素 C & E:调节氧化还原电位
肠道核心菌群(如厚壁菌门和拟杆菌门)多为专性厌氧菌,对氧气极为敏感。维生素 C 和 E 具有显著的抗氧化作用,能够清除肠腔内的活性氧 (ROS),维持肠道较低的氧化还原电位。这种厌氧环境有利于核心有益菌的代谢与生存,同时限制肠杆菌科(多为兼性厌氧菌)等机会性致病菌的过度增殖。
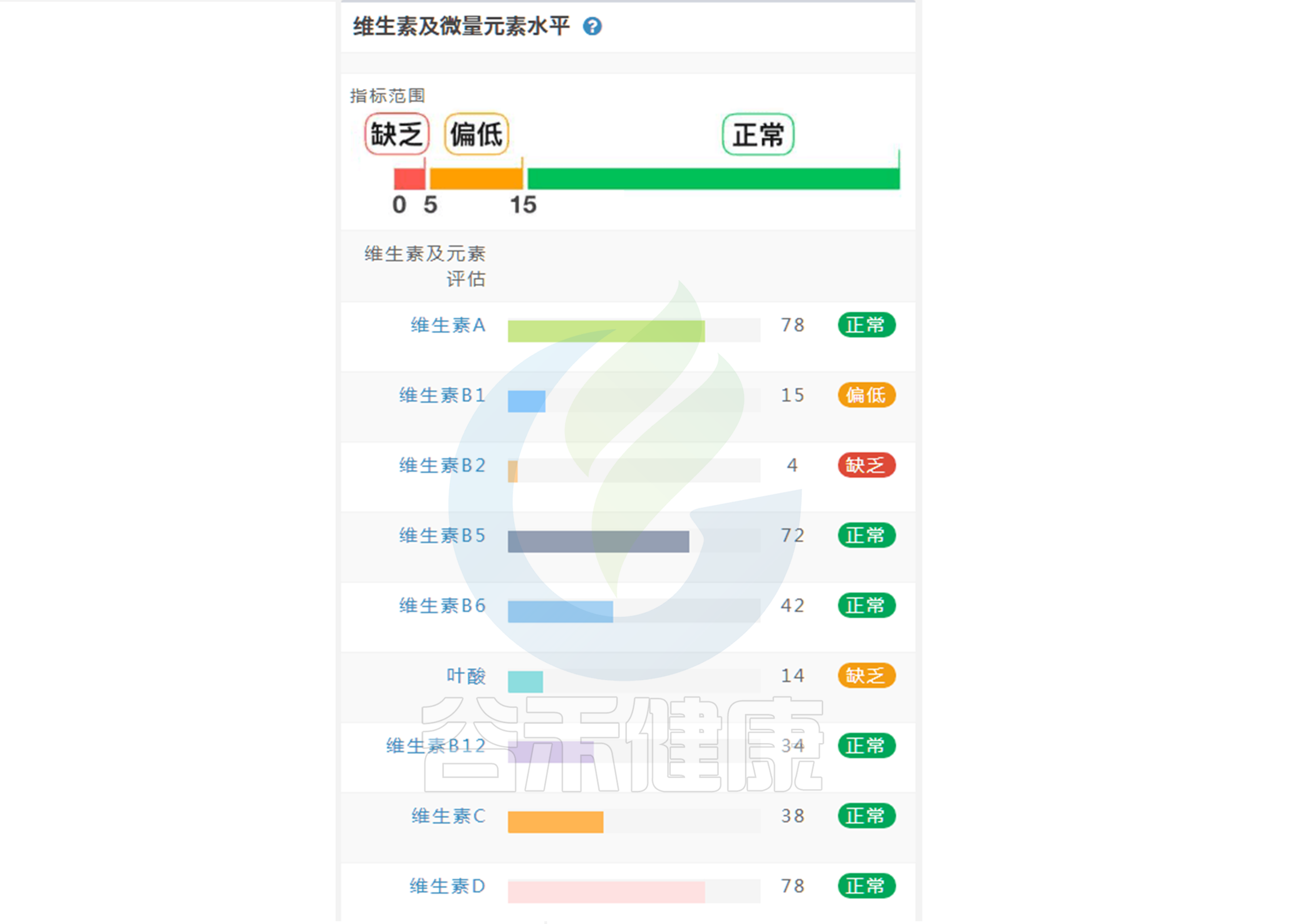
维生素摄入水平肠道菌群可以告诉你14 赞同 · 0 评论 文章
下表列出了常见的维生素的食物来源,可供参考。

矿 物 质
铁
铁是细菌界的稀缺资源。正常情况下,人体会限制肠道内的游离铁(营养免疫),防止细菌疯长。
但问题在于,沙门氏菌和致病性大肠杆菌等肠杆菌科细菌,进化出了极强的“抢铁工具”——铁载体(Siderophores)。相比之下,乳杆菌等有益菌抢夺铁的能力很弱。
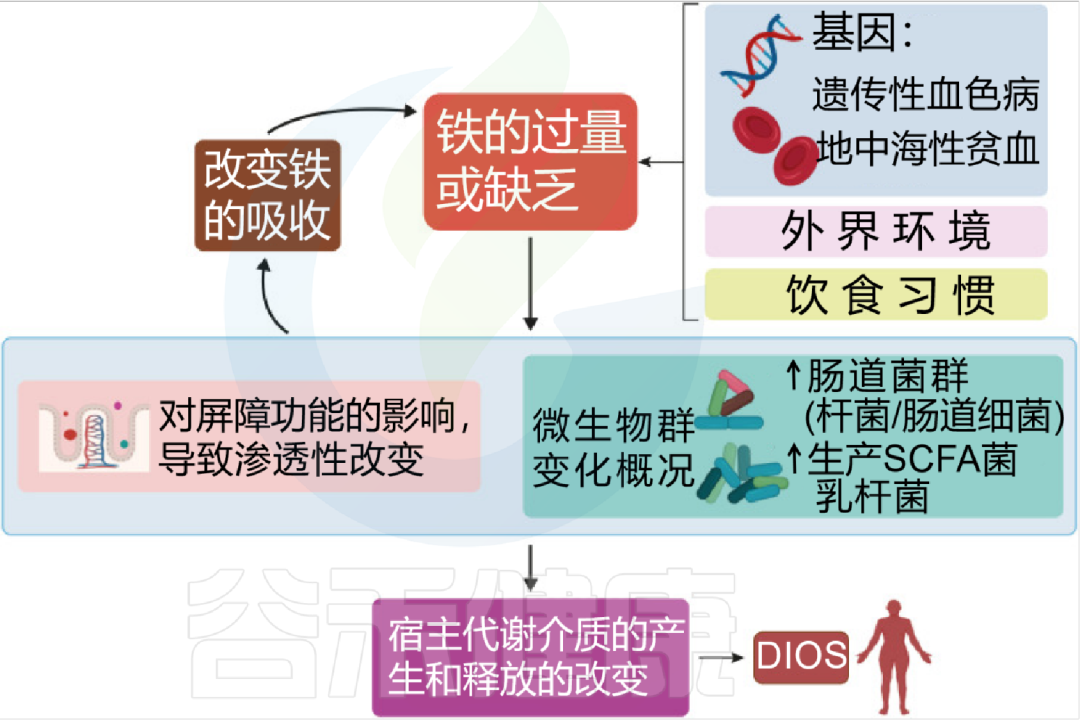
人与菌对铁的竞争吸收 | 塑造并控制肠道潜在病原菌的生长15 赞同 · 0 评论 文章
因此,一旦结肠中出现未被吸收的游离铁(比如吃太多红肉或过量补铁),这些铁就会优先被致病菌抢走,助长它们爆发性繁殖,从而压制有益菌并引发炎症。

锌
锌不仅能加固肠道屏障,更是维持菌群结构稳定的关键。
研究发现,缺锌会直接导致肠道中的主力军——厚壁菌门的数量大幅下降。这种多样性的丧失,意味着肠道的定植抵抗力被削弱了。

膳食锌缺乏或过量对人体肠道菌群及健康的影响11 赞同 · 1 评论 文章
这就好比城墙上的守卫变少了,原本被压制的艰难梭菌就会趁虚而入,利用空出来的生态位大量繁殖并分泌毒素,引发生严重的肠道感染。

这种微观层面的营养不良,往往是导致菌群失调和系统性炎症的隐蔽开端,也进一步凸显了通过高质量饮食纠正营养短板的紧迫性。
前面关注了“吃什么”,“吃多少”,接下来我们来看第三个维度:进食时机。
人体内存在两套主要的生物钟系统:
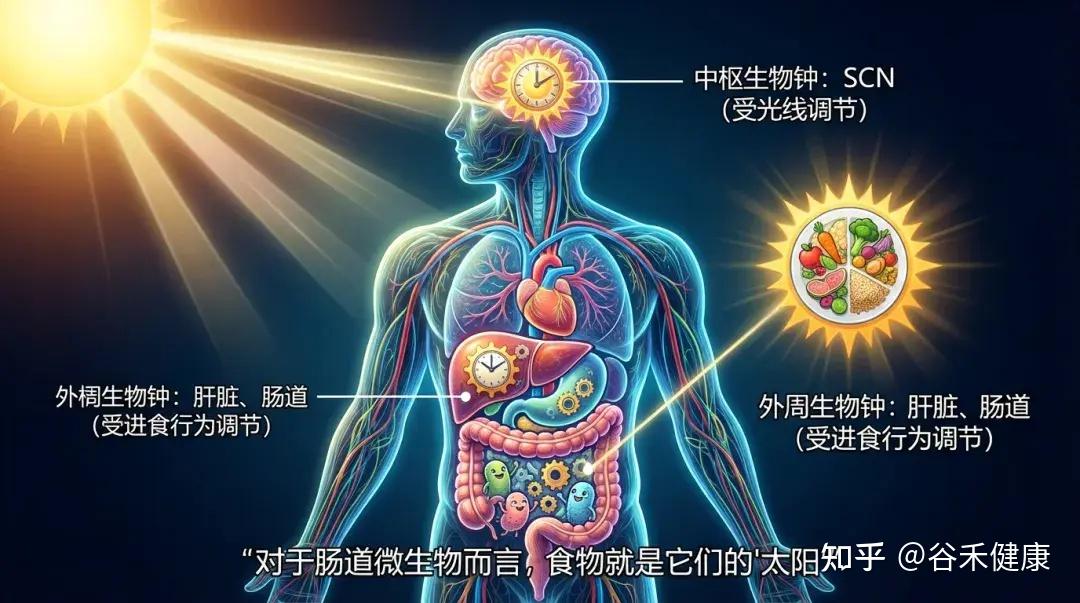
微生物也会“倒时差”
你可能不知道,肠道菌群也是分早班和晚班的。肠道微生物的组成和功能会呈现出显著的昼夜震荡。
这种节律性波动是如此重要,以至于产生的代谢物(如我们前面提到的短链脂肪酸、胆汁酸衍生物)在一天中的浓度也是波动的。这种波动指导着宿主的肝脏何时储存脂肪、何时释放葡萄糖。
现代生活方式:“光”与“食”错位
当我们在深夜(大脑认为是休息时间)吃一顿宵夜(肠道接收到工作信号)时,中枢生物钟和外周生物钟就发生了脱钩。
这种时钟错位会导致肠道微生物节律的丧失。原本应该在休息期清理毒素的细菌被迫加班处理食物,不仅效率低下,还会引发代谢混乱。这被认为是倒班工作者更容易患肥胖、糖尿病和肠道炎症的核心机制之一。
限时进食(TRE):重启肠道节律
限时进食(Time-Restricted Eating, TRE)——即把每天的进食窗口限制在 8-10 小时内,其余时间禁食。
这不仅仅是减少热量摄入的手段,更是一种微生物重塑策略。
–恢复昼夜节律
TRE 能够强力恢复微生物群落的昼夜节律震荡。让不同的细菌在正确的时间做正确的事,重建宿主代谢通路与微生物活动的同步性。
-特定功能菌群的富集
延长的禁食窗口为特定共生菌提供了生态位优势。
研究显示,禁食期间,以AKK菌(Akkermansia muciniphila)为代表的黏液降解菌丰度显著增加。这类菌群利用内源性黏蛋白进行增殖,反向刺激杯状细胞分泌黏液,从而强化肠道屏障功能,减少内毒素血症风险。
-代谢保护
动物模型和人类研究,表明 TRE 可以预防由高脂饮食引起的肥胖和代谢综合征。哪怕摄入的总热量没有改变,仅仅是改变进食的时间窗口,就能显著改善血糖稳态。
对于现代人来说,最糟糕的饮食习惯可能是进食时间的不规律。今天不吃早饭,明天半夜撸串,这种行为让肠道微生物始终处于“倒时差”的应激状态中。

因此,为了维护肠道健康,除了多吃膳食纤维、少吃加工食品外,我们还需要给微生物一个明确的作息表:在白天的活跃期进食,在夜晚的休息期禁食。这不仅是对身体的尊重,也是对居住在你体内的万亿微生物生命的尊重。
小结:从填饱肚子到精准滋养微生态
热量达标不代表菌群吃饱。必须保证膳食纤维的充足供应。这是防止菌群因底物匮乏而倒戈吞噬肠道黏膜的第一道防线。
蛋白质与脂肪对菌群的影响,可能取决于纤维的在场。控制饱和脂肪摄入,选择优质脂肪,能减少次级胆汁酸对有益菌的杀伤,避免内毒素血症。
均衡的微量营养素摄入,比如维生素和矿物质,能精准强化共生菌的竞争优势,助其在生态位争夺战中抢占先机,从而有效压制机会致病菌的野蛮生长。
当我们站在微生物生态学的前沿回望,传统的“金字塔式”饮食建议显得过于粗糙且缺乏维度。Singh等人的数据警示了“饮食大波动有风险”,Estrela等人的机制揭示了“细菌怕长期挨饿”,而Sanz等人的综述则描绘了通过饮食调节菌群的多维度健康蓝图。
这就要求我们必须升级我们的营养系统,从单纯关注成分转向关注生态稳定性与精准化。
新时代的营养观
对于普通大众而言,建立一个基线饮食节奏至关重要。
建立核心菜单
不要让每一顿饭都成为随机事件。尝试确立每天固定的核心食物,例如早餐固定的全谷物燕麦,或晚餐固定的深色蔬菜。这能确保护肠道内的核心共生菌每天都能获得稳定的底物供应,避免其因“断粮”而进入休眠或衰退。
平滑过渡
当你试图改变饮食习惯(比如从高碳水转向低碳水,或者开始吃地中海饮食)时,切忌急刹车或急转弯。根据 Estrela等人的理论,剧烈变换的底物会诱发细菌的饥饿应激和黏液降解。更合适的做法是循序渐进,给微生物群落留出数周的适应期,让代谢网络慢慢重塑。
精准营养 2.0:整合微生物组
每个人的肠道菌群构成都是独一无二的,这意味着同样的食物在不同人体内会引发截然不同的微生物反应(例如,不同人吃同样的香蕉,血糖反应可能截然不同)。未来的营养干预将不再是千篇一律的指南,而是根据人群的代谢表型或微生物特征,提供分层建议。
肠道菌群监测
比如说核心菌群,如厚壁菌门/拟杆菌门比值、产丁酸菌比例等指标,建立个人化菌群基线。
长期的饮食习惯会在菌群上留下印记。例如,长期缺乏膳食纤维的人,其肠道内负责降解植物多糖的酶系可能已经退化。此时若盲目大量补充纤维,不仅无法被利用,反而可能导致腹胀不适。这时肠道菌群数据能提示我们,可能需要采用缓慢饮食过渡方案,给菌群以适应和重建的时间。
靶向性补充
针对特定的功能缺失进行干预。例如,如果发现黏液降解菌(如 Akkermansia)异常升高,这往往是肠道缺乏膳食纤维、菌群正在吃内源性黏液的信号。可能不仅要补充益生菌,更需精准增加抗性淀粉、菊粉等摄入,以提供替代碳源,保护肠道屏障。
拥抱时间营养学
我们不仅要问吃什么,还要问什么时候吃。微生物组具有自身的昼夜节律,这种节律受宿主进食时间的强烈驯化。
保持规律的进食时间,避免深夜进食
这能让微生物群的代谢活动与宿主的生理时钟同步,优化代谢产物的分泌时机,使其在宿主最需要的时候(如日间活动时)发挥作用。
避免长期的随机断食
间歇性断食在某些情况下有益,但无序的、饥一顿饱一顿的“随机断食”是细菌的噩梦。如果你选择断食,请保持断食窗口的规律性,让细菌能够建立起预期的代谢循环。
保持饮食的节奏,不仅仅是一种自律的生活态度,更是一种对生命的敬畏。维护肠道内的和平与稳定,我们实际上是在守护自身健康的根基。正如研究所示,每日稳定摄入蔬菜、水果等富含纤维的食物,远比间断性大量食用更能维持菌群多样性。
在这个充满不确定性的世界里,科学的节奏与精准的滋养,或许就是你能给身体最好的确定性。
主要参考文献
Estrela S, Long JZ, Huang KC. How nutrient starvation impacts the gut microbiome. Nat Microbiol. 2025 Nov;10(11):2663-2672. doi: 10.1038/s41564-025-02139-9. Epub 2025 Sep 30. PMID: 41028229.
Singh R, McDonald D, Hernandez AR, Song SJ, Bartko A, Knight R, Salathé M. Temporal nutrition analysis associates dietary regularity and quality with gut microbiome diversity: insights from the Food & You digital cohort. Nat Commun. 2025 Sep 30;16(1):8635. doi: 10.1038/s41467-025-63799-z. PMID: 41028733; PMCID: PMC12484809.
Sanz Y, Cryan JF, Deschasaux-Tanguy M, Elinav E, Lambrecht R, Veiga P. The gut microbiome connects nutrition and human health. Nat Rev Gastroenterol Hepatol. 2025 Aug;22(8):534-555. doi: 10.1038/s41575-025-01077-5. Epub 2025 Jun 4. PMID: 40468006.

谷禾健康

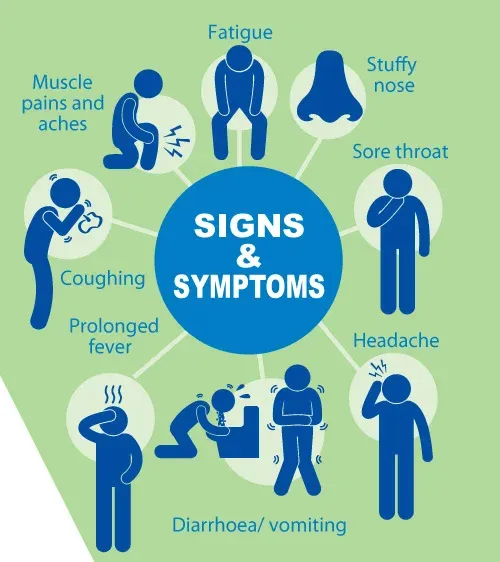
如果近期出现鼻子、喉咙、肺部相关症状,如咽喉痛、发烧(体温迅速升高通常超过38.5℃)、咳嗽、流鼻涕、鼻塞、乏力、发冷、浑身疼痛等情况,很有可能是甲流。
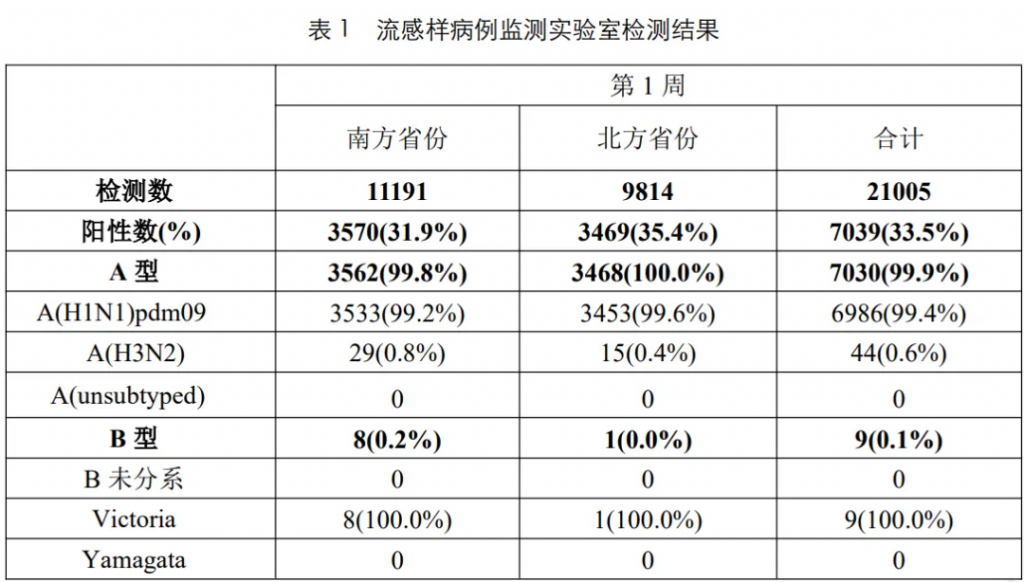
根据中国疾病预防控制中心2025年第1周流感监测周报显示(截至2025年1月5日),本周南、北方省份流感病毒检测阳性率继续上升,甲型H1N1流感占比99.4%。
来源:Chinacdc
甲型流感是一种高度传染性的呼吸道感染疾病,其传播速度快、感染范围广,给公共卫生带来了巨大挑战,甲流每年导致300万-500万例严重感染和25万-50万例死亡。甲型流感主要通过咳嗽、打喷嚏或说话时的飞沫传播,症状可持续几天到几周。
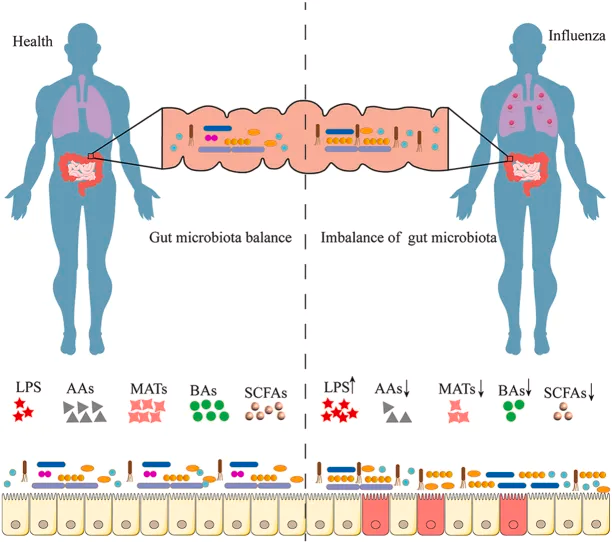
近年来的研究发现,甲流感染可能会破坏肠道微生物群的平衡,而肠道生态失调可能会影响甲流患者的疾病进展。
调节肠道菌群可以通过肠-肺轴促进抗甲流病毒的免疫效应。这包括在感染的早期阶段促进甲流病毒清除,并在后期阶段减少炎症损伤。此外,肠道菌群还可以通过维持肠道屏障功能、产生具有保护作用的代谢产物(如短链脂肪酸、氨基酸、胆汁酸)等,促进宿主的免疫反应。
本文我们主要来详细了解一下甲流的症状、原因、潜伏期、危险因素、感染过程,包括肠道菌群及其代谢产物与甲流的关系,以及通过调节肠道菌群及其代谢产物来防治流感的潜在策略,包括益生菌、植物化学物质、中药等干预措施,这为甲流的预防和治疗提供了新的策略。
流感病毒有四种类型:甲(A)、乙(B)、丙(C)、丁(D)。甲型和乙型流感病毒几乎每个冬天都可能会引起季节性疾病流行。
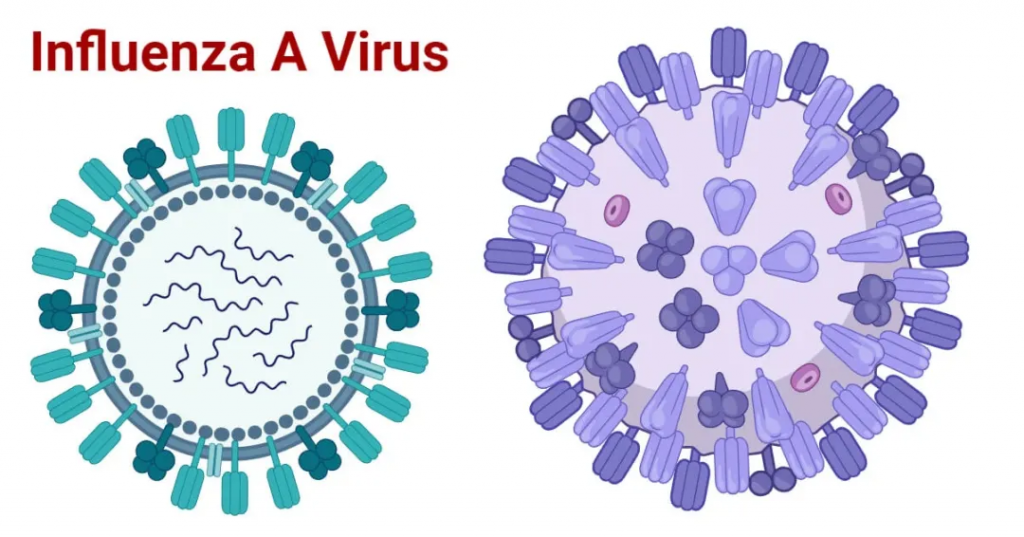
甲流病毒是一种包膜病毒,包膜含有两种糖蛋白,一种叫血细胞凝集素(HA),另一种叫神经氨酸酶(NA)。
注:有18种不同的血凝素亚型和11种不同的神经氨酸酶亚型(分别为H1至H18和N1至N11)。
这两个可以排列组合形成不同的流感亚种,比如说H1N1,就是血细胞凝集素的1型和神经氨酸酶的1型组合。目前经常在人群中传播的甲型流感病毒亚型包括H1N1和H3N2。
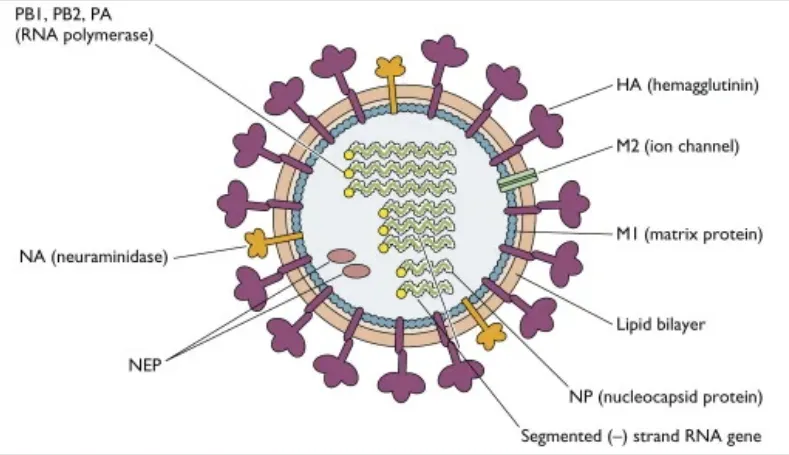
甲型流感主要影响呼吸系统,包括鼻子、喉咙、肺。症状可能会突然出现,可能包括:
严重的症状
在严重病例中,甲流引起一系列症状,可能较少见:
图源:mypositiveparenting
并非所有流感都出现呼吸道症状
医生提醒,呼吸道症状是流感的典型症状,但以恶心、呕吐为主的消化道症状患者也大有人在。此外,还有部分患者会出现反应迟钝、嗜睡、躁动等精神系统症状。以上这些症状可能合并出现,也可单独出现,容易给人误导,导致没有及时就诊,延误流感的治疗。
当病毒感染上呼吸道(鼻窦,口腔和喉咙)或下呼吸道(肺部)的组织时,可能会发生甲型流感。病毒可以在这些组织内复制,从而引起症状。
这种流感具有高度传染性。你可以通过咳嗽、打喷嚏或在他人附近说话将病毒传染给他人。
甲流病毒通常在每个流感季节迅速变异。免疫系统可能无法立即抵抗新形式的病毒,即使以前得过流感,你也可能会有几天的症状。
如果被感染,通常会在接触后一到四天(潜伏期)出现流感症状,平均 2 天。
流感可以持续几天到两周。
发烧和身体疼痛等症状可能会突然出现,但通常比其他症状消失得更快。咳嗽或流鼻涕会持续更长时间。
普通感冒由鼻病毒等多种病原体导致,传染性弱,发病没有明显的季节特征,症状表现为鼻塞、流涕、喷嚏、咳嗽等,一般不发热或仅有低热,没有全身性症状,5-7天即可自愈,很少有并发症出现。
甲流传染性强,容易大范围流行,发病季节特征明显。患者表现为高烧、头痛、乏力,并伴有全身肌肉酸痛等。甲流有一定自限性,但容易引起其他并发症,包括肺炎、中耳炎、心肌炎、脑膜炎等严重并发症。
甲流和乙流之间有几个区别:
其他两种流感:
任何人都可能患上甲型流感。某些人出现严重症状和并发症的风险更大,例如:
大多数甲流病例在几周内消退,甲流可能更严重,并导致一些人的并发症,并发症可能包括:
耳部感染:对甲型流感的免疫反应会引起炎症,这会影响并导致咽鼓管中的液体积聚。这根管子把喉咙后部和中耳连接起来。这种液体会吸引可能导致耳部感染的细菌。尤其在儿童中较为常见。
鼻窦感染:甲型流感可能会导致鼻窦充血和炎症,从而吸引可能导致感染的细菌。
脑炎:免疫反应可能导致这种大脑炎症。甲流病毒可以通过血液或神经系统进入脑部,引起脑组织的炎症和损伤。
脑膜炎:表现为头痛、呕吐、意识障碍等症状。
心肌炎: 流感病毒可以直接攻击心肌细胞,引起心肌受损,表现为心悸、胸闷、胸痛、乏力等症状。
肌肉炎症:对流感过度活跃的免疫反应可导致肌肉炎症。症状包括疼痛、触痛和肌肉无力。
肺炎:甲型流感会削弱免疫系统,使其更容易受到细菌的感染,导致肺部感染。表现为高热、咳嗽加剧、呼吸困难等,严重时可导致呼吸衰竭。
继发性细菌性肺炎:它通常发生在病程的后期,在急性疾病观察到一段时间的改善之后,症状和体征是典型的细菌性肺炎。继发性细菌性肺炎比原发性病毒性肺炎更常见。
脓毒症:这是一种严重的、危及生命的感染反应。如果细菌进入血液就会发生。如果不治疗,败血症会导致器官损伤和死亡。
急性呼吸窘迫综合征(ARDS):在重症病例中可能出现,导致严重的呼吸困难。
这些并发症在免疫力低下的人群中更为常见和严重,如老年人、儿童、孕妇以及患有慢性疾病的人。因此,及时就医和治疗对于预防并发症的发生至关重要。
病毒入侵
首先,甲流病毒主要通过呼吸道进入人体。
甲流病毒通过其表面的血凝素(HA)蛋白与呼吸道上皮细胞表面的唾液酸受体结合,从而进入宿主细胞。
病毒复制
病毒进入细胞后,其基因组RNA在细胞核内进行复制,并指导宿主细胞合成病毒蛋白。新合成的病毒颗粒在细胞内组装后,通过细胞膜释放到外界,感染其他细胞。
免疫反应
当甲型流感病毒入侵人体后,免疫系统会迅速识别病毒的病原相关分子模式(PAMPs),激活先天性免疫应答。
巨噬细胞、树突状细胞等免疫细胞被激活,开始分泌多种细胞因子,包括IL-1、IL-6、TNF-α和干扰素等。这些细胞因子一方面协调免疫细胞的募集和活化,增强机体的抗病毒能力;另一方面作用于下丘脑体温调节中枢,导致体温升高,同时还可引起全身性炎症反应,造成肌肉关节疼痛、乏力等症状。
症状形成机制
发热:发热是由于病毒感染触发免疫系统释放的细胞因子(如IL-1、IL-6等)作用于下丘脑温度调节中枢,使体温设定点上调所致,这种发热反应实际上有利于抑制病毒复制并增强免疫功能。
咳嗽:病毒直接感染呼吸道上皮细胞,导致细胞损伤、炎症反应和气道分泌物增多的结果,刺激气道感受器引起咳嗽反射。
全身症状:如肌肉酸痛、乏力、头痛等,主要是由细胞因子介导的系统性炎症反应引起,这些炎症介质可以作用于全身多个器官系统,影响神经-内分泌网络,导致患者出现全身不适。症状的严重程度往往与机体免疫反应的强度直接相关。
病毒变异特点
抗原漂移:点突变导致的小幅变异
抗原转变:基因重配导致的大幅变异
变异使病毒逃避免疫系统识别,是季节性流感和流感大流行的重要原因。
在传统认知中,我们往往将甲流视为一种单纯的呼吸道感染,但随着研究的深入,研究人员发现这种认识可能过于简单化。近年来,越来越多的研究表明,人体的免疫系统是一个高度统一的网络,其中肠道菌群作为人体最大的微生态系统,在调节全身免疫反应中扮演着关键角色。
肠道菌群可以通过调节免疫细胞的分布和功能,影响宿主对流感病毒的免疫反应,显著影响呼吸道感染的疾病进程和预后。此外,肠道菌群的代谢产物,如短链脂肪酸,也被发现能够调节免疫系统,从而可能对甲流的发病机制产生间接影响。接下来,我们进一步探讨肠道菌群是如何参与和调节甲流感染的过程。
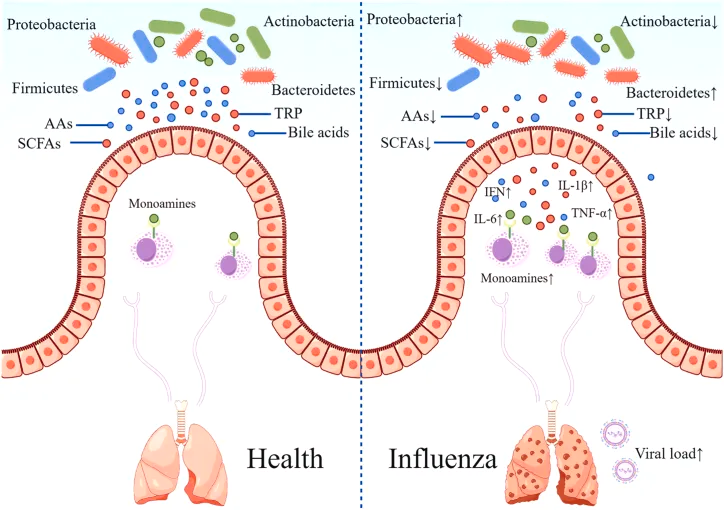
研究表明,肠道微生物群的丰富性和多样性响应于甲流感染发生了显著变化,包括拟杆菌门中细菌数量的增加和厚壁菌门中细菌数量的减少。同样,另一项研究表明,流感感染改变了肠道微生物群,促进肠道特异性厌氧菌的消耗和变形菌门的富集,导致肠道生态失调。
doi: 10.1016/j.heliyon.2024.e37661
▸甲流病毒感染
肠道菌群多样性增加,同时下列菌群增殖较为明显:
而一些有益菌的丰度则降低:
在健康个体中,肠道微生物群以平衡、稳定的方式在肠道中定植,与肠道粘膜屏障和抑菌物质一起维持肠道微生态。 一个平衡良好的肠道菌群能够增强机体的免疫功能,从而降低感染甲型流感的可能性。以下是几个关键机制:
调节免疫系统
在流感病毒感染后,CCR9 + CD4 + T细胞(其是源自肺的效应细胞)被募集到小肠,在小肠中它们分泌干扰素-γ(IFN-γ)。这导致肠道微生物群的不平衡,促进了小肠中的Th17细胞极化。最终导致IL-17 A分泌,其介导免疫损伤。接下来,我们从先天免疫和适应性免疫两方面详细了解肠道菌群对甲流的影响。
先天免疫
肠道微生物主要通过两种方式影响流感病毒感染的先天免疫:
首先,肠道菌群能够影响一种叫做天然淋巴细胞(ILCs)的免疫细胞。这些ILCs细胞在我们的肺部可以对抗病毒,而肠道菌群就像是一个“信号员”,通过释放一些信号物质,告诉肺部的ILCs该怎么做。比如,肠道菌群产生的短链脂肪酸(SCFAs)可以调节肺部ILCs的数量和功能,帮助我们更好地对抗流感病毒。
此外,肠道菌群还能够影响我们的身体识别病毒的能力。它们通过激活一些特殊的受体(比如Toll样受体和RIG-I样受体),帮助我们的身体更快地发现病毒并启动免疫反应。一旦有病毒入侵,就能迅速发出警报,让免疫细胞及时赶到“战场”去消灭病毒。
适应性免疫
肠道微生物群对甲型流感的适应性免疫影响主要体现在三个方面:
1- CD4+T细胞的调节
肠道微生物及其代谢产物可调节CD4+T细胞的分化。
在感染早期,主要促进Th1和Th17细胞分化,有助于病毒清除,乳酸杆菌通过参与色氨酸代谢和产生芳烃受体配体,促进IL-22表达,影响Th17分化;梭菌属通过诱导TGF-β释放,促进结肠Treg细胞分化。
短链脂肪酸(SCFA)通过多种机制促进Treg细胞分化,帮助控制炎症。
抗生素破坏菌群会显著降低CD4+T细胞数量,影响病毒清除。
2- 细胞毒性T淋巴细胞(CTL)的影响
CTL是消灭病毒感染的关键角色,而肠道微生物群能够通过调节树突状细胞(DCs)的活动来增强CTL的细胞毒性作用。
抗生素导致的菌群破坏会降低CTL的免疫应答。
3- 参与调节流感疫苗的免疫效果,促进流感特异性抗体的产生
预防流感的最佳方法是在流行期前接种流感疫苗,以产生特异性抗体。近期的临床试验表明,益生菌制剂可以有效增强流感疫苗的保护效力及提高个体抗体滴度。
然而,动物实验显示,接种前使用抗生素会降低疫苗诱导的抗体滴度及其中和能力,而在无菌小鼠中,恢复肠道植物群能恢复疫苗保护效力。此外,短链脂肪酸(SCFA)的不足会影响B细胞向特异性抗体产生浆细胞的分化。
维护肠道屏障功能
感染甲型流感病毒后,肠黏膜屏障功能障碍与感染的严重程度密切相关。
肠黏膜屏障由肠上皮细胞构成,分泌多种免疫因子并传递细菌抗原,在维持肠道菌群与宿主的共生关系中发挥着重要作用,并作为维持肠道菌群稳定性和生态平衡的控制开关。
流感病毒感染通过破坏肠上皮细胞中紧密连接蛋白和粘附蛋白的功能来影响肠道屏障,这些蛋白调节肠道屏障功能,阻止肠腔内大分子(如细菌和毒素)进入血液。
这些蛋白表达的降低可导致屏障功能受损,从而增加甲型流感病毒的疾病进展和危重症的发生。研究发现,小鼠感染H1N1导致肺和结肠中紧密连接蛋白的表达显著降低。这种减少导致这些器官的屏障结构受损,从而允许肠道细菌易位。随后,通过体液循环发生继发性细菌感染。
产生有益代谢产物
短链脂肪酸
短链脂肪酸包括乙酸盐、丙酸盐和丁酸盐,SCFAs可以通过调整流感病毒感染宿主的肠道菌群结构,如增加双歧杆菌等有益菌的数量,增强免疫适应性等来抵抗流感病毒。
短链脂肪酸能够增强肠道上皮细胞的免疫功能,促进免疫细胞的增殖和分化,同时具有抗炎作用,能够减轻流感病毒感染引起的炎症反应。
在流感期间补充短链脂肪酸,可以减轻肠道病原体如鼠伤寒沙门氏菌的移位,并提高合并感染的存活率。
肠道菌群及其代谢产物对正常人和流感患者的影响
doi: 10.1016/j.heliyon.2024.e37661
氨基酸
支链氨基酸被认为是身体健康的“潜在生物标志物”,在蛋白质合成、分泌和激素(如胰岛素和生长激素)释放中发挥重要作用。 研究表明,庆大霉素治疗后,肠道微生物群紊乱诱导流感小鼠体内支链氨基酸水平升高,从而抑制CD11b + Ly6G +细胞的发育,增加CD8+T细胞水平,导致流感病毒感染程度增加。
色氨酸是必需氨基酸,其缺乏会损害肠道免疫力,通过改善宿主先天免疫应答,降低流感期间的发病率和死亡率,补充色氨酸可能是预防流感的有效策略。
脱氨基酪氨酸(DAT),一种Clostridium orbiscindens菌产生的代谢物,可以通过提高I型干扰素(IFN)的水平,来增强身体对流感病毒的抵抗力,从而减少流感感染小鼠的体重减轻和死亡率。
胆汁酸
初级胆汁酸在肝脏产生,分泌到肠道中,约95%通过肠-肝循环被重吸收。
肠道菌群衍生的代谢产物脱氧胆酸(DCA)通过TGR5受体信号通路,抑制病毒复制,抑制嗜中性粒细胞依赖性组织损伤,增加宿主对流感病毒的抵抗力。
牛磺胆酸是一种胆汁酸。牛磺胆酸钠水合物(STH)抑制流感病毒复制,降低流感病毒RNA、互补RNA和mRNA水平,并对多种流感病毒株(H5N6、H5N1、H1N1、H3N2)表现出广谱抗病毒活性。 此外,STH降低流感病毒感染小鼠中炎症因子(TNF-α、IL-1β、IL-6)的表达,减轻其临床症状,抑制体重减轻,并降低其死亡率,这归因于STH通过抑制NF-B途径的激活而在流感抗性中的作用。
鹅去氧胆酸对甲型流感病毒(H5N1、H9N2和H1N1)具有抑制作用,它能够通过阻断病毒RNA复合物的核输出来抑制甲型流感病毒的复制。
以上我们了解到健康的肠道菌群通过多重免疫调控机制能够增强机体对甲型流感病毒的抵抗力,包括增强免疫系统的警戒能力、提升适应性免疫防护、调节炎症反应等,但在实际临床工作中,准确及时的诊断仍然是控制流感传播和开展针对性治疗的关键。接下来我们来看在临床中,医生可能借助的实验室检测手段。
甲型流感与其他病毒感染(如COVID-19)的症状类似。诊断测试包括:
★ 病毒分离和鉴定
从患者的呼吸道标本中分离出甲型流感病毒,并通过电镜或免疫荧光等方法进行鉴定。
优点:是诊断甲流的金标准。
缺点:操作复杂且耗时较长,一般不作为常规诊断方法
★ 甲型流感病毒核酸检测
通过聚合酶链式反应(PCR)等技术检测病毒的核酸。采集患者的呼吸道标本(如鼻咽拭子、口咽拭子等),进行核酸提取和扩增。
优点:准确率高,是确诊甲流的常用方法。
缺点:需要专业的实验室设备和技术
★ 快速抗原检测
通常使用检测试剂条,从鼻子或喉咙采集组织样本后检测病毒的存在,最快可在15分钟内显示结果,类似于新冠抗原检测。
优点:速度快;
缺点:敏感性和特异性相对较低。
★ 血常规检查
通过检测血液中的白细胞水平等指标,辅助诊断甲流。
优点:可以提供一些间接的诊断信息。
缺点:不能直接确诊甲流
★ 胸部X光
拍摄肺部图像以排除细菌感染或肺炎。
优点:可以排除其他肺部疾病。
缺点:影像学表现无特异性,不能单独用于确诊甲流。
利福昔明通过调节肠道菌群改善甲流病毒感染引起的肺屏障损伤
IAV引起了显着的体重减轻,并破坏了肺和肠的结构。16 S rRNA和代谢组学分析结果表明,感染甲流的小鼠粪便样品中益生菌Lachnoclosdium、Ruminococcocceae_UCG-013和色氨酸代谢产物的水平显著降低。
相比之下,补充50mg/kg利福昔明可以逆转这些变化,包括促进肺屏障的修复,增加粪便中Muribaculum、Papillibacter和色氨酸相关代谢物的含量。此外,利福昔明治疗增加了ILC3细胞数量、IL-22水平以及肺中RORγ和STAT-3蛋白的表达,减轻对肠屏障的损伤,同时增强小肠中AHR、IDO-1和紧密连接蛋白的表达。
在病原体清除方面,用冻干鼠李糖乳杆菌GG和加氏乳杆菌TMC0356进行口服预处理显著降低了PR8感染后6天小鼠肺部的病毒载量。
此外,单独口服煮沸的植物乳杆菌06CC2、植物乳杆菌DK119、热灭活b240和副干酪乳杆菌也降低了甲流病毒感染后BALF中的病毒载量。
口服加氏乳杆菌SBT2055可在感染后5天降低PR8感染小鼠肺部的病毒载量,并上调抗病毒基因Mx1和Oas1a的表达。益生菌治疗降低肺部病毒载量可能与促进对甲流病毒的先天免疫和适应性免疫有关。
煮沸的植物乳杆菌06CC2在感染早期(第二天)增加了抗病毒效应分子IFN-a、IFN-γ、IL-12的水平和NK细胞的活性。
口服植物乳杆菌DK119可增加BALF中IL-12和IFN-γ水平。
副干酪乳杆菌增加了甲流感染后肺组织中树突状细胞的募集。
植物乳杆菌0111口服预处理在H9N2感染后7天上调ISG转录,同时提高脾脏中CD3+CD4+TNF-α+T淋巴细胞百分比和CD3+CD8+TNF-β+T淋巴细胞百分比,增强对病毒的适应性免疫。
在感染的晚期,一些益生菌还可以抑制炎症损伤,促进组织修复。鼠李糖乳杆菌M21可减少甲流感染小鼠肺部的炎症损伤,并增加肺部裂解物中的IFN-γ和IL-2水平。
A. muciniphila可降低H7N9感染小鼠中促炎因子IL-1β和IL-6的水平,并增加炎症调节因子IL-10、IFN-β和IFN-γ的水平。
与益生菌粘膜乳杆菌L. mucosae1025和短双歧杆菌CCFM1026联合治疗可提高甲流感染小鼠盲肠粪便中的丁酸水平,并减轻肺组织中的炎症浸润。
一些口服益生菌可以双向作用,在甲流感染的早期阶段创造一个有利于病毒清除的炎症环境,并在后期抑制过度的炎症激活。
口服Bacteroides dorei在感染早期(第3天)更快地增加了1型干扰素的表达,降低了肺部的病毒载量,而在感染后期(第7天),它降低了1型IFN和其他促炎因子的水平,这有利于组织修复。与此同时,Bacteroides dorei治疗也改变了肠道菌群组成,增加了拟杆菌、普氏菌和乳杆菌,减少了大肠杆菌、志贺氏菌和副拟杆菌。
除此之外,益生菌制剂还可以通过促进甲流特异性抗体的产生来提高流感疫苗的有效性。
植物乳杆菌16和鼠李糖乳杆菌P118共同口服,改善了宿主对甲型流感病毒感染的防御。
研究人员利用C57BL/6和BALB/c小鼠模型的研究结果表明,单独施用植物乳杆菌16(L.plantarum 16)或鼠李糖乳杆菌P118(L.rhamnosus P118)并不能提供足够的流感防护。然而,植物乳杆菌16和鼠李糖乳杆菌P118的联合给药显著降低了呼吸道和肺部的病毒滴度,从而显著缓解了临床症状,改善了预后,降低了死亡率。
这种作用的机制涉及通过共同施用植物乳杆菌16和鼠李糖乳杆菌P118来调节宿主肠道微生物群和代谢,导致厚壁菌门富集和苯丙氨酸相关代谢增强,最终导致抗病毒免疫反应增强。值得注意的是,研究人员发现循环代谢分子2-羟基肉桂酸在抗击流感中起着重要作用。数据表明,植物乳杆菌16和鼠李糖乳杆菌P118这两种细菌或2-羟基肉桂酸在预防流感方面具有潜在的效用。
膳食中添加益生元短链低聚半乳糖和长链低聚果糖会增加小鼠流感疫苗特异性T辅助细胞1反应和mLN中特异性B细胞活化,导致IgG1和IgG2A水平升高。
β-葡聚糖重编程中性粒细胞以促进对甲型流感病毒的疾病耐受
最新研究表明,β-葡聚糖通过重编程造血干细胞来产生具有”调节”功能的中性粒细胞,这些特殊的中性粒细胞具有线粒体氧化代谢特征并能产生IL-10。这种机制通过RoRγt+ T细胞促进中性粒细胞向肺部组织募集,提高了机体对甲流病毒感染的疾病耐受能力,有助于维持肺部组织的完整性,从而降低发病率和死亡率,而这种保护作用并不依赖于抑制病毒载量。
益生元改善肠道菌群,延长流感疫苗抗体效果
接受肠内营养治疗的60岁以上老年人在标准肠内营养配方治疗的基础上,接受了双歧杆菌生长刺激素和半乳糖低聚糖治疗14周,并在治疗后第4周接种了三价季节性流感疫苗(A/H1N1、A/H3N2和B)。在第0、4、6、8和12周测量抗体滴度。结果显示,两组疫苗免疫应答率无差异,但实验组肠道内双歧杆菌数量明显高于对照组,实验组A/H1N1抗体滴度维持时间长于对照组。这表明益生元可能会增加肠道中益生菌的数量,从而维持抗体滴度。
中药在临床应用已有一千多年的历史,最近研究表明,中药在减轻甲流患者肺部炎症、改善临床症状、缩短治疗时间、促进康复等方面具有功效。
感染肺部后,甲流病毒可以改变肠道微生物群的组成和代谢,导致肠粘膜屏障受损、免疫功能受损和炎症因子水平升高。尽管如此,中药干预具有调节肠道微生物群、恢复体内平衡、保持肠粘膜屏障完整性、增强免疫功能和调节炎症反应的潜力。
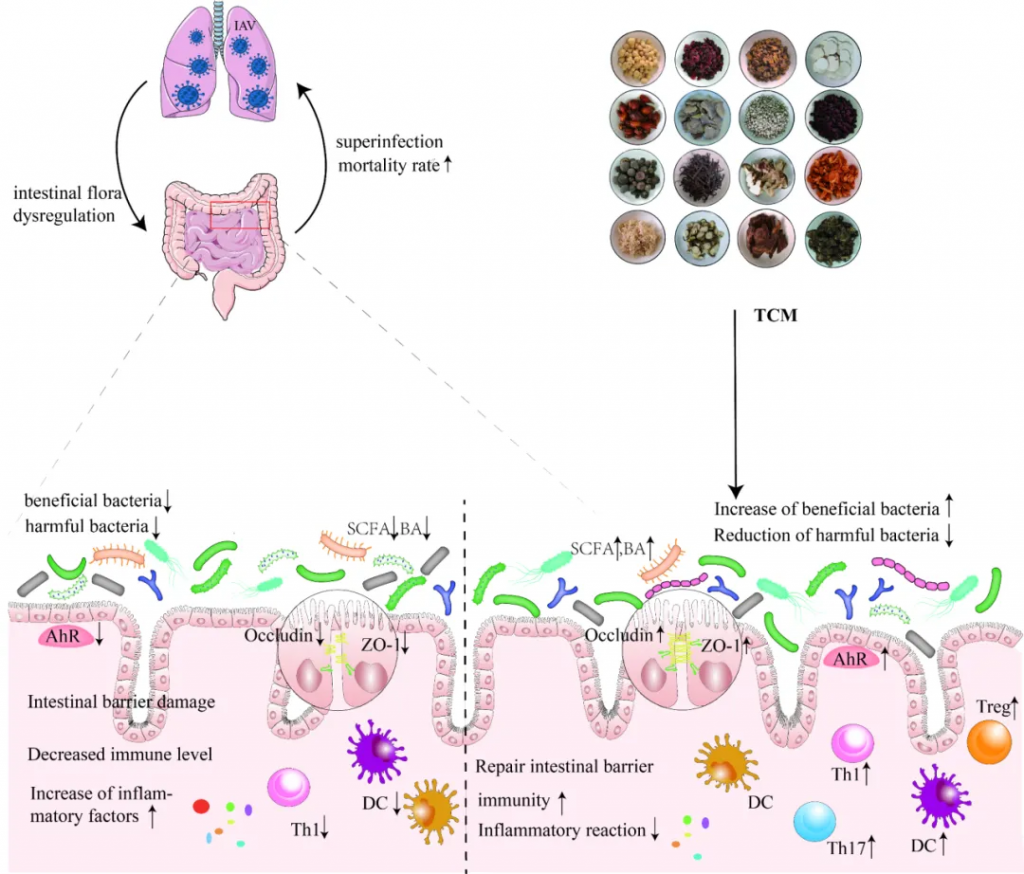
doi: 10.1186/s12985-023-02228-3.
宣肺败毒汤调节肠道微生物群多样性,并与拟杆菌、志贺氏菌、Eubacterium nodatum、Turicibacter、Clostridium sensu stricto 1 的变化呈正相关,而这些变化与 TNF-α 水平相关。
升麻素苷(Prim-O-glucosylcimifugin,POG)是中药防风的提取物,可以通过上调紧密连接蛋白Occludin、Claudin-3和ZO-1的表达水平来调节肠道菌群结构并修复肠道免疫屏障。
999 小儿感冒颗粒可以缓解H1N1感染小鼠的体重减轻,降低IL-6和IL-1β等炎性细胞因子的水平。 降低肺指数和病理损伤,通过维持结肠杯状细胞的数量来保护肠道屏障,降低结肠组织中IL-17 A的表达。
大黄中蒽醌类成分不仅增加了大鼠肠道中一些益生菌和产短链脂肪酸菌的丰度,而且通过上调ZO-1和闭塞素的表达水平来增强肠道屏障功能,从而抑制炎症。
其他中药对菌群及免疫的影响
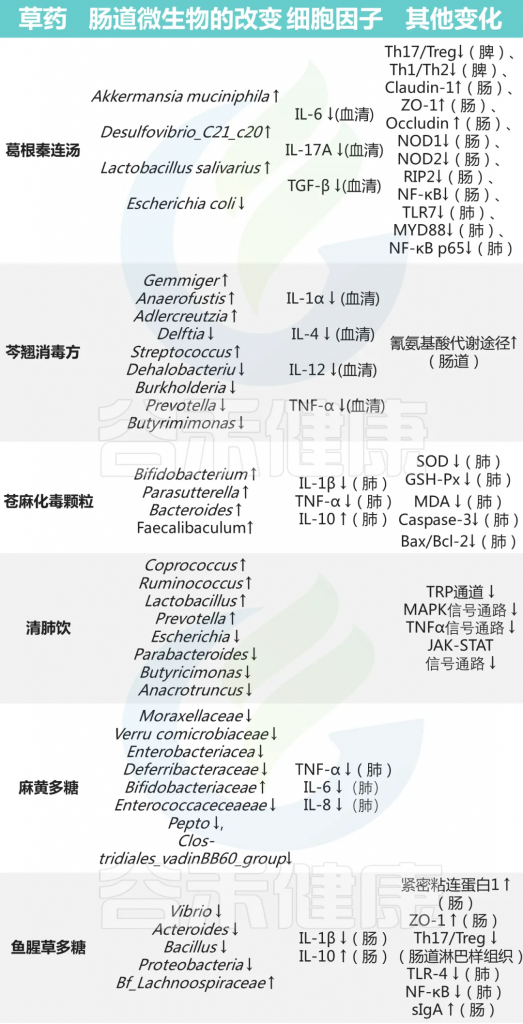
编辑
doi: 10.3389/fimmu.2023.1147724
黄芪多糖具有免疫增强作用,有望成为甲流疫苗的新型佐剂
黄芪多糖组表现出更高的免疫球蛋白G(IgG)、IgG 1和IgG 3水平,以及中和抗体水平。此外,它增加了CD 8+细胞的频率,以增强对致死性感染的抵抗力。
感染后第14天,高剂量黄芪多糖组的存活率(71.40%)高于血凝素组(14.28%),体重恢复更快。
黄芪多糖还能改善肺泡损伤和肠道结构紊乱。上调肠组织紧密连接蛋白Occludin和Claudin-1的表达水平,降低血清TNF-α的表达水平。此外,Colidextribacter、消化球菌科和瘤胃球菌科的群体是病毒感染后黄芪多糖组中的优势肠道微生物群。
doi: 10.1002/ptr.8334
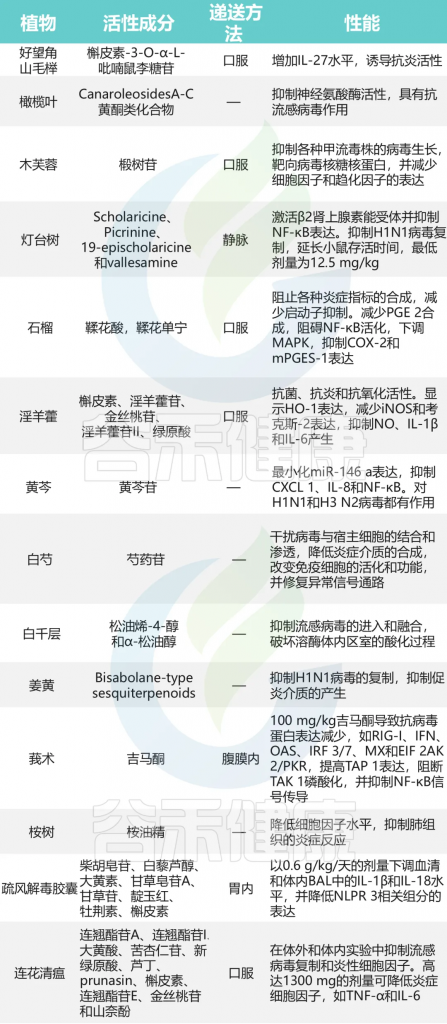

doi: 10.2147/IJGM.S361001
维生素C
维生素 C 具有重要的抗炎、免疫调节、抗氧化、抗血栓和抗病毒特性。诺贝尔奖获得者莱纳斯·鲍林从随机对照试验中得出结论,维生素 C 可以预防和缓解感冒。
一项针对儿童上呼吸道感染的荟萃分析发现,维生素C的补充能够减少感染持续时间约1.6天。
口服维生素 C(2-8 克/天)可以减少呼吸道感染的发生率和持续时间。
英国安慰剂对照试验由 168 名志愿者组成,他们在 60 天的冬季期间随机接受安慰剂或维生素 C(每天 2 × 500 毫克)。
维生素 C 组的感冒次数较少(37次 vs.50次,p=0.05)
病毒感染的“感冒”天数更少(85次 vs.178次,p=0.03)
严重症状持续时间较短(1.8天 vs.3.1天,p=0.03)。
试验期间患过两次感冒的参与者人数显着减少(维生素 C 组为 2/84,安慰剂组为 16/84;p=0.04)
维生素D
维生素D缺乏会影响呼吸道感染的发生和哮喘的恶化。
维生素D和肠道微生物组以多种类似的方式影响呼吸道疾病中的免疫系统。它们之间可能存在一些相互作用和/或协同作用。
肠道微生物组可以改变肠道维生素D代谢,1,25(OH)2D (维生素D的活性形式)水平较高的人更有可能拥有有利的肠道微生物群,尤其是更多的产丁酸菌。
维生素D->抗病毒感染->降低哮喘发生和恶化的风险
一项涉及不同国家儿童的队列研究发现,补充维生素D 与 RV感染呈负相关。此外,患有下呼吸道感染的儿童的平均维生素 D 水平明显低于对照组。下呼吸道感染的发生率和严重程度也与维生素 D 水平相关。
维生素D可以双向调节肠道微生物群
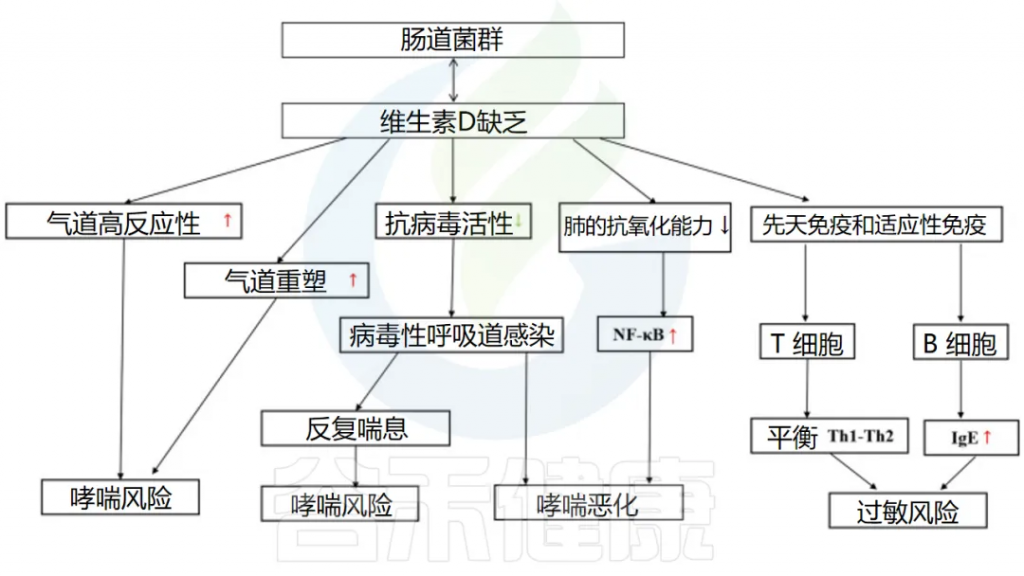
doi: 10.3389/fmicb.2023.1219942
维生素D通过多种途径影响哮喘的发生
因此,保持足够的维生素D水平对于预防和管理哮喘以及呼吸道感染至关重要。
研究表明,甲流病毒主要破坏气道上皮紧密连接,导致急性呼吸窘迫综合征,且胃肠道症状常与甲流病毒感染同时发生,提示肠-肺轴参与了宿主对甲流病毒的反应。在感染甲流病毒的患者和小鼠中发现SCFA(尤其是乙酸盐)显著减少。
在FMT后的小鼠中,这些条件被逆转,减少了肺部炎症损伤,并证实乙酸盐可能是肠-肺轴的重要介质。进一步的实验表明,乙酸盐激活了GPR 43,恢复了一些甲流病毒诱导的气道上皮屏障功能,并降低了TNF-α、IL-6、IL-1β水平。FMT能够有效调节流感感染小鼠肠道菌群结构紊乱。
粪菌移植通过增强I型干扰素通路改善甲流防御
在病毒感染中,I型干扰素(IFNs)非常重要,它们是病原体和宿主之间的重要调节因子。I型干扰素是抵御病毒感染的第一道防线。通过使用感染了甲流病毒的小鼠模型,研究人员发现IFN-κb是最早对H9N2感染做出反应的I型干扰素之一,并且IFN-κb能够有效地抑制多种流感病毒在培养的人类肺细胞中的复制。因此,阻断IFN-κ特异性途径可以作为预防和治疗甲流的依据。
I型干扰素途径对身体很重要。适当调节它既能抵御病毒感染,又能避免免疫或病理对身体造成过度损伤。比如降低IFNAR1水平可抑制流感病毒早期繁殖。
I型干扰素主要会激活一些干扰素刺激基因(ISGs)的表达。ISGs编码的蛋白质具有多种抗病毒功能。抗生素的使用会导致肺间质细胞中ISGs的减少,从而使身体更容易感染流感病毒。
然而,粪菌移植(FMT)可以逆转这一情况,增加肺间质中的I型干扰素信号通路和I型干扰素驱动的抗病毒状态,从而增强对流感病毒感染的防护。
在流感季节很容易感染甲型流感,因为它传染性很强。预防策略可以保护你免受流感或减少并发症的风险。一些常见的预防方法包括:
肠道微生物群是一个复杂而广泛的群落,显著影响各种生物系统,包括免疫系统和代谢功能。最近的研究越来越多地强调肠道微生物群与流感之间的潜在联系,表明肠道微生物群可能影响流感病毒的致病性,从而提供了一种新的治疗靶点。
总之,肠道微生物群表现出对流感的治疗潜力,这可以通过调节肠道微生态来解决。未来的研究应侧重于确定肠道微生物群中的关键菌株、特定代谢物和免疫调节机制,以精确靶向微生物群干预,预防和治疗流感和其他呼吸道病毒感染。
在此基础上,菌群组合的优化研究显得尤为重要。比如说通过研究植物乳杆菌16和鼠李糖乳杆菌P118等益生菌的协同作用,探索不同菌群配比对免疫调节的影响,从而制定个体化的菌群干预方案。
可以进行新型保护性代谢物的筛选与鉴定,深入研究短链脂肪酸、胆汁酸等代谢产物的作用机制,并结合代谢组学分析推进临床应用。
开展一系列临床转化研究,包括建立菌群检测作为辅助诊断的标准化体系,开展益生菌制剂的临床试验,并根据不同患者特点制定个性化预防和治疗方案。同时,预防策略的优化也需要重点关注,特别是探索疫苗免疫效果与肠道菌群的关系,建立预防性菌群调节方案,并为高危人群制定个性化预防策略。
这些研究方向相互关联、相互促进。分子机制的研究为菌群组合优化提供理论指导,代谢产物研究则为临床应用提供新靶点,而临床转化研究的结果又能反馈指导基础研究的方向。通过多维度、多层次的研究,将更全面地理解肠道菌群与甲型流感的关系,为开发新型防治策略提供坚实的科学依据。
主要参考文献
Khan N, Tran KA, Chevre R, Locher V, Richter M, Sun S, Sadeghi M, Pernet E, Herrero-Cervera A, Grant A, Saif A, Downey J, Kaufmann E, Khader SA, Joubert P, Barreiro LB, Yipp BG, Soehnlein O, Divangahi M. β-Glucan reprograms neutrophils to promote disease tolerance against influenza A virus. Nat Immunol. 2025 Jan 8.
Luo C, Yang Y, Jiang C, Lv A, Zuo W, Ye Y, Ke J. Influenza and the gut microbiota: A hidden therapeutic link. Heliyon. 2024 Sep 10;10(18):e37661.
Ma L, Ji L, Wang T, Zhai Z, Su P, Zhang Y, Wang Y, Zhao W, Wu Z, Yu H, Zhao H. Research progress on the mechanism of traditional Chinese medicine regulating intestinal microbiota to combat influenza a virus infection. Virol J. 2023 Nov 13;20(1):260.
Liu X, Wang Q. Effect of natural products on host cell autophagy induced by Influenza A virus infection. Front Cell Infect Microbiol. 2024 Sep 30;14:1460604.
Ho JSS, Ping TL, Paudel KR, El Sherkawi T, De Rubis G, Yeung S, Hansbro PM, Oliver BGG, Chellappan DK, Sin KP, Dua K. Exploring Bioactive Phytomedicines for Advancing Pulmonary Infection Management: Insights and Future Prospects. Phytother Res. 2024 Dec;38(12):5840-5872.
Ou G, Xu H, Wu J, Wang S, Chen Y, Deng L, Chen X. The gut-lung axis in influenza A: the role of gut microbiota in immune balance. Front Immunol. 2023 Oct 20;14:1147724.
Gounder AP, Boon ACM. Influenza Pathogenesis: The Effect of Host Factors on Severity of Disease. J Immunol. 2019 Jan 15;202(2):341-350.
Zhang Y, Chen Y, Xia J, Li L, Chang L, Luo H, Ping J, Qiao W, Su J. Rifaximin ameliorates influenza A virus infection-induced lung barrier damage by regulating gut microbiota. Appl Microbiol Biotechnol. 2024 Sep 19;108(1):469.
Wan C, Yan S, Lu R, Zhu C, Yang Y, Wu X, Yu Z, Jiang M, Peng W, Song W, Wu H, Fang B, He Y. Astragalus Polysaccharide improves immunogenicity of influenza vaccine as well as modulate gut microbiota in BALB/c mice. Microb Pathog. 2024 Oct;195:106893.

谷禾健康

自古以来,中医就有“药食同源”的理念,强调食物与药物之间的内在联系,认为许多食物既可作为日常饮食,又具有调治疾病的作用。随着现代科学的发展,这一古老的智慧得到了新的诠释和应用,逐渐发展成为今天的营养大健康行业的重要组成部分。
药食同源的理念,源于对自然界植物、动物等观察和长期实践。在古代,人们发现某些食物在特定情况下能够缓解或治疗某些症状,这些食物因而被赋予了药用价值。例如,生姜被用来缓解感冒症状,大枣用来滋补身体,这些实践在现代医学中也得到了相应的科学解释和验证。
然而,药食同源的意义远不止于此,它还涉及到食物与人体之间复杂的相互作用,以及食物如何通过影响人体内部环境,特别是肠道菌群,来发挥其健康效益。
近年来,随着研究的深入,人们逐渐认识到肠道菌群对人体健康的重要性。它不仅参与食物的消化和营养吸收,还与免疫系统、神经系统以及许多代谢过程密切相关。因此,肠道菌群的健康状态直接影响到个体的健康状况,而饮食则是影响肠道菌群组成的主要因素之一,这一发现为个性化营养提供了新的视角。
个性化营养的兴起,标志着营养学从“一刀切”的群体指导向“量身定制”的个体化服务转变。在这一过程中,药食同源的概念被赋予了新的生命。通过结合现代营养学、微生物学、分子生物学、数据科学等多学科知识,个性化营养能够更精准地满足个体在不同生理阶段、不同健康状况下的营养需求。这种基于个体差异的精准营养干预,有望提高营养建议的依从性和有效性,从而更好地促进健康和预防疾病。
本文从药食同源的基本概念出发,探讨其在现代营养学中的应用,分析肠道菌群与健康的关系,特别是在肠道菌群检测技术日益成熟的背景下,如何将传统理念与现代科技相结合,为人们提供更科学、更有效的健康解决方案。这里展示药食同源在大健康行业中的潜力和前景,同时指出面临的挑战和未来的发展方向。
在这个营养大健康行业的新时代,我们可以更深入挖掘药食同源的科学意义,利用现代科技手段,为人们提供更加精准、个性化的营养服务。这不仅是对传统智慧的传承和创新,更是对未来健康生活方式的探索和引领。期待能够为营养学界、健康产业等带来相关启示。
本文目录
01 药食同源
药食同源的定义、特点、物质
传统中医中的药食同源理论
现代科学中的药食同源
02 营养基因组学与药食同源:个性化健康新纪元
03 什么原因导致不同个体之间的效果差异?
04 如何实现个性化干预?
肠道菌群参与活性成分的生物转化
药食同源成分调节肠道菌群(多糖、多酚等)
药食同源物质通过肠道菌群影响疾病
消化系统疾病、肝病、内分泌疾病、
神经精神疾病、心血管疾病、其他
05 药食同源干预和开发的注意事项
药食同源-循证依据
如何监测其效用?
药食同源技术创新
展望
药食同源,这一概念最早源于中国古代的医学典籍,其核心思想是某些物质既可以作为日常食物,也可以作为药材使用,即“药食同源”。
在中医理论中,这一理念体现了食物与药物之间的内在联系和相互转化的可能性。
在现代,药食同源的定义得到了进一步的扩展和科学化。它不仅包括了传统意义上的食疗,还涵盖了食物中活性成分的研究、功能性食品的开发以及营养与健康的密切关系。药食同源的物质通常指的是那些在自然界中既可以食用,又具有一定的药理作用,能够在不造成副作用的前提下,通过日常饮食来维护或改善健康的植物、动物或矿物。
▼
药食同源物质的特点
安全性:这些物质应当是长期被人类食用,且对人体没有明显毒性或副作用的。
功能性:含有能够对人体健康产生积极影响的生物活性成分,如多糖、黄酮、皂苷、挥发油等。
营养性:提供必要的营养素,如维生素、矿物质、蛋白质、膳食纤维等。
可食性:这些物质应当能够以食物的形式被人体消化吸收,且在口感、风味上能够被接受。
药食同源的物质在中医中有着广泛的应用,如黄芪、当归、枸杞、山药等,它们既可作为食材加入日常饮食,也可作为药材用于疾病的治疗和调理。
在现代,随着科学研究的深入,越来越多的药食同源物质被发掘和验证,如大蒜、生姜、绿茶、蓝莓等,其健康益处得到了科学界广泛认可。
药食同源的物质 例如:
传统“药食同源”理念的智慧和现代营养学、食品技术的进步,使得药食同源材料,如益智仁、川贝母、苦茶、桂皮、灵芝、生姜、银杏、鱼腥草、甘草、百合、枸杞、黑胡椒、紫苏、茯苓、马齿苋、薏仁、枸杞、大枣等在医药、普通膳食、功能食品和保健品中的应用日益广泛,即从2002年的 86 种增加到2021年的 110 种。

doi: 10.1016/j.jare.2023.05.011
在传统中医中,药食同源理论是一种深植于中国几千年文化和医学实践中的核心理念。中医认为,人体是一个整体,与自然环境息息相关,疾病的产生与人体内外环境的失衡有关。因此,中医治疗的目标是恢复和维持身体的平衡状态,即“阴阳平衡”。在这一理论体系中,食物不仅仅是满足基本营养需求的物质,更是调节身体、预防和治疗疾病的天然药物。
食物的性味归经
中医认为食物具有“四气”(寒、凉、温、热)和“五味”(酸、苦、甘、辛、咸),这些特性决定了食物对人体的作用和影响。
– 寒凉性食物通常具有清热、泻火的作用,适合于热性体质或热性疾病的患者;
– 温热性食物则有温中、补阳的功效,适用于寒性体质或寒性疾病的患者。
此外,食物还根据其对人体脏腑经络的作用被归入不同的“经”,如心经、肝经、脾经等,通过食物的归经特性,可以针对性地调节相应脏腑的功能。
传统中医强调“辨证施食”
根据个体的体质、疾病状态和环境因素来定制饮食方案。这种方法体现了中医个体化治疗的特点,认为没有一种食物或药膳适合所有人。因此,中医会根据患者的具体情况,调整饮食结构,推荐适合的食物和药膳,以达到最佳的治疗效果。例如,某些温热性的食物可能对寒性体质的人有益,但对热性体质的人则可能造成不适。
传统“药食同源”思想的主要特征是:
药食相隐、辨证施食、阴阳平衡、五脏滋养调理、防治结合、顺应自然、适可而止、适度食用。
这些思想体现了一种深度融合医学理论、兼顾个体差异、强调食物与药物功能相辅相成、追求整体平衡与自然和谐的饮食观念。这一理念在当今社会仍然具有重要的指导意义,对提高民众健康意识、倡导健康生活方式有着积极的影响。
现代“药食同源”饮食理念,是在继承和发扬传统“药食同源”思想的基础上,逐步融入了现代遗传学、代谢和营养学理论、生物医学和临床研究成果、先进的工具和技术,以及实际的社会生活经验等。
在中药材理念的基础上,一条集食品、保健品和药品于一体的紧密产业链已经形成。这条产业链不仅包括中药的生产和分销,还包括药食同源食品和营养补充剂的发展。桑葚和枸杞的兴起表明传统和现代健康领域的成功融合。
2022 年,桑葚被创新地用于保健茶,成为药食同源市场中增长最快的成分,价值超过 300 亿元人民币。
枸杞已从中老年人的传统保健选择转变为年轻人中流行的保健元素,预计到 2023 年消费量将达到 138 万吨,市场规模将达到 653 亿元人民币。
由于基因、环境、生活方式等因素的差异,同一种药食同源物质在不同人群中可能产生不同的效果。
例如,大枣这种药食两用的果实,在传统医学中被用于补气养血、安神益智。然而,现代研究发现,大枣的这些效果可能因个体差异而有所不同:
随着人们对健康的追求日益个性化,“药食同源”理念也在不断演变。现代的药食同源不仅包括传统的食疗,还涵盖了功能性食品的开发以及营养与健康的密切关系研究。
然而,这种演变也带来了新的挑战:如何在保持药食同源物质整体效用的同时,实现真正的个性化应用?
融合东西方饮食文化、借助最新技术
融合东西方饮食文化和医疗实践甚至调和/推进两者的现代“药食同源”饮食在当今世界越来越受欢迎。借助人工智能、大数据等新兴技术,基于“药食同源”的个性化营养建议、健康饮食/保健建议、智能饮食生活计划、定制食谱提示、定制膳食建议等远程营养咨询服务应运而生,这将使“药食同源”的体验更具吸引力。

科技赋能传统智慧
全基因组关联研究的进展,包括表观基因组学、代谢组学、转录组学、蛋白质组学和微生物组分析技术(如 DNA 下一代测序)在内的先进“组学”技术等技术突破,使个体营养需求、遗传状况和肠道菌群分布得到全面分析,可以快速识别涉及基因-饮食相互作用的遗传变异及其与各种疾病的潜在联系,从而使“药食同源”饮食更加个性化和精准,从而提高饮食和生活方式建议的有效性。
总的来说,现代“药食同源”的主要特征包括:
科学性、循证性、精准性、标准化、功能性、多样性、生态化、可持续化、智能化、数字化、教育普及化、跨学科协作化、跨文化、国际化。
换言之,现代“药食同源”是一套将传统“药食同源”智慧与现代智能技术、先进的食物、人类和地球知识深度融合的饮食原则,旨在满足当代社会对健康、营养、精神健康、便利性和环境可持续性以及地球健康的多方面饮食需求。
正是在这样的背景下,营养基因组学应运而生。这一领域的出现,为我们理解和应对药食同源效果的个体差异提供了全新的视角和工具。下一章节,我们来探讨营养基因组学如何推动药食同源理论的发展,开启个性化健康的新纪元。
随着人们对饮食及其影响健康的潜力的认识和了解不断增长,导致了营养基因组学出现。
营养基因组学
营养基因组学作为一门新兴的学科,它研究了基因与饮食之间的相互作用,以及如何通过个性化的饮食干预来优化健康。
营养基因组学于 2001 年首次提出,旨在研究食物与遗传基因之间的关系,已应用于开发支持健康和降低饮食相关疾病风险的食品或饮食。
来自世界各地的 1,072 条与营养基因组学相关的研究文献显示,营养基因组学使个性化饮食方法能够恢复体内平衡并消除与饮食相关的疾病,提供了一系列工具来深入了解可能影响基因、蛋白质组或代谢组水平的主要途径以及肠道微生物群和相关代谢物对人类健康的潜在贡献,并提供了重要见解。
通过营养基因组学的研究,可以发现不同人群对药食同源物质的代谢和反应差异,从而为个性化营养提供依据。例如,某些人群可能对某种药食同源物质的代谢能力较弱,需要适当调整摄入量;而另一些人群可能对某种药食同源物质的反应较为敏感,需要谨慎使用。
个性化营养理念与现代人的健康需求不谋而合
现代人更加意识到通过健康的生活方式来预防疾病。人们需要安全、营养充足、身体、精神和情感健康、环境可持续、经济公平和负担得起、文化可接受的食品和饮食。
近年来出现的“个性化食品/饮食”、“个性化营养”、“主动健康”和“天然功能性食品”等术语都反映了人类对基于个人基因、微生物群和生活方式的特定饮食/食品的需求日益增加。
因此,具有特定健康促进特性和定制产品形式的超级成分和功能性食品产品的普及预计将在全球范围内进一步增加。
药食同源物质的机会
自 2023 年以来,人们寻求从方便食品/餐食中获得有意识的享受,这进一步模糊了正餐和零食之间的界限。这为药食两用材料/物质提供了巨大的机会,它们可以作为额外的“补充”加入/强化各种零食类消费食品/餐食,提供维持/促进健康、预防/治疗疾病和延长寿命的效果。
科学知识、现代加工技术和生物技术、组学技术和创新的生物信息学工具的进步,为实现”为人类生命和健康量身定制食品/饮食”提供了可能。这与中医”药食同源”理念的智慧不谋而合,后者强调了”预防”高于”治疗”的首要地位,强调了人与自然的相互影响,以及每个人健康的独特性。
这些理念的现代体现就是”主动护理“或”主动健康”的趋势。
“主动护理”的趋势,重塑可持续健康管理
主动护理(也称为主动健康)是 2019 年疫情以来的主导趋势,在 2020-2021 年成为更为重要的服务模式。在新冠疫情期间和之后,“食物作为药物提供天然的功能”再次得到强调,并得到了显著加强。
人们希望在早期阶段增强对生活压力和不可预测疾病和状况的抵抗力,改善全身健康状况,提高生活质量,延迟和减少进一步医疗和住院治疗的需求,并建立更可持续、更高效的卫生和社会护理体系,从而推动主动护理的转变。
“更安全、温和”的趋势
同时,越来越多的人开始追求更安全、更温和的治疗。预防保健应运而生,以促进生活质量和更健康的生活方式,提倡及早发现健康问题。
当然它也有缺陷,包括不同社会经济群体之间资源可及性的差异、个人的依从性以及不可预见的健康风险和疾病的风险。
根据世界卫生组织(WHO)的数据,草药为全球一半以上的人口提供了初级卫生保健的基础。食物和传统药物的综合使用(例如“人体阴阳平衡和气调”的思想),而不是单独使用药物/药物,已成为古代和现代正常人和亚健康人群预防保健的趋势。

药食两用的水果举例:龙眼
龙眼就是一个很好的例子,它是一种药食两用的水果。龙眼在中国和日本传统医学中用于补心健脾、养血安神,以及治疗健忘、失眠、气血不足等症状。
现代研究表明,龙眼通过抑制NF-κB 和 AP-1 信号通路来抑制脂多糖刺激的巨噬细胞一氧化氮的产生,其多糖能提供免疫调节作用。
在小鼠实验中龙眼能够增强学习和记忆能力(部分由脑源性神经营养因子表达和未成熟神经元存活介导),并改善认知能力、减轻病理损伤 [部分通过抑制RAS/丝裂原活化蛋白激酶(MEK)/细胞外信号调节激酶(ERK)信号通路介导]。
药食同源理论和个性化营养的发展为我们提供了全新的健康管理视角。然而,在实际应用中,有些人可能对龙眼的免疫调节作用特别敏感,而另一些人则可能在认知功能改善方面受益更多。
这不仅关系到药食同源理论的实际应用效果,也是个性化营养和精准医疗领域的核心挑战。要回答这个问题,我们需要深入探讨导致个体差异的多种因素,包括遗传背景、生活环境、饮食习惯、肠道菌群等。
要回答这个问题之前,我们先了解一下有哪些食物或者说药材及其成分。
2020年,国家卫健委、国家市场监督管理总局联合发布的《关于开展党参等9种按传统既是食品又是中药材的物质管理试点工作的通知》指出:
众多药食同源的中药材中含有当归、八角、豆蔻、丁香、小茴香、白芷、地茯苓、火麻仁、人参、人参果、人参叶、山楂、马苋菜、刀豆、甘草、人参、木瓜、梅干、白果、山药、木薯等84种成分。
这些药食同源物只要使用得当,几乎没有任何危险的副作用,且含有生物碱、长链脂肪酸、多酚、多糖、蛋白质、三萜类化合物、有机酸和维生素等生物活性物质,具有抗氧化、抗炎、抗菌、抗癌、抗高血压、增强免疫力和保护肾脏等多种生理功能。
例如,枸杞含有丰富的维生素C、维生素E、矿物质和多糖,具有增强免疫力和抗氧化能力,促进患者康复的功效。
现代科学研究:药食同源物质中的活性成分
现代科学研究揭示了许多传统药食同源物质中的活性成分,如多酚类、黄酮类、皂苷类、生物碱等,这些成分具有抗氧化、抗炎、抗菌、抗病毒等多种生物活性。例如:
正如我们所了解的,药食同源物质含有多种生物活性成分,这些成分对健康有着广泛的影响。然而,这些成分在不同个体中的作用效果会有差异。这种差异性主要是由以下因素造成的:
遗传差异
药食同源物质含有多种成分,个体基因的不同会影响这些成分的代谢途径。例如,某些人可能有更高效的酶来代谢这些成分,从而影响其效果。有些人可能对某些药食同源物质更敏感,即使是很小的剂量也可能产生显著效果。例如,某些人对大蒜中的蒜素特别敏感,可能会有更强烈的生理反应。
健康状况
个体的健康状况,特别是肝脏和肾脏功能,对药食同源物质的代谢和排泄至关重要。例如,肝脏功能不佳可能会影响甘草中甘草酸的代谢,进而影响其抗炎效果。
年龄和性别
不同年龄和性别的人可能对药食同源物质有不同的反应。随着年龄的增长,新陈代谢减慢可能会影响某些成分的效果。
生活习惯
饮食、运动、睡眠和压力管理等生活习惯也会影响药食同源物质的效果。例如,高脂肪饮食可能会影响绿茶中儿茶素的吸收,而规律运动可能增强黄芪的抗疲劳效果。
剂量
药食同源物质的剂量也会影响其效果,不同个体可能需要不同的剂量以达到最佳效果。例如,不同个体对人参的敏感性不同,所需的最佳剂量也会有所不同。
药食同源成分——相互协同作用
中医认为这些同源植物具有“四气”(寒、热、温、凉)和“五味”(酸、苦、甘、辣、咸),有助于调节人体各方面的机能和阴阳平衡,相互促进和制约,促进脏腑功能和气血协调,从而预防或治疗疾病。例如:
张锡纯在《中西医结合》一书中指出:“食疗既治病又充饥,既充饥又可口,对症下药,病自然会慢慢好,即使不对症下药,也不会有其他问题。”
这些思想强调食疗与药疗的协同作用,在现代依然适用,比如说:
药食同源物质/成分中的营养成分和生物活性物质是可靠的,在人类治疗某些健康状况或疾病方面有着悠久的安全历史,副作用较小,尤其适用于慢性病的长期治疗。这些药食同源物质/成分的组合应经过量身定制,以最大限度地发挥其对人体阴阳平衡和免疫力的调节作用,以达到治疗某些疾病或在药物治疗过程中起到辅助作用。
基于这些药食同源物种的特点,对食物和药物进行个性化选择,可以使两者共同发挥作用,提高药物的疗效和生物利用度,同时抵消部分药物引起的不良反应。
肠道菌群不仅参与消化过程,帮助我们分解食物中的营养素,还参与了药物和食物成分的代谢,影响其生物利用度和效果。
因此,当我们考虑药食同源物质对每个人效果的差异时,必须将肠道菌群作为一个关键因素纳入考量。
个性化的营养和健康管理策略应当考虑到个体的肠道菌群组成,以及它们如何与药食同源物质相互作用,从而优化这些天然资源的健康效益。
不同的厨师用同样的食材,可以做出不同口味的菜肴,那么同样,不同人的身体体质,基础条件,代谢能力等都不一样,药食同源物质活性成分发挥的效果就不一样。这些差异不仅体现在生理和遗传层面,还涉及到很重要的——肠道微生物群。不同的肠道菌群可能通过不同的代谢途径处理相同的活性成分,产生不同的代谢产物。
肠道菌群会分泌出一些酶,这些酶能够改变这些天然材料的结构。一旦结构被改变了,这些天然材料的物理化学性质和生物活性也会跟着变化,这样的变化能让它们在身体里发挥更好的治疗效果。
肠道微生物群转化,比化学合成有什么优势?
与化学合成对这些天然产物的修饰相比,肠道菌群的生物转化具有独特的优势:
1) 能干
肠道菌群分泌的催化酶驱动的大多数反应,难以通过化学合成完成;
2) 精准
酶促反应选择性强,也就是特别挑,只对特定部位下手,不用担心误伤到不用改变的部分;
3) 温和
生物转化反应条件相对温和,不会像高温、高压那样粗暴,这样能更好地保护那些珍贵的活性成分不受损。
下面具体来看,一些药食同源的成分经过肠道菌群代谢后,如何产生更容易吸收的或者更有益于人体的物质。
呋喃香豆素—经黏液真杆菌属—更容易吸收代谢
白芷里就含有多种呋喃香豆素,比如花椒毒素、佛手柑内酯、欧前胡素和异欧前胡素等等。
呋喃香豆素是一种在食物和草药里常见的活性成分,抗炎、抗癌、保护神经。但是,如果我们吃了含有呋喃香豆素的东西再去晒太阳,可能会有光毒性,就是皮肤对光特别敏感,容易发炎。
呋喃香豆素还会影响肝脏里的一种叫做CYP3A的酶,这种酶负责代谢药物,一旦被抑制了,药物在身体里待的时间就会变长。
肠道菌群是怎么发挥作用的?
肠道菌群中的经黏液真杆菌属(Blautia),能产生一种叫做 Co O-甲基转移酶MRG-PMF1,裂解甲基芳基醚,这种酶能把花椒毒素和香柠檬烯这些成分变成花椒毒醇和香柠檬醇,重要的是,异戊二烯基芳醚基团以相同的方式裂解。
去甲基化和去异戊烯化
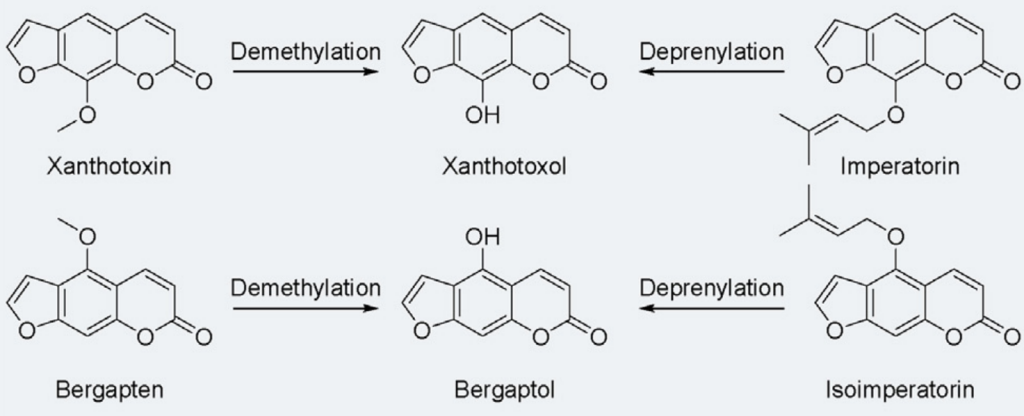
doi: 10.1016/j.jare.2023.05.011
欧前胡素和异欧前胡素经肠道微生物转化脱异戊烯基化也产生了上述产物。
这些溶解性更好的脱甲基和脱异戊烯基酚代谢物可以迅速随尿液排出。
也就是说,肠道内经黏液真杆菌高的人,可能更有效地代谢和排出体内的某些毒素,减少因体内毒素积累引起的炎症反应,从而降低慢性炎症性疾病的风险。
人参皂苷—双歧杆菌——抗癌、抗疲劳效果↑
人参皂苷的生物利用度通常约为给药量的 0.1% ~ 0.5%。某些肠道菌群如拟杆菌、双歧杆菌、真杆菌、普氏菌、梭杆菌,可以代谢人参皂苷并产生具有促进健康作用和显著提高生物利用度的新化合物。
比如,人参皂苷Rb1在双歧杆菌的作用下,先变成Rd,继续去糖基化,再变成抗癌和抗糖尿病效果更强的Compound K。而且,Rg1去糖基化变成的20(S)-protopanaxatriol(PPT),抗疲劳效果就更强。
那么,有些肠道内双歧杆菌含量较高的人,对他们来说,吃人参的效果可能更显著。
黄芪中毛蕊异黄酮—拟杆菌属13—抗病毒效果↑
黄芪中的主要异黄酮类化合物有毛蕊异黄酮-7-O-β-D-葡萄糖苷 (CG) 。
来自人类肠道细菌的拟杆菌属 13对 CG 进行去糖基化,获得了糖苷配基毛蕊异黄酮,它比相应的糖苷具有更强的抗病毒能力,可以保护 PC12 细胞免受损伤。
去糖基化
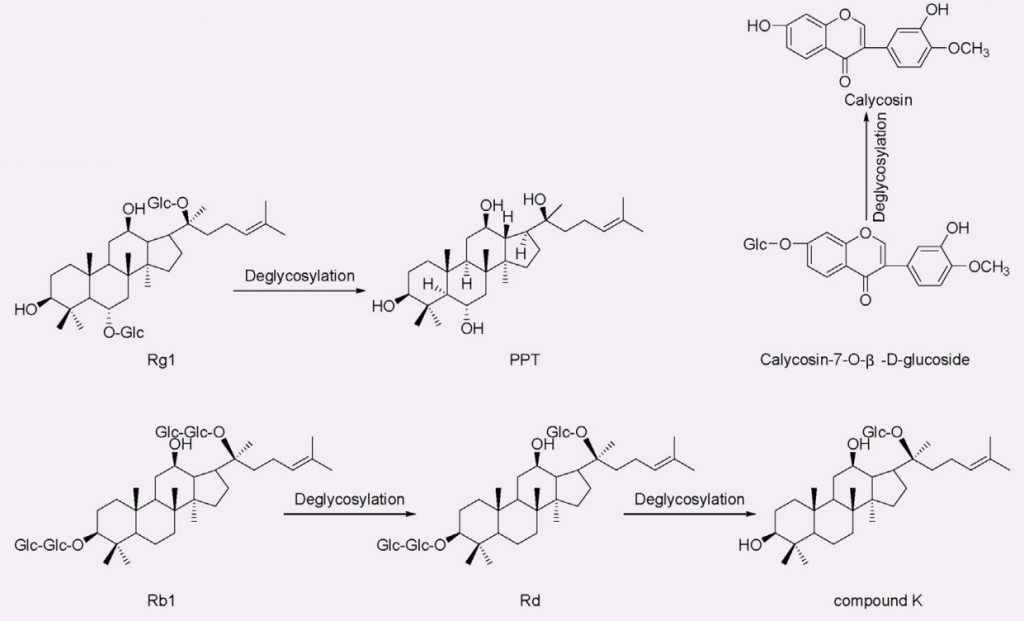
doi: 10.1016/j.jare.2023.05.011
毛蕊异黄酮—拟杆菌58—芒柄花素预防癌症
芒柄花素是一种植物雌激素,用于预防和治疗乳腺癌、前列腺癌、结肠癌和骨质疏松症。
来自人类肠道细菌的拟杆菌属58能够使毛蕊异黄酮脱水并将其转化为芒柄花素。
此外,毛蕊异黄酮的乙酰化是由菌株梭菌属21-2完成的。
脱水和乙酰化
doi: 10.1016/j.jare.2023.05.011
药食同源物质对肠道菌群的调节作用是现代营养学和传统医学交汇点上的一个研究热点。
药食同源物质,如中药材、功能性食品和富含生物活性成分的天然食品,已被证明能够对肠道菌群产生积极影响。这些物质中含有的多糖、多酚、挥发油、皂苷等生物活性成分,都可以调节肠道菌群。
这些生物活性成分不仅为肠道菌群提供营养,还能选择性地促进某些有益菌的生长,同时抑制有害菌的繁殖,从而帮助维持肠道微生态的平衡。
多糖
促进有益菌,减少有害菌,比如说,麦冬多糖可以通过调节肠-肝轴显著保护非酒精性脂肪性肝病。
麦冬多糖显著降低了一些有害细菌的相对丰度,包括乳球菌、肠杆菌、Turicibacter、Tyzzerella、Oscillibacter等,并增加一些有益菌,如Alistipes、Ruminiclostridium、Rikenella。这种多糖还显著增加了两种产短链脂肪酸菌( Butyricimonas、Roseburia )丰度以及乙酸和戊酸的水平,从而改善了炎症反应和肝脏脂质代谢。
促进短链脂肪酸(SCFAs)的产生
枸杞多糖补充剂可降低厚壁菌门与拟杆菌门的比例,增加产短链脂肪酸菌,如Lacticigenium、Butyricicoccus、Lachnospiraceae等,从而改善肥胖小鼠的肠道菌群失调。
改善代谢,缓解疾病
银耳多糖通过多途径调节肠道菌群及其代谢物,改善了DSS诱导的溃疡性结肠炎。银耳多糖可以增加Lactobacillus的丰度,从而改善色氨酸的分解代谢。这导致黄嘌呤酸、KA和吲哚衍生物(如5-羟吲哚、5-羟吲哚-3-乙酸、5-羟吲哚乙酰酸)的增加。
天然多糖因其在缓解运动性疲劳中的潜在效果和较少的副作用而受到关注。研究表明,肌肉功能与肠道菌群的多样性和组成密切相关,而天然多糖如决明子、灵芝、枸杞、冬虫夏草等可通过不同机制发挥抗疲劳作用。
doi.org/10.3390/foods12163083
多酚
多酚是药食同源食物中含量丰富的活性化合物,膳食多酚类化合物具有预防慢性疾病的抗氧化剂,而临床试验中证据很弱,主要因为个体间的差异很大。多酚的生物利用度低(5%–10% 被小肠吸收)。这些化合物的生物利用度严格取决于肠道微生物的酶促机制。
肠道微生物群通过改变糖苷配基、糖苷和结合物的结构来影响多酚的生物利用度。
一般来说,口服多酚在上消化道的吸收相对较低;很大一部分多酚积聚在结肠中,影响和改变肠道微生物群的组成。摄入多酚可能通过促进有益细菌的生长,抑制有害细菌的生长,从而使宿主受益。
随机,双盲,安慰剂对照的人类试验表明,经口摄入没食子儿茶素-3-没食子酸酯和白藜芦醇,持续12周超重男性显著降低拟杆菌的粪便丰度和趋向于降低Faecalibacterium prausnitzii 的丰度。
在高脂饮食中补充膳食葡萄多酚导致肠道微生物群落结构发生显著变化,包括厚壁菌门与拟杆菌门的比例降低以及AKK菌的大量繁殖。膳食多酚促进肠道细菌Akkermansia muciniphila 的生长并减轻高脂饮食诱导的代谢综合征。
Vemana Gowd, et al.,Trends in Food Science & Technology, 2019
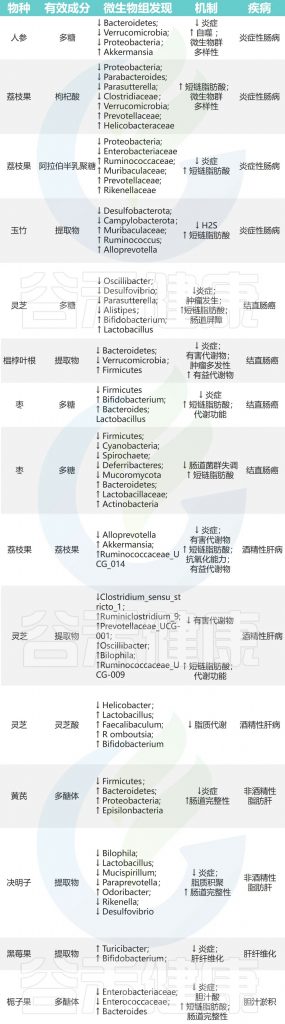
下面按照疾病类型分类分为消化系统疾病、肝病、内分泌疾病、神经精神疾病、心血管疾病等,逐一了解药食同源如何通过肠道菌群影响健康。
■ 消化系统疾病
炎症性肠病(IBD)
炎症性肠病(IBD)是一种肠道的慢性病,它会反复发生,造成肠道发炎和损伤。肠道屏障是保护肠道不受病菌侵害的关键。肠道菌群失衡可能会引起IBD。特别是,如果肠道里的革兰氏阴性细菌多了,它们细胞壁上的脂多糖(LPS)也会增加,这可能会引发过度的免疫反应,导致IBD。
人参→拟杆菌、疣微菌、变形菌↓→LPS↓→抗炎
枸杞→副拟杆菌属,Parasutterella,梭菌属↓ 螺杆菌科↑
玉竹提取物→脱硫弧菌科↓
除了上面提到的,还有很多药食同源的植物也能调节肠道菌群,帮助治疗IBD,比如山楂、蜂蜜、山药、菊花、酸枣仁、姜黄、黄芪和灵芝。这些植物可能成为治疗IBD的新药物。
多糖治疗IBD的机制
doi.org/10.1016/j.ijbiomac.2023.126799
结直肠癌(CRC)
结直肠癌(CRC)是全球常见的癌症之一,占全球每年所有癌症诊断和所有癌症相关死亡的 10%。长期患有 IBD 和不健康的生活方式导致肠道菌群紊乱的患者患结直肠癌的风险更高。因此,发基于药食同源物种的新型、有效但低毒的产品用于预防和治疗结直肠癌变得越来越重要。
灵芝→厚壁菌门、双歧杆菌、乳酸杆菌↑ 拟杆菌门、脱硫弧菌、颤杆菌↓ →预防结直肠癌
西洋参→疣微菌↓→抗炎、抗肿瘤
大枣→双歧杆菌、拟杆菌、乳酸杆菌↑→预防肿瘤
■ 肝 病
酒精性肝病(ALD)
酒精性肝病(ALD)与长期喝酒太多有关,它包括脂肪肝、酒精性肝炎和酒精性肝硬化等不同的肝脏问题。喝酒太多不仅会伤害肝脏,还会让肠道菌群不平衡,破坏肠道屏障,这会影响肠道和肝脏之间的正常联系,导致肝病。
枸杞→阿克曼氏菌、瘤胃球菌↑→保护肝脏
灵芝→瘤胃球菌、普雷沃氏菌、颤杆菌克属↑→改善脂肪代谢、抑制炎症
对沙棘、葛根、黄芪及其相关加工产品的药食同源物种的研究表明,它们通过肠道菌群在预防和减轻ALD方面发挥越来越多作用。
非酒精性脂肪性肝病
非酒精性脂肪性肝病(NAFLD)肝脏中脂肪积累过多,这与胰岛素抵抗和氧化应激有关,可能导致肝细胞损伤和炎症。虽然NAFLD的肝脏变化与酒精性肝病(ALD)相似,但NAFLD患者并不饮酒过量。目前,除了运动和饮食调整外,还没有特定的药物被批准用于治疗NAFLD。
黄芪多糖→厚壁菌门/拟杆菌门比例↓→抗炎
决明子中的蒽醌+益生菌 DM9054 和 86066→预防 NAFLD
其他药食同源的物质,如砂仁、茯苓、山楂、葛根,也显示出通过调节肠道菌群来预防和治疗NAFLD的潜力,可能通过激活相关的信号通路来发挥作用。
其他肝病
其他肝病还包括其他亚型,比如肝纤维化和肝硬化,它们可能由炎症或外界因素引起。
覆盆子→双歧杆菌、Turicibacter↑→肝功能改善
马齿苋→阿克曼氏菌和粪杆菌↑→减轻肝肾损伤
这些草药通过调节肠道菌群,显示出在肝病治疗中的潜力。
doi: 10.1016/j.jare.2023.05.011
■ 神经和精神疾病
阿尔茨海默病(AD)
阿尔茨海默病(AD)的大脑中淀粉样斑块和神经纤维缠结的形成,会导致大脑损伤和认知能力下降,目前还没有治愈的方法。近年来,研究表明肠道菌群,也就是我们体内的“第二大脑”,可能通过肠-脑轴影响阿尔茨海默病的发展。
茯苓→乳酸杆菌↑产内毒素菌↓→产GABA
黄芪→Roseburia、Lactobacillus↑→延缓淀粉样蛋白的沉积
天麻→约翰逊乳杆菌、鼠乳杆菌、罗伊氏乳杆菌↑→改善认知障碍
西洋参和黄芪→异杆菌属、嗜粘蛋白阿克曼氏菌、乳酸杆菌↑→有助于治疗AD
茯苓在阿尔茨海默治疗中作用
doi: 10.1016/j.jare.2023.05.011
抑郁症
抑郁症是一种常见的精神障碍,影响很多人的生活。科学家认为,大脑中某些化学物质,比如GABA、去甲肾上腺素(NE)和血清素(5-HT)水平降低,可能会导致抑郁症。还有一种叫做脑源性神经营养因子(BDNF)的物质,它在调节抑郁症状中也很重要。
豆豉→瘤胃球菌↑ 拟杆菌↓→抗抑郁
肉苁蓉→瘤胃球菌↓ 拟杆菌↑→缓解抑郁症
茯苓→普雷沃氏菌、异杆菌、苍白杆菌↓→抗抑郁
焦虑症
焦虑症是一种常见的精神障碍,主要症状是过度紧张、担忧、失眠等,严重影响患者生活质量。
茯苓→Blautia↓瘤胃球菌、普雷沃氏菌↑→抗焦虑
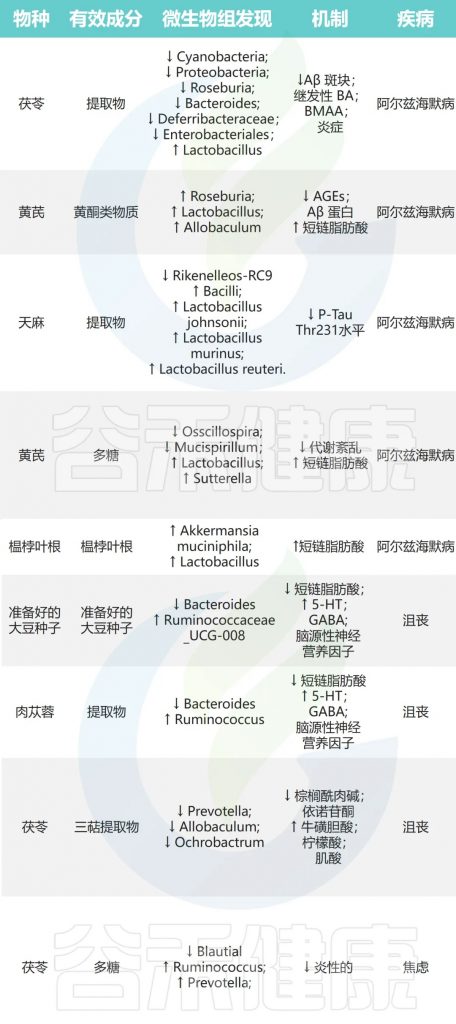
doi: 10.1016/j.jare.2023.05.011
■ 心血管疾病
动脉粥样硬化(AS)
动脉粥样硬化(AS)是一种心血管疾病,可能因为血脂异常等问题引起,是全球主要的死亡原因之一。研究发现,一些天然物质可以通过调节肠道菌群来帮助缓解动脉粥样硬化。
人参皂苷→Muribaculaceae、乳杆菌、双歧杆菌↑
氧化三甲胺 (TMAO) 可以预测动脉粥样硬化早期阶段,它与胆固醇代谢和氧化应激有关。
银杏内酯B→拟杆菌↑、幽门螺杆菌↓→TMAO↓
草果→异杆菌、脱硫弧菌↓ Ruminococcus_2↑→降低胆固醇
灵芝→普氏菌、产短链脂肪酸菌↑→改善血脂异常
这些研究表明,通过调节肠道菌群,天然物质可能在预防和治疗动脉粥样硬化方面发挥作用。
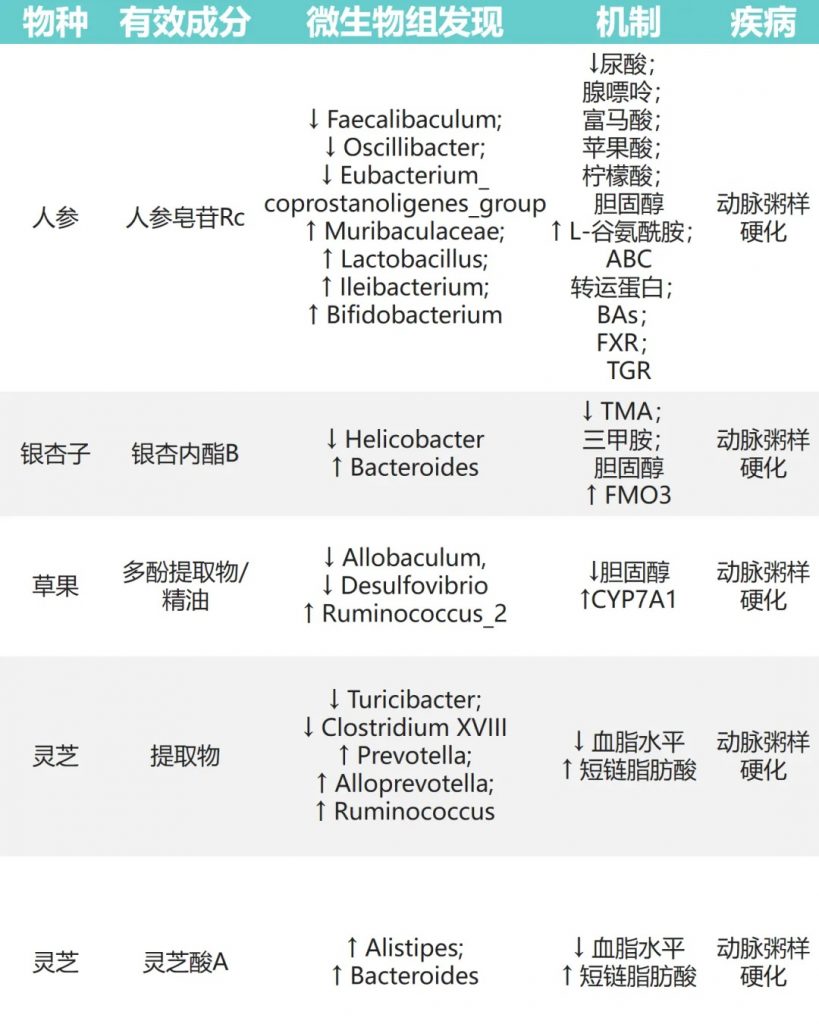
doi: 10.1016/j.jare.2023.05.011
■ 内分泌疾病
糖 尿 病
糖尿病是一种代谢紊乱,高血糖是由于胰岛素分泌不足和/或作用不足造成的。根据国际糖尿病联合会2021年的数据,全球有 5.37 亿人患有糖尿病。研究表明,肠道菌群在控制宿主的生理和代谢方面至关重要,其失调与糖尿病的进展有关。
枸杞→瘤胃球菌科、Intestinimonas↑→GLP-1、PYY↑→促进胰岛素的分泌
罗汉果→Elasimicrobium↑、脱硫弧菌、大肠埃氏菌属-志贺氏菌属↓
桑叶→ Romboutsia、Oscillatoriales cyanobacterium↓ Alloprevotella、副拟杆菌、Muribaculaceae↑→缓解糖尿病
马齿苋→ 支链氨基酸↓→ 减缓糖尿病
肥 胖
肥胖已成为全球严重的健康问题,药食同源物种通过调节肠道菌群和相关信号发挥其抗肥胖活性。
这些研究表明,通过调节肠道菌群,药食同源物种可能成为管理肥胖的有效策略。

doi: 10.1016/j.jare.2023.05.011
■ 其他疾病
慢性非细菌性前列腺炎 <茯苓多糖>
茯苓多糖(PPs)可以通过调节肠道菌群来缓解慢性非细菌性前列腺炎。茯苓多糖显著增加副拟杆菌属、梭杆菌属、Parasutterella等有益菌,同时改变结肠上皮中关键基因表达,调节激素水平,抑制前列腺炎症。
恶性黑色素瘤 <黄芪多糖>
黄芪多糖(AP)能够通过调节肠道菌群来降低髓系抑制细胞(MDSC)的数量和相关分子的表达,增加CD8 T细胞的数量,削弱MDSC抑制CD8 T细胞杀死肿瘤细胞的能力。黄芪多糖干预下,与假长双歧杆菌呈负相关、与约氏乳杆菌呈正相关的L-谷氨酸和肌酸显著上调,揭示了黄芪多糖抑制肿瘤生长的治疗能力。
乳腺癌 <茯苓>
茯苓能够通过增加有益细菌如乳酸杆菌和双歧杆菌,减少有害细菌如硫酸盐还原菌脱硫弧菌和Mucispirillum等,来改善乳腺癌小鼠的菌群失调。
骨质疏松症 <杜仲叶提取物>
杜仲叶提取物补充剂能够促进保加利亚乳杆菌的生长,增加粪便和血清中的短链脂肪酸浓度,表现出抗骨质疏松症活性。
慢性肾脏疾病 <茯苓补充剂>
茯苓补充剂可以通过调节肠道菌群及其代谢产物来延缓慢性肾脏疾病的发展。
药食同源领域的研究正处于快速发展阶段,它融合了传统智慧与现代科学,为我们提供了一个全面的健康新视角。随着研究的深入,我们对药食同源物质的安全性、独立性效益以及它们如何影响肠道菌群有了更深入的理解。
药食同源物质的安全性是其研究的首要关注点。历史上,许多药食同源物质已被人类长期安全食用。这块还可以探索这些物质在不同剂量、不同人群中的使用效果,以及可能的长期影响。
如何通过科学的方法来证明药食同源物质的疗效和安全性?
它涉及到的是研究设计、实验方法、数据分析等,目的是建立药食同源物质功效的科学证据基础。这通常包括以下几个方面:
文献回顾:查找和分析现有的研究,了解药食同源物质的历史和当前的知识状态。
实验室研究:在细胞和动物模型中测试药食同源物质的生物活性。
临床试验:通过随机对照试验等方法,在人体中测试药食同源物质的效果。
横断面研究:在某一时间点对大量人群进行调查,了解药食同源物质的使用情况及其与健康状况的关联。
系统评价和荟萃分析:综合多项研究的结果,以评估药食同源物质的整体效果。
长期跟踪和安全性评估:对药食同源物质进行长期跟踪,评估其长期使用的效果和潜在的副作用。通过毒理学研究和临床监测,确保药食同源物质的安全性。
法规和标准化:遵循相关法规和指南,同时应确保药食同源物质的质量,包括纯度、稳定性和成分标准化。
利用微生物组数据进行疾病筛查和个性化预防
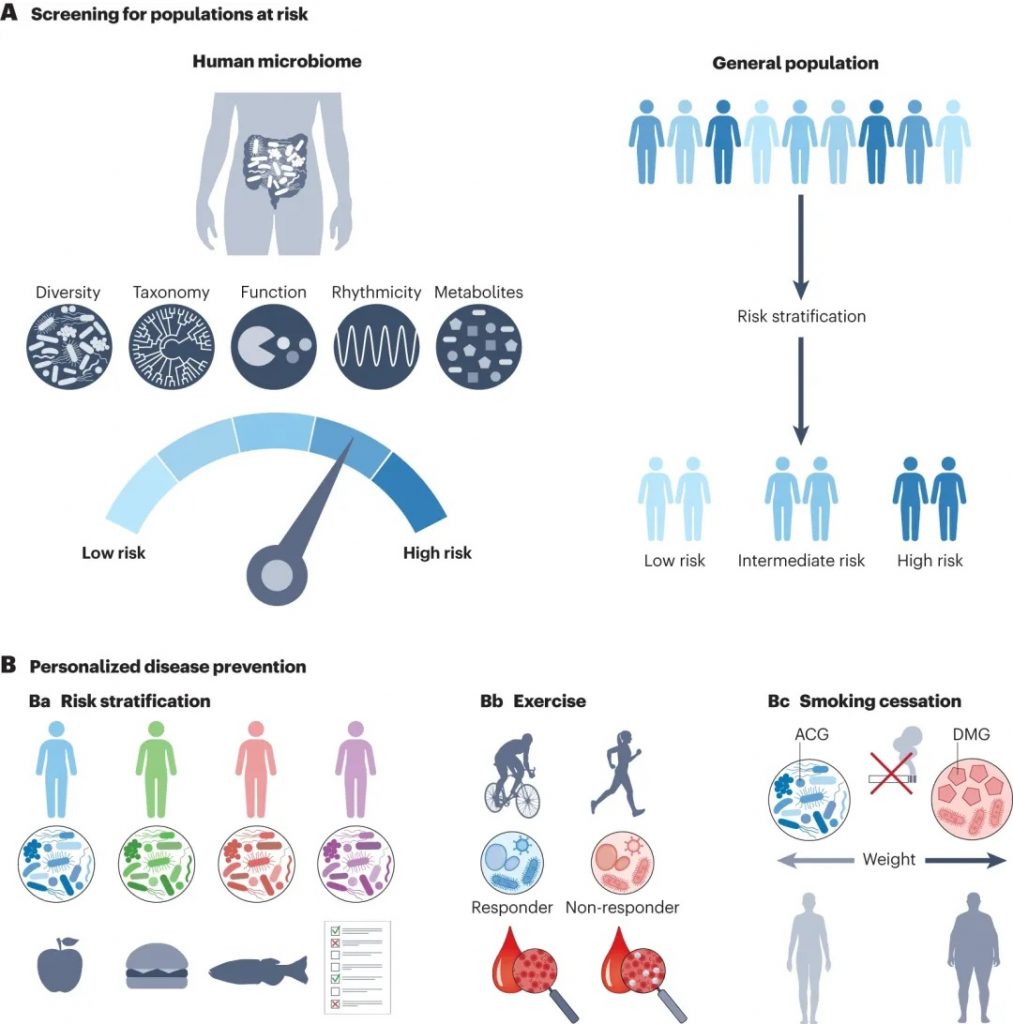
doi.org/10.1038/s41579-023-00998-9
目前常用的监测手段包括生理指标监测(心率、血压、血糖等)、生物标志物检测(血液、尿液等)、肠道菌群检测、自我报告和问卷调查等。
症状记录:记录使用药食同源物质前后的症状变化,如疲劳感、消化问题、睡眠模式等。
免疫功能检测:例如,灵芝多糖可以通过增加NK细胞活性和T细胞增殖来增强宿主的抗肿瘤免疫反应。可以检测外周血中NK细胞活性和T细胞亚群比例来评估灵芝多糖的效用。
肠道通透性检测:例如,枸杞多糖可以通过上调紧密连接蛋白(如Occludin和ZO-1)的表达来增强肠道屏障功能。可以通过检测血清中细菌内毒素(LPS)的水平来间接评估肠道通透性,从而评估枸杞多糖的效用。谷禾肠道菌群检测报告中也有相关详细的菌群代谢产物水平提示。
肠道菌群检测:可以用来评估特定药食同源物质(如中药材、功能性食品)对肠道菌群组成的影响。通过比较干预前后的菌群变化,可以了解这些物质如何改变肠道微生物的多样性、丰度等,这有助于监测治疗效果和疾病进展。同时,结合大数据分析与生物信息学技术,能够识别出一些特定菌群的变化,疾病风险评估,根据肠道菌群评估营养状况,找到一些个性化的健康管理方案。
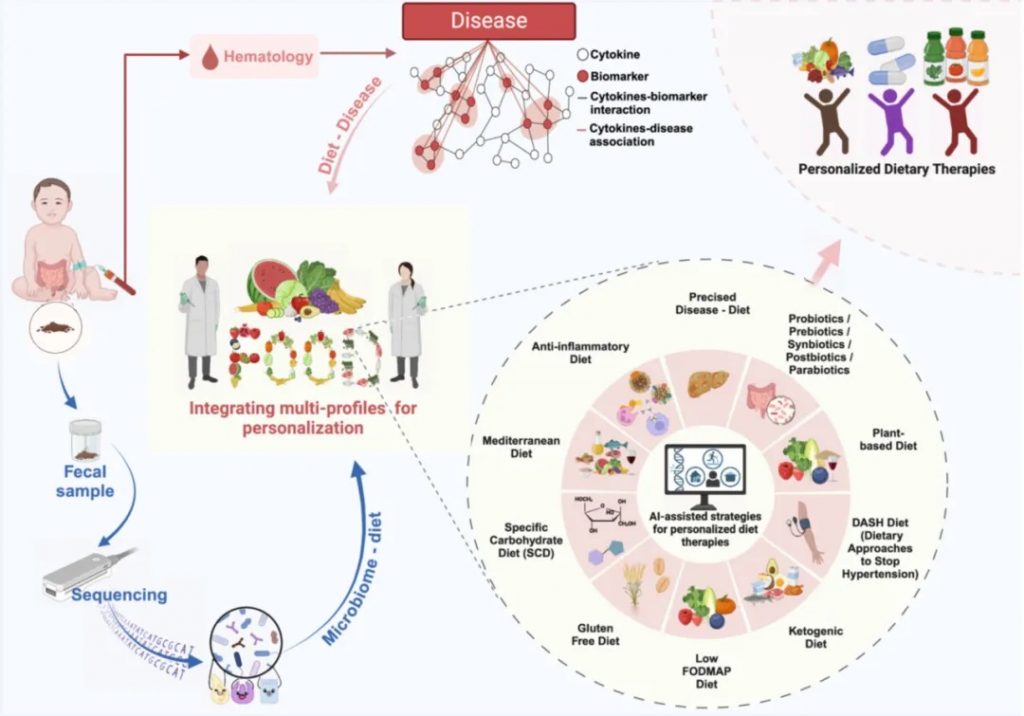
doi.org/10.1002/imt2.230
提高生物利用度
例如,基于纳米技术的人参皂苷Rb1递送系统,可以显著提高其在肠道中的稳定性和吸收率。这种新型递送系统不仅可以提高药食同源物质的效果,还可能降低所需剂量,减少潜在的副作用。
新的药食同源物开发
利用大数据分析技术,可以从大量的药食同源物质中筛选出具有潜在药用价值的候选物质。通过分析这些物质的化学成分、生物活性和用途,结合肠道菌群检测技术和药食同源的研究,为药食同源物质的深入研究提供科学依据,推动理论创新和技术进步,发现新的生物活性物质和药物靶点,同时可以推动新药食同源物质和/或功能性食品的开发。
药食同源物质与现代药物的协作
药食同源物质与现代药物协同作用的研究,例如,灵芝多糖可以增强某些化疗药物的抗肿瘤效果,同时减轻其副作用。这种协同作用的研究不仅可以提高现有治疗方案的效果,还可能为开发新的联合治疗策略提供依据。
污染问题监测的新型解决方案
药食同源产品的生产和加工过程中可能会遇到食品安全和污染的问题,如农药残留、重金属污染等。确保产品的安全性是药食同源产品开发的重要挑战。
肠道菌群检测可以作为评估和解决这一问题的有效工具。
每个人的基因、代谢类型、生活方式、健康状况都不同,对营养的需求也各异。随着科技的发展,药食同源可以与肠道菌群检测、人工智能、大数据分析、基因编辑等前沿科技相结合,为实现精准、高效、可持续的个性化营养提供更多创新的可能。比如,根据个人的肠道菌群特点选择合适的药食同源物质,满足个性化的营养需求,从而提高营养干预的有效性和依从性。
药食同源的研究涉及营养学、医学、微生物学、遗传学等多个学科,推动了跨学科研究的发展。这种跨学科合作有助于深入理解食物、营养和健康之间的复杂关系,有助于制定促进全民健康的膳食指南。
主要参考文献
Xia X, Xiao J. Natural Ingredients from Medicine Food Homology as Chemopreventive Reagents against Type 2 Diabetes Mellitus by Modulating Gut Microbiota Homoeostasis. Molecules. 2021 Nov 17;26(22):6934.
Yang, Minmin, et al. “Advances in understanding of health‐promoting benefits of medicine and food homology using analysis of gut microbiota and metabolomics.” Food frontiers 1.4 (2020): 398-419.
Zhong, Huan, et al. “The evolution and significance of medicine and food homology.” Acupuncture and Herbal Medicine 4.1 (2024): 19-35.
Zuo WF, Pang Q, Yao LP, Zhang Y, Peng C, Huang W, Han B. Gut microbiota: A magical multifunctional target regulated by medicine food homology species. J Adv Res. 2023 Oct;52:151-170.
Neu, J. The evolution of personalized nutrition. Nat Med 30, 1826–1827 (2024).
Sun-Waterhouse, et al. “Transformation from traditional medicine-food homology to modern food-medicine homology.” Food & Medicine Homology 1.1 (2024).
Doris Vandeputte, Personalized Nutrition Through The Gut Microbiota: Current Insights And Future Perspectives, Nutrition Reviews, Volume 78, Issue Supplement_3, December 2020, Pages 66–74
Chen, Jiali, et al. “Dietary therapies interlinking with gut microbes toward human health: Past, present, and future.” iMeta: e230.
Singar S, Nagpal R, Arjmandi BH, Akhavan NS. Personalized Nutrition: Tailoring Dietary Recommendations through Genetic Insights. Nutrients. 2024 Aug 13;16(16):2673.
Guess, N. Big data and personalized nutrition: the key evidence gaps. Nat Metab 6, 1420–1422 (2024).
Simon, Marie‐Christine, et al. “Gut microbiome analysis for personalized nutrition: the state of science.” Molecular Nutrition & Food Research 67.1 (2023): 2200476.

谷禾健康

随着大家陆续“阳康”,大家逐渐恢复以往的生活,城市的烟火气回来了。
然而阳康后真的万事大吉了吗?
还是有很多朋友处于这样的状态:感觉恢复了,又好像没有完全恢复,身体多少有点不适,开始关心:
这种新冠肺炎后遗症,也就是临床上常说的“长新冠”,已经成为部分人不得不面临的事实。
“长新冠”是一种多系统疾病,据估计,全球至少有 6500 万人患有长新冠,病例每天都在增加。由于许多未记录在案,这个数字实际可能要高得多。
“长新冠”与所有年龄段和急性期疾病严重程度相关,许多患者在多个器官系统中经历了数十种疾病,包括心血管、血栓、脑血管疾病、2型糖尿病、自主神经功能障碍等。基于对其超过 2 年的研究,如果不采取行动任其发展,很大一部分患有长新冠的人可能会有严重后果。
新出现的临床前和临床研究表明,肠道微生物群可能有助于理解 COVID-19 的发病机制和疾病结果;SARS-CoV-2 感染与肠道微生物群的改变有关,并与炎症和免疫反应相关。
本文基于多篇文献报道,主要介绍关于“二次感染”以及“长新冠”问题的最新研究进展,同时也着重介绍了多种与新冠恢复期调理相关的干预措施。
本文由于篇幅较长,主要分为上、中、下三大篇章,主要包括以下内容:
上篇: 关于“二次感染”
中篇: 关于“长新冠”
下篇: 关于“干预措施”
上 篇
关于 “二次感染”
已经阳康的朋友,可能关心会不会马上又来一波,出现“二次感染”?
我们先了解一下,二次感染指的是什么?
“二次感染” 也叫“再感染”或者“重复感染”,是指一个人感染了新冠之后,经过足够的时间,然后再次感染。一般而言,如果一个人在第一次阳性检测后 90 天或更长时间再次检测呈阳性,则被视为二次感染。
注:也有部分研究定义间隔>30天。
再感染后可能出现临床症状,患者因核酸载量高而具有传染性。
与没感染过的人群相比,已经感染过的人群再感染风险低87%
先看一组数据:
➪
一项Meta分析综合了先前感染SARS-CoV-2人群再感染风险的全球证据:先前感染SARS-CoV-2的人可能会再次感染,他们的感染风险比之前没有感染的人低。
SARS-CoV-2再感染发病率为:
0.7 / 10,000人日(标准差0.33).
以前感染过的人比从未感染过的人再次感染的可能性低87%(HR = 0.12)。

注:该研究荟萃分析和系统审查分别包括11项研究和11份病例报告(样本量都不小于100)。
看到这里是不是觉得可以放心了,再次感染的概率很低?
并不一定。需要注意的是,该研究虽在近期发表,但研究的数据是基于出现在2021年4月及之前的毒株,当时奥密克戎变种尚未出现。
研究表明,奥密克戎变异株的免疫逃逸,导致比其他变异株具有更高的传播。那么,有没有关于奥密克戎毒株的数据?
有。
与感染过德尔塔毒株的人群相比,在奥密克戎阶段,再感染风险显著高于德尔塔时期
➪
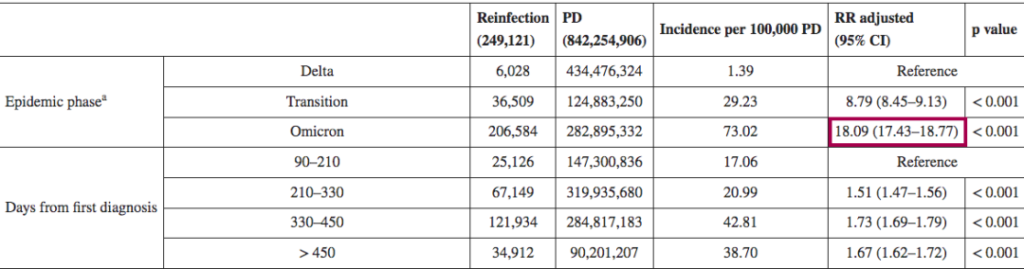
一项回顾性观察性研究,分析来自意大利北部利古里亚地区的感染者,在研究期间(2021年9月至2022年5月),利古里亚记录了335117例SARS-CoV-2感染病例,其中15715例再次感染。在奥密克戎阶段(从2022年1月3日开始占主导地位),再感染的风险是德尔塔阶段的4.89倍(p<0.001)。
其他也有来自意大利的研究(2021年8月至2022年3月)认为,奥密克戎时期的再感染风险比德尔塔时期高18倍。
DOI: 10.2807/1560-7917.ES.2022.27.20.2200372
➪
英国爱丁堡大学的研究人员发现,奥密克戎变异株的可能再感染率约为德尔塔变异株的10倍。
➪
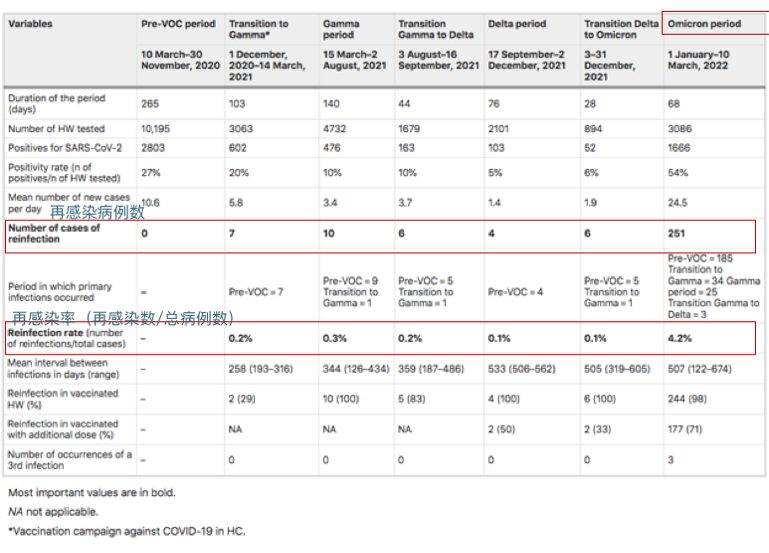
来自圣保罗大学医院281名医护人员的再感染率(2020年3月10日至2022年3月10日):
奥密克戎时期再感染率显著增加(0.8%到4.3%;相对风险5.45 [95%IC 3.80–7.81];p < 0.001)
Guedes AR, et al., Sci Rep. 2023
关于奥密克戎再感染率上升的证据相当多,此处就不一一列举了。既往感染虽然可以在一定程度上防止新冠的再次感染,但对于奥密克戎来说,之前的抗体保护作用较弱,并且在一定期限后迅速减弱,接下来我们来看一下,既往感染的保护期限大概能维持多久。
队列研究证实,既往感染对奥密克戎变异株(BA.1、BA.2、BA.4 和 BA.5)再感染的保护作用低于对德尔塔和较旧变异株再感染的保护作用。
➪
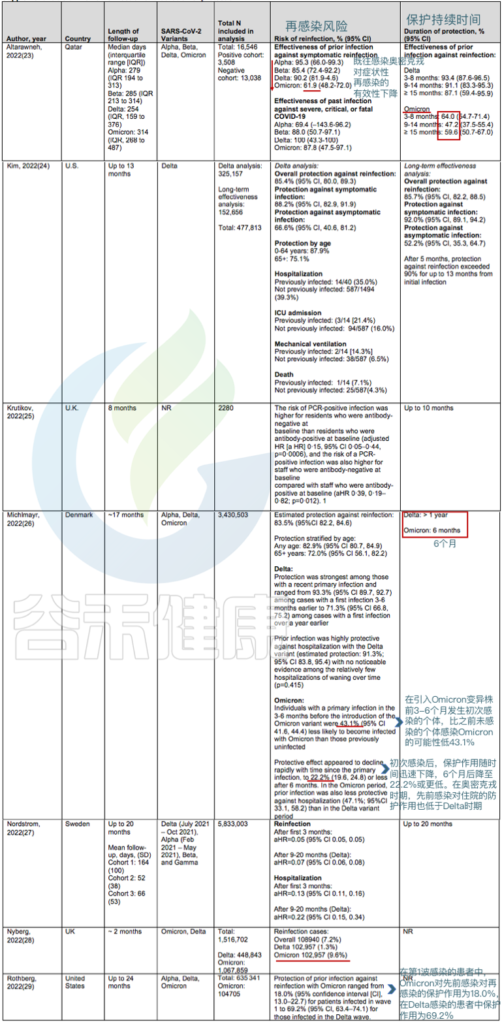
50项研究共纳入118名再感染患者,从首次感染到再感染的最短时间为19日,最长为293日。
● 针对奥密克戎BA.1和BA.2毒株:
先前感染德尔塔变异株可将症状性感染的风险降低50%至67%.
➪
在丹麦的一项队列研究中,如果先前感染发生在3至6个月前,则对奥密克戎BA.1或BA.2的保护率为43.1%,如果先前感染至少发生在6个月前,则为22.2%.
● 针对奥密克戎BA.4和BA.5毒株:
BA.4 和 BA.5 这两个变体与 BA.2 的相似性高于 BA.1 菌株,携带着它们自己独特的突变,包括病毒刺突蛋白中 L452R 和 F486V 的变化,这些变化可能会调整其锁定宿主细胞并避开某些免疫反应的能力。
对卡塔尔人群的分析提供了关于奥密克戎BA.4和BA.5防护的详细信息:
在未接种疫苗的人群中,既往感染奥密克戎BA.1或BA.2可使任何感染奥密克戎BA.4或BA.5的风险降低至少68.7%(CI,64.0%至72.9%),而如果先前感染发生在奥密克戎变异株出现之前,则仅为27.7%(CI,19.3%至35.2%).
针对BA.4或BA.5免受BA.1或BA.2感染的保护作用在4个月内是强大的,但这种保护可能会迅速减弱。
关于再感染的风险和保护期限的研究
doi:10.7326/M22-1745
高龄和抑郁状态是奥密克戎再感染的危险因素
一项前瞻性队列研究,纳入了 933 名被诊断为 Omicron BA.2.2 感染且治疗后检测呈阴性的成年患者。
最终,683例符合标准,进行研究分析。
注:数据来源以及筛选标准:
患者来自四川省临水县,数据由四川省疾病预防控制中心提供。如果患者符合以下任何标准,则被排除在外:
感染前诊断为精神疾病,伴随需要住院治疗的严重疾病,以及交流障碍或拒绝参与。
在683名奥密克戎感染患者中,出院后30天内有116例再阳性,总体再阳性率为16.4%.
预测再阳性风险变量的单变量逻辑回归
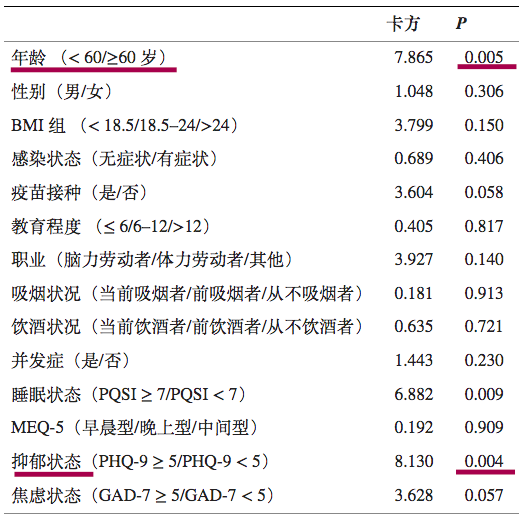
DOI:10.3389/fpubh.2022.1014470
注:PHQ-9,患者健康问卷九。PHQ-9量表的总分范围为0至27分,其中0至5分表示没有抑郁,得分>5表示抑郁状态;评分越高,抑郁症状越严重。
比较分析显示:
慢性肾功能衰竭、心血管疾病、支气管肺病、神经病变和自身免疫性等疾病患者再感染的风险相对增加
来自意大利北部地区的数据显示:
女性个体的再感染风险比男性高17%(OR为1.17,95%CI为1.13-1.21,p <0.0001)
在再感染者中,60岁及以上患至少一种潜在慢性病人群的风险比其他年龄组高7倍。
在慢性心血管疾病中,心力衰竭和脑血管病变与再感染风险的相关性最高,风险为1.24(95%CI为1.04-1.47,p = 0.0184)和1.49(95%CI为1.29-1.71,p <0.0001)是 未再感染个体的1.24倍(95%CI为1.29-1.71,p 0.0001).
在慢性肾衰竭患者中,接受透析的患者再感染风险几乎高出 3 倍(OR 为 2.77,95% CI 为 1.76–4.38,p < 0.0001).
与未再感染者相比,哮喘和呼吸衰竭/氧疗患者的再感染风险分别增加 1.17 倍(95% CI 为 1.05 –1.33,p = 0.0070)和 1.67 倍(95% CI 为 1.23–2.25,p = 0.0009).
在神经病变患者中,癫痫患者、帕金森病和阿尔茨海默病的再感染风险几乎是未再感染个体的两倍。
痴呆患者的风险大约高出四倍(OR为3.71,95%CI为3.04-4.52,p <0.0001).
在患有自身免疫性疾病的个体中,桥本甲状腺炎是再感染个体中最相关的疾病(OR为1.19,95%CI为1.00-1.44,p = 0.0479)
2021年9月至2022年5月期间与SARS-CoV-2再次感染患者有关的主要合并症的详细信息:
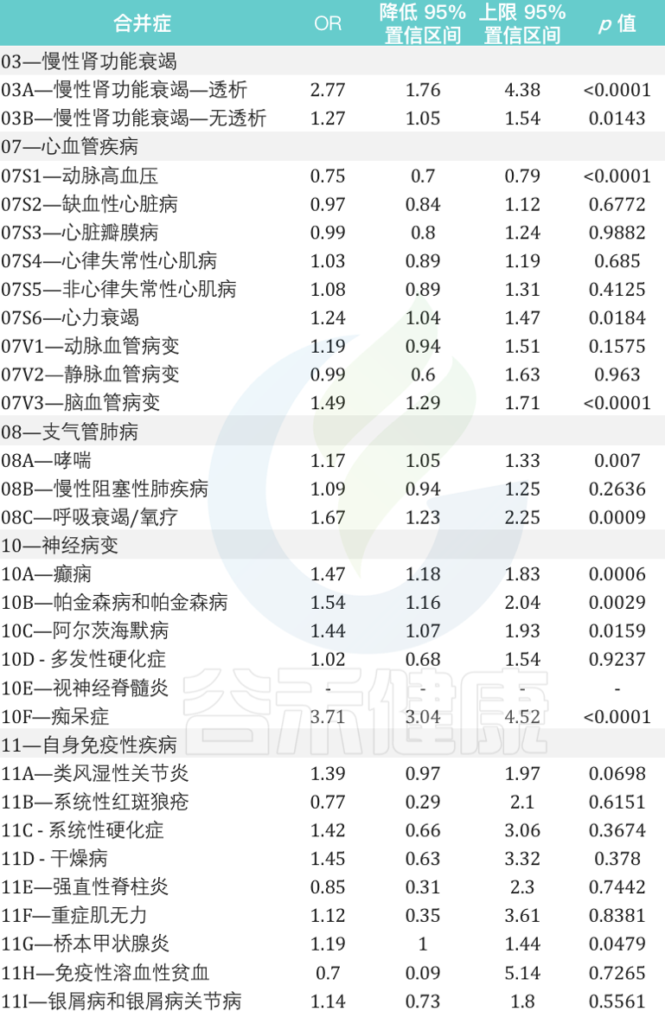
doi: 10.3390/vaccines10111885
此外,2022年发表的一篇系统评价报告了2019年12月1日至2021年9月1日的数据,发现高血压和肥胖是再感染患者中最常见的,其次是终末期肾衰竭、哮喘、慢性阻塞性肺病、痴呆、血脂异常和2型糖尿病。
其他研究也报道,终末期肾衰竭、高血压、糖尿病、慢性呼吸系统疾病、肝病和心血管疾病病史患者的再感染风险更高。
二次感染依然有症状
大多数再感染患者表现出临床症状,只有少数研究报告患者在第一次和继发感染时均无症状。
其他包括50项研究的数据显示再感染患者特征:


注:以上数据是2019年12月1日至2021年9月1日期间的研究
➪
二次感染相对首次感染严重程度有所减轻
韩国疾病控制和预防局于2020年1月20日至2022年5月7日在流行病学调查中通过综合系统报告的新冠肺炎病例数据库与健康保险审查和评估服务系统合并。使用具有二项分布的广义线性模型估计二次感染发作时与一次感染时的严重性比值比(SOR)。
结果发现,在所有患者中,再次感染的SOR为0.89(95%置信区间[CI]:0.82–0.95),与首次感染发作相比,严重程度有所减轻。
➪
一项研究显示,截至 2022 年 11 月 9 日,估计 94%(95% CrI,79%-99%)的美国人口至少感染过一次 SARS-CoV-2。
2022年11月针对SARS-CoV-2感染和重症的有效保护大大高于2021年12月
结果发现,2022年11月9日,在美国,对奥密克戎变异株SARS-CoV-2感染的保护估计为63%(51%-75%),对重症的保护率为89%(83%-92%).
11 月的人口免疫力高于最初奥密克戎激增后立即出现的情况。
对二次感染后的重症情况,不同研究结果不一致。
➪
发表在《Nature Medicine》的一项研究建立了一个包括5819264人的队列,其中SARS-CoV-2感染者(n = 443588)、再感染(两次或多次感染,n = 40947)和非感染对照(n = 5334729). 使用逆概率加权生存模型来估计死亡、住院和事件后遗症的风险和6个月的负担。
结果发现,与无再感染相比,再感染增加了死亡风险(危险比(HR) = 2.17,95%置信区间(CI)1.93–2.45),住院风险(HR = 3.32,95%可信区间3.13-3.51)和后遗症风险,包括肺部、心血管、血液学、糖尿病、胃肠道、肾脏、精神健康、肌肉骨骼和神经系统疾病。无论疫苗接种状况如何,风险都很明显。
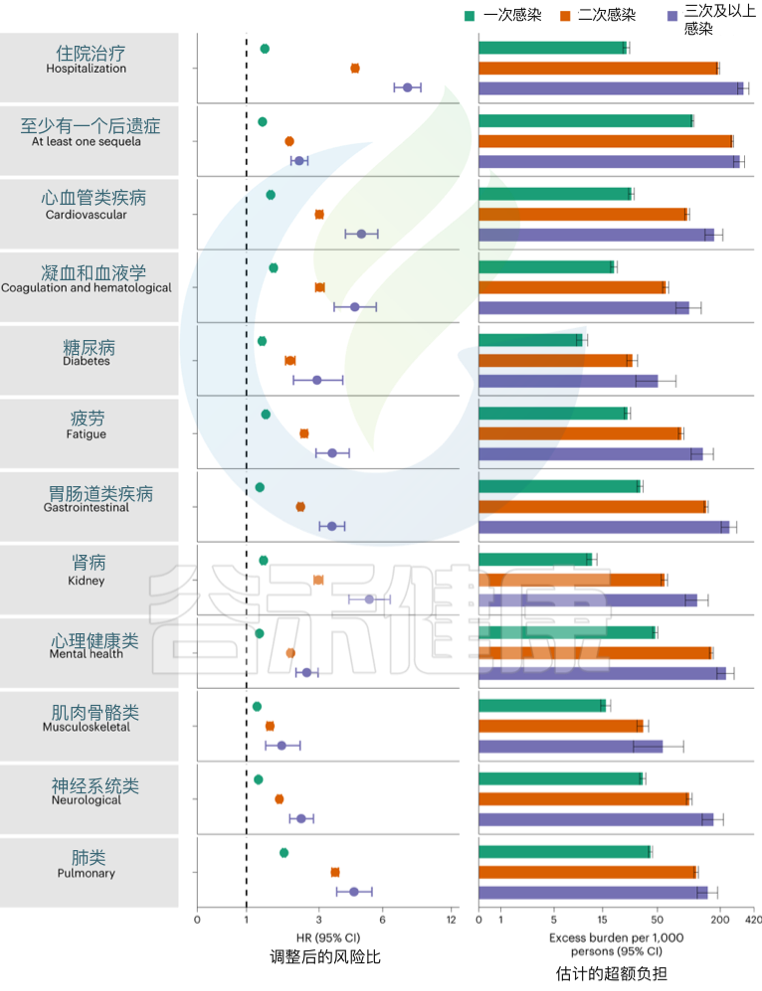
Bowe B, et al., Nat Med. 2022
风险在急性期最为明显,但在6个月后持续存在。与未感染的对照组相比,反复感染的累积风险和负担随着感染次数的增加而增加。
注:该研究数据主要来自美国退伍军人事务部国家医疗保健数据库,选取时间在2020年3月1日至2022年4月6日期间。退伍军人事务部的人口大多由老年人和男性组成,该队列也包括 10.3% 的女性,12% 在 38.8 岁以下(2021 年美国人口的中位年龄)。
关于未来:
英国牛津大学研究病毒进化的科学家认为,奥密克戎及其分支继续占据主导地位的时间越长,慢性感染产生全新变种的可能性就越小。
流行病学研究表明,连续的 COVID-19 浪潮正在变得温和。但这种趋势不应该被视为理所当然。
随着全球对反复接种疫苗和感染后免疫力的增强,研究人员预计 SARS-CoV-2 浪潮的频率将会放缓。
也有研究人员认为,SARS-CoV-2 的一个可能未来是,随季节起伏,通常在冬季达到顶峰,通常每三年左右重新感染一次。
关于其带来的症状是否会越来越轻等问题,研究人员还将持续关注。
总的来说,COVID-19疫情是一个高度动态的全球事件,各种流行病学驱动因素随着时间的推移而变化(包括新变异株的出现、疫苗吸收的增加和免疫力的减弱等各种因素),再感染的流行病学及其健康后果也可能随着时间的推移而改变。
对于已经感染过一次的人来说,继续保持警惕,降低再感染的风险,对于整体健康来说可能很重要。
以上是针对阳康后担心自己是否会二次感染的朋友的问题,然而也有一些朋友到现在,仍然觉得身体没有完全恢复,那就要考虑新冠可能带来的后遗症,也就是临床上说的“长新冠”,接下来章节,我们来了解一下关于“长新冠”及其持续时间,什么人群容易发生,会影响哪些器官功能,具体形成机制,与肠道菌群的关联等。
中 篇
关于“长新冠”
▾◆▽◆▽◆▾
►
“长新冠”是如何定义的?
2021年10月,世界卫生组织将其定义为:
有疑似或确诊新冠感染史,通常发生于起病三个月后,症状通常至少持续两个月,且不能被其他诊断所解释的症状。
►
“长新冠”会有哪些表现?
常见症状包括:
也包括其他一些症状,通常或多或少会影响日常生活。
症状可能是:
从新冠急性发作初步恢复后新出现的症状;
也可能从最初的疾病中持续存在;
也可能随着时间的推移而波动或复发。
►
“长新冠”什么时候发生发展?持续多长时间?
症状的发作和时间过程因个体和症状类型而异。
神经系统症状通常延迟发作数周至数月:在有认知症状的参与者中,43%的人报告在COVID-19至少1个月后才出现认知症状,延迟发作与年龄较轻有关。一些神经认知症状会随着时间的推移而恶化,并且往往会持续更长时间。而胃肠道和呼吸道症状更容易解决。
关节、骨骼、耳朵、脖子和背部的疼痛在1年时比2个月时更常见,感觉异常、脱发、视力模糊以及腿、手和脚肿胀也是如此。
麻痹症在初次感染后平均3个月发病;与其他神经认知症状不同,它通常会随着时间的推移而减少。
很少有长新冠患者能够完全康复,一项研究发现,在最初感染2个月后出现症状的患者中,85%在症状出现1年后出现症状。尽管ME/CFS和自主神经障碍的诊断通常是终身的,但未来的预后仍不确定。
►
有多少人会患“长新冠”?
据保守估计,全世界至少有 6500万 人患有长新冠,病例每天都在增加。
注:有许多未登记病例,这个数字实际上可能要高的多。
据估计,非住院病例的发病率为10-30%,住院病例为50-70%,接种疫苗病例为10-12%。
长冠肺炎与所有年龄段和急性期疾病严重程度相关,36岁至50岁之间的确诊率最高,大多数长冠肺炎病例发生在患有轻度急性疾病的非住院患者中,因为该人群占新冠肺炎总病例的大多数。
►
哪些人群更有可能患“长新冠”?
风险因素可能包括:
注:三分之一的长期 COVID 患者没有确定的原有疾病。
COVID-19 可能对任何患者产生长期影响,包括无症状或轻症患者。相比儿童和青少年,“长新冠”看起来在成人中更为常见。
►
“长新冠”的发病机制?
简单来说,潜在机制包括:
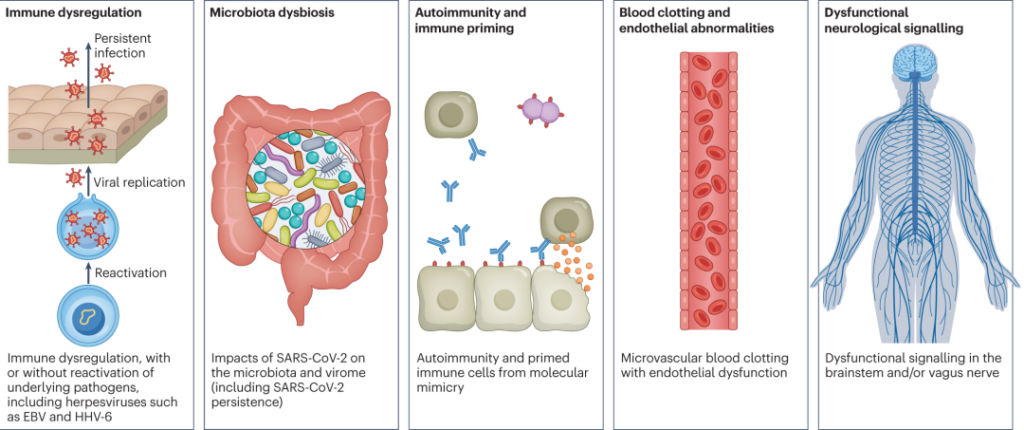
DOI: 10.1038/s41579-022-00846-2
以上是关于“长新冠”的一些基本科普,具体关于“长新冠”带来的多种不良后果,需要关注的疾病,形成机制,与菌群的关联等,我们将在接下来的小节详细介绍。
▾◆▽◆▽◆▾
长新冠包括多种不良后果,常见的新发疾病包括:心血管、血栓和脑血管疾病, 2型糖尿病、肌痛性脑脊髓炎/慢性疲劳综合征(ME/CFS)和自主神经功能障碍,体位性心动过速综合征 (POTS).
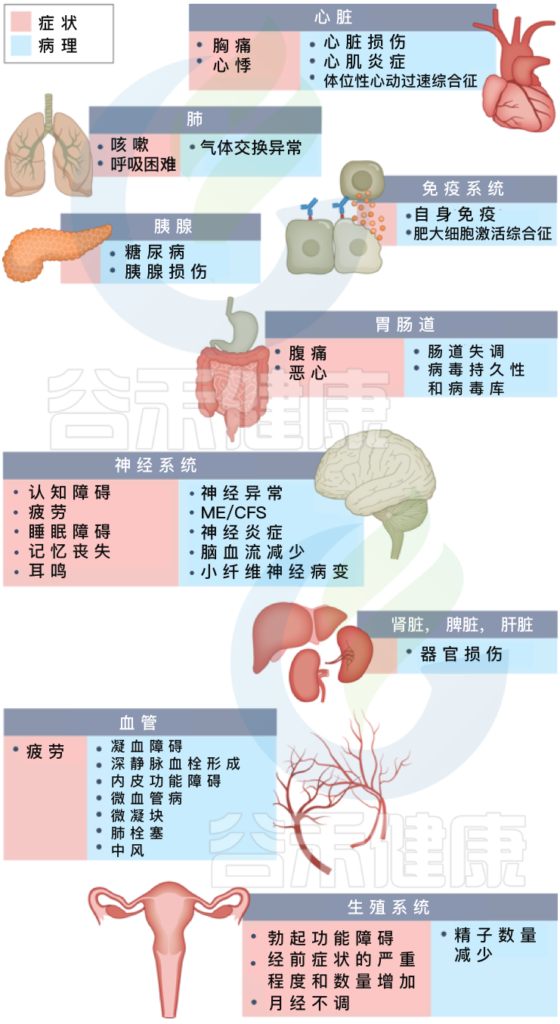
长新冠症状及其对多种不同病理器官的影响
Davis HE, et al., Nat Rev Microbiol. 2023
★
血管问题和器官损伤
SARS-CoV-2会损害许多器官系统。在不同组织中已经证明的损伤主要归因于免疫介导的反应和炎症,而不是病毒对细胞的直接感染。
循环系统破坏包括内皮功能障碍和随后的下游影响,以及深静脉血栓形成、肺栓塞和出血事件的风险增加。
微凝块-> 促进血栓形成
在急性新冠肺炎和长冠肺炎中检测到的微凝块有助于血栓形成,在长新冠中也发现了血细胞大小和硬度的长期变化,有可能影响氧气输送。感染18个月后,长新冠患者的血管密度长期降低,特别影响小毛细血管。
心血管疾病风险增加
对美国退伍军人事务部数据库的分析显示,SARS-CoV-2感染1年后超过150000人患多种心血管疾病的风险显著增加,包括心力衰竭、心律失常和中风,与最初出现新冠肺炎的严重程度无关。
持久的心脏异常
心脏MRI研究显示,在100名既往有新冠肺炎发作史的患者中,78%的患者(感染后平均71天进行调查)和58%的长期冠状病毒感染者(感染后12个月进行研究)存在心脏损害,这增强了心脏异常的持久性。
新冠与多器官损害有关
除了心脏之外,新冠还与其他多种器官受损相关。
一项针对低风险个体的前瞻性研究,观察了心脏、肺、肝脏、肾脏、胰腺和脾脏,发现201名患者中70%至少有一个器官受损,29%有多个器官受损。
在同一研究小组对536名参与者进行的一项为期一年的随访研究中,研究作者发现,59%的人有单器官损伤,27%的人有多器官损伤。
一项针对VA数据的专门肾脏研究,包括89000多名患有新冠肺炎的患者,发现许多肾脏不良结果的风险增加。
另一项VA数据分析,包括181000多名患有新冠肺炎的患者,发现感染也会增加2型糖尿病的风险。
长新冠患者的心血管疾病风险增加,此外,器官损伤似乎是持久的,长期影响仍然未知。
★
神经和认知系统
神经和认知系统的症状是长新冠的主要特征,包括感觉运动症状,记忆丧失、认知障碍、感觉异常、头晕和平衡问题、对光和噪音的敏感性、嗅觉或味觉丧失(或幻觉)以及自主神经功能障碍,影响日常生活。长新冠的前庭听觉表现包括耳鸣、听力损失和眩晕。
认知障碍程度,类似酒驾上限
一项荟萃分析中,在感染后12周,32%的新冠肺炎患者出现疲劳,22%的患者出现认知障碍。长新冠患者的认知障碍会使人衰弱,与英国酒后驾驶限制的醉酒程度或认知衰老10年的程度相同,并且可能会随着时间的推移而增加。
犬尿氨酸途径的激活可能与认知障碍相关
一项研究发现,16%的患者在感染后2个月出现,26%的患者在感染后12个月出现。犬尿氨酸途径的激活,特别是代谢产物喹啉酸、3-羟基邻氨基苯甲酸和犬尿氨素的存在,已在长新冠中确认,并与认知障碍相关。
部分患者可能没有意识到认知障碍
在新冠康复的个体中也发现了认知障碍,当使用客观与主观测量时,认知障碍的比率更高,这表明有一部分认知障碍患者可能没有意识到和/或报告他们的障碍。
认知障碍是一种独立于焦虑和抑郁等心理健康状况的特征
认知障碍在住院和非住院患者中发生率相似。一份有130多万新冠肺炎患者参与的报告显示,随着时间的推移,焦虑和抑郁等心理健康状况恢复正常,但认知障碍(脑雾)、癫痫、痴呆、精神病和其他神经认知疾病的风险增加至少持续了2年。
神经病理学的可能机制包括:神经炎症、凝血病和内皮功能障碍对血管的损伤以及神经损伤
长新冠患者脑脊液异常,年龄较小可能延迟发作
研究发现,患有长新冠的患者存在阿尔茨海默病样信号,脑和脑干代谢低下与特异性症状和长新冠患者中的异常脑脊液发现相关,且年龄较小与神经症状延迟发作相关。
长新冠患者——“化疗脑”
在最近的一份预印本中,轻度感染的长新冠患者的多线细胞失调和髓磷脂丢失,其小胶质细胞反应性类似于化疗,即“化疗脑”。
即使非住院患者,认知能力也可能下降
英国生物银行(UK Biobank)的一项研究,包括新冠流行前后相同患者以及对照组的大脑成像,显示眶额皮层和海马旁回(初级嗅觉皮层相关区域的组织损伤标志物)的灰质厚度减少,与对照组相比,即使是非住院患者,新冠后患者的大脑整体缩小,认知能力下降更大。
尽管该研究将新冠感染者与对照组进行了比较,但并不是特别长的新冠患者,这可能对长新冠的认知成分有影响。在中枢神经系统中发现了线粒体蛋白以及SARS-CoV-2刺突蛋白和核衣壳蛋白的异常水平。在长新冠中也发现了四氢生物蝶呤缺乏症和氧化应激。
眼睛不适?可能与病毒在视网膜感染和复制有关
在眼睛中,在长新冠患者中发现角膜小神经纤维丢失和树突细胞密度增加,瞳孔光反应显著改变,视网膜微循环受损。SARS-CoV-2可以在视网膜和大脑类器官中感染和复制。长新冠的其他表现包括视网膜出血、棉絮斑和视网膜静脉闭塞。
焦虑和抑郁人群比例上升
在爱尔兰,研究报告了20-28%的普通人群出现焦虑和抑郁症状,多达4%的人有自残或自杀的想法。而在2018年爱尔兰健康调查(一项全国性的代表性调查),结果显示,在新冠大流行之前,自我报告的抑郁和焦虑发生率为6%.
仓鼠模型:持续炎症与焦虑和抑郁行为相关
轻度感染的小鼠模型显示小胶质细胞反应性和CCL11水平升高,这与认知功能障碍和受损神经发生有关。
仓鼠模型表现出持续的炎症状态,包括T细胞和髓细胞活化、产生促炎细胞因子和干扰素反应,与仓鼠的焦虑和抑郁行为相关,在新冠肺炎患者的组织中发现了类似的转录特征。轻度疾病感染的非人灵长类动物表现出神经炎症、神经元损伤和凋亡、脑微出血、慢性低氧血症和脑缺氧。
血液皮质醇水平较低,持续症状超过1年
最近的报告表明,与对照组相比,长新冠患者的血液皮质醇水平较低,持续症状超过1年。肾上腺产生的低皮质醇应通过垂体产生的促肾上腺皮质激素(ACTH)来补偿,但事实并非如此,这支持下丘脑-垂体-肾上腺轴功能失调。这也可能反映了潜在的神经炎症过程。此前,ME/CFS患者的皮质醇水平较低。
注:ME/CFS——肌痛性脑脊髓炎/慢性疲劳综合征,是一种多系统神经免疫性疾病。将在下一小节详细阐述。
★
ME/CFS、自主神经功能障碍和相关疾病
ME/CFS通常在病毒或细菌感染后发病。标准包括至少6个月的“疾病前从事职业、教育、社会或个人活动的能力大幅降低或受损”,伴随着无法通过休息缓解的严重疲劳,以及运动后不适、睡眠不足和认知障碍或直立不耐受(或两者兼有)。
高达75%的ME/CFS患者不能全职工作,25%的人患有重度ME/CFS,这通常意味着他们卧床,对感官输入极度敏感,并依赖他人照顾。
大约一半的长新冠患者符合ME/CFS标准
许多研究人员评论了ME/CFS与长新冠之间的相似性;据估计,大约一半的长新冠患者符合ME/CFS标准,在测量运动后不适的主要ME/CFS症状的研究中,大多数长新冠患者报告经历了运动后不舒服。
一项对长新冠患者和ME/CFS患者的直立压力的研究发现,与健康个体相比,两组患者的血流动力学、症状和认知异常相似。
• ME/CFS中一致的异常发现
包括自然杀伤细胞功能减弱、T细胞衰竭和其他T细胞异常、线粒体功能障碍以及血管和内皮异常,包括红细胞变形和血容量减少。
其他异常包括运动不耐受、耗氧量受损和无氧阈值降低,以及代谢异常,包括脂肪酸和氨基酸的使用改变。还观察到神经功能改变,包括神经炎症、脑血流减少、脑干异常和心室乳酸水平升高,以及眼睛和视力异常。反应性疱疹病毒(包括EBV、HHV-6、HHV-7和人巨细胞病毒)也与ME/CFS相关。
• 长新冠患者中观察到上述这些发现
长新冠研究发现,线粒体功能障碍包括线粒体膜电位丧失和可能的线粒体代谢失调、脂肪酸代谢改变和线粒体依赖性脂质分解代谢失调,与运动不耐受、氧化还原失衡、运动不耐受和氧提取受损的线粒体功能障碍一致。
研究还发现了内皮功能障碍、脑血流异常和代谢变化(即使是POTS症状减轻的长新冠患者)、广泛的神经炎症、疱疹病毒重新激活、红细胞变形以及其他地方讨论的许多发现。不仅在长新冠患者中,而且在ME/CFS患者中也发现了微裂纹和过度活化的血小板。
自主神经障碍,特别是POTS,通常与ME/CFS共病,也常伴有病毒性发作
POTS与G蛋白偶联的肾上腺素能受体和毒蕈碱乙酰胆碱受体自身抗体、血小板储存库缺陷、小纤维神经病变和其他神经病变有关。POTS和小纤维神经病变通常在长新冠中发现,一项研究发现67%的长新冠队列中存在POTS。
注:POTS——体位性心动过速综合征,一种随着姿势的改变而心率增加的情况,例如躺着坐起来或站着。这会导致头晕或昏厥。
肥大细胞激活综合征也通常与ME/CFS共病
与新冠前患者和对照组相比,长新冠患者肥大细胞激活综合征症状的数量和严重程度显著增加,组胺受体拮抗剂可改善大多数患者的症状。
注:肥大细胞活化综合征(MCAS)是一种由肥大细胞异常活化导致的慢性多系统性疾病.肥大细胞广泛分布于胃肠道,因此MCAS易累及胃肠道并出现相应症状。
其他可能共病的疾病
其他通常与ME/CFS共病的疾病包括结缔组织疾病,包括Ehlers–Danlos综合征和高移动性、神经矫形脊柱和颅骨疾病以及子宫内膜异位症。
长新冠中观察到与ME/CFS,自主神经障碍,肥大细胞激活综合征等疾病类似的发现,其他疾病也可能与长新冠合并。应进一步探讨病毒后条件与这些条件的重叠。
★
生 殖 系 统
长新冠中经常报告对生殖系统的影响。与无冠状病毒病史的女性以及患有新冠肺炎但不长时间冠状病毒的女性患者相比↓↓↓
患长新冠的女性更有可能发生月经改变
月经和月经前一周已被患者确定为长新冠症状复发的诱因。
在新冠肺炎患者中观察到卵巢储备下降和生殖内分泌紊乱,初步理论表明SARS-CoV-2感染会影响卵巢激素的产生和/或子宫内膜反应,因为卵巢和子宫内膜组织中ACE2受体丰富。
与那些没有月经变化的人相比,同时患有新冠和月经改变的人更容易出现疲劳、头痛、身体疼痛和气短,最常见的月经变化是月经不规律、经前症状增加和月经不频繁。
ME/CFS与多种妇科疾病存在关联
对ME/CFS的研究表明,ME/CFS与经前焦虑障碍、多囊卵巢综合征、月经周期异常、卵巢囊肿、绝经早期和子宫内膜异位症之间存在关联。妊娠、产后变化、围绝经期和月经周期波动会影响ME/CFS,并影响代谢和免疫系统变化。长新冠的研究应该关注这些关系,以更好地理解病理生理学。
病毒在阴茎组织中的持续存在,勃起功能障碍的风险也增加
这可能是由内皮功能障碍引起的。在一项研究中,与对照组相比,长新冠患者的精子计数、精液体积、活力、精子形态和精子浓度受损,并与细胞因子水平升高以及精液中胱天蛋白酶8、胱天蛋白酶9和胱天蛋白酶3的存在相关。
长新冠患者女性月经变化(月经不规律等),更容易出现疲劳,头痛等症状,男性精子质量变化,长期影响仍需进一步研究。
★
呼吸系统
呼吸系统疾病是长新冠的常见表现型,在一项研究中,新冠肺炎幸存者的发病率是普通人群的两倍。
呼吸短促和咳嗽是最常见的呼吸道症状,分别在40%和20%的长新冠患者中持续至少7个月。
几项包括长新冠患者的非住院患者的影像学研究显示了肺部异常,包括空气潴留和肺部灌注。
对感染后3-6个月的患者进行的免疫学和蛋白质组学研究表明,气道中的细胞凋亡和上皮损伤,但血液样本中没有。
进一步的免疫学特征比较了长新冠肺炎患者和新冠肺康复者,发现肺功能下降、全身炎症和SARS-CoV-2特异性T细胞之间存在相关性。



doi: 10.3389/fimmu.2021.686029
★
胃肠道系统
长新冠的胃肠道症状包括恶心、腹痛、食欲不振、胃灼热、便秘等。
持续的呼吸道和神经系统症状都与特定的肠道病原体有关。
SARS-CoV-2 RNA存在于新冠肺炎患者的粪便样本中,一项研究表明,12.7%的参与者在新冠肺炎确诊4个月后粪便中持续存在,3.8%的参与者在确诊7个月后持续存在。大多数感染7个月后出现长新冠症状和炎症性肠病的患者在肠粘膜中存在抗原持久性。
与没有长新冠或SARS-CoV-2阴性对照的患者相比,长新冠肺炎患者的血浆中发现了来自肠道和/或肺上皮的较高水平的真菌易位,可能会诱导细胞因子的产生。
长新冠患者的胃肠道症状可能与肠道菌群变化相关
与非新型冠状病毒肺炎对照组(疫情爆发前)相比,长新冠感染者中发现了较高水平的Ruminococcus gnavus和普通拟杆菌(Bacteroides vulgatus)和较低水平的普氏粪杆菌(Faecalibacterium prausnitzii),肠道失调持续至少14个月;低水平的产丁酸盐细菌与6个月时的长新冠密切相关。
将长新冠患者的肠道细菌转移到健康小鼠体内,导致小鼠认知功能丧失,肺部防御受损。
为什么长新冠患者的肠道菌群会发生变化?
胃肠道和呼吸道症状怎样将微生物群与SARS-CoV-2感染联系起来?
病毒是如何感染肠道的?
感染后的肠道菌群及宿主免疫会受到什么样的影响?
……
我们将在下一小节详细介绍。
▾◆▽◆▽◆▾
要了解病毒是如何感染,为什么会与肠道菌群相关联,我们来先从病毒的结构说起:
SARS-CoV-2是新冠肺炎的病原体。它是一种正向单链RNA病毒。它编码膜蛋白(M蛋白)、核衣壳蛋白(N蛋白)、刺突蛋白(S蛋白)和包膜结构蛋白(E蛋白)和多种非结构蛋白。
呼吸道胃肠道是人类微生物群的主要栖息地,也是SARS-CoV-2感染的目标
⇓⇓⇓
SARS-CoV-2病毒如何实现感染?
病毒利用表面的刺突蛋白和人体细胞上的ACE2(血管紧张素转化酶2)进行结合,从而实现感染。
在病毒体上,刺突蛋白(S蛋白)是包含S1和S2亚基的同源三聚体:
病毒劫持宿主细胞表面蛋白酶,如跨膜丝氨酸蛋白酶2(TMPRSS2),TMPRSS2反过来激活病毒S蛋白,切割ACE2受体,并促进病毒与宿主细胞膜的结合。
除了ACE2和TMPRSS2介导的进入外,SARS-Cov-2还可以利用宿主细胞的吞噬作用或内吞作用侵入某些免疫细胞类型,如巨噬细胞。
为什么SARS-CoV-2可感染肠道?
ACE2和TMPRSS2在呼吸道和胃肠道中强烈表达。由于后者与外部环境沟通,它们是SARS-CoV-2入侵的主要目标。
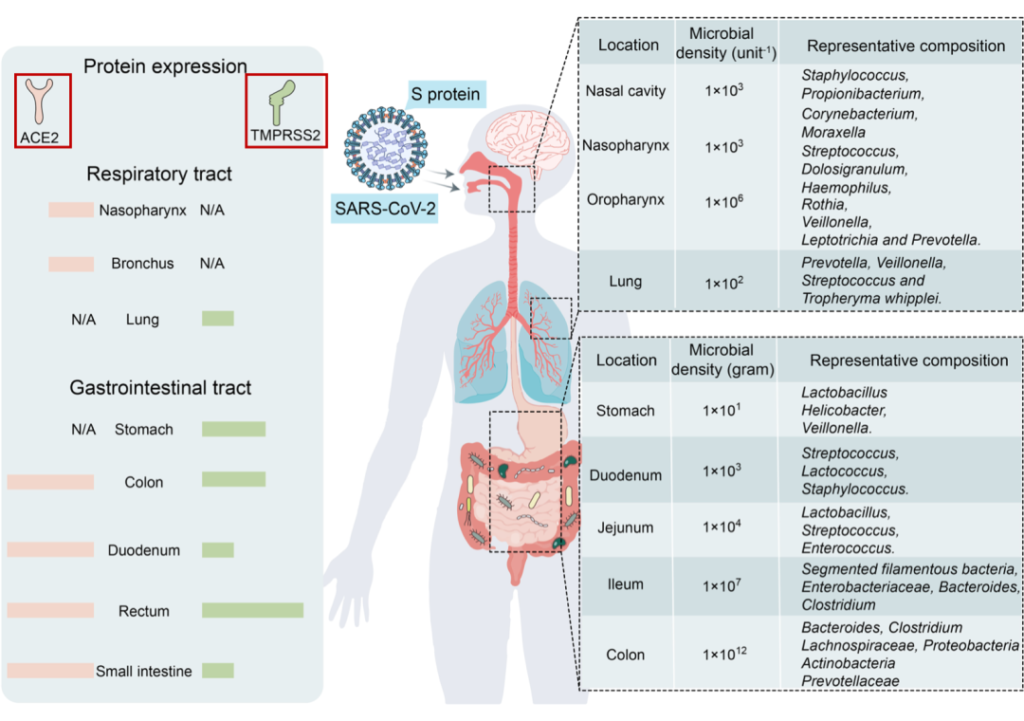
Wang B, et al., Signal Transduct Target Ther. 2022
SARS-CoV-2受体ACE2和TMPRSS2主要在呼吸道和胃肠道中表达,为微生物提供了许多合适的栖息地。
由于ACE2和TMPRSS2在胃肠道中高度表达,SARS-CoV-2也以肠道为靶点。一些研究报告称,新冠肺炎患者粪便样本中SARS-CoV-2病毒RNA呈阳性。
对一名新冠肺炎患者进行的活组织检查显示,SARS-CoV-2蛋白涂层存在于胃、十二指肠和直肠中。因此,SARS-CoV-2可感染肠道。
COVID-19的胃肠道和呼吸道症状将微生物群与SARS-CoV-2感染联系起来
⇓⇓⇓
几项临床研究报告,11-39% 的 COVID-19 患者有胃肠道症状,包括恶心、呕吐、腹泻和腹痛。
智利进行的一项研究报告称,在 7016 名 COVID-19 患者中,有 11% 表现出胃肠道症状。
在浙江的651例COVID-19患者中,8.6%表现出腹泻,4.15%表现出恶心或呕吐。
胃肠道症状与相对较高的住院风险和/或更高的疾病严重程度相关。在重症和/或危重患者中,疾病进展并引起并发症,例如急性呼吸窘迫综合征(ARDS),败血症,继发性病原体肺炎和终末期器官衰竭。
由于微生物群维持呼吸道和胃肠道稳态和健康,上述COVID-19相关症状可能将微生物群与SARS-CoV-2感染联系起来。
一些研究证实,肠道菌群有助于调节肠道免疫稳态和病原体感染。因此,肠道细菌可能对SARS-CoV-2感染的宿主免疫反应至关重要。
一些研究小组报告称,与新冠完全康复的患者相比,长新冠患者的肠道微生物群存在差异。在诊断时检测到微生物差异,但在6个月后被夸大。特别是,长新冠患者出院后,微生物群的丰富度没有恢复到正常状态。
持续的症状可能与免疫隔离组织中存在少量残余病毒有关,特别是身体中不受抗体直接保护的区域,如肠道。
一个重要的观察结果显示,病毒清除后,肠道失调持续了数月。与作为对照的健康个体相比,从新冠肺炎中恢复的患者在3个月时细菌多样性和丰富度降低,同时有益共生菌丰富度较低,机会性病原体丰富度较高。在随访6个月时,与对照组相比,COVID-19患者中双歧杆菌和瘤胃球菌的相对丰度显著降低(P < 0.001).
一项前瞻性研究追踪了香港106名新冠肺炎住院患者肠道微生物群的纵向动态,大约四分之三的患者在感染后6个月出现”长新冠”症状(通常是疲劳、记忆力差和焦虑)。
粪便样本的Shotgun宏基因组分析显示,与没有长新冠的个体和作为对照的健康个体相比,长新冠患者微生物多样性显著降低,细菌类型减少。
长新冠患者的Bacteroides vulgatus和Ruminococcus gnavus 的丰度增加,而P.prausnitzii的丰度减少。
有趣的是,与健康个体(n = 11)相比,PI-IBS患者(n = 11)的粪便样本中Bacteroides vulgatus也显示出6倍的升高;这一发现表明,Bacteroides vulgatus可能与长新冠和PI-IBS的发病机制有关。
注:因感染而导致的IBS被称为感染后肠易激综合征(PI-IBS)
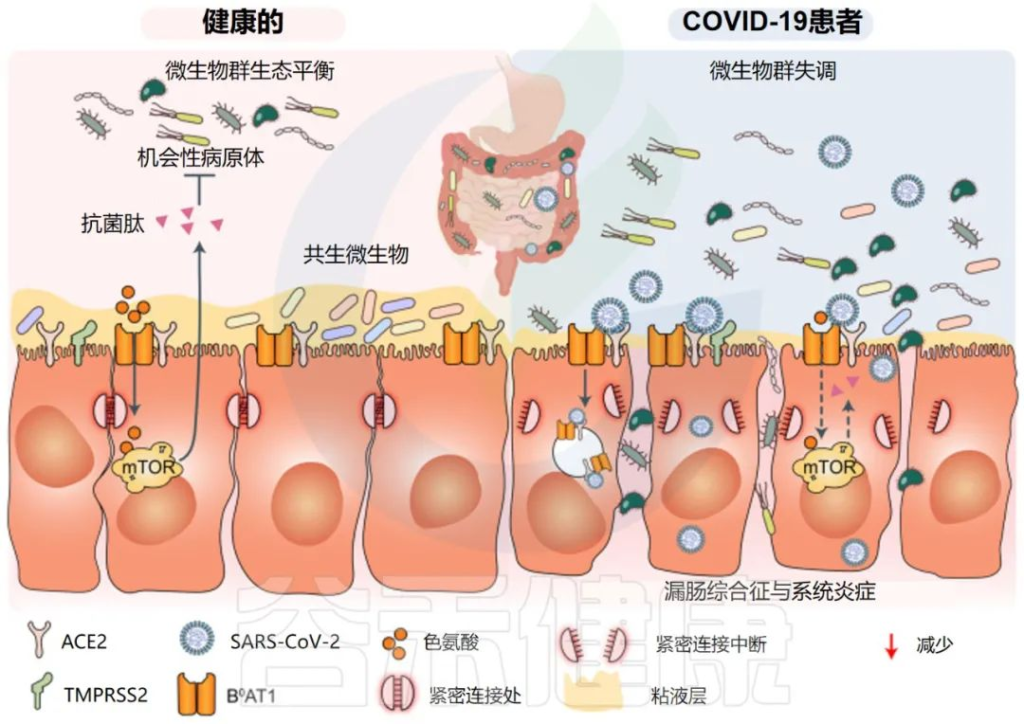
doi: 10.1038/s41392-022-00986-0
此外,SARS-CoV-2感染后6个月出现呼吸道症状与Streptococcus vestibularis和Streptococcus anginosus等机会性致病物种的水平升高有关。
而疲劳和神经精神症状与医院内病原体有关,如:Clostridium innocuum 和 Actinomyces naeslundii。
在脱发患者中,产丁酸盐细菌显著减少,某些细菌,如Bifidobacterium pseudocatenulatum和F. prausnitzii,与长新冠的发展具有最大的负相关。入院时的细菌种类,包括长双歧杆菌(B.longum)和Blautia wexlerae,与6个月时长新冠的发展呈负相关,这意味着这些细菌在恢复期具有潜在的保护作用。
相比之下,在长新冠患者中富集的菌有:
Atopobium parvulum
Actinoomyces johnsonii
Actinomyces sp. S6 Spd3
这些发现表明,一个人在感染时的肠道微生物组组成能会影响其对新冠长期并发症的敏感性。尽管如此,这些变化可能代表长新冠的反应性变化,未来的研究需要包括从感染到症状发展的非住院患者的前瞻性纵向研究,以描述肠道菌群失调对长新冠症状的确切影响。
持久战——免疫细胞数量变化
针对患有轻度急性新冠肺炎的长冠肺炎患者的免疫失调进行的研究发现,T细胞改变,包括耗尽的T细胞、CD4+和CD8+效应记忆细胞数量减少以及中央记忆细胞PD1表达升高,持续至少13个月。
研究还报道了高度活化的先天免疫细胞,缺乏初始T细胞和B细胞,I型和III型干扰素(IFN-β和IFN-λ1)的表达升高,持续至少8个月。
一项综合研究将长新冠患者与未感染者和无长新冠的感染者进行了比较发现,在感染后中位数14个月,长新冠患者的非经典单核细胞、活化B细胞、双阴性B细胞以及分泌IL-4和IL -6的CD4+ T细胞数量增加,常规树突状细胞和T细胞数量减少,皮质醇水平降低。
疲劳和神经认知功能障碍可能与细胞因子变化和EBV再激活相关
细胞毒性T细胞的扩增已被发现与长冠的胃肠道表现有关。更多的研究发现细胞因子水平升高,特别是IL-1β、IL-6、TNF和IP10,最近的预印本报道了CCL11水平的持续升高,这与认知功能障碍有关。
在长新冠患者中发现了包括EBV和HHV-6在内的反应性病毒(已在ME/CFS45中发现),并导致线粒体断裂,严重影响能量代谢。最近的一份预印本报告,在长新冠患者中,EBV再激活与疲劳和神经认知功能障碍相关。
抗体生成量低,可预测长新冠
几项研究表明,在新冠肺炎急性期,无论是住院患者还是非住院患者,SARS-CoV-2抗体生成量低或无,以及其他免疫反应不足,都可以预测6至7个月后长新冠。
这些不足的免疫反应包括IgG的低基线水平、受体结合域和刺突特异性记忆B细胞的低水平、核衣壳IgG的低水平和刺突特异性IgG的低峰值。
在最近的一份预印本中,发现严重长新冠患者的CD4+T细胞和CD8+T细胞应答较低或缺失,另一项研究发现,与无长新冠的感染对照组相比,长新冠患者的CD8+T淋巴细胞表达CD107a的水平较低,核衣壳特异性干扰素-γ-产生的CD8+T细胞下降。
二次感染可能与抗体水平低相关
长新冠患者体内高水平的自身抗体与保护性新冠肺炎抗体呈负相关,这表明高水平自身抗体的患者更有可能发生突破性感染。
SARS-CoV-2病毒在肠道内反弹,可能是由于病毒持续存在,也与受体结合域IgA和IgG抗体的水平较低和产生较慢有关。
长新冠驱动因素:病毒持续存在
一些报告指出,病毒持续存在可能是长新冠的驱动因素;在生殖系统、心血管系统、大脑、肌肉、眼睛、淋巴结、阑尾、乳腺组织、肝组织、肺组织、血浆、粪便和尿液中发现了病毒蛋白和/或RNA。胃肠道活检后的多份报告表明存在病毒,提示某些患者体内存在持久性病毒库。
ACE2——病毒感染人体细胞的“钥匙”
前面我们已经知道,病毒利用表面的刺突蛋白和人体细胞上的ACE2(血管紧张素转化酶2)进行结合,从而实现感染,可见,ACE2作为病毒进入的一个入口点,扮演者重要的角色。
ACE2能做什么?
ACE2在肾素-血管紧张素系统(RAS)中起主要作用,除此之外,其活性在肺部也有作用,因为它通过抑制des-Arg9-缓激肽调节缓激肽1受体信号传导,从而减少血管舒张和血管通透性。
ACE也在肠道肠细胞中表达,它可以调节微生物生态、先天免疫和饮食氨基酸稳态。
ACE2亦敌亦友
ACE2在肺部的保护作用可能是COVID-19中的一把双刃剑:
ACE2在肾素-血管紧张素系统(RAS)中的作用以及严重急性呼吸综合征SARS-CoV-2诱导的细胞表面ACE2表达下调的机制如下:
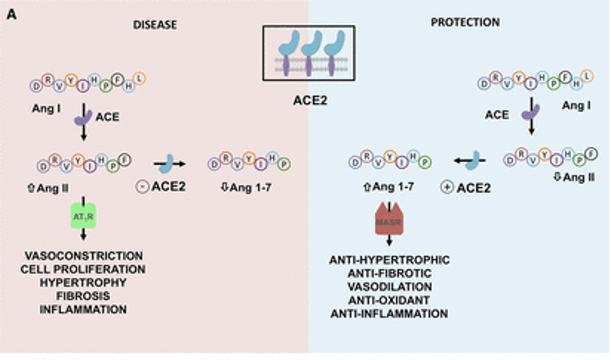
doi: 10.1161/CIRCULATIONAHA.120.047049
ACE2平衡肾素-血管紧张素系统的2个轴:
➭ 增加的ACE2促进保护性ACE2/Ang 1-7/MASR
➭ ACE2的丢失导致向以ACE/血管紧张素II(Ang II)/AngII受体1型(AT1)受体轴(AT1R)过度活性为特征的疾病状态转变。
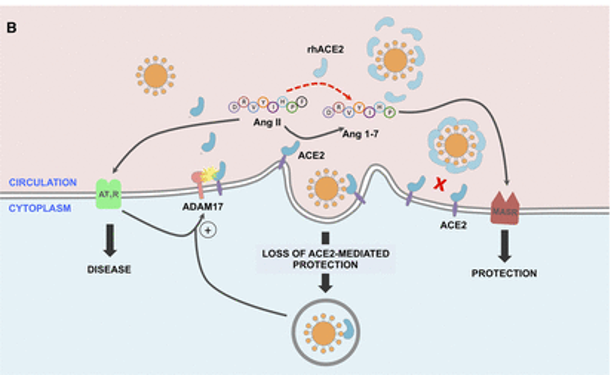
doi: 10.1161/CIRCULATIONAHA.120.047049
SARS-CoV-2的病毒刺突糖蛋白与细胞表面ACE2相互作用,并通过内吞作用一起内化,导致表面ACE2表达降低。ACE2的丢失导致Ang II的积累,Ang II通过AT1受体也上调ADAM17,导致细胞表面ACE2的进一步裂解。
肠道微生物群对肠道ACE2表达的影响?
动物研究中,无菌小鼠的肠道和肺部ACE2表达水平明显高于常规小鼠。以不同微生物群定殖的促性腺激素小鼠显示出肠道ACE2表达的可变性,这可能部分归因于微生物组编码的蛋白酶和肽酶类型的差异。
2021发表的一项研究确定了调节肠道ACE2表达的转录因子,包括已知受肠道微生物群调节的GATA4。这些数据表明,肠道微生物群可能在调节ACE2表达中发挥作用。
特定肠道菌群抑制ACE2表达
在小鼠模型中,特定的细菌种类,如多氏拟杆菌(Bacteroides dorei)和长双歧杆菌,可以抑制结肠ACE2的表达。
与小鼠结肠ACE2表达下调相关的四种拟杆菌显示出显著性差异(P < 0.05),与粪便SARS-CoV-2载量呈负相关。
“阳”之前肠道菌群已经异常,促进易感性
死于新冠肺炎的高危人群通常是那些患有糖尿病、心血管疾病和肥胖症等共病的人群,这些疾病也与微生物异常有关,其特征是细菌多样性减少。
这一发现表明,感染前的肠道微生物群可能促进宿主对SARS-CoV-2和ACE表达的易感性。
拟议的感染前、中、后肠道菌群变化模型及新冠措施如何影响人一生中的菌群多样性
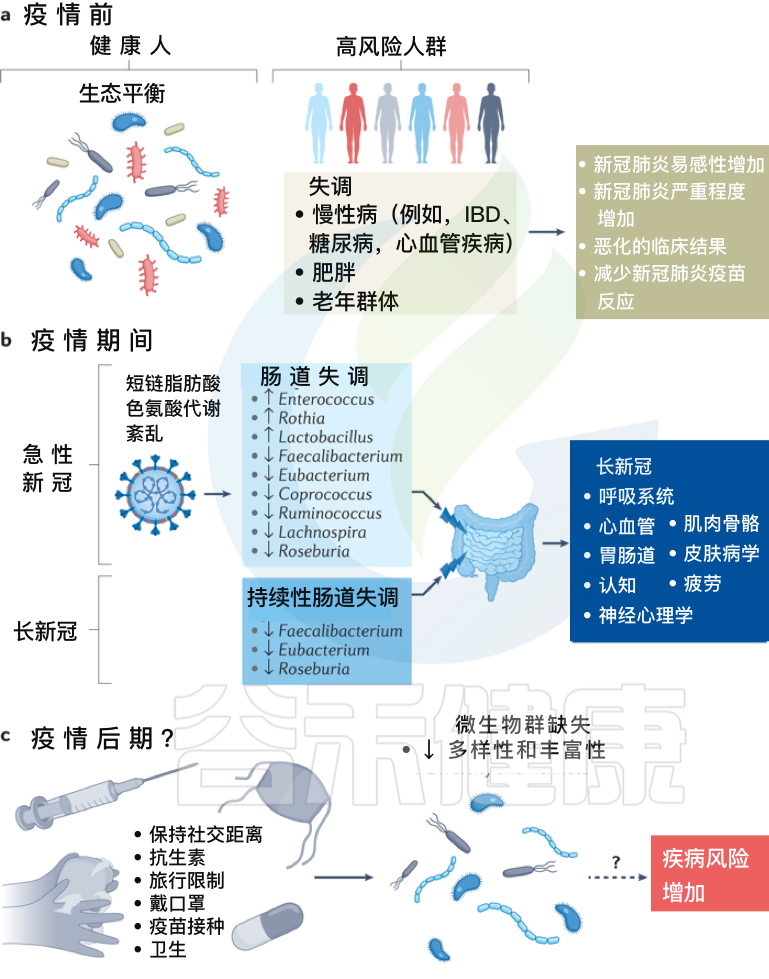
Zhang F, et al., Nat Rev Gastroenterol Hepatol. 2022 Oct
a、在新冠疫情之前,健康个体的肠道微生物群以“生态平衡”为特征,这是一个具有丰富微生物多样性的平衡肠道生态系统。
而某些个体,包括老年群体和患有炎症性肠病、糖尿病、心血管疾病和肥胖等慢性病的个体,肠道生态系统发生了变化,微生物多样性降低,肠道微生物组成失调可能导致严重急性呼吸综合征SARS-CoV-2感染的易感性增加,新冠肺炎严重程度增加,临床结局恶化和/或新冠肺炎疫苗反应降低。
b、在疫情期间,急性新冠感染与持续的肠道微生物群组成变化、短链脂肪酸生物合成受损和色氨酸代谢紊乱有关。
最初感染中出现的功能障碍也与急性后新冠肺炎综合征有关,包括慢性呼吸道症状(例如咳嗽或气短)、心血管症状(例如胸痛或心悸)、胃肠道症状(例如食欲不振或腹泻)、神经精神症状(例如焦虑或失眠)、肌肉骨骼症状(例如关节疼痛或肌肉无力)和皮肤病症状(例如皮疹或脱发)。
在急性新冠肺炎疫情后阶段,肠道微生物群持续受到破坏,其特征是产短链脂肪酸的细菌粪杆菌、真杆菌和Roseburia持续耗竭。急性期肠道菌群组成的改变也与多器官急性后新冠肺炎综合征有关。
c、除了大流行之外,现有的疫情控制做法,包括严格执行社交距离、广泛的卫生消毒措施、定期接种疫苗和限制旅行,可能会对婴儿的微生物组多样性产生负面影响,并对肠道中的早期细菌定植产生重大影响,对疾病风险产生未知后果。
需要做更多的工作来调查和确认新冠、微生物群丧失和未来疾病风险之间的潜在联系。未来导致微生物损失的感染控制措施需要与促进微生物多样性的战略相平衡,以确保子孙后代的健康益处。
迄今为止,大多数临床研究表明 SARS-CoV-2 感染与肠道菌群改变之间存在关联,但尚不清楚肠道菌群改变是感染的原因还是影响。
为此研究人员提出了两种假设,并推断了相应的机制。
SARS-CoV-2感染 ▬► 肠道菌群失调
那么研究人员假设了 SARS-CoV-2 可导致肠道菌群失调,推断了几种可能的机制:
1) SARS-CoV-2侵入肺部可导致组织损伤,可以激活以NF-κB和TNF途径上调为特征的强促炎途径,激活模式识别受体(TLR、RLR、NLR),这些受体被先天免疫细胞识别,导致各种促炎细胞因子的释放。
或者肠道感染可导致肠道结构的直接损伤和肠上皮屏障的破坏,可能损害肠道通透性,并促进肠道炎症。
激活的全身炎症和肠道炎症可能导致破坏肠道微生物群平衡,导致:
• 机会病原体(例如肠杆菌科和肠球菌)的丰度增加
• 共生菌(例如Faecaliberium、Eubacterium和Roseburia)的丰度降低
关于Faecaliberium详见:
肠道核心菌属——普拉梭菌(F. Prausnitzii),预防炎症的下一代益生菌
关于Eubacterium 详见:
肠道核心菌属——优/真杆菌属(Eubacterium),你为什么要关心它?
关于Roseburia 详见:
2) SARS-CoV-2感染可下调肠上皮细胞管腔表面ACE2和B0AT1(分子ACE2伴侣)的表达,这可能促进病原菌的生长。
3) 一项体外研究发现SARS-CoV-2可能直接感染细菌。揭示了SARS-CoV 2 影响肠道微生物群的另一种可能机制。
肠道菌群特征 ▬► 严重程度和免疫反应
动物研究提供了证据,SARS-CoV-2感染可能在驱动肠道微生物群生态变化中发挥作用。
➪
当用SARS-CoV-2攻击恒河猴和食蟹猴的非人灵长类动物模型时:
➪
仓鼠模型能够重现人类严重新冠的一些特征:
研究人员提出SARS-CoV-2感染点的特定内在“微生物组特征”,可以通过几种假设机制影响感染的严重程度和宿主免疫反应:
i) 增加的机会性病原体可能会被先天性淋巴细胞进一步识别,并强化肠道促炎反应。
ii)机会性病原体和毒素可能转移到循环系统中,导致菌血症,加剧系统炎症和疾病严重程度。
iii)有益菌逐渐减少耗尽,可能会对免疫细胞的募集产生负面影响,如激活的粘膜相关不变性T细胞(MAIT),从而影响呼吸道感染的易感性和严重性。
肠道菌群可能导致免疫反应功能失调和 COVID-19严重程度的潜在机制
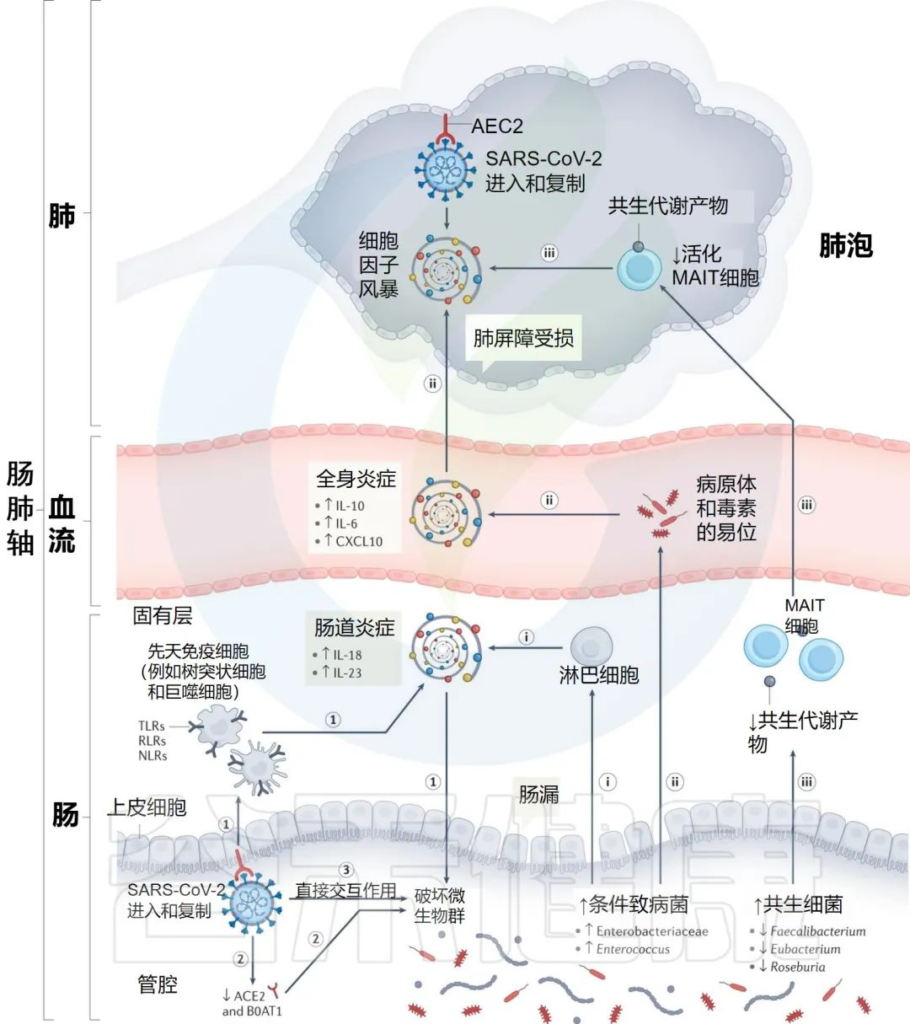
Zhang F, et al., Nat Rev Gastroenterol Hepatol. 2022 Oct
肠道菌群代谢产物
SARS-CoV-2感染与肠道微生物群的碳水化合物、脂质和氨基酸代谢改变有关。
——短链脂肪酸:合成受损
多项研究表明,COVID-19 患者的粪便样本中的短链脂肪酸生物合成受损。
在对66名新冠肺炎抗生素无效患者和70名未感染新冠的患者进行的宏基因组分析中,SARS-CoV-2感染患者的肠道微生物群合成短链脂肪酸的能力降低,这与疾病严重程度和血浆中促炎细胞因子IL-10和趋化因子CXCL10浓度升高呈负相关。
通过粪便代谢物的测量,19名与新冠相关的严重和/或危重疾病患者的粪便中短链脂肪酸(包括乙酸、丙酸、丁酸、戊酸和己酸)浓度持续下降。
短链脂肪酸可以激活免疫细胞的抗炎反应,抑制炎症信号通路,并保持肠道屏障的完整性,以防止肠道内毒素和细菌进入循环,从而减轻局部和全身炎症反应。
鉴于短链脂肪酸在调节宿主免疫反应中的重要性,新冠肺炎中短链脂肪酸生物合成不足可能与疾病发病机制和严重程度有关。然而,短链脂肪酸缺失是否是新冠感染的原因或后果尚待阐明。
——色氨酸代谢:受到干扰
一些测量新冠患者血浆代谢物的研究表明,与健康人作为对照组相比,色氨酸代谢受到干扰,与色氨酸新陈代谢有关的犬尿氨酸途径的激活增强。
色氨酸代谢通过调节调节性T细胞与TH17细胞的比率和B细胞活性与自身免疫、病毒感染和肠道健康相关。
在人类和动物研究中,犬尿氨酸途径代谢产物进入大脑的增加可能会引发疲劳、记忆力差和抑郁等症状,这是“长新冠”的常见症状。重要的是,色氨酸代谢产物是宿主-微生物群界面的关键介质。
根据人类和动物研究的证据,肠道微生物群可以直接使用色氨酸作为底物,并影响宿主色氨酸的吸收和代谢,以调节宿主的生理和免疫反应。内源性宿主色氨酸代谢产物可以深刻影响肠道微生物群的组成和功能,如阿克曼氏菌和乳杆菌。
综上所述,这些数据表明色氨酸代谢是肠道微生物群参与新冠肺炎的一种可能机制。
——胆汁酸代谢:菌群失调影响胆汁酸代谢,胆汁酸浓度升高破坏肠道屏障,引起炎症
初级胆汁酸由胆固醇、胆酸和鹅去氧胆酸通过与甘氨酸或牛磺酸结合在肝脏中合成。然后,它们被分泌到小肠,在那里它们被肠道菌群转化为次级胆汁酸,主要是脱氧胆酸(DCA)和石胆酸(LCA)。
次级胆汁酸在上皮细胞和内皮细胞以及肝细胞中充当核受体FXR、VDR和PXR的配体。它们还与TGR5相互作用。
注:TGR5是一种在肠、胰腺、淋巴组织和大脑中表达的膜结合受体。DCA和LCA都能够通过上述受体调节免疫系统。
研究人员根据疾病严重程度将新冠肺炎患者从无症状患者到处于关键阶段的患者进行分组。随着疾病严重程度的增加,来自患者的肠道菌群中厚壁菌/拟杆菌的比例逐渐受到更大的影响。
来自无症状患者的肠道菌群保留了有益菌种类,这些细菌与新冠肺炎的不良后果呈负相关:
此外,与危重症患者的微生物群不同,他们的微生物群的特征在于参与次级胆汁酸生物合成代谢途径的基因的高表达。
Harry Sokol等人观察了SARS-CoV-2感染对灵长类微生物群的影响,并发现总胆汁酸的数量随疾病严重程度而增加。值得注意的是,初级/次级胆汁酸的比率也明显较高。
这些数据表明,SARS-CoV-2感染对肠道菌群的破坏随着疾病的严重程度而加剧。随着菌群失调程度的增加,回肠的内在功能进一步改变,导致肠内转运增加,从而阻止胆汁酸的完全重吸收,从而增加其在结肠中的浓度。此外,重症新冠肺炎患者的肠道菌群功能有限,因此胆汁酸集中在这些患者的粪便中。
血清胆汁酸谱显示,急性呼吸窘迫综合征(ARDS)患者符合这些观察结果,因此可以推断,在严重的新冠肺炎中,胆汁酸浓度升高可能会破坏肠道屏障,并通过血流到达包括肺、心脏、肾和内皮在内的外周组织。它们的细胞毒性活性可能会损伤外周组织的细胞膜,导致局部和全身炎症反应,并在临床上表现出来。
——鞘脂:肠道微生物鞘脂代谢改变
据报道,新冠肺炎患者血清和粪便中鞘脂浓度降低,肠道微生物鞘脂代谢改变。鞘磷脂是生物膜的组成部分,介导信号转导和免疫激活。
拟杆菌产生的鞘脂可以增加外源鞘脂,从而增强体外或体内研究中观察到的调节性T细胞的分化,这可能抑制冠状病毒的复制。
这一观察支持肠道微生物群衍生的鞘脂可能调节宿主对SARS-CoV-2感染的防御的假设。
——蔗糖、葡萄糖:异常
与47名健康人作为对照组相比,56名新冠肺炎患者的粪便蔗糖水平升高,粪便葡萄糖水平降低。蔗糖和葡萄糖的异常水平可能与蔗糖酶-异麦芽糖酶活性受损有关。
这种变化可能与新冠肺炎常见的肠道症状有关,如腹泻、呕吐、肠胃气胀和腹痛。胀气通常是由细菌在肠道中发酵未吸收的碳水化合物引起的。
蔗糖水平的增加与放线菌和Streptococcus parasanguinis水平的增加有关,这意味着COVID-19 中的生态失调,可能会破坏肠道发酵并导致胃肠道症状。
▾◆▽◆▽◆▾
累积的证据表明,肠道菌群失调与 COVID-19 感染的严重程度和疾病恢复后的长期多系统并发症有关。
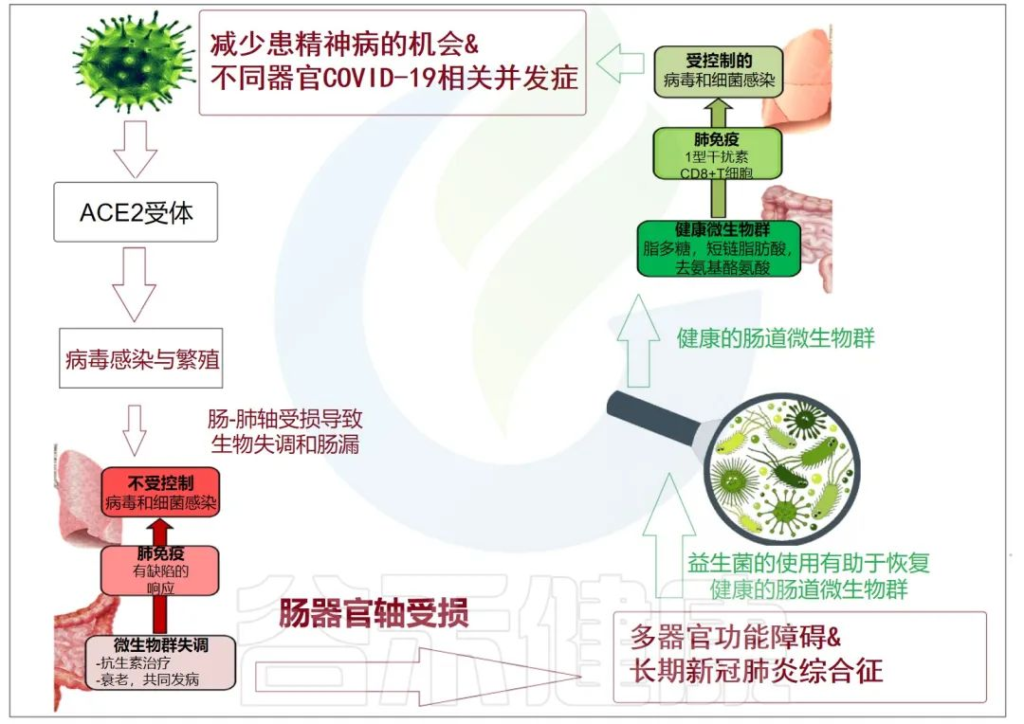
doi: 10.3390/metabo12100912
肠-肝轴是指肠道及其微生物群和肝脏之间的双向通路。这种相互作用是由门静脉建立的,通过门静脉,肠道菌群产物直接运输到肝脏,肝脏将胆汁和抗体反馈到肠道。
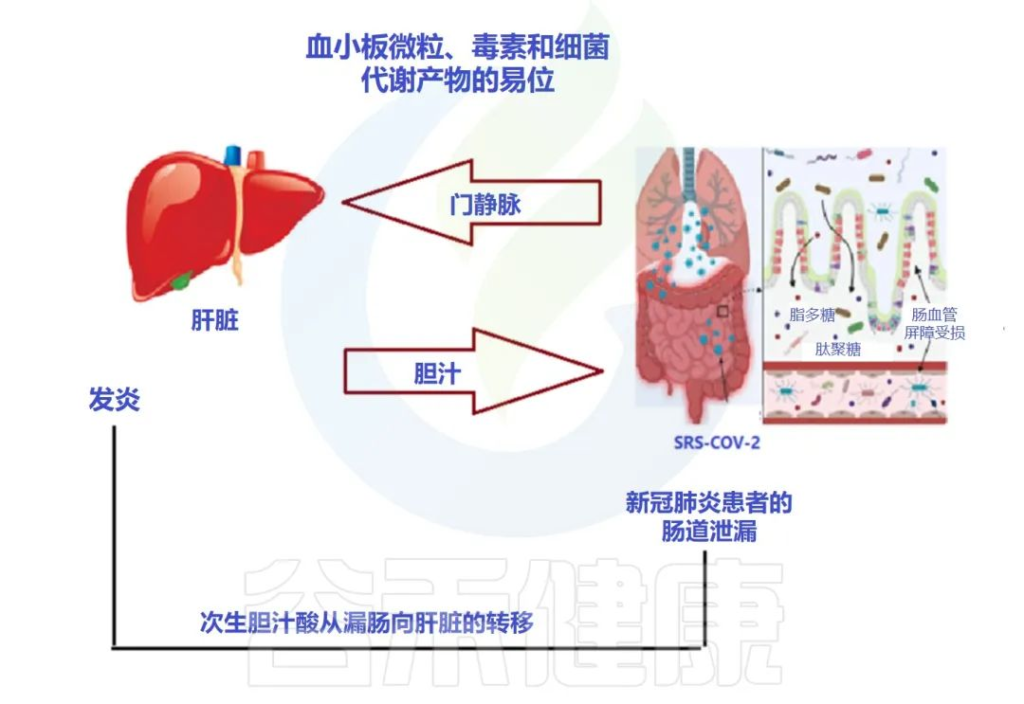
doi: 10.3390/metabo12100912
最近的两项研究表明:
代谢功能障碍相关性脂肪肝(MAFLD)是进展为严重和长期COVID-19的主要危险因素。
MAFLD征象的患者风险高
两项研究均证明,有MAFLD征象的患者发生呼吸系统疾病进展的风险高于无MAFLD的患者,年轻COVID-19患者的风险远高于老年COVID-19患者。
风险增加与病毒影响肠道通透性有关
研究人员认为,在MAFLD患者中观察到的风险增加可能与SARS CoV-2感染对肠道的影响有关,SARS CoV-2感染使肠道通透性和粘膜炎症恶化,从而加剧全身免疫功能障碍,这是严重COVID-19的特征。
当然,这个过程也可以阐明肥胖、2型糖尿病甚至炎症性肠病中 COVID-19 进展的较高风险,这与肠道微生物群改变、粘膜炎症和肠道通透性增加有关。
大量研究表明,腹泻、呕吐和腹痛等胃肠道症状在COVID-19患者中很常见,胃肠道症状的严重程度与呼吸系统疾病和肝功能障碍同时增加。
胃肠道中病毒进入受体表达的增加
已发现ACE-2 SARS CoV-2受体在肠细胞细胞上表达,因为粪便中高水平的SARS CoV-2病毒表明肠道是病毒感染和炎症的合理部位。
用于SARS-CoV-2进入的跨膜丝氨酸蛋白酶2在肠道细胞中也广泛表达。基于此,胃肠道中病毒进入受体表达的增加以及胃肠道症状的早期发作,意味着胃肠道异常可能是由病毒的直接恶化肠漏引起的,而不是对上呼吸道感染的继发性免疫致病反应的结果。
胃肠道症状的临床表现与肝功能不全的生物标志物呈正相关,支持了PAMPs向肝脏传播增加的观点。
SARS-CoV-2 感染会破坏肠道屏障,导致全身细菌脂多糖和肽聚糖升高,并有助于增强全身炎症。因此,肠漏和肠道菌群失调可能导致COVID-19重症患者发生细胞因子风暴。
基于此,已经开发的用于治疗肠漏的治疗方法,例如用于肠道粘膜保护/再生的益生菌和益生元,可以最大限度地减少进展为严重和长新冠的 MAFLD/肥胖/T2D 患者的数量。此外,在SARS CoV-2病毒感染期间,应避免使用干扰肠道微生物群的药物,例如抗生素。
充分证据表明,肠道微生物群改变和肠道细菌多样性减少,在心力衰竭合并冠状动脉疾病患者中很常见。
肠漏导致炎症,和心血管疾病相关
功能失调的肠道屏障会延缓菌群产物的被动泄漏,其中包括促炎脂多糖(LPS)进入血液,这可以通过炎症小体激活导致全身炎症。LPS结合蛋白(LBP)作为老年男性心血管风险高预测生物标志物的血浆水平显著升高,证明了这一点。
有趣的是已经发现,肠漏和炎症小体激活,与肌钙蛋白作为心肌损伤的标志物呈正相关。
肠道菌群-心轴在长新冠综合征中的作用
相当大比例的COVID-19住院患者有心脏问题。早期心血管疾病和心血管疾病危险因素(如肥胖)似乎是发生严重且长新冠并发症的关键危险因素。然而,高比例的COVID-19患者既往无心血管疾病的心脏受累。
在COVID-19患者中,心脏问题也被视为一个危及生命的实质性问题,从MI和心肌炎到伴有心脏应激的肺动脉高压。这种心脏受累的机制尚不清楚。
心肌感染可能与ACE2受体相关
ACE2在多个器官中表达,除肺、心脏和肾脏组织外,ACE2也在肠道中表达,肠细胞中的ACE2表达区可作为SARS-CoV-2进入和提示肠道感染的位点。继发于下调ACE2(SARSCoV-2受体)的抗炎和心脏保护性血管紧张素(AT)-1-7通路下调,通过表达ACE2的心脏细胞引导心肌感染,导致心脏炎症。
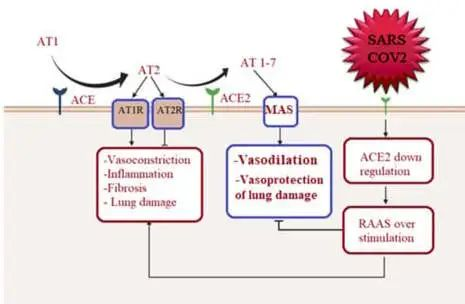
doi: 10.3390/metabo12100912
心脏成像的长期随访,结合肠道菌群分析,是进一步测试长冠状病毒肺炎患者肠道-心脏轴潜在影响的必要后续步骤。
肠道微生物群与肾脏疾病之间的致病性相互关联
肠道菌群参与广泛的临床表现,如慢性肾脏病(CKD),急性肾损伤(AKI)和高血压。
在肠漏的情况下,活细菌经常从肠道转移到其他肠外位置,例如肾脏。这种细菌易位可能伴有菌群失调、病原菌过度生长和宿主免疫系统低下。
在慢性肾病的情况下,肠道微生物群会产生许多毒素和尿毒症溶质,例如对甲酚硫酸盐 (PCS)、硫酸吲哚酯和三甲胺 (TMA) N-氧化物。另一方面,尿素水平升高可能导致肠道微生物群的改变(图3)。
尿毒症毒素可能导致慢性肾病患者出现疲乏、矿物质骨疾病、神经系统疾病和心血管损害。
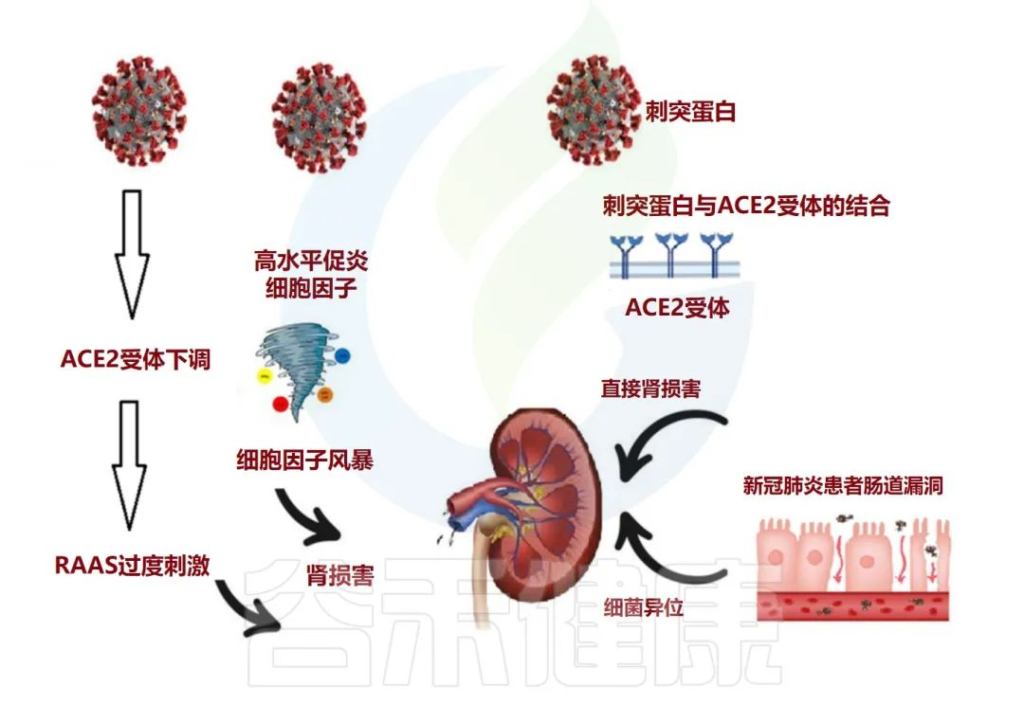
doi: 10.3390/metabo12100912
肠道生态失调在与 COVID-19 相关的长期肾脏问题中的作用
急性肾损伤 (AKI) 通常被视为 COVID-19 患者的并发症。除了先前存在的慢性肾病与COVID-19中的重症或死亡有关外,值得注意的是,解决SARS CoV-2通过AEC2受体进入肾脏,并诱导临床表现的不同途径。
人们普遍认为,该病毒可直接进入肾脏并复制,导致功能障碍,并且通过肾素-血管紧张素-醛固酮系统(RAAS)稳态的局部紊乱影响肾脏。
研究显示,既存慢性肾病患病率较高的群体可能更容易发生急性肾损伤。新出现的证据还表明,COVID-19的肾脏表现与长期严重COVID-19相关肾脏并发症的风险增加有关。
在菌群失调型COVID-19患者中,有益菌(主要是双歧杆菌和乳酸杆菌)逐渐消失,并且由于微生物群改变和病原体优势,观察到短链脂肪酸和胆汁酸水平下降。
短链脂肪酸,特别是丁酸盐是结肠细胞的重要能量来源,在上皮完整性中也起着重要作用。此外,短链脂肪酸受体GPR109A的激活与几种促炎介质的抑制有关。这可能解释了在 COVID-19 患者中出现的显著长期并发症。
作者报告说,慢性肾病患者的厌氧菌群减少,而有氧菌群增加,以肠杆菌科为主。所有这些机制都可以解释一些COVID-19患者的长期肾脏并发症。
在COVID-19住院期间监测肾功能,有助于识别后果更严重风险的患者,有助于早期和更有效的干预。
尽管 COVID-19 的主要临床表现与呼吸系统有关,但也会带来脑相关的问题,引发急性脑血管问题和颅内感染。
约35%的患者和高达85%的重症患者报告神经系统症状,包括头痛、头晕、肌痛或味觉和嗅觉丧失。
COVID-19感染可能导致神经系统疾病以及大脑结构和功能改变的机制有很多。
部分感染后的患者存在一致的记忆缺陷模式
认知问题是最常报告的症状之一,影响10%-25%的COVID-19患者,表现为SARS-CoV感染后的慢性疾病。作者发现,经历过COVID-19感染的人存在一致的记忆缺陷模式,随着自我报告的持续症状的严重程度,记忆缺陷也在增加。
此外,他们报告说,最初疾病期间的疲劳/混合症状和持续的神经系统症状可以预测认知能力。
doi: 10.3390/metabo12100912
COVID-19与神经损伤有关,主要见于神经系统症状
对COVID-19死亡患者的尸检显示,有缺血性损伤的指征和神经炎症的证据是病因机制。许多研究记录了不同脑区的功能和结构畸形,如出血性损伤和癫痫样放电。
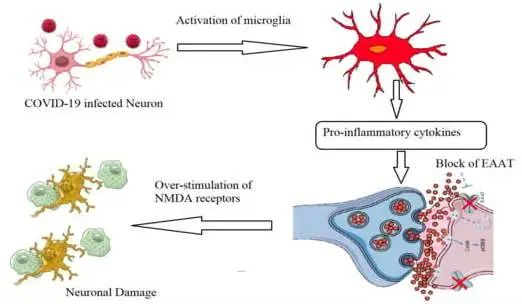
谷氨酸兴奋性毒性的作用:诱导促炎细胞因子产生
关于神经炎症,谷氨酸兴奋性毒性的作用应考虑为导致长新冠相关神经系统症状的原因。Ahmed等人(2020)报道,由于谷氨酸兴奋性毒性,SARS-CoV感染可诱导促炎细胞因子的产生和神经元变性显著增加。
简单地说,谷氨酸作为神经系统中的主要兴奋性神经递质,主要由神经元产生并在突触间隙中排出,之后它与配体依赖性AMPA受体(α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体)结合。这有助于钠离子的进入和神经冲动通过突触后神经元,导致N-甲基-D-天冬氨酸受体(NMDA)的激活,从而诱导钙离子进入。
新冠引起的神经元感染,扰乱谷氨酸稳态的控制
在新冠病毒引起的神经元感染过程中,小胶质细胞产生促炎细胞因子(TNF-α、IL-1β和IL-6),下调星形胶质细胞和突触前神经元上的谷氨酸转运蛋白1(GLT-1)。这将降低谷氨酸有效再摄取的速率,并导致谷氨酸 / GABA神经递质的不平衡和NMDA受体的过度刺激。这些事件扰乱了谷氨酸稳态的控制,突触间隙中谷氨酸的过量产生诱导神经元兴奋性毒性,钙显著进入,最终导致神经细胞变性和损失。
关于谷氨酸与大脑健康以及肠道菌群之间的关联,我们在之前的文章也有写过,详见:
新冠引起的肠道菌群失衡➔影响肠道屏障和血脑屏障通透性 ➔ 菌群代谢产物进入大脑➔脑功能障碍
肠道菌群维持肠上皮屏障、免疫稳态和防止病原体入侵。此外,肠道菌群可以通过增加紧密连接蛋白的表达来影响血脑屏障 (BBB) 的完整性和通透性。ACE2与肠道微生物稳态密切相关。
SARS-CoV-2 感染引起的肠道感染和 ACE2 表达下调可导致肠道菌群组成异常,包括乳酸杆菌和双歧杆菌等菌群水平降低。微生物失衡和肠道炎症势必会影响肠道屏障功能和血脑屏障的完整性和通透性,从而导致肠道细菌、毒素等肠道微生物代谢产物易位,通过血液循环进入大脑,最终导致脑功能障碍。
SARS-CoV-2侵入肠神经系统,出现异常,通过迷走神经影响大脑
迷走神经与肠神经系统中的神经元形成突触连接,并将肠道信息传输到NTS,在那里信息被整合并传递到大脑。
肠神经系统的异常不仅会导致胃肠功能障碍,还会通过肠-脑轴影响大脑功能。先前的研究表明,嗜神经病毒持续感染肠神经系统,并导致肠功能障碍。
SARS-CoV-2进入肠道后,通过与ACE2结合侵入肠神经系统,然后通过迷走神经进入大脑,影响中枢神经系统功能。
更重要的是,肠神经系统损伤导致肠道运动障碍、肠道血流异常和上皮屏障功能障碍,从而进一步促进肠道微生物和细菌代谢产物的毒素进入血液,加重大脑损伤。
越来越多的证据表明,肠道菌群失调也被发现是增加骨质流失的关键因素,而骨质流失又反过来促进了几种骨相关疾病的发展,例如类风湿性关节炎和骨质疏松症。
一系列报告显示,肠道菌群通过改变骨组织的质量来影响骨强度。肠道菌群调节骨骼健康的机制是通过促进调节代谢产物的生成,如吲哚衍生物、三甲基胺N-氧化物(TMAO:氧化胺)、短链脂肪酸和气体递质,如硫化氢(H2S)。
在卵巢切除术(ovx)诱导的绝经后骨质疏松小鼠模型中,H2S供体化合物GYY4137通过激活Wnt10b生成,从而增加骨形成,减少小梁骨损失,从而增强骨健康。
短链脂肪酸如乙酸、丙酸和丁酸诱导骨吸收细胞的代谢重编程,导致糖酵解增强,从而降低破骨细胞的特异性基因,如NFATc1和TRAF6,这是骨骼稳态的有效调节因子。
肠道菌群失调会加剧COVID-19疾病的严重程度和骨质流失
Sapra L, et al., Inflamm Res. 2022
还需要在该领域进行更多研究,并对康复的 COVID-19 感染患者进行长期随访,以确定 COVID-19 引起的骨病变的机制。
★ 肠-脾轴
SARS-CoV-2 被证明可能通过 ACE-2 受体诱导脾脏的特定嗜性。人们认为脾功能障碍与其他机制一起导致B细胞和T细胞淋巴细胞减少,这是感染后COVID-19的典型特征。
与健康对照组相比,脾切除术或脾功能障碍患者的革兰氏阴性菌产物LPSs丰度较高,因此肠道微生物群组成改变是血浆LPS升高的主要原因,可能与长期COVID-19并发症有关。
下 篇
干 预 措 施
饮 食 模 式
坚持高质量的饮食模式与较低的COVID-19感染和住院风险相关
一项Meta分析纳入5项研究,包括4023663名受试者(3149784名高质量饮食者和873881名对照组)。
高质量饮食模式对SARS-CoV-2感染和住院的有效性分别为28%(95% CI 19% ~ 36%)和62% (95% CI 25% ~ 80%)。
基于不同类型的高质量饮食和COVID-19感染风险的亚组分析显示:
一项病例对照研究调查了来自六个国家(法国、德国、意大利、西班牙、英国、美国)的2884名一线医护人员的饮食模式与新冠肺炎之间的关系。
注:这些医护人员是根据与新冠肺炎患者的大量接触情况进行筛选的。这项研究依赖于主要由男性医生组成的自我报告人群,不包括受最严重COVID-19病例影响的个体。
报告食用植物性饮食或鱼素饮食(包括益生元食品在内的)的人,中度至重度 COVID-19 的几率分别降低了 73% 和 59%。
地中海饮食特征:
地中海饮食的依从性高,COVID-19严重程度和症状的可能性降低
一项横断面研究中,对 250 名年龄在 18 至 65 岁之间的 COVID-19 患者进行了检查。结果发现,对地中海饮食的依从性越高,COVID-19严重程度和症状的可能性降低,住院和康复时间缩短,炎症生物标志物也越短。
地中海饮食和COVID-19风险及相关死亡呈负相关
一项仅针对欧洲国家的生态学研究表明,地中海饮食与COVID-19相关死亡之间存在显着的负相关(r2= 0.771, p = 0.030).
一项观察性病例对照研究探讨了不同饮食模式与 COVID-19 事件和结局之间的可能关联。结果显示,病例的地中海饮食评分平均值(p=0.009)低于对照组,表明地中海饮食与COVID-19风险呈负相关。
地中海饮食有益地调节肠道微生物群和免疫系统
地中海饮食富含益生元物质,如半乳聚糖、果聚糖、纤维和菊粉。大量报道表明,这些化合物被宿主微生物使用,支持有利细菌的生长并促进有益代谢物的产生。
膳食纤维是影响复合碳水化合物对炎症影响的重要因素。研究表明,纤维消耗量的增加(约30g/d)与hs-CRP浓度的显着降低有关。膳食纤维摄入的另一个优点是对肠道微生物组组成更有利,可降低肠道和全身炎症。
多酚是地中海饮食中最丰富的次生植物化合物或植物化学物质之一,可能通过抑制NF-κB和AP-1以及激活Nrf2发挥许多抗氧化和抗炎作用。对肠道微生物群具有益生元作用。
地中海饮食:对抗冠状病毒感染的潜在策略
DOI:10.3390/medicina57121389
植物性饮食并不完全等于素食。在少量摄入动物源性食物的基础上,健康植物性饮食更倾向于新鲜蔬菜、坚果等健康的植物源性食物;而不健康的植物性饮食则更倾向于腌制蔬菜、糖等不健康的植物源性食物。
研究报告了植物性饮食是营养丰富的,包括高浓度的多酚,类胡萝卜素,纤维,维生素A,C和E,叶酸,铁,钾和镁。植物性饮食在预防高血压和心血管等疾病方面有益处。素食植物性饮食还可以增强免疫系统,减少炎症和氧化应激,并可能有助于预防慢性肾脏疾病和保持肾功能。
一项流行病学前瞻性队列研究表明,植物性食物与较低的COVID-19严重程度有关。
对来自美国和英国的五十多万参与者进行了一项研究,其中记录了 31815 例 COVID-19 病例。那些食用健康植物性饮食的人患 COVID-19 的风险降低了 10%,COVID-19 的严重程度降低了 40%.
对于年龄较大的COVID-19患者,研究人员发现,非素食饮食与COVID-19严重程度的风险较高有关。
对 2021 年 5 月至 2021 年 8 月期间在一家医疗中心被诊断为 COVID-19 的 509 名患者进行了回顾性评估。患者根据疾病严重程度分为三组。对于 ≥65 岁的患者,COVID-19 症状严重程度与坚持素食有统计学意义且呈负相关(p = 0.013).
水果、蔬菜摄入的重要性
一项针对COVID-19住院患者的横断面研究表明,水果、蔬菜和纤维的摄入量增加与 COVID-19 的严重程度、临床症状、住院和康复持续时间以及炎症标志物的浓度呈负相关。
水果和蔬菜富含纤维,是抗炎和增强免疫力的维生素,矿物质和抗氧化剂的良好来源。
为了确定饮食习惯对全球大流行期间COVID-19风险和严重程度的影响,需要进行进一步的研究。
间歇性禁食是一种潜在的补充疗法,不仅影响慢性病风险,而且有充分证据表明对传染病有影响。
SARS-CoV-2可能诱发肠道微生物群失调,导致致病菌的增殖增强,并导致有害的继发性病原体从肠道进入血流。
没有研究直接评估禁食对SARS-CoV-2感染者微生物组的影响,但由于其他观察结果,禁食塑造微生物组以支持与最佳代谢健康和低肥胖风险相关的物种,因此可以预期在预防不良变化方面产生影响。禁食期间,肠道微生物生长及其副产物(例如三甲胺N-氧化物)的产生受到抑制。
间接性禁食改变了微生物群丰度
间歇性禁食改变了各种微生物的丰度,例如脱硫弧菌科、Hydrogenoanaerobacterium、阿克曼氏菌、瘤胃球菌科等。
一项针对两种间歇性禁食(即限时进食和隔日禁食)的系统评价报道,禁食对微生物组有明显影响,例如改变厚壁菌/拟杆菌的比例,两种方案均增加了代谢保护微生物(如乳杆菌属和 Akkermansia municiphila)的丰度。
周期性禁食患者的死亡、住院和新诊断心力衰竭的风险也较低。特别是,禁食会在禁食期间急剧大幅降低葡萄糖水平,并在长期内降低基础葡萄糖水平,这在两种情况下都会使葡萄糖在感染期间减少使用,因此应该抵消SARS-CoV-2对糖酵解的刺激。
注意:禁食的安全问题包括轻微的潜在副作用,如饥饿、疲劳、头晕、便秘、头痛等,对健康的人是安全的。禁食会降低血糖,并可能导致低血糖。也可能导致脱水。2型糖尿病患者应谨慎禁食。其他安全问题可能包括身体过度紧张和营养缺乏等。
然而不可忽视的是间歇性禁食的一系列机制,使受损的人体免疫系统自我修复。在感染之前开始间歇性禁食方案可能对预防 COVID-19 等疾病的严重后果最有利。
总的来说,整体健康的饮食可能在预防SARS-CoV-2感染和降低感染严重程度方面发挥作用。需要更多的研究来证实这些发现,未来的研究应确定饮食质量与COVID-19感染风险之间关系的生物学机制。
生 活 方 式
注意,这里的运动并不是剧烈运动,特别是爬山、徒步等运动量大的活动更要注意量力而行。仍要加强健康监测。
刚阳康后需要进行一个休息阶段,尤其是老年“阳康”者,建议可循序渐进,先进行低等强度的温和运动,如适当散步、拉伸等。可以配合一些温和的养生方法,例如广播操,太极拳,八段锦等。
⇘⇘
太极拳作为中国传统运动之一,其特点是动作连贯、柔和,既能增强体质,调和身心,又能改善肺功能,避免运动时的呼吸短促。太极拳作为一种慢性病辅助治疗方法,已被临床证实能改善和缓解慢性阻塞性肺病。慢性阻塞性肺病,是一种常见的导致呼吸困难的慢性肺部疾病,被认为是COVID-19患者病情恶化的一个风险因素。
一项Meta分析共纳入11项随机对照实验,共纳入708名慢性阻塞性肺疾病患者。中期(3-6个月)或长期(12个月)太极拳运动对改善肺通气功能有效,且对改善慢性阻塞性肺疾病患者肺通气功能效果而言,干预时间在12个月以上的太极拳运动相较于中期运动更明显。
太极拳的简单易操作更容易让疫情期间老年人群体做出选择,同时也因为负荷量小更能够保证老年人的锻炼需求,从而达到免疫力提升的效果。
⇘⇘
八段锦具有运动强度小、动作幅度舒缓等特征,符合新冠肺炎患者年龄偏大、身体乏力、行动不便的需求,对于预防期新冠肺炎的发生以及预后呼吸功能的回复具有很好的预防和恢复作用。
90名亚健康状态学生为研究对象,随机分为对照组、散步组、八段锦组,30例/组。结果:八段锦组亚健康恢复率为50.00%(15/30),高于对照组的13.33%(4/30)和散步组的30.00%(9/30),差异有统计学意义(P<0.01). 八段锦练习能够显著改善亚健康状态,提高亚健康恢复率,且效果优于日常散步活动。
吸烟被认为与不良疾病预后有关,因为大量证据强调了吸烟对肺部健康的负面影响。吸烟会增加肺部感染的风险和严重程度,因为它会损害上呼吸道并降低肺部免疫功能。
吸烟已被证实是 COVID-19 负面进展的一个危险因素,尤其是在疾病严重程度和死亡方面。
Meta分析纳入 40 项研究,目前吸烟和以前吸烟都会显著增加疾病严重程度的风险(分别为:OR=1.58;95%CI:1.16–2.15,p=0.004;OR=2.48;95%CI:1.64–3.77,p<0.001),表现出中度异质性。
前吸烟者患疾病严重程度的几率是从不吸烟者的 1.58 倍。前吸烟者患疾病严重程度的几率是从不吸烟者的 2.48 倍。
同样,目前吸烟和以前吸烟也会显著增加死亡风险(分别为OR=1.35;95%CI:1.12–1.62,p=0.002;OR=2.58;95%CI:2.15–3.09,p<0.001;),并出现中度异质性。
对于死亡结果,当前和以前吸烟也分别使死亡风险显著增加 1.35 倍和 2.58 倍。
冥想练习调节注意力和情绪,向外关注特定的身体和感官刺激,向内转向精神体验和身体体验的躯体感觉。
由于冥想对包括抑郁症、焦虑症、慢性疼痛和药物滥用在内的精神病理学的特定领域产生积极影响,以及它与注意力障碍、创伤性压力、饮食失调和严重精神疾病的关联,冥想越来越多地被纳入心理健康干预措施。
与当地招募的对照组相比,长期冥想的佛教僧侣的肠道微生物群组成发生了显著变化。在属水平上,普氏菌属和拟杆菌属在冥想组中显着丰富。根据 LEfSe 分析,两个有益细菌属(巨型单胞菌属和粪杆菌属)在冥想组中显着增加。功能预测分析进一步表明,包括聚糖生物合成、新陈代谢和脂多糖生物合成在内的几种途径在冥想组中显着丰富。
这种改变的肠道微生物群组成可以降低焦虑和抑郁的风险,并改善身体的免疫功能。生化标志物概况表明冥想可以降低心身医学中心血管疾病的风险。这些结果表明,长期深度冥想可能对肠道微生物群产生有益影响,使身体保持最佳健康状态。
来自麻省理工学院、加州大学圣地亚哥分校、乔普拉综合研究图书馆和哈佛大学的研究人员探索后认为,某些冥想、瑜伽体式(姿势)和调息(呼吸)练习可能是治疗和/或预防SARS-CoV-2感染的有效辅助手段。
来自 13 个国家的 44 项研究,共 4023 人,时间范围从 20 到 4800 分钟不等。主要研究结果表明,瑜伽、冥想和调息,无论是单独使用还是组合使用,都可以通过调节抗炎和促炎生物标志物来有效提高健康和临床人群的免疫力,可能有效降低 IL-6、皮质醇和 TNF-α 患者的水平。
⇘⇘
晒太阳
时间可以选择在11点-15点,晒5-30分钟,尽量不隔着玻璃,夏季应注意避开紫外线最强的时候。
2022 年 1 月发表在《韩国家庭医学杂志》上的一项研究着眼于气候如何影响 COVID-19。研究人员发现,当涉及较高的湿度、气温和暴露在阳光下时,COVID-19 病例较少。
⇘⇘
卫生措施
阳康后依然有必要进行日常的防护措施,包括出门戴口罩,回家后勤洗手。
衣服上的病毒会传染吗?
2020 年 11 月发表的一项研究发现,虽然活病毒在皮肤上存在长达四天,但在衣服上,病毒存活不到八小时。
美国疾病控制与预防中心指出,COVID-19 主要通过三种方式传播:
受污染的衣服(或其他材料)不被视为主要传播方式。
马里兰州约翰霍普金斯健康安全中心资深学者、传染病专家认为,病毒的生长和存活在很大程度上取决于环境条件——温度和湿度。总的来说,衣服不是 SARS-CoV-2 的“主要传播媒介”。
衣服上的病毒可以被洗掉吗?
莱斯特德蒙福特大学的研究表明,使用洗涤剂在洗衣机中用热水洗衣服可以完全消除病毒。
⇘⇘
保暖
此外,天气寒冷时去户外应注意防寒保暖,天气寒冷时可适当减少外出。
以上是针对饮食、生活方式的调整,是所有调理方式的基石。当然可能还有许多没有列举出来的其他健康的生活方式,可以慢慢探索,找到一种适合自己的健康的生活方式,“病毒”就难以伤害你。
肠道菌群对免疫调节至关重要。针对肠道菌群的干预措施可能对COVID-19患者产生全身性有益作用。
益生菌和益生元是我们饮食中会影响微生物组的两个组成部分。营养状况和饮食在COVID-19中起着至关重要的作用,主要是由于肺和肠道微生物群之间的双向相互作用。
下图描述了人体肠道和肺部之间的相互作用以及益生菌和益生元引发的潜在阳性免疫反应。
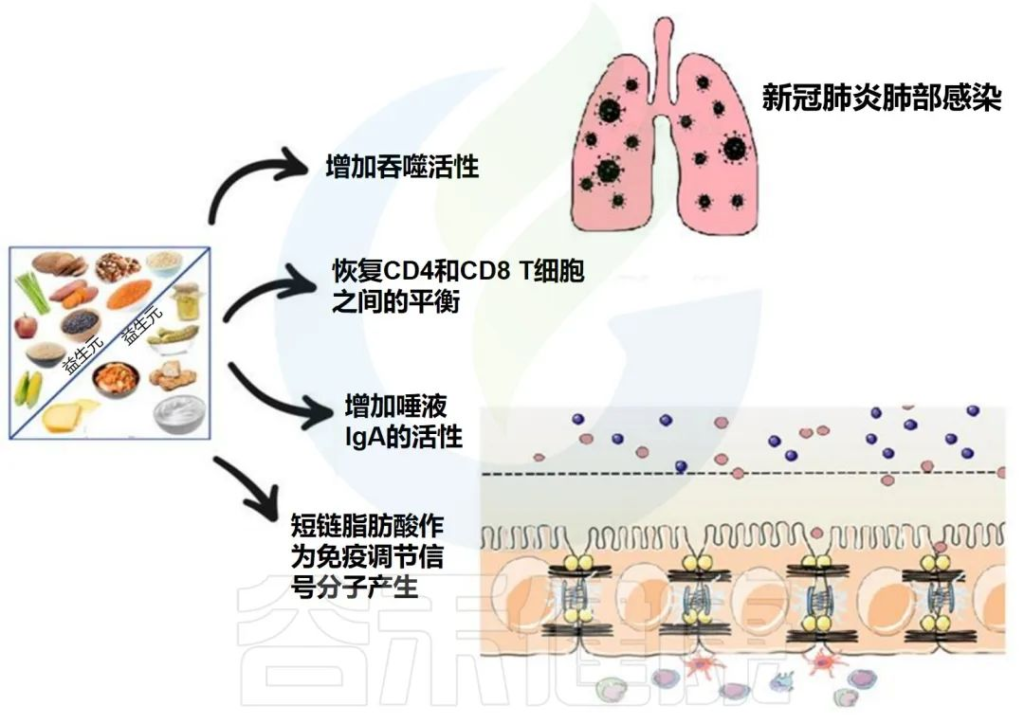
doi.org/10.3390/metabo12100912
益生菌和益生元都可以增强巨噬细胞的吞噬活性,平衡T细胞免疫以有利于更多的调节状态,增加唾液IgA的活性,并通过产生短链脂肪酸作为重要的信号分子,来发挥免疫调节细胞外和细胞内功能。
在临床研究中,使用益生元和益生菌操纵肠道微生物群是治疗肺部疾病的一种有前途的方法。
国家卫生健康委员会和国家中医药管理局指南建议重症COVID-19感染患者在常规治疗的同时食用益生菌,以改善肠道菌群平衡并预防继发细菌感染。
益生菌可能会改变肠道微生物群的组成,并在维持肠道微生物群的生态系统中发挥至关重要的作用。
益生菌通过调节肠道菌群有助于COVID-19治疗
益生菌有利于增强上皮屏障功能和改善肠道微生物多样性。此外,益生菌可对抗和阻断肠道中的有害细菌菌株或增强有益的信号通路。
尽管细菌引起的免疫反应与病毒引起的免疫反应相对不同,但许多临床研究得出结论,益生菌有助于治疗COVID-19。
注:已有超过 25 项注册临床试验旨在调查益生菌给药对 COVID-19 管理的生物学和治疗作用。
在迄今为止发表的有限试验中,关于益生菌给药的主要发现是:症状的更快改善,疲劳减少,并可能解决胃肠道问题。
已发表的研究:服用益生菌对COVID-19及其相关后遗症的影响

编辑
doi: 10.1016/j.clnesp.2022.08.023
益生菌通过调节宿主免疫系统带来益处
除了改善肠道微生物平衡外,最近的证据表明,益生菌还可以通过调节宿主免疫功能对宿主产生有益作用。一些研究报告了益生菌与ACE2相互作用的潜力,ACE2是SARS-COV2 进入宿主的受体。
例如,据报道,几种益生菌(主要是益生菌乳酸菌)在牛奶发酵过程中释放出对ACE2具有高亲和力的肽。同样,益生菌也可能通过ACE2途径改善呼吸道感染。
益生菌还可以提高肺免疫系统中自然杀伤细胞(NK细胞)、I.型干扰素、T和B淋巴细胞以及APC的水平。
注:NK细胞在针对病毒感染的早期免疫反应中起重要作用,主要是通过清除病毒感染。
先前的一项研究表明,益生菌会改变IL-10的表达并降低炎性细胞因子的表达。
益生菌还抑制其他促炎细胞因子,如TNF-a、CRP、IL-1b、IL2、IL-6、IL7、MCP1和LDH等。
益生菌通过细菌素抑制病毒与其受体的结合
除了抗炎作用、免疫调节和调节微生物组的机制外,益生菌还可以通过细菌素抑制 SARS-CoV-2 与其受体的结合。
益生菌植物乳杆菌(LPG)的独特菌株可以通过增强干扰素信号传导和抑制凋亡和炎症途径,在有效阶段和记忆阶段促进SARS-CoV-2特异性免疫反应。
由植物乳杆菌等益生菌分泌的植物素等细菌素参与抑制SARS-CoV-2的进入和复制
doi: 10.1016/j.clnesp.2022.08.023
分子对接研究预测,植物素结构可能通过靶向S蛋白或结合RNA依赖RNA聚合酶(RdRP)来阻碍病毒的进入,从而阻碍基因组的转录。
植物乳杆菌的PlnE和PlnF可以通过在解旋酶的ssRNA或ATP结合位点结合来抑制SARS CoV-2复制。
益生菌并不是治疗COVID-19的灵丹妙药,益生菌的功效和安全性在文献中存在争议,例如在接受Bacillus clausii 治疗的免疫功能低下患者中出现了菌血症等现象。因此,对一个病人有益的配方可能对另一个病人有害。还需要进行更多的研究。
此外,在推断临床试验结果时,重要的是要意识到混淆因素,如不同年龄组,不同免疫系统状态,不同季节,益生菌的成分,剂量,营养状况,正在服用的其他补充剂等。因此,也可能需要根据症状进行调整。
更有针对性的方法,包括肠道菌群检测等措施,以充分了解微生物群的作用及其在饮食和外部应激源之间的相互作用,以对抗SARS-CoV-2感染,可能会带来个性化治疗,以便益生菌能给每个需要的人带来真正益处。
益生元包括多不饱和脂肪酸、抗性淀粉、阿拉伯寡糖、低聚糖、果聚糖、低聚糖、半乳甘露聚糖、车前子、蔗糖乳糖、乳糖酸、多酚等。
大多数益生元是从植物多糖中合成或分离的,是低聚糖,例如:
含有益生元的食物,如纤维、低聚糖和多酚,可以改善细菌的生长。例如,富含菊粉的饮食刺激双歧杆菌和拟杆菌的生长;全麦谷物可以改变细菌谱,增加双歧杆菌和乳酸杆菌的相对数量。
益生元以与益生菌类似的方式调节肠道微生物群,从而抑制病原体并刺激免疫系统。同样,益生元通过直接和间接机制,对免疫系统和宿主的健康产生有益的改变。
益生元为益生菌的生长提供能量
此外,益生元选择性地刺激益生菌的有利生长并增强益生菌的活性。益生元通过增强益生菌的生长和生存能力,对 COVID-19 感染具有潜在作用。益生元也可能通过阻断ACE2对COVID-19引起的胃肠道症状产生潜在影响。
益生元明显降低了促炎IL-6的水平,这似乎是迄今为止描述的COVID-19严重预后的主要原因,并改善了抗炎IL-10的水平。
母乳低聚糖:在COVID-19中的潜在应用
母乳低聚糖在母乳中固体成分的比例排名第三。母乳低聚糖可以发挥多种功能,即抗感染(针对细菌和病毒),信号传导,抗炎/免疫调节和益生元作用。
母乳低聚糖对抗SARS-CoV-2的潜在作用模式
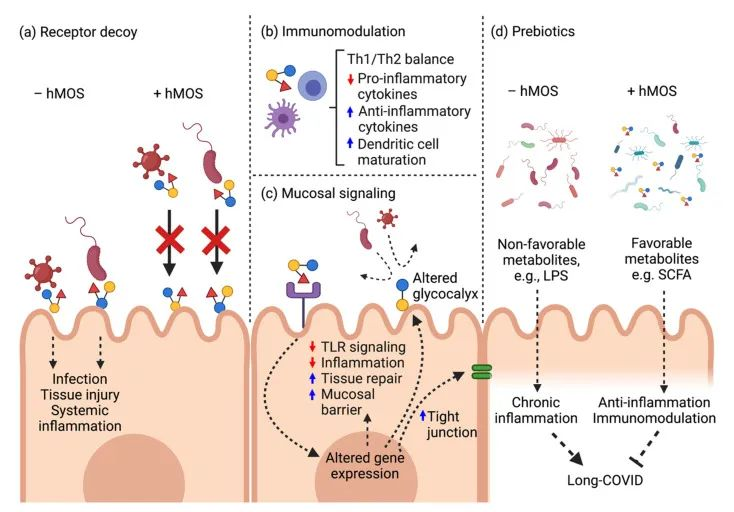
doi: 10.3390/biomedicines10020346
a) 母乳低聚糖分子结构类似于HBGA,并充当受体诱饵以阻止病毒进入。
b) 母乳低聚糖诱导局部防御和免疫调节。
c) 母乳低聚糖减弱TLR4介导的信号通路以维持粘膜稳态。
d) 母乳低聚糖在长新冠中缓解肠道菌群失调并恢复健康的肠道微生物群。
地中海饮食多酚:对 COVID-19 引起的炎症的潜在用途
研究人员发现,地中海饮食中存在的主要酚类化合物作为COVID-19预防/治疗剂的潜在用途,基于其抗氧化和抗炎作用。
目前的证据支持羟基酪醇、白藜芦醇、黄酮醇(如槲皮素)、黄烷醇(如儿茶素)和黄烷酮可能对 COVID-19 产生的潜在益处。
茶多酚:具有抗病毒固体和抗氧化特性,可能有助于降低出现严重COVID-19症状的风险
肠肺轴在SARS-CoV-2感染中起着重要作用,因此靶向肠肺轴治疗COVI-19尤为重要。茶多酚被认为是多功能生物活性分子,除了抗菌和调节肠道菌群以增强免疫功能外,还具有抗病毒作用。因此,茶多酚对COVID-19具有潜在的预防和治疗作用。
茶多酚降低 COVID-19 合并症风险

DOI:10.3389/fnut.2022.899842
茶多酚可以促进肠道中有益细菌的生长,并抑制肠道中病原微生物的生长,从而调节肠道菌群的组成。
研究人员研究了茶多酚对回肠损伤和肠道菌群紊乱的治疗和预防作用。结果表明,茶多酚可以减少炎症和氧化应激标志物,提高抗氧化酶和紧密连接蛋白的水平,有效改善肠道菌群失衡,减少对肠粘膜的损害,增强机体免疫力。
使用茶多酚预防和治疗COVID-19并发症
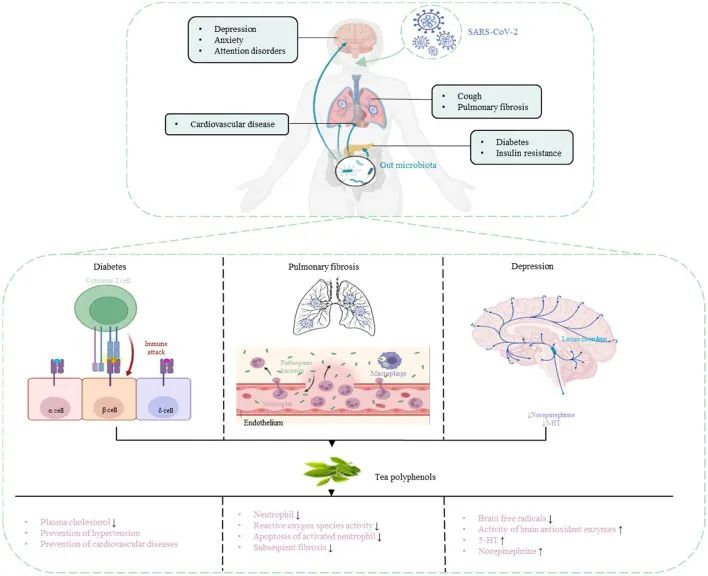
DOI:10.3389/fnut.2022.899842
在一项针对200名医护人员的随机双盲试验中,每天六粒胶囊(包括378毫克儿茶素和270毫克EGCG)持续5个月,在预防流感病毒方面优于安慰剂。
注意:在确定使用茶多酚治疗COVID-19之前,仍然需要大量实验来确认具体的药物给药(绿茶饮料、粉状绿茶提取物、儿茶素混合物、单独儿茶素)、剂量方案(不同剂量、不同治疗持续时间)和给药途径管理(饮食口服、饮料口服)。
针对COVID-19住院患者研究中,接受合生元患者临床症状缓解的比例更高
在一项针对55名COVID-19住院患者的开放标签研究中,与标准治疗组相比,接受双歧杆菌菌株和益生元的合生元配方(SIM01)4周的患者的临床症状得到缓解的比例更高(88%对63.3%),抗SARS-CoV-2的IgG抗体增加,IL-6、CCL2、M-CSF、TNF和IL-1RA等血液促炎标志物减少。
在接受SIM01的个体肠道菌群中,共生菌(如双歧杆菌、真杆菌和粪杆菌)的丰度也有所增加,而机会致病菌(如大肠杆菌和拟杆菌)的丰度则有所下降。
合生元配方 SIM01 可加速针对 SARS-CoV-2 的抗体形成,降低鼻咽病毒载量,减少促炎免疫标志物,并恢复住院 COVID-19 患者的肠道生态失调。
合生元辅助治疗两周可以有效调节针对COVID-19感染的炎症反应
一项随机安慰剂对照试验招募了 78 名确诊 COVID-19 感染的住院患者。干预组和对照组分别每天两次接受合生元或安慰剂胶囊,持续两周。
注:合生元胶囊含有多种菌株益生菌,如鼠李糖乳杆菌 、瑞士乳杆菌、干酪乳杆菌、乳双歧杆菌、嗜酸乳杆菌、短双歧杆菌、保加利亚乳杆菌、长双歧杆菌、植物乳杆菌、双歧双歧杆菌、格氏乳杆菌和嗜热链球菌,以及低聚果糖益生元剂。
结果发现:
后生元:在宿主中具有生物活性的微生物的非活细菌产物或代谢产物。也有研究人员称之为“幽灵益生菌”、“灭活益生菌”、“非活性益生菌”等。
短链脂肪酸、微生物细胞组分、功能蛋白、细胞外多糖(EPS)、细胞裂解物、替胆酸、肽聚糖衍生的多肽和毛状结构等多种代谢产物都算后生元。
后生元对抗 COVID-19 的抗病毒机制可以与以下作用相关联:
(a) 抗病毒抑制代谢物的产生
(b) 改善肠上皮衬里屏障功能
(c) 调节先天性和适应性免疫系统
(d) 对肠脑轴的影响
(e) 缓解继发性真菌感染
各种后生元对肠道屏障完整性的调节
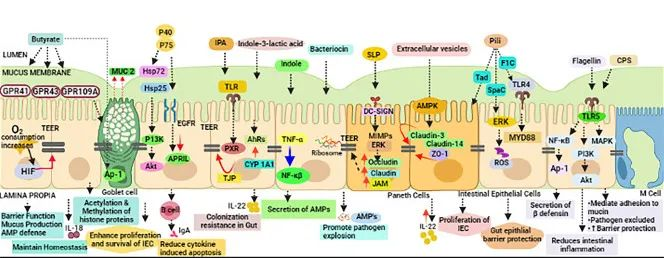
doi: 10.1007/s12602-021-09875-4
人们越来越热衷于利用益生菌,尽管由于宿主微生物组和侵入性病毒之间的固有复杂性和串扰,其详细的作用机制仍在研究中。后生元在降低致命的SARS-CoV-2感染严重程度方面可能比益生菌具有显着优势。
然而从治疗和调节的角度来看,还有一些关键问题需要回答,例如:最适合提取它们的方法,它们在宿主内的有效传递方法,它们的稳定性和保质期,后生元商业化的生物处理策略等。
未来,根据病原体变异的流行情况,将后生元用作个性化疗法或许是一种可行的选择。基于后生元在增强或调节个体免疫力方面的作用,也可以探索降低对其他病毒感染的易感性或严重程度。
在粪菌移植中,来自健康供体的体外培养或粪便物质纯化的粪便或复杂微生物群落被接种到患者的肠道中。粪菌移植已证明对结肠炎、糖尿病和复发性艰难梭菌感染有效。
11名COVID-19患者中有5名报告胃肠道症状有所改善,血液免疫标志物和肠道微生物群组成有良好的改善,双歧杆菌和粪杆菌的丰度增加。
在两名合并复发性艰难梭菌感染的 COVID-19 患者中,FMT 治疗似乎是安全的,并且 COVID-19 相关呼吸道症状在 FMT 后 1 个月内迅速消退。
一项注册临床试验(ClinicalTrials.gov 标识符号 NCT04824222),试图验证粪菌移植作为免疫调节风险降低剂,在与细胞因子风暴和炎症升级相关的COVID-19疾病进展中的功效。
对照组接受标准的药物治疗,而实验组也接受口服FMT,剂量为30–50,双层,耐胃酸,肠溶性冷冻60-g胶囊。
➳ 主要的结果指标是:
给药后第30天安全试验组的不良事件发生率。
➳ 另一个结果指标是:
研究组和对照组中需要升级无创氧疗方式的患者百分比
如增加FiO2、给予高流量鼻插管氧治疗(HFNOT)、持续气道正压(CPAP)或有创通气、呼吸机和/或ICU住院治疗,对应于新冠肺炎表现状态量表中5-7级疾病恶化。
这个试验仍在进行中。然而,考虑到肠道微生物群在免疫调节中的重要作用,研究人员认为FMT是抑制新冠肺炎诱导的细胞因子风暴和炎症的一种可能的治疗选择。
益生菌、益生元和FMT旨在增加有益细菌的丰度,而抗生素则用于抑制有害微生物群的丰度。世卫组织建议,患有可能患有严重急性呼吸道感染(SARI)和败血症的COVID-19患者可能需要广谱抗生素,这可以覆盖尽可能多的致病菌。
密歇根州38家医院新冠肺炎患者的随机数据显示,至少50%的患者接受了早期经验性抗生素治疗。抗生素在危重症患者中的应用也占很大比例,并在抑制患者继发感染方面发挥关键作用。
然而,抗生素治疗可以不加区别地消除正常的共生微生物群,同时消除病原体,导致肠道菌群失调。
与健康对照组相比,新冠肺炎患者的抗生素治疗对肠道微生物群有显著影响,有益于宿主免疫的共生菌较少,包括粪杆菌、粪球菌和直肠真杆菌,而铜绿假单胞菌和分枝杆菌,这已被证实与新冠肺炎的严重程度增加呈正相关。
特别是在疫情期间,抗生素的使用面临巨大挑战。
在早期大流行中,抗生素被普遍使用。一项荟萃分析估计,全球四分之三的新冠肺炎患者曾服用过抗生素,这一比例明显高于新冠肺炎中细菌合并感染的估计发生率,后者仅为8.6%。
45名中度新冠肺炎患者的临床结果显示,服用和未服用抗生素的患者之间没有差异,这表明抗生素对改善新冠肺炎的临床结局并无益处。
据报道,在住院期间接受抗生素治疗的新冠肺炎患者出现明显的肠道失调,抗生素诱导的肠道失调损害了人类对季节性流感疫苗的免疫反应。
一项对200名新冠肺炎患者的纵向研究表明,新冠肺炎爆发前一年抗生素摄入量的减少与疾病严重程度的减轻和SARS-CoV-2的快速清除有关。
因此,抗菌药物管理对于预防抗生素诱导的失调、严重的新冠肺炎和新冠肺炎患者的抗菌药物耐药性风险至关重要。抗菌治疗必须有明确严格的适应症,应谨慎选择病原学检测后敏感的抗生素,并根据患者的具体情况适当调整用药时间。
➤ 多 酚
多酚是源自植物的酚类化合物,富含抗氧化和抗炎特性。膳食多酚大致分为四类,包括酚酸、木脂素、二苯乙烯和类黄酮。
有大量证据强调了多酚对肠道的益生元作用。这可能有助于纠正据报道由SARS-CoV-2感染引发的肠道微生物群的生态失调。
——槲皮素
槲皮素被认为有助于预防严重的COVID-19症状,因为它具有已知的抗炎、抗氧化和免疫调节特性。分子对接和体外研究通过多种机制揭示了强大的抗病毒潜力,包括阻止与ACE2受体的附着和阻断病毒复制。
槲皮素的临床试验结果很有希望。在一项随机、开放标签试验中,研究人员测试了用向日葵磷脂配制的槲皮素提高吸收的有效性。
与标准护理相比,槲皮素组的住院风险降低了68.2%,住院时间缩短了76.8%,对氧气治疗的需求减少了93.3%。此外,槲皮素组没有患者入住ICU或死亡,对照组分别有10.5%和3.9%的患者入住ICU或死亡。同一组的进一步随访研究证实,槲皮素显著改善了病毒清除率,缩短了症状时间,改善了炎症标志物,与对照组的19%相比,槲皮素组的57%在7天后完全康复。
最近的一项小型研究证实了这些结果。槲皮素组的炎症标志物和住院时间显著减少。此外,槲皮素组入住ICU的患者数量减少,ICU天数减少,无死亡,而对照组有3例死亡。在所有情况下,这些结果都接近显著性,但很可能由于样本量小而没有统计学意义。
虽然缺乏大型临床试验,存在局限性,上述研究仍显示了症状减轻、进展至严重疾病和死亡率方面的益处。鉴于槲皮素在短期服用时具有良好的安全性,以及其广泛的可用性和众多其他健康益处,可以与患者讨论使用。
槲皮素可以从几种水果和蔬菜中获得,如浆果、芦笋,红叶生菜、洋葱、苹果、莳萝、萝卜、刺山柑、香菜、银杏叶、葡萄、葱、西红柿、西兰花、青椒、豌豆等。也可以从含有槲皮素或其一些合成衍生物的补充片剂中补充。
——姜黄素
姜黄素是姜黄中存在的生物活性化合物,具有多机制作用模式。
它可以抑制病毒进入细胞,包裹病毒和病毒蛋白酶。它调节各种信号通路。
姜黄素可能在治疗 COVID-19 感染中发挥有益作用,因为它能够调节负责 SARS-CoV-2 在许多器官(如肾脏、肝脏和心血管系统)中的附着和内化的各种靶点。它还可以抑制COVID-19感染时触发的纤维化相关通路和肺水肿。
研究表明,口服姜黄素可降低死亡率、恢复时间、对氧气的需求、机械通气、住院时间以及存在几种炎症标志物。
在三项安慰剂对照试验中,每天服用160 mg纳米姜黄素或1050 mg姜黄素和胡椒碱的患者的死亡率分别降低了80%、50%和82%。最近的一项荟萃分析表明,姜黄素治疗患者的死亡率总体降低了77%.
六项临床试验中,有五项也发现轻度、中度和重度新冠肺炎患者的症状持续时间显著缩短。
虽然还需要进行更大规模的试验,但现有数据表明姜黄素对降低新冠肺炎的严重程度非常有效。
鉴于几乎所有先前的临床试验都表明姜黄素补充剂是安全且耐受性良好的,即使剂量高达8000 mg/d,建议在症状出现时或首次阳性试验时每天服用1000 mg 较为合适。
虽然补充剂是达到试验中同等剂量的最佳方法,但用于烹饪的姜黄粉含有约3%的姜黄素。因此,一茶匙(5克)的姜黄粉含有大约150毫克。虽然姜黄素的低生物利用度一直存在问题,但胡椒碱(一种存在于黑胡椒中的化合物)已被证明可将生物利用度提高20倍,因此想要提高饮食中姜黄素摄入量的做法,可以在加姜黄粉的同时加入黑胡椒。
——白藜芦醇
白藜芦醇是一种多酚,白藜芦醇可能与SARS-CoV-2相互作用,至少部分是通过触发Nrf2,而Nrf2作为宿主防御机制对某些呼吸道病毒疾病(如呼吸道合胞病毒病)具有重要的调节作用。
白藜芦醇可以降低氧化应激,通过谷胱甘肽过氧化物酶的调节。这增强了谷胱甘肽的产生,并抵消了氧化应激介导的组织损伤。
白藜芦醇通过抗氧化和抗炎机制对SARS-CoV-2诱导的损害的主要潜在保护作用
doi: 10.1007/s13105-022-00926-0.
白藜芦醇通过eIF2α和NADPH氧化酶途径降低氧化应激水平。
高血压和动脉粥样硬化是新冠病毒感染的两个危险因素。在这方面,白藜芦醇调节SIRT1和Nrf2通路的能力,以及ROS的产生,导致更大的一氧化氮(NO)生物利用度。因此,白藜芦醇介导的NO增加很可能是多酚的血管扩张剂和抗血小板作用的基础,这反过来又可以减轻许多患者的COVID-19严重程度。
白藜芦醇在内皮细胞中积累,由于其潜在的抗血栓作用,能够保护内皮屏障。
由于其抗氧化活性,白藜芦醇可以减轻与ROS介导的氧化应激相关的炎症反应。较低的ROS水平导致NF-κB和细胞外信号调节激酶/丝裂原活化蛋白激酶(ERK/MAPK)的抑制。
对随机临床试验的各种荟萃分析强调了白藜芦醇的抗炎作用,这可能有助于缓解新冠肺炎特有的所谓“炎症形式”。
项研究利用网络药理学方法和生物信息学基因分析探讨了白藜芦醇对新冠肺炎患者作用的潜在机制。该研究表明,白藜芦醇可以通过抑制IL-17、TNF和NF-κB信号通路来减轻SARS-CoV-2产生的过度炎症。
白藜芦醇,自然存在于不同的食物来源中,浓度较低,典型的地中海饮食,包括葡萄、红酒、浆果和坚果。
关于白藜芦醇与肠道菌群的关联详见:
——羟基酪醇
羟基酪醇,存在于橄榄中,在橄榄成熟过程中由于橄榄苦苷水解而增加。它是从橄榄叶和果实中提取出来的,在特级初榨橄榄油中含量尤其丰富。
注:橄榄油是地中海饮食中最具特色的食物之一。
羟基酪醇的抗病毒能力是众所周知的,部分原因是其抗炎作用。不同的研究表明,这种酚类化合物抑制MMP-9和COX-2酶的活性。
MMP-9循环水平升高被认为是COVID-19患者呼吸衰竭的早期指标。在急性肺损伤(例如COVID-19中发生的肺损伤)中,MMP-9从中性粒细胞中释放出来,从而产生炎症和肺泡毛细血管屏障的退化,进而促进炎症细胞的迁移,导致肺组织的进一步破坏。
羟基酪醇诱导的MMP-9抑制可以通过该途径减轻和/或部分预防COVID-19产生的肺损伤。
羟基酪醇通过抗炎机制对 SARS-CoV-2 诱导的肺泡组织损伤的潜在保护作用
doi: 10.1007/s13105-022-00926-0.
➤ 类胡萝卜素
类胡萝卜素是四萜类。它们包括由植物、藻类和细菌产生的橙色、红色和黄色有机色素。一些常见的类胡萝卜素是α-和β-胡萝卜素、叶黄素、玉米黄质和番茄红素。类胡萝卜素以其抗氧化特性和抑制ROS而闻名。
因此,低水平的类胡萝卜素与氧化应激有关。叶黄素、胡萝卜素和玉米黄质的抗病毒作用已被报道。
一些类胡萝卜素可作为维生素A的前体,与免疫调节功能直接相关。据报道,类胡萝卜素可缓解COVID-19感染期间导致肺损伤的炎症反应。
当通过饮食提供必要的微量营养素(如维生素 A、B 和 D)以及硒、锌和铜等必要质量和数量时,可以达到最佳健康状况。
随着新冠的持续,很明显,最容易感染的人是那些失去生理营养状况和免疫系统平衡的人。这种不平衡使SARS-CoV-2病毒得以发展并导致疾病的不同临床形式(无症状,轻度,中度和重度)。
SARS-CoV-2感染中个体反应的微量营养素调节
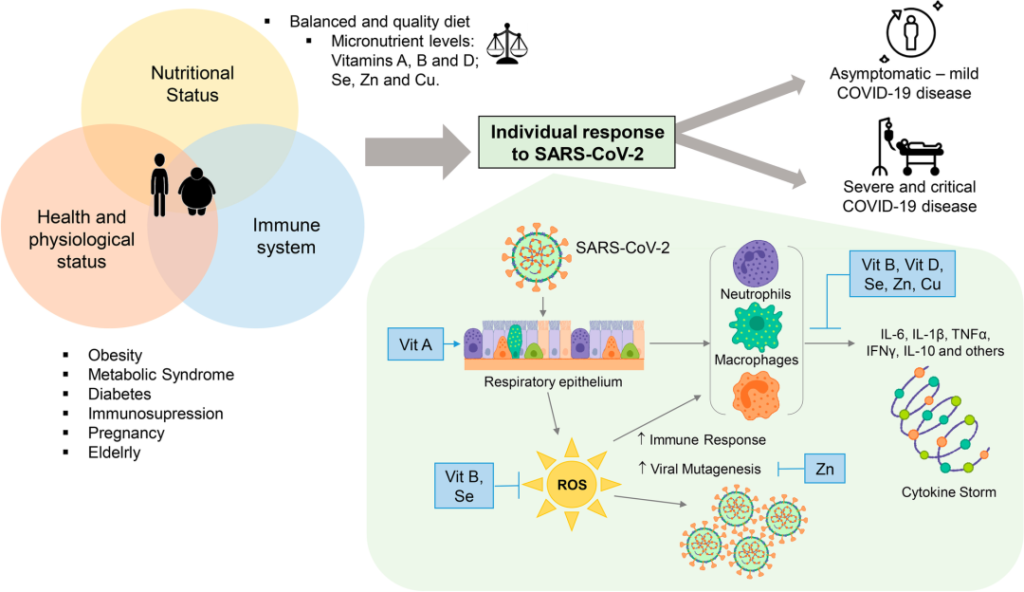
DOI:10.1007/s12011-022-03290-8
维生素A缺乏导致第一道防御屏障缺乏先天免疫的重要成分,从而增强了病毒的反应。
维生素B和硒在感染期间抵抗氧化应激的免疫和抗氧化反应中发挥作用。维生素B、D、硒、锌和铜以非常重要的方式参与,促进抑制促炎细胞因子的合成,促炎细胞素引发细胞因子风暴,从而通过抑制Th1反应和促进Th2细胞产生细胞因子来调节适应性免疫应答。
锌本身参与细胞信号转导,因此参与细胞和病毒基因表达模式,从而避免病毒突变。
➤ 维 生 素 A
维生素A,一种脂溶性维生素。是身体许多部位正常生长和功能所必需的,包括眼睛、皮肤和免疫系统。
维生素A或视黄酸在全身水平上作为一种激素,并通过核视黄酸受体(RAR和RXR)信号调节免疫系统中的I型干扰素(IFN)合成。此外,它还通过维甲酸诱导基因I(RIG-I)信号通路负责对病毒感染的永久性免疫系统反应。另外调节NF-kB的活化。
德国进行的一项多中心、观察性、横断面、前瞻性分析调查中,研究人员发现维生素A缺乏与ARDS的发展和死亡率之间存在很强的关联(OR 5.21 [1.06–25.5],p = 0.042)。
注:ARDS,呼吸窘迫综合征
该研究纳入了40名SARS-CoV-2感染住院患者,并被诊断为中度、重度和危重度ARDS。对照组由47例症状较轻且不需要住院治疗的康复患者组成,结果显示,随着ARDS严重程度的增加,维生素A缺乏症更高,康复组的维生素A缺乏症明显降低(p <0.01至p <0.001)。
最近一项针对155名老年患者(18-95岁)的研究显示,36.5%的患者缺乏维生素A (< 0.343 mg/L); 作者认为,COVID-19疾病患者耗尽了血清维生素A储存。
免疫反应机制从先天转变为适应性,阻止了维甲酸的使用,这表明炎症平衡了COVID-19严重程度和维生素A水平之间的关系。
维生素A缺乏会降低影响上皮机械屏障功能的先天免疫应答,并增强呼吸道和肠道感染。这些上皮中的粘蛋白产生受视黄酸调节;因此,中等剂量维生素A补充剂通过调节上皮生长因子和相关细胞因子的基因表达来改善屏障完整性。
食物来源:肝脏,鱼类,鸡蛋,乳制品等,还包括橙黄色蔬菜、绿叶蔬菜、西红柿、水果等。
注意:维生素 A 补充剂可能与某些类型的避孕、抗癌药物、痤疮治疗和血液稀释剂相互作用,服用任何这些类型药物的人在服用维生素A补充剂之前应咨询医生。
➤ B 族 维 生 素
B族维生素是多种细胞反应的辅助因子,介导氨基酸的合成。包括维生素 B1、B2、B3、B5、B6、B7、B9、B12等,对免疫系统对抗感染反应至关重要。
B族维生素在激活先天性和适应性免疫应答中起关键作用,下调促炎细胞因子和炎症的产生,并显著改善呼吸功能。B族维生素还可以减少胃肠道问题,预防高凝状态,并缩短COVID-19患者的住院时间。
一项研究的311名法国受试者中,与7455名健康受试者相比,SARS-CoV-2阳性患者的维生素B9摄入量较低(OR = 0.84 (0.72,0.98),p = 0.02)。
在以色列,162例诊断为重症COVID-19的患者叶酸水平低于中轻度病例(分别为9.6ng/mL vs 12.9ng/mL vs 18.2ng/mL,p=0.005),其中12%为免疫抑制,9%需要无创氧合,15%为插管。
一组来自新加坡的患者纳入了43例50岁以上的COVID-19患者,发现联合补充维生素B12、维生素D和镁入院后与疾病严重程度的降低有关。在补充的患者中,与未接受这些微量营养素补充剂的患者相比,对氧疗的需求减少(17.6 vs 61.5%,p = 0.006)和重症监护需求减少有关。
——维生素B12
维生素B12对DNA合成和调节至关重要。转钴胺素发挥其抗氧化机制,促进还原性谷胱甘肽在细胞质中的生物利用度,从而促进氧化性谷胱甘肽的合成。钴胺素由肠道微生物群产生,有助于调节肠-脑轴,防止肠道生态失调,并有利于产生适当比例的微生物代谢物。这些过程对DNA合成、细胞稳态、造血和免疫至关重要。
在生理条件下,VB12调节抗炎细胞因子和生长因子的表达,减轻全身炎症。此外,通过促进NK细胞和CD8 + T细胞的增加,提高免疫反应,调节抗病毒反应。
当维生素B12缺乏时,感染的风险更大,严重程度也会增加。
一些因素如年龄和某些药物的使用与维生素B12缺乏的风险较高有关。在老年人中,内因子(intrinsic factor)的产生减少导致B12吸收不良、营养不良或尿和肠损失增加。
二甲双胍作为2型糖尿病的治疗也与VB12吸收不良引发的缺乏有关。因此,这可能会使这些患者更容易受到感染。
➤ 维 生 素 C
维生素C在免疫功能和伤口愈合中很重要,并具有抗氧化,抗病毒和抗炎的特性。维生素C已被证明可以增加中性粒细胞向感染部位的迁移,引发活性氧(ROS)和吞噬作用的产生。
据报道,饮食中的抗坏血酸可以降低c反应蛋白的浓度。维生素C被认为通过增加干扰素蛋白的产生而表现出抗病毒活性。
维生素C被认为是严重疾病的潜在治疗方法,也是降低感染风险的预防措施,因为它能够调节免疫细胞活性并减少炎症。
小规模研究显示,在对ICU入院后24小时内循环维生素C水平的分析中发现,高达82%的COVID-19患者缺乏维生素C,许多患者的维生素C水平仅为0.1mg/dL(正常值为0.4-2mg/dL),18%的维生素C水平检测不到(低于0.1mg/dL)。
在 50 例 COVID 病例中进行了一项临床试验,其中给予了高剂量维生素C 静脉干预,结果显示 COVID 患者的氧合指数发生了积极变化。
有研究表明,高剂量(8000mg/d)口服维生素补充剂可使COVID-19恢复率提高70%.
仍需要进一步的临床试验来充分描述维生素 C 对 COVID-19 感染的影响。
维生素 C 静脉注射被 FDA 归类为药物,只有口服剂量才能被评估并用作膳食补充剂,儿童(取决于年龄)每天 400 至 1800 毫克,成人每天 2000 毫克被认为是安全的。
富含维生素C的食物包括:猕猴桃,橙子,辣椒,草莓,樱桃,苹果,西兰花,菠菜,青椒,甜菜,花椰菜等。
➤ 维 生 素 D
除了对钙的吸收和骨骼强度的强大影响外,维生素D对于维持免疫力至关重要。它还减慢病毒复制,降低炎症活动,并增加体内 T 调节细胞的数量。
维生素 D 还可以缓解传染病、感染性休克和 ARDS 疾病(由于维生素 D 水平低)等并发症,这可能有助于预防新型冠状病毒作为辅助补充剂。
维生素D通过中性粒细胞和巨噬细胞合成组织蛋白酶和防御素来提高先天免疫力。这些作用控制病毒复制,并下调肿瘤坏死因子TNFα和IFN-γ的表达。
维生素D在增强免疫力中的作用
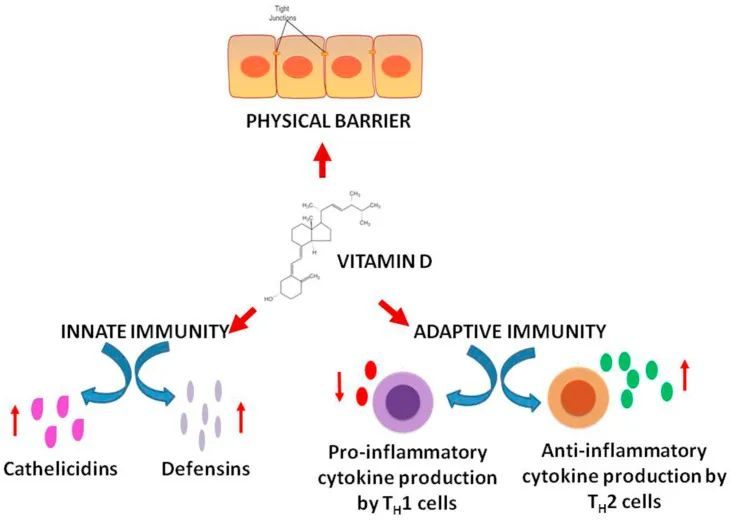
DOI:10.1016/j.clnesp.2022.04.007
低水平的维生素D(<20 ng/mL)与慢性疾病的发展和进展有关,如心血管疾病、2型糖尿病、癌症和抑郁症,也与骨骼健康不良有关。一些研究认为,维生素 D 水平低的人更容易患上 COVID-19 并患有更严重的疾病。维生素 D 缺乏会导致宿主体内的 SARS-CoV-2 病毒存活和复制。
与维生素D充足(感染率8.1%)或最高(感染率5.9%)的患者相比,缺乏维生素D的患者更有可能感染COVID-19(感染率12.5%)。
一项研究比较了中国335名COVID-19患者和560名健康志愿者的血液25(OH)D水平,发现COVID-19患者的25(OH)D浓度(中位数为26.5 nmol·L−1 [10.6 ng·mL−1])明显低于健康志愿者(中位数为32.5 nmol·L−1 [13 ng·mL−1])。
维生素D不足[具体定义为血清25(OH) D低于30 nmol·L−1 (12 ng·mL−1)]在COVID-19患者中比健康志愿者更常见。
与轻度COVID-19相比,重度COVID-19症状与最显著的维生素D缺乏相关。
土耳其的95名住院COVID-19患者,向他们补充了25-羟基维生素D,显示纤维蛋白原浓度降低,补充维生素D减少了住院时间,即使存在合并症。
在对13项研究的荟萃分析中,Pal等人计算出补充维生素D的人患严重疾病的风险降低了73%。在COVID-19发病后进行补充的研究中,风险降低最为显著(降低88%,OR 0.12)。
对SARS-CoV-2感染确诊病例的回顾性分析表明,维生素D水平低与较高的死亡风险显着相关,特别是在既往患病的老年人和男性个体中。
补充维生素D可以帮助25(OH) D水平低于25 nmol·L−1 (10 ng·mL−1) 的患者避免呼吸道感染。
补充维生素D,可以通过多晒太阳;饮食补充富含脂肪的鱼类如鲑鱼,鳟鱼,鲫鱼,金枪鱼,鳗鱼等,其他包括蘑菇,肝脏,蛋黄,新鲜水果蔬菜等。
注:冬季日照不够的情况可以通过维生素D补充剂,推荐最低剂量是每日400IU.
➤ 维 生 素 E
维生素E是一种脂溶性维生素,包括生育酚和生育三烯酚。是一种有效的抗氧化剂。可以影响免疫系统细胞,因为它具有抗氧化活性、蛋白激酶C(PKC)抑制和通过酶调节的信号转导。
在巨噬细胞中,维生素E修饰环氧化酶活性,从而控制过氧亚硝酸盐的合成。这导致前列腺素E2的产生降低,T细胞介导的T淋巴细胞反应上调。此外,它通过一氧化氮调节提高自然杀伤(NK)细胞活性。
与健康对照组相比,COVID-19患者的维生素E水平较低。
补充维生素E既往已被证明可增加免疫活性,特别是T细胞增殖,改善老年患者对疫苗接种的反应,并将老年肺炎患者的再住院风险降低63%.
维生素E来源:如小麦胚芽、葵花籽、杏仁、榛子、松子、鳄梨和甜红辣椒等。
扩展阅读:
➤ 铁
先天免疫反应精心控制铁代谢。铁稳态的破坏与感染,癌症,心血管疾病,肾脏疾病和血液疾病密切相关。
铁在病毒感染中也起着重要作用。在病毒复制过程中,需要ATP,而ATP合成需要铁。此外,铁调节素铁调素的表达增加几种细胞因子(例如,IL-6、IL-1),已知铁调素水平升高与血浆铁水平低有关(一种基于铁剥夺入侵病原体的非特异性宿主防御机制)。
注:铁调素通过结合和介导铁转运蛋白的降解来发挥其作用,铁转运蛋白是唯一已知的细胞铁输出剂,存在于肠细胞和巨噬细胞的细胞膜中,从而防止铁从这些细胞外排到血浆中。
铁缺乏在预测从轻度到重度疾病的转变方面很有价值,低血清铁水平是COVID-19患者死亡的独立危险因素。
汇总研究结果显示,COVID-19患者、严重程度状态和非幸存者的铁水平分别明显低于对照组、非严重程度状态和幸存者。
最近的研究中,与对照组(1.87±0.66mg/L)相比,COVID-19患者的血清铁(重症患者为1.33±0.7mg/L)显著降低。
此外,铁稳态的紊乱可在疾病发作后持续数月,并与肺部病变未消退和体能受损密切相关。
细胞内铁水平的升高和降低都是危险信号,分别通过NF-κB和HIF-1激活炎症和抗菌途径。
与中度病例相比,重症病例的血红蛋白、红细胞计数较低,铁蛋白水平较高,而非幸存者的铁蛋白水平高于幸存者。
铁过量也被认为是COVID-19发病机制的一个因素,因为它在活性氧的产生中发挥了作用,但更重要的可能是由于诱导非凋亡细胞死亡的铁死亡。
富含铁的食物包括:肝脏、动物血、红肉、扇贝、干、木耳、紫菜、菠菜、海带、黑芝麻、李子、桃、杏、苹果等。
扩展阅读
➤ 锌
锌是最普遍和最重要的微量元素,它参与细胞代谢的许多方面和近 100 种酶的催化活性。
它刺激适应性和固有免疫力,以及有助于维持呼吸上皮等组织屏障的抗病毒和抗炎特性。初步证据表明,ACE-2表达受Sirtuin 1(SIRT1)调节。由于锌能够下调SIRT1活性,这可能导致ACE-2表达降低,并减少SARS-CoV 2 进入细胞。
锌缺乏会阻碍淋巴细胞的产生、刺激和成熟,导致免疫功能下降。它还影响免疫介质,抑制 T 细胞、白细胞介素-2 合成以及抑制自然杀伤和细胞毒性 T 细胞活性。此外,它的缺失与更多的促炎介质有关,这可能会增加对疾病和炎症性疾病的易感性,尤其是那些影响肺部的疾病和炎症性疾病。
补充锌可能减轻COVID-19症状,因为这种金属抑制细胞内SARS-CoV 2复制的pH依赖性步骤,增加细胞内小泡的pH.
COVID-19典型的细胞因子过度产生(即“细胞因子风暴”),能够影响多个器官,似乎与短暂缺锌显著相关。
在2020年报告的一项研究显示,COVID-19患者的高剂量锌盐(每天<200毫克)改善了治疗后24小时的氧合并减少了发烧。尽管评估的病例数量很少,但这项工作确定了锌在SARS-CoV-2病毒控制和COVID-19并发症中可能产生的有益作用。
一项横断面对照研究报道,血清锌水平相对于疾病严重程度下降(中位数56.61μg/dL,n=200),重度COVID-19患者的降幅最大。
锌的典型每日剂量为15-30毫克锭剂,直接保护上呼吸道。补锌前检测确定锌水平至关重要。
➤ 硒
硒(Se)具有广泛的作用,如抗氧化和抗炎。硒在病毒感染中的氧化还原信号传导、氧化还原稳态和抗氧化防御中具有重要作用。
硒在保护呼吸系统,特别是抵御病毒感染方面发挥着重要作用。大量证据表明,硒缺乏与RNA病毒感染的易感性和不良结局有关。
硒与辅酶Q10联合使用可降低非特异性炎症反应和心血管疾病的死亡率。当与乙酰半胱氨酸一起服用时,硒有助于实现细胞内GSH(还原型谷胱甘肽)的正常水平,这是GPX(谷胱甘肽过氧化物酶是最强的抗氧化硒酶之一)的最佳水平的原因。GPX模拟依布硒(ebselen,一种合成硒化合物)是主要SARS-CoV-2蛋白酶的强抑制剂。
硒在正常免疫系统功能中的作用与其抗氧化特性和增加白细胞介素IL-2产生的能力有关,白细胞介介素IL-2具有免疫调节特性;例如,它根据当前需求刺激或抑制免疫反应。
适当剂量的硒对SARS-Cov-2感染患者的免疫系统的有益作用很重要,因为它调节IL-6的分泌,IL-6在疾病的病理生理学中起关键作用。硒的剂量建议为每天100至200µg。
➤ 铜
铜(Cu)是一种必需的微量元素,具有两种主要的生物学功能,第一种是酶的结构/催化辅因子,第二种是关键转录因子的辅激活因子。
铜转运基因参与巨噬细胞介导的宿主防御,其缺乏会降低IL-2和T细胞的增殖,并降低循环中性粒细胞的数量及其产生超氧阴离子的能力。在病毒感染和ROS启动氧化反应时,铜下调NF-κB表达,导致炎症细胞因子、趋化因子和粘附分子受到抑制。
一项对铜消费的荟萃分析显示,中国儿童反复呼吸道感染的发生与免疫功能、遗传因素和营养状况有关。在这项研究的结果中,锌和铜缺乏可能是儿童易患呼吸道感染的因素。

编辑
DOI:10.1007/s12011-022-03290-8
微量元素锌和铜之间存在拮抗作用和竞争吸收关系。当锌摄入量长期超标时,会导致铜缺乏,反之亦然。
自行服用锌补充剂的COVID-19患者,极有可能缺铜。作为一种必需的微量元素,铜是维持生物机制和细胞稳态所必需的;因此,有必要注意保持平衡。
关于微量元素的补充,应考虑锌与其他微量金属和维生素的相互作用。锌、铜、铁的吸收和生物利用度取决于元素之间的竞争,当以等比例给予时,铁和铜的吸收约减少40%。因此,过量补充锌可能导致铜或铁不足。
从目前的角度来看,除临床试验外,COVID-19中的维生素和微量元素补充剂不应超过一般人群和年龄组的推荐剂量。
药用植物,作为抗病毒、抗感染、抗炎、抗氧化、退热和肺肠道免疫增强剂,已被用于治疗与新冠肺炎相关的症状。
药用植物,在免疫刺激和维持平衡肠道微生物组中具有支持作用,可能是管理COVID-19的有效策略。
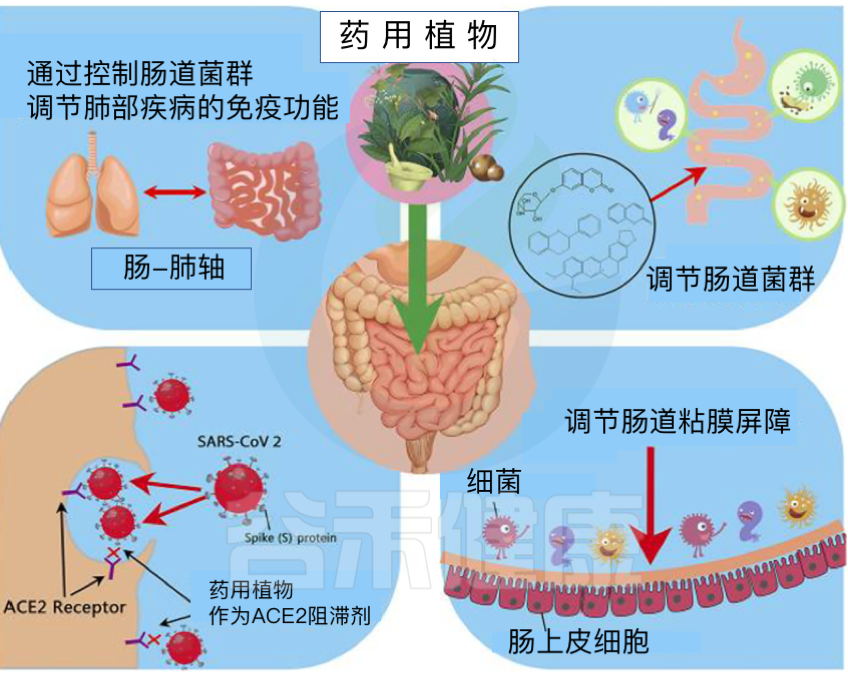
doi: 10.1186/s43088-022-00277-1.
➦ 吉 洛 伊 (Giloy,Guduchi)
由于其免疫调节特性,粉末状吉洛伊植物在前病毒期和后病毒期被彻底使用。此外,吉洛伊植物也可用作抗氧化剂,因此可以降低体内的整体氧化应激。这进一步防止了体内重要生物分子的氧化分解。
在慢性新冠肺炎感染期间,吉洛伊表现出抗炎作用,这在冠状病毒诱导的肺炎和肺部炎症中有很大的作用。血液中的氧饱和度低于正常范围,导致缺氧、疲劳,甚至死亡。
临床试验评估其对新冠肺炎确诊的无症状至轻度症状患者的疗效。91名年龄在18岁至75岁之间的患者,其中11.7%的对照组在平均1.8天后出现轻微症状,试验组没有任何其他症状。研究人员从研究中建议,Guduchi Ghan Vati可以作为无症状新冠肺炎患者的预防和治疗药物(NCT04480398)。
➦ 甘 草 (Mulethi)
由豆科甘草的根和细根组成,其活性化学成分是甘草酸。甘草是一种阿育吠陀药,以其外围和中枢作用的抗咳特性而闻名。
研究表明,甘草酸苷具有止咳作用,可以抑制咳嗽和相关的呼吸短促;也就是新冠肺炎感染的主要症状。它已被证明可以阻止被SARS感染的细胞释放HMGB1核蛋白(高运动性基盒蛋白1)。这使巨噬细胞失效,巨噬细胞在激活免疫中发挥积极作用,并负责产生促炎细胞因子。因此,避免了“细胞因子风暴”的开始及其对健康的不利影响。
在伊朗进行了一项单中心、开放标签、随机、平行组临床试验,以评估甘草对60名年龄≥18岁(体重≥35 kg)的新冠肺炎患者的抗炎作用(IRCT20200506047323N2)。
➦ 茯 苓 (Poria cocos)
其活性成分为茯苓酸。蛋白酶负责生物在宿主细胞中的复制。在冠状病毒中发现的一种蛋白酶是Mpro酶。Mpro是SARS-CoV-2的关键酶,参与介导病毒复制和转录。茯苓的主要活性成分茯苓酸与Mpro酶结合并抑制,从而阻止生物体在宿主细胞中的进一步复制和生长。
在COVID-19重症病例中,很少患者可能出现肺炎并发症,65岁或以上人群的并发症甚至更高。在这种情况下,茯苓酸的抗炎特性可以被解释为提供缓解。在一项研究中,用茯苓酸治疗肺炎大鼠肺部,结果显示通过NF-κB通路抑制炎症因子的表达。
➦ 蒙古紫云英(Mongolian milkvetch)
它由豆科黄芪的根、茎和叶组成。活性植物化学物质为黄芪甲苷、熊竹素和毛蕊异黄酮。黄芪甲苷是黄芪根、茎和叶中发现的多糖,可调节促炎因子如细胞因子、TNFα、IL-1β和NFATc4的表达,从而发挥免疫调节作用。它已被发现有助于避免细胞因子风暴的状况。
熊竹素在一定程度上也能成功抑制Mpro酶。作为一种免疫调节剂,在COVID-19的情况下,作为一种预防措施,可以使用蒙古紫云英来增强免疫力。
研究人员对小鼠血浆进行了代谢组学研究。结果表明,蒙古紫云英与人参同时食用可提高大鼠的脾、胸腺指数、脾淋巴细胞增殖和NK细胞毒活性。
➦ 其 他
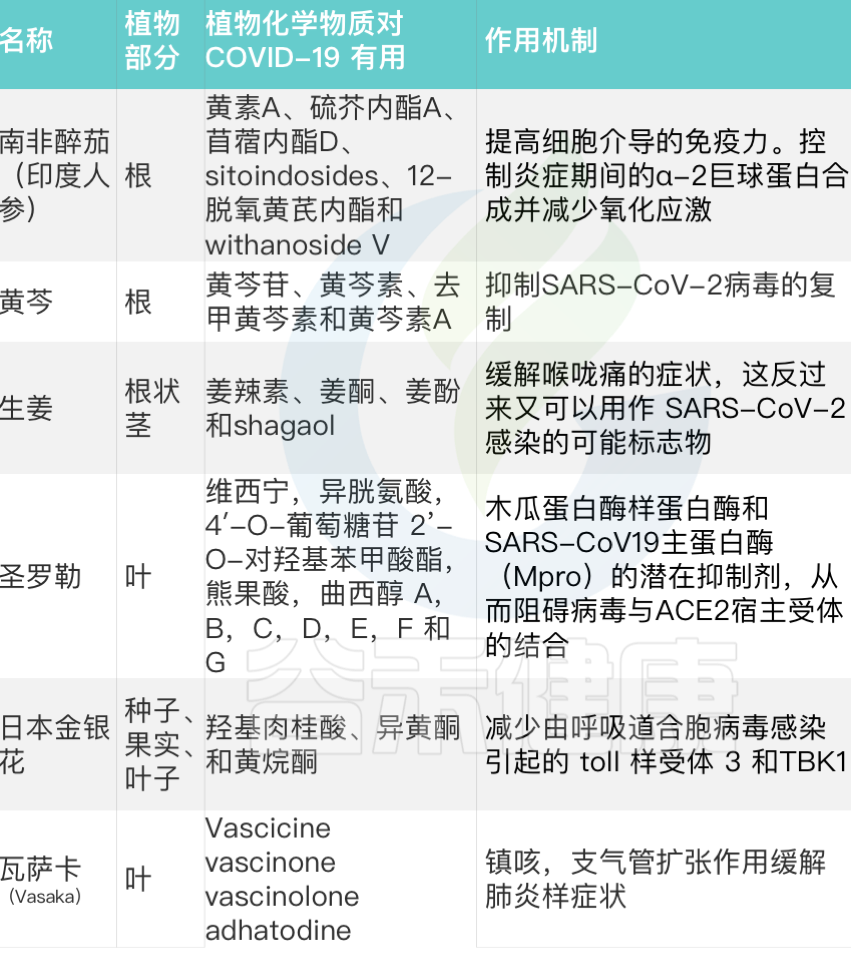
doi: 10.1016/j.ccmp.2022.100021.
改变的肠道微生物群或菌群失调可以作为全身炎症活动的调节剂,并可以通过多个肠道器官轴影响不同的器官。肠道通透性增加或者说肠漏,使细菌代谢物和毒素进入循环系统,并进一步恶化全身炎症反应,导致不同的新冠肺炎并发症。
肠道微生物群不仅显着影响COVID-19的发展和疾病的严重程度,而且还反映了COVID-19患者对长期并发症的易感性。
初步临床研究揭示了益生菌对 SARS-CoV-2 感染及恢复期的潜在调节作用。鉴于针对COVID-19的特定药物仍然是个谜,疫苗是有效的预防和控制策略;然而,病毒的持续突变加剧了这一难题。因此,通过益生菌、益生元、膳食补充剂、药用植物、FMT等多种方式,进行肠道菌群干预,是未来治疗COVID-19的有前途的补充策略。
尽管大规模临床试验有限,但相信这个领域正在发展,并蕴藏着巨大的机遇,一个个新诞生的研究可以在疫情的不同浪潮中推动微生物群的发现走向临床应用。
在此,也向一直奋斗在前线的医务工作者、在该领域辛勤耕耘的科研人员、其他相关工作者致敬。
对于个人而言,通过多种方式增强体质提高自身免疫力,是抵抗病毒侵袭的最好选择。
在新开启的2023里,希望大家都能找到属于自己的健康生活。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献:
Li M, Peng H, Duan G, Wang J, Yu Z, Zhang Z, Wu L, Du M, Zhou S. Older age and depressive state are risk factors for re-positivity with SARS-CoV-2 Omicron variant. Front Public Health. 2022 Oct 4;10:1014470. doi: 10.3389/fpubh.2022.1014470. PMID: 36268004; PMCID: PMC9576942.
Sacco C, Petrone D, Del Manso M, Mateo-Urdiales A, Fabiani M, Bressi M, Bella A, Pezzotti P, Rota MC, Riccardo F; Italian Integrated Surveillance of COVID-19 study group. Risk and protective factors for SARS-CoV-2 reinfections, surveillance data, Italy, August 2021 to March 2022. Euro Surveill. 2022 May;27(20):2200372. doi: 10.2807/1560-7917.ES.2022.27.20.2200372. PMID: 35593164; PMCID: PMC9121659.
Deng L, Li P, Zhang X, Jiang Q, Turner D, Zhou C, Gao Y, Qian F, Zhang C, Lu H, Zou H, Vermund SH, Qian HZ. Risk of SARS-CoV-2 reinfection: a systematic review and meta-analysis. Sci Rep. 2022 Dec 1;12(1):20763. doi: 10.1038/s41598-022-24220-7. PMID: 36456577; PMCID: PMC9714387.
Hansen CH, Friis NU, Bager P, Stegger M, Fonager J, Fomsgaard A, Gram MA, Christiansen LE, Ethelberg S, Legarth R, Krause TG, Ullum H, Valentiner-Branth P. Risk of reinfection, vaccine protection, and severity of infection with the BA.5 omicron subvariant: a nation-wide population-based study in Denmark. Lancet Infect Dis. 2022 Oct 18:S1473-3099(22)00595-3. doi: 10.1016/S1473-3099(22)00595-3. Epub ahead of print. PMID: 36270311; PMCID: PMC9578720.
Guedes AR, Oliveira MS, Tavares BM, Luna-Muschi A, Lazari CDS, Montal AC, de Faria E, Maia FL, Barboza ADS, Leme MD, Tomazini FM, Costa SF, Levin AS. Reinfection rate in a cohort of healthcare workers over 2 years of the COVID-19 pandemic. Sci Rep. 2023 Jan 13;13(1):712. doi: 10.1038/s41598-022-25908-6. PMID: 36639411; PMCID: PMC9837751.
Holmer HK, Mackey K, Fiordalisi CV, Helfand M. Major Update 2: Antibody Response and Risk for Reinfection After SARS-CoV-2 Infection-Final Update of a Living, Rapid Review. Ann Intern Med. 2023 Jan;176(1):85-91. doi: 10.7326/M22-1745. Epub 2022 Nov 29. PMID: 36442059; PMCID: PMC9707440.
Bowe B, Xie Y, Al-Aly Z. Acute and postacute sequelae associated with SARS-CoV-2 reinfection. Nat Med. 2022 Nov;28(11):2398-2405. doi: 10.1038/s41591-022-02051-3. Epub 2022 Nov 10. PMID: 36357676; PMCID: PMC9671810.
Davis HE, McCorkell L, Vogel JM, Topol EJ. Long COVID: major findings, mechanisms and recommendations. Nat Rev Microbiol. 2023 Jan 13:1–14. doi: 10.1038/s41579-022-00846-2. Epub ahead of print. PMID: 36639608; PMCID: PMC9839201.
O’ Mahony L, Buwalda T, Blair M, Forde B, Lunjani N, Ambikan A, Neogi U, Barrett P, Geary E, O’Connor N, Dineen J, Clarke G, Kelleher E, Horgan M, Jackson A, Sadlier C. Impact of Long COVID on health and quality of life. HRB Open Res. 2022 Apr 22;5:31. doi: 10.12688/hrbopenres.13516.1. PMID: 36101871; PMCID: PMC9440374.
Zhang F, Lau RI, Liu Q, Su Q, Chan FKL, Ng SC. Gut microbiota in COVID-19: key microbial changes, potential mechanisms and clinical applications. Nat Rev Gastroenterol Hepatol. 2022 Oct 21:1–15. doi: 10.1038/s41575-022-00698-4. Epub ahead of print. Erratum in: Nat Rev Gastroenterol Hepatol. 2023 Jan 12;: PMID: 36271144; PMCID: PMC9589856.
Sun K, Tempia S, Kleynhans J, von Gottberg A, McMorrow ML, Wolter N, Bhiman JN, Moyes J, Carrim M, Martinson NA, Kahn K, Lebina L, du Toit JD, Mkhencele T, Viboud C, Cohen C; PHIRST-C group. Rapidly shifting immunologic landscape and severity of SARS-CoV-2 in the Omicron era in South Africa. Nat Commun. 2023 Jan 16;14(1):246. doi: 10.1038/s41467-022-35652-0. PMID: 36646700; PMCID: PMC9842214.
Wang B, Zhang L, Wang Y, Dai T, Qin Z, Zhou F, Zhang L. Alterations in microbiota of patients with COVID-19: potential mechanisms and therapeutic interventions. Signal Transduct Target Ther. 2022 Apr 29;7(1):143. doi: 10.1038/s41392-022-00986-0. PMID: 35487886; PMCID: PMC9052735.
Vaezi M, Ravanshad S, Rad MA, Zarrinfar H, Kabiri M. The effect of synbiotic adjunct therapy on clinical and paraclinical outcomes in hospitalized COVID-19 patients: A randomized placebo-controlled trial. J Med Virol. 2023 Jan 5. doi: 10.1002/jmv.28463. Epub ahead of print. PMID: 36602047.
Chutipongtanate S, Morrow AL, Newburg DS. Human Milk Oligosaccharides: Potential Applications in COVID-19. Biomedicines. 2022 Feb 1;10(2):346. doi: 10.3390/biomedicines10020346. PMID: 35203555; PMCID: PMC8961778.
Nasir Ahmed M, Hughes K. Role of ethno-phytomedicine knowledge in healthcare of COVID-19: advances in traditional phytomedicine perspective. Beni Suef Univ J Basic Appl Sci. 2022;11(1):96. doi: 10.1186/s43088-022-00277-1. Epub 2022 Aug 4. PMID: 35966214; PMCID: PMC9362587.
Gang J, Wang H, Xue X, Zhang S. Microbiota and COVID-19: Long-term and complex influencing factors. Front Microbiol. 2022 Aug 12;13:963488. doi: 10.3389/fmicb.2022.963488. PMID: 36033885; PMCID: PMC9417543.
Xu L, Ho CT, Liu Y, Wu Z, Zhang X. Potential Application of Tea Polyphenols to the Prevention of COVID-19 Infection: Based on the Gut-Lung Axis. Front Nutr. 2022 Apr 14;9:899842. doi: 10.3389/fnut.2022.899842. PMID: 35495940; PMCID: PMC9046984.
Xu L, Yang CS, Liu Y, Zhang X. Effective Regulation of Gut Microbiota With Probiotics and Prebiotics May Prevent or Alleviate COVID-19 Through the Gut-Lung Axis. Front Pharmacol. 2022 Apr 25;13:895193. doi: 10.3389/fphar.2022.895193. PMID: 35548347; PMCID: PMC9081431.
Rahmati M, Fatemi R, Yon DK, Lee SW, Koyanagi A, Il Shin J, Smith L. The effect of adherence to high-quality dietary pattern on COVID-19 outcomes: A systematic review and meta-analysis. J Med Virol. 2023 Jan;95(1):e28298. doi: 10.1002/jmv.28298. Epub 2022 Nov 18. PMID: 36367218.
Pandey M, Bhati A, Priya K, Sharma KK, Singhal B. Precision Postbiotics and Mental Health: the Management of Post-COVID-19 Complications. Probiotics Antimicrob Proteins. 2022 Jun;14(3):426-448. doi: 10.1007/s12602-021-09875-4. Epub 2021 Nov 22. PMID: 34806151; PMCID: PMC8606251.
Horne BD, Bunker T. Pathogenic Mechanisms of the Severe Acute Respiratory Syndrome Coronavirus 2 and Potential Direct and Indirect Counteractions by Intermittent Fasting. Nutrients. 2022 Dec 21;15(1):20. doi: 10.3390/nu15010020. PMID: 36615679; PMCID: PMC9823718.
Hou YC, Su WL, Chao YC. COVID-19 Illness Severity in the Elderly in Relation to Vegetarian and Non-vegetarian Diets: A Single-Center Experience. Front Nutr. 2022 Apr 29;9:837458. doi: 10.3389/fnut.2022.837458. PMID: 35571931; PMCID: PMC9101048.
Karupaiah T, Lu KC. Editorial: Nutraceuticals for the recovery of COVID-19 patients. Front Nutr. 2022 Nov 14;9:1054632. doi: 10.3389/fnut.2022.1054632. PMID: 36451742; PMCID: PMC9703639.
Itsiopoulos C, Mayr HL, Thomas CJ. The anti-inflammatory effects of a Mediterranean diet: a review. Curr Opin Clin Nutr Metab Care. 2022 Nov 1;25(6):415-422. doi: 10.1097/MCO.0000000000000872. Epub 2022 Aug 30. PMID: 36039924.
Yue Y, Ma W, Accorsi EK, Ding M, Hu F, Willett WC, Chan AT, Sun Q, Rich-Edwards J, Smith-Warner SA, Bhupathiraju SN. Long-term diet and risk of Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) infection and Coronavirus Disease 2019 (COVID-19) severity. Am J Clin Nutr. 2022 Dec 19;116(6):1672-1681. doi: 10.1093/ajcn/nqac219. PMID: 35945354; PMCID: PMC9384672.
Zargarzadeh N, Tadbir Vajargah K, Ebrahimzadeh A, Mousavi SM, Khodaveisi H, Akhgarjand C, Toyos FMP, Cerqueira HS, Santos HO, Taghizadeh M, Milajerdi A. Higher Adherence to the Mediterranean Dietary Pattern Is Inversely Associated With Severity of COVID-19 and Related Symptoms: A Cross-Sectional Study. Front Med (Lausanne). 2022 Jul 19;9:911273. doi: 10.3389/fmed.2022.911273. PMID: 35928288; PMCID: PMC9343686.
Xu J, Ren Z, Cao K, Li X, Yang J, Luo X, Zhu L, Wang X, Ding L, Liang J, Jin D, Yuan T, Li L, Xu J. Boosting Vaccine-Elicited Respiratory Mucosal and Systemic COVID-19 Immunity in Mice With the Oral Lactobacillus plantarum. Front Nutr. 2021 Dec 22;8:789242. doi: 10.3389/fnut.2021.789242. PMID: 35004816; PMCID: PMC8733898.
Gualtieri P, Marchetti M, Frank G, Cianci R, Bigioni G, Colica C, Soldati L, Moia A, De Lorenzo A, Di Renzo L. Exploring the Sustainable Benefits of Adherence to the Mediterranean Diet during the COVID-19 Pandemic in Italy. Nutrients. 2022 Dec 26;15(1):110. doi: 10.3390/nu15010110. PMID: 36615768; PMCID: PMC9824251.
Ferro Y, Pujia R, Maurotti S, Boragina G, Mirarchi A, Gnagnarella P, Mazza E. Mediterranean Diet a Potential Strategy against SARS-CoV-2 Infection: A Narrative Review. Medicina (Kaunas). 2021 Dec 20;57(12):1389. doi: 10.3390/medicina57121389. PMID: 34946334; PMCID: PMC8704657.
Chavda VP, Patel AB, Vihol D, Vaghasiya DD, Ahmed KMSB, Trivedi KU, Dave DJ. Herbal Remedies, Nutraceuticals, and Dietary Supplements for COVID-19 Management: An Update. Clin Complement Med Pharmacol. 2022 Mar;2(1):100021. doi: 10.1016/j.ccmp.2022.100021. Epub 2022 Feb 5. PMID: 36620357; PMCID: PMC8816850.
Nasir Ahmed M, Hughes K. Role of ethno-phytomedicine knowledge in healthcare of COVID-19: advances in traditional phytomedicine perspective. Beni Suef Univ J Basic Appl Sci. 2022;11(1):96. doi: 10.1186/s43088-022-00277-1. Epub 2022 Aug 4. PMID: 35966214; PMCID: PMC9362587.
Renata RN, Arely GA, Gabriela LA, Esther MM. Immunomodulatory Role of Microelements in COVID-19 Outcome: a Relationship with Nutritional Status. Biol Trace Elem Res. 2022 Jun 6:1–19. doi: 10.1007/s12011-022-03290-8. Epub ahead of print. PMID: 35668151; PMCID: PMC9170122.
Li Y, Luo W, Liang B. Circulating trace elements status in COVID-19 disease: A meta-analysis. Front Nutr. 2022 Aug 12;9:982032. doi: 10.3389/fnut.2022.982032. PMID: 36034929; PMCID: PMC9411985.
Bego T, Meseldžić N, Prnjavorac B, Prnjavorac L, Marjanović D, Azevedo R, Pinto E, Duro M, Couto C, Almeida A. Association of trace element status in COVID-19 patients with disease severity. J Trace Elem Med Biol. 2022 Dec;74:127055. doi: 10.1016/j.jtemb.2022.127055. Epub 2022 Aug 4. PMID: 35985069; PMCID: PMC9349050.
Milton-Laskibar I, Trepiana J, Macarulla MT, Gómez-Zorita S, Arellano-García L, Fernández-Quintela A, Portillo MP. Potential usefulness of Mediterranean diet polyphenols against COVID-19-induced inflammation: a review of the current knowledge. J Physiol Biochem. 2022 Nov 8:1–12. doi: 10.1007/s13105-022-00926-0. Epub ahead of print. PMID: 36346507; PMCID: PMC9641689.
Sun Y, Ju P, Xue T, et al., Alteration of faecal microbiota balance related to long-term deep meditation. General Psychiatry 2023;36:e100893. doi: 10.1136/gpsych-2022-100893
Callaway E. What Omicron’s BA.4 and BA.5 variants mean for the pandemic. Nature. 2022 Jun;606(7916):848-849. doi: 10.1038/d41586-022-01730-y. PMID: 35750920.
Wang K, Gheblawi M, Oudit GY. Angiotensin Converting Enzyme 2: A Double-Edged Sword. Circulation. 2020 Aug 4;142(5):426-428. doi: 10.1161/CIRCULATIONAHA.120.047049. Epub 2020 Mar 26. PMID: 32213097.
Sapra L, Saini C, Garg B, Gupta R, Verma B, Mishra PK, Srivastava RK. Long-term implications of COVID-19 on bone health: pathophysiology and therapeutics. Inflamm Res. 2022 Sep;71(9):1025-1040. doi: 10.1007/s00011-022-01616-9. Epub 2022 Jul 28. PMID: 35900380; PMCID: PMC9330992.
Alenazy MF, Aljohar HI, Alruwaili AR, Daghestani MH, Alonazi MA, Labban RS, El-Ansary AK, Balto HA. Gut Microbiota Dynamics in Relation to Long-COVID-19 Syndrome: Role of Probiotics to Combat Psychiatric Complications. Metabolites. 2022 Sep 27;12(10):912. doi: 10.3390/metabo12100912. PMID: 36295814; PMCID: PMC9611210.
Shi Y, Li Z, Yang C, Liu C. The role of gut-brain axis in SARA-CoV-2 neuroinvasion: Culprit or innocent bystander? Brain Behav Immun. 2021 May;94:476-477. doi: 10.1016/j.bbi.2021.01.024. Epub 2021 Feb 15. PMID: 33600935; PMCID: PMC7883713.
De R, Dutta S. Role of the Microbiome in the Pathogenesis of COVID-19. Front Cell Infect Microbiol. 2022 Mar 31;12:736397. doi: 10.3389/fcimb.2022.736397. PMID: 35433495; PMCID: PMC9009446.