-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
厌氧棒状菌属(Anaerostipes)隶属于厚壁菌门下的毛螺菌科,是一类革兰氏阳性厌氧产丁酸菌,在维持宿主肠道稳态与代谢平衡中具有关键作用。
该菌属的显著特征是能够产生丁酸,并且其中的A.caccae与A.hadrus还能利用体内的乳酸与乙酸,将其转化为丁酸。一些菌株还拥有维生素B₁₂和E生物合成通路基因,或是将肌醇转化为丙酸与乙酸的代谢途径。
Anaerostipes与其他肠道内重要菌属还存在密切的相互作用。例如A.caccae可发酵由粘蛋白降解菌A.muciniphila生成的葡萄糖、甘露糖、半乳糖等粘蛋白衍生糖,产生丁酸盐、乙酸盐和乳酸盐。此外,A.hadrus通过分解低聚果糖生成的水解产物能够有效促进包括 Lactobacillus 在内的多种益生菌生长和繁殖,表现出其特有的“互利共代谢”特征。
厌氧棒状菌属中的A.hadrus被发现可代谢抗癌药5‑氟尿嘧啶(5‑FU),参与其降解或转化,这一代谢活动可能改变5‑FU在肠道中的稳定性与吸收效率,从而进一步影响其在体内的生物利用度及临床治疗效果。
Anaerostipes具有作为肠道健康和疾病生物标志物的重要潜力,其在儿童克罗恩病、胆汁淤积、结直肠癌、重度抑郁症、强迫症、食物过敏患者中丰度普遍下降,且与疾病进展、炎症及免疫调控密切相关。
深入研究Anaerostipes的生态特征及其在疾病中变化,不仅有助于揭示肠道菌群与宿主互作机制,还为微生态干预与疾病防治提供潜在的新靶点。
1
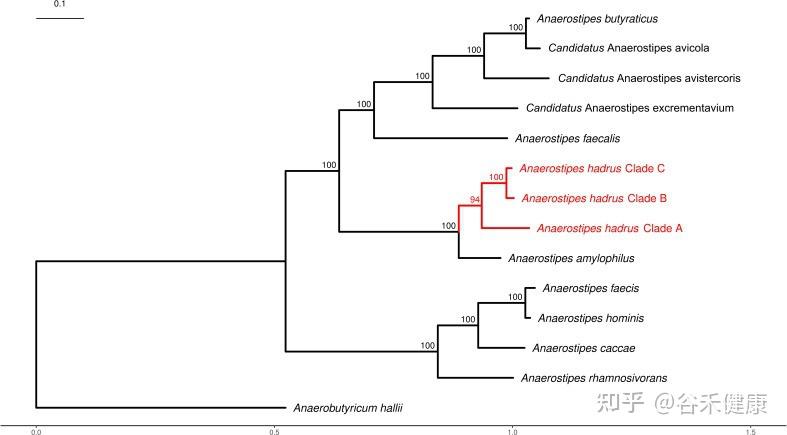
分类地位与主要菌种
厌氧棒状菌属(Anaerostipes)隶属于厚壁菌门(Firmicutes)、Clostridiales(梭菌目)下的毛螺菌科(Lachnospiraceae)。
毛螺菌科是人体肠道中重要的核心菌群,在碳水化合物代谢、短链脂肪酸(SCFAs)生成及宿主健康调控中发挥关键作用。
模式种为 :Anaerostipes caccae,其丰度受饮食膳食纤维与碳水组成显著影响;
–A. hadrus为主要优势种,呈泛基因组开放性,适应性强;
–A. rhamnosivorans:新从婴儿粪便中分离出来;
–A. butyraticus在禽类肠道中较为丰富。
DNA G+C 含量(mol%):45.5–46
Anaerostipes属的系统发育树
2
细胞及形态特征
细胞形态
–革兰氏阳性,杆状或略弯曲杆形,无运动性。
-多数为严格厌氧菌,部分可形成芽孢。
-尾端圆钝,长度约2–5μm。
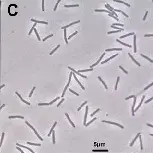
芽孢形成能力
-厌氧棒状菌属(Anaerostipes)中的A. caccae、A. hominis、A. rhamnosivorans能形成芽孢,观察到内生孢子结构。
-虽然A. hadrus、A. butyraticus、A. amylophilus 在实验所用条件下未形成可见孢子,但其基因组保留主要的孢子形成核心基因(spo0A 等)。
-芽孢具有较强的耐氧和耐热能力,部分菌株可在常温下存活数。
3
生长条件
-厌氧棒状菌属(Anaerostipes)为严格厌氧菌,最适生长温度约37°C,适宜pH为6.8–7.2。
– 代谢途径显示该属具极高适应能力,属于肠道生态系统中的“代谢枢纽”。
4
重要的代谢能力
关键丁酸生成菌
-厌氧棒状菌属(Anaerostipes)的一个显著特征是其能够产生丁酸(butyrate),这是一种短链脂肪酸(SCFA),对肠道健康至关重要。丁酸不仅为结肠细胞提供能量,还能促进肠道免疫稳态,并刺激有益菌群的生长。
-同时可生成少量乙酸(acetate)和丙酸(propionate)。
–A.caccae可利用乳酸与乙酸共生成丁酸,是肠道“乳酸清除者”。
–A.hadrus具有细胞外GH32类水解酶,可降解果寡糖(FOS)及菊粉,这种能力使其能与非 FOS 利用菌共代谢。
–A.rhamnosivorans和A.caccae具有独特的肌醇(inositol)转化途径,可将膳食肌醇厌氧代谢为丙酸和乙酸,其代谢活性与宿主血糖、胰岛素水平呈负相关。
–非溶血性,过氧化氢酶和氧化酶均为阴性。
维生素与胆汁酸代谢能力
-厌氧棒状菌属拥有胆汁盐水解酶(bsh)基因,能够去结合胆汁酸,影响宿主胆汁酸稳态。
-厌氧棒状菌属还具有维生素B₁₂和E生物合成通路基因。
5
生态学分布
-广泛存在于全球人群粪便样本中,也出现在部分哺乳动物及禽类(A.butyraticus在鸡盲肠中富集)。
-A.hadrus为人群中优势种,具有开放泛基因组特征,表明其具较高的生态可塑性。
-A.caccae丰度与饮食成分(膳食纤维、寡糖)密切相关。
6
与其他细菌和宿主的互作
厌氧棒状菌属(Anaerostipes)通过代谢共生在肠道生态系统中发挥“碳转接”和“代谢桥梁”的重要作用。
利用乳酸菌产生的乳酸生成丁酸盐
A. caccae已被证明可利用双歧杆菌和乳杆菌等共生菌产生的乳酸盐和乙酸盐发酵产物生成丁酸盐,并能分别转化双歧杆菌的l-乳酸和乳酸杆菌的d-乳酸,从而在减少乳酸积累和维持肠道菌群平衡中发挥重要作用。
利用AKK菌的粘蛋白衍生产物
另一项实验研究发现,A.caccae 可发酵由粘蛋白降解菌 A.muciniphila 生成的葡萄糖、甘露糖、半乳糖和 N-乙酰半乳糖胺等粘蛋白衍生糖,产生丁酸盐、乙酸盐和乳酸盐。A.caccae 和 A.muciniphila 之间的肠粘液层似乎存在共生交叉摄养。
此外,A.hadrus通过分解低聚果糖(FOS)生成的水解产物能够有效促进包括 Lactobacillus 在内的多种益生菌生长和繁殖,表现出其特有的“互利共代谢”特征。
Anaerostipes还与其他细菌存在相互作用,如下所示:
增强
Bacteroidales
Bacteroides
Odoribacter
Peptococcaceae
抑制
Coriobacteriales
Adlercreutzia
Collinsella
Porphyromonas
Prevotella
Clostridium
Clostridiales incertae sedis
Clostridiales Family XIII. Incertae Sedis
Blautia
Coprococcus
Dorea
Lachnospiraceae
Ruminococcaceae
Ruminococcus
Dialister
Campylobacteraceae
Erysipelotrichaceae
此外,Anaerostipes的丁酸盐与丙酸盐产物不仅为结肠上皮提供能量来源,还可:
–促进调节性 T 细胞(Treg)分化;
–抑制 NF‑κB 介导的炎症通路,
–加强肠屏障紧密连接蛋白表达。
7
耐药性
对大多数抗生素都敏感
目前关于 Anaerostipes 的耐药性研究较少,但由于其严格的厌氧特性和对特定环境的依赖,它通常不会对抗生素产生广泛的耐药性。
A. hominis 和一些 A. hadrus 菌株仅表现出编码 β-内酰胺类和多粘菌素抗性的基因,而这些基因在所有 A.caccae 基因组中都不存在。在3个物种中零星观察到与其他抗生素(如四环素、氨基糖苷类和杆菌肽)耐药性相关的基因。
整体而言,A.caccae 与 A.hadrus 均未携带主要的抗生素耐药、毒性或耐胆酸基因。其耐受性主要源于对氧化应激和低pH的内源性适应,与抗生素无关。
厌氧棒状菌属(Anaerostipes)是典型的产丁酸厌氧菌,在人类肠道生态系统中扮演了“代谢枢纽”的角色。它通过能量代谢、基质转化、宿主营养协同、免疫调节和药物代谢等多层机制,对维持肠道与全身健康具有重要意义。
产丁酸、乙酸与丙酸——肠屏障修复、抗炎与能量供应核心驱动力
厌氧棒状菌属(Anaerostipes)的代表菌如A.caccae、A. hadrus、利用乳酸、乙酸及多糖降解产物,通过乙酰辅酶A途径生成丁酸和丙酸。
√ 主要生理作用
–肠上皮能量供给:丁酸是结肠上皮细胞主要能量来源(可达 70% )。
–肠道屏障修复与增强:丁酸刺激紧密连接蛋白(ZO‑1、occludin、claudin)的表达,修复屏障结构,减少肠漏。
-抗炎与免疫调节:丁酸通过抑制 NF‑κB 信号,促进调节性 T 细胞(Treg)分化,减少促炎细胞因子(IL‑6、TNF‑α)释放。
-能量代谢优化:丙酸参与肝糖异生、乙酸供其他益菌利用,共同维持肠内碳流平衡。
这一发酵体系在维持低炎症水平、促进黏膜修复与调节全身能量代谢方面具有核心作用。
分解乳酸、肌醇等底物——维持菌群生态平衡
A. caccae与A. hadrus能使用由双歧杆菌和乳酸杆菌等生成的乳酸与乙酸共代谢,转化为丁酸。这可以避免乳酸过度积累,防止肠腔过酸化,维持pH稳定。

利用低聚果糖和肌醇:A.hadrus可水解低聚果糖,产物反过来促进乳酸菌增殖;并具备将肌醇转化为丙酸与乙酸的代谢途径,有助于调节宿主能量与脂质代谢。
对微生态的意义:通过分解中间代谢物和益生元,Anaerostipes属增强了肠道代谢网络的互补性,是稳定微生态平衡的关键成员。
维生素B12合成——宿主营养代谢支持因子
除了短链脂肪酸的产生外,某些厌氧棒状菌属还可能有助于其他重要的次级代谢物,例如维生素B12。
√ 作用意义
-肠道维生素B12供应源:为需B12菌群如甲烷菌、部分脱硫弧菌提供前体;
–宿主营养参与:B12参与脂肪酸与氨基酸代谢,与能量稳态及神经系统功能密切相关;
–互利生态效应:在共生系统中,Anaerostipes的B12产能增强了菌群代谢互补性。
药物代谢——调节宿主药物应答
√ 可代谢影响抗癌药5‑氟尿嘧啶
A.hadrus被发现可代谢抗癌药5‑氟尿嘧啶(5‑FU),参与其降解或转化,可能影响药物的生物利用度与疗效。

其机制可能涉及脱氨酶或还原酶通路对5‑FU的结构修饰,从而调节肠腔中药物浓度和毒副作用。这表明Anaerostipes在肠道药物代谢群中具有潜在作用,为利用菌株优化药效、降低毒性、实现个体化药物治疗提供新方向。
产生丁酸盐的A.hadrus可能会干扰氟嘧啶药物的疗效或减少结直肠癌患者的不良反应,这可能取决于人类宿主二氢嘧啶脱氢酶(DPD)的水平。
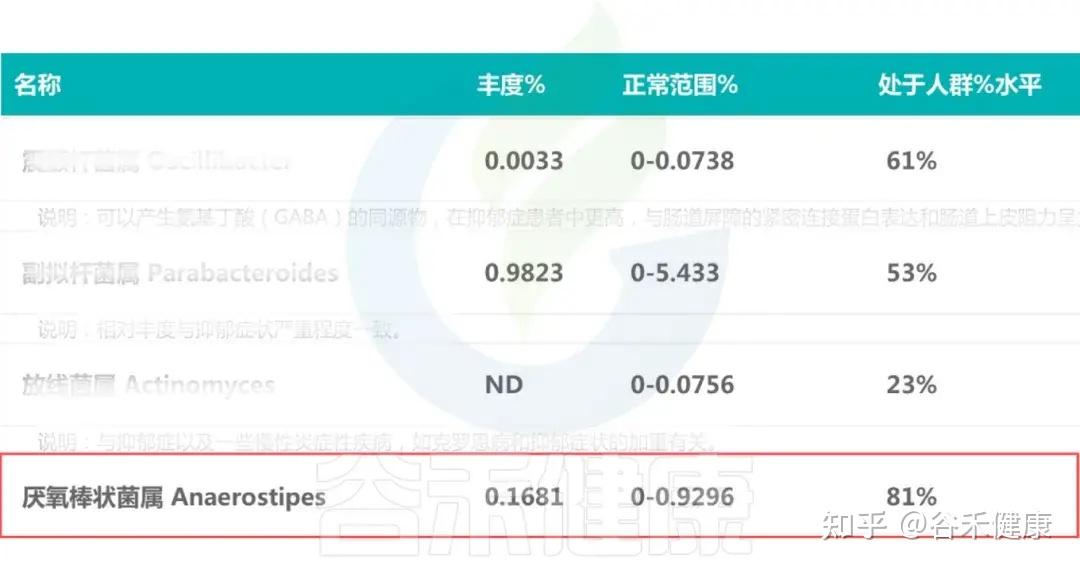
在人体肠道微生态中,厌氧棒状菌属(Anaerostipes)是重要的丁酸生成菌之一,其丰度常被视为肠道健康与代谢稳态的重要指标。
近年来的多项研究发现,不同疾病状态——包括克罗恩病、胆汁淤积、结直肠癌、强迫症、抑郁症、食物过敏等——均伴随着 Anaerostipes 丰度的显著变化。这些波动不仅反映了宿主代谢和免疫环境的改变,也提示该菌属可能在多种疾病的发生与缓解过程中发挥关键调节作用。
1
儿童克罗恩病中Anaerostipes下降

研究显示,克罗恩病患者(尤其是活动期或有高应激水平者)粪便中Anaerostipes的丰度显著下降,与健康儿童对照相比差异明显。
同时,患者中促炎或条件致病菌(如Escherichia-Shigella、Enterococcus、Ruminococcus gnavus等)增加。
2
胆汁淤积患者中Anaerostipes减少

临床与动物模型研究显示,无论是肝胆疾病(如原发性胆汁性胆管炎、药物性胆汁淤积)还是肝外胆汁阻滞,Anaerostipes的相对丰度均呈下降趋势。
这可能是由于Anaerostipes拥有胆汁盐水解酶(bsh)基因,能够去结合胆汁酸,影响宿主胆汁酸稳态。
因此,Anerostipes丰度下降不仅是胆汁淤积相关肠道菌群失衡的标志之一:一方面反映宿主胆汁酸代谢环境的毒性压力;另一方面通过丁酸减少和屏障损伤途径,放大肝‑肠轴炎症与代谢紊乱。
3
Anaerostipes在结直肠癌中减少
√ Anaerostipes随着结直肠癌的发展逐渐减少

有研究显示,从健康个体 → 结直肠腺瘤(CRA) → 结直肠癌(CRC),Anaerostipes的丰度逐渐并显著下降。
在早期腺瘤阶段,该菌种相对丰度已明显低于健康对照;在癌症阶段,其丰度降至最低水平,几乎完全缺失于部分患者样本中。
Anerostipes是主要的丁酸盐生成菌之一。其减少会导致丁酸水平下降,损害上皮细胞线粒体功能,使能量代谢从稳态转向糖酵解。同时,丁酸缺乏削弱了免疫调控和细胞凋亡诱导,使异常增殖细胞逃避免疫清除。
丁酸还能通过抑制组蛋白去乙酰化酶(HDAC)调节基因表达,当产丁酸菌减少时,HDAC 活性增强,促进癌变相关基因(如 c‑Myc、Cyclin‑D1)上调。
综上所述,Anaerostipes既是结直肠肿瘤发生的重要微生态标志,也是肠道微生物干预与癌症预防的潜在靶点。
4
强迫症患者中Anaerostipes减少

有研究收集了21名非抑郁、无药物的强迫症患者和22名年龄和性别匹配的非精神病对照者的晨间粪便和血液样本。
√ 强迫症患者中Anaerostipes等丁酸盐生产菌减少
与对照组相比,强迫症组的物种丰富度/均匀度较低(α多样性,逆辛普森)和三个丁酸盐生产属(Oscillospira、Odoribacter和Anaerostipes)的相对丰度较低。同时,患者的平均CRP水平升高(而IL‑6和TNF‑α无显著变化),且CRP与精神症状呈中至强相关。
5
肾移植受者中Anaerostipes减少

多项肾移植后微生物组研究显示,Anaerostipes丰度在移植早期明显下降,并持续低于健康对照组。
√ 肾移植受者中Anaerostipes减少,并可能导致腹泻
在肾移植受者(KTRs)中,Anaerostipes丰度显著下降,尤其在伴有肠道菌群失调及抗生素或免疫抑制剂相关腹泻的患者中更为明显。
Anaerostipes丰度下降,导致丁酸缺乏削弱上皮细胞能量供应,降低紧密连接蛋白(ZO‑1、occludin)表达,使黏膜屏障完整性受损,从而诱发腹泻。
Anaerostipes缺失与丁酸水平下降呈正相关,提示代谢失衡可能是腹泻的重要机制。
6
重度抑郁症患者中Anaerostipes减少

一项研究探讨了肠道微生物群与重度抑郁症(MDD)的关系,共招募46名活动性MDD患者(a-MDD)及45名健康对照(HC)。
√ Anaerostipes在重度抑郁症患者中丰度较低
研究发现,与健康对照相比,重度抑郁症(MDD)患者中存在相对丰度改变的细菌属:Bilophila(2 倍)和Alistipes(1.5 倍)更高,而Anaerostipes和Dialister在 MDD 患者中较低。
在重度抑郁障碍患者中,Anaerostipes显著减少,伴随丁酸合成能力下降和免疫炎症失衡。这种改变可能通过破坏肠‑脑屏障、增强神经炎症及损害神经营养调控,参与抑郁症的发生与维持。
7
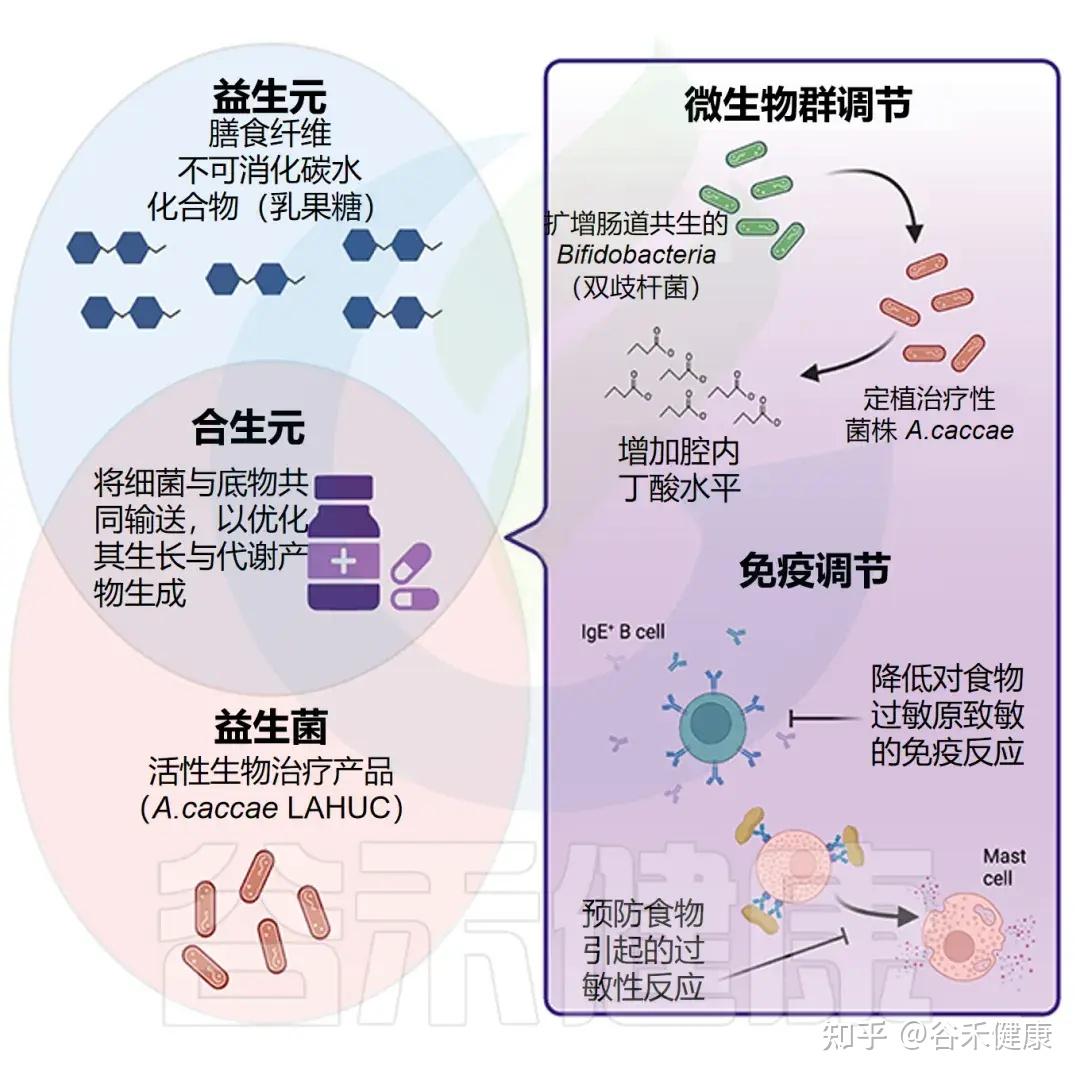
食品过敏婴儿中Anaerostipes减少

在食物过敏婴儿,尤其是牛奶过敏患者中,研究显示 Anaerostipes(特别是 Anaerostipes caccae)丰度显著下降。相反,在健康婴儿中,这一菌种丰富且与免疫耐受密切相关。
√ Anaerostipes减少可能作为食物过敏发生潜在指标
我们大胆推测Anerostipes的减少可作为婴幼儿食物过敏风险和肠道失衡的潜在标志;恢复A.caccae或其丁酸代谢活性(如补充丁酸菌、乳酸底物或膳食纤维)有望通过微生态干预促进免疫耐受并减轻过敏反应。
8
Anaerostipes在其他疾病中的丰度变化
√ 阿尔茨海默病患者中减少
研究结果显示,与健康对照相比,阿尔茨海默病患者(尤其是APOE‑ε4携带者)肠道中Anaerostipes的相对丰度显著下降。
注:APOE-ε4是载脂蛋白E(APOE)基因的一个等位基因,与阿尔茨海默病(老年痴呆症)风险显著相关。
√ 焦虑、创伤后应激人群中减少
具有焦虑、抑郁或创伤后应激特征(PTSD样表现)的人群中,Anaerostipes丰度显著下降。而在心理状态健康的对照组中,Anaerostipes 丰度明显较高,且与积极情绪和心理韧性评分呈正相关。
√ 儿童局灶性癫痫患者中减少
研究发现,儿童局灶性癫痫患者发病时肠道中Anaerostipes的丰度显著下降,与健康对照组相比明显减少。
在接受抗癫痫治疗后(尤其是病情稳定、发作频率下降者),Anaerostipes丰度明显回升,丁酸代谢通路相关活性亦随之增强。
这提示Anaerostipes的丰度与癫痫活动状态呈负相关,可能反映肠‑脑功能恢复与神经代谢平衡的改善。
√ 慢性疲劳综合征中减少
研究发现,慢性疲劳综合征(CFS)患者肠道中Anaerostipes相对丰度显著下降,与健康对照相比变化明显。
该菌的降低与患者的疲劳严重程度和认知功能障碍评分呈负相关,即Anaerostipes越少,临床症状越重。
与此同时,CFS患者中促炎或条件致病菌(如Enterobacteriaceae、Alistipes的某些菌株)相对增加,提示肠道生态由抗炎平衡型转向炎症型。
编者的话
厌氧棒状菌属(Anaerostipes)在多种疾病(尤其是慢性炎症、代谢疾病、心理疾病及肿瘤相关疾病)中丰度普遍下降,且与疾病进展、炎症及免疫调控密切相关。
其作为肠道健康和疾病生物标志物具有重要潜力,未来可通过饮食或微生态干预提升其丰度以改善健康。
多种方法可有效调节厌氧棒状菌属(Anaerostipes)丰度,主要包括膳食纤维、益生元、益生菌和生活方式干预。
1
膳食纤维补充
多项研究表明,高纤维饮食——包括菊粉、抗性淀粉及阿拉伯木聚糖等——能够显著提高厌氧棒状菌属(Anaerostipes)的丰度,并增强肠道丁酸盐的生成能力。
这些膳食纤维可作为产丁酸菌的发酵底物,为它们的生长提供能量来源,从而改善肠道微生态结构。该方法在健康成人及动物模型中均显示出良好的效果。
2
益生元与合生元干预
特定类型的益生元(如菊粉型果寡糖)以及合生元组合(如 Lactobacillus fermentum K73 联合高油酸棕榈油与乳清)对Anaerostipes的增殖具有促进作用。这些干预方式通过改变肠道内短链脂肪酸代谢路径与底物利用率,进而提升丁酸生成效率。该策略适用于儿童及成人人群。
3
益生菌联合干预
部分益生菌(如 Bifidobacterium animalis、Lactobacillus rhamnosus)在配合膳食纤维应用后,能间接提升 Anaerostipes的丰度。这种组合干预有助于改善肠道代谢环境和菌群多样性,常用于功能性便秘患者及儿童群体中。
4
饮食结构调整
研究指出,增加全谷物、蔬菜(大蒜、洋葱等)与水果的摄入,减少精制碳水化合物比例,可有效改善肠道微生态组成,并促进 Anaerostipes 的生长。这一健康饮食结构可长期维持肠道菌群稳定,对中国成年人及一般健康人群均有益。
5
运动干预
规律的有氧运动与抗阻训练被证实能够显著提升老年人肠道中 Anaerostipes 的丰度,同时增加粪便中丁酸盐的浓度。这一发现表明,运动干预不仅对维护机体代谢健康具有积极作用,还能通过改善肠道菌群结构,促进产丁酸菌的增长,从而增强能量代谢效率和抗炎能力。
此外,该研究结果进一步说明,长期坚持科学的运动方式能够在多层面维持肠道生态平衡,降低慢性炎症水平,对老年人整体健康状况的改善与代谢功能的恢复具有重要意义,体现了运动与肠道微生态之间的密切关联。
6
减少高盐饮食
研究发现,高盐饮食可显著降低Anaerostipes 丰度,从而削弱丁酸生成与肠道免疫平衡。降低盐摄入对维持肠道微生态多样性与代谢稳态具有重要意义,动物模型结果为该机制提供了有力证据。
主要参考文献
Bhattacharjee D, Millman LC, Seesengood ML, Seekatz AM. Diversity and prevalence of Anaerostipes in the human gut microbiota. bioRxiv [Preprint]. 2025 May 1:2025.05.01.651700.
Liu D, Xie L-S, Lian S, Li K, Yang Y, Wang W-Z, Hu S, Liu S-J, Liu C, He Z. Anaerostipes hadrus, a butyrate-producing bacterium capable of metabolizing 5-fluorouracil. mSphere. 2024 Apr 23;9(4):e0081623.
Hesser LA, Puente AA, Arnold J, Ionescu E, Mirmira A, Talasani N, Lopez J, Maccio-Maretto L, Mimee M, Nagler CR. A synbiotic of Anaerostipes caccae and lactulose prevents and treats food allergy in mice. Cell Host Microbe. 2024 Jul 10;32(7):1163-1176.e6.
Bui TPN, Mannerås-Holm L, Puschmann R, Wu H, Troise AD, Nijsse B, Boeren S, Bäckhed F, Fiedler D, deVos WM. Conversion of dietary inositol into propionate and acetate by commensal Anaerostipes associates with host health. Nat Commun. 2021 Aug 10;12(1):4798.
Caso JR, MacDowell KS, González-Pinto A, García S, de Diego-Adeliño J, Carceller-Sindreu M, Sarramea F, Caballero-Villarraso J, Gracia-García P, De la Cámara C, Agüera L, Gómez-Lus ML, Alba C, Rodríguez JM, Leza JC. Gut microbiota, innate immune pathways, and inflammatory control mechanisms in patients with major depressive disorder. Transl Psychiatry. 2021 Dec 21;11(1):645.
Endo A, Tanno H, Kadowaki R, Fujii T, Tochio T. Extracellular fructooligosaccharide degradation in Anaerostipes hadrus for co-metabolism with non-fructooligosaccharide utilizers. Biochem Biophys Res Commun. 2022 Jul 12;613:81-86.
Guo C, Li Y, Wang P, Li Y, Qiu C, Li M, Wang D, Zhao R, Li D, Wang Y, Li S, Dai W, Zhang L. Alterations of Gut Microbiota in Cholestatic Infants and Their Correlation With Hepatic Function. Front Microbiol. 2018 Nov 13;9:2682.
Turna J, Grosman Kaplan K, Anglin R, Patterson B, Soreni N, Bercik P, Surette MG, Van Ameringen M. The gut microbiome and inflammation in obsessive-compulsive disorder patients compared to age- and sex-matched controls: a pilot study. Acta Psychiatr Scand. 2020 Oct;142(4):337-347.
Singh V, Lee G, Son H, Koh H, Kim ES, Unno T, Shin JH. Butyrate producers, “The Sentinel of Gut”: Their intestinal significance with and beyond butyrate, and prospective use as microbial therapeutics. Front Microbiol. 2023 Jan 12;13:1103836.
Low A, Sheludchenko M, Cheng HE, Koh XQ, Lee JWJ. Complete genome sequences of butyrate producing Anaerostipes hadrus strains BA1 and GIF7 isolated from the terminal ileum of a healthy lean male. Microbiol Resour Announc. 2023 Oct 19;12(10):e0070123.
Modica V, Glávits R, Clewell A, Endres JR, Hirka G, Vértesi A, Béres E, Szakonyiné IP. A Comprehensive Toxicological Safety Evaluation of Anaerostipes caccae. Int J Toxicol. 2025 Nov-Dec;44(6):471-487.
Morinaga K, Kusada H, Watanabe M, Tamaki H. Complete Genome Sequence of Anaerostipes caccae Strain L1-92T, a Butyrate-Producing Bacterium Isolated from Human Feces. Microbiol Resour Announc. 2021 Apr 22;10(16):e00056-21.

谷禾健康

嗜胆菌属
嗜胆菌属 (Bilophila)是变形菌门,脱硫弧菌科的一种厌氧、革兰氏阴性、耐胆汁、过氧化氢酶阳性杆菌。目前通过数据库发现在越来越多的人群,尤其男性,甚至低龄儿童中检出了高丰度的该菌。
该菌被认为是“喜欢动物脂肪喜欢胆汁”的微生物——在以动物为基础的饮食,尤其富含肉类和乳制品脂肪时,其肠道中Bilophila丰度会增加和积累。
目前为止,该属下研究最多和证据充分的菌种是沃氏嗜胆菌(Bilophila wadsworthii, B.wadsworthii),它是从穿孔和坏疽性阑尾炎患者的临床材料中回收的第三大最常见的厌氧菌。
Bilophila是机会致病菌,其丰度的增加的负面影响对肠道炎症的影响已经得到证实,B. wadsworthia与高脂肪饮食协同促进更高炎症反应、肠屏障功能障碍和胆汁酸代谢异常,导致更高的葡萄糖代谢异常和肝脂肪发生。
2021年《Cell》子刊最新研究发现生酮饮食会加剧间歇性缺氧引起的认知障碍,并认为这是由肠道菌群介导的。在生酮饮食和间歇性缺氧的双重条件下,Bilophila大量繁殖富集,进而对海马体功能造成损伤,增加认知障碍风险。
此外,证据显示Bilophila 在便秘,白赛病,重症感染,脑脓肿,帕金森,结直肠癌,卵巢癌患者中增加。
但是Bilophila属中的一些物种是有用的共生细菌,促进宿主新陈代谢并有利地塑造免疫反应。来自mSystems上发表的一项最新研究,发现Bilophila的基因组中存在遗传密码扩张现象,使三甲胺(TMA)甲基转移酶中的一个终止密码子可编码吡咯赖氨酸,从而导致嗜胆菌属可代谢TMA且不产生氧化三甲胺(TMAO)。该研究提示,嗜胆菌属可能通过“绕行”TMAO的生成,以降低动物性饮食诱导的心血管疾病风险,但是这一结论需要更多的样本支持和验证。
Bilophila 作为正常菌群存在于人类粪便中,偶尔也存在于唾液和阴道中。来自人类的分离物通常是β-内酰胺酶阳性,因此该菌对某些β-内酰胺抗生素具有抗药性。部分的菌株也对克林霉素有抗药性。
本文基于文献调查和谷禾数据库讨论和介绍肠道重要菌属——嗜胆菌属 (Bilophila)。
嗜胆菌属 (Bilophila)是变形菌门,脱硫弧菌科除了脱硫弧菌属(Desulfovibrio) 的第二类重要菌属。一种革兰氏阴性厌氧菌,包括 B. wadsworthia,可引起腹腔内和其他感染。
Bilophila 属下代表物种是:Bilophila wadsworthia。该菌最初从坏疽和穿孔性阑尾炎患者的感染中分离出来。后来在包括来自阴囊脓肿、下颌骨髓炎和腋窝化脓性汗腺炎的胸水、关节液、血液和脓液的临床组织样本中也逐渐发现。
Bilophila wadsworthia 是一种革兰氏阴性、专性厌氧、过氧化氢酶阳性、耐胆汁和解酶杆菌。单独或成对出现;偶尔观察到长丝。没有观察到孢子形成。菌落宽度约为 0.7 μm,长 1.0-10.0 μm,细胞呈多形性,细胞壁不规则,约 75% 的菌株为脲酶阳性。DNA G + C 含量约为59.2。
已鉴定菌种:
Bilophila wadsworthia
Bilophila sp. 4_1_30
基于核糖体 RNA 的系统发育研究表明 Bilophila与 脱硫弧菌科另外一个成员 脱硫弧菌属(Desulfovibrio)物种关系最密切。
基于数据库和文献Bilophila和其他肠道菌属的关系如下图:
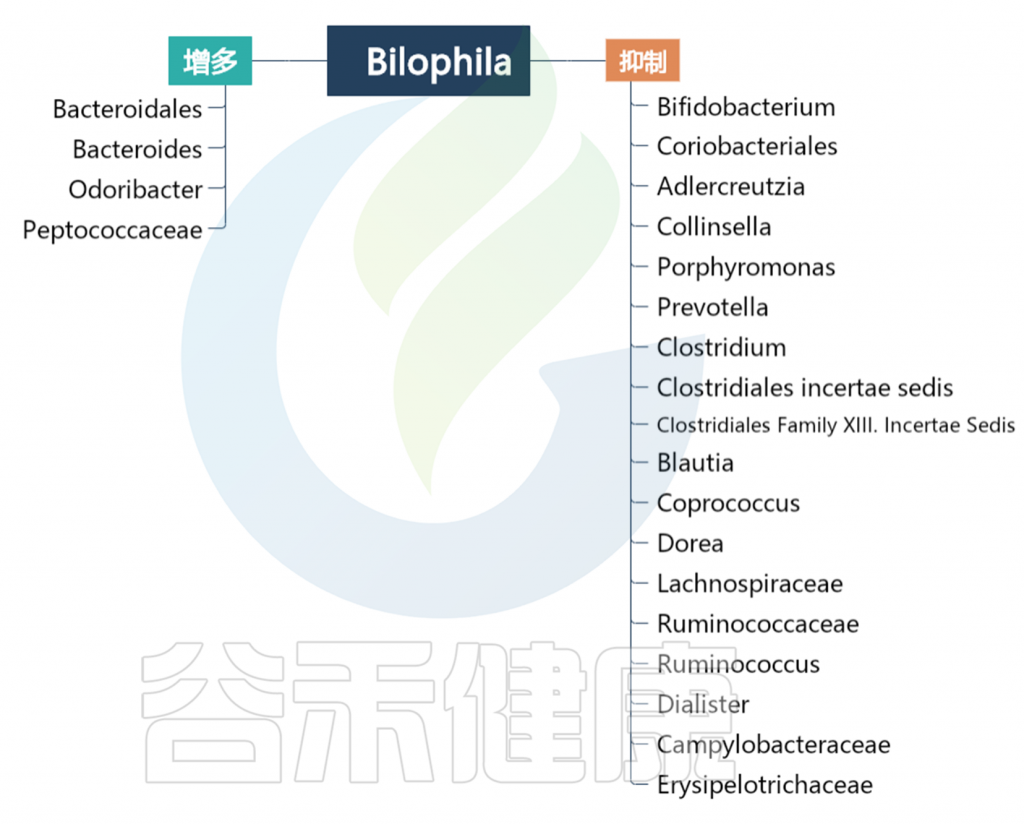

编辑
▸ 代谢牛磺酸,嗜好胆汁
该菌具有呼吸型新陈代谢,化学有机异养和非发酵。代谢蛋白底物,但不代谢碳水化合物。蛋白底物的主要产物是乙酸,含有少量至痕量的琥珀酸。能将硝酸盐还原为亚硝酸盐。
硫化物由含硫氨基酸和亚硫酸盐产生,有时由硫代硫酸盐产生,但Bilophila不会还原硫。过氧化氢酶强阳性。在甲酸盐存在的情况下,B. wadsworthia利用牛磺酸作为电子受体产生乙酸盐并将磺酸盐硫还原为硫化物。
Bilophila是机会致病菌,培养实验等得出硫,蛋白胨,L-牛磺酸,丙酮酸以及胆汁酸是B. wadsworthia扩张的基础。其代谢产物主要为硫化物,硫化氢,乙酸盐,琥珀酸等。
胆汁酸是胆固醇在肝脏分解以及肠肝循环中的一组代谢产物。在肝脏中,牛磺酸与甘氨酸一起用于结合胆汁酸以产生初级胆汁酸。胆汁酸经历肠肝循环,并被微生物群转化为次级胆汁酸。饱和动物源性脂肪先前已被证明可促进牛磺酸结合胆汁酸的产生。至少在高脂环境中,已经提出增加牛磺酸结合胆汁酸的产量是B. wadsworthia扩张的基础。
所有高脂肪喂养小鼠脂多糖(LPS)生物合成和牛磺酸代谢途径的活化显着提高,而涉及氨基酸、糖、淀粉和氮代谢的许多途径显着减少。
B. wadsworthia进一步加剧了高脂饮食情况下的胆汁酸失调,也表明该菌可能加强了高脂饮食诱导的代谢障碍和宿主功能障碍,特别是炎症和屏障功能障碍的一种机制。
▸ 喜欢动物脂肪和乳脂
小鼠和人类实验表明以动物脂肪和乳源性饱和脂肪为基础的饮食可以增加耐胆汁菌Bilophila wadsworthia.
研究人员称并没有刻意去衡量Bilophila的丰度,但当比较哪种细菌含量增加最快时,Bilophila排在首位。
不同的饮食可以快速且可重复地改变肠道微生物群的组成和功能。
《Nature》杂志的一项研究发现,当人们从素食转变为以肉类和奶酪为主的饮食结构上时,他们肠道里的细菌Bilophila几乎立即增加,但植物性为主的饮食结构可以降低该菌群的数量。一项人群研究实验,在清肠后 5 至 7 天收集素食者和杂食者的粪便样本。发现Bilophila和Lachnoclostridium与膳食动物蛋白呈正相关,与膳食植物蛋白来源呈负相关。
《Cell Metabolism》发表了一项研究,发现经常伴随红肉的饱和脂肪,还可能让人变肥胖,脂肪还会出现炎症。与之相反,以鱼肉为代表的白肉所包含的不饱和脂肪则健康很多。线性判别分析(LDA)表明,拟杆菌, Turicibacter和嗜胆菌(Bilophila)属细菌在猪油组小鼠肠道中显著增多,而在鱼油组小鼠中,主要是双歧杆菌和另一种菌 (Bifidobacterium,Adlercreutzia),乳酸菌(lactic acid)等增加。
当前西方化饮食(低纤维、高糖、高脂肪和高动物蛋白)饮食持续增加粪便中Bilophila丰度,所以在越来越多的人群水平中发现Bilophila的富集。研究表明Bilophila可以将亚硫酸盐还原为硫化氢(H2S气体),诱发炎症以及免疫和代谢障碍。这对那些尝试许多流行的“品牌”饮食(例如生酮、旧石器时代、食肉动物等)的个体具有临床意义。
▸ 产生硫化氢
硫代喹诺酮糖是葡萄糖的磺酸衍生物,在菠菜和生菜等所有绿色蔬菜中都能找到。专门的细菌配合利用磺基糖产生硫化氢(H2S)。
这种气体以臭鸡蛋味著称,也对人类健康有不同的影响:在低量的情况下,硫化氢可以对肠黏膜产生抗炎消炎作用。另一方面,肠道微生物产生的硫化氢增多,与慢性炎症性疾病和甚至癌症有关。
研究表明,与葡萄糖等喂养肠道内大量微生物不同,硫代喹诺酮糖刺激肠道微生物组中非常特定的关键微生物的生长。这些关键生物包括Eubacterium rectale物种的细菌,它是健康人常见的肠道微生物之一。E.rectale细菌通过发酵硫代喹诺酮糖,产生一种硫化合物,即二羟基丙烷磺酸盐,而这种硫化合物又是其他肠道细菌如Bilophila wadsworthia的能量来源。
Bilophila wadsworthia最终会通过一种新陈代谢途径从二羟基丙烷磺酸盐中产生硫化氢,这种途径也是最近才发现的。
以往认为主要是由于富含肉类或脂肪的饮食导致肠道中的硫酸盐和牛磺酸含量增加,已知它们是微生物的硫化氢来源。目前发现来自菠菜和藻类等绿色食物的硫代奎诺糖也有助于肠道内气体的产生,这让人感到意外。
病原菌,与肠道炎症有关
B. wadsworthia具有固有的促炎特性。然而,尚不清楚这种B. wadsworthia特征在多大程度上在宿主代谢障碍的发展中发挥作用。炎症是代谢综合征的一个重要特征;因此,尚不清楚与B. wadsworthia相关的代谢障碍是否仅继发于B. wadsworthia-驱动炎症。
为了解决这些问题,研究用广泛使用的免疫抑制剂环孢素抑制了喂食高脂饮食(HFD)的小鼠的炎症。
发现环孢素 (Ci) 有效地消除了高脂饮食喂养小鼠的炎症反应,无论它们是否含有低密度或高密度的B. wadsworthia,因此,可以清楚地推断出B. wadsworthia 的直接代谢作用。
高脂饮食 —— B. wadsworthia过度积累
为了更好地确定更高密度的B. wadsworthia是否会影响代谢功能,特意通过灌胃将B. wadsworthia给予小鼠。
结果强调高脂饮食不是B. wadsworthia在宿主肠道中茁壮成长所必需,但却是B. wadsworthia 的持续增长必不可少的。这个结果比较有意义,表明B. wadsworthia的过度积累离不开高脂饮食的喂养。
B. wadsworthia 诱发的全身炎症相关疾病
B. wadsworthia增加了高脂饮食诱导的代谢综合征,这是一种通常与低程度全身炎症相关的疾病。同时,B. wadsworthia已被证明会加剧遗传易感小鼠的肠道炎症并在野生型动物中诱发全身炎症。较高的炎症状态的特征是消瘦和体重减轻,而代谢综合征的特征是低度炎症和较高的体重指数。
因此,一个关键问题是:
B. wadworthia 如何影响两种相反的病理?
通过药理学抑制炎症,揭示了B. wadsworthia直接诱导对宿主代谢功能的负面影响的能力。
具体来说,不同的代谢障碍,即葡萄糖清除率降低和脂肪肝表型,受B. wadworthia的影响,它们并不完全依赖于其促炎特性。
尽管如此,B. wadworthia驱动的炎症仍然是一个重要因素,它进一步使平衡向更强的代谢功能障碍倾斜。因此,这可以解释为什么B. wadworthia能够在两种截然不同的环境中发挥病态作用。
B. wadsworthia通过恶化高脂饮食诱导的肠道炎症、抑制参与代谢稳态的途径、有利于增加 LPS 的产生和易位,以及减少微生物群的丁酸盐产生来作用于宿主和微生物群。这些与B. wadsworthia相关的改变中的大多数被鼠李糖乳杆菌CNCM I-3690 给药完全或部分逆转。
导致认知障碍
2021年cell最新研究,喂食生酮饮食并间歇性缺氧的小鼠的肠道微生物群中,嗜胆菌属(Bilophila)的细菌浓度急剧增加。他们还发现,沃氏嗜胆菌(Bilophila wadsworthia)沃氏嗜胆菌损害海马体,导致小鼠的认知能力下降。
减轻心血管疾病
目前导致心血管疾病(CVD)发生的心血管风险因素并没有减少,反而在增加。因此,想要防止这种疾病发生,仅靠控制传统风险因素是不够的。虽然许多二级预防患者的传统风险因素控制较好,但仍会出现新的心血管事件。
已证实肠道菌群导致胆汁酸功能性改变,决定了其与法尼酯X受体或G蛋白偶联胆汁酸受体(TGR5)等潜在受体的结合。
动物性饮食是三甲胺(TMA)的主要来源,肠道菌群代谢TMA产生的氧化三甲胺(TMAO)与心血管疾病风险的增加密切相关。
来自mSystems上发表的一项最新研究,发现嗜胆菌属(Bilophila)的基因组中存在遗传密码扩张现象,使TMA甲基转移酶中的一个终止密码子可编码吡咯赖氨酸,从而导致嗜胆菌属可代谢TMA且不产生TMAO。
该研究提示,嗜胆菌属可能通过“绕行”TMAO的生成,以降低动物性饮食诱导的心血管疾病风险。这个结果让临床看到了机会,后续这一机制希望能尽快完成临床实验验证。
扩展阅读:
饮食-肠道微生物群对心血管疾病的相互作用
结直肠癌
结直肠癌是最常见的恶性肿瘤之一,与年龄和生活习惯密切相关,饮食风险因素包括红肉、加工肉类以及酒精,另一个风险因素是炎症性肠病,包括克罗恩病和溃疡性结肠炎。
根据已有报道发现结直肠癌患者中生成硫化物的细菌增加:
美国黑人的结肠直肠癌发病率显著高于非西裔白人,研究假设:硫酸盐还原菌在结肠粘膜中的丰度可能是导致美国黑人结肠直肠癌发病风险较高的环境因素。
无论是结肠直肠癌患者还是健康人,美国黑人的结肠硫酸盐还原菌丰度均高于非西裔白人;沃氏嗜胆菌(Bilophila wadsworthia)特异性dsrA在美国黑人结肠直肠癌患者中高于健康美国黑人;美国黑人日常摄入的脂肪及蛋白质显著高于非西裔白人,多种饮食组分与硫酸盐还原菌的丰度较高相关。
扩展阅读:
结直肠癌防治新策略——微生物群
白塞病(BD)
贝塞特氏病(Behctet,白塞病,BD)是一是一种顽固的多系统性炎症性疾病,可导致不可逆转的失明。
微生物因子被认为是造成这种疾病的原因,但其潜在机制仍不清楚。来自活动性BD患者的粪便样品富含Bilophila spp,一种硫酸盐还原细菌(SRB)和一些机会病原体。活跃的BD患者的荚膜多糖转运系统,氧化还原过程,III型和IV型分泌系统也有所增加。
网络分析表明,富含BD的硫酸盐还原细菌和机会性病原体彼此呈正相关。动物实验表明,粪便微生物群与BD患者粪便的移植增加了包括IL-17和IFN-γ在内的炎性细胞因子的产生。
帕金森病进展
对比分析了帕金森患者与对照的菌群组成及代谢功能差异,发现帕金森相关的特定菌群组成变化与疾病严重程度相关,特定的菌群代谢功能也与疾病表型相关,例如:Hoehn-Yahr分级与Paraprevotella菌属呈负相关,与嗜胆菌属(Bilophila)呈正相关;
帕金森相关菌群变化与甲硫氨酸等9种菌群代谢产物的变化相关,菌群产生泛酸的能力与帕金森患者的特定非运动症状相关。
扩展阅读:
肠道微生物与帕金森以及相关影响因素
重症病人
许多重症医学科室住院患者有严重感染。这部分是由于危重患者经常接受各种各样的药物治疗,这些药物影响肠道菌群多样性,部分是由于患者病情不稳定,可导致缺氧病变、炎症、上皮完整性破坏、运动障碍、腔内pH值变化或肠道免疫功能受损。在一项多中心研究中,ICU患者的菌群显示与炎症密切相关的微生物丰度增加,如拟杆菌属、梭菌属和嗜Bilophila菌属。
脑脓肿:病例报告
研究报道了一例20 年慢性中耳炎病史的患者并发胆脂瘤和脑脓肿的病例。使用对比材料的 CT 扫描显示右小脑半球有三个脓肿腔。
胆脂瘤标本的培养物和脑脓肿的脓液中分离出了大量的 Bilophila wadsworthia、Bacteroides fragilis 和 Prevotella oris。不存在需氧菌。患者接受了开颅手术,最大的脓肿与胶囊一起被切除。抗菌治疗包括青霉素加甲硝唑和后来的增效素。治疗的结果是患者完全治愈并完全康复。这是在慢性中耳炎和脑脓肿中分离出 B. wadsworthia 的一个典型案例。
衰老相关
Cell 子刊一项研究分析了251位18-80岁个体十二指肠菌群多样性,发现多样性受年龄、伴随疾病和用药情况多因素影响,与衰老过程呈负相关;
十二指肠核心菌群随衰老进程变化,变形菌门相对丰度增加,大肠杆菌和克雷伯菌增加,拟杆菌进行性降低;该研究显示克雷伯氏菌属增加仅与药物服用相关,梭菌属和嗜胆菌属增加则与伴随疾病相关。
症状性手骨关节炎
我国湘雅医院2021年纳入1388名平均年龄为61.3岁的受试者分析研究症状性手骨关节炎患者的肠道菌群变化,发现粪便菌群的β-多样性(而非α-多样性)与手骨关节炎显著相关;手骨关节粪便菌群中有更高的嗜胆菌属(Bilophila)与脱硫弧菌属、更低的罗斯氏菌属。
功能分析显示,手骨关节炎患者的粪便菌群中,与氨基酸、碳水化合物及脂质代谢相关的通路发生显著变化。
“
降 低
鼠李糖乳杆菌CNCM I-3690 (Lr) 的每日口服管饲导致粪便 B. wadsworthia 丰度显着降低。同样,鼠李糖乳杆菌CNCM I-3690 能够进一步减少盲肠和小肠中的 B. wadsworthia 扩张。表明除了通过阻止其在体内扩张来抑制与 B. wadsworthia 相关的代谢功能障碍外,它还通过其调节胰岛素水平的固有能力来改善代谢功能。
菊苣根纤维(低聚果糖和菊粉)是益生元营养素,可滋养有益的肠道微生物,尤其是双歧杆菌。众多人体临床研究表明,这些益生元增加了肠道内的有益双歧杆菌,同时可以减少Bilophila菌。
大枣与巴豆霜合用可减缓巴豆霜的快速利尿作用。研究发现大枣合用高剂量巴豆霜后Bilophila水平降低。巴豆霜为大戟科植物巴豆Croton tiglium L.(CT)的干燥成熟果实经去皮制霜后制得的炮制品,具有峻下冷积、逐水退肿、豁痰利咽、蚀疮的功效。因其有大毒,临床应用受到一定限制。
酵母 β-葡聚糖 (Y-BG) 是一种以其免疫调节作用而闻名的膳食补充剂,在健康小鼠中进行了为期 4 周的膳食补充剂,发现 2% 的 Y-BG 颗粒物诱导强大的肠道微生物群落变化,包括粪便Bilophila丰度的显着减少。
水果和蔬菜富含纤维、维生素 B、维生素 C、β-胡萝卜素、钾和生物活性化合物,如番茄红素和白藜芦醇。食用水果可以在维持肠道菌群平衡和改善肠道生态方面发挥作用。健康成年人食用十字花科蔬菜(西兰花、花椰菜)显示出拟杆菌门与厚壁菌门的比例呈正变化,硫酸盐还原菌(SRB) ,包括嗜胆菌和脱硫弧菌丰度下降。
扩展阅读:
常见水果对肠道菌群、肠道蠕动和便秘的影响
在患有轻度便秘的健康成年人中,食用菊粉可能会导致厌氧菌、嗜胆菌和双歧杆菌的相对丰度发生变化。特别是,食用菊粉后Bilophila丰度的下降与较软的粪便和便秘特异性生活质量指标的有利变化有关。
扩展阅读:
排便困难?便秘反复?不要忽视肠道菌群
“
增 强
主要参考文献
Natividad JM, Lamas B, Pham HP, Michel ML, Rainteau D, Bridonneau C, da Costa G, van Hylckama Vlieg J, Sovran B, Chamignon C, Planchais J, Richard ML, Langella P, Veiga P, Sokol H. Bilophila wadsworthia aggravates high fat diet induced metabolic dysfunctions in mice. Nat Commun. 2018 Jul 18;9(1):2802. doi: 10.1038/s41467-018-05249-7. PMID: 30022049; PMCID: PMC6052103.
Kivenson V, Giovannoni SJ. An Expanded Genetic Code Enables Trimethylamine Metabolism in Human Gut Bacteria. mSystems. 2020 Oct 27;5(5):e00413-20. doi: 10.1128/mSystems.00413-20. PMID: 33109749; PMCID: PMC7593587.
Yazici C, Wolf PG, Kim H, Cross TL, Vermillion K, Carroll T, Augustus GJ, Mutlu E, Tussing-Humphreys L, Braunschweig C, Xicola RM, Jung B, Llor X, Ellis NA, Gaskins HR. Race-dependent association of sulfidogenic bacteria with colorectal cancer. Gut. 2017 Nov;66(11):1983-1994. doi: 10.1136/gutjnl-2016-313321. Epub 2017 Feb 2. PMID: 28153960; PMCID: PMC5575988.
Sun Y, Ma Y, Lin P, Tang YW, Yang L, Shen Y, Zhang R, Liu L, Cheng J, Shao J, Qi T, Tang Y, Cai R, Guan L, Luo B, Sun M, Li B, Pei Z, Lu H. Fecal bacterial microbiome diversity in chronic HIV-infected patients in China. Emerg Microbes Infect. 2016 Apr 6;5(4):e31. doi: 10.1038/emi.2016.25. PMID: 27048741; PMCID: PMC4855070.
Baron EJ. Bilophila wadsworthia: a unique Gram-negative anaerobic rod. Anaerobe. 1997 Apr-Jun;3(2-3):83-6. doi: 10.1006/anae.1997.0075. PMID: 16887567.
Baldini F, Hertel J, Sandt E, Thinnes CC, Neuberger-Castillo L, Pavelka L, Betsou F, Krüger R, Thiele I; NCER-PD Consortium. Parkinson’s disease-associated alterations of the gut microbiome predict disease-relevant changes in metabolic functions. BMC Biol. 2020 Jun 9;18(1):62. doi: 10.1186/s12915-020-00775-7. PMID: 32517799; PMCID: PMC7285525.
Wei J, Zhang C, Zhang Y, Zhang W, Doherty M, Yang T, Zhai G, Obotiba AD, Lyu H, Zeng C, Lei G. Association Between Gut Microbiota and Symptomatic Hand Osteoarthritis: Data From the Xiangya Osteoarthritis Study. Arthritis Rheumatol. 2021 Sep;73(9):1656-1662. doi: 10.1002/art.41729. Epub 2021 Aug 6. PMID: 33760399; PMCID: PMC8457181.
Leite G, Pimentel M, Barlow GM, Chang C, Hosseini A, Wang J, Parodi G, Sedighi R, Rezaie A, Mathur R. Age and the aging process significantly alter the small bowel microbiome. Cell Rep. 2021 Sep 28;36(13):109765. doi: 10.1016/j.celrep.2021.109765. PMID: 34592155.
Marina M, Ivanova K, Ficheva M, Fichev G. Bilophila wadsworthiain brain abscess: case report. Anaerobe. 1997 Apr-Jun;3(2-3):107-9. doi: 10.1006/anae.1997.0084. PMID: 16887572.
Chen Y, Zhang S, Zeng B, Zhao J, Yang M, Zhang M, Li Y, Ni Q, Wu D, Li Y. Transplant of microbiota from long-living people to mice reduces aging-related indices and transfers beneficial bacteria. Aging (Albany NY). 2020 Mar 16;12(6):4778-4793. doi: 10.18632/aging.102872. Epub 2020 Mar 16. PMID: 32176868; PMCID: PMC7138539.
Wu YT, Shen SJ, Liao KF, Huang CY. Dietary Plant and Animal Protein Sources Oppositely Modulate Fecal Bilophila and Lachnoclostridium in Vegetarians and Omnivores. Microbiol Spectr. 2022 Apr 27;10(2):e0204721. doi: 10.1128/spectrum.02047-21. Epub 2022 Mar 14. PMID: 35285706; PMCID: PMC9045121.
So SY, Wu Q, Leung KS, Kundi ZM, Savidge TC, El-Nezami H. Yeast β-glucan reduces obesity-associated Bilophila abundance and modulates bile acid metabolism in healthy and high-fat diet mouse models. Am J Physiol Gastrointest Liver Physiol. 2021 Dec 1;321(6):G639-G655. doi: 10.1152/ajpgi.00226.2021. Epub 2021 Oct 13. PMID: 34643089.
Wu YT, Shen SJ, Liao KF, Huang CY. Dietary Plant and Animal Protein Sources Oppositely Modulate Fecal Bilophila and Lachnoclostridium in Vegetarians and Omnivores. Microbiol Spectr. 2022 Apr 27;10(2):e0204721. doi: 10.1128/spectrum.02047-21. Epub 2022 Mar 14. PMID: 35285706; PMCID: PMC9045121.