-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
在快节奏的现代生活中,我们面临着的食品安全挑战也在升级。全球化的食品供应链让美食跨越千山万水来到我们的餐桌,但也为病原菌的传播提供了更多机会。每一餐美食的背后,都可能潜藏着看不见的威胁。从夏日烧烤到家庭聚餐,食源性病原菌如同”隐形杀手”般悄然存在,威胁着我们的健康。
据世界卫生组织统计,全球每年有超过6亿人因食用被污染的食物而患病。在中国,食源性疾病同样影响着数百万人的健康。
有时候我们认为腹泻、呕吐只是”吃坏肚子”的小毛病,忍忍就过去了。然而这可能掩盖了严重的健康风险。食源性病原菌感染不仅会引起急性胃肠炎症状,还可能导致:
脱水和电解质紊乱:特别是对老人和儿童;
肠道菌群失调:破坏肠道微生态平衡;
免疫系统受损:降低机体抵抗力;
慢性健康问题:如肠易激综合征、炎症性肠病等后遗症。
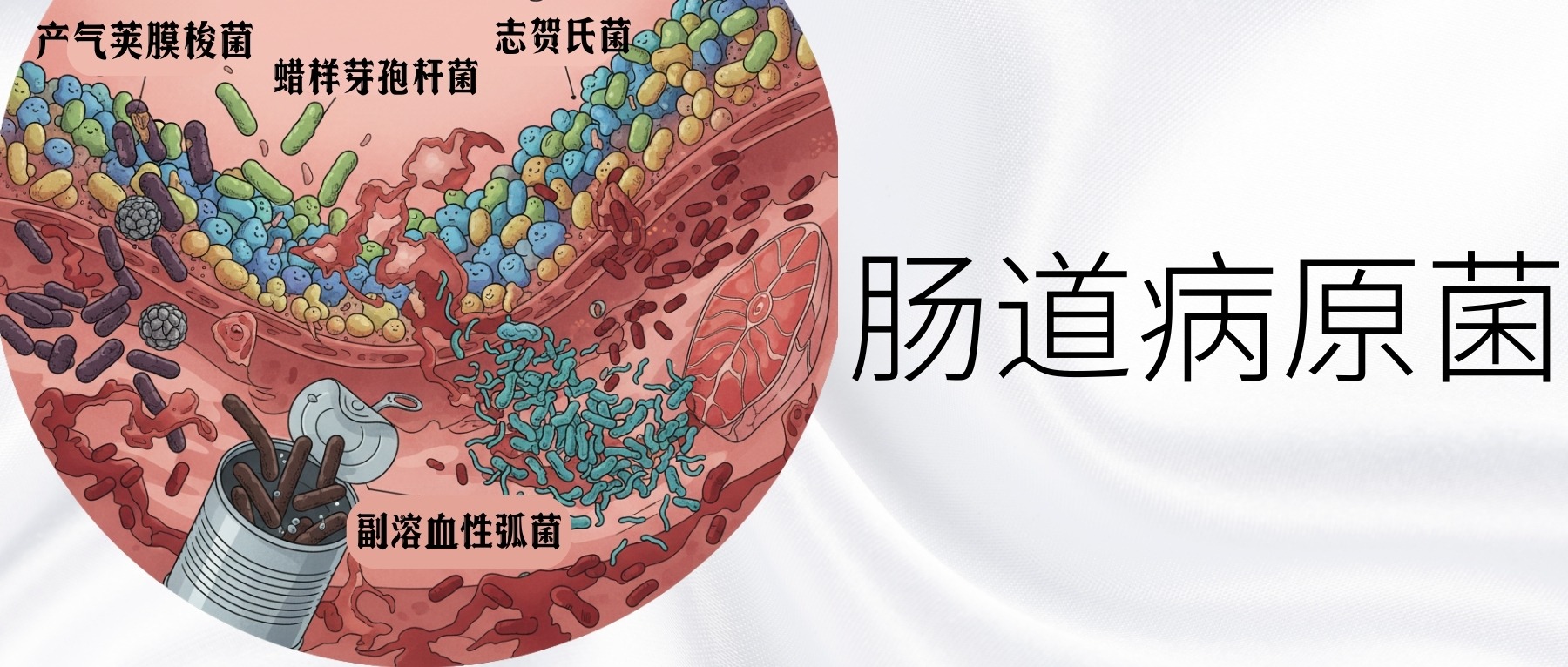
产气荚膜梭菌、蜡样芽孢杆菌、肉毒杆菌、副溶血性弧菌、志贺氏菌等是最常见且危险的食源性病原菌。它们各具特色:有的耐高温,有的耐酸,有的产生致命毒素,有的传播力极强。
通过了解这些常见食源性病原菌的特性和传播规律,有助于我们识别和避免食用易受污染的食物,掌握正确的储存、烹饪和食用方式,同时监测肠道健康状况及时发现菌群异常变化。因为每个人的肠道菌群构成都是独特的,就像指纹一样。这意味着不同的人对同一种病原菌的易感性和抵抗力也不相同。有些人可能对某种病原菌特别敏感,而另一些人则相对耐受。
▶▷▶▷▶▷
▮ 产 气 荚 膜 梭 菌 ▮
产气荚膜梭菌(Clostridium perfringens)是一种革兰氏阳性杆状细菌,会引起食源性腹泻,是工业化国家常见的食源性致病菌之一,全年均有腹泻病例报道。它广泛存在于环境中,对人和动物均具致病性。
作为一种能够形成芽孢的厌氧细菌,产气荚膜梭菌在芽孢形成过程中会产生肠毒素(CPE),其A型到E型菌株与不同疾病相关。其中人类坏死性肠炎是一种致命的危及生命的疾病,会导致小肠溃疡。
该菌能在短期内快速繁殖、在相对较高的温度范围内生长、芽孢能抵抗恶劣环境条件、以及尽管是厌氧菌却具有耐氧能力,这些特性使得产气荚膜梭菌具有很强的环境适应性和致病潜力。
• 梭菌属中具有重要临床意义的致病菌种还有:
破伤风梭菌(Clostridium tetani)
肉毒梭菌(Clostridium botulinum)
巴氏梭菌(Clostridium baratii)
艰难梭菌(Clostridium difficile)
Clostridium argentinese
产气荚膜梭菌的常见栖息地是土壤、水、污泥、污水、食物(主要是生肉和冷冻肉)、受污染的设备等。产气荚膜杆菌也存在于人和动物的肠道中,尤其是老年人的粪便中。
产气荚膜梭菌需要多种氨基酸与维生素,最适生长温度为43–45°C。富含蛋白的肉类尤其适合其繁殖,特别是猪肉、牛肉和家禽产品;用酱料烹制的污染风险很高。
在加热和冷却过程中,如果食物在室温下没有足够的冷却温度,它会增殖并产生毒素。通常,学校食堂,医院,餐馆,监狱和集会是梭菌爆发的高风险场所。
产气荚膜梭菌在应激条件下孢子形成时产生肠毒素,已知可产生14种毒素与5类肠毒素(A–E型)。其还分泌4类细胞外毒素:α、β、ε、iota。
产气荚膜梭菌毒素和降解酶的作用
doi: 10.1080/21505594.2021.1886777.
A型:在人类中引起气性坏疽和腹泻相关的感染性腹泻,在动物中引起肠毒血症、坏死性肠炎和急性胃扩张。
C型:在人类中导致坏死性肠炎(空肠炎),在小猪、羔羊、小牛和鸟类中导致肠毒血症和坏死性肠炎。
B、D、E型:尚未证实致人类疾病;在动物可致肠炎与肠毒血症。
此外,该菌还能产生溶素O(θ毒素)与胶原酶(κ毒素),也需警惕。
与暴发有关的因素是大量准备食物、烹饪温度不够(食物的核心区域没有适当烹饪)、准备好的食物和食用期间受到污染。
集中爆发经常发生在提前准备大量食物的地方,如医院和学校食堂、监狱、聚会和研讨会。
案例调查显示,一道在室温下放置20小时且未再加热的羊肉菜是感染来源。产气荚膜杆菌还从羔羊肉、感染者粪便及尸检样本中被分离出。某校食堂因饮用制备后置于室温的受污染奶昔,导致77例腹泻。
产气荚膜梭菌只有在摄入含有约 10⁷-10⁹个营养细胞/克 的污染食物时才引起感染。
⑴第一阶段:胃肠道定植
-营养细胞抵抗胃酸
-在小肠内生长、增殖和产孢
⑵第二阶段:肠毒素作用机制
靶点结合:大量肠毒素与肠上皮细胞紧密连接处的 claudin蛋白 结合。
复合物形成:结合宿主膜蛋白,经构象变化形成 CPE复合物。
细胞损伤:
-细胞崩解和分离
-肠绒毛尖端损伤
-上皮细胞脱落
-绒毛缩短
膜损伤效应:
-膜上形成孔道
-电解质大量泄漏
-导致细胞溶解
-肠道吸收能力下降
-细胞骨架崩塌
⑶第三阶段:严重并发症
高浓度CPE (>10μg/ml):引起坏死(oncosis)
β-毒素作用:
-引起细胞毒性坏死性肠炎
-影响自主神经系统
-导致肠黏膜出血性坏死
-在真核细胞膜形成孔道
这种多重毒素协同作用使得产气荚膜梭菌食物中毒具有较强的致病性和复杂的临床表现。
主要症状多在食用重度污染食物后8–24小时出现。
常见症状包括腹部绞痛、水样腹泻、呕吐、恶心和发烧,大多数情况下通常在12至24小时内消退。致死率低于0.05%;但婴幼儿、老年人及慢性病患者风险较高;该菌可能侵入并导致严重溃疡,最终因急性脱水而死亡。
婴儿猝死综合征(SIDS)也是由产气荚膜梭菌与睡眠期间大脑的缺陷有关。
检测原理:产气荚膜梭菌食物中毒通过检测粪便样本中的肠毒素和营养细胞/芽孢数量来诊断。
⑴肠毒素检测
培养基法:熟肉培养基 → 巯基乙酸盐流体培养基(10ml) → Duncan-Strong产孢培养基
分子检测方法:通过PCR、多重PCR以及高通量测序手段检测样本中产气荚膜梭菌。例如谷禾健康依托高通量测序的tNGS技术可以特异性的识别粪便样本中的产气荚膜梭菌。
(来源:谷禾健康16S Plus版报告)
生物学方法
小鼠致死试验:评估毒素致死活性
Vero细胞毒性试验:检测细胞毒性效应
⑵免疫学检测
凝胶扩散法
对流免疫电泳
ELISA法
酶联免疫吸附试验进行CPE定量
注意事项:样本蛋白酶活性可降低IgG敏感性,需用1%血清白蛋白保护
⑶分子生物学方法
PCR技术:常规PCR、实时PCR
LAMP:环介导等温扩增
⑴治疗策略
一般治疗
抗生素使用原则
重症治疗
坏死性肠炎需要:
补液治疗
⑵预防控制措施
关键预防原则:烹调后立即食用
时间-温度控制
食品安全措施
▶▷▶▷▶▷
▮ 蜡 样 芽 孢 杆 菌 ▮
蜡样芽孢杆菌(Bacillus cereus)是一种致病性食源性微生物,广泛分布于自然界,如植物、土壤和昆虫及哺乳动物的胃肠道。
也常见于食品加工环境,其耐受性内生孢子可在恶劣条件下存活,污染原料与食品。
该菌可致两型食物中毒:腹泻型(在小肠产多种肠毒素)与呕吐型(摄入含耐热毒素的食物)。亦可引发机会性感染,如菌血症、败血症、肺炎、脑膜炎、胃炎、肝衰竭、肝坏死与脑水肿。
• 其他食源致病性芽孢杆菌:
B. subtilis(枯草芽孢杆菌):可致腹泻、呕吐;
B. licheniformis(地衣芽孢杆菌):常见食物中毒病因;
B. pumilus(短小芽孢杆菌):污染食品致胃肠炎。
• 其他特殊芽孢杆菌:
B. weihenstephanensis:强低温生长能力;
B. anthracis(炭疽芽孢杆菌):炭疽病原,极危;
B. mycoides(蕈状芽孢杆菌):形态特殊;
B. pseudomycoides(假蕈状芽孢杆菌):与蕈状近缘;
B. thuringiensis(苏云金芽孢杆菌):生物杀虫剂,偶可致病。
这些芽孢杆菌都具有形成芽孢的能力,使其在环境中具有很强的抵抗力和传播能力。
⑴基本特征
–革兰阳性菌
–产孢菌
–需氧至兼性厌氧
-有运动性
-杆状细菌
血培养的革兰氏染色蜡样芽孢杆菌
doi: 10.1128/CMR.00073-09.
⑵生长条件
生长温度范围:8-55°C
最适温度:25-37°C
pH范围:4.9-9.3
耐盐浓度达7.5%
内生孢子耐高温、辐射、干燥和消毒剂
⑶污染源
-从原料到包装储存的全程食品加工污染
-生物技术设备和机器污染
-土壤栖息,易传播至蔬菜和农作物
⑷常见污染食品
-大米、小麦、面食、面粉
-乳制品、肉制品、香料
-婴儿食品、鱼类、汤类
-蔬菜和水果
⑸流行病学特点
-全球性分布
-年度持续发生
-与饮食文化相关的地区差异
⑹易感人群
老年人、低胃酸患者
⑺防控挑战
其孢子高耐受性与污染源多样性要求从源头到终端的全程管控,尤其要严格温度控制并预防交叉污染。
蜡样芽孢杆菌产生蛋白质毒素,即肉毒毒素和催吐毒素。
⑴肉毒毒素(腹泻毒素)
当摄入的营养细胞在小肠增殖时产生腹泻毒素。该毒素对蛋白酶敏感,如链霉蛋白酶、胃蛋白酶、胰蛋白酶和胰凝乳蛋白酶。
潜伏期通常为摄入后8–16小时,病程多持续24–48小时。症状以轻度水样腹泻和腹部痉挛为主;少数儿童或免疫低下者可出现血性腹泻与坏死性肠炎,进而致肝功能衰竭和脑水肿。
与肠道疾病相关的三种染色体编码肠毒素包括:
Hbl(溶血素BL):蜡样芽孢杆菌食物中毒的主要毒力因子,在小肠通过渗透溶解形成跨膜孔。
Nhe(非溶血性肠毒素):与 Hbl 同源,亦为三组分成孔毒素。
CytK(细胞毒素K):原型样β-桶成孔毒素,可致出血性腹泻与坏死性肠炎。
⑵呕吐毒素
呕吐型起病更急且更重,由小分子环状耐热肽引起,潜伏期为摄入受污染食物后约2–5小时。
其症状类似金黄色葡萄球菌食物中毒:恶心、呕吐、腹部痉挛,通常持续约24小时。催吐毒素作用机制尚不明,但高度耐热,可经受油炸、烘烤、煮沸和微波等烹调过程。
环境因素(温度、pH、大气成分、营养来源、食物稠度)亦影响毒素的产生。
⑴培养方法
实验室培养基如营养琼脂或血琼脂
⑵ELISA
ELISA技术在商业上被用于测定毒素,但它在评估蜡样芽孢杆菌的产毒活性方面不准确。它只检测一种毒素,溶血素BL或两种无毒蛋白质。
⑶反向被动乳胶凝集(RPLA)肠毒素试验
将样品煮沸以使其在生物学上稳定,从而产生阳性结果。该试验可识别溶血素B组分,但在存在高葡萄糖浓度的情况下,无法检测到毒素。
⑷PCR或高通量测序
通过检测蜡样芽孢杆菌DNA序列,来分析其丰度和毒力基因的存在。
蜡样芽孢杆菌食物中毒多为自限性,通常24–48小时内自行缓解。建议卧床休息并补充液体;重症时可在医生指导下使用抗生素,如克林霉素、万古霉素、庆大霉素或氯霉素。
蜡样芽孢杆菌耐热性强,常规烹调可杀灭营养细胞,但孢子仍可存活,故应在孢子萌发前切断污染。
食品应在储存前迅速冷却、食用前充分加热;芽孢杆菌属难以在高酸性环境存活。保持良好食品处理习惯与卫生。
▶▷▶▷▶▷
▮ 肉 毒 杆 菌 ▮
肉毒杆菌(Clostridium botulinum)是一种生长在缺氧环境下的细菌,在罐头食品及密封腌渍食物中具有极强的生存能力,是毒性最强的细菌之一。
肉毒杆菌中毒是由摄入肉毒毒素(BoNT)导致的致命性食源性麻痹性疾病,虽罕见但病死率高,微量毒素即可致命。
中毒来源包括食物中预先形成的BoNT或肠道内产生的BoNT。已知毒素分为A–G七型,可致人畜发病,其中A、B、E型与人类食源性肉毒中毒最相关。
肉毒杆菌为厌氧、产芽孢的革兰阳性菌,孢子广泛存在于土壤、污水、泥浆及湖海沉积物中,也见于陆生和水生动物肠道。
肉毒杆菌的孢子形成和发芽
doi: 10.1080/21505594.2023.2205251.
其孢子易污染食物并产生毒素。蜂蜜和糖浆曾被报道受其孢子污染,是婴儿肉毒中毒的主要来源。加工不当的罐头亦为重要来源,因孢子可耐受高温。其他高风险食物包括湖鱼、海鱼,以及烟熏、盐腌和发酵肉制品。
A型和B型毒素常见于土壤与生物肥料,故可能污染蔬果,尤其是加热不足的蔬菜制品。
症状通常在摄入后18–38小时出现,先累及胃肠道,常见腹痛、恶心、呕吐、腹泻,偶见便秘。随后出现神经系统表现:弛缓性麻痹、对称性下行无力、构音不清、吞咽困难、眩晕、视物模糊、口干及眼外肌无力。
婴儿肉毒中毒多见于1岁以下,因肠道菌群未成熟,毒素可在肠内产生。表现为哭声微弱嘶哑、上睑下垂、吮吸差、抬头困难与肌无力。
伤口型肉毒中毒为梭菌在伤口、脓肿等处定植,孢子发芽并产毒。其症状包括低血压、呼吸困难、眼肌麻痹、共济失调与瞳孔固定性散大,少见,通常在暴露后3–6天发病。
肉毒杆菌毒素曾在第二次世界大战期间被美国,日本军队用作生化武器。
1991年埃及因食用传统腌鱼 fesaikh 中的E型毒素发生大规模疫情,报告91例、死亡18例。
约90%的肉毒中毒病例见于美国,每年报告约9–10起暴发,常与家庭自制食品相关,尤以自制罐藏、瓶装及油浸食品为主。
口服或肠道内生成的肉毒毒素需先抵御胃酸,经肠道到达十二指肠与空肠。随后经内吞入血,分布至周围神经系统。
毒素进入神经元后作为锌依赖性蛋白酶,切割SNARE蛋白(可溶性N-乙基马来酰亚胺敏感因子附着受体)。其在神经肌肉接头终末结合并抑制乙酰胆碱释放,阻断神经传递,导致弛缓性麻痹。
肉毒毒素中毒的分子步骤
doi: 10.1038/srep23707.
⑴生物测定
小鼠生物测定是检测肉毒毒素最敏感、应用最广的方法:通过注射毒素评估其毒性,小鼠常在4小时内出现腹部颤动、蜂腰样腹部、四肢瘫
一个人表现出类似的肉毒中毒症状应立即置于重症监护与胃肠外营养供应。
如果怀疑有毒素,应在24小时内服用抗毒素,因为它能在到达神经肌肉接头之前中和血液中的所有游离毒素。
在伤口肉毒杆菌中毒的情况下,伤口应该用抗生素治疗,如青霉素。
以上都需要咨询医生确定。
食品应充分加热(≥121°C)并冷藏(≤4°C);加入柠檬酸等酸化剂可降低罐装食品中孢子形成的风险。
避免食用可疑的生或未充分加热食物,并避免其接触伤口。
▶▷▶▷▶▷
▮ 副 溶 血 性 弧 菌 ▮
副溶血性弧菌(Vibrio parahaemolyticus)是导致人类急性肠胃炎的主要病原体之一,通常发生在食用生的、未煮熟的和交叉污染的海鲜产品时。
该菌常见于热带海洋与沿海环境,可在滤食性贝类(牡蛎、蛤蜊、贻贝)肠道黏附并繁殖。除胃肠炎外,还可引起伤口与耳部感染,免疫低下者暴露海水时可发生败血症。
与之相关的人类致病弧菌还包括霍乱弧菌(Vibrio cholerae)与创伤弧菌(Vibrio vulnificus)。在日本及多国亚洲地区,副溶血性弧菌每年占食物中毒病例的约20%–30%。
其在全球范围内是胃肠炎的重要病因之一,亟需关注其流行情况、毒力因子及健康影响,并完善鉴定技术以降低风险。
–革兰氏阴性
-曲线杆状
-非孢子形成者的兼性厌氧菌
-轻度嗜盐,氧化酶阳性
-最佳温度30至35°C
-pH值范围为6.8至10.2。
副溶血性弧菌是海洋嗜盐菌,依靠单极鞭毛在水中游动,并可附着于鱼、蟹、虾、龙虾、浮游动物等水生动物表面。
当食用被副溶血性弧菌污染的生的和未煮熟的海鲜时,它会引起人类急性胃肠炎。当开放性伤口或伤口暴露于受污染的海水时,也会引起感染。
其他来源是副溶血性弧菌强毒株从海产品或设备到其他产品的交叉污染。
副溶血性弧菌按抗原性分为体细胞(O)和荚膜(K)抗原。其主要毒力因子包括粘附素、耐热直接溶血素(TDH)、TDH相关溶血素(TRH)及III型分泌系统(T3SS-1、T3SS-2)。
副溶血性弧菌的结构和毒力因子
doi: 10.3389/fmicb.2015.00437.
此外,它具有两类鞭毛用于运动,并可形成有助于在恶劣环境中生存的荚膜。感染多经粪-口途径,通过细菌表面粘附因子黏附宿主细胞。
TDH通过与红细胞膜结合并在其表面打孔致溶血;同时通过形成通道使细胞外Ca²⁺内流、细胞内Cl⁻分泌增加,导致渗透压升高、细胞形态与功能紊乱,最终细胞膨胀死亡。
TRH与TDH共同介导细胞毒性并诱发肠道感染;不耐热溶血素(TLH)主要用于种属鉴定,对红细胞溶血作用较弱。早期研究还显示,尿素酶是trh⁺菌株的重要辅助毒力因子,有助于在胃肠道定植与致病。
注:尿素酶指可以催化尿素,导致尿素分解成氨和二氧化碳的一种酶,在临床上明确幽门螺杆菌就是人体胃内能够产生大量尿素酶的细菌。
第三型分泌系统(T3SS 1)在组织细胞感染期间诱导自噬和细胞毒性。它连续引起自噬、细胞起泡、溶解最后导致死亡。
在我国东部沿海省份的部分暴发病例中,副溶血性弧菌感染相对较高。并且在亚洲、欧洲、非洲和美洲国家,类似病例的爆发已被频繁报道。
1950年,日本首次爆发副溶血性弧菌病,报告了272例急性胃肠炎,其中20人死亡。
1997年至1998年,美国报告了700多起食用受污染的生牡蛎的病例。
副溶血性弧菌食物中毒多发于夏季(6—10月),因温暖水域有利于其繁殖。
螃蟹、虾、龙虾、贝类、牡蛎、蛤蜊和金枪鱼是高风险的海产品,必须在食用前彻底煮熟。
副溶血性弧菌中毒典型的症状是水样腹泻、恶心、呕吐、腹部痉挛、发烧和发冷。进食受病原体污染的食物后,潜伏期约为12至24小时,并于5至7天内消退。
免疫功能低下的个体可能需要约10至15天的长时间才能恢复,因为疾病是自限性的,不需要药物治疗。
有些严重的患者可能会出现粘液或便血,血压下降,失去知觉,皮肤苍白、发紫,甚至死亡。此时应立即就医。
⑴菌株培养鉴定
使用含十二烷基硫酸钠(SDS)、烷基苯磺酸盐和胆汁盐的选择性增菌培养基可用于副溶血性弧菌的培养与分离。以碱性蛋白胨水为代表的增菌液具最佳pH和较高NaCl浓度,有利于弧菌生长。
⑵分子检测技术
副溶血性弧菌菌株的鉴定也可采用分子技术,如常规表型与生化试验、PCR及DNA检测。高通量宏基因组测序或靶向tNGS可用于分型与菌株区分。
该病多为自限性,但重症时需药物治疗。常用措施包括口服补液及应用四环素等抗生素;充足饮水以补充电解质、卧床休息亦有助于恢复。
副溶血性弧菌食物中毒的预防与控制:
–避免食用生或未熟透的贝类、牡蛎等海产品。
-处理海产品时注重个人卫生,生熟分开,防止交叉污染。
-皮肤有割伤或创口者应避免接触海水或微咸水,并尽量使用防水敷料。
▶▷▶▷▶▷
▮ 志 贺 氏 菌 ▮
志贺氏菌属(Shigella)是引起急性胃肠道感染的原因,这种感染会损害回肠和结肠上皮并引起细菌性痢疾。志贺氏菌感染多见于贫困、欠发达且缺乏卫生与医疗设施的国家和地区。
志贺氏菌病死亡率较高,尤以5岁以下营养不良儿童为甚。患者在腹泻期间因大量丢失电解质和血液而营养受损,可能致死。
• 志贺氏菌属分为四个血清群:
A群:痢疾志贺菌(S.dysenteriae)
B群:福氏志贺菌(S.flexneri)
C群:鲍氏志贺菌(S.boydii)
D群:宋内志贺菌(S.sonnei)
其中,S.dysenteriae 1型(志贺毒素产生菌)可引起严重的流行性痢疾,具有较高的致死率;而其他血清型通常引起相对较轻的痢疾症状。
–革兰阴性杆菌;无芽孢、无鞭毛(不运动)、无荚膜;兼性厌氧。
-最适生长温度为 37°C,生长范围约 10–40°C;可耐受一定盐度与酸性环境。
-低感染剂量:约 10–100 个菌体。
-对巴氏灭菌温度敏感(≥60°C 易被杀灭)。
-对紫外线和化学消毒剂敏感。
-能在不利的物理和化学条件下存活。
⑴病原菌储存宿主
–人类肠道是志贺菌的主要天然储存库;
-动物感染极为罕见,几乎不作为传染源。
⑵传播途径
–粪—口传播为主要途径
–人与人直接接触
–被污染的水和食物
-受污染的灌溉水可污染蔬果
⑶易感人群
–儿童和婴幼儿为高危人群
–免疫力低下者
–密切接触者(如家庭成员、托幼机构)
⑷流行特征
–发展中国家发病率较高
-与卫生设施不完善和个人卫生不良相关
-季节性:夏秋季高发
2003-2013年中国志贺氏菌的流行情况
doi: 10.3389/fcimb.2016.00045.
症状通常在摄入细菌后1–3天出现,视剂量可在12小时至7天内发病。
典型症状包括发热、食欲减退、腹痛、血性或水样腹泻、结肠炎、乏力与不适。大量水样便可致脱水,但较少见。伴随的厌食与营养不良需积极处理,是5岁以下儿童死亡的主要原因。少数患者可出现神经症状,如嗜睡、不自主运动和头痛。
这种疾病一般在5至7天内自行消退,但感染者可能会在很长一段时间内无症状地在粪便中排出细菌,并可能造成传播感染的威胁。
⑴侵入阶段
经口进入消化道
胃酸耐受:可抵抗低 pH
穿越小肠:因上皮更新快、液流迅速,难以定植
最终定植于大肠
⑵细胞侵袭机制
M细胞摄取:进入并被吞噬泡包裹
逃逸入胞:自吞噬泡逃出,进入细胞质
巨噬细胞:被吞噬后诱导其凋亡
⑶细胞内增殖与扩散
在大肠上皮内快速繁殖
经质膜包裹进行细胞间直接传播
继而感染邻近上皮细胞
⑴志贺毒素(主要由S.dysenteriae产生)
作用机制:经胞吞进入宿主细胞
毒性效应:抑制蛋白合成,致细胞死亡
临床表现:出血性腹泻
⑵脂多糖(LPS)
释放时机:细菌死亡破裂时释放
损伤效应:破坏肠道上皮组织
炎症反应:激发强烈的炎症应答
⑶炎症因子
IL-12释放:S. flexneri特别容易诱导IL-12产生
线粒体损伤:导致细胞坏死
组织破坏:引起肠道组织广泛炎症和溃疡
⑷病理损伤特点
组织破坏:主要由宿主免疫反应引起,而非病原菌直接作用
粘膜溃疡:免疫系统过度反应导致的继发损伤
炎症反应:局部组织出现严重炎症和水肿
⑴细菌培养方法
及时采样:出现痢疾症状后立即采集粪便标本
采集时机:感染初期阶段最佳,病原菌体外存活时间有限
样本处理:需要立即检测,避免病原菌死亡
⑵免疫学检测方法
酶免疫测定(EIA):成本低、操作简便。
⑶分子诊断技术
PCR/测序:基因检测快速、可靠,可区分不同志贺菌种。
⑷目标基因
ipaH基因:侵袭相关基因
virA基因:毒力基因
iral基因:调节基因
LPS基因:脂多糖合成基因
质粒DNA:毒力质粒
⑴抗菌治疗
首选:氟喹诺酮类(如环丙沙星)、大环内酯类(如阿奇霉素)
原则:尽早治疗,依据病情调整;监测耐药性
注意:具体用药请遵医嘱
⑵支持治疗
口服补液盐:轻中度脱水
静脉输液:重度脱水或电解质紊乱
营养支持:维持免疫功能
⑶环境与个人卫生
-完善卫生设施与排污系统
-安全处置粪便,防止污染
-保护水源,避免饮用水污染
-手卫生:勤洗手,使用肥皂或消毒剂
⑷食品安全
-生熟分开
-充分加热
-适当冷藏
-果蔬反复清洗
⑸重点人群
儿童与婴幼儿:加强护理与监测
食品从业人员:定期健康检查
集体生活人群:(学校、托幼机构等)
食源性病原菌虽“微小”,却以顽强的生存力、多样的毒力因子与隐匿的传播路径,对公众健康构成持续挑战。产气荚膜梭菌的耐受与产毒、蜡样芽孢杆菌的双型中毒与广泛污染、肉毒杆菌的致命神经毒素、以及志贺氏菌的低感染剂量与高传播力,共同勾勒出从农田到餐桌、从环境到个体的风险图谱。
守护肠道健康,关键在于两端同时用力:一端是系统性防控——完善卫生基础设施、保障饮水安全、规范食品加工与冷链管理、强化时间—温度控制与流程监测;另一端是个人与社区层面的良好习惯——勤洗手、生熟分开、充分加热、规范冷藏、创口防护与及时就医。面向重点人群(婴幼儿、老年人、免疫低下者及集体生活人群),还需更精准的健康教育与常态化监测。
科学认知让风险可见,规范行动让风险可控。以循证为底、以习惯为桥、以制度为盾,我们就能在快节奏与全球化的餐桌上,稳稳地守住每一个人的“肠道安全线”。
主要参考文献
Popoff, M. R.(2014). CLOSTRIDIUM | Detection of Enterotoxin of Clostridium perfringens. Encyclopedia of Food Microbiology, 474–480.
McLauchlin, J., & Grant, K. A. (n.d.). Clostridium botulinum and Clostridium perfringens. Foodborne Diseases, 41–78.
Miyamoto, K., & Nagahama, M. (2016). Clostridium: Food Poisoning by Clostridium perfringens. Encyclopedia of Food and Health, 149–154.
Chukwu, E. E., Nwaokorie, F. O., Coker, A. O., Avila-Campos, M. J., Solis, R. L., Llanco, L. A., & Ogunsola, F. T. (2016). Detection of toxigenic Clostridium perfringens and Clostridium botulinum from food sold in Lagos, Nigeria. Anaerobe, 42, 176–181.
Granum, P. E., & Lund, T. (2006). Bacillus cereus and its food poisoning toxins. FEMS Microbiology Letters, 157(2), 223–228.
Tewari, A., & Abdullah, S. (2014). Bacillus cereus food poisoning: international and Indian perspective. Journal of Food Science and Technology, 52(5), 2500–2511.
Parihar, H. S. (2014). Bacillus cereus. Encyclopedia of Toxicology, 353–354.
Batt, C. A. (2014). BACILLUS | Bacillus cereus. Encyclopedia of Food Microbiology, 124–128.
Carlin, F. (2016). Bacillus cereus and Other Bacillus sp. Causing Foodborne Poisonings, Detection of. Encyclopedia of Food and Health, 301–306.
Drobniewski, F. A. (1993). Bacillus cereus and related species. Clinical Microbiology Reviews, 6(4), 324–338.
Tewari, A., & Abdullah, S. (2014). Bacillus cereus food poisoning: international and Indian perspective. Journal of Food Science and Technology, 52(5), 2500–2511.
Marrollo, R. (2016). Bacillus cereus Food-Borne Disease. The Diverse Faces of Bacillus Cereus, 61–72.
Pavlik, B., Hruska, E., Van Cott, K. et al. Retargeting the Clostridium botulinum C2 toxin to the neuronal cytosol. Sci Rep 6, 23707 (2016).
Notermans, S. H. W., Stam, C. N., & Behar, A. E. (2014). CLOSTRIDIUM | Detection of Neurotoxins of Clostridium botulinum. Encyclopedia of Food Microbiology, 481–484.
Aureli, P. (2017). Botulism. International Encyclopedia of Public Health, 254–262.
McLauchlin, J., & Grant, K. A. (n.d.). Clostridium botulinum and Clostridium perfringens. Foodborne Diseases, 41–78.
Austin, J. W. (2016). Clostridium: Occurrence and Detection of Clostridium botulinum and Botulinum Neurotoxin. Encyclopedia of Food and Health, 155–159.
Lebeda, F. J., Dembek, Z. F., & Adler, M. (2018). Foodborne Botulism From a Systems Biology Perspective. Foodborne Diseases, 275–308.
Horowitz, B. Z. (2005). Botulinum Toxin. Critical Care Clinics, 21(4), 825–839.
Letchumanan, V., Chan, K.-G., & Lee, L.-H. (2014). Vibrio parahaemolyticus: a review on the pathogenesis, prevalence, and advance molecular identification techniques. Frontiers in Microbiology, 5.
Wang R, Zhong Y, Gu X, Yuan J, Saeed AF, Wang S. The pathogenesis, detection, and prevention of Vibrio parahaemolyticus. Front Microbiol. 2015 Mar 5;6:144.
Risk assessment tools for Vibrio parahaemolyticus and Vibrio vulnificus associated with seafood, Food and Agriculture Organization of the Unites Nations, ISSN 1726-5274.
Baker-Austin, C., Jenkins, C., Dadzie, J., Mestanza, O., Delgado, E., Powell, A., … Martinez-Urtaza, J. (2020). Genomic epidemiology of domestic and travel-associated Vibrio parahaemolyticus infections in the UK, 2008–2018. Food Control, 115, 107244.
Yaashikaa, P. R., Saravanan, A., & Kumar, P. S. (2016). Isolation and identification of Vibrio cholerae and Vibrio parahaemolyticus from prawn (Penaeus monodon) seafood: Preservation strategies. Microbial Pathogenesis, 99, 5–13.
Bolen, J. L., Zamiska, S. A., & Greenough, W. B. (1974). Clinical features in enteritis due to vibrio parahemolyticus. The American Journal of Medicine, 57(4), 638–641.
Mumy, K. L. (2014). Shigella. Encyclopedia of Toxicology, 254–255.
Ashkenazi, S. (2018). Shigella Species. Principles and Practice of Pediatric Infectious Diseases, 842–846.e2.
谷禾健康
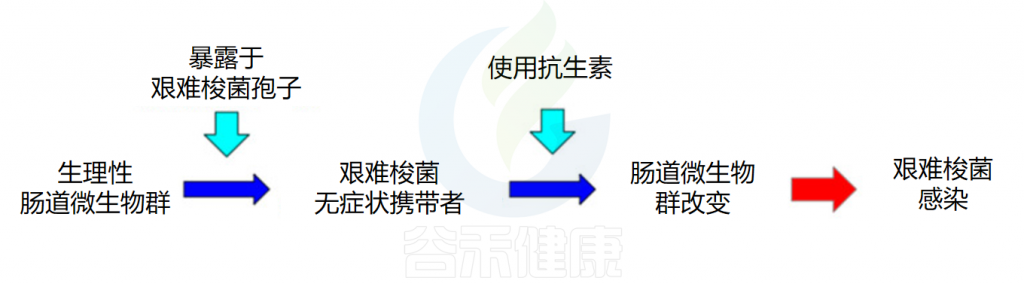
艰难梭菌是一种革兰氏阳性、形成孢子的厌氧芽孢杆菌,是艰难梭菌感染(CDI)的病原体。该菌于1935年首次分离得到,1977年报道了第一例确诊的CDI病例。从那时起,CDI的发病率逐年上升,艰难梭菌感染现在是全世界医院腹泻的最常见原因。
艰难梭菌在我国健康成年人结肠的定植率约为4%-7%,而腹泻患者的检出率高达15%-40%。但为什么一些人群肠道中存在艰难梭菌,却没有出现任何症状?而另一些则会出现腹泻、腹痛,甚至发展为假膜性结肠炎?
这是因为艰难梭菌可分为产毒型和非产毒型,通常只有产毒型会引发临床症状,其感染的表现主要受多种毒力因子影响,这些毒力因子可能比艰难梭菌的存在更为重要。并且健康的肠道微生物组对艰难梭菌感染具有保护作用。平衡的微生物和宿主因子可抑制艰难梭菌的发芽和生长,同时微生物群与宿主免疫系统的相互作用调节免疫反应,刺激抗菌肽和分泌型IgA的产生,维持菌群平衡,通过营养竞争、生态竞争和生态位排斥等机制抵抗艰难梭菌的定植和感染。
例如一些有益菌通过产生短链脂肪酸降低管腔pH值(不利于艰难梭菌),并刺激粘蛋白和抗菌肽的生成以增强防御屏障。丁酸盐还能稳定缺氧诱导因子-1(HIF-1)、增强紧密连接,保护肠道上皮免受艰难梭菌毒素损害。
艰难梭菌的孢子和生长依赖特定胆汁酸,肠道共生细菌通过调节胆汁酸代谢产物,抑制其萌发和定植。例如,Clostridium scindens可催化胆汁酸7α-脱羟基化,生成次级胆汁酸,从而增强对艰难梭菌感染的抵抗力。
当肠道微生物组的平衡状态受到干扰或破坏时,艰难梭菌感染(CDI)的易感性会显著增加。例如由于使用抗生素,年龄增长、其他胃肠道疾病,营养状态不佳、肥胖、癌症化疗这些因素都会增加艰难梭菌感染的风险。
由于艰难梭菌的危害由毒力因子决定,检测产毒菌株或基因显得尤为重要。目前,一些检测方法只能识别艰难梭菌菌株,无法区分是否为产毒菌株,可能导致误诊或过度治疗。为提高诊断准确性,近年来开发了多种技术,包括检测毒素基因的分子诊断技术和直接检测毒素蛋白的免疫学方法。16S测序仅能分辨到物种层面,宏基因组测序(包括一些靶向的测序)则可识别毒力基因。这些技术能够较快速、准确地识别产毒菌株,帮助临床医生制定更有效的治疗方案,减少不必要的抗生素使用及相关并发症。
艰难梭菌感染的治疗和预防也是人们所关心的,其治疗方法包括针对细菌(抗生素)、针对毒素(抗体、结合剂)以及微生物群(保护或恢复)的方法,在暴发性病例或非手术治疗失败时,还可选择结肠切除术或其他微创手术。通过疫苗和益生菌预防艰难梭菌感染的研究逐渐显示出一定的临床效果。
希望通过本文的内容,能够帮助人们更加全面和清晰地了解艰难梭菌的相关知识,同时提高对其危害的认识,从而采取更加科学和有针对性的措施来预防和应对艰难梭菌感染。
艰难梭菌是一种革兰氏阳性、形成孢子的厌氧芽孢杆菌,近年来,由于抗生素的滥用导致肠道菌群失调,艰难梭菌感染(CDI)的发病率在中国和全球范围内不断上升,显示出这一公共卫生问题的严重性。
2022年,中国艰难梭菌感染治疗市场规模达34.14亿元,全球艰难梭菌感染治疗市场规模达到78.74亿元,预计全球艰难梭菌感染治疗市场规模将在2028年达到147.95亿元。
艰难梭菌的感染率不断上升,很多人可能想知道自己体内是否存在这种细菌,以及是否艰难梭菌存在于人体就会致病及造成危害?随着谷禾的视角一起往下看。
1
毒力因子影响艰难梭菌的致病性
首先要强调的一点是,艰难梭菌感染的临床表现受到多种毒力因子的影响,这些毒力因子可能比艰难梭菌的存在更为重要。艰难梭菌分为产毒型和非产毒型,通常只有产毒型会引发临床症状。
产毒艰难梭菌主要产生毒素A(肠毒素)和毒素B(细胞毒素),少部分仅产生毒素B。高毒力菌株(如027型)除了产生这两种毒素外,还产生二元毒素。
据国外综合医院统计,A(+)B(+)占艰难梭菌的57%,A(-)B(+)占34%,A(-)B(-)占9%。毒素A阳性,毒素B阴性的菌株尚未被发现,毒素B可以单独导致艰难梭菌致病。
◮ 艰难梭菌的毒力因子
毒素A:主要作用于肠道,导致肠道上皮细胞的损伤和炎症反应。它通过结合肠道细胞表面的受体,诱导细胞内信号转导,导致细胞凋亡和肠道通透性增加,从而引发腹泻。
毒素B:具有更强的细胞毒性,能够直接破坏细胞骨架,导致细胞死亡,破坏紧密连接并丧失肠道屏障功能。它在致病过程中,尤其是在高毒力菌株中,起着关键作用。
二元毒素:一种ADP-核糖基转移酶,导致肌动蛋白细胞骨架解聚(导致屏障功能丧失和紧密连接破坏)和微管突起(导致艰难梭菌粘附增加)。
致病性基因和毒素作用方式
Buddle JE,et al.Virulence.2023
◮ 毒素诱导引发的免疫反应导致各种症状
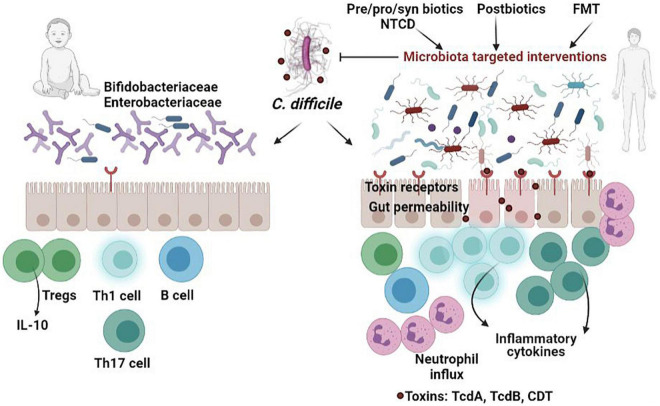
这些毒素在致病性位点(PaLoc)内编码,能够与肠上皮细胞的受体结合并被内化。在细胞内,它们使小的Rho蛋白葡萄糖化,导致紧密连接破裂、上皮完整性降低,并增加细菌对宿主上皮的粘附。
毒素诱导的肠道屏障损伤会引发免疫反应,其特征是分泌促炎细胞因子和趋化因子,导致中性粒细胞、肥大细胞、单核细胞和先天性淋巴细胞的募集和激活;以及花生四烯酸代谢物的分泌、P物质和活性氧中间体的生产。这些细胞因子和免疫细胞的作用会引发艰难梭菌感染的临床症状。例如,肥大细胞脱颗粒刺激组胺释放,增加肠道屏障的通透性,导致大量液体流失到管腔中,从而引发严重的腹泻、痉挛、脱水和伪膜性肠炎等症状。
艰难梭菌的各种毒力因子

Buddle JE,et al.Virulence.2023
2
产毒艰难梭菌及我国的流行情况
目前已鉴定出几十种艰难梭菌菌株,其相对比例在过去几年中迅速变化,且毒力和感染能力可能存在差异。我们这里简单介绍几种高毒性艰难梭菌菌株以及我国的主要流行情况。
◮ 毒力较高的艰难梭菌
⑴027菌株
027菌株是近年来备受关注的高毒力菌株,部分027菌株在体外能够产生更多毒素,并且更容易与人类肠道上皮细胞结合,通常与严重腹泻和高死亡率相关。该菌株在北美和欧洲的医院中广泛传播,成为医院获得性腹泻的主要原因。
⑵017菌株
这种菌株在1990年代首次被识别,主要在亚洲地区流行。017菌株通常被认为是毒素A阴性、毒素B阳性的菌株。由于毒素A检测通常用于识别粪便样本中的艰难梭菌,因此可能会遗漏这种菌株。
⑶078菌株
078介导的艰难梭菌感染患者更常见于靠近农场的地区,078菌株是食用动物中最常见的类型,在牛和猪中都有发现,人可能通过食用动物导致感染。078菌株的毒力特征与027菌株相似,所有027和078菌株似乎都具有完整的肌动蛋白特异性ADP核糖基化毒素。
⑷其他菌株
除了027、017和078菌株,还有其他核糖型的艰难梭菌菌株,如001、106和053等。然而每种核糖型的相对比例在过去几年中迅速变化。核糖型001的比例从25.1%下降到7.8%,核糖型106的比例从26.2%下降到20.2%,且106几乎只在英国发现。
◮ 我国的艰难梭菌流行情况

一项荟萃分析统计了我国大陆部分省份的艰难梭菌感染发病率及主要流行和耐药的艰难梭菌。
艰难梭菌在健康成年人结肠的定植率约为4%-7%,而国内腹泻患者的检出率为15%-40%(共分析了15,313个样本)。在中国大陆,ST-37(017)和ST-3是最普遍的菌株;幸运的是,ST-1(027)和ST-11(078)等高毒力菌株迄今很少出现。
并且不同省份的阳性率存在差异显著:
湖北:23%
河北:19%
安徽:19%
四川:17%
宁夏:4%
河南:3%
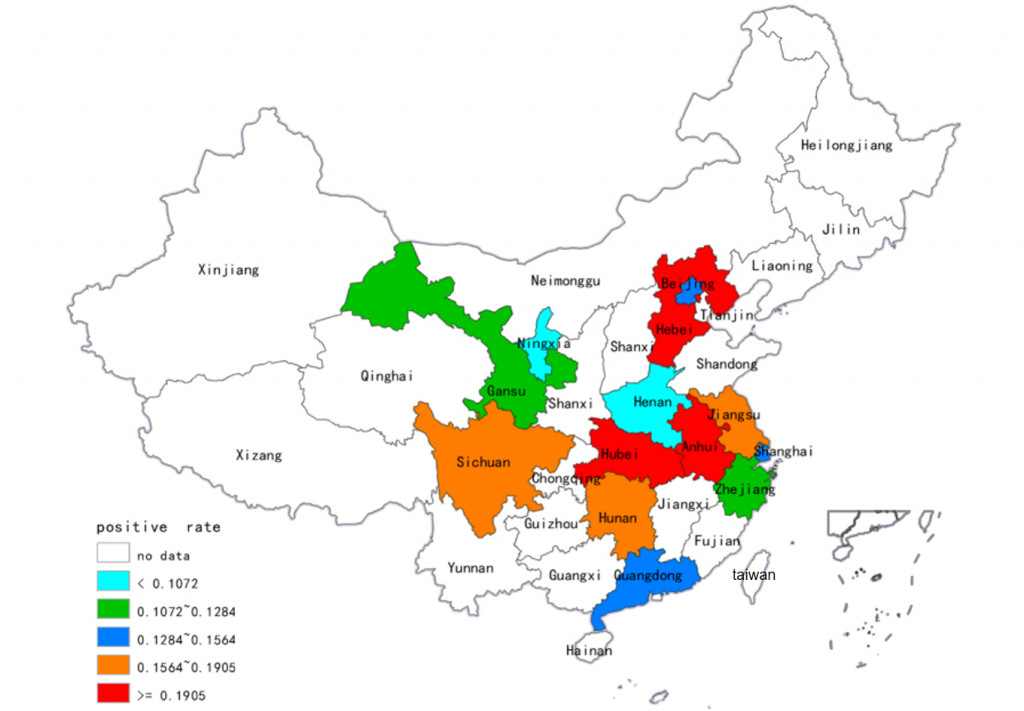
doi: 10.1038/srep37865.
中国临床艰难梭菌的分子特征
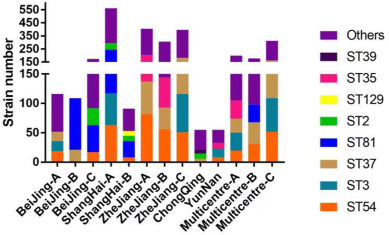
Wu Y,et al.Anaerobe.2022
中国大陆的流行艰难梭菌株并非高毒力类型,这可能是近年来没有艰难梭菌感染爆发的原因。此外,关于毒素A阴性和毒素B阳性菌株的报道逐渐增加,许多研究也发现了这一现象。在亚洲,毒素A阴性和毒素B阳性菌株的数量明显高于欧美国家。
◮ 我国的艰难梭菌耐药情况
我国的艰难梭菌对环丙沙星、克林霉素和红霉素的耐药率高于其他地区;然而,报道的艰难梭菌分离株均未对甲硝唑、万古霉素、替加环素或哌拉西林/他唑巴坦耐药。
3
非产毒艰难梭菌
◮ 菌株特性不同,不会致病
非产毒性艰难梭菌(NTCD)是指那些不产生致病毒素的艰难梭菌菌株。这些菌株能够在肠道中定殖,并且通常从无症状个体中分离出来。
非产毒性艰难梭菌菌株表现出与产毒性菌株不同的表型特征,如更高的甲硝唑耐药性和更高的孢子形成效率。
◮ 非产毒菌株定植可能具有保护作用
非产毒性艰难梭菌能够在肠道中定殖而不引起症状,并有研究发现其可能有助于降低由产毒性艰难梭菌引起的感染风险。研究表明,NTCD的定殖可以通过竞争性抑制机制,防止产毒性菌株的定殖和毒素产生。
临床应用与研究:在临床试验中,NTCD-M3等菌株已被用于预防艰难梭菌感染,通过诱导肠道和系统性免疫反应,从而减少产毒性艰难梭菌的附着和感染。
了解艰难梭菌感染的发病机制对于制定有效的疾病治疗和预防措施至关重要。让我们一起来看下人体是如何感染艰难梭菌以及感染后会出现的症状。
◮ 艰难梭菌主要通过孢子传播感染
艰难梭菌(C.difficile)作为一种专性厌氧菌,通常无法在大气中存活,那么它是如何传播到人体的呢?这是通过形成孢子来实现的,这些孢子即使在恶劣的环境条件下也能存活。除了提供对氧的抵抗力外,孢子还对紫外线、干燥、热、许多消毒剂和抗生素具有抵抗力。
注:艰难梭菌孢子已在各种环境来源中检测到,包括家畜、水源和土壤。
艰难梭菌感染的发病机制
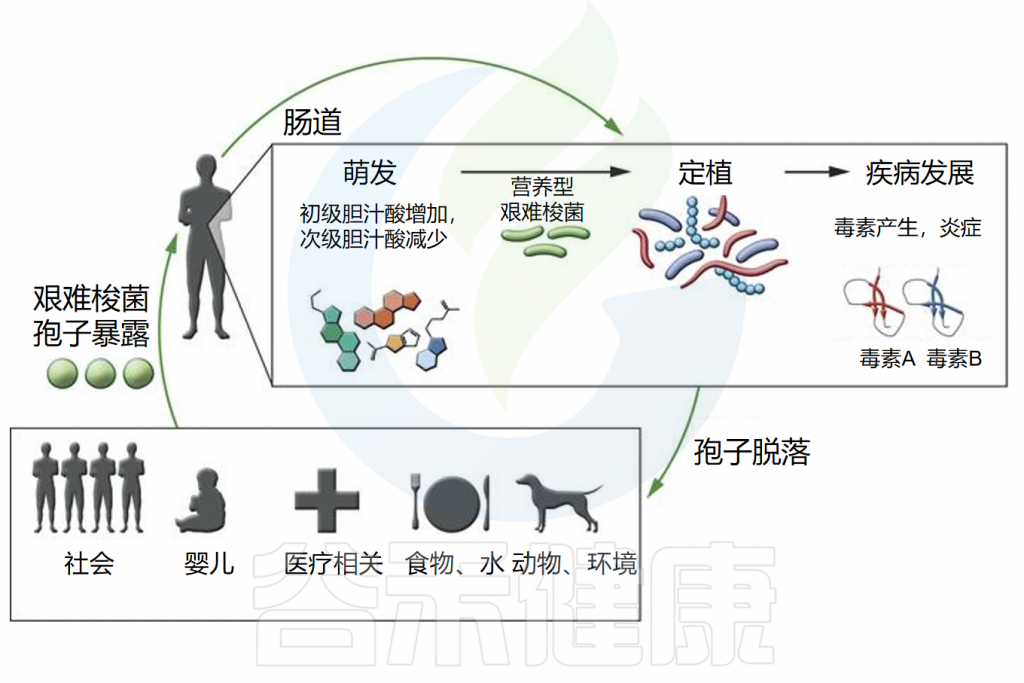
doi.org/10.1172/JCI72336.
1
感染过程
◮ 孢子生长必须依赖特定的胆汁酸
通过粪口途径摄入艰难梭菌孢子后,孢子需要发芽并生长为定植于胃肠道的营养细胞。然而,摄入孢子并不总是会导致定植,因为胃肠道环境必须适宜这一过程的发生。
体外研究表明,发芽和生长成营养形式取决于特定初级胆汁酸(如牛磺胆酸)的存在。相反,其他胆汁酸,如鹅去氧胆酸,可能会抑制艰难梭菌孢子的发芽。
胃肠道内的微生物在胆汁酸代谢中起关键作用,微生物群落的调节会影响代谢物的可用性。来自抗生素处理小鼠的盲肠提取物含有高水平的胆盐并促进孢子萌发,而来自未处理小鼠的盲肠提取物则没有。我们推测:抗生素的使用改变了肠道微生物群的代谢,导致胆汁酸种类更易促进艰难梭菌孢子的生长。
◮ 定植后毒素介导炎症和疾病
一旦定植,艰难梭菌会引发毒素介导的炎症和疾病。它产生两种主要毒素,即艰难梭菌毒素A和B(TcdA和TcdB),这些毒素在营养生长的静止期产生,主要导致粘膜上皮损伤和炎症反应。
另一种毒素,艰难梭菌二元毒素(CDT),会破坏肌动蛋白细胞骨架,研究表明其存在可能增加菌株的毒力。
由于孢子暴露和艰难梭菌定植不一定导致临床疾病,胃肠道微生物群和宿主在艰难梭菌的疾病发展中可能发挥重要作用。
2
艰难梭菌感染后的临床症状
产毒艰难梭菌菌株感染的临床表现通常从无症状携带到轻度或中度腹泻,或是暴发性,有时是致命的。症状在定植后不久开始,中位发病时间为2至3天。
◮ 常见的症状
腹泻:这是艰难梭菌感染最常见的症状,通常表现为水样腹泻,频率可达每天多次。腹泻可能伴有粘液或脓性分泌物。
腹痛和腹部不适:患者常感到腹部绞痛或不适,疼痛可能是间歇性的,且通常与腹泻发作相关。
发热:部分患者可能出现低热,体温通常在37.5°C至38.5°C之间。
恶心和食欲减退:患者可能会感到恶心,伴随食欲减退,进而导致体重下降。
脱水:由于频繁腹泻,患者可能出现脱水症状,如口干、尿量减少、皮肤弹性下降等。
腹胀:部分患者可能会感到腹部胀气或腹部膨胀。
◮ 严重并发症
在一些情况下,艰难梭菌感染可能导致更严重的并发症,包括:
伪膜性结肠炎:表现为严重的腹痛、腹泻和发热,肠道内形成伪膜。
肠穿孔:极少数情况下,感染可能导致肠道穿孔,表现为剧烈腹痛和急性腹膜炎。
中毒性巨结肠:具有全身中毒症状及全结肠或节段性结肠扩张的临床表现。是一种危及生命的并发症,表现为腹痛、腹胀、腹泻和全身症状加重,可能需要手术干预。
◮ 肠外表现
艰难梭菌感染不仅会导致肠道相关的症状,还可能引发一些肠道之外的表现,包括脱水、电解质紊乱、低白蛋白血症、低血压、肾功能衰竭、全身炎症反应综合征、关节炎、菌血症、败血症甚至死亡。
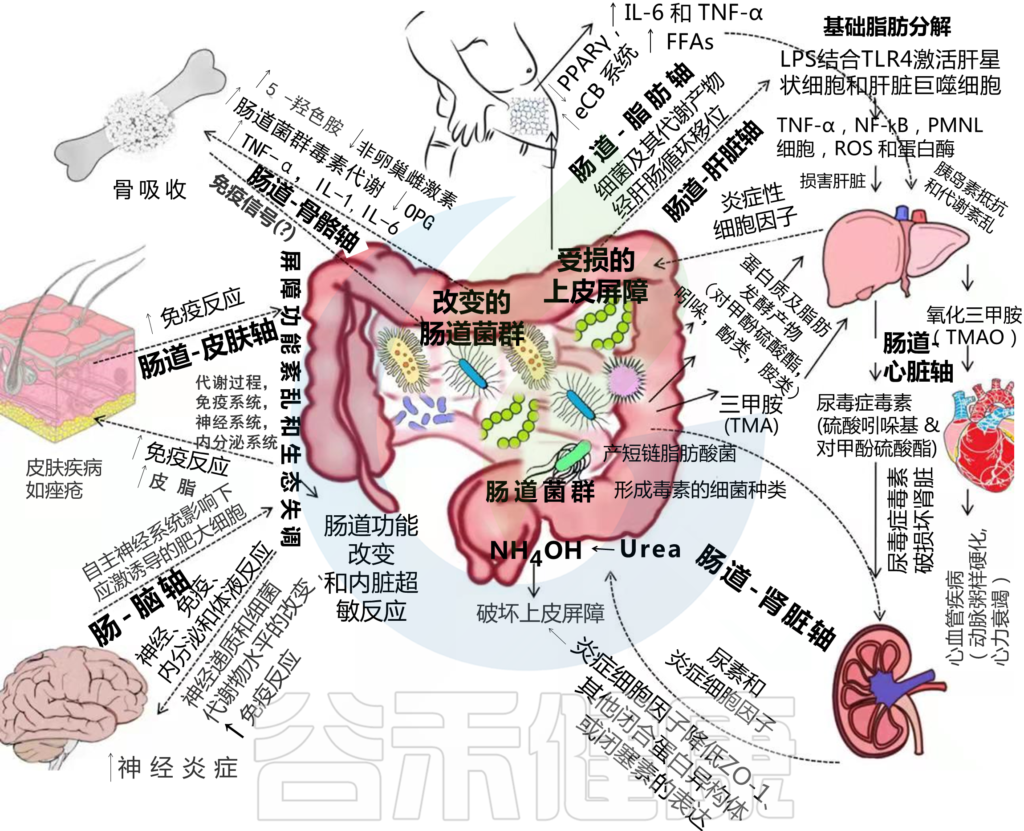
感染的核心是肠道菌群平衡被破坏
艰难梭菌感染发病机制的核心是微生物群的破坏。健康的肠道微生物群对于防止病原体定植(称为定植抗性)至关重要 。
未被破坏的微生物群能够抵抗病原体的定植,健康平衡的微生物和宿主因子均可抑制艰难梭菌的发芽和生长。同时微生物群和宿主免疫系统之间的串扰导致调节免疫反应。此外,微生物群可以刺激抗菌肽和分泌型IgA的产生,从而维持微生物群的组成。并且已经提出了多种机制来解释为什么微生物群被破坏会导致定植抗性丧失,包括营养竞争、生态竞争和生态位排斥。
而由于抗生素使用、药物、年龄变化、饮食或炎症等因素导致微生物群的破坏,可导致艰难梭菌感染的发展。由于结构或代谢环境的变化,菌群失调会导致定植抗性丧失。特定群落成员的损失可能会影响微生物和宿主产生的代谢物的水平,从而促进孢子萌发和艰难梭菌生长。菌群失调也可能通过免疫调节的丧失和促炎状态导致免疫反应失衡,这两者都会影响疾病的发展。营养型艰难梭菌产生的毒素可刺激炎性细胞因子、中性粒细胞和抗毒素抗体的生成。
微生物群对CDI期间病原体抗性和宿主的机制
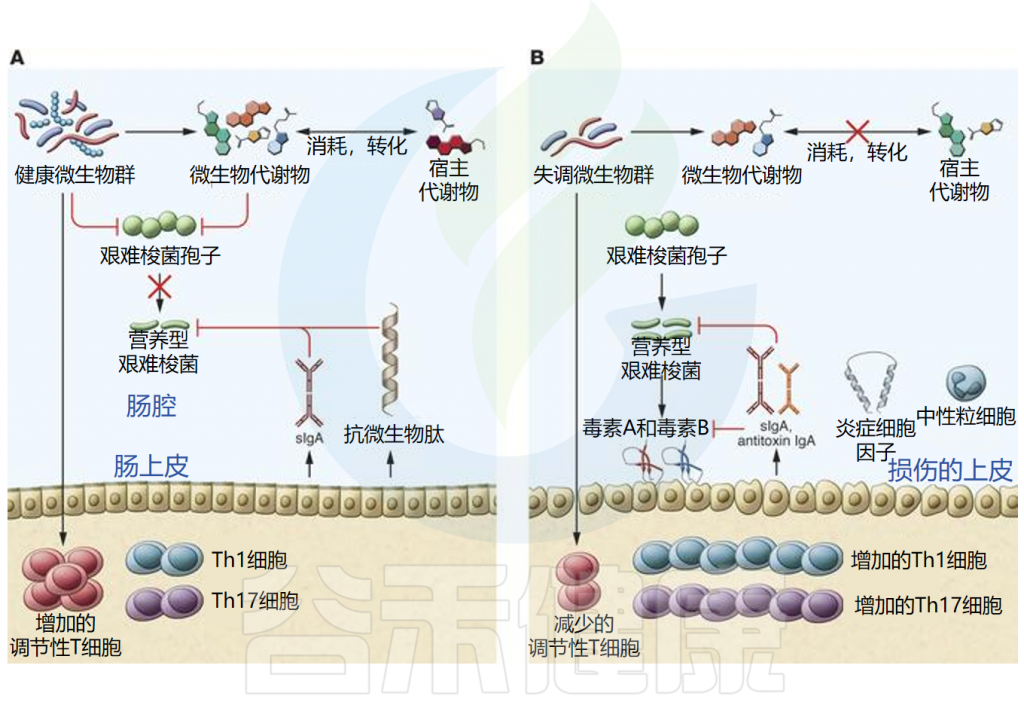
doi.org/10.1172/JCI72336.
据研究文献报道,以下这些因素会增加获得CDI的风险。
1
使用抗生素
◮ 使用过抗生素的人患病率更高
使用抗生素是艰难梭菌感染中最常见的诱发因素。一项大型回顾性研究分析了10154例艰难梭菌感染患者的数据,发现78%的患者在感染前3个月内使用过抗生素。
大多数抗生素都与艰难梭菌感染(CDI)发展相关,但最常见的药物包括青霉素、头孢菌素和氟喹诺酮类药物。在一项关于社区获得性CDI中抗生素使用情况的荟萃分析中,克林霉素发生社区获得性CDI的风险最高,然后依次是氟喹诺酮类药物、头孢菌素类、青霉素类、大环内酯类和磺胺类/甲氧苄啶类。
◮ 使用抗生素导致肠道微生物平衡被破坏增加艰难梭菌感染的风险
抗生素的使用,尤其是广谱抗生素,会显著改变肠道微生物群的组成和多样性,导致微生物群失调。这种失调主要表现为有益菌群(如双歧杆菌、乳酸菌等)数量减少,抑制艰难梭菌的生长和毒素产生的能力减弱,导致更易感染艰难梭菌。
艰难梭菌感染的发病机制
Piccioni A,et al.Int J Mol Sci.2022
2
高龄
◮ 高龄人群CDI的患病率和死亡率更高
正如多项研究所记录的那样,高龄是CDI的重要风险因素。65岁及以上的老人患病人数显著增加,人口发病率比其他年龄组高5倍以上。
并且还发现CDI的死亡率随着年龄的增长而显著升高。在2011年对美国CDI负担的最新研究中,发现65岁及以上的人大约占CDI病例总数的57%,但该年龄组的CDI死亡占CDI死亡总数的83%。
◮ 年龄增长免疫退化、微生物多样性下降
年龄增长会影响肠道微生物组结构。人类肠道微生物组在一生中经历显著变化,老年人群的微生物组多样性较低且不断变化。研究发现,老年人保护性物种(如双歧杆菌和部分厚壁菌门成员)减少,有害物种(如变形菌门)增加。这些变化与免疫系统退化(即免疫衰老)有关。
尽管年龄是CDI的独立危险因素,但其与抗生素使用增加、更频繁的医院就诊及疾病发展密切相关,这些因素共同提高了艰难梭菌的易感性。
新生儿与成人艰难梭菌感染的比较
Vasilescu IM,et al.Front Microbiol.2022
3
其他胃肠道疾病
患有其他胃肠道疾病的患者也可能更容易感染艰难梭菌。炎症性肠病(IBD)已被证实是CDI的危险因素,并与更严重的疾病结果相关。IBD患者肠道菌群呈现多样性降低,同时存在以变形菌门为主的多种潜在致病菌。然而,这些微生物群落如何影响艰难梭菌易感性的具体机制较为复杂。
◮ 肠道炎症性疾病会促进艰难梭菌感染
宿主免疫反应能调节微生物群,而IBD加重CDI病情表明炎症可促进CDI发展。抗菌肽脂质运载蛋白-2和钙卫蛋白等炎症产物限制肠道环境中营养物质可用性,可能为艰难梭菌创造有利条件。肠道菌群类型影响粘膜IgA库,复发性CDI患者结肠活检中IgA产生细胞减少。
还观察到各种微生物会影响T细胞的亚群,例如梭菌属诱导Treg物种和分段丝状细菌诱导Th17细胞分化。这些微生物种群的调节,例如抗生素后,可能会影响艰难梭菌的定植。
4
其他风险因素
除此之外,还有一些因素也会增加艰难梭菌感染的风险。如:
医疗机构暴露:住院患者,特别是长期住院者,长期护理机构居住者容易艰难梭菌感染;
胃酸抑制剂使用:质子泵抑制剂(PPIs)和H2受体拮抗剂,降低胃酸可能导致艰难梭菌孢子存活率增加,长期使用与CDI风险增加相关。
手术和医疗操作:胃肠道手术、鼻胃管和胃肠营养管的使用、结肠镜检查会导致艰难梭菌感染风险升高;
营养状态不佳:低蛋白血症、营养不良的人群易感染艰难梭菌;
肥胖、癌症化疗也可能会增加艰难梭菌感染的风险。
肠道微生物群被破坏是艰难梭菌感染发病的关键机制。健康的肠道菌群对防止艰难梭菌定植和感染至关重要。那么,微生物群究竟如何在这一过程中发挥作用?那我们一起来看看。
艰难梭菌感染中的微生物群改变
正常的肠道菌群通过对艰难梭菌的定植抗性在预防 艰难梭菌感染中起着核心作用。这导致了一个问题,即是否存在一种微生物群紊乱模式,这种模式易导致艰难梭菌定植和感染。
◮ 菌群多样性降低,厚壁菌门增加
多项研究一致显示,与健康人群相比,艰难梭菌感染(CDI)患者的菌群复杂性和丰富度明显降低。这种多样性降低被认为是CDI发病和复发的关键因素。
厚壁菌门(Firmicutes)减少:CDI患者中厚壁菌门的丰度和多样性显著降低,尤其是瘤胃球菌科(Ruminococcaceae)和毛螺菌科(Lachnospiraceae)等保护性菌群。
拟杆菌门(Bacteroidetes)改变:CDI患者通常表现为拟杆菌门多样性降低,但有研究显示有症状患者中某些拟杆菌属(Bacteroides)可能增加。
变形菌门(Proteobacteria)增加:CDI患者体内变形菌门(特别是肠杆菌科)的比例明显增高。
◮ 产丁酸细菌减少,机会性病原体增加
接受多轮抗生素治疗的复发性CDI患者肠道微生物群组成遭受严重破坏。对比CDI患者、艰难梭菌阴性院内腹泻患者和健康对照受试者的远端肠道微生物群发现,艰难梭菌感染可能导致功能性菌群发生以下变化:
产丁酸盐细菌减少:包括罗氏菌属(Roseburia)、普拉梭菌(Faecalibacterium Prausnitzii)、假丁酸弧菌属等。
产乳酸细菌增加:特别是肠球菌属(Enterococcus)。
机会性病原体增加:研究发现,与健康者相比,白色念珠菌和光滑念珠菌在艰难梭菌阳性样本中更常见。
在艰难梭菌感染患者的肠道微生物群中,肠球菌、乳酸菌、大肠杆菌、肠杆菌、副拟杆菌、嗜粘蛋白阿克曼菌的相对丰度增加,以及粪杆菌、Roseburia、Blautia、Prevotella、链球菌的水平降低。
艰难梭菌感染相关的肠道微生物群失调

Vasilescu IM,et al.Front Microbiol.2022
生化和免疫紊乱影响感染
肠道菌群失调还引发多种生化和免疫紊乱:如短链脂肪酸(SCFA)水平降低、初级胆汁酸增多、碳水化合物可利用性提高、免疫功能受抑及竞争微生物缺乏。这些变化共同促进艰难梭菌的定植、孢子萌发和生长繁殖。
◮ 丁酸盐有助于减轻艰难梭菌毒素的损害
短链脂肪酸可以通过降低管腔pH值(对艰难梭菌不利)并通过产生粘蛋白和抗菌肽来刺激防御屏障。丁酸盐还可以通过稳定缺氧诱导因子-1(HIF-1)和增加紧密连接来保护肠道上皮免受艰难梭菌毒素的损害,抑制肠道炎症和细菌易位。
在小鼠的饮用水中添加丁酸盐,施用丁酸盐的前药、三丁酸甘油酯或富含菊粉的饮食(菊粉可以被肠道共生细菌发酵,产生短链脂肪酸,主要是乙酸盐、丙酸盐和丁酸盐)可使小鼠免受CDI的侵害。
◮ 胆汁酸会影响艰难梭菌的定植和生长
艰难梭菌孢子萌发由蛋白酶CspC和CspA感知胆汁盐和氨基酸复合物而调控。某些胆酸盐衍生物和甘氨酸可促进孢子萌发,而脱氧胆酸盐抑制艰难梭菌生长,鹅去氧胆酸盐则阻断牛磺胆酸盐介导的萌发过程。
共生肠道梭菌通过调节胆汁酸代谢产物,创造不利于艰难梭菌萌发和定植的环境。例如,Clostridium scindens能催化胆汁酸7α-脱羟基化,产生次级胆汁酸,增强对艰难梭菌感染的抵抗力。失去这类能将初级胆汁酸转化为具抗菌活性次级胆汁酸的微生物,将显著增加CDI风险。
◮ 艰难梭菌会刺激其他细菌产生吲哚造成不利肠道环境
最近的研究发现,CDI患者肠道腔中的吲哚水平增加(色氨酸代谢物参与微生物生长、毒力诱导、抗酸性、生物膜形成),艰难梭菌本身不能产生这种代谢物,但会刺激其他细菌产生吲哚,以阻止和抑制吲哚敏感菌株的生长和发展,包括保护性肠道微生物群代表, 从而确保有利于艰难梭菌生存的肠道环境。
微生物群介导艰难梭菌的定植和感染
一些人群中虽然有艰难梭菌定植,但并不会出现致病症状,这可能与肠道微生物群的保护作用相关。
◮ 婴儿艰难梭菌的定植率较高,但很少出现症状
由于婴儿肠道的不成熟和肠道微生物群的不稳定,其特别容易受到艰难梭菌定植的影响,但并不会出现症状和发展为疾病。
在<1个月大的婴儿中,艰难梭菌的平均定植率为 37%,范围在0到61%之间。在1到6个月大之间,定植率仍然很高,为30%,出生后第一年结束时下降到约10%。不同研究报告的12个月以下儿童的定植率从14%到71%不等,这个年龄组最常被艰难梭菌定植,并且他们没有症状。
无症状携带率在3岁左右下降至0-3%,接近成人水平。同时,出生至24个月间血清针对毒素A和B的IgG抗体浓度逐渐升高。3岁左右,儿童肠道微生物群趋于稳定并具备成人特征,这可能导致症状性CDI从该年龄开始增加。
注:新生儿微生物群以革兰氏阳性球菌、肠杆菌科或双歧杆菌科为主,逐渐过渡到以双歧杆菌科为主。双歧杆菌可通过上调肠道树突状细胞产生IL-10,解释了艰难梭菌定植婴儿无症状的原因。在剖宫产新生儿中,T细胞和CD4+辅助性T细胞水平降低,可能因未成熟的免疫系统无法激活炎症反应所致。
研究发现,配方奶喂养婴儿的艰难梭菌定植率高于母乳喂养婴儿,且母乳喂养婴儿的菌落计数明显更低,这可能与母乳中含有毒素A和B的抗体有关。
总之,新生儿艰难梭菌定植的高携带率可以用新生儿肠道的不成熟和肠道微生物群的存在来解释。然而,出生后的母乳喂养带有毒素抗体,加上艰难梭菌毒素受体的缺乏,可以帮助婴儿免受艰难梭菌毒素的有害影响。
◮ 肠道微生物多样性降低的人群和老年人更易受艰难梭菌影响
几项研究还比较了老年人群的肠道微生物样本,这些人群更容易受到艰难梭菌影响。
老年艰难梭菌感染患者的肠杆菌科、肠球菌属和乳酸杆菌的数量较高,而健康的老年人携带更多样化的拟杆菌属菌株。并且与任一老年人群相比,健康成年人也更有可能拥有更多的双歧杆菌和拟杆菌。最近使用16S rRNA 基因高通量测序的研究更深入地研究了艰难梭菌阳性人群的群落结构。观察到,与健康患者相比,活动性CDI患者的肠道微生物群多样性较低。
类似研究发现,与健康成人相比,CDI腹泻患者的肠道微生物群多样性显著降低,尤其是厚壁菌门的多样性较低。健康人群中以Lachnospiraceae、Ruminococcaceae和Bacteroidaceae为主导,而CDI和非CDI腹泻患者的微生物群落高度相似,表明腹泻或炎症可能与特定微生物群落相关。
在小鼠模型中进行了类似观察,与人类相似,抗生素降低了小鼠肠道微生物群多样性,使其更易患肠道疾病,包括CDI。研究发现,头孢哌酮、克林霉素或多种抗生素处理后,易感小鼠感染前以乳酸菌科和肠杆菌科为主,而对CDI具有保持抗性的动物以Lachnospiraceae为主。后续研究表明,被Lachnospiraceae定植的小鼠比被大肠杆菌定植的小鼠艰难梭菌定植减少且病情较轻。小鼠模型为识别CDI保护性成分提供了可测试的方法。
◮ 复发性CDI:微生物群恢复不完全
艰难梭菌感染(CDI)最常见的并发症是恢复不完全和反复感染。初次感染后复发率约为20-30%,3次感染后高达60%。研究发现,复发患者的微生物群多样性低于单次CDI患者,这表明可能可以根据感染期间存在的微生物群落预测复发。尽管一些研究在分析中包含了复发样本,但尚未确定复发性CDI患者特有的微生物特征。
另外有研究发现,复发性CDI患者体内初级胆汁酸浓度较高。粪菌移植后,次级胆汁酸浓度增加,接近健康供体水平,而这些酸在FMT前样本中未检测到。该结果与体外和小鼠研究一致,表明次级胆汁酸(如石胆酸和脱氧胆酸)可抑制艰难梭菌生长。尽管细菌群落决定代谢环境,但不同细菌群落可能通过相似功能实现相同代谢结果,仅靠群落结构可能不足以预测复发风险。
如何定义艰难梭菌感染病例?
只有产生毒素的产毒艰难梭菌菌株才具有致病性。根据欧洲临床微生物学和传染病学会(ESCMID)指南,CDI定义为:(i)符合CDI的临床表现,且粪便中检测到毒素A或毒素B的艰难梭菌,且无其他腹泻原因;或(ii)伪膜性结肠炎(PMC)患者。
美国医疗保健流行病学学会和美国传染病学会的定义类似:CDI病例需具备症状(通常为腹泻),且粪便检测产毒艰难梭菌或其毒素阳性,或结肠镜或组织病理学显示PMC。
那我们该如何检测艰难梭菌感染(CDI)?艰难梭菌感染检测通常包括以下方法:
1
临床评估
•症状:难梭菌感染病的主要症状包括腹泻(每天3次或以上稀便,持续2天以上)、腹痛、发热、恶心和脱水等。严重病例可能出现伪膜性结肠炎(PMC)、中毒性巨结肠或感染性休克。
•病史:重点关注患者的抗生素使用史(尤其是第三代头孢菌素、氟喹诺酮类等)、住院史、免疫抑制状态以及质子泵抑制剂(PPI)的使用。
2
实验室检测方法
◮ 细菌培养
用环丝氨酸头孢西丁果糖琼脂培养基(CCFA)等进行厌氧培养,需时72小时,灵敏度高且可获得菌株,但不能检测毒素不能区分非产毒株。
但分离菌株后,可以通过直接从菌落悬浮液或细菌生长的肉汤上清液中检测其体外毒素的产生来确定其致病潜力。
◮ 高通量测序
高通量测序可检测艰难梭菌菌株或毒力基因,16S测序仅能分辨到物种层面,可通过谷禾16S健康报告的解读,并结合自身有没有腹泻症状。然后进一步去判别是否存在产毒菌株。
与此同时,宏基因组测序(包括一些靶向的测序)则可识别毒力基因。
◮ 谷氨酸脱氢酶测定
谷氨酸脱氢酶(GDH)是所有艰难梭菌菌株表达的代谢酶,可通过ELISA或免疫层析法检测。阳性结果仅表明存在艰难梭菌,无法判断其是否产毒。由于其高阴性预测值(NPV,80.0%-100%),GDH阴性结果通常可排除感染,常用于初筛。
◮ 毒素检测
细胞毒性测定被认为是检测艰难梭菌的游离毒素(主要是毒素 B)的参考方法。
酶联免疫吸附试验(EIA):检测艰难梭菌毒素A或毒素B,快速但敏感性较低。
细胞毒素中和试验:检测毒素活性,敏感性和特异性较高,但耗时较长。
◮ 核酸扩增检测(NAATs)
实时PCR或环介导等温扩增法(LAMP) :检测艰难梭菌毒素基因,耗时短,敏感性高,但可能检测到无症状定植者,且成本高。
3
综合算法
根据欧洲临床微生物学和传染病学会(ESCMID)指南,推荐使用两步或三步算法:
初筛:谷氨酸脱氢酶(GDH)抗原检测或核酸扩增试验(NAAT)。
确认:毒素检测(EIA或细胞毒素试验)。
4
其他辅助检查
血常规:轻、中度感染者外周血白细胞可正常,严重感染者白细胞升高。
降钙素原(PCT):对诊断CDI意义不大,但PCT>0.2 ng/ml时,提示CDI有重症化趋势。
腹部CT:对重症CDI患者有辅助诊断意义,即结肠壁增厚、结节状结肠袋增厚、水肿厚度>4 cm,特别是炎症部位在升结肠。
内镜检查:内镜检查可作为辅助诊断,典型征象包括黏膜充血、水肿、糜烂、溃疡、直肠乙状结肠有多发性隆起的斑片或融合为大片的灰绿色、黄褐色伪膜覆盖黏膜表面。部分患者表现可不典型,尤其炎症性肠病合并艰难梭菌感染时多无特征性病变。伪膜性改变可能表明感染了产毒艰难梭菌。
艰难梭菌感染(CDI)的治疗包括针对细菌(抗生素)、针对毒素(抗体、结合剂)、宿主反应(调节炎症)或微生物群(保护或恢复)的方法,以及在暴发性病例或非手术方法失败的情况下,结肠切除术或其他侵入性较小的手术。选择取决于疾病严重程度、病史和宿主因素。
1
针对细菌——抗生素
停用有问题的抗生素以恢复正常肠道菌群是治疗CDI的理想方法。但在感染负担高或需持续抗生素治疗其他感染时,通常需要使用针对艰难梭菌的抗菌药物。
然而,几乎所有抗生素,包括针对艰难梭菌的药物,都可能进一步破坏肠道微生物群,延迟耐药性菌群的恢复,并增加再次感染的风险。目前用于治疗CDI的主要抗菌药物包括:
•万古霉素:万古霉素是美国食品药品监督管理局(FDA)批准的第一种CDI药物。最近的临床试验数据表明,万古霉素在治疗重症时优于甲硝唑。
•甲硝唑:与万古霉素的疗效相当,成本优势以及对万古霉素耐药肠球菌传播的担忧,甲硝唑成为CDI的推荐药物。但随着艰难梭菌流行菌株 BI/NAP1/027/III 的出现,甲硝唑治疗失败的报道越来越多。
•非达霉素:非达霉素也是获得FDA批准的其他治疗CDI药物。
•新型小分子抗菌剂:乳酸菌素3147是一种由乳酸乳球菌产生的双组分抗生素,它靶向细胞壁前体脂质II,抑制肽聚糖的生物合成,并在细胞膜上形成孔,实现细胞死亡。粪便发酵模型证明了乳酸素 3147 对一系列艰难梭菌分离株的强效细胞杀伤活性,在 30 分钟内完全消除艰难梭菌。
与传统药物相比,这种窄谱抗菌药物可能具有多种优势,包括减少对微生物组的影响、降低复发率、优于常规治疗以及改善药代动力学特征。然而,在保持非孢子形成厌氧菌和总革兰氏阴性厌氧菌完好无损的同时,这种抗菌剂对乳酸杆菌和双歧杆菌产生了负面影响。
2
针对毒素——阻断、中和毒素
CDI的发病机制以毒素介导为主,因此中和或阻断毒素是合理策略。但尽管抗毒素在动物模型中可改善疾病,但在人类中仅表现为减少复发性CDI。
•单克隆抗体:一项随机双盲安慰剂对照研究评估了针对艰难梭菌毒素A和B的两种中和单克隆抗体。在200名参与者中,治疗组的CDI复发率显著低于安慰剂组。然而,单克隆抗体未能缩短腹泻持续时间、降低严重程度或减少住院时间。住院、年龄较大、有严重潜在疾病或重症CDI的患者对治疗反应较差。
•Tolevamer:Tolevamer 是一种高分子量苯乙烯磺酸盐聚合物,可在体外中和艰难梭菌毒素。一项针对轻中度疾病的研究显示,6克剂量的Tolevamer与每日500毫克万古霉素疗效相当。
注:然而,Tolevamer的临床成功率低于甲硝唑和万古霉素。汇总分析显示,Tolevamer组的临床成功率为44.2%,显著低于甲硝唑组的72.7%和万古霉素组的81%。随着疾病严重程度增加,Tolevamer的疗效进一步下降。
•免疫球蛋白(IG):在人体研究中,针对毒素A和B的血清IgG抗体与保护相关,静脉注射IG治疗复发性或重症CDI的效果尚无系统研究支持,仅有少量病例报告和系列报道提供个案证据。剂量、给药次数和间隔存在较大差异。静脉注射IG对临床效果的差异可能与人群中抗毒素抗体水平的不可预测性有关。
3
微生物疗法
肠道微生物群的扰动是艰难梭菌感染(CDI)发生的关键因素。一些抗生素治疗无症状感染会导致艰难梭菌持续脱落和复发风险增加。通过特定微生物群恢复受损的肠道微生物群,已成为打破CDI-抗生素-CDI循环的策略。
• 粪菌移植的治疗效果优于仅用抗生素
粪菌移植(FMT)或微生物群替代疗法的原理是通过正常供体的粪便恢复CDI患者受损的肠道微生物群。系统评价显示,CDI患者接受FMT的腹泻消退率约为77%-90%。
一项随机对照试验比较了粪菌移植(FMT)与两种对照方案。FMT组在口服万古霉素(500mg,每天4次)4-5天后接受移植,对照组则接受14天相同剂量的万古霉素治疗。结果显示,FMT组3个月症状消退率为81%,显著高于万古霉素组(31%)和万古霉素加灌肠组(23%)。
尽管FMT已使用数十年,但其对严重复杂CDI的疗效、免疫功能低下患者的安全性及不明供体粪便长期安全性仍存疑。据报道,28.5%的患者出现FMT相关不良事件,最常见为腹部不适和排便异常,具体取决于给药途径。
• 口服微生物组疗法—SER-109
SER-109是一种由活性厚壁菌门细菌孢子组成的口服微生物组疗法,用于降低艰难梭菌感染复发风险。其机制可能通过与艰难梭菌竞争必需营养物质或调节胆汁酸谱来重建定植抵抗力,或两者兼具。
进行了一项3期、双盲、随机、安慰剂对照试验,其中艰难梭菌感染发作3次或以上(包括符合条件的急性发作)的患者在标准护理抗生素治疗后接受SER-109或安慰剂(每天4粒胶囊,持续3天)。
结果显示,在接受标准护理抗生素治疗后艰难梭菌感染症状消退的患者中,口服SER-109在降低复发感染风险方面优于安慰剂。
以微生物群为中心的治疗方法

Vasilescu IM,et al.Front Microbiol.2022
4
手术干预
艰难梭菌感染(CDI)的手术治疗通常用于严重或复杂病例,尤其是当药物治疗(如抗生素或粪便微生物群移植)无效,或患者出现危及生命的并发症时。以下是艰难梭菌感染的主要手术治疗方法:
• 全结肠切除术
适应症:严重的中毒性结肠炎、肠穿孔或肠坏死;严重的腹腔感染(腹膜炎),药物治疗无效且病情迅速恶化。
优点:快速去除感染源,降低死亡风险。
缺点:创伤较大,术后恢复时间长,可能影响生活质量。
• 分段结肠切除术
适应症:感染局限于结肠的某一部分。
优点:保留更多的肠道功能。
缺点:感染可能扩散,手术效果不如全结肠切除术稳定。
• 回肠造口术联合结肠灌洗
适应症:不适合全结肠切除的高危患者(如老年人或伴有多种合并症)。
优点:创伤较小,适合高危患者。
缺点:疗效可能不如全结肠切除术。
• 腹腔引流术
适应症:腹腔内脓肿或局部感染。
优点:辅助治疗,减轻感染负担。
缺点:仅适用于局部并发症,不能根治感染。
5
噬菌体疗法
噬菌体疗法利用天然噬菌体感染并裂解病原菌,是应对抗菌药物耐药性危机的潜在治疗方法。与抗生素不同,噬菌体具有进化能力,可持续克服细菌的抗性机制,从而避免疗法过时。
• 噬菌体可以降低艰难梭菌的生长和毒素水平
一些噬菌体在治疗艰难梭菌感染中表现出潜力。例如,ФCD27在CDI分批发酵模型中可显著降低艰难梭菌的生长和毒素水平。一种噬菌体组合已在体外完全裂解艰难梭菌,并在小鼠模型中减轻疾病症状和细菌定植。该组合进一步优化为4种噬菌体,成功在发酵容器中彻底根除艰难梭菌,显示出作为治疗选择的可行性。
总体而言,特异性以及对抗细菌耐药性的能力表明噬菌体治疗作为艰难梭菌治疗剂的巨大前景。
6
通过疫苗预防艰难梭菌感染
随着艰难梭菌感染(CDI)的发病率、死亡率和医疗成本不断上升,预防疾病的免疫接种成为理想选择。人类研究表明,对艰难梭菌毒素的强体液反应可减少复发和无症状定植。目前,多种候选疫苗正在开发中,包括基于类毒素、重组毒素肽、DNA和表面蛋白抗原的疫苗,但大多处于临床前阶段。
• 疫苗有助于减少复发和无症状定植
已发现部分纯化的类毒素A和B疫苗在30名健康成人中具有安全性和免疫原性,≥90%的受试者对两种毒素产生血清抗体反应。在一项试点研究中,3名多次复发CDI患者在第0、7、28和56天接受类毒素肌肉注射,其中2人对毒素A和B的IgG水平显著升高,且3人均在疫苗接种后停用万古霉素,随访6个月无复发。
两项2期试验已完成,测试疫苗在高危中老年人和首发CDI患者中的效果。一项3期试验正在17个国家中进行,计划评估疫苗在多达15,000名参与者中预防首发CDI的效果。其他候选疫苗包括基因和化学修饰的全长TcdA和B及重组融合蛋白IC84,其1期研究已完成,但结果尚未公布。
7
通过益生菌预防艰难梭菌感染
• 益生菌有助于预防艰难梭菌定植及相关腹泻
多项小型研究及荟萃分析表明,益生菌的使用可能与预防艰难梭菌相关腹泻有关。益生菌通常通过抑制艰难梭菌定植、调节肠道微生物群和胆汁酸代谢、破坏细胞壁和细胞膜、下调炎症反应、改善肠道屏障功能以及缓解病原性结肠炎来预防和治疗CDI。
最常研究的益生菌为嗜酸乳杆菌和双歧杆菌属。最近,一项多中心、随机、双盲、安慰剂对照研究测试了含嗜酸乳杆菌和双歧杆菌(双歧双歧杆菌和乳双歧杆菌)的高剂量益生菌制剂对≥65岁接受抗生素治疗患者的疗效。1,493名受试者接受益生菌,1,488名接受安慰剂。分析显示,益生菌组发生抗生素相关性腹泻和艰难梭菌感染的数量少于安慰剂组。
• 益生菌发挥抗菌活性抑制艰难梭菌定植
短双歧杆菌(YH68)通过抑制生长、孢子形成、毒力发生及毒力基因表达,展现出抗艰难梭菌活性,并增强抗艰难梭菌抗生素的体外效果或预防体内临床表现。
克劳氏芽孢杆菌和罗伊氏乳杆菌可分泌直接抑制艰难梭菌的可溶性化合物,而Clostridium scindens等产生次生胆汁酸的菌体可增强艰难梭菌的定植抗性。
此外,研究发现了一些可能有效的新型益生菌和制剂,如:
Bacteroides thetaiotaomicron,
E.thailandicus strain d5B,
B.amyloliquefaciens C-1,
B.longum JDM301,
Pediococcus pentosaceus LI05,
B.breve (YH68)
未来需要更大样本量的多中心双盲研究,以明确益生菌在CDI中的作用,同时考虑菌株和抗菌剂类型等因素。
艰难梭菌感染作为一种全球性公共卫生挑战,其发病率和医疗负担正不断攀升。通过本文的系统介绍,我们可以了解到,艰难梭菌感染的致病性主要取决于其产生的毒素,而非仅仅是菌株的存在。
健康的肠道微生物群在预防艰难梭菌感染中扮演着至关重要的角色,肠道微生物平衡的破坏是导致感染风险增加的关键因素。随着科学研究的深入,我们对艰难梭菌的检测、诊断、治疗和预防手段也在不断完善,从传统抗生素到粪菌移植、益生菌干预和疫苗开发等多元化策略均显示出积极成效。
了解艰难梭菌感染的本质和发病机制,对于临床医生制定合理治疗方案、减少不必要的抗生素使用以及患者接受适当预防措施至关重要。希望在未来研究的推动下,我们能够进一步降低艰难梭菌感染的发病率和复发率,减轻其对公共健康的威胁。
注:本账号内容仅供学习和交流,不构成任何形式的医疗建议。
主要参考文献
Buddle JE, Fagan RP. Pathogenicity and virulence of Clostridioides difficile. Virulence. 2023 Dec;14(1):2150452.
Piccioni A, Rosa F, Manca F, Pignataro G, Zanza C, Savioli G, Covino M, Ojetti V, Gasbarrini A, Franceschi F, Candelli M. Gut Microbiota and Clostridium difficile: What We Know and the New Frontiers. Int J Mol Sci. 2022 Nov 1;23(21):13323.
Wu Y, Wang YY, Bai LL, Zhang WZ, Li GW, Lu JX. A narrative review of Clostridioides difficile infection in China. Anaerobe. 2022 Apr;74:102540.
Arcay R, Barceló-Nicolau M, Suárez L, Martín L, Reigada R, Höring M, Liebisch G, Garrido C, Cabot G, Vílchez H, Cortés-Lara S, González de Herrero E, López-Causapé C, Oliver A, Barceló-Coblijn G, Mena A. Gut microbiome and plasma lipidome analysis reveals a specific impact of Clostridioides difficile infection on intestinal bacterial communities and sterol metabolism. mBio. 2024 Oct 16;15(10):e0134724.
Vasilescu IM, Chifiriuc MC, Pircalabioru GG, Filip R, Bolocan A, Lazăr V, Diţu LM, Bleotu C. Gut Dysbiosis and Clostridioides difficile Infection in Neonates and Adults. Front Microbiol. 2022 Jan 20;12:651081.
Maslanka JR, Gu CH, Zarin I, Denny JE, Broadaway S, Fett B, Mattei LM, Walk ST, Abt MC. Detection and elimination of a novel non-toxigenic Clostridioides difficile strain from the microbiota of a mouse colony. Gut Microbes. 2020 Nov 9;12(1):1-15.
Nibbering B, Gerding DN, Kuijper EJ, Zwittink RD, Smits WK. Host Immune Responses to Clostridioides difficile: Toxins and Beyond. Front Microbiol. 2021 Dec 21;12:804949.
Samarkos M, Mastrogianni E, Kampouropoulou O. The role of gut microbiota in Clostridium difficile infection. Eur J Intern Med. 2018 Apr;50:28-32.
Kelly CR, Fischer M, Allegretti JR, LaPlante K, Stewart DB, Limketkai BN, Stollman NH. ACG Clinical Guidelines: Prevention, Diagnosis, and Treatment of Clostridioides difficile Infections. Am J Gastroenterol. 2021 Jun 1;116(6):1124-1147.
Dawson LF, Valiente E, Wren BW. Clostridium difficile–a continually evolving and problematic pathogen. Infect Genet Evol. 2009 Dec;9(6):1410-7.

谷禾健康

日常生活中大部分人都可能碰到过食用了不卫生或过期变质食物以及水源后,出现过恶心、腹痛,并伴有腹泻、食欲不振、呕吐等症状?如果有就要当心,这可能是病原体感染引起的胃肠道炎症。
但是,即使食用了同样食物水源,不同人表现不一样。有的人表现无严重症状,有的人却症状严重,那么是什么因素导致病原体进入肠道后定植或无法定植,什么因素影响其进一步的感染?

胃肠道感染,也称作胃肠炎,是指病毒、细菌或其他病原微生物侵入消化道,引起的一系列消化系统症状的疾病。
这些微生物主要是通过食物或水进入人体后,在胃肠内繁殖并产生毒素,导致黏膜损伤和免疫细胞浸润,进而引发一系列病理生理变化。胃肠道感染的症状包括腹泻、腹痛、恶心呕吐以及食欲减退等。严重时还可能出现脱水、电解质紊乱甚至死亡。
有人可能会问:我们胃肠道中有那么多的微生物,为什么稍微一点外来的微生物就会让我们生病呢?的确,人体肠道内栖息着大量微生物,包括数万亿细菌,统称为肠道微生物群。微生物群的各种细菌成员在多个复杂层面上参与合作和竞争的生理网络。在过去10年中,测序技术领域的进步极大地增进了我们对共生微生物群影响的各种生理和病理过程的理解。
越来越多的人类疾病,如炎症性肠病、2型糖尿病、肥胖、心血管疾病、过敏和结直肠癌等被发现与微生物群组成的改变有关。此外,关于健康个体中人类微生物群的组成、其随时间和不同人之间的差异以及环境因素(即饮食)和遗传背景如何塑造微生物群的也正在变得更加清晰。
正常、健康的肠道微生物群可以在肠道中产生不利于肠道病原体定植的条件,这被称为定植抗性。肠道微生物群通过多种机制提供针对感染的保护,包括抗菌物质的分泌、营养竞争、上皮屏障完整性的支持、噬菌体和免疫激活。这些机制共同有助于抵抗外源微生物的定植。
当微生物群稳态受到干扰时,定植抗性可能会暂时受到破坏,病原体就有机会生长到高水平。这种破坏可能是由接触抗生素、饮食变化、益生菌和药物的应用以及各种疾病引起的。定植抗性的减弱会促进内在病原体的定植或增加对感染的易感性。
病原体扩张的后果之一是引发宿主炎症反应和病原体介导的疾病。同时在肠道炎症患者中,通常会观察到微生物群组成异常,称为“生态失调”。这通常的特征是兼性厌氧细菌(例如肠杆菌科、芽孢杆菌)的相对丰度增加,同时,拟杆菌属等专性厌氧细菌的减少。不过到目前为止,尚不清楚生态失调是肠道炎症的原因还是结果,但我们有充分的理由证明两者之间存在显著的相关性。
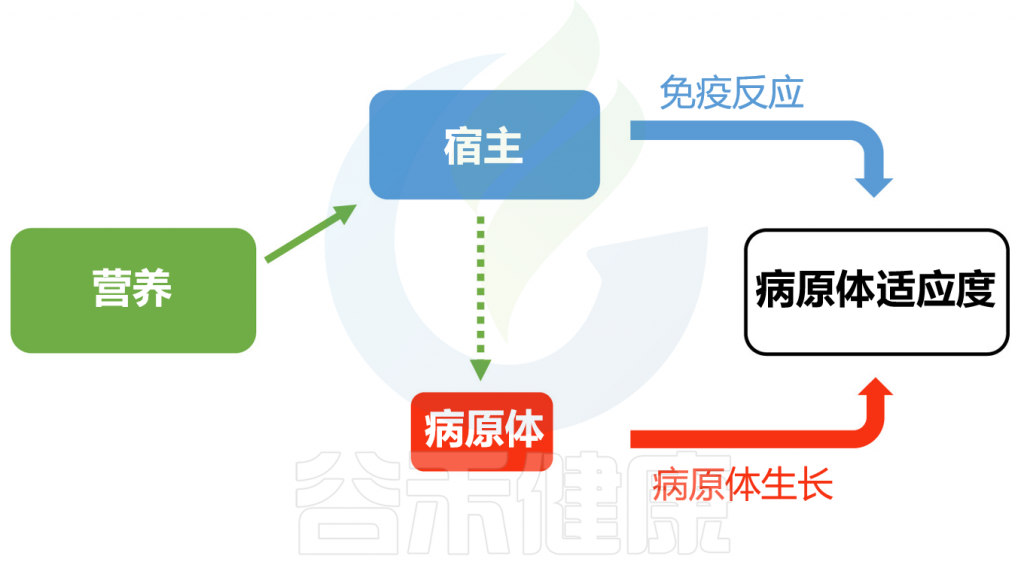
除了肠道微生物外,宿主营养通过影响宿主免疫系统和病原体资源的可用性,进而影响感染结果。从宿主角度看,维持活跃的免疫反应需耗费大量精力。营养状况的降低可能削弱宿主抵抗感染的能力,并在其他条件不变的情况下增加病原体的危害。
另一方面,从病原体角度看,宿主营养的数量(食物量)和质量(特定营养成分)的变化可能影响感染期间病原体生长资源的可用性和类型。在此情况下,生长较快的病原体或更高的病原体适应性/负载量可能导致更大的毒力。
Pike VL,et al.Proc Biol Sci.2019
在本文中,我们将讲述健康人体肠道微生物的抗感染作用;讨论了营养与感染的关联。此外,本文重点关注肠道感染中炎症与微生物群的双向作用、发炎肠道中肠道病原体和肠道微生物群的竞争,以及最后提出了通过营养与微生物作用有助于预防和治疗感染的方法。
▸ 如何区分病原菌和共生菌
在感染医学中,共生菌和致病菌之间的区分仍然是一个重要标准,有益的共生现象和对立的致病性代表了细菌行为范围的两个极端,尽管很少有细菌微生物组成员表现出真正的致病行为。多细菌物种或菌株可以根据其环境背景和宿主生理状态动态改变其作为共生体或病原体的能力。
例如,微生物组失调和宿主免疫缺陷,可以将肠球菌(Enterococcus faecium)从一个几乎无害的肠道微生物组成员转变为血流感染的原因。
单个水平基因转移事件可以改变共生生活方式和致病生活方式之间的平衡,例如,当预测的编码毒素成为肠出血性大肠杆菌或皮肤定植和口咽定植的白喉杆菌的主要毒力因子时。这意味着,原本可能是相对无害的微生物,在获得某些特定基因后,其生物学性质和行为可能发生显著变化,从而增加了其致病潜力。这种基因的转移和表达可以使这些微生物在宿主体内表现出更强的侵袭性和病原性,从而对宿主健康构成更大的威胁。
扩展阅读:
在这篇文章中,我们将常规引起感染的外来细菌称为病原体,而不常引起感染的细菌称为共生菌,越来越多的证据表明,一些共生细菌对人类健康至关重要。
▸ 稳定的肠道共生菌对健康至关重要
而健康的肠道内有一个稳定的微生物群落,可以抵抗外来细菌和病原体的侵袭,这就是所谓的“定植抵抗”,这个概念至少从上世纪50年代就被认识到了。
不成熟的微生物群落(比如婴儿的微生物群落)或者受到抗生素或者饮食破坏的微生物群落可能会失去这种保护作用。
在健康个体中,共生稳定的肠道微生物群通过多种机制提供针对感染的保护,包括抗菌物质的分泌、营养竞争、上皮屏障完整性的支持、噬菌体和免疫激活。这些机制共同有助于抵抗外源微生物的定植。
肠道微生物介导的定植抵抗机制
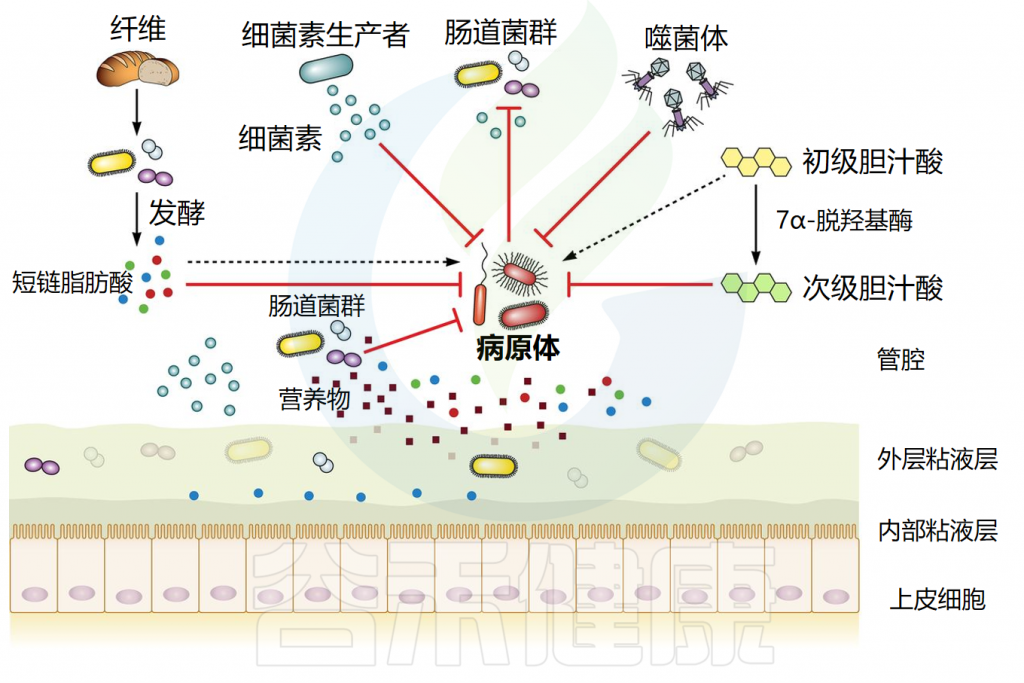
Ducarmon QR,et al.Microbiol Mol Biol Rev.2019
肠道微生物群能产生各种具有抗菌作用的产物,包括短链脂肪酸、次级胆汁酸和细菌素。每一种都以特的方式抵抗外源微生物的定植。它们的作用机制如下所述。
// 短链脂肪酸影响细胞内pH值和代谢功能来抑制细菌生长
短链脂肪酸(SCFA)主要由细菌通过不易消化的碳水化合物发酵产生。三种主要的SCFA是乙酸盐、丙酸盐和丁酸盐,占总量的90%至95%。在稳态条件下,丁酸盐是肠上皮细胞的主要营养物质,并通过β-氧化进行代谢,可以维持肠道内的厌氧环境。
短链脂肪酸通过影响细胞内pH值和代谢功能来抑制细菌生长。研究表明,SCFA浓度与肠道不同区域的pH值呈负相关。在较低pH值下,短链脂肪酸以其非离子形式更为普遍,这些非离子酸可以穿过细菌膜,扩散到细胞质中。在细胞质内,它们解离,导致阴离子和质子积聚,从而降低细胞内pH值。
短链脂肪酸已被确认为抑制鼠伤寒沙门氏菌(Salmonella typhimurium)生长的关键因素,并且对致病性大肠杆菌和艰难梭菌具有抑制作用。这些SCFA主要由拟杆菌和梭菌等厌氧共生细菌产生,这些细菌是成年哺乳动物微生物群中的重要成员。
短链脂肪酸还可以影响病原体的毒力:例如,丙酸和丁酸可以抑制鼠伤寒沙门氏菌的毒力因子。短链脂肪酸还可以作用于宿主,降低氧气浓度,为病原体生长创造一个不利环境。
// 胆汁酸具有抗菌作用,减少病原体定植
胆汁酸是分泌到小肠中的两亲性胆固醇衍生分子。它们的主要功能是乳化脂肪和脂溶性维生素以供吸收,但它们也具有抗菌特性。
大部分结合的初级胆汁酸(50%至90%)在远端回肠中被重吸收,而其余部分可以在结肠中进行细菌代谢。一些细菌(主要是梭状芽胞杆菌)通过复杂的生化途径进行 7α-脱羟基作用,将解离的初级胆汁酸转化为两种主要的次级胆汁酸:脱氧胆酸和石胆酸。
一些胆汁酸对许多细菌具有杀菌作用,包括金黄色葡萄球菌、多形拟杆菌、艰难梭菌等。证据如下:
-其中一种细菌,C. scindens ,通过产生次级胆汁酸与对艰难梭菌的定植抗性相关。C.scindens能够保护小鼠免受艰难梭菌的侵害,并恢复次级胆汁酸水平。
-使用HT-29细胞系,石胆酸已被证明可以增强肠上皮中抗菌肽LL-37的转录。
-此外,初级胆汁酸鹅去氧胆酸通过激活小肠FXR受体,间接启动先天防御机制,具有保护作用。
// 细菌素通过多种机制发挥其抗菌作用
细菌素是由特定细菌物种产生的短有毒肽,能够抑制其他物种的定殖和生长。细菌素通过多种机制发挥其抗菌作用,主要方式包括直接杀死目标细菌或抑制其生长。这些机制具体如下:
-细胞膜破坏:许多细菌素可以通过插入到细菌的细胞膜中,形成孔洞。这些孔洞破坏了细胞膜的完整性,导致细胞内容物的泄漏,最终引起细菌细胞的死亡。
-干扰细胞壁合成:某些细菌素能够干扰细菌细胞壁的合成。例如,它们可能会抑制细胞壁的主要构建块(如肽聚糖)的形成,从而阻止细胞壁的正常建造和修复,导致细菌无法在分裂或生长过程中维持其结构的完整性。
-抑制核酸合成:直接或间接影响DNA和RNA的合成或功能。例如,它们可能会阻止核酸的复制或转录,或者干扰核酸的修复过程,从而抑制细菌的生长和繁殖。
-蛋白质合成抑制:细菌素还可能通过抑制蛋白质的合成来发挥作用。这通常是通过与细菌的核糖体结合,阻断蛋白质合成的关键步骤来实现的。
-代谢途径干扰:此外,一些细菌素可能会干扰细菌的代谢途径,如阻断能量产生的关键酶的活性,从而削弱细菌的生存能力。
细菌会在肠道中竞争营养物质,这对于同一物种的不同菌株尤为重要,因为它们通常需要相同的营养物。多项研究使用不同的大肠杆菌菌株已经证明了营养竞争在细菌定植抵抗中的重要性。以下是一些研究证据:
// 利用相同营养物的菌株竞争有助于抑制病原菌
本土大肠杆菌菌株与致病性大肠杆菌O157:H7 竞争氨基酸脯氨酸。在粪便悬浮液中,高脯氨酸利用率的菌株通过耗尽脯氨酸池抑制致病菌的生长,而添加脯氨酸可逆转此抑制效果,证实了菌株间的营养竞争。
除氨基酸外,不同的大肠杆菌菌株还利用肠粘液中的不同糖类。当小鼠肠道中存在两种大肠杆菌菌株共同利用与O157:H7相同的糖时,O157:H7无法在小鼠中定植。但若只有一种共生菌株存在,O157:H7则能成功定植,显示这两种共生体能共同耗尽所有致病菌所需的糖。
营养竞争还涉及微量营养素,如铁。已知鼠伤寒菌在感染过程中从发炎的肠道吸收大量铁。益生菌大肠杆菌Nissle能高效清除铁,单次给药可显著降低鼠伤寒菌的水平。对铁的竞争可能是大肠杆菌Nissle 能够减少鼠伤寒沙门氏菌在小鼠体内定植的另一种解释。
总之,这些研究表明,通过营养竞争吸收病原体所需的关键营养物质,可以有效地抵抗病原体定植。因此,未来的策略可能会集中在培养能在特定营养素上胜过病原体的益生菌菌株,这在肠道微生物群紊乱时尤为重要,如抗生素治疗期间及其后,因为这是外源细菌最易定植的时期。
// 对粘附位点的空间竞争可以预防感染
除了基于营养的功能性生态位外,细菌还必须竞争物理空间。有些物种更喜欢以内腔或外粘液层的食物为生,或更罕见的是上皮表面的食物。
与上皮细胞的密切身体接触是某些病原体生活方式的重要组成部分(例如弯曲杆菌、某些致病性大肠杆菌、鼠伤寒沙门氏菌),因此对粘附位点(通常是聚糖结构)的物理竞争有助于预防感染或病理。
定植抵抗的直接和间接机制
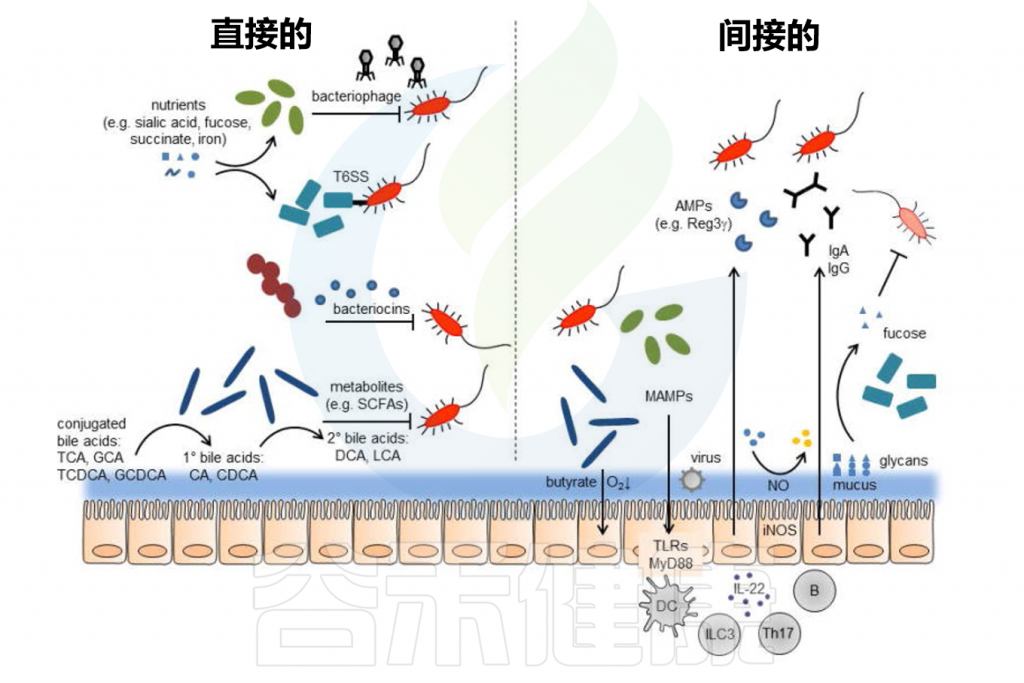
Pickard JM,et al.Immunol Rev.2017
肠道屏障由内外粘液层、上皮屏障及其相关的免疫屏障组成。内部粘液层不可穿透且牢固地附着在上皮层上,形成了一道防止细菌直接接触上皮层并引发潜在炎症的物理屏障。
// 缺乏可利用营养物质时粘液降解细菌会消耗外粘液层
共生肠道微生物居住在非附着的外粘液层中并代谢营养物。粘液层变薄会增加对病原体定植的敏感性,这可能由于西式饮食中缺乏微生物可利用的碳水化合物(MAC)引起。
当MAC稀缺时,粘液降解细菌如Akkermansia muciniphila和Bacteroides caccae会消耗外粘液层,使细菌更接近上皮层。宿主通过增加粘蛋白(MUC2)的表达来适应,但这种适应往往不足。
然而,内粘液层的损伤可以通过施用长双歧杆菌逆转,这可能因其刺激粘液生成。
// 肠道微生物对于维持粘液屏障的完整性非常重要
一方面,有益的微生物如乳酸菌和双歧杆菌可以通过产生短链脂肪酸等代谢产物来增强粘液层的保护作用,这些代谢产物能刺激粘液的产生和分泌,从而增强屏障功能。
另一方面,某些条件下如不健康的饮食习惯导致有益微生物减少,而粘液降解细菌的比例增加,可能会导致粘液层被过度消耗,粘液屏障变薄,从而使肠道更容易受到病原体的侵袭。
总之,粘液层是抵御外源微生物定植的首要屏障。研究已证明饮食是维持屏障正常功能的重要因素,这表明通过饮食干预或特定的益生元和益生菌可能成为未来的治疗选择。
目前,肠道微生物影响全身免疫反应的最佳机制可能是其对适应性免疫系统T细胞的影响。
// 肠道微生物影响T细胞的分化、影响炎症反应
研究表明,胃肠道微生物群可以影响T细胞群分化为辅助性T(Th)Th1、Th2和Th17细胞或具有调节表型的T细胞。具体来说,丁酸盐作为短链脂肪酸促进外周诱导的调节性T细胞的分化,并以这种方式能够抑制全身炎症的发展。
SCFA还能够重新编程细胞的代谢活动,从而诱导调节性B细胞并通过戊酸抑制Th17细胞的生成,这可能与炎症性肠病和自身免疫性疾病有关。
此外,微生物来源的ATP可以诱导Th17细胞的扩增,色氨酸分解产物可以导致上皮内CD4+ CD8αα+ T细胞的增加,细菌来源的多糖可以启动调节性T细胞。通过其诱导调节群体的能力,微生物组可以支持抑制炎症反应。
噬菌体是地球上最丰富的微生物,也在人类肠道中大量存在。噬菌体已被提议作为抗生素的潜在替代品,因其高度特异性,仅针对单一或少数细菌菌株,从而极大地减少对微生物群共生成员的影响。
// 使用噬菌体有效减少了霍乱弧菌感染
在实验中,使用小鼠和兔子的预防性噬菌体混合物可以有效控制霍乱弧菌感染。这种预防性混合物在体外能够杀死霍乱弧菌,减少其在小鼠肠道中的定植,并预防兔子的霍乱样腹泻。
研究表明,肠道中噬菌体的浓度是预防感染成功的关键因素,噬菌体的给药时间与霍乱弧菌接种的时间间隔与治疗效果密切相关。空肠弯曲杆菌在鸡体内的定植也通过噬菌体混合物显著降低。
// 噬菌体为肠道共生细菌提供竞争优势
噬菌体还可以提供共生体竞争优势。例如,粪肠球菌V583含有能够感染并杀死其他粪肠球菌菌株的噬菌体,为粪肠球菌V583创造了竞争优势。
噬菌体在排除特定肠道细菌方面发挥重要作用,对肠道健康具有潜在贡献。噬菌体的人类治疗应用尚未广泛进行,主要是因为缺乏足够的安全性和有效性证据。然而,最近的病例报告显示,噬菌体治疗在对抗多重耐药细菌方面展现出明显的潜力。
VI 型分泌系统(T6SS)是在一些革兰氏阴性细菌中发现的蛋白质易位复合物,其与一些噬菌体蛋白质具有相似的机制,具有注射毒素到邻近细胞的能力,这一功能使其在微生物间的竞争以及宿主与病原体间的相互作用中发挥关键作用。
T6SS的结构类似于细菌噬菌体的尾部,能够将效应蛋白直接转运到靶细胞中,这些效应蛋白能够破坏靶细胞的细胞结构或功能,从而抑制或杀死竞争对手。
T6SS 示意图
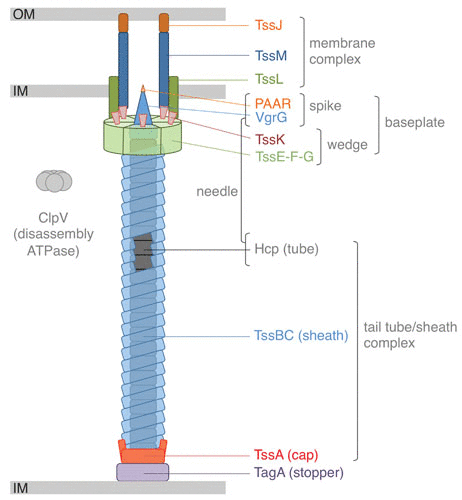
Cherrak Y,et al.Microbiol Spectr.2019
// T6SS通过注射毒素杀死或抑制病原细菌
在抵抗病原体感染方面,T6SS可以被视为一种防御机制。一些非病原性或共生细菌利用T6SS对抗侵入的病原细菌,通过直接向病原体注射毒素来抑制其生长或直接杀死这些病原体。
注:这种机制不仅限于细菌间的相互作用,也可能影响更高级生物的细胞,如真核宿主细胞,进而影响病原体的感染能力和宿主的免疫反应。
最近,在拟杆菌门成员中发现了一个新的T6SS蛋白家族,该门与厚壁菌门一起在哺乳动物肠道中占主导地位。多项研究表明,T6SS及其相关效应子和免疫蛋白的存在在小鼠肠道内拟杆菌属物种之间的竞争中发挥着重要作用。重要的是,T6SS 介导的竞争是接触依赖性的,可以涉及效应子和免疫蛋白的多种组合,并且可以具有比其他杀伤机制更广泛的目标范围。
// T6SS能够调节宿主的免疫系统
此外,T6SS还能够调节宿主的免疫系统。一些研究表明,T6SS可以通过调控炎症反应和影响免疫细胞的活性来影响宿主的免疫环境。例如,T6SS可以影响巨噬细胞的吞噬作用和炎症因子的释放,从而调节宿主的免疫反应。
因此,T6SS不仅是细菌间相互作用的武器,也是细菌与宿主互作的重要因素,对于维持微生物群落的平衡、抵抗病原体侵袭以及调节宿主免疫反应具有重要作用。
通过进一步研究T6SS的具体机制和作用,可以为开发新的抗感染策略提供理论基础和潜在靶点。
营养与感染之间存在密切的相互关系。首先,营养直接影响人体免疫系统的发展。此外,营养状况还会影响感染的发生,包括胃肠道感染、食物中毒、肠道疾病以及其他全身性传染病。
营养与感染的关系可分为以下几种:
(1)营养对人体免疫系统发育的影响;
(2)营养对感染(如胃肠道感染)、食物中毒、肠道疾病(如微生物性腹泻)和全身感染性疾病(如布鲁氏菌病、伤寒)发生的影响;
(3)营养不良与感染的关系;
(4)严重联合免疫缺陷患者的营养;
(5)暴饮暴食与感染的关系。
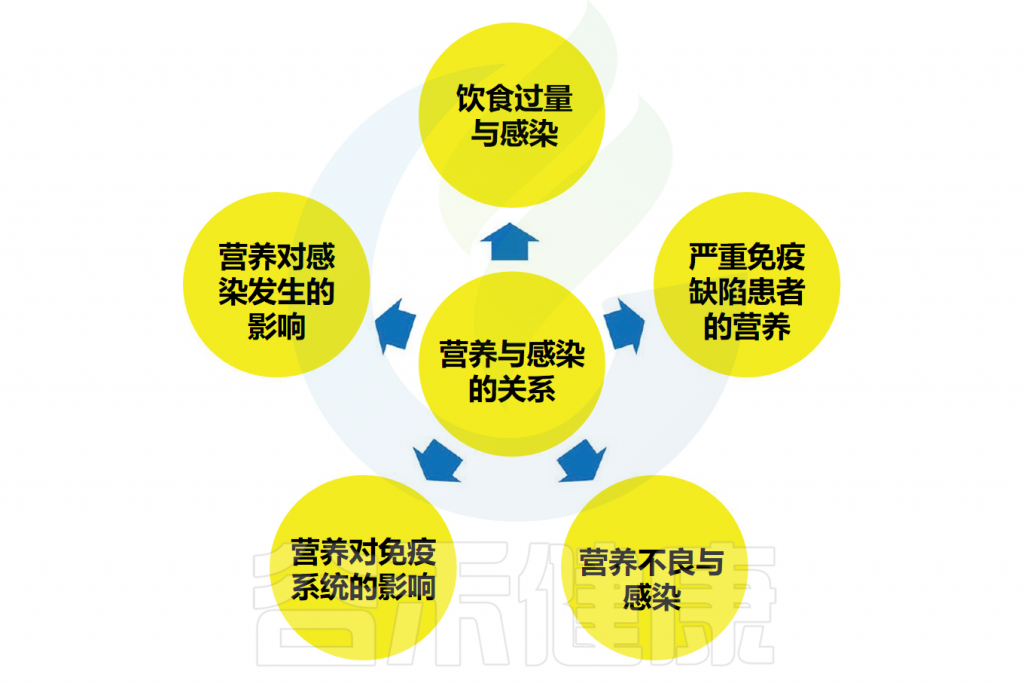
// 营养对免疫系统的发育至关重要
营养从胚胎阶段起就对人体免疫系统的发育产生影响。怀孕期间,尤其是前三个月,如果母亲摄入足够的蛋白质、维生素和矿物质,胚胎组织将得到良好的发育。胎儿营养不良会对免疫系统的正常发育造成不利影响,如果免疫系统在这一关键时期未能有效发展,将来对抗病原体的能力会受到影响。
// 营养不良抵抗病原体的能力会受到影响
母乳喂养是建立强健免疫系统的关键步骤。未经母乳喂养的营养不良婴儿,容易因缺乏蛋白质和维生素而易感染疾病,并且对疫苗的反应也不佳。因此,良好的营养是提高人体对环境病原体防御能力的基石。
广泛的研究已经证实了营养在增强抵抗感染能力方面的重要作用。例如,研究显示,相比仅接种结核疫苗的儿童,饮食充足的儿童患结核病的风险更低。同时保证营养健康和接种疫苗的人,患结核病的风险显著减少。
进行了一项研究来显示儿童感染与营养不良之间的关系。结果显示,营养不良的儿童经常出现腹泻。这些儿童的腹泻发生率和严重程度较高。结果表明,营养不良程度与腹泻风险之间存在直接关系。另一项研究评估了婴儿从出生到24个月大期间腹泻的影响。结果显示,腹泻发生率每增加 5%,生长障碍就会增加(约16%)。
营养不良和菌血症风险之间存在可变关系,营养不良儿童更有可能患革兰氏阴性菌血症。在坦桑尼亚进行的一项血培养研究结果表明,假单胞菌属、肠杆菌属和金黄色葡萄球菌的患病率很高。
溶组织内阿米巴寄生虫引起的阿米巴病与营养不良儿童腹泻的发生率和严重程度增加之间存在密切关系。据观察,溶组织内阿米巴感染可导致发展中国家儿童腹泻的发生率为2%–10%。全球每年由阿米巴病引起的死亡率和感染率估计分别约为100000例和5000万例。分泌性抗体(免疫球蛋白A)可促进针对溶组织阿米巴腹泻的免疫保护。营养不良儿童中IgA分泌细胞的减少会增加溶组织内阿米巴感染的发生率。
// 受污染的食物和水会导致人体发生感染
食物是人体的主要能量来源,但如果受到微生物污染,可能会引发消化系统疾病和食物中毒等问题。在不同季节,人们可能会遭遇不同程度的食物中毒。尤其在炎热天气中,肠道疾病的发生率较高。
// 受霍乱弧菌污染的食物会使人感染霍乱
其中霍乱是最危险的一种,霍乱是由一种叫做霍乱弧菌(Vibrio cholerae)的细菌引起的急性肠道传染病。这种病主要通过饮用或食用被霍乱弧菌污染的水和食物传播。人们在卫生条件差、饮用水处理不当或个人卫生习惯不佳的环境中更容易感染霍乱。
// 布鲁氏菌病
此外,通过水和食物传播的微生物污染可能导致儿童严重腹泻和传染病。布鲁氏菌病是通过摄入受布鲁氏菌(Brucella)污染的食物和水引起的传染病,这是人类和动物之间的常见疾病。
布鲁氏菌可感染绵羊、山羊、牛、猪和狗,人类则可能通过食用未经高温消毒的牛奶或未煮透的感染动物肉类而感染。密切接触受感染动物的分泌物也可能将病菌传播给人类。
// 其他可能通过食物导致人体的感染
阿米巴原虫病主要通过摄入受污染的水和食物引起,而弓形虫病则是通过食用生或未煮熟的肉类传播。当寄生虫包囊进入人体胃部,胃酸作用下释放,通过肠粘膜传入肝脏和淋巴结。
蛲虫感染是一种通过食物传播的寄生虫病,在全球范围内普遍存在,儿童的感染率高于成人。其他如带虫病和钩虫感染也常由不良营养引起。
注:由于病原体可能具有抗生素耐药性,这给治疗带来了挑战。
1968年,世界卫生组织报告就指出,感染可能会加剧人类营养不良,这种现象被称为协同作用。感染通常会对人的营养状态产生负面影响,从而导致营养不良,反过来又可能加重感染。
// 感染期间代谢和吸收功能会被削弱
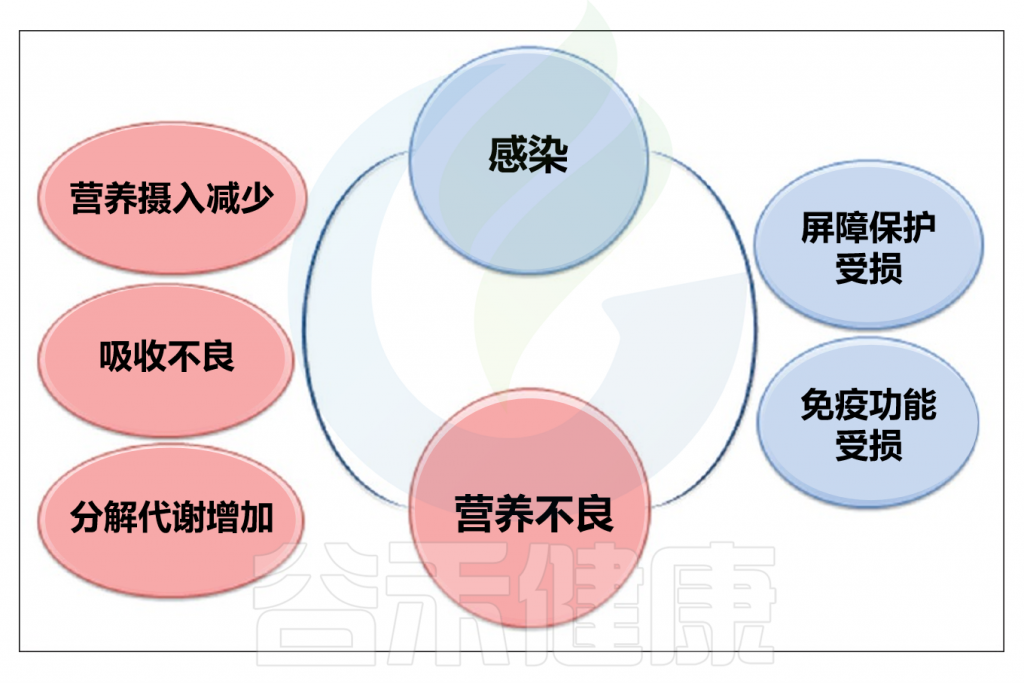
多种因素可能削弱人体对抗感染的能力并引发营养不良。例如,厌食可能导致营养不良,从而削弱免疫系统。某些传统行为也会加剧营养不良和感染问题,如在一些文化中,发烧或腹泻的人被禁止进食。肠道感染可能导致肠道吸收功能降低,蛋白质、碳水化合物和脂肪的吸收量可能分别减少43%、42%和72%,具体数值取决于感染类型。
感染期间,如蛋白质丢失等代谢损伤会增加膳食蛋白质的需求。脂质和碳水化合物的代谢紊乱(如脂肪酸自身代谢紊乱、酮体和甘油三酯的变化)在各种感染中可见。此外,感染期间,通过糖异生途径,氨基酸可转化为葡萄糖。在呼吸道感染期间,血液中的维生素A浓度可能降低,肝炎、急性扁桃体炎、类风湿性关节炎等疾病也会降低血清维生素A浓度。
// 感染时体内许多营养素过低
感染时,血液中维生素C浓度降低,而尿液中维生素C浓度增加,即使是接种过麻疹和天花疫苗的人也会出现。感染后,体内维生素B2(核黄素)含量会减少,这种减少具有统计学意义。
铁是感染期间体内减少的另一种营养素,铁的有效利用有助于降低病原体活性并治疗感染。锌和铜是感染时浓度可能降低的其他元素,研究显示感染中铜和锌的平衡呈负值,尽管血液中铜浓度可能增加,但感染者体内铜水平可能显著降低。
有人说,营养不良会增加感染的风险,那我尽量多吃行不行,其实这也是不可取的。
// 暴饮暴食会降低抗感染能力
暴饮暴食可能会对人体的免疫系统造成负面影响,从而降低抗感染的能力。当人体摄入过量的食物,尤其是高脂肪、高糖的食物时,可能会导致炎症反应增强,肠道微生物失衡,这些都可能削弱身体的免疫功能。
因此,暴饮暴食不仅对健康有害,还可能增加感染的风险,包括消化系统的感染如胃肠炎等。合理的饮食习惯和适量的食物摄入对维护免疫系统和预防感染至关重要。
此外,肥胖的人有患糖尿病的潜力,所有糖尿病人都对感染敏感。一些研究还表明,超重的人患呼吸道感染的风险更大。
炎症和感染之间存在密切的关系,炎症通常是身体对感染的一种防御反应。当病原体如细菌、病毒或寄生虫侵入人体时,免疫系统会激活,产生炎症反应以抵抗感染。这种反应包括血液中的白细胞和其他免疫分子到达感染部位,以消灭病原体。
人类肠道微生物群的组成表现出很大的个体差异。而感染和肠道炎症可导致肠道微生物群组成发生改变,称为生态失调。
关于微生物群如何参与肠道炎症发病机制,人们提出了不同的理论:
(1)导致粘膜屏障功能缺陷(例如粘液层、先天杀伤、抗菌肽)的突变涉及共生细菌的过度易位和促炎信号的触发;
(2)宿主免疫调节异常会引起针对内在共生菌的过度免疫反应;
(3)不明病原体的存在会导致疾病的诱发;
(4)失调的微生物群,其特征是“有益”和“潜在有害”共生细菌之间的不平衡,是疾病的触发因素或驱动因素。
慢性结肠炎或肠道病原体感染过程中的炎症可能会破坏正常的微生物群组成,诱发生态失调,并有利于病原体和共生菌的过度生长,并增加毒力潜力。因此,菌群失调不仅被认为是肠道炎症的原因,而且也是肠道炎症的结果。
炎症相关的菌群失调有哪些特点?越来越多的证据表明,感染病原体导致肠道微生物群落的扰动可能会助长丰度较低的有害细菌大量繁殖,从而进一步加剧肠道炎症。
这些研究使用分子、独立于培养的技术,如16S rRNA 基因测序和宏基因组学。
事实上,远端肠道的生态失调通常以特定专性厌氧革兰氏阳性菌(如瘤胃球菌科、毛螺菌科)的丰度降低,同时兼性厌氧菌(如肠球菌和链球菌)以及革兰氏阴性变形菌(特别是肠杆菌科成员)也随之增加。
已提出将人类肠道中丰富的丁酸盐生产菌——普氏栖粪杆菌(F. prausnitzii)的减少作为活动性疾病的微生物标志物。
// 肠杆菌的大量增加可能是肠道炎症的一个重要标志物
肠杆菌科(Enterobacteriaceae)是革兰氏阴性兼性厌氧菌的一个大家族,由于它们对从上皮屏障扩散的氧气具有相对较高的耐受性,因此通常位于靠近肠道上皮的位置。事实上,肠杆菌科仅占远端肠道微生物群落的一小部分,大约为0.1%。然而,它们在各种肠道炎症环境中过度生长,例如炎症性肠病、乳糜泻和结肠癌。
肠道炎症是由病原体感染后产生的,炎症引起的环境和营养变化可能赋予肠杆菌科细菌生长优势。例如在克罗恩病(CD)和溃疡性结肠炎(UC)(炎症性肠病的两种主要形式)患者中观察到肠杆菌科细菌(包括粘附性侵袭性大肠杆菌)的患病率增加。
// 许多肠道病原体利用炎症环境来促进自身生长
许多肠道病原体能够利用炎症反应来谋取自身利益。在健康的肠道中,复杂的厌氧微生物群有效地阻止主要人类肠道病原体的定植和感染。这种“定植抵抗”在肠道炎症存在时会减弱,从而使病原体过度生长。
一个典型的例子是啮齿类柠檬酸杆菌(Citrobacter rodentium),一种引起鼠类传染性结肠增生的病原体;空肠弯曲杆菌;以及引起人类小肠结肠炎的鼠伤寒沙门菌(S. Typhimurium)。
许多研究已经表明,其他病原体如肺炎克雷伯菌、奇异变形杆菌、霍乱弧菌、艰难梭菌和肠球菌属也可能从肠道炎症环境中获益。因此,肠道中的炎症环境能够改变肠道病原体及其相关共生物种的存活、附着或生长情况。
细菌转录组的分析揭示了炎症对微生物功能及其在炎症环境中生存能力的影响。
// 病原菌粘附能力的增强使之持续存在并诱导肠道炎症
粘附性侵袭性大肠杆菌(AIEC)能够通过常见的1型菌毛粘附素FimH粘附到回肠肠上皮细胞,并识别在克罗恩病(CD)回肠上皮细胞上异常表达的癌胚抗原相关细胞粘附分子6(CEACAM6)。
最近的DNA序列分析表明,AIEC菌株主要表达带有新近氨基酸突变的FimH。这些新突变显著增强了AIEC对表达CEACAM的肠上皮细胞的粘附能力,使其能在遗传易感宿主中持续存在并诱导肠道炎症。
// 在不同炎症条件下表达特定的蛋白来促进生存
在另一项研究中,分析了从IBD和非IBD儿科患者中分离的粘膜相关大肠杆菌菌株的FimH基因突变模式,发现了每种大肠杆菌特征(即状态、门群和粘附类别)的不同FimH突变模式。溃疡性结肠炎(UC)患者的大肠杆菌菌株显示出突变数量增加,而克罗恩病(CD)患者的分离株显示出突变率增加,但出现了不同的FimH突变。
这些结果表明,在特定的选择压力下,FimH蛋白会发生选择性氨基酸突变以维持细菌的生存,并暗示大肠杆菌在不同炎症条件下(如CD和UC)采用独特的生存策略。
因此,可以想象,炎症环境可能会选择表达特定的微生物蛋白,从而促进细菌存活并进一步维持炎症。
许多文献已经提出了导致发炎肠道中一些有害细菌大量繁殖的机制,包括营养变化、粘蛋白利用、抗菌剂的产生、无氧/有氧呼吸和金属利用。我们这里主要以肠道炎症中的标志物种肠杆菌(Enterobacteriaceae)为例来介绍。
// 炎症下的营养变化使病原菌更具竞争优势
居住在远端肠道的微生物群落竞争有限的食源性碳水化合物或宿主粘液源性聚糖。因此,饮食对肠道微生物群的组成起着关键作用,饮食的变化可能导致肠道微生物群落结构的扰动。
在健康肠道中,专性厌氧梭菌和拟杆菌仍然保持对兼性厌氧肠杆菌科的主导地位。在正常情况下,梭状芽胞杆菌和拟杆菌利用糖苷水解酶分解复杂的碳水化合物,并通过结合蛋白质增加其表面的碳水化合物浓度,最终通过主动转运系统将碳水化合物转运穿过梭状芽胞杆菌的细胞质膜和拟杆菌的外膜。相比之下,肠杆菌科因缺乏糖苷水解酶,其分解复杂碳水化合物的能力较差,只能通过外膜扩散通道被动运输寡糖。
因此,在健康状态下肠杆菌科细菌在与专性厌氧菌竞争高能营养物质时处于劣势,这种竞争性生长劣势解释了健康远端肠道中梭状芽胞杆菌和拟杆菌对肠杆菌科细菌的优势。
而在炎症过程中,肠上皮损伤导致死亡上皮细胞脱落增加,增强了上皮细胞膜衍生磷脂(如磷脂酰胆碱和磷脂酰乙醇胺)的可用性。特别是,乙醇胺可被变形菌门中的某些细菌及病原菌(如沙门氏菌和假单胞菌)作为唯一的碳或氮源利用。这种利用乙醇胺的能力有助于这些细菌在肠道中成功定植并维持其致病机制。
// 粘蛋白的分解促进发炎肠道中病原菌的定植
肠杆菌科细菌在发炎肠道中扩张的另一个机制是利用粘蛋白。粘液层覆盖肠上皮,分为两层;外层可移动,被细菌定殖,通常限制共生菌的定殖,而内层牢固地附着在上皮上,基本上无细菌。
分泌的凝胶形成粘蛋白MUC2是人结肠粘液的主要成分。值得注意的是,MUC2缺陷小鼠表现出细菌对表面上皮的粘附增强、肠道通透性增加以及发生自发性或DSS诱导的结肠炎和结直肠癌的易感性增加。
最近的一篇论文强调了粘蛋白衍生的唾液酸在DSS治疗诱导小鼠肠道炎症期间促进肠杆菌科细菌扩张的作用。唾液酸是粘蛋白中的主要碳水化合物之一,可以被无法从头合成这些糖的细菌(如大肠杆菌)摄取,并掺入细菌荚膜和脂寡糖中。
此外,鼠伤寒沙门氏菌和艰难梭菌在肠道内扩张期间,采用了一种常见策略来分解代谢微生物群释放的粘膜糖,如岩藻糖和唾液酸。这些观察结果表明,唾液酸的分解代谢可能为发炎肠道中肠杆菌科细菌的生长提供优势。
// 肠杆菌产生大肠杆菌素来抑制其他细菌
肠杆菌科细菌还可以通过产生抗菌分子来战胜其他细菌,更利于自身在肠道中的繁殖。例如,大肠杆菌素是由某些大肠杆菌菌株产生的细菌素,对系统发育上的近亲致命。在发炎肠道中,大肠杆菌素Ib(col1B)的产生赋予鼠伤寒沙门氏菌相对于敏感大肠杆菌菌株的竞争优势。
col1B的表达受到低铁可用性和SOS反应的正向调节,这两种情况通常由中性粒细胞募集和氧化应激诱导的DNA损伤在发炎肠道中引发。
因此,肠道中的炎症环境似乎创造了一种有利的条件,可以增强大肠杆菌素的作用,大肠杆菌素作为适应因素,为肠杆菌科细菌的大量繁殖提供竞争性生长优势。
// 肠杆菌科的呼吸灵活性使其在炎症条件下更好地生长
导致肠杆菌科细菌在发炎的远端肠道中扩张的进一步机制是宿主在这种基本上厌氧的环境中诱导的生长条件的变化。
炎症期间血流量和血红蛋白升高而产生的高水平氧气,可以为兼性厌氧菌(如肠杆菌科)提供比专性厌氧菌(如梭菌属和拟杆菌属)更有利的生长优势。肠道炎症期间产生的新呼吸电子受体可能通过无氧呼吸(包括硝酸盐呼吸)支持细菌生长。
已经证明硝酸盐是作为宿主炎症反应的副产物而产生的。这种源自宿主的硝酸盐的富集可以为肠杆菌科(例如大肠杆菌和鼠伤寒沙门氏菌)带来适应性优势,因为编码硝酸还原酶的基因存在于大多数肠杆菌科细菌中,但在属于梭菌属和拟杆菌属的专性厌氧菌中基本上不存在。
由宿主炎症反应产生的活性氧(ROS)可以与内源性硫化合物(即硫代硫酸盐)反应,产生一种新的呼吸电子受体,称为四硫酸盐。这种新产生的电子受体为伤寒沙门氏菌提供了选择性生长优势,而不是发炎肠道中竞争的发酵肠道微生物。这些观察结果表明,病原体可以利用宿主反应来超越肠道微生物群。
肠杆菌科的呼吸灵活性使它们能够对肠道内不同的氧气供应量做出反应。例如,在没有氧气的情况下,大肠杆菌可以使用硝酸盐、亚硝酸盐、三甲胺-N-氧化物(TMAO)、二甲基亚砜(DMSO)和富马酸盐作为电子受体,而在氧气存在下,大肠杆菌表达使用氧作为电子受体的末端氧化酶。
此外,链霉素治疗导致小鼠体内产生丁酸的共生梭状芽孢杆菌的耗竭,导致丁酸水平降低,上皮氧合升高,伤寒沙门氏菌有氧繁殖。鼠类柠檬酸杆菌(C.rodentium)使用III型分泌系统(T3SS)促进小鼠结肠隐窝增生,这反过来增加了表面上皮的氧化,并促进了C.rodentim在结肠中的有氧扩张。
鼠类柠檬酸杆菌(C.rodentium)感染是常用的模型之一。
// 许多病原体进化出了高亲和力的金属摄取机制
肠杆菌科细菌在肠道炎症中大量繁殖的另一机制是金属获取。铁是宿主和病原菌重要的营养物质,大部分储存在细胞内,使得病原体难以获取。
然而,为了克服这种铁限制,许多病原体已进化出高亲和力的铁摄取机制,与宿主的限制性铁环境竞争。这些机制包括释放铁螯合铁载体、血红素获取系统和转铁蛋白/乳铁蛋白受体。
例如,大肠杆菌能产生肠杆菌素,一种儿茶酚铁载体,有效抑制中性粒细胞的杀菌髓过氧化物酶,使大肠杆菌在发炎肠道中具有明显的生存优势。因此,大肠杆菌释放的铁载体既能获取铁,也能抵御宿主源性氧化应激。
此外,粘附性侵袭性大肠杆菌(AIEC)生长依赖铁,chuA(血红素铁获取)的存在与其在巨噬细胞内持续存在的能力相关。这些结果支持铁载体需氧菌素增强巨噬细胞内存活及AIEC NRG857c (O83:H1)在小鼠肠道中的定植,该菌株是从CD患者回肠分离的AIEC临床菌株。
总体来看,这些研究突显了铁获取在促进发炎肠道中毒性更强的肠杆菌科细菌扩张的关键作用。肠杆菌科细菌也进化出了获取其他金属(如锌和锰)的策略,以利于它们在发炎肠道中的生长。
!
注意
肠道炎症通常会促进毒性更强的肠杆菌科细菌的出现,这些细菌已进化出多种策略来逃避宿主免疫反应、战胜共生细菌,并在发炎的肠道中茁壮成长。
众所周知,营养对肠道微生物群和免疫系统具有显著影响,在健康与疾病的发展中扮演着关键角色。例如,西方饮食通过诱导骨髓祖细胞的表观遗传和转录重编程,与炎症反应的增强有关,这直接影响了多种疾病的发展。
增强对肠道微生物群、宿主反应及其他微生物间关系的理解,为通过营养调节这三者之间的互动提供了可能,帮助维护肠道稳态和抵抗感染。
应考虑到不同的饮食成分,如矿物质、碳水化合物、维生素、脂质和蛋白质,它们具有特定的功能特性,能够以直接或通过微生物组间接的方式影响宿主与病原体的相互作用。在这些营养素之间建立机制联系为影响健康提供了多种可能。
因此,饮食干预应视为一种调节感染风险、预防病原微生物入侵、减轻感染严重程度及支持感染治疗的重要手段。尽管已知多种营养化合物对宿主微生物组和免疫系统有影响,但膳食纤维、益生元和益生菌仍然是研究的热点。
益生元是不易消化的食物成分,通过选择性刺激结肠中一种或有限数量的细菌的生长或活性,对宿主产生有益影响。典型的益生元是人乳低聚糖、菊粉、低聚果糖和低聚半乳糖。
膳食纤维不是典型的益生元,但具有益生元特性,例如,β-葡聚糖、阿拉伯木聚糖、果胶和抗性淀粉。益生元和特定的膳食纤维通过充当发酵底物促进肠道中有益细菌的生长,同时通过生态位排除抑制病原体的生长。
// 益生元与膳食纤维的代谢产物具有抗菌活性有助于预防胃肠道感染
主要发酵产物是短链脂肪酸,如上所述,它对免疫系统具有重大影响,因此可以抑制感染的发展。除短链脂肪酸外,益生元和膳食纤维还可以通过排除和抗菌活性直接预防胃肠道感染。
// 与免疫细胞作用预防感染、并减轻感染后的炎症
此外,益生元和膳食纤维与上皮细胞和免疫细胞的直接相互作用也有助于预防感染。β-葡聚糖和阿拉伯木聚糖等膳食纤维已被证明可以激活CLR dectin-1,这是一种参与诱导训练免疫的重要受体,可增强针对继发感染的免疫反应。
人乳低聚糖、阿拉伯木聚糖和果胶还与Toll 样受体 (TLR)相互作用,从而提高树突状细胞(DC)的功效,通过肠上皮细胞诱导耐受性DC,并保护胃肠道免受过度的TLR信号传导影响,而且还支持解决胃肠道感染后的炎症。
饮食改变与肠道炎症相关的肠道微生物群
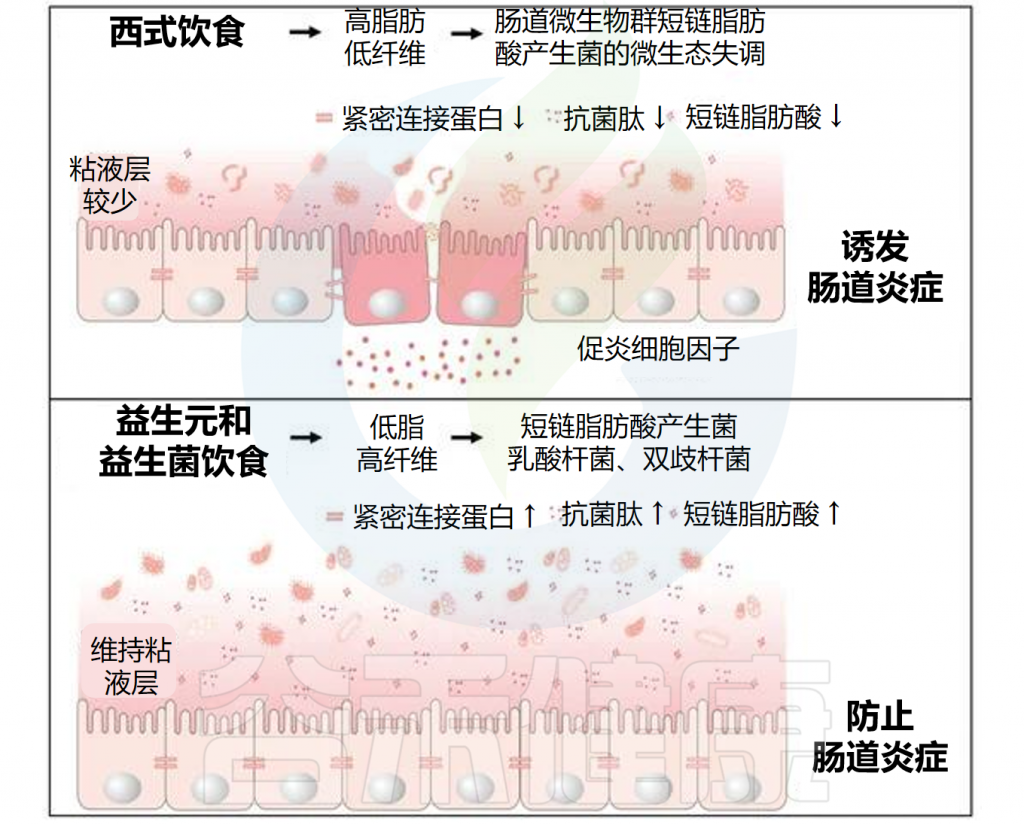
Lobionda S,et al.Microorganisms.2019
益生菌是活细菌,当摄入足够量时,可为宿主提供健康益处。使用益生菌的基本原理主要是基于它们改变肠道微生物群的能力,支持共生菌的生长而不是致病菌的生长。它们能够通过提供短链脂肪酸、维生素和其他通过粘蛋白降解产生的食物来源等代谢物来刺激常驻细菌的生长。
在一项关于益生菌治疗急性腹泻功效的研究中,益生菌通过缩短急性感染性腹泻的持续时间和减少平均排便次数具有明显的积极作用。
许多研究探讨了益生菌在预防和治疗感染方面的潜在作用,包括以下几种机制:
// 竞争性抑制
益生菌可以与病原菌竞争肠道黏膜的结合位点。通过占据这些位点,益生菌阻止病原菌的附着和进一步的入侵。此外,益生菌还能竞争肠道内的营养资源,限制病原菌的生长和繁殖。
// 产生抗菌物质,营造病原菌生存不利的环境
许多益生菌能产生抗菌物质,如细菌素、过氧化氢等。这些物质能直接杀死或抑制病原菌的生长,帮助清除肠道中的感染。
乳酸菌(LAB)可以通过产生抗菌肽(例如细菌素)来防止病原体入侵,抗菌肽可以通过在细菌细胞壁上形成孔并抑制细胞壁合成来消灭病原菌。此外,益生菌通过产生乳酸和乙酸来降低pH值,创造酸性环境,具有抗菌作用,不利于细菌病原体的生长。
// 增强肠道屏障功能
肠道完整性的损害可以解释胃肠道感染的发展。因此,益生菌增强肠道屏障的能力可能会对感染提供一些保护。
据报道,乳酸杆菌通过调节参与紧密连接信号传导的基因表达来改善肠道屏障功能。VSL3(益生元和益生菌的混合物)治疗可促进MUC2的表达和粘液分泌,有助于增强肠道屏障。这种屏障的增强有助于减少病原体的侵袭和内毒素的吸收,从而减轻感染的严重程度。
乳杆菌(尤其是L.reuteri)和动物双歧杆菌亚群,通过乳酸产生促进粘液粘附的蛋白质,称为粘液结合蛋白(MUBs),增强益生菌与宿主之间的相互作用。
// 调节免疫系统
宿主免疫系统和细胞因子谱的调节可能是益生菌有益的主要机制之一。益生菌和宿主免疫系统之间的相互作用在微生物相关分子模式中可见,包括细胞壁成分,如多糖、肽聚糖、脂蛋白和脂磷壁酸,这些成分可被上皮或宿主免疫细胞中表达的模式识别受体 (PRR) 识别。
Toll样受体2(TLR2)是一种跨膜受体,可在多种细胞类型(包括小胶质细胞、单核细胞、巨噬细胞和树突状细胞)中表达,在先天免疫反应中起着重要作用
益生菌还可以刺激肠道免疫系统产生特定的抗体(如IgA),这些抗体能够中和病原体,减少其感染性。
// 调节炎症反应
益生菌能够调节宿主的炎症反应,减少由过度免疫反应引起的组织损伤。它们通过产生抗炎细胞因子(如IL-10)和降低促炎细胞因子(如TNF-α)的水平来实现这一点。
除了单独使用益生元和益生菌外,还有将益生元和益生菌组合成合生元混合物的营养概念。考虑到上述临床研究的局限性,合生元已显示出临床成功,因此有望成为未来的治疗选择。
!
通过营养治疗感染需要注意的
与药物化合物的靶向作用相比,饮食治疗可能更加多因素。个体对营养化合物的反应受到个体遗传特征的影响。例如,炎症基因(如IL-1B、IL-6和TNF-α)中的单核苷酸多态性(SNP)会导致不同的炎症反应,这可以部分解释观察到的对营养化合物反应性的差异。
此外,越来越多的证据表明,每个人的肠道微生物群都是独一无二的,这种多样性使得个体对营养和治疗感染的反应存在显著差异。
研究显示,肠道微生物的组成可以影响营养物质的吸收和代谢,同时也会影响宿主的免疫系统功能。因此,了解个体的肠道微生物组成对于制定个性化的营养和治疗策略至关重要。
通过针对特定肠道微生物群优化的营养干预,可以更有效地预防和治疗各种感染,提高治疗的精准性和效果。这一新兴领域的研究不仅有助于推动精准医疗的发展,同时也为临床实践提供了新的视角和方法。
肠道感染仍然在全世界范围内造成沉重的疾病和经济负担。如何更好的预防和治疗胃肠道感染成了许多百姓和临床工作者关心的问题。
大量研究表明营养不良与感染之间存在双向作用。总体而言,营养影响人体免疫系统发育,而某些因素会导致营养不良并削弱人体抵抗感染的能力。包括厌食、肠道吸收减少、代谢损伤、脂质和碳水化合物代谢紊乱、维生素、铁、锌、铜减少。需要注意的是暴饮暴食可能也会增加感染风险。
与此同时,肠道微生物群在抵抗肠道病原体定植、生长和促进宿主免疫系统成熟以及影响宿主代谢方面发挥着不可或缺的作用。一些人类疾病被确定与特定微生物群的改变具有相关性或因果关系。
越来越多的人类疾病被确定与特定微生物群的改变具有相关性或因果关系。肠道中的炎症免疫反应(炎症性肠病和病原体诱导的)也可以直接塑造微生物群的组成并引发菌群失调。这一发现具有深远的影响。它从根本上改变了我们对人类肠道炎症发病机制的理解。
肠道微生物群在帮助宿主应对全身感染方面可能还有许多其他功能尚未被发现。越来越多的证据表明肠道菌群失调与慢性肠道炎症相关疾病的表现有关,尤其是炎症性肠病。抑制肠道炎症、利用益生菌或调整营养变化(如益生元和金属)可能是未来限制肠杆菌等致病细菌大量繁殖的潜在方法。
主要参考文献
Stecher B. The Roles of Inflammation, Nutrient Availability and the Commensal Microbiota in Enteric Pathogen Infection. Microbiol Spectr. 2015 Jun;3(3).
Pike VL, Lythgoe KA, King KC. On the diverse and opposing effects of nutrition on pathogen virulence. Proc Biol Sci. 2019 Jul 10;286(1906):20191220.
Cristofori F, Dargenio VN, Dargenio C, Miniello VL, Barone M, Francavilla R. Anti-Inflammatory and Immunomodulatory Effects of Probiotics in Gut Inflammation: A Door to the Body. Front Immunol. 2021 Feb 26;12:578386.
Ducarmon QR, Zwittink RD, Hornung BVH, van Schaik W, Young VB, Kuijper EJ. Gut Microbiota and Colonization Resistance against Bacterial Enteric Infection. Microbiol Mol Biol Rev. 2019 Jun 5;83(3):e00007-19.
Wiertsema SP, van Bergenhenegouwen J, Garssen J, Knippels LMJ. The Interplay between the Gut Microbiome and the Immune System in the Context of Infectious Diseases throughout Life and the Role of Nutrition in Optimizing Treatment Strategies. Nutrients. 2021 Mar 9;13(3):886.
Lobionda S, Sittipo P, Kwon HY, Lee YK. The Role of Gut Microbiota in Intestinal Inflammation with Respect to Diet and Extrinsic Stressors. Microorganisms. 2019 Aug 19;7(8):271.
Farhadi, Sedigheh1; Ovchinnikov, Roman S.2,. The Relationship between Nutrition and Infectious Diseases: A Review. Biomedical and Biotechnology Research Journal (BBRJ) 2(3):p 168-172, Jul–Sep 2018.
Cherrak Y, Flaugnatti N, Durand E, Journet L, Cascales E. Structure and Activity of the Type VI Secretion System. Microbiol Spectr. 2019 Jul;7(4).
Pickard JM, Zeng MY, Caruso R, Núñez G. Gut microbiota: Role in pathogen colonization, immune responses, and inflammatory disease. Immunol Rev. 2017 Sep;279(1):70-89.

谷禾健康

感染是人类面临的健康威胁之一。各种病原体,如细菌、病毒、真菌、寄生虫等,存在于我们日常接触的环境、物品、食物等中。一些常见的感染病例包括感冒、流感、腹泻、组织器官或血液感染等,在全球范围内广泛传播。这些疾病的传播方式多样,可能通过空气、水源、接触和食物等途径传播。
感染的症状包括发热、头痛、咳嗽、呕吐、腹泻等,严重感染可能导致器官衰竭、败血症等并发症。感染的原因包括接触感染源、免疫力下降、不良生活习惯等,易感人群有免疫力低下者、老年人、慢性疾病患者等。
研究发现,肠道菌群与感染也有密切关系。肠道菌群有助于消化、吸收营养物质,同时还调节人体免疫系统的功能。但如果肠道菌群失衡,会导致多种疾病,包括感染。
本文我们来了解一下关于感染的种类,症状,致病途径,易感因素,免疫系统应对病原体的三大防线,肠道菌群失衡与免疫系统的关联,以及肠道菌群检测在临床感染案例中的应用。
▼
感染可以按多种不同方式分类。
按影响部位分为局部和全身的:
按影响持续时间分为急性和慢性的:
按病原体类型划分:
病毒、细菌、真菌、寄生虫等都是导致感染的不同类型的病原体。
► 细菌感染
细菌感染是由体内过量的有害细菌引起的。正常情况下,人体的免疫系统能够通过白细胞和吞噬细胞等机制对抗细菌感染。但如果人体的免疫系统出现异常或受到外界因素干扰,细菌就可能趁虚而入,导致细菌感染的发生。
常见的细菌感染包括:肺炎、腹泻、皮肤感染、脑膜炎、膀胱炎、中耳炎等。
► 真菌感染
真菌感染多为继发性感染,由机会致病性真菌引起,特别是深部真菌感染多是由于各种诱因使机体免疫功能显著下降所致。
真菌是一类与细菌和病毒不同的微生物,它们包括霉菌、酵母菌等,常见的真菌感染有白色念珠菌感染、曲霉菌感染等。
► 病毒感染
病毒感染与细菌感染不同,因为病毒本身并不能独立存在,只有当它侵入人体细胞后才能产生病毒性病变。当病毒进入细胞时,它会留下迫使细胞复制的遗传物质。
当细胞死亡时,它会释放新的病毒感染其他细胞。并非所有的病毒都会破坏细胞——有些病毒会改变细胞的功能。
病毒会导致多种疾病,包括普通感冒、流感、登革热、水痘、艾滋病等。
► 寄生虫感染
寄生虫是需要以其他生物为食才能生存的生物。有些寄生虫不会对人产生明显影响,而有些寄生虫会生长、复制并侵入器官系统。
常见的寄生虫感染有阿米巴病、血吸虫病、肠道蠕虫感染等。
▼
无论何时发生感染,身体的一线反应都是炎症性的。
炎症是身体抵御疾病的方式,同时促进受影响组织的愈合。炎症的主要症状:红、肿、热、痛、组织功能的暂时丧失。
在感染期间,由于潜在的炎症反应,人们通常会出现非特异性的全身症状。症状和严重程度可能因受影响的器官系统而异,但可能包括:
▼
► 病史采集
询问患者或病人家属发病情况、既往病史、服药史、过敏史、流行病学史等。
► 体格检查
体温、呼吸、心率、血压、身体部位肿胀、红肿、局域性压痛、淋巴结肿大等都是感染体征,可以作为诊断和判断感染病情严重程度的参考指标。
► 实验室检查(抽血、尿检等)
通过血液、尿液、呼吸道分泌物、伤口分泌物等样本的化验检查可以更直接地确定病原体的种类和数量,以及感染程度的严重程度。
► 影像学检查(做CT等)
如X射线、CT、MRI等技术,可以帮助医生了解感染的程度以及可能受影响的部位,从而确定感染的类型和严重程度。影像学检查为临床医生在明确诊断之前的经验性治疗提供线索。
► 快速诊断测试(做核酸等)
如血清学检测、ELISA试剂盒、PCR技术等,可以在短时间内快速准确地检测出患者血清中的病原体抗体、抗原以及核酸等,提供对感染病原体的敏感性和特异性的快速诊断。
▼
呼 吸 道
普通感冒的另一个名称是上呼吸道感染。鼻病毒是引起感冒的最常见病毒。其他通过空气传播的传染病也以这种方式感染。
感冒和流感通常不会直接影响肺部,但它们可能会导致继发性细菌感染——肺炎。
消 化 道
如果不小心吃了被细菌或病毒感染的食物、饮料或水、或是农产品在种植或运输过程中接触了污染物,或者过期变质的食物等,病原体也一并被吞入,感染胃部或肠道,有时表现为腹泻和/或呕吐。一个常见的例子是细菌性肠胃炎,也称为食物中毒。
泌尿生殖系统
病原体也可以通过泌尿系统进入人体,如尿路感染,或生殖系统,如性传播疾病。传染源可能停留在局部,也可能进入血液。例如,性传播疾病最常感染生殖器,而艾滋病毒通过体液携带,也可以通过唾液、精液或血液传播。
皮 肤 接 触
皮肤的功能之一是充当抵御感染的屏障。但如果有割伤、抓伤、虫咬或任何类型的开放性伤口,皮肤阻挡不住,病原体可能会进入血液。如:蜂窝组织炎、脓疱疮等都是通过皮肤接触开始的常见感染。
▼
无论来源如何,任何人都可能感染。但有些人更容易感染,或感染并发症的风险增加,例如:
以上我们可以看到,那些免疫系统功能低下的人更容易发生感染。那么当病原体入侵时,免疫系统正常运作会发生什么呢?
下一章节我们来了解一下,默默帮助我们抵抗病原体的——免疫系统。
前面章节我们知道感染是微生物进入人体并造成伤害的结果。引起感染的生物体很多,包括病毒、细菌、真菌、寄生虫等。
当它们试图攻击的时候,免疫系统是如何运作的?
第一道防线——物理屏障
正常情况下,皮肤、呼吸道等组成的物理屏障在保护你,一般只有水分、气体等小分子物质进出,细菌、病毒难以入侵。
然而,也许你只是摔了一跤擦破了皮,也许只是水果刀不小心划伤了…皮肤作为免疫系统的第一道防线破了。
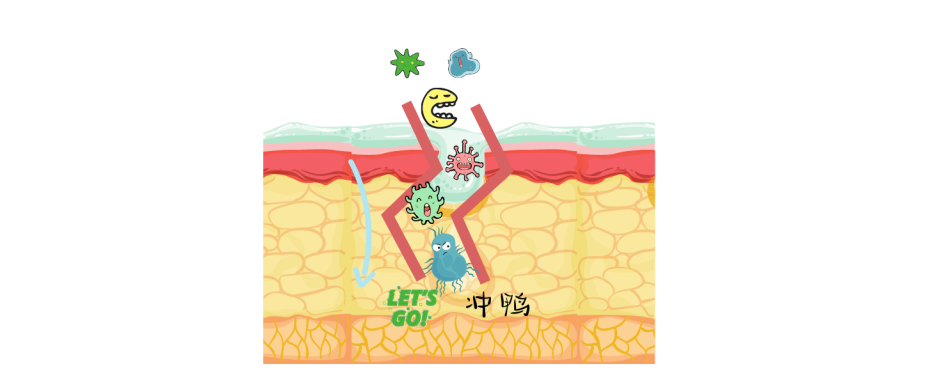
这时候细菌就开始争先恐后进入体内,不断繁殖,增强武力值。
第二道防线——先天性免疫防线
(广泛执行任务)
巨噬细胞——以吞制敌
巨噬细胞开始介入这场搏斗,它往往通过吞噬的方式以一敌百,不管三七二十一先吞下将其困在膜泡里,利用酶等物质分解杀敌,如果细菌还来不及生长繁殖就被吞完了,这场搏斗也就随之终止了。该过程可能引发局部的炎症,表现为红,肿,痛,热等。

但如果一直持续下去,巨噬细胞也可能累了,它开始发出紧急信号,召集后援团…
中性粒细胞——不分敌我直接干
中性粒细胞出现了,它离开了原本在血液中巡逻的路线,第一时间冲过来加入,武力值开始飙升,健康细胞也会被它误杀,它也会给细菌设置障碍,从而困住细菌将其干掉。
它们也会“适可而止、功成身退”,几天后自杀,不带来更多伤害。
如果这还不足以击退,发出的求救信号越来越多,当中枢神经检测到,下丘脑便会开始调节体温上升,也就是发烧。较高的体温可以抑制病原体的活性与繁殖。
以上就是人体免疫系统的第二道防线,也就是先天性免疫(非特异性免疫)。
如果第二道防线没有阻止入侵者呢?
最终对抗会发生在第三道防线,也就是后天性免疫。
第三道防线——后天性免疫防线
(形成记忆,长期保护)
后天性免疫系统是一个成长、学习和经验的累积,学习和记忆着病原体的模式,进而识别并产生特异性的免疫应答。具有极强的打击和防守能力,可以持续有效地保护我们的身体。

这时候,树突状细胞登场了。
树突状细胞——先天性免疫和后天性免疫之间的桥梁
树突状细胞开始手撕敌军,把病原体碎片暴露在自己的细胞膜上,带着病原体的信息去淋巴结,这里有很多T细胞待激活,当T细胞出生时会经过一个训练,之后会配备一个装备。
树突状细胞要寻找的正是可以和病原体表面特征蛋白结合的那个T细胞。
T细胞——等待激活,加入战斗
找到后该T细胞会被瞬间激活,然后开始分裂复制,并分化出三种T细胞,分别为:
B细胞——产生抗体,继续奋斗
当辅助T细胞过去找到B细胞识别结合之后,B细胞瞬间激活,大量复制,产生抗体。
抗体的出现意味着胜利的曙光,抗体表面有多个结合点,可以把多个病原体结合在一起,病原体捆在一起行动不便,失去活力。其他免疫细胞过来可以轻松把它们干掉。
抗体还可以拉着病原体连接杀伤细胞,将其消灭。
记忆T细胞和B细胞——学会对付,默默守护
在清除病原体后,分化出来的大量免疫细胞完成任务,会程序性自杀,防止继续占用资源。会有一小部分留下来,也就是记忆T细胞和记忆B细胞,等待病原体下次来的时候直接杀敌。
以上就是免疫系统的三大防线,它们的存在为人体提供了多重保护。正是因为它们的不懈努力,在感染发生后我们也会挺过来。
研究发现肠道菌群与人体免疫功能以及许多疾病的发生密切相关。
肠道菌群失衡如何与感染相关?肠道菌群与免疫系统之间存在怎样的关联?
下一章节我们继续来看。
肠道菌群中某些微生物和宿主的免疫系统之间存在相互作用,肠道菌群能够影响和调节上述第三大防线中B细胞和T细胞的活性,通过调节免疫细胞的行为,促进抗原递呈细胞的活化和作用,影响细胞因子及其受体的表达等。
肠道微生物代谢产物能够影响免疫平衡。例如,肠道菌群可以通过代谢产生短链脂肪酸、色氨酸胆汁酸等代谢产物,这些代谢产物能够通过激活特定的神经元和免疫细胞来调节免疫反应,从而维持肠道黏膜的免疫稳态。
短链脂肪酸可能具有抗炎和免疫调节作用,当然短链脂肪酸只是一部分,因为除了产生的酶和其他代谢物之外,细菌本身的成分,包括脂多糖、细胞囊碳水化合物和其他内毒素,也可能被释放并对宿主产生二次影响。
肠道微生物群衍生的代谢物丙酸盐(一种短链脂肪酸)水平降低可能导致 Th17/Treg 细胞分化的病理失衡。
一些菌群代谢物,如 4-甲基苯甲酸、3,4-二甲基苯甲酸、己酸和庚酸等,已被证明会加剧结肠上皮细胞的损伤,从而影响免疫。
在肠道菌群失调的情况下,某些有益菌可能会缺乏消化酶等必要的代谢产物和物质,使机体免疫系统无法及时有效地对病原体进行攻击。
许多致病菌与肠道屏障的特定元素相互作用。一些有益的菌群可以激活上皮细胞,加强它们的黏附能力和抗病原性,从而提高肠黏膜的免疫防御能力。
致病菌和抗生素的使用可能会通过增强黏液降解,或抑制正常的共生黏液生成触发器来扰乱肠道黏液层,从而破坏肠道屏障,也就是我们常说的“肠漏”。
肠道屏障的破坏也会诱发体内炎症:与微生物相关的代谢物离开肠道并进入血液。作为回应,身体会产生细胞因子和其他介质,有效地启动炎症反应。
肠道上皮组织内的细胞将细菌代谢物传递给免疫细胞,从而在局部和全身范围内促进炎症。这种情况的持续存在可能导致亚急性或慢性炎症,随后可能会导致炎症性肠病、糖尿病或心血管疾病等疾病的发展。
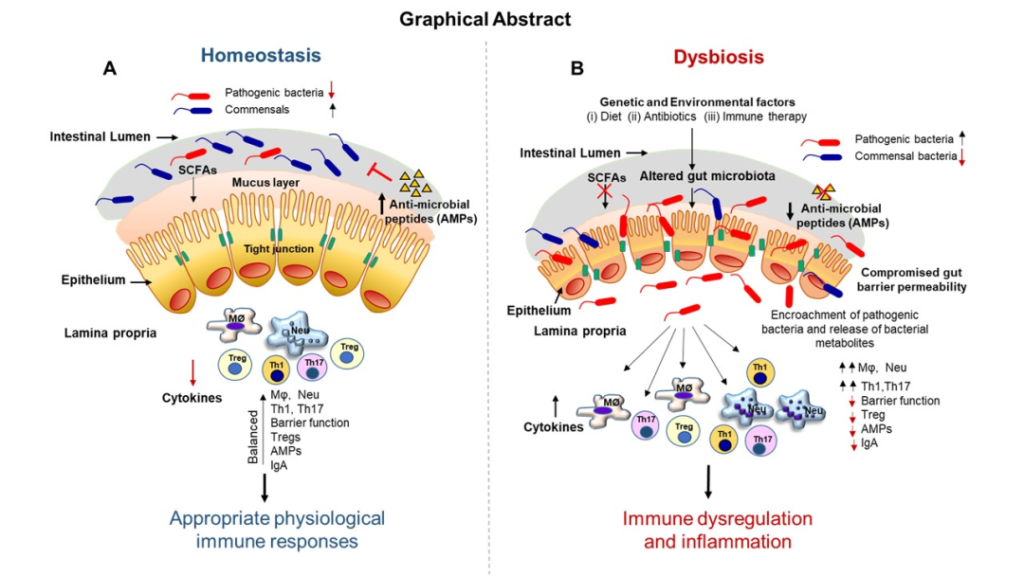
doi.org/10.3390/biomedicines11020294
C 反应蛋白 (CRP) 是一种下游炎症标志物,可以通过特定肠道微生物的抗炎代谢产物的作用下调。当巨噬细胞和 T 细胞分泌白细胞介素 IL-6 时,该分子随后以高水平释放到循环中。我们在肠道菌群检测报告中也可以用CRP来辅助判断炎症状况。
炎症标志物是复杂的双向调节机制的组成部分,并且参与多个重叠过程,与感染和体内稳态的维持有关。
由此,肠道菌群变化对于免疫功能强弱具有重要指示作用,那么我们可以结合肠道菌群检测中的实际案例,来了解更多关于肠道菌群和感染的关联。
在谷禾肠道菌群健康检测中,有许多关于感染的病例,我们选取一例来详细看一下。
年初,一名7岁女孩入院,经诊断后发现患有:
菌血症是一种严重的感染症状,通常由细菌或真菌等微生物感染引起。菌血症分为原发性和继发性。
只有大约20%病例是原发性菌血症,也就是说病原体最初进入血液系统并引起血流感染,例如创伤、手术、注射等导致血管受损直接感染。
其余大多数都是继发性菌血症,也就是在其他部位先感染,未能及时处理,致使病原菌进入血液系统引起继发性菌血症。
常见的菌血症类型包括葡萄球菌菌血症,肺炎链球菌菌血症,鲍曼不动杆菌菌血症,克雷伯菌菌血症,真菌菌血症等,都是相应的致病菌感染引起的。
入ICU后,出现腹胀问题,且愈发严重 ⇊
肠道菌群检测结果显示:
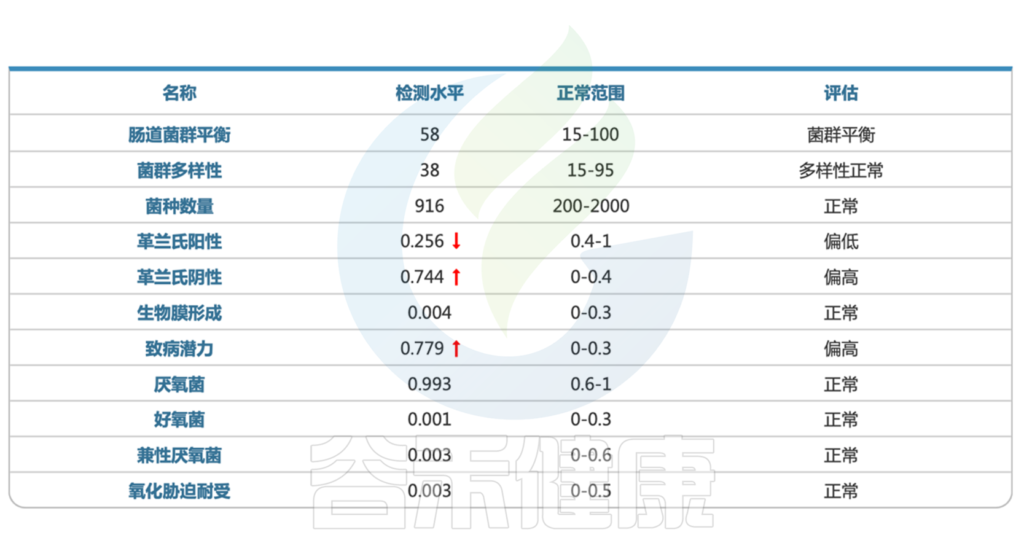
1. 患儿肠道菌群严重失调
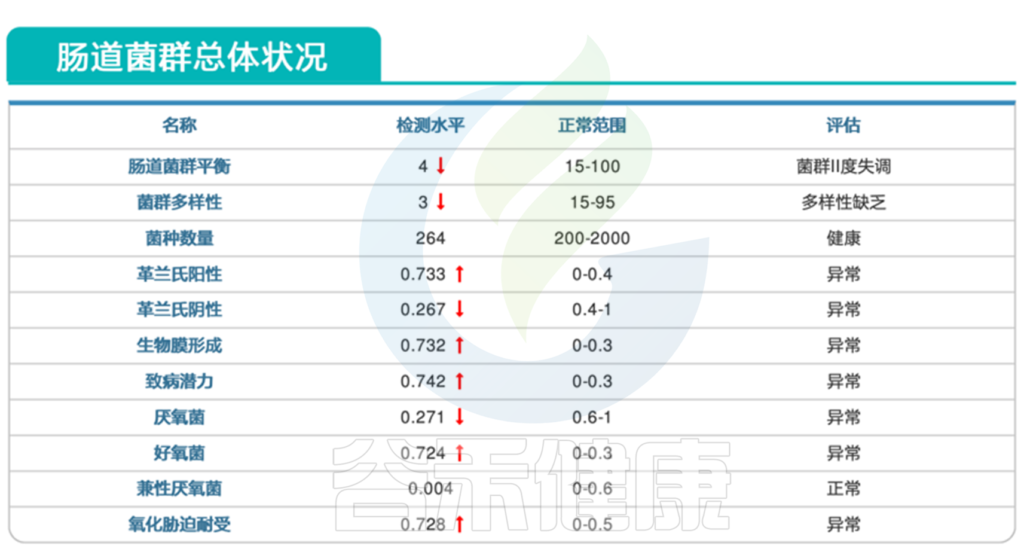
<来源:谷禾健康肠道菌群检测数据库>
显然,该患者的肠道菌群失调,多项指标均显示异常。
从报告的肠道菌群总体状况这部分,我们可以看到,菌群多样性下降,其中革兰氏阳性菌明显偏高,革兰氏阳性菌包括葡萄球菌,链球菌,梭菌等,可能与多种感染相关。同时报告中致病潜力这项指标也是大幅上升。
2. 存在艰难梭菌携带超标、酵母菌感染、不动杆菌超标严重(感染)情况
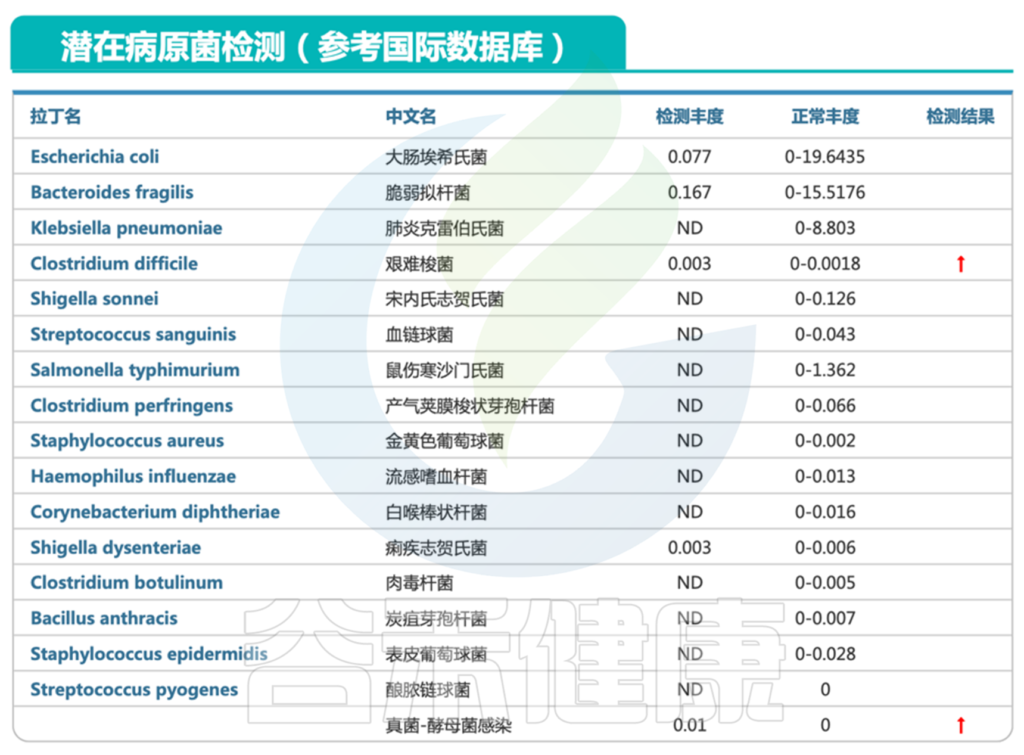
<来源:谷禾健康肠道菌群检测数据库>
艰难梭菌超标 ↑
艰难梭菌是一种常见的肠道病原菌。它可以引起广泛感染,症状最常见的是腹泻,伴随着腹部疼痛,刺痛,腹胀等不适,有些人还可能会出现发热,发冷,胃部压痛或疼痛,恶心呕吐的症状。
更严重的可能出现水样腹泻,心跳加快、体温升高、腹部绞痛、体重下降、腹部肿胀、肾功能衰竭等。
这与患儿的某些症状相符,从肠道菌群检测中可以发现艰难梭菌感染。
艰难梭菌感染与免疫功能有怎样的关联?
艰难梭菌毒素通过炎症小体和TLR4、TLR5和含有核苷酸结合寡聚结构域的蛋白1(NOD1)信号通路刺激先天免疫细胞,随后产生大量促炎细胞因子(如IL-12、IL-1β、IL-18、IFN-γ和TNFα)和趋化因子(MIP-1a、MIP-2、IL-8),导致粘膜通透性增加、肥大细胞脱颗粒、上皮细胞死亡和中性粒细胞浸润,引发免疫功能低下。
这与患者一开始诊断中中性粒细胞功能低下相符。
艰难梭菌感染通常与抗生素使用相关
通过某些抗生素,特别是克林霉素,可能会去除大量肠道中的有益细菌,使艰难梭菌得以繁殖,导致结肠炎和随后的腹泻。
真菌——酵母菌感染 ↑
报告中可以看到酵母菌超标,存在感染。这与入院时的粪便培养中的真菌感染相吻合。
真菌感染可能通过影响肠道微生物群和免疫反应,促进病原体的定殖和发展。
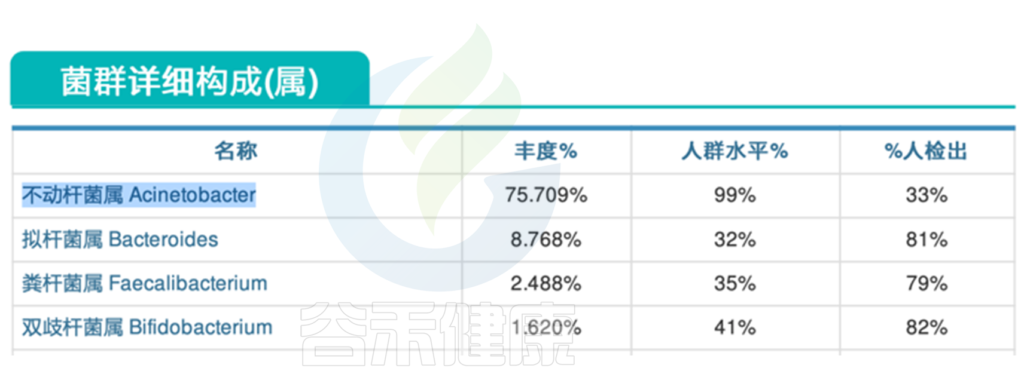
<来源:谷禾健康肠道菌群检测数据库>
不动杆菌属(75.709%)占比过多 ↑
从报告中的菌群详细构成这部分可以看到,不动杆菌属的丰度竟然超过75%,严重超标。
这种情况下,不动杆菌属严重挤压了其他肠道核心菌属的生存空间,有益菌生长受限,菌群多样性下降,肠道菌群整体失调。
不动杆菌属Acinetobacter是一类革兰氏阴性菌,该菌属于常见的医院感染病原体之一。不动杆菌属感染常见的病症包括呼吸道感染、泌尿道感染、创伤感染等,严重情况下还可能导致败血症。
不动杆菌属对常见抗生素经常会产生抗药性。这里不动杆菌属丰度较高可能与抗生素使用较多相关。
结合该患者的情况,一开始入院时的组合抗生素一周未见好转,可能与不动杆菌属占比过多相关,对许多常见的抗生素已经产生耐药性,且免疫功能低下,因此难以好转。
针对上述情况,临床考虑口服抗生素,针对消化道微生物进行抗感染治疗。
初步选定:口服利福昔明 + 甲硝唑治疗。2天未见明显改善。
后改为:口服万古霉素 + 阿莫西林治疗。当天腹胀症状明显缓解,3天治疗腹胀明显改善。
同时辅助康复新液+B族维生素+谷氨酰胺治疗。
用药两周后,患儿整体情况平稳,仍存在轻微腹胀⇊

肠道菌群复查提示菌群结构基本恢复正常。
<来源:谷禾健康肠道菌群检测数据库>
一年后随访,该儿童身体已经好转,生活正常。
备注:临床中还有其它治疗药物等没有全部分享,主要分享了与菌群相关的治疗,仅做交流,不能作为治疗参考。
宿主感染与肠道菌群之间存在复杂的相互作用,免疫系统有两个分支,即先天性和适应性,它们协同工作以保护身体免受外部和内部威胁。这两个免疫系统分支都受到严格调节,肠道微生物群是其中的一个重要因素。
要揭开这其中的机制关联可能需要依靠营养学、流行病学、医学、免疫学和微生物学等多学科研究人员的共同努力。
不过从以上案例我们可以看到,肠道菌群健康检测在感染治疗中发挥重要价值。
辅助判别
在传统诊断中得知患者存在菌血症,真菌感染,但通过肠道菌群健康检测可以了解更多具体的感染信息,比如说艰难梭菌感染可能引起的腹胀等问题,不动杆菌属占比过大形成的抗生素耐药性。
除了致病菌超标等直观的信息之外,我们还可以判断整个肠道微生态的健康状况。肠道微生物群的失调可能导致肠道易感性增加,使得易感性疾病如艰难梭菌感染更容易发生。
辅助用药
针对这些具体信息可以使用药更加精确,而不是直接使用常见的组合抗生素。
用对抗生素对于恢复速度有很大提升,同时也避免了患者因使用不必要的抗生素产生耐药性。

谷禾健康

大多数细菌对我们的生活是有帮助和必要的,某些细菌可以帮助消化,为身体提供能量,分解毒素,保护肠道,增强免疫力等,从而有益健康;也有一些细菌会给我们的健康带来一些危害。
然而有些菌并不是天生注定就是致病菌,也许正常状况下,它只是体内默默地存在着,但可能在某种特定条件下突然变身,彰显其致病威力。
事实上,许多严重的疾病是由健康个体的皮肤、粘膜或肠道中常见的细菌引起的。在这些情况下,致病菌根本不是专性病原体,而是遵循新的生态轨迹的共生体,通常会迁移到与宿主不再和谐相处的侵入性生态位。
细菌从共生到致病的转变在肺炎、脑膜炎、全身感染和医院获得性感染等疾病中发挥重要作用。当然,宿主环境扰动可能会提供感染机会。
因此,我们需要对致病菌的个性、不同环境下的状态有个基本的了解。
在谷禾肠道菌群健康检测报告中,我们会看到关于有益菌,有害菌,致病菌的检测:
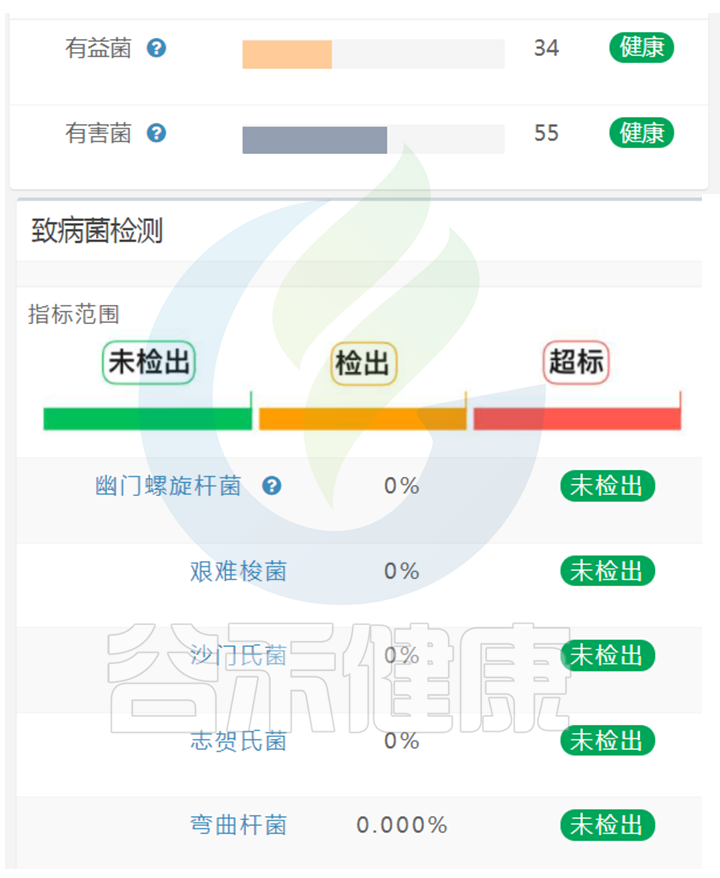
有小伙伴有疑问,这里既显示有害菌又有致病菌,有害菌不是致病菌吗?
携带致病菌就一定会生病吗?
条件致病菌是如何引起感染的?
有害菌很多,该如何改善?
…
本文也将围绕着这些问题,展开一些讨论。
致病菌是引起疾病的细菌,也称为病原菌。当它进入身体时,就会破坏细胞或干扰身体的正常活动,人可能会患上轻微疾病或致命疾病。
✦ +
致病菌通过多种方式导致宿主生病。最明显的方法是在复制过程中直接破坏组织或细胞,通常是通过产生毒素,使病原体到达新组织或离开它复制的细胞。细菌毒素是已知的最致命的毒物之一,包括著名的例子,如破伤风、炭疽等。
然而,对宿主的损害通常是通过强烈的或有时是过度的免疫反应自行造成的,这种免疫反应会不加选择地杀死受感染和未感染的细胞并损害宿主组织。免疫系统过度反应的典型例子包括乙型肝炎中的肝硬化和肝癌。
一些病原体受益于宿主的免疫反应,可以在受感染的宿主内传播或增加它们向未感染宿主的传播。
流感主要通过它引起的打喷嚏和咳嗽产生的气溶胶传播。
霍乱弧菌在肠道粘膜中引发强烈的炎症反应,导致水样腹泻,并确保其在环境中的释放,从而感染更多的宿主。
✦ +
从概念上来讲,致病菌和病原菌意思差不多。需要注意的是,这里我们报告用的两个词分别是:
肠道致病菌,病原菌。
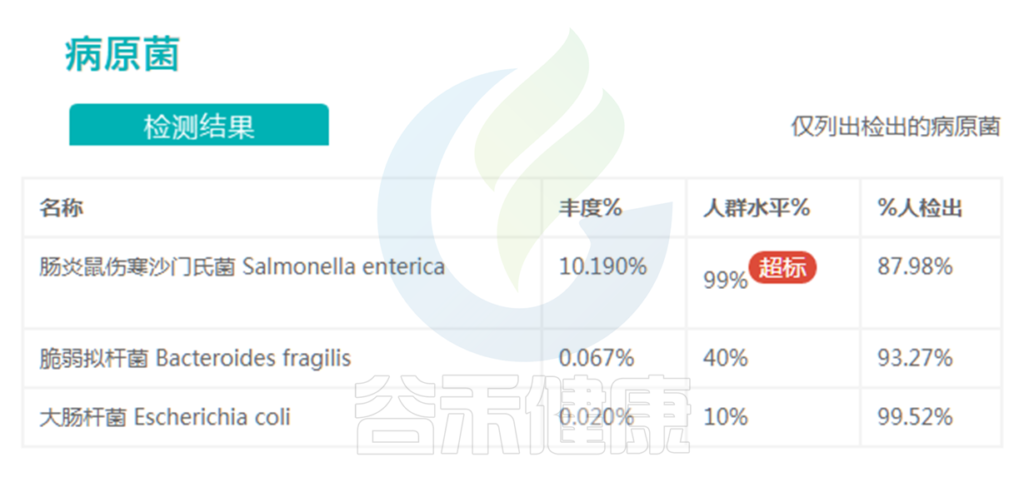
✦ +
正常情况下,肠道内是存在少量的病原菌,但是其丰度相对较低,丰度低于健康人群98%以下,不一定会导致疾病的发生。
这里我们可以了解一下关于“细菌感染”:
细菌感染:
病原菌侵入宿主体内并引起病理变化称为“感染”。
也就是说,如果报告中只是检出极少的病原菌,同时并没有症状,那么可能只是表面有病原菌摄入,需要注意饮食和生活卫生,这并不能称之为病原菌感染,因此不需要过于恐慌。
如果报告中病原菌检出已经超过98%人群,则代表可能存在感染的风险,需要结合相应症状和具体菌群丰度比例综合进行判断。
此外,如果出现多种病原菌或病原菌丰度水平很高,则需要引起注意。
✦ +
需要注意的是,谷禾肠道菌群检测报告中的疾病风险,是综合了多项指标判别的,并不只是考虑了致病菌。
慢病是每一种病单独构建模型,不一定和有害菌或菌群平衡指标直接有关。
下面我们来看一些致病菌,这些致病菌一旦感染可能会给人体带来较大危害。
✦ +
★ 炭疽杆菌 Bacillus anthracis
炭疽杆菌是革兰氏阳性、非运动、兼性厌氧、孢子形成和杆状细菌。
炭疽杆菌是一种人畜共患病的病原体,是一种专性病原体,因为细菌的繁殖周期只发生在合适的宿主中。
编辑
图源:tvmdl.tamu.edu . by Mallory Pfeifer
炭疽杆菌的发病机制主要由两种毒力因子引起:三方外毒素和聚γ-d-谷氨酸(γ-DPGA)。
人类可以通过四种不同的方式感染炭疽:吸入、摄入、通过皮肤和注射。
吸入性炭疽被认为是最致命的炭疽形式。如果不进行治疗,病死率接近95%,而立即干预可以将病死率降至50%。
胃肠道炭疽的发生是由于食用了来自感染炭疽的动物制备不当的肉类或肉制品。死亡率是可变的,通过适当的抗生素治疗可以达到≤40%.
皮肤炭疽通常通过皮肤接触受感染的动物或动物产品而发生。这种形式的炭疽病占全球人类病例的 95%。治疗后病死率<1%。潜伏期为 3-7 天。临床表现从轻度到重度不等。
抗生素疗法用于治疗炭疽感染。青霉素、强力霉素、环丙沙星。抗生素治疗必须在接触后立即开始,因为其有效性会随着毒血症的进展而降低。炭疽疫苗在治疗中也很重要。在确诊或疑似接触炭疽孢子的情况下,建议进行 60 天抗生素治疗。
★ 鼠疫耶尔森菌 Yersinia pestis
鼠疫耶尔森菌是一种小型、非运动的革兰氏阴性细菌,属于肠杆菌科。鼠疫耶尔森氏菌是鼠疫的病原体,鼠疫是一种罕见但高度致命的人畜共患病。
图源:onlinebiologynotes
大多数人类感染是由于与受感染的动物接触或被受感染的跳蚤叮咬造成的。
鼠疫在全球超过 25 个国家流行。尽管有有效的抗生素治疗,流行地区的死亡率仍超过 10%,这主要是由于发病机制的快速发展。
鼠疫主要以三种形式发生:肺鼠疫、腺鼠疫和败血症鼠疫。
鼠疫最严重的表现,发展最快的是肺鼠疫,在没有治疗的情况下死亡率接近100%.
肺鼠疫通过呼吸道飞沫在人与人之间传播。经过 2-4 天的潜伏期后,疾病的各种症状包括发烧、头痛、恶心、不适、呕吐、咳痰带血、呼吸困难和胸痛。如果在症状出现后 24 小时内给予适当的抗生素治疗,死亡率可降低高达 50%。
腺泡形式是最常见的,腺鼠疫是鼠疫的主要形式,占病例的 80-95%。死亡率为 10–20%。腺鼠疫由受感染的跳蚤叮咬引起。腺鼠疫的特点是形成淋巴结(淋巴结肿大)。通常的潜伏期从 2 到 6 天不等,有时更长。
如果腺鼠疫没有在适当的时间得到诊断和治疗,它会通过血液传播细菌而发展成败血性鼠疫。这种形式的瘟疫也可能是由传染性跳蚤叮咬通过受损的皮肤或粘膜直接进入鼠疫耶尔森氏菌引起的。通常的潜伏期为 2-7 天,但这种类型的鼠疫甚至在临床表现出现之前就可能导致死亡。
败血性鼠疫的症状包括腹痛、皮肤和其他器官出血。皮肤和其他组织可能会坏死,尤其是鼻子、手指和脚趾。此外,可以观察到发烧、腹泻、呕吐和虚弱。败血症性鼠疫以高菌血症为特征,并伴有危险的内毒素血症。
★ 土拉弗朗西斯菌 Francisella tularensis
土拉弗朗西斯菌是一种革兰氏阴性、非运动、非产孢球杆菌。它是一种小的细胞内病原体,具有高毒力和低感染剂量(1-10 个细胞)的特点。
细菌可以通过接触受污染的水进一步传播。吸入受感染的气溶胶,或直接接触受感染动物的组织和液体,也可用作细菌传播的途径。
细菌进入体内后,在局部繁殖,引起溃疡和坏死,然后侵入血液和淋巴管,扩散至肝、脾、肺、肾、浆膜、骨髓等淋巴结和器官,引起多发性凝固性坏死灶。
图源:DeviantArt
土拉弗朗西斯菌不仅容易在巨噬细胞中生长,而且还可以感染许多其他细胞类型,如上皮细胞、肝细胞、肌肉细胞和中性粒细胞。
有六种主要形式的土拉菌病,根据症状分类:肺病、腺病、溃疡腺病、口咽病、伤寒病和眼腺病。
该病的潜伏期通常为暴露后3-5天。
溃疡腺形式是最常见的,是节肢动物媒介叮咬或在与受感染动物接触期间通过皮肤获得感染的结果。
细菌通过磨损进入生物体后,可能会发生腺体形式的土拉菌病。
食用未煮熟、受感染的食物或受污染的水后,可能会形成口咽形式,之后细菌会感染咽部。患者常出现发热、咽痛、颈淋巴结肿大伴耳下淋巴结受累。
在疾病的严重形式中,可能会出现由于肠溃疡导致的胃肠道出血。
当细菌进入循环系统并从另一个感染部位扩散到肺部时,就会出现继发性肺炎性土拉菌病。症状包括高烧、干咳、胸痛和肺门淋巴结肿大;也可能出现肺部浸润或胸腔积液。
伤寒形式的主要症状是发烧、发冷和严重疲劳。然后出现呕吐、腹泻、谵妄和腹痛。临床表现还包括全身疲劳、败血症和死亡。伤寒形式是最难诊断的,因为它的一般症状没有明显的外部病变或区域淋巴结肿胀。
★ 肉毒杆菌 Clostridium botulinum
革兰氏阳性菌,厌氧菌,可运动,致病菌。
它会引起一种罕见但严重的疾病。产生一种特殊类型的外毒素,通过抑制神经肌肉连接的活动来影响神经系统。因此,肉毒杆菌毒素表现为一种神经毒素,它会阻止神经递质的释放。
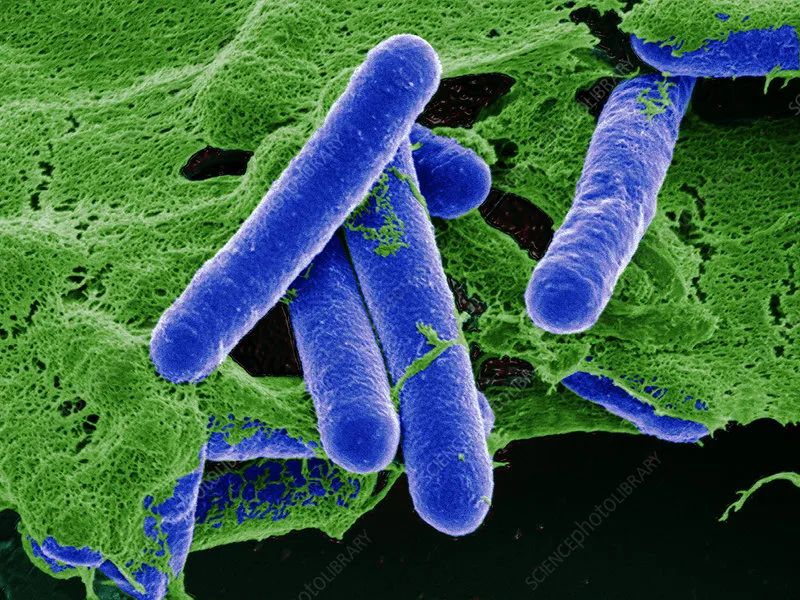
图源:Science Photo Library
肉毒中毒的症状通常始于控制眼睛,面部,嘴巴和喉咙的肌肉无力。
这种无力可能会蔓延到脖子,手臂,躯干和腿部。肉毒杆菌中毒还会削弱呼吸所涉及的肌肉,从而导致呼吸困难甚至死亡。
分为五种传播类型:
预防:
包括减少微生物污染水平,酸化,减少水分水平,以及尽可能破坏食物中所有肉毒杆菌孢子。
易感食物包括罐装芦笋、绿豆、油蒜、玉米、汤、熟橄榄、金枪鱼、香肠、午餐肉、发酵肉、沙拉酱和熏鱼。食用前,考虑将这些食物煮沸10分钟。
以上列举了一些常见的致病菌。致病菌与非致病菌并不是绝对的,是一个动态作用的过程。我们知道肠道中还有大量其他菌群,这些菌群在特定条件下,也可能转为致病菌,我们把这类细菌称为条件致病菌,接下来章节我们来详细了解一下条件致病菌的特点。
正常菌群与宿主、其他菌群之间,通过营养竞争、代谢产物的相互制约等因素,维持着良好的生存平衡。
然而,在一定条件下这种平衡关系被打破,一部分平时看起来正常的细菌就开始“作妖”,变成可以致病的细菌,这就是所谓的 “条件致病菌”。
条件致病菌包括引起肺炎、血流感染、脑膜炎和其他疾病的细菌。它们存在于环境中,可以通过皮肤上的伤口或吸入含有细菌的灰尘进入人体。
健康的免疫系统可以对抗许多病原体,但如果它受损,条件致病菌通常会引起感染。
与免疫系统受损相关的因素有:
遗传易感性;
癌症化疗;
给予免疫抑制药物以防止移植后排斥反应;
艾滋病感染;
严重营养不良;
长期抗生素治疗;
天生免疫系统较弱的婴儿和老年人;
导致白细胞生成减少的骨髓疾病;
怀孕;
正所谓 “橘生淮南则为橘,生于淮北则为枳”。某些细菌在肠道内是乖乖成长的,可一旦冲破束缚,例如在肠漏的情况下,细菌或其代谢物泄露到循环中,可能会变身“有害菌”,可以通过诱导慢性或急性炎症反应,导致疾病发生,包括损害肝脏和胰腺等重要器官,肝癌和胰腺癌可能与细菌易位有关。
如果没有健康的器官和器官系统来适当调节正常的身体功能,条件致病菌就有下手的机会,利用此环境推动疾病的发生。
手术通常涉及切口和伤口,这些切口和伤口为病原体进入身体创造了入口。这也为条件致病菌创造了有利条件。
长期使用会破坏体内正常的微生物群,杀死有益细菌,并导致条件致病菌增殖。
其实细菌(即便是致病菌),它们要生存下来并没有我们想象的容易,生活在复杂的群落中,多个物种和菌株存在相互竞争。
例如,在共生葡萄球菌中,分泌蛋白酶的表皮葡萄球菌菌株,会抑制金黄色葡萄球菌的生物膜形成和鼻腔定植。此外,生物膜破坏介导与其他物种的相互作用,并增加金黄色葡萄球菌对宿主免疫反应成分的易感性。可以看到宿主和共生细菌发出协同反应以排除其他物种。
然而你以为只有宿主和其他菌会带来威胁吗?不,另一种威胁来自与它们同居的同一物种的另一个谱系,同种内部也会互相竞争。这种种内争夺优势的斗争在金黄色葡萄球菌中得到了例证。
关于细菌之间如何交流详见:
金黄色葡萄球菌
Staphylococcus aureus
金黄色葡萄球菌是一种需氧的革兰氏阳性细菌,通常在健康人的鼻腔和皮肤上定植。
但当存在于假体关节和静脉输液管等内部装置中时,可能会导致感染,感染可能导致严重的败血症。
铜绿假单胞菌
Pseudomonas aeruginosa
铜绿假单胞菌是一种需氧、不发酵、高度运动的革兰氏阴性菌。
当感染宿主时,铜绿假单胞菌需要铁。因此铜绿假单胞菌合成了两种铁载体:pyochelin和pyoverdin。铜绿假单胞菌随后将这些嗜铁细胞秘密地存在于细胞的外部,与铁紧密结合并将铁带回细胞。铜绿假单胞菌还可以利用肠杆菌素中的铁来满足其铁需求。
其优先代谢是呼吸,通过将电子从葡萄糖(还原的底物)转移到氧(最终的电子受体)来获得能量。当处于厌氧状态时,铜绿假单胞菌使用硝酸盐作为末端电子受体。
形成生物膜,附着在金属,塑料,医疗植入材料和组织表面。
症状:
肺部感染:发烧和发冷、呼吸困难、胸痛、疲倦、咳嗽
尿路感染:强烈尿频冲动、小便疼痛、尿液中难闻的气味、尿液混浊或带血、骨盆区域疼痛
伤口感染:伤口发炎、漏液
耳部感染:耳痛、听力下降、外耳发红或肿胀、发热
也可能是囊性纤维化患者或机械呼吸机患者呼吸道感染的重要原因。
传播:
当暴露于受该菌污染的水或土壤中时,可以传播到医院患者。还可以在医院中通过被污染的手,设备或表面从一个人传播到另一个人。
治疗:
抗生素治疗
注:铜绿假单胞菌感染通常难以治疗,因为该细菌对许多抗生素具有抗性,并且具有形成生物膜的非凡能力。
易感人群:
免疫力低下人群
使用呼吸机患者、使用导管等装置、有手术或烧伤的伤口患者
预防:
患者和护理人员应保持双手清洁,避免感染。尤其是在护理伤口或触摸医疗设备之前和之后要彻底洗净双手。每天打扫房间。避免共享个人物品。
艰难梭菌
Clostridium difficile
革兰氏阳性,厌氧菌。经过氨基酸发酵,以产生ATP作为能量来源,并且还可以利用糖。
产生两种毒力因子:在70%的菌株中发现肠毒素(毒素A)和在所有菌株中发现的细胞毒素(毒素B)。毒素通过糖基化使Rho-gtpase失活,破坏肠上皮细胞的紧密连接,导致细胞旁通透性增加,从而导致体液分泌(腹泻)、粘膜损伤和炎症。
艰难梭菌存在于整个环境中,包括土壤,空气,水,人类和动物的粪便以及食品(例如加工肉)中。
疾病症状:
艰难梭菌通常影响住院的老年人。
常见症状有:严重腹泻、发热、排便频繁、胃部压痛或疼痛、食欲不振、恶心。
更严重的症状可能包括:
水样腹泻,每天10至15次;
脱水、心跳加快、体温升高、食欲不振、严重的腹部绞痛和疼痛、粪便中有脓液或血、体重下降、腹部肿胀、肾功能衰竭等。
传播:
通过粪-口途径在人与人之间转移。感染通常在医院发生。
该菌可以从粪便传播到食物,然后传播到其他物体表面,如果不洗手或者不正确洗手,就容易感染。
治疗:
抗生素(万古霉素,非达霉素)治疗。患有艰难梭菌感染的人容易脱水,可能需要住院治疗。但是,使用抗生素治疗可能会攻击体内有益细菌。
其他治疗感染的方法,包括:
脆弱拟杆菌
bacteroides fragilis
无芽孢,专性厌氧革兰氏阴性杆菌,人类结肠正常菌群的一部分。
BF毒素引起剧烈的炎症和“细胞间附着物的丧失”,从而引起典型的腹痛和腹泻。
某些脆弱类芽孢杆菌菌株无毒,甚至对其宿主生物有益。
疾病症状:
菌血症、阑尾炎、褥疮、化脓性关节炎、脑膜炎、喉咙发炎、上呼吸道感染、皮肤感染、心内膜炎、软组织感染、心包炎
该菌是正常肠道菌群成员,但是如果转移到周围组织中也会引起腹腔内感染。
这些感染包括产后子宫内膜炎,盆腔脓肿,会阴切开后软组织感染,微管卵巢脓肿和盆腔炎。
菌血症定义为血液中细菌的存在。脆弱拟杆菌是血液培养后最常见的厌氧菌。细菌在腹部,软组织和女性生殖道中的存在是最常见的菌血症来源。
该菌不是人体皮肤微生物菌群的一部分。如果这种细菌进入任何组织,则会引起皮肤感染,例如坏疽和坏死。糖尿病患者还容易受到该菌引起的皮肤感染的影响。
该菌还与引起心包炎,心内膜炎,脑膜炎,阑尾炎和咽喉发炎有关。
传播:
如果细菌被转移到任何其他人体组织,则可能导致该组织的疾病;可能由于外伤,割伤,烧伤,异物侵入或由于不当的外科手术做法造成感染。
治疗:
单一药物治疗或组合治疗
易感人群:
患有腹腔内感染的患者,糖尿病患者易感染
预防:
产气荚膜梭状芽胞杆菌
Clostridium perfringens
革兰氏阳性细菌,是嗜温菌,最适生长温度为37℃,产生内生孢子的非运动性菌。
通过无氧呼吸产生能量,使用硝酸盐作为其电子受体。可能导致许多胃肠道疾病,严重程度从轻微的肠毒血症到致命的气性坏疽。
还具有进行糖酵解和糖原代谢所需的所有酶,利用各种糖酵解酶将糖化合物分解为更简单的形式。
可以在人体肠道,污水和土壤中正常发现。
图源:Food Safety News
疾病症状:
食源性疾病(食物中毒)的最常见原因之一。
关于食源性疾病详见:正值夏季,警惕食源性疾病,常见的食物中毒的病原菌介绍
大多数感染了产气荚膜梭菌的人在食用受污染的食物后6-24小时内会出现腹泻和胃痉挛。这种疾病通常突然发作,持续不到24小时。
这种感染通常不会引起发烧或呕吐。
传播:
营养和食品卫生状况较差的地区人群;
糖尿病和动脉粥样硬化等患者;
产气荚膜梭菌感染也与多发性硬化症有关
危险因素:
常见感染来源包括肉类,禽类,肉汁和其他不安全温度下的食物。
爆发往往发生在医院,学校食堂,监狱和疗养院,以及带有餐饮的活动。最常发生在11月和12月。
治疗:
大多数人未经抗生素治疗即可恢复。
如持续腹泻应多喝水,多休息。
对于源自深层伤口的感染, 必须尽可能清洁该区域,并应使用抗生素。
预防:
将食物煮至安全温度;
食物煮熟后应保持在大于60度或低于4度
可以将热食直接放入冰箱,从冰箱拿出来后加热食用。
结核分枝杆菌
Mycobacterium tuberculosis
革兰氏阳性,专性需氧菌,无运动能力,无孢子形成,细胞内生长的细菌。
通常感染单核吞噬细胞。
在感染的潜伏期,结核分枝杆菌利用一系列效应蛋白将宿主免疫系统弄混,并使其生活方式驻留在肉芽肿中,肉芽肿是宿主为应对持续感染而建立的复杂和有组织的免疫细胞结构。肉芽肿中的结核分枝杆菌通常被限制在具有免疫能力的宿主中,但是当宿主免疫力受损时,它可能导致结核病复发。
常见的症状:
低烧、盗汗、疲劳、厌食(食欲不振)、体重下降。肺结核患者通常会产生咳嗽,并伴有低烧发冷,肌痛(疼痛)和出汗。
潜伏期没有症状。
引发疾病:
传播:
吸入飞沫(咳嗽或打喷嚏)
治疗:
抗生素治疗
预防:
肺炎链球菌
Streptococcus pneumoniae
柳叶刀形,革兰氏阳性,兼性厌氧菌,α-溶血性,条件致病菌。
该菌通过胞外酶系统获得大量的碳和氮,胞外酶系统允许多糖和己糖胺的代谢,并对宿主组织造成损害并使其定植。
荚膜多糖的组成和数量在毒力中起主要作用。产生最大量多糖的菌株可能是最强毒的。
图源:Science Photo Library
疾病症状:
从无症状的咽部定植到粘膜疾病(中耳炎,鼻窦炎,肺炎)再到侵袭性疾病(通常在无菌部位的细菌;菌血症,脑膜炎,脓胸,心内膜炎,关节炎)
传播:
通过呼吸道飞沫直接进行人与人接触,上呼吸道携带细菌的人自动接种。
易感人群:
治疗:
抗生素;静脉注射疗法
预防:
无乳链球菌
Streptococcus agalactiae
革兰氏阳性双球菌,不耐酸,不形成孢子,不易动,兼性厌氧的条件致病菌。
通常称为B组链球菌(GBS),是四种Beta-溶血性链球菌之一,可导致血琼脂上细菌菌落周围宽阔清晰区域显示的血细胞完全破裂。
使用葡萄糖作为能源。该细菌能够通过氧化磷酸化合成ATP。
是一种异养菌,能够导入多种碳源。能够将不同的碳源发酵成多种副产物,如乳酸,乙酸盐,乙醇,甲酸盐或乙酰丙酮。
需要许多氨基酸才能生长,因为它不存在任何TCA循环来合成氨基酸。
毒力因子: 多糖胶囊, β溶血素毒素
属于生殖道的正常菌群。5-20%的女性阴道定植。
疾病症状:
尿路感染, 新生儿和幼儿败血症,脑膜炎
患有基础疾病的成年人:肺炎,心内膜炎,皮肤和软组织感染等。
传播:
GBS阴道或直肠定植的母亲所生的婴儿中,有1%至2%的婴儿发生早发感染。
通过孕妇在怀孕或分娩期间的生殖器官和/或肠道,以及来自其他新生儿或妇产医院的医院工作人员。
治疗:
抗生素治疗
易感人群:
预防:
流感嗜血杆菌
Haemophilus influenzae
革兰氏阴性杆菌。有6种囊化血清型(指定为a至f)具有不同的囊化多糖。
该菌在人的鼻子和喉咙中,通常不会造成伤害。但有时会移动到身体的其他部位并引起感染:
肺炎(肺部感染),菌血症,脑膜炎,喉咙肿胀,蜂窝织炎(皮肤感染);
引起儿童耳部感染和成人支气管炎;
较不常见的感染包括心内膜炎和骨髓炎。

图源:ecdc.europa.eu
易感人群:
5岁以下和65岁以上感染风险增加,免疫力低下的(如艾滋病患者,癌症患者)感染风险增加。
传播方式:
咳嗽或打喷嚏;新生儿可以通过吸入羊水或与含有该菌的生殖道分泌物接触而感染。
治疗:
服用抗生素
预防:
婴儿接种Hib疫苗
衣氏放线菌
Actinomyces israelii
直径为1μm的革兰氏阳性杆菌,厌氧细菌,它是肠道正常菌群的一部分,条件致病菌。
浸润性,组织渗透/破裂;可引起慢性化脓性感染,放线菌病。
通过在各种手术(牙科,胃肠道),抽吸或病理性疾病(例如憩室炎)过程中破坏粘膜屏障来建立感染。
感染部位:
口腔,宫颈,面部疾病是最常见形式,有时感染可能发生在胸部(肺放线菌病),腹部,骨盆或身体其他部位。
当细菌进入人体时,它可以在软组织上形成脓肿。随着脓肿随着时间的流逝而扩大,它会穿透皮肤表面,引起皮肤溃疡。这些脓肿或肿块通常会影响头和颈部,并且会引起肌肉痉挛,阻止下巴正常运动。
其他常见症状包括:
发烧,体重减轻,咳嗽,胸痛和窦腔过度引流。症状可能发展缓慢,但是早期治疗是迅速康复的关键。
易感人群:
治疗:
抗生素;如果与宫内节育器有关,则须卸下
预防:
良好的口腔卫生和定期看牙医可能有助于预防某种形式的放线菌病。
嗜肺军团菌
Legionella pneumophila
具有一定铁含量的细胞内多形革兰氏阴性细菌,条件致病菌。
普遍存在于水环境中,例如饮用水系统、温泉、冷却水,可引起人类感染军团菌肺炎。
通过抽吸或直接吸入到达肺部后,会附着在呼吸道粘膜上。

图源:apotheekteirlinck.be
症状:
高烧(可能到40℃或更高),发冷,咳嗽,肌肉酸痛和头痛。
传播:
可以在人类制造的水系统(例如空调)中繁殖。大多数人吸入含有军团菌细菌的微小水滴时会被感染。这可能来自淋浴,水龙头或漩涡浴池中的喷雾,或者来自大型建筑物中通风系统中的水。
如何避免致病菌感染?
尽快恢复免疫力,减少致病菌感染的发生率。
个人应通过煮熟鸡蛋和肉类来避免传染源,饮用巴氏杀菌乳制品,避免感染个人和医院的潜在感染源,避免与粪便、灰尘或农场动物接触,这些是主要的感染源。
不要饮用未经处理的水,例如直接来自湖泊或河流的水。避免在国外饮用自来水。使用瓶装水或滤水器。
不要共用针头、注射器或其他药物注射设备。
有害菌和肠道内的其他共生菌共同构成菌群微生态,也是大部分人群肠道内常见的菌群。
有害菌是相对而言的。正常肠道菌群也包含许多有害菌,但有害菌比例或个别菌属丰度超标可能预示着肠道菌群的健康状况受到破坏。
有害菌过多会影响肠道内环境,如pH值,含氧量以及肠道内毒素等,可能会导致出现一些机会感染和机会致病菌入侵,进而诱发炎症和疾病。
谷禾肠道菌群检测报告中的有害菌包含了原发致病菌和条件致病菌,以及属内主要菌种为致病菌的属。
为便于统计,我们在计算的时候统一按照属层级进行计算比例。
报告中的有害菌包括了以下的菌属:韦荣氏球菌属、葡萄球菌科、变形菌属、弓形菌属、弯曲菌属、螺杆菌属、厌氧螺菌属以及弧菌属等。
具体每个菌相关介绍详见:
全面认识——肺炎克雷伯菌 (Klebsiella pneumoniae)
慢病是每一种病单独构建模型,不一定和有害菌或菌群平衡指标直接有关。
肠道菌群中的有害菌过多,也就是说肠道菌群趋向于失衡,这会给身体带来诸多麻烦。
当肠道内的有害菌增多时,起初可能会有些症状出现,例如:
随着时间的推移,如果没有采取相应的干预措施,有害菌变得过多,则可能会对身体方方面面产生影响:
特殊类型的细菌会产生一种化学物质,肝脏会将其转化为三甲胺- n -氧化物(TMAO)。
TMAO产生的增加会导致血管中胆固醇的积聚,从而可能导致心脏病。
详见:
TMAO产生的增加也与慢性肾脏疾病有关。也会导致肾结石的发展。
与健康对照组相比,终末期肾病患者体内的TMAO浓度可高出20倍。
对终末期肾病患者的类似研究表明,从普雷沃氏菌向拟杆菌转变,产丁酸菌减少。

有害细菌将纤维转化为脂肪酸。身体可能会把它们沉积在肝脏中,如果不及时治疗,可能导致代谢综合征的发展。
肝硬化患者中韦荣球菌属和链球菌增多。
肝细胞癌与肠道大肠杆菌过度生长有关,患者微生物群多样性增加,与产丁酸菌属(如Alistipes)减少有关,而致病性产脂多糖菌(如克雷伯氏菌)增加。
研究表明,肠道菌群在宿主的代谢和疾病状态中起着重要的作用。特别是2型糖尿病,其病因复杂,包括肥胖、慢性低度炎症,受肠道微生物群和微生物代谢产物的调节。
在2型糖尿病患者普遍具有相对高丰度的特定属:
Blautia、Coprococcus、Sporobacter、Abiotrophia、Peptostreptococcus、Parasutterella、Collinsella
2型糖尿病患者肠道菌群详见:
谷禾数据库统计发现,在有害菌属的丰度水平分布上,肥胖人群要高于对照人群。进一步对具体菌属进行分析,发现肺炎克雷伯氏菌的丰度水平肥胖人群更高。
肥胖患者肠道菌群详见:
肠道有许多直接与大脑沟通的神经末梢,称为肠脑轴。肠道炎症和菌群失调与心理健康不良有关。过多的有害肠道细菌会导致:
详见:
不良的肠道细菌会影响你的整体健康。它会增加消化问题的风险,这些症状通常伴有体重减轻和腹痛。比如:
肠道上皮、免疫系统和共生细菌之间的串扰是启动全身炎症反应的关键。有益菌和有害菌的失衡,抗炎和促炎细胞因子之间的失衡,包括白细胞介素(IL)-1β、肿瘤坏死因子、干扰素(IFN)-γ、白细胞介素-6、白细胞介素-12和白细胞介素-17,在参与RA发病机制的炎症过程中起着核心作用。
为了支持肠道菌群成分变化在类风湿性关节炎发病和进展中起重要作用的假说,已经提出了肠道菌群与关节炎相关的几种机制。
这些包括调节宿主免疫系统(触发T细胞分化)、通过作用Toll样受体(TLR)或NOD样受体(NLR)激活抗原呈递细胞(APC)、通过酶促作用促进肽的瓜氨酸化、抗原模拟和增加肠粘膜通透性。关于对APCs TLRs表达的影响,这可能导致Th17/Treg细胞比率失衡,这种局部免疫反应可能导致系统性自身免疫。
有害菌过多会导致肠道通透性和肠道屏障破坏。肠黏膜屏障功能障碍可能导致血清脂多糖 (LPS) 水平升高,从而导致代谢性内毒素血症。早期研究表明,LPS 可促进体内股骨的骨质流失和体外破骨细胞的。
与骨骼疾病相关的肠道菌群变化如下:

编辑
详见:
鉴于具有高度稳定性的平衡肠道微生物群与宿主的免疫系统具有共生相互作用,能够抑制有害菌增长。然而不稳定的状态例如肠道紊乱,慢性疾病,由遗传易感性、化学物质或肠道病原体感染引起的肠道炎症会导致有害菌增加。
其他包括饮食、生活方式、环境等因素也会影响肠道微生物群的分类和功能组成。例如,西方饮食、高糖饮食,饮食结构过于单一,加工食品过多摄入等不健康的饮食方式,睡眠不足,作息不规律,不运动等不良生活习惯,压力过大,服用药物等因素都会导致有害菌增多。
有害菌和肠道内的其他共生菌共同构成菌群微生态,如果有害菌过多,通常我们可以通过服用益生菌或益生元的方式首先增加有益菌的比例,相应的有害菌比例就会降低。
双歧杆菌和乳酸杆菌有助于发酵碳水化合物,同时会产短链脂肪酸,有助于维持良好的消化系统。
乳酸杆菌
乳酸杆菌菌株产生乳糖酶。它有助于分解乳制品中的乳糖,有助于维持肠道的酸度水平,对于吸收关键矿物质至关重要。
双歧杆菌
保护肠壁;维持肠道的酸度;限制产生硝酸盐菌的生长;生产 B 族维生素和维生素 K 等。
益生菌抑制其他菌群的生长:
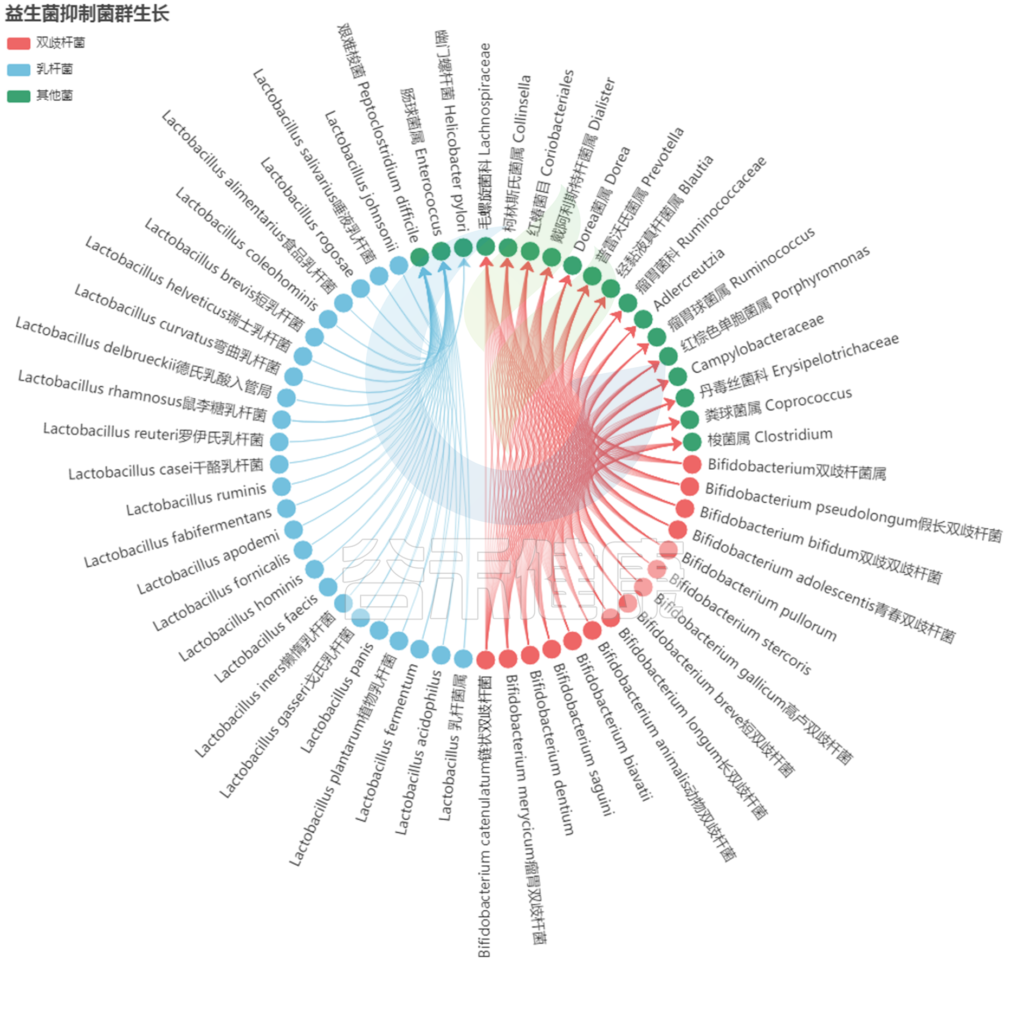
编辑
<来自谷禾健康数据库>
除了直接服用益生菌这种方式之外,有些食物中也富含益生菌,如:
乳制品:酸奶、牛奶、开菲尔等
发酵食品:泡菜、酸菜、味噌汤、豆豉等
益生元是一种可溶于水的可溶性纤维,可以作为益生菌的“食物”。
最广泛认可的益生元包括低聚果糖 (FOS)、菊粉和低聚半乳糖 (GOS) 等。
此外还包括抗性淀粉、果胶寡糖 (POS)、多酚等。
含益生元的食物包括:菊芋、青香蕉或青香蕉粉、大麦和燕麦、魔芋根、菊苣根、牛蒡根、亚麻籽、海藻、苹果、土豆等。
关于益生菌,益生元的补充详见:
想要持久的改善菌群结构降低有害菌水平就需要改善生活方式,适当增加抗性淀粉等膳食纤维并规律饮食和睡眠,增加运动等。
下面介绍一些日常生活中可以自行调整的饮食及生活方式。
尝试食用多种食物,避免每天食物一样
饮食多样性更有利于菌群维持健康平衡。体内的微生物群就好比一群挑剔的孩子,每个孩子都会去吃自己喜欢的食物。当你吃下各种食物时,就相当于喂食了各种微生物。
如果可以的话,一个星期的饮食中可以摄入 40 种及以上不同类型的天然食物,尽可能地提高肠道多样性。
减少西方饮食
西方饮食(其特点是大量摄入脂肪、蛋白质、糖、盐和加工食品),可能增加有害菌,与伴随的导致自身免疫疾病发展的微生物变化之间的联系越来越明显。
尝试地中海饮食
其他可以参考地中海饮食结构摄入,适量食用纤维,多吃各种颜色的水果和蔬菜。将红肉的摄入限制在每月两三次,可以将其视为一种“奢侈品”,每周食用两到三次家禽。它的饱和脂肪和胆固醇比红肉少得多,选择健康的脂肪,每周可以食用两次三文鱼等,做菜选择橄榄油,适量食用坚果(杏仁、巴西坚果、榛子、松子、开心果和核桃都是非常健康的坚果类型),它们是单不饱和脂肪的重要来源。
尝试抗炎饮食
很多种食物均具有抗炎特性,其中包括抗氧化剂和多酚含量高的食物。肠道抗炎饮食推荐的食物包括:浆果类,西兰花,牛油果,辣椒,姜黄,洋葱,大蒜等。
详见:
避免膳食纤维过多或过少
膳食纤维细菌发酵的产物(短链脂肪酸、乙醇和乳酸)过多会破坏细菌。纤维也会让人“上瘾”,其发展方式:随着发酵破坏细菌,需要越来越多的纤维来形成粪便。
但是膳食纤维摄入不足或突然停止所有纤维摄入,也会发生菌群失衡,导致便秘或其他肠道问题,从而导致有害菌增加。
减少摄入加工和包装食品
食用的加工食品越多,饮食越无菌,加工食品会减少我们体内有益细菌的数量,相应的有害菌会逐渐增多,破坏肠道菌群原有的平衡。
具体来说,防腐剂,比如聚山梨酯80和羧甲基纤维素(CMPF),它们是许多加工食品中常见的乳化剂,直接改变了肠道微生物群的组成。
食品添加剂对菌群的影响详见:
你的焦虑可能与食品添加剂有关,警惕食品添加剂引起的微生物群变化
尽量避免含糖饮食
对于我们大多数人来说,糖在我们的饮食中太普遍了。
在现代饮食中,糖无处不在,而且形式多种多样。我们大多数人现在都知道,过度消费“游离糖”的精制糖并不健康。糖也是造成菌群失调的主要因素。然而在忙碌的现代生活中,很难不过度摄入糖分。
高糖食物的常见罪魁祸首包括碳酸饮料、能量饮料、糖果、饼干、甜点、蛋糕、果汁和谷物等,它们都会导致菌群失调。
还有一些食物,含有的糖分更加隐蔽。这些包括:即食食品、腌泡汁、酸辣酱和泡菜、一些酒精饮料、调味酱、白面包、白米饭和土豆。
糖对菌群的影响详见:
吃八分饱
少吃多餐,每三到四个小时吃一顿小餐或吃零食,以补充精力。
间歇性禁食
间歇性禁食是一种越来越流行的健康实践,研究发现间歇性禁食导致肠道菌群结构改变,进食时机和频率可以一定程度上改善生活方式和心血管代谢,防止2型糖尿病和心血管疾病的发生。
关于间歇性禁食详见:
维生素维持肠道菌群稳态和减少肠道炎症以预防癌症的机制;肠道菌群帮助吸收营养,并参与维生素代谢。几项观察表明,微生物群失调和维生素缺乏是相互关联的。
例如:
补充维生素 C 可减少肠杆菌科细菌的数量,增加乳酸杆菌的丰度,抑制有害菌的生长,促进有益菌的增加。
维生素 D 的缺乏会增加拟杆菌门、变形杆菌门和螺杆菌科的丰度。
维生素E对变形菌有抑制作用,而维生素E(和纤维)的摄入量较低与Sutterella水平较高相关。


详见维生素的文章:
当肠道渗漏也就是屏障受损时,大量的有害菌及微生物代谢毒素、食物中的有毒物质逃离肠道,涌入血液循环,这可能会产生炎症并导致组织损伤,器官从感染到炎症再到功能缺失,甚至是到癌症。
关于什么情况会导致肠漏,肠漏带来的危害详见:
即使是很小的压力也会触发体内激素和化合物的释放。压力会慢慢积累,如果你是一个压力大的人,经常烦躁,愤怒,那么会对微生物群产生负面影响,扰乱 HPA 轴。不过这是双向的,肠道中的某些细菌菌株也会影响体内神经递质的方式。
适当给自己减压,可以帮助菌群恢复平衡。减压的方式包括:
农村环境和微生物群与过敏患病率的降低有关。通过暴露于农村室内灰尘来调节肠道微生物群可以改善过敏预防。
城市儿童和小鼠暴露在城市灰尘提取物中,肠道菌群向拟杆菌类的变化是明显的。相比之下,农村儿童和接触农村粉尘提取物的小鼠肠道菌群分别富含普雷沃氏菌属和梭状芽孢杆菌属。
环境对菌群的文章详见:
环境污染物通过肠脑轴影响心理健康,精神益生菌或将发挥重要作用
睡眠质量与肠道菌群组成之间存在双向关系。

编辑
拟杆菌门和厚壁菌门的丰度与睡眠质量呈正相关,而毛螺菌科(Lachnospiraceae)、棒状杆菌(Corynebacterium)、Blautia等几种菌与睡眠质量测量值呈负相关。
睡眠不足或者其他因素如受伤、食物摄入、压力、昼夜节律和运动等,可致肠屏障损伤和细菌移位,增加感染易感性,激活HPA轴从而影响菌群。
详见睡眠对肠道菌群的影响的文章:
抗生素
正常情况下,强大的免疫系统会追捕并消灭病原体,但在系统较弱的情况下,人体的免疫防御系统无法控制病原菌的生长。
服用抗生素会杀死体内的许多好细菌和坏细菌。在瑞典的一项临床试验中,研究人员发现,在服用抗生素仅一周后,一些参与者在一整年后就破坏了微生物组。
抗生素使用对肠道菌群变化的不同影响

Yang L, et al., AMB Express. 2021
我们之前写过抗生素对菌群的影响文章,详见:
其他包括非甾体抗炎药、质子泵抑制剂 (PPI)等也会影响肠道菌群的组成。
限制饮酒量
酒精诱导的胃肠道菌群组成和代谢功能的变化可能有助于建立酒精诱导的氧化应激、肠道对菌群产物的高通透性和随后发展的酒精性肝病和其他疾病之间建立明确联系。如果体内酒精过多,肝酶可能没有足够的能力对其进行处理。过量的酒精会在身体的其余部分循环,产生负面影响。
坚持适量运动
运动锻炼与肠道微生物群组成之间可能存在密切关联。经常中等强度的耐力运动对肠道微生物产生最有益的影响,促进健康和抗炎细菌增加;长期运动的人菌群多样性更高。
运动改善菌群多样性,增加菌群种类,有益于提高菌群稳定性,降低有害菌的相对比例。
运动对菌群的影响详见:
肠道微生物组如何影响运动能力,所谓的“精英肠道微生物组”真的存在吗?
在我们的检测实践中,以上的这些干预调节方式可以有效的定向改善特定有害菌和致病菌的超标,并最终带来整体健康状况的改善。
主要参考文献:
Janik E, Ceremuga M, Niemcewicz M, Bijak M. Dangerous Pathogens as a Potential Problem for Public Health. Medicina (Kaunas). 2020 Nov 6;56(11):591. doi: 10.3390/medicina56110591. PMID: 33172013; PMCID: PMC7694656.
Sheppard SK. Strain wars and the evolution of opportunistic pathogens. Curr Opin Microbiol. 2022 Jun;67:102138. doi: 10.1016/j.mib.2022.01.009. Epub 2022 Feb 12. PMID: 35168173.
Balloux F, van Dorp L. Q&A: What are pathogens, and what have they done to and for us? BMC Biol. 2017 Oct 19;15(1):91. doi: 10.1186/s12915-017-0433-z. PMID: 29052511; PMCID: PMC5648414.
Kinnula H, Mappes J, Sundberg LR. Coinfection outcome in an opportunistic pathogen depends on the inter-strain interactions. BMC Evol Biol. 2017 Mar 14;17(1):77. doi: 10.1186/s12862-017-0922-2. PMID: 28288561; PMCID: PMC5348763.
Engen PA, Green SJ, Voigt RM, Forsyth CB, Keshavarzian A. The Gastrointestinal Microbiome: Alcohol Effects on the Composition of Intestinal Microbiota. Alcohol Res. 2015;37(2):223-36. PMID: 26695747; PMCID: PMC4590619.
Kouzu K, Tsujimoto H, Kishi Y, Ueno H, Shinomiya N. Bacterial Translocation in Gastrointestinal Cancers and Cancer Treatment. Biomedicines. 2022 Feb 4;10(2):380. doi: 10.3390/biomedicines10020380. PMID: 35203589; PMCID: PMC8962358.
谷禾健康
Phascolarctobacterium,考拉杆菌属,专性厌氧和革兰氏阴性细菌,可产生短链脂肪酸,包括乙酸盐和丙酸盐,并可能与宿主的代谢状态和情绪有关,在人体胃肠道大量定植。
每个人都有可能具有与其他人不同的个体特异性微生物遗传成分,并且可能从童年到成年持续存在。Phascolarctobacterium属物种在较长的时间内显示出相对较高的个体内稳定性。一项调查中国南方1-80 岁健康个体研究发现,随着年龄的增长(1至60岁),该菌数量逐渐增加,维持在高水平,但随着年龄继续增加,老年人(> 60岁)的其数量反而减少)。
来自梅奥临床医学中心的研究人员研究发现比较容易减肥的人体肠道内考拉杆菌属水平较高。该菌除了减肥同时也是肠道菌群动态平衡的关键调节因素。
Phascolarctobacterium 多形棒状杆菌,0.5 × 2.0 µm 至 0.5 × 5 –20 µm。在琥珀酸的存在下,小棒会变成带有多个分支的细长和碎片状的棒。革兰氏染色阴性、不运动、不形成孢子的化学有机营养物。丙酸是琥珀酸发酵的主要终产物。富马酸盐抑制其生长。在 30–37°C 时生长最快。
系统发育上属于韦荣菌科,厚壁菌门。到目前为止, Succiniclasticum ruminis是最近的系统发育邻居。
DNA G + C 含量(mol %):41.4–42.3 ( Tm )
主要存在于人体肠道内,我们根据谷禾数据库认为其是基石核心菌。
目前报告的3个物种如下:
Phascolarctobacterium faecium
Phascolarctobacterium succinatutens
Phascolarctobacterium wakonense
其中,Phascolarctobacterium faecium (P. faecium)最早是从以有毒桉树叶为食的动物考拉中分离出来的,它可能与肠道菌群的解毒有关。因此,P. faecium可能在人体胃肠道中发挥有益作用。该菌种是一种专性厌氧和革兰氏阴性细菌,不形成孢子、不运动、分解酶,属于厚壁菌门。
它在普通琼脂上生长不良,但在培养基中添加琥珀酸盐可促进其生长。表明其利用生长需要琥珀酸。
虽然在人类胃肠道的样本中经常检测到与P. faecium密切相关的未培养菌落,但文献中尚未描述从人类胃肠道中分离出Phascolarctobacterium和扩大培养物,从而限制了Phascolarctobacterium faecium相关的功能研究和临床应用。
Phascolarctobacterium wakonense从普通狨猴 (Callithrixjacchus) 粪便中分离出,他们不仅利用了琥珀酸,还利用了丙酮酸。补充丙酮酸后,他们同时产生丙酸和乙酸,而琥珀酸仅产生丙酸。
肠道菌群的遗传特异性可用来做宿主的“微生物指纹”。
研究发现人体肠道菌群的遗传特征比其相对丰度更具有个体特异性。其中Phascolarctobacterium succinatutens 的鉴别准确率达到了88%。
饮食模式
一项调查中国南方1-80 岁健康个体研究发现,随着年龄的增长(1至60岁),该菌数量逐渐增加,维持在高水平,但随着年龄继续增加,老年人(> 60岁)的其数量反而减少。作者指出这种现象可能与饮食习惯有关。
考拉杆菌属专注于利用其他细菌产生的琥珀酸盐,同时,琥珀酸的主要生产者拟杆菌属和副拟杆菌属的丰度因高脂饮食而增加,并且与体重呈正相关。
老年人和1岁以下个体消耗的脂肪相对较少,体重相对较低,这可能导致拟杆菌属和副拟杆菌属减少,可用于考拉杆菌属的琥珀酸盐减少。
已发现体重和脂肪量与Phascolarctobacterium丰度呈负相关,因此可以帮助预测肥胖风险。
与年轻人相比,老年人群的体育锻炼较少,这可能是Phascolarctobacterium减少的另一个原因。
高脂饮食组富含拟杆菌属和Phascolarctobacterium,在人体肠道微生物群中,拟杆菌属产生乙酸和琥珀酸作为主要代谢产物。琥珀酸在肠道中的过量积累会导致腹泻,而利用琥珀酸的细菌的存在可能对人类有益。因此,Phascolarctobacterium可能和拟杆菌,尤其Bacteroides thetaiotaomicron(常栖息在人类肠道中,能够消化多糖)等菌存在共生。
此外,除了Phascolarctobacterium,研究发现高脂肪饮食更有可能导致大量产生丙酸和乙酸的细菌物种,如奇异变形杆菌(Proteus mirabilis)和韦荣氏球菌 (Veillonellaceae)。
含淀粉类食物、谷物和奶制品,与较高的Phascolarctobacterium 相对丰度。
一些小样本证据显示:
菊粉、岩藻多糖、中等剂量木糖醇可以增加Phascolarctobacterium 的丰度,但是低聚果糖的补充会降低Phascolarctobacterium。
此外,小檗碱和二甲双胍可以显着增加这种菌,这反过来可能有助于这两种药物对宿主的有益作用。
与其他菌互作
人体肠道中存在多种微生物,其中一些被认为是相互作用的。大多数这些相互作用涉及细菌代谢物。考拉杆菌属Phascolarctobacterium几乎不用碳水化合物进行生长,而是使用琥珀酸盐作为底物。研究发现Bacteroides thetaiotaomicron产生的琥珀酸支持Phascolarctobacterium菌的生长和伴随的通过琥珀酸途径产生丙酸。
丙酸生产的三种不同生化途径包括琥珀酸、丙烯酸酯和丙二醇途径。拟杆菌属拥有琥珀酸途径,该途径也存在于Phascolarctobacterium。然而,由于缺乏延胡索酸还原酶,推测P. faecium JCM 30894 无法产生琥珀酸,这是琥珀酸途径的关键代谢物。因此,与产生琥珀酸的细菌(如拟杆菌属)共存对于考拉杆菌属是必不可少的。
此外,从琥珀酸到丙酸的转化反应之一涉及甲基丙二酰辅酶 A 变位酶,它需要维生素 B12 。Bacteroides thetaiotaomicron 一些菌株缺乏维生素 B族 所需的上游基因12生物合成。
此外,发现Phascolarctobacterium与颤螺菌属一般呈正相关。
在一项对 314 名中国健康青年样本的队列研究中,9 个核心属中的 8 个,包括Blautia、Clostridium、Ruminococcus、Faecalibacterium、Subdoligranulum、Roseburia、Coprococcus、Bacteroides,彼此之间呈显著正相关,而核心属Phascolarctobacterium与其他八个核心属呈负相关。综合谷禾数据库和相关研究结果:

环境条件
考拉杆菌属(Phascolarctobacterium),这些细菌与他们的种族/地理和生活方式有关。通过对来自9个省份与自治区、7个民族的20个健康年轻人群的314名居民粪便进行16SrRNA测序,发现厚壁菌门、拟杆菌门、变形杆菌门和放线菌门是4种最主要的细菌门,其中,来自厚壁菌门的考拉杆菌属在人群中丰度占比较高。
人体肠道微生物群是可塑的,与周围环境密切相关。医务人员在日常工作中不断与患者接触,并暴露于医院环境中,这种高风险的接触与暴露使很多病原微生物成为医务人员手部微生物群的一部分而被携带。
万献尧教授团队2021年发表在《Clin Microbiol Infect》上的研究评估了医务人员与非医疗人员肠道微生物组的变化。与非ICU工作人员相比,ICU工作人员肠道内Phascolarctobacterium丰度显著增加。
疾病状态
而与健康人相比,早期肝癌患者中,考拉杆菌属(Phascolarctobacterium)和瘤胃球菌属(Ruminococcus) 明显减少。
在重度抑郁、阿尔茨海默病(AD)、自闭症等疾病中发现Phascolarctobacterium高富集,尽管疾病组内异质性也较高,因此,有必要开展大人群队列和临床验证该菌对于神经类疾病的发生和发展贡献情况。
在参与一项小型研究的复发缓解型多发性硬化症(RRMS) 患者中确定了肉类消费与其如何影响肠道细菌、免疫细胞谱和新陈代谢之间的关系。发现许多与多发性硬化症和多发性硬化症患者残疾严重程度与肠道4种细菌产气柯林氏菌、Coprococcus come、Phascolarctobacterium succinatutens、Sutterella wadsworthensis呈正相关。
Phascolarctobacterium属的减少与结肠炎症的存在有关。
阻止艰难梭菌定植
宿主免疫在肠道微生物群介导的对艰难梭菌感染 (CDI) 的定植抗性中发挥重要作用。研究发现人类微生物群相关小鼠中的 IL-22 信号传导调节宿主糖基化,这使得消耗琥珀酸的细菌Phascolarctobacterium 能够生长。在肠道微生物群中,Phascolarctobacterium降低了琥珀酸的可用性,这是艰难梭菌生长的关键代谢物,因此阻止了艰难梭菌的生长。
Phascolarctobacterium有助于肺癌的免疫治疗
免疫检查点阻断(ICB),特别是PD1/PDL1轴的阻断,为非小细胞肺癌(NSCLC)的治疗开辟了新的标准。然而,尽管临床护理取得了重大进展,但许多患者仍然对这些疗法无效。PD-L1 表达和肿瘤突变负荷等生物标志物与 ICB 疗效相关。Phascolarctobacterium在具有临床益处的患者中富集,并与延长的无进展生存期相关,而Dialister在进展性疾病患者中的代表性更高,其较高的相对丰度与无进展生存期和总生存期降低相关,具有独立的预后价值多变量分析。
有助于减肥
研究发现,比较容易减肥的人体肠道内考拉杆菌属(Phascolarctobacterium)水平较高,因此该菌也用来预测肥胖指标。而难以减肥的人体内则小类杆菌属(Dialister)水平较高。此外,在代谢综合征女性中观察到的Phascolarctobacterium属的丰度高于代谢综合征男性。
无论健康的核心细菌是如何定义的,以及群体研究中的鉴定结果有多么不同,可以肯定的是,普遍和优势的核心细菌对于宿主肠道稳态和健康至关重要。因此,重要的是发现一个全面的核心微生物群概况,以定义健康的肠道微生物群并指导它们对宿主健康的干预。
考拉杆菌属作为我们东方人肠道的核心菌属 ,其丰度高低对于维持健康和情绪等非常重要,后续期待更多关于该菌的深入研究信息。
主要参考文献:
Wu F, Guo X, Zhang J, Zhang M, Ou Z, Peng Y. Phascolarctobacterium faecium abundant colonization in human gastrointestinal tract. Exp Ther Med. 2017;14(4):3122-3126. doi:10.3892/etm.2017.4878
Watanabe Y, Nagai F, Morotomi M. Characterization of Phascolarctobacterium succinatutens sp. nov., an asaccharolytic, succinate-utilizing bacterium isolated from human feces. Appl Environ Microbiol. 2012 Jan;78(2):511-8. doi: 10.1128/AEM.06035-11. Epub 2011 Nov 11. PMID: 22081579; PMCID: PMC3255759.
Ogata Y, Suda W, Ikeyama N, Hattori M, Ohkuma M, Sakamoto M. Complete Genome Sequence of Phascolarctobacterium faecium JCM 30894, a Succinate-Utilizing Bacterium Isolated from Human Feces. Microbiol Resour Announc. 2019;8(3):e01487-18. Published 2019 Jan 17. doi:10.1128/MRA.01487-18
Bhandarkar NS, Mouatt P, Majzoub ME, Thomas T, Brown L, Panchal SK. Coffee Pulp, a By-Product of Coffee Production, Modulates Gut Microbiota and Improves Metabolic Syndrome in High-Carbohydrate, High-Fat Diet-Fed Rats. Pathogens. 2021 Oct 22;10(11):1369. doi: 10.3390/pathogens10111369. PMID: 34832525; PMCID: PMC8624503.
Zheng YH, Xu Y, Ma HX, Liang CJ, Yang T. Effect of High-Fat Diet on the Intestinal Flora in Letrozole-Induced Polycystic Ovary Syndrome Rats. Evid Based Complement Alternat Med. 2021 Jun 25;2021:6674965. doi: 10.1155/2021/6674965. PMID: 34257691; PMCID: PMC8257354.

谷禾健康
疾病表现、进展和治疗反应的可变性一直是医学的核心挑战。尽管宿主因素和遗传学的变异性很重要,但很明显,在迈向个性化治疗的过程中,必须考虑肠道微生物组具有巨大的遗传和代谢多样性。
疾病表现、治疗反应和治疗不良反应的个体差异是有效管理疾病和患者安全的主要挑战。这种认知是精准医学的基础,其最简单的形式可以这么说,用个性化方法为合适的患者确定合适的治疗方法,无需反复试验。
将肠道微生物组与人类遗传学区分开来的一个方面是它代表了我们健康的动态组成部分,通过复杂的网络不断与宿主和环境因素相互作用。虽然存在潜在挑战,肠道微生物组的可塑性也提供了一个独特的机会,使其成为精准医学的一个有吸引力的目标。
本文支持使用肠道微生物组作为精准医学工具的当前证据,并建议未来需要将微生物组作为个体化治疗或干预工具的工作。
该研究团队选择了六个广泛的疾病组,这些组具有相对较强的证据表明肠道微生物组的作用。 尽管每个疾病组都有不错的发展,但在考虑临床影响时,不同疾病组的前景和成熟度各不相同(下图)。
抗生素诱导的肠道微生物组破坏会促进机会性和医院感染的机制。最常见的院内腹泻感染艰难梭菌为例,强调可能解释临床结果的个体差异的微生物组和病原体特异性特征。
复发性艰难梭菌感染 (CDI) 一直是微生物组研究的中心焦点。CDI 出现最常见的原因是使用抗生素,但矛盾的是,CDI 的一线治疗也包括抗生素。
抗生素对一般人相当有效,但为什么部分患者出现治疗失败,或是成功治疗后复发?
这可能与宿主特征(例如高龄)或药物的使用(例如质子泵抑制剂)有关, 以及肠道微生物组中特定病原体的特征有关。
除了宿主因素外,肠道微生物群的破坏也是 CDI 的关键因素。
· 与健康对照个体相比,CDI患者的肠球菌、韦永氏菌、乳杆菌、γ-变形菌属的相对丰度较高,而拟杆菌属、毛螺菌科、瘤胃球菌科的含量较低。