-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
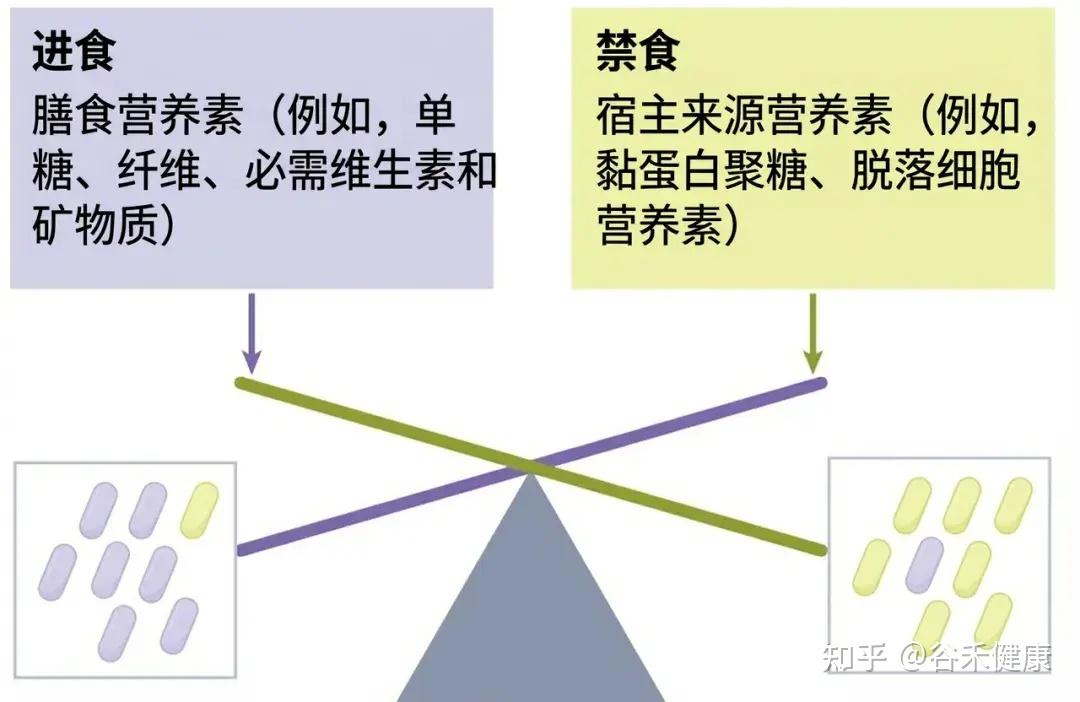
在当代营养流行病学的视野中,我们长期致力于寻找一种最佳饮食模式。无论是地中海饮食、生酮饮食还是植物基饮食,焦点往往集中在吃什么。然而,这种静态的视角忽略了人类饮食行为中最显著的一个特征:时间上的波动性。
举个例子,工作日与周末的割裂,很多人在周一至周五严格控制热量,吃高纤维的健康沙拉;而一旦到了周五晚上或周末,各种吃大餐,高脂、高糖食物轮流上,或者饮食时间变得极不规律。

如果我们将时间跨度拉长,计算其营养摄入的平均值,这些人的数据可能依然显示为健康。这就带来了一个问题:
如果平均营养摄入达标,为什么代谢紊乱和肠道微生态失调的问题依然普遍存在?
近期《Nature》几个子刊的研究,揭示了被长期忽视的真相:
饮食的规律性与营养供给的精准度,可能比单一的追求饮食质量,更能影响肠道微生态的健康。

Singh 等人发表的最新研究(Nat Commun, 2025),通过分析“Food & You”数字队列中近1000名参与者长达两周的高分辨率饮食记录与微生物组数据,饮食质量的时间波动性是破坏肠道菌群多样性的独立风险因素。
Estrela等人的研究(Nat Micro, 2025)深入微观层面,告诉我们肠道菌群挨饿的时候到底会发生什么。
随机休眠-唤醒,可能会让细菌本应用于繁殖的能量储备耗尽,共生菌因无法快速复苏而被淘汰。细菌一旦应激,可能啃食肠壁,使屏障功能变薄;若饥荒持续,则启动终极生存策略——同类相食。这种层层升级的生存博弈,最终将肠道生态系统推向从共生到对抗的危险边缘。
那么,如何才能让肠道菌群真正吃饱吃好,避免生存博弈演变成对宿主的反噬?
膳食纤维与脂肪、蛋白质之间又存在怎样的微妙平衡,才能既满足人体需求又不伤害有益菌?
那些看似不起眼的微量元素,又是如何在这场微观战争中决定菌群的站队?
…
本文将综合这些前沿成果,详细了解菌群喂养的底层逻辑,从关注宏观层面饮食营养的平均达标,转向整合多维度包括时间层面的规律饮食与微观层面的精准喂养。我们将探讨如何通过消除隐性饥饿、维持微量元素平衡以及建立稳定的饮食节律,从而为预防代谢性疾病和构建深层免疫防线提供可落地的精准营养行动指南。
在既往的营养学研究中,我们习惯于通过平均值来评估一个人的饮食质量。例如,如果一个人在一个月内摄入了足够总量的膳食纤维,无论他是每天均匀摄入,还是集中在几天内突击摄入,他在传统的营养评估中得到的得分往往是相似的。
然而,Singh等人的研究通过高分辨率的时间序列分析,彻底打破了这一平均值的说法,揭示了饮食规律性作为独立健康维度的决定性作用。

突破传统的方法论:从回忆问卷到动态观测
该研究依托于“Food & You”数字队列(http://clinicaltrials.gov NCT03848299),这是一个极具前瞻性的研究项目。不同于传统流行病学依赖参与者回忆过去一年饮食习惯的食物频率问卷,这种方法类似一张模糊的静态快照,Singh 等人利用智能手机应用程序辅助的实时追踪技术,记录了近 1000 名参与者在两周内每一餐的详细构成。
这种方法论的革新使得研究者能够计算出一个全新的指标:每日健康饮食指数(Daily HEI)。传统的平均健康饮食指数掩盖了每日的波动,而每日健康饮食指数则像一部动态电影,捕捉了饮食质量在时间轴上的每一次震荡。
研究人员进一步引入了个体内变异系数(Intra-individual Coefficient of Variation, CV),专门用于量化这种震荡的幅度。通过将微生物组测序数据(16S rRNA gene sequencing)与这些高频饮食数据进行关联分析,一个隐藏在平均值背后的规律浮出水面。
每天吃沙拉,健康饮食的人,菌群多样性反而不如饮食普通但规律的人?
数据的统计分析揭示了一个单调且稳健的负相关关系:
饮食质量的变异性越高,肠道微生物群的 α-多样性越低(尤其是 Shannon 指数)。
不同生理和饮食因素与香农多样性之间的相关性
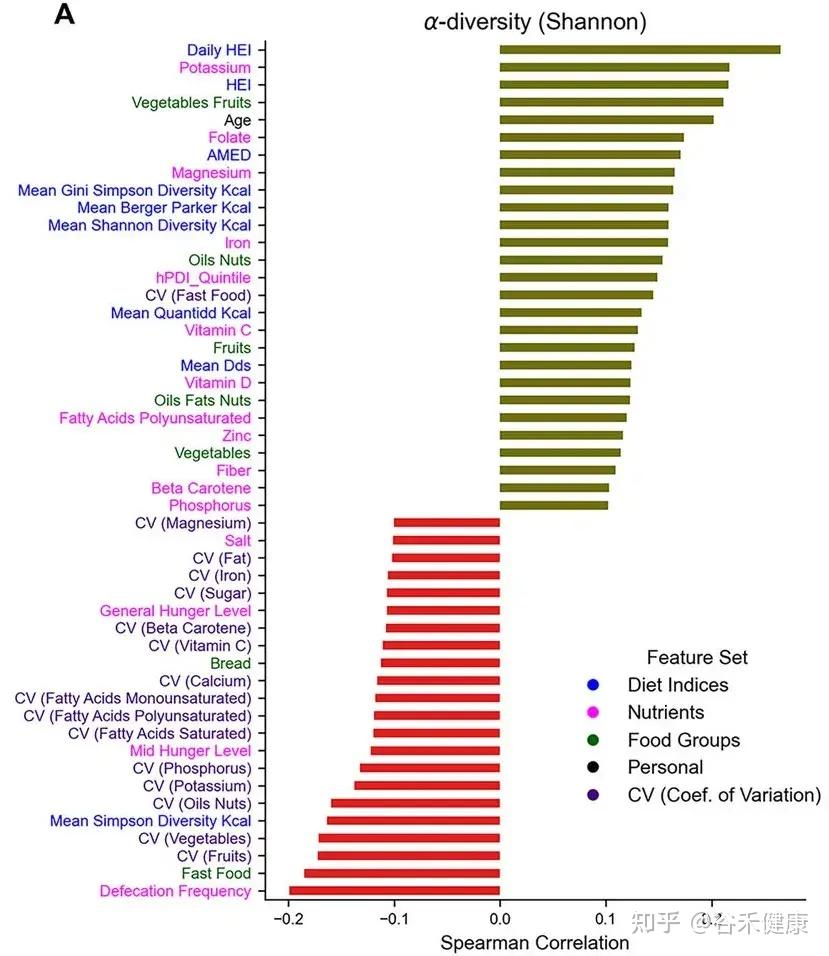
这一发现具有极高的临床意义。Shannon 指数反映了群落中物种的丰富度和均匀度,通常被视为生态系统健康和韧性的标志。
研究数据显示,即使在那些平均饮食质量较高的参与者中,如果他们的饮食习惯呈现出高波动性(例如:周一吃素,周二高脂,周三断食),其微生物多样性依然显著低于那些饮食质量中等但非常规律的个体。
这意味着,肠道微生态系统对于“不确定性”忍耐度有限。 剧烈的饮食波动相当于在肠道内制造了不稳定的生态位,导致只有少数菌能够快速适应环境变化的,能够存活,从而降低了整体生态系统的复杂度和稳定性。
具体菌群的响应
Singh 等人的研究并未止步于宏观的多样性指标,而是深入到了分类学(Taxonomy)层面,明确指出了哪些细菌是饮食规律性的受益者,哪些则是波动的获益者。
规律饮食滋养:毛螺菌科、粪球菌属
数据表明,属于厚壁菌门下的毛螺菌科(Lachnospiraceae),尤其是粪球菌属(Coprococcus),与饮食的规律性呈现最强的正相关。
毛螺菌科,如真杆菌属(Eubacterium)、毛螺菌属(Lachnospira)和丁酸杆菌属(Butyribacter),均是预测高健康饮食指数、蔬菜、水果、坚果及膳食纤维摄入的关键特征菌。
粪球菌属是肠道内重要的产丁酸者。丁酸盐不仅是结肠上皮细胞的主要能量来源,还具有强大的抗炎功能。
研究发现,粪球菌属的丰度对于蔬菜、水果和全谷物摄入的稳定性高度敏感。当这些富含纤维的食物来源在几天内忽高忽低时,粪球菌属的种群数量会迅速崩塌。
这表明这类有益菌需要持续、稳定的底物供应,来维持其在竞争激烈的肠道环境中的生态位。
趁乱反噬:活泼瘤胃球菌
与之形成鲜明对比的是,饮食质量的高变异性与活泼瘤胃球菌(Ruminococcus gnavus)的富集显著相关。
研究还发现,Mediterraneibacter、Lawsonibacter、Dysosmobacter等,与肉类摄入、快餐消费以及蔬菜、水果、坚果摄入的不规律性(高 CV)呈正相关,并与腹泻比例增加显著相关。
活泼瘤胃球菌是一种典型的病原共生菌。在健康肠道中,它可能以低丰度存在,但在炎症性肠病、克罗恩病患者体内,常观察到该菌的过度生长。
该菌具有分解含有唾液酸的宿主黏蛋白的能力。当饮食中的外源性营养(如膳食纤维)波动剧烈导致供应中断时,活泼瘤胃球菌能够迅速切换代谢模式,利用宿主的黏液层作为备用能源。
数据暗示,饮食的不规律性实际上是在为活泼瘤胃球菌、Mediterraneibacter、Lawsonibacter这类具有高度适应性的机会主义者创造竞争优势,从而增加了肠道促炎环境的风险。
蔬果摄入波动大,是菌群失衡的关键推手
研究进一步细化了不同食物类别的波动影响。结果显示,蔬菜、水果、坚果摄入量的变异性,即吃得忽多忽少,对微生物组的影响最为显著。相比之下,精制谷物或乳制品的摄入波动对菌群多样性的冲击较小。
这背后的逻辑在于:蔬菜和水果是膳食纤维的主要来源,对于肠道细菌而言,这些纤维是赖以生存的“口粮”。
如果这些纤维的供应不稳定(高变异性),那些专性依赖纤维发酵的细菌(如前述的毛螺菌科)就会面临周期性的饥饿压力,无法建立稳定的种群;而那些代谢灵活、能吃“杂食”甚至能“吃人”(降解黏液)的细菌则会占据主导地位。
小结:规律性是独立的健康参数
上述研究确立了一个新的营养学范式:规律性本身就是一个独立的、关键的健康参数。
我们不能再单纯地建议人们多吃蔬菜,而应该建议每天稳定地吃蔬菜。因为从微生态的视角来看,三天吃一次大量的沙拉,其生态效益远不如每天吃一小份沙拉。
不规律的饮食习惯,实际上是在肠道内进行着一场持续的、负面的自然选择,逐渐淘汰了那些维护健康的共生菌,而筛选出了潜在的致病菌。
那么,为什么细菌对波动如此敏感?在微观层面上,当营养供应中断的那几个小时或几天里,细菌究竟经历了什么?
下一章节,我们接着来看Estrela等人的一篇文章,有详细的机制解析,深入到细菌的细胞内部,去洞察微观世界的隐形饥荒。
如果说上述研究从宏观层面来告诉我们,饮食波动会导致多样性下降和机会病原菌滋生。但要真正理解这场危机的根源,我们需要深入到细菌的视角,去体验它们在面对“断粮”时的生死抉择。
Estrela等人发表在《Nature Microbiology》的文章为我们揭开了这场微观“饥饿游戏”的规则。

研究表明,细菌并不只是被动地等待死亡,它们演化出了一套极其复杂的策略来应对营养匮乏。对于肠道细菌而言,宿主少吃一顿,或者饮食结构的一次剧烈跳变,就意味着它们必须在毫秒级的时间内启动应急预案。
肠道里的“盛宴与饥荒”循环
尽管现代人往往处于营养过剩的状态,但这并不意味着肠道细菌总能吃饱。相反,细菌生活在一种“盛宴与饥荒”交替的极端环境中。
盛宴期
当宿主进食后,膳食成分进入结肠,营养物质瞬间激增。此时,那些生长速度快、擅长降解复杂膳食多糖的厚壁菌门细菌占据绝对优势。例如,罗氏菌属(Roseburia)、真杆菌属(Eubacterium)和瘤胃球菌属(Ruminococcus),它们在有食物时不仅自身快速增殖,还通过交叉喂养滋养其他菌群。
饥荒期
在宿主睡眠期间、餐间空隙,或者当宿主摄入缺乏纤维的精细饮食时,肠道内的可发酵膳食纤维会迅速耗尽。此时,群落结构发生变化:厚壁菌门的丰度下降,而拟杆菌门、变形菌门以及疣微菌门开始主导局面。
研究人员指出,正是这种不可预测的饥荒期长度,决定了群落的最终结构。不规律的饮食习惯,本质上是在人为地延长或随机化“饥荒期”,迫使细菌长期处于应激状态。
策略一:蛰伏以求生——休眠与生长停滞
面对饥饿,细菌的第一反应往往是节能。
许多细菌会进入一种被称为生长停滞或休眠的状态。它们关闭大部分代谢活动,停止细胞分裂,将原本用于繁殖的能量,转用于维持细胞结构的完整性。
断臂求生:细菌的饥饿应对机制
细菌会通过复杂的分子机制(如 (p)ppGpp 介导的严谨反应)下调核糖体的合成,这是细胞内最耗能的过程,所以立刻叫停这个耗能的事。
对于大肠杆菌和其他变形菌来说,它们会依赖 Sigma因子 RpoS 来重新编程基因表达,将原本用于繁殖的能量转用于维持细胞结构的完整性,甚至不惜降解自身的核糖体,以回收氨基酸和核苷酸作为应急储备。
持久细胞:极度不活跃,却能保生存
文章还提到了一种“两面下注策略”(bet-hedging),即细菌分化出一小部分代谢极度不活跃的持久细胞。它们虽然不生长,但能耐受极端的压力(包括抗生素),确保存活。
内生孢子的形成
某些厚壁菌门的成员,如艰难梭菌或枯草芽孢杆菌,能够形成高度耐受的内生孢子。这就像是把自己锁进一个时间胶囊里,以此度过长达数天甚至数年的饥荒。
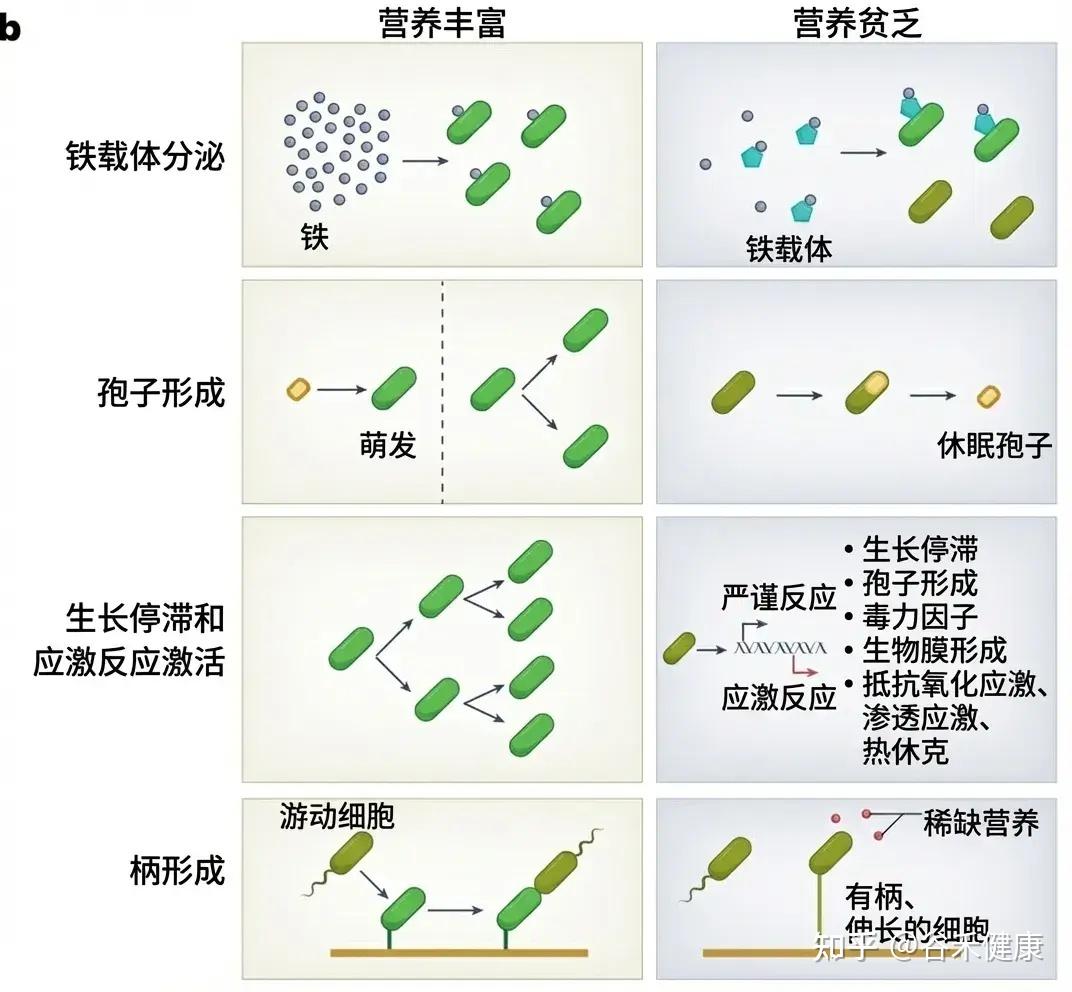
然而,这种策略是有代价的。进入休眠意味着放弃了繁殖的机会。如果饮食波动过于频繁,细菌反复在“唤醒”和“休眠”之间切换,会消耗巨大的能量储备。那些无法快速从休眠中复苏的菌种,就会在下一轮盛宴来临时因为起步太慢而被竞争对手淘汰。这也解释了前面的研究提到的饮食高变异性会导致微生物多样性的丧失——许多脆弱的共生菌因为经不起反复折腾而灭绝了。
策略二:吃宿主——营养毒力与黏液降解
如果说休眠是一种被动的防御,那么另一种策略则显得极具侵略性:当外源性食物(膳食纤维)断供时,去找内源性的替代品——宿主自己。
这就是研究人员强调的“营养毒力”概念。
我们的肠道内壁覆盖着一层厚厚的黏液层,主要由高度糖基化的黏蛋白组成。对于细菌来说,这层黏液不仅是屏障,更是一个巨大的、全天候供应的备用糖库。
黏液降解菌的崛起
正常情况下,像AKK菌(Akkermansia muciniphila)和多形拟杆菌(Bacteroides thetaiotaomicron)这样的细菌,会以受控的方式降解少量陈旧的黏液,这有助于黏液的更新。
但在饥饿状态下,当膳食纤维严重缺乏或供应中断时,多形拟杆菌会通过转录调控,迅速上调分解宿主聚糖的酶系表达。而AKK菌更依赖宿主黏蛋白上的糖链作为能量来源,在别的菌饿得不行的时候还能活得不错,数量甚至上升。
这种代谢切换使它们能够生存下来,但代价是过度啃食保护肠壁的黏液层。
黏液层变薄:病原菌的入侵
更危险的是,这种黏液层的变薄为病原菌打开了缺口。例如,肠出血性大肠杆菌(EHEC)在饥饿状态下会感知这种环境信号,上调其毒力因子的表达,利用这一机会粘附并侵袭肠上皮细胞。
这就是为什么饮食不规律(尤其是纤维摄入的波动)不仅影响菌群结构,更直接威胁肠道屏障功能。你的细菌饿急了,是真的会“吃”你的。
游离糖:病原菌的扩张燃料
此外,拟杆菌在降解黏液时,会释放出岩藻糖、唾液酸等游离糖。在盛宴期,这些糖滋养共生菌;但在饥荒期,它们成了病原菌的“救命粮”。
鼠伤寒沙门氏菌(Salmonella Typhimurium)和艰难梭菌能够利用这些游离的唾液酸和岩藻糖迅速扩增。
策略三:GASP表型——长期饥饿,同类相食
如果饥荒持续的时间足够长(例如极端的节食或长期的饮食紊乱),细菌就不会仅仅满足于生理调节,而是会开启基因层面的进化。
强者通吃:残酷的 GASP 现象
文中提到了一个经典的微生物学现象:
在长期的营养限制下,细菌会发生基因突变,产生“长期静止期生长优势”表型(简称GASP)。
如果将已经饿了10天的大肠杆菌培养物,与仅培养了1天(刚进入静止期)的同种细菌混合,那些饿了10天的老细菌反而会竞争过并取代那些年轻的细菌。
激进策略:弃守为攻与同类相食
老细菌并不是单纯地在等死,而是通过 RpoS 基因突变采取了激进策略。它们主动放弃了原本用于防御(如耐热、耐酸)的盾牌以节省能量,转而全力强化进食能力。这让它们能掠夺环境中仅存的资源,比如说,大肠杆菌被证明能够利用死细胞释放的天冬氨酸、谷氨酸、甘氨酸、丝氨酸、苏氨酸来维持生存,从而在同类相食的竞争中,把那些还在老实防守的同伴彻底淘汰。
生态隐患
虽然这保证了某个物种的延续,但这种突变往往伴随着功能的丧失或毒力的增强。这意味着,经过长期饥饿筛选后的肠道菌群,可能在遗传上已经发生了漂变,肠道菌群变成了一个由一群“生存狂”组成的群落:它们为了活命可能丧失了原有的有益功能,甚至增强了毒力,对宿主不再那么友好。
人类不同的饮食习惯(如长期断食、热量限制、饮食结构改变)对菌群产生的共同影响
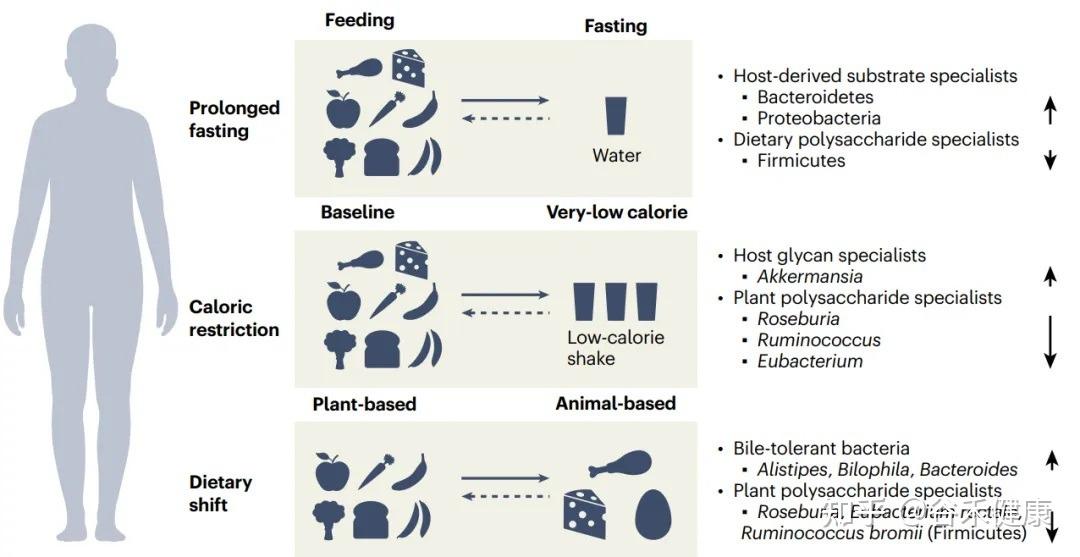
例如,当饮食结构从植物基转向动物基(素食转向肉食)时,会导致耐胆汁细菌的增加,同时那些专门负责分解植物多糖的细菌则会减少。
小结:微观机制的宏观映射
多样性下降是因为许多菌种无法承受反复的“休眠-复苏”能量损耗,或在竞争中落败。
病原菌(如沙门氏菌)的泛滥,是因为它们具备更灵活的代谢切换能力,能在纤维断供时迅速利用宿主黏液糖、琥珀酸等替代营养源。
饮食的规律性,本质上就是为肠道微生物提供一份安全感。消除了对迫近饥荒的恐惧,那些对宿主有益但相对脆弱的专性共生菌才能安心定植,繁衍生息,而不是被迫进入生存模式去啃食宿主的肠壁。
在解决了‘不饿着它们’这一基础问题后,我们需要深入探讨更深层的问题:如何通过特定的饮食成分,将肠道菌群从一个仅仅是活着的群体,引导为一个能为宿主提供健康的共生群落。
一旦细菌脱离了饥饿造成的极端环境,它们的功能重点就会从生存转向代谢。最新的综述研究指出,此时底物的类型(即你吃了什么)将决定菌群的代谢产出。

饮食习惯是肠道微生物群变异的主要决定因素,其影响力远超宿主遗传背景。换句话说,你每天吃进嘴里的食物,才是你肠道微生态的“总设计师”。
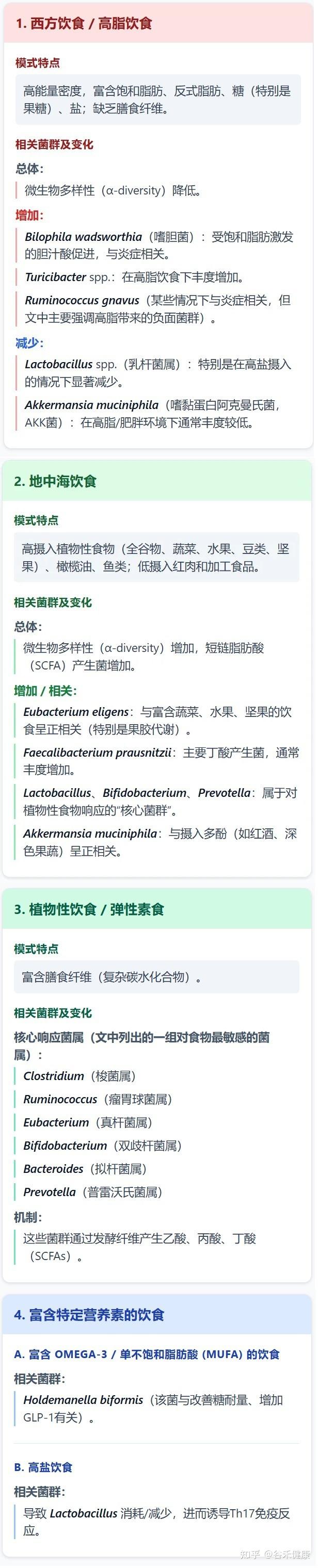
★ 一般性饮食模式
我们先来说一些的日常饮食习惯。
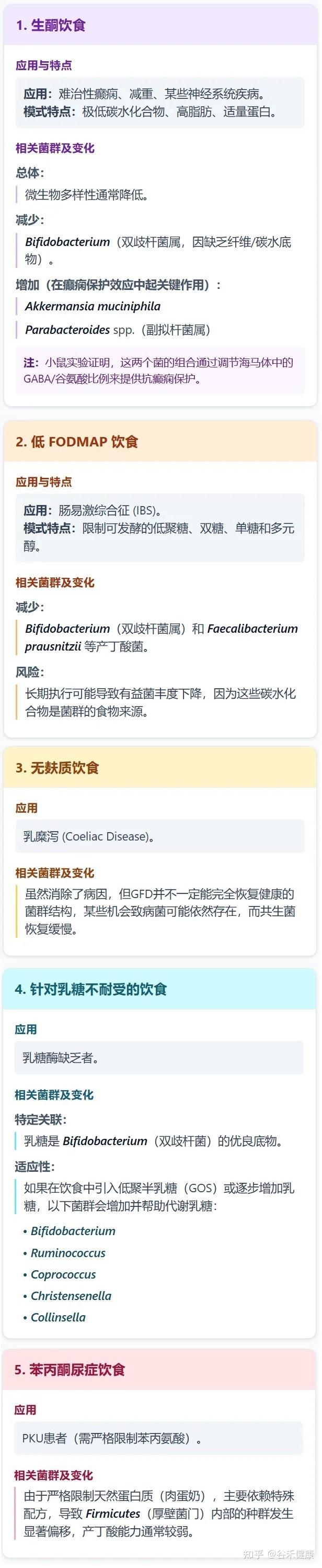
★ 治疗性/医学饮食模式
接下来我们来说一些饮食,通常用于特定疾病的干预。
膳 食 纤 维
在传统的营养学认知中,膳食纤维往往被简化为帮助通便的工具。但在微生物组的视角下,它的定义远不止于此。这是肠道共生菌最主要、甚至是赖以生存的能量来源。
从纤维到短链脂肪酸:点石成金的转化
膳食纤维进入结肠后,并不会像在小肠里那样被简单吸收,未被消化的膳食纤维被细菌发酵后,会产生一系列具有强大生物活性的代谢产物——短链脂肪酸(SCFAs),乙酸、丙酸和丁酸。
膳食纤维代谢产物在维护肠道屏障中的核心作用
-加固屏障,紧密连接
细菌产生的丁酸具有组蛋白去乙酰化酶(HDAC)抑制剂的功能。它能直接作用于肠上皮细胞的基因表达,上调紧密连接蛋白(如 Occludin 和 Claudin)的合成,好比给肠道细胞之间的缝隙抹上了强力胶水,防止细菌内毒素渗入血液。
-筑牢免疫防线(Treg 和 IL-22)
纤维发酵产物能与免疫细胞表面的G蛋白偶联受体(如 GPR43/GPR109A)结合。这种结合会向免疫系统发送和平信号,促进调节性T细胞(Treg)的分化,并刺激IL-22的分泌。IL-22 被称为屏障守护因子,它能加速上皮细胞的修复,并诱导细胞分泌抗菌肽(AMPs),将病原体拒之门外。
-降低环境 pH 值
发酵产生的酸性环境(低 pH)能有效抑制许多对酸敏感的致病菌(如沙门氏菌、大肠杆菌)的生长,这是一种最原始但有效的生态位竞争策略。
吃多少才够?
上一章节我们已经了解到,膳食纤维如果喂不饱菌群,那么菌群就会吃你的粘液层,肠道屏障就会随之薄弱,可能出现肠漏,低度慢性炎症等情况,那么吃多少才够呢?
目前的膳食指南通常建议每日摄入 25-30g 的膳食纤维。然而,Sanz 等人在综述中提出一个观点:这个标准可能仅仅是维持基本功能的底线,而非优化健康的理想值。
研究人员指出,为了达到预防非传染性慢性病(如心血管疾病、代谢综合征)的最佳效果,膳食纤维的摄入量可能需要提高到 35-50g/日。这个数字更接近人类祖先(狩猎采集时期)的摄入水平。
但这里有一个关键的注意事项:
对于肠道已经处于高度敏感或炎症状态(如 IBD 或 IBS 患者)的人群,突然摄入大量粗纤维可能会导致耐受不良。这也引出了精准营养的概念——不同人的菌群对纤维的处理能力是不同的。
因此,策略不是盲目地吃草,而是循序渐进,并注重纤维种类的多样性(可溶性与不可溶性纤维的搭配),以喂养更广泛的共生菌群。

蛋 白 质
在健身房里,蛋白质是增肌的必需品;但在结肠深处,蛋白质的命运却充满了变数。
与膳食纤维的健康益处不同,蛋白质对肠道微生物组的影响是双向的。这取决于两个关键因素:蛋白质的来源,以及你是否同时摄入了足够的碳水化合物。
当有益菌遇到色氨酸:免疫系统的调停者
首先,我们来看看蛋白质天使的一面。
蛋白质由氨基酸组成,比如说,色氨酸(Tryptophan),是连接饮食、微生物和宿主免疫的关键桥梁。
肠道细菌(如乳杆菌属和部分梭菌属)能够将未消化的色氨酸代谢为吲哚(Indole)及其衍生物(如吲哚-3-丙酸 IPA、吲哚-3-乙醛等)。这些吲哚类物质并非废料,而是高级的生化信使,它们可以:
从这个角度看,适量的蛋白质摄入,特别是富含色氨酸的食物,是维持肠道免疫稳态的重要一环。

黑暗面:当发酵转向“腐败”
当膳食纤维摄入不足,或者蛋白质摄入过量导致大量未消化的蛋白质进入结肠(尤其是远端结肠)时,微生物的代谢模式会发生危险的逆转。
在这个过程中,细菌会产生一系列具有细胞毒性的代谢产物:
这种“腐败发酵”主要发生在远端结肠,那里是碳水化合物最先被耗尽的地方,也是结直肠癌的高发部位。这非巧合。
关键在于“碳氮比”:别让细菌只吃肉
那么,我们该如何避免蛋白质的“黑化”?
研究人员认为,碳水化合物(纤维)的存在可以抑制蛋白质的腐败发酵。
这是一种名为分解代谢抑制的生存策略:只要有容易发酵的碳水化合物存在,细菌就会优先利用它们,而此时产生的酸性环境会进一步抑制蛋白水解酶的活性。
因此,问题的核心往往不在于肉吃多了,而在于菜吃少了。
植物蛋白 vs 动物蛋白
相比于红肉(富含血红素铁,可能催化致癌物 N-亚硝基化合物的形成),植物蛋白通常自带膳食纤维。这种自带解药的属性,使得植物蛋白在被细菌分解时,往往伴随着更有益的代谢环境。

肠道菌群与蛋白质代谢14 赞同 · 3 评论 文章

动物蛋白与植物蛋白对肠道微生态的不同“改造”与健康风险”6 赞同 · 2 评论 文章
脂 肪
与纤维(作为食物)不同,脂肪更多是通过改变肠道环境(特别是胆汁酸代谢)来间接筛选微生物。
长期以来,我们对脂肪的恐惧主要集中在变胖和心血管堵塞。但在微观视角下,高脂饮食对健康的打击是从肠道屏障的崩塌开始的。
这其中牵涉到两个核心机制:
胆汁酸的改变 与 内毒素的易位。
高脂饮食的代价:当助消化的胆汁变成致癌毒素
当你吃下一块肥美的五花肉,肝脏会立刻分泌胆汁酸(Bile Acids)来乳化这些油脂,帮助消化吸收。这本是正常的生理过程。
然而,问题在于量。
长期摄入高脂肪饮食,会迫使肝脏源源不断地向肠道泵入大量的初级胆汁酸。当这些胆汁酸流经小肠未被完全回收,进入结肠后,它们就落入了微生物的手中。

肠道细菌(如梭菌属)通过7α-脱羟基作用会将初级胆汁酸进行二次加工,转化为次级胆汁酸,如脱氧胆酸(DCA)和石胆酸(LCA)。
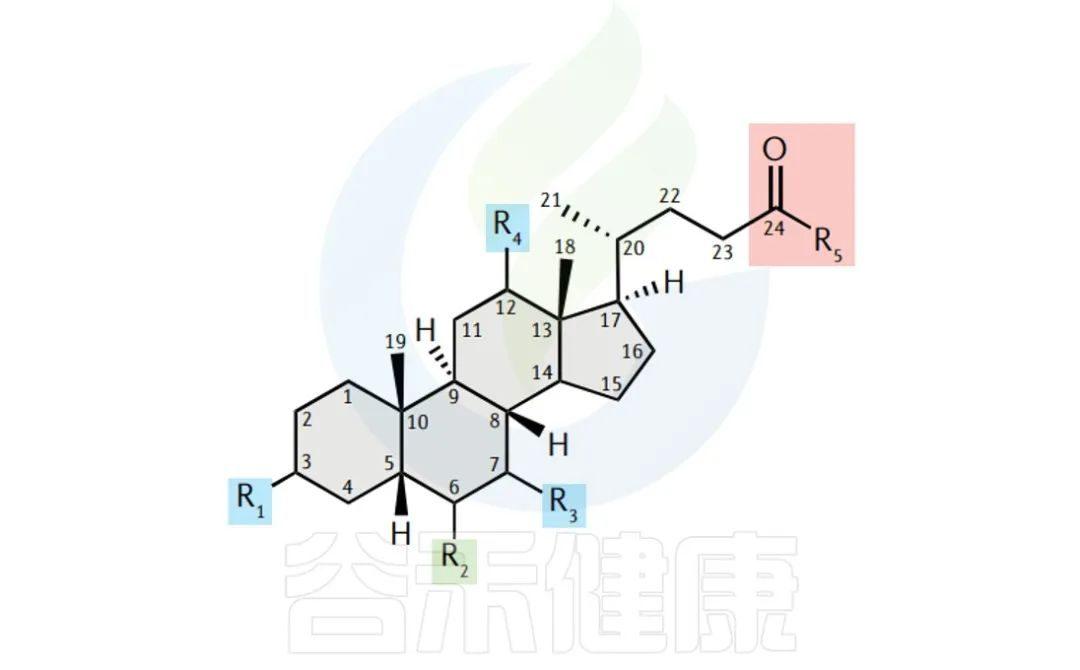
什么是胆汁酸,其与肠道微生物互作如何影响人体健康18 赞同 · 0 评论 文章
次级胆汁酸的蓄积,是一个危险的信号:
当然,次级胆汁酸也有另一面——某些特定的衍生物(如 isoalloLCA)能特异性地抑制艰难梭菌等病原体。
但在典型的高脂“西方饮食”模式下,负面效应往往占据了主导地位。
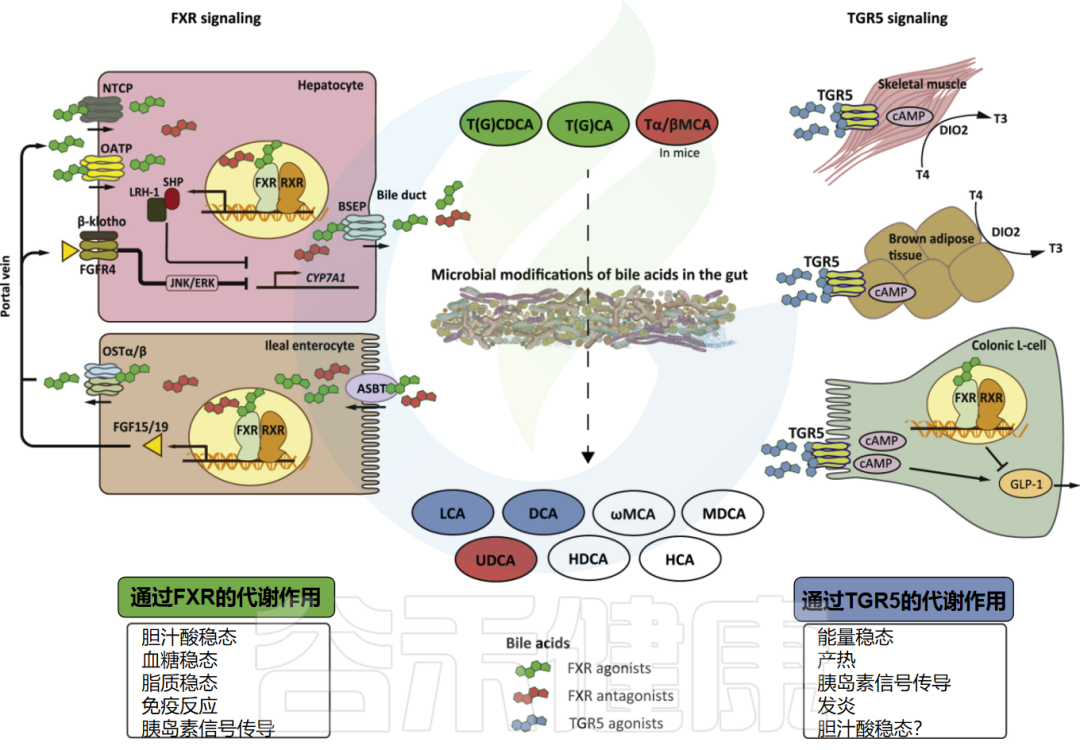
肠道微生物群对胆汁酸代谢和信号传导影响的最新研究成果20 赞同 · 1 评论 文章
脂肪的类型(质量)远比数量重要
研究对比了饱和脂肪酸(如猪油、棕榈油)与多不饱和脂肪酸(PUFAs,如鱼油、亚麻籽油):
-饱和脂肪:代谢性内毒素血症
摄入过多的饱和脂肪,不仅会降低微生物的多样性,更关键的是它充当了细菌毒素的载体。
革兰氏阴性菌的细胞壁成分——脂多糖(LPS,即内毒素),极易溶解在脂肪微粒(乳糜微粒)中。当饱和脂肪穿过肠壁进入血液时,它会顺手把 LPS 也带进去。
这就是著名的代谢性内毒素血症。血液中微量的 LPS 升高,会触发全身性的低度慢性炎症,诱导胰岛素抵抗,成为肥胖和糖尿病的隐形推手。
-Omega-3
相反,富含 Omega-3 的多不饱和脂肪酸,被证明能够增加产丁酸菌丰度,逆转由饱和脂肪引起的菌群失调,并有助于维护肠道屏障的完整性。
探索Omega-3脂肪酸:健康益处与营养补充12 赞同 · 0 评论 文章
维 生 素
我们常以为维生素只是为了身体好,其实肠道里的细菌也是维生素大户。
许多有益菌(如双歧杆菌)虽然能为我们合成维生素K和部分B族维生素,但它们自身往往无法从头合成生长所需的全部维生素(尤其是B族),必须依赖我们的饮食摄入或原本的交叉喂养网络。
B2(核黄素)
当饮食中缺乏维生素B2(核黄素)时,肠道中产丁酸菌(如普拉梭菌)就会因缺乏口粮而减少,而这可能间接给大肠杆菌等潜在有害菌腾出生存空间。
B9(叶酸)与 B12(钴胺素)
乳杆菌和双歧杆菌通常缺乏从头合成叶酸和钴胺素的完整酶系,属于维生素营养缺陷型微生物。必须依赖宿主摄入。如果叶酸摄入不足,这些益生菌的生长就会受限,进而削弱其对肠道微生态的调节功能。
B3(烟酸)
烟酸不仅是细胞能量代谢(NAD+合成)的关键前体,还是结肠上皮及免疫细胞表面 GPR109A 受体的特异性配体。烟酸通过激活该受体发挥抗炎作用,抑制促炎因子的释放。
缺乏烟酸会导致肠道免疫耐受性降低,增加结肠炎易感性,并伴随微生物群落Alpha 多样性的显著下降及微生态结构的崩塌。严重缺乏会导致糙皮病。
B7(生物素)
生物素是细菌羧化酶不可或缺的辅助因子,在菌群的种间竞争中起着关键作用。研究显示,在生物素缺乏的环境下,某些机会性致病菌(如鼠乳杆菌Lactobacillus murinus)会利用代谢优势发生异常增殖,导致严重的菌群失调;而恢复生物素水平则能有效遏制这种过度扩张,通过生态位竞争维持肠道微生态的稳态。

B族维生素与肠道菌群互作52 赞同 · 1 评论 文章
维生素A
维生素 A 的代谢产物(视黄酸)是调节肠道黏膜免疫的关键信号。它能直接促进 B 细胞分化,上调分泌型免疫球蛋白 A (sIgA) 的合成与分泌。sIgA 能够特异性地包裹细菌,在阻止致病菌黏附上皮组织的同时,协助乳杆菌(Lactobacillus) 等共生菌在黏膜表面的稳定定植,防止菌群易位。
维生素D
维生素 D 通过激活肠上皮细胞中的维生素 D 受体 (VDR),上调紧密连接蛋白(如 Occludin 和 Zonulin)的表达,从而维持肠道屏障的物理完整性。
此外,维生素D还能发起主动进攻,它能诱导宿主分泌防御素和组织蛋白酶等抗菌肽。这种选择性压力有助于重塑菌群结构,研究显示其可显著促进Akkermansia muciniphila的生长,并抑制变形菌门等潜在致病菌。
维生素 C & E:调节氧化还原电位
肠道核心菌群(如厚壁菌门和拟杆菌门)多为专性厌氧菌,对氧气极为敏感。维生素 C 和 E 具有显著的抗氧化作用,能够清除肠腔内的活性氧 (ROS),维持肠道较低的氧化还原电位。这种厌氧环境有利于核心有益菌的代谢与生存,同时限制肠杆菌科(多为兼性厌氧菌)等机会性致病菌的过度增殖。
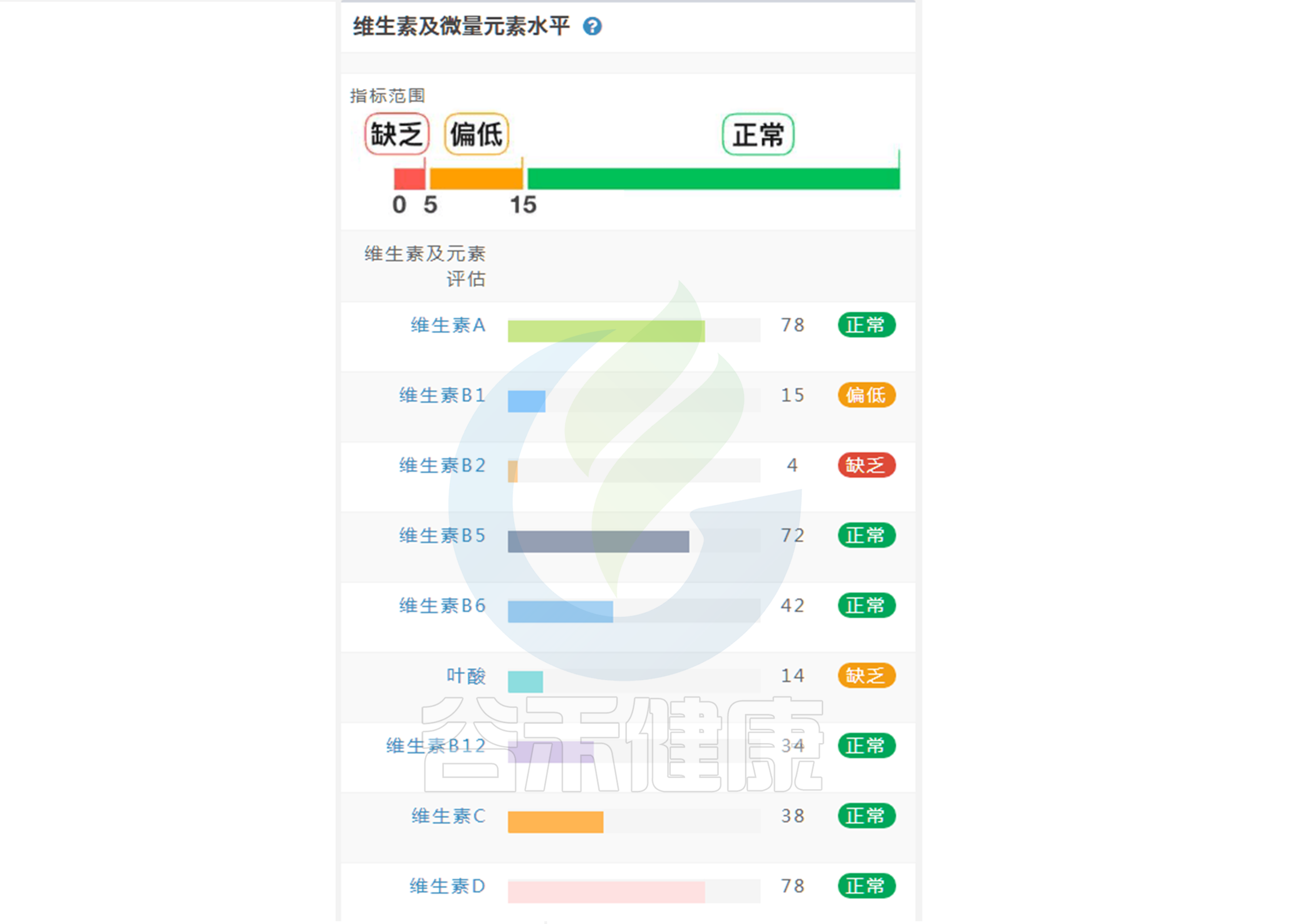
维生素摄入水平肠道菌群可以告诉你14 赞同 · 0 评论 文章
下表列出了常见的维生素的食物来源,可供参考。

矿 物 质
铁
铁是细菌界的稀缺资源。正常情况下,人体会限制肠道内的游离铁(营养免疫),防止细菌疯长。
但问题在于,沙门氏菌和致病性大肠杆菌等肠杆菌科细菌,进化出了极强的“抢铁工具”——铁载体(Siderophores)。相比之下,乳杆菌等有益菌抢夺铁的能力很弱。
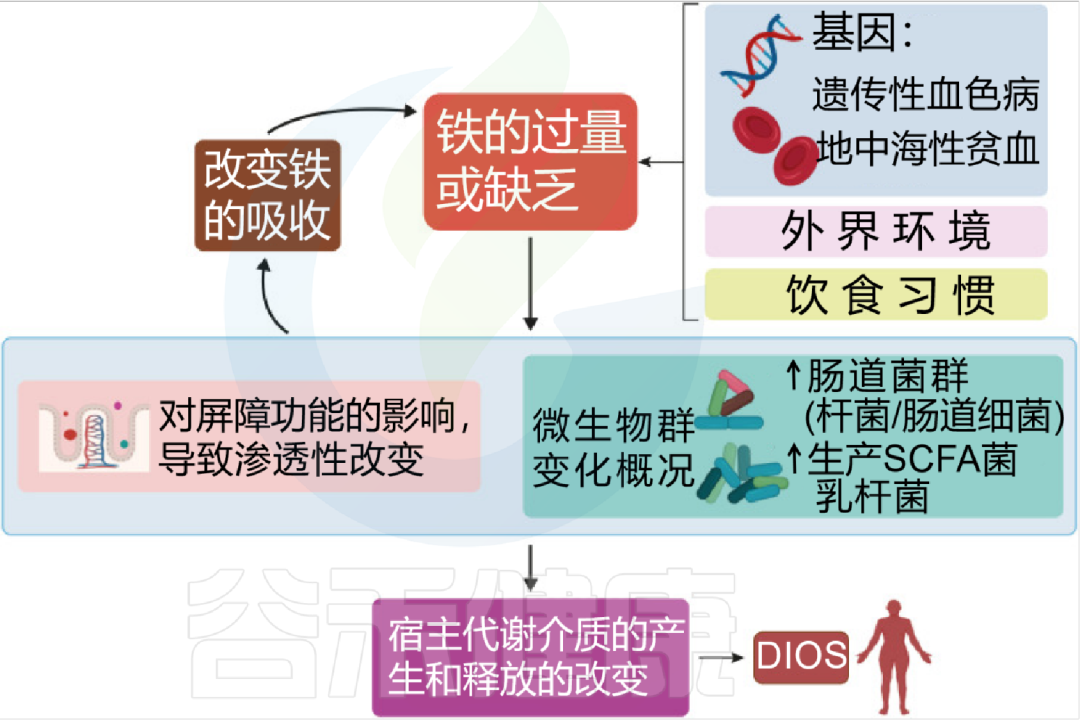
人与菌对铁的竞争吸收 | 塑造并控制肠道潜在病原菌的生长15 赞同 · 0 评论 文章
因此,一旦结肠中出现未被吸收的游离铁(比如吃太多红肉或过量补铁),这些铁就会优先被致病菌抢走,助长它们爆发性繁殖,从而压制有益菌并引发炎症。

锌
锌不仅能加固肠道屏障,更是维持菌群结构稳定的关键。
研究发现,缺锌会直接导致肠道中的主力军——厚壁菌门的数量大幅下降。这种多样性的丧失,意味着肠道的定植抵抗力被削弱了。

膳食锌缺乏或过量对人体肠道菌群及健康的影响11 赞同 · 1 评论 文章
这就好比城墙上的守卫变少了,原本被压制的艰难梭菌就会趁虚而入,利用空出来的生态位大量繁殖并分泌毒素,引发生严重的肠道感染。

这种微观层面的营养不良,往往是导致菌群失调和系统性炎症的隐蔽开端,也进一步凸显了通过高质量饮食纠正营养短板的紧迫性。
前面关注了“吃什么”,“吃多少”,接下来我们来看第三个维度:进食时机。
人体内存在两套主要的生物钟系统:
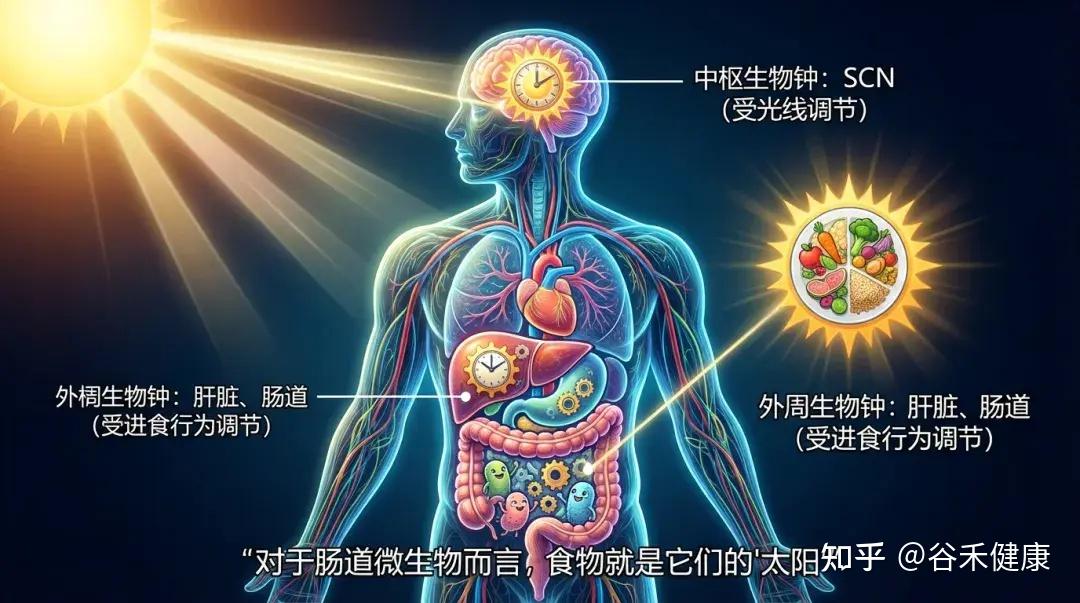
微生物也会“倒时差”
你可能不知道,肠道菌群也是分早班和晚班的。肠道微生物的组成和功能会呈现出显著的昼夜震荡。
这种节律性波动是如此重要,以至于产生的代谢物(如我们前面提到的短链脂肪酸、胆汁酸衍生物)在一天中的浓度也是波动的。这种波动指导着宿主的肝脏何时储存脂肪、何时释放葡萄糖。
现代生活方式:“光”与“食”错位
当我们在深夜(大脑认为是休息时间)吃一顿宵夜(肠道接收到工作信号)时,中枢生物钟和外周生物钟就发生了脱钩。
这种时钟错位会导致肠道微生物节律的丧失。原本应该在休息期清理毒素的细菌被迫加班处理食物,不仅效率低下,还会引发代谢混乱。这被认为是倒班工作者更容易患肥胖、糖尿病和肠道炎症的核心机制之一。
限时进食(TRE):重启肠道节律
限时进食(Time-Restricted Eating, TRE)——即把每天的进食窗口限制在 8-10 小时内,其余时间禁食。
这不仅仅是减少热量摄入的手段,更是一种微生物重塑策略。
–恢复昼夜节律
TRE 能够强力恢复微生物群落的昼夜节律震荡。让不同的细菌在正确的时间做正确的事,重建宿主代谢通路与微生物活动的同步性。
-特定功能菌群的富集
延长的禁食窗口为特定共生菌提供了生态位优势。
研究显示,禁食期间,以AKK菌(Akkermansia muciniphila)为代表的黏液降解菌丰度显著增加。这类菌群利用内源性黏蛋白进行增殖,反向刺激杯状细胞分泌黏液,从而强化肠道屏障功能,减少内毒素血症风险。
-代谢保护
动物模型和人类研究,表明 TRE 可以预防由高脂饮食引起的肥胖和代谢综合征。哪怕摄入的总热量没有改变,仅仅是改变进食的时间窗口,就能显著改善血糖稳态。
对于现代人来说,最糟糕的饮食习惯可能是进食时间的不规律。今天不吃早饭,明天半夜撸串,这种行为让肠道微生物始终处于“倒时差”的应激状态中。

因此,为了维护肠道健康,除了多吃膳食纤维、少吃加工食品外,我们还需要给微生物一个明确的作息表:在白天的活跃期进食,在夜晚的休息期禁食。这不仅是对身体的尊重,也是对居住在你体内的万亿微生物生命的尊重。
小结:从填饱肚子到精准滋养微生态
热量达标不代表菌群吃饱。必须保证膳食纤维的充足供应。这是防止菌群因底物匮乏而倒戈吞噬肠道黏膜的第一道防线。
蛋白质与脂肪对菌群的影响,可能取决于纤维的在场。控制饱和脂肪摄入,选择优质脂肪,能减少次级胆汁酸对有益菌的杀伤,避免内毒素血症。
均衡的微量营养素摄入,比如维生素和矿物质,能精准强化共生菌的竞争优势,助其在生态位争夺战中抢占先机,从而有效压制机会致病菌的野蛮生长。
当我们站在微生物生态学的前沿回望,传统的“金字塔式”饮食建议显得过于粗糙且缺乏维度。Singh等人的数据警示了“饮食大波动有风险”,Estrela等人的机制揭示了“细菌怕长期挨饿”,而Sanz等人的综述则描绘了通过饮食调节菌群的多维度健康蓝图。
这就要求我们必须升级我们的营养系统,从单纯关注成分转向关注生态稳定性与精准化。
新时代的营养观
对于普通大众而言,建立一个基线饮食节奏至关重要。
建立核心菜单
不要让每一顿饭都成为随机事件。尝试确立每天固定的核心食物,例如早餐固定的全谷物燕麦,或晚餐固定的深色蔬菜。这能确保护肠道内的核心共生菌每天都能获得稳定的底物供应,避免其因“断粮”而进入休眠或衰退。
平滑过渡
当你试图改变饮食习惯(比如从高碳水转向低碳水,或者开始吃地中海饮食)时,切忌急刹车或急转弯。根据 Estrela等人的理论,剧烈变换的底物会诱发细菌的饥饿应激和黏液降解。更合适的做法是循序渐进,给微生物群落留出数周的适应期,让代谢网络慢慢重塑。
精准营养 2.0:整合微生物组
每个人的肠道菌群构成都是独一无二的,这意味着同样的食物在不同人体内会引发截然不同的微生物反应(例如,不同人吃同样的香蕉,血糖反应可能截然不同)。未来的营养干预将不再是千篇一律的指南,而是根据人群的代谢表型或微生物特征,提供分层建议。
肠道菌群监测
比如说核心菌群,如厚壁菌门/拟杆菌门比值、产丁酸菌比例等指标,建立个人化菌群基线。
长期的饮食习惯会在菌群上留下印记。例如,长期缺乏膳食纤维的人,其肠道内负责降解植物多糖的酶系可能已经退化。此时若盲目大量补充纤维,不仅无法被利用,反而可能导致腹胀不适。这时肠道菌群数据能提示我们,可能需要采用缓慢饮食过渡方案,给菌群以适应和重建的时间。
靶向性补充
针对特定的功能缺失进行干预。例如,如果发现黏液降解菌(如 Akkermansia)异常升高,这往往是肠道缺乏膳食纤维、菌群正在吃内源性黏液的信号。可能不仅要补充益生菌,更需精准增加抗性淀粉、菊粉等摄入,以提供替代碳源,保护肠道屏障。
拥抱时间营养学
我们不仅要问吃什么,还要问什么时候吃。微生物组具有自身的昼夜节律,这种节律受宿主进食时间的强烈驯化。
保持规律的进食时间,避免深夜进食
这能让微生物群的代谢活动与宿主的生理时钟同步,优化代谢产物的分泌时机,使其在宿主最需要的时候(如日间活动时)发挥作用。
避免长期的随机断食
间歇性断食在某些情况下有益,但无序的、饥一顿饱一顿的“随机断食”是细菌的噩梦。如果你选择断食,请保持断食窗口的规律性,让细菌能够建立起预期的代谢循环。
保持饮食的节奏,不仅仅是一种自律的生活态度,更是一种对生命的敬畏。维护肠道内的和平与稳定,我们实际上是在守护自身健康的根基。正如研究所示,每日稳定摄入蔬菜、水果等富含纤维的食物,远比间断性大量食用更能维持菌群多样性。
在这个充满不确定性的世界里,科学的节奏与精准的滋养,或许就是你能给身体最好的确定性。
主要参考文献
Estrela S, Long JZ, Huang KC. How nutrient starvation impacts the gut microbiome. Nat Microbiol. 2025 Nov;10(11):2663-2672. doi: 10.1038/s41564-025-02139-9. Epub 2025 Sep 30. PMID: 41028229.
Singh R, McDonald D, Hernandez AR, Song SJ, Bartko A, Knight R, Salathé M. Temporal nutrition analysis associates dietary regularity and quality with gut microbiome diversity: insights from the Food & You digital cohort. Nat Commun. 2025 Sep 30;16(1):8635. doi: 10.1038/s41467-025-63799-z. PMID: 41028733; PMCID: PMC12484809.
Sanz Y, Cryan JF, Deschasaux-Tanguy M, Elinav E, Lambrecht R, Veiga P. The gut microbiome connects nutrition and human health. Nat Rev Gastroenterol Hepatol. 2025 Aug;22(8):534-555. doi: 10.1038/s41575-025-01077-5. Epub 2025 Jun 4. PMID: 40468006.

谷禾健康
氨基酸(AA)稳态对人体健康至关重要,其紊乱与多种疾病的发生和进展密切相关,如2型糖尿病和炎症性肠病(IBD),并且常常是治疗结果的决定性因素。
肠道微生物群可能通过多种机制调节宿主氨基酸的可用性,例如影响消化酶(如胰蛋白酶)的活性。肠道微生物群定殖还可能改变肠道通透性,从而影响胃肠道中游离氨基酸的运输和吸收。此外,肠道微生物可能直接利用或代谢肠道中的氨基酸,或合成并向宿主提供氨基酸。以往研究表明,肠道微生物组的变化(或其存在)可能影响肠道氨基酸谱。然而,参与调控宿氨基酸稳态的关键菌株及代谢基因仍未完全明确。
今天分享的这一篇发表在《Cell Host & Microbe》期刊上的研究论文”Microbiota metabolism of intestinal amino acids impacts host nutrient homeostasis and physiology”,通过比较Met无菌(GF)小鼠与无特异病原体(SPF)小鼠的分解物谱已证明,肠道细菌定殖会影响胃肠道(GI)中游离氨基酸谱,还通过高效代谢肠道氨基酸来重塑宿主氨基酸的格局。为确定责任微生物/基因,该研究开发了基于代谢组学的检测法,筛查了104个共生菌,并识别出能高效利用氨基酸的候选基因,并发现这些基因调控了肠道和循环氨基酸的可用性。
结果显示,不同氨基酸具有特定的细菌消费者,消耗效率差异明显。例如,天冬酰胺和谷氨酸被拟杆菌和部分梭菌高效利用,而芳香族氨基酸(色氨酸、酪氨酸)及支链氨基酸(BCAAs)仅为部分厚壁菌门成员所代谢,效率较低。值得注意的是,支链氨基酸与色氨酸代谢相关的微生物基因还能通过调节外周血清素间接影响宿主葡萄糖平衡。
总体而言,该研究首次系统揭示了肠道微生物群编码的氨基酸代谢活动对宿主营养稳态的深远影响,为理解微生物介导的氨基酸利用及其对宿主代谢调控机制提供了关键分子依据。
氨基酸稳态对人类健康至关重要,其紊乱与2型糖尿病和炎症性肠病(IBD)等多种疾病的进展密切相关。虽然传统上认为肠道和肝脏是调控营养代谢的主要器官,但最新研究发现,肠道微生物群通过代谢氨基酸能够深刻重塑宿主的氨基酸谱。
★该研究的核心意义在于:
•揭示了肠道微生物群通过代谢肠道氨基酸影响宿主氨基酸稳态的分子机制;
•鉴定了高效消耗氨基酸的特定肠道微生物及其代谢基因;
•阐明了微生物群氨基酸代谢基因如何通过外周血清素调节宿主葡萄糖稳态;
•为通过调节肠道微生物群代谢活性改善人类健康提供了新的靶点和策略。
▸ 肠道微生物群对宿主氨基酸水平的影响
研究首先通过比较无菌(GF)小鼠、无特定病原体(SPF)小鼠以及接受SPF微生物群移植(FMT)的GF小鼠,证实了肠道微生物群定植显著降低了肠道和循环氨基酸水平。
靶向代谢组学分析显示,SPF小鼠或接受SPF微生物群的GF小鼠肠道和循环氨基酸浓度普遍降低,这与之前的研究结果一致,表明微生物对肠道氨基酸的利用可能是影响宿主氨基酸稳态的主要途径之一。
▸ 高效代谢氨基酸的肠道微生物筛选
为识别高效代谢肠道氨基酸的微生物,研究者建立了一种基于活细胞的高通量代谢组学筛选方法,对104种肠道共生菌进行了系统分析。该方法综合考虑多个因素:
•生长阶段差异:绘制各菌株生长曲线并进行参数拟合,确保在可比生长阶段进行筛选;
•时间动态分析:分别在15、30和60分钟测定氨基酸消耗量,以精确评估不同菌株对特定氨基酸的利用速率;
•营养条件优化:在测定缓冲液中除氨基酸外,补充无机氮源、微量矿物质、维生素及额外碳源(如葡萄糖),以避免因营养限制导致的氨基酸非特异性快速消耗。
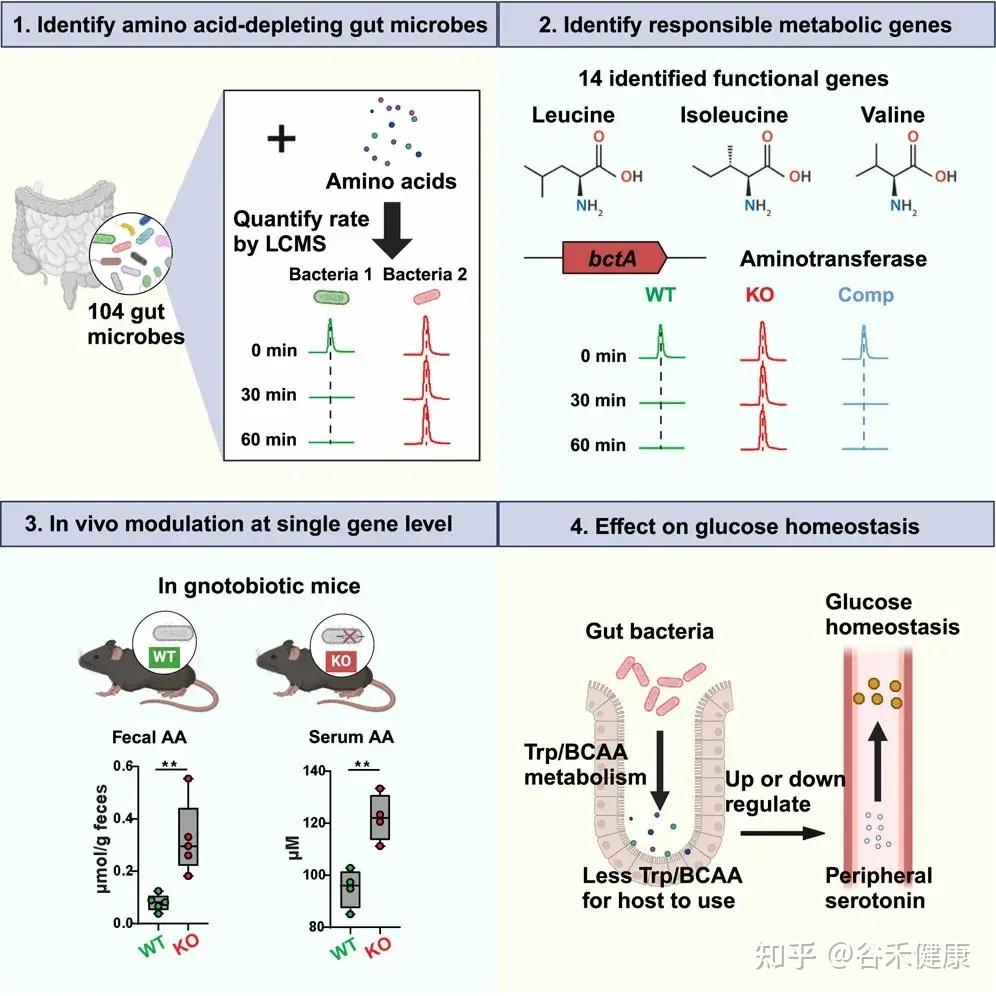
研究流程图展示了从识别消耗氨基酸的肠道微生物、鉴定负责的代谢基因、单基因水平的体内调节到对葡萄糖稳态影响的完整研究路径。
▸ 微生物代谢基因的鉴定与功能验证
研究利用CRISPR-Cas9和ClosTron等基因编辑技术,在系统发育多样的肠道微生物中开展大规模基因缺失分析,以鉴定氨基酸代谢的关键基因。筛选标准包括:
1.代谢基因编码的酶以氨基酸为直接底物;
2.这些基因存在于高效代谢氨基酸的肠道菌株中;
3.携带相关基因的菌株能稳定定植于无菌(GF)小鼠肠道,并降低宿主体内相应氨基酸水平。
通过构建基因敲除和互补菌株并结合代谢组学分析,研究识别出多种氨基酸代谢相关基因,并在单菌定植的GF小鼠模型中验证了其对肠道及血清氨基酸水平的调控作用。
▸ 高效代谢氨基酸的肠道微生物鉴定
通过大规模筛选,研究发现不同肠道微生物对氨基酸的代谢效率和偏好存在显著差异:
鉴定高效利用氨基酸的肠道微生物候选者
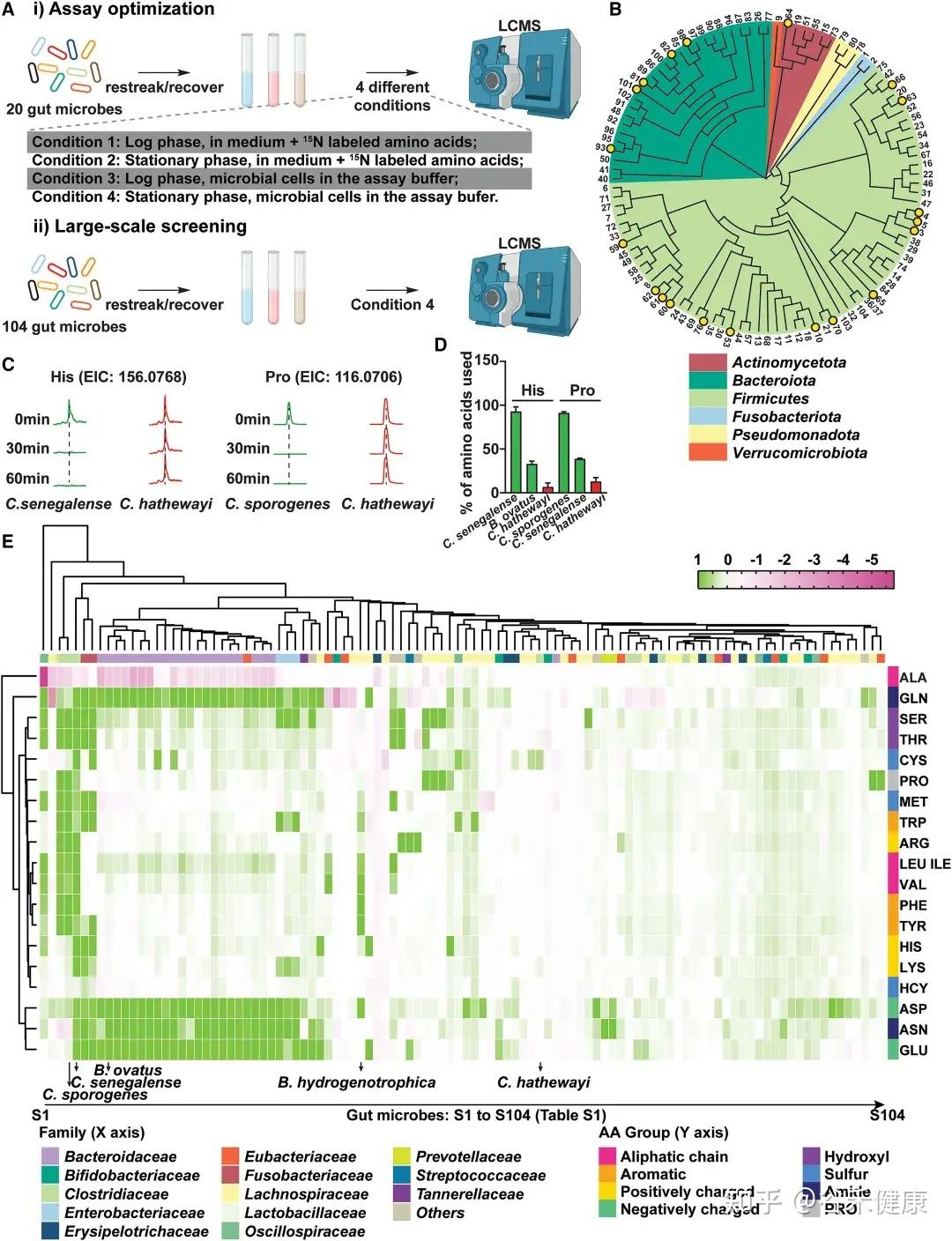
热图展示了104种肠道微生物对不同氨基酸的代谢情况,揭示了微生物系统发育与氨基酸代谢效率之间的复杂关系。
★ 关键发现包括:
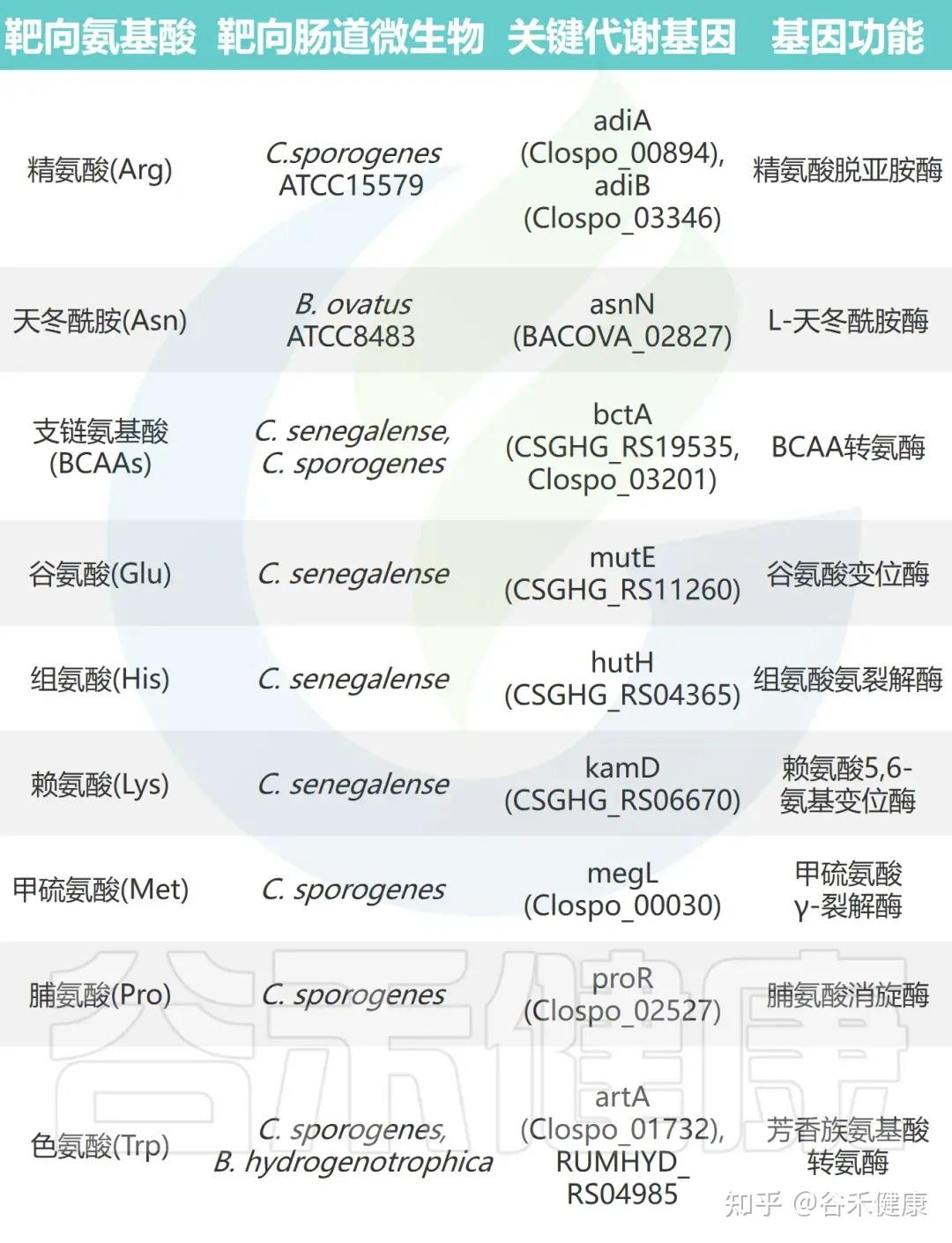
•梭菌属微生物:如Clostridium sporogenes ATCC15579和Clostridium senegalense DSM25507,可高效代谢多种氨基酸,包括精氨酸、芳香族氨基酸、支链氨基酸、组氨酸、赖氨酸和脯氨酸等。
•拟杆菌属共生菌:作为肠道多糖的主要利用者,也能有效代谢天冬酰胺(Asn)、天冬氨酸(Asp)和谷氨酰胺(Gln)等氨基酸。
•氨基酸特异性代谢:不同氨基酸具有特定的细菌“消费者”,消耗效率差异明显。天冬酰胺和谷氨酸通常被拟杆菌和部分梭菌快速利用,而芳香族氨基酸(色氨酸、酪氨酸)及BCAA仅被部分厚壁菌门或梭菌较低效地代谢。
▸ 氨基酸代谢相关微生物基因的鉴定
通过对高效代谢氨基酸的肠道微生物进行大规模基因缺失分析,研究鉴定出多种关键氨基酸代谢基因。这些基因编码的酶包括转氨酶、脱羧酶、消旋酶和氨裂解酶等,具有以下特征:
•功能冗余性:单株细菌常含多个具有相似功能的基因。例如,C. sporogenes 携带两种精氨酸脱亚胺酶基因(adiA 和 adiB),单基因敲除影响较小,而双敲除可完全消除其精氨酸代谢能力。
•底物特异性:代谢酶展现高度底物选择性。例如,C. sporogenes 的转氨酶 ArtA 特异作用于色氨酸和酪氨酸,但对苯丙氨酸代谢影响极小。
•催化多样性:不同类型的酶参与多条代谢途径。支链氨基酸和色氨酸经转氨途径代谢,脯氨酸通过还原反应被 C. sporogenes 利用,而谷氨酸、甲硫氨酸、丝氨酸和苏氨酸则由氨裂解酶快速分解。
•功能可转移性:这些酶的催化功能具有可转移性,在其他肠道共生菌中表达其编码基因可赋予相应氨基酸的消耗能力。
▸ 微生物代谢基因调控宿主氨基酸稳态
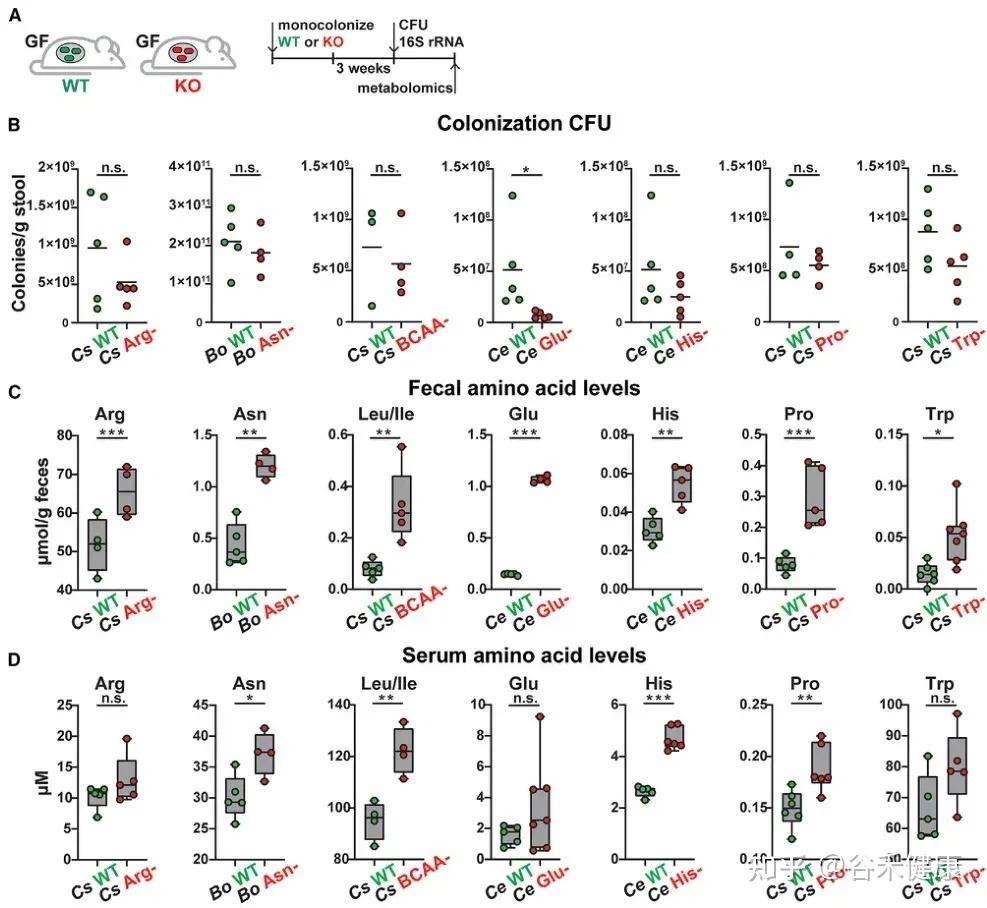
通过将野生型菌株及其代谢基因缺失突变体分别单菌定植于GF小鼠,研究发现这些基因显著影响宿主肠道及循环系统中的氨基酸水平:
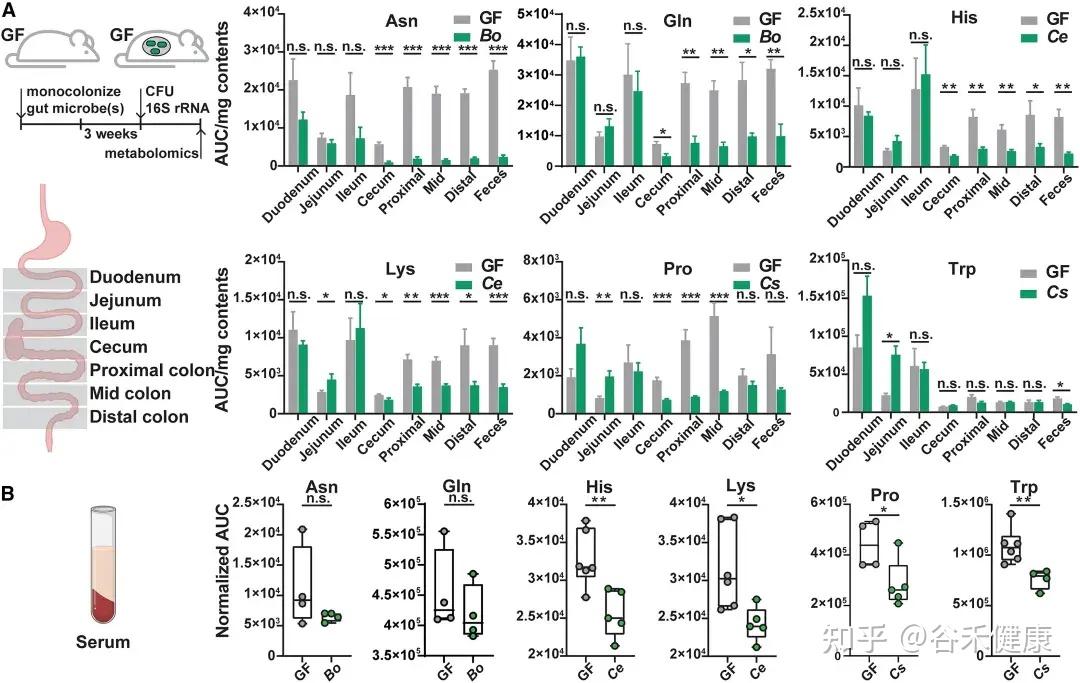
无菌小鼠单一定植B. ovatus、C. senegalense和C.sporogenes野生型菌株后,肠道和血清中特定氨基酸浓度显著降低。
★ 主要发现包括:
•肠道氨基酸稳态调控:多数鉴定出的微生物代谢基因或酶影响肠道氨基酸平衡。由于突变体的相应代谢途径被阻断,肠道内容物和粪便中相关氨基酸显著积累。
•循环氨基酸谱变化:部分代谢基因还影响宿主血清氨基酸水平。定植 Asn、Leu/Ile、Pro 和 His 利用缺陷突变体的无菌小鼠,其血清中对应氨基酸明显升高。
•系统性调节的复杂性:循环氨基酸水平的变化并不总与微生物在肠道中的代谢能力一致。例如,定植 C. sporogenes 精氨酸利用缺陷突变体可显著提高肠道精氨酸水平,但对循环精氨酸影响有限,提示肠上皮或肝脏代谢等额外机制亦参与精氨酸的全身稳态调控。
单基因水平的微生物群氨基酸代谢调控
单基因水平的体内调节实验显示,氨基酸代谢基因缺陷突变体定植的无菌小鼠粪便和血清中相应氨基酸水平显著升高。
▸ 微生物氨基酸代谢通过外周血清素调控宿主葡萄糖稳态
研究发现,微生物中支链氨基酸(BCAAs)和色氨酸代谢相关基因可通过外周血清素间接调节宿主葡萄糖稳态。将 C. sporogenes 野生型、BCAA 缺陷型及色氨酸缺陷型突变体分别单菌定植于 GF 小鼠,并进行口服葡萄糖耐量试验(OGTT),结果显示以下关键发现:
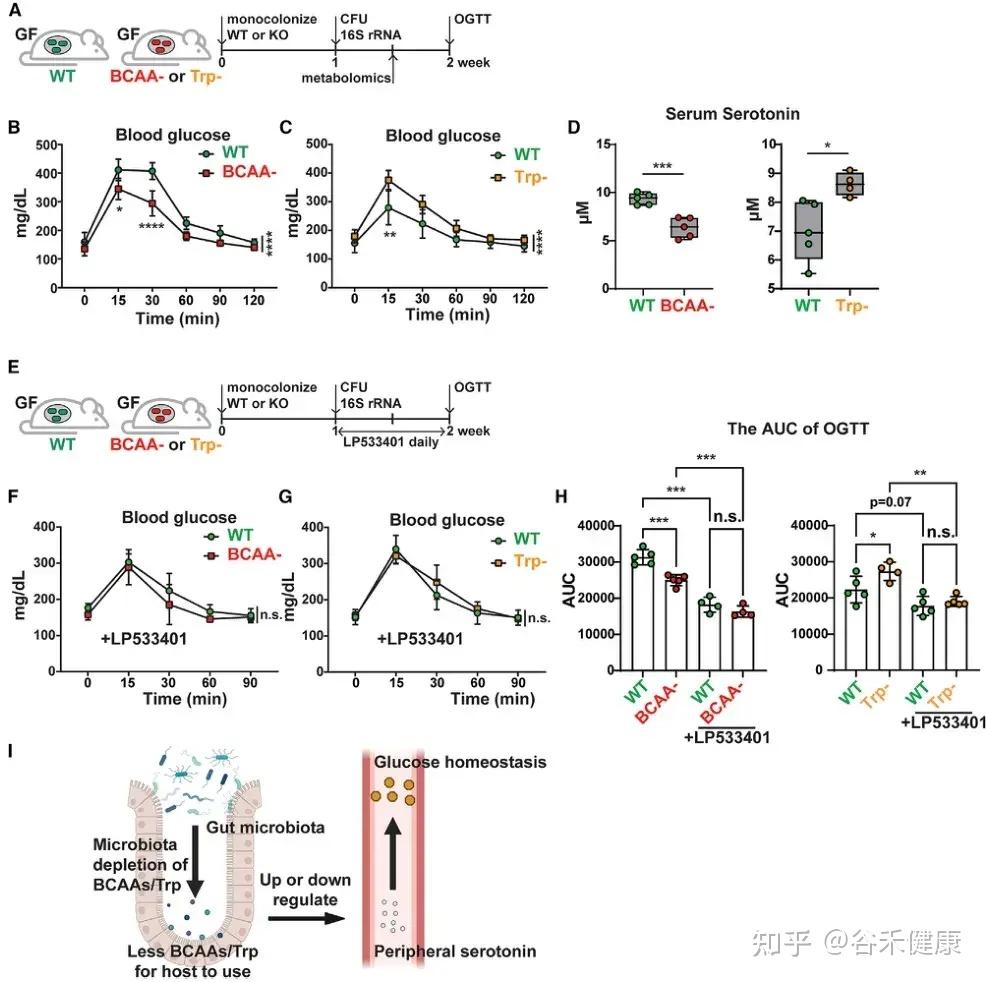
微生物支链氨基酸和色氨酸代谢通过调节外周血清素水平影响宿主葡萄糖稳态的机制示意图及实验验证。
•BCAA代谢与葡萄糖耐受性:定植 BCAA 缺陷突变体的小鼠葡萄糖耐受性显著增强,伴随血清素水平下降。
•色氨酸代谢与葡萄糖耐受性:定植色氨酸代谢缺陷突变体的小鼠表现相反,葡萄糖耐受性下降,血清素水平升高。
•血清素介导机制:应用 Tph1 抑制剂 LP533401 阻断外周血清素合成后,野生型与突变体定植小鼠间的葡萄糖处理差异显著减小,证实微生物氨基酸代谢通过调控外周血清素影响宿主葡萄糖稳态。
这一发现揭示了肠道微生物群、氨基酸代谢、外周血清素及葡萄糖稳态间的复杂关联,为理解代谢性疾病的机制提供了新思路。
!
研究局限性
尽管该研究取得了重要发现,但仍存在一些局限性:
1.微生物氨基酸代谢的多样性:研究主要关注肠道微生物对氨基酸的消耗,而其合成、转运等途径也可能影响宿主氨基酸稳态。体外测定仅反映特定条件下的代谢效率,难以全面代表其在宿主体内的作用。
2.模型简化的局限性:研究采用单菌定植的 GF 小鼠模型,未来应在更接近生理状态的模型(如定植简化微生物群的 GF 小鼠)中验证这些机制。
3.复杂微生物群中基因操作的挑战:虽然本研究成功在宿主定植背景下操纵单一氨基酸代谢途径,但在复杂微生物群中实现精确基因操作仍需进一步技术突破。
4.宿主响应机制研究不足:研究揭示了野生型与突变体共生菌定植小鼠间的生理差异,但尚需深入解析相关宿主细胞类型及信号通路的具体调控机制。
未来的研究在单基因分辨率下揭示了肠道微生物群如何通过代谢肠道氨基酸影响宿主氨基酸稳态。研究鉴定出多种积极代谢肠道氨基酸的细菌,并通过大规模基因缺失分析确定了其关键代谢基因。功能实验显示,这些代谢途径通过直接调控宿主肠道和循环氨基酸的生物利用度,或间接影响外周血清素合成,从而调节宿主的葡萄糖代谢和整体营养稳态。
研究表明,定植微生物群可能以“竞争”模式与宿主共同调控营养平衡,为理解其分子层面的调节机制提供了新视角。更值得关注的是它揭示了一个新的通路:微生物氨基酸利用 → 改变宿主血中氨基酸/代谢产物 → 改变激素/神经递质(如外周 5‑HT)→ 改变葡萄糖代谢等生理功能,所以这些菌在肠道里的存在,更可能是:微调宿主营养和代谢状态,而不是简单的“好/坏”。
参考文献:
Li TT, Chen X, Huo D, Arifuzzaman M, Qiao S, Jin WB, Shi H, Li XV; JRI Live Cell Bank Consortium; Iliev ID, Artis D, Guo CJ. Microbiota metabolism of intestinal amino acids impacts host nutrient homeostasis and physiology. Cell Host Microbe. 2024 May 8;32(5):661-675.e10.

谷禾健康


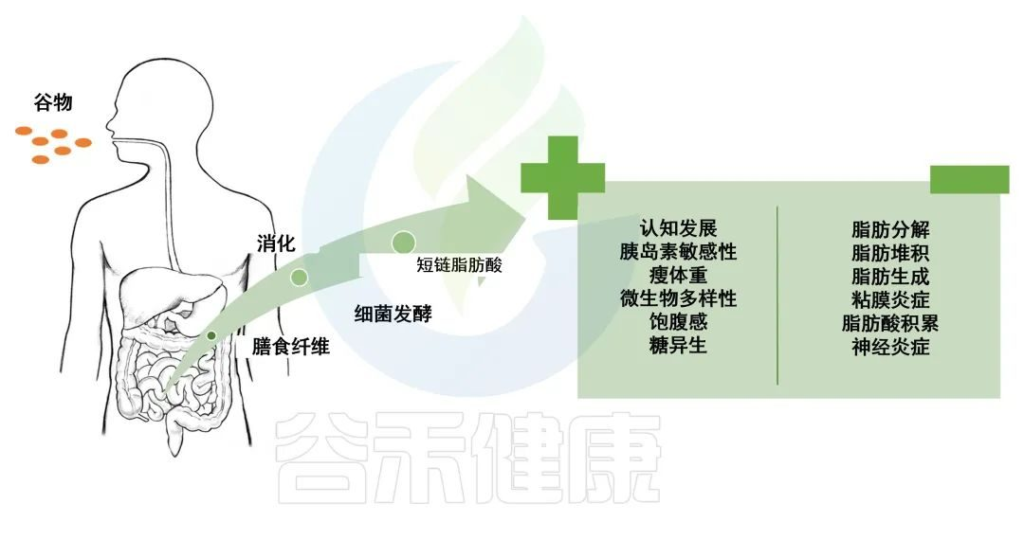
饮食可以调节人体肠道微生物群的组成和功能,以维持宿主微生物群的互惠共生。
谷物富含特定的功能元素,是维持人类健康的重要膳食成分。谷物可以改变肠道微生物群,并可能改善能量和葡萄糖稳态,干扰宿主能量稳态、食欲、血糖调节、胰岛素敏感性和宿主代谢的调节。
什么是全谷物
全谷物是禾本科植物的可食用种子,由胚(或胚芽)、胚乳和外部麸皮组成。
全谷物是一种富含膳食纤维的食物,而膳食纤维可以调节肠道微生物群,从而调节人体的特定生物过程,例如调节免疫、炎症、碳水化合物和脂肪代谢以及肠-脑神经回路。
全谷物是营养和植物化学物质的极好来源,可能对心血管疾病、高血压、糖尿病、不同类型癌症和肥胖症等多种慢性疾病具有保护作用。
全谷物的摄入还与健康肠道微生物群的增加有关,这一点可以从它们的丰富度和多样性以及短链脂肪酸的产生中看出。
短链脂肪酸,作为发酵终产物并促进有益细菌的生长。短链脂肪酸还可以降低结肠 pH 值,防止病原菌生长,并改善结肠上皮细胞的完整性。
本文讨论了不同谷物如何通过调节肠道微生物群对宿主产生有益的健康影响。主要从以下几个方面讲述:
• 谷物通过调节肠道菌群在动脉粥样硬化中的作用
• 谷物通过调节肠道菌群在高血压中的作用
• 谷物通过调节肠道菌群在肥胖中的作用
• 谷物通过调节肠道菌群在II型糖尿病中的作用
• 谷物通过调节肠道菌群在结肠健康中的作用
动脉粥样硬化是一种以胆固醇积聚和巨噬细胞聚集到动脉壁为特征的状态,它是心血管疾病的主要危险因素。
肠道微生物群组成的平衡很重要,平衡一旦破坏可能会导致毁灭性的病理生理后果。
在高脂饮食的Apo E−/−小鼠中,某些菌群的丰度,如Bilophila和Mucispirillum,与动脉粥样硬化斑块大小呈正相关。
物种丰富度也是肠道健康的一个主要标志,因为高细菌丰富度和多样性往往反映了生态系统的稳定性和复原力,以及疾病与粪便样本中物种数量减少之间的一致联系。
▸野生稻:具有抗脉粥样硬化作用
野生稻主要作为全谷物食用,食用后对健康有很多好处。野生稻含有抗性淀粉,可以作为益生元。
野生稻具有显著的抗动脉粥样硬化作用,但其作用机制尚不清楚。这些影响可能是由于血浆胆固醇水平的降低。
细菌代谢产物如短链脂肪酸和三甲胺-N-氧化物(TMAO)是动脉粥样硬化中的重要化合物。
▸抗动脉粥样硬化作用可能与肠道菌群改变有关
最近的研究还发现,肠道微生物群与动脉粥样硬化的形成之间存在关联。短链脂肪酸主要参与碳水化合物、脂肪和胆固醇代谢,其免疫调节功能可能有助于心血管疾病的治疗。动脉粥样硬化斑块中细菌DNA的存在为肠道微生物群与动脉粥样硬化的相关性提供了证据。
▸野生稻:影响菌群丰度和多样性,预防动脉粥样硬化
另一项研究调查了野生稻对小鼠粪便细菌物种丰度和多样性的影响。结果表明,在低密度脂蛋白受体基因敲除(LDL-r-KO)的小鼠中,长期食用60%的野生稻与预防动脉粥样硬化有关。
参与预防的机制可能是粪便细菌数量和多样性的显著改变,以及几种炎症和代谢生物标志物的显著变化。
与对照组相比,在野生稻喂养的小鼠粪便中发现了下列菌群丰度更高:
治疗组和对照组小鼠血浆中的细胞因子谱存在显著差异。白细胞介素-10(IL-10)和促红细胞生成素(EPO)水平的升高可以解释野生稻的抗动脉粥样硬化特性。然而,需要使用动物模型进行额外的研究支持该结果。
许多研究表明,维持健康的心血管系统可能有助于维持认知功能,因为一些心血管疾病与认知障碍和阿尔茨海默病的风险增加有关。
▸ 燕麦和燕麦制品:降胆固醇,产生短链脂肪酸,调节菌群,降低肠道通透性,抑制炎症
燕麦和燕麦制品是谷物纤维的其他重要来源,它们富含β-葡聚糖。β-葡聚糖是一种粘性和可溶性纤维,具有有益的降胆固醇潜力。
动物研究表明,燕麦纤维可以上调肝组织中低密度脂蛋白(LDL)受体的表达。
研究表明,膳食燕麦纤维可延缓动脉粥样硬化所致小鼠认知功能障碍的进展。燕麦纤维通过为人体产生短链脂肪酸,很好地恢复了微生物群的丰度和多样性。这些短链脂肪酸可降低肠道通透性,抑制神经系统的神经炎症。
▸ 小米:保护肠道屏障,重塑肠道菌群,防止动脉粥样硬化
另一种越来越受消费者欢迎的谷物是小米。使用喂食高脂肪饮食的Apo E−/−小鼠研究小米壳多酚的抗动脉粥样硬化潜力。
结果表明,小米壳多酚通过保护肠道屏障和重塑肠道菌群,防止主动脉粥样硬化斑块的形成。
微生物群组成的特征是颤螺菌属(Oscillospira)和瘤胃球菌(Ruminococcus)丰度较高,以及Allobaculum丰度降低,抑制动脉粥样硬化斑块的形成。
大多数以动脉粥样硬化为研究重点的体外、动物和人体研究报告的结果不一致,这可能是由于实验对象的数量有限(包括研究中人体受试者的数量较少),以及实验对象的性质(实验对象之间存在的可变性会影响结果),如采样技术,也可能是由于饮食成分的相互作用的影响。
相关阅读:
高血压是心血管疾病的重要危险因素,受遗传易感性和环境因素的影响。
近年来,对肠道菌群与高血压的关系进行了研究。研究对象是老鼠和人类。在两个实验对象中都观察到了肠道菌群的改变。
▸ 高血压患者:梭状芽胞杆菌大量存在
梭状芽孢杆菌在小鼠和人类高血压患者体内都发现大量存在。此外,高血压人群中Bacterodiales增加,但在小鼠中与血压呈负相关。
在饮食中加入富含纤维的食物,如谷物,可以改变肠道菌群的组成。膳食纤维的降血压机制尚不完全清楚。
▸ 短链脂肪酸降压:通过激活受体
有研究发现,发酵产生的短链脂肪酸可以激活在肾脏和血管中的G蛋白偶联受体和嗅觉受体,这些受体抑制肾素的释放,从而降低血压。
▸ 纤维:通过短链脂肪酸,促进有益菌生长,加强肠道屏障完整性
一项研究表明,健康女性在怀孕过程中,纤维摄入量越高,可以缓解肠道通透性增加的程度。
可发酵纤维促进有益菌的生长,并产生短链脂肪酸作为发酵最终产物。短链脂肪酸可以通过降低结肠pH值来阻止致病菌的生长。
此外,短链脂肪酸还可以提高结肠上皮细胞紧密连接的完整性。这加强了肠道壁屏障的完整性,降低了肠道通透性。
然而,纤维摄入并不影响未来妊娠高血压疾病女性的肠道渗透性。这项研究表明,纤维干预可能不会通过改善肠道屏障功能来阻止高血压疾病的发展。
大部分的研究都是研究分离纤维对高血压的影响;需要更多的研究来了解习惯性纤维摄入通过调节肠道菌群对高血压的影响。
短链脂肪酸对宿主代谢的有益作用
Kulathunga J,et al.Curr Nutr Rep.2022
▸ 燕麦麸(谷物分离物):降血压,菌群改变
对谷物分离物的研究也将为营养保健品和功能性食品开辟新的途径和机会。研究对象为食用燕麦麸12周的参与者(30 g / 天)。结果显示,摄入膳食纤维的参与者的收缩压和舒张压低于对照组。与对照组相比,双歧杆菌(Bifidobacterium)和螺旋菌(Spirillum)等细菌物种的丰度显著升高。
需要进一步的研究来阐明本研究的现有发现。例如,研究人员没有量化短链脂肪酸水平,对于双歧杆菌和螺旋菌的变化是否与短链脂肪酸的变化有关不清楚。
▸ 藜麦蛋白降压(动物研究)
在动物模型研究中,研究了藜麦蛋白摄入对自发性高血压大鼠的降压作用。结果显示血压显著降低,肠道中Turicibacter和Allobaculum属的丰度与血压呈负相关。
血压与肠道菌群之间存在双向关系。血压水平及相关病理状态导致微生物群变化,微生物来源的代谢物有助于调节血压。然而,大多数谷物蛋白的体内降压作用尚不清楚,需要更广泛的研究。
相关阅读:认识肠道微生物及其与高血压的关系
已知肠道微生物群参与控制体重、代谢改变和与肥胖相关的炎症性疾病。
文献表明,肥胖的发病机制与下列菌群正相关:
肥胖的发病机制与下列菌群负相关:
肥胖症与肠道菌群代谢产物之间的关系尚不完全清楚。然而,提出了以下假设。据估计,短链脂肪酸等微生物的代谢物对人体能量平衡的贡献高达约200千卡/天,并有助于脂肪细胞中的脂肪生成和积累,从而获得能量。
▸ 高粱多酚:可能增加有益菌丰度
使用不同体重等级(正常和超重)的人类受试者评估高粱多酚对肠道微生物群的影响。结果表明,正常体重和超重/肥胖组之间的短链脂肪酸总产量没有显着变化。
一项最新营养学报告研究发现,高粱多酚和低聚果糖的组合可增加双歧杆菌和乳酸杆菌的数量,高粱多酚可独立增加罗氏菌属(Roseburia)和普雷沃氏菌属(Prevotella)的丰度。
关于罗氏菌属详见: 肠道重要基石菌属——罗氏菌属(Roseburia)
普雷沃氏菌属详见:肠道重要基石菌属——普雷沃氏菌属 Prevotella
▸可溶性玉米纤维:使变形菌减少,厚壁菌增加
在小鼠中添加可溶性玉米纤维长达8周的高纤维饮食表明,变形菌(Proteobacteria)数量减少,这种细菌门通常与肥胖呈负相关。
厚壁菌的增加抵消了高纤维饮食,并诱导了与肥胖相关的菌的增加,如瘤胃球菌、嗜胆汁菌Bilophila、脱硫弧菌Desulfovibrio、颤螺菌属Oscillospira和Paenibacillus.
关于瘤胃球菌属详见:瘤胃球菌属——消化降解关键菌?炎症标志菌?
脱硫弧菌详见: 肠道有害菌——脱硫弧菌属(Desulfovibrio)
▸麦麸:补充影响菌群变化,或与减肥相关(多项研究结果不一)
在一项动物研究中,添加5%麦麸的高纤维饮食增加了微生物群的多样性和某些细菌物种的丰度。Akkermansia muciniphilia的数量增加,这与体重增加有关。此外,双歧杆菌物种的丰度增加。已知包括短双歧杆菌在内的双歧杆菌可防止脂肪积聚。
在另一项研究中,连续8周麦麸补充剂(7.5%)可以减轻体重和肥胖,这与乳酸菌丰度降低有关。
然而,在另一项研究中,麦麸补充量的增加表明盲肠乳酸菌的增加,尽管体重或肥胖没有变化。
▸含有抗性淀粉的全麦面粉:减少腹部脂肪
最近的研究发现,在肥胖的糖尿病脂肪大鼠中,含有抗性淀粉的全麦面粉,比分离的抗性淀粉产生更大的发酵,更大的发酵会产生不同的微生物群,减少腹部脂肪,提高胰岛素敏感性。
肥胖大鼠服用抗性淀粉可增加拟杆菌门与厚壁菌门的比率,并可能导致胰岛素敏感性的改善。
▸玉米抗性淀粉:调节菌群,影响体脂等指标
在临床研究中,向人类志愿者提供玉米抗性淀粉饮食可显著增加链球菌和Ruminococcaceae_UCG-005的丰度,并降低厌氧菌、拟杆菌、Blautia的丰度,它们可有效调节体脂、短链脂肪酸、早期胰岛素和胰高血糖素样肽-1(GLP-1)的分泌。
由于人与人之间肠道微生物群的差异,补充抗性淀粉的饮食对人的影响不同。补充抗性淀粉会增加粪便丁酸盐浓度。然而,对抗性淀粉补充剂的反应因个人而异。
因此,为了有效地设计人体试验,应该考虑几个限制因素。根据性别、饮食习惯、健康和生活方式的不同,不同个体的微生物群组成有显著差异。
▸ 小米:增加有益菌,改善葡萄糖耐量,但不影响体重增加
小米补充剂的摄入增加了有益菌丰度,包括乳酸杆菌、双歧杆菌、阿克曼菌和罗氏菌属(Roseburia),小米改善了葡萄糖耐量,抑制了血清胆固醇和血脂参数的增加,但不影响体重增加。
这类研究的结果取决于谷物品种的性质及其生物活性成分的组成。此外,谷物成分在很大程度上取决于生长位置、农艺措施和其他生长因素,如温度和施肥。
相关阅读:体重增长:目前为止我们所知道的一切(更新你的减肥工具箱)
关于谷物通过调节肠道微生物群的降血糖作用的研究较少。
肠道微生物群在宿主的大多数代谢功能中起着至关重要的作用,如氨基酸合成、膳食脂肪和脂溶性维生素的吸收、短链脂肪酸的产生、葡萄糖稳态的激活、脂质能量代谢、热量去除和调节胆汁酸转化等。
▸ 糖尿病患者的菌群特征
与瘦人相比,II型糖尿病患者的微生物群多样性和普拉梭菌(Faecalibacterium prausnitzii)丰度显著降低。II型糖尿病与厚壁菌门丰度较低有关,而拟杆菌门和变形菌门丰度较高。
▸ 高直链玉米淀粉:降低II型糖尿病风险
最近利用动物模型进行的研究发现,食用高直链淀粉玉米会增加拟杆菌和某些厚壁菌分类群(乳酸杆菌和Erysipelotrichaceae)。此外,这种饮食可以增强肠道免疫和内分泌反应,从而降低II型糖尿病的风险。
▸谷子:降血糖作用
最近的一项研究,评估谷子在高脂饮食和糖尿病大鼠中的降血糖作用。根据结果,乳酸杆菌和瘤胃球菌的相对丰度增加,与空腹血糖和2小时血糖呈负相关。
▸可溶性玉米纤维:改变菌群,产生短链脂肪酸
另一项研究侧重于在人类饮食中添加10克或20克纤维,其中含有85%的可溶性玉米纤维,持续4周,导致较高比例的菌群,如:
已知这些细菌会消化淀粉并产生短链脂肪酸,而健康的老年人在每天补充6克可溶性玉米纤维3周后,Parabacteroides的丰度有所增加。
▸抗性淀粉(RS2)降血糖
开展了多项研究,以评估小麦抗性淀粉II型(RS2)对血糖反应和肠道微生物群的影响。
在一项研究中,评估了食用富含II型抗性淀粉的小麦卷1周的效果,结果表明,富含II型抗性淀粉的小麦卷可以降低餐后葡萄糖和胰岛素反应。
粪便内容物中的瘤胃球菌属和Gemmiger比例增加,反映了远端肠道的组成。抗性淀粉干预还降低了肠道微生物群落的生物多样性和丰富度。
关于抗性淀粉详见:你吃的膳食纤维对你有帮助吗?
▸抗性淀粉(RS2)增加氢气和甲烷
此外,在食用富含II型抗性淀粉的小麦期间,空腹呼气中,氢气和甲烷增加。氢气和甲烷气体是微生物代谢产物,是微生物发酵的标志物。
关于肠道气体详见:肠道气体带来什么影响,饮食如何对其产生作用?
▸抗性淀粉(RS2):短链脂肪酸与菌群变化呈正相关
对照组和添加抗性淀粉的小麦卷消耗量之间的粪便短链脂肪酸浓度没有显著变化,但丁酸盐和总短链脂肪酸与下列菌群的相对丰度呈正相关:
▸短链脂肪酸能调节与肥胖相关的脂肪因子的表达,降低血糖,提高发酵活性
短链脂肪酸浓度与胰岛素敏感性有关。丁酸可降低胰岛素敏感性。短链脂肪酸还刺激肠内分泌L细胞产生饱腹激素,如肽YY(PYY)和胰高血糖素样肽(GLP-1)。
此外,短链脂肪酸调节瘦素、脂联素和抵抗素等脂肪因子的表达。它们通过调节肠道和全身炎症间接导致肥胖,促进或加剧心脏代谢功能障碍。
这些影响表明,与野生型小麦相比,食用富含II型抗性淀粉的小麦可以降低餐后血糖,改变肠道微生物组成,提高发酵活性。
▸ 小麦胚芽:产短链脂肪酸菌的种类显著增加,提高免疫力
现有文献表明,在饮食中补充小麦胚芽可以改善小鼠的肠道微生物群。此外,与对照组相比,拟杆菌门水平减少,厚壁菌门水平增加。产生短链脂肪酸的细菌种类显著增加:
其中,Roseburia的百分比增加了三倍以上。
此外,细胞因子和免疫球蛋白的变化与肠道微生物群有关。小麦胚芽可以提高免疫力,作为一种增强免疫力的功能性食品具有潜在的应用价值。
▸ 短链脂肪酸促进食欲刺激激素,葡萄糖刺激的胰岛素分泌增加
另一项研究发现,血液中较高水平的乙酸盐会导致胰岛素抵抗并增加胃中生长素释放肽(一种食欲刺激激素)的产生,而丁酸盐水平的降低也会促进胰岛素抵抗。
此外,啮齿动物肠道菌群改变导致乙酸盐的产生增加,会导致副交感神经系统激活,从而促进葡萄糖刺激的胰岛素分泌增加、生长素释放肽分泌增加、食欲过盛、肥胖和相关后遗症。
还需要开展额外的研究工作来确定肠道微生物群在帮助预防2型糖尿病方面的遗传和代谢潜力。此外,任何未来的研究都应该明确定义,可以通过在2型糖尿病患者的饮食中加入不同谷物来调节的菌群种类。此类研究还应解决这种调节是否与谷物剂量有关。
相关阅读:2型糖尿病如何做到可防可控?肠道菌群发挥重要作用
▸米糠:调节肠道菌群代谢,促进益生菌生长
米糠具有益生元特性,对结肠健康有益。米糠含有大量的生物活性化合物,包括各种氨基酸、小肽、脂类、核苷酸、维生素和辅助因子,以及可供宿主消化和不可消化的植物化学物质。
肠道微生物群可以在动物和人类体内发酵米糠碳水化合物、植物化学物质、脂质和氨基酸。
研究发现,米糠成分有助于调节宿主和肠道微生物代谢,与对照组相比,摄入米糠显著促进肠道益生菌菌株的生长。然而,还需要更多的研究来提高对米糠发酵如何影响结肠组织微生物群的理解。
▸大米:减缓肿瘤和病原体生长
大米可以通过改变细胞增殖、对抗氧化应激、减少炎症、调节肠道微生物组和代谢来减缓肿瘤和病原体的生长。
研究了大米抗性淀粉(RS)和脂肪水平对C57BL/6小鼠肠道微生物群的影响。处理是三个品种的三个水平的抗性淀粉作为碳水化合物的主要来源,两个脂肪水平,低(10%)和高(39%)。
抗性淀粉导致厚壁菌与拟杆菌的比率降低,增加拟杆菌科和S24-7的短链脂肪酸产量。
米饭中的抗性淀粉含量(0.44%)可以调节小鼠的肠道微生物群,并且与防止肥胖饮食的有害影响有关。
此外,微生物类群与碳水化合物和脂质代谢相关的组织基因表达之间存在相关性。
▸ 米糠和槲皮素等组合:有利于排除肠道病原体
另一项研究发现,槲皮素和米糠的联合作用减少了致病性肠杆菌科细菌的数量,并且减少量与丙酸水平高度相关。
因此,米糠和槲皮素等底物的组合将有助于排除肠道内的肠道病原体。
▸ 麦麸:增加有益菌,改善肠道完整性,减少炎症
麦麸是面粉加工的另一个重要副产品,也是膳食纤维最丰富的来源之一。麦麸中的膳食纤维可改善矿物质代谢基因表达和肠道功能,并增加体内促进健康的细菌数量。
膳食中添加麦麸可以改变肠道微生物群,从而改善肠道完整性,减少炎症。麦麸补充水平的增加表明盲肠乳酸菌数量增加,肠道炎症减少,补充麦麸后炎性细胞因子TNF-α和IL-6减少,与内毒素血症和抗炎细胞因子减少相关的紧密连接蛋白增加。
需要进一步研究以了解谷物和肠道微生物群在维持结肠健康方面的相互作用。特别是,适当控制饮食干预的人类干预试验可以证实全麦谷物对肠道相关健康的益处,并允许在个人基础上得出更有效的结论。
谷物通过调节肠道菌群发挥健康益处的研究总结


Kulathunga J,et al.,Curr Nutr Rep.2022
肠道微生物群在日常饮食和健康状况之间起着重要作用。大多数研究报告了谷物通过调节肠道微生物群对调节代谢疾病的有益作用。
膳食摄入谷物可以预防动脉粥样硬化、高血压、防止体重增加和脂肪积累、改善血糖耐受性和血脂水平、通过调节肠道微生物群组成减少全身炎症,并促进包括短链脂肪酸在内的不同代谢物的释放。
通过调节肠道菌群健康检测,了解适合的饮食方式,合理调整膳食,可以在预防慢性病方面起重要作用。
主要参考文献
Kulathunga J, Simsek S. A Review: Cereals on Modulating the Microbiota/Metabolome for Metabolic Health. Curr Nutr Rep. 2022 Jun 3. doi: 10.1007/s13668-022-00424-1. Epub ahead of print. PMID: 35657489.
Marcelino G, Hiane PA, Freitas KC, Santana LF, Pott A, Donadon JR, Guimarães RCA. Effects of olive oil and its minor components on cardiovascular diseases, inflammation, and gut microbiota. Nutrients. 2019;11:1826.
Toral M, Robles-Vera I, de la Visitacion N, Romero M, Sanchez M, Gomez- Guzman M, Rodriguez-Nogales A, Yang T, Jimenez R, Algieri F, Galvez J, Raizada MK, Duarte J. Role of the immune systemin vascular function and blood pressure control induced by faecal microbiota transplantation in rats. Acta Physiol. 2019;227:e13285.
Zhang L, Ouyang Y, Li H, Shen L, Ni Y, Fang Q, Wu G, Qian L, Xiao Y, Zhang J, Yin P, Panagiotou G, Xu G, Ye J, Jia W. Metabolicphenotypes and the gut microbiota in response to dietary resistant starch type 2 in normal-weight subjects: a randomized crossover trial. Sci Rep. 2019;9:4736.