-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
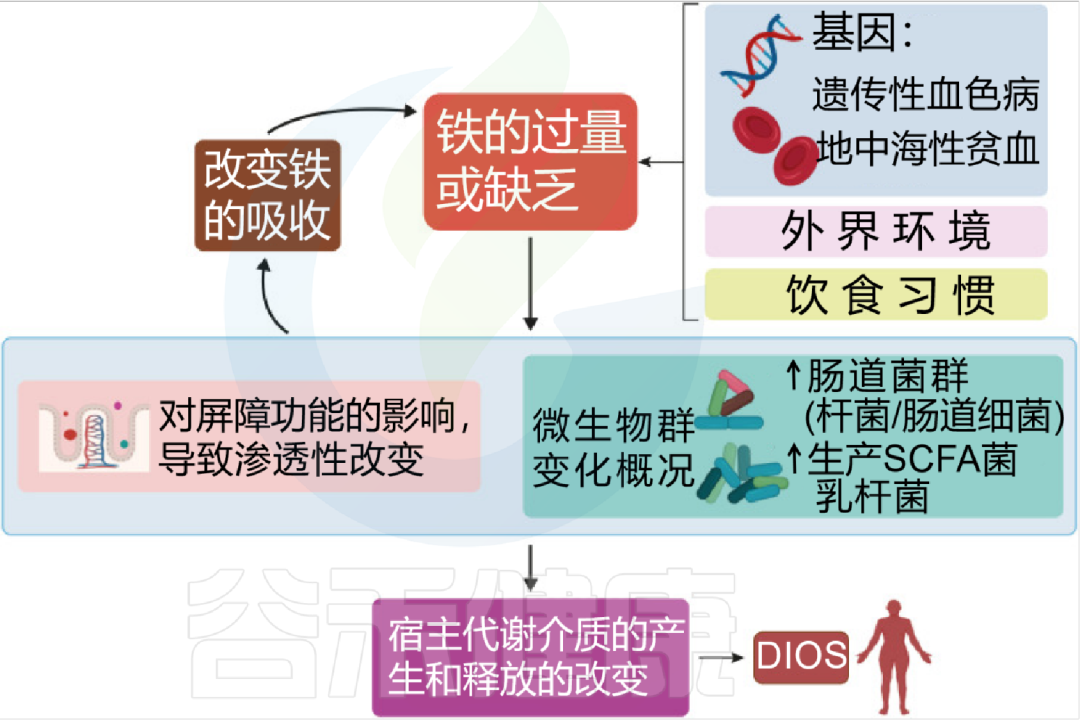
结肠,作为我们消化系统中的关键一环,却是最容易受到衰老影响的器官之一。随着年龄的增长,结肠的结构和功能发生了显著变化,这些变化会导致肠道屏障变得脆弱,进而影响我们的健康。
研究表明,衰老导致结肠黏膜上皮更新速度减缓,隐窝干细胞活性降低,紧密连接蛋白(如occludin、claudin、ZO-1)的表达异常。这些变化使得细胞通透性增加,黏液层变薄,黏液屏障的完整性下降。同时,免疫系统也出现了免疫衰老现象,降低了对有害菌的防御能力。
这一切都可能导致低度炎症状态,表现为内毒素易位和系统性炎症标志物的升高。而在微生态方面,老年人的肠道菌群多样性下降,产短链脂肪酸菌减少,潜在的促炎菌却相对增加,形成了一个恶性循环。
近年来,益生菌作为调节微生态和修复肠道屏障的干预策略,在老年相关便秘、抗生素相关腹泻、感染性腹泻、炎症性肠病辅助治疗和肠易激综合征等多个领域积累了丰富的临床证据。然而,益生菌的效果并非一概而论,它们的保护作用高度依赖于特定菌株,并受到个体差异的影响。
注:不同实验体系中的挑战因素(如大肠杆菌、TNF-α、LPS、氧化应激)、观测指标(如TEER、FITC-dextran通透性、紧密连接蛋白定位、炎症因子谱)和给药形式(活菌、热灭活菌、上清、菌体裂解物)都可能导致不同结论。因此,实际应用中仍需逐株验证其作用机制和可重复性,并明确其“预防型”、“抗炎型”或“修复型”的屏障支持作用。
本文将探讨衰老对结肠的影响,重点围绕益生菌是否能够改善肠屏障功能的临床证据,从结局指标和证据强度等方面进行梳理,尤其关注现有的随机对照试验,并总结不同菌株的具体功效及适应证,提出应用建议和研究展望。
01
衰老和结肠老化
随着年龄增长,身体各个器官以不同的速度衰老。这些变化跨度极大,可能只是轻微的外貌改变,也可能是严重的功能障碍,进而导致疾病、生活质量降低和死亡率增加。
脆弱的消化道:对衰老尤为敏感
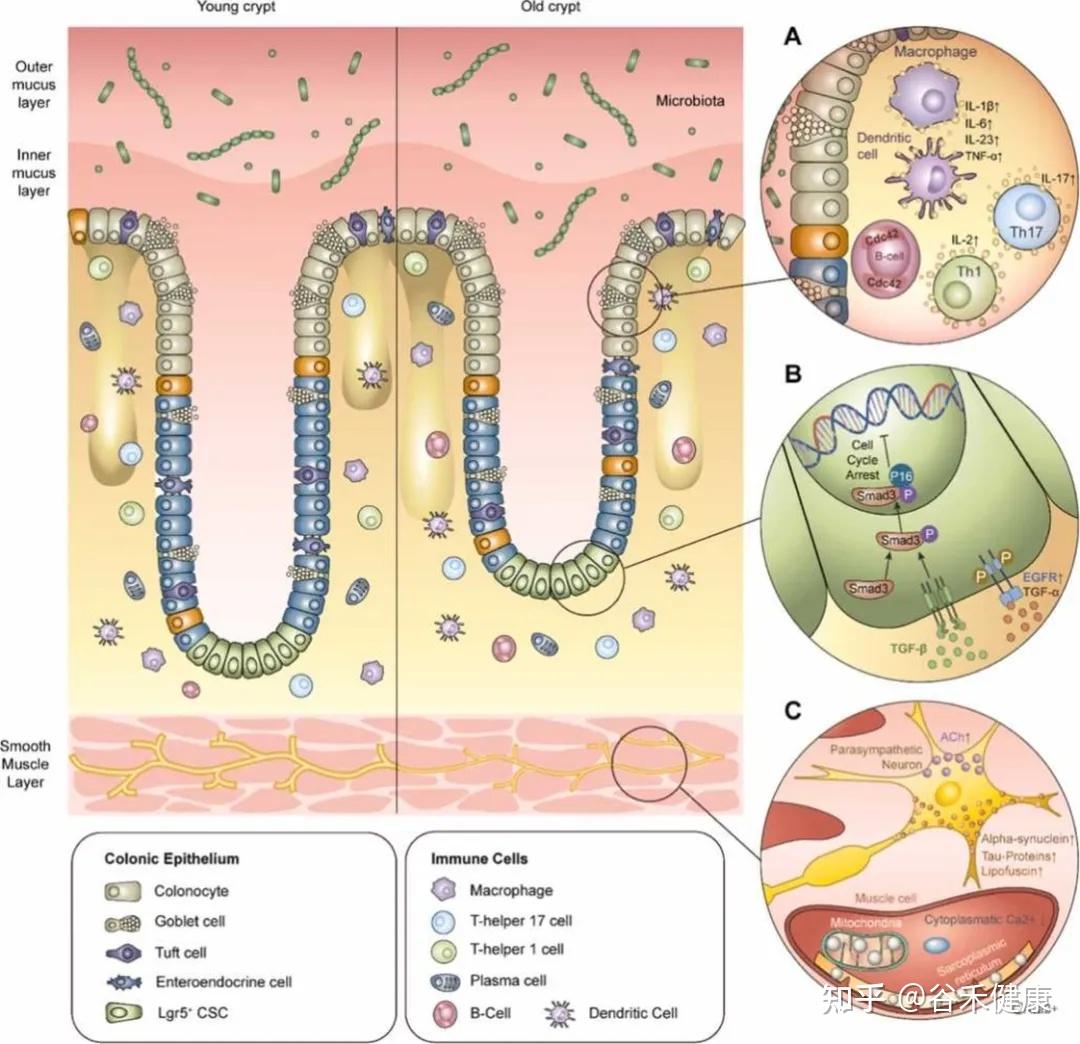
在全球范围内,65岁及以上人群(本文定义的“老年人”)中消化系统疾病发病率显著上升。衰老波及整个消化系统,程度不一,其中结肠似乎最容易受累。常见的相关疾病包括憩室病、结直肠癌、显微镜下结肠炎及慢性便秘,都是老年人常见的问题。
结肠不同部位老化不一样,研究有挑战
虽然这些疾病发病率很高,但科学界直到最近才开始重视人类结肠衰老的分子机制研究。研究老化的结肠特别具有挑战性。因为结肠像一个复杂的工厂,不同区段(升结肠、降结肠等)的结构和功能差异巨大,导致它们老化的方式也不尽相同。
此外,结肠包含多种细胞,每种细胞的老化路径都不同,再加上肠道菌群和局部免疫系统等外部因素的干扰,这让研究变得更加困难。
下面我们将从微观层面详细拆解:
上皮:脆弱的第一道防线
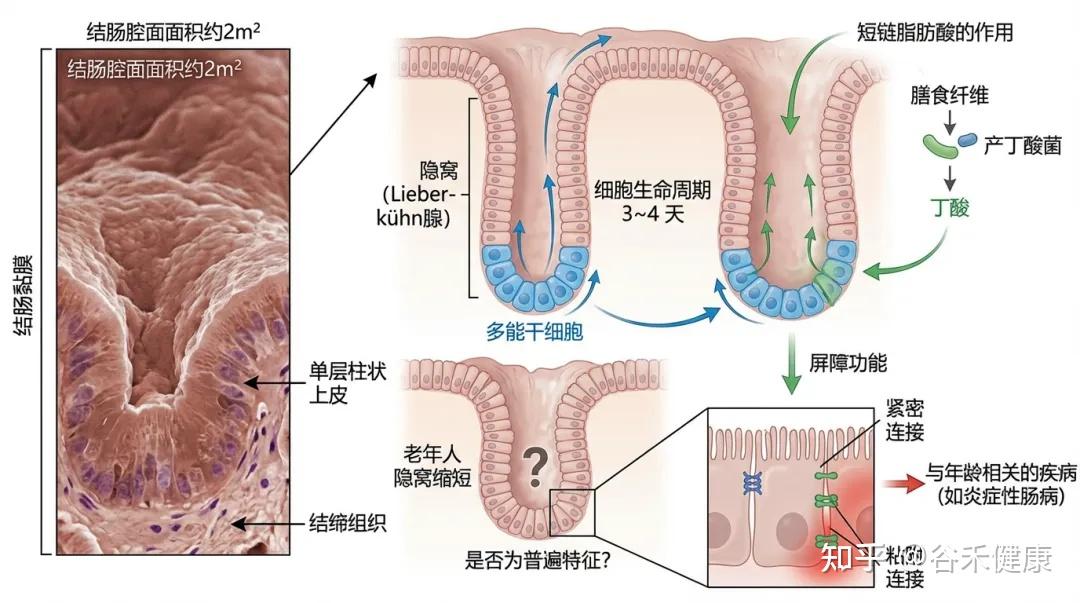
结肠的腔面面积约为2平方米,由结肠黏膜覆盖,黏膜由单层柱状上皮和结缔组织构成,上皮层向结缔组织内凹陷形成隐窝(Lieberkühn 腺)。
结肠的隐窝中有多能干细胞,负责快速更新肠细胞。这些细胞在3~4天内完成生命周期,最终脱落到腔内。(读过我们文章的可能了解,这个干细胞的更新需要短链脂肪酸,尤其丁酸,所以缺乏膳食纤维以及产丁酸菌会影响结肠隐窝底部的干细胞更新)
隐窝结构的老化
研究发现,老年人的隐窝可能会缩短,但是否这是结肠老化的普遍特征仍需进一步验证。
结肠上皮必须提供强大的屏障功能,允许选择性吸收水分、电解质和短链脂肪酸。屏障功能由紧密连接和粘附连接维持,任何功能障碍都可能导致与年龄相关的疾病加重,例如炎症性肠病(前面谷禾的文章也讲了很多关于肠道屏障的文章,其中上皮的构成紧密连接起到关键作用,相关阅读:什么是肠道屏障,影响因素,监测评估以及如何治疗干预 )。
研究显示,老年灵长类动物(非人)的结肠中,紧密连接蛋白显著减少,而在不同解剖区域的变化也存在差异。这表明,结肠的老化特征可能因部位而异。
杯状细胞的变化:为何重要?
衰老还影响结肠上皮的分泌成分。研究发现,老年小鼠的杯状细胞数量显著下降,伴随分泌功能受损。这些变化与慢性低度炎症及氧化应激有关,导致结肠屏障功能减弱(有兴趣可以翻翻以前关于肠道屏障的文章,影响因素以及干预等)。
在像结肠上皮这样的高复制组织中,组织的老化与结肠干细胞的老化密切相关,因为干细胞对于维持上皮的稳态至关重要。
干细胞老化的内外因素是什么?
影响结肠干细胞老化的因素可分为内因和外因。内因包括干细胞的基本特性和突变率,外因则涉及复杂的信号通路。例如,老年大鼠表现出表皮生长因子受体(EGFR)的基础活化增加,这可能与对TGF-α的敏感性增加有关。
Wnt信号在衰老中的作用:如何影响干细胞功能?
Wnt信号通路在维持干细胞功能中起着关键作用。研究发现,衰老小鼠的肠道干细胞中Wnt3水平降低,添加Wnt3可以恢复其形成类器官的能力。这表明Wnt信号在肠道衰老中扮演着重要角色。
内分泌细胞的功能:为何不可忽视?
尽管内分泌细胞在结肠上皮中所占比例不到1%,但它们在调节结肠运动和分泌中发挥着重要作用。老年小鼠的研究显示,肠内分泌细胞的数量显著增加,可能是对年龄相关受体抗性的补偿。
老年小鼠与人类的比较:有什么不同?
在人类乙状结肠中,尽管感觉神经密度降低,肠嗜铬细胞的数量却保持稳定。这表明老年结肠可能存在代偿性神经免疫适应。
表观遗传重塑与衰老:如何影响癌症风险?
衰老是结直肠癌的主要风险因素,结肠粘膜的表观遗传重塑可能是生理衰老与肿瘤发生之间的重要联系。研究发现,正常结肠粘膜中存在年龄相关的甲基化变化,这些变化可能导致癌症的发生。
表观遗传时钟的研究:如何评估衰老?
通过分析334份结肠粘膜样本,研究发现不同的表观遗传时钟与实际年龄之间存在强烈相关性。这些发现表明,功能失调而非加速的表观遗传衰老可能促进肿瘤易感性。
衰老结肠中的表观遗传漂移不仅反映了被动的分子磨损,更是一个塑造组织脆弱性的主动过程。受区域和环境因素影响的表观遗传衰老失调,可能是生理衰老与结直肠肿瘤发生之间的关键机制。
小 结
随着年龄的增长,身体各个器官就像老旧的机器,以不同的速度磨损,消化系统尤其敏感。65岁以上的人群中,结肠问题频繁出现,比如憩室病和结直肠癌,成为老年人常见的健康隐患。研究发现,结肠的不同部分衰老方式各异,内部细胞和微生物的互动让问题更加复杂。结肠上皮的脆弱性与干细胞老化和慢性炎症有关,这不仅影响消化,还可能增加癌症风险。了解这些变化,有助于减缓衰老带来的影响,提升生活质量。
在我们身体的消化系统中,结肠扮演着至关重要的角色。它的推进运动依赖于神经元与平滑肌细胞的精密协调。然而,随着年龄的增长,这种协调性逐渐受到影响,结肠的功能也随之下降。这一过程涉及复杂的生物机制,值得我们深入探讨。
神经网络的角色
结肠的神经网络是自主神经系统的重要组成部分,主要分布在以下两个区域:
这些神经元通过信号传递来调节肠道的运动和分泌,确保消化过程的顺利进行。
衰老对神经元的影响
研究发现,结肠中的神经元随着年龄的增长表现出不同的退行性变化:
-数量减少
胆碱能神经元(兴奋性)数量显著下降,而氮氧化酶神经元(抑制性)数量变化较小。
-形态变化
肠神经元的形态变化高度异质,且结肠周径的增加可能导致神经元密度的稀释效应。
这些变化意味着,尽管神经元的数量在减少,但观察到的密度下降可能并不完全反映真实的细胞损失。
在对13名成人尸检样本的分析中(<35岁 n=6;>65岁 n=7),研究者发现老年人肌间神经元总体减少。此外,另一项对16名患者(33-99岁)降结肠和乙状结肠的研究显示,Hu阳性和ChAT阳性神经元选择性丧失,而nNOS阳性神经元保持相对稳定。
有趣的是,最大规模的研究发现,肌间神经丛中的神经元总数随衰老并无显著变化。但在老年个体的升结肠中,ACh阳性神经细胞体数量却增加,这可能是由于轴突功能障碍导致神经递质在细胞体中积累。
神经支配的变化
结肠不仅受到内在神经元的支配,还受到来自交感神经和副交感神经的广泛外在神经支配:
随着年龄的增长,迷走神经和盆腔副交感神经的结构也经历了退化,影响了肠道的正常功能。
神经营养信号与细胞衰老
衰老过程还显著影响神经营养信号通路。研究表明,GDNF、RET和NOS1的表达在衰老过程中发生变化,提示营养支持的减少可能导致神经元维持能力的下降。此外,慢性衰老标志物p16的表达在老年患者的升结肠中增加,而在降结肠中未见类似变化。
胶质细胞的变化
肠道胶质细胞(EGCs)同样随着年龄的增长经历了结构重塑。尽管SOX10阳性肠道胶质细胞体的数量保持稳定,但S100阳性胶质细胞突起的密度显著下降。这种变化可能影响神经与胶质细胞之间的交流,从而损害神经肌肉协调能力。
小 结
随着年龄的增长,结肠的神经元和平滑肌细胞发生了明显变化。研究发现,兴奋性神经元数量减少,而抑制性神经元相对保留。神经元密度的下降可能是因为结肠周围的组织变大了。此外,衰老还影响了神经营养信号,导致神经元的维持能力下降。肠道胶质细胞也经历了结构变化,虽然数量保持不变,但功能可能受到影响。这些变化共同导致结肠的运动能力和整体健康下降。
结肠平滑肌细胞的作用是什么?
结肠中的平滑肌细胞(SMC)负责产生推进运动,并通过基线张力维持器官的结构完整性。收缩可以通过神经递质(乙酰胆碱,ACh)的化学方式或通过机电耦合来启动。在这两种情况下,收缩最终由钙离子从细胞外间隙和肌浆网流入细胞质来介导。这种钙内流激活肌球蛋白轻链激酶(MLC 激酶),它磷酸化肌球蛋白轻链(MLC),从而触发肌肉收缩。
年龄增长如何影响ACh的反应?
随着年龄的增长,ACh的作用似乎发生了变化。对老年大鼠和狒狒的多项研究表明,来自老年动物的结肠平滑肌细胞对ACh的收缩反应减少,或在接触ACh拮抗剂时放松受损。
在老年个体中,从升结肠分离的肌肉条对电场刺激表现出增强的放松反应,而降结肠的肌肉条则没有表现出类似的变化。
这些发现表明,衰老可能在结肠内引发区域特异性的神经肌肉功能改变,其中抑制通路在近端部分似乎被选择性增强。由于抑制性肠神经元的数量和功能能力在衰老过程中保持稳定,因此推测局部的胆碱能功能障碍可能是观察到的放松增强的根源,且这种障碍仅限于老化的升结肠。
钙稳态变化与胆碱能功能障碍:有什么联系?
关于结肠平滑肌细胞中钙稳态的年龄相关变化也有证据。在从老年大鼠的远端结肠提取的细胞中,细胞质钙水平减少,而钙则在线粒体和肌浆网中积累。
总体而言,观察到的结肠中的年龄相关变化似乎与其他器官中的平滑肌细胞变化相呼应。结肠平滑肌细胞是否存在特定于结肠的与衰老相关的变化仍需进一步研究。
小 结
结肠平滑肌细胞的主要功能是帮助推动食物并保持结肠的形状。随着年龄的增长,这些细胞对一种叫乙酰胆碱的神经递质的反应变得不如以前强,尤其是在升结肠部分,它们更容易放松。这种变化与细胞内钙的平衡失调有关,表明衰老可能导致结肠的神经和肌肉功能发生特定区域的变化。
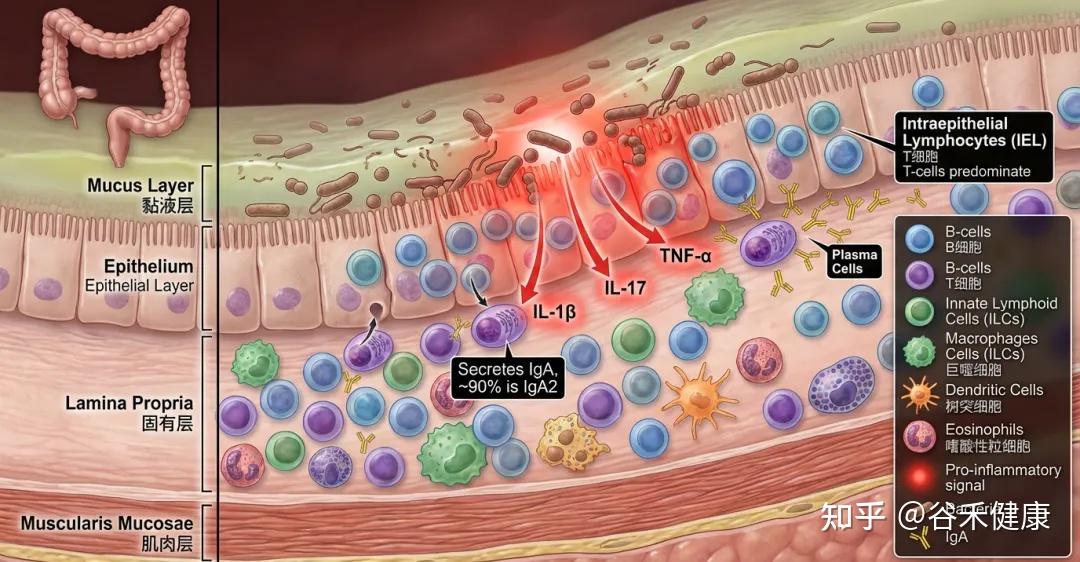
结肠里的免疫细胞有哪些?
结肠里的免疫细胞很多,主要集中在肠壁表面上皮细胞的下方(称为固有层),包括:
在上皮层内部还有一类“上皮内淋巴细胞”(IEL),以T细胞为主。结肠里“浆细胞”也很多,它们主要分泌IgA抗体(对肠道微生物的选择性定植非常关键),用来在肠道表面“温和地管住细菌”。其中大约90%是IgA2这一类型。
老年人的免疫系统:更易出现慢性炎症
老年人更容易出现“低度、长期”的炎症状态。衰老常见的特征之一是全身长期的低水平炎症,被称为“炎症衰老”。在结肠里也能看到类似现象:免疫系统更容易处在被激活状态,例如一些促炎信号分子增加(如IL-1β、IL-6、IL-17、TNF-α等),B细胞和T细胞也更活跃。
一种可能机制:黏液“隔离层”变弱,细菌更靠近肠壁,引发炎症。
黏液层的保护作用:为什么会变弱?
在衰老小鼠中,细菌更容易钻进这层本该相对干净的内层黏液,从而触发免疫反应和炎症。
进一步的链条可能是:衰老相关地出现一种小RNA(miR-124–3p)表达升高,它会抑制一种关键酶(T合成酶),这会影响MUC2这种黏液主要成分的“糖基化”(可以理解为:黏液蛋白需要正确“挂糖”才能形成坚固有效的保护层)。
免疫细胞的局部差异:老年小鼠的观察结果
研究人员用单细胞技术,对比了年轻和老年小鼠的结肠免疫细胞发现:老年小鼠结肠里“免疫细胞大类的比例”整体看起来变化不大。但如果把结肠按不同部位拆开看,就会发现明显的“局部差异”。
具体来说:
在盲肠和结肠远端(更靠近直肠的一段),老年小鼠的 T 细胞更容易处于被激活的状态,提示局部免疫反应更“紧绷”。
在结肠近端(更靠近小肠的一段),老年小鼠的 B 细胞和浆细胞更多。浆细胞是负责大量分泌抗体的细胞。
Cdc42基因的变化:与衰老有什么关系?
还有一个值得注意的发现:老年小鼠的 B 细胞里,Cdc42 这种基因/蛋白的表达更高。Cdc42 与干细胞衰老有关(包括造血干细胞和肠道干细胞),在人类老年人的血细胞中也发现会升高。这提示结肠局部免疫系统的老化变化,至少有一部分和血液中观察到的免疫老化现象是同方向的。
免疫系统衰老通常表现为免疫能力下降:更容易感染、肿瘤风险上升,也更可能出现免疫紊乱(包括自身免疫问题)。
研究结果显示,老年小鼠结肠免疫系统存在局部差异,反映出免疫功能的复杂变化及其对健康的影响。免疫能力下降导致肠道屏障脆弱,可能引发健康问题。因此,探索益生菌等干预手段以调节肠道功能、改善免疫状态和增强屏障功能显得尤为重要。接下来,我们将深入探讨益生菌对肠道健康的调节作用。
益生菌指的是“在适当剂量和适当组合下,能为所给生物体(如人类)带来健康益处的活微生物”。这些细菌长期被证明通过促进粘液层的形成、分泌抗菌因子、竞争性地粘附肠道上皮细胞以及增加紧密连接形成来调控肠道上皮功能。
益生菌通过多种机制调节肠道屏障功能,主要包括以下几个方面:
增强紧密连接结构
益生菌可通过上调紧密连接蛋白的表达来增强机械屏障功能。例如,研究发现某些乳杆菌和双歧杆菌菌株可增加occludin、claudins和ZO-1的表达,从而加固紧密连接结构,降低肠道通透性。
抑制炎症反应
慢性炎症是导致肠道屏障功能障碍的主要原因之一,而益生菌可通过多种途径抑制炎症反应:
特别值得一提的是,益生菌还可通过激活过氧化物酶体增殖物激活受体γ(PPARγ)来发挥抗炎作用。PPARγ是一种核受体,可调节炎症反应和细胞分化,某些益生菌菌株可通过激活PPARγ来保护肠道屏障功能。
调节肌球蛋白轻链激酶(MLCK)通路
肌球蛋白轻链激酶(MLCK)是调节紧密连接通透性的关键酶。炎症因子可通过激活MLCK,导致肌球蛋白轻链磷酸化,进而破坏紧密连接结构。益生菌可通过抑制MLCK表达或活性来保护肠道屏障。
例如,罗伊氏乳杆菌可通过下调MLCK表达,减轻肠毒素诱导的肠道屏障功能障碍。这一机制在预防和治疗感染性腹泻中具有重要意义。
激活模式识别受体
益生菌可通过与肠道上皮细胞表面的模式识别受体(PRRs)相互作用来调节肠道屏障功能。其中,Toll样受体2(TLR-2)是研究较多的受体之一。
研究发现,某些益生菌菌株可通过激活TLR-2,触发下游信号通路,促进紧密连接蛋白表达和抗炎因子产生。例如,双歧双歧杆菌BB1可通过TLR-2/p38 MAPK通路增强肠道屏障功能,同时抑制NF-κB激活,发挥双重保护作用。
调节肠道菌群平衡
益生菌作为肠道生物屏障的重要组成部分,可通过以下方式调节肠道菌群平衡:
肠道菌群平衡的恢复可减少有害菌对肠道屏障的破坏,同时增加有益菌的保护作用,形成良性循环。
改善消化功能
益生菌可促进食物消化和营养吸收,缓解多种消化问题:
调节免疫功能
肠道是人体最大的免疫器官,益生菌可通过调节肠道免疫细胞活性来增强全身免疫功能:
这些作用使益生菌在预防感染、过敏和自身免疫性疾病方面具有潜力。
影响代谢和体重管理
近年来研究发现,益生菌还可能通过”肠-脑轴”和代谢调节影响体重和代谢健康:
虽然这一领域的研究仍在深入,但已有证据表明某些益生菌菌株可能有助于预防肥胖和代谢综合征。接下来,我们将具体探讨哪些益生菌对肠道健康和代谢调节具有积极影响,以及它们如何在改善整体健康方面发挥作用。
乳杆菌属是发酵食品生产中最广泛使用的益生菌之一,这些食品来源包括动物(例如牛奶和肉类)和植物(例如蔬菜和谷物)。
乳杆菌属包括一大类异质的革兰氏阳性兼性厌氧菌,包括嗜酸乳杆菌(L.acidophilus) 、鼠李糖乳杆菌(L.rhamnosus)、发酵酵母菌(L.fermentum)、干酪乳杆菌(L.casei)、植物乳杆菌(L. plantarum)、瑞士乳杆菌(L. helveticus)、罗伊氏乳杆菌(L. reuteri)
除了在食物发酵中的作用外,乳杆菌属还因物种、宿主年龄或肠道位置不同而异,是人类和动物消化系统中健康的组成部分。
动物研究和临床前结果表明 ,乳杆菌可能有助于预防和治疗多种胃肠道疾病。这些疾病包括肠道感染、抗生素相关腹泻、早产儿 NEC、炎症性肠病、结直肠癌和肠易激综合征。
多项研究证实 ,乳杆菌在消化系统疾病管理中发挥重要作用,通过体外和体内维持上皮屏障完整性。该功能的多种机制包括调节细胞骨架、诱导粘液生成以及紧密连接蛋白的磷酸化,这些都会增强紧密连接功能和免疫反应,同时预防上皮细胞凋亡。
以下总结了乳杆菌的不同菌株及其在肠道健康中的作用。
✧ Lactobacillus amylophilus D14
研究发现,把Lactobacillus amylophilus D14 加到健康状态的肠道细胞(Caco-2)上时,细胞之间的紧密连接通透性不会发生变化,也就是不会让屏障变得更松或更紧。
但如果这些细胞先被致病菌(肠源性大肠杆菌 K88 或鼠伤寒沙门氏菌 SL1344)弄伤,D14 就能起到保护作用,它可以减少关键连接蛋白(ZO-1、claudin-1、E-cadherin)的受损,从而帮助维持紧密连接和屏障功能。其原因可能是 D14 抑制了细胞内的 ERK 信号通路活化(ERK 的磷酸化降低),并减少炎症因子 IL-8 的释放,进而减轻炎症和屏障破坏。
✧ 嗜酸乳杆菌 (Lactobacillus acidophilus)
嗜酸乳杆菌 (Lactobacillus acidophilus) 表面有一种特殊的“外衣蛋白”,叫表面层蛋白(Slp)。
嗜酸乳杆菌的外衣蛋白有什么作用?
研究发现,这种蛋白对肠道有多方面的保护作用,比如:
抢先占住肠道黏膜上的“附着位点”,让有害菌不容易黏上去,帮助肠道细胞减少不必要的凋亡(细胞过早死亡),降低脂多糖(LPS,常见于某些细菌成分)引发的炎症反应。
Slp如何增强肠道屏障?
在细胞实验中,研究人员把Slp作用在Caco-2细胞(常用来模拟肠道上皮的细胞模型)上,发现它能让肠道屏障更牢固,表现为:
注:TER可以理解为用电学方法测试上皮细胞层“漏不漏”。TER越高,说明细胞之间的连接越紧密、屏障越强;TER越低,说明屏障受损、变漏了。
不同菌株的效果差异明显
一项研究比较了20多种益生菌(不同物种和不同“菌株”)对肠道屏障的影响,重点看它们能不能把肠道上皮细胞之间的紧密连接变得更牢。
结果发现嗜酸乳杆菌整体上能明显增强这种封口功能,但同一种细菌的不同菌株效果差很多。
LA1:效果最好,增强幅度接近翻倍
LA2:只有大约一半的提升
LA3:几乎没有影响
这说明:益生菌不能只看“是什么菌”,还要看“是哪一株”。
LA1的保护机制是什么?
进一步研究显示,LA1之所以有效,是因为它能被肠道免疫系统表面的识别开关(TLR2与TLR1/6组成的受体组合)识别并触发信号,从而加强屏障。用小鼠实验也看到:在正常小鼠中,LA1可以减轻一种用DSS诱导的结肠炎;但在缺少TLR2的敲除小鼠里,这种保护作用就消失了,说明LA1的效果离不开TLR2这条通路。
注:TLR-2 指 Toll 样受体 2(Toll-like receptor 2),是一种先天免疫的模式识别受体(PRR),常表达在肠上皮细胞和免疫细胞表面,用来识别微生物成分并触发信号通路。
不同细胞中的信号通路有何不同?
最近的研究发现,同一种乳酸菌成分(LA1)在不同细胞里“走的通路”不一样,所以产生的效果也不一样。
在免疫细胞里LA1会通过TLR-2这类警报器启动经典的炎症信号通路(依赖MyD88),进而激活NF‑κB,让免疫细胞更容易进入应战状态。这属于比较符合预期的免疫激活反应。
在肠道上皮细胞里LA1同样需要TLR‑2,但不走MyD88这条路,而是改走PI3K通路。结果不是“点火”,而是“刹车”——它能抵消TNF‑α这种炎症因子造成的肠道紧密连接变松、通透性升高的问题,从而降低NF‑κB和MLCK等会破坏屏障的分子活性,帮助肠道屏障更稳。
其他乳杆菌的表现如何?
L. acidophilus W37:让TER提高约15%,说明屏障更“紧”。
L. brevis、L. casei:对TER没明显影响。
注:Caco‑2 是来源于人结肠腺癌的上皮细胞系。它常被用来在体外建立“肠上皮屏障模型”,因为在 Transwell 等培养条件下会分化成类似小肠吸收上皮的单层细胞,形成紧密连接,能模拟肠屏障的通透性变化。
常用指标:TER/TEER(跨上皮电阻)和 TER/TEER,以及分子通量(如葡聚糖/荧光葡聚糖)。
有研究发现,嗜酸乳杆菌分泌的一些代谢产物,能让肠道细胞之间的“缝隙”变得更紧:细胞屏障的紧密度指标(TER)会小幅上升(约25%),而一些大分子(比如葡聚糖)从细胞间漏过去的量会减少。进一步看机制,这种乳杆菌的“培养上清液”(相当于它在培养液里释放的各种物质)能抑制炎症信号通路NF-κB的激活,并把紧密连接相关蛋白(如occludin、claudin-1)的状态恢复到更正常,从而防止炎症因子IL‑1β导致的肠道屏障“变漏”。
热灭活的嗜酸乳杆菌还有用吗?
有报告指出,即使把嗜酸乳杆菌加热杀死(热灭活),它本身以及它的上清液也能在另一种肠道细胞模型(HT‑29)里减轻阿司匹林造成的屏障损伤,主要和调节紧密连接蛋白ZO‑1的表达与位置有关。
Lcr35对肠道屏障的保护作用如何?
为了研究另一株乳杆菌Lcr35对肠道屏障的保护作用,研究人员用Caco‑2细胞在体外搭了一个“肠道屏障模型”,并在细胞下方放入免疫细胞(PBMC)模拟免疫环境。然后用沙门氏菌的LPS(会引发炎症的细菌成分)去刺激细胞,模拟感染带来的炎症损伤。结果是:只用LPS会让屏障变差;但在LPS刺激后再加入Lcr35,并培养到48小时,屏障紧密度(TER)明显回升,比仅LPS组高了87%。这提示Lcr35可能帮助修复被LPS破坏的肠道屏障、减少“肠漏”。
Lcr35如何影响炎症反应?
此外,Lcr35 还能明显减少一种炎症信号分子 IL-8 在“肠上皮细胞 + 免疫细胞(PBMC)”共培养体系中向基底侧(相当于体内朝向血液的一侧)释放,说明它有助于降低炎症反应。
干酪乳杆菌(Lactobacillus casei)
最近有研究专门看了干酪乳杆菌(Lactobacillus casei,简称 L. casei)对“肠道屏障受损”的保护作用,并探讨是否和肥大细胞有关。
结果发现:和对照相比,干酪乳杆菌能让猪肠上皮细胞的“电阻值(TER)”提高约 60%(电阻越高通常表示屏障越紧密),同时让大分子(葡聚糖)的渗漏减少 80% 以上。面对会引发腹泻的致病菌产肠毒素性大肠杆菌 K88(ETEC K88)时,干酪乳杆菌能减轻肠屏障变漏的情况,关键在于它能阻止紧密连接相关蛋白(occludin、claudin-1、ZO-1)以及免疫识别相关受体(TLR-2、TLR-4)的表达被病原体“压低”。
L. casei DN-114 001
更早的研究也发现,L. casei DN-114 001 的“菌体裂解物”(把菌体打碎后的成分)可以在小鼠 DSS 诱导的肠炎模型中起到保护作用,带来健康收益。L. casei 能抑制 DSS 导致的肠道渗漏增加,这与它降低炎症因子 TNF-α 和 IFN-γ、并改变肠道菌群组成有关。
还有研究发现,L. casei DN-114 001 在 T84 肠上皮细胞中也能对抗肠致病性大肠杆菌(EPEC)感染带来的类似屏障损伤。
L. casei CRL 431:减少感染损伤
比较了不同乳杆菌对抗沙门氏菌感染的效果,发现:
在他们测试的菌株里,只有 L. casei CRL 431 能明显起到保护作用:表现为肠屏障功能更好、局部炎症更低,从而减少感染损伤。
有研究认为,起保护作用的是活菌,不是培养上清液
活的 L. casei 可以防止 TNF-α 和 IFN-γ 导致的 TER 下降。机制上,它可能通过激活 MAPK/PI3K/Akt 这类细胞信号通路、提高 TLR-2 表达,并保护 Caco-2 细胞中 ZO-1 蛋白的水平,从而避免炎症因子引起的通透性升高。
✧ 植物乳杆菌(Lactobacillus plantarum)
有研究发现,植物乳杆菌(Lactobacillus plantarum)以及它产生的一些成分,可能通过修补肠道屏障来减轻肠道炎症(比如溃疡性结肠炎模型中的结肠炎)。如果肠道屏障损伤,肠道通透性升高,细菌或毒素更容易“漏过去”,炎症就会加重。
下面是这些研究想说明的要点:
研究提示这种保护作用和 STAT3 这个细胞信号“开关”有关:如果在细胞实验里把 STAT3 敲低,再用 EPS116 处理,ZO-1 和 occludin 就上不去,肠道通透性反而变高。说明 EPS116 需要通过 STAT3 才能更好地“加固屏障”。
植物乳杆菌可在感染情况下保护肠道屏障
在人正常结肠上皮细胞模型(NCM460)中,植物乳杆菌能减轻 ETEC(产肠毒素大肠杆菌)感染对屏障的破坏。还有研究显示它能增强 NK 细胞产生 IL-22(一种有助于黏膜修复和屏障保护的免疫因子),即使在 ETEC 感染时也能帮助维持紧密连接屏障。
不同菌株对屏障电阻提升明显
屏障电阻(TER)可以粗略理解为细胞单层的密封程度指标:TER 越高,说明屏障越紧密、渗漏越少。
L. plantarum DSM 2648:让 Caco-2 细胞 TER 比对照提高约 235%;还能显著抵消致病性大肠杆菌(EPEC)对 TER 的破坏,并减少 EPEC 黏附。
L. rhamnosus HN001:也能提高 TER(约 148%)。
L. plantarum MB452:在 10 小时内让 TER 随剂量增加,最高比对照高约 60%;同时提高 ZO-1 和 occludin 的表达。
植物乳杆菌 HY7714 可能通过关掉炎症通路,保护紧密连接
在TNF-α(强促炎因子)处理的 Caco-2 单层模型里,HY7714 能保护 ZO-1、claudin-1、occludin 不被破坏。它还抑制一些与炎症和屏障破坏相关的信号(如 NF-κB、MLCK 等)被 TNF-α 诱导升高,提示其可能通过降低炎症信号来维持屏障完整。
植物乳杆菌 LR002 改善小鼠溃疡性结肠炎
修屏障 + 抗炎 + 调菌群。在 DSS 结肠炎/UC 模型中,LR002 能恢复紧密连接蛋白(ZO-1、Occludin、Claudin-3)的水平。同时降低促炎因子、减少氧化应激;调节肠道菌群,并让短链脂肪酸(SCFA,肠道有益代谢物)水平回升。
机制上可能与激活PPARγ信号、抑制 MAPK/NF-κB 炎症通路有关。
这些研究总体指向同一件事——某些植物乳杆菌菌株或其代谢产物,可能通过增强紧密连接蛋白、降低炎症信号、改善菌群与代谢物,来减少“肠漏”和肠道炎症;不同菌株差别很大;人体研究里未必能直接看到“阻止肠漏”的效果,但在组织/细胞与动物模型中,某些植物乳杆菌确实能增强紧密连接、减轻炎症、提高屏障相关指标。
扩展阅读:
客观认识植物乳杆菌 (L. plantarum) 及其健康益处
✧ 鼠李糖乳杆菌(Lactobacillus rhamnosus)
鼠李糖乳杆菌 LGG 在儿童克罗恩病中的初步研究
较早的研究把一种常见益生菌——鼠李糖乳杆菌 LGG——用于儿童克罗恩病(CD)。结果发现:肠漏明显改善(用尿液中的双糖通透性试验来测),疾病活动度也下降了。但可惜的是,这种改善在随访到 24 周时没有持续下去。
特定菌株 CNCM I-3690 的保护机制
后来又有研究指出:鼠李糖乳杆菌的某个特定菌株 CNCM I-3690,在小鼠炎症模型里能保护肠道屏障。它可以阻止炎症因子 TNF-α 让肠上皮细胞“缝隙变大”(表现为电阻下降),还会影响杯状细胞和黏液层(相当于让肠道表面的保护胶层更稳)。
小鼠的结肠基因表达分析还显示,这个菌株可能通过抑制某些体内蛋白酶,来增强一批与健康肠道屏障相关的基因活动,比如与营养吸收、细胞更新和防护功能有关的基因。
体外实验支持 LGG 的保护作用
很多体外实验(细胞/类器官实验)也支持:活的 LGG 对紧密连接有保护作用,能让屏障在炎症或病原体攻击时更不容易被破坏。
用 TNF-α 和 IFN-γ 模拟炎症攻击 Caco-2 细胞时,活 LGG 可以减轻屏障受损,可能与抑制 NF-κB、ERK1/2 等炎症通路有关;而一些其他乳杆菌即使用更高浓度,也未必能达到同样效果。
在人肠道类器官实验中,活 LGG 能防止 IFN-γ 把关键的紧密连接蛋白压下去。
在“麦醇溶蛋白”(与小麦相关蛋白)诱导屏障变漏的模型中,LGG 能把屏障功能拉回去;不仅活菌有效,热杀死的菌体和它的培养上清(菌分泌/代谢产物的混合物)在某些实验里也显示出一定恢复效果。
在细菌感染中的保护作用
细胞先用活 LGG 处理后,再感染肠出血性大肠杆菌(EHEC O157:H),可以减轻屏障电阻下降、通透性升高,并阻止紧密连接蛋白(如 claudin-1、ZO-1)被“挪位/打散”。但热灭活 LGG 在这类实验里往往效果不明显,提示“活菌状态”可能很关键。
其他不同的 L. rhamnosus 菌株也各有差异
有的本身对屏障指标影响不大,但在大肠杆菌攻击时能起到保护;有的能抑制 TNF-α 造成的损伤并减少 IL‑8(炎症信号)上升,但它的培养上清却未必有效。
总结来说,不少实验提示某些鼠李糖乳杆菌(尤其是 LGG 及特定菌株)可能通过稳定紧密连接、维持黏液层、调节炎症信号等方式,帮助肠道不那么容易漏。但不同菌株、活菌/灭活、以及人体长期效果差异很大;早期儿童克罗恩病研究里也出现了短期改善、长期不一定维持的情况。
✧ 发酵乳杆菌(Lactobacillus fermentum)
发酵乳杆菌 AGR1487
和其他益生菌菌株不一样,发酵乳杆菌 L. fermentum 的 AGR1487 这一株在肠上皮细胞模型(Caco-2)里会削弱屏障:给得越多,细胞层的电阻(TER,常用来衡量屏障是否紧密)下降得越明显,说明细胞之间的封条变松了。
但有趣的是,如果不把细菌本身加进去,而是加入它培养后留下的上清液(可以理解为细菌分泌物/代谢产物的混合液),反而会让TER比对照培养基提高约34%,也就是屏障变得更紧。
AGR1485的不同表现
相比之下,同一物种的另一株 AGR1485(无论是细菌本体还是上清液)对TER基本没影响。
另外,AGR1487 还会让甘露醇更容易穿过细胞单层(甘露醇通量增加),这通常意味着屏障通透性变高、漏得更多;而 AGR1485 不会造成这种变化。
这意味着即使是同一种乳杆菌,不同菌株也可能作用完全不同。AGR1487 会以不利于紧密连接屏障的方式改变细胞内相关基因和蛋白(包括微管蛋白及其相关蛋白)的水平,最终导致肠道屏障功能变差。
✧ 罗伊氏乳杆菌(Limosilactobacillus reuteri)
最近一些研究发现,某些罗伊氏乳杆菌(Limosilactobacillus reuteri)可能有助于加固肠道屏障、降低肠漏风险。
高脂饮食小鼠模型中的积极效果
在高脂饮食小鼠中的发现,研究人员从人类母乳中分离到一株罗伊氏乳杆菌(L. reuteri FN041)。把它给高脂饮食(HFD)的小鼠后,发现小鼠原本因高脂饮食而更漏的肠道(肠通透性升高)得到了缓解。
与此同时,一些与炎症相关的物质(如LPS、TNF-α、IL-16)水平下降。肠道屏障的关键“封条蛋白”(紧密连接蛋白,如occludin、ZO-1、claudin-6、claudin-7)在高脂饮食下通常会减少,而FN041能阻止这种下降。研究者认为,这种益处与肠道菌群产生的短链脂肪酸变化有关(研究中提示与短链脂肪酸减少相关)。
对细胞层渗漏的抑制作用
在仔猪肠道细胞+致病菌模型中的发现,使用从健康断奶仔猪粪便中分离的罗伊氏乳杆菌,先用它“预处理”肠上皮细胞(IPEC-1),再让细胞感染致病性大肠杆菌ETEC K88。
结果发现:预处理能减少细胞屏障被破坏、降低大分子(如葡聚糖)穿过细胞层的渗漏。但如果只用罗伊氏乳杆菌而不感染细菌,效果不明显或较弱。机制上,这种保护与维持紧密连接蛋白(尤其ZO-1、occludin)有关,并且可能通过MLCK相关通路来实现。也有研究观察到:单独用罗伊氏乳杆菌处理时,细胞层的渗漏指标甚至可降低约25%。
不同菌株的效果略有差异
处理IPEC-J2细胞10小时后,细胞层的电阻(TER,数值越高通常代表屏障越紧)只小幅上升约8%,并伴随claudin-1、occludin、ZO-1轻度增加。更重要的是,在LPS(内毒素)刺激下,这株菌的活菌或培养上清都能阻止紧密连接蛋白被下调,同时抑制炎症因子(TNF-α、IL-6)过度升高。
它也能让TER上升约10%,并减少ETEC导致的屏障变漏。
研究者还发现另一种益生菌詹氏乳杆菌(Lactobacillus jensenii)也能在ETEC攻击时起保护作用,但在没有感染压力时,单独使用对屏障影响不明显。它们的保护效应可能与提升热休克蛋白HSP-27以及增加ZO-1有关,意味着这个菌株是发挥感染压力下的保护作用,而不是预防或维持作用。
扩展阅读:
认识罗伊氏乳杆菌(Lactobacillus reuteri)
✧ 唾液乳杆菌 (Lactobacillus salivarius)
L. salivarius SMXD51处理Caco-2细胞24小时后,可使跨上皮电阻(TER)提高约20%;同时还能对抗铜绿假单胞菌PAO1引起的TER下降,起到保护肠道屏障的作用。这种益生与保护效果被认为与上调F-肌动蛋白细胞骨架有关。
进一步比较了不同L. salivarius菌株对过氧化氢(H₂O₂)造成的屏障损伤的保护能力。在检测的33株菌中,UCC118和CCUG38008能通过依赖ERK1/2磷酸化的途径,减轻H₂O₂导致的紧密连接(TJ)蛋白(ZO-1、occludin、claudin-1和JAM)的降解与错位;而无效菌株AH43324则没有这种作用。
在迄今为止报道的各种益生菌细菌中,Bifidobacterium spp.是研究最广泛和使用最广泛的益生菌细菌之一。双歧杆菌属属于放线菌门,目前包括80个(亚)种,它们分布在不同的生态位,包括人类的胃肠道,口腔等。
双歧杆菌属是最早定植人类肠道的细菌,与母乳衍生的低聚糖有关。因此,它们占母乳喂养婴儿肠道中微生物占比很高。B. breve、B. bifidum、B. longum、Bifidobacterium infantis是婴儿阶段常见的检测到的细菌,其中B. bifidum是最突出的物种,其次是B. breve、B. longum、B. infantis。
随着年龄的增长,双歧杆菌的总体下降,但在整个成年期保持相对稳定,并在老年时再次下降。成人肠道中常见的物种包括B. adolescentis和B. catenulatum,其次是B. longum 和 B. bifidum。
需要注意的是,并不存在绝对的“婴儿专属种”和“成人专属种”,只是不同年龄段更常见的种类不同。
为什么双歧杆菌被当作益生菌?
双歧杆菌因为被认为较安全(很多菌株具有GRAS地位,意思是通常被认为是安全的),而且与多种健康益处相关,所以被广泛做成益生菌产品。研究中常提到的潜在作用包括:
因为双歧杆菌本来就是人体肠道的常住居民,不少研究认为它对于维持肠道上皮屏障完整性很关键。
一些研究用16S rRNA(常见的菌群测序方法)分析溃疡性结肠炎患者的肠道菌群时发现:双歧杆菌明显减少,尤其是B. bifidum减少更突出。这提示双歧杆菌(特别是B. bifidum)可能与溃疡性结肠炎的发生发展有关,也可能成为一种有参考价值的微生物标志物。
双歧杆菌怎么加固肠道屏障?
在细胞实验中(如Caco-2、HT-29、T-84等肠上皮细胞模型),用某些双歧杆菌先处理细胞,能够减轻多种因素造成的紧密连接损伤。
机制上常见的解释包括:
一个具体例子:B. bifidum BB1菌株
研究发现,B. bifidum 的某个特定菌株(BB1)能以菌株特异性的方式把肠上皮细胞单层的屏障变得更紧(用TER指标衡量,最高可增加50%–80%,TER越高通常表示屏障越紧)。
保护肠道的机制
有研究用DSS(一种常用来在小鼠体内制造结肠炎/肠损伤的化学物质)做肠道损伤模型,发现一株双歧杆菌 B. bifidum FL-228.1 的预防效果最明显。它之所以能保护肠道,主要做了几件事:
不同双歧杆菌的保护效果
其他动物研究也发现,不同双歧杆菌在多种胃肠道疾病模型中都可能对肠屏障有帮助,例如:
NEC(新生儿坏死性小肠结肠炎)模型:B. infantis能减轻肠通透性升高(不那么漏),并更好地维持 occludin、claudin-4 等紧密连接蛋白在细胞连接处的正常分布,从而降低 NEC 发生率。
另一种 NEC 大鼠模型:B. bifidum 也被证明能改善肠道完整性。
DNBS 诱导的轻度肠炎模型:B. animalissubsp. lactis 能把肠道通透性拉回正常水平,机制包括让多种紧密连接蛋白(尤其 claudin-4)恢复正常,同时帮助结肠局部免疫细胞(Th1/Th2)维持更平衡的状态。
DSS 结肠炎模型:不同菌株效果不一样。有研究显示 双歧杆菌的某个菌株(CCM 7952)能维持紧密连接蛋白表达、降低血液中“肠漏”指标(如 FITC-葡聚糖),疾病严重度也更低;但同物种的另一个菌株(Bl 372)却做不到,说明“菌株差异”很关键。
酒精相关肝病与双歧杆菌的菌株特异性
在酒精相关肝病(长期饮酒)方面,很多研究认为:长期饮酒会导致肠道菌群和代谢物失衡,使肠屏障受损、通透性上升;这样细菌内毒素 LPS 更容易进入门静脉循环,激活 TLR4-NF-κB 通路,引发更多炎症因子。
体外实验也发现,双歧杆菌可以在 LPS 处理的肠上皮细胞模型中降低炎症因子(如 IL-6、TNF-α),并上调/稳定紧密连接蛋白(occludin、claudin-3、ZO-1),从而减少细胞间渗漏。
特别需要强调的是:双歧杆菌的作用高度菌株特异性。同属甚至同种的不同菌株,效果可能完全不同,甚至在免疫反应上方向相反。因此,不能因为某一株有效,就推断所有双歧杆菌都有效。
一些更间接的保护方式
B. infantis 的“无菌条件培养上清”(可以理解为它产生的可溶性代谢物混合物)能抑制 NF-κB 炎症通路,减少 TNF-α 等炎症因子,并阻止炎症因子诱导的肠通透性升高。
B. bifidum 通过酶作用产生成分(如半乳寡糖)后,可能减少沙门氏菌对肠道的黏附和侵袭(相当于降低致病菌“粘上去、钻进去”的机会)。
最后,虽然证据很多,说明双歧杆菌对维持肠屏障有益,但分子机制为什么会这样、到底哪条通路最关键,仍然没有完全弄清。
未来研究的挑战与方向
目前有以下主要难点:
1)菌株差异太大,很难用一套机制解释所有双歧杆菌;
2)它们和人体细胞、以及肠道里其他微生物之间相互作用非常复杂;
3)双歧杆菌不太容易做遗传改造,导致研究工具受限。
未来如果有更好的分子生物学工具、更聚焦的研究,才更有希望把双歧杆菌如何与人体互作并发挥作用的关键机制讲清楚。
扩展阅读:
其他益生菌
✧ 布拉氏酵母菌 (Saccharomyces boulardii)
对肠道屏障的保护作用
较早的研究表明,布拉氏酵母菌(S. boulardii)保护T84单层中EPEC诱导的TER降低和甘露醇通量增加;然而,布拉氏酵母菌不改变健康T84细胞中的TJ屏障功能。
布拉氏酵母菌的保护作用是通过ZO-1的保存和ERK1/2信号通路的抑制介导的。
临床效果
布拉氏酵母菌在第三个月末与未接受益生菌治疗的患者相比,CD患者的肠通透性降低33%。
此外,S. boulardii CNCM I-745已显示出保护免受病原体诱导的TJ屏障功能障碍。
影响上皮屏障完整性的作用
布拉氏酵母菌共孵育有助于维持上皮屏障完整性,而预孵育是显著减少IL-8分泌所必需的。布拉氏酵母菌通过阻断MLC磷酸化并抑制T84感染细胞中的NF-κB和MAPK信号通路来保护屏障功能并抑制EHEC诱导的炎症。
对 Shigella flexneri 感染的影响
另一项研究使用人肠上皮的体外和体内模型检查了布拉氏酵母菌对Shigella flexneri感染的影响。在感染期间,布拉氏酵母菌通过上调TJ蛋白ZO-2并减少ERK、Jun N-末端激酶(JNK)和NF-κB信号通路的激活来增强屏障完整性。
抗炎作用的验证
无细胞布拉氏酵母菌上清液重现了这些抗炎作用。布拉氏酵母菌的抗炎作用在人胎儿肠异种移植模型中得到证实,其中酵母菌株减轻S. flexneri造成的损伤和炎症,但不能预防感染。
✧ E. coli Nissle 1917 (EcN)
只有活的 EcN 益生菌(以及它培养后的上清液,也就是细菌分泌物所在的液体)才能明显增强肠道上皮细胞的“紧密连接”屏障;把细菌热杀死后就几乎没效果。
细胞模型中的屏障增强
在 HT-29 和 Caco-2 细胞模型里,活菌或上清液能让细胞层的电阻(TER,代表屏障紧密程度)提高约 40%–75%,同时让甘露醇这种小分子“漏过去”的程度降低约 40%。
TcpC蛋白的作用机制
研究认为关键原因是 EcN 产生的一种蛋白 TcpC,它会启动细胞内的一些信号通路(如 PKCζ 和 ERK1/2 的磷酸化),并促进紧密连接相关蛋白(如 claudin-14)增加,从而把细胞之间的“缝”收紧。
EcN上清液对肠道屏障的保护作用
EcN 的上清液能防止化疗药 5-FU 导致的肠上皮细胞(IEC-6)屏障变差,表现为 TER 不那么容易下降。
在脓毒症相关的炎症条件下,EcN 上清液可以在体内和体外保护紧密连接屏障:它通过抑制 NF-κB 相关通路,减少会“拉开细胞缝隙”的 MLCK-P-MLC 信号被激活。并且在 TNF-α 和 IFN-γ 这类炎症因子一起存在时,EcN 上清液仍能提高 TER,从而减轻屏障功能障碍。
外膜囊泡的保护机制
EcN 释放的外膜囊泡(OMV,可理解为细菌分泌的“微小包裹”)和可溶性因子,能在 EPEC 致病菌感染时保护 T-84 和 Caco-2 细胞的紧密连接屏障,这种保护与 occludin 和 claudin-14 等紧密连接蛋白不被破坏有关。
在 DSS 诱导的结肠炎小鼠模型中,EcN 还能防止 DSS 造成的肠道通透性升高(减少“肠漏”),这与紧密连接支架蛋白 ZO-1 的表达得以维持有关。
✧ 枯草芽孢杆菌 (Bacillus subtilis)
比较了三种不同的枯草芽孢杆菌(B. subtilis)菌株对肠道上皮细胞模型(Caco-2)屏障的影响。结果发现:只有其中一株(B. subtilis 29784)能让细胞屏障更“紧”(电阻TER提高约50%),另外两株要么没效果,要么反而让屏障变差。
同时,B. subtilis 29784之所以能增强屏障,和细胞里几种“把细胞缝起来”的关键紧密连接蛋白增加有关,包括ZO-1、occludin和claudin-1。
在抗炎方面,不同菌株的效果也不一样(有明显“菌株差异”):某些B. subtilis菌株能抑制IL‑1β引发的NF‑κB信号通路激活,从而显著减少炎症相关物质IL‑8的产生,并降低IL‑1β刺激下iNOS蛋白水平的上升。
在坏死性小肠结肠炎(NEC)的细胞和动物模型中研究了两种益生菌(L. plantarum 和 L. rhamnosus)对肠道紧密连接的影响。
细胞实验结果显示屏障增强
在细胞实验里:他们把这两种菌加到 Caco-2 肠上皮细胞表面 5 小时。
结果显示:两种菌都能让细胞层更不漏(TER 升高、葡聚糖更不容易穿过去),说明屏障更紧。
当用 LPS 或 EGTA 这类物质去破坏屏障时,提前用这两种菌处理能减轻损伤,可能与调节 ZO-1(一种关键紧密连接蛋白)有关。
其中 L. rhamnosus 的保护效果看起来比 L. plantarum 更强。
动物模型中益生菌效果不一致
但在大鼠 NEC 模型里(用阪崎克罗诺杆菌感染诱导):直接给乳杆菌组合反而观察到肠道通透性增加(更漏),这与细胞实验相反。
不过如果在感染前先用这组益生菌预处理,通透性并不会增加,而且还能减少肠道损伤。
作者因此提醒:益生菌并不一定永远是“有益无害”,在某些条件下可能也会刺激或伤害肠上皮,所以临床使用特定菌株需要谨慎。
BWI多菌株益生菌的保护作用
有研究发现,一个叫 BWI 的多菌株益生菌混合物(含 8 种活菌 + 1 种热处理菌株成分)对肠屏障更稳:在 Caco-2 与免疫细胞(THP-1)的共培养模型中,它能维持 occludin(紧密连接蛋白)水平,并激活 AMPK 通路(有助于紧密连接组装),从而保护屏障完整性。
在 LPS 引发的炎症环境下,它还能抑制 NFκB 通路,降低促炎因子相关基因表达。
TER 测量也支持:BWI 能随剂量增加而更有效地防止通透性升高(减少“渗漏”)。
B. bifidum + 嗜热链球菌
一项双盲研究显示:含 B. bifidum 和嗜热链球菌(S. thermophilus) 的商业益生菌配方,能显著减少婴儿的抗生素相关性腹泻。
L. rhamnosus + L. acidophilus + L. helveticus
有研究把L. rhamnosus、L. acidophilus、L. helveticus混合给健康志愿者:当用吲哚美辛(NSAID)人为造成胃肠屏障受损时,活菌能明显减轻“胃”的通透性升高,但对“肠”的通透性影响不明显,说明作用可能因部位不同而不同。
L. helveticus R0052 + B. longum R0175
动物实验中,L. helveticus R0052 与 B. longum R0175联用,能保护心肌梗死后大鼠出现的肠道紧密连接通透性升高;但对健康对照大鼠的屏障并没有明显提升。研究者推测机制可能与抑制NF-κB炎症信号、激活抗凋亡通路以及TLR-2相关调节有关。
很多实验提示改善肠上皮屏障往往需要“活的菌”,因为它们要通过黏附、与上皮细胞直接互动等方式来触发紧密连接的调整;但在个别情况下,细菌产生的特定产物(如胞外多糖)也可能提供类似保护。不同菌株、不同部位、以及是否处在炎症/损伤状态下,都会影响效果。
肠道内壁的上皮细胞之间有一套紧密连接蛋白,像拉链/密封条一样把细胞缝隙关紧,防止细菌、毒素和未消化的大分子随意穿过去,同时又让营养正常吸收。这道屏障一旦变漏,就很容易引发或加重多种胃肠道问题,比如炎症性肠病、肠易激综合征、坏死性小肠结肠炎以及一些病原体导致的肠炎。
越来越多的细胞实验、动物研究和部分临床研究提示:某些益生菌可以帮助维持或修复这道封口带,它们可能通过以下方式保护肠屏障:
而且这些效果往往非常看菌株——同一种类的益生菌,不同菌株效果可能差很多;有时还取决于益生菌是不是活的、它分泌的代谢物、或它表面的成分。另外,它在上皮细胞和免疫细胞里起作用的方式也可能不一样。
不过,我们目前对“益生菌到底是怎样在分子层面修好TJ屏障”的理解还不够完整。
研究结果之所以经常不一致,常见原因包括:
未来更需要做的是:明确哪个菌株通过哪条通路,对哪类人群最有效,并结合肠道菌群检测的结果,分析不同菌群的组成和功能,以指导益生菌的选择。同时,应将剂量、给药方式、疗程标准化,再用设计良好的临床试验去验证这些策略的有效性。
总体来说,益生菌作为一种思路合理的干预手段,确实有潜力帮助加强肠道屏障、缓解与肠漏相关的胃肠疾病,但要实现可靠应用,还需要更扎实的机制研究和更严格的临床证据,免疫功能低下人群使用活菌也应更谨慎。
注:本账号发表的内容仅是用于信息的分享,在采取任何预防、治疗措施之前,请先咨询临床医生。
主要参考文献
Hofmann C, Geiger H. Aging of the Colon – A Mechanistic View. Mech Ageing Dev. 2025 Dec 11:112143.
Baidoo N, Rasis E, Tahiri D, Sanger GJ. The impact of ageing on the structural compositions of the mucosa of human colon. Tissue Cell. 2025 Dec;97:103090.
Abahussin HM, Alotaibi MS, Alhazzaa OA, Alotaibi AG, Alsaab SM, Aljawini NA, Alawad AO. Exploring the intricate link between gut microbiota dysbiosis and the aging process: implications for age-related diseases. Gut Pathog. 2025 Dec 14.
Elfers K, Sehnert AS, Wagner A, Zwirner U, Linge H, Kulik U, Poehnert D, Winny M, Gundert B, Aselmann H, Mazzuoli-Weber G. Functional and Structural Investigation of Myenteric Neurons in the Human Colon. Gastro Hep Adv. 2024 Aug 24;4(1):100537.

谷禾健康
在当代营养流行病学的视野中,我们长期致力于寻找一种最佳饮食模式。无论是地中海饮食、生酮饮食还是植物基饮食,焦点往往集中在吃什么。然而,这种静态的视角忽略了人类饮食行为中最显著的一个特征:时间上的波动性。
举个例子,工作日与周末的割裂,很多人在周一至周五严格控制热量,吃高纤维的健康沙拉;而一旦到了周五晚上或周末,各种吃大餐,高脂、高糖食物轮流上,或者饮食时间变得极不规律。

如果我们将时间跨度拉长,计算其营养摄入的平均值,这些人的数据可能依然显示为健康。这就带来了一个问题:
如果平均营养摄入达标,为什么代谢紊乱和肠道微生态失调的问题依然普遍存在?
近期《Nature》几个子刊的研究,揭示了被长期忽视的真相:
饮食的规律性与营养供给的精准度,可能比单一的追求饮食质量,更能影响肠道微生态的健康。

Singh 等人发表的最新研究(Nat Commun, 2025),通过分析“Food & You”数字队列中近1000名参与者长达两周的高分辨率饮食记录与微生物组数据,饮食质量的时间波动性是破坏肠道菌群多样性的独立风险因素。
Estrela等人的研究(Nat Micro, 2025)深入微观层面,告诉我们肠道菌群挨饿的时候到底会发生什么。
随机休眠-唤醒,可能会让细菌本应用于繁殖的能量储备耗尽,共生菌因无法快速复苏而被淘汰。细菌一旦应激,可能啃食肠壁,使屏障功能变薄;若饥荒持续,则启动终极生存策略——同类相食。这种层层升级的生存博弈,最终将肠道生态系统推向从共生到对抗的危险边缘。
那么,如何才能让肠道菌群真正吃饱吃好,避免生存博弈演变成对宿主的反噬?
膳食纤维与脂肪、蛋白质之间又存在怎样的微妙平衡,才能既满足人体需求又不伤害有益菌?
那些看似不起眼的微量元素,又是如何在这场微观战争中决定菌群的站队?
…
本文将综合这些前沿成果,详细了解菌群喂养的底层逻辑,从关注宏观层面饮食营养的平均达标,转向整合多维度包括时间层面的规律饮食与微观层面的精准喂养。我们将探讨如何通过消除隐性饥饿、维持微量元素平衡以及建立稳定的饮食节律,从而为预防代谢性疾病和构建深层免疫防线提供可落地的精准营养行动指南。
在既往的营养学研究中,我们习惯于通过平均值来评估一个人的饮食质量。例如,如果一个人在一个月内摄入了足够总量的膳食纤维,无论他是每天均匀摄入,还是集中在几天内突击摄入,他在传统的营养评估中得到的得分往往是相似的。
然而,Singh等人的研究通过高分辨率的时间序列分析,彻底打破了这一平均值的说法,揭示了饮食规律性作为独立健康维度的决定性作用。

突破传统的方法论:从回忆问卷到动态观测
该研究依托于“Food & You”数字队列(http://clinicaltrials.gov NCT03848299),这是一个极具前瞻性的研究项目。不同于传统流行病学依赖参与者回忆过去一年饮食习惯的食物频率问卷,这种方法类似一张模糊的静态快照,Singh 等人利用智能手机应用程序辅助的实时追踪技术,记录了近 1000 名参与者在两周内每一餐的详细构成。
这种方法论的革新使得研究者能够计算出一个全新的指标:每日健康饮食指数(Daily HEI)。传统的平均健康饮食指数掩盖了每日的波动,而每日健康饮食指数则像一部动态电影,捕捉了饮食质量在时间轴上的每一次震荡。
研究人员进一步引入了个体内变异系数(Intra-individual Coefficient of Variation, CV),专门用于量化这种震荡的幅度。通过将微生物组测序数据(16S rRNA gene sequencing)与这些高频饮食数据进行关联分析,一个隐藏在平均值背后的规律浮出水面。
每天吃沙拉,健康饮食的人,菌群多样性反而不如饮食普通但规律的人?
数据的统计分析揭示了一个单调且稳健的负相关关系:
饮食质量的变异性越高,肠道微生物群的 α-多样性越低(尤其是 Shannon 指数)。
不同生理和饮食因素与香农多样性之间的相关性
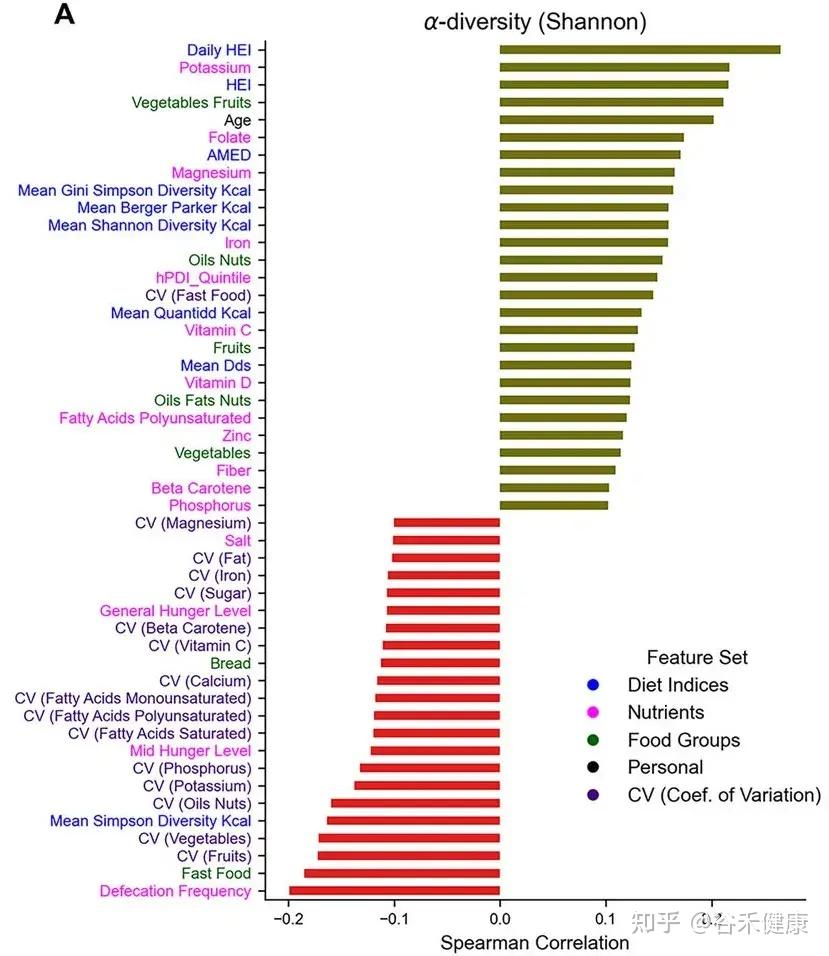
这一发现具有极高的临床意义。Shannon 指数反映了群落中物种的丰富度和均匀度,通常被视为生态系统健康和韧性的标志。
研究数据显示,即使在那些平均饮食质量较高的参与者中,如果他们的饮食习惯呈现出高波动性(例如:周一吃素,周二高脂,周三断食),其微生物多样性依然显著低于那些饮食质量中等但非常规律的个体。
这意味着,肠道微生态系统对于“不确定性”忍耐度有限。 剧烈的饮食波动相当于在肠道内制造了不稳定的生态位,导致只有少数菌能够快速适应环境变化的,能够存活,从而降低了整体生态系统的复杂度和稳定性。
具体菌群的响应
Singh 等人的研究并未止步于宏观的多样性指标,而是深入到了分类学(Taxonomy)层面,明确指出了哪些细菌是饮食规律性的受益者,哪些则是波动的获益者。
规律饮食滋养:毛螺菌科、粪球菌属
数据表明,属于厚壁菌门下的毛螺菌科(Lachnospiraceae),尤其是粪球菌属(Coprococcus),与饮食的规律性呈现最强的正相关。
毛螺菌科,如真杆菌属(Eubacterium)、毛螺菌属(Lachnospira)和丁酸杆菌属(Butyribacter),均是预测高健康饮食指数、蔬菜、水果、坚果及膳食纤维摄入的关键特征菌。
粪球菌属是肠道内重要的产丁酸者。丁酸盐不仅是结肠上皮细胞的主要能量来源,还具有强大的抗炎功能。
研究发现,粪球菌属的丰度对于蔬菜、水果和全谷物摄入的稳定性高度敏感。当这些富含纤维的食物来源在几天内忽高忽低时,粪球菌属的种群数量会迅速崩塌。
这表明这类有益菌需要持续、稳定的底物供应,来维持其在竞争激烈的肠道环境中的生态位。
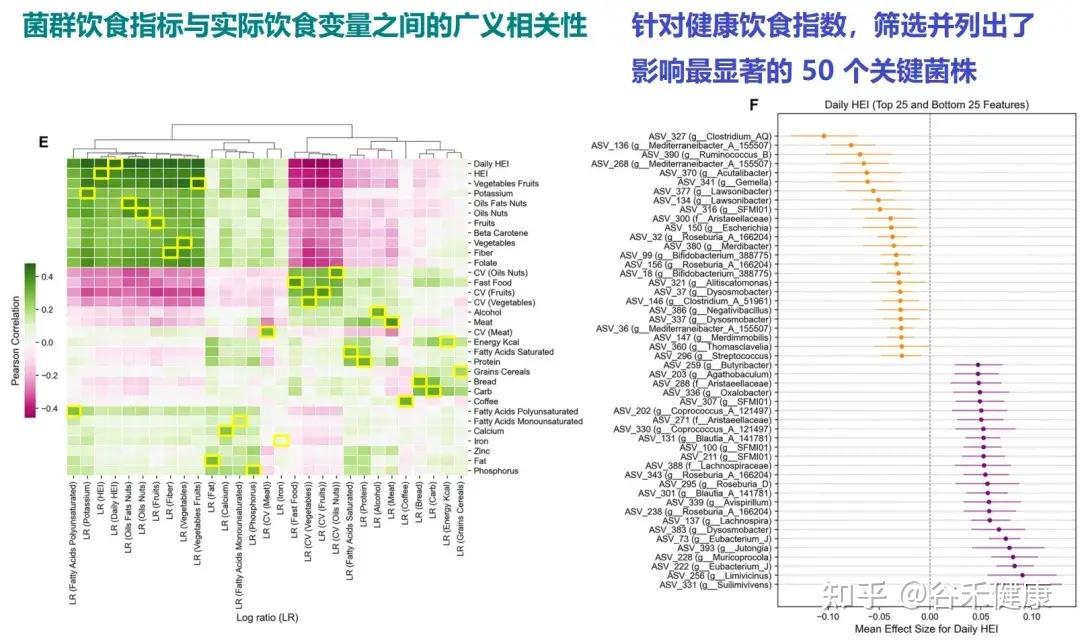
趁乱反噬:活泼瘤胃球菌
与之形成鲜明对比的是,饮食质量的高变异性与活泼瘤胃球菌(Ruminococcus gnavus)的富集显著相关。
研究还发现,Mediterraneibacter、Lawsonibacter、Dysosmobacter等,与肉类摄入、快餐消费以及蔬菜、水果、坚果摄入的不规律性(高 CV)呈正相关,并与腹泻比例增加显著相关。
活泼瘤胃球菌是一种典型的病原共生菌。在健康肠道中,它可能以低丰度存在,但在炎症性肠病、克罗恩病患者体内,常观察到该菌的过度生长。
该菌具有分解含有唾液酸的宿主黏蛋白的能力。当饮食中的外源性营养(如膳食纤维)波动剧烈导致供应中断时,活泼瘤胃球菌能够迅速切换代谢模式,利用宿主的黏液层作为备用能源。
数据暗示,饮食的不规律性实际上是在为活泼瘤胃球菌、Mediterraneibacter、Lawsonibacter这类具有高度适应性的机会主义者创造竞争优势,从而增加了肠道促炎环境的风险。
蔬果摄入波动大,是菌群失衡的关键推手
研究进一步细化了不同食物类别的波动影响。结果显示,蔬菜、水果、坚果摄入量的变异性,即吃得忽多忽少,对微生物组的影响最为显著。相比之下,精制谷物或乳制品的摄入波动对菌群多样性的冲击较小。
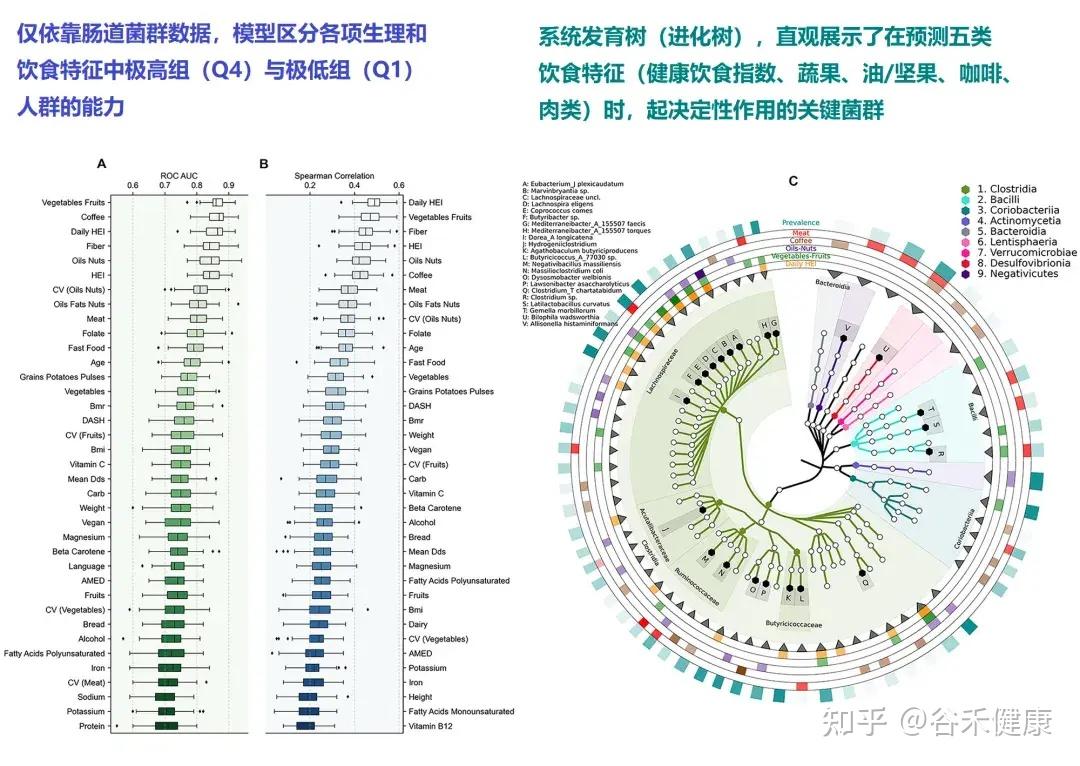
这背后的逻辑在于:蔬菜和水果是膳食纤维的主要来源,对于肠道细菌而言,这些纤维是赖以生存的“口粮”。
如果这些纤维的供应不稳定(高变异性),那些专性依赖纤维发酵的细菌(如前述的毛螺菌科)就会面临周期性的饥饿压力,无法建立稳定的种群;而那些代谢灵活、能吃“杂食”甚至能“吃人”(降解黏液)的细菌则会占据主导地位。
小结:规律性是独立的健康参数
上述研究确立了一个新的营养学范式:规律性本身就是一个独立的、关键的健康参数。
我们不能再单纯地建议人们多吃蔬菜,而应该建议每天稳定地吃蔬菜。因为从微生态的视角来看,三天吃一次大量的沙拉,其生态效益远不如每天吃一小份沙拉。
不规律的饮食习惯,实际上是在肠道内进行着一场持续的、负面的自然选择,逐渐淘汰了那些维护健康的共生菌,而筛选出了潜在的致病菌。
那么,为什么细菌对波动如此敏感?在微观层面上,当营养供应中断的那几个小时或几天里,细菌究竟经历了什么?
下一章节,我们接着来看Estrela等人的一篇文章,有详细的机制解析,深入到细菌的细胞内部,去洞察微观世界的隐形饥荒。
如果说上述研究从宏观层面来告诉我们,饮食波动会导致多样性下降和机会病原菌滋生。但要真正理解这场危机的根源,我们需要深入到细菌的视角,去体验它们在面对“断粮”时的生死抉择。
Estrela等人发表在《Nature Microbiology》的文章为我们揭开了这场微观“饥饿游戏”的规则。

研究表明,细菌并不只是被动地等待死亡,它们演化出了一套极其复杂的策略来应对营养匮乏。对于肠道细菌而言,宿主少吃一顿,或者饮食结构的一次剧烈跳变,就意味着它们必须在毫秒级的时间内启动应急预案。
肠道里的“盛宴与饥荒”循环
尽管现代人往往处于营养过剩的状态,但这并不意味着肠道细菌总能吃饱。相反,细菌生活在一种“盛宴与饥荒”交替的极端环境中。
盛宴期
当宿主进食后,膳食成分进入结肠,营养物质瞬间激增。此时,那些生长速度快、擅长降解复杂膳食多糖的厚壁菌门细菌占据绝对优势。例如,罗氏菌属(Roseburia)、真杆菌属(Eubacterium)和瘤胃球菌属(Ruminococcus),它们在有食物时不仅自身快速增殖,还通过交叉喂养滋养其他菌群。
饥荒期
在宿主睡眠期间、餐间空隙,或者当宿主摄入缺乏纤维的精细饮食时,肠道内的可发酵膳食纤维会迅速耗尽。此时,群落结构发生变化:厚壁菌门的丰度下降,而拟杆菌门、变形菌门以及疣微菌门开始主导局面。
研究人员指出,正是这种不可预测的饥荒期长度,决定了群落的最终结构。不规律的饮食习惯,本质上是在人为地延长或随机化“饥荒期”,迫使细菌长期处于应激状态。
策略一:蛰伏以求生——休眠与生长停滞
面对饥饿,细菌的第一反应往往是节能。
许多细菌会进入一种被称为生长停滞或休眠的状态。它们关闭大部分代谢活动,停止细胞分裂,将原本用于繁殖的能量,转用于维持细胞结构的完整性。
断臂求生:细菌的饥饿应对机制
细菌会通过复杂的分子机制(如 (p)ppGpp 介导的严谨反应)下调核糖体的合成,这是细胞内最耗能的过程,所以立刻叫停这个耗能的事。
对于大肠杆菌和其他变形菌来说,它们会依赖 Sigma因子 RpoS 来重新编程基因表达,将原本用于繁殖的能量转用于维持细胞结构的完整性,甚至不惜降解自身的核糖体,以回收氨基酸和核苷酸作为应急储备。
持久细胞:极度不活跃,却能保生存
文章还提到了一种“两面下注策略”(bet-hedging),即细菌分化出一小部分代谢极度不活跃的持久细胞。它们虽然不生长,但能耐受极端的压力(包括抗生素),确保存活。
内生孢子的形成
某些厚壁菌门的成员,如艰难梭菌或枯草芽孢杆菌,能够形成高度耐受的内生孢子。这就像是把自己锁进一个时间胶囊里,以此度过长达数天甚至数年的饥荒。
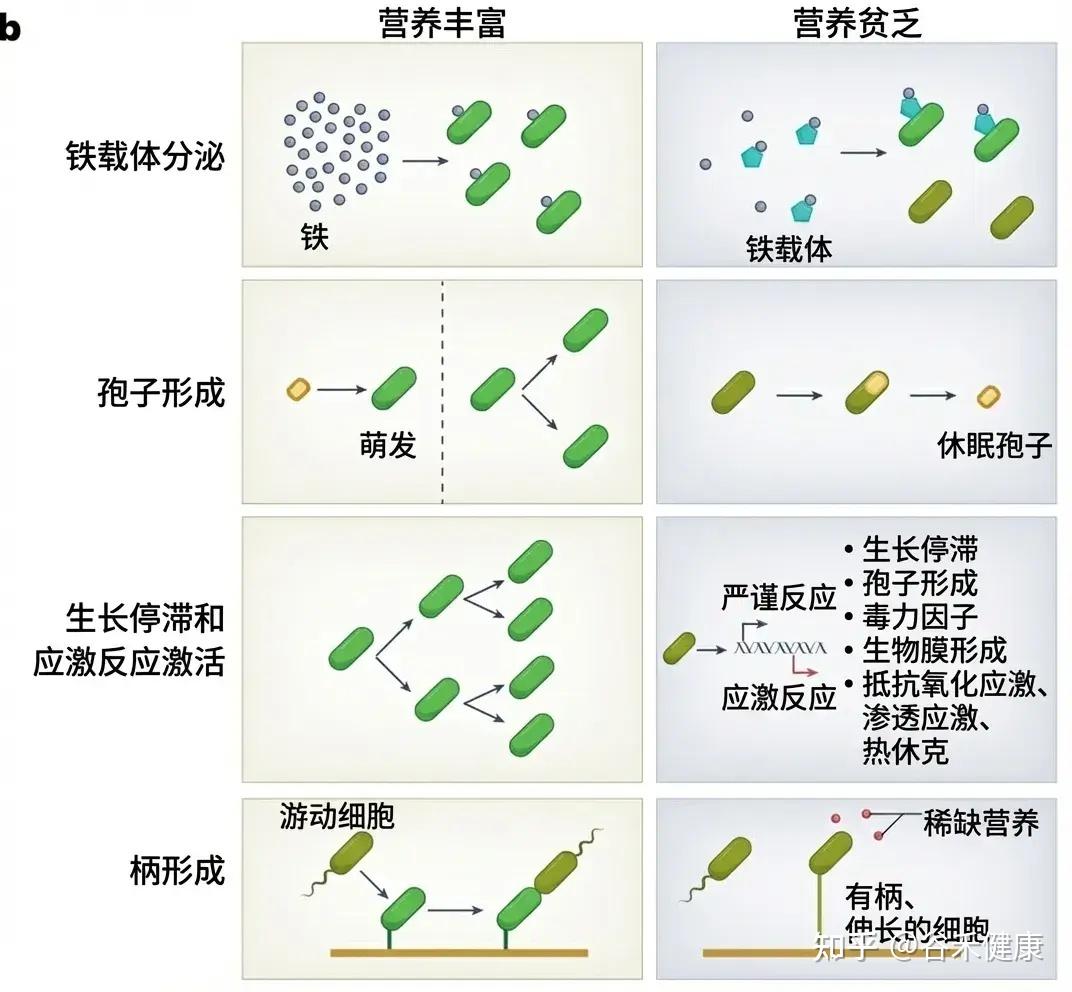
然而,这种策略是有代价的。进入休眠意味着放弃了繁殖的机会。如果饮食波动过于频繁,细菌反复在“唤醒”和“休眠”之间切换,会消耗巨大的能量储备。那些无法快速从休眠中复苏的菌种,就会在下一轮盛宴来临时因为起步太慢而被竞争对手淘汰。这也解释了前面的研究提到的饮食高变异性会导致微生物多样性的丧失——许多脆弱的共生菌因为经不起反复折腾而灭绝了。
策略二:吃宿主——营养毒力与黏液降解
如果说休眠是一种被动的防御,那么另一种策略则显得极具侵略性:当外源性食物(膳食纤维)断供时,去找内源性的替代品——宿主自己。
这就是研究人员强调的“营养毒力”概念。
我们的肠道内壁覆盖着一层厚厚的黏液层,主要由高度糖基化的黏蛋白组成。对于细菌来说,这层黏液不仅是屏障,更是一个巨大的、全天候供应的备用糖库。
黏液降解菌的崛起
正常情况下,像AKK菌(Akkermansia muciniphila)和多形拟杆菌(Bacteroides thetaiotaomicron)这样的细菌,会以受控的方式降解少量陈旧的黏液,这有助于黏液的更新。
但在饥饿状态下,当膳食纤维严重缺乏或供应中断时,多形拟杆菌会通过转录调控,迅速上调分解宿主聚糖的酶系表达。而AKK菌更依赖宿主黏蛋白上的糖链作为能量来源,在别的菌饿得不行的时候还能活得不错,数量甚至上升。
这种代谢切换使它们能够生存下来,但代价是过度啃食保护肠壁的黏液层。
黏液层变薄:病原菌的入侵
更危险的是,这种黏液层的变薄为病原菌打开了缺口。例如,肠出血性大肠杆菌(EHEC)在饥饿状态下会感知这种环境信号,上调其毒力因子的表达,利用这一机会粘附并侵袭肠上皮细胞。
这就是为什么饮食不规律(尤其是纤维摄入的波动)不仅影响菌群结构,更直接威胁肠道屏障功能。你的细菌饿急了,是真的会“吃”你的。
游离糖:病原菌的扩张燃料
此外,拟杆菌在降解黏液时,会释放出岩藻糖、唾液酸等游离糖。在盛宴期,这些糖滋养共生菌;但在饥荒期,它们成了病原菌的“救命粮”。
鼠伤寒沙门氏菌(Salmonella Typhimurium)和艰难梭菌能够利用这些游离的唾液酸和岩藻糖迅速扩增。
策略三:GASP表型——长期饥饿,同类相食
如果饥荒持续的时间足够长(例如极端的节食或长期的饮食紊乱),细菌就不会仅仅满足于生理调节,而是会开启基因层面的进化。
强者通吃:残酷的 GASP 现象
文中提到了一个经典的微生物学现象:
在长期的营养限制下,细菌会发生基因突变,产生“长期静止期生长优势”表型(简称GASP)。
如果将已经饿了10天的大肠杆菌培养物,与仅培养了1天(刚进入静止期)的同种细菌混合,那些饿了10天的老细菌反而会竞争过并取代那些年轻的细菌。
激进策略:弃守为攻与同类相食
老细菌并不是单纯地在等死,而是通过 RpoS 基因突变采取了激进策略。它们主动放弃了原本用于防御(如耐热、耐酸)的盾牌以节省能量,转而全力强化进食能力。这让它们能掠夺环境中仅存的资源,比如说,大肠杆菌被证明能够利用死细胞释放的天冬氨酸、谷氨酸、甘氨酸、丝氨酸、苏氨酸来维持生存,从而在同类相食的竞争中,把那些还在老实防守的同伴彻底淘汰。
生态隐患
虽然这保证了某个物种的延续,但这种突变往往伴随着功能的丧失或毒力的增强。这意味着,经过长期饥饿筛选后的肠道菌群,可能在遗传上已经发生了漂变,肠道菌群变成了一个由一群“生存狂”组成的群落:它们为了活命可能丧失了原有的有益功能,甚至增强了毒力,对宿主不再那么友好。
人类不同的饮食习惯(如长期断食、热量限制、饮食结构改变)对菌群产生的共同影响
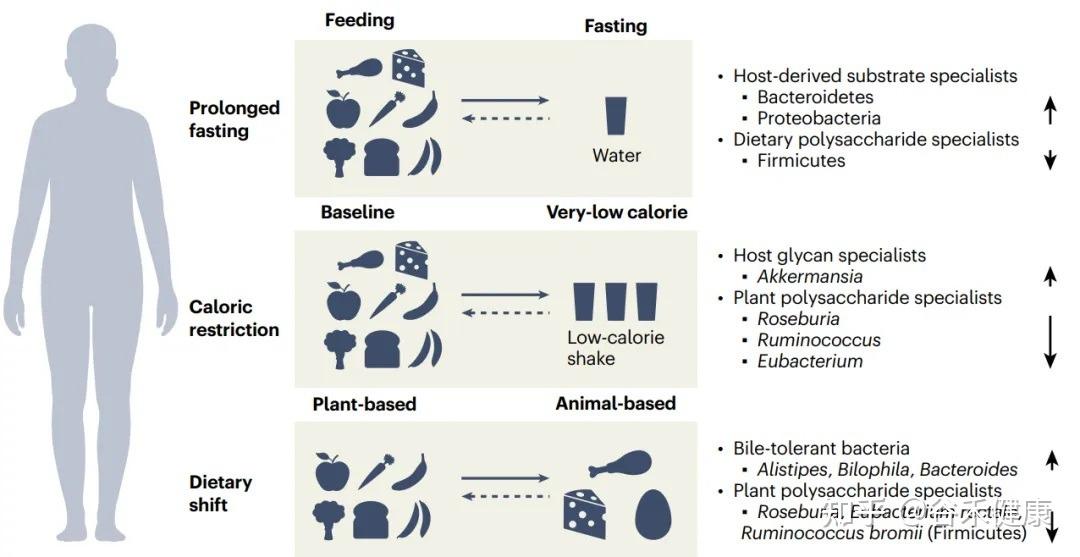
例如,当饮食结构从植物基转向动物基(素食转向肉食)时,会导致耐胆汁细菌的增加,同时那些专门负责分解植物多糖的细菌则会减少。
小结:微观机制的宏观映射
多样性下降是因为许多菌种无法承受反复的“休眠-复苏”能量损耗,或在竞争中落败。
病原菌(如沙门氏菌)的泛滥,是因为它们具备更灵活的代谢切换能力,能在纤维断供时迅速利用宿主黏液糖、琥珀酸等替代营养源。
饮食的规律性,本质上就是为肠道微生物提供一份安全感。消除了对迫近饥荒的恐惧,那些对宿主有益但相对脆弱的专性共生菌才能安心定植,繁衍生息,而不是被迫进入生存模式去啃食宿主的肠壁。
在解决了‘不饿着它们’这一基础问题后,我们需要深入探讨更深层的问题:如何通过特定的饮食成分,将肠道菌群从一个仅仅是活着的群体,引导为一个能为宿主提供健康的共生群落。
一旦细菌脱离了饥饿造成的极端环境,它们的功能重点就会从生存转向代谢。最新的综述研究指出,此时底物的类型(即你吃了什么)将决定菌群的代谢产出。

饮食习惯是肠道微生物群变异的主要决定因素,其影响力远超宿主遗传背景。换句话说,你每天吃进嘴里的食物,才是你肠道微生态的“总设计师”。
★ 一般性饮食模式
我们先来说一些的日常饮食习惯。
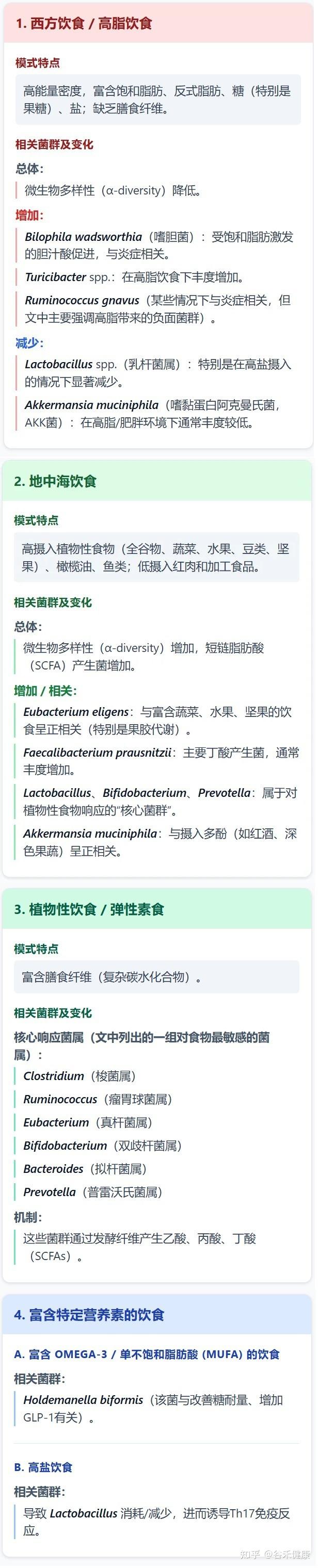
★ 治疗性/医学饮食模式
接下来我们来说一些饮食,通常用于特定疾病的干预。
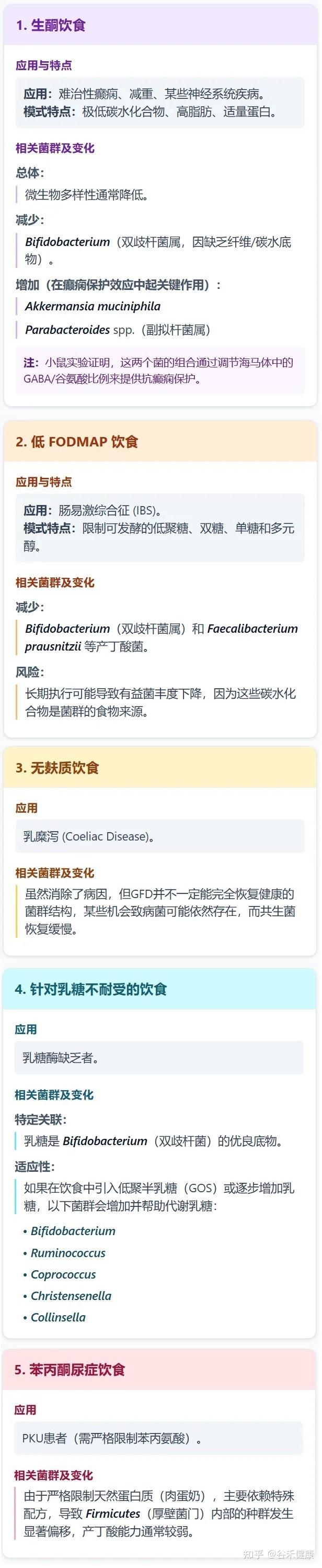
膳 食 纤 维
在传统的营养学认知中,膳食纤维往往被简化为帮助通便的工具。但在微生物组的视角下,它的定义远不止于此。这是肠道共生菌最主要、甚至是赖以生存的能量来源。
从纤维到短链脂肪酸:点石成金的转化
膳食纤维进入结肠后,并不会像在小肠里那样被简单吸收,未被消化的膳食纤维被细菌发酵后,会产生一系列具有强大生物活性的代谢产物——短链脂肪酸(SCFAs),乙酸、丙酸和丁酸。
膳食纤维代谢产物在维护肠道屏障中的核心作用
-加固屏障,紧密连接
细菌产生的丁酸具有组蛋白去乙酰化酶(HDAC)抑制剂的功能。它能直接作用于肠上皮细胞的基因表达,上调紧密连接蛋白(如 Occludin 和 Claudin)的合成,好比给肠道细胞之间的缝隙抹上了强力胶水,防止细菌内毒素渗入血液。
-筑牢免疫防线(Treg 和 IL-22)
纤维发酵产物能与免疫细胞表面的G蛋白偶联受体(如 GPR43/GPR109A)结合。这种结合会向免疫系统发送和平信号,促进调节性T细胞(Treg)的分化,并刺激IL-22的分泌。IL-22 被称为屏障守护因子,它能加速上皮细胞的修复,并诱导细胞分泌抗菌肽(AMPs),将病原体拒之门外。
-降低环境 pH 值
发酵产生的酸性环境(低 pH)能有效抑制许多对酸敏感的致病菌(如沙门氏菌、大肠杆菌)的生长,这是一种最原始但有效的生态位竞争策略。
吃多少才够?
上一章节我们已经了解到,膳食纤维如果喂不饱菌群,那么菌群就会吃你的粘液层,肠道屏障就会随之薄弱,可能出现肠漏,低度慢性炎症等情况,那么吃多少才够呢?
目前的膳食指南通常建议每日摄入 25-30g 的膳食纤维。然而,Sanz 等人在综述中提出一个观点:这个标准可能仅仅是维持基本功能的底线,而非优化健康的理想值。
研究人员指出,为了达到预防非传染性慢性病(如心血管疾病、代谢综合征)的最佳效果,膳食纤维的摄入量可能需要提高到 35-50g/日。这个数字更接近人类祖先(狩猎采集时期)的摄入水平。
但这里有一个关键的注意事项:
对于肠道已经处于高度敏感或炎症状态(如 IBD 或 IBS 患者)的人群,突然摄入大量粗纤维可能会导致耐受不良。这也引出了精准营养的概念——不同人的菌群对纤维的处理能力是不同的。
因此,策略不是盲目地吃草,而是循序渐进,并注重纤维种类的多样性(可溶性与不可溶性纤维的搭配),以喂养更广泛的共生菌群。

蛋 白 质
在健身房里,蛋白质是增肌的必需品;但在结肠深处,蛋白质的命运却充满了变数。
与膳食纤维的健康益处不同,蛋白质对肠道微生物组的影响是双向的。这取决于两个关键因素:蛋白质的来源,以及你是否同时摄入了足够的碳水化合物。
当有益菌遇到色氨酸:免疫系统的调停者
首先,我们来看看蛋白质天使的一面。
蛋白质由氨基酸组成,比如说,色氨酸(Tryptophan),是连接饮食、微生物和宿主免疫的关键桥梁。
肠道细菌(如乳杆菌属和部分梭菌属)能够将未消化的色氨酸代谢为吲哚(Indole)及其衍生物(如吲哚-3-丙酸 IPA、吲哚-3-乙醛等)。这些吲哚类物质并非废料,而是高级的生化信使,它们可以:
从这个角度看,适量的蛋白质摄入,特别是富含色氨酸的食物,是维持肠道免疫稳态的重要一环。

黑暗面:当发酵转向“腐败”
当膳食纤维摄入不足,或者蛋白质摄入过量导致大量未消化的蛋白质进入结肠(尤其是远端结肠)时,微生物的代谢模式会发生危险的逆转。
在这个过程中,细菌会产生一系列具有细胞毒性的代谢产物:
这种“腐败发酵”主要发生在远端结肠,那里是碳水化合物最先被耗尽的地方,也是结直肠癌的高发部位。这非巧合。
关键在于“碳氮比”:别让细菌只吃肉
那么,我们该如何避免蛋白质的“黑化”?
研究人员认为,碳水化合物(纤维)的存在可以抑制蛋白质的腐败发酵。
这是一种名为分解代谢抑制的生存策略:只要有容易发酵的碳水化合物存在,细菌就会优先利用它们,而此时产生的酸性环境会进一步抑制蛋白水解酶的活性。
因此,问题的核心往往不在于肉吃多了,而在于菜吃少了。
植物蛋白 vs 动物蛋白
相比于红肉(富含血红素铁,可能催化致癌物 N-亚硝基化合物的形成),植物蛋白通常自带膳食纤维。这种自带解药的属性,使得植物蛋白在被细菌分解时,往往伴随着更有益的代谢环境。

肠道菌群与蛋白质代谢14 赞同 · 3 评论 文章

动物蛋白与植物蛋白对肠道微生态的不同“改造”与健康风险”6 赞同 · 2 评论 文章
脂 肪
与纤维(作为食物)不同,脂肪更多是通过改变肠道环境(特别是胆汁酸代谢)来间接筛选微生物。
长期以来,我们对脂肪的恐惧主要集中在变胖和心血管堵塞。但在微观视角下,高脂饮食对健康的打击是从肠道屏障的崩塌开始的。
这其中牵涉到两个核心机制:
胆汁酸的改变 与 内毒素的易位。
高脂饮食的代价:当助消化的胆汁变成致癌毒素
当你吃下一块肥美的五花肉,肝脏会立刻分泌胆汁酸(Bile Acids)来乳化这些油脂,帮助消化吸收。这本是正常的生理过程。
然而,问题在于量。
长期摄入高脂肪饮食,会迫使肝脏源源不断地向肠道泵入大量的初级胆汁酸。当这些胆汁酸流经小肠未被完全回收,进入结肠后,它们就落入了微生物的手中。

肠道细菌(如梭菌属)通过7α-脱羟基作用会将初级胆汁酸进行二次加工,转化为次级胆汁酸,如脱氧胆酸(DCA)和石胆酸(LCA)。
什么是胆汁酸,其与肠道微生物互作如何影响人体健康18 赞同 · 0 评论 文章
次级胆汁酸的蓄积,是一个危险的信号:
当然,次级胆汁酸也有另一面——某些特定的衍生物(如 isoalloLCA)能特异性地抑制艰难梭菌等病原体。
但在典型的高脂“西方饮食”模式下,负面效应往往占据了主导地位。
肠道微生物群对胆汁酸代谢和信号传导影响的最新研究成果20 赞同 · 1 评论 文章
脂肪的类型(质量)远比数量重要
研究对比了饱和脂肪酸(如猪油、棕榈油)与多不饱和脂肪酸(PUFAs,如鱼油、亚麻籽油):
-饱和脂肪:代谢性内毒素血症
摄入过多的饱和脂肪,不仅会降低微生物的多样性,更关键的是它充当了细菌毒素的载体。
革兰氏阴性菌的细胞壁成分——脂多糖(LPS,即内毒素),极易溶解在脂肪微粒(乳糜微粒)中。当饱和脂肪穿过肠壁进入血液时,它会顺手把 LPS 也带进去。
这就是著名的代谢性内毒素血症。血液中微量的 LPS 升高,会触发全身性的低度慢性炎症,诱导胰岛素抵抗,成为肥胖和糖尿病的隐形推手。
-Omega-3
相反,富含 Omega-3 的多不饱和脂肪酸,被证明能够增加产丁酸菌丰度,逆转由饱和脂肪引起的菌群失调,并有助于维护肠道屏障的完整性。
探索Omega-3脂肪酸:健康益处与营养补充12 赞同 · 0 评论 文章
维 生 素
我们常以为维生素只是为了身体好,其实肠道里的细菌也是维生素大户。
许多有益菌(如双歧杆菌)虽然能为我们合成维生素K和部分B族维生素,但它们自身往往无法从头合成生长所需的全部维生素(尤其是B族),必须依赖我们的饮食摄入或原本的交叉喂养网络。
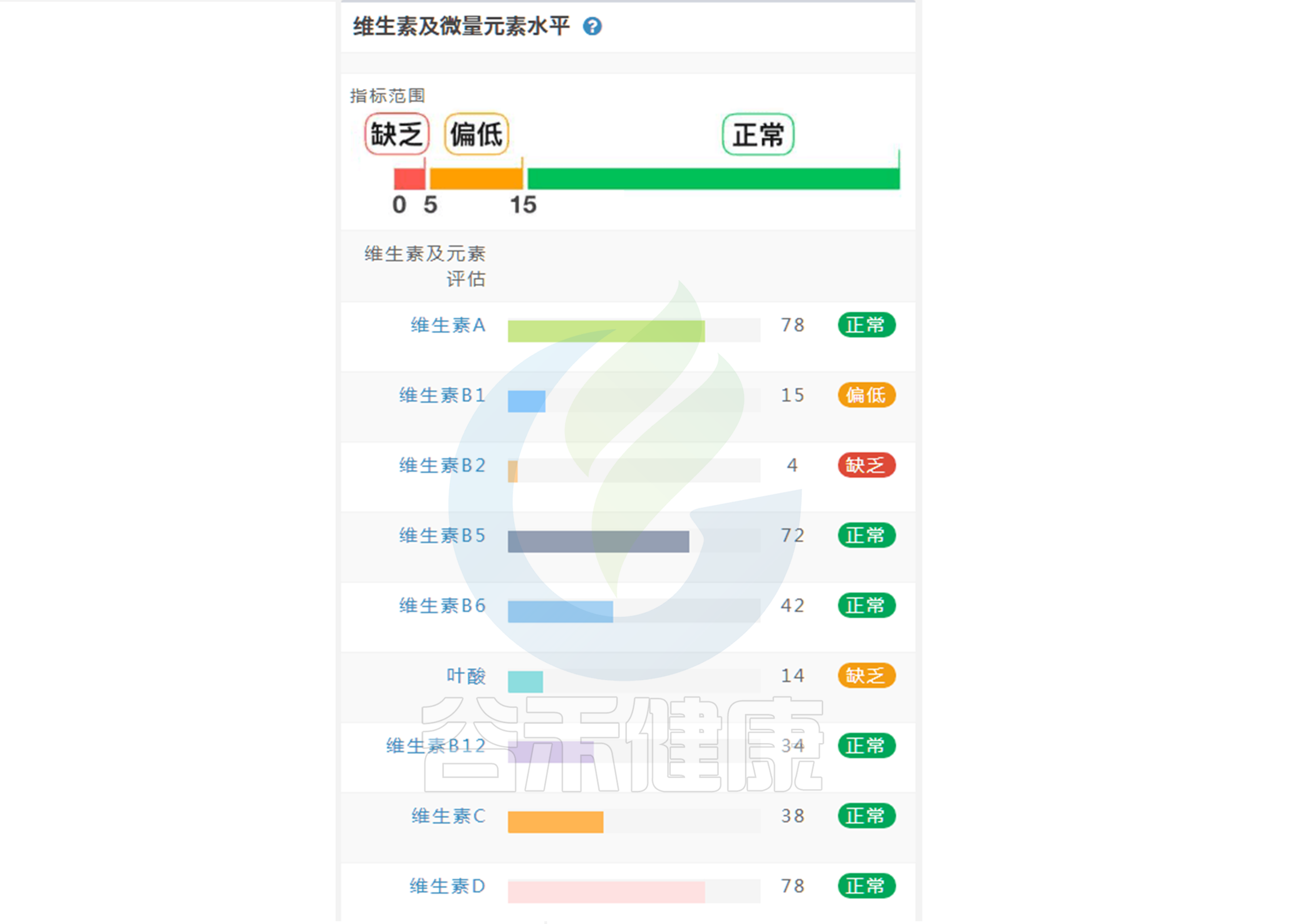
B2(核黄素)
当饮食中缺乏维生素B2(核黄素)时,肠道中产丁酸菌(如普拉梭菌)就会因缺乏口粮而减少,而这可能间接给大肠杆菌等潜在有害菌腾出生存空间。
B9(叶酸)与 B12(钴胺素)
乳杆菌和双歧杆菌通常缺乏从头合成叶酸和钴胺素的完整酶系,属于维生素营养缺陷型微生物。必须依赖宿主摄入。如果叶酸摄入不足,这些益生菌的生长就会受限,进而削弱其对肠道微生态的调节功能。
B3(烟酸)
烟酸不仅是细胞能量代谢(NAD+合成)的关键前体,还是结肠上皮及免疫细胞表面 GPR109A 受体的特异性配体。烟酸通过激活该受体发挥抗炎作用,抑制促炎因子的释放。
缺乏烟酸会导致肠道免疫耐受性降低,增加结肠炎易感性,并伴随微生物群落Alpha 多样性的显著下降及微生态结构的崩塌。严重缺乏会导致糙皮病。
B7(生物素)
生物素是细菌羧化酶不可或缺的辅助因子,在菌群的种间竞争中起着关键作用。研究显示,在生物素缺乏的环境下,某些机会性致病菌(如鼠乳杆菌Lactobacillus murinus)会利用代谢优势发生异常增殖,导致严重的菌群失调;而恢复生物素水平则能有效遏制这种过度扩张,通过生态位竞争维持肠道微生态的稳态。

B族维生素与肠道菌群互作52 赞同 · 1 评论 文章
维生素A
维生素 A 的代谢产物(视黄酸)是调节肠道黏膜免疫的关键信号。它能直接促进 B 细胞分化,上调分泌型免疫球蛋白 A (sIgA) 的合成与分泌。sIgA 能够特异性地包裹细菌,在阻止致病菌黏附上皮组织的同时,协助乳杆菌(Lactobacillus) 等共生菌在黏膜表面的稳定定植,防止菌群易位。
维生素D
维生素 D 通过激活肠上皮细胞中的维生素 D 受体 (VDR),上调紧密连接蛋白(如 Occludin 和 Zonulin)的表达,从而维持肠道屏障的物理完整性。
此外,维生素D还能发起主动进攻,它能诱导宿主分泌防御素和组织蛋白酶等抗菌肽。这种选择性压力有助于重塑菌群结构,研究显示其可显著促进Akkermansia muciniphila的生长,并抑制变形菌门等潜在致病菌。
维生素 C & E:调节氧化还原电位
肠道核心菌群(如厚壁菌门和拟杆菌门)多为专性厌氧菌,对氧气极为敏感。维生素 C 和 E 具有显著的抗氧化作用,能够清除肠腔内的活性氧 (ROS),维持肠道较低的氧化还原电位。这种厌氧环境有利于核心有益菌的代谢与生存,同时限制肠杆菌科(多为兼性厌氧菌)等机会性致病菌的过度增殖。
维生素摄入水平肠道菌群可以告诉你14 赞同 · 0 评论 文章
下表列出了常见的维生素的食物来源,可供参考。

矿 物 质
铁
铁是细菌界的稀缺资源。正常情况下,人体会限制肠道内的游离铁(营养免疫),防止细菌疯长。
但问题在于,沙门氏菌和致病性大肠杆菌等肠杆菌科细菌,进化出了极强的“抢铁工具”——铁载体(Siderophores)。相比之下,乳杆菌等有益菌抢夺铁的能力很弱。
人与菌对铁的竞争吸收 | 塑造并控制肠道潜在病原菌的生长15 赞同 · 0 评论 文章
因此,一旦结肠中出现未被吸收的游离铁(比如吃太多红肉或过量补铁),这些铁就会优先被致病菌抢走,助长它们爆发性繁殖,从而压制有益菌并引发炎症。

锌
锌不仅能加固肠道屏障,更是维持菌群结构稳定的关键。
研究发现,缺锌会直接导致肠道中的主力军——厚壁菌门的数量大幅下降。这种多样性的丧失,意味着肠道的定植抵抗力被削弱了。

膳食锌缺乏或过量对人体肠道菌群及健康的影响11 赞同 · 1 评论 文章
这就好比城墙上的守卫变少了,原本被压制的艰难梭菌就会趁虚而入,利用空出来的生态位大量繁殖并分泌毒素,引发生严重的肠道感染。

这种微观层面的营养不良,往往是导致菌群失调和系统性炎症的隐蔽开端,也进一步凸显了通过高质量饮食纠正营养短板的紧迫性。
前面关注了“吃什么”,“吃多少”,接下来我们来看第三个维度:进食时机。
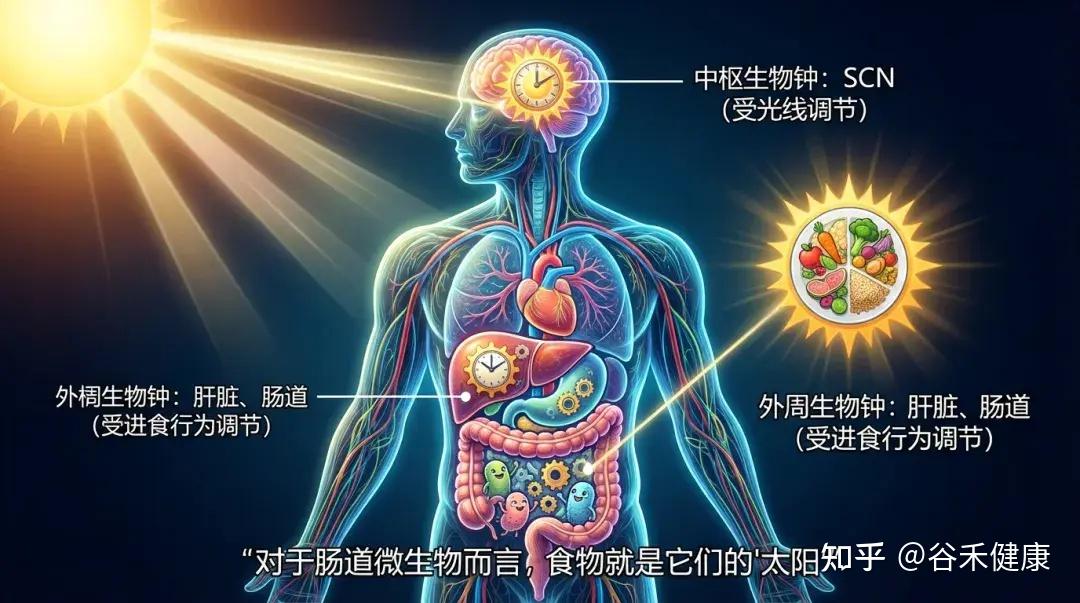
人体内存在两套主要的生物钟系统:
微生物也会“倒时差”
你可能不知道,肠道菌群也是分早班和晚班的。肠道微生物的组成和功能会呈现出显著的昼夜震荡。
这种节律性波动是如此重要,以至于产生的代谢物(如我们前面提到的短链脂肪酸、胆汁酸衍生物)在一天中的浓度也是波动的。这种波动指导着宿主的肝脏何时储存脂肪、何时释放葡萄糖。
现代生活方式:“光”与“食”错位
当我们在深夜(大脑认为是休息时间)吃一顿宵夜(肠道接收到工作信号)时,中枢生物钟和外周生物钟就发生了脱钩。
这种时钟错位会导致肠道微生物节律的丧失。原本应该在休息期清理毒素的细菌被迫加班处理食物,不仅效率低下,还会引发代谢混乱。这被认为是倒班工作者更容易患肥胖、糖尿病和肠道炎症的核心机制之一。
限时进食(TRE):重启肠道节律
限时进食(Time-Restricted Eating, TRE)——即把每天的进食窗口限制在 8-10 小时内,其余时间禁食。
这不仅仅是减少热量摄入的手段,更是一种微生物重塑策略。
–恢复昼夜节律
TRE 能够强力恢复微生物群落的昼夜节律震荡。让不同的细菌在正确的时间做正确的事,重建宿主代谢通路与微生物活动的同步性。
-特定功能菌群的富集
延长的禁食窗口为特定共生菌提供了生态位优势。
研究显示,禁食期间,以AKK菌(Akkermansia muciniphila)为代表的黏液降解菌丰度显著增加。这类菌群利用内源性黏蛋白进行增殖,反向刺激杯状细胞分泌黏液,从而强化肠道屏障功能,减少内毒素血症风险。
-代谢保护
动物模型和人类研究,表明 TRE 可以预防由高脂饮食引起的肥胖和代谢综合征。哪怕摄入的总热量没有改变,仅仅是改变进食的时间窗口,就能显著改善血糖稳态。
对于现代人来说,最糟糕的饮食习惯可能是进食时间的不规律。今天不吃早饭,明天半夜撸串,这种行为让肠道微生物始终处于“倒时差”的应激状态中。

因此,为了维护肠道健康,除了多吃膳食纤维、少吃加工食品外,我们还需要给微生物一个明确的作息表:在白天的活跃期进食,在夜晚的休息期禁食。这不仅是对身体的尊重,也是对居住在你体内的万亿微生物生命的尊重。
小结:从填饱肚子到精准滋养微生态
热量达标不代表菌群吃饱。必须保证膳食纤维的充足供应。这是防止菌群因底物匮乏而倒戈吞噬肠道黏膜的第一道防线。
蛋白质与脂肪对菌群的影响,可能取决于纤维的在场。控制饱和脂肪摄入,选择优质脂肪,能减少次级胆汁酸对有益菌的杀伤,避免内毒素血症。
均衡的微量营养素摄入,比如维生素和矿物质,能精准强化共生菌的竞争优势,助其在生态位争夺战中抢占先机,从而有效压制机会致病菌的野蛮生长。
当我们站在微生物生态学的前沿回望,传统的“金字塔式”饮食建议显得过于粗糙且缺乏维度。Singh等人的数据警示了“饮食大波动有风险”,Estrela等人的机制揭示了“细菌怕长期挨饿”,而Sanz等人的综述则描绘了通过饮食调节菌群的多维度健康蓝图。
这就要求我们必须升级我们的营养系统,从单纯关注成分转向关注生态稳定性与精准化。
新时代的营养观
对于普通大众而言,建立一个基线饮食节奏至关重要。
建立核心菜单
不要让每一顿饭都成为随机事件。尝试确立每天固定的核心食物,例如早餐固定的全谷物燕麦,或晚餐固定的深色蔬菜。这能确保护肠道内的核心共生菌每天都能获得稳定的底物供应,避免其因“断粮”而进入休眠或衰退。
平滑过渡
当你试图改变饮食习惯(比如从高碳水转向低碳水,或者开始吃地中海饮食)时,切忌急刹车或急转弯。根据 Estrela等人的理论,剧烈变换的底物会诱发细菌的饥饿应激和黏液降解。更合适的做法是循序渐进,给微生物群落留出数周的适应期,让代谢网络慢慢重塑。
精准营养 2.0:整合微生物组
每个人的肠道菌群构成都是独一无二的,这意味着同样的食物在不同人体内会引发截然不同的微生物反应(例如,不同人吃同样的香蕉,血糖反应可能截然不同)。未来的营养干预将不再是千篇一律的指南,而是根据人群的代谢表型或微生物特征,提供分层建议。
肠道菌群监测
比如说核心菌群,如厚壁菌门/拟杆菌门比值、产丁酸菌比例等指标,建立个人化菌群基线。
长期的饮食习惯会在菌群上留下印记。例如,长期缺乏膳食纤维的人,其肠道内负责降解植物多糖的酶系可能已经退化。此时若盲目大量补充纤维,不仅无法被利用,反而可能导致腹胀不适。这时肠道菌群数据能提示我们,可能需要采用缓慢饮食过渡方案,给菌群以适应和重建的时间。
靶向性补充
针对特定的功能缺失进行干预。例如,如果发现黏液降解菌(如 Akkermansia)异常升高,这往往是肠道缺乏膳食纤维、菌群正在吃内源性黏液的信号。可能不仅要补充益生菌,更需精准增加抗性淀粉、菊粉等摄入,以提供替代碳源,保护肠道屏障。
拥抱时间营养学
我们不仅要问吃什么,还要问什么时候吃。微生物组具有自身的昼夜节律,这种节律受宿主进食时间的强烈驯化。
保持规律的进食时间,避免深夜进食
这能让微生物群的代谢活动与宿主的生理时钟同步,优化代谢产物的分泌时机,使其在宿主最需要的时候(如日间活动时)发挥作用。
避免长期的随机断食
间歇性断食在某些情况下有益,但无序的、饥一顿饱一顿的“随机断食”是细菌的噩梦。如果你选择断食,请保持断食窗口的规律性,让细菌能够建立起预期的代谢循环。
保持饮食的节奏,不仅仅是一种自律的生活态度,更是一种对生命的敬畏。维护肠道内的和平与稳定,我们实际上是在守护自身健康的根基。正如研究所示,每日稳定摄入蔬菜、水果等富含纤维的食物,远比间断性大量食用更能维持菌群多样性。
在这个充满不确定性的世界里,科学的节奏与精准的滋养,或许就是你能给身体最好的确定性。
主要参考文献
Estrela S, Long JZ, Huang KC. How nutrient starvation impacts the gut microbiome. Nat Microbiol. 2025 Nov;10(11):2663-2672. doi: 10.1038/s41564-025-02139-9. Epub 2025 Sep 30. PMID: 41028229.
Singh R, McDonald D, Hernandez AR, Song SJ, Bartko A, Knight R, Salathé M. Temporal nutrition analysis associates dietary regularity and quality with gut microbiome diversity: insights from the Food & You digital cohort. Nat Commun. 2025 Sep 30;16(1):8635. doi: 10.1038/s41467-025-63799-z. PMID: 41028733; PMCID: PMC12484809.
Sanz Y, Cryan JF, Deschasaux-Tanguy M, Elinav E, Lambrecht R, Veiga P. The gut microbiome connects nutrition and human health. Nat Rev Gastroenterol Hepatol. 2025 Aug;22(8):534-555. doi: 10.1038/s41575-025-01077-5. Epub 2025 Jun 4. PMID: 40468006.

谷禾健康

众多的文献和谷禾之前写过的文章都阐述了微生物群与人类健康密切相关。这种联系甚至可能在还未出生的时候就已经开始形成。微生物群的存在和活动从母体怀孕前到幼年的过程中,持续地参与和调节着人体的各种生理功能,从而在每一个生命阶段都扮演着至关重要的角色。
在受孕之前,男性和女性生殖道中的微生物就具有关键作用,它们可以在受孕期间产生影响。例如女性阴道、子宫颈内膜、子宫、输卵管和卵巢中的微生物群,其特征是生物量低,并且与生殖和子宫健康相关。精液微生物群可能会干扰受孕和早产。据报道,怀孕期间典型的精液细菌(如嗜酸乳杆菌)的存在率较高与早产有关,而另一种常见的精液细菌——卷曲乳杆菌(Lactobacillus crispatus)被确定为具有保护作用。
在怀孕期间,母体微生物的变化与所经历的生理和激素变化同步。阴道微生物多样性降低,乳杆菌成员增加,潜在地加强了它们的免疫保护功能,而较低水平的乳杆菌与早产风险增加相关。妊娠三个月后肠道中促炎的微生物更丰富,产短链脂肪酸的微生物减少。同时妊娠期口腔微生物群的特征是活菌数量增加,同时致病菌水平较高。需要注意的是,口腔生态失调与妊娠期糖尿病、先兆子痫和胎儿紊乱的风险增加相关。
此外,母婴间的垂直传播与婴儿健康相关。一些有益菌种(双歧杆菌、乳杆菌)可以从母亲传播到婴儿体内并定植。但与此同时,一些抗生素抗性基因也会随着微生物的转移,从而使新生儿对一些药物具有耐药性,这将不利于一些新生儿疾病的治疗。
因此了解从受孕到生命最初几年期间关键的微生物群非常重要。本文总结了有关人类生殖微生物群的现有证据,以及生命早期的微生物集群,重点是对婴儿发育和健康结果的潜在影响。
研究还发现:包括特定益生菌和其他益生菌混合物在内的一些饮食策略可能会成为潜在的工具,调节母婴微生物群,并在整个生命周期中实现健康结果。
★ 生命早期的微生物群对代谢和免疫非常重要
生命的前1000天(即从怀孕到出生后的前2年)对于先锋微生物在人体内的定植以及免疫系统的发育和成熟都是至关重要的。因此,这一时期被认为是一个“关键时期”,在此期间,任何事件都将对代谢、免疫和微生物行为产生关键影响,从而影响人类健康。
而对逐步形成的新生儿微生物群的任何改变和破坏都有可能在短期和长期增加个体患病的风险和倾向。
▸ 阴道微生物群
母体微生物群是新生儿最相关的产前和产后微生物来源。
阴道微生物群是一个复杂的生态系统,大约由200多种细菌组成,最主要的阴道种群是乳杆菌(Lactobacillus),在阴道中已检测出超过20种乳杆菌,占细菌群落的近70%。以及其他不太丰富的细菌,如普雷沃氏菌属、链球菌属、拟杆菌属和韦荣氏球菌属。
✦ 阴道微生物群主要分为五种类型
阴道微生物群主要分为五种类型,它们在组成和丰度方面都不同,每个类型都会以一种细菌为主导:
卷曲乳杆菌(CSTI),加氏乳杆菌(CSTII),惰性乳杆菌(CSTIII),多元组(CSTIV表现出较低的乳杆菌属丰度)和詹氏乳杆菌(CSTV)。
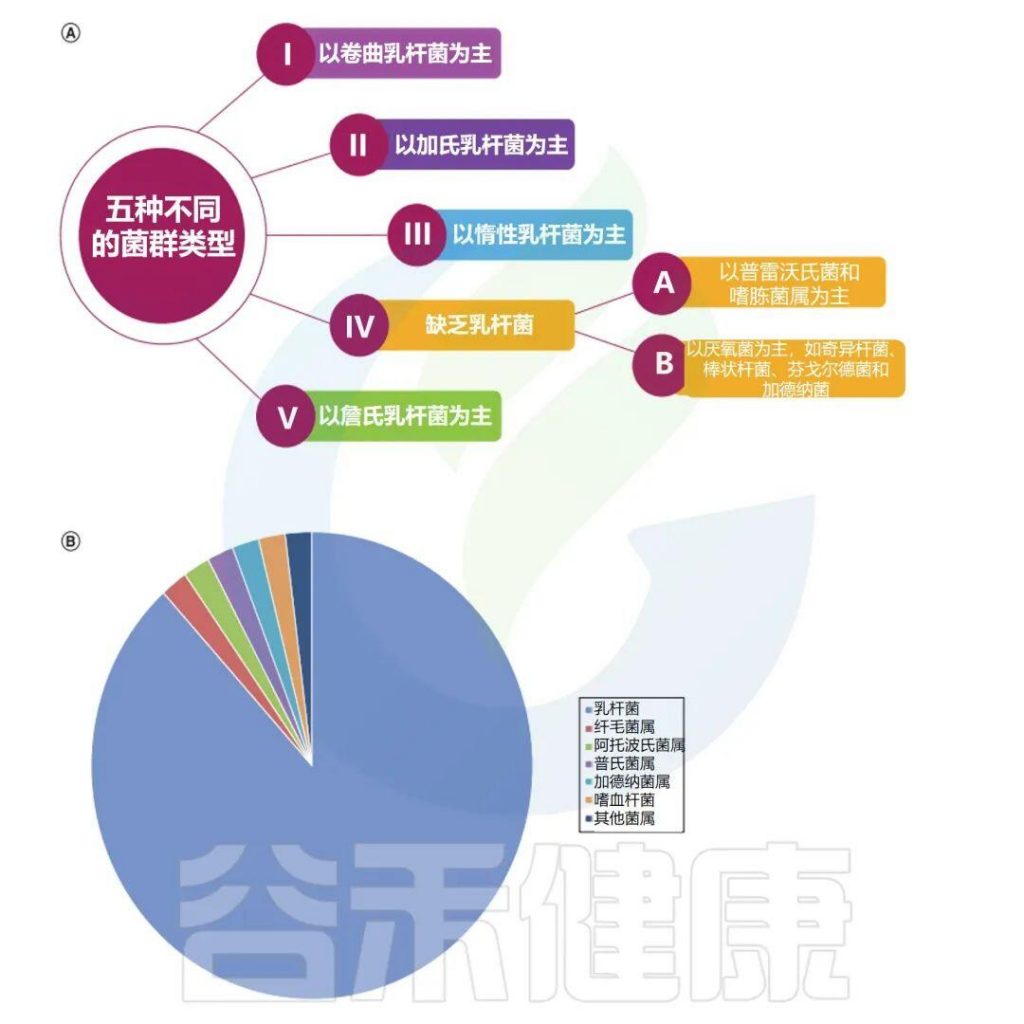
阴道微生物群会因地理位置、种族和卫生条件而异。例如,在美国的非裔美国人和西班牙裔妇女中CSTIV的丰度较高,这些成员在维持低pH值和代谢物分泌中起重要作用,以防止病原体在阴道中定植。
✦ 阴道微生物群会随激素水平、分娩、母乳喂养而变化
越来越多的研究证据表明阴道微生物群是阴道健康的重要生物标志物。然而,阴道微生物群并非一成不变。事实上,阴道微生物群显示出时间动态变化,有些群落发生变化,有些则相对稳定,这取决于核心菌群。

最近一项涉及比利时3345名妇女(18-98岁)的研究显示,阴道微生物群与激素变化(雌激素水平和避孕药的使用)正相关。
相反,阴道微生物群与分娩和母乳喂养等因素呈负相关。此外,同一项研究表明,富含阴道加德纳菌(Gardnerella)、普雷沃氏菌属(Prevotella)和拟杆菌(Bacteroides)的阴道微生物群与更年期、月经卫生和避孕药具使用有关。
▸ 子宫、输卵管的微生物群对生殖健康也有影响
女性生殖系统含有对女性健康有影响的细菌,这些细菌也存在于阴道之外。先前的几项研究表明,女性上生殖道(UFRT)中存在微生物群,包括子宫颈内膜、子宫、输卵管和卵巢,其特征是生物量低,并且与生殖和子宫健康相关。
✦ 子宫内膜也以乳杆菌为主,但与阴道菌群有所不同
子宫内膜微生物群的特征是大量乳杆菌(Lactobacillus),其次是加德纳菌(Gardnerella), 普雷沃氏菌属、Atopobium和Sneathia,这也在阴道中发现。然而,似乎子宫内膜细菌群与阴道中的细菌群有些不同,这表明这两种微生物群是相关的,但并不相同。
✦ 输卵管中的菌群
此外,输卵管中也有一些细菌定居,如乳杆菌属、葡萄球菌属、肠球菌属、普雷沃氏菌属和丙酸杆菌,与假单胞菌属。
▸ 男性生殖道的微生物群
之前很少有人研究男性生殖道中的微生物群。最近的研究显示,精液中存在微生物群,其中芽孢杆菌门(Bacillota)是最主要的门,其次包括拟杆菌门、假单胞菌门和放线菌门,其中最常见的属有乳杆菌属、普雷沃氏菌属、Gillisia、棒状杆菌属和加德纳菌。
✦ 男性的生殖道微生物群对生育健康有一定影响
阴道加德纳菌在阴道微生物群中的优势可能与男性炎症有关,这或与阴道定植/感染有关。有人认为,男性和女性生殖微生物群之间存在联系,影响生育、生殖健康和妊娠。
事实上,之前的大多数关于精液微生物组研究都集中在不孕不育问题上,突出了微生物特征和多样性的差异。据报道,男性微生物群受到包括环境在内的不同因素的影响。此外,精液微生物群可能会干扰受孕和早产。据报道,怀孕期间典型的精液细菌(如嗜酸乳杆菌)的存在率较高与早产有关,而另一种常见的精液细菌——卷曲乳杆菌(Lactobacillus crispatus)的优势已被确定为具有保护作用。
总之,女性和男性的生殖微生物组与生殖健康密切相关。研究显示,微生物可作为生物标志物,有助于开发诊断和治疗不孕症的新工具。
生殖过程发生在“微生物环境”下,这些微生物及其代谢物需得到更多关注,因为它们与孕前阶段密切相关。
在怀孕期间,妇女的生理和代谢有所变化,以便为胎儿提供最佳子宫内环境,促进其健康发育。妊娠期间的内分泌、免疫和代谢变化,会营造一种促炎状态,反映在阴道、肠道和口腔的微生物群变化中。
研究微生物标志物与妊娠结局之间的关系,有助于预防和调整与妊娠并发症相关的不利微生物变化。
▸ 阴道微生物群
据报道,怀孕后阴道微生物多样性降低,而乳杆菌成员增加,潜在地加强了它们的保护功能。
✦ 较低水平的乳杆菌与早产风险增加相关
就个别物种而言,卷曲乳杆菌与来自足月妊娠的样本相关。进一步证明,病史包括反复尿路感染的妇女表现出早产风险增加。在足月分娩和早产分娩之间,已经观察到阴道微生物群在组成、稳定性和多样性方面的差异。
加特纳菌(Gardnerella)、Atopobium和Uraplasma spp.的存在,以及较低水平的乳杆菌成员或较高水平的白色念珠菌的存在,已被发现与早产风险有关。
因此,在妊娠期间检测阴道微生物组内的异常可以用作预测早产可能性的微生物生物标志物,特别是在妊娠前三个月检查阴道微生物组。

最近的一项研究报告称,无抗生素的阴道微生物群移植(VMT)和供体移植解决了复发性流产后的阴道生态失调问题。这些研究表明,VMT是一种潜在的治疗具有不良生育和妊娠结局的严重阴道生态失调的方法,然而,还需要进一步的研究。
▸ 肠道微生物群
虽然在妊娠的前三个月期间,肠道微生物群的组成保持稳定,并且类似于孕前微生物群,但是从妊娠的前三个月结束起,其组成发生了根本的变化。
✦ 妊娠三个月后促炎的微生物更丰富,产短链脂肪酸的微生物减少
这些变化反映了更具促炎性的特征,包括妊娠晚期假单胞菌门(肠杆菌科成员)和放线菌门(主要是双歧杆菌成员)的增加,以及短链脂肪酸(SCFA)生产者的减少。
肠道微生物群与多种妊娠表型有关,包括体重增加、轻度炎症和胰岛素抵抗。
✦ 怀孕期间的饮食、营养、抗生素的使用会影响后代的微生物
已经有研究广泛证明,怀孕期间暴露于抗生素会改变母亲的微生物生态系统,从而改变后代的微生物生态系统。怀孕期间使用抗生素会增加阴道内葡萄球菌物种,此外,肠道以外的其他区域的潜在微生物转移可能与过敏和肥胖的风险增加有关。
此外,微生物群在怀孕期间受到母亲的饮食和营养状况的影响,也对其后代的微生物群组成产生影响。人体研究表明,妊娠期女性肠道微生物群的变化易受孕前母体最大体重指数(身体质量指数)的影响,也易受妊娠期体重增加的影响。较低的双歧杆菌属物种在超重和肥胖的母亲以及在怀孕期间体重增加过多的母亲中观察到。
另一项研究报告了怀孕期间体重状况的类似变化和较低水平的拟杆菌物种,以及更丰富的葡萄球菌和大肠杆菌物种在超重孕妇中被发现。
母体肠道微生物群的这种变化可能与通过阴道分娩出生的新生儿的肠道定植过程的差异有关。
▸ 口腔微生物群
怀孕还会引起口腔微生物群的变化。比较孕妇和非孕妇口腔中几种物种的丰度时,已经报道了显著的差异。
✦ 怀孕时口腔中的微生物数量增加,致病菌水平也较高
妊娠期口腔微生物群的特征是活菌数量增加,同时致病菌水平较高,例如牙龈卟啉单胞菌(Porphyromonas gingivalis),Aggregatibacter actinomycetemcomitans和假丝酵母(Candida genus)。
✦ 口腔生态失调与妊娠期并发症存在一定关联
越来越多的证据表明口腔感染和与妊娠并发症(包括早产)之间的联系。还有证据表明,妊娠期口腔生态失调与妊娠期糖尿病、先兆子痫和胎儿紊乱的风险增加相关。
这些数据表明,口腔微生物群在孕产妇和新生儿结局中也起着关键作用,包括妊娠并发症、早产风险和早期胎儿/新生儿微生物定植。
越来越多的证据表明了细菌从母亲到孩子的垂直传播。垂直传播是一个显著的过程,其中细菌菌株在母亲和新生儿之间交换。
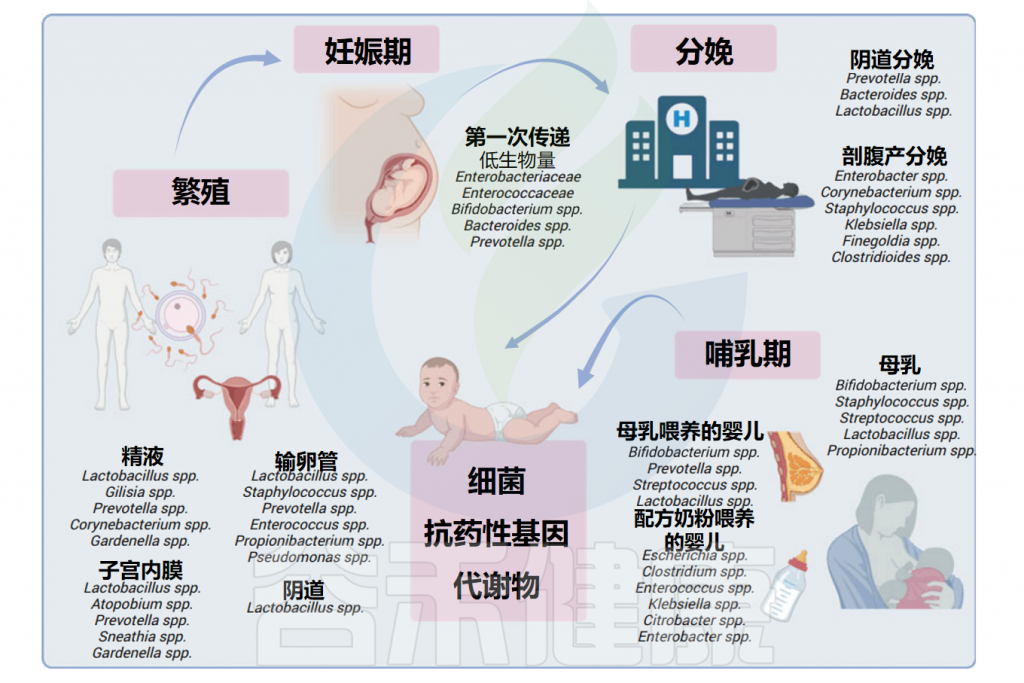
研究人员探索了各种母体菌群来源,包括粪便、母乳、阴道微生物群和皮肤,以揭示这些关键细菌菌株的来源。影响婴儿肠道定植的关键因素包括出生时的胎龄、分娩方式、产前暴露、遗传、抗生素的使用和是否纯母乳喂养。
▸ 特定的垂直传播——例如双歧杆菌
双歧杆菌属(Bifidobacterium)是从母亲传播到婴儿肠道的最常见的微生物,主要传播源是母乳和粪便,出生时的胎龄、出生地、分娩方式和抗生素使用等变量可能会影响双歧杆菌的状态。
✦ 双歧杆菌等菌属从出生时自母亲传播到婴儿体内并定植
已知胃肠道微生物的早期正常定殖有助于免疫系统的发育,并有助于通过调节环境来维持体内平衡。

一项纵向研究表明长双歧杆菌(B.longum)和B. Brief的菌株似乎从出生到4个月一直存在于婴儿的微生物生态系统中。
通过宏基因组测序,我们深入了解了母体肠道到婴儿肠道的传播,外部因素的影响——地点、出生模式和抗生素的使用,每个因素都在形成婴儿微生物群中发挥作用。
双歧杆菌属物种表现出持久性和适应性。与母乳中发现的生物活性化合物(如母乳低聚糖)一起,在支持婴儿肠道微生物群和免疫系统的成熟方面发挥着至关重要的作用。
▸ 抗生素抗性基因转移
双歧杆菌等有益菌可以由母亲传递给婴儿并定植,与此同时,一些带有抗生素抗性基因的微生物也在母体到婴儿之间转移。
抗生素抗性微生物(ARMs)分布广泛,在人、动物之间传播,并通过动物性食物传播。它们携带抗生素抗性基因(ARG),整个细菌群体中的ARG组被称为抗性组。
✦ 耐药病原体可能从母体转移至新生儿体内
生命早期,尤其是围产期和产后,是婴儿肠道微生物群和免疫力发育的关键时期。此外,婴儿的免疫系统尚未成熟,因此他们特别容易获得和携带耐药病原体。这导致每年估计有214000名新生儿因抗生素抗性病原体引起的脓毒性感染而死亡。
婴儿肠道中抗生素耐药微生物菌株的主要来源尚不确定;虽然母体微生物群是主要来源,但其他个体和环境也是相关的,并可能导致婴儿耐药性。微生物在出生、哺乳和密切接触期间从母亲传播给后代。
✦ 母乳喂养、剖腹产等因素影响抗性基因的转移
各种围产期因素,如剖腹产、抗生素暴露、早产和母乳喂养会影响微生物从母亲到婴儿的垂直传播。一些研究阐明了抗生素抗性基因(ARG)在新生儿出生后不久就存在,表明ARMs的最初定殖发生在出生后不久,可能来自与母亲或医院环境的接触。一些研究表明,母亲向婴儿传播耐药细菌,包括各种抗生素耐药菌株,如大肠杆菌, 链球菌等。
众所周知,母乳喂养对婴儿健康有益,为婴儿提供营养和细菌。然而,对于发育中的婴儿来说,母乳似乎是耐药细菌和精氨酸的来源之一。在人乳中发现了耐药菌株。宏基因组分析揭示了母乳中高水平的精氨酸和遗传元素,类似于婴儿对母乳的抵抗力。这表明母亲通过抗性细菌的转移在发展婴儿的肠道抗性中起作用。
需要更多的研究来了解耐药细菌在母体与婴儿间的垂直传播,以理解其对婴儿最初肠道定植的影响。这种更深入的理解将有助于开发控制抗生素耐药基因在母婴之间传播的策略。
在出生时,除了来自环境的微生物之外,新生儿还会遇到来自阴道和母体肠道的数量巨大、种类繁多的微生物。
新生儿中的微生物群定植是一个与健康密切相关的敏感、动态过程。早期多样的微生物建立和特定短链脂肪酸的产生对免疫系统的成熟至关重要。
▸ 最早的新生儿微生物群
✦ 母体与婴儿之间的微生物接触最早可能始于子宫收缩时
不同的研究报告了通过培养依赖性和独立性方法确定的第一次粪便中存在细菌,即胎粪。一些研究人员认为,微生物接触可能最早始于子宫收缩和胎膜破裂期间,从而解释了胎粪中细菌的存在。
首个微生物群由变形菌门(Pseudomonadota)和芽孢杆菌门(Bacillota)的物种组成,如肠杆菌科(Enterobacteriaceae)和肠球菌科(Enterococcaceae)。
此外,还发现了其他菌属,包括双歧杆菌属、拟杆菌属和普雷沃氏菌属。与7天新生儿微生物群相比,首次通过的胎粪微生物群显示出更高的微生物多样性和丰富性,这表明新生儿出生时大量接触微生物,但只有少数能够在肠道中定植并持续存在,以便在出生后的第一年逐步进化。
▸ 影响新生儿微生物群的因素
肠道微生物群会随时间进化,变得更加多样。因此,新生儿定植是一个脆弱的、动态的和逐步的过程,它会受到许多母婴因素以及环境因素的影响。
其中,最相关的因素包括:孕龄、分娩方式(阴道分娩与剖腹产)、地点(医院与家庭)、喂养方式(母乳、混合膳食或婴儿配方奶粉)以及产妇健康状况、遗传、药物、接触异生物质或物理化学制剂的环境、兄弟姐妹、宠物以及人与人之间的水平微生物传播等。
✦ 抗生素的使用

分娩期抗生素预防可能会改变出生后第一周的肠道微生物群,包括放线菌的减少以及假单胞菌属和杆菌属比例的稳步增加。
另一项研究报道,分娩期间施用的抗生素也可以改变新生儿的口腔微生物群,从而导致在抗生素治疗后假单胞菌门的丰度更高。这可能会对儿童发育产生重要影响。
此外,据观察,在妊娠中期和晚期接受抗生素治疗的儿童患肥胖症的风险增加了84%,这可能是由于肠道微生物的变化引起的。
✦ 早产影响婴儿的肠道微生物群平衡
此外,有几项研究报道早产婴儿的微生物群是不平衡的。例如,已有研究表明,与足月婴儿相比,早产胎粪微生物组导致无菌小鼠粪便移植后免疫功能改变、生长受限和激素水平变化。
然而,早产儿有其他合并症,因为他们大多数是通过剖腹产出生的,在出生时和住院期间暴露于抗生素;他们也用母乳喂养,并在新生儿重症监护室呆了更长时间,这些因素可能都会影响早产婴儿的肠道微生物群。
✦ 母亲的健康状况也会影响婴儿的微生物群
也有越来越多的证据表明,子宫内炎症导致围产期并发症增加。婴儿健康和微生物群的母婴传播之间的关联可能受到诸如母亲糖尿病等因素的驱动、特应性疾病、饮食,身体质量指数和围产期抗生素使用。
研究人员观察到患有妊娠期糖尿病(GDM)前期的母亲所生婴儿的胎粪中含有丰富的细菌,这些细菌通常在成年糖尿病患者中观察到。母亲的高脂肪饮食影响婴儿微生物群,表现为拟杆菌属显著减少。
此外,婴儿微生物群影响免疫系统发育的分子机制尚未完全了解,尽管有越来越多的证据表明肠道微生物群在儿童期和成年期的疾病和健康中具有免疫调节活性。
✦ 顺产的婴儿微生物群与母亲肠道微生物更相似
先前已经证明,阴道出生的新生儿具有类似于阴道和肠道母体微生物群的微生物群,富含乳杆菌和普雷沃氏菌,尽管也存在其他细菌,如肠杆菌科,包括埃希氏菌属或克雷伯菌属。
而通过剖腹产出生的新生儿呈现出与口腔、皮肤和环境微生物群相似的独特微生物群。母体肠道似乎也是早期定植细菌的重要来源,因为在经阴道分娩的新生儿中,已发现72%的肠道细菌来自母体肠道,相比之下,经剖腹产出生的受试者中只有41%来自母体肠道,已显示双歧杆菌属在新生儿肠道定植过程中作为先锋细菌的成员,剖腹产出生的婴儿表现出拟杆菌属的延迟定植和多样性降低。
✦ 母乳喂养有助于母亲的微生物群在婴儿中定植
出生后,母乳喂养既支持了微生物的肠道定殖,又促进了免疫系统的成熟。据报道,母乳喂养和配方奶粉喂养的新生儿微生物群之间存在差异。
此外,母乳喂养的停止,而不是补充和固体食物的引入,对婴儿微生物群产生了关键影响。传统上,母乳被认为是无菌的。尽管如此,证据表明,母乳样本中存在活微生物,包括葡萄球菌和链球菌,是最丰富的微生物群,其次是乳酸菌、双歧杆菌和某些假单胞菌(Pseudomonas和Acinetobacter)。

最近的一项研究表明,婴儿肠道中27.7%的细菌来自母乳,10.3%来自乳晕皮肤,从而突显了母乳喂养对婴儿肠道微生物群的潜在影响。
此外,母乳和婴儿肠道之间共享的微生物和病毒种类也有被发现。
饮食是塑造我们肠道微生物群的一个关键因素。因此,建议进行饮食和营养咨询以及营养补充,以便在孕前和妊娠阶段达到适当的营养状态。最近有报道称,怀孕期间以及随后的母乳喂养期间,母亲的饮食对母亲和婴儿的微生物群都有重要影响。
★ 地中海饮食有助于改善母婴的健康水平
母亲的蛋白和纤维摄入量会影响母乳成分,如微生物群、脂质、母乳低聚糖(HMO)和microRNA表达谱。地中海饮食(MD)被证明在怀孕期间能够改善母婴健康结果,包括生长受限、胎儿和新生儿大脑发育、儿童神经发育。
妊娠期地中海饮食,主要是水果、蔬菜和豆类的摄入量增加,红肉的摄入量减少,与Acidaminoacaeae家族水平以及短链脂肪酸生产者的丰度较高有关。
植物蛋白、纤维和多酚的摄入量增加与瘤胃球菌属(Ruminococcus)、Christenselacae科、Dehalobacterium和真/优杆菌属(Eubacterium)以及短链脂肪酸生产菌的存在增加有关。
✦ 饮食不仅改善肠道微生物,对阴道、口腔微生物也有影响
大多数关于饮食-怀孕-微生物群的可用数据都集中在肠道微生物群上,但据报道,增加水果、维生素D、纤维和酸奶的摄入量与女性阴道卷曲乳杆菌(L.Crispatus)有关;纤维摄入与较高的异质性相关。
有限的证据表明饮食对阴道微生物群和妊娠结局的影响。在这种情况下,仍需确定哪些食物、食物成分、营养素和其他膳食化合物会影响围产期妇女的微生物群(肠道、口腔和阴道),以及对母婴结局的潜在影响。
对围产期饮食干预的研究兴趣日益增加,以及在怀孕期间使用益生菌、益生元和共生体来调节微生物群和促进“有利的微生物垂直传播”。有一些证据表明,在怀孕和哺乳期间服用益生菌可以起到保护作用,而益生元和其他益生菌的证据较少。
值得注意的是,脆弱和敏感人群需要特殊的安全性考虑,包括安全性和与妊娠、哺乳和婴儿期相关的不良反应的潜在报告。
▸ 益生菌对生育能力的影响
补充乳杆菌有利于重建阴道菌群平衡
阴道感染会影响乳杆菌的平衡,导致可能影响生育能力的细菌的生长。因此,补充乳杆菌应有助于重建平衡。
一项涉及健康女性的体外受精研究显示,在阴道定植卷曲乳杆菌(L.Crispatus)后,受孕结果很有希望。
补充益生菌有助于提高精子质量
在不孕症和辅助生殖医学的病例中,已报道了精液微生物群组成的差异,使用益生菌可能在精液特征和质量参数方面具有有益的效果。研究已经显示出Lacticaseibacillus rhamnosus CECT8361和B.longum CECT7347在弱精子症男性中,补充为期六周可以改善精子质量参数和活力,并降低DNA片段和活性氧(ROS)水平。
另一方面,有报道称,共生菌(Flortec, Lacticaseibacillus paracasei B21060 和阿拉伯半乳聚糖、低聚果糖和l-谷氨酰胺)对少弱畸形精子症患者精液质量和数量具有一定的改善作用。
此外,系统综述和荟萃分析表明,益生菌有利于精子活力。然而,关于益生菌对接受辅助生殖的女性的功效,存在相互矛盾的证据。这表明需要更多临床研究来证明益生菌对生育能力的影响。
▸妊娠期使用益生菌降低疾病风险
孕期服用益生菌为减少母婴健康风险提供了方案。现有研究主要集中在早产风险、减少生殖器感染、妊娠期糖尿病(GDM)和先兆子痫前期等方面,这些往往被视为次要健康结果。
益生菌有助于改善孕妇生殖器感染
孕妇经常患有复发性尿路感染(UTIs)、外阴阴道念珠菌病(VVC)和细菌性阴道病(BV)。这些问题与不利的母婴妊娠结果有关,包括早产风险和胎儿生长受限。益生菌已被提出作为治疗BV和UTI的预防性替代品,通过维持或恢复阴道微生物群或防止病原体在尿道定植。
先前的研究表明,益生菌组合,即嗜酸乳杆菌、乳双歧杆菌(B.lactis)和长双歧杆菌(B.longum),对孕妇B组链球菌(GBS)定植具有潜在的治疗作用。

此外,最近的研究表明益生菌菌株在治疗妊娠期GBS感染方面的有效性,其中一项临床研究报告称,补充鼠李糖乳杆菌GR-1和罗伊氏乳杆菌RC-14被证明对治疗GBS感染有效。
最近一项涉及36名GBS阳性女性的研究报告称阴道共生菌显著增加,对阴道GBS有影响。而一项对18项研究的系统综述和荟萃分析表明,抗生素和益生菌显著降低了细菌性阴道病(BV)的复发率,提高了治愈/缓解率。其他报告益生菌对阴道炎影响的研究也显示了类似的结果。
✦ 降低先兆子痫的风险

最近一项涉及70149名孕妇的研究发现,益生菌(嗜酸乳杆菌[LA-5],乳双歧杆菌[Bb12]还有鼠李糖乳酸杆菌GG [LGG])显著降低先兆子痫的风险。
这项研究还强调了“时机”(即何时进行益生菌干预)的相关性,因为在怀孕前或怀孕早期食用益生菌没有观察到任何影响。孕晚期(而非孕前或孕早期)摄入益生菌牛奶与降低先兆子痫风险显著相关(调整后的 OR:0.80(95% CI 0.68 至 0.94)p 值:0.007)。孕早期(而非孕前或孕晚期)摄入益生菌与降低早产风险显著相关(调整后的 OR:0.79(0.64 至 0.97)p 值:0.03)。
然而另一项系统综述报告称,与安慰剂相比,益生菌会导致肥胖受试者的先兆子痫风险增加。肥胖与先兆子痫的风险较高有关。因此,需要更多的研究来确定弱势群体中与益生菌相关的风险。
预防妊娠期糖尿病,改善胰岛素敏感性
鼠李糖乳杆菌(L.rhamnosus)GG和乳双歧杆菌(B.lactis)BB12与饮食相结合已被证明可以预防妊娠期糖尿病(GDM),降低血糖浓度和改善胰岛素敏感性。
另一种益生菌菌株,鼠李糖乳杆菌(L.rhamnosus) HN001菌株能够降低GDM的患病率,特别是在中老年妇女和那些以前患有妊娠期糖尿病的妇女中。
最近的一项系统综述包括30多项在怀孕期间进行的研究,表明益生菌干预对改善血糖控制、降低低密度脂蛋白胆固醇(VDL)和甘油三酯以及减少炎症标记物的潜在作用。
益生菌补充剂可能会降低妊娠期糖尿病(GDM)的发病率,并有助于控制健康孕妇和超重和肥胖妇女的血糖参数。
最近的荟萃分析显示,益生菌将GDM发病率降低了33%,当使用多种菌株益生菌组合时,效果更好。一项系统综述和荟萃分析还报告称,摄入酸奶(活微生物)可以降低GDM的风险,并降低空腹血糖。
减少产后压力和抑郁
越来越多的数据显示益生菌对抑郁、焦虑和情绪的潜在用途。一项研究(系统综述和荟萃分析)显示,益生菌在减少孕妇和哺乳期妇女的焦虑和抑郁方面具有积极作用。
其他研究报告了益生菌和对照组在抑郁评分方面没有差异,然而,在总体精神健康评分方面,报告了焦虑的降低。
▸ 出生后使用益生菌的有益作用
文献中有数据和研究表明特定益生菌的有益作用,例如布拉氏酵母菌,鼠李糖乳酸杆菌GG(LGG),罗伊氏乳杆菌和动物乳双歧杆菌(Bb12)。
婴儿早期使用益生菌的主要目标是:
1)预防腹泻和感染;
2)预防过敏;
3)预防坏死性小肠结肠炎和早产儿迟发性败血症、预防婴儿绞痛。
此外,一项系统综述强调了灭活益生菌的潜在益处,灭活益生菌在生命的早期和敏感期以及敏感人群是一种安全的替代品,如早产儿和儿科人群。
产后使用益生菌的另一个例子与患有乳腺炎的女性有关,包括感染性乳腺炎和葡萄球菌乳腺炎。
在探索微生物群与人类健康之间的复杂关系时,我们发现,从受孕到生命最初几年,微生物群在每一个生命阶段都扮演着不可或缺的角色。母体的微生物环境不仅影响着怀孕过程中的生理变化,还直接关系到婴儿的健康和发育。通过了解这些微生物的作用,我们可以更好地认识到早期干预的重要性,尤其是通过饮食和生活方式的调整来优化母婴微生物群。
随着科学研究的不断深入,我们有望开发出更有效的策略,以促进母婴健康,预防潜在的健康问题。未来的研究将继续揭示微生物群的奥秘,帮助我们在整个生命周期中实现更好的健康结果。
主要参考文献
Samarra A, Flores E, Bernabeu M, Cabrera-Rubio R, Bäuerl C, Selma-Royo M, Collado MC. Shaping Microbiota During the First 1000 Days of Life. Adv Exp Med Biol. 2024;1449:1-28.
Arzamasov AA, Nakajima A, Sakanaka M, Ojima MN, Katayama T, Rodionov DA, Osterman AL (2022) Human milk oligosaccharide utilization in intestinal Bifidobacteria is governed by global transcriptional regulator NagR. mSystems 7(5):e00343–e00322.
Calvo-Lerma J, Selma-Royo M, Hervas D, Yang B, Intonen L, González S, Martínez-Costa C, Linderborg KM, Collado MC (2022) Breast milk lipidome is associated with maternal diet and infants’ growth. Front Nutr 9:854786.
Canha-Gouveia A, Pérez-Prieto I, Rodríguez CM, Escamez T, Leonés-Baños I, Salas-Espejo E, Prieto-Sánchez MT, Sánchez-Ferrer ML, Coy P, Altmäe S (2023) The female upper reproductive tract harbors endogenous microbial profiles. Front Endocrinol 14:1096050.
Mikami K, Kimura M, Takahashi H (2012) Influence of maternal Bifidobacteria on the development of gut Bifidobacteria in infants. Pharmaceuticals 5(6):629–642.
Garcia-Mantrana I, Selma-Royo M, Gonzalez S, Parra-Llorca A, Martinez-Costa C, Collado MC (2020) Distinct maternal microbiota clusters are associated with diet during pregnancy: impact on neonatal microbiota and infant growth during the first 18 months of life. Gut Microbes 11(4):962–978.
García-Mantrana I, Bertua B, Martínez-Costa C, Collado MC (2016) Perinatal nutrition: how to take care of the gut microbiota? Clin Nutr Exp 6:3–16.
Li W, Tapiainen T, Brinkac L, Lorenzi HA, Moncera K, Tejesvi MV, Salo J, Nelson KE (2021) Vertical transmission of gut microbiome and antimicrobial resistance genes in infants exposed to antibiotics at birth. J Infect Dis 224(7):1236–1246.

谷禾健康

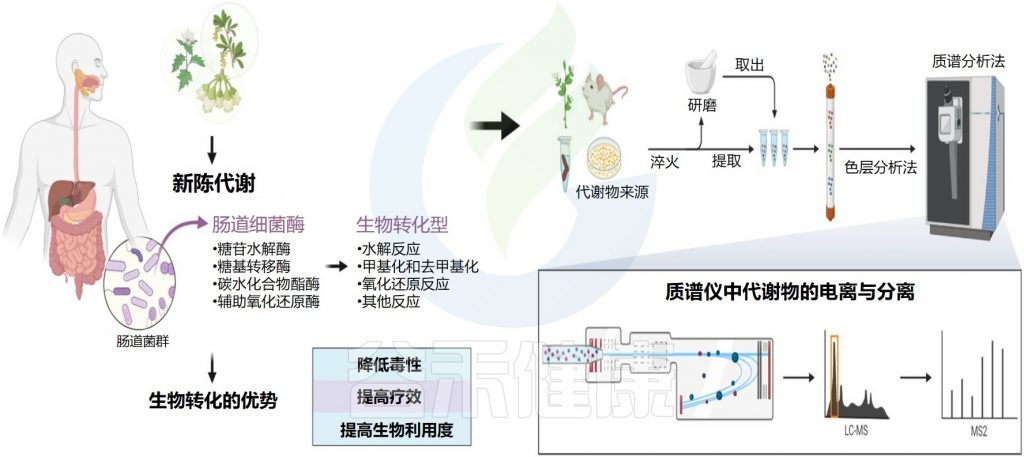

什么是天然产物?
天然产物是指动物、植物、昆虫或微生物体内的组成成分或其代谢产物以及人和动物体内许多内源性的化学成分,是自然产生的小分子。值得注意的是,天然产物来源中,植物来源占85%以上。
谷禾在这里主要介绍植物来源的天然产物,包括营养素和药物。它们很容易与肠道微生物群相互作用,因为它们的成分复杂,在肠道中的停留时间长。通常,外源物质在小肠中的停留时间为1-6小时,在结肠中的停留时间为1-3天。特定的肠道微生物分解和转化天然产物,产生丰富的代谢物和功能化合物,具有宿主本身无法合成的生理活性。
天然产物在食品、药品、保健品领域均有运用。天然产物是极为重要的新药来源。近年来临床应用的药物,三分之二左右源自天然产物、天然产物衍生物以及天然的生物大分子,几乎涵盖了疾病治疗的各个方面。这在防治癌症及传染类疾病领域中的表现尤为明显。
天然产物在临床上得到了广泛的应用,其特点是多组分、多靶点、药效学物质多、作用机理复杂、生理活性多样。
对于口服天然产物,肠道菌群与临床疗效密切相关,但这种关系尚不明朗。肠道微生物在酶系统多样性引起的天然产物的转化和利用中起着重要作用。黄酮类化合物、生物碱、木酚素和酚类等有效成分不能通过人体消化酶直接代谢,但可以通过肠道微生物产生的酶转化,然后加以利用。因此,重点是通过肠道微生物群进行天然产物的代谢。
本文介绍了肠道微生物群及其对天然产物各组分生物转化的影响的研究,并强调了所涉及的常见菌群,反应类型,药理作用和研究方法。为临床疾病防治中的应用提供理论支持,以及日常的选择健康的药物提供一定的参考,并为基于肠道生物转化的天然产物研究提供新思路。
基于肠道微生物的天然产物的生物转化和代谢

Zhao Y,et al.Front Microbiol.2022
★人体肠道中的微生物
肠道微生物群由1000-1250种细菌组成,这些细菌以各种形式与人类相互作用,例如共生和寄生,这种相互作用通过微生物代谢物作为信号分子极大地影响人类健康。
肠道微生物构成了一个动态和多样化的微生态系统,这是抵抗致病细菌的天然屏障。肠道微生物具有丰富的酶系统,包括葡萄糖苷酶,还原酶,裂解酶,转移酶等,并大大扩展了人体内的代谢反应池。
✦肠道菌群影响口服给药的效果
口服给药是药物递送的首选途径,口服药物占市场最畅销药物的大部分。近年来,肠道微生物群对天然产物口服给药稳定性的影响受到广泛关注。
肠道具有丰富的细菌,有助于正常的消化功能,其中健康受试者中约98%的肠道微生物可分为四个门,厚壁菌门(Firmicutes),拟杆菌门(Bacteroidetes),变形菌门(Proteobacteria)和放线菌门(Actinobacteria)。
一些肠道微生物如大肠杆菌,双歧杆菌,真杆菌,乳酸杆菌,拟杆菌和链球菌参与天然产物的生物转化,其部分代谢物有利于肠道吸收并发挥显著的药理作用。
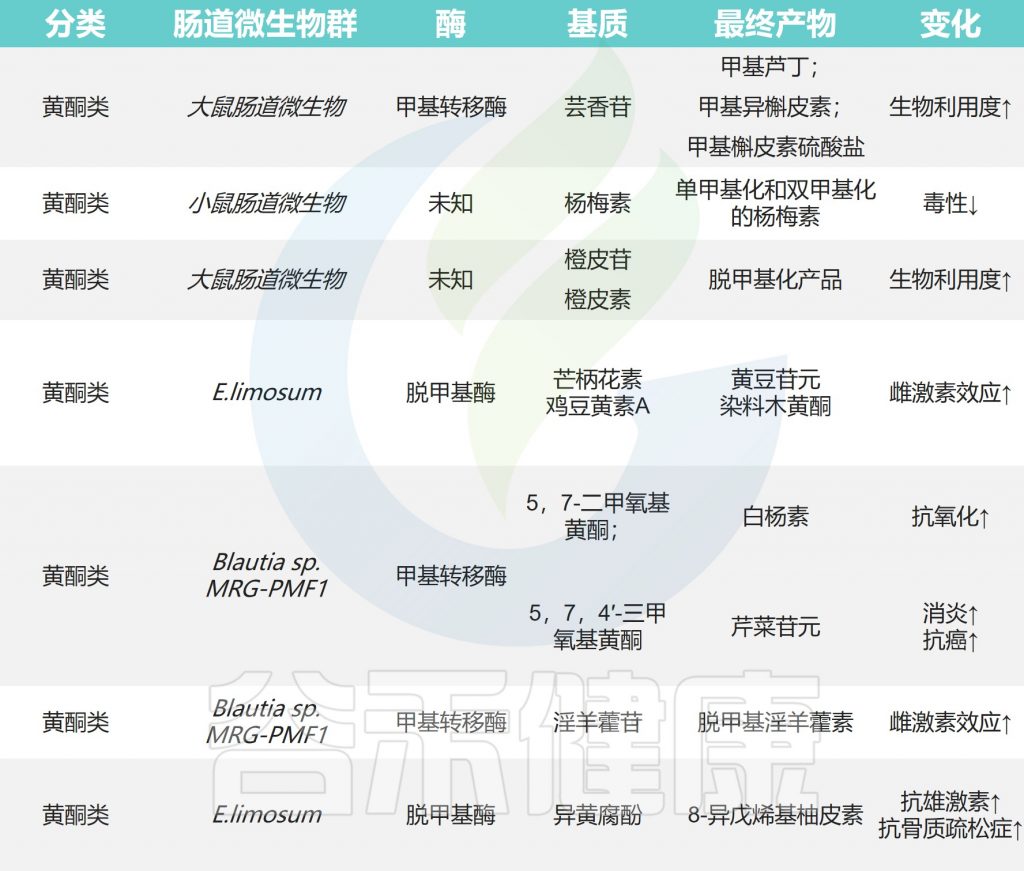
关键肠道微生物对天然产物的生物转化

Zhao Y,et al.Front Microbiol.2022
▸
大肠杆菌(Escherichia coli),又叫大肠埃希氏菌,是一种革兰氏阴性,无孢子,兼性厌氧细菌,主要栖息在脊椎动物的肠道中。
✦水解黄芩苷而具有抗炎抗氧化作用
部分大肠杆菌可以产生糖苷酶参与外源物质的转化,从而产生其有益作用。例如,E.coli HGU-3产生β-葡萄糖醛酸酶,水解黄芩苷中的糖苷键以产生黄芩素。
在相同剂量下,黄芩素比黄芩蒿素更有效地抑制组胺诱导的抓挠行为,并通过抑制Nrf2-ARE和NF-κB信号通路而具有抗炎和抗氧化作用。
✦在脂肪肝变性中有治疗益处
一些大肠杆菌菌株具有较高的姜黄素转化活性。E.coli DH10B的高表达NADPH依赖性姜黄素/二氢姜黄素还原酶(CurA)将姜黄素还原为二氢姜黄素(DHC)和四氢姜黄素(THC),其全基因组序列已经确定。
NADPH是一种辅酶,叫还原型辅酶Ⅱ,学名烟酰胺腺嘌呤二核苷酸,在很多生物体内的化学反应中起递氢体的作用,具有重要的意义。
二氢姜黄素和四氢姜黄素通过调节SREBP-1C和PPARα的mRNA和蛋白质表达水平来降低细胞中的甘油三酯水平,并以依赖性方式衰减肝脏脂肪生成;二氢姜黄素和四氢姜黄素在肝脂肪变性中比姜黄素具有新的治疗益处。
✦水解肉桂酸后有抗氧化和抗癌特性
E.coli Nu, E.coli MC和E.coli WC-1具有肉桂酰酯酶活性,可通过水解共轭羟基肉桂酸和游离羟基肉桂酸酯释放羟肉桂酸,在体外和体内均显示出抗氧化和抗癌特性。
目前,对大肠杆菌的遗传和生化特征的良好理解可能有助于在体外合成具有各种健康活性的天然产物衍生物。
▸
双歧杆菌(Bifidobacterium)是属于放线菌门的广泛而丰富的属,是人类肠道微生物群的首批定植者之一。人类肠道中最常见的双歧杆菌包括青春期双歧杆菌,B.angulatum, B.bifidum, B. breve, B.catenulatum, B.dentium, B.longum, B.pseudocatenulatum和B.pseudolongum,占成人微生物组的10%,它们与宿主健康有关。
✦预防急性肝损伤
某些种类的双歧杆菌可以通过表达阿魏酰酯酶产生酚酸。例如,动物双歧杆菌的阿魏酰酯酶可以将绿原酸(CHA)水解成咖啡酸(CAA)。咖啡酸可以通过增加Nrf2转录来预防对乙酰氨基酚诱导的小鼠急性肝损伤。
✦调节胆汁酸和降低胆固醇
部分双歧杆菌的参与促进了黄烷酮,糖苷和皂苷在肠道中的代谢。B.longum R0175中的β-葡萄糖苷酶和去甲基化酶通过环裂解和脱甲基作用促进3-(3′-羟基苯基)丙酸和3-苯丙酸的产生。
B.longum SBT2928水解六种主要的人类和两种动物胆汁盐。因此,双歧杆菌可以调节胆汁酸代谢并降低体内胆固醇水平。
✦抗肿瘤和提高免疫
此外,B.breve ATCC 15700产生β-葡萄糖苷酶,在人参皂苷Rd的C-3和C-20位置裂解糖苷,生成脱糖基化的人参皂苷。
人参皂苷主要存在于人参和马铃薯药材中
人参皂甙的作用和功能是抑制肿瘤细胞的生长,诱导肿瘤细胞死亡,研究肿瘤的活性功能,肿瘤的异常逆行分化,提高人体免疫功能。
这些天然产物具有潜在的益处,代谢特征使双歧杆菌成为共生发展的主要候选者。
▸
真杆菌(Eubacterium)菌株的属是革兰氏阳性菌,它是人类肠道微生物群的核心属之一,并显示出在人类肠道的广泛定植。
一些真杆菌产生糖苷酶,还原酶等,并参与外源性物质的代谢。
✦抗炎抗氧化
E. ramulus是研究最广泛的类黄酮降解肠道细菌之一,它在人体肠道中很普遍。广泛存在于人体肠道中。来自E. ramulus的查尔酮异构酶和黄烷酮/黄烷醇裂解还原酶降解某些类黄酮产生查尔酮和二氢查尔酮。
二氢查尔酮及其代谢物具有抗炎和抗氧化作用,可以下调促炎细胞因子的分泌,并挽救脂多糖诱导的氧化磷酸化。
✦降解黄酮类化合物
研究了E.ramulus strain wK1对槲皮素和木犀草素的降解,发现静止细胞和酶制剂通过2,3位双键的还原和随后的环分裂将这些黄酮转化为3,4-二羟基苯基乙酸和3-(3,4-二羟基苯基)丙酸。
来自E.ramulus strain wK1的根皮素水解酶将邻近根皮素芳香A环的C-C键水解为3-(4-羟基苯基)丙酸和间苯三酚。
E.cellulosolvens ATCC 43171T可通过释放的葡萄糖部分的发酵促进类黄酮和葡萄糖苷的去糖基化。
注意:葡萄糖苷的去糖化仅由细菌酶催化。
✦预防气道过敏性炎症
Eubacterium L-8将甘草酸(GL)水解为18β-甘草次酸(18β-GA)。18β-甘草次酸通过抑制NF-κB磷酸化和增强Nrf2/HO-1通路来预防气道过敏性炎症。
NF-kB——核因子κB,参与细胞对外界刺激的响应,在细胞的炎症反应、免疫应答等过程中起到关键性作用
Nrf2/HO-1信号通路已成为细胞抗氧化应激的主要防御机制之一
这些代谢转化体现从真杆菌中获得的各种益处。然而,还需要进一步的体内研究,以最大限度地发挥真杆菌属的潜在益处。
▸
乳酸菌属(Lactobacillus)属于厚壁菌门,可以平衡微生物群落并保护胃肠粘膜。一些乳杆菌属富含代谢酶,如α-鼠李糖酶,单宁酶,没食子酸酯脱羧酶等,它们转化外源性物质。
✦抗炎、抗氧化作用
L. rhamnosus NCTC 10302具有β-葡糖苷酶和α-鼠李糖苷酶活性,通过水解,环裂变和脱氢将橙皮素7-O-葡萄糖苷和柚皮素-7-O-芸香糖苷转化为各自的糖苷元和3-(苯基)丙酸。
L. plantarum表达单宁酶水解没食子酸酯,具有短脂肪醇取代基的原儿茶酸酯和复杂的没食子单宁以产生没食子酸。没食子酸通过抑制MAPK/NF-κB途径并激活Akt/AMPK/ Nrf2途径,在脂多糖诱导的炎症和氧化应激中起保护作用。
MAPK是信号从细胞表面传导到细胞核内部的重要传递者。
Akt,蛋白激酶B,又称PKB或Rac,在细胞存活和凋亡中起重要作用。
✦预防代谢紊乱
观察到,没食子酸和邻苯三酚是由L.plantarum WCFS1中没食子甘氨酸代谢酶降解没食子甘肽而产生的。这项研究意味着益生元-益生菌相互作用在预防饮食诱导的代谢紊乱方面的潜在作用。
✦改善骨质疏松
具有大豆苷元还原酶活性的Lactobacillus sp. Niu-O16。二氢大豆苷元抑制NF-κB活化和MAPK磷酸化,从而改善骨质疏松症。
L.casei, L.plantarum和L.acidophilus影响白藜芦醇苷到白藜芦醇的去糖基化。这种转化对于提高白藜芦醇苷的生物利用度和生物活性非常重要。来自L.reuteri, L.helveticus和L.fermentum的阿魏酰酯酶水解绿原酸以释放咖啡酸。
这些发现为乳杆菌在促进健康的制药和食品应用中的作用开辟了新的视角。然而,潜在的转化机制值得进一步研究。
▸
拟杆菌属(Bacteroides)的成员是革兰氏阴性专性厌氧菌,占结肠中细菌总数的25%,在人类肠道细菌组中起着多种作用。在临床中经常检测到拟杆菌物种,例如脆弱拟杆菌,B.distasonis, B.ovatus和B.thetaiotaomicron。
✦抑制炎症反应
拟杆菌属拥有一系列水解酶,并通过转化外来物质参与与其微生物邻居的物种间关联。体外共孵育实验表明,某些拟杆菌物种参与类黄酮的生物转化。
Bacteroides sp. 45表达α-L-鼠李糖苷酶和β-芦丁糖苷酶,用于将芦丁水解成槲皮素3-O-葡萄糖苷,槲皮素和白花青素。
槲皮素3-O-葡萄糖苷比其他形式的槲皮素吸收得更好,并且可以通过抑制NF-κB和MAPK信号通路来抑制结肠炎小鼠的炎症反应。
Bacteroides sp. 54将槲皮苷代谢为羟基槲皮素和去甲基槲皮素。槲皮苷也被α-L-鼠李糖苷酶降解为槲皮素,并通过Bacteroides sp.45进行进一步的环裂解以产生3,4-二羟基苯甲酸。
β-葡萄糖醛酸酶由拟杆菌J-37表达,将甘草酸代谢为18β-甘草次酸。
天然产物在拟杆菌作用下进行生物转化,产生具有不同功能活性的代谢物。了解人体内天然产物的整个过程以评估其对人体健康的影响是很重要的。
▸
链球菌属(Streptococcus)是革兰氏阳性菌,呈球形或卵形,通常成链排列或成对排列,广泛存在于人类粪便和鼻咽中。
宏转录组学分析表明,磷酸转移酶系统主要由链球菌表达,这表明这些细菌是小肠中可用碳水化合物的主要利用者。
✦抗癌、抗过敏作用
Streptococcus LJ-22表达β-葡萄糖醛酸酶将甘草酸代谢为18β-甘草次酸-3-O-β-D-葡萄糖醛酸(GAMG)。GAMG对脂多糖诱导的RAW264.7细胞具有抗过敏活性。
甘草酸和甘草次酸均有一定的防癌和抗癌作用。甘草次酸可抑制原癌细胞的信息传递和基因表达.甘草酸对多种恶性肿瘤均有抑制作用。甘草次酸还具有抗病毒感染的作用,对致癌性的病毒如肝炎病毒,EB病毒及艾滋病毒的感染均有抑制作用。
此外,单宁酸被Streptococcus gallolyticus subsp.Gallolyticus(SGG)的单宁酶降解以产生邻苯三酚。SGG可能通过消除单宁酸对肿瘤细胞的毒性来促进结直肠癌的发展。因此,有必要进行进一步的体内研究,以确定消除这些单宁酸降解微生物是否可以支持结直肠癌的有效治疗。
✦降低血压,抗氧化
S.thermophilus GIM 1.321很高的β-葡萄糖苷酶生产能力,用于将果实花青素降解为绿原酸,咖啡酸和阿魏酸。
CAA和CHA(10/15毫克/千克/天)的施用可以降低血压并发挥抗氧化作用。
链球菌菌株可能是肠道中的共生、致病和机会性病原体,需要更多关于其对人类健康影响的信息。更好地了解链球菌如何代谢天然产物,可以调节肠道微生物组以提高治疗效果。
▸
经黏液真杆菌(Blautia)属物种严格无氧,不可移动,通常为球形或椭圆形,广泛存在于哺乳动物的肠道和粪便中。越来越多的证据表明,经黏液真杆菌的益生菌特性对天然产物的生物转化有影响。
✦影响生物转化
在类黄酮生物转化过程中,Blautia催化的反应包括去甲基化,去糖基化以及环裂解,其可能被相应的酶催化,例如O-糖苷酶和β-葡萄糖苷酶。
研究表明,Blautia sp. MRG-PMF1菌株分别将5,7-二甲氧基黄酮和5,7,4-三甲氧基黄酮转化为生物活性白杨素和芹菜素,对芳基甲基醚官能团具有水解能力。Blautia sp. MRG-PMF1还具有去糖基化活性,并且发现各种异黄酮,黄酮和黄酮被代谢成相应的糖苷元。
✦去甲基产物具有抗炎、抗癌、抗氧化能力
Blautia sp. MRG-PMF1在菌株进一步代谢具有雌激素作用的去甲基香菜素。该菌株还可以催化姜黄素以产生具有抗炎和抗癌特性的去甲氧基姜黄素。
此外,Blautia sp. AUH-JLD56能够单独生物转化牛蒡子苷或牛蒡子苷元,制成具有更好抗氧化能力的去甲基化产物。
最近,关于Blautia对草本植物和功能性食品的生物转化和代谢研究越来越多。探索Blautia的生物转化对于开发新的酶和生物活性代谢物具有重要意义。
复杂的微生物酶催化肠道中天然产物的代谢,产生有利于宿主利用/排泄的亲脂性和低分子量代谢物。与人类遗传学不同,肠道微生物组的特征是可改变的,使其成为优化治疗的潜在治疗靶点。
口服天然产品进入消化道后,首先会接触大量肠道微生物及其产生的活性酶。因此,天然产物的肠道生物转化可能发生在通过肝脏的第一次传递效应之前,也可以被运输到肝脏进行修饰/结合,然后排泄到肠道,与肠道微生物反应形成一系列代谢产物。
因此,与健康或疾病相关的特定菌株、特定代谢途径和特定酶的组合对于确定肠道微生物对宿主的影响非常重要。
✦水解提高生物活性和生物利用度
某些天然产物具有高分子量和低脂溶性,并且它们难以在肠道中被人体吸收并且具有低生物利用度。通过肠道微生物介导的水解,它们的物理性质发生了变化,它们的生物活性和生物利用度大大提高。
大多数糖苷具有低活性,被认为是“天然前体药物”。在与肠道微生物相互作用后,糖苷的糖基被去除,然后,糖苷部分被肠细胞吸收以发挥生理作用。水解反应是进一步转化所必需的,产物(例如糖)参与促进肠道微生物的生长和存活。
肠道微生物对天然产物的水解反应







Zhao Y,et al.Front Microbiol.2022
✦类黄酮
类黄酮是天然酚类化合物,大量存在于水果和蔬菜中。肠道微生物可能是黄酮类化合物(糖苷形式)功效的部分原因,由于存在水溶性糖成分,其生物利用度较低。
具有3羟基黄酮碱和平面环体系的黄烷醇构成了一类重要的黄酮类化合物。异鼠李素-3-O-新橙皮苷首先被Escherichia sp.23脱糖基化为异鼠李苷-3-O–葡糖苷,去糖基化成苷元异鼠李甙。
•肠道酶代谢比肠道微生物更快
肠道微生物和衍生酶共同控制通过体外测定确定的淫羊藿类黄酮的代谢。在目前的研究中,肠道酶代谢类黄酮的速度比肠道微生物更快。
来自Bacteroides thetaiotaomicron VPI-5482的α-L-鼠李糖苷酶可以水解淫羊藿定C的α-1,2糖苷键以产生芸香苷。
芸香苷,又叫芦丁。具有抗炎、抗氧化、抗过敏、抗病毒等功效。
•肠道酶在水解中起着重要作用
E. ramulus和Clostridium saccharogumia将花青素-氰苷3-葡萄糖苷转化为氰苷。人类肠道酶如β-葡糖苷酶在汉黄芩苷水解成汉黄苷素中起着关键作用。
茶氨酸菌素A是红茶中发现的一种生物活性儿茶素二聚体,通过人类粪便微生物群脱乙酰产生茶氨酸霉素C。
•空间位阻会限制酶降解
观察了黄烷醇的代谢差异,结果表明,在肠道微生物发酵过程中,空间位阻可能限制细菌酶降解部分黄烷醇环。
在肠道微生物的作用下,许多其他类黄酮也会发生水解反应。值得注意的是,考虑到类黄酮的结构差异,肠道微生物对类黄酮的降解程度差异很大,从而影响其生物可利用性。需要进一步研究肠道代谢在类黄酮生物利用度和吸收中的作用,以及可能的细菌类黄酮相互作用活性。
✦萜类化合物
萜类化合物是具有抗癌,抗炎和神经保护作用的最大一类天然产物。部分萜类化合物也可被肠道微生物水解。
萜类化合物广泛存在于自然界,是构成某些植物的香精、树脂、色素等的主要成分。如玫瑰油、桉叶油、松脂等都含有多种萜类化合物。另外,某些动物的激素、维生素等也属于萜类化合物。
肠道微生物也可以水解部分萜类化合物。京尼平苷在Eubacterium sp. A-44表达的β-葡萄糖苷酶的作用下产生京尼平。芍药苷在β-葡萄糖苷酶的作用下转化为PM-I,该酶由L. brevis和脆弱拟杆菌(B. fragilis)表达。通过与大鼠厌氧肠道微生物群孵育,芍药苷也被脱糖并脱苯基为小分子量的白花苷和酰基白花苷。
•肠道微生物中的酶促进水解作用
研究证明,几种具有酯酶的双歧杆菌物种可以在体外将白芍苷水解为苯甲酸。体外研究表明积雪草苷被糖苷键水解酶逐渐去糖基化,并产生相应的苷元。柴胡皂苷B1在β-葡萄糖苷酶和β-D-聚焦酶的作用下逐渐水解为原柴胡皂素和柴胡皂甙A,由Eubacterium sp. A-44表达。
除上述化合物外,萜类人参皂苷Rh2、阿迪普西洛苷I、罗汉果苷III和具栖冬青苷也可在肠道微生物的作用下发生水解反应。
肠道微生物在萜类化合物代谢中起着重要作用,其代谢产物对肠道微生物组和人体健康的影响有待进一步研究。
✦其他化合物
具有极低生物利用度的尿石素只有在来自Gordonibacter urolithinfaciens, Gordonibacter pamelaeae和Ellagibacter isourolithinifaciens的鞣酸酶作用下水解成鞣花酸和尿石等衍生物时才能发挥药理作用。
尿石素——存在于水果和坚果中的一类化合物鞣花单宁的天然代谢产物
从大黄中提取的蒽醌糖苷被肠道微生物水解为蒽醌苷元。Sennoside A是大黄提取物的主要成分,通过Bifidobacterium sp. strain SEN的β-葡萄糖苷酶代谢为大黄蒽酮。
大黄蒽酮具有泻下攻积、清热泻火、解毒、活血祛瘀、利胆退黄等功效。
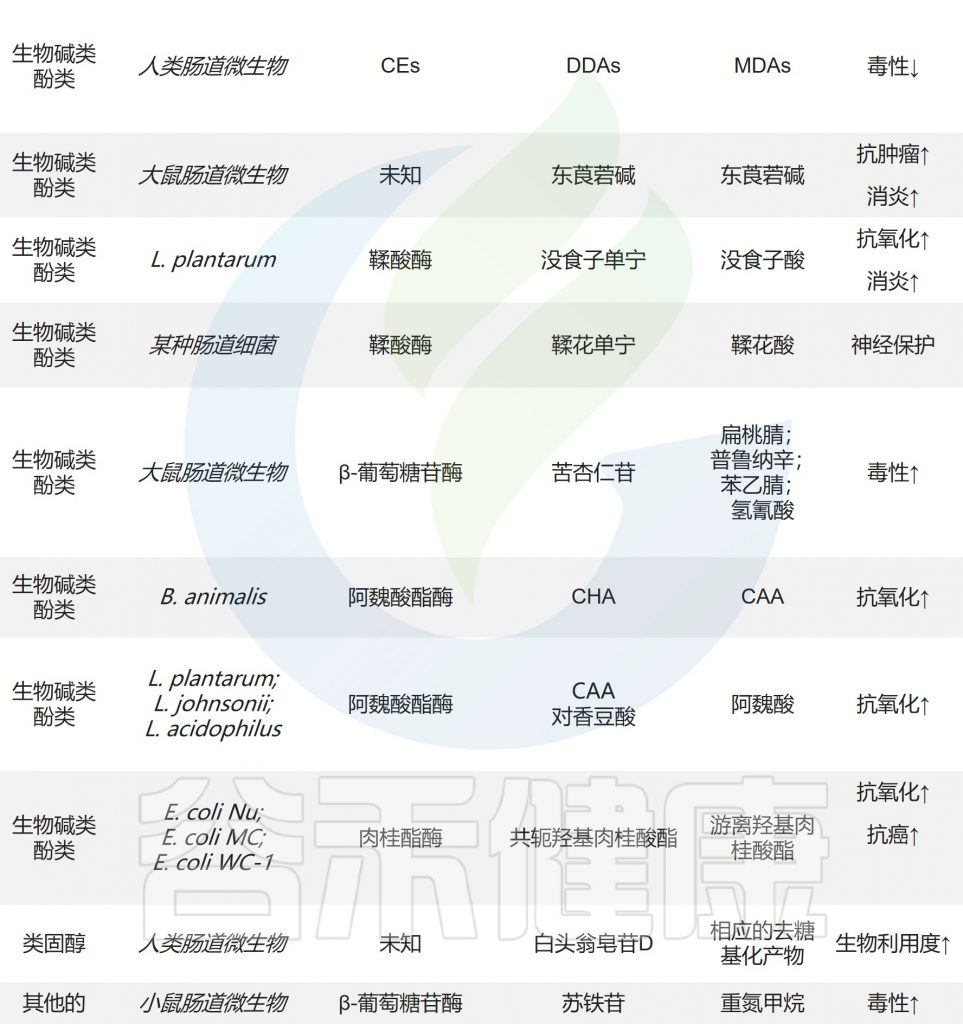
在肠道微生物表达的羧酸酯酶(CE)的作用下,二酯二萜生物碱(DDAs,如乌头碱)水解C-8和C-14的酯键,产生毒性较小的单酯二萜生物碱。生物碱东莨菪碱、类固醇化合物白头翁皂苷D和半胱氨酸在肠道微生物的作用下也会发生水解反应。
小结
水解反应是肠道微生物代谢天然产物的重要步骤,是生物活性表达和进一步生物转化所必需的。
应重点关注参与该反应的特定微生物和酶,以充分了解天然产物的最终命运及其对人体健康的影响,并为个性化治疗提供依据。
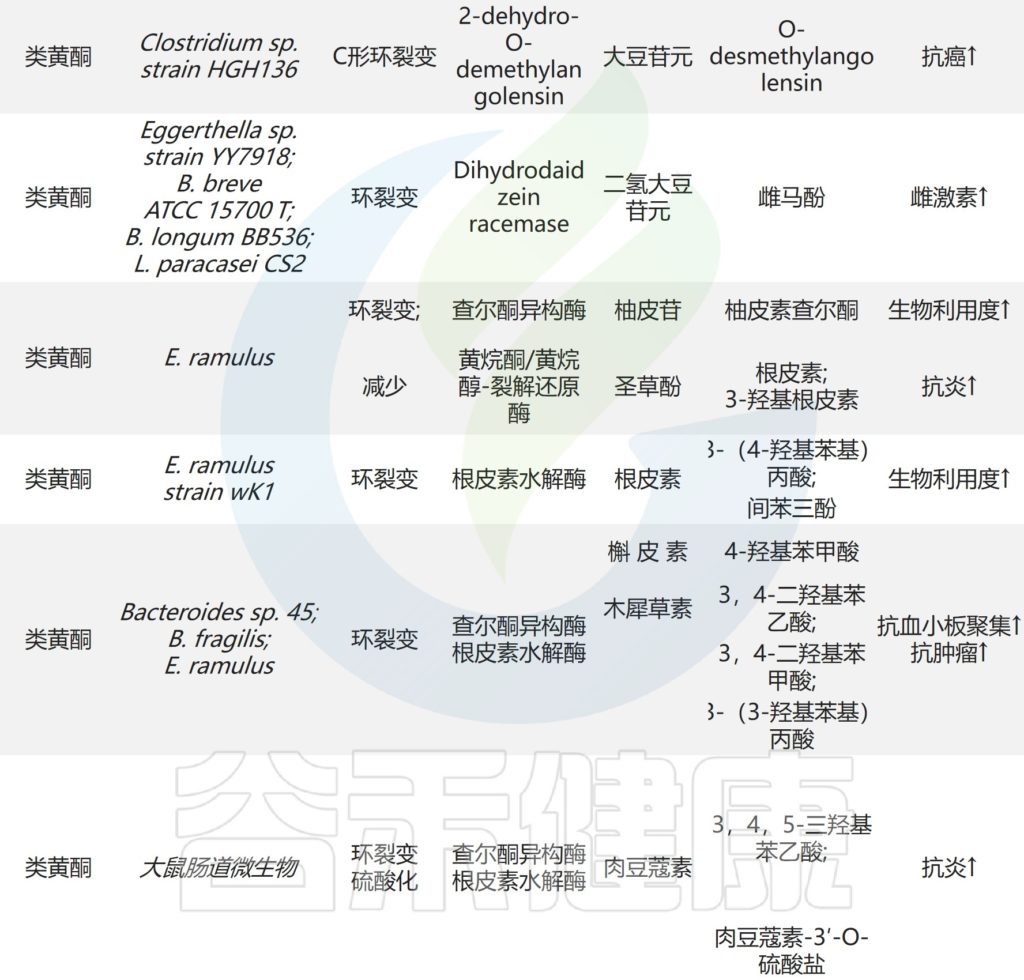
肠道微生物可以通过亲核取代反应表达转移酶并在两种底物之间移动官能团。
肠道微生物将甲基添加到外源物质中需要化学活化的辅底物,如乙酰辅酶A、三磷酸腺苷或腺苷甲硫氨酸,而去甲基化需要可以进行亲核催化的辅因子。
甲基化修饰可以优化天然产物的生理活性,去甲基化可以释放极性基团以进一步结合和排出体外,并为肠道微生物的生长提供碳源。
下图显示了肠道微生物作用下天然产物的甲基化和去甲基化以及带来的影响。
肠道微生物对天然产物的甲基化和去甲基化



Zhao Y,et al.Front Microbiol.2022
✦类黄酮甲基化后具有抗癌活性
类黄酮甲基化修饰可以在类黄酮结构中的C-2,C-3,C-4,C-5,C-6,C-7和C-8位置进行,甲基化类黄酮的生物利用度大大提高。
甲基化类黄酮具有显著的抗癌活性和对肝脏代谢的抵抗力。在大鼠口服芦丁后,在粪便样品中检测到许多甲基化代谢物,如甲基芦丁,甲基异槲皮素和甲基槲皮素硫酸盐。
作用过程
甲基化的异黄酮类化合物在E.limosum ATCC 8486的作用下进行去甲基化以产生大豆苷元和染料木黄酮。异氧杂环丁酚通过苌香产生去甲基化产物8-异辛基柚皮素。橙皮苷,5,7-二甲氧基黄酮,黄腐酚和5,7,4′-三甲氧基黄酮也可以在肠道微生物的作用下进行去甲基化反应。
✦生物碱具有抗癌性和抗病毒活性
生物碱是含氮化合物,由海洋和陆地生物生物合成,它们具有抗癌性和抗病毒活性。
绝大多数生物碱分布在高等植物,尤其是双子叶植物中,如毛茛科、罂粟科、防己科、茄科、夹竹桃科、芸香科、豆科、小檗科等。
在肠道微生物表达的酶的作用下,苦木中的主要生物碱成分准碳质酮被甲基化为准碳质碱丁基。异喹啉生物碱巴马汀通过体外厌氧培养产生去甲基产物,如哥伦比亚胺、药根碱、去甲基小檗碱和去甲基小蘖碱。通过离子阱电喷雾电离串联质谱法证明了肠道微生物对乌头碱的去甲基作用,并产生了去甲基乌头碱。
✦木酚素可以抗炎防心血管疾病
膳食木酚素是植物雌激素,主要存在于种子,坚果,豆类和蔬菜中。
木酚素在微生物作用下的一些转化
牛蒡苷可由Eubacterium sp. ARC-2菌株去甲基化为二羟基内酯和其他产物。从人类粪便细菌中分离出一种名为Lautia sp. AUH-JLD56的细菌,该物种可以有效地将牛蒡苷或牛蒡苷元转化为去甲基化代谢物3′-去甲基牛蒡苷(3′-DMAG)。
Secoisoolaricinol是亚麻籽中最常见的木脂素之一,可在Blautia producta、Gordonibacter和Lactonifactor longoviformis的存在下去甲基,形成肠内酯和肠二醇。
芝麻素通过甲基化、去甲基化和肠道微生物的其他反应代谢为哺乳动物木脂素内酯和肠二醇。罗汉松树脂酚和连翘脂素也可以去甲基化以产生内酯。水飞蓟宾A和B被人类粪便微生物群去甲基为去甲基水飞蓟宾A和脱甲基水飞蓟宾B。
✦其他化合物
多酚化合物姜黄素被Lautia sp. MRG-PMF1去甲基化,以产生代谢物去甲基姜黄素(DMC)和双去甲基姜黄素(bDMC)。二氢异铁酸的去甲基化产物,如二氢咖啡酸,也在粪便代谢物中获得。
研究发现,甲基化反应发生在甘草皂苷22β-乙酰氧基甘草酸糖链的内部和外部葡萄糖醛酸残基处,产生22β-乙氧基甘草酸甲酯。
丹参素,萜类化合物,二苯乙烯类化合物和类固醇化合物在肠道微生物的作用下经历甲基化和去甲基化。
小结
甲基化和去甲基化反应是肠道微生物代谢的重要途径。甲基化能引起染色质结构、稳定性及蛋白质相互作用方式的改变,从而控制基因表达。去甲基化则诱导了基因的重新活化和表达。
然而,介导这种反应的基因/酶尚未完全确定,还需要进一步的实验研究。
肠道微生物可以表达许多氧化还原酶并通过调节各种官能团转化天然化合物,如烯烃、羧酸衍生物、硝基、氧化物和a,b不饱和羧酸衍生物,这些官能团影响体内天然产物的活性。
下图显示了肠道微生物作用下天然产物的氧化和还原反应。
肠道微生物对天然产物的还原和氧化反应






Zhao Y,et al.Front Microbiol.2022
✦类黄酮
黄酮类化合物大豆苷元在Clostridium sp. strain HGH6和Lactobacillus. sp. Niu-O16的作用下还原为二氢大豆苷元和进一步的四氢大豆苷元。还原产物二氢染料木黄酮是由染料木黄酮在人类粪便细菌的作用下产生的。
通过分析,在厌氧条件下与槲皮素一起孵育,在大鼠肠液培养液中鉴定出脱氧代谢物山奈酚和双键氢化还原产物西叶素等化合物。
从Flavonifractor plautii ATCC 49531中发现了黄酮还原酶,该酶特异性催化黄酮/黄烷醇C环的C2-C3双结合的氢化作用,并在黄酮类化合物整个生物降解途径的初始步骤中起作用。
去甲黄腐酚,一种查尔酮化合物,被分枝杆菌还原为去甲-α,β-二氢黄腐酚
•药理作用
黄酮类化合物分布广泛,具有多种生物活性。
1.黄酮类化合物具有抗自由基和抗氧化作用;2.防治心血管疾病方面均具有良好的效果;3.抑菌抗免疫作用;4.对动物激素的调节作用。
✦生物碱
•小檗碱具有杀菌消炎的功效
由肠道微生物产生的硝酸还原酶催化生物碱中的醚和配位键反应。小檗碱(BBR)作为黄连的主要成分,可以通过肠道微生物表达的硝基还原酶还原为二氢小檗碱,这种还原产物具有很高的极性。
二氢小檗碱可以在肠道中被吸收,然后被氧化成原型小檗碱进入血液。二氢小檗碱在肠道中的吸收率是小檗碱的五倍。同时还发现,肠道微生物可以通过氧化将小檗碱转化为氧小檗碱。
小檗碱的功效和作用主要就是起到杀菌消炎的作用,抗菌谱比较广,主要用于治疗各种肠道感染和菌痢等。
•其他生物碱产物
血红素是小檗碱的一种新代谢产物,可能是一种值得探索的生物活性剂。黄连碱是一种天然的原小檗碱生物碱,具有与小檗碱相同的母体结构。口服黄连后,C-O键打开并断裂,随后发生还原反应,生成氢化小檗碱。阿南酰胺被小鼠和人类肠道微生物群还原为二氢阿南酰胺,生物利用度更高。
✦苯丙酸
•咖啡酸具有抑菌、抗病毒作用
咖啡酸(CAA)作为食品和饮料中的主要膳食多酚,在酯化后很容易进入结肠并与肠道微生物群发生反应。
苯丙酸通过C4双键还原和脱氢作用转化为3-羟基苯基丙酸,然后通过体外肠道微生物的β氧化迅速转化为3-苯基丙酸。苯丙酸也可以脱羟基化为间香豆酸或氢化为二氢咖啡酸。
咖啡酸片具有较普遍的抑菌效果,可用于抑菌、抗病毒。除此之外,还具有中枢兴奋、解毒凝血等作用。
丹参素是丹参的主要单体酚酸,通过肠道微生物群进行脱氢和脱氧,生成3-苯基-2-羟基丙酸、3-(3,4-二羟基苯基)-2-丙烯酸(咖啡酸)和3-(3,4-二羟基苯)丙酸。
✦其他化合物
甘草次酸通过盲肠中的Ruminococcus sp. po1-3的3β-羟基类固醇脱氢酶生成3-氧代甘草次甲酸。
•通便作用
番泻甙是一类天然蒽醌衍生物和二聚糖苷,首先被β-葡萄糖苷酶水解生成番泻甙-8-O-单糖苷,然后在体内被链球菌还原为具有通便作用的大黄蒽醌。
二萜类白藜芦醇被Slackia equolifaciens和Eggerthella lentaATCC 4305还原为二氢白藜芦醇。
此外,二酮姜黄,类固醇化合物地高辛和其他化合物马兜铃酸也可以在肠道微生物的存在下减少。肠道微生物黄酮还原酶和硝基还原酶具有特殊的催化选择性,填补了肠道微生物转化途径的关键空白。
然而,介导肠道微生物减少的特定基因和酶尚未完全确定。
肠道微生物对天然产物的其他反应
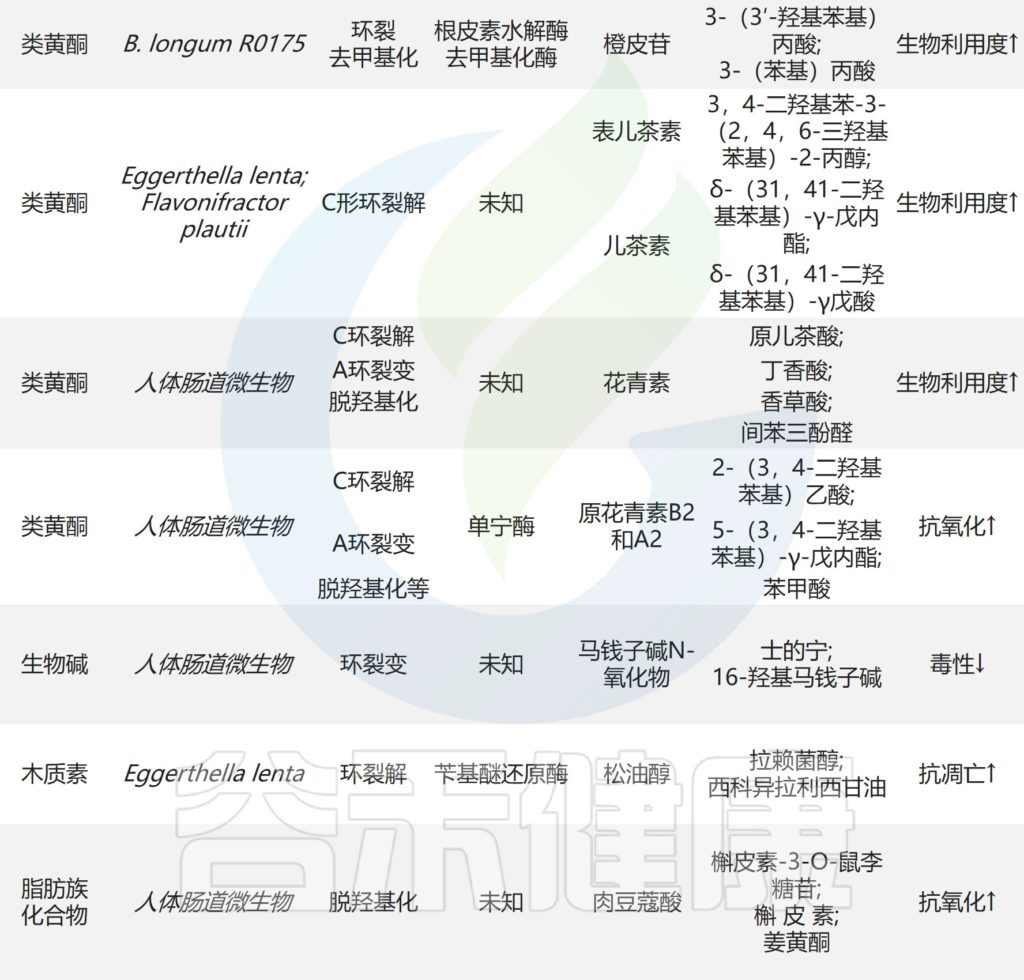
Zhao Y,et al.Front Microbiol.2022
如图中所示,肠道微生物也通过环分裂、硫化、芳构化和其他反应转化天然产物。
龙胆苦苷是一种天然的环烯醚萜苷,可通过肠道微生物β-葡萄糖苷酶水解为龙胆醛,然后通过N-杂环反应水解为含氮化合物。
京尼平丙酮醇的部分开环导致肠道微生物形成二醛。奎宁酸可以在肠道微生物存在下芳香化为马尿酸。
原花青素B2和A2与人类肠道微生物体外发酵,获得了主要的水解和环裂解代谢物,即苯甲酸、2-(3,4-二羟基苯基)乙酸和5-(3,4-二羟基苯)-γ-戊内酯。
口服木犀草素后,在大鼠粪便样品中检测到硫酸盐和氢还原代谢物。由肠道微生物促进的大豆苷元转化为雌马酚是另一个有趣的例子。
木犀草素,多以糖苷的形式存在于多种植物中,具有镇咳和祛痰作用。
雌马酚的作用:1.抗氧化,雌马酚属于多酚类物质,可作为氢/电子受体,清除自由基;2. 免疫调控,雌马酚的免疫保护作用可能是有其抗氧化作用所介导的,涂抹雌马酚对皮肤有免疫保护作用。
SesA是一种来自Sinomonas sp.no.22的芝麻素代谢酶,通过环裂解催化亚甲基从芝麻素或芝麻素单儿茶酚转移到四氢叶酸,产生芝麻素一儿茶酚或二儿茶酚和5,10-亚甲基四氢叶酸酯。
萜类化合物,类黄酮,苯酚,生物碱和脂肪酸都可以在肠道微生物的作用下进行生物转化反应,产生活性代谢物。
这些研究证明了各种肠道微生物组的巨大代谢潜力。天然产物的肠道微生物代谢及其在宿主健康中的作用应该是未来研究的重点。
小结
本节总结了来自单个反应的肠道微生物群介导的天然产物的生物转化。
但是,观察到一些限制。首先,考虑到肠道微生物的复杂性和肠道微生物酶的多样性,天然产物在肠道中经历复杂的转变。单个反应只能描述一定的新陈代谢过程。可以通过激活/抑制这一过程来优化治疗。
此外,考虑到肠道微生物含有各种潜在的多功能酶,可以预期肠道微生物会有更多的生物转化反应被天然产物所低估。
为了阐明肠道微生物代谢如何影响人类健康,研究人员应该将功能与基因和酶联系起来。
除了调节肠道微生物对天然产物的处置外,天然产物对肠道微生态学的调节作为潜在的功效机制也很重要。
越来越多的肠道微生物群研究逐渐揭示了大多数天然产品的高药理作用与低口服利用率之间的关系。大多数糖苷具有复杂的母体结构,很难被肠细胞吸收,从而限制了它们的组织特异性生物可及性。
这些化合物通过依赖于微生物/肠道微生物酶的降解反应转化为小分子代谢物/独特代谢物,从而对宿主产生广泛影响。肠道微生物还作用于膳食酚类物质,产生有助于宿主健康的功能代谢物。
✦增强抗肿瘤、抗炎、降脂作用
肠道微生物的生物转化促进了天然产物的治疗效果。人参皂苷对化合物K(CK)的典型代谢模型已被广泛报道,具有增强的抗肿瘤,抗炎和降脂作用。
人参皂苷的生物转化和代谢物化合物k的功效
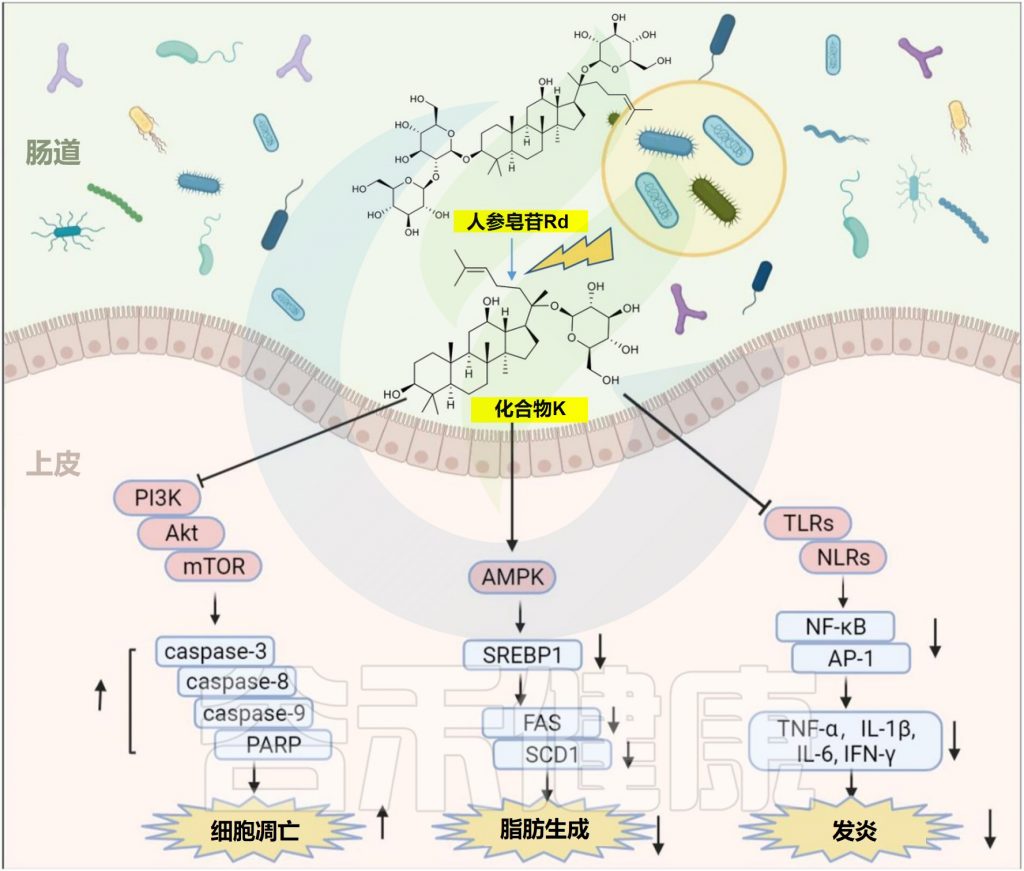

编辑
Zhao Y,et al.Front Microbiol.2022
1 —降脂
在20μM时,化合物K通过激活AMPK减少人肝细胞癌细胞中的肝脂堆积
2–抗癌
在50μM时,化合物K通过上调半胱天冬酶-3,半胱天冬酶-8,半胱天冬酶-9和环磷酸腺苷依赖性蛋白激酶来抑制胶质母细胞瘤细胞的生长。
3–减弱炎症
化合物K通过自噬诱导和调节NF-κB、p38蛋白和JNK/MAPK信号来减轻巨噬细胞炎症和泡沫细胞形成。
✦姜黄素可以抑制炎症
姜黄素代谢物的生物利用度取决于微生物群依赖性。例如,去甲基姜黄素增加PPARγ表达,导致自噬和核转录因子κB抑制,随后抑制脂多糖诱导的炎症。
PPARγ——是一种过氧化物酶体增殖物激活受体
MAPK——即AMP依赖的蛋白激酶,是生物能量代谢调节的关键分子
去甲基姜黄素通过抑制炎症因子的分泌和MAPK和NF-κB途径的激活来减轻体内和体外的炎症反应。由于在其原型苯环结构中不存在甲基,去甲基姜黄素的化学稳定性增加,从而解释了姜黄素的强大有益作用。
姜黄素来源:姜黄素是从植物根茎中提取,主要来源于生姜,然后就是那些植物中,胡萝卜、番茄以及辣椒,咖喱,芥末中也含有一些姜黄素。
✦尿石素具有抗炎和神经保护等作用
值得注意的是,尿石素A(UA)是一种天然化合物,由肠道微生物从摄入的鞣花单宁和鞣花酸中产生,具有显著的抗炎和神经保护作用。
在1μM时,尿石素A足以降低聚(I:C)诱导的RAW264.7细胞中肿瘤坏死因子和MCP-1的产生,并使TLR3/TRIF信号失活。尿石素A提高高脂饮食小鼠的全身胰岛素敏感性并降低肝脏白细胞介素1β水平。
MCP-1,是一种由星形胶质细胞分泌的促进炎症的蛋白质。
Toll样受体3(TLR3)是TLR家族的成员,介导I型干扰素、促炎细胞因子和趋化因子的转录诱导
尿石素A通过降低皮层和海马体中白细胞介素6、白细胞介素1β和肿瘤坏死因子的水平来改善小鼠的认知障碍,并抑制神经炎症。
小结
这些研究强调了鉴定天然产物微生物代谢的重要性。此外,许多体外药理活性测量应与微生物代谢产物一起进行,微生物代谢产物实际上与体内的生化受体相互作用。
肠道微生物的组成,结构,功能和代谢物已成为天然产物发挥有益作用和降低毒性的潜在目标。
例如,肠道微生物可以通过羧基酯酶催化双酯型二萜生物碱的C-8和C-14的酯键水解,或催化C-8的酯交换以产生毒性较小的单酯二萜烯生物碱。
大肠杆菌的地高辛还原型菌株含有强心苷还原酶,它可以还原地高辛环上的α和β-不饱和内酯,并将其代谢为活性较低的二氢地高辛,从而抑制其可能的心脏毒性。
地高辛,主要用于心脏类疾病的治疗,对心脏的作用表现为正性肌力作用,减慢心率,抑制心脏传导。
然而,这种能力是有限的,并且50%的地高辛可以通过肠道微生物转化而失活。强心苷还原酶可能是地高辛失活的有效生物标志物,其表达可以被精氨酸抑制。
•饮食可能调节微生物代谢活动
饮食可以解释地高辛还原的个体间差异,并可能调节体内微生物代谢活动。相比之下,有毒化合物可以由肠道微生物产生。桦木素在来自肠道微生物的β-葡萄糖苷酶的作用下水解成致癌性重氮甲烷。
建议
应开发微生物肠道酶的小分子抑制剂,以在这个复杂的栖息地的特定转化中发挥调节作用。肠道微生物群转化的代谢物与前体物质之间的毒性差异值得进一步研究。
此外,过量的药物可能导致肠道微生物失衡和不良反应,不同剂量的天然产物对肠道微生物和新陈代谢的影响也需进一步研究。
考虑到肠道微生物可以增加宿主对药物或天然产物的复杂和可变反应,这一过程值得研究。
生物转化的方法
(1)肠液转化。转化产物的大规模制备可以通过肠液生物转化来实现;
(2)与宿主微生物群的样品一起孵育。原型药物和代谢物的类型和数量可以使用该方法检测。它具有准确表示个体的整个肠道微生物组的优点;
(3)代表性菌株的孵育。该方法具有高通量潜力,这对于大规模药物研究很有价值,并有助于有益代谢物的工业生产。
✦模型分析有利于认识微生物代谢
器官微生理系统,胃肠道类器官的各种预测/计算工具可能有助于提高我们对未来微生物代谢的理解。
此外,在动物模型中已经研究了天然产物代谢与肠道微生物之间的关系,其结果可用于研究代谢物的分布和形式。无菌/抗生素处理的动物与传统动物进行了比较,以证明肠道微生物在天然产物代谢中的关键作用。
这种方法的局限性在于人类和啮齿动物之间存在固有的胃肠道和微生物差异。在临床试验中从受试者收集的粪便进行详细微生物群和代谢物分析可以全面反映天然产物在体内的代谢过程,并用于解释个体差异。
✦增加测序技术的应用
增加测序技术的应用,以研究微生物的转录活性和代谢谱。通过使用单细胞法,可以表征肠道微生物的生理结构,以确定其代谢活性。
转录组测序技术(RNA-Seq)可以直接分析人体肠道中具有强代谢活性的微生物的基因表达谱。
单细胞方法,宏转录组学和宏基因组学的组合已被用于鉴定和表征肠道微生物群的活性亚群,并确定它们对天然产物的代谢反应。
肠道微生物群是编码各种代谢酶的基因库。大多数天然产物的生物活性和潜在健康益处的激活极度依赖肠道微生物作为底物加工工厂。
了解微生物如何独特地调整天然产物以及这些代谢物对宿主健康的影响。已经得出以下结论:
(1)肠道微生物可以改变天然产物;
(2)天然产物可以调节肠道微生物的组成和丰度;
(3)肠道微生物可以介导天然产物的多组分协同作用。
此外,肠道微生物的巨大可塑性和个体间差异是值得注意的。因此,需要提高对肠道微生物对天然产物代谢的生理,化学和微生物贡献的理解,以帮助解释天然产物反应的个体差异,并为个性化治疗提供支持。
确认生物转化中极其参与的象征性功能及其物质基础将有助于探索天然产物与肠道微生物群之间相互作用的治疗模式。
主要参考文献
Zhao Y, Zhong X, Yan J, Sun C, Zhao X, Wang X. Potential roles of gut microbes in biotransformation of natural products: An overview. Front Microbiol. 2022 Sep 29;13:956378. doi: 10.3389/fmicb.2022.956378. PMID: 36246222; PMCID: PMC9560768.
Abookleesh F. L., Al-Anzi B. S., Ullah A. (2022). Potential antiviral action of alkaloids. Molecules 27:903. doi: 10.3390/molecules27030903.
Agatonovic-Kustrin S., Kustrin E., Gegechkori V., Morton D. W. (2020). Anxiolytic terpenoids and aromatherapy for anxiety and depression. Adv. Exp. Med. Biol. 1260, 283–296. doi: 10.1007/978-3-030-42667-5_11.
Al-Ishaq R. K., Liskova A., Kubatka P., Büsselberg D. (2021). Enzymatic metabolism of flavonoids by gut microbiota and its impact on gastrointestinal cancer. Cancers 13:3934. doi: 10.3390/cancers13163934.
Augusti P. R., Conterato G. M. M., Denardin C. C., Prazeres I. D., Serra A. T., Bronze M. R., et al.. (2021). Bioactivity, bioavailability, and gut microbiota transformations of dietary phenolic compounds: implications for COVID-19. J. Nutr. Biochem. 97:108787. doi: 10.1016/j.jnutbio.2021.108787.
Berlinberg A. J., Brar A., Stahly A., Gerich M. E., Fennimore B. P., Scott F. I., et al.. (2022). A novel approach toward less invasive multiomics gut analyses: a pilot study. Microbiol. Spectr. 10:e0244621. doi: 10.1128/spectrum.02446-21.
Bess E. N., Bisanz J. E., Yarza F., Bustion A., Rich B. E., Li X., et al.. (2020). Genetic basis for the cooperative bioactivation of plant lignans by Eggerthella lenta and other human gut bacteria. Nat. Microbiol. 5, 56–66. doi: 10.1038/s41564-019-0596-1.