-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

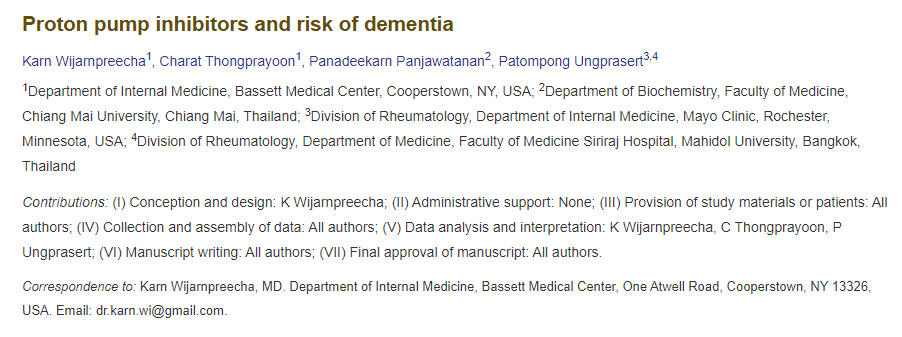
质子泵抑制剂(PPI)是一种抑制胃酸分泌最有效和最常见的胃酸抑制药物, 于1989年被引入医学领域,可阻断胃壁细胞中的H+/K+ ATPase 酶系统,从而抑制壁细胞分泌氢,并抑制细胞外钾的吸收,这种机制抑制了胃壁细胞的酸分泌。
由于质子泵抑制剂抑制胃酸分泌的能力,已成为治疗和预防胃酸反流、胃食管反流病(GERD)、溃疡非糜烂性反流病(NERD)、非甾体抗炎药相关溃疡、食管炎、消化性溃疡病(PUD)和卓-艾氏综合症(ZES)等疾病的一线药物。此外,PPI还与抗生素一起用于幽门螺杆菌根除疗法。
质子泵抑制剂(PPI)通常被认为是安全的,因此经常被过度开具和长期使用(多项研究发现,在住院患者中,约有40%-71.4%在住院期间接受了PPI治疗)。然而,越来越多的研究表明,PPI的过度使用与多种健康状况有关,已知PPI引起的胃内pH值升高和随后的胃肠道生理改变会对整个胃肠道造成不良影响。
国际著名期刊《GUT》等多项期刊都有发表研究显示,质子泵抑制剂(PPI)治疗可能会破坏肠道微生物群,降低胃肠道微生物群的多样性和丰富度。检测了1827名患者的粪便样本。研究人员表示,质子泵抑制剂(PPI)会导致肠道共生菌的丰度降低,微生物多样性减少。具体来说,具有抗炎特性的Faecalibacterium减少,肠道重要基石菌瘤胃球菌、毛螺菌科也显示出减少。
此外,肠道感染病原体风险增加;一项荟萃分析了涉及近30万名患者的23项研究的结果。结果表明,65%的患者在使用PPI后出现了与艰难梭菌肠道定植相关的腹泻。使用PPI还可能导致小肠细菌过度生长;并且还会增加炎症性肠病患者的病情严重程度。2023年对45151名成年患者的数据研究发现,PPI会增加结肠炎的严重程度,并显示体重减轻和疾病活动指数评分显著增加。
质子泵抑制剂的副作用不仅限于肠道微生物群的破坏,长期使用PPI似乎还会影响营养吸收,包括钙、镁、维生素B12的吸收不良。此外,PPI可能会干扰骨代谢,从而增加骨折的发生率。胃液抗酸药已被证明能抑制肠道对磷酸盐的吸收。而这一过程又会导致低磷血症和骨矿化受损。
还有研究表明,PPI可通过影响脑-微生物轴诱发包括痴呆在内的神经退行性疾病。在小鼠模型中,PPI 已被证明会增加脑内淀粉样蛋白的沉积,从而诱发阿尔茨海默病。PPI使用者患痴呆症的风险增加了1.4倍。

此外,研究还显示,每日两次使用PPI的人更容易感染 COVID-19。使用PPI后的细菌易位可能与肝硬化腹水或隐源性肝脓肿患者发生自发性细菌性腹膜炎有关。因此,找到一种方法来减轻质子泵抑制剂(PPI)给药带来的副作用非常重要。
本文将在众多临床和实验研究的基础上客观的讨论下什么是质子泵抑制剂(PPI),包括哪些常见的药物,对应的治疗适用性,益处,副作用,尤其对肠道和神经系统等的副作用,以及有哪些改善副作用的措施和建议。
▼
质子泵抑制剂(PPI)是一类药物,它们能够抑制胃壁细胞中的质子泵,从而减少胃酸的分泌。
质子泵抑制剂(PPI)是苯并咪唑衍生物,由两个杂环基团组成,这些杂环基团包含吡啶和苯并咪唑基团,通过甲基亚磺酰基连接。
PPI通过与质子泵的活性位点形成共价结合,不可逆地抑制其活性,从而减少胃酸的生成。这种抑制作用是剂量依赖性的,意味着质子泵抑制剂的剂量越高,胃酸的分泌就越少。
▼
质子泵抑制剂可阻断产生胃酸的酶。这种酶被称为氢钾ATP酶泵,简称“质子泵”。质子泵是一种H+/K+-ATPase酶,主要存在于胃壁细胞的分泌小管膜上,负责将氢离子(H+)从细胞内部泵入胃腔,同时将钾离子(K+)泵回细胞内,这个过程是形成胃酸的关键步骤。
质子泵抑制剂的作用机制
Morris N,et al.Natl Res Cent (2023)
可以这样想:质子泵抑制剂“抑制”(或阻止)质子泵完成产生胃酸所需的化学过程。
•使用质子泵抑制剂后仍有一部分胃酸供分解食物
但质子泵抑制剂(PPI)不会阻止所有胃酸的产生。你仍然有足够的胃酸来消化食物。如果你每天服用 PPI 约五天,这些药物会减少你约65%的胃酸。你仍然有剩余的35%供你的胃分解食物。
由于PPI是弱碱,它们会积聚在胃壁细胞活跃的酸性空间中。这种酸性很重要,因为PPI是前体药物,需要酸才能被激活。不同的质子泵抑制剂(PPI)与H+/K+ ATPase 的不同半胱氨酸残基结合,从而导致PPI的特性略有不同。
• 质子泵抑制剂的持续时间
由于质子泵抑制剂(PPI)通过不可逆抑制胃H+/K+ ATPase,因此它们能够产生较为持久的作用。但是,由于胃H+/K+ ATPase 的周转,并不是所有的H+/K+ ATPase 泵都能被阻断,并且可能需要几天的PPI给药才能达到最佳效果。
PPI从胃中排出后,会在小肠近端被吸收。血清半衰期很短,约为1-2小时。吸收后,血液循环将PPI输送到腹壁细胞,并在那里聚集在酸性分泌小管中。然后,PPI在酸催化下生成活性亚磺酸或磺酰胺,这些化合物与H+ /K+ ATPase中的半胱氨酸残基共价结合,并对酸分泌产生抑制作用,直到替代泵合成,也就是大约36小时。这些化合物与H+/K+ -ATPase 泵形成不可逆二硫键。
质子泵抑制剂(PPI)通常在餐前使用,因为它们需要小管中H+/K+ -ATPases 的活跃表达,才能在进餐后发生结合。建议胃内pH值高于4,胃腔内的pH值在2以下时,每天服用一片PPI可使胃液pH值维持在4以上达10-16小时。
注:PPI与蛋白质结合力强,可被肝细胞色素 P450 降解。奥美拉唑和埃索美拉唑经CYP2C19代谢,雷贝拉唑、兰索拉唑和右兰索拉唑也经CYP2C19代谢,但也对CYP3A4有亲和力。经肝脏代谢后,大多数苯并咪唑类药物最终通过肾脏排泄,但兰索拉唑和右兰索拉唑也经胆道排泄。
▼
质子泵抑制剂主要治疗因胃酸刺激或损害消化系统某些部位(如胃、十二指肠(小肠最靠近胃的部分)或食道)而引起的病症。例如以下几种疾病:
-胃食管反流病(GERD)
质子泵抑制剂(PPI)可缓解GERD症状,如胃灼热。GERD会导致胃酸渗入食道,刺激食道。胃酸会损害食道内壁(糜烂性食管炎)。PPI可减少胃酸,让食道有时间愈合和修复。
-糜烂性食管炎
质子泵抑制剂通过显著减少胃酸的分泌,可以帮助缓解症状,促进食管黏膜的愈合。质子泵抑制剂是治疗糜烂性食管炎的常用药物之一。
-胃溃疡和十二指肠溃疡
PPI可帮助治愈胃酸破坏胃的保护性内壁而形成的胃溃疡和小肠溃疡。PPI还可帮助治愈和预防因服用NSAID(非甾体抗炎药)而形成的溃疡。
定期服用NSAID的人中,多达30%的人会患上胃溃疡。
-幽门螺杆菌感染
质子泵抑制剂(PPI)可以与某些抗生素联合使用,用于根除幽门螺杆菌,从而使抗生素更有效地杀死细菌。
-佐林格-埃利森综合征
质子泵抑制剂(PPI)可抵消佐林格-埃利森综合征的影响。患有这种罕见疾病的人,肿瘤会释放一种促进胃酸分泌的激素。
-其他与质子泵抑制剂治疗或相关的疾病:
巴雷特食管
胃炎/十二指肠炎
胃肠道出血
食管裂孔疝
消化不良
多发性内分泌腺瘤
病理性高分泌情况
消化性溃疡
应激性溃疡预防
系统性肥大细胞增多症
▼
质子泵抑制剂是一类具有选择性抑制胃酸分泌作用的药物,临床常用的质子泵抑制剂包括奥美拉唑、泮托拉唑、雷贝拉唑、埃索美拉唑、兰索拉唑、右兰索拉唑等。一个简单好记的方法就是:一般带有“拉唑类”的药物,即质子泵抑制剂。
它们的名称听起来相似,作用相似,副作用也类似。但还是存在差异,在这里,我们简单介绍六种常用的质子泵抑制剂。
■ 奥美拉唑
奥美拉唑用于治疗非癌性胃溃疡、胃食管反流病、活动性十二指肠溃疡、佐林格-埃利森综合征和糜烂性食管炎等疾病引起的胃酸过多。奥美拉唑通过阻止胃酸产生起作用,属于质子泵抑制剂类药物。
奥美拉唑还可以与抗生素一起使用来治疗由幽门螺杆菌(H. pylori) 感染引起的胃溃疡。
奥美拉唑治疗胃食管反流病的剂量一般为每天一次,每次20毫克。应在每日第一餐前至少30分钟服用。每天服用效果最好,而不是仅在出现症状时服用。
非处方奥美拉唑只能连续服用14天。可能需要1至4天才能改善症状。
一些药物可能会影响奥美拉唑的效果:
■ 埃索美拉唑
埃索美拉唑(Nexium)是奥美拉唑的近亲。它具有相似的化学成分,也获准用于相同的用途。更重要的是,它既可以作为非处方药,也可以作为处方药。
埃索美拉唑治疗的剂量通常为每天一次20毫克,在一天的第一顿饭前至少30分钟服用。埃索美拉唑不能立即缓解胃灼热症状。
一些药物可能会影响埃索美拉唑的效果:
■ 泮托拉唑
泮托拉唑用于治疗成人和至少5岁儿童的糜烂性食管炎(胃食管反流病(GERD)引起的胃酸对食管的损害)。泮托拉唑通常一次给药长达8周,直至食管愈合。
与奥美拉唑和埃索美拉唑不同,它未被批准用于治疗溃疡或预防幽门螺杆菌溃疡。
泮托拉唑的剂量一般为每天一次,每次40毫克,在第一次进餐前至少30分钟服用。但是,体重低于40公斤的儿童的剂量会有所不同。
一些药物可能会影响泮托拉唑的效果:
■ 兰索拉唑
兰索拉唑(Prevacid)获准用于治疗与奥美拉唑和埃索美拉唑相同的疾病,以及其他一些疾病。它可以预防和治疗成人非甾体抗炎药(NSAID)相关胃溃疡。它还可以治疗1岁及以上儿童的胃食管反流和糜烂性食管炎。
治疗胃食管反流的兰索拉唑剂量通常为每天一次15毫克,在第一次进餐前至少30分钟服用。
硫酸铝(Carafate)会使身体更难吸收兰索拉唑。服用兰索拉唑后至少等待30分钟再服用硫酸铝。
■ 右兰索拉唑
右兰索拉唑(Dexilant)和泮托拉唑一样,只能凭处方购买。它是兰索拉唑的近亲,具有相似的化学结构。右兰索拉唑用于治疗胃食管反流病引起的胃灼热,以及糜烂性食管炎。
治疗胃食管反流病时,右兰索拉唑的剂量通常为每天一次30毫克。服用右兰索拉唑的好处是,它可以在一天中的任何时间服用,无需考虑是否进食。
一些药物可能会影响右兰索拉唑的效果:
■ 雷贝拉唑
雷贝拉唑(AcipHex)是另一种需凭处方购买的质子泵抑制剂 。雷贝拉唑用于成人治疗胃酸过多的疾病,例如Zollinger-Ellison 综合征。雷贝拉唑还用于成人促进十二指肠溃疡或糜烂性食管炎的愈合。
注:它是20毫克DR片剂,每天服用一次。
雷贝拉唑的第一剂可能比奥美拉唑的第一剂产生更大的效果。这是因为雷贝拉唑被认为在阻止酸产生方面比奥美拉唑起效稍快。
一些药物可能会影响雷贝拉唑的效果:
▼
质子泵抑制剂(PPI)通常耐受性良好且安全。它们是治疗各种胃肠道疾病的常用药物,包括胃十二指肠溃疡、糜烂性食管炎、胃食管反流病、胃酸分泌过多综合征,并用于治疗幽门螺杆菌感染。
如果按照推荐剂量和推荐时间服用,PPI通常是安全的。然而,它们可能与几种严重的不良反应有关,包括:
急性间质性肾炎(一种肾衰竭):可能在PPI治疗期间的任何时间发生;
艰难梭菌相关性腹泻:这是一种特别严重且持续性的腹泻;
骨质疏松症导致髋部、腕部或脊柱骨折的风险增加:接受高剂量治疗(通常每日多次服用)和PPI治疗持续时间超过一年的患者风险更高;
皮肤型红斑狼疮(CLE) 和系统性红斑狼疮(SLE);
抑制氯吡格雷的作用,氯吡格雷是一种用于降低心脏病患者血小板凝结能力的药物;
此外,使用PPI可能会掩盖胃癌症状。所有对PPI反应不佳或停用PPI后症状复发的患者都应接受额外的诊断检测,老年人在开始治疗前应考虑进行内镜检查。
质子泵抑制剂(PPI)通常耐受性良好。使用PPI后报告的较常见副作用包括:
临床治疗中还发现,长期过量使用PPI所引起的病症会影响各种身体系统。受影响的系统可能包括胃肠道、呼吸系统、骨骼肌肉系统、免疫系统、泌尿系统和神经系统。
这些系统受到PPI引起的不同机制的影响,例如营养缺乏、pH值变化、肠道菌群组成变化和胃肠道微生物过度生长等等。研究表明,长期过量使用PPI会损害肠粘膜。这些变化可能会增加胃肠道癌症的风险。长期或过量使用PPI的风险与受影响的身体系统的关系将在下面的章节详细讨论。
尽管通常情况下质子泵抑制剂(PPI)耐受性良好且安全。但是已经有许多研究发现质子泵抑制剂的长期使用可能会导致胃肠道菌群的失衡。
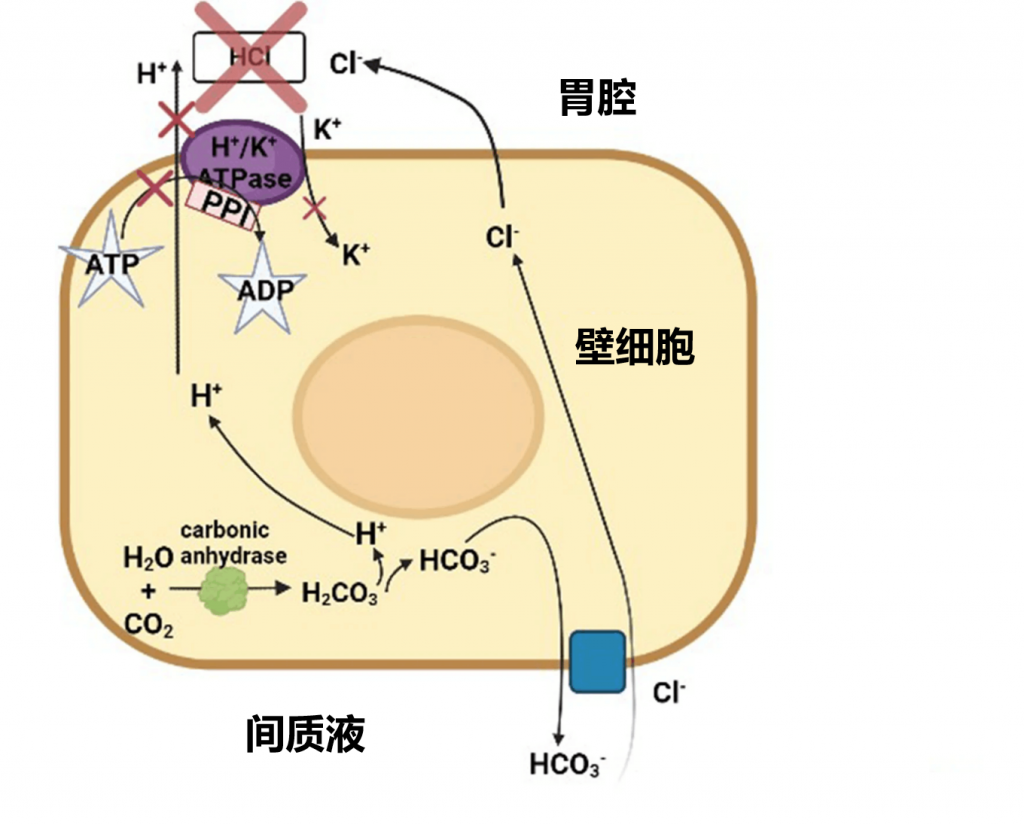
胃肠道微生物对于消化/分解膳食营养素以及抵御病原体至关重要。这些微生物群受pH值、其他微生物、环境因素和遗传因素等不同因素的调节。正常的微生物群彼此之间处于精确的平衡状态,这种平衡正是促进肠道健康的关键。如果微生物群的平衡被打破,就会引发肠道和肠外疾病。
质子泵抑制剂(PPI)可以降低胃酸度,PPI使用者的胃液pH值>4,因此口腔和胃中的许多细菌可以存活。

口腔中一些菌群的丰度增加
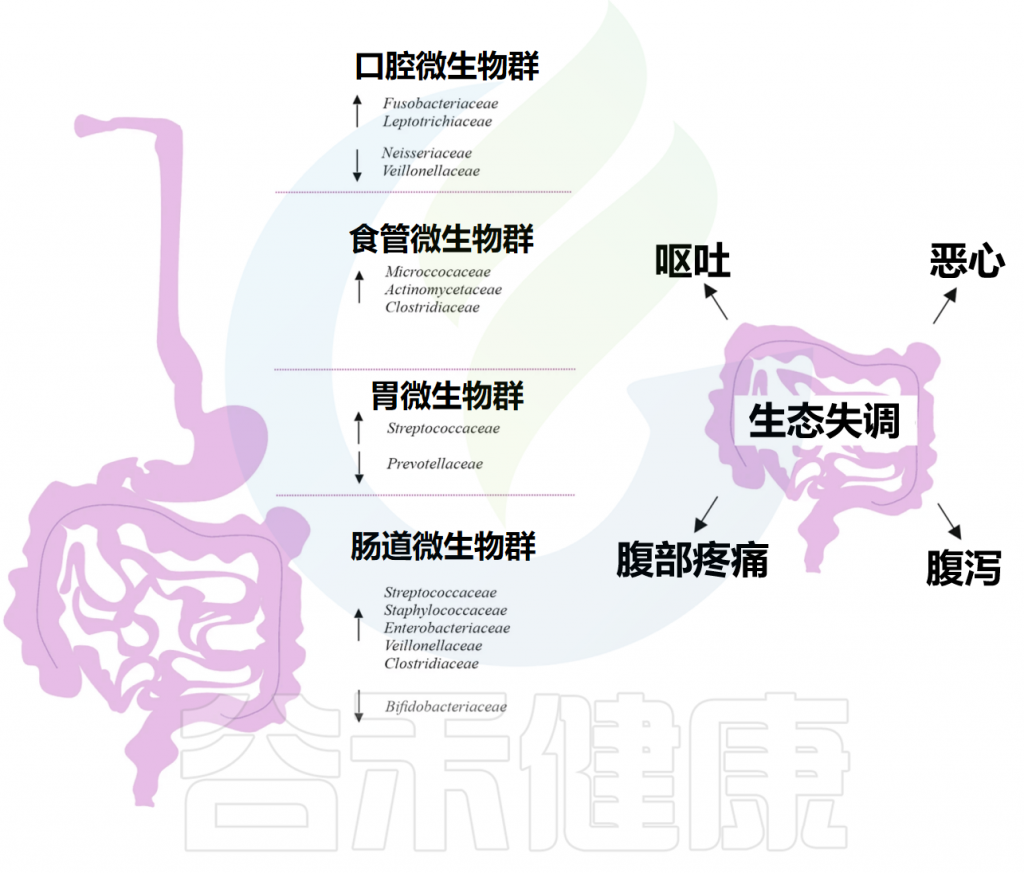
对1815名荷兰个体进行了研究。发现,PPI使用者口腔中的Rothia mucilaginosa、Rothia dentocariosa、细菌属Scardovia和放线菌以及微球菌科等物种更多。
在健康个体中,服用埃索美拉唑4周后,牙周袋中梭杆菌(Fusobacterium)和纤毛菌(Leptotrichia)增多,但唾液中奈瑟菌(Neisseria)和韦荣氏球菌(Veillonella)减少。
注:有记录显示,健康个体的食管中大多发现革兰氏阳性菌,而不健康个体的食管(如 Barrett 食管)中大多发现革兰氏阴性菌。这种细菌类型的变化可能导致脂多糖增加,从而引发炎症反应。
食管和胃中的菌群组成也发生变化
同时,食管微生物群中微球菌科(Micrococcaceae)、丹毒丝菌科(Erysipelotrichaceae)和肠杆菌科(Enterobacteriaceae)的数量有所增加,而丛毛单胞菌科(Comamonadaceae)减少。研究表明,使用质子泵抑制剂(PPI)会改变食管菌群,导致厚壁菌门增多、拟杆菌门和变形菌门减少。
而PPI使用者的胃液pH值 >4,因此许多口腔细菌可以在胃中存活。胃中链球菌科增多、普雷沃氏菌科减少。
pH 值的增加还可能导致幽门螺杆菌感染以及其他微生物的过度生长。
doi: 10.1007/s43440-023-00489-x.

国际著名期刊《GUT》发表的一项研究表示,检测了1827名患者的粪便样本。研究人员表示,质子泵抑制剂(PPI)会导致肠道共生菌的丰度降低,微生物多样性减少。
具有抗炎特性的Faecalibacterium减少
服用PPI的受试者粪便中Faecalibacterium属有所减少。众所周知,该属具有抗炎特性。此外,粪便微生物群中的 OTU 有所减少。
乳杆菌的数量有所增加
对20名反流性食管炎患者施用PPI(埃索美拉唑),持续 8 周。他们随后测定了粪便和血液中的细菌组成,此外还测定了粪便中的有机酸浓度和pH值。研究显示,使用PPIs治疗后,加氏乳杆菌、发酵乳杆菌、罗伊氏乳杆菌和瘤胃乳杆菌的数量增加。
乳杆菌被认为对人体健康有益,但有几份报道称乳酸杆菌在敏感的免疫功能低下患者中引起了菌血症和肝脓肿等严重感染。
胃食管反流病患者使用PPI后的菌群变化
使用质子泵抑制剂(PPI)治疗会导致整个胃肠道中的微生物群多样性显著降低。研究了胃食管反流病患者胃黏膜和粪便的微生物群变化,发现长期使用PPI的患者组粪便微生物群中链球菌科、韦荣氏球菌科、氨基酸球菌科(Acidaminococcaceae)、微球菌科和黄杆菌科(Flavobacteriaceae)的丰度较高,而Pelobacter、脱硫单胞菌属(Desulfuromonas)、Alkanindiges、Koridiimonas、Marinobacterium和Marinobacter的相对丰度降低。
而Luteimonas、Limonobacter、Herbaspirillum、Sphingobium、Phenylobacterium、Comamonas、Chryseobacterium、Duganella、Pedobacter的相对丰度也较高。
短期使用质子泵抑制剂(PPI)与细菌水平显著降低有关,例如Pelobacter、Desulfuromonas、Alcanlvorax、Kordiimonas、Desulfuromusa、Marinobacterium和Marinobacter丰度均有所下降。
使用质子泵抑制剂后发生改变的胃肠道细菌
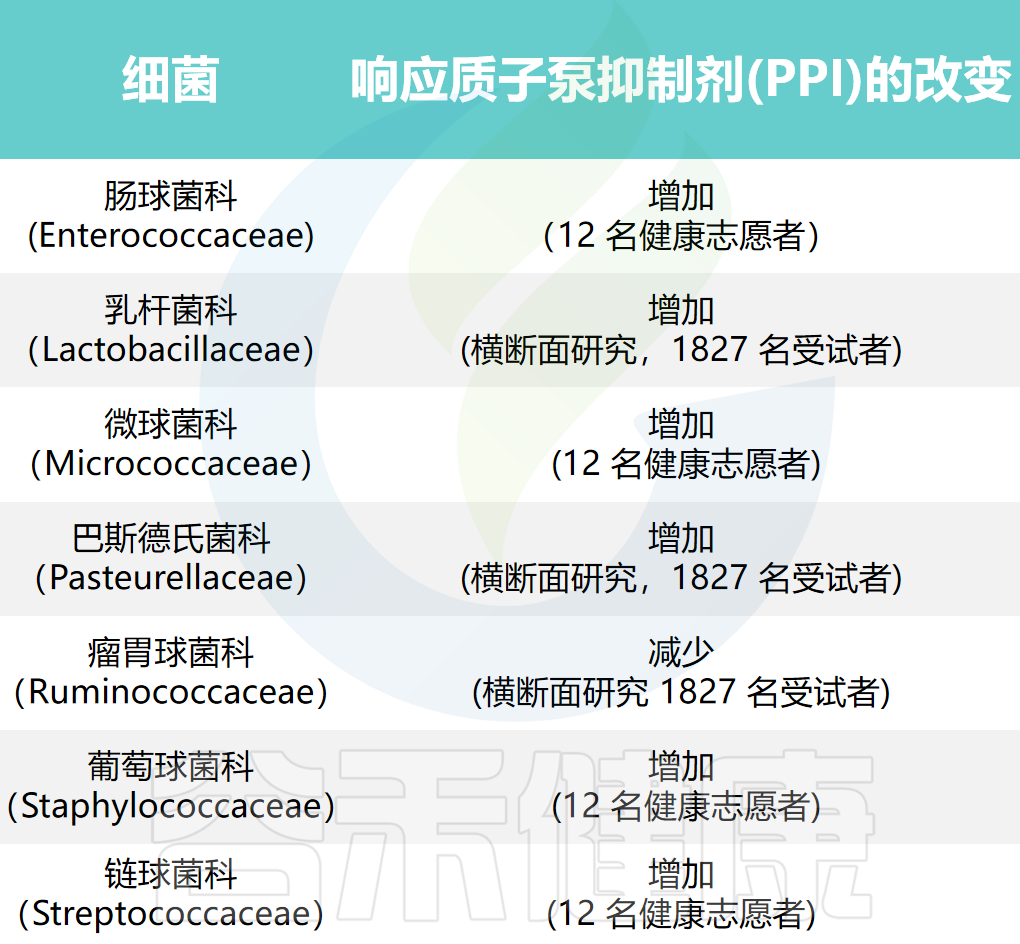
Morris N,et al.Natl Res Cent (2023)
使用质子泵抑制剂(PPI)还会增加致病微生物感染的风险。这可能是因为益生菌由于其他微生物过度生长而丢失,或者由于胃酸分泌受到抑制导致pH值变得更碱性,这也会允许通常被胃酸消灭的微生物存活,从而导致后续微生物环境的改变,使致病微生物更容易引发感染。
使用质子泵抑制剂的人艰难梭菌感染风险更高
艰难梭菌感染是最常见的感染之一。它会导致严重腹泻、结肠扩张甚至死亡。
人们怀疑肠道菌群失调和诱发的炎症可能是艰难梭菌感染的原因。胃酸是许多病原微生物的重要屏障,抑制胃酸产生可能促使肠道感染倾向增加。
研究了艰难梭菌感染相关腹泻的发生与质子泵抑制剂(PPI)使用之间的关系发现,使用PPI的患者发生艰难梭菌感染相关腹泻的风险更高。未服用PPI的患者艰难梭菌感染的发生率为4.4%,而服用PPI的患者为9.3%。

另一项研究也发现,服用质子泵抑制剂(PPI)的患者艰难梭菌感染的发生率从近37%上升到63%左右。此外,美国胃肠病学杂志进行的一项荟萃分析了涉及近30万名患者的23项研究的结果。结果表明,65%的患者在使用PPI后出现了与艰难梭菌肠道定植相关的腹泻。
PPI治疗后促炎细胞因子表达增加,易感性增强
用质子泵抑制剂(PPI)治疗的结肠炎小鼠表现出促炎细胞因子表达增加,例如IL-1β、IL-6、白细胞介素-17A(IL-17A)、TNF-α、干扰素-γ(IFN-γ)、巨噬细胞炎症蛋白-2(MIP-2)和单核细胞趋化蛋白-1 (MCP-1)。
研究还显示,PPI可导致瘤胃球菌科和双歧杆菌属细菌减少,而γ-变形菌纲、肠球菌科、肠杆菌科和乳酸杆菌科以及肠球菌属和韦荣球菌属细菌增加,这些细菌与艰难梭菌感染易感性增加有关。
产短链脂肪酸的菌群减少,炎症加重
与PPI使用相关的肠道微生物群的改变可能会改变产生短链脂肪酸的细菌种类的数量和比例。研究发现,PPI给药减少了拟杆菌属和普雷沃氏菌属。这种减少会改变短链脂肪酸的总体产生量,导致结肠调节性T细胞活化减少,从而可能导致炎症加重。
因此,PPI不仅可能增加艰难梭菌感染的风险,还可能增加相关死亡率。
质子泵抑制剂使用者沙门氏菌定植增加
沙门氏菌病是一种主要由沙门氏菌引起的胃肠道感染。研究表明,非伤寒沙门氏菌病患者更多包括质子泵抑制剂(PPI)使用者。
一项病例对照研究表明,沙门氏菌感染的原因之一是近期使用PPI。原因可能是PPI减少胃酸分泌作用可能抑制胃液的保护性抗菌作用,从而促进沙门氏菌感染。
报告还显示,使用PPI治疗降低了小肠和大肠各个部位的丁酸水平。丁酸显著影响对沙门氏菌的抑制。在沙门氏菌感染期间也观察到IL-1β和TNF-α表达增加。
长期使用质子泵抑制剂(PPI)治疗会影响小肠微生物群,由于失去胃酸这一“防御屏障”,可能引发小肠细菌过度生长。
小肠细菌过度生长是指每毫升上肠道抽吸物中的细菌数量超过10^5个,而正常值则为每毫升上肠道抽吸物中的细菌数量少于10^4个。
小肠细菌过度生长是一种以小肠中细菌增多或类型异常为特征的综合征。它可能没有症状,也可能出现非特异性症状,包括腹胀、腹部不适、腹痛或腹泻。更严重的病例会出现体重减轻、营养不良、肝脏变化、关节痛和贫血、维生素D3缺乏引起的低钙血症所致的手足搐溺症、代谢性骨病以及维生素B12缺乏引起的多发性神经病。
使用质子泵抑制剂可能导致小肠细菌过度生长风险增加
一些报告表明,质子泵抑制剂(PPI)的使用会影响小肠细菌过度生长(SIBO)的发生。给一组老年患者每天服用20毫克奥美拉唑。他们在试验前后采集了患者的十二指肠抽吸物。试验前,患者的细菌计数< 10^4 菌落形成单位(CFU)/mL(96%的患者),而在接受PPI治疗后,43%的患者细菌计数>10^5 CFU/mL。
对200例使用PPI36个月的胃食管反流病患者、未使用PPI的肠易激综合征(IBS)患者和健康对照者进行了葡萄糖-氢呼气试验(GHBT)以检测小肠细菌过度生长。
50%的PPI使用者、24.5%的IBS患者和6%的健康对照者患有小肠细菌过度生长。比较了使用埃索美拉唑20mg每日两次治疗糜烂性反流病和胃食管反流病的患者,持续6个月。在PPIs治疗8周后,患者主诉腹胀(43%)、气胀(17%)、腹痛(7%)和腹泻(2%)。经过6个月的治疗,肠道症状的发生率继续增加。
小肠细菌过度生长的患者肠道多样性降低
而小肠细菌过度生长(SIBO)有影响到肠道菌群的构成。与没有小肠细菌过度生长的患者相比,在诊断患有小肠细菌过度生长的患者中,肠道菌群的组成显示出α多样性显著降低。链球菌的相对丰度增加,拟杆菌的相对丰度降低。
此外,研究表明SIBO与炎症有关。在SIBO患者十二指肠中发现促炎细胞因子IL-1β、IL-6和TNF-α升高。
使用质子泵抑制剂会增加肠道炎症的严重程度

在研究质子泵抑制剂(PPI)使用及其导致的实验性结肠炎严重程度的小鼠中,发现PPI会增加结肠炎的严重程度,并显示体重减轻和疾病活动指数评分显著增加。
在同一研究中,长期使用质子泵抑制剂(PPI)导致炎症性肠病(IBD)患者的住院率增加,其中包括 45151 名匹配的成年患者。
这些实验数据表明,长期使用PPI会对与炎症性肠病相关的各种途径产生深远影响,从而导致更严重的并发症。此外,在一项分析了3个队列的研究中(n=82269),与非PPI使用者相比,PPI使用者患IBD的风险增加。
IBD患者同时使用PPI会影响肠炎的治疗效果
此外,证据还表明,正在接受治疗的 IBD 患者在同时接受 PPI 治疗时不太可能获得缓解。在一项使用生物药物英夫利昔单抗治疗 IBD 的研究中,缓解率下降与 PPI 的使用有显著关联。第30周 PPI 组的缓解率为30%,非PPI组的缓解率为49%。
注:这种显著性仅在克罗恩病中可见,而在溃疡性结肠炎中则不可见。与非PPI使用者相比,使用PPI的患者住院率增加。
研究观察到在克罗恩病和溃疡性结肠炎中,质子泵抑制剂(PPI)使用与炎症性肠病相关住院和手术的比值比增加。经过倾向评分匹配后,发现与不使用 PPI 相比,PPI使用与新生物制剂使用、IBD相关入院和手术均显著相关。此外,PPI剂量与新生物制剂使用和 IBD 相关住院也存在关联,但与手术无关。
使用质子泵抑制剂还可能增加儿童患IBD风险
质子泵抑制剂(PPI)还与儿童IBD有关,PPI的疾病风险评分为3.6,研究使用H2RA(H2受体阻滞剂)作为对照,将PPI给药与之比较,H2RA的疾病风险为 1.6。
然而,由于样本量小(对照组n=6,PPI组n=6)以及研究前可能对 IBD 进行误诊,因此有必要进一步调查。
这些发现表明,使用质子泵抑制剂(PPI)可能会增加患炎症性肠病(IBD)的风险,并且可能与某些 IBD 治疗的有效性降低有关。
不同人群的基础生理特征不同,年龄、体重、原有基础疾病、肠道微生物群的构成等都会影响质子泵抑制剂使用后的副作用。以下是更容易受到质子泵抑制剂(PPI)对肠道微生物群影响的人群:
-体质较弱或微生物群失调的群体
研究发现,体质虚弱或微生物群失调的群体更容易受到质子泵抑制剂(PPI)使用影响,从而导致肠道微生物群进一步紊乱。
-存在胃肠道疾病的人群
例如患有炎症性肠病(IBD)或肠易激综合征(IBS)的患者,他们的肠道微生物群可能已经因为疾病本身而受到影响,PPI 的使用可能会进一步改变其微生物群组成。
-肝硬化患者
两项正在进行的研究,提供了更多证据,说明PPI引起的微生物群改变与肝硬化患者存在临床关联。
-胃食管反流病(GERD)患者
同样,GERD患者也是质子泵抑制剂(PPI)使用后微生物群改变显著的群体之一。
-老年人
老年人可能因为使用质子泵抑制剂(PPI)而面临更高的风险,因为他们可能已经是易受感染和其他并发症影响的个体。
-长期使用PPI的人
研究表明长期使用PPI的人肠道微生物群会发生了一些变化,但这些变化是否会对健康产生不利影响仍有待证实。
-使用抗生素或其他常用药物的人
质子泵抑制剂(PPI)使用者中观察到的微生物组成变化不是由于腹泻或排便频率增加引起的,而是与抗生素和除PPI之外的其他常用药物类别有关。
-社区获得性肺炎的高风险群体
使用PPI后,社区获得性肺炎的风险显著增加,特别是链球菌源性肺炎,这表明胃肠道可能成为其他身体部位潜在病原体的储存器。
长期使用质子泵抑制剂(PPI)会使身体对多种重要营养素的吸收产生负面影响。营养素吸收受阻会导致多种健康并发症。
与长期使用PPI相关的营养异常包括低镁血症、低钙血症、维生素B12缺乏症和低/高钾血症。
值得注意的是,并非每个人都会出现与长期使用PPI 相关的异常,但使用 PPI 可能会增加此类缺陷的风险,例如在之前已经存在营养吸收问题的个体中。
长期使用质子泵抑制剂导致镁缺乏,低镁血症可导致严重的健康问题,如癫痫和心律失常。
研究发现长期使用PPI,尿液中Mg2+排泄量减少,表明肠道对Mg2+吸收减少的补偿,并且排除了肾脏 Mg2+丢失是缺乏的原因。
奥美拉唑会抑制镁吸收,受到剂量和时间影响
据估计,30-50%的Mg2+在肠道中吸收。奥美拉唑治疗 14 天后, Mg2+从顶端到基底外侧的转运受到抑制。此外,值得注意的是,在 PPI 治疗期间补充镁对镁水平没有影响。如果缺乏,则需要停止 PPI 治疗以恢复镁水平。
这种抑制可能呈剂量和时间依赖性,因为与14天奥美拉唑治疗相比, 21天奥美拉唑治疗进一步降低了 Mg2+从顶端到基底外侧的转运。瞬时受体电位黑色素瘤素(TRPM6/7)负责结肠对镁的吸收,PPI可抑制或降低其活性。
有研究提出,PPI对胃酸的抑制会阻碍从食物中溶解钙的能力,并由于pH值的变化而导致吸收减少。低钙血症会导致精神状态改变,并且由于骨骼变弱而导致骨折增加。
长期使用PPI导致胃泌素增多,钙流失增加
甲状旁腺激素(PTH)通过维持血清钙水平、刺激骨吸收、增加肾小管钙重吸收和骨化三醇生成(可增加上肠钙的主动转运)来调节钙和骨代谢。
质子泵抑制剂(PPI)通过抑制粘膜 D 细胞释放生长抑素而导致胃泌素显著增加,这已被证明对甲状旁腺有刺激作用,表现为高胃泌素血症导致大鼠甲状旁腺体积和重量增加。长期使用PPI会导致高胃泌素血症,这还会影响甲状旁腺,导致骨骼中钙质流失增加。
在人类中,八周的奥美拉唑疗法导致 PTH 水平增加 28%。如前所述,长期使用PPI会导致钙吸收降低。研究还发现,奥美拉唑会降低老年女性吸收碳酸钙的能力。
多吃牛奶和奶酪可以适当减轻钙缺乏
值得注意的是,牛奶和奶酪等钙源具有更高的生物利用度,因此如果遵循适当饮食的方案,可能能够减少钙缺乏症。
由于质子泵抑制剂(PPI)的使用,胃酸分泌受到抑制,维生素B12不能被正确分解,从而导致吸收减少。
在缺乏胃酸和不能被正确分解的情况下,维生素B12无法避免胰腺消化,导致吸收量降低。维生素B12缺乏会导致精神状态改变、虚弱、贫血和心悸。
维生素B12摄入受到阻碍的人群应谨慎使用PPI
由于维生素B12的生理储备,大部分人群不会出现维生素B12缺乏症,但在维生素B12摄入已经受到阻碍的人群中,应谨慎使用质子泵抑制剂(PPI)。
此外,还有研究表明,质子泵抑制剂(PPI)会抑制肾上腺皮质类固醇的合成,从而导致血清钾水平升高。高钾血症可导致心律失常和肌肉无力,从而引起严重的健康并发症。
也有患者在接受PPI治疗时出现低钾血症,尿钾排出量增加。因此,可能需要测量服用PPI的患者的钾水平。
使用质子泵抑制剂(PPI)对神经系统是否有影响?虽然罕见,但已有因质子泵抑制剂(PPI)治疗导致神经病变的病例报告,使用了奥美拉唑,也有兰索拉唑。
▼

与H2RA(H2受体拮抗剂)给药相比,PPI给药的记忆障碍不良反应结果显著增加。H2RA给药组没有关于阿尔茨海默病型痴呆的报告,而PPI给药组有80份。注:与PPI治疗相关的神经病变可能是维生素B12缺乏症的继发性因素。
记忆障碍包括阿尔茨海默病(AD)型痴呆、非AD型痴呆、记忆障碍和遗忘症。此外,研究还发现,与H2RA治疗相比,PPI治疗在神经病变、听力障碍、视力障碍和癫痫方面具有更高的风险关联。
神经病变症状出现的时间与使用PPI的时间重叠
在该案例研究中,神经病变症状的出现与开始使用兰索拉唑的时间点相重叠,并且停用兰索拉唑后这些临床和电生理症状的停止,因此我们推断质子泵抑制剂(PPI)与神经病变存在因果关系。
▼
一项使用德国老龄化、认知和痴呆数据库进行的研究发现,长期使用质子泵抑制剂(PPI)的个体与非长期使用PPI的个体相比,患痴呆症的风险增加。
质子泵抑制剂会导致β淀粉样蛋白增加
研究发现,质子泵抑制剂(PPI)可能会破坏清除酶及其活性,导致脑中β淀粉样蛋白的数量增加,这已被证明与痴呆进展有关。
在细胞培养和小鼠模型中,兰索拉唑、奥美拉唑、泮托拉唑和埃索美拉唑均显示出使淀粉样蛋白β浓度增加,特别是淀粉样蛋白β40和42以剂量依赖性方式增加(5µM-50µM),这在生理上是相关的。
注:γ-分泌酶具有多个淀粉样蛋白前体裂解位点,并且可以受到称为γ-分泌酶调节剂的小分子药物的影响。这些调节剂可以改变γ-分泌酶裂解位点,产生不同的淀粉样β蛋白生成模式,会产生多种淀粉样β蛋白,其中淀粉样β40是最常见的。
此外,PPI 可能对多种途径产生影响,导致淀粉样β蛋白生成异常,表现为PPI给药增加β位淀粉样蛋白前体蛋白裂解酶 (BACE1) 活性,并可能通过pH值变化影响蛋白酶(如meprinβ),导致淀粉样β蛋白生成增加。
▼
胆碱能神经元网络的退化是阿尔兹海默病、唐氏综合症、帕金森病痴呆和路易体痴呆的主要特征。质子泵抑制剂(PPI)会抑制人类胆碱乙酰转移酶(chAT)的活性,所有测试的PPI均几乎完全抑制 chat 的酶活性。奥美拉唑的效力与强效chAT抑制剂α-NETA相似,而埃索美拉唑和雷贝拉唑的效力分别强2倍和5倍。
使用质子泵抑制剂导致胆碱能神经元网络的退化可能是质子泵抑制剂对神经系统产生的另一个负面影响。
除了对胃肠道和神经系统的影响外,质子泵抑制剂还可能影响心血管系统、肾脏,甚至还可能与肺炎有关。
▼
长期使用质子泵抑制剂(PPI)与心肌梗死和中风等心血管事件有关。人们推测长期使用PPI会导致心血管事件的途径有多种,包括一氧化氮水平变化、镁缺乏、嗜铬粒蛋白A增加以及对细胞色素P450酶的影响。

缺血性中风和心肌梗死风险上升
质子泵抑制剂(PPI)引起的心血管事件大多与高剂量和长期使用有关。一项平均随访时间约为6年、涉及214998人的研究表明,长期使用PPI会增加缺血性中风和心肌梗死的风险。
短期和长期使用PPI均与缺血性中风和心肌梗死的风险比增加相关,风险比分别为1.13和1.31。而高剂量PPI的使用与上述风险显著相关。
在使用PPI时应考虑患者的心血管疾病风险
因此,在开具和使用质子泵抑制剂(PPI)时应考虑心血管疾病风险,尤其是在需要长期使用或高剂量使用的情况下。
此外,应密切评估和监测患有心血管疾病高风险的个体的长期PPI使用情况。
▼
质子泵抑制剂(PPI)治疗是否会导致肾脏损伤还存在争议。
正在使用质子泵抑制剂的人患急性间质性肾炎风险更高
一项研究调查了肾脏损伤是否与当前、近期或既往使用PPI有关,结果发现,当前使用PPI的人患急性间质性肾炎的风险高于既往或近期使用PPI的人。该研究还指出,随着年龄的增长,PPI与肾脏损伤之间的关联性增强。
另一项利用医疗健康记录的研究发现,质子泵抑制剂(PPI)的使用与急性肾损伤风险之间存在关联,还与慢性肾病风险之间存在关联。
然而,不同的慢性肾病分期和PPI的使用与死亡率无显著相关性。这些异质性结果源于不同研究人群的基础生理特征不同,需要进行更多随机研究来调查肾损伤与长期PPI使用之间的关联。
▼
还有一些研究评估了长期质子泵抑制剂(PPI)使用与肺炎的关联,但结果也相互矛盾。
使用质子泵抑制剂肺炎发病率会增加,但具体原因还不确定
多项研究表明,在使用PPI之前和之后,肺炎发病率都会增加。然而,解释有所不同,一些人将这种肺炎关联归因于在PPI给药前后存在的潜在肺炎风险,而与PPI的使用无关。但进一步的研究证明肺炎发病率的增加与第二年长期使用PPI有关。
此外,在台湾患有二型糖尿病的患者中,使用 PPI 与肺炎风险增加有关。研究发现,在二型糖尿病患者队列中,PPI 使用者的肺炎发病率比非使用者高 11.4% (30.3%vs.18.9%)。肺炎的相关风险也呈剂量依赖性增加,即PPI剂量越高,肺炎风险越高。
质子泵抑制剂(PPI)用于治疗胃酸相关疾病,如胃食管反流病(GERD)、胃溃疡和十二指肠溃疡等。
但是,长期或不当使用PPI可能会引起一些副作用,如导致肠道微生物群紊乱、骨折风险增加、维生素和矿物质缺乏、感染风险增加等。以下是一些详细的措施,可以帮助减轻或预防PPI的副作用:
▼
-医生评估
在使用PPI前,请务必咨询医生进行全面评估,确保有明确的使用指征。仅在医生建议的情况下使用PPI,避免不必要的长期使用。
-尽量使用最小有效剂量
使用最低有效剂量和最短疗程,以减少长期使用的风险,不要自行增加剂量或延长使用时间。
-定期评估PPI使用的必要性
定期与医生讨论PPI使用的效果和副作用,评估是否需要继续使用。如果症状得到缓解,考虑在医生的建议下逐渐减少PPI的剂量或停药。
注:PPI突然停药可能引起反弹性胃酸分泌。建议逐渐递减剂量,逐步停药,减少反弹风险。
-替代药物选择
对于需要长期减酸治疗的患者,可以在医生指导下尝试替代药物如H2受体拮抗剂。
-注意PPI与其他药物的相互作用
了解PPI可能与其他药物(如抗抑郁药、他汀类药物等)发生相互作用,影响药物的效果或增加副作用。
在使用其他药物时,告知医生你正在使用的PPI,以便医生调整药物剂量或更换药物。
-定期复查治疗和体检
定期复诊和进行体检,评估是否需要继续使用PPI。部分患者可能在症状缓解后可以逐渐停药,及时发现并处理健康问题。
-多学科协作,个性化治疗
将PPI作为综合治疗的一部分,包括生活方式改变、其他药物治疗和行为疗法等。
根据个体情况调整治疗方案,确保治疗的安全性和有效性。
▼
长期使用质子泵抑制剂(PPI)可导致肠道菌群失调,从而增加感染的易感性,并会导致肠道疾病以及其他疾病。最近有研究发现在PPI治疗期间额外补充益生菌,除了增强PPI治疗效果外,益生菌补充剂还能潜在地抑制肠道菌群失调和长期使用PPI的副作用。
减轻了肠道菌群失调

对患有胃食管反流病的儿童进行了12周的质子泵抑制剂(PPI)治疗,同时还给研究组施用了益生菌罗伊氏乳杆菌DSM 17938。结果显示,未服用益生菌的组中56.2%的儿童出现了肠道菌群失调,而服用益生菌的组中只有6.2%的儿童出现了肠道菌群失调。
减少病原菌的定值
益生菌在PPI治疗中发挥健康促进作用的潜在机制可能有很多。首先,益生菌的作用机制之一可能是竞争性排斥。通过与其他细菌竞争胃肠道中的受体位点,从而减少一些病原菌的定值。
益生菌充当限制致病菌增殖的“屏障”。研究表明,某些益生菌代谢物可能在调节细胞中的各种代谢和信号通路中发挥作用。此外,乳酸杆菌和双歧杆菌可产生抑制某些病原体增殖的细菌素。益生菌菌株能够通过影响肠道菌群来刺激短链脂肪酸(SCFA)的产生,这对于肠道健康也至关重要。
已有报道显示益生菌可有效减轻艰难梭菌感染,将含有艰难梭菌毒素的上清液与克劳氏芽孢杆菌一起可保护细胞免受毒素的影响,这与克劳氏芽孢杆菌产生丝氨酸蛋白酶有关。使用双歧杆菌和布拉氏酵母菌等益生菌也显示出对艰难梭菌的抑制。
嗜热双歧杆菌RBL67对沙门氏菌有抑制作用。其中,VSL#3 益生菌混合物中的婴儿双歧杆菌和短双歧杆菌被证实可改善细胞上皮完整性和对沙门氏菌侵袭的抵抗力。
缓解小肠细菌过度生长
研究发现,一些益生菌菌株可有效调节小肠菌群,这与小肠细菌过度生长的减少有关。
给使用质子泵抑制剂(PPI)超过12个月的患者施用了四种选定的益生菌,即鼠李糖乳杆菌LR06 (DSM 21981)、戊糖乳杆菌LPS01 (DSM 21980)、植物乳杆菌LP01 (LMG P-21021) 和德氏乳杆菌LDD01 (DSM 22106)。益生菌混合物显著减少长期使用PPI治疗的患者的细菌过度生长。
在128名接受PPI治疗的胃食管反流病(GERD)儿童中,服用额外的罗伊氏乳杆菌DSM 17938益生菌菌株降低了肠道菌群失调的发生率并抑制小肠细菌过度生长的风险。
调节宿主免疫反应
此外,益生菌还能调节宿主的免疫反应。超过70%的免疫细胞位于肠道,尤其是小肠,形成肠道相关淋巴组织 (GALT)。GALT 包含派尔集合淋巴结、淋巴小结、淋巴细胞和粘膜等结构。
益生菌已被证明能诱导树突状细胞(DC)成熟模式,其特征是释放少量TNF-α和白细胞介素12(IL-12),同时增加IL-10水平,从而抑制促炎性Th1淋巴细胞的产生。
因此,益生菌对小肠细菌过度生长、艰难梭菌感染、沙门氏菌感染有影响,即对质子泵抑制剂(PPI)治疗副作用的有一定的改善效果。
除了补充益生菌可以调节肠道微生物群并减轻使用质子泵抑制剂的副作用外,以下这些方法可能也有助于改善使用质子泵抑制剂后的副作用。
▼
益生元是一类不可消化的食物成分,它们可以促进益生菌的生长和活动。常见的益生元包括:
可溶性纤维:如菊粉、低聚果糖和低聚半乳糖。
不可溶性纤维:如全谷物中的纤维素。
益生元可以通过以下方式帮助减轻质子泵抑制剂的副作用:
促进益生菌生长:益生元为益生菌提供营养,促进其生长和活动。
改善肠道屏障功能:益生元可以帮助维持肠道屏障的完整性,减少病原体的入侵。
▼
-增加膳食纤维的摄入
膳食纤维可以促进肠道蠕动,帮助缓解便秘,这是某些质子泵抑制剂可能引起的副作用之一。建议多食用洋葱和大蒜等蔬菜、柑橘类水果和全谷类食品等富含膳食纤维的食物。
-均衡摄入各类营养素
长期使用PPI可能导致钙、镁、维生素B12等营养素的吸收障碍,增加骨折或其他营养不良风险。需要保证足够的维生素和矿物质摄入,可以通过食物或补充剂来确保足够的摄入量。
-适量摄入发酵食品
发酵食品如酸奶、酸菜等含有益生菌,可以改善肠道微生物群的平衡,有助于维持消化系统的健康,并可能减轻由于长期使用质子泵抑制剂可能引起的肠道菌群失衡问题。
-避免卧床进食
饭后至少待立或坐姿30分钟,避免立即卧床,以减少胃酸反流。
-避免刺激性食物
辛辣、油腻、烧烤等食物可能刺激胃肠道,加重消化不良症状。减少这类食物的摄入,选择易消化的食物如米粥、面条、煮熟的蔬菜等。
-少食多餐
每天分成4-5餐,每餐食量适中,避免暴饮暴食,这有助于减轻胃部负担,减少胃酸分泌,从而可能降低质子泵抑制剂的副作用。
-避免过度饮酒和吸烟
酒精和烟草会刺激胃肠道,加重消化不良症状,应尽量避免。
-注意饮食卫生
避免食用过期食品、生冷食物等容易引起胃肠道感染的食物,PPI使用可能增加肠道感染的风险,如艰难梭菌感染。保持良好的个人和食品卫生习惯,减少感染风险。
-喝足够的水
保持足够的水分摄入可以促进肠道蠕动,缓解便秘症状。
-限制饮料的摄入
咖啡是一种带有兴奋作用的饮料,可能会导致身体进入兴奋状态,增加胃酸分泌,从而加重症状或副作用。而碳酸饮料可能增加胃部气体,引起腹胀等不适,应尽量避免。
▼
定期检测肠道健康可以帮助及时发现和纠正肠道微生物群的失衡。这可能包括:
肠道微生物群分析:通过检测肠道内的微生物组成,了解益生菌和有害菌的比例以及相关代谢物的含量,并根据此来更有针对性、个性化的饮食及相关调整。
肠道屏障功能检测:评估肠道屏障的完整性,及时发现潜在的肠道屏障功能障碍。
骨密度检查:长期使用PPI可能增加骨折风险,尤其是老年人。建议定期进行骨密度检测,评估骨骼健康。
血液检查:定期进行血液常规、肝功能、肾功能、维生素和矿物质水平检测,及早发现和纠正异常。
▼
适量的运动可以帮助改善肠道健康,促进益生菌的生长。运动可以通过以下方式帮助减轻质子泵抑制剂的副作用:
促进肠道蠕动:运动可以增加肠道蠕动,帮助食物通过肠道,减少有害菌的生长。
降低压力水平:运动可以帮助降低压力水平,减少压力对肠道微生物群的负面影响。
小 结
通过补充益生菌和益生元、调整饮食、定期检测肠道健康以及适量运动,可以帮助改善肠道微生物群的平衡,从而减轻质子泵抑制剂的副作用。
然而,这些策略的有效性可能因个体差异而异,因此在实施这些策略时应考虑个人的健康背景和医生的建议。
质子泵抑制剂(PPI)包括奥美拉唑、埃索美拉唑、兰索拉唑、右兰索拉唑、泮托拉唑和雷贝拉唑,是治疗食管反流病(GERD)、溃疡非糜烂性反流病(NERD)、非甾体抗炎药相关溃疡、食管炎、消化性溃疡病等疾病的一线药物。
近年来,质子泵抑制剂对肠道微生物群的潜在影响及其对健康的长期后果引起了广泛关注。PPI治疗可能会带来一些副作用,如头晕、头痛、发热、腹痛、便秘、腹泻、胀气、恶心或呕吐等,科学界正在积极研究如何减轻这些影响。
PPI治疗的一些报道指出,其可能会对肠道微生物群产生影响,包括可能降低胃肠道微生物群的多样性和丰富度。这可能使得某些肠道感染风险增加,但这种情况各异。长期使用PPI还可能与小肠细菌过度生长及炎症性肠病病情波动有关。但这些关联在个体间的表现并不一致。
此外,PPI可能会影响某些营养的吸收,如钙、镁和维生素B12,并可能对骨代谢产生影响,但发生骨折的风险需个体风险因素综合考虑。PPI与神经退行性疾病(如痴呆)之间的关系也在研究中,但目前的证据并不确定。同样,有关PPI与心血管疾病、肾脏损伤、肺炎之间联系的证据也仍然在不断完善。
为了减轻PPI可能带来的长期影响,优化肠道微生物群平衡显得尤为重要。研究表明,益生菌(如罗伊氏乳杆菌DSM 17938)在接受PPI治疗的个体中显示出缓解某些副作用的潜力。
通过合理使用质子泵抑制剂(PPI),定期监测评估症状包括肠道,神经系统以及营养状况如维生素B12, 钙,镁等,针对性使用益生菌、益生元、改善饮食或选择替代药物,同时预防肠道感染或菌群失衡,从而综合减轻质子泵抑制剂药物(PPI)给个体带来的可能副作用。
注:本篇内容仅为科学知识的分享,无任何立场,仅供参考与学习。
主要参考文献
Kiecka A, Szczepanik M. Proton pump inhibitor-induced gut dysbiosis and immunomodulation: current knowledge and potential restoration by probiotics. Pharmacol Rep. 2023 Aug;75(4):791-804.
Morris, N., Nighot, M. Understanding the health risks and emerging concerns associated with the use of long-term proton pump inhibitors. Bull Natl Res Cent 47, 134 (2023).
Nighot M, Liao PL, Morris N, McCarthy D, Dharmaprakash V, Ullah Khan I, Dalessio S, Saha K, Ganapathy AS, Wang A, Ding W, Yochum G, Koltun W, Nighot P, Ma T. Long-Term Use of Proton Pump Inhibitors Disrupts Intestinal Tight Junction Barrier and Exaggerates Experimental Colitis. J Crohns Colitis. 2023 Apr 19;17(4):565-579.
Fossmark R, Olaisen M. Changes in the Gastrointestinal Microbiota Induced by Proton Pump Inhibitors-A Review of Findings from Experimental Trials. Microorganisms. 2024 May 30;12(6):1110.
Belei O, Olariu L, Dobrescu A, Marcovici T, Marginean O. Is It Useful to Administer Probiotics Together With Proton Pump Inhibitors in Children With Gastroesophageal Reflux? J Neurogastroenterol Motil. 2018 Jan 30;24(1):51-57.
Lespessailles E, Toumi H. Proton pump inhibitors and bone health: An update narrative review. Int J Mol Sci. 2022;18:10733.
Willems RPJ, Schut MC, Kaiser AM, Groot TH, Abu-Hanna A, Twisk JWR, et al. Association of proton pump inhibitor use with risk of acquiring drug-resistant Enterobacterales. JAMA Netw Open. 2023;6: e230470.
Su T, Lai S, Lee A, He X, Chen S. Meta-analysis: proton pump inhibitors moderately increase the risk of small intestinal bacterial overgrowth. J Gastroenterol. 2018;53:27–36.
谷禾健康
人的脑部大约有860亿个神经元和数万亿个突触连接,由250-300亿的神经胶质细胞支持,消耗基础氧气中约20%的比例来维持ATP驱动的活动。
与其他器官相比,大脑及其神经组织由于其高代谢率和能量活动而产生大量的 ROS(活性氧)。与此同时,与其他组织相比,大脑的抗氧化防御系统较弱,因此容易出现氧化还原稳态紊乱。
氧化应激是指由于 ROS 水平高于抗氧化剂水平而导致细胞内氧化还原信号通路中断。这种不平衡状态会产生有害影响,是许多神经系统疾病的主要原因。当大脑缺氧时,每分钟有大约190万个神经元和1400万个突触会开始丧失。
人们最初认为神经退行性疾病 (NDD) 是由神经系统缺陷引起的,而忽略了肠道和大脑之间的通讯涉及神经、代谢、内分泌和免疫途径。
大量研究观察到,肠道微生物组在通过其自身代谢产物或产生次生代谢产物减轻氧化应激、炎症和能量代谢方面发挥了不可忽视的作用,而通过使用具有抗氧化和抗炎活性的益生菌来调节肠道微生物组种群已显示出有希望的神经恢复能力。据报道从德氏乳杆菌(Lactobacillus delbrueckii)亚种Lactobacillus delbrueckii ssp. bulgaricus B3和 Lactobacillus plantarum GD2中分离出的胞外多糖可保护 SH-SY5Y 细胞免受 Aβ(1–42) 诱导的细胞凋亡,这表明它们有望成为药物治疗阿尔茨海默病 (AD)的有前途的天然化学成分。
doi: 10.1016/j.jare.2021.09.005
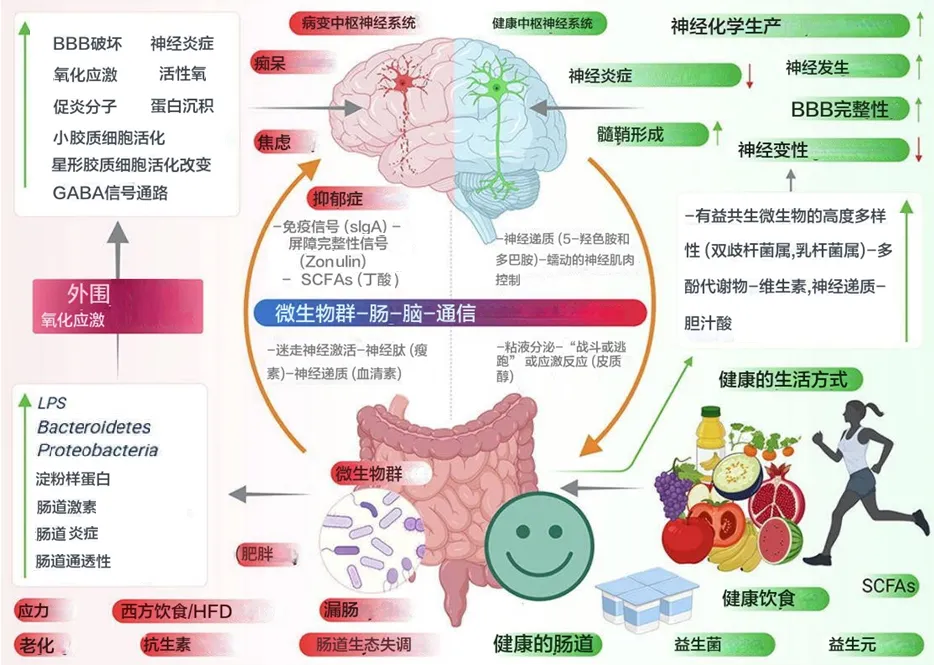
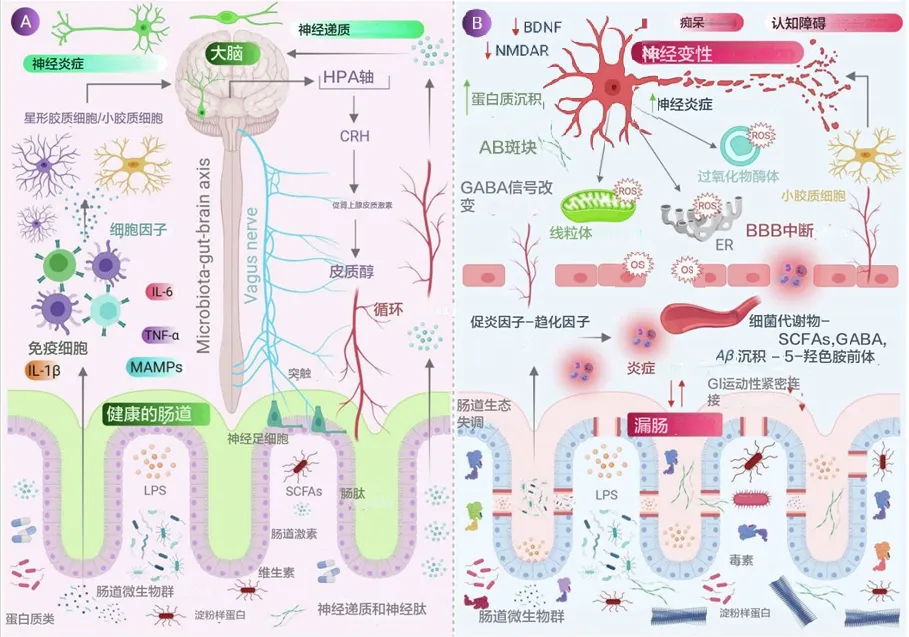
肠道微生物分子,如神经递质、氨基酸、短链脂肪酸 (SCFA)、淀粉样蛋白、脂多糖 (LPS) 和微生物相关分子模式 (MAMP),通过循环与宿主免疫系统相互作用,影响宿主的代谢和神经系统,并通过肠道神经系统直接激活迷走神经影响大脑。压力等情况会导致下丘脑神经元分泌促肾上腺皮质激素(CRH),触发肾上腺皮质激素释放激素(ACTH) 的释放,随后激活皮质醇的释放,影响肠道屏障完整性,进而影响肠道健康。
当肠道菌群失调时,抗炎分子(如SCFAs、H2)的含量减少,而促炎分子(LPS、淀粉样蛋白)的含量增加,同时有益菌种数目减少,致病菌增加。这导致肠道和血脑屏障通透性增加,随之增加外周免疫反应,进而在中枢神经系统(CNS)中增加氧化应激。在神经元的细胞器(如线粒体、内质网(ER)和过氧化物体)中观察到反应性氧化物种(ROS)的产生增加,同时伴随神经毒素的聚集,导致神经退行性变化。
近期的研究提出了肠道微生物群与大脑之间的两个最重要的联系:
所以本文想和大家一起深入了解相关方面研究成果和进展,重点关注涉及神经退化的肠道微生物群介导的氧化应激,以及显示肠道微生物群及其代谢物参与神经保护的研究。
神经退行性疾病(NDD)是一类涉及神经元退化和功能损害的疾病,通常会导致神经细胞的死亡或损伤,进而引起神经系统功能障碍。随着时间的推移逐渐恶化,影响患者的日常生活和活动能力,目前的发病人群越来越大。
阿尔茨海默病:一种进行性痴呆疾病,主要表现为记忆丧失、认知功能下降和行为变化。
帕金森病:一种影响运动控制的疾病,其中运动功能受损,如震颤、肌肉僵硬和运动迟缓。
亨廷顿病(Huntington’s Disease):一种遗传性疾病,表现为神经元的逐渐死亡,导致运动障碍、认知功能下降和精神障碍。
路易体痴呆症(Amyotrophic Lateral Sclerosis, ALS):一种肌萎缩性疾病,导致运动神经元受损,最终导致肌肉无力和萎缩。
多发性硬化:这是一种影响中枢神经系统的慢性疾病,导致神经纤维的髓鞘损伤,影响神经信号的传递。
中风与脑损伤:中风是一种急性神经退行性疾病,由于脑部血流中断导致脑组织损伤。脑损伤也可以是慢性的,随着时间的推移导致神经细胞的损伤。
肠道的“第二大脑”:肠神经系统 (ENS)
肠道不仅仅是消化食物的地方,它还有一个聪明的“大脑”——肠神经系统 (ENS)。它在胃肠道 (GI) 和中枢神经系统 (CNS) 之间架起了一座沟通的桥梁。
肠道神经元通过迷走神经、内分泌和免疫途径与中枢神经系统进行对话,确保我们的肠道健康有序。
肠道微生物群:调节通讯的关键
上面说的“肠神经系统”并不是独自工作的,它有一个重要的合作伙伴——肠道微生物群。这些微生物不仅数量庞大,其代谢能力甚至可以与我们的肝脏相媲美。它们是调节肠道与大脑之间通讯的幕后英雄。
肠道微生物群的多重角色
该领域的持续研究表明,肠道微生物群不仅参与免疫系统的建设和代谢调节,还在我们身体各种器官的发育中扮演着重要角色。
饮食、药物等各种环境因素以及年龄和遗传等宿主因素,不仅会改变肠道菌群的组成,还会造成它们的信号活性发生变化,进而影响我们的健康。
IgA:肠道菌群的守护者
免疫球蛋白A (IgA) 是粘膜表面分泌的最丰富的抗体,她不仅能够包裹病原体以防止其侵入,还能包裹肠道中的共生菌,从而共同抵抗病原菌,维持着肠道菌群的稳定。
连蛋白:肠道屏障的调控者
肠道菌群还会影响连蛋白(zonulin),而连蛋白是调节肠道和血管内皮 (血脑屏障) 紧密连接所必需的。肠道菌群的变化直接影响连蛋白通路,我们常听说的“肠漏”就与此相关。
肠道菌群与情绪
肠道菌群还能影响我们的肠道蠕动,甚至与我们的内分泌系统有关。例如,压力和抑郁可能与皮质醇水平的升高有关,而这种激素的变化又与肠道菌群的平衡有关。
简而言之,肠道菌群通过感知和调节大量化学信号,直接影响我们的身心健康。
肠道细菌与神经系统的联系:从被忽视到被认可
肠道细菌与神经系统疾病之间的关系首次在20世纪提出,现在已被众多研究人员认可。
最初,人们认为神经退行性疾病(NDDs)仅由神经系统内部的缺陷引起,但现代研究揭示了一个事实:肠道微生物能产生和改变各种免疫、代谢和神经化学因子,它们实际上在调控我们的大脑健康方面发挥着关键作用。
肠道菌群:参与神经退行性疾病的双重角色
——失调带来的破坏
神经退行性疾病主要由氧化损伤、活性氧 (ROS) 生成增加、神经炎症和能量代谢紊乱引起,这些病理过程不仅侵袭大脑,也影响肠道微生物群的平衡。
肠道微生物组成会随着身体新陈代谢从健康状态到患病状态的变化而改变。这表明肠道菌群与宿主和环境之间存在交集,且与各种神经和心理疾病存在关联。
肠道菌群失调和神经炎症是各种神经系统疾病病理生理学中一致的因素。在本文中,我们重点展示了肠道微生物群介导的氧化应激在神经退行性疾病中的作用,包括 ROS 产生机制的解释、大脑更容易受到氧化应激的原因以及肠道微生物代谢物如何影响氧化应激引起的大脑损伤,重点关注阿尔茨海默病、帕金森病、创伤性脑损伤。
——保护作用
虽然说肠道菌群在神经退行性疾病的病理学中发挥着作用,但肠道菌群也具有保护大脑免受损伤的潜力,一些细菌能够释放代谢物,这些代谢物转化自膳食纤维、多酚或宿主分子,如胆汁酸、类固醇激素等。此外,通过益生元调节肠道菌群的组成,可以增强神经恢复力。
益生菌的神经保护作用:实验室到临床的探索
肠道菌群的神经保护作用在最近的研究中已得到充分证实,从发酵食品中分离的 Lactobacillus buchneri KU200793菌株表现出较高的抗氧化活性,并且能够保护 SH-SY5Y 细胞免受有害物质 1-甲基-4-苯基吡啶 (MPP + ) 的侵害,表明其具有益生菌和神经保护作用。
同样,从德氏乳杆菌亚种Lactobacillus delbrueckii ssp. bulgaricusB3和 Lactobacillus plantarum GD2 中分离出的胞外多糖,展现出保护神经细胞免受阿尔茨海默相关毒性的能力。
热灭活的Rumnicoccus albus菌株在细胞和小鼠模型中显示出降低ROS水平和提高抗氧化酶(SOD和GSH)水平的能力。此外,植物乳杆菌MTCC1325在动物模型中显示出抗阿尔茨海默病的潜力,预防记忆缺陷。
总之,这些研究反映了肠道微生物群的良好作用、它们的抗氧化作用以及随后的神经保护作用。
氧化应激的微妙平衡
氧化应激是一种生物学现象,当细胞内的活性氧(ROS)水平超过抗氧化剂的防御能力时,就会发生。这种失衡可能会导致细胞内的氧化还原信号通路中断,进而引发一系列有害的生物效应,成为众多神经系统疾病的潜在推手。
ROS是怎么产生的?
有氧代谢中涉及的每个化学反应都会形成不稳定且短暂的反应性中间产物,即 ROS。
注:生物分子氧 (O2) 具有两个不成对电子,不能被完全还原,因此其不完全还原会形成高度亲电且短寿命的 ROS,如:H2O2、超氧化物阴离子、一氧化氮、过氧亚硝酸根阴离子、羟基、过氧化物自由基等。
ROS要么在正常细胞过程中通过ROS生成酶作为中间体产生,要么在药物、毒素和辐射等外源性因素存在下产生。
神经组织更容易产生ROS
与其他器官相比,神经组织因其高代谢率而更容易产生ROS。
线粒体,作为细胞的能量工厂,同时也是ROS生成的主要场所。在ATP生成的过程中,线粒体可能会产生超氧化物,这些超氧化物随后被转化为H2O2和O2。O2的量越多,超氧化物的形成越多,这进一步导致更多的 ROS,如 H2O2和羟基自由基等。
线粒体与神经元活动的紧密联系
线粒体 ROS 的产生与神经元活动密切相关。强烈的突触传递不仅能促进超氧化物的产生,而且这种产生还受到细胞内钙(Ca2+)水平的调节,线粒体 ROS 产生的增加也与线粒体膜电位的增加有关。
单胺氧化酶(MAO)与神经健康
线粒体外膜上有一种酶,叫单胺氧化酶(MAO),它在神经细胞的发育和功能中起着关键作用。MAO通过催化单胺的氧化脱氨,产生H2O2作为副产物,这在神经退行性疾病中可能起到重要作用。
注:MAO-A 主要存在于儿茶酚胺能神经元中,参与去甲肾上腺素和血清素的氧化,而 MAO-B 则特别表达于血清素能神经元和神经胶质细胞中,并氧化 β-苯乙胺。
一氧化氮合酶(NOS):神经信号与氧化应激的交汇点
一氧化氮合酶(NOS)是神经元中产生ROS的酶,也是脑内ROS的来源之一。它通过催化L-精氨酸的氧化,产生一氧化氮(NO),NO在调节突触传递和干扰氧化还原稳态中起着双重作用。
NADPH氧化酶(NOX):神经元活动的响应者
NADPH氧化酶(NOX)是另一种在神经组织中产生ROS的酶,也是脑内ROS的来源之一,在脑皮质和海马区域丰富。它在神经元活动中的作用表明,NOX可能参与了多种中枢神经系统疾病的进展,包括AD、PD、肌萎缩侧索硬化症 (ALS) 和亨廷顿氏病 (HD)等。
注:Ca2+是 NOX 的主要激活剂,导致酶复合物在神经元中定位于突触后,从而表明NOX 参与神经元活动。已报道 7 种 NOX 的同源物,即 NOX (1-5)、双氧化酶 DUOX (1 和 2),它们的大小和结构域不同,但主要参与 ROS 的生成。
先前的报道还揭示了线粒体 ROS 和 NOX-ROS 之间的协同关系,从而支持彼此的 ROS 生成。
因此,开发异构体选择性 NOX 抑制剂可能是治疗急性和慢性中枢神经系统疾病的一种有前途的治疗方法。
其他产ROS的酶
在细胞质中,非血红素铁酶(如脂氧合酶)在分子O2存在下催化花生四烯酸的过氧化,并产生超氧化物和羟基自由基。
细胞质中的许多其他酶,如黄嘌呤氧化酶、细胞色素 P450 单加氧酶、环氧酶、D-氨基氧化酶也是重要的ROS 产生者。
氧化应激通过介导脂质过氧化、蛋白质氧化和核酸损伤三种主要反应导致细胞损伤。
事实上,氧化应激是衰老过程中正常生理过程的一部分,但已知它与大脑慢性疾病有关,如阿尔茨海默病 (AD)、帕金森病 (PD)、HD、缺血性中风、抑郁症和硬化症。此外,它在生活方式相关的代谢紊乱中也起着重要作用,如 2 型糖尿病 (T2D)、非酒精性脂肪肝、非酒精性脂肪性肝炎、肥胖、心血管疾病和癌症。
Tips:生理状态下正常浓度ROS在脑中的作用
虽然高浓度的ROS是有害的,会导致生物分子损伤,从而引起多种细胞功能障碍,但在安全稳定的水平上,ROS其实是细胞生理功能中不可或缺的助手。
详情展开如下:
免疫反应的哨兵
在正常生理条件下,细胞外的ROS是先天免疫系统的得力助手,它们能够引发免疫反应,帮助身体抵御外来的感染。
细胞信号的激活者
细胞内产生的ROS也是信号通路的激活者,它们参与刺激细胞凋亡和增强细胞对氧化应激的防御能力。
NF-κB的触发器
ROS在激活核转录因子NF-κB方面扮演着重要角色,这一过程会引发炎症反应,进而可能引发氧化应激。
病原体的克星
次氯酸(HOCl)这样的自由基,由髓过氧化物酶在溶酶体中作用产生,是一种对抗病原体的强大氧化剂。
中枢神经系统的调控者
对于中枢神经系统,生理条件下许多反应产生的副产物ROS,不仅是细胞内信号转导途径的调节者,还参与调控细胞的增殖、分化和成熟。
促进神经发生
研究表明,ROS的产生和氧化还原平衡有助于前体神经元祖细胞向神经元的分化,以及轴突的形成,促进神经元在其微环境中的扩增。
影响信号级联
氧化还原信号,包括ROS,能够调节多种转录因子和信号分子的功能,影响神经发生的信号级联。
神经元兴奋性的调节者
ROS,如H2O2,能通过增强细胞内钙(Ca2+)信号来调节皮质神经元的兴奋性。
影响神经系统信号级联
氧化还原信号(ROS和氧化状态)还调节转录因子(如NF-κB)、活化T细胞的核因子和活化蛋白1(AP-1)以及酪氨酸磷酸化蛋白PKC的氧化还原状态的功能。
研究人员观察到 H2O2可增加皮质神经元和 PC12 细胞中 ERK 和 cAMP 反应元件结合蛋白 (CREB) 的磷酸化。
参与学习和记忆
ROS 在大脑的不同部位(如海马、大脑皮层、下丘脑、杏仁核和脊髓)充当第二信使,海马中的长期增强(LTP)被证实是必不可少的,而海马与哺乳动物的学习和记忆有关,因此表明 ROS 参与了突触增强。
参与疼痛调节
ROS还通过参与增加杏仁核中央核的兴奋性来影响疼痛相关行为,杏仁核是大脑中负责疼痛调节情绪方面的区域。同样,在脊髓中,与神经性疼痛和炎症疼痛相关的神经可塑性过程也受 ROS 作为信号分子的控制。
ROS在细胞生理中的作用是复杂而精细的。它们既是细胞健康的守护者,也是潜在的挑战者。了解ROS如何在不同生理条件下发挥作用,对于我们理解健康和疾病的机制至关重要。
(为何大脑更容易积累过量ROS,清除机制vs产生机制)
我们将从以下方面来阐述大脑易受氧化应激影响的因素:
Ca2+在神经细胞中的作用:在神经细胞中,动作电位引起的Ca2+瞬变对于维持神经元之间的连接强度(即双向突触可塑性)至关重要。
Ca2+稳态失调的影响:当细胞膜上的Ca2+通道功能受损,导致Ca2+流入过多时,细胞内的游离Ca2+浓度会异常增加。
激活有害酶类:这种高浓度的Ca2+会激活一些有害的酶,如神经一氧化氮合酶(NOS)、磷脂酶A2和钙蛋白,这些酶的活性增加可能导致细胞骨架的破坏。
NO的产生及其影响:NOS的激活会产生一氧化氮(NO),NO是一种信号分子,但高浓度时会对细胞产生负面影响。NO会与线粒体内的细胞色素C氧化酶结合,抑制线粒体的呼吸作用,影响能量产生。
形成有害物质:NO还可以与超氧阴离子(O2.– )反应生成过氧亚硝酸盐(ONOO–),这是一种强氧化剂,可以对细胞造成进一步的损害。
线粒体功能障碍:线粒体内的Ca2+超载会导致线粒体通透性转换孔(MPTP)开放,使得Ca2+和H2O2流出,这可能导致细胞坏死。
大脑易受氧化应激:由于上述过程,Ca2+的稳态失调会使大脑细胞更容易受到氧化应激的影响,氧化应激是指细胞内氧化剂和抗氧化剂之间的不平衡,可能导致细胞损伤。
谷氨酸的兴奋性作用:谷氨酸是一种主要的兴奋性神经递质,它在神经元之间的信号传递中起着关键作用。然而,当谷氨酸在细胞外环境中大量积累时,它可能导致神经细胞的损伤甚至死亡。
谷氨酸的毒性作用:谷氨酸的过量积累可以激活神经元上的谷氨酸受体,尤其是AMPA和NMDA受体。这些受体的激活会导致细胞内Ca2+和Na+的持续流入,引发所谓的“兴奋性毒性”。
注:AMPA和NMDA是两种类型的谷氨酸受体,它们在神经元之间的信号传递中起着关键作用。这些受体是离子通道受体,意味着它们不仅能够结合神经递质谷氨酸,还能够控制特定离子的流动,从而影响神经细胞的电活动。
AMPA受体:AMPA受体(α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体)是快速兴奋性突触后电流的主要介质。当谷氨酸结合到AMPA受体时,受体通道打开,允许Na+和K+离子通过,导致突触后膜的去极化,这是神经信号传递的一个重要步骤。AMPA受体的激活通常与快速的、短暂的信号传递相关。
NMDA受体:NMDA受体(N-甲基-D-天冬氨酸受体)是另一种类型的谷氨酸受体,它们在学习和记忆中起着重要作用。NMDA受体通道的开放需要谷氨酸的结合以及突触后膜的去极化(通常由AMPA受体的激活引起)。NMDA受体通道开放时,允许Ca2+和Na+离子进入细胞,同时也允许K+离子流出。Ca2+的流入可以激活多种细胞内信号途径,包括那些涉及长期增强(LTP)和长期抑制(LTD)的途径,这些都是学习和记忆的关键机制。
这两种受体在神经传递中的协同作用对于正常的脑功能至关重要,包括感知、运动控制、学习和记忆。然而,当这些受体过度激活时,它们也可能参与神经退行性疾病和神经损伤的过程,如兴奋性毒性。
反应性物质的形成:细胞内Ca2+的增加可以激活NOS,产生一氧化氮(NO),NO与超氧阴离子(O2–)反应生成过氧亚硝酸盐(ONOO–)。ONOO–是一种强氧化剂,可以对细胞造成损害。
谷氨酸合成酶的抑制:ONOO–等反应性物质可以使谷氨酸合成酶失活,这种酶负责将谷氨酸转化为谷氨酰胺,从而抑制了谷氨酸的代谢。
谷氨酸与半胱氨酸的交换受阻:谷氨酸还可以通过Xc-载体抑制细胞内谷氨酸与半胱氨酸的交换。半胱氨酸是合成谷胱甘肽(GSH)的关键成分。
主编解读:在细胞内,氨基酸不仅是蛋白质的构建块,还参与多种生物化学反应。谷氨酸(Glutamate)和半胱氨酸(Cysteine)是两种重要的氨基酸,它们在细胞内的水平受到严格调控。
谷氨酸与半胱氨酸的交换通常通过特定的转运蛋白(载体)进行,这些转运蛋白位于细胞膜上,负责将氨基酸从细胞外环境转运到细胞内。这种交换是双向的,意味着谷氨酸可以从细胞内转运到细胞外,同时半胱氨酸可以从细胞外转运到细胞内。
半胱氨酸是合成谷胱甘肽(Glutathione, GSH)的关键前体。谷胱甘肽是一种重要的抗氧化剂,对于保护细胞免受氧化应激的损害至关重要。因此,半胱氨酸的供应对于维持细胞内GSH的水平和细胞的抗氧化能力非常重要。
当谷氨酸与半胱氨酸的交换受阻时,意味着这种双向转运过程受到了干扰。这可能是由于转运蛋白的功能障碍、细胞外谷氨酸水平的异常升高(如在兴奋性毒性情况下),或者其他因素导致的细胞膜通透性的改变。
这种交换受阻可能导致细胞内半胱氨酸的供应不足,进而影响GSH的合成。GSH的减少会使细胞更容易受到氧化应激的影响,可能导致细胞损伤或死亡。在某些情况下,这种交换受阻还可能与特定的疾病状态或病理过程相关。
谷胱甘肽的耗竭与铁死亡:由于谷氨酸与半胱氨酸的交换受阻,导致细胞内GSH的耗竭。GSH的减少会使细胞更容易受到氧化应激的影响,并可能导致一种称为“铁死亡”的细胞死亡形式,这是一种由铁依赖的脂质过氧化驱动的细胞死亡。
总结来说,谷氨酸的过量积累通过激活神经元上的受体,导致细胞内Ca2+和Na+的持续流入,进而引发一系列的生物化学反应,包括反应性物质的形成、谷氨酸代谢的抑制、GSH的耗竭,最终可能导致神经元的损伤和死亡。这些过程表明,谷氨酸的稳态对于维持神经细胞的健康至关重要。
扩展阅读:
过渡金属离子,如铁(Fe2+)和铜(Cu+),在大脑中扮演着多重角色。它们不仅是许多酶的辅因子,参与能量代谢、抗氧化防御和神经递质的合成等多种生物化学过程,而且还与神经退行性疾病和脑损伤有关。
酶的辅因子:Fe2+和Cu+等过渡金属离子是许多酶的必要组成部分,这些酶参与细胞内的各种代谢过程。例如,铁是细胞色素c氧化酶和铁硫蛋白的组成部分,而铜是细胞色素c氧化酶和超氧化物歧化酶的组成部分。
自由基反应的催化剂:在某些情况下,过渡金属离子可以催化自由基反应,这些反应可以产生有害的氧化剂,如羟自由基(·OH)。自由基是不稳定的分子,它们可以损害细胞结构,包括脂质、蛋白质和DNA。
铁的持久存在:大脑中的铁主要以Fe2+的形式存在,它在脑脊液中的结合能力较低,这意味着铁离子可以在脑脊液中相对自由地移动,并且可能积累在某些区域。铁的积累与氧化应激和神经退行性疾病(如阿尔茨海默病和帕金森病)有关。
脑损伤的应激因素:在脑损伤或疾病状态下,细胞可能会释放更多的过渡金属离子。这些离子在细胞外环境中可能催化自由基的产生,导致进一步的细胞损伤。
总结来说,过渡金属离子在大脑中的正常功能对于维持神经细胞的健康至关重要。然而,当这些离子在细胞外环境中过度积累或以不适当的形式存在时,它们可能成为氧化应激和细胞损伤的催化剂。因此,维持大脑中过渡金属离子的稳态对于预防神经退行性疾病和脑损伤具有重要意义。
神经递质的自动氧化:多巴胺、5-羟色胺和去甲肾上腺素等神经递质在有氧条件下可以发生自动氧化反应。这些反应涉及神经递质与氧气之间的化学反应,产生活性氧(ROS),如超氧阴离子(O2–)和羟自由基(·OH)。
多巴胺的自动氧化过程:多巴胺与氧气反应首先生成半醌(一种不稳定的中间产物)和超氧阴离子(O2–)。半醌可以进一步与氧气反应生成醌。醌是一种氧化产物,它可以被氧气重新氧化为醌醇和过氧化氢(H2O2)。
线粒体和溶酶体功能障碍:ROS的积累可以导致线粒体和溶酶体的功能障碍。线粒体是细胞的能量工厂,而溶酶体是细胞的“消化系统”,负责分解和回收细胞内的废物。这些细胞器的功能障碍可能导致细胞能量代谢的紊乱和细胞内废物的积累。
总结来说,神经递质的自动氧化是一个产生ROS的过程,这些ROS可以对细胞造成损害,特别是通过损害线粒体和溶酶体的功能。这种损害可能与多种神经退行性疾病有关,包括帕金森病和阿尔茨海默病。因此,控制神经递质的自动氧化和ROS的产生对于维持神经细胞的健康至关重要。
大脑对葡萄糖的依赖:大脑是身体中对葡萄糖依赖性最高的器官之一。葡萄糖不仅是大脑的主要能量来源,还参与多种代谢途径和信号传导过程。
糖醇磷酸途径:糖醇磷酸途径(Glycolysis)是葡萄糖分解代谢的第一步,产生能量和中间代谢产物。磷酸果糖激酶(Phosphofructokinase, PFK)是糖醇磷酸途径中的一个关键酶,它控制着糖酵解的速率。
神经元降解磷酸果糖激酶:在某些情况下,神经元可能会降解磷酸果糖激酶,这可能导致糖酵解速率的降低。糖酵解速率的降低意味着葡萄糖的利用效率下降。
蛋白质糖基化和AGE的形成:糖酵解速率的降低可能导致葡萄糖在细胞内的积累。过量的葡萄糖可以非酶促地与蛋白质发生反应,形成糖基化产物,最终生成高级糖基化终产物(Advanced Glycation End Products, AGE)。
AGE的损害作用:AGE可以与细胞内的AGE受体结合,引发炎症反应和氧化应激。这种氧化应激可以损害蛋白质和线粒体的功能。线粒体是细胞的能量工厂,其功能障碍可能导致细胞能量代谢的紊乱。
炎症性氧化应激:AGE诱导的炎症性氧化应激可能导致细胞内氧化剂和抗氧化剂之间的不平衡,进一步加剧细胞损伤。
Tips:以上总结就是葡萄糖诱导的氧化应激涉及糖酵解速率的降低、蛋白质糖基化和AGE的形成,以及由此引发的炎症性氧化应激。这些过程可能导致蛋白质和线粒体功能的损害,从而影响神经细胞的健康。因此,维持适当的糖酵解速率和控制AGE的形成对于预防神经退行性疾病和脑损伤具有重要意义。
大脑中的多不饱和脂肪酸:大脑富含多不饱和脂肪酸,特别是二十碳五烯酸(Docosahexaenoic Acid, DHA)。DHA是构成神经细胞膜的重要成分,对于维持神经细胞的结构和功能至关重要。
氧化应激的影响:多不饱和脂肪酸由于其化学结构中的多个双键,容易受到氧化应激的影响。氧化应激可以引发脂质过氧化反应,导致脂肪酸的氧化和损伤。
脂质过氧化和信号传导:脂质过氧化产物可以参与脑部的信号传导过程。然而,这些过氧化产物也可能对神经细胞产生负面影响,包括细胞膜的损伤和细胞功能的紊乱。
4-羟基壬酸醛的神经毒性:脂质过氧化产物之一,4-羟基壬酸醛(4-Hydroxynonenal, 4-HNE),可以通过提高细胞内Ca2+水平使谷氨酸转运体失活,从而具有神经毒性。谷氨酸转运体的失活可能导致谷氨酸的积累,引发兴奋性毒性。
α-酮戊二酸脱氢酶的失活:脂质过氧化物还可以使α-酮戊二酸脱氢酶(α-Ketoglutarate Dehydrogenase)失活,这是一种参与三羧酸循环(TCA循环)的酶。该酶的失活可能导致能量代谢的紊乱。
血管收缩作用和蛋白酶体的破坏:脂质过氧化物具有血管收缩作用,可能导致脑血流的减少。此外,它们还可以破坏蛋白酶体,这是一种负责蛋白质降解的细胞器,其功能障碍可能导致细胞内废物的积累。
脂质过氧化物在多种神经退行性疾病,如阿尔茨海默病中起着持续的作用。这些疾病的特点是神经细胞的进行性损伤和死亡。
大脑中多不饱和脂肪酸的易感性使得神经细胞更容易受到氧化应激的影响。脂质过氧化产物如4-HNE可以通过多种机制对神经细胞产生负面影响,包括神经毒性、能量代谢的紊乱、血管收缩和蛋白酶体的破坏。这些过程可能与神经退行性疾病的病理机制有关。
微胶质细胞的角色:微胶质细胞(Microglia)是大脑和脊髓中的常驻免疫细胞,它们在维持大脑的正常功能和发育中起着关键作用。微胶质细胞参与多种生理过程,包括神经保护、突触修剪、炎症反应和组织修复。
吞噬活动和反应性物质的产生:在正常的吞噬活动中,微胶质细胞可以清除死亡的细胞碎片和外来的病原体。在这个过程中,微胶质细胞产生超氧阴离子(O2–)和其他反应性物质,这些物质在清除病原体和受损细胞中起着重要作用。
NOX-2酶的作用:NOX-2(NADPH氧化酶2)是一种酶,它在微胶质细胞中产生O2–。NOX-2的激活可以增加O2–的产生,这是微胶质细胞应对损伤和感染的一种防御机制。
氧气生物可用性与微胶质细胞活性:微胶质细胞的活性取决于总的氧气生物可用性。在损伤或疾病状态下,微胶质细胞可能通过消耗更多的氧气来产生更多的O2–,这可能导致局部氧浓度的降低。
反应性物质与突触损伤:H2O2和NO等反应性物质在损伤部位吸引微胶质细胞,这些物质可以引发局部炎症反应。炎症反应可能导致突触的损伤,这是神经退行性疾病中的一个关键过程。
神经退行性的推动:微胶质细胞的过度激活和炎症反应可能推动神经退行性过程。在某些情况下,微胶质细胞的持续激活可能导致神经细胞的损伤和死亡,这是多种神经退行性疾病的共同特征。
一句话总结就是微胶质细胞在大脑中扮演着多重角色,包括免疫防御、吞噬活动和炎症反应。然而,微胶质细胞的过度激活和炎症反应可能导致神经细胞的损伤和神经退行性疾病的进展。因此,平衡微胶质细胞的活性对于维持大脑健康和预防神经退行性疾病至关重要。
大脑抗氧化防御系统的脆弱性:大脑是一个高代谢活跃的器官,对氧气的需求很高,因此容易受到氧化应激的影响。与其他组织相比,大脑的抗氧化防御系统相对较弱,这使得大脑更容易出现氧化还原稳态的紊乱。
过氧化氢酶的含量:过氧化氢酶(Catalase)是一种重要的抗氧化酶,它能够分解过氧化氢(H2O2)为水和氧气。神经元中的过氧化氢酶含量比肝细胞中的低得多,这可能是因为神经元对H2O2的处理能力较弱。
过氧化物酶体的限制:过氧化氢酶主要存在于过氧化物酶体中,这是一种细胞器,专门负责处理过氧化氢和其他有害物质。然而,过氧化物酶体的存在限制了过氧化氢酶的活性,使其无法作用于其他亚细胞区室(如线粒体和细胞质)产生的H2O2。
谷胱甘肽的含量:谷胱甘肽(Glutathione, GSH)是一种重要的细胞内抗氧化剂,它能够清除自由基并参与亲电子物质的代谢。神经元中的GSH含量非常低,这使得它们更容易受到氧化应激的影响,并且难以代谢亲电子物质。
铁死亡的风险:铁死亡是一种由铁依赖的脂质过氧化驱动的细胞死亡形式。神经元中GSH的低含量可能增加它们发生铁死亡的风险,这是一种与多种神经退行性疾病相关的细胞死亡机制。
总结来说,大脑的抗氧化防御系统相对脆弱,这使得神经元更容易受到氧化应激的影响。过氧化氢酶和谷胱甘肽的低含量限制了神经元处理氧化应激的能力,可能导致氧化还原稳态的紊乱和细胞损伤。
血红蛋白与H2O2的反应:血红蛋白(Hemoglobin)是红细胞中的一种蛋白质,负责携带氧气。当血红蛋白与过量的过氧化氢(H2O2)反应时,它可以释放出铁离子(Fe2+)和血红素(Heme)。这些产物可以参与进一步的化学反应,产生有害的过氧化物。
血红蛋白的氧化:在氧化应激条件下,血红蛋白可以被过氧化氢(H2O2)或其他氧化剂氧化。这种氧化过程可以破坏血红蛋白的结构,导致其携氧能力下降。
铁离子的释放:血红蛋白的氧化可以导致铁离子(Fe2+)从血红蛋白中释放出来。这些游离的铁离子可以参与Fenton反应,即铁离子与H2O2反应生成羟自由基(·OH)。羟自由基是一种强氧化剂,可以对细胞造成广泛损害。
血红素的释放:血红蛋白的氧化还可以导致血红素的释放。血红素是一种铁卟啉化合物,它是血红蛋白的活性部分。血红素可以催化脂质过氧化反应,导致细胞膜的损伤。
脂质过氧化:血红素可以催化不饱和脂肪酸的过氧化反应,生成脂质过氧化物。这些过氧化物可以进一步分解产生更多的自由基,加剧氧化应激。
血管收缩:血红素还可以与一氧化氮(NO)结合,形成复合物。这种复合物可能导致血管收缩,影响脑血流和氧气供应。
因此,控制血红蛋白与H2O2的反应对于预防神经毒性和维持大脑健康具有重要意义。
CYP2E1(Cytochrome P450 2E1)是一种属于细胞色素 P450 酶家族的酶。细胞色素 P450 酶是一组含有血红素(铁卟啉)的酶,它们在许多生物体内参与多种化合物的氧化代谢。CYP2E1 主要存在于肝脏中,但它也在其他组织中表达,包括大脑。
CYP2E1 的主要功能是催化小分子化合物的氧化反应,包括乙醇、某些药物、致癌物和其他外源性物质。这些反应通常涉及将分子中的氢原子移除,并添加一个氧原子,从而使化合物更容易被进一步代谢或排出体外。
CYP2E1 酶的角色:CYP2E1(Cytochrome P450 2E1)是一种存在于肝脏和其他组织中的酶,包括大脑。它参与多种代谢过程,包括小分子(如乙醇、某些药物和致癌物)的氧化代谢。
电子泄漏与氧化应激:CYP2E1 在催化反应时可能会发生电子泄漏,这意味着在代谢过程中,它可能会产生超氧阴离子(O2–)和其他活性氧(ROS)。这些 ROS 是高度反应性的分子,可以导致氧化应激,即细胞内氧化剂和抗氧化剂之间的不平衡。
大脑中的 CYP2E1:虽然大脑中含有低水平的细胞色素 P450 酶,但 CYP2E1 的存在使得大脑在代谢过程中容易受到氧化应激的影响。大脑中的 CYP2E1 活性可能导致神经细胞的损伤。
饮酒和吸烟的影响:研究表明,CYP2E1 的水平可能会因饮酒和吸烟而增加。这是因为乙醇和其他烟草中的化合物可以诱导 CYP2E1 的表达和活性。CYP2E1 的增加可能导致更多的 ROS 产生,从而加剧氧化应激。
总结来说,DNA 修复酶如 PARP-1 在修复 DNA 损伤中起着关键作用,但它们的过度激活可能导致 NAD+ 的消耗和能量产生的限制,以及可能通过 TRPM2 通道导致细胞内 Ca2+ 浓度的增加,从而导致神经元细胞死亡。
DNA 修复酶的角色:DNA 修复酶是一类酶,它们在细胞内负责修复 DNA 分子的损伤。这些损伤可能由多种因素引起,包括氧化应激、紫外线辐射、化学物质和复制错误。
PARP-1 的功能:聚 ADP 核糖聚合酶 (PARP-1) 是一种重要的 DNA 修复酶。当 DNA 发生单链断裂时,PARP-1 会被激活。它通过裂解烟酰胺腺嘌呤二核苷酸 (NAD+) 并将 ADP 核糖部分转移到核蛋白上,从而启动 DNA 修复过程。
PARP-1 的过度激活:在严重的 DNA 损伤或氧化应激条件下,PARP-1 可能会过度激活。这种过度激活会导致大量的 NAD+ 消耗,因为 NAD+ 是 PARP-1 活性所必需的底物。
因此,平衡 PARP-1 的活性对于维持细胞健康和预防神经退行性疾病具有重要意义。
RNA 的易感性:RNA 是单链分子,不像 DNA 那样有双螺旋结构和组蛋白的保护。因此,RNA 更容易受到氧化应激的影响。氧化应激可以导致 RNA 分子中的核糖和碱基发生氧化损伤。
氧化的 RNA 的影响:氧化的 RNA 可能会阻止核糖体合成蛋白质。核糖体是细胞内的蛋白质合成工厂,它们通过读取 RNA 分子上的遗传信息来合成蛋白质。如果 RNA 被氧化,其结构可能会改变,导致核糖体无法正确读取遗传信息,从而影响蛋白质的合成。
蛋白质合成异常:如果 RNA 的氧化损伤未得到修复,可能会导致合成的蛋白质未折叠或截短。未折叠或截短的蛋白质可能无法正常执行其功能,甚至可能形成有害的蛋白质聚集体,这在多种神经退行性疾病中是一个关键的病理特征。
氧化的 RNA 与氧化还原活性过渡金属(如铁和铜)一起可以催化 Fenton 反应。Fenton 反应是一种产生羟自由基(·OH)的化学反应,羟自由基是一种强氧化剂,可以对细胞造成广泛损害。
此外,超氧化物歧化酶(SOD)是一种重要的抗氧化酶,能够将超如果氧阴离子(O2–)转化为过氧化氢(H2O2)。铜锌超氧化物歧化酶(CuZn-SOD)的 mRNA 被氧化,可能是肌萎缩侧索硬化症(ALS)的临床前征兆。ALS 是一种神经退行性疾病,其特点是运动神经元的进行性退化和死亡。
注意,尽管神经退行性疾病中氧化的 RNA 在神经退行性疾病中的作用已经引起了关注,但其确切的作用机制和重要性仍需要进一步的研究。
胃肠道 (GI) 包含数万亿共生微生物和约 200-2000左右个物种,它们在维持膜屏障功能方面发挥着重要作用。这些微生物是肠道内的永久居民,参与宿主生物体内分子的不断流动,从而调节各种代谢功能。
人在出生后两年内,宿主胃肠道中的微生物群就会稳定下来,但它们的组成因个体而异,并且会根据年龄、健康、遗传和生活方式等外界因素而改变。胃肠道的腔侧暴露于饮食成分和肠道微生物群,此外,70% 的免疫细胞位于肠道组织,并由连接肠道和大脑的神经元支配,涉及肠道和大脑之间的持续沟通。
肠道微生物群与大脑之间的沟通主要涉及四条途径;
1、神经高速公路——迷走神经
第一种重要模式包括激活迷走神经,迷走神经连接胃肠道的肌肉层和粘膜层与脑干。最近研究显示,肠道病原体和益生菌通过激活迷走神经元改变大脑中的 γ-氨基丁酸 (GABA)、色氨酸、催产素和脑源性神经营养因子 (BDNF) 信号,从而调节宿主的焦虑、进食和抑郁等行为。
2、肠嗜铬细胞释放的血清素影响大脑
直接或间接影响大脑活动的通讯途径涉及通过肠道内壁的肠嗜铬细胞 (EC) 释放的血清素发出信号。一项研究表明,在用益生菌双歧杆菌治疗抑郁症小鼠模型时,其血清素和血清素前体水平会增加,从而改善其抑郁状态。同样,据报道,产芽孢细菌(梭菌属)的代谢物能够刺激 EC 产生血清素。
3、肠道菌群通过小胶质细胞介导对神经系统的调节
肠道菌群在小胶质细胞的发育、成熟和激活中起着至关重要的作用。在一项研究中,据报道,无菌 (GF) 小鼠携带的未成熟小胶质细胞数量比传统小鼠多,而且用双歧杆菌治疗时,可通过转录激活小胶质细胞。在行为和神经退行性疾病 (NDD) 中观察到小胶质细胞功能的变化,表明肠道微生物群通过小胶质细胞介导对 NDD 的影响。肠道微生物群还通过全身免疫系统(即细胞因子和趋化因子)影响神经系统。研究表明,与传统小鼠相比,GF 小鼠的血脑屏障 (BBB) 通透性更大,因此大脑更容易接触微生物产物,进而导致神经病理学状况。
4、肠道菌群传递化学信号
肠道微生物群通过直接向大脑传递化学信号进行交流。例如,肠道细菌发酵膳食纤维会产生短链脂肪酸 (SCFA),已被证明可以调节中枢神经系统的神经可塑性,还可以改善小鼠的抑郁行为。此外,肠道微生物群如拟杆菌、双歧杆菌、副拟杆菌、大肠杆菌属。能够产生神经递质 GABA,这表明肠道微生物群调节宿主生物体神经递质的浓度。
人体肠道内定植着四种主要的共生菌门,包括厚壁菌门、拟杆菌门、放线菌门、变形菌门。肠道中的共生菌和致病菌都能通过调节线粒体活性来改变细胞的 ROS。
共生菌产生甲酰化肽,这些肽与巨噬细胞和中性粒细胞上的 G 蛋白偶联受体 (GPCR) 结合,从而引发上皮细胞炎症。该过程导致 NOX-1 产生超氧化物,从而增加细胞的 ROS。
肠道乳酸杆菌和双歧杆菌具有将硝酸盐和亚硝酸盐转化为 NO 的能力,使肠道上皮成为 NO 的丰富来源。类似地,链球菌和杆菌利用 NOS 从 L-精氨酸产生 NO。
低浓度NO→保护;高浓度NO→有害
纳摩尔浓度的 NO 具有神经保护作用,是去甲肾上腺素能、非胆碱能肠道神经元的神经递质。而在较高浓度下,它会导致产生活性氧和氮物质 (RONS)(如超氧化物和 H2O2)而引起的有害影响,这进一步形成高活性羟基自由基,使其与神经炎症、轴突变性和神经退行性疾病相关。
肠道细菌产生的有益代谢物(如 SCFA)有助于通过影响线粒体活动来降低 ROS。这个后面章节详细讨论。
MAMPs维持微生物结构功能,影响大脑发育与炎症反应
膜相关分子模式 (MAMP) 维持着所有微生物类别的结构完整性和基本功能,甚至大脑也能检测到。这些是不同的化学基团,包括肽、核苷酸、碳水化合物和脂质。当宿主无法检测到此类分子模式时,它可能伴有急性到慢性炎症,并被发现会改变大脑的发育和功能。这些高度保守的结构基序与先天免疫系统细胞上的模式识别受体 (PRR) 结合,从而诱导线粒体 ROS 的产生和 NF-κB 通路的激活,导致炎症反应,引起神经元应激和细胞死亡。
在最近的一项研究中,据报道,细菌细胞壁成分肽聚糖易位到发育中的大脑,影响基因表达并导致社会行为的改变。同样,革兰氏阴性细菌细胞壁中的脂多糖被发现会损害小鼠的胎儿大脑发育、急性抑郁和认知障碍。此外,在 PD、自闭症谱系障碍 (ASD) 和突触核蛋白病模型中,急性和慢性暴露于 MAMP 是导致疾病症状的一个因素。
机会性病原体产生的细菌毒素,也对神经系统产生负面影响
发现梭菌属(Clostridium )产生的致命毒素,如毒素 B、肠毒素和ε 毒素,可降低神经元活力,并通过破坏的 BBB到达大脑,抑制神经递质的释放。
葡萄球菌属(Staphylococcus)和芽孢杆菌属(Bacillus)产生的肠毒素和麦芽孢杆菌素可通过刺激迷走神经引起呕吐和疾病行为。
沙门氏菌和大肠杆菌等致病菌能够降解含硫氨基酸,从而在肠道中产生硫化氢 (H2S) 。H2S水平的升高会引起各种代谢活动的变化,如乳酸增加和ATP生成减少、环氧合酶2 (COX-2)活性抑制、线粒体对O2的消耗减少、促炎细胞因子表达增加,并且已知会刺激高血压和神经炎症。
肠道菌群介导的氧化应激在神经退行性病变中的作用
doi: 10.1016/j.jare.2021.09.005
神经退行性疾病(如阿尔茨海默病和帕金森病)的病因病理涉及神经细胞内蛋白质错误折叠及其聚集,氧化应激也被认为是其病理因素之一。发现帕金森患者的肠道中肌间神经丛(Auerbach丛)和粘膜下神经丛(Meissner丛)存在α-突触核蛋白的聚集,暗示了肠道菌群在启动肠道α-突触核蛋白聚集中的作用,然后通过跨突触途径向上影响中枢神经系统神经元导致神经退行性变化。
阿尔茨海默病:全球性的健康挑战
阿尔茨海默病 (AD) 是导致痴呆的主要原因,影响着全球超过 5000 万人口,其中老年人群的发病率更高,85 岁以上每 1000 人中约有 80 人患有该病。阿尔茨海默病的无症状病理学在记忆力减退和认知障碍等症状出现前约20年就开始了。
病理变化:蛋白质的异常积累
与阿尔茨海默相关的脑病理变化包括蛋白质淀粉样β蛋白 (Aβ-淀粉样斑块) 的细胞外积累和 tau 蛋白 (tau 缠结) 的细胞内积累。这种异常的蛋白质积累导致小胶质细胞被激活以清除 Aβ 和 tau 蛋白,但随着随后的衰老,会发生慢性炎症,引起神经元细胞死亡,从而导致萎缩。
氧化应激:阿尔茨海默的潜在危险因素
在可能的危险因素中,氧化应激和肠道微生物群的作用引起了科学界的关注,并被认为是神经退行性过程的直接可能后果。
许多研究表明,阿尔茨海默病患者大脑的抗氧化防御系统发生了变化,即超氧化物歧化酶和过氧化氢酶的活性和水平降低。同时,氧化应激生物标志物(如丙二醛、4-羟基壬烯醛和F2-异前列腺素、蛋白质羰基、3-硝基酪氨酸、8-羟基脱氧鸟苷)在血液和脑脊液中含量较高,这些物质的浓度与认知障碍和脑重量成正比。
阿尔茨海默症脑内ROS的产生还表现为细胞器功能障碍,如线粒体(细胞色素C氧化酶缺乏)、未折叠蛋白反应 (UPR) 引起的内质网、神经斑块中金属离子的积累以及小胶质细胞的过度活化和随后的NADPH氧化酶的过度表达。
Aβ沉积和氧化应激之间也存在相互关系
即Aβ聚集会诱导氧化应激(也存在于线粒体、内质网和高尔基体等细胞器中),而氧化应激会诱导Aβ积累。甚至,神经元中tau蛋白的聚集会导致NADH-泛醌还原酶活性降低,从而导致ROS生成增加和线粒体功能障碍。
肠道菌群失调→炎症→神经退行性病变
最近的事实和数据显示,阿尔茨海默不仅是局限性脑炎症的结果,也是外周炎症的结果。肠道菌群失调会导致炎症,而炎症会随着年龄的增长而增加,血脑屏障被破坏,免疫系统被激活,随后出现神经退行性病变,另一方面,健康均衡的肠道有助于减少 ROS 产生的有害影响。
共生菌减少,致病菌增加
已发现患有阿尔茨海默的个体体内共生菌如双歧杆菌和厚壁菌数量减少,大肠杆菌、志贺氏菌和拟杆菌数量增加,随后出现炎症和 Aβ 积累增加。
肠道菌群变化与阿尔茨海默病严重程度的关联
同样,在 APP/PS1 小鼠模型中,当用广谱抗生素联合治疗时,Aβ 斑块形成也减少。5xFAD 小鼠阿尔茨海默模型显示微生物群向促炎物种转变,同时氨基酸分解代谢也发生变化,相反,抗生素治疗可逆转这种影响,这表明疾病的严重程度和肠道菌群转化之间可能存在联系。
Toll样受体激活与肠道屏障紊乱
肠道中形成的微生物淀粉样蛋白激活 Toll 样受体 (TLR),分化簇 14 (CD14) 促进免疫反应,导致被忽视的错误折叠 Aβ 和 Aβ 清除受损,随后细胞因子产生增加,导致肠道和血脑屏障紊乱。此外,研究还表明,阿尔茨海默患者的肠道激素水平下降,相反,肠道微生物代谢物如 H2S 和三甲胺增加。
与年龄有关的肠道微生物多样性下降
研究表明,随着年龄的增长,双歧杆菌属减少,变形菌增加,痴呆症不是由于 SCFA 减少而是由于脂质代谢受到干扰。双歧杆菌在调节胆固醇水平方面发挥着重要作用,直接促进胆固醇通过粪便排出,间接通过增加血清瘦素水平,从而参与维持海马可塑性和记忆功能。
肠道菌群影响神经递质
肠道细菌如乳酸杆菌和双歧杆菌会代谢抑制性神经递质 GABA。一项研究发现,在 APPSwe/PSEN1DeltaE9 双基因 (人类早老素(DeltaE9)和人鼠淀粉样前蛋白(APPswe)融合体阿尔茨海默小鼠模型中,海马突触可塑性发生了改变,其中发现 GABA 生成减少,同时谷氨酸能神经传递增加。虽然有报道显示蓝藻门太高会产生导致认知障碍的神经毒素,但尚未观察到与阿尔茨海默的关系。
淀粉样蛋白的交叉播种机制
另一个可能的连接环节是脑淀粉样蛋白的积累和肠道微生物群,涉及微生物淀粉样蛋白的交叉播种机制,其方式类似于朊病毒的传播,因此形成的不同淀粉样蛋白构象体在其细胞靶标中诱导不同水平的毒性,推测存在阿尔茨海默表型。
口腔菌群与阿尔茨海默
除了肠道微生物群外,还研究了口腔共生菌与阿尔茨海默之间的联系。有趣的是,口腔卫生不良和牙齿脱落会增加阿尔茨海默早期发病的风险。
关于口腔菌群与神经系统疾病的关联,详见:
帕金森病 (PD) 的病理特征是多巴胺能神经元的进行性退化、磷酸化蛋白 α-突触核蛋白的聚集、过量 ROS 产生、线粒体功能障碍和小胶质细胞活化。其症状特征是患者无法控制自主运动(震颤、肌肉僵硬、行走困难和驼背姿势),这是由于大脑的黑质和纹状体区域受损所致。
它是第二常见的神经退行性疾病 (NDD),影响全球超过 1% 的老年人口。
关于肠道与帕金森病之间的关系的第一份报告出现在1817年詹姆斯·帕金森的一篇关于震颤麻痹的文章中。
注:詹姆斯·帕金森,我们所说的描述帕金森病的这位前辈,全名是“James William Keys Parkinson”。1817年,62岁的James Parkinson发表了论文“An Essay on the Shaking Palsy”,在文中,详细地描述了六例被其称为患有“震颤麻痹”的患者,在论文中他注意到了患者不适,像被无法逃脱的魔鬼所控制。他对这种疾病的描述,很多都被现在的医学观察所承认:不自主震颤的同时还有肌肉乏力,即使在被支撑时也不能缓解;身体前驱,不能刹车,越走越快甚至要小跑起来;感觉和智能几乎不受影响…..
肠道病理与帕金森病的联系
后来的研究支持了这一观点,表明了病理过程是从肠道开始,然后影响大脑。越来越多的证据显示,帕金森病患者常见的特征包括肠道炎症、磷酸化α-突触核的早期积累导致跨过迷走神经的腹背侧运动神经元、便秘问题和肠道通透性增加,这表明了肠道菌群与帕金森病发病机制之间的密切关系。
接受迷走神经切断手术的个体患帕金森病的风险降低,这进一步支持了肠道与PD之间的联系。
氧化应激与神经元损伤
较低水平的谷胱甘肽(GSH)和较高水平的铁和H2O2使黑质致密部 (SNc) 神经元易受氧化应激。而且,该区域的脂质过氧化和多巴胺氧化会导致神经元细胞死亡。研究还表明,线粒体呼吸链功能障碍会导致过量的 ROS 产生。
相关病理与细胞毒性
复合物 1 的抑制剂会对多巴胺神经元产生细胞毒性作用,这一事实也支持了这一观点,患有 α-突触核蛋白、磷酸酶和张力蛋白同源物 (PTEN) 诱导的假定激酶 1 (PINK1) 和 Parkin 病理的患者被检测到患有线粒体功能障碍和氧化应激增加。
异常蛋白聚集与肠道微生物群
与 AD 类似,异常蛋白质 α-突触核蛋白的聚集与氧化应激增加相关,反之亦然。谈到肠道微生物群的作用,一些致病菌会释放毒素,导致肠道和肠神经系统 (ENS)细胞的线粒体功能障碍,从而导致神经退行性。
肠道致病菌及其产物参与发病
帕金森病患者肠道中的致病菌增加及其微生物产物直接参与帕金森病的发病机制。为了支持这一事实,最近有报道称,大肠杆菌会产生一种名为 curli 的淀粉样蛋白,这种蛋白会促进 α-突触核蛋白在肠道和大脑中的聚集,会导致小鼠的运动障碍。
另一方面,当小鼠接受肠道限制性淀粉样蛋白抑制剂治疗时,小鼠的运动功能得到改善,便秘也得到改善,表明肠道与 PD 症状的病因有关。
克罗恩病与帕金森病共病风险高
肠道细菌引起的肠道炎症与 PD 中的进行性神经退行性病变直接相关。虽然 PD 患者的血清代谢谱和肠道成分发生了改变,但研究发现,在严重的 PD 情况下,肠道中的肠杆菌科细菌水平会增强,而抗炎细菌水平却非常低,这也表明它与克罗恩病的肠道炎症具有平行关联。这表明克罗恩病患者患 PD 的风险非常高。
同样,研究发现,在PINK1基因敲除小鼠模型中,柠檬酸杆菌(Citrobacter rodentium)感染会通过诱发肠道炎症加重 PD 症状。
肠道菌群代谢物影响PD药物疗效
除了诱发炎症之外,肠道菌群还会发挥代谢作用,例如,在 PD 患者中,其代谢物 β-葡萄糖醛酸、色氨酸和 SCFA 会发生改变。
肠道菌群的一个显著特性是,它能够通过降低抗 帕金森药物的生物利用度或增加药物失活来降低其疗效,就像在标准左旋多巴治疗中的那样。
H2饱和水对PD症状的改善
在这些研究中,还发现肠道细菌产生H2的减少是导致 PD 的因素之一。
当向患PD大鼠和 MPTP 小鼠模型提供 50% H2饱和水时,发现它能够成功减少黑质中的神经元丢失以及氧化应激标志物,当在人体中进行双盲随机试验时,PD患者的运动评分有所改善。
肠道菌群参与帕金森病的证据
此外,针对这一观点,最近对过表达人类 α-突触核蛋白基因的 GF 小鼠 PD 模型的研究表明,SCFA 水平降低,小胶质细胞活化减少,运动功能改善,这表明肠道菌群直接参与了增强 PD。
当将 PD 患者的肠道菌群移植到无菌α-突触核蛋白过表达的小鼠模型中时,运动症状恶化,表明肠道菌群功能失调在 PD 患者中起着作用。同样,用神经毒素治疗的小鼠模型显示肠道菌群组成发生改变,致病性肠杆菌科细菌水平升高。
一些特定的细菌物种,如奇异变形杆菌(Proteus mirabilis)发现能促进小鼠的神经退行性病变。综合起来,这些研究表明,肠道微生物群加剧了人类和动物帕金森病模型中的神经元功能障碍和神经炎症。
注:奇异变形杆菌(Proteus mirabilis, PM)是革兰阴性细菌,属于肠杆菌科。在自然界中广泛存在,具有特殊的群集运动能力,可促进结石形成,在导管、泌尿系上皮中形成结晶生物膜,是引起感染的重要病原。
创伤性脑损伤 (TBI) 是世界范围内最常见的损伤类型之一,是导致死亡和残疾的主要原因之一。
TBI的广泛影响
TBI 造成的残疾不仅包括脑的原发性机械损伤,还包括损伤后的继发性损伤,这种损伤发生在细胞和分子水平,可能导致代谢异常,如线粒体功能障碍、氧化应激、炎症、小胶质细胞活化、兴奋性毒性,从而造成暂时或终身的认知障碍。TBI 的严重程度不仅集中在大脑上,还可能造成多器官损伤,是一种异质性病理生物学状况。
TBI的治疗现状
由于脑损伤的异质性,针对 TBI 引起的神经病理学的治疗方法仍然缺乏,需要考虑新的治疗方案。针对这一问题,肠道益生疗法因其能够恢复肠道菌群失调和 TBI 之间的双面关系而受到广泛关注。
肠道微生物群与 TBI 损伤之间存在双向关系
TBI 的全身表现之一是肠道蠕动和通透性紊乱、粘膜损伤、肠绒毛组织病理学改变,这表明肠道微生物群组成受到干扰。
最近的报告显示,暴露于轻度反复性脑损伤 20 天的小鼠会逐渐出现白质损伤、认知能力下降和轻度、短暂性的肠道菌群失调。
肠道菌群失调也会影响创伤性中枢神经系统损伤的病理生理、血脑屏障通透性改变和小胶质细胞激活,导致严重后果。
研究发现,在脑损伤之前和之后,小鼠 TBI 模型中的肠道菌群耗尽会导致海马 CA1 区神经元密度增加、联想学习障碍减轻以及病变体积缩小。
TBI中肠道菌群的变化
最近的研究还表明,脊髓创伤后会出现肠道菌群失调,导致椎管内炎症和病变病理。
肠道菌群在TBI恢复中的作用
最近的一项研究指出,在 TBI 之前、期间和之后,广谱抗生素引起的肠道菌群失调会导致神经元丢失增加、神经发生受到抑制以及小胶质细胞和外周免疫反应发生改变,同时恐惧记忆反应也会发生调节。
因此,肠道菌群对 TBI 患者的影响具有至关重要的临床意义,因为 TBI 患者由于定期使用抗生素和长期住院,肠道菌群容易发生改变。此外,检测肠道菌群调节可能为识别 TBI 严重程度提供诊断工具,从而提供有针对性的治疗方法。
中枢神经系统与氧化应激
中枢神经系统极易受到氧化应激的影响,并导致神经系统疾病。由于高 O2需求和过氧化敏感脂质细胞的涌入,中枢神经系统运作期间会产生高水平的 ROS。这种氧化代谢产生活性物质,用于传递氧化还原信号以调节突触可塑性等关键功能。
抗氧化剂(无论是酶促还是非酶促、内源性还是外源性)通过阻止 ROS 的产生或清除自由基或使自由基产物失活来保护大脑免受氧化应激。
抗氧化防御机制
抗氧化酶的作用
抗氧化酶如:SOD通过催化超氧化物歧化为O2和H2O2来降低超氧化物阴离子的浓度;GPx还原H2O2和脂质过氧化物;硫醇特异性过氧化物酶如过氧化物酶减少羟基过氧化物的量,过氧化氢酶将H2O2转化为H2O和普通分子O2。
自由基激活参与抗氧化途径的基因转录,保护细胞免受不利影响。
谷胱甘肽不足可能会限制过氧化物酶的活性,从而使神经元更容易受到氧化应激的影响。
体内和体外研究表明:
重要途径与相关机制
Keap1-Nrf2-ARE 与神经退行性疾病相关的氧化应激防御机制有关,调节 SOD、硫氧还蛋白、过氧化物酶和 GPx 的活性。
NF-κB 是中枢神经系统 (CNS) 中的氧化还原传感器,可由 ROS 激活。
中枢神经系统抗氧化代谢的调节受到严格控制,而肠道微生物的作用是高度动态的。
肠道菌群之间、与宿主等相互作用产生代谢物
肠道菌与菌之间、菌与宿主之间的相互作用通过产生各种代谢物(如可吸收维生素、多酚、SCFA、BDNF、可扩散抗氧化剂和氧化剂气体等)来调节内源性和外源性 ROS 水平。
肠道菌群通过代谢物调节屏障、免疫系统、神经系统
肠道微生物还控制代谢物对血脑屏障的通透性、紧密连接完整性和肠道屏障,调节免疫系统,阻止病原体在肠道定植。副交感神经系统的迷走神经感知肠道代谢物,并将肠道信息传达给中枢神经系统,以产生特定的反应。
肠道菌群与神经系统疾病的关系
在应激条件下,迷走神经张力受到抑制,并由于菌群失调而表现出有害影响,如肠易激综合征 (IBS) 和炎症性肠病 (IBD)。参与 AD 发病机制的 Aβ 蛋白由肠道细菌(如ENS 中的大肠杆菌和肠道沙门氏菌)表达。
有益的肠道微生物还会产生多巴胺、血清素和 GABA。这些是调节 ENS 活性并可能相互关联的中枢神经递质。
肠道菌群管理小胶质细胞,失调引发神经炎症
一些研究表明,肠道微生物管理小胶质细胞的激活和成熟,而激活的小胶质细胞会释放大量诱导型一氧化氮合酶 (iNOS) 来调节 NO 的产生。菌群失调会引发炎症性 iNOS 并导致神经炎症。
我们已经看到肠道菌群的潜在作用以及氧化应激在介导神经元疾病中的重要作用,近年来,开发基于抗氧化剂的疗法来治疗氧化应激诱导的神经退行性疾病的需求日益增长,并且成为科学研究的重点。
抗氧化剂疗法与肠道微生物组的作用
抗氧化剂是能够抵消ROS/RNS诱导的氧化应激的化学或天然物质。尽管已经观察到抗氧化剂对糖尿病、关节炎、白内障和骨质疏松症等疾病的强大治疗作用,但用于中枢神经系统疾病的抗氧化疗法有限,仍然需要深入了解其机制。
肠道微生物组的双重作用
肠道微生物组的作用具有两面性,一方面它负责神经退行性(肠道菌群失调和神经炎症)的基本机制,另一方面,肠道微生物组及其代谢物调节许多相关通路,表明它们具有神经保护治疗作用。
蛋白质、维生素等微生物分子通过多步生物合成途径产生,可能对宿主系统产生有益或有害的影响。因此,通过包括益生元和益生菌在内的适当饮食来维持健康的肠道微生物群是维持神经元健康的先决条件。
肠道菌群代谢物的作用及其对肠道菌群的调节过程在神经退行性疾病(NDDs)中的作用
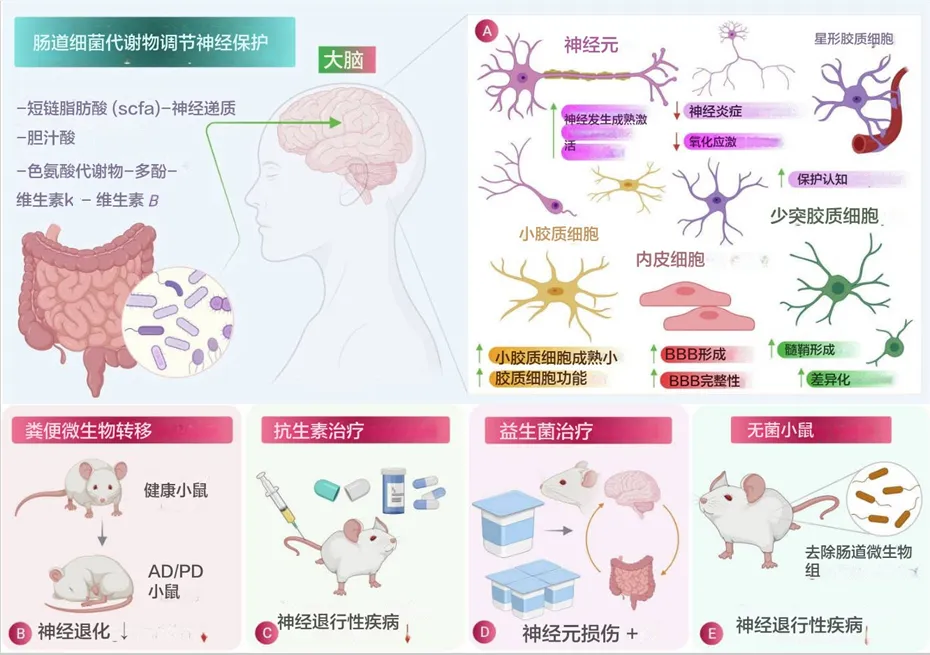
doi: 10.1016/j.jare.2021.09.005
肠道菌群在神经保护中的作用:
(A)肠道菌群释放的有益代谢物在减少炎症和氧化应激方面对脑细胞的特定影响示意图。
(B)粪菌移植 (FMT) 涉及将粪便细菌从健康个体转移到有病理状况的个体,被发现是一种有效的程序,可减少阿尔茨海默病、帕金森病、亨廷顿病和多发性硬化症等神经退行性疾病的病理生理。
(C)和(D)分别使用抗生素治疗和益生菌治疗,它们在减少神经退行性疾病的发病机制方面显示出相当大的效果。
(E)无菌小鼠(没有肠道微生物的小鼠)显示神经退行性疾病的减少,也用于研究肠道微生物对大脑生理的影响,从而显示肠道微生物参与神经退行性疾病。
肠道微生物群在神经保护中的作用

doi: 10.1016/j.jare.2021.09.005
肠道菌群与宿主分子的相互作用
胆汁酸的生成与功能
胆汁酸在肝脏中产生并在肠腔中释放,主要参与脂质和脂溶性维生素的溶解、能量代谢信号传导,并且在脑的生理学和病理生理学中发挥重要作用。
胆汁酸对神经系统的影响
胆汁酸通过直接结合穿过血脑屏障的脑内受体或通过与肠道受体结合间接诱导成纤维细胞生长因子 (FGF) 和胰高血糖素样肽 1 的释放,影响脑不同区域的神经元活动以及迷走神经活动。
胆汁酸的神经保护特性
胆汁酸如熊去氧胆酸 (UDCA) 和牛磺熊去氧胆酸 (TUDCA) 具有神经保护特性且无细胞毒性,这分别在其 III 期临床试验和动物研究中得到证实。最近的数据显示,TUDCA 有助于减弱慢性 PD 小鼠模型中的自噬、α-突触核蛋白聚集和蛋白质氧化。
此外,它还有助于通过Takeda G 蛋白偶联受体 5/sirtuin-3 (TGR5/SIRT-3) 通路防止蛛网膜下腔出血大鼠的神经元凋亡。同样,UDCA 在带电多泡体蛋白 2B (CHMP2B) 内含子 5 额颞叶痴呆模型中表现出神经保护作用。
肠道微生物对胆汁酸的影响
肠腔内的肠道微生物群在脱水酶的作用下将初级胆汁酸(胆酸和鹅去氧胆酸)转化为次级胆汁酸,包括氨基酸与胆汁盐水解酶和其他酶促过程的解离,从而改变它们的核受体结合、溶解度和循环。在人类和小鼠的 AD、PD、ASD多发性硬化症模型中发现了次级胆汁酸水平的变化。
此外,细菌修饰的胆汁酸对 ALS 和中风有神经保护作用。肠道微生物群落的调节可导致胆汁酸水平和性质的变化,这可能是神经退行性或神经保护性的。
胆汁酸在神经保护和疾病治疗中的潜在应用
肠道微生物介导的脱氧胆酸增加会诱导小鼠 EC 中神经递质血清素的释放。胆汁酸代谢物被发现可改善脱髓鞘和减少氧化应激,通过分别作用于少突胶质细胞和小胶质细胞增强其神经保护作用。然而,微生物操纵的胆汁酸的潜在作用和影响尚不清楚,仍有待明确定义。
类固醇激素在大脑发育和功能中的作用
类固醇激素发出的信号对大脑的发育和功能(记忆、决策和性行为)至关重要。类固醇激素在整个身体中循环时,会遇到肠腔内的微生物群。
肠道微生物对类固醇激素的修饰作用
肠道细菌在 β-葡萄糖醛酸酶和 β-葡萄糖苷酶介导的去结合反应中修饰类固醇激素,从而重新激活激素并阻止其排泄。因此,肠道微生物群通过降解和活化途径影响活性和非活性类固醇激素的水平。
肠道微生物与性激素代谢
研究发现,雄激素和雌激素受到肠道微生物群的影响。研究发现,大量肠道细菌能代谢雌激素,雌激素在粪便样本中也会发生氧化还原反应,这表明肠道微生物群发挥了作用。
研究发现,肠道微生物群还具有将睾酮和胆固醇转化为雄激素的能力。受微生物影响的雌激素具有神经保护作用,对小胶质细胞具有抗炎作用。
此外,肠道微生物群落改变会导致雌激素水平降低,从而导致慢性炎症和认知障碍。雌激素分子还会影响少突胶质细胞的分化和髓鞘形成。最近的报告还显示,即使在 MPTP 帕金森病小鼠模型中使用黄体酮治疗也显示出神经保护、抗炎和免疫调节作用,但神经保护作用是始于肠道还是大脑仍不清楚。
肠道菌群与饮食分子的相互作用
膳食氨基酸与肠道微生物代谢
膳食氨基酸也可以被肠道微生物代谢,它们对大脑的影响取决于膳食摄入的类型和频率。虽然肠道微生物编码的氨基酸在宿主体内循环,但影响中枢神经系统的氨基酸是由肠道细菌代谢的膳食氨基酸。
芳香族氨基酸
酪氨酸、色氨酸和苯丙氨酸等芳香族氨基酸被肠道细菌代谢为短链脂肪酸、吲哚衍生物、神经递质、有机酸、胺和氨。
酪氨酸
酪氨酸代谢的最终产物是由酪胺中间体形成两种儿茶酚胺、多巴胺和去甲肾上腺素。体外研究表明,大量肠道细菌可以产生毫摩尔范围内的去甲肾上腺素。最近的报告显示,非肾上腺素通过刺激 B-3 肾上腺素能受体增加星形胶质细胞的谷胱甘肽供应,从而保护神经元免受 H2O2诱导的神经元死亡。
研究发现,酪氨酸也被肠道微生物代谢为苯酚,如 4-乙基苯酚,随后在宿主体内被硫酸化为 4-乙基苯酚硫酸盐,在 ASD 小鼠模型中发现该物质升高,也是 ASD 儿童尿液的生物标志物。
色氨酸代谢产生的神经活性分子
色胺和犬尿氨酸等吲哚衍生物是肠道细菌代谢色氨酸的产物,是一种神经活性分子。吲哚丙酸是一种吲哚衍生物,可作为抗氧化剂减少神经炎症,并被观察到在减少 AD 病理方面具有潜在作用。
发现犬尿氨酸代谢物会影响焦虑、记忆和应激样行为。还观察到犬尿氨酸代谢途径的紊乱会促进炎症、兴奋毒性谷氨酸的产生和自由基攻击,表明平衡的犬尿氨酸具有神经保护作用,并在 AD、PD 和 HD 中具有抗炎作用。
色氨酸代谢物通过调节其芳烃受体有助于降低星形胶质细胞的炎症反应,同时也影响它们与小胶质细胞的相互作用。同样,还观察到吲哚酚-3-硫酸盐控制小胶质细胞的活化,随后控制其与星形胶质细胞的相互作用。
谷氨酸和精氨酸的神经保护
氨基酸谷氨酸也被肠道细菌谷氨酸脱羧酶转化为 GABA,一种抑制性神经递质,在小鼠模型中观察到它可以减轻抑郁和焦虑症状。
就氨基酸精氨酸而言,它被代谢成四种多胺,即胍丁胺、腐胺、亚精胺和精胺,它们的作用机理是谷氨酸受体并参与维持突触可塑性和记忆形成。
胍丁胺在作为脑中 α-2 肾上腺素能受体和咪唑受体的配体时,对中枢神经系统疾病有治疗作用。亚精胺也在 3-硝基丙酸 3-NP HD 模型中显示出神经保护作用。
此外,胍丁胺能刺激 Nrf-2 信号通路,改善脂多糖 (LPS) 诱导的 ROS 产生。体外和体内研究还表明,胍丁胺可保护星形胶质细胞和小胶质细胞免受氧化应激引起的损伤。这些研究表明肠道微生物内分泌学在神经科学中的潜在作用。
肠道菌群可以将膳食纤维代谢成短链脂肪酸
未消化的膳食纤维(如复合碳水化合物多糖)在肠道微生物酶糖苷水解酶和多糖裂解酶的作用下,通过厌氧发酵转化为短链脂肪酸(SCFA)。
丁酸、乙酸和丙酸组成短链脂肪酸,是结肠上皮细胞的能量来源。除此之外,它还进入体循环,随后直接或间接影响许多器官的生理功能,包括神经发育和功能。
短链脂肪酸在神经退行性疾病中的作用
有报道显示,当通过使用益生菌混合物或使用抗炎短链脂肪酸来调节 AD 小鼠模型的肠道菌群时,有助于抵消疾病的进展。同样,短链脂肪酸被发现能有效加剧 GF 小鼠 PD 模型中的运动症状。
SCFA对神经系统的直接影响
短链脂肪酸和乙酸穿过血脑屏障,激活神经元,调节神经递质和神经营养因子的水平。一项研究表明,丙酸和丁酸会影响神经元细胞内的钾水平。
丁酸是调节表观遗传基因活化(组蛋白去乙酰化酶)的酶的强效抑制剂,并被发现在 AD、PD、HD、中风和记忆障碍的小鼠模型中起到强效抗炎剂的作用。
有趣的是,SCFA 会干扰 Aβ 肽之间的相互作用,形成神经毒性低聚物,从而预防 AD 病理。据报道,将野生型小鼠的粪便微生物群移植到 PD 动物模型中,同时给予丁酸,可显著改善运动症状和多巴胺缺乏症。
SCFA对神经系统保护的多重机制
当我们观察细胞特异性反应时,丁酸已被证明可以在体外减少星形胶质细胞中的神经炎症和氧化,而乙酸盐被这些细胞用作能量来源。
一项研究发现,SCFA 通过与内皮细胞上的 SCFA 受体结合来增加紧密连接蛋白的表达,从而有助于降低 血脑屏障的通透性并预防 LPS 诱发的癫痫和中风。
SCFA 通过减少小胶质细胞活化来减少大脑中的氧化应激,从而对抗 AD 和 PD 中的神经炎症。总之,从膳食纤维中获得的 SCFA 有助于改善大脑健康,具体取决于个人的肠道健康状况。
多酚的分类及抗氧化特性
多酚是植物中存在的生物活性分子,在植物的生长、保护和繁殖中起着根本性的作用。多酚分为黄酮类化合物、酚酸类化合物和单宁类化合物。
多酚的分子结构,即羟基的位置和芳香环取代的性质,使其具有清除自由基的能力,并被广泛研究作为治疗NDD的抗氧化疗法。
多酚的代谢及其神经保护机制
未吸收的多酚在宿主体内通过水解和酯化作用,在肠道微生物群的作用下转化为生物可利用和生物活性的代谢物,随后在到达外周组织之前进行甲基化、硫酸化、羟基化等修饰。
研究表明,从葡萄和葡萄酒中提取的白藜芦醇、从绿茶中提取的姜黄素和表没食子儿茶素-3-没食子酸酯等不同多酚通过激活蛋白激酶通路(如 Keap1/Nrf-2/ARE)发挥神经保护作用,而这些通路是缓解内源性和外源性 ROS 的主要通路。
多酚代谢物在神经退行性疾病中的潜在作用
据报道,细菌多酚代谢物如 3-羟基苯甲酸和 3-(3′-羟基苯基)丙酸可抑制淀粉样蛋白聚集,从而有助于抑制 AD 的进展。
同样,据观察,黄酮类槲皮素可作为 BACE-1 抑制剂。此外,天然黄酮类原花青素可在体外 减轻鱼藤酮诱导的多巴胺能神经元的氧化应激。此外,肠道菌群产生的多酚(如阿魏酸)可促进神经发生,并在 AD和脑缺血的小鼠模型中显示出神经保护作用。
多酚与肠道菌群的相互作用及其对神经保护的影响
雌马酚和肠内酯也是肠道细菌通过代谢植物雌激素(多酚之一)产生的衍生物,可能对雌激素受体介导的经典神经保护途径产生影响。有趣的是,多酚还可以调节肠道菌群的组成,进一步将其转化为抗炎和神经保护代谢物。
扩展阅读:
肠道微生物与维生素合成
肠道微生物也是维生素的重要来源,特别是维生素B和K,它们不仅对肠道微生物代谢至关重要,而且还对宿主的生理途径产生影响。
维生素的吸收与生理作用
虽然膳食维生素通过小肠吸收,但微生物衍生的维生素的吸收发生在结肠中。为了预防新生儿出血性疾病,在肠道菌群建立之前,需要补充维生素K,这是血栓形成过程中必不可少的物质。
此外,维生素B和K对大脑发育和功能也很重要。就神经退行性疾病 (NDD)而言,许多研究表明维生素B和K在改善神经元健康方面发挥着有效作用。
维生素K在神经退行性疾病中的作用
研究发现,维生素K缺乏与AD的发病机制有关,增加膳食中维生素K的摄入有助于改善老年患者的记忆功能。
最近的报告显示,维生素K2(甲基萘醌-4)具有强大的抗氧化特性,能显著抑制鱼藤酮诱导的p38活化、ROS产生和caspase-1活性,进而恢复线粒体膜电位,显示出其在治疗神经炎症诱导的帕金森方面的潜力。
类似地,维生素 K2 可有效调节 PC12 小鼠神经母细胞瘤细胞中的 bax 和 caspase-3 活化,保护其免受 6-OHDA 诱导的细胞凋亡。
维生素缺乏与神经系统疾病的关系
最近的一份报告显示,帕金森病患者体内维生素 K2 水平低与炎症反应失调和凝血信号级联有关。
维生素 B 缺乏还与脚气病和多发性神经病等神经系统疾病有关。同样,叶酸缺乏与老年女性的认知障碍和进行性痴呆有关。而且,大量摄入 B6、B9 和 B12 可降低与 AD 认知能力下降有关的大脑区域萎缩的速度。此外,还需要更多建设性的研究来证明肠道微生物群产生的维生素在神经保护中的潜在联系。
扩展阅读:
自由基可能带来的危害
ROS 形式的自由基是细胞正常代谢过程的副产物。自由基有可能破坏遗传物质、使酶失活、使复合碳水化合物解聚以及使脂质过氧化。
抗氧化剂的保护机制
细胞内分子的这种破坏会导致细胞死亡。为了平衡自由基,身体具有特定的抗氧化剂,如谷胱甘肽。
一些产品也开始流入医药市场以应对氧化应激,如阿魏酸 (FA),因为它具有抗氧化和抗炎特性。它通过增强 BDNF 和神经生长因子 (NGF) 以及一些具有抗炎特性的神经肽的产生来帮助神经干细胞增殖。
益生菌在抗氧化应激中的作用
2017 年的研究,益生菌如植物乳杆菌 NCIMB 8826、发酵乳杆菌 NCIMB 5221和动物双歧杆菌也能通过细菌 FA 酯酶大量产生 FA。
由于其治疗效果,它在 AD 治疗中的应用越来越受到关注,用 FA 进行预处理已被证明可以减少 Aβ 原纤维并治疗 AD 小鼠的神经炎症。产生 FA 的益生菌通过清除 ROS 来抑制 β-淀粉样蛋白原纤维的形成和聚集。
SIRT1蛋白脱乙酰酶的抗氧化特性
其他益生菌蛋白,sirtuin-1 (SIRT1) 蛋白脱乙酰酶已被证明具有抗氧化特性。这种蛋白质调节宿主抗氧化途径的基因,并具有神经保护作用。
在接受治疗的转基因 3xTg-AD 小鼠中,观察到大脑中 SIRT1 蛋白的表达和活性恢复,Aβ 肽的形成减少。然而,在未经治疗的 AD 小鼠中,发现 SIRT1 的表达显著下降。
此外,SIRT1 活性增强可降低 p53 蛋白乙酰化,并通过抑制凋亡途径提高应激细胞的存活率。其他研究也表明,益生菌补充剂可激活 SIRT1 途径并激发抗氧化作用。
SLAB51益生菌配方的神经保护作用
最近的研究探究了一种名为 SLAB51(嗜热链球菌、嗜酸乳杆菌、植物乳酸杆菌、副干酪乳酸杆菌、德氏乳酸杆菌保加利亚亚种、短乳酸杆菌、长双歧杆菌、短双歧杆菌、婴儿双歧杆菌)的益生菌配方缓解氧化应激的能力,并发现了其作用的分子机制。
SLAB51 还能增强 GPx 和过氧化氢酶抗氧化酶的活性,从而减轻氧化应激引起的损伤。在人类中也观察到了类似的发现,AD 患者大脑中的 SIRT1 浓度显著降低,这与 AD 患者大脑皮层中淀粉样蛋白 β 和 tau 的积累密切相关。一项补充益生菌菌株干酪乳杆菌 01 的人体研究报告称,SIRT1 水平有所提高。
肠道菌群与免疫反应
肠道菌群与宿主免疫细胞之间的关系非常脆弱。免疫细胞专门区分宿主友好细菌和致病细菌。如果这种关系受到损害,则会导致不必要的免疫反应,引发慢性炎症。这种分化是由肠上皮细胞启动的,肠上皮细胞负责根据细菌细胞表面抗原(如 LPS、肽聚糖和鞭毛蛋白)产生受过训练的巨噬细胞表型。当上皮细胞变得容易受到致病攻击时,抗原会转移到脉管系统中,并产生促炎细胞因子,如 IL(白细胞介素)-1、IL-6 和肿瘤坏死因子-α (TNF-α),从而导致感染性休克以及肠道和脑部炎症。
肠道微生物与神经系统炎症的关联
一些细菌毒素也可以穿过血脑屏障。为了探究微生物在淀粉样变性中的作用,研究人员通过评估认知障碍患者几种肠道微生物的促炎(CXCL2、CXCL10、IL-1β、IL-6、IL-18、IL-8、炎症小体复合物 NLRP3、TNF-α)和抗炎(IL-4、IL-10、IL-13)细胞因子活性进行了研究,结果发现:
大肠杆菌/志贺氏菌的数量增加和直肠真杆菌的数量减少与认知障碍和淀粉样蛋白阳性患者的促炎和抗炎细胞因子浓度变化显著相关。同时,在 AD 患者中观察到 IL-6、CXCL2、NLRP3 和 IL-1β 水平升高,而 IL-10 水平降低。这项研究表明,肠道微生物群可能引发、加重或减轻神经系统疾病的外周炎症。
扩展阅读:
随着技术的进步,有关大脑的知识正在成倍增加。神经科学家从分子生物学、分子遗传学、脑成像和其他新技术中生成了大量数据,并且对共享神经科学数据以进行各种分析有着浓厚的兴趣。
神经成像在预测和检测神经退行性疾病和精神障碍方面也非常有帮助。为了收集和分析神经科学数据,正在开发各种生物信息学工具,以进一步开发基于大脑功能的设备。到目前为止,研究人员对因各种压力条件而导致神经退化的分子通路有了初步了解。
集成数据库将有助于从公开来源收集与神经退行性疾病相关的不同类型的数据。
当前与神经数据相关的活跃数据库
编辑
doi: 10.1016/j.jare.2021.09.005
随着高通量技术的加强,人们对微生物组的全面了解及其在人类健康中的重要性正在快速增长。
近期已证明肠道细菌可以改变中枢神经系统生理,而菌群失调可能是神经炎症的一个潜在因素。
微生物群影响左旋多巴治疗PD效果,数据库助力解析神经退行性疾病
据报道,在临床试验中,左旋多巴治疗 PD 的结果在招募受试者之间有所不同。这种差异是由于他们的微生物群造成的。L-多巴由不同肠道细菌物种(即粪肠球菌和Eggerthella lenta A2)的酪氨酸脱羧酶 (TDC) 和多巴胺脱羟酶 (Dadh) 代谢。
为了灭活细菌 L-多巴脱羧酶,人们发现了一种药物,即 (S)-α-氟甲基酪氨酸 (AFMT)。L-多巴和 AFMT 的组合被用于治疗帕金森病。与健康个体相比,AD 患者的肠道微生物群在分类学水平上发生了改变,例如拟杆菌、放线菌、瘤胃球菌、毛螺菌科。
宏基因组数据/16S RNA 测序数据支持菌群失调与 AD 之间存在明确关联。细菌产物(如 LPS 和 SCFA)与淀粉样蛋白病理有关。开发这些数据库的主要目的是将数据组织成一组结构化记录,这些记录有助于分析师检索信息进行不同的分析,从而为与神经退行性疾病相关的各种未解之谜提供解决方案。
肠道微生物群与大脑的相互联系已导致神经科学研究取得变革性进展。迄今为止,发现的大多数研究都与肠道细菌神经科学研究有关,但肠道微生物群非常庞大,需要科学家的关注,以确定和描述肠道微生物及其群落对肠脑信号传导途径的影响。
★ 为什么大脑容易发生氧化应激?
目前我们了解到大脑含有丰富的神经元,突触以及神经胶质细胞,相比于其他器官有更高的能量代谢活动和要求,大脑的抗氧化防御系统较弱,因此容易出现氧化还原稳态紊乱。
大脑Ca2+的稳态失调,神经元的兴奋性氨基酸在大量摄入导致谷胱甘肽(SH)的耗竭,从而引发神经元的铁死亡。
神经递质如多巴胺、5-羟色胺和去甲肾上腺素自动氧化生成ROS。大脑对由葡萄糖诱导的氧化应激敏感。大脑富含多不饱和脂肪酸,尤其是二十碳五烯酸(DHA),这使得其更容易受到氧化应激的影响,因为脂质过氧化和脑部利用过氧脂质进行信号传导。
脑部的微胶质细胞是大脑的常驻免疫细胞,对于大脑发育和功能至关重要。微胶质细胞活性取决于总的氧气生物可用性,并借此展示对突触的损伤,通过消耗更多氧气来产生O2–。H2O2和NO等反应性物质在损伤部位吸引微胶质细胞,引发局部炎症并推动神经退行性。
因此综合以上因素表面大脑容易发生氧化应激,这是很多神经退行疾病比如阿尔茨海默病,帕金森以及痴呆等的主要原因。
而大量的研究观察到肠道微生物组在通过其自身代谢产物或产生次生代谢产物减轻氧化应激、炎症和能量代谢方面发挥了不可忽视的作用。
★ 肠道菌群如何影响神经系统?
肠道微生物还控制代谢物对血脑屏障的通透性、紧密连接完整性和肠道屏障,调节免疫系统,阻止病原体在肠道定植。副交感神经系统的迷走神经感知肠道代谢物,并将肠道信息传达给中枢神经系统,以产生特定的反应。
在应激条件下,迷走神经张力受到抑制,并由于菌群失调而表现出有害影响,如肠易激综合征 (IBS) 和炎症性肠病 (IBD)。参与 AD 发病机制的 Aβ 蛋白由肠道细菌(如ENS 中的大肠杆菌和肠道沙门氏菌)表达。有益的肠道微生物还会产生多巴胺、血清素和 GABA。这些是调节 ENS 活性并可能相互关联的中枢神经递质。
肠道微生物管理小胶质细胞的激活和成熟,而激活的小胶质细胞会释放大量诱导型一氧化氮合酶 (iNOS) 调节 NO产生。菌群失调会引发炎症性 iNOS 并导致神经炎症。
★ 肠道菌群代谢物的作用
胆汁酸通过直接结合穿过血脑屏障的脑内受体或通过与肠道受体结合间接诱导成纤维细胞生长因子 (FGF) 和胰高血糖素样肽 1 的释放,影响脑不同区域的神经元活动以及迷走神经活动。
色胺和犬尿氨酸等吲哚衍生物是肠道细菌代谢色氨酸的产物,是一种神经活性分子。吲哚丙酸是一种吲哚衍生物,可作为抗氧化剂减少神经炎症,并被观察到在减少 AD 病理方面具有潜在作用。
短链脂肪酸和乙酸穿过血脑屏障,激活神经元,调节神经递质和神经营养因子的水平。一项研究表明,丙酸和丁酸会影响神经元细胞内的钾水平。
雌马酚和肠内酯也是肠道细菌通过代谢植物雌激素(多酚之一)产生的衍生物,可能对雌激素受体介导的经典神经保护途径产生影响。
而通过使用具有抗氧化和抗炎活性的益生菌来调节肠道微生物组已显示出有希望的神经恢复能力。
★ 益生菌帮助恢复神经系统
益生菌如植物乳杆菌 NCIMB 8826、发酵乳杆菌 NCIMB 5221和动物双歧杆菌也能通过细菌 FA 酯酶大量产生 FA。由于其治疗效果,它在 AD 治疗中的应用越来越受到关注,
最近的研究探究了一种名为 SLAB51(嗜热链球菌、嗜酸乳杆菌、植物乳酸杆菌、副干酪乳酸杆菌、德氏乳酸杆菌保加利亚亚种、短乳酸杆菌、长双歧杆菌、短双歧杆菌、婴儿双歧杆菌)的益生菌配方缓解氧化应激的能力,并发现了其作用的分子机制。
从德氏乳杆菌(Lactobacillus delbrueckii)亚种Lactobacillus delbrueckii ssp. bulgaricus B3 和 Lactobacillus plantarum GD2 中分离出的胞外多糖可保护 SH-SY5Y 细胞免受 Aβ(1–42) 诱导的细胞凋亡,这表明它们有望成为药物治疗阿尔茨海默病 (AD)的有前途的天然化学成分。
★ 饮食塑造肠道菌群缓解氧化应激助力大脑健康
氨基酸谷氨酸也被肠道细菌谷氨酸脱羧酶转化为 GABA,一种抑制性神经递质,在小鼠模型中观察到它可以减轻抑郁和焦虑症状。
就氨基酸精氨酸而言,它被代谢成四种多胺,即胍丁胺、腐胺、亚精胺和精胺,它们的作用机理是谷氨酸受体并参与维持突触可塑性和记忆形成。
从葡萄和葡萄酒中提取的白藜芦醇、从绿茶中提取的姜黄素和表没食子儿茶素-3-没食子酸酯等不同多酚通过激活蛋白激酶通路(如 Keap1/Nrf-2/ARE)发挥神经保护作用,而这些通路是缓解内源性和外源性 ROS 的主要通路。
主要参考文献
2020 Alzheimer’s disease facts and figures. Alzheimer’s Dement 2020;16:391–460.
Akasaka Naoki, Fujiwara Shinsuke. The therapeutic and nutraceutical potential of agmatine, and its enhanced production using Aspergillus oryzae. Amino Acids. 2020;52(2):181–197.
Barua Sumit, Kim Jong Youl, Kim Jae Young, Kim Jae Hwan, Lee Jong Eun. Therapeutic Effect of Agmatine on Neurological Disease: Focus on Ion Channels and Receptors. Neurochem Res. 2019;44(4):735–750.
谷禾健康
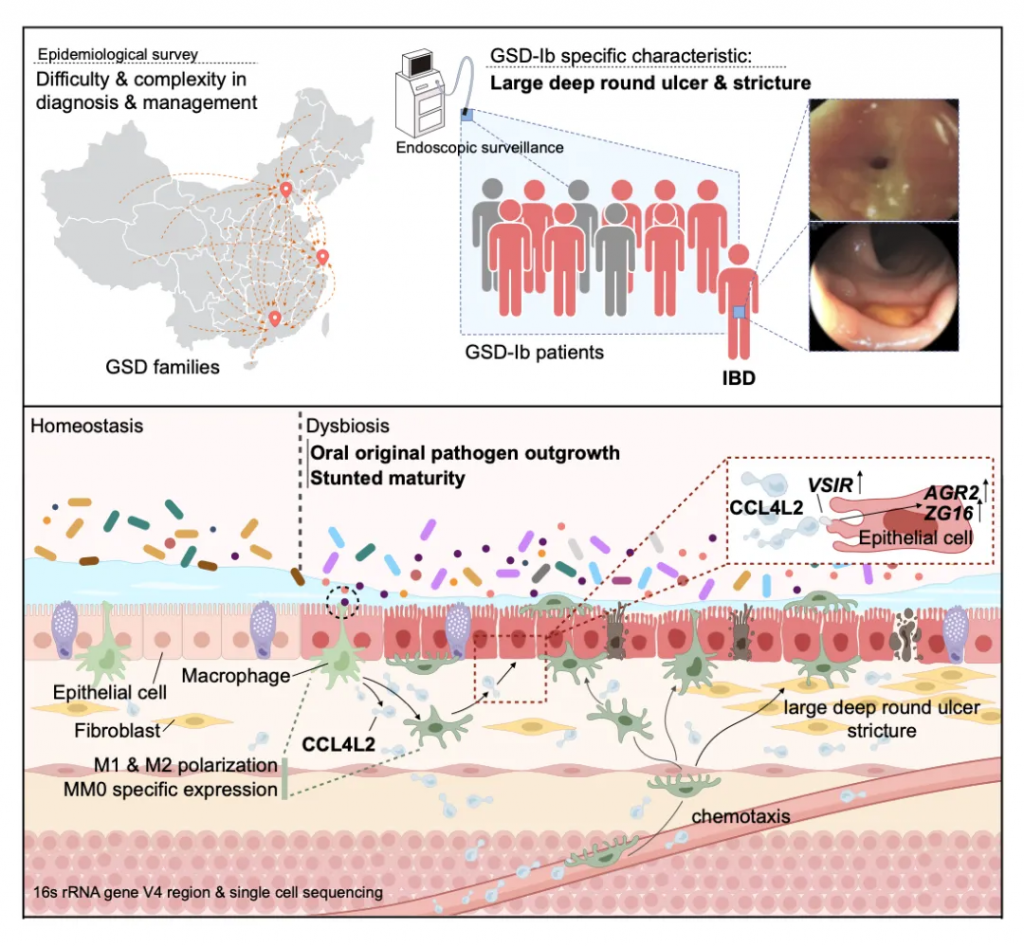
2024年6月19日,广东省人民医院儿科杨敏团队取得了一项备受瞩目的成果。该团队关于“肠道菌群失调通过糖原贮积病中的 CCL4L2-VSIR 轴引发炎症性肠病”,在国际著名期刊《Advanced Science》(影响因子IF=15.1)发表,针对这一通路不仅可以为 GSD 患者提供有益的治疗,还可以为结肠炎和其他形式的 IBD 患者提供有益的治疗。
谷禾健康技术团队参与并支持本研究的菌群测序和分析部分。
这一突破性研究为糖原贮积病及其相关并发症的治疗提供了新的视角,这也是我国儿科在罕见病领域的研究中取得的重大突破。

糖原贮积病(GSD),是一类由于先天性酶缺陷所造成的糖原代谢障碍疾病,多数属常染色体隐性遗传,发病因种族而异。该病类型多样,其中GSD-Ib型患者常伴有炎症性肠病。
在GSD-Ib型患者中,肠道菌群失调通过CCL4L2-VSIR轴影响炎症性肠病(IBD)。研究发现,与典型IBD不同,GSD-Ib患者展现出独特的消化道症状和肠道菌群特征。
肠道菌群失调主要由特定病原菌引起,导致肠道巨噬细胞过度激活,CCL4L2-VSIR轴的过度激活促进上皮细胞特定基因的表达,从而推动IBD的进展。
研究结果表明,靶向肠道菌群失调或CCL4L2-VSIR轴可能成为治疗GSD相关IBD的潜在策略。
糖原是肝脏和骨骼肌中储存的葡萄糖形式,其分解提供稳定的葡萄糖供应。当特定酶的活性缺失时,会导致糖原积累,进而影响组织的功能,导致一系列健康问题,包括低血糖、肌肉痉挛、疲劳、肝脏肿大等。
糖原贮积病的类型多样,根据受影响的酶和组织不同,可以分为几种主要类型。例如:
糖原贮积病的治疗主要是通过调节血糖水平和预防低血糖来管理。对于GSD-Ia和GSD-Ib,过去十多年的治疗方法包括间歇性未煮玉米淀粉或通过胃管给予夜间葡萄糖输注。给GSD-III患者高蛋白饮食,以增加儿童的生长速率。
GSD不仅影响儿童,成人也可能受到影响。未经最佳终身饮食葡萄糖治疗的成人GSD患者的长期预后不佳,可能会出现多种并发症,成人GSD患者常见的并发症包括骨质疏松症和骨折、肾结石、肾盂肾炎等。
▼
正常情况下,人体摄入的碳水化合物会被转化为葡萄糖,一部分葡萄糖会被立即利用以提供能量,而多余的葡萄糖则会在肝脏和肌肉等组织中合成糖原储存起来。当身体需要能量时,糖原又会分解为葡萄糖以供使用。
然而,在糖原贮积病患者中,由于参与糖原合成或分解的某些酶存在缺陷,导致糖原的合成、分解或储存出现异常,从而引起一系列的健康问题,包括低血糖、肌肉痉挛、疲劳、肝脏肿大等。
这类疾病有一个共同的生化特征,即是糖原贮存异常,绝大多数是糖原在肝脏、肌肉、肾脏等组织中贮积量增加。
▼
糖原贮积病是一种罕见病,总体发病率相对较低,但具体的发病率因不同类型的糖原贮积病而有所差异。
《世界胃肠病学杂志》资料显示,发病率约为20000-43000名新生儿中的1人。
由于其症状的多样性和隐匿性,一些病例可能未被准确诊断,实际的发病率可能被低估。
为了调查中国大陆GSD的流行病学和临床特征,杨敏及其团队进行了两项大型多中心研究,并通过问卷调查报告了2020年10月至2021年6月的209例GSD病例(如图)。
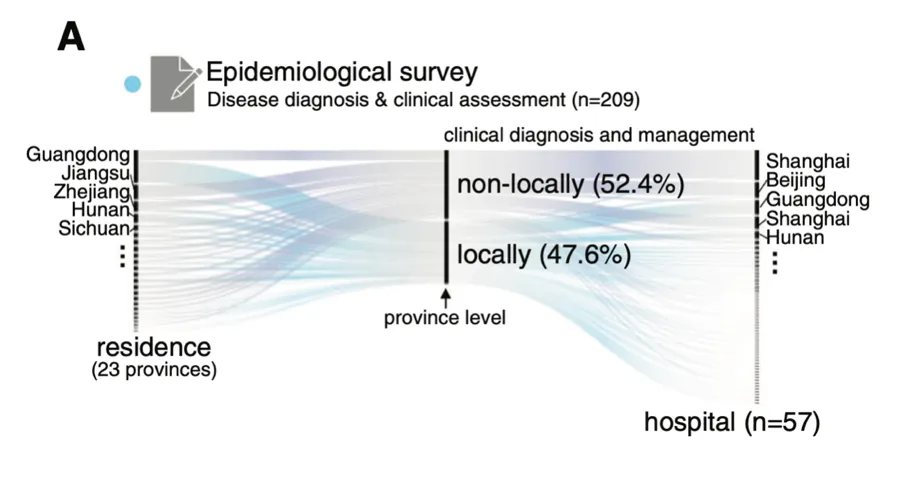
关于患者的就医情况,其中最显著的一个特点是超半数家庭(52.4%)为“省级”外来病例,就医的医院主要来自相对发达地区。且就诊地主要集中在上海、北京、广东等医疗资源相对发达的城市。
▼
糖原合成和分解代谢中所必需的各种酶至少有8种,由于这些酶缺陷所造成的临床疾病有15型,其中:
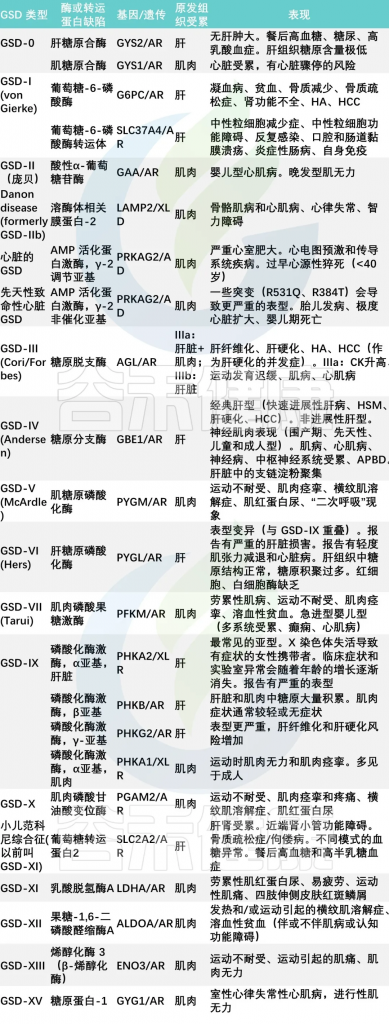
doi: 10.3748/wjg.v29.i25.3932
杨敏团队的调查研究中,主要包括6种类型的GSD,即:
其中最常见的是I型(66.9%)。
▼
不同类型的糖原贮积病临床表现各异,但常见的症状包括:
低血糖、肝肿大、酸中毒(乳酸性酸中毒)、高脂血症、高尿酸血症、疲劳、肌肉无力等。
由于糖原无法正常分解为葡萄糖,患者在空腹或长时间运动后容易出现低血糖症状,如头晕、乏力、出汗、心慌等。
糖原在肝脏中过度积累,导致肝脏体积增大。
长期的低血糖和代谢紊乱可能影响儿童的生长发育,导致身高、体重增长缓慢。
某些类型的糖原贮积病会影响肌肉功能,表现为肌肉无力、疼痛、痉挛等。
如Ⅱ型糖原贮积病可能导致心脏肥大、呼吸肌无力等,严重影响心肺功能。
其中:
口疮性口炎、肛周病变、胃肠炎、呼吸道感染和皮肤感染等症状在I型GSD中更常见;
厌食、呕吐、腹泻、粘液/血便、腹痛和腹胀是 GSD 患者常见的胃肠道并发症,尤其是在 GSD-Ib 组(77.8%)。
造成患者家庭问诊困难的一个主要原因是该疾病表型的复杂,例如下图:
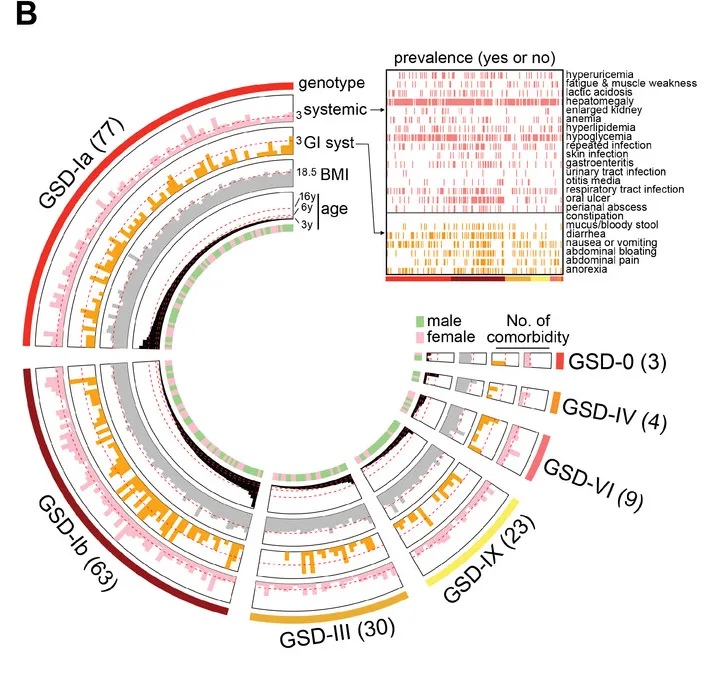
一种奇怪的糖原贮积病亚型:许多GSD-lb患者也患有慢性 IBD
杨敏教授表示,他们关注 GSD相关IBD 已有近10年了。多中心内镜监测研究中,他们招募了 32 名 GSD 患者。这些患者在内镜检查期间表现出活动性胃肠道症状。在这 32 名患者中,27 名患有 GSD-Ib,25 名最初诊断为 IBD。
其中GSD-Ib型患儿消化道症状比例最高(77.8%)且最为特殊,表现为单个或多发散在深圆形溃疡、炎性假息肉、梗阻和狭窄(如下图)。
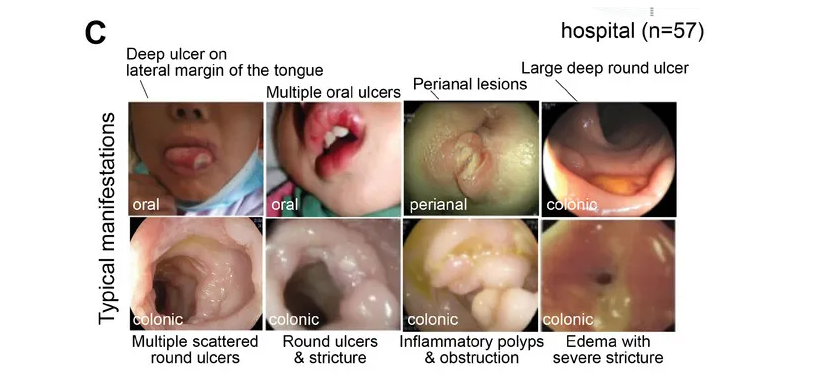
目前人们对 GSD-lb 中 IBD 的发病机制和发病原因知之甚少,超过 70% 的病例会出现严重的消化道症状,而这种症状在其他疾病亚型中偶尔才会出现。
如果不具体了解这些机制以及免疫系统与肠道微生物群之间的关系,科学家将无法开发出针对与 GSD 相关的 IBD 症状的有效治疗方法或干预措施。杨敏及其团队希望改变这一现状,开始了他们的实验探索过程。
▼
为了探究GSD群体消化系统异常,特别是IBD高发的原因,杨敏及其团队在全国23个省份招募了150名GSD患者(共涵盖Ia、Ib、III、IX、VI、IV及0型共7种类型)采集粪便样本, 327个健康对照者的粪便样本。
注:这327个对照样本包括:137 名家庭对照者和 190 名在山东、浙江、湖南等地收集的无关健康对照者。
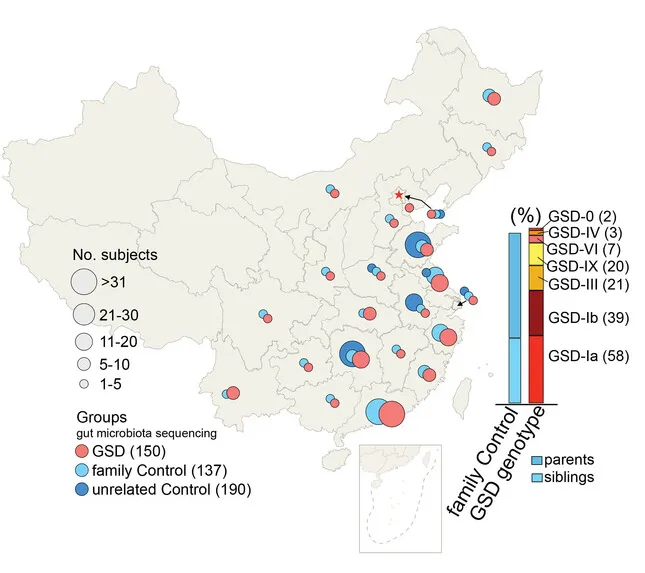
GSD基因型是肠道菌群的主要影响因素
肠道菌群受多种因素影响,包括饮食、地域和医疗条件等。
通过结合个人临床信息与肠道菌群数据的EnvFit分析发现(如下图),共有45个个人因素与肠道菌群的变异显著相关,如疾病情况(基因型)、家庭因素、年龄、身高体重、共患病等等。
值得注意的是,在这个队列中,GSD基因型主要影响肠道菌群组成。总体而言,家庭因素(家庭组配对比较)和居住地区是影响肠道菌群组成的第二和第三重要因素。
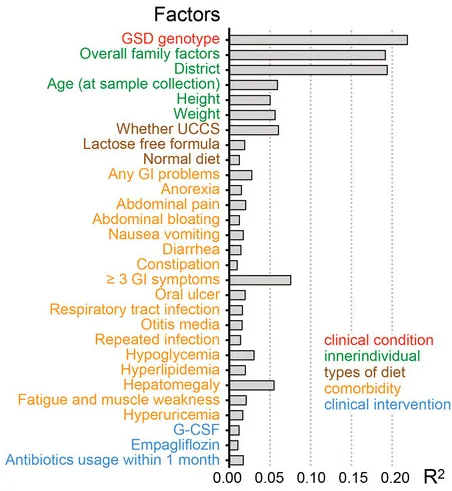
这在肠道菌群研究中颇为少见,因为多数研究认为地域因素极大且显著地影响个体菌群构成。这说明,特殊的基因型对于塑造个体肠道菌群构成起到决定性作用。
具体而言,研究人员将患者分为三组:
GSD-Ia、GSD-Ib、GSD-no IaIb
▼
GSD引起了个体肠道菌群多样性显著降低(下图H)及潜在致病菌显著升高(下图G),特别是GSD-Ia和GSD-Ib。这些肠道菌群的变化在校正性别、年龄、BMI和地域等因素后,仍然存在。
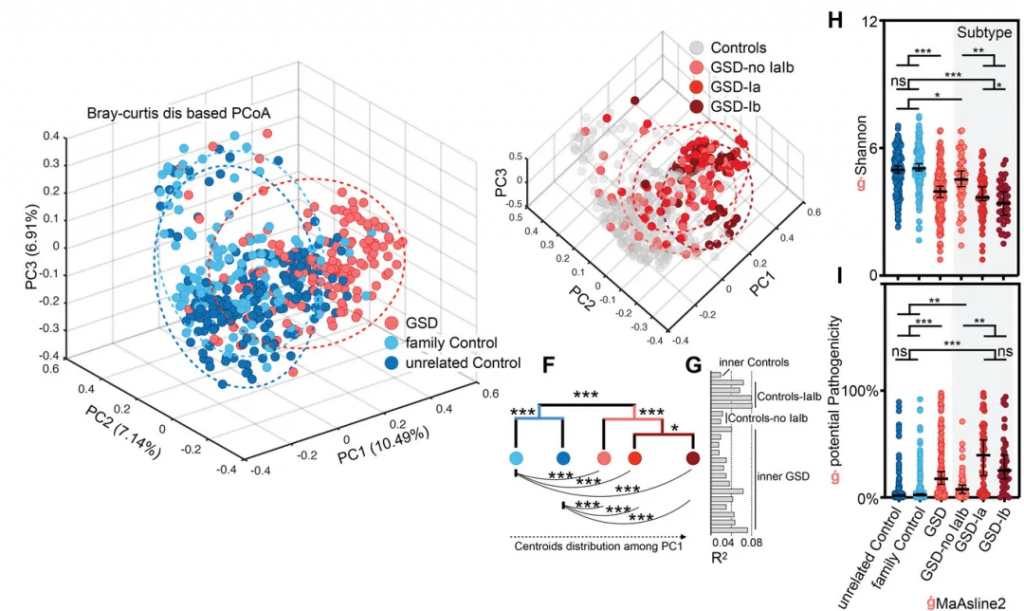
厚壁菌门和拟杆菌门仍是主要菌群;但变形菌门和放线菌门的比例显著增加。
GSD 患者共有31个属发生显著改变。其中18个属减少,而其余13个增加。这31个属中28个属在校正掉性别、年龄、BMI和地域等因素影响后,仍与GSD显著相关(下图D)。
有22物种的丰度和GSD显著关联(下图E),其中10 个增加和12个降低。
这31个显著改变的属的总丰度在不同分组人群中的总占比达到60-70%,种水平则为~25%,表明这些GSD相关的属种变化,是肠道菌群构成主体的紊乱。
▼
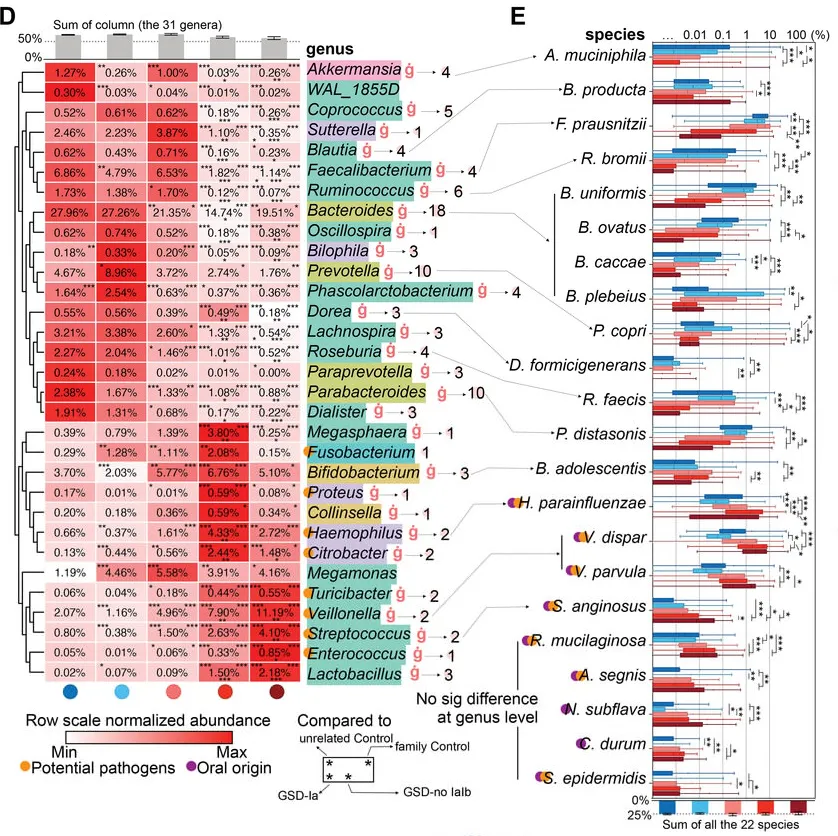
GSD-Ia和GSD-Ib患者表现出更严重的菌群紊乱,特别是那些最常见、功能性的微生物类群在其肠道内丢失,例如下列菌群在GSD-Ia和-Ib几乎完全耗尽:
丁酸可增强上皮氧合,有利于结肠中的低氧微环境并抑制病原体定植。然而,主要丁酸生产菌,如拟杆菌属、粪杆菌属和瘤胃球菌,以及相关代谢途径在GSD中显著降低,这可能导致兼性厌氧病原菌的延伸。
具体到每个菌来说:
AKK菌与肠道屏障的维持和抗炎作用有关,其减少可能会削弱肠道屏障,增加肠道炎症的风险,从而可能与IBD症状的出现有关。
粪杆菌参与肠道内的发酵过程,对维持肠道健康和免疫功能有重要作用。在糖原贮积病患者中,由于糖原代谢异常可能影响了肠道环境,进而影响了粪杆菌的定殖和功能,导致其数量减少。这可能会减少短链脂肪酸的产生,影响肠道健康。
拟杆菌在肠道内参与碳水化合物的分解,产生短链脂肪酸,糖原贮积病患者拟杆菌的减少可能导致肠道炎症反应加剧,与IBD症状的出现有关。
瘤胃球菌是产生短链脂肪酸的重要菌群,对肠道健康和宿主能量代谢有重要作用。瘤胃球菌的减少可能会导致短链脂肪酸的产生下降,影响肠道屏障功能和抗炎作用,从而可能与IBD症状的出现有关。以动物为基础的饮食会增加有害菌Ruminococcus gnavus。
GSD患者中存在口腔源的潜在病原体激增,例如:
口腔中的致病菌可以在肠道中定植和繁殖,说明肠道为这些菌群的生长繁殖提供了条件和环境。
链球菌,已被证明可通过GasderminA依赖性细胞焦亡诱导肠道损伤;可能通过产生超抗原等物质激活宿主T细胞免疫反应进而引发肠道炎症。
肠球菌的成员已显示出促炎作用;肠球菌可以通过分泌金属蛋白酶分解上皮钙黏蛋白破坏肠屏障。
韦荣氏球菌属在IBD中延伸,细小病毒通过产生硝酸盐诱导炎症。韦荣氏球菌属和链球菌的组合抑制了IL-12p70的生物合成,随后增强了IL-8、IL-6和TNFα的炎症反应。
菌群该定植时未定植,该退出时却长期占据
值得注意的是,双歧杆菌、韦荣球菌和乳杆菌这些本应该在健康儿童生命早期保持较高比例的细菌,在GSD患者的肠道中扩张,并且这些细菌在 GSD 患者的整个童年和成年期都会扩增,这可能抑制了其他正常菌群的定植。
▼
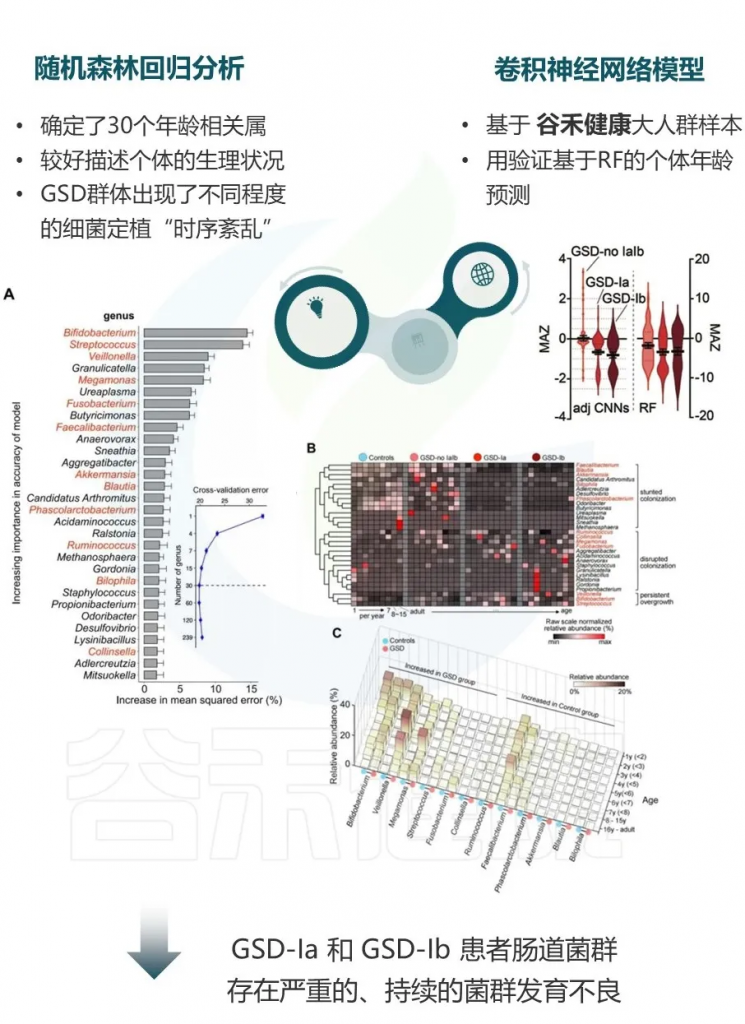
GSD患者肠道菌群发育落后于实际年龄
使用微生物组年龄Z分数(MAZ)评估菌群发育状态,随机森林回归和调整的深度神经网络分析均显示GSD患者的MAZ显著降低,特别是在GSD-Ia和Ib患者中。
这表明GSD患者的肠道菌群发育落后于实际年龄,呈现发育延迟状态。
▼
从数据分析的角度,研究团队进一步分析了GSD患病情况、共患病与肠道菌群紊乱的中介关系。
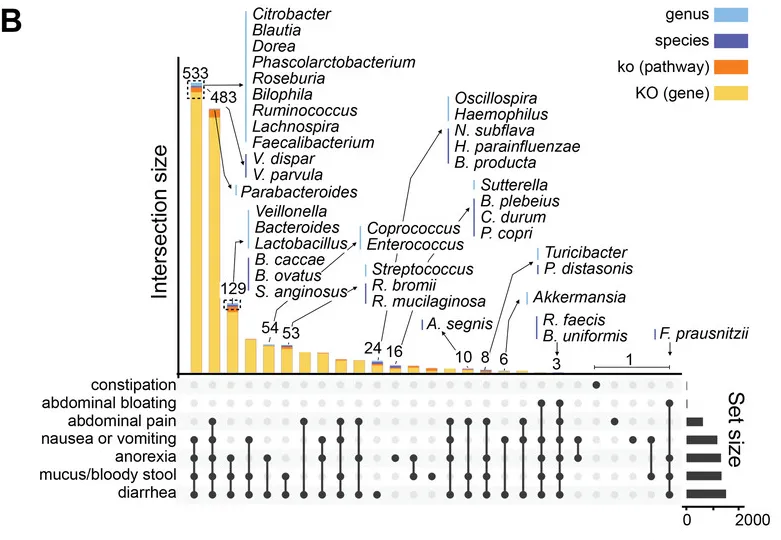
他们用最具代表性的肠道微生物特征和临床元数据构建了一个中介模型,在校正年龄、性别、BMI、地域及特殊治疗性饮食(生玉米淀粉)的影响后,肠道菌群仍然是GSD背景下,患者消化道异常的显著中介因子(下图)。说明GSD会通过影响肠道菌群构成最终造成消化道异常。
GSD 中这些细菌可能相互依赖资源和生存,形成一个复杂的相互支持网络,肠道菌群失调可能通过细菌的“群体犯罪”引起 GSD 患者的肠道上皮功能障碍。
下面我们来看一下该研究的另一个重要内容——肠道微生物群和免疫细胞之间的“串扰”。
▼
为了明确GSD相关的肠道菌群紊乱,如何引起个体IBD表性的产生。研究者们采集3名GSD-Ib患者的结肠粘膜组织(下图G),并使用单细胞测序技术分析患者结肠粘膜单细胞层面的转录水平变化。通过转录水平注释发现,相较于健康人、典型IBD和结肠炎的肠粘膜组织,GSD-Ib患者肠粘膜上有非常高的巨噬细胞聚集(下图H)。
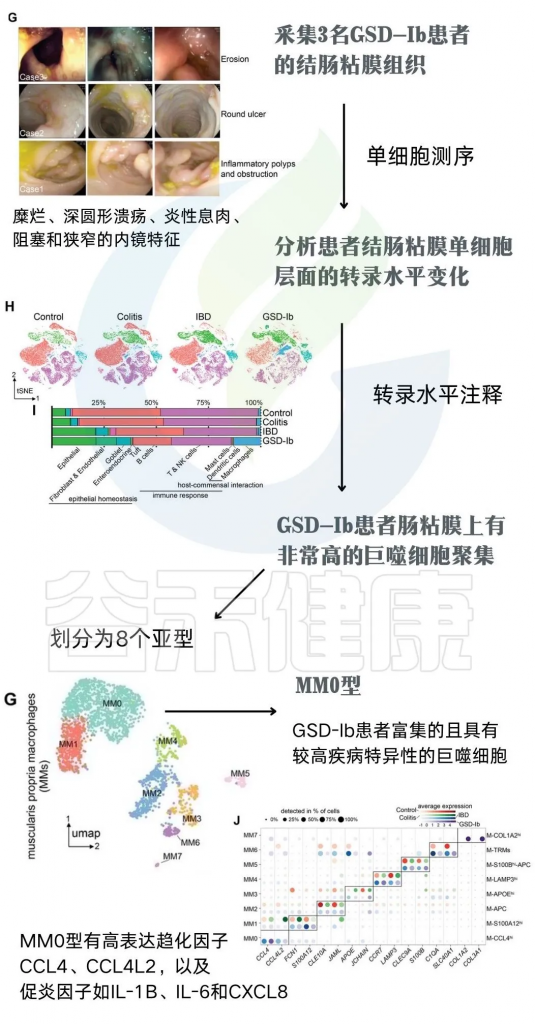
注:巨噬细胞中差异表达基因的KEGG通路注释显示,GSD-Ib中调节抗菌体液免疫反应和趋化因子介导的信号通路的基因集显著富集。GSD-Ib组中上调的基因主要参与环境信息处理和人类疾病。
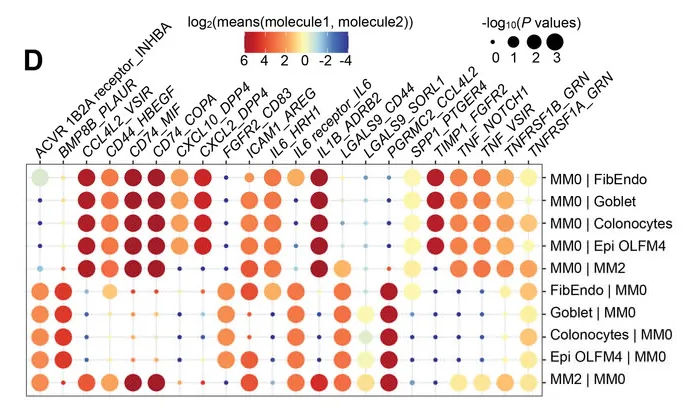
“
更深入的分析确定了一种巨噬细胞亚型(MM0)的重要性,这种亚型产生一种名为CCL4L2的趋化因子,负责激活其他免疫细胞对抗有害细菌的生长。
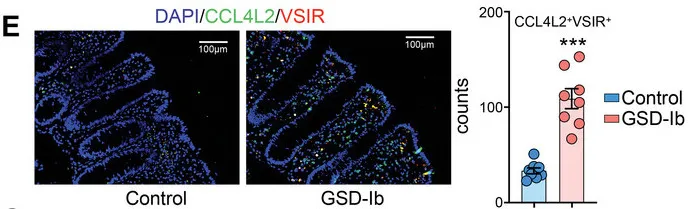
虽然CCL4L2的自然功能通常是保护性的,但杨敏及团队怀疑,由于GSD-Ib患者相关肠道细菌的存在,CCL4L2的过度或失调刺激可能是他们出现IBD症状的可能原因。
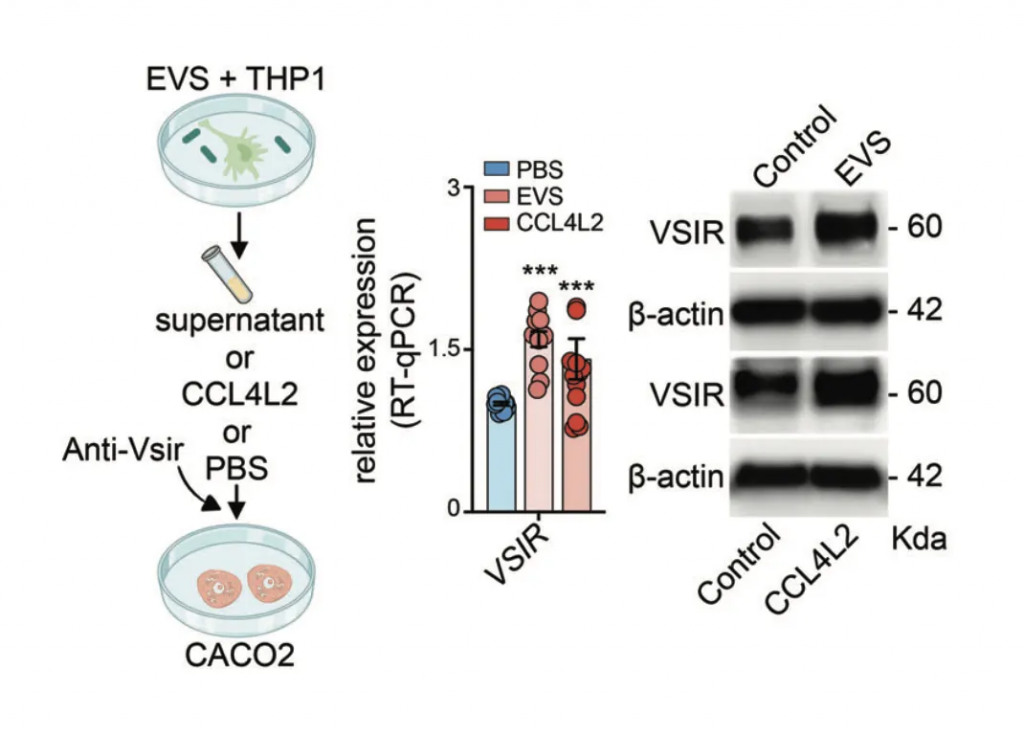
这一点最初在实验室中得到了支持,其中用有害细菌感染的细胞获得的细胞培养基处理的巨噬细胞,比用对照培养基处理的巨噬细胞更加“激活”。
下面我们来看一下他们选用了哪些菌群进行相关实验,来刺激巨噬细胞:
▼
研究人员选择了三种GSD相关菌群来刺激巨噬细胞,即:
暴露于粪肠球菌、小弧菌和咽峡炎链球菌以及混合感染 (EVS) 的巨噬细胞中 CCL4L2 的表达在 mRNA 和蛋白质水平上显著增加,但不影响 IL-1 β和 IL-6 的表达。
来自EVS感染的条件培养基(CM)与对照组相比,诱导了显著的巨噬细胞迁移趋化性,而这种趋化性部分被CCL4L2中和所减弱。
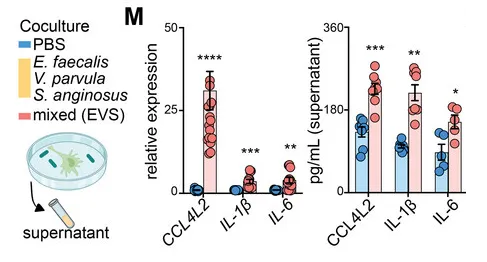
因此,是特定的肠道病原菌(如E. faecalis、V. parvula、S. anginosus)引发了CCL4L2的高表达,那么具体是如何影响炎症性肠病的进展?我们接着看。
“
然后,团队在从GSD-Ib患者取得的活检样本中寻找CCL4L2,并发现CCL4L2蛋白与一种叫做VSIR的受体结合,这种受体存在于肠道细胞壁中。
在IBD的小鼠模型中也发现了类似的结果,科学家们发现与健康对照组相比,巨噬细胞的水平更高,并且在用一种旨在抑制VSIR的抗体处理后,他们发现小鼠的症状加重了。
巨噬细胞通过CCL4L2-VSIR配体-受体信号与肠道上皮细胞相互作用,以促进损伤修复。
具体研究如下:
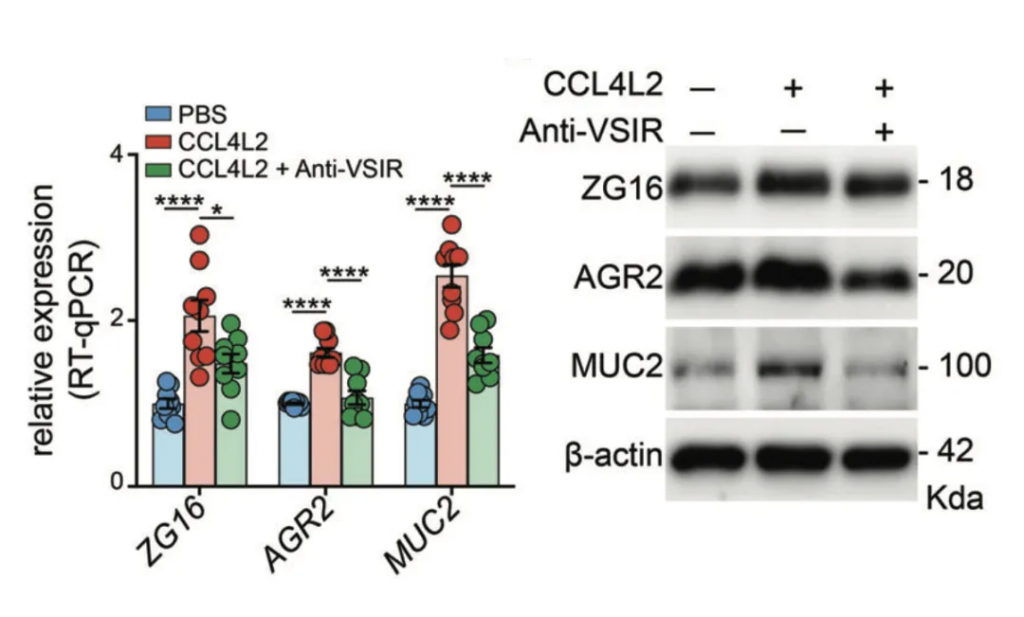
调节核糖体、氧化磷酸化途径和抗病原体反应的基因集在GSD-Ib上皮细胞中特异性富集。
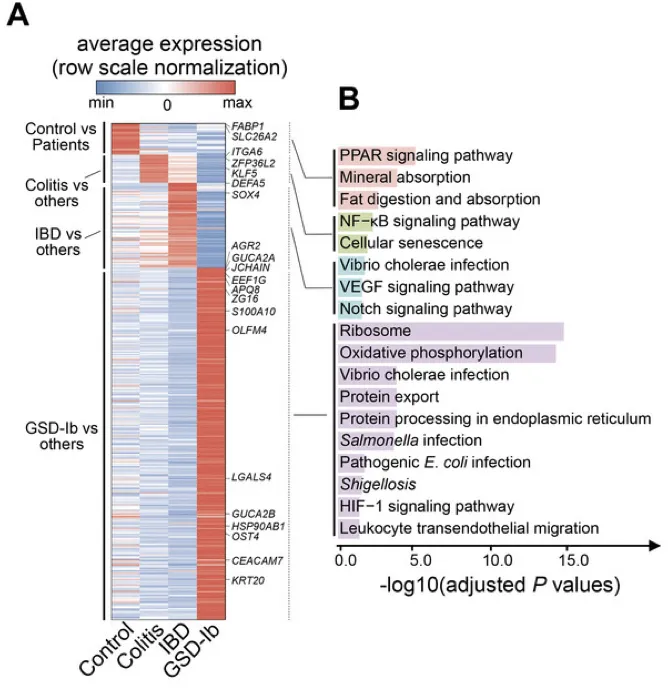
上皮细胞中典型的差异表达基因是AQP8、ZG16、GUCA2C、SLC26A3、AGR2,它们负责吸收、分泌、代谢、上皮屏障完整性、pH稳态、粘液屏障功能。
▼
免疫荧光染色显示GSD-Ib患者肠道组织中CCL4L2和VSIR的显著共定位,进一步验证了CCL4L2在巨噬细胞中的高表达及其与VSIR的相互作用。
CCL4L2与其受体VSIR形成的CCL4L2-VSIR轴主导参与了MM0型巨噬细胞与其他类型细胞交互,特别是OLFM4+上皮细胞(这类细胞是GSD特异性增加的,同时也被报道在克罗恩病中较高)。
预测MM0巨噬细胞与其他细胞类型之间的相互作用
而这些受体细胞的基因表达情况,决定了患者肠道组织的疾病发展方向,如AGR2、ZG16、MUC2等。
表明GSD相关的肠道菌群紊乱,通过引起肠上皮巨噬细胞高表达趋化因子CCL4L2,激活其他下游细胞膜蛋白VSIR表达,从而引起了GSD独有的消化系统IBD表型。这个现象进一步在C57BL/6小鼠中得到验证。
▼
研究人员在C57BL / 6小鼠中进行了选择性细菌移植,通过口服灌胃的方式将EVS移植到小鼠体内,并用DSS诱导结肠炎。研究发现,抗生素治疗显著降低了EVS灌胃诱导的小鼠血清CCL4L2水平,而抗VSIR则显示出完全相反的趋势。
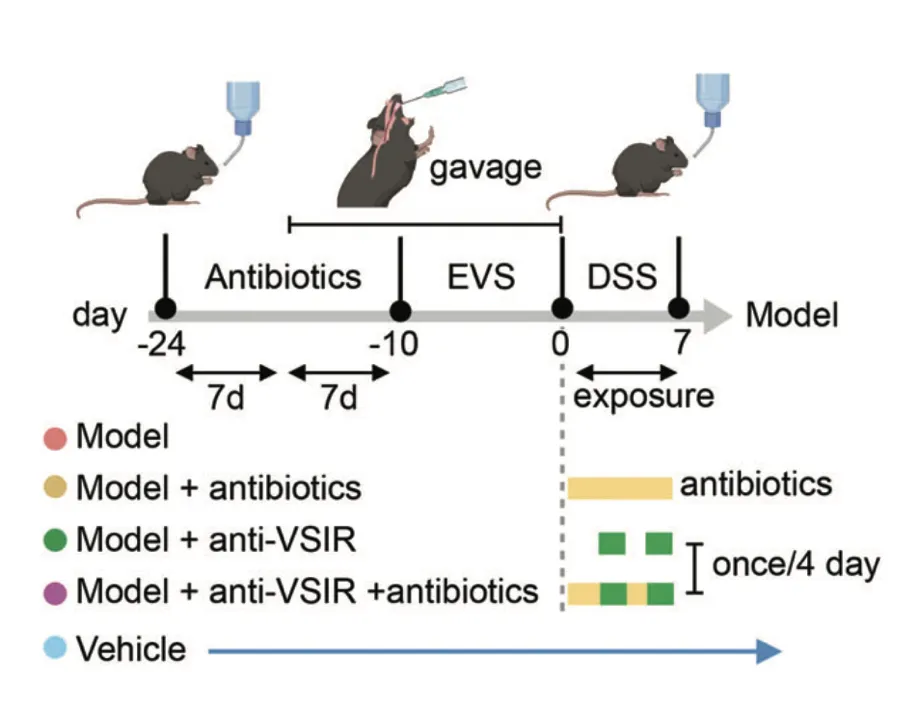
免疫荧光染色显示,模型组中MM0巨噬细胞增强,但在给予抗生素或抗VSIR注射后减少,这进一步导致模型组中肠上皮细胞的MUC2、AGR2和ZG16表达显著下调,引发粘膜损伤。
研究结果表明,EVS 增强的 MM0 巨噬细胞可以通过调节 CCL4L2-VSIR 轴来介导结肠肠上皮稳态。因此,靶向CCL4L2-VSIR通路可用于结肠炎和IBD的广泛应用。
肠道驻留免疫细胞和上皮之间的串扰,对于胃肠道稳态、抗原致敏调节、预防感染和 IBD 发展至关重要。在该研究中 GSD相关IBD 与典型的 IBD 相比具有不同的特征,特别是复杂的内镜表现及其特殊的解构:大量巨噬细胞积聚和上皮细胞增殖。
从病因上讲,肠道致病菌激活粘膜巨噬细胞导致胃肠道内形成炎症环境。在 GSD-Ib 中,一群独特的巨噬细胞由致病菌诱导,并表达高水平的趋化因子CCL4L2。
关于CCL4L2的有益方面:
潜在有害方面:
值得注意的是,CCL4L2-VIR通路的激活可能促进严重细胞因子风暴中的T细胞耗竭,这与新冠肺炎的不良预后有关。
靶向CCL4L2-VSIR可以抑制各种炎症性疾病、自身免疫性疾病和肿瘤转移。在这里,研究人员揭示了胃肠道中CCL4L2-VSIR轴的异常激活,最终驱动GSD-Ib中的非典型IBD。该发现为诊断和治疗GSD-Ib以及潜在的GSD相关IBD引入了一个新的靶点,并为VSIR相关研究提供了证据。
总的来说,这项研究证实了在糖原贮积病群体中独有的肠道菌群紊乱,即:
而这样的肠道菌群紊乱会引起个体结肠巨噬细胞高表达CCL4L2,并通过其受体蛋白VSIR介导上皮细胞的异常基因表达,最终造成GSD相关的IBD表型。
该研究的意义及未来方向:
该研究通过识别GSD-Ib与IBD之间的特定生物学联系,推动了精准医疗在代谢性疾病和消化系统疾病中的应用。
目前杨敏团队正在研究 CCL4L2-VSIR 通路的作用机制,并将探索其在患者治疗中的潜力。该团队预计,针对这一通路不仅可以为 GSD 患者提供有益的治疗,还可以为结肠炎和其他形式的 IBD 患者提供有益的治疗。
CCL4L2-VSIR轴的发现也可能促进新药开发,特别是针对GSD-Ib相关IBD的治疗。
这些研究结果也可应用于个性化治疗方案(基于肠道菌群特征),为患者提供更有效的治疗选择,有助于改善GSD-Ib患者及更广泛消化系统疾病患者的生活质量。
主要参考文献
Lan J, Zhang Y, Jin C, Yang M et al., Gut Dysbiosis Drives Inflammatory Bowel Disease Through the CCL4L2-VSIR Axis in Glycogen Storage Disease. Adv Sci (Weinh). 2024 Jun 18:e2309471.
Gümüş E, Özen H. Glycogen storage diseases: An update. World J Gastroenterol. 2023 Jul 7;29(25):3932-3963.
Hannah WB, Derks TGJ, Drumm ML, Grünert SC, Kishnani PS, Vissing J. Glycogen storage diseases. Nat Rev Dis Primers. 2023 Sep 7;9(1):46.
Zhong J, Gou Y, Zhao P, Dong X, Guo M, Li A, Hao A, Luu HH, He TC, Reid RR, Fan J. Glycogen storage disease type I: Genetic etiology, clinical manifestations, and conventional and gene therapies. Pediatr Discov. 2023;1(2):e3.
Wang Y, Liu H, Dong F, Xiao Y, Xiao F, Ge T, Li D, Yu G, Zhang T. Altered gut microbiota and microbial metabolism in children with hepatic glycogen storage disease: a case-control study. Transl Pediatr. 2023 Apr 29;12(4):572-586.

谷禾健康

小克里斯滕森氏菌(Christensenella minuta)是一种革兰氏阴性、不产生孢子、不运动的细菌:它属于厚壁菌门,这是细菌界中最大的门之一,包括多种对人类健康有重要影响的细菌。
在厚壁菌门下,C.minuta属于梭菌纲,这一纲的细菌多为厌氧菌,能在缺氧的环境中生长。梭菌目是梭菌纲下的一个目,包含了多种与消化道健康密切相关的细菌。
在梭菌目下,C.minuta属于Christensenellaceae属,这是一个与肠道健康紧密相关的科。由Christensenella minuta和少数其他菌种组成的属。
Christensenella minuta于2012年首次从健康人类粪便中发现,被认为是新一代益生菌。克里斯滕森菌科(Christensenellaceae)及其成员Christensenella minuta已被证明具有许多健康益处。
研究表明,Christensenella minuta在2型糖尿病和肥胖等代谢紊乱以及炎症性肠病中的丰度显著下降。其相对丰度与低 BMI 指数相关的瘦表型呈正相关。
除此之外,支气管哮喘和过敏性疾病、肾结石、情感障碍、甲状腺癌、粘膜类天疱疮、多囊卵巢综合征和复发性口疮性口炎等疾病中Christensenella minuta的丰度也较低。
Christensenella minuta能够代谢多种碳水化合物,例如纤维素、半纤维素和果胶,产生乙酸和丁酸等短链脂肪酸,这些物质不仅对肠道健康有益,还能调节宿主的代谢过程。
C.minuta通过几种机制影响代谢健康,包括使肠道微生物群重新正常化、产生功能性短链脂肪酸、抑制脂肪生成、维持肠道上皮完整性以及通过胆汁酸代谢调节能量代谢。
此外,C.minuta还通过抑制NF-κB信号通路和促炎细胞因子IL-8的分泌来缓解炎症性肠病。
C.minuta还可能对患有过敏性疾病的患者大有裨益,因为它可以改善肠道通透性并减轻全身炎症。而患有哮喘、湿疹和食物过敏的患者更容易出现“肠漏”,这被认为是导致疾病发病和诱发病情的一个因素。
鉴于其能够限制肠道干细胞增殖,未来C.minuta衍生的益生菌也可能对恶性肿瘤患者有益,尤其是结肠癌患者。
此外,Christensenella minuta显示出与其他潜在有益菌株的强烈相关性;由于C.minuta能够产生短链脂肪酸或塑造酸性环境,有利于其他有益菌(如Akkermansia muciniphila和Roseburia faecis)或与传统益生菌菌株(如双歧杆菌和乳酸杆菌)的生长,C.minuta还能够产生氢气,为M.smithii提供代谢底物(它利用H2和CO2产生甲烷),同时会抑制如克雷伯菌、大肠杆菌等机会性病原体的定值和增殖。
本文从基本属性、人群分布、Christensenella minuta的丰度与一些人体疾病(如肥胖、炎症性肠病和 2 型糖尿病)中的关联,以及与其他细菌的相关性,讲述了可能成为新一代益生菌的Christensenella munita。更好的了解Christensenella可以为基于肠道微生物群的个性化药物或疗法铺平道路。
▸ 发现历史
小克里斯滕森氏菌(Christensenella minuta)(DSM 22607) 于2012年通过 16S rRNA 测序发现,并首次从健康日本男性的粪便样本中培养出来。
2021年,发现了另一个C.minuta菌株DSM33407。其序列与菌株DSM22607有 99% 的一致性,并表现出相似的微生物学特性。次年,另一株菌株C.minuta DSM 33715 被公布并登记。
此外发现了两个新的细菌物种Christensenella massiliensis和Christensenella timonensis ,经 16S rRNA 测序,它们与C. minuta的序列相似性分别为 97.4% 和 97.5%。
而Caldicoprobacter oshimai JW/HY-331 T、Tindallia californiensis DSM 14871 T和Clostridium ganghwense JCM 13193 T是最近的亲属。
▸ 基本属性
从分类学上讲,Christensenella minuta属于厚壁菌门、梭菌纲和梭菌目。该细菌以丹麦微生物学家 Henrik Christensen 的名字命名,其种名反映其小巧的体型(Minuta在拉丁语中是“小”的意思)。该菌株的基因组相对较小,由大约150万个碱基对组成。
Christensenella minuta的细胞形态
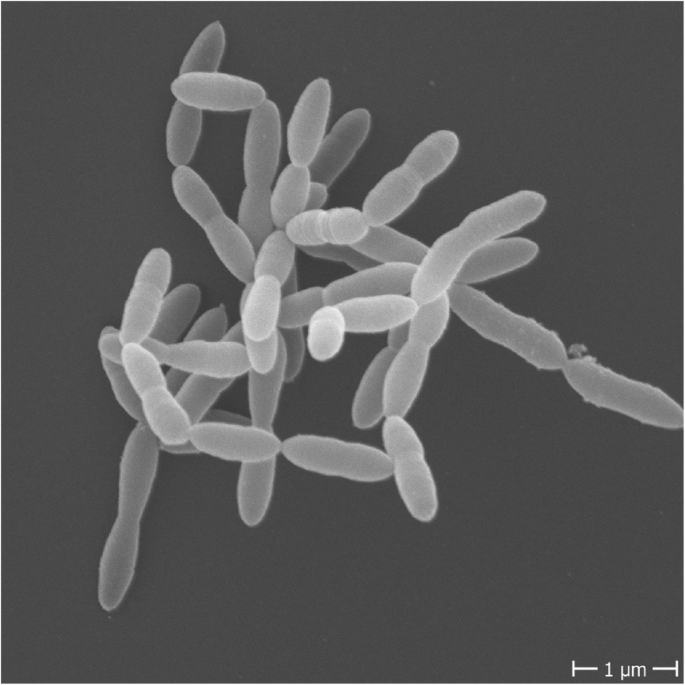
doi: 10.1186/s12915-019-0699-4.
Christensenella minuta是一种小型杆状细菌,末端呈锥形、大小从0.5毫米到1.9毫米不等、革兰氏阴性、不产生孢子、不运动的细菌,可形成圆形、几乎无色的菌落。菌落的平均尺寸为:宽度0.507±0.04μm、长度1.27±0.28μm、直径0.5–1.0μm,单独或成对出现。
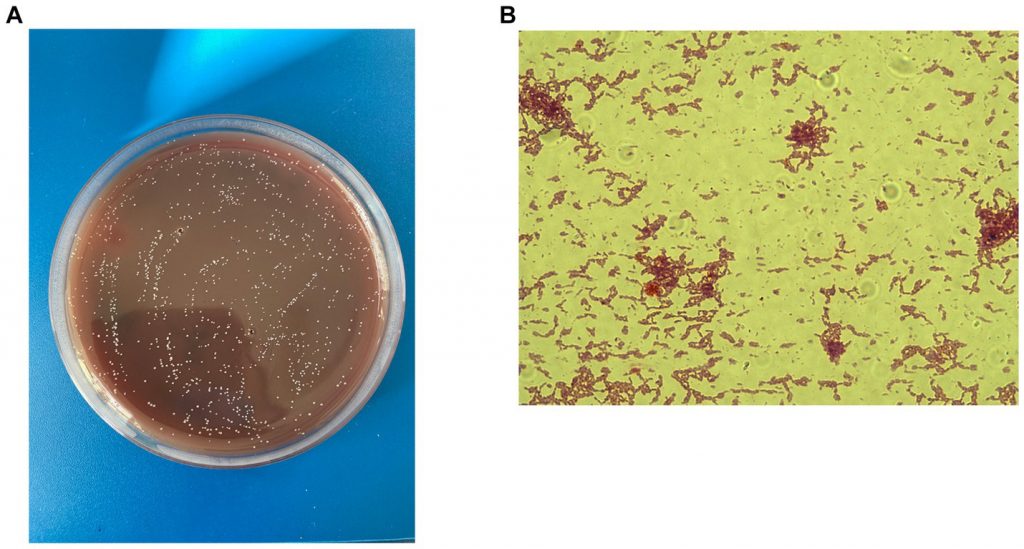
Ignatyeva O,et al.Front Microbiol.2024
A)革兰氏染色;B)在Schaedler琼脂上生长的菌落
-暴露于空气中会显著降低活性
它最初被描述为严格厌氧的;然而,后来的研究表明,它可以耐受氧气数小时。与普遍看法相反,暴露在大气中不会立即杀死细菌,而是会降低其活力。Christensenella minuta在37–40°和pH7.5时生长最快。它不是特别挑剔,可以在各种培养基中生长。
Christensenella minuta具有边界清晰的细胞壁,由丙氨酸、谷氨酸、丝氨酸和LL-二氨基庚二酸组成,这些细胞壁与半乳糖、葡萄糖、鼠李糖和核糖作为全细胞糖连接。
-对氨苄西林和四环素有抗性
菌株DSM22607的胆汁抗性为20%,而菌株 DSM33715的胆汁抗性高达80%。
对氨苄西林和四环素有抗性,但对氯霉素、克林霉素、美罗培南、甲硝唑、莫西沙星和哌拉西林/他唑巴坦敏感。
-可以利用多种单糖,但无法代谢色氨酸
在碳源利用方面,Christensenella minuta显示出对多种碳水化合物的利用能力,包括纤维素、半纤维素和果胶等。这些碳水化合物在肠道中不易被宿主消化酶分解,但C. minuta能够通过其独特的酶系统进行发酵,从而获取能量和营养物质。
C.minuta可以利用多种单糖,如葡萄糖、D-木糖、L-阿拉伯糖、L-鼠李糖和D-甘露糖,进行糖酵解发酵。C. minuta对葡萄糖的主要发酵产物是短链脂肪酸(乙酸和丁酸)。此外,已证明它可以通过发酵转化有机底物以产生大量氢气。
C. minuta对过氧化氢酶、氧化酶和脲酶的检测结果均为阴性。它也不能还原硝酸盐,也不能代谢色氨酸。最近, C. minuta菌株之一 DSM 22607被证明能产生一种新型胆盐水解酶(BSH)。
克里斯滕森菌科(Christensenellaceae)成员遍布各大洲。它们生活在各种动物的微生物群中,从蟑螂和蜥蜴到鸟类和哺乳动物,包括人类。这些细菌主要存在于胃肠道中,但也存在于灵长类动物的呼吸道和泌尿生殖道。
▸ 不同种族和性别之间丰度差异显著
Christensenella minuta作为健康成人结肠中的亚优势共生微生物种群,约占细菌总种群的0.2%到2%。其流行率在个体之间差异很大。在人群中,与克里斯滕森菌科(Christensenellaceae)不同相对丰度相关的特征包括种族和性别。
例如,对居住在阿姆斯特丹的2000多名不同种族的个体进行了研究,报告称荷兰受试者的Christensenellaceae科相对丰度最高。同样,比较了1673名居住在美国的人种族间微生物组差异,报告称与其他种族相比,亚太岛民的粪便样本中Christensenellaceae科的总体代表性较低。

一项研究还发现,与男性相比,女性中Christensenellaceae的相对丰度更高,在动物中也报告了类似的观察结果。这些种族和性别差异的根本原因尚不清楚。
▸ 百岁老人和瘦体型的人群中丰度更高

还有研究表明,在中国、意大利和韩国等国,百岁老人和超百岁老人体内的Christensenellaceae相对丰度高于年轻人群,因此Christensenellaceae可能与人类长寿有关。
针对多个地理位置的相对年轻个体的研究也发现了Christensenellaceae与年龄的正相关的关系 。鉴于这些研究均未对同一个体进行长期跟踪,因此 Christensenellaceae 与年龄的关联可能反映的是队列效应,而非年龄效应。
例如,随年龄而变化的饮食模式可能会影响这种关联,或者较早出生的个体体内的Christensenellaceae含量可能一直高于较晚出生的个体。
基于 16S rRNA 基因的肠道微生物群检测,该菌群在瘦体型个体中较为丰富。M.smithii是最丰富的产甲烷菌,它利用H2和CO2(C.minuta细菌发酵膳食纤维的产物)产生甲烷,表明以H2为基础的共营养与瘦表型和健康状态相关。这表明C.minuta和M.smithii之间存在跨物种氢转移,并且这两个物种与瘦表型呈正相关。
▸ 炎症性肠病等疾病中丰度降低
研究发现,C. minuta在健康个体的肠道微生物群中普遍存在,但在患有炎症性肠病(IBD)等特定疾病的个体中,其丰度显著降低。
这种分布的差异性提示了C. minuta在维持肠道健康和预防疾病方面可能具有重要作用。
越来越多的研究揭示了Christensenella minuta在人体健康和疾病中的重要作用。Christensenellaceae与多种代谢过程密切相关。研究表明,这种细菌在调节宿主的能量平衡、脂质代谢、脂多糖代谢、抗炎作用以及维持肠道屏障功能方面发挥着关键作用。
进一步的研究还发现,Christensenellaceae的丰度与肥胖、糖尿病、炎症性肠病等多种疾病的风险呈负相关。它还与健康衰老有关。在短短10年内,已经积累了大量证据表明,Christensenellaceae在许多疾病中显著减少。
Christensenellaceae与人类健康之间的关联

Ignatyeva O,et al.Front Microbiol.2024
▸ 肥胖患者中减少 ↓
肥胖是一种复杂的疾病,由体内过多的脂肪堆积引起,会对身体健康产生不利影响。许多非传染性疾病,如心血管疾病、各种癌症、2 型糖尿病、高血压和中风,以及精神健康问题都与肥胖有关。
研究认为,肥胖的病因与肠道菌群失调和先天性瘦素缺乏有关。已提出了几种机制将肥胖的发生与肠道菌群组成联系起来,这些机制是通过代谢和炎症活动的功能障碍实现的。
肥胖的发生涉及肠道菌群和宿主,是通过与近端器官的直接相互作用或通过代谢物分泌与肝脏、脂肪组织和大脑等远处器官的间接相互作用介导的。
在许多研究中,C. minuta被反复与其治疗性抗肥胖潜力联系在一起,这表明C. minuta在肠道微生物生态系统中的作用与宿主代谢的调节之间存在很强的相关性。C. minuta发挥治疗性抗肥胖作用的机制包括调节肠道上皮完整性、产生短链脂肪酸、改善脂质代谢和胆汁酸代谢。
Christensenella minuta抗肥胖作用的潜在机制
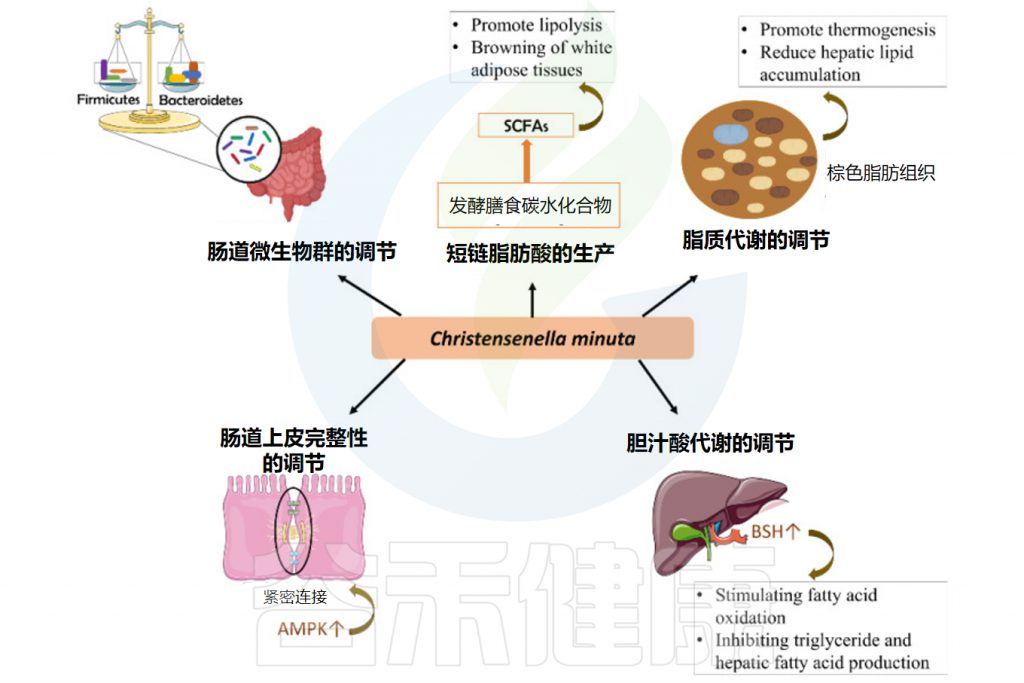
Ang WS,et al.Foods.2023
-产生短链脂肪酸来调节能量代谢和肠道稳态
研究发现C. minuta DSM 22607以5:1的比例产生高水平的乙酸盐和中等水平的丁酸盐,而不产生丙酸盐。
同时,在近端和远端结肠中均发现了低水平的支链脂肪酸,即异丁酸、异戊酸和异己酸,这表明C.minuta可降低细菌蛋白水解并刺激碳水化合物发酵。
肠道菌群通过短链脂肪酸(SCFA)产生参与调节能量代谢和肠道稳态。SCFA 被吸收并充当宿主体内葡萄糖和脂质代谢的能量来源或前体。SCFA可能通过G蛋白偶联受体,即游离脂肪酸受体2(FFAR2)和3(FFAR3)与结肠、肝脏、肌肉和脂肪组织相互作用。
-调节瘦素水平,减少脂肪的生成
此外,短链脂肪酸会上调抑制饥饿的瘦素合成,抑制脂肪生成并促进脂肪分解。研究评估了丁酸盐的施用可以通过促进脂肪细胞形成和脂肪组织褐变来减少能量摄入,增强脂肪氧化和能量消耗,从而治疗和预防肥胖。
这些由肠道微生物群产生的短链脂肪酸还与结肠粘膜中的肠内分泌细胞相互作用,诱导释放胰高血糖素样肽1(GLP-1)和肽YY(PYY)。这些激素进入体循环并对许多器官和组织发挥作用,最重要的是胃和胰腺。GLP-1和PYY共同防止胃排空过快,抑制酸分泌和运动,减缓胃肠道运输,从而导致食欲减少和食物摄入量减少。GLP-1还能刺激胰岛素分泌并防止胰腺β细胞衰竭。
–C.minuta改善了肠道上皮完整性,增强肠道屏障

此外,C. minuta合成的两种短链脂肪酸可能都参与维持肠上皮屏障。例如,乙酸和丁酸可通过与G蛋白偶联受体GPR43和GPR109A 结合来激活核苷酸结合寡聚化结构域3(NLRP3)炎症小体,这会增加IL-18的释放,促进上皮细胞的修复。
丁酸能稳定缺氧诱导因子(HIF),后者是屏障保护和组织再生的关键分子,它上调紧密连接蛋白,增加杯状细胞的黏蛋白生成,从而增强肠道屏障。
一项研究表明,C. minuta在体外和涉及高脂饮食组的动物研究中改善了肠道紧密连接蛋白(ZO-1)、闭合蛋白(OCLN)和紧密连接蛋白-1(CLDN1)的表达。
肠道通透性增加被认为是脂肪诱导性肥胖的一个驱动因素,与肠道菌群失调和肠道炎症有关。已证实肥胖小鼠的紧密连接减少,这表明肥胖是由肠道通透性增加和跨上皮阻力降低引起的。
肠道紧密连接蛋白下调可导致肠道渗漏,其中脂多糖细菌物质和其他炎症介质通过紧密连接扩散并与宿主免疫细胞相互作用,导致低度炎症、暴食并最终导致体重增加。
-调节甘油三酯和游离脂肪酸的积累
此外,与肥胖水平或体脂相关的身体质量指数(BMI)也与肠道中C.minuta的丰富程度密切相关。调节脂肪酸的合成和氧化以及抑制脂肪生成对体脂和体重有有利的影响。
早期的一项研究表明,肠道微生物群中C.minuta的存在与肥胖降低之间存在联系。一项针对C.minuta的干预研究表明,在饮食诱导的肥胖小鼠模型中,肝脏甘油三酯和游离脂肪酸的积累受到阻碍。这一发现与基因表达水平一致,在补充了C.minuta的动物模型中,编码肝脏葡萄糖激酶的gck基因受到强烈抑制。
葡萄糖激酶的过度表达促进了糖的过度吸收、肝脏脂质积累和棕色脂肪组织(BAT)中产热蛋白的下调,导致肥胖。从机制上讲,增强BAT中的脂肪组织产热作用并诱导白色脂肪组织(WAT)褐变可导致体重减轻。
-通过调节胆汁酸代谢来发挥抗肥胖能力
胆汁酸代谢对于调节葡萄糖和能量代谢、肠道完整性和免疫力至关重要。胆汁酸代谢的改变与肥胖密切相关。胆汁酸代谢通过刺激脂肪酸氧化和抑制甘油三酯和肝脏脂肪酸的产生。
C.minuta的抗肥胖潜力还通过结肠中的胆酸/牛磺胆酸(CA/TCA)比率来展现。这一发现意义重大,为抗肥胖与糖分解代谢以及初级胆汁酸的有效解离之间的关联提供了重要的理论基础。
C.minuta菌株 DSM33407和DSM22607在80%胆汁存在48小时的情况下均对胆汁酸具有高度耐受性。胆汁酸水解酶(BSH)基因已在两种C.minuta菌株中被鉴定,并且由于其水解结合胆汁酸的强能力而高度表达。
C.minuta还通过法尼醇x受体和G蛋白偶联胆汁酸受体(TGR5)促进胆汁酸代谢,而 TGR5 在肠道中高度表达。一些体内研究表明,肠道生态系统中BSH的高水平表达被认为是抗肥胖的关键调节因素,可显著降低体重、肥胖、循环低密度脂蛋白(LDL)胆固醇和甘油三酯。
注:BSH活性是肥胖控制的关键机制目标。利用具有高BSH活性的细菌菌株来丰富肠道微生物群可能是预防和控制肥胖的一种策略。
▸ 炎症性肠病中减少 ↓
炎症性肠病(IBD)是一种影响胃肠道的慢性炎症性疾病,主要有两种类型:克罗恩病和溃疡性结肠炎,每种类型都有不同的生理症状。研究发现,IBD患者的微生物组成会发生变化,其特征是厚壁菌门与拟杆菌门的比例下降。
-抑制NF-κB信号通路和IL-8来减轻结肠炎症
肠道菌群失调伴有短链脂肪酸组成的变化,随后是肠道屏障完整性的破坏,最终通过免疫系统调节引发炎症反应。尽管 IBD 的病因仍不太清楚,但研究表明,它们是由不受控制的炎症反应引发的,与白细胞介素8(IL-8)细胞因子和活性氧(ROS)的增加有关。
许多研究已经证明克罗恩病(CD)和溃疡性结肠炎(UC)患者的Christensenellaceae会减少。在发作前立即观察到静止期CD患者中Christensenellaceae的丰度显著下降,这可能表明它们在疾病进展中发挥了作用。在腹泻患者中也观察到了Christensenellaceae的丰度较低。
最近的体外和体内研究表明,C.minuta具有强效抗炎和免疫调节特性。C. minuta通过抑制 NF-κB 信号通路和促炎细胞因子IL-8的分泌来减轻结肠炎症。
-克罗恩病患者缺乏C.minuta

一项对C.minuta的介入研究表明,克罗恩病(CD)患者中缺乏Christensenella minuta(C.minuta),并且有记录证明它们会在人类上皮细胞中诱导抗炎作用,这支持了它们作为一种新型生物疗法的潜力。
在两种不同的急性结肠炎动物模型和一种人类肠道细胞系中,C.minuta限制结肠损伤、促进粘膜愈合并降低因炎症引起的中性粒细胞(特别是髓过氧化物酶和嗜酸性粒细胞过氧化物酶)的活化。
在C.minuta治疗动物模型中,肠道炎症的非侵入性生物标志人脂质运载蛋白-2(LCN-2)的浓度降低。在基因层面,携带克罗恩病风险基因 IL23R 的个体体内与C.minuta相关的微生物丰度降低,表明肠道微生物组受到宿主遗传学的影响。
据报道,当小鼠补充C.minuta时,IL23R 保护性编码变体会增加,从而预防克罗恩病。C.minuta还会产生丁酸,通过丁酸受体 GPR109a 来控制脂肪细胞、肠上皮细胞和免疫细胞中的炎症反应。
值得注意的是,C.minuta的抗炎功效已被证实与美沙拉嗪(也称为5-氨基水杨酸(5-ASA),一种用于治疗IBD的药物)相似。
▸ 2型糖尿病患者中减少 ↓
2型糖尿病(T2D)是一种复杂的代谢和内分泌功能障碍,其特征是胰岛素抵抗、胰腺β细胞功能障碍、低度全身炎症、肠道菌群失调、肥胖和其他内分泌疾病引起的高血糖。
中药是一种源自天然产物的补充药物,在治疗代谢综合征方面具有潜力。口服中药干预会影响肠道微生物群,但由于其活性成分(如黄酮类化合物)的亲脂性较差,因此生物利用度较低。肠道菌群的生物转化促进药物的吸收,这对药理学有重大影响。
-增加C.minuta有助于改善糖尿病
中药成分可能会调节宿主肠道菌群的数量。黄芪苓化散(HQLHS)由黄芪、灵芝、桦褐孔菌和苦瓜组成,是专门用于治疗2型糖尿病的中药复方。

最近的一项研究表明,在小鼠模型中,HQLHS抑制了致病菌并丰富了有益菌,特别是C.minuta和Christensenella timonensis。值得注意的是,该研究表明HQLHS显著增加了小鼠肠道菌群中Christensenella的相对丰度。该研究还描述了C.minuta对肝脏代谢的影响,为理解C.minuta在糖尿病治疗和控制中的药理机制奠定了基础。
-减少氧化应激、改善葡萄糖代谢
在同一项研究中,C. minuta DSM 22607 降低了糖尿病大鼠体内的氧化应激、色氨酸和酪氨酸等糖尿病诱因。抗氧化酶和脂质过氧化生物标志物 MDA 的水平也得到了控制。
C. minuta的抗糖尿病特性有多种机制,例如改善糖脂代谢、通过抑制肠道葡萄糖转运中SGLT1和GLUT2的表达来抑制葡萄糖吸收、促进GLP-1分泌以刺激胰岛素抵抗并调节葡萄糖稳态。
▸ 支气管哮喘和过敏性疾病中减少 ↓
-C.minuta丰度较高时患哮喘的可能性较低
小克里斯滕森氏菌(Christensenella minuta)还与支气管哮喘和过敏性疾病有关。研究发现,粪便微生物组中富含C. minuta的儿童患湿疹和对吸入性过敏原致敏的可能性较小。
值得注意的是,家庭环境中克里斯滕森菌科的丰富程度可能在支气管哮喘中发挥重要作用。分析了从健康儿童以及患有哮喘的儿童和成人家中收集的灰尘的宏基因组学谱。他们发现,克里斯滕森菌科在“健康”房屋的灰尘中显著过多,而在“哮喘”房屋的灰尘中却很少。
其他一些研究还发现:肾结石、情感障碍、甲状腺癌、粘膜类天疱疮、多囊卵巢综合征和复发性口疮性口炎也与Christensenellaceae科丰度较低有关。
▸ 过高在一些患者中可能有害 ↑
然而,有证据表明,Christensenellaceae科的丰度较高可能与一些病理之间存在联系。在一项研究中,Christensenellaceae科的丰度较高会增加重症监护病房中患有神经系统疾病的危重患者的死亡风险。
该分类单元在帕金森病患者中显著富集,尤其是在临床特征较差的患者中。在患有阿尔茨海默病、多发性硬化症和神经性厌食症的人中也观察到了Christensenellaceae科的丰富度增加。
Christensenellaceae科与健康表型或疾病之间关联




Ignatyeva O,et al.Front Microbiol.2024
C.minuta和Christensenellaceae科的有益作用可能归因于它们与肠道中许多其他细菌群落相互作用的特殊能力。除了直接作用外,C.minuta还可以通过促进或限制某些分类群的生长来间接影响宿主。
-与Christensenellaceae正相关的菌群
Christensenellaceae与许多菌群呈正相关,包括:
颤螺菌属(Oscillospira)
瘤胃球菌属(Ruminococcus)
粪球菌属(Coprococcus)
普雷沃氏菌属(Prevotella)
嗜粘蛋白-阿克曼氏菌(Akkermansia muciniphila)
罗氏菌属(Roseburia)
-与Christensenellaceae负相关的菌群
相反,几个属与Christensenellaceae呈负相关:
克雷伯氏菌属(Klebsiella)
链球菌属(Streptococcus)
梭杆菌属(Fusobacterium)
经黏液真杆菌属(Blautia)
Magamonas
▸ 能够促进一些有益菌的生长
此外, Christensenellaceae丰度越高,微生物丰富度和多样性就越高。值得注意的是,几种与之呈正相关的菌群已被提议作为新一代益生菌(Oscillospira、Roseburia)或目前已经是这种身份(Akkermansia)。
–C.minuta能够促进双歧杆菌生长
C.minuta能够促进双歧杆菌属的生长,这是通过产生代谢产物如短链脂肪酸(SCFAs),特别是乙酸和丁酸,这些SCFAs是双歧杆菌属的重要能量来源。这种交叉喂养关系有助于双歧杆菌属在肠道中的定植和增殖。
–C.minuta塑造适合乳酸杆菌生长的环境
C.minuta可能通过产生乳酸来降低肠道pH值,从而为乳酸杆菌属创造一个更适宜的生长环境。此外,C.minuta产生的代谢产物可能直接或间接地激活乳酸杆菌属的代谢途径,增强其在肠道中的竞争力。
–C.minuta促进普拉梭菌生长
Faecalibacterium prausnitzii是一种潜在的下一代益生菌,具有高丁酸生产、抗炎和预防肠道病原体的作用。
研究发现,Christensenella minuta通过产生外源乙酸、半胱氨酸、脯氨酸和赖氨酸来交叉喂养F.prausnitzii,这些都是F. prausnitzii发酵和繁殖所必需的。从而促进了Faecalibacterium prausnitzii的增殖。
–C.minuta与粪肠球菌
C.minuta与F.prausnitzii之间存在正向的相互作用。C.minuta产生的代谢产物可能作为F.prausnitzii的底物,促进其生长和SCFA的生产,特别是丁酸盐,这是一种对肠道健康至关重要的短链脂肪酸。
▸ 减少一些有害菌群
有趣的是,在存在Christensenellaceae的情况下通常会减少几种有害菌群,例如机会性病原体,已知会导致人类和动物感染的克雷伯氏菌和链球菌,以及可能导致癌症的微生物梭杆菌。
因此,我们假设C. minuta可以通过支持有益物种的生长和抑制潜在有害物种来调节肠道微生物群。
–C.minuta抑制克雷伯菌的定植
C.minuta可能通过竞争营养物质或产生抗菌物质来抑制K.pneumoniae等潜在的病原菌。这种竞争和抑制作用有助于维持肠道微生物群的平衡,防止病原菌的过度生长。
–C.minuta限制大肠杆菌的增殖
C.minuta可能通过调节肠道中的氧化还原电位来影响大肠杆菌的生长。由于C.minuta是严格的厌氧菌,它可能通过降低肠道的氧化还原电位来限制需氧菌如大肠杆菌的增殖。
▸ 与甲烷杆菌存在互作并可能影响体重
不同细菌种属很可能通过代谢物转移进行相互作用。Christensenellaceae科和甲烷杆菌科的相互作用可能影响体重指数并呈负相关。

对来自10项独立研究的1821个样本进行了荟萃分析,证实了在科水平(Christensenellaceae科和甲烷杆菌科)和种水平(C.minuta和Methanobrevibacter smithii)之间均存在很强的正相关性。
此外,发现了它们之间的物理和代谢相互作用。作为一种氢气生产者,C.minuta有效地支持了依赖氢气供应的M.smithii的生长。在共同培养时,C.minuta释放的氢气量足以确保M.smithii的生存力,与氢气过量的单一培养中相当。
反过来,M.smithii也能调节C.minuta的代谢,导致短链脂肪酸的产生从丁酸转向乙酸。根据观察到的乙酸盐产量的增加。除此之外,甲烷杆菌科的甲烷生产会导致碳损失和宿主可用能量减少,这可能部分解释了该细菌与体重减轻之间的关联。
Christensenellaceae可能是一种高效益生菌药物的来源,可使许多患者群体受益,尤其是那些患有代谢紊乱和炎症性胃肠道疾病的患者。我们在下面总结了C.minuta作为益生菌在人体健康中的一些作用。
▸ 抗炎作用
C.minuta益生菌活性的所有潜在机制尚未完全了解;不过,已经取得了许多积极的进展。在一系列体外和体内实验中测试了C. minuta DSM 22607。首先,该细菌及其上清液均表现出强大的抗炎潜力,因为它们能够限制HT-29细胞中的IL-8产生,此外发现上清液还能抑制NF-kB信号通路。
从9位捐献者身上分离并测试了 32 株新的C.minuta菌株,以确定最佳候选益生菌药物。他们在一系列实验中分析了这些菌株的抗炎和保护特性,并选出了5种主要候选菌株。五种候选菌株均在体外细胞模型中阻止TNF-α刺激后的NF-kB通路激活并诱导IL-10的产生。
在动物模型中,五种菌株中的两种显著改善了TNBC引起的炎症病变,并具有明显的局部抗炎作用。
此外,还证明了C.minuta菌株在体外模型中刺激人源 PBMC 产生 IL-10的能力。
▸ 保护肠道屏障
其次,C.minuta还显示出保护 TNF-α 受损的 Caco-2 细胞中肠道屏障的能力。这些结果在二硝基苯磺酸(DNBS)和三硝基苯磺酸(TNBS)诱发的结肠炎小鼠模型中得到了证实。
在这两项实验中,C.minuta表现出独特的抗炎特性,保护结肠组织的效果与5-氨基水杨酸(5-ASA)一样有效。该细菌减少了宏观和微观化学损伤,减少了结肠中的免疫细胞浸润(ICI),限制了氧化应激,并降低了促炎细胞因子的分泌和脂质运载蛋白-2的表达。
▸ 能够产生乙酸盐、丁酸盐
实验还揭示了C. minuta的代谢作用,特别是其产生大量乙酸盐和适量丁酸盐的能力。据报道, C.minuta可以同时产生短链脂肪酸(SCFA)中的乙酸盐和丁酸盐,而大多数微生物只能产生丁酸盐或乙酸盐其中一种。
▸ 抗肥胖能力
对C.minuta DSM22607 的抗肥胖能力进行了研究。他们发现,每天施用2×10^9个C. minuta菌落形成单位(CFU)可防止喂食高脂饮食(HFD)的小鼠体重增加和高血糖,但不影响它们的食物摄入量。
令人惊讶的是,食用益生菌菌株的动物和喂食正常食物的动物在体重增加方面没有统计学上的显著差异;然而,接受载体的HFD喂养小鼠体重增加明显且快速。这强烈表明C.minuta通过改变新陈代谢而不是影响进食行为来限制脂肪堆积。
这些发现与对血清代谢标志物的观察结果相关,即高脂饮食小鼠的瘦素和抵抗素水平下降。C.minuta可能破坏了肝脏脂肪生成,这通过编码葡萄糖激酶的Gck基因表达降低来证明。
此外,益生菌菌株通过上调编码主要紧密连接蛋白的Ocln和Zo1基因,对肠道通透性具有强大的保护作用。这也可能有助于C. minuta通过限制由肠漏引起的全身炎症而发挥抗肥胖作用。
▸ 改善糖尿病
进一步证实了C. minuta的有益作用及其在代谢过程中的关键作用的证据。使用两种Christensenella属菌株(C.minuta DSM 22607 和C.timonesis DSM 102800)治疗小鼠2型糖尿病,两种菌株均改善了许多代谢指标。
管饲益生菌可降低血糖水平、限制氧化应激、促进受损胰岛和肝细胞的修复,并抑制肝脏和结肠中几种促炎细胞因子和 TLR4 的表达。
重要的是,用C.minuta和C.timonesis治疗还上调结肠中的Zonula occludens-1和Claudin-1,从而加强肠道屏障。测试对象血清脂多糖水平下降支持了这一发现。这两种菌株还通过刺激胰高血糖素原的表达、增加血清胰高血糖素样肽-1(GLP-1)水平和限制肝糖异生,对代谢产生了重大影响。
总体而言,C.minuta和C.timonesis改善了2型糖尿病的代谢过程并减轻了炎症反应。
▸ 免疫调节作用
C.minuta能够通过调节肠道微环境影响宿主的免疫系统。研究表明,C. minuta能够促进Th17细胞的分化,这些细胞在维持肠道免疫耐受和防御病原体入侵方面发挥着关键作用。
此外,C.minuta还可能通过与其他肠道共生菌的复杂相互作用,间接影响宿主的免疫系统。肠道微生物群落之间的相互作用是复杂的,C.minuta通过其代谢产物和分泌物,可以影响其他菌群的生长和功能,进而调节宿主的免疫反应。这种间接调节机制为宿主免疫系统提供了额外的调节途径。
最后,C.minuta对宿主免疫系统的调节作用可能还与其在肠道中的定植能力有关。研究表明,C.minuta在人体肠道中具有较高的遗传性,这意味着它能够有效地定植并长期存在于宿主肠道中。这种定植能力可能是C. minuta发挥其免疫调节作用的基础。
▸ 增加有益菌丰度,改善肠道菌群组成
此外,Christensenella菌株通过增加许多有益微生物(如双歧杆菌和Phascolarctobacterium)的丰度来改变肠道微生物群的组成。
06
调节C.minuta的策略
调节C.minuta的策略可以通过多种途径实现,包括饮食调节、益生菌和益生元的使用、药物治疗以及功能性食品的摄入。
▸ 通过饮食调节C.minuta的策略
调节肠道共生菌C.minuta的一种有效方法是通过饮食。
研究表明,某些食物成分可以促进C.minuta的生长和活性。例如,高纤维食物,如全谷物、豆类、坚果和水果,可以作为益生元,为C.minuta提供必要的营养物质。这些纤维在肠道中被微生物发酵,产生短链脂肪酸,这些物质对C.minuta的生长至关重要。
此外,一些特定的益生元,如低聚果糖和菊粉,已被证明能够特异性地增加C.minuta的数量。
▸ 益生元和合生元的应用
益生元是指能够促进肠道内有益菌生长的非消化性食品成分,而合生元则是益生元和益生菌的组合。在调节C.minuta中,益生元和合生元的应用是两个重要的策略。
益生元如多糖、半纤维素、果胶等,能够通过刺激C.minuta的生长,增强其在肠道中的竞争力。合生元则结合了益生元和益生菌的双重优势,通过提供C.minuta所需的营养物质和直接补充C.minuta,更有效地调节肠道微生物群。
▸ 药物和功能性食品的作用
在某些情况下,药物和功能性食品也可以用于调节C.minuta。例如,某些抗生素可以在必要时用来减少有害菌的数量,为C.minuta提供更好的生长环境。
功能性食品,如含有特定益生菌的酸奶或补充剂,可以直接补充C.minuta,增加其在肠道中的数量。此外,一些植物提取物和天然化合物也被研究用于调节肠道微生物群,包括C.minuta。
主要参考文献
Ignatyeva O, Tolyneva D, Kovalyov A, Matkava L, Terekhov M, Kashtanova D, Zagainova A, Ivanov M, Yudin V, Makarov V, Keskinov A, Kraevoy S, Yudin S. Christensenella minuta, a new candidate next-generation probiotic: current evidence and future trajectories. Front Microbiol. 2024 Jan 11;14:1241259.
Ang WS, Law JW, Letchumanan V, Hong KW, Wong SH, Ab Mutalib NS, Chan KG, Lee LH, Tan LT. A Keystone Gut Bacterium Christensenella minuta-A Potential Biotherapeutic Agent for Obesity and Associated Metabolic Diseases. Foods. 2023 Jun 26;12(13):2485.
Pan T, Zheng S, Zheng W, Shi C, Ning K, Zhang Q, Xie Y, Xiang H, Xie Q. Christensenella regulated by Huang-Qi-Ling-Hua-San is a key factor by which to improve type 2 diabetes. Front Microbiol. 2022 Oct 12;13:1022403.
Mazier W, Le Corf K, Martinez C, Tudela H, Kissi D, Kropp C, Coubard C, Soto M, Elustondo F, Rawadi G, Claus SP. A New Strain of Christensenella minuta as a Potential Biotherapy for Obesity and Associated Metabolic Diseases. Cells. 2021 Apr 6;10(4):823.
Relizani K, Le Corf K, Kropp C, Martin-Rosique R, Kissi D, Déjean G, Bruno L, Martinez C, Rawadi G, Elustondo F, Mazier W, Claus SP. Selection of a novel strain of Christensenella minuta as a future biotherapy for Crohn’s disease. Sci Rep. 2022 Apr 11;12(1):6017.
Waters JL, Ley RE. The human gut bacteria Christensenellaceae are widespread, heritable, and associated with health. BMC Biol. 2019 Oct 28;17(1):83.
Pető, Á.; Kósa, D.; Szilvássy, Z.; Fehér, P.; Ujhelyi, Z.; Kovács, G.; Német, I.; Pócsi, I.; Bácskay, I. Scientific and Pharmaceutical Aspects of Christensenella minuta, a Promising Next-Generation Probiotic. Fermentation 2023, 9, 767.
Xu C, Jiang H, Feng LJ, Jiang MZ, Wang YL, Liu SJ. Christensenella minuta interacts with multiple gut bacteria. Front Microbiol. 2024 Feb 19;15:1301073.

谷禾健康

随着技术的发展,高通量测序技术已成为研究微生物群落的重要工具。这种技术使得科学家们能够解析巨量微生物DNA序列,从而获得丰富的微生物组数据,包括16S rRNA基因、ITS序列和宏基因组。然而,这些数据只是迈向揭示微生物群落复杂性的第一步。
通过对环境样本的可变区域如16S、18S、ITS序列进行高通量测序获得的原始序列数据,再对其进行聚类,数据分析,统计学差异比较等得到微生物多样性分析报告。那么,什么是微生物群落多样性?
微生物群落多样性(Microbial Community Diversity)是指在特定环境中存在的微生物种类的数量和分布情况,它不仅包含不同种类微生物的丰度,还包括它们之间的相互关系。多样性可以从不同角度进行评价,主要分为以下几种:
α多样性(Alpha Diversity): 这是衡量某一特定样本内部多样性的一种指标。常用的α多样性指标包括物种丰富度(Species Richness)、香农指数(Shannon Index)和辛普森指数(Simpson Index)。这些指标可以帮助我们了解样本内部的复杂性和均一性。
β多样性(Beta Diversity):不同样本之间的多样性比较被称为β多样性。常用的β多样性指标包括Bray-Curtis距离和Jaccard指数,通过这些指标可以探索样本之间的相似性和差异性,揭示不同环境或条件下微生物群落的变化模式。
γ多样性(Gamma Diversity): 这是指在一个更大尺度、多个样本的总体多样性,通常用以评估一个较大区域的整体多样性水平。
为理解这些多样性指标,我们可以借助一些简单的比喻来形象解释。例如,α多样性就像是在观察一个花园的花卉种类和数量;β多样性则是比较不同的花园之间的相似性或不同之处;而γ多样性则是对一个城市中所有花园的总览评价。
在接下来的部分中,我们将深入探讨这些多样性指标的详细内涵,以及从多个角度展示如何通过高通量测序技术解析微生物群落中的这些多样性规律。
下图是实验上机测序流程,提取的样本总DNA经过质检、PCR扩增、建库等步骤进行高通量测序得到测序原始数据。

原始数据经过Reads拼接、tags过滤、去嵌合体等步骤得到有效数据clean data。在特定的相似度下进行聚类得到OTU/ASV,报告中通过降噪方法得到ASV表,一切后续分析都围绕ASV表来进行。根据ASV表可以继续做物种分类注释、丰度计算、多样性分析、差异分析、功能预测等。所以ASV特征表是微生物多样性分析中关键数据结果。
OTU和ASV的区别
OTU和ASV是微生物组学中用来表示微生物多样性的两个不同概念。两者都是从环境样本中获得的DNA序列数据,通过一定的分析方法分类得到的用于表示微生物种类或种群的单位。它们之间的主要区别在于定义的精确度和建立的方法。
– OTU(Operational Taxonomic Units):
OTU是一种将序列通过相似度聚类的传统方式,来表示相似序列组成的种群。通常,这种聚类方法会将序列之间相似度达到97%(或其他设定的阈值)的序列分到同一个OTU。OTU聚类通常不考虑序列中的单个变异位点,而是基于整体相似度。
由于使用阈值聚类,OTU不能准确反映序列之间的实际差异,可能会将生态学意义上不同的微生物序列归为一个OTU。OTU分析可能过于简化,有时无法捕获低水平的微生物多样性。
– ASV(Amplicon Sequence Variants):
ASV采用较新的降噪方法,可以精确地解析序列中的每一个核苷酸差异,简单来说就是以100%相似度进行聚类,对低质量序列进行去除和校正,这种方法可以生成“零半径OTU”,即互不相同的基于序列的变体。
ASV通常使用误差校正算法来排除测序错误,从而提供更精确的序列变体识别。ASV方法对单一核苷酸变异敏感而能提供更细粒度的微生物多样性解析。ASV为每一种变异提供更一致、可复制的标识符,这在比较不同研究之间的微生物群落组成时非常有用。
简而言之,ASV方法提供了比OTU更高分辨率、更精准的序列变体检测。换句话说,ASV提供了一种微生物组多样性分析的“高清”视角,它更可能捕捉到微生物群落内变化的微妙差异,尤其是在不同环境或时间点间的比较中。
原始序列数据(raw tags)经过质控、过滤、去嵌合体,最终得到有效数据(effective tags)。再对有效数据进行UNOISE降噪处理,得到ASV特征表。数据处理过程中各步骤得到的序列进行途径统计,可以直观的反映每个样本的数据量和物种丰度。
文件目录:
01_pick_otu/summary/sumOTUPerSample.txt
raw-tags:每个样本的原始序列数据;
singleton :每个样本中无完全匹配的单条序列的数量。singleton ASV 是指只有单条代表序列的 ASV,可能由于测序错误,或者是来自于PCR过程中产生的嵌合体;
tagsmatchedASVs: 每个样本中比对到ASVs的最终有效序列数据 及其比例,聚类的同时vsearch会根据UCHIME算法将singleton ASV及嵌合体去除,得到最终的有效序列数据 Effective Tags;
ASVs:每个样本的ASVs数量。
一般文献中的测序原始数据量raw-tags 要求达到3万条以上,可以满足数据分析的基本要求。绝大多数文献数据量平均在5万条左右。世面上不同公司承诺的数据指标有所不同,谷禾测序得到的原始数据一般可以达到10万 reads左右,足够满足当前文章发表要求的参考数据量。
若原始数据量低于1万条,尤其是少于3000条reads以下,则很有可能受环境污染的杂带较多,建议重新上机补测数据。ASVS列可以反映每个样本的物种多样性,一般一个ASVs就代表一个物种。因此可以用ASV数量来代表物种数量。将每个样本的有效原始数量和ASVs数据可视化做成柱状图,可以更直观的观察每个样本/分组数据量的变化。
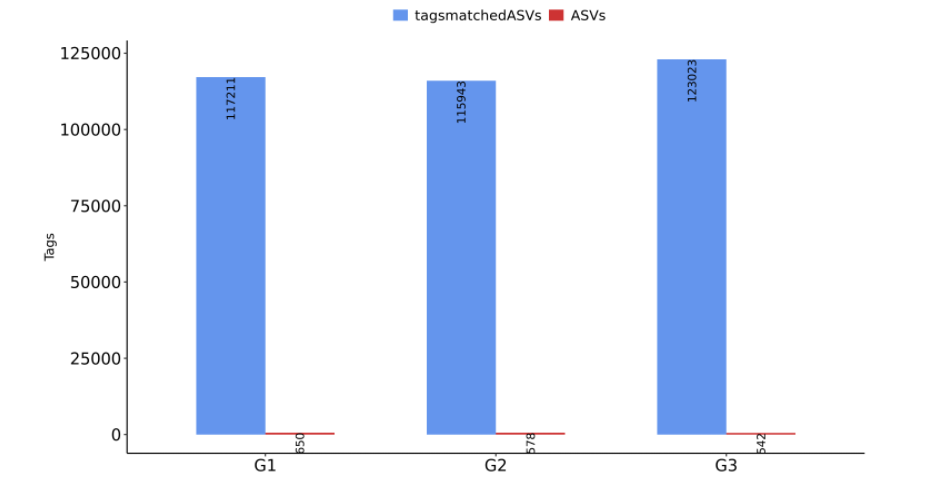
每个样本/分组可能会有一些共有的和独有的ASV,通常用韦恩图或花瓣图表示(样本数/分组数<=5个样本用维恩图,数量大于5出花瓣图)。除了用Venn图将几个数据集之间的交集进行可视化,还可以使用upset图表示。
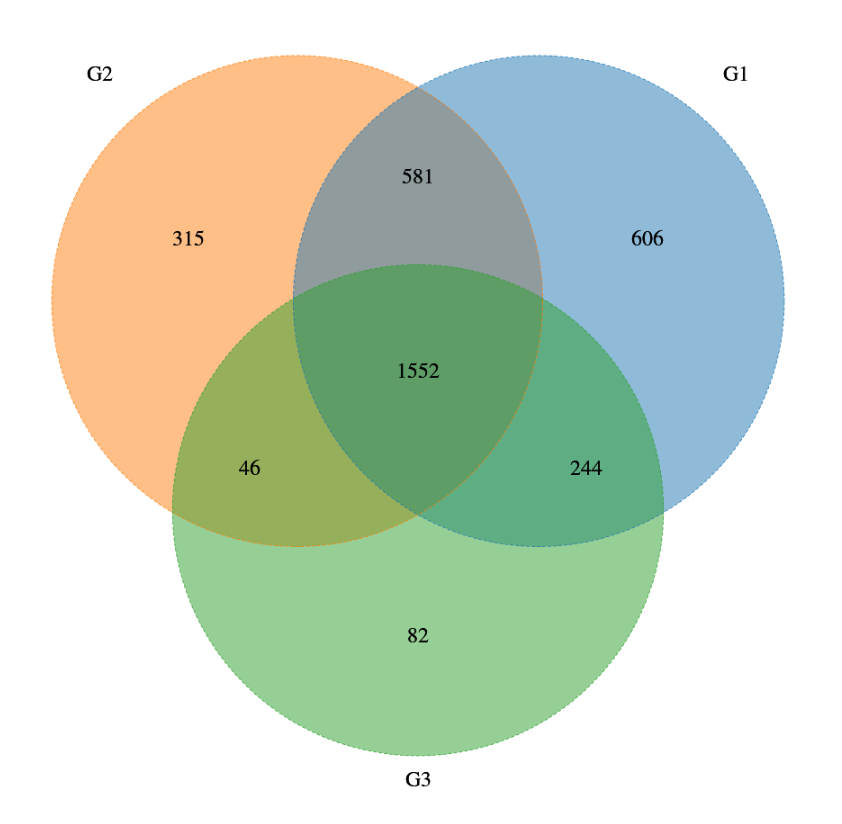
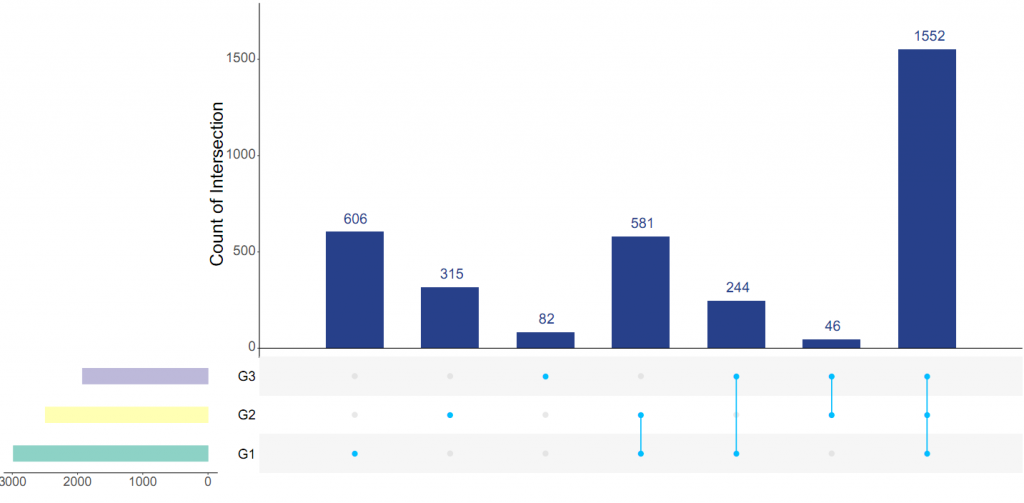
韦恩图中不同颜色的圆圈代表一个样本/分组,圈之间的重迭区域表示样本/分组间共有的ASVs,每个区域的数字大小表示该区域对应的ASVs数目。
UpSet图主要包含三个部分:上部分为各个分组独有和共有的ASV数量,下部分为各个分组独有和共有的分类情况,左部分每一个行代表一个分组。
alpha多样性主要用来衡量单个样本内的菌群多样性,不涉及样本之间的比较。alpha多样性与两个因素相关,分别是:一、丰富度(richness),二、多样性(diversity)。
丰富度指的是单个样本物种的种类数目;而多样性是指菌群在个体中分配的均匀度。样本的丰度高不一定就代表菌群的多样性丰富,丰度高如果是因为里边含有较多低丰度的杂带,这些可能是来源于环境的污染物导致的,这些低丰度的物种并不会使菌群的多样性增加。
alpha多样性有三类相关指数,其中包括菌群丰度指数(Chao1和ACE)、菌群多样性指数(shannon和simpson)和测序深度指数(Goods coverage和Observed spieces)。
Chao1:Chao1算法用于评估样本中所含ASV数目的指数,Chao1在生态学中常用来估计物种总数,由Chao(1984)最早提出。通过计算群落中只检测到1次和2次的ASV数估计群落中实际存在的物种数。chao1指数可以评估一个样本中的ASV数量,chao指数越大,ASV数目越多,说明该样本物种数越多。
计算公式如下:
编辑
其中:
Schao1=估计的OTU数;
Sobs=观测到的OTU数;
n1=只有一条序列的OTU数目(如“singletons”);
n2=只有两条序列的OTU数目(如“doubletons”)。
ACE:用来估计群落中含有ASV数目的指数,由Chao提出,是生态学中估计物种总数的常用指数之一,与Chao1的算法不同。预设将序列量10以下的ASV都计算在内,从而估计群落中实际存在的物种数。
计算公式如下:
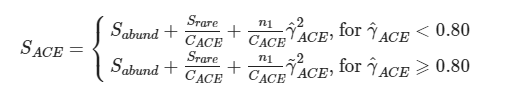
其中
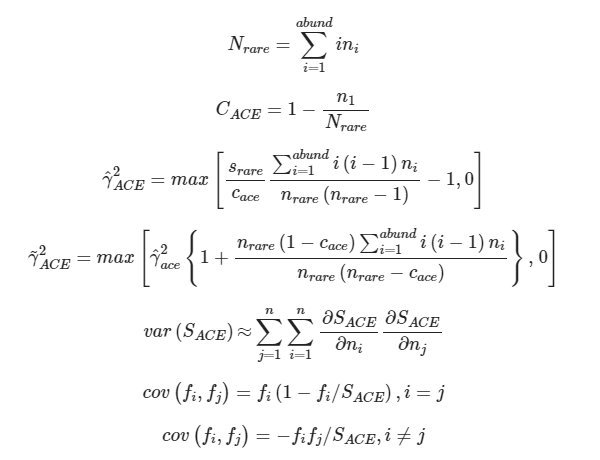
ni=含有i条序列的ASV数目;
Srare=含有“abund”条序列或者少于“abund”的OTU数目;
Sabund=多于“abund”条序列的OTU数目;
abund=被视为“优势”的ASV的阈值,默认为10。
Shannon:香农-威纳指数综合考虑了群落的丰富度和均匀度,是用来评估样本中微生物多样性指数之一。Shannon指数值越高,表明群落的多样性越高。
计算公式如下:
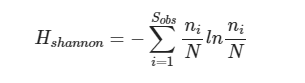
其中:
Sobs=观测到的ASV数目;
ni=含有i条序列的ASV数目;
N=所有的序列数。
Simpson:辛普森多样性指数对菌群多样性评估,Simpson指数值越高,表明群落多样性越高。由EdwardHugh Simpson(1949)提出,在生态学中常用来定量描述一个区域的生物多样性。一般而言,Shannon指数侧重对群落的丰富度以及稀有ASV,而Simpson指数侧重均匀度和群落中的优势ASV。
计算公式一如下:
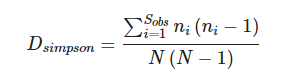
计算公式二如下:
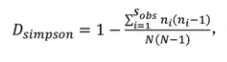
此时,Simpson指数越大,说明群落多样性越大。报告中用到的是计算公式二。
其中:
Sobs=观测到的ASV数目;
ni=含有i条序列的ASV数目;
N=所有的序列数。
Coverage:是指各样品克隆文库的覆盖率,其数值越高,则样品中序列被测出的概率越高,而没有被测出的概率越低。该指数反映本次测序结果是否代表了样品中微生物的真实情况。
计算公式如下:
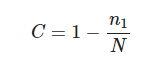
其中:
n1=只含有1条序列的ASV数目;
N=所有的序列数。
下表统计了每个样本的各项alpha多样性指标:
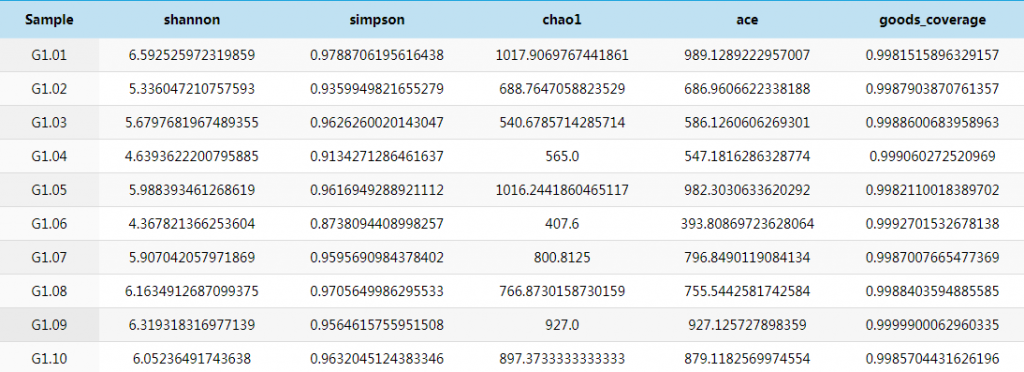
结果目录:
03_diversity-metrics/alpha/alpha_div.txt
可以选择不同的alpha多样性指数进行显著性差异比较,一般常用丰富度指数Chao1,多样性指数Shannon、simpson,比较不同组间指数是否有显著差异。Alpha多样性分析将样本的菌群群整体研究并转换为具体的指数与p值,来说明群落的变化与差异。
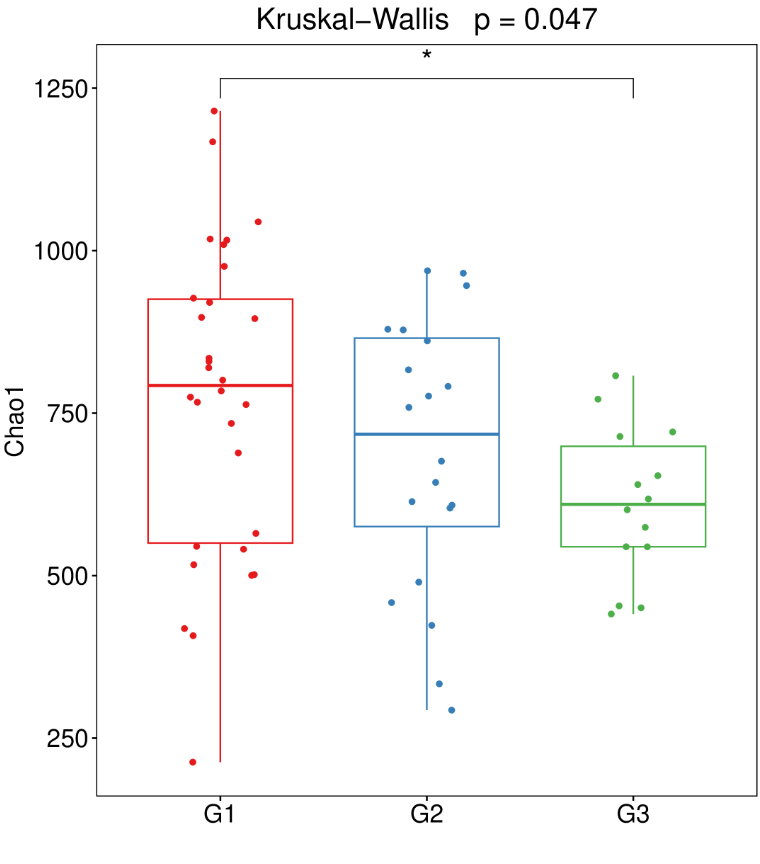
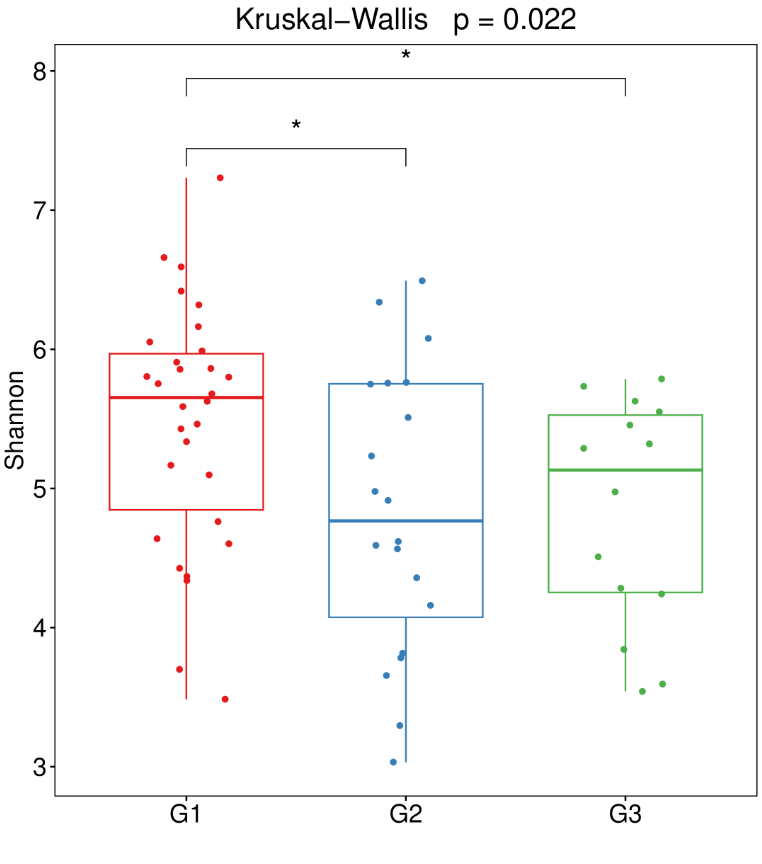
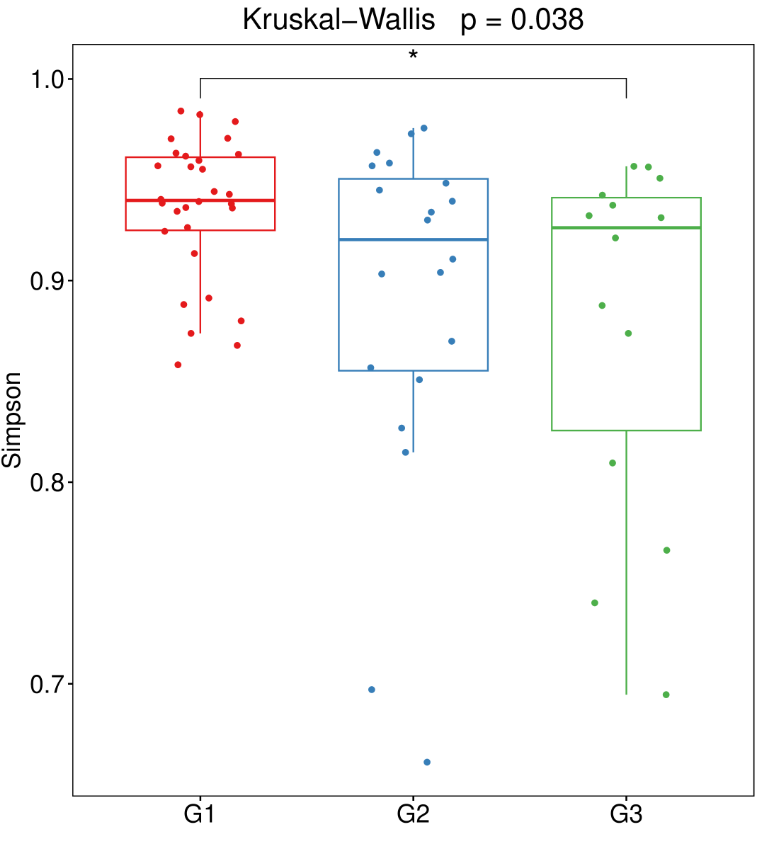
•稀释性曲线(Rarefaction curve)
稀释曲线是从每个样本中随机抽取一定数量的序列,统计这些序列所代表的ASV数目,以随机抽取的序列数与ASV数量来构建曲线。可以用来比较不同样本中的物种多样性,也可以用来说明样本出测序数据量是否足以反映环境中的物种多样性。
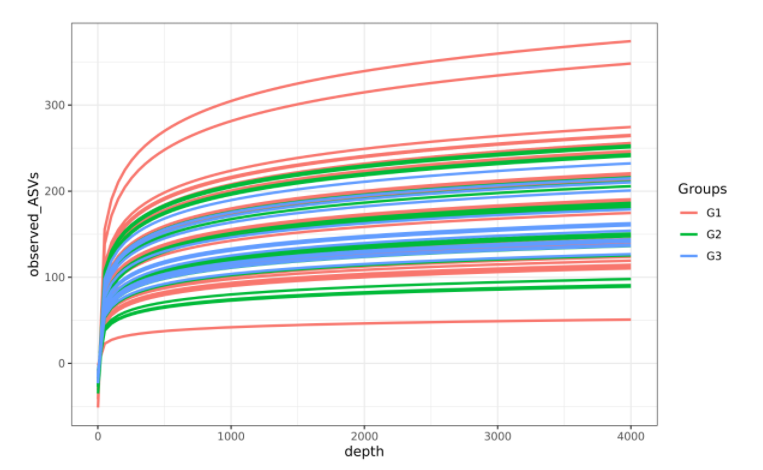
•
菌群多样性指数(shannon和simpson)
丰度等级曲线(Rank abundance curve)是分析多样性的一种方式。构建方法是统计单一样品中,每一个OTU所含的序列数,将OTU按丰度(所含有的序列条数)由大到小等级排序,再以OTU等级为横坐标,以每个OTU中所含的序列数(也可用OTU中序列数的相对百分含量)为纵坐标做图。
Rank-abundance曲线可用来解释多样性的两个方面,即物种丰度和物种均匀度。在水平方向,物种的丰度由曲线的宽度来反映,物种的丰度越高,曲线在横轴上的范围越大;曲线的形状(平滑程度)反映了样品中物种的均度,曲线越平缓,物种分布越均匀。
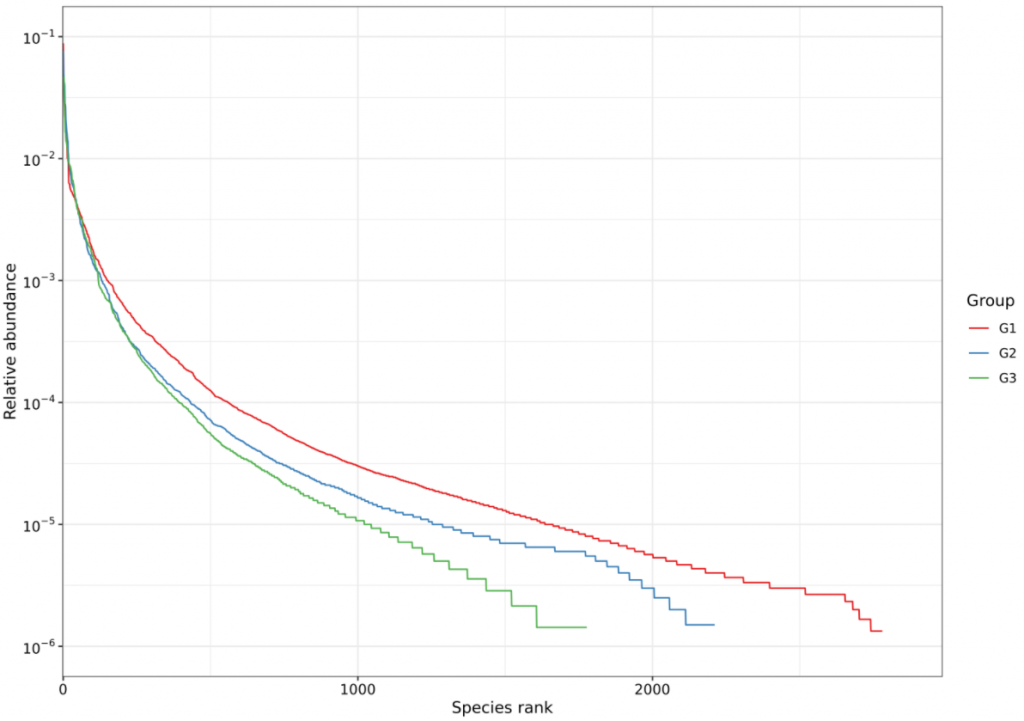
Beta多样性指的是样本间多样性,Beta多样性是衡量个体间菌落构成相似度的一个指标。通过计算样本间距离可以获得beta多样性距离矩阵,Beta多样性计算主要基于OTU的群落比较方法,有欧式距离、bray curtis距离等,这些方法优势在于算法简单,考虑物种丰度(有无)和均度(相对丰度),但其没有考虑OTUs之间的进化关系,认为OTU之间不存在进化上的联系,每个OTU间的关系平等。
另一种算法Unifrac距离法,是根据系统发生树进行比较,并根据16s的序列信息对OTU进行进化树分类,因此不同OTU之间的距离实际上有“远近”之分。而其他距离算法认为OTU之间的关系是平等的。Unifrac距离分为加权距离和非加权距离。
1
欧式距离(Euclidean distance):
欧几里得距离是空间中两点间“普通”(即直线)距离。
2
Bray-Curtis距离:
Bray-Curtis距离是生态学中用来衡量不同样地物种组成差异的测度。由J. Roger Bray and John T. Curtis 提出。其计算基于样本中不同物种组成的数量特征(多度,盖度,重要值等)。
计算公式为:
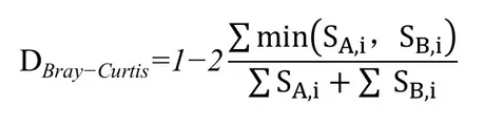
SA,i=表示A样本中第i个OTU所含的序列数;
SB,i=表示B样本中第i个OTU所含的序列数。
3
Unweighted UniFrac距离:
非加权距离包含特征之间的系统发育关系的群落差异定性度量。
4
Weighted UniFrac距离:
加权距离包含特征之间的系统发育关系的群落差异定量度量。
两者的区别在于:Weighted Unifrac 距离是一种同时考虑各样品中微生物的进化关系和物种的相对丰度,计算样品的距离,而Unweighted Unifrac则只考虑物种的有无,忽略物种间的相对丰度差异。
一般采用PCA、PCoA、NMDS等进行图像化展示,区分样本间的菌群组成差异。其原理是利用降维思想把样本平铺到二维平面上,使得相似的样品距离相近,相异的样品距离较远。
PCA图是基于ASV table的欧式距离,PCoA是基于两两样品之间的距离矩阵(有Bray-Curtis距离、加权距离、非加权距离),基于距离矩阵的统计检验方法有ANOSIM相似性分析和Adonis多元方差分析。
Anosim分析是一种非参数检验,用来检验组间差异是否显著大于组内差异,从而判断分组是否有意义。对 Anosim 的分析结果,基于两两样本之间的距离值排序获得的秩(组间的为 between,组内的为 within),这样任一两两组的比较可以获得三个分类的数据,并进行箱线图的展示(若两个箱的凹槽互不重迭,则表明它们的中位数有显著差异)。
该方法主要有两个数值结果:R值,用于比较不同组间是否存在差异;P值,用于说明是否有显著差异。
R-value 介于(-1,1)之间,R-value > 0,说明组间差异大于组内差异。R-value < 0,说明组间差异小于组内差异, R只是组间是否有差异的数值表示,并不提供显著性说明。统计分析的可信度用 P-value 表示,P< 0.05 表示统计具有显著性。
Adonis检验,多元方差分析,其实就是PERMANOVA,亦可称为非参数多元方差分析。其原理是利用距离矩阵(比如基于Bray-Curtis距离、Unifrac距离)对总方差进行分解,分析不同分组因素对样品差异的解释度,并使用置换检验对其统计学意义进行显著性分析。它与Anosim的用途相似,也能够给出不同分组因素对样品差异的解释度(R值)与分组显著性(P值)。
PCA(Principal Components Analysis)即主成分分析,首先利用线性变换,将数据变换到一个新的坐标系统中;然后再利用降维的思想,使得任何数据投影的第一大方差在第一个坐标(称为第一主成分)上,第二大方差在第二个坐标(第二主成分)上。
这种降维的思想首先减少数据集的维数,同时还保持数据集的对方差贡献最大的特征,最终使数据直观呈现在二维坐标系。经过一系列的特征值和特征向量进行排序后,选取PCA分析得到的前三个主成分(PC1、PC2和PC3)中的任意两个数据作图。通过PCA 可以观察个体或群体间的差异。
主坐标分析 PCoA (Principal component analysis)是一种非约束性的数据降维分析方法,可用来研究样本群落组成的相似性或相异性。通过 PCoA 可以观察个体>或群体间的差异。
它与PCA类似,两者的区别为PCA是基于样本的相似系数矩阵(如欧式距离)来寻找主成分,而PCoA是基于距离矩阵(欧式距离以外的其他距离)来寻找主坐标。我们基于Bray-Curtis 距离、 Weighted Unifrac 距离和Unweighted Unifrac 距离来进行 PCoA 分析。
该图是基于Bray-Curtis距离做的PCoA图,图中右下角的P值就是基于Adonis检验得到的结果:
编辑
非度量多维尺度分析 NMDS 分析(Nonmetric Multidimensional Scaling)与上述 PcoA 分析类似,也是一种基于样本距离矩阵的分析方法,通过降维处理展现样本特定的距离分布。
与 PcoA 的区别是 NMDS 分析不依赖于特征根和特征向量的计算,而是通过对样本距离进行等级排序,使样本在低维空间中的排序尽可能符合彼此之间的距离远近关系(而非确切距离数值)。因此,NMDS 分析不受样本距离的数值影响,对于结构复杂的数据排序结果可能更稳定。
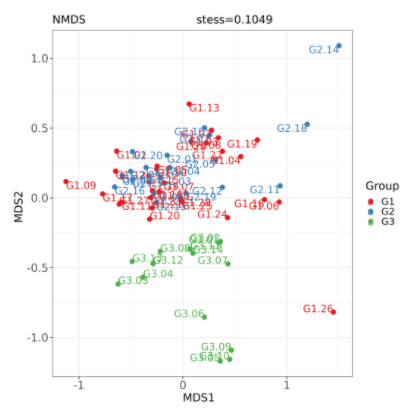

谷禾健康

“胖!可怎么办?”《柳叶刀》发布的一项报告称,截止2022年,全球超过10亿人患有肥胖症,超过20亿人存在超重。从1990年到2022年间,全球患肥胖症的成年人增加了一倍多,患肥胖症的儿童和青少年(5至19岁)更是增加了约3倍。超重和肥胖已成为全球日益严重的流行病。
超重和肥胖的不良影响可能不会马上体现,有时会延迟十年或更长时间。流行病学研究证实,超重和肥胖程度的增加是寿命缩短的重要预测因素。在一项心脏研究中,在30岁到42岁之间,体重每增加一磅(0.45公斤),26年内死亡的风险增加1%,在50岁到62岁之间,死亡风险增加2%。
肥胖还会引起或加剧许多健康问题,这些问题既有独立的,也有与其他疾病相关的。例如超重和肥胖增加了患高血压、冠心病和中风等心血管疾病的风险。肥胖还是2型糖尿病主要风险因素;此外,肥胖和超重人群更容易患上睡眠呼吸暂停、哮喘和其他呼吸系统问题。过重的身体还会给骨骼和关节造成巨大压力,增加骨质疏松症和关节炎的风险。
“那么我们应该如何改善或是预防肥胖呢?”除了常规的“管住嘴,迈开腿”,谷禾在最近与减肥前后相关的检测中发现,在不改变其他生活方式和饮食的情况下,额外补充一定量的膳食纤维对减肥的帮助效果显著。
肠道菌群已越来越多地被认为是宿主生理和病理的重要调节器。肠道菌群调节炎症、脂肪储存和葡萄糖代谢进而影响体重和代谢健康。
而对肠道微生物群影响最大的是饮食,人类从食物中提取和储存卡路里的能力至少部分受到肠道微生物的影响。这使得饮食成为驱动人类肠道微生物群组成的重要因素。
膳食纤维是一种来自植物的复合多糖,在消化过程中不被小肠吸收,并通过为微生物生长提供底物来改变肠道微生态环境。膳食纤维可能会改变微生物群的丰度、多样性和代谢,包括短链脂肪酸的产生。最近的研究表明,富含膳食纤维的饮食具有预防肥胖的潜力。
首先,膳食纤维的物理化学性质(粘性、可发酵性等)具有预防肥胖的作用,因为粘稠的纤维可以延长胃排空和小肠运输时间,从而增加饱腹感,减少进食频率,降低热量的摄入。
其次,膳食纤维可通过增加代谢相关有益肠道菌群的丰度和多样性来改善能量稳态并预防肥胖,降低门水平上厚壁菌门/拟杆菌门的比例(F/B比)并增加罗氏菌属(Roseburia)的相对丰度。
第三,膳食纤维可被肠道菌群发酵产生短链脂肪酸 (SCFA),通过降低肠道腔内pH值、抑制致病或有害肠道细菌、减少脂多糖(LPS)和代谢有害化合物,在能量代谢方面发挥重要作用。同时,研究还表明,在高脂膳食中添加纤维可降低外周血炎症水平,在本文一起了解下肥胖的原因,哪些肠道菌群参与肥胖及其作用机理,此外,我们还分享了几个根据检测报告针对性调整和补充膳食纤维合生元等干预措施减重改善健康的案例。
肥胖不仅仅是因为吃得多这一个原因造成的,而是由多种因素共同导致的慢性代谢性疾病。
肥胖受到遗传、环境、生活方式、社会心理因素、内分泌和健康状况、个体的微生物和营养差异等因素的影响,这些因素通过能量摄入和消耗的生理机制相互作用,最终导致了肥胖。
变胖最直接的原因就是能量摄入与能量消耗的不平衡。我们知道,要维持健康的体重,需要保持食物摄入和能量消耗的平衡。

★ 摄入大于消耗时,变成脂肪慢慢堆积
当一天中人体的能量摄入大于能量消耗时,多余的能量就会被储存为脂肪、糖原或蛋白质,而体重就会上涨;相反,当摄入量小于消耗量时,机体就会通过转化储存能量(大部分来源于脂肪)来弥补热量差,体重就会下降。
简单来说就是:当你吃的比消耗的多时,能量储存=能量摄入-能量消耗
尽管在过去的20年里,环境变化导致了肥胖率的上升,但家庭和双胞胎研究表明,遗传因素在肥胖的发展中也起着关键作用。
★ 瘦素等基因突变易导致肥胖
迄今为止,已确定十几个基因的变异是肥胖的单基因原因;包括瘦素、瘦素受体、黑皮质素3受体和黑皮质素4受体(MC4R)基因。
最著名的肥胖相关基因是瘦素(ob)及其受体(db)基因。洛克菲勒大学的研究首次发现ob基因突变和缺乏ob基因的小鼠导致严重肥胖,能量摄入增加(暴饮暴食),但能量消耗减少(代谢率、产热和身体活动减少)。
注:该基因产物后来被描述为循环因子,命名为瘦素。瘦素主要由脂肪细胞分泌,循环至全身并穿过血脑屏障屏障来传递饱腹信号,从而减少食物摄入。
★ 肥胖的遗传原因大致可分为:
1)单基因原因:由单个基因突变引起,主要位于瘦素-黑皮质素通路。许多基因,如PYY(食欲促进基因)或MC4R(黑皮质素4受体),被发现与单基因肥胖有关,这些基因会破坏食欲和体重的调节系统以及位于下丘脑弓状核的受体感知激素信号(胃促生长素、瘦素、胰岛素)。
罕见的单基因缺陷与高饥饿水平有关,并可能导致幼儿严重肥胖。
2)综合征性肥胖是由神经发育异常和其他器官/系统畸形引起的严重肥胖。这可能是由单个基因或包含多个基因的较大染色体区域的改变引起的。
3)多基因肥胖是由许多基因的累积作用引起的。这些类型的基因存在会导致热量摄入增加、饥饿感增加、饱腹感减少、储存身体脂肪的倾向增加以及久坐不动的倾向增加。
★ 有肥胖家族史的人患肥胖风险较高

一项研究发现,如果父母一方肥胖,孩子成年后患肥胖的风险会提高3倍;而如果父母双方都肥胖,那么孩子成年后患肥胖的风险会提高10倍。(当然这在一定程度上也可能与相同的生活方式有关)
一项针对260名儿童(139名女性、121名男性,年龄分别为2.4岁至17.2岁)的横断面观察研究表明,心脏代谢疾病家族史和肥胖是儿童期肥胖严重程度的关键危险因素。
生活方式等环境因素在肥胖发展中也发挥作用。肥胖患病率的显著增加与饮食和生活方式的改变密切相关。
在工业化国家,教育程度较低和收入较低的人超重和肥胖的发生率较高,尽管发展中国家的情况可能正好相反。
例如,生活在美国的皮马印第安人平均比生活在墨西哥的皮马印第安人重25公斤。生活在美国的非洲人也出现了类似的趋势。
在男性和女性中,超重和肥胖的患病率随着年龄的增长而增加,直到50至60岁;这在20岁到40岁之间尤为明显。结婚后,超重的趋势也会增加。
★ 高糖的零食和饮料加剧了肥胖
在众多导致肥胖的因素中,过量食用高热量食物是罪魁祸首之一。目前,无论是发达国家还是发展中国家,高热量食物在食品行业的大规模生产和营销方面都相当成功。这类食物在商店、餐馆、超市和家庭中随处可见。
两餐之间(尤其是晚餐后)吃零食,以及每天饮用果汁、碳酸饮料、糖果和高糖食物。这些不健康的饮食与肥胖风险增加密切相关。
★ 运动量的减少也导致肥胖率增加
体育锻炼应该是人们日常生活的一部分,但是随着青少年的学业负担增加、中年人的工作负担沉重,运动量大幅减少。如果平时不注意运动,长时间久坐,会导致脂肪堆积,从而出现肥胖的现象。
其他可能导致身体活动减少的因素包括花在电子游戏和移动设备上的时间增加,而花在户外活动上的时间减少。这些不良习惯都会损害人们的健康。
★ 睡眠不足导致皮质醇升高也不利于减肥
缺乏充足睡眠会引发皮质醇水平的升高,这对身体的减肥过程是不利的,因为高水平的皮质醇可能会干扰新陈代谢和影响体重管理的效果。
你也许见过,本来身材挺匀称的一个人,因为生病或是吃了一些药物而迅速变胖,这就是内分泌紊乱进而导致肥胖的结果。
许多外周激素参与中枢神经系统(CNS)对食欲和食物摄入、食物奖励或成瘾的控制。美味的食物和一些药物都能激活中脑边缘多巴胺(DA)奖励系统,而该系统对于调节人类和动物的成瘾至关重要。
★ 瘦素、胰岛素等激素会影响进食行为
来自脂肪组织的瘦素、胰腺的胰岛素和胃肠道的胆囊收缩素、胰高血糖素样肽-1(GLP-1)、肽YY3-36(PYY3-36)和生长素释放肽参与通过主要针对下丘脑和脑干的神经激素肠脑轴传递有关饥饿和饱腹信号,这些信号可能会直接或间接地调节食欲,影响个体的进食行为。
瘦素和瘦素受体的基因缺陷可导致儿童早发性严重肥胖。同时当内分泌系统出现紊乱时,可能会导致个体无法有效地控制食欲,进而对食物上瘾或是出现严重的暴饮暴食症。
肠道能量吸收、饱腹感调节和全身炎症
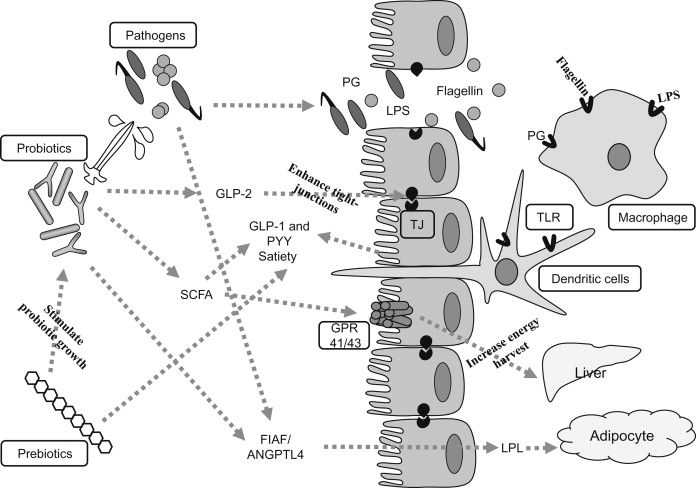
DOI:10.1016/B978-0-12-407825-3.00011-3.
★ 内分泌紊乱影响代谢更易导致肥胖
一些疾病如甲状腺功能减退会影响基础代谢率,导致能量代谢异常,进而影响体重控制,甚至引发肥胖。
胰岛素抵抗是指身体细胞对胰岛素的反应下降,导致血糖不能有效地被细胞吸收利用。这可能导致胰岛素分泌增加,促使脂肪细胞更多地吸收葡萄糖并转化为脂肪,从而引起肥胖。
多囊卵巢综合征(PCOS)一种影响女性生殖系统的疾病,患者常伴有胰岛素抵抗和雄激素水平异常。这些因素会导致体重增加和脂肪堆积,使得患者更容易发展为肥胖。
有证据表明,胎儿在宫内发育期间的营养不良可能决定了肥胖、高血压和2型糖尿病的后期发病,而这与基因遗传无关。这种现象表明,由于宫内生长的改变,可能存在基因表达的长期编程。
★ 胎儿时期的营养不良可能导致中老年时的肥胖
研究人员假设,子宫内不良的营养环境会导致身体器官发育缺陷,从而导致“程序化”的易感性,这种易感性与后来的饮食和环境压力相互作用,在几十年后导致明显的疾病。
这表明胎儿的生长和新陈代谢为了适应出生后营养不足的预期。这可能在子宫内具有生存优势,因为它将可用的营养物质定向到重要器官,并在以后的生活中,通过增加以脂肪形式储存能量的能力,为食物短缺时提供能量储备。
有报告显示腹部脂肪与出生体重呈负相关,一项研究提供了一些有说服力的证据,证明妊娠早期和晚期是随后肥胖发展的关键时期。与没有在怀孕期间接触过饥荒的对照组相比,那些胎儿在怀孕的前两个月接触过饥荒等到成年后的肥胖患病率明显更高。
肠道微生物群在肥胖中的作用是多方面的,并且与肥胖的发生和发展密切相关。肠道微生物群参与能量稳态的调节,并通过影响营养吸收、食欲和脂肪组织功能来影响肥胖的发生。
接下来我们详细了解下肠道微生物群在肥胖中的作用和角色。
越来越多的研究和谷禾实践检测数据表明肠道微生物群与肥胖之间存在着许多相互作用,虽然大人群水平来看,肠道菌群只能解释其中部分的肥胖原因,但是在个体水平上,肠道菌群的状况和构成对于肥胖以及肥胖相关的能量摄入,炎症反应,食物消化等都息息相关。
肠道菌群在肥胖中的作用简单分为两个层面,直接参与与间接影响。
一,菌群是直接影响致肥胖途径还是通过其成分/代谢产物影响致肥胖途径?
二,是否存在导致肥胖的特定宿主-微生物信号传导机制?
队列人群和小鼠研究试验均表明,肥胖个体的肠道微生物群种类和丰富度与正常体重个体存在明显差异。
★ 肥胖人群与健康个体之间占主导的肠道微生物不同
大量研究集中于拟杆菌门和厚壁菌门水平变化与肥胖和减肥之间的动态关系。通过比较瘦人和肥胖个体的肠道菌群,发现大人群水平上肥胖个体的拟杆菌门比例降低,而厚壁菌门水平升高。更有趣的是,经过饮食治疗后,拟杆菌门的相对丰度增加,而厚壁菌门的相对丰度降低。
在谷禾的检测案例里也发现,同一个人减肥前后的肠道菌群构成(如下桑基图展示)发生了较大的变化,有的肠型也会发生改变。
减肥前后的主要肠道菌群构成变化
通过上图的变化可以看到:减肥之后拟杆菌门的比例增加,与此同时,普雷沃氏菌属的丰度也大大增加,其他菌属的构成也有一定程度的变化。
该案例通过饮食管理和膳食纤维补充,减肥后普雷沃氏菌占比为主可能是水果蔬菜、高纤维豆类的饮食摄入相关。
★ 减肥的效果与基线肠道菌群相关
2021年,发表在《Gut Microbes》和《Gastroenterology》两篇研究分别以饮食控制和维生素给予为变量,同时都研究了基线时和干预后肠道菌群的变化。研究结论表示作为节食前个人体重减轻轨迹的预测指标,基线肠道微生物的作用超过了其他因素。
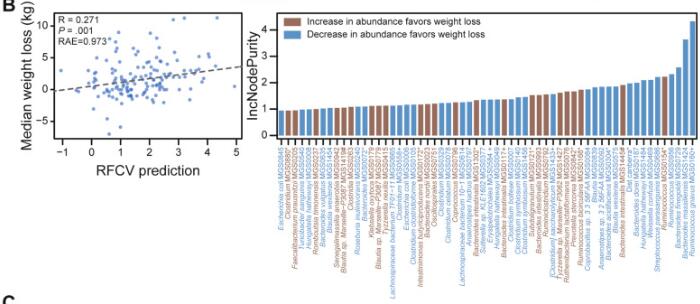
doi: 10.1053/j.gastro.2021.01.029.
同时使用随机森林算法,基于相对于基线的种水平物种变化来预测体重下降,预测精度R=0.271,发现R. gnavus (MGS0160), Bacteroides massiliensis (MGS1424)和Bacteroides finegoldii (MGS0729)这三个物种在模型中贡献度最大。
此外,基线菌属如普雷沃氏菌,罗氏菌属(Roseburia)的丰度也会影响饮食营养干预的减肥效果。
这些研究同时确定有哪些饮食因素与个体的体重下降相关。使用GLMMLASSO模型,结果如下图,当coef为非零时被认为是显著的。发现,在所有受试者中,体重下降与卡路里摄入量(系数=-0.153)、膳食中大量营养素组成(脂肪,系数=-0.161;碳水化合物,系数=-0.055;蛋白质,系数=0.084;纤维,系数=0.1)、膳食微量营养素含量和体力活动之间的具有弱相关。
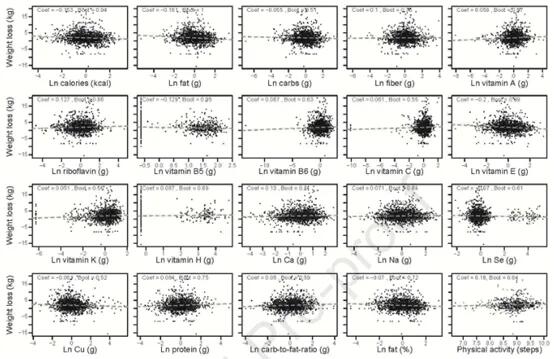
Jie Zhuye, et al., .Gastroenterology, 2021
但是在个体间有很大差异。例如在受试者F00161中,纤维摄入量的增加与减肥之间存在正相关关系,而在F00147中,受试者的脂肪摄入量增加与体重减轻之间存在负相关关系。相反,尽管纤维或脂肪摄入量发生变化,F00203人仍然对体重变化不敏感。所以,即使是相似的膳食大量营养素,体重反应也是高度个性化的。
饮食控制期间肠道菌群的组成变化是否会影响减肥轨迹?
研究发现许多参与者的肠道菌群组成发生了实质性的变化,0-3个月的微生物群的变化幅度与体重下降的程度呈正相关,有15个个体肠型被改变了,体重变化范围从20公斤到+7公斤。这两个时间段都是一致的。这一发现表明,在饮食控制计划中,饮食和肠道菌群之间存在着持续的相互作用。如下图:
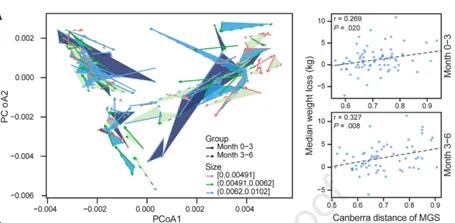
Jie Zhuye, et al., .Gastroenterology, 2021
这些结果表明可以基于基线肠道菌群组成和饮食数据建立个性化的体重预测模型。我们可以利用肠道菌群的分布做个性化的饮食推荐,以此调节体重,进而促进宿主健康。
此外,谷禾根据权威研究和检测大数据库,在菌群检测报告中给出了肥胖,便秘,失眠,过敏等症状相关菌(包括正相关,负相关菌,证据强度,菌的说明和异常菌的个性化干预调整措施)。
如下是谷禾菌群报告里肥胖相关菌的截图展示:
与肥胖症状相关的菌属
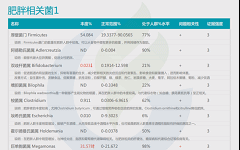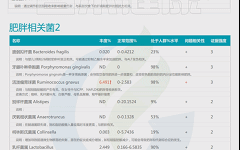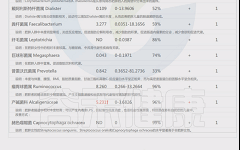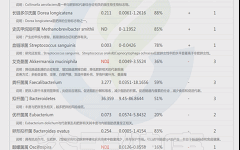
这些菌里,包括有益菌,核心菌,以及有害菌和致病菌等。部分菌在以往文章中详细介绍过:
★ 普雷沃氏菌——在摄入膳食纤维后对减脂更有利
普雷沃氏菌丰度高的健康超重成人在食用富含全谷类和纤维的随意饮食6周后,比普雷沃氏菌丰度低的受试者减脂更多。
普雷沃氏菌的高水平不仅与肥胖有关,且与非糖尿病患者的BMI指数、胰岛素抵抗、高血压和非酒精性脂肪性肝显著相关。
★ Blautia——治疗炎症肥胖相关的潜力菌
Blautia是肠道中常见的乙酸生产者,可通过激活G蛋白偶联受体 GPR41 和 GPR43 来抑制脂肪细胞中的胰岛素信号传导和脂肪积累,进而促进其他组织中未结合的脂质和葡萄糖的代谢,从而减轻肥胖相关疾病。
Blautia是有效减肥组女性肠道菌群中的优势菌属,但在减肥无效组中则不然。Blautia,特别是B. luti和B. wexlerae,可能有助于减少与肥胖相关的炎症。
肠道核心菌属——经黏液真杆菌属(Blautia),炎症肥胖相关的潜力菌
★ Bifidobacterium——减轻体重和减少体脂
双歧杆菌对糖尿病、肥胖症和高脂血症的有益作用也得到了研究,证据显示其对普通人群的血糖水平和胰岛素抵抗具有有益作用,同时还能降低孕妇妊娠糖尿病的发病率。
★ Phascolarctobacterium——帮助减肥
比较容易减肥的人体肠道内考拉杆菌属(Phascolarctobacterium)水平较高,因此该菌也被认为可以用来预测肥胖指标。在代谢综合征女性中观察到的Phascolarctobacterium属的丰度高于代谢综合征男性。
肠道核心菌属——考拉杆菌属(Phascolarctobacterium),与减肥相关?
★ Ruminococcus——含量过多与炎症和肥胖有关
瘤胃球菌(Ruminococcus)在新陈代谢中起着至关重要的作用。
一项研究包括肥胖组(BMI≥40kg/m2)和对照组(BMI18.5~ 24.9kg/m2之间)的粪便菌群,其中Ruminococcus bromii, Ruminococcus obeum 在肥胖患者中丰度较高。
瘤胃球菌喜欢植物中的多糖。如果肠道中有过多的瘤胃球菌,细胞可能会吸收更多的糖,导致体重增加。
★ Desulfovibrio——含量过高与肥胖相关
脱硫弧菌属(Desulfovibrio)里的一种能够引起炎症的细菌,当其含量过多时与肥胖相关。并在便秘型肠易激综合征患者,帕金森,系统性硬化症患者患者富集,可产生硫化氢对肠道上皮具有毒性,会导致人体腹泻。
★ 嗜胆菌属——喜欢脂肪、耐胆汁的促炎菌
嗜胆菌属(Bilophila)是变形菌门,脱硫弧菌科的一种厌氧、革兰氏阴性、耐胆汁,该菌是“喜欢动物脂肪喜欢胆汁”的微生物——在以动物为基础的饮食,尤其富含肉类和乳制品脂肪时,其肠道中Bilophila丰度会增加。
《Nature》杂志的一项研究发现,当人们从素食转变为以肉类和奶酪为主的饮食结构上时,他们肠道里的细菌Bilophila几乎立即增加,但植物性为主的饮食结构可以降低该菌群的数量。
Bilophila是机会致病菌,其丰度的增加与肠道炎症相关。其代表菌种Bilophila wadsworthia增加了高脂饮食诱导的代谢综合征,这是一种与低程度全身炎症相关的疾病,伴随着较高的体重指数。
肠道重要菌属——嗜胆菌属 (Bilophila)喜欢脂肪、耐胆汁的促炎菌
★ 脆弱拟杆菌——肥胖儿童中含量较高
宿主的生活方式和生理状态也会影响肠道脆弱拟杆菌的丰度。例如,缺乏运动可能会导致脆弱拟杆菌和其他拟杆菌属物种显著富集。
以往的研究表明,脆弱拟杆菌过多与肥胖呈正相关,肥胖儿童中脆弱拟杆菌的丰度高于瘦儿童。
扩展阅读:
★ 短链脂肪酸影响饱腹感、促进能量消耗
菌群关键代谢物短链脂肪酸(SCFA)可以说是研究最广泛的微生物代谢物,对人体代谢有许多影响。
短链脂肪酸(SCFA)在维持宿主健康和影响代谢方面发挥着广泛的作用。SCFA调控体内各种生理过程,包括维持结肠上皮和粘液水平的先天性肠道屏障的完整性、调节肠道蠕动以及控制重要肠道激素的分泌,如肽YY(PYY)、血清素、胃抑制肽和胰高血糖素样肽1(GLP-1) 。
短链脂肪酸参与L细胞产生的肽YY和胰高血糖素样肽1(GLP1)激素的调节。这两种激素都调节神经系统的饱腹感,GLP1在葡萄糖刺激的胰岛素敏感性和分泌中也起作用。
-乙酸盐
乙酸盐的健康影响还存在争议。一些研究将其与通过GPR41/43相互作用减少食欲、减轻体重以及增强胰岛素敏感性联系起来,而另一些研究则表明其作为肝脏和脂肪组织脂肪产生的底物,在促进肥胖方面发挥着作用。
-丙酸盐
丙酸可由拟杆菌属、考拉杆菌属(Phascolarctobacterium succinatutens)、戴阿利斯特杆菌属(Dialister)和韦荣氏球菌属通过琥珀酸途径产生;或是由埃氏巨球形菌属(Megasphaera elsdenii)、粪球菌属(Coprococcus catus)、沙门氏菌属(Salmonella spp.)、Roseburia inulinivorans和Ruminococcus obeum通过丙烯酸途径产生。
人体研究表明,丙酸具有整体抗肥胖作用,因为它可以增加餐后GLP-1和PYY水平,减少体重增加、腹部脂肪和肝细胞内脂质含量,并预防胰岛素敏感性问题。丙酸还通过减少中性粒细胞释放白细胞介素8(IL-8)和肿瘤坏死因子α(TNF-α)而表现出抗炎特性。
-丁酸盐
在胃肠道发酵产生的所有短链脂肪酸中,丁酸尤其值得注意。重要的产丁酸属和种有Coproccocus 属、Anaerostipes属、真杆菌属(Eubacterium)、普拉梭菌(Faecalibacterium prausnitzii)和罗氏菌属。
丁酸盐是成熟结肠细胞的主要能量来源,支持结肠健康,并且是一种具有强效抗炎特性的微生物代谢物,局部和系统性作用均有。此外,丁酸盐在调节局部和全身免疫、维持粘膜完整性和抑制细胞水平的肿瘤改变方面起着至关重要的作用。丁酸盐与丙酸盐类似,具有通过刺激食欲抑制激素的释放和促进瘦素的合成来减少肥胖的作用。
★ 胆汁酸影响脂肪代谢
许多研究报告了肠道微生物组、胆汁酸和肥胖或肥胖相关疾病之间存在联系。胆汁酸在肠道中与脂肪分子结合,形成复合物,促进脂肪的分解和吸收。适当的胆汁酸可以帮助提高脂肪代谢效率,减少脂肪在体内的堆积。
此外,胆汁酸在消化系统中可以影响胃液分泌,从而影响饱腹感和食欲调节。适当的胆汁酸水平可以帮助控制饥饿感,减少摄入的热量,有助于减轻体重。
★ 吲哚——抗肥胖特性
一项研究发现较高的血浆吲哚丙酸水平与降低患2型糖尿病的风险之间存在关联。
另一项研究发现,与瘦对照相比,患有2型糖尿病的肥胖受试者的吲哚丙酸水平降低。吲哚丙酸显示通过与孕烷X受体结合并随后下调肿瘤坏死因子α来调节炎症。
吲哚丙酸也被证明在小鼠中具有抗肥胖活性,微生物衍生的吲哚乙酸进一步限制了巨噬细胞中脂肪酸的积累和炎症标志物的产生。
★ 谷氨酸过量与肥胖潜在危害有关
谷氨酸是一种多功能氨基酸,谷氨酸在生物体内的蛋白质代谢过程中占重要地位。根据对肥胖和瘦受试者的队列进行的全基因组关联分析显示,谷氨酸盐具有潜在危害。
通过进行途径分析,谷氨酰胺/谷氨酸转运系统在肥胖个体中高度富集。这与拟杆菌属(包括B.thetaiotaomicron)的物种呈负相关。事实上,与瘦受试者相比,肥胖者体内这种细菌的数量减少。因此谷氨酸与人体肥胖之间也存在一定联系。
★ 肥胖人群的肠道微生物能够更多地获取能量
对肠道微生物群影响膳食能量收集和储存过程的探索揭示了两种关键机制:肥胖人群具有分解难以消化的膳食细菌多糖水解酶从而对多糖降解;以及抑制一种名为禁食诱导脂肪因子(FIAF)或血管生成素样4(ANGPTL4)的脂蛋白脂肪酶(LPL)抑制剂的肠道基因表达。
一项比较肥胖小鼠及瘦小同窝小鼠的功能性宏基因组的研究发现,肥胖微生物群富含八个能够水解膳食多糖的糖苷水解酶家族。第二种机制涉及微生物对FIAF的抑制,通过影响LPL活性导致脂肪堆积增加。
细菌多糖水解产生脂肪形成底物,即单糖和短链脂肪酸。肠道微生物群还通过增强钠/葡萄糖转运蛋白-1(SGLT1)的表达以及使小肠毛细血管密度加倍来促进有效的单糖吸收。这些脂肪形成底物到达肝脏后促进了肝脏甘油三酯的合成。
★ 肠道微生物群的组成影响从食物中获取的能量
“能量获取理论”最近也在人类受试者身上进行了测试。招募了12名瘦弱和9名肥胖的成年男性,在最初3天的体重维持饮食之后,以随机交叉的方式分配到2400或3400千卡/天的饮食,持续3天。
在初始体重维持饮食中,瘦人和肥胖个体的三大细菌门(厚壁菌门、拟杆菌门和放线菌门)存在显著差异。作为对改变的热量负荷的反应,肠道厚壁菌门增加、拟杆菌门减少与宿主能量吸收增加约150kcal有关。
瘦人似乎对增加热量摄入更为敏感,在2400vs. 3400 kcal/天饮食中,粪便能量损失和肠道微生物组成的变化均显著减少。而肥胖个体没有出现类似的变化。我们认为,与体重维持饮食相比,能量摄入的差异程度可能会通过肠道微生物群影响饮食中能量的吸收效率。
暴饮暴食是肥胖的主要诱因,是由调节食物摄入的过程失衡造成的,包括“饥饿”、“食欲”和“饱腹感”,以及环境因素。
★ 饱腹和饥饿信号影响人们的进食行为
正常的饮食行为在我们感到饱腹(饱腹感)时就会停止,并在感到饥饿一段时间后再次开始。两餐之间的时间是饱腹感的指标。有许多肠道激素会向大脑传递“饱腹”或“饥饿”的信号。肠内分泌L细胞分泌的胆囊收缩素(CCK)和胰高血糖素样肽1(GLP-1)是与饱腹感相关的肠道激素,可传递“饱腹”信号。
肠内分泌L细胞分泌的肽YY(PYY)和肠内分泌K细胞分泌的葡萄糖依赖性胰岛素促泌多肽(GIP)也传达“饱腹感”,而胃细胞分泌的生长素释放肽则传达决定开始进餐的“饥饿”信号。
★ 短链脂肪酸可以影响激素水平进而调节饱腹感
研究表明,肠道微生物群和其发酵产物短链脂肪酸可以影响肠道激素水平,进而调节饱腹感。肠内分泌L细胞分泌的GLP-1和PYY含有短链脂肪酸受体GPR41和GPR43,暗示结肠短链脂肪酸的生成与食欲或摄食量存在关联。
膳食纤维可选择性地支持肠道中有益细菌的生长和短链脂肪酸的产生。与饲喂对照饮食或高蛋白饮食的大鼠相比,饲喂高纤维饮食的大鼠血浆GLP-1和PYY水平较高,血浆GIP水平较低,结肠PYY mRNA水平增加5倍,胰高血糖素原mRNA水平增加11倍。
菊粉型果聚糖已被证明可以提高血浆GLP-1水平和结肠胰高血糖素原基因表达,保护免受高脂肪饮食引起的肥胖。一项人体研究表明,每天摄入21克低聚果糖(FOS)可降低超重成人的生长素释放肽并增加PYY,同时减少卡路里摄入量,有助于减肥。
★ 肠道微生物通过影响免疫也会导致贪食、肥胖
另一个影响食物摄入和肥胖的因素是肠道微生物群与先天免疫系统之间的相互作用。Toll样受体5(TLR5)是被广泛研究的受体之一。TLR5在小鼠肠粘膜中高表达,可以识别细菌鞭毛蛋白作为病原相关分子模式(PAMP),与肠道炎症和肠道微生物群的变化有关。
最新研究表明,TLR5基因敲除小鼠(T5KO)表现出贪食、肥胖、代谢综合征以及相关的高脂血症、高血压和胰岛素抵抗。T5KO小鼠的贪食/肥胖表型与肠道微生物群组成的细菌物种水平变化相关,T5KO小鼠有116种来自不同门类的细菌属丰富或减少。
将T5KO小鼠肠道微生物移植到健康小鼠中,导致健康小鼠发展代谢综合征,表明T5KO小鼠的肠道微生物影响代谢健康。
总的来说,肠道微生物群通过短链脂肪酸信号传导或与先天免疫系统相互作用,在调节食欲、肥胖和糖尿病方面发挥着重要作用。
因此,可发酵纤维和益生元等膳食成分以及肠道内生成的微生物代谢产物可以作为对抗这些疾病的简单而有效的手段。
肥胖与慢性、轻度全身性炎症相关。脂肪细胞和肥胖下的脂肪组织内的巨噬细胞都释放炎症细胞因子。这种轻度全身性炎症部分来源于细菌脂多糖(LPS)从肠道进入血液循环。
血浆中脂多糖浓度增加两到三倍,被称为“代谢性内毒血症”,与肥胖、胰岛素抵抗、糖尿病和动脉粥样硬化等多种慢性疾病相关。
★ 高脂饮食会加剧炎症状态
肠道脂多糖倾向于通过乳糜微粒携带,这些是脂蛋白颗粒,用于输送膳食脂质。因此,高脂饮食可能诱发或加剧代谢性内毒血症。
肠道通透性可能导致脂多糖位移,肠道微生态失调或引发肠道壁炎症可能增加通透性。双歧杆菌和乳酸杆菌的几种菌株及其代谢产物(如短链脂肪酸)已被证实能促进紧密连接蛋白的表达,这些蛋白维持有效的肠道屏障。而肠道中双歧杆菌相对缺乏与肠道通透性增加相关。
★ 肥胖状态下促炎巨噬细胞比例增加
引起脂肪组织炎症加剧的一个关键因素是巨噬细胞的渗入。产生促炎细胞因子的脂肪组织主要来自渗入的巨噬细胞。动物研究表明,巨噬细胞在肥胖中逐渐积累,瘦小鼠脂肪组织中不到10%的细胞是巨噬细胞,而肥胖小鼠中这一比例超过50%。
巨噬细胞本身表现出不同表型,可极化为促炎的“M1”或抗炎的“M2”表型。肥胖状态改变了M1和M2巨噬细胞的比例,导致M1巨噬细胞增加。
注:有趣的是,TLR4缺乏可减轻脂肪组织炎症,促进脂肪组织和腹膜巨噬细胞极化为M2型,但不会影响全身胰岛素敏感性。
另一项研究比较了无菌小鼠和大肠杆菌单个定植小鼠,结果显示单个定植小鼠脂肪组织中存在脂多糖依赖性巨噬细胞积累。大肠杆菌的定植还增加了巨噬细胞的极化,使其转变为促炎的M1型,并导致葡萄糖和胰岛素耐受性下降。
小结
肠道微生物组影响肥胖和相关代谢状态的三种机制,即通过能量获取、食欲调节和炎症状态,综合起来看,每条途径都是协同作用而非独立作用。这些调节过程的核心是宿主、微生物组和饮食之间复杂而动态的三向相互作用。
人体的消化过程和细菌作用在肠道中协同处理膳食成分。产生的代谢产物的特征取决于宿主遗传、宿主生理和肠道微生物的组成。微生物与营养消化产物结合,可以通过与宿主细胞受体的特定相互作用或以非特定方式进入一般血液循环,对宿主代谢产生不同的影响。
以下是来自君好美健康科技公司的3个案例,采取“膳食纤维+后生元”君好美膳食片作为主食,三餐吃饱——肉鱼蛋奶豆制品蔬菜充分吃,水果干果控制吃,在基本不改变在原有饮食情况下,一段时间后,个案的体重体脂明显下降、肠菌菌群得到有效改善。
案例一
女,44岁,原本体重为182.5斤,属于严重偏胖。
经历144天的改善后,体重减轻了36.3斤,减脂了22.2斤,减肥效果非常明显。体脂率、皮下脂肪和内脏脂肪都有所减少。
身体数值的各项变化
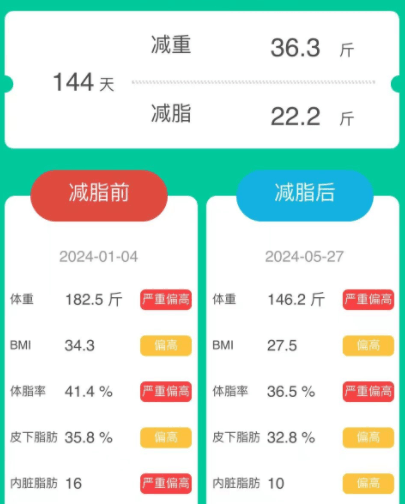
编辑
改善前后的报告对比
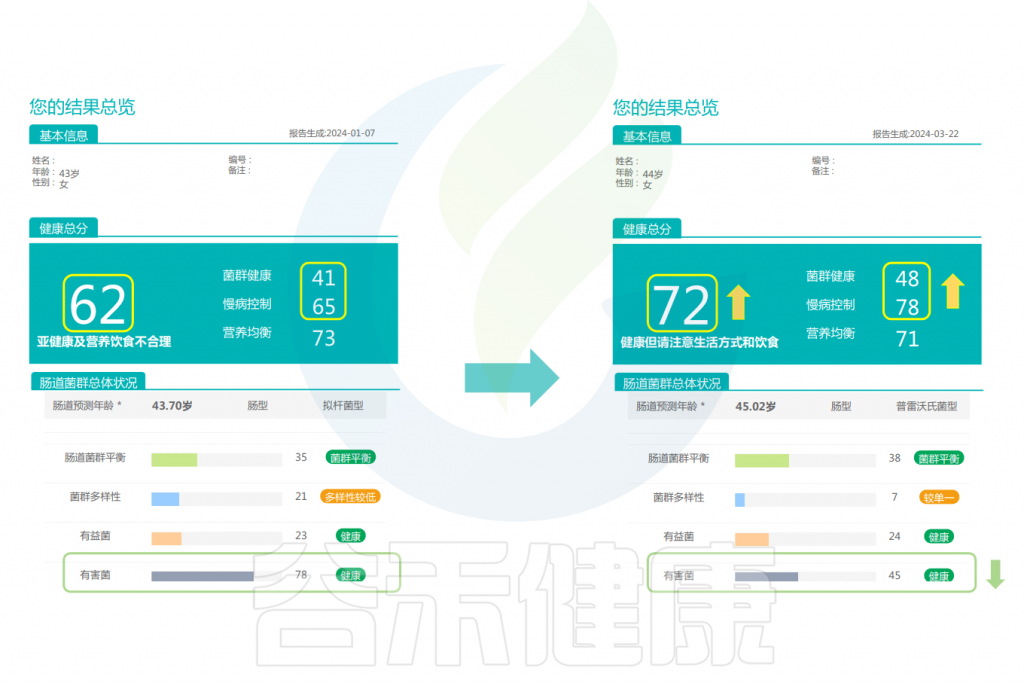
可以看到:在额外补充膳食纤维后,健康总分升高,肠道微生物的结构更健康,通过增加膳食纤维来增加微生物的数量和多样性是非常有效的。有益菌的分值提高,有害菌明显减少,肠型由原来拟杆菌型变成了普雷沃氏菌型,慢病风险总分下降。
▸ 具体到菌种

活泼瘤胃球菌与短链脂肪酸的产生有关。与非酒精性脂肪肝病和肥胖等疾病存在正相关。在改善后由原本的过高丰度,降低到了正常水平。
干预前:

干预后:

颤螺菌属也是与肥胖相关的菌群,过多或过少都可能影响肥胖。在改善后由原本的过低,丰度有所增加,恢复到了正常水平。
干预前:
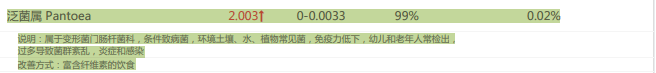
干预后:

泛菌属是一种条件致病菌,过多导致菌群紊乱,炎症和感染。而在补充膳食纤维后丰度有所降低(尽管还有一点偏高)。
干预前:
干预后:
此外,丙酸盐的丰度也有一定程度的提高。有充分证据表明,随着膳食纤维摄入量的增加,产生的短链脂肪酸(SCFA)也增加。SCFA能够激活游离脂肪酸受体,从而促使厌食激素(如瘦素和肽YY)的分泌。在减肥中发挥益处。
根据以上这些变化,可以看出在额外补充膳食纤维后,可以在一定程度上改善人体的肥胖和代谢健康。
案例二
女,52岁,原本体重为142.4斤,属于严重偏胖。
经历73天的改善后,体重减轻了11.6斤,减脂了7斤,虽然没有上一个人减重多,但是BMI恢复到了正常水平。体脂率、皮下脂肪和内脏脂肪也均有所减少。
身体数值的各项变化
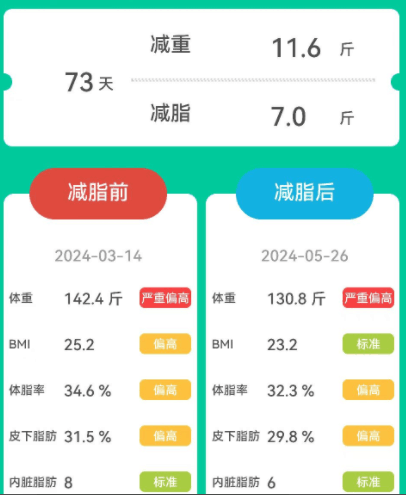
改善前后的报告对比
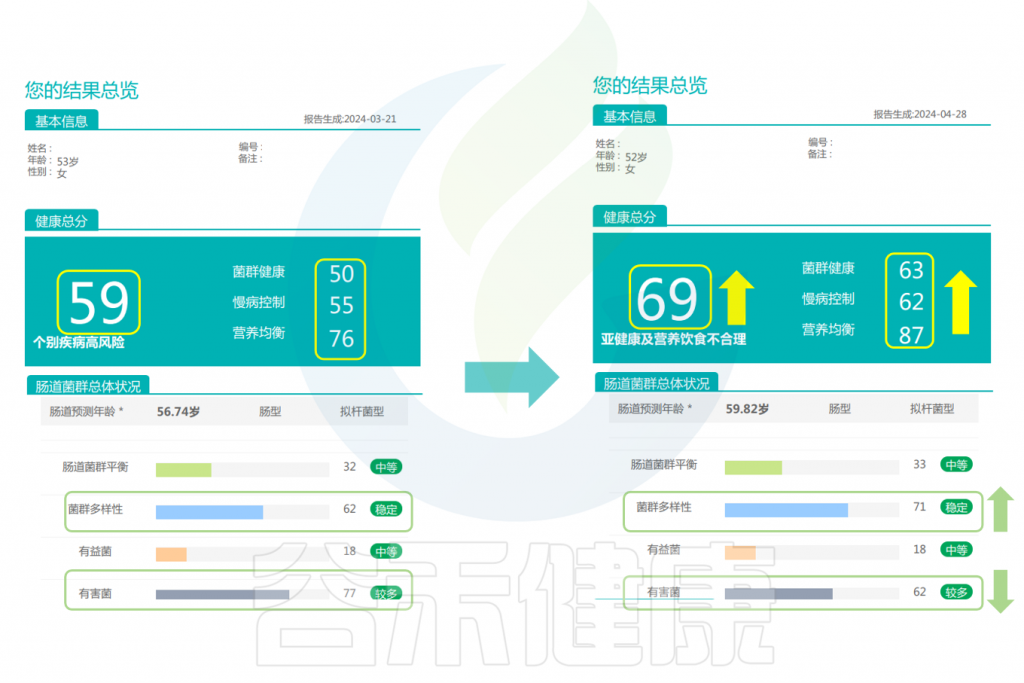
可以看到,该女性在经过干预后,健康总分也升高了。并且菌群变得更健康、对于慢病的控制评分更高,营养也更均衡了。肠道菌群多样性提高,有害菌明显减少。
与此同时,核心菌属也发生了一定程度的变化:
干预前:

干预后:
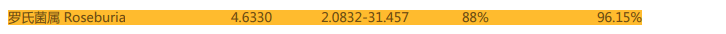
重要的肠道基石菌,产短链脂肪酸菌属罗氏菌在改善后由原来的丰度过低变成了正常丰度。罗氏菌具抗炎特性,有助于分解不可消化的碳水化合物如膳食纤维,对健康有利。
干预前:

干预后:

过多会导致菌群紊乱的副拟杆菌属由原本的过高丰度降低到了正常值。
肠道核心菌——副拟杆菌属(Parabacteroides),是否是改善代谢减轻炎症的黑马?
干预前:

干预后:

能够产生脂多糖,代谢生成苯酚,引发感染和并发症的梭杆菌属丰度由原来的过高水平恢复到了正常水平。
梭杆菌属Fusobacterium——共生菌、机会致病菌、致癌菌
干预前:

干预后:

过高时会导致肥胖和2型糖尿病的副萨特氏菌属在额外补充膳食纤维后丰度也有所下降(尽管仍然高于正常值)。
干预前:
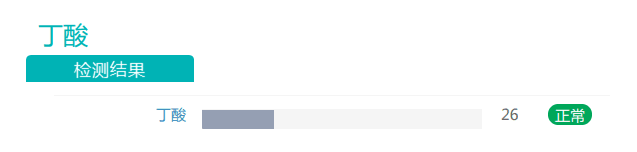
干预后:
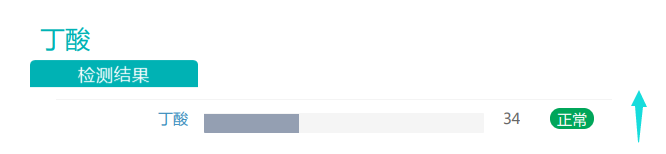
随着膳食纤维摄入量的增加,丁酸盐的丰度有所上升。丁酸对于维持肠道内环境温度预防结直肠癌发生具有重要作用,是肠上皮细胞最重要能量来源,对肠粘膜有营养作用,利于代谢健康的重要物质。
案例三
男,54岁,原本体重为131.1斤,属于标准体重,本来健康状态就比较好。因此在经历173天后,体重只下降了4.4斤,减脂2.1斤。体脂率、皮下脂肪、内脏脂肪也稍微有所下降,但都变得更健康了。
此外,三个案例可以看出膳食纤维对不同基础体重人群的作用效果不太一样,大体重人群在额外补充膳食纤维后减重更多。
身体数值的各项变化
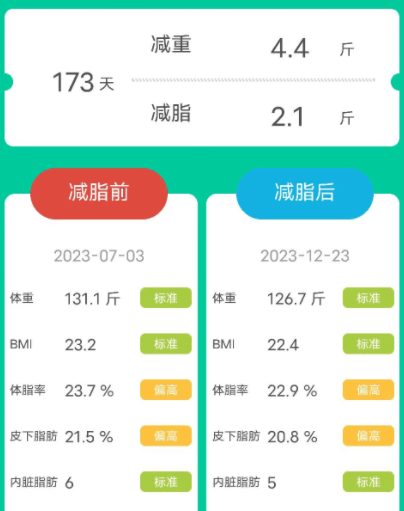
改善前后的报告对比
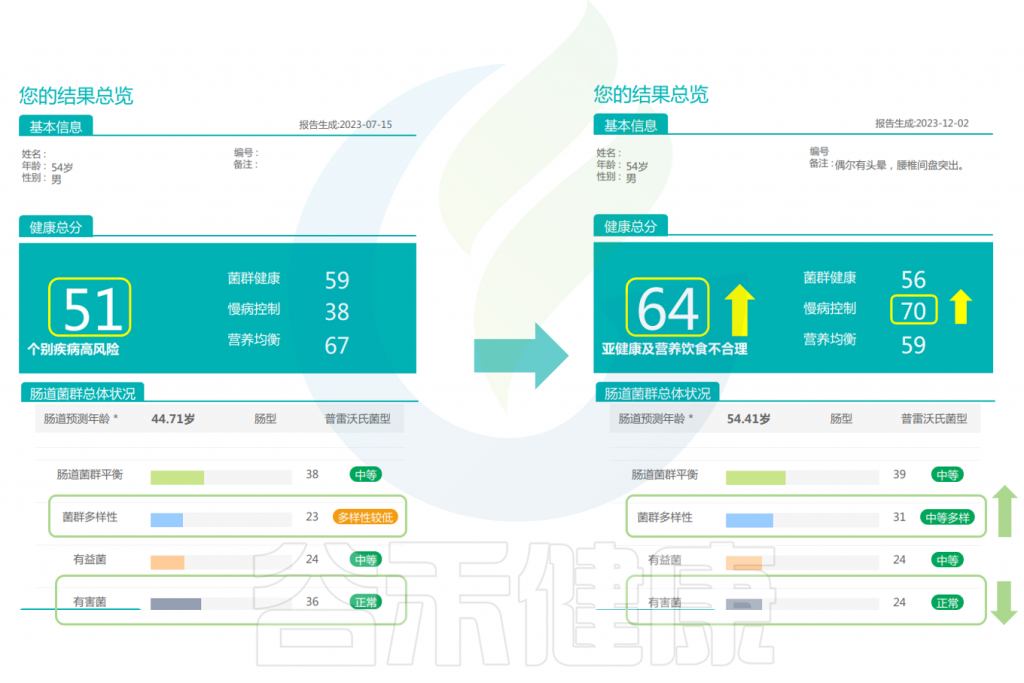
<来源:谷禾肠道菌群健康检测数据库,下同>
根据谷禾的健康报告前后对比可以看到,该男性在经过干预后,健康总分升高,对于慢病控制的评分显著升高。肠道微生物的多样性变得更丰富,有害菌减少明显。
干预前:

干预后:

过高时与肥胖相关,可能通过抑制乙酸水平来加速肥胖的脆弱拟杆菌在额外补充膳食纤维后丰度降低到了正常水平。
干预前:

干预后:
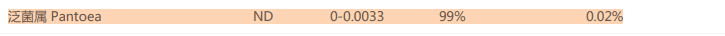
肠道的条件性致病菌泛菌属,过多导致菌群紊乱,炎症和感染。在补充额外的膳食纤维后水平也下降到正常值。
肠道微生物群多样性和高纤维摄入量与长期体重增加较低有关
此外一项对1632个人的研究也发现,微生物群多样性会影响膳食纤维与体重增加之间的关系。在微生物群多样性较高的人群中,纤维摄入量与体重增加风险降低有显著相关性。

膳食纤维对体重的有益作用可能在微生物组多样性较高的个体中更为明显。实验表明,纤维摄入会降低饮食的能量密度,由此产生的短链脂肪酸促进肠道糖异生、肠促胰岛素形成并随后产生饱腹感,同时短链脂肪酸也会向宿主输送能量并影响脂肪异生。
TIPs: 膳食纤维与益生元的区别
膳食纤维和益生元虽然都是植物性食物中的复杂碳水化合物,但它们之间存在一些区别:
1.膳食纤维的定义: 膳食纤维是指植物性食物中不被人体消化酶分解的碳水化合物,包括不溶性纤维和可溶性纤维。不溶性纤维,如纤维素,主要作用是增加大便体积,促进肠道蠕动,帮助消化系统健康。可溶性纤维,如果胶和树胶,可以溶解在水中,形成凝胶状物质,有助于降低血糖和胆固醇。
2.益生元的定义: 益生元是一种可溶于水的可溶性纤维,它作为益生菌的食物,可以被肠道中的有益细菌发酵,从而促进有益细菌的生长和活动。益生元主要包括低聚果糖(FOS)菊粉、低聚半乳糖(GOS)等。
3.作用机制: 膳食纤维的作用更广泛,包括促进肠道蠕动、帮助排便、降低血糖和胆固醇等。而益生元的主要作用是喂养和促进益生菌的生长,尤其是那些能够产生短链脂肪酸(如丁酸盐)的细菌,这些短链脂肪酸对肠道健康至关重要。
4.种类: 膳食纤维的种类很多,包括纤维素、半纤维素、果胶、树胶、抗性淀粉等。而益生元的种类相对较少,主要是一些特定的低聚糖和某些类型的多糖。
5.健康益处: 膳食纤维对整体消化系统健康有益,而益生元则更专注于通过促进益生菌的生长来改善肠道微生物群的平衡。
总的来说,膳食纤维是一个更广泛的概念,包括了益生元但它们的作用和重点略有不同。膳食纤维对消化系统的整体健康有益,而益生元则专门针对促进一些细菌的生长。
拓展:不同纤维对肠道菌群的影响

一项研究了不同谷物纤维(包括麦麸)对健康成人肠道菌群组成的影响。
-食用小麦纤维对肠道微生物的影响:
食用小麦纤维或麸皮纤维对肠道菌群有显著影响,以下门类的菌群均显著增加:
双歧杆菌(Bifidobacteria) ↑↑↑
乳酸杆菌(Lactobacillus) ↑↑↑
奇异菌属(Atopobium) ↑↑↑
肠球菌(Enterococci) ↑↑↑
梭状芽孢杆菌(Clostridia) ↑↑↑
毛螺菌科(Lachnospiraceae) ↑↑↑
埃格氏菌(Eggerthella) ↑↑↑
柯林斯菌(Collinsella) ↑↑↑
棒状杆菌(Corynebacterium) ↑↑↑
拟杆菌(Bacteroides) ↑↑↑
普氏菌属(Prevotella) ↑↑↑
-食用大麦纤维对肠道微生物的影响:
所有研究都表明大麦纤维对肠道菌群标志物有显著影响:要么改变微生物群落 ,要么改变发酵代谢物。发现厚壁菌门和放线菌(特别是罗氏菌属、Dialister、真杆菌和双歧杆菌)显著增加,拟杆菌减少。
其余3项研究测量了发酵标志物,结果显示,在食用大麦纤维后,总短链脂肪酸、丁酸盐和乙酸盐显著增加,呼气氢显著增加。由于发酵代谢物的积极作用,血糖反应同时改善。
-食用燕麦纤维对肠道微生物的影响:
燕麦粒的外层含有不溶性和可溶性(β-葡聚糖)纤维的混合物,这两种纤维都为肠道微生物群提供了食物来源。已证实可溶性燕麦β-葡聚糖有助于降低血液胆固醇水平。
对患有轻度高血糖症或高胆固醇血症的参与者研究了每天早餐食用全麦燕麦片与精制谷物片的影响。据报道,食用全麦燕麦片后,粪便总细菌、乳酸杆菌和双歧杆菌数量显著增加,而食用精制谷物片后,总细菌数量和双歧杆菌数量均下降。
-食用玉米纤维对肠道微生物的影响:
玉米的淀粉含量相对于其他谷物来说较高,麸皮含量较低。
一项急性干预研究比较了单次食用48克全麦玉米早餐麦片(14.2克纤维)对肠道菌群的影响,并与48克低纤维玉米早餐麦片(0.8克纤维)进行了比较。
3周后,高纤维组和低纤维组均报告粪便双歧杆菌增加,高纤维组的增幅更大,但未达到显著性,乳酸杆菌、肠球菌和奇异菌属物种的增加不显著。
-混合全谷物对肠道微生物的影响:
全麦谷物包括谷物的胚乳、胚芽和麸皮成分,因此其营养成分与谷物的麸皮纤维部分不同,这可能会影响肠道微生物群。
共计357人的研究发现,增加完整谷物纤维的摄入具有显著的益生元作用,细菌多样性、放线菌、双歧杆菌、梭菌、毛螺菌显著增加;但阿克曼氏菌、罗氏菌、乳酸杆菌和肠球菌的增加趋势不显著。促炎性肠杆菌科细菌的水平也显著下降。
作者认为,对高纤维干预的反应取决于基线肠道微生物丰富度——由于膳食纤维的增加,基线微生物丰富度有限的人会随着时间的推移表现出更大的微生物群变化。
如今全球肥胖症的流行,寻求新的有效解决方案已成为研究的重中之重。这主要是因为大多数人无法长期坚持既定的饮食和身体活动方案,从而无法达到并保持健康的体重。
肠道微生物群由于位于宿主营养/能量代谢的关键位置并能够影响它,因此已成为一种有希望的新治疗靶点。
饮食、肠道微生物群和肥胖之间的相互关系是高度互动和动态的。虽然饮食热量摄入是能量平衡方程的主要因素,研究估计现在知道某些肠道微生物可以从饮食中获取“额外”的能量,大约150千卡/天;相当于一年内可能增加6.8公斤的体重。
除了热量含量外,饮食成分也是与肥胖相关的饮食-微生物相互作用的重要因素,例如肠道微生物失调以及高脂饮食引起的全身炎症。
肠道微生物还通过调节食欲、食物摄入和饱腹感来影响肥胖:这是能量平衡的一部分。膳食纤维、合生元是调节肠道微生物组成的有效方法,这些干预措施不仅降低了体重,体脂,而且同时改善了与肥胖和相关代谢状况相关的生物标志物,例如血糖水平、胰岛素敏感性、血浆脂联素等。
总体而言,这些结果表明,通过膳食纤维,合生元以及饮食调节肠道微生物群可以作为人类减肥的独立方法,同时可以有助于减轻风险并控制肥胖相关疾病(如心血管疾病、胰岛素抵抗和2型糖尿病)的症状。
在当前肥胖流行和健康挑战的背景下,个体化肠道菌群干预显得尤为重要。每个人的肠道微生物群独一无二,受基因、生活方式和环境等多方面影响。因此,针对个体的肠道菌群进行精准干预,可以更有效地调节体重、改善健康状况。
主要参考文献
Li H, Zhang L, Li J, Wu Q, Qian L, He J, Ni Y, Kovatcheva-Datchary P, Yuan R, Liu S, Shen L, Zhang M, Sheng B, Li P, Kang K, Wu L, Fang Q, Long X, Wang X, Li Y, Ye Y, Ye J, Bao Y, Zhao Y, Xu G, Liu X, Panagiotou G, Xu A, Jia W. Resistant starch intake facilitates weight loss in humans by reshaping the gut microbiota. Nat Metab. 2024 Mar;6(3):578-597.
Jie Zhuye,Yu Xinlei,Liu Yinghua et al. The Baseline Gut Microbiota Directs Dieting-Induced Weight Loss Trajectories.[J] .Gastroenterology, 2021.
Pham Van T,Fehlbaum Sophie,Seifert Nicole et al. Effects of colon-targeted vitamins on the composition and metabolic activity of the human gut microbiome- a pilot study.[J] .Gut Microbes, 2021, 13: 1-20.
Corica D, Aversa T, Valenzise M, Messina MF, Alibrandi A, De Luca F, Wasniewska M. Does Family History of Obesity, Cardiovascular, and Metabolic Diseases Influence Onset and Severity of Childhood Obesity? Front Endocrinol (Lausanne). 2018 May 2;9:187.
Bartsch M, Hahn A, Berkemeyer S. Bridging the Gap from Enterotypes to Personalized Dietary Recommendations: A Metabolomics Perspective on Microbiome Research. Metabolites. 2023 Dec 2;13(12):1182.
Zhang M, Liu J, Li C, Gao J, Xu C, Wu X, Xu T, Cui C, Wei H, Peng J, Zheng R. Functional Fiber Reduces Mice Obesity by Regulating Intestinal Microbiota. Nutrients. 2022 Jun 28;14(13):2676.
Menni C, Jackson MA, Pallister T, Steves CJ, Spector TD, Valdes AM. Gut microbiome diversity and high-fibre intake are related to lower long-term weight gain. Int J Obes (Lond). 2017 Jul;41(7):1099-1105.
Mayengbam S, Lambert JE, Parnell JA, Tunnicliffe JM, Nicolucci AC, Han J, Sturzenegger T, Shearer J, Mickiewicz B, Vogel HJ, Madsen KL, Reimer RA. Impact of dietary fiber supplementation on modulating microbiota-host-metabolic axes in obesity. J Nutr Biochem. 2019 Feb;64:228-236.
Jefferson A, Adolphus K. The Effects of Intact Cereal Grain Fibers, Including Wheat Bran on the Gut Microbiota Composition of Healthy Adults: A Systematic Review. Front Nutr. 2019 Mar 29;6:33.
Zhang, Y.; Liu, J.; Yao, J.; Ji, G.; Qian, L.; Wang, J.; Zhang, G.; Tian, J.; Nie, Y.; Zhang, Y.E.; et al. Obesity: Pathophysiology and Intervention. Nutrients 2014, 6, 5153-5183.
Lin X, Li H. Obesity: Epidemiology, Pathophysiology, and Therapeutics. Front Endocrinol (Lausanne). 2021 Sep 6;12:706978.Lin X, Li H. Obesity: Epidemiology, Pathophysiology, and Therapeutics. Front Endocrinol (Lausanne). 2021 Sep 6;12:706978. Pathophysiology, and Therapeutics. Front Endocrinol (Lausanne). 2021 Sep 6;12:706978

谷禾健康

植物多酚是一大类生物活性化合物,其特点是化学和结构特性不同、生物利用度低,并具有多种体外生物活性。在这些化合物中,木脂素因其类固醇类似物的化学结构而受到广泛研究,被认为是植物雌激素。
木脂素是一类与纤维相关的化合物,存在于许多植物家族和常见食物中,包括谷物、坚果、种子、蔬菜以及茶、咖啡或葡萄酒等饮品中。膳食木脂素浓度最高的食物是亚麻籽和芝麻,其中含有一种叫做松脂素二葡萄糖苷的化合物。其他膳食木脂素包括芝麻素、松脂醇、松脂素和落叶松脂素。
肠道细菌代谢能够将膳食木脂素转化为治疗相关的多酚(即肠木脂素),例如肠内酯和肠二醇。这些肠木脂素具有多种生物活性,包括组织特异性的雌激素受体激活、抗炎和促凋亡作用。因此,木脂素与肠道菌群的相互作用,不仅关系到个体对特定食物的响应,也关系到整体健康和疾病预防。
肠木脂素的生物利用度在个体间存在很大差异,受遗传、饮食和生活方式等因素影响。
流行病学研究发现木脂素可降低心血管疾病的风险,并具有针对各种肿瘤(如乳腺癌、结肠癌和前列腺癌)和/或心血管疾病的化学预防特性。
与其他多酚一样,木脂素在被全身吸收之前先被肠道细菌代谢。饮食等因素已被证明会影响微生物群的组成。植物性饮食者的微生物群在微生物多样性方面与非素食者存在很大差异,从而影响代谢物的产生和提取效率。
约 80% 的木脂素相关论文发表于 2000 年之后,其中约一半发表于 2010 年或之后;这清楚地表明在过去 20 年里人们对这一天然产物家族的兴趣显著增长。此外,亚麻、五味子、连翘的整体重要性在木脂素的文献分析中显而易见。许多论文不仅局限于植物生物学,还集中在药理学(约四分之一)和化学(约四分之一)上。
本文主要讲述了木脂素的多方面特性,包括其在自然界中的分布、如何通过肠道细菌的代谢转化,讨论了木脂素在降低某些疾病风险中的潜在作用,尤其是在乳腺癌、结直肠癌和前列腺癌的预防中。同时,也探讨了影响木脂素代谢的个体间差异因素,如性别、饮食习惯和生活方式等。了解这些可以为个性化的医学和营养方案提供更好的指导。
根据其来源,木脂素大致可分为:
植物木脂素主要在对位含有氧取代基,而哺乳动物木脂素则在间位具有羟基。这种细微的结构差异,决定了它们在生物体内的不同作用和代谢途径。
木脂素在结构上类似于木质素,木质素是三维聚合物,与纤维素、半纤维素和果胶交织在一起,形成植物细胞的坚固细胞壁。此外,木脂素和木质素都是通过相同的初始苯丙烷途径产生的,它们是由单木质素(来源于苯丙氨酸或酪氨酸)合成的,但最终进入不同的生化途径。实际上,尽管木质素在植物界无处不在,但并非所有植物都会产生木脂素。
已知来自食用植物的糠醛型木脂素,包括落叶松树脂醇、开环异落叶松树脂醇、马泰尔树脂醇和松脂醇,可被肠道微生物群转化为哺乳动物木脂素、肠二醇或肠内酯。与木质素前体相比,这些细菌副产物对人类健康更有益。
肠木脂素(哺乳动物木脂素)也是食物木脂素的代谢产物,是人类肠道细菌的产物。它们经常在人类血浆和尿液中被检测到。
作为食物成分,木脂素存在于大多数富含纤维的植物中:
常见食物中木脂素(以苷元形式)的每份和
100克(鲜重)总微克含量及其分布及其植物来源
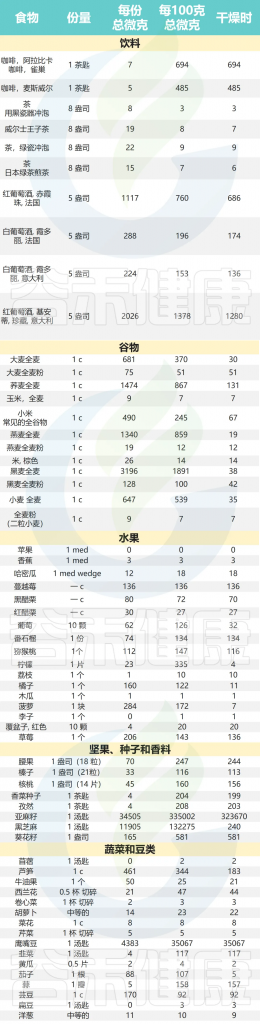
Peterson J, Nutr Rev. 2010 (10):571-603.
食物中的木脂素含量通常较低,一般不超过2毫克/100克。芝麻和亚麻籽是例外,它们的木脂素含量比其他食物来源高出几倍。
亚麻籽来源于亚麻科植物亚麻(Linum usitatissimum L.),其含有的生物活性成分可能对健康有益,例如 α-亚麻酸(占总脂肪酸组成的 50–55%)、膳食纤维(25–28%)和酚类化合物。
亚麻籽是已知最丰富的木脂素来源 [ 9–30 毫克/克(约 301 毫克/100 克)],木脂素产量是谷物、豆类、其他油籽、蔬菜和水果的 75–800 倍。亚麻籽中存在的主要膳食木脂素是开环异落叶松树脂酚(2,3-双(3-甲氧基-4-羟基苄基)丁烷-1,4-二醇),它以共轭 SDG 的形式储存,是植物中线性酯键复合物的组成部分。
芝麻(Sesamum indicum L.)是一种开花植物,属于胡麻科。芝麻籽中的木脂素浓度相对较高(接近29mg/100g,主要是松脂素和落叶松脂素)。芝麻素是一种呋喃型木脂素,是芝麻中的主要木脂素成分之一,在种子中的含量为 0.1–0.5%。
芝麻素还可以通过肠道微生物群转化为哺乳动物木脂素,这可能对乳腺癌等激素相关疾病具有保护作用。
木脂素的健康益处
doi.org/10.3390/ph12020068
饮食中木脂素的消耗主要因地理位置而异,但饮食模式也受到文化和种族的影响。
传统的地中海饮食以植物为主,其特点是:
这种饮食的健康益处主要归因于纤维和生物活性化合物(包括抗氧化剂和功能性脂肪酸和脂质)摄入量的增加,以及饱和脂肪摄入量低。
木脂素来源
地中海人群饮食中的木脂素来源包括:
每种食物在总多酚摄入中所占的比例(11–70%)和亚型都不同。
事实上,许多典型的地中海饮食食品(例如谷物)都含有高浓度的木脂素和其他酚类化合物。
最近,人们开始评估全谷物摄入在预防慢性病方面的作用。许多研究表明,作为全谷物饮食的一部分,木脂素摄入与心血管疾病、癌症和糖尿病等慢性病发病率降低之间存在联系。
栗子、特级初榨橄榄油
地中海饮食的另一个组成部分——栗子,是钙、抗氧化剂和酚类化合物的极佳来源。
特级初榨橄榄油是地中海饮食的重要组成部分。事实上,经常食用特级初榨橄榄油与动脉粥样硬化、心血管疾病和某些类型癌症的发病率降低有关。这种效果可能归因于特级初榨橄榄油中含有高浓度的 (+)-1-乙酰氧基松脂醇和(+)-松脂醇。

这种饮食习惯常见于北欧和北欧地区,特点是:
大量食用海藻、贝类、多脂鱼(如鲭鱼、鲱鱼和鲑鱼)、瘦肉、菜籽油、豆类、坚果(如杏仁)、蔬菜、水果(如浆果)、全谷物(如燕麦)、低脂乳制品,并限制盐和糖的摄入量。
在北欧国家,植物木脂素的主要饮食来源是蔬菜、水果和全麦谷物。
在许多经常食用的富含木脂素的植物物种中,一些物种主要分布在北半球(例如菊科的蓟属植物)。这些植物的营养结构含有三萜、多乙炔、酚酸、黄酮类化合物和生物碱。欧洲蓟属植物的最新植物化学研究表明,其种子是新木脂素和木脂素的丰富来源。
印度餐桌上的木脂素宝库
各类食品构成了典型印度饮食的重要组成部分,其中包括鱼、葡萄、巧克力、油、咖啡、茶、饼干和面包。
巴戟天——传统医学中的木脂素宝库
巴戟天(印度桑树)的果实传统上被广泛用于治疗癌症、糖尿病、高血压、腹泻、头痛和炎症,这主要是由于其木脂素含量高。
芝麻:印度饮食中的木脂素明星
芝麻是印度饮食中的典型成分,芝麻和芝麻油都富含木脂素。芝麻油因其显著的抗氧化性和营养价值而闻名。
尽管木脂素仅占芝麻总质量的一小部分(0.5 %至 1.0%),但主要的芝麻木脂素——例如 (+)-芝麻素酚、(+)-芝麻林和 (+)-芝麻素葡萄糖苷——因其显著的健康促进特性而备受关注(已在体内和体外得到证实),包括抗炎、抗氧化和抗高血压活性。
疾病预防
有研究表明,长期摄入(+)-芝麻素酚可抑制阿尔茨海默病中观察到的致病性细胞外β-淀粉样蛋白聚集。同样,(+)-芝麻素具有预防前列腺癌和乳腺癌的作用,并且是肠二醇和肠内酯的前体(已证明具有抗癌、抗糖尿病和抗衰老作用。
亚洲饮食的特点是大量食用大米、面条、香料和蔬菜、芝麻和油。此外,人们也常食用海鲜、豆腐和其他大豆制品。
亚洲是木脂素的主要植物来源;这些植物通常被纳入饮食中,在中国也被用作药用植物。这类植物包括:
牛蒡
其果实提取物和种子是生物活性木脂素的丰富来源,包括牛蒡苷和牛蒡苷元。这两种木脂素具有抗炎活性,例如,抑制脂多糖诱导的一氧化氮生成和小鼠巨噬细胞中促炎细胞因子的释放。此外,牛蒡中的木脂素在抗癌方面也显示出了强大的潜力,能诱导癌细胞凋亡并抑制其增殖。
某些草药通常用作水浸剂。其中包括香茶菜属植物和雷公藤属植物。
香茶菜属
香茶菜属植物包括近 150 个种,分布于亚洲亚热带和热带地区,是极好的木脂素来源。一些种,如日本香茶菜,已被用于传统中药,治疗关节痛、胃痛、乳腺炎、胃炎和肝炎等。香茶菜还因其降血压、抗氧化、免疫、抗菌、抗肿瘤和抗炎特性而被用于传统医学。
雷公藤
一种传统药草,可以改善类风湿性关节炎和其他自身免疫性疾病的症状。多项植物化学研究已从该植物的根部分离出数百种生物活性化合物,包括木脂素。
五味子
长期以来,中药一直将五味子果实用作镇静和止咳补药,广泛分布于中国四川东南部和湖北西部地区。其他国家还使用这种水果来生产功能性食品、果酱和饮料。
从五味子中分离出的二苯并环辛二烯木脂素具有抗炎和抗氧化特性,并能改善认知功能(如记忆力)。此外,先前的研究报告称,五味子果实提取物(其中主要生物活性成分是木脂素)具有神经保护作用,并具有有助于预防阿尔茨海默病的生物活性。
五味子果实可能对肝脏、胃肠道、免疫、交感神经和中枢神经系统有积极作用。木脂素提取物已被证明能成功抑制肝细胞癌细胞增殖,并防止化学毒素引起的肝损伤。然而,整个五味子果实中只有 2% 由木脂素组成,而且大部分木脂素存在于种子中,而种子通常在制造水果衍生产品的过程中被去除。
这种藤本植物的茎被用作多种疾病的止痛药,包括关节炎、风湿病和挫伤。迄今为止,已从五味子中分离出 1 种倍半萜类化合物、25 种木脂素和 43 种三萜类化合物。此外,五味子浆果被认为对肾脏和肺部有益,例如可缓解哮喘症状。
山楂
已被用于功能性食品行业。一些研究报告称,它具有防止低密度脂蛋白 (LDL) 氧化、清除自由基和发挥抗炎作用的能力。山楂主要以新鲜水果、加工果汁或果酱的形式食用。果汁和果酱的制造会产生大量副产品,包括种子和叶子。
红花南洋参
根、茎、果实和叶均可入药,尤其是其果实,具有重要的药用和营养价值。其活性三萜类化合物和木脂素因其报道的生物活性而备受关注,包括抗炎和抗肿瘤作用 。
花椒
已被用于促进血液循环以及治疗各种疾病。由于其独特的味道和独特的香气(通常被描述为绿色、辛辣、花香和清新),花椒果实在许多传统的亚洲美食中被用作香料。先前的药理研究表明,这种植物的叶子和果实具有药用特性,包括抗肿瘤、抗炎和抗氧化活性,以及抑制血小板聚集和单胺氧化酶的产生。
拉丁美洲饮食的基础是玉米、土豆、花生和豆类。这种饮食中还包括亚麻籽。
亚麻籽是木脂素的最佳膳食来源之一,其木脂素含量高于豆类或谷物 。富含亚麻籽的饮食与降低各种疾病的风险有关,包括心血管疾病、骨质疏松症、糖尿病、前列腺癌和乳腺癌。可能的机制包括降低循环葡萄糖、LDL 和总胆固醇水平的能力。
亚麻籽具有重要的商业应用,例如在亚麻纤维制造中。就木脂素而言,亚麻籽主要含有secoisolariciresinol和 secoisolariciresinol二葡萄糖苷,但也含有少量的matairesinol 。事实上,亚麻籽总质量的 95% 以上是由开环异落叶松树脂醇二葡萄糖苷组成,其主要位于种子的纤维壳中,而不是其内部 。
亚洲饮食似乎最有利于木脂素的摄入,而且木脂素的生物利用度也更高。这主要是由于亚洲人食用大量蔬菜,以及传统医学中使用富含木脂素的植物浸剂。
在大多数人群中,木脂素摄入量通常不超过 1 mg/天。木脂素摄入量的估计值从约 150 μg/天(马泰瑞香酚和开环异落叶松树脂醇)到约 1600 μg/天(松脂醇、丁香树脂醇、开环异落叶松树脂醇、中树脂醇、马泰瑞香酚、落叶松树脂醇、肠内酯、肠二醇)不等。
木脂素的肠道代谢
几种摄入的植物木脂素在结肠细菌的作用下去糖基化并部分转化为哺乳动物木脂素肠内酯和肠二醇。肠二醇很容易氧化成肠内酯。然后,这些代谢物在结肠中被吸收。
注:含有酚羟基的木脂素是 II 期代谢反应的靶点,并与谷胱甘肽(GSH)、硫酸盐或葡萄糖醛酸结合,导致木脂素的药理活性降低。
尽管植物木脂素具有抗微生物特性,但它们可以被居住在肠道中的细菌代谢并转化为肠内木脂素(”entero-“来源于希腊语的”enteron”,意为“肠”)。肠内木脂素也被称为哺乳动物木脂素,是由两支研究团队几乎同时独立发现的。随后,在人体中证明了植物木脂素是肠内木脂素的膳食前体。
代谢物的吸收与排出
一些代谢物可能经历肠肝循环。木脂素以结合葡萄糖醛酸苷的形式随尿液和胆汁排出,以非结合形式随粪便排出。
亚麻籽木脂素增强、吸收和生物利用度
doi.org/10.1080/10408398.2022.2140643
在植物木脂素向哺乳动物木脂素的吸收和生物转化以及随后的吸收上,不同形态吸收不同,人与人之间存在显著差异(关于个体之间的差异在后面章节会详细阐述)。
木脂素的不同形态与吸收
木脂素在植物中既以糖苷形式存在(含糖),又以糖苷配基形式存在(不含糖)。不同形态的木脂素在肠道中的释放和吸收效率不同,进而影响其生物利用度。
目前,亚麻籽中仅发现开环异落叶松树脂醇作为木脂素低聚物。木脂素糖苷经肠道细菌代谢为肠木脂素(肠二醇和肠内酯)和木质素糖苷配基后,在胃肠道中被吸收。从亚麻中的糖和低聚物中释放木脂素的水解量以及肠木脂素的形成和其生物利用度因人而异。
亚麻籽木脂素结构变化导致生物利用度变化
doi.org/10.1080/10408398.2022.2140643
不同吸收速度
肠木脂素肠内酯和肠二醇在结肠中被吸收,其中大部分与结肠组织中的葡萄糖醛酸结合。它们通常在饮食摄入后 8-10 小时出现在血液中。
另一项研究表明,一些植物木脂素(例如环松脂素、脱水开环异松脂素、7′-羟基松脂素、松脂素、松脂素、松脂素、落叶松脂素、开环异松脂素和芝麻素)在摄入芝麻籽一小时后被小肠迅速吸收并在体循环中检测到。
肠木脂素、开环异松脂素和芝麻木脂素的肠肝循环显著。肠内酯、肠二醇和开环异落叶松树脂醇的硫酸盐和葡萄糖醛酸苷可能只是通过胆汁、尿液排出,或进行肠肝循环。
常见植物食物木脂素转换为肠内木脂素
(肠内木脂素和肠内二醇)的转化途径
实箭头表示已知的途径。虚箭头表示理论路径。
木脂素糖苷,如芝麻芝麻林三葡萄糖苷和亚麻 SDG 酯基复合物,在肠道厌氧微生物的作用下水解为木脂素苷元。然后,游离木脂素在几种肠道细菌的代谢反应中转化为肠木脂素。转化效率取决于多种因素。
组织中的木脂素代谢受遗传因素影响,但这些因素目前尚不十分清楚。在体外粪便微生物群代谢系统中,落叶松树脂醇在 24 小时内完全转化为肠木脂素、肠二醇 (54%) 和肠内酯 (46%);而其他植物木脂素如松脂醇二葡萄糖苷(55%)、马泰尔木脂醇(62%)和 SDG(木酚素)(72%)转化不完全。
许多研究者评估了多种特定肠道细菌进行必要的反应以将糖苷化木脂素转化为肠内木脂素的能力。确定了脆弱的拟杆菌(Bacteroides fragilis)、卵拟杆菌(Bacteroides ovatus)、Clostridium cocleatum、丛形菌、噬糖梭菌(Clostridium saccharogumia)、多枝梭菌(Clostridium ramosum),吉氏拟杆菌(Bacteroides distasonis)其中前四个细菌在实验的20小时内可以完全去糖基化SDG。而且这些菌被证明可以降低李斯特菌相关的感染。
此外,有研究发现十种双歧杆菌菌株能够水解SDG。一旦去糖基化后,SECO 可以去甲基化生成中间产物DHEND。其中丁酸菌、Enterobacter Callander、 Clostridium limosum、Bacteroides Producta能够催化这一反应。
植物性食物或植物油主要以加工形式使用,如薯片、烘焙产品、焯水和煮熟的蔬菜。因此,在加工过程中考虑木脂素含量的变化非常重要。
烘焙、研磨、加热、干燥、煮沸和提取等加工技术可能会影响木脂素含量,因此可能会影响木脂素的生物利用度,因为在食用前会破坏天然食物基质或微观结构。
干燥和烹饪等其他加工过程对木脂素含量的影响各不相同,具体取决于木脂素的结构、木脂素概况、结合类型和食品基质的性质。
不同食物:大麦加工 vs 小麦加工
将大麦加工成膨胀大麦可以降低松脂醇、马泰瑞斯醇、开环异落叶松脂醇的含量,而提高落叶松脂醇的含量。
干燥精制小麦粉对木脂素的总浓度有总体积极影响,并提高了开环异落叶松树脂醇、松脂醇和落叶松树脂醇的浓度。虽然全粒燕麦对松脂醇水平有积极影响,但其开环异落叶松树脂醇、松脂醇和落叶松树脂醇的含量较低。
不同温度:蒸汽(100℃) vs 烘烤(250℃)
用蒸汽(或 100 摄氏度)处理谷物、黑麦粉和芝麻可以降解木脂素,而更高的烘烤温度(例如 250 摄氏度)会降解芝麻和黑麦中的糖苷和苷元。在亚麻籽中,松脂醇、落叶松脂醇、开环异落叶松脂醇和异落叶松脂醇主要以酯化化合物的形式存在,在 250 摄氏度下加热 3.5 分钟后,这些物质会保持稳定。
不同食物基质
在芝麻油中,加热条件几乎不影响芝麻素的含量,而芝麻酚的含量会增加,而芝麻林的含量会略有降低。此外,当油温保持在 200℃ 并持续 20 分钟时,芝麻素会降解。
报告称,煮沸十字花科蔬菜样品会降低木脂素含量,而胡萝卜的木脂素含量没有显著变化。研究表明,许多蔬菜(尤其是块茎类蔬菜)的木脂素含量在烹饪后会有所增加。
从芝麻饼中分离出的 STG 和芝麻中最丰富的木脂素糖苷与人体肠道细菌一起发酵时,与对照组相比,STG 样品中的系统发育群双歧杆菌、乳酸杆菌、肠球菌明显更多。
植物木脂素底物也会影响肠道微生物群体产生肠二醇(Enterodiol,简称,END)和肠内木脂素(Enterolactone,简称,ENL)的潜力。不同的植物来源木脂素向END和ENL的转化率各异,从异落基瑞醇没有转化,到LARI的100%转化。类似地,生成ENL的效率在牛蒡苷葡萄糖苷和MAT之间分别为5%到62%。这些结果进一步支持了植物木脂素与肠道微生物群体相互作用的重要性,这在决定肠内木脂素的暴露上起到了关键作用。
注:END和ENL这两种化合物是植物木脂素在肠道内经过微生物代谢生成的生物活性代谢产物。在肠道微生物群体中,植物木脂素底物的摄入会影响肠道微生物产生肠二苯乙烯二醇和肠内木脂素的能力。这些代谢产物可能对健康和疾病风险具有一定影响,因此对它们的生成过程和机制进行研究具有重要意义。
食物中的大多数植物木脂素通过大肠上部的肠道菌群转化为肠木脂素。
血浆肠内酯含量低可能会增加乳腺癌的风险,主要是雌激素阴性乳腺癌。有证据表明,纯木脂素、亚麻籽和 SDG 可抑制肿瘤形成并减少血管细胞进展,从而预防前列腺癌、结肠癌、卵巢癌和转移、心血管疾病、糖尿病、肥胖症、肾脏和骨骼疾病等多种疾病。
功能性食品或营养食品是除提供基本营养成分外,还声称具有预防疾病或促进健康特性的食品。许多功能性食品或营养食品都是用亚麻粉、全亚麻籽和磨碎的亚麻制成的。
此外,通过添加木脂素等成分、加工或包装,可以增加食品的价值。与主要原始来源相比,这些产品更受消费者的接受和青睐。增值产品的一些例子有挤压零食、酸奶、脱脂牛奶、冰淇淋、奶酪、早餐麦片等。
木脂素在商业上用于烘焙、乳制品、挤压、零食、发酵、传统(印度薄饼、哈克拉、蔬菜奇拉)产品等产品。例如,亚麻籽可以作为整粒、烘烤、磨碎、碾磨和油的形式加入到烘焙产品中。
此外,亚麻籽木脂素已被添加到各种乳制品中,包括牛奶、酸奶、奶酪、冰淇淋、黄油和乳清饮料。研究发现,添加到牛奶、酸奶和奶酪中的 SDG 具有良好的耐受发酵、高温巴氏杀菌和牛奶凝乳酶工艺。
天然抗氧化剂花青素、黄酮类胡萝卜素和多酚在预防和治疗多种疾病方面发挥着重要作用。尽管近年来有多项研究表明天然抗氧化剂主要在过渡金属离子(主要是 Cu 和 Fe)存在下才具有促氧化活性。酚类化合物在某些条件下(例如高酚浓度、高 pH 值和存在金属离子)可诱导促氧化活性并产生自由基,最终导致诱变和 DNA 损伤。
研究报道了芝麻木脂素芝麻酚的反常作用。在这项研究中,芝麻酚在人类结肠直肠癌 (HCT116) 细胞中表现出高浓度(0.5、1、2 和 5 mM) 的促氧化活性和低浓度 (<0.05 mM)的抗氧化活性。芝麻酚基于其促氧化作用,通过细胞内 O2−生成诱导 HCT116 细胞中的线粒体凋亡途径。
活性氧 (ROS) 是有氧代谢的必然结果。
内源或外源产生的 ROS 可能导致多种病理因素,如细胞变性和DNA损伤。如果阻止氧化损伤的细胞抗氧化能力不能中和 ROS 的产生,细胞就会表现出一种称为氧化应激的状态。
氧化应激直接或间接地导致多种疾病
ROS 在细胞器或细胞质中积累可以通过破坏核酸的结构和功能、激活凋亡途径、蛋白质氧化修饰、引起脂质过氧化、抑制抗氧化酶以及最终导致细胞功能障碍来破坏细胞的平衡。
木脂素的抗氧化活性可通过多种机制实现
包括减弱 ROS 生成和 MDA,以及通过增强 SOD、CAT、GSH-Px 和 GSH 活性来增加组织抗氧化酶能力。
它们还可以抑制脂质过氧化、蛋白质和 DNA氧化。抗氧化剂激活 JAK2/STAT3信号通路,通过P38MAPK磷酸化和Nrf2/ARE通路上调 PI3K/AKT 信号和 HO-1。
通过这些不同的机制,抗氧化剂可以通过下调I – κB激酶的活性和NF-κB的DNA结合活性,减少促炎细胞因子(IL-1β、IL-6、TNF-α)和介质(COX-2、iNOS、ROS)的产生,来调节参与氧化应激和炎症的关键分子。
大肠杆菌、克雷伯氏菌、肠杆菌、沙门氏菌和许多其他细菌是导致人类许多疾病的病原菌。
金黄色葡萄球菌可产生多种肠毒素,导致胃肠炎,而胃肠炎是大多数国家的主要食源性疾病。
一项研究表明,亚麻籽木脂素提取物在 MIC 值为 1.5 mg/ml 时,对金黄色葡萄球菌和弧菌等革兰氏阳性菌具有有效的抗菌活性。同样,由于含有多酚(包括木脂素),亚麻籽粗木脂素提取物和水解木脂素提取物对革兰氏阳性菌和革兰氏阴性病原体都表现出抗菌活性。
亚麻籽粉酚提取物可抑制单核细胞增生李斯特菌,其抑菌圈直径为 26 毫米,其次是鼠伤寒沙门氏菌、大肠杆菌和铜绿假单胞菌,其抑菌圈直径分别为 25 毫米、22 毫米和 10 毫米。
木脂素可以与 Ca+2和 Mg+2离子结合,降低外膜脂多糖的离子浓度,引发脂多糖释放,从而削弱膜,从而增加木脂素活性。
黄曲霉和黑曲霉这两种真菌都会产生黄曲霉毒素,这是一种强烈的肝毒素和致癌物。它们是各种主要粮食作物收获前的感染物。这些化学物质可导致农场动物死亡或生产力下降。2.5-3.0 mg/ml 的木脂素粗提取物对黄曲霉和黑曲霉均表现出相当强的抗真菌功效。
一项研究表明,亚麻籽成分具有显著的抗真菌作用,特别是对抗白色念珠菌的生长。此外,与常用的制霉菌素相比,富含木脂素的亚麻籽水提取物表现出明显更强的抗真菌活性。亚麻木脂素能刺激胃中益生菌的生长,还能帮助消除引起真菌感染的酵母菌和念珠菌。
以上是木脂素抗氧化,抗菌的一些特性,这些特性为木脂素在维护健康方面的潜在作用提供了科学依据。接下来我们来进一步了解木脂素与人类健康之间的密切关系。
植物木脂素,尤其是其代谢产物——肠内木脂素,显示出了多种生物活性。
由于END和ENL结构上与常见性激素17β-雌二醇相似,使得肠内木脂素能够结合到雌激素受体α(ERα)上,从而产生微弱的雌激素或抗雌激素效应,这也是它们最初被归类为“植物雌激素”的原因。
然而,无论是在体外还是体内的研究,都鉴定出肠内木脂素可能影响几种慢性疾病风险的多种其他机制。这些机制包括抗增殖、抗炎和促进细胞凋亡的效应。这里我们总结了木脂素及其对人类健康影响的现有证据。
在与木脂素暴露相关的研究中,探讨最深入的三类癌症是乳腺癌、结直肠癌和前列腺癌,这些癌症与木脂素的癌症预防作用有关。
注:关于其他类型癌症的研究较为稀少。人类关于子宫内膜癌和木脂素的少数几项研究倾向于无关联,另外在欧洲癌症与营养前瞻性研究(EPIC-Norfolk)中的一项嵌套病例对照研究显示木脂素与胃癌之间没有关联。
尽管胃癌和子宫内膜癌的研究结果不显著,但总体证据倾向于支持木脂素与几种常见癌症之间存在负相关关系。
木脂素与癌症风险的流行病学研究
在2005年,Webb和McCullough对已有的关于膳食木脂素暴露与癌症的文献进行了综述。他们得出结论,体外和动物研究支持富含木脂素的食物和提取的木脂素在调节结肠、乳腺和前列腺癌的癌变过程中的作用;然而少数可用的流行病学研究结果可能不一致。
结直肠癌是一种在结肠或直肠内发展的恶性肿瘤。它是一种常见的癌症,通常起因于结肠或直肠内的息肉转变成癌细胞。结直肠癌早期可能没有明显症状,但随着病情不断恶化,患者可能出现腹痛、腹泻、便秘、便血等症状。
木脂素摄入降低结直肠癌风险
一项在加拿大进行的病例对照研究考察了通过食物频率问卷(FFQ)测量的木脂素摄入量与结直肠癌风险之间的关系,包括1095个病例和1890个对照组。
研究人员发现,摄入高水平的木脂素与降低结直肠癌风险相关。具体来说,摄入最高水平的膳食木脂素(每天超过0.255毫克)的个体显示出显著降低的结直肠癌风险,其几率比为0.73(95% CI 0.56–0.94)。也就说摄入较高水平的人群其患结直肠癌的风险更低。
血浆中END含量与结直肠腺瘤风险
2006年的一项荷兰研究发现,血浆中END(肠内一种木脂素)的含量与显著降低的结直肠腺瘤风险相关。在这项研究中,对首次确诊的结直肠腺瘤患者进行了分析,结果显示END与降低的风险相关,其几率比为0.53(95% CI 0.32–0.88)。这意味着含有较高END水平的个体患结直肠腺瘤的风险更低。
ENL与结直肠腺瘤风险
另一种肠内木脂素ENL也与降低结直肠腺瘤风险相关,但其影响程度较弱。具体而言,ENL与降低的风险相关,其几率比为0.63(95% CI 0.38–1.06)。这表明相对于END,ENL对结直肠腺瘤风险的影响较轻。
总的来说,这些研究结果显示了木脂素在降低结直肠癌和结直肠腺瘤风险中的潜在作用,尤其是高水平的木脂素摄入与较低的患病风险相关。然而,需要更多研究来确认这些关联以及木脂素对人类健康的确切影响。
性别差异在木脂素影响中的表现
在丹麦进行的一项病例队列研究同样探讨了血浆ENL与结直肠癌之间的关系,发现女性中血浆ENL浓度每增加一倍,结肠癌的发病率比值显著降低(IRR 0.76;95% CI 0.60–0.96)。然而,有趣的是,在男性中,直肠癌的发病率与血浆ENL浓度每增加一倍相关,风险增加(IRR 1.74;95% CI 1.25–2.44)。
乳腺癌是一种影响女性乳腺组织的恶性肿瘤。基于人类流行病学研究的结论对于木脂素在绝经前和绝经后乳腺癌风险中的作用存在差异。在2005年的综述中,Webb和McCullough总结道,当时关于木脂素在癌症预防中的作用,最有支持力的是绝经前乳腺癌。
一项综合分析包括了21个研究,其中有11个前瞻性队列研究和10个病例对照研究,得出的结论是总体上植物木脂素摄入与乳腺癌风险无关。
绝经后的女性:木脂素摄入与降低乳腺癌风险显著相关
当研究根据绝经状态进行分析时,他们发现绝经后的女性中植物木脂素摄入与降低乳腺癌风险显著相关,合并风险比为0.85 (95%的置信区间是0.78-0.93,p<0.001),有显著性关联。而在绝经前女性中,植物木脂素摄入与乳腺癌风险之间则没有明显相关。
肠内木脂素与乳腺癌风险呈负相关
研究人员进一步检查了血液中肠内木脂素ENL的浓度,并尝试用体外发酵模型来估计肠内木脂素的暴露。他们发现,肠内木脂素暴露与乳腺癌风险之间存在着显著的负相关,合并风险比为0.73(95%的置信区间是0.57-0.92)。但是,当考虑血液ENL水平时,这种关联性就不再显著。
在四项研究中观察膳食中的肠内木脂素,也发现了类似的关联,即高摄入肠内木脂素与降低乳腺癌风险相关。
近期的研究继续支持着肠内木脂素对乳腺癌的保护作用的假说,但这种作用取决于绝经状态。
总的来说,这些研究表明绝经状态在木脂素与乳腺癌之间的关系中扮演着重要的角色,可能需要考虑不同的机制来理解这种复杂的关联。
另一研究表明,高木脂素摄入量的女性乳腺癌发生率降低40-50%,不受绝经状态影响。不过,在绝经前女性中,与PINO和LARI有较强关联,而绝经后女性与MAT有较强关联。
动物模型的研究显示,木脂素可以促进乳腺细胞的分化,延缓乳腺肿瘤的发生,并在妊娠和哺乳期对乳腺结构具有益处的变化。
实验证明,SES可以减少乳腺癌细胞的增殖,增加凋亡。在另一项研究中发现,肠内木脂素对抗癌效应产生影响。
综合这些研究结果,表明植物木脂素摄入可能对乳腺癌的风险有保护作用,尤其在特定类型的肿瘤和绝经后女性中表现更为显著。动物模型的研究也支持了木脂素在乳腺癌防治中的潜在作用。
前列腺癌是一种发生在前列腺组织中的恶性肿瘤。前列腺是男性生殖系统的一部分,位于膀胱下方,主要负责产生精液。前列腺癌通常会导致尿频、尿急、尿痛等症状,严重时可能会影响患者的性功能和生活质量。早期发现和治疗前列腺癌对于患者的康复非常重要。
木脂素在前列腺癌中作用的证据多样化
一方面,一些体外和动物研究,这些研究表明木脂素在前列腺细胞中具有化学预防作用。
最近的证据确认,即使在进食木脂素前体后体内可达到的浓度下,ENL(肠内植物雌激素)也能抑制早期前列腺癌细胞的增殖。
来自人类研究的数据却不一致
一些证据显示有益处,而一些研究则发现木脂素与前列腺癌之间没有关联。
有两项病例对照研究显示,较高的木脂素摄入与前列腺癌风险增加相关。
EPIC-Norfolk的一项嵌套病例对照研究考察了木脂素与前列腺癌的关系。
参与者完成了为期7天的饮食记录,用以估算每日木脂素摄入量。除了估算植物木脂素MAT和SECO的摄入量,研究人员还估算了来自乳制品和其他动物产品的预形成肠内木脂素的摄入量。
这是首次在木脂素暴露的总体估算中考虑动物来源的肠内木脂素。考虑到哺乳动物,尤其是反刍动物,能够在其瘤胃中生成大量肠内木脂素,因此一些动物产品,特别是乳制品,含有肠内木脂素。
该研究包括204例前列腺癌病例和812个对照组。估算的预形成肠内木脂素平均摄入量在前列腺癌病例中为20 μg/天(±9),在对照组中为18 μg/天(±9)。在年龄调整模型中,总木脂素摄入量与前列腺癌无关(OR 1.05; 95% CI 0.81–1.36; p=0.72)。然而,总肠内木脂素摄入量(包括非木脂素植物雌激素Equol)与前列腺癌呈正相关(OR 1.41; 95% CI 1.12–1.76; p=0.003),Equol(OR 1.43; 95% CI 1.14–1.80; p=0.002)和ENL(OR 1.39; 95%CI 1.12–1.71, p=0.003)单独考虑时也是如此。
然而,在进一步调整了年龄、身高、体重、身体活动、社会阶层、前列腺癌家族史和每日能量摄入等协变量后,这些关联性变得不显著,表明木脂素的对前列腺癌健康的影响可能取决于木脂素在肠内转化。
心血管疾病是指影响心脏和血管系统的疾病。包括高血压、冠心病、中风、心肌病等。心血管疾病是导致全球死亡的主要原因之一。
2010年发表的一篇关于木脂素和心血管疾病风险的综述总结了随机对照试验(RCTs)和观察性研究的发现。虽然一些RCTs未显示出任何效果,但许多研究显示对血压、C反应蛋白和血脂分布有有益效果。作者还讨论了研究木脂素摄入的观察性研究以及研究血清中ENL(肠内木脂素)的观察性研究。
在11项观察性研究中,有5项显示随木脂素饮食摄入增加或血清ENL浓度增加,心血管风险降低;有5项被作者描述为具有边缘显著性,另有1项未发现任何关联。作者指出,由于研究间实验协议的差异,系统评估这些干预措施的能力受到限制。
2012年的一项横断面研究发现,尿液中的肠内木脂素与血清甘油三酯水平呈负相关,与高密度脂蛋白(“好”胆固醇)呈正相关。
以上是木脂素与各类疾病之间的关联,这些研究为我们提供了木脂素潜在的健康益处的宝贵信息。
然而,每个人对木脂素的代谢能力是不同的,这可能会影响其健康效果的个体体验。接下来,我们深入了解个体间木脂素代谢的差异。个体间的这些差异可能由遗传因素、肠道微生物组成、饮食习惯、生活方式等多种因素造成。
食物中木脂素的复杂摄入模式
研究人群中木脂素暴露与疾病风险之间的关系既具有挑战性又复杂。各种食物都是木脂素的来源,而且这些食物不会单独食用。传统上,饮食来源木脂素的菜肴也包含其他可能被视为健康或不那么健康的食物。要分辨一般高木脂素食物(通常也是高纤维食物)或特定木脂素的摄入量与疾病风险之间的关联是非常困难的。
高木脂素食物与疾病风险的关联难度
比如在乳腺癌研究中,作者描述了几种可能导致流行病学研究中获得结果模糊的因素。他们指出,几种因素在肠木脂素暴露中起作用,包括肠道微生物群的组成、含木脂素食物的饮食摄入、抗生素使用、吸烟状况、便秘等。作者还指出准确可靠地确定肠木脂素暴露的难度,以及基因因素在癌症发展和肠木脂素作用中的复杂角色。
即使在受控条件下,关于肠木脂素生产的个体差异也很大。
一项药代动力学研究中显示,固定剂量的 SDG 会产生多种血浆曲线,其中一些个体产生大量的 ENL 和 END,或者产生较高量的其中一种(例如,高ENL、低END,反之亦然),或者两者产生量都很低。
肠道菌群
这种变异大部分被认为是由于个体之间的肠道微生物群差异所致。不同的 END 和 ENL 血液循环出现模式及累积排泄值范围表明,肠道微生物在处理 SDG 代谢的不同步骤上的能力不同(有些不能有效地将 SDG 水解成 SECO,有些则无效将 END 转换为 ENL)。
木脂素转换细菌的系统发育树显示参与肠木脂素生成的生物分布于不同门类中
不同个体肠道菌群,在肠木脂素生成中的差异
有研究将新鲜粪便样本与630 μmol/L 的亚麻籽提取物孵育72小时,发现100个个体中END和ENL的生成量存在很大差异。63%的样本生成了不同量的END,而只有39%的样本生成了ENL。此外,END和ENL的生成量呈正相关,并且与较高的β-葡萄糖醛酸苷酶活性相关,这支持了在SDG转换过程中初始步骤的重要性。
个体在肠木脂素生物转化过程中的差异
另一个导致尿液或血液中ENL和END测量值变异的潜在来源,可能是个体在肠木脂素生物转化过程中的差异。尽管尚未进行遗传变异对木脂素可利用性影响的控制评估。
在人体内,植物木脂素及其代谢物有效地与葡萄糖醛酸或在较小程度上与硫酸结合。结合过程在肠道上皮和肝脏中由UDP-葡萄糖醛酸转移酶(UGT)和硫转移酶进行,结合体通过尿液和胆汁排出。那些重新经胆汁排出的进行肠肝循环。
在尿液中,ENL和END主要以单葡糖醛酸结合物形式排出(分别为95%和85%),小部分以单硫酸盐形式(2-10%)和自由苷元形式(0.3-1%)排出。
结肠细胞系已被证明能快速葡糖醛酸化肠木脂素,这表明大多数木脂素的结合可能在结肠中发生。此外,肝微粒体氧化比葡糖醛酸化慢得多,这表明END和ENL的氧化产物是肠木脂素的小代谢物。
饮 食
饮食在肠木脂素生成中起着重要作用,这不仅是由于食物中前体物质含量的差异,还因为食物基质和其他饮食因素对植物木脂素的可用性和转换为肠木脂素的影响。
水果、蔬菜和浆果已被证明能增加ENL的生成。黑麦作为一种富含植物木脂素的食物,在三项饮食干预研究中被证明能增加ENL的生成。
然而,一项涉及黑麦制品的类似干预研究显示,ENL生成没有增加。这种差异的原因尚不清楚,但研究作者指出,他们的参与者通常较年轻,可能比其他研究的参与者摄入更多的膳食纤维,这可能导致木脂素在肠道中的转运速度加快,从而导致不完全的植物木脂素生物转化。其他涉及富含木脂素的亚麻籽和芝麻的饮食试验显示显著的ENL生成。
食物基质和食物加工影响木脂素的生物利用度
在一项随机交叉研究中,12名参与者每天摄入全亚麻籽、压碎的亚麻籽和研磨的亚麻籽(0.3 g/kg体重)。结果表明,与研磨的亚麻籽相比,全亚麻籽的平均相对生物利用度为28%,压碎的亚麻籽为43%。
另一项饮食研究发现,烘焙对尿液或血浆中肠木脂素浓度没有影响,当参与者摄入混入苹果酱中的研磨亚麻籽或烘焙在面包和松饼中的研磨亚麻籽时,表明这些化合物是热稳定的。
不同类型膳食纤维,影响肠木脂素的生成
在体外实验中,通过不同提取方法得到的黑麦分馏产生了截然不同的结果。
总体来说,不同类型的膳食纤维可能会影响木脂素的生物利用度。含有不可提取分馏的悬液产生了显著更多的ENL。
性 别
关于木脂素代谢的性别差异的证据不一,但似乎女性比男性生成更多的肠木脂素。
几项研究饮食与肠木脂素生成关系的横断面研究显示没有性别差异。
女性的血浆ENL和END更早达到更高的浓度
然而,一项对2380名芬兰男女的横断面研究显示,女性血清ENL浓度高于男性。确实,当服用一次SDG剂量(1.31 μmol/kg体重)时,女性的血浆ENL和END不仅出现的更早,而且达到了更高的最大浓度。
女性的平均基线血清ENL浓度更高
一项全谷物饮食试验,发现女性的平均基线血清ENL浓度更高,尽管全谷物饮食后血清ENL的上升在男女之间是相似的。
亚麻籽,无性别差异;
蔬菜,男性排泄ENL比女性多
另一个随机交叉试验中,研究人员给男女吃亚麻籽并测量尿液中的木脂素排泄量,结果显示男女之间没有差异。其他涉及木脂素剂量的类似试验也未显示男女之间的肠木脂素生成差异。相反,在一项蔬菜摄入的控制饮食研究中,男性在实验饮食期间排泄的ENL比女性多。
女性:更多生成ENL和END的细菌
女性可能比男性生成更多肠木脂素的趋势,往往女性携带更多生成ENL和END的细菌。
此外,研究表明女性的胃肠道通过时间较男性更长;这种含纤维食物和植物木脂素在肠道中停留时间更长,可能进一步导致更多肠木脂素生成。
其他因素
抗微生物剂使用
由于肠道微生物群对肠木脂素生成的关键作用,口服抗微生物药物的使用与血清ENL浓度呈负相关。
在一项横断面研究中,在2753名芬兰男女样本中,使用抗微生物剂的参与者,ENL浓度明显降低,尽管在取样前的12-16个月内未接受治疗。而且抗微生物剂使用次数也与ENL浓度呈负相关。
肠道停留时间
肠道停留时间似乎是影响ENL生成的另一因素,尽管大多数研究依赖于非定量测量方式评估此因素。同一研究还发现,在女性中,血清ENL浓度与年龄和便秘呈正相关,而与吸烟呈负相关。
体重
此外,体重正常的女性ENL浓度明显高于体重不足或肥胖女性。其他欧洲研究支持Kilkkinen的发现,报告了BMI、吸烟和排便频率与血浆ENL浓度成反比。
生活方式
最近,一项研究考察了其他生活方式因素与尿液ENL水平之间的关系,该研究在一大样本20岁以上的美国男女中进行。
在2003-2006年国家健康与营养检查调查(NHANES)的一部分(n=3000)中,发现年龄、收入和体育活动与尿液ENL呈正相关。
此外,与欧洲研究相似,吸烟和BMI与尿液ENL呈负相关。尽管存在这些关联,选择的社会人口学和生活方式因素仅解释了总变异量的一小部分(R2≤4%),这表明,它们对肠木脂素水平的影响相对较小。
木脂素作为一类多酚,由植物木脂素和哺乳动物木脂素组成。本文探讨了什么是木脂素,哪些食物和饮食方式中木脂素的分布差异,同时概括总结了在体外、动物和人类三个层面上可能的对健康的影响。
木脂素的健康效益并非一成不变,比如芝麻酚在低浓度下显示抗氧化活性,在高浓度下呈促氧化活性,并在细胞中引发线粒体凋亡途径。在动物和体外模型中,木脂素的氧化应激研究主要涉及亚麻木酚素、芝麻素、厚朴酚、五味子,而只有少数临床试验评估了其作用。
根据现有研究,我们了解到这种暴露因多种环境和生理因素而异,包括植物木脂素类型、食物基质、其他可能影响肠道微生物活性的摄入物(如膳食纤维、抗微生物药物)、肠道微生物组成和活性,以及肠道停留时间及其他影响因素。
测量尿液或循环中的肠二苯乙烯二醇(END)和肠木质素(ENL)可能更好地表征这些生物活性化合物的内部暴露水平。这种方法也可作为饮食和健康生活方式的生物标志,甚至是肠道微生物活性的指标。
随着新技术的出现,能够有效快速地表征肠道微生物组,将其信息整合到统计模型中,未来将会有助于更好地理解微生物对木脂素与疾病风险关联的调节作用。
主要参考文献:
Seth C. Yoder, Samuel M. Lancaster, Meredith A.J. Hullar, Johanna W. Lampe, Chapter 7 – Gut Microbial Metabolism of Plant Lignans: Influence on Human Health, Editor(s): Kieran Tuohy, Daniele Del Rio, Diet-Microbe Interactions in the Gut, Academic Press, 2015,Pages 103-117
Senizza A, Rocchetti G, Mosele JI, Patrone V, Callegari ML, Morelli L, Lucini L. Lignans and Gut Microbiota: An Interplay Revealing Potential Health Implications. Molecules. 2020 Dec 3;25(23):5709.
D. Ayres, J. Loike, Lignans: Chemical, Biological and Clinical Properties, Cambridge University Press, Cambridge (1990)
Adlercreutz H. Lignans and human health. Crit Rev Clin Lab Sci. 2007;44(5-6):483-525.
T. Umezawa. Diversity in lignan biosynthesis
Phytochem Rev, 2 (2003), pp. 371-390
W.M. Hearon, W.S. MacGregor. The naturally occurring lignans. Chemical Rev, 55 (1955), pp. 957-1068
J.-Y. Pan, S.-L. Chen, M.H. Yang, J. Wu, J. Sinkkonen, K.
Zou. An update on lignans: natural products and synthesis.
Nat Prod Rep, 26 (2009), pp. 1251-1292
D.R. Gang, A.T. Dinkova-Kostova, L.B. Davin, N.G. Lewis. Phylogenetic links in plant defense systems: lignans, isoflavonoids, and their reductases.
P.A. Hedin, R.M. Hollingworth, E.P. Masler, J. Miyamoto (Eds.), Phytochemicals for Pest Control, American Chemical Society, Washington, DC (1997), pp. 59-89
P. Mäki-Arvela, B. Holmbom, T. Salmi, D.Y. Murzin
Recent progress in synthesis of fine and specialty chemicals from wood and other biomass by heterogeneous catalytic processes
Catal Rev, 49 (2007), pp. 197-340
B. Holmbom, C. Eckerman, P. Eklund, et al. Knots in trees – a new rich source of lignans. Phytochem Rev, 2 (2003), pp. 331-340
I. Cesarino, P. Araújo, A.P. Domingues Júnior, P. Mazzafera. An overview of lignin metabolism and its effect on biomass recalcitrance
Braz J Bot, 35 (2012), pp. 303-311
L.B. Davin, M. Jourdes, A.M. Patten, K.-W. Kim, D.G. Vassão, N.G. Lewis. Dissection of lignin macromolecular configuration and assembly: comparison to related biochemical processes in allyl/propenyl phenol and lignan biosynthesis
Nat Prod Rep, 25 (2008), pp. 1015-1090
W.R. Cunha, M. Luis, R.C. Sola, et al. Lignans: chemical and biological properties V. Rao (Ed.), Phytochemicals – A Global Perspective of Their Role in Nutrition and Health, InTech, Rijeka, Croatia (2012), pp. 213-234
J. Harmatha, L. Dinan. Biological activities of lignans and stilbenoids associated with plant–insect chemical interactions. Phytochem Rev, 2 (2003), pp. 321-330
N.G. Lewis, M.J. Kato, N. Lopes, L.B. Davin. Lignans: diversity, biosynthesis, and function. P.R. Seidl, O.R. Gottlieb, M.A.C. Kaplan (Eds.), Chemistry of the Amazon, American Chemical Society, Washington, DC (1995), pp. 135-167
I.E.J. Milder, I.C.W. Arts, B. Van de Putte, D.P. Venema, P.C.H. Hollman Lignan contents of Dutch plant foods: a database including lariciresinol, pinoresinol, secoisolariciresinol and matairesinol
A.I. Smeds, P.C. Eklund, S.M. Willför
Content, composition, and stereochemical characterisation of lignans in berries and seeds
Food Chem, 134 (2012), pp. 1991-1998
A.I. Smeds, P.C. Eklund, R.E. Sjöholm, et al.
Quantification of a broad spectrum of lignans in cereals, oilseeds, and nuts. J Agric Food Chem, 55 (2007), pp. 1337-1346
谷禾健康
让食物成为你的药物,让药物成为你的食物
随着现代生活节奏的加快,疲劳、压力、不均衡的饮食,都在悄悄侵蚀着我们的健康。多糖,这些来自植物、真菌乃至海洋生物的天然赠礼,正以其独特的方式,为我们提供了一种全新的健康支持。
多糖由单糖通过糖苷键结合而成的高分子碳水化合物。研究表明,多糖具有多种生物活性,包括调节免疫功能、降低血脂和血糖、抗癌、抗病毒、抗肥胖、抗精神病、抗氧化、抗炎、抗凝血、止吐、抗辐射等作用。因此,多糖已成为最重要的天然成分之一,并引起了世界上越来越多研究者的关注。
虽然部分多糖如淀粉可以在人体胃和小肠中被消化吸收,但仍有许多特殊结构的多糖不能在这两个部位分解。对于那些不能被宿主消化的多糖,它们可以进入结肠,而结肠是大多数肠道菌群居住的地方。在结肠中,多糖可以与肠道菌群相互作用,从而发挥营养或药理作用。
多糖与肠道菌群之间相互作用可以影响健康,同时也通过肠道菌群的代谢作用,转化为有益的代谢产物,如短链脂肪酸,这些产物对维持肠道屏障的完整性、调节免疫反应发挥着至关重要的作用,甚至扩展到了全身的健康状况,可以影响我们的精力水平、情绪状态,对疾病的抵抗力等方方面面。
本文将深入探讨多糖,了解其在人体内的消化过程、与肠道菌群的相互作用,以及它们如何通过调节肠道菌群代谢物影响健康,如短链脂肪酸、三甲胺、色氨酸,还讨论了多糖在疾病预防和治疗中的应用,包括它们在改善代谢性疾病、炎症性肠病、缓解疲劳、改善肿瘤,神经系统疾病等方面的潜在效果。这为靶向肠道菌群开发新型的营养补充剂和药物提供了新的思路。

本文目录
01 多糖
02 多糖调节肠道菌群的组成
为什么多糖可以调节肠道菌群的组成?
多糖促进或抑制肠道微生物群
多糖分子量、糖苷键影响其细菌调节活性
03 肠道微生物将多糖代谢为短链脂肪酸
短链脂肪酸的生物学效应
人体内的多糖代谢
多糖补充与短链脂肪酸的生成
04 多糖调节其他肠道微菌群代谢物
三甲胺和氧化三甲胺(TMAO)
色氨酸及其代谢产物
胆汁酸、脂多糖、胃肠道气体
05 多糖调节肠道菌群修复肠道屏障
06 多糖通过肠道菌群改善疾病
2型糖尿病、非酒精性脂肪肝、肥胖、高血脂症
炎症性肠病、其他肠胃疾病、肿瘤
疲劳、神经系统疾病(认知障碍、抑郁等)
07 部分多糖营养与菌群调节
路易波士茶多糖、地黄多糖、五指毛桃根多糖
大蒜多糖、槐耳多糖、黄芩多糖、枸杞多糖
岩藻多糖、桑叶多糖、沙棘多糖、蘑菇多糖
08 结语
糖,这个小小的分子,是能量的源泉,是细胞的加油站。除了我们熟知的葡萄糖以外,还有一种叫做多糖,由许多糖分子手拉手组成,从植物的根茎到海洋生物的细胞壁,它们以复杂多样的形态存在。
根据糖单元的数量,碳水化合物可分为几类:
多糖是由多个单糖分子通过糖苷键连接而成的聚合物,属于高分子碳水化合物。它们广泛存在于自然界中,包括植物、真菌和海藻等生物体内。根据其来源和结构特性,多糖具有多种生物活性,如免疫调节、抗氧化、抗肿瘤等。
多糖是由10个以上相同或不同的单糖通过α或β糖苷键连接而成的大分子化合物,分子量从几万到数百万。
多糖的空间构象非常复杂,具有一级、二级、三级和四级结构。研究表明,多糖的活性与其结构密切相关。此外,通过分子修饰,如乙酰化、硫酸化、羧甲基化、硒化、磷酸化和磺化等可显著提高多糖的生物活性。
根据来源和结构的不同,多糖可以分为天然多糖和合成多糖,其中天然多糖又可根据其在自然界中的分布分为植物多糖、动物多糖、微生物多糖等。
例如,透明质酸和硫酸软骨素属于动物多糖,而纤维素、淀粉和糖原是常见的植物多糖。
淀粉
由大量葡萄糖分子通过α-1,4-糖苷键和α-1,6-糖苷键连接而成,形成直链淀粉和支链淀粉两种结构。广泛存在于谷物(如大米、小麦、玉米)、薯类(如土豆、红薯)等食物中。在人体消化过程中,被淀粉酶逐步分解为葡萄糖,为身体提供能量。
纤维素
由葡萄糖分子通过β-1,4-糖苷键连接而成,形成长而直的链状结构。是植物细胞壁的主要成分,在蔬菜(如芹菜、菠菜)、水果(如苹果)中含量丰富。由于人体缺乏分解β-1,4-糖苷键的酶,纤维素难以被人体消化吸收,但对促进肠道蠕动、预防便秘等具有重要作用。
果胶
是一种复杂的多糖,由半乳糖醛酸等组成。常见于水果(如柑橘、苹果)中。在食品工业中,常用于制作果酱、果冻等,增加其黏稠度和稳定性。
尽管功能性糖因其在健康和疾病预防中的潜在作用而受到越来越多的关注,但它们的天然可用性相对较小。这意味着,为了充分利用这些有益的分子,需要采用特定的提取方法来增加它们的可获得性,多糖提取常用的方法有热水提取、酸提取、碱提取和酶水解等。
近年来,一些新的方法,如超声波提取、微波提取、超滤、高压电场法、超临界流体萃取、亚临界水萃取等也用于多糖的提取。这些方法不仅能够提高多糖的提取率,还能够在一定程度上保护多糖的结构完整性,从而保留其生物活性。
通常,人体分泌的消化酶只能分解几种多糖,而纤维等许多多糖不能被吸收和直接使用。因此,多糖可以通过小肠进入结肠,这是大多数肠道细菌居住的地方,然后与肠道微生物群相互作用。
细菌在肠道中通过发酵降解多糖
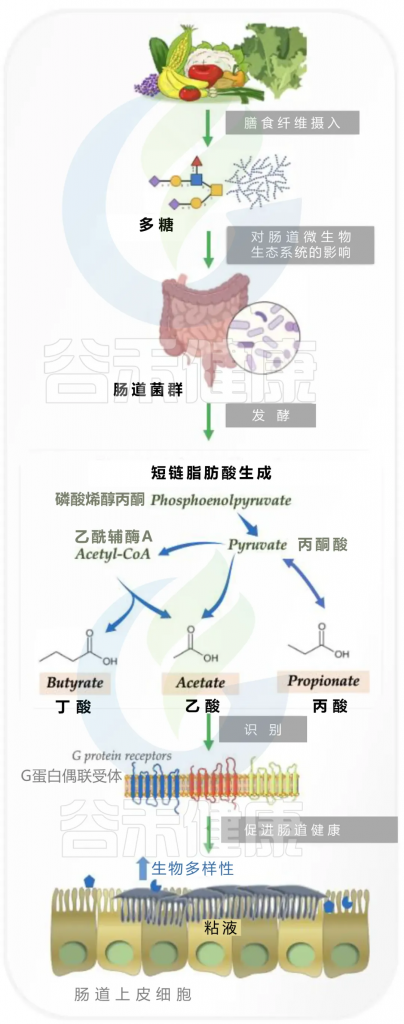
doi.org/10.3390/nu14194116
多糖转化为短链脂肪酸
首先与多糖能够发酵生成酸性的短链脂肪酸密切相关。未电离的短链脂肪酸能够穿过细菌细胞膜,对肠道细菌产生一系列影响,例如改变DNA合成和氨基酸摄取。
短链脂肪酸对肠道细菌的影响
例如,短链脂肪酸能够通过调节侵袭基因的表达,抑制沙门氏菌(一种常见的食源性病原体)的生长。因此,短链脂肪酸的增加可以改变肠道菌群的功能,进而影响其组成。
肠道pH值的变化
短链脂肪酸的增加还会导致肠道pH值下降,影响细菌的适应能力。每种细菌都有其适宜的pH范围,不同细菌在特定pH条件下的适应能力各异。
多糖的降解产物作为能量来源
多糖对肠道菌群组成的调节作用还与其降解产物有关。一些肠道细菌能够利用多糖的降解产物作为碳源和能量来源,而另一些细菌则不能。
综上所述,多糖通过影响肠道菌群的代谢功能,直接调节了肠道菌群的组成。这些发现为我们理解多糖如何通过肠道菌群影响宿主健康提供了新的视角。
多糖的益生元效应
具有选择性刺激有益微生物生长能力的多糖被称为益生元,例如果聚糖,它能丰富乳酸菌和/或双歧杆菌。这些有益细菌的减少与糖耐量受损密切相关。一些多糖能够丰富这些细菌,因此可以用来改善糖尿病表型。
多糖抑制病原菌
病原菌在胃肠道中的定植和增加会导致一系列疾病,而抑制它们可以控制疾病的严重程度。例如,致病性 Sutterella、Desulfovibrionaceae、Streptococcaceae 、Clostridium 的比例较高与肥胖发展呈正相关。
多糖的双向调节作用
疾病的发生是一个复杂的过程,涉及不同的微生物,包括有害细菌和有益细菌。例如:
多糖能够对肠道微生物发挥双向调节作用,即促进有益细菌的同时抑制有害细菌。
例如,口服灰树花多糖(GFHP)对非酒精性脂肪肝病的积极作用与调节肠道菌群有关。
在分子量方面,不同分子量的魔芋葡聚糖(KGM)对2型糖尿病(T2DM)大鼠的降血糖作用研究表明,中等分子量的KGM显著增加了Muribaculaceae,减少了Romboutsia和Klebsiella,但高分子量和低分子量的KGM对这些细菌的影响不显著。
灵芝的低分子量多糖(<10 kDa)具有更好的发酵和更高的产气能力,刺激肠道细菌快速生长。另一方面,高分子量多糖(>100 kDa)更难被肠道细菌发酵,并且在肠道中的停留时间更长,导致对肠道微生物群的影响更长。
高分子量的黄芪多糖具有一定的生物活性,但其相对分子量较大,溶解性差,生物利用度低,限制了其功效的发挥。低分子量的黄芪多糖具有较好的水溶性,能够在更大程度上刺激巨噬细胞摄取中性红、NK细胞增殖,发挥免疫活性。
多糖由各种通过糖苷键连接的单糖组成,糖苷键的类型和位置导致肠道微生物群的选择性发酵存在差异。
多糖的单糖组成越复杂,调节细菌的活性越强
一项关于龙眼多糖和燕麦多糖的研究表明,龙眼多糖能显著促进干酪乳杆菌、嗜酸乳杆菌、植物乳杆菌、粪肠球菌的增殖,但燕麦多糖的作用并不明显。原因是龙眼多糖由葡萄糖、甘露糖和阿拉伯糖组成,而燕麦多糖的单糖主要是葡萄糖。
短链脂肪酸(SCFA)是一组含有少于六个碳的脂肪酸,包括甲酸盐、乙酸盐、丙酸盐、丁酸盐、戊酸盐。
乙酸盐、丙酸盐和丁酸盐是肠道中的主要SCFA,约占所有SCFA的95%,三者的比例约为3:1:1。
作为肠道微生物群和宿主的重要能量来源,短链脂肪酸通过不同的作用模式在健康和疾病中发挥着重要作用。
作用机制
与GPRs的相互作用
抗炎作用
免疫调节
HDAC抑制作用
丁酸盐的作用
与疾病的关系
多糖对SCFA的调节及其对靶标的影响
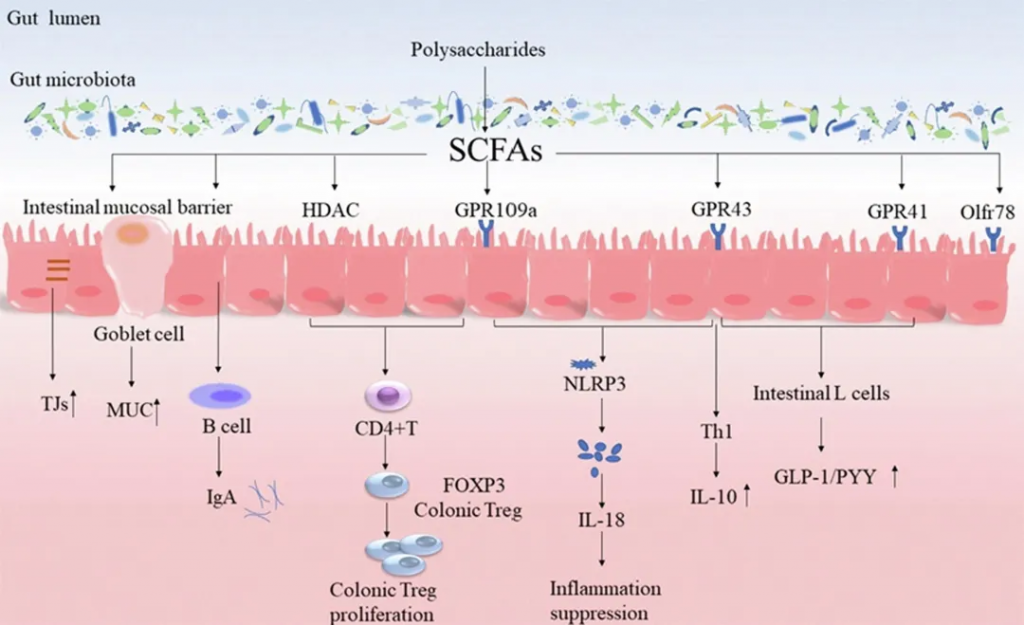
doi.org/10.1016/j.foodres.2022.111653
人体内消化酶的局限
在人体消化系统中,我们自身分泌的消化酶往往难以分解复杂的多糖。这些多糖分子,因其结构复杂,通常在我们体内无法被有效代谢。
肠道菌群的代谢作用
我们的肠道菌群拥有破解这些复杂多糖的秘密武器——一系列的酶,统称为碳水化合物酶(CAZymes)。这些酶能够分解多糖,将其转化为对人体健康有益的短链脂肪酸。
碳水化合物酶的种类
肠道菌群中的“专家”与“通才”
在肠道菌群中,拟杆菌门和厚壁菌门是编码CAZymes的两大主力。
多糖的初步降解
在属的水平上,多糖最初可以由某些微生物降解,例如双歧杆菌属、真杆菌属、梭菌属、罗氏菌属(Roseburia spp.)。
SCFAs的生成途径
尽管人体自身无法分解复杂的多糖,但我们的肠道菌群却具备了这一能力,它们通过一系列特殊的酶,将多糖转化为对人体健康有益的短链脂肪酸。
多糖对SCFAs生成的促进作用
饮食补充多糖可以为产生SCFAs的细菌提供有利的生长环境,从而促进SCFAs的生成。例如,沙棘多糖(CCPP)通过调节肠道菌群和SCFAs,能够缓解2型糖尿病。
沙棘多糖调节肠道菌群和SCFAs,缓解2型糖尿病
枸杞多糖调节肠道菌群,提高SCFAs
多糖结构对短链脂肪酸生成的影响
不同的多糖因其分子结构的不同,对SCFAs的调节作用也不尽相同。
多糖的疗效与SCFAs的非直接关联
尽管大多数多糖可以被代谢成SCFAs,但它们的疗效并不一定与SCFAs直接相关。
多糖通过调节肠道菌群和促进SCFAs的产生,对健康具有多方面的益处。然而,多糖的结构与它们对SCFAs生成的调节作用之间的关系仍需进一步研究。此外,多糖的疗效可能不仅限于SCFAs的产生,还可能涉及肠道菌群产生的其他分子。
在肠道微生物群的作用下,脂质和蛋白质等饮食成分可以代谢为一系列代谢产物,如三甲胺-N-氧化物(TMAO)、色氨酸、脂多糖(LPS)等。此外,肠道微生物群还可以与宿主合成和释放的化合物相互作用。例如,肠道微生物群可以将初级胆汁酸(BA)转化为次级胆汁酸。由于肠道微生物群的组成与肠道微生物群代谢物的产生直接相关,因此可以推断,除了SCFAs,多糖还可以调节其他肠道微生物群代谢产物,如BA。
三甲胺和TMAO的代谢过程
在肠道中,饮食中的四胺类物质如胆碱、L-肉碱和卵磷脂(来自红肉、鸡蛋、鱼、海鲜)首先被微生物胆碱三甲胺裂解酶分解成三甲胺(TMA)。随后,TMA被吸收进入门脉循环,并运输到肝脏,在黄素单加氧酶1和黄素单加氧酶3的作用下转化为三甲胺-N-氧化物(TMAO)。
TMAO的潜在危害
值得注意的是,TMAO是一种潜在的有害代谢产物。多项研究指出,TMAO水平的增加与多种疾病的发生和发展呈正相关。例如,TMAO可以直接增强血小板的反应性,促进血栓形成,并通过激活核因子κB(NF-κB)和NLRP3炎症体影响血管炎症。
多糖对TMA和TMAO代谢的影响
最近的研究表明,TMA和TMAO在理解多糖的作用机制中扮演重要角色。例如:
不同多糖对肠道菌群的调节作用
不同的多糖可以通过调节相同的肠道细菌来降低TMA和TMAO的代谢,例如变形菌门。研究表明,变形菌门负责TMA的转化,增加变形菌门可能导致TMA增加。然而,也有研究表明TMAO与变形菌门呈负相关,这表明多糖调节变形菌门与TMA产生的效应之间的关系需要进一步研究。
多糖通过调节肠道菌群,影响TMA和TMAO的代谢,从而可能对人体健康产生积极影响。然而,多糖与TMAO之间的关系复杂,需要更多的研究来阐明这些相互作用的确切机制。
色氨酸代谢的重要性
色氨酸(Trp)是人体必需的氨基酸。它的代谢可以分为内源性代谢和细菌性代谢。内源性代谢主要通过犬尿氨酸途径(KP)和5-羟色氨酸途径进行,前者产生犬尿氨酸(KYN)、犬尿酸(KA)、烟酸、黄嘌呤酸等,后者转化为5-羟色氨酸(5-HT)和褪黑素。
色氨酸代谢物的生理功能
增强免疫:色氨酸可加强免疫力,减少炎症。
神经保护:KA作为谷氨酸受体拮抗剂,具有神经保护和抗惊厥作用,还能调节能量代谢。
情绪调节:5-HT作为神经递质,可调节情绪、肠道通透性和肠道蠕动。
肠道菌群在色氨酸代谢中的作用
肠道细菌代谢色氨酸产生吲哚及其衍生物,如吲哚丙酸、吲哚乙酸等,这些物质可以缓解炎症,促进肠道上皮屏障功能。肠道菌群的色氨酸代谢异常与肠易激综合症、代谢综合症和结肠癌等疾病有关。例如,结肠癌患者常伴有色氨酸水平下降和KP代谢物水平升高。
多糖影响肠道微生物色氨酸代谢,从而改善疾病
吲哚是硫酸吲哚酚的前体,是一种蛋白结合尿毒症毒素,是心血管疾病的危险因素。对于患有终末期肾病心血管疾病的患者,吲哚水平升高,患者粪便中产吲哚细菌丰富。
总的来说,多糖可以通过调节肠道菌群来改变色氨酸代谢,最常见的是增加乳杆菌和阿克曼菌,从而缓解疾病。
胆汁酸的生物合成与功能
胆汁酸(BAs)是一类由肝脏产生的特殊类固醇分子,经过肠道菌群转化。肝脏中存在两种BA生物合成途径:
CA和CDCA是体内的主要胆汁酸。经过肠道菌群的改造,CA转化为脱氧胆酸(DCA),CDCA转化为鹅去氧胆酸(LCA)。
胆汁酸受体及其作用
胆汁酸受体包括细胞表面受体和细胞内受体。细胞表面受体包括TGR5,细胞内受体包括法尼酰X受体FXR、孕烷X受体、维生素D3受体(VDR)和组成型雄烷受体。胆汁酸通过激活相应的受体调节脂质、葡萄糖和能量代谢。例如,TGR5和VDR的激活导致GLP-1和FGF19分泌,GLP-1可以改善胰岛素敏感性,FGF19可以通过抑制脂肪生成减少肝脏脂肪变性。
多糖对胆汁酸代谢的调节作用
近年来的研究表明,多糖可以通过恢复胆汁酸的代谢来缓解疾病。
多糖对胆汁酸代谢影响的总结
多糖通过调节肠道菌群的组成,特别是Bacteroides、Lactobacillus、Clostridium、Ruminococcus、Bifidobacteria,影响胆汁酸的代谢。
某些多糖如岩藻聚糖和灰树花多糖减少了Clostridium的水平,这与文献报道的促进胆汁酸转化的作用似乎矛盾,需要进一步研究确认这些肠道细菌与多糖之间的关系。
脂多糖的危害
脂多糖(LPS)是由革兰氏阴性细菌(如大肠杆菌)产生的内毒素。持续暴露于LPS或LPS异常增加,可通过减少肠道上皮细胞活性、降低肠道细胞增殖、抑制肠道细胞迁移和诱导肠道细胞凋亡等方式,导致肠道损伤。
LPS的转移还能损伤肠道,并可能通过与多种受体的相互作用,如LPS结合蛋白、簇分化14、髓样分化2和Toll样受体4,引发糖尿病、非酒精性脂肪肝病、肥胖、动脉粥样硬化等一系列疾病。
多糖对LPS产生菌的抑制作用
许多多糖能够抑制产生LPS的细菌。例如,在链脲佐素(STZ)诱导的糖尿病肾病模型中:
多糖调节肠道菌群的矛盾效应
尽管多糖可以通过调节肠道细菌来抑制LPS,但对特定细菌的调节作用可能存在矛盾。例如,作为LPS产生菌的拟杆菌门,在多糖处理后的水平变化并不一致。有研究表明,黄精多糖和蝉花多糖增加了拟杆菌门的水平,而竹荪多糖却降低了它。这些研究表明,多糖对肠道菌群的调节效应有时可能相互矛盾,需要进一步研究以确认结果。
胃肠道气体的生成
胃肠道内通过细菌发酵食物,会产生一系列气体,包括氢气(H2)、甲烷(CH4)、二氧化碳(CO2)、硫化氢(H2S)和一氧化氮(NO)。这些气体在胃肠道中发挥着调节作用,例如影响结肠蠕动、神经通讯、血管功能和免疫反应等。
气体产生的部位和作用
CO2 主要在胃中产生,而其他气体如 H2、CH4、CO2 和 H2S 主要在小肠和结肠中产生。
这些气体对人体健康至关重要,它们可以调节肠道功能,影响营养物质的吸收和疾病的发生。
多糖对气体产生的调节
尽管多糖对 H2、CH4 和 CO2 的产生有明显影响,但关于多糖结构与气体产生之间具体关系的研究会相对较少。需要更多的研究来明确这些关系,以及多糖如何通过影响肠道菌群来调节气体的产生。
肠道菌群是一个复杂的微生物群落,具有显著的组成和功能多样性。不同的微生物可以介导相同或不同的代谢物的产生,相同的微生物也有助于不同代谢物的生产。
例如,持续的研究表明:
拟杆菌门(特别是Bacteroides thetaiotaomicron、Bacteroides fragilis)、厚壁菌门(如Clostridiaceae、Erysipelotrichia)、以及变形菌门可以促进TMA的产生。
放线菌门(如Bifidobacteria)、厚壁菌门(如Lactobacillus、Clostridium、Peptostreptococcus)、拟杆菌门(如Bacteroides)可以促进色氨酸(Trp)的转化。
双歧杆菌、乳酸菌、梭菌、Peptostreptococcus、拟杆菌也有助于次级胆汁酸(BAs)的产生。
因此,就像肠道菌群组成的调节一样,多糖对特定肠道菌群代谢物功能的调节作用不是孤立的。
肠道是我们抵御外界有害物质和病原体侵袭的第一道防线。它由多个层次的子屏障构成:
生物屏障:由肠道细菌和病毒组成;
化学屏障:包含免疫球蛋白A(IgA)、抗菌肽(AMPs)和粘液(MUC);
物理屏障:由肠道上皮细胞构成;
免疫屏障:含有T细胞、B细胞、巨噬细胞和树突细胞等免疫细胞。
这些子屏障协同工作,限制病原体与肠道的接触,维持肠道稳定。肠道屏障的损伤与多种疾病正相关,包括肠易激综合症(IBS)、代谢综合征、过敏、肝脏炎症等。
肠道菌群及其代谢物可以直接或间接影响肠道屏障:
越来越多的证据表明,多糖通过调节肠道菌群对肠道屏障有益。正常的肠道菌群组成可以通过竞争性排除,通过消耗营养源和占据附着位点,作为抵御外界病原体的屏障。
多糖→ 调节肠道菌群→ 修复肠道屏障
肠道菌群可以刺激宿主产生抗菌化合物,如IgA和AMPs,这些是化学屏障的关键组成部分。
例如,菊粉型果聚糖可以促进乳杆菌的丰度和IgA的分泌。在DSS诱导的溃疡性结肠炎小鼠模型中,金银花多糖通过增加双歧杆菌和乳杆菌,增加了分泌型IgA含量,从而调节肠道屏障。
在DSS诱导的结肠炎小鼠中,海蜇皮多糖增加Akkermansia,Akkermansia muciniphila作为粘液的降解者,可以增强肠道屏障的完整性,减少炎症。同时海蜇皮多糖增加结肠中TJs和MUC2的表达,保护了肠道屏障。
多糖→ 短链脂肪酸→ 修复肠道屏障
短链脂肪酸和胆汁酸等肠道菌群代谢物在调节肠道屏障功能中也扮演重要角色。
多糖→ 色氨酸和胆汁酸代谢→ 修复肠道屏障
这些研究表明,多糖可以通过调节肠道菌群及其代谢物,维护肠道屏障的完整性。
代谢性疾病包括一组因碳水化合物、脂质和蛋白质代谢错误而导致的疾病。2 型糖尿病 (T2DM)、非酒精性脂肪性肝病 (NAFLD) 和肥胖是常见的代谢性疾病。
生活方式干预、全身药物治疗和外科手术等多种方法被用于预防和治疗代谢性疾病。尽管代谢性疾病的药物治疗取得了最新进展,但潜在的不良反应仍然是关键挑战。
使用天然物质的药物治疗被认为是改善代谢疾病的一种有前途且可行的方法。
doi.org/10.1016/j.biopha.2023.114538
多糖通过多种机制在治疗2型糖尿病方面表现出良好的效果,比如:
肠道菌群在代谢紊乱,特别是 2 型糖尿病的发展中起着重要作用。
◤车前子多糖 对 STZ 诱导的 2 型糖尿病大鼠有抗糖尿病作用,这可能与其调节肠道菌群和增加短链脂肪酸水平有关。车前子多糖可显著增加糖尿病大鼠粪便中Bacteroides vulgatus、发酵乳杆菌、Prevotella loescheii、Bacteroides vulgates等结肠细菌的多样性和丰度,以及短链脂肪酸的浓度。
◤桑果多糖 可以丰富糖尿病小鼠的功能菌并调节微生物多样性。具体而言,该多糖显著富集了一些有益细菌(拟杆菌目、乳杆菌属、Allobaculum、拟杆菌属、阿克曼菌属),同时减少了一些致病菌(葡萄球菌、棒状杆菌属、Jeotgalicoccus、Aerococcus、Enterococcus、Facklamia)。
◤罗布麻叶的两种富含多糖的提取物改善了糖尿病小鼠的肠道微生物群失调,包括增加了Odoribacter、Anaeroplasma、Parasutterella、Muribaculum的丰度,并降低了肠球菌属、克雷伯菌属、Aerococcus的丰度。这可能有助于它们的抗糖尿病作用。
◤菊粉补充增加了双歧杆菌的丰度并增强了肠道屏障的完整性,这与2型糖尿病呈负相关。
◤青钱柳叶中分离的多糖通过增加 SCFAs 含量和有益的肠道细菌瘤胃球菌科来减轻 HFD/STZ 诱导的 2 型糖尿病大鼠的糖尿病症状。
◤苦瓜中的天然多糖通过增加 SCFAs 含量和Prevotella loescheii、Lactococcus laudensis 的丰度来改善 HFD/STZ 诱导的 2 型糖尿病大鼠的高血糖、高脂血症、高胰岛素血症。
◤天然南瓜多糖通过增加阿克曼氏菌和减少丹毒丝菌科(Erysipelotrichaceae)来显示出对 HFD/STZ 诱导的 2 型糖尿病的降血糖作用。此外,南瓜多糖还能增加 2 型糖尿病模型中肠道短链脂肪酸的产生。
◤灵芝多糖(GLP)通过恢复HFD/STZ诱导的肠道微生物群失调,特别是通过增加Blautia、拟杆菌、Dehalobacterium、Parabacteroides,以及减少有害的肠道细菌Aerococcus、Corynebacterium、Ruminococcus、Proteus,显示出抗糖尿病作用。
◤薏苡仁多糖通过降低厚壁菌门/拟杆菌门的比例和增加SCFAs的含量,在HFD/STZ诱导的T2DM小鼠模型中表现出降血糖活性。
◤葡甘聚糖作为铁皮石斛、芦荟和魔芋的天然多糖,通过增加厚壁菌门的丰度和减少拟杆菌门、变形杆菌的丰度,改善HFD/STZ喂养大鼠的T2DM代谢紊乱。
多糖对改善NAFLD具有有益作用,比如:
多糖可以改善肠道菌群失调并保护非酒精性脂肪性肝动物的肠道屏障完整性
◤枸杞多糖结合有氧运动通过改善肠道菌群失调改善 NAFLD,包括调节肠道菌群的丰度和多样性,增加微生物代谢产物 SCFA 的水平,减少变形菌和厚壁菌门/拟杆菌门的比例。厚壁菌门和拟杆菌门是参与宿主代谢和脂肪积累的关键细菌。
◤麦冬多糖可以通过调节肠-肝轴显著保护 NAFLD。具体来说,这种多糖显著降低了一些有害细菌的相对丰度,包括乳球菌、肠杆菌、Turicibacter、Clostridium- sensu-stricto -1、Tyzzerella、Oscillibacter,并增加一些有益菌的相对丰度,如Alistipes、Ruminiclostridium、Rikenella。这种多糖还显著增加了两种产SCFAs菌( Butyricimonas、Roseburia )的丰度以及乙酸和戊酸的水平,从而改善了炎症反应和肝脏脂质代谢。
◤灰树花杂多糖可通过调节肠道菌群来改善高脂饮食诱导的NAFLD,包括显著增加Allobaculum、拟杆菌属和双歧杆菌属丰度,减少Acetatifactor、Alistipes、Flavonifractor、Paraprevotella、Oscillibacter的丰度。
◤黄芪多糖可减轻HFD喂养小鼠的NAFLD,丰富了脱硫弧菌属,尤其是作为SCFAs、乙酸的产生者的Desulfovibrio vulgaris,减轻肝脂肪变性。
◤诺尼果多糖来源于辣木,通过促进短链脂肪酸的产生缓解HFD喂养小鼠的NAFLD,并通过改善肠道微生物群的多样性和组成逆转HFD诱导的肠道微生态失调。
◤核桃青皮多糖通过提高肠微生物群(包括普氏菌科、Allobaculum)的SCFAs含量和丰度,预防HFD喂养大鼠的肥胖和NAFLD。
◤从贻贝中提取的贻贝多糖,α-D-葡聚糖(MPA)可保护HFD喂养的大鼠的NAFLD,补充MPA可逆转HFD抑制的微生物微生态失调和SCFAs。
◤海带可溶性多糖通过降低厚壁菌门/拟杆菌门的比例,促进Verrucomirobia和丙酸盐产生菌拟杆菌和阿克曼菌,减轻高脂饮食喂养小鼠的NAFLD。
多糖通过多种机制表现出良好的抗肥胖作用,作用机制如:
◤枸杞多糖补充剂可降低厚壁菌门与拟杆菌门的比例,增加产短链脂肪酸菌,如Lacticigenium、Butyricicoccus、Lachnospiraceae_NK4A136_group数量,从而改善肥胖小鼠的肠道菌群失调。
◤桑叶多糖治疗可调节肥胖小鼠肠道菌群的组成和功能,这与增加Allobaculum、Parabacteroides、Porphyromonadaceae、Butyricimonas、Ruminococcus 的水平有关。
◤黄精多糖调节HFD喂养的肥胖大鼠的肠道微生物群结构,包括降低梭菌、肠球菌、Coprobacillus、乳球菌、Sutterella的相对丰度。
◤沙蒿多糖给药8周显著上调了屏障完整性的结肠基因,并通过增加有益细菌(双歧杆菌和Olsenella)和抑制有害细菌(Mucispirillum和幽门螺杆菌)改善了肥胖小鼠的肠道微生物微生态失调。同时,它显著富集了与促进SCFAs产生相关的碳水化合物代谢,同时显著抑制了与肥胖和肠道微生态失调相关的氨基酸代谢。
◤从海带中提取的天然多糖可通过使肠道菌群正常化来缓解小鼠HFD引起的肥胖,特别是通过增加拟杆菌目和Rikenellaceae的丰度。
◤从杏鲍菇中分离出的蘑菇多糖通过增加产生 SCFA 的肠道细菌Anaerostipes和Clostridium 的数量,在高脂饮食喂养的小鼠中表现出抗肥胖作用。
◤茶树菇多糖对HFD诱导的小鼠脂肪堆积和减肥的影响,发现脱硫弧菌减少,副拟杆菌增加,从而显著降低肥胖相关的TNF-α 和 IL-6 的水平。
◤从苦瓜中获得的多糖通过增加有益细菌(如放线菌、Coprococcus、乳酸杆菌)和减少有害细菌(变形菌和幽门螺杆菌)来改善HFD诱导的小鼠肥胖。
◤日本刺参的硫酸多糖通过富集益生菌Akkermansia、减少携带内毒素的变形杆菌和提高SCFAs含量来预防HFD诱导的小鼠肥胖。
◤ 破壁灵芝孢子多糖能逆转 HFD 喂养小鼠中许多细菌的相对丰度,特别是一些潜在的益生菌,包括Allobaculum、双歧杆菌,这与抗肥胖呈正相关。双歧杆菌、乳杆菌和阿克曼菌可促进SCFAs的产生,并抑制梭菌科、脱硫弧菌和肠球菌的丰度,这将有助于减少体重和脂质积累。
总的来说,多糖可通过作用于多个环节、调控多个疾病相关靶点来改善这三种代谢性疾病。
doi.org/10.3389/fmicb.2022.859206
高脂血症是指脂质代谢紊乱,其特征是甘油三酯 (TG)、总胆固醇 (TC) 和低密度脂蛋白浓度升高,同时高密度脂蛋白水平降低。
◤果胶多糖(高支链 RG-I,531.5 kDa)显著改善了 HFD 引起的脂质代谢异常,TG、TC、LDL-C 和游离脂肪酸水平降低。它还通过增加Roseburia、Clostridium等产生 SCFA 的细菌的数量来恢复肠道菌群失衡。
◤裙带菜多糖 ( Undaria pinnatifida )修复了高脂饮食引起的肠道微生物群改变,特别是Prevotellaceae_UCG-001,发现这与脂质代谢紊乱有关。
◤鲍鱼性腺多糖显著增加了丁酸水平,丁酸是一种重要的短链脂肪酸,它通过GPR依赖性途径抑制脂质相关基因的表达。
◤龙须菜多糖调节拟杆菌、瘤胃球菌_1和乳酸杆菌的相对丰度来增强胆固醇向BAs的转化。在遗传水平上,有人认为BA代谢的调节主要涉及CYP39A1和CYP7B1。
炎症性肠病 (IBD) 包括溃疡性结肠炎 (UC) 和克罗恩病 (CD),其特点是胃肠道持续炎症。IBD 的症状包括腹泻、腹胀、腹痛、便血、体重减轻和不适。
◤银耳多糖(TPs)通过多途径调节肠道菌群及其代谢物,改善了DSS诱导的溃疡性结肠炎。TPs可以增加Lactobacillus的丰度,从而改善色氨酸的分解代谢。这导致黄嘌呤酸、KA和吲哚衍生物(如5-羟吲哚、5-羟吲哚-3-乙酸、5-羟吲哚乙酰酸)的增加。
TPs还可以增加Romboutsia的水平,促进DCA的产生。因此,TPs可以通过影响色氨酸代谢和胆汁酸代谢来保护小鼠免受结肠炎的侵害。
◤金针菇多糖已被证明可以通过控制结肠微生物失调、增加短链脂肪酸和抑制 TLR4-NF-κB 信号通路来缓解结肠炎。能促进益生菌的生长,抑制致病菌的生长,恢复肠道稳态,缓解IBD症状。
◤竹荪多糖由59.84%的葡萄糖、23.55%的甘露糖和12.95%的半乳糖组成,已被证明可以通过增加粘蛋白和紧密连接蛋白的表达,抑制有害细菌(如γ-变形菌、变形菌、拟杆菌科、拟杆菌科和肠杆菌科)并增强有益细菌(如嗜酸乳杆菌)来改善肠道菌群组成和肠道屏障功能。
◤坛紫菜多糖通过上调紧密连接蛋白,增加粘液层及其分泌,调节肠道微生物群落,富集有益细菌,如拟杆菌、Muribaculum和乳酸杆菌,从而减轻DSS诱导的结肠损伤,从而改善结肠粘膜屏障的完整性。
◤白术多糖可以缓解在DSS诱导的溃疡性结肠炎小鼠模型炎症。白术多糖可以增加Butybacterium、Lactobacillus,同时减少Actinomyces、Akkermansia、Faecalibaculum、Verrucomicrobia、Bifidobacterium等。
肠道菌群的变化逆转了DSS引起的短链脂肪酸的减少以及色氨酸和色氨酸相关代谢物5-羟基-N-甲酰基犬尿氨酸和吲哚-3-乙酸的减少。白术多糖还剂量依赖性地逆转了LCA、DCA、缬氨酸、亮氨酸等的异常变化。
天然植物多糖治疗IBD的机制
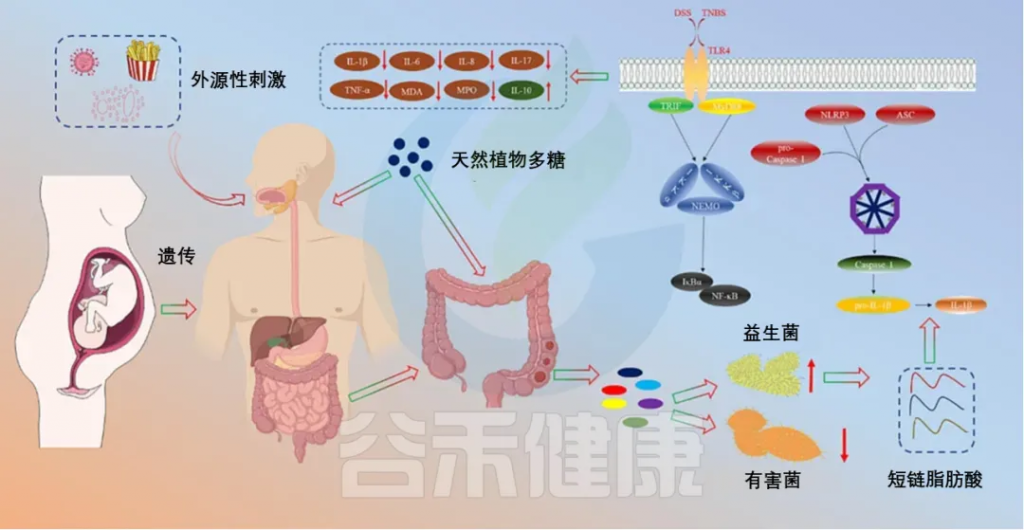
doi.org/10.1016/j.ijbiomac.2023.126799
◤甘草多糖GPS上调乳杆菌科、S24–7、Turicibacteraceae、Verrucomicrobiaceae和双歧杆菌科的丰度,下调脱硫弧菌科、瘤胃球菌科、毛螺菌科、肠杆菌科、丹毒丝菌科的丰度。GPS能促进乳杆菌、拟杆菌和产SCFAs菌的生长繁殖,起到减轻炎症、升高IL-10水平、抑制TLR4活化、降低血浆LPS水平的作用,从而保护肠道免受LPS诱导的炎症。
◤何首乌多糖(TSG)的给药显著增加了厚壁菌门和拟杆菌门的相对丰度,同时也降低了幽门螺杆菌和拟杆菌门的属水平,改善了肠道菌群,起到治疗IBD的作用。

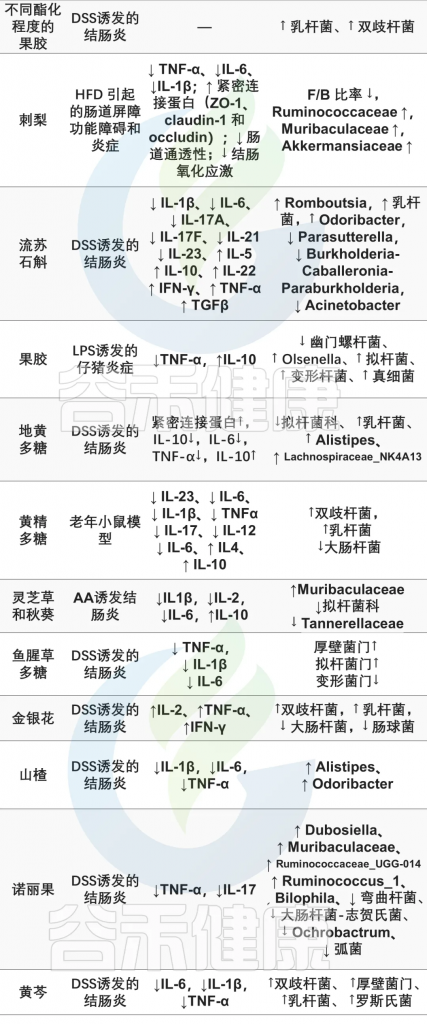
doi.org/10.3390/nu15153321
◤乳果糖通过重塑肠道菌群组成和代谢物,改善了由洛哌丁胺引起的便秘小鼠模型中的肠道水和盐代谢。具体来说,乳果糖上调了Bacteroides的丰度,并显著降低了厚壁菌门和Verrucomicrobia的水平。
此外,乳果糖减少了胆汁酸(包括CA、DCA等)、粪便中高浓度的吲哚(高浓度吲哚对细胞有毒)并增加了丙酸。
◤西洋参多糖(WQP) 可增强大鼠肠道结构的恢复,降低炎性细胞因子水平,改善短链脂肪酸 (SCFA) 水平,促进肠道菌群和肠黏膜屏障的恢复,并减轻盐酸林可霉素引起的腹泻和菌群失调等抗生素相关副作用。
◤葛根多糖( PPL )可缓解抗生素相关性腹泻引起的结肠病理改变和肠道菌群失调。
◤紫菜中提取的多糖(Nemacystus decipiens)能显著缓解小鼠抗生素相关性腹泻(AAD)的症状,并且显著增加了 Muribaculum、Lactobacillus 和 Bifidobacterium 的丰度,降低Enterobacter 、Clostridioides 的丰度。
◤茯苓多糖(PCP)通过恢复7种肠道菌菌缓解了抗生素相关性腹泻小鼠的症状,包括:Parabacteroides distasonis、Akkermansia muciniphila、Clostridium saccharolyticum、Ruminococcus gnavus、Lactobacillus salivarius、Salmonella enterica、Mucispirillum schaedleri.
适当调节免疫反应可以降低炎症反应引起的病原体入侵的风险。
结直肠癌
◤灵芝多糖在缓解结直肠癌症状方面比瓜尔胶更有效,因为它们能增加Akkermansia、结肠长度,并下调直肠癌相关基因。灵芝多糖通过动态调节肠道菌群和宿主免疫反应,已证明具有预防和治疗癌症的功能。
灵芝多糖通过调节乳酸杆菌、双歧杆菌等有益菌的相对丰度,诱导SCFAs的产生,改善肠道屏障损伤,抑制TLR4/MyD88/NF-κB信号通路,从而降低结肠炎和致癌风险。
◤绞股蓝与灵芝多糖联合使用显著提高了SCFAs产生菌的丰度,提高了丁酸和异丁酸水平,抑制了硫酸盐还原菌的丰度。
乳腺癌
◤来自灵芝破壁孢子(分子量为 3659 Da)的多糖可作为乳腺癌治疗的天然佐剂,增加细胞毒性 T 细胞和辅助性 T 细胞的数量。
灵芝孢子提取物(ESG)重塑了4T1荷瘤小鼠的肠道菌群:厚壁菌门和变形菌门的相对丰度增加,放线菌、拟杆菌门和蓝藻的相对丰度降低。
◤灵芝多糖联合紫杉醇对4T1乳腺荷瘤小鼠有抗肿瘤作用。联合治疗能显著富集拟杆菌、瘤胃球菌等5个菌属,降低脱硫弧菌和Odoribacter的丰度,平衡肠道菌群,抑制肿瘤代谢。
疲劳是一种普遍的不适感,表现为极度疲倦和力竭,通常在生理、病理或心理失衡时出现。体力劳动、心理压力、高原缺氧和长期疾病都可能引发疲劳。疲劳不仅影响日常生活,还可能导致内分泌、免疫、代谢等系统功能受损,甚至与癌症、糖尿病等严重疾病相关。此外,疲劳还与焦虑、抑郁和神经系统疾病有关。
近年来,天然多糖因其在缓解运动性疲劳中的潜在效果和较少的副作用而受到关注。研究表明,肌肉功能与肠道菌群的多样性和组成密切相关,而天然多糖如决明子、灵芝、枸杞和冬虫夏草等可通过不同机制发挥抗疲劳作用。
doi.org/10.3390/foods12163083
多糖抗疲劳机制如下:
抗疲劳多糖干预后肠道菌群的变化
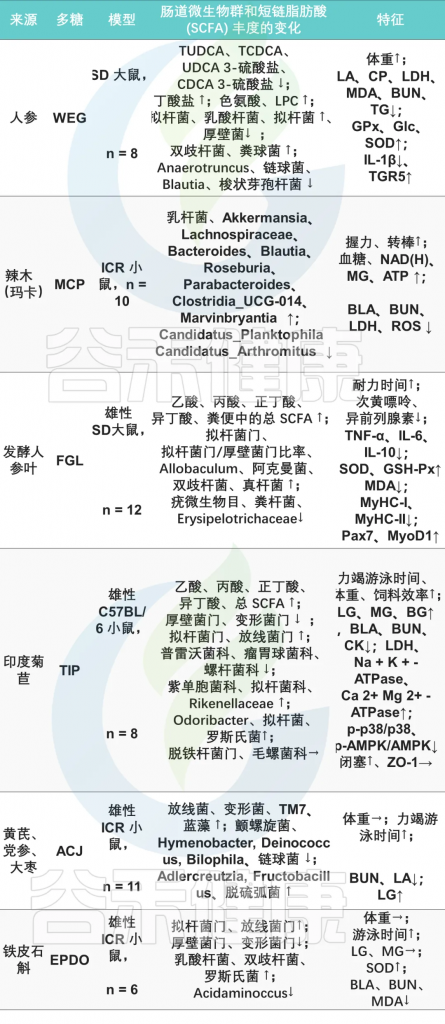
doi.org/10.3390/foods12163083
肠道-肌肉轴是肌肉与消化道之间的双向沟通,微生物可以通过微生物-肠道-肌肉轴作用于全身的肌肉。肠道微生物在膳食多糖的作用下,产生一些代谢产物(短链脂肪酸等),有些代谢产物会直接穿过肠道上皮细胞,通过血液循环直接或间接作用于肌肉组织和细胞,引起细胞发生生理生化反应,对疲劳产生一定的影响。
补充膳食多糖通过作用于肠道菌群及其代谢产物,间接激活AMPK/PGC-1α、PI3K/AKT、NF-κB、Nrf2/Keap1信号通路,调节能量代谢,降低炎症水平,增强线粒体功能和抗氧化能力,进一步维持肌肉质量和功能,从而缓解疲劳。
扩展阅读:
◤银杏叶中的一种水溶性多糖(GPS)可减轻压力引起的抑郁症并逆转肠道菌群失调。GPS 治疗可以缓解压力引起的血清素阳性和多巴胺阳性细胞密度降低。GPS 逆转了与抑郁相关的肠道菌群失调,并增加了乳杆菌的丰度,而乳杆菌已被证明是缓解抑郁的途径。
◤从秋葵中提取的多糖,发现它对抑郁小鼠的肠道菌群有明显的恢复作用,表现为厚壁菌门比例上调,拟杆菌门和放线菌门相对比例下调。这种调节有助于强化肠黏膜屏障,维持肠道免疫系统正常功能,减少肠道炎症反应,对抗抑郁有效,抑郁症小鼠的抑郁症状有所改善。用秋葵多糖治疗的小鼠体内的SCFAs显著增加,而SCFAs作为重要的通讯介质,对抗抑郁障碍有积极的影响。
◤接受金针菇多糖 (FVP)治疗的小鼠的肠道微生物组成发生显著改变,放线菌、丹毒菌和拟杆菌的丰度增加,梭菌的丰度降低,并且接受FVP治疗的小鼠的学习和记忆能力得到改善。
◤肉苁蓉多糖可以通过恢复小鼠模型中D-半乳糖诱导的衰老引起的肠道菌群稳态来抑制氧化应激和外周炎症,从而改善小鼠的认知功能。
◤从黄芪中提取的一种多糖已被证明可以通过改变糖尿病小鼠的肠道菌群来改善认知障碍。
扩展阅读:
以下是关于一些多糖的详细介绍,包括其功效,与肠道菌群的关联等,更深入地了解多糖在人体中的重要作用。
路易波士茶是什么?
路易波士茶(Rooibos)又名Aspalathus linearis,中文也有译作“路易博士茶”,取自原产于南非的一种豆科植物的茎叶。虽然带有一个茶字,但路易波士茶并不是传统意义上的茶叶。
路易波士茶因不含咖啡因、单宁含量低而受到南非人的喜爱,并在全球范围内进行商业化种植和销售。2014年,中国卫生和计划生育委员会批准路易波士茶作为新的食品原料,丰富了中国的食品和药物资源。
路易波士茶具有良好的抗氧化、抗过敏、解痉和降血糖作用。也可以预防心血管疾病、神经退行性疾病、各种癌症、骨质疏松症等。
路易波士茶多糖
一项研究从路易波士茶中分离得到均一酸性多糖(ALPs) ,水溶性多糖ALP由β-糖苷键连接,含有吡喃糖环,主要由岩藻糖、鼠李糖、阿拉伯糖和半乳糖组成。
结合RT-PCR结果推测,ALP可能通过降低Cyp2e1和Keap1的mRNA表达,增加Nrf2和HO-1的mRNA表达,激活Cyp2e1/Keap1-Nrf2-HO-1信号通路,调控下游抗氧化酶活性和炎症因子表达,减轻氧化应激损伤和炎症反应造成的损伤,从而改善急性酒精性肝损伤。
路易波士茶多糖对肠道菌群的影响
多样性
急性酒精性肝病模型对照组(MC)的物种多样性和丰富度显著降低(p≤0.05)。高剂量和低剂量ALP处理组的物种多样性和丰富度有所增加,其中高剂量组的增加更为显著。
干预后改善的菌群
ALP 干预后疣微菌丰度显著升高(p≤0.01),而脱硫杆菌丰度及F / B值均降低,但差异不显著。
肠道菌群中乳酸杆菌科的丰度与肝脏 AST 和 ALT 水平呈负相关。小鼠ALP干预后,乳酸杆菌科的丰度显著增加(p ≤ 0.05),而Rikenellaceae的丰度显著降低(p ≤ 0.05)。
ALP 显著改善了小鼠急性酒精性肝损伤中Alloprevotella和Alistipes丰度显著降低的情况( p ≤ 0.05)。
“肠-肝轴”途径
对属级别排名前20位的菌种进行了 Spearman 相关性分析。
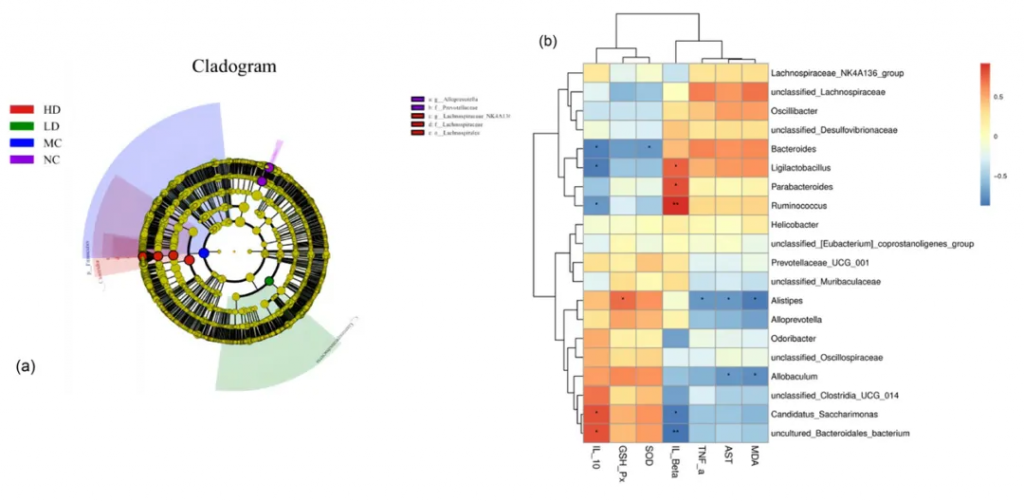
推测ALP可能通过“肠-肝轴”通路促进肠道菌群与抗氧化酶及炎症因子相互作用,从而减轻酒精性肝损伤,而上述菌群与酒精损伤标志物、抗氧化酶及炎症因子的表达均密切相关。
酒精及其代谢产物会影响肠道菌群的平衡和组成,导致肠道功能受损。这反过来又会影响肝脏健康,而肝脏健康与肠道菌群稳态密切相关。肠道和肝脏之间的相互作用被称为“肠-肝轴”通路。
地黄是玄参科地黄属植物,在我国拥有久远的药用历史,作为滋阴补肾的传统中药,也被《神农本草经》列为上品。
多糖是地黄中的主要活性成分之一。地黄多糖具有免疫调节、抗肿瘤、抗氧化、抗衰老等多种生物活性。
迄今为止,从地黄中分离纯化了20多种多糖,主要由阿拉伯糖、鼠李糖、半乳糖、葡萄糖、甘露糖、木糖、岩藻糖和半乳糖酸组成。
地黄多糖能增加DSS诱发小鼠的体质量指数和结肠长度、降低DAI评分,改善组织病理学损伤。同时,地黄多糖能阻断NF-κB信号通路,降低细胞内促炎因子表达,减轻炎症,增加紧密连接蛋白表达,维持肠道上皮屏障。
地黄多糖可能在肠道微生物作用下发酵转化为SCFAs,增加肠道中乙酸、丙酸和丁酸的含量,起到缓解IBD的作用。
拟杆菌属、乳酸杆菌属、Alistipes是导致DSS结肠炎组肠道微生物组失衡的关键细菌类型,而补充地黄多糖可以逆转这种有害变化。
五指毛桃,又叫粗叶榕(Ficus hirta Vahl),常被用作滋补品的草药成分,以其丰富的多糖含量和生物活性而闻名。
一项研究发现,FHVP-3 对肠道微生物群产生影响:
下列菌群富集:
FHVP-3 抑制了下列机会性致病菌属的丰度:
作为可发酵底物,FHVP-3 还增加了短链脂肪酸的浓度,包括乙酸盐、丙酸盐和丁酸盐。FHVP-3 对脂多糖 (LPS) 诱导的 RAW 264.7 巨噬细胞表现出显着的抗氧化活性和显着的抗炎作用。
doi.org/10.1021/acsfoodscitech.3c00626
大蒜多糖 (GP) 占大蒜干重的 75% 以上。它们的特征是具有 2,1- β – d -Fruf 主链和 2,6- β – d -Fruf 分支的果聚糖。
研究表明,大蒜多糖在调节肠道微生物群方面发挥着作用,但它们是否具有维持肠道健康的全面功能并可作为有效的益生元仍不清楚。
为了探索这一点,通过管饲法给昆明小鼠施用不同剂量的大蒜多糖(1.25-5.0g/kg 体重)和菊粉(作为阳性对照),并评估它们对肠道上皮、化学和生物屏障的影响。还使用洛哌丁胺建立了便秘模型,以研究大蒜多糖对缓解便秘的潜在影响。
施用大蒜多糖显著上调昆明小鼠小肠组织中紧密连接蛋白和粘蛋白的表达。大蒜多糖提高了盲肠丁酸含量,降低了脱硫杆菌的丰度,并降低了厚壁菌门与拟杆菌门的比例(F/B)。大蒜多糖还促进了 Bacteroides acidifaciens、Clostridium saccharogumia的生长。
Tax4Fun 功能预测表明,大蒜多糖具有预防人类疾病的潜力,可降低胰岛素抵抗、传染病和耐药性的风险。
大蒜多糖还通过增强小肠转运、软化粪便稠度、加速排便和促进兴奋性神经递质的释放,在缓解洛哌丁胺引起的便秘症状方面表现出有益作用。
多年来,槐耳 (Trametes robiniophila Murr) 一直被用于药物治疗。槐耳含有多种成分,包括多糖、蛋白质、酮和生物碱,其中蛋白聚糖和多糖是主要的生物活性成分。
槐耳提取物具有免疫调节活性,并可通过激活自噬、抑制铁死亡、抑制内质网应激等过程对细胞发挥保护作用。研究表明,槐耳水提取物可通过抑制NLRP3炎症囊泡活化,减轻肠道屏障损伤和炎症反应,并抑制DSS和氧化偶氮甲烷 (AOM) 联合诱导的结肠肿瘤形成。
可缓解 DSS 引起的肠道菌群紊乱
一项小鼠研究显示,槐耳多糖干预显著逆转了 DSS 引起的Muribaculaceae_unclassified、Anaerotruncus、Ruminococcaceae_unclassified丰度的下降以及Escherichia-Shigella丰度的增加( p < 0.05)。
其中,Muribaculaceae_unclassified是健康人中发现的肠道微生物,参与丁酸代谢和色氨酸代谢,可产生对人体有益的短链脂肪酸。
相关性分析,Muribaculaceae_unclassified与结肠长度、SOD 和 T-AOC 呈正相关,而与 DAI 评分以及炎症和氧化指标呈负相关。
Anaerotruncus与结肠长度、SOD 和 T-AOC 呈正相关,但与炎症标志物 LPS、MDA 和 MPO 呈负相关。
黄芩的根通常用作药物,用于清热利湿、泻火解毒。多糖是黄芩的最重要成分之一。
一种来自黄芩的多糖通过抑制 NF-κB 信号传导和NLRP3 炎症小体活化来改善溃疡性结肠炎。在多糖的分离和纯化过程中,研究人员还获得了另一种名为 SP2-1 的均质多糖。SP2-1由甘露糖、核糖、鼠李糖、葡萄糖醛酸、葡萄糖、木糖、阿拉伯糖和岩藻糖组成。
研究人员发现其对肠道菌群紊乱、肠道屏障改善以及短链脂肪酸产生影响。
在UC患者中,SP2-1显著抑制了促炎性细胞因子IL-6,IL-1β和TNF-α。
溃疡性结肠炎患者的屏障完整性被破坏,TJ 蛋白的表达发生改变,SP2-1增加小鼠TJ蛋白的表达,修复肠道屏障。
SP2-1对肠道菌群的影响
SP2-1组的粪便微生物群多样性明显高于DSS组。
临床上,溃疡性结肠炎患者的双歧杆菌和乳酸杆菌的丰度降低。与模型组相比,SP2-1 组的双歧杆菌、乳酸杆菌和Roseburia的水平提高。
而拟杆菌和葡萄球菌的种群受到抑制。肠道菌群中存在过量的拟杆菌和葡萄球菌对肠道免疫系统有害。
Roseburia 通过调节调节性 T 细胞的发育和分化、增加抗炎细胞因子的分泌和抑制促炎细胞因子的产生来缓解UC。
枸杞多糖(简称LBPs)是从枸杞中提取的一类多糖物质。枸杞是一种多年生灌木,属于茄科,枸杞多糖因其多样的药理活性和生理功能而受到越来越多的关注。
枸杞多糖 (LBPs)作为最重要的生物活性分子,可通过肠道微生物参与有益作用,包括调节代谢、降血糖、神经保护、抗衰老、保护各种器官免受氧化应激相关疾病的侵害。
枸杞多糖对肠道菌群的影响
癌症
一般来说,抗癌化疗药物除了会诱导癌细胞凋亡外,还会对肠道菌群产生不利影响,主要表现在肠绒毛缩短,乳酸杆菌和肠球菌丰度下降,节段丝状菌丰度增加。而枸杞多糖治疗可通过增加有益菌相对丰度来改善肠道环境和免疫功能,逆转环磷酰胺引起的有害菌(瘤胃拟杆菌科、Longibraceae、脱硫弧菌和厌氧拟杆菌科)相对丰度的增加。
还发现毛螺菌科、瘤胃菌科、脱铁菌科、脱硫弧菌科、Aneoplasmataceae与细胞因子IL-2、IL-6、IL-1β、TNF-α、IFN呈负相关。因此,主要肠道菌群的相对丰度可能与免疫调节有关。
厚壁菌门与拟杆菌门(F/B)比例的变化与许多疾病状态有关,它被视为菌群失调的重要指标,有助于了解肝脏和代谢疾病的发展。枸杞多糖可降低高脂饮食大鼠的 F/B 比,表明补充枸杞多糖有助于调节肠道菌群失调。
doi.org/10.1080/10408398.2022.2128037
神经系统
枸杞多糖可通过调节肠道菌群-肠-脑轴的神经免疫通路,对中枢神经系统产生多方面的保护作用。枸杞多糖可改善菌群失调、肠道屏障受损等问题,并通过抑制细胞凋亡、促进自噬等机制发挥神经保护效应。
肝脏
枸杞多糖能够影响NAFLD患者的肠道菌群组成、肠道屏障及肝脏炎症。
代谢(肥胖、糖尿病)
肥胖个体的研究中,肠道内F/B比例较高,因此推测肠道内F/B比例与肥胖呈显著正相关。
后续研究发现,LBPs可通过调节肠道菌群组成和短链脂肪酸生成来改善肥胖。
枸杞多糖可作为2型糖尿病的潜在辅助药物。
LBPs能调节肠道菌群,激活大鼠肠黏膜TLR2+上皮细胞γδT细胞,增强肠道屏障功能,改善糖尿病。此外,LBPs能明显降低血浆中促炎性细胞因子IL-1β、IL-6、IL-17A和TNF-α,而抗炎性细胞因子IL-10水平在糖尿病大鼠中有所升高。
哮喘
枸杞多糖还可以通过直接或间接地改变肠道菌群,参与炎症介质的调控,从而改善肺功能和过敏性哮喘症状。
肠道菌群测序分析显示,LBPs能够促进哮喘小鼠肠道中乳酸杆菌和双歧杆菌增加,并降低厚壁菌门和放线菌水平,通过肠道介导缓解哮喘。
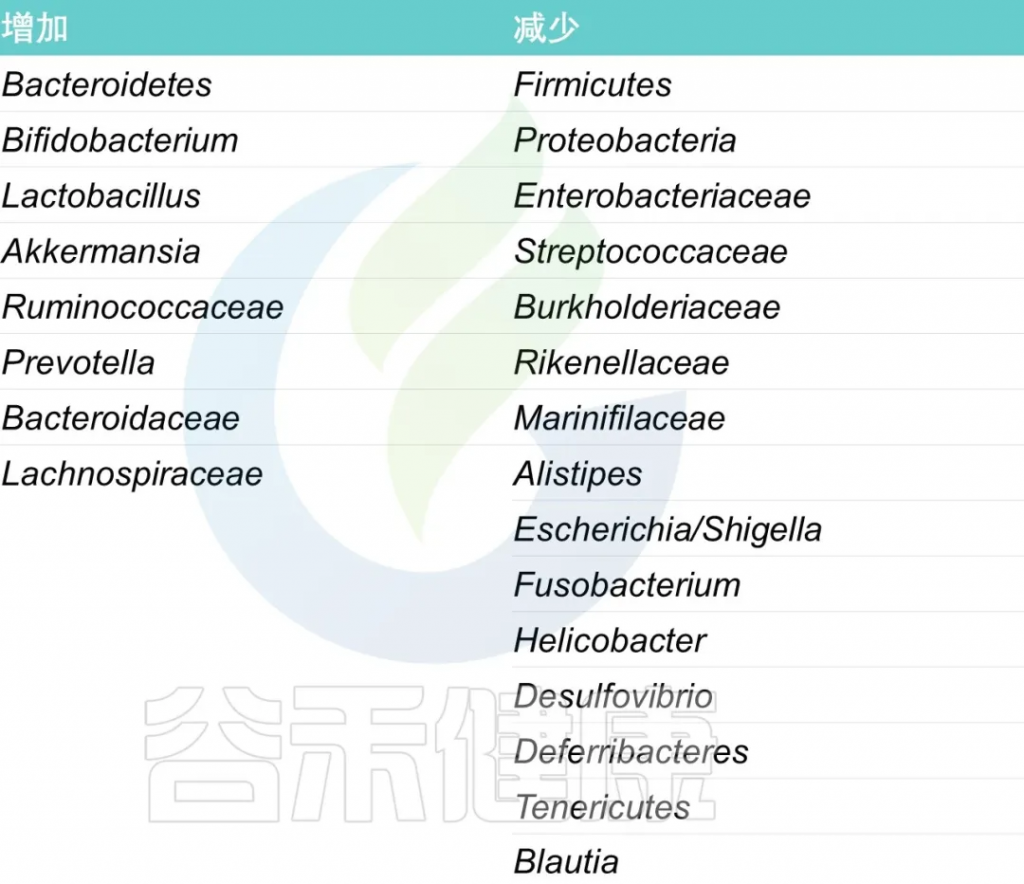
岩藻糖(Fucose),参与构成肠上皮细胞(IEC)顶端表达的聚糖,并介导肠道中的许多生物过程,尤其是宿主-微生物相互作用。
释放的岩藻糖可被微生物用作膳食聚糖、能量来源或合成结构蛋白。肠道中岩藻糖的变化影响微生物群的定植。
岩藻多糖
岩藻多糖是一种含有岩藻糖和硫酸基团的多糖,可改善糖尿病肾病。
一项小鼠研究发现,岩藻多糖可显著改善肾小球滤过率高滤过和肾纤维化,其机制与短链脂肪酸产生菌富集、增加盲肠内乙酸浓度、提高肾脏ATP水平以及改善线粒体功能障碍有关。此外,岩藻多糖还可通过抑制MAPKs通路来改善肾脏炎症和纤维化。总之,岩藻多糖可通过改善线粒体氧化应激和抑制MAPKs通路,靶向肠道菌群-线粒体轴,改善早期糖尿病肾病。
桑叶的药用功能最早在2000多年前的汉代被发现,并记载于《神农本草经》。明代李时珍在《本草纲目》中对桑叶的药用功效有更详细的描述,包括活血化瘀、祛风、清热解毒等功能。桑叶已被列入国家卫生健康委员会公布的食药同源资源名单。
桑叶多糖(Mulberry Leaves Polysaccharides,MLPs)是从桑树(Morus alba L.)叶片中提取的一种植物多糖。它们是桑叶中主要的活性成分之一,由多种单糖组成,主要包括木糖、阿拉伯糖、果糖、半乳糖、葡萄糖、甘露糖等。
桑叶多糖对人体的影响
桑叶多糖具有多种生物学活性,包括降低血糖、抗氧化、免疫调节、抗肿瘤、抗菌、抗凝和调节肠道菌群等。这些活性使得MLPs在医药和食品领域具有广泛的应用前景。并且安全、有效、低毒、副作用小。
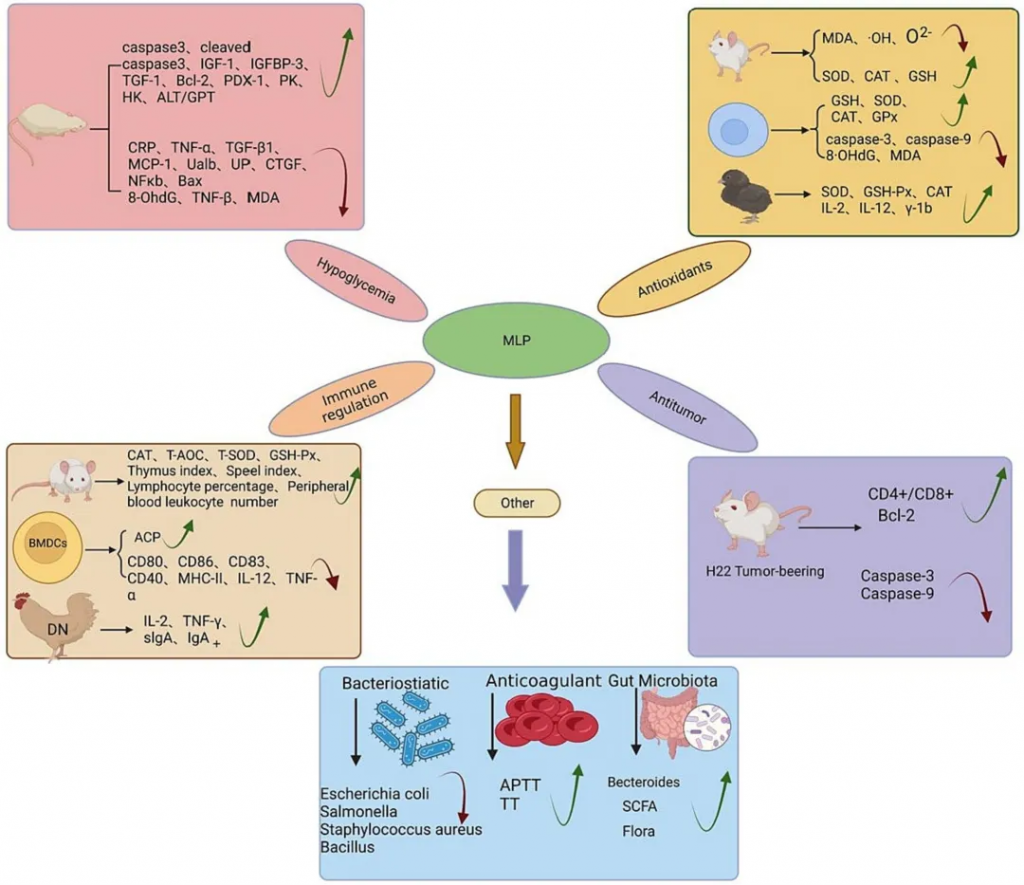
doi.org/10.1016/j.ijbiomac.2023.128669
桑叶多糖对肠道菌群的影响
桑叶多糖通过调节肠道菌群的平衡,进而对人体的健康产生积极的影响。以下是桑叶多糖影响的肠道菌群及其变化情况:

桑叶多糖能够调节短链脂肪酸和肠道菌群的相对丰度,降低真细菌与过敏性细菌的比例,从而改善肠道屏障功能。
沙棘果实在藏族食品和药物中已有数千年的传统。沙棘多糖 (SP) 是沙棘果实中的主要功能成分之一。
对高脂饮食诱导的肥胖小鼠:沙棘多糖治疗提高了 p-AMPKα 和 PPARα 蛋白的表达,刺激了小鼠肝脏中 ACC1 的磷酸化,并抑制了 FAS、PPARγ 和 CD36 的蛋白表达。
沙棘多糖上调Muribaculaceae_unclassified、双歧杆菌、Rikenellaceae_RC9_gut_group、Alistipes、Bacteroides的比例,并下调Lactobacillus、 Firmicutes_unclassified 、Dubosiella Bilophila、 Streptococcus 的比例,重组了HFD诱导的肥胖小鼠的肠道微生物群。
此外,粪便中的微生物代谢物短链脂肪酸 (SCFAs) 的产生也有所增加。此外,相关性分析结果表明沙棘多糖的肥胖改善作用与粪便中的SCFAs水平高度相关。因此,沙棘多糖对肝脏脂质代谢的调节可能是由于肠道微生物群的变化和SCFAs产生量的增加。这些结果表明,沙棘多糖可以通过调节肠-肝轴发挥改善肥胖的潜在营养保健作用。
蘑菇多糖是一类存在于蘑菇中的生物活性多糖,它们包括但不限于几丁质、甘露聚糖、半乳糖聚糖、木聚糖、葡聚糖、云芝多糖、灵芝多糖、半纤维素。这些多糖在蘑菇细胞壁中含量丰富,赋予蘑菇独特的结构和生物活性。
蘑菇多糖的功效
蘑菇多糖对人体具有多种潜在的健康益处。它们可以增强免疫系统、具有抗肿瘤活性、调节肠道菌群、抗氧化、抗糖尿病、抗衰老作用。
蘑菇多糖对肠道菌群的影响
促进益生菌生长
蘑菇多糖通过选择性地促进益生菌的生长,增强肠道健康。例如,灵芝和茯苓中的多糖被发现可以增加有益细菌的数量,这些细菌可以对抗肥胖、产生短链脂肪酸和乳酸。香菇中的多糖也显示出对嗜酸乳杆菌(Lactobacillus acidophilus)有促进作用。
抑制病原菌
蘑菇多糖能够通过增强肠道屏障功能和促进益生菌的生长来间接抑制病原菌。双孢蘑菇中的多糖已被证明可以限制大肠杆菌的生长。
增强肠道屏障功能
蘑菇多糖通过增强肠道上皮细胞的功能,提高肠道屏障的完整性,减少有害物质的渗透。云芝(Trametes versicolor)中的多糖肽PSK和PSP能够调节肠道菌群,增加有益菌双歧杆菌和乳杆菌的数量,同时减少有害菌如梭状芽孢杆菌和金黄色葡萄球菌。在降低腹泻、艰难梭菌感染、炎症性肠病等方面发挥作用。
调节免疫反应
蘑菇多糖通过激活肠道相关淋巴组织,增强机体的免疫反应。灵芝多糖能刺激和增加免疫细胞如自然杀伤细胞、T淋巴细胞和巨噬细胞的数量。
产生短链脂肪酸
蘑菇多糖在肠道发酵过程中产生短链脂肪酸,这些物质对维持肠道健康和调节宿主代谢具有重要作用。蚝菇(Pleurotus ostreatus)中的β-葡聚糖衍生物能够诱导前列腺癌细胞的凋亡,并且显示出免疫调节、巨噬细胞激活、抗肿瘤和免疫刺激活性。

多糖的多样性和复杂性使其在人体内的作用千变万化,它们能够通过与肠道菌群的互动,从调节免疫功能到改善代谢性疾病等。
然而,利用天然多糖通过肠道菌群治疗疾病仍存在一些限制和挑战。对肠道菌群和多糖之间相互作用的全面了解需要进一步研究,由于大多数研究都是在动物身上进行的,因此开展研究多糖-微生物组-疾病相互作用的临床试验并实现临床转化至关重要。
幸运的是,随着生命科学领域新兴技术的发展,我们有了更多的工具来揭示这些复杂问题。高通量测序技术、多组学技术、人工智能和大数据分析的交叉融合,为研究多糖和肠道菌群的相互作用提供了强大的技术支持,推动了这一领域的快速发展。
此外,多糖与肠道菌群之间的相互作用不仅揭示了多糖的生物活性,也突显了肠道菌群对健康的重要贡献。多糖与肠道菌群的相互作用为我们提供了一个全新的视角,了解个体的肠道菌群组成,不仅有助于我们理解自身的健康状况,更为个性化的营养和健康管理提供了科学依据。肠道菌群检测可以揭示个体对多糖等营养成分的响应差异,从而为制定个性化的饮食和治疗计划提供指导。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
Xue H, Mei CF, Wang FY, Tang XD. Relationship among Chinese herb polysaccharide (CHP), gut microbiota, and chronic diarrhea and impact of CHP on chronic diarrhea. Food Sci Nutr. 2023 Aug 6;11(10):5837-5855.
Xu X, Wang L, Zhang K, Zhang Y, Fan G. Managing metabolic diseases: The roles and therapeutic prospects of herb-derived polysaccharides. Biomed Pharmacother. 2023 May;161:114538
Zhang D, Liu J, Cheng H, Wang H, Tan Y, Feng W, Peng C. Interactions between polysaccharides and gut microbiota: A metabolomic and microbial review. Food Res Int. 2022 Oct;160:111653.
Chen R, Zhou X, Deng Q, Yang M, Li S, Zhang Q, Sun Y, Chen H. Extraction, structural characterization and biological activities of polysaccharides from mulberry leaves: A review. Int J Biol Macromol. 2024 Feb;257(Pt 2):128669.
Lan Y, Sun Q, Ma Z, Peng J, Zhang M, Wang C, Zhang X, Yan X, Chang L, Hou X, Qiao R, Mulati A, Zhou Y, Zhang Q, Liu Z, Liu X. Seabuckthorn polysaccharide ameliorates high-fat diet-induced obesity by gut microbiota-SCFAs-liver axis. Food Funct. 2022 Mar 7;13(5):2925-2937.
Feng Y, Song Y, Zhou J, Duan Y, Kong T, Ma H, Zhang H. Recent progress of Lycium barbarum polysaccharides on intestinal microbiota, microbial metabolites and health: a review. Crit Rev Food Sci Nutr. 2024;64(10):2917-2940.
Cui L, Guan X, Ding W, Luo Y, Wang W, Bu W, Song J, Tan X, Sun E, Ning Q, Liu G, Jia X, Feng L. Scutellaria baicalensis Georgi polysaccharide ameliorates DSS-induced ulcerative colitis by improving intestinal barrier function and modulating gut microbiota. Int J Biol Macromol. 2021 Jan 1;166:1035-1045.
Tang YF, Xie WY, Wu HY, Guo HX, Wei FH, Ren WZ, Gao W, Yuan B. Huaier Polysaccharide Alleviates Dextran Sulphate Sodium Salt-Induced Colitis by Inhibiting Inflammation and Oxidative Stress, Maintaining the Intestinal Barrier, and Modulating Gut Microbiota. Nutrients. 2024 Apr 30;16(9):1368.
Zhao Q, Jiang Y, Zhao Q, Patrick Manzi H, Su L, Liu D, Huang X, Long D, Tang Z, Zhang Y. The benefits of edible mushroom polysaccharides for health and their influence on gut microbiota: a review. Front Nutr. 2023 Jul 6;10:1213010.
Álvarez-Mercado AI, Plaza-Diaz J. Dietary Polysaccharides as Modulators of the Gut Microbiota Ecosystem: An Update on Their Impact on Health. Nutrients. 2022 Oct 3;14(19):4116.
Tang M, Cheng L, Liu Y, Wu Z, Zhang X, Luo S. Plant Polysaccharides Modulate Immune Function via the Gut Microbiome and May Have Potential in COVID-19 Therapy. Molecules. 2022 Apr 26;27(9):2773.
Sun CY, Zheng ZL, Chen CW, Lu BW, Liu D. Targeting Gut Microbiota With Natural Polysaccharides: Effective Interventions Against High-Fat Diet-Induced Metabolic Diseases. Front Microbiol. 2022 Mar 15;13:859206.
Gan L, Wang J, Guo Y. Polysaccharides influence human health via microbiota-dependent and -independent pathways. Front Nutr. 2022 Nov 9;9:1030063.
Chen J, Gao Y, Zhang Y, Wang M. Research progress in the treatment of inflammatory bowel disease with natural polysaccharides and related structure-activity relationships. Food Funct. 2024 Jun 4;15(11):5680-5702.
Chen P , Hei M , Kong L , Liu Y , Yang Y , Mu H , Zhang X , Zhao S , Duan J . One water-soluble polysaccharide from Ginkgo biloba leaves with antidepressant activities via modulation of the gut microbiome. Food Funct. 2019 Dec 11;10(12):8161-8171.
Wang, A.; Liu, Y.; Zeng, S.; Liu, Y.; Li, W.; Wu, D.; Wu, X.; Zou, L.; Chen, H. Dietary Plant Polysaccharides for Cancer Prevention: Role of Immune Cells and Gut Microbiota, Challenges and Perspectives. Nutrients 2023, 15, 3019.
Zhou, Y.; Chu, Z.; Luo, Y.; Yang, F.; Cao, F.; Luo, F.; Lin, Q. Dietary Polysaccharides Exert Anti-Fatigue Functions via the Gut-Muscle Axis: Advances and Prospectives. Foods 2023, 12, 3083
Shen, Y.; Song, M.; Wu, S.; Zhao, H.; Zhang, Y. Plant-Based Dietary Fibers and Polysaccharides as Modulators of Gut Microbiota in Intestinal and Lung Inflammation: Current State and Challenges. Nutrients 2023, 15, 3321
Lv H, Jia H, Cai W, Cao R, Xue C, Dong N. Rehmannia glutinosa polysaccharides attenuates colitis via reshaping gut microbiota and short-chain fatty acid production. J Sci Food Agric. 2023 Jun;103(8):3926-3938.


病原微生物和/或有害微生物成功入侵、繁殖并定居于宿主的体内或体内,从而导致健康障碍,称为感染。简单地说,它可以定义为由微生物引起的疾病。感染也被称为传染病或传染病或传染性疾病。
感染每年导致 1300多万 人死亡;2019 年死亡人数为 1370万人(新英格兰医学,2022年统计)。在这 1370 万人死亡中,有 770 万人与细菌感染有关。由于抗菌素耐药性的迅速出现和蔓延,与传染病相关的病例严重程度和死亡率也在增加。
感染和疾病是两个经常互换使用的术语,但它们的含义截然不同。了解两者之间的区别对于有效预防、诊断和治疗至关重要。
感染是指有害微生物(如细菌、病毒或真菌)侵入人体。这些病原体可以通过各种途径进入人体,如呼吸系统、消化系统或皮肤等。感染可以是局部的,也可以是全身性的,程度可轻可重。
疾病是指由于感染或其他原因而出现的症状或异常的表现。感染是原因,而疾病是结果。简而言之,感染是体内存在病原体,而疾病是感染导致的症状的表现。感染可能只是局部的轻微症状,而疾病则是影响身体正常功能的更严重的情况。在某些情况下,如果免疫系统无法控制微生物的传播,感染可能会发展成疾病。
在诊断时,区分感染和疾病非常重要。一个人可能感染了病原微生物,但没有表现出任何疾病症状。另一方面,一个人可能患病但没有活动性感染。在这种情况下,疾病可能是由感染以外的因素引起的,例如遗传易感性或环境诱因。
虽然预防策略主要侧重于避免感染,但防止感染发展为疾病也同样重要。及早发现和适当治疗感染有助于防止发展为严重疾病。比如,长期的呼吸道或肠道感染被认为是相关肿瘤发生的高风险因素之一。
因此,早期识别感染、诊断、治疗和预防是控制感染和疾病的重要组成部分。感染可以用抗生素或抗病毒药物等药物治疗,而疾病可能需要更专业的治疗方案。准确诊断潜在病因对于有效治疗至关重要。
疾病的定义,原因,诊断
// 定义
疾病是一种以身体或精神功能异常为特征的医疗状况。它通常由感染或受伤等外部因素引起,但也可能是由内部失衡或遗传倾向造成的。疾病的严重程度各不相同,会影响身体的不同器官或系统。
// 原因
疾病有多种原因,包括:
// 症状
疾病可表现出各种症状,包括疼痛、疲劳、发烧和身体功能异常,以及癌症。疾病的症状会因具体情况而有很大差异。
常见症状包括发烧、疲劳、疼痛、炎症和身体功能变化。某些疾病还可能导致与受影响器官或系统相关的特定症状,例如呼吸系统疾病的咳嗽或胃肠道疾病的消化问题。
疾病的形成方式多种多样。有些疾病,例如由遗传性疾病引起的疾病,是天生的。其他疾病可能是通过接触有害物质或环境因素而获得的。感染也会导致疾病的发展。当病原体侵入人体并造成伤害时,免疫反应可能会引发炎症、组织损伤和其他导致疾病的变化。
// 诊断和预防
诊断疾病通常需要结合病史、体格检查、实验室检查和影像学检查等。
预防疾病对于保持整体健康至关重要。这可以通过各种方式实现,例如保持良好卫生习惯、接种疫苗、保持健康的生活方式以及避免危险因素。早期发现和治疗感染也有助于防止其发展成更严重的疾病。
疾病的治疗包括药物治疗、手术治疗、其他疗法或这些方法的组合。
总之,疾病涉及身体或精神的异常功能,可能由感染、受伤、遗传因素或失衡引起。识别症状、诊断和了解疾病的原因对于有效预防和治疗疾病至关重要。
感染的定义,原因,诊断
// 原因
感染是一个术语,用于描述有害微生物在体内的入侵和繁殖。这些微生物被称为病原体,包括细菌、病毒、真菌和寄生虫。当这些病原体进入人体时,它们会引起感染。
感染的原因多种多样,包括细菌、病毒、真菌和寄生虫。这些微生物可以通过各种途径进入人体,例如吸入、摄入或通过皮肤破损。
// 症状
虽然感染的严重程度各不相同,但它们通常具有共同的症状。这些症状包括发烧、疲劳、咳嗽、打喷嚏、喉咙痛和炎症。在某些情况下,感染还可能导致更具体的症状,具体取决于所涉及的病原体类型。
感染可能是局部的,即传染源仅感染特定的器官或组织,或者可能是全身性的,即传染源通过血液或淋巴到达身体的不同部位,从而感染不同的器官和组织。
感染可能不会导致疾病等特定症状,因为大多数感染往往是亚临床的。相反,其他感染可能导致严重的症状和并发症。
虽然有些感染可能不被宿主的免疫系统察觉并自行消退,但其他感染可能会引起症状并发展为疾病。
// 预防与治疗
预防是控制感染的一个重要方面。这可以通过保持良好的卫生习惯来实现,例如经常洗手和避免与受感染者密切接触。疫苗接种也可以通过提供针对特定病原体的免疫力来帮助预防某些感染。
预防在降低感染和疾病风险方面发挥着重要作用。保持良好的卫生习惯、接种疫苗和避免与受感染者接触等措施有助于防止感染传播。此外,保持健康的生活方式和增强免疫系统可以降低感染发展为疾病的可能性。
一旦感染,治疗可能涉及使用抗生素、抗病毒药物、抗真菌药物或抗寄生虫药物,具体取决于引起感染的具体微生物。在某些情况下,支持性护理(如休息、补液和缓解症状的药物)可能足以恢复。
// 原因与传播
感染的原因可能因所涉及的微生物类型而异。例如,细菌可通过直接接触受污染的表面、咳嗽或打喷嚏时产生的飞沫,或通过食用受污染的食物或水引起感染。另一方面,病毒通常通过呼吸道飞沫、与受感染者的直接接触或通过受污染的表面传播。
总之,了解感染的原因和传播方式对于预防、诊断和治疗感染至关重要。通过保持良好的卫生习惯、采取适当的预防措施并及时就医,个人可以降低感染风险并最大程度地减少相关疾病的影响。
感染的诊断是基于通过不同的诊断过程对传染源的识别。
某些感染可能会表现出可用于症状诊断的症状,但通常需要进一步确认。感染直接取决于传染源以及宿主对该传染源的免疫反应。
现在我们认为手术是理所当然的,但不久前,即使是最小的手术,如果感染进入体内,也可能是致命的。消毒为我们提供了一种预防手术感染和确保手术安全的方法。
消毒法是使用化学物质(称为防腐剂)来消灭引起感染的细菌的方法。它是由英国外科医生约瑟夫·李斯特发明的。
约瑟夫·李斯特找到了一种预防手术期间和手术后伤口感染的方法。他是第一个将细菌理论的科学应用于外科手术的人。李斯特消毒系统是现代感染控制的基础。
感染和疾病的区别在于症状的严重程度以及对个人整体健康的影响。
感染的定义是细菌、病毒和真菌等微生物在体内的入侵和生长。
感染可能由多种因素引起,包括接触病原体、卫生条件差、免疫系统受损以及食物或水受污染。感染的症状因感染类型和部位而异,但通常包括发烧、疼痛、炎症和疲劳。
疾病是指影响身体或精神功能的特定状况。
疾病可能是由感染引起的,但也可能是由其他因素引起的,例如遗传异常、环境毒素、生活方式选择或自身免疫反应。疾病的症状范围从轻微到严重,并且可能持续很短时间或变成慢性病。
感染的诊断通常涉及检测体液或组织样本以确定病原体的存在。另一方面,疾病的诊断通常需要结合病史、体格检查、实验室检查和影像学检查。
在治疗方面,感染通常使用抗生素、抗病毒药物或抗真菌药物治疗。治疗的目的是消除入侵的微生物并缓解症状。另一方面,疾病可能需要更全面的方法,包括药物治疗、手术、改变生活方式和支持疗法。
大致的区别总结如下:

总之,虽然感染和疾病相关,但它们的定义、原因、症状和治疗方法不同。了解两者的区别可以帮助医护人员和个人采取适当的措施来预防和控制疾病。
感染常见类型
细菌感染是由有害细菌进入人体引起的。它们会影响身体的不同部位,例如呼吸系统、泌尿道或皮肤。常见症状包括发烧、疼痛、肿胀和发红。细菌感染通常用抗生素治疗。
病毒感染是由病毒引起的。它们可导致各种疾病,例如普通感冒、流感或 COVID-19。症状从轻微到严重不等,可能包括发烧、咳嗽、喉咙痛和疲劳。病毒感染通常会自行痊愈,但有些可能需要抗病毒药物。
真菌感染是由真菌引起的,例如酵母菌或霉菌。它们会影响皮肤、指甲或内脏器官。常见的真菌感染包括足癣、酵母菌感染和癣。症状可能包括瘙痒、发红和不适。真菌感染的治疗方法包括抗真菌药物和外用药膏。
寄生虫感染是由寄生在人体内或体表的寄生虫引起的。寄生虫感染的例子包括疟疾、虱子感染和贾第虫病。症状可能因寄生虫类型而异,但可能包括发烧、瘙痒、腹泻和疼痛。寄生虫感染的治疗可能涉及抗寄生虫药物。
性传播感染是通过性接触传播的感染。常见的性传播感染包括衣原体感染、淋病和疱疹。症状范围从轻微到严重,可能包括生殖器分泌物、疼痛和溃疡。性传播感染通常通过检测诊断,可以用抗生素或抗病毒药物治疗。
通过了解不同类型的感染、其症状、原因和治疗方法,个人可以采取预防措施来降低感染风险并在需要时寻求适当的医疗护理。
说到疾病和健康,有各种各样的疾病会影响人体。以下是一些常见的疾病类型:
– 传染性疾病
传染病是由细菌、病毒、真菌和寄生虫等微生物引起的。它们可以通过各种方式在人与人之间传播,包括直接接触、呼吸道飞沫和受污染的食物或水。传染病的例子包括普通感冒、流感、肺结核和艾滋病毒/艾滋病。症状和治疗方法因具体感染而异。
– 慢性疾病
慢性病是一种长期疾病,通常会随着时间的推移而发展,并且没有已知的治疗方法。这些疾病通常有多种原因,并可能受到遗传、生活方式选择和环境因素的影响。慢性病的例子包括心脏病、糖尿病、癌症和慢性阻塞性肺病 (COPD)。治疗通常侧重于控制症状和预防并发症。
其他常见疾病类型
– 自身免疫性疾病
当免疫系统错误地攻击健康细胞和组织时,就会发生此类疾病,从而导致炎症和组织损伤。例如类风湿性关节炎、狼疮和多发性硬化症。
– 心血管疾病
影响心脏和血管。包括冠状动脉疾病、心力衰竭和中风等。
– 呼吸系统疾病
这些疾病会影响肺部和呼吸。一些常见的呼吸系统疾病包括哮喘、慢性支气管炎和肺炎。
– 精神健康障碍
这些障碍会影响一个人的情绪、心理和社会健康。例如抑郁症、焦虑症和精神分裂症。
– 遗传性疾病
这些疾病是由遗传异常基因或突变引起的。这些疾病包括囊性纤维化、镰状细胞病和亨廷顿氏病等。
这些疾病的诊断、治疗和预防策略因具体情况而异。
预防感染
预防是感染和疾病管理的一个重要方面。虽然治疗和诊断很重要,但采取措施预防感染可以大大降低疾病的发病率。
预防感染的一个关键因素是了解病因和传播方式。感染可通过与感染者直接接触、受污染的表面或空气中的颗粒传播。通过了解传播途径,个人可以采取必要的预防措施,将感染风险降至最低。
定期洗手是预防感染最有效的措施之一。用肥皂和水洗手至少 20 秒或使用含酒精的洗手液有助于消除有害微生物。
此外,例如咳嗽或打喷嚏时捂住口鼻,有助于防止呼吸道感染的传播。
接种疫苗是预防感染的另一个重要方面。疫苗刺激免疫系统产生对抗特定病原体的抗体,从而提供免疫力。通过接种疫苗,个人可以保护自己并为社区免疫做出贡献,从而降低传染病的总体流行率。
教育和意识在预防感染方面也发挥着重要作用。了解常见感染的体征和症状可以及早发现并及时治疗,防止进一步的并发症。此外,提倡卫生习惯并提供有关适当预防措施的教育可以使个人能够做出明智的决定并保护自己和他人。
总之,预防是对抗感染和疾病的关键。通过采取积极措施,例如保持良好的卫生习惯、接种疫苗和提高认识,个人可以大大降低感染风险,并为整个社区的健康做出贡献。
预防疾病
预防在减轻疾病负担方面起着至关重要的作用。了解各种感染和疾病的原因、症状和诊断有助于制定有效的预防策略。
预防疾病不仅仅是避免感染。它涉及采取健康的生活方式并做出明智的选择以降低患病风险。这包括保持均衡饮食,定期进行体育锻炼,避免吸烟和过量饮酒等行为,这些行为会增加患某些疾病的风险。
定期筛查和检查对于疾病的早期发现和治疗也很重要。通过早期发现疾病,医护人员可以及时治疗,改善治疗效果并减轻疾病的总体负担。
感染和疾病预防还涉及教育公众预防的重要性,并提供必要的资源和服务。
总之,预防在减少疾病的发生和影响方面起着至关重要的作用。通过了解感染和疾病的原因、症状和诊断,实施预防措施并促进健康行为。
感染治疗
在治疗感染时,了解这些疾病的病因、预防和诊断非常重要。
治疗感染的关键因素之一是防止其传播。
感染的诊断对于有效治疗至关重要。医生可以使用多种方法,包括体检、实验室检查和成像技术来确定感染的原因并确定最合适的治疗方案。
感染的治疗方法取决于感染的类型和严重程度。细菌感染通常用抗生素治疗,而病毒感染则使用抗病毒药物。真菌感染使用抗真菌药物,寄生虫感染则使用抗寄生虫药物。
症状管理
除了针对感染的根本原因外,症状管理也是治疗的一个重要方面。这可能涉及使用非处方药来缓解疼痛、发烧和充血等症状。
治疗持续时间
感染的治疗时间各不相同。有些感染可能需要短期用药,而有些感染可能需要更长时间的治疗。即使症状有所改善,也必须完成处方药物的全部疗程,以确保感染完全根除。
总之,感染的治疗涉及多方面的方法,包括解决根本原因、症状管理和防止感染扩散。通过了解感染的原因、预防和诊断,医疗保健专业人员可以为患者提供最有效的治疗。
疾病治疗
疾病的治疗取决于具体症状和致病因素。
在感染病例中,治疗通常侧重于消除引起感染的生物体。这可能涉及使用抗生素、抗病毒药物或抗真菌药物,具体取决于感染的具体类型。在某些情况下,可以预防性地使用抗病毒或抗真菌药物,以防止感染传播给他人。
另一方面,疾病的治疗不仅仅是治疗感染本身。当疾病被诊断出来后,治疗的目的是缓解症状、控制并发症,并改善整体健康和福祉。
疾病的治疗可能涉及药物治疗、生活方式改变和支持疗法的结合。对于糖尿病或高血压等慢性疾病,主要重点通常是通过药物治疗和生活方式改变(包括定期锻炼和健康饮食)来控制病情。
在某些情况下,可能需要手术干预来治疗疾病。这可能涉及切除受感染或患病的组织、修复受损器官,或在受伤或退化的情况下恢复功能。
预防也是疾病治疗的一个重要方面。通过解决风险因素并实施预防措施,例如接种疫苗、定期健康检查和改变生活方式,可以减少疾病的发生和严重程度。
诊断在确定疾病的最适当治疗方法方面起着至关重要的作用。准确及时的诊断使医疗保健提供者能够根据每位患者的个人需求量身定制治疗计划。
总之,治疗疾病需要综合考虑具体症状、潜在病因和个体因素。通过了解感染和疾病之间的区别,医护人员可以就治疗方案做出明智的决定,并改善患者的治疗效果。
▼
与心血管系统相关的感染,包括血液,即心脏、血管和血液的感染,也称为血流感染或血液循环系统感染。与心血管系统相关的一些常见感染包括:

▼
消化系统是参与食物消化的身体系统。它包括胃肠道 (GI 道) 和相关消化器官。胃肠道两端开放,是外来、可能受污染的物质(包括食物和饮料)的停靠点。这使得消化系统极易受到感染。
幽门螺杆菌感染
消化系统感染包括胃肠道任何部位(从口腔到肛门)和任何消化器官(如肝脏、胰腺和胆囊)的感染。消化系统感染主要包括细菌、病毒、原生动物和寄生虫,真菌病原体感染较少。


▼
呼吸道感染 (RTI) 是指呼吸系统任何器官的感染。它是人类最常见的感染类型。根据感染呼吸道的部位,RTI 可分为上呼吸道感染 (URTI)(即鼻、鼻窦、咽和喉感染)和下呼吸道感染 (LRTI)(即气管、支气管、细支气管和肺感染)。

▼
神经系统感染是指大脑、脊髓和/或人体神经的任何形式的感染。此类神经系统感染可能危及生命。它们是由不同的微生物引起的,主要是病毒和细菌。
▼
泌尿系统包括尿道、膀胱、输尿管和肾脏。这些器官中的任何一个感染都称为尿路感染 (UTI)。UTI 主要由细菌引起,但也有真菌和病毒感染的报道,但这种情况很少见。由于女性尿道较短,因此女性比男性更容易患上 UTI。

▼
生殖系统包括所有参与生殖过程的器官。它在人类中与泌尿系统非常接近。许多引起尿路感染的微生物是造成生殖系统感染的原因。生殖系统感染分为三种类型:

▼
淋巴系统是淋巴管、淋巴结和淋巴器官的网络,淋巴液在其中流动。它是免疫系统的一部分,也是循环系统的一部分。淋巴感染并不常见,但有报道称存在多种细菌和寄生虫感染。

▼
外皮系统包括身体的所有外部覆盖物。它包括皮肤、头发和指甲。外皮系统是我们身体的第一层防御。它是数百万微生物作为正常菌群的家园。病原体在侵入身体之前首先与外皮接触。

▼
肌肉系统包括我们身体的所有肌肉。肌肉感染通常是血源性或传染性传播,但通常很严重,需要立即治疗。

骨骼:
▼
内分泌系统由内分泌腺组成,内分泌腺感染主要是通过血源性播散感染或进行性全身感染而引起。
在当今世界,传染病始终是一个威胁,了解感染的各个阶段对于有效诊断和治疗至关重要。从感染到康复的过程可以粗分为四个不同的阶段,每个阶段都有各自的症状和结果。
了解感染的四个阶段对于确定适当的行动方案至关重要,从预防和早期发现到治疗和康复。识别前驱期及其独特症状有助于早期干预,降低传播率并预防并发症。下面详细了解一下每个时期不同的特征及相关干预。
▼
潜伏期
感染的第一阶段称为潜伏期,在此期间,患者接触到病原体,但可能不会出现任何症状。潜伏期的长短取决于具体感染源,可能为几小时至数周不等。
最初接触病原体的方式多种多样,例如接触受污染的表面、空气中的颗粒物,或直接接触受感染者。在此期间,患者可能并未意识到自己已经接触到病原体。
潜伏期内可能出现前驱期
此阶段的特点是出现轻微症状,这些症状通常不具特异性,容易被忽视或归因于其他因素。前驱期的症状可能包括疲劳、头痛、轻微发烧和全身不适。
值得注意的是,并非所有感染都会经历前驱期。有些感染可能直接从潜伏期进入急性期,这取决于具体病原体和个人的免疫反应。
▼
潜伏期过后,感染进入第二阶段,即入侵和复制。在此阶段,病毒或细菌已成功侵入宿主体内,并开始快速繁殖。这导致体内病原体的浓度较高,从而导致症状的出现。
前驱期是侵袭和复制阶段的一部分,其特点是出现初始症状。这些症状可能是一般性的和非特异性的,例如疲劳、发烧、头痛和肌肉疼痛。前驱期是感染正在发展的警告信号,可让免疫系统为即将到来的战斗做好准备。
随着感染的进展,它会进入急性期,症状会变得更加严重,并且针对特定病原体。人体的免疫系统在各种防御机制的帮助下,试图对抗入侵的病原体。然而,在这个阶段,战斗仍在继续,结果尚不确定。
在慢性期,一些感染可以在体内持续很长一段时间。此阶段的特点是症状较轻,甚至完全没有症状。然而,病原体继续复制并慢慢损害身体组织。如果不及时治疗,慢性感染会导致长期并发症和后遗症。
在某些情况下,随着人体免疫系统成功消灭病原体,感染会自然消退。这会导致康复,症状逐渐消退,患者恢复正常健康状态。然而,在其他情况下,可能会出现并发症,如继发感染或器官损伤,这会延长康复过程,并可能需要额外的医疗干预。
值得注意的是,感染过程的各个阶段可能因具体病原体、个人免疫反应和医疗条件而异。
▼
经过潜伏期和症状出现后,感染者进入前驱期,预示着疾病急性期的开始。
在前驱期,症状逐渐恶化,变得更加明显。感染者可能会出现疲劳、不适和发烧等一般症状,以及特定感染特有的特定症状。
此阶段至关重要,因为它通常表明免疫系统正在积极对抗感染。然而,需要注意的是,并非所有感染都有明确的前驱期。有些人可能会直接从潜伏期进入急性期,而不会出现任何前驱症状。
可能出现并发症
如果不及时治疗或免疫系统无法有效控制感染,前驱期可能会导致进一步的并发症。这些并发症的严重程度可能因感染类型和个人的整体健康状况而异。
前驱期可能出现的一些并发症包括继发感染、器官损伤或感染扩散至身体其他部位。这些并发症会延长病程,增加重症甚至死亡的风险。
前驱期的恢复
对于大多数感染来说,前驱期标志着急性期的开始,在此期间症状达到顶峰。急性期过后,身体逐渐恢复并进入缓解期,症状开始消退,患者开始感觉好些。
从前驱期和随后的急性期恢复可能需要一些时间,因此遵循处方治疗并根据需要休息很重要。在某些情况下,即使感染痊愈后,也可能出现复发或出现长期后遗症,如慢性疲劳或器官损伤。
总体而言,了解前驱期的进展和症状对于有效管理和治疗感染至关重要。认识到这一阶段的开始可以帮助个人寻求适当的医疗护理并采取措施预防进一步的并发症。
▼
潜伏期结束后,感染者进入感染的急性期。在这个阶段,症状会完全显现,感染也会达到高峰。
前驱期是急性期的初始阶段,其特点是出现发烧、疲劳、头痛和肌肉疼痛等症状。在此阶段,感染者还可能感到全身不适。
严重感染的急性期通常持续数天至数周。此阶段的严重程度和持续时间可能因具体病原体和个人的免疫反应而异。
并发症和后遗症
在某些情况下,感染的急性期会导致并发症。这些并发症可能是由于病原体对身体的直接影响或身体对感染的免疫反应而引起的。常见的并发症包括肺炎、器官衰竭和继发感染。
一旦成功控制了急性期,感染者就会进入恢复期。在此阶段,身体会逐渐消除感染,症状开始改善。根据感染的严重程度,恢复可能需要几天到几周的时间。
在某些情况下,感染可能会发展为慢性阶段。当身体无法完全消除病原体时,就会发生这种情况,并且感染会持续很长时间。慢性感染可能导致长期健康问题,可能需要持续治疗。
值得注意的是,并非所有感染都会经历所有阶段,并且进展和症状可能因具体病原体和个体因素而异。
常见症状
在感染的这个阶段,可能会出现常见症状,这些症状可能因具体病原体和个人的免疫反应而异。值得注意的是,并不是所有人都会出现相同的症状,有些人的表现可能比其他人更严重。
在急性期,患者可能会出现发烧、疲劳、身体疼痛和头痛等症状。这些症状通常表明身体对感染产生了免疫反应,可能会持续数天。
急性期过后,患者可能会进入慢性感染期。在此阶段,症状可能会持续很长时间,有时持续数月甚至数年。常见的慢性症状包括持续疲劳、关节疼痛、肌肉无力和认知困难。
有些感染还可能产生后遗症,即感染导致的长期后果或并发症。这些后遗症的严重程度可轻可重,可能影响身体的各个器官或系统。后遗症的例子包括器官损伤、神经系统疾病和免疫功能受损。
复发是另一种可能的结果,尤其是某些病原体引起的感染。经过一段时间的明显缓解后,症状可能会再次出现,表明感染复发。这可能是由于各种因素造成的,例如病原体根除不彻底或休眠感染重新激活。
▼
在感染的呼吸道症状阶段,病毒已到达呼吸系统并开始影响肺部和呼吸道。此阶段通常是在前驱期结束后,发烧和疲劳等一般症状开始消退。
呼吸道症状的严重程度因个人和引起感染的特定病毒而异。常见症状包括咳嗽、呼吸急促、胸痛或不适以及喘息。这些症状通常表明呼吸系统发炎和充血。
在某些情况下,呼吸道症状可能导致肺炎、支气管炎或呼吸衰竭等并发症。这些并发症可能需要额外的医疗干预,并可能延长整体康复过程。如果呼吸道症状恶化或没有随着时间的推移而改善,请务必就医。
一旦呼吸道症状开始改善,患者即被认为处于康复阶段。在此阶段,身体继续抵抗感染,免疫系统努力清除呼吸系统中的病毒。康复阶段的持续时间可能因个人和感染严重程度而异。
在极少数情况下,有些人可能会出现与呼吸道症状相关的后遗症或长期影响。这些可能包括慢性肺损伤、肺功能下降或感染痊愈后仍持续存在的呼吸道疾病。同样,有些人可能会出现呼吸道症状复发,即症状在改善一段时间后再次出现。
为了帮助康复和预防并发症,休息、保持水分充足并遵照处方治疗或药物非常重要。健康的生活方式(包括均衡饮食和定期锻炼)也可以支持免疫系统并促进整体呼吸系统健康。
▼
在感染的第七阶段,即胃肠道阶段,患者可能会出现一系列与消化系统相关的症状。这些症状的严重程度和持续时间可能有所不同,
可能包括:
这些胃肠道症状可能是感染扩散至肠道或人体对感染的免疫反应所致。在某些情况下,这些症状可能会随着时间和休息而自行缓解。但是,可能会出现脱水等并发症,需要医疗干预。
对于处于此阶段的人来说,控制症状并在必要时寻求适当的医疗护理非常重要。根据症状的严重程度,医疗保健专业人员可能会建议休息、补充水分和改变饮食。在某些情况下,可能会开药来缓解症状或治疗并发症。
还要注意的是,虽然有些人可能在此阶段后症状完全消失,但其他人可能会继续经历其他阶段,例如复发或出现后遗症。
▼
神经系统症状可发生在感染的急性期,也可发生在恢复期、复发期和并发症期。这些症状可能是病毒直接入侵的结果,也可能是病毒对神经系统的继发影响。
在感染的急性期,部分患者可能会出现头痛、头晕和精神错乱等神经症状。这些症状通常较轻且短暂,可在数天或数周内缓解。
但在某些情况下,神经系统症状可能会在恢复阶段持续存在。这些症状可能包括持续性头痛、注意力不集中和记忆力问题。
在复发阶段,神经系统症状可能会再次出现或恶化。这可能是病毒重新激活或对神经系统造成进一步损害的结果。
此阶段还可能出现并发症,导致更严重的神经系统症状。这些并发症可能包括脑炎、脑膜炎和中风。
经过适当的医疗护理和治疗,大多数人可以从这些神经症状中恢复过来。然而,有些人可能会出现长期的神经后遗症,如认知障碍或运动功能障碍。
值得注意的是,感染潜伏期也可能出现神经症状。这是接触病毒和出现症状之间的阶段。此阶段的神经症状很少见,但可能包括嗅觉或味觉丧失。
在慢性感染病例中,神经系统症状可能会持续很长一段时间。这些症状可能是间歇性的,严重程度也各不相同。
如果您在感染的任何阶段出现任何神经系统症状,请务必重视。
▼
在感染的急性期,个人通常会出现皮肤症状。皮肤症状是指影响皮肤的任何症状。这些症状的范围从轻微到严重,并可能以各种方式表现出来,具体取决于感染的类型。
在潜伏期,个人可能不会出现任何皮肤症状。然而,随着感染进展到慢性阶段,皮肤症状可能开始出现。这些症状可能包括皮疹、水泡、病变或皮肤变色。这些症状的严重程度因人而异,有些人只会出现轻微症状,而另一些人可能会出现影响日常活动的严重症状。
在某些情况下,皮肤症状可能导致并发症。当感染扩散到身体其他部位或免疫系统对感染反应强烈时,就会出现并发症。这些并发症可能导致更严重的皮肤症状,甚至可能导致其他健康问题。
感染急性期过后,患者可能会出现感染的后遗症或长期影响。这些后遗症可能包括持续的皮肤症状,如疤痕或色素沉着变化。这些长期影响因人而异,取决于感染的严重程度和个人的免疫反应等因素。
在某些情况下,即使感染痊愈,患者也可能会出现皮肤症状复发。如果感染未从体内完全清除,或者免疫系统受损,则可能会出现这种情况。如果患者出现皮肤症状复发,请务必就医,因为这可能表明感染复发或其他潜在健康问题。
总之,皮肤症状可发生在感染的各个阶段,从急性期到慢性期,甚至感染消退后。这些症状可从轻微到严重,并可能对皮肤产生长期影响。个人必须注意这些症状,并在必要时寻求医疗帮助,以确保正确的诊断和治疗。
▼
血液学症状通常出现在感染的恢复期。此阶段发生在急性期之后,急性期的特点是出现症状并出现并发症。
在此阶段,人体的血液系统开始稳定并恢复正常。前驱症状(即感染前出现的一般症状)开始消退。人体开始产生更多的白细胞,负责抵抗感染。
在某些情况下,血液学症状可能会复发。如果感染在急性期没有完全解决,就会出现这种情况。复发可能是由于病毒重新激活或出现新的细菌菌株引起的。
常见的血液学症状:
潜伏期(即从接触感染到症状首次出现之间的时间)也会出现血液学症状。然而,此阶段的症状通常较轻微,可能不明显。
如果血液学症状在恢复期持续存在或恶化,则可能表明出现并发症或发展为慢性感染。在这种情况下,可能需要额外的医疗干预。
在感染的不同阶段密切监测血液学症状对于确保正确的诊断和治疗非常重要。可以定期进行血液检查以跟踪血液系统的变化并指导治疗计划。
▼
在感染的肌肉骨骼症状阶段,患者可能会出现肌肉、关节和骨骼的急性疼痛、僵硬和肿胀。这些症状通常发生在前驱期之后,可能是身体对感染的免疫反应的结果。
肌肉骨骼症状的强度和持续时间会有所不同,具体取决于个人和引起感染的具体病原体。有些人可能只会感到轻微不适,而另一些人则可能会感到剧烈疼痛和活动受限。
在某些情况下,肌肉骨骼症状可能是感染的后遗症,这意味着即使感染已经消退,这些症状仍会持续存在。这在某些病毒感染中更为常见,例如寨卡病毒或基孔肯雅病毒。
注:寨卡病毒属黄病毒科,黄病毒属,单股正链RNA病毒,直径20nm,是一种通过蚊虫进行传播的虫媒病毒,宿主不明确,主要在野生灵长类动物和栖息在树上的蚊子。
基孔肯雅病是由伊蚊传染的一种急性传染病,其临床症状为突然发烧、头疼、呕吐、关节痛及腰下部疼痛等,而最有效的应对途径是采取预防措施,减少蚊虫的滋生。
肌肉骨骼症状的恢复通常包括休息、疼痛管理和物理治疗,以改善力量和活动能力。如果症状严重或持续,可能需要更密集的治疗。
值得注意的是,肌肉骨骼症状也可能是感染的并发症,可能需要额外的医疗干预。并发症可能包括关节炎症、骨骼或软骨损伤或周围组织感染。
在极少数情况下,患者在经过一段时间的缓解或恢复后可能会出现肌肉骨骼症状复发。这可能是由于引起最初感染的病毒或细菌重新激活,或被同一病原体再次感染。
总体而言,感染过程中的肌肉骨骼症状会极大地影响个人的生活质量。如果您出现任何这些症状,建议处理以便获得准确的诊断和适当的治疗。
▼
泌尿生殖系统症状可作为某些传染病发展的一部分出现。这些症状可能表明感染已到达泌尿生殖道,包括生殖系统和泌尿系统的器官。并非所有感染都会发展到这个阶段,并且出现泌尿生殖系统症状并不总是表明感染严重或晚期。
泌尿生殖道阶段通常发生在感染的初期阶段之后,例如急性期和前驱期。在此阶段,病毒或细菌可能已经通过血液或其他身体系统到达泌尿生殖道。
出现泌尿生殖系统症状的患者可能会注意到泌尿系统的变化,例如排尿频率或尿急增加、排尿疼痛、尿液浑浊或带血,或难以完全排空膀胱。影响生殖系统的感染也会导致阴道分泌物、异常出血、盆腔疼痛或男性睾丸疼痛等症状。
在某些情况下,泌尿生殖系统症状可能伴有并发症。这些并发症可能包括肾脏感染、尿路感染、盆腔炎或性传播感染。如果出现这些症状或怀疑有感染,请务必就医。
泌尿生殖系统阶段的持续时间可能因具体感染和个人因素而异。在某些情况下,症状可能会通过适当的休息、补水和对症治疗自行缓解。但是,如果感染未得到适当治疗或存在潜在健康问题,感染可能会发展为慢性阶段或导致复发。
值得注意的是,某些感染会对泌尿生殖系统产生长期影响或后遗症。这些后遗症可能包括不孕症、慢性疼痛、疤痕或其他可能需要持续医疗管理的并发症。
常见的泌尿生殖系统症状:
▼
在感染过程中,个人可能会经历多个阶段。这些阶段包括潜伏期、复发、并发症、缓解,甚至慢性和急性后遗症。然而,一个经常被忽视的阶段是心理症状阶段。
心理症状可发生在感染的任何阶段,程度从轻微到严重不等。这些症状通常表现为情绪、行为和认知的变化。常见的心理症状包括焦虑、抑郁、易怒、困惑和注意力难以集中。
心理症状的存在会对个人的整体幸福感和生活质量产生重大影响。这些症状会影响一个人进行日常活动、维持人际关系甚至工作或上学的能力。为了提供适当的支持和治疗,识别和解决这些症状非常重要。
病原微生物检测在感染管理中的重要性不容忽视。通过病原微生物检测可以有效地控制和预防医院内感染,并加速患者的恢复过程。
随着分子生物学技术的发展,现代医学微生物学检验技术已经取得了显著进步,正在成为指导临床感染辅助诊断和治疗的重要依据。
多种检测手段应用于病原体检测,例如:
在感染的临床管理中,除了传统的病原体检测方法外,肠道菌群检测也是一个重要的发展方向。肠道菌群有助于消化、吸收营养物质,同时还调节人体免疫系统的功能,对人体健康起着至关重要的作用,肠道菌群失衡与多种疾病的发生发展密切相关。
肠道菌群与宿主之间的相互作用对维持内稳态很重要,但这种相互作用一旦受到干扰,就会成为许多慢性疾病的核心驱动因素。
在肠道、相关微生物群和各种器官之间的双向或多向通信连接(轴)
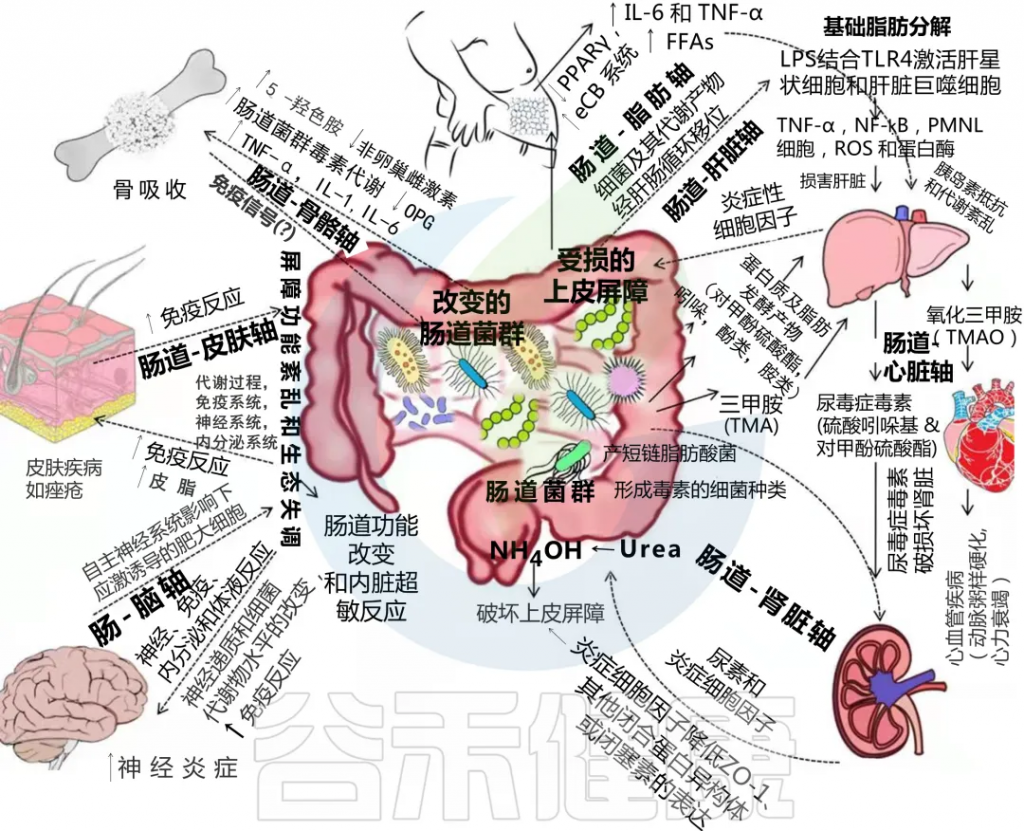
Ahlawat S,et al.,Lett Appl Microbiol. 2021
关于这方面可详见我们之前的文章:
肠道菌群报告中会有致病菌超标等明确指示,此外我们还可以判断整个肠道微生态的健康状况。肠道微生物群的失调可能导致肠道易感性增加,使得易感性疾病如艰难梭菌感染更容易发生。
通过分析肠道微生物组的变化,可以帮助我们更好地理解感染过程,评估治疗效果,并为个性化干预提供依据。
感染,作为全球健康的主要威胁,其影响甚至超过个体的病痛,它触及社会的每一个层面。本文在了解各种感染阶段、症状的同时,也强调了病原体检测在感染管理中的重要性,病原体相关检测手段让我们能够及时识别感染类型,评估其严重程度,并预测可能的并发症。
面对不断演变的病原体和日益严峻的抗生素耐药性问题,我们在推动科研创新的同时,也需提高公众对感染性疾病的认识,强化预防措施,如感染源的识别、个人卫生习惯等,对于控制感染的传播同样至关重要。
在治疗方面,针对病原体的特异性治疗是帮助患者恢复健康的关键。这需要医疗相关专业人员根据相关诊断结果,选择最合适的治疗方案,包括抗生素、抗病毒、抗真菌等。同时,症状管理和支持性护理也是治疗过程中不可或缺的组成部分。
随着科技的进步和医疗知识的积累,整合病原体相关检测,加强跨学科的研究,以及普及健康教育,有望不断提升治疗效果,为患者带来更好的康复和生存机会。
免责声明:本文仅供参考,不构成医疗建议。请务必咨询医疗保健专业人员,以正确诊断和治疗任何感染。
主要参考文献:
Murray, P. R., Rosenthal, K. S., & Pfaller, M. A. (2013). Medical microbiology. Philadelphia: Elsevier/Saunders
Parija S.C. (2012). Textbook of Microbiology & Immunology.(2 ed.). India: Elsevier India.
Sastry A.S. & Bhat S.K. (2016). Essentials of Medical Microbiology. New Delhi : Jaypee Brothers Medical Publishers.
Joseph Lister’s antisepsis system,2018,Science Museum
sciencedirect.com/topics/immunology-and-microbiology/germ-theory-of-disease
biologydictionary.net/germ-theory/
infectioncycle.com/articles/infection-stages-understanding-the-progression-of-infectious-diseases-and-their-impact-on-health
germ theory,Adam Augustyn,2024, 5
National Research Council (US) Committee to Update Science, Medicine, and Animals. Science, Medicine, and Animals. Washington (DC): National Academies Press (US); 2004.
Murray, P.R., Rosenthal, K.S., & Pfaller, M.A. (2015). Medical microbiology (8th ed.). Elsevier.
Fauci, A.S., Braunwald, E., Kasper, D. L., Hauser, S. L., Longo, D. L., & Jameson, J. L. (Eds.). (2008). Harrison’s principles of internal medicine (17th ed.). McGraw-Hill Medical
Mandell, G. L., Bennett, J. E., & Dolin, R. (2010). Mandell, Douglas, and Bennett’s principles and practice of infectious diseases (7th ed.). Churchill Livingstone.
Brook, I. (2013). Microbiology and management of respiratory tract infections. CRC Press.
Control of Communicable Diseases Manual by David Heymann.
G. Authia, S. Fablina, 2022. Global and regional sepsis and infectious syndrome mortality in 2019: a systematic analysis. Published by Elsevier Ltd. Published:March, 2022
Loretta J. Bubenik (2005). Infections of the Skeletal System. , 35(5), 0–1109. doi:10.1016/j.cvsm.2005.05.001
Morrison WB, Kransdorf MJ. Infection. 2021 Apr 13. In: Hodler J, Kubik-Huch RA, von Schulthess GK, editors. Musculoskeletal Diseases 2021-2024: Diagnostic Imaging [Internet]. Cham (CH): Springer; 2021.
Megran DW. Enterococcal endocarditis. Clin Infect Dis. 1992 Jul;15(1):63-71. doi: 10.1093/clinids/15.1.63. PMID: 1617074.
Roberts RB, Krieger AG, Schiller NL, Gross KC. Viridans streptococcal endocarditis: the role of various species, including pyridoxal-dependent streptococci. Rev Infect Dis. 1979 Nov-Dec;1(6):955-66. doi: 10.1093/clinids/1.6.955. PMID: 551516.
Infective endocarditis: A contemporary update. Ronak Rajani, John L Klein. Clinical Medicine Jan 2020, 20 (1) 31-35; DOI: 10.7861/clinmed.cme.20.1.1
Lamas, C. C., & Eykyn, S. J. (2003). Blood culture negative endocarditis: Analysis of 63 cases presenting over 25 years. Heart, 89(3), 258-262.
Smith DA, Nehring SM. Bacteremia. [Updated 2022 Jul 31]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 Jan-.
Britannica, The Editors of Encyclopaedia. “septicemia”. Encyclopedia Britannica, 23 Jun. 2022
Martinez RM, Wolk DM. Bloodstream Infections. Microbiol Spectr. 2016 Aug;4(4).
Akhondi H, Simonsen KA. Bacterial Diarrhea. 2022 Aug 8. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 Jan–. PMID: 31869107.
Bacterial gastroenteritis: Causes, treatment, and prevention (medicalnewstoday.com)
Typhoid (who.int)
Imam Z, Simons-Linares CR, Chahal P. Infectious causes of acute pancreatitis: A systematic review. Pancreatology. 2020 Oct;20(7):1312-1322.


短链脂肪酸这一词经常出现在谷禾的文章和报告中,那你真的了解短链脂肪酸吗?短链脂肪酸(SCFA)主要是肠道微生物群在结肠内通过发酵碳水化合物(包括膳食和内源性碳水化合物,主要是抗性淀粉和膳食纤维)和一些微生物可利用的蛋白质而产生的。
短链脂肪酸主要是乙酸、丙酸和丁酸,在结肠中的浓度比大致为60-70%:20-30%:10-20%。这些代谢产物能够被宿主利用,尤其是丙酸和丁酸,它们发挥一系列促进健康的功能。它们能被肠粘膜有效吸收,作为能量来源,还能作为基因表达调节剂以及特定受体识别的信号分子,对宿主生理产生重要影响。近几年的研究还发现其能够调节免疫细胞发育并抑制炎症。
然而,三种主要短链脂肪酸——乙酸盐、丙酸盐和丁酸盐——它们在体内的功能和组织分布不同,对宿主生理的影响存在显著差异。丁酸盐优先被肠粘膜用作能量来源,还具有抗炎特性,可增强肠道屏障功能和粘膜免疫。丙酸盐有助于抵抗肝脏中的脂肪形成、降低胆固醇、也有一定的抗炎和抗致癌作用。而乙酸在血液中浓度最高,可用作肝脏胆固醇和脂肪酸合成的底物,增加结肠血流量和氧气吸收,并通过影响回肠收缩来增强回肠运动。
其次,它们与宿主蛋白(如丁酸和丙酸抑制组蛋白去乙酰化酶)和受体的相互作用也不同。因此,特别需要考虑这些短链脂肪酸的微生物来源。与此同时,饮食结构和肠道生理变化如何影响这些脂肪酸的相对产量和在结肠中的浓度也是至关重要的。
本文将重点介绍丙酸盐和丁酸盐,因为这两种短链脂肪酸被认为对健康有重要影响,包括丁酸预防结直肠癌,丙酸促进饱腹感并降低胆固醇。而乙酸是大多数肠道厌氧菌的主要发酵产物,也可由还原性乙酸生成,而丙酸和丁酸则由不同的肠道细菌群产生。
我们将探讨在人类结肠微生物群中已知的形成这两种短链脂肪酸的途径,以及各种饮食和环境因素对其产生的调节可能性。详细了解肠道微生物群的短链脂肪酸代谢及其生理功能对于制定个性化的健康营养方案是必不可少的。
丙酸盐和丁酸盐在结构、来源、生理功能以及对健康的影响方面存在一些差异。
▸ 结构上的差异:
丙酸盐(Propionate)含有三个碳原子,羟基(-OH)位于第二个碳原子上。
丁酸盐(Butyrate)含有四个碳原子,羟基(-OH)位于第四个碳原子上。
▸ 来源上的差异:
丙酸盐通常由肠道细菌通过发酵L-鼠李糖、聚葡萄糖、阿拉伯木聚糖、D-塔格糖、甘露寡糖、昆布多糖等糖类物质产生。
丁酸盐可以通过肠道微生物群发酵富含抗性淀粉和果聚糖的食物来增加,如菊粉、马铃薯、洋葱等。
▸ 功能上的差异:
丙酸盐在体内的主要功能是作为肝脏中糖原合成的前体物质,有助于调节血糖水平,影响食欲。
丁酸盐是结肠上皮细胞的首选能源,有助于维持肠道屏障,发挥免疫调节和抗炎作用。丁酸盐还可以通过减少NF-kB信号传导和诱导凋亡来促进神经保护。
▸ 对健康的影响:
丙酸盐的健康益处主要是调节能量代谢和改善代谢综合征,可能对调节肠道菌群平衡也有积极作用,但其具体影响取决于个体的肠道菌群组成。
丁酸盐对健康的影响更为广泛,包括维持肠道稳态、促进肠道屏障的完整性、刺激绒毛的生长、促进粘蛋白的产生。以及改善认知功能、促进睡眠、调节社交行为和在糖尿病中的潜在益处。
丙酸盐是许多生物(从细菌到人类)的代谢副产物,产生丙酸的代谢途径可分为三类。主要发酵途径将不同的碳源分解代谢为丙酸盐(图A);分解代谢途径则能将多种氨基酸降解为丙酸盐(图B);此外,通过与从丙酮酸或二氧化碳生成生物质前体相关的合成代谢途径也可以生产丙酸盐(图C)。
产生丙酸盐的代谢途径
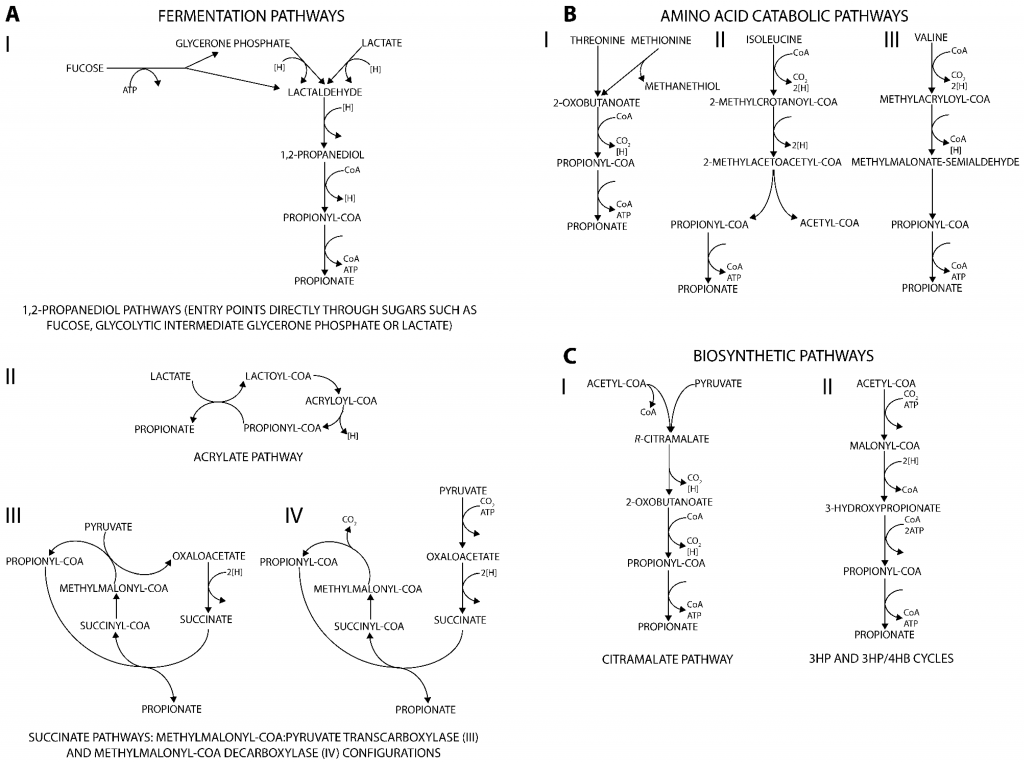
doi.org/10.3390/fermentation3020021
肠道微生物通过发酵不可消化的碳水化合物产生的丙酸盐是体内丙酸盐的主要来源。下面将讲述肠道中丙酸盐通过发酵碳水化合物的三种主要产生途径以及参与这些途径的微生物。
与氨基酸降解和生物合成途径相比,发酵途径不仅提供能量,还帮助消耗由糖分解代谢产生的还原辅因子。它们在能量产生和维持氧化还原平衡中的作用,使这些途径能够与细胞生长相耦合。
能够产生丙酸盐的微生物种类

doi.org/10.3390/fermentation3020021
▸
丙二醇相关途径
• 鼠伤寒沙门氏菌和Roseburia inulinivorans在这一过程可以产生丙酸
丙酸盐在肠胃中的生成是由1,2-丙二醇(PDO)发酵菌和PDO消耗菌组成的微生物联合作用的结果。已知一些生物体(如鼠伤寒沙门氏菌和Roseburia inulinivorans)能同时进行这两种过程。
在二醇脱水酶和两种常与乙酸代谢相关的混杂酶(辅酶A依赖性醛脱氢酶磷酸转酰基酶和乙酸激酶)的共同作用下,PDO分解代谢为丙酸,同时生成一个ATP和一个还原辅因子。
然而,通过该途径产生丙酸取决于可用于其他细菌生长的碳水化合物,据报道岩藻糖和鼠李糖是丙酸的前体。
通过1,2-丙二醇形成丙酸的微生物途径
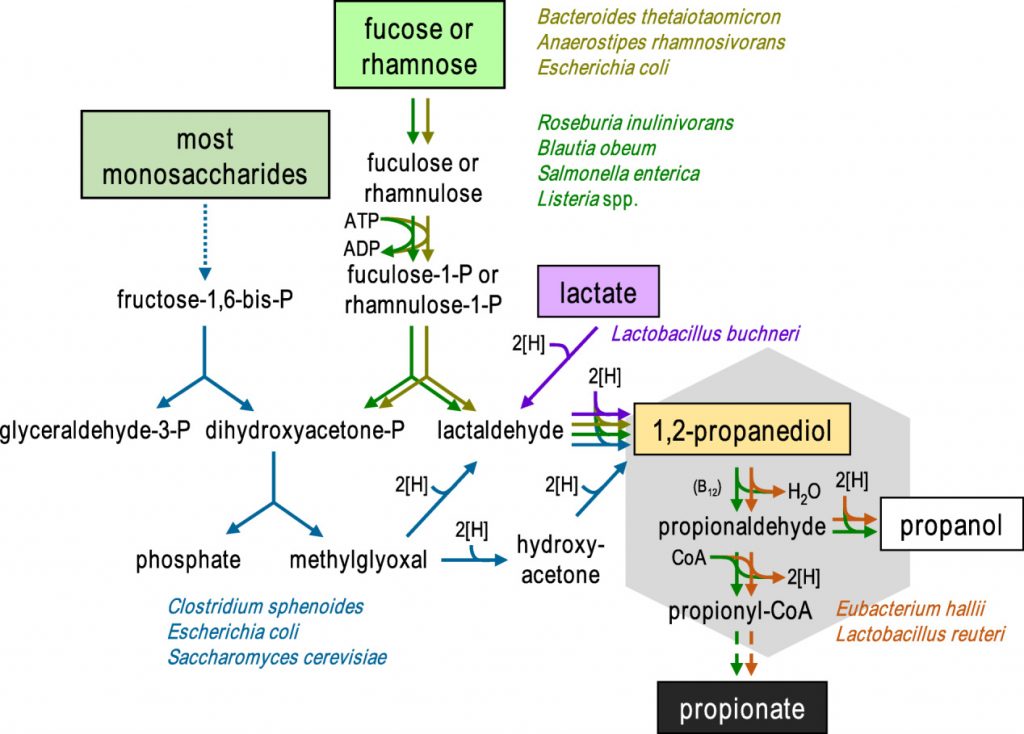
doi: 10.1111/1462-2920.13589.
霍氏大肠杆菌(E.hallii)和罗伊氏乳杆菌(Lactobacillus reuteri)虽然无法在岩藻糖或鼠李糖上生长,但仍然能够利用1,2-丙二醇产生丙酸和丙醇。此外,宏基因组研究表明,其他肠道厌氧菌,包括Flavonifractor plautii、Intestinimonas butyriproducens和Veillonella spp. 也可能能够从这种底物中产生丙酸。因此,不同细菌之间中间体 1,2-丙二醇可能在脱氧糖生产丙酸中发挥重要作用。
▸ 丙烯酸酯途径
丙烯酸酯途径在消耗NADH的情况下,使乳酸在ATP中性条件下转化为丙酸。该途径存在于几种细菌中,包括丙酸梭菌(Clostridium propionicum)、埃氏巨球菌(Megasphaera elsdenii)和瘤胃普氏菌(Prevotella ruminicola)。
虽然多种底物可以分解为丙酸和乙酸,包括乳酸、丝氨酸、丙氨酸和乙醇,但葡萄糖发酵在这过程中似乎不会导致任何天然生产者产生丙酸,这可能是因为葡萄糖发酵不会触发启动循环所需的乳酸消旋酶的表达。
▸ 琥珀酸途径
琥珀酸途径主要存在于拟杆菌门和厚壁菌门中,拟杆菌门的一些细菌从膳食碳水化合物生成丙酸,并且拟杆菌门的相对丰度与人类粪便中丙酸盐的相对水平相关。
• 琥珀酸转化为丙酸盐还需要维生素B12
琥珀酸是丙酸的前体,但在高pCO2(二氧化碳分压)和高稀释率等条件下,它可在磷酸烯醇式丙酮酸羧激酶受到抑制的拟杆菌属培养物中积累。琥珀酸转化为丙酸还需要维生素B12,如果缺乏B12,琥珀酸可能无法转化成丙酸盐。
人类结肠中的一些厚壁菌门细菌(例如Phascolarctobacterium succinatutens)能将琥珀酸转化为丙酸;其他革兰氏阴性菌通过琥珀酸途径(如韦荣氏球菌属)或丙烯酸酯途径(Megasphaera elsdenii)将乳酸转化为丙酸盐。
▸ 氨基酸降解产生丙酸
缬氨酸、苏氨酸、异亮氨酸和蛋氨酸的降解可导致通过丙酰辅酶A产生丙酸和ATP。
由于氨基酸的合成和随后的分解代谢途径存在于多种微生物中,因此可以使用氨基酸合成代谢和分解代谢途径的组合从葡萄糖生产丙酸。
几种拟杆菌在蛋白水解和肽形成丙酸方面发挥重要作用。
苏氨酸的产生和分解代谢已在大肠杆菌中得到广泛研究,作为丙酰辅酶A的可能来源,可用于生产各种化学物质,包括丙醇、红霉素和3-羟基戊酸。此外,考虑到氧化还原和能量平衡,缬氨酸/异亮氨酸和苏氨酸途径的组合具有协同作用,可以略微提高丙酸产量。
除此之外,可以利用丙酮酸经过柠檬酸途径产生丙酸,由于和菌群关联较小,在这就不展开描述了。
▸ 增加丙酸盐生成的底物
一些益生元等化合物可以影响丙酸盐的生产,不过由于浓度以及肠道微生物群落构成的不同,这些化合物的调节丙酸盐产生时具有一定差异。
• L-鼠李糖能够明显增加丙酸盐产量
L-鼠李糖或6-脱氧-L-甘露糖是一种天然脱氧糖。它存在于多种动物、植物和细菌多糖中。在短期体外实验中,L-鼠李糖已被证明能使丙酸产量增加四倍于乳果糖。
在一项人体体内研究中也获得了类似的结果,其中受试者在三个不同的时间被给予25克L-鼠李糖、乳果糖或D-葡萄糖。摄入后24小时测量血清丙酸,L-鼠李糖的血清丙酸明显高于乳果糖或D-葡萄糖的血清丙酸。
一项长期研究也证实了L-鼠李糖诱导丙酸的作用,该研究结果表明,与摄入D-葡萄糖作为对照相比,摄入25克L-鼠李糖可显著提高人体28天内的血清丙酸水平。
• 抗性淀粉有助于增加丙酸
抗性淀粉对淀粉酶降解具有抗性,但它会发酵成丁酸或丙酸。特别是,来自大米的抗性淀粉与丙酸产量增加有关。
研究了抗性淀粉在大鼠体内的发酵情况,饲喂抗性淀粉(630g/kg饲料)的大鼠的肝脏甘油三酯和总胆固醇浓度显著低于对照组。与此同时,血清丙酸浓度也显著增加。
• 菊粉对于增加丙酸和丁酸非常有效
菊粉属于果聚糖家族,主要由β-(2,1)连接的果糖基组成。它天然存在于菊苣和菊芋等开花植物中。作为益生元,菊粉已被证明对增加丁酸和丙酸的产量非常有效。使用人体肠道微生物体外模拟研究了菊粉增加丙酸的效果。
补充菊粉1周(5g/d)后观察到短链脂肪酸产生的代谢变化。较高浓度的短链脂肪酸源于丙酸和丁酸产量的增加。
此外一项针对喂食菊粉(10%)的大鼠的体内研究也导致丙酸产量大幅增加,高达 58.4mmol/。
• 聚葡萄糖
聚葡萄糖是一种支链、随机聚合的多糖,主要由葡萄糖合成,在胃肠道上部不会被消化。使用结肠模拟器研究了这种底物对结肠微生物组成和代谢活性的调节作用。与对照糖木糖醇(8.3mmol/L)相比,短链脂肪酸产量显著增加,尤其是丙酸盐(22.9mmol/L)。
• 阿拉伯木聚糖
阿拉伯木聚糖是许多谷物中发现的主要非淀粉多糖,是膳食纤维的一部分。
在体内研究中,比较了54只大鼠,这些大鼠分别喂食对照饮食(含710g/kg小麦)、阿拉伯木聚糖补充饮食(610g/kg小麦淀粉加100g/kg玉米阿拉伯木聚糖)和胆固醇补充饮食(不含或含2g/kg 胆固醇)。由于短链脂肪酸的积累,尤其是丙酸(摩尔百分比>45%),盲肠pH值从7降至6。然而,丁酸的产生不受影响。
车前草是一种可溶性纤维来源,可提供与麦麸阿拉伯木聚糖相当的多糖。在一项大鼠体内研究中,比较了车前草(5%)对盲肠和结肠发酵的影响与麦麸 (10%) 的影响。研究发现,车前草发酵可产生更高的短链脂肪酸,尤其是盲肠和所有结肠中的丙酸更多。
除此之外,D-塔格糖、甘露寡糖、昆布多糖等物质也可以增加人体丙酸盐的产生。
丙酸盐已被证明具有抗脂肪形成和降低胆固醇的作用。它还对体重控制和进食行为有很强的影响。此外,有研究表明,丙酸和丁酸一样,对结肠癌细胞具有抗增殖作用。
丙酸盐对健康的影响
doi: 10.1111/j.1753-4887.
然而,与结肠细胞用作能量来源的丁酸不同,丙酸在血液循环中的浓度较高。因此,丙酸的生物活性可能不仅限于结肠本身,还扩展到人体的其他部位。需要强调的是,了解体内结肠丙酸浓度或短链脂肪酸浓度不足以推断健康状况。
▸ 影响肝细胞的脂质合成
肝脏的脂质合成包括将饮食来源的脂肪酸和甘油转化为具有不同脂肪酸组成的胆固醇和甘油三酯。然后,这些肝脏脂质分子被结合到脂蛋白中,从而通过循环分布到各种组织中。
• 脂质合成受到短链脂肪酸的强烈影响
有趣的是,肝细胞中的脂质合成受到肠道纤维发酵产生的短链脂肪酸的数量和类型的强烈影响。丙酸盐已被确定在其中一些过程中发挥重要作用。
对肝脏脂质合成的饮食调节早期观察显示,膳食纤维摄入与肝脏脂质合成密切相关。这种影响的部分原因如下:1)粪便中胆固醇和胆汁酸从肠道排出的增加;2)胆固醇向胆汁酸的肝脏转化率较高;3)通过减少乳糜微粒的大小和降低胆固醇在乳糜微粒中的掺入来优化脂蛋白的外周代谢。
• 降低血清胆固醇水平、抑制脂肪酸合成
短链脂肪酸作为微生物碳水化合物发酵的产物,在肝脏脂质合成中发挥着特定作用,已被证明在喂食大鼠时可降低血清胆固醇水平。对分离的大鼠肝细胞的体外研究表明,丙酸对脂肪酸合成有抑制作用,但对胆固醇合成没有抑制作用。
其他大鼠实验表明,加入纤维的饮食可降低肝和血浆胆固醇水平及血浆甘油三酯中的胆固醇,而肝甘油三酯没有受到影响。
尽管这些研究的结果令人信服,但其他研究并不总是能够证实丙酸盐对脂质代谢的抑制作用。例如,每天在面包中补充9.9克丙酸盐不会改变6名健康志愿者的脂质代谢,甚至会导致5名受试者的甘油三酯浓度升高。
在另一项研究中,比较了丙酸盐对人和大鼠肝细胞脂质代谢的影响。发现浓度为0.1mmol/L的丙酸盐对大鼠乙酸盐合成脂质有抑制作用。然而,在人类肝细胞中,需要更高浓度的丙酸盐(约10-20 mmol/L)才能获得同样的抑制作用。该值比门静脉血中丙酸盐的浓度高100-200倍,表明大鼠模型不能完全外推到人类的情况。
▸ 作为影响饱腹感的分子
丙酸盐不仅具有降低胆固醇和抗脂肪生成的作用,还可能通过刺激饱腹感来控制体重。已有研究表明,短链脂肪酸(如乙酸、丙酸、丁酸)具有诱发饱腹感的作用。
• 丙酸盐影响肠道激素的形成进而影响饱腹感
现有证据表明,细菌调节肠道激素(如胰高血糖素样肽1(GLP-1)和肽YY(PYY))的形成,是通过短链脂肪酸介导的。乙酸、丙酸和丁酸的生理浓度,以及pH值从7.5降至6.0,会显著增加肠内分泌结肠细胞系STC-1中的胰高血糖素原和PYY。
GLP-1和PYY是刺激饱腹感的激素,由L细胞(主要位于回肠和结肠)响应营养摄入而释放。GLP-1促进胰岛素分泌和胰腺β细胞增殖,同时控制肌肉细胞中的糖原合成;而PYY则减缓胃排空。相反,生长素释放肽刺激食欲,主要由胃中的P/D1细胞产生。
不易消化的碳水化合物,如低聚果糖、乳糖醇和抗性淀粉,通过调节肠道肽GLP-1、PYY和生长素释放肽的产生,有效地诱导饱腹感,这一机制还涉及肠道微生物群落。
• 丙酸盐对摄食行为有显著影响,诱导瘦素产生
在短链脂肪酸中,丙酸盐被重点研究作为一种饱腹感诱导剂,对能量摄入和摄食行为有显著影响。人体和动物试验表明,丙酸盐给药(体内范围为130-930mmol/L,体外范围为0.01-10mmol/L)显著增强饱腹感并降低进食欲望。
丙酸盐触发的饱腹感信号之一是瘦素,这是一种强效的厌食激素,通过中枢神经系统中表达的受体抑制食物摄入。研究显示,每天服用500µmol的丙酸盐几乎使小鼠血浆中的瘦素浓度翻了一倍。
在另一项研究中,浓度为3mmol/L的丙酸在mRNA和蛋白质水平上诱导了人内脏脂肪组织中瘦素的产生。这些数据表明,肠道微生物群对肥胖的调节作用可能部分由短链脂肪酸(特别是来自微生物碳水化合物发酵的丙酸)介导。
▸ 影响心脑血管健康
丙酸盐通过与肠道受体GPR 41和GPR 43(也称为脂肪酸受体FFAR2和FFAR3)相互作用,对心脑血管健康具有一些潜在的影响。
• 脑血管患者体内的丙酸盐含量较低
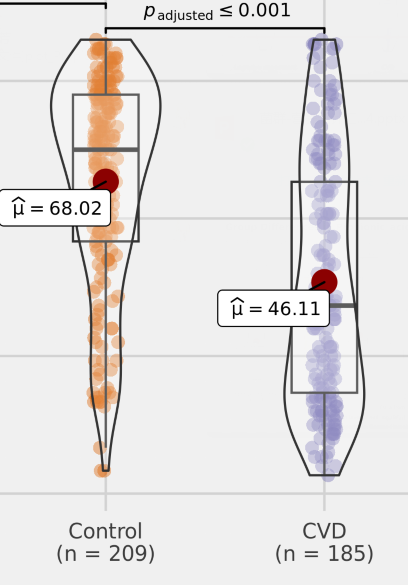
编辑
谷禾的数据中发现,与健康对照相比,脑血管疾病患者中的丙酸盐含量较低,并且具有明显的统计学差异。因此丙酸盐的含量可能是影响心脑血管健康的一个重要指标。
• 较高的丙酸盐浓度患冠状动脉硬化风险较低
最近一项大型横断面研究表明血浆丙酸浓度与冠状动脉疾病存在关联,较高浓度的丙酸盐与较低的冠状动脉粥样硬(CAD)风险相关,且与已知的心血管风险因素无关。
如上所述,越来越多的实验数据表明,丙酸盐可能对高血压、内皮功能障碍和高胆固醇血症等心血管风险因素产生有益影响。
▸ 丙酸盐在癌症中的潜在作用
短链脂肪酸对癌症(尤其是结肠癌)的影响已被广泛研究。丁酸能够调节基因表达,并对细胞凋亡和细胞周期的关键调节因子产生影响。
几种机制促成了丁酸对基因表达的调节作用。这些机制包括组蛋白和非组蛋白的过度乙酰化以及DNA甲基化的改变,从而增强了转录因子对核小体DNA的可及性。
• 丙酸盐诱导结直肠癌细胞凋亡
在一项研究中,丙酸盐和乙酸盐(浓度分别为26-40和9-16mmol/L)在人类结直肠癌细胞系中诱导了典型的细胞凋亡迹象。这些迹象包括线粒体跨膜电位的丧失、活性氧的产生、胱天蛋白酶3加工和核染色质凝聚。
• 抑制结肠癌细胞系的生长
短链脂肪酸对结肠上皮细胞增殖具有矛盾作用。虽然这些阴离子刺激正常隐窝细胞,但它们抑制结肠癌细胞系的生长。
丁酸盐和丙酸盐也是诱导分化和细胞凋亡的最有效脂肪酸。因此,它们通常可以预防癌症的发展,尤其是预防结直肠癌。虽然丁酸比丙酸更有效,但它主要被结肠细胞吸收作为能量来源。相比之下,丙酸和乙酸盐进入血液循环的浓度比丁酸高得多,并且它们被肝脏大量吸收(约60%)。由于这些阴离子在肝脏中的浓度很高,它们很可能会影响肝癌细胞以及已知会导致肝脏转移的其他典型癌细胞,例如乳腺癌和结肠癌。
一项针对猝死患者的研究表明,外周血中的短链脂肪酸数量可以量化。因此,这种循环中的丙酸盐、乙酸盐和丁酸盐的抗癌作用非常值得研究;例如,这种影响会在多大程度上延伸到小肠、大肠和肝脏之外,从而影响不同的组织?
!
• 丙酸盐过量可能与阿尔茨海默病相关
最近的几项研究提供了丙酸盐与阿尔茨海默病(AD)之间联系的证据。例如,分析了阿尔茨海默病患者和健康对照者的唾液样本,发现阿尔茨海默病患者的丙酸水平比健康对照者高出1.35倍。分析了轻度认知障碍者、阿尔茨海默病患者和健康对照者的唾液样本,也发现AD患者的丙酸水平显著升高。
几项啮齿动物研究也将粪便和循环中丙酸盐水平与阿尔茨海默病联系起来。接受AD患者粪便微生物群移植的小鼠丙酸水平高于对照组。
此外,发现阿尔茨海默病小鼠海马体中的丙酸增加了1.23倍。也发现阿尔茨海默病小鼠前额叶皮层中的丙酸浓度显著高于野生型小鼠,6个月大的阿尔茨海默病小鼠粪便中的丙酸浓度也显著更高。
• 丙酸血症的丙酸盐代谢异常
丙酸血症是人类最常见的有机酸代谢紊乱,是一种由丙酰辅酶A羧化酶基因缺陷引起的先天性代谢错误,丙酸过量且无法通过丙酰辅酶A转化。
丙酸血症患者的体内丙酸及其代谢物水平显著升高,会引起代谢性酸中毒、血氨升高,可能还会诱导一些严重的并发症如脑损伤、心肌病发生。
•有研究认为过多的丙酸盐可能导致肥胖和糖尿病
2019年哈佛大学公共卫生学院发表的一篇文献称:小鼠长期接触丙酸将导致肝细胞产生更多葡萄糖,形成高血糖症,这是糖尿病的一个典型特征。此外,研究人员还发现,长期服用丙酸盐剂量的小鼠,其体重会显著增加,胰岛素抗性也会增大。
还对14名健康人开展对照试验,受试者被随机分为两组,其中一组的餐食中添加1克丙酸盐,另一组添加安慰剂。结果显示,进餐后不久,丙酸盐组受试者血液中的去甲肾上腺素水平显著升高,胰高血糖素等激素水平也有所增长。这表明丙酸盐可能会作为“代谢破坏者”,增加人类患糖尿病和肥胖症的风险。
而这与前文丙酸盐会影响脂质合成与摄食行为相矛盾,因此,丙酸盐对人体的影响可能取决于其含量以及人体独特的肠道菌群结构与代谢能力。
内源性丙酸盐与外源性丙酸盐存在区别
内源性丙酸:指的是人体内部产生的丙酸,通常情况下,人体中的微生物能够在结肠中通过发酵未完全消化的碳水化合物来产生丙酸,这些丙酸对人体是有益的。
外源性丙酸:指的是从外部来源摄入的丙酸,比如通过食物摄入或作为补充剂。以及在一些药物中也可能含有丙酸盐。
★ 外源性丙酸盐摄入过多对代谢健康有害
但已经有各种研究表明,外源性地摄入和自体产生的丙酸作用并不一样,外来的丙酸对个体的许多代谢过程有不利影响。
哈佛大学公共卫生学院的研究人员完成了一项实验,发现从食品中摄入的丙酸在短期内会导致高血糖、胰岛素偏高,而且长期摄入将会造成肥胖和胰岛素抵抗等更严重的症状。
我们通过口腔摄入含丙酸添加剂的食物后,会激活我们的交感神经系统,并促使体内胰高血糖素和脂肪酸结合蛋白4等激素的升高。受到激素影响,肝糖原持续分解,血糖升高。身体开始分泌更多胰岛素进行代偿降低血糖浓度,最终导致胰岛素抵抗和肥胖产生。
这项研究表明,自身产生的丙酸和外界摄入的丙酸具有不同的功能,我们推测,这是因为从食物中摄入会极大地增加细胞和丙酸的接触,而细菌产生的仅仅只会局限在结肠部分。
在人体肠道中,丁酸由膳食纤维经细菌发酵产生,通过两种代谢途径。在第一条途径中,丁酰辅酶A被磷酸化形成丁酰磷酸,并通过丁酸激酶转化为丁酸。在第二条途径中,丁酰辅酶A的辅酶A部分通过丁酰辅酶A:乙酸辅酶A转移酶转移到乙酸盐,从而形成丁酸和乙酰辅酶A。其中丁酰辅酶A:乙酸辅酶A转移酶途径占主导地位。
对人类粪便微生物群的放射性同位素分析也表明,肠道中的大多数丁酸盐是由碳水化合物通过Embden-Meyerhof-Parnas(糖酵解途径)由乙酰辅酶A产生的。
• 少量的丁酸盐也可由蛋白质合成
除了碳水化合物,少量的丁酸也可以通过谷氨酸、赖氨酸、戊二酸和γ-氨基丁酸途径由蛋白质合成。厚壁菌种也对氨基酸表现出高活性,特别是肠单胞菌(Intestinimonas AF211),它通过不同的途径将葡萄糖和赖氨酸发酵成丁酸。
形成丁酸盐的微生物途径
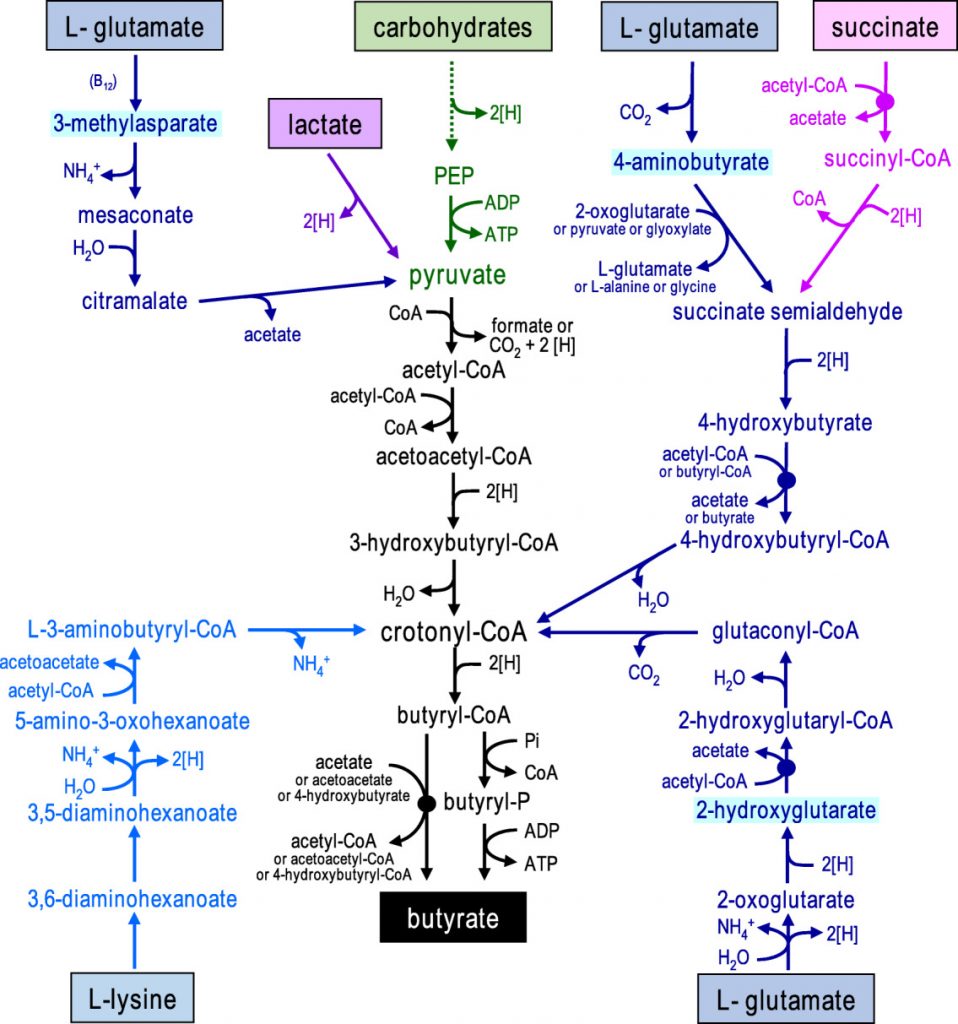
doi: 10.1111/1462-2920.13589.
碳水化合物通过糖酵解发酵为丙酮酸显示为绿色,从乙酰辅酶A形成丁酸盐显示为黑色,氨基酸发酵途径显示为蓝色(以中间体命名不同的谷氨酸途径),乳酸和琥珀酸发酵分别显示为紫色和粉色。
• 人结肠中的瘤胃球菌和毛螺菌是产丁酸的主力
除食源性丁酸,人体内丁酸主要是由盲肠和结肠的厌氧型细菌发酵产生,而由胃和小肠产生的丁酸含量极低。大肠产丁酸的菌种主要是梭菌属XIVa和IV族,以及真杆菌属和梭杆菌属
盲肠和结肠中丁酸的产生速度和数量主要取决于肠道微生物组成、日常膳食中可利用发酵成分组成等。在人的结肠中,厚壁菌门中的瘤胃球菌科(Ruminococcaceae)和毛螺菌科(Lachnospiraceae)这两个主要科,以及包括丹毒丝菌科(Erysipelotrichaceae)和梭菌科(Clostridiaceae)在内的其他厚壁菌门物种,都发现了丁酸生产菌种与非生产菌种的交替存在。
但应注意,许多人类结肠的主要厚壁菌门(例如Blautia spp.、Eubacterium eligens、Ruminococcus spp.)缺乏从碳水化合物中生成丁酸的能力。
产生丁酸盐的细菌被认为在生命的第一年内定植于宿主,并且在成年时占总细菌群落的20%以上。在消化道中发现的已知丁酸盐生产者中,大多数似乎属于毛螺菌科和瘤胃球菌科。我们将简要介绍两个丁酸生产菌。
▸ 普拉梭菌
普拉梭菌(Faecalibacterium prausnitzii)是健康人类微生物群中最丰富的菌种之一,也是主要的丁酸盐生产者之一。它通过丁酰辅酶A:乙酸辅酶A转移酶产生丁酸,并消耗乙酸。
虽然F.prausnitzii菌株是专性厌氧菌,但在核黄素(维生素B2)和还原性化合物(如半胱氨酸或谷胱甘肽)存在的情况下,低浓度氧气也能促进其生长。
氧气消耗会伴随丁酸形成的减少。F. prausnitzii分离株在利用食物多糖(如淀粉和半纤维素)生长方面能力有限,但一些菌株可以利用菊粉和果胶衍生物,并且普遍利用糖醛酸。
• 肠道炎症患者产生丁酸会减少
F. prausnitzii在炎症性肠病患者中很少见,尤其是克罗恩病,有证据表明它具有抗炎作用,因此引起了人们对其作为潜在治疗药物的兴趣。同样,据报道,Butyricicoccus pullicaecorum在炎症性肠病患者中较少见,并且也可能具有治疗潜力。
注:其他瘤胃球菌科细菌也能产生丁酸,但人们对大多数此类生物知之甚少。关于Faecalibacterium prausnitzii,详见:肠道核心菌属——普拉梭菌(F. Prausnitzii),预防炎症的下一代益生菌
▸ 毛螺菌科
直肠真杆菌(Eubacterium rectale)和密切相关的罗氏菌属(Roseburia)构成了产丁酸毛螺菌科的主要群体,它们具有相同的丁酰辅酶 A:乙酸辅酶 A 转移酶途径来生产丁酸,并且其丁酸合成基因的基因组组织也相同,从乙酰辅酶A到丁酰辅酶A。
• 罗氏菌属通过代谢饮食多糖产生丁酸
在某些Roseburia菌株中,特别是在弱酸性pH值下,丁酸几乎是唯一产生的发酵酸,乙酸的净消耗通常伴随着丁酸的形成。一些其他菌株和物种除了产生丁酸外,还产生甲酸和乳酸。基因组分析表明,该群体具有相当大的利用饮食来源的多糖的能力,包括淀粉、阿拉伯木聚糖和菊粉,不同菌株和物种之间的差异很大。
其他拥有丁酰辅酶A:乙酸辅酶A转移酶基因的毛螺菌科包括Eubacterium hallii、Anaerostipes hadrus、Coprococcus catus、与分离株SS3/4和M62/1有关的未鉴定物种。
• 一些毛螺菌科细菌利用乳酸和乙酸来产生丁酸
某些毛螺菌科能够在乳酸和乙酸盐存在下生长并产生丁酸,其总净化学计量为4mol乳酸和2mol乙酸盐产生3mol丁酸 。
这包括仅使用D-乳酸的物种Anaerostipes hadrus和能够利用两种乳酸异构体的E. hallii。
此外,双歧杆菌等常见益生菌配方中的微生物与丁酸盐生产者之间的交叉喂养相互作用已被证明是可以产丁酸盐的。
人体肠道中的主要丁酸生产者
doi: 10.3389/fmicb.2022.1103836.
▸ 增加丁酸盐生成的食物
饮食对人体微生物群有显著影响,通过饮食干预可显著改变细菌数量并增加微生物多样性。富含纤维的饮食对丁酸盐的产生特别有益,因为它可以滋养产生丁酸盐的细菌。
• 高纤维饮食能够有效增加丁酸盐的生成
蔬菜、水果、豆类和全谷物,它们含有膳食纤维,可被肠道细菌发酵成丁酸盐等有机化合物。通过食物增强微生物群是促进消化系统健康和丁酸盐生成的有效且安全的方法。因此,增加丁酸盐产量的最佳方法是通过高纤维饮食。
• 高脂、低纤维饮食不利于丁酸盐的生成
高蛋白、高脂肪、低碳水化合物的饮食已被证明会破坏微生物组中丁酸盐的产生。在一项研究中,研究人员分析了短期饮食限制碳水化合物摄入量的肥胖参与者的微生物组,从而限制了他们对植物性膳食纤维的消耗。
在低碳水化合物饮食(每天24克)和中等碳水化合物饮食(每天164克)4 周后,短链脂肪酸的浓度低于高碳水化合物饮食(每天399克)。具体来说,当碳水化合物摄入量减少时,丁酸盐浓度会降低。
同时还发现,厚壁菌门细菌Roseburia和E.Rectale的密度与丁酸盐浓度之间存在联系,两者都随着碳水化合物摄入量的减少而降低。
一些食源性物质产生短链脂肪酸的量
• 抗性淀粉
研究表明,从生马铃薯、高直链淀粉玉米和全谷物中提取的阿拉伯木聚糖中,含有高含量2型抗性淀粉的食物显著增加了丁酸盐的产量。
在174名健康年轻人的饮食中添加马铃薯抗性淀粉后,丁酸盐产量增加。玉米、菊苣和玉米中的抗性淀粉也进行了测试,但只有当食用土豆中的抗性淀粉时,粪便中的丁酸总量才会显著增加。
• 果聚糖(菊粉)
许多研究表明,菊粉可以增加短链脂肪酸的产量,包括丁酸盐。这可能解释了香蕉在溃疡性结肠炎和克罗恩病患者的饮食中如此有效的原因之一。然而,链长较短的果聚糖通常比链长的果聚糖(如菊粉)更容易喂养产丁酸菌。
也就说,抗性淀粉和果聚糖(短链低聚果糖和长链菊粉)在肠道中发酵时会产生丁酸盐。
富含抗性淀粉的食物:全麦面包、燕麦、大麦和糙米等全谷物;黑豆、红豆、绿豆等豆类;马铃薯、玉米、菊苣根、牛蒡根、魔芋根、亚麻籽。
富含果聚糖的食物:洋葱、菊苣、香蕉、朝鲜蓟、芦笋、大蒜、韭菜、西兰花、开心果。
需要注意的
由于人与人之间的常驻微生物存在显著差异,并且它们消化某些底物的能力不同,因此比较明智的选择是食用包含多种抗性淀粉和果聚糖的饮食。例如以马铃薯抗性淀粉、燕麦麸皮纤维或车前草种子或短链低聚半乳糖、长链低聚果糖和谷氨酰胺的混合物的形式短期补充,增加丁酸盐水平。
丁酸盐作为一种重要的的调节因子,是宿主-微生物串扰的关键介体。丁酸盐在体内可以通过脂肪酸氧化为机体供应能量,是肠道上皮细胞的主要供能物质。
丁酸盐还与机体健康密切相关,对调节肠道健康、修复肠道屏障、抑制炎症及癌症等病症意义重大。在养殖业中常添加丁酸盐保护动物健康生长,如预防断奶仔猪腹泻、调节鸡肠道菌群并增强其免疫力等。
▸ 为肠道细胞提供能量
丁酸盐是结肠细胞的主要能量来源,结肠细胞是构成肠道内壁的细胞。
与身体中使用糖(葡萄糖)作为主要能量来源的大多数其他细胞不同,肠道内壁细胞(结肠细胞)主要使用丁酸盐。如果没有丁酸盐,这些细胞就无法正确执行其功能。
• 丁酸盐为结肠细胞提供能量,细胞利于产丁酸盐细菌的生长
厚壁菌属的成员以产生丁酸盐而闻名,像Roseburia,Faecalibacterium prausnitzii,直肠真杆菌(E.rectale)等。
这种关系是相互的。丁酸盐为结肠细胞提供燃料,作为回报,这些细胞有助于提供一个无氧环境,有益的肠道微生物在其中茁壮成长。这可以控制炎症,保持肠道细胞健康,并使肠道细菌保持健康。
▸ 促进肠道运动
实验研究表明,丁酸盐通过作为短链脂肪酸受体的配体和激活剂,诱导肠道激素肽YY或介导肠嗜铬细胞释放5-羟色胺来促进肠道运动。
丁酸盐还可以通过上调Na+—H+交换器和诱导ATPase离子交换器基因来增强水和电解质的吸收。并且可能有益于预防某些类型的腹泻。
▸ 抗炎、抗癌特性
丁酸盐对肠道具有抗炎和抗癌功能。
肠道内壁会保持低水平的炎症,以防与微生物群接触的粘膜表面发生任何变化。低水平的炎症受到严格控制,但如果它被破坏,会导致氧化损伤,并可能在很长一段时间内导致癌症。
• 丁酸盐减少促炎细胞因子的产生
丁酸盐会阻止体内的一些促炎物质发挥作用。丁酸盐的抗炎作用可减少氧化应激并控制自由基造成的损害。
丁酸盐的抗炎特性,部分原因是其抑制核转录因子(NF-κB)的激活,通过下调NF-κB信号通路,丁酸盐可以调节促炎细胞因子的产生。
• 丁酸盐阻止结肠癌细胞的生长
丁酸盐也是一种组蛋白脱乙酰酶(HDAC)抑制剂。组蛋白脱乙酰酶是大多数癌症中产生的酶。因为丁酸盐是一种抑制剂,它实际上会改变基因表达,抑制细胞增殖,诱导细胞分化或凋亡。因此,它可以阻止癌细胞的发展。
有证据表明,结直肠癌(CRC)患者的微生物组图显示主要产丁酸菌属减少,包括罗氏菌属(Roseburia)、Clostridiales、Faecalibacterium和Lachnospiraceae科成员,而使用产丁酸的丁酸梭菌可有效减少癌细胞增殖并增强癌细胞凋亡。
▸ 修复肠道屏障,防止肠漏
肠上皮细胞的屏障功能是重要的第一道防线,确保上皮层具有适当的通透性。研究发现丁酸盐能够修复和增强肠上皮细胞的屏障功能。
• 丁酸盐上调粘蛋白的表达,增强粘液屏障
最新研究表明,丁酸对肠屏障功能具有保护作用。例如,丁酸能够上调粘蛋白2(MUC2)的表达。粘蛋白2是肠粘膜表面主要的粘蛋白,可增强粘膜层,从而限制有害物质通过肠道。
• 丁酸盐对肠道屏障的影响可能具有浓度依赖性
此外,丁酸还能增加三叶因子(TFF)的表达,这是一种粘蛋白相关肽,有助于维持和修复肠粘膜。丁酸还调节紧密连接蛋白的表达,以降低细胞旁通透性。其中一种机制是通过激活单分子层中的AMP活化蛋白激酶。
体外模型研究表明,丁酸对肠道屏障功能的影响可能具有浓度依赖性。丁酸在低浓度(≤2 mM)时可促进肠道屏障功能,但在高浓度(5或8 mM)时可能通过诱导细胞凋亡来破坏肠道屏障功能。
根据哺乳动物胃肠道中的生理浓度,目前体外模型中推荐使用的丁酸浓度为0-8mM。然而,考虑到大多数丁酸在结肠上皮中被代谢为能量底物,体内和体外模型中治疗剂量可能存在差异。
▸ 抗氧化能力
说起抗氧化,我们先了解一下自由基。它基本上是体内化学反应产生的废物。另一方面,抗氧化剂是身体抵御它们的防御措施。大量自由基会造成损害并压倒身体的修复系统。我们称之为氧化应激。氧化应激被认为是导致衰老和疾病的一个重要因素。
• 丁酸盐增加谷胱甘肽,可以中和自由基
结肠或大肠是身体产生的废物的储存容器。较高的丁酸盐水平已被证明会增加谷胱甘肽的水平,谷胱甘肽是一种在人体细胞中产生的抗氧化剂,可以中和肠道中的自由基(自由基与炎症和许多疾病有关),从而起到抗氧化作用。
▸ 调节肠道免疫
• 维持厌氧环境,阻止有害菌生长
丁酸通过增强结肠细胞的氧消耗和稳定缺氧诱导因子(HIF)来维持结肠内的厌氧环境,而丁酸的缺失则会促进潜在有害细菌和分子的积聚,例如沙门氏菌、大肠杆菌和一氧化氮(NO)。
肠道中丁酸水平降低,这促进了肠道上皮氧合和鼠伤寒沙门氏菌(S.Typhimurium)的生长,鼠伤寒沙门氏菌是食源性肠道炎症和腹泻的已知病因。
• 影响免疫细胞迁移、粘附
除了营造无氧环境外,短链脂肪酸,尤其是丁酸盐,还可以作为免疫细胞趋化和粘附的调节剂。丁酸可以调节肠上皮细胞介导的中性粒细胞向炎症部位的迁移,并且这种作用是浓度依赖性的。
此外,丁酸在细胞增殖和凋亡中发挥作用。丁酸刺激细胞生长和DNA合成,并诱导细胞周期G1期的生长停滞。虽然低浓度的丁酸会增强细胞增殖,但高浓度的丁酸会诱导细胞凋亡。
丁酸盐等短链脂肪酸可以在先天反应过程中通过影响巨噬细胞和粒细胞以及树突状细胞的抗原呈递发生,也可能在适应性免疫反应过程中通过影响T细胞和B细胞功能发生。
短链脂肪酸的免疫调节作用
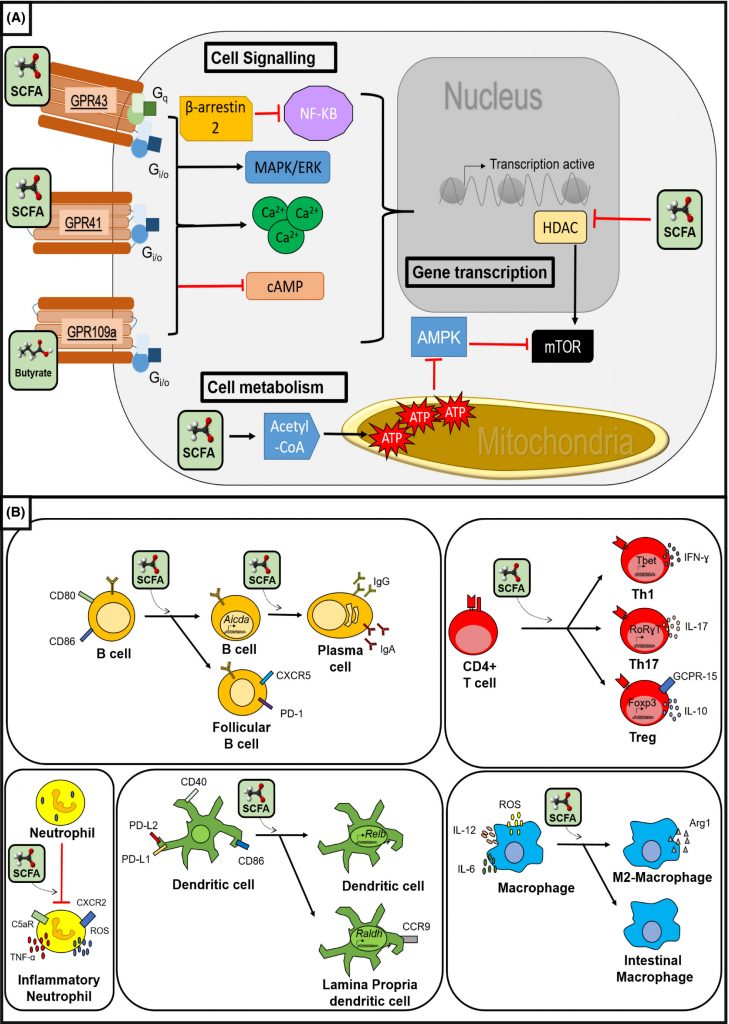
doi: 10.1111/apt.14689.
▸ 影响代谢健康
• 对肥胖存在一定影响,但还不能完全确定
包括丁酸盐在内的短链脂肪酸可通过激活肠细胞内的FFAR来降低食欲和体重。这促进胰高血糖素样肽1(GLP-1)和肽YY的释放,前者促进胰岛素分泌并抑制胰高血糖素分泌,后者降低食欲并减缓胃排空。
短链脂肪酸还能减少所谓的“饥饿激素”——胃促生长素(ghrelin)的分泌;FFAR2存在于ghrelin分泌细胞上,包括丁酸盐和丙酸盐在内的FFAR2激动剂可减少ghrelin分泌。
丁酸盐影响脂质代谢的机制
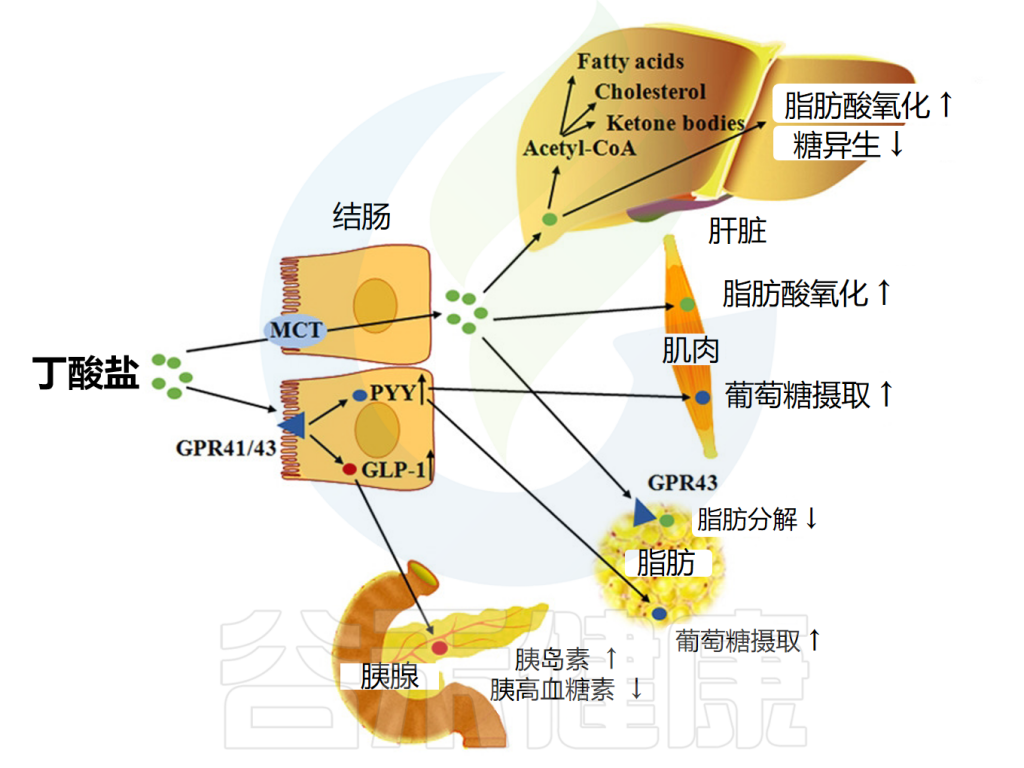
doi: 10.1093/advances/nmx009.
也有证据表明短链脂肪酸作用于交感神经系统,交感神经节中FFAR3的激活导致能量消耗增加。
然而,与丙酸盐一样,关于丁酸盐对食物摄入的影响,有相互矛盾的结果报道。
• 丁酸盐对控制血糖水平可能有潜在好处
研究发现,糖尿病患者和糖尿病前期受试者中丁酸盐水平降低。
丁酸在肠内分泌细胞(EEC)中与游离脂肪酸受体(FFAR)FFAR2和FFAR3结合,调节肠道激素释放,如胰高血糖素样肽1(GLP-1)和肽YY(PYY)。
丁酸盐通过多种途径影响糖代谢的调节
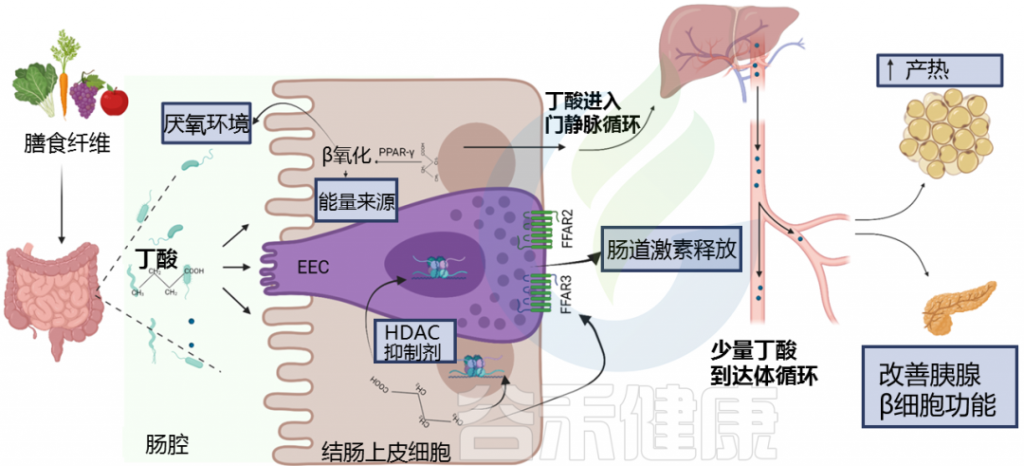
doi: 10.3389/fendo.2021.761834.
这些激素共同作用以保持血糖水平稳定。当血糖过高时,胰岛素会告诉身体的肌肉和脂肪细胞吸收多余的葡萄糖,所以说这些激素对肥胖和糖尿病很重要。丁酸盐增加这些肠道激素的释放,表明对控制血糖水平和防止体重增加有潜在的好处。
!
丁酸盐过低可能会导致以下危害:
•肠道屏障功能受损:丁酸盐有助于维持结肠的“生理性缺氧”,并提供能量给结肠细胞,有助于维持肠道稳态。丁酸盐的减少可能导致肠道屏障功能受损。
•增加慢性疾病风险:变形菌门的兼性厌氧细菌的扩张几乎总是伴随着产丁酸盐细菌丰度的减少,并与许多慢性疾病有关,包括炎症性肠病、肠易激综合症、结直肠癌、2型糖尿病、肥胖等。
•神经炎症:丁酸盐具有抗炎特性,对大脑健康具有重要意义。丁酸盐过低可能导致炎症增加,影响大脑健康。
•睡眠问题:丁酸盐可能作为细菌源性促睡眠信号,丁酸盐过低可能影响睡眠,导致睡眠问题。
•肠道菌群失衡:丁酸盐过低可能导致肠道菌群失衡,因为变形菌门的扩张伴随着产丁酸盐细菌的减少。
•不利于肠道损伤修复:在轻微炎症或轻度溃疡部位添加丁酸盐可以促进肠道损伤的修复,而丁酸盐过少可能不利于溃疡的恢复。
!
丁酸盐并不总是越多越好,低浓度丁酸促进细胞增殖和生长,高浓度丁酸反而抑制细胞增殖和生长,增加肠道的通透性。
• 不同部位对丁酸盐的耐受阈值存在差异
胃肠道不同部位对丁酸盐的耐受阈值也存在一定差异,胃和小肠对丁酸的耐受阈值低,结肠和盲肠耐受阈值高。
添加普通丁酸钠制剂(主要在肠道前端被吸收利用),反而造成肠道炎症、菌群失调。
• 肠道严重溃疡时丁酸盐可能加剧症状
更有意思的是,轻微炎症或者轻度溃疡部位添加丁酸盐可以促进肠道损伤的修复,在严重溃疡肠道部位添加,不利于溃疡的恢复,甚至加剧整个溃疡。
有学者发现溃疡部位的粘膜组织对丁酸的代谢降低,甚至只有正常粘膜组织的一半,主要是由于其转运载体和氧化相关的酶活降低。
主要参考文献
Louis P, Flint HJ. Formation of propionate and butyrate by the human colonic microbiota. Environ Microbiol. 2017 Jan;19(1):29-41.
Gill PA, van Zelm MC, Muir JG, Gibson PR. Review article: short chain fatty acids as potential therapeutic agents in human gastrointestinal and inflammatory disorders. Aliment Pharmacol Ther. 2018 Jul;48(1):15-34.
Hosseini E, Grootaert C, Verstraete W, Van de Wiele T. Propionate as a health-promoting microbial metabolite in the human gut. Nutr Rev. 2011 May;69(5):245-58.
Arora T, Tremaroli V. Therapeutic Potential of Butyrate for Treatment of Type 2 Diabetes. Front Endocrinol (Lausanne). 2021 Oct 19;12:761834.
Singh V, Lee G, Son H, Koh H, Kim ES, Unno T, Shin JH. Butyrate producers, “The Sentinel of Gut”: Their intestinal significance with and beyond butyrate, and prospective use as microbial therapeutics. Front Microbiol. 2023 Jan 12;13:1103836.
Gonzalez-Garcia, R.A.; McCubbin, T.; Navone, L.; Stowers, C.; Nielsen, L.K.; Marcellin, E. Microbial Propionic Acid Production. Fermentation 2017, 3, 21.
Reichardt N, Duncan SH, Young P, Belenguer A, McWilliam Leitch C, Scott KP, Flint HJ, Louis P. Phylogenetic distribution of three pathways for propionate production within the human gut microbiota. ISME J. 2014 Jun;8(6):1323-35.
Liu H, Wang J, He T, Becker S, Zhang G, Li D, Ma X. Butyrate: A Double-Edged Sword for Health? Adv Nutr. 2018 Jan 1;9(1):21-29.