 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

肠易激综合征 (IBS) 是一种普遍存在的、症状驱动的慢性疾病,其特征是腹部不适和排便不规律,估计影响全球 11.2% 的人口。这些患者中大约三分之一被诊断患有便秘型肠易激综合征(IBS-C),这是IBS 的一种亚型。
鉴于传统治疗的局限性,越来越多的证据强调分泌药物的有效性。这些靶向氯离子通道的新药具有明确的作用机制,一个例子是鸟苷酸环化酶C激动剂利那洛肽。利那洛肽不仅可以缓解便秘症状,还可以改善腹部不适、疼痛和腹胀等全身症状。该药物已获得美国食品和药物管理局 (FDA) 和美国胃肠病学会认可用于治疗成人慢性特发性便秘 (CIC) 和便秘型肠易激综合征。
然而,利那洛肽治疗的疗效已被证明表现出显著的个体差异。 2018 年中国的一项 III 期试验显示,约 40% 患者对利那洛肽治疗没有反应,这可能是由于IBS-C的多因素病因所致。
研究表明,肠道菌群不仅影响IBS-C的发病,也影响疾病治疗的有效性,包括结肠癌患者的化疗敏感性、二甲双胍对糖尿病的影响以及利法昔明治疗IBS-D的疗效。通过动物实验,一项日本研究确认利那洛肽能增强肾功能不全患者的肠道环境。然而,利那洛肽是否能改善肠道菌群失调,以及肠道菌群与利那洛肽治疗IBS-C患者症状缓解之间的关系尚待确定。
近日,来自重庆医科大学附属第一医院、第三军医大学第二附属医院、遂宁市中心医院等消化内科的研究人员,发现肠道菌群尤其是经黏液真杆菌属(Blautia属),对利那洛肽治疗效果具有潜在影响,该研究结果发表在《Journal of Translational Medicine》(转化医学杂志)上。

该研究通过多中心临床试验,评估利那洛肽的疗效和安全性,辨别利那洛肽治疗提供的缓解与肠道菌群变化之间的关系,治疗后Blautia的丰度可用于预测利那洛肽的疗效,这对IBS-C治疗具有重要意义。
本文我们来详细了解一下吧。
这项多中心、前后临床试验于2020年1月-2021年6月期间在六家医院进行,包括:
IBS-C患者
纳入标准如下:
排除标准如下:
健康志愿者
排除标准如下:
治疗及随访
所有患者均接受相同剂量的利纳洛肽治疗(每天一次,早餐前半小时口服290微克),治疗周期为6周。每周进行两次随访。治疗期间,患者不得服用任何其他与便秘相关的药物,包括益生菌和泻药。
样本、指标收集
在利纳洛肽治疗前后各收集一次粪便样本。每位患者收集三份粪便样本,进行16s rRNA测序。
每两周评估一次腹痛变化:
治疗期间每日根据饮食状况评估布里斯托粪便形态量表(BSFS)和自发性大便次数(SBMs)。
治疗后,将患者分为缓解组和无缓解组。根据FDA响应标准;
缓解组中的患者进一步分为响应者和非响应者。
IBS-C的FDA响应终点标准如下:
IBS-C的缓解标准是在至少50%的治疗期间腹痛或便秘得到缓解。
01
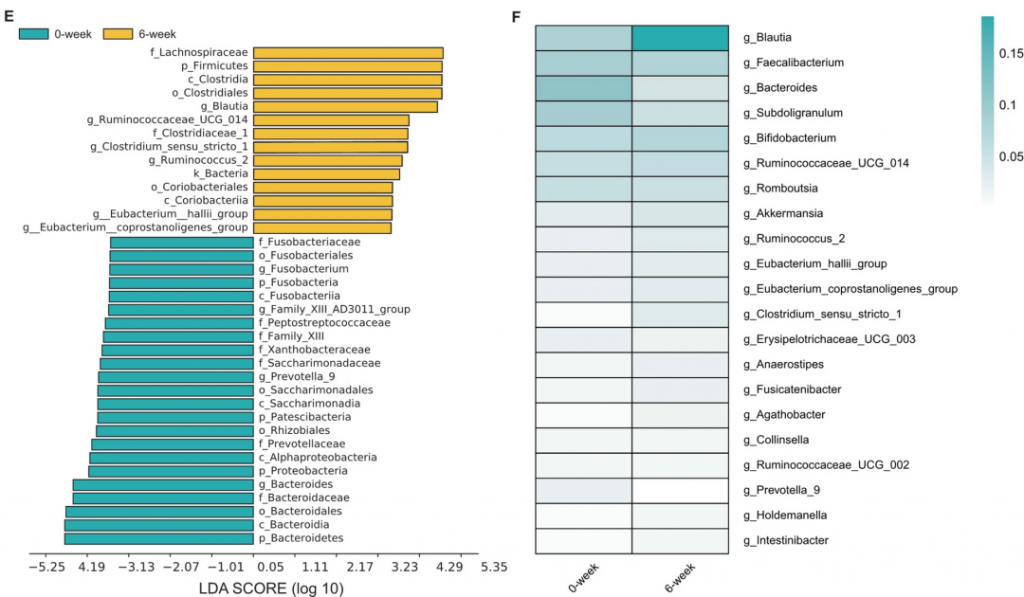
利那洛肽改变了IBS-C患者的肠道菌群
从60名患者中收集了初始(第0周)和最终(第6周)的粪便样本,并进行了16S rRNA的测序分析。通过广义线性模型使用各种方法评估了肠道菌群的alpha多样性,并且不同指数(ACE和Chao1)的一致结果显示,第6周组的alpha多样性显著高于第0周组(p < 0.0001)。
用Jaccard距离算法的主坐标分析(PCoA)评估了beta多样性。OTUs的清晰聚类分离表明,第0周组和第6周组之间存在着明显的群落结构差异。
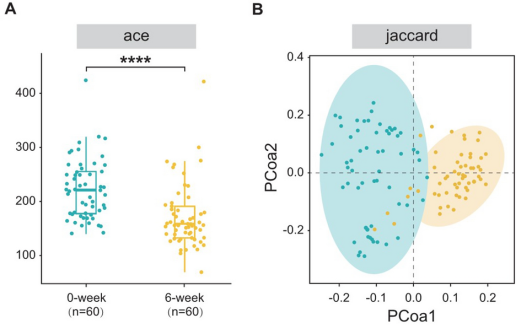
在门级别,厚壁菌门是最丰富的门,分别占0周组和6周组肠道微生物群的63.81%和77.93%(p < 0.0001)。
在属级别,两组之间观察到生物组成的明显差异。其中,Blautia属(分别为18.57%对7.77%,p < 0.001)和Fusicatenibacter属(分别为1.23%对1.69%,p < 0.001)在6周组中的丰度相对较高。
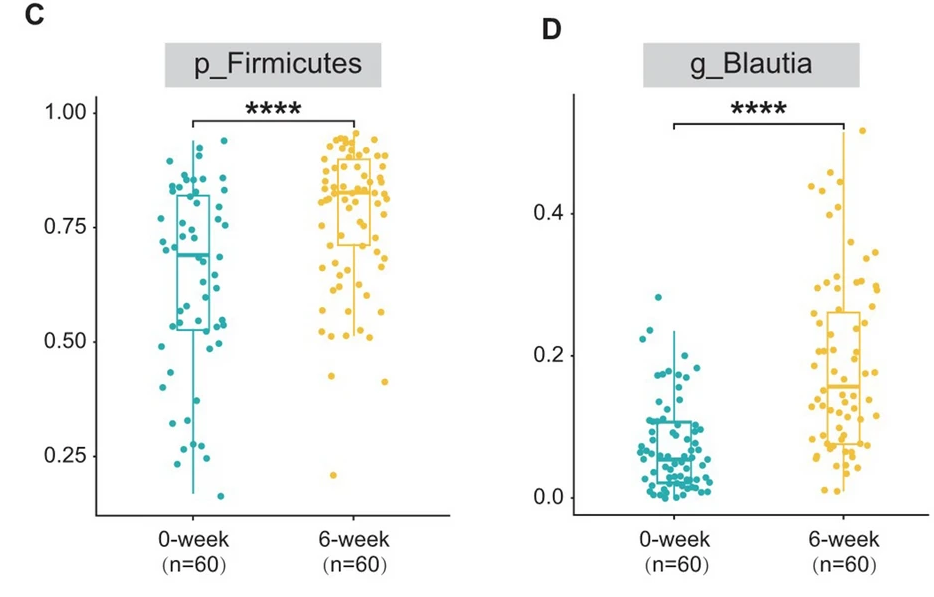
用LEfSe进行了高维比较,发现Blautia属(来自厚壁菌门和毛螺菌科)是导致6周组肠道微生物群失调的关键细菌类型。
LEfSe结果表明,厚壁菌门在门级别和Blautia属在属级别在健康志愿者中占主导地位。IBS-C患者的Blautia属丰度低于健康志愿者,而利那洛肽治疗后的Blautia属丰度高于健康志愿者。
在连续观察中(利那洛肽撤药后4周),还发现Blautia属的丰度高于治疗前,但低于治疗期间。
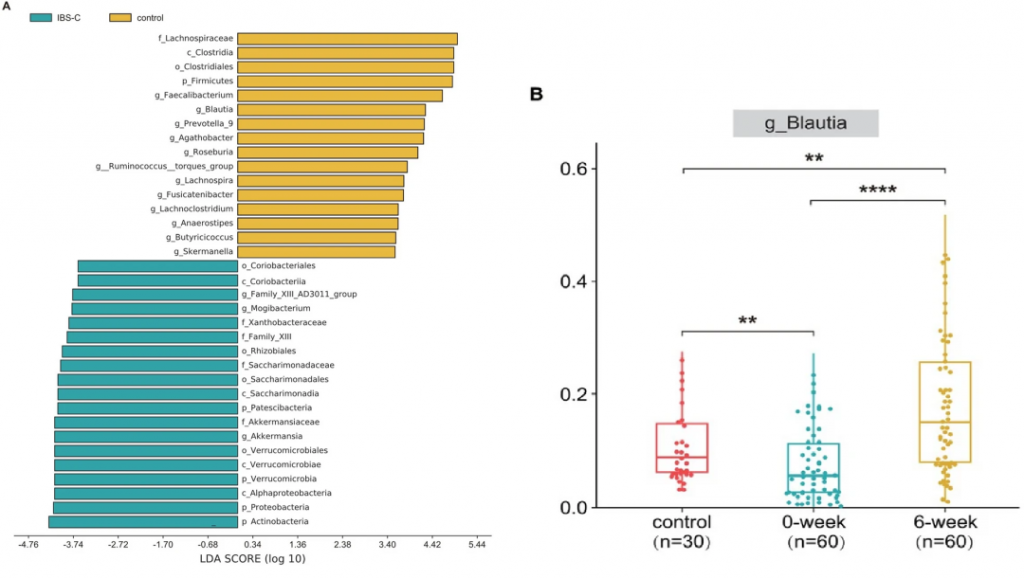
这些发现进一步支持了利纳洛肽可能通过调节肠道菌群发挥作用的观点。
02
Blautia属的丰度与利纳洛肽的疗效相关
为了控制性别、年龄和BMI等混杂因素,使用了1:4的比例匹配了9位未缓解(NR)的患者和51名缓解的患者中的36名。还分析了0周和6周收集的粪便样本,结果显示缓解和未缓解患者之间的肠道菌群整体结构和α多样性没有差异。
有趣的是,如果治疗后Blautia属的丰度明显高于治疗前,观察到更明显的症状缓解(下图CD)。
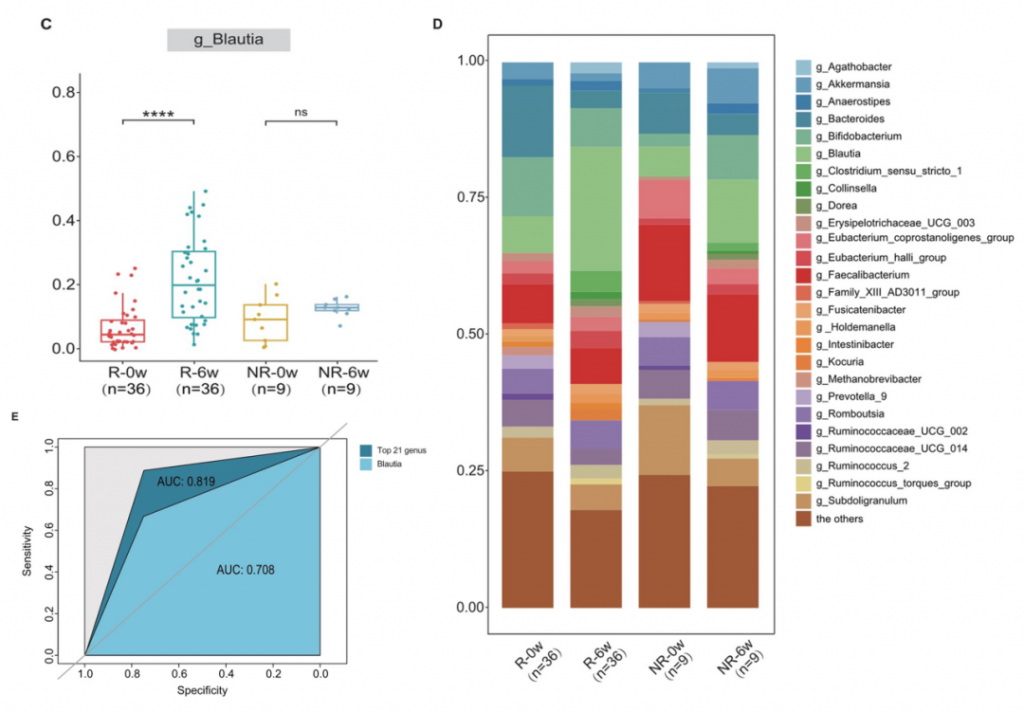
ROC分析,属级别的基线丰度可以用来预测IBS-C治疗的效果,AUC为0.819,而Blautia属AUC为0.708,位于前21个属之中(上图E)。
这些发现表明,某些特定肠道微生物如Blautia属这样的菌,在缓解的患者和未缓解的患者之间,对利纳洛肽效果的影响存在显著差异(p < 0.01)。
03
Blautia属和短链脂肪酸水平与临床症状的缓解呈正相关
根据相关研究,Blautia属是产生短链脂肪酸的细菌。对粪便样本的代谢组学分析显示,经过6周利纳洛肽治疗的IBS-C患者粪便中乙酸(p < 0.01)、丙酸(p < 0.05)、丁酸(p < 0.01)和异丁酸(p < 0.05)的浓度显著增加(下图A)。
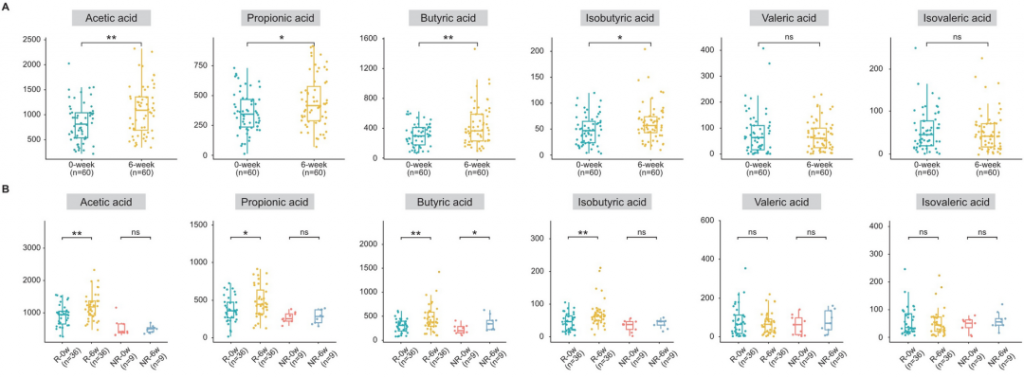
缓解组和未缓解组之间的比较显示,治疗后缓解组的乙酸(p < 0.0001)、丙酸(p < 0.0001)和异丁酸(p < 0.001)水平显著更高(上图B)。
随后进行了相关性分析,以探讨Blautia属的丰度、短链脂肪酸的含量和临床症状之间的关系。
Blautia属的丰度与乙酸、丙酸和丁酸的含量之间存在正相关关系。肠易激综合征生活质量量表分数的增加,肠易激综合征症状严重度评分,胃肠症状评分量表分数的减少与Blautia属的丰度呈正相关。
此外,肠易激综合征生活质量量表分数的增加,肠易激综合征症状严重度评分分数的减少与乙酸和丁酸的含量呈正相关(下图)。
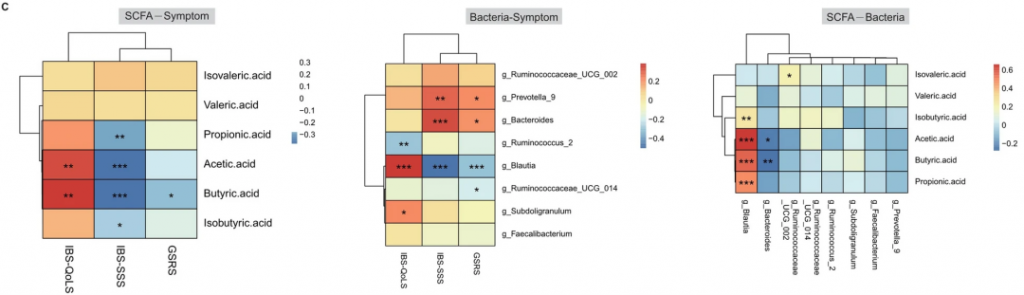
这些发现表明,Blautia属可能在利纳洛肽治疗的效果中扮演着关键角色。
利纳洛肽能够改善排便、缓解腹部症状,并在大多数IBS-C患者中改变排便习惯,而腹泻是一种常见的副作用。然而,结果显示治疗效果存在个体差异,这可能归因于病理生理学的多因素性质。肠道菌群失调已被认定为IBS-C患者中的一个重要致病因素。
越来越多的证据表明,IBS-C患者存在肠道微生态失衡。例如,IBS-C患者表现出更高的肠道微生物多样性,粪便产甲烷菌(主要是甲烷杆菌Methanobrevibacter )的相对丰度更高。
这种失衡可能涉及粪便在肠道中停留时间过长,这会改变肠道微生物和菌群代谢产物如短链脂肪酸、细菌的细胞成分(脂多糖)的数量和平衡,或影响细菌与宿主免疫系统之间的相互作用,所有这些都会影响各种肠道功能。
这里,研究人员对治疗前后6周收集的IBS-C患者粪便进行了16S测序。结果表明,利那洛肽会影响肠道菌群,即使在调整了年龄、饮食和其他因素后,IBS-C患者的Blautia和Fusicatenibacter的丰度也会增加。
最近的一项II期临床研究发现,MRx1234含有一种Blautia hydrogenotrophica菌株,可以改善IBS-C患者的腹痛评分,并显著改善其排便习惯。特别是,IBS-C患者的Blautia丰度低于健康志愿者,这表明Blautia有可能成为一种新的、安全的治疗选择。
作为厚壁菌门的一员,Blautia在缓解炎症和代谢疾病方面表现出了希望,因为它对特定微生物具有抗菌活性。Blautia在肠道中的组成和丰度受到各种因素的影响,包括饮食、年龄、健康、疾病状态、基因型、地理和生理条件。这些发现与本研究中获得的实验结果一致。
在我们前面的文章中,也强调了肠道微生物群和各种临床药物之间复杂的双向相互作用。肠道微生物组会受到药物的影响,反之亦然,肠道微生物组可以通过影响药物结构和改变其生物利用度、生物活性或毒性来影响药物的治疗效果(药物微生物学)。详见:
为什么药物对人效果不一?探索药物-微生物群相互作用对效果的影响
在这项研究中,研究人员还发现缓解组的Blautia丰度显著增加,而非缓解组的则没有,这表明利那洛肽可能会调节Blautia的丰度,作为其作用机制的一部分。
先前的研究已经阐明了Blautia作为一种共生厌氧细菌的作用,它有助于维持肠道环境平衡,预防炎症,增加肠道调节性T细胞,并产生短链脂肪酸。
关于Blautia属详见:
IBS-C患者的总短链脂肪酸浓度低于健康个体,主要是由于乙酸和丙酸水平降低。此外,短链脂肪酸的水平与IBS患者粪便的粘度有关。如果IBS-C患者(其主要临床表现为便秘)的粪便质地干燥,相应的短链脂肪酸含量也会降低。
在这项研究中,症状改善、Blautia丰度和短链脂肪酸浓度之间呈正相关,表明利那洛肽的治疗效果可能涉及通过调节肠道菌群,特别是通过增加Blautia的丰度来增加短链脂肪酸浓度。这些结果表明,肠道微生物群及其代谢产物可能有助于利那洛肽的治疗及其治疗效果。
这项研究有局限性,它不是一项随机、对照、双盲的临床研究,样本量也不够大。其次,明确报告了IBS的性别差异,大多数IBS-C患者为女性。尽管患者的性别分布显示了上述现象,并且研究人员进行了一项自我控制的前后研究以排除性别干扰因素,但无法获得利那洛肽治疗中性别差异的有效结果。
研究表明,肠道微生物群是必要的,而且足以在临床环境中介导利那洛肽的作用。利那洛肽的功效与Blautia丰度和短链脂肪酸浓度的调节有关。治疗后Blautia的丰度可用于预测利那洛肽的疗效。利那洛肽补充Blautia治疗可能是提高IBS-C临床治疗总体疗效的一种潜在方法。

谷禾健康

益生菌被世界卫生组织定义为“当摄入足够量时,可为宿主带来健康益处的活微生物”。近年来,随着人们发现其可用于预防、减轻或治疗特定疾病以及改善健康,益生菌在食品和临床治疗中的应用越来越广泛。
大量研究表明,益生菌有助于维持肠道菌群的平衡,促进消化和吸收营养物质;可以改善皮肤状况,减少皮肤问题如湿疹、痤疮等的发生;对治疗肠道疾病如腹泻、便秘、肠炎等有积极作用;此外,益生菌还可以减少细菌性阴道病,预防婴儿特应性皮炎,减少口腔病原体和龋齿,减少常见上呼吸道感染的发病率和持续时间。益生菌和益生元也被用于预防代谢综合征的一些表现,包括超重、2型糖尿病和血脂异常等。
然而,益生菌也不是什么“灵丹妙药”,盲目地补充益生菌也是不好的。谷禾曾检测发现一些人过量补充益生菌,导致肠道微生物群极度不平衡,这也是不利于健康的。
并且一些研究已证实了益生菌导致的不良事件是存在的。国际益生菌和益生元科学协会召开了一次会议,涉及益生菌潜在的急性和长期风险、对弱势群体的风险、益生菌产品质量满足弱势群体需求的重要性以及与益生菌使用相关的不良事件报告。
益生菌理论上可能会导致五种潜在风险:
1.微生物群组成或功能的改变;
2.入侵其他组织导致感染;
3.有害的代谢活动;影响药物功能;
4.易感个体的过度免疫刺激;
5.抗生素耐药基因转移。
此外,有大量证据表明益生菌的有效性针对菌株和疾病具有特异性。益生菌的效果因使用的菌株、给药周期和持续时间而异。并且对干预措施的反应也可能会因人而异,他们的健康状况、年龄和肠道微生物组的组成,都会影响使用益生菌的效果。
鉴于益生菌的使用日益广泛,必须全面了解其风险和益处,重新审视益生菌的安全问题。在本文中,我们回顾了益生菌所带来的一些健康益处,并讨论了其使用过程中存在的一些风险以及特别需要注意的人群。尽管益生菌在大多数时候是安全的,但在某些患者群体中应谨慎使用,尤其是早产儿或免疫缺陷的新生儿。
Merenstein D,et al.Gut Microbes.2023
益生菌一词源自拉丁语“pro”,意思是“为了”,希腊语“biotic”意思是“生命”。益生菌被广泛认为是促进健康的微生物。
联合国粮食及农业组织(FAO)和世界卫生组织(WHO)将益生菌定义为“在摄入足够量时可为宿主带来健康益处的活微生物”。
此外,国际奥委会(IOC)表示:“益生菌是活的微生物,口服几周后可以增加肠道中有益细菌的数量。这些与肠道健康的一系列潜在益处以及免疫功能的调节有关”。与其他膳食补充剂相比,益生菌制剂是独一无二的,它含有足够数量的活的、有活力的、明确的微生物,可以提供有益的健康效果。
乳杆菌和双歧杆菌是最常用的益生菌,但酵母菌和一些大肠杆菌和芽孢杆菌也被使用。新型益生菌还包括最近被批准的丁酸梭菌。
唾液乳杆菌UCC118的电镜照片
World Gastroenterology Organisation.2017
★ 益生菌用于改善健康已有悠久历史
益生菌的原理可以追溯到100多年前,早在1857年,法国微生物学家巴斯德就已经在酸奶中发现了益生菌。1908 年,乳酸菌之父 Elie Metchnikoff 提出,改变我们体内的微生物群并用有用的微生物取代有害的微生物是可能的。
在过去的几十年里,益生菌领域的研究取得了长足的进步,由于益生菌产品对健康有益,益生菌产品的使用和接受度在全球范围内不断增加。
迄今为止,人类对于益生菌的研究依然处在一个世界热门课题阶段,可见益生菌对于人类健康事业的重要意义。
★ 益生菌的作用机制
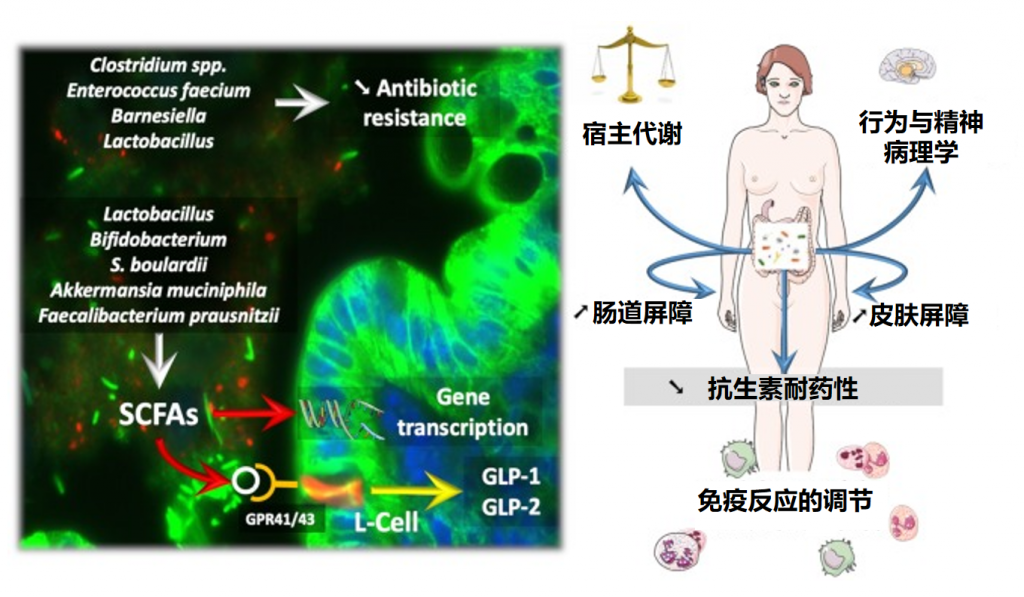
益生菌通常在胃肠道发挥作用,可能影响肠道微生物群。益生菌可以以高度个性化的模式短暂定植于人类肠道粘膜,具体取决于基线微生物群、益生菌菌株和胃肠道区域。
益生菌影响微生物群和疾病进程
Wieërs G,et al.Front Cell Infect Microbiol.2020
益生菌还通过非特异性、物种特异性和菌株特异性机制发挥健康作用。常用益生菌补充剂的菌株、物种甚至属之间的非特异性机制差异很大。这些机制包括抑制胃肠道中病原微生物的生长(通过促进定植抵抗、改善肠道转运或帮助受干扰的微生物群正常化)、产生生物活性代谢物(例如短链脂肪酸)以及减少管腔结肠中的pH值。
物种特异性机制包括维生素合成、肠道屏障强化、胆汁盐代谢、酶活性和毒素中和。
菌株特异性机制非常罕见,并且仅被特定物种的少数菌株使用,包括细胞因子产生、免疫调节以及神经递质分子参与肠-脑轴通讯、对内分泌和神经系统的影响。通过所有这些机制,益生菌可能对人类健康和疾病产生广泛的影响。
微生物群和益生菌与宿主相互作用的机制
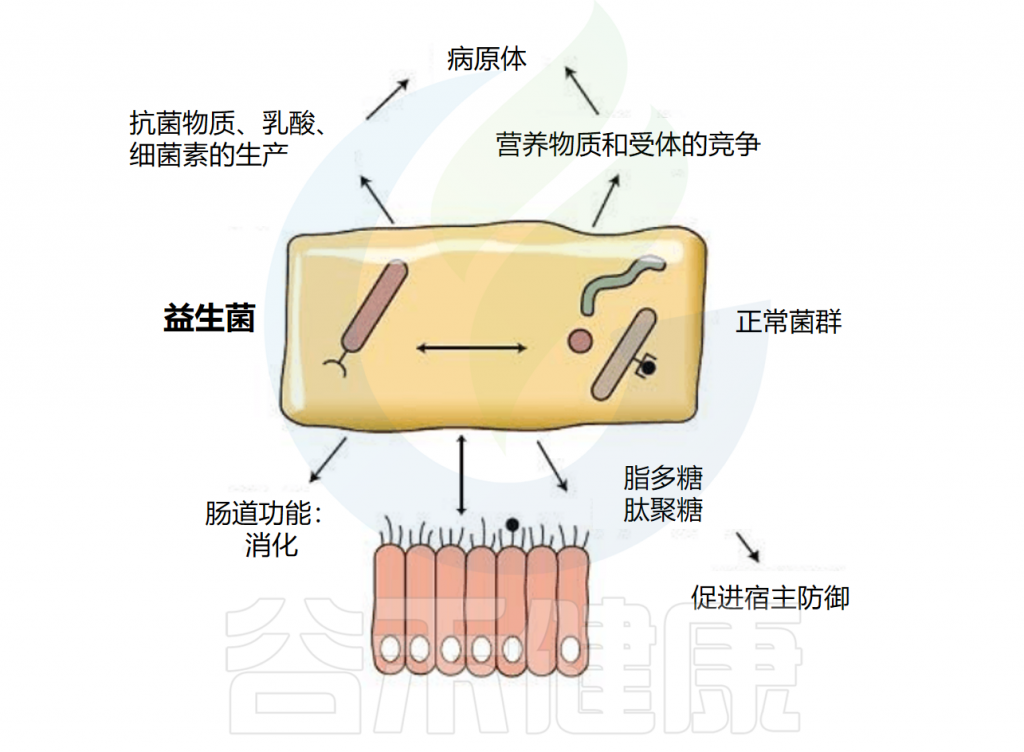
World Gastroenterology Organisation.2017
注:由于益生菌的作用可能特定于某些物种和菌株,因此其在临床或研究中使用的建议需要针对物种和菌株而定。此外,汇集不同类型益生菌研究的数据可能会导致关于其功效和安全性的误导性结论。
★ 益生菌的安全性也值得重视
尽管有潜在的好处,但益生菌对人类健康的有效性仍然存在不确定性,这主要是因为许多研究没有考虑到这些影响可能是针对菌株、剂量和条件的,并且对干预措施的反应可能会因人而异。独特的部分取决于他们的健康状况、年龄和肠道微生物组的组成。
重要的是,许多研究未能报告不良反应,或没有提供有关不良反应的具体细节,例如症状发生的时间、持续时间和严重程度。缺乏安全数据收集和报告可能会导致不良或意外的健康结果。
临床医生、研究人员和政策制定者已经提出了与益生菌安全性相关的担忧。这些问题可以广泛地分为与益生菌菌株、产品质量或益生菌管理相关的问题。
益生菌携带的抗生素抗性基因转移
一个令人担忧的问题是,益生菌携带的抗生素抗性基因可以转移到常驻的潜在病原体、宿主携带的其他微生物或环境微生物中,从而增加抗生素耐药性基因的生态库。
微生物污染物的存在
特别值得关注的是有害活微生物污染物的存在。由于益生菌被设计为活微生物形式施用,因此与经过有意灭菌过程的产品相比,被致病或潜在致病微生物污染的风险更大。最终产品的微生物污染以及过敏原或其他污染物的存在也令人担忧。
与益生菌产品配方安全相关的问题包括需要确定最终产品的纯度、效力(提供的活微生物的数量)和成分。此外,益生菌产品必须经过充分的测试(适合预期用途)以检测潜在污染物。
使用益生菌的方式也必须是安全的
给予或服用益生菌的方式也必须是安全的。安全给药包括对宿主的适当给药途径以及益生菌在现场的正确操作或制备。产品应以安全的剂量和最终配方交付。
例如,此类管理问题之一是一旦益生菌在现场打开并使用,医院环境和弱势患者可能会受到交叉污染。在医院病房内混合干燥的益生菌会导致静脉导管感染。
发酵食品
食用发酵食品是获取益生菌的一种重要方式,发酵食品是通过各种活微生物培养物的生长和代谢活动制成的。其中许多食物都含有丰富的活微生物和潜在有益微生物。
一些发酵食品,例如酵母面包和大多数商业泡菜,在发酵后进行加工,在食用时不含有活菌。而许多酸奶含有益生菌微生物,例如保加利亚乳杆菌(Lactobacillus bulgaricus)和嗜热链球菌(Streptococcus thermophilus)。
• 发酵食品中的部分活微生物无法到达远端肠道
用于制造许多发酵食品(包括酸奶)的活微生物通常在产品的整个保质期内都能很好地存活。然而,它们通常无法通过胃,并且可能无法抵抗小肠中水解酶和胆汁盐的降解,因此可能无法到达远端肠道。
然而,酸奶或其他食物中含有的部分益生菌菌株确实可以在肠道运输中存活下来。
含有活菌但不确定是否是益生菌微生物的发酵食品包括许多奶酪、泡菜(一种韩国发酵卷心菜)、普洱茶(一种发酵茶)、酸菜(发酵卷心菜)、味噌(一种发酵大豆酱),以及由发酵苹果糖制成的未经过滤的生苹果醋。
• 一些未发酵食品中也添加了微生物
某些未发酵食品,例如牛奶、果汁、冰沙、麦片、营养棒以及婴幼儿配方奶粉,都添加了微生物。这些食物是否是真正的益生菌取决于它们食用时所含的微生物水平、它们是否能在肠道运输中存活,以及它们的特定物种和菌株是否对健康有影响。
益生菌补充剂
益生菌也可以作为含有多种菌株和剂量的膳食补充剂(胶囊、粉末、液体和其他形式)提供。这些产品通常含有活微生物的混合培养物而不是单一菌株。
• 益生菌补充剂并不是含有的菌种数量越多带来的健康效果就越好
许多益生菌补充剂每剂含有1至100亿CFU,但有些产品含有高达500亿CFU或更多。然而,较高的CFU计数并不一定会改善产品的健康效果。
益生菌以菌落形成单位(CFU)为单位进行测量,它表示活细胞的数量。数量可以写在产品标签上,例如,1×10^9表示10亿CFU,或1×10^10表示100亿CFU。
由于益生菌必须活着食用才能对健康有益,而且益生菌可能在保质期内死亡,因此用户应寻找在产品保质期结束时(而不是在制造时)标有CFU数量的产品。
目前的法规仅要求制造商在益生菌产品的补充成分标签上列出微生物的总重量;该细胞团可由活微生物和死微生物组成,因此与产品中活微生物的数量无关。
益生菌的潜在健康益处是大量科学研究的焦点。本节介绍了使用益生菌在预防或治疗一些疾病中的作用,包括:特应性皮炎、小儿急性感染性腹泻、炎症性肠病、肠易激综合征、高胆固醇血症和肥胖。
1
特应性皮炎
特应性皮炎是最常见的湿疹形式,也是最常见的慢性炎症性皮肤病之一,影响全世界约15%至20%的儿童和1%至3%的成人。
许多益生菌研究评估了不同种类和菌株的细菌对预防特应性皮炎的作用,并且一些荟萃分析综合了这些研究的结果。
• 怀孕和婴儿早期接触益生菌可能降低儿童特应性皮炎的风险
研究和荟萃分析表明,在怀孕期间和婴儿早期接触益生菌可能会降低儿童患特应性皮炎的风险。例如,2018年的一项荟萃分析包括27项随机对照试验和一项对照队列研究,共有6907名婴儿和儿童在子宫内接触益生菌2周至7个月(通过母亲口服补充剂)或出生后2至13个月的婴儿口服给药。
在6个月至9岁之间,使用单一菌株或包括乳杆菌、双歧杆菌和丙酸杆菌菌株的混合物进行益生菌治疗可显著降低特应性皮炎的风险,从对照组的34.7%降至益生菌组的28.5%。
• 益生菌的治疗效果因菌株而异
此外,益生菌治疗的效果因益生菌菌株而异。例如,补充鼠李糖乳杆菌(Lactobacillus rhamnosus)或副干酪乳杆菌(Lactobacillus paracasei)可显著降低特应性皮炎的发病率,而补充罗伊氏乳杆菌或嗜酸乳杆菌则不会。
另一项荟萃分析包括8项随机临床试验,共有741名从出生到36个月大的参与者接受了乳酸菌或双歧杆菌治疗4至24周。结果表明,含有乳酸菌的益生菌可能会减轻婴儿和幼儿的特应性皮炎症状,但含有双歧杆菌的益生菌则不然。该治疗显著改善了患有中度至重度疾病的参与者的症状,但没有改善轻度疾病参与者的症状。
对2599名1至55岁参与者(大多数是儿童)使用单一益生菌和益生菌混合物治疗湿疹的39项随机对照试验进行了审查,发现益生菌治疗可能会略微降低 SCORAD评分。
SCORAD评分是一种用于评估湿疹严重程度的临床工具,它考虑了湿疹的病变严重程度、病变范围和瘙痒程度。
总体而言,现有证据表明,使用益生菌可能会降低患特应性皮炎的风险,并导致特应性皮炎SCORAD评分显著降低,但这些产品只能有限地缓解病情。
此外,益生菌的效果因使用的菌株、给药时间和患者年龄而异,因此很难提出建议。
2
小儿急性感染性腹泻
急性腹泻通常被定义为稀便或液状粪便或排便频率增加(通常24小时内至少3次)。急性腹泻可伴有发烧或呕吐,通常持续不超过7天。
• 使用益生菌缩短了腹泻的持续时间
对8014名参与者(主要是婴儿和儿童)进行了审查,发现单菌种和多菌种益生菌可显著缩短急性感染性腹泻的持续时间约25小时。这些补充剂还可以将腹泻持续4天或以上的风险降低59%,并且与未服用益生菌的患者相比,服用益生菌的患者第二天排便次数减少约1次。
对总共2444名参与者的11项随机临床试验的评估表明,鼠李糖乳杆菌(LGG)在治疗感染性腹泻方面最有效,每日剂量至少为10^10 CFU。布拉氏酵母菌(最常见的是10^9至10^10 CFU/天,持续5-10天)可减少腹泻持续时间和排便频率。
在这两项分析中,LGG和布拉氏酵母菌将急性感染性腹泻的持续时间缩短了大约1天。
然而,随后的两项临床试验发现,为期5天的LGG疗程(一项试验中每天两次单独服用1×10^10 CFU,另一项试验中每天两次总计4×10^9 CFU LGG 和瑞士乳杆菌R0052)没有效果。
然而,最近的研究表明,益生菌在急诊科可能并不有效,因为大多数急性感染性腹泻的发作都是自限性的,除了补液治疗外不需要其他治疗。
3
炎症性肠病
炎症性肠病(IBD)是一种慢性炎症疾病,包括溃疡性结肠炎和克罗恩病。IBD的确切原因尚不清楚,但可能是遗传因素和环境因素的结合,包括遗传改变和免疫系统功能障碍。IBD有多种治疗方法,包括口服类固醇和其他药物,但尚无治愈方法。
研究人员正在探索IBD患者的肠道微生物组是否发生改变,以及益生菌是否有助于控制炎症性肠病。研究得出了类似的结论——某些益生菌可能对溃疡性结肠炎有一定的有益作用,但对克罗恩病没有作用。
• 益生菌补充配合常规疗法可能使治疗效果更好
美国胃肠病学协会2020年的一项系统综述研究了益生菌在治疗胃肠道疾病中的作用。根据有限的证据,这些补充剂与常规疗法相结合可能会适度降低轻度至中度溃疡性结肠炎患者的疾病活动度。
但证据的局限性包括现有研究使用不同的患者群体、益生菌配方、治疗持续时间和伴随疗法。
2020年对865名溃疡性结肠炎参与者进行的14项研究也表明,益生菌可能有助于诱导缓解,并且益生菌与5-ASA(一种常用于治疗IBD的抗炎药物)联合使用可能优于单独使用5-ASA。
尽管益生菌可能对溃疡性结肠炎有一定的益处,但不常规使用。对于克罗恩病,还没有发现任何益处的证据。
还需要进行更多研究,包括强有力的随机对照试验,以确定哪些炎症性肠病患者可能受益于益生菌以及哪些益生菌菌株最有效。
4
肠易激综合症
肠易激综合征(IBS)是一种常见的胃肠道功能性疾病,其特征是反复出现腹部不适或疼痛、腹胀以及大便形式或频率的变化。尽管IBS的病因尚不完全清楚,但越来越多的证据表明肠道微生物群在其病理生理学和症状中具有潜在作用。
IBS患者体内含有丰富的促炎细菌,包括肠杆菌科细菌,而乳杆菌和双歧杆菌的数量通常也会相应减少。益生菌产品通常含有乳杆菌和双歧杆菌,因此有可能恢复一些缺失的微生物功能,从而帮助控制肠易激综合症症状。
• 益生菌对肠易激综合症患者具有一定积极作用
多项荟萃分析评估了益生菌对肠易激综合症患者的作用。大多数发现益生菌具有积极的、虽然有限的有益作用。例如,对总共2575名患者的23项 RCT 进行的荟萃分析发现,总体而言,益生菌可将IBS 症状持续或未改善的风险降低21%。
不同种类和菌株的益生菌对整体IBS症状、腹痛、腹胀和肠胃气胀具有有益作用,但研究质量较低。在此分析中,某些益生菌组合优于单个菌株,但没有特定组合优于其他组合。
对总共1793名IBS患者的15项RCT进行的第二次荟萃分析发现,治疗8至10周后,益生菌比安慰剂更能减轻总体症状和腹痛;在儿童中,这些补充剂还改善了粘膜屏障功能。
• 不同菌株对肠易激综合症的作用具有差异
不同菌株的益生菌对IBS的有益作用可能取决于所评估的IBS症状。在一项荟萃分析中,共有877名成人接受益生菌或安慰剂治疗4周至6个月,与安慰剂治疗相比,服用含有短双歧杆菌、长双歧杆菌或嗜酸乳杆菌的益生菌后疼痛评分显著改善。
相反,唾液链球菌嗜热亚种、动物双歧杆菌、婴儿双歧杆菌、干酪乳杆菌、植物乳杆菌、保加利亚乳杆菌和布拉酵母菌的益生菌无显著影响。
而使用含有短双歧杆菌、婴儿双歧杆菌、干酪乳杆菌或植物乳杆菌的益生菌可改善腹胀。使用所有测试的益生菌后,胀气现象有所减少。
总体而言,现有证据表明益生菌可能会减轻肠易激综合症的某些症状。然而,需要额外的高质量临床试验来确认所需的具体菌株、剂量和治疗持续时间,以及可以用益生菌有效治疗的肠易激综合症类型(例如腹泻或便秘)。
5
肥胖
肠道微生物群在从食物中提取营养和能量方面发挥着重要作用。研究表明,肠道微生物群不仅影响饮食中能量的使用,还影响宿主体内的能量消耗和储存。
评估益生菌对肥胖相关影响的临床试验结果不一致。例如,一项为期12周的临床试验,随机抽取210名年龄在35至60岁、内脏脂肪较多的健康成年人,每天饮用加氏乳杆菌的发酵奶。
• 益生菌对肥胖的影响可能并不显著
与对照组相比,接受10^7或10^6 CFU/g加氏乳杆菌牛奶的参与者的内脏脂肪面积(平均分别减少8.5%和8.2%)、体重指数、腰围和臀围以及身体脂肪量显著减少。
在另一项随机临床试验中,连续24周每日补充3.24x 10^8 CFU鼠李糖乳杆菌CGMCC1.3724,并在前12周进行能量限制饮食(比估计的卡路里需求少500kcal/天)并没有显著影响体重。然而,与安慰剂相比,77名女性参与者在12周(减轻1.8公斤)和24周(减轻2.6公斤),补充乳酸菌确实减轻了体重。
最近对957名超重或肥胖个体的15项随机对照试验进行的另一项系统回顾和荟萃分析发现,补充不同剂量和菌株的益生菌3至12周可导致体重(减少0.6公斤)、体重指数下降。比安慰剂低0.27kg/m2和脂肪百分比(低 0.6%)。然而,这些影响较小。
综上所述,这些结果表明,益生菌对体重和肥胖的影响可能取决于多种因素,包括益生菌菌株、剂量和持续时间以及使用者的某些特征,包括年龄、性别和基线体重。需要进行更多研究来了解益生菌对人体脂肪、体重和肥胖的潜在影响。
6
高胆固醇血症
血液中高水平的胆固醇或动脉壁中的胆固醇是心血管疾病的危险因素。低密度脂蛋白(LDL)将胆固醇携带至组织和动脉。LDL水平越高,患心血管疾病的风险就越大。高密度脂蛋白(HDL)将胆固醇从组织运送到肝脏并导致其排泄。高密度脂蛋白水平低会增加患心血管疾病的风险。
• 益生菌影响胆固醇水平的机制
研究人员研究了使用益生菌来改善血脂状况。它们对胆固醇浓度的影响机制包括通过增加胆固醇的分解代谢:
•影响胆盐水解酶活性,增加对新胆汁酸的需求,从而降低血清胆固醇水平;
•与小肠中的胆固醇结合,从而减少身体吸收的量;
•将胆固醇同化并掺入细菌中,从而降低血液中的胆固醇水平;
•乳杆菌和双歧杆菌产生短链脂肪酸,降低肝脏胆固醇合成并调节胆固醇代谢。
• 一些益生菌降低了总胆固醇和低密度脂蛋白水平
一项对30项随机对照试验的荟萃分析显示,与安慰剂组相比,接受益生菌治疗3至12周的受试者总胆固醇降低7.8mg/dL,低密度脂蛋白胆固醇浓度降低7.3mg/dL。
在亚组分析中,在持续8周或更长时间的研究中,以及在基线胆固醇水平高于240 mg/dL的参与者中,益生菌的益处略大。在三项以上研究中包括的菌株中,嗜酸乳杆菌、乳双歧杆菌以及植物乳杆菌的混合物与总胆固醇和低密度脂蛋白胆固醇浓度的显著降低有关,但瑞士乳杆菌和粪肠球菌则不然。
• 益生菌对高密度脂蛋白水平可能没有影响
在对602名胆固醇水平正常或高胆固醇成年人进行的11项随机对照试验中进行的一项小型荟萃分析显示,与安慰剂治疗组相比,接受益生菌治疗2至10周的患者总胆固醇水平降低了6.6mg/dL,低密度脂蛋白胆固醇水平降低了8.5mg/dL ,但益生菌治疗对高密度脂蛋白胆固醇水平没有显著影响。
另一项综述发现,使用含有多种菌株的益生菌可显著降低总胆固醇和低密度脂蛋白胆固醇水平(分别降低12.0和20.1mg/dL),而使用单一菌株的试验则没有这种效果。
总体而言,研究表明,组合使用多种益生菌菌株以及含有嗜酸乳杆菌和乳双歧杆菌的混合物或植物乳杆菌的益生菌可能会降低总胆固醇和低密度脂蛋白胆固醇水平。然而,需要更多的研究来证实这些发现。
尽管有潜在的好处,但益生菌人类健康的有效性仍然存在不确定性,这主要是因为许多研究没有考虑到这些影响可能是针对菌株、剂量和条件的,并且个人对干预措施的反应可能会因人而异。
独特的部分取决于他们的健康状况、年龄和肠道微生物的组成。在这节中我们会讲述当前使用益生菌还存在的一些安全隐患。
微生物群组成或功能改变
• 大多数口服益生菌不会长期定植
益生菌微生物的功效并不依赖于长期定殖于宿主的能力。长期定植通常意味着在停止给药后数周或数月仍可从宿主中检测到施用的微生物。
对于口服益生菌来说,这意味着微生物必须积极复制并且已经在宿主体内持续存在。迄今为止积累的关于从粪便中回收益生菌的证据表明,目前大多数益生菌不会定植。这几乎肯定是由于无法与常驻微生物群竞争造成的。
对于大多数人来说,仅仅遇到微生物并不会导致定植,但如果存在“开放生态位”,外来的微生物可能能够填补该生态位并进行定殖。
• 潜在风险有哪些?
有哪些安全隐患?在大多数情况下,来自常见共生微生物群的益生菌的低水平定植不会对宿主健康造成问题。即使没有明显毒力潜力的高水平微生物也不会对宿主健康产生负面影响。然而,可以想象的是,长期定植的益生菌所固有的暴露增加可能会带来以下风险:
(i) 益生菌可能会取代发挥重要功能的微生物;
(ii) 益生菌可能会对周围微生物群的结构和功能产生负面影响;
(iii) 如果正常的肠道屏障被破坏,益生菌可能会进入体循环,导致侵袭性感染。
• 潜在好处是什么?
有人可能会说,益生菌的长期存在(根据其定义可带来健康益处)可能是一种提供长期健康益处的有效方式。事实上,一种能够永久占据空缺生态位并提供缺失的代谢功能(例如代谢婴儿母乳寡糖的能力)的微生物,有助于宿主健康,可以代表一种优秀的益生菌候选者。
另一个考虑因素是,如果生态位注定要被占领,那么长期定殖的益生菌是否会比未知微生物更安全、更理想的占领者?这波新的菌株似乎更适合在人体中存在和生活,有可能实现独特和卓越的益处。例如,通过长期定植益生菌可以最好地实现赋予酶能力以补偿苯丙酮尿症等代谢紊乱。
• 建议:生物组分析有助于评估益生菌摄入后的健康作用
根据目前的理解,建议开发长期定植益生菌时,必须有一个明确的目标,即实现不易、可靠或经济上难以实现的效益,并权衡风险与这些明确定义的效益。建议仔细考虑确定哪些长期安全数据可能与宿主体内持续存在的益生菌菌株相关。应进行研究以确定有助于评估长期定植益生菌安全性的相关急性暴露试验和生物标志物。
生物组分析是评估基线微生物群组成和群落结构以及转录和代谢读数的过程。评估益生菌摄入前后的微生物组结果可能表明益生菌在塑造微生物组中的因果作用。
此类研究可能会为有关促进健康、引起安全问题或确定益生菌治疗反应者和非反应者特征的微生物机制和途径的假设提供信息。这种分析可能有助于解释或在一定程度上预测益生菌对特定宿主产生有益作用的能力。
抗生素抗性基因的转移
自从益生菌开始使用以来,人们担心抗生素耐药性可能从益生菌菌株转移到肠道微生物群中更多的致病菌。
例如许多乳杆菌菌株对万古霉素具有天然耐药性,这引发了人们对这种耐药性可能转移到更具致病性的生物体,特别是肠球菌和金黄色葡萄球菌的担忧。然而,乳杆菌的万古霉素抗性基因是存在于染色体的,因此不容易转移到其他物种。研究也尚未发现乳杆菌的万古霉素抗性基因转移到其他属。
• 评估益生菌中的抗生素抗性基因变得重要
评估益生菌基因组中现有抗生素抗性(AR)基因的风险需要基因型和表型方法。表型方法需要评估菌株表达的AR基因,通过最小抑制浓度技术确定。在某些情况下,AR 基因的表达是物种固有的,而不是由于可以获得的基因的表达。
常见益生菌种类的正常AR范围已经确定。然而,当开发信息未知的物种菌株(下一代菌株)时,需要进一步研究。
需要注意的是,即使不存在非内在AR基因的转移风险,也存在通过裸露DNA转化进行转移的可能性, 或通过噬菌体转导。
• 当考虑益生菌抗生素抗性基因的安全性时,应考虑几个问题:
(i)是与提供水平转移的可能机制的基因相关的基因;
(ii)如果转移至初始宿主,这些基因是否能够进行功能表达;
(iii)是该物种典型的抗生素耐药表型(内在耐药性);
(iv)耐药表型是否如此普遍,以至于益生菌不会对其在环境微生物中的存在产生实质性影响;
(v)是否对临床相关抗生素的耐药性。
这些问题必须作为严格分析的一部分来考虑,以平衡患者或消费者安全和公共卫生问题的利益。分析必须考虑益生菌是否被开发用于广泛分发给一般健康的消费者(食品或补充剂,其合理确定的无害性是一般标准)或限制分发给患者群体(药物)。
由于益生菌有可能加剧或减轻人类体内存在抗生素抗性基因库,因此可能需要采取具体情况具体分析的安全方法。
此外,基因修饰方法可用于改变或消除所关注的抗性元件。根据所采用的技术,该选项可能适用于食品应用的益生菌(例如质粒固化)或可通过药物途径的下一代益生菌。
侵袭性感染
在极少数情况下,益生菌可能会从胃肠道转移,导致侵袭性感染。
从心内膜炎、菌血症局部感染中分离出的菌株

Doron S,et al.Clin Infect Dis.2015
• 一小部分接受益生菌给药的患者曾出现过感染
对1995年至2021年间儿童中与益生菌给药相关的败血症、菌血症和真菌血症进行了系统回顾。大多数符合感染临床定义的儿童年龄在两岁以下,并且有早产或留置静脉导管等诱发因素,94%的儿童通过抗菌治疗成功治愈。
最常报告的单一事件是菌血症,至少有33份报告称,食用益生菌布拉氏酵母菌的患者的血培养物中存在酿酒酵母或布拉氏酵母菌(这些微生物在微生物学上无法区分)。
至少有8例与乳杆菌相关的菌血症已被报道,包括嗜酸乳杆菌(Lactobacillus acidophilus)、干酪乳杆菌(Lactobacillus casei)和鼠李糖乳杆菌(Lactobacillus rhamnosus GG)。
已报道了9例明显脓毒症病例,与布拉氏酵母菌(S.boulardii)、鼠李糖乳杆菌(Lactobacillus rhamnosus GG)、枯草芽孢杆菌(Bacillus subtilis)、短双歧杆菌(Bifidobacterium breve)或组合益生菌有关。
乳杆菌和链球菌益生菌引起的心内膜炎事件也有报道。与鼠李糖乳杆菌相关的脓肿的发展也被报道过两次。
人类使用益生菌相关的细菌性感染病例
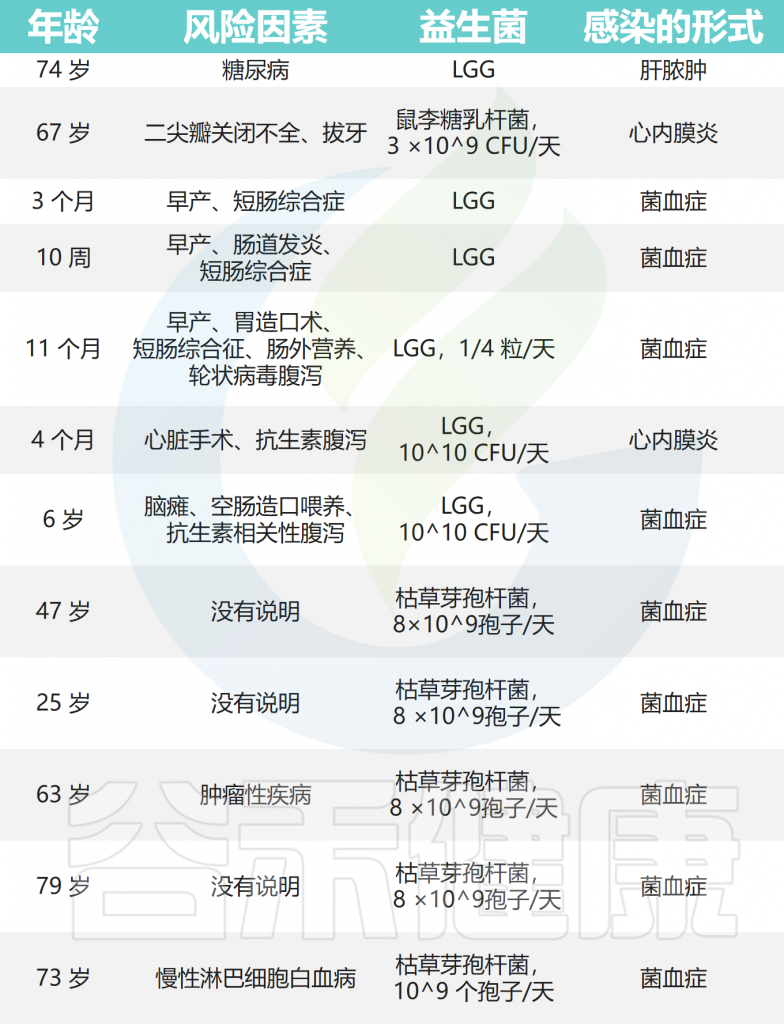
Boyle RJ,et al.Am J Clin Nutr.2006
• 在使用益生菌时,应考虑其感染风险和应对措施
由于多种原因,益生菌相关侵袭性感染的实际频率很难确定。大多数已发表的病例报告都发生在临床试验之外。并非所有临床实验室都会从血培养物中常规培养和鉴定益生菌,并且益生菌试验中的危害报告通常是不完整的。
尽管如此,在大多数对早产儿使用益生菌的试验中,经培养证明的侵袭性感染被作为主要或次要结果进行研究,荟萃分析表明,益生菌的使用不会增加这一弱势群体的败血症发生率。然而,益生菌相关脓毒症的真实发生率仍不确定。
我们认为,应在临床环境中认真监测侵袭性感染和菌血症,并在所有益生菌试验中充分报告。使用菌株水平分子技术,应将临床分离株与施用的益生菌进行比较。
补充益生菌微生物与侵入性临床分离株的分子匹配支持益生菌与全身感染之间的关联。在评估任何下一代益生菌的安全性时,应确定易位的可能性,并权衡风险与益处。
降解粘蛋白,影响肠道屏障
粘蛋白是一种蛋白质,是粘液的核心结构元素,粘液是整个消化道粘膜表面的重要组成部分。除其他作用外,粘蛋白还提供了保护宿主上皮免受微生物和化学入侵的屏障。
• 粘蛋白降解细菌过多可能不利于黏膜屏障稳定
当许多细菌将粘液用作碳源时,会发生一定程度的粘液降解。例如,Akkermansia muciniphila以粘蛋白为食,将其转化为短链脂肪酸。这些短链脂肪酸是胃肠道细胞的重要能量来源。
已鉴定出40多个与粘蛋白代谢相关的细菌基因。全基因组测序可用于鉴定与粘蛋白降解相关的细菌基因,并可通过评估细菌菌株在液体或含有粘蛋白作为唯一碳源的琼脂平板上生长的能力来体外分析其活性。
一些人认为,粘蛋白降解细菌的变化引起的生理平衡变化会导致人类疾病和感染,但据报道,这种特性在肠道微生物内受到非常严格的调节,并且受膳食多糖可用性的影响。
粘蛋白降解能力是益生菌综合安全性分析的一部分,因此,了解益生菌物种基因组中包含的粘蛋白降解基因的数量是益生菌菌株安全性整体审查的一部分,因为单独的粘蛋白降解潜力不应被视为毒力特征。
对药物功能的影响
• 微生物影响药物的代谢可能提高药效也可能产生毒性
肠道微生物群可以对药物的代谢产生直接和间接的影响,从而影响药效和毒性。例如,当大鼠接受抗生素治疗时,口服偶氮类药物Prontosil的大鼠中, 62%的总磺胺通过微生物偶氮还原酶的作用而减少,说明药物激活可以由微生物群介导。
微生物群也可以减少药物相关的毒性。一个众所周知的例子是葡萄糖醛酸化,结合物水解反应,通过 UDP-葡萄糖醛酸基转移酶将葡萄糖醛酸与底物连接成亲水性且带负电荷的葡萄糖醛酸苷。许多厌氧细菌可以诱导β-葡萄糖醛酸酶,这种酶能够解聚外源物质和之前通过葡萄糖醛酸化途径解毒的内源性化合物。这种解结合可以增强毒素、激素和各种药物的肠肝再循环以及局部致癌物的形成。因此,过量的β-葡萄糖醛酸酶可能会增加患结肠癌的风险。
然而,一定量的β-葡萄糖醛酸酶活性对于保证维生素D、甲状腺激素或雌激素等必需化合物的肠肝再循环非常重要。
• 益生菌影响药物的能力具有一定安全隐患
益生菌影响药物功能的能力可能会产生安全后果。毒物微生物组学或药物微生物组学是一门相对较新的学科,研究微生物群和外源化合物之间的相互作用。了解微生物群多样性、饮食和药物处置和反应之间的相互作用以及这如何影响未来的个性化医疗很重要。
过度的免疫刺激
研究还表明,肠道微生物群对于刺激正常免疫发育,特别是肠道相关淋巴组织的发育很重要。肠道微生物群的存在对于一系列免疫功能是必需的,包括抗体的产生、对食物抗原的口服耐受的发展和持续,以及淋巴滤泡内生发中心的形成。
由于益生菌已被证明会影响先天性和适应性免疫系统,包括对细胞因子分泌和树突状细胞功能的影响,因此人们担心益生菌可能会过度刺激某些个体的免疫反应。
• 新生儿和孕妇补充益生菌可能对免疫产生影响
肠道微生物群在正常免疫发育中的关键作用表明,旨在改变微生物群的操作可能具有显著的免疫调节作用。这些操作对宿主的长期影响很难预测,并且仍然有可能对免疫发育产生不利影响。
这在新生儿益生菌补充剂领域尤其重要,在该领域可能会实现微生物群的中长期改变或免疫反应的终生改变。
第二个可能面临不良免疫刺激风险增加的群体是孕妇。在怀孕期间,T细胞反应存在对Th2表型的偏向,这被认为对于维持胎儿活力很重要,因为Th1细胞因子与妊娠失败相关。
益生菌乳杆菌已被证明可以在体外抑制Th2细胞因子反应,并且在一些人体研究中发现可以增加Th1细胞因子干扰素γ的产生。这些影响可能不利于妊娠活力。
目前,实证研究很少支持益生菌导致免疫发育不良的假设,但这是一个值得进一步研究的领域。
尽管据报道益生菌对人群具有有益作用,但免疫功能低下的宿主由于抵御微生物入侵的能力降低,可能面临更高的不良事件风险。
益生菌在高危人群(例如免疫功能减弱/受损的个体、老年人、新生儿,特别是早产儿)中的安全性还有待研究。
√ 益生菌有时会变成机会性病原体
短期观察的证据表明,某些益生菌菌株可能在免疫功能低下、压力大、老龄或新生儿人群中充当机会病原体。
不良事件包括危及生命的肺炎、心内膜炎和败血症。一般来说,在弱势群体中,如果存在单一主要风险因素(例如免疫功能低下状态)或多个次要风险因素,则在使用益生菌时应谨慎。
然而,如果有令人信服的证据表明益生菌可以使一些弱势群体受益,则应考虑使用益生菌。根据现有数据,当对弱势目标人群施用益生菌时,需要进行额外监测。
益生菌对孕妇和哺乳期妇女的风险已得到审查。在100项妊娠期间服用益生菌的研究中,有28项报告了 不良事件。其中,只有11种报告的不良事件可能与治疗存在因果关系,包括胃肠道问题、恶心和头痛;但没有关于母亲或婴儿严重健康问题的报道。
一项研究报告称,施用鼠李糖乳杆菌GR-1和罗伊氏乳杆菌RC-14时,阴道分泌物风险增加,并且粪便稠度发生变化。
√ 一些疾病患者使用益生菌时应注意潜在风险
另一项研究结果显示,当对肥胖女性(先兆子痫风险增加)施用益生菌时,先兆子痫的风险增加(472名服用益生菌的女性中有31例先兆子痫,而安慰剂组中有17例)。尽管数据并不一定可靠,但我们仍然建议轻度至病态肥胖孕妇服用益生菌的同时监测先兆子痫的潜在风险。
而在非怀孕人群中,也有报道与使用益生菌相关的不良反应,包括胃肠道副作用,如腹部绞痛、恶心、软便、胀气和味觉障碍。
人们对一些人群中使用的某些益生菌的代谢活性表示担忧。D-乳酸性酸中毒可能发生在因手术改变肠道解剖结构的人身上,例如短肠或减肥手术,这是由常驻微生物的活动引起的。很少有公开报道将此与益生菌补充剂联系起来。由于缺乏早产儿数据,因此对该人群使用产生D-乳酸的益生菌持谨慎态度,尽管一项针对健康足月婴儿的对照试验表明,产生D-乳酸的罗伊氏乳杆菌DSM-17938不会导致酸中毒和含益生菌的婴儿配方奶粉与酸中毒无关。
√ 生命早期补充益生菌对发育可能有影响
鉴于在众多相互竞争的产前、围产期和产后因素中调节微生物群结构和功能的独特机会窗口,早产儿值得特别考虑。新生儿微生物群靶向疗法有可能影响宿主整个生命周期的生物学,可以通过在最有利于定殖的条件下引入异源微生物菌株,或者通过影响包括大脑在内的重要器官的早期发育轨迹。
迄今为止,几乎没有证据表明生命早期补充益生菌会对神经发育结果产生不利影响。在一项针对1099名极早产儿的后续研究中,接受益生菌治疗的存活婴儿与未接受益生菌治疗的婴儿相比,3-5岁时的主要神经发育结果没有差异。
有趣的是,接受益生菌治疗的儿童中耳聋的发生率较低,这不能归因于抗生素疗程数量或接受万古霉素或庆大霉素总天数的差异。
其他研究已经确定了生命早期微生物群的改变与肥胖之间的联系。一项针对美国333353名儿童的大型队列研究报告称,在生命的头两年内服用抗生素和抑酸药物与儿童后期的肥胖有关;这些改变微生物群的药物每增加一类,每增加30天的处方,这些关联就会得到加强。
现有的有限证据并不表明生命早期使用益生菌会增加儿童期不良后果的风险。没有足够的数据来确定围产期益生菌使用与成年期不良事件之间是否存在潜在关联。
因此,我们鼓励对围产期接受益生菌的早产儿进行至少2年的随访,以比较代谢、过敏、免疫和其他健康结果。
需谨慎使用益生菌的人群
然而使用益生菌时,一些特定人群需要格外注意:
• 免疫系统较弱的个体
如HIV感染者、正在接受化疗或免疫抑制治疗的患者,因为他们更容易受到感染。婴幼儿和老年人由于免疫系统不够成熟或衰弱,使用益生菌时也应谨慎。
• 患有消化系统问题的人
对于患有病毒性肠炎、细菌性胃肠炎等疾病的人群,为了避免益生菌的大量繁殖,导致病毒或细菌进一步增长,这类人群也需要慎重食用益生菌。
• 胃肠道屏障不完整的人
如消化道溃疡、胃肠道手术恢复期患者、胃出血等不建议服用,益生菌有随血液扩散至全身引起感染的风险。
• 身体过于虚弱者
因严重发热、感冒等导致的体能虚弱患者,摄入益生菌后,可能会加重身体负担,不利于身体恢复。
• 对益生菌成分过敏者
对益生菌成分过敏者吃了益生菌后,可能会出现皮肤起丘疹、腹泻次数增加、胃部不适等情况。
此外,怀孕和哺乳期妇女在使用益生菌前应咨询医生。总之,在使用益生菌补充剂前,最好先评估体内原有的肠道微生物群并咨询医疗专业人士是否需要额外补充益生菌。
益生菌的最佳剂量取决于菌株和产品。因此,建议患者使用益生菌的临床医生指定益生菌菌株、剂量和使用持续时间。
益生菌因其健康益处而被越来越多的消费者使用,并受到许多医疗保健专业人士的提倡。因此我们更需要了解使用益生菌的益处和一些潜在风险。
研究发现益生菌对于大部分健康的人来说是安全的,但由于存在感染的风险,因此对某些人群应谨慎使用。其中包括免疫功能低下的患者、早产儿、短肠综合征患者、使用中心静脉导管的患者以及心脏瓣膜疾病患者。
尽管关于益生菌的作用机制和施用还有很多东西有待了解,但很明显不同的菌株可以产生非常特定的效果。益生菌特异性取决于剂量、菌种、持续时间、给药途径和适应症等影响因素,此外还可能因施用对象的健康或疾病状况、不同年龄、肠道微生物组成而异。
因此,一个群体中一种益生菌菌株的临床试验结果不能自动推广到其他菌株或不同群体。需要进一步研究来探索益生菌的机制和对人体的作用。我们建议人们在使用益生菌之前了解自身具体的健康状况和微生物组成,以便能够“对症下药”。
主要参考文献
Merenstein D, Pot B, Leyer G, Ouwehand AC, Preidis GA, Elkins CA, Hill C, Lewis ZT, Shane AL, Zmora N, Petrova MI, Collado MC, Morelli L, Montoya GA, Szajewska H, Tancredi DJ, Sanders ME. Emerging issues in probiotic safety: 2023 perspectives. Gut Microbes. 2023 Jan-Dec;15(1):2185034.
Doron S, Snydman DR. Risk and safety of probiotics. Clin Infect Dis. 2015 May 15;60 Suppl 2(Suppl 2):S129-34.
Boyle RJ, Robins-Browne RM, Tang ML. Probiotic use in clinical practice: what are the risks? Am J Clin Nutr. 2006 Jun;83(6):1256-64; quiz 1446-7.
Sheyholislami H, Connor KL. Are Probiotics and Prebiotics Safe for Use during Pregnancy and Lactation? A Systematic Review and Meta-Analysis. Nutrients. 2021 Jul 13;13(7):2382.
Asha MZ, Khalil SFH. Efficacy and Safety of Probiotics, Prebiotics and Synbiotics in the Treatment of Irritable Bowel Syndrome: A systematic review and meta-analysis. Sultan Qaboos Univ Med J. 2020 Feb;20(1):e13-e24.
Jäger R, Mohr AE, Carpenter KC, Kerksick CM, Purpura M, Moussa A, Townsend JR, Lamprecht M, West NP, Black K, Gleeson M, Pyne DB, Wells SD, Arent SM, Smith-Ryan AE, Kreider RB, Campbell BI, Bannock L, Scheiman J, Wissent CJ, Pane M, Kalman DS, Pugh JN, Ter Haar JA, Antonio J. International Society of Sports Nutrition Position Stand: Probiotics. J Int Soc Sports Nutr. 2019 Dec 21;16(1):62.
Roe AL, Boyte ME, Elkins CA, Goldman VS, Heimbach J, Madden E, Oketch-Rabah H, Sanders ME, Sirois J, Smith A. Considerations for determining safety of probiotics: A USP perspective. Regul Toxicol Pharmacol. 2022 Dec;136:105266.

谷禾健康

最近新型冠状病毒肺炎(COVID-19)感染人数再次开始上升,Covid-19危机和近期频发的流感(甲流、乙流、支原体感染等),可能让免疫学进入一个新的时代。
现在人们因 Covid-19 感染住院或死亡的可能性降低了,那么危险已经过去了吗?如果您第二次、第三次甚至第四次感染,还有理由担心吗?
专家表示,感染 Covid-19 的风险比以前要小,但仍有充分的理由不要随意对待它。
在大流行的破坏中,医学研究和科学家收集了关于免疫系统的新见解,这些见解正在重塑一些长期以来关于人类免疫的观念。
这场全球性的大流行不仅提升了公众对免疫系统工作原理的认识,也推动了科学界对免疫学研究的投资和兴趣。在这个时期,肠道菌群和微生态管理成为了其中串联的角色,因为它们在人体免疫系统中扮演着至关重要的角色。随着对肠道微生态和宿主健康关系的深入理解,免疫学的疆界被进一步拓展,带来了研究和治疗上的新机遇。在这个新时代,我们可以预见到几个关键的发展趋势。
首先,疫苗开发将更加快速和高效。COVID-19疫苗的研发打破了速度记录,mRNA技术的成功应用预示着未来可以对抗更多疾病的疫苗将以更快的速度被开发出来。同时,针对肠道菌群的疫苗也将成为可能,直接通过调节菌群来提高免疫力。
其次,免疫疗法的研究和应用将得到扩展。COVID-19疫情期间,对于如何调节免疫系统以治疗严重病例的研究取得了进展。这些知识的积累将有助于治疗其他免疫炎症相关的疾病,如自身免疫疾病、炎症性疾病、过敏性疾病以及某些类型的癌症。免疫疗法也将受益于对肠道微生态的深入研究。
第三,全球免疫监测和疾病预防策略将得到加强。大流行暴露了许多国家在疾病监测和应对方面的不足。因此,未来可能会看到更多的资源被投入到预防性策略和监测系统的建立上,以便更快地识别和遏制新的疫情。
此外,精准医疗在免疫学领域的应用也将增加。通过对个体免疫系统的深入了解,医生可以为患者量身定制更加精确的治疗方案。基因组学、蛋白质组学和细胞组学等技术的结合,将使得医生能够更好地预测疗法的效果,减少副作用,并提高治疗成功率。在个性化医疗时代,肠道菌群检测也将成为重要的诊断工具,用以预测疗效、指导用药。这可以大大提高治疗的精准性,减少不必要的试错。
最后,公共卫生政策和教育将更加注重免疫健康。从学校教育到成人继续教育,对免疫系统的知识将被纳入课程,以提高人们对于预防疾病的认识。这需要从基础教育做起,向公众宣传合理膳食、生活习惯的重要性。如果社会环境本身就是一个促进健康的生态系统,有望尽早打造出一个更加健康的世界。
总之,COVID-19疫情虽然给全球带来了巨大的挑战,但也催生了免疫学领域的重大进展。在这个新的黄金时代,我们有理由相信,通过科学的力量,人类将更加有能力应对未来可能出现的健康危机。
✦ 疫苗带来的免疫保护可能会逐渐减弱
从这次大流行中得出的一个关键见解是认识到 mRNA 疫苗引起的免疫反应逐渐减弱可能并不是这些疫苗所独有的。对于以前被认为能诱导终身免疫的其他疫苗来说,情况也可能如此。
mRNA疫苗是一种全新的免疫方式。它能对有症状的新冠病毒产生快速、有力但短暂的反应。虽然 mRNA 疫苗针对死亡和严重疾病的保护作用随着时间的推移仍然很强,但针对症状感染的保护作用不太持久。这主要是因为病毒不断变异,因此它可以逃避免疫系统的防御——宿主和病原体之间的进化竞赛。
不过,这也是因为人体免疫系统需要更多时间来形成针对病原体的长期免疫记忆。每次免疫系统遇到病毒时,无论是通过疫苗还是自然暴露,这种记忆都会增强。
✦ 接种了疫苗并不意味着终生免疫
水痘和麻疹也可能发生类似的情况。你得了麻疹或水痘,或者你接种了疫苗,你以为就终身免疫了么?有新的证据表明情况并非如此。
例如,最近的一项研究发现,带状疱疹的发病率在过去60年里有所上升,但其原因仍知之甚少。引起带状疱疹的病原体水痘带状疱疹病毒也是儿童感染水痘的罪魁祸首。
一种可能的解释可能是近年来传播的病毒水平相对较低,而在过去,这些病毒会导致亚临床感染,从而自然地“增强”先前感染或接种疫苗的个体的免疫系统。
✦ 人体可能在多次感染中增强了免疫,而不仅仅是因为接种了疫苗
在过去,我们会接种疫苗或从感染中恢复,但感染仍然是地方性的,因此我们都可能被再次感染并多次加强,而往往是在不知情的情况下。
我们大多数人可能多次被许多病毒再次感染,并产生了非常好的免疫力。因此,一次接触病原体就会导致终生免疫的想法可能需要重新考虑。疫苗也是如此——一些疫苗和病毒暴露所产生的保护作用必然会随着时间的推移而减弱。
疫苗、mRNA 等可以挽救生命。然而可能需要放弃这样一种观念,即它们提供一次性的保护。疫苗仍然是增强我们免疫防御的最重要且最安全的工具。
然而免疫力是单独来自疫苗还是由于疫苗加上暴露后的自然增强?对于一种非常容易传播的病原体变异后,我们能否获得完全的免疫力?这些问题还值得深入研究,但确定的是我们可以通过疫苗接种来预防重大疾病。
新型疫苗有望成为癌症等疾病治疗的新平台
COVID mRNA 疫苗的工作原理是诱导人体产生对自己安全的SARS-CoV-2刺突蛋白,并训练免疫系统识别和禁用它,然后在遇到实际病毒时执行相同的操作。
这种方法首次成功用于对抗 SARS-CoV-2,已成为利用人体免疫反应产生针对各种传染病以及多种癌症、心脏病、罕见疾病和某些自身免疫性疾病的“疗法”蓝图。
这次大流行使人们对免疫印记(免疫的核心特征)有了更细致的了解。
当我们的身体第一次遇到病毒时,它们会对其形成长期记忆。这种最初的遭遇不仅影响了对同一种病毒的后续反应,也影响了对看起来相似的病原体的后续反应。这种形式的免疫印记通常被描述为“原始抗原原罪”,指的是第一次遇到特定抗原,随后使免疫系统偏向于该病原体。
✦ 免疫系统对新病毒和曾感染过的相似病毒具有不同反应
当免疫系统遇到一种新病毒时,它不会快速产生针对这种新病毒的高度特异性抗体,而是默认对最初的相似病毒的记忆——就像一个视力不佳的人在远处看到模糊的熟悉的面孔,当他们只是看起来像熟人的陌生人时,他们会像朋友一样打招呼。
免疫印记可以对类似于原始抗原的病毒产生保护性免疫反应,因为这些新病毒的某些部分看起来像创建记忆的原始抗原。然而,免疫印记也会干扰针对新病毒或先前见过的病毒突变部分的快速免疫反应的形成。它在一定程度上削弱了初始防御的准确性。
✦ 曾感染过的病毒突变可能会更容易受到感染
疫情是一件可怕的事情,但抛开这一点,看看我们的免疫系统如何处理信息并看到生物学在起作用,这对我们今后的健康至关重要。
初次接触记忆会更强烈,并可能导致终生对病毒原始毒株的偏见。事实上,即使随后的暴露扩大了免疫反应以涵盖更新的毒株,对原始病毒的反应性仍然较高。这可能意味着,当以前遇到的病毒发生足够的突变而无法被产生抗体的免疫细胞识别时,个体会变得更容易受到感染。
但是,生命早期接触病毒往往也能提供持久的保护,防止类似病毒株引起的严重疾病,即使晚年的反应可能不足以预防有症状的感染。
再次感染(COVID-19)会怎么样?
有证据表明,当感染过SARS-CoV-2病毒原始毒株或接种疫苗的个体遇到后来的变种时,与原始毒株相比,他们产生了更高水平的针对原始毒株的抗体,而针对新毒株的抗体水平则更少。
然而,研究表明,任何先前通过感染或接种疫苗接触 SARS-CoV-2 的情况都会降低随后感染的疾病严重程度。
此外,先前的疫苗接种并不排除对病毒突变部分形成新的反应。免疫印记的局限性可以通过在疫苗中使用更高的抗原剂量、通过对一种以上变体产生反应的多价疫苗或通过用佐剂(增强免疫反应的物质)增强疫苗来克服。
最重要的是,当快速反应比高度精确的反应更重要时,基于过去暴露的免疫回忆的抗体生产是一种快速、经济的方法,可以在不确定的情况下建立快速保护。
免疫系统具有广泛的功能和对过去接触的长期记忆,具有进化优势。这是一种对抗未来病原体遭遇风险的方法。
之前认为免疫系统可以释放记忆并删除带有先前病毒遭遇记忆的细胞,但事实并非如此。保留这些旧的“文件”增加了至少一些长寿的抗体产生细胞识别前所未见的病毒的某些部分的可能性。制造高度适应新病毒的新抗体需要时间和精力,这在反应速度至关重要的高风险情况下是宝贵的资源。
因此,免疫系统部署了两种反应路线:一种是快速但不精确的反应,依赖于先前存在的防御;另一种是缓慢但更精确的反应,逐渐磨练其武器库来攻击新病毒。
免疫系统足够聪明,知道它需要速度和精度,但为了做到这两点,它最初会放弃一点精度,转而追求速度。
研究人员早就知道病毒和宿主免疫系统处于永久的竞争中,但为什么这场战斗在大多数人身上达到停滞状态,而在其他人身上却造成严重感染呢?
更重要的是,这场战斗在细胞和分子层面上到底是如何展开的?这个问题一直困扰着科学家,并阻碍了对预防或治愈感染的治疗的探索。
哈佛医学院的研究人员最近使用实验室工程细胞进行了一项研究,并发表在《美国国家科学院院刊》上,揭示了宿主和病原体在争夺细胞主导地位时所使用的精确策略。
此外,该研究还展示了免疫系统如何在细胞控制中心(细胞核)发生的战斗中阻止病毒。
✦ 干扰素信号蛋白阻止病毒感染
该研究揭示了一组称为干扰素的信号蛋白的关键作用,它们招募其他保护性分子并阻止病毒建立感染。
一旦进入宿主体内,单纯疱疹病毒就会利用宿主的遗传机制在细胞核内复制自身,从而进行繁殖。为此,病毒必须战胜宿主的免疫系统。
干扰素因其干扰病原体感染细胞的能力而得名,是当免疫系统检测到微生物(例如病毒)存在时释放的信号分子。干扰素发出的求救信号会激活该细胞和其他产生蛋白质的细胞中的基因,从而首先阻止病毒建立感染。
干扰素用于阻止细胞质(充满细胞的凝胶状液体)内的病毒的几种不同机制是众所周知的。但干扰素如何对抗DNA病毒——那些在细胞核内发起攻击的病毒——仍然是个谜。
✦ 干扰素阻止病毒复制
在这项新研究中发现,干扰素会招募一种名为 IFI16 的宿主蛋白,以多种方式帮助阻止病毒复制。
IFI16 用来抵御病毒的策略之一是在病毒 DNA 基因组周围构建和维持分子外壳。这种分子“气泡膜”可以防止病毒展开。当病毒被包裹起来时,它就无法激活其 DNA 来表达其基因并复制自身。
注:然而,为了对抗这些保护性策略,病毒会产生称为VP16和ICP0的分子,这些分子可以去除包裹物,使宿主细胞的保护性分子失活,并使病毒能够繁殖。
IFI16 对抗病毒感染的另一种机制是中和VP16和 ICP0。正常情况下,当细胞未准备好击退病毒入侵者时,细胞核内会存在一些IFI16。但IFI16的水平不足以对抗病毒辅助蛋白并保持病毒的包裹和抑制。
如果没有干扰素向细胞发出更多的IFI16信号,病毒就会赢得军备竞赛并感染细胞。然而,实验表明,当干扰素信号招募更高水平的IFI16时,免疫系统就会获胜。
目前的这项研究与类似的发现相呼应,即在组织的临床样本中发现 IFI16 水平升高,在这些组织中,免疫系统似乎成功地控制了密切相关的病毒症状,这提供了有关避免病毒爆发的分子机制的重要见解。
最新研究显示,五分之一的人在服用抗病毒药物后出现新冠病毒反弹。病毒反弹是指在对病毒性疾病进行治疗后,病毒水平暂时下降但之后再次上升的现象。
Paxlovid 是一种用于治疗 COVID-19 的口服抗病毒药物。此前的研究表明,该药物可有效减少重症 COVID-19 病例的住院率和死亡人数。自从 Paxlovid 纳入 COVID-19 治疗以来,一些患者报告了病毒学反弹。此前一项名为 EPIC-HR 的 3 期临床试验表明,服用 Paxlovid 的患者中只有1%至2%出现病毒学反弹。
✦ 特定药物可能增加了新冠病毒反弹
哈佛医学院研究人员进行的一项新研究发现,在接受尼尔马瑞韦-利托那韦疗法(俗称 Paxlovid)治疗 COVID-19 严重症状的人中,有五分之一的检测结果呈阳性,并且已痊愈初次康复且检测呈阴性后,存在潜在传染性的活病毒。相比之下,不服用 Paxlovid 的人只有大约2%出现反弹。
研究人员指出,这些发现不应阻止临床医生开出药物,但应促使他们向服用药物的患者提供关于病毒反弹和将病毒传播给他人的风险的咨询。
新研究表明,Paxlovid 引起的病毒反弹比之前认为的更为常见。结果表明,病毒反弹的发生频率可能比之前认为的要高,这引发了人们对那些确实经历病毒复发的人传播病毒风险的质疑。
✦ 病毒反弹使一些患者在康复后可能具有传染性
超过20%服用 Paxlovid 的人出现这种现象——而且个体在出现反弹时会释放活病毒,这意味着他们在最初康复后可能具有传染性。
研究人员警告说,该研究依赖于观察,而不是随机对照试验,因此科学家们不能确定服用 Paxlovid 的人的反弹率增加仅仅是由于使用该药物所致。
该团队使用阳性病毒培养物作为传播病毒风险的标志,但没有正式测量经历病毒学反弹的人的传染性有多大。尽管如此,他们指出,活病毒脱落是其他呼吸道病毒传播的一个公认因素,因此临床医生应建议患者在反弹期间保持警惕并进行隔离。
✦ 出现反弹的个体传染性持续时间也较长
出现反弹的个体病毒排出时间也较长,平均为14天,而没有出现反弹的个体则少于5天,这表明他们的传染性可能会持续更长时间。令人欣慰的是,没有证据表明病毒在反弹的患者中会对药物产生耐药性。
最初的EPIC-HR 研究仅在两个时间点评估患者的结果,而新研究则更频繁地跟踪患者。当研究人员将他们的数据与第一个 EPIC-HR 研究的选定时间点进行比对时,他们也发现只有2.4%的参与者出现了病毒学反弹,这一发现表明之前的研究并未捕捉到病毒学反弹的全部范围。
这项研究在未来还需要知道为什么有些人会经历反弹,而另一些人却没有。他们计划研究 Paxlovid 反弹现象背后的生物学机制,并确定改变治疗持续时间是否有助于对抗反弹效应。
一些研究探讨肠道细菌在抵抗病毒感染中的作用,肠道微生物组在疾病和健康中的作用已得到充分证实。然而,我们肠道中的细菌如何保护我们免受病毒感染尚不清楚。
✦ 肠道微生物调节免疫以抵御病毒入侵
哈佛医学院的研究人员首次描述了这种情况在小鼠身上发生的情况,并确定了调节局部和全身免疫反应以抵御病毒入侵的特定肠道微生物群。
这项研究于11月18日发表在《细胞》杂志上,精确定位了一组肠道微生物以及其中的一个特定物种,这些微生物会导致免疫细胞释放被称为1型干扰素的病毒排斥化学物质。
研究人员进一步确定了该组中许多肠道细菌所共有的精确分子,该分子可以解锁免疫保护级联反应。研究人员指出,这种分子可以成为增强人类抗病毒免疫力药物的基础。
“鉴于干扰素在疾病和健康中发挥的关键作用,我们鉴定出一种可以诱导干扰素保护信号的细菌分子,这为开发治疗化合物提供了一种有前景的新方法,这种化合物可以增强抗病毒免疫力,从而降低病毒感染的风险。”该研究的资深作者、哈佛医学院免疫学教授丹尼斯·卡斯珀说。
✦ 脆弱拟杆菌通过产生干扰素β进行抗病毒保护
在对细胞和动物进行的一系列实验中,研究人员发现,大多数人类肠道中存在的一种微生物——脆弱拟杆菌,会启动信号级联反应,诱导结肠中的免疫细胞释放一种名为干扰素-β的蛋白质——一种重要的免疫化学物质,通过两种方式提供抗病毒保护:它诱导病毒感染的细胞自我毁灭,并刺激其他类别的免疫细胞攻击病毒。
具体来说,实验证明细菌表面的一种分子通过激活所谓的TLR4-TRIF信号通路来触发干扰素β的释放。这种细菌分子会刺激由九种Toll样受体(TLR)之一启动的免疫信号通路,TLR是先天免疫系统的一部分。
当免疫细胞表面的蛋白质识别出各种感染性生物体表面的某些明显的分子模式时,该途径就会被激活,并针对这些入侵者组织免疫防御。
✦ 其他肠道细菌可能也具有免疫保护信号传导作用
由于解锁这一级联的特定表面分子并非脆弱拟杆菌所独有,并且也存在于同一家族的多种其他肠道细菌中,因此研究人员测试了携带该分子的其他细菌物种是否可以触发类似的免疫信号传导。
在一组小鼠中进行的一组实验表明,在拟杆菌属细菌家族的多个其他物种中发现的含有这种分子的膜可以成功地启动类似的信号传导——这一发现表明,广泛的肠道细菌共有更广泛的免疫保护信号传导。
为了确定脆弱拟杆菌是否可以保护动物免受感染,研究人员测试了两组小鼠,一组使用抗生素治疗以耗尽肠道微生物群,另一组则保持完整的肠道微生物群。
接下来,研究人员将接受治疗和未接受治疗的动物暴露于水疱性口炎病毒(VSV)中,这种生物体几乎感染所有哺乳动物,但在人类中导致大部分无症状感染。与未接受抗生素且肠道微生物群完整的小鼠相比,经过抗生素治疗且肠道微生物群耗尽的小鼠在接触病毒后更有可能出现活动性感染,并且在感染后病情更严重。
结果证明了肠道微生物在诱导保护性干扰素-β信号传导和增强对病毒感染的自然抵抗力方面的作用。观察结果证实,共生微生物群正是通过干扰素-β信号传导发挥其保护作用。
大多数时候,病毒的变化是渐进的。从本质上讲,它只改变了其表面的一部分,但这还不足以在它试图闯入时完全掩盖我们的免疫系统或疫苗。
• 病毒发生巨大变化时会导致疫苗和免疫系统无法识别
有时,它会进行改造。可以说,它剪了头发、染了头发、做了整容手术,还减掉了很多体重。这些巨大的变化使得我们的免疫系统无法识别它,有时我们用来抵御它的疫苗和药物也无法识别它。
这发生在奥密克戎(Omicron)毒株的第一波浪潮中,它迅速在世界范围内传播,感染接种疫苗的人和以前感染过的人,仍然引起了Covid-19。2021年冬季,Omicron在全球范围内造成大量感染,令人瞠目结舌。
另一种新冠变异病毒也已经出现在世界舞台上,它被称为BA.2.86,它的刺突蛋白有30多个氨基酸变化,这使得它在基因上与其下一个最近的祖先 BA.2 相距甚远,就像最初的 Omicron 变体来自 SARS 的祖先菌株一样。
• 疫苗和人体的免疫也需要不断加强
目前尚不清楚 BA.2.86 的具体来源。科学家认为,它所携带的突变模式是一种在慢性感染者体内发生变化的病毒特征。通常,这些患者的免疫功能减弱,无法完全清除体内的病毒,但他们有足够的免疫力,这会给病毒带来压力,使其不断变化以求生存。
新型冠状病毒可以以这种方式变异,这意味着我们可能需要不断更新我们的疫苗和免疫力才能跟上步伐。
新冠病毒感染者担心三件事:“‘我会死吗?我最终会住院吗?但对于大多数人来说,问题是‘我会生病并病上好几个月吗?我会长期感染新冠病毒吗?”
• 长期并发症的风险正逐渐下降
“实际上,对于大多数人来说,这是最重大的风险。”
专家指出,根据我们现有的科学知识,长期并发症的风险似乎正在下降。
澳大利亚最近的另一项研究对2022年7月至8月期间近 23000名确诊感染Covid-19的人进行了研究,结果发现,在超过11000名接受调查的人中,有18%符合长期 Covid 的病例定义。研究人员将其定义为感染 Covid-19 后 90 天以上出现的任何新症状或持续症状。
• 中老年群体更有可能长期感染新冠病毒,即使接种过疫苗也不例外
这也是一个高度接种疫苗的群体。超过94%的受访者至少接种了三剂Covid-19疫苗。在这项研究中,女性、年龄在50岁至69岁之间的人、居住在农村地区的人以及疫苗剂量较少的人更有可能报告长期感染新冠病毒。
• 但接种疫苗可以降低感染的风险和病情程度
根据治疗长期新冠患者的经验表示,人们接种疫苗后,感染新冠病毒的风险会从大约10%到20%下降到个位数。他说,如果他们使用Paxlovid等抗病毒药物,感染率会进一步下降。
“一般原则是,你的病情越重,你的免疫越弱,出现急性和慢性并发症的机会就越高,多项研究表明,通常在大流行的早期,随着最初的变异,人们有更多的急性和慢性并发症。”加州大学旧金山分校传染病专家 Peter Chin-Hong 博士说。
新冠病毒以这种方式引起长期疾病的能力似乎仍然是独一无二的,感染流感的人有可能会患上长期流感的问题,但最终患上这种疾病的人比例约为1%。
传染病专家表示,这种风险足够大,不应忽视。她说:“即使是轻微的新冠病例也可能导致症状持续数周、四个月或更长时间,所以不应该掉以轻心。”
• 再次感染可能会出现更严重的危害
在整个人群中,感染导致慢性并发症的风险可能会下降,但每一次感染都会增加一个人可能面临持久伤害的机会。最近发表在《自然医学》杂志上的一项研究发现,再次感染不是良性的。每一次额外的感染都会增加一个人的死亡、住院和其他长期问题的风险。
美国国立卫生研究院最近资助的一项研究通过梳理数百万份患者记录来查找首次和第二次感染Covid-19的人,该研究支持了这些发现。
研究人员发现,在超过30万名再次感染的人中,第二次感染更严重疾病的风险略高。
此外,新冠对儿童的危害也不容忽视,可能还会出现一些特定的症状。
• 儿童感染新冠病毒后可能出现罕见并发症
在大流行早期,儿科传染病专家一直在寻找儿童感染 Covid-19 的一种罕见并发症,称为儿童多系统炎症综合征(MIS-C)。
MIS-C在Covid-19感染后两到六周开始。据美国疾病控制与预防中心称,它可能会导致持续发烧以及以下一种任意症状:胃痛、眼睛充血、腹泻、头晕、皮疹或呕吐。
注:MIS-C可能很严重,但大多数孩子通过医疗护理会有所好转。
最近的研究表明,随着时间的推移,全球MIS-C病例的数量和严重程度均有所下降。而接种疫苗可进一步降低风险,达90%以上。
过去,研制传统疫苗需要四到二十年的时间,而针对新冠病毒的新型信使RNA (mRNA)疫苗来说,这是创纪录的11个月。这个过程可能永远改变了药物开发的方式。
支持COVID-19疫苗开发的是对 mRNA 疫苗十多年的研究,该疫苗教会人类细胞如何制造触发特定免疫反应的蛋白质。
• 未来mRNA疫苗还可能治疗心脏病等复杂疾病
有一天,疫苗可能会治疗心脏病等疾病。在不久的将来,mRNA 技术可能会带来更好的流感疫苗,随着流感病毒随季节的变化而快速更新,或者开发出可能有效数年的“通用”流感疫苗。
它也可能针对我们最大的杀手。未来的mRNA疗法可以帮助衰竭心脏的肌肉再生,并通过个性化癌症疫苗针对个体癌症的独特遗传学。医生将能够对你的肿瘤进行测序,并用它来制造疫苗,唤醒你的免疫系统来对抗它。mRNA 疫苗也将使我们为未来的流行病做好准备。
与此同时,请使用我们现有的疫苗,不要跳过目前为老年人推荐的流感、肺炎、带状疱疹等常规疫苗。仅流感疫苗一项每年就可以挽救数万人的生命,并将因流感住院的风险降低28%。
自我保健是指个人为了维持和提升健康而采取的一系列主动行为和习惯。这包括合理膳食、适量运动、良好睡眠、避免有害物质、管理压力和保持积极心态等方面。
为什么要关心自我保健?呵护对于您自己和周围人的幸福至关重要。让人感到放松的活动对我们的健康和平衡至关重要,而且这种自我保健的心态可能会持续下去。
• 自我保健有助于提高免疫,更好地抵御病毒
无论是长时间的泡澡,在后院修建花草,享受下午茶,还是晒晒太阳。对自己好一点,可以让我们免受来自外面威胁的任何恐惧。舒适将帮助我们轻松恢复生活,更好地抵御病毒的入侵。
通过自我保健,个人可以在很大程度上控制和改善自己的健康状况,减少对医疗系统的依赖。因此,推广自我保健意识和实践对于提高公众健康水平至关重要。
你的健康与生活方式直接相关——营养、身体活动、健康的体重和恢复性的睡眠。”
• 高龄会导致致命感染的风险增加
然而年龄带来的风险也较高,合并症(本质上是同时存在两种或多种健康问题)更为重要。具体来说,75 岁及以上的健康人发生致命感染的风险是所有65岁以下参与者的四倍。但如果你比较所有75岁及以上的人——包括那些患有高血压、肥胖或肺病等慢性疾病的人问题,可能性增加了十三倍。
• 而生活方式的改善可以降低老年人患新冠风险
研究发现:健康的75岁老人死于冠状病毒的可能性是患有多种慢性健康问题的65岁老人的三分之一。年龄会影响患上新冠肺炎重症的风险,但应该更加注重避免慢性健康问题。生活方式的改变可以改善您的整体健康状况,这可能会直接降低您患上严重新冠病毒或死于新冠病毒的风险。
锻炼仍然至关重要,英国对387109名40岁至60岁成年人进行的一项研究发现,避免体力活动的人患重症新冠病毒的风险要高出38%。活动能力应该被视为健康的重要标志之一。
从新冠疫情中学到的另一点,孤独是每个人的问题。这不仅发生在老年人身上,也发生在我们所有人身上。
孤独有多致命?一项令人震惊的调查,在大流行的前5个月里,旨在保护患有痴呆症的老年人和弱势成年人的疗养院封锁导致比往年增加了13200人死亡。
• 新冠疫情期间隔离造成孤独问题需要正确对待
隔离可能成为新常态。密歇根大学的一项民意调查发现,56%的50岁以上成年人表示,他们在2020年感到孤独,是2018年(新冠疫情爆发前)感到孤独的人数的两倍。根据约翰·霍普金斯大学在《美国医学会杂志》上发表的一项调查,随着疫情的加剧,所有成年人的心理困扰率都在上升,年轻人的心理困扰率增加了六倍,30至54岁的人则增加了四倍。
新冠疫情期间实施的隔离措施导致了广泛的孤独感,这对人们的健康产生了负面影响。孤独不仅影响心理健康,如增加抑郁和焦虑的风险,还可能对身体健康造成损害,比如增加心脏病和免疫系统功能下降的风险。
因此,新冠时期隔离措施虽然是控制疫情传播的必要手段,但其带来的孤独感需要被认真对待,并采取措施减轻其对健康的不良影响。
如果说老年人的生活围绕着定期亲自看医生,那么由于大流行给我们的医疗保健系统带来的压力,从某种程度上来说,医疗保健系统已经开始转变:远程医疗逐渐兴起并应用在医疗中,特别是对于那些患有慢性疾病的人来说。
• 远程医疗能够更早发现问题并及时调整
告别例行就诊,注册远程血糖监测的患者使用支持蓝牙的仪表,通过智能手机应用程序将结果直接传输到他们的健康记录中。远程监控使我们能够及早发现何时应该调整治疗。
但这需要意愿和大量装备,例如支持蓝牙的血压监测仪,以及医生方面存储和分析数据的系统。“人们需要使用设备,医疗保健系统必须准备好处理所有这些数据。”
• 集体就诊有助于提高医疗效率
集体就诊是指一组人在同一时间和地点接受医疗服务,通常是由一名医生或医疗团队为他们提供服务。
集体就诊可能是一种先进的方式。这种方式不仅有助于提升医疗服务的效率,还能促进患者之间的信息交流和经验分享,有助于患者更好地理解自身的病情和治疗方法。
参考链接:
medicalxpress.com/news/2024-01-pandemic-immune.html
www.aarp.org/health/conditions-treatments/info-2021/lessons-from-covid.html
www.cnn.com/2023/08/28/health/risk-from-catching-covid-wellness/index.html
谷禾健康

随着生活方式的变化和环境压力的增加,慢性疾病的发病率正在全球范围内急剧上升。这些慢性疾病,包括心血管疾病、糖尿病、抑郁症和多种自身免疫性疾病,不仅对个人的健康和生活质量构成了严重威胁,也给全球卫生系统带来了前所未有的挑战。
我们知道抗生素对肠道菌群会产生很大影响,事实上,其他这些药物也被报告具有类似的改变肠道微生物群的效果。这引发了人们对药物通过影响肠道微生物群从而影响健康和疾病的关注。特别是,肠道微生物群与大脑之间的相互作用,也就是所谓的“肠-脑轴”,成为一个热点领域,这可能为一些神经系统疾病的新治疗方法提供线索。
另一方面,神经系统疾病的治疗面临着许多难点,其中包括疾病机制的复杂性、治疗效果的个体差异、长期药物治疗的副作用,缺乏针对疾病根本原因的治疗方法。这些难点突显了寻找新的治疗目标和策略的重要性。
本文我们来了解一下药物引起的生态失调,以及日常处方药包括二甲双胍、他汀类药物、质子泵抑制剂和非甾体抗炎药为什么以及如何可能通过微生物群改变肠脑轴,以抑郁症、多发性硬化症、帕金森病和阿尔茨海默病等神经系统疾病为例来说明。
关于药物和肠道菌群及其与神经系统疾病之间的关联研究,提供了一个全新的视角,对于开发新的神经系统疾病相关治疗方法具有重要意义。
不同的细菌种群在消化道的不同部位繁殖,这是由于不同的微环境所致。关于居住在胃和肠道中的肠道细菌组成的总结见下图:
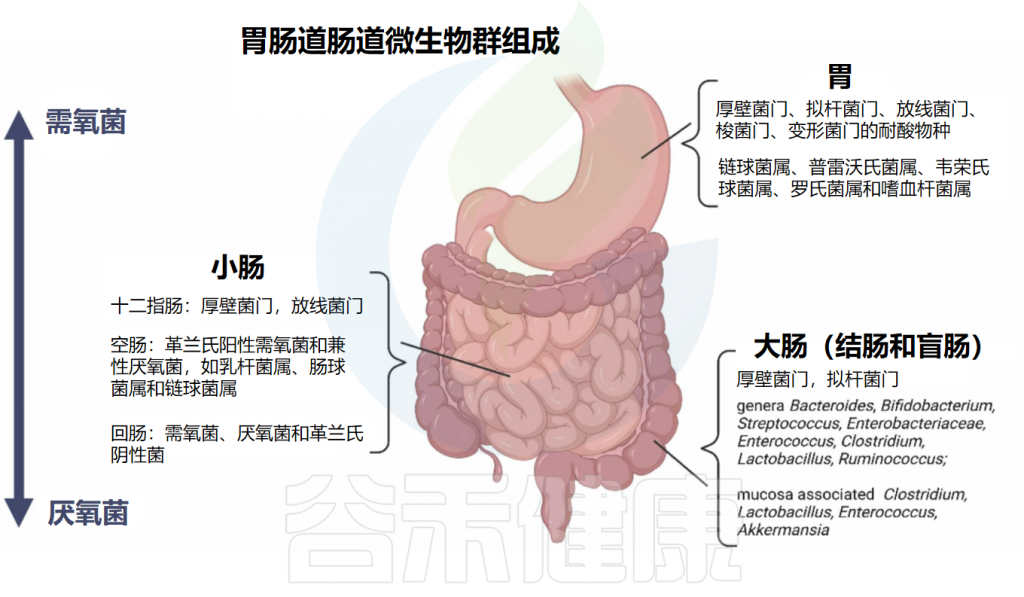
doi.org/10.1016/j.brainresbull.2024.110883
从上消化道到下消化道,细菌种类从需氧菌过渡到厌氧菌。
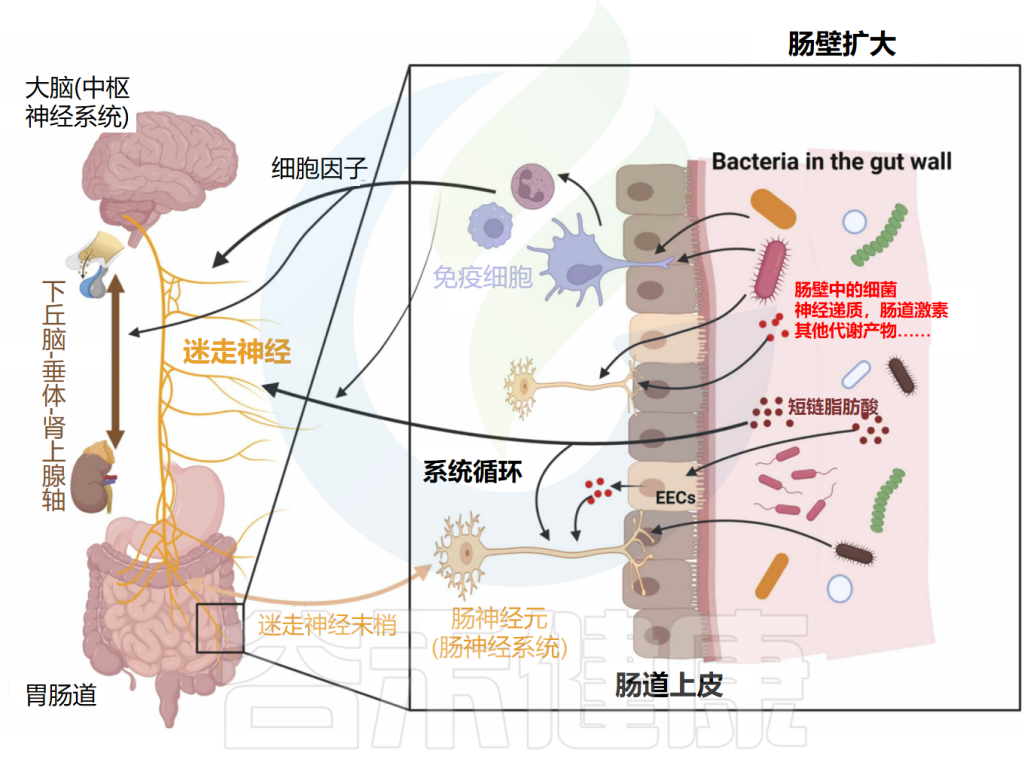
肠脑轴定义了肠神经系统(ENS)和中枢神经系统(CNS)之间的连接。随着研究的深入,微生物群在这一轴线中扮演着至关重要的角色。现已将肠脑轴扩展到了微生物群-肠-脑轴(MGBA)。
微生物群-肠-脑轴是肠道菌群和CNS之间的双向通信路径,肠道菌群可能通过细菌产生的神经递质和代谢物(所谓的化学信号)、迷走神经、免疫系统或包括下丘脑-垂体-肾上腺轴(HPAA)在内的神经内分泌系统影响大脑。
微生物群-肠-脑轴通信图
doi.org/10.1016/j.brainresbull.2024.110883
神经、免疫和内分泌介质,如神经递质、细胞因子和肠激素,是微生物群-肠-脑轴双向路径中的通信者。释放的细胞因子在免疫细胞识别细菌后可直接影响大脑。细胞因子和迷走神经也可以影响下丘脑-垂体-肾上腺轴(HPA轴)。细菌还可以通过其脂多糖(LPS)直接与肠神经元通信,触发肠神经元上的TLR4。
间接路径包括由肠道细菌产生的代谢物,如神经递质和短链脂肪酸(SCFAs)。这些代谢物可以进入全身血液循环,从而影响大脑。此外,这些代谢物可以刺激肠道中的肠内分泌细胞(EECs),然后它们在血液中释放肠激素。细菌代谢物和肠激素也可以通过属于迷走神经的肠神经元发送传入信号。
另一方面,大脑通过传出迷走神经纤维和其他肠神经系统(ENS)细胞进行通信。它因此在诸如粘液分泌和肠蠕动等重要方面影响肠生理。
关于微生物群-肠-脑轴在我们前面的文章已经详细阐述,详见:
最新研究速递 | 柳叶刀:肠道微生物群在神经系统疾病中的作用
抗糖尿病药物二甲双胍是 2 型糖尿病的一线治疗药物,已用于2 型糖尿病患者 60 多年。
口服后,二甲双胍在小肠吸收后的生物利用度约为40-60%。它在人肠道中的浓度比血浆中高 30-300 倍。
二甲双胍发挥什么作用?
二甲双胍通过改善胰岛素的作用、抑制肝脏糖异生、抑制肝脏中的胰高血糖素信号传导、增加骨骼肌中的葡萄糖摄取和降低体重来调节血糖水平,从而发挥其作用。新的研究表明,它通过抑制不同肿瘤类型的发作或进一步生长,具有抗癌作用。此外,二甲双胍已被证明通过与肠道菌群的相互作用降低葡萄糖水平。
二甲双胍对肠道微生物的影响
二甲双胍的肠道改变作用可能是由于对肠道微生物组的直接作用和/或通过其他代谢物的间接作用。高胰岛素血症也会改变肠道微生物群。因此,通过二甲双胍降低胰岛素会引起肠道微生物群的间接变化。
在接受二甲双胍治疗的患者中肠道菌群变化
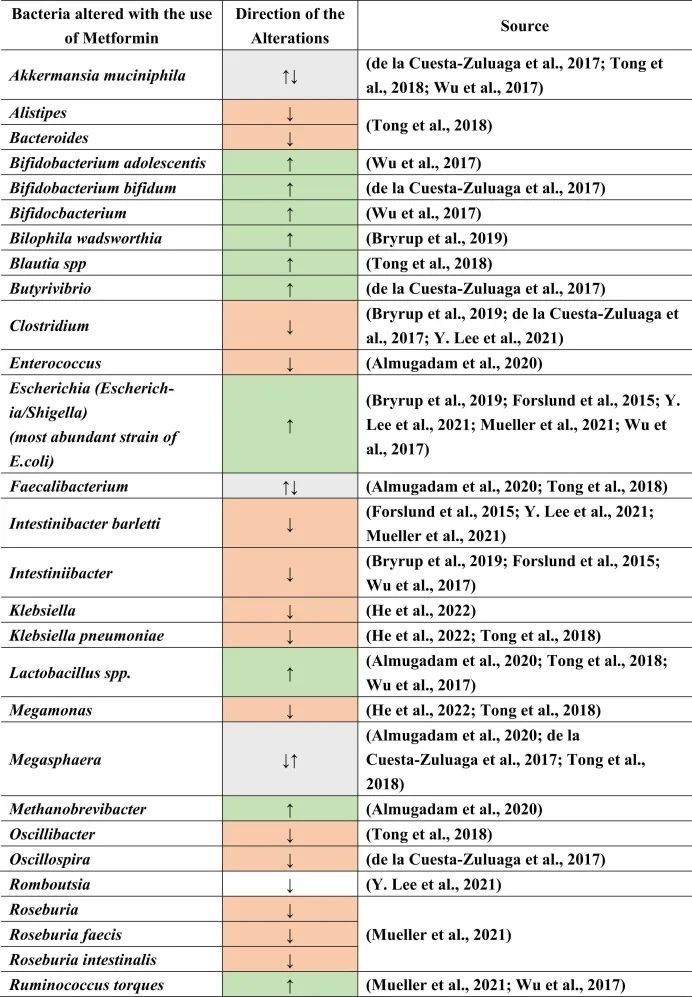
doi.org/10.1016/j.brainresbull.2024.110883
由于二甲双胍诱导的肠道菌群改变,该药物也正在研究用于治疗IBD、自身免疫病等,和/或用于恢复其他肠道改变药物的作用。
研究人员讨论了二甲双胍改善抗精神病药物引起的代谢功能障碍的可能性,代谢功能障碍主要通过各种途径引起体重增加,如胰岛素抵抗和高血糖,并影响神经活性物质(如神经递质和神经肽)。
二甲双胍→肠道菌群→改善抗精神病药物副作用
用抗精神病药物治疗的小鼠比微生物组耗尽的小鼠体重增加更大,这表明肠道菌群在体重管理中的作用。在抗精神病药物治疗的小鼠中,发现许多菌群减少,如乳酸杆菌和阿克曼菌。另一方面,大肠杆菌和双歧杆菌增加。特别是二甲双胍可以减少体重增加,A.muciniphila也显示了这一点。后者已被提议作为缓解全身炎症的益生菌治疗。因此,二甲双胍可以通过肠道微生物组改善抗精神病药物使用的副作用。
人体研究是在较小的队列规模(5-25名受试者)中进行的,还没有足够的数量。然而,对小鼠模型的研究充分证实了二甲双胍和肠道菌群之间的相互作用。
他汀类药物是预防心脏病和动脉粥样硬化最常用的心血管药物之一。超过2亿人单独或联合服用各种类型的他汀类药物。他汀类药物通过抑制HGM-CoA还原酶产生胆固醇的酶来降低低密度脂蛋白(LDL)。
在人类中进行的研究很少,以确定他汀类药物对肠道微生物群的影响,数据不一致。例如,瑞舒伐他汀在动力不足的人体试验中没有显示出显著变化。另一方面,它引起了肠道菌群功能潜力的显著改变,即细菌代谢物的水平。
他汀类药物治疗促炎菌降低
一项荟萃分析研究表明,他汀类药物通过降低Bact2肠型(Bacteroides 2)的发生率,而具有抗炎作用。
注:有研究人员根据在肠道占有优势地位的细菌种类将人的肠道微生物组成划分为4种“肠型”:拟杆菌1型(Bact1)、拟杆菌2型(Bact2)、瘤胃球菌型(Rum)和普氏菌型(Prev),其中拟杆菌2型可以被归类为“不健康肠型”,它与肥胖和系统性炎症水平高有关。
观察到接受他汀类药物治疗的患者Bact2较低,拟杆菌水平降低。这一结果可以进一步解释,在他汀类药物治疗下,粪杆菌属(Faecalibacterium)也可能增加,或者拟杆菌与粪杆菌属的比例较低,导致Bact2发生率降低。
他汀类药物治疗与产丁酸菌的增加有关
具体而言,与未治疗的高胆固醇血症患者相比,阿托伐他汀治疗的高胆固醇血症患者的下列菌群丰度增加:
促炎菌群减少,如:
与未经治疗的高胆固醇血症患者相比,在减少的共生菌中也测量到了Oscillospira(抗炎菌),Firmicutes,Proteobacteria,Desulfovibrio属和条件致病菌,包括克雷伯氏菌,链球菌和柯林斯菌属。
此外,在相同的比较中观察到Bilophila wadsworthia和双歧双歧杆菌(胆汁酸相关物种)的相对减少。他汀类药物治疗后,也观察到不同种类的拟杆菌如B.dorei和B.uniformis的丰度增加,同时B.vulgatus和B.ovatus的生长降低。这些结果表明他汀类药物引起的肠道菌群变化,可能通过肠道菌群进一步影响GBA。
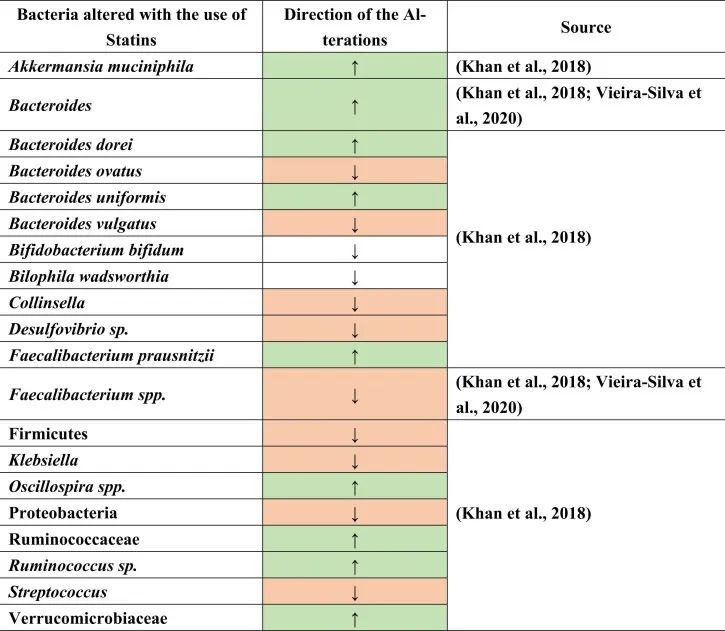
doi.org/10.1016/j.brainresbull.2024.110883
质子泵抑制剂(PPIs)用于预防胃病。很多患者尤其是老年人,会同时服用质子泵抑制剂和其他药物,如止痛药或抗抑郁药,以抵消后者对胃的副作用。
PPI对人体健康的影响
虽然说PPI的作用主要针对胃,但许多研究表明肠道微生物群发生了改变。PPI对微生物组诱导的人体代谢的影响还包括口腔,胃和小肠细菌过度生长(SIBO),肠道艰难梭菌的增加和沙门氏菌感染,肝性脑病,自发性细菌性腹膜炎,社区获得性肺炎,炎症性肠病的不良后果以及功能途径的变化。
PPI对肠道菌群的影响
许多这些疾病和改变是PPI使用后继发的生态失调的后果。一般来说,拟杆菌门丰度较低,厚壁菌门丰度较高。胃肠道中特定的菌群失调:
Naito等人总结了下列菌群丰度的相对增加:
而下列菌群减少:
功能性消化不良患者使用PPI的菌群变化
另一项研究得出结论,功能性消化不良与对照组相比,与粘液相关的细菌,如奈瑟氏菌(Neisseria)、卟啉单胞菌(Porphyromonas)、硒单胞菌(Selenomonas)、梭杆菌、嗜血杆菌(Haemophilus)的丰度较低。
使用PPI后对照组和功能性消化不良的普雷沃氏菌减少。停用PPI后,奈瑟氏菌仍然增加,表明药物使用后微生物变化持续存在。此外,其他细菌群如Holdemania和Blautia,Granulicatella,Rothia和Dorea,以及梭状芽孢杆菌簇XIVa和XIVb在PPI使用者中也有所增加。
在物种水平上:
反流性食管炎使用PPI治疗的菌群变化
由于PPI是给有胃病或反流问题的人服用的,因此一项研究仅检查了PPI治疗前后反流性食管炎患者的粪便微生物群组成。其中,在治疗的不同时间间隔中,乳杆菌(兼性厌氧菌)如加氏乳杆菌,罗伊氏乳杆菌和瘤胃乳杆菌,发酵乳杆菌,短乳杆菌的亚群在治疗后显著增加。
同样,对于链球菌属、肠杆菌科下的兼性厌氧菌计数以及葡萄球菌(也是兼性厌氧菌)也是如此。
有关于口服空肠弯曲菌或罗伊氏乳杆菌等研究显示,迷走神经传入信号发生变化,并在切除迷走神经的小鼠中恢复正常。
使用PPI后,细菌向下消化道区域的转移
在口腔,喉咙和鼻腔中发现了许多上述菌群,这表明由于使用PPI导致胃酸降低,细菌向下消化道区域的转移。通过PPI使用粪便样品显示远端肠道部分与上部胃肠道部分的定植,增加下列菌群:
减少下列菌群:
在一项健康双胞胎的研究中也观察到了同样的情况,结论是生态失调主要是由于咽部和口腔微生物群定殖到下肠道引起的,导致与上述文献相同的细菌改变。
PPI使用与肠道菌群多样性及SIBO相关影响
PPI的使用会导致细菌种群的进一步变化。例如,在PPI治疗后,远端肠道由上肠道的微生物群定殖。总体而言,微生物多样性较低,细菌种类减少,而上消化道中肠道共生菌的丰度较高。
小肠细菌过度生长(SIBO)是后一种情况的一个例子,导致链球菌,埃希氏菌,克雷伯菌,拟杆菌,乳酸杆菌,肠球菌,韦荣氏菌的丰度增加;双歧杆菌和放线菌科的减少。
与细菌转移相关联的是肠道的副交感神经刺激减少,如小肠细菌过度生长。下表总结了菌群的变化。
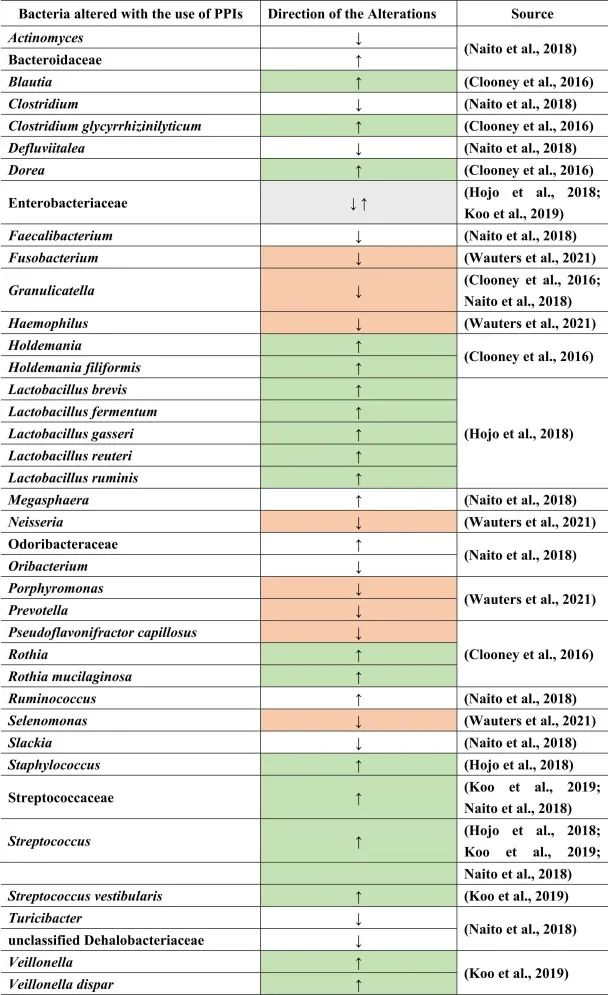
doi.org/10.1016/j.brainresbull.2024.110883
PPI使用增加链球菌,导致功能性消化不良等疾病患者消化不良症状持续
此外,在功能性消化不良,肝硬化,血液透析,类风湿性关节炎和癌症患者中观察到生态失调,这些患者表现出链球菌属的特异性增加。质子泵抑制剂用于缓解消化不良,尤其是幽门螺杆菌感染。然而,随着它增加链球菌的丰度,消化不良症状可能持续存在。来自胃窦胃炎患者的活检显示链球菌数量过多,证实了链球菌与消化不良的关系。
PPI引起肠道微生物失衡,增加肠道感染机会
总之,PPI用于预防其他药物(如NSAIDs)引起的消化不良,其作用是通过减少酸的产生。然而,它改变了肠道环境,使近端肠道细菌转移到肠道的远端。同时,它会导致一些菌群的丰度增加或减少。因此,这种生态失调导致更多的机会的肠道感染,涉及有害细菌,如艰难梭菌或沙门氏菌。
PPI治疗消化不良,影响肠道菌群,改变细菌丰度和细菌移位。主要影响链球菌丰度和艰难梭菌感染的高发病率。
与上述其他药物组一样,非甾体抗炎药(NSAIDs)用于疼痛和抗炎,或低剂量阿司匹林作为心血管健康的血小板聚集抑制剂。NSAIDs也可能导致菌群失调及后果,如小肠细菌过度生长。大量使用NSAID诱导肠道病变。这是由于肠细胞死亡和免疫系统破坏导致肠道屏障受损的结果,从而导致革兰氏阴性细菌的增殖和革兰氏阳性细菌的减少。
PPIs和NSAIDs共同作用于肠道病变与微生物群失衡
PPIs和NSAIDs在由于生态失调引起的肠道肠病中发挥联合作用。NSAIDs可导致胃病,PPIs可减少其发生。NSAIDs和PPIs的联合摄入导致肠病,因为PPIs将微生物群从上胃肠道转移到远端肠道。
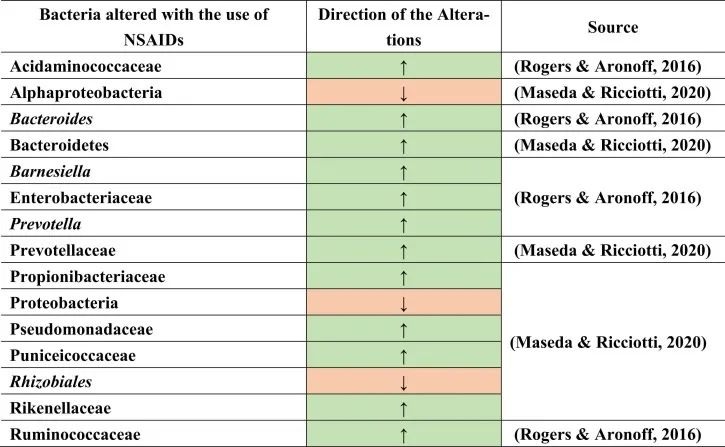
例如,用阿司匹林治疗会导致肠道微生物群组成的变化,增加普雷沃氏菌,拟杆菌,Ruminococcaceae,Barnesiella。
塞来昔布和布洛芬增加了酸性氨基球菌科(Acidaminococcaceae)和肠杆菌科的丰度。
与非使用者或萘普生使用者相比,布洛芬会导致丙酸杆菌科(Propionibacteriaceae),假单胞菌科,Puniciecoccaceae,Rikenellaceae的富集。
吲哚美辛诱导拟杆菌,普氏菌科的增加;变形菌门,α变形菌纲,根瘤目(Rhizobiales),假单胞菌科的减少。
同一项研究显示了性别特异性效应,因为女性肠道中的厚壁菌门较低,而男性肠道中的厚壁菌门较高。
一项比较研究表明,各种非甾体抗炎药诱导的生态失调增加了分类群,如肠杆菌科,酸性氨基球菌科,丙酸杆菌科,假单胞菌科,Punicecoccaceae,Rikenellaceae。
总结上述结果,在导致生态失调和NSAID肠病的不同细菌类群和物种中发现了明显的变化。
doi.org/10.1016/j.brainresbull.2024.110883
抗抑郁药(例如选择性5-羟色胺再摄取抑制剂SSRIs)是抑郁症的一线治疗方法。5-羟色胺是选择性5-羟色胺再摄取抑制剂(SSRIs)的靶标,增加了其在大脑中的可用性水平。
肠脑轴与抑郁症之间存在联系,但只有少数人体研究抗抑郁药对肠道菌群的影响。
抗抑郁药对肠道菌群的影响
艾司西酞普兰改变了肠道菌群,Christensenellaceae,Eubacterium ruminantium group,Fusobacterium显著增加,同时乳酸杆菌丰度相应降低,拟杆菌发生了显著变化。
注:艾司西酞普兰是一种用于治疗抑郁症和广泛性焦虑症的药物,通过增加大脑中神经递质5-羟色胺的水平来改善情绪。
Le Bastard等人的文章研究了非典型抗精神病药物治疗对双相情感障碍患者的影响,结果显示Lachnospiraceae的相对丰度增加(p=0.029),Akkermansia和Sutterella的相对丰度降低(p=0.0006)。
在荷兰队列的另一项研究中,B.dorei(p=0.051)和Coprococcus eutactus(p=0.041)与抗抑郁药呈正相关,而Eubacterium hallii与抗抑郁药呈负相关(p=0.055)。
在小鼠模型中存在许多关于SSRIs诱导的肠道改变的研究。常见的选择性5-羟色胺再摄取抑制剂(SSRI)舍曲林,氟西汀和帕罗西汀显示出对革兰氏阳性细菌如葡萄球菌和肠球菌的活性。
产毒肠杆菌随着SSRIs的使用而减少
其他潜在的产毒肠杆菌,如铜绿假单胞菌,肺炎克雷伯菌,柠檬酸杆菌属和摩根氏菌(M. morganii),产气荚膜梭菌和艰难梭菌也在一定程度上随着SSRIs的使用而减少。这些结果是在体外研究的基础上发现的。
服用某些抗抑郁药(如氟西汀)的抑郁成年人更容易发生艰难梭菌感染(CDI)。据报道,在小鼠中,艾司西酞普兰和锂在相似程度上增加了血清素水平。然而,这项研究没有讨论生态失调是根本原因。虽然SSRI对抑郁症的作用机制与这些药物的任何抗菌作用无关,但仍然可以看到微生物群落的潜在变化,并可能影响与情绪相关的其他炎症或生理参数。
抑郁症或重度抑郁症是最常见的神经精神疾病。它是导致残疾、发病率和死亡率的主要原因之一,导致生活质量低下。大约每五个人一生中就被诊断出一次。
抑郁症的基本症状
抑郁症是一种复杂的疾病,具有不同的症状和病理生理学。根据DSM-5,它被诊断出患有持续2周以上的一系列以下症状:持续的抑郁情绪,快感缺失,孤独感,动机降低,食欲和睡眠障碍,精神运动激动,注意力不集中,疲劳,内疚感或无价值感以及自杀念头。
抑郁症的病因
病因或病理生理学通过许多机制来解释,但整体上仍不清楚,可能有以下情况:
1) 血清素,去甲肾上腺素和多巴胺水平低,谷氨酸水平高;
2) HPA轴的改变;
3) 由于免疫介质的不平衡导致错误的免疫细胞通信,特别是微胶质细胞,引起系统性炎症;
4) 最后但同样重要的是与肠道微生物组-脑-肠轴有关的微生物群。
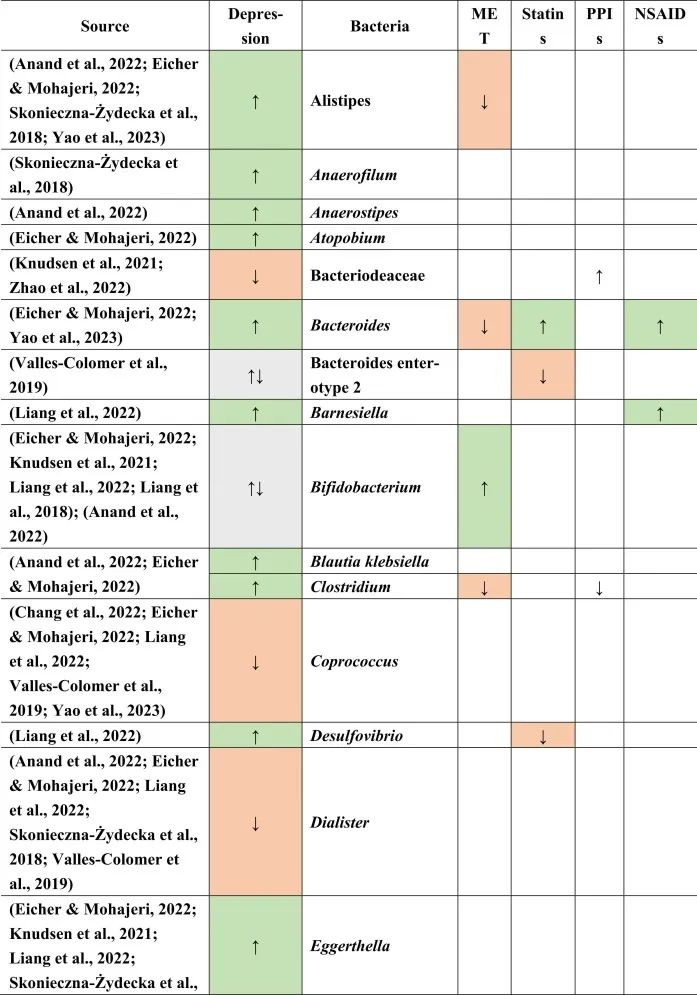
抑郁症的肠道菌群变化
迄今为止,研究发现,在门水平上,拟杆菌,变形杆菌,放线菌,放线菌增加,而抑郁症患者粪便中的厚壁菌减少。
在科的水平上,下列菌群有所增加:
下列菌群有所减少:
在属的层面上,提到了下列菌属减少:
下列菌属增加:
在少数细菌群体中,如Prevotellaceae,Prevotella,Bacteroides enterotype 2,双歧杆菌,Parasutterella,在不同的研究中发现了差异。
抑郁症患者菌群改变与二甲双胍,他汀类药物,
PPIs和NSAIDs使用者菌群改变有关
doi.org/10.1016/j.brainresbull.2024.110883
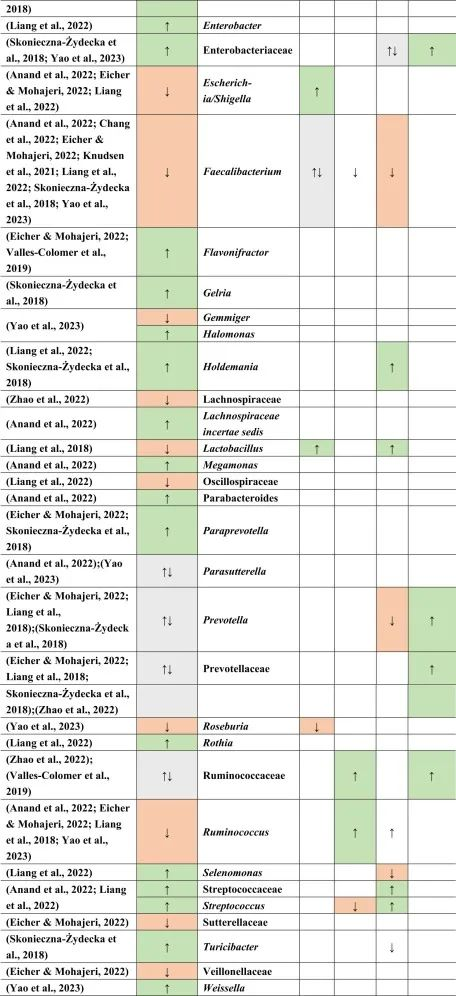
在比较抑郁症患者的肠道菌群与上述药物引起的生态失调时,可以观察到不同细菌分类群水平与一种或多种药物的相似性。
拟杆菌的增加可能对抑郁症有潜在益处
拟杆菌在使用他汀类药物和非甾体抗炎药(NSAIDs)以及抑郁症患者的肠道中都有所增加。拟杆菌是一种产生γ-氨基丁酸(GABA)的革兰氏阴性菌,具有免疫触发LPS和抗炎SCFAs,从而引发免疫反应。
抑郁症与血清素减少相关的系统性和神经炎症都有关联。然而,原本拟杆菌产生的短链脂肪酸和GABA在抑郁症患者体内的含量较低,那么拟杆菌的增加,也增加了GABA和短链脂肪酸,有助于缓解抑郁行为。
他汀类药物和PPIs → 瘤胃球菌↑
瘤胃球菌(Ruminococcus)是一种产短链脂肪酸菌,在他汀类药物和PPI的使用者中增加,再次抵消了短链脂肪酸的低含量。后者也可能是抑郁症患者在口服他汀类药物或PPIs后,粪杆菌属数量低下的原因,粪杆菌是已知的丁酸盐生产者,对肠道屏障稳态和抗炎作用很重要。
他汀类药物 → Bact2↓
特别是他汀类药物可以降低拟杆菌2型(Bact2),这反过来可能导致抑郁症状。
抑郁症可能与他汀类药物和PPI的使用呈负相关,因为抑郁症患者的瘤胃球菌较低,而他汀类药物和PPI使用者的瘤胃球菌较高。
二甲双胍和PPI → 梭菌↓
二甲双胍和PPI中可以降低梭菌丰度,但在抑郁症中没有,因此,二甲双胍和PPI可能有助于减少梭菌。
梭菌的过度生长可能带来的不利结果大于有利结果,例如,艰难梭菌具有毒性和传染性,而梭菌簇XIVa产生短链脂肪酸带来益处。
二甲双胍 → 大肠杆菌↑
血清素可能通过迷走神经影响体液肠-脑通路。大肠杆菌和链球菌与肠杆菌科物种参与血清素合成。在抑郁症患者中,大肠杆菌低丰度,链球菌高丰度,二甲双胍可以缓解低水平的大肠杆菌,因为在使用二甲双胍后大肠杆菌的丰度增加。
他汀类药物抵消PPIs
NSAIDs和PPIs可能分别对肠杆菌科和链球菌产生相同的作用,而他汀类药物可能抵消PPIs的作用,与链球菌数量减少呈正相关。
药物影响与谷氨酸途径的菌群
拟杆菌,乳酸杆菌,双歧杆菌,链球菌也可能参与谷氨酸途径。因此,它们的药物诱导影响可能在单独或通过彼此的相互作用提高谷氨酸能神经传递中发挥作用。
关于谷氨酸详见:兴奋神经递质——谷氨酸与大脑健康
因此,二甲双胍,他汀类药物,PPIs和NSAIDs药物诱导的菌群失调可能各自影响抑郁症的发展和进展,并且它们的作用可能相互抵消或加剧。
扩展阅读:
多发性硬化症是中枢神经系统中最丰富的自身免疫性疾病。全世界有250多万人受到影响,其中大多数是年轻人。它是一种慢性炎症性疾病,其特征是神经纤维脱髓鞘和轴突继发性破坏,表现为白质组织病变。
多发性硬化的症状
症状因受影响的组织区域而异。第一个最常见的症状是视神经炎引起的视觉障碍以及感觉障碍和疲劳。间歇性症状是运动障碍,疼痛,认知,心理和植物障碍,使疾病具有进行性或复发性。
多发性硬化的病因
炎症过程通过自身反应性外周T淋巴细胞侵入中枢神经系统来解释。然而,这种自身免疫反应的出现尚不清楚。脂肪因子和细胞因子水平之间的遗传不平衡,爱泼斯坦-巴尔病毒(EB病毒)感染引起的自身反应性,维生素D缺乏,吸烟以及改变微生物-肠-脑轴的细菌和病毒肠道生态失调,都与多发性硬化的病理生理学有关。
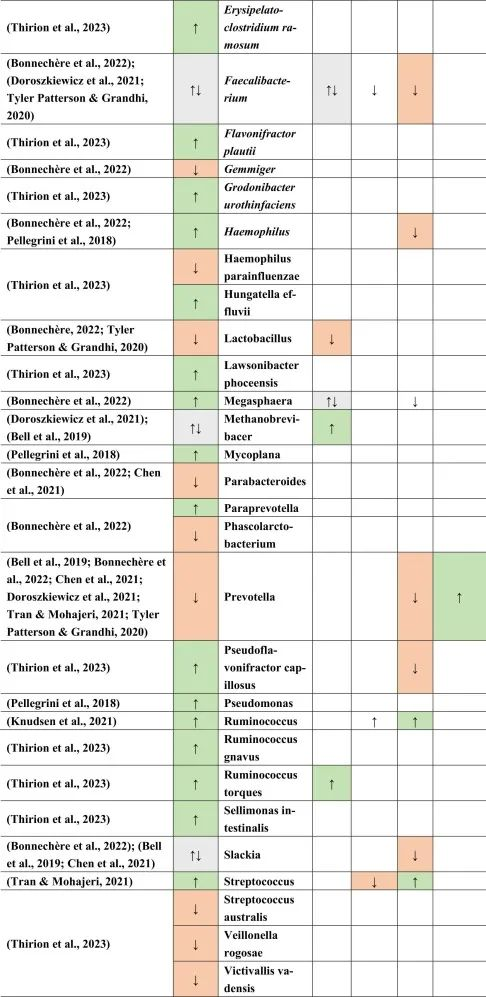
多发性硬化患者与健康对照组微生物群不同
移植了多发性硬化患者粪便物质的GF小鼠复制了自身免疫性脑脊髓炎(一种在动物中发现的脱髓鞘疾病)的表型。这些结果与具有健康对照粪便物质的GF小鼠形成对比。甚至疾病的严重程度和/或活动性似乎也与不同的微生物组成有关。一般来说,抗炎菌群丰度较低。
多发性硬化的微生物群特征
临床活跃的病例(即复发性发作)与临床非活跃的治疗前患者相比,具有更丰富的微生物组。
在比较细菌种类时,临床上不活跃的多发性硬化患者的普拉梭菌(Faecalibacterium prausnitzii)和Gordonibacter urolithinfaciens的丰度显著高于临床活跃的多发性硬化患者。
同一研究发现61种在微生物组成上有差异的物种。多发性硬化中富集的物种如下:
减少的菌群包括:
总体而言,多发性硬化患者的微生物组成丰富度低于健康对照组。这也与多发性硬化相关细菌物种相关的特定炎症生物标志物的丰度更高有关。
其他研究产生了类似的结果,下列菌群增加:
下列菌群减少:
总体而言,拟杆菌门减少,相应的物种也有所减少,例如B.coprocola,B.coprophilus,B.stercoris。
在Faecalibacterium,Slackia,Clostridium,Methanobrevibacter和Butyricimonas中观察到不一致的结果。
在所有引用的有关多发性硬化的文献中,阿克曼菌的增加和普雷沃氏菌的减少一直是菌群持续改变的原因之一。
doi.org/10.1016/j.brainresbull.2024.110883
他汀类药物,NSAID → 拟杆菌↑
与多发性硬化患者相比,他汀类药物和非甾体抗炎药使用者的拟杆菌(一种革兰氏阴性细菌属和SCFA和GABA生产者)增加。
多发性硬化、二甲双胍→Bilophila wadsworthia↑
另一种革兰氏阴性物种Bilophila wadsworthia 在多发性硬化和二甲双胍中增加,但在他汀类药物中减少,这表明二甲双胍可能对多发性硬化患者不利,而他汀类药物对多发性硬化患者有利。革兰氏阴性细菌由于其细胞壁中存在LPS而诱导宿主免疫应答。
多发性硬化、PPI→链球菌↑ 他汀类→ 链球菌↓
链球菌属也是如此,在多发性硬化患者和PPI使用者中发现链球菌数量增加,而在他汀类药物使用者中发现链球菌数量减少。链球菌是一种条件致病菌,可产生神经毒素,乙酸盐和5-羟色胺(5-HT)。
多发性硬化、二甲双胍、PPI → Blautia↑
另一方面,Blautia 在多发性硬化,二甲双胍和PPI中增加。Blautia是丁酸盐生产者,这对于肠道屏障和血脑屏障等完整性以及小胶质细胞成熟和活化很重要。
二甲双胍和PPIs → 梭菌↓
然而,在多发性硬化症患者中,二甲双胍和PPIs使用者的梭状芽孢杆菌数量减少。梭菌产生SCFA,这可能影响Treg细胞,影响多发性硬化患者的自身免疫。
产短链脂肪酸菌Ruminococcus在多发性硬化和他汀类药物和PPI使用后增加。
Prevotella是LPS携带者和GABA生产者和丙酸生产者,NSAIDs增加,多发性硬化和PPIs减少。
双歧杆菌和乳酸杆菌,GABA和乙酸盐生产者在多发性硬化和摄入MET后分别增加和减少,表明这两个属可能影响多发性硬化疾病和进展。
从结果来看,多发性硬化与药物引起的生态失调之间可能存在许多关联。然而,需要更明确的研究结果来证明这些假设的关联。
扩展阅读:
帕金森病(PD)主要症状是运动症状,伴有运动障碍,僵硬,静息性震颤和姿势不稳,由多巴胺缺乏引起,多发生在黑质。路易体聚集体由错误折叠的蛋白质聚集体组成,即淀粉样蛋白,主要是α-突触核蛋白淀粉样蛋白,是多巴胺能神经元破坏的主要原因。
帕金森病的非运动前驱症状及其对疾病进展的影响
帕金森患者在很大程度上受到非运动症状的影响,其中许多症状在运动功能缺失发生前数十年就已出现。胃肠功能障碍,抑郁情绪,睡眠障碍,肌肉和关节疼痛是这些前驱症状中的一些。前者最常见的是便秘或胃排空延迟,流涎,吞咽困难,胃轻瘫和SIBO。患有这些前驱胃肠道疾病的患者帕金森进展更为严重。在ENS神经元中也观察到淀粉样蛋白的形成,特别是在小鼠和帕金森患者的早期。最近的研究表明,大脑中路易体的形成是由小鼠胃肠道中的淀粉样蛋白纤维诱导的,并且通过迷走神经干切断术大大降低了路易体形成的风险。
淀粉样蛋白的交叉形成与肠道微生物的潜在关联
淀粉样蛋白的形成不一定仅限于一种蛋白质。产生淀粉样蛋白的蛋白质可以相互交叉形成淀粉样蛋白。分子过程仍然未知,但可能发生在人类之间以及人类和非人类淀粉样蛋白之间。肠道微生物群中的多个物种能产生包含淀粉样蛋白的生物膜。有人提出,肠道淀粉样蛋白理论上可以通过迷走神经路径传输到大脑,并与α-突触核蛋白交叉促使形成淀粉样蛋白。
大肠杆菌、假单胞菌、链球菌、葡萄球菌、沙门氏菌、分枝杆菌、克雷伯菌、柠檬酸杆菌和芽孢杆菌是肠道中产生这种胞外淀粉样蛋白的候选细菌。Nuzum等人还指出产短链脂肪酸菌的总体丰度较低。因此,肠道微生物群可能既能启动也能调节帕金森病的发起。
帕金森患者的肠道菌群特征
当比较帕金森患者与健康对照组的微生物组成时,在帕金森患者中主要是下列菌群增多:
下列菌群减少:
乳杆菌科不一致,显示出较高和较低的丰度。
doi.org/10.1016/j.brainresbull.2024.110883
在比较帕金森的生态失调和药物引起的生态失调时,假设如下:PPI诱导小肠细菌过度生长,并增加沙门氏菌感染的风险。两者都可能影响帕金森,因为小肠细菌过度生长也在帕金森病患者中发现,沙门氏菌是细胞外淀粉样蛋白的产生者。然而,在PPI和帕金森中没有观察到沙门氏菌作为一个共同因素。
与多发性硬化类似,瘤胃球菌科在帕金森,他汀类药物和NSAIDs中增加。然而,已知短链脂肪酸可以增强BBB的完整性,因此可以降低炎症因子通过大脑从而形成细胞外淀粉样蛋白的风险。
帕金森,他汀类药物,PPI → 粪杆菌↓
另一方面,粪杆菌(Faecalibacterium)是一种已知的丁酸盐生产者,对肠道和BBB完整性以及抗炎菌群具有重要意义,在帕金森,他汀类药物和PPI中减少,这表明粪便杆菌可能是帕金森病患者屏障减弱和炎症过程加剧的原因之一。
二甲双胍和PPIs可能有助于逆转粪杆菌的不利影响
因为二甲双胍和PPIs增加了Blautia的存在,而帕金森患者则减少了Blautia。同样,由于他汀类药物和非甾体抗炎药,瘤胃球菌科的丰度增加,也可以补偿粪杆菌和其他不利菌的影响。这也表明,没有一种药物会产生所有负面或正面影响,例如,PPI会增加Blautia(一种有利的短链脂肪酸生产菌)并同时增加小肠细菌过度生长,这是人体的负面过程。
菌群之间的相互作用力量不可忽视
总体而言,与本文提到的其他药物相比,二甲双胍对微生物组产生的影响与帕金森病中所见的影响最相似。在帕金森患者和二甲双胍使用者中均观察到Akk菌(短链脂肪酸生产者和LPS携带者),青春双歧杆菌(GABA生产者)和大肠埃希氏菌(LPS携带者,5-HT-metabolsier)的丰度增加,其中第一种和后一种细菌是革兰氏阴性,其细胞壁中存在LPS,但也分别产生短链脂肪酸和5-HT。
同样,它们都传达了有利和不利的影响,这表明没有一种细菌是某种疾病发病机制的主要决定因素。菌群之间的相互作用和相对丰度似乎对疾病发作和进展的总体影响很重要。
阿尔茨海默病(AD)是老年痴呆症最常见的形式,约占全球痴呆症病例的50-70%。由于其患病率随着年龄的增长而增加,并且世界人口正在老龄化,阿尔茨海默的发病率在未来几年将更高。在大多数情况下,它始于新形成的记忆的丧失,神经认知和执行功能(如语言和视觉空间取向)进一步下降。
阿尔茨海默病的病理生理学
病理生理学是多方面的,导致不可逆的神经元细胞和突触丢失。除年龄外,阿尔茨海默的其他标志是不溶性淀粉样β斑块的积累,其次是Tau蛋白的神经原纤维缠结,神经递质的失衡和神经炎症。随着年龄的增长,肠道微生物组会发生实质性变化,因此,有人认为与年龄相关的肠道菌群失调也可能导致阿尔茨海默的发病。
扩展阅读:
老年人肠道菌群失衡与阿尔茨海默病发病
在老年人中,随着促炎细菌与抗炎细菌比例的增加以及产短链脂肪酸菌的减少,导致肠漏,BBB紊乱和小胶质细胞活化。后者在清除Aβ斑块方面很重要,当其清除能力因Abeta的过度产生或由于炎症性结构变化导致的能力丧失而受阻时,淀粉样斑块可能会在阿尔茨海默病患者的大脑中积累。
淀粉样蛋白的细菌来源与神经炎症加剧
据推测,淀粉样蛋白也被推测可能来自细菌源,类似于帕金森,要么在大脑中与其他淀粉样结构交叉播种,要么由于肠漏引起的系统性炎症而加剧神经炎症。此外,据报道,通过显著阳性的SIBO呼吸试验(p=0.025)报告细菌移位。阿尔茨海默患者的细菌移位和LPS水平升高都会加剧神经炎症。
主要发现表明促炎细菌埃希氏菌/志贺氏菌水平升高,抗炎直肠真杆菌水平降低。它们失衡可能是认知障碍和淀粉样蛋白合成的主要原因之一,因为在促炎细胞因子和抗炎细胞因子之间发现了各自的相关性,而且大肠杆菌也属于产生淀粉样蛋白的细菌。
阿尔茨海默患者的肠道菌群特征
据报道,阿尔茨海默患者中下列菌群增加:
下列菌群减少:
在厚壁菌门,乳酸杆菌,Lachnospiraceaea和拟杆菌科中发现了不一致的结果。
doi.org/10.1016/j.brainresbull.2024.110883
他汀类药物 → 普拉梭菌↑ → 抗炎
在上述药物和阿尔茨海默病患者中,他汀类药物的使用与改变的微生物群的关联最强。特别是,产丁酸菌普拉梭菌在他汀类药物使用者中增加,这可能有助于维持血脑屏障,因为丁酸盐在抗炎过程和小胶质细胞活化和成熟中起主要作用。
他汀类药物联合PPI → 抵消链球菌富集
他汀类药物与PPI一起使用,可能有助于抵消由于PPI使用而导致的链球菌富集,因为链球菌被认为会产生细胞外淀粉样蛋白。
瘤胃菌科是一种短链脂肪酸生产者,在他汀类药物以及NSAID使用者和阿尔茨海默患者中升高,可能具有与帕金森病相同的补偿作用,因为在阿尔茨海默患者中观察到短链脂肪酸丰度较低。
与帕金森一样,在阿尔茨海默患者中观察到阳性小肠细菌过度生长结果,PPI可能是其主要贡献者,无论是否口服NSAIDs。
扩展阅读:
有力的证据表明药物使用与肠脑轴之间、肠脑轴与神经系统疾病之间分别存在联系。由于药物和神经系统疾病,菌群失调环境中存在共同的细菌菌株。少数药物可以在特定疾病情况下缓解菌群失调,但也可能引起菌群失调。菌群彼此之间及其相互作用将影响肠脑轴,药物在共病患者中通经常联合使用。因此,它们的效果可能相互抵消或加剧细菌种群的相应变化,并与神经系统疾病中的菌群失调呈正面或负面关联。
由于肠道微生物群会因食物、环境、生活方式等各种因素而发生变化,因此在这类研究中也应考虑伴有共病的老年人。当老年人同时服用多种药物且因食欲不振而饮食不佳时,可能会预期其肠道微生物群发生不同的变化。然而,药物引起菌群失调及其通过肠脑轴对神经系统疾病影响的相关性仍是一个新领域。
本文中有些数据也是有限的,没有考虑原发病情况、其他药物的合并使用、药物剂量、药物暴露和服药时间、年龄、性别、患者饮食、共病等混杂因素,缺乏大队列数据支持,目前还没有足够的数据来得出建议性的结论。因此,还需要更多的工作来克服现有的局限性并提供更加坚实的证据基础,包括设计大型的、多中心的、随机对照试验,以收集高质量的数据来验证这些初步发现。
主要参考文献
Garg K, Mohajeri MH. Potential effects of the most prescribed drugs on the microbiota-gut-brain-axis: A review. Brain Res Bull. 2024 Jan 18;207:110883.
Garg K, Mohajeri MH. Potential effects of the most prescribed drugs on the microbiota-gut-brain-axis: A review. Brain Res Bull. 2024 Jan 18;207:110883.
Deng X, Zhang C, Wang P, et al., Cardiovascular Benefits of Empagliflozin Are Associated With Gut Microbiota and Plasma Metabolites in Type 2 Diabetes. J Clin Endocrinol Metab. 2022 Jun 16;107(7):1888-1896.
Epishina IV, Budanova EV. Rol’ mikrobioty cheloveka v razvitii neirodegenerativnykh zabolevanii [A role of human microbiota in the development of neurodegenerative diseases]. Zh Nevrol Psikhiatr Im S S Korsakova. 2022;122(10):57-65.
He D, Han H, Fu X, Liu A, Zhan Y, Qiu H, Ma L, Zhang X, Wang X. Metformin Reduces Blood Glucose in Treatment-Naive Type 2 Diabetes by Altering the Gut Microbiome. Can J Diabetes. 2022 Mar;46(2):150-156.
Knudsen JK, Bundgaard-Nielsen C, Hjerrild S, Nielsen RE, Leutscher P, Sørensen S. Gut microbiota variations in patients diagnosed with major depressive disorder-A systematic review. Brain Behav. 2021 Jul;11(7):e02177.

谷禾健康

脆弱拟杆菌(Bacteroides fragilis)是拟杆菌门拟杆菌属的重要成员。事实上,脆弱拟杆菌因其免疫调节功能而成为该属中研究最多的共生微生物。它是革兰氏阴性、不形成孢子、杆状专性厌氧菌。在人类健康中扮演着复杂而双面的角色。
这种革兰氏阴性专性厌氧菌常见于人类肠道菌群中,但也在口腔、上呼吸道和女性生殖道中检测到。第一个发现的脆弱拟杆菌菌株是从感染患者体内作为病原体分离出来的,随后的研究表明,该物种经常在患有各种炎症性疾病的患者中检测到,例如腹部、皮肤和软组织、骨和关节、女性生殖道、中枢神经系统和下呼吸道感染以及炎症性肠道感染疾病、心内膜炎、菌血症和败血症。
脆弱拟杆菌也通常定植于各种哺乳动物的下胃肠道粘膜表面,包括人类、新生羔羊、牛犊、幼兔和小猪。据报道,这种细菌物种可以代谢饮食和宿主来源的多糖作为碳和能量来源,并且能够耐受氧气暴露。
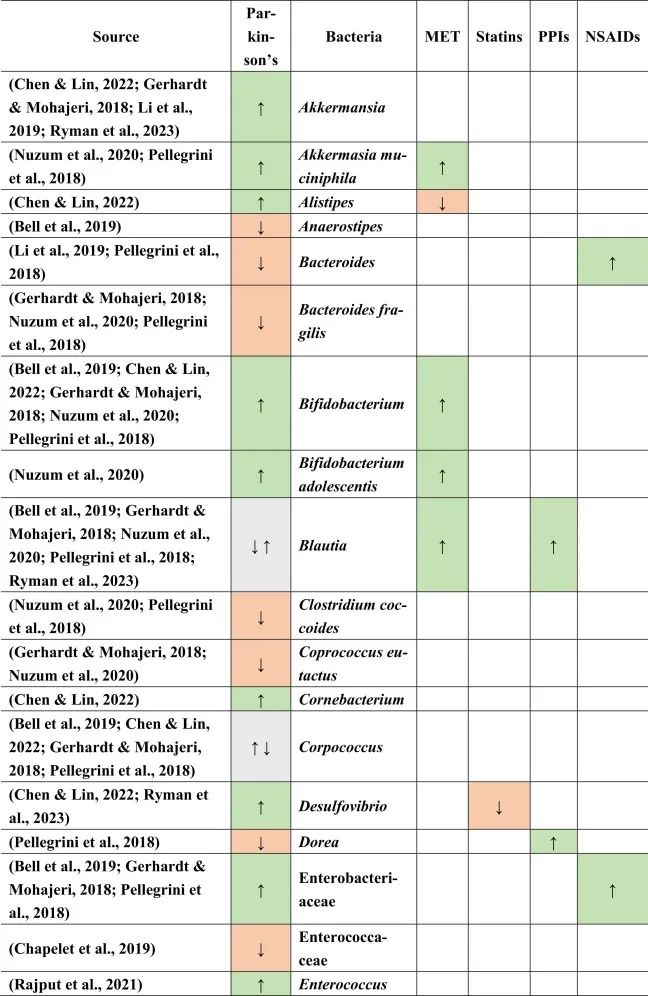
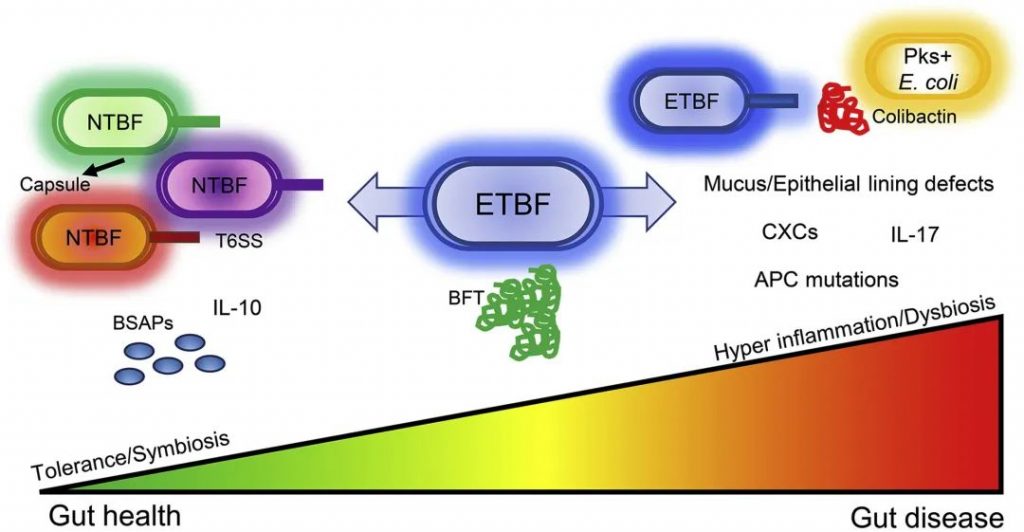
人类脆弱拟杆菌生态位具有物种特异性,使得单一菌株能够占据主导地位并经历适应性多样化。根据合成和分泌脆弱拟杆菌毒素(BFT)的能力分为产肠毒素脆弱拟杆菌(ETBF)和不产肠毒素脆弱拟杆菌(NTBF)。 ETBF 已被确定为临床感染中常见的机会致病菌,可促进慢性炎症,从而导致结肠炎、阿尔兹海默症甚至是结直肠癌。
★ 脆弱拟杆菌的危害
从人类中分离出的脆弱拟杆菌菌株中有10%至20%编码脆弱拟杆菌毒素(BFT),这是一种锌依赖性金属蛋白酶,可通过E-钙粘蛋白裂解损害结肠上皮屏障。BFT是脆弱拟杆菌研究最多的毒力因子之一,目前的证据表明这种毒素可能是慢性结肠炎和结直肠癌的驱动因素。
含毒素菌株或产肠毒素脆弱拟杆菌(ETBF)还会引起儿童和成人的急性和慢性肠道疾病。BFT通过诱导小带粘附蛋白E-钙粘蛋白裂解并启动以炎症和c-Myc依赖性促癌过度增殖为特征的细胞信号传导反应来损害结肠上皮屏障。因此,携带易患结肠炎症或肿瘤形成的基因突变的宿主特别容易受到毒素介导的损伤。最近在具有结肠癌易感位点的人类结肠活检中观察到带有ETBF的生物膜,强烈表明ETBF是结直肠癌的驱动因素。
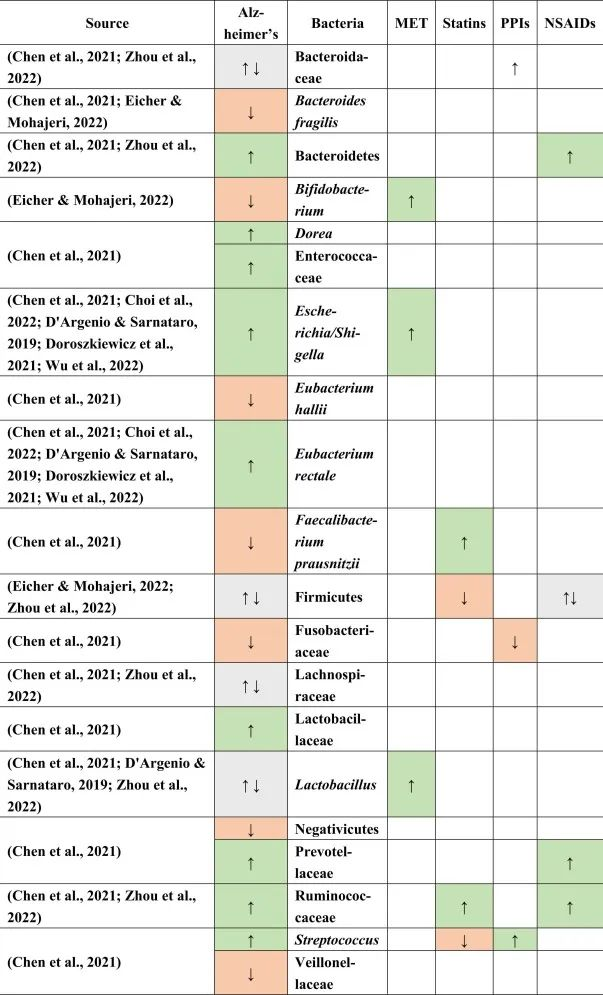
★ 脆弱拟杆菌的益处
尽管与疾病存在关联,但大约20%的人群似乎是无症状的ETBF携带者。不产肠毒素脆弱拟杆菌(NTBF)对结肠上皮细胞有有益作用,增强屏障作用,降低膜通透性,抑制其他病原菌定植,优先占据结肠生态位,维持肠道菌群稳态。
此外,脆弱拟杆菌具有多种代谢潜力,与多糖利用相关的各种基因通过调节肠道微生物群的组成和促进肠道内短链脂肪酸的产生来影响宿主生理机能。
脆弱拟杆菌的功效很大一部分是由于荚膜多糖的合成。据报道,脆弱拟杆菌可产生八种荚膜多糖,考虑到大多数细菌只能合成一种荚膜多糖(如果它们能合成的话),这是一个惊人的数字 。脆弱拟杆菌荚膜多糖A(PSA)由于其免疫调节功能被广泛描述,这种共生细菌产生由抗原呈递细胞处理的独特荚膜多糖,并激活CD4+ T细胞调节炎症细胞因子的平衡。
脆弱拟杆菌/多糖A已被证明可以减少脓肿、细菌感染,预防结肠炎、结直肠癌、改善中枢神经系统疾病、肺部炎症等。
Sun F,et al.Food Res Int.2019
★ 脆弱拟杆菌耐药性很强
多项研究进一步揭示,与胃肠道中的其他厌氧菌相比,脆弱拟杆菌表现出最高的抗生素耐药性和最多的抗生素耐药机制。这不仅使得治疗脆弱拟杆菌引起的感染变得困难,而且有可能成为抗生素抗性基因的储存库,导致它们通过整合转座子、整合遗传元件转移到其他正常细菌菌群中。
甲硝唑只是针对所有脆弱拟杆菌分离株的体外活性最强的药物,应被视为经验性治疗脆弱拟杆菌感染的一线抗生素。但是持续监测不同地理区域脆弱拟杆菌的抗生素耐药性模式对于提供合适的治疗方案和更准确地预防感染至关重要。
人们对脆弱拟杆菌的研究不仅要关注其对肠道健康的积极影响,还应关注其潜在的病原性。了解脆弱拟杆菌的特性对于未来的人群的健康至关重要。
脆弱拟杆菌(B. fragilis)普遍存在于人体内,但随着越来越多的研究和对人体样本的测序,我们发现脆弱拟杆菌在不同人群中存在很大的差异(丰度、菌种组成)。

Sun F,et al.Food Res Int.2019
究竟是什么造成了如此显著的差异,主要总结为:宿主因素和菌群自身的特殊结构以及细菌间的竞争机制。
研究发现,多种因素,包括年龄、饮食、身体状况、药物摄入和生活习惯,都会影响肠道中脆弱拟杆菌的丰度。
★ 饮食对脆弱拟杆菌的丰度有重要影响
其中,饮食对脆弱拟杆菌肠道丰度的影响最大。对蒙古人群饮食干预的研究表明,从含有高水平蛋白质和脂肪的传统饮食转向富含碳水化合物的饮食导致脆弱拟杆菌丰度发生显著变化。
在泰国,对来自两个饮食偏好不同地区的60名健康儿童的肠道微生物群落进行分析发现,来自肉类和碳水化合物占饮食比例较高地区的儿童中脆弱拟杆菌的丰度较高。
此外,在六名患有2型糖尿病或高血压的肥胖受试者中,严格的素食饮食被证明可以增加共生微生物的丰度,例如脆弱拟杆菌。另一项对913名婴儿(1个月)进行的研究显示,母体补充维生素D和婴儿直接补充维生素D与脆弱拟杆菌丰度呈正相关。
★ 不同年龄的人脆弱拟杆菌存在差异
不同年龄段的人肠道中脆弱拟杆菌存在差异。脆弱拟杆菌在宿主体内的丰度在出生时会丰富,弱的粘膜选择性使得多种脆弱拟杆菌菌株能够在婴儿宿主体内共存。
脆弱拟杆菌的持久性在4个月至1-2岁之间增加,这与适应性免疫系统的发育相对应。随着人类肠道微生物群的成熟,脆弱拟杆菌的特定菌株更有可能在肠道定殖。研究表明,随着时间的推移(即数十年),拟杆菌门的成员在宿主肠道内构成最稳定的细菌成分,并且单一菌株通常在该物种中占主导地位。
★ 生活方式和健康状态影响脆弱拟杆菌丰度
与健康人相比,患有真菌性角膜炎、急性阑尾炎、炎症性肠病、家族性腺瘤性息肉病和结直肠癌等疾病的患者肠道细菌微生物组中脆弱拟杆菌的丰度通常会增加。
此外,同一疾病中不同年龄段患者的脆弱拟杆菌丰度也不同,儿童脊柱关节炎患者的脆弱拟杆菌丰度增加,而成人患者则出现相反的现象。
对短期二甲双胍治疗后从2型糖尿病患者收集的粪便样本进行的分析显示,脆弱拟杆菌的丰度有所减少。然而,抗结核治疗导致脆弱拟杆菌的丰度显著增加。
腹泻患者产肠毒素脆弱拟杆菌感染率较高
已在健康个体和腹泻患者的粪便样本中鉴定出产肠毒素脆弱拟杆菌(ETBF)。注意,腹泻患者中ETBF的患病率(20-30%)大约是健康个体(10-20%)的两倍。
来自不同城市和地理位置的报告显示,1岁以上腹泻儿童的ETBF定植百分比高于年龄匹配的对照组。
有趣的是,一岁以下的儿童,患病率在一般人群中最低,并且与腹泻无关,这表明发育轨迹对于腹泻相关性的发生很重要。
肥胖人群的脆弱拟杆菌丰度较高
宿主的生活方式和生理状态也会影响肠道脆弱拟杆菌的丰度。例如,缺乏运动可能会导致脆弱拟杆菌和其他拟杆菌属物种显著富集。
以往的研究表明,脆弱拟杆菌与肥胖呈正相关,肥胖儿童中脆弱拟杆菌的丰度高于瘦儿童。
★ 抗生素和药物的使用减少脆弱拟杆菌
抗生素可以显著改变肠道微生物群的组成,可能导致脆弱拟杆菌数量减少。除了抗生素,其他药物如抗酸药、非甾体抗炎药等也会对脆弱拟杆菌的丰度产生影响。
此外,宿主的遗传背景和不同地理位置也可能影响肠道中脆弱拟杆菌的丰度和组成。
★ 一部分以毒性依赖的方式定植
由于不产毒素脆弱拟杆菌(NTBF)很容易在人类结肠中定殖,并且在小鼠模型中进行的研究表明其有利于宿主T细胞反应的发展。
一种特定的 ETBF 菌株(43859)可以以毒素依赖性方式定植先前被NTBF(TM4000) 占据的生态位。然而,毒素的存在并不是腔内生态位获取或竞争的普遍决定因素,这也部分依赖于脆弱拟杆菌VI型分泌系统(T6SS)和其他遗传决定因素。
中毒促进ETBF的传播。如前所述,在1至5岁儿童中,腹泻患者的ETBF计数会增加。毒素的产生和相关的腹泻可能是病原体通过增加粪口污染在人与人之间传播的关键策略。
霍乱弧菌和肠沙门氏菌等人类肠道病原体利用腹泻作为在人类宿主之间传播感染的手段,因此产肠毒素脆弱拟杆菌也可能属于这种情况。
• 造成多组织感染甚至菌血症
适量的脆弱拟杆菌定植于肠道可能不会引起任何症状,然而,脆弱拟杆菌表现出侵入体内多个组织部位的能力。当这种细菌逃离肠道并进入血液或其他组织时,可能造成感染甚至菌血症。
如果脆弱拟杆菌逃逸到腹腔、血液或其他无菌环境,它可能导致感染,如腹膜炎、菌血症、败血症、脑膜炎、肺炎、皮肤和软组织感染等。
脆弱拟杆菌毒素(BFT)已被证明对肾和肺上皮细胞以及内皮细胞具有体外毒性,表明其在肠外感染中具有潜在作用 。尽管定植的其他遗传决定因素(包括荚膜多糖)与肠外感染和脓肿形成有关,但BFT的这种作用尚未明确定义。
ETBF 在血流分离株和阴道感染样本中可能更具代表性 。
• 与慢性肠道疾病存在关联
产肠毒素脆弱拟杆菌(ETBF)与慢性肠道疾病的关联已经建立了二十多年,首次报道是在炎症性肠病患者中。ETBF还与溃疡性结肠炎和结肠肿瘤呈正相关。
结直肠癌患者中ETBF的相关性包括散发病例和家族病例,表明这种疾病无论何时起病,都具有生理学共性。人群中ETBF的高无症状携带率与 ETBF 相关炎症性肠病和散发性结直肠癌病例数低之间的差异表明,致病性不是随机的,而是取决于未知的宿主易感性决定因素。
• 造成抗生素耐药性
脆弱拟杆菌是已知的可以携带抗生素耐药基因的细菌,这使得感染难以治疗,并且可能导致耐药性在细菌之间传播。
拓展:脆弱拟杆菌毒素的发现
1984年首次报道了脆弱拟杆菌的肠道毒性,描述了羔羊腹泻。当时,产肠毒素菌株和非产肠毒素菌株之间存在明显区别,但腹泻的病因尚不清楚。
1992年,首次证明产肠毒素菌株培养物上清液中的一种成分导致了先前在向羔羊回肠环(LIL)注射细菌时观察到的分泌表型。开发了一种使用结肠癌HT29细胞系进行脆弱拟杆菌毒素(BFT)细胞损伤的体外测定方法,允许同时筛选多种产肠毒素菌株。该毒素最初从培养物上清液中纯化为20-KDa蛋白质,并在LIL和HT29模型中分别具有肠毒性和细胞毒性。
该毒素的部分克隆和表达表明它是一种不耐热的金属蛋白酶。还开发了用于检测毒素的诊断方法,从而可以确认患有ETBF相关腹泻的人中分离出的ETBF菌株中存在肠毒素。
克隆了BFT基因的完整序列,氨基酸序列的表征和生化分析表明,BFT是作为原毒素产生的,经过处理后将活性C末端结构域释放到细胞外环境中 。进一步的研究表明,原毒素的裂解不依赖于金属蛋白酶结构域的锌结合基序,并且整个C末端结构域对于毒素活性至关重要。
详细的结构分析确定,N端前结构域可能参与原毒素通过细胞被膜的分泌以及细菌细胞内毒素活性的抑制。有趣的是,N端结构域包含代表独特折叠的脂蛋白信号肽,而C端金属蛋白酶结构域是真核A解整合素和金属蛋白酶(ADAM)蛋白酶的异种同源物,表明脆弱拟杆菌水平获取BFT。
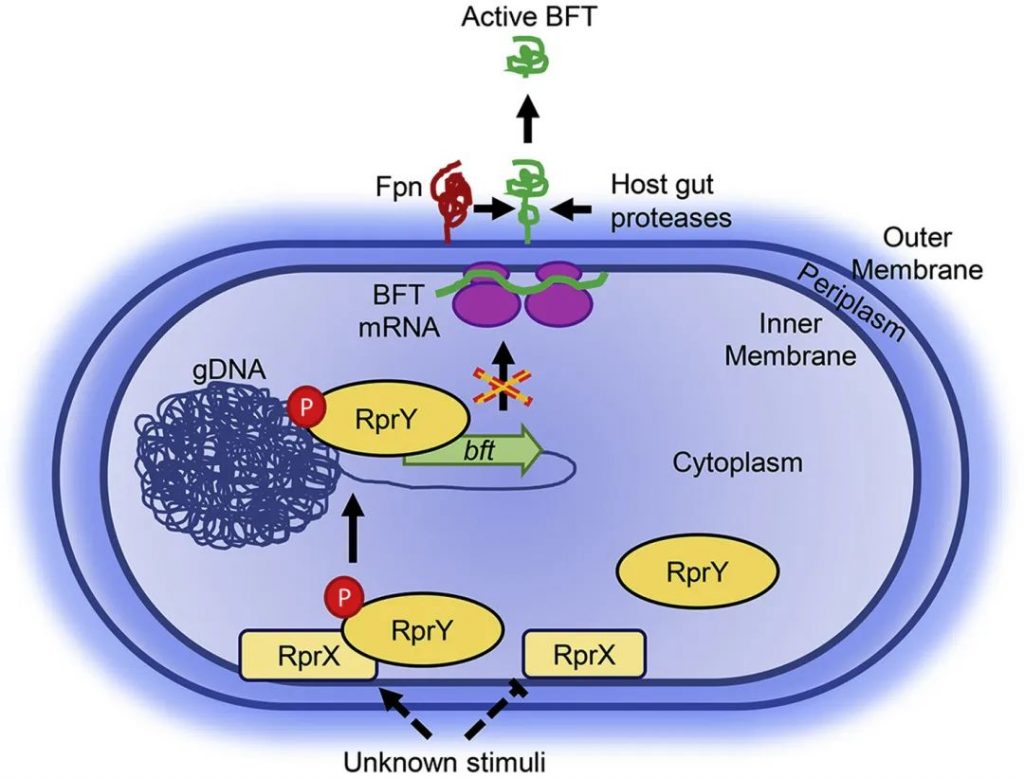
如下图所示,原毒素的裂解可通过来自肠腔的宿主蛋白酶在体内发生。有趣的是,在血液中,BFT只能被单一的内源性细菌半胱氨酸蛋白酶激活命名为fragipain (Fpn) 。当静脉注射细菌时, ETBF fpn突变菌株无法导致小鼠死亡,这表明 Fpn 在 ETBF 介导的脓毒症中的重要性。fpn基因存在于大多数 NTBF 和 ETBF 菌株中,表明 Fpn 除了 BFT 激活之外还有其他作用。
控制脆弱拟杆菌毒素分泌的已知分子机制
Valguarnera E,et al.J Mol Biol.2020
自从发现脆弱拟杆菌毒素(BFT)以来,控制宿主细胞损伤的分子机制已经被描述。当建立HT29细胞模型(结肠癌HT29细胞)时,观察到BFT引起细胞变圆和脱落,推测是由于细胞间连接损伤所致。
经BFT处理的HT29细胞的形态变化被发现是F-和 G-肌动蛋白重排的产物。BFT以蛋白酶依赖性方式与未识别的细胞受体结合,并诱导小带粘附蛋白E-钙粘蛋白的胞外结构域裂解;这种裂解事件仅发生在完整细胞的情况下。
鉴于BFT与ADAM10的相似性,BFT可能直接促进E-钙粘蛋白裂解。由于尚无证据表明BFT可以直接处理细胞E-钙粘蛋白,因此另一种假设是,BFT对其受体或另一种宿主蛋白的活性可能触发导致E-钙粘蛋白丢失的信号传导途径(下图)。
脆弱拟杆菌毒素-宿主细胞相互作用
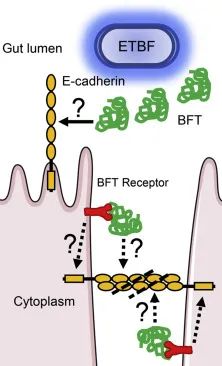
Valguarnera E,et al.J Mol Biol.2020
BFT通过未知受体与结肠上皮细胞(CEC)结合,并触发 E-钙粘蛋白的裂解。
BFT:脆弱拟杆菌毒素;ETBF:产肠毒素脆弱拟杆菌。
• 增加了白细胞介素-8的分泌
BFT介导的E-钙粘蛋白裂解促进β-连环蛋白迁移至细胞核。此外,BFT对E-钙粘蛋白的切割会触发丝裂原激活蛋白激酶(MAPK)和NF-κB通路的诱导,从而增加白细胞介素-8(一种吸引多形核细胞的趋化因子)的分泌。
NF-κB 激活通过诱导 COX2 和增加前列腺素 E2控制肠细胞的液体分泌水平。BFT诱导COX2和血红素加氧酶1 与肠上皮细胞凋亡延迟有关。
• 诱导宿主防御机制,影响疾病进展
BFT还可以诱导宿主防御机制,例如β-防御素2和铁载体结合抗菌蛋白 lipocalin-2 的表达,并且还可以通过 MAPK、AP-1增加人脐静脉内皮细胞的自噬。
受毒素影响的信号通路导致HT29细胞中基因表达差异和表观遗传变化。当毒素刺激取消时,宿主细胞转录谱和表观遗传标记的变化就会消失,这表明ETBF持续分泌毒素可能是疾病进展的一个组成部分。
拟杆菌属的物种在生命早期获得,常见于下胃肠道。给定菌株能否在其生态位中建立成功,有许多潜在的决定因素,包括宿主饮食、发育、抗生素的使用以及与微生物群其他成员的相互作用。
尽管外部因素(例如上述因素)对于定植至关重要,但脆弱拟杆菌携带定植的遗传决定因素,通过与宿主和微生物竞争者相互作用,有助于占据生态位。
• 荚膜多糖
在20世纪70年代的研究中描述了脆弱拟杆菌的荚膜,认为这是该生物体相对于拟杆菌属其他物种的显著特征。这些观察结果,再加上脆弱拟杆菌是人类厌氧感染中最常见的拟杆菌属,尽管其在微生物组中的相对丰度较低,因此得出了脆弱拟杆菌荚膜与疾病发病机制有关的假设。
荚膜多糖利于脆弱拟杆菌在宿主体内生存
事实上,研究表明脆弱拟杆菌减少了免疫细胞的吞噬作用,从而增加了结肠腔外的细菌适应性。与这一发现一致,荚膜多糖是脆弱拟杆菌形成肠外脓肿的主要因素。
脆弱拟杆菌(B.fragilis)拥有8个不同的基因组位点,每个基因座都编码合成特定荚膜多糖变体所需的酶。这些基因座的表达是通过启动子倒位为“开”或“关”构型来调节的。
当脆弱拟杆菌经过动物传代时,荚膜多糖水平会增加,表明其在宿主体内的生存中发挥着关键作用。无菌小鼠的单定植实验表明,任何荚膜多糖都足以建立生态位;然而,这一发现并不表明所有荚膜变体在宿主内具有免疫等效性,或者单个荚膜变体足以在复杂的生态系统中定植。
荚膜多糖会影响免疫,使脆弱拟杆菌更耐受
B. fragilis荚膜多糖由两性离子聚糖的重复单元组成。与大多数聚糖抗原不同,多糖A(PSA)可以在MHCII抗原呈递细胞的背景下呈递,诱导调节性T细胞的形成,从而有助于对脆弱拟杆菌的免疫耐受。
PSA通过Toll样受体(TLR)2 途径诱导IL-10产生,并抑制无菌小鼠中IL-17的产生,从而促进低炎症环境 。然而,缺乏PSA不会降低不产肠毒素脆弱拟杆菌(NTBF)定植的小鼠中的 IL-10。对于产肠毒素脆弱拟杆菌(ETBF),最近使用人类结肠组织活检的速冻样本进行的研究表明,PSA表达与脆弱拟杆菌毒素基因携带之间呈负相关,这表明可能会加剧炎症。
总之,这些研究表明可能存在菌株和环境依赖性调节元件来调节宿主对脆弱拟杆菌多糖的反应。
• 多糖利用位点
多糖利用位点(PUL)是专门负责复杂聚糖分解和同化的特殊位点;这些构成了一些拟杆菌属物种基因组含量的近20%。
加工不同的膳食多糖增加了生存机会
不同的PUL可以加工不同的多糖,使拟杆菌能够加工膳食聚糖和宿主聚糖。营养物质利用的多功能性增加了宿主饮食变化期间的生存机会;因此,拟杆菌属物种内的PUL多样性是生态位获取和稳定生态位占有的关键。
通过基因筛查发现了“共生定植因子”(ccf)操纵子,ccf操纵子的结构类似于拟杆菌属的典型多糖利用位点(PUL)。与大多数PUL类似,ccf操纵子由控制基因表达的转录调节因子sigma/antisigma因子对(ccfA和ccfB)组成。ccfA/B的下游是TonB依赖性受体,它将分解产物转运到细胞周质(ccfC)和SusD样辅助脂蛋白 (ccfD),这是控制ccfC营养转运所需的。
最近的一项研究表明,ccf基因座控制荚膜变异,抑制PSA并诱导多糖C(PSC)表达。ccf功能允许响应PSC建立IgA依赖性生态位,使脆弱拟杆菌细胞能够定位到更靠近肠道上皮的位置。
• 脆弱拟杆菌溶血素
许多革兰氏阴性和革兰氏阳性细菌分泌裂解红细胞的酶,称为溶血素。脆弱拟杆菌也不例外,因为许多菌株携带溶血素直系同源基因。溶血素A和B(分别为HlyA和HlyB)已被证明在体外对红细胞具有酶活性。
缺乏溶血素A和B的脆弱拟杆菌适应性较低
缺乏hlyA/B基因的脆弱拟杆菌突变株在体外和体内表现出适应性降低,表明溶血素可能参与定植。但目前尚无明确证据表明溶血素在脆弱拟杆菌引起的疾病发病机制中具有特定作用。
• 神经氨酸酶
细菌糖苷酶无处不在,被许多生物体用来降解复杂的多糖,以达到营养和生态目的。而脆弱拟杆菌和其他拟杆菌属可以通过分泌神经氨酸酶将唾液酸从宿主糖蛋白上裂解下来。
神经氨酸酶有助于脆弱拟杆菌利用更多的营养物质,从而帮助定植
唾液酸通常存在于宿主糖蛋白上。研究最多的来自脆弱拟杆菌的神经氨酸酶是由nanH基因编码的。nanH的缺失会产生突变株。
宿主糖蛋白的唾液酸释放和利用可能作为营养多样性的额外衡量标准,这对肠道共生至关重要。神经氨酸酶似乎还通过释放唾液酸和发现其他聚糖部分来增加脆弱拟杆菌与哺乳动物上皮细胞的结合。nanH基因的存在也被用作附加分类信息的手段,用于对感染部位和粪便样本中分离的脆弱拟杆菌进行分类。
• 蛋白酶
脆弱拟杆菌已被证明可产生除脆弱拟杆菌毒素和脆杆蛋白酶以外的其他蛋白酶。在脆弱拟杆菌菌株的基因组中发现了C10家族(BFP)的半胱氨酸蛋白酶子集。
蛋白酶有助于适应环境变化
BFP基因表达,特别是BFP4,在体外随着氧气浓度的增加而被诱导,这表明BFP在适应环境变化中具有一定的作用。
BFP基因在感染部位的细菌分离物和健康捐赠者的粪便样本中均被发现;然而,尚未对同基因BFP缺失菌株进行评估,以评估BFP在致病性中的作用。
在脆弱拟杆菌中也发现了一种纤维蛋白原降解蛋白酶,尽管其在毒力中的作用尚不清楚。
• 粘附分子
细菌细胞通过粘附素粘附到基质上,粘附素是特异性结合宿主细胞受体的蛋白质。许多粘附素表达为菌毛或菌毛的一部分。
在拟杆菌等共生肠道细菌中,与肠道粘液和上皮细胞的结合有利于稳定的肠道生态位定植。在人类中,绒毛菌株更常见于脓肿和健康粪便样本,而非绒毛菌株则富含血液感染的分离株。
细胞粘附性丧失会促进肠外传播和免疫逃避
粘附的毛状拟杆菌更容易被中性粒细胞吞噬;因此,细胞粘附性的丧失可以促进肠外传播和免疫逃避。
在血液分离物中比在脓肿或健康粪便分离物中更频繁地观察到与红细胞的特异性结合或血凝作用。
结合蛋白有助于脆弱拟杆菌在肠外存活
脆弱拟杆菌还呈现细胞外基质(ECM)结合蛋白,表明其在肠外存活中发挥作用。与ECM中最丰富的蛋白质纤连蛋白的结合是由类似于TonB依赖性受体BF1991的蛋白质介导的。
令人惊讶的是,缺乏BF1991的突变菌株比野生型菌株对纤连蛋白的粘附性更强,这表明存在多余的纤连蛋白结合蛋白。BF1991突变体在体外更容易被巨噬细胞吞噬。
脆弱拟杆菌与层粘连蛋白-1和胶原蛋白-1的结合也有报道。与其他人类病原体类似,脆弱拟杆菌可以与凝血相关的血浆蛋白相互作用。BF-FBP是一种54-KDa的蛋白质,可结合纤维蛋白原,纤维蛋白原是纤维蛋白脓肿形成的主要成分。
其他蛋白质可以结合纤溶酶原和高分子激肽原,但在脆弱拟杆菌操纵宿主凝血过程中的作用尚不清楚。脆弱拟杆菌可能结合的宿主靶标的多样性使我们能够假设体内可能会诱导不同的结合模式作为对环境和宿主线索的反应。
• 氧化应激反应
由于肠腔内的氧气浓度梯度,肠道细菌暴露于宿主外部和肠腔内的氧气。拟杆菌临床分离株比非临床分离株具有更高的耐氧性,表明这种适应在发病机制中发挥着作用。
含氧量会影响脆弱拟杆菌的感染率
氧化应激反应(OSR)机制在肠外感染的情况下可能特别具有保护作用,因为肠外感染时组织的含氧量比肠腔的含氧量更高。
厌氧/需氧通量可以改变基因表达谱,潜在地改变生物体的致病性及其与腹部和腹膜感染的关联。尽管脆弱拟杆菌可以在低摩尔氧浓度下生长,但暴露于较高浓度的氧气会阻止其生长;因此,需要OSR来避免细胞氧化损伤。
注:OSR是通过大量具有不同功能的蛋白质来实现的,包括超氧化物歧化酶、过氧化氢酶、过氧化物酶、铁储存蛋白和硫氧还蛋白。转录因子OxyR负责诱导OSR途径中的许多基因。据报道,另一种转录因子bmoR是OSR的组成部分,可诱导维持细胞内氧化还原状态所需的基因。
• 其他环境刺激,例如胆汁酸
脆弱拟杆菌已被证明对胆汁盐的存在有反应,在体外增加细胞粘附和聚集。
没有证据表明拟杆菌属的胆汁盐耐受性是一种致病性状,而不是环境应激反应的一部分。mar系统等转录调节因子介导对抗菌药物和其他环境压力源的耐药性。
• 拟杆菌中的T6SS
栖息在肠道中的细菌大量存在,并且在这种环境中争夺稳定位置的情况通常存在。有毒蛋白的分泌是一种常见的竞争机制,最近多项研究表明T6SS在拟杆菌生态位建立中的重要性以及更广泛的肠道内细菌间竞争。
六型分泌系统(T6SS)是病原菌中高度保守的蛋白质分泌系统,可分泌效应蛋白作用于真核宿主或其他细菌,从而促进其生存及感染。
T6SS类似于反向噬菌体,序列和结构分析表明这些系统之间存在同源性。T6SS通过以接触依赖性方式将效应物(毒素)直接从细菌细胞的细胞质分泌到另一个细胞中来发挥作用。
细菌细胞分泌T6SS效应子时会合成特定的免疫蛋白,从而抵抗姐妹细胞的攻击。每个效应蛋白都包含一个同源免疫蛋白,通常由邻近基因编码。尽管已经表明某些细菌可以利用T6SS将毒素注入真核细胞,但大多数物种使用T6SS作为细菌间杀伤机制。
在拟杆菌目的物种中,编码T6SS的基因可以存在于被称为基因组结构(GA)、GA1、GA2和GA3的三种不同遗传排列中。虽然GA1和GA2存在于拟杆菌目的许多物种中,但GA3仅限于脆弱拟杆菌。对脆弱拟杆菌GA3限制的进化解释是,GA1和GA2可以通过遗传元件在细菌细胞之间动员,但GA3不包含这种传播特征。
携带T6SS的脆弱拟杆菌有助于竞争中占据优势
根据人类微生物组的序列分析,存在于高达75%的人群中。携带T6SS的拟杆菌在人类中的高流行表明该基因在结肠生态位建立的竞争中发挥着重要作用。
大多数成年人宿主都被单一脆弱拟杆菌菌株定殖;T6SS是幼儿期初始利基获得的关键特征。同一项研究表明,携带T6SS的脆弱拟杆菌与同一生态系统中其他拟杆菌属的增加之间存在关联,这表明GA3效应子-免疫对在体内主要用于脆弱拟杆菌菌株之间的竞争。这可能是由于其他拟杆菌属物种在结肠内占据不同的地理位,限制了脆弱拟杆菌的T6SS的负面影响。
• 拟杆菌中的抗菌蛋白
除了接触依赖性杀伤作用外,拟杆菌还能分泌可溶性毒素。拟杆菌基因组携带编码毒素的基因,这些毒素属于拟杆菌目分泌的抗菌蛋白(BSAP)。
抗菌蛋白对于体内外菌株竞争非常重要
BSAP是含有膜攻击复合物/穿孔素(MACPF)结构域的蛋白质的直系同源物,已被证明对于拟杆菌属物种之间的体外和体内菌株竞争非常重要。
• 拟杆菌分泌的类泛素蛋白
拟杆菌属物种还可以分泌一种类泛素蛋白,介导细菌间杀伤作用。用于细菌竞争的各种各样的接触依赖性和非接触依赖性机制和效应分子强化了这样的概念:单一遗传决定因素不足以在给定生态位中击败许多不同的生物体;多种遗传因素可能控制脆弱拟杆菌占据的生态位。
因此,菌株之间的基因组多样性降低了单一菌株用作通用益生菌以取代肠道生态系统中的ETBF的可能性。目前来看,基因功能的管理仍然是理解脆弱拟杆菌基因组15-20%菌株特异性部分在定植中的作用的主要瓶颈之一。
当我们说脆弱拟杆菌是条件致病菌时,意思是在正常情况下,它可能是无害的,但在特定条件下(如免疫力低下),它可以引起疾病。这种菌在特定的环境或宿主状态下,具有潜在的致病能力。而在一般情况下,其可能有一定的健康益处。
迄今为止,共生不产肠毒素脆弱拟杆菌(NTBF)菌株已被证明可以抑制不同器官的炎症,包括腹膜、肠道、大脑和肺。这些菌株还可以抑制病原菌感染并支持癌症治疗。
多糖A(PSA)已被确定为脆弱拟杆菌NCTC 9343产生的主要功能分子。这种多糖具有由重复寡糖单元组成的两性离子结构,该重复寡糖单元包含具有游离氨基和羧基的组成糖,并且对于菌株的有利生物活性至关重要。
此外,脆弱拟杆菌产生的两性离子PSA已被确定为一种免疫调节分子,在免疫系统成熟中发挥作用。T 辅助细胞1(TH1)和TH2细胞是效应CD4+ T细胞群的亚型。在之前的一项研究中,脆弱拟杆菌NCTC 9343或多糖A(PSA)都可以纠正无菌小鼠中的TH1/TH2细胞失衡并增强调节性T细胞(Treg)功能。
最近的研究揭示了脆弱拟杆菌NCTC 9343以及相关PSA在不同疾病中使用的免疫调节机制。新发现的菌株B. fragilis ZY-312 也已被证实对宿主发挥有益的免疫调节作用。
此外,源自涉及碳水化合物发酵(包括脆弱拟杆菌)的肠道微生物群的短链脂肪酸,例如主要是乙酸盐、丙酸盐和丁酸盐,具有有益的功能,包括为结肠粘膜提供能量和维持结肠稳态。
例如,口服脆弱拟杆菌可以显著增加沙门氏菌感染大鼠肠道内容物中的短链脂肪酸浓度,这可能会进一步减少炎症并恢复肠道屏障的完整性。
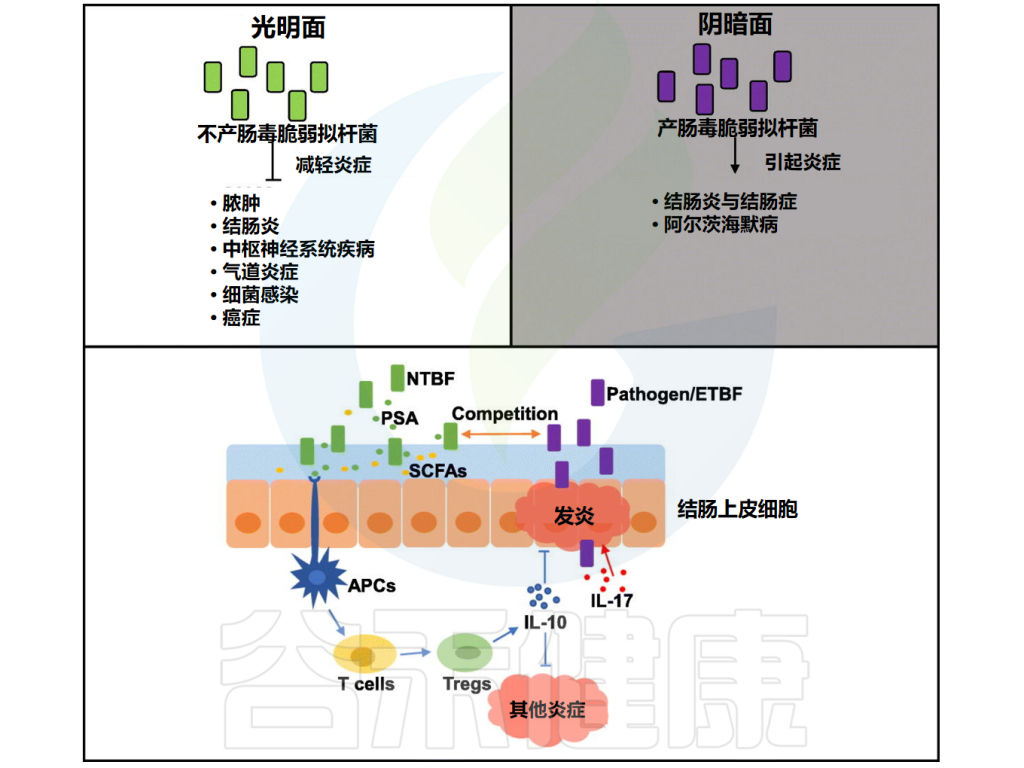
脆弱拟杆菌的免疫调节作用

Sun F,et al.Food Res Int.2019
经过二十年的研究,脆弱拟杆菌荚膜多糖的免疫调节特性已被阐明。研究表明,皮下注射脆弱拟杆菌NCTC 9343 (ATCC 25285) 和 ATCC 23745 荚膜复合物(包含多糖A和多糖B(PSB)),可以防止脓毒症形成的腹腔内脓肿。
尽管这种保护活性可能不符合抗原特异性的传统标准,但它可能专门针对多糖上带相反电荷基团的基序。因此,观察到的保护将是T细胞依赖性的。
• 通过介导T细胞产生细胞因子减轻脓肿
随后的研究还表明,脆弱拟杆菌产生的两性离子多糖介导CD4 + T细胞反应。观察到的反应需要抗原呈递细胞(APC)内化PSA,然后抗原呈递细胞将 PSA 抗原呈递到主要组织相容性复合物(MHC)II类分子上 。CD4+ T 细胞通过产生白细胞介素-2、干扰素-γ和IL-10等细胞因子,进一步提供针对病原菌引起的脓肿的保护。
特别地,IL-2被鉴定为脓肿形成的重要抑制剂。
下面还将讲述其他研究报道了脆弱拟杆菌相关疾病与具体免疫机制的关联,包括脆弱拟杆菌NCTC 9343 PSA免疫调节机制的典型例子。
对小鼠的研究表明,脆弱拟杆菌(B.fragilis NCTC 9343)释放的多糖A(PSA)对结肠炎的治疗具有显著影响,并且可以防止体重减轻和炎症。
• 多糖A具有抗炎作用,并有效抑制促炎细胞因子产生
作为一种有用的抗炎分子,PSA被证明可以通过扩大产生IL-10的CD4+CD45Blow T细胞的数量和抑制促炎性IL-17的产生来介导健康的免疫反应并预防小鼠中肝螺杆菌诱导的结肠炎。
在无菌小鼠中,脆弱拟杆菌定殖需要TLR2信号来诱导CD4+Foxp3+T调节细胞的发育,并通过产生IL-10来增强炎症抑制能力。值得注意的是,PSA在动物模型中不仅可以预防结肠炎,还可以治愈结肠炎。
外膜囊泡(OMV)中包装的PSA可改善动物结肠炎,类似于口服纯化PSA的效果。此外,最近的一项研究证明了一种相互作用机制,其中脆弱拟杆菌OMV 可以激活非典型宿主自噬途径,从而预防 2,4-二硝基苯磺酸 (DNBS) 诱导的结肠炎。该机制同时需要宿主炎症性肠病相关基因ATG16L1和NOD2的表达。
• 脆弱拟杆菌对适应性免疫与先天免疫都有益
ZY-312 是一种从健康婴儿粪便中分离出来的新型非肠毒素脆弱拟杆菌菌株,最近被证实是拟杆菌门的潜在下一代益生菌候选者。研究报告称,除了对适应性免疫的影响外,脆弱拟杆菌还与先天免疫系统有关。B. fragilis ZY-312 可增强巨噬细胞的吞噬活性并诱导极化至M1表型。
• B.fragilis ZY-312 未来可能成为重要益生菌
进一步的研究表明,B. fragilis ZY-312 可以缓解抗生素相关性腹泻(AAD)大鼠模型中的腹泻并增加微生物丰度。所有这些作用都促进了肠道屏障的恢复和肠上皮细胞的再生,这些机制可能解释了 AAD 治疗的策略。
脆弱拟杆菌产生的短链脂肪酸还可以增加结肠 Tregs 的数量并预防结肠炎。一项体外研究还表明,源自脆弱拟杆菌的短链脂肪酸可以抑制可能导致患者腹泻的产气荚膜梭菌的孢子形成。
据报道,脆弱拟杆菌对宿主具有间接影响,这归因于其独特的免疫调节功能。脆弱拟杆菌分泌的多糖A(PSA)是中枢神经系统脱髓鞘疾病的有效调节剂和抑制剂。
• 预防和改善抗生素引起的肠道细菌变化
在一项实验性自身免疫性脑脊髓炎(EAE)小鼠模型研究中,纯化的脆弱拟杆菌PSA被证明可以预防和治疗口服抗生素治疗引起的肠道细菌变化和疾病发展。人们发现这种保护机制依赖于IL-10的产生。
进一步研究表明,脆弱拟杆菌PSA可能通过TLR2介导的CD39信号传导预防 EAE,并且CD4+细胞上 CD39 的表达可能与分泌IL-17的Th17和分泌IL-10的Tregs之间的平衡有关。
• 改善神经发育障碍和胃肠道异常
上述发现表明肠粘膜组织、大脑和脊髓之间存在复杂的相互作用。与此同时,在怀孕期间腹腔注射 20 mg/kg Poly(I:C) 诱导母体免疫激活 (MIA) 的小鼠后代中也发现了肠道-微生物组-大脑的联系。
这些后代表现出自闭症谱系障碍(ASD)的特征,伴有社交障碍和胃肠道屏障缺陷。然而,口服脆弱拟杆菌可以改善这些缺陷后代的神经发育障碍和胃肠道异常。
脆弱拟杆菌与人体之间相互作用的潜在免疫机制
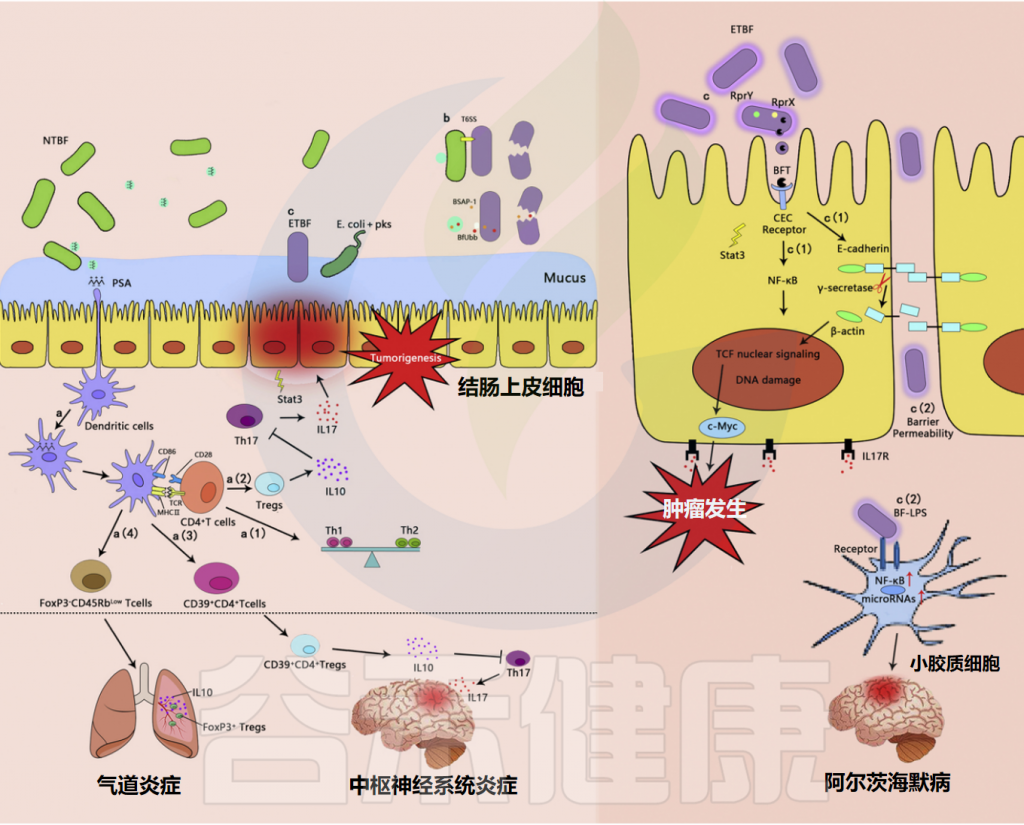
Sun F,et al.Food Res Int.2019
最近的研究表明,脆弱拟杆菌PSA可以通过诱导 CD4+ T 细胞的扩增和IL-10的产生来预防气道炎症和实验性哮喘。与免疫的系统性本质一致,研究证实PSA激活的效应/记忆T细胞可以与肺组织中的FoxP3 + Tregs协同预防肺部炎症。
首先,PSA抗原被内化并呈递在APC表面表达的MHC II类分子上,促进肠道中CD4+ T细胞的激活。接下来,效应T细胞与肺部常驻FoxP3 + Tregs之间的通讯会增强Tr1细胞的抑制能力,最终导致抗炎细胞因子IL-10的释放并预防肺部炎症。
如上所述,脆弱拟杆菌的荚膜多糖通过依赖于CD4+ T细胞激活和随后T细胞驱动的 IL-10 产生的机制抑制气道炎症。
研究发现,脆弱芽孢杆菌NCTC 9343 可预防多种病原体,包括肝螺杆菌和汉氏巴尔通体。最近的一项研究发现,新型脆弱拟杆菌菌株ZY-312分泌的某些物质可以预防副溶血性弧菌感染。另一项研究表明,根据T6SS竞争机制,共生NTBF可以限制致病性ETBF的定植并预防结肠炎。
如上所述,BSAP-1是影响微生物群菌株水平组成的重要竞争因子。因此,我们推测脆弱拟杆菌在种间竞争中既使用了已知的竞争机制,也可能与病原体竞争。
B.fragilis NCTC 9343 还有效促进抗癌免疫监视。口服脆弱拟杆菌或多糖可以逆转 CTLA-4 阻断抗癌疗法的无反应性。然而,许多患者不能很好地耐受多种副作用,特别是促炎作用。
幸运的是,最近的一项小鼠研究发现脆弱拟杆菌减轻了广泛使用的抗癌免疫抑制剂甲氨蝶呤(MTX)引起的不良反应。PSA 在体外诱导 IL-8 的产生,这可能会抑制结直肠癌细胞的增殖并限制上皮间质转化。
在体内,脆弱拟杆菌可以预防结肠癌的发展。AOM/DSS 诱导的结肠炎相关结肠癌小鼠模型在施用脆弱拟杆菌后表现出肿瘤发生减少。
ETBF菌株与多种涉及肠道和肠外感染的病症有关,包括炎症性肠病、菌血症、全身炎症和神经系统疾病。


Sun F,et al.Food Res Int.2019
然而,无症状ETBF定植在成人中也很常见。事实上,ETBF和NTBF都可以长期定植于人体等宿主,尽管只有前者可以触发致癌的多步炎症反应。
在儿童中,ETBF相关腹泻通常发生在1至5岁之间。在成人中,ETBF相关腹泻的发生率可能随着年龄的增长而逐渐增加。
一项针对台北市513名肠胃炎患者的研究显示,ETBF感染多发生于老年人和寒冷干燥的冬季。此外,ETBF相关腹泻因地理位置而异。
接下来我们重点讲述两种ETBF会引起的疾病。
结肠炎和结直肠癌与携带产肠毒素脆弱拟杆菌(ETBF)之间的关联产生了这样的假设:由于其组织损伤性毒素,该菌株是结直肠癌的致病因子。
• 感染ETBF可能导致结直肠癌
ETBF可以释放复杂的毒素。一个值得注意的ETBF 毒力因子是脆弱拟杆菌毒素(BFT),一种锌依赖性金属蛋白酶,具有三种不同的分子亚型(BFT-1、-2和-3)。
最近的一项研究表明,BFT可能被fragipain激活。此外,与外膜成分发生疏水和静电相互作用的BFT可能在囊泡形成过程中分泌。
ETBF的暂时扩张会破坏肠粘膜和毒素调节系统 RprXY,从而诱发炎症性肠病和结直肠癌。ETBF被认为是结直肠癌的危险因素,因为它增加肠上皮细胞的通透性并促进细胞增殖,这与结肠炎和结直肠肿瘤的发生有关。此外,还发现ETBF比例与结直肠癌发生之间存在显著关联。
• 感染ETBF会诱导结肠炎的产生
研究表明,口服接种ETBF可以引发肠上皮中细胞间粘附蛋白 E-钙粘蛋白的严重裂解,导致无特定病原体小鼠出现持续性亚临床结肠炎,但在无菌小鼠中迅速导致致命性结肠炎。
进一步的报告显示,ETBF产生的BFT可能与假定的结肠上皮受体结合,在γ分泌酶调节的过程中刺激β-肌动蛋白-T细胞因子核信号传导。这种结合会诱导 E-钙粘蛋白的裂解,从而促进原癌蛋白 c-Myc 的表达,并最终促进细胞增殖。
此外,在被结肠上皮受体识别后,BFT被证明可以激活 Wnt 和 NF-κB 信号通路,导致 ETBF 诱导的结肠炎小鼠模型中免疫细胞中的Stat3持续激活和粘膜 Th17 免疫反应。
研究发现,家族性腺瘤性息肉病(FAP)患者的结肠粘膜中脆弱拟杆菌毒素基因高度富集。超过一半的FAP患者同时被ETBF和携带基因毒性pks基因岛的大肠杆菌菌株共同定殖,从而产生协同致癌作用。
ETBF可以降解粘膜,以促进大肠杆菌pks+E对粘膜组织的再定植。因此,活性氧和IL-17的产生会增加结肠上皮细胞的DNA损伤,导致癌变。
ETBF可能因肠道菌群失调和屏障功能障碍而进入血流。最近的研究表明,极度促炎的脆弱拟杆菌脂多糖(BF-LPS)通过胃肠道裂口渗漏到血液中,是导致宿主发生全身炎症的主要因素。BF-LPS还可能穿过血脑屏障,逐渐促进阿尔茨海默病的发展。
• 可能导致促炎性退行性神经疾病的发生
一旦被小胶质细胞上的TLR2、TLR4 CD14识别,BF-LPS可以引发NF-kB 复合物(一种炎症转录因子)以及促炎性 microRNA 的表达。
这些事件抑制 miRNA 结合 mRNA 的表达并触发骨髓/小胶质细胞中的受体,与大脑中散发性阿尔茨海默病的观察结果一致。
因此,我们认为与人类胃肠道微生物组相关的神经毒素,例如 BF-LPS,可能是促炎性退行性神经病理学的驱动因素。
除此之外,产肠毒素脆弱拟杆菌(ETBF)对肠道健康具有重要影响。
• ETBF与肠道稳态紧密相关
研究发现,经口灌胃产肠毒素脆弱拟杆菌(ETBF)后,约4周出现结肠疾病。BFT驱动的APC突变小鼠结肠细胞损伤以Stat3和IL-17依赖性方式触发过度增殖反应和炎症级联反应。
IL-8和其他CXC趋化因子的分泌会招募未成熟的多形核细胞,导致炎症和细胞损伤加剧。这些实验表明,ETBF可以在易患模型生物体中彻底重塑结肠上皮,使其进入疾病状态。
最近,来自健康个体和结肠癌患者的粘膜细菌群落被证明可以在三种Apc模型中诱导肿瘤。肠道上皮稳态的主要扰动似乎伴随着更严重的产肠毒素脆弱拟杆菌依赖性表型。
脆弱拟杆菌毒素对免疫反应的影响
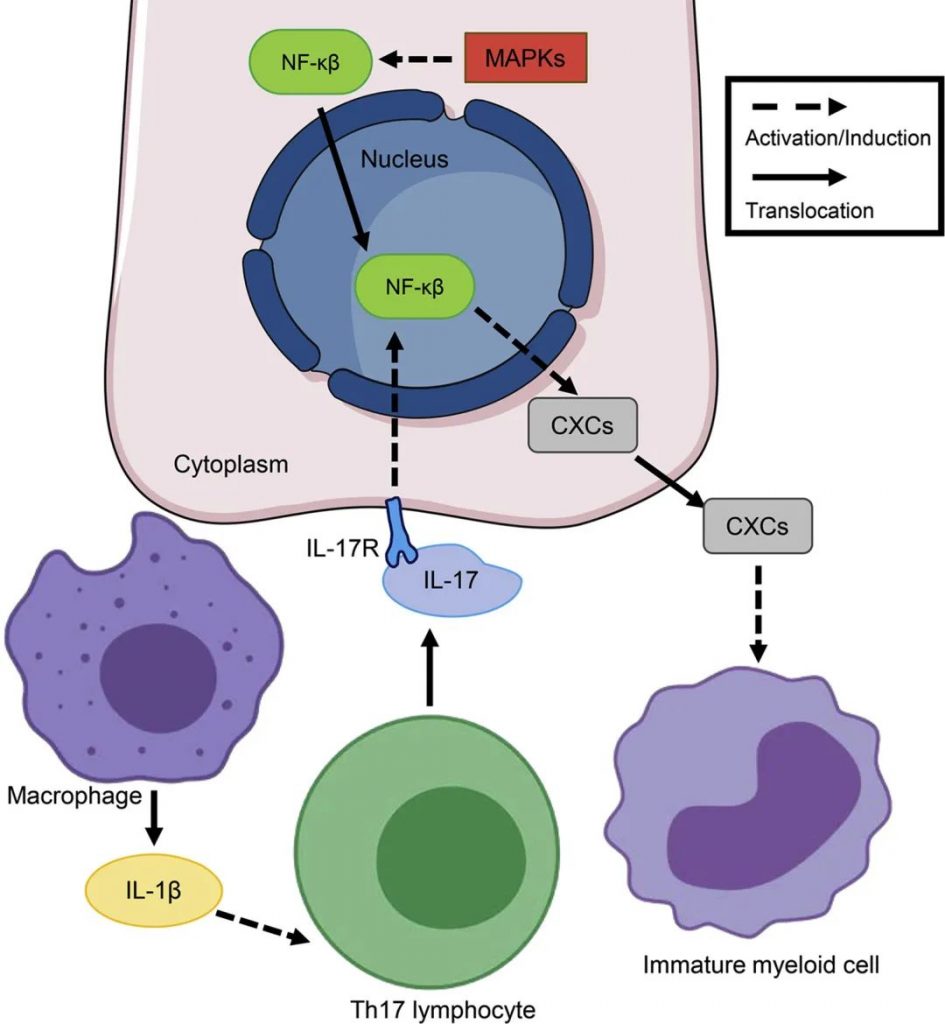
Valguarnera E,et al.J Mol Biol.2020
细胞损伤和炎症需要激活β-catenin/Wnt、STAT3 和NF-κβ通路。固有层内的巨噬细胞分泌促炎细胞因子,促进Th17细胞表型。结肠上皮细胞分泌CXC 趋化因子,例如IL-8,促进骨髓细胞募集到损伤部位。
• 肠道稳态期间毒素可能被消除
每个个体对结肠炎症和生态失调的内在倾向可能决定ETBF是否表现出与无症状定植或严重结肠疾病一致的表型。宿主对ETBF的易感性由哺乳动物宿主细胞本身和共生微生物的状态决定,它们共同形成复杂且动态的生态系统。
在肠道稳态期间,毒素的产生可以被消除,或者在具有健康粘液层和共生微生物组的宿主中变得无害。肠道环境的扰动可能引发ETBF的致病性,导致炎症和生态失调。
调节ETBF共生性或致病性程度的宿主和微生物因素
Valguarnera E,et al.J Mol Biol.2020
由于脆弱拟杆菌毒素(BFT)的分泌和细胞损伤,ETBF携带可能导致结肠疾病的风险,但宿主易感性是ETBF疾病的关键。不允许ETBF定植的健康稳态微生物群落应包含与ETBF竞争结肠生态位的NTBF细菌。
NTBF要求胶囊定植并通过T6SS和BSAP建立竞争。
• ETBF感染影响益生菌干预的效果
益生菌干预可能是一种非常有价值的工具,可以延缓易感人群由 ETBF 引起的疾病进展。但最近的研究表明,在小鼠中,将 NTBF和 ETBF联合接种,或在 ETBF 定植后接种 NTBF,并不能挽救慢性结肠炎和结直肠癌的进展。
因此,ETBF之前的生态位占据大大降低了益生菌 NTBF菌株定植的成功率。在这项研究中,ETBF 相对于 NTBF 的主导地位部分是由MACPF非 T6SS 毒素的分泌来解释的,这突显了益生菌干预在临床环境中的潜在复杂性,临床环境中遗传多样性很高,而且大多数利基获得决定因素仍未被探索。
▼
拓展:脆弱拟杆菌的耐药性
传统抗生素,如甲硝唑、碳青霉烯类药物和头孢西丁,通常有效地用于治疗脆弱拟杆菌感染。
• 脆弱拟杆菌适应性很强,极易产生耐药性
然而,这种细菌对周围环境的适应性很强,很容易产生抗生素耐药性,抗生素的不当使用进一步助长了耐药性。因此,抗生素耐药性已成为脆弱双歧杆菌感染治疗的主要障碍。
这种抗性在很大程度上归因于脆弱拟杆菌的遗传可塑性,即反转、复制、水平基因转移和大规模染色体转移。根据文献,脆弱拟杆菌携带四个CRISPR-Cas系统。其中三个涉及与1类IB型、1类IIIB型和2类IIC型紧密匹配的相邻cas基因。相反,从血液中分离的CRISPR-Cas系统是一个非典型的IIIB型系统,缺乏相邻的Cas基因。此外,脆弱芽孢杆菌的CRISPR-Cas系统可能调节与共生体和病原体转化相关的内源性基因。
此外,脆弱拟杆菌具有多药外排泵转运系统,可以将有毒的抗菌底物输出到外部环境,并可能导致对多种抗生素产生耐药性。
甲硝唑只是针对所有脆弱拟杆菌分离株的体外活性最强的药物,应被视为经验性治疗脆弱拟杆菌感染的一线抗生素。但是持续监测不同地理区域脆弱拟杆菌的抗生素耐药性模式对于提供合适的治疗方案和更准确地预防感染至关重要。
“
单一脆弱拟杆菌菌株可保护肠道完整性并降低移植物抗宿主病

移植物抗宿主病(GVHD)是一种由供体T细胞引发的促炎综合征,也是同种异体造血细胞移植(allo-HCT)后的主要并发症。
GVHD有两种形式:急性(aGVHD)和慢性(cGVHD)。aGVHD主要由T细胞诱导,通常以1型 T细胞反应为特征,而cGVHD由T细胞和B细胞诱导,具有与自身免疫性疾病相似的表现。
在急性期,GVHD通常针对一组有限的器官,包括皮肤、肺、肝脏和胃肠道。在这些组织部位中,胃肠道在GVHD发病机制中尤为重要,因为肠道损伤在全身GVHD的引发和放大中发挥着关键作用。其结果可归因于粘膜屏障的破坏,这是由于细菌产物(例如内毒素)和驻留在宿主胃肠道中的免疫细胞之间相互作用而导致全身性促炎细胞因子的产生增加。
在临床上,肠道损伤本身和随后的感染并发症可能会危及患者的生命。
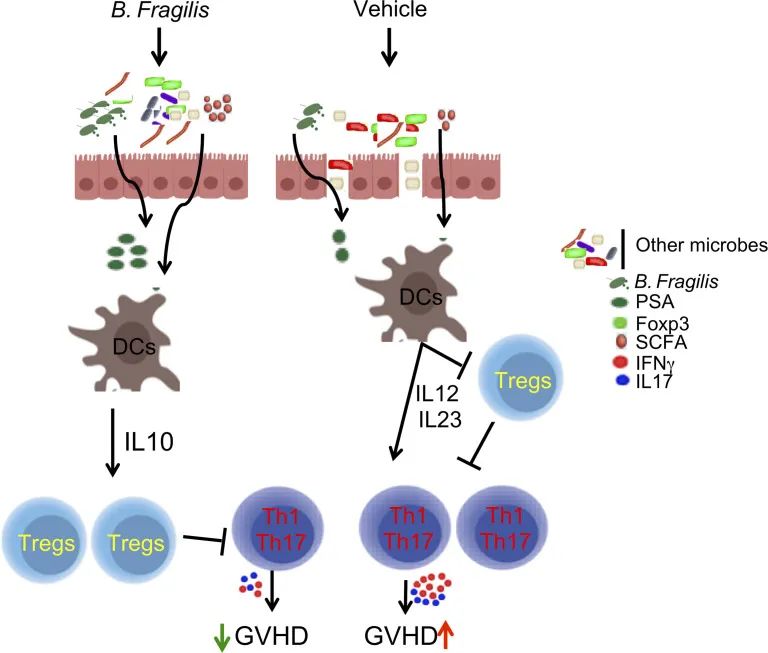
该研究证明了脆弱拟杆菌可降低急性和慢性移植物抗宿主病。GVHD的降低与诱导的T细胞和B细胞同种异体反应的一些变化有关。脆弱拟杆菌(B.fragilis)通过PSA依赖性方式和短链脂肪酸介导的机制稳定肠道环境来调节这些反应。因此,受体肠道完整性得以维持,部分归因于通过IL-22和 GRP43实现肠隐窝再生,最终将免疫反应转向减少炎症,从而产生GVHD保护。
这项研究为使用单一菌株(如脆弱拟杆菌)作为安全有效的干预措施提供了强有力的理由和手段,这将有利于临床上的移植患者。
“
脆弱拟杆菌菌株可增强肠道紧密连接蛋白并表现出肠道抗炎作用

脆弱拟杆菌介导的保护机制很复杂,但来自脆弱拟杆菌的细胞外囊泡及其外膜PSA对 NF-κB 介导的炎症也有效,这种炎症不仅限于结肠疾病。
此外,脆弱拟杆菌定植诱导的肠道代谢物(短链脂肪酸)在体内和体外调节免疫细胞发育(Treg)和肠道通透性。
研究发现单独使用脆弱拟杆菌处理是无害的,并且对细胞活力或细胞凋亡没有影响。虽然TNF-α可以预见地降低了细胞活力并增加了细胞凋亡,但脆弱拟杆菌却减弱了这种恶化。
TNF-α激活的NF-κB通路以及炎症细胞因子IL-6和IL-1β也被脆弱拟杆菌阻断。值得注意的是,脆弱拟杆菌的代谢上清液还具有抗炎作用。
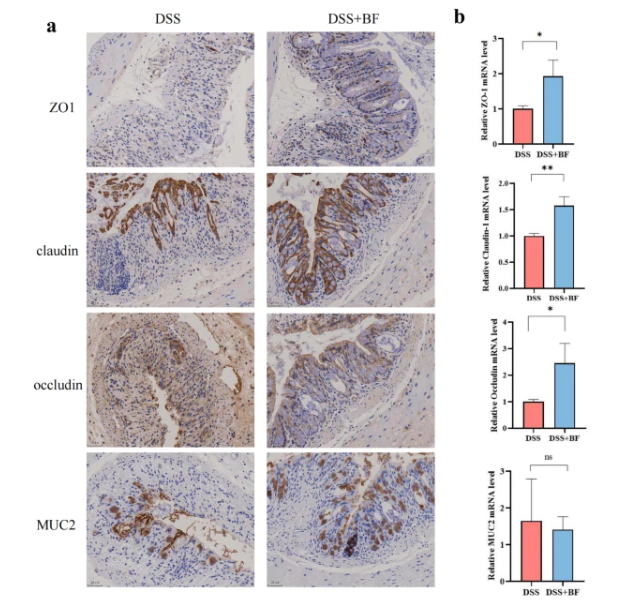
动物研究表明,活体脆弱拟杆菌(而非死亡菌株)可改善 DSS 诱发的结肠炎,体重减轻、结肠长度缩短和屏障功能增强即可证明这一点。
施用脆弱拟杆菌后,结肠组织炎症细胞因子(TNF-α、IL-1β、IL-6)水平降低,抗炎细胞因子IL-10水平增加。
总之,脆弱拟杆菌ATCC 25285无论在体内还是体外都表现出抗炎作用,它可能是一种潜在的改善结肠炎的益生菌剂。
“
脆弱拟杆菌调节宿主对病毒感染和治疗的反应

脆弱拟杆菌及其荚膜多糖A调节 I 型干扰素的组成水平以预防病毒感染
I型干扰素 (IFN-Is) 是一类专门的细胞因子,可协调宿主对病毒的免疫反应。IFN-Is 调节宿主机制,最终杀死受感染的细胞以限制病毒传播。然而,它们还参与免疫细胞的增殖和激活,这对于控制其他细胞内感染、抗肿瘤和抗炎反应至关重要。
哺乳动物中最明确的IFN-Is是干扰素-α和干扰素-β。先前的文献表明,肠道微生物群的耗竭降低了肠道和脾脏干扰素刺激的表达基因(ISG)。
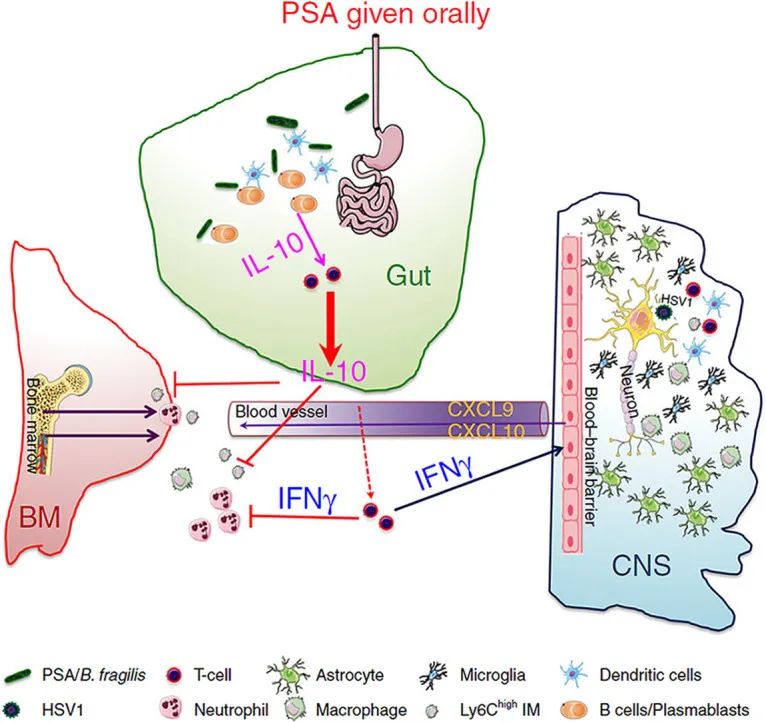
在这项研究中,单独给无菌小鼠灌胃脆弱拟杆菌可增加IFN-β基因的表达。正如预期的那样,来自脆弱拟杆菌的多糖A还显著增加了ISG的体外和体内表达以及 IFN-β的分泌。
PSA/脆弱拟杆菌的免疫保护机制
编辑
脆弱拟杆菌多糖A的双重性——炎症特性
事实上,来自脆弱拟杆菌的PSA因其细胞因子诱导特性而被广泛研究,并被证明可以协调炎症过程的抑制,以预防实验性自身免疫性疾病(EAE) 、炎症性肠病等疾病。相反,来自脆弱拟杆菌的PSA也可以促进炎症作用,从而诱发例如脓肿。
在最近的一项研究中,描述了PSA反应的这种双重性。在这里,来自脆弱拟杆菌的PSA上调了许多干扰素相关基因的表达,并诱导肿瘤坏死因子-α (TNF-α)、IL-6、IFN-γ和趋化因子配体(CXCL)-10 的分泌。
“
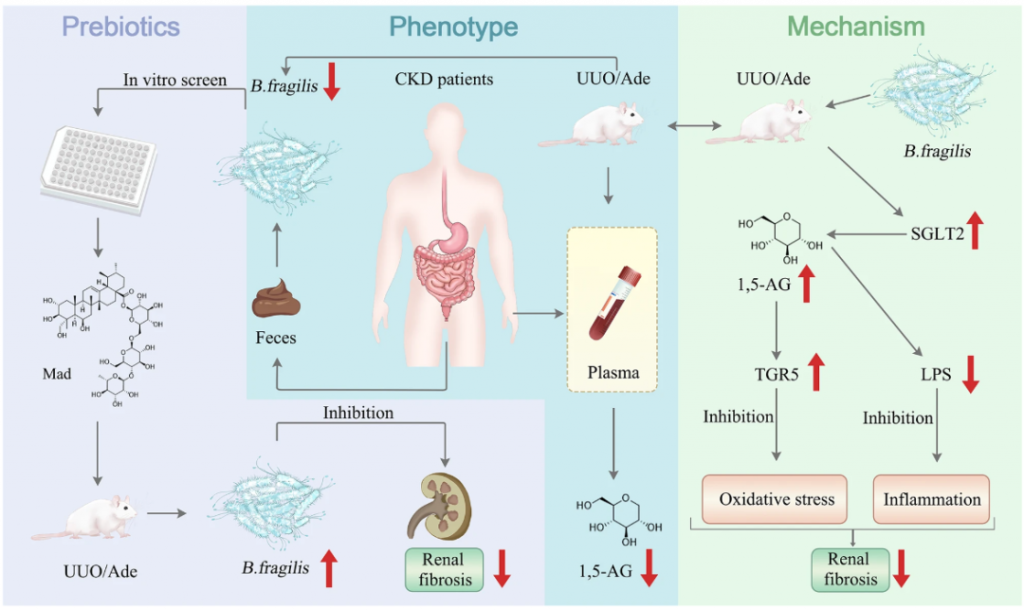
肠道脆弱拟杆菌可改善肾纤维化

大约10%的普通人群患有慢性肾病(CKD)。肾纤维化不可避免地导致CKD进展,其特征是成纤维细胞和肌成纤维细胞的增殖。肌成纤维细胞的特点是产生α-平滑肌肌动蛋白(α-SMA)纤维、胶原蛋白和细胞外基质(ECM)蛋白。
持续的ECM产生会导致肾小球滤过率降低和肾损伤。完全停止疾病进展或诱导肾纤维化消退可以缓解CKD。肾纤维化是进行性慢性肾脏病(CKD)各种表现的必然结果。因此,对针对肾纤维化的有效治疗方案的需求怎么强调都不为过。在这篇研究里,展示了脆弱拟杆菌(B.fragilis)对小鼠肾纤维化的保护作用。
脆弱拟杆菌通过降低脂多糖水平来减轻肾纤维化。由于血液中1,5-脱水葡萄糖醇 (1,5-AG) 水平增加,它还能抑制Nrf2/Keap1和TGF-β/Smad信号通路。发现 1,5-AG 是钠-葡萄糖协同转运蛋白 2 (SGLT2) 的底物。B. fragilis恢复了 UUO 和腺嘌呤模型肾脏中 SGLT2 表达的降低。因此,调节肠道中脆弱拟杆菌的丰度可能是治疗慢性肾病的一种策略。
“
脆弱拟杆菌通过代谢调节参与甲氨蝶呤对关节炎的治疗作用

甲氨蝶呤(MTX)是治疗类风湿性关节炎(RA)的首选缓解病情抗风湿药物。然而,MTX的毒性和低效限制了其临床应用。肠道微生物群与MTX的副作用和功效有关。
脆弱拟杆菌有助于提高甲氨蝶呤对类风湿性关节炎的疗效
在这项研究中,对RA患者肠道微生物群的分析表明,MTX治疗后肠道脆弱拟杆菌的丰度有所降低。还观察到,在没有脆弱拟杆菌的情况下,MTX没有明显的治疗作用,而脆弱拟杆菌的移植在抗生素预处理的胶原诱导性关节炎(CIA)小鼠中恢复了MTX的功效。
此外,强饲脆弱拟杆菌还伴随着丁酸盐的增加。补充丁酸盐可以恢复肠道微生物群缺陷小鼠对 MTX 的反应,达到与脆弱拟杆菌灌胃相似的水平。这些结果表明,肠道微生物群调节的丁酸盐在甲氨蝶呤的疗效中发挥着重要作用,这将为提高甲氨蝶呤在类风湿性关节炎治疗中的有效性提供新的策略。
“
脆弱拟杆菌衍生代谢物可降低沙门氏菌的毒力

大量研究表明,肠道微生物群含有分泌代谢物的健康细菌,有助于对抗肠道和其他器官的疾病。肠道微生物群产生的代谢物包括叶酸、吲哚、γ-氨基丁酸、血清素、次级胆汁酸、脱氨基酪氨酸和短链脂肪酸。
多项研究表明,这些存在于无细胞上清液中的微生物群衍生代谢物可能成为对抗大肠杆菌和沙门氏菌等病原体的抗生素的替代品。
在这项研究中,在接受脆弱拟杆菌和沙门氏菌生物活性组分的小鼠中,与单独接受沙门氏菌相比,结肠中 cldn-1和occludin的表达显著增加,表明肠道屏障得到改善。在单独存在生物活性组分的情况下,仅cldn-1被上调。
已有报道称,脆弱拟杆菌NTBF ZY-312 会诱导患有抗生素相关性腹泻(AAD)的小鼠中occludin过度表达。B. fragilis NTCC 9343增加了结肠中紧密连接蛋白ZO-1、occludin和claudin-1的表达,以对抗 DSS 诱导的溃疡性结肠炎,而B. fragilis菌株FJSWX11BF没有起到保护作用。然而,在这两项研究中,由于仅使用活细菌,因此并未鉴定出与该调节有关的细菌化合物。
然而,这项研究有一些局限性。实验是在实验室条件下进行的,这并不能完全反映人类肠道的复杂性以及共生细菌可能发挥其有益作用的环境。此外,需要对含有 20%血清的完整 DMEM 进行更多研究,以了解脆弱拟杆菌影响的具体机制。
脆弱拟杆菌(Bacteroides fragilis)是人类肠道中的一种共生菌,对于健康有着重要的影响。以前经常将脆弱拟杆菌认为是一种条件致病菌,然而,越来越多的研究发现其有作为益生菌的潜力。
脆弱拟杆菌菌株可分为两种亚型:不产毒脆弱拟杆菌(NTBF)菌株,不携带或分泌脆弱拟杆菌毒素 (BFT),以及产肠毒素脆弱拟杆菌(ETBF)菌株,携带BFT基因并编码脆弱拟杆菌毒素。
ETBF菌株具有致病性,可能诱发能量代谢功能障碍、影响肠道稳态,产生的毒素能导致结肠炎、阿尔兹海默病甚至是结直肠癌。
相比之下,NTBF菌株通常被认为是有益的共生微生物,可能通过种间竞争对抗ETBF。它还参与调节免疫系统、保护肠道屏障以及代谢关键营养物质。这些有益菌株通过释放某些有利分子来促进肠道健康,其中一种已被明确鉴定为多糖A。
通过深入理解脆弱拟杆菌与宿主之间的微妙平衡,我们可以更好地利用这种微生物来促进人类健康,并开发新的治疗策略来对抗相关疾病。
主要参考文献:
Sofi MH, Wu Y, Ticer T, Schutt S, Bastian D, Choi HJ, Tian L, Mealer C, Liu C, Westwater C, Armeson KE, Alekseyenko AV, Yu XZ. A single strain of Bacteroides fragilis protects gut integrity and reduces GVHD. JCI Insight. 2021 Feb 8;6(3):e136841.
He Q, Niu M, Bi J, Du N, Liu S, Yang K, Li H, Yao J, Du Y, Duan Y. Protective effects of a new generation of probiotic Bacteroides fragilis against colitis in vivo and in vitro. Sci Rep. 2023 Sep 22;13(1):15842.
Xia Y, Xiao Y, Wang ZH, Liu X, Alam AM, Haran JP, McCormick BA, Shu X, Wang X, Ye K. Bacteroides Fragilis in the gut microbiomes of Alzheimer’s disease activates microglia and triggers pathogenesis in neuronal C/EBPβ transgenic mice. Nat Commun.
Eribo OA, du Plessis N, Chegou NN. The Intestinal Commensal, Bacteroides fragilis, Modulates Host Responses to Viral Infection and Therapy: Lessons for Exploration during Mycobacterium tuberculosis Infection. Infect Immun. 2022 Jan 25;90(1):e0032121.
Hu, J., Chen, J., Xu, X. et al. Gut microbiota-derived 3-phenylpropionic acid promotes intestinal epithelial barrier function via AhR signaling. Microbiome 11, 102 (2023).
Zhou, W., Wu, Wh., Si, Zl. et al. The gut microbe Bacteroides fragilis ameliorates renal fibrosis in mice. Nat Commun 13, 6081 (2022).
Jiang K, Li W, Tong M, Xu J, Chen Z, Yang Y, Zang Y, Jiao X, Liu C, Lim B, Jiang X, Wang J, Wu D, Wang M, Liu SJ, Shao F, Gao X. Bacteroides fragilis ubiquitin homologue drives intraspecies bacterial competition in the gut microbiome. Nat Microbiol. 2024 Jan;9(1):70-84.
Nakajima A, Sasaki T, Itoh K, Kitahara T, Takema Y, Hiramatsu K, Ishikawa D, Shibuya T, Kobayashi O, Osada T, Watanabe S, Nagahara A. A Soluble Fiber Diet Increases Bacteroides fragilis Group Abundance and Immunoglobulin A Production in the Gut. Appl Environ Microbiol. 2020 Jun 17;86(13):e00405-20.
Wieland Brown LC, Penaranda C, Kashyap PC, Williams BB, Clardy J, Kronenberg M, Sonnenburg JL, Comstock LE, Bluestone JA, Fischbach MA. Production of α-galactosylceramide by a prominent member of the human gut microbiota. PLoS Biol. 2013 Jul;11(7):e1001610.
Zhou Q, Shen B, Huang R, Liu H, Zhang W, Song M, Liu K, Lin X, Chen S, Liu Y, Wang Y, Zhi F. Bacteroides fragilis strain ZY-312 promotes intestinal barrier integrity via upregulating the STAT3 pathway in a radiation-induced intestinal injury mouse model. Front Nutr. 2022 Dec 15;9:1063699.
Sun L, Zhang Y, Cai J, Rimal B, Rocha ER, Coleman JP, Zhang C, Nichols RG, Luo Y, Kim B, Chen Y, Krausz KW, Harris CC, Patterson AD, Zhang Z, Takahashi S, Gonzalez FJ. Bile salt hydrolase in non-enterotoxigenic Bacteroides potentiates colorectal cancer. Nat Commun. 2023 Feb 10;14(1):755.
Valguarnera E, Wardenburg JB. Good Gone Bad: One Toxin Away From Disease for Bacteroides fragilis. J Mol Biol. 2020 Feb 14;432(4):765-785.
谷禾健康
当人还是婴儿时,会从父母那里得到微生物;和宠物玩耍或接触时,也会从宠物那得到微生物;有时候人没有直接和动物玩耍,只是接触动物的粪便,甚至其他环境的微生物,都会交换微生物…
这些其实都与微生物的社会传播有关。社会互动对微生物组成的影响可以从出生延伸到成年。比如说同一家庭内的个体通常共享12%的肠道微生物菌株。
我们知道社会互动会推动病原体的传播,比如说,狩猎和食用森林猎物会增加感染人畜共患病毒的风险,从而将病原体引入人类社交;但与宿主相关的互惠共生体和共生微生物通过社会传播对宿主健康和疾病的贡献还很少研究。
刚刚,来自世界顶级学术殿堂——哈佛大学的人类进化生物学系Amar Sarkar研究团队发表在《Cell》上的综述成果,使用“社会微生物组”的概念——即宿主社会网络中的微生物群落整体,来分析社会微生物传播对宿主健康和疾病的影响。
社交可能带来一些潜在好处:
当然,社交也可能伴随微生物风险:
本文谷禾小编与大家分享此篇文章内容及观点。文章综合论述了社会微生物组概念下微生物的社会传播,研究主要关注肠道微生物组及其对宿主健康的关联,同时也探讨了其他身体部位的微生物组。
文中提出了五个塑造社会微生物组的社会生态力量层面,包括在不同宿主间、网络层面、群体间、物种内以及物种间的微生物交换。
定义了两个维度来分析社会微生物传播与宿主健康和疾病之间的关系,包括更广泛的生态进化过程和特定微生物在宿主间的传播。
这些过程涵盖了定居抗性、毒力和微生物传播性的进化、对生态干扰的微生物组反应、具有显著代谢和免疫效应的微生物传播、跨种传播和人畜共患病溢出、耐抗生素微生物和微生物基因的传播,以及宿主病毒组的病毒传播。
文章描述了这些类别的一系列效应、结果和预测,并提出了实证方法来检验这些预测。
最后,分析了微生物的社会传播在传染病和非传染性疾病(如心血管疾病、自身免疫疾病、代谢性疾病、过敏性疾病、神经系统疾病和癌症)中的作用,并评估了非传染性疾病可能包含由微生物社会传播引起的传染性成分。根据宿主-微生物相互作用的性质和其他宿主因素,这种社会传播的成分可能会减轻或加剧疾病风险和严重程度…
这些内容对于理解健康的社会决定因素具有重要意义。我们一起来详细了解一下吧。
图 1 塑造社会微生物组的社会生态力量以及社会传播微生物对宿主健康和疾病的影响
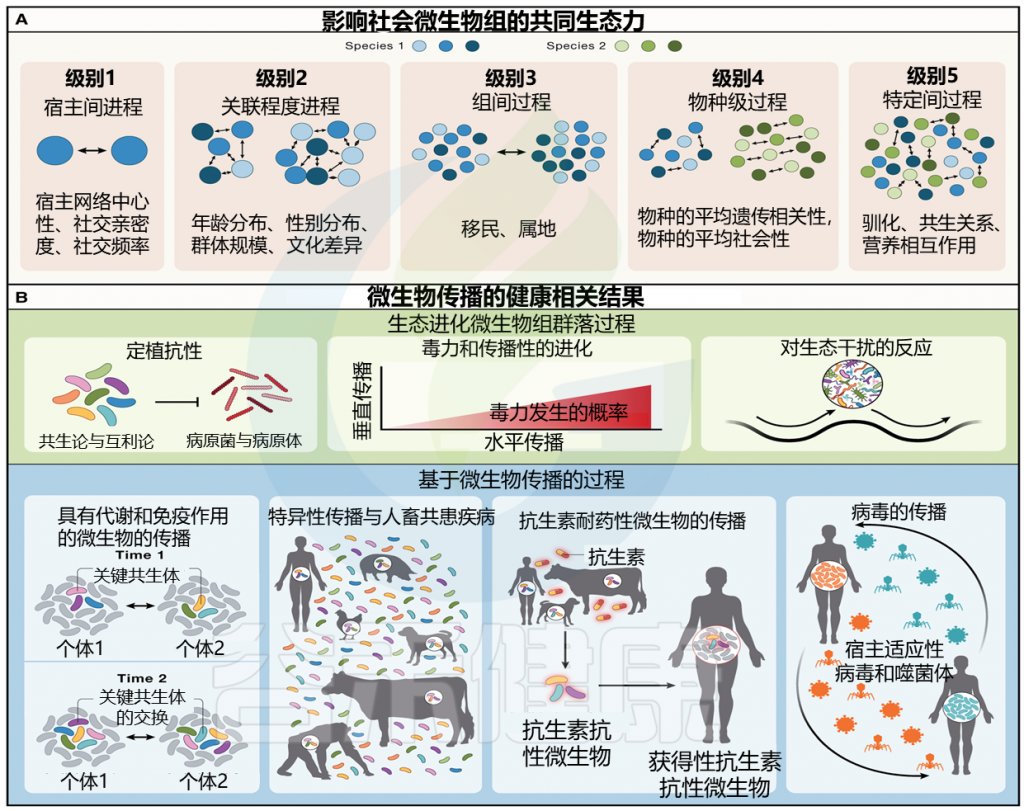
doi.org/10.1016/j.cell.2023.12.014
(A) 不同社会生态尺度的过程影响社会微生物组。蓝色和绿色圆圈表示独特的宿主个体。这些过程不必相互排斥。
(B) 预计受微生物社会传播影响的健康相关过程。这些可以分为两大维度:生态进化微生物群过程和基于微生物传播的过程。
动物肠道微生物组是高度动态的生态系统,它们在不同宿主之间以及随时间在同一宿主内显示出相当大的变化。
微生物的组成受到环境因素的影响,例如饮食和从外部来源的微生物的传播,以及宿主内在因素的影响,如生理和遗传。
如何理解微生物组的动态变化?
群落生态学理论为理解这些动态提供了一个有用的框架。在这个框架下,每个宿主的微生物组是一个“岛屿”,一个由在宿主内部和宿主之间运作的生态过程所塑造的独特群落。
其中宿主内部包括微生物间的相互作用和宿主对微生物的选择作用;宿主之间包括社会传播和外部环境施加的选择,如下图。
图2 社交微生物组中微生物组装和微生物传播
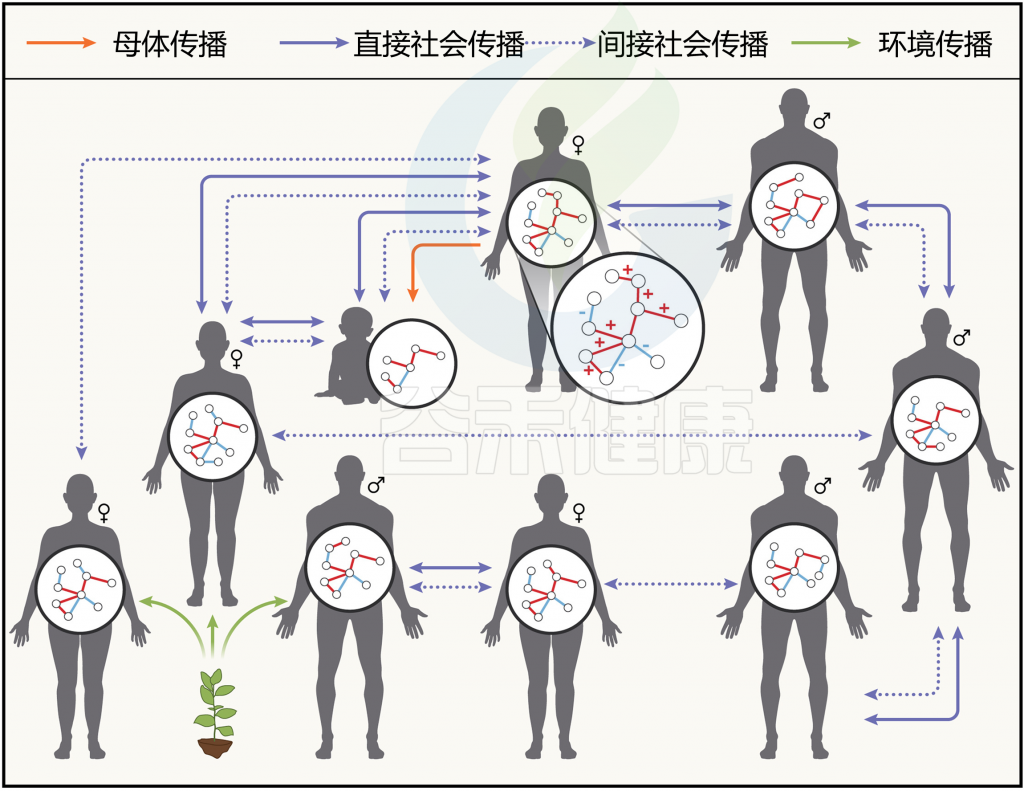
doi.org/10.1016/j.cell.2023.12.014
怎么理解社会微生物组?
社会微生物组指的是动物社会网络(以及其基因和基因产物)的微生物群落整体,其中宿主岛屿网络可以形成独特的生物群岛(上图)。
此外,同一宿主物种的不同社会群体即使栖息在相似的生态环境中,往往也具有不同的社会微生物组。每个微生物组都嵌入在一个社会生态网络中,并通过微生物传播与其他微生物组相连。
如何通过互动影响微生物的传播和变化?
微生物的社会传播可以在五个不同但不相互排斥的递增生态尺度级别上进行分析。这些范围从宿主间到种间互动,可以影响宿主间微生物交换的性质和频率(图1A;表1)。
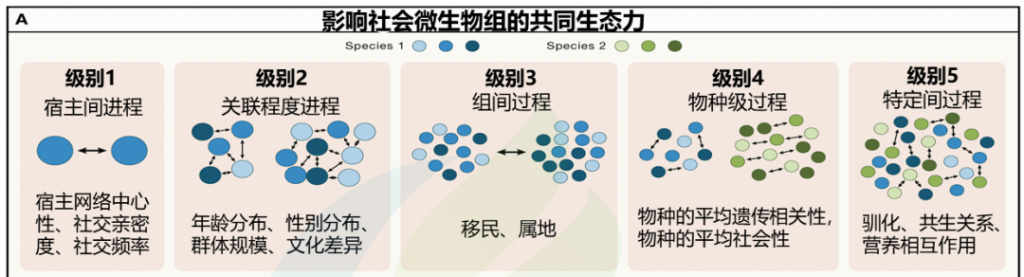

编辑
doi.org/10.1016/j.cell.2023.12.014
重要的是,微生物的社会传播已被显示与宿主社会网络呈共变,并反映宿主社会网络。实际上,社会传播的微生物甚至可以在人类的二阶互动中被检测到。
例如,如果A与B互动,B与C互动,那么C就会带有从A获得的、通过与B的互动获得的共生体和互惠共生体的微生物痕迹。之前已在像结核分枝杆菌这样的病原体中就有这种现象。
然而,如果这样的模式也描述了共生体和互惠共生体的传播,那么它将表明个体的扩展社会网络通过作为社会网络其他部分微生物的储藏库的中介社会伙伴影响微生物组的组成。
微生物的社会传播有哪些形式?
可以分为三种广泛的形式。
1)早期生活中发生的亲代传播,由于其重要影响,被单独视为一种社会微生物传播形式;
2)直接社会传播,动物通过社会互动水平地获得微生物;
3)在共享环境中的间接社会传播,微生物通过偶然接触粪便或其他具有持久机制的宿主相关微生物在宿主之间传播。
doi.org/10.1016/j.cell.2023.12.014
微生物组的组成受到社会网络内成对关系的影响,社会互动对微生物组成的影响可以从出生延伸到成年。近期的人类案例显示了社会影响对微生物组成的动态和嵌套性质。
个体之间的菌株共享
在同一家庭内,共同居住导致母亲和子女之间、兄弟姐妹之间以及非亲属之间微生物菌株的共享增强。
家庭层面的特征也会影响微生物组成
例如,婴儿肠道中某些细菌属的相对丰度,包括乳杆菌属、梭菌属、肠杆菌属和克雷伯菌属,已显示与家庭大小和兄弟姐妹数量相关。
肠道微生物组在大约三岁时变得更稳定,并显示出更成熟的特征。此后,成对共享的菌株数量不再取决于亲缘关系(母婴、父婴、伴侣之间或兄弟姐妹之间),而是取决于社会环境。
此外,共同居住的影响似乎比年龄对成年双胞胎菌株共享模式的影响更大。这表明成年人观察到的菌株共享模式更多依赖于社会关系而非母源性微生物组。
微生物的社会传播特征在哪些部位体现?
包括肠道、皮肤和口腔。
特定身体部位的微生物可能迁移到新的部位。例如,近期的研究表明,在个体人类中,口腔微生物组到肠道微生物组的传输非常广泛,尽管在某些情况下,这种传输与类风湿性关节炎和炎症性肠病等病理状态相关。
社会传播的特定类群和微生物组的社会结构化程度可能因身体部位而异
例如,一项研究发现,显示肠道微生物社会传播证据的个体并不总是显示口腔微生物社会传播的证据。
相比之下,其他研究发现,通常耐氧的口腔微生物比大多数厌氧的肠道微生物具有更高的传播性,后者不太可能在富含氧气的外部环境中持久存在足够长的时间来感染新宿主。
实际上,共同居住的时间越长(例如,伴侣或父母与子女),个体的口腔微生物组的相似性越大。同样,狗和其主人的皮肤微生物显示出比肠道微生物更强的跨物种传播证据。
总体而言:直接和间接社会传播对微生物组的影响因身体部位而异:
在身体部位内,特定的细菌类群可能更适合或更易于社会传播。例如,在狒狒中,属于双歧杆菌属和梭菌属的肠道细菌显示出比其他细菌类群更强的社会传播证据。相比之下,在人类中,细菌的社会传播似乎与细菌分类无关。
这表明在人类中,大多数微生物类群至少在原则上可能是社会可传播的。尽管微生物在不同身体部位、不同微生物类群以及不同宿主群体间的社会传播程度存在差异,但微生物的社会传播似乎是决定人类和非人类动物微生物组成的一个广泛且稳健的因素。
群居生活有什么适应性优势?
群居生活和不同的社会联系为个体带来了许多适应优势,包括保护免受捕食、增加交配机会以及在获取和防守资源方面的帮助。健康框架的社会决定因素考察了社会性与健康和进化适应性之间的联系。社会环境的各个方面,包括社会等级、社会融入和早期生活逆境,是个体发病率和死亡率最强烈且一致的预测因素之一。
社会环境与生物学健康的联系
社会科学和自然科学共同关心的是连接社会环境与动物健康、疾病结果和死亡风险的生物学过程,如遗传、表观遗传、免疫和内分泌过程,通过这些过程社会环境与个体生理过程相互作用,从而影响健康和进化适应性。
微生物组与社会互动的健康影响
现在开始强调微生物组在介导社会互动与宿主健康状况之间关系的潜在作用。社会可传播的微生物和驱动微生物组成的社会行为因素可能有助于这些效应。
在健康的社会决定因素框架内,社会性对健康的影响之一是接触可传播的微生物。这包括病原体和共生体和互利共生体的影响。
病原体传播与社会性的进化策略
就病原体而言,一个最古老的研究领域长期以来一直在研究病原体传播与宿主社会性之间的联系。例如,生活在较大群体中、社会接触率较高、在特定网络位置或结构中运作、或与同种人接触时间更长、更密切的个体,比孤立的个体面临更高的传染病风险,因此,已经进化出各种社会行为来避免或控制病原体。
微生物传播的社会行为与进化挑战
共生体和互惠体的传播策略目前没有得到充分重视,但如果它们与病原体的传播策略不同,这可能会选择通过微生物传播有益于宿主健康的各种社会行为的进化。这一提议的一个困难在于,致病性和非致病性肠道微生物通常采用相同或相似的传播策略。
因此,尽管广泛的社会行为,包括梳理毛发、共同喂养、口口互动、护理、粪食,被假设可以促进细菌的传播,从而带来代谢和免疫方面的益处,目前还不清楚共生体和互利共生体的传播策略是否与病原体的传播策略有足够的不同,或者是否足够有益,以促进这种传播的社会行为的出现。
社会微生物传播与社会性进化的未来探索
事实上,对于这些行为中的许多行为,都有其他的进化解释,而与它们对微生物传播的影响无关。未来对互利共生体、共生体和病原体传播策略差异的研究和建模工作可能能够揭示社会微生物传播与社会性进化之间的关系。
这方面的一个核心问题是,自然选择的共生体、共生体和病原体的传播策略是否存在足够的变化,以有利于促进有益微生物而非有害微生物传播的社会行为的出现。当然,有利于传播的社会行为的演变还取决于共生和互利共生相对于宿主接触病原体的危害的相对益处,而不仅仅是传播途径的差异。
微生物社会传播的一些影响发生在整个微生物组群落水平,包括定植抵抗、毒力和传播性的演变以及对生态干扰的反应。
殖民抵抗力是指个体微生物组固有的能力,能够抵御入侵性病原体的定植和扩散。
微生物组中的一些常见成员,例如艰难梭菌(以前被归类为梭状芽孢杆菌),是病原体(即机会性致病的微生物),在很多情况下,它们的入侵和致病性取决于生态环境。在这里,作者认为一个典型的或健康的微生物组是指能够减少微生物入侵和在生态位中过度定植的机会的微生物组。预测社会微生物组会影响宿主的殖民抵抗力。
共生和互利的微生物通过各种机制有助于增强殖民抵抗力。这些机制包括直接与其他微生物以及病原体竞争空间和营养、分泌抗菌分子、改变肠道环境的生化特性,以及训练免疫系统区分无害微生物和潜在的危险微生物(下图)。
图3 社会传播肠道细菌与宿主免疫系统之间的相互作用
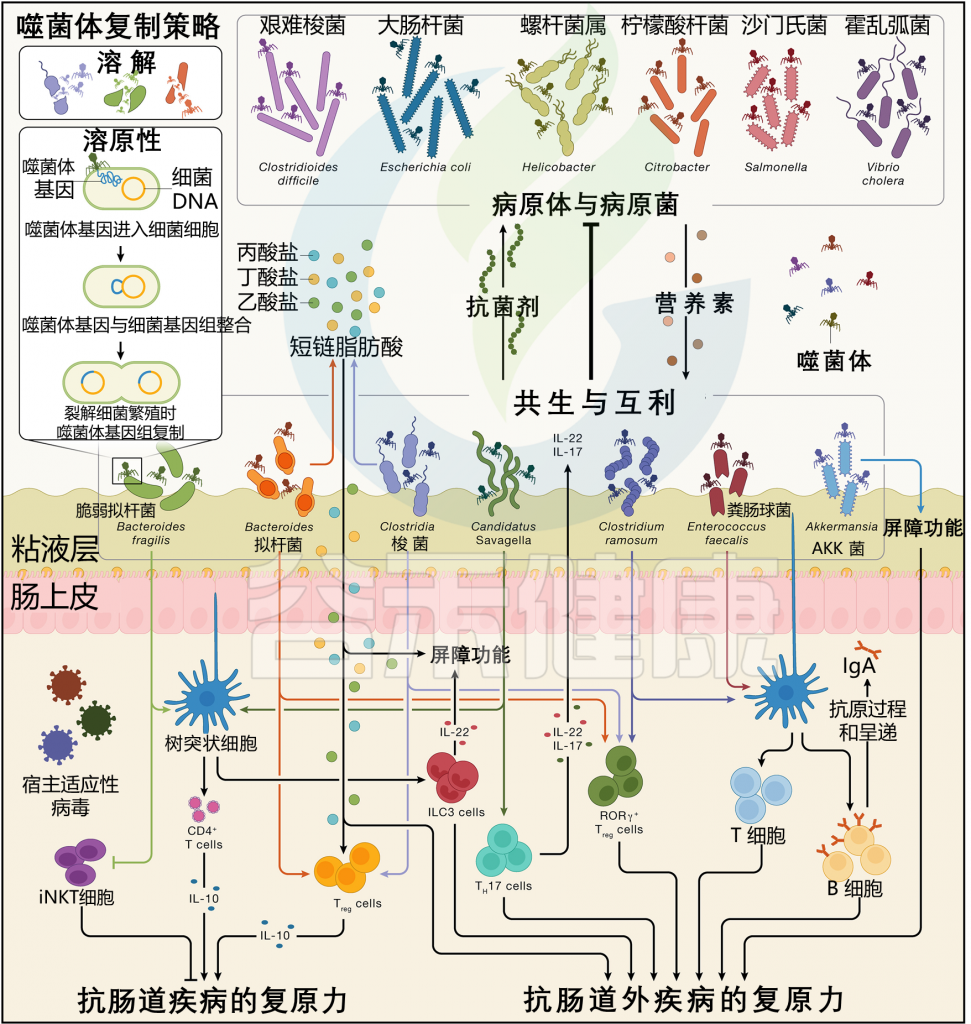
doi.org/10.1016/j.cell.2023.12.014
在哺乳动物中,一些最常见的肠道细菌类群参与维持宿主的定植抵抗力,并且也具有社会传播性。社会传播的微生物可以通过涉及特定类群的过程以及整个微生物组的新兴群落特性来影响定植抵抗力。
影响微生物组定植抵抗力的四个关键属性
这些属性可能受到社会传播过程的影响:
1)对定植抗性重要的特定微生物类群的存在
2)微生物组多样性
3)微生物组稳定性
4)宿主之间微生物组相似性
接下来我们一一看着四个关键属性:
对定植抗性重要的特定微生物类群的存在
共生菌株与病原体竞争资源,抑制病原体生长
一些与宿主相关的微生物通过消耗病原体生存或病原体过度生长(即竞争性排斥)所需的资源,有利于宿主的定殖抵抗。例如,大肠杆菌的共生菌株消耗许多与肠出血性大肠杆菌致病菌株生长所需相同的有机酸、氨基酸和其他营养物质。来自共生菌株的这种竞争抑制了致病菌株的生长。
微生物群以依赖于环境的方式促进定植抵抗
例如,在简单的共培养中,大肠杆菌的共生菌株对肺炎克雷伯菌和肠沙门氏菌的病原体的生长几乎没有影响。然而,作为更加多样化的微生物群落的一部分,它们至关重要,它们有助于其他微生物通过营养消耗战胜这些病原体的能力。
另一个例子,小鼠肠道中的共生微生物消耗膳食氨基酸支持对高度传播的病原体啮齿类柠檬酸杆菌(在小鼠模型中用于模拟致病性大肠杆菌)的定植抵抗,这也依赖于这些氨基酸。
为潜在病原体创造敌对环境,保护宿主
特定的肠道微生物还可以通过改变肠道生态条件,为潜在病原体创造敌对环境,从而保护宿主免受病原体定植。例如,双歧杆菌属可以通过降低局部环境的 pH 值来防止致病性大肠杆菌在肠道定殖。
微生物组多样性对定植抗性的影响
微生物组多样性增强利用生态位空间的能力
微生物组的多样性可能会增强其利用所有可用生态位空间的能力,从而抵抗定植。该假设基于生态理论,即生物多样性与群落的入侵性(即群落对入侵的脆弱性)负相关。
一项研究发现,限生小鼠肠道微生物组的多样性线性增加了微生物组抵抗病原体入侵的能力。
多样化的微生物群落蕴藏着许多相互竞争的微生物,这有助于稳定群落免受扰动并占据可能被入侵者利用的生态位。
多样性与病原体入侵的关联
最常见细菌病原体可能利用的生态位空间可以在高度多样性的微生物组中饱和,共生和互惠的肠道微生物利用大多数可用的营养物质,从而将病原体和致病生物保持在低丰度并限制入侵。与这些理论相似,人类和小鼠的抗生素治疗证据支持这样的假设:微生物组多样性的极度减少会使宿主更容易受到病原体入侵。
关于微生物组多样性与定植抗性之间相关性的一致性和线性性仍存在相当大的争论,以及微生物组多样性和宿主健康之间的关系。
微生物组多样性与宿主健康间的复杂联系:是不是越高越好?
不一定。虽然说微生物组多样性高通常与宿主健康状况良好相关,但多项研究发现,微生物组的高度多样性与不良的健康结果有关或者与健康无关。
重要的是,微生物组多样性可能与某些病原体呈正相关,但与其他病原体呈负相关。同样,社会传播对微生物组多样性的影响比简单的积极社会性-多样性关联更为复杂。
社会传播对微生物组多样性有什么影响?
社交互动有可能增加或减少多样性。
例如,最近在自由生活的红腹狐猴种群中证明了和黄腹土拨鼠社会互动程度与个体宿主内的平均微生物多样性之间存在负相关关系。
为什么可能会有负相关?试想如果特定的微生物谱系在宿主内比其他谱系拥有竞争优势,则可能会出现这种负相关关系。
微生物组多样性的“临界点”与定植抗性
在社会分散的人群中,这种微生物可能只会在少数宿主的微生物组中占主导地位,而在社会联系的人群中,微生物可能会传播到大多数或所有宿主,并在其中增殖。
这些变化暗示了微生物组多样性与定植抗性之间的复杂关系。定植抗性和微生物组多样性之间并非存在一致的正相关关系,而是可能存在多样性减少的“临界点”,它可以使微生物组失去平衡,从而创造有利于病原体入侵的生态位空间。
微生物组稳定性对定植抗性的影响
定植抗性与微生物组的稳定性有着内在的联系。一般来说,稳定的群落比不稳定的群落更能抵抗入侵,因为群落组成的不稳定可以创造生态位空间,从而为入侵提供机会。
不稳定是人类微生物群失调状态的一个方面,与不稳定性相关的扰动可能导致某些致病性类群的过度生长。
不一定只有致病菌过度生长,共生菌过度生长也会失调
事实上,典型共生微生物通过过度生长而产生的机会性发病机制可能是腹泻的致病机制。例如,旅行者腹泻通常没有明显的肠道病原体,而是似乎可归因于与菌群失调相关的共生微生物过度生长。这些不稳定驱动的入侵说明了发病机制是如何由于生态位空间的突然可用性而不是病原体本身的入侵倾向而发生的。
微生物组不稳定与社会关系不稳定相关
微生物组稳定性受社会微生物传播影响的程度是一个尚未得到充分研究的领域。例如,个人在社交网络中的位置是否会影响微生物组的更替(稳定性的常见衡量标准)尚未得到彻底探索,可能是由于缺乏来自自然宿主微生物组系统的详细纵向数据。
一些证据表明社交不稳定可能与肠道微生物组不稳定有关。例如,在野生维罗狐猴中,社会关系更不稳定的个体表现出更高的肠道微生物组更替率。不稳定的社会关系可能会影响微生物组的组成和稳定性,社会压力会导致社会不稳定和微生物组不稳定之间的关联。
不稳定的社会关系会引发荷尔蒙压力反应,进而可能导致成分变化,进而可能导致微生物组稳定性降低。未来的研究可以通过实验操纵模型动物的社会等级,并研究社交网络位置如何与压力和微生物组组成等因素相互作用,从而影响宿主表型,包括定植抵抗力。
宿主之间微生物组相似性对定植抗性的影响
定植抗性可能受到社交宿主之间微生物组相似性的影响。这是因为社交互动增加了宿主之间微生物组的相似性。理论上,宿主之间微生物群落相似性的增强可以增强或减弱定植抵抗力,我们依次讨论每种可能性。
宿主对熟悉菌群的定植可能表现出更强的抵抗力
关于增强定植抗性,由于宿主的免疫系统对那些微生物的预适应,宿主可能对熟悉的微生物的定植表现出更高的抗性。例如,许多通常被认为是共生或互利的微生物在某些条件下可能会致病,例如艰难梭菌就是一个典型的例子。发病机制的转变可能部分取决于宿主对特定微生物的适应程度。人类研究表明,宿主与微生物的相互作用可以训练宿主的适应性免疫,减少由熟悉的微生物引起的发病机制。相反,不熟悉的微生物可能更有可能致病。
因此,社会伙伴之间微生物组的相似程度可能会影响微生物在传播后在新宿主中致病的可能性。例如,想象一个宿主与一个新的社会伙伴互动,该伙伴的免疫系统不习惯宿主的共生和互利共生。相对于具有社会互动和微生物交换历史的宿主之间的相互作用,这种相互作用可能更有可能导致发病机制。这是因为熟悉的宿主预计会有更多相似的微生物组和免疫训练。
微生物组的高度相似性也可能降低定植抵抗力
具体来说,由于社交互动增强了微生物组之间的相似性,这种微生物的相似性也可能赋予病原体优势,这些病原体已经开发出克服或颠覆定植抗性的机制。因此,具有与社会微生物组非常相似的微生物组的个体也可能最容易受到先前成功入侵类似微生物群落的病原体的入侵。
研究病原体通过社交网络的传播,作为个体微生物组和社会微生物组之间相似程度的函数,应该可以深入了解病原体在社会微生物组中传播的速度。这将能够评估传播是否与社交网络中宿主之间的微生物组相似程度呈正相关。
社会生态因素(如群体大小、社会性、与不同微生物接触)都影响着宿主对病原体的定殖抵抗力
所有社会传播对定植抵抗的影响都可能受到社会微生物群背景下的各种社会生态力量的影响(图 1 A)。例如,更大、更异质的群体应该提供最大数量的殖民机会(2级)。
同样,平均而言更具社会性(4 级)的宿主物种可能会经历更高的潜在侵入性传播事件发生率。然而,由于它们传播非病原微生物的机会更多,因此它们也可能具有更强的内在定植抗性。
由于与拥有不同微生物组的其他微生物相互作用也可以通过向宿主引入新微生物来增强多样性,因此在“安全”共享共生和互利微生物与获取更多样化(但可能更危险)的微生物之间存在固有的权衡。
灵长类动物研究表明,在社会伙伴中分配一组熟悉的微生物可能有助于保持多样性,因为任何宿主中因局部灭绝而丢失的微生物都可以通过社会接触重新获得。保持多样性还可以降低通过社会互动获得完全不熟悉的微生物的风险,这些微生物可能具有更大的发病潜力。
肠道微生物的社会传播预计会影响社会微生物组成员的毒力进化。
微生物如何与我们共同成长?
严格的肠道微生物在宿主的垂直传播中创造了一种情况,在这种情况下,微生物谱系的长期适应性取决于宿主。也就是说这些微生物非常依赖我们的身体,因为它们要在我们这里生存得好,就需要和身体相处得很融洽。
在这种情景下,那些严重降低宿主适应性的菌株可能会降低自身的适应性,并且与不那么致病的菌株相比,会遭受进化上的劣势,也就是说如果这些微生物让我们的身体不健康,它们自己也会找不到好的住所,最终可能被其他更友好的微生物取代。
这种现象的一个例子是寄生真菌Ophiocordyceps unilateralis,它控制并最终杀死其蚂蚁宿主以增强其孢子的分布。极端致病性的狂犬病毒和原虫寄生虫弓形虫是微生物介导的宿主损伤的突出例子。
总的来说,微生物对宿主适应性的控制预计只会在非常精确的情况下偶尔进化。因此,微生物对宿主的高度依赖通常应该有利于降低毒力。然而,微生物的社会传播的可能性,尤其是在非亲属之间的传播,可能会使微生物的适应性部分与宿主的适应性脱钩。
有机会殖民多个无关的宿主可能会增加那些施加有害影响的微生物谱系的长期适应性,这些有害影响在高度忠实于宿主谱系的微生物谱系中可能会受到选择的不利。
在这种情况下,如果毒力对于宿主内微生物适应性的积极效应超过了严重宿主疾病或死亡对微生物适应性的负面影响,那么毒力可能会进化。
尽管增加微生物水平(社会)传播的机会可能会促进毒力的进化,但进化理论还预测:
更多社会传播实际上可能降低毒力
增加社会传播在某些情况下,可能会选择降低垂直和社会传播微生物的毒力。例如,高社会传播率会增加宿主人群中微生物的流行率,从而减少进一步的社会传播机会,并降低依赖社会传播的毒力菌株的适应性。因此,社会传播对社会微生物组成员毒力进化的影响肯定比社会传播机会与毒力之间的正线性关系更复杂。
神秘的传播途径:微生物通过看不见的社交网络在宿主间传播
许多微生物(病原体、共生体和互利共生体等)的传播机会可以根据影响社会微生物组的不同社会生态力量来概念化。例如,通过频繁和亲密的社会接触以及更集中的网络个人,传播机会可能会最大化(1级)。在体型较大的群体之间(2级)、迁徙个体数量较多的群体之间(3级)、社会性更强的物种之间、群体内遗传相关性平均值更高的物种之间以及促进密切社会互动的季节和环境中(第4级),以及在物种间接触较多的情况下(5级),传播机会也可能增加。
值得注意的是,其中一些相互作用可能是间接的,是由个体和群体之间的多方联系造成的,正如最近在蝙蝠中观察到的那样。在这些“神秘”的联系中,微生物谱系在从不直接互动的宿主之间进行社会传播。
在宿主社会网络中,微生物更容易适应并传播
社会微生物组也可能影响微生物传播能力的关键特征的进化。病原体的长期适应性是它能够感染的新宿主数量的函数,对于适应肠道的共生菌和互利共生菌也可能是如此。在宿主紧密相连的社会网络中,空间和时间距离之间的潜在宿主得以减少,并允许适应宿主的微生物比在更为孤立的宿主中通过社会网络传播得更成功。
厌氧肠道菌通过亲密接触在宿主间传播
这对肠道微生物组的成员特别相关,其中许多是需厌氧菌,在富氧的外部环境中没有足够的耐受机制来显著持续存在。因此,一个具有许多近距离宿主的密集社会网络应该增加厌氧肠道细菌的定殖机会。事实上,在研究了微生物的直接社会传播的地方,最具社会传播性的细菌类群也是最不可能在需氧的外部环境中持久存在的,拥有较少支持宿主外生存的机制。
孢子菌通过环境间接在宿主间传播
孢子形成等耐力机制有利于细菌在宿主外环境中生存。孢子细菌比非孢子细菌具有明显更高的耐氧性。与专性厌氧菌不同,孢子形成细菌可以很容易地在个体之间传播,不依赖于直接的社会接触。一致的是,通过野生小鼠之间直接社会接触传播的肠道微生物大多是厌氧的,而通过共享环境间接传播的肠道细菌富含需氧孢子形成类群。
含有芽孢细菌的属约占肠道微生物丰度的 30%,并且存在于几个常见细菌家族中,包括毛螺菌科、瘤胃球菌科和梭菌科。值得注意的是,致病生物艰难梭菌会产生代谢休眠且高度耐药的孢子,这些孢子有助于在恶劣条件下在宿主体内持续存在,并通过共享环境进行间接社会传播。
宿主社会性与耐力机制选择强度之间关系的两种假设
微生物耐力机制的进化,例如形成孢子的能力,可能是由宿主物种的社会性程度决定的。关于宿主社会性与耐力机制选择强度之间的关系,人们可以提出两种相互竞争的假设。
1.
首先,在局限于独居或很少有社会伙伴的宿主物种的微生物中,可能会选择诸如孢子形成之类的耐力机制。这是因为社会接触可能非常稀疏,以至于殖民另一个宿主的机会太有限,无法支持耐力机制的进化,从而能够有效地间接向新宿主进行社会传播。
2.
其次,进化压力可能会选择相对于社会宿主物种而言更孤独的宿主物种增强的耐力机制,使微生物能够在环境中持续存在,通过间接的社会传播到达新的、不常见的宿主。当然,从其他同域物种获取微生物也可能影响此类结果。
这些假设可以通过比较与宿主物种相关的微生物谱系之间是否存在耐力机制来进行经验或荟萃分析的检验,这些宿主物种的社会性程度各不相同,同时考虑到与其他同域物种的相互作用。
一般的“生态干扰“”的是指的是引发显著生态系统和生态变化的短暂环境事件(例如洪水、森林火灾、飓风)。
生态恢复力的一个定义是被干扰的生态系统恢复并返回到或类似于其干扰前状态的程度。
从干扰生态学和宏观生态系统的生态恢复力原理也可以有益地应用于理解微观生态过程,包括宿主-微生物相互作用。
微生物组生态的干扰,包括暴露于新饮食、抗生素暴露、疾病或感染,可能导致内源性微生物群落的丧失及其被其他微生物群落取代(下图)。例如,抗生素引起的干扰和随后的微生物丧失使得肠道中的生态位变得可供定殖,使宿主容易受到外来且可能具有病原性的微生物的侵袭,或者使如艰难梭菌这样的病原体的生长失去控制。
图4 肠道微生物组在社会微生物组中的稳定性格局
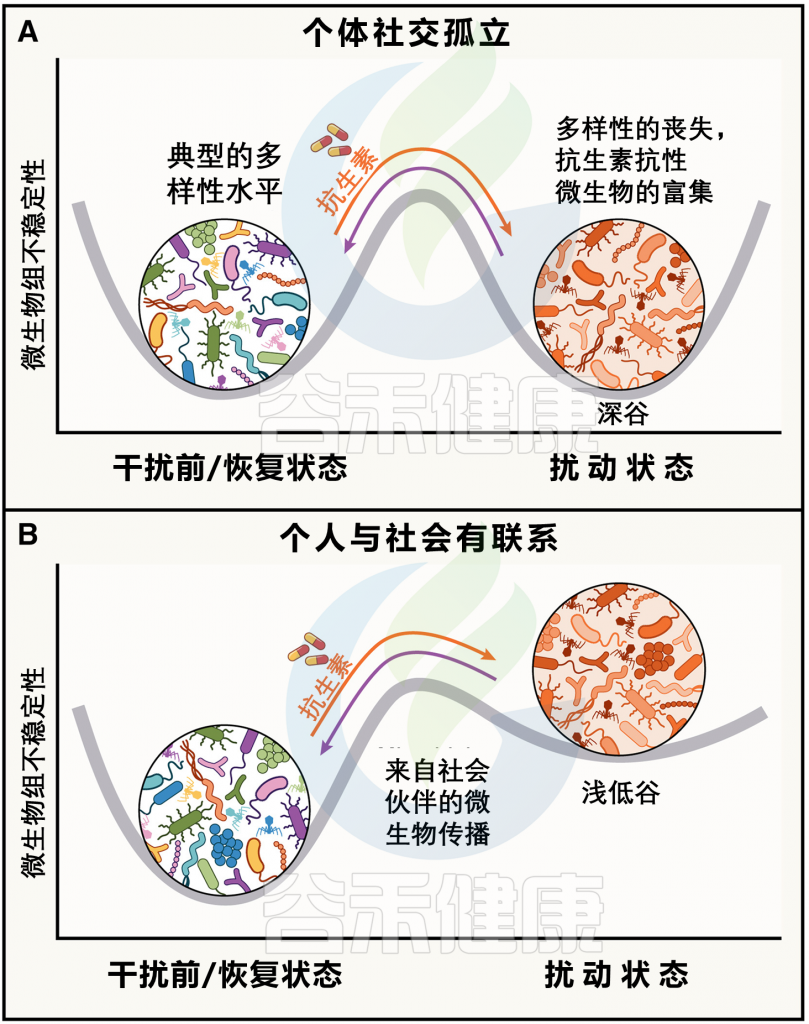
doi.org/10.1016/j.cell.2023.12.014
接触同种的社会网络可能会通过提供来自邻近宿主的社会可用微生物的元群落,以促进干扰后的再定殖,从而增强微生物组的恢复力(上图)。
成年人的菌群被抗生素干扰后有恢复力
例如,在人类中,即使是短期的抗生素治疗也会导致细菌多样性大幅减少,而且在抗生素暴露后数月甚至数年内微生物组可能仍然受到干扰。
尽管早期生活中抗生素引起的肠道微生物组破坏可能会产生终生影响,但在成年人中,抗生素介导的干扰通常是轻微的,微生物组倾向于在停止抗生素治疗后相当快速地恢复到稳定的、基本上是暴露前的状态。
成年人菌群的恢复力,可能与社会微生物的助力相关
成年人肠道微生物组在干扰后恢复到基线状态的能力可能反映了宿主控制的机制,但也可能是由于密集的社会网络提供了大量社会微生物传播的机会而得到促进。
从周围的社会网络和环境中接触到与人类相关的微生物,可能会补偿抗生素治疗后共生和互利微生物群落的损失。然而,这种模式更可能适用于熟悉的社会伙伴。
熟人还是陌生人?社交选择的微生物风险——不熟的社会伙伴可能不助力,甚至导向疾病
相比之下,在抗生素治疗后接触不熟悉的社会伙伴可能导致病理变化,因为可能传播个体缺乏免疫耐受性的新微生物。这些动态可以在实验上易于操作的社会性物种中进行测试,比如在抗生素治疗后将小鼠和蜜蜂这样的动物暴露于熟悉或新的社会伙伴。
来自社会微生物组五个层面的各种社会生态力量可能会影响从干扰中成功恢复的概率
来自同种动物的微生物传播可能与个体在社会群体中的网络化程度以及社会接触的频率和亲密程度(1级)、社交网络的规模(2级)以及社交网络中更远的组成部分之间的互动次数(3级)呈正相关。平均而言,更多的社会物种(4级)可能会经历更快速的干扰后重新定殖。
然而,微生物组通常对扰动具有弹性。因此,一个重要的研究领域是了解与其他生物机制(例如宿主免疫)相比,社会传播对微生物组恢复力的相对贡献。这个问题可以通过将宿主暴露于标准化抗生素治疗同时操纵宿主社会结构(例如单独饲养动物或将动物分成不同大小的群体)来在模型生物中进行实证检验。
社会伙伴有助于抗生素扰乱后肠道菌群恢复力
抗生素引起的蜜蜂微生物组消融增加了死亡率,支持了社会传播在微生物组恢复力中的重要性,但与蜂巢中的其他宿主接触7天后,经过抗生素治疗的蜜蜂的细菌组成部分恢复。
相比之下,与不含抗生素的对照蜜蜂相比,单独饲养的蜜蜂仍然缺乏细菌。
同样,当接受抗生素治疗的小鼠与未经治疗的小鼠(充当微生物库)共同饲养时,抗生素治疗后小鼠肠道微生物组的恢复会加速。
啮齿动物社交网络的菌落模型可用于检查微生物组在更接近自然社会环境的环境中从干扰中恢复的情况。由于微生物传播和获得的增强,具有更多社会互动的更核心的个体可能比更多的外围个体能够更快地恢复。然而,由于更融入社交网络的个人总体上往往拥有更好的健康状况,需要仔细处理才能通过实验解开这两个过程。
尽管社会性微生物传播的一些与宿主健康相关的影响是基于整个微生物组群落水平的过程,但社会性也推动了影响宿主健康和疾病的特定微生物的传播,包括具有代谢和免疫作用的微生物的传播、种间传播、抗生素耐药微生物的传播和病毒的传播。
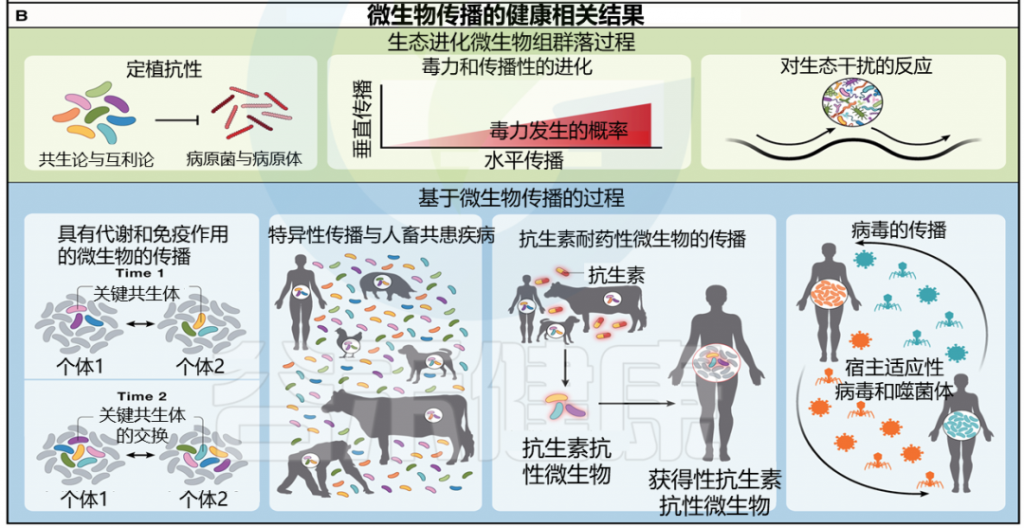
doi.org/10.1016/j.cell.2023.12.014
社交互动可能会促进特定微生物的传播,从而对宿主的新陈代谢和免疫产生明显的影响。例如,一项针对狒狒的研究测试了微生物通过宿主社交和梳理网络的传播。
“核心”微生物群通常有助于为其宿主产生重要的生态系统服务,包括复杂碳水化合物的消化、维生素的合成以及短链脂肪酸的生产,例如丁酸盐,丁酸盐是结肠细胞的主要能量底物。
“核心”微生物群是否也受社会行为的影响?
鉴于它们对宿主的重大贡献,人们认为宿主体内丰富的核心微生物对于宿主健康来说太重要了,不能依赖于宿主的社会互动。
与这一预期相反,这些核心微生物(包括双歧杆菌属和粪杆菌属)的存在和丰度是通过社会群体成员资格和社会行为预测的。
社会传播微生物促进宿主适应新饮食资源
可社会传播的肠道微生物也可能有助于宿主利用特定生态位的能力。例如,沙漠林鼠食用富含单宁的植物,这些植物由粪肠球菌等肠道微生物代谢,可社会传播的分类单元。这些微生物对于单宁的适当降解是必需的,它们的缺乏预示着通常与单宁消耗相关的体重减少和肝损伤。这也是微生物社会传播可能促进宿主适应新饮食资源的一种途径。这一提议可以通过将缺乏能够降解饮食来源的异生物质的微生物的啮齿动物与拥有此类细菌的啮齿动物共同饲养来进行实验研究。
作者预测,缺乏这些细菌的啮齿动物将通过直接和间接的社会传播获得这些细菌,并且能够更好地耐受异生素。这种现象对于理解宿主范围扩张具有重要意义。使宿主能够利用新资源和生态位的社会传播微生物最终可能会促进宿主分散到新的生态系统中。
社交微生物影响宿主免疫健康
微生物组在塑造和调节宿主免疫力方面也发挥着至关重要的作用,特定的社会传播微生物类群可能会影响宿主的总体免疫状态。例如,最近对野生猕猴的一项研究发现,宿主的社交能力与肠道细菌属(例如粪杆菌属)的存在呈正相关,这些细菌具有抗炎和其他对健康有益的作用。
然而,不太善于交际的猕猴表现出链球菌属的水平升高,链球菌属的成员包括多种病原体和病原体。通过短链脂肪酸介导的信号传导、对屏障功能的影响和其他机制,肠道微生物可以调节广泛的宿主免疫细胞群(图 3;表 3),并且微生物组-免疫相互作用可以加剧或保护宿主免受这两种肠道疾病的影响以及各种肠外疾病,包括癌症、自身免疫性疾病和病毒感染(可能包括 SARS-CoV-2)。
社会传播微生物通过代谢物调节宿主免疫
常见的微生物代谢物,如短链脂肪酸(也是由社会传播的微生物产生的)可以对宿主免疫产生显著影响。例如,短链脂肪酸可诱导结肠中Treg细胞,从而赋予小鼠模型抵抗结肠炎的能力。个别细菌种类也会影响不同免疫细胞类型的频率。其中一些微生物还会与药物相互作用,并可以改变药物代谢,从而影响宿主药物反应和治疗结果。
至关重要的是,发挥这些作用的微生物也被观察到具有社会传播性(图3;表3)。这些证据表明社会传播微生物可能产生免疫影响。
表 3 社会传播微生物对宿主免疫的影响

doi.org/10.1016/j.cell.2023.12.014
人畜共患病和人畜共患病溢出效应是生物医学和公共卫生领域长期关注的问题,并且在有关 SARS-CoV-2 起源的争论中占据突出地位。不同物种动物之间的微生物传播很容易被解释为将社会微生物群背景化的社会生态力量的 5 级过程。
种间微生物传播发生在一系列环境中
例如,生活在城市环境中的变色蜥蜴、土狼和麻雀都拥有人类常见的肠道细菌谱系。其他案例包括跨捕食者-被捕食者网络的微生物传播,以及通过与家养动物的相互作用传播微生物。宿主物种之间的这种相互作用具有众所周知的宿主间病原体转移的潜力。例如,在养猪场逗留的时间增加了人类游客体内有害微生物的数量。
物种间微生物传播增加疾病风险
彼此密切接触并可能共享微生物的宿主物种,可以使宿主和肠道微生物适应度脱钩。这种脱钩可能会增强社会微生物组成员中毒力的出现。许多致命的人类疾病,如埃博拉病毒和获得性免疫缺陷综合症(艾滋病),都是其他宿主物种人畜共患感染的结果。许多种相互作用都可能导致此类感染。例如,狩猎和食用森林猎物会增加感染人畜共患病毒的风险,从而将病原体引入人类社交网络。同样,几种人类病毒、细菌和真核病原体可以感染其他物种并引起疾病,包括各种类人猿。
种间微生物传播也有一些潜在益处
尽管这一领域的研究主要集中在人畜共患病和种间微生物传播的负面后果上,但也可能有一些好处。例如,在生活得很近的同域物种中,这种种间传播可能会增强个体和社会群体的微生物多样性。同样,与牲畜的相互作用可能有助于增加人类肠道微生物组的微生物多样性。
如前所述,不同的社会微生物组代表了生态群落,它们可能能够通过定植抵抗更好地抵抗潜在的病原体,还可以通过直接和间接抑制宿主体内的病毒等病原体。
在某些情况下,这些特异性间的相互作用也可能对免疫生理学产生有益的影响
例如,将小鼠暴露在与狗相关的室内灰尘中会丰富有益的约氏乳杆菌,抑制炎症的生物标志物,并保护小鼠免受随后的呼吸道感染和病理变化。可以通过用包含来自其他一些宿主物种的微生物的混合或更多样化的微生物组定植无菌小鼠来研究这些类型的建议,并与用来自单一宿主物种的微生物定植的小鼠(前一组可能对实验引入的病原体表现出更强的抵抗力)。
作者可以类似地测量无菌小鼠的病原体抵抗力,这些小鼠被来自农场、水坑或其他几种动物交换微生物的“自然”混合宿主微生物群样本定植。
此类实验将帮助我们更好地了解包括来自不同宿主物种的微生物在内的微生物组是否具有有益作用。
总体而言,尽管大多数关于微生物种间传播的研究都集中在疾病风险上,但种间微生物传播同时也有可能为宿主带来隐藏的好处,值得进一步研究。
抗生素耐药性的发展是一种古老的适应,使细菌能够相互竞争。然而,用于医疗和农业目的的抗生素的广泛利用正在推动抗生素耐药性的出现,达到造成严重公共卫生风险的水平。
关于抗生素耐药性的许多研究都集中在接触抗生素后宿主体内抗生素耐药性的发展或通过横向基因转移获得抗生素耐药性细菌基因。
在这里讨论如何利用塑造社会微生物组的不同社会生态力量以新颖的方式检查不同水平的抗生素抗性微生物的传播。
抗生素耐药性的多途径传播(5个层级)
例如,在第1级,预计同住一个家庭的个人将从接受抗生素治疗的同居者那里获得抗生素耐药微生物。如果抗生素疗程持续数月或数年,这种情况可能会加剧。
有两个观察结果支持这样的提议。
1.
拟杆菌目细菌是家庭内传播性最强的细菌之一。
2.
拟杆菌门成员充当抗生素抗性基因的储存库。
因此,一些传播性最强的物种和菌株也可能非常有效地传播抗生素耐药性。
在第2级,文化、社会和国家使用抗生素的程度有所不同,从而为抗生素抗性微生物和基因创造了依赖于文化的传播环境。
在第3级,长途旅行的人类可能会不同程度地接触抗生素抗性微生物和基因。
在第5级,已观察到人类和共享环境的其他动物之间存在抗生素抗性微生物和基因的转移。例如,伴侣动物(宠物)是抗生素抗性微生物和基因的潜在来源。
农业动物抗生素使用中的耐药性传播
此外,与接触抗生素的农业动物或在这些动物居住的环境中工作的个人,显示出微生物组重塑和获得抗生素抗性微生物和微生物基因的证据。
至少存在三个主要问题:
所有这些途径都可能导致隐藏的、可社会传播的抗生素耐药性层。当然,这意味着这种传播可能会使未来的抗生素治疗对个人的社会交往和护理人员的效果降低。这种影响的可能性和程度需要进一步的实证研究。
几乎所有生物体都是多种病毒的宿主。除了引起急性疾病的致病病毒(如 SARS-CoV-2 和人类免疫缺陷病毒)之外,多细胞生物还具有内在的病毒群体(病毒体),其由两种不同的成分组成:在宿主细胞中复制的宿主适应共生或条件性致病病毒,以及感染宿主微生物组原核成员的更大的细菌病毒(噬菌体)和古菌病毒(图3)。这些病毒成员也是个体微生物组的一部分,而社会病毒组则构成社会微生物组的一部分。
在人类中适应宿主的病毒组的常见成员
包括内源性逆转录病毒(即与人类基因组整合的病毒基因组的组成部分)、指环病毒、pegiviruses、多瘤病毒和乳头瘤病毒、细小病毒和疱疹病毒。尽管其中一些病毒(特别是乳头瘤病毒和疱疹病毒)与病理有关并引起散发性疾病,包括几种类型的癌症,大多数似乎与任何病理无关。
病毒与宿主的互利共生关系
例如,指环病毒(anelloviruses)——一组神秘的小病毒,具有单链 DNA 基因组,在人类中几乎无处不在 – 尚未被证明会导致任何疾病。一些非致病性或条件致病性病毒在特定情况下甚至可以被认为是互利共生的,因为它们给宿主带来了某些好处。
病毒在宿主免疫发育与社会传播中的作用
例如,人类pegiviruses的双重感染与毒性较低的艾滋病和埃博拉病毒感染有关。一般来说,适应宿主的病毒可能参与宿主免疫的形成。在这方面,指环病毒有助于在发育过程中训练人类免疫系统。此外,用鼠诺如病毒感染无菌小鼠促进了无菌小鼠的典型免疫发育并促进体内平衡,而未感染的小鼠表现出无菌状态特有的异常发育模式。
因此,一些适应宿主的病毒可以模仿宿主细菌定植的发育效应。这些适应宿主的病毒的传播可以通过多种途径发生,并且应该受到社会互动的影响。其中一些病毒,例如指环病毒,可以通过血液传播,因此,它们的传播应该受到塑造社会微生物组的社会生态力量 1-5 级中讨论的几个相同过程的影响。
宿主病毒组的大部分由针对微生物组的病毒组成。细菌种群普遍受到感染它们的噬菌体的控制,宿主微生物组也不例外。尽管微生物组的病毒成分仍未完全表征,但宏基因组学的进步已经导致发现了许多以前未知的噬菌体群体,其中一些噬菌体在人类肠道中非常丰富。
例如,Crassvirales感染拟杆菌门成员,拟杆菌门是人类肠道微生物组的主要组成部分,其中包含难以培养的细菌。培养拟杆菌门成员的挑战意味着其相关的噬菌体群落的特征仍然相对较差。
细菌、噬菌体和宿主的三角互动
噬菌体-原核生物关联具有高度特异性,噬菌体谱系通常感染范围非常窄的原核宿主。在某种程度上,所有微生物组-免疫相互作用(图3)都可以反映各种噬菌体-细菌相互作用。
换句话说,任何细菌不仅参与与宿主相互作用并与其他细菌竞争,而且还参与适应噬菌体的存在并协调抗噬菌体防御。因此,所有或大多数细菌对宿主的影响应在相互作用的三方系统的背景下考虑,包括细菌-宿主相互作用、细菌-细菌相互作用和细菌-噬菌体相互作用。
社会生态影响噬菌体传播
由于噬菌体很可能伴随任何细菌传播,因此噬菌体应经历 1-5 级相同的社会生态过程,从而形成社会微生物组。最近的几项研究发现了这种现象的证据。例如,根据狒狒社会结构肠道细菌群落的发现,宿主社会群体也可以根据其噬菌体群落来区分。
细菌组成的平行结果,狒狒之间的梳理强度预测噬菌体群落的相似性,即使在控制遗传相关性之后。在人类研究中也观察到了细菌和噬菌体动力学之间的这种相似之处。例如,在成年同卵双胞胎的研究中,噬菌体多样性与细菌多样性密切相关。
此外,与细菌一样,婴儿病毒组具有出生模式的特征,阴道分娩的婴儿比剖腹产婴儿表现出更多样化的病毒组。最后,与肠道微生物组的细菌成员一样,噬菌体的组成在衰老过程中也会发生变化。这些发现强调了噬菌体和细菌传播以及社会微生物组的宿主内动态之间的相似性。
噬菌体对宿主健康的有益/有害影响
例如,在感染霍乱弧菌的个体中,那些携带感染霍乱弧菌的噬菌体的个体所患的疾病毒性较低。这些有益的影响也可能扩展到心理领域,例如认知表现。例如,一些噬菌体感染了可以损害宿主认知能力的细菌,从而提高了宿主的认知表现。这种模式已在人类中观察到,并在小鼠和苍蝇中得到实验证明。
相反,噬菌体可能通过感染对宿主有益的细菌,或感染与病原体和致病生物竞争的共生细菌,从而损害宿主健康。
总的来说,噬菌体传播可能是健康和疾病中尚未得到充分研究的一个组成部分。事实上,由于噬菌体在研究中很少被量化或有意控制,因此值得考虑以下可能性:目前归因于微生物组细菌成分的许多生理效应部分源于细菌与其相关噬菌体之间的无数相互作用。
要更全面地了解微生物传播如何影响宿主健康,需要明确掺入病毒组。例如,纳入病毒持久性和复制策略和更广泛的生态过程(例如捕食者-猎物动态)可以进一步增强我们对宿主中微生物传播、组装、演替、恢复力和功能影响的理解。
总体而言,推动宿主之间微生物传播的社会互动类型预计会导致感染这些微生物的噬菌体的伴随传播。病毒的传播意味着社会微生物组还包含一个密不可分的社会病毒组,对宿主健康产生影响,为发现提供了许多机会。
社会传播微生物的潜在影响也可能与传染病和非传染性疾病相关。虽然传染病在流行病学转变期间有所下降,但非传染性疾病却变得更加普遍,目前约占全球死亡人数的 75%。利用本视角中提出的主题和原则,研究人员提出微生物的社会传播可能会增强或降低宿主对传染性和非传染性疾病的易感性(图 5),因此非传染性疾病可能存在未被充分认识的风险。
图5 微生物的社会传播和疾病风险
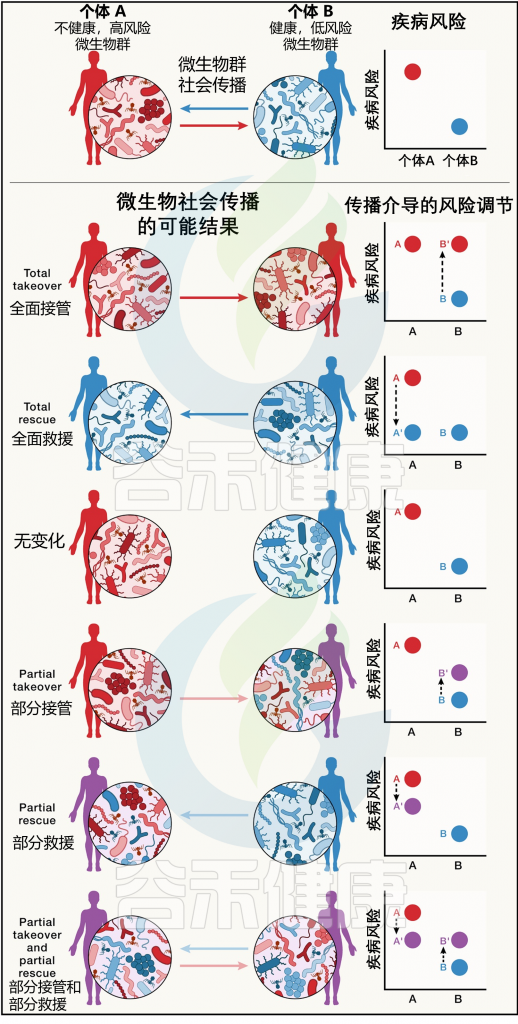
doi.org/10.1016/j.cell.2023.12.014
社会传播的微生物可以调节传染病的风险和影响。例如,微生物可以促进宿主的病毒感染,包括通过增强病毒颗粒与宿主细胞结合时的稳定性或抑制宿主抗病毒反应。就此类微生物的可传播性而言,宿主对病毒感染的反应可能至少部分是社会获得的微生物的功能。
社会微生物调控宿主疫苗反应
由于可传播的肠道微生物与宿主疫苗反应相互作用并调节宿主疫苗反应(表3),因此宿主疫苗介导的对各种细菌和病毒病原体的抵抗力可能至少部分受到社会获得的微生物的影响。
抗生素抗性微生物和微生物基因的社会传播,也可能增强接受者在未来细菌感染期间对抗生素治疗的抵抗力。
非抗生素药物促进耐药性微生物传播
事实上,最近的体外证据表明,即使是抗抑郁药等非抗生素药物也可能在临床相关浓度下导致抗生素耐药性的出现。这可能为耐抗生素微生物的社会传播创造更多机会。
例如,可以想象一个假设的场景,其中一名家庭成员正在接受重度抑郁症的治疗。患者不仅面临产生抗抑郁药介导的抗生素耐药性的风险,而且这些抗生素耐药性微生物也有可能传播给其他家庭成员。通过该途径,非传染性疾病的治疗可能会影响患者社交网络中传染性疾病的治疗结果。
微生物的社会传播也有助于减轻传染病
社会获得的微生物可能有助于定植抵抗,从而保护宿主免受各种细菌病原体的侵害,并降低疾病的风险和严重程度(图3)。
在昆虫中,社会获得的微生物对传染病的保护作用是众所周知的。例如,在熊蜂中,宿主在蛹羽化后通过接触巢友的粪便来获得肠道细菌,这些细菌可以防止有毒的锥虫小虫引起的寄生虫感染。
这一原则最近被扩展到合成益生菌的设计中以保护宿主。给予蜜蜂合成共生体增强了对蜜蜂微孢子虫的抵抗力,蜜蜂微孢子虫是一种经常与蜂群崩溃性疾病相关的微孢子虫寄生虫。至关重要的是,合成益生菌在共同饲养的蜜蜂中传播,这种现象对整个蜂巢的保护具有影响。
抵抗力可以通过微生物群转移
在哺乳动物中,预防疾病已被证明是一种可传播的表型:当来自人类的肠道微生物对肠道感染表现出不同的易感性被转移到无菌小鼠体内时,受体小鼠在暴露于啮齿类柠檬酸杆菌感染时会重现其供体的抵抗特征。
具体来说,当最易感的小鼠(即被来自最易感人类的微生物定植的小鼠)与最有抵抗力的小鼠(即被来自最有抵抗力的人类的微生物定植的小鼠)共同饲养时,易感小鼠变得更加抵抗,但抵抗力强的小鼠并没有变得更容易受到柠檬酸杆菌感染(在图 5)。
内源微生物群体与致病性真核病毒相互作用,可能会抑制病毒感染
例如,在病毒颗粒试图附着在宿主细胞上时干扰病毒颗粒。噬菌体的传播还可以降低某些传染病的毒力,噬菌体对人类霍乱弧菌感染的有益作用就是例证。此外,一些研究表明,来自社会传播细菌属双歧杆菌、乳杆菌和链球菌的细菌(表 3)可能与预防疟疾有关。
与昆虫一样,微生物的社会传播可以保护哺乳动物宿主免受感染或通过多种机制限制其严重程度。此外,为蜜蜂设计合成的、可传播的益生菌也对针对人类的类似方法产生影响,设计可传播的益生菌和治疗方法可能对人类传染病是可行的。例如,某些益生菌可以促进金黄色葡萄球菌去除,对人类健康产生有益影响。如果给予目标宿主的益生菌能够在宿主体内定植并在宿主之间传播,这可能为传染病的管理带来机遇,同时也带来新的伦理困境。
非传染性疾病可能也有微生物传播的成分
通常认为非传染性疾病是由非传染性风险因素引起的,包括遗传和生活方式特征。然而,非传染性疾病也可能具有由微生物的社会传播引起的传染性成分,这可能会加剧和减轻疾病风险。
许多最初被归类为非传染性疾病的疾病现在正在接受微生物相关性和原因的评估,包括代谢疾病、动脉粥样硬化,各种癌症,以及与大脑相关的综合症和病症。将患者粪便移植到无菌动物体内表明,供体微生物可以促使幼稚受体出现一系列临床相关表型。然而,许多这些研究涉及将整个肠道微生物群从供体转移到受体,而不是通过社会互动传播选定的微生物群成员。
此外,一些具有社会传播性的微生物还会干扰用于治疗癌症和各种其他非传染性疾病(包括帕金森病、心血管疾病和抑郁症)的药物的代谢(表 3)。因此,下一步是测试与疾病相关或干扰药物代谢的微生物是否具有社会传播性。
微生物传播对非传染性疾病的双重影响
许多非传染性疾病可能具有传染性成分,因为影响宿主易感性、结果和治疗反应的微生物具有社会传播性,这一普遍假设得到越来越多的实证支持。例如,在自闭症小鼠模型中,怀孕期间分段丝状细菌的社会传播与母体免疫激活相互作用,诱导母体TH17细胞群,进而导致后代的社会行为缺陷。
社会传播的微生物也可能提供一定程度的预防非传染性疾病的保护作用。例如,家庭规模预计与群体内微生物传播呈正相关,但与炎症性肠病的发病率呈负相关。在小鼠研究中也观察到了这种流行病学模式的一种形式,其中与生活在较小群体中的小鼠相比,生活在较大群体中的小鼠对葡聚糖硫酸钠诱导的结肠炎表现出更强的抵抗力。这种保护与微生物组成的变化有关,而微生物组成的变化可归因于群体规模的增加。
微生物传播和生活方式相互作用,影响健康
就代谢条件而言,共同饲养含有与肥胖不一致的人类双胞胎肠道微生物的小鼠,会导致瘦双胞胎衍生微生物的偏向转移,从而保护携带肥胖双胞胎微生物的小鼠免于体重增加(在图5中的“拯救”场景中进行了可视化)。
然而,这些保护作用依赖于饮食,只有当受体小鼠被喂食食物或脂肪含量相对较低、水果和蔬菜含量较高的饮食时才会显现出来。这表明微生物的社会传播和饮食等生活方式因素可能相互作用,从而影响宿主的健康结果。
共同饲养提升黑色素瘤免疫治疗效果,与社会性获得有益微生物相关
当治疗抵抗性小鼠与治疗反应性小鼠共同饲养时,抵抗性小鼠表现出改善的治疗结果,这归因于社会性地从反应性小鼠中获得有益微生物。
值得注意的是,有反应的小鼠并没有对治疗失去反应,在这种情况下,建议在没有明显成本的情况下进行利益的社会传递。
癌症等非传染性疾病的治疗可能至少部分受到社会传播微生物的影响
宿主对癌症治疗的反应与微生物组成有关,而对宿主反应重要的微生物是可社会传播的(表3)。因此,癌症等非传染性疾病的治疗可能至少部分受到社会传播微生物的影响。
当然,并不是说传统意义上的非传染性疾病,应该根据介导疾病的微生物社会传播的可能性重新归类为传染性的,或者来自不太健康个体的微生物必然会使他们的社会接触容易患上疾病。事实上,从生态理论和经验模式来看,与健康相关的微生物组往往更加多样化和有弹性,传播的效果可能更可能发生在“拯救”方向而不是“接管”方向(图5)。
微生物社会传播对健康影响的复杂性
当然,有益的传播也并不总是发生,这种可能性值得进一步调查。非致病微生物的社会传播是否会加剧或减少非传染性疾病风险仍然是一个悬而未决的问题。同样,与人类的相关性仍有待确定,因为迄今为止大多数研究都是在实验室小鼠身上进行的,这些小鼠表现出食粪行为,有望促进高保真度的社会传播。
总体而言,对疾病相关或保护性微生物的社会接触和获得,分别可能丰富或减少发展临床表型的可能性,其调节程度可能与宿主特异性特征(如遗传学和生活方式)相互作用(图5) 。当然,社会传播微生物对宿主健康和疾病的影响可能并不大,这些影响作为健康的社会决定因素的贡献者,以及可能在社会进化中的作用,值得研究。
在本视角中,作者利用大视角和独特的概念应用了社会微生物组概念来研究微生物的社会传播对宿主健康、疾病和社会进化的影响。
社会传播的微生物可以影响与宿主健康相关的广泛过程,这些过程可以分为生态进化微生物群落过程和基于微生物传播的过程。至关重要的是,社会传播的共生体可能会改变传染性疾病和非传染性疾病的疾病风险。
如果非传染性疾病的风险和结果确实会受到社会传播微生物的影响,必须考虑非传染性疾病具有传染性成分的可能性。研究社会传播微生物与人类的相关性以及改变传染性和非传染性疾病发生风险的机制,可能会促进有关这些疾病的知识和疗法的出现。
了解致病性和非致病性微生物的传播生态将是一个重要的研究领域:如果病原体、共生体利用至少在某种程度上不同的传播策略,或者不同地改变宿主行为(例如,病原体引发社会隔离和疾病行为),那么特定的社会结构可能对致病性与共生体的传播产生不同的影响微生物。这提出了自然选择的不同目标,并对社会进化产生影响。
社会微生物组不仅包含细菌成分和社会病毒组,还包含社会古菌组、社会真菌组等。此外,正如人类文化进化产生了抑制病原体传播的行为和实践一样,文化进化也可能有利于行为模式和实践的出现,以促进共生和互惠微生物在人类之间的传播。
所有生物体和环境都通过微生物传播在某种程度上相连,这也是“同一个健康”观对人类、其他动物和环境健康的基本前提。
因此,阐明这些微生物之间的联系也可能在人类疾病背景之外发挥作用,并有助于应对全球健康挑战。最终,通过更广泛的视角(包括共生体、病原体)来观察社会微生物传播,可以帮助我们更好地理解影响健康社会决定因素的微生物信号以及可传播微生物在社会进化中的多效性作用。
主要参考文献:
Sarkar A, McInroy C J A, Harty S, et al. Microbial transmission in the social microbiome and host health and disease[J]. Cell, 2024, 187(1): 17-43.

谷禾健康

食物让我们填饱肚子,补充养分,且感受到快乐与满足,然而,对有些人来说,部分食物却成为了难以预料的健康障碍。
“当时坐在一家优雅的西餐厅,四周萦绕着新鲜烘焙面包的诱人香气,我感受到一场味蕾的盛宴”,刚毕业的小楠回忆着,“然而,就在我大口享受那细腻丝滑的奶油酱和意面时,肠胃却在暗暗策划一场叛变”… “随之而来的腹胀、腹痛,彻底破坏了圣诞节的氛围”…
小楠也是“食物不耐受”的群体之一。“当时出去吃饭常有状况发生,但并不知道是和食物不耐受有关,还是一起吃饭的同学提醒了我”。
对于食物不耐受的人来说,由于其症状形式多样,较迟缓发烧,且不那么严重,许多人甚至根本没有意识到自己患有食物不耐受。有时候,人会感到疲倦,但并没有把疲倦,或情绪低落,或头痛这些与食物不耐受关联起来。
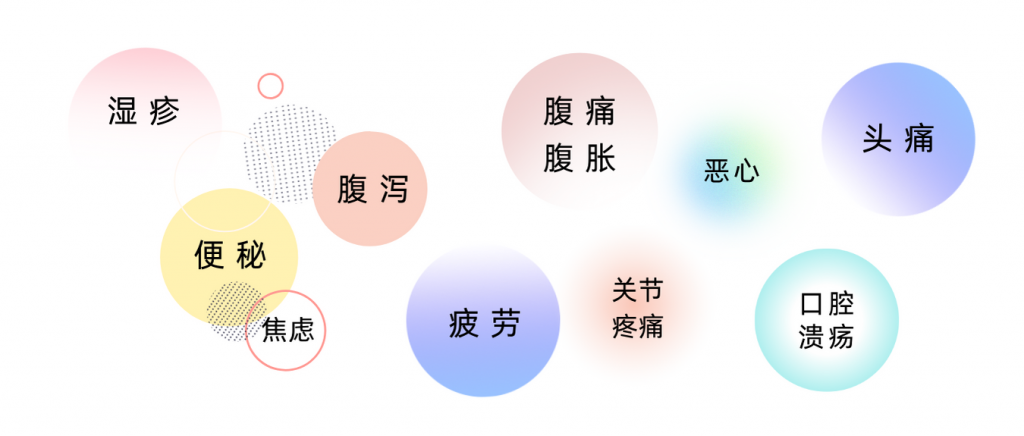
以上一系列症状都有可能与食物不耐受相关。其实,像小楠这样食物不耐受的人其实比较常见,据估计,全世界约有 20% 的人有食物不耐受。
很多人小时候并没有食物不耐受,等成年后的某一天突然发现出现食物不耐受,这说明遗传因素并不一定主导,有其他潜在的因素在起作用。环境因素、生活方式和饮食习惯的改变等都可能会导致食物不耐受的出现。
以下是一些常见的原因:酶缺乏(乳糖不耐受中的乳糖酶缺乏),化学物质敏感(如咖啡因、防腐剂、色素、味精等),药物反应,消化系统疾病,饮食习惯(高FODMAP食物),遗传,心理(压力和焦虑)等。
食物不耐受和食物过敏又不一样,食物过敏涉及免疫系统,如IgE介导的反应,这可能会迅速导致严重甚至危及生命的反应。而食物不耐受主要涉及消化系统。
食物不耐受可能在进食后30分钟左右开始,但也可能要在一两天后才发生。症状的延迟发作特点意味着食物不耐受的诊断可能更为复杂。症状包括腹泻、腹胀、胃痛、疲劳、头痛等,可能与消化系统的功能紊乱有关,而肠道菌群在这里扮演了重要的角色。
比如部分健康人群的肠道微生物组蛋白水解能力较低,可能与喝牛奶后肠道不适相关。有研究发现,在乳糖不耐受患者中,乳制品摄入量与胃肠道不适之间的关联部分是由双歧杆菌丰度介导的。
此外,由于感染,炎症等因素带来的肠道菌群失调,有害菌过度增长,产生毒素和其他代谢产物,损害肠道细胞,肠道功能紊乱,肠道屏障破坏增加肠道通透性,可能导致食物成分不能在正确的位置也不能恰当处理,从而发生食物不耐受。
虽然说食物不耐受很常见,但诊断起来却很困难,通常需要时间、耐心和仔细观察,也需要专业人士帮助识别触发食物或成分。症状及其严重程度取决于所吃食物的类型和数量。
许多食物都有可能触发一系列症状,比如牛奶、小麦、贝类、坚果、西红柿、花生、鱼、茄子等,但有时候我们并不知道是哪种食物,又是如何引发这些症状,因此常常踩雷而不自知。
当有一天食物成了罪魁祸首时,会面临一系列挑战,比如缺乏基础知识,对其诊断的延迟、不适当,而不正确的饮食管理更会放大该问题的影响,甚至带来营养缺乏,这对同时患有其他疾病的人群更是雪上加霜,这种情况下,了解食物不耐受就非常重要。
本文我们就来了解一下常见的食物不耐受的关键证据和科学理解,食物如何诱发其反应的机制及相关诊断,食物不耐受与肠道微生物群之间的复杂关系,这有助于我们更好地理解食物不耐受与身体症状的关联,从而采取措施来减轻其带来的不适。
“食物不耐受”(Food Intolerance)并不是一个最近出现的词,事实上,这个概念最早可以追溯到20世纪初。食物不耐受是指人体在消化某些食物时出现困难,这通常是由于缺乏特定的消化酶或者对食物中的某些成分有不良反应,但并不涉及免疫系统的反应。
在20世纪,随着医学和营养科学的发展,人们逐渐开始了解到并非所有的消化不良都是由传统意义上的疾病引起的,而有可能是由于身体对某些食物成分的不耐受。例如,乳糖不耐受是一种大家都知道的食物不耐受,它是由于身体内乳糖酶的缺乏或不足导致的,使消化乳糖变得困难。
在过去的二十年中,食物不良反应的病例显着增加,人们对食物不耐受的认识也不断深化,相关的研究不断增多。现如今,食物不耐受已经成为营养学和临床医学中的一个重要话题。
一般来说,食物不耐受的临床表现涉及多个器官或系统,常见症状包括:
但还有许多其他可能的症状,包括:
症状可能持续几个小时或几天。
不是。食物不耐受常常与食物过敏混淆。它们之间的区别在于其免疫基础。
食物不耐受主要是由于人体消化系统的问题导致对某些食物产生反应,但不涉及免疫系统。可由任何(非蛋白质)食物成分引起,比食物过敏更为常见。症状通常与食用量成正比,每次摄入都会有类似症状。有些人对乳糖不耐受,乳糖酶水平可能降低或缺乏。
而食物过敏涉及到免疫系统,对过敏食物的反应不仅与摄入量有关,即使很少量也可能引起严重反应。食物过敏的影响可能更严重,甚至可能涉及生命安全。
食物过敏的特征是摄入特定食物后,IgE介导的针对食物蛋白的抗体被激活。例如,对花生过敏的人可能会产生影响组织中肥大细胞和血液中嗜碱性粒细胞的反应。乳糜泻是一种 T 细胞介导的免疫反应,无 IgE 介导的反应。T 细胞免疫反应与更延迟的反应相关,这意味着症状在摄入后数小时或数天内出现,而不是在食用后立即出现。
总的来说,食物不耐受主要由消化问题引起,食物过敏则是由免疫系统的异常反应引起,两者机理上有区别。

有可能的。
虽然食物不耐受和食物过敏是由不同机制引起的,但一个人可能同时经历这两种情况。食物不耐受可能会加剧食物过敏的症状,反之亦然。此外,食物不耐受可能会导致肠道刺激和炎症,这可能会影响肠道菌群的平衡,进而影响免疫系统的反应。
据估计,食物不耐受影响多达 20% 的人口,但鉴于临床表现和非免疫机制差异很大,对诊断和管理的完全理解很复杂。
一项在瑞士儿童医院以及 4 家儿科私人诊所进行的横断面研究。共纳入2036名54个月至46岁(平均年龄:1.18岁)的儿童和青少年(7%为男性,4%为女性),其中316名(16%)参与者报告因不耐受而避免食物。乳糖不耐症是最常见的一种。在所有病例中,有55%没有进行任何医学检查来证实这种不耐受。251名(12%)参与者表示,出于假定的健康原因避免耐受的食物。
食物不耐受是由于身体无法消化某种食物或食物中的成分而引起的。
最常见的食物不耐受是乳糖不耐受。
当然,其他任何食物都可能与食物不耐受相关,例如:
◗ 麸质(小麦、黑麦和大麦)——存在于面包和面食等食物中
◗ 组胺——存在于葡萄酒和奶酪等食物和饮料中
◗ 咖啡因——存在于咖啡、茶和一些碳酸饮料中
◗ 亚硫酸盐——存在于苹果酒、啤酒和葡萄酒中
◗ 水杨酸盐——存在于一些水果、蔬菜、香草和香料中
◗ 谷氨酸钠 (MSG) – 存在于成熟的水果、腌肉和咸味食品中
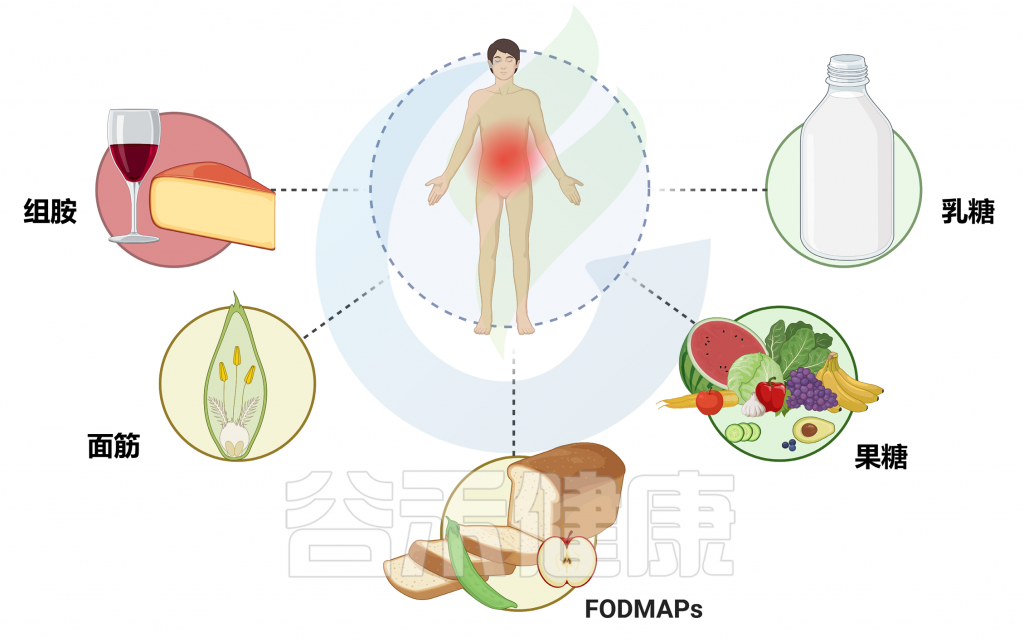
doi.org/10.3390/nu15234969
遗传、消化系统疾病(IBS、IBD等)、消化酶缺乏、对食品添加剂的敏感性、肠道菌群失调、药物食物相互作用、食物中的自然毒素、压力和情绪等因素都可能与食物不耐受有关。具体原因取决于食物不耐受的类型。
接下来我们逐一了解常见的食物不耐受、原因、诊断、治疗/改善措施等。
小时候,大家喝牛奶基本没啥问题,但现在越来越多人开始出现乳糖不耐受。
这其中有些人是随着年龄的增长慢慢地出现乳糖不耐受,也有人是生病或者服用一些药物之后突然开始了乳糖不耐受…
●
当未消化的乳糖通过肠道而不被吸收时,就会发生乳糖吸收不良。管腔中未消化的乳糖会受到细菌发酵,增加渗透压,导致摄入乳糖后出现不耐受症状。当乳糖吸收不良伴有上述症状时,通常称为乳糖不耐受。
简单来说:
乳糖不能直接在肠道中吸收,而是必须被乳糖酶分解成两种较小的糖成分。
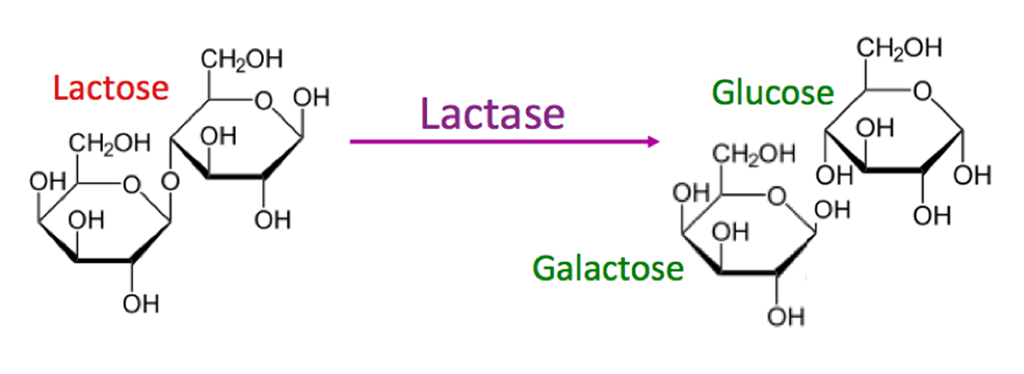
图源:evo-ed
乳糖酶缺乏可能导致乳糖不耐受。
主要原因有四个:
原发性乳糖酶缺乏或乳糖酶不持续
乳糖酶活性随着个体年龄的增长而逐渐下降。这种衰退从婴儿期开始,症状通常出现在青春期或成年早期。
乳糖酶持久性是由 2 号染色体上的显性基因突变引起的。乳糖酶不持久不是疾病而是遗传表型。
大约 70%–100% 的亚洲成年人口是乳糖酶非持久性 (LNP)基因型。
继发性乳糖酶缺乏症
继发性乳糖酶缺乏症是由肠上皮损伤引起的,可能发生在多种情况下,如胃肠炎、化疗、抗生素使用、乳糜泻、炎症性肠病、艾滋病、营养不良或吸收表面减少的情况,如短肠综合症。
乳糖酶活性的降低是暂时的、可逆的,一旦潜在的肠道损伤得到治疗或解决,乳糖酶活性的降低通常会得到改善。
先天性乳糖酶缺乏症
先天性乳糖酶缺乏症是一种极其罕见的儿科疾病,会导致婴儿出现严重症状和发育不良。这种情况源于常染色体隐性遗传模式,导致出生时乳糖酶活性降低或缺失。
发育性乳糖酶缺乏
在妊娠28-37周之间出生的早产儿中观察到发育性乳糖酶缺乏症。在这些情况下,婴儿的肠道发育不全导致无法分解乳糖。然而,随着年龄的增长,随着肠道的成熟和喂养,特别是母乳喂养,这种情况通常会改善。
乳糖吸收不良,无论是由于原发性还是继发性乳糖酶缺乏,都会导致未消化的乳糖与肠道微生物群相互作用。
乳糖的细菌发酵会产生短链脂肪酸(乙酸盐、丙酸盐和丁酸盐)和气体(氢气、二氧化碳,有时还有甲烷)。当乳糖的量超过结肠微生物群的发酵能力,或者短链脂肪酸的负荷超过结肠的吸收能力时,就会发生腹泻。水的渗透滞留进一步增加了结肠中的渗透负荷,从而放大了效果。
个体可能患有乳糖酶缺乏症但没有症状。
在出现临床表现的情况下,症状包括腹胀、腹痛、胀气、腹泻,有时还包括恶心。
症状的严重程度可能有所不同,大多数人可以耐受相对少量的乳糖而不会感到不适。
一些方法可以检查一个人是否有乳糖不耐症,如基因检测、酶活性测试、呼气测试等。在这些检测中,小肠活检测量乳糖酶的活性是最精确的方法,但是需要通过内窥镜检查直接从小肠壁取样,这种侵入性的方法通常不作为首选诊断手段。
乳糖呼气测试是一个更简单、不伤身体的方法,用来看一个人消化乳糖的能力,以及是否因为吃了乳糖而有不适的症状。
但是,这些测试有一个问题:有的人虽然测试显示他们有乳糖不耐症,但是他们吃乳糖后并没有不舒服,所以测试结果并不能完全确定不舒服是不是因为乳糖不耐症造成的。
为了解决这个问题,有些时候在做呼气测试的时候会用一些标准化的问卷,或者用盲测(测试者不知道他们吃的是不是含乳糖的东西)。盲测特别有用,因为很多时候人们自己说的乳糖不耐症的症状和客观结果之间的相关性较低,特别是在有肠易激综合征(IBS)的人群中。
总的来说,乳糖不耐症的诊断可以通过准确的病史和临床评估,并在避免含乳糖的食物 5-7 天后通过症状消退来确诊。
可以和其他食物一起吃
如果乳糖与其他营养素一起食用,耐受阈值就会升高。
因此,一种解决方案可能是将乳糖与其他食物一起食用,以减缓胃排空和小肠运输,从而使乳糖有更多时间分解和吸收,从而减少出现症状的可能性。
陈年奶酪也是比较好的选择
与新鲜奶酪不同,陈年奶酪几乎不含或不含乳糖。事实上,在成熟过程中,细菌消耗了所有存在的乳糖。
常见奶酪类乳制品的乳糖含量
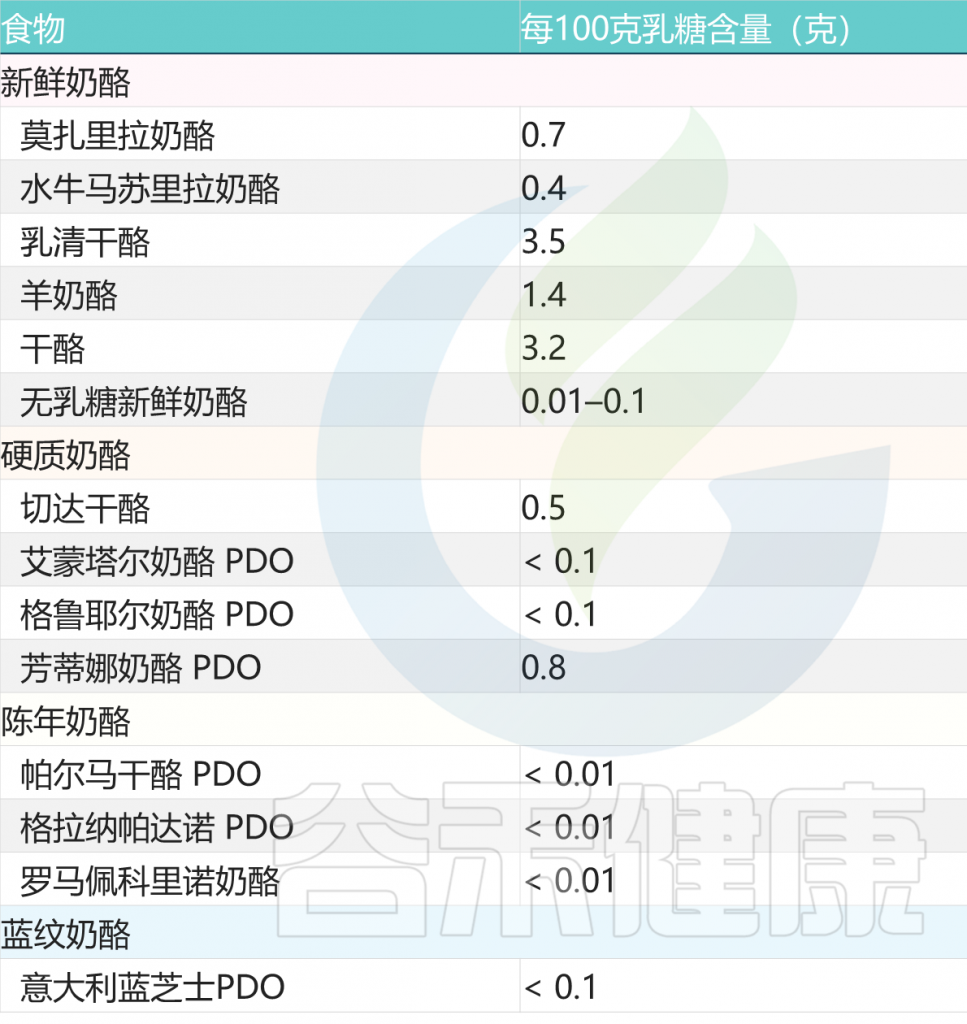
doi: 10.1186/s12967-020-02429-2
无乳糖食品
为了确保乳制品中所含物质的摄入不会因乳糖而引起腹部不适,现在有一些无乳糖食品。从营养的角度来看,它们与经典乳制品相当,不同之处在于它们不含乳糖。不含乳糖、添加乳糖酶的乳制品通常被认为是安全的。
技术的不断进步正在不断提高无乳糖乳制品的营养价值、功能、感官吸引力和质量。这些发展旨在为乳糖不耐症患者提供更多样、更可口的选择,同时确保最佳营养摄入和整体健康。
也可以喝牛奶,但一开始量不建议太多
对于乳糖不耐受患者,如今不再建议避免食用所有乳制品,因为大多数乳糖不耐受患者可以耐受每单剂量最多 5 克乳糖,大约相当于 100 毫升牛奶,并且可能比严格的无乳糖饮食有好处。
常见牛奶类乳制品的乳糖含量
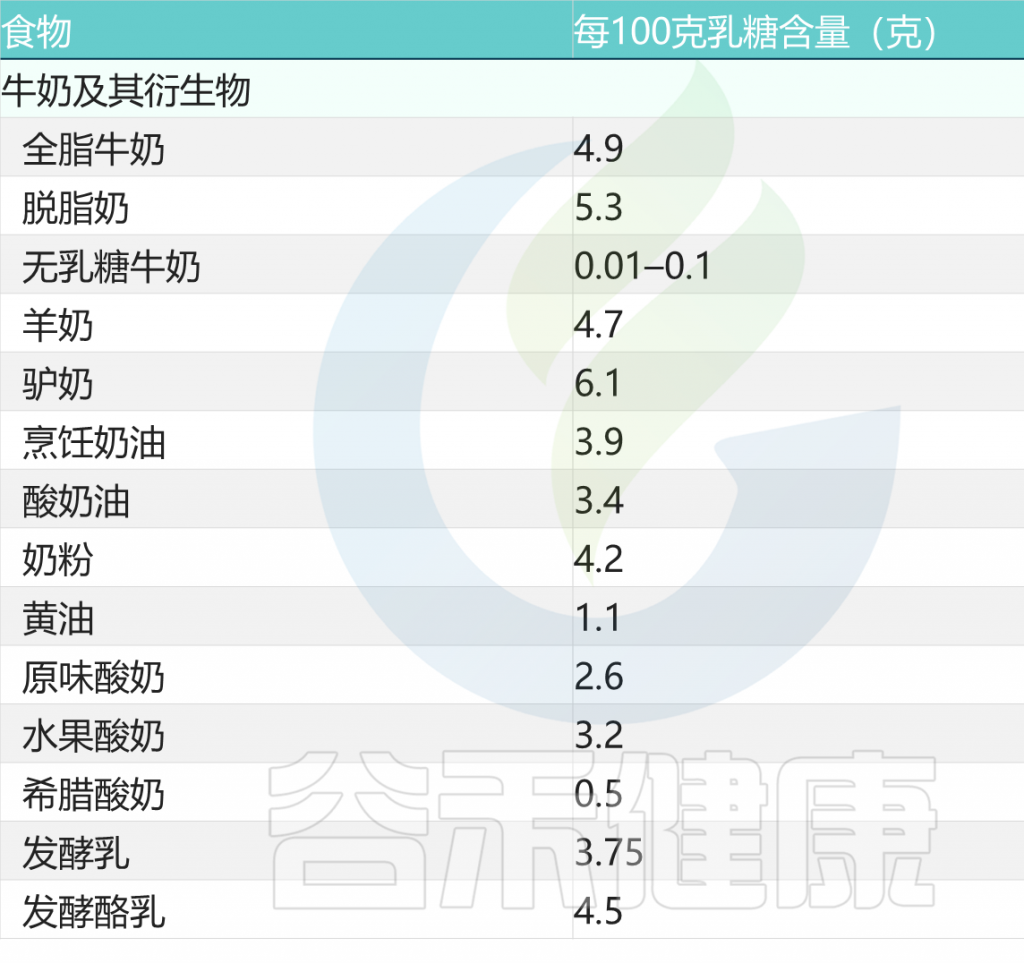
doi: 10.1186/s12967-020-02429-2
摄入乳糖后出现症状的可能性受到多种因素的影响。
外在因素包括:
内在因素包括:
我们详细看一下,肠道微生物组成这个内在因素发挥的作用。
有研究发现,与非乳糖不耐受个体相比,在乳糖不耐受个体中双歧杆菌丰度增加( P Wilcox =4.56×10 -9 ),并且与乳糖不耐受组的乳制品摄入量呈正相关 (R=0.22,p =0.05)。乳糖不耐受组和非乳糖不耐受组之间的乳制品摄入量没有显著差异。在乳糖不耐受个体中,双歧杆菌丰度与总肠道不适评分之间呈正相关(R=0.33,p=0.003)。
在六种特定的肠道疾病中,双歧杆菌丰度与腹痛、不适和腹胀呈正相关,但与任何其他疾病无关。研究人员发现乳制品摄入量与胃肠道不适之间的关联部分是由双歧杆菌丰度介导的(Prop介导=43%,p=0.054)
乳糖不耐症个体的双歧杆菌丰度和肠道不适
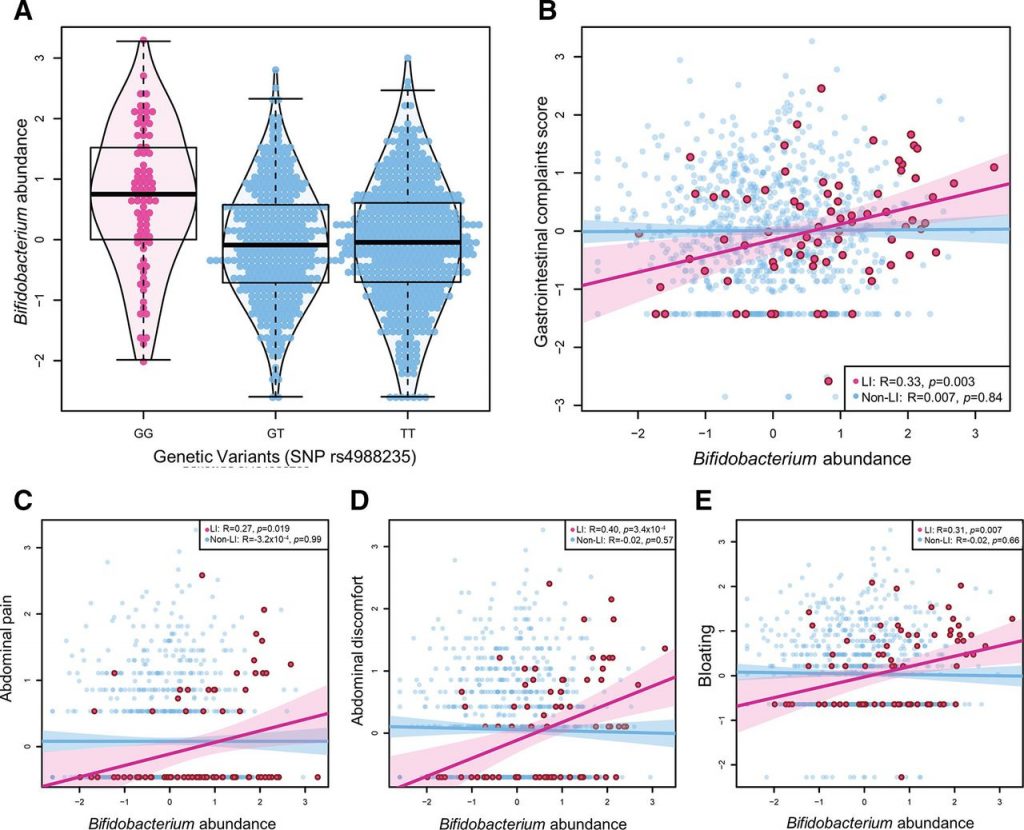
doi.org/10.1136/gutjnl-2020-323911
A)与 SNP rs4988235 的乳糖耐受基因型(G/T 和 T/T)相比,乳糖不耐受基因型(纯合 G/G)个体的双歧杆菌丰度更高。
B) 在乳糖不耐受个体中,双歧杆菌丰度与胃肠道症状总评分显著相关 (p=0.003)。
更具体地说,双歧杆菌丰度与 (C) 腹痛、(D) 胃肠道不适和 (E) 腹胀呈正相关。
分析牛奶摄入量、双歧杆菌丰度和肠道不适之间的直接和间接关系
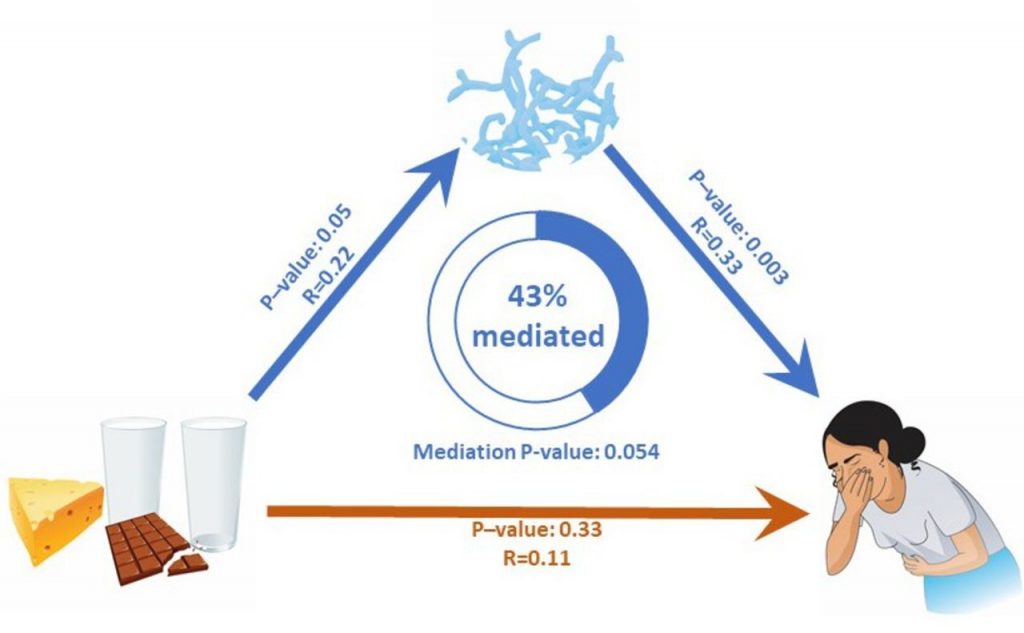
doi.org/10.1136/gutjnl-2020-323911
具有统计学意义的关联用蓝色箭头显示。
红色箭头表示不显著的相关性。
乳糖不耐受个体中与乳制品消费相关的肠道不适很大程度上是由双歧杆菌丰度介导的。
该研究结果证明,乳糖不耐受患者所经历的特定肠道症状可能是肠道中双歧杆菌丰度的结果,而不是乳糖摄入的直接影响。这项工作支持了初步报告,乳糖发酵细菌的代谢产物可能与乳糖不耐受症状的发生有关。
许多健康人尽管没有乳糖不耐症,但患有与牛奶相关的胃肠道不适;造成这种情况的机制尚不清楚,这可能与他们体内牛奶蛋白消化相关的生理反应有关。这种差异可能源于他们肠道微生物组的特定构成,这反过来又受到他们的饮食习惯影响。我们来看一项研究 ↓↓
该研究旨在探讨19名耐乳糖健康非习惯性牛奶消费者[NHMCs]在食用牛奶后报告胃肠不适的牛奶蛋白消化和相关生理反应(主要结果)、肠道微生物组和肠道通透性,并与20名没有胃肠不适的习惯性牛奶消费者[HMCs]进行比较。
doi.org/10.1016/j.foodres.2023.112953
结果表明,与习惯性牛奶消费者相比,非习惯性牛奶消费者中的牛奶消耗量以及胃肠不适导致循环BAP缓慢而较低的增加,胃饥饿素(ghrelin)、胰岛素和内源性大麻素的反应较低,葡萄糖反应和血清DPPIV活性较高。
两组的肠道通透性相似,而习惯饮食(非习惯性牛奶消费者中乳制品含量较低,膳食纤维与蛋白质比例较高)可能形成了肠道微生物组;非习惯性牛奶消费者表现出双歧杆菌丰度较低、普氏菌丰度较高和蛋白酶编码基因丰度较低等特点,这可能会降低蛋白质消化,如硫酸吲哚的尿排泄量较低所示。
总之,研究结果表明,由于肠道微生物组较低的蛋白水解能力,牛奶蛋白质的消化效率较低,这可能解释健康人食用牛奶后的胃肠不适。
在精准医疗和个性化营养时代,该研究的结果有利于个性化饮食疗法。也就是是,患有牛奶相关胃肠道不适的健康人可能会受益于基于蛋白水解酶的疗法或针对微生物组的临时干预。此外,在个性化饮食方法中,牛奶相关的胃肠道不适可以通过食用含有预消化牛奶蛋白的牛奶食品来管理。食用在肠道中发挥蛋白水解活性的益生菌可能会进一步减轻敏感个体的胃肠道疾病和焦虑。
以前可能会建议乳糖不耐受患者尽量避免乳制品。但实际上,牛奶和乳制品是钙、磷、胆碱、核黄素、维生素 B12 和维生素 A 的主要来源,排除所有乳制品有可能会导致微量营养素缺乏。
从饮食中完全消除乳制品相关的主要风险是缺钙和损害骨骼健康。
* 膳食钙的最佳来源包括牛奶、奶酪、乳制品,西兰花、羽衣甘蓝、羽衣甘蓝、萝卜叶菜等。
大多数分析研究得出的结论是,乳制品是适当骨骼状态所需营养的极好来源,且在不食用乳制品的情况下达到建议的钙摄入量是具有挑战性的。
然而,对于乳糖不耐受的个体来说,摄入乳制品可能导致消化不适和其他相关症状。这就引出了一个重要的问题:如何在不引发消化不适的情况下为这些个体提供必要的营养素?
还是可以从肠道菌群的角度去考虑,因为肠道菌群的稳态,可能会帮助本来乳糖不耐受的人群慢慢适应乳糖。
我们来看最新的一项研究,该研究展示了乳糖酶非持久性基因型(LNP)个体每天补充乳糖前后肠道微生物群和乳糖不耐受症状的变化。
该研究前后为期 12 周,纳入了 25 名携带 LNP 基因型的亚洲裔健康成年人。参与者逐渐增加乳糖剂量,从每天两次 3 克到 6 克到 12 克,连续 4 周每天提供 6 克、12 克或 24 克的剂量。参与者在 12 周干预前后提交了重复的粪便样本,并接受了 25 克乳糖挑战氢呼吸测试 (HBT)。记录乳糖挑战期间的每日胃肠道症状和总症状评分(TSS)。
结果发现,干预后双歧杆菌相对丰度从 5.5% ± 7.6% 显著增加至 10.4% ± 9.6% (P =0.009),粪便 β-半乳糖苷酶活性增加2倍(570±269U/g;P <0.001),与基线 (272 ± 158 U/g) 相比。
双歧杆菌的β-半乳糖苷酶活性使这些个体能够更有效地消化乳糖。
双歧杆菌通过双歧分流发酵糖,比通过糖酵解发酵产生更多的 ATP,从而产生竞争优势。乳酸和乙酸盐是双歧杆菌乳糖发酵的主要代谢产物,不会产生氢气、二氧化碳或甲烷等气体。
乳酸和乙酸盐是肠道中其他细菌的底物,如产丁酸的Anaerostipes。Anaerostipes的相对丰度也因乳糖干预而增加。
双歧杆菌和Anaerostipes之间的交叉喂养可能发挥作用。这种交叉喂养产生的丁酸盐是肠细胞的重要能量来源,在改善肠道屏障功能方面发挥作用,并发挥抗炎活性。
乳糖干预前后优势属和双歧杆菌属的平均相对丰度
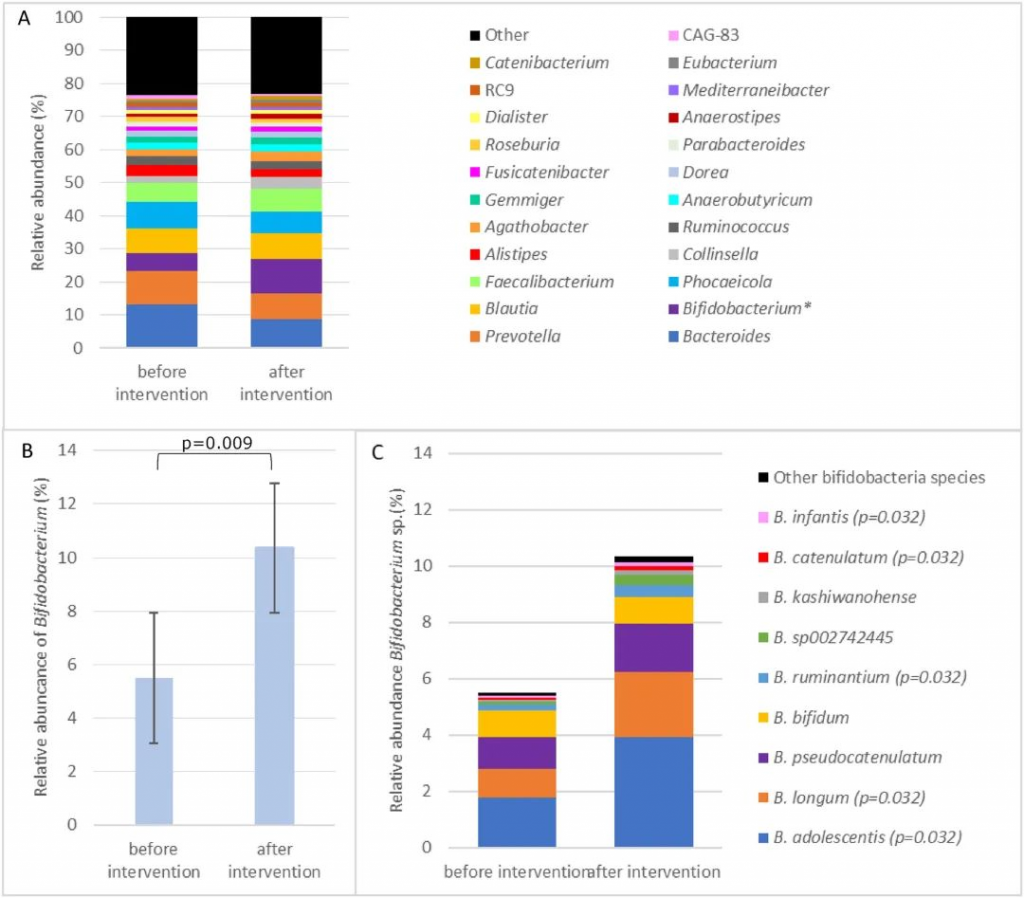
doi.org/10.1016/j.ajcnut.2023.12.016
与基线 HBT (57 ± 38 ppm·min) 相比,第二次 HBT (38 ± 35 ppm·min) 期间观察到呼出氢气减少 1.5 倍(曲线下增量面积;P = 0.01)。这也证实了双歧杆菌发酵不产生氢气,双歧杆菌多了,氢气就少了。
TSS 无显著下降(干预前为 10.6 ± 8.3,干预后为 8.1 ± 7.2;P =0.09)。
12 周乳糖干预前后的乳糖氢气呼气测试
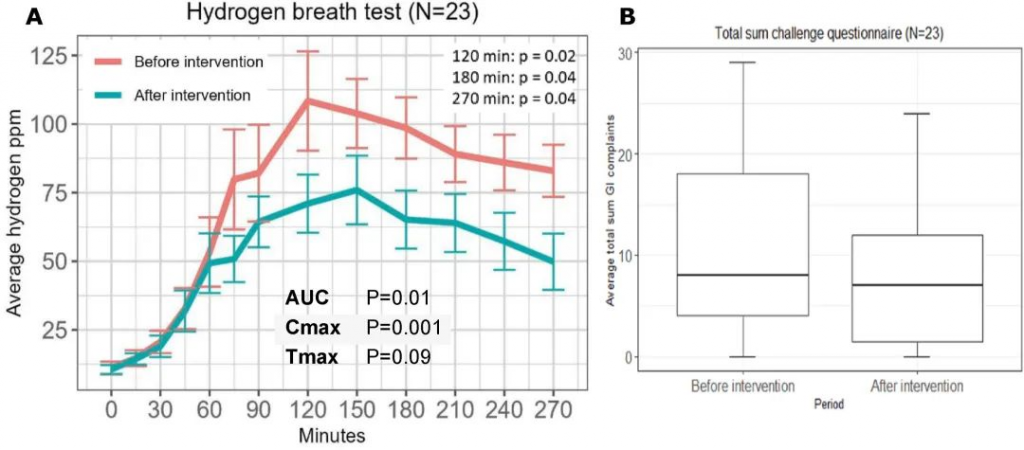
doi.org/10.1016/j.ajcnut.2023.12.016
每日摄入乳糖的耐受性良好,在干预期间报告有轻微甚至没有胃肠道不适。
双歧杆菌水平的增加表明肠道微生物群在重复消耗增量剂量的乳糖后发生了适应,第二次 25 g 乳糖 HBT 期间呼出的氢气浓度降低证明了肠道菌群的耐受性良好。双歧杆菌代谢乳糖而不产生气体,从而可能减少具有 LNP 基因型的个体肠道内气体的形成。
一些古代游牧民族可能就是通过这种肠道微生物组的改变适应了乳制品饮食,他们没有乳糖酶持续活性的遗传证据。
这表明,即使在遗传上缺乏分解乳糖的能力,人们也可能通过其他生物学机制,比如肠道菌群的改变来适应乳制品。
这种增加的乳糖耐受性可能消除了完全从饮食中去除乳制品的必要性。
上述研究我们了解到,既然肠道菌群的调整可以帮助逐渐适应乳糖,那么这可能会为乳糖不耐受者提供新的策略,通过益生菌、益生元等方式可以调节肠道菌群。
益生菌
益生菌经常被添加到乳制品中,既作为发酵剂又作为食品添加剂。例如乳杆菌、长双歧杆菌或动物双歧杆菌,它们在肠道中产生乳糖酶。
2022 年发表的文献包括使用益生菌双歧杆菌900791、罗伊氏乳杆菌DSM 17938和嗜酸乳杆菌DDS-1 的三项研究,共 117 名受试者。结果显示,只有罗伊氏乳杆菌DSM 17938 表现出症状显著改善和呼出氢气减少,而嗜酸乳杆菌DDS-1 表现出乳糖不耐受症状显著改善。
最近的一项荟萃分析包括 12 项研究,总样本量为 263 名患者,结果发现服用益生菌可以缓解乳糖不耐受症状。
摄入乳酸菌可以缓解乳糖不耐受的症状,但这些细菌可能不会在结肠中持久存在。一个新策略是“喂养”乳酸菌,益生元人类无法消化,但乳酸菌可以吃。在初步的临床试验中,使用这种“益生元”的受试者报告说乳糖耐受性有所改善,并且他们的肠道微生物组也相应发生了变化。
益生元
最近的一项系统回顾包括两项研究,其中在总共 462 名受试者中研究了短链低聚半乳糖 GOS (RP-G28) 的功效。作者发现,GOS (RP-G28) 在治疗阶段以及停止后 30 天内显示出乳糖不耐受症状的改善。
一项针对 377 名乳糖不耐受患者的随机安慰剂对照研究报告称,定期摄入短链 GOS (RP-G28) 发现,与安慰剂相比,总体评估结果显著改善,并且五种双歧杆菌分类群显著增加。
以上是研究中发现的部分有效果的益生菌和益生元,但对于每一位乳糖不耐受个体是否有效,效果是否持久,还需要结合肠道菌群检测报告辅助评估。比如某患者的有益菌并不是显著缺乏,但是其肠道菌群中某些条件致病菌超标,可能会加重乳糖不耐受的症状,这就需要医生或专业人士综合评估给出个性化干预建议。
此外,了解停止补充后某些症状恶化可能与哪些菌群及其相关代谢有关,也能帮助医生和患者更有针对性地进行干预,以达到更好的健康效果。
一类特定的食物不耐受与麸质摄入有关。
乳糜泻和小麦过敏是众所周知的病理状况,会引发独特的免疫反应。乳糜泻涉及主要针对胃肠道的自身抗体的产生,而小麦过敏会引发 IgE 介导的反应,过敏可能会导致瘙痒、呕吐或呼吸急促。
然而,有一部分人在食用麸质后会出现肠道和肠外症状,但没有表现出乳糜泻特异性抗体或过敏生物标志物。这些人被归类为患有非乳糜泻麸质敏感性 (NCGS),与乳糜泻不同,麸质敏感性不会损害小肠,麸质不耐受症状也往往比乳糜泻症状出现得更快,一般在食用麸质后几分钟到几小时内就出现了。
这种病症首次在 20 世纪 80 年代被描述,当时一名 43 岁的患者出现腹泻,但缺乏乳糜泻的生物标志物。该患者在采用无麸质饮食(GFD)后表现出显著改善。
典型的肠道症状包括:
肠外表现可能包括:
症状通常在摄入麸质后数小时至数天内出现,并在从饮食中去除麸质后消失。
通常,许多非乳糜泻麸质敏感性患者有乳糜泻或食物过敏家族史,并且还与桥本甲状腺炎和糖尿病等其他自身免疫性疾病相关。
麸质不耐受和乳糜泻虽然都是与麸质有关,都会引起胃肠道症状,如胃痛、腹胀、恶心和腹泻,但具有不同的生理机制和临床表现。

哪些食物中含有麸质?
小麦、大麦和黑麦都是含麸质的谷物。麸质也会出现在许多加工食品中,尤其是那些以这些谷物为基础或含有这些谷物成分的食品,例如:
小麦中的其他成分也可能引发不耐受
无麸质饮食在大多数情况下可以有效减轻症状,但一些 NCGS 患者尽管在诊断后多年遵循严格的无麸质饮食,但仍然报告症状。这表明除麸质外,小麦的其他成分可能是造成这些 NCGS 患者症状的原因。
小麦含有多种蛋白质,根据其功能可分为结构蛋白、功能蛋白或储存蛋白。其中,80%是储存蛋白,包括麦醇溶蛋白和麦谷蛋白,它们有助于麸质的形成。
注:这是一种蛋白质网络,赋予面包和硬质小麦面团独特的粘弹性。
这些储存蛋白富含脯氨酸,这使得它们能够抵抗肠道蛋白水解酶。高脯氨酸含量会导致免疫原性肽的产生,从而引发炎症和氧化应激反应。
麸质作为不耐受罪魁祸首的确切作用尚不完全清楚。小麦含有 2-4% 的淀粉酶胰蛋白酶抑制剂 (ATI),这也会加剧肠道免疫反应并增加炎症。
注:ATI是植物来源的蛋白质,可以使小麦具有抗虫性(能够抵抗黄粉虫和臭虫的损害)。
小麦中还包含一些果聚糖,这些也会在小肠中缓慢吸收,并被肠道细菌快速发酵,导致气体产生和腹胀。一项双盲交叉挑战,以检查麸质和果聚糖对自我报告的NCGS患者的影响。结果显示,在这一组中,似乎是果聚糖而不是麸质引发了更显著的胃肠道症状。
麸质不耐受其实比乳糜泻更常见。任何人都可能患有麸质不耐受,但在 30 岁- 40 岁之间人群发病率较高,在女性中更为常见。
也有研究认为,在儿童中,男性 NCGS 的患病率高于女性。
由于缺乏对该疾病及其致病原因的了解,因此没有可以诊断NCGS的实验室测试或影像学研究。诊断主要基于测试和排除所有其他可能的原因。
乳糜泻:通过可检测乳糜泻自身抗体的血液检查和小肠活检以检查绒毛萎缩来诊断。
小麦过敏:通过过敏血液测试、皮肤点刺测试或斑贴测试来诊断。
可能会进行其他测试以排除其他可疑原因。
如果排除乳糜泻和小麦过敏,可能会建议吃无麸质饮食六周,然后重新摄入麸质一周。一些人认为,饮食能使症状改善30%,重新引入麸质能使症状增加30%,即可诊断为非乳糜泻麸质敏感性。
IBS和NCGS的症状相似可能导致错误的诊断和无效的治疗。一例临床病例描述一名 49 岁女性,曾被诊断患有 IBS。患者主诉腹痛、便秘、胃酸反流和头痛。
考虑并最终排除以下情况:自身免疫性疾病、甲状腺激素水平异常、幽门螺杆菌感染。在不适当的治疗过程中,患者出现了类似系统性红斑狼疮的症状。此外,患者在服用皮质类固醇后表现出一些改善,这也很难做出正确的诊断。最终,经过多年的不当治疗,才发现是NCGS。
当然一些研究表明 NCGS 可能是发生 IBS 的主要触发因素。事实上,由于NCGS 和类似 IBS的症状往往重叠,因此诊断过程特别具有挑战性。
IBS 和 NCGS 之间的重叠
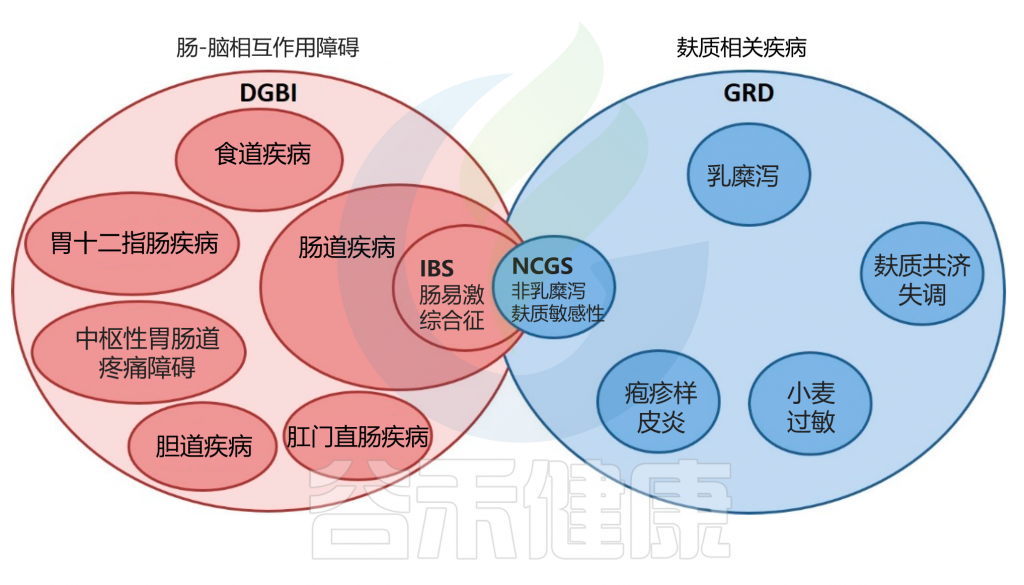
doi.org/10.3390/nu12123735
通常需要通过详细的病史收集、排除其他医学原因、饮食日记记录以及可能的饮食干预来辅助诊断。同时,也可以结合肠道菌群健康检测辅助判别,如果检测到肠道中某些细菌的增多,这些菌参与的代谢途径可能与小麦或麸质摄入有关,这可能支持NCGS的诊断。如果在饮食中去除小麦或麸质后肠道菌群发生了积极的变化,并且症状得到缓解,这也有助于NCGS诊断。
在进行诊断时,需要综合考虑多种因素,肠道菌群检测的结果与临床症状、病史、其他实验室测试和可能的饮食干预结果一起考虑,可以更加全面地加以评估。
NCGS 的病理生理学涉及免疫激活、通透性改变、神经免疫相互作用和遗传因素。麸质和微生物群可以增加上皮通透性,有利于不同抗原进入粘膜并随后激活免疫系统。神经免疫激活和分泌运动功能障碍可能影响大脑活动。
非乳糜泻麸质敏感性病理生理学中涉及的潜在机制
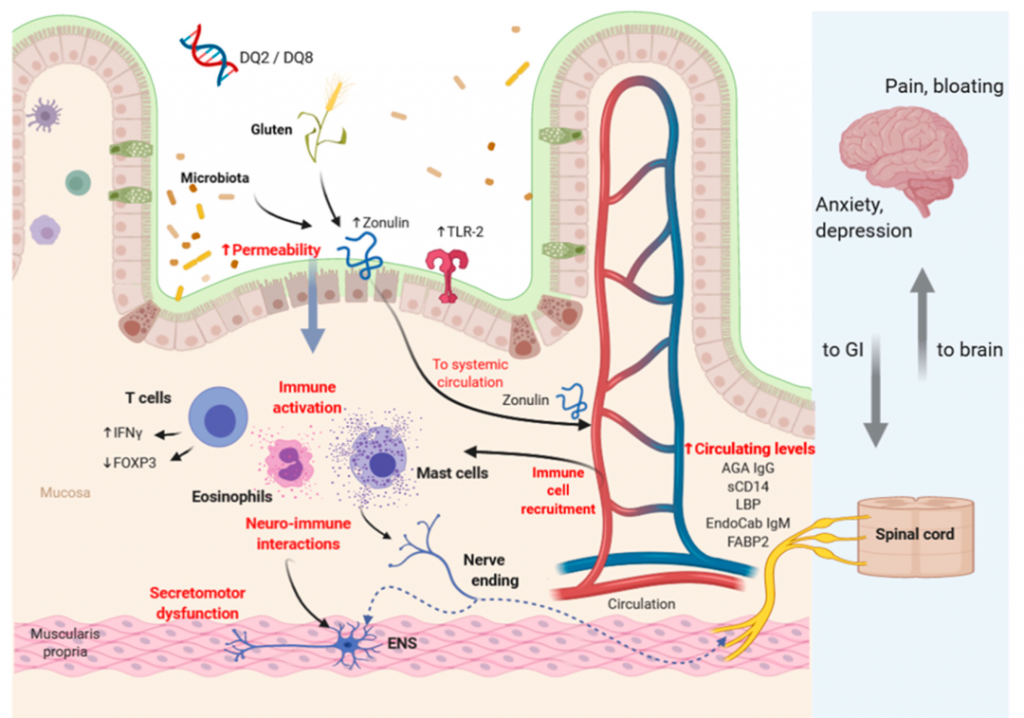
doi.org/10.3390/nu12123735
从组织学角度来看,与健康个体相比没有太多差异,因为正常的绒毛结构维持在十二指肠水平。上皮内淋巴细胞(IEL≤25/100肠细胞)的截止值用于定义正常十二指肠组织学,对应于Marsh 0。然而,归类为非乳糜泻麸质敏感患者显示十二指肠上皮内淋巴细胞计数增加(>25/100肠细胞),对应于Marsh I 病变。
绒毛上皮中 IEL 的不规则分布和簇状分布作为支持 NCGS 诊断的组织学发现,但需要更大规模的研究来证实。
最近一项多中心研究发现,即使在绒毛结构的Marsh 0期,非乳糜泻麸质敏感患者十二指肠粘膜也表现出与肠腔抗原反应一致的独特变化。非乳糜泻麸质敏感患者固有层水平存在嗜酸性粒细胞,这表明这种情况可能更接近于食物过敏。
Zonulin是一种在调节肠屏障通透性方面发挥作用的蛋白质。有人认为,在HLA-DQ2/8阳性个体中,非乳糜泻麸质敏感患者中zonulin增加,而在采用无麸质饮食后降低,因此可以用于与腹泻型肠易激综合征(IBS-D)进行鉴别诊断。
肠道微生物群与麸质相关疾病之间的关系很复杂。人类肠道中存在大量能够水解麸质蛋白和肽的细菌。
NCGS 患者表现出有益菌种(双歧杆菌)的减少和促炎细菌(肠杆菌科和大肠杆菌)的增加。
上皮水平上的 Toll 样受体 (TLR 2-4) 会因病原微生物而被激活。肠道微生物群的参与,非乳糜泻麸质敏感性患者中致病性拟杆菌门增加,腐生菌(厚壁菌门)减少。这种失调可能会导致患者出现腹胀,这可能是由于发酵增加所致。
在分子水平上,观察到Claudin-4的增加,这是负责细胞旁通透性的紧密连接的组成部分。因此,对非乳糜泻麸质敏感性提出了“漏肠”假设,表明肠屏障受损。这可以导致食物成分(如麸质)和其他外来物质更容易穿越肠道壁,这可能触发免疫反应和炎症,增加对麸质的敏感性。
★ 无麸质饮食
大多数麸质不耐受患者通过遵循无麸质饮食可以缓解症状。
无麸质饮食中可以吃的谷物有:
藜麦、糙米、野米、高粱、木薯、小米、燕麦等
麸质存在于无数食品、饮料和其他产品中,仔细阅读食品和饮料标签,了解哪些食物、饮料和成分含有麸质。
低麸质饮食通过调节肠道菌群改善不耐受
一项研究比较了60名丹麦成年人,他们分别接受了8周的低麸质饮食和8周的高麸质饮食。低麸质饮食改变了粪便微生物组,降低了双歧杆菌、Dorea、Blautia、Lachnospiraceae的相对丰度,以及两种产丁酸的细菌Anerostipes hadrus和Eubacterium hallii。然而,低麸质饮食也增加了梭状芽孢杆菌目和毛螺菌科一个未分类物种的相对丰度,这两个类群产丁酸。
总能量、纤维和FODMAP的摄入量在两种不同的饮食条件下没有变化。低麸质饮食减少了餐后的呼吸氢,减轻了自我报告的腹胀。它还显著增加了饱腹激素PYY的产生,并导致体重减轻。低麸质饮食可以降低血清IL-1β,这是参与炎症反应的分子。
需要更多的研究来了解不同的无麸质饮食如何影响粪便微生物组和免疫系统。
其他饮食方式也包括:
★ 低ATI饮食
我们前面讲到,小麦中的除了麸质之外的其他成分也可能引发消化道症状,其中也会ATI 可能会促进 NCGS 中出现的肠道炎症症状,这与乳糜泻不同。
应避免的 ATI 含量高的食物包括黑麦、大麦、小麦(以及所有小麦产品变体)以及含麸质的食物。
★ 益生菌
益生菌可能减轻麸质敏感个体的影响。在细胞培养和动物研究中,已发现某些长双歧杆菌(NCC2705 和 CECT 7347)、动物双歧杆菌(乳酸亚种)和鼠李糖乳杆菌 (GG) 菌株可减弱醇溶蛋白对肠粘膜的破坏作用。
在一项针对新诊断克罗恩病儿童的随机安慰剂对照试验中,长双歧杆菌 CECT 7347 补充剂三个月可改善生长参数,降低潜在促炎菌属脆弱拟杆菌的丰度,并减少粪便分泌 IgA,表明肠道免疫系统不再处于“高度警戒”状态。
另一项针对无麸质饮食的克罗恩病患儿的研究发现,补充短双歧杆菌(BR03 和 B632)三个月可显著降低循环 TNFα,这是全身炎症的标志物。停止补充益生菌三个月后,TNFα水平再次升高。
总的来说,补充益生菌在减轻麸质造成的损害和改善麸质敏感个体的整体健康方面潜力很大。
不过,在补充益生菌之前,最好进行肠道菌群健康检测,因为益生菌的效果因人而异,可能受到个体肠道菌群的影响。假如某位麸质不耐受患者本身长双歧杆菌较多,补充长双歧杆菌不一定有用,那么可能需要结合该患者的总体肠道菌群检测报告来看,哪些菌群不平衡,过多或多少带来怎样的健康风险,对麸质不耐受可能产生什么样的影响,综合评估是否需要补充以及什么方案更适合总体健康。
★ 益生元
多酚是我们饮食中常见的植物化学生物活性成分。多项研究表明,多酚可以通过与蛋白质等其他大分子相互作用来发挥促进健康的特性,优先与富含脯氨酸的蛋白质结合,例如麸质蛋白。
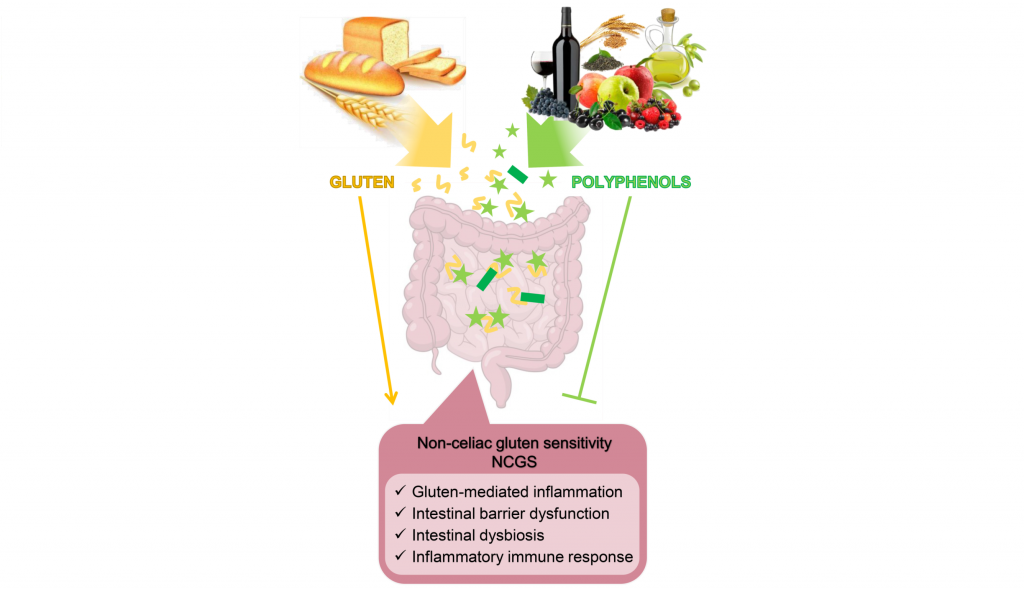
doi.org/10.3390/nu14132679
多酚通过改善肠道菌群缓解 NCGS 症状
作为益生元底物,多酚刺激有益细菌种类的生长和活性,例如Akkermansia muciniphila、多形拟杆菌(Bacteroides thetaiotaomicron)、Faecalibacter prausnitzii 、双歧杆菌、乳杆菌,促进微生态转变,发挥其抗炎、抗氧化、免疫和屏障完整性保护作用,从而在肠道和全身水平上抑制麸质的毒性作用。
NCGS 中多酚及其代谢物的潜在目标
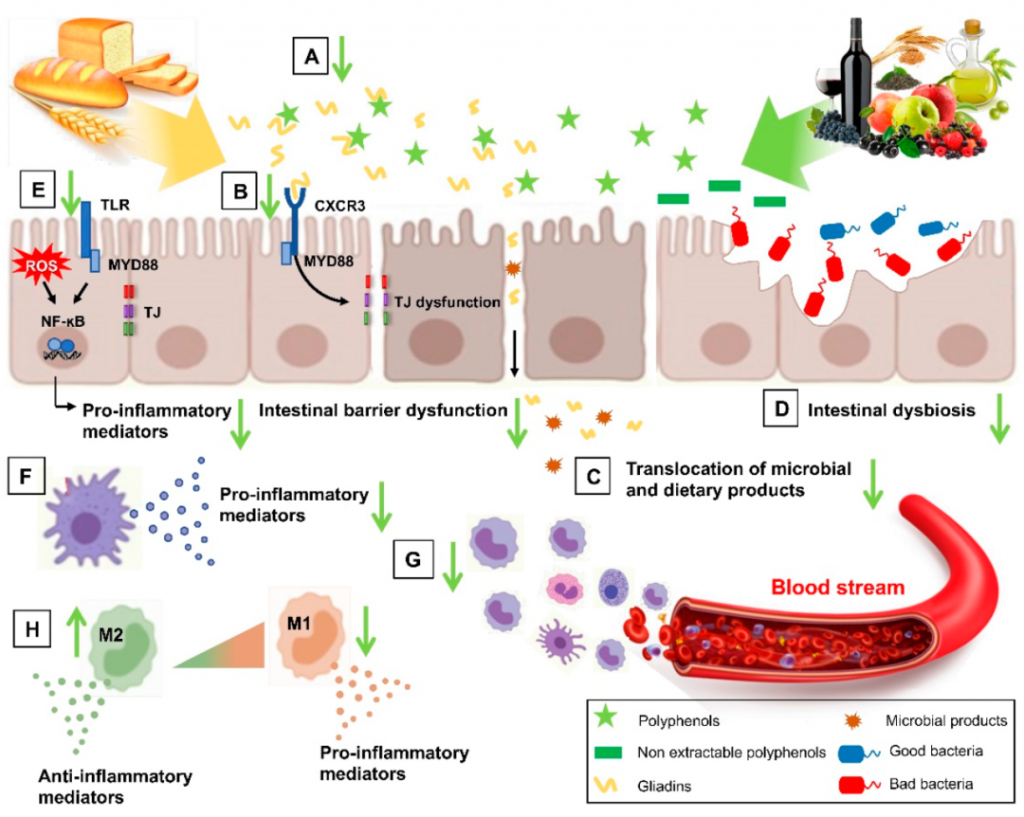
doi.org/10.3390/nu14132679
多酚可以结合并隔离麸质,降低麸质的生物利用度(A);它们可以抑制麦醇溶蛋白肽和 CXCR3 受体之间的相互作用,恢复改变的肠道通透性(B),然后减少微生物和膳食产品的易位(C);它们还可以改善肠道菌群失调,肠道屏障功能障碍(D)。多酚可以削弱肠道水平的氧化应激和炎症诱导途径 (E),并抑制压倒性的炎症免疫反应(F),减少固有层 (G) 中骨髓细胞的募集,并增加 M2 极化抗炎巨噬细胞 (H)。
富含多酚的食物包括:
橄榄油、红葡萄/葡萄酒、水果(浆果类如蓝莓、草莓、黑莓和覆盆子等)、蔬菜(如洋葱、茄子、菠菜等)、谷物(豆类如黑豆和红豆等)、坚果(如核桃、杏仁)、可可、咖啡、茶等。
现在“无麸质饮食”的概念越来越流行,无麸质饮食可以说是欧美健康饮食界近几年的流行饮食方式,甚至很多健康人包括各类博主也开始遵循无麸质饮食,然而这也可能会伴随一些健康风险。
与遵循常规饮食的受试者相比,无麸质饮食与常量营养素(例如饱和脂肪和糖)的消耗增加以及微量营养素(例如铁、叶酸和锌)的摄入量较低有关。
也有研究表明,健康成人持续无麸质饮食后,双歧杆菌、乳酸杆菌和长双歧杆菌减少,而肠杆菌科和大肠杆菌增加。
无麸质饮食饮食明显影响多种菌群的丰度,特别是那些专门参与碳水化合物和淀粉代谢的物种,如韦荣氏球菌科。
无麸质饮食也可能会导致下列风险增高:
无麸质饮食人群最好定期进行检查下列指标:
因此,对于健康人来说,在决定是否采用无麸质饮食之前,应该充分了解其可能的健康风险,每个人应该根据自身身体状况和需求来决定。
FODMAP 是短链碳水化合物,包括乳糖、超过葡萄糖的果糖、糖醇(山梨醇和甘露醇)、果聚糖和 GOS(水苏糖和棉子糖),天然存在于水果、蔬菜、谷物、乳制品等大量食品和甜味剂中。
这组碳水化合物已被确定为触发功能性胃肠道症状患者的症状,如肠易激综合征(IBS)。
高FODMAP食品是指含有超过 4 克乳糖、超过 0.3 克甘露醇、山梨醇、低聚半乳糖或果聚糖的食品。因此,可以通过考虑食物的 FODMAP 含量来对食物进行分类。
敏感个体食用高FODMAP饮食与腹痛、腹胀、肠胃胀气和肠道习惯改变等低胃肠道症状相关。
在IBS患者队列中,使用低FODMAP饮食对症状的改善已被证明在50-80%之间变化。该范围可能受到几个因素的影响,包括研究设计、患者选择和习惯饮食中的FODMAP摄入量。
FODMAPs难以被肠道细菌吸收和发酵。
因此,摄入大量FODMAPs会导致大量短链脂肪酸(SCFAs)和大量气体(包括二氧化碳、氢气和甲烷)的过度产生,这些物质会导致肠腔膨胀和肠腔内水潴留。
在内脏超敏反应患者中,增加内腔水分输送和气体的联合作用导致膨胀,导致疼痛和不适。
关于内脏超敏详见我们之间的文章:
腹胀、腹痛、肠胃不明原因疼痛?–可能是内脏高敏感,详细了解内脏高敏的原因后果
最近,还提出了其他作用机制,如由于低FODMAP饮食后尿组胺和促炎细胞因子的显著减少,高FODMAP食物的免疫激活潜力。
然而,需要进一步的数据来证实这些发现,并确认它们对症状反应的影响。
那些对特定高FODMAP食物反应明显的人,可能需要减少这些食物的摄入。
其他人群还包括:
肠易激综合征(IBS)患者
IBS是一种常见的消化系统疾病,其症状包括腹痛、腹胀、腹泻和便秘。低FODMAP饮食已被证明可以有效减轻这些症状。
小肠细菌过度生长(SIBO)患者
SIBO是一种病状,其中小肠中的细菌数量异常增多,可能导致类似IBS的症状。限制FODMAPs可以帮助减少细菌的食物来源,从而减轻症状。
功能性腹胀患者
这是一种以腹部不适和腹胀为主要症状的状况,而低FODMAP饮食可以帮助减少腹胀和其他相关症状。
炎症性肠病患者
如克罗恩病和溃疡性结肠炎,虽然低FODMAP饮食并非治疗这些疾病的主要方法,但它有时可以帮助控制某些症状,尤其是在病情活动期间。
其他消化不良的人
有些人可能没有特定诊断,但发现减少高FODMAP食物的摄入能够减轻他们的消化不良。
IBS 是一种功能性胃肠道疾病,影响全世界多达 20% 的人。胃肠道症状受到不同因素的影响,例如心理社会领域、生理功能及其相互作用(肠-脑轴)。IBS的特点是内脏运动和敏感性异常,以及免疫功能和微生物群组成异常;因此,它与各种胃肠道症状和生活质量受损有关。罗马 IV 诊断标准允许根据症状将 IBS 患者分为三类:伴有腹泻的 IBS(IBS-D)、伴有便秘的 IBS(IBS-C)和具有混合排便习惯的 IBS(IBS-M)。
IBS的发病机制仍不完全清楚,但不同的研究表明饮食在症状管理中发挥着重要作用。最有证据支持的饮食是低 FODMAP 饮食 (LFD),它对 IBS 治疗有效。
七项研究证实了低 FODMAP 饮食的积极作用,表明低 FODMAP 饮食后 IBS 严重程度评分系统(IBS-SSS)显著下降。同样,与遵循标准饮食的患者相比,生活质量有所改善。
最后,与 IBS-C 患者相比,低 FODMAP 饮食在 IBS-D 和 IBS-M 患者中的疗效似乎更高。
低FODMAP饮食在世界范围内广泛研究,并显示出良好的疗效证据,得到荟萃分析的支持,并已纳入临床指南。
低FODMAP饮食减少碳水化合物亚类的摄入,包括:
针对低 FODMAP 饮食的特点,可以采用“自上而下”的方法,分为限制、重新引入和个性化长期维护三个步骤。
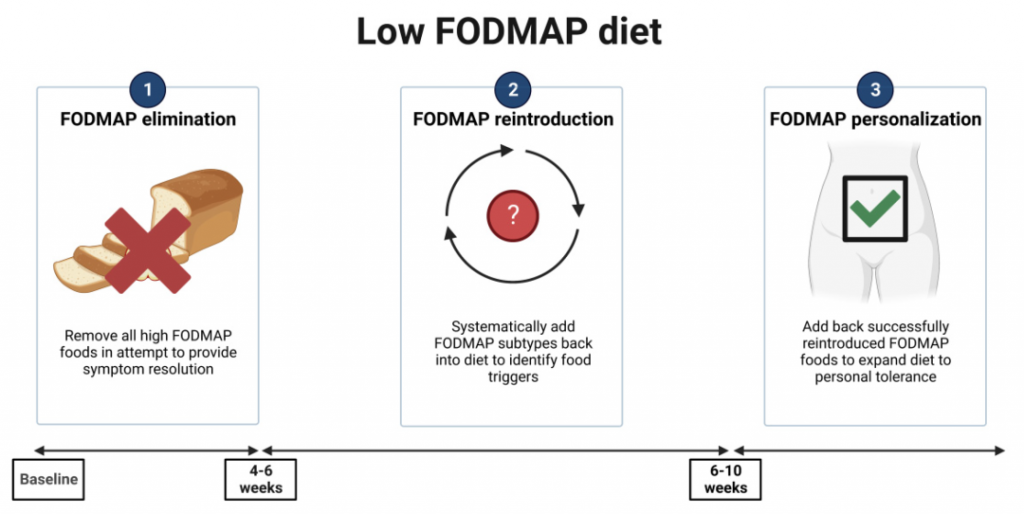
第一阶段要求从饮食中排除所有高 FODMAP 食物,通常持续 4-6 周。这是最关键的阶段,重要的是向患者解释 FODMAP 在胃肠道症状发生中的作用。
第二阶段的目的是重新引入 FODMAP 并评估每位患者的耐受性,调整饮食以进行长期维持。在此阶段,评估饮食依从性和临床反应也很重要;个性化重新引入食物,考虑每种食物 3 天,可以识别患者症状的特定触发因素。
第三阶段涉及制定长期饮食,根据患者的 FODMAP 耐受性进行定制。关键是要制定灵活的饮食结构,以保持多样化和营养充足,并控制肠易激综合征症状。
低 FODMAP 饮食并不是所有受胃肠道紊乱影响的患者的灵丹妙药。
营养缺乏风险
主要原因是缺乏适当的饮食咨询和自我限制饮食。关于膳食摄入量的研究并不一致。由于碳水化合物摄入量的减少,纤维缺乏症是最常见的;此外,当过量摄入乳制品时,钙摄入量也会降低。
考虑到维生素的消耗,维生素缺乏的风险与严格减少饮食中的蔬菜和水果有关。排除几种蔬菜可能会导致天然抗氧化剂的减少,例如类黄酮、类胡萝卜素和维生素C,酚酸和花青素等。
不过总的来说,缺乏有关低 FODMAP 饮食长期影响的数据,但如果患者在饮食过程中得到专业人员的适当监测,营养缺乏的风险非常低。
便秘风险
低 FODMAP 饮食的另一个潜在限制是纤维消耗量低,这可能会加重便秘,尤其是 IBS-C 患者。
适当的营养随访和知识科普可以改善饮食管理和纤维摄入量。
饮食失调风险
低 FODMAP 饮食第一步中施加的限制可能会对患者的情绪状态产生负面影响。有研究表明,低 FODMAP 饮食后的 IBS 患者与食物相关的生活质量较低。
此外,低 FODMAP 饮食对IBS症状恶化的焦虑以及随之而来的饮食限制似乎与饮食失调的发生相关。特别是,回避性限制性食物摄入障碍和神经性厌食症是与低 FODMAP 饮食相关的最常见的饮食失调。
微生物群变化的风险
高 FODMAP 食物通常是益生元的良好来源,尤其是那些含有低聚果糖、低聚半乳糖和纤维的食物,因此减少摄入量可能会改变微生物群结构。这会减少短链脂肪酸的产生及其对结肠细胞的重要保护和营养活性。
短期研究表明,低 FODMAP 饮食可能会导致总体细菌丰度、双歧杆菌和普拉梭菌减少。普拉梭菌的减少可能对肠粘膜屏障的完整性有害。
总之,这不是一种“简单”的饮食,当患者在没有任何专业建议的情况下遵循该饮食时,问题就会增加。同时,有必要在这一新领域进一步研究,以确定哪些患者可以从低FODMAP饮食中受益,并改善管理。
果糖不耐受分为遗传性果糖不耐受和非遗传性果糖不耐受。
遗传性果糖不耐受 (HFI) 是一种罕见的常染色体隐性遗传疾病,无法正常代谢果糖,导致各种代谢紊乱和临床症状。
这是由位于染色体 9q22.3 上的醛缩酶 B 酶突变引起,摄入果糖后可导致明显的胃肠道症状,并可能导致长期器官损伤,特别是肾和肝脏损伤。
临床特征
当患有这种疾病的个体直接或通过蔗糖或山梨醇间接接触膳食果糖时,遗传性果糖不耐受症状就会出现。
果糖不耐受的人在食用高果糖食物或饮料后经常会出现胃肠道症状,如腹痛、腹胀、腹泻和恶心。这些症状可以是轻微到严重的不适,并且可以显着影响个人的生活质量。
症状及其严重程度取决于果糖剂量、患者年龄、伴随疾病和醛缩酶 B 的残留酶活性,并且是非特异性的,因此很难仅根据症状来怀疑遗传性果糖不耐受。常见的临床表现是恶心、呕吐、腹部不适和生长受限/生长迟缓。
治疗
遗传性果糖不耐受的管理包括严格避免含有果糖、蔗糖和山梨醇的食物。通过正确的诊断和坚持果糖限制饮食,果糖不耐受的个体可以有效地控制他们的病情并改善他们的整体健康。
遵循严格的不含有果糖、蔗糖和山梨糖醇的饮食,并补充葡萄糖和玉米淀粉等碳水化合物,可以使症状迅速逆转。患者应避免使用含有蔗糖的药物和疫苗,例如两种口服轮状病毒活疫苗 Rotarix ® 和 RotaTeq ®。鉴于减少水果和蔬菜摄入量是饮食要求,建议每天补充“无糖”多种维生素,以防止微量营养素缺乏,特别是水溶性维生素缺乏。
非遗传性果糖不耐受是怎么回事?
相对于管腔果糖的量而言,肠上皮细胞摄取果糖不足。
小肠中果糖的吸收能力远低于葡萄糖的吸收能力;葡萄糖以剂量依赖性方式刺激果糖吸收,当果糖含量多于葡萄糖时,就会发生吸收不良。然后,未吸收的果糖进入结肠,并以与 LNP 患者的乳糖相同的方式发酵。
如何诊断?
果糖吸收不良 (FM) 的诊断通常需要结合病史评估、症状评估和特定测试。多年来,一直使用特定的氢气呼气测试来评估果糖吸收不良。关于氢气和甲烷呼气试验的适应症、性能和临床影响的欧洲指南建议,成人诊断果糖吸收不良和不耐受时的果糖剂量应为 20-25 克。
关于“胃肠道疾病中 H2 呼吸测试的方法和适应症”的罗马共识会议和 ESPGHAN 关于呼气测试使用的文件均表示,在临床实践中不建议进行果糖呼气测试。
鉴于这种诊断的不确定性,可能会建议消除饮食,即在特定时期内从饮食中去除高果糖食物。如果症状在此期间有所改善,然后在重新摄入含果糖食物时又出现,则可能表明果糖吸收不良。
如何改善?
由于果糖是一种 FODMAP,因此通常建议采用低 FODMAP 饮食来代替低果糖饮食,特别是对于怀疑患有伴随功能障碍的患者。先前的调查表明,诊断为 IBS 或 FGID 的个体中,很大一部分(35%~73%)表现出与果糖吸收不良一致的特征。
木糖异构酶已被提议作为果糖不耐受的潜在治疗方法,因为它能够将果糖转化为葡萄糖。一项双盲、安慰剂对照研究表明,口服木糖异构酶与摄入果糖后呼吸氢显著减少有关,并且恶心和腹痛显著改善。目前,经验疗法包括采取限制饮食和评估症状。
蔗糖由一种葡萄糖和一种果糖分子组成。这两个分子之间的结合被膜结合酶蔗糖酶-异麦芽糖酶破坏。先天性蔗糖酶-异麦芽糖酶缺乏症(CSID)是一种罕见的常染色体隐性遗传疾病,染色体 3q25-26 上的蔗糖酶-异麦芽糖酶基因发生突变。
获得性形式的蔗糖酶-异麦芽糖酶缺乏症可能继发于与肠绒毛萎缩相关的其他慢性胃肠道疾病,例如肠道感染、乳糜泻、克罗恩病和影响小肠的其他肠病。
功能性蔗糖酶-异麦芽糖基因变异似乎在具有提示 IBS 症状的患者中更为常见。然而,如上所述,最近的指南不建议对这些患者进行碳水化合物测试。
使用来自酿酒酵母产生的酶糖化酶来水解蔗糖,作为这种不耐受的可能治疗方法。因为一项古老的双盲研究显示,与安慰剂相比,这种酶与食物一起服用可以显著预防在含蔗糖饮食中的患者的不耐受症状。
组胺一般在哪些食物中出现?
发酵食品、酒精、贝类、熏肉、豆类、巧克力、某些水果和蔬菜等。
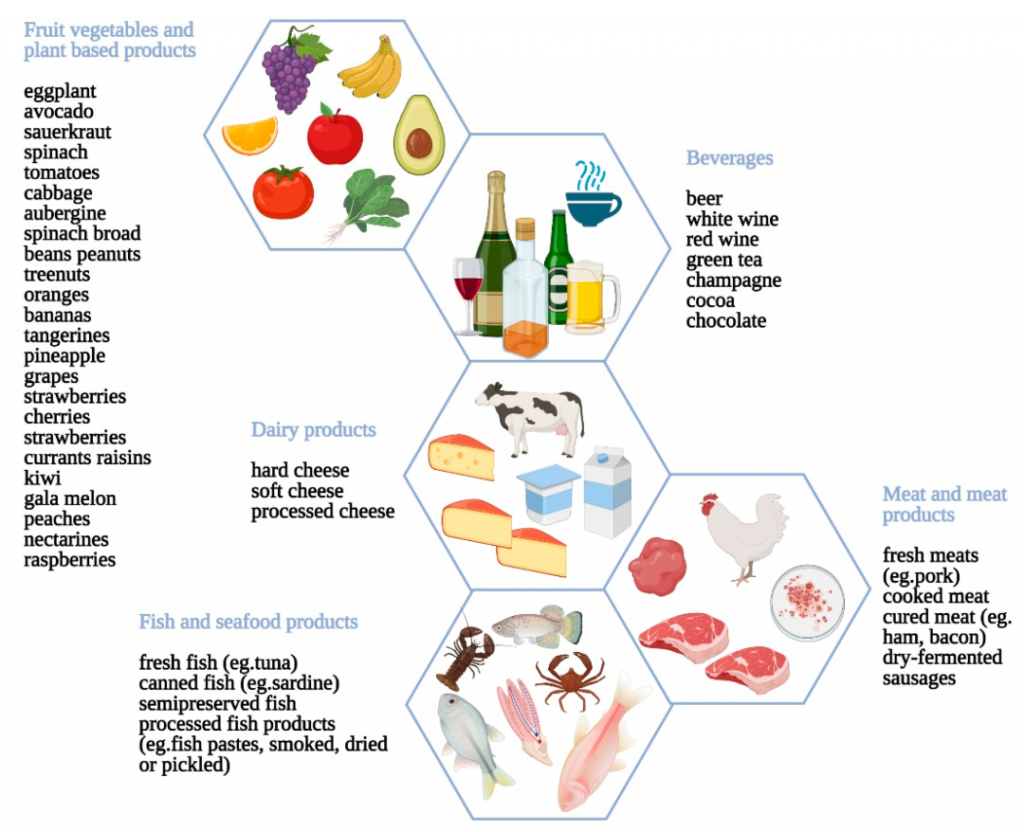
doi.org/10.3390/nu13051638
组胺不耐受是如何发生的?
由于二胺氧化酶(DAO)活性低,肠道中组胺降解途径受损或减慢,导致组胺在血浆中积聚并出现不良反应,特别是在高饮食摄入的情况下。然而,这种因果关系尚未得到证实。
组胺不耐受有哪些表现?
由于组胺受体普遍分布在身体的不同器官和组织中,组胺不耐受的临床表现包括多种非特异性胃肠道和肠外症状。
这种多形性的表现导致难以就组胺不耐受的诊断标准达成共识。
组胺不耐受的发病率
缺乏可靠的诊断系统对目前报告的组胺不耐受发生率产生了影响,估计约占人口的 1-3%。随着更多关于组胺不耐受的知识和诊断工具的出现,这种情况可能会增加。
肠道微生物会影响组胺不耐受的发生
肠道微生物群也会影响组胺不耐受的发生。最近的研究表明,组胺不耐受可能是由肠道微生物群的改变引起的。肠道中大量的组胺分泌细菌可能会导致组胺不耐受。健康人体内双歧杆菌的数量较多。而在血清二胺氧化酶活性降低的人群中观察到变形菌属数量较多。
在组胺不耐受人群中观察到肠道菌群失调,与健康个体相比,与肠道健康相关的普氏菌科(Prevotellaceae)、瘤胃球菌(Ruminococcus)、粪杆菌(Faecalibacterium)和普拉梭菌(Faecablibacterium prausnitzii)的比例明显较低。组胺不耐受人群还具有显著更高丰度的组胺分泌细菌,包括葡萄球菌属和变形杆菌属、属于肠杆菌科的几个未识别属,以及产气荚膜梭菌和粪肠球菌。
组胺不耐受的治疗建议
组胺不耐受疗法的基础是基于低组胺含量食物的消除饮食。一般来说,公认的饮食指南尚未制定;但是,建议避免食用富含组胺的食物如奶酪、油性鱼类和贝类,以及生发酵肉制品、腌菜、发酵豆制品、葡萄酒和啤酒、鸡蛋、巧克力和蘑菇。
此外,应避免食用会刺激内源性组胺释放的蔬菜和水果(如菠菜、西红柿、柑橘类水果、草莓、茄子、鳄梨、木瓜、香蕉、猕猴桃、菠萝和李子)。
关于组胺不耐受,详见之前的文章:
茄属植物是属于茄科的一组蔬菜。超过 3,000 种植物属于这一类。常见的品种有茄子、西红柿、土豆、青椒等。有些人对茄属蔬菜不耐受。
那些对茄属植物敏感或过敏的人可尝试一些替代品。其中包括:
亚硫酸盐
白葡萄酒和干果中含有大量的亚硫酸盐等,亚硫酸盐也会添加到其他食品中,增强脆度或防止霉菌生长,而 FDA 禁止亚硫酸盐作为新鲜水果和蔬菜的喷雾防腐剂。
摄入后,不良反应最常见于易感人群,例如哮喘患者。所提出的机制包括吸入摄入的亚硫酸盐产生的二氧化硫、亚硫酸盐氧化酶缺乏以及 IgE 介导的反应。
此外,有人提出可能涉及副交感神经系统,亚硫酸氧化酶不足会导致亚硫酸盐积累,引起胆碱能介导的支气管收缩。
谷氨酸钠
另一种被认为是不良非免疫反应罪魁祸首的食品添加剂是谷氨酸钠 (MSG-E621),它通常作为咸味增强剂添加。然而,富含天然结合或游离形式谷氨酸的食物以与味精相同的方式代谢,并且没有证明它会引起与添加味精的食物相同的症状。
食物不耐受的存在会影响患者的心理健康。与对照组相比,食物不耐受患者的焦虑、抑郁和躯体症状更常见。
一些关注心理社会相关性的研究表明,食物不耐受与年龄较小、女性、高等教育和肠易激综合症之间可能存在关联。
此外,研究表明,食物不耐受也可能与IBS中的食物厌恶重叠,并且这可能在食物不耐受中也很重要。事实上,如果摄入某种特定食物同时伴随着心理障碍,那么胃肠道症状就会在摄入某种食物后出现,并且可以习得对该食物的厌恶。
针对 IBS 人群的研究表明需要更好的沟通,积极的医患关系可以改善症状管理。因此,可以假设这对于食物不耐受的患者来说会是成功的。
此外,与胃肠道症状相关的食物不耐受的存在也可能成为饮食失调患者拒绝食物的理由。考虑到饮食失调患者中膳食相关症状的发生率很高,临床医生调查饮食行为障碍的存在至关重要。
饮食日记可以帮助你了解自己的饮食习惯和模式,帮助你识别对某些食物或成分的反应。

每天列出你吃的食物和出现的症状。一旦你确定了一种似乎会引发你症状的食物,就几个星期不吃它,看看会发生什么。过了几个星期后重新再吃它。如果症状随着它的减去而消失,但随着重新开始吃又复发,这样你就逐渐找到罪魁祸首。

编辑
每餐后填写相关栏目。列出症状时,按1-10 的等级对其严重程度进行评分。“其他因素”列用于记录压力或情绪不安等因素。
在每周结束时,寻找任何可能的模式或潜在的食物触发因素。一旦确定了可能存在问题的食物,请遵循消除饮食至少两周,有些认为4-8周,具体取决于严重程度。
每次最好只排除一种食物,以免其他因素干扰。
关于写饮食日记的小技巧:
饮食日记是一场马拉松,所以要对自己宽容一点,一开始不必面面俱到把所有的都记下来,那样只会变成日常生活的负担,轻松一点有利于坚持。
如果要记录的话,尽量在吃完几个小时内就写,不要拖太久,不然等过两天回忆再写会很麻烦。可以随身带个小本子或者记在手机等电子设备中。
如果在外面吃饭来不及记录,可以迅速把吃的东西拍个照,回去再写。
注:这里列的饮食日记的样式仅供参考,也可以用自己习惯的样式来进行。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
Tuck CJ, Biesiekierski JR, Schmid-Grendelmeier P, Pohl D. Food Intolerances. Nutrients. 2019 Jul 22;11(7):1684.
Facioni MS, Raspini B, Pivari F, Dogliotti E, Cena H. Nutritional management of lactose intolerance: the importance of diet and food labelling. J Transl Med. 2020 Jun 26;18(1):260.
JanssenDuijghuijsen L, Looijesteijn E, van den Belt M, Gerhard B, Ziegler M, Ariens R, Tjoelker R, Geurts J. Changes in gut microbiota and lactose intolerance symptoms before and after daily lactose supplementation in individuals with the lactase nonpersistent genotype. Am J Clin Nutr. 2023 Dec 28:S0002-9165(23)66349-X.
Brandao Gois MF, Sinha T, Spreckels JE, Vich Vila A, Bolte LA, Weersma RK, Wijmenga C, Fu J, Zhernakova A, Kurilshikov A. Role of the gut microbiome in mediating lactose intolerance symptoms. Gut. 2022 Jan;71(1):215-217.
Tagliamonte S, Barone Lumaga R, De Filippis F, Valentino V, Ferracane R, Guerville M, Gandolfi I, Barbara G, Ercolini D, Vitaglione P. Milk protein digestion and the gut microbiome influence gastrointestinal discomfort after cow milk consumption in healthy subjects. Food Res Int. 2023 Aug;170:112953.
Sánchez-Pérez S, Comas-Basté O, Duelo A, Veciana-Nogués MT, Berlanga M, Latorre-Moratalla ML, Vidal-Carou MC. Intestinal Dysbiosis in Patients with Histamine Intolerance. Nutrients. 2022 Apr 23;14(9):1774.
Gargano D, Appanna R, Santonicola A, De Bartolomeis F, Stellato C, Cianferoni A, Casolaro V, Iovino P. Food Allergy and Intolerance: A Narrative Review on Nutritional Concerns. Nutrients. 2021 May 13;13(5):1638.
Hon E, Gupta SK. Gastrointestinal Food Allergies and Intolerances. Gastroenterol Clin North Am. 2021 Mar;50(1):41-57.
Légeret C, Lohmann C, Furlano RI, Köhler H. Food intolerances in children and adolescents in Switzerland. Eur J Pediatr. 2023 Feb;182(2):867-875.
Onyimba F, Crowe SE, Johnson S, Leung J. Food Allergies and Intolerances: A Clinical Approach to the Diagnosis and Management of Adverse Reactions to Food. Clin Gastroenterol Hepatol. 2021 Nov;19(11):2230-2240.e1.
Caio G, Lungaro L, Segata N, Guarino M, Zoli G, Volta U, De Giorgio R. Effect of Gluten-Free Diet on Gut Microbiota Composition in Patients with Celiac Disease and Non-Celiac Gluten/Wheat Sensitivity. Nutrients. 2020 Jun 19;12(6):1832.
Bascuñán KA, Araya M, Roncoroni L, Doneda L, Elli L. Dietary Gluten as a Conditioning Factor of the Gut Microbiota in Celiac Disease. Adv Nutr. 2020 Jan 1;11(1):160-174.
Calabriso N, Scoditti E, Massaro M, Maffia M, Chieppa M, Laddomada B, Carluccio MA. Non-Celiac Gluten Sensitivity and Protective Role of Dietary Polyphenols. Nutrients. 2022 Jun 28;14(13):2679.
Alkalay MJ. Nutrition in Patients with Lactose Malabsorption, Celiac Disease, and Related Disorders. Nutrients. 2021 Dec 21;14(1):2.
Leis R, de Castro MJ, de Lamas C, Picáns R, Couce ML. Effects of Prebiotic and Probiotic Supplementation on Lactase Deficiency and Lactose Intolerance: A Systematic Review of Controlled Trials. Nutrients. 2020 May 20;12(5):1487.
Roszkowska, A.; Pawlicka, M.; Mroczek, A.; Bałabuszek, K.; Nieradko-Iwanicka, B. Non-Celiac Gluten Sensitivity: A Review. Medicina 2019, 55, 222
Cenni S, Sesenna V, Boiardi G, Casertano M, Russo G, Reginelli A, Esposito S, Strisciuglio C. The Role of Gluten in Gastrointestinal Disorders: A Review. Nutrients. 2023 Mar 27;15(7):1615.
Losurdo G, Principi M, Iannone A, Amoruso A, Ierardi E, Di Leo A, Barone M. Extra-intestinal manifestations of non-celiac gluten sensitivity: An expanding paradigm. World J Gastroenterol. 2018 Apr 14;24(14):1521-1530.
Barbaro, M.R.; Cremon, C.; Wrona, D.; Fuschi, D.; Marasco, G.; Stanghellini, V.; Barbara, G. Non-Celiac Gluten Sensitivity in the Context of Functional Gastrointestinal Disorders. Nutrients 2020, 12, 3735.
Tagliamonte S, Barone Lumaga R, De Filippis F, Valentino V, Ferracane R, Guerville M, Gandolfi I, Barbara G, Ercolini D, Vitaglione P. Milk protein digestion and the gut microbiome influence gastrointestinal discomfort after cow milk consumption in healthy subjects. Food Res Int. 2023 Aug;170:112953.
Bellini M, Tonarelli S, Nagy AG, Pancetti A, Costa F, Ricchiuti A, de Bortoli N, Mosca M, Marchi S, Rossi A. Low FODMAP Diet: Evidence, Doubts, and Hopes. Nutrients. 2020 Jan 4;12(1):148.
Hrubisko, M.; Danis, R.; Huorka, M.; Wawruch, M. Histamine Intolerance—The More We Know the Less We Know. A Review. Nutrients 2021, 13, 2228.
Cotton, C.; Raju, S.A.; Ahmed, H.; Webster, G.; Hallam, R.; Croall, I.; Coleman, S.; Trott, N.; Rej, A.; Shiha, M.G.; et al. Does a Gluten-Free Diet Improve Quality of Life and Sleep in Patients with Non-Coeliac Gluten/Wheat Sensitivity? Nutrients 2023, 15, 3461.

谷禾健康

卵巢的衰老发生在其他器官系统的衰老之前,可以看作是多个器官衰老过程的“起搏器”。随着预期寿命的延长,预防卵巢衰老已成为促进女性延长生殖功能、改善与卵巢衰老相关的骨骼和泌尿生殖系统状况的重要目标。
卵巢衰老是指卵巢功能随着年龄的增长而逐渐衰退。其特点是卵母细胞数量和质量逐渐恶化,并伴有月经周期不规律、不孕,最后导致月经停止。
卵巢的寿命与其他器官不同。最近,多组学分析发现,女性在三十岁和五十岁左右的生物衰老显著加速,这与生育能力下降和更年期状态的时间点相一致。
随着全球预期寿命的延长,卵巢衰老将逐渐成为女性的主要健康问题。卵巢衰老是一个极其复杂的过程,包括,性激素的水平,促卵泡激素(FSH)、黄体生成素(LH)和抗缪勒管激素(AMH)等。此外,近年来越来越多的证据表明肠道微生物群与卵巢功能之间存在联系,肠道微生物群-卵巢轴有助于卵泡发育。肠道微生物群的组成和功能特征的改变对卵巢功能具有深远的影响。肠道微生物群和卵巢之间的相互作用是双向的。
本文带大家综合了解卵巢-微生物群串扰的不同方面,并提供有意义的结论。另外还尝试解释微生物群在一些抗衰老方法中的潜在作用。
在人类衰老以及与年龄相关的疾病中,优势微生物的特性、细菌多样性和功能特征发生了显著变化。最近的一项研究表明,体内存在多个“时钟”:器官/系统以不同的速度老化,并且特定器官或系统的老化速度与肠道微生物组的老化速度相关。因此,个体可能会表现出不同的健康或疾病状态。
肠道微生物特征可用于预测老年人的健康衰老或死亡率。有趣的是,小鼠实验表明,老年供体微生物群的移植会加速受体中与年龄相关的大脑退化的特定过程,相反,年轻供体微生物群的移植可以逆转这种情况。有人建议,肠道微生物群可以作为新的抗衰老干预措施的潜在治疗靶点。
更年期是卵巢自然衰老的标志事件。自然更年期多发生在49岁至52岁之间。随着卵巢卵泡的有限储备耗尽,剩余卵泡失去对促性腺激素的敏感性,卵泡停止发育和分泌卵巢激素雌激素和黄体酮。
雌二醇(E2)水平仅在围绝经期过渡过程相对较晚的情况下下降。然而,在最后一个月经周期期间,血浆E2水平急剧下降,绝经后卵巢停止合成E2。
√ 肠道微生物是循环雌激素的重要调节因子
肠道微生物 β-葡萄糖醛酸酶(gmGUS)可以将雌激素从失活形式转化为活性形式,并进一步影响宿主体内的雌激素水平。
肠道微生物群失调和微生物多样性降低会导致gmGUS减少和全身雌激素改变。反过来,肠道细菌也受到雌激素的影响。据报道,据报道,两个细菌类群的相对丰度,即γ-变形菌纲(Gammaproteobacteria)和Mixococcales目中的一个未知科,与雌二醇水平呈正相关,而普雷沃氏菌科(Prevotellaceae)的丰度与雌二醇水平呈负相关。
√ 雌激素也能发挥微生物调节作用
此外,雌激素或雌激素样化合物在患有代谢综合征的小鼠中发挥微生物组调节作用并维持肠道上皮屏障完整性。在绝经后妇女中,补充大豆异黄酮等类雌激素食物可增加双歧杆菌属(Bifidobacterium)和真杆菌属(Eubacterium )的丰度,同时抑制乳杆菌属 (Lactobacillus)和未分类的梭菌科细菌。
在某些病理条件下,肠道微生物群失调和gmGUS 活性升高可能通过参与内源性和外源性雌激素样化合物的循环或激活,导致雌激素驱动的疾病和更年期相关疾病的发生。
√ 更年期的变化影响女性肠道菌群及其代谢
众所周知,更年期状态会影响肠道微生物群。不同绝经状态的女性肠道微生物群的组成和功能特征的差异已经有报道,如下所述。
观察到绝经前(n=44)和绝经后(n=45)女性之间总共有90个差异丰富的分类群 ,与绝经后女性相比,绝经前女性与叶酸途径相关的嘧啶和碳库更加丰富。
罗氏菌属(Roseburia)被确定为区分绝经前群体(n=17)和绝经后群体(n=20)的显著的细菌分类群,并且观察到绝经前妇女的丙酸和丁酸代谢较高。
还有研究发现绝经后女性(n=24)的微生物组α多样性显著低于绝经前女性(n=24),厚壁菌门(Firmicutes)和罗氏菌属(Roseburia)丰度较低,而拟杆菌门(Bacteroidetes)和甲苯单胞菌属(Tolumonas)在绝经后妇女中被富集,绝经后妇女的同型半胱氨酸合成相关过程被激活。
在动物模型中,也描述了卵巢衰老引起的肠道微生物群的变化。4-乙烯基环己烯二环氧化物(VCD)是一种化学物质,可直接杀死卵巢的原始卵泡和初级卵泡,但对卵巢外组织没有毒性,可诱导卵巢衰老,类似于自然卵巢衰老。研究人员确定,VCD组和对照组小鼠在α多样性和β多样性上都存在显著差异。
VCD组占主导地位的微生物群中,包括幽门螺杆菌、Odoribacter和另枝菌属(Alistipes)水平较低,而梭菌XIVa群(Clostridium XIVa)、巴恩斯氏菌(Barnesiella)、拟杆菌属和Mucispirillum属的水平较高。
随着雌性的年龄增长,肠上皮恶化,导致微生物群负荷增高、屏障功能受损和寿命减短。
肠道微生物群在卵巢自然衰老过程中的生理演替
Huang F,et al.Gut Microbes.2024
为了进一步探讨肠道微生物群与卵巢自然衰老之间更复杂、更深入的因果关系,将粪便微生物群移植(FMT)应用于自然衰老的小鼠。使用来自年轻供体 (5周龄)FMT治疗的老年小鼠(42周龄)肠道微生物组呈现出“年轻动物样表型”,卵泡闭锁和细胞凋亡减少,从而提高了老年小鼠的生育能力。
这些卵巢衰老延迟效应可能是通过改善炎症状态和免疫微环境来解释的。老年斑马鱼的大量证据也证明了年轻微生物群对生殖调节的影响。从年轻供体到老年斑马鱼的FMT可以抵消随后接触有毒污染物的不利影响,有效降低膜结合孕激素受体转录物的水平,促进卵子发生的进展,并降低有毒污染物引起的畸形率,及其后代表现出更强的运动能力并且游得更快。
总体而言,在卵巢衰老过程中维持“年轻”的肠道微生物群可能会限制卵巢衰老并提供额外的好处。
人群中的一些女性并非卵巢自然衰老,而是卵巢功能过早衰退,即卵巢早衰(POI)。POI 是一种临床综合征,定义为40岁以下患者正常卵巢活动衰竭,表现为月经失调(闭经或月经稀发),促性腺激素水平升高和雌二醇水平低。
据估计,全球患病率高达3.7%,而30岁以下女性和20岁以下女性中分别有0.1%和0.01%患有该病。卵巢早衰因其对生育能力的不利影响以及随之而来的负面健康影响而引起公众关注,例如心血管疾病风险增加、认知障碍、情绪和性功能障碍、骨质疏松症和预期寿命缩短。
卵巢早衰是一种高度异质性的病症,70%至90%的卵巢早衰病例除了已知的遗传、自身免疫、感染和医源性因素外,病因不明,即特发性卵巢早衰。最近,越来越多的证据表明肠道微生物群失调与卵巢早衰相关。在本节中,我们回顾当前肠道菌群与卵巢早衰之间联系的研究,重点关注特发性卵巢早衰、医源性卵巢早衰和卵巢早衰驱动的疾病。
√ 卵巢早衰患者β多样性减少
研究注意到,卵巢早衰患者的β多样性有所减少。在门层级,观察到卵巢早衰患者中拟杆菌门(Bacteroides)的丰度较高,而厚壁菌门(Firmicutes)的丰度较低。
而在属(genus)层级,与健康女性(n=18)相比,卵巢早衰患者(n=35)中的丁酸弧菌(Butyricimonas)、Dorea、Lachnobacterium和萨特氏菌(Sutterella)的丰度较高,而Bulleidia和普拉梭菌(Faecalibacterium)的丰度较低。
此外,与对照组(n=10)相比,在卵巢早衰(POI)患者(n=10)中,观察到埃格氏菌属(Eggerthella)和葡萄球菌属(Staphylococcus)的丰度降低,而Comamonas和巴恩斯氏菌(Barnesiella)的丰度增加。
这些微生物变化与卵泡刺激素(FSH)、黄体生成素(LH)、雌二醇(E2)和抗米勒管激素(AMH)的水平以及FSH/LH比值相关。
√ 健康的肠道微生物可能保护卵巢
激素替代疗法(HRT)是推荐用于卵巢早衰(POI)女性的治疗方法,既可用于症状管理也可用于疾病预防。与POI相关的β多样性变化、埃格特氏菌属(Eggerthella)相对丰度、血清代谢物以及雌二醇和孕酮激素水平,在实施HRT后显著逆转,这进一步验证了雌激素和肠道微生物之间的相互作用。
动物实验证实,E. lenta灌胃可诱导小鼠卵巢纤维化,而雌激素治疗可缓解卵巢纤维化。
综上所述,这些研究结果显示,肠道微生物群失调,如核心微生物群Lachnoclostridium和拟杆菌属扰动,短链脂肪酸产生菌Bacteroides和Faecalibacterium的减少,以及机会致病菌如埃格特氏菌属(Eggerthella)的增加,可能参与了原发性卵巢功能衰竭(POI)的病理生理过程。
肠道微生物群的逆转可能在一定程度上成为新的卵巢保护策略。尽管卵巢早衰与肠道微生物存在潜在关联,但这种关系的因果性仍需深入研究。
如上所述,大多数卵巢早衰病例是特发性的。但在少数已知原因的病例中,医源性因素占很大比例。许多医疗因素会损害肿瘤患者的卵巢功能,例如盆腔放疗、化疗和手术,这可能导致卵巢功能过早衰退甚至完全丧失。
√ 接受过卵巢手术的患者发生卵巢早衰概率较高
治疗剂量越高、照射面积越大、手术面积越大,对卵巢功能的影响就越大。接受过卵巢手术,尤其是腹腔镜手术的患者是医源性卵巢早衰的主要人群。由于医源性卵巢损伤,骨质流失和泌尿生殖系统萎缩是许多年轻癌症患者和术后妇女面临的两大挑战,严重影响了她们的整体生活质量。
一项研究对接受不同抗癌治疗的卵巢癌患者肠道微生物群的变化进行了分析,发现与手术后样本相比,拟杆菌门和厚壁菌门的丰度显著下降,变形菌门的丰度显著增加。然而,使用化疗呈现出了不一样的结果。与化疗前相比,化疗后的样本显示出拟杆菌门和厚壁菌门的丰度显著增加,变形杆菌门的丰度降低。
√ 肠道微生物群的变化与医源性卵巢早衰有关
根据卵巢切除(OVX)小鼠模型的许多研究显示,医源性绝经可能影响肠道微生物。在OVX组和假手术组的肠道微生物之间观察到β多样性和α多样性有显著差异。几项研究发现,OVX组在门水平上厚壁菌/拟杆菌比例更高,变形菌相对丰度更低。
双侧卵巢切除术是构建医源性更年期动物模型最成熟的方法,已广泛应用于更年期及绝经相关研究,如绝经期骨质疏松症、泌尿生殖系统萎缩等。
在属水平上,假手术组中优势属的丰度在OVX组中显著下降(87%VS29%)。相反,假手术组中丰度较低的属在OVX组中显著富集(<5%VS63%)。
在卵巢切除大鼠中确定了四个重要的关键属:Incertae Sedis、Anaerovorax、Anaerotruncus和Helicobacter。此外,卵巢切除组表现出明显的体重增加、肠屏障受损、骨丢失和阴道萎缩。
√ 补充益生菌有助于预防和治疗卵巢早衰
肠道微生物群对于卵巢切除诱导的破骨细胞分化是必不可少的。
厚壁菌门和拟杆菌门的比例对于破骨细胞分化至关重要,补充来自厚壁菌菌门的益生菌唾液乳杆菌(Lactobacillus salivarius LI01)可以预防卵巢切除诱导的骨质疏松症。
而来自卵巢完整小鼠的粪菌移植抑制了卵巢切除诱导的肠道微生物群变化和体重增加,抑制了促破骨细胞因子的释放,增加了粪便短链脂肪酸水平(主要是乙酸和丙酸),降低了肠道通透性,并最终防止了卵巢切除引导的骨丢失。
令人惊讶的是,来自卵巢完整的可育雌性的粪菌移植改变了卵巢切除小鼠的肠道微生物群,并显著缓解了阴道上皮萎缩。总的来说,粪菌移植可能是预防和治疗医源性卵巢早衰及相关后果的一个有前途的方案。
粪菌移植改变肠道微生物群并减缓卵巢衰老相关疾病
Huang F,et al.Gut Microbes.2024
迄今为止,还没有临床上可行的技术可以延迟或逆转与高龄相关的卵巢功能障碍。然而,过去几十年来,抗卵巢衰老领域取得了重要进展,出现了许多新兴的抗衰老药物,如辅酶Q10(CoQ10)、褪黑激素、烟酰胺单核苷酸(NMN)、白藜芦醇、雷帕霉素和N-乙酰基-L-半胱氨酸(NAC)已显示出延缓卵巢衰老的巨大潜力。
虽然没有研究直接探讨这些抗衰老药物、卵巢功能和肠道微生物群之间的关系,但一些间接证据表明这些药物的有益作用可能与肠道微生物有关。如图所示表格,这些药物可能通过肠道微生物发挥作用。

Huang F,et al.Gut Microbes.2024
1
辅酶Q10
辅酶Q10(CoQ10)是一种脂溶性的,类似维生素的苯醌化合物,在细胞能量生产中起关键作用,并且以还原形式起抗氧化剂的作用。
• 给予CoQ10改善卵巢反应
随着年龄的增加,CoQ10的合成似乎会下降,这与生育力和卵子质量下降的时间点一致。在生育治疗期间预先给予CoQ10可以改善卵巢储备减少的年轻患者的卵巢反应和胚胎质量。
在小鼠中,CoQ10治疗不仅保留了卵巢卵泡储备,还促进了能支持正常发育的配子的排卵。CoQ10的饮食补充对老年母鸡、高胎次妊娠母猪和红罗非鱼引用的生殖变量也有益效果。然而,在接受辅助生殖技术的不孕妇女中,CoQ10增加了临床妊娠率,但对活产率或流产率没有影响。
• CoQ10影响肠道微生物群组成,保护肠道屏障
CoQ10还影响肠道微生物及其产生的后续生物标志物。给予CoQ10 3周结果使瘤胃球菌(Ruminococcus)和Lachnospiraceae AC 2044群的相对丰度分别增加2.4倍和7.5倍,以及丁酸盐增加了1.26倍。
富含CoQ10的南瓜汁灌胃增加了小鼠肠道中乳酸菌和双歧杆菌的丰度,并通过减少变形菌门进一步保护了肠道屏障。
2
褪黑素
作为一种强大的抗氧化剂,褪黑素已被证明可以延缓雌性动物生育力的衰退。氧化应激被认为是卵巢老化的关键因素,它加速卵泡的损失和闭锁,同时也伴有显著的肠道微生物群失调。
• 褪黑素的抗氧化作用可以延缓卵巢老化
而褪黑素可以逆转氧化应激导致的表型,并改善肠道微生物群落。在小鼠身上,褪黑素治疗不仅显著增加了卵子的数量和质量,而且在体外受精后产生了更多的囊胚,产仔数也比对照组的更多。
褪黑素可能增加老年产蛋母鸡的雌二醇和黄体生成素水平,以及免疫球蛋白的水平和生长卵泡的数量。褪黑素预处理减少了厚壁菌门的丰度和厚壁菌门与拟杆菌门的比例,并在门的层面上增加了拟杆菌门的含量。
• 口服褪黑素可以逆转高脂饮食导致的菌群失调
此外,口服褪黑素补充剂显著逆转了高脂肪饮食诱导的肠道微生物群失调,包括肠道微生物群的α多样性降低,拟杆菌属和Alistipes属的相对丰度降低,以及乳杆菌目和乳杆菌属的相对丰富度增加。
褪黑素治疗小鼠粪菌移植后乙酸产生与拟杆菌属和Alistipes属的相对丰度之间的显著相关性表明,肠道微生物群重编程可能是褪黑素治疗的潜在机制。
扩展阅读:
3
烟酰胺单核苷酸
“NMN”是“烟酰胺单核苷酸”(Nicotinamide Mononucleotide)的缩写。它是细胞内 NAD+(烟酰胺腺嘌呤二核苷酸)的前体物质之一。
NAD+是一种重要的辅酶,存在于所有活细胞中,对于能量代谢、DNA修复、基因表达调控以及细胞信号传递等生命过程都至关重要。
随着年龄的增长,人体内NAD+的水平会逐渐下降,这与多种衰老相关的疾病有关。NMN作为一种补充剂,通过提高体内NAD+的水平,有望改善与衰老相关的各种生理功能下降,增强细胞的活力和代谢功能,因此被广泛研究作为抗衰老和提升健康寿命的潜在治疗方法。
• 延缓卵巢衰老,提高卵母细胞质量
NMN是另一种有前途的抗卵巢衰老药物。随着生殖衰老,卵母细胞质量的下降伴随着烟酰胺腺嘌呤二核苷酸(NAD+)水平的下降,作为NAD+生物合成的中间体,可以通过补充NMN来补偿,发挥延缓卵巢衰老的作用。
中年小鼠口服 NMN 20 周,改善发情周期状况,增加不同阶段卵泡数量以及黄体和血清FSH,与对照处理相比增强颗粒细胞(GCs)线粒体生物发生、自噬和蛋白酶活性。
在高脂饮食诱导的卵巢早衰小鼠中,给予 NMN 可以减少卵巢炎症和腹部脂肪组织的脂肪大小,并提高卵母细胞质量。NMN 处理增加了产生丁酸的细菌属的丰度,如Ruminococcae UCG-014, Prevotellaceae NK3B31 group 和 Akkermansia muciniphila,同时降低了几种有害细菌属的丰度,如Oscillibacter和嗜胆菌属(Bilophila)。NMN 还减少肠粘膜损伤并维持粘膜屏障完整性。
4
白藜芦醇
在谷禾菌群检测报告中,有很多菌的调节措施中给了白藜芦醇。白藜芦醇是一种天然多酚类化合物,可以延缓卵巢衰老并预防与年龄相关的不孕症,它还能够恢复微生物群的组成,并逆转肠道菌群失调。
• 白藜芦醇提高短链脂肪酸浓度并调节卵巢功能
一项研究揭示,白藜芦醇改善了氧化应激引起的产卵率下降和血清激素水平变化,以及肠道微生物群失调,并提高了产蛋母鸡体内主要短链脂肪酸的浓度。
这项研究直接证明了白藜芦醇通过肠道微生物调节卵巢功能。富集的微生物群,包括拟杆菌、Lachnospiraceae NK4A136群、Blautia、Lachnoclostridium,Parabacteroides和Ruminiclostridium 9(统称为白藜芦醇微生物群),显示出抗肥胖功能。
5
雷帕霉素
哺乳动物雷帕霉素靶蛋白 (mTOR) 信号通路在女性生殖细胞的卵泡发生中发挥着至关重要的作用。已有报告称,卵巢早衰患者激活了AKT/mTOR信号通路。
在高脂饮食诱导的卵巢早衰小鼠中抑制mTOR信号,逆转了卵泡丢失并延长了卵巢寿命。
• 雷帕霉素延长卵巢寿命,改善卵子质量
雷帕霉素是一种最初从细菌中分离出来的天然大环内酯化合物,作为TOR信号的抑制剂。雷帕霉素治疗增加了卵巢储备,并延长了卵巢寿命,特别是在老年小鼠中,改善了卵子质量。
在环磷酰胺诱导的卵巢早衰模型中,雷帕霉素防止了原始卵泡的损失,并保护了卵巢储备。在雷帕霉素处理的小鼠中观察到分段丝状细菌水平的显著增加。
然而,尽管雷帕霉素挽救了果蝇的肠道屏障功能障碍并增加了微生物负荷,但其抗衰老效果似乎与肠道微生物群无关。
6
乙酰氨基酚
乙酰氨基酚(NAC)有助于刺激谷胱甘肽的合成,发挥抗氧化作用。一项在小鼠身上进行的研究提出,NAC的给药可以改善植入前卵子的质量,并增加囊胚总细胞数和窝仔数,从而延缓生殖老化带来的生育能力下降。
NAC通过促进几种有益细菌的生长并影响肠道细菌的代谢途径,缓解了高脂饮食小鼠的肠道菌群失调。
总的来说,关于NAC治疗对生殖老化和肠道微生物群影响的证据是罕见的,需要进行与生育相关的研究来评估NAC给药的效果。
除了抗衰老药物之外,抗衰老饮食似乎是更受欢迎的选择,其中热量限制目前被认为是最可重复的策略。热量限制是指减少能量摄入,但不会导致营养不良或缺乏必需营养素。
作为抗衰老饮食的主导范式,其延长寿命的效果已被广泛认可。在过去的几十年里,人们关注了热量限制对生殖和肠道微生物群的影响(见下表)。
热量限制调节卵巢功能

Huang F,et al.Gut Microbes.2024
热量限制引起的肠道微生物群变化
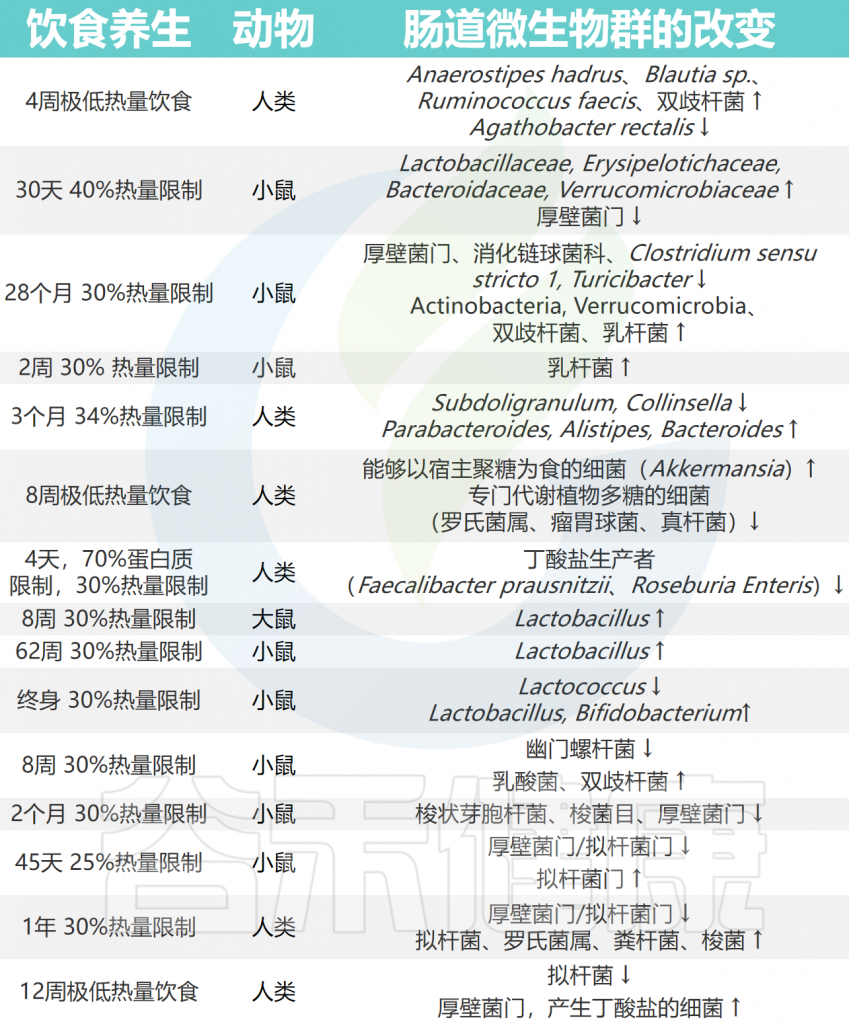
Huang F,et al.Gut Microbes.2024
• 抑制卵泡的丢失和保护卵泡库
肥胖、过多的体脂和胰岛素抵抗对卵巢卵泡的发育有不利影响,从而损害了雌性动物的生殖能力。
热量限制(CR)与体重减轻、腹部内脏脂肪积聚减少和胰岛素敏感性增加有关。因此,通过抑制卵泡丢失和保护卵泡库,实施了延缓卵巢老化的效果。
与对照组啮齿类动物不同,接受CR治疗的啮齿类动物显示出原始卵泡数量显著增加,并抑制了不同阶段卵泡的发育。
十周的热量限制喂食降低了血清黄体生成素、卵泡刺激素和雌激素水平。热量限制在高脂饮食诱导的卵巢早衰小鼠中产生了类似的效果。由CR引起的p53下调可能因其对细胞周期和凋亡的影响而抑制卵泡萎缩。
• 改善与年龄相关的菌群变化
热量限制还可以挽救老年雌性小鼠中观察到的与年龄相关的菌群变化。三个月34%的CR帮助实现了显著的体重减轻,并且腰围减小与五个细菌属(Subdoligranulum、Collinsella、Parabacteroides、Alistipes和Bacteroides)的变化相一致。
40%的热量限制喂食30天增加了 Lactobacillaceae, Erysipelotrichaceae,Bacteroidaceae 和 Verrucomicrobiaceae 丰度,并减少了厚壁菌门丰度。
• 改善葡萄糖代谢,降低脂多糖水平
热量限制还改善了葡萄糖代谢、脂肪棕化和耐寒能力,降低了脂多糖结合蛋白和循环脂多糖水平。
此外,严格的热量限制减少了体脂沉积,改善了葡萄糖耐受性。但富集了能够以宿主糖原为食的Akkermansia,并消耗了专门用于代谢植物多糖的Roseburia、Ruminococcus和Eubacterium,这些都是在人类肠道的核心菌。
• 热量限制可以减少炎症有助于防止卵巢衰老
慢性炎症是衰老以及卵巢衰老的另一种常见状况。炎症可能是导致生殖衰老的机制之一。卵巢内B细胞、CD4+ T细胞和巨噬细胞比例的增加与卵巢衰老的过程一致,并且在生殖衰老过程中观察到多种促炎细胞因子(包括IL-6、TNF-α和IL-1α/β)以及炎症小体基因NLRP3和ASC的年龄依赖性过表达。
抑制NLRP3炎症小体有助于防止卵巢衰老。肠道微生物群在调节炎症反应中起着至关重要的作用。热量限制可能通过塑造肠道微生物组来延迟免疫衰老。热量限制增加了受体的α多样性,并降低了梭状芽孢杆菌、Hungatella hathewayi和Alistipes obesi的丰度,这些CR相关的微生物群降低了肠道和肝脏效应记忆CD8+ T细胞、肠道记忆B细胞和肝脏效应记忆CD4+ T细胞的水平。
热量限制持续2周可显著减少肠道炎症,增加保护性肠道微生物群乳酸菌。终身热量限制诱导的双歧杆菌和乳酸菌增加与胆汁酸水平呈负相关,包括 ChDxCA 和次级胆汁酸(DxCA/TDxCA 和 ChDxCA 衍生物)。CR 促进的以乳杆菌群落降低了全身微生物抗原和炎症标志物的水平。
基于上述与热量限制相关的几种分子途径的发现,热量限制可能是改善炎症并可能促进肥胖相关不孕症和生殖寿命的一种可能策略。
!
不足之处
值得注意的是,上述这些抗衰老干预措施要么检查了对肠道微生物组或卵巢功能的影响,但很少有研究同时推测抗衰老药物、肠道微生物组和卵巢功能。
因此,目前涉及治疗机制影响卵巢功能的肠道微生物组的证据是支离破碎且分散的,这也是本综述的局限性。这些抗衰老干预措施在肠道微生物群和卵巢功能之间的相互作用方面仍然存在很大差距。因此,迫切需要更多的研究关注这些干预措施对肠道微生物组和卵巢功能的影响,以将这三个部分的相互作用联系起来。
肠道微生物群组成和功能的改变在生殖衰老的发病机制中发挥着重要作用。实验和临床研究揭示了肠道菌群失调与卵泡发育以及免疫反应紊乱之间的关系。粪菌移植研究结果为抗卵巢衰老提供了新的见解,即维持年轻的肠道菌群有助于保护卵巢功能并预防卵巢相关疾病。
基于微生物群的干预来延缓卵巢衰老是一种有吸引力的方法,并且可能为肠道微生物群调节提供新的治疗策略,以提高女性生育能力。
此外,抗衰老药物和限制热量等抗衰老干预措施的研究可能会改善肠道微生物失衡,促进更健康的肠道生态环境。然而,当前科学文献的证据无法提供有关这些措施的直接结论。大多数相关研究都是在动物模型中进行的,不能简单地适用于人类。因此,未来的研究应从简单的相关性分析转向大规模队列研究,重点关注潜在原因和潜在机制,以验证这些干预措施对卵巢衰老的有益作用。
鉴于肠道微生物群组成和功能在卵巢衰老过程中发生广泛变化,有人认为肠道微生物群可能适合破译女性预期和意外卵巢衰老的过程。肠道微生物群的失衡可能导致各种卵巢衰老相关疾病的进展。尽管卵巢衰老是不可避免的,但维持平衡的肠道微生物群是延缓卵巢衰老和随后不良后果的潜在方法。
特定菌株及其代谢物在卵泡发育中的作用和分子机制仍不确定,并且在很大程度上尚未得到探索。多项研究报告卵巢早衰样本中同时存在肠道和血清代谢紊乱,一些代谢物可能介导下丘脑-垂体-卵巢轴的功能。
发现短链脂肪酸与卵泡发育和卵泡液激素之间存在显著相关性。补充特定代谢物可能是调节卵巢功能的另一种选择。老年小鼠卵巢中多胺代谢物亚精胺水平降低,补充亚精胺可促进卵泡发育,恢复卵母细胞质量,提高老年小鼠的生育率。
发现支链氨基酸不足可能导致卵巢早衰,补充支链氨基酸可改善活性氧诱导的小鼠的卵巢功能障碍。
此外,卵泡闭锁是随着出生后GC细胞的凋亡而开始的。一项研究表明,肠道微生物群可能通过短链脂肪酸影响GC细胞凋亡来参与调节卵泡发育。其他某些代谢物对GC细胞凋亡的影响也值得探索。
大量研究还表明,使用三种略有不同的药物进行细菌疗法:益生菌、益生元和合生元,有望用于预防和治疗人类一般衰老和与年龄相关的疾病。
其中乳杆菌和双歧杆菌是最常用的,尽管不同研究的效果有所不同,具体取决于剂量、持续时间及其成分。研究表明,一些益生菌菌株对男性生殖功能障碍具有有益作用。补充乳酸菌和双歧杆菌可改善男性精子活力并降低DNA断裂率。然而,益生菌、益生元和合生元对卵巢衰老的影响尚不清楚,需要更多的研究来证明它们是否可以成为对抗卵巢衰老的有效策略。
尽管卵巢衰老是不可避免的,但维持平衡的肠道微生物群是延缓卵巢衰老和随后不良后果的潜在方法。
主要参考文献
Huang F, Cao Y, Liang J, Tang R, Wu S, Zhang P, Chen R. The influence of the gut microbiome on ovarian aging. Gut Microbes. 2024 Jan-Dec;16(1):2295394.
Fan Y, Pedersen O. Gut microbiota in human metabolic health and disease. Nat Rev Microbiol. 2021 Jan;19(1):55-71.
Ling Z, Liu X, Cheng Y, Yan X, Wu S. Gut microbiota and aging. Crit Rev Food Sci Nutr. 2022;62(13):3509-3534.
谷禾健康
随着人口老龄化的不断加重,骨质疏松症(OP)已成为三大慢性疾病之一。骨质疏松症会导致骨折风险增加,骨骼变性,身体功能受限等。因此,骨质疏松症的防治逐渐成为中老年人健康关注的焦点,减少和治疗骨质疏松症对于减轻医疗负担、缓解社会压力具有重要意义。
数据显示,全球大约每3秒就有一例骨质疏松性骨折发生,大约50%的女性和20%的男性在50岁后患有原发性骨质疏松性骨折。
骨质疏松症是一种慢性疾病,其特征是骨组织微结构恶化和骨量减少。研究表明,体内激素失衡和氧化炎症可影响破骨细胞和成骨细胞的动态平衡,主要表现为骨微结构退化、骨量减少、骨强度下降。骨髓间充质干细胞的成骨分化和骨内血管生成的下降同时发生,导致骨脆性增加和骨折易感性增加。
我们日常的饮食中多酚类物质含量极其丰富,并且可以在自然界的多种植物中找到。多酚在化学上被鉴定为具有酚类结构特征的化合物。多酚的丰富来源包括水果、蔬菜和全谷物,以及其他类型的食物和饮料,如茶、巧克力和葡萄酒。
多酚可以通过影响骨形成和骨吸收而在骨重建中发挥作用。多酚作用于破骨细胞、成骨细胞和骨髓间充质干细胞,调节多个重要信号通路,在骨重塑中发挥重要作用。此外,多酚还通过抗炎、促进骨形成等机制抑制骨质疏松症。
此外,越来越多的研究表明,骨质疏松症患者及相关动物模型的肠道菌群与健康个体的肠道菌群有些不同,骨质流失的严重程度也与肠道菌群的改变有关。这也表明肠道微生物群可能成为预防和治疗骨质疏松症的潜在目标。
通过产生代谢物,肠道微生物影响和调节肠道屏障功能。正常的肠道屏障对于隔离有害物质、促进营养吸收和提供免疫保护非常重要。肠道屏障功能受损被认为是导致骨质疏松症的致病因素之一。
肠道微生物紊乱削弱了肠道屏障功能,导致有害物质进入体内,从而促进激活破骨细胞并导致骨吸收因子的产生,影响骨形成和骨吸收,最终导致骨质疏松。
而多酚等膳食成分还与肠道微生物群存在相互作用。肠道微生物群可以将多酚降解为更容易吸收的代谢物,从而提高其生物利用度。多酚可以塑造肠道微生物群并增加其丰度和活性,增强肠道屏障功能。在两者的协同作用下,可能对骨质疏松症的治疗效果最大化。
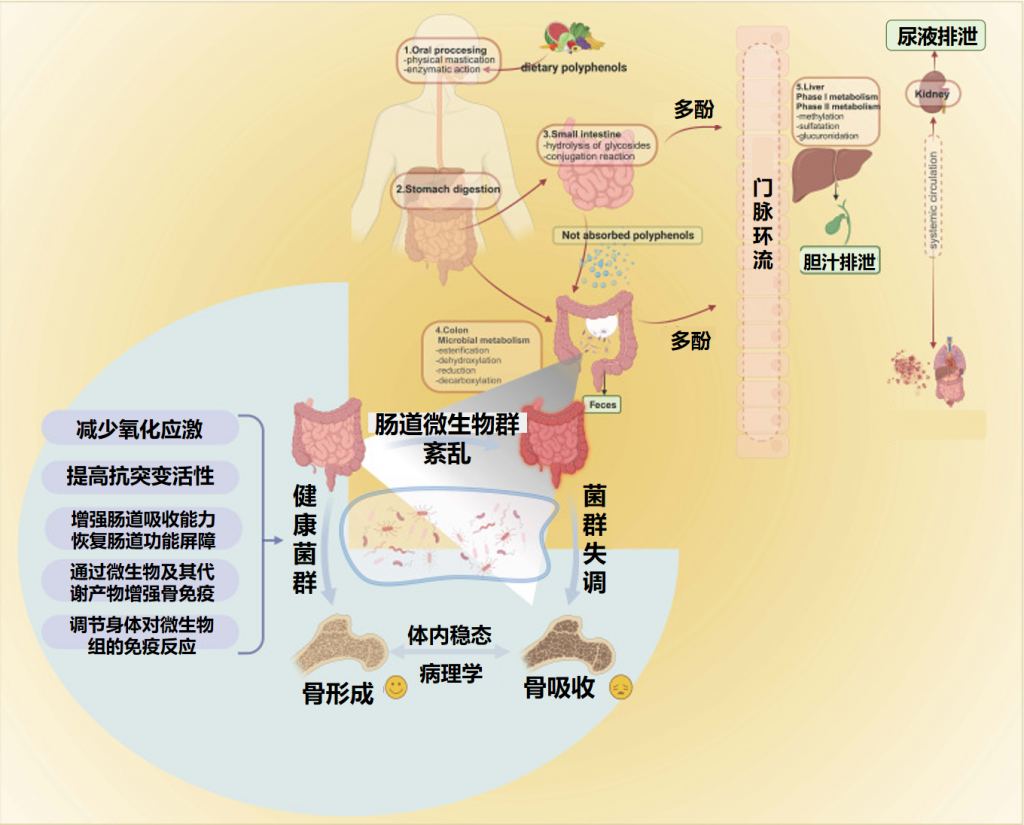
Wang K,et al.Front Immunol.2023
随着人口老龄化的不断加重,骨质疏松症(OP)已成为三大慢性疾病之一。这种全身性骨骼疾病的特点是骨矿物质密度(BMD)低,骨组织微结构恶化和骨量减少。
世界卫生组织将骨质疏松症定义为骨密度T值低于相应年龄和种族的健康年轻人平均密度2.5或更多标准差。
骨质疏松症的特点是破骨细胞功能增加,随后骨吸收增加,骨形成相应减少。成骨细胞和破骨细胞失衡是骨密度低和骨愈合不良的标志。成骨细胞是骨骼生长和维持的重要细胞,它们形成骨组织。
★ 年龄增加和女性绝经是骨质疏松的最常见原因
骨质疏松症最常见的原因是绝经和年龄,因为骨重塑过程受到雌激素、甲状旁腺激素、炎症细胞因子和维生素D的调节。
因此,老年女性的患病率(30%)高于老年男性(16%)
研究表明,体内激素失衡和局部氧化炎症也可影响破骨细胞和成骨细胞的动态平衡,主要表现为骨微结构退化、骨量减少、骨强度下降。骨髓间充质干细胞的成骨分化和骨内血管生成的下降同时发生,导致骨脆性增加和骨折易感性增加。
每年估计有890万起骨折是由于骨质疏松症而造成的。
由于骨骼是一种可塑性物质,它会根据生理和体外因素不断进行重塑,因此骨吸收增加以及随之而来的骨质流失,呈现出一种复杂的病理生理学,可能受到年龄、激素水平、遗传倾向,以及药物(如糖皮质激素)、生活方式和饮食的影响。
骨质疏松症分为原发性和继发性二大类。
✦ 原发性骨质疏松症
原发性骨质疏松症是指没有明显的诱因或疾病导致的骨质疏松症。它包括与年龄相关的骨质疏松症和绝经后骨质疏松症以及特发性骨质疏松(包括青少年型)。
老年性骨质疏松症:老年性骨质疏松症是一种与年龄相关的骨质疏松症,通常发生在50岁以上的男性和女性。它是由于骨骼的自然老化和骨形成减少而引起的。
老年性骨质疏松症患者的全身性骨质减少,尤其是脊椎、髋部和前臂骨。因此一些老人在不慎摔倒后特别容易出现髋部骨折。
绝经后骨质疏松症:绝经后骨质疏松症是绝经后女性最常见的骨质疏松症类型。在绝经后,女性体内雌激素水平下降,导致骨质流失加速。
绝经后骨质疏松症主要影响脊椎骨和髋部骨,增加骨折的风险。
特发性骨质疏松症:特发性骨质疏松症是指非目前所知的任何原因引起的骨质疏松。它包括特发性青少年骨质疏松和特发性成年骨质疏松,它们的病因和发病机制有很大不同。特发性青少年骨质疏松是一种比较罕见的病症,而特发性成年骨质疏松较常见。
特发性骨质疏松原因尚未明确,可能的原因是骨量的峰值下降造成骨量与同龄人比相对减少。骨量减少可能在早年就已经开始,并持续至成年。
✦ 继发性骨质疏松症
继发性骨质疏松症是由其他疾病、药物或疗法引起的骨质疏松症。它可以是由以下原因引起的:
激素失衡:某些激素失衡,如甲状腺功能亢进、垂体功能减退、库欣综合征(皮质醇增多症)等,都可能导致骨质疏松症。
药物:长期使用某些药物,如糖皮质激素、抗癫痫药物、抗抑郁药物等,也可能导致骨质疏松症。
慢性疾病:一些慢性疾病,如类风湿性关节炎、炎症性肠病、慢性肾病等,会增加骨质疏松的风险。
营养不良:缺乏足够的钙、维生素D和其他营养素,也可能导致骨质疏松症。
其他原因:骨质疏松症还可能与酗酒、吸烟、久坐不动、低体重指数等因素有关。
骨质疏松症是一种骨骼疾病,其主要特征是骨组织的密度和质量下降,导致骨骼变得脆弱和易碎。但骨质疏松症还可能带来以下其他危害:
✦ 骨折风险增加
骨质疏松症使骨骼变得脆弱,易于发生骨折。常见的骨折部位包括腕部、脊椎、髋部和股骨颈。即使是日常活动中的轻微压力或摔倒,也可能导致骨折,严重影响生活质量。
✦ 身体功能受限
骨质疏松症引起的骨折可能导致疼痛、残疾和功能受限。脊椎骨折可能导致身高减少、姿势异常和背部疼痛,严重影响日常活动和生活质量。
✦ 骨骼变形
骨质疏松症使骨骼弱化,容易发生骨骼变形,如驼背(脊柱前屈)和骨质疏松相关的骨折,这可能导致身体外观的改变和功能障碍。
✦ 慢性疼痛
骨质疏松症可能导致慢性骨痛,尤其是脊椎骨折引起的背部疼痛。这种疼痛可能会影响日常活动、睡眠和心理健康。
✦ 增加死亡风险
骨质疏松症相关的骨折,特别是髋部骨折,与较高的死亡风险相关。骨折还可能导致并发症,如感染、血栓形成和肺栓塞等,严重影响患者的生存率。
✦ 经济负担
骨质疏松症和相关骨折对个人、家庭和社会都带来了巨大的经济负担。治疗骨质疏松症和骨折的医疗费用、康复费用和长期护理费用都很高。
骨质疏松症有多种合适的治疗方法,目前的治疗建议包括锻炼、补充钙和维生素D,以及最终的双磷酸盐治疗。
正确的临床管理需要采取分阶段的方法,并仔细考虑具体干预措施的时机。
许多女性在绝经后会出现骨质减少,但尚未达到骨质疏松症的诊断标准;这可能是开始更保守治疗的理想时机,以防止骨质减少发展为骨质疏松症,并可能获得更好的长期疗效。
临床治疗可分为四个主要领域,其侵入性各不相同,分别为改变生活方式、补充营养、药物干预和手术治疗。
对于有骨质疏松症风险的患者,一致建议改变生活方式以防止骨质流失。充足的钙和维生素D、锻炼、戒烟、预防跌倒咨询和避免大量饮酒都是应注意的生活方式,特别是对于有骨质疏松症家族史的人来说。
高纤维饮食有助于预防骨质疏松症
饮食调整和运动是两种最有益和保守的治疗方法之一。对啮齿动物的研究表明,高纤维饮食以及由此增加肠道微生物群中短链脂肪酸的产量,特别是丁酸。
短链脂肪酸似乎可以防止小鼠绝经后和炎症性骨质流失、修复肠道屏障并预防骨质疏松症的发展。这些结果适用于人群,其中膳食纤维消耗增加与骨矿物质密度之间的关联已被证明。
避免使用促进骨质流失的药物
此外,处于骨质疏松症初始阶段或经历骨质减少的个体应避免使用促进骨质流失的药物,例如糖皮质激素。
在糖皮质激素引起骨质流失的情况下,发现饮食中添加山奈酚(一种在水果和蔬菜中发现的黄酮类化合物)可诱导成骨标志物的更高表达,并且在功能上似乎可以改善愈伤组织骨损伤部位形成并减少骨质流失,有效对抗糖皮质激素对骨骼健康的不利影响。
适度运动可以减少骨质疏松的发生
运动已显示出多种有益的健康效应,包括改善肌肉组织以预防跌倒和改善骨矿物质密度。
关于骨骼健康的运动训练,还发表了一篇有价值的文献,他们采用更多的细胞方法来考虑运动有益效果的机制。无论具体的获益机制如何,生活方式改变的证据表明,运动应该成为一线临床建议,以防止患者从骨质减少进展为骨质疏松症。
营养干预措施比较容易实现,而且相对便宜,应考虑将其作为骨质减少和骨质疏松症临床管理的措施。
增加钙与维生素D的摄入
增加钙摄入量并补充维生素D已被证明可以降低骨矿物质流失率,且不会损害肠道微生物群。膳食钙摄入不足的患者应在膳食中分次补充钙(通常为500至 1000毫克/天),将总钙摄入量提高到约1200毫克/天。
需要注意的是,钙的总摄入量(饮食加补充剂)通常不应超过2000毫克/天,因为钙摄入过高可能会出现不良反应,包括肾结石、心血管疾病、消化不良、铁和甲状腺激素失调以及便秘等。
关于维生素D的剂量存在争议。众所周知,维生素 D3(胆钙化醇)可促进小肠中钙的吸收;因此,确保足够的水平是必要的。
益生菌与益生元有助于钙代谢和骨骼健康
益生元和益生菌已被发现有助于治疗各种慢性炎症性疾病,并且越来越多的证据表明它们还有助于钙代谢和骨骼健康。
此外,向长期接受糖皮质激素治疗的小鼠添加益生菌、抗生素或粘液补充剂可预防糖皮质激素诱导的骨质疏松症的发生。

de Sire A,et al.Cells.2022
除了生活方式和其他保守的干预措施之外,骨折风险高或经历过脆性骨折的患者最有可能受益于药物辅助治疗。
双膦酸盐是一类抗骨吸收药物,自20世纪60年代首次用于治疗骨疾病以来,已被广泛使用。不过,渐进式新一线治疗方法越来越受欢迎,例如狄诺塞麦和合成代谢药物,包括甲状旁腺激素相关肽类似物和抗硬化素抗体。
具体药物需要根据患者的情况进行评估
值得注意的是,尽管有许多药物可以支持骨骼平衡和重塑,但它们的成功通常取决于患者对药物治疗的依从性。因此,最好根据患者的骨折风险设计治疗策略,并结合骨矿物质密度和临床风险因素进行评估。
此外,在开始药物治疗之前,所有患者的血钙和25-羟基维生素D水平应在范围内,如果食物摄入不足,应给予营养干预。骨质疏松症的药物治疗可分为抗吸收剂、合成代谢剂或激素调节剂。
重点来了
然而,还有其他方法可以治疗或预防骨质疏松症,这些方法可能更有效且副作用更少。本文接下来讲述的多酚等膳食成分与肠道菌群的协同作用可能就属于一种新型疗法。
多酚是存在蔬菜、谷物、水果、咖啡、茶等植物性食物中的次生代谢产物,具有潜在促进健康作用。
多酚按结构可分为黄酮类、酚酸类、木脂素类、芪类等。
流行病学研究表明,长期食用植物多酚可以预防心血管疾病、癌症、骨质疏松症、糖尿病和神经退行性疾病。
研究人员广泛研究了多酚类物质的有益作用,已知多酚可以增强骨形成并抑制骨吸收。
✦ 淫羊藿苷促进成骨细胞分化、抑制破骨细胞形成
淫羊藿苷(ICA)是8-异戊烯基黄酮苷。研究发现淫羊藿苷可以促进成骨细胞的分化,增加骨密度。骨形成主要通过成骨细胞的增殖和分化促进骨基质的合成和矿化,成骨细胞在骨形成和骨质疏松中发挥重要作用。
淫羊藿苷具有类似雌激素的药理活性,可以刺激成骨细胞的分化和矿化,调节破骨细胞的分化,并增加成骨细胞分化为成熟成骨细胞的数量。
淫羊藿苷抑制破骨细胞的形成,ICA抑制前破骨细胞向破骨细胞的分化。它还抑制参与破骨细胞形成和骨吸收的各种基因的表达。
研究表明,淫羊藿苷可以通过抑制NF-κB的激活,阻断MCF 7和MDA-MB-231诱导的破骨细胞形成。
✦ 芒柄花素增加骨量、减少骨吸收
芒柄花素(FO)是从黄芪中提取的主要异黄酮之一。研究表明,它可以刺激成骨细胞的形成,从而增加骨量,改善骨的微观结构。
芒柄花素还可以抑制破骨细胞的活化。研究表明,芒柄花素可抑制原代骨髓单核巨噬细胞向破骨细胞的增殖和分化,下调破骨细胞骨吸收功能相关蛋白和基因的表达。
✦ 葛根素对骨吸收也有调节作用
葛根原产于中国,历史悠久,是亚洲最常用的中药之一。由于异黄酮含量高,它已被广泛用作绝经后激素疗法的天然替代品。
研究表明,葛根素(PUE)对骨吸收也有调节作用。葛根素能够下调破骨细胞标志基因CTR、CATH-K、NFATc1和c-fos的mRNA水平,表明PUE抑制破骨细胞功能。
在体外,葛根素减弱骨吸收而不损害破骨细胞活力,并通过抑制骨吸收而不改变骨形成来显著防止骨丢失。此外,随着葛根素浓度的增加,葛根素会在体外抑制RANKL诱导的破骨细胞活化、骨吸收能力和F-肌动蛋白环形成。
白藜芦醇和淫羊藿苷控制成骨分化的分子机制
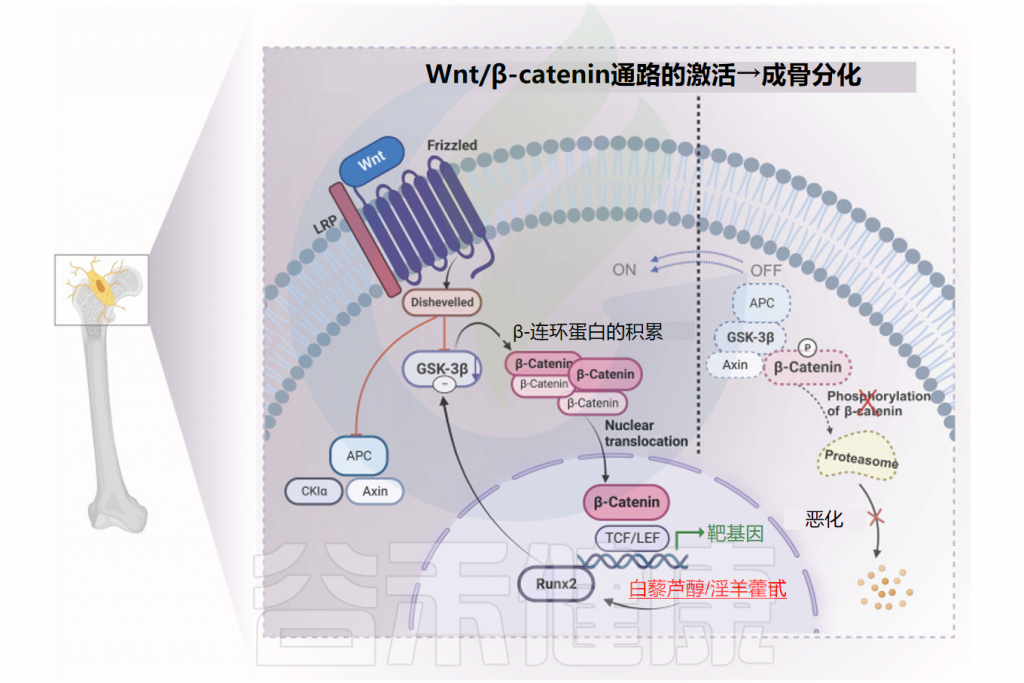
Wang K,et al.Front Immunol.2023
✦ 抗氧化应激
当活性氧的产生和消除不平衡时,就会发生氧化应激。过多的活性氧会导致细胞损伤和凋亡,影响细胞功能,引发疾病。
氧化应激可以影响骨髓间充质干细胞的功能,从而影响间充质干细胞的骨生长和成骨分化。因此,这可能导致成骨细胞功能受损并加速成骨细胞的形成和分化。
多酚化合物含有大量酚羟基,可作为抗氧化剂,防止活性氧引起的损伤。将单线态氧还原为活性较低的三线态氧,从而降低氧自由基产生的概率,终止自由基引发的链式反应。
有研究证据表明,摄入富含食源性多酚化合物的天然浆果,如蔓越莓和蓝莓,可以通过清除自由基来对抗氧化应激,预防和治疗骨质疏松症。
✦ 抗炎作用
多酚类化合物通过负调节炎症途径,特别是对关键的NF-κB转录因子的调节,发挥抗炎作用。雌激素受体能够参与与NF-κB的蛋白质相互作用,导致复合物的形成以及随后NF-κB与特定反应元件的结合。这些特异性反应元件以细胞类型特异性的方式调节NF-κB依赖性基因的转录,在调节炎症过程中至关重要。
例如,可以通过调节转录因子NF-κB并在HMC-1细胞中作为雌激素受体ERK来抑制脂质过氧化和对抗氧化应激。诱导型一氧化氮合酶表达受损会减少炎症因子TNF-1、IL-6、IL-8和NO的产生和释放。这一过程会产生抗炎作用,并有助于减轻骨丢失。
此外,多酚化合物已被证明通过下调受体激活的NF-κB配体(RANKL)来抑制骨吸收,并通过下调NFATc1和炎症介质来直接抑制成骨细胞的产生,从而降低成骨活性。
✦ 激活Wnt/β-Catenin信号通路
Wnt信号通路在骨骼发育和代谢稳态的维持中发挥着关键作用。Wnt相关蛋白或因子可以与卷曲基因受体(Fzd)结合并启动下游细胞内级联反应,从而调节β-Catenin、过氧化物酶体增殖物激活受体γ(PPARγ)和RUNX2等靶基因的转录或表达。然后调节成骨细胞形成、分化和成熟的生理过程。
Runx2是成骨细胞特异的转录因子,与成骨细胞的增殖和分化密切相关。
β-Catenin是通路中的关键因子,是Wnt/β-Catenin信号通路的中心调节因子。β-Catenin可以增强碱性磷酸酶(ALP)的活性,同时促进骨骼生长。
在一项研究中,发现淫羊藿苷对大鼠骨髓基质细胞的干预通过刺激β-连环蛋白的激活来增加总β-连环素和核转位。此外,Wnt信号传导成员(β-catenin、Lef1、TCF7、c-jun、c-myc和细胞周期蛋白D)的表达显著上调。
雌激素受体(ERα)的激活可增强成骨基因的表达,从而促进BMSCs的增殖和成骨分化。白藜芦醇是一种非黄酮类多酚有机化合物,具有雌激素样作用。一些研究人员通过白藜芦醇介导的Wnt/β-catenin途径得出结论。白藜芦醇通过刺激Runx2的表达,下调GSK38的表达水平,阻止β-连环蛋白降解复合物的有效形成,确保β-连环素在细胞质中的稳定积累和向细胞核的移位,从而激活Wnt/B-连环蛋白通路,促进成骨分化,提高骨密度,在预防和治疗骨质疏松症中发挥作用。
多酚调节骨形成或骨吸收的多种信号通路
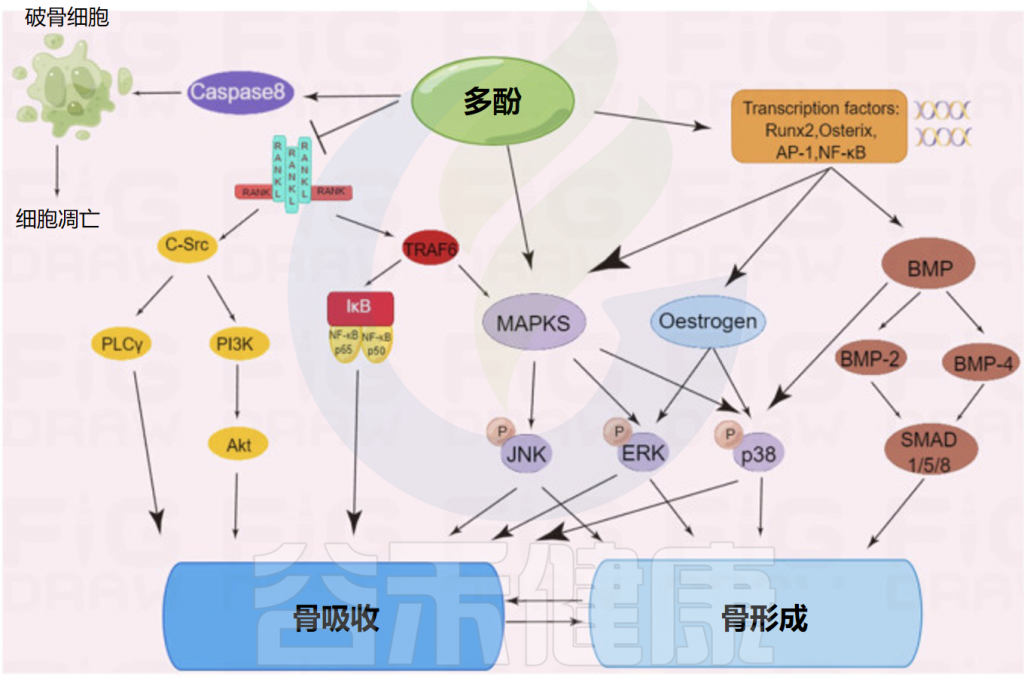
Li Y,et al.Front Pharmacol.2022
✦ 抑制NF-κB通路
NF-κB信号通路在骨代谢中也具有重要作用,并且还可以与其他信号通路相互作用,影响骨质疏松症的进展。
应用芍药苷干预RAW 264.7细胞系分化的破骨细胞模型,观察芍药苷对破骨细胞信号通路的影响。结果表明,芍药苷减弱了p65 NF-κB的磷酸化水平,即抑制了NF-κB信号通路的激活。NF-κB途径是破骨细胞分化的主要生物学途径之一。已经证实,芍药苷通过抑制p65 NF-κB的激活,降低NF-κB信号通路的活性,降低破骨细胞的活性,减少骨吸收,并进一步维持骨稳态。
芍药和蛇籽都是中药,都含有多酚类物质。通过抑制NF-κB信号通路,抑制破骨细胞的产生,来达到骨质疏松的治疗效果。
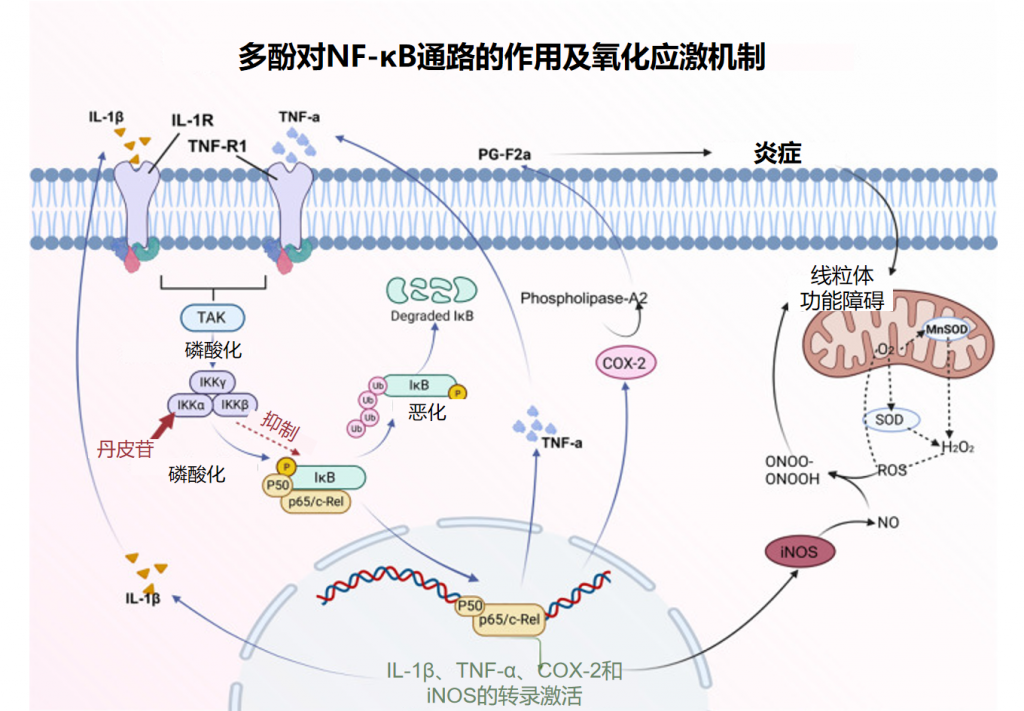
Wang K,et al.Front Immunol.2023
许多研究还揭示了肠道微生物群与骨质疏松症之间的显著联系。肠道微生物群调节骨稳态,并可以通过多种机制影响骨质疏松症。
这些包括调节其代谢物、影响宿主代谢、改变药物代谢以及调节肠道屏障功能的完整性。一些研究还强调了肠道微生物对胶原蛋白特性的改变,这与骨骼脆弱性密切相关。
肠道微生物群组成的变化会导致肠道炎症并破坏免疫调节网络的平衡,许多研究表明这与骨质疏松症有关。
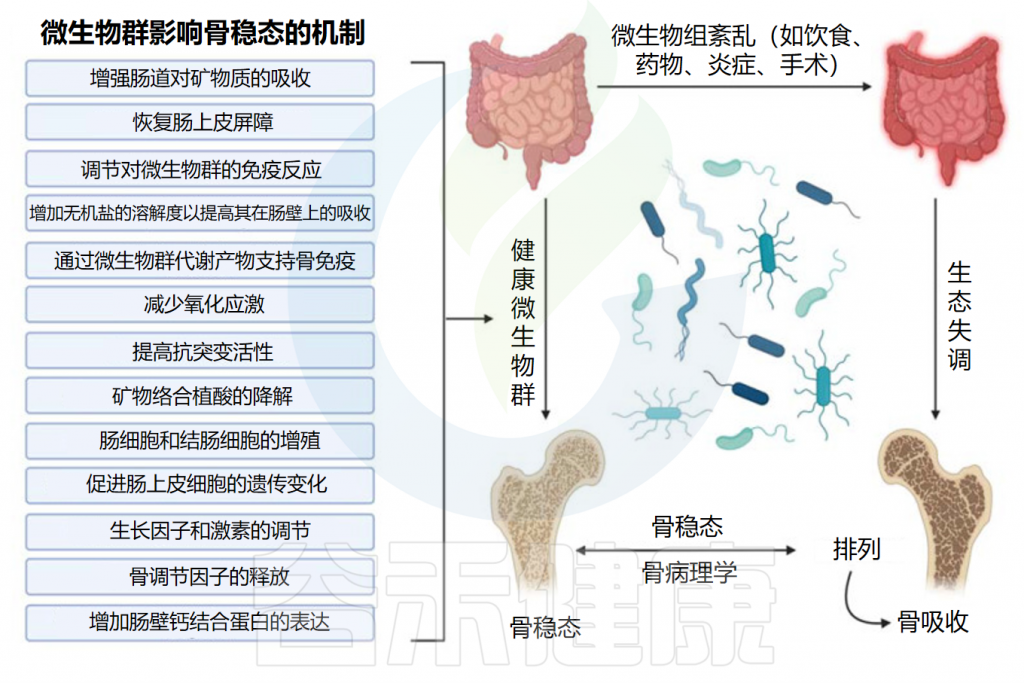
Seely KD,et al.Int J Mol Sci.2021
1.增加无机盐的溶解度,以改善其在肠壁的吸收
磷酸盐等无机盐的可用性对于成骨细胞的骨矿物质沉积和骨稳态至关重要。这种效应可能部分归因于微生物合成植酸酶将矿物质复合植酸代谢为无机磷酸盐和磷酸肌醇衍生物。
2.增强肠道矿物质吸收表面
通过促进肠上皮细胞和结肠细胞的增殖,介导肠道微生物群稳态,并支持肠道矿物质吸收。结肠细胞代谢的增加已被证明可以促进专性厌氧菌的产生,专性厌氧菌可以代谢纤维,从而增加短链脂肪酸,这对于骨稳态以及其他生理功能都至关重要。
3.恢复和维持肠道上皮屏障
肠道微生物群稳态有助于构建肠道上皮屏障,而健康的肠道上皮屏障可以防止因紧密连接受损而导致的通透性过高。通透性过高或“肠漏”会渗出异常高水平的炎症细胞因子,产生全身炎症并导致破骨细胞过度活跃和骨质退化。
4.通过微生物群代谢物增加骨密度
肠道微生物群产生的短链脂肪酸通过抑制活化B细胞的核因子kappa轻链增强子的活化来提供抗炎作用,从而减少自身免疫炎症。此外,短链脂肪酸,特别是丙酸和丁酸,通过下调TRAF6和NFATc1来抑制破骨细胞生成和骨吸收,从而有效增加骨密度,而不直接改变成骨细胞。
5.减少氧化应激
氧化应激被证明会导致过度的骨细胞凋亡,从而导致破骨细胞生成的失衡,导致骨重塑、周转和损失增加。特异性益生菌可以通过产生几种抗氧化分子(如谷胱甘肽、叶酸和胞外多糖)来缓解氧化应激。此外,几种肠道微生物群产生的短链脂肪酸还可以通过促进抗氧化分子的产生来帮助缓解氧化应激。
6.调节免疫反应
肠道微生物群通过影响与骨细胞密切相关的免疫系统,在维持骨骼健康方面发挥着至关重要的作用。在异常状态下,免疫系统对微生物群刺激的反应会通过T细胞的作用导致循环破骨细胞因子增加。它通过利用宿主完全发育的免疫系统来调节整个身体的反应来实现这一点,从而控制骨转换和密度。
7.增加抗诱变活性
尽管这种能力已在癌症领域得到广泛探索,但某些产乳酸微生物群可以有效的结合诱变剂,例如热解产物和杂环胺在肠道中降低这些化合物的诱变活性。减少DNA损伤可以减少炎症、保护肠壁、增加矿物质吸收并抑制骨质疏松症。
8.增加肠壁钙结合蛋白的表达
增加肠壁钙结合蛋白D9k基因的表达可以增加吸收钙的能力,通过抑制甲状旁腺激素的作用,有效抑制骨降解和促进骨沉积。此外,增强钙吸收以及抑制甲状旁腺激素活性和胰岛素样生长因子1的产生也可以改变破骨细胞和成骨细胞的发育。
9.调节生长因子和激素的分泌
肠道微生物群可以被视为基于大量分泌分子的内分泌器官。具体来说,肠道微生物群通过短链脂肪酸介导的途径促进胰岛素样生长因子1(IGF-1)的产生。已知IGF-1可刺激成骨细胞、破骨细胞和软骨细胞的分化。
肠道微生物群也可能通过皮质醇介导的相互作用增强骨降解。肠道微生物群还调节肠道血清素的产生,这是一种与骨细胞相互作用的分子,被认为可以充当骨量调节剂。
人类肠道微生物群和宿主相互作用,影响骨量的动态平衡,以及骨骼生长、骨骼老化和病理性骨质流失的过程,这催生了骨微生物学领域的兴起。
骨微生物学的最新研究将骨表型的变化与肠道菌群的变化联系起来。平衡、健康的微生物组似乎对于防止骨质流失是必要的,这一假设有证据支持,在小鼠的饮食中补充益生菌可逆转骨质疏松症的致病过程。
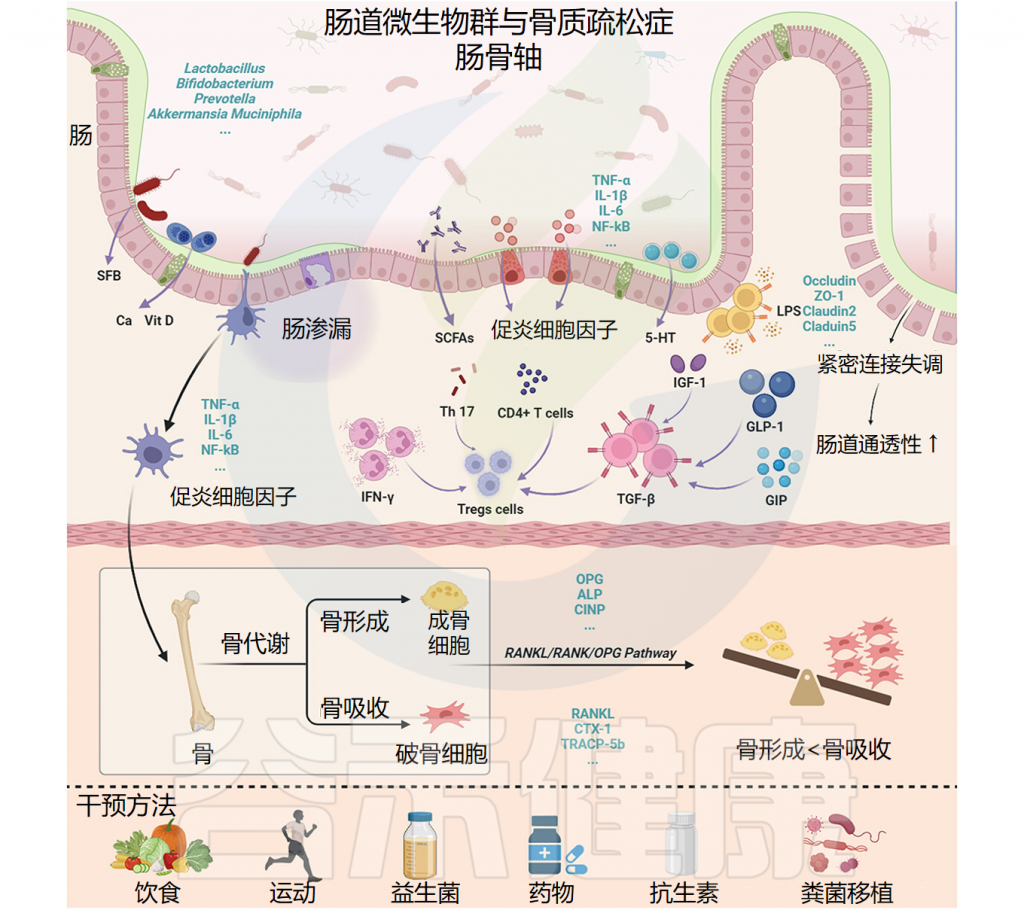
Zhang YW, et al.Gut Microbes.2024
✦ 骨质疏松症患者肠道菌群的多样性减少
评估骨质疏松症患者肠道内细菌种群数量和多样性的几项研究检查表明,骨质疏松症成年人的生物多样性似乎有所减少,某些物种如梭菌属(Fusobacterium),戴阿利斯特杆菌属 (Dialister),Faecalibacterium,甲苯单胞菌属(Tolumonas)以及拟杆菌属(Bacteroides)和罗氏菌属(Roseburia)减少。
注:上述这些基本都是肠道核心菌甚至是对人体健康非常重要的益生菌。
✦ 肠道菌群影响免疫细胞进而影响骨稳态
事实上,肠道微生物群与骨骼愈合和重塑之间的部分关联是由免疫细胞调节的。
免疫细胞成熟和功能所必需的许多细胞信号级联在一定程度上取决于肠道微生物群在整个生命过程中持续的最佳功能和体内平衡。尽管非常复杂,但近期文献中关于整体骨骼健康与肠道微生物组之间联系的主要假设以T细胞和Th17免疫细胞为中心 。在T细胞依赖性机制中,免疫系统对微生物群刺激的反应会增加循环的破骨细胞因子。
此外,虽然其作用尚不完全清楚,但Th17免疫细胞似乎是破骨细胞群的一个组成部分。因此,可以假设肠道微生物群的任何不平衡可能反过来影响骨稳态所需的关键免疫机制。
除了所提出的T细胞介导的相互作用之外,更广泛的免疫系统对微生物组的反应导致产生许多循环细胞因子和基于细胞的免疫效应物,这些效应物对骨细胞具有显著影响,这表明考虑肠道微生物群的健康可能会有益于骨愈合障碍。
✦ 肠道微生物影响微小RNA进而影响骨骼健康
尽管肠道微生物群对宿主免疫系统的影响有着相对较长的记录历史,但这并不是肠道微生物群影响骨骼健康的唯一潜在机制。类固醇激素、甲状旁腺激素和维生素D代谢物都可能受到微生物群的影响。
此外,细菌衍生的化合物(例如维生素)可能会进入血液并直接影响骨细胞活性。或者,肠道微生物群可能通过对宿主微小RNA (miRNA) 的影响来影响骨质疏松症的发展,宿主微小 RNA 是参与基因表达调节的非编码 RNA 分子。
一些 miRNA 可以影响与骨质疏松症中成骨细胞分化相关的转录物,例如 miRNA-33-5p、miRNA-194和miRNA-433-3p。尽管尚未完全了解,但在支持肠道微生物失调的反馈机制中,微生物群可能会影响宿主 miRNA,进而抑制成骨细胞发育,对骨质疏松修复构成障碍。
总的来说,肠道微生物群通过破骨细胞生成影响骨愈合和重塑有多种潜在途径。
益生菌是一类对宿主有益的活性微生物,定植于人体肠道和生殖系统等部位,能够产生精准的健康益处,改善微生态平衡,发挥有益作用。随着生命结构的不断改变,越来越多的益生菌被开发和利用,这与维持机体功能的稳定密不可分。
除了食品之外,益生菌的应用范围也越来越广,牙膏、啤酒等都在添加益生菌。益生菌对骨质疏松症的调节是一个新兴领域,研究益生菌如何改善骨代谢、预防或治疗骨质疏松症已成为研究热点,并已取得一定进展。
✦ 益生菌恢复肠道微生物平衡利于骨骼健康
目前的研究证据表明,补充益生菌以恢复肠道微生物群及其代谢产物的平衡对骨骼健康有益。
具体来说,被诊断患有炎症性肠病或相关疾病的个体由于肠道微环境的变化和随之而来的菌群失调而经常患有骨质疏松症,并研究了乳双歧杆菌BL-99可以作为有益的益生菌制剂来预防骨质疏松症。
最近的研究还表明,益生菌治疗可以通过抑制IL-6的分泌和肠道炎症反应来抑制卵巢切除术(OVX)诱导的小鼠破骨细胞的活性,从而增强骨量。
例如补充Bacteroides vulgatus ATCC 8482可以缓解骨质疏松小鼠肠道微生物群的失衡,下调脂多糖/TLR-4/p-NF-κB通路,改善腰椎的骨丢失和骨微结构破坏,这表明Bacteroides vulgatus ATCC 8482可能是一种具有改善绝经后骨丢失潜力的益生菌。
✦ 同时补充益生菌对改善绝经后女性的骨质疏松比单一常规药物更有效
目前益生菌防治骨质疏松的研究多集中于动物实验,临床试验报道较少。但一项基于人群的试验表明,在治疗绝经后骨质疏松症方面,施用Bifidobacterium animalis subsp. lactis Probio-M8与常规药物/补充剂的组合比单独使用常规药物/补充剂更有效。
在一项双盲、安慰剂对照研究中,75至80岁且骨矿物质密度较低的女性被随机分配每天口服10^10菌落形成单位的罗伊氏乳杆菌 ATCC PTA 6475或安慰剂,并且结果表明,补充罗伊氏乳杆菌 ATCC PTA 6475可能是预防骨质疏松症的新方法。
此外,在一项随机对照试验中,补充罗伊氏乳杆菌 ATCC PTA 6475有可能预防骨密度低的老年女性肠道微生物群恶化和炎症状态,这可能对骨代谢产生有益影响。
由此可见,越来越多的学者开始从补充益生菌的角度探讨调节肠道菌群及其代谢物的深层机制,益生菌也成为预防和治疗骨质疏松症的潜在候选者。
不同食物中营养素的组成和含量显著影响肠道微生物群的组成和丰度,进而影响骨代谢,调节骨质疏松。
因为一些微生物直接利用某些营养物质作为生长物质的来源,而大量摄入此类营养物质可能会导致细菌丰度增加并作用于骨代谢。例如,链球菌(Streptococcus), 芽孢杆菌(Bacillus),丙酸杆菌(Propionibacterium), 拟杆菌(Bacteroides)和梭菌属(Clostridium)等微生物可以利用蛋白质作为氮源,较高的膳食蛋白质摄入量也可以增加其丰度和多样性。
此外,人们还认识到,日常饮食摄入引起的生理环境的变化会影响微生物群落的选择。以膳食脂肪摄入为例,富含脂肪的膳食可能会促进胆汁分泌,以利于脂质的消化,而胆汁酸对细菌的细胞膜有不利影响,这使得胆汁酸对微生物产生强大的选择压力并导致这些肠道微生物群相关代谢物在骨质疏松症的代谢调节中发挥负面作用。
由于多酚抑制炎症因子并参与各种其他机制的能力,多酚已被确定为治疗骨质疏松症和慢性炎症的潜在药物,并且与肠道屏障的功能密切相关。
同时,多酚还可以充当肠道屏障-骨-免疫系统的调节介质和诱导剂。多酚可以通过两种方式影响肠道微生物群,即促进有益细菌的增殖和增加其丰度。
✦ 多酚可作为益生元增加有益菌的丰度
多酚具有益生元的属性并改变人类肠道微生物群组成。富含多酚的食物已被一致证明可以有效改变肠道微生物群。
大多数研究一致证明多酚可以引起肠道微生物群组成的有利改变。具体来说,当个体食用富含多酚的饮食时,人体肠道菌群会发生显著变化,乳杆菌、双歧杆菌、阿克曼氏菌、肠球菌和拟杆菌的数量增加,而梭菌和厚壁菌与拟杆菌的比例显著下降。
富含多酚的食物改变肠道微生物组成的证据
例如,富含多酚的红酒被发现可以刺激肠道微生物群中某些细菌的生长,例如拟杆菌和罗氏菌属。
发酵木瓜汁中发现的某些类型的多酚,例如没食子酸和咖啡酸,可以影响肠道微生物的组成。研究表明,这些多酚可以减少肠球菌、产气荚膜梭菌和艰难梭菌等有害细菌的数量,同时促进双歧杆菌等有益细菌的生长。
此外,某些多酚还可以促进肠道微生物群中真菌的生长。食用富含原花青素的葡萄籽可以增加肠道中乳酸杆菌、梭菌和瘤胃球菌的数量。
蔬菜与水果类似,富含多酚和益生元纤维。摄入胡萝卜中的膳食多酚可以增加拟杆菌和乳杆菌的数量,并减少产气荚膜梭菌、科氏梭菌、球状拟杆菌和肠杆菌。
利用16S rRNA和宏基因组测序分析研究了白藜芦醇对肠道生物屏障的影响。研究结果表明,白藜芦醇对肠道微生物群的多样性和结构具有积极影响。具体来说,它增加了益生菌的丰度并调节肠道微生物群的功能以对抗免疫抑制。


Wang K,et al.Front Immunol.2023
✦ 多酚衍生代谢物具有抗炎作用增强肠道健康
除了上述益生菌作用外,多酚衍生的代谢物可以增强肠道健康和表现出抗炎特性。例如,可可多酚的生物活性代谢物可以增强肠道健康,具有抗炎作用,对免疫系统有积极作用,并降低各种疾病的风险。
摄入多酚可以通过促进短链脂肪酸的产生、增强肠道免疫功能和其他生理过程来改善肠道微生物群的健康效应。
✦ 多酚减少有害细菌的水平
据观察,在含有人类粪便细菌的培养基中加入茶多酚,特别是儿茶素,可以减少有害细菌的水平,包括大肠杆菌、产气荚膜梭菌。
这一发现表明,在肠道环境中引入茶多酚可能对抗这些特定病原菌的增殖。强调了茶多酚对肠道微生物群平衡的积极影响。
还研究了茶多酚对肠道氧化还原状态的影响及其与肠道微生物群的相关性。研究发现螺旋体和拟杆菌属被确定为肠道氧化还原状态的生物标志物,并揭示了茶多酚的益处。
因此,多酚和肠道微生物群之间的协同作用成为治疗骨质疏松症的关键因素。
营养因素也对骨质疏松症有着至关重要的影响,低钙摄入、维生素D缺乏、高磷和钠饮食、过量饮酒以及碳酸饮料的摄入被普遍认为是骨质疏松症的危险因素,而充足的蛋白质摄入有利于骨骼健康。
膳食营养素通过作用于肠道微生物群及其代谢物对骨质疏松症产生影响:
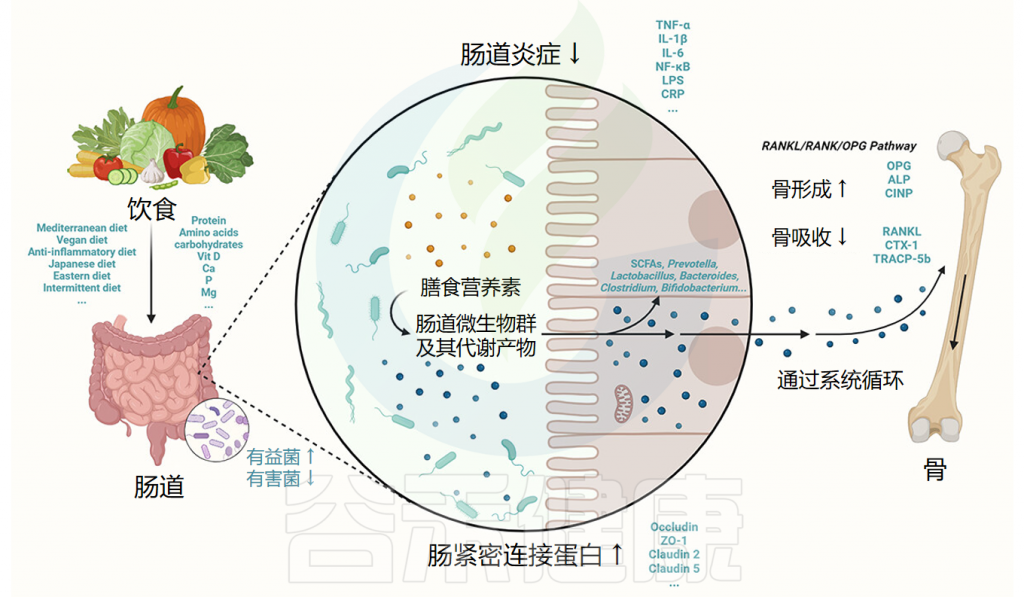
Zhang YW, et al.Gut Microbes.2024
人体的膳食蛋白质摄入可以通过细菌发酵、甲烷化、脱羧反应和硫还原来改变呼吸链中的电子受体,从而对转化为对健康具有不同影响的物质。
✦ 改变细菌生长环境,调整肠道菌群的组成
例如,含硫氨基酸如蛋氨酸和半胱氨酸可以在硫还原作用下生成硫化氢,而氨基酸和肽可以在厌氧菌的作用下通过脱羧反应产生胺类。这些代谢产物改变了细菌的生长微环境,并使细菌获得了一定的生长优势,从而改变了肠道菌群的组成和丰度。
同时,研究表明,高蛋白饮食者的肠道菌群中Bacteroides, Prevotella, Treponema, Fusobacterium, Clostridium perfringens和Bacillus的数量相对于传统饮食者增加,而厚壁菌门的数量减少。这种改变也已被证实与骨质疏松症的逆转一致。
✦ 蛋白质的代谢产物影响骨吸收和骨形成
研究人员揭示,肠道菌群发酵的蛋白质、氨基酸和肽的主要代谢产物是短链脂肪酸,如乙酸、丙酸和丁酸,而短链脂肪酸参与了骨形成和骨吸收的调节。
学者们还发现,肠道厌氧菌能够从甘氨酸、苏氨酸、谷氨酸、赖氨酸、鸟氨酸和天冬氨酸中合成乙酸,从苏氨酸、谷氨酸和赖氨酸中主要合成丙酸。
更重要的是,包括乙酸、丙酸和丁酸在内的短链脂肪酸的调节与骨质疏松症的发生和发展密切相关。与此同时,梭菌属可以利用支链氨基酸(缬氨酸、亮氨酸和异亮氨酸)合成支链脂肪酸,而支链氨基酸和短链脂肪酸也是代谢性疾病如骨质疏松症、肥胖症、2型糖尿病等的潜在调节因素。
膳食脂肪是身体的有效能量来源。先前的研究已表明,膳食脂肪摄入的质量和数量可能会影响肠道微生物群的组成和丰度。
✦ 适量的不饱和脂肪酸可助肠道菌群有益改变
不饱和脂肪酸通过提高拟杆菌门与厚壁菌门的比例来改变肠道微生物群的组成和丰度。Omega-3脂肪酸可导致肠道微生物群的有益改变,包括增加双歧杆菌、乳酸杆菌、链球菌、脱硫弧菌和阿克曼菌。
✦ 高脂饮食会导致骨代谢紊乱和骨质疏松
但大量摄入饱和脂肪酸和反式脂肪酸会增加心血管和骨代谢相关疾病的风险,减少拟杆菌、普雷沃氏菌、乳杆菌和双歧杆菌的丰度,从而可能导致全身炎症、骨代谢紊乱和骨质疏松。
研究发现,长期高脂饮食会导致骨量下降、微生物群失调、肠漏和全身炎症,而低聚果糖或低聚半乳糖的施用可以显著增强肠道微生物群的生物多样性和短链脂肪酸浓度,逆转高肠道通透性和炎症细胞因子,最终预防高脂饮食诱导的骨质疏松症。
研究结果还表明,高脂饮食引起的骨质流失伴随着骨髓脂肪组织的扩张和骨形成的抑制。
高脂饮食对骨骼结构和健康具有至关重要的影响,肠道菌群失衡、肠道屏障恶化、炎症反应、氧化应激、脂肪因子改变和骨髓脂肪组织堆积被认为是潜在的机制。
研究还发现,运动可以预防高脂饮食对男性骨骼健康的多种负面影响,运动引起的肠道微生物群变化(降低厚壁菌门与拟杆菌门的比例)可能表现出一种新的机制,有助于运动诱导的骨骼健康益处。
可消化和不可消化的碳水化合物都可能影响肠道微生物群的组成和丰度,这两者都已被证实可以增加双歧杆菌的数量。各种水果中的可消化碳水化合物(例如葡萄糖、蔗糖和果糖)已被证明会降低拟杆菌和梭菌的丰度。
✦ 高膳食纤维的摄入有助于骨骼健康
难消化的碳水化合物也称为膳食纤维。近年来,随着肠骨轴研究的快速发展,膳食纤维发酵的短链脂肪酸已成为一种重要的介质,重点关注肠道微生物群与骨质疏松症之间的联系。
膳食纤维通过调节拟杆菌门与厚壁菌门的比例来改变肠道微生物群,并改变多种功能途径(包括氨基酸和脂质相关代谢),从而参与骨代谢的调节。研究人员分析了膳食纤维摄入不足的后果,观察到低纤维饮食显著降低了长达三代的微生物多样性,并且补充膳食纤维后微生物多样性无法恢复。
更重要的是,研究人员总结,摄入更多富含纤维的食物(包括粗粮、新鲜水果和蔬菜),再加上充足的运动、适当的饮水和规律的排便,可能有助于维持人体肠道和骨骼的健康,尤其是中老年人,以预防骨质疏松症。因此,食用多种食物中的膳食纤维对维持肠道健康和防止骨质流失至关重要。
肠道菌群在调节宿主健康中发挥着至关重要的作用,不同个体肠道菌群的组成存在显著差异,并受到饮食、环境等多种因素的影响,其中饮食是不可忽视的重要因素。
★ 饮食模式和膳食成分都会影响健康
不同的饮食模式对肠道微生物群的结构、代谢和功能有不同的影响,并参与各种生理活动,如食物消化、营养代谢吸收、能量供应、免疫调节和胃肠道稳态的维持,与骨质疏松症的发生发展密切相关。
此外,饮食不仅会影响肠道微生物群的结构和组成,还会影响其基因和功能。即使是同一属的细菌,在不同饮食模式的影响下,其功能和核心基因也存在显著差异。
纯素食和地中海饮食可以增强肠道微生物群的多样性,促进有益细菌的生长,如双歧杆菌、乳酸杆菌和普雷沃氏菌,而西方饮食可以减少肠道微生物群多样性,增加厚壁菌门与拟杆菌门的比例。
!
不同饮食对骨骼健康的影响
通过阅读相关文献,谷禾在这里为大家整理了不同饮食模式对肠道微生物群、代谢物和骨骼健康的影响,如下图:

Zhang YW, et al.Gut Microbes.2024
多元化的饮食更利于骨骼健康
不同的膳食成分可能以时间依赖性的方式塑造肠道细菌群落,并且不同的膳食成分对肠道微生物群的影响显著不同。
因此,合理的膳食结构、正确的膳食习惯和方法、适当的营养配比是保证人体健康的基础,而不合理的膳食结构则是高血压、糖尿病、骨质疏松等多种慢性病的罪魁祸首。在此基础上,还必须根据肠道菌群及其代谢产物对骨质疏松症的调节影响提出合理的饮食建议。
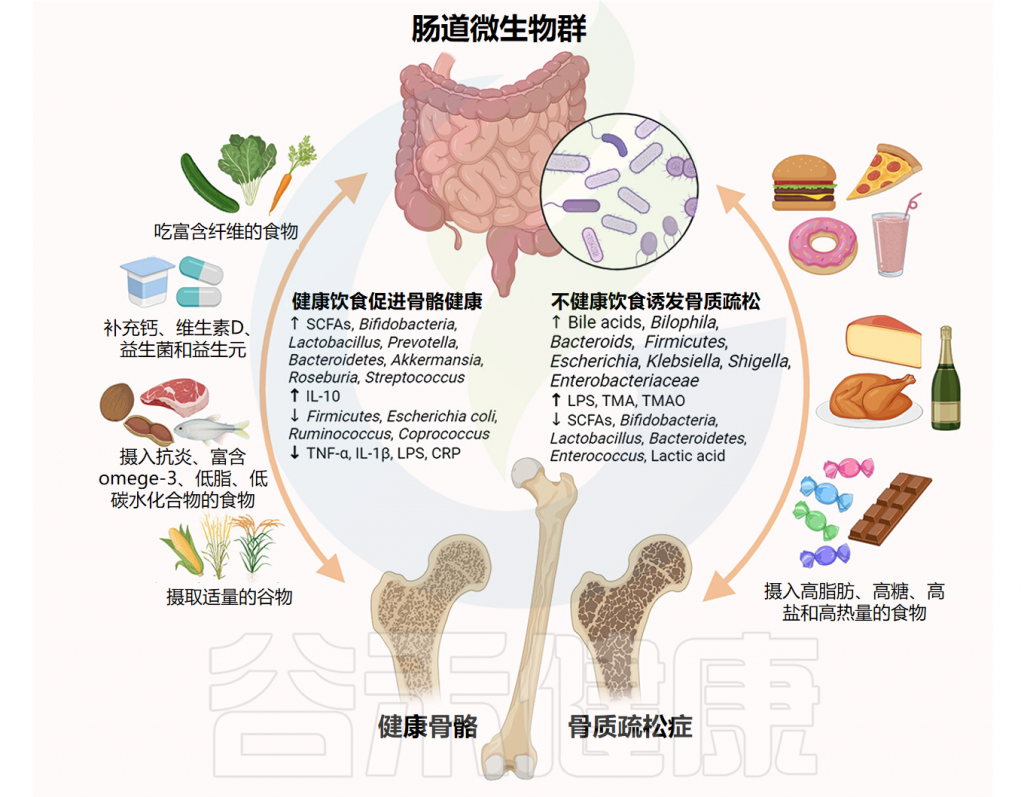
Zhang YW, et al.Gut Microbes.2024
合理的饮食模式融合了地中海饮食、抗炎饮食等健康饮食模式的特点,主要包括食物多样化、高纤维摄入、低糖摄入、低脂肪摄入、高谷物摄入。
合理的膳食结构主要以食物多样化为原则,建议多食用蔬菜、水果、豆类及其制品、鱼类、海鲜,同时少吃红肉和饱和脂肪酸,保证充足的摄入以植物性食物为主,适量动物性食物为主,从而获得种类齐全、数量充足、比例适当的膳食营养素,满足中老年人群维持骨骼健康、预防骨质疏松的生理需要。
合理的饮食模式也为塑造肠道稳态、有益菌繁殖、消除有害菌、维持肠道菌群多样性奠定了坚实的基础。
骨质疏松症作为一种中老年人常见的慢性疾病,在日常生活中如何更好地预防和改善非常重要。
除了常规的日常护理外,肠道微生物群与饮食也起着至关重要的作用。肠道微生物群可以将多酚等膳食成分分解为更容易吸收的有益代谢物,如短链脂肪酸,而多酚可以增加肠道中有益菌的丰度和活性,增强肠道屏障,从而促进骨健康。
两者协同作用下,更大程度地发挥各自的功能和作用,可能作为预防和治疗骨质疏松症的新方法。
主要参考文献:
Zhang YW, Song PR, Wang SC, Liu H, Shi ZM, Su JC. Diets intervene osteoporosis via gut-bone axis. Gut Microbes. 2024 Jan-Dec;16(1):2295432.
Wang K, Hu S. The synergistic effects of polyphenols and intestinal microbiota on osteoporosis. Front Immunol. 2023 Oct 23;14:1285621.
Seely KD, Kotelko CA, Douglas H, Bealer B, Brooks AE. The Human Gut Microbiota: A Key Mediator of Osteoporosis and Osteogenesis. Int J Mol Sci. 2021 Aug 31;22(17):9452.
Zhou RX, Zhang YW, Cao MM, Liu CH, Rui YF, Li YJ. Linking the relation between gut microbiota and glucocorticoid-induced osteoporosis. J Bone Miner Metab. 2023 Mar;41(2):145-162.
Cheung KCP, Jiao M, Xingxuan C, Wei J. Extracellular vesicles derived from host and gut microbiota as promising nanocarriers for targeted therapy in osteoporosis and osteoarthritis. Front Pharmacol. 2023 Jan 6;13:1051134.
de Sire A, de Sire R, Curci C, Castiglione F, Wahli W. Role of Dietary Supplements and Probiotics in Modulating Microbiota and Bone Health: The Gut-Bone Axis. Cells. 2022 Feb 21;11(4):743.
Martiniakova M, Babikova M, Mondockova V, Blahova J, Kovacova V, Omelka R. The Role of Macronutrients, Micronutrients and Flavonoid Polyphenols in the Prevention and Treatment of Osteoporosis. Nutrients. 2022 Jan 25;14(3):523.
Inchingolo AD, Inchingolo AM, Malcangi G, Avantario P, Azzollini D, Buongiorno S, Viapiano F, Campanelli M, Ciocia AM, De Leonardis N, de Ruvo E, Ferrara I, Garofoli G, Montenegro V, Netti A, Palmieri G, Mancini A, Patano A, Piras F, Marinelli G, Di Pede C, Laudadio C, Rapone B, Hazballa D, Corriero A, Fatone MC, Palermo A, Lorusso F, Scarano A, Bordea IR, Di Venere D, Inchingolo F, Dipalma G. Effects of Resveratrol, Curcumin and Quercetin Supplementation on Bone Metabolism-A Systematic Review. Nutrients. 2022 Aug 26;14(17):3519.
Li Y, Li L, Li X, Luo B, Ye Q, Wang H, Yang L, Zhu X, Han L, Zhang R, Tian H, Wang P. A mechanistic review of chinese medicine polyphenols on bone formation and resorption. Front Pharmacol. 2022 Oct 12;13:1017538.

谷禾健康

如今,全球约有 26 亿人(约占世界人口的 40%)受到超重或肥胖的影响。除非采取果断的行动来遏制这一日益严重的流行病,否则预计到 2035 年,将有超过 40 亿人,也就说世界人口的一半受到超重或肥胖的影响(世界肥胖联合会的研究统计)。
超重和肥胖的特点是能量摄入超过能量消耗时产生过多的脂肪量积累。控制能量消耗的一种可能的方法是调节白色脂肪组织(WAT)和/或棕色脂肪组织(BAT)中的生热途径。
脂肪组织分为白色、棕色和米色,在体内能量储存、产热和新陈代谢中具有不同的作用。环境因素极大地影响能量代谢,其中饮食、运动和睡眠是主要影响因素。
在能够影响宿主代谢和能量平衡的不同环境因素中,肠道微生物群现在被认为是关键因素。肠道细菌参与肠道和脂肪组织之间的双向通讯,影响能量代谢、营养吸收、食欲和脂肪组织功能。
开创性研究表明,缺乏肠道微生物(即无菌小鼠)或肠道微生物群耗尽(即使用抗生素)的小鼠产生的脂肪组织较少,许多研究调查了肠道细菌之间存在的复杂相互作用,其中一些它们的膜成分(即脂多糖)及其代谢物(即短链脂肪酸、内源性大麻素、胆汁酸、芳基烃受体配体和色氨酸衍生物)以及它们对 WAT 褐变和/或米色脂肪的贡献以及 BAT 活动的变化。
肥胖与多种不良健康后果相关,包括代谢紊乱,如 2 型糖尿病、心血管疾病和某些类型的癌症。因此,迫切需要新的治疗策略来解决日益流行的肥胖及其相关的健康问题。
一种有前途的方法是调节白色脂肪组织(WAT)和棕色脂肪组织(BAT)中的生热途径,这可以帮助控制能量消耗并有助于减肥(下图)。此外,肠道微生物群已成为调节宿主代谢和能量平衡的关键角色,通过有针对性的方法对其进行调节可能有望治疗超重和肥胖。
Cani PD, et al., Nat Rev Gastroenterol Hepatol. 2023
除了储存脂质(白色和米色脂肪组织)和产生热量(米色和棕色脂肪组织)外,人体脂肪组织还通过产生脂肪因子参与各种代谢功能。
本文我们一起来了解关于白色、棕色、米色脂肪组织的一般生理学,人类和小鼠之间的区别,同时也了解一下肠道菌群及其不同代谢物,它们的受体和信号通路如何调节脂肪组织的发育及其代谢能力,通过呈现具体的关键示例,深入阐述了肠道微生物群和脂肪组织代谢之间的复杂机制,同时也展示了从实验室转向临床的主要挑战与前景。
肥胖人数翻倍
自1975 年以来,全球肥胖人数几乎增加了两倍,目前有超过 6.5 亿人的体重指数 (BMI) ≥30 kg/m2被归类为肥胖。
肥胖相关合并症
由于肥胖与其合并症(包括 2 型糖尿病、心脏病、中风以及罹患多种癌症的风险增加)之间的密切关联,肥胖每年导致全球超过 470 万人过早死亡。因此,开发新的疗法至关重要,不仅可以减少体重过度增加,还可以限制体内脂肪过多的人患病的风险。
肥胖是如何形成的?
肥胖是由于长时间的正热量摄入而产生的,其中能量摄入超过能量消耗,过量的营养物质以甘油三酯 (TG) 的形式积聚在白色脂肪组织 (WAT) 内。
什么是白色脂肪组织?它有什么作用?
白色脂肪组织最初被认为是一种不良的结缔组织,但越来越清楚的是,白色脂肪组织发挥着广泛的重要生物功能,而且缺乏 WAT 与脂肪量过多一样对代谢健康有害。
因此,如今脂肪组织被认为是一个中央代谢器官,通过营养物质交换和脂肪源性激素和细胞因子的分泌(统称为脂肪因子)密切参与能量代谢的系统调节。
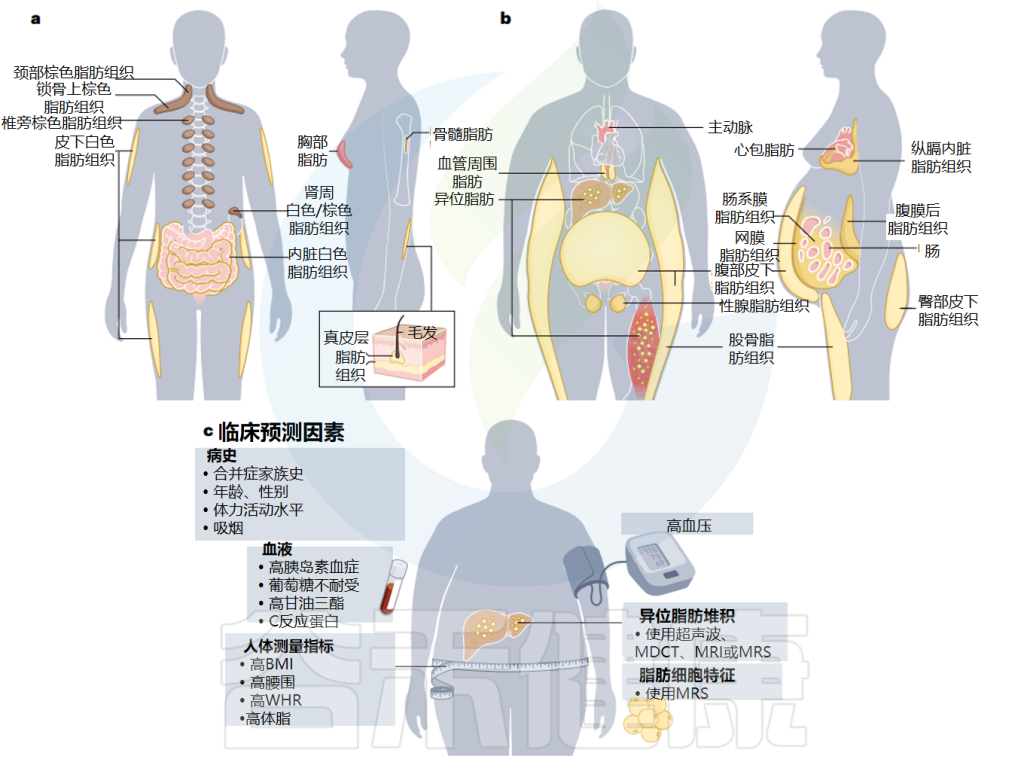
Hagberg CE, et al., Nat Rev Mol Cell Biol. 2023
人体脂肪组织大致可分为:
BAT 主要在瘦人的颈部、锁骨上、椎旁和肾周区域。此外,瘦人还含有乳房(粉红色)脂肪组织、骨髓脂肪组织和真皮白色脂肪组织(WAT),后者在解剖学上与 SAT 是分开的。
在肥胖个体中,脂质开始异位累积在肝脏和肌肉等器官中,并且在更大程度上累积在VAT库中,包括网膜、纵隔、腹膜后、网膜和肠系膜库。脂肪也开始在血管周围积聚为血管周围脂肪组织 (PVAT) 和心脏周围的心包位置。
临床上可以根据病史、血液检查和人体测量指标以及异位脂肪堆积和不良脂肪细胞特征的成像来预测与肥胖相关的病理。
BMI,身体质量指数;DXA,双能X射线吸收测定法;MDCT,多探测器计算机断层扫描;MRI、磁共振成像;MRS、磁共振波谱;WHR,腰臀比。
脂肪组织的复杂性与功能多样性
脂肪组织远非均匀的能量储存室。相反,它体现了一个由不同细胞类型组成的动态生态系统,这些细胞类型的相互作用决定了其生理和病理作用。这些细胞群(包括脂肪细胞、巨噬细胞、T 细胞、成纤维细胞、内皮细胞、脂肪干细胞和祖细胞、中性粒细胞和 B 细胞)之间的相互作用形成一个高度整合的网络,协调脂肪组织功能和体内平衡。
每个脂肪库都显示出其独特的功能模式、细胞组成和疾病倾向,以及脂肪细胞类型的变化。
肥胖白色脂肪组织的特征
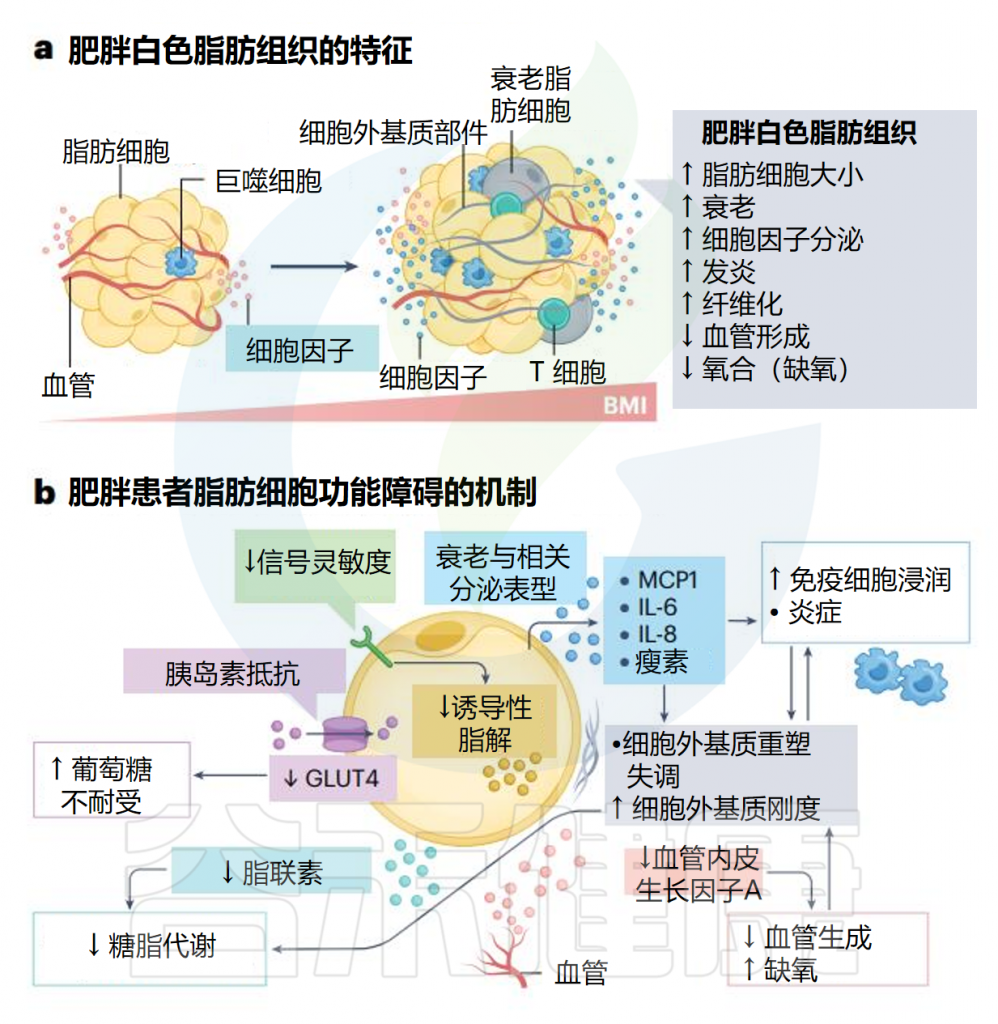
Hagberg CE, et al., Nat Rev Mol Cell Biol. 2023
例如,人类皮下脂肪组织(SAT)主要由白色单房(含有单个脂肪滴)脂肪细胞以及基质血管细胞组成,而血管周围脂肪垫通常包括多房(含有多个较小的脂肪滴)生热米色/brite脂肪细胞和乳腺脂肪组织含有粉红色脂肪细胞,有利于哺乳。
尽管这些特殊的脂肪细胞亚型对其各自的组织功能非常重要,但成人中的大多数人类脂肪细胞驻留在 WAT 中并发挥能量储存的作用。
脂肪细胞功能与代谢疾病
重要的是,这些也是与人类肥胖引起的病理学关系最密切的脂肪细胞。由于人类和啮齿动物脂肪库之间的解剖学、生理学和病理学特征存在巨大差异,当前的本文将主要关注人体研究的证据,旨在阐明哪些脂肪细胞功能已得到充分证实,以及哪些方面需要更多研究。
全基因组关联研究和转录分析的结果相结合,证实了脂肪细胞和 WAT 分布对于肥胖期间维持代谢健康的关键作用,并强调脂肪细胞功能障碍的发展是导致代谢疾病的第一步。这包括脂肪组织在胰岛素抵抗和 2 型糖尿病发展中的既定作用,这在上面进行了简要讨论,我们建议读者阅读一些近期的优秀评论,以进行更深入的分析。
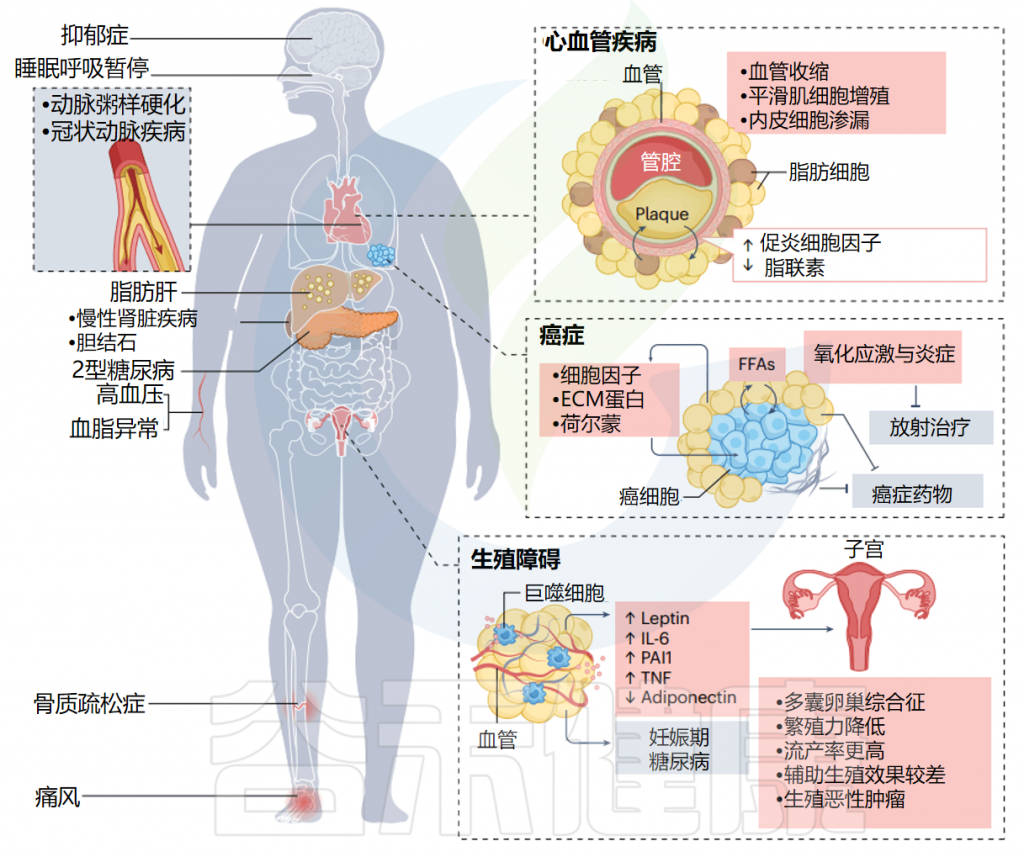
Hagberg CE, et al., Nat Rev Mol Cell Biol. 2023
体重增加和肥胖与罹患各种慢性、身体和精神疾病的风险增加有关,其中描述了其中一些疾病。
肥胖和脂肪细胞功能障碍对心血管疾病、癌症和生殖的影响。
心血管:血管周围脂肪细胞功能障碍改变脂肪因子和促炎细胞因子的分泌,从而促进血管收缩、平滑肌细胞增殖和内皮细胞渗漏,加剧动脉粥样硬化中发现的许多病理变化,从而增加发生症状性心血管疾病的风险疾病。
癌症:癌细胞与癌症相关脂肪细胞合作,促进邻近脂肪细胞释放游离脂肪酸 (FFA),促进癌细胞增殖和迁移。此外,脂肪细胞通过释放细胞因子、细胞外基质(ECM)蛋白和激素来促进癌症生长。癌症相关脂肪组织也与治疗抵抗有关。脂肪细胞以及相关的纤维 ECM 会阻碍癌症药物的输送。肥胖者的脂肪组织还具有慢性低度炎症和氧化应激增加的特征。
生殖:功能失调的白色脂肪组织改变脂肪因子分泌可直接损害生殖器官功能,并导致多囊卵巢综合征(PCOS)和生育能力下降。肥胖还会增加患妊娠糖尿病的风险。
IL-6、白介素-6;PAI1,纤溶酶原激活剂抑制剂1;TNF,肿瘤坏死因子。
长期以来,脂肪组织只是以脂肪形式被动储存多余能量的场所。然而,研究表明,它是一个活跃、动态的内分泌器官,能分泌激素,在调节体内新陈代谢和其他生理过程中发挥着至关重要的作用。
人体内的脂肪组织可以根据其位置(皮下和内脏)或根据其形态(WAT或BAT)来划分,每个脂肪库都有其独特的生理和代谢特征。
脂肪因子有什么用?
脂肪因子可以局部作用(自分泌、旁分泌)或分泌到血流中,对远处的器官和组织发挥作用(内分泌)。
脂肪因子在调节体内各种生理过程中发挥着至关重要的作用,包括能量代谢、胰岛素敏感性、食欲调节、脂质代谢、生殖以及免疫和心血管功能。
在肥胖和代谢紊乱中经常观察到的脂肪因子失调会导致多种慢性疾病的发生,包括胰岛素抵抗、炎症相关疾病、心血管疾病和癌症。
脂肪因子在不同的脂肪室中差异表达
例如,与皮下脂肪组织(SAT)相比,内脏脂肪组织(VAT)中的vistatin、网膜素(omentin)、chemerin、BMP2、BMP3和RBP4更高,SAT中的脂联素、瘦素、抵抗素、脂素(adipsin)和颗粒蛋白前体(progranulin)更高。
多种细胞分泌600+ 脂肪因子
脂肪因子可由成熟脂肪细胞以及基质血管细胞(包括脂肪细胞前体细胞、内皮细胞、巨噬细胞、泡沫细胞、中性粒细胞、淋巴细胞、成纤维细胞等)分泌。已鉴定出超过 600 种潜在的分泌蛋白从脂肪组织中分泌。
脂肪细胞表达的脂肪因子的选择、它们的关键生物学作用以及表达水平随肥胖的变化如表所示。为了更深入地回顾脂肪因子(包括非脂肪细胞表达的脂肪因子)及其在健康和病理学中的作用。
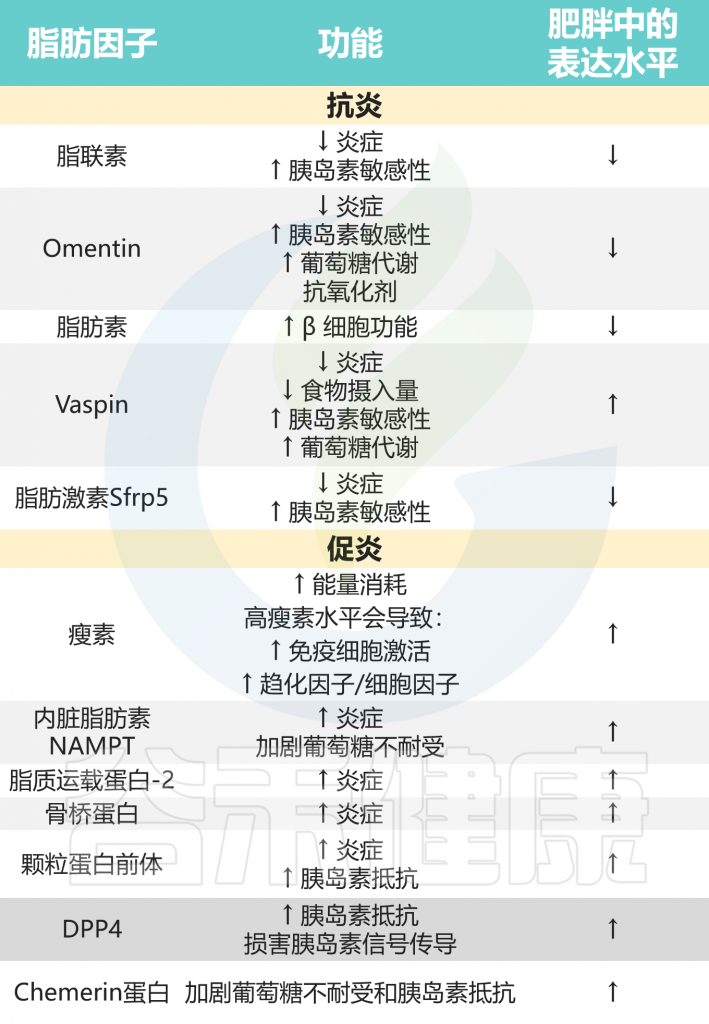
Hagberg CE, et al., Nat Rev Mol Cell Biol. 2023
皮下脂肪扩张限制,可能导致异位脂肪沉积,与肥胖病变相关
有人提出,当皮下脂肪组织(SAT)扩张受损时,特别是当增生受到限制时,会导致肝脏和骨骼肌中异位脂肪沉积,从而导致肥胖相关疾病的发病机制。
持续的代谢改变可能会导致脂肪组织从健康变为功能失调,从而产生系统性后果。
人体皮下脂肪的增加,对新陈代谢具有中性或有益的影响
人们越来越认识到皮下脂肪可能对新陈代谢具有保护作用。与此相一致的是,人体试验表明,皮下 WAT 的大容量吸脂术提供的代谢优势极小甚至没有。
来自小鼠模型的证据进一步表明,将皮下 WAT 移植到受体小鼠的内脏腔中会导致体重、总脂肪量、葡萄糖和胰岛素水平下降,并提高胰岛素敏感性,而移植的内脏脂肪则没有效果。这些数据表明皮下脂肪本质上不同于内脏脂肪。
不同类型的脂肪组织和脂肪细胞
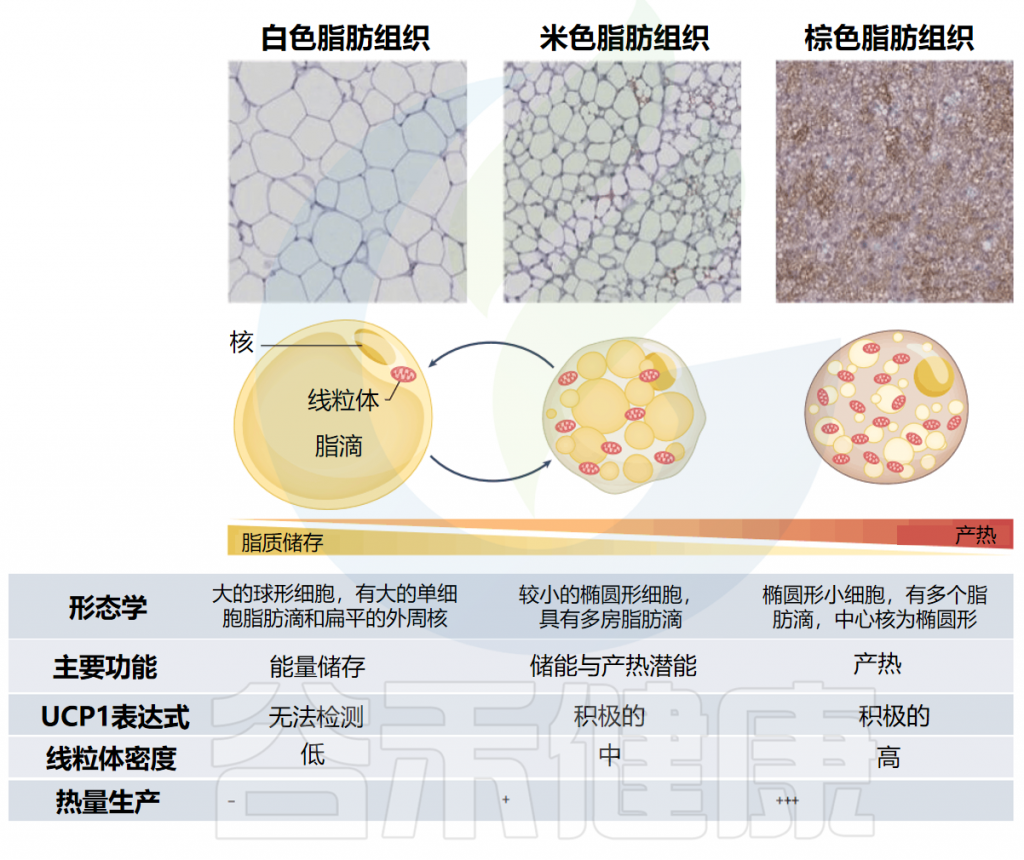
Cani PD, et al., Nat Rev Gastroenterol Hepatol. 2023
白色脂肪组织包含单房白色脂肪细胞,其特征在于单个大脂滴和少量线粒体。
棕色脂肪组织由具有小多房脂滴和高线粒体密度的棕色脂肪细胞组成。
白色脂肪细胞在特定刺激下(例如寒冷暴露)可以呈现棕色样特征,这一过程称为白色脂肪组织米色化。
皮下脂肪组织是体内最丰富的脂肪组织类型,是身体里存放多余能量的地方,以甘油三酯的形式。
白色脂肪组织WAT 由脂肪细胞组成,脂肪细胞是一种特殊细胞,可以根据身体的能量需求储存和释放脂质。除脂肪细胞外,WAT 还含有基质细胞、免疫细胞和细胞外基质成分。
这种白色脂肪组织主要位于两个地方
皮下的脂肪组织比较活跃,而包围内脏的脂肪组织跟身体的一些代谢问题,比如胰岛素抵抗有更直接的联系。
人类和啮齿动物不同类型的脂肪组织
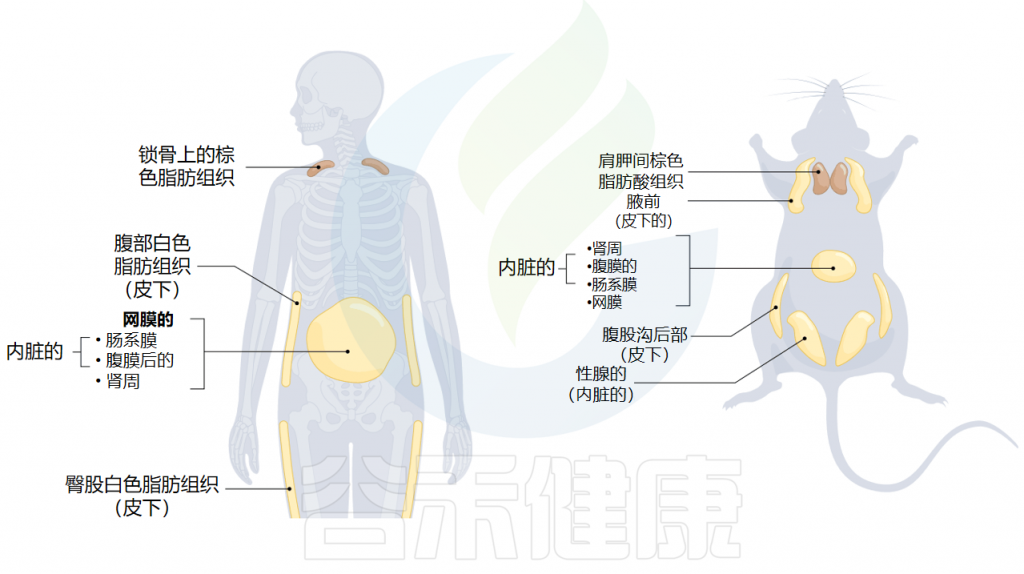
Cani PD, et al., Nat Rev Gastroenterol Hepatol. 2023
与人类一样,小鼠的脂肪组织由多个储存库组成。皮下白色脂肪组织 (WAT) 遍布全身皮肤下,而内脏 WAT 则包裹着腹部的器官。
然而,人类有两个主要的皮下脂肪库位于腹部和臀股区域,而小鼠的两个主要皮下脂肪垫位于前面和后面。在成年人中,大多数产热米色脂肪组织 (BAT) 库位于颈部的锁骨上区域。相比之下,肩胛间库是小鼠中最主要的 BAT。
值得注意的是,与成年人相比,BAT 在成年小鼠中更为明显和可见。性腺 WAT 库位于卵巢和睾丸附近,在研究中经常用作内脏 WAT 的代表。
在这些脂肪组织类别(VAT 和皮下 WAT)中,有多种储存亚型。内脏脂肪组织VAT包括位于胃肠道的心外膜脂肪组织、肾周脂肪组织、腹膜后脂肪组织和肠系膜脂肪组织。
这些库具有不同的解剖位置、细胞特征、代谢功能和健康影响
例如,肾脏周围的脂肪组织主要充当缓冲垫和隔热体。它还通过分泌脂肪因子和促炎细胞因子影响肾功能和血压调节。
另一方面,肠系膜脂肪组织在肠道免疫、屏障功能和营养吸收方面发挥作用。它还通过与肠道神经系统和肠道微生物群相互作用来调节肠道蠕动、分泌和激素释放。
人体中的 WAT 库及其与代谢病理学的关系
皮下脂肪组织(SAT)是储存多余脂肪的首选部位,这一过程有助于保护个体免受代谢疾病的影响,在肥胖症中也是如此。
SAT扩张保护代谢,超量则引发异位脂质沉积与疾病
代谢健康的一个主要决定因素是 SAT 安全扩展以响应能量需求和储存多余脂肪的能力。SAT 减少,如发生在脂肪营养不良综合征(全身或部分缺乏脂肪组织)中,由于缓冲过量脂质的能力下降,导致心脏代谢风险增加。
相反,当肥胖期间超过 SAT 储存容量时,游离脂肪酸 (FFA) 就会在 VAT 和异位位点积聚。
异位脂质沉积——代谢疾病的独立危险因素
异位部位包括组织驻留脂肪细胞(例如,心外膜和胰腺脂肪组织)、循环和非脂肪细胞(例如,骨骼肌和肝细胞中的脂质积累)。这些部位的脂质积累会引发脂毒性,导致葡萄糖代谢异常、全身胰岛素抵抗和炎症。因此,异位脂质沉积(VAT 扩张是其标志)是肥胖相关心血管和代谢疾病的独立危险因素。
WAT 库在储存和释放脂肪酸以及产生脂肪因子的能力方面彼此不同。此外,它们的细胞特征也因区域分布而异,包括细胞组成、神经支配、代谢、血管化、细胞外基质(ECM)组成和分泌因子的库差异。
身体脂肪的位置和数量,在确定疾病风险中发挥着重要作用
上半身的脂肪堆积(即 VAT,但在某种程度上,腹部 SAT)会增加患糖尿病、高血压、动脉粥样硬化、血脂异常和癌症的风险,而外周或下半身脂肪(臀部皮下和股骨)可能会代谢保护。
这些差异是如何产生的?
储存库之间的差异可能是由于微环境造成的,例如独特的神经支配和血管方面(例如,内脏脂肪的静脉引流排空到门静脉循环中,并使肝脏沐浴在脂肪代谢和脂肪因子的副产物中),和/或由于细胞内在差异。
储存差异也可能是由于前脂肪细胞表型的不同造成的,因为WAT可以通过前脂肪细胞分化成新的脂肪细胞(增生)或通过预先存在的脂肪细胞增大(肥大)来扩张。与此相一致的是,前脂肪细胞的基因特征和分化潜力已被证明在不同的脂肪库之间存在差异,即使在相同条件下分离和长期培养后,这种情况仍然保持不变,表明脂肪细胞特征的强表观遗传调节。
不同仓库之间 WAT 的相对分布由多种因素决定,包括性别、遗传、年龄、疾病状态、食物摄入量以及对药物和激素的反应。
性别:女性更容易肥胖?
女性的肥胖率通常高于男性,并且在外围(雌性脂肪分布)储存脂肪的效率比在中央(机器人脂肪分布)储存脂肪的效率更高。男性往往有更多的肝内脂肪积累,这与男性比女性更高的胰岛素抵抗有关。
然而,这种情况在女性绝经后发生了变化,脂肪储存变得更加集中,代谢风险变得与男性相似。性激素对脂肪生成的影响不同,睾酮会损害脂肪生成,雌激素会刺激前脂肪细胞,孕激素会刺激分化,这也许与许多女性孕育生产后更容易肥胖有关系。
遗传和环境因素也会影响脂肪分布
不同种族之间的内脏脂肪分布存在差异,南亚人比欧洲人后裔有更多的中心性肥胖,白人比非裔美国人和西班牙人有更多的内脏脂肪,我国北方人群比南方有更多的皮下脂肪。
年龄与腹部脂肪的优先增加以及下半身 SAT 的减少有关
随着年龄的增长,心脏、肝脏和骨骼肌等异位部位的脂肪沉积会增加,从而增加胰岛素抵抗和心血管疾病的风险。
总而言之,尽管仍然很难控制储存间脂肪的相对分布,但很明显,VAT 中甘油三脂储存量的增加是异位脂质沉积的替代标志,因此与代谢疾病密切相关,而 SAT 积累是中性的或者甚至可以对全身健康和新陈代谢产生一些有益的影响。
功能失调的 WAT 的特征
WAT 是一个高度动态的组织。在肥胖期间,WAT 的几个形态特征发生显着改变,包括脂肪细胞大小、组织炎症、血管化和细胞外基质组成。这些形态学变化与病理学密切相关,是 WAT 功能障碍的重要组织水平标志物。
★ 脂肪细胞大小和数量
在体重增加期间,脂肪组织需要储存更多的能量,这通常表现为甘油三酯的形式。脂肪细胞可以通过两种方式来适应这种增加的能量储存需求:
这两种机制都是人体调节能量储备和脂肪组织大小的方式。
脂肪细胞——先肥大,后增生?
在某些情况下,脂肪细胞可能首先通过肥大来适应增加的脂肪存储需求,但当它们达到一定的容量限制时,脂肪组织会通过增生来进一步扩张。这个过程是复杂的,并且受到多种因素的调节,包括遗传、饮食、生活方式和激素等。
早期长胖时,脂肪细胞大小随 BMI 线性增加
研究表明,人类早期体重增加主要是通过脂肪细胞大小的增长来实现的,而病态(极度)肥胖则进一步与增生性组织扩张相关。
一项对超过 89 项比较人类脂肪细胞大小的研究进行的荟萃分析表明,脂肪细胞大小随 BMI 线性增加。
脂肪细胞大小的增加——代谢功能障碍最一致的标志之一
脂肪细胞肥大与代谢和心血管疾病密切相关,肥大而不是肥胖本身是 2 型糖尿病的强有力预测因子。这种对病理学的贡献在内脏脂肪中尤其明显。
在严重肥胖的女性中,内脏脂肪组织(VAT)肥大与胰岛素抵抗和高血压相关,而皮下脂肪组织 (SAT)细胞大小仅与高血压相关。
脂肪细胞大小与代谢疾病之间的关系
其他研究证实了内脏脂肪细胞大小与代谢功能障碍之间的关系,包括胰岛素抵抗、糖化血红蛋白和血脂异常。
增加小脂肪细胞数量(通过促进脂肪生成和增生)的治疗可显著改善 2 型糖尿病患者的代谢功能。
大脂肪细胞会分泌更多炎症因子,包括IL-6、IL-8、MCP1、瘦素,这与多种炎症相关疾病的发生有关,比如糖尿病和心血管疾病。
此外,大脂肪细胞在胰岛素刺激下的葡萄糖摄取能力也受到损害。这种损害包括GLUT4到细胞膜的运输缺陷。
注:GLUT4是胰岛素依赖型葡萄糖转运蛋白,负责将血液中的葡萄糖转运进细胞,供细胞使用。在大脂肪细胞中,GLUT4功能受损会导致葡萄糖摄取减少,这是糖尿病发病机制的一部分。
★ 慢性低度炎症
肥胖的特点是脂肪组织中存在慢性低度炎症。脂肪细胞本身可以分泌促炎分子,这种分子在患有肥大性 WAT 的肥胖个体中会增加,导致免疫细胞的募集和激活,从而进一步放大炎症。这种慢性炎症会导致胰岛素抵抗、心血管疾病和其他合并症。
例如,在啮齿类动物中,肿瘤坏死因子 (TNF) 的分泌可以直接降低脂肪细胞的胰岛素敏感性。
为什么在肥胖小鼠中“王冠状结构”较为常见,而在人类中不太常见?
“王冠状结构”(crown-like structures),是由巨噬细胞和其他免疫细胞形成的环状聚集体,它们环绕在濒临死亡的脂肪细胞周围,试图吞噬这些细胞的脂质,以防止这些脂质渗漏到血液循环中去。
肥胖相关胰岛素抵抗与脂肪组织炎症无关?有关?
新出现的数据还表明,肥胖患者的胰岛素抵抗与脂肪组织炎症无关。这可能强调了通过针对 WAT 炎症来治疗代谢疾病的临床策略的失败,这在一定程度上削弱了脂肪组织炎症作为引发人类肥胖诱发代谢疾病的致病因素的观点。
然而,最近的研究表明,针对某些炎症介质如MCP1的信号传导途径在治疗糖尿病患者中显示出了一些积极的效果。这说明完全排除炎症作为改善白色脂肪组织功能障碍的治疗目标可能还为时过早。
同时也应该认识到,WAT炎症在一定程度上具有生理上的组织调节作用。虽然这一点在小鼠身上的证据更为充分,但在人类中也有例证,比如健康的网膜和肠系膜脂肪组织内的驻留巨噬细胞,很可能有助于肠道的免疫防御。
总结来说,尽管在肥胖和代谢疾病中脂肪组织炎症的角色可能没有之前想象的那么直接或者重要,但炎症和免疫反应在这一过程中仍然扮演着一定的角色,并且可能是未来治疗策略的一个潜在目标。同时,脂肪组织中的炎症反应也具有生理上的正面作用,这一点在治疗策略的设计中需要考虑。
★ 血管生成和血管化
在瘦状态下,人体脂肪组织血管化良好,每个脂肪细胞都与至少一个毛细血管微血管相邻。脂肪组织的扩张需要同时从现有血管形成新血管(血管生成),以便为扩张的组织提供营养和氧气。
早期体重增加是通过增加血管生成生长因子的分泌和血管萌芽来进行的。然而,随着固有脂肪细胞增大,微血管之间的距离增大,组织的血管密度逐渐减小。
此外,增大的脂肪细胞会减少促血管生成因子,例如血管内皮生长因子A(VEGFA)的分泌,进一步减少氧扩散并导致肥胖期间组织的相对氧压降低。这导致肥胖 WAT (白色脂肪组织)血管生成潜力降低、毛细血管密度降低(毛细血管稀疏)甚至血管退化。
此外,WAT 氧合减少会激活缺氧诱导因子 1A (HIF1A) 和下游缺氧反应通路(例如 NF-κB 通路),并促进促炎因子和纤维化胶原蛋白的分泌。因此,脂肪组织炎症可以被视为组织低氧环境的症状表现,这可能解释了为什么仅针对促炎细胞因子信号传导不足以改善整个组织功能和代谢健康。除了增加炎症外,组织缺氧的增加还会激活肥胖者脂肪组织的促纤维化硬化。
★ 脂肪细胞外基质(ECM)改变
所有脂肪细胞都被一个丰富的三维细胞外基质(ECM)网络所包围,这个网络为脂肪细胞提供了机械支持,帮助保持脂肪组织的结构,并且在细胞信号传递中起着重要作用。
细胞外基质的作用与结构
在人类的脂肪组织中,细胞外基质网络主要由多种类型的胶原蛋白构成,尤其是COLI-VII,此外还有层粘连蛋白、纤连蛋白、透明质酸、弹性蛋白和糖胺聚糖等成分,这些都是由脂肪细胞和组织基质细胞所产生的。
在健康的脂肪组织中,细胞外基质会经历一个连续的重塑过程,这个过程中合成和降解细胞外基质的成分,以便适应脂肪量的变化、细胞信号的传递以及组织血管化的需要。
肥胖对脂肪组织重塑的影响
然而,在肥胖症状态下,细胞外基质的这种重塑能力受到损害,导致某些细胞周围的细胞外基质胶原蛋白过度积累,最终可能导致脂肪组织的纤维化。其中包括胶原蛋白6(COL6),在小鼠研究中可以限制脂肪细胞扩张,这种限制作用可能直接导致在体重增加期间脂肪组织的功能障碍。
具有高水平脂肪 ECM 的肥胖受试者同样被证明在减肥手术后体重减轻减少。除了 ECM 重塑减少之外,肥胖还与 WAT 中 ECM 成分之间较高水平的交联有关,这会增加组织硬度。较高的 WAT 硬度与胰岛素抵抗、葡萄糖代谢受损和炎症增加有关,可能是因为它阻止了必要的组织重塑。
肥胖相关的细胞外基质异常及其后果
值得注意的是,ECM 交联程度和组织硬度可能比 ECM 积累水平更能决定 WAT 功能障碍。好几项研究发现发现代谢不健康的肥胖受试者与瘦受试者相比,脂肪组织 ECM 沉积的总体水平降低,并且某些 ECM 成分(如 COL1 和纤连蛋白)的表达降低,而组织僵硬和相关转录本肥胖人群中增加。
这在一定程度上可以通过分泌基质金属肽酶 (MMP) 和其他促进肥胖症 ECM 降解的酶的免疫细胞来解释,促进免疫细胞侵入 WAT,同时通过降解限制性 ECM 促进脂肪细胞扩张。这一假设仍有待彻底检验,但可以解释为什么 WAT 形态学的许多病理变化(肥大、炎症、ECM 重塑)经常同时发生。这些病理性 ECM 变化的主要上游引发因素和驱动因素被认为是脂肪组织氧合作用的减少。缺氧还直接加剧炎症,进一步加速 ECM 变化和 WAT 纤维化的发展。
总之,脂肪组织中细胞外基质变化会导致脂肪细胞功能失调、胰岛素敏感性受损、慢性炎症和其他与肥胖相关合并症相关的代谢异常。
棕色脂肪组织(Brown Adipose Tissue, BAT)含量低于白色脂肪组织,主要位于身体的锁骨上和肩胛间区域,并且其分布在个体之间差异很大。它由多房脂肪细胞组成,其中含有大量具有中央核和线粒体的细胞质脂滴,赋予它们特有的棕色。
注:多房脂肪细胞(multilocular adipocytes)是指那些含有多个脂质滴的脂肪细胞,通常与棕色脂肪组织中的细胞相关。这些细胞与单房脂肪细胞(unilocular adipocytes)不同,后者是指含有单一大脂质滴的白色脂肪组织(WAT)中的细胞。
这种特殊类型的脂肪组织负责通过称为非颤抖产热的过程燃烧储存的脂质来产生热量。这一过程是通过解偶联蛋白 1 (UCP1) 的高表达来实现的,UCP1是一种线粒体内膜蛋白,负责呼吸和产热活动的解偶联。BAT 的代谢活性比 WAT 更高,并且已被证明在调节能量稳态和葡萄糖代谢方面具有作用。
此外,还在小鼠的 WAT 库和肌束之间发现了可诱导的非表达 MYF5 的棕色脂肪细胞祖细胞。
2023 年,两篇补充论文证明,来自不同人类脂肪库(包括 BAT 和 WAT)的脂肪祖细胞具有相似的转录组,表明有一个共同的祖细胞。这些祖细胞分化为两种主要细胞命运之一:脂肪形成细胞或多能细胞,称为结构性WNT调节脂肪组织驻留(SWAT)细胞,提供了终生维持的祖细胞池。研究人员认为,这两种细胞命运(分化的脂肪细胞和未分化的多能祖细胞)之间的微妙平衡可能是脂肪组织组成和功能的决定因素。
米色脂肪组织(有时称为浅色脂肪组织)是一种介于 WAT 和 BAT 之间的脂肪组织。米色脂肪组织存在于一些 WAT 库中,具有 BAT 的形态和功能特征,例如燃烧储存的脂质和产生热量的能力。
脂肪组织内可以诱导生热作用来调节能量稳态并对抗肥胖的发展,这引起了人们对鉴定所谓的褐变剂(即可以增加 UCP1 数量或活性的条件或试剂)的高度兴趣。
尽管动物(小鼠和大鼠)研究取得了有希望的结果,表明米色脂肪细胞可以响应各种刺激(包括寒冷暴露、运动和某些药物制剂)而被诱导,但其病理生理学相关性仍不清楚,因为与米色褐变相关的生热能力与经典 BAT 相比,它可能仅具有次要的生理重要性。
虽然上面列出的 WAT 功能障碍的标志已得到充分证实,并且易于在人类 WAT 活检中测量,但与肥胖相关的功能变化仍然不太清楚。
从功能上讲,肥大脂肪细胞的早期变化之一是对生理胰岛素信号产生抵抗,同时对许多其他外源信号的反应性降低,如肾上腺素能刺激和有益代谢调节因子成纤维细胞生长因子21(FGF21)的信号传导。这对脂肪细胞功能具有广泛的影响,最值得注意的是脂肪细胞通过脂解释放脂肪酸的失调。
肥胖→胰岛素不能正常限制脂肪分解→脂质渗漏
在健康的餐后状态下,胰岛素有效地限制基础脂肪分解和激素诱导的脂肪分解。两餐之间,儿茶酚胺会诱导脂肪分解,以便为肌肉和其他器官提供营养。
肥胖期间脂肪细胞胰岛素抵抗的发生降低了胰岛素限制食物摄入后脂肪细胞脂解的能力。这种脂肪分解失调导致脂肪酸从肥胖脂肪组织持续低级渗漏到循环系统中,并在肝脏中早期积累。
随着脂质渗漏的继续,从脂肪组织释放的脂肪酸也开始在其他器官中积累,例如骨骼肌、胰腺β细胞和肾足细胞,以及作为氧化脂蛋白的一部分在较大血管的壁中积累。
肥胖矛盾:脂肪释放减少与体重增加
矛盾的是,肥胖症中脂肪细胞的信号敏感性降低也使它们对相反的信号不敏感,即禁食期间通过肾上腺素刺激诱导脂肪分解。这种信号敏感性的降低至少部分是由于肥胖相关的脂肪细胞表面肾上腺素能受体的下调所致,导致激素诱导的脂肪分解水平降低,尽管基础脂肪分解增加。
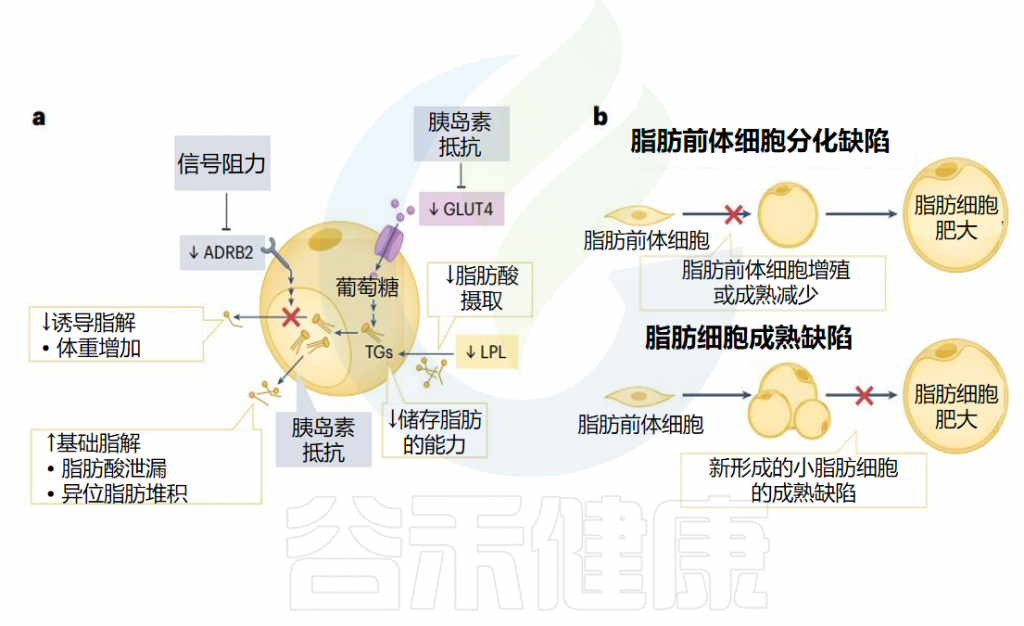
Hagberg CE, et al., Nat Rev Mol Cell Biol. 2023
这两种相反的变化的相对重要性,一种是由于胰岛素信号传导减少,另一种是由于肾上腺素信号传导减少,在人类中很难确定,但最近的研究提供了一些见解:纵向研究显示,肾上腺素刺激的脂肪分解水平降低,与储存脂质更长时间的倾向增加有关,可能导致体重增加和糖耐量受损的发展。
重要的是,在体重增加的女性中,激素驱动的脂肪分解水平的降低与基础代谢健康状况不佳的关系比基础(胰岛素控制的)脂肪分解水平的增加更为密切。几项测量脂肪酸通量的研究还指出,每公斤脂肪释放的脂肪酸速率随着体重的增加而下降,再次表明肥胖症中脂肪细胞的总脂肪分解能力受到损害。
这可以解释为什么尽管脂肪量大幅增加,但肥胖受试者的血浆 FFA 水平与瘦人相比仅略有增加。此外,一项荟萃分析发现脂肪酸水平与胰岛素抵抗测量之间没有相关性,这对胰岛素抵抗导致肥胖症中脂肪组织脂解的教条提出了质疑。这些研究表明,肾上腺素刺激的脂肪分解减少是肥胖人类脂肪组织的一个主要表型特征,这可能解释了肥胖期间脂肪组织持续扩张的矛盾(表明脂肪酸释放减少),尽管基础脂肪酸释放水平较高。
肥胖者的脂肪组织在储存脂肪方面存在问题
除了肥胖者脂肪组织中脂肪酸释放的变化之外,WAT 的储存能力也受到循环中脂质摄取率降低的负面影响。使用稳定同位素或测量内脏(腹部)脂肪组织清除率的研究表明,肥胖者 SAT 摄取的脂肪酸较低。
脂蛋白脂肪酶的水平下降,可能导致肥胖和代谢综合征
需要更全面地了解肥胖症中介导脂质储存缺陷的机制,但一种已确定的分子机制涉及脂解酶脂蛋白脂肪酶(LPL)。LPL 是主要的脂肪分解酶,参与从循环中富含 TG 的脂蛋白(例如乳糜微粒和极低密度脂蛋白VLDL)中利用脂肪酸。
患有肥胖和代谢综合征的女性,她们体内的脂蛋白脂肪酶(LPL)水平通常会降低。LPL是一种重要的酶,它在脂质代谢中起着关键作用,可以帮助分解血液中的三酸甘油脂,从而使脂肪酸能够被肌肉和脂肪组织吸收并用作能量。较高的LPL水平通常被认为具有保护作用,因为它有助于维持脂质代谢的正常运作,减少脂肪积累,从而降低患上代谢疾病的风险。
不同人群和个体在脂肪组织的脂质代谢速度上存在显著差异
通过测量稳定同位素氘(一种氢的重同位素)的掺入情况来研究脂肪组织中的脂质周转,在人体内发现了脂质代谢的种族差异和储存模式。具体来说,他们发现与胰岛素敏感的人相比,胰岛素抵抗者体内的甘油三酯(TG)合成速度明显降低。
研究发现,相比瘦人,肥胖者的皮下脂肪组织(SAT)中的TG去除率降低,这反映了脂肪分解和随后的脂肪酸氧化过程的减缓;同时,他们的脂质储存率增加,即脂肪组织每年吸收的脂质量更多。
脂肪细胞中脂质周转的速率与代谢疾病的风险密切相关
在体外实验中,分离出的脂肪细胞在受到刺激时脂肪分解的情况与体内通过放射性碳测年技术测量的TG去除率呈现正相关。这进一步证实了脂肪分解通过调节TG去除率来决定脂肪细胞中脂质周转的速度。因此,高脂质储存和低TG去除率会促进脂肪组织的积累,进而导致肥胖。相反,如果一个人的TG去除和储存率都低(如在家族性混合型高脂血症患者中观察到的情况),这会导致脂肪细胞储存和释放脂肪酸的能力降低。
降低的TG周转率可能导致肝脏中脂肪酸异常积累,引起血脂症
脂肪组织中 TG 周转率的降低可能会促进脂肪酸在肝脏中的异位沉积,从而导致血脂异常。因此,脂肪细胞脂质周转已成为预防和治疗代谢疾病的新目标。
这些结果共同描绘了肥胖脂肪细胞失去有效摄取饮食来源脂肪酸的能力,以及在两餐之间从脂肪组织中保留和释放脂肪酸的能力,导致在进食期间将脂肪酸作为甘油三酯储存的能力总体上存在严重缺陷。
应该指出的是,除了脂质储存缺陷之外,肥胖脂肪细胞还表现出细胞内能量代谢和底物利用的普遍功能障碍。例如,研究表明,代谢不健康个体的脂肪细胞表现出柠檬酸循环代谢物的消耗,以及组织氨基酸水平和氨基酸分解代谢酶表达的显着改变。
脂质信号传导是指一个复杂的生化过程,其中脂质(例如脂肪酸)在细胞通讯和各种生理和病理过程的调节中发挥着关键作用。特别重要的是肥胖对脂质信号通路的影响,这可能为脂肪肝和高脂血症等有害疾病的出现铺平道路。
胰岛素抵抗引发的脂肪分解失调及对健康的影响
如上所述,脂质信号传导的关键参与者之一是胰岛素。胰岛素抵抗会损害脂肪细胞响应胰岛素而有效调节脂肪分解的能力。因此,脂肪细胞释放的 FFA 水平升高,涌入血流,导致脂毒性现象。
过剩脂肪如何导致肝脏疾病和血脂异常
过量的脂肪酸会进入肝脏,在那里重新组装成甘油三酯。这种流入压倒了肝脏处理脂肪的能力,导致脂质在肝细胞内积聚,称为脂肪肝或肝脂肪变性。此外,肥胖扰乱了不同脂肪因子(例如脂联素和瘦素)之间的平衡。
肥胖导致的脂联素和瘦素水平变化
脂联素通常具有抗炎和胰岛素增敏作用,但在肥胖时会减少。相反,调节食欲和能量消耗的瘦素也可能失调,导致脂质稳态被破坏。脂质信号通路错综复杂的网络还涉及转录因子,例如过氧化物酶体增殖物激活受体 (PPAR) 和甾醇调节元件结合蛋白 (SREBP) 。
代谢指挥官出错:肥胖影响关键转录因子
在肥胖症中,这些转录因子表达错误,导致参与脂肪酸合成和储存的基因上调,同时抑制负责脂肪酸氧化的基因。这些破坏的最终结果导致高脂血症——一种以血液中脂质水平升高为特征的疾病。
脂肪过多,健康受损:高脂血症与肥胖代谢问题
由脂蛋白运输的甘油三酯和胆固醇变得丰富,增加了动脉粥样硬化和心血管疾病的风险。此外,肥胖和相关的脂肪细胞肥大也会引发促炎细胞因子和趋化因子的释放,为慢性低度炎症状态奠定基础,进一步加剧脂质失调。
因此,肥胖对脂质信号通路的多因素影响对代谢稳态产生深远的影响,由此产生的脂质失调为脂肪肝和高脂血症的发展奠定了基础。
众所周知,体重增加显著减少有益脂肪因子脂联素的分泌,同时增加瘦素的分泌。此外,SAT 脂肪细胞的大小与大量其他促炎细胞因子的分泌增加呈线性相关,包括 IL-6、IL-8、MCP1 和 TNF5 。这些细胞因子不仅可以促进脂肪组织内免疫细胞(包括巨噬细胞、T细胞和中性粒细胞)的浸润和激活,而且还可以损害成脂分化,诱导脂肪细胞胰岛素抵抗和细胞因子渗漏到循环中,促进全身代谢。
诱发炎症和发生合并症的风险
不同的脂肪组织库会带来更大或更小的疾病风险。例如,肌内脂肪比 SAT(和 VAT)具有更大的心脏代谢疾病风险,这在某种程度上归因于脂肪细胞代谢和分泌特性的差异。
肥胖症中脂肪因子分泌改变背后的新兴机制之一是细胞过早衰老或衰老,这也已知会影响细胞代谢。除了在人类脂肪组织中已充分确定的前脂肪细胞和内皮细胞衰老。之外,据报道,免疫细胞(T 细胞、巨噬细胞)衰老也在小鼠和人类肥胖症中累积 VAT。
为了更深入地了解这些细胞类型,读者可以阅读下最近报道,高胰岛素血症促进成熟人类脂肪细胞衰老,增加其细胞因子释放,这是衰老相关分泌表型 (SASP) 的一部分。
减少脂肪细胞衰老——减少WAT炎症
衰老细胞通过启用衰老抗凋亡途径来避免凋亡。人们发现一类被称为 senolytics 的化合物可以诱导衰老细胞凋亡,并对小鼠和人类的健康产生有益的影响。
两种抗衰老药物达沙替尼和槲皮素的短暂全身给药,可以减轻糖尿病肾病患者人体脂肪组织中的衰老细胞负担,已知这种疾病的脂肪组织衰老细胞负担会增加。其他人在小鼠和人类研究中也报告了类似的结果。因此,减少脂肪细胞衰老可能是减少肥厚性肥胖期间 WAT 炎症的有效方法。
能量代谢是一个复杂的过程,涉及将食物转化为身体可用的能量形式。能量代谢的准确调节对于维持能量平衡和预防肥胖及相关代谢紊乱的发展至关重要。虽然年龄、性别和遗传等内在生物因素肯定在能量代谢中发挥作用,但饮食、运动和睡眠等环境因素也有很大影响(下图)。
值得注意的是,肠道微生物群还可以在调节脂肪组织代谢和产热方面发挥作用,并且人类和小鼠肠道微生物群的组成和功能可能有所不同。这些差异凸显了研究人类和小鼠模型以充分了解脂肪组织在代谢健康和疾病中的作用的重要性。
Cani PD, et al., Nat Rev Gastroenterol Hepatol. 2023
肠道菌群是一个动态的生态系统,其组成和功能受到饮食、吸烟、吸毒、睡眠、运动和情绪压力等多种环境和外部因素的影响。然而,这些因素的变化引起的调节程度在个体之间可能存在很大差异。
这种变异性受到肠道微生物群的初始组成以及年龄、生物性别和遗传易感性等内在因素的影响。这种微妙的平衡是我们的生活方式选择和固有特征之间复杂相互作用的结果,任何干扰都会深刻影响我们的整体健康。
饮食是影响能量代谢的最重要的环境因素之一。除了消耗的卡路里数量外,研究表明饮食质量还可以显着影响能量摄入、能量消耗和能量代谢。
富含纤维和蛋白质的食物往往更容易产生饱腹感,并且可以减少总体卡路里摄入量。相比之下,高度加工和能量密集的食物往往可能导致过量。此外,卡路里的来源会影响食欲和食物选择,高脂肪饮食可能会增加饥饿感,并促进高热量食物的消费。
饮食质量也会影响能量消耗
体力活动和锻炼是能量消耗的重要因素,但食物的热效应 (TEF) 也占总能量消耗的约 10%。
TEF是消化、吸收和代谢食物所需的能量;它因人而异,并取决于体力活动水平和饮食的常量营养素成分。蛋白质的 TEF 高于碳水化合物或脂肪,这意味着与低蛋白饮食相比,高蛋白饮食可能会增加能量消耗。
饮食结构也会影响能量代谢
高糖和精制碳水化合物的饮食与胰岛素抵抗和葡萄糖代谢受损有关,影响身体有效利用能量的能力。相反,富含纤维、全谷物、水果和蔬菜的饮食可以提高胰岛素敏感性并促进更有效的能量利用。
运动可以通过促进瘦肌肉质量的发展、提高胰岛素敏感性和减少炎症来增加能量消耗并改善代谢健康。此外,运动可以增加参与能量代谢的基因的表达。
AMPK途径
一种重要的途径是 AMP 激活蛋白激酶 (AMPK) 途径,该途径在运动过程中被激活,并增加肌肉细胞中的葡萄糖摄取和脂肪酸氧化。AMPK 还调节线粒体生物发生和氧化代谢,改善能量代谢和代谢健康。
PGC1α 途径
另一个重要途径是过氧化物酶体增殖物激活受体-γ 共激活剂 1α (PGC1α) 途径,该途径参与线粒体生物发生和氧化代谢。运动可以增加 PGC1α 表达,从而增加线粒体生物合成并改善能量代谢。
运动可以直接影响棕色脂肪组织中特定生物活性脂质的产生
有人认为,运动过程中该组织释放的物质是与定期身体活动相关的一些健康益处的可能机制。通过脂质组学分析,研究人员发现,一段中等强度的运动可显著提高以下人群中循环亚油酸代谢物 12,13-二羟基-9Z-十八碳烯酸 (12,13-diHOME) 的水平(P < 0.05),包括男性、女性、年轻人(24-42 岁)和老年人(65-90 岁),以及那些经常运动或久坐生活方式的人。
12,13-DiHOME 是一种棕色脂肪组织衍生代谢物,也会因寒冷而释放。然而,在运动背景下,对小鼠进行的研究表明,单次运动和定期运动训练均可直接增加来自棕色脂肪组织的循环 12,13-diHOME 水平。如果通过手术切除棕色脂肪组织,则 12,13-diHOME 的增加就会消失。此外,给小鼠施用 12,13-diHOME 会导致骨骼肌中脂肪酸的摄取和氧化增强,但不会影响葡萄糖的摄取。
这些发现表明,这种12,13-diHOME代表了一类由运动引起的新型循环因子,可能有助于身体活动期间发生的代谢变化。
睡眠是一个经常被忽视的环境因素,它会影响能量代谢。对于人类来说,睡眠不足或睡眠质量差与肥胖和代谢紊乱的风险增加有关。睡眠不足会扰乱食欲激素的调节,导致饥饿感和食物摄入量增加。
睡眠不足的人的血液样本显示出与肥胖者相似的代谢特征
此外,睡眠不足会损害葡萄糖代谢和胰岛素敏感性,从而导致 2 型糖尿病的发生。有趣的是,睡眠时间长也与人类患 2 型糖尿病的风险升高有关。
长期睡眠不足——下丘脑-垂体-肾上腺轴失调
受睡眠剥夺影响的一个重要联系是下丘脑-垂体-肾上腺轴,负责释放应激激素皮质醇,调节葡萄糖代谢和食欲。长期睡眠不足会导致下丘脑-垂体-肾上腺轴失调,导致人体皮质醇释放增加和葡萄糖代谢受损。
睡眠不足——扰乱生物钟
另一个重要途径是生物钟系统,它调节生理过程的时间,包括新陈代谢。睡眠不足会扰乱生物钟系统,导致能量代谢失调。在小鼠中,这种失调是由几个基因介导的,包括Clock、Bmal1、Dec、Per1和Cry1,这些基因参与昼夜节律的调节。
睡眠不足——损害胰岛素信号与代谢
睡眠不足还会通过 AKT 途径损害胰岛素信号传导和葡萄糖代谢。AKT 是葡萄糖代谢的关键调节因子,睡眠剥夺已被证明会降低 AKT 磷酸化并损害人类和小鼠脂肪细胞和肌肉细胞的葡萄糖摄取。
睡眠不足——影响人类食欲激素的调节
包括生长素释放肽和瘦素。胃饥饿素是一种刺激食欲的激素,睡眠不足已被证明会增加胃饥饿素水平,导致饥饿感和食物摄入量增加。瘦素是一种发出饱足感的激素,睡眠不足已被证明会降低瘦素水平,进一步促进人类食欲增加。
肠道微生物群是一个复杂的微生物生态系统,包括驻留在胃肠道中的细菌、病毒、真菌、原生动物和古细菌。肠道细菌由于其可培养性、相对较大的基因组大小、复杂的功能多样性和有前景的治疗潜力,是迄今为止该菌群中研究和理解最广泛的成员。
肠道微生物群可以通过调节营养物质的吸收和利用、调节食欲以及影响脂肪组织的发育和功能,对能量代谢产生重大影响。
肠道微生物群可以产生多种影响能量代谢的代谢物,包括短链脂肪酸、胆汁酸,不同的生物活性脂质包括内源性大麻素 (eCB)、氧脂素和氨基酸衍生物。
肠道微生物群与肥胖和代谢疾病的发展有关,肠道微生物群可以调节小鼠脂肪组织的发育和功能。例如,特定的肠道微生物群可以促进或消除 WAT 的褐变,从而增加小鼠的能量消耗并改善代谢健康。
前面提到的影响能量的环境因素,如饮食、睡眠和运动,都与肠道微生物群组成的变化有关。一些临床前研究表明,肠道微生物群可能是影响能量代谢的关键因素之一,通过胆汁酸、SCFA、生物活性脂质等多种代谢物的变化发挥作用。
以微生物群为靶点改变脂肪组织代谢的方法
这里列出的所有饮食成分都被描述为会增加脂肪组织的米色或褐色并影响微生物群。它们都能防止小鼠因饮食引起的肥胖。这些化合物中的大多数通过改变脂肪褐变和脂肪氧化的相同标记物在棕色脂肪组织 (BAT) 和白色脂肪组织中发挥作用,例如增加解偶联蛋白 1 (UCP1)、DIO2、CPT1α、Cidea、过氧化物酶体增殖物的水平。激活受体-γ 共激活因子 1α (PGC1α)、SIRT1 和 BMP7。其中一些会增加冷诱导的生热作用和线粒体的数量和/或活性。
白藜芦醇:又称反式-3,5,4′-三羟基二苯乙烯,是一种有机化合物,属于天然多酚。它主要存在于植物和植物衍生产品中,例如虎杖、各种水果,包括葡萄和浆果、花生和红酒。
辣椒素:一种存在于辣椒中的生物碱化合物。
槲皮素:一种重要的类黄酮,常见于人类饮食中,存在于苹果、浆果和洋葱中。
表没食子儿茶素-3-没食子酸酯:一种多酚化合物,存在于茶树 ( Camellia sinensis ) 264植物未发酵的干叶中。
小檗碱:一种天然衍生的生物碱,存在于小檗科、黄连和加拿大水螅等特定开花植物中,用于传统中药。
大黄提取物:源自大黄根的富含蒽醌的粗提取物。
卡姆果 ( Camu Camu,Myrciaria dubia ):一种具有独特植物化学特征的亚马逊水果。
特定细菌
Akkermansia muciniphila:增加褐变、脂肪酸氧化和BAT活性,与增强肠道屏障功能有关。
Dysosmobacter welbionis J115 T:是一种丁酸盐生产者,最近被鉴定并描述为通过产生多种生物活性脂质(包括12,13-diHOME)来减少 BAT 白化并增加线粒体活性。
其他详细可以看我们以前写的关于肥胖和肠道菌群文章。
扩展阅读:
禁食诱导脂肪因子 (FIAF),也称为血管生成素样蛋白 4 (ANGPTL4),是多种组织(包括肠道、肝脏和脂肪组织)响应禁食而产生的循环蛋白,它是主要的过氧化物酶体增殖物激活受体 (PPAR) 蛋白的作用位点。
FIAF 在小鼠体内可通过抑制脂蛋白脂肪酶 (LPL)(循环脂蛋白中甘油三酯核心水解的限速酶),来调节脂质代谢,从而减少脂肪酸进入脂肪组织和肌肉的摄取。
肠道微生物群与FIAF表达的相互作用
小鼠研究表明肠道微生物群调节 FIAF 的产生。FIAF 在无菌小鼠中组成型表达,而常规化(非无菌小鼠肠道微生物群的定植)会降低 FIAF 表达并增加 LPL 活性,从而导致体脂肪量增加。
此外,FIAF基因被敲除的无菌小鼠失去了对高脂肪饮食引起的肥胖的抵抗力。然而,谨慎对待这些发现至关重要。
FIAF与肥胖抵抗力的复杂关系
目前的研究结果挑战了人们普遍认为的观点,即肠道微生物群的缺乏本质上会产生对肥胖的抵抗力,不同的结果可能与所使用的膳食脂肪来源有关。一项开创性研究的复制尝试未能反映最初的发现,因此肠道微生物群的缺失对肥胖的影响仍然没有定论。
这一证据强调了肠道细菌与代谢疾病之间关系的复杂性,并表明需要进一步探索。FIAF 的产生是否与肠道微生物群介导的脂肪储存效应之间存在因果关系仍存在争议,特别是在无菌小鼠中,高脂肪饮食诱导的肥胖仅增加了肠道中 FIAF 的蛋白表达,而没有增加循环中的蛋白表达。
多项研究表明,施用某些细菌可以增加小鼠体内循环 FIAF 水平,并增加其在人肠上皮细胞中的表达,这表明肠道微生物群的调节可以影响 FIAF 的产生。
尽管 FIAF 似乎还通过抑制小鼠下丘脑 AMPK 活性在能量代谢的中枢调节中发挥着至关重要的作用,但肠道微生物群调节 FIAF 蛋白表达的确切机制仍不完全清楚。肠道微生物群是否调节下丘脑 FIAF 尚不清楚。
人类不具备分解膳食纤维所需的消化酶。因此,不可消化的碳水化合物在穿过上胃肠道并到达大肠时保持不受影响,在大肠中它们可被厌氧细菌发酵。该发酵过程导致产生各种代谢物,其中短链脂肪酸是主要的代谢物。消耗的纤维的数量和类型对肠道微生物群的多样性和组成有重大影响,进而影响短链脂肪酸的产生。
短链脂肪酸(其中乙酸盐、丁酸盐和丙酸盐是肠道中的主要形式)是从未消化的食物中获取额外能量的重要来源。据估计,短链脂肪酸可以提供人类每日热量的 10%,并且结肠细胞使用短链脂肪酸,尤其是丁酸作为其首选能量来源。
此外,肠道来源的短链脂肪酸可以通过结肠细胞转运到血液中,在血液中与内源性短链脂肪酸(由组织和器官产生和释放)混合,并对多种组织中的脂质、葡萄糖和胆固醇代谢产生各种影响通过充当底物或信号分子3(下图)。
肠道微生物群产生的分子机制和代谢产物
作用于肠道或白色和棕色脂肪组织中的特定受体
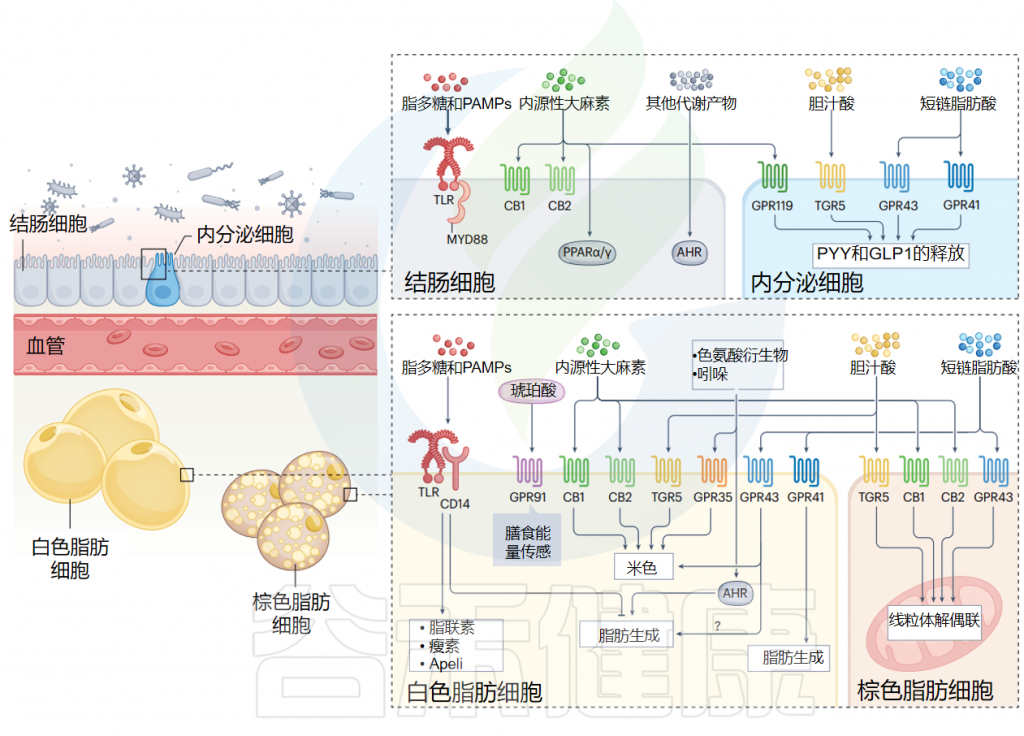
Cani PD, et al., Nat Rev Gastroenterol Hepatol. 2023
某些微生物分泌的代谢物(例如脂多糖LPS、病原体相关分子模式PAMP、内源性大麻素),通过微生物消化膳食成分(例如短链脂肪酸)或通过转化产生宿主衍生因子(例如内源性大麻素和胆汁酸)可以通过各种受体和途径来感知,从而改变肠道完整性和宿主健康。右上图指结肠细胞或肠内分泌细胞中表达的特异性受体,不同的特异性受体及其配体来自微生物代谢产物或成分。右下图描绘了白色和棕色脂肪细胞中表达的受体、来自微生物代谢物或成分的特定配体,以及这些受体激活引起的特定代谢效应。
AHR,芳烃受体;CB,大麻素受体;CD14,分化簇 14;GLP1,胰高血糖素样肽1;GPR,G蛋白偶联受体;MYD88,骨髓分化初级反应88;PPAR,过氧化物酶体增殖物激活受体;PYY,肽YY;TGR5,武田G蛋白偶联受体5;TLR,Toll 样受体。
短链脂肪酸的浓度平衡与健康
低浓度和过高浓度的短链脂肪酸对人类和小鼠的健康都有不利影响。为了防止血液中短链脂肪酸含量过高,肝脏有效地吸收循环中的大部分短链脂肪酸。在肝脏中,乙酸盐用作能量来源并用作合成长链脂肪酸和胆固醇的底物,丙酸盐用作糖异生的前体。
在人类、小鼠和大鼠中,低 SCFA 浓度与肥胖、胰岛素抵抗和糖尿病等慢性代谢紊乱的发展有关,对小鼠和大鼠的研究已经证实,膳食纤维或 SCFA 补充剂可以缓解高脂饮食引起的肥胖的发展。
短链脂肪酸:从食欲控制到能量平衡
其中一种机制是 SCFA 作为信号分子的作用。SCFA,特别是丁酸盐和丙酸盐,充当信号分子,可以调节涉及食欲调节、饱腹感和能量消耗的各种激素的分泌。例如,SCFA 可以刺激GLP1、PYY和瘦素的释放。GLP1 和 PYY 是促进饱腹感和减少食物摄入的激素,而瘦素则通过向大脑发出有关能量储存的信号来帮助调节能量平衡。
此外,SCFA可以与肠内分泌L细胞表面的G蛋白偶联受体(GPR),特别是GPR41和GPR43相互作用,刺激肠肽的分泌。SCFAs除了直接刺激肠肽分泌(参与食欲调节)外,还提出SCFAs在这些受体激活后触发细胞内信号通路,最终影响不同细胞类型的能量代谢、炎症和胰岛素敏感性(即白色和棕色脂肪细胞、肝细胞、神经元和免疫细胞)。
SCFA 与脂肪组织之间的关系很复杂且尚未完全了解。例如,一些研究表明,SCFA 浓度升高可能会导致肥胖和胰岛素抵抗,而其他研究则发现 SCFA 可以提高小鼠、大鼠和人类体内的胰岛素敏感性并有助于减轻体重。
不同的 SCFA 对脂肪组织代谢的影响有所不同
例如,丁酸盐可通过GPR43激活来诱导脂肪生成,而丙酸盐则通过GPR41激活来刺激成熟脂肪细胞中的脂肪生成。
事实上,在脂肪组织中,GPR41 和 GPR43 的激活可以促进脂肪细胞分化和脂肪生成,导致新脂肪细胞的形成(增生)和脂肪组织质量增加。
SCFA 对 BAT 的影响
一项体外研究表明,乙酸盐可促进小鼠棕色脂肪细胞中脂肪细胞蛋白 2(AP2;脂肪细胞分化标志物)、PGC1α 和 UCP1 的基因和蛋白表达上调,从而增加线粒体生物发生,但这些作用在细胞中受到损害GPR43 表达减少。
在人类白色脂肪细胞中,结果却有所不同
从培养 13 天的人网膜脂肪组织中分离出的前脂肪细胞,并暴露于不同的 GPR43 激动剂(即生理的或合成的)以研究对脂肪细胞分化的影响,没有显示出对AP2基因表达和最终分化的任何影响。
相反,曲格列酮(一种 PPARγ 激动剂)增加这些细胞中的AP2基因表达,并降低GPR43基因表达的趋势(P = 0.06) 。这一观察结果表明,与小鼠不同,GPR43 与人类脂肪细胞分化之间没有关系。
此外,同一研究人员还发现,肥胖个体的脂肪组织中GPR43基因表达并未增加,但主要与肿瘤坏死因子 (TNF) 相关的炎症过程有关。
丁酸盐对食欲的调节
如果我们关注丁酸盐,丁酸盐给小鼠和人类带来代谢益处的机制仍然不完全清楚。2018年,李等人研究了丁酸盐对食欲和能量消耗的影响,以确定这两个因素对丁酸盐的有益代谢作用的贡献程度,并发现通过胃管灌注一次急性口服丁酸(而不是静脉注射),能在饥饿过夜的小鼠重新进食后的1小时内减少食物摄入。
丁酸盐还抑制大脑不同区域的食欲神经元的活动。研究人员证实,在饮用水中长期补充丁酸盐可以预防饮食引起的肥胖、高胰岛素血症、高甘油三酯血症和肝脂肪变性,但他们主要将这种效应归因于食物摄入量的减少。
丁酸盐还适度增强脂肪酸氧化并激活 BAT
增加脂肪酸的利用率,这不仅是由于食物摄入量减少,而且主要是由于 BAT 的交感神经流出增加。研究人员最终发现,膈下迷走神经切断术消除了丁酸盐对食物摄入的影响和对 BAT 代谢活动的刺激。
总之,这些发现表明丁酸盐作用于肠-脑神经回路,通过减少能量摄入并通过激活 BAT 增强脂肪酸氧化来改善能量代谢。
低度炎症是肥胖和相关代谢紊乱的标志之一。由于代谢性内毒素血症的发生,这种炎症的起源最初与肠道微生物群有关。代谢性内毒素血症也称为内毒素诱导的代谢性炎症,是指以血液中循环脂多糖(LPS;通常称为内毒素)水平升高为特征的病症,可导致低度慢性炎症和代谢功能障碍。LPS 是在某些类型的细菌(例如革兰氏阴性细菌)的外膜上发现的分子。在正常情况下,肠屏障防止内毒素从肠腔易位到血流中。
然而,除了典型的感染或炎症性肠病外,某些因素也会损害肠道屏障的完整性,使内毒素渗入循环系统。这些因素包括高脂肪饮食、过量饮酒、肥胖、高血糖和缺乏膳食纤维,所有这些都会导致肠道屏障完整性的明显改变。这些改变涉及紧密连接蛋白的排列和定位的变化、抗微生物肽的产生的变化以及粘液层的组成的修改。
已经提出了多种机制,通过这些机制,肠道衍生的化合物(例如脂多糖)可以影响脂肪组织代谢。其中之一是通过 TLR4及其辅助受体 CD14 刺激炎症途径,从而触发脂肪组织中的免疫反应。
LPS暴露,抑制脂肪细胞分化
当暴露于 LPS 时,脂肪细胞和前脂肪细胞会发生变化,干扰正常的脂肪生成。例如,LPS 可以通过破坏参与脂肪形成的关键转录因子(例如 PPARγ 和 CEBPA )的表达来抑制小鼠前脂肪细胞分化为成熟脂肪细胞。LPS 触发促炎细胞因子的释放,例如 TNF,它通过 WNT-β-连环蛋白-T 细胞因子 4 (TCF4) 途径干扰分化过程。
具体而言,在体外,TNF 增强 TCF4 依赖性转录活性,并促进 β-连环蛋白和阻碍脂肪生成的促炎环境的稳定。
LPS可以改变不同脂肪因子的分泌
除了LPS和炎症对脂肪生成过程的直接影响外,在小鼠中也发现LPS可以改变不同脂肪因子的分泌,包括增加apelin、脂联素和瘦素的分泌,这些在调节能量代谢中具有重要作用和炎症还有脂肪生成。在体外,LPS 也可能在脂肪生成受损和脂肪组织细胞衰老的发生中发挥作用,特别是在肥胖和衰老的情况下。
然而,值得注意的是,LPS 对脂肪生成的影响可能因暴露的浓度和持续时间以及特定的细胞环境而异。事实上,一些体内和体外研究表明,LPS 可以通过 JAK-STAT 和 AMPK 依赖性 cPLA2 蛋白表达以及 CD14 依赖性机制,来增加前脂肪细胞增殖和脂肪生成。
大肠杆菌产生的LPS影响肠道健康,葡萄糖代谢问题
为了研究肠道中的 LPS 是否足以促进葡萄糖和胰岛素耐受性以及 WAT 中巨噬细胞的积累,用大肠杆菌单定植无菌小鼠,发现这种产生 LPS 的细菌在肠道定植会导致葡萄糖代谢受损、巨噬细胞积累增加以及 WAT 中促炎 M1 表型的极化。
相反,用表达LPS但免疫原性降低的大肠杆菌(即大肠杆菌MLK1067)对无菌小鼠进行单定植不会诱导WAT中的巨噬细胞积聚或炎症。
不同来源的LPS对代谢和免疫反应有不同影响
同样,数据表明,来自特定细菌的 LPS 可以对 TLR4 产生拮抗作用,但根据内毒素单位测量,仍会导致内毒素血症。来自大肠杆菌的 LPS损害了肠道屏障的完整性并加剧了小鼠的血糖控制。
然而,当比较来自其他细菌(例如,球形红杆菌)的等量内毒素单位剂量的 LPS 时,研究人员发现,小鼠并没有产生相同的负面影响,甚至抵消了等量的大肠杆菌LPS 引起的血糖异常。肥胖小鼠的脂多糖。
这些发现表明,代谢性内毒素血症不应仅仅局限于 LPS 负荷,还应考虑 LPS 分子的具体特征,例如脂质 A 酰化。
肽聚糖和脂肽也与肠道屏障损伤和肥胖相关
除了脂多糖之外,与超重和肥胖相关的肠道屏障的破坏也与其他病原体相关分子模式的易位和脂肪量的发展有关。例如,研究表明,肽聚糖和脂肽也可能导致代谢紊乱的发生,并且受肥胖影响的个体已被证明血液中肽聚糖和脂肽的浓度增加。肽聚糖是革兰氏阳性和革兰氏阴性细菌中细菌细胞壁的成分。
NOD1等受体通过激活多个信号途径促进肥胖个体中的脂肪分解
细菌肽聚糖可以通过激活含有核苷酸结合寡聚结构域的蛋白 1 (NOD1) 来诱导脂肪细胞中的脂肪分解。这种 NOD1 介导的脂肪分解涉及应激激酶(ERK1 和 ERK2)、PKA 和 NF-κB 途径,汇聚于激素敏感脂肪酶。内质网应激肌醇需求蛋白 1作为炎症期间脂肪分解和血液甘油三酯的关键调节剂。
这些数据表明,病原体相关分子模式的受体,例如 TLR 和 NOD 样受体,是一个汇聚点,可以将与肥胖相关的免疫反应与高脂血症和胰岛素抵抗联系起来,至少在小鼠中。
特定受体如Tlr5和Tlr2的缺陷,或改变与代谢综合征的特征相关
鞭毛蛋白(细菌鞭毛的蛋白质成分)、细菌 DNA 和细菌脂蛋白也是作用于特定 TLR 的分子,并且由于肥胖和糖尿病患者肠道通透性增加或易位而被释放到血流中。然而,这些化合物在代谢紊乱发生中的作用仍然存在争议。
例如,Tlr5(细菌鞭毛蛋白受体)遗传缺陷的小鼠的微生物群组成发生了改变,并表现出与代谢综合征相关的特征。
同样与肠道微生物群组成的特定改变有关,缺乏Tlr2(一种检测细菌中许多配体的模式识别受体)的小鼠表现出代谢综合征表型,其特征是胰岛素抵抗、葡萄糖不耐受、脂肪量和体重增加以及循环 LPS 水平升高和亚临床炎症。
最后,缺乏Nod2(检测肽聚糖)的小鼠在脂肪组织和肝脏中表现出更高的炎症,在高脂肪饮食喂养期间加剧了胰岛素抵抗,并且增加了共生细菌从肠道到脂肪组织和肝脏的易位。
总而言之,这些发现强调了研究细菌成分检测以及更好地了解肥胖和 2 型糖尿病背景下肠道微生物、炎症和脂肪组织之间联系的重要性。
色氨酸可以在肠道微生物群和组织细胞中代谢成不同的代谢物。细菌来源的色氨酸代谢物吲哚,如 3-丙酸吲哚 (IPA),在肥胖个体的血液样本中的含量低于正常体重对照样本中的水平。
犬尿氨酸途径负责将色氨酸降解为犬尿氨酸 (Kyn)、犬尿酸 (Kyna) 和喹啉酸。相反,在肥胖个体的血浆中Kyn 水平升高,这可能归因于吲哚胺 2,3-双加氧酶 1 (IDO1) 的酶活性增强。然而,一些肠道细菌编码与真核 Kyn 途径同源的酶。
AHR信号通路
来自肠道微生物群的色氨酸衍生物和吲哚可以通过激活芳烃受体(AHR)信号通路促进前脂肪细胞分化为成熟脂肪细胞,从而调节脂肪组织发育。AHR 信号通路参与脂肪生成和脂肪细胞代谢的调节。
Kyna和GPR35
Kyna 通过激活 GPR35,促进脂肪组织中的脂肪酸氧化、产热和抗炎基因表达,从而抑制高脂肪饮食喂养的小鼠体重增加并改善葡萄糖耐量。
Kyna 和 GPR35 增强了脂肪细胞中 PGC1α 的表达和细胞呼吸,并增加了Rgs14的基因表达水平,从而增强了 β-肾上腺素能受体的信号传导。相反, Gpr35的基因缺失会导致体重逐渐增加、葡萄糖不耐受以及对高脂肪饮食的敏感性增加。
此外,Gpr35基因敲除小鼠表现出运动引起的脂肪组织褐变受损。这些发现揭示了一种新的途径,肠道微生物群衍生的代谢物通过该途径进行交流以调节能量稳态。
IDO1酶活性
在肥胖症中,IDO1酶活性增加,与肠道中的活性增强相关,导致色氨酸代谢色氨酸代谢从吲哚衍生物和 IL-22 的产生转变为犬尿氨酸的产生。研究表明,抑制或删除IDO1可以改善胰岛素敏感性,保护肠道屏障,减少代谢性内毒素血症和炎症,以及改变肝脏和脂肪组织中的脂质代谢。
脂肪组织可能是 Kyn 的主要直接来源
体内研究表明,IDO1基因和蛋白质在脂肪细胞中表达。消耗脂肪细胞中的Ido1可以防止Kyn的积累,并保护小鼠免于肥胖。有趣的是,这种效应背后的机制仍然涉及 AHR 的激活,因为从脂肪细胞中基因去除Ahr会抵消 Kyn 171的影响。
肠道微生物影响miR-181表达,调节脂肪代谢
研究还表明,肠道微生物群产生的色氨酸衍生代谢物控制小鼠白色脂肪细胞中 miR-181 家族的表达,从而调节能量消耗和胰岛素敏感性。此外,肠道微生物群-miR-181轴的失调会导致小鼠肥胖、胰岛素抵抗和WAT炎症的发生。 在一组按体重百分位数分类的儿童中发现,肥胖患者 WAT 中的 miR-181 表达和色氨酸 衍生代谢物的血浆丰度失调。
生物活性脂质是一类源自脂质(脂肪酸、磷脂和鞘脂)的信号分子,参与广泛的生物活动,包括炎症、疼痛调节、血压调节、细胞生长和分化、细胞凋亡(程序性细胞死亡)和免疫反应。
宿主和肠道微生物群产生的生物活性脂质可以影响微生物群的组成和活性以及各种宿主代谢过程。
★ 胆汁酸
胆汁酸的生产和调节
胆汁酸由肝脏产生,但受到微生物群的活性和组成的高度调节。胆汁酸在与甘氨酸或牛磺酸结合后,被储存在胆囊中,随后在进食时释放到小肠中。
脂质消化和吸收
胆汁酸的释放有助于膳食脂肪的消化和吸收。它们使脂肪乳化,增加了脂肪酶的作用效率,从而促进了脂质的分解和脂溶性维生素的吸收。
胆汁酸循环
大约95%的胆汁酸在小肠的回肠部分被重吸收,并被运回肝脏重新分泌,形成了一种高效的循环。这个过程影响了胆固醇的代谢和体内胆汁酸的总量。
胆汁酸作为信号分子
胆汁酸不仅仅是消化助手,它们还能作为信号分子,发挥激素的作用,影响葡萄糖、脂质和能量代谢。胆汁酸通过激活特定的受体,如G蛋白偶联胆汁酸受体1(TGR5),来调节代谢过程。
TGR5受体的作用
TGR5受体广泛分布于多种组织,特别是在棕色脂肪组织(BAT)中高度表达。通过TGR5受体,胆汁酸可以激活与脂质代谢、能量消耗和炎症相关的信号和基因表达。
胆汁酸对能量代谢的影响
胆汁酸可以增加脂肪分解和底物可用性,改善线粒体功能和线粒体β-氧化,从而影响能量代谢。例如,口服补充CDCA可以增加棕色脂肪组织的活性和全身能量消耗。
胆汁酸与肠内分泌激素的相互作用
在肠内分泌L细胞上表达的TGR5受体与胃肠道激素如PYY和GLP1的释放有关,这些激素对维持能量平衡和代谢调节至关重要。
★ 内源性大麻素
eCB 系统以其广泛的生理作用而闻名,包括调节食欲(即能量代谢)、葡萄糖和脂质代谢,以及其在免疫、炎症以及微生物群与宿主之间相互作用中的作用。
对小鼠、大鼠和人类的几项开创性研究表明,eCB 参与脂肪组织的代谢,并且 eCB 系统的激活促进脂肪生成。
eCB系统在肠道屏障功能、肠道微生物群和脂肪组织代谢发挥重要作用
具体来说,在小鼠中,肥胖和糖尿病期间 anandamide 的存在增加,这通过 CB1 依赖性机制触发肠道通透性。此外,当使用有效的 eCB 激动剂药理激活 eCB 系统时,它会增加脂肪生成并破坏肠道屏障。渗透性的增加进一步放大了血流中 LPS(即代谢性内毒素血症)的水平,扰乱了肠道屏障并影响了整个肠道和脂肪组织中的 eCB 系统。
在肥胖的病理状态下,eCB 张力的改变和 LPS 水平的升高导致脂肪生成失调,使最初的不平衡长期存在,并建立一个有害的循环,导致脂肪组织代谢发生改变。这是一种将肠道微生物群与肠道 eCB 系统连接起来的新型病理生理学机制,在调节脂肪生成方面发挥着重要作用。
脂肪生成与eCB系统
脂肪生成受到内源性大麻素系统和脂多糖(LPS)之间反馈回路的影响。肥胖与eCB系统的变化、血浆LPS水平升高以及肠道微生物群组成的破坏有关。
肠道微生物群与代谢
肥胖和糖尿病小鼠的肠道微生物群组成发生了变化,这与代谢功能的变化和eCB系统功能的变化有关。这些发现在饮食诱导的肥胖小鼠模型和无菌小鼠中也得到了证实。
NAPEPLD酶的重要性
NAPEPLD酶在脂肪细胞中参与生物活性脂质的合成,对维持正常的代谢功能至关重要。小鼠模型显示,缺乏NAPEPLD酶导致自发的肥胖、胰岛素抵抗和炎症,即使在正常热量饮食下也是如此。
NAPEPLD酶缺陷小鼠的肠道微生物群转移到无菌小鼠后,可以复制出类似的代谢表型,包括减少的产热程序和肠道微生物群的改变。
NAPEPLD酶的失调可能导致代谢并发症。
总之,所有证据都表明宿主 eCB 系统和肠道微生物群之间存在双向通讯。然而,还需要进一步研究来找出几个潜在的新治疗靶点。
★ 氧脂质
氧脂质是一类多样化的生物活性脂质分子,源自多不饱和脂肪酸的氧化。肠道微生物群对氧脂素介导的炎症过程有影响。
12,13-DiHOME是一种由亚油酸通过细胞色素 P450 和可溶性环氧化物水解酶的作用形成的氧脂素。12,13-DiHOME 主要由 BAT 或米色脂肪组织产生,运动、饮食和温度等因素会影响其在体内的浓度。它具有调节脂肪组织中脂肪酸的摄取和寒冷暴露期间的体温调节的作用。
研究发现,28 名肥胖青少年男性的 12,13-DiHOME 浓度低于 28 名体重正常的同龄男性,并且随着剧烈运动而增加。在高脂肪饮食诱导的肥胖小鼠中,给予 12,13-diHOME 两周可促进脂肪酸转运至 BAT,降低循环甘油三酯浓度并增加 BAT中LPL(一种水解脂蛋白中甘油三酯的酶)的基因表达。
一些肠道细菌可以产生并分泌 12,13-diHOME。例如,在Welbionis Dysosmobacter产生的几种生物活性脂质中发现了 12,13-diHOME ,将这种细菌给予小鼠可显著减少(P < 0.001)高脂饮食引起的 BAT 变白并增加线粒体活性。
★ 琥珀酸和 GPR91 的作用
琥珀酸是三羧酸循环(也称为柠檬酸循环或克雷布斯循环)的中间体,是细胞代谢和能量稳态的核心。
代谢调节
琥珀酸通过在脂肪细胞上的GPR91参与代谢调节,它可以由微生物通过碳水化合物发酵产生,作为分解代谢物出现。
微生物产物的重要性
琥珀酸作为微生物产物,在消耗膳食纤维时对代谢健康有益,例如通过普雷沃氏菌的作用增加琥珀酸的产生。Akkermansia muciniphila等琥珀酸生产者与肥胖、糖尿病和代谢紊乱有负相关性。
克罗恩病中的琥珀酸水平
克罗恩病患者的血浆琥珀酸水平显著高于健康对照组,且在活动性克罗恩病患者的脂肪组织中,SUCNR1的表达更高。
琥珀酸盐可能在克罗恩病中促进白色脂肪细胞向米色脂肪细胞的转变。
GPR91的作用
GPR91在小鼠白色脂肪组织(WAT)中高度表达,并调节脂肪量和葡萄糖稳态。在Gpr91敲除的小鼠模型中,GPR91的缺失影响新陈代谢和体重,但具体效果(增重/减重)取决于实验条件。
Gpr91敲除小鼠在常规饮食下表现出较小的WAT隔室、较小的脂肪细胞、增加的能量消耗和改善的葡萄糖调节。
GPR91可能是肥胖、高血压和糖尿病治疗的潜在靶点。
这些研究结果揭示了琥珀酸和GPR91在能量代谢和脂肪组织功能中的重要作用,以及在疾病状态下可能的病理作用。这为未来的治病策略提供了新的方向。
目前的人类研究表明,个体的脂肪组织中存在微生物群特征,并且该特征可能根据宿主的代谢负担而不同。在本节中,我们讨论这个新课题,重点关注以下几个方面:
1)检测和表征脂肪组织微生物群的方法和挑战;
2) 微生物从肠道转移到脂肪组织的潜在来源和机制;
3)脂肪组织微生物群在不同脂肪库和代谢条件下的多样性和功能作用;
4) 对未来研究和治疗干预的影响和前景。
检测和表征脂肪组织微生物群的方法和挑战
研究脂肪组织微生物群的主要挑战之一是确保微生物检测方法的可靠性和有效性。多项研究使用基于 16S rRNA基因的细菌定量来识别和比较不同脂肪组织库和代谢条件下的微生物谱。然而,这种方法具有一些局限性,例如环境或试剂来源污染的风险、一些引物和探针的低灵敏度和特异性、以及难以区分活细菌和死细菌。
微生物从肠道转移到脂肪组织的可能途径
微生物从肠道转移到脂肪组织的起源和途径尚不完全清楚,但已经提出了几种机制。
1.
一种可能性是细菌或其成分通过增加肠道通透性穿过肠道屏障,这通常在肥胖和 2 型糖尿病中。
2.
另一种可能性是细菌或其遗传物质被免疫细胞主动运输,例如巨噬细胞或树突细胞,从肠道相关淋巴组织迁移到脂肪组织。
3.
第三种可能性是细菌或其成分由门静脉或淋巴系统携带至肝脏或其他器官,在那里它们可以影响局部或全身炎症和代谢。
脂肪组织微生物群,在不同脂肪库和代谢条件下的多样性和功能作用
脂肪组织微生物群的多样性和功能作用可能会因多种因素而异,例如脂肪库的解剖位置、宿主的代谢状态以及与其他宿主因素的相互作用。
例如,患有或不患有 2 型糖尿病的肥胖个体的不同脂肪组织库(皮下、肠系膜、网膜和肝脏)具有不同的微生物特征,并且这些特征与 BMI 无关。
组织特异性定量、分类和组成细菌特征与组织依赖性炎症标记物和代谢特征相关。
与体重正常的个体相比,肥胖个体的 SAT 细菌载量较高,细菌多样性较低,这些差异与脂质代谢和炎症相关基因表达的改变有关。
母乳中特定细菌的存在及其起源之间的联系
脂肪组织微生物群背景下的另一个重要挑战,涉及母乳中特定细菌的存在及其起源之间的联系,以及最终与“粉红色”脂肪细胞发育的可能联系。
“粉红色”脂肪细胞是一种可以发现的独特脂肪细胞在怀孕和哺乳期小鼠的皮下脂肪库中。这些粉红色脂肪细胞是源自皮下白色脂肪细胞的特殊细胞,产生并释放乳汁。
越来越多的证据表明,它们经历了一个转分化的过程,成为乳腺肺泡上皮细胞。证据还支持这样的假设:转分化可以以可逆的方式从白色到粉色、粉色到棕色以及棕色到肌上皮细胞发生。
在母乳中发现了具有独特组成的微生物群。健康女性的乳汁中细菌含量通常较低,主要包括葡萄球菌、链球菌、乳酸菌和其他革兰氏阳性菌,如棒状杆菌、丙酸杆菌和双歧杆菌,但也可以发现来自严格厌氧菌的DNA。它由协调的微生物群和互连网络构成。
关键的未知因素之一是乳腺组织以及最终母乳中微生物群的改变是否可能影响乳房健康、乳腺脂肪组织以及从白色脂肪细胞到粉红色脂肪细胞的转分化。值得注意的是,除了初乳和牛奶之外,无论是否哺乳的女性的乳腺组织都可能含有微生物群,这可能对乳腺癌的发生、进展和治疗产生影响。
对未来研究和治疗干预的影响和前景
脂肪组织微生物群的研究是一个新颖且有前途的研究领域,可能为代谢疾病的病理生理学和治疗提供新的见解。然而,许多悬而未决的问题和挑战仍然需要解决。例如:
需要更多的纵向、介入和机制研究,以及脂肪组织微生物群数据采样、处理、分析和报告的标准化方案,来回答这些问题。
对肠道微生物群和脂肪组织之间复杂相互作用的研究揭示了一种有趣的相互作用,这种相互作用远远超出了消化和新陈代谢的范围。
肠道微生物群影响各种生理过程,包括能量稳态、炎症和胰岛素敏感性。肠道-脂肪轴代表了一个双向通讯系统,涉及肠道微生物群和脂肪组织之间交换的信号分子、代谢物和免疫介质。
脂肪组织曾经被认为是惰性能量储存库,现在被认为是一种活跃的内分泌器官,可以释放脂肪因子、细胞因子和其他具有全身效应的因子。另一方面,肠道微生物群产生一系列影响宿主代谢和免疫反应的代谢物。肠道微生物群和脂肪组织之间的这种动态相互作用为识别与肥胖和胰岛素抵抗相关的生物标志物开辟了新途径。
这种相互作用产生的潜在生物标志物有望识别有代谢紊乱风险的个体,从而实现早期干预和个性化策略,以减轻肥胖的影响并提高胰岛素敏感性。
微生物多样性和组成
肠道微生物群多样性和特定微生物类群丰度的改变与肥胖和胰岛素抵抗有关。例如,脂肪细胞直径、葡萄糖和胰岛素敏感性的替代指标似乎与人类中阿克曼氏菌的丰度密切相关。皮下白色脂肪细胞直径与A. muciniphila丰度呈负相关,A. muciniphila丰度高的个体具有较低的平均脂肪细胞大小。尽管由于许多混杂因素和巨大的个体差异而仍存在激烈争论,但某些微生物(核心)特征的识别,可以作为代谢功能障碍的早期指标。
代谢物
微生物代谢物,例如短链脂肪酸、次级胆汁酸和三甲胺-N-氧化物,可以反映肠道微生物群活动,并可能预测肥胖和胰岛素抵抗的风险。
短链脂肪酸水平的增加还与体重、脂肪量、腰围、空腹血糖、胰岛素抵抗和炎症的减少有关。
次级胆汁酸水平升高与体重指数、腰臀比、空腹血糖、胰岛素抵抗和炎症降低有关。
三甲胺-N-氧化物水平的增加与体重指数、腰围、体脂百分比、空腹血糖、胰岛素抵抗、血压、炎症和氧化应激的增加相关。
脂肪因子和炎症标志物
受脂肪组织健康影响的大量脂肪因子和炎症标记物的循环水平可以作为肥胖相关胰岛素抵抗的指标。
对饮食的代谢反应
肠道微生物群对饮食干预反应的个体差异可能与肥胖风险和胰岛素敏感性相关,为个性化饮食建议打下了基础。
微生物-宿主相互作用基因
影响肠道微生物与宿主之间相互作用的遗传变异可能导致肥胖和胰岛素抵抗易感性,为风险评估提供遗传标记。
尽管过去几年人们对肠道微生物群和脂肪组织之间的相互作用获得了宝贵的见解,但将体外和动物研究的发现转化为人类仍然特别具有挑战性。
动物模型固有的局限性
无菌小鼠在没有肠道微生物群的情况下饲养,可以深入了解某些肠道细菌或细菌组合的作用。然而,这些小鼠在发育过程中缺乏微生物相互作用,因此代谢发生改变并损害免疫系统功能,这可能无法准确反映人类生理学。
遗传性肥胖小鼠(如ob/ob和db/db小鼠)有助于我们了解肥胖的病理生理学,但它们的遗传基础限制了它们向人类肥胖的转化,因为瘦素和瘦素受体缺陷在人类中很少见,而且突变会导致重大肥胖代谢调节途径的破坏。
物种差异与研究成果转化的复杂性
另一方面,高脂肪饮食的肥胖小鼠模仿了人类肥胖的某些方面,但未能复制该疾病的多因素性质。遗传和生活方式因素在人类肥胖中起着重要作用,并且很难在实验室中复制。
由于物种之间的生物学差异,将动物模型的研究结果转化为人类也具有挑战性。遗传变异、饮食、肠道微生物群组成和环境影响各不相同,使得直接翻译变得困难。动物模型常常过度简化复杂的人类代谢途径,并且无法解释在人群中观察到的异质性。这是动物研究的结果在人类研究中经常得不到证实的主要原因之一,也是为什么仅从动物实验中获得的数据必须谨慎解释的原因之一。
肠道微生物群的个体差异和动态性
尽管许多动物研究表明,针对肠道微生物群及其代谢物的干预措施有望对抗肥胖和代谢紊乱,但设计临床试验来证实这些发现提出了独特的挑战。肠道微生物群表现出显着的个体间差异,因此很难建立在不同人群中产生一致效果的标准化干预措施。更复杂的是,肠道微生物群是一个高度动态且复杂的生态系统,可能受到饮食、药物、压力和其他环境因素等多种因素的影响,并且肠道微生物群的变化可能需要一段时间才能显现出来。
肠道微生物干预领域标准化的缺乏延伸到研究设计、样本收集和数据分析,使得比较和评估这些干预措施的有效性变得极其困难。
干预参数的变异性
肠道微生物群干预的参数存在相当大的变异性。这种差异包括所使用的益生菌和益生元的类型、给药剂量以及干预的持续时间和时机。不同的临床和临床前研究使用不同的菌株或菌株组合,因此比较它们的功效具有挑战性。此外,最佳干预剂量和持续时间尚未确定,导致治疗方案不一致。干预开始的时间和给药途径也不同,给研究带来了额外的可变性。
数据收集缺乏标准化
样本收集方法的变化,例如粪便收集技术、储存条件和运输方案,可能会影响肠道微生物群数据的质量和一致性。此外,元数据(包括饮食信息、生活方式因素、药物使用和临床特征)的收集和报告在研究中通常不一致。缺乏标准化的数据收集程序阻碍了准确解释和比较结果的能力。
粪便样本的局限性
由于其非侵入性收集方法和足够的生物量用于分析,粪便样本仍然是大多数肠道微生物群研究的主要材料来源。然而,重要的是要认识到仅依靠粪便样本时的局限性,因为粪便中的微生物群可能无法准确代表肠道内不同位置的微生物群落,从而导致不完全了解对肠道微生物群的作用和对健康的影响。
肠道微生物群的空间异质性
肠道微生物群沿着胃肠道的长度而变化,其影响因素包括环境变化、营养可用性以及从胃到大肠的不同氧气水平。不同的微生物群落在这些不同的条件下茁壮成长。
粘膜与肠腔微生物群的差异
此外,肠腔(粪便)中的肠道微生物群可能与靠近肠壁的粘膜的肠道微生物群有很大不同。粘膜层是宿主与微生物相互作用发生的动态界面。附着于粘膜的微生物可以具有与内腔中自由漂浮的微生物不同的作用和效果。此外,肠道不同部位的微生物群落可能具有不同的代谢活动。例如,结肠中的细菌通过发酵产生各种代谢物,对宿主健康产生系统性影响。仅研究粪便代谢物可能无法提供完整的信息,因为它们可能受到不同肠道部分细菌之间相互作用的影响。
微生物易位与系统性影响
最后,某些细菌或代谢物可以从肠腔转移到身体的其他部位,可能影响远处的器官和系统。了解易位动态和所涉及的特定微生物种群需要更全面的采样策略,而不仅仅是粪便样本。然而,迄今为止,尚无明确的易于临床使用的生物标志物来全面反映肠道通透性及其动态。因此,尽管粪便提供了宝贵的见解,但认识到它们的局限性并解决准确描述整个胃肠道肠道微生物群的挑战对于更全面地了解它们在健康和疾病中的作用至关重要。
肠道微生物群分析的技术挑战
由于缺乏标准化技术和工作流程,分析肠道微生物群也面临着自身的挑战。不同的研究采用不同的方法来分析肠道微生物群,例如 16S rRNA 基因测序、鸟枪法宏基因组学或宏转录组学。每种方法都有其自身的优点和局限性,技术的选择会影响结果的准确性和全面性。
通过识别有助于各种生理过程的功能性细菌基因和途径,使用鸟枪法测序和生化解释的功能性宏基因组方法已成为微生物组研究的强大工具,但即使这种技术也有其局限性。除了高成本、数据解释的复杂性和功能注释的挑战之外,鸟枪法宏基因组测序仅提供有关功能基因存在的信息,但可能无法完全捕获有关基因表达和调控的信息。此外,不存在用于处理和分析肠道微生物群数据的标准化生物信息学流程。不同的质量控制、分类分配和统计分析方法可能会导致比较研究结果的差异和困难。
虽然存在上述困难与挑战,但科研的步伐不会就此停止。随着技术的不断发展和完善,肠道微生物群分析的方法也将不断改进。标准化的技术和工作流程的建立将有助于提高数据的可重复性和准确性,从而推动肠道微生物群研究突破。
与早期将脂肪细胞描述为储存和释放脂质的简单血管不同,我们越来越认识到脂肪细胞的复杂性。
当我们过量喂养脂肪细胞时,我们开始欣赏WAT对全身健康的无数贡献。了解肥胖相关的脂肪细胞功能障碍如何导致疾病状态,可能有助于开发新的细胞靶向策略,改善或恢复脂肪细胞功能。
虽然肥胖率持续上升,包括儿童肥胖率,但我们有了更多新兴治疗方法来解决肥胖和相关的合并症。鉴于肥胖、脂肪细胞大小和脂肪细胞功能障碍之间的紧密联系,减少脂肪量(和脂肪细胞大小)的策略是很好的治疗目标。
技术和数据整合的进步将继续为脂肪细胞如何受到体重增加的影响提供新的见解,并让我们更清楚地了解肥胖和相关疾病中的脂肪细胞功能障碍。
因此,尽管存在挑战,这方面的研究仍然充满着无限的潜力和机遇。微生物组时代的重点是了解和利用肠道微生物群的潜力,包括其在不同脂肪组织中的作用,这无疑是未来医学和医疗保健范式转变的重要组成部分。
主要参考文献
Hagberg CE, Spalding KL. White adipocyte dysfunction and obesity-associated pathologies in humans. Nat Rev Mol Cell Biol. 2023 Dec 12.