 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康

现如今,有过敏症状的宝宝越来越多,如何防治孩子过敏成了颇受关注的公共健康问题之一。
过敏的原因除了遗传因素外,还与宝宝肠道菌群失调,自身的免疫系统发育不成熟,环境因素等息息相关。
本文列举的最新研究进展,从过敏早期识别干预,耐药基因,食物过敏及其因果关联等方面,展示了微生物群如何在其中发挥作用,为儿童过敏的防治提供新思路。
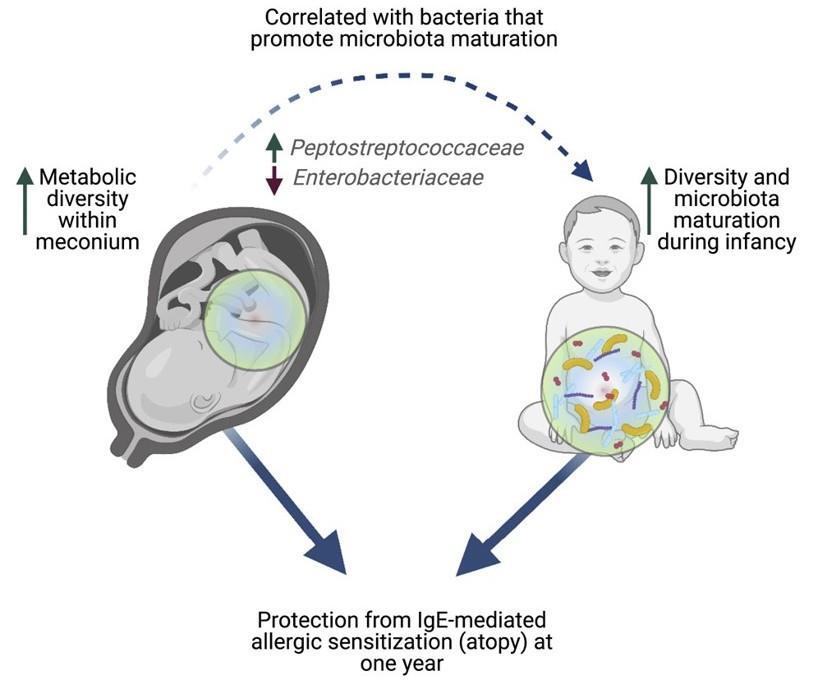
新生儿的第一次大便可能揭示发生过敏的风险
微生物群的成熟与免疫系统的发育同时发生,两者都与一系列疾病有关,包括过敏、花粉热、哮喘和湿疹。
发表在Cell Reports Medicine 通过分析 100 名新生儿的粪便,研究人员发现婴儿第一次粪便的成分可以决定儿童在以后的生活中是否有可能患上过敏症和其他疾病。研究小组发现,缺乏特定分子与一年后过敏的风险增加有关。这些化学物质的减少与在微生物群成熟中起关键作用的细菌的变化有关。
Petersen Cet al., Cell Rep Med. 2021
新生儿的第一次粪便,称为胎粪。胎粪是一种粘稠的深绿色物质,在怀孕 16 周左右开始在胎儿肠道中形成,含有羊水、皮肤细胞以及婴儿摄入的其他物质和分子。
胎粪也是出生后在肠道中定殖的第一批微生物的最初“食物来源”。胎粪就像一个时间胶囊,揭示了婴儿在出生前接触过的东西。
过 敏
为了评估胎粪成分是否会影响以后发生过敏的风险,研究人员研究了新生儿第一次粪便中存在的代谢物。然后,当孩子们满一岁时,该团队进行了一项皮肤测试,以测量免疫系统的反应性。
分析表明,婴儿胎粪中不同类型的分子越少,孩子在出生后第一年内发生过敏的风险就越高。
一些代谢途径,包括那些涉及氨基酸代谢的途径,在后来出现过敏性疾病的婴儿的胎粪中最少。
与没有发生过敏反应的新生儿相比,在一岁时发生过敏反应的新生儿在出生时的胎粪代谢多样性降低。
早 期 干 预
接下来,研究人员分析了胎粪成分是否会影响肠道微生物群的成熟。胎粪“代谢组”较少的婴儿的细菌丰度平较水平低,如肠杆菌科,这在微生物群的成熟中起着关键作用。
最后,研究人员将有关胎粪和微生物群组成的信息与新生儿及其母亲的临床数据相结合,以准确预测婴儿是否会在 1 岁时出现过敏反应。
这项工作表明,健康的免疫系统和微生物群的发展实际上可能在孩子出生之前就开始了——这表明婴儿在子宫内接触的微小分子对未来的健康起着至关重要的作用。
研究人员说,调节子宫内关键代谢物的早期干预措施有助于促进微生物群和免疫系统的健康发育,从而预防过敏性疾病的症状。
这些发现可能有助于识别有患过敏症或哮喘风险的婴儿,并制定有助于预防这些疾病的早期干预措施。
参考文献:
Petersen C, Dai DLY, Boutin RCT, Sbihi H, Sears MR, Moraes TJ, Becker AB, Azad MB, Mandhane PJ, Subbarao P, Turvey SE, Finlay BB. A rich meconium metabolome in human infants is associated with early-life gut microbiota composition and reduced allergic sensitization. Cell Rep Med. 2021 Apr 29;2(5):100260.
婴儿的肠道微生物群包含数百个抗生素抗性基因
人类肠道微生物群已成为细菌的储存库,这些细菌含有帮助它们抵抗抗生素的基因。
发表在Cell Host & Microbe的一项研究通过分析丹麦 650 多名一岁儿童的粪便样本,发现婴儿的肠道细菌有数百个抗生素抗性基因。

谷禾健康

抗生素自问世以来挽救了无数生命
曾被誉为治病的“神药”,风靡全球。
然而,由于抗生素药物的滥用
它开始变得越来越无效
更可怕的是
一些药物抗生素还伴有有害的副作用,如呕吐、腹泻、过敏反应、皮疹,
甚至还会导致人的微生物群失调,并伴有免疫系统减弱及慢性炎症发展…
现如今,在“不要滥用抗生素”的呼吁下
很多人都知道吃抗生素对身体不好
明知不好却依然摆脱不了啊…
有没有别的方式可以帮助预防改善?
天然抗生素或许可以帮到你
其实在日常生活中常见的食物,一些植物或者提取物也能达到同样的效果,它们的杀菌特性展现其作为天然抗生素治疗的潜力,本期我们为大家介绍15种天然抗生素。
01 大 蒜
大蒜在历史上一直被广泛用于治疗和预防疾病。最近的研究评估了大蒜的潜在益处,包括其抗菌、抗真菌和抗病毒活性。
作用机理
大蒜素是大蒜中的主要活性化合物,负责其大部分抗菌活性。它对多种细菌菌株有效,包括多药耐药菌株。
大蒜素通过阻断对能源生产至关重要的酶(乙醇脱氢酶、乙酰辅酶 A 合成酶和乙酸激酶)维持细胞结构来杀死细菌。
此外,大蒜素可以通过阻断生物膜的形成来阻止细菌和真菌的生长,人体内大多数持续性感染源于生物膜,能阻断生物膜的形成意义重大。
有关生物膜感染,详见:
抗 细 菌 性
在接受14天治疗的60名患者中,大蒜素单独或与标准抗生素联合帮助34名患者根除幽门螺杆菌感染。然而,在对17人进行的2次试验中,大蒜对这种感染无效。
此外,在对75名健康人群进行的临床试验中,一种大蒜提取物漱口水降低了口腔变异链球菌的水平。
* 变异链球菌具有分泌酸性物质腐蚀牙釉质的特点,为人类主要致龋齿菌之一。
大蒜提取物可能有助于治疗牙龈肿胀和预防蛀牙,因为它们可以杀死试管中的口腔致病菌,
例如:牙龈卟啉单胞菌 Porphyromonas gingivalis、
中间普氏菌 Prevotella intermedia、
Aggregatibacter actinomycetemcomitans。
它还提高了其他抗生素在试管中对铜绿假单胞菌的有效性。然而,在34人的临床试验中,它未能阻止铜绿假单胞菌在肺组织瘢痕中形成生物膜。
大蒜提取物除了杀死金黄色葡萄球菌和化脓性链球菌,还能通过减少细菌毒素(如α-毒素和链球菌溶血素O)的产生来保护身体免受伤害。
抗 真 菌 性
大蒜素可以抑制试管中孢子的萌发和真菌的生长(白色念珠菌、隐球菌、曲霉和酿酒酵母)。
念珠菌可感染口腔粘膜,引起炎症性疾病,称为假牙炎或口腔念珠菌病。在对96名患有这种疾病的人进行的2项临床试验中,大蒜提取物(作为漱口水或牙膏使用)显示出与抗真菌药物制霉菌素和克霉唑相似的效果。
在110名妇女的临床试验中,大蒜提取物片(Garcin)改善阴道念珠菌病的症状与氟康唑一样有效。然而,另一种配方(大蒜素)在63名感染但无症状妇女的试验中无效。
在两项对81人进行的临床试验中,大蒜中的另一种成分,大蒜烯Ajoene(0.4-1%乳膏)杀死了导致足癣的真菌。
抗 病 毒 性
大蒜提取物对流感病毒和疱疹病毒(单纯型1、2和3)也有效。
在对146名健康成年人和172名儿童进行的2项临床试验中,用一种含有大蒜素的大蒜补充剂(每天1粒胶囊,持续12周)可以预防普通感冒,并缩短症状持续时间。
副 作 用
大蒜可能会引起恶心、胃灼烧和口臭。
★ 小 结 ★
大蒜对蛀牙/牙龈疾病、口腔念珠菌病、脚气和普通感冒有效。
02 茶树油
茶树油是从茶树植物(互叶白千层)中提取的,是一种用于皮肤的广谱抗生素。它是许多用于治疗皮肤感染的制剂中的活性成分。
作用机理
茶树油中的一些化合物,称为单萜(萜品烯-4-醇,芳樟醇,α-蒎烯和α-萜品醇)负责抗菌。
单萜阻断能量产生(细胞呼吸),破坏细菌和真菌细胞的外层(膜)。
抗 细 菌 性
茶树油对导致皮肤感染、痤疮、肺炎、食物中毒等细菌有效。
部分菌株包括葡萄球菌(金黄色葡萄球菌和表皮葡萄球菌),疮疱丙酸杆菌,绿脓杆菌,金黄色葡萄球菌,沙门氏菌,和大肠埃希氏菌。
在一项对 236 名住院患者进行的临床试验中,含有茶树油(分别为 10% 和 5% 茶树油)的乳霜和沐浴露使用 5 天,有助于清除耐抗生素金黄色葡萄球菌皮肤感染。
在30名受试者的唾液中,0.2%茶树油溶液减少了变异链球菌和其他微生物。
抗 真 菌 性
茶树油对以下真菌有效:白色念珠菌、曲霉菌、小孢子菌、表皮癣菌等。这些真菌会导致皮肤病(例如脚气和癣)以及其他问题。
在一项对 117 名患者的研究中(25% 和 50% 茶树油),每天两次使用茶树油治疗脚趾甲感染(甲真菌病)6 个月。
在一项137名患者的研究中(100%茶树油),每天使用两次,连续4周,也有治疗足癣的作用。
在大鼠研究中,外用茶树油治愈了阴道念珠菌感染。
抗 病 毒 性
茶树油抑制疱疹病毒的生长(单面型1和2)
副 作 用
注意,食用茶树油是有毒的。
另外,在皮肤上使用时,茶树油也有可能会导致干燥、灼热、瘙痒、炎症和过敏反应。
★ 小 结 ★
茶树油有助于治疗细菌和真菌性皮肤感染(包括痤疮、肺炎、脚趾甲感染、脚气等),预防蛀牙或牙龈疾病。
接下来介绍的也是天然抗生素,相对来说,证据不够充分,可以作为参考。
03 牛至油
牛至油(从牛至中提取)一直被用作食品添加剂。它以其抗菌、抗真菌和抗氧化特性而闻名。
作用机理
牛至油的抗生素和抗真菌活性来自两种化合物,香芹酚和百里酚。百里酚和香芹酚破坏细胞外细菌(膜),杀死细胞。
抗 细 菌 性
在一项对40名外科手术伤口康复患者的临床试验中,牛至油软膏减少了金黄色葡萄球菌对伤口的污染,从而有助于愈合过程。
百里酚和香芹酚可以阻止导致蛀牙的细菌(变异链球菌Streptococcus mutans)的生长,在大鼠试验中,可以保护大鼠免受牙龈疾病的侵袭。
在试管中,牛至抑制并杀死以下细菌:导致食物中毒、尿路感染、腹泻、肺炎、葡萄球菌感染等的细菌。
这些细菌包括:大肠杆菌Escherichia coli、沙门氏菌Salmonella、肺炎克雷伯菌 Klebsiella pneumoniae、枯草芽孢杆菌Bacillus subtilis、金黄色葡萄球菌Staphylococcus aureus、铜绿假单胞菌Pseudomonas aeruginosa、荧光假单胞菌Pseudomonas fluorescens、液化沙雷菌Serratia liquefaciens、变异链球菌 Streptococcus mutans、粪肠球菌Enterococcus faecalis、梭菌Clostridium、鸟分枝杆菌Mycobacterium avium和腐败希瓦氏菌 Shewanella putrefaciens。
在试管中,墨西哥牛至油与百里香和芥子油一起对三种细菌(单核增生李斯特菌,金黄色葡萄球菌和肠炎沙门氏菌)有效。
牛至油与丁香和肉桂油一起抑制了鲍氏不动杆菌Acinetobacter baumannii、鲍氏不动杆菌 RCH、肺炎克雷伯菌、大肠杆菌和铜绿假单胞菌的生长。
抗 真 菌 性
百里酚和香芹酚可有效阻止试管中三种不同的引起感染的真菌(酵母、曲霉和皮肤癣菌)的生长。
抗 病 毒 性
在基于细胞的研究中,香芹酚和百里酚对以下病毒具有抗病毒活性:
疱疹病毒(单纯型1)、人呼吸道合胞病毒、人轮状病毒、小鼠诺如病毒
抗 寄 生 虫
在一项小型试验中,14人感染了三种导致消化问题的寄生虫(人芽囊原虫blastocystis hominis、哈氏阿米巴原虫Entamoeba hartmanni和微小内蜒阿米巴Endolimax nana),在大多数情况下,补充牛至油可使寄生虫完全消失,并改善症状。
副 作 用
虽然很少见,但牛至油会引起过敏反应,尤其是对唇形科(如百里香)过敏的人。
药物间相互作用
牛至可以阻断肝酶(细胞色素p450)清除血液中的有毒物质。这可能会增加某些药物的效果。
★ 小 结 ★
只有几个小型临床试验表明牛至可能有助于治疗细菌和寄生虫感染。需要对更大人群进行更多的临床试验,以确定其对抗传染病的潜力。
04 紫锥菊
紫锥菊一直被用作草药。紫锥菊提取物以其潜在的抗菌和免疫保护特性而闻名。
作用机理
虽然紫锥菊的确切成分因物种而异,但主要成分是碳水化合物、咖啡酸和蛋白质(糖蛋白)。
紫锥菊通过阻断细胞因子等炎症标志物的释放来减轻细菌感染的症状。其抑菌作用机制尚未明确。
抗 细 菌 性
紫锥菊可有效减少多种细菌菌株的生长,例如化脓性链球菌、流感嗜血杆菌、嗜肺军团菌、艰难梭菌和痤疮丙酸杆菌。
抗 真 菌 性
紫锥菊阻止多种真菌菌株的生长,并保护小鼠细胞免受致命感染(白色念珠菌和单核细胞增生李斯特菌)。它还对酿酒酵母有效。
抗 病 毒 性
在对 282 人进行的临床试验中,在出现感冒症状时服用紫锥菊补充剂 (Echinilin),可减轻症状的严重程度。
然而,在一项对 100 多人的临床试验和一项对 700 多人的试验中,含有紫锥菊提取物的药片无法预防。一项荟萃分析得出结论,紫锥菊产品对治疗普通感冒无效,但可能有助于预防。
在对 95 名有早期感冒或流感症状的人进行的临床试验中,紫锥菊有助于缓解症状。
在154人的临床试验中,一种结合了紫锥菊和鼠尾草的喷雾剂与一种含有氯己定和利多卡因的喷雾剂对治疗喉咙痛同样有效。
然而,在一项针对400多名儿童的试验中,紫锥菊未能治疗上呼吸道感染;在两项针对近400名成人的试验中,紫锥菊未能预防上呼吸道感染。
基于细胞的研究表明紫锥菊对这些病毒有抗病毒活性:
鼻病毒、疱疹病毒(单纯型1和2)、甲型和乙型流感、呼吸道合胞体病毒
副 作 用
食用紫锥菊的副作用包括皮疹和恶心、胃痛等轻微胃部问题,但很罕见。
过敏反应可能发生,特别是对菊科其他植物(如甘菊)过敏的人。
★ 小 结 ★
尽管在患有普通感冒和其他上呼吸道感染的人群中进行了广泛调查,但结果有效和无效都存在,因此紫锥菊的有效性尚无定论。需要更多的临床试验来阐明其治疗潜力。
05
麦卢卡 蜂蜜
麦卢卡蜂蜜是由以麦卢卡树(Leptospermum scoparium)的花为食的蜜蜂生产的,被认为是最具药用价值的蜂蜜,但需要更多数据。
作用机理
麦卢卡蜂蜜的主要活性抗生素成分是一种叫丙酮醛的化合物。
蜂蜜的另一种成分是蜂胶,它含有黄酮类化合物(如高良姜精和匹诺塞林pinocembrin)、酚酸和酯类物质,可能有助于增强免疫系统。
麦卢卡蜂蜜还富含葡萄糖氧化酶,这种酶可以将葡萄糖转化为具有抗菌特性的过氧化氢。
另一种化合物葡萄糖内酯可以降低蜂蜜的pH值,并具有天然的抗菌特性。水无法在蜂蜜中流动,使得细菌难以在蜂蜜中生存。
抗 细 菌 性
麦卢卡蜂蜜是一种广谱抗菌剂,可以杀死以下细菌:大肠杆菌、金黄色葡萄球菌、几种肠球菌、铜绿假单胞菌、化脓性链球菌Streptococcus pyogenes、奇异变形杆菌Proteus mirabilis、鼠伤寒沙门氏菌Salmonella typhimurium等。
在 150 名有消化问题的患者中,每周食用蜂蜜与降低感染幽门螺杆菌的风险有关。
在42名慢性鼻窦炎患者的临床试验中,术前用麦卢卡蜂蜜冲洗改善了结果,包括细菌计数。
在一项针对 30 名健康志愿者的试点试验中,咀嚼麦卢卡蜂蜜口香糖可减少牙菌斑积聚和牙龈出血。
将麦卢卡蜂蜜外用于感染了耐抗生素金黄色葡萄球菌的腿部溃疡,促进了使用免疫抑制剂药物患者的伤口愈合。
抗 病 毒 性
麦卢卡蜂蜜可抑制水痘-带状疱疹病毒在人类皮肤细胞中的生长。
它还能抑制甲型流感病毒在狗肾细胞中的生长。
副 作 用
麦卢卡蜂蜜在 20 名健康成人中服用 4 周后没有产生副作用。虽然没有观察到过敏反应,但建议对蜜蜂过敏的个体应谨慎。
★ 小 结 ★
很少有小型临床试验支持在细菌感染患者中使用麦卢卡蜂蜜,虽然结果很有希望。需要更大规模、更稳健的临床试验来验证这些初步结果。
06 肉 桂
肉桂(Cinnamomum zeylanicum和Cinnamomum cassia) 是一种广泛使用的草药,以其抗氧化、抗炎、抗病毒、抗菌和抗真菌特性而闻名。
作用机理
肉桂醛和丁香酚这两种化合物负责肉桂的抗菌和抗病毒特性。
抗 细 菌 性
在试管中,丁香酚和肉桂醛阻止了幽门螺杆菌的生长。然而,4周治疗肉桂(80毫克/天)对15例幽门螺杆菌没有改善。
肉桂提取物还阻止了痤疮丙酸杆菌和表皮葡萄球菌的生长,这两种细菌会导致痤疮。
肉桂油和丁香油可阻止大肠杆菌、小肠结肠炎耶尔森氏菌Yersinia enterocolitica、铜绿假单胞菌Pseudomonas aeruginosa、猪霍乱沙门氏菌Salmonella choleraesuis、金黄色葡萄球菌Staphylococcus aureus、单核细胞增生李斯特菌Listeria monocytogenes、蜡样芽孢杆菌Bacillus cereus和粪肠球菌Enterococcus faecalis 在试管中的生长。
抗 真 菌 性
肉桂提取物对抗真菌的许多菌株,如念珠菌,曲霉Aspergillus,青霉菌等都有效。
在一项为期 7 天的试点研究中,每天服用 8 片肉桂含片可改善5 名 HIV 患者中 3 名的口腔念珠菌感染症状。
在一项针对60名肠道念珠菌感染患者的临床试验中,肉桂和藿香油胶囊解决了72%的感染,改善了28%.
肉桂油、迷迭香油和百里香油的组合减少了Penicillium expansum和Botrytis cinerea真菌的生长。
抗 病 毒 性
肉桂醛可阻止流感病毒(流感 (A/PR/8))的生长并提高大鼠的存活率。
在一项细胞研究中,源自肉桂的 IND02(一种原花青素 A 型分子)可阻止丙型肝炎病毒细胞进入,因此可能是治疗丙型肝炎和肝病的有效疗法。
在另一项细胞研究中,肉桂提取物阻止了另一种类型的流感病毒 (H7N3) 进入细胞。
副 作 用
肉桂提取物可能引起恶心,胃疼痛,和便秘。
★ 小 结 ★
肉桂只在临床试验中对念珠菌病进行了测试,其中一个非常小。需要在更大的人群中进行更多的临床试验,才能确定肉桂是否对治疗念珠菌感染有任何作用。
07 姜 黄
姜黄( Curcuma longa )常用于印度美食,它不仅以其风味而闻名,而且还以其众多的健康益处而闻名。
作用机理
姜黄素是姜黄中活性最强的化合物。在试管中,它阻断了引起尿路感染的细菌生物膜,如大肠杆菌、铜绿假单胞菌、奇异变形杆菌Proteus mirabilis和粘质沙雷氏菌Proteus mirabilis。
姜黄素还会干扰细菌细胞间通讯(群体感应)并阻止重要化合物(pyocyanin和酰基高丝氨酸内酯)的产生。
姜黄素还会破坏真菌中参与存活的蛋白质(ATP 酶活性、麦角甾醇和蛋白酶)的活性。
姜黄素抑制丙型肝炎病毒的复制(通过PI3K /Ak 途径)。
抗 细 菌 性
经过 7 周的治疗,姜黄素摄入量(30 毫克,2 次/天)仅治愈了 25 名幽门螺杆菌患者中的 3 名。但 2 个月后,其余患者的症状有所改善(临床试验)。
在大鼠和小鼠中,姜黄素的摄入减少了由幽门螺杆菌引起的胃部炎症。
姜黄素可预防小鼠创伤弧菌引起的血液中毒。
当与抗生素联合使用时,姜黄素可减轻小鼠肺炎(肺炎克雷伯菌感染)。
抗 真 菌 性
姜黄素通过破坏存活蛋白来杀死念珠菌。
抗 病 毒 性
姜黄素抑制HIV病毒,丙型肝炎病毒,流感病毒A和流感肺炎。
★ 小 结 ★
一项小型临床试验的适度结果显然不足以支持使用姜黄治疗幽门螺杆菌感染。需要进一步的临床研究。
接下来介绍的也是天然抗生素,但没有临床证据支持其对抗感染,是对现有动物和细胞研究的总结,对进一步的研究工作具有指导意义。
08 辣 椒
辣椒的多种变型椒(Capsicum annuum),如红椒,辣椒粉,墨西哥辣椒等,具有抗菌性能的影响。
作用机理
辣椒素是辣椒中的主要活性化合物,使辣椒具有辣味,可通过降低胃部 pH 值来防止细菌感染。
此外,咖啡酸、槲皮素和山奈酚使细菌细胞的外层(膜)变硬,从而杀死它们。
辣椒中的一种化合物 ( CAY-1 ) 通过破坏细胞外层(增加细胞膜渗透性)来杀死真菌。
抗 细 菌 性
辣椒素限制了金黄色葡萄球菌α-毒素的产生并预防了小鼠的肺炎。
辣椒素可阻止细菌(霍乱弧菌)毒素的产生,并防止细菌(化脓性链球菌和金黄色葡萄球菌)在试管中侵入细胞。
抗 真 菌 性
CAY-1在试管中对许多真菌有效,如白色念珠菌、曲霉、小孢子菌等。其中一些真菌会引起皮肤病,例如脚气和癣。
副 作 用
适量的辣椒素被认为是安全的,但可能会引起胃部刺激。
药物相互作用
使用辣椒素可能会增加服用治疗高血压药物(ACE抑制剂)的患者出现咳嗽的风险。
★ 小 结 ★
辣椒限制限制了金黄色葡萄球菌α-毒素,霍乱弧菌毒素的产生,对引起脚气和癣的许多真菌有效,需要更多的临床研究。
09 姜
生姜是一种源自植物生姜根的香料。它常用于烹饪许多亚洲、阿育吠陀和中东美食。它以其许多治疗特性而闻名。
作用机理
生姜含有姜辣素、姜酚、姜油酮、萜类化合物、黄酮类化合物和其他具有抗菌和抗生物膜特性的化合物。姜酚和姜二醇是主要的抗真菌成分。
抗 细 菌 性
生姜在试管中对许多细菌菌株有效,其中一些是葡萄球菌、芽孢杆菌、沙门氏菌、大肠杆菌、铜绿假单胞菌、肺炎克雷伯菌、幽门螺杆菌等。
生姜提取物减少了胃中压力引起的损伤并抑制了胃酸的产生,从而限制了小鼠体内幽门螺杆菌的生长。
在一项细胞研究中,姜化合物杀死了这三种导致牙龈疾病的菌,分别是:牙龈卟啉单胞菌、牙髓卟啉单胞菌和中间普氏菌。
抗 真 菌 性
生姜对试管中的几种真菌菌株有效,包括导致皮肤病(如足癣)和食物腐败的真菌菌株:镰刀菌、曲霉属、白色念珠菌、酿酒酵母、石膏小孢子菌等。
抗 病 毒 性
新鲜生姜可防止人类呼吸道合胞病毒 (HRSV) 附着在人体细胞上,并阻止气道中斑块的形成。
此外,姜提取物抑制疱疹病毒(单纯型1和2)。
副 作 用
姜看起来几乎没有副作用。
药物相互作用
生姜中的一种活性成分(姜酚)会阻断一种分解药物的酶(细胞色素 p450)的活性,这可能会增加药物的作用。
★ 小 结 ★
姜对导致肠胃疾病,口腔疾病的细菌菌株有效,对导致皮肤病(如足癣)和食物腐败的真菌菌株有效,防止人类呼吸道合胞病毒附着,抑制孢疹病毒。也需要更多临床研究。
10 丁 香
丁香(Eugenia caryophyllata)以其抗氧化、抗菌、抗真菌和抗病毒特性而闻名。
作用机理
丁香会破坏细菌细胞的细胞和外层(膜),限制其生长以及 DNA 和关键蛋白质的产生。
抗 细 菌 性
丁香酚是丁香中最重要和最有效的成分,对试管中的空肠弯曲杆菌、大肠杆菌、单核细胞增生李斯特菌和肠沙门氏菌有效。
丁香阻止了许多细菌菌株的生长,包括金黄色葡萄球菌和大肠杆菌。它还可以杀死牙龈疾病患者唾液样本中的细菌。
此外,丁香油和肉桂油可抑制大肠杆菌、小肠结肠炎耶尔森氏菌、铜绿假单胞菌、猪霍乱沙门氏菌、金黄色葡萄球菌、单核细胞增生李斯特菌、蜡样芽孢杆菌和粪肠球菌的生长。
丁香、牛至和肉桂油的组合抑制鲍氏不动杆菌、鲍曼不动杆菌 RCH、肺炎克雷伯菌、大肠杆菌和铜绿假单胞菌的生长。
抗 真 菌 性
口服丁香提取物可防止口腔白色念珠菌的生长并减轻大鼠的感染症状。
丁香的主要成分丁香酚可对抗多种念珠菌属,可用于治疗口腔念珠菌感染(口腔念珠菌病)以及假牙使用引起的炎症和酸痛(假牙口炎)。
抗 病 毒 性
研究表明,丁香油可能有效对抗:
单纯疱疹病毒、丙型肝炎。
★ 小 结 ★
丁香对口腔疾病患者的许多菌株有效,需要更多的临床研究。
11 百里香
百里香(Thymus vulgaris)是地中海美食中使用的一种香料,也因其药用特性而闻名。
作用机理
百里香提取物和精油可阻断细菌的群体感应,如大肠杆菌和铜绿假单胞菌。
抗 细 菌 性
百里香提取物和精油的抑制细菌的许多菌株,包括大肠杆菌,沙门氏菌属,假单胞菌属(荧光假单胞菌和铜绿假单胞菌),粪肠球菌等。
抗 真 菌 性
百里香油与迷迭香和肉桂油一起减少了Penicillium expansum和Botrytis cinerea真菌的生长。
百里香、墨西哥牛至和芥子油可抑制单核细胞增生李斯特菌、金黄色葡萄球菌和肠炎沙门氏菌的生长。
抗 病 毒 性
百里香抑制以下病毒:
疱疹病毒(单纯型 1, 2)
12 迷迭香
迷迭香( Rosmarinus officinalis L. )是一种广泛使用的草药,以其抗氧化、抗炎、抗菌、抗真菌和抗病毒特性而闻名。
作用机理
迷迭香包含化合物(酚衍生物和二萜烯)等1,8-桉树脑,α蒎烯,莰烯,α萜品醇,和冰片,即具有抗氧化,抗微生物剂,抗癌作用。
迷迭香提取物和精油阻断细菌的群体感应,如大肠杆菌和铜绿假单胞菌。
抗 细 菌 性
迷迭香提取物有效地降低许多细菌菌株等的生长,如沙门氏菌,金黄色葡萄球菌,肺炎克雷伯氏菌,大肠杆菌,铜绿假单胞菌等。
抗 真 菌 性
迷迭香油与肉桂油和百里香油一起阻止了Penicillium expansum和Botrytis cinerea真菌的生长。
抗 病 毒 性
迷迭香提取物鼠尾草酚(一种酚类二萜)具有抗 HIV 的抗病毒特性。
13 柠檬草
柠檬草(Cymbopogon citratus)以其抗炎、抗氧化、抗菌和抗真菌特性而闻名。它被广泛用于治疗和芳香目的。
作用机理
柠檬醛α和柠檬醛 β是柠檬草油的主要成分,可阻止不同种类细菌(革兰氏阳性和革兰氏阴性菌)的生长。
抗 细 菌 性
在试管中,柠檬草提取物可以有效减少金黄色葡萄球菌、沙门氏菌、大肠杆菌、铜绿假单胞菌和许多其他细菌的生长。
抗 真 菌 性
柠檬草提取物减少了白色念珠菌、曲霉、石膏小孢子菌和多种青霉菌的生长。
抗 病 毒 性
柠檬草精油降低了一种蛋白质(HIV-1 Tat蛋白)的功能,从而减少了HIV病毒的复制。
14 没 药
没药(Commiphora molmol)在古埃及被用于制作木乃伊。现在,没药被用于治疗伤病和感染,因为它具有抗细菌和抗真菌特性。
作用机理
樟脑、冰片、芳樟醇和α-萜品醇是没药精油的主要成分,具有抗菌特性。
没药可防止生物膜的形成。
抗 细 菌 性
在试管,没药抑制细菌的生长,如金黄色葡萄球菌,大肠杆菌,沙门菌,铜绿假单胞菌,肺炎克雷伯氏菌。
抗 真 菌 性
没药提取物对白色念珠菌、黑曲霉和青霉菌有效。
副 作 用
据报道,没药引起皮肤过敏反应。此外,还报告了腹泻、鼻子刺激和心率变化等可能的副作用。
15 橄榄叶提取物
橄榄叶提取物仅攻击病原体而对人体共生的肠道细菌无害,这是其超越人造抗生素的一大优点,且广泛用于保健品和化妆品。
作用机理
橄榄叶提取物的抗菌活性是由于其多酚。
抗 细 菌 性
橄榄叶提取物抑制了三种食源性病原体(单核细胞增生李斯特菌、大肠杆菌和肠炎沙门氏菌)的生长。抑制了单核增生乳杆菌和肠炎链球菌的生物膜,抑制了单核增生乳杆菌的运动(细胞研究)。
抗 真 菌 性
叶子的甲醇提取物抑制酵母菌株(白色念珠菌和酿酒酵母)。
副 作 用
橄榄叶提取物传统上已在多种培养物中以多种不同方式制备和使用。
在大鼠身上评估了橄榄叶提取物的毒性,并认为是安全的。需要进行人体研究来验证这一点。
■ 目前还缺乏支持这些天然抗生素益处的人体试验,支持它们安全性的研究也有限。在某些情况下,临床试验的结果好坏参半。还需要进一步的临床试验来证实其对人类的益处。
■ 如有慢性病,应该遵循原有的治疗计划,而不是直接用来代替药物。或者与医生讨论这些是否可以作为补充方法。
附录:如何使用天然抗生素?
* 以下不作为临床验方使用,仅供参考
足部或指甲真菌感染
将几茶匙牛至油放入一桶水中,然后把脚浸泡。也可以将一滴牛至油与一茶匙椰子油或冷榨橄榄油混合来稀释油,涂抹在指甲或皮肤上。
鼻窦感染
在一大锅热气腾腾的水中滴几滴牛至油,吸入蒸汽(注意不要太热)。或者使用洗鼻壶(仅使用一小滴),感到有点闷之后结束,效果很好。
口腔感染(如鹅口疮)
用一茶匙冷压椰子油稀释一滴牛至油。漱口几分钟,然后冲洗干净。每天重复3-4次。
皮肤感染
用麦卡卢蜂蜜轻拍患处,并在患处涂抹泡沫,用纱布包上,或者用创可贴贴上。
也可以将1汤匙冷榨橄榄油和1瓣捣碎的大蒜混合。将大蒜放入油中,静置30分钟,然后过滤。如果你想加热的话,可以把它放在温水里(不是热水)。然后滴在感染的地方。
也可以用几滴高品质锡兰肉桂油。把它和麦卢卡蜂蜜混合在一起,然后把它涂抹在感染部位。这种方法非常有效,因为它是两种不同的天然抗生素的组合。
耳部感染
根据 Natasha Campbell-McBride MD 博士的说法,可以用上述注入大蒜油来治疗耳部感染。取油,稍微加热,每小时滴几滴在受影响的耳朵中。这也将有助于松动耳垢堆积。
感冒——增强免疫力
如果你或者周围人最近感冒了,可以每天服用1-2杯麦卡卢蜂蜜茶。可以帮助你预防或缩短病情持续时间。麦卡卢蜂蜜有点贵,不建议长时间每天都吃它,免疫力差时吃点。
压碎 1 瓣生大蒜,压碎比咀嚼要好(减少口臭),吞下大蒜,每天服用一次。
还可以将高质量的有机锡兰肉桂粉与麦卢卡蜂蜜或普通的有机生蜂蜜混合,每天两次。预防感冒,或显著缩短感冒的时间。
生姜可以缓解流感带来的恶心。比较糙吃不下的话,可以和别的(如蜂蜜,肉桂等)结合泡一泡。
主要参考文献:
Leng BF, Qiu JZ, Dai XH, Dong J, Wang JF, Luo MJ, Li HE, Niu XD, Zhang Y, Ai YX, Deng XM. Allicin reduces the production of α-toxin by Staphylococcus aureus. Molecules. 2011 Sep 15;16(9):7958-68.
Lu X, Rasco BA, Jabal JM, Aston DE, Lin M, Konkel ME. Investigating antibacterial effects of garlic (Allium sativum) concentrate and garlic-derived organosulfur compounds on Campylobacter jejuni by using Fourier transform infrared spectroscopy, Raman spectroscopy, and electron microscopy. Appl Environ Microbiol. 2011 Aug;77(15):5257-69.
Watson CJ, Grando D, Fairley CK, Chondros P, Garland SM, Myers SP, Pirotta M. The effects of oral garlic on vaginal candida colony counts: a randomised placebo controlled double-blind trial. BJOG. 2014 Mar;121(4):498-506
Salgueiro LR, Cavaleiro C, Pinto E, Pina-Vaz C, Rodrigues AG, Palmeira A, Tavares C, Costa-de-Oliveira S, Gonçalves MJ, Martinez-de-Oliveira J. Chemical composition and antifungal activity of the essential oil of Origanum virens on Candida species. Planta Med. 2003 Sep;69(9):871-4.
Valcourt C, Saulnier P, Umerska A, Zanelli MP, Montagu A, Rossines E, Joly-Guillou ML. Synergistic interactions between doxycycline and terpenic components of essential oils encapsulated within lipid nanocapsules against gram negative bacteria. Int J Pharm. 2016 Feb 10;498(1-2):23-31.
Foster BC, Vandenhoek S, Hana J, Krantis A, Akhtar MH, Bryan M, Budzinski JW, Ramputh A, Arnason JT. In vitro inhibition of human cytochrome P450-mediated metabolism of marker substrates by natural products. Phytomedicine. 2003 May;10(4):334-42.
Manayi A, Vazirian M, Saeidnia S. Echinacea purpurea: Pharmacology, phytochemistry and analysis methods. Pharmacogn Rev. 2015;9(17):63-72. doi:10.4103/0973-7847.156353
Carlos Tello, Jonathan Ritter, Puya Yazdi, 15 Natural Antibiotics and Side Effects, 2020
Mavric E, Wittmann S, Barth G, Henle T. Identification and quantification of methylglyoxal as the dominant antibacterial constituent of Manuka (Leptospermum scoparium) honeys from New Zealand. Mol Nutr Food Res. 2008 Apr;52(4):483-9.
Prabuseenivasan S, Jayakumar M, Ignacimuthu S. In vitro antibacterial activity of some plant essential oils. BMC Complement Altern Med. 2006 Nov 30;6:39. doi: 10.1186/1472-6882-6-39. PMID: 17134518; PMCID: PMC1693916.
Packiavathy IA, Priya S, Pandian SK, Ravi AV. Inhibition of biofilm development of uropathogens by curcumin – an anti-quorum sensing agent from Curcuma longa. Food Chem. 2014 Apr 1;148:453-60. doi: 10.1016/j.foodchem.2012.08.002. Epub 2012 Aug 10. PMID: 24262582.
Renault S, De Lucca AJ, Boue S, Bland JM, Vigo CB, Selitrennikoff CP. CAY-1, a novel antifungal compound from cayenne pepper. Med Mycol. 2003 Feb;41(1):75-81. doi: 10.1080/mmy.41.1.75.82. PMID: 12627807.
Aghazadeh M, Zahedi Bialvaei A, Aghazadeh M, et al. Survey of the Antibiofilm and Antimicrobial Effects of Zingiber officinale (in Vitro Study). Jundishapur J Microbiol. 2016;9(2):e30167.
Cameron Hooper, The Top 7 Most Effective Natural Antibiotics and How to Use Them, 2017,5
Chaieb K, Hajlaoui H, Zmantar T, Kahla-Nakbi AB, Rouabhia M, Mahdouani K, Bakhrouf A. The chemical composition and biological activity of clove essential oil, Eugenia caryophyllata (Syzigium aromaticum L. Myrtaceae): a short review. Phytother Res. 2007 Jun;21(6):501-6.
Vattem DA, Mihalik K, Crixell SH, McLean RJ. Dietary phytochemicals as quorum sensing inhibitors. Fitoterapia. 2007 Jun;78(4):302-10. doi: 10.1016/j.fitote.2007.03.009. Epub 2007 Apr 11. PMID: 17499938.
Nikkhah M, Hashemi M, Habibi Najafi MB, Farhoosh R. Synergistic effects of some essential oils against fungal spoilage on pear fruit. Int J Food Microbiol. 2017 Sep 18;257:285-294. doi: 10.1016/j.ijfoodmicro.2017.06.021. Epub 2017 Jun 24. PMID: 28763743.
Mothana RA, Al-Rehaily AJ, Schultze W. Chemical analysis and biological activity of the essential oils of two endemic Soqotri Commiphora species. Molecules. 2010 Feb 1;15(2):689-98. doi: 10.3390/molecules15020689. PMID: 20335939; PMCID: PMC6263184.
Liu Y, McKeever LC, Malik NS. Assessment of the Antimicrobial Activity of Olive Leaf Extract Against Foodborne Bacterial Pathogens. Front Microbiol. 2017;8:113. Published 2017 Feb 2. doi:10.3389/fmicb.2017.00113

谷禾健康
ResistoXplorer基于Web的耐药基因组数据可视化,统计和探索性新分析工具。
对宏基因组测序后的数据进行抗生素耐药性基因组的注释与分析,逐渐成为一条必经之路。过去,人们需要自己下载相关数据库再用比对工具进行比对,然后去冗余,再进行下游分析。这通常需要学习编程并熟练应用,对于一些临床医生或科研人员是一个很大的挑战。
最近有一款新的工具,用于对耐药基因组数据的成分分析,功能分析和比较分析。
ResistoXplorer,一款Web程序,地址:http://www.resistoxplorer.no
ResistoXplorer的主要功能包括:
1.支持多种常用和先进的方法,用于成分分析、可视化和探索性数据分析
2.全面支持各种数据归一化方法,包括标准的和最新的统计和机器学习算法
3.支持对配对数据集进行垂直数据综合分析的多种方法
4. ARG功能注释及其微生物和表型关联,基于10多个参考数据库的对比结果
5.功能强大且齐全的网络可视化,直观展现ARG于微生物的关联
打开网址后的界面:

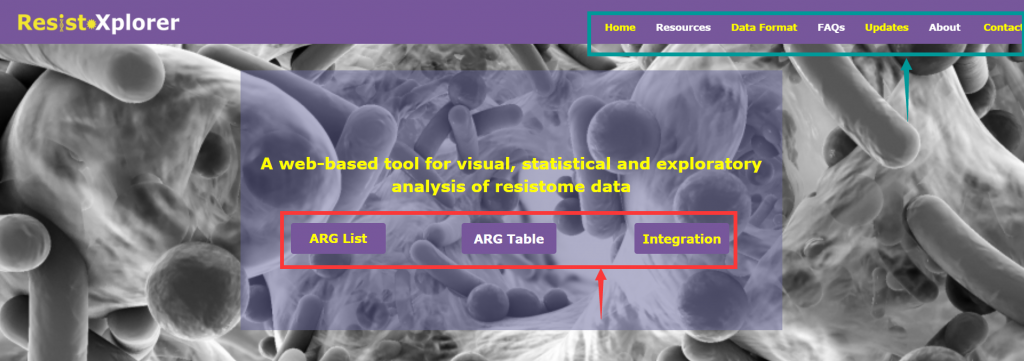
由三个主要分析模块组成(上图红色箭头所指框内):
“ARG List”:探索给定的ARG信息的功能和微生物宿主的关联,可视化网络。
“ARG Table”:对从宏基因组组学研究中获得的耐药基因组丰度文件进行功能分析,α多样性分析,排序分析,差异丰度分析等。
“Intergration”:综合分析,进一步探索潜在的联系,并结合新的生物学见解和假说,相似性分析,成对微生物-ARG相关分析等
上图绿色箭头所指框内:
“DataFormat”和“About”: 提供了关于注释表的格式、结构和数据库统计信息的详细描述
“FAQs”:提供了一些问题的答疑
“Resources”:分为“Manuals”和“Downloads”两个模块
Manuals是使用手册,对用户进行操作指导,建议仔细阅读。

Downloads,提供了示例上传文件和单个数据库的下载
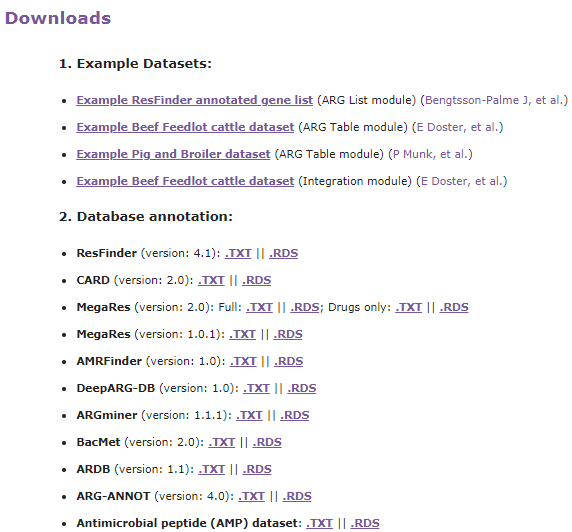
分析流程
ResistoXplorer接受抗性基因列表和ARG/taxa丰度表作为输入数据。然后是数据处理、数据分析和结果输出三个步骤。数据处理包括数据过滤和标准化,数据分析包括成分分析,比较分析和综合分析。结果输出以可视化图形,表格或html格式输出。
ResistoXplorer的功能注释使用的参考数据库来自9个通用的AMR数据库,CARD、ResFinder、MEGARes、AMRFinder、SARG、DeepARG-DB、ARGminer、ARDB和ARG-ANNOT。
此外,研究人员还从BacMet数据库和抗菌肽(AMP)耐药基因数据集中手动构建了功能注释信息,使用户能够对抗菌药物/金属和AMP抗性基因进行功能分析和下游分析。
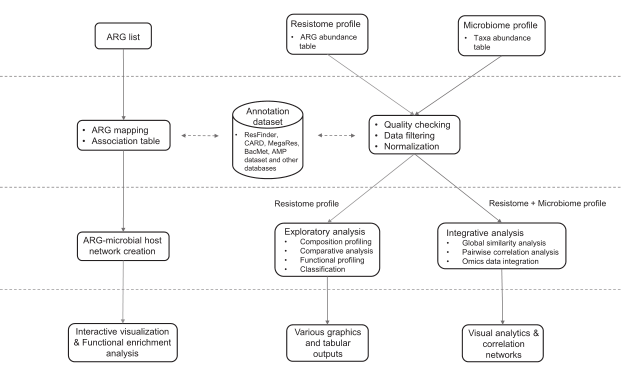
数据处理、分析及结果
数据过滤和标准化
默认情况下,低质量的特征会根据样本流行度及其丰度水平进行过滤。默认值是其他工具所使用的值,大多数在文献中可以找到。用户可以根据分位数间范围、标准差或变异系数排除这些低变异特征。
除alpha多样性和稀疏性分析外,过滤后的数据大多数用于下游分析。在综合分析的情况下,用户还可以对分类注释和耐药基因组丰度数据选择不同的数据筛选标准。
过滤后的数据还需要normalization(归一化)。ResistoXplorer提供了三种数据归一化方法,rarefying, scaling和transformation(稀疏、缩放和转换)。此外还支持其他归一化方法,如中心对数(CLR)和加性对数比(ALR)变换,以便于成分数据分析。方法的选择取决于要执行的分析类型。归一化后的数据用于探索性数据分析,包括排序、聚类和综合分析。用户可以自行探索适合的参数。
成分分析
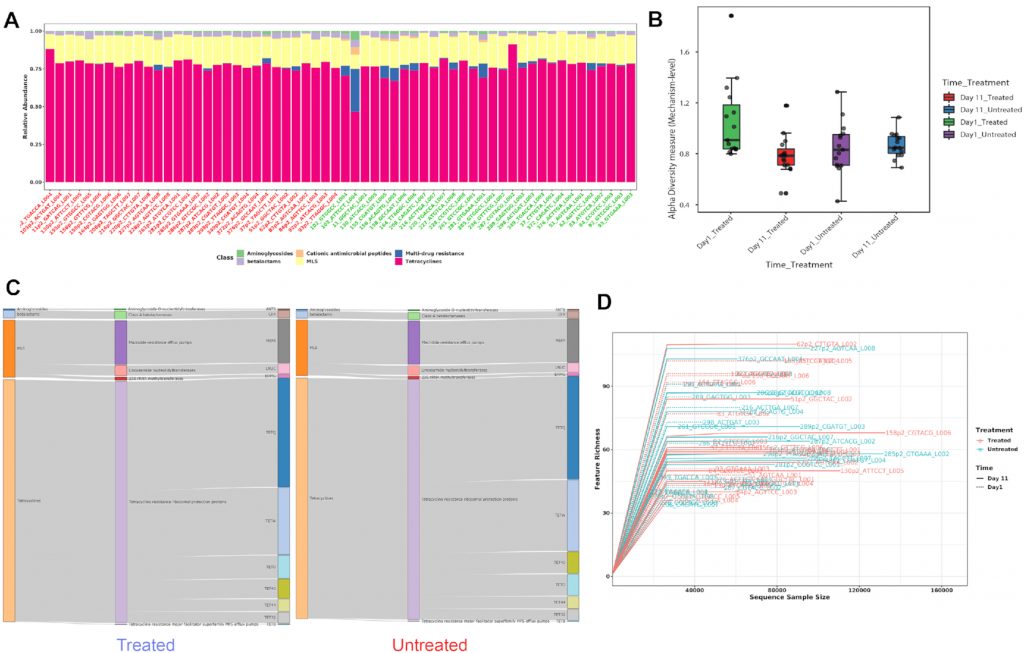


A) 显示各样本在不同分类水平下的ARG丰度。
B) Shannon多样性指数
C) 桑基图。显示了各组内的包括类别,机制和分组的ARG丰度分布。
D) 稀疏曲线。评估样本中估计的多样性的可靠性,在稀疏曲线中,识别的唯一特征(ARG)的数量与序列样本大小相对应。
E) 排序分析。左边是基于时间点的带有样本颜色的3D PCA图。右边是根据不同的治疗组和时间点绘制3D PCoA图。目前,支持三种通用的排序方法, PCoA、NMDS和 PCA。结果表示为2D和3D样本图。
比较分析
差异丰度分析
使用DESeq2、Edger、metagenomeSeq、Lefse,以及单变量分析方法,比如ALDEx2和ANCOM。DESeq2和Edger说明计数数据的特征,相比之下metagenomeSeq使用推荐的CSS规范化,在更大的分组规模下具有更高的性能。
Lefse使用标准的非参数检验统计显著性,结合线性判别分析来评估差异丰富特征的效应大小。
ALDEx2对来自数据的模型化概率分布的对数比值执行参数或非参数统计测试,并返回统计测试的期望值以及效应大小估计。
ANCOM使用非参数统计检验来检验所有特征对的对数比丰度,以找出均值差异。结果以表格样式展现。
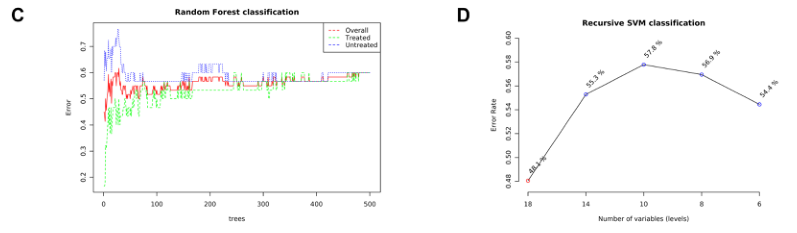
基于机器学习的分类
提供了两种功能强大的监督分类方法–随机森林和支持向量机(SVM),以识别潜在的生物标志物。
C)随机森林
D)展示了SVM在特征(变量)数量减少的情况下的分类性能
其他的一些可视化分析

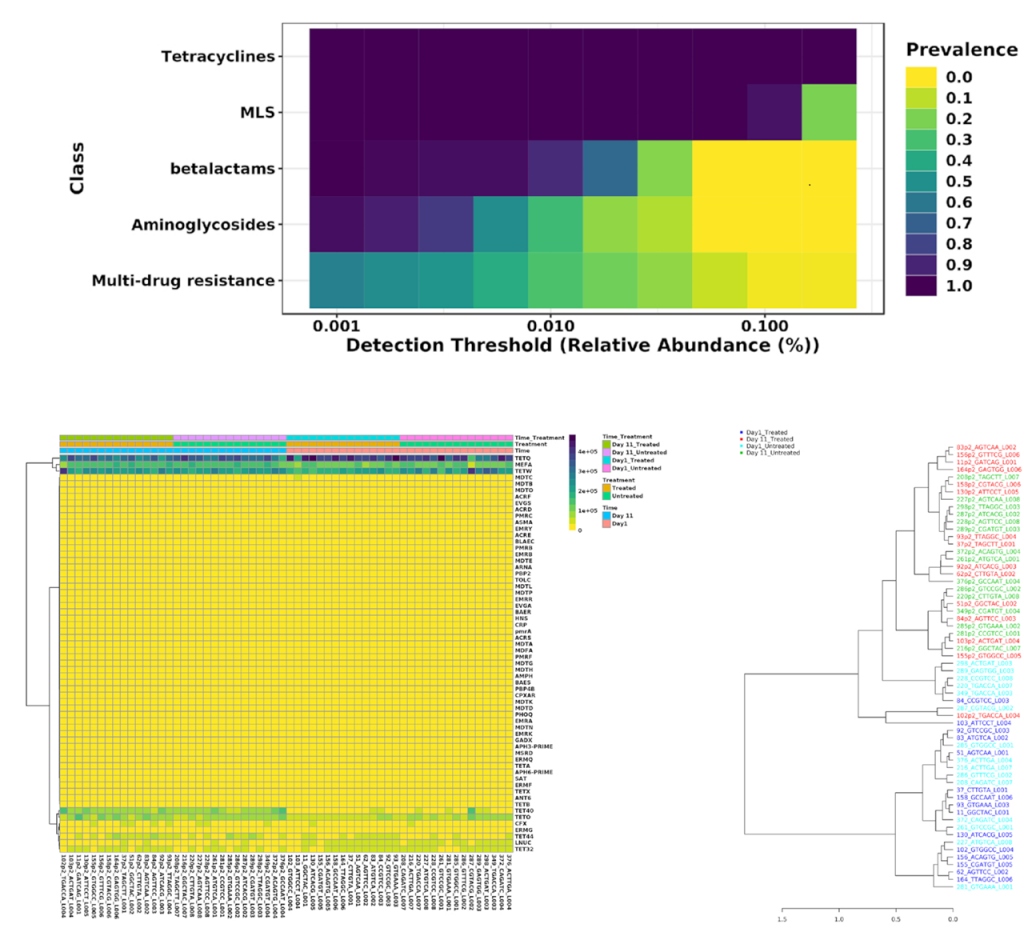
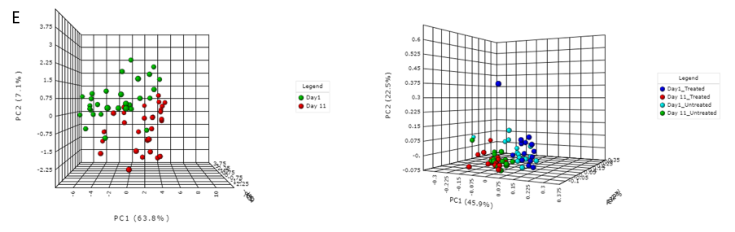
用户可以根据样本的丰度和流行程度,执行核心抗性分析来检测样本或样本组中存在的核心特征集,以热图的形式展现;以及关联分析和层次聚类,使用热图或者树状图可视化。
综合分析
使用各种综合数据分析方法来探索和揭示微生物群和抗性群之间潜在的潜在关联,这种分析大多用于探索不同环境中细菌和ARGs之间的联系。目前,为数据集成和相关分析提供了几种领先的、常用的单变量和多变量统计方法。所有这些分析都是在过滤和归一化数据集上执行的。
全局相似性分析
用两种基于多变量相关性的方法来确定微生物组和AMR数据集之间的总体相似性,分别为普鲁克分析(PA)和协惯量分析(CIA),在各种功能和分类级别上执行分析。相似系数和P值用于评估两个数据集之间的关联的强度和显著性,相似性系数在0到1之间,0表示两个数据集之间的完全相似,而1表示两个数据集之间的完全不相似。可视化结果用2D和3D排序图表示,如下图

A) 来自普鲁克分析的3D NMDS图,包含与数据集相关的样本、形状和颜色。
B) 来自协惯量分析的3D PCoA图,其中连接两点的线的长度表示两个数据集之间的样本的相似性。
组学数据集成方法
基于多变量投影的探索性方法,如正则化典型相关分析(RCCA)和稀疏偏最小二乘法(SPLS),用于微生物组和AMR数据的集成。这些方法旨在突出高维“组学”数据集之间的相关性。
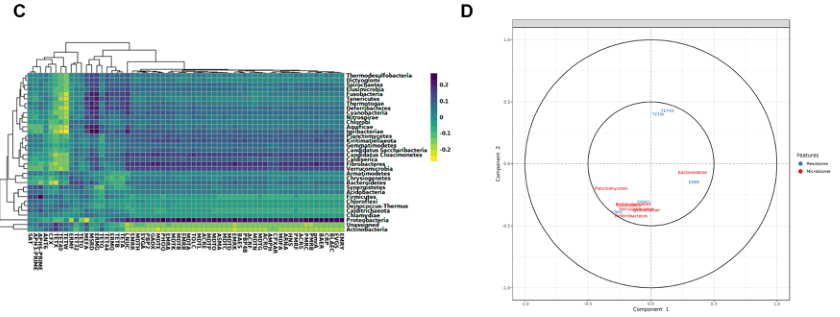
A 门水平微生物群落与ARGs(组水平)之间的聚类图像热图
B 显示存在于两个数据集中的特征(分类群/参数)的相关结构的相关圆图
成对微生物-ARG相关分析
使用单变量相关分析来确定单个菌群和ARGs(耐药基因组)之间是否存在强相关。使用Spearman、Pearson、CCLasso和最大信息系数(Maximal Information Coefficient)四种方法。用户可以使用绝对相关系数和调整p值的组合来选择强且显著的成对相关性。结果如下图,每个节点表示一个菌或ARG。用户可以双击一个节点,以突出显示网络中相应的相关节点。边缘的宽度和颜色表示两个节点之间相关性的强度和方向。
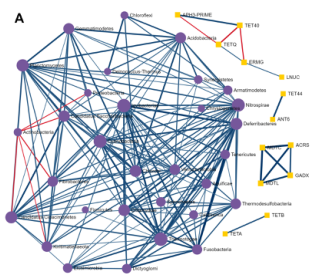
探索ARGs-微生物宿主网络
基于网络的可视化分析系统,提供了解ARGs和微生物宿主之间复杂的“多对多”关系的可能性。例如,通过查找在多个微生物中发现的ARGs或通过识别同时包含多个感兴趣的ARGs的微生物,可以直接从网络的角度找到承上启下的关键点。
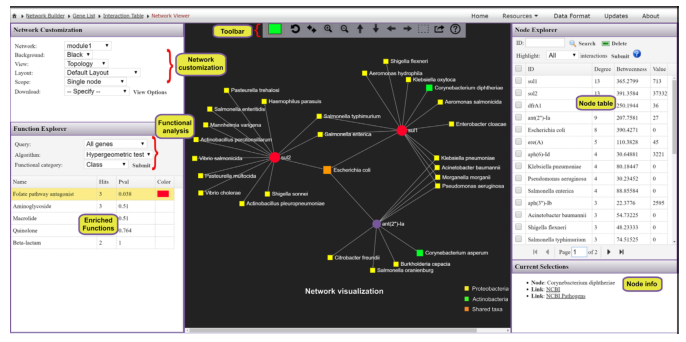
从ResistoXplorer程序中涵盖的数据库中搜集ARGs-微生物宿主信息,构建的关联表用于网络可视化和功能分析。如下图,它由三个主要组件组成:中央网络可视化区、左侧的网络定制和功能分析面板,包含节点表的右侧面板。
用户可以使用带滚轮的鼠标直观地查看和操作中心区域的网络。例如,可以滚动滚轮来放大和缩小网络,将鼠标悬停在任何节点上以查看其名称,单击节点以在右下角显示其详细信息,或双击节点以将其选中。
顶部的水平工具栏显示了操纵网络的基本功能。第一个是颜色选择器,能够为下一次选择选择高亮颜色。还可以使用工具栏中的虚线方形图标选择并拖动多个节点。对当前网络中存在的ARGs进行功能富集分析,使用超几何测试方法,这种方法与网络可视化系统相结合,在解释AMR耐药机制和提供ARGs的可能传播路径信息可能会有更好的效果。
文章中为了展示该工具的可用性,在已发表的一些研究中,选择了1个研究进行抗性分析,“利用商业饲养牛检验图拉霉素(抗菌药物)对肠道微生物组和耐药性的影响”,分析的内容就如同上面展示的那样,这里就不多加赘述。
与其他工具的比较,文章中也列举了一个表格,分别与AMR++Shiny、resistomeAnalusis、WHAM!在分析模块上进行了比较。实际上大同小异,主要的分析模块以及使用的数据库都是相似的,只是谁的数据库更强大,搭载的分析模块更多的区别。
哪款软件的算法和统计分析匹配你的实验数据,或者它能为你提供更多的数据信息,就是适合你的。
这款在线分析抗生素耐药性基因组的程序值得探索一下,统计分析方法和数据库内容都挺强大的,交互式的使用也免去了对编程语言的探索,并且开发人员也表示会持续更新和精选数据库以达到更准确的下游分析。
参考文献
Dhariwal A, Junges R, Chen T, Petersen FC. ResistoXplorer: a web-based tool for visual, statistical and exploratory data analysis of resistome data. NAR Genom Bioinform. 2021 Mar 24;3(1): lqab018.
Interagency Coordination Group on Antimicrobial Resistance No time to wait–securing the future from drug-resistant infections. Rep. Secret. Gen. Nations. 2019.
Simonsen G.S., Tapsall J.W., Allegranzi B., Talbot E.A., Lazzari S. The antimicrobial resistance containment and surveillance approach-a public health tool. Bull. World Health Organ. 2004; 82:928–934.
Cecchini M., Langer J., Slawomirski L. Antimicrobial Resistance in G7 Countries and Beyond: Economic Issues, Policies and Options for Action. Paris: Organization for Economic Co-operation and Development. 2015; 1–75.
Xia Y., Zhu Y., Li Q., Lu J. Human gut resistome can be country-specific. PeerJ. 2019; 7:e6389.
Forslund K., Sunagawa S., Kultima J.R., Mende D.R., Arumugam M., Typas A., Bork P. Country-specific antibiotic use practices impact the human gut resistome. Genome Res. 2013; 23:1163–1169.

谷禾健康
幽门螺杆菌(helicobacterpylori,H.pylori)是一种独特的,能持续定植于人类胃粘膜并能引起胃感染的细菌。
幽门螺杆菌是革兰氏阴性,螺旋形,微需氧细菌,定居于人类胃粘膜中。世界上有超过一半的人感染了幽门螺杆菌,但很多没有临床症状。幽门螺杆菌及其患病率在某些人群中高达80%。
据推测,幽门螺杆菌可能是人类土著微生物组的一部分,它与人类宿主之间有着很复杂的关系。
本文主要讨论幽门螺杆菌是如何与人类共同进化的,可能的机制可以解释基于人群的研究中幽门螺杆菌感染与几种疾病的发展之间的正相关性和负相关性,以及炎症和/或微生物组的变化是如何联系的各自的结果。
大多数幽门螺杆菌感染者并没有明显症状,但当症状出现时,一般是以下几种:
恶心,胃痛或胃灼热,空腹时腹部疼痛加剧。
怎样的情况有可能感染此菌?
幽门螺杆菌可能通过接触感染者的唾液、呕吐物或粪便传播,食用受污染的食物或水也会感染。
大多数感染幽门螺杆菌的人都是在儿童时期感染的。
有些因素可能会增加感染幽门螺杆菌的风险:
比如在拥挤的空间生活,没有干净的水,和患有幽门螺杆菌的人一起生活等。
什么情况下需要看医生?
当感觉有不寻常的胃痛或不适时,尤其是持续或反复发作的胃痛;
吞咽困难;
血腥,黑色或柏油样的粪便;
呕吐物带血或看起来像咖啡渣;
…
以上情况,最好去看医生。
( 如自行随意服用抗生素,效果不好的同时很可能带来抗生素耐药 )
如何诊断幽门螺杆菌?
目前最常见也实惠的方法是呼气检测,从分析到出结果只需数分钟,简单准确。
胃镜检查:做胃镜检查也包括幽门螺杆菌检测,因为可以取到胃里活性组织做病理切片检查。
抗体检查:通过抽血检查,以确定是否感染过幽门螺杆菌以及目前处于感染状态。
幽门螺杆菌会导致并发症?
包括溃疡,胃炎和胃癌。
溃疡约有10%的幽门螺杆菌患者会发展为胃溃疡(疼痛)。当幽门螺杆菌破坏保护胃和小肠内壁的粘膜时,就会发生这种情况,胃酸会渗透到衬里并造成伤害。
幽门螺杆菌可导致90%以上的肠道溃疡和80%的胃溃疡。
溃疡本身也会导致严重的并发症:
• 内部出血胃酸或溃疡渗入血管可能导致出血。
•阻塞溃疡会阻止食物离开您的胃。
•穿孔溃疡可能会深入并穿透胃或肠壁。
•腹膜炎 当溃疡引起感染或发炎时,可能发生腹膜炎症(腹膜)。
胃炎胃炎是胃黏膜炎症。幽门螺杆菌是处于患有这种病症的风险增加。
如果不治疗胃炎,可能会导致严重失血,并可能增加患胃癌的风险。胃癌是世界上与癌症相关的死亡的第二大最常见原因。
此外,幽门螺杆菌感染还与其他疾病有关,例如缺血性心脏病,2型糖尿病,贫血,肥胖受试者的不良代谢特征和胰岛素抵抗等。
幽门螺杆菌(Hp)感染会在胃微环境中产生剧烈变化,进而影响胃微生物群组成,并可能与肠道微生物群变化有关。可能会触发肠道共生稳态的重大改变,从而出现新的胃肠道平衡。
同时,用于根除幽门螺杆菌的治疗策略可以调节这种生理共生,但也可能相反,受到其特性的影响。感染,饮食,抗生素和/或生活方式会干扰这种共生关系。
幽门螺杆菌感染对胃微生物群的干扰
下一代测序对胃液和活检标本中的人体胃微生物群进行了研究,结果表明胃中存在多种细菌类群,主要由五个门组成,包括放线菌门、拟杆菌门、厚壁菌门、梭菌门和变形菌门。幽门螺杆菌感染极大地改变了胃微生物群的特征。
一项初步研究报道,幽门螺杆菌定植改变了胃微生物群,降低了微生物多样性,根除幽门螺杆菌可以恢复微生物多样性。
幽门螺杆菌可以利用几种机制来调节胃微环境。通过干扰质子泵的表达,幽门螺杆菌可以调节胃腔的酸度,从而使微环境与通常不能在胃中生长的微生物相容。
评估幽门螺杆菌感染对胃微生物群影响的研究
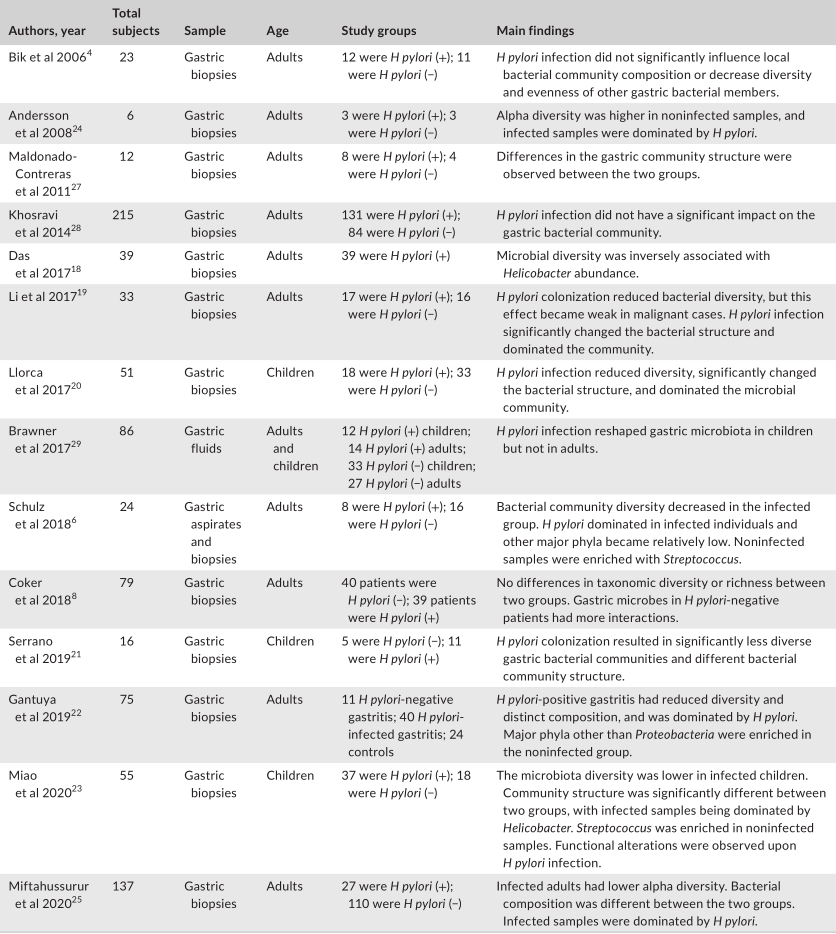
Tao et al., Helicobacter, 2020
此外,由于幽门螺杆菌的存在而改变的免疫反应可能会影响其他微生物群。幽门螺杆菌还可能通过动员抗菌肽或通过营养竞争来改变其他微生物群的生长。一般来说,研究人员表明,幽门螺杆菌的定植与α多样性的显著降低有关。微生物多样性和幽门螺杆菌丰度之间存在反比关系。
幽门螺杆菌感染对肠道微生物群的影响
与幽门螺杆菌阴性对照组相比,胃内有大量幽门螺杆菌的个体具有不同的肠道菌群,这表明胃肠段之间存在相互作用。
大多数研究表明,幽门螺杆菌感染与肠道微生物多样性之间的呈正相关。由于较高的微生物多样性通常与总体较好的健康状况有关,因此,探讨幽门螺杆菌感染后肠道微生物多样性的增加是否对宿主有一些有益的影响将是一个有趣的问题。
幽门螺杆菌感染对肠道微生物群影响的研究分析
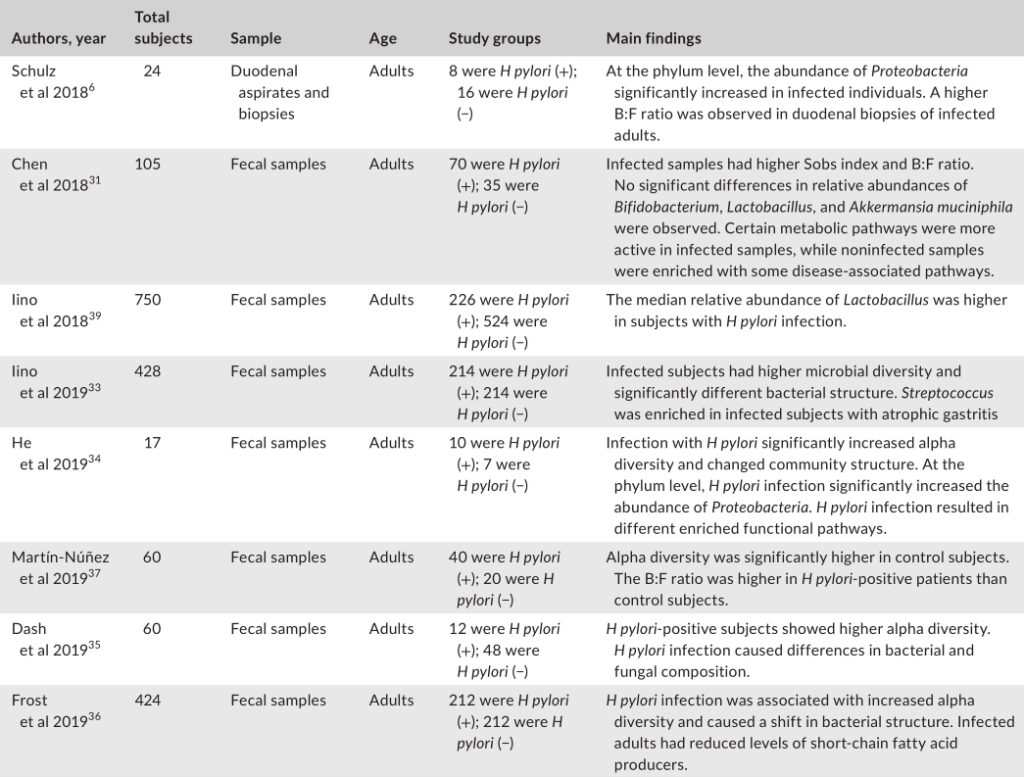
Tao et al., Helicobacter, 2020
幽门螺杆菌感染组和阴性对照组的微生物群落结构存在显著差异。
在门水平上的成分分析发现,受感染个体中变形菌的丰度显著增加,这可能是由于幽门螺杆菌从胃转移到肠腔所致。值得注意的是,拟杆菌与厚壁菌(B:F)的比率在幽门螺杆菌阳性组中更高。改变的B:F比值与临床相关,因为发现厚壁菌和拟杆菌与宿主的脂质代谢和能量平衡有关。
受感染与没感染组相比,双歧杆菌、乳酸杆菌和嗜粘液阿克曼菌的丰度没有显著差异。其他研究人员发现,幽门螺杆菌感染者体内乳酸杆菌的丰度更高。
一项研究发现,在幽门螺杆菌感染的患者中,萎缩性胃炎患者的肠道微生物群中链球菌更为丰富。
另一项研究发现,幽门螺杆菌感染的个体表现出短链脂肪酸(SCFA)产生者(如丁酸盐)水平的下降,SCFA对宿主产生有益的代谢作用。
此外,鉴于SCFAs受体在免疫细胞中的普遍表达,这些代谢物被认为在调节肠道内稳态中发挥重要作用。因此,幽门螺杆菌感染时抑制SCFAs的输出可能对人类健康有害。
有功能分析指出,在幽门螺杆菌阴性人群中,疾病相关途径更活跃。相比之下,许多代谢途径在感染的患者中的比例过高。因此,微生物群中的功能变化可能是特定于部位的,因为在肠道中观察到的变化与在胃中观察到的变化呈现不同的趋势。
根除疗法对胃微生物群的影响
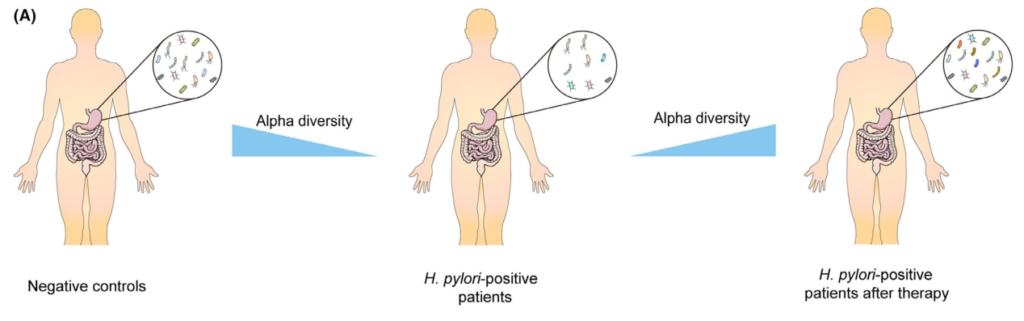
Tao et al., Helicobacter, 2020
充分的证据表明,成功清除幽门螺杆菌后,胃微生物多样性显著增加,但显示治疗失败后没有改善。研究人员认为恢复可能需要一定的时间,因为他们认为多样性从第0周到第6周和第26周逐渐增加。
此外,研究表明,成功根除幽门螺杆菌后,α多样性可以完全恢复到未感染对照组的水平。相反,尽管在清除幽门螺杆菌后,群落结构也可以部分恢复,但对于是否仍存在显著差异存在争议在根除后组和阴性对照组之间。
一些研究人员发现,接受抗幽门螺杆菌治疗的患者在治疗2个月后,胃微生物群落的组成恢复到未感染儿童的水平,然而,其他研究确定,成功治疗6个月后的成人样本仍显示出不同的菌群结构,阴性对照组则不同。
纳入分析的不同年龄组可能解释了相反的结论,因为另一项招募儿童的研究也发现根除组的菌群结构在治疗4周后与幽门螺杆菌阴性组的菌群结构接近。
根除治疗后评估胃微生物群变化的研究

Tao et al., Helicobacter, 2020
成分分析揭示了幽门螺杆菌的相对丰度治疗后幽门螺杆菌显著下降,而其他主要菌门,包括放线杆菌、拟杆菌、厚壁菌和梭杆菌,则增加。
在属水平上,治疗后乳酸杆菌和双歧杆菌(两种公认的益生菌)的数量显著增加。
两项研究的功能分析表明,成功治疗后,蛋白质和碳水化合物代谢途径上调。因此幽门螺杆菌感染期间,胃微生物群营养代谢功能受损,根除治疗可部分恢复。然而,预测的功能改变还需要进一步的验证。
根除治疗后肠道微生物群的变化
通过降低酸度,质子泵抑制剂(PPIs)已被证明对肠道微生物群产生显著影响。因此,抗幽门螺杆菌治疗对肠道微生物群的影响是PPIs、抗生素、铋联合应用的共同结果。总的趋势是,α多样性在根除后立即下降,随后又恢复。
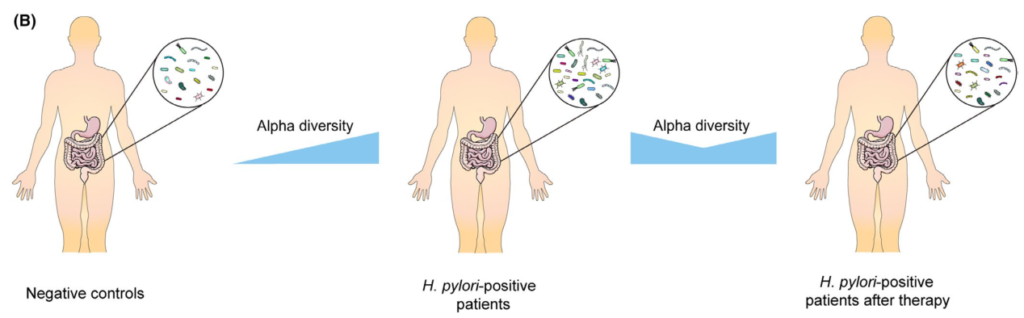

Tao et al., Helicobacter, 2020
具体来说,恢复需要多长时间仍有待阐明。大多数研究收集了随访2个月内的信息显示α多样性降低,而此后报告与基线无显著差异。
然而,一项研究报告,从第0周到第6周和第26周,Sobs指数和Chao指数都在下降没有达到统计学意义。值得注意的是,另一项研究发现,不同的治疗方案对肠道微生物群的影响可能不同。
在临床试验中,三种不同的治疗方案,包括三联疗法、联合疗法和铋四联疗法。结果表明,所有组的α多样性在第2周时都有所下降,但只有接受三联疗法的患者在第8周时才具有基本α多样性,而其他两组的α多样性在治疗后1年也无法恢复。
希望将来的研究验证根除疗法是否会导致肠道菌群的持续紊乱,以及不同的治疗方案如何影响可逆性。
分析根除疗法对肠道微生物群影响的研究
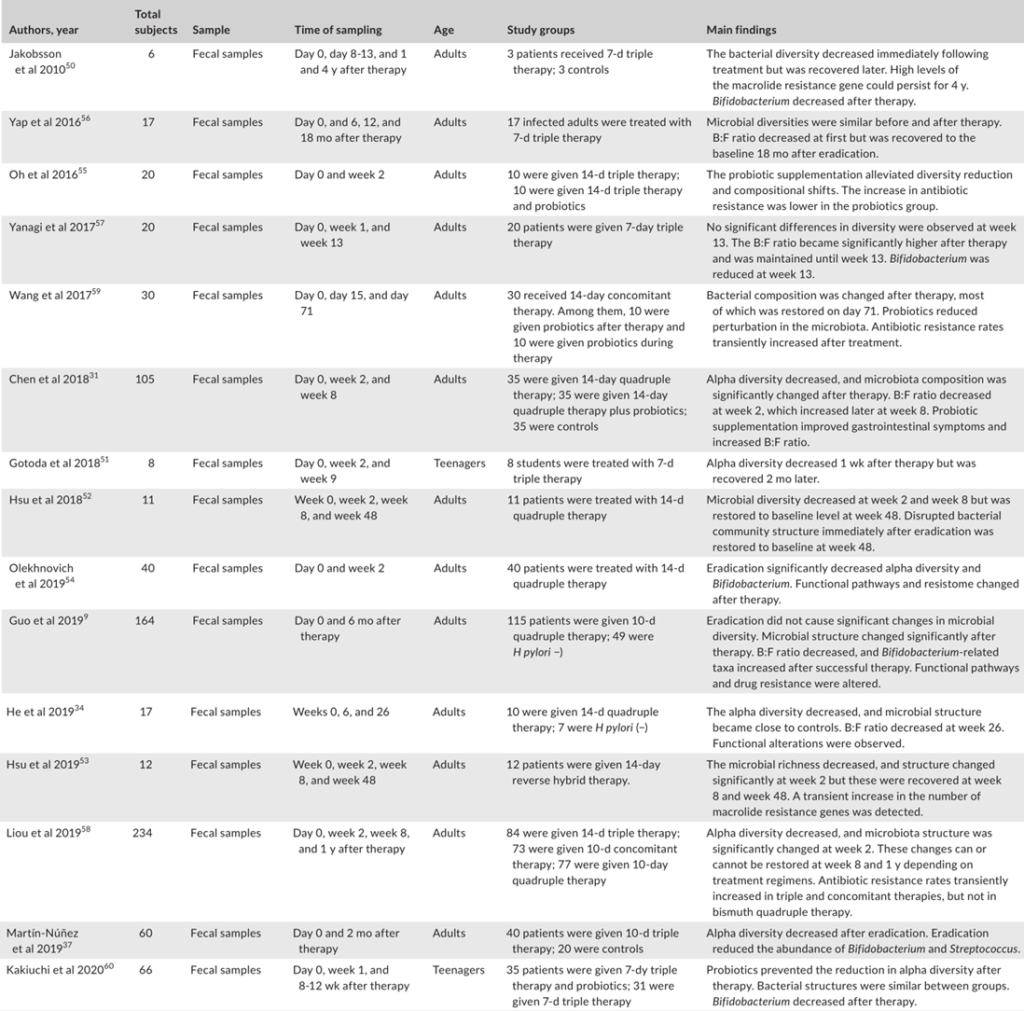

Tao et al., Helicobacter, 2020
益生菌的补充可以缓解抗生素引起的多样性和结构紊乱
益生菌,已被证明可稳定微生物群并改善胃肠道症状。在门水平上,治疗6个月后观察到厚壁菌群增加和拟杆菌减少,表明在幽门螺杆菌感染的个体中观察到的高B:F比率逆转。在另一项研究中报告了9个类似的结果。
临床证据支持肥胖与B:F比率降低相关。因此,这些研究中检测到的B:F比率降低可能为根除治疗后体重增加提供了一种可能的解释。然而,一些研究人员说明,在根除18个月后,降低的B:F比率可以逆转。有趣的是,益生菌补充被证明与根除治疗后较高的B:F比率相关。值得注意的是,报告的结果不一致。
一项研究表明,治疗后B:F比率立即增加,并在第13周保持高于基线水平。宏基因组研究的分类图谱显示,治疗后双歧杆菌的相对丰度下降。然而,另一项研究表明,双歧杆菌在成功根除6个月后增加。
在幽门螺杆菌阳性萎缩性胃炎的肠道微生物群中富集的链球菌在根除治疗后显著减少。
尽管不同研究中肠道微生物群的长期变化不同,但根除引起肠道内稳态的短期紊乱似乎是一致的。
根除疗法对肠道菌群抗生素耐药性的影响
随着根除疗法的广泛应用,抗生素耐药性的出现已成为临床实践中的一个重要问题。
根除幽门螺杆菌感染后,抗生素耐药性的上升以及根除治疗后的长期安全性是重要的问题。
通过药敏试验指导的个性化治疗可以在一线治疗中提供可靠的优异根除率,但贵且无法广泛获得。根据局部地区的抗生素耐药性,针对特定人群的经验疗法可能是一种替代策略。
已证明会改变幽门螺杆菌相关疾病风险的宿主因素包括宿主的年龄、在幽门螺杆菌的获得和幽门螺杆菌感染之间的持续时间,但更重要的是宿主免疫介质(多态性)和酸分泌状态。
除宿主因素外,吸烟和饮食等环境因素还会影响幽门螺杆菌定植的生态位,因此可能会影响疾病风险。

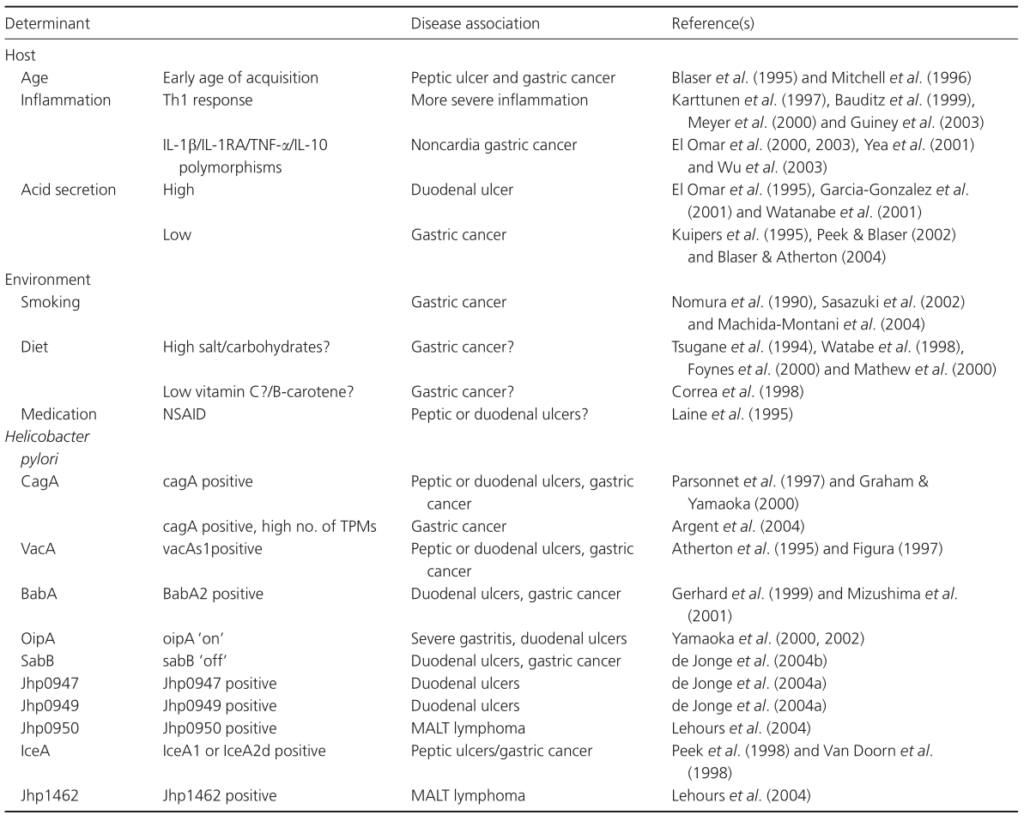
Karin et al., FEMS Microbiol Rev. 2006
在年幼时期感染幽门螺杆菌会增加患胃溃疡和胃癌的风险。 胃溃疡和胃癌的发展需要幽门螺杆菌的长期感染,因此,推测这些疾病是在慢性感染幽门螺杆菌的患者中更为常见。
此外,这种关联被认为是由不同年龄组的宿主免疫反应的差异所决定的。
感染幽门螺杆菌后,宿主胃上皮细胞释放细胞因子IL-8。这种细胞因子参与了巨噬细胞、中性粒细胞、肥大细胞、B细胞和T细胞募集到炎症部位。这些细胞通过分泌其他炎症介质,如干扰素(IFN-g)、肿瘤坏死因子(TNF-a)和白细胞介素(IL-1b),进一步增强免疫反应。
幽门螺杆菌相关发病机制的示意图

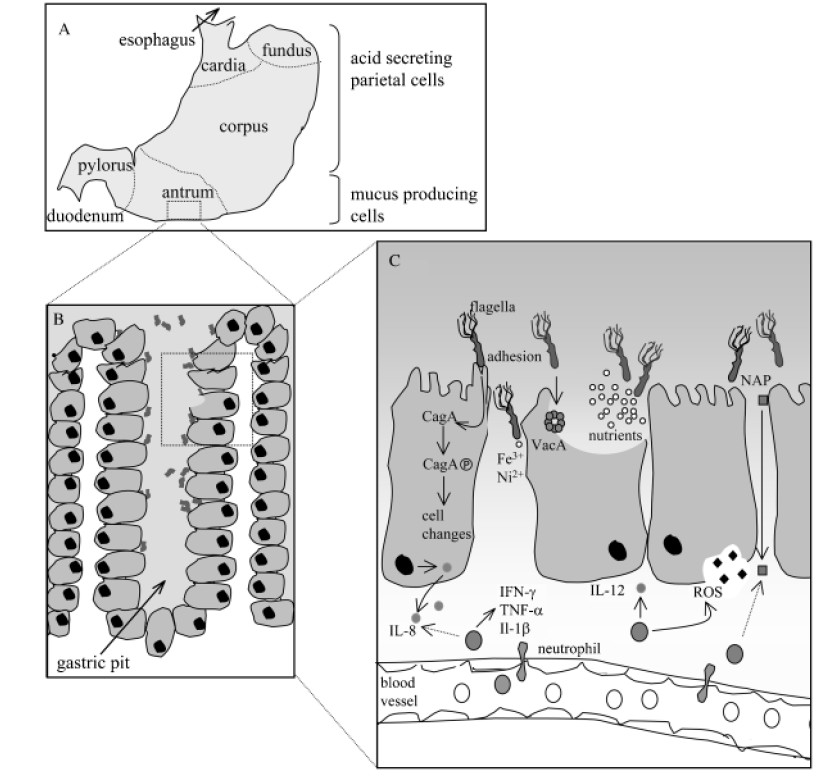
Karin et al., FEMS Microbiol Rev. 2006
A)在人类胃中,幽门螺杆菌主要定植于缺乏胃酸分泌壁细胞的胃窦中;
B)在胃小凹中,幽门螺杆菌尤其在上皮细胞紧密连接处附近增殖;
C)幽门螺杆菌对定植、持续和疾病发展具有重要作用的因子。
针对幽门螺杆菌的免疫反应进一步表现为活化的人类中性粒细胞中的氧化爆发。这种爆发会导致活性氧(ROS)的释放,活性氧是一种低分子量的代谢物,可破坏包括核酸在内的重要生物分。ROS可能损伤控制细胞生长的基因;并刺激癌症的发展。因此,免疫介质的存在会导致胃上皮的完整性受损。这种损伤是引起大多数与幽门螺杆菌感染相关的病理学,而不是直接的幽门螺杆菌活动。
幽门螺杆菌感染期间存在的免疫细胞主要是促炎细胞,而不是抗炎细胞。促炎介质由辅助性T细胞1(Th1)分泌。原始T细胞受多种因素驱动分化为Th1细胞,如TNF-a和IL-12。
在幽门螺杆菌刺激下,单核细胞大量产生细胞因子IL-12。因此,通过刺激IL-12的释放,幽门螺杆菌增强了促炎反应。这导致更多的损伤胃上皮,这容易发展胃萎缩。
一些编码免疫调节因子的宿主基因含有多态区域。这些基因的多态性将改变它们的转录,从而影响炎症过程。因此,幽门螺杆菌相关疾病的风险可能会改变。到目前为止,IL-1b、IL-1受体拮抗剂、IL-10和TNF-a基因的多态性已被证明与远端胃癌显著相关。
人类白细胞抗原(HLA)通过将病原体衍生的肽片段呈递给适当的T细胞,有助于消除病原体。HLA基因具有高度多态性,某些HLA等位基因与胃腺癌的发生有关。幽门螺杆菌感染也与胃腺癌的发生有关,但其存在与这些HLA等位基因的存在无关。因此,HLA等位基因在幽门螺杆菌介导的腺癌中的重要性仍然存在争议。
因此,遗传上预定的显性促炎性Th1反应与幽门螺旋杆菌疾病相关。
另一方面,Th1反应的强度可能受到抗炎Th2细胞因子IL10的产生的限制,从而延长感染时间。Th2型反应是由寄生虫引起的。因此,感染幽门螺杆菌的人的炎症反应和病理改变逐渐减弱。这可能导致这些个体慢性胃炎进展为胃癌的时间延迟。另外,不同的促炎反应可能直接导致幽门螺杆菌相关病理学的不同途径。
前面提到Th1反应导致胃壁细胞抑制其酸分泌。酸性较低的环境可能促进幽门螺杆菌的传播和持续。此外,当胃酸水平较低时,幽门螺杆菌以外的微生物可能在人体胃中生长,从而增强局部炎症反应。促炎细胞因子和胃酸分泌减少的联合作用增加了患消化性溃疡病和胃癌的风险。
另一方面,当酸的分泌减少时,十二指肠溃疡就不太可能发生。当酸的分泌增强时,十二指肠溃疡发生的风险增加。然而,同样在低酸性条件下,幽门螺杆菌感染后十二指肠溃疡的风险可能会增加。
胃壁细胞控制其产酸的能力在幽门螺杆菌相关疾病的发展中是重要的。幽门螺杆菌感染主要发生在人类胃中酸性较弱的部位,如胃窦。因此,胃酸分泌量高的宿主胃窦内幽门螺杆菌密度高,且主要发展为胃窦性胃炎。随后,胃体中完整的壁细胞被刺激分泌酸,从而诱导十二指肠的胃化生。幽门螺杆菌定植于这种胃化生,这可能导致十二指肠溃疡。
另一方面,胃酸分泌量低的宿主不仅胃窦易受幽门螺杆菌感染,而且胃体也易受幽门螺杆菌感染。感染的幽门螺杆菌可进一步抑制胃壁细胞的酸分泌。这可刺激胃上皮细胞持续增殖,导致胃腺进行性丧失,最终导致胃萎缩和癌症。
吸烟
一些环境因素与幽门螺杆菌相关的发病机制有关。吸烟是胃癌发展的主要因素。烟草烟雾含有致癌的亚硝胺,引发癌症的发展。
高盐饮食
一些饮食因素与幽门螺杆菌疾病有关。高盐饮食与幽门菌定植率、胃炎和胃癌风险增加。高盐浓度导致壁细胞萎缩,粘膜屏障破坏。然而,只有长期高盐摄入才会增加幽门螺杆菌相关疾病的风险。
高米饭摄入量
高米饭摄入量与胃癌之间存在正相关关系。米饭含有碳水化合物,可能会刺激胃粘膜。
水果和蔬菜摄入量低
水果和蔬菜摄入量低可能会增加胃癌的风险。水果和蔬菜含有抗氧化剂维生素C和β-胡萝卜素,通过中和活性氧来防止致癌。
因此,尽管有几个环境因素被认为与幽门螺杆菌相关疾病的发生有关,但它们的作用往往是有争议的。据推测,不同环境因素以及宿主和细菌因素之间的复杂相互作用妨碍了对研究结果的解释。
幽门螺杆菌因素在疾病发展中的总体影响是复杂的。到目前为止,已经描述了几种与幽门螺杆菌相关疾病的发生有关的幽门螺杆菌特异性蛋白。这些蛋白质被认为是导致幽门螺杆菌持续存在的原因。作为副作用,这些幽门螺杆菌蛋白诱导和改变炎症过程,损伤胃上皮,从而决定幽门螺杆菌感染后的结局。
CagA
与感染cagA阴性幽门螺杆菌分离株的患者相比,携带细胞毒素相关基因A(cagA)的幽门螺杆菌分离株的定植与严重胃炎、消化性溃疡病和远端胃腺癌的风险增加有关。
幽门螺杆菌cagA基因的存在或不存在经常被用作幽门螺杆菌中致病岛(PAI)存在或不存在的标记。 cag PAI由大约30个基因组成,并且在所有幽门螺杆菌分离株中占50%–70%。 位于cag PAI侧翼的两个31 bp重复序列之间的重组可能导致整个cag区域的缺失或获得。
cag PAI上的18个基因对于产生IV型分泌系统至关重要。 IV型分泌系统将细菌细胞中的蛋白(与毒力相关)转运到宿主细胞的胞质溶胶中。 这通常导致上皮细胞反应的级联反应的启动,例如细胞骨架的变化和细胞因子IL-8的分泌。
在幽门螺杆菌中,IV型分泌系统的成分将CagA蛋白转运到胃上皮细胞中。 随后,CagA蛋白被磷酸化。 然后,这种磷酸化的CagA与宿主磷酸酶SHP-2相互作用,引起细胞骨架的重排。 这导致宿主细胞形态发生变化,也称为“蜂鸟”表型。该表型的特征在于细胞扩散,上皮细胞的延长生长以及片状脂蛋白和丝状伪足的存在。
作为抵消事件,磷酸化的CagA与宿主Src激酶相互作用,从而减弱宿主SHP-2磷酸酶的信号传导。 这个过程减少了细胞骨架的重排,并阻止了CagA的进一步磷酸化。
最近,已经证明幽门螺杆菌菌株在体内诱导较高水平的CagA磷酸化。上皮细胞诱导更多的细胞骨架变化,并且更可能与胃癌有关。CagA磷酸化水平的差异是由cagA基因的30个区域内酪氨酸磷酸化基序(TPM)数量的差异引起的。
幽门螺杆菌人群,需要最低限度的免疫识别。因此,在萎缩的生态位中,这些TPM数量减少的亚克隆诱导了较弱的宿主免疫反应。
另一方面,较高水平的CagA磷酸化可引起强烈的炎症反应。 这种炎症会导致萎缩,并可能在限制高酸输出的生态位酸应激中发挥作用。
通过观察发现,缺乏cagA基因的幽门螺杆菌菌株是从消化性溃疡或胃癌患者中分离出来的,尽管其频率比cagA阳性幽门螺杆菌菌株的频率更低。
cagA和幽门螺杆菌相关疾病之间的关联在不同的地理区域中有所不同。 这种变异可能与CagA表达的差异有关。
然而,CagA并不是唯一的。幽门螺杆菌蛋白负责屏障功能障碍,而这一过程并没有随着CagA的清除而丢失。下一节讨论的VacA蛋白也很重要。
VacA
最初显示真核细胞在带有幽门螺杆菌的体外测试系统中经历空泡化和连续变性。 后来证明这种现象是由幽门螺杆菌毒素诱导的,现在被称为空泡细胞毒素A(VacA)。
VacA或CagA不能单独用作临床结果的决定因素。
VacA如何发挥作用,导致细胞死亡?
幽门螺杆菌VacA是一种高度免疫原性的95-kDa蛋白。VacA结合上皮细胞的顶端部分,形成阴离子选择性孔。
通过这些孔,碳酸氢盐,氯化物和尿素从细胞质中释放出来,然后,VacA被内吞进入晚期的内体区室,并改变这些区室的通透性。
在弱碱(例如氨)的存在下,这会导致水涌入,从而导致囊泡肿胀和液泡形成。 细胞内内吞途径的损伤最终导致细胞死亡。
这导致了上皮细胞抗性的降低,因此低分子量分子如Fe3+和Ni2+可以很容易地穿过上皮细胞层。Fe3+和Ni2+分子分别是幽门螺杆菌生长和脲酶活性的关键因子。
因此,推测通过降解上皮细胞屏障,幽门螺杆菌可以更容易地获得这些关键因子。
幽门螺杆菌VacA也与壁细胞的降解有关,这导致酸分泌减少,使宿主容易患上胃癌。 持续感染过程中VacA表达水平的差异导致毒性改变。 因此,溃疡的消长可以通过随时间变化的VacA表达变化来解释。
在体外在胃上皮细胞附近诱导vacA基因的转录。 这一发现证实了VacA与宿主细胞相互作用的重要性。 此外,VacA可以逃避适应性免疫反应,从而增强幽门螺杆菌在胃粘液层中的持久性。
幽门螺杆菌外膜蛋白(HOPs)
在革兰氏阴性细菌中,外膜介导与其周围环境的相互作用。 在感染期间,假定存在于幽门螺杆菌外膜上的蛋白质被改变,使得宿主免疫系统的识别作用降至最低。
幽门螺杆菌分离物含有约30种不同的外膜蛋白(HOP)。 其中几种是粘附素。 在革兰氏阴性细菌中,粘附素最常形成聚合菌毛结构。 但是,在幽门螺杆菌中,这些粘附素已经适应了胃环境,其中酸性条件可能会使这种聚合物菌毛结构解聚。
岩藻糖基化的糖蛋白和唾液酸化的糖脂都已被证明是胃上皮中幽门螺杆菌的结合位点。
与宿主细胞的粘附可保护幽门螺杆菌免受蠕动和粘膜脱落。
此外,推测粘附力可以使幽门螺杆菌更好地获取从胃上皮释放的营养物质,并更有效地将细菌毒素传递至宿主细胞。
另一方面,在剧烈炎症的部位,粘附特性的丧失可能使幽门螺杆菌逃脱宿主免疫细胞的杀伤。目前为止,一些HOP与疾病的发展有关。
幽门螺杆菌BabA (HopS)介导幽门螺杆菌粘附于人Leb血型抗原,这些抗原存在于胃上皮细胞上。BabA黏附促进幽门螺杆菌定植,增加上皮细胞分泌IL-8,导致粘膜炎症增强。
BabA调节的两种机制都有助于促进慢性感染的动态反应。
在慢性炎症期间,选择增加或减少粘附的周期可在所有血型的人群中获得所有类型的Leb结合。
宿主粘膜糖基化模式导致BabA进化,使幽门螺杆菌菌株适应其个体宿主,这有助于避免宿主反应,并在全世界范围内造成幽门螺杆菌感染的异常长期性。
幽门螺杆菌可塑性区域毒力因子
两个单独菌株基因组序列的比较表明,一个菌株中存在的幽门螺杆菌基因中约有6%-7%不存在于另一个菌株中,反之亦然。
大约一半的菌株特异性基因存在于高变区;可塑性区。 位于这种可塑性区域的基因通常与毒力增加相关。
在幽门螺杆菌中,可塑性区确实编码了与IV型分泌有关的Vir型ATP酶。 在幽门螺杆菌中,该分泌系统在例如分泌CagA细胞毒素中很重要。目前为止,一些位于可塑性区的幽门螺杆菌基因与幽门螺杆菌相关的疾病有关。
幽门螺杆菌Jhp0947和Jhp0949与十二指肠溃疡疾病相关。这两个基因均位于幽门螺杆菌菌株J99可塑性区,在幽门螺杆菌介导的IL-12释放中很重要。
在体外测试系统中从单核细胞中提取。 细胞因子IL-12对于使免疫反应偏向促炎性Th1应答是必不可少的,并且与十二指肠溃疡的形成密切相关。
由jhp0947和jhp0949编码的蛋白质的功能未知。 然而,已经假设这些蛋白通过与单核细胞的相互作用诱导促炎细胞因子IL-12的产生。
IL-12水平升高会导致幼稚T细胞分化为活化的Th1细胞,从而导致炎症反应增强和组织损伤增加。
幽门螺杆菌Jhp0950,编码一种未知功能的蛋白质,也是J99可塑性区的一部分。该基因的存在与cagA、cagE、vacA s1m1、babA2、hopQ T1、oipA有关。
在幽门螺杆菌J99基因组中,Jhp0950与Jhp0949相邻。与Jhp0949不同,Jhp0950与十二指肠溃疡风险增加无关。然而,它与疾病的关联支持了位于可塑性区域的幽门螺杆菌基因可能与毒性相关的观点。
其他幽门螺杆菌毒力因子
在美国和荷兰,幽门螺杆菌iceA1基因(iceA基因的两个等位基因变体之一)在幽门螺杆菌感染的消化性溃疡患者中比仅在幽门螺杆菌感染的胃炎患者中更为普遍。
与许多其他与毒力相关的基因相似,IceA表达与幽门螺杆菌相关疾病之间的联系是群体依赖性的。
在东南亚,未发现iceA1与幽门螺杆菌相关疾病之间的关联。 有趣的是,对iceA1呈阳性的南非幽门螺杆菌分离株在幽门螺杆菌感染的胃癌患者中比仅在幽门螺杆菌感染的胃炎患者中更普遍。
注:幽门螺杆菌iceA1最初是在与胃上皮细胞接触后转录上调后被鉴定的,iceA1基因编码的核酸内切酶与乳球菌中的限制性核酸内切酶NlaIIIR非常相似,伴随的高度保守的脱氧核糖核酸腺嘌呤甲基转移酶的活性,由幽门螺杆菌编码,似乎与控制幽门螺杆菌的基因表达有关。
幽门螺杆菌Jhp1462与MAL T淋巴瘤、十二指肠溃疡和胃腺癌的风险增加相关。由Jhp1462编码的蛋白质的功能是未知的,其在严重胃十二指肠疾病发展中的重要性仍有待阐明。
以上,我们看到幽门螺杆菌通过各种方式给人体带来种种不利影响,它似乎不应该在人体中长期生存,然而,幽门螺杆菌在人体内存在有着的悠久的历史,那么幽门螺杆菌是如何保护自己在人体中安稳生存下来?
幽门螺杆菌在疾病发生之前会长期感染人胃粘膜。 因此,导致幽门螺杆菌定植和持续存在的因素与幽门螺杆菌相关的发病机理具有内在联系。 在胃腔进入后,幽门螺杆菌必须应付胃酸。
幽门螺杆菌通过其耐酸性在这种酸性条件下得以生存:然后穿过粘液层到达其接近胃上皮细胞的位置。趋化性,运动性和粘附性是胃上皮细胞定殖的重要过程。
为了在人胃粘膜中长期持久存在,幽门螺杆菌还不断需要宿主提供营养。 这是通过降解粘液层和下面的胃上皮细胞的完整性来实现的。 此外,通过抑制宿主免疫系统,抗原变异和抗原拟态避免了幽门螺杆菌的清除。
耐酸性
幽门螺杆菌生长的下限pH值是5.0-5.5,具体取决于测试的分离物。在胃粘膜层中,pH也是酸性的,大约在4-6.5之间变化。而且,当粘液层被破坏时,pH值可能会偶尔下降。
酸冲击(pH<3)后幽门螺杆菌的存活取决于幽门螺杆菌蛋白脲酶的活性,该酶将尿素转化为氨和碳酸氢盐。这导致幽门螺杆菌的周质或细胞质被中和。幽门螺杆菌尿素酶活性对于在酸性pH下体外存活以及在动物模型中胃粘膜定植至关重要,这证明了尿素酶在幽门螺杆菌感染中的重要性。
在中性pH下高度活跃的脲酶和酸调节的尿素通道的结合解释了为什么幽门螺旋菌在人类胃部的生存能力是独特的。有效抑制UreI蛋白,将提供一种从正常的,分泌酸的胃中根除幽门螺杆菌的方法。
除耐酸性外,脲酶还具有与胃定植有关的其他基本功能
尽管尿素酶对于酸休克的生存是必不可少的,但是幽门螺杆菌尿素酶在处理胃上皮细胞附近的慢性酸性环境时还是不够的。 用酸抑制剂治疗不能恢复尿素酶阴性突变体定殖在生侏儒仔猪胃中的能力。
脲酶参与幽门螺杆菌的氮代谢,脲酶活性产生的氨和碳酸氢盐被认为会影响宿主的许多细胞过程,包括细胞裂解。
除脲酶外,非脲酶基因也有助于耐酸,并且在酸性pH下的存活和生长与脲酶无关。 在这些非脲酶基因中,已显示三种调节蛋白(Fur,NikR和HP0166)对幽门螺杆菌的适应性有贡献。 这表明严格调节耐酸机理的重要性。
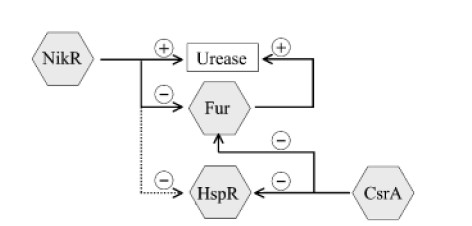
Karin et al., FEMS Microbiol Rev. 2006
NikR通过Fur调节系统直接和间接调节脲酶的表达。CsrA调节Fur和HspR调节系统的表达。通过不同基因调节蛋白的相互作用,幽门螺杆菌能够感知和响应多种信号。
细胞的趋化作用与运动
胃上皮细胞层覆盖着一层厚厚的粘液。假定该层甚至对于小分子也相对不可渗透。幽门螺杆菌的能动性和趋化性是有效穿透这一粘液层的关键。
在小鼠感染模型中,几乎任何运动和趋化性系统基因的诱变都消除了幽门螺杆菌感染胃粘膜的能力,强调了这些因素对定殖的重要性。
运动性
幽门螺杆菌的运动性是通过存在两到六个极性的带鞘鞭毛而实现的。鞭毛由三个结构元素组成:基体,钩子和细丝。迄今为止,超过50种蛋白质与鞭毛的结构或调控组织有关。
鞭毛丝由两个亚基FlaA和FlaB组成。幽门螺杆菌flaA和flaB突变体无法在感染仔猪的模型中定植,表明幽门螺杆菌鞭毛对定殖是必需的,幽门螺杆菌的毒力也因此而增加。
幽门螺杆菌motB基因编码鞭毛运动旋转蛋白。 幽门螺杆菌motB基因敲除突变体仍包含鞭毛,但不能运动。该突变体在小鼠中定植的能力降低,证实了运动性是完全传染性所必需的。
鞭毛基因转录的调控不同于许多其他细菌。与许多其他带鞭毛的革兰氏阴性细菌相反,幽门螺杆菌没有转录调控因子来调控鞭毛基因的转录。
据推测,幽门螺杆菌的运动不需要严格的调节,因为它在任何时候都是不可或缺的。然而,在幽门螺杆菌中仍然可以看到一些转录调控。例如,蛋白质FlhA和FlhF,基体的组成部分,需要在中后期鞭毛基因转录之前出现。
趋化性
除了运动性,趋化性对于幽门螺杆菌的定植也是必不可少的。趋化性允许幽门螺杆菌将其运动导向胃上皮细胞层。
由HP0099编码的幽门螺杆菌趋化性受体传感器识别碳酸氢盐和精氨酸作为引诱剂。幽门螺杆菌外膜上这种传感器蛋白与反应调节剂CheY偶联。
反应调节剂CheY调节鞭毛运动蛋白的表达,使幽门螺杆菌游向其生态位。
应答调节因子CheY的一个敲除突变体未能在非生物小猪体内定殖,强调了趋化性在最初定殖中的重要性。
反应调节因子CheY及其组氨酸激酶的敲除突变体显示出对粘蛋白的趋化性反应减弱。
免疫逃避
在长期的定殖过程中,宿主对多种幽门螺杆菌抗原产生强大的免疫反应。然而,这些抗原通常没有表面暴露。
另一方面,表面暴露的抗原通常高度多样化,使宿主清除幽门螺杆菌变得更加困难。幽门螺杆菌感染极少产生足够的免疫反应,能够清除细菌。 实际上,幽门螺杆菌能够有效规避先天性和适应性免疫反应。
先天的免疫反应不能实质上识别幽门螺杆菌。大肠杆菌脂多糖(LPS)通过TLR4激活先天免疫应答。然而,幽门螺杆菌LPS远不是TLR4介导的基因表达的有效诱导剂。
在幽门螺杆菌中,TLR5介导的免疫应答激活效率也较低。 与肠沙门氏菌血清型鼠伤寒鞭毛蛋白相比,幽门螺杆菌鞭毛蛋白没有被释放,并且在通过TLR5激活IL-8分泌中也没有那么强。
先天性免疫反应未能识别幽门螺杆菌可能导致适应性免疫反应失败以随后清除感染。
自适应免疫系统的逃避至少由两个重要机制介导:抗原模拟和免疫抑制。抗原模拟导致宿主免疫系统无法正确识别幽门螺杆菌。例如,幽门螺杆菌LPS上的Le血型抗原也在人类上皮细胞上表达。结果,幽门螺杆菌LPS免疫原性差,从而支持幽门螺杆菌的持久性。在其LPS上缺少O抗原的幽门螺杆菌菌株在小鼠中定殖的能力显着降低。因此,幽门螺杆菌LPS的典型结构在定植中很重要。
除了通过抗原模拟来逃避免疫外,免疫抑制也有助于幽门螺杆菌感染的慢性化。
免疫应答可能偏向更抗炎的应答,或者下调(VacA)。幽门螺杆菌VacA可以阻断巨噬细胞中的吞噬体-溶酶体融合,导致巨噬细胞无法杀死幽门螺杆菌。
此外,VacA表达阻断T细胞活化并因此增殖,活化T细胞凋亡,并抑制T细胞中的抗原呈递。
B淋巴细胞的抗原加工可能被阻止,可能是通过将内体的成熟限制在发生抗原加载的MHC II类区室中。因此,VacA限制了针对幽门螺杆菌的T细胞和B细胞应答。
幽门螺杆菌的存在可以预防某些疾病?
通过以上各种方式,幽门螺杆菌得以在人体中生存下来,从某种程度上来说,幽门螺杆菌并不总是对人类宿主有害。
研究表明,幽门螺杆菌的存在可能抑制引起结核的细菌(结核分枝杆菌),预防哮喘,克罗恩病,食管反流,腹泻病以及食道癌。 幽门螺杆菌的发病率下降与儿童过敏性疾病和自身免疫性疾病,多发性硬化,腹腔疾病的发病率上升相关。
因此,从某种程度上来说,幽门螺杆菌有其存在的价值。这引起了关于是否需要根除幽门螺杆菌的讨论。
需要明确的是,幽门螺杆菌感染后不会立即对人体产生致死性危害和严重后果,所导致的慢性胃炎、消化道溃疡和胃癌等疾病是长期存在并慢性与其他因素共同作用的结果。
第五次全国幽门螺杆菌感染处理共识报告中有如下陈述:
根除幽门螺杆菌的获益在不同个体之间存在差异
根除幽门螺杆菌促进消化性溃疡愈合和降低溃疡并发症发生率,根除幽门螺杆菌可使约80%早期胃 MALT 淋巴瘤获得缓解。与无症状和并发症的 幽门螺杆菌感染者相比,上述患者根除幽门螺杆菌的获益显然更大。胃癌发生高风险个体有胃癌家族史、早期胃癌内镜下切除术后和胃黏膜萎缩和(或)肠化生等。根除幽门螺杆菌预防胃癌的获益高于低风险个体。

在做出可靠的功能性消化不良诊断前,必须排除幽门螺杆菌相关消化不良。
幽门螺杆菌胃炎伴消化不良症状的患者,根除幽门螺杆菌后可使部分患者的症状获得长期缓解,是优选选择。
幽门螺杆菌感染是消化性溃疡主要病因,不管溃疡是否活动和是否有并发症史,均应该检测和根除幽门螺杆菌。
…
总的来说,对于无抗衡因素 ( 高龄、伴存疾病、社区再感染率、卫生经济因素等 ) 的个体,根除幽门螺杆菌治疗利大于弊。
儿童:
不推荐对 14 岁以下儿童行常规检测幽门螺杆菌。推荐对消化性溃疡儿童进行幽门螺杆菌检测和治疗,因消化不良行内镜检查的儿童建议行幽门螺杆菌检测与治疗。
与成人相比,儿童根除治疗不利因素较多,包括抗菌素选择余地小,对药物不良反应耐受性低。此外,儿童幽门螺杆菌感染有一定自发清除率,根除后再感染率也可能高于成人。
老年人:
老年人根除幽门螺杆菌治疗药物不良反应风险增加,因此对老年人根除幽门螺杆菌治疗应该进行获益-风险综合评估,个体化处理。
问卷调查显示,多数临床医生对老年人根除幽门螺杆菌治疗的态度趋向保守。一般而言,老年人(年龄>70 岁)对根除幽门螺杆菌治疗药物的耐受性和依从性降低,发生抗生素不良反应的风险增加;另一方面,非萎缩性胃炎或轻度萎缩性胃炎患者根除幽门螺杆菌预防胃癌的潜在获益下降。
合理看待幽门螺杆菌感染后果至关重要,对自然人群中幽门螺杆菌感染是否需要进行干预,需要综合权衡利弊。对于有根除治疗指征的患者,需要给予规范治疗,提高首次根除率,减少耐药性发生。
在慢性感染过程中,多株菌株同时定植于一个宿主,并且幽门螺杆菌分离株的遗传变异使幽门螺杆菌相关的发病机理难以从单个因素中预测。 幽门螺杆菌与其宿主的共同进化使它得以终生定居。
随着现代卫生环境改善及抗生素的大量使用,幽门螺杆菌的生长和传播越来越难,年轻一代中感染率较低,在未来几十年中幽门螺杆菌感染率将进一步下降。
更好地理解幽门螺杆菌和其他胃肠道微生物群之间的对话可能为预防或治疗其感染提供新的方向。如在肠道菌群健康检测报告中发现幽门螺杆菌感染,则应引起重视。当需要治疗时,应评估新的治疗策略和药物,或者应该制定替代策略来控制细菌的毒力,从而避免出现溃疡和胃癌而不消除其积极影响。
附录: 幽门螺杆菌的发现史
在1980年代初,幽门螺杆菌首次被发现是引起胃部疾病的原因。该发现帮助研究人员将幽门螺杆菌感染与胃炎,溃疡和胃癌等联系起来。
1982年,两名澳大利亚研究人员巴里·马歇尔和罗宾·沃伦描述了幽门螺杆菌感染的作用。
然而,沃伦和马歇尔关于幽门螺杆菌功能的理论并未立即被医学界接受。当时,大多数科学家都不相信细菌可以在人的胃中生活。
马歇尔无法在实验室小鼠中进一步测试他的工作,也不允许在人身上进行实验。马歇尔这位勇敢的科研工作者想到了一个办法。
他决定亲自吃下幽门螺杆菌。他从病人的肠道中提取该菌,将其放入肉汤中,然后饮用。
几天后,马歇尔出现了肠道症状,例如恶心,呕吐,口臭和疲劳。他做了胃活检,且能够培养幽门螺杆菌,证明是细菌引起了他的症状。
医学界最终接受了幽门螺杆菌引起溃疡和其他肠道问题的观念,但是接受的道阻且长。
1994年,美国国立卫生研究院共识发展会议正式承认幽门螺杆菌与溃疡之间的紧密联系。该小组建议对溃疡患者进行抗生素治疗。
1996年,FDA批准了首个针对幽门螺杆菌引起的溃疡的抗生素疗法。
一年后,疾控中心(CDC)与其他政府机构和学术机构合作发起了一项全国运动,为医患相关人员提供有关幽门螺杆菌与溃疡之间的联系。
2005年,马歇尔和沃伦获得了诺贝尔生理学或医学奖。溃疡不再被视为无法治愈的慢病,而是一种可以通过短期的抗生素和酸分泌抑制剂治疗的疾病。
【参考文献】
Burucoa C, Axon A. Epidemiology of Helicobacter pylori infection. Helicobacter. 2017 Sep;22 Suppl 1. doi: 10.1111/hel.12403. PMID: 28891138.
Camilo V, Sugiyama T, Touati E. Pathogenesis of Helicobacter pylori infection. Helicobacter. 2017 Sep;22 Suppl 1. doi: 10.1111/hel.12405. PMID: 28891130.
Eusebi LH, Zagari RM, Bazzoli F. Epidemiology of Helicobacter pylori infection. Helicobacter. 2014 Sep;19 Suppl 1:1-5. doi: 10.1111/hel.12165. PMID: 25167938.
Mentis A, Lehours P, Mégraud F. Epidemiology and Diagnosis of Helicobacter pylori infection. Helicobacter. 2015 Sep;20 Suppl 1:1-7. doi: 10.1111/hel.12250. PMID: 26372818.
Thorell K, Lehours P, Vale FF. Genomics of Helicobacter pylori. Helicobacter. 2017 Sep;22 Suppl 1. doi: 10.1111/hel.12409. PMID: 28891132.
Julie Marks.Robert Jasmer, MD What Is H. Pylori? Symptoms, Causes, Diagnosis, Treatment, and Prevention. 2020.9
History of H. Pylori: What We Do and Don’t Know Before the discovery of the bacterium, doctors thought stomach ulcers were due to stress and spicy foods.
Burucoa C, Axon A. Epidemiology of Helicobacter pylori infection. Helicobacter. 2017 Sep;22 Suppl 1. doi: 10.1111/hel.12403. PMID: 28891138.
Kamboj AK, Cotter TG, Oxentenko AS. Helicobacter pylori: The Past, Present, and Future in Management. Mayo Clin Proc. 2017 Apr;92(4):599-604. doi: 10.1016/j.mayocp.2016.11.017.
Eusebi LH, Zagari RM, Bazzoli F. Epidemiology of Helicobacter pylori infection. Helicobacter. 2014 Sep;19 Suppl 1:1-5. doi: 10.1111/hel.12165. PMID: 25167938.
Yang JC, Lu CW, Lin CJ. Treatment of Helicobacter pylori infection: current status and future concepts. World J Gastroenterol. 2014 May 14;20(18):5283-93. doi: 10.3748/wjg.v20.i18.5283.
Sun Y, Zhang J. Helicobacter pylori recrudescence and its influencing factors. J Cell Mol Med. 2019 Dec;23(12):7919-7925. doi: 10.1111/jcmm.14682. Epub 2019 Sep 19.
Tao Zhi-Hang,Han Ji-Xuan,Fang Jing-Yuan,Helicobacter pylori infection and eradication: Exploring their impacts on the gastrointestinal microbiota.[J] .Helicobacter, 2020, 25: e12754.
Algood HM, Cover TL. Helicobacter pylori persistence: an overview of interactions between H. pylori and host immune defenses. Clin Microbiol Rev. 2006 Oct;19(4):597-613. doi: 10.1128/CMR.00006-06.
Kori M, Daugule I, Urbonas V. Helicobacter pylori and some aspects of gut microbiota in children. Helicobacter. 2018 Sep;23 Suppl 1:e12524. doi: 10.1111/hel.12524. PMID: 30203591.
van Amsterdam K, van Vliet AH, Kusters JG, van der Ende A. Of microbe and man: determinants of Helicobacter pylori-related diseases. FEMS Microbiol Rev. 2006 Jan;30(1):131-56.
Waskito LA, Yamaoka Y. The Story of Helicobacter pylori: Depicting Human Migrations from the Phylogeography. Adv Exp Med Biol. 2019;1149:1-16. doi: 10.1007/5584_2019_356. PMID: 31016625.
Pereira-Marques J, Ferreira RM, Pinto-Ribeiro I, Figueiredo C. Helicobacter pylori Infection, the Gastric Microbiome and Gastric Cancer. Adv Exp Med Biol. 2019;1149:195-210.
RU Nan, DU Yi-qi, LI Zhao-shen. 幽门螺杆菌根除指征的演变[J]. 中国实用内科杂志, 2019, 39(006):515-519.
中华医学会消化病学分会幽门螺杆菌和消化性溃疡学组, 全国幽门螺杆菌研究协作组, 刘文忠,等. 第五次全国幽门螺杆菌感染处理共识报告[J]. 胃肠病学, 2017(6).