 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
朋友小杨是个科研人,每天按时吃饭,三餐规律,但在某次腹泻之后,小杨突然想起了医生的建议:做肠镜检查。
肠镜检查对于小杨而言是陌生而又新奇的,于是小杨开始飞速查阅相关文献。
用于检查肠道内部病变。对大肠息肉;大肠炎症性疾病如溃疡性结肠炎;慢性结肠炎;结肠癌等诊断有重要意义。
https://v.qq.com/x/page/r05303w8449.html谷禾肠镜过程介绍及肠镜检查后的注意事项动画_腾讯视频
谷禾肠镜过程介绍及肠镜检查后的注意事项动画_腾讯视频
查完后,小杨对肠镜检查有了大概的了解,需要先喝泻药排便清肠,才能进行正式的肠镜检查。与此同时,他脑海中又浮现出新的问题:
都说肠道中有大量的微生物,那么在大量排出粪便时会不会同时将肠道内的肠道菌群大量清除?
一次肠镜检查究竟对肠道菌群会有多大影响呢?
遗憾的是,目前文献较少提及此方面的内容。与我们进行沟通之后,小杨决定亲自做肠镜前后的肠道菌群检测,对比看看究竟会有什么变化。
肠镜检查前需要进行清肠准备,良好的准备可以为肠镜提供更好的视野,也会决定肠镜检查的效果。
目前常见的清肠方式主要采用复方聚乙二醇电解质方案,也就是泻药,主要成分为PEG4000,同时补充电解质。
好的清肠准备一般需要彻底排净粪便,直到排出无色清水便。
肠镜前准备会对肠道菌群产生怎样的变化呢?
是简单的等比例减少还是完全改变菌群构成?
满怀疑问的小杨开始了肠镜检查之旅。
检查当天,小杨开始服用聚乙二醇后,很快开始排便,状态为稀便,此时肠道尚未完全清空。等排空后,马上进行了肠镜检查。
做完肠镜检查,还没来得及思考太多,小杨就拿到了肠镜检查报告。
“ 肠镜结果显示正常 ”。
耳边传来了医生的话,小杨感到松了口气。
确保身体健康没问题了,小杨心中的疑惑却没有打消,是不是原本健康的肠道菌群会因此紊乱?
如果有不好的变化,我是不是应该做些什么帮助肠道菌群恢复?
小杨积极与我们进行沟通,希望我们给出相应的建议。我们基于文献及临床菌群干预经验给予饮食方面的小建议,这部分后面详述。
他按自己的理解结合我们的建议,采取了一些饮食干预措施。
当肠道菌群检测报告出来时,他很兴奋。
在整个过程包括前后,小杨完整地采集,总共完成了4次肠道菌群检测,分别为以下几个时间点:
· 肠镜检查前
· 检查当天服用聚乙二醇后首次排便
· 肠镜完成后首次排便
· 一周后
“怎么样?有变化吗?变化如何?”
…显然小杨很想知道结果。
为了便于理解,我们仔细帮他做了肠镜前一周和肠镜当天菌群的对比分析。
“一般人可没这待遇啊”,我们打趣道。
“来,看这些图表吧”…
肠镜当天菌群构成和丰度变化

从图中可以看到,原本肠道内占极高比例的黄色拟杆菌属比例大幅压缩,罗氏菌属几乎消失不见。对应的普雷沃氏菌属以及埃希氏菌属(主要是大肠杆菌)比例快速增加,另外除了这些菌外还有大量的原占比很低的其他菌属出现(图中未展示)。
而更大的变化出现在完成肠镜检查后,他发现核心菌属变为埃希氏菌属、韦荣菌属、梭杆菌属和瘤胃球菌属。原来的三大核心菌属占比被压缩到了5%左右。
这样的结果虽然与预想的差不多,小杨不禁感慨道:
“ 看来做一次肠镜,菌群确实受到影响了 ”。
肠镜当天肠道菌群总体状况变化
从肠道菌群总体状况来看,也有非常明显的变化。
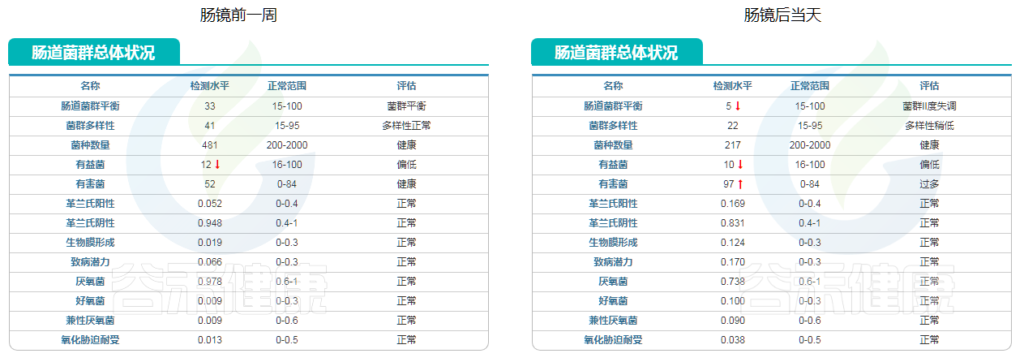
上图显示,肠道菌群平衡这项指标明显下降,菌群多样性也随之下降。紧接着的指标也很有意思,有益菌下降,有害菌大幅上升。说明肠镜检查当天服用聚乙二醇后大量排便扰乱了原先的菌群平衡。
这样的结果再一次印证了他当初的想法。
“ 菌群也许失衡了 ”,小杨开始低落了。
“做完肠镜当天,你吃了什么?”
“肠镜检查后当天及之后的一天,海带、蔬菜…” 小杨仔细回忆了一下,“哦,对了,发现粪便中存在较多未消化的蔬菜和纤维…”
“说明肠道对膳食纤维的消化利用能力尚未恢复”。
“参考肠镜检查后第一次排便的菌群结构” ,我们分析人员指着那张图说到,“其中埃希氏菌属以及韦荣菌属和梭杆菌属都没有代谢复杂碳水化合物的能力…”
“这不就对上了嘛…那之后呢?菌群怎么样了?” 小杨着急地问道。
“别担心,马上给你看一周后的检测结果”
肠镜后一周检测结果
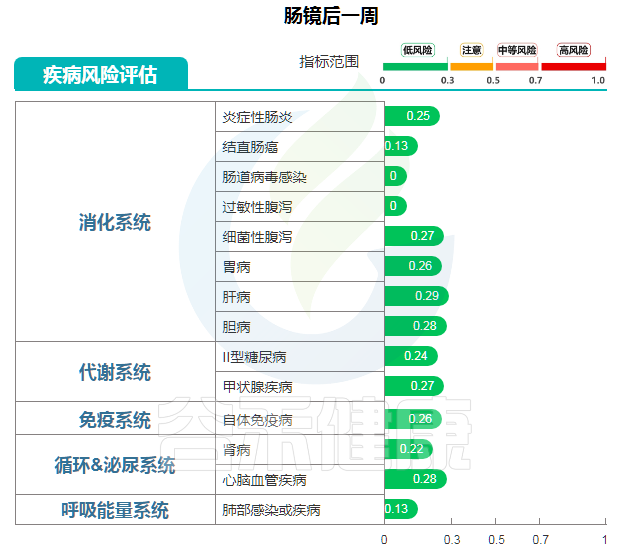
图中可以明显看到,肠镜后一周恢复健康,结直肠癌风险值为0.13,风险很低,也未见肠炎等消化道疾病风险。
“ 一切正常 ”
“肠镜检查我也很正常的,那就是说和肠镜检查结果一致咯…” 这回小杨神色又轻松了不少。
“当然”
“那我能不能知道,我的菌群到底恢复了没有?” 小杨果然没有忘记。
“行吧,既然你这么惦记,再给你整明白点儿…还记得2019年,你在我们这儿测的菌群结果吗?”
“怎么可能忘记,那可是我第一次尝试肠道菌群检测啊” 小杨好像有些得意。
“那这次要不要拿出来一起分析下?”
“可以啊,求之不得,就问你数据还在不?” 说着,小杨笑了起来。
“在啊,我们可是经过你同意的哦” …
“哪儿那么多废话,赶紧吧” 小杨知道这样的机会并不多。
“让我们把时间线再拉长到1年前…”
下图是基于小杨 2019-2020年不同时间点取样的肠道菌群结果变化图(“河流”图),从图中我们可以看到肠镜检查对肠道菌群产生的影响。
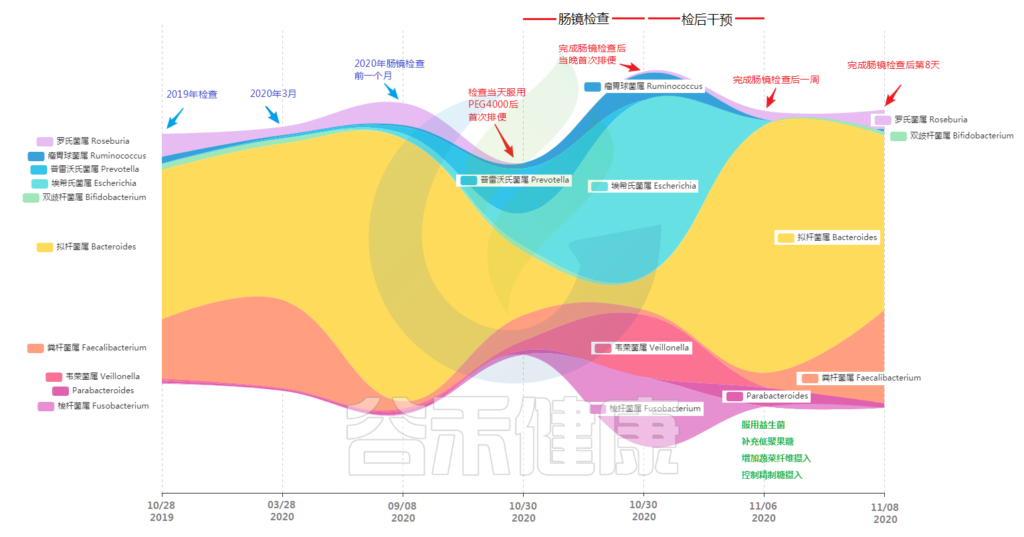
首先图表中的第1/2/3个时间点分别是小杨检查前一年、半年和一个多月前,可以看到其中肠道菌群核心构成的菌属为拟杆菌属。
此外粪杆菌属也就是柔嫩梭菌属Faecalibacterium也是主要菌属,但是期间比例变化较大,从半年前的近30%到了检查前不到5%,另外罗氏菌属也是核心菌属。以上这几个属占据了80%以上的菌群构成,而且存在相对稳定,其他菌属丰度含量较低,均在1%左右。
“我能不能问下,肠镜检查后占比大幅提高的几种菌,是一直存在于肠道内?还是经过清肠准备时引入的?” 小杨又开始好奇了。
“ 经过对之前几次数据的比对,确认这些菌在之前的几个时间点就存在于肠道内,但是比例不高 ”
“那么为什么聚乙二醇服用后在没有引入新的菌的情况下,会改变原来菌群的构成比例?” 小杨的大脑飞速运转着。
“ 这里可能的原因是肠道内不同空间位置的菌分布存在不同。”
“不好意思,我还是不太明白,能给我详细解释下吗?”
“ 固体粪便主体包含了绝大部分的肠道菌群,这些肠道菌群是利用结肠食物残渣的主要菌群,此外肠粘膜部位的黏膜部分也存在大量菌群,这些菌群的构成与粪便主体的菌群有所差异,除了食物残渣之外还可以利用粘液作为食物来源。” 分析人员耐心解释,
“ 梭杆菌属、韦荣菌属以及埃希氏菌属可能在肠粘膜部位含量较丰富,清肠过程后期随着水分排出的黏膜部分菌占据主要比例。”
“哦,我好像又明白了…” 小杨点了点头。
“对了,从图中看来,菌群差不多恢复了” 小杨的眼里闪烁着一丝喜悦。
“你说的没错”
“多亏了你们的饮食建议啊…” 小杨还没来得及长篇大论发表感谢,却又被阻止了。
“另外,健康人的肠道菌群具有恢复健康的能力”。
“能详细解释下吗?”显然又勾起了小杨的好奇心。
“你想啊,吃药,各种不健康的方式都会影响肠道菌群变化没错吧?而你现在却这么健康地站在这儿,某种程度上,肠道菌群有自己的恢复力,当然你可以理解为,整个肠道菌群像一个弹簧一样,有弹性,可受到干扰也可以恢复健康…” 分析人员说着,又甩给小杨一个链接,“可以看看这个文章”
看完后,小杨若有所思,“这么说,肠道菌群恢复力和饮食干预都有功劳,你能告诉我,你们是怎么想到这样的干预方式吗?”
“这…我们其实参考的是抗生素的情况,把你的肠镜检查比作一次抗生素的干扰,这么说明白吗?”
“哦,就是按照抗生素干扰处理呗”,小杨秒懂。
“是的,我们查阅相关文献结合临床经验…” 分析人员开始了讲述。
“ 与抗生素杀死菌群的情况类似,服用泻药将大量菌群排出同样也会导致菌群数量和丰度下降,和抗生素不同的是肠道不同部位的菌可能清除比例存在差异。”
小杨觉得很有道理,频频点头示意。
“ 如果在这种情况下直接摄入大量精制碳水化合物或游离糖,很容易使上述这些菌占据主要菌群,所以在菌群恢复的过程中需要结合自身原有菌群特点进行饮食调节和干预。”
“ 小杨你看,这是2020年一项针对抗生素服用后肠道菌群恢复情况的研究 ” 分析人员拿出早已看过几遍的资料。
研究显示,肠道菌群能否恢复(以是否恢复之前的菌群多样性为标准)包括以下几个阶段:
1、主要恢复菌首先利用黏蛋白多糖在肠粘膜中定植,部分可以通过降解复杂碳水化合物利用能量(如单形拟杆菌)
2、上述产物可以对下游其他菌进行交叉喂养,这部分菌其中一些可以生成短链脂肪酸(如柔嫩梭菌和罗氏菌属的一些菌),进一步为下游其他菌定植提供能量。以上所有菌及代谢物进一步帮助肠粘膜的重建,从而形成正向循环
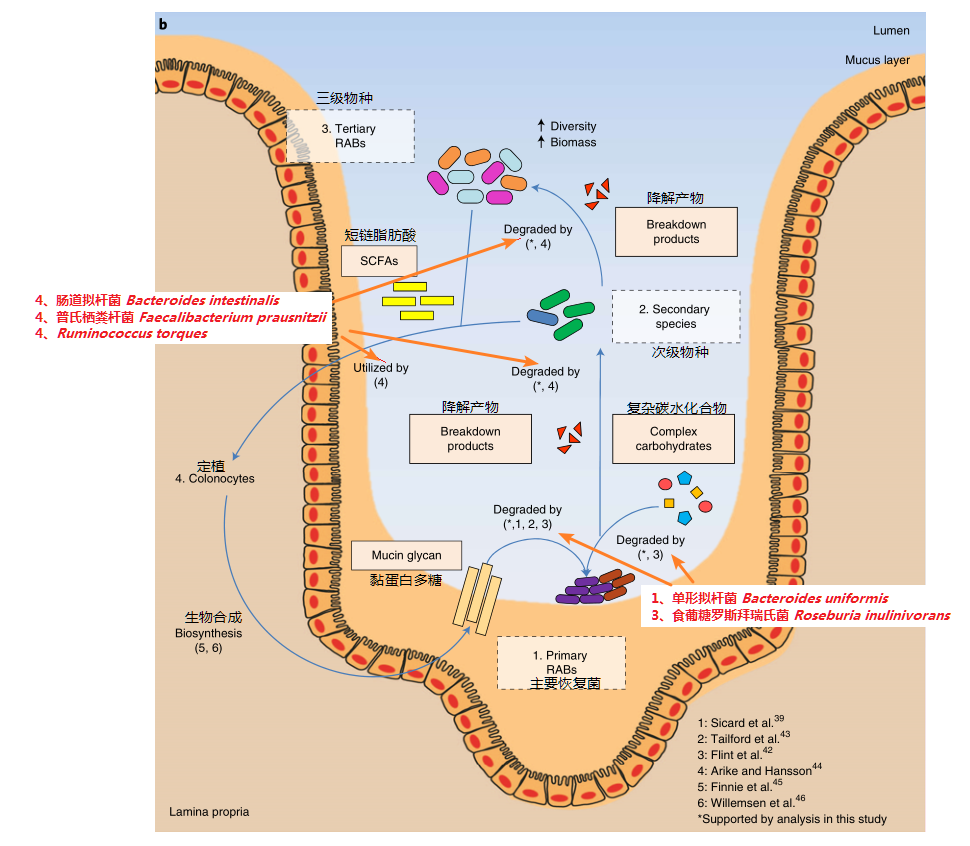
Chng KR et al., Nat Ecol Evol. 2020
从我们这个例子来看,核心菌群中就包括有主要重建菌:单形拟杆菌Bacteroides uniformis、多形拟杆菌Bacteroides thetaiotaomicron、食葡糖罗斯拜瑞氏菌Roseburia inulinivorans以及普氏栖粪杆菌Faecalibacterium prausnitzii 等,属于较易恢复的菌群结构。
“所以说,让我多吃膳食纤维和复杂碳水化合物,另外同时补充益生菌和低聚果糖,控制糖的摄入。其实是为了重建菌群对吧? ” 小杨觉得自己一下懂了好多。
“当然要尽可能地在短时间内,让你的主要核心菌大部分得到恢复。对了,你在第8天有改变了什么饮食习惯吗?”
“增加了低聚果糖的摄入,从每天10g增加到每天20g,怎么了?是有什么变化吗?” 小杨有些不解。
“ 看这里,第8天可以看到明显的粪杆菌属和罗氏菌属的丰度上升… ”
……
这一天,小杨感到格外轻松自在。
关于小杨的故事,到这里,告一段落。
文中描述的人物是真实案例(小杨是化名),前后多次进行谷禾肠道菌群健康检测,以及在医院做的肠镜检查。
我们在征得本人同意的情况下,将此案例发布于此。在这里,我们也要感谢小杨(化名)愿意提供部分报告信息,以便于我们分享时,大家能更好地理解。
最后,分享两个需要注意的点。
#
如果肠道菌群构成中:
单形拟杆菌Bacteroides uniformis、多形拟杆菌Bacteroides thetaiotaomicron、食葡糖罗斯拜瑞氏菌Roseburia inulinivorans以及普氏栖粪杆菌Faecalibacterium prausnitzii这几种菌占比很少,那么在进行如肠镜检查、抗生素或者较严重腹泻之后,需要特别注意肠道菌群的重建。
如果肠型构成中主要以普雷沃氏菌属或瘤胃球菌为主,且普氏栖粪杆菌Faecalibacterium prausnitzii 比例较低,那么需要考虑增加益生元的供给,并注意主食中以抗性淀粉为主,帮助第二级菌群定植,辅助重建。
总之,无论是关于肠镜检查,还是菌群恢复,都希望大家能从中得到一些收获。
谷禾健康
世界卫生组织报告说,银屑病(俗称“牛皮癣”)影响全世界近一亿人。 发病的平均年龄在15至35岁之间。


牛皮癣最常见的形式是斑块状牛皮癣
皮肤细胞异常快速地生长并在皮肤上堆积
多余的细胞会产生厚而有光泽的鳞片
带有干燥,发痒的红色斑块,有时会很痛
关于牛皮癣的常见类型详见附录。
大多数牛皮癣患者会经历症状的“周期”。有时可能会在几天或几周内出现严重的症状,然后症状可能会消失。在几周内,病情可能会再次发作。周而复始。没有症状的时候并不意味着牛皮癣不会复发。
有一点需要说明的是,牛皮癣并不会传染。


牛皮癣的症状是如何产生的?
与其说牛皮癣是皮肤病,倒不如说是一种自身免疫性疾病。自身免疫性疾病是身体自我攻击的结果。当牛皮癣发生时,T细胞会错误地攻击皮肤细胞。
这种错误的攻击会导致皮肤细胞生产过程过度运转。加速的皮肤细胞生成会导致新的皮肤细胞发育过快,然后被推到皮肤表面堆积。
那么,肠道微生物如何影响皮肤?肠-脑-皮肤轴如何发挥作用?肠道神经递质有什么样的调节功能?与牛皮癣之间有什么关系?具体的病理作用是什么?我们来详细了解一下。
牛皮癣患者肠道微生物组成
多项研究采用16S rRNA测序技术,分析了牛皮癣患者和健康人的粪便微生物组。结果显示,牛皮癣患者的肠道菌群结构与健康人不同。
在门水平上,牛皮癣患者的厚壁菌门和放线菌门丰度显著增加;在种水平上,牛皮癣患者的Ruminoccocus gnavus, Dorea formicigenerans,Collinsella aerofaciens丰度显著增加,而Prevotella copri ,Parabacteroides distasonis,Akkermansia muciniphila丰度显着降低。
最近的研究发现,牛皮癣患者的厚壁菌门和拟杆菌门的相对丰度在门的水平上是颠倒的,16种系统型在属水平上存在显著差异。
Hidalgo-Cantabrana 等人在牛皮癣患者中观察到严重的菌群失调,某些菌群多样性较低且相对丰度发生改变。研究表明,牛皮癣改变了患者肠道菌群的特性和功能。
牛皮癣和其他全身性炎症性疾病一样,涉及各种免疫途径的不适当激活,导致促炎性细胞因子升高。而肠道菌群参与促炎性Th17细胞的发育,调节炎症性肠病和肥胖症等疾病中的炎症。
前面提到牛皮癣患者肠道中的艾克曼菌(A. muciniphila)明显减少,该菌是可以增强肠道上皮的完整性并能抵抗全身性炎性疾病。
同样发现艾克曼菌减少的还有Scher等人,他们的研究,发现牛皮癣患者同时还伴有Ruminococcus, Pseudobutyrivibrio的相对丰度降低。而金黄色葡萄球菌(Staphylococcus aureus),白色念珠菌(Candida albicans)和马拉色菌(Malassezia)在皮肤和肠道中定植的增加与牛皮癣加剧有关。所以说,肠道和皮肤之间的联系是强烈的和双向的。
那么,肠道菌群是怎么对皮肤产生影响的呢?
取决于肠道微生物群及其代谢产物从肠道到皮肤的传播。某些致病细菌可以产生某些代谢产物,例如苯酚和对甲酚。 这些代谢物可以破坏皮肤屏障的完整性和表皮分化,减少皮肤的水合作用,并损害角化作用,这些作用与进入血液和在皮肤中积累有关。
短链脂肪酸(SCFA)是一种代谢产物,参与免疫细胞的活化和凋亡。 越来越多动物实验证据表明,慢性系统性炎症是肠道生态失调的主要后果。由于促炎性细胞因子的分泌,上皮通透性增加和激活的效应T细胞之间的不平衡,这导致了慢性全身性炎症的恶性循环。 这可能是肠道微生物组诱导皮肤损伤的众多机制之一。
肠道微生物的畸变导致多种炎症性皮肤病,例如寻常痤疮,脂溢性皮炎和牛皮癣。 越来越多的证据表明肠道菌群失衡会诱发炎症性皮肤病。
当然这也为我们提供了一种改善皮肤状况的可行方法——肠道菌群调节。基于这些发现,益生菌可以治皮肤炎症,方法简单,安全且便宜。(更多关于牛皮癣的预防措施详见后面章节)
关于微生物群和神经系统之间的干扰,研究表明宿主神经递质和/或相关途径在交流过程中起着关键作用。
斯托克斯和皮尔斯伯里首先基于各种实验证据和临床轶事,提出了肠-脑-皮轴概念,表明胃肠道调节介导了情绪和神经状态对皮肤的影响,情绪状态(如抑郁、焦虑等)会促进局部和全身性炎症。
研究还发现,情绪状态与炎症性皮肤状况之间的重要联系可以通过肠道菌群来调节。
最近的研究支持肠-脑-皮肤理论的证据。 我们前面的文章说过,肠道微生物会影响皮肤状况(痤疮的严重程度,点此查看 痘痘?粉刺?皮肤问题很可能是肠道问题),这与它们调节全身性炎症,氧化应激和情绪变化的能力是一致的。
牛皮癣患者肠道微生物通过分泌神经递质介导免疫系统和神经系统之间的相互作用
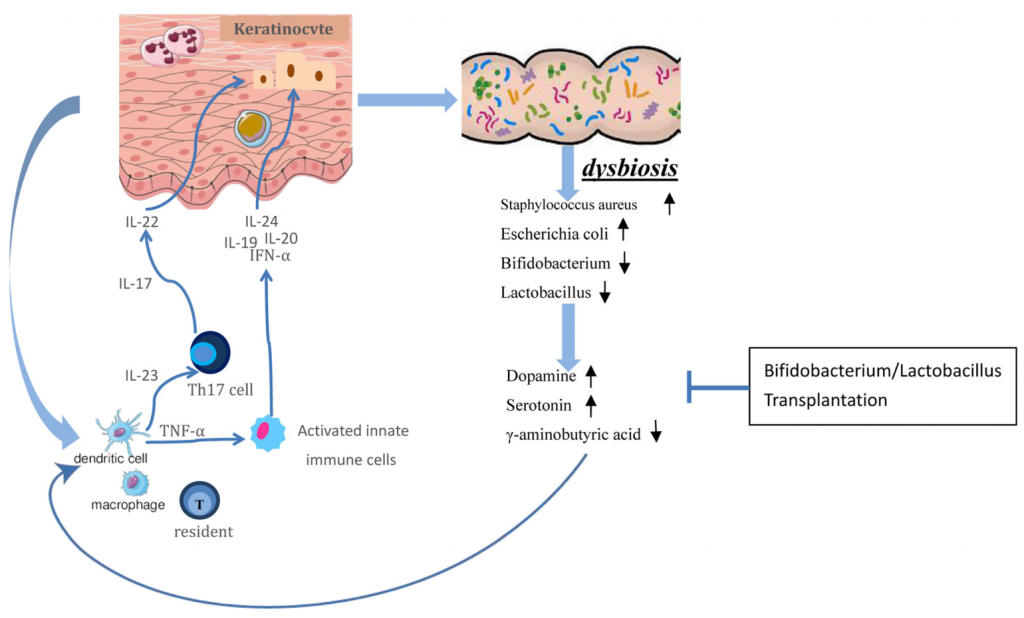

Guang Chenet al., Dermatol Ther (Heidelb),2020
细菌代谢产物对内源性中枢神经系统信号的激活涉及许多神经递质,包括GABA,5-羟基色胺(5-HT),去甲肾上腺素,多巴胺等。
以下对3种常见的神经递质展开讨论。
多 巴 胺
多巴胺是中枢神经系统中的一种重要神经递质,可控制认知、情绪、免疫和神经内分泌。
1. 在牛皮癣中,免疫系统和神经系统之间的串扰通过神经递质(如多巴胺)通过影响局部组织环境来调节免疫反应,并可能例如影响T细胞的活化状态和迁移。 免疫细胞还利用神经递质相互交流,以牛皮癣的组织特异性炎症为目标。
2. 证据表明,在31–88%的病例中,患者报告称压力是其牛皮癣的诱因。压力也是牛皮癣暴发的结果。 因此,所有的压力激素,包括多巴胺,都应该是牛皮癣的重要调节剂。
3. 多巴胺可以增加角质形成细胞的活性,这在细胞因子和趋化因子的释放中起作用。
5- 羟 色 胺
5-羟色胺是一种信号分子,通过旁分泌,内分泌和邻分泌调节多种生理过程,包括免疫系统,胃肠道和神经系统。超过90%5-HT是由胃肠道肠嗜铬细胞(EC)合成的,而5%的5-HT是在肠系膜神经元中合成的,还有一部分是在大脑中合成的。
血清素水平可以通过色氨酸羟化酶的帮助,通过分泌小分子(如SCFAs)来促进ECs产生血清素。
80年代,5-HT被定义为一种免疫调节剂,因为它具有抑制炎症的能力,包括牛皮癣,5-HT改变了血清素能系统失调患者的免疫反应。
GABA
GABA作为CNS的主要抑制性神经递质,具有广泛的生物学活性,包括调节突触传递,促进神经元发育和放松,预防失眠和抑郁。
越来越多的证据表明,GABA可以被细菌消耗和/或产生。乳酸菌和双歧杆菌是GABA的主要来源。
最近的一项人类研究中,从瘦到肥胖个体的粪便微生物组移植提高了血浆中的GABA水平,这表明微生物组可以控制GABA的产生水平。
GABA 的免疫作用
研究人员发现了GABA的各种生物活性,例如抗高血压,抗糖尿病,抗癌,抗氧化剂,抗发炎,抗微生物和抗过敏作用。
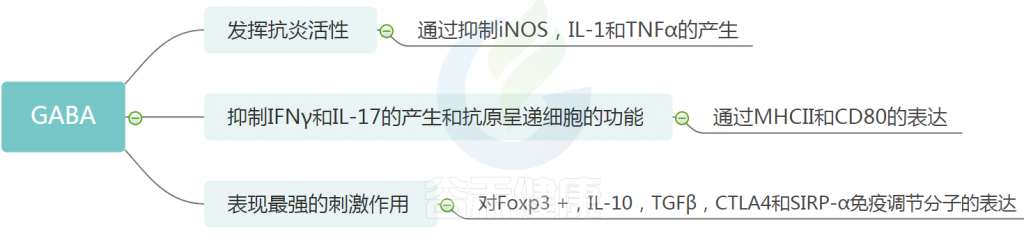

GABA与牛皮癣
牛皮癣患者通常有瘙痒,可能与GABA系统有关。 实验研究报道了牛皮癣患者皮肤中GABA配体和GABAA受体的表达增加,表明它们在与牛皮癣相关的发病和瘙痒中具有关键作用。 因此,GABA可以被认为是预防和治疗牛皮癣的潜在替代疗法。
表 神经递质产生菌(代表性的菌)
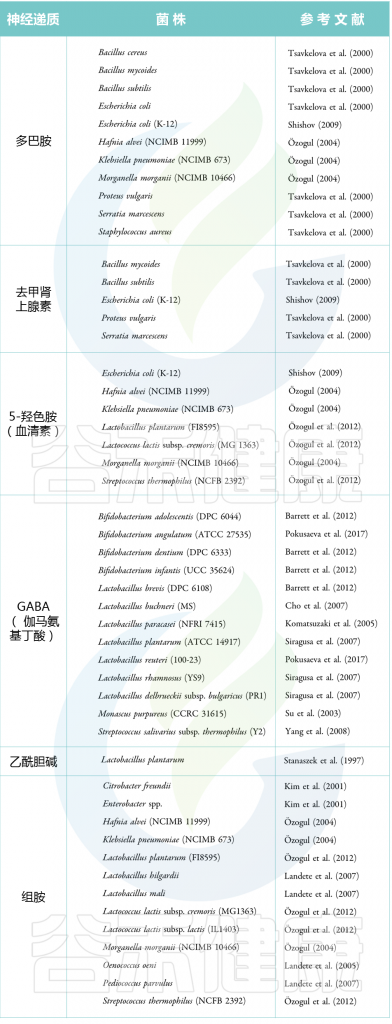

Guang Chenet al., Dermatol Ther (Heidelb),2020
综上,肠道菌群可能通过分泌神经递质来介导神经系统和免疫系统之间的串扰。FMT(粪菌移植)可能是牛皮癣的一种新型疗法。 需要进一步的临床试验以提供可靠的证据,验证潜在机制。
肠-脑-皮轴是神经传递调节中可能的通讯途径。通过了解这些途径及其与疾病特征的关系,可以设计肠道菌群介导的干预措施来操纵这些靶点以治疗牛皮癣。
虽然牛皮癣的症状可能反反复复,但至少可以做一些相应的预防措施,避免不断诱发其发作。
1. 减 轻 压 力
生活中的日常压力可能会对任何人产生负面影响,但对牛皮癣患者而言尤其成问题。身体容易对压力产生炎症反应。这种反应会引起牛皮癣发作。
——心理咨询
牛皮癣患者更容易出现抑郁等心理问题。当出现新斑点时,可能会不太自信。这种情况的持续循环会造成心理伤害。可以咨询专业的心理专家或加入牛皮癣患者正规论坛等进行交流。
——瑜珈
瑜伽促进身心放松,帮助缓解压力。
——冥想和其他放松技术。
尝试读书,跑步,与家人朋友聊天等。
2. 避 免 某 些 yao 物
某些yao物可能会干扰人体的自身免疫反应并引起炎症,从而引发牛皮癣。
3. 防 止 皮 肤 受 伤
有些人的皮肤损伤会进一步引发牛皮癣。这就是所谓的Koebner现象。引发牛皮癣的常见皮肤损伤包括晒伤和擦伤。
保护好皮肤可以帮助预防牛皮癣。如果外出时,应始终采取额外的预防措施,可以包括以下措施:
–外出时使用防晒霜并戴上帽子
–进行园艺时戴长袖手套
–在户外活动前喷杀虫剂
–参加户外活动时要谨慎
对于牛皮癣患者来说,过多的阳光会导致症状加剧。虽然说,适量的阳光可以缓解某些症状,保持10分钟左右,晒伤会引起耀斑。
4. 温 和 清 洁
牛皮癣患者应选择温和的保湿清洁剂,避免使用会导致皮肤干燥或刺激皮肤的配方。
避免含以下刺激成分:
月桂醇、肉豆蔻醇、棕榈醇、鲸蜡醇、二十二醇、视黄酸等。
5. 注 意 保 湿
寒冷干燥的气候也会加剧牛皮癣的症状。在这种天气下,皮肤水分较少,尤其热空调会更加干燥,实在太干的情况,最好配备加湿器。
洗澡不要超过10分钟,洗完澡后尽快保湿。可用毛巾拍干皮肤并涂上无气味的乳液,帮助锁住水分。
6. 避 免 感 染
感染会引发牛皮癣,因为感染会对免疫系统造成压力,从而引起炎症反应。
特别是链球菌性咽喉炎与小儿牛皮癣的发作有关。牛皮癣突然发作可能发生在耳痛,扁桃体炎或呼吸道或皮肤感染后。
如果发现有皮肤受伤(例如割伤或伤口),请确保正确清洁包扎以防感染。其他预防感染的方法包括:
–全天经常洗手
–避免与他人共享食物,饮料或饮食用具
–限制接触生病的人,尤其是儿童
7. 饮 食 健 康
如果是肥胖或超重患者,牛皮癣症状可能加重。因此,需要注意通过锻炼和饮食健康的饮食来控制体重。2013年发表在JAMA Dermatology上的一项研究发现,低热量饮食有利于改善牛皮癣。
另外,某些食物可能会引起人体内的炎症,从而引发牛皮癣症状。当然也有食物可以帮助减轻炎症和爆发现象。
可能引起炎症的食物包括:
红肉、乳制品、高脂食品、加工食品、精制糖、茄属植物、柑橘水果等。
可能减轻炎症的食物包括:
肥鱼,例如鲑鱼和金枪鱼
种子,例如亚麻籽和南瓜籽
坚果,尤其是核桃和杏仁
绿叶蔬菜,例如菠菜和羽衣甘蓝
关于抗炎饮食,促炎饮食可查看我们之前的文章:
8. 避 免 酗 酒
酒精是许多牛皮癣患者的诱因。哈佛大学医学院附属医院的一项研究发现,每周喝两到三杯酒(不是淡啤酒)和牛皮癣的患病率增加有关。
9. 避 免 吸 烟
如果患有牛皮癣,请避免吸烟。烟草会增加牛皮癣的风险,加剧牛皮癣症状。
10. 保 证 睡 眠
建议成年人每天睡七至八个小时。充足的睡眠可以支持免疫系统,并可以帮你保持健康的体重和控制压力。所有这些对于预防牛皮癣都很重要。
附录:
牛皮癣的常见类型
斑块状银屑病——常见类型
导致红色发炎的斑块,覆盖皮肤区域。这些斑块通常覆盖着发白的银鳞或斑块。
肠状牛皮癣——儿童时期很常见
引起小的粉红色斑点。常见的部位包括躯干,手臂和腿。很少像斑块状牛皮癣那样浓密或凸起。
脓疱性牛皮癣——多见于成人
导致白色的脓性水疱和大面积的红色发炎皮肤。
反向银屑病——特殊部位
导致皮肤发红,发亮,发炎。在腋下或乳房等部位皮肤皱褶周围发展。
红皮病性牛皮癣——严重且非常罕见
通常一次覆盖身体的大部分,鳞片经常脱落成大块或片状脱落。患有这种牛皮癣的人可能经常发烧或生病。
相关阅读:
主 要 参 考 资 料:
Mayo Clinic Staff. (2017). Psoriasis. mayoclinic.org/diseases-conditions/psoriasis/symptoms-causes/syc-20355840
Chen Guang,Chen Zai-Ming,Fan Xiao-Yan et al. Gut-Brain-Skin Axis in Psoriasis: A Review.[J] .Dermatol Ther (Heidelb), 2020.
Kurd SK, et al. (2010) The risk of depression, anxiety and suicidality in patients with psoriasis: A population-based cohort study. DOI:10.1001/archdermatol.2010.186
Rachakonda TD, Schupp CW, Armstrong AW. Psoriasis prevalence among adults in the United States. J Am Acad Dermatol. 2014 Mar;70(3):512-6. doi: 10.1016/j.jaad.2013.11.013. Epub 2014 Jan 2. PMID: 24388724.
Psoriasis. (n.d.).aad.org/public/diseases/scaly-skin/psoriasis
Women who drink beer more likely to develop psoriasis.(2010).sciencedaily.com/releases/2010/08/100816162645.htm
Mayo Clinic Staff. (2018). Psoriasis. mayoclinic.org/diseases-conditions/psoriasis/symptoms-causes/syc-20355840

谷禾健康
功能性腹痛性疾病(FAPD)是儿童期最常见的疾病,全世界25%的儿童和婴儿受其影响。
功能性腹痛性疾病
小儿功能性腹痛性疾病,目前称为肠脑相互作用障碍,包括肠易激综合症,功能性消化不良,腹型偏头痛和功能性腹痛。
<罗马IV诊断标准见附录>
近日,英国和美国的研究科学家联合发表在《NATURE REVIEWS | DISEASE PRIMERS》上的一篇综述文章题为:“Paediatric functional abdominal pain disorders”(小儿功能性腹痛症)。


该文总结了FAPD患病率和致病性的最新进展,并特别关注了早期生命的影响和构建。对食源性发病机理和病理生理学有了更深入的了解,包括肠道器官(炎症,运动和微生物群),核心因素(心理方面,某些大脑区域的敏感性和/或连通性或活动性差异)以及外在因素(感染)。
此外,讨论了当前的诊断方法并着重介绍了这些疾病的治疗选择,特别是IBS和FAP-NOS。强调可用的药理干预措施仅限于儿童,因此,干预管理重点落在综合方法上,包括针对精神的干预措施(催眠疗法和认知行为疗法),饮食(益生菌)和经皮神经电刺激。这些方向将有助于理解病理生理学并更好地治疗这些疾病。
FAPDs的特征通常内脏痛觉过于敏感以及内脏刺激中枢感知增加而导致残疾,是遗传易感性和早期生活事件背景上叠加的社会心理因素和医学因素的最终结果。
功能性消化不良的症状特征主要来自胃肠道近端,涉及上腹部腹痛和/或餐后饱胀和/或早期饱腹感。
腹型偏头痛的特点是发作性长时间发作,剧烈,急性脐周,中线或弥漫性腹痛。这些痛苦的发作通常无能为力并干扰正常生活。
这些发作通常但不总是与其他症状(例如厌食,恶心,呕吐,头痛,畏光等)相关,这些症状可能在疼痛持续时间之前或与疼痛持续时间同时发生,并且这种症状性发作可能相隔数周至数月不等。
风险因素如下:


FAPDs是一种复杂的疾病,似乎是由于一个或多个元素的功能和/或更微妙的结构完整性的破坏造成的菌群-肠-脑轴。这些条件下相互作用的复杂性和多面性被整合到一个生物心理社会模型中。
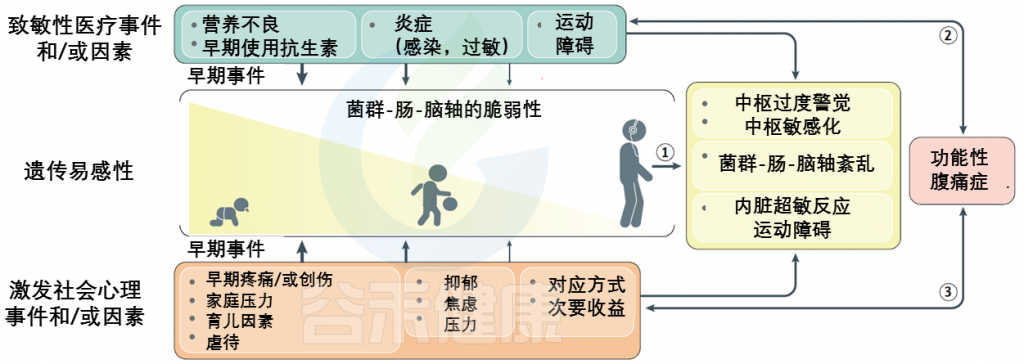

该模型的关键组成部分是内脏超敏反应和中枢敏感化。
内 脏 超 敏 反 应
内脏超敏反应描述了对周围信号的知觉反应(即痛觉过敏),并且可能是内脏传入信号处理变化的结果或疼痛下调变化的结果(例如,中枢敏感化)。
表现:疼痛的感觉阈值降低,也就是稍微一点点刺激就会感到疼痛。
可能原因:在肠扩张期间或由于暴露于食糜的化学成分改变引起,部分解释了对诸如饮食调整和抑酸等治疗的反应。
潜在诱因:炎症,感染和压力
从本质上讲,这些触发因素可引起粘膜通透性变化并导致炎症,释放促生因子,包括5-羟色胺,组胺,NGF,蛋白酶和前列腺素,它们能够激活传入伤害感受器(痛觉神经)上的受体,引起急性疼痛以及持久的功能和结构改变,这是维持慢性疼痛的关键。
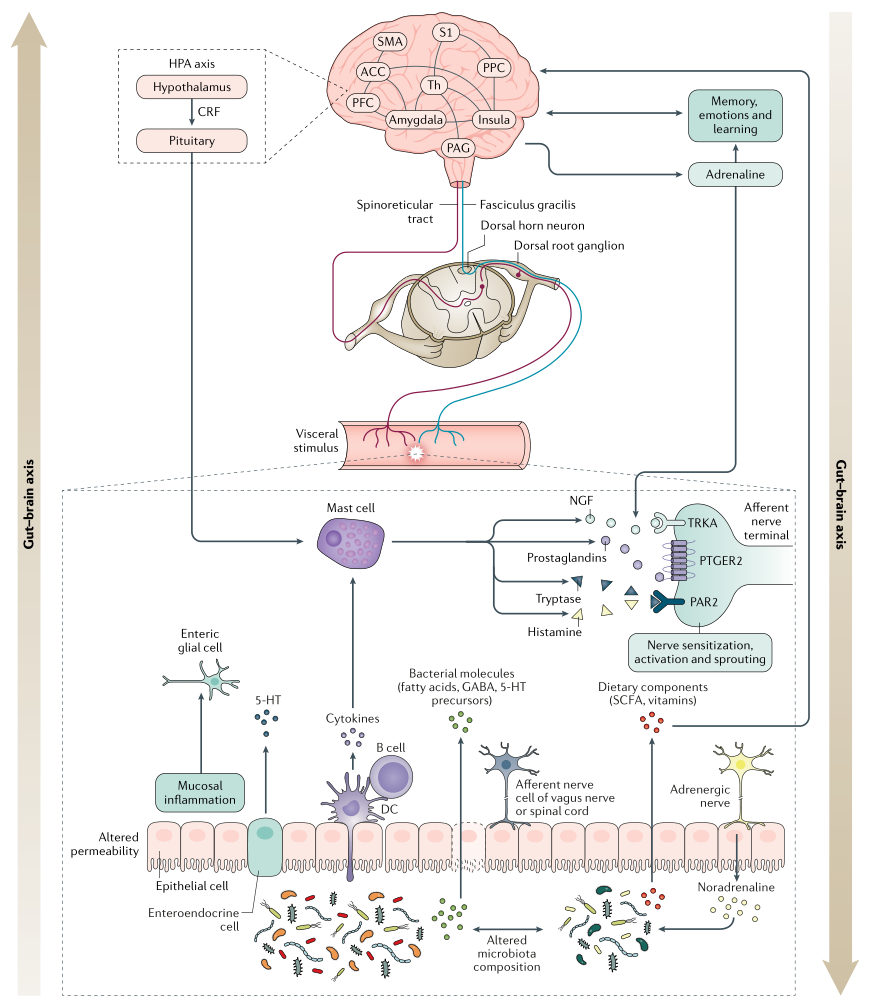

中 枢 敏 感 化
中枢敏化是指通过增强中枢神经系统内的神经元功能和神经信号来放大疼痛敏感性的现象,会引起疼痛超敏反应,并且是一种发展和维持慢性疼痛的机制。
除了疼痛超敏反应外,中枢敏化还会导致脑部活动的继发性变化,可以通过电生理或成像技术进行检测。患有FAPD的个体可能更倾向于发展来源不明的中央致敏。
2018年进行的一项系统性回顾涉及12项病例对照研究,发现功能性腹痛儿童的继发性痛觉过敏和皮质伤害感受改变。
生 命 早 期 事 件
在小儿FAPD中,损伤时机比导致微生物群-肠-脑轴成分破坏的多种因素或该轴本身的破坏更为关键。在生命的头二十年中,尤其是从围产期到儿童时期直至青春期,支撑其功能的肠脑轴所有元素的发育和成熟的关键过程至关重要。
包括手术(例如脐疝和幽门狭窄),细菌性胃肠道感染,炎性或免疫介导的疾病(例如乳糜泻,炎性肠病),以及在生命的最初几个月中发生无害的侮辱,例如婴儿期对牛奶过敏和早期使用抗生素等。
神 经 免 疫 相 互 作 用
在一些患有FAPD的儿童中,证据表明存在低度的肠道炎症,并在发病机理中发挥了神经免疫相互作用的作用。
一项研究发现,IBS患儿回结肠结肠粘膜中靠近神经的肥大细胞数量增加。神经纤维相关的肥大细胞计数与腹痛的强度和疼痛发作的频率相关。
胃 肠 蠕 动
胃肠动力异常促进FAPD的病理生理。具有上消化道症状的患者可能有胃排空延迟和/或胃适应性降低或两者都不存在。功能性下消化道症状的患者可能延迟,加速或正常结肠转移,和/或骨盆底运动障碍(肌肉协调障碍导致试图放松骨盆底肌肉时收缩)。
—功能性消化不良
—肠易激综合征
微 生 物 群
FAPD与肠道微生物群的多样性和菌群组成有关,尤其是IBS。2019年,一项系统评价86评估了健康个体和IBS患者(成人和儿童)的肠道菌群组成。发现双歧杆菌属的丰度下降。IBS患者中的抗炎作用与Faecalibacterium spp,尤其是Faecalibacterium prausnitzii一样,具有抗炎作用。
IBS患者的粪便微生物群的多样性降低或保持不变。粪便微生物群组成或代谢组组成可以预测患者可能从饮食中获益。
除细菌外,真菌或病毒也可能在FAPD病理生理中起作用。但是,有关真菌菌群失调或病毒菌群失调的可用数据有限,目前的研究主要集中于炎症性肠病,而不是IBS。
营 养
在患有FAPD的儿童中起着至关重要的作用。
饮食失调(例如神经性贪食症)可能导致IBS患儿肥胖的发生率增加。
碳水化合物的吸收不良可引起胃肠道症状。吸收不良可能与特定的酶缺乏症有关(例如乳糖酶缺乏症中的乳糖;蔗糖和异麦芽糖酶缺乏症中的蔗糖和淀粉)或与碳水化合物(如果糖,山梨糖醇或甘露醇)的吸收能力有限有关。
在糖较小的情况下,所引起的渗透负荷可导致肠腔膨胀小和快速转运。对于诸如果聚糖等较大的糖,人不具有消化的酶促能力,因此,吸收不良的糖会被结肠菌群发酵,从而导致气体形成和潜在的结肠扩张。
心 理 因 素
肠脑轴的生理很复杂,包括传入和传出成分。
下丘脑-垂体-肾上腺轴通过皮质醇和促肾上腺皮质激素释放因子的释放(在压力条件下均会增加),以及通过刺激肥大细胞和诱导脯氨酸释放的反馈回路,促进肠-脑相互作用。
研究表明,在成年人和有FAPDs的儿科患者中,压力都会增加肠道炎症标志物,如粪便钙卫蛋白和CRP。
肠道与大脑的相互作用涉及自上而下和自下而上的过程,因此,肠道菌群也可以影响脑功能。在压力条件下,肠道菌群可以增加上皮屏障的通透性,使抗原和/或病原体能够通过并引起炎症反应。由此产生的循环性促炎细胞因子可能会与中枢神经系统通讯,刺激大脑的免疫反应,从而可能导致或加重心理症状(例如焦虑和抑郁)。
几项研究表明,与健康儿童相比,患有家族性帕金森病的儿童的心理压力和行为问题有所增加。心理因素可能既是FAPD的起因,也是后果。

无论采用哪种治疗方法,患者与临床医生之间有效的沟通和病人教育,是成功进行FAPD管理的核心。必须花足够的时间向每位患者的照护者解释诊断,并讨论生物心理社会模型。
FAPD的管理受到几个因素的限制
1. 由于FAPD生物心理社会特性,每个孩子都有一套独特的病理生理因素,并且对疗法的反应也不同。
2. FAPD患儿的证据基础很小,许多治疗建议都是基于对成年人的研究。 儿童通常不会像成年人那样做出反应。
3. 一些有效的治疗方法是行为疗法(饮食疗法和心理疗法),由于缺乏专职医疗保健专业人员以及缺乏保险,这些方法并不容易。
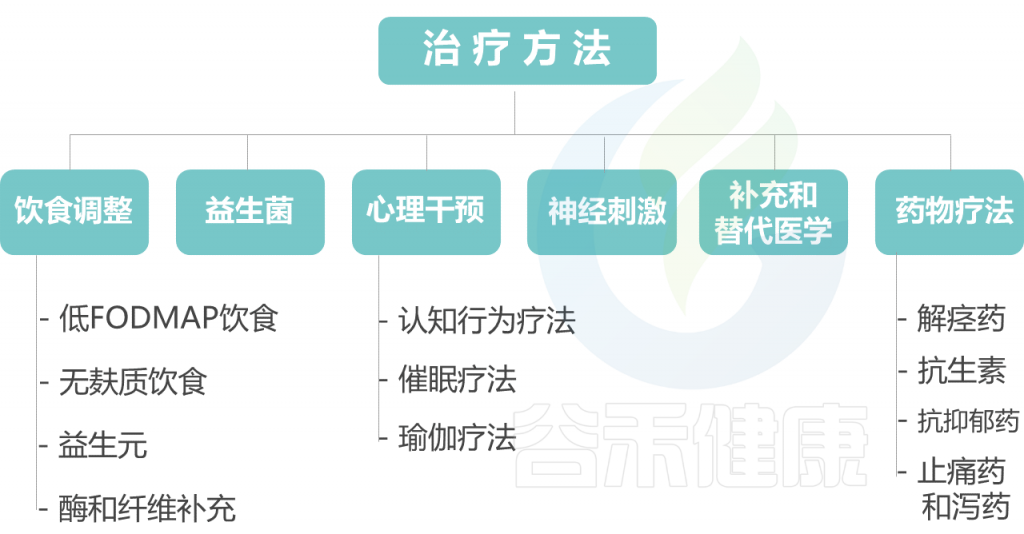

以下对每种治疗方法展开讨论。
饮 食 调 整


益 生 菌
多项研究检查了益生菌治疗FAPD的功效(大多成年IBS患者)。这些研究表明,益生菌或特定菌特定组合可能是有效的,但研究有局限性,如样品量,致盲性,所用益生菌的差异以及不同的剂量,其作用仍不清楚。
在患有IBS的儿童中,两项研究发现鼠李糖乳杆菌GG可有效减轻腹痛症状,而一项研究则报告腹痛没有改善,但感觉到的腹胀有所改善。在不同的研究中,疼痛程度再次有所不同。
在一个多中心,IBS儿童中进行的交叉RCT研究中,VSL#3(八种益生菌菌株的混合物)在改善症状和改善生活质量方面比安慰剂更安全,更有效。
心 理 干 预
心理干预迄今为止,诸如CBT和催眠治疗等心理干预已被证明是管理FAPD的最成功干预措施,并主张将其普遍纳入管理策略。
认知行为疗法(CBT)
CBT是治疗IBS的研究最多的心理疗法,其目的是改变认知,情绪和行为,这些不良情绪行为等都可能加剧或维持IBS症状。
在成人和儿童中的研究表明,与教育和其他控制干预措施相比,CBT在改善疼痛和参与社交生活的能力以及减轻焦虑或抑郁症状方面是有效的。
十二项随机对照试验涉及990名IBS儿童(7-18岁),显示出CBT对生活质量,学校表现和社会参与产生了长期的,持久的有益影响。CBT可以作为面对面的治疗提供,也可以通过互联网面向儿童或通过电话面向父母。
已报道,CBT在改善肠易激综合征儿童的疼痛和残疾方面具有有效性。患有家族性帕金森病的儿童的社区康复治疗主要集中在学习应对症状和减少残疾上,这些治疗应该是综合护理方法的理想组成部分。
催 眠 疗 法
在治疗师的指导下,患者会进入催眠状态,以响应改变主观体验,感知,情感,思想或行为的建议。
在成年人中,催眠疗法已被证明可导致结肠运动改变,改善内脏超敏性并减少长期持续存在的心理因素,例如躯体化和心理压力。
然而,在IBS患儿中,尽管接受了标准疗法的儿童的疼痛评分和躯体化评分均较低,但在催眠治疗后并未发现超敏反应降低(通过实验测试)。
IBS或FAP-NOS(n = 412;6-18岁)儿童的5个随机对照试验,无论是单独治疗还是在家中通过CD进行催眠治疗,均产生了长期有益影响。
在1年和5年的随访中,接受催眠治疗的患者中分别有85%和68%已没有症状,而对照组中分别只有25%和20%的患者缓解
瑜 珈 疗 法
瑜伽练习已被证明可以改善应激诱导的副交感神经系统活性不足。三个随机对照试验,包括127名IBS儿童(7-18岁),瑜伽疗法在减少腹痛方面具有积极作用。
但是,一项荷兰研究表明,在1年的随访中,瑜伽干预并没有比不包括CBT的标准治疗更有效。由于学习方法的重大缺陷,尚不能提出将瑜伽作为FAPD儿童的常规干预措施的建议。
神 经 刺 激
多项研究表明,脊髓和大脑的电刺激在调节疼痛途径中的功效,能够减少脊髓和中央杏仁核中50%以上的神经元放电,从而减轻内脏疼痛。
一项研究表明,经皮神经电刺激(PENFS)可以调节杏仁核和脊髓神经元的反应特性,并显着降低大鼠内脏超敏反应的发展。
随后,同一组受试者在115名FAPD的青少年(11至18岁)的随机对照试验中显示,具有主动装置的PENFS可以改善健康状况,并显着减轻疼痛和残疾 与假刺激组。
此外,PENFS的有益作用在2个月的随访期间得以维持。尽管有些耳部不适,但未报告严重的不良反应。
补 充 和 替 代 医 学
补充和替代医学包括不同的方法,从针灸和阿育吠陀医学到脊椎指压疗法、整骨疗法、顺势疗法、精神治疗、按摩和冥想等身心技术。大约40%的澳大利亚和荷兰诊断为糖尿病肾病的儿童使用其中某些替代疗法,其中草药治疗是最常见的(46%)。
许多补充疗法被公众认为是“自然的”,比现代医学的医疗设备更安全、更温和。FAPDs儿童对对抗疗法药物相关可能产生不良反应的恐惧,常规治疗没太大效果,让父母希望寻求补充和替代治疗。
然而,到目前为止,评估草药疗法、针灸、顺势疗法、身心疗法或肌肉骨骼操作(如整骨疗法和脊椎指压疗法)对患有家族性帕金森病的儿童的效果的随机对照试验尚不可用。
由于糖尿病周围神经病变的自发缓解率很高(30-70%),采取逐步的管理方法是明智的;必要时,教育、识别和改变压力因素和饮食干预可能是第一步。当症状持续或再次出现时,下一步可能是开始一种心理治疗,如认知行为疗法和催眠疗法,或PENFS。
药 物 疗 法




胃肠症状的严重程度和发生频率对不同患者的功能状态有不同的影响。患者报告的健康相关生活质量(HRQOL)测量应该有助于深入了解FAPDs对儿童和青少年功能状态的不同影响,包括身体、情感、行为、社会和认知方面。
评估症状和HRQOL影响的患者报告结果已成为成人临床状态和治疗结果的公认指标。但在儿童环境中,自我报告的HRQOL措施在仪器开发和临床应用中遇到了挑战,部分原因是担心儿童能否可靠地自我报告与健康相关的信息。
量化个体胃肠道症状对于开发以患者为中心和针对症状的干预措施很重要,这可以改善整体HRQOL。例如,一项针对259名患有功能性便秘,功能性腹痛或IBS的儿科患者的多中心研究发现,胃肠道症状最能预测整体受损。
FAPD在儿童时期很常见,FAPD患病率和/或复杂性可能会增加。因此,需要有来自所有地理区域以及世界各地精心设计的流行病学研究,才能真正了解问题的性质和规模。
特别重要的是,我们目前对导致儿童FAPD发病机理的潜在因素的了解,需要使用来自FAPD患儿的组织样本来解决免疫功能障碍和神经功能障碍的基础和转化科学研究。如上所述,早期的影响,即在复杂的肠脑轴各要素发展的关键阶段发生的事件,通常是辱骂或创伤(心理或医学方面的事件),使易感人群容易患上FAPD。
异常改变肠道菌群的因素可能会改变肠神经系统的结构或功能完整性,进而改变其与中枢神经系统的复杂且平衡的相互作用。结果可能是胃肠道重新调整为过敏状态,而大脑则重新编程为过度警觉状态。
当然,其他遗传因素,社会因素和生理变化,例如在青春期或青春期发生的那些,也可能促进症状发展。
现代工具越来越多地与焦虑和压力相关联,也可能会对FAPD产生重大影响。
总体而言,在过去十年中,儿童家庭保护方案取得了相当大的进展。对所有影响因素,及其与触发FAPD最终发展有关时机的更深入了解,可能带来更合适的预防或治疗策略。
【附录】
功能性腹痛疾病的罗马IV诊断标准
肠易激综合征
该标准必须满足至少2个月,并包括以下所有:
• 每月至少有4天腹痛伴有排便和/或排便次数的改变和/或大便外观的改变
• 腹痛不能随着便秘的解决而消失(疼痛消除的儿童患有功能性便秘,非肠易激综合征)
• 经过适当评估,症状不能完全由另一种疾病解释
功能性消化不良
诊断前必须至少满足2个月的标准,并且必须包括以下一种或多种症状,每月至少4天:
• 餐后饱腹感
• 早期饱腹感
• 与排便无关的上腹部疼痛或灼热感
• 经过适当评估,这种症状不能完全由另一种医学状况来解释
腹型偏头痛
必须在诊断前至少6个月内达到标准,并包括以下所有至少发生两次的情况:
• 持续1小时或更长时间的剧烈、急性脐周、中线或弥漫性腹痛的阵发性发作(应为最严重和最痛苦的症状)
• 发作间隔数周至数月;疼痛使人丧失能力并干扰正常活动;个体患者的定型模式和症状
• 疼痛与以下两种或两种以上症状相关:厌食、恶心、呕吐、头痛、畏光或苍白
• 经适当评估,症状不能完全由另一种医学状况解释,
功能性腹痛
未另行规定标准必须在诊断前至少2个月完成,每月至少四次,包括以下所有内容:
• 并非仅在生理事件(例如,饮食和月经)期间发生的偶发性或持续性腹痛;肠易激综合征、功能性消化不良或腹部偏头痛的标准不足
• 经过适当评估,腹痛不能由其他医疗状况完全解释
相关阅读:
主要参考文献:
Sjölund, J. et al. Prevalence and progression of recurrent abdominal pain, from early childhood to adolescence. Clin. Gastroenterol. Hepatol. 2020
Paediatric functional abdominal pain disorders.[J] .Nat Rev Dis Primers, 2020, 6: 88.
Rutten, J. M. T . M., Korterink, J. J., Venmans, L. M. A. J., Benninga, M. A. & T abbers, M. M. Nonpharmacologic treatment of functional abdominal pain disorders: a systematic review. Pediatrics 135, 522–535
Masuy, I., Van Oudenhove, L. & T ack, J. Review article: treatment options for functional dyspepsia. Aliment. Pharmacol. Ther. 49, 1 134–1 172 (2019)
Russell, A. C., Stone, A. L. & Walker, L. S. Nausea in children with functional abdominal pain predicts poor health outcomes in young adulthood. Clin. Gastroenterol. Hepatol. 15, 706–71 1 (2017)
Maragkoudaki, M. et al. Lactobacillus reuteri DSM 17938 and a placebo both significantly reduced symptoms in children with functional abdominal pain. Acta Paediatr. 106, 1857–1862 (2017).