 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

牛奶蛋白过敏(CMPA)是婴儿最常见的食物过敏类型之一。粪便病原菌培养显示产气荚膜梭菌阳性率超过30%,明显高于其他细菌。因此推测产气荚膜梭菌定植可能是婴儿牛奶蛋白过敏的发病因素之一。
一项真实世界的研究,杨敏团队从我国一家大型三甲医院(广州市妇女儿童医疗中心)招募患有腹泻、粘液便和/或血便的 0-6 个月婴儿的研究中,通过飞行质谱法证实了用于检测产气荚膜梭菌的粪便病原体培养物,并通过PCR鉴定了潜在的毒素基因。随访12个月后,记录牛奶蛋白过敏和食物过敏的诊断。通过Pearson相关分析评估相关性。
这项研究表明产气荚膜梭菌肠道定植在婴儿中很常见,与婴儿牛奶蛋白过敏和食物过敏的发生有关。
产气荚膜梭菌是一种厌氧、革兰氏阳性芽孢杆菌,是一种可引起胃肠道或皮肤和深层组织感染的细菌。产气荚膜梭菌的定植可能导致侵袭性胃肠道感染,产生肠毒素,可能破坏肠上皮细胞间的紧密连接,造成上皮损伤,引起肠道菌群失衡,导致宿主免疫反应异常。
本文我们来详细看一下这项研究过程及相关结果,结合产气荚膜梭菌的生物学特性、毒素等相关知识,深入探讨产气荚膜梭菌定植对婴幼儿过敏相关疾病及其他健康问题的影响,了解这些可以帮助我们更好地了解其在婴幼儿免疫系统发育中的作用,为临床上预防和治疗相关疾病提供新的思路和方法。
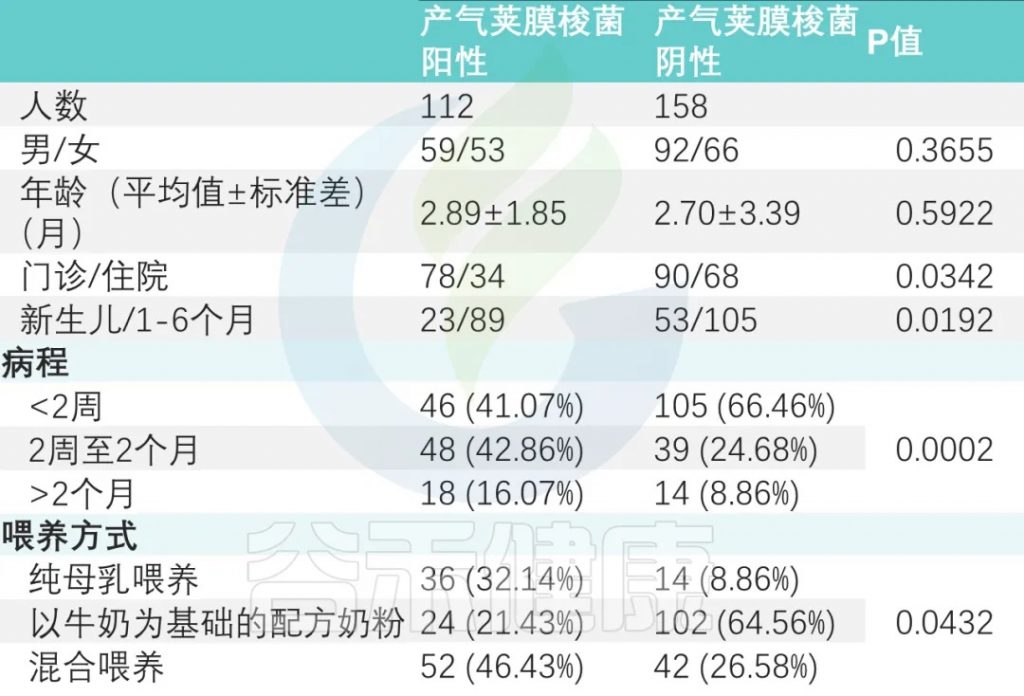
在这项广州妇女儿童医疗中心的研究中,共招募了358名0-6个月的婴儿。对这些婴儿粪便样本进行病原培养,其中128名产气荚膜梭菌呈阳性。
共有270名婴儿(44.07% 为女孩;平均年龄为 2.78 ± 2.84 个月)参加了为期 12 个月的跟踪调查。
注:
▪ 2020年1月1日至2021年12月31日期间因胃肠道症状住院或门诊的所有0-6个月大的婴儿
▪ 排除先天性代谢性疾病、免疫缺陷性疾病和恶性肿瘤的患者

doi: 10.1186/s13099-023-00572-x
专门针对食物过敏和牛奶蛋白过敏的临床诊断,其中包括湿疹、过敏性鼻炎以及食物蛋白诱导的过敏性直肠结肠炎等相关病症。食物过敏是根据症状、饮食排除和口服食物挑战进行临床诊断的。
病程差异
产气荚膜梭菌阴性组与产气荚膜梭菌阳性组显著差异(P < 0.001)。
喂养方式
纯母乳喂养组、母乳添加配方奶喂养组和纯配方奶喂养组产气荚膜梭菌定植阳性率分别为 32.14%、46.43%、21.43%(P<0.05)(下表)。
doi: 10.1186/s13099-023-00572-x
主要症状及诊断
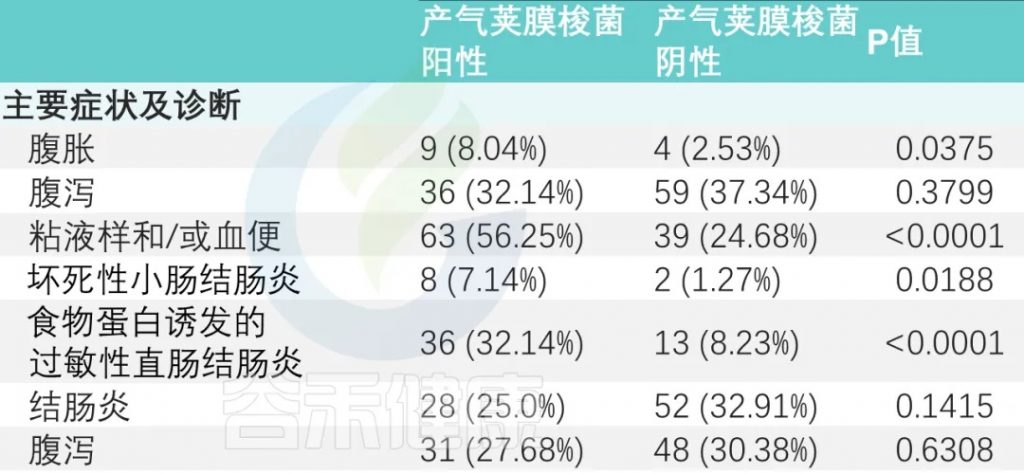
主要症状是腹胀、腹泻和粘液便和/或血便。
有或没有产气荚膜梭菌定植的婴儿,腹胀和粘液样便和/或血便的发生率存在显著差异(P<0.05)。
与产气荚膜梭菌阴性组相比,阳性组NEC(坏死性小肠结肠炎)和FPIAP(食物蛋白诱发的过敏性直肠结肠炎)发生率显著升高(下表)。
抗生素
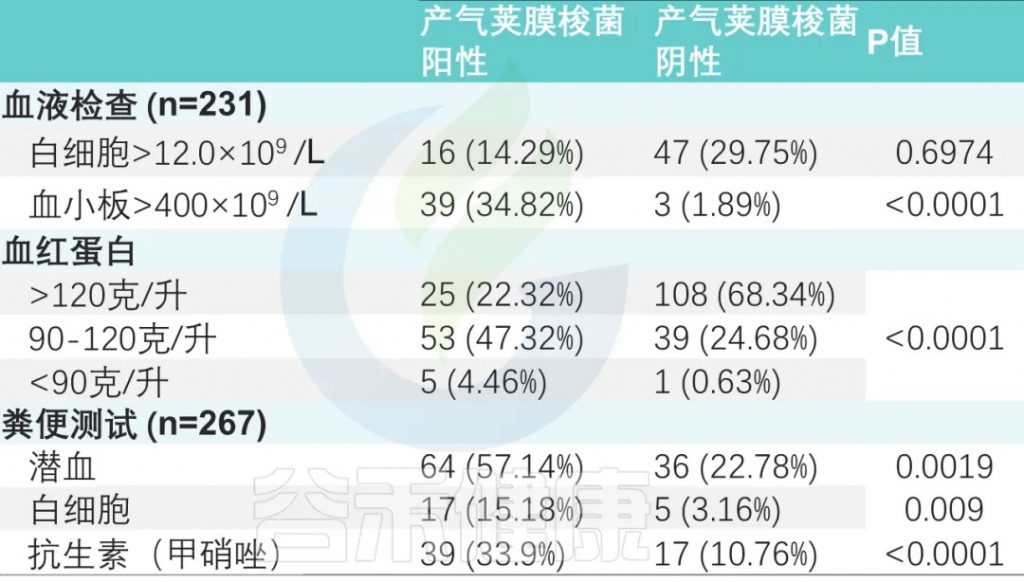
甲硝唑给药率:产气荚膜梭菌阳性组高于阴性组(33.9% vs. 10.76%)(P < 0.0001)。
血常规检查 (231名患者)
两组之间白细胞增多、血小板增多和中性粒细胞减少事件的数量存在显著差异。
粪便常规检查 (267次)
粪便潜血阳性率为37.45%(100/267),
粪便白细胞阳性率为8.2%(22/267)。
两组比较差异有显著性(P <0.001)(下表)。
在 30 名患者不同时间点(0、2、4、12 和 24 周)的 85 份粪便样本中检测到了潜在的特异性毒素基因。
产气荚膜梭菌携带潜在特异性毒素基因的出现率如下:
没有携带其他毒素的分离株。
对83份样本进行基因型鉴定,其中:
17例患者中同时检测到A基因型和C基因型。
经过12个月的随访调查,根据症状、饮食排除和口服食物挑战,临床诊断如下:
24.44%的病例(66/270)食物过敏,其中18.5%的儿童(50/270)患有牛奶蛋白过敏。
在产气荚膜梭菌阳性组队列中:
这两个比例都显著高于产气荚膜梭菌阴性组 [分别为7.59%(12/158)和5.06%(8/158)] (P<0.0001)
(下图)。
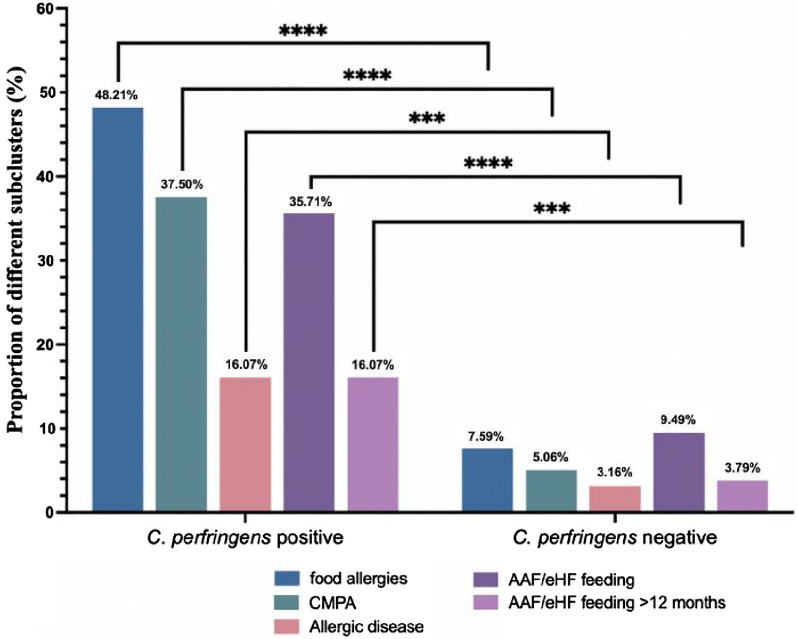
共有8.52%(23/270)的儿童被诊断为过敏性疾病,其中:
共有20.37%(55/270)的儿童喂养氨基酸配方奶粉(AAF)或深度水解配方奶粉(eHF),其中8.89%(24/270)喂养时间超过12个月。
产气荚膜梭菌阳性组氨基酸配方奶粉/深度水解配方奶粉利用率为35.71%,高于阴性组9.49%(P < 0.0001)。两组中喂养氨基酸配方奶粉和/或深度水解配方奶粉超过12个月的儿童人数分别为 16.07%和 3.79%(P = 0.0005)
为了探索产气荚膜梭菌阳性与食物过敏之间的相关性,进行了皮尔逊相关分析,生成了热图,显示食物过敏与产气荚膜梭菌阳性显著相关,粪便潜血、粪便中的白细胞、抗生素使用、血小板增加,血红蛋白减少(P <0.0001)。
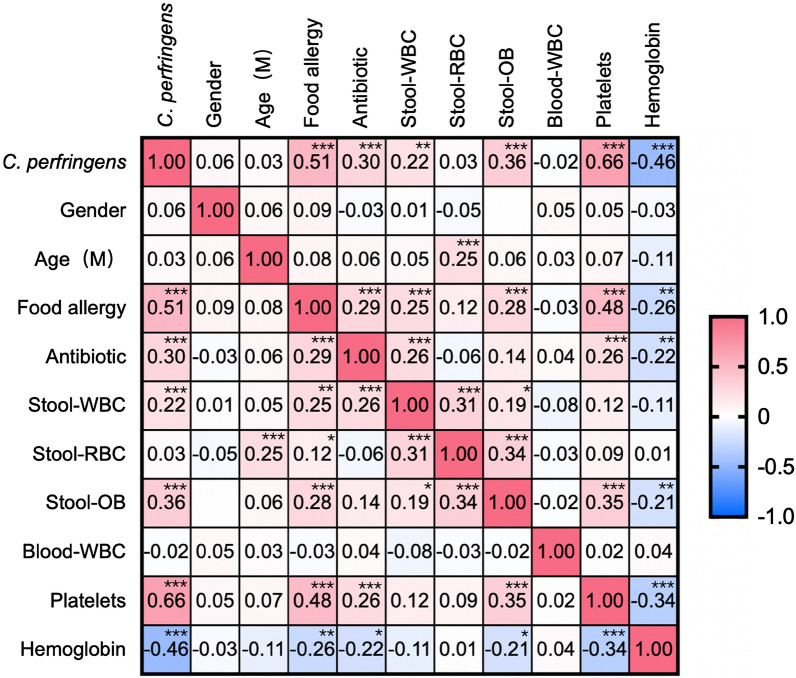
据报道,血小板与食物过敏反应有关,并且与过敏反应的严重程度相关。我们的研究显示食物过敏与血小板之间呈正相关(P<0.0001),这与报道的研究一致。婴儿食物过敏的常见症状包括腹泻和血便,常被误诊为急性或慢性肠炎而采用抗生素治疗。持续便血可能导致贫血,这可以解释本研究中食物过敏与抗生素使用(P<0.0001)和血红蛋白水平(P=0.0001)之间的相关性。
这项真实世界研究结果首次表明,产气荚膜梭菌在有胃肠道症状的中国婴儿中定植率很高,并且与食物过敏和牛奶蛋白过敏的发生有关。
产气荚膜梭菌广泛存在于健康人和动物的胃肠道中。
本研究显示,有胃肠道症状的婴儿中有33.52%有产气荚膜梭菌定植,新生儿和1~6月龄婴儿产气荚膜梭菌阳性率分别为30.25%和45.88%。不同的定植率可能是由于不同的患者群体、分娩方式、喂养方法和胃肠道疾病状况所致。
产气荚膜梭菌和艰难梭菌是可能与婴儿胃肠道感染和过敏相关的致病性梭菌。
先前的研究表明,产气荚膜梭菌定植可能导致多种病理状况,从无症状感染到严重危及生命的败血性休克,例如气性坏疽、食物中毒、坏死性肠炎、抗生素相关性腹泻、菌血症、肠毒血症和严重血管内感染溶血。
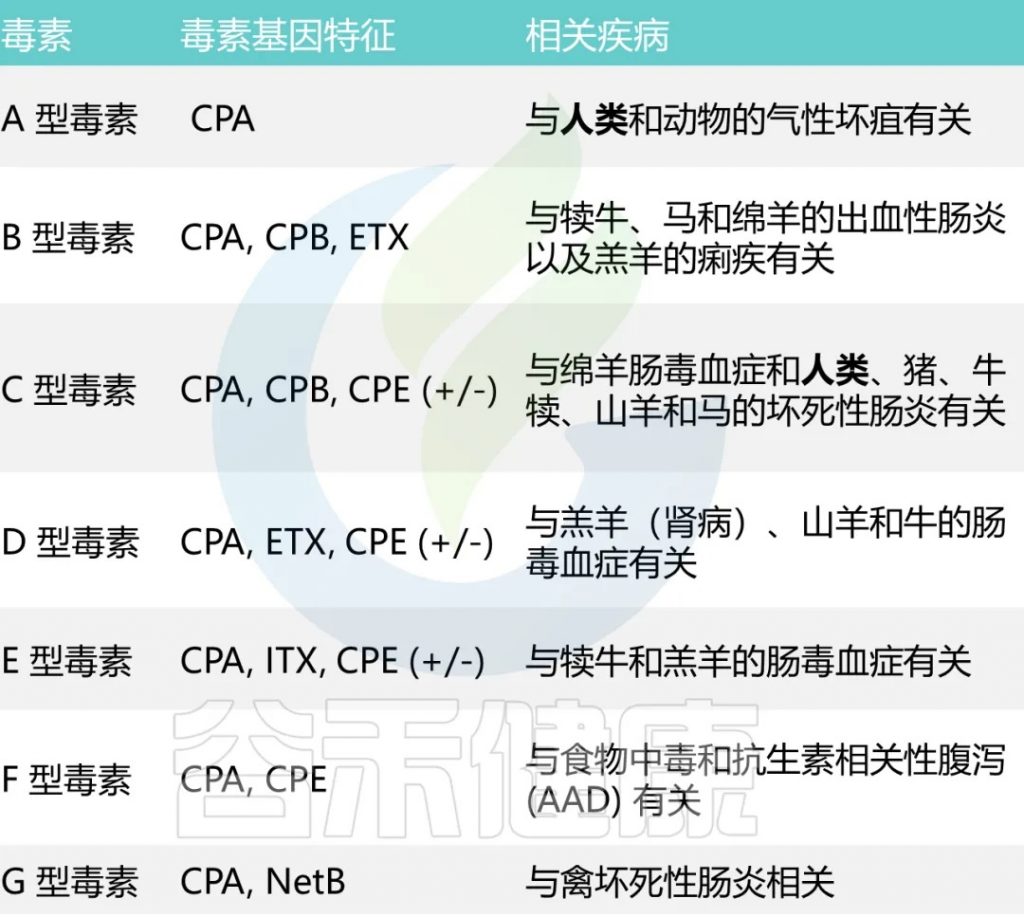
研究重点是产气荚膜梭菌感染及其产生一系列致命毒素(七种主要毒素型 A-G)和酶(例如卵磷脂酶、纤维蛋白酶、透明质酸酶、胶原酶和 DNA 酶)的能力,这些酶有助于其侵袭性。
大多数已确定的腹泻相关病原体是病毒,但在近 80% 的报告病例中并未发现特定病原体。这些病例的病因可能包括产气荚膜梭菌胃肠道感染和饮食/环境因素。
目前还没有关于产气荚膜梭菌定植是否影响儿童食物过敏发生的报道。在112名确诊产气荚膜梭菌定植婴儿队列中,其中 48.21% 出现食物过敏,37.5% 出现牛奶蛋白过敏,这两种患病率均显著高于产气荚膜梭菌阴性组(7.59% 和 5.06%),并且显著高于一般儿科人群中报告的水平。
此外,相关分析显示,食物过敏与该研究队列中产气荚膜梭菌定植、抗生素使用、粪便潜血、粪便白细胞、血小板和血红蛋白水平显著相关。该研究结果清楚地表明,产气荚膜梭菌在出生后第一年定植可能会促进食物过敏和牛奶蛋白过敏的发生。
研究表明,产气荚膜梭菌肠毒素(CPE)在促进紧密连接分解和诱导上皮损伤方面发挥着关键作用,从而导致微生物群变化并触发宿主免疫反应。免疫细胞群的变化很大程度上是由环境和微生物抗原驱动的。
关于产气荚膜梭菌定植与食物过敏的研究很少,但结果并不一致。有报道,过敏婴儿的拟杆菌和/或克雷伯氏菌定植率较高,而产气荚膜梭菌/丁酸梭菌定植率较低。
总之,研究人员推测产气荚膜梭菌定植会因其肠毒素而引起侵袭性胃肠道感染,导致紧密连接分解、上皮损伤、微生物群变化、宿主免疫反应异常,并最终导致食物过敏。
需要进一步的研究来阐明产气荚膜梭菌定植的婴儿发生食物过敏的潜在免疫学和分子机制。
总的来说,产气荚膜梭菌定植为婴儿牛奶蛋白过敏和食物过敏提供了一个思路,应用肠道菌群检测可以帮助识别食物过敏的风险,从而采取相应的预防措施。
此外,对于产气荚膜梭菌定植的抵抗力、空间和特定营养物质的竞争或毒素功能的研究,也能为进一步探索肠道菌群与过敏关系及预防和治疗提供了新的视角。
通过深入研究肠道菌群的变化及其与过敏疾病的关联,这可能涉及有效的药理学抑制剂/化合物的合理设计,调节补充剂/益生菌等各种方式对肠道菌群加以改善,有望为未来开发更加个性化的过敏预防和治疗策略提供重要参考。
这里我们来系统地了解一下产气荚膜梭菌。
产气荚膜梭菌是一种革兰氏阳性,产毒厌氧细菌,有荚膜、非运动、无鞭毛,属于梭菌属,是人类和动物肠道固有的机会病原体。
芽胞形成能力强,可在不利环境下存活
可以形成在传播过程中至关重要的孢子。产气荚膜梭菌孢子对高温、氧气或低营养水平等应激环境具有极强的抵抗力。当遇到有利条件时,内生孢子迅速萌发,产气荚膜梭菌的世代时间最短,为 6.3 分钟。在缺氧环境下生长迅速,能快速繁衍和侵袭宿主组织。对抗生素和化学消毒剂具有一定耐受性。
这些特征有利于其在不同的环境生态位中生存,包括土壤、粪便、污水、食物以及人类和动物的肠道。
这种“生存能力”意味着产气荚膜梭菌与许多感染和疾病有关,包括食源性细菌性疾病等。
具有多种水解酶
可分解蛋白质、脂肪等营养物质,为自身生长提供营养。
产气荚膜梭菌产生大量胞外降解酶,例如蛋白酶(例如梭菌蛋白酶)、透明质酸酶(mu毒素)、胶原酶和糖苷内切酶。
内切-N-乙酰半乳糖酰胺酶 EngCP,在 A 型菌株引起的气性坏疽期间很重要,而两种锌金属蛋白酶则导致 G 型菌株引起的禽坏死性肠炎。
最广为人知的产气荚膜梭菌降解酶是神经氨酸酶,它从宿主细胞表面或粘液中的各种唾液酸糖结合物上产生游离的神经氨酸。产生三种神经氨酸酶,分别为NanJ、NanI、NanH。
产生多种细胞外毒素
已知它能分泌超过20 种毒素,每种毒素类型都与特定疾病相关
A型和C型毒素被认为会引起人类疾病。
A型毒素是导致大多数与产气荚膜梭菌相关的食物中毒和非食源性腹泻疾病的主要因素。根据CDC对食源性疾病暴发的流行病学监测数据,产气荚膜梭菌占5%的暴发事件,10%的疾病病例,4%的住院率。
男性的发病率略高(65%),大多数病例发生在20-49岁人群中。
C型毒素与1944年-1949年在德国战后出现的地方性坏死性肠炎,以及在巴布亚新几内亚高地出现的猪痢有关。严重营养不良会增加对 C 型感染的易感性。
CPE基因,在孢子形成后细胞裂解时产生肠毒素CPE,可能会导致胃肠炎。
产气荚膜梭菌主要毒素的结构域示意图
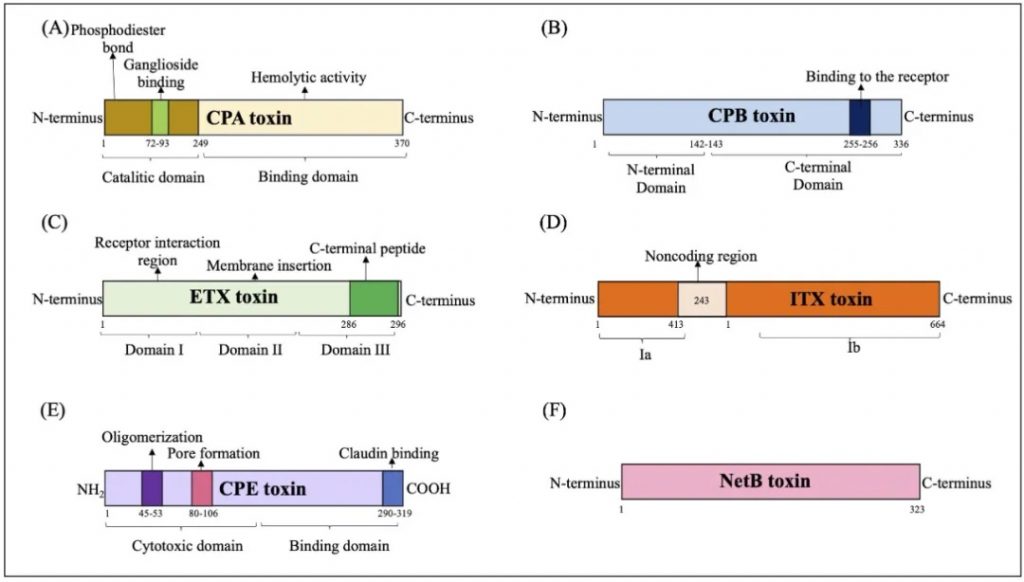
doi.org/10.1080/22221751.2024.2341968
(A) CPA 毒素:CPA毒素与GM1a相互作用,水解磷脂酰胆碱(PC)和鞘磷脂(SM),导致二酰甘油(DAG)和神经酰胺(CER)的形成,并激活原肌球蛋白激酶A受体(TrKA),并触发细胞内信号级联与IL-8释放。磷脂酰肌醇 3 (IP3) 的激活促进细胞质内钙 (Ca+) 进入。
(B) CPB 毒素:CPB 与血小板内皮细胞粘附分子 1 (PECAM-1) 结合,随后释放三磷酸腺苷 (ATP) 并形成允许离子交换进出细胞的孔。
(C) ETX 毒素:ETX 毒素与蛋白质“髓磷脂和淋巴细胞”(MAL) 相互作用,形成活性孔,诱导离子跨细胞膜运输和交换。
(D) ITX 毒素:Ib与脂解刺激脂蛋白受体(LSR)受体的结合介导其进入宿主细胞,通过内吞作用促进Ia进入通道的形成,随后肌动蛋白丝解聚,产生形态变化和改变细胞通透性。
(E) CPE 毒素:CPE毒素与紧密连接蛋白受体结合,通过离子交换和渗透失衡促进细胞表面孔的形成。
(F) NetB 毒素:通过形成允许 Na+、Cl–y 和 Ca2+等离子进入的七聚体亲水孔来识别细胞膜中的无胆固醇区域。
有研究培养从 333 名婴儿的粪便样本中分离出的产气荚膜梭菌,其中29.4% 的婴儿在出院前已被产气荚膜梭菌定植。
三个因素与携带概率呈负相关:
产气荚膜梭菌在母乳中生长不良,说明母乳喂养在早产新生儿护理中的重要性。
长期使用抗生素或持续气道正压通气(CPAP)氧气治疗会在早产儿肠道中为产气荚膜梭菌创造一个不利的环境,从而降低携带的可能性。
产气荚膜梭菌分离物在营养丰富的培养基或母乳中生长,可以作为单一培养物,也可以与婴儿双歧杆菌共培养,婴儿双歧杆菌被选为代表典型的竞争性肠道物种。
食源性疾病
产气荚膜梭菌是食源性疾病(食物中毒)的常见原因,产生肠毒素导致急性胃肠炎。食源性产气荚膜梭菌会导致:腹泻、腹部绞痛、胀气和腹胀。
通常,人们在摄入细菌及其孢子后,当微生物在肠道中形成孢子时,就会形成毒素,通常在 6-24 小时内就会出现症状。腹泻突然发生,但通常症状会在 24-48 小时内消失。
非食源性胃肠道感染
这种类型的感染通常归因于抗生素的使用。但有些人即使不服用抗生素,也会因产气荚膜梭菌而出现偶发性胃肠道症状。免疫系统较弱的人患此类疾病的风险最大。
非食源性产气 荚膜梭菌胃肠道感染导致:
这种类型的产气荚膜梭菌感染通常发生在最近服用过抗生素的60 岁以上成年人中。症状与食源性梭菌感染相似,但持续三天到几周不等。
这种类型的梭菌感染可导致严重脱水(体内水分流失)。然而,人们通常会康复。
一项研究表明,与健康个体 [5%] 相比,IBD 成年患者[19-27%] 产气荚膜梭菌的患病率更高,这表明与 IBD 存在潜在关联。
产气荚膜梭菌具有大量HMO消化所需的糖苷水解酶,表明它具有婴儿肠道机会性定植的可能性,从而导致临床疾病。
皮肤和深层组织感染
产气荚膜梭菌与严重外伤后可能发生的严重皮肤和深层组织感染(气性坏疽)有关。
从受污染的伤口(例如复合性骨折、产后子宫)开始,感染会在 1-3 天内扩散。
皮肤或深层组织产气荚膜梭菌感染(气性坏疽)会导致:
有时,感染仅导致厌氧性筋膜炎或蜂窝织炎。
其他感染
如乳腺炎、子宫内膜炎等。
促进定植
定植能力,即体内持续和增殖/存活的能力,是一些产气荚膜梭菌感染(例如F型菌株非食源性人类胃肠道疾病)的重要特征,产气荚膜梭菌定植通常涉及生长/生存和粘附所需的营养获取。例如,F型非食源性胃肠道疾病即使在腹泻时也能持续长达数周,这表明肠道粘附和营养获取对于这些 F型菌株在腹泻时稳定定植于肠道是必需的。
肠道粘附
为了在胃肠道中定殖,产气荚膜梭菌使用多种分子策略,包括产生唾液酸酶。虽然产气荚膜梭菌产生三种唾液酸酶,但 NanI 是由持续存在于肠道中的 F 型非食源性胃肠道疾病菌株产生的。这种相关性表明 NanI 对产气荚膜梭菌慢性肠道疾病有重要贡献。
NanI 的蛋白酶激活可能进一步促进产气荚膜梭菌菌株引起的定植。
增加营养物质的获取
多项体外研究支持 NanI 对与肠道感染相关的产气荚膜梭菌菌株的生长和存活的贡献。例如,NanI在宿主粘蛋白或培养的 Caco-2 细胞存在的情况下支持F 型非食源性疾病菌株 F4969 的体外生长和存活。这种生长促进涉及 NanI 生成的唾液酸的产生和利用,然后唾液酸可以被产气荚膜梭菌代谢。
可能涉及几种潜在的机制:
NanI 可能通过修饰肠细胞表面来促进产气荚膜梭菌粘附,从而允许暴露用于结合的未知受体,和/或减少该表面上唾液酸的负电荷。
大批量烹制并在不安全温度下保存的食物,通常会导致产气荚膜梭菌食物中毒的爆发。通常与产气荚膜梭菌食物中毒有关的特定食物包括:
产气荚膜梭菌食物中毒的爆发往往发生在为大量人群提供服务并且将食物保持在适当温度可能很困难的环境中,例如医院、学校食堂、监狱、疗养院和提供餐饮的大型活动。
组织感染
食物中毒
将食物煮至安全的内部温度杀死细菌。使用食物温度计进行检查,尤其是整只家禽和大块烤肉。
如果煮熟的食物不尽快食用,请将其保持在60 ℃或更高温度或4℃或更低温度。
烹饪食物或将其从保持安全内部温度的器具中取出后 2 小时内,将剩菜冷藏在4℃或更低的温度下。如果食物暴露在32℃以上的温度下(例如炎热的汽车或野餐),请在 1 小时内冷藏。
热食可以直接放入冰箱。
将大锅食物(例如汤和炖菜)和大块肉类(例如烤肉)分成小份,以帮助其在冰箱中快速冷却。
食用前将剩菜重新加热至74℃或更高温度。
主要参考文献
Huang KY, Liang BS, Zhang XY, Chen H, Ma N, Lan JL, Li DY, Zhou ZW, Yang M. Molecular characterization of Clostridium perfringens isolates from a tertiary children’s hospital in Guangzhou, China, establishing an association between bacterial colonization and food allergies in infants. Gut Pathog. 2023 Oct 8;15(1):47.
Yao PY, Annamaraju P. Clostridium perfringens Infection. [Updated 2023 Aug 8]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan-.
McDonald AG, Lisacek F. Simulated digestions of free oligosaccharides and mucin-type O-glycans reveal a potential role for Clostridium perfringens. Sci Rep. 2024 Jan 18;14(1):1649.
Low KE, Smith SP, Abbott DW, Boraston AB. The glycoconjugate-degrading enzymes of Clostridium perfringens: Tailored catalysts for breaching the intestinal mucus barrier. Glycobiology. 2021 Jun 29;31(6):681-690.
Mehdizadeh Gohari I, A Navarro M, Li J, Shrestha A, Uzal F, A McClane B. Pathogenicity and virulence of Clostridium perfringens. Virulence. 2021 Dec;12(1):723-753.
Camargo A, Rámirez JD, Kiu R, Hall LJ, Muñoz M. Unveiling the pathogenic mechanisms of Clostridium perfringens toxins and virulence factors. Emerg Microbes Infect. 2024 Apr 9:2341968.
Arjomand Fard N, Wine E. Clostridium perfringens: A Potential Pathobiont in Inflammatory Bowel Disease. J Crohns Colitis. 2024 Feb 16:jjae019.
Kiu R, Shaw AG, Sim K, Acuna-Gonzalez A, et al., Particular genomic and virulence traits associated with preterm infant-derived toxigenic Clostridium perfringens strains. Nat Microbiol. 2023 Jun;8(6):1160-1175.

谷禾健康

当地时间12月19日,微软联合创始人、亿万富翁比尔·盖茨发布了对来年的年度预测,称 2024 年将是一个“转折点”。
在这封长达 10 页的信中他展示了对人工智能领域的更多创新、婴儿营养不良问题的突破、气候变化谈判的进展等多方面的期待。
人工智能可以让世界变得更加公平。盖茨对人工智能的预测超越了去年的超声波预测,他断言人工智能的进步将广泛改善全球健康,同时促进创新。
人工智能可以帮助世界各地对抗抗生素耐药性疾病,识别高风险妊娠并估计孕龄等,他预计人工智能在开发新药、诊断疾病和增强教育资源方面将发挥至关重要的作用。
盖茨表示,世界在利用肠道微生物补充剂来解决儿童营养不良方面即将取得突破。
本文我们来看看盖茨眼中的儿童营养不良问题及解法,盖茨预计,随着对微生物组的深入研究,人们将能够开发出以微生物为基础的新型营养治疗方案,这将给解决全球儿童营养危机带来重要进展。
期待已久的营养不良问题的突破即将到来
在盖茨基金会,我们愿意下大赌注。我们知道每一次冒险都可能没有回报,但这没关系。我们的目标不仅仅是逐步取得进展。我们的目标是将我们的努力和资源投入到重大项目中,这些项目一旦成功,就能拯救和改善生命。
当你下一个大赌注时,你往往要等待很长时间才能看到它是否有回报。当你终于意识到它会成功时,那种感觉是难以置信的。我最兴奋的一次豪赌就接近了这一时刻:利用我们对肠道微生物群的了解来预防和治疗营养不良。
经常有人问我,如果只能解决一个问题,我会选择什么。我的答案不变:营养不良。这是世界上最严重的健康不平等现象,大约每四个儿童中就有一个受到影响。如果在生命的头两年得不到足够的营养,身体和智力都无法正常发育。通过解决营养不良问题,我们可以减少导致儿童死亡的最大因素之一。
营养不良的原因远比没有得到足够的食物要复杂得多。大约15年前,研究人员注意到脊髓灰质炎等口服儿童疫苗在营养不良率高的地区效果不佳,他们开始怀疑生活在肠道中的微生物群可能在其中发挥了作用。很明显,有什么东西妨碍了它们被正常吸收。
这种怀疑在2013年得到了证实,当时生物学家杰夫·戈登(Jeff Gordon)发表了一项有里程碑意义的研究,关于马拉维一对双胞胎婴儿的微生物群。微生物群不仅是健康的副产物,还是健康的决定因素。这是第一条重要线索,表明我们或许可以通过改变肠道微生物群来减少营养不良问题。
经常有人问我,如果只能解决一个问题,我会选择什么。我的答案不变:营养不良
在过去的十年里,我们对肠道微生物群的了解比之前的1000年还要多。我们发现,生活在肠道中的细菌可能处于功能失调状态,从而导致炎症,使人无法吸收营养。我们发现,如果及早干预,就能最大程度地改善肠道微生物群。
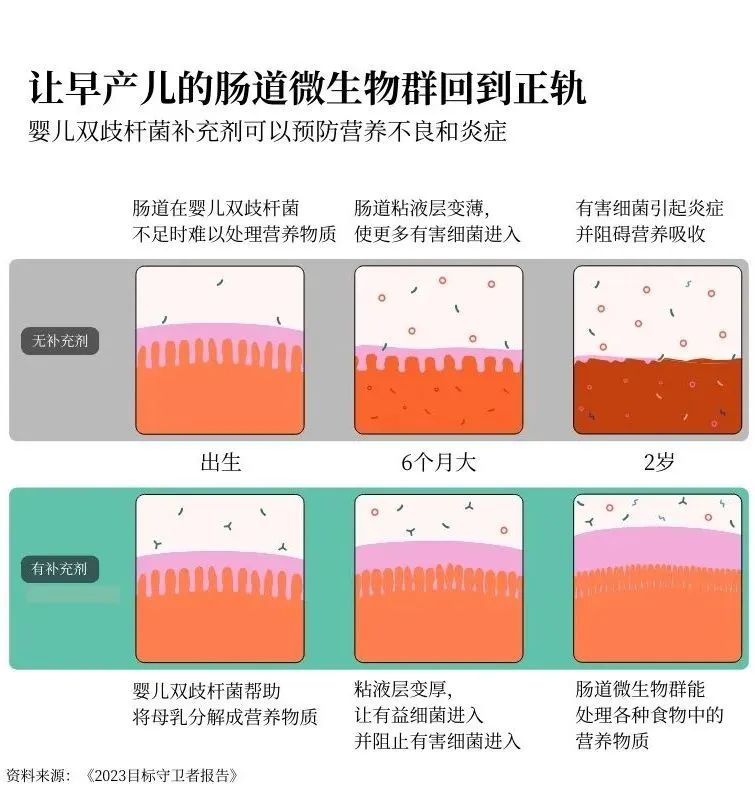
在人类发育过程中最先出现的肠道细菌之一叫做婴儿双歧杆菌。它能帮助将母乳中的糖分分解成人体生长所需的营养物质。反过来,母乳又为婴儿双歧杆菌和整个肠道微生物群提供食物。这是一个良性循环。但是,如果婴儿一开始没有足够的婴儿双歧杆菌,他们就可能无法从母乳中吸收足够的营养来支持其他必要的肠道细菌的生长。
要克服这种缺陷几乎是不可能的。你可以获得世界上所有富含营养的食物,但这并不管用。如果你的肠道生长路径过早被打乱,你可能永远无法吸收到所需的全部营养。
但是,如果我们能给高危婴儿服用婴儿双歧杆菌作为益生菌补充剂呢?我们能否及早干预,让他们正常发育?
这正是基金会合作伙伴多年来一直在研究的问题——我们终于找到了答案。我们正在对一种可添加到母乳中的婴儿双歧杆菌粉末补充剂进行三期临床。来自5个国家的16000名婴儿参与了试验,研究人员正在对每个婴儿进行跟踪,以确保益生菌既安全又有效。
目前的研究结果令人惊叹:通过给婴儿喂食这种益生菌,可以帮助他们的微生物群进入积极状态,从而使他们能够长大并充分发挥潜力。这对预防营养不良大有裨益。
在婴儿出生前就能改善肠道微生物群,这也让我感到兴奋。新的研究发现,婴儿的微生物群与母亲的微生物群息息相关。解决子宫内的炎症问题会给产妇、胎盘和发育中的胎儿带来更多益处。
如果我们能给准妈妈提供一种益生菌补充剂,让她的孩子从出生第一天起肠道就正常发育,那会怎么样呢?目前还不清楚这些活体生物药到底是什么样的,也不清楚如何给药,这还只是非常早期的研究。但研究表明,健康的微生物群可帮助婴儿在妊娠晚期每天增加5克体重。
在过去十年里,儿童健康领域发展速度超出了我一生中的预期。看到微生物群从一个完全看不见的东西变成解决世界上最大健康不平等之一的关键策略,真是令人惊叹。我迫不及待地期待在接下来一年里我们将学到多少新知识,以及我们将如何运用这些知识来拯救生命…
——比尔·盖茨
儿童营养不良问题的现状如何?带来什么问题?
儿童营养不良问题给全球健康带来巨大挑战,据世界卫生组织和联合国儿童基金会的数据统计,到 2020 年,估计有1.49亿 5岁以下儿童生长发育迟缓(年龄身高低),而 4500万儿童出现消瘦(WLZ 低)。
营养不良及其长期后遗症是该年龄段人群发病和死亡的主要原因。后遗症包括线性生长、免疫和代谢功能以及神经发育的持续损害——所有这些都对当前的干预措施有很大的抵抗力。
从比尔·盖茨的年度总结我们也可以看到,他十分重视肠道微生物对健康的影响,总的来说,微生物方面的研究给儿童健康带来了很大希望。
从肠道微生物组的角度入手,对营养不良儿童进行基于微生物群的相关干预措施,比尔及梅琳达·盖茨基金会已支持多项相关研究。我们来看近期得到该基金会支持的两篇研究文献。
在健康儿童中,肠道微生物组在分类和功能多样性方面稳步增长,直到3岁,其中最明显的变化发生在断奶期间。相比之下,营养不良儿童的肠道微生物组是年龄倒退的,即肠道微生物组与年幼儿童相似。
抗生素是严重急性营养不良的标准治疗方法,因为即使儿童没有出现明显的疾病,他们也可能因急性感染而突然恶化。
在马拉维和尼日尔,与安慰剂相比,短期(即7天)阿莫西林给药已被证明在降低全因死亡率、住院率、腹泻病和改善人体测量方面具有益处。
然而,抗生素治疗对严重急性营养不良儿童的潜在后果(如抗生素耐药性的发展和微生物组破坏)仍存在不确定性。
研究设计
研究人员想要确定 7 天的阿莫西林治疗,对接受严重急性营养不良治疗的儿童肠道微生物组和抗生素耐药组的急性和长期变化的影响。该成果发表在《Lancet Microbe》。

研究人员对尼日尔门诊治疗的严重急性营养不良儿童(6-59 个月)的阿莫西林随机、双盲、安慰剂对照试验 (NCT01613547) 进行了二次分析。从2013年9月23日至2014年2月3日从整个队列中随机选择了161名儿童(n = 2399)进行最初12周的随访。
根据人体测量结果从这161名儿童中选择了一个方便样本,2年后(2015年9月28日至10月27日)进行随访。儿童在基线、第 1 周、第 4 周、第 8 周、第 12 周以及 2 年随访队列中的第 104 周提供了粪便样本。研究人员进行了宏基因组测序,然后对粪便样本进行了微生物组和耐药组分析。38 名无严重急性营养不良的儿童和 6 名与原始队列基线年龄相匹配的严重急性营养不良儿童被用作参考对照。
研究结果
结果表明,营养不良的尼日尔儿童在接受抗生素治疗后,虽然发现克雷伯氏菌属、埃希氏菌属等增加,这些菌可能与更严重的感染相关,但是,微生物组和耐药组扰动的负面影响似乎是短暂的,在三周内完全消失。
进一步观察到阿莫西林治疗的一些意想不到的长期益处,包括改善长期微生物组丰富度,多样性和成熟度。
阿莫西林对长期微生物组成熟的影响
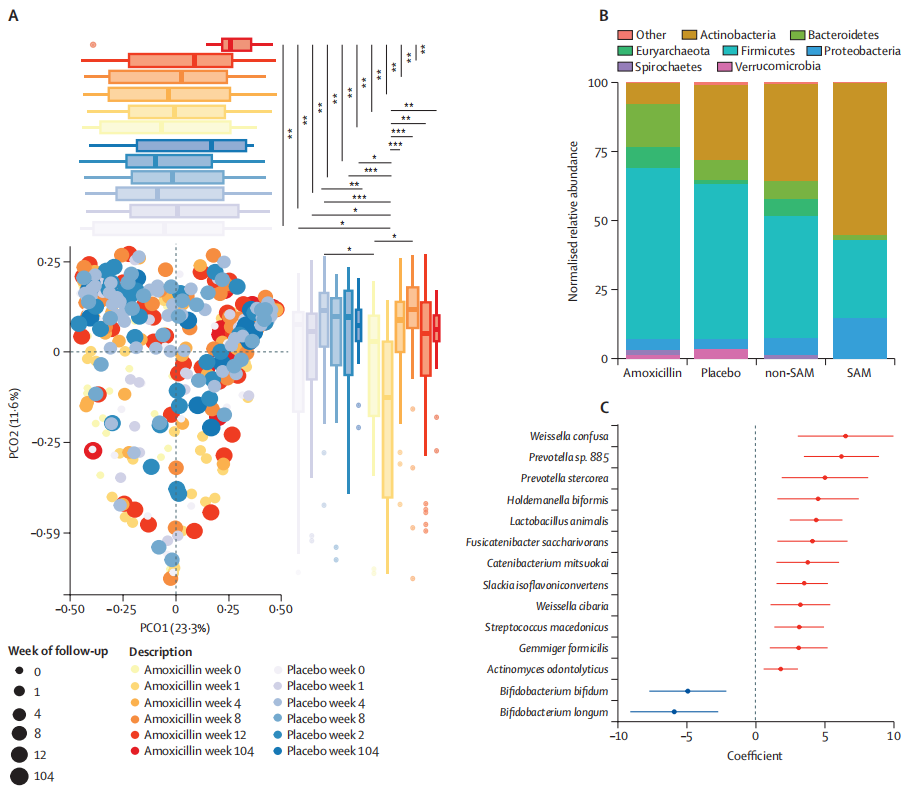
doi.org/10.1016/S2666-5247(23)00213-6
生命头三年肠道微生物组急剧成熟的一些关键驱动因素包括婴儿在出生期间和出生后接触母体微生物、加入牛奶、奶粉以及向固体食物的过渡。在营养不良的儿童中,肠道微生物组的成熟过程和生长都受到阻碍。但在治疗计划中加入抗生素改善了他们的身体测量和微生物组发育。
抗生素可能起到重置的作用,使有助于固体食物消化的微生物群在肠道生态系统中繁衍生息。
“
接受抗生素治疗的效果,对严重营养不良儿童来说算是个好消息,对于这一特定人群,抗生素治疗的益处似乎大于风险,但风险确实存在。研究人员警告说,儿童中已知的耐药细菌和耐药基因的增加不应被忽视。
营养干预措施,如即食治疗性食品,已被证明可以暂时改善肠道微生物组的成熟度和人体测量得分;然而,这种改善并不总是持续的。
在过去的5年里,合理设计的以微生物群为导向的治疗性食品在中度和重度急性营养不良儿童的微生物组恢复和人体测量得分方面显示出了希望。
接下来我们来看对于微生物群为导向的治疗性食品研究的最新进展。
生命头两年,肠道微生物群的发育需要与身体其他部分、其他器官系统的发育同步。当这个微生物群不完全形成时,仅仅增加热量是无法修复的。研究人员试图寻找特定的食物成分,以滋养健康的肠道微生物群,希望修复营养不良儿童肠道微生物群的功能失调。
使用传统食疗食品治疗可减少死亡,但并不能实质性改善营养不良的其他长期影响,包括新陈代谢、骨骼生长、免疫功能和大脑发育问题。
近日,来自华盛顿大学医学院的一项研究,已经确定了一种新型治疗食品中天然存在的关键生化成分,以及处理这些成分的重要细菌菌株。
该研究表明,识别这些成分以及作为其治疗靶标的关键促生长肠道细菌菌株,研究强调了了解细菌菌株如何加工特定食物成分的重要性,可以帮助指导当前食品配方的治疗,并可以在未来创造新的、更有效的配方。该研究成果于2023年12月13日发表在《Nature》杂志。
研究人员从试验参与者的粪便微生物群中重建了1000个细菌基因组(宏基因组组装基因组,简称MAG),确定了75个丰度与体重生长(体重长度Z评分变化,简称WLZ)正相关的MAGs。将MAG基因表达的变化表征为治疗类型和WLZ反应的函数,并定量MDCF-2和粪便中的碳水化合物结构。
结果表明,两个与WLZ呈正相关的普雷沃氏菌MAG是MDCF-2诱导的代谢途径表达的主要贡献者,这些代谢途径涉及利用MDCF-2的组分聚糖。
结果强调了微生物组反应的显著菌株特异性,并指出两种普氏菌菌株(MAG Bg0018 和 MAG Bg0019)是 MDCF-2 聚糖代谢和宿主体重生长反应的关键介质。
在生长相关细菌分类群代谢的MDCF中鉴定生物活性聚糖结构,有助于指导关于其在急性营养不良儿童中使用的建议,并有助于开发其他制剂。
在这项工作的基础上,世界卫生组织与比尔及梅琳达·盖茨基金会正在支持一项大型多站点临床试验,研究这种新的治疗性食品——MDCF-2,或微生物组导向的补充食品。
MDCF-2 治疗性食品包括哪些食物成分?
在 2021 年的临床试验中,MDCF-2 治疗性食品作为膳食补充剂提供,以提供儿童每日能量需求的约 20%。
Prevotella copri 两个菌株对MDCF-2干预改善营养不良的关键作用
研究人员发现:普雷沃氏菌Prevotella copri与儿童的生长发育呈正相关。
P. copri是拟杆菌门的成员,该门的成员含有一组叫多糖利用基因座(PUL)的基因,这些基因介导特定聚糖或一组聚糖的检测、导入和代谢。
它们在利用MDCF-2治疗食品中有益的生物活性碳水化合物结构的代谢途径中表现出活性的增加。
与接受传统治疗性食物的儿童相比,接受MDCF-2的儿童血液中支持肌肉骨骼生长和神经发育的某些蛋白质水平较高,与炎症有关的蛋白质水平较低。也表明,微生物群修复的作用远不止于肠道。
研究人员对这些儿童的粪便样本进行了广泛的基因组分析,了解对这些食物成分有反应的细菌,以及这些细菌对治疗的反应所具有和表达的代谢能力。事实证明,许多与儿童生长密切相关的细菌富含碳水化合物代谢的途径。
分析不同食物中的关键有效成分
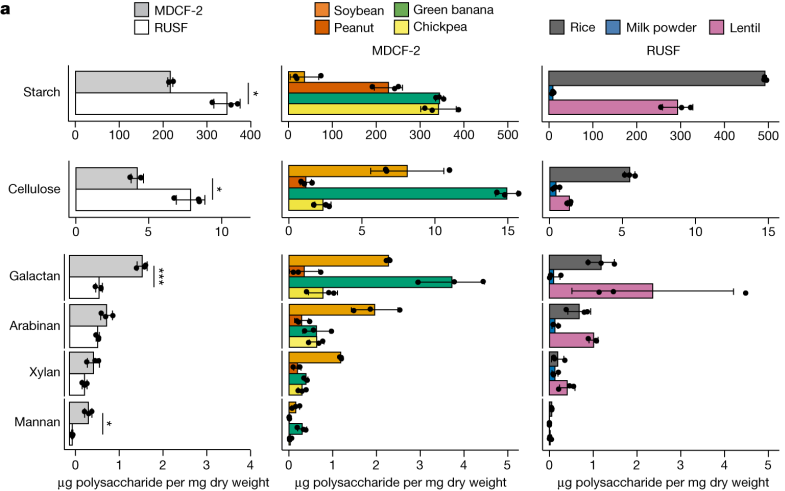
在该研究中,通过质谱分析MDCF-2和RUSF两类食品,确定其组成成分。
MDCF-2、RUSF 及其食品成分中的多糖
DOI: 10.1038/s41586-023-06838-3
对这些食物详细分析表明,MDCF-2食物中L-阿拉伯糖、D-木糖、L-岩藻糖、D-甘露糖和D-半乳糖醛酸 (GalA) 显著更丰富(P < 0.05)。
也就是说,MDCF-2含有更多的多糖,即半乳聚糖和甘露聚糖。而传统的治疗性食物RUSF含有更多的淀粉和纤维素。
MDCF-2 有效提高营养不良儿童生长
尽管MDCF-2的热量密度比高热量食物低15%,但与接受传统补充食物的儿童相比,接受MDCF-2治疗的儿童表现出更高的生长速度。
与MDCF-2治疗相关的生长增加与儿童微生物群中某些普氏菌菌株中存在的代谢途径的表达增加有关,这些途径与生物体利用MDCF-2中存在的多糖有关。
“来自食物频率问卷的信息表明,对MDCF-2反应最大的儿童也食用了更多的坚果和豆类作为他们日常饮食的一部分” ,研究人员表示,“这些坚果和豆类具有一些与MDCF-2相同的多糖。这表明可能有机会调整MDCF-2的成分和剂量,以进一步增强其治疗效果”。
营养不良儿童“微生物组修复”的一个定义是,重新平衡有益菌的表现和表达功能,使其呈现出更有利于健康微生物组-宿主共同发育的构型。
以这种方式将膳食聚糖和微生物代谢联系起来,为基于培养的计划提供了一个起点,这些计划旨在检索这些“效应”类群的分离物,用作潜在的益生菌制剂,或者如果与他们渴望的关键营养素相结合,修复对单独基于食物的干预反应不足紊乱的微生物群,提供合生元配方。
当然,P.copri菌株和MDCF-2聚糖之间的关系并不排除其他宏量或微量营养素对MDCF-2在增重方面优于RUSF的贡献。
总之,为改善微生物群的营养干预提供了一种新的见解。
这些和其他研究的结果有助于加深我们对微生物如何与人类细胞和器官合作,从而影响发育生物学的理解,帮助相关产业科研人员开发微生物组导向疗法的方法,帮助开发构建儿童营养健康的新策略,以确保在出生后的头几年形成健康的微生物组,尽可能规避儿童营养不良风险。
同时,随着人工智能技术及高通量测序等先进技术的不断发展,整合食物-微生物-人体交互作用研究,通过对婴幼儿的肠道菌群进行定期检测,可以帮助家长更好地监测儿童肠道菌群的变化,及时发现异常,采取相应的纠正措施,有利于促进儿童的身心健康发育。
谷禾健康

现如今,有过敏症状的宝宝越来越多,如何防治孩子过敏成了颇受关注的公共健康问题之一。
过敏的原因除了遗传因素外,还与宝宝肠道菌群失调,自身的免疫系统发育不成熟,环境因素等息息相关。
本文列举的最新研究进展,从过敏早期识别干预,耐药基因,食物过敏及其因果关联等方面,展示了微生物群如何在其中发挥作用,为儿童过敏的防治提供新思路。
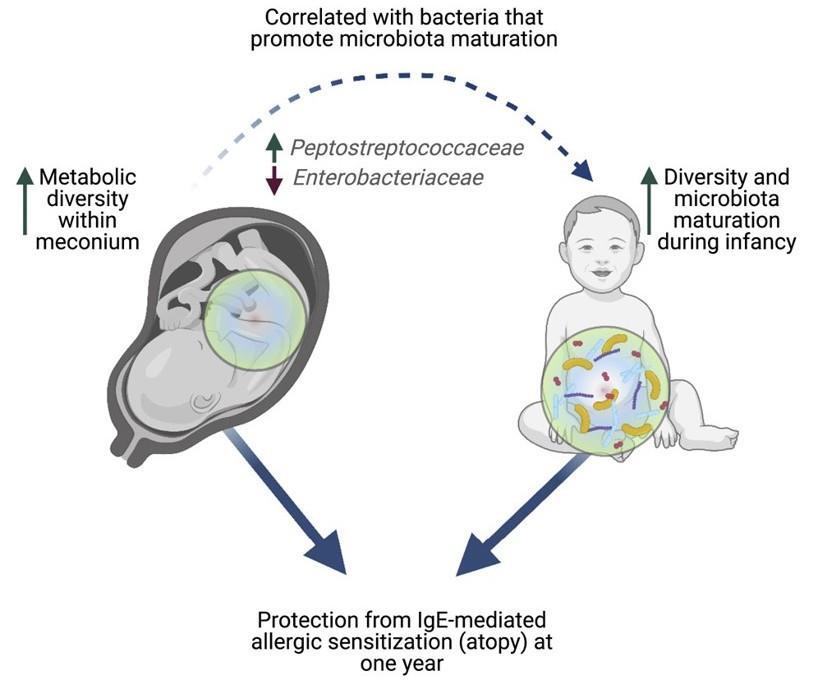
新生儿的第一次大便可能揭示发生过敏的风险
微生物群的成熟与免疫系统的发育同时发生,两者都与一系列疾病有关,包括过敏、花粉热、哮喘和湿疹。
发表在Cell Reports Medicine 通过分析 100 名新生儿的粪便,研究人员发现婴儿第一次粪便的成分可以决定儿童在以后的生活中是否有可能患上过敏症和其他疾病。研究小组发现,缺乏特定分子与一年后过敏的风险增加有关。这些化学物质的减少与在微生物群成熟中起关键作用的细菌的变化有关。
Petersen Cet al., Cell Rep Med. 2021
新生儿的第一次粪便,称为胎粪。胎粪是一种粘稠的深绿色物质,在怀孕 16 周左右开始在胎儿肠道中形成,含有羊水、皮肤细胞以及婴儿摄入的其他物质和分子。
胎粪也是出生后在肠道中定殖的第一批微生物的最初“食物来源”。胎粪就像一个时间胶囊,揭示了婴儿在出生前接触过的东西。
过 敏
为了评估胎粪成分是否会影响以后发生过敏的风险,研究人员研究了新生儿第一次粪便中存在的代谢物。然后,当孩子们满一岁时,该团队进行了一项皮肤测试,以测量免疫系统的反应性。
分析表明,婴儿胎粪中不同类型的分子越少,孩子在出生后第一年内发生过敏的风险就越高。
一些代谢途径,包括那些涉及氨基酸代谢的途径,在后来出现过敏性疾病的婴儿的胎粪中最少。
与没有发生过敏反应的新生儿相比,在一岁时发生过敏反应的新生儿在出生时的胎粪代谢多样性降低。
早 期 干 预
接下来,研究人员分析了胎粪成分是否会影响肠道微生物群的成熟。胎粪“代谢组”较少的婴儿的细菌丰度平较水平低,如肠杆菌科,这在微生物群的成熟中起着关键作用。
最后,研究人员将有关胎粪和微生物群组成的信息与新生儿及其母亲的临床数据相结合,以准确预测婴儿是否会在 1 岁时出现过敏反应。
这项工作表明,健康的免疫系统和微生物群的发展实际上可能在孩子出生之前就开始了——这表明婴儿在子宫内接触的微小分子对未来的健康起着至关重要的作用。
研究人员说,调节子宫内关键代谢物的早期干预措施有助于促进微生物群和免疫系统的健康发育,从而预防过敏性疾病的症状。
这些发现可能有助于识别有患过敏症或哮喘风险的婴儿,并制定有助于预防这些疾病的早期干预措施。
参考文献:
Petersen C, Dai DLY, Boutin RCT, Sbihi H, Sears MR, Moraes TJ, Becker AB, Azad MB, Mandhane PJ, Subbarao P, Turvey SE, Finlay BB. A rich meconium metabolome in human infants is associated with early-life gut microbiota composition and reduced allergic sensitization. Cell Rep Med. 2021 Apr 29;2(5):100260.
婴儿的肠道微生物群包含数百个抗生素抗性基因
人类肠道微生物群已成为细菌的储存库,这些细菌含有帮助它们抵抗抗生素的基因。
发表在Cell Host & Microbe的一项研究通过分析丹麦 650 多名一岁儿童的粪便样本,发现婴儿的肠道细菌有数百个抗生素抗性基因。