 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

目前越来越多营养概念诸如”低碳水化合物饮食”正在流行,然而,所有的碳水化合物都是不好的吗? 其实并非如此。
其中,抗性淀粉就是一种特殊的碳水化合物,它与我们通常所熟知的淀粉有区别。抗性淀粉之所以得名,是因为它能够抵抗人体消化酶的作用,逃离被吸收的命运,直接进入肠道。这种特性使得抗性淀粉拥有许多健康功效,它不仅能调节血糖,还能促进有益菌的生长,改善肠道功能,甚至还能增强饱腹感,帮助控制体重。
抗性淀粉天然存在于豆类(如扁豆、鹰嘴豆)、某些谷物(如大麦、燕麦)、块茎(如土豆、山药)等食物中。此外,各种食品加工和烹饪方法可以提高食品中的抗性淀粉含量,进一步使这种淀粉的潜在膳食来源多样化。
作为一种膳食纤维,抗性淀粉可以作为微生物发酵的底物,例如拟杆菌属,瘤胃球菌,双歧杆菌等可以发酵抗性淀粉。
一些肠道细菌促进抗性淀粉发酵产生短链脂肪酸。短链脂肪酸的主要功能是改善肠上皮屏障的完整性,缓解局部和全身炎症,产生全身效应,影响代谢健康、免疫功能,甚至可能影响大脑健康。
目前代谢性疾病负担正在增加,一些膳食可以通过调节肠道菌群干预疾病,其中抗性淀粉也很重要,它结合了传统和科学,促使研究人员和消费者重新审视传统饮食习惯并认识到其潜在的健康影响。
本文探讨了抗性淀粉和肠道微生物组之间复杂的相互作用,包括抗性淀粉影响微生物群落的机制、这些相互作用对健康的影响。此外,还讨论了富含抗性淀粉的饮食对肠道健康的影响。随着对肠道菌群在健康和疾病中的作用了解越来越多,强调从天然来源获取抗性淀粉的饮食将会不断增长,为营养干预提供新途径。
▼
什么是抗性淀粉?
抗性淀粉(RS)是一种不被人体消化酶分解的淀粉,被认为是膳食纤维。
淀粉作为葡萄糖的储存形式天然存在于植物中。食品中的淀粉可分为慢消化淀粉(SDS)、快速消化淀粉(RDS)或抗性淀粉(RS)。
一般淀粉在小肠中迅速分解并转化为葡萄糖,并迅速吸收到血液中,而抗性淀粉则抵抗正常消化,因此得名。它不会分解成葡萄糖,而是不受干扰地通过消化道,直到到达结肠。
首先,淀粉的基本结构基于两种不同的葡萄糖聚合物——直链淀粉和支链淀粉。
直链淀粉主要是由α-1,4-葡萄糖单元组成的线性分子,与支链淀粉的分支结构形成对比,支链淀粉还包含α-1,6键连接。
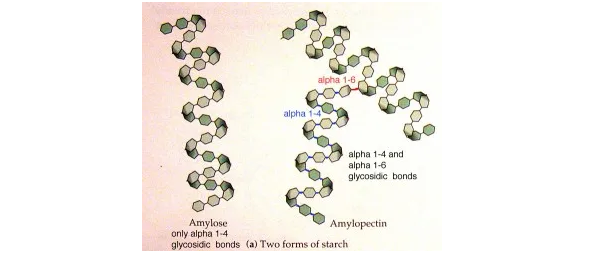
这两种组分的比例及它们在淀粉颗粒内的排列方式显著影响淀粉的可消化性。这些分子越密集、排列越紧密,消化酶就越难接近它们。
抗性淀粉(RS)是一种独特的膳食纤维,不是在小肠中消化,而是在大肠中发酵。不同食物类别(包括谷物、豆类、块茎和某些加工食品)中抗性淀粉的含量差异很大。
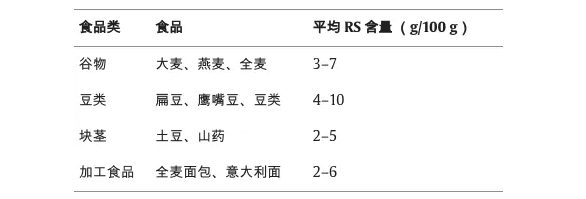
doi.org/10.1016/j.fochx.2024.101118
谷物,特别是大麦、燕麦和全麦等全谷类食物,是抗性淀粉的重要来源,尤其是在它们经过最低限度加工的情况下。比如,煮熟并冷却大米会增加其抗性淀粉含量,这是由于直链淀粉的逆淀粉化作用。
扁豆、鹰嘴豆等豆类也富含抗性淀粉。它们的抗性淀粉含量归因于它们的高直链淀粉和支链淀粉比率,这有助于它们缓慢的消化率。烹饪和冷却过程进一步增加了其抗性淀粉含量。
块茎,包括马铃薯和山药,含有抗性淀粉,尤其是在煮熟和冷却时,这是一个诱导淀粉回生的过程。这使得冷土豆沙拉等菜肴成为良好的抗性淀粉来源。
某些加工食品,特别是那些由全谷物制成或含有 抗性淀粉作为成分的食品,可能是重要的抗性淀粉来源。经过挤压烹饪等过程的全麦面包和意大利面保留了大量的抗性淀粉。
了解这些来源及其抗性淀粉含量对于饮食计划和营养优化至关重要。
在此基础上,抗性淀粉可以根据其起源和特性大致分为四种主要类型:
RS1型(RS1):由于食物基质和蛋白质外壳形成的保护屏障,这种形式的 RS 在物理上无法被酶接近。常见的来源包括全谷物和种子。
RS2型(RS2):RS2 的特点是其天然颗粒形式,主要存在于某些生食中。例子包括生土豆、青香蕉、高直链淀粉玉米。这些来源的高直链淀粉含量导致紧密堆积的颗粒结构,限制了酶的获取。
RS3型(RS3):也称为逆行淀粉,当某些食物煮熟然后冷却时会形成 RS3。这种冷却过程导致淀粉分子的重新排列和重结晶,进一步使它们对酶分解具有抵抗力。煮熟和冷却的土豆、意大利面和米饭等食物是 RS3 的主要来源。
RS4型(RS4):这种类型包括食品中天然不存在的化学改性淀粉,例如一些商业生产的面包和糕点。各种工业过程在淀粉分子中引入交联或取代,以增强其对消化的抵抗力。
部分分类有:
RS5型(RS5): 这是一个较新的类别。它需要通过加热和冷却含有特定脂质(例如脂肪或蜡)的淀粉类食品的过程产生的抗性淀粉。例如含有脂肪成分的面包或含有人工制造的淀粉-脂质复合物的食物。

虽然这些类别有助于讨论和研究,但许多现实世界的食物都含有抗性淀粉类型的混合物。此外,食品加工方法,储存条件和其他食品成分的存在等因素可以显着调节这些食品中的抗性淀粉含量。
抗性淀粉的潜在健康益处和生理影响主要来自其在大肠中的发酵。然而,这些益处的程度和特异性可能因抗性淀粉类型而异。例如,不同的抗性淀粉类型可能优先促进特定微生物物种的生长或导致挥发性脂肪酸的产生速率不同。
总之,抗性淀粉的生化结构和分类对于确定其与肠道微生物组的相互作用以及随后的健康结果至关重要。全面了解这些基础方面对于旨在利用抗性淀粉潜在益处的饮食干预的研究和应用至关重要。
保持血糖稳定
由于抗性淀粉消化缓慢,因此可以保持血糖水平稳定。这可以帮助减少餐后血糖峰值,这对糖尿病患者特别有益。
抗性淀粉具有第二餐的效果:根据一项小型研究的结果,早餐吃抗性淀粉可以降低午餐时的血糖。
2022年1月发表在《Frontiers in Nutrition》 的一篇评论指出,在饮食中添加抗性淀粉是一种简单的生活方式调整,可以帮助糖尿病管理。
促进心脏健康
2018年6月《Nutrition Research》发表的荟萃分析结果,抗性淀粉可以通过降低胆固醇水平有益于心脏健康。它还可以改善血糖控制,正如2017年《Nutrition Journal》上发表的一项针对超重成年人的小型研究所证明的那样,它通过促进肠道中健康细菌的生长来实现这一点,这些细菌产生具有有益作用的短链脂肪酸。
根据2022年3月发表在《国际分子科学杂志》上的一篇评论,短链脂肪酸有助于调节交感神经系统。抗性淀粉可能有助于治疗因神经系统过度活跃而加剧的心脏病,例如慢性心力衰竭、高血压和冠状动脉疾病。
减肥效果
抗性淀粉非常有饱腹感,可能会降低食欲。与其他碳水化合物相比,它的热量也较低,通过这些方式,抗性淀粉可能有助于减肥。
虽然早期研究表明抗性淀粉可能在减肥中发挥作用,但还需要进一步的研究来证实任何此类益处。2017 年《营养杂志》上发表的研究表明,每天吃 30 克抗性淀粉,持续六周,18 名超重成年人减少饥饿激素和无意识地吃零食,但不会改变身体成分。
支持肠道健康
抗性淀粉的作用类似于纤维,而纤维会被肠道中的健康细菌发酵。“这些有益的肠道细菌可以产生短链脂肪酸,这对肠道健康有帮助。
例如,短链脂肪酸可以帮助保持肠道内壁坚固,并有助于粘液产生和炎症,还可能有助于降低结直肠癌的风险。这在后面章节我们会详细阐述。
成人每天应摄入约15克抗性淀粉。然而,据估计大多数人每天的摄入可能不到这个量。
抗性淀粉食品含量表
(每100克食品的平均含量)
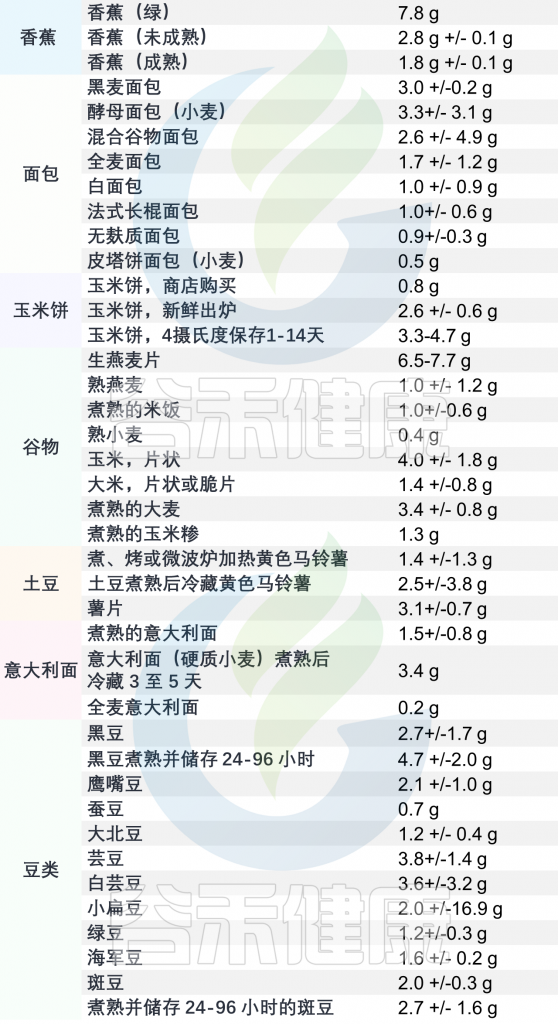
注:如果要增加摄入量时,请逐步增加,一下子吃太多可能会腹胀和胀气。
挤压烹饪,广泛用于生产即食谷类食品和零食,可以增加最终产品的抗性淀粉含量,取决于应用的条件,诸如含水量、螺杆速度和温度等参数可以进行调整以优化抗性淀粉的形成。
退火过程涉及水化淀粉颗粒而不使其明胶化,已发现这一过程可以增加一些谷物中的抗性淀粉含量。
发酵,是各种文化中历史悠久的烹饪和保鲜方法,具有提高抗性淀粉水平的固有能力。这一过程通常涉及有益细菌或酵母分解和发酵糖类,可以改变淀粉结构,使更多的淀粉对消化具有抗性。例如,将谷物发酵制成酸面包或某些传统非洲菜肴不仅赋予了独特的风味,还增加了它们的抗性淀粉含量。
虽然探索和应用这些方法可以显著增加抗性淀粉含量,但必须考虑更广泛的营养后果。并非所有增加抗性淀粉的方法都是普遍有益的。有些加工方法可能会剥夺食物的重要营养素,或引入不良化合物。
在增强抗性淀粉获得肠道健康益处,和确保食物整体营养价值保持完整之间取得平衡至关重要。
抗性淀粉(RS)与肠道微生物组之间错综复杂的相互作用主要发生在结肠,结肠是大多数未消化碳水化合物达到代谢目的的地方。
肠道微生物群发酵抗性淀粉
人类结肠内有着丰富多样、复杂的微生物群,对发酵未消化膳食成分,尤其是抗性淀粉,起着至关重要的作用。
抵达结肠后,抗性淀粉将被居住在肠道的微生物群体进行厌氧发酵。这一发酵过程导致了短链脂肪酸的产生,主要是乙酸、丙酸和丁酸,以及氢气、甲烷和二氧化碳等气体。
在短链脂肪酸中,丁酸在结肠健康中发挥着关键作用。作为结肠细胞的主要能源来源,丁酸还具有抗炎性能,加强结肠防御屏障,并潜在降低结肠癌的风险。此外,短链脂肪酸通过调节肠道pH值,有利于有益菌的生长,同时抑制致病菌株的增殖。
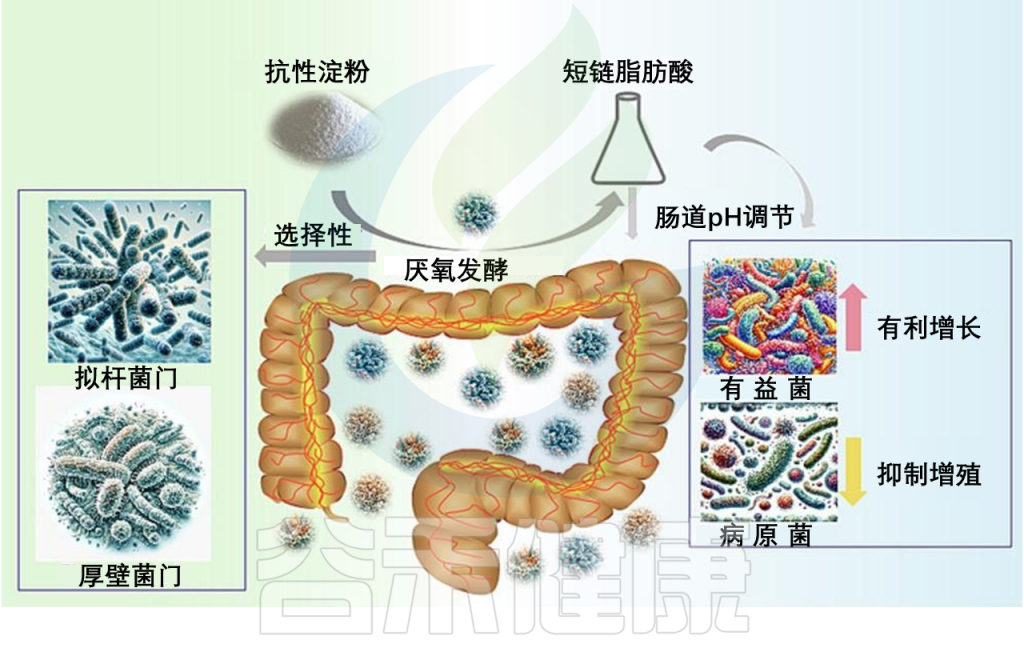
doi.org/10.1016/j.fochx.2024.101118
选择性发酵:抗性淀粉增多→有益菌随之增加
抗性淀粉发酵的另一个有趣的方面是其选择性。并非所有肠道微生物都能够有效发酵抗性淀粉;特定菌群,特别是来自拟杆菌门和厚壁菌门的细菌群,是主要的抗性淀粉发酵者。
这种选择性发酵会导致肠道微生物组成的变化。持续的抗性淀粉摄入可以促进这些抗性淀粉发酵细菌的增殖,使肠道富含有益微生物,进一步提高发酵效率和短链脂肪酸的产生。因此,抗性淀粉和肠道微生物群之间的动态相互作用有望进行有针对性的干预,有可能通过饮食策略调节肠道微生物组成和活性。
抗性淀粉为微生物发酵提供了底物,作为回报,肠道微生物会产生有益于宿主健康的代谢物。
前面我们了解了结肠中抗性淀粉发酵的机制,这里了解这一过程中的关键微生物参与者也很重要。
拟杆菌门
积极参与抗性淀粉发酵的主要群体属于拟杆菌门,尤其是拟杆菌属,拟杆菌的代谢能力使它们能够在各种复杂的碳水化合物中茁壮成长,包括抗性淀粉。它们的酶库有助于将抗性淀粉分解成更简单的单元,然后发酵以产生短链脂肪酸。
厚壁菌门
抗性淀粉发酵的另一个重要贡献者是厚壁菌门,尤其是瘤胃球菌属,瘤胃球菌是这一领域的关键物种,因其在启动抗性淀粉降解方面的无与伦比的效率。瘤胃球菌(R. bromii)进行的初步降解使抗性淀粉更易于其他微生物群进一步发酵。考虑到在摄入富含抗性淀粉饮食的个体中的统治地位,其重要性变得明显。此外,瘤胃球菌的丰度较高与改善的肠道健康状况相关,表明其潜在的保护作用。
放线菌门
虽然拟杆菌门和厚壁菌门脱颖而出,但另一个门放线菌门通过双歧杆菌属促进抗性淀粉发酵。双歧杆菌是备受推崇的益生菌,已知具有无数的健康益处。在抗性淀粉的背景下,双歧杆菌发酵它以产生短链脂肪酸,从而降低肠道 pH 值,从而创造不利于病原菌的环境。此外,抗性淀粉的双歧杆菌效应,即补充抗性淀粉导致双歧杆菌增加,已在各种研究中得到充分证明。
产甲烷古细菌
古菌,特别是产甲烷的Methanobrevibacter smithii,在抗性淀粉发酵领域也发挥作用。
M. smithii消耗其他微生物在抗性淀粉发酵过程中产生的氢气,将其转化为甲烷。这种氢气的去除至关重要,因为它防止了结肠中氢气的积累,否则可能会阻碍发酵过程。因此,M. smithii通过维持其他发酵者的适宜环境,间接支持抗性淀粉发酵过。
总而言之,结肠中的抗性淀粉发酵并不是归因于单个微生物分类群的孤立过程。这是一项涉及多个微生物群体的协同合作,每个微生物群体都为该过程及其健康益处做出了独特的贡献。
只有少数菌群如瘤胃球菌和青春双歧杆菌能够利用淀粉,这些细菌本身并不直接产生丁酸盐,而是依靠与其他肠道细菌的交叉喂养相互作用来产生丁酸盐。
他们的集体行动强调了肠道是一个代谢“器官”的概念,其中饮食成分,主要是抗性淀粉,以协调的方式代谢。
丁酸梭菌(Clostridium butyricum)是一种降解抗性淀粉的菌,能够在多种类型和来源的抗性淀粉上生长,在这个过程中产生大量的丁酸盐。它通过使用一种酶系统来实现这一点,该酶系统虽然是迄今为止在能够降解抗性淀粉的细菌中发现的最简单的酶系统,但在抗性淀粉的消化过程中表现出高度的协同作用和功能多样性。在一个生物体中,消化抗性淀粉和丁酸生产的结合有可能绕过交叉喂养网络的复杂性,而交叉喂养网络通常是抗性淀粉消耗过程中生产丁酸所必需的。
这种独特的性状组合表明,它可能作为一种与抗性淀粉协同使用的菌株,促进更广泛的丁酸反应,从而为更多人群解锁这种益生元的健康益处。
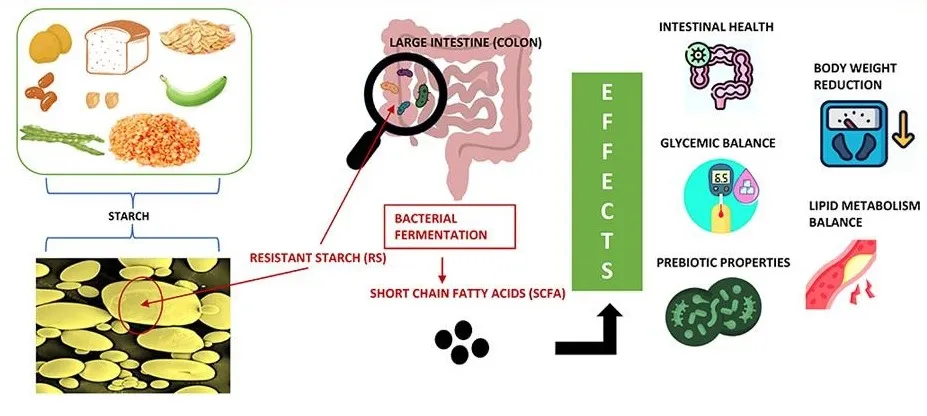
doi.org/10.1016/j.jff.2022.105094
我们了解到肠道微生物群领域及其与抗性淀粉的错综复杂互动是广阔而多层次的。抗性淀粉可以影响肠道微生物群的组成和功能,但同样明显的是,这些影响的程度和性质受到各种因素的调节。揭示这些因素可以增进我们对肠道健康复杂性的理解,并帮助更有效地定制膳食和治疗干预措施。
个体肠道微生物群的基线组成
一个主要决定因素是个体肠道微生物群的基线组成。每个人的肠道微生物群具有独特的特征,受到遗传、早期生活暴露、抗生素和饮食模式等因素的影响。引入膳食时,抗性淀粉可能会因个体肠道微生物的起始点而在个体之间产生不同效应。例如,基线拟杆菌水平较低的个体,在摄入抗性淀粉后,可能会比那些已经拥有更高丰度的个体出现这些细菌增加更显著。
不同类型的抗性淀粉会被特定菌群优先代谢
消费的抗性淀粉类型是另一个重要因素。根据其物理化学性质和来源,抗性淀粉有多种类型:RS1、RS2、RS3、RS4。每种类型可能会被特定微生物类群优先代谢。例如,瘤胃球菌对高直链淀粉玉米中的RS2表现出明显的偏好,而某些拟杆菌物种可能更青睐来自逆行淀粉的RS3。因此,膳食中包含的抗性淀粉类型可以引导微生物群变化的轨迹。
其他营养素的影响
抗性淀粉消费的膳食背景也不容忽视。其他膳食纤维、蛋白质、脂肪和微量营养素的存在可以影响抗性淀粉的可获得性和发酵性。例如,富含可溶性纤维的饮食可能通过促进有益菌(如乳杆菌)的生长来放大抗性淀粉的益生效应。相反,富含蛋白质的饮食可能会使一些结肠细菌转向蛋白质发酵,产生像氨之类的潜在有害化合物。
抗性淀粉摄入的持续时间
抗性淀粉摄入的持续时间也起着关键作用。初始引入抗性淀粉可能会导致微生物群组成的快速变化。然而,随着摄入时间的延长,微生物群可能会稳定下来,表明适应性。长期摄入抗性淀粉可以导致更具弹性和多样化的微生物群,这些微生物群更能抵抗干扰和潜在的菌群失调。
其他宿主相关因素
最后,宿主相关因素,如年龄、健康状况和遗传,调节着抗性淀粉与微生物群的相互作用。与微生物群的年龄相关变化、肠道传输时间的差异和酶活性可能会影响抗性淀粉在肠道中的发酵。同样,患有肠道紊乱症状如肠易激综合征(IBS)或炎症性肠病(IBD)的个体可能对抗性淀粉有不同反应,鉴于这些情况下肠道环境和微生物群的组成发生了改变。
总之,抗性淀粉与肠道微生物群之间的互动是一个受多种因素影响的动态过程。认识和理解这些因素对于个性化营养策略旨在利用抗性淀粉的肠道健康益处是至关重要的。这些见解呼唤着在营养和肠道健康领域采取更个性化的方法,更胜于一刀切的建议。
抗性淀粉已成为膳食的关键成分,其影响远远超出了其营养价值。抗性淀粉最重要的作用之一在于它能够维持肠道的屏障功能。这种错综复杂的粘膜细胞和细胞间连接是我们全身健康的关键,可防止病原体入侵并维持代谢平衡。鉴于肠道相关疾病的负担不断加重,了解抗性淀粉如何影响这一屏障可以为疾病预防和治疗干预提供关键的见解。
肠道屏障是一个动态和反应灵敏的系统,而不是一个静态的实体。在其核心,上皮细胞形成前线,作为对管腔环境的主要防御。
抗性淀粉促进粘蛋白分泌
抗性淀粉通过支持细胞更新和促进粘蛋白的分泌来增强上皮屏障,粘蛋白是一种糖蛋白,可润滑和保护上皮表面免受潜在病原体和研磨性食物颗粒的侵害。粘蛋白层不仅形成保护毯,还为共生细菌提供栖息地,有助于宿主和微生物群之间的双向关系。
抗性淀粉正向调节紧密连接蛋白
紧密连接蛋白,结合上皮细胞的微观结构,对于维持屏障完整性至关重要。这些蛋白质决定了屏障的渗透性,决定了哪些物质被允许通过,哪些物质仍然被排除在外。在“肠漏”的情况下,这些蛋白质会受到损害,导致肠道通透性增加。这种情况会允许不需要的物质(包括病原体和毒素)进入血液,引发全身炎症。研究表明,抗性淀粉正向调节这些蛋白质。抗性淀粉发酵产生短链脂肪酸,特别是丁酸盐,在上调紧密连接蛋白的表达、强化肠道屏障方面发挥作用。
抗性淀粉间接影响局部免疫反应
驻留在肠道粘膜内的免疫细胞为屏障的防御机制增加了另一层。在这里,抗性淀粉展示了其免疫调节能力。通过改变肠道微生物群组成,抗性淀粉间接影响局部免疫反应。它促进有益细菌的生长,进而与免疫细胞相互作用,指导它们的功能。这种串扰确保了潜在病原体的迅速消除,同时保持了对膳食抗原和共生微生物的耐受性。
抗性淀粉通过神经,免疫,血管等相互作用,间接提供保护
除了这些直接影响外,抗性淀粉诱导的肠道微生物群变化也会影响肠脑轴。肠道和中枢神经系统之间的这种双向沟通渠道对整体健康至关重要。肠道屏障功能的破坏与神经系统疾病有关,强调了抗性淀粉等膳食成分在神经保护中的重要性。
此外,肠道内的血管结构,包括血液和淋巴管,在屏障功能中发挥作用。它们确保营养吸收和免疫细胞运输。抗性淀粉通过其代谢物调节血管内皮屏障,优化营养吸收并确保有效的免疫监测。
总之,抗性淀粉与肠道屏障的细胞、免疫和血管成分错综复杂的相互作用,为应对环境挑战提供了强大的防御能力。拥抱抗性淀粉的治疗潜力可以重新定义面向胃肠道健康及其他方面的策略。
炎症是免疫系统对病原体、伤害或有害刺激发起的保护性反应,当放松管制时,可能会成为一把双刃剑。特别是在肠道内,持续的炎症会加剧从炎症性肠病发展到结直肠癌等多种疾病。人们的注意力已经转向可以调节炎症的饮食成分,其中抗性淀粉已成为一个至关重要的参与者。
抗性淀粉促进抗炎短链脂肪酸 (丁酸盐) 产生
与其他淀粉不同,抗性淀粉在小肠中抵抗消化,基本完好无损地到达结肠。一旦进入结肠,抗性淀粉就会充当某些有益肠道细菌的底物,导致短链脂肪酸的产生,主要是乙酸盐、丙酸盐和丁酸盐。值得注意的是,丁酸盐因其显着的抗炎作用而得到认可。丁酸盐通过抑制促炎细胞因子的产生来发挥作用,例如TNF-α和IL-6,它们在炎症传播中起着核心作用。
抗性淀粉影响免疫细胞分化
抗性淀粉发酵和随后的短链脂肪酸产生已被证明会影响免疫细胞分化,尤其是调节性 T 细胞(Tregs)。这些细胞在维持肠道免疫稳态方面起着不可或缺的作用。Tregs数量的增加与炎症减少有关,这证明了它们抑制异常免疫反应的能力。短链脂肪酸,特别是丙酸盐,影响幼稚T细胞分化为Tregs,确保肠道内平衡的免疫反应。
抗性淀粉影响肠道神经系统
肠道神经系统功能微妙,确保肠道蠕动和分泌,同时与免疫系统密切相互作用。肠道神经系统的破坏会导致肠道运动障碍,从而为细菌过度生长和炎症创造有利的环境。抗性淀粉通过其代谢物,尤其是丁酸盐,影响肠道神经系统功能。它有助于维持肠道神经元的健康和功能,随后促进肠道的定期肌肉收缩,最大限度地减少细菌停滞和炎症的机会。
抗性淀粉维持平衡的肠道pH值
此外,抗性淀粉可以通过调节肠道的 pH 值来影响肠道炎症。抗性淀粉发酵产生的短链脂肪酸导致结肠中的微酸性环境。这种酸度阻止了病原菌的生长,同时促进了有益共生细菌的增殖。这两个细菌群之间的平衡对于维持肠道健康至关重要,任何向致病性优势的转变,称为生态失调,都可能引发炎症。通过维持酸性 pH 值,抗性淀粉间接阻止炎症的发生和发展。
总之,抗性淀粉在调节肠道炎症中的复杂作用揭示了其潜在的治疗应用。它能够改变微生物组成,促进抗炎短链脂肪酸的产生,影响免疫细胞分化,并维持平衡的肠道pH值,这表明其在确保肠道稳态方面的多方面方法。随着肠道相关炎症的患病率不断上升,利用抗性淀粉的益处可以为提供预防和治疗潜力的新型饮食干预铺平道路。
肠道和免疫系统之间的界面是人体内最具活力的相互作用之一。我们整个免疫系统的近70%都存在于肠道内,随时准备对来自食物和病原体的各种抗原做出反应。正是在这种背景下,抗性淀粉等膳食成分占据了中心位置。抗性淀粉不仅仅是消化过程中的旁观者,它还以多种方式塑造和影响肠道的免疫反应。
抗性淀粉发酵产物,减少促炎细胞因子
抗性淀粉天然抵抗上消化道的消化,到达结肠基本保持不变。在结肠中,抗性淀粉由特定菌群发酵,导致短链脂肪酸的产生增加,主要是乙酸盐、丙酸盐和丁酸盐。除了作为结肠细胞的能量底物外,这些短链脂肪酸还调节各种免疫细胞功能。例如,短链脂肪酸可以降低炎性细胞因子的表达并增加抗炎介质,从而有效地抑制过度的免疫反应。特别是丁酸盐对中性粒细胞功能具有深远的影响,并减少炎症介质如TNF-α和IL-6的产生。
肠道相关淋巴组织 (GALT) 是免疫系统不可或缺的一部分,在维持肠道稳态方面起着至关重要的作用。在 GALT 内,树突状细胞不断对肠道的管腔内容物进行采样。这些细胞在遇到细菌代谢物(如抗性淀粉发酵产生的短链脂肪酸)时,其活性受到调节,导致调节性T细胞的产生增加,这些T细胞在控制炎症和自身免疫方面起着关键作用。此外,已经注意到短链脂肪酸对巨噬细胞的直接影响,观察到抗炎细胞因子产生增加和促炎细胞因子产生减少。
抗性淀粉增强屏障功能,减少LPS易位
抗性淀粉发酵产物会影响肠道屏障的完整性。维持肠上皮层连续性的紧密连接蛋白被短链脂肪酸上调,从而增强屏障功能,并减少细菌内毒素如脂多糖(LPS)进入体循环的易位。LPS易位减少导致内毒素血症相关免疫激活减少,有益于整体健康。
抗性淀粉促进有益菌生长,IgA升高
抗性淀粉作为一种益生元,选择性地滋养有益菌,进而积极调节免疫反应。例如,双歧杆菌和乳酸杆菌等有益细菌的富集通常与抗性淀粉消耗有关,与免疫球蛋白 A(IgA)的产生增强有关,IgA是粘膜防御中的一抗。升高的IgA水平在中和病原体和维持粘膜稳态方面起着关键作用。
从本质上讲,抗性淀粉与免疫系统之间的相互作用强调了饮食、微生物群和免疫力之间复杂的相互作用。通过其发酵产物和肠道微生物群的调节,抗性淀粉有可能成为调节免疫反应和维持肠道健康的重要膳食成分。它带来了全身益处,并为免疫调节的饮食策略开辟了途径。
抗性淀粉越来越被认为是一种重要的膳食成分,不仅因为它对肠道健康的直接影响,还因为它更广泛的代谢影响,特别是与代谢综合征有关。代谢综合征是一组疾病,包括血压升高、高血糖、腰部脂肪过多以及胆固醇或甘油三酯水平异常,会增加患心脏病、中风和糖尿病的风险。抗性淀粉减轻代谢综合征方面的潜力主要归因于其肠道微生物群发酵产物,如乙酸盐、丙酸盐和丁酸盐。
尤其是丁酸盐,在维持肠道屏障完整性方面发挥着重要作用,并具有抗炎特性,这对于对抗与代谢综合征相关的炎症过程至关重要。丁酸盐还通过增强结肠中的能量消耗和脂肪氧化,与改善胰岛素敏感性有关,胰岛素敏感性是代谢综合征的关键因素。此外,丙酸盐具有糖异生作用,有可能调节血糖水平,这对患有或有2型糖尿病风险的人至关重要。
此外,抗性淀粉在食欲调节中的作用也值得一提。随着短链脂肪酸的产生,它们会刺激厌食激素的释放,如肽YY(PYY)和胰高血糖素样肽-1(GLP-1),从而增加饱腹感并减少卡路里摄入量。这种食欲调节作用,加上对血脂和血压的潜在益处,使抗性淀粉消费成为预防或管理代谢综合征的有前途的策略。
体重管理和肥胖的全球挑战与饮食成分及其代谢结果有着内在的联系。肥胖的增加伴随着 2 型糖尿病、心血管疾病和几种癌症风险的增加,使其成为最重要的健康问题。从这个角度来看,抗性淀粉不仅作为一种膳食纤维脱颖而出,而且作为对抗肥胖症的潜在变革性膳食成分脱颖而出。
一些研究表明,抗性淀粉可能对体重管理有直接影响。一个主要机制是食物的热效应,这是消化和加工食物时消耗的能量的量度。抗性淀粉对立即消化具有抵抗力,往往会增加这种热效应,导致在大肠发酵过程中消耗更高的能量。这不仅有助于负能量平衡,还会影响脂肪储存并增强脂肪氧化,这对体重管理至关重要。此外,如前几节所述,抗性淀粉发酵导致短链脂肪酸的产生,短链脂肪酸通过释放 PYY 和 GLP-1 等激素在控制食欲方面发挥积极作用。调节食欲等同于减少热量摄入,这是体重管理的一个重要方面。
此外,抗性淀粉与改善肠道健康有关,这对肥胖有间接影响。健康的肠道生物群与更瘦的表型有关。当肠道微生物群发酵抗性淀粉时,它会导致微生物组成的变化,有利于与肥胖呈负相关的有益菌。
近日,一项针对 37 名超重或肥胖参与者的随机安慰剂对照交叉设计试验(ChiCTR-TTRCC-13003333) 中,研究人员测试了抗性淀粉作为膳食补充剂是否会影响肥胖相关的结果。
研究表明补充抗性淀粉 8 周有助于实现体重减轻(平均 -2.8 公斤)并改善体重超重个体的胰岛素抵抗。
补充青春双歧杆菌(一种与减轻研究参与者肥胖显著相关的物种)可以保护雄性小鼠免受饮食引起的肥胖。从机制上讲,抗性淀粉诱导的肠道微生物群变化会改变胆汁酸分布,通过恢复肠道屏障来减少炎症,并通过调节ANGPTL4抑制脂质吸收,提高脂肪组织对FGF21的敏感性。
次级胆汁酸,例如甘氨脱氧胆酸、脱氧胆酸、甘氨胆酸和牛磺脱氧胆酸,对于提高胰岛素敏感性和改善肝脂肪变性具有重要作用。胆盐水解酶负责次级胆汁酸的去偶联。补充抗性淀粉降低了胆盐水解酶的产生,增加了次级胆汁酸的水平。
抗性淀粉至少可以部分通过青春双歧杆菌促进体重减轻,并且肠道微生物群对于抗性淀粉的作用至关重要。
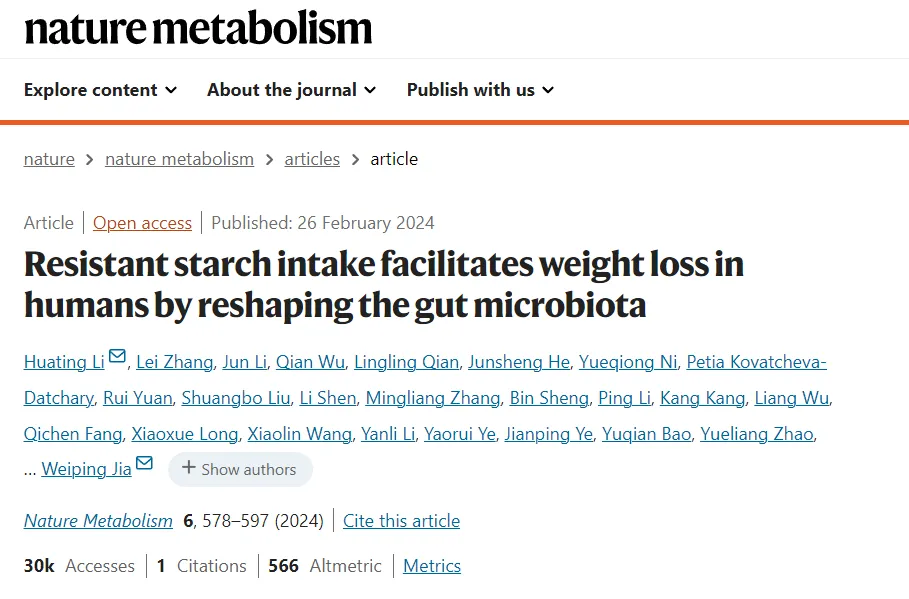
因此,持续食用富含抗性淀粉的食物可能会导致肠道环境不太容易使体重增加和肥胖。
糖尿病是一种以慢性高血糖为特征的代谢紊乱,是一个不断升级的全球健康问题,具有从个人健康恶化到国家经济负担的多方面影响。鉴于发病率不断上升,迫切需要饮食干预来缓解或可能逆转这种疾病的进展。抗性淀粉是一种引人注目的膳食成分,其多种代谢影响与糖尿病管理和血糖控制有关。
糖尿病管理的核心是调节餐后血糖和胰岛素反应。摄入抗性淀粉似乎有利地调节这些反应。与快速消化的淀粉不同,抗性淀粉不会直接导致餐后血糖峰值,因为它绕过了小肠的消化,它在大肠中的发酵会产生短链脂肪酸。特别是,丙酸盐可促进肝脏葡萄糖产生调节,降低餐后葡萄糖偏移的风险。此外,丁酸盐在促进胰高血糖素样肽-1(GLP-1)分泌中的作用。
注:GLP-1是一种增强胰岛素分泌和减少胰高血糖素释放的激素,协调血糖水平。
此外,长期服用抗性淀粉与提高胰岛素敏感性有关,这是 2 型糖尿病发病机制的关键因素。研究表明,食用富含抗性淀粉的饮食的胰岛素抵抗个体表现出胰岛素敏感性的显著改善。这种改善被认为与短链脂肪酸的抗炎特性有关,尤其是丁酸盐,以及它在减少氧化应激中的作用,氧化应激有助于胰岛素抵抗。此外,抗性淀粉培养有益肠道微生物群组成的能力对代谢健康有间接影响,进一步强调了其在糖尿病管理中的潜在作用。
莲子抗性淀粉抑制高脂血症大鼠中下列菌群的生长:
莲子抗性淀粉促进初级胆汁酸(CA、CDCA 、β-MCA)和次级胆汁酸(LCA、UDCA)的产生,降低高脂血症中TCA、DeHydro-LCA、isoLCA、LCA-3-S、THDCA的含量。
Blautia、norank_f__Muribaculaceae、norank_f__Eubacteria_coprostanoligenes_group与 DeHydro-LCA、isoLCA、TCA、LCA-3-S、 TCHO、TG和 LDL-C呈正相关。
莲子抗性淀粉通过调节肠道菌群并加速肝脏中胆固醇分解为胆汁酸来改善血脂水平。
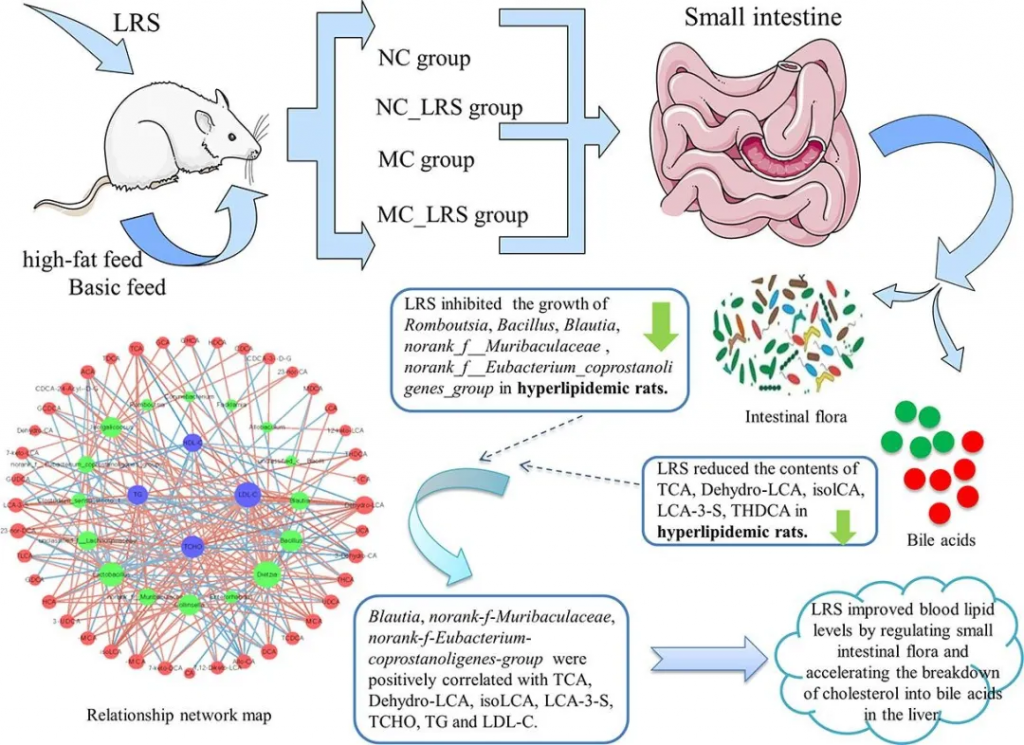
doi.org/10.1016/j.foodchem.2022.134599
认知能力下降是衰老的常见后果。缺乏纤维和高饱和脂肪的饮食模式会引发促炎症途径和代谢功能障碍,从而加剧认知障碍。新的证据强调了富含纤维的饮食对神经认知的益处以及肠道-微生物-大脑信号传导的关键作用。
经过为期20周的饮食方案,包括含有5%重量比来自芸豆(PTB)、黑眼豆(BEP)、扁豆(LEN)、鹰嘴豆(CKP)或菊糖纤维(INU)的抗性淀粉的西式饮食(实验组),与不含抗性淀粉的西式饮食(对照组),发现抗性淀粉特别是来自扁豆的抗性淀粉,可以改善西式饮食引起的认知障碍。
从机理上看,抗性淀粉通过改善肠道菌群-代谢组,包括增加短链脂肪酸和降低支链氨基酸水平,从而改善神经认知功能评估。这种肠道菌群-代谢物-大脑信号级联抑制了神经炎症、细胞衰老和血清瘦素/胰岛素水平,同时通过改善肝功能增强脂质代谢。总的来说,数据证明了抗性淀粉的益生菌效应可通过调节肠-脑轴改善神经认知功能。
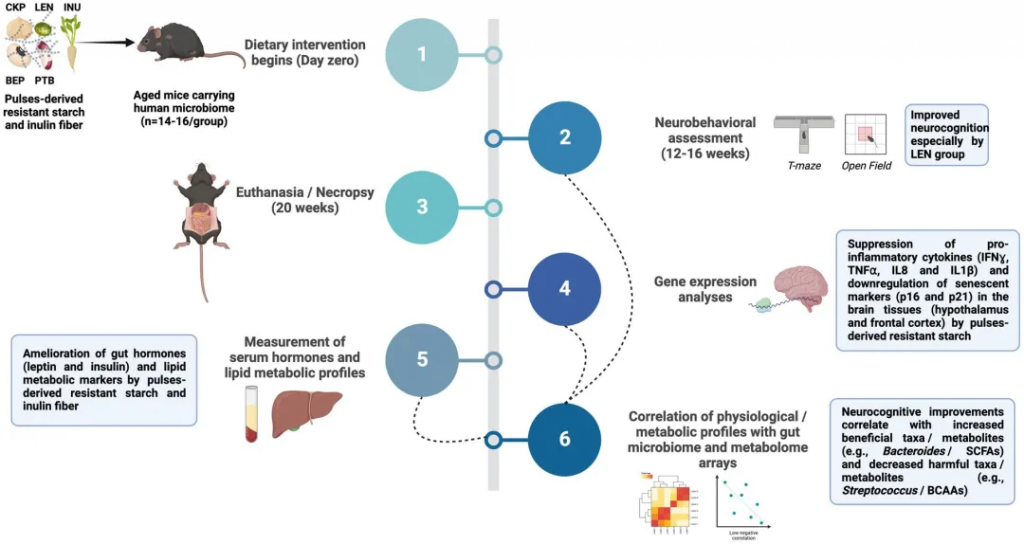
doi.org/10.3389/fnut.2024.1322201
溃疡性结肠炎是一种复杂的炎症性疾病,发病率不断上升。一项研究通过酶法分离方法从紫甘薯中获得抗性淀粉(PSPRS)。然后,研究了PSPRS的结构特性及其对葡聚糖硫酸钠诱导的结肠炎的保护功能。
结构表征结果表明,PSPRS的结晶度从CA型转变为A型,并且在酶水解过程中层状结构被完全破坏。与结肠炎小鼠相比,PSPRS给药以剂量依赖性方式显著改善病理表型和结肠炎症。
ELISA 结果表明,给予PSPRS的结肠炎小鼠表现出较高的 IL-10 和 IgA 水平,但较低的 TNF-α、IL-1β 和 IL-6 水平。同时,高剂量(300 mg/kg)的PSPRS显著增加了乙酸盐、丙酸盐和丁酸盐的产生。
16S rDNA高通量测序结果显示,PSPRS治疗组中厚壁菌门与拟杆菌门的比例以及潜在益生菌水平显著增加,如乳杆菌、Alloprevotella, 毛螺菌科_NK4A136_组、双歧杆菌。同时,高剂量 PSPRS 显著抑制了拟杆菌属、葡萄球菌属和阿克曼氏菌等有害细菌 (p < 0.05)。因此,PSPRS有潜力成为促进肠道健康、缓解溃疡性结肠炎的功能食品。
慢性肾病是与心血管疾病、发病率和死亡率风险增加相关的主要健康问题。最近的研究表明,慢性肾病的进展可能与肠道菌群的变化有关。抗性淀粉是一种膳食纤维,可以作为微生物发酵的底物。一些研究发现补充抗性淀粉可以改善慢性肾病患者的肠道菌群紊乱。
在 2022 年随机对照试验的荟萃分析中,发现补充抗性淀粉可以降低患有透析患者血液中硫酸吲哚酚、磷、IL-6和尿酸的水平。
抗性淀粉还对肠道环境产生有益影响,包括增加Ruminococcus bromide。
Ruminococcus brucei是厚壁菌门的主要成员之一,是一种主要的抗性淀粉发酵菌株。通过其针对抗性淀粉的特殊活性,Ruminococcus brucei从淀粉中释放能量以逃避宿主酶的消化。此外,摄入富含抗性淀粉的食物可以增加肠道短链脂肪酸水平,调节微生物代谢物,并改善葡萄糖稳态和胰岛素敏感性。
通过摄入抗性淀粉,胆固醇和甘油三酯降低,胰岛素敏感性提高,可以大大降低代谢综合征的发生率。慢性肾病患者也可能受益于更好的葡萄糖代谢、血脂水平和更好的体重管理。
近年来,富含抗性淀粉(RS)的食物因其多方面的健康益处而受到越来越多的关注,从肠道健康到调节全身新陈代谢。
益处
作为一种必需的膳食成分,抗性淀粉与典型的淀粉不同,主要是由于其对小肠消化的抵抗力,它基本上完好无损地到达大肠,在那里它作为微生物发酵的底物,产生有益的代谢物,如短链脂肪酸。
抗性淀粉中天然丰富的食物包括青香蕉、豆类、全谷物和某些类型的煮熟然后冷却的食物,如土豆和米饭。食用此类食物的好处之一是它们有可能增强血糖控制。富含抗性淀粉的食物具有较低的升糖指数,转化为较慢的餐后血糖升高。这一特性对患有糖尿病等代谢紊乱的人特别有益。此外,抗性淀粉发酵产生的短链脂肪酸,特别是丁酸盐,丁酸盐是结肠细胞的主要能量来源,并具有抗炎特性,使其对结肠健康不可或缺。
注意事项
抗性淀粉摄入量的快速和大量增加会导致胃肠道不适,包括腹胀、胀气和排便习惯改变。通常建议逐渐将富含抗性淀粉的食物引入饮食中,以使肠道微生物群有时间适应。此外,患有某些健康状况的人,例如患有肠易激综合征(IBS)或特定碳水化合物不耐受的人,应谨慎对待富含抗性淀粉的食物,并在专业指导下。抗性淀粉的发酵有时会加剧这些人的症状。
总之,虽然富含抗性淀粉的食物具有许多健康益处,尤其是在肠道健康和代谢调节方面,但个人应注意摄入饮食中的抗性淀粉的来源和数量。
最好取得平衡:优化健康益处,同时最大限度地减少潜在的不利影响。
抗性淀粉的作用超越了其个人益处,使其成为各种饮食模式和制度的关键成分。
地中海饮食
例如,当考虑因其保护心脏的益处而广受赞誉的地中海饮食时,我们发现豆类,抗性淀粉的天然来源,是其成分的基石。经常食用豆类,其丰富的抗性淀粉含量不仅有助于增强肠道健康,还有助于与这种饮食模式相关的心脏保护作用,因为抗性淀粉具有调节餐后血糖反应的潜力。
旧石器饮食
旧石器时代的饮食,俗称旧石器饮食,是另一个有趣的领域,其中抗性淀粉找到了相关性。对旧石器饮食的当代解释集中在块茎和某些根的消费上,当通过特定方法制备时,例如烹饪后冷却,这些根会富含抗性淀粉。这证实了我们的祖先可能已经消耗了大量的抗性淀粉,为他们的肠道微生物群提供了可发酵的底物。从理论上讲,肠道微生物与其宿主之间的共生关系已经共同进化了数千年,而抗性淀粉可能是推动这一进化过程的关键饮食元素。
低碳和生酮饮食
低碳水化合物和生酮饮食,在减肥和代谢健康方面很受欢迎,通常会限制淀粉的摄入。然而,将抗性淀粉整合到这些饮食中可以提供明显的优势。由于抗性淀粉不表现出与普通淀粉相同的消化率,因此它的加入不会显著提高血糖水平。这意味着这种饮食的人可以获得抗性淀粉的好处,例如增强肠道健康和饱腹感,而不会影响酮症或低碳水化合物方案的状态。从根本上说,抗性淀粉允许当代饮食方法之间的共生关系,重点是减肥或代谢益处,以及滋养肠道微生物群的古老进化重要性。
将抗性淀粉纳入饮食中不仅要承认其生理益处,还要了解其最佳摄入量并融入各种饮食中,以最大限度地发挥其潜力。随着越来越多的证据描绘抗性淀粉的多方面优势,从调节肠道微生物群到调节血糖水平,向更广泛的公众提供可操作的指南变得至关重要。
循序渐进
首先,身体可能需要一些时间来适应饮食中添加抗性淀粉。因此,需要循序渐进逐步添加。
添加少量抗性淀粉。例如,早餐中加入一根绿色香蕉,午餐中加入四分之一杯扁豆。
食物中获取
最好从食物中获取抗性淀粉,常见的食物补充包括:青香蕉、豆类(豌豆、扁豆)、全谷物(燕麦和大麦)、煮熟并冷却的米饭。
注:增加纤维摄入量时,要慢慢喝大量的水,以减少胃肠道副作用。

补充剂
补充性抗性淀粉通常以粉末形式服用,可混合到食品或饮料。如绿色香蕉粉、木薯粉等。
烹饪,可进一步提高抗性淀粉的含量
必须认识到并非所有抗性淀粉来源都是一样的。虽然豆类、全谷物和某些块茎天然富含抗性淀粉,但烹饪方法可以进一步调节其抗性淀粉含量。例如,烹饪然后冷却土豆或米饭等淀粉类食物可以增加其抗性淀粉含量,提供了一种直接的策略来提高饮食中的抗性淀粉水平,而无需任何剧烈变化。
抗性淀粉的推荐每日摄入量通常在 15-30 克之间。这可以通过多样化的饮食来实现,包括冷意大利面沙拉、隔夜燕麦或豆类菜肴等食物。
考虑个人的消化耐受性的重要性
抗性淀粉摄入量的突然激增会导致一些人的胃肠道不适。因此,谨慎的做法是在几周内逐渐增加抗性淀粉的摄入量,让肠道进行调整。此外,将富含抗性淀粉的食物与益生菌食物(如酸奶或开菲尔)相结合,可以产生协同效应,为有益的肠道细菌茁壮成长营造一个好的环境。与任何饮食改变一样,应根据个人口味、健康状况和饮食习惯定制抗性淀粉,确保方法既平衡又可持续。
抗性淀粉作为益生元可以调节肠道微生物群,对于肠道菌群失调相关的许多疾病包括炎症性肠病、肠易激综合征、结直肠癌等具有重要意义,为这些疾病辅助治疗的潜在用途奠定了基础。
抗性淀粉的另一个治疗意义在于其抗炎特性。慢性炎症在心血管疾病、2型糖尿病和某些癌症等多种疾病的发病和进展中发挥着关键作用。肠道微生物群发酵抗性淀粉会产生短链脂肪酸,尤其是具有抗炎作用的丁酸,可以抑制促炎细胞因子,使抗性淀粉成为减轻炎症引起的疾病的潜在候选者。
抗性淀粉也有望成为对抗肥胖和相关并发症的饮食策略。鉴于其调节饱腹感、提高胰岛素敏感性和调节脂质代谢的能力,抗性淀粉可以作为代谢综合征和相关病症的辅助或预防措施。例如,将抗性淀粉纳入饮食中可以改善糖耐量受损个体的餐后葡萄糖反应,强调其潜在的治疗相关性。
抗性淀粉在个性化营养方面的潜力也不容忽视,但仍需谨慎对待。剂量、持续时间和个体差异在决定抗性淀粉在任何治疗应用中的功效方面发挥着关键作用。
个体对抗性淀粉的反应可能存在很大差异。年龄、遗传、肠道微生物群组成和整体健康状况等因素会影响人们处理抗性淀粉摄入及益处。例如,摄入相同量抗性淀粉的两个人可能会表现出不同的餐后葡萄糖反应或结肠中不同的短链脂肪酸产生情况。此外,肠道微生物群将抗性淀粉发酵成有益代谢物的能力在个体之间可能有所不同,特别是在微生物群多样性高的人和微生物群较少的人之间差异较大。
这种个体差异突出了个性化营养方法的必要性。与其采取一刀切的抗性淀粉摄入建议,不如根据个人独特的代谢和菌群特征来定制饮食建议。随着深入探索个性化医疗时代,整合肠道菌群数据或许能为优化个人抗性淀粉摄入、获得健康效益提供更精准的建议。
主要参考文献:
Chen Z, Liang N, Zhang H, Li H, Guo J, Zhang Y, Chen Y, Wang Y, Shi N. Resistant starch and the gut microbiome: Exploring beneficial interactions and dietary impacts. Food Chem X. 2024 Jan 3;21:101118.
Li H, Zhang L, Li J, et al., Resistant starch intake facilitates weight loss in humans by reshaping the gut microbiota. Nat Metab. 2024 Mar;6(3):578-597.
Junejo SA, Flanagan BM, Zhang B, Dhital S. Starch structure and nutritional functionality – Past revelations and future prospects. Carbohydr Polym. 2022 Feb 1;277:118837.
Arp CG, Correa MJ, Ferrero C. Modified celluloses improve the proofing performance and quality of bread made with a high content of resistant starch. J Sci Food Agric. 2023 Apr;103(6):3041-3049.
Du X, Wu J, Gao C, Tan Q, Xu Y. Effects of Resistant Starch on Patients with Chronic Kidney Disease: A Systematic Review and Meta-Analysis. J Diabetes Res. 2022 Jul 18;2022:1861009.
Tekin T, Dincer E. Effect of resistant starch types as a prebiotic. Appl Microbiol Biotechnol. 2023 Feb;107(2-3):491-515.
Wang, Z.; Gao, M.; Kan, J.; Cheng, Q.; Chen, X.; Tang, C.; Chen, D.; Zong, S.; Jin, C. Resistant Starch from Purple Sweet Potatoes Alleviates Dextran Sulfate Sodium-Induced Colitis through Modulating the Homeostasis of the Gut Microbiota. Foods 2024, 13, 1028
Chen R, Zhang C, Xu F, Yu L, Tian F, Chen W, Zhai Q. Meta-analysis reveals gut microbiome and functional pathway alterations in response to resistant starch. Food Funct. 2023 Jun 6;14(11):5251-5263.
Kadyan S, Park G, Hochuli N, Miller K, Wang B, Nagpal R. Resistant starches from dietary pulses improve neurocognitive health via gut-microbiome-brain axis in aged mice. Front Nutr. 2024 Jan 24;11:1322201.
Pickens TL, Cockburn DW. Clostridium butyricum Prazmowski can degrade and utilize resistant starch via a set of synergistically acting enzymes. mSphere. 2024 Jan 30;9(1):e0056623.

谷禾健康
肥胖和代谢综合征在全球范围内日益流行,是21世纪人类健康面临的重大威胁之一。据世界卫生组织(WHO)全球数据估计,目前全球约13%(即近65亿)成年人口受肥胖症影响。

肥胖和代谢综合征对健康的危害包括增加患心血管疾病、糖尿病和高血压的风险,影响身体的免疫系统和内分泌系统,还可能导致肝脏疾病等。
更令人担忧的是,模型预测到2030年,约五分之一的成年人将患有肥胖症,这些数字突显了寻求新疗法的迫切需要,这些新疗法将独特地利用肥胖和代谢综合征背后的复杂途径来促进体重减轻以及代谢和免疫系统的调节。
“肥胖”是指身体过度脂肪堆积,超过正常范围的体重。通常是由于摄入热量过多,消耗热量不足导致的。同时肥胖患者还伴有慢性低度炎症,以及肠内分泌和神经激素的失调。
体重通过激素、神经和代谢途径之间复杂的相互作用进行调节,并受到许多环境因素的影响。能量摄入和支出之间的不平衡可能是由于多种因素造成的,包括饮食行为的改变、异常的饱腹感或饥饿感以及低能量支出。
目前主要有两种新兴的治疗方式:通过肠道微生物群和膳食纤维。肠道微生物群通过涉及粘膜和全身免疫、激素和神经系统的多种机制,深刻影响能量稳态的各个方面。
膳食纤维对新陈代谢和肥胖的益处也已通过机制研究和临床试验得到证明,在本文,我们讨论了不同纤维的理化特性、纤维和肠道微生物群如何相互作用以调节体重稳态的最新发现,以及与使用膳食纤维作为补充策略。
了解膳食纤维沿胃肠道的生理效应,包括肠道微生物群的作用,将支持开发利用微生物群和临床特征来预测个体对纤维补充反应的精准医学方法,用于调节免疫、代谢和体重稳态。随着临床前和临床研究继续探索膳食纤维能够促进哪些与健康相关的微生物群和代谢物,对这种纤维-微生物群的相互作用将为开发基于纤维的精准营养提供框架,以实现更优化、个性化的肥胖和代谢综合征相关治疗。
为了更好地预防和改善肥胖,我们需要先了解关于肥胖的一些知识。
✦ 肥胖患者肠内分泌和神经激素会失调
肥胖不仅仅是体重过高,其实是一种复杂的慢性进行性疾病,其特征是体内脂肪堆积过多以及肠内分泌和神经激素信号通路失调,从而增加食欲和能量储存。
✦ 肥胖还伴有慢性低度炎症
肥胖也被描述为一种慢性低度全身炎症,循环促炎细胞因子水平升高,对中枢神经系统(CNS)以及参与能量和代谢稳态的所有器官产生负面影响。
肥胖个体下丘脑尺寸的增加被认为是由于下丘脑炎症所致,这将加剧能量稳态失调。内脏脂肪组织和胃肠道失调似乎是全身炎症的主要原因。来自肥胖动物模型的大量证据支持肠道微生物群衍生的脂多糖数量增加通过增强细胞旁运动或通过乳糜微粒运输的跨细胞途径进入体循环的作用,从而启动许多炎症途径,进一步导致体重增加。
尽管来自人类研究的证据不如来自动物模型的结果清楚地表明肠道来源的脂多糖与肥胖之间的关联,但人体中的一些研究结果已将全身性脂多糖增加与肥胖联系起来,特别是与肥胖相关的代谢疾病风险。
此外,一些人类研究的结果表明,高水平的餐后内毒素血症先于2型糖尿病的发生,这表明存在潜在的致病作用。
在正常生理条件下,能量稳态通过调节饮食行为和能量储存的肠内分泌和神经激素信号通路受到严格控制。除了胰腺产生胰岛素和胰高血糖素之外,胃肠道和脂肪组织也会产生主要整合在下丘脑内的信号,以调节食物摄入和能量消耗。
✦ 肠内分泌激素有促食欲和抑制食欲两种作用
肠内分泌激素,由整个胃肠道中专门的肠内分泌细胞(EEC)响应营养和其他信号而释放。这些激素在胃肠道和远处器官中发挥局部作用,协调能量稳态的维持,包括饥饿、饱腹感、肠道屏障完整性、肠道转运、血糖控制和整体能量平衡。
肠内分泌激素的功能可根据其促食欲(刺激食欲)和厌食(抑制食欲)特性大致分类。胆囊收缩素(CCK)、肽 YY(PYY)、胰高血糖素样肽1(GLP1)、葡萄糖依赖性促胰岛素多肽(GIP)和胃泌酸调节素是主要由小肠EEC产生并在餐后释放以诱导饱腹感和减少食物的摄入。
从胃中释放的生长激素释放肽和从结肠中的EEC释放的胰岛素样因子5(INSL5)充当促食欲信号。瘦素和脂联素从脂肪组织中释放,也有助于调节饮食行为和能量稳态。
主要肠道激素及其对能量稳态的影响


Deehan EC,et al.Nat Rev Gastroenterol Hepatol.2024
✦ 进食速度和食物适口性也会影响能量摄入
然而,肠道源性食欲激素的水平并不一定与能量摄入相关;此外,一些研究表明,人类对急性饮食的激素反应并未表现出对常量营养素摄入量长期差异的实质性适应。这些发现表明,其他因素,例如食物能量密度和食物摄入速度以及食物的适口性,可能会增加人类的能量摄入。
✦ 中枢神经系统调节饥饿、饱腹感和能量储存
中枢神经系统是多种肠道源性激素的重要作用部位,也是通过整合涉及自主下丘脑回路、皮质执行回路和皮质边缘奖励通路的大脑网络来调节饥饿、饱腹感和能量储存的中枢调节器。
下丘脑的弓状核内有两个独立且相对的神经元群:促食欲NPY-AgRP神经元和促厌食POMC-CART神经元。
NPY-AgRP神经元被能量不足和信号(如生长激素释放肽)激活,以刺激食物摄入,并被胃肠道中营养物质的存在和饱足信号(如CCK和PYY)抑制。相比之下,瘦素等信号激活POMC-CART神经元会抑制进食,并由于释放与大脑黑皮质素受体结合的α-黑素细胞刺激激素而改变葡萄糖代谢。
✦ 肥胖患者的能量信号受损导致易暴饮暴食
有证据表明,肥胖成人中营养信号的受损会导致暴饮暴食和肥胖。在一项针对健康体重个体和肥胖个体的单盲、随机、对照交叉研究中,结果显示,肥胖个体在大脑对摄入营养素的反应中表现出整体和营养特异性受损。因此肠道和脂肪源性激素以及中枢神经系统共同是能量稳态治疗操纵的基本目标。
过去二十年的研究表明,肥胖代谢特征的特征是人类血清胆囊收缩素、胰岛淀粉样多肽、胃饥饿素、INSL5和胰岛素水平升高,同时瘦素、GLP1和PYY水平降低。
重要的是,这些血浆激素水平被发现随着减肥手术后肥胖的解决而恢复正常,从而强调了它们作为关键治疗靶点的作用。
✦ 激素药物的疗法会受到胃肠道耐受性的影响
针对肥胖的内源性神经分泌机制的药物是治疗肥胖和代谢综合征最有效的长期药物疗法。GLP1激动剂(索马鲁肽、利拉鲁肽和西他列汀)已被证明对持续减肥和改善心脏代谢功能具有良好功效。
使用作用于GIP、GLP1或胰高血糖素受体的双重和三重激素受体激动剂的临床试验已显示出在减肥和改善代谢参数方面的卓越功效。
然而,这些基于肠降血糖素的疗法的使用目前受到高成本、有限的医疗保健覆盖范围和胃肠道耐受性问题的限制。此外,人们还担心这些药物对肠道功能的长期影响。
✦ 基于饮食的疗法将是未来的趋势
由于这些限制,人们越来越有兴趣开发替代性肠促胰岛素靶向疗法,特别是基于饮食的方法,通过使肠促胰岛素激素(如GLP1和GIP)水平正常化来治疗肥胖并预防肥胖相关代谢功能障碍的发生。
在动物模型和人类中进行的大量研究表明膳食纤维摄入对宿主代谢和减肥有好处,因此增加膳食纤维摄入量作为一种基于饮食的肥胖疗法已引起广泛关注。
膳食纤维是碳水化合物的一种聚合物,主要存在于植物食物中,可抵抗哺乳动物基因组中编码的酶的消化;它们到达近端结肠,在其中经历肠道微生物群不同速率和程度的糖分解发酵。
✦ 目前大部分人群膳食纤维摄入不足
膳食纤维的生理益处多种多样,取决于其理化特性和摄入量,膳食纤维的推荐膳食摄入量为每1000kcal 14克(成年女性每天25克,成年男性每天38克)。然而,目前大部分人群通常每天摄入的纤维少于15克,即推荐量的一半左右。
✦ 肠道微生物在纤维代谢促进健康中起重要作用
几项大型前瞻性研究已经证明了纤维消耗与代谢健康之间的关联,目前的工作强调了肠道微生物群在将膳食纤维摄入与有益效果联系起来。
越来越多的证据表明,肠道微生物群通过涉及免疫、激素和神经系统影响的多种机制,深刻影响能量稳态的各个方面,并且肠道菌群失调或肠道微生物类群的异常组成可能会导致能量代谢紊乱并对脂肪组织、肌肉和肝脏造成影响。
肠道微生物群发酵纤维会释放出多种代谢物,包括短链脂肪酸、酚类和吲哚化合物、支链脂肪酸、乳酸、琥珀酸和各种气体(氢气、二氧化碳、甲烷、一氧化氮和含硫化合物)。
肠道微生物产生代谢物的途径和前体对饮食摄入具有高度适应性;因此,通过特定的饮食干预措施(例如膳食纤维)来针对微生物代谢是改善代谢功能障碍和肥胖的关键因素。
短链脂肪酸是通过微生物可接触的膳食纤维发酵产生的主要代谢物,人体肠腔中主要短链脂肪酸的相对比约为乙酸盐(60):丙酸盐(20):丁酸盐(20)。
短链脂肪酸可以通过与G蛋白偶联受体相互作用并抑制组蛋白脱乙酰化来介导多种局部和外周效应,从而导致基因表达的表观遗传调节变化。
丁酸盐在结肠中被结肠细胞用作能量来源,而丙酸盐和乙酸盐通过门静脉吸收到肝脏,其中丙酸盐主要用作糖异生和脂肪生成的底物;相反,乙酸盐以更高的量进入体循环。
✦ 短链脂肪酸影响激素分泌从而改善葡萄糖代谢
除了纤维对胃排空和抑制消化的影响已得到充分证明外,增加饮食中的纤维含量可能会通过产生短链脂肪酸来帮助减肥和葡萄糖代谢。
大量体外和小鼠研究表明,短链脂肪酸通过G蛋白偶联受体GPR41和GPR43(也称为FFAR3和FFAR2)直接刺激肠道肠内分泌细胞分泌胰高血糖素样肽-1(GLP-1)和肽YY(PYY)。
体内研究表明,急性直肠输注醋酸盐或短链脂肪酸混合物会增加PYY和GLP1的全身水平。此外,一项人体研究表明,与单独使用菊粉相比,在20名健康成年人中,急性口服菊粉丙酸盐会增加全身PYY和GLP1的水平,并减少食物摄入量,这表明丙酸盐水平增加在调节血糖新陈代谢方面发挥着作用。
✦ 短链脂肪酸影响神经系统抑制食欲和能量摄入
短链脂肪酸还可以直接与肠神经系统相互作用,从而允许肠道来源的短链脂肪酸向大脑直接发出信号。小鼠研究表明,短链脂肪酸给药可通过中枢神经系统相关机制抑制食欲和能量摄入。
此外,体外和小鼠研究表明,短链脂肪酸可以通过多种机制增强血脑屏障,包括减少氧化和促炎途径以及增加紧密连接蛋白。
在小鼠研究中,乙酸盐和丁酸盐已被证明可以穿过血脑屏障并刺激迷走神经和下丘脑,从而调节食物摄入量和饱腹感。使用功能性磁共振成像的人体研究表明,结肠丙酸盐输送减少了与食物渴望相关的大脑区域的活动,并减少了食物摄入量。
需要注意的是,尽管在人脑和脑脊液中发现了可测量浓度的短链脂肪酸,但人脑对循环短链脂肪酸的摄取似乎有限,这表明一些记录在案的循环短链脂肪酸对大脑活动的影响可能是这是由于短链脂肪酸诱导的与免疫和内分泌系统的相互作用,而不是大脑内的直接相互作用。
短链脂肪酸对能量稳态的作用机制
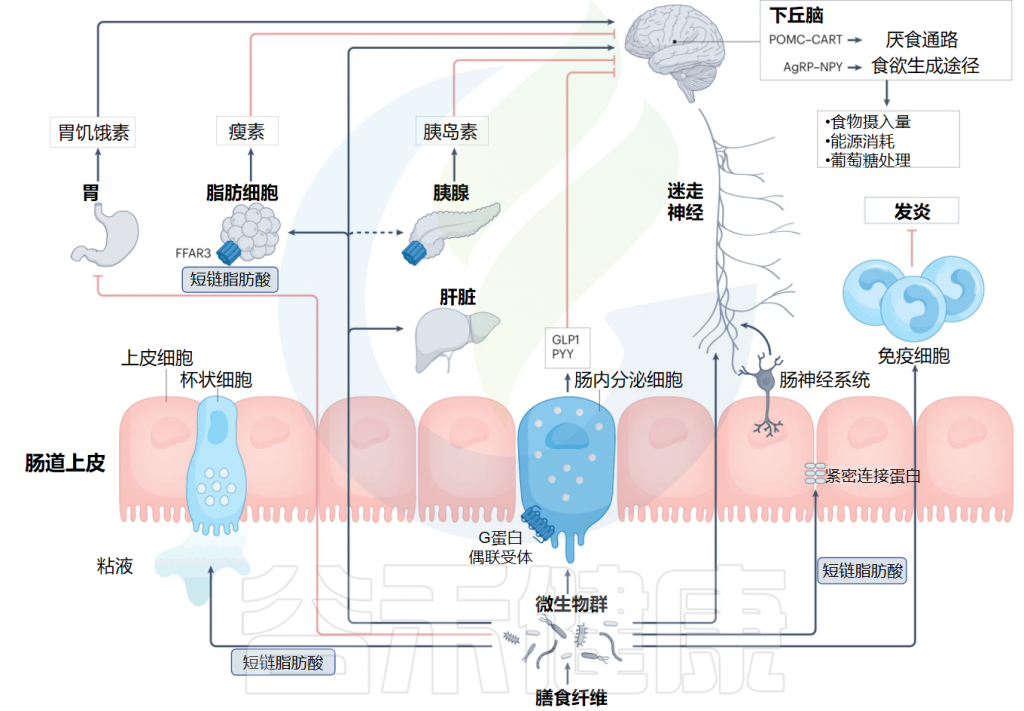
Deehan EC,et al.Nat Rev Gastroenterol Hepatol.2024
✦ 短链脂肪酸影响脂肪的分解和积累
在培养的小鼠和人类脂肪细胞中,乙酸盐和丙酸盐已被证明能够以G蛋白偶联受体依赖性方式促进脂肪分解并抑制脂肪生成,从而可能减少非脂肪组织和脂肪组织中的全身脂质循环和脂肪积累,同时还提高胰岛素敏感性。
在人类研究中,短链脂肪酸的直肠给药已证明可以促进全身脂肪分解,并且在体外培养的人类脂肪细胞中,短链脂肪酸也已被证明可以刺激瘦素分泌。短链脂肪酸还可以减少人类外植体脂肪组织的促炎细胞因子分泌,因此可能有助于减少与肥胖相关的全身低度炎症。
注意:仍然存在一些不确定性
然而,尽管大量工作支持短链脂肪酸在调节体重增加和宿主代谢方面具有潜在的有益作用,但该领域关于短链脂肪酸在肥胖中的作用仍然存在很大的不确定性,因为许多影响主要体现在小鼠模型无法在人类研究中复制。
事实上,据报道短链脂肪酸水平升高和降低都与肥胖有关。然而,大多数人类研究测量粪便样本中的 短链脂肪酸,这反映了生产、吸收和利用的净结果,并不一定反映可能更相关的全身水平。
为了支持这一观点,对160名BMI在19.2 kg/m2至41kg/m2且葡萄糖代谢正常或受损的参与者进行的横断面研究中证明,全身短链脂肪酸水平与空腹甘油呈负相关。三酰甘油和游离脂肪酸,与空腹GLP1呈正相关,而粪便水平与这些参数均无关联。此外还发现循环醋酸盐与胰岛素敏感性之间呈负相关,而丙酸盐与胰岛素敏感性呈正相关。
总体而言,研究短链脂肪酸对宿主代谢的生理影响的可用人体体内数据仍然有限。由于纤维、肠道微生物群和人体新陈代谢之间相互作用的复杂性,目前尚不清楚增加纤维摄入量的有益影响是由于微生物代谢和某些代谢物(例如短链脂肪酸)的产生或其他有据可查的影响而产生的纤维的变化,包括运输时间、营养吸收或粪便膨胀和结合的改变。
除了短链脂肪酸之外,肠道微生物群还在膳食纤维发酵过程中产生乳酸和琥珀酸,然而,这些代谢物通常被认为是微生物生产短链脂肪酸的中间体。
✦ 肥胖和代谢综合征患者乳酸和琥珀酸含量增加
乳酸和琥珀酸以低浓度存在于血液和组织中,与没有肥胖的人相比,在肥胖和代谢综合征患者中检测到的水平有所增加。乳酸是宿主衍生的葡萄糖代谢产物,当糖酵解通量超过线粒体氧化时,血液中的乳酸会增加。
✦ 乳酸可能作为活性信号分子减少促炎反应
因此,乳酸可以被认为是葡萄糖代谢受损的生物标志物。此外,体外和小鼠研究表明,乳酸可以作为活性信号分子,调节脂肪细胞功能和代谢,并通过GPR81依赖性和非GPR81依赖性来减少脂肪组织和免疫细胞功能中的促炎症反应。
由于这些有益的发现,有人建议通过增加纤维摄入量和由此产生的乳酸产量来靶向GPR81可能代表肥胖和代谢紊乱的新治疗靶点。
✦ 琥珀酸作为代谢稳态的一种信号分子
尽管琥珀酸传统上被认为是三羧酸循环的代谢物,但目前的研究已证明琥珀酸可作为参与应激和组织损伤的代谢信号。
肠腔中琥珀酸含量较低,但对小鼠的研究发现,细胞外琥珀酸的浓度随着纤维摄入量的增加而增加。琥珀酸可以通过与几种不同细胞类型(包括脂肪细胞和免疫细胞)上的琥珀酸受体1(SUCNR1;也称为GPR91)结合而充当信号分子。
在人类中,横断面研究报告称,血浆琥珀酸水平、肥胖和葡萄糖代谢损伤之间存在负相关。据报道,琥珀酸还可以充当生热激活剂和褐变剂,并且对脂肪分解具有影响。
一项使用脂肪细胞特异性Sucnr1敲除小鼠和从肥胖人群中分离出的人类脂肪细胞的研究发现,通过与SUCNR1相互作用调节脂肪细胞中的生物钟和瘦素表达,琥珀酸诱导的代谢效应具有新功能。
✦ 琥珀酸可能有助于解释代谢与炎症之间的联系
还有强有力的证据表明琥珀酸-SUCNR1信号传导可以充当代谢应激和炎症之间的联系。
利用人类原代巨噬细胞证明,细胞外琥珀酸可以诱导巨噬细胞产生抗炎作用。有趣的是,肥胖与全身琥珀酸水平高有关,但脂肪组织驻留巨噬细胞中琥珀酸受体的表达减少,这可能有助于解释为什么肥胖患者往往无法控制炎症。
在小鼠模型中,研究表明,肠道微生物群响应补充低聚果糖 的饮食而产生的琥珀酸增加,通过充当肠道糖异生的底物并随后减少肝脏葡萄糖的产生来改善血糖控制和能量代谢。
随着越来越多的研究检查琥珀酸诱导的生理效应,它可能有助于阐明细胞外琥珀酸的作用及其在调节宿主代谢中的局部和全身作用模式以及如何最好地针对这些途径。
✦ 微生物发酵膳食纤维产生的气体会导致一些胃肠道症状
膳食纤维经微生物发酵还会进一步产生H2、CO2和CH4等气体。然而,纤维发酵过程中气体产量的增加可能会引起不良症状,并且是个体不耐受高水平纤维的主要原因之一。
因此,还需要进行更多研究来增加肠道气体对宿主生理和代谢影响的了解,使用纤维和大量营养素的饮食控制来减轻患有与产气相关的胃肠道疾病的患者症状。
了解膳食纤维在胃肠道中的生理效应机制,包括其与肠道微生物群的作用,将有助于开发基于膳食纤维的补充策略,以调节免疫、代谢和体重稳态。
所有膳食纤维的共同特征是它们的低聚或多聚碳水化合物结构可抵抗小肠的消化,并且如果分离和合成,则对人类健康显示出生理益处。然而,纤维之间的化学和物理结构以及理化特性存在巨大的异质性。
常见分离和合成的商业膳食纤维
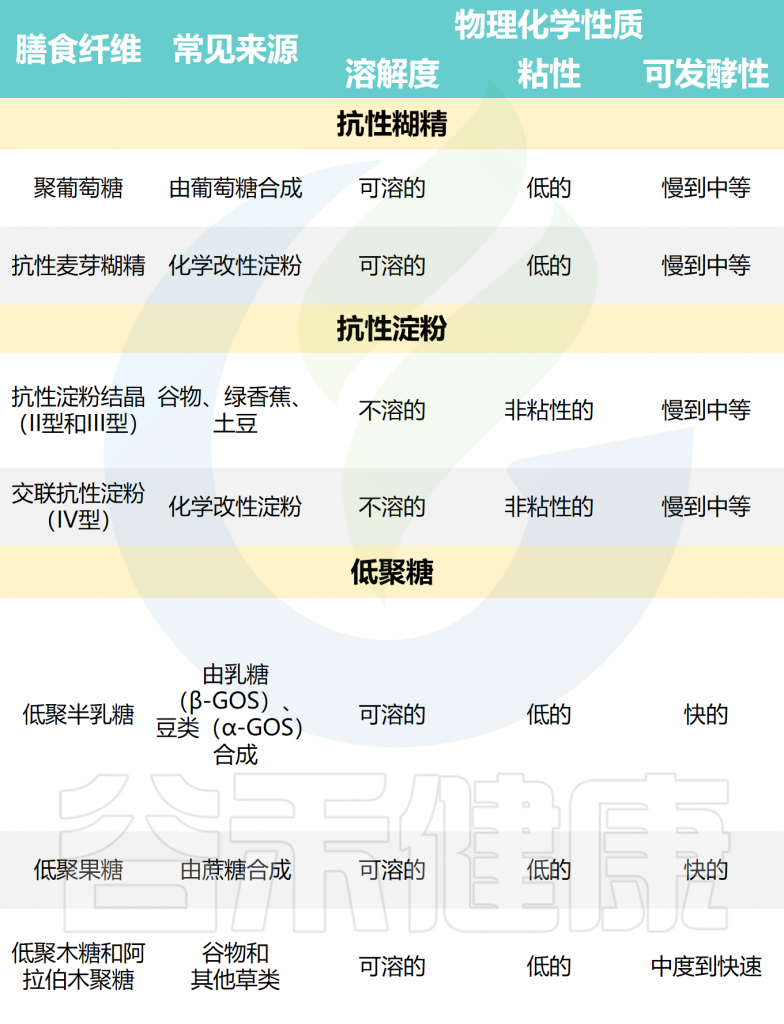

Deehan EC,et al.Nat Rev Gastroenterol Hepatol.2024
✦ 膳食纤维的差异会影响其对人体的作用
具有较长、无支链的线性碳水化合物结构(如纤维素)通常不溶于水性溶剂,阻碍了人类肠道微生物群对其进行发酵,使较少的微生物能够接触到这种结构。
相比之下,具有混合连接或支链的低聚合物和聚合物通常可溶于水,更容易被肠道微生物接近。因此,随着聚合度的增加,可溶性纤维倾向于将水和其他化合物截留在聚合物内和聚合物之间,从而以浓度依赖性方式增加粘度。分子量也会影响微生物的发酵和短链脂肪酸生产速率;然而,分子量与发酵之间的关系取决于纤维结构,且不一定是线性的。
尽管纤维通常根据物理化学性质(例如溶解度、粘度、结合能力或发酵性)进行分类,但这种分类并不能反映离散纤维结构所表现出的全部性质。
例如,来自高粱或稻米等草类的阿拉伯木聚糖低聚物或简单结构的聚合物很容易发酵,而复杂结构的阿拉伯木聚糖要么在整个结肠中缓慢发酵,要么很难被人类肠道微生物群作用。
因此,了解纤维的结构和理化特性,尤其是分离或合成后的纤维,对于更精确地应用纤维来治疗肥胖至关重要。
膳食纤维的理化特性影响它们在胃肠道中的作用,从而决定它们对炎症、代谢和能量稳态的影响。
✦ 粘性纤维和较大纤维会增加饱腹感并减少摄入
从口腔开始,粘性纤维和大纤维颗粒(如谷类麸皮)可以通过获得更坚硬和耐嚼的食物基质来延长咀嚼和口腔感官暴露,从而改变内分泌相对饱腹感的反应并减少能量摄入。
当食品应用中热量密集的糖和脂肪减少时,菊粉、低聚果糖和微纤丝纤维等纤维也可以保持感官特性(如甜味和口感)。天然食品中的纤维基质进一步充当唾液淀粉酶等消化酶的屏障。咀嚼过程中这些三维植物细胞壁结构的维持影响细胞内成分(如淀粉)沿胃肠道的生物利用度。
增加食糜粘度的纤维,例如较高分子量的混合连接或支化聚合物和微纤丝纤维,可促进胃扩张并延迟胃排空。小肠腔内增加的食糜粘度通过限制营养物质向粘膜扩散和内源性消化酶的活性进一步延迟营养物质吸收,这通过触发回肠破裂进一步减慢近端胃肠传输。
✦ 纤维结构影响脂质的吸收和利用率
除了粘度之外,某些纤维结构还可以结合或捕获化合物,例如常量营养素和微量营养素、酚类和胆汁酸,从而延迟或阻止小肠吸收。胆汁酸与膳食纤维的结合会干扰胆汁酸的肠肝循环并阻碍胶束形成,从而减少脂质的吸收和利用率。
此外,增加纤维结合胆汁酸向大肠的输送可能会导致微生物胆汁盐水解酶和 7α-脱羟酶将初级胆汁酸转化为次级胆汁酸。对人类和小鼠的研究以及使用分离的人类胰岛和哺乳动物培养细胞的体外实验表明,这些次级胆汁酸通过多种膜和核受体(包括G蛋白偶联胆汁酸受体(TGR5)和法尼醇X受体,导致饱腹感增加、肝糖原合成、肝脏、棕色脂肪和肌肉组织中的胰岛素分泌和能量消耗。
一项针对肥胖和2型糖尿病患者(n=23)的研究证明,将结合胆汁酸输送到回结肠区域可降低餐后血糖和空腹胰岛素水平,并增加GLP1分泌,这支持了胆汁酸在葡萄糖代谢中的作用。
✦ 膳食纤维会影响小肠对营养的反应
尽管了解甚少,但膳食纤维可能会进一步改变驻留的小肠微生物群,在大鼠模型中显示这种相互作用会影响小肠营养感应,特别是低聚果糖诱导的脂质感应,从而促进肠内分泌细胞(EEC)释放GLP1以增加饱腹感。
在培养细胞、动物模型和人类中进行的大量工作也表明微生物代谢物与胃肠道味觉受体表达和活性的改变有关,从而导致味觉偏好和食物摄入的改变。
最后,所有膳食纤维,无论是天然存在的、分离的还是合成的,都可以通过简单地用不可消化的碳水化合物代替一部分可消化的化合物来减少能量摄入,这与能够在不改变感官特性的情况下在食物中实现更高水平的较低粘性纤维相关。
总体而言,小肠的营养吸收率受到结构依赖性的影响,增加了纤维消耗的阻碍。这有助于促进饱腹感,减弱餐后血糖、血脂和炎症反应,而这些反应通常在肥胖症中失调。
纤维摄入量的增加相当于未吸收的营养物质增加,这些营养物质到达近端结肠并可供人体肠道微生物群利用。
膳食纤维对胃肠道的生理影响
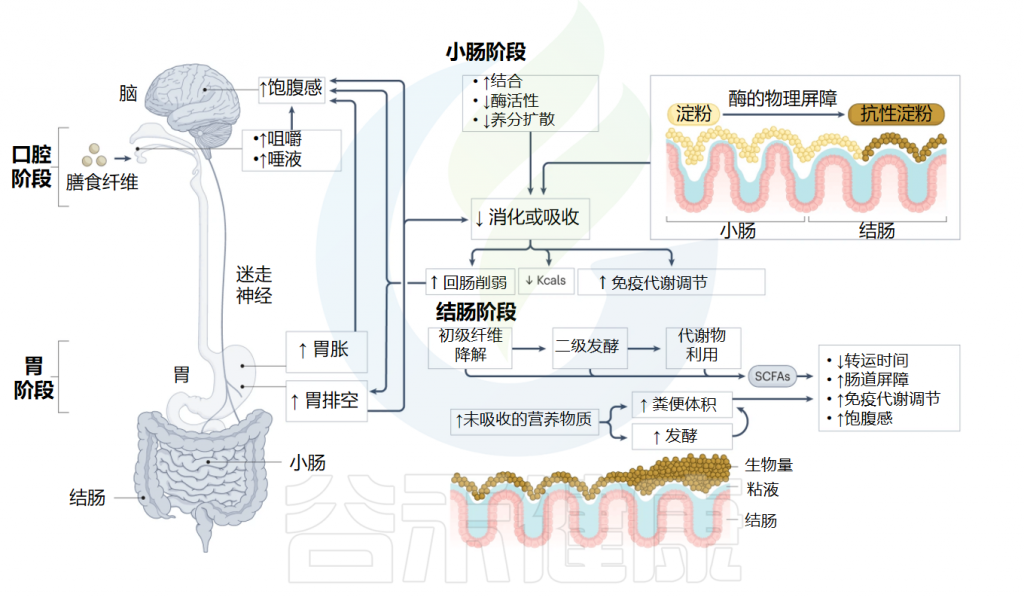
Deehan EC,et al.Nat Rev Gastroenterol Hepatol.2024
✦ 微生物对膳食纤维作用改善排便和减轻炎症
与小肠中的化合物结合的纤维进一步在结肠中被作用,使底物和其他生长因子接近利用它们的特定微生物。肠道微生物群对发酵缓慢或发酵不良的化学和物理结构,如大纤维颗粒、纤维素或车前草,通过刺激蠕动、粘膜分泌和抑制水的重吸收来提供其他胃肠道益处,这已被证明可以增加体积和软化人类粪便。
这些纤维通过抑制微生物发酵可能减少结肠转运时间,促进结合化合物的排泄并减轻全身炎症。尽管可发酵纤维还可以通过增加微生物生物量以及产生短链脂肪酸和气体来影响结肠转运时间,但纤维发酵的主要生理效应归因于假定有益微生物的结构特异性扩张以及随后结肠内短链脂肪酸和其他代谢物的产生。
✦ 富含膳食纤维的饮食使肠道微生物群更丰富
纤维到达结肠时会引发微生物群落内复杂的交互作用,这些群落共同获取、降解和利用代谢产物,最终丰富了成员多样性。
初级降解和次级发酵释放短链脂肪酸、气体和其他代谢产物,被代谢物利用者进一步转化,影响与结肠细胞的相互作用。
消耗可发酵纤维支持多种微生物群成员,解释了纤维结构多样的饮食与多样化微生物群的关联,这是健康肠道微生物组的特征。
结肠中成员的富集和代谢产物的促进取决于纤维结构、个体群落和生态因素,如结肠微环境。研究表明,特定饮食可增加能量利用,降低脂肪含量,并提高胰高血糖素样肽-1(GLP-1),而食物摄入量无显著变化。
✦ 复杂结构的膳食纤维增加结肠远端的短链脂肪酸产量对代谢有利
尽管纤维发酵过程中微生物群落产生的副产物主要发生在结肠近端,但通过消耗具有结晶或复杂结构的纤维可以减慢发酵速率,从而减轻肠道气体的产生并将短链脂肪酸输出转移到远端。
研究表明,增加短链脂肪酸远端产量可通过上调PYY和GLP1等肠内分泌激素,对人类的饱腹感、血糖和能量代谢产生有利影响。
事实上,在肥胖男性中,远端结肠中施用的醋酸盐增加了脂肪氧化和循环PYY;然而,当在近端结肠中施用醋酸盐时,没有看到效果。尽管向增加脂肪氧化和PYY产生的转变意味着有利的能量代谢,但仍需要进一步研究来确定是否可以通过增加远端结肠中纤维发酵和短链脂肪酸的产生来减少体重和肥胖。
✦ 远端结肠可能是未来治疗肥胖的靶点
糖分解发酵向远端结肠的扩展和延伸进一步减少了膳食和粘膜蛋白质的发酵。蛋白水解发酵的抑制部分是由于肠道微生物对碳水化合物而非氨基酸的普遍偏好,以及乳酸和纤维发酵过程中结肠pH值降低抑制蛋白水解酶。
人类蛋白水解发酵的减少可能会随后降低被认为有害和促炎的病原体(例如脱硫弧菌)和代谢物(例如氨或对甲酚)的水平。纤维和蛋白质发酵之间的平衡已在人类身上得到证实,因为增加抗性淀粉的剂量以及将饮食模式从高蛋白、低碳水化合物转变为体重维持饮食已被证明可以增加粪便中的短链脂肪酸并减少支链脂肪酸,支链氨基酸发酵产生的代谢物。
促进结肠中短链脂肪酸的产生可能会通过刺激粘液分泌、上调紧密连接蛋白、增加抗菌肽浓度和调节结肠上皮增殖来增强胃肠道屏障完整性,共同减轻细菌脂多糖的易位和随之而来的代谢性内毒素血症。总之,这些结果支持将远端结肠作为控制肥胖的治疗靶点。
除了膳食纤维结构之外,还有一些生态因素会影响纤维发酵过程中促进健康相关的微生物和代谢物的产生。
✦ 结肠转运时间影响微生物群和宿主代谢
结肠转运时间被认为是影响肠道微生物群和宿主代谢的关键因素,转运时间较慢与纤维发酵速率降低和短链脂肪酸减少、远端结肠pH值和蛋白水解发酵增加以及肠道对粪便能量的回收减少。
体外实验进一步表明,结肠pH值的降低可通过选择对酸敏感的微生物(如拟杆菌)来塑造参与纤维结构发酵的独特微生物群落。由于参与结肠纤维发酵的大多数共生微生物是专性厌氧菌,因此如在炎症中观察到的那样,结肠微环境中氧浓度的增加,也通过支持耐氧微生物(例如大肠杆菌)的大量繁殖来形成特殊菌群成员。
✦ 不同人群对补充膳食纤维会产生个性化反应
由于生态因素影响微生物对膳食纤维的个体化反应,因此在实施基于可发酵纤维的治疗策略来预防和治疗肥胖和代谢综合征时,需要从个人生态角度出发。
据报道,纤维引起的肠道微生物群变化仅限于少数主要反应类群,而其余成员和代谢副产物则发生更多个性化变化。
例如,数十年的人类研究证实,低聚果糖和低聚半乳糖等益生元寡糖可通过选择性促进经常用作益生菌的乳酸菌和双歧杆菌来增加乳酸和乙酸,从而为人类带来健康益处。
丁酸盐生产菌
体外研究还表明,厌氧丁酸菌、真杆菌、粪杆菌等丁酸盐生产菌可以通过乳酸和乙酸的交叉喂养或通过利用抗结晶淀粉、木聚糖和菊粉等底物来富集。
丙酸盐生产菌
另外,丙酸盐生产者,如拟杆菌属、副拟杆菌属、葡萄杆菌属和韦荣球菌属,可以通过交叉饲喂乳酸和琥珀酸盐或通过降解底物(如酯化抗性淀粉、果胶和木聚糖)来富集。
下一代益生菌
下一代益生菌有望改善患有肥胖和代谢综合征的成年人的代谢,其中包括Akkermansia muciniphila或Anaerobutyricum soehngenii ,这两种细菌已被证明可以通过补充纤维来丰富。
小结
因此,可发酵膳食纤维可用于选择性地扩大肠道微生物群内与健康相关的类群。然而,仍需要进行更多研究来阐明与肥胖和代谢功能障碍有因果关系的其他共生微生物和代谢物,并可通过选择膳食纤维来靶向。
肠脑轴连接肠道和中枢神经系统,促进双向通讯。这一过程牵涉到肠神经系统、迷走神经、内源性大麻素系统以及神经免疫和神经内分泌通路。
肠道代谢产物可直接调节神经系统活动,通过作用于肠神经元、迷走神经和交感神经末梢,或者经体循环传输至大脑。
★ 肠道微生物产生的多种神经递质会影响食欲
此外,肠道微生物还产生多种神经递质,如血清素、多巴胺、乙酰胆碱和GABA(γ-氨基丁酸),这些物质通过迷走神经在肠神经系统或中枢神经系统内发挥作用。一项小鼠研究指出,细菌肽聚糖片段与大脑下丘脑神经元上的NOD2相互作用,调节食物消耗和体温,进而影响食欲。
研究者还发现,从肥胖小鼠体内提取的微生物移植到瘦小鼠体内,可影响大脑奖励系统,与微生物代谢产物3-3′-羟苯基丙酸存在因果关系,影响多巴胺能和阿片类标记物,进而调节食欲行为和动机。进一步分析显示,嗜黏蛋白阿克曼菌(Akkermansia)、Muribaculum、普雷沃氏菌(Prevotellaceae)和副拟杆菌(Parabacteroides)的水平与3-3′-羟苯基丙酸血浆水平相关。
肥胖症中微生物群与肠道之间的相互作用
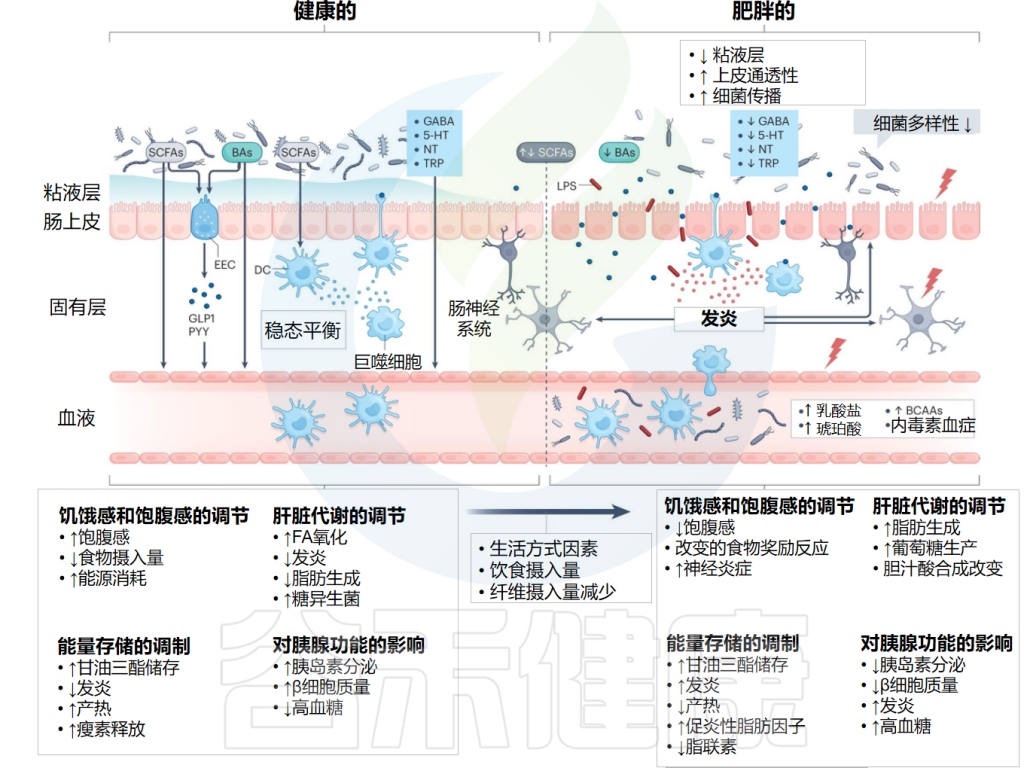
Deehan EC,et al.Nat Rev Gastroenterol Hepatol.2024
这些研究共同表明,肠道微生物群与宿主相互作用,通过不同的自主神经和体细胞神经内分泌途径改变新陈代谢,并且肥胖患者的这些相互作用发生了实质性改变。实际上,每个途径都代表了可以通过饮食干预(例如增加纤维摄入量)进行调节的潜在途径。
扩展阅读:
治疗肥胖症的精准医学方法是通过个性化的诊断和治疗方案来帮助患者减肥和改善健康状况。这种方法结合了先进的科学技术和专业知识,以确保每位患者都能得到最有效的治疗。
通过精准医学方法,医生可以根据患者的基因、生活方式、肠道微生物群和其他因素制定个性化的治疗计划,从而更好地管理和治疗肥胖。
对于减肥饮食干预的反应存在着高度的个体差异,这种差异可以归因于多种因素,包括遗传背景、微生物群组成以及生活方式因素(如进餐时间、睡眠、锻炼和昼夜节律)。为了实现减肥效果,需要确定影响个体对饮食干预反应的关键因素,并制定个性化的营养策略。
✦ 肠道微生物群是预测减肥效果的良好指标
研究表明,基线微生物宏基因组谱,尤其是与纤维降解相关的几个基因的存在,与随后的体重减轻密切相关。在一项为期6个月的减重研究中,研究人员发现,个体的肠道微生物群是预测体重减轻效果的一项重要指标。
特定的肠道细菌,如布劳特氏菌(Blautia wexlerae)和多氏拟杆菌(Bacteroides dorei),在含量丰富的个体往往能更好地预测体重减轻效果。
此外,体重减轻与活泼瘤胃球菌(Ruminococcus gnavus)、马赛拟杆菌(Bacteroides Massiliensis)和芬氏拟杆菌(Bacteroides Finegoldii)相关。
✦ 具有高发酵肠道微生物水平时增加纤维摄入有利于减肥
这些微生物群,如阿克曼氏菌和普雷沃氏菌,由于其处理植物来源复杂纤维的能力,与富含纤维的饮食密切相关。相比之下,食用低纤维饮食的个体通常具有更高水平的拟杆菌;而食用高纤维饮食的人群普雷沃氏菌更丰富。在人类减肥试验中,与普雷沃氏菌水平较高的个体相比,以拟杆菌为主的个体在摄入富含纤维的饮食时通常不太可能减肥或维持体重减轻效果。
这些发现表明,高水平发酵代谢的肠道微生物群(如普雷沃氏菌)可能更有利于减肥,尤其是在增加纤维摄入量时。
最后,试验(n=1002)的数据显示,肠道微生物群组成是餐后脂质和血糖反应,以及空腹心血管代谢标志物的良好预测因子。然而,必须指出的是,肠道微生物群组成仅解释了餐后甘油三酯、葡萄糖和C肽升高的5-7%变化,其他因素也在其中起作用。
将基于精准医学的方法应用于肥胖和代谢紊乱的另一种方法是根据个体的潜在病理生理学和行为特征使用针对表型的干预措施。
肥胖表型通常可分为四类:异常饱腹感、异常餐后饱腹感、情绪性进食和异常静息能量消耗。针对每种表型进行了可行性试验,比如通过使高纤维饱腹感异常的个体饮食,可以关闭大脑饥饿中枢并实现最大的胃扩张。支持这一概念的是,与接受标准治疗的参与者相比,接受表型定制生活方式干预的参与者减重更多,代谢和临床参数改善更显著。
✦ 根据不同表型采取饮食会有更好的效果
在一项为期12周的饮食干预试验中,患有肌肉胰岛素抵抗或肝脏胰岛素抵抗的人被随机分配到高单不饱和脂肪酸饮食或低脂肪、高蛋白和高纤维饮食。具有肌肉胰岛素抵抗的个体(n =149)在食用低脂肪、高蛋白和高纤维饮食时代谢参数有更多改善,而具有肝脏胰岛素抵抗的个体食用高单不饱和饮食时,肝脏胰岛素抵抗(n=93)有更大的改善。
需要注意的是,另一种基于代谢表型的方法根据CORDIOPREV-DIAB试验显示出相互矛盾的结果。可能是由于研究人群的差异或饮食干预措施的组成差异造成的,说明了基于某些表型设计精准饮食干预措施的还存在一些挑战。
通过营养干预进行个性化葡萄糖优化研究旨在测试这种通过根据组织特异性胰岛素抵抗表型调节膳食营养素含量来改善葡萄糖稳态参数和心脏代谢健康的方法。
尽管开发个性化营养干预措施存在相关的挑战,但这些原理验证研究总体上支持使用基于生物和表型因素开发个性化饮食干预措施的基本概念。
此外,了解肠道微生物及其基因途径如何与饮食成分相互作用可能有助于设计更有效的个性化疗法,并有可能提高饮食干预减肥的成功率。
膳食纤维的结构和理化多样性为开发基于纤维的策略提供了潜力,还能从一定程度上改善肥胖和代谢综合征药物和手术疗法。
富含纤维的天然食品,如全谷物、蔬菜、水果、豆类、坚果和种子,为以肥胖为中心的医学营养疗法提供了非淀粉多糖和抗性淀粉的混合来源,分离和合成的浓缩和均匀特征纤维为针对代谢综合征病理生理学的营养保健品开发提供了途径。
✦ 膳食纤维对于控制肥胖有重要作用
几种纯化的食品级膳食纤维已经作为食品成分或补充剂在市场上销售,其中许多可以被选定的微生物群落获取、降解和利用。
一项包含22项随机对照试验、总共1428名参与者的系统回顾和荟萃分析表明,使用分离的可溶性膳食纤维补充剂(菊粉、低聚果糖、抗性玉米糊精、瓜尔豆胶、亚麻籽粘液、海藻酸盐粉、葡甘露聚糖和黄原胶)的个体至少12周后, 与对照干预措施相比 ,体重减轻和代谢功能改善显著更高(可消化的碳水化合物),支持补充分离纤维在控制肥胖中的作用。
然而,体重的减少相对适度(平均差-1.25公斤),表明单独分离的可溶性纤维可能无法实现实质性的体重减轻。
!
补充膳食纤维需要和个体特征相匹配
使用基于膳食纤维的策略相关挑战在于需要什么剂量才能产生有益效果以及个人对这些剂量的反应如何?
通常,小鼠和大鼠模型中使用的剂量转化为人类每日摄入量>100 g ,这可能会导致严重的副作用。事实上,一项对18名参与者进行的纵向、随机交叉研究表明,补充30克菊粉会增加促炎细胞因子(如IL-6和TGFβ)以及肝酶的水平。
另一项结合使用人体组织样本、人体结肠活检离体培养和细胞培养模型的研究表明,饮食中的β-果聚糖可引发人体巨噬细胞和患有活动性肠道炎症的炎症性肠病患者的活检样本中的促炎症反应。研究人员推测,在缺乏发酵纤维(如β-果聚糖)所需的特定微生物类群(如罗氏菌属和普氏粪杆菌)的个体中,这些未发酵的纤维可能会在胃肠道中诱发炎症反应。
这些研究强调了基于将特定纤维混合物与宿主现有微生物功能特征相匹配的个性化饮食疗法的必要性。
了解膳食纤维如何沿着胃肠道表现并与人体肠道微生物群相互作用后,可以根据纤维独特的理化特性、对肠道微生物群的影响以及对饱腹感、血糖、血脂或炎症反应的影响来合理选择纤维。
✦ 根据对肠道微生物群的影响等选择合适的纤维
一个商业化的例子是PolyGlycopleX,它是海藻酸钠、魔芋胶和黄原胶的混合物,协同相互作用形成高粘性和凝胶形成的多糖复合物,先前已证明可以促进饱腹感并降低总胆固醇水平。
注:人们可以推测,将PolyGlycopleX与有利于丙酸产生的可发酵纤维混合物配对可能会增强临床反应,因为人类补充丙酸已被证明对饱腹感和胆固醇代谢有良好的影响。
39名患有高心脏代谢疾病风险的成年人服用含有七种可发酵纤维的专有混合物,可以改善葡萄糖和胆固醇代谢的替代标志物,并显著调节肠道微生物群的组成和功能特征。
快速(菊粉)和缓慢(抗性淀粉)发酵纤维的混合物,旨在将乙酸盐的产生扩展到远端结肠,也被证明可以在健康个体的餐后促进能量消耗并减弱血糖反应,但有趣的是,它并没有患有糖尿病前期的个体。
这些结果强调了微生物发酵能力的改变以及正常体重个体和肥胖或代谢功能障碍个体之间短链脂肪酸代谢的差异会影响对纤维补充剂的反应。
✦ 纤维引起的微生物变化会影响代谢、信号传导
虽然纤维混合物是一种新兴方法,可以部分克服对纤维补充的个性化反应,但仍需要精心设计的临床前和临床研究来开发和确定此类纤维混合物单独以及与治疗肥胖症和代谢综合征的护理标准相结合的功效。
对14名成年人进行的受控饮食研究中使用特定的纤维组合,证明不同的纤维组合在微生物功能基因表达和生长中引发了共同的和纤维特异性的反应。
例如,豌豆纤维和菊粉或豌豆纤维、菊粉、橙纤维和大麦麸的组合都促进了多种拟杆菌的生长,并增加了阿拉伯低聚糖和低聚木糖利用的途径。
此外,纤维诱导的特定微生物基因的变化可能与宿主葡萄糖代谢、钙调神经磷酸酶和AKT信号传导、细胞凋亡、激肽释放酶-激肽蛋白酶和免疫过程的变化相关。
尽管体外研究进一步证明了离散纤维结构能够操纵肠道微生物组的潜力,但仍需要在人体中进行额外的随机对照试验来确认纤维补充剂的生理效应。
膳食纤维和健康相关细菌基因组之间的联系表明,活体微生物的施用,无论是益生菌、活体生物治疗药物还是粪菌移植,都可能与选择性发酵的膳食纤维相互作用。
与将益生菌和益生元结合在一起的互补合生元不同,这种精确配对是协同合生元开发的基础,其中精确开发底物以供共同施用的活微生物选择性利用,从而为宿主带来健康益处。
✦ 膳食纤维协同合生元改善代谢和肥胖
一些早期的临床前和临床研究结果表明,协同合生元可能并不总是可预测地相互作用以促进健康。例如,根据三氯蔗糖与乳果糖的比率估计,在94名肥胖个体中补充益生元低聚半乳糖、益生菌青春双歧杆菌或协同合生元已被证明可以类似地增强肠道屏障完整性。
然而,根据系统评价和荟萃分析的报告,合生元补充剂,或益生元(或多种益生元)和益生菌(或多种益生菌)的一般配对,已显示出减轻体重和纠正肥胖代谢失调的希望。
一个例子是Pendulum Glucose Control,它是菊粉、低聚果糖、嗜黏蛋白阿克曼菌(Akkermansia muciniphila)、拜氏梭菌、丁酸梭菌和婴儿双歧杆菌专有混合物,已被证明可以改善2型糖尿病患者的葡萄糖代谢,这些患者单独通过饮食和运动治疗。
✦ 膳食纤维的摄入与粪菌移植的效果会相互影响
整个粪便微生物群落的管理可能会进一步受益于精确膳食纤维的共同管理,这些纤维支持群落内与健康相关的成员或调节防止微生物植入的环境限制。
在一项研究中,粪菌移植与不可获取的微晶纤维素 (n=17) 配对,但不是可发酵纤维混合物(n=17)(抗性麦芽糖糊精、IV型抗性淀粉和阿拉伯胶),改善了接受者中肥胖和代谢综合征患者的胰岛素敏感性。
微晶纤维素是一种食品添加剂,也常用作药物包衣材料。它是一种水溶性纤维素衍生物,具有优异的增稠、乳化、稳定等功能。在食品工业中,微晶纤维素常用于调制冰淇淋、奶油、果冻等产品;在药物制剂中,微晶纤维素常用作控释药物的包衣剂。
补充微晶纤维素有助于增加群落丰富度以及几种与健康相关的类群的植入或富集,例如Akkermansia、Christensenellaceae和Phascolarctobacter,这可能是通过将结肠环境转向更有利的条件,例如减少肠道炎症。
捐赠者在获得粪便之前的饮食会进一步影响粪菌移植的功效。例如,与遵循地中海减肥(n=16)或健康饮食指南(n=19)饮食后接受自体粪菌移植胶囊的个体相比,含有绿茶和较高膳食纤维的地中海饮食在粪菌移植后8个月可减弱体重增加。
总体而言,将益生菌、活生物治疗和粪菌移植疗法与具有离散结构的新型纯化的膳食纤维相结合,将有助于开发创新的营养保健品和药物疗法,通过平衡失调的肠道微生物群来针对代谢综合征的病理生理学。
主要参考文献
Deehan EC, Mocanu V, Madsen KL. Effects of dietary fibre on metabolic health and obesity. Nat Rev Gastroenterol Hepatol. 2024 Feb 7.
Lin D, Peters BA, Friedlander C, Freiman HJ, Goedert JJ, Sinha R, Miller G, Bernstein MA, Hayes RB, Ahn J. Association of dietary fibre intake and gut microbiota in adults. Br J Nutr. 2018 Nov;120(9):1014-1022.
Ricardo-Silgado ML, McRae A, Acosta A. Role of Enteroendocrine Hormones in Appetite and Glycemia. Obes Med. 2021 May;23:100332.
Crooks B, Stamataki NS, McLaughlin JT. Appetite, the enteroendocrine system, gastrointestinal disease and obesity. Proc Nutr Soc. 2021 Feb;80(1):50-58.
Brown SSG, Westwater ML, Seidlitz J, Ziauddeen H, Fletcher PC. Hypothalamic volume is associated with body mass index. Neuroimage Clin. 2023;39:103478.
She Y, Mangat R, Tsai S, Proctor SD, Richard C. Corrigendum: The interplay of obesity, dyslipidemia and immune dysfunction: a brief overview on pathophysiology, animal models, and nutritional modulation. Front Nutr. 2023 Oct 11;10:1304102.
Gill SK, Rossi M, Bajka B, Whelan K. Dietary fibre in gastrointestinal health and disease. Nat Rev Gastroenterol Hepatol. 2021 Feb;18(2):101-116.
Mah E, Liska DJ, Goltz S, Chu Y. The effect of extracted and isolated fibers on appetite and energy intake: A comprehensive review of human intervention studies. Appetite. 2023 Jan 1;180:106340.

谷禾健康

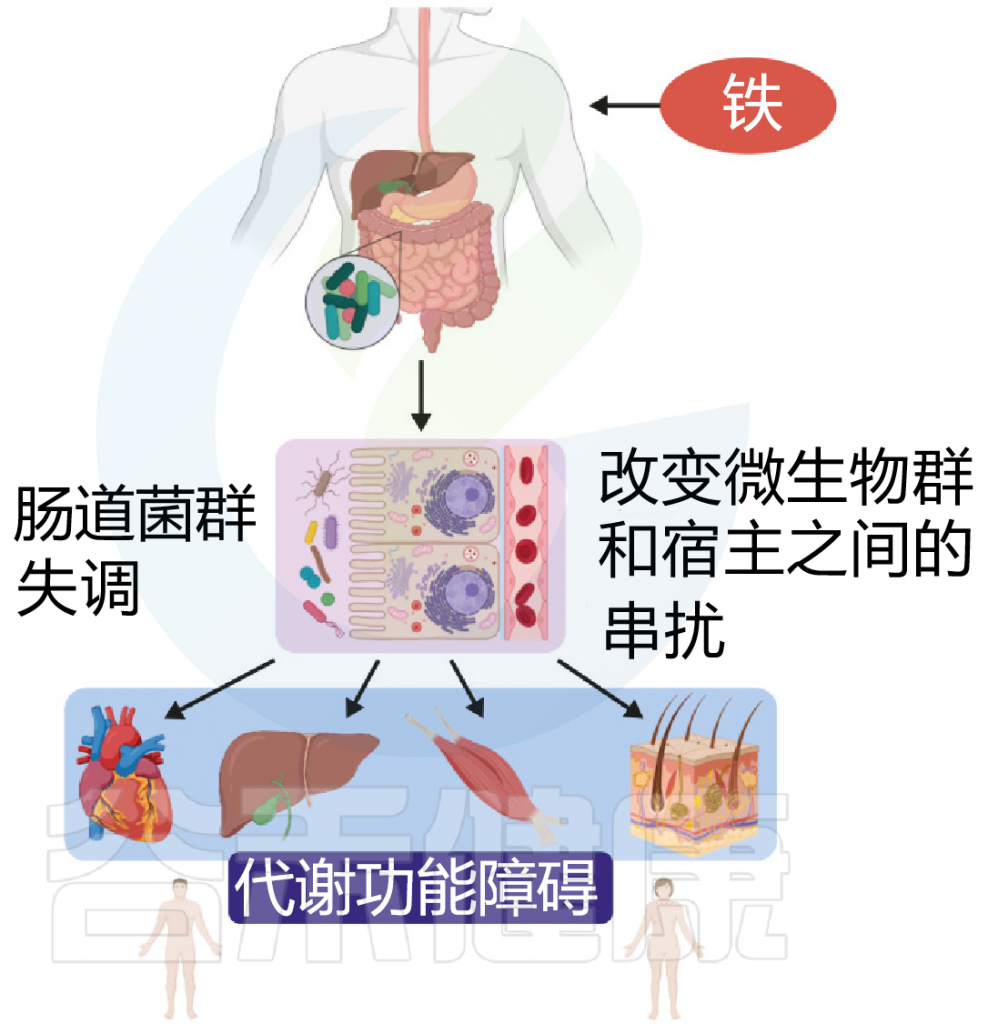
铁 (Iron)作为人体不可或缺的元素之一,在氧气运输,新陈代谢和免疫防御中起着基本作用。铁元素的良好调控是人体健康的保障,过多过少都会对人体产生不利影响。铁稳态的失调与各种疾病的发生和发展息息相关:铁缺乏会导致宿主发育迟缓,免疫低下,而铁过载更易引发炎性反应和代谢问题, 还可能与癌症的发生发展密切相关。
在人类中,小肠作为宿主体内铁的主要吸收场所,大约每天吸收2-3mg铁,但是在一些病理条件下,小肠并不能完全将食物中的铁吸收,而相当一部分铁进入结肠中与肠道菌群发生密切的交互作用,并影响肠道菌群的“生态系统”,从而进一步调节宿主的健康和代谢。
自法国国家农业研究院与法国国家健康与医学研究院(INSERM)的研究人员首次发现肠道菌群如何影响肠道内铁元素的转运与储备成果后,多项研究表明,铁失衡会导致肠道菌群的改变,进而改变微生物多样性,增加病原体丰度并诱导肠道炎症的发生发展。
谷禾在多年的肠道菌群研究和检测实践中,也发现饮食中的铁水平是导致肠道菌群改变的重要因素。我们基于机器学习算法,建立了预测模型,可以预测评估膳食摄入和铁的菌群代谢的总体水平,这有助于避免缺铁和铁过量引起的肠道菌群失调及其可能导致的宿主健康损害和疾病风险。
铁和微生物组之间相互作用
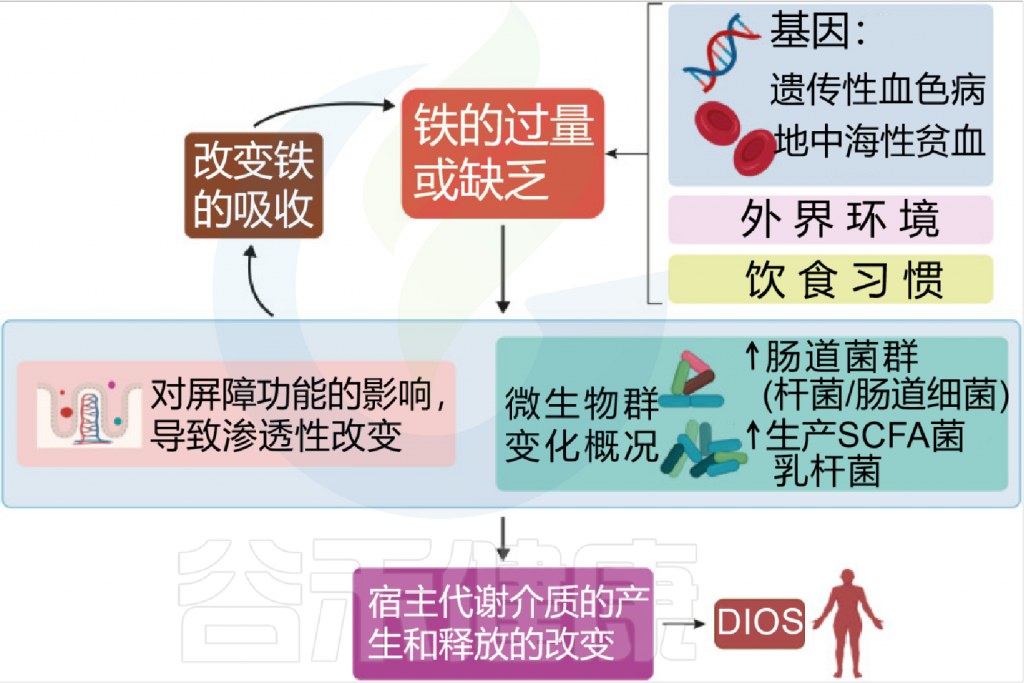

Botta A, et al., J Lipid Atheroscler. 2021
铁是人类必需的营养素,在环境中含量非常丰富,并参与了许多生物过程,如氢气的产生、呼吸和DNA 生物合成。它还在宿主细胞内的许多代谢途径中起到辅助因子的作用。
在人类中,由于没有排泄铁的途径,小肠上皮细胞对铁的吸收是一个非常严格的调节过程。
吸收效率取决于饮食中铁的潜在可用性,并受生理铁需求的调节,包括体内铁储存,铁调素在控制吸收中起核心作用。
膳食铁大致分为两种类型,非血红素铁和血红素铁。两种形式的膳食铁都有单独的肠细胞吸收途径:


这里主要关注的是非血红素铁(口服铁通常以非血红素铁的形式给予)。
肠上皮细胞对非血红素铁的吸收
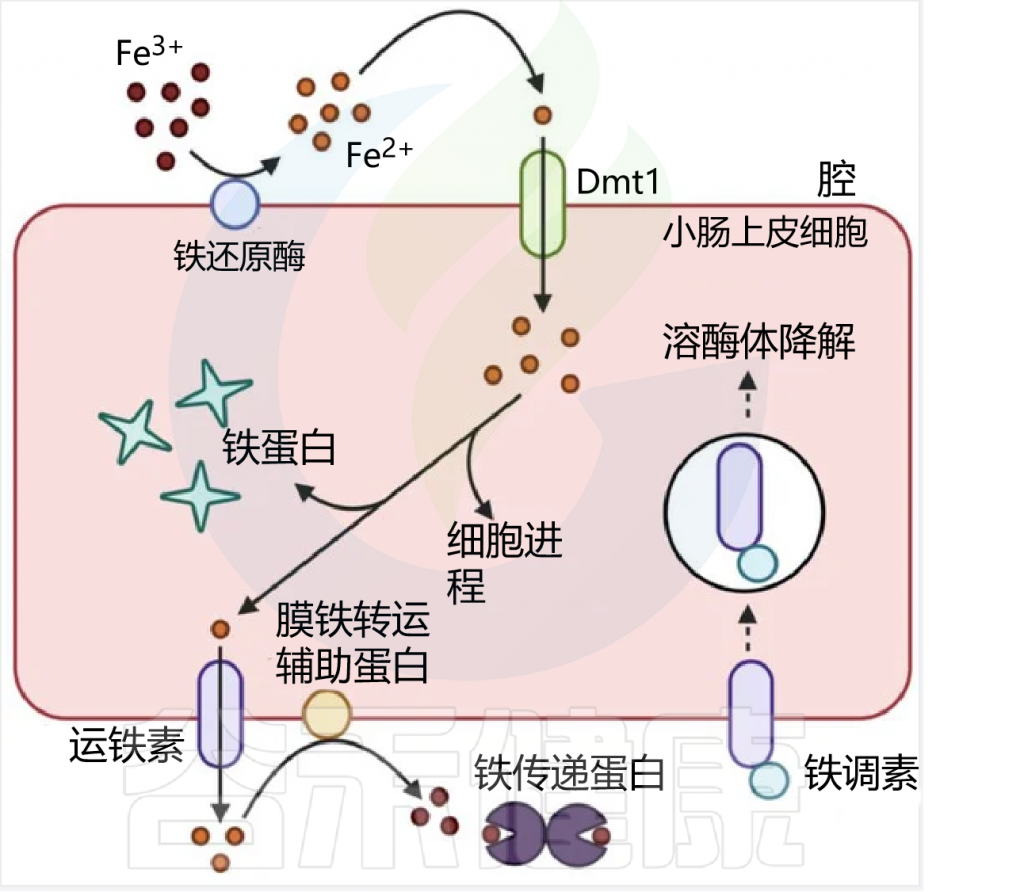

日常生活中,缺铁的常见症状包括:
一般我们常见的缺铁,主要是以下几个原因:
这很好理解。我们的身体不能制造铁,需要从食物中获取。如果你每天摄入的铁量没有达到身体需要的量,就会出现缺铁。
快速生长会增加铁需求,因此儿童、孕妇和哺乳期女性更可能缺铁。此外,进行耐力锻炼的人更容易患低铁症。
出血和失血会增加铁的流失,包括:月经出血、分娩、溃疡、痔疮、因受伤或手术而出血、献血等。长期使用消炎药(布洛芬、萘普生、双氯芬酸)会增加肠道出血的可能性。
需要注意的是,缺铁性贫血的一个常见且常被忽视的原因是月经过多。随着时间的推移,这种缓慢的血液流失通常会导致铁流失过多。
在慢性炎症性疾病中也会出现缺铁,例如自身免疫性疾病、慢性感染、慢性肾病或癌症。这被称为慢性病性贫血。
因为铁对病原体和癌细胞的生长很重要,所以当发生感染或炎症时,身体会试图通过锁定铁来抑制病原体或恶性细胞的生长。
受感染或炎症影响的组织会释放降低铁血水平的细胞因子,从而导致贫血的发展。
消化系统的疾病会降低铁的吸收,包括:
乳糜泻、炎症性肠病、胃炎、幽门螺杆菌感染、小肠细菌生长过度等,此外,减肥手术也会减少营养吸收,包括铁。
铁吸收不足的其他原因包括大量摄入抑制铁吸收的食物或药物,包括:植酸盐(全谷物、豆类)、多酚(茶、咖啡、葡萄酒)、抗酸药、H2受体阻滞剂、四环素或消胆胺等药物等。还有一个很重要的我们可能会忽略的环节,就是菌群。
细胞铁浓度是感染性的关键决定因素之一。肠道病原体在宿主细胞中的存活可能部分取决于宿主铁的状态。铁也可以促进肠道病原体的复制和毒力,例如沙门氏菌属、志贺氏菌属和弯曲杆菌属。
利用铁载体获取铁的一些细菌还包括如:
大肠杆菌、铜绿假单胞菌、肺炎克雷伯菌、金黄色葡萄球菌和结核分枝杆菌。
这些病原菌的定植会与宿主进行铁的竞争吸收,同时诱发肠道炎症,改变肠腔环境,影响菌群构成,进一步导致缺铁加剧。


大多数细菌都依赖于铁的存在来进行呼吸和各种代谢过程。在细菌内部,铁在生长和增殖中起着至关重要的作用,例如,某些细菌蛋白质和酶的正常功能需要铁。此外,铁还可以调节某些毒力因子的表达。
铁浓度的波动会产生病理影响,对肠道微生物群组成产生负面影响。铁的波动有两种情况,过多或者缺乏,接下来我们逐一来看铁过量和缺乏会对菌群造成什么影响。
宿主铁稳态的改变可能会影响肠道的管腔铁含量,从而影响肠道菌群的组成。在无菌小鼠中,铁转运蛋白表达减少两倍,细胞铁含量较低,在移植肠道细菌定植后,上皮细胞利于铁的能力增加,细胞内铁含量增加。
铁过量
肠道中富含铁的环境有利于变形菌。对儿童的研究表明,过量的铁会导致炎症和病原菌的生长。这些病原菌可能会诱发炎症性肠病或结直肠癌。铁的强化增加了粪便钙卫蛋白的水平,显示了肠道的炎症。
患有铁过载综合征(包括血色素沉着症和难治性贫血)的人更容易受到细菌感染,包括:
耶尔森菌属Yersinia
单核细胞增生李斯特菌Listeria monocytogenes
创伤弧菌Vibrio vulnificus
膳食铁过量摄入可影响大鼠正常的生长发育,并引起小肠粘膜炎性损伤。过量铁摄入可引起大鼠肠道菌群失调,肠道菌群丰度有所降低,其中乳酸杆菌、双歧杆菌降低,血清中肿瘤坏死因子和内毒素水平升高可能与肠道菌群紊乱有关。
铁缺乏
当铁水平下降时,也会对肠道微生物群组成产生影响,诱发肠道感染。缺铁会抑制细菌细胞繁殖过程,从而损害细菌生长。
在啮齿类动物模型中,缺铁导致微生物群组成的显著重组,微生物多样性降低。
在铁含量非常低的条件下(0.9 mg Fe/L),Roseburia,肠杆菌减少,丁酸盐水平也降低,而Lactobacillus增加。此外,低铁条件下生长的Roseburia gutis优先产生乳酸而不是丁酸盐。
图 铁和炎症之间相互作用
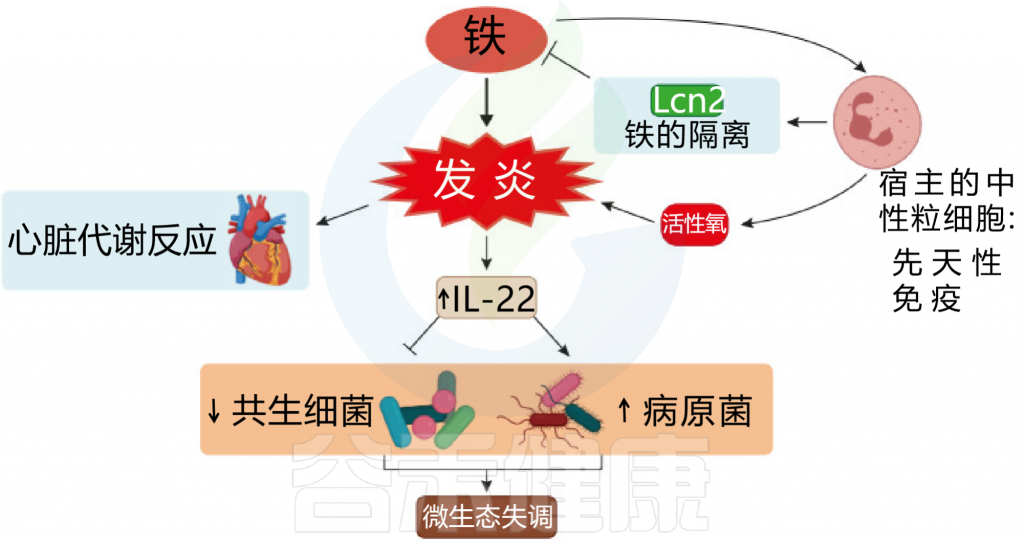

Botta A, et al., J Lipid Atheroscler. 2021
铁补充
铁的补充和强化对人体肠道细菌组成有不同的影响。
接受低剂量(0-10 mg Fe/天)或高剂量(大于60 mg Fe/天)铁补充剂的孕妇在肠道菌群任何分类水平上均没有显著差异。
接受含铁微量营养素粉(12.5 mg/天)的肯尼亚婴儿的病原体丰度增加。在健康、非贫血的瑞典婴儿中,食用高铁配方奶粉(6.6 mg Fe/天)45天不会增加病原菌的生长;然而,双歧杆菌的相对丰度降低。
但是,值得注意的是在同一项研究中,与服用高铁配方奶粉的婴儿相比,服用铁滴剂(6.6 mg Fe/天)的婴儿的乳酸菌种类相对丰度较低。尽管剂量相当,但这项研究表明,给药形式(即配方奶粉与滴剂)对肠道微生物组成的影响存在差异。
此外,由于铁滴剂会导致乳酸杆菌的减少,乳酸杆菌是重要的共生细菌,因此铁滴剂可能会增加感染的易感性。
在疟疾流行地区补充铁被证明会增加严重不良事件的发生率,包括因疟疾和其他感染而住院。疟疾感染恶化的潜在机制被认为是过量铁抑制铁转运蛋白(ferroportin,防止红细胞中铁过量,防止感染)。
口服铁补充剂和强化对 4-59 个月儿童腹泻发病率的影响。在19项研究中发现,12项研究中铁不会影响腹泻发病率,在其余的研究中,四项记录的腹泻发病率显着增加,三项记录在特定亚群中的增加。
为什么有些研究表明补铁导致腹泻增加?
有两个主要假设可以解释有时观察到的效果。
首先,铁可以在肠道内产生活性氧,从而导致肠道损伤,并导致炎症性腹泻。这一假设得到了体外实验的支持,在体外实验中,铁暴露后,肠上皮细胞失去了完整性。
其次,铁可以改变肠道细菌的组成,创造一个更具炎症性的环境。
口服铁剂后结肠腔内的微生物和代谢变化
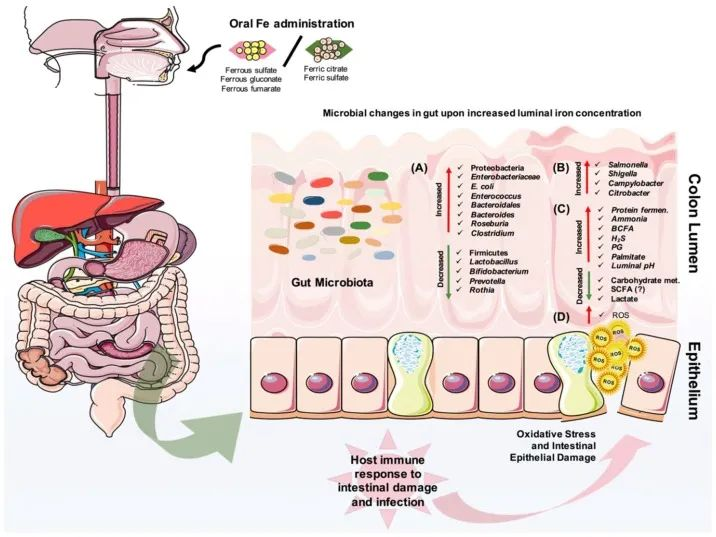
Yilmaz B, Li H. Pharmaceuticals (Basel). 2018
口服铁对肠道微生物组成的改变有直接影响。
(A)它可以导致有益微生物群的减少和致病菌的扩张,
(B)也可以为肠道病原体的扩张提供机会。
(C)此外,蛋白质发酵的增加和碳水化合物代谢的减少也会影响宿主的代谢。
(D)重要的是,铁可以在肠道中诱导活性氧(ROS)的产生,从而导致氧化应激,从而导致肠上皮损伤。
· 反过来,宿主的肠道免疫系统会对炎症、肠道损伤和可能的感染做出反应。
对于缺铁个体的补铁,可以改善肠道微生物的组成,降低致病菌的数量。但是在一些研究中,缺铁性贫血的个体口服补铁常会伴随胃肠道症状和肠道感染等副作用。在非洲的研究中,接受了铁强化剂饼干的儿童,铁补充并未改善机体贫血状况,反而增加了肠道致病菌肠杆菌数量,减少了乳酸菌和双歧杆菌数量,这些现象的发生可能与宿主的肠道高炎症水平密切相关,受到肠道内铁含量和微生物的影响。
当人体存在低肠道病原体负担时,补充铁剂对于肠道优势菌群或肠道炎症没有明显的影响;当人体不存在肠道病原负担的时候,补充铁剂可恢复肠道菌群,显著增加粪便中抗炎短链脂肪酸浓度并且降低肠道炎症,改善肠道微环境。
铁与病原菌
在哺乳动物中,大多数铁在血红素的卟啉结构中被螯合。由于病原菌生长需要铁,有的病原菌如霍乱包含的基因使霍乱弧菌能够从血红素中获取铁。霍乱毒素通过堵塞末端的毛细血管增加管腔血红素的生物利用度,导致宿主铁利用降低。
图 铁和代谢功能之间联系

Botta A, et al., J Lipid Atheroscler. 2021
此外,霍乱弧菌产生一种称为弧菌素的铁载体。与肠杆菌素等其他儿茶酚酸酯铁载体不同,这种独特的协同作用有助于逃避宿主免疫系统。霍乱毒素还会增加管腔内的长链脂肪酸和L-乳酸代谢产物,从而导致编码TCA循环含铁硫簇酶的霍乱弧菌基因上调。
因此,霍乱和霍乱毒素的产生在肠道中创造了一个缺铁代谢生态位,通过获得宿主来源的血红素和脂肪酸,选择性地促进霍乱弧菌的生长。
空肠弯曲菌也能捕获宿主铁并在宿主内引起感染。空肠弯曲菌感染是通过食用生的或未煮熟的家禽、海鲜、肉类和未经处理的饮用水发生的,当空肠弯曲菌通过胃时,它必须首先在极端酸性环境中存活。铁的存在增强了它在酸胁迫环境中的生存能力,因此它含有与铁介导的酸保护有关的基因,包括鞭毛生物发生基因、细胞膜生物发生基因、热休克蛋白(GroEL、GroES),这些基因有助于它的生存。
膳食铁可抑制肠道病原体柠檬酸杆菌的生长,并促使选择无症状的柠檬酸杆菌菌株;这些反应与胰岛素抵抗和抑制病原体毒力的葡萄糖水平升高有关。
除了促进胰岛素抵抗外,膳食铁还增加了肠道葡萄糖水平,这是抑制病原体毒力的关键肠道环境变化,并推动了无症状柠檬酸杆菌菌株的选择。然而,相比之下,其他研究表明,铁可用性的降低是有益的,因为它可以减少潜在致病性肠道细菌的生长。
铁对促、健康的 SCFAs 产生的影响
细菌代谢对我们的肠道健康很重要。短链脂肪酸是结肠中的主要代谢物,对肠道健康非常有益,并且是肠细胞和更远距离组织的能量来源。
铁与短链脂肪酸
两项研究首次描述了铁和短链脂肪酸产生之间的联系。
具体来说,体内大鼠管腔缺铁期间丁酸盐和丙酸盐水平较低,并通过补铁恢复。尽管不能排除饮食干预会改变肠道对短链脂肪酸的摄取,但这些结果表明,补铁可以通过增加短链脂肪酸的产生对肠道健康产生有益的影响。
然而,相比之下,高铁条件下似乎没有太大刺激体外短链脂肪酸的产生,而在极低铁条件下丁酸盐和丙酸盐的产生最明显受到损害。这种产量下降伴随着产生短链脂肪酸的菌Roseburia spp./ E. rectale和Clostridium Cluster IV 成员的减少。
体外发酵研究表明,补充铁会略微增加丙酸盐水平,但总短链脂肪酸水平没有显着变化。
与补充铁饮食的大鼠相比,缺铁饮食大鼠的盲肠乙酸盐、丙酸盐和丁酸盐水平降低。他们还表明,与对照组饮食(并且没有首先耗尽铁)的大鼠相比,补充铁饮食的大鼠的丙酸盐和丁酸盐水平更高。因此可以假设,缺铁饮食(与缺铁相结合)可能对肠道健康无益,因为在这些条件下,腔内短链脂肪酸水平会降低。相反,铁补充剂可能会增加促进健康的肠腔短链脂肪酸水平。
值得注意的是,短链脂肪酸可能会影响肠道病原体的毒力。丁酸盐的减少也可能会降低肠内 AMP 导管素的表达,从而削弱宿主的防御能力。
铁与支链氨基酸(BCFA)
与碳水化合物发酵相比,肠道细菌的蛋白质发酵会产生有毒或潜在有毒的代谢物,例如氨、H2S、BCFA(例如异丁酸和异戊酸)、吲哚和酚类化合物。
在体外,低铁条件下 BCFAs 的产生减少,也就是说:铁增加了成人粪便微生物群的 BCFA 的产生以及有毒氨的产生。
值得注意的是,BCFAs 和氨被认为是蛋白质发酵的指标。研究表明铁会刺激蛋白质发酵,这可能会导致更腐败、潜在有毒或致癌的环境。相比之下,在体外发酵研究中发现乳酸(主要来自碳水化合物)水平会随着铁的反应而降低。
虽然在多项体外研究中显示了源自蛋白质发酵的产品毒性的证据,但体内毒性是有限的,最近的一项试验不支持蛋白质发酵在人体肠道毒性中的作用。
另一方面,蛋白质发酵通常与病原菌的生长有关。因此,有必要在体内研究铁对蛋白质发酵和毒性的影响。
重要的是要认识到微生物代谢物的影响不仅限于肠道,因为它们被吸收,并且可能对远处部位和全身宿主代谢产生影响。目前我们还不知道这如何影响人类健康和疾病,但研究暗示铁诱导的肠道微生物活性变化也可能具有全身性影响。
在稳态条件下,肠道内的微生物必须相互竞争,并与宿主竞争可用铁。因此,细菌发展了不同的吸收系统,如铁运输系统和铁载体(铁螯合分子),以便在铁有限的环境中更有利地竞争。
前面我们知道,铁对于细菌的生长繁殖至关重要,但过量的铁也会产生毒性,因此,细菌对铁离子的摄取必须受到精确严格的调控。
细菌已经进化出了铁源的摄取系统。
细菌获取铁的机制
细菌可以通过分泌铁载体摄取Fe3+。铁载体是一种Fe3+特异性的螯合剂,对Fe3+具有超强的络合力。
铁载体能够与宿主体内的转铁蛋白、乳铁蛋白等铁结合蛋白竞争Fe3+,从而形成可溶性的Fe3+-铁载体复合体,这种复合体可以特异性地与细菌细胞外膜上的铁载体受体蛋白(OMRs)相结合,最终被转运至细胞周质中,转运过程通过TonB系统提供能量。
细胞周质中的Fe3+-铁载体复合体与周质结合蛋白(PBPs)相结合,形成Fe3+-铁载体-PBPs复合物。最后Fe3+-铁载体-PBPs复合物由ABC转运蛋白介导,通过内膜进入胞浆。进入细胞后,Fe3+-铁载体-PBPs复合物中的Fe3+被铁还原酶还原为Fe2+,Fe2+与铁载体的亲和力低,从而被释放。
除了分泌高亲和力的铁载体竞争Fe3+外,一些细菌还进化出直接利用转铁蛋白或乳铁蛋白中Fe3+的机制。
大多数革兰氏阳性菌存在直接吸收血红素而获得铁元素的转运系统。
细菌外膜上的血红素受体可以直接与血红素或血红蛋白结合,并将血红素或血红蛋白转运至周质,通过ABC转运蛋白转运至胞质降解或利用,整个过程由TonB系统提供能量。
金黄色葡萄球菌铁依赖性表面决定系统(Isd)可从血红蛋白中获取Fe2+。
除直接的血红素转运系统外,还存在间接的血红素转运系统。如革兰氏阴性菌中存在的Hemophore蛋白介导的血红素转运系统。
除此之外,细菌也可以产生分泌的或位于膜上的铁还原酶,将Fe3+还原成更容易溶解的Fe2+形式,并通过Feo、Yfe、Efe等转运系统来摄取Fe2+。其中Feo转运系统最为重要,大约80%的革兰氏阴性菌都存在Feo转运系统。
调节铁稳态
铁储存蛋白通过以可溶且无毒的形式储存细胞内游离铁来降低其浓度。在铁缺乏时,例如当存在于哺乳动物宿主细胞内或血液中时,铁可以从这些细菌储存中释放出来。
例如,大肠杆菌可以通过FieF输出铁,而且已经描述了一种用于伤寒杆菌的柠檬酸铁外排转运体(IceT);这些铁外流系统的目的是防止细胞内高水平的游离铁造成的压力。此外,血红素输出机制(HrtAB或同源蛋白)已被证明可以缓解某些细菌中血红素的铁胁迫。
最后,双歧杆菌科能够将铁结合到其表面,从而减少周围环境中自由基的形成,并可能在结肠腔中起到铁螯合的作用,以防止病原菌吸收铁。
铁的形态、可用性和结肠腔中的铁之争

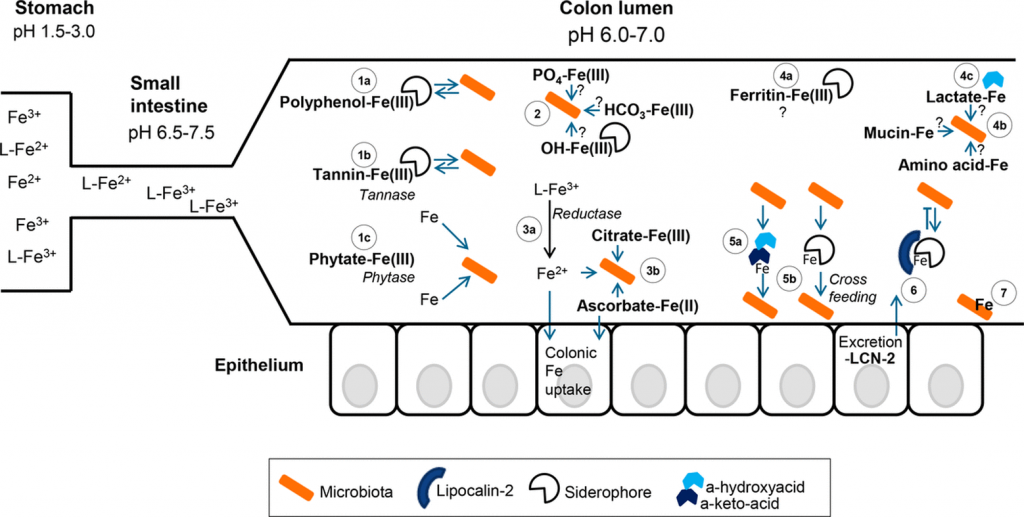
Kortman GA, et al., FEMS Microbiol Rev. 2014
胃肠道中的铁形态可能对肠道微生物群获取铁起着重要作用。
低pH值有利于铁和亚铁的溶解性,不一定需要配体(L)来溶解。
当小肠内的pH值升高时,主要是三价铁的溶解度降低,并与食物成分和宿主排泄物形成更多的络合物。
在结肠内,由于微生物群产生乳酸和短链脂肪酸等,pH值略有下降。图中结肠部分的微生物群以橙色表示(有益的)常驻物种和致病物种。
铁调素(Hepcidin)是一种由肝脏产生的肽激素,是全身铁稳态的主要调节剂。铁调素结合并降解铁转运蛋白,从而影响铁被巨噬细胞回收、被肠上皮细胞吸收以及被肝细胞储存的过程。
当体内缺铁时,铁调素浓度较低,从而有利于铁的吸收和从储存部位输送到血浆;
但当体内铁含量充足时,较高的铁调素浓度会降低铁的吸收,并损害铁的释放。
体内“铁稳态”
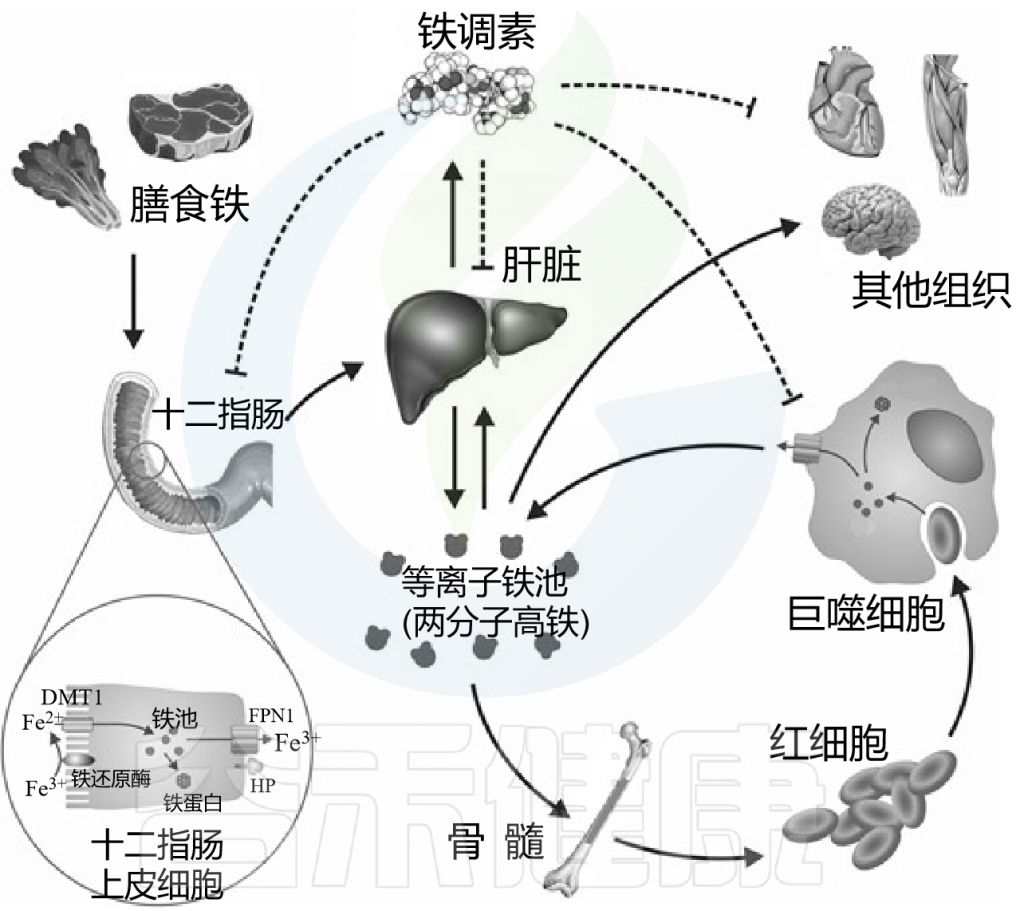

Anderson GJ, et al., Am J Clin Nutr. 2017
铁在饮食中以血红素和非血红素形式存在。非血红素铁通过DMT1穿过肠上皮细胞的根尖膜,通过FPN1穿过基底外侧膜后进入血液循环。铁与血浆TF结合,分布到全身组织。
菌群会通过代谢物信号传导途径调控系统铁稳态平衡。美国密西根大学研究人员在《Cell-Metabolism》上发表的研究证明了,细菌具有铁依赖性机制,可以抑制宿主铁的运输和储存。肠道菌群产生的代谢物能抑制肠道铁吸收主要转录因子低氧诱导因子 2α (HIF-2α),并增加铁存储蛋白铁蛋白 (Ferritin),从而抑制宿主的铁吸收。
两种菌群代谢物——1,3-二氨基丙烷 (DAP) 和 Reuterin,通过抑制异二聚化作用作为 HIF-2α 抑制剂,可以有效缓解全身铁超负荷。
与铁摄取相关的抗菌治疗
针对细菌生存繁殖对铁稳态的严重依赖,可将病原菌的铁获取系统作为抗菌治疗的靶点,开发针对病原菌铁稳态的化合物治疗细菌感染,同时可基于该系统研发疫苗。
大鼠和家兔服用抗生素后,铁的吸收也减少了。然而,小鼠研究发现,抗生素治疗后,铁的吸收增加了。这些发现表明,抗生素的使用可能改善铁缺乏症患者的铁吸收。
铁是饮食变化、微生物组改变和代谢功能障碍之间串扰的关键节点。
代谢综合征指的是一组异常,包括肥胖、血脂异常、胰岛素抵抗和2型糖尿病,这些疾病共同增加了心血管疾病的风险,包括心力衰竭(HF)和非酒精性脂肪性肝病。
通过血清中非转铁蛋白结合铁的存在、高铁蛋白血症、肝铁超载与胰岛素抵抗的相关性,明确了代谢综合征患者中轻度铁过量的患病率。
铁过量与胰岛素抵抗的结合通常被称为代谢异常铁过量综合征,15%-30%的代谢综合征患者会出现这种情况。因此,目前铁过量与代谢当量的关系已被充分认识,但导致代谢功能障碍的机制尚不完全清楚。
降低代谢疾病中铁的效果
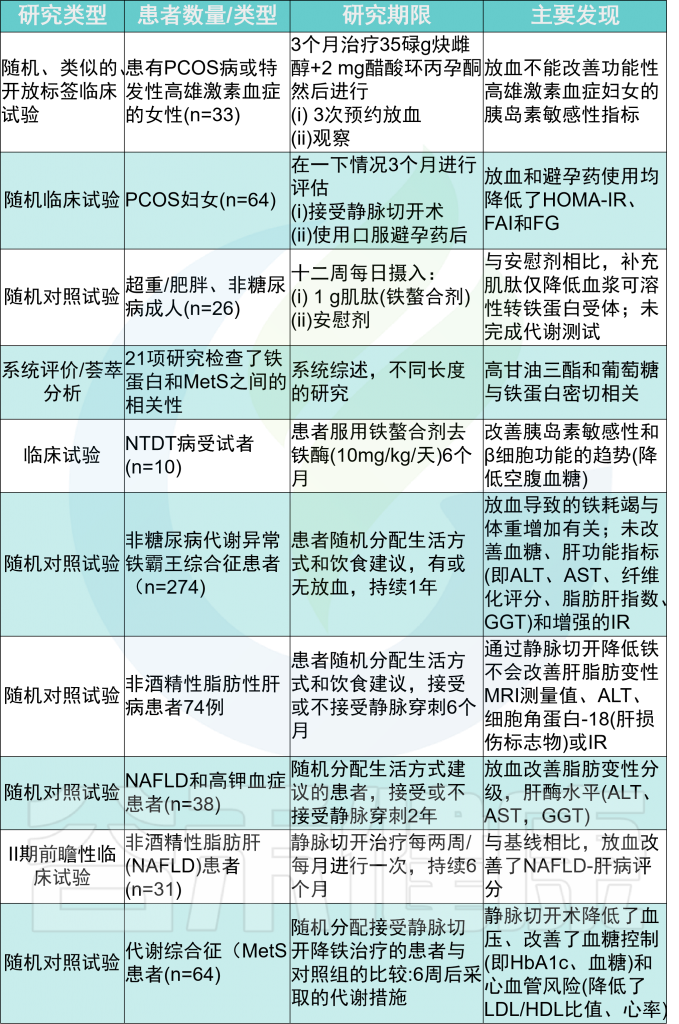

在铁储量较高的MetS患者中,男性对心脏和肝脏疾病的易感性较高。
通过静脉切开或使用螯合剂等降低铁含量的干预措施,在某些情况下可以提高胰岛素敏感性,延缓2型糖尿病(T2DM)和心力衰竭的发病,但并不总是成功的。
在长期病态肥胖后,缺铁是一种常见现象,同样也可导致2型糖尿病和心力衰竭。因此,之前的研究表明铁和葡萄糖稳态或心肌病之间存在双向关系,表明最佳铁水平的平衡至关重要。
可能铁在代谢综合征发病机制及其并发症中的作用仍未得到充分重视,而微生物群的修饰是铁代谢影响的一种重要且相对未被探索的中介物。特别是,肠道内饮食中的铁水平改变了微生物群的组成。预计随后会影响微生物组的代谢组谱功能,包括短链脂肪酸和支链氨基酸。这种改变的后果将是宿主的外周胰岛素抵抗和代谢功能障碍。
炎症性肠病 (IBD) 的特征是胃肠道的慢性炎症。炎症与溃疡性结肠炎 (UC) 和克罗恩病 (CD) 中的肠道溃疡有关。IBD 也可能出现出血和吸收不良,三分之一的患者会出现缺铁性贫血。
一项IBD小鼠模型的研究发现,铁含量的改变显着影响 DSS 在小鼠中诱导的结肠炎的严重程度,铁含量的过多或过少都会加剧结肠炎的严重程度。
DSS治疗的高铁饮食小鼠的体重减轻程度不如低铁饮食小鼠,但粪便钙卫蛋白测定的肠道炎症更严重。这些喂食高铁饮食的小鼠经历了变形菌的增加,同时厚壁菌和拟杆菌的减少。
膳食铁水平与结肠炎症的 DSS 治疗和粪便钙卫蛋白水平之间似乎存在协同作用。
摄入两倍于标准水平铁(400 ppm)的饮食会导致微生物组的关键变化,这意味着观察到的这些变化不仅仅是由炎症的严重程度驱动的,还有管腔游离铁也会导致导致IBD中经常观察到的异源状态发展的复杂因素相互作用。
还需要更多了解的是,管腔铁如何影响IBD。此外,还需要研究管腔铁的增加对肠道微生物群的生理影响,以及这可能如何影响菌群多样性。未来也需要更多人体干预研究,进一步确定不同剂量的治疗性口服铁对人体肠道微生物群的复杂影响,尤其是代谢后果。
研究表明,缺铁和铁过量都与结直肠癌的发病机制有关,这表明必须谨慎平衡最佳铁摄入量。
在 965 名 50-75 岁的人群研究中,发现铁摄入量与结直肠息肉之间存在 U 型关系,铁摄入量高(>27.3 毫克/天)或低量(<11.6 毫克/天)的人更容易患上结直肠息肉,这是结直肠癌的前兆病变。
缺铁
由于铁在维持免疫功能中至关重要,铁的可用性不足可能会通过削弱对肿瘤变化的免疫监测,并潜在地改变肿瘤免疫微环境而增强致癌性。来自临床研究的数据表明,在结直肠癌患者中,缺铁与较差的预后和较低的治疗反应相关。
铁过量
大多数强有力的研究证实,膳食铁和铁储存过量都会增加结直肠癌的风险。
五项前瞻性人类队列研究,包括566607名个体和4734例结肠癌患者的数据,表明高血红素铁摄入量与结肠癌风险增加有关(虽然有一个队列没有发现任何关联)。
在防御方面,长双歧杆菌和嗜酸乳杆菌是肠道保护性共生菌。它们形成了一道保护屏障,防止病原菌定植,并产生丁酸盐,作为一种抗癌剂。双歧杆菌科可通过将铁结合到其表面来影响自由基的形成,并促进结肠上皮的日常更新,而乳酸杆菌菌株可降低胆汁酸的诱变效应。
大多数致病菌都具有增强的铁获取机制,因此往往比保护性细菌更容易获得游离铁。也就是说,铁可以促进致病菌和肠道共生菌之间比例的变化,增加肠道中的特定代谢物和炎症。
研究显示,拟杆菌/普氏杆菌、梭状芽孢杆菌、牛链球菌和粪肠球菌可产生遗传毒性代谢物,如硫化氢和次生胆盐,这可能会促进炎症和致癌。
基于抗生素的肠道致病菌清除降低了结肠癌的发病率,并改变了小鼠的肠道微生物群。这些发现得到了人体研究的支持。
可见,针对肠道微生物群的饮食干预有望治疗结直肠癌,但这些方法仍需要进一步研究。
过量的铁对身体会带来不良影响,因此如果体内铁过量则需要采取相应措施。
多酚-铁:结合牢固,防止铁被吸收
饮食中通常含有单宁和儿茶酚等多酚,它们大量存在于茶和咖啡中。这些化合物可以非常牢固地结合铁,从而防止宿主吸收铁,但也防止细菌吸收铁。
然而,在铁缺乏的环境中,致病菌可以产生和/或占用含铁细胞可能受益于铁多酚提取机制,很可能通过清除铁绑定到多酚。
目前尚不清楚这种机制是否在肠腔中发挥重要作用,但可能与此有关,因为肠环境中可能同时存在多酚和铁载体。
此外,某些细菌,如甘蓝链球菌或卢格敦葡萄球菌,可以降解多酚鞣酸盐,并通过这种方式暂时将铁从这种有效的铁粘合剂中释放出来。
可以通过在用餐后一小时内饮用以下饮料来减少铁的吸收:


植酸盐-铁:结合物通过菌群降解,释放铁
另一种具有强铁结合活性的化合物是植酸盐,在食用谷物和豆类为主的饮食后,其肠道可利用性很高。
与单宁酸类似,某些肠道微生物(如大肠菌和双歧杆菌科)可以降解植酸盐,这可能是一种特殊的释放铁的方式,铁可能被降解生物体或其他细菌物种利用。因此,与植酸盐结合的铁可能是结肠肠道微生物群的相关铁源。
然而,应该注意的是,铁与植酸盐的复合物到达结肠时大多是不溶性的,因此不易被降解。然而,之前在常规大鼠的结肠中发现了只能通过微生物作用产生的植酸盐降解产物,但在无菌大鼠中却没有发现。这些发现表明微生物降解的植酸发生在结肠。
在每餐 2-10mg 植酸盐的极低浓度下,植酸盐会降低铁的吸收。
大豆蛋白(存在于豆腐、组织化植物蛋白和一些加工肉制品中)可以减少铁的吸收,因为它含有植酸盐。
钙
钙对骨骼很重要,但它也可能抑制铁的吸收。为了更好地吸收铁,避免在吃富含铁的食物的同时服用钙补充剂。
牛奶和鸡蛋中的蛋白质
虽然动物肉中的蛋白质会增加铁的吸收,但牛奶和鸡蛋中的蛋白质(卵清蛋白除外)在与低铁食物一起食用时会减少铁的吸收。
锌
过量摄入锌(由于过度使用锌补充剂)也会损害铁的吸收。
考虑到缺铁对人体健康影响重大,因此实施适当的策略来解决这一问题至关重要。
最常见的策略是食物中的铁补充、益生菌、益生元、铁药物补充剂等方法。
富含铁的食物
前面我们知道,膳食铁有两种形式:血红素和非血红素。血红素铁具有较高的生物利用度,膳食因素对其吸收的影响最小,而非血红素铁的吸收要低得多,并受到其他食物类型的强烈影响。
大多数对年轻女性的研究发现铁状态(铁蛋白和铁)与肉类和其他血红素铁的消耗量之间存在正相关关系。
增加富含铁的食物的摄入量,以补充铁储备,确保饮食健康均衡。
其中常见的富含铁元素的食物包括:
红肉、家禽(包括肝脏类)、鱼、豆类、扁豆、豆腐、豆豉、坚果、种子等
非血红素形式的铁含量高的植物性食物(但也可能含有高含量的阻止铁吸收的物质)包括:
● 豆类,包括鹰嘴豆、豆类、豌豆和小扁豆
● 种子,包括芝麻和南瓜子
● 绿叶蔬菜,包括西兰花和羽衣甘蓝
以上是富含铁元素的食物,同时其他富含维生素的食物也能辅助铁的吸收,例如,维生素A,维生素C.
维生素C:促进铁的吸收
如果膳食中含有大量维生素C,那么蔬菜膳食的吸收量可能会增加六倍。维生素C和柠檬酸以剂量依赖的方式促进铁的吸收,部分是通过充当弱螯合剂来帮助溶解小肠中的铁。
一项研究发现,维生素 C 的摄入量与女性的铁含量呈正相关。
在存在抑制铁吸收的物质(包括植酸盐、多酚、钙和蛋白质)的情况下,维生素 C 还有助于铁的吸收。
如果同时服用,维生素 C可将植物性食物中的非血红素铁的吸收提高 2 至 3 倍。因此,为了提高铁的摄入量,可以将富含铁的植物性食物与富含维生素 C 的食物结合起来。
水果或蔬菜中都会包含维生素 C,包括:
● 柑橘类水果
● 奇异果
● 草莓
● 番茄
● 辣椒
● 西兰花
● 卷心菜
● 菠菜


维生素A:克服植酸盐的影响促进铁的吸收
维生素 A直接影响铁转运和红细胞生成。
全谷物和豆类中的植酸盐会降低铁的吸收,但如果加入富含维生素A和β-胡萝卜素的食物可以增加铁的吸收,并可以克服植酸盐的影响。
维生素A(视黄醇)有助于治疗缺铁性贫血,并能改善儿童和孕妇的铁状况。
常见的富含维生素A和β-胡萝卜素的食物:
● 胡萝卜
● 红薯
● 鱼
● 哈密瓜
● 甜椒
● 南瓜
● 葡萄柚
益生菌
大多数益生菌产生乳酸,这可能会降低 pH 值,从而增加铁的溶解度,帮助其吸收。
例如,植物乳杆菌 299v 有助于预防缺铁性贫血。这种益生菌可以改善活跃的高加索欧洲人的膳食非血红素铁吸收。
发酵乳杆菌是人类微生物群中的一种主要益生菌,具有显著的铁还原活性。对羟基苯乳酸是该菌株产生的代谢物,通过DMT1转运体将Fe3+还原为Fe2+来增加肠细胞对铁的吸收。
与益生菌菌株给药相关的铁吸收
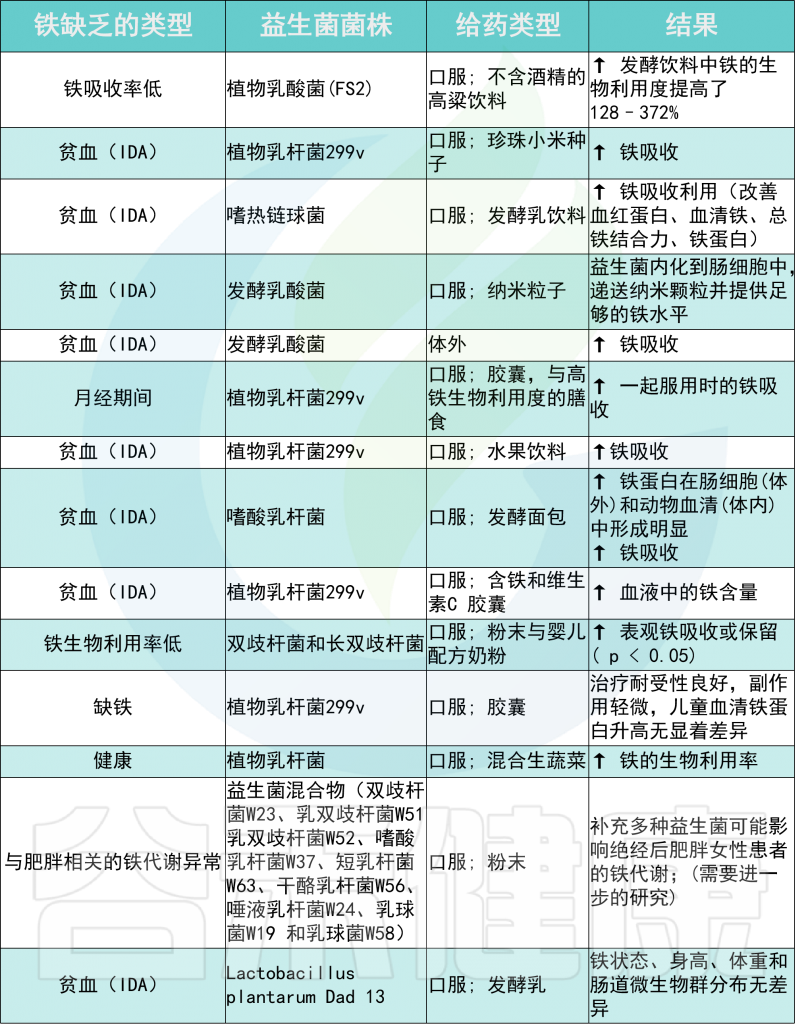

Rusu IG,et al., Nutrients. 2020
益生元
益生元是功能性食品成分,可刺激肠道中有益细菌的生长和定植,最终改善身体健康。肠道微生物群定植在肠道生理学中起着重要作用。
几项研究将益生元和/或合生元的摄入与铁可用性的增加联系起来,主要是通过将 Fe 3+转化为 Fe 2+(由于它们的铁还原活性),并促进肠细胞对铁的吸收。
例如,在肯尼亚儿童中进行的一项补铁试验报告称,在服用益生元期间铁吸收更高半乳糖寡糖 (GOS)底物。
不同类型铁缺乏症的益生元和合生元摄入量及其对机体铁水平的影响
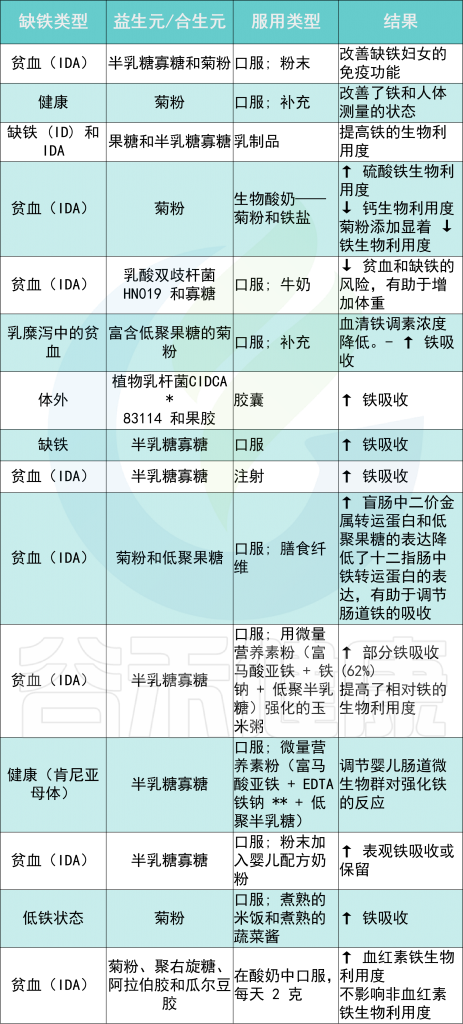

Rusu IG,et al., Nutrients. 2020
* CIDCA——食品冷冻技术研发中心
** EDTA——乙二胺四乙酸
补充剂
不同形式的铁补充剂补充铁以亚铁(+2)和铁(+3)的形式存在。由于铁形态必须在体内转化为亚铁形态以供吸收,因此亚铁形态更具生物利用度。
常用的口服亚铁补充剂包括:
● 柠檬酸亚铁
● 硫酸亚铁
● 葡萄糖酸亚铁
● 铁琥珀酸亚铁
● 氨基酸螯合物(如双甘氨酸铁、天冬氨酸铁)
● 血红素铁
虽然最常研究的铁补充剂是硫酸亚铁,但食品强化和补充剂研究表明,氨基酸螯合形式的铁(如甘氨酸)更好或同样好地被吸收。
例如,在一项针对孕妇的研究中,25mg甘氨酸亚铁能够将铁水平提高到与50mg硫酸亚铁相同的水平。
较新配方的铁补充剂可能比亚铁盐更容易耐受,胃肠道副作用更少,如:
然而,在提高产品螯合率、安全性,降低产品成本等方面有待进一步研究。
铁注射需要医疗监督。当口服铁补充剂不能耐受时,可以注射,这通常适用于患有腹腔疾病和炎症性肠病的患者。在手术或输血后血红蛋白必须迅速增加的情况下,也建议使用。注射铁剂比口服疗法更昂贵,而且不能在怀孕的前三个月用。
建议注射羧麦芽糖铁和异麦芽糖铁,因为它们能够以更大剂量给药,且安全性好。


另外,特殊人群对铁的需求量不同:
健身人群补铁
运动会加快铁在机体中的代谢,长期的运动使组织内储存铁的含量明显下降,是红细胞的更新速度加快,运动还导致机体对铁的吸收率降低,这些都增加了健身人群对铁的需要量。
我国对健身人群每日膳食的推荐的摄入量为:男性20毫克/天,女性25毫克/天。
妊娠期补铁
孕妇对铁的需求量比一般人群更高,每天 27 毫克。
妊娠期间,受母体铁状态调节的铁调素血清浓度极低。由于铁调素是肠道铁吸收的负调节剂,低水平表明对铁的需求高。
妊娠早期和中期缺铁与孕产妇发病率增加和不良妊娠结局风险增加有关,包括低出生体重、早产或宫内生长受限。
大多数产前维生素都含有足够的铁来弥补这种增加,但由于对血液产生的需求增加,缺铁性贫血在怀孕期间很常见。因此需要合理补铁。
具体补铁方式可参考上面列出的形式。
铁对于维持宿主肠道菌群稳态和肠道微生物的生长定植有重要作用。一些菌群,尤其是致病菌的生存,必须依靠铁的存在,因此形成了多种摄取铁的机制,并且参与调节宿主的肠道铁吸收。同时,铁与宿主的肠道微生物和微生物代谢产物共同作用,可对肠道乃至整体健康产生影响。
在补铁的同时,需要防止补铁带来的代谢紊乱和炎症损伤,也就是说铁的补充要在允许的条件下适度补充。那么怎么知道是否在合理范围内?目前对铁的监测以血液检测较常见,但血液检测波动较大。
此外,既已发现了铁与肠道菌群相关性,肠道菌群检测也是一个可行方向。谷禾肠道菌群健康检测报告中包含铁的水平,这是基于菌群代谢计算得到的,与血液检测有所不同,肠道菌群检测反映的是一段时间(2周左右)的长期状态。
未来需要更多的研究来证明铁、宿主与肠道菌群的相互作用机制,以及其与肠道炎症疾病等多种慢性疾病发生发展之间的因果关系,为铁补充的个性化策略提供更多支持。
各类人群的铁需求量


►►►
铁补充的副作用及相关禁忌
► 可能出现的副作用
► 禁忌症
铁补充剂不应用于以下人群:
声明:本账号发表的内容用于信息的分享,仅供学习参考使用。在采取任何预防、治疗措施之前,请先咨询临床医生。
主要参考文献:
Yilmaz B, Li H. Gut Microbiota and Iron: The Crucial Actors in Health and Disease. Pharmaceuticals (Basel). 2018;11(4):98. Published 2018 Oct 5. doi:10.3390/ph11040098
Botta A, Barra NG, Lam NH, et al. Iron Reshapes the Gut Microbiome and Host Metabolism. J Lipid Atheroscler. 2021;10(2):160-183. doi:10.12997/jla.2021.10.2.160
Finlaysontrick E C , Fischer J A , Goldfarb D M , et al. The Effects of Iron Supplementation and Fortification on the Gut Microbiota: A Review[J]. Gastrointestinal Disorders, 2020, 2(4):327-340.
Yilmaz B, Li H. Gut Microbiota and Iron: The Crucial Actors in Health and Disease. Pharmaceuticals (Basel). 2018 Oct 5;11(4):98. doi: 10.3390/ph11040098. PMID: 30301142; PMCID: PMC6315993.
Kortman GA, Raffatellu M, Swinkels DW, Tjalsma H. Nutritional iron turned inside out: intestinal stress from a gut microbial perspective. FEMS Microbiol Rev. 2014 Nov;38(6):1202-34. doi: 10.1111/1574-6976.12086. Epub 2014 Sep 29. PMID: 25205464.
Georgieff MK. Iron deficiency in pregnancy. Am J Obstet Gynecol. 2020;223(4):516-524. doi:10.1016/j.ajog.2020.03.006
Rusu IG, Suharoschi R, Vodnar DC, et al. Iron Supplementation Influence on the Gut Microbiota and Probiotic Intake Effect in Iron Deficiency-A Literature-Based Review. Nutrients. 2020;12(7):1993. Published 2020 Jul 4. doi:10.3390/nu12071993
Anderson GJ, Frazer DM. Current understanding of iron homeostasis. Am J Clin Nutr. 2017 Dec;106(Suppl 6):1559S-1566S. doi: 10.3945/ajcn.117.155804. Epub 2017 Oct 25. PMID: 29070551; PMCID: PMC5701707.
LIU Fang-Tong, FAN Hao-Nan, SHEN Li-Xin, LI Bo. Iron acquisition by bacterial and adaptive immune responses[J]. Microbiology China, 2019, 46(12): 3432-3439.
Tolkien Z, Stecher L, Mander AP, Pereira DI, Powell JJ. Ferrous sulfate supplementation causes significant gastrointestinal side-effects in adults: a systematic review and meta-analysis. PLoS One. 2015;10(2):e0117383. Published 2015 Feb 20. doi:10.1371/journal.pone.0117383
GUAN Lingjuan,CAO Congcong,TU Piaohan,et al. Research progress of the effect of iron deficiency on intestinal immune function and new iron supplements[J]. Food and Fermentation Industries,2020,46(19):264 -270
高鹤, 杨浕滢, 应晓玲,等. 铁,宿主和肠道菌群相互作用的研究进展[J]. 现代预防医学, 2020, 47(20):4.