 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

在研究肠道菌群或复杂微生物样本构成时,“门”(Phylum)是细菌分类的高级分类单位之一。
细菌分类依次为门纲目科属种亚种,最大的分类层面是门,以前写过人群肠道菌群构成主要是以拟杆菌门和厚壁菌门为主,大部分人群占比超90%(个别的变形菌门或放线菌门占比也很高),作为两大“细菌王国”,这两大王国有着不同的生态和代谢属性,又有着相似的营养和生存需求,它们如同天平的两端的砝码,不同的人有着不同倾斜,即使同一个人不同时期不同身体状态下天平的倾斜都不一样。
拟杆菌门被比喻为肠道微生物群落的“多面手”,有超过7000种不同的革兰氏阴性菌组成,主要来自拟杆菌属、副拟杆菌属、普氏菌属和卟啉单胞菌属。它们的脂多糖和鞭毛蛋白与细胞受体相互作用,并通过细胞因子合成增强免疫反应。
拟杆菌门作为多糖降解联盟的成员,尤其是拟杆菌属和普雷沃氏菌属,具有多种可以利用多糖的聚糖和糖苷酶。它们有助于分解膳食纤维和淀粉释放能量,并且它们可能是丙酸盐的主要来源。
拟杆菌门一些细菌的功能还包括胆汁酸的解离。肠道微生物群,特别是肠道拟杆菌,一定程度上也具有使初级胆汁酸解离和脱水并将其转化为人结肠中次级胆汁酸的能力。它们也参与蛋白质分解过程中有毒产物的释放。比如氨,组胺,硫化氢等,这些高浓度的产物会对肠黏膜产生毒性。
该群体的成员具有一些可能有助于抑制炎症的活动,但它们也有可能促进炎症,其中一些已知是机会病原体。
厚壁菌门细菌大多为革兰氏阳性菌,通过短链脂肪酸合成在宿主的营养和代谢中发挥关键作用。
通过其代谢产物,厚壁菌门细菌与其他组织和器官间接连接并调节饥饿和饱腹感。厚壁菌门由大量功能更加多样化的核心细菌组成。从代谢的角度来看,共生梭菌簇 XIVa 和 IV 通过产生短链脂肪酸在宿主和肠道稳态中发挥着重要作用,使肠道通透性正常化,参与脑肠轴调节。许多厚壁菌门的能力与宿主的体重有关。
F/B比率升高或降低被视为生态失调,前者通常与肥胖,代谢障碍相关,这可能与从食物中提取热量增加、脂肪沉积和脂肪生成、胰岛素敏感性受损有关;而后者则与炎症性肠病,抑郁,阿尔茨海默病等相关,这可能与短链脂肪酸尤其丁酸的生成减少,蛋白代谢物组胺,脂多糖累积等相关诱导的免疫炎症反应相关。
目前许多研究工作都集中在识别特定的微生物特征,特别是与肥胖、2型糖尿病和炎症相关的微生物特征。
我们从谷禾肠道菌群检测数据库中随机抽取5万例样本,统计的人群厚壁菌门/拟杆菌门(F/B)比率如下:
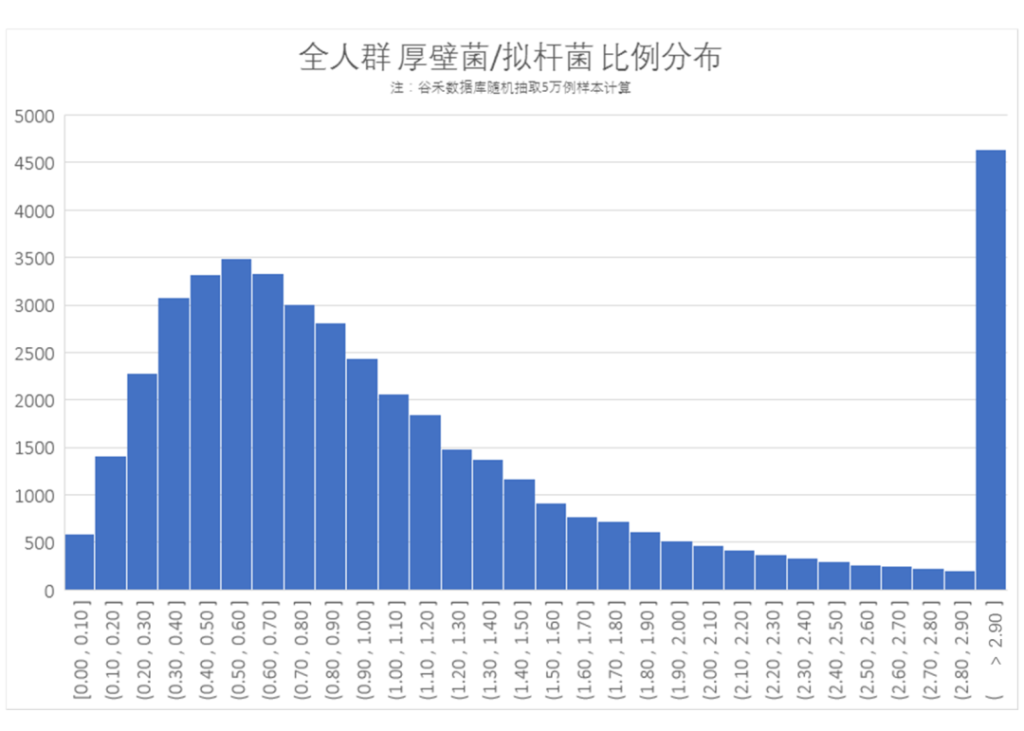
可以看出大部分人群的厚壁菌/拟杆菌比率在0.30-1.0之间(谷禾健康数据库随机抽样5万例样本),表明国人大部分人群肠道菌群的构成中拟杆菌占比多一点;同时抽样人群中1/10人厚壁菌/拟杆菌比率大于2.9,表明也有相当一部分人群厚壁菌门占比较高。
一般而言,从出生到成年,厚壁菌门/拟杆菌门的比例不断增加,并随着年龄的增长而进一步改变。该比率在婴儿、成人和老年人之间存在差异。它可能与生命不同阶段细菌谱的整体变化有关。
厚壁菌门/拟杆菌门比率是一个考虑高水平分类等级(即门)的指数,同一群体的受试者之间厚壁菌门和拟杆菌门的相对丰度差异很大。这可能是由于许多与生活方式相关的因素造成的,包括饮食、疾病状态、食品添加剂和污染物、抗生素消耗、体力活动等影响胃肠道微生物群组成的因素。
由于菌群是一个复杂的生态体系,门层面的简单划分只能提供一个最简单的线索,想要了解肠道菌群需要从最主要的核心菌属,常见的有害菌属以及大量功能菌属的构成来更加准确的分析,此外菌群的代谢通路也提供了不同角度的信息。
Wexler AG,et al.Nat Microbiol.2017
大多数健康成人微生物群仅由两个细菌门控制——革兰氏阳性厚壁菌门(许多属)和革兰氏阴性拟杆菌门(主要是拟杆菌属、另枝菌属、副拟杆菌属和普氏菌属)——它们共同构成了微生物中的大多数细菌分类群。
此外还有其他分类群包括变形菌门、放线菌门、梭杆菌门、疣微菌门、产甲烷古菌、真核生物(原生生物和真菌)和其他更短暂的定植者。
健康个体中发现的类群在家庭成员(例如父母及其子女)之间往往最相似,而在不同文化和地理空间(例如西方社会与非西方社会)之间则最不相似。
厚壁菌门(Phylum Firmicutes)是细菌的一个门,大多数具有革兰氏阳性细胞壁结构。然而,一些细菌,如巨球菌属、梳状菌属、月单胞菌属和嗜发酵菌属,具有多孔的假外膜,导致它们被染成革兰氏阴性。
科学家们曾经将厚壁菌门分类为包括所有革兰氏阳性细菌,但最近将它们定义为相关形式的核心组,称为低 G+C 组。与放线菌相反。它们有圆形细胞,称为球菌(单球菌),或杆状细胞(芽孢杆菌)。厚壁菌门缺乏脂多糖,而是向宿主呈现厚厚的肽聚糖层;研究人员已经发现了200多种不同类型的属于厚壁菌门的细菌。
★ 厚壁菌门中有许多有益的菌
厚壁菌门的成员包括许多有益的菌。比如乳酸菌是一种常见于酸奶和其他发酵乳制品中的益生菌,属于该门。这些微生物会产生醋酸盐(另一种促进健康的短链脂肪酸)以及乳酸和抗菌物质,以防止病原体定植。
又比如普氏栖粪杆菌(Faecalibacterium prausnitzii),又名:普拉梭菌,是人类肠道菌群中最重要的细菌之一,占健康人粪便样本中检测到的细菌总数的5-15%,是丁酸的重要生产者之一,具有抗炎作用,维持细菌酶的活性,保护消化系统免受肠道病原体的侵害。
★ 厚壁菌门中也存在一些致病菌
但是一些致病菌也属于该门。例如,产气荚膜梭菌是一种引起胃肠道感染的细菌。还有金黄色葡萄球菌,它是一些严重感染的常见原因。
丁酸盐是研究最深入的短链脂肪酸之一,是肠道上皮细胞营养的主要来源。丁酸盐的消耗与肠道屏障完整性受损有关。
注:研究支持,长寿、健康的老年人肠道内的丁酸细菌含量明显较高。
人类肠道包含一个非常密集的代谢活跃微生物群落。然而,只有有限数量的肠道细菌为丁酸生产者。人类肠道中大多数丁酸合成细菌分布于厚壁菌门。在厚壁菌门中,毛螺菌科、瘤胃球菌科、真杆菌科和梭状芽孢杆菌科是四个重要的丁酸合成科。
梭菌目的簇 IV、XIVa、XVI 和 I 包含大多数丁酸盐生产菌种。其中两个重要的物种,直肠真杆菌和普拉梭菌分别属于梭菌簇 XIVa 和梭菌簇 IV,占健康成人粪便样本中肠道菌群总数的12-14% 。此外,还有罗氏菌属,粪球菌属,瘤胃球菌属, Anaerostipes ,丁酸弧菌属和梭菌属。
分布在XIVa 簇中的Butyricicoccus pullicaecorum、Subdolicapsulu variabile、Anaaerotruncus colihominis和分布在 IV 簇中的Papillibacter cinnamivorans是其他产丁酸菌种。
据报道,属于韦荣氏球菌科、热厌氧杆菌科 III 的Megasphaera elsdenii和Caldocellum saccharolyticum也能合成丁酸盐。
最近,对人类样本的高通量宏基因组测序表明,Rawsonibactera saccharolyticus是瘤胃球菌科中的一个新物种,并且肠单胞菌AF211编码丁酰辅酶A:用于合成丁酸的乙酰辅酶A转移酶。
许多厚壁菌门细菌可以产生内生孢子,其耐干燥并且可以在极端条件下生存。孢子在细菌生长中起着重要的作用。细菌的孢子是一种休眠状态,可以在不利环境下存活,并在适宜条件下重新发芽成为活跃的细菌。这种休眠状态使得细菌能够在恶劣条件下存活并传播。
★ 内生孢子可以帮助细菌在恶劣条件下存活
内生孢子由细菌的DNA和部分细胞质组成,周围有一层非常坚韧的外层。它们可以在没有营养的情况下生存,并且能够抵抗紫外线、干燥、高温、极端冷冻和化学消毒剂。
厚壁菌门的代谢偏好
科学家发现,人类肠道微生物群虽然独特,但都可以按照几个分类划分下,称为肠型。第三种肠道型,被称为“谷物爱好者” ,通常以瘤胃球菌(厚壁菌门的成员)为主。
肠型往往可以追溯到长期的饮食习惯。顾名思义,具有“谷物爱好者”微生物组类型的人倾向于消耗更多全谷物中的抗性淀粉和膳食纤维。
✦ 高纤维饮食的人体内厚壁菌更丰富
高纤维饮食可以增加厚壁菌门的丰度并减少拟杆菌的丰度 ,从而增加肠道内短链脂肪酸的浓度。
而葡萄籽原花青素显著降低了肥胖大鼠肠道菌群中厚壁菌门的含量,提高了拟杆菌门的含量,显著降低了厚壁菌门与拟杆菌门比值。
✦厚壁菌偏向从膳食蛋白和循环尿素中获取氮
在厚壁菌门成员中,偏好尿素氮的属往往是菊粉的疯狂使用者,即使用菊粉和尿素合成自己的氨基酸。这包括一些脲酶阴性菌属,它们可能通过交叉喂养获得尿素氮。
此外,在厚壁菌中也看到了一些属更喜欢从膳食蛋白质中获得氮,而其他菌属更喜欢循环尿素。
静脉注射尿素以提高循环尿素浓度后,偏好尿素的厚壁菌以及阿克曼菌的丰度大幅增加。
膳食蛋白质和循环尿素是厚壁菌的主要氮原料,而分泌的宿主蛋白质为拟杆菌提供氮。
!
如果厚壁菌门过高意味着什么?
可能的原因:
– 不良的饮食习惯
– 生态失调
– 消化不良
– 胃酸过少
– 代谢疾病
可能的治疗方法和注意事项:
– 平衡共生细菌
– 当厚壁菌门含量较高时,考虑主要使用双歧杆菌益生菌和布拉氏酵母菌
– 乳杆菌属和芽孢杆菌属(益生菌中发现)可以提高厚壁菌门的数量
– 优化饮食结构:低脂肪饮食可能有助于厚壁菌门水平正常化
滋养肠道内厚壁菌门的食物
纤维和淀粉,是这些细菌的能量来源。富含水果、蔬菜、豆类和全谷物的饮食也是理想的。
研究表明,地中海饮食与更丰富的厚壁菌门有关,包括普拉梭菌。另一方面,富含动物蛋白、脂肪和糖的西方饮食会对有益的这些细菌产生负面影响。
如果想增加肠道中厚壁菌门的丰度,那么应该多吃高纤维食物。以下是一些可以添加到饮食中的食物,以支持您的肠道微生物组并促进厚壁菌门和丁酸盐的产生:
-苹果
-蒜
-大麦
-菊苣根
-燕麦
-亚麻籽
-洋葱
拟杆菌是肠道生态系统中非常成功的竞争者,表现出相当大的营养灵活性以及对宿主和肠道环境施加的压力做出反应的能力。很难权衡肠道拟杆菌对宿主是否产生负面或正面影响。
拟杆菌是复杂碳水化合物的主要降解者,迄今为止调查的所有生态系统中都普遍发现该属,在土壤以及人类和动物肠道中尤其占主导地位。大多数已测序的拟杆菌基因组编码大量多糖降解酶(CAZymes),表明代谢重点是聚糖降解。
CAZymes 在碳水化合物活性酶数据库中分为类别和家族,其中降解酶存在于糖苷水解酶(GH)、多糖裂解酶(PL)、碳水化合物酯酶(CE)和辅助活性酶 (AA) 类别中。
拟杆菌还通过与免疫系统的相互作用,在激活T细胞介导的反应中发挥作用,从而有助于宿主的整体健康。
✦ 防止特定炎症反应
基于多项研究,发现脆弱拟杆菌通过产生称为两性离子多糖的多糖来激活CD4+ T细胞。CD4+ T细胞的产生会刺激白细胞介素10的释放,从而防止特定的炎症反应和脓肿形成。
肠道免疫保护取决于拟杆菌、白细胞介素36信号和巨噬细胞的发育。拟杆菌的这种作用需要其保守的共生定植因子的多糖利用位点。
✦ 抑制胃肠道中的病原体
与胃肠道中发现的其他一些细菌相比,研究表明拟杆菌门的一些成员对各种抗生素和胆汁等物质具有耐药性,这给了他们竞争优势。
除了这种竞争优势之外,这些细菌还被证明在调节胃肠道中其他正常菌群和病原体的数量方面发挥着重要作用。
拟杆菌可以积极改善肠道环境,使其更适合自身和其他微生物。
✦降低肠道内氧水平从而促进厌氧菌生长
例如,许多编码细胞色素bd氧化酶,据推测该酶可以降低细胞内氧水平,进而降低肠道氧水平,从而允许严格厌氧菌生长,否则这些厌氧菌会被氧气的存在杀死。
这种耐受和降低氧气水平的能力可能有助于拟杆菌传播到新宿主,这可能是它们在哺乳动物中如此广泛传播的主要原因。
✦改变肠道的营养状况
它们还可以通过促进宿主的生理变化来诱导某些食物来源(例如岩藻糖基化糖蛋白)的产生,或通过从糖蛋白中释放岩藻糖和唾液酸残基来改变肠道的营养状况,这些残基可以被其他微生物消耗,包括病原体。
通过比较缺乏自身微生物的无菌动物和与单个拟杆菌属菌株和突变体单相关的无菌动物(出生时无菌但后来被微生物定殖),已经鉴定了许多这些拟杆菌属依赖性的肠道环境变化。
✦拟杆菌拥有多糖利用位点有助于代谢
尽管人们可能会想象肠道中的生命充满了微生物的过多食物选择,但在结肠(细菌密度最高的地方),简单、容易获得的糖大部分已经被消耗或吸收。其中的残留物是复杂的长链多糖,它们不能自由吸收,也不能被人类酶促消化。对于许多细菌来说,这些复杂的多糖同样难以处理,并且无法跨膜运输。
然而,早期研究证实拟杆菌是熟练的聚糖降解剂,具有识别和代谢十多种植物和宿主来源的多糖的不同寻常的能力。拟杆菌属物种通过基因簇来实现这一点,这似乎是拟杆菌特有的,称为多糖利用位点(PUL)。
多糖利用位点可以确定拟杆菌可以占据哪些代谢生态位,甚至可以确定它们在肠道内的生物地理位置。多糖利用位点被如此分类是因为它们的susC和susD的同系物,以及其他成分(糖苷水解酶、多糖裂解酶、糖基转移酶、碳水化合物酯酶),它们对于分解多种植物或宿主来源的聚糖很重要。
肠道细菌的其他谱系,包括革兰氏阳性放线菌,降解和输入膳食多糖的途径远不那么复杂,这在很大程度上是由于缺乏外膜屏障。例如,短双歧杆菌使用多结构域、细胞表面锚定酶(而不是一系列单独的酶),可以结合并降解聚合物,例如淀粉、支链淀粉和糖原。
拓展
比较基因组分析已在每个拟杆菌属中鉴定出数十种不同的多糖利用位点。例如,Bacteroides thetaiotaomicron是第一个对其基因组进行测序的拟杆菌属成员,将其 6.26 Mbp 基因组的近五分之一专用于88个不同的多糖利用位点。
拟杆菌不是同时表达所有多糖利用位点以捕获周围环境中可能存在的任何多糖,而是通过大量SusR样调节因子、混合双组分系统和涉及胞质外 σ/抗的跨包膜信号通路来严格调节其表达。
也许是由于在跨外膜运输之前需要部分降解长多糖链,B. thetaiotaomicron和其他肠道拟杆菌已经成功地将适当的多糖利用位点转录与其相应多糖分解中间体的丰度(而不是丰度)耦合起来。
这使得肠道细菌能够快速适应营养可用性的变化。糖分解物质形成甲酸盐、乙酸盐、乳酸盐、丙酸盐和琥珀酸盐作为主要发酵产物。拟杆菌可能是结肠中丙酸盐形成的主要贡献者。
由于多糖利用位点激活是肠道环境的产物,富含植物源性多糖和糖蛋白的饮食将导致多糖利用位点暂时上调,从而降解这些膳食营养素。然而,当这些底物稀缺时,例如在禁食期间或某些低纤维饮食期间(如高糖、高脂肪的西方饮食),亲糖拟杆菌会改变其转录谱以消耗宿主衍生的聚糖,这些暂时的转换可能是导致某些细菌在婴儿期最初在肠道定殖并在我们一生中持续存在的主要因素。
根据最近使用动物模型的研究,拟杆菌属可以在相对较短的宿主婴儿期主要依靠宿主聚糖生存,但当在多个宿主世代的时间内被迫以低纤维饮食为生时,它们最终可能会灭绝。
有的菌会通过破坏中性粒细胞趋化性等机制帮助逃避免疫系统(例如,伤寒沙门氏菌)和逃避宿主补体系统(例如肺炎克雷伯菌)。
相比之下,拟杆菌使用一种称为相变的过程,以开/关方式控制其荚膜多糖生物合成位点的表达。例如,脆弱拟杆菌从八个生物合成位点产生不同的荚膜多糖,其表达受到可逆启动子区域和反式位点抑制剂的严格调控,限制多个位点的同时表达,从而使脆弱拟杆菌的同基因群体共同表现出广泛的多样性。当脆弱拟杆菌漏入通常无菌的腹膜腔时,可能会发生腹膜炎。
注:绝大多数人类腹膜炎病例都是由脆弱拟杆菌引起的。
目前,拟杆菌门中研究的最充分的,包括拟杆菌属和普氏菌属以及卟啉单胞菌属。
✦ 卟啉单胞菌属可导致急性坏死溃疡性牙龈炎
卟啉单胞菌属的成员作为共生体或机会性病原体生活在人类口腔中。牙龈卟啉单胞菌引起临床上侵袭性牙龈炎,可导致急性坏死溃疡性牙龈炎或扩展到口腔和面部组织,这种情况称为坏疽性口炎或口腔癌。
✦ 普雷沃氏菌也是一种条件性致病菌
普氏菌属是一个大属,包括50多个不同的物种。大多数可以从口腔和肠道中分离出来。普雷沃氏菌属存在于人类中,帮助分解蛋白质和碳水化合物食物。也可作为条件致病菌,引起牙周和牙齿、肠道炎症、类风湿性关节炎、细菌性阴道炎等问题。
大型基因组计划,包括美国国立卫生研究院(NIH)资助的人类微生物组项目(http://nihroadmap.nih.gov/hmp/)和欧盟资助的 MetaHIT 项目 (http://www.metahit.eu)对50多种人类来源的拟杆菌门的拟杆菌和普氏菌分离株进行了测序。
基因组草图可从 Genbank 公开获得,并揭示这些物种拥有多种糖苷酶,这些糖苷酶具有预测的对抗植物和宿主来源的多糖的活性,以及维生素和辅因子合成的许多途径。
拟杆菌门的基因组大小相对较大,例如B.thetaiotaomicron 为 6.26 Mb。迄今为止在拟杆菌属中发现的16S rRNA基因的最高拷贝数为7个(在普通拟杆菌中)。
✦ 拟杆菌的组成和代谢受到饮食调节
在全基因组水平上,拟杆菌属与副拟杆菌属共享超过1000个蛋白质家族的核心,但与卟啉单胞菌属和普雷沃菌属共享较少数量的核心家族蛋白质家族。它们的组成和代谢活动在很大程度上受饮食调节。
拟杆菌与高脂肪和蛋白质的摄入量有关,而普雷沃氏菌与富含植物的饮食(高水平的复合碳水化合物和水果和蔬菜的摄入量)有关。因此,拟杆菌属和普雷沃氏菌属物种在人体内具有其特定的栖息地,因为它们大多数是拮抗的。
厚壁菌门与拟杆菌门之间的比率(F/B)与维持体内平衡有关,该比率的变化可能导致各种病理。
例如,特定厚壁菌门或拟杆菌门物种丰度的增加分别导致肥胖和肠道炎症。尽管人们非常关注 F/B 比率,但应该记住,这一比率可能会受到其他门的增加的影响,但是其他门的菌群失调增加或减少并不一定会改变 F/B 比率。
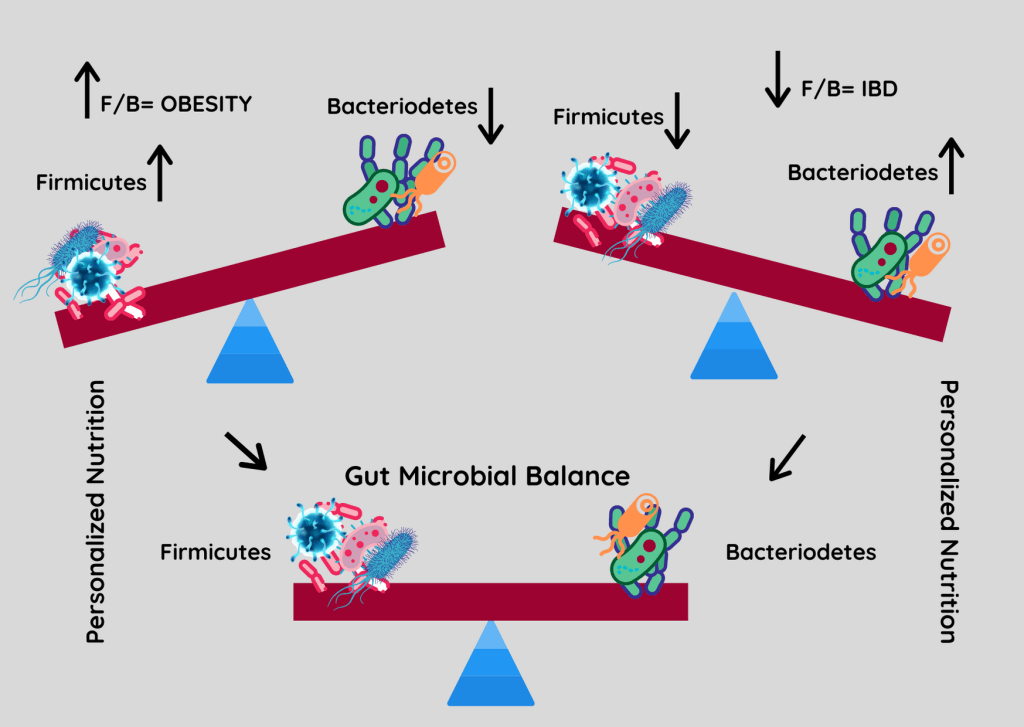
Stojanov S,et al.Microorganisms.2020
肥胖是一种复杂的、多因素的疾病,其原因包括宿主遗传背景、体力活动减少和食物摄入过多等多种因素。在过去的几十年里,肠道微生物群被认为是有利于脂肪储存、体重增加和胰岛素抵抗的额外因素。
世界范围内的研究正在不断寻找其致病因素。厚壁菌门和拟杆菌门的改变首先在肥胖动物和受试者中被描述,这些动物和受试者表现出厚壁菌门丰度增加,而拟杆菌门却减少了。
✦ F/B 比率较高时相同食物会吸收更多能量
当F与B的比例较高或体重增加和肥胖状态时,这两个细菌门影响我们体重的原因是它们调节我们吸收的脂肪量。想象一下两个人都消耗2000卡路里,但F与B的比例不同。F/B 比率较高的一种会吸收更多的卡路里,因此会比另一种增加更多的体重。因此,重点应该是平衡F与B的比例,一方面防止肥胖,另一方面预防炎症性肠病的发生。
当受试者接受热量限制饮食一年后,他们的拟杆菌门丰度增加,厚壁菌门/拟杆菌门比例正常化,同时体重减轻。这些研究得到了对喂食高脂肪或高纤维饮食的动物的研究的支持,这些研究显示厚壁菌门和拟杆菌门的丰度分别较高。
基于这些结果以及从肥胖动物和人类身上获得的其他结果,有人提出厚壁菌门比拟杆菌更能有效地从食物中提取能量,从而促进有效吸收热量和随后的体重增加。
肥胖双胞胎的微生物组富含编码营养转运蛋白的基因,而瘦双胞胎的微生物组富含编码与碳水化合物代谢相关的酶的基因。
最近发表的一项系统综述显示,大多数研究都支持 F/B 比率增加与肥胖之间的关系。
对肥胖和非肥胖日本受试者的粪便样本进行的一项研究显示,他们的 F/B 比率存在显著差异。厚壁菌门的百分比为 37.0 ± 9.1%(非肥胖者)和 40.8 ± 15.0%(肥胖者),而拟杆菌门的百分比为 44.0 ± 9.8%(非肥胖者)和 37.0 ± 14.0%(肥胖者)。
在61名乌克兰成年人中也报告了类似的结果,其中 F/B 比率与体重指数(BMI)显著相关。F/B 比率≥ 1 的个体超重的可能性比F/B 比率<1 的个体高出23%。
同样,卡塔尔受试者(37名肥胖者和36名瘦者)表现出肠道微生物群的改变;肥胖和瘦受试者的 F/B 比率分别为 2.25 ± 1.83 和 1.76 ± 0.58。在哈萨克族和比利时学童中,肥胖组的F/B比值显著高于对照组。
✦ 肥胖人群与正常人群拟杆菌存在差异
然而,两个拟杆菌属的存在差异:与肥胖组相比,正常组中拟杆菌属的高出20%,而肥胖组中普雷沃氏菌属比正常组高出19%。拟杆菌属和普雷沃氏菌属都属于拟杆菌门。
同一群体的受试者之间厚壁菌门和拟杆菌门的相对丰度差异很大。这可能是由于许多与生活方式相关的因素造成的,包括饮食、体力活动、食品添加剂和污染物、抗生素消耗等影响胃肠道微生物群组成的因素。
这种高度变异性可能解释了在比较正常体重和肥胖受试者之间的微生物群时观察到的矛盾结果,使得很难将厚壁菌门/拟杆菌门比率与确定健康状况联系起来。
重要的是要观察肠道微生物种群结构的整体组成,将其作为肥胖和肥胖相关病理(例如GSD)的指标,而不仅仅是厚壁菌门/拟杆菌门的比率。然而,在我们看来,可以修改这个比率,例如引入表征拟杆菌门底下的拟杆菌属或普氏菌属与梭状芽胞杆菌 XIVa 簇菌的比例。
!
F/B 比改变导致肥胖的争议
然而,与这些结果相反,许多研究没有观察到该参数的任何改变,甚至报告肥胖动物和人类中厚壁菌门/拟杆菌门的比例降低。
事实上,在大多数研究中,肥胖患者比瘦受试者表现出更少的细菌多样性,这表明在科、属或种水平上存在其他组成变化,这可能比厚壁菌门/拟杆菌门比率更相关。
✦肥胖增加可能与长期暴露脂多糖有关
关于这一点,代谢性内毒素血症的假说提出,肥胖增加和全身炎症的发展可能是由于长期暴露于脂多糖所致,脂多糖是一种源自革兰氏阴性细菌的促炎分子,它会通过肠腔进入血液。
这一假设与肥胖症中所报道的拟杆菌门丰度下降的情况并不相符,因为该门是肠道微生物群中革兰氏阴性菌的主要群体。
这种差异可以通过这样的事实来解释:来自拟杆菌门细菌的脂多糖的内毒素活性被认为低于来自其他革兰氏阴性细菌(例如属于变形菌门的细菌)的内毒素活性。有趣的是,在肥胖受试者或动物中也观察到变形菌门的增加,并且在无菌小鼠中施用变形菌门成员肠杆菌会导致这些动物出现肥胖和胰岛素抵抗。
✦ F/B比率增加与短链脂肪酸产生无关
另一方面,厚壁菌门/拟杆菌门比例的增加与肥胖个体中观察到的短链脂肪酸产生无关。事实上,据报道,拟杆菌门主要产生乙酸和丙酸,而厚壁菌门则产生更多的丁酸。丁酸盐被认为是一种促进健康的分子,因为它具有增加胰岛素敏感性、发挥抗炎活性、调节能量代谢和增加瘦素基因表达的能力。
结肠中的丙酸盐刺激L-肠内分泌细胞释放GLP-1和 PYY,从而抑制食欲。它还可能到达门静脉循环,主要被肝脏捕获,参与肝糖异生并减少参与脂肪酸和胆固醇从头合成的酶的表达。
乙酸也被吸收并到达全身循环和周围器官,包括脂肪组织、肌肉和大脑。在肝脏中,与丙酸盐相反,它刺激肝脏合成脂质,导致血脂异常。在大脑中,它激活副交感神经系统,分别促进胰腺和胃粘膜分泌胰岛素和生长素释放肽。
这些事件会导致脂肪储存和食欲增加,从而导致肥胖。根据这些结果,醋酸盐通常被认为更容易导致肥胖。肥胖个体中厚壁菌门/拟杆菌门比例的增加意味着这些受试者中丁酸盐的产量较高,丙酸盐和乙酸盐的产量较低,这一发现与这些短链脂肪酸各自的抗肥胖和致肥胖作用部分矛盾。一种解释是,肥胖个体中产生丁酸的细菌减少,并逐渐被属于同一门的其他细菌取代,导致结肠腔中丁酸的产生量降低。例如,葡萄球菌属和罗伊氏乳杆菌的丰度增加(均来自厚壁菌门)
肥胖状态还与A. muciniphila (疣微菌门)丰度较低有关,这是一种粘蛋白降解细菌,有助于稳定肠道屏障功能、分泌抗菌肽和控制炎症。
✦生理及病理状况都会影响肠道微生物群
另一方面,性别、年龄、宿主遗传学的差异。男性和女性的肠道微生物群存在差异,例如男性中拟杆菌-普雷沃氏菌群的水平较高,而女性中厚壁菌门的比例较高。然而,个别研究也发现女性中拟杆菌门的丰度最高。
此外,存在病理状况(糖尿病、心血管疾病、炎症性肠病等)。例如,Oddi括约肌松弛与胆管结石有关,可能是由于肠内容物回流增强改变了微环境所致。
治疗(抗生素、二甲双胍等)通过富集Akkermansia muciniphila以及几种产生短链脂肪酸的微生物群(丁酸弧菌、两歧双歧杆菌等)来改变肠道微生物群组成。
总之,这些导致厚壁菌门/拟杆菌门比率并不是与肥胖相关的微生物群失调的有力标志。
我们建议与肥胖相关的肠道微生物组研究不应该研究肥胖本身的分类标志物,而应侧重于确定用于将患者分层为亚组的分类标志物。引入微生物组患者分层将通过直接操纵患者微生物组来制定个性化治疗决策,从而改善肥胖的管理。
炎症性肠病代表小肠和大肠炎症反应引起的肠道疾病,由两种疾病组成:克罗恩病(CD)和溃疡性结肠炎(UC)。
溃疡性结肠炎是由结肠和直肠(从大肠末端开始到肛门结束的腔室)的长期炎症引起的,而克罗恩病是由结肠或回肠(小肠的最后部分)或两者的长期炎症引起的。
✦ 炎症性肠病患者厚壁菌门丰度下降
肠道微生物群会导致这些疾病。具体来说,当厚壁菌门减少或拟杆菌门相对于厚壁菌门增加时(两种情况下肠道菌群失调),就会导致慢性炎症和消化系统疾病,如克罗恩病和溃疡性结肠炎。
一项研究检查了克罗恩病和溃疡性结肠炎患者以及健康对照活检组织中的微生物多样性。观察到厚壁菌门丰度下降;更准确地说,克罗恩病患者中梭状芽胞杆菌类细菌减少,但溃疡性结肠炎患者或健康个体中则没有减少。
相反,与溃疡性结肠炎患者和健康个体相比,克罗恩病患者的拟杆菌丰度显著增加(分别为74.97%、64.31%和67.41%)。
✦肠道微生物变化与炎症性肠病严重程度相关
肠道微生物群的变化也与克罗恩病和溃疡性结肠炎的疾病活动度和严重程度相关。例如,与患有非活动性疾病的患者相比,患有活动性疾病的溃疡性结肠炎患者中厚壁菌门的含量较低。同样,与患有非侵袭性疾病的克罗恩病患者相比,患有侵袭性疾病的克罗恩病患者的厚壁菌门丰度显著降低。
具有抗炎作用的普氏粪杆菌减少
普氏粪杆菌(F. prausnitzii)是一种厚壁菌门物种,在炎症性肠病患者中减少,其减少与克罗恩病术后六个月复发相关。
普氏粪杆菌在体内和体外均表现出抗炎作用。在患有诱导性结肠炎的小鼠中,活普氏粪杆菌(或其上清液)降低了结肠炎的严重程度并纠正了生态失调。此外,普氏粪杆菌对血液单核细胞的体外刺激导致IL-10分泌增加以及IL-12和干扰素-γ(IFN-γ)分泌减少。
拟杆菌在炎症性肠病中增加
相比之下,拟杆菌在炎症性肠病中通常会增加,并与其进展和发展相关。对炎症性肠病患者和健康个体肠道炎症和非炎症区域的粘膜活检显示,炎症性肠病样本中厚壁菌门减少,拟杆菌门丰度增加,而肠杆菌科仅在克罗恩病患者中增加。活检还显示,与非发炎区域相比,发炎区域的细菌失调程度更高。
另一项对克罗恩病和溃疡性结肠炎患者进行粘膜活检和粪便菌群构成的研究证明了肠道微生物群和 F/B 比率的改变。克罗恩病和溃疡性结肠炎患者的F/B比值均较对照组显著降低。
此外,种、属和科的组成也发生了变化。与克罗恩病患者和对照组相比,溃疡性结肠炎患者中拟杆菌和乳酸菌的丰度较高;与对照组相比,溃疡性结肠炎患者中大肠杆菌的丰度也有所增加。相反,克罗恩病患者中球状梭菌减少。
✦ 不同拟杆菌种类与不同炎症性肠病程度相关
不同的拟杆菌与不同程度的炎症性肠病相关。在经过抗生素预处理且存在转化生长因子(TGF)βRII和IL-10R2信号传导缺陷的小鼠系中,在用普通拟杆菌和多形拟杆菌灌胃后观察到严重的溃疡性疾病。
与显示 F/B 比率对肥胖影响不大的研究类似,并不是在所有炎症性肠病病例中都观察到 F/B 比率降低。炎症性肠病患者粪便微生物分析显示,拟杆菌门、厚壁菌门和疣微菌门的丰度下降,而变形菌门、放线菌门和梭杆菌门的丰度增加。在48名克罗恩病患者中,粪便样本中的拟杆菌细菌丰度不到健康个体的10%,梭菌亚群 XIVab(厚壁菌门)也显著降低。
然而,大多数研究表明,拟杆菌因内毒素而表现出促炎特性,并影响细胞因子的产生,从而导致炎症性肠病。此外,厚壁菌门细菌具有抗炎作用,可以缓解炎症性肠病的进展。
2型糖尿病(T2DM)是一种代谢性疾病,其主要原因是与肥胖相关的胰岛素抵抗。然而,其他一些因素,如精神压力、感染和遗传倾向也可能导致糖尿病。
肥胖和糖尿病的特征都是慢性低度炎症状态,并伴有多种炎症介质(例如肿瘤坏死因子和白细胞介素)的异常表达和产生。
最近的研究基于大规模16S rRNA 基因测序、定量实时PCR (qPCR) 和荧光原位杂交 (FISH),显示了肠道微生物群组成与糖尿病等代谢疾病之间的关系。
有人提出,肠道微生物群引导增加肠道对单糖的摄取,并指示宿主增加肝脏产生与胰岛素抵抗相关的甘油三酯。
✦ 2型糖尿病患者中产丁酸厚壁菌门丰度降低
权威研究显示主要的丁酸盐合成菌厚壁菌门在2型糖尿病患者中显著减少。多项人体研究支持这样一个事实:与健康受试者相比,2型糖尿病受试者中合成丁酸的厚壁菌门丰度显著降低。
对这些患者的粪便微生物群分析显示,与正常耐糖受试者相比,新诊断或长期患有糖尿病的受试者中瘤胃球菌科和毛螺菌科等科的丰度有所下降。
还报告了罗氏菌属(Roseburia)和普拉梭菌(Faecalibacter prausnitzii)的丰度在健康对照中比2型或1型糖尿病患者更高。
对粪便样本进行深入的宏基因组学和宏蛋白质组学分析证实,在患有糖尿病前期 (Pre-DM) 或初治2型糖尿病 (TN-T2D) 的个体中,产生丁酸盐的菌含量显著降低。与正常耐糖个体相比, 患有糖尿病前期个体中的普拉梭菌的水平低于正常耐糖个体和初治2型糖尿病个体。
肠道微生物组可以反映整个身体的健康状况。厚壁菌门和拟杆菌门是结肠的主要门,可以影响与肥胖相关的疾病,这些疾病也是乳腺癌的危险因素。
✦ 乳腺癌患者F/B比值比健康人群低很多
因此,研究对乳腺癌患者和健康对照者的血清中提取细菌细胞外囊泡,使用微生物组测序分析厚壁菌门和拟杆菌门。分析乳腺癌的预后因素和血清学检测结果与 F/B 比值的相关性。发现乳腺癌患者的 F/B 比值比健康对照者低三倍。
此外,乳腺癌的危险因素,如空腹血糖,被发现与F/B比值有关。F/B比值可以作为乳腺癌的危险因素,并可能作为解释影响乳腺癌发生的潜在机制的线索之一。
健康对照者和乳腺癌患者中 F/B 的比率
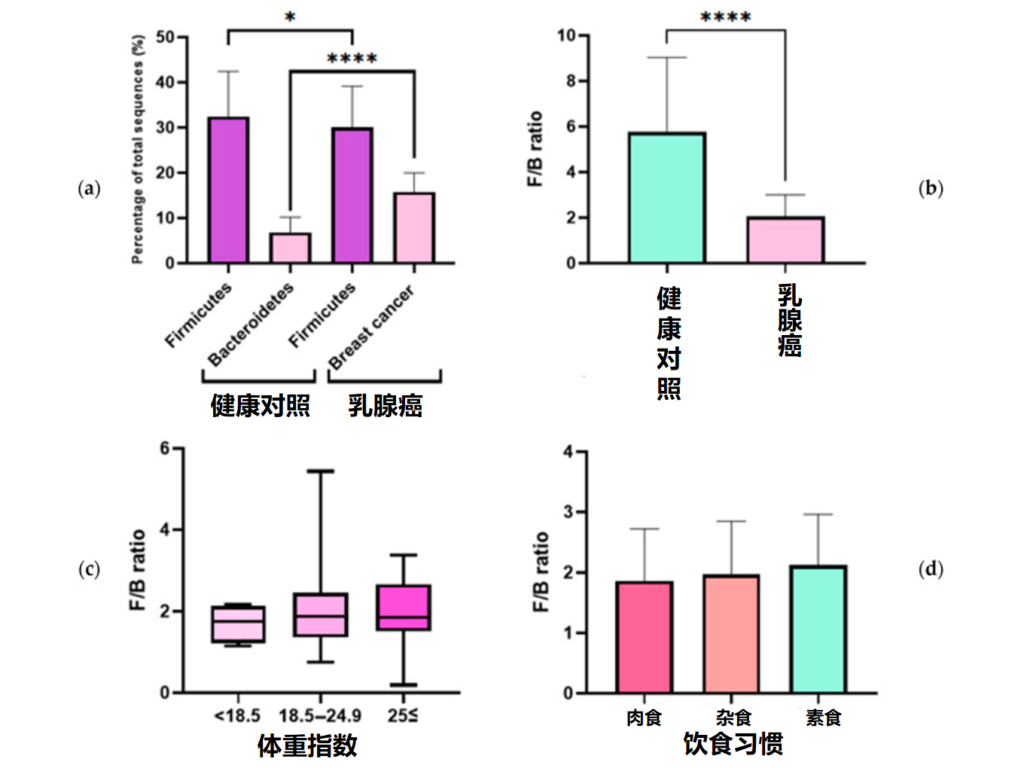
An J,et al.J Clin Med.2023
(a)健康对照组和乳腺癌患者中厚壁菌门和拟杆菌门占总微生物群的比例;(b)健康对照者和乳腺癌患者的F/B比率;(c)F/B比与体重指数之间的关系;(d)F/B比与饮食习惯的关系(*p≤0.05,**** p≤0.0001)。
调查研究发现中国饮食中的动物脂肪和蛋白质含量高于印度饮食中的全谷物和植物性素食。而印度参与者微生物组中拟杆菌的比例几乎是中国参与者的四倍,分别为16.39%和4.27%(p=0.001)。
✦ 动物产品食用较少与拟杆菌数量较多有关
据推测,印度人体内拟杆菌门的丰度较高是由于他们对动物产品的消耗较少;表明饮食中动物产品含量较低与拟杆菌数量较多有关。
对欧洲儿童和布基纳法索儿童的微生物群的比较也显示了由于饮食习惯不同而导致的微生物群组成的差异,欧洲儿童的饮食富含动物蛋白、糖、淀粉和脂肪,纤维含量低。以素食为主的饮食主要由碳水化合物、纤维和非动物蛋白组成。欧洲儿童微生物组富含厚壁菌门和变形菌门,而放线菌门和拟杆菌门在非洲儿童中较多。
✦ 营养不良儿童的肠道微生物多样性较低
研究发现,与同一地区中高收入家庭的健康儿童相比,孟加拉国贫困社会经济地位家庭的营养不良儿童的肠道微生物群多样性较低,其特点是拟杆菌门的相对丰度较低,变形菌门占主导地位。
注:拟杆菌门的存在率较低众所周知,它们可以消化复杂的膳食材料,从而提高从各种食物中提取能量,而潜在致病性变形菌的较高含量可能有助于解释营养不良儿童的健康状况不佳。
✦ 增加纤维摄入量可以增加厚壁菌门的数量
一项研究将西方饮食的美国儿童与食用大米、面包和扁豆等植物性饮食的孟加拉国儿童进行了比较。在食用西方饮食的美国儿童中,厚壁菌门/拟杆菌门的比例减少了三倍。
另一项研究要求参与者增加纤维摄入量并避免西方减肥食品。研究表明厚壁菌门:拟杆菌门比率增加了。
通过分析三名健康受试者6-12个月的肠道宏蛋白质组,进一步证实了这些结果。在这项研究中,参与碳水化合物运输和代谢的蛋白质占检测到的蛋白质的10%以上,构成了所有测试对象中发现的核心宏蛋白质组的一部分。
糖酵解途径尤其引人注目,并鉴定出几种相关酶。在为每个门的每个COG功能类别分配光谱命中后,很明显,厚壁菌门和放线菌门负责活跃的碳水化合物代谢,而拟杆菌门则显示出更多的混合功能。
这些例子反映了将某些门与特定饮食广泛联系起来主要挑战是需要考虑涵盖整个微生物组的微生物的状态和相互作用动态。
✦ 当F/B比率增加时
即更多厚壁菌门,拟杆菌较少。或两者兼而有之,厚壁菌门增长更快。可能导致以下疾病:
-肥胖(BMI较高)
-高血压中的肠道菌群失调
-自闭症谱系障碍
-慢性疲劳综合症
-肠易激综合症
-干燥综合症
-类风湿性关节炎
✦当F/B比率下降时
即厚壁菌门较少,更多拟杆菌。或两者兼而有之,厚壁菌门减少得更快。可能导致以下疾病:
-系统性红斑狼疮
-乳糜泻
-克罗恩病
-老龄化
我们审查评估了饮食干预如何影响微生物组成的相关文章。总体而言得出以下建议供参考:
✦ 增加植物蛋白摄入,避免摄入过量动物蛋白
总体而言,蛋白质摄入量,尤其植物蛋白的摄入与肠道拟杆菌门,细菌多样性呈正相关。乳清和豌豆蛋白可以增加双歧杆菌和乳酸菌的数量,而乳清还可以减少脆弱拟杆菌和产气荚膜梭菌的数量,这两种细菌都是致病性的。
此外,豌豆蛋白被发现可以增加短链脂肪酸水平,短链脂肪酸被认为具有抗炎作用,并在粘膜完整性中发挥作用。然而,一项研究发现,高动物蛋白/低碳水化合物饮食会导致罗氏菌属和直肠真杆菌(这两种有益细菌)减少。动物蛋白可能含有大量脂肪,而脂肪也会影响肠道微生物群。
✦ 尽量摄入不饱和脂肪
当研究人员观察脂肪时,发现并不是所有的脂肪都是平等产生的。在一项研究中,小鼠被喂食猪油或鱼的脂肪。喂猪油的小鼠中拟杆菌属和嗜胆菌属(Bilophila)增加,而双歧杆菌和Adlercreutzia、乳酸菌(乳杆菌和链球菌)和疣微菌属(Akkermansia muciniphila)在鱼油喂养的小鼠中增加。
猪油喂养的小鼠还出现白色脂肪组织炎症和胰岛素敏感性受损。喂食鱼油的小鼠总体表现更好,研究人员得出结论,肠道微生物群促进了高饱和脂肪饮食的整体炎症反应。
✦ 高纤维的饮食可以减少炎症
碳水化合物,包括可消化的(淀粉和糖)和不可消化的(纤维),可能是研究最多的常量营养素,因为它们具有改变肠道微生物组的能力。
人类喂食大量葡萄糖、果糖和蔗糖,双歧杆菌水平增加,拟杆菌减少。相反,当喂食糖精(一种人工甜味剂)时,拟杆菌丰度增加,罗伊氏乳杆菌减少,微生物发生与天然糖完全相反的变化。
纤维被认为是一种不易消化的膳食成分,有时被称为益生元,因为它通过刺激有益肠道细菌的生长而对宿主有益。
来源包括大豆、菊粉、未精制的小麦和大麦、生燕麦和不可消化的低聚糖,例如果聚糖、聚葡萄糖、低聚果糖 (FOS)、低聚半乳糖 (GOS)、低聚木糖 (XOS) 和阿拉伯低聚糖 (AOS)。
低纤维饮食与较低的细菌丰度有关,而富含这些不易消化的碳水化合物的饮食会增加双歧杆菌和乳酸杆菌。较高的纤维摄入量导致促炎细胞因子IL-6和胰岛素抵抗减少。
✦ 发酵食品可以增加双歧杆菌和乳杆菌水平
除了常量营养素和纤维对肠道细菌的影响外,含有乳酸菌的发酵食品(例如发酵乳制品)也被发现可以增加双歧杆菌和乳酸杆菌的水平。
✦ 多酚具有抗氧化活性能够减少一些致病菌
最后但并非最不重要的是多酚,包括儿茶素、黄酮醇、黄酮、花青素、原花青素和酚酸(存在于水果、种子、蔬菜、茶、可可制品和葡萄酒等食品中),被发现可以增加拟杆菌,减少金黄色葡萄球菌、鼠伤寒沙门氏菌和梭菌等致病菌。
拟杆菌门的成员被假设可以降低细胞内的氧水平,从而有利于厌氧菌的生长,从而促进肠道平衡的维持,并且它们被认为是关键的聚糖降解细菌比厚壁菌门等其他类群更能代谢多酚。
多酚可以改变肠道环境,它们可以被肠道细菌分解代谢,将它们转化为多种化合物比原始化合物具有更强的抗氧化活性。
厚壁菌门/拟杆菌门(F/B比率)作为一个指标在很多关于肠道菌群的研究中被提及和表征,从疾病发生进展,到药物饮食干预,涉及肠道菌群的研究,首先会描述细菌门水平的变化,而人类或动物肠道细菌约90%都属于厚壁菌门与拟杆菌门,而它们的比率也被认为是肠道菌群动态平衡的标志。
拟杆菌门主要为革兰氏阴性菌,能激活T细胞介导的免疫反应,降解多糖保护肠道和其他病原菌,厚壁菌门主要为革兰氏阳性菌,尤其产丁酸的菌,但是更容易吸收能量。
但是肠道菌群受到抗生素,药物,年龄以及分析注释数据库等的影响,此外随着肠道菌群研究队列的扩大,以及对菌群构成与不同疾病状态和药物饮食等因素的相关性研究的深入,F/B比率作为一个相对粗放的指标已经无法准确反映复杂的肠道菌群状况。我们需要更加深入和全面的通过菌属甚至菌种的构成变化来解释和分析肠道菌群特征,并进而更准确的解释肠道菌群和健康及生活方式的关联。
主要参考文献
Stojanov S, Berlec A, Štrukelj B. The Influence of Probiotics on the Firmicutes/Bacteroidetes Ratio in the Treatment of Obesity and Inflammatory Bowel disease. Microorganisms. 2020 Nov 1;8(11):1715.
Mariat D, Firmesse O, Levenez F, Guimarăes V, Sokol H, Doré J, Corthier G, Furet JP. The Firmicutes/Bacteroidetes ratio of the human microbiota changes with age. BMC Microbiol. 2009 Jun 9;9:123.
Gui X, Yang Z, Li MD. Effect of Cigarette Smoke on Gut Microbiota: State of Knowledge. Front Physiol. 2021 Jun 17;12:673341.
Grigor’eva IN. Gallstone Disease, Obesity and the Firmicutes/Bacteroidetes Ratio as a Possible Biomarker of Gut Dysbiosis. J Pers Med. 2020 Dec 25;11(1):13.
Vaiserman A, Romanenko M, Piven L, Moseiko V, Lushchak O, Kryzhanovska N, Guryanov V, Koliada A. Differences in the gut Firmicutes to Bacteroidetes ratio across age groups in healthy Ukrainian population. BMC Microbiol. 2020 Jul 22;20(1):221.
Indiani CMDSP, Rizzardi KF, Castelo PM, Ferraz LFC, Darrieux M, Parisotto TM. Childhood Obesity and Firmicutes/Bacteroidetes Ratio in the Gut Microbiota: A Systematic Review. Child Obes. 2018 Nov/Dec;14(8):501-509.
Hidalgo-Cantabrana C, Delgado S, Ruiz L, Ruas-Madiedo P, Sánchez B, Margolles A. Bifidobacteria and Their Health-Promoting Effects. Microbiol Spectr. 2017 Jun;5(3).
An J, Kwon H, Kim YJ. The Firmicutes/Bacteroidetes Ratio as a Risk Factor of Breast Cancer. J Clin Med. 2023 Mar 13;12(6):2216.

谷禾健康
健康的肠道微生物群特点是氧气含量低,并且存在大型专性厌氧菌细菌群落,这些共生菌通过限制肠道病原体的扩张为宿主提供益处。
那么是什么导致肠道健康走下坡路,是什么原因引起肠道菌群失调,在科学界一直有2种观点:
■ 一种是“营养生态位假说”
大肠内多种微生物的共存要求群落中的每个成员,都能够比所有其他成员在少数有限资源条件下,能更快地生长。
■ 另外一种是“氧气假说”
氧气增加将中断或抑制厌氧菌群的生长繁殖,同时导致将赋予兼性厌氧菌甚至需氧菌生态选择优势,使它们变得更具竞争力并可能过度生长。相反,对氧气敏感并因其存在而受到伤害的专性厌氧菌将处于不利地位。
当我们有肠道炎症时会发生什么?
上皮细胞,即肠道内的细胞,开始发炎,它们开始将氧气泄漏到肠道中。当这种情况发生时,许多机会性病原体如大肠杆菌、沙门氏菌和肠球菌属(Enterococcus)等喜欢氧气的菌,可以在有氧条件下利用氧气作为电子受体代替其他代谢途径,从而获得更多的能量和生长优势。
在不同的慢性疾病中,常常观察到兼性厌氧菌的过度生长,这些微生物可以在氧气存在时使用它们,并且会“竞争”,消耗其他有益微生物所需的营养物质,包括一些对维持肠道屏障非常重要的产丁酸菌,如毛螺菌科、梭状芽孢杆菌、真杆菌属、罗氏菌属、普拉梭菌等,导致肠道菌群失衡,从而引起多种消化系统问题和慢性疾病。
人体需要氧气才能生存。几乎人体内的每个细胞都需要氧气。
然而地球上大部分微生物却不能很好地耐受氧气,例如肠道的大多数微生物细胞在缺氧的环境中才可以茁壮成长。在健康状态下,结肠是一个低氧环境。如果肠道状态受到干扰,比如使用抗生素,发炎,氧气泄漏到肠道中,它会加剧细菌失衡和炎症,从而开始肠道生态失调、细胞处理能量饥饿和炎症的恶性循环中。
本文我们将重点讨论氧气与肠道菌群失调之间的联系,并分享总结氧气对肠道治疗的潜在影响。
# 1
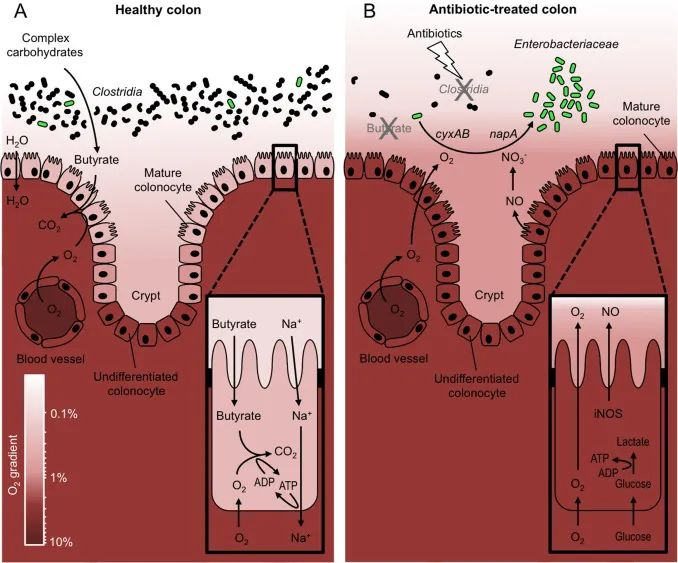
健康的人类结肠含有估计超过30万亿个细菌细胞,这些细菌很重要,可以分解复杂的碳水化合物,蛋白质等,产生重要的肠道代谢物(如短链脂肪酸)等。然而这些细菌中大部分只能在缺氧的环境中生长和繁殖,属于专性厌氧菌。
婴儿时期,低氧环境利于专性厌氧菌定植
在婴儿的“经典”定植模式中,第一步涉及兼性厌氧菌,例如大肠杆菌(Escherichia coli)和肠球菌(Enterococcus)。
兼性厌氧菌在胃肠道的定植发生在,出生后立即发生氧化还原电位 (简称Eh) 高或呈阳性的肠道环境中。兼性厌氧菌的增加导致可用氧的消耗,从而产生一个氧气减少的环境,有利于出生后几天内专性厌氧菌的到来。然后,与氧气浓度相关的 Eh 降低到一个低水平,类似健康成人的肠道那样。
氧化还原状态通过创造抑制竞争者和潜在肠道病原体的生理环境来参与抵抗肠道定植。未经处理的小鼠大肠中的 Eh 约为 -200 mV。用链霉素处理后,脂肪酸水平下降,氧化还原态变为 +200 mV,同时沙门氏菌数量增加。
健康成人的肠道内:大量专性厌氧菌
在健康成人中,胃肠道远端的特点是低氧张力,通常含有大量专性厌氧菌群落:
大部分胃肠道的细菌在体外很难或还没有被培养出来,部分原因是它们的厌氧或对氧气的敏感性,及时培养出来的也需要长时间和费力的技术。
在过去的几十年中,健康人肠道微生物群的组成已经通过独立于培养的技术进行了探索,并通过测序分析进一步描述,在大人群水平的微生物群中鉴定出超过 20个门。两个主要的门,厚壁菌门和拟杆菌门,占肠道细菌的 90%,主要是专性厌氧菌。
在较低的分类学水平上,一个个体通常存在多达一千种。在个体间变异中,个体间共享的物种少于 60 种。这些物种代表了核心肠道微生物群。
肠道核心菌属
人体肠道菌群中的核心菌属是指在不同人群中普遍存在、数量相对较高、对人体健康具有重要作用的菌属。
目前对于核心菌属的定义还没有统一标准,但一般认为核心菌属应该具备以下特征:
1. 在不同人群中普遍存在:核心菌属应该在不同人群中都能够被检测到,而不是仅存在于某些特定人群中。
2. 数量相对较高:核心菌属应该在肠道菌群中占据较高的比例,而不是仅占据极小的比例。
3. 对人体健康具有重要作用:核心菌属应该对人体健康具有重要作用,如参与食物消化、维持肠道屏障功能、调节免疫系统等。
谷禾健康基于庞大的60万人肠道菌群检测样本数据,给出了人体肠道菌群核心菌属的标准:
在90%人群检出,人群平均丰度1%以上的菌属为核心菌属(双歧杆菌和乳杆菌作为益生菌相对丰度低于1%但是重要性很高)。
核心菌属及有益菌累加占总肠道菌群比例低于60%就可能出现肠道菌群紊乱。
# 2
现在,“肠道菌群失调”通常是指肠道微生物群的状态改变,一般与疾病有关。在肠道生态失调期间观察到的最一致和最强大的生态模式可能是属于变形菌门的兼性厌氧细菌的扩张。
变形菌门是人类肠道中常见的五种主要细菌门之一。它包括多种属,包括埃希氏菌属、志贺氏菌属、沙门氏菌属、螺杆菌属、弧菌属、耶尔森氏菌属、假单胞菌属、弯曲杆菌属和脱硫弧菌属,其中大多数被认为是机会性病原体。
关于变形菌门详见:
氧气的存在使变形菌门有了生存优势
在平衡的生态系统中,低丰度时无害的微生物,但当环境变得特别适合它们的生长时,它们会迅速扩散并引起问题。
导致变形杆菌快速扩张的一个环境因素是——氧气。大多数变形菌是兼性厌氧菌,这意味着它们可以在氧气存在的情况下生存和繁殖。这使它们在含氧环境中比有益的专性厌氧菌具有显着的竞争优势。
变形菌扩张的同时,产丁酸菌减少
值得注意的是,变形杆菌的扩张几乎总是伴随着产丁酸盐细菌丰度的减少。高变形菌和低产丁酸菌这种组合,是微生物群失调特征,并与许多慢性疾病有关,包括:炎症性肠病、肠易激综合症、结直肠癌、憩室炎、组胺不耐受、2 型糖尿病、肥胖等。
这个特征还表明,存在潜在的上皮功能障碍,这个后面会讲到。
# 3
专性厌氧菌产生的一种代谢物是丁酸盐。丁酸盐是这些细菌在结肠中代谢膳食纤维时产生的短链脂肪酸之一。我们之前写过丁酸盐对健康的好处,包括它能够减轻神经炎症、预防结肠癌和帮助维持肠道屏障功能。
丁酸盐给结肠细胞提供能量,该过程耗氧量大,由此导致的低氧对维持肠道稳态很重要
在健康的肠道中,丁酸盐提供结肠细胞所需能量的大约 70%。这些结肠细胞排列在结肠上,形成肠道屏障。被结肠细胞摄取后,丁酸盐和其他短链脂肪酸通过β 氧化途径在线粒体中分解。该过程使用大量氧气。事实证明,这种结肠细胞耗氧量对于维持肠道稳态非常重要。
2015 年,科罗拉多大学研究小组证明,丁酸盐的肠道代谢是维持结肠“生理性缺氧”所必需的。通过一系列实验,他们证明了丁酸盐以及较小程度上的短链脂肪酸丙酸盐和乙酸盐会耗尽结肠细胞中的氧气水平。低氧导致缺氧诱导因子 (HIF)的蛋白质稳定,它在细胞中充当一种“氧传感器”。
氧气含量高低如何影响HIF?
当氧气水平低时,HIF 会促进有助于协调肠道屏障保护的基因的表达。如果氧气水平升高,HIF 将不再稳定,这些肠道保护基因将不再表达。
抗生素是否会影响缺氧,从而影响肠道屏障?
研究人员仅使用三天广谱抗生素后,丁酸盐水平急剧下降,肠道含氧量上升,上皮缺氧状态消失。氧气传感器 HIF 不再稳定,肠道保护基因不再表达,导致肠道屏障功能丧失。
这不仅仅是因为缺乏纤维(纤维是生产丁酸盐的基质),抗生素治疗小鼠的肠道菌群,完全丧失了从膳食可发酵纤维中产生丁酸盐或其他短链脂肪酸的能力。不过好在他们又发现,补充丁酸盐能够挽救“生理性缺氧”,修复肠道屏障功能。
# 1
上皮细胞是排列在肠道壁上的细胞,是宿主与微生物通讯的主要界面。
正常代谢过程,正反馈循环维持稳态
当肠道健康且处于体内平衡状态时,结肠细胞主要通过利用大量氧气的过程代谢丁酸等脂肪酸。由此导致的肠道粘膜缺氧有助于维持以专性厌氧菌为主的肠道微生物群。
这些专性厌氧菌反过来通过将纤维发酵成短链脂肪酸(如丁酸盐)来促进健康,短链脂肪酸被结肠上皮细胞吸收。这种正反馈循环可维持肠道健康状态。
异常:结肠细胞从其他途径获取能量带来的问题
然而,当干扰使结肠上皮细胞的代谢远离脂肪酸的 β 氧化时,系统就会崩溃。能量匮乏的结肠细胞必须寻找其他能量来源,最终从血液中提取葡萄糖并将其发酵成乳酸,这个过程不使用氧气。由此产生的炎症也会导致硝酸盐的产生增加。由于没有其他地方可去,氧气、乳酸盐和硝酸盐会“泄漏”到肠道粘膜中。
那么氧气泄露到肠道粘膜后会发生什么呢?
这种变化有利于变形杆菌门中的病原体茁壮成长。例如沙门氏菌、克雷伯氏菌、柠檬酸杆菌和大肠杆菌,它们可以耐受氧气并依靠乳酸和硝酸盐。
同时,结肠的氧合作用抑制了专性厌氧菌的生长,包括非常重要的产丁酸菌。换句话说,“结肠细胞的新陈代谢充当肠道微生物群的控制开关,调节群落在稳态和失调之间的转变。”
兼性厌氧菌:有氧也可以生长,包含许多肠道病原体,引发炎症
健康的结肠还可能含有少量兼性厌氧菌,它们能够在有氧或无氧环境中生长和繁殖。兼性厌氧菌包括许多肠道病原体。健康肠道的低氧浓度和丰富的专性厌氧菌都会抑制这些兼性厌氧菌的生长。
所以一般来说,兼性厌氧菌往往更容易发炎,所以它们往往会给肠道带来压力,引起炎症、结肠上皮细胞缺氧,肠道通透性增加,并且还会直接使肠道上皮细胞发炎,然后导致肠道产生更多的氧气。
病原菌破坏肠道菌群,继续扩张,形成恶性循环
因此,这些病原体几乎可以破坏肠道新陈代谢,为自己提供生存所需的底物,开始扩张,然后形成了一个恶性循环。兼性厌氧菌大多数都属于变形菌门,特别是肠杆菌科在这种氧气泄漏增加的情况下最常见,如在IBD中那样,潜在有害的变形菌,尤其是肠杆菌科的大量繁殖,也就是增强炎症反应。一些粘附侵入性大肠杆菌 (AIEC) 在 IBD 发病机制中发挥重要作用(关于IBD中肠道菌群变化与氧气相关在后面章节有详细介绍)。
这些观察结果表明变形杆菌的生态失调扩张是肠道菌群失调和上皮功能障碍的潜在诊断微生物特征。
# 2
抗生素介导的肠道微生物群破坏,会增加感染沙门氏菌引起的胃肠炎的风险,它会增加患者肠道携带沙门氏菌血清型的持续时间,并且偶尔会导致复发。
使用一种特殊的染色技术,有研究人员证明,抗生素治疗增加了结肠细胞的氧合作用并导致肠道粘膜缺氧的丧失(也就是说进去了些氧气)。这种缺氧丧失导致沙门氏菌和其他兼性厌氧菌在氧气驱动下扩张。
链霉素 -> 肠道菌群破坏 -> 兼性厌氧菌扩张
链霉素介导的小鼠肠道菌群破坏,与兼性厌氧肠杆菌科(例如共生大肠杆菌)或致病性肠沙门氏菌不受控制的扩张有关。
注:实验室特别选择了链霉素,因为它在消除梭状芽孢杆菌方面特别有效,这样他们就可以研究丁酸盐消耗对结肠代谢的影响。链霉素通常不用于人体口服;然而,已知许多其他广谱抗生素会影响产生丁酸盐的细菌,因此 1-2 周的其他抗生素疗程可能也会通过相同的机制促使氧气泄漏到肠道中。
链霉素治疗 -> 耗尽产短链脂肪酸菌 -> 短链脂肪酸降低
链霉素治疗,优先耗尽肠道相关微生物群落中属于梭状芽胞杆菌纲(Clostridia)的细菌。链霉素处理后恢复定植抗性的尝试表明,转移梭状芽胞杆菌(Clostridia)在防止小鼠肠道内共生大肠杆菌扩张方面最有效。
梭状芽胞杆菌是肠道相关微生物群落中短链脂肪酸的重要生产菌。链霉素治疗与大肠中短链脂肪酸浓度的显着降低有关。由于短链脂肪酸可在体外阻碍大肠杆菌或肠道沙门氏菌(S. enterica)的生长,因此有人提出短链脂肪酸这些代谢物的存在,通过代谢排斥限制了大肠中肠杆菌科的生长。
也有人认为,短链脂肪酸的代谢排斥不足以解释问题
然而,有的研究者认为,短链脂肪酸的代谢排除,无法解释共生肠杆菌科在健康个体中保持低丰度,因为过多的抑制物会导致它们被消除,而过少的抑制物会导致它们的扩张,直到另一种资源变得有限。将肠杆菌(Enterobactericeae)维持在恒定的低水平需要持续保持一种精确的抑制剂浓度,这与体内发生的短链脂肪酸浓度波动不相容。
一个更强大的抗定植概念框架:营养生态位假说
它提出大肠内多种微生物物种的共存,要求群落中的每个成员都能够比所有其他成员在少数有限资源上更快地生长。
为了解释抗生素治疗后肠杆菌科不受控制的扩张,营养生态位假说预测,抗生素介导的肠道微生物群破坏,增加了通常限制肠杆菌科生长的关键资源的可用性。
因此,要了解定殖抗性,揭示此类有限资源的特性,并阐明抗生素处理后它们的丰度升高的原因至关重要。
抗生素介导的肠道菌群消耗,增加了唾液酸和岩藻糖的可用性
肠道相关微生物群落中的糖分解细菌可以从复杂的碳水化合物中释放出这些糖分,并随后消耗它们。链霉素治疗提高了唾液酸和岩藻糖的可用性,这有助于链霉素治疗小鼠肠腔扩张。
链霉素处理后在小鼠盲肠粘膜中观察到的另一个变化是,诱导型一氧化氮合酶(iNOS)的合成增加,一种宿主酶,可催化l-精氨酸产生一氧化氮 (NO)。
源自一氧化氮的活性氮物种可以氧化单糖,例如半乳糖和葡萄糖,分别产生葡糖二酸和半乳糖二酸,这在链霉素处理的小鼠的生长过程中赋予大肠杆菌和鼠伤寒沙门氏菌的管腔适应性优势。
总的来说,这些数据表明糖是肠道中的关键资源,但目前尚不清楚为什么肠杆菌科在这些有限资源上,比肠道微生物群的所有其他成员生长得更快。
最近的数据表明,肠杆菌科可以在可用碳源上生长得更快,因为抗生素介导的微生物群落破坏,通过改变宿主生理学提高了呼吸电子受体的可用性。
在这方面特别重要的一种微生物代谢物是短链脂肪酸丁酸盐。肠道微生物群通过乙酰辅酶 A 途径、戊二酸途径、4-氨基丁酸途径或赖氨酸途径产生丁酸,编码这些途径的大多数细菌都是梭状芽胞杆菌纲的成员。
丁酸盐是结肠细胞的重要能量来源。结肠的主要功能是通过吸收钠 (Na + )产生渗透梯度来吸收水分。Na +通过位于表面结肠细胞顶膜中的通道沿着电化学梯度扩散,然后被位于其基底外侧膜中的 Na +泵(Na + K + ATP 酶)主动挤出。

DOI: 10.1016/j.freeradbiomed.2016.09.022
表面结肠细胞激活 Na+ 所需的 ATP运输来自微生物群衍生的丁酸盐氧化成二氧化碳 (CO2)。这种新陈代谢消耗大量氧气,从而使表面结肠细胞缺氧,这对应于小于 7.6 mmHg(<1% 氧气)的氧分压 (pO2)。相比之下,含氧量正常的宿主组织的 pO2在 23 和 70 mmHg 之间(即含氧量在 3% 和 10% 之间)。
# 3
某些病原体也可能利用这种结肠细胞转换在肠道中获得竞争优势。如果你曾经因急性食物中毒而倒下,之后又出现肠道健康问题,这可以解释原因。
在前面中提到的某些沙门氏菌菌株(特别是肠沙门氏菌血清型鼠伤寒沙门氏菌,以下缩写为S. Tm)可以操纵宿主上皮细胞以促进肠道菌群失调。
S. Tm 是一种特别有毒的细菌,它会侵入宿主粘膜,引起严重的炎症。这种炎症导致产生丁酸盐的梭状芽胞杆菌耗尽,进一步增强了S. Tm 在肠道中增殖的能力。换句话说,这表明某些病原体可能会“破坏”肠道新陈代谢以增加自身健康,从而损害健康细菌。
值得注意的是,丁酸盐生产者的消耗似乎比抗生素治疗更缓慢,大约需要 1-3 周,但恢复速度也慢得多。感染后 4 周,梭菌的丰度仍比基线水平低两个半数量级。
由S. Tm 引起的炎症还导致活性氧和氮物质释放到肠道中,它们与单糖反应形成底物,选择性地喂养S. Tm 和肠杆菌科(变形杆菌门)内的其他微生物。
这不仅适用于S. Tm。在小鼠模型中证明,柠檬酸杆菌(Citrobacter)和空肠弯曲杆菌(Campylobacter jejuni)感染也能够引起宿主肠道炎症并驱动肠杆菌科过度生长。
空肠弯曲杆菌详见:细菌大盘点(二) | 葡萄球菌、沙门氏菌、弯曲杆菌
总的来说,这表明肠道感染可能有助于结肠的氧合作用并促进肠道生态失调的长期状态。因此,清除现有感染可能是恢复肠道上皮细胞正常代谢和健康肠道微生物群的关键步骤。

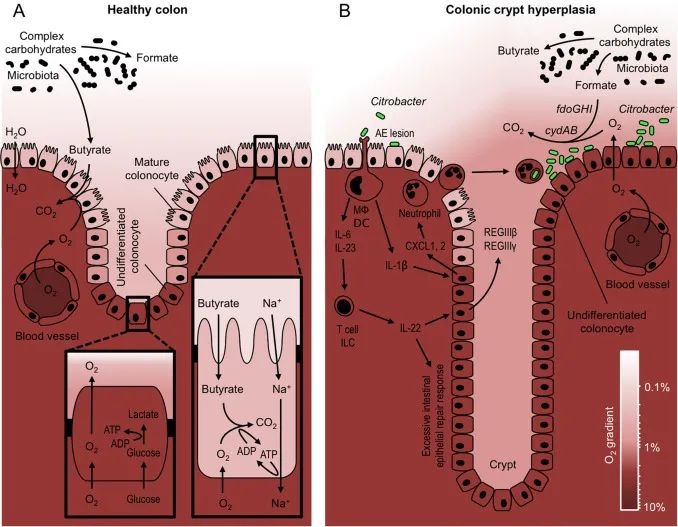
DOI: 10.1016/j.freeradbiomed.2016.09.022
(A) 专性厌氧菌降解复合碳水化合物产生发酵产物,如甲酸盐和丁酸盐。成熟的结肠细胞通过将丁酸氧化成二氧化碳 (CO2 ) 来产生能量 (ATP),这会导致粘膜表面缺氧。相反,位于隐窝中的未分化结肠细胞通过将葡萄糖发酵成乳酸来获取能量。
(B) 病原体C. rodentium ( Citrobacter ) 利用其毒力因子紧密附着在结肠细胞表面(AE 损伤)。树突状细胞 (DC) 和巨噬细胞 (MΦ) 引起的宿主反应导致产生作用于结肠细胞和淋巴细胞(T 细胞和 ILC)的细胞因子(IL-6、IL-23 和 IL-1β),从而诱导合成嗜中性粒细胞趋化因子(CXCL1, 2) 和 IL-22,可激活上皮增殖。
过度的上皮增殖导致隐窝伸长和粘膜表面未分化的含氧量正常的结肠细胞的积累。由此产生的氧气扩散到肠腔的增加,使用cydAB基因驱动C. rodentium的有氧扩张,编码高亲和力细胞色素bd氧化酶。由fdoGHI基因编码的氧依赖性甲酸脱氢酶使病原体能够消耗微生物群衍生的甲酸。
右下角显示的色标表示原理图着色方案表示的氧浓度。
#4
到目前为止,我们已经看到两个例子,其中丁酸盐耗尽导致肠道氧合和生态失调。鉴于丁酸盐的第一大来源来自膳食纤维,从理论上讲,低纤维饮食很可能可以通过相同的机制促进变形菌的扩张。
如果膳食纤维摄入量低,丁酸盐和其他短链脂肪酸的产生水平将无法满足结肠细胞的能量需求。结肠细胞将转向厌氧葡萄糖代谢。无氧代谢会消耗更少的氧气,并导致更多的氧气泄漏到肠道中。
虽然这种机制中的所有步骤并没有像低纤维饮食对抗生素和肠道感染的影响那样有序地得到证明,但一些研究确实将低纤维摄入量与较高水平的变形杆菌联系起来:
那么低纤维生酮饮食是否也如此?
正如之前讨论的,酮体乙酰乙酸和 β-羟基丁酸可以补充丁酸作为肠道上皮细胞的燃料来源。因此,低纤维生酮饮食不太可能激活这种机制来驱动肠道菌群失调。事实上,酮可能有助于恢复上皮缺氧。
#5
有趣的是,所有这些肠道菌群失调的驱动因素,包括抗生素、肠道感染和低纤维加工饮食,都与肠道炎症有关。
肠道炎症
2007 年,在动物模型中证明,肠道炎症本身足以破坏肠道微生物群并促进肠杆菌科的过度生长。通过敲除 IL-10,无论是接触葡聚糖硫酸钠(一种破坏肠道屏障完整性的化学物质),还是严重的遗传易感性,都能够导致肠道菌群失调。
其他更温和的炎症因子也可以促进这些炎症细菌的扩张。2015的一项研究表明,给小鼠喂食羧甲基纤维素和聚山梨醇酯 80(加工食品中常用的两种乳化剂),12 周会降低微生物多样性并导致粘膜相关变形菌增加。同样,发现给小鼠喂食无热量甜味剂阿斯巴甜 8 周会导致肠杆菌科细菌增多。
关于食品添加剂与肠道菌群详见:
你的焦虑可能与食品添加剂有关,警惕食品添加剂引起的微生物群变化
心理压力
压力还会促进炎症和肠道菌群失调。研究报道了在慢性社会心理压力的小鼠模型中变形杆菌的扩张。
食物不耐受
未被识别的食物不耐受也可能导致肠道炎症、结肠细胞代谢改变和肠道生态失调,尽管需要更多的研究来证实这一点。
以上,我们已经回顾了一些可能导致肠道缺氧和导致肠道菌群失调的因素。
在患有 IBD 的患者中观察到微生态失调。反复观察表明专性厌氧菌(F. prausnitzii)减少,兼性厌氧菌(肠杆菌科)增加,甚至出现需氧菌。加上远端肠道的正常厌氧肠道生理学,这些观察结果支持了细菌群落变化的假设,该变化是由氧气增加引起的,从而改变了胃肠道中的 Eh。
F. prausnitzii对氧气极其敏感,但仍可以看到粘附在氧气从上皮细胞扩散的肠道粘膜上。为了解释这个悖论,2012有研究报道说F. prausnitzii可以在低氧环境下生长。他们表明F. prausnitzii 利用黄素和硫醇的细胞外电子穿梭将电子转移到氧气。然而,存在于健康人体肠道中 的黄素和硫醇是普拉梭菌在氧气存在下存活所必需的,而在IBD患者的受损组织中可能并非如此。
IBD 患者中的肠道微生态失调
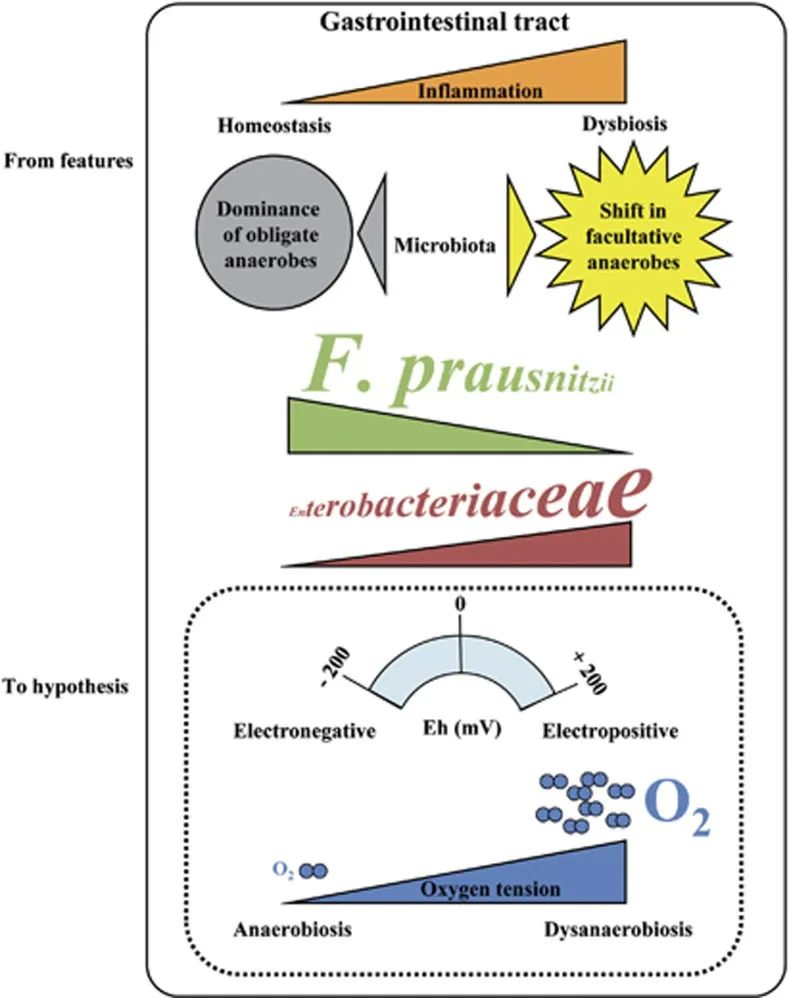

doi: 10.1038/ismej.2013.80
肠道微生物在肠道中的氧依赖性变化
研究在小肠移植和回肠造口术后监测微生物成分,肠道细菌群落从专性厌氧菌转变为以兼性厌氧菌为主的群落,并且肠杆菌科增加,就像 IBD 患者的微生物群一样。
在回肠造口关闭后,假设它提供了氧气入口,转变被逆转,专性厌氧菌再次占主导地位。
这些研究作者提出,氧气是菌群从专性厌氧菌转变为兼性厌氧菌或需氧菌的原因。
虽然肠杆菌科增加,但在大多数患者中未观察到炎症。与 IBD 菌群失调形成鲜明对比的是,乳酸杆菌也大量繁殖,后者很少见乳酸菌增加的报道。研究表明,乳酸杆菌及其细胞壁成分具有抗炎特性,这表明调节或补充乳酸杆菌可能会限制 IBD 患者的炎症反应。
菌群失调与炎症和氧气增加相关
在 IBD 中,氧气浓度的增加可能是由于血液进入胃肠道引起的,这种情况在慢性炎症期间经常观察到,这会促使携带氧气的血红蛋白在肠道细菌所在的肠粘膜和内腔中释放。小鼠模型表明,炎症可能导致微生物群失调,并促进肠杆菌科的过度生长。
一项初步研究评估了克罗恩病中抗肿瘤坏死因子-α 抗体治疗对粪便微生物群的组成和活性的影响,并报告了Faecalibacterium的适度增加, 这表明阻断炎症反应可能会促进这些菌增加。
氧气条件的变化也可能是由于炎症反应本身,导致肠道组织氧化爆发,例如,通过中性粒细胞释放活性氧。有趣的是,活性氧可以与内源性腔内硫化合物反应,形成肠道沙门氏菌使用的呼吸电子受体血清型 Typhimurium(一种好氧物种和属于肠杆菌科的肠道病原体),赋予沙门氏菌相对于专性厌氧菌的竞争性肠道微生物群的生长优势。
“
——丁酸盐有助于恢复肠道菌群
第一步只是确保有基本的健康。我们可以讨论各种先进的肠道干预措施,但最基础的永远都是要从源头上开始,比如说健康的饮食、锻炼、睡眠和压力管理等方式,如果饮食等很糟糕,那么再多肠道治疗,先进的疗法改变肠道和健康状况都不会持久。所以这是第一步。
健康的饮食对于不同人有不同的定义
是的。我们并不完全知道对肠道微生物组最好的饮食是什么,而且并没有一种所谓对肠道微生物组最好的饮食。每个人的微生物组都不同,大家知道,有些人可能对生酮饮食反应非常好,而有些人可能对包含更多植物性食物的饮食效果更好。
建议大家可以从自己身上进行健康探索,比如某一阶段进行某种健康的饮食或生活方式,坚持一段时间后进行肠道菌群检测,配合自身感受,更多角度更细微层次地去了解自己的身体状况。
假如说肠道真的发炎了,做一个短期的低过敏性饮食(比如自身免疫方案)可能是有益的,去除一些更容易引起炎症的食物,至少在一段时间内促进康复。减少炎症将从根本上阻止导致菌群失调的氧气泄漏。
如果变形菌过多和氧气失调的情况发生怎么办?它的典型症状是什么?
通过我们多年研究发现这个可以以很多不同的方式表现出来。基本上这种高变形杆菌和低产丁酸盐的微生物特征存在于各种不同的疾病中:炎症性肠病、肠易激综合症、结直肠癌,也可能是2型糖尿病、肥胖症、过敏以及牛皮癣等。
像这样情况的人通常倾向于腹泻或大便不成形?
不一定。在持续腹胀和胀气的患者身上看到了很多。这是看到的一个非常常见的问题,但它也可能因谷禾目前客户群体而有所偏差。
扩展阅读:“肚子像气球?”“好像怀孕?”——可能是腹胀惹的祸
建议补充丁酸盐可能会扭转这种生态失调状态?
是的,当然并不是单靠补充丁酸盐就一定能够解决这种生态失调。因此,本文概述了一些不同的因素,包括饮食和生活方式因素,以及可能有助于防止氧气泄漏到肠道并恢复体内平衡状态的补充因素,丁酸盐是其中的重要方式之一。
如果没有丁酸盐,氧气没有得到利用,就会溢出肠腔喂养病原体
基本上发生的氧气泄漏的部分原因是肠道内的上皮细胞缺乏能量。当极度缺乏能量时,如果它们没有丁酸盐,就不会代谢丁酸盐。所以从血液中提取葡萄糖,基本上发酵成乳酸,然后乳酸渗入肠道,除了通常通过丁酸代谢使用的氧气。所以实际上如没有丁酸盐存在,就意味着从血液流入上皮细胞的氧气没有得到利用。那就是它最终溢出到肠腔并喂养病原体的时候。
因此,从本质上讲,提供补充丁酸盐就是提供的是上皮细胞喜欢的能量。它们将使用更多的氧气作为丁酸代谢的一部分,并且基本上不需要进行厌氧葡萄糖发酵。这会产生乳酸,最终不会耗尽氧气,这意味着氧气和乳酸会渗入肠道,并喂养沙门氏菌、肠杆菌科和许多不同的变形菌。
抗生素治疗期间补充丁酸盐——雪中送碳
2019 年,在小鼠模型中证明,同时给予丁酸盐和抗生素可以减轻艰难梭菌引起的结肠炎。艰难梭菌是一种革兰氏阳性、形成孢子的细菌,是使用抗生素后肠道感染的常见原因。
在使用抗生素前一天开始补充丁酸盐,并在整个抗生素疗程和 5 天感染挑战期间持续使用。有趣的是,丁酸盐对艰难梭菌定植或毒素产生没有影响,但通过稳定 HIF-1 和增加肠道屏障的完整性,丁酸盐减少了肠道炎症和细菌穿过肠道屏障的运动。
研究人员继续测试另外两种提供丁酸盐的策略。在感染前后的三天内给予高剂量三丁酸甘油酯与丁酸盐具有同样的保护作用,就像在感染前服用抗生素后喂食高纤维饮食(含有高达25%的菊粉)一样。
显然,丁酸盐可以防止抗生素后病原体的扩张。但丁酸盐能否通过支持结肠细胞代谢来预防与抗生素相关的所有生态失调,这仍有待在对照研究中确定。
1
在分子生物学领域,过氧化物酶体增殖物激活受体 (PPAR) 是一组核受体蛋白,作为转录因子调节基因的表达。PPAR 在调节细胞分化、发育和代谢(碳水化合物、脂质、蛋白质)以及肿瘤发生中起着重要作用。
PPAR-γ:一个具体的结肠细胞代谢“开关”
如果说前面一直在抽象地谈论导致肠道菌群失调的结肠细胞代谢“开关”,那么这里来个具体的。研究人员已经确定了一种特殊的基因 PPAR-γ,它似乎可以调节这种转换。PPAR(过氧化物酶体增殖物激活受体的缩写)是一组与 DNA 结合以直接影响基因表达的蛋白质。PPAR-γ 在许多细胞中表达,但在脂肪(脂肪)组织和结肠中表达最高。
健康肠道:
丁酸盐 ⇔ PPAR-γ:互相促进,正向循环
在健康的肠道中,丁酸盐不仅可以为结肠细胞提供能量,还可以增强 PPAR-γ 的激活。这起到了一个正反馈循环的作用:PPAR-γ 激活了增加丁酸盐和其他脂肪酸代谢的基因。这会降低上皮细胞和肠粘膜中的氧气浓度,从而抑制致病性变形菌的生长,并促进有益的、产生丁酸盐的细菌的生长。
失调肠道:没有足够丁酸盐→ 较低的 PPAR-γ 表达→ 致病菌生长
然而,在失调的肠道中,没有足够的丁酸盐或其他底物来激活 PPAR-γ。较低的 PPAR-γ 表达导致 Nos2 的表达增加,Nos2 是编码诱导型一氧化氮合酶 (iNOS) 的基因,并且增加了硝酸盐释放到肠道中。这与厌氧糖酵解产生的乳酸和氧气一起促进了致病菌的生长。
PPAR-γ 激活对于维持肠道先天免疫也至关重要
2010 年发表在PNAS杂志上的一项研究通过一系列实验证明,PPAR-γ 有助于维持抗菌肽β-防御素的持续表达,后者调节结肠的微生物定植。缺乏 PPAR-γ 的小鼠表现出对白色念珠菌、脆弱拟杆菌、粪肠球菌和大肠杆菌的免疫防御缺陷。
分泌型 IgA 的产生也需要 PPAR-γ 。
IgA 详见:对抗病原菌,帮助共生菌定植的“重要开关”
2
多项研究表明,PPAR-γ 激活可能会预防或逆转与免疫激活相关的肠道菌群失调和组织损伤。例如,PPAR-γ 表达在炎症性肠病 (IBD) 中显着降低。
药物激活PPAR-γ :罗格列酮(不适合长期使用)
罗格列酮是一种与 PPAR-γ 结合并增加其活性的药物,在动物模型中已被证明在急性给药时可预防生态失调并减轻结肠炎的症状。虽然这种药物有时仍被用作抗糖尿病药物,但它有一些不良副作用,不适合长期使用。尽管如此,它证明了该途径对肠道微生物群产生重大变化的能力。
药物激活PPAR-γ :美沙拉嗪 (目前使用较多)
研究人员一直在寻找其他方法来刺激这一途径。另一种药物美沙拉嗪也可以激活 PPAR-γ,但程度适中。它在肠道中具有更多的局部作用,因此相对具有更少的全身副作用。这种药物现在被用作 IBD 的一线治疗药物。这种药物的抗炎作用是通过其上调 PPAR-γ 的能力介导的。此外,对照研究表明,美沙拉嗪处理可降低变形杆菌的丰度并增加粪杆菌和双歧杆菌的丰度。
药物激活PPAR-γ :丹参素冰片酯(激活程度小,但仍然提供显著保护作用)
北京的一组研究人员还发现丹参素冰片酯(DBZ)是一种 PPAR-γ 激动剂,具有预防或逆转肠道菌群失调的潜力。DBZ 是传统中药复方丹参中天然存在的两种化合物的合成版本。与罗格列酮和其他经典噻唑烷二酮类药物相比,DBZ 被发现对 PPAR-γ 的激活程度更小,但仍然能够在小鼠饮食模型中提供显着的保护作用,防止肠道菌群失调、肠屏障功能障碍、胰岛素抵抗和体重增加-诱发肥胖。
丁酸盐补充剂也可能参与激活
丁酸盐补充剂也被证明可以改变人类的肠道生态系统。一项针对 49 名 IBD 患者的前瞻性、随机、安慰剂对照研究发现,每天 1800 毫克的丁酸盐不仅可以减轻炎症并改善生活质量,而且还会增加产丁酸菌的数量。
经过两个月的补充,患有克罗恩氏病的人的丁酸球菌和Subdoligranulum丰度增加,而患有溃疡性结肠炎的人的毛螺菌科则大量增加。虽然研究人员没有直接测量 PPAR-γ,但考虑到产丁酸菌和炎症标志物的丰度发生了如此巨大的变化,这一途径可能参与其中。
▼
总而言之,这是一个非常有趣的研究领域,在未来几年无疑会受到更多关注。
《科学》杂志上的评论中写道:“结肠细胞的代谢重编程以恢复上皮细胞缺氧,代表了一种有前途的新治疗方法,可以在广泛的人类疾病中重新平衡结肠微生物群”。
换句话说,如果能够靶向结肠细胞的新陈代谢,我们就可以恢复肠道中的低氧环境,并有可能逆转肠道微生态失调。
谷禾也正积极开展研究合作,以确定丁酸盐和其他 PPAR-γ 激动剂是否可以预防抗生素引起的各种菌群失调。
3
以下是可能增加肠道 PPAR-γ 活性以支持肠道缺氧的干预措施的总结。可能有助于解决对其他治疗没有反应的肠道菌群失调疑难病例,尤其是那些以高变形杆菌和低丰度产丁酸菌为特征的肠道菌群失调。
首先应该关注的地方依然是日常能做到的,比如说健康的饮食,定期锻炼,充足的睡眠、阳光和健康的社交互动。
其他疗法包括:
美沙拉嗪 (5-ASA):该药物通常用作 IBD 的一线治疗药物。它的抗炎作用已被证明是通过其上调 PPAR-γ 的能力介导的。
丹参素冰片酯(DBZ):这种化合物来源于丹参酚和冰片,存在于中药复方丹参中。它上调 PPAR-γ,并已证明具有减轻微生态失调的潜力。注意:草药的来源和剂量应谨慎,最好是在草药方面经验丰富的医生的指导下。
丁酸盐:一种短链脂肪酸和 PPAR-γ 的有效刺激剂。即使是低浓度的丁酸盐也能将 PPAR-γ 蛋白表达增加 7 倍。
酮类: β-羟基丁酸和乙酰乙酸会激活肠上皮细胞中的 PPAR-γ,就像丁酸一样。生酮饮食已被证明可以在许多组织中上调 PPAR-γ,还可以为 β 氧化和上皮能量产生提供底物。希望能有更多支持这方面的研究。
禁食/热量限制:一项研究发现,在热量限制期间,交感神经系统激活需要肠道 PPAR-γ。然而,禁食或热量限制在多大程度上在肠道中诱导该通路仍不清楚。
运动:一个研究小组发现,在结肠炎模型和饮食诱导的肥胖模型中,自愿运动对肠道的保护作用是由运动增加肠道内源性糖皮质激素和上调 PPAR-γ 的能力介导的。
压力管理:压力会降低肠道中 PPAR-γ 的表达。
大麻素:大麻二酚 (CBD) 降低了溃疡性结肠炎患者直肠活检中的 iNOS 活性,这种作用是通过激活 PPAR-γ 介导的。
萝卜硫素:2008 年发现这种来自十字花科蔬菜的植物化学物质通过激活 PPAR-γ 增强先天免疫成分。
姜黄素:一项研究发现姜黄素通过激活 PPAR-γ 抑制小鼠化学诱导的结肠炎。达到这些效果所需的口服剂量尚不清楚。
其他草药:洋甘菊、当归、水飞蓟素、甘草根和柠檬香脂都是 PPAR-γ 的部分激活剂。
脂肪酸:共轭亚油酸 (CLA) 和 omega-3 脂肪酸 (DHA) 均可增强 PPAR-γ 的表达。
益生菌:对结肠细胞的体外研究表明,布拉酵母菌(Saccharomyces boulardii)具有增加 PPAR-γ 表达的能力。
益生元:对结肠细胞的体外研究表明,低聚糖 alpha3-唾液酸乳糖和 FOS 的抗炎作用是通过它们诱导 PPAR-γ 的能力介导的。
维生素 A:视黄酸是维生素 A 的一种形式,是 PPAR-γ 的激活和功能所必需的。维生素 A也称为“抗感染素”。
注:本账号内容仅作交流参考,不应将以上信息视为医疗建议。采取干预措施前请咨询医生,了解治疗是否适合。
主要参考文献
Bradley PH, Pollard KS. Proteobacteria explain significant functional variability in the human gut microbiome. Microbiome. 2017 Mar 23;5(1):36. doi: 10.1186/s40168-017-0244-z. PMID: 28330508; PMCID: PMC5363007.
Lucy Mailing. The oxygen-gut dysbiosis connection(What causes gut health to go downhill, and how to break the cycle of gut inflammation, dysbiosis, and epithelial energy starvation). 2019,11.14, lucymailing.
Rigottier-Gois L. Dysbiosis in inflammatory bowel diseases: the oxygen hypothesis. ISME J. 2013 Jul;7(7):1256-61. doi: 10.1038/ismej.2013.80. Epub 2013 May 16. PMID: 23677008; PMCID: PMC3695303.
Henson MA, Phalak P. Microbiota dysbiosis in inflammatory bowel diseases: in silico investigation of the oxygen hypothesis. BMC Syst Biol. 2017 Dec 28;11(1):145. doi: 10.1186/s12918-017-0522-1. PMID: 29282051; PMCID: PMC5745886.
Byndloss MX, Olsan EE, Rivera-Chávez F, Tiffany CR, Cevallos SA, Lokken KL, Torres TP, Byndloss AJ, Faber F, Gao Y, Litvak Y, Lopez CA, Xu G, Napoli E, Giulivi C, Tsolis RM, Revzin A, Lebrilla CB, Bäumler AJ. Microbiota-activated PPAR-γ signaling inhibits dysbiotic Enterobacteriaceae expansion. Science. 2017 Aug 11;357(6351):570-575. doi: 10.1126/science.aam9949. PMID: 28798125; PMCID: PMC5642957.
Roudsari NM, Lashgari NA, Zandi N, Pazoki B, Momtaz S, Sahebkar A, Abdolghaffari AH. PPARγ: A turning point for irritable bowel syndrome treatment. Life Sci. 2020 Sep 15;257:118103. doi: 10.1016/j.lfs.2020.118103. Epub 2020 Jul 15. PMID: 32681913.
What Is Dysbiosis? Written by WebMD Editorial Contributors. Medically Reviewed by Dan Brennan, MD on December 06, 2022
Yajie Wang, Yue Chen, Xiaoyu Zhang, Yangpeng Lu, Haixia Chen, New insights in intestinal oxidative stress damage and the health intervention effects of nutrients: A review, Journal of Functional Foods,2020. Volume 75,104248,
Shelton CD, Byndloss MX. Gut Epithelial Metabolism as a Key Driver of Intestinal Dysbiosis Associated with Noncommunicable Diseases. Infect Immun. 2020 Jun 22;88(7):e00939-19. doi: 10.1128/IAI.00939-19. PMID: 32122941; PMCID: PMC7309626.

谷禾健康
微生物群代表宿主肠道中存在的整个微生物群。肠道内细菌界的“贫富差距”非常大,和人类社会创造的大部分的财富都流向少部分人口的现实类似,只有少数几十种的细菌分布在近乎90%的人群中。换句话说,大部分细菌都只能在特定的环境中生存,只有少数细菌适应能力超强,这可能也是我们需要重点关注的对象。
如果把不同细菌品种看作互相竞争的国家,那么细菌界的“超级大国”就属拟杆菌门和厚壁菌门了。当然它们都不是单独某一种细菌,而是一大类细菌的统称。
然而近年来随着患有肠内外疾病的人群越来庞大,变形菌门也逐渐被关注和研究,变形菌门是含有最丰富细菌的门,麾下包括多种“著名的”病原菌,如大肠杆菌、幽门螺杆菌、克雷伯氏菌、沙门氏菌、志贺氏菌、绿脓杆菌、霍乱弧菌、空肠弯曲菌、鼠疫杆菌、脑膜炎双球菌、淋球菌等,让其备受关注。
事实上,越来越多的数据将变形菌确定为疾病的可能微生物特征。目前主要证据涉及代谢紊乱和炎症甚至癌症。然而,最近的研究表明,在哮喘和慢性阻塞性肺病等肺部疾病中也有作用,有些疾病中变形菌不受控制扩张导致疾病易感和发生。
变形菌(proteobacteria)是细菌中最大、种类最多的一个门,它们在系统发育、生态和致病方面具有广泛的重要性。所有变形菌都是革兰氏阴性菌,外膜主要由脂多糖组成。
图源:esacademic
变形菌门主要是由核糖体RNA序列定义的,名称取自希腊神话中能够变形的神普罗透斯(这同时也是变形菌门中变形杆菌属的名字),因为该门细菌具有极为多样的形状,代谢特征等。
△ 形状:杆状和球菌、弯曲的、螺旋状的、环状的、丝状的和带鞘的细菌都有。
△ 新陈代谢:新陈代谢类型也多种多样,一系列代谢特征包括化学自养(从无机化合物的氧化中获取能量)、化学有机营养(从有机化合物的氧化中获取能量)和光养(从光中获取能量)。
△ 氧气利用:从严格厌氧菌和严格需氧菌到兼性厌氧菌和微需氧菌株的都有,但是大多数变形菌门的成员是兼性厌氧菌。
△ 运动:许多使用鞭毛移动,但有些不能移动或依赖细菌滑动,而一些细菌是不运动的。
△ 生态分布:变形菌门的成员具有极大的可变形态和多才多艺的生理学,这使它们在各种生态位中生存具有竞争优势。已观察到变形菌在不同生境中无处不在。
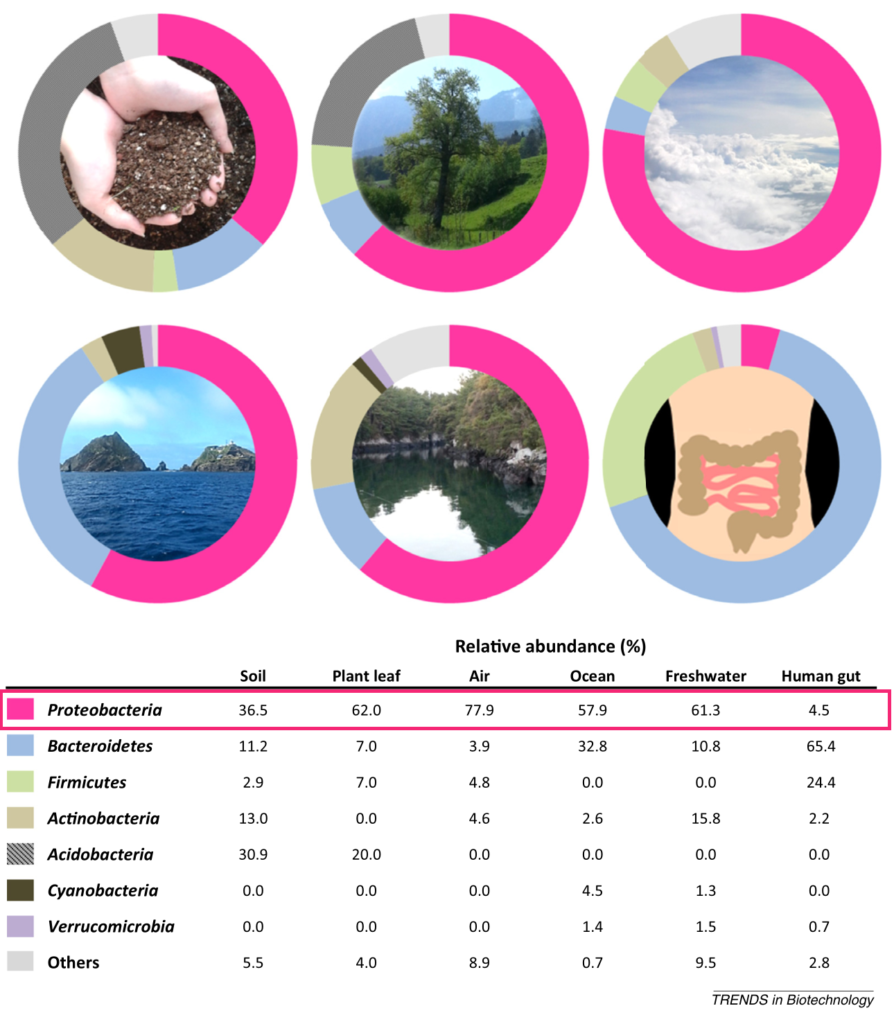
Shin NR, et al., Trends Biotechnol. 2015
植物 、海水、淡水 ,空气,以及人和动物的身体部位,包括肠道、口腔、皮肤、阴道。尽管存在研究间差异,但健康人口腔微生物群的变形菌相对丰度最高(17.2-36.8%),其次是皮肤(6.8-30.0%)、胃肠道(2.5-4.6%)和阴道(2.3%)。
在系统发育学上,变形菌是根据小核糖体亚单位RNA基因(16S rRNA)的测序定义的。这是一个巨大的革兰氏阴性原核生物门,原线粒体起源于此。
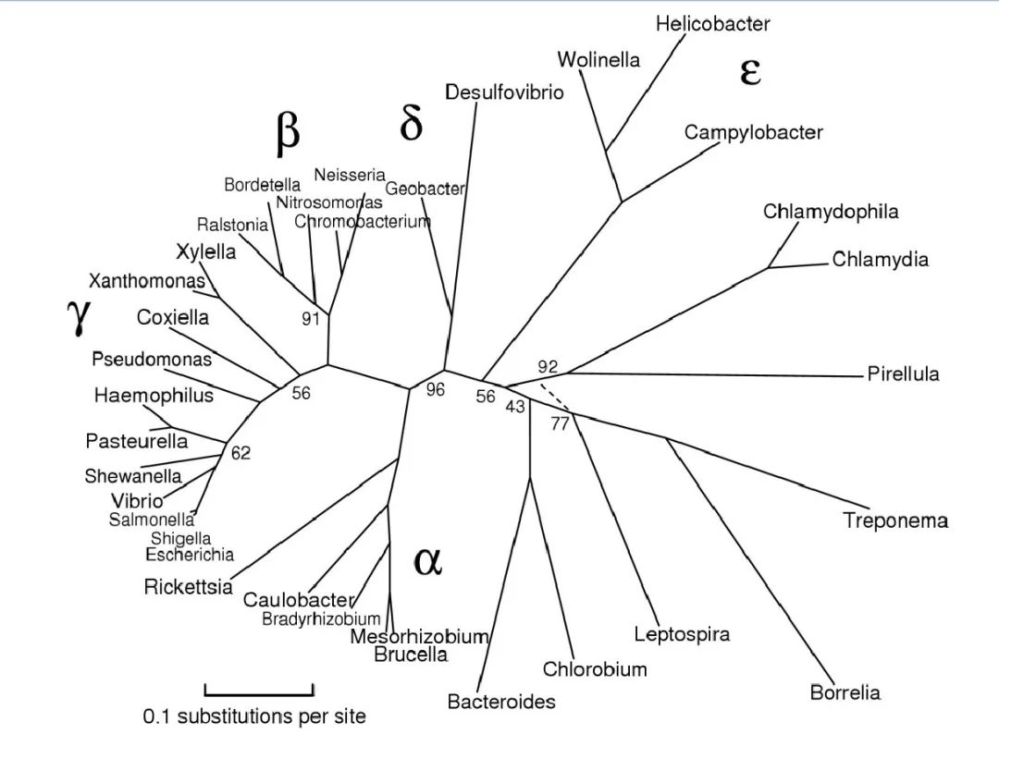
图片来源:Maria Lane,eportfolio
该门主要分为以下几大类:
最初,变形菌包括 α、β、γ 和 δ 四个亚类。ε变形菌 和 δ变形菌 通常被认为是最古老的变形菌群,因为它们包括利用硫化合物进行能量代谢的专性厌氧菌。
α变形菌(Alpha-proteobacteria)
第一类变形菌是α-变形菌。这一类的统一特征是它们是寡营养生物,能够生活在低营养环境中,如深海沉积物、冰川或深层地下土壤。同时α-变形菌是多样化的细菌分支之一,在生活方式、地理分布和基因组大小方面表现出极大的差异。
在 α-变形菌 中有两个重要分类群,衣原体和立克次体,它们是专性细胞内病原体,这意味着它们的部分生命周期必须发生宿主细胞内。由于它们无法合成自己的三磷酸腺苷 (ATP),因此,量需求依赖宿主于细胞。
立克次体属是人类很多严重疾病的病原体。例如,布鲁氏菌属、埃立克体属和立克次氏体。立克次氏杆菌会导致落基山斑疹热,这是一种威胁生命的脑膜炎(包裹大脑的膜发炎)。R. rickettsii 感染蜱,并可以通过被感染的蜱叮咬传播给人类。此外,布鲁氏菌科(Brucellaceae)和巴尔通氏菌科(Bartonellaceae)的细菌是人类病原体。
α-变形菌 还包括固氮细菌,例如固氮螺菌属和根瘤菌属。这两种细菌都使用一种称为固氮酶途径的复杂酶途径将大气中的氮 (N2) 转化为氨 (NH3)。此外,α变形菌还包括硝化细菌。这种类型的细菌将氨和铵 (NH4+) 还原为硝酸盐 (NO3–)。乙酸杆菌属和葡糖杆菌属的变形菌可用于生产乙酸。
β变形菌(Beta-proteobacteria)
与依靠最少量营养物质生存的 Alpha-proteobacteria 不同,Beta-proteobacteria 类是富营养生物,这意味着它们需要大量的有机营养物质。
Beta-proteobacteria 通常在需氧和厌氧区域之间生长(例如,在哺乳动物的肠道中)。一些属包括作为人类病原体的物种,能够引起严重的,甚至可能危及生命的疾病。例如,奈瑟球菌属包括淋病奈瑟菌( STI淋病的病原体)和脑膜炎奈瑟菌(细菌性脑膜炎的病原体)
β变形菌中的亚硝化单胞菌可以将亚硝酸盐还原为亚硝酸盐 (NO2–)。同时,硫杆菌属物种是将硫化氢 (H2S) 和元素硫氧化成硫酸盐 (SO42-) 的细菌,以及用于污水处理的菌胶团(Zoogloea)和Sphaerotilis 。
γ变形菌(Gamma-proteobacteria)
最多样化的革兰氏阴性细菌是γ-变形菌,它包括许多人类病原体。包括几个医学和科学上重要的细菌群,例如肠杆菌科、弧菌科和假单胞菌科。
此外,许多重要的病原体属于这一类,例如:
Richard B. Frankel
△ 铜绿假单胞菌
一个庞大而多样的科,假单胞菌科,包括假单胞菌属。铜绿假单胞菌在该属内,它是一种病原体,可以造成身体不同部位的各种感染。铜绿假单胞菌是一种严格需氧、不发酵、高度运动的细菌。
它通常可能造成伤口和烧伤感染,也可能是慢性尿路感染的原因,并且可能是囊性纤维化患者或机械呼吸机患者呼吸道感染的重要原因。
铜绿假单胞菌感染通常难以治疗,因为该细菌对许多抗生素具有抗性,并且具有形成生物膜的非凡能力。
△ 肠杆菌科
肠杆菌科是属于γ-变形菌 的一大类肠道细菌。它们是兼性厌氧菌,能够发酵碳水化合物。在这个家族中,微生物学家认识到两个不同的类别。
第一类,大肠杆菌,以其原型细菌种类大肠杆菌命名。大肠菌能够完全发酵乳糖(即产生酸和气体)。
第二类,非大肠杆菌,要么不能发酵乳糖,要么不能完全发酵(产生酸或气体,但两者不能同时产生)。
非大肠杆菌包括一些值得注意的人类病原体,例如沙门氏菌属,志贺氏菌,鼠疫耶尔森氏菌。
δ 变形菌(Delta-proteobacteria)
δ-变形菌(Delta-proteobacteria )包括基本好氧的形成子实体的粘细菌和严格厌氧的一些种类,如脱硫球菌属(Desulfococcus)、脱硫线菌属(Desulfonema)、硫酸盐还原菌(脱硫弧菌属(Desulfovibrio)、脱硫菌属(Desulfobacter)、和硫还原菌(如除硫单胞菌属Desulfuromonas),以及具有其它生理特征的厌氧细菌,如还原三价铁的Geobacter和互营菌属(Syntrophus)。
△ 蛭弧菌属:
δ-变形菌还包括蛭弧菌属,Bdellovibrio侵入宿主细菌的细胞,将自身定位在周质中,即质膜和细胞壁之间的空间,以宿主的蛋白质和多糖为食。这种感染对宿主细胞是致命的。
△粘细菌:
粘细菌(“粘液细菌”)是一组主要生活在土壤中并以不溶性有机物质为食的细菌。与其他细菌相比,粘细菌具有非常大的基因组,例如 9-1000 万个核苷酸。
Sorangium cellulosum 拥有最大的已知(截至 2008 年)细菌基因组,有 1300 万个核苷酸。
粘细菌产生许多在生物医学和工业上有用的化学品,例如抗生素。他们将这些化学物质输出到细胞外。
ε变形菌(Epsilon-proteobacteria )
ε-变形菌(Epsilon-proteobacteria) 是革兰氏阴性微需氧细菌(意味着它们在其环境中只需要少量氧气)。多数是弯曲或螺旋形的细菌,如沃林氏菌属(Wolinella)、螺杆菌属(Helicobacter)和弯曲菌属(Campylobacter)。它们都生活在动物或人的消化道中,为共生菌(沃林氏菌在牛中)或致病菌(螺杆菌在胃中或弯曲菌在十二指肠中)。
△ 弯曲杆菌:
变形菌门Epsilon-proteobacteria 中的两个临床相关属是弯曲杆菌属和螺杆菌属,它们都包括人类病原体。
弯曲杆菌可引起食物中毒,表现为严重的肠炎(小肠发炎)。这种由空肠弯曲杆菌引起的疾病在发达国家相当普遍,通常是因为食用了受污染的家禽产品。鸡通常携带空肠弯曲杆菌在胃肠道和粪便中,它们的肉在加工过程中可能会受到污染。
△螺杆菌:
螺杆菌是ε-变形菌的一个属,具有特征性的螺旋形状。它们最初被认为是弯曲杆菌属的成员,但自 1989 年以来,它们独立为自己的属。
螺杆菌属属于ε-变形菌,弯曲杆菌目,螺杆菌科,已经有超过 35 种。已经发现一些菌生活在上胃肠道的内壁,以及哺乳动物和一些鸟类的肝脏中。
该属中最广为人知的物种是幽门螺杆菌,它感染多达 50% 的人口。这种细菌的某些菌株对人类具有致病性,因为它与消化性溃疡、慢性胃炎、十二指肠炎和胃癌密切相关。它也作为该属的模式种。
幽门螺杆菌在胃的高酸性环境中存活的能力有些不同寻常。它产生脲酶和其他酶来改变其环境以降低其酸性。
幽门螺杆菌也有它存在的意义,可能抑制引起结核的细菌(结核分枝杆菌),预防哮喘,克罗恩病,食管反流,腹泻病以及食道癌。
❥ 识别微生物编码的基因,与特征相关联
栖息在哺乳动物肠道中的微生物编码了大量的蛋白质,这些蛋白质有助于广泛的生物功能,从调节免疫系统到参与新陈代谢。
我们从这些微生物中识别蛋白质编码基因并将基因水平与疾病、药物功效或副作用以及其他宿主特征相关联。
例如,与传统的高纤维农业饮食相关的人类肠道微生物群编码了参与纤维素和木聚糖水解的基因家族,而这些基因家族在吃典型西方饮食的人群(年龄匹配)中不存在。
一般编码适应肠道环境所必需的功能的微生物有很强的选择性,在不同宿主中具有大量冗余的基因库。然而,目前的研究和临床很容易忽略健康人类微生物组之间基因丰度的生理意义差异。
❥ 较少丰度的变形菌门,才是是跨宿主丰度变异性最大的基因的主要来源
人体肠道通常由拟杆菌门和厚壁菌门主宰,这些门内的进化枝(尤其是拟杆菌属、普氏菌属和瘤胃球菌科)是最常用于将个体聚集成“肠型”,因为它们解释了最多的分类变异。Bacteroidetes 与 Firmicutes 的比率也被推定为疾病或健康的潜在生物标志物。
有人提出,人类肠道微生物组中可能存在少量“肠型”,每一种都具有不同的分类组成。因此,虽然拟杆菌门和厚壁菌门可能对宿主之间的分类变异贡献最大,但变形菌门的丰度可能会捕获更多的功能变异。
与先前确定的肠型标记分类群相比,变形菌门的水平和可能的 Euryarchaeota 更好地解释了肠道微生物基因功能的人与人之间的差异。
在肠型研究中遗漏了这些不太丰富的门,可能是因为肠型是通过倾向于对高丰度分类群进行更多加权的方法鉴定的,并且肠型是从分类学而非功能数据中鉴定的。这对解释人类肠道微生物群的分类数据具有重要意义。
例如,变形菌门的过度生长与代谢综合征和炎症性肠病有关。通过 TLR5 敲除小鼠测试的肠道炎症关联到变形菌门(超过拟杆菌门和厚壁菌门),并且一些变形杆菌可以在这种背景下诱发结肠炎,可能导致反馈循环。因此,可变基因家族对解释人类肠道微生物群的分类数据具有重要意义。
备注:肠道受体蛋白TLR5参与积极地塑造新生小鼠肠道微生物群落的长期组成,敲除的Toll样受体(TLR5),是免疫系统识别鞭毛细菌(比如变形菌和梭状芽孢杆菌)的关键受体,缺乏它则机体可能不会在感知到细菌鞭毛时对细菌产生免疫应答。
肠道相关微生物群落组成的变化与许多人类疾病有关,但驱动这种不平衡(生态失调)的机制尚不完全清楚。
在肠道菌群失调期间观察到的最一致和最强大的生态模式是属于变形菌门的兼性厌氧细菌的扩张。
变形菌的菌群失调是上皮功能障碍的微生物特征
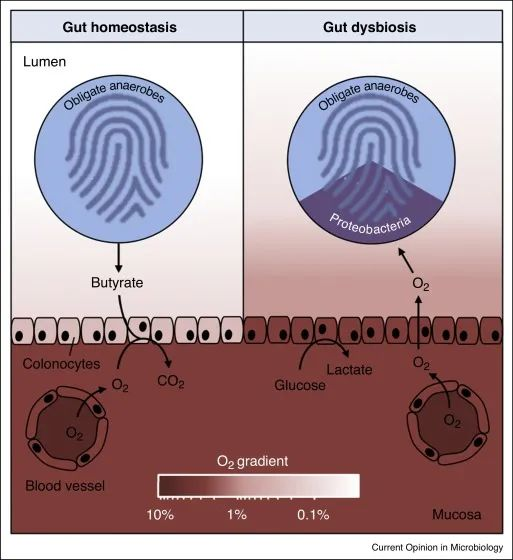
在肠道稳态期间(左),微生物群衍生的丁酸盐的 β 氧化导致上皮缺氧,从而维持大肠腔内的厌氧状态。反过来,腔内厌氧症导致肠道微生物群内专性厌氧菌占主导地位。
备注:丁酸(Butyrate acid,BA),俗称酪酸,是构成脂肪的一种脂肪酸,含有4个碳原子又称短链脂肪酸。人体的丁酸部分来自于食物中丁酸的吸收,主要的来自结肠厌氧菌的发酵产生。人体结肠产生的短链脂肪酸丁酸占比大部分)。
在肠道菌群失调期间(右),表面结肠细胞通过无氧糖酵解获得能量,从而导致上皮氧合增加,这种上皮功能障碍破坏了管腔中的厌氧菌,从而通过有氧呼吸推动兼性厌氧变形菌的扩张。
健康结肠的厌氧菌导致肠道微生物群的组成以专性厌氧菌为主,而菌群失调通常与兼性厌氧变形菌的丰度持续增加有关,这表明厌氧菌的破坏。
结肠上皮是缺氧的,但肠道炎症或抗生素治疗会增加结肠中的上皮氧合,从而破坏厌氧作用,通过有氧呼吸驱动兼性厌氧变形菌的菌群失调。
肠沙门氏菌(S. enterica)是一种食源性病原体,属于肠杆菌科,变形菌门,可引起小鼠结肠炎。在肠道沙门菌S. enterica诱导的结肠炎期间,肠腔内的氧气可用性增加,这表明结肠中病原体的氧气呼吸依赖性大量繁殖以及随之而来的专性厌氧梭状芽胞杆菌的丰度下降。
同样,结肠隐窝增生由鼠肠道病原体柠檬酸杆菌(肠杆菌科,变形菌门)引发,可提高肠腔内的氧气利用率,从而通过有氧呼吸推动变形菌病原体扩张。
这些观察结果表明,变形菌的菌群失调是上皮功能障碍的潜在诊断微生物特征,建议将变形菌负荷作为生态失调和疾病的潜在诊断标准,所以在谷禾即将更新的肠道菌群检测报告中,我们会加入变形菌门丰度和参考范围这一指标。
大肠中专性厌氧菌的优势可能是宿主环境的氧气限制严重的结果,这反过来又对用于营养物质的分解代谢途径产生重要影响。
避免被上消化道中的宿主酶降解的复合碳水化合物,可以被大肠中的专性厌氧细菌水解并发酵成更小的化合物。专性厌氧菌最终将许多发酵产物转化为短链脂肪酸,其中乙酸盐、丙酸盐和丁酸盐是最丰富的产物。宿主吸收了大约 95-99% 的微生物产生的短链脂肪酸,它到达血流以影响免疫发育。因此,大肠中专性厌氧菌的优势确保了维持肠道稳态的代谢物的产生。
变形菌是平衡的肠道相关微生物群落中的一个次要成分。然而,由遗传易感性、化学物质或肠道病原体感染引起的肠道炎症会导致小鼠模型中变形杆菌的管腔扩张不受控制。
同样,在患有严重肠道炎症的人类中,包括炎症性肠病、结直肠癌或坏死性小肠结肠炎的患者中观察到变形杆菌的丰度增加。此外,在包括肠易激综合征和代谢综合征在内的低水平肠道炎症条件下观察到大量变形菌。
肠道炎症增加了替代电子受体的可用性,这些电子受体通过厌氧呼吸支持兼性厌氧细菌的生长。肠道炎症过程中产生的活性氧可以将内源性硫化合物氧化为连四硫酸盐,这是一种电子受体,通过连四硫酸盐呼吸作用在鼠结肠中驱动类似肠沙门氏菌和Yersinia enterocolitica(一种属于肠杆菌科,变形菌门的病原体)的管腔扩张 。
一氧化氮由宿主酶产生化学诱导的结肠炎或由遗传易感性引发的结肠炎期间的诱导型一氧化氮合酶(iNOS) 。一氧化氮在肠腔内分解成硝酸盐,从而通过硝酸盐呼吸支持生长,从而增加小鼠结肠中共生大肠杆菌的丰度。类似,宿主衍生的硝酸盐的呼吸有助于在 S. enterica 诱导的小鼠结肠炎期间腔内病原体扩张。
有趣的是,即使在没有明显肠道炎症的情况下,例如在抗生素治疗期间,呼吸电子受体也有助于细菌群落从专性厌氧菌转变为兼性厌氧菌。为了支持这一观点,用链霉素治疗小鼠可将盲肠中的氧化还原电位提高到接近需氧培养液的水平。链霉素治疗通过硝酸盐呼吸和氧气呼吸的结合增加结肠中共生大肠杆菌或致病性肠杆菌的生长。
其他类似研究的结论也表明,氧气,单独或与其他呼吸电子受体结合,是广泛的胃肠道失衡中肠道菌群失调的常见驱动因素。因此,为了开发新的预防或治疗策略,必须了解在肠道菌群失调期间呼吸电子受体的可用性如何升高。
基于这些观察,有人提出变形菌的扩增是肠道菌群失调的微生物特征,而氧气、用药,遗传易感,肠炎驱动了变形菌的扩张,反过来加剧疾病的进展。
宿主遗传因素和外在环境因素,如饮食和生活环境,不断影响肠道微生物群的分类和功能组成。鉴于具有高度稳定性的平衡肠道微生物群与宿主的免疫系统具有共生相互作用,能够抑制变形杆菌失控的扩张,肠道中变形杆菌的大量繁殖可以反映肠道微生物群落结构的不稳定;这种不稳定的结构可以在非疾病状态下观察到(例如,新生儿期 和胃绕道手术后和疾病状态例如,代谢紊乱和肠道炎症)。
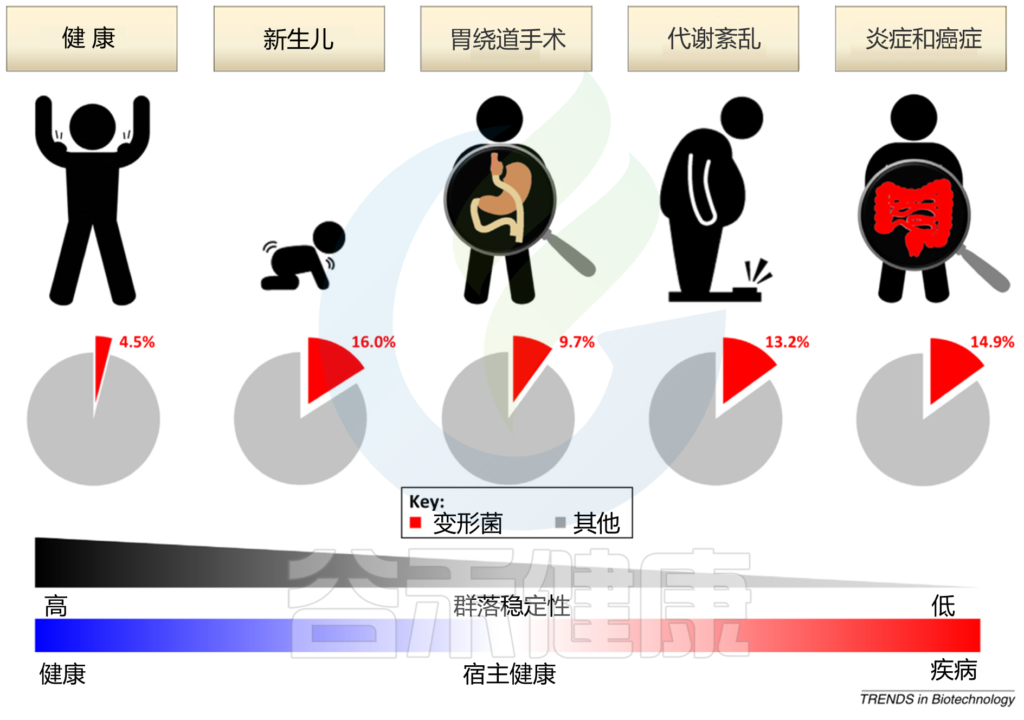
Shin NR, et al., Trends Biotechnol. 2015
在新生儿胃肠道的初始定植期间,兼性厌氧变形菌使肠道生态位有利于专性厌氧菌的定植;后者很快被专性厌氧的厚壁菌门和拟杆菌门所取代,它们在健康成年人的肠道微生物群中占主导地位。胃绕道手术导致的胃肠道重排可以改变 pH、胆汁流量和肠道激素,所有这些因素都会影响变形杆菌的丰度。
新生儿肠道中的变形菌
新生儿肠道中的微生物群备受关注,因为它不仅反映了细菌群落的脆弱结构,而且反映了哺乳动物肠道微生物群的真正起源。新生儿肠道中的细菌群落由于其快速的时间变化而不稳定。然而,这种脆弱性与更重要的肠道菌群定植有关,例如严格的厌氧菌。
具体来说,由于新生儿肠道中的氧气丰富,生命第一周的微生物群经常以兼性厌氧菌为主,主要是变形菌属(例如,埃希氏菌属、克雷伯氏菌属和肠杆菌属)。这些兼性厌氧菌通过消耗氧气、改变 pH 值、降低氧化还原电位并产生二氧化碳和营养物质,使栖息地适合严格的厌氧菌定殖。
因此,可以推测变形杆菌在为新生儿肠道准备好接受严格厌氧菌的连续定植方面发挥了作用,这些厌氧菌在健康成人的肠道中含量丰富。
最近对母体胎盘微生物组的一项研究描述了共生细菌群落的存在,其中大肠杆菌的丰度最高。尽管关于胎盘微生物群的活力和起源存在争议,但在母体胎盘中发现的这些有趣的细菌群落与来自母体羊水和新生儿胎粪的细菌群落重叠。
因此,新生儿肠道中的变形菌可能通过胎儿在子宫内吞咽羊水从母体胎盘传播。有趣的是,妊娠后期孕妇肠道中变形菌的比例增加。这意味着母亲微生物群中的这种特定细菌群转移到了新生儿身上。
在新生儿肠胃道中观察到的变形杆菌定植生长的持续时间很可能在母体控制之下。事实上,新生儿微生物群会受到各种母体因素的影响,例如分娩方式、饮食和怀孕期间接触抗生素。
最重要的是,新生儿肠道中变形菌的丰度受喂养类型的影响,这些细菌在配方奶喂养的婴儿中的频率更高,但在母乳喂养的婴儿中很少见。
人乳寡糖 和分泌型 IgA 的产生参与在最初的肠道定植过程中选择性抑制变形菌。因此,越来越多的人认为,及时减少变形菌的丰度是初始微生物定植的正常部分,而这种定植模式的紊乱与新生儿疾病的风险增加有关。
肠道中微生物群和宿主细胞之间的相互作用对于免疫系统的形成和调节至关重要,由于肠腔内有大量外源性抗原,免疫系统必须严格调节其反应以维持与共生菌的共生关系。共生体传递一种信号,诱导宿主免疫的耐受性反应。因此,宿主可以区分有益的本土微生物和有害病原体,并建立健康的微生物群。
变形杆菌的主要分类及其与IBD的关系

Mukhopadhya I, et al., Nat Rev Gastroenterol Hepatol. 2012
为了防止对共生细菌的炎症反应,肠道内的免疫细胞,如单核吞噬细胞(巨噬细胞和树突状细胞)和 CD4 + T 细胞,对微生物刺激反应迟钝或表现出共生反应。
同时,黏膜免疫系统负责清除病原体,这一过程需要积极的促炎信号级联反应。因此,不适当的免疫反应会破坏肠道稳态,引发生态失调,并导致局部和全身炎症和代谢功能障碍。
这种慢性进行性肠道炎症的状态在临床上被诊断为炎症性肠病 (IBD),其中包括溃疡性结肠炎 (UC) 和克罗恩病 (CD)。IBD 的确切病因仍然无法获得,但新出现的证据表明,肠道微生物群成为了这种疾病的主要嫌疑。
许多研究报告了动物和人类各种炎症持续条件下微生物群组成的改变。在这种情况下,通常发现变形菌在疾病中增加,变形菌在肠道炎症中的作用已在各种结肠炎小鼠模型中得到解决,与疾病呈正相关。
例如,使用易发炎症的小鼠模型,即鞭毛蛋白受体 TLR5 缺陷小鼠 (T5KO),发现,进展为结肠炎的小鼠表现出明确的微生物群特征,其特征是变形菌的水平增加,尤其是大肠杆菌属。并且一些作者已将其确定为微生物群不稳定性的潜在标志物,因此易诱发疾病发作。
与变形杆菌属大量繁殖的同时,结肠炎Tlr5-/- 小鼠表现出杂乱无章的结肠粘液层,与非结肠炎Tlr5-/- 同胞相比,感染性病原体的清除延迟。
这些结果表明,短暂不稳定的肠道微生物群,尤其是以变形菌为主的群落,会使遗传易感的小鼠易患慢性结肠炎。
先天免疫反应失调推动变形杆菌生长的假设这反过来又会促进肠道炎症,这一点得到了其他小鼠模型研究的支持,这些小鼠模型具有影响适应性免疫的突变,白细胞介素 (IL)-10 是对本地微生物群产生免疫耐受所需的主要免疫调节细胞因子。
IL-10 缺陷小鼠由于对肠道菌群不耐受而表现出自发性结肠炎。随着结肠炎症的发生和发展,在定植常规微生物群或缺乏特定病原体的微生物群的 IL-10-/- 小鼠中,变形杆菌和大肠杆菌比野生型小鼠多。
在另一项对 IL-10 缺陷小鼠的研究中,富含饱和乳脂的饮食扰乱了肠道微生物群,导致亚硫酸盐还原Delta-proteobacteriumBilophila wadsworthia 大量繁殖。这种病原菌在 IL-10 -/-小鼠中诱导促炎性黏膜免疫反应并促进自发性结肠炎的发生率和严重程度;它还在喂食高乳脂饮食的野生型小鼠中促进葡聚糖硫酸钠 (DSS) 诱导的结肠炎。
除了对结肠炎的易感性与肠道变形菌的相对丰度之间存在正相关性之外,对先天性和适应性免疫系统均缺陷的小鼠的研究提供了支持变形菌在肠道炎症中的致病作用的证据。
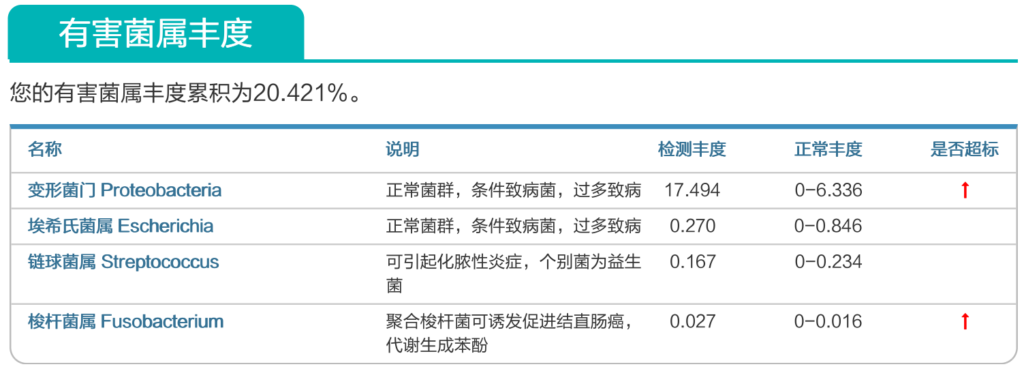
来源:谷禾健康肠道菌群数据库
谷禾健康肠道菌群检测大数据也显示,在炎症性肠病,结直肠癌等患者的肠道菌群检测报告中,85%以上的患者显示变形菌门超标或多项变形菌门病原菌超标或占比丰度偏高。
在最近的一项研究中重现了,结肠炎中变形杆菌的显着扩增,该研究比较了患有活动性结肠炎的 TRUC 小鼠的肠道微生物组与因庆大霉素、甲硝唑或抗肿瘤坏死因子 (TNF)-α 治疗而缓解的小鼠的肠道微生物组。
值得注意的是,从 TRUC 小鼠的粪便中分离出的两种肠杆菌科细菌(肺炎克雷伯菌和奇异变形杆菌)即使在没有任何遗传免疫缺陷的受体小鼠中也足以引发结肠炎。
然而,这两种微生物的致结肠潜力并未在无菌 TRUC 小鼠中复制,这表明结肠炎的发病机制需要其他共生成员。口服伤寒杆菌,另一种富含 TRUC 小鼠的变形菌,也会在非结肠炎 TRUC 小鼠中引发结肠炎,这些小鼠具有大量的促炎细胞因子(例如,TNF-α)。
遗传易患结肠炎的小鼠的生态失调与人类 IBD 特别相关,因为与 IBD 相关的风险等位基因或多态性与先天性和适应性免疫成分有关。与小鼠研究相似,两项人类研究表明,与健康受试者相比,IBD 患者肠道微生物群落的特点是微生物多样性低、变形菌门(尤其是肠杆菌科)的产物以及厚壁菌门的减少。
一项人类队列研究发现,核苷酸结合寡聚化结构域 (NOD)-2 风险等位基因剂量与 IBD 患者肠道标本中肠杆菌科的相对丰度呈正相关。
在 UC 患者中,与炎症的中度和轻度阶段相比,在严重阶段观察到的变形杆菌水平显着升高。
在新发 CD 的初治儿科患者和非 IBD 对照受试者之间,回肠和直肠活检(但不在粪便样本中)的粘膜相关微生物组存在明显差异。变形菌的相对丰度增加,包括肠杆菌科、巴氏杆菌科和奈瑟菌科,将 CD 相关细菌群落与健康对照组区分开来。与慢性炎症一致,伴随变形杆菌属优势的肠道微生物群落改变不仅见于传染性病原菌或原生动物寄生虫引起的急性炎症,而且见于实验性和人类结肠炎相关的结肠直肠癌。
最有趣的生物体,通过一个孤立的病例报告与 IBD 有关,该病例报告一名感染这种细菌的小男孩在放射成像上出现回肠增厚,这是克罗恩病的典型表现。
血清学研究表明,与健康对照相比,克罗恩病患者的大肠杆菌抗体数量增加。具体地说,已发现37-55 % 的克罗恩病患者、2-11% 的溃疡性结肠炎患者和 <5% 对照组患者的百分比。
此外,克罗恩病患者中这些抗体的存在与更严重的表型相关,其特征是小肠受累、疾病进展频繁、病程更长和对手术的需求更大,这表明它们可以用作克罗恩病的预后标志物。
饮食被认为是塑造肠道微生物结构的最关键的环境因素之一。
△ 肥胖:丰富的变形菌为特征
累积证据表明,人类和啮齿动物的健康和肥胖个体的肠道微生物群的分类和功能组成存在差异。
此外,肥胖表型通过粪便移植的传播能力表明肠道微生物群落的改变,作为主要触发因素,是因果关系而不是结果。
肠道微生物群的分类组成失衡,称为生态失调,在代谢紊乱中得到充分证明,并被视为厚壁菌门相对于拟杆菌门的相对丰度增加(F:B 比率)。尽管一致的研究结果普遍支持这一概念,但代谢紊乱期间的生态失调通常包括变形菌的患病率增加。
例如,一项对儿童肠道微生物群的研究发现,与低脂肪、高纤维饮食儿童相比,食用高热量、高脂肪、低纤维饮食的欧洲儿童中的变形杆菌数量更多。
这种差异揭示了肠道微生物群落对非洲儿童饮食的适应性,这可以提高他们从难消化的多糖中获取能量的能力。此外,一些导致有害代谢影响的因素,例如食用无热量的人造甜味剂和乳化剂(通常用作加工食品中的添加剂),也会损害血糖控制并诱发变形杆菌繁殖。
特别是,人造甜味剂介导的肠杆菌科和Delta-proteobacteria类相对丰度的升高与 2 型糖尿病 (T2DM) 患者的结果一致,表明葡萄糖稳态和肠道变形菌之间存在联系。相比之下,证明变形菌的丰度与糖尿病表型呈负相关,挑战代谢疾病患者中高丰度变形菌的概念。
为支持代谢紊乱与变形菌属的扩张之间的关系,变形杆菌属的致肥胖潜力已在无菌小鼠的单关联研究中被确定。
在对一名病态肥胖志愿者进行的减肥试验中,肠杆菌科的相对丰度逐渐减少,假设肠杆菌在代谢恶化中具有致病作用。用从肥胖的人类肠道中分离出来的阴沟肠杆菌B29对无菌小鼠进行单菌定植足以诱导肥胖和胰岛素抵抗。
这一发现支持了这样一个假设,即以丰富的变形菌为特征的不稳定的肠道微生物群落可能代表代谢紊乱的主动特征,而不是被动后果。
△ 营养不良儿童:变形菌成为优势菌
营养不良会导致其他健康问题,例如消瘦和夸希奥科病。在发展中国家,营养不良是威胁 5 岁以下儿童生命的疾病。
营养不良的主要病因是在孕期或产后头 3 年由于大量营养素缺乏和微量营养素缺乏导致的慢性能量负平衡。
然而,最近的研究表明,孟加拉国和马拉维营养不良儿童的肠道微生物群落结构和基因含量与营养良好的儿童不同。在这些研究中,在营养不良的儿童中普遍观察到变形菌的优势和肠道微生物群的低多样性,并被认为是肠道微生物群成熟的障碍。
此外,最近的一项研究揭示了肠杆菌科细菌与营养不良下的肠道黏膜免疫球蛋白 A (IgA) 反应之间存在机制上的相互关系,这会引发肠病并中断黏膜免疫的发展和健康微生物群的组装。
鉴于生态失调驱动的选择压力似乎干扰了微生物群的稳定性,变形菌随后借此机会增加了它们的适应性。微生物群落在异常代谢条件下的不稳定性已被解释为对定植的抵抗力受损。
当接种来自肥胖人类供体的培养细菌(“肥胖受体小鼠”)的无菌小鼠与携带来自瘦肉供体的细菌物种(低脂肪、高纤维饮食)的小鼠共同饲养时,它们被瘦肉有效定殖供体来源的细菌菌株及其肥胖表型得到改善。相比之下,瘦小鼠没有被来自肥胖小鼠的外源或外源细菌菌株定殖。
这一发现表明,生态失调的特点是传播能力减弱和对定植的抵抗力。鉴于 kwashiorkor 儿童的肠道微生物不成熟且富含肠道病原体营养不良被认为与对殖民化的抵抗力有缺陷有关。
总的来说,这一间接证据导致了这样一种观点,即肠道变形菌的扩张反映了宿主的能量不平衡和不稳定的微生物群。有趣的是,在非疾病状态下,如新生儿期和胃绕道手术后也观察到肠道微生物群落的不稳定结构和高丰度的变形菌。
与大多数细菌一样,在细胞外环境中对变形菌的初步识别是通过病原体识别受体 (PRRs) 发生的,PRRs 识别微生物相关分子模式 (MAMPs)——一个包括病原体相关分子模式 (PAMPs) 和危险相关分子模式的统称分子模式(DAMP)。
这些信号受体可分为三个家族:
尽管至关重要的是,只有 TLR 家族参与识别肠细胞表面的细菌配体。
存在于变形菌细胞表面的主要 MAMP 是脂多糖 (LPS) 和鞭毛蛋白,它们分别被 TLR4 和 TLR5 识别。其他参与细菌识别的TLR包括检测细菌脂蛋白的TLR2和检测未甲基化 CpG DNA 的细胞内受体 TLR9。
LPS 的产生和鞭毛组装是在原核生物中观察到的两个最动态的过程,这些结构组成的巨大差异反映在不同变形菌家族成员中观察到的先天免疫反应的强度和方向上。例如,弯曲杆菌和螺杆菌属LPS 与大肠杆菌LPS 的不同之处在于具有更长的酰基链和增加的链连接和脂质 A 磷酸基团的修饰。
在许多病原生物体(例如百日咳杆菌和幽门螺杆菌)中观察到脂质 A 锚中的一个或两个磷酸基团丢失,并且已被证明可提供对抗菌肽的抗性。
参与细菌识别的 TLR 的遗传变异与 IBD 相关。2010 年发表的一项荟萃分析表明,TLR4 Asp299Gly 和 Thr399Ile 变体都赋予白人患克罗恩病和溃疡性结肠炎的统计学显着风险。有趣的是,这两种变体都位于 LPS 结合域内 TLR4 的胞外域,并且被认为会影响蛋白质的二级结构。
这些功能变体的存在已被证明会影响 LPS 反应性,并使个体更容易受到革兰氏阴性菌的感染。证据还表明,这些遗传变异的存在可能会影响基础免疫状态。
因此,有理由推测,在 TLR4 基因变异的携带者中,在营养不良事件之前或期间发生的免疫反应改变,可能足以驱动 IBD 发生不可挽回的免疫反应改变。TLR9 中的遗传变异也与 IBD 易感性增加有关。证据不如TLR4那样令人信服,尽管这一警告可能反映了 TLR9 处理来自所有细菌的配体而 TLR4 反映革兰氏阴性菌易感性的事实。
变形菌门是肠道菌群中四个主要门(厚壁菌门、拟杆菌门、变形菌门和放线菌门)中最不稳定变化最快的门。变形菌门作为一线反应者,对环境因素(如饮食)反应敏感。
总的来说,迄今为止的许多研究都支持这样一个概念,即肠道中大量变形菌反映了生态失调或不稳定的肠道微生物群落结构。除了外源性肠致病性变形杆菌外,健康的哺乳动物肠道还含有数种属于该门的共生细菌,作为其天然肠道菌群。
这些细菌在比例较小时似乎是良性的,而在某些肠道环境下,它们会变成可引发炎症反应甚至代谢障碍。
然而,肠道中变形菌的长期富集可能代表不平衡的不稳定微生物群落结构或宿主的疾病状态。因此,时间顺序监测,而不是横断面研究,可能是根据肠道中变形菌的比例确定疾病风险的更好方法。
在健康肠道中,免疫系统严格调节其反应以维持与共生菌的共生关系。这种可能性表明存在正反馈循环。环境或宿主因素(例如低纤维饮食和急性或慢性炎症)破坏体内平衡,具有选择性并导致肠道内大量变形菌的生态失调。由于宿主无法保持共生的变形菌而导致变形菌的不受控制的扩张,在一小部分和微生物群落对定植的抵抗力降低的情况下,可以进一步促进炎症或外源性病原体的入侵。
因此,切断反馈回路的策略可能包括优化肠道微生物群和宿主之间的伙伴关系。鉴于大多数研究已经在与宿主生理学相关的背景下描述了微生物群落状态,因此对于未来的炎症和代谢干预治疗,首先需要判别变形菌的丰度以及是其是否不受控制扩张,另外需要确定变形杆菌大量繁殖的原因以开发有效的治疗方法。
主要参考文献:
Rizzatti G, Lopetuso LR, Gibiino G, Binda C, Gasbarrini A. Proteobacteria: A Common Factor in Human Diseases. Biomed Res Int. 2017;2017:9351507. doi: 10.1155/2017/9351507. Epub 2017 Nov 2. PMID: 29230419; PMCID: PMC5688358.
Mukhopadhya I, Hansen R, El-Omar EM, Hold GL. IBD-what role do Proteobacteria play? Nat Rev Gastroenterol Hepatol. 2012 Feb 21;9(4):219-30. doi: 10.1038/nrgastro.2012.14. PMID: 22349170.
Litvak Y, Byndloss MX, Tsolis RM, Bäumler AJ. Dysbiotic Proteobacteria expansion: a microbial signature of epithelial dysfunction. Curr Opin Microbiol. 2017 Oct;39:1-6. doi: 10.1016/j.mib.2017.07.003. Epub 2017 Aug 4. PMID: 28783509.
Shin NR, Whon TW, Bae JW. Proteobacteria: microbial signature of dysbiosis in gut microbiota. Trends Biotechnol. 2015 Sep;33(9):496-503. doi: 10.1016/j.tibtech.2015.06.011. Epub 2015 Jul 22. PMID: 26210164.
Shin NR, Whon TW, Bae JW. Proteobacteria: microbial signature of dysbiosis in gut microbiota. Trends Biotechnol. 2015 Sep;33(9):496-503. doi: 10.1016/j.tibtech.2015.06.011. Epub 2015 Jul 22. PMID: 26210164.
Rigottier-Gois L. Dysbiosis in inflammatory bowel diseases: the oxygen hypothesis. ISME J. 2013 Jul;7(7):1256-61. doi: 10.1038/ismej.2013.80. Epub 2013 May 16. PMID: 23677008; PMCID: PMC3695303.

谷禾健康
一般在肠道菌群健康检测报告中,会有主要菌属构成比例,类似下图:
图源:谷禾肠道菌群健康检测报告我们可以看到图中列举了拟杆菌门,厚壁菌门…等。很多小伙伴拿到报告之后,对于这些细菌门表示困惑。
这些细菌门都代表了什么意思?
某个细菌门比例高了会怎么样?
某个细菌门比例高,是好是坏?
是不是与某些疾病相关?
…….
实际上,这几大类门的丰度和构成比例变化与人类健康和疾病发生息息相关。
两个主要门类,拟杆菌门和厚壁菌门,构成人类肠道细菌的大部分。七岁以后,拟杆菌和厚壁菌之间的比例相对稳定,而它们比例紊乱可能会导致肥胖和糖尿病等代谢综合征。
本文,我们就给大家详细介绍一下这其中最常见的几大细菌门:
拟杆菌门、厚壁菌门、变形菌门、放线菌门。
为什么选这四大细菌门?
依据自然属性分类,人类肠道菌群已经鉴定出细菌的几十个门,包括:拟杆菌门、厚壁菌门、变形菌门、放线菌门、疣微球菌门、梭杆菌门、蓝藻菌门、螺旋体门等。 但是其中98%的肠道菌可以归属为前四类,拟杆菌门、厚壁菌门、变形菌门和放线菌门,大多数人这4个门的菌占据肠道细菌数量的99%。 了解这四大细菌门,可以说你对大部分人体内肠道菌群的有了一定的了解。
▲ 拟杆菌 :革兰氏阴性菌
不形成孢子 厌氧菌 杆菌 ▲
它们具有外膜、肽聚糖层和细胞质膜。它们无氧呼吸的主要副产物是乙酸、异戊酸和琥珀酸。
包括碳水化合物的发酵、含氮物质的利用以及胆汁酸和其他类固醇的生物转化。大多数肠道细菌是糖酵解的,这意味着它们通过碳水化合物分子的水解获得碳和能量。
据估计,只有约 2% 的单糖通过上消化道到达结肠。因此,单糖可能不是拟杆菌的主要能量来源。然而,来自植物纤维的多糖,如纤维素、木聚糖、阿拉伯半乳聚糖和果胶,以及植物淀粉,如直链淀粉和支链淀粉,在结肠中更为普遍。
多糖还被证明可以诱导来自拟杆菌的多种葡糖苷酶活性,包括负责海带多糖降解的 β-1,3-葡糖苷酶活性以及多种 α、β-1,4 和 α、β–1,6 木糖苷酶和葡糖苷酶活性。大部分拟杆菌成员蛋白质组包括水解这些多糖的蛋白质。
表现出相当大的营养灵活性和对宿主和肠道环境施加的压力做出反应的能力。很难说肠道拟杆菌是否对宿主产生负面或正面影响。拟杆菌能够通过预防可能定植和感染肠道的潜在病原体感染来使宿主受益。由但是,在短链脂肪酸存在下,弱酸性 pH 值会抑制生长。诸如脆弱拟杆菌之类的致病物种已经开发出逃避宿主免疫系统的策略。
作为多糖降解联盟的成员,它们有助于从膳食纤维和淀粉中释放能量,它们很可能是丙酸盐的主要来源;然而,它们也参与了蛋白质分解过程中有毒产物的释放,这个群体的成员有一些可能有助于抑制炎症的活动,但他们也有可能促进炎症,有些是已知的机会性病原体。