 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

血清素,5-羟色氨(5-HT)不仅充当体内系统的神经递质和激素,而且还是胃肠系统中的旁分泌信使。
5-HT神经元系统起源于中脑中缝核,下面示意图强调了血清素(5-HT)神经元与释放不同神经递质的其他神经元以及神经胶质细胞之间的解剖相互作用。
中枢神经系统几乎所有区域的神经末梢都会释放5-HT。换句话说,可能很难找到不受5-HT调节的神经元/细胞通信的单一参与者。血清素是一种抑制性神经递质,会抑制其它神经递质的分泌,比如(多巴胺,肾上腺素等)。所以它有时也被人们称为:“幸福激素”或“幸福神经递质”。
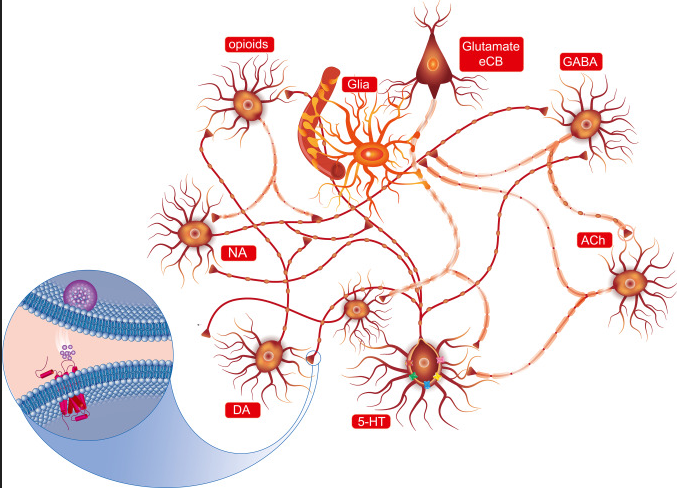
目前(血清素)5-HT系统是开发治疗中枢神经系统疾病药物的重要靶点。但是血清素仅有5%左右来自中枢神经产生,体内大约95%的血清素是由肠嗜铬(EC)细胞(胃肠道中最常见的神经内分泌细胞类型)通过感测来自肠腔和循环系统的信号合成和分泌的。肠道菌群及其代谢物、营养物质和激素是调节EC细胞分泌5-HT的主要因素。要注意,由于5-HT不能穿过血脑屏障,中枢和外周5-HT系统在解剖学和功能上是分开的。
循环血小板可以从胃肠道中隔离5-HT,并将其存储或需要时释放以促进止血并将其分布到身体各个部位。因此,肠道来源的5-HT调节多种功能,包括肠运动和分泌反射、血小板聚集、葡萄糖稳态、免疫反应和骨骼发育和心脏功能。
此外,血清素的生理作用受到多种蛋白质的调节,这些蛋白质调节其合成、储存、释放、再摄取和降解。血清素信号传导由至少14种不同的受体介导。
研究发现血清素传输的改变发生在许多中枢神经系统(CNS)疾病中,血清素过低或血清素使用障碍与精神分裂症、焦虑症、抑郁症、成瘾、癫痫、肥胖、强迫症、多发性硬化症、帕金森病和阿尔茨海默病的有关。因此,各种精神活性药物和药物的作用通常通过直接或间接机制涉及5-HT系统。
血清素产生和随后分解的速度之间的相对平衡是决定一个人拥有多少可用的“活性”血清素的主要因素之一。研究表明,一些补充剂能够增加血清素水平,如色氨酸,抗抑郁药物,维生素D、omega-3脂肪酸和某些益生菌,具有较强证据支持。此外,阳光照射,适当锻炼、积极思考、社交互动等也是增加血清素的重要手段。
与此同时,由于药物、补充剂或草药的组合导致也会血清素升高至不安全水平而引起血清素综合征。它可能导致意识混乱、发烧、呕心、不自主的肌肉痉挛、癫痫发作甚至死亡。任何食用改变血清素水平的产品的人都应该注意到这些症状。
然而,迄今为止,缺乏在体内相关探测这种难以捉摸的神经递质所需的有效工具。最近的技术进步,例如血清素 FSCV(”阶段性”测量)和 FSCAV(”环境”测量),刚刚开始揭示血清素活性对行为相关时间尺度的复杂性和影响。此外,血液高效液相色谱法也被用来测定血清素水平。
但是,血清素的变化受多方面因素的影响,其中大部分血清素是在肠道产生的。血清素与肠道菌群之间存在密切关系。因此利用肠道菌群的大数据库可以帮助我们从新的角度评估血清素,尤其是肠源性血清素的变化尺度和动态,可以反映个体整体的生理状态和代谢特点。
本文将探讨血清素的发现进化及其与光的作用,产生代谢,影响的生理功能和疾病,以及增加血清素水平的潜在自然方法。此外还有血清素综合征的定义,危害以及注意事项。希望本文的能够为5-HT在营养、临床医学和健康领域的应用提供一些见解。
血清素存在于身体的大部分器官中,例如皮肤、肠道、肺、肾、肝脏和睾丸中,以及地球上几乎所有生物体中,包括真菌、植物和动物中。血清素在系统发育上很古老,并且在植物和神经元出现之前就已进化。
根据文献,血清素的进化始于近三十亿年前单细胞生物中的前体色氨酸。色氨酸合成血清素需要氧气和光。保守的血清素生物合成途径始于蓝藻、绿藻和真菌的单细胞系统,并不断进化到目前在人脑中的位置。
▸ 阳光对血清素的合成以及水平有重要影响
血清素进化分析中出现的一个重要概念是它与光的关系。从色氨酸吲哚环的光吸收特性开始,随着系统发育的进一步发展,阳光对人类的血清素水平以及情绪、睡眠和自杀意念都有影响。与色氨酸结合并减轻与季节性情感障碍(SAD) 相关的抑郁症的最有效的光类型是蓝光。
色氨酸的光捕获特性归因于其吲哚结构。叶绿体中的色氨酸合成特别高,叶绿体吸收蓝光波会激发色氨酸的吲哚结构,使其失去吲哚环结构中的一个电子,从而被氧化。叶绿体细胞器含有色氨酸合成所需的基因和酶,类似于蓝细菌中的基因和酶。水果、蔬菜和坚果中的色氨酸含量要高得多。
拓展:除此之外,色氨酸产生烟酸及其所有前体。 NAD+和NADP+辅因子几乎参与细胞代谢的所有方面。从色氨酸从头合成NADH是这些辅酶比利用膳食烟酰胺或烟酸更重要的来源。在细胞核中,烟酸对于DNA修复很重要,并且色氨酸捕获光似乎是导致DNA光损伤的原因,该损伤与突变和缺乏修复的细胞死亡相关。
尽管光合作用具有营养价值,但对细胞来说却是一个主要风险。破坏光收集率和光利用率之间的平衡会扰乱光合作用,导致活性氧(ROS)的产生。如果不加以控制,活性氧会损害蛋白质功能和膜完整性,并对光合生物构成严重威胁。色氨酸产生荧光光产物,抑制培养的受精海胆卵和小鼠成纤维细胞的生长和分化。
因此,从细菌到哺乳动物的多种细胞都会受到光氧化色氨酸的损害。阳光对人体皮肤造成的损害很大程度上归因于色氨酸通过吡咯酶、犬尿氨酸和烟酸途径代谢的作用。
大约于1937年从纯化浓缩的牛血清中鉴定出一种具有吲哚核的血管收缩物质,并将其命名为“5-羟色胺”(5-HT)。5-HT后来被称为“血清素”,该术语源自其衍生物“血清”及其调节血管内张力的能力。
1960年,人们发现肠道是5-HT生物合成的主要枢纽;对大鼠进行全胃肠切除术导致尿液中5-HT和主要代谢物5-羟基吲哚乙酸(5-HIAA)大幅减少。这一发现以及大脑中完整的5-HT水平表明,神经元5-HT生物合成独立于其肠道来源。
▸ 血清素(5-HT)合成
人体也是从色氨酸生物合成血清素。色氨酸被色氨酸羟化酶(TPH)分解,产生前体5-羟基色氨酸(5-HTP),然后被氨基酸脱羧酶(AADC)转化为5-HT。
TPH是5-HT合成中的特异性限速酶,它包含两种亚型,即TPH1和TPH2。TPH1负责外周5-HT的合成,主要在肠道肠嗜铬(EC)细胞中表达。TPH2主要表达于中枢神经系统(脑干裂齿核)和肠神经系统 。
色氨酸羟化酶(TPH)需要分子氧(O2)和四氢生物蝶呤(tetrahydrobiopterin,简写为BH4)作为共底物。该酶对亚铁(Fe2+)有绝对需求。
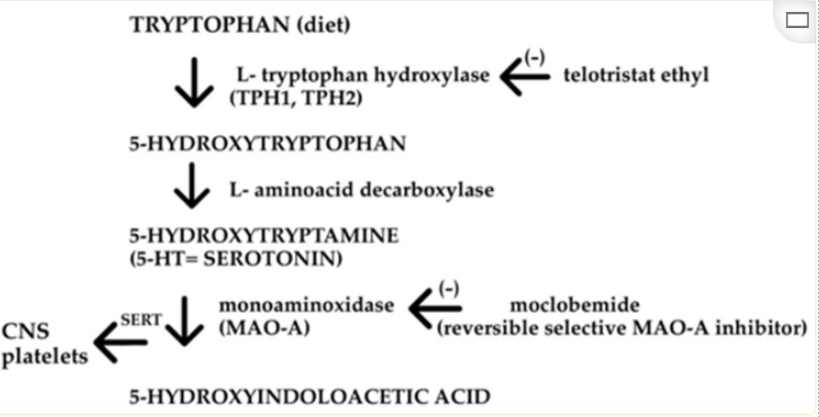
Guzel T and Mirowska-Guzel D.Molecules.2022
拓展:
四氢生物蝶呤(tetrahydrobiopterin)是一种天然存在的营养素,简写为BH4。是参与5-羟色胺、多巴胺、去甲肾上腺素、肾上腺素、褪黑素、一氧化氮生物合成的酶的重要辅助因子;
四氢生物蝶呤缺乏症是一种常染色体遗传性疾病,是迄今得以确认的5000~6000种人类的罕见病之一,四氢生物蝶呤缺乏症通过对新生儿进行疾病筛查,检出高苯丙氨酸血症(HPA)后可得到进一步确诊。BH4缺乏症主要会对人的神经系统造成损害,导致患儿出现智力低下、癫痫等症状。
♢色氨酸羟化酶活性影响血清素的水平
色氨酸羟化酶(TPH)是神经递质血清素 (5-HT) 生物合成中的限速酶。因此,TPH催化活性的增加或减少会导致神经元5-HT含量的相应变化。
TPH需要还原蝶啶辅助因子、分子氧和非血红素铁来羟基化其底物L-色氨酸。这四个因素中任何一个的组织含量的改变都可能改变TPH活性。TPH的翻译后修饰,包括磷酸化和半胱氨酸氧化,会导致其催化活性发生显著变化。
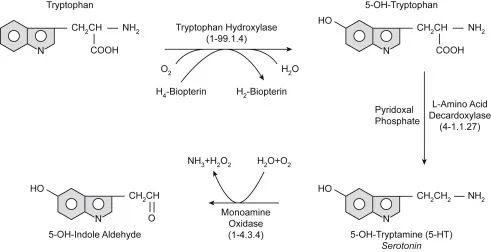
doi.org/10.1016/B978-0-444-64125-0.00001-3
上图显示了从色氨酸合成血清素的过程。色氨酸羟化酶和一般L-氨基酸脱羧酶的作用与必要的辅助因子一起显示。血清素代谢为5-OH-吲哚醛,与生长素(吲哚醛)类似,生成过氧化氢(H2O2 )。血清素也是脊椎动物合成褪黑激素的前体。
♢肠嗜铬细胞合成全身95%的血清素
除了在CNS(中枢神经系统)中合成外,胃肠粘膜内的肠嗜铬细胞(EC细胞)合成和分泌高达95%的全身血清素,也存在胰岛、乳腺和脂肪组织中。这些细胞对化学和机械刺激做出反应,但也收集来自肠道微生物群的信号以释放血清素。
肠嗜铬细胞(EC细胞)细胞激活将血清素释放到附近细胞的间隙中。 EC细胞感知胃肠道内的餐后变化,包括pH值、营养和毒素。
EC细胞产生高浓度的血清素,而调节系统从肠道间质空间去除高水平的血清素,该调节系统抑制血清素能传递并防止血清素中毒。血清素在肠细胞中循环或隔离以去除间质血清素。肠粘膜的肠细胞通过 SERT 吸收血清素,单胺氧化酶将其分解,然后粘膜下毛细血管将血清素转运到血液中。
▸ 血清素的吸收
我们现在知道,几乎血液中的所有5-HT都由血小板携带,血小板不会产生5-HT,而是在肠道循环时吸收它。因此,血清素在肠道中分泌并被血小板吸收后,就变成了“血清血清素”。
一旦5-HT被释放到固有层,它就会通过血清素再摄取转运蛋白(SERT)被上皮细胞吸收。接下来,5-HT 扩散到血流中,被血小板吸收并转运到外周靶组织。然而,血清素在体内可以通过多种方式被吸收和代谢,并且其吸收可以根据给药途径而变化。
一般来说,口服血清素不容易被吸收,因为它的活性形式很难穿过血脑屏障。中枢和外周血清素库在功能上彼此不同,因为它们分别控制大脑和外周区域的血清素依赖性行为。这就是为什么脑细胞必须从L-色氨酸或5-羟色氨酸(5-HTP)(L-色氨酸的副产品)产生自己的血清素。
注释:血清素再摄取过程,例如细胞X若是释放出了很多血清素,与其相靠近的细胞Y就会检测到周围血清素浓度的变化。信号发出后一段时间,细胞X会“回收”周围的血清素。这个过程叫神经递质的再摄取。再摄取不仅可以减少细胞X所需要生成的血清素,更能控制细胞之间信号的的传输。
▸ 血清素(5-HT)降解
过量的血清素以及大脑和肠道会通过几种不同的机制“失活”。例如,称为血清素转运蛋白的蛋白质可以有效地“清理”或“去除”(重新摄取)神经突触中的血清素,并将其带回神经元中以供重复使用,或者,释放到血液中的血清素要么被血小板吸收,要么在肝脏和肺部被单胺氧化酶(MAO-A)、乙醛和乙醇脱氢酶等酶分解(代谢)。
血清素主要被单胺氧化酶(MAO)分解代谢为5-羟基吲哚醛(5-HIA),然后被醛脱氢酶(ALDH)代谢为5-羟基吲哚乙酸(5-HIAA)。
单胺氧化酶有两种亚型:MAOA和MAOB。前者对5-HT的亲和力较高。5-HT也可以通过芳烷基胺N-乙酰基转移酶(AANAT)代谢为N-乙酰基血清素(NAS),随后通过羟基吲哚O-甲基转移酶(HIOMT)转化为褪黑激素。
此外,吲哚胺2,3-双加氧酶(IDO)对色氨酸、5-HTP、5-HT和褪黑激素等多种血清素通路成分的吲哚部分具有广泛的底物特异性。因此,5-HT也可以通过IDO进入犬尿氨酸途径。与抑郁症相关的血清素减少和犬尿氨酸增加与IDO活性有关。因此,除了Tph之外,犬尿氨酸途径对于调节血清素合成和可用性至关重要。
▸ 血清素周转和传递的复杂性
血清素(5-HT)在体内的周转速度非常快,尽管大脑中的5-HT含量只占体内总量的很小一部分(3%~5%),但在大脑中的循环速度却非常迅速。
♢血清素的周转速率非常快
研究表明,在健康的大鼠身上,5-HT的周转速率为15分钟到一个多小时。使用多室模型时,5-HT的合成、释放和降解可以被视为“后进先出”,这意味着这些过程发生得非常迅速,不到5分钟就会完成。
5-HTP是5-HT的前体,无需转运蛋白即可轻松穿过血脑屏障,并增加大脑5-HT水平,从而产生抗抑郁样作用。然而,5-HTP的快速药代动力学(在人体中的半衰期约为2小时)使其作为药物不切实际,神经药理学界将注意力转向更有效和安全的选择性血清再吸收抑制剂(SSRI)。
SSRIs可以通过阻断血清素转运蛋白(SERT)来提高大脑中细胞外5-HT水平,从而具有抗抑郁功能。根据临床反馈,目前SSRIs的药理潜力有限,只有三分之一的患者在治疗后情绪得到改善。因此,单独使用SSRIs抑制SERT活性可能不足以提高细胞外5-HT水平以引发大脑的抗抑郁反应,而用第二种协同药物治疗抑郁症则可以提高细胞外5-HT水平,从而超出其效果(这个不在本文讨论范围,下次有机会再讨论SSRIs与其他药物的协同互作)。
▸ 血清素(5-HT)受体
哺乳动物的受体存在巨大的多样性。有数百个血清素受体克隆,人脑至少有20个独立的5-HT受体神经元转录本。血清素与人脑中至少14种特定受体蛋白特异性结合,调节神经元中的离子通道、c-AMP 水平和激酶活性。
5-HT受体存在于身体的每个细胞中。为什么这么多,为什么分布这么大?可以推测,是由于动物体内制造和获取色氨酸的困难导致血清素利用率低。受体的功能是警告细胞环境中存在化学物质,而不去除或改变化学物质。
♢人体拥有众多的血清素受体
因此,如果化学物质供应短缺,受体分子的出现允许其作用传递到整个生物体。为了使其发挥最大效果,需要一种有效的血清素分配机制。动物的血液中含有特定的色氨酸和血清素结合蛋白,有助于将这些分子转运到特定的目标区域,例如大脑。
血脑屏障交界处的神经胶质细胞具有特殊的转运蛋白,用于浓缩色氨酸并将其递送至血清素神经元。血清素能神经元发育出长的无髓鞘轴突,可以吸收色氨酸并利用整个大脑和肠道合成血清素所需的酶。总之,色氨酸的丧失促进了高度分支、无髓鞘的神经网络和大量特定受体的形成,以最大限度地发挥血清素的作用。
迄今为止,已鉴定出14种血清素能受体,可以精确、快速地传递血清素的神经化学信息。此外,多种机制影响血清素再摄取,包括除SERT之外的其他单胺转运蛋白(例如多巴胺转运蛋白[DAT]、去甲肾上腺素转运蛋白[NET]和有机阳离子转运蛋白[OCT])对血清素的混杂再摄取。进一步强调该系统的复杂性,对血清素再摄取的显著控制是通过与SERT偶联的G蛋白的血清素自身受体实现的。
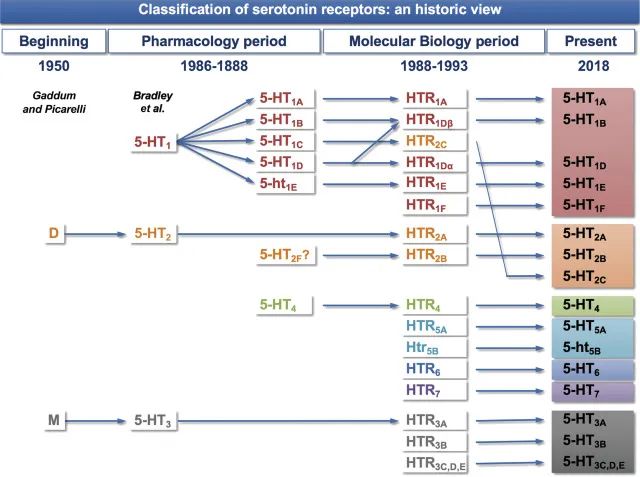
doi.org/10.1016/B978-0-444-64125-0.00005-0
过去了近10年。 5-HT受体的数量保持不变:14种受体亚型分为7个家族。
新发现与表达5-HT受体的细胞表型的鉴定及其与其他相关神经递质和神经递质受体的共定位有关,其中一些在神经元中,另一些在神经胶质细胞或星形胶质细胞中。免疫组织化学的应用增加了有关这种共定位的新信息。许多研究都集中在与偏头痛相关的大脑区域中5-HT受体的表达。
具有相似化学结构的血清素代谢物在细胞外的浓度可能比血清素本身高出近500倍,进一步阻碍测量,表明代谢过程很复杂。快速再摄取机制与快速代谢相结合,不仅减少了血清素可检测的时间,而且一些代谢物已被证明会显著降低微电极检测探针的完整性。总之,这些情况使体内血清素的测量和理解以及最终血清素活性与行为的对应关系变得复杂。
▸ 血清素(5-HT)反馈
血清素神经元在形态、连接性、电生理参数和基因表达方面表现出相当大的多样性。血清素神经元具有多种共递质,包括GABA或谷氨酸,以及许多不同的神经肽。
这些神经元能通过相同的神经递质语言进行交流,感知并相互调节血清素的释放,形成反馈回路。
反馈机制包括直接和间接的多突触途径,调节血清素系统的功能。不同区域的血清素神经元对反馈抑制的敏感性存在差异,与行为环境有关。
♢血清素的反馈机制可能影响人体系统功能
反馈机制可能不是维持血清素神经元稳态的主要作用,而是控制系统功能的重要机制。反馈的改变可能与多种与血清素相关的疾病有关,血清素选择性再摄取抑制剂可能通过重新平衡不同亚群间的相互作用发挥作用。
总而言之,血清素系统内的大量反馈机制在调节网络动态和塑造血清素神经传递的时间和空间方面发挥着关键作用。
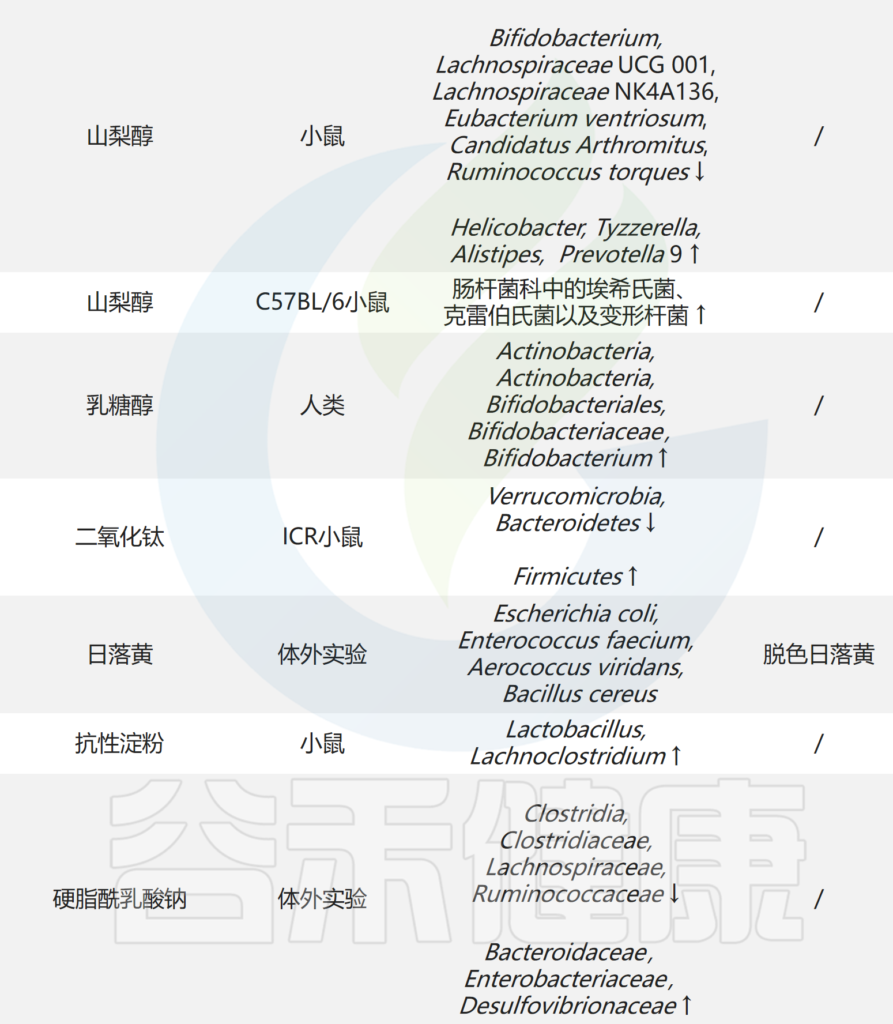
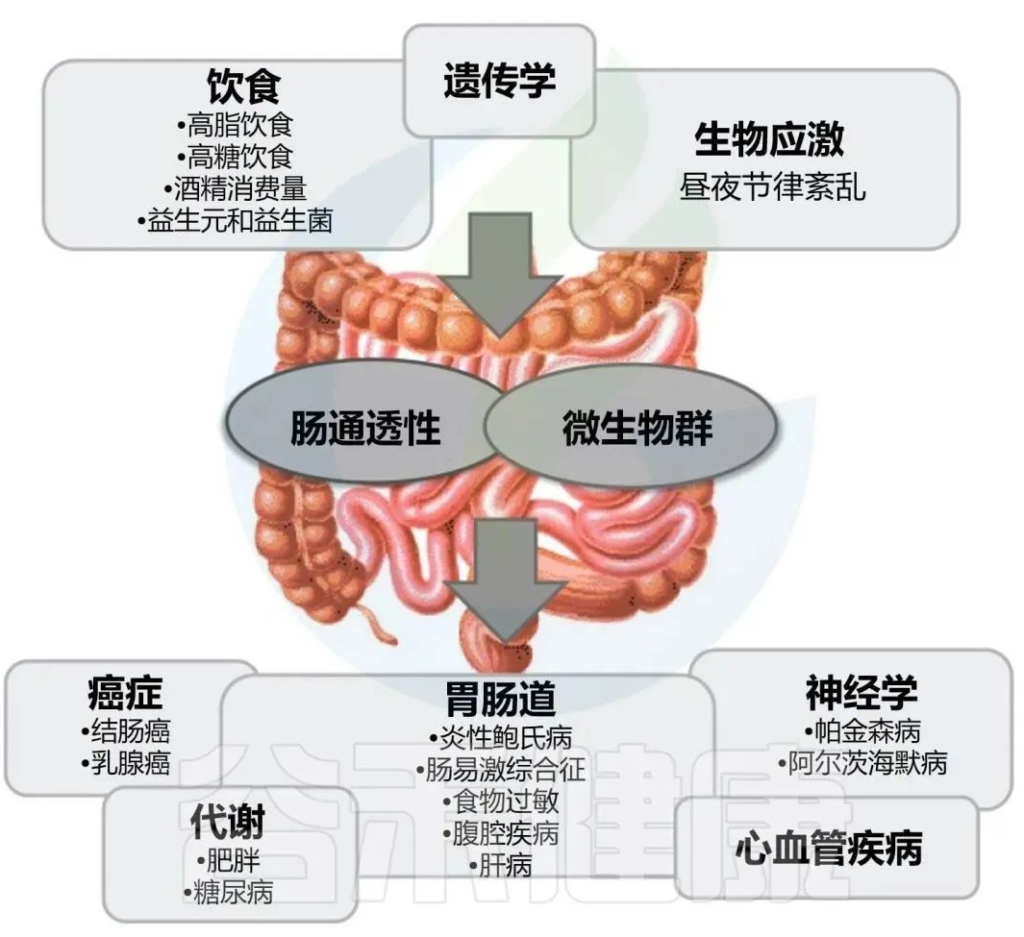
▸ 肠道微生物与血清素合成,传递
肠道微生物群可以通过多种机制影响大脑中的血清素水平和神经传递,包括肠道中血清素的产生、SERT的调节、免疫系统相互作用、迷走神经通讯以及短链脂肪酸等代谢物的产生。
使用无菌小鼠或抗生素相关微生物群扰动进行的干预研究提供了令人信服的证据,研究使用无菌(GF)和抗生素治疗的小鼠,这些小鼠的外周5-HT水平显著降低,这种现象在正常肠道微生物定植后会逆转,表明5-HT和肠道微生物群之间的新型相互作用对于维持肠道稳态至关重要。
♢肠道微生物群对合成血清素有重要影响
越来越多的证据表明,外周5-HT是宿主与微生物群相互作用的关键介质,这对于维持肠道健康至关重要。膳食色氨酸(Trp)的很大一部分要么进入犬尿酸途径,要么被肠道微生物分解代谢为吲哚;只有一小部分用于外周5-HT合成。话虽如此,肠道微生物却是宿主5-HT合成的重要介质,这一过程主要由微生物代谢物驱动,向EC细胞发出信号并促使宿主机通过TPH1生成5-HT。
此外,宿主血清素能系统受到TLR2的严格调节。TLR2激活会降低5—羟色胺转运蛋白(SERT)表达和活性,而高水平的5-HT对TLR2表达产生负反馈效应。与此同时,TLR2 缺陷的小鼠表现出结肠5-HT水平和Tph1表达降低,非造血细胞(很可能是肠上皮细胞)中TLR2的激活负责肠道中5-HT的产生。这些发现与之前的观察结果一致,即Akkermansia muciniphila的外膜蛋白(Amuc 1100)通过TLR2信号传导促进5-HT生物合成。
此外,多形拟杆菌和齿双歧杆菌已被证明可以通过短链脂肪酸(例如乙酸盐和丙酸盐)的作用恢复EC细胞网络,从而促进5-HT合成,并增加肠道5-HT水平。
相反,胃内施用假长双歧杆菌可通过减少EC细胞数量来降低结肠5-HT水平,而鼠李糖乳杆菌GG上清液则上调结肠中的SERT表达。
此外,一些细菌菌株,如大肠杆菌、肺炎克雷伯菌和植物乳杆菌,可以直接转化色氨酸以从头合成5-HT ,而一些葡萄球菌则表达葡萄球菌AADC(sadA)基因负责转化5-HTP至5-HT。尽管已有证据,但这些细菌中5-HT的生理功能以及这种细菌来源的5-HT是否与宿主具有任何生物学相关性仍然难以捉摸。
虽然肠道产生的血清素不能穿过血脑屏障,它会影响血脑屏障的通透性,从而导致大脑炎症。此外,肠道微生物群对迷走神经的刺激可以改变动物和人类大脑中血清素、GABA 和谷氨酸的浓度,无菌雄性小鼠实验表现出类似焦虑的行为,并改变大脑中血清素的丰度。
♢使用精神药物产生的个体副作用差异可能与肠道菌群有关
其实抗抑郁和治疗精神障碍的药物包括SSRIs引起的副作用存在个体差异的事实可以用肠道微生物失调来解释。肠道血清素能神经元参与肠道蠕动的调节,这一事实可以很好解释恶心、便秘或腹泻等不良反应。
最近来自一项专门针对大鼠的氟西汀的小型临床前研究,其中体重增加伴随着某些细菌菌株(例如乳酸菌)的破坏,已知乳酸菌与体重调节有关。从临床试验和临床经验来看,一些患者似乎特别反应大,并且可能因使用SSRIs而体重显著增加 。这是否是由于个体的肠道微生物组成造成的,这也可能未来治疗领域需要关注的领域。
然而,在许多不同的精神疾病中也检测到其水平的改变。一些胃肠道功能障碍的症状可能是由于神经内分泌免疫刺激导致中枢神经系统活动失调、外周水平(肠)失调或两者(脑肠轴)的组合所致。此外,多项研究证明了5-HT在肝脏中的促纤维化作用,表明它与血小板衍生生长因子协同作用,刺激肝星状细胞增殖。
♢血清素是宿主与微生物群互作的关键介质
最近的一项研究指出大约50%的肠道来源5-HT受到肠道微生物群的调节,特别是以梭状芽孢杆菌科(Clostridiaceae)和苏黎世杆菌属(Turicibacteraceae)为主的孢子形成细菌,对宿主肠道蠕动、止血和骨化产生下游影响。
虽然大部分肠道5-HT由肠嗜铬细胞从基底外侧分泌到周围肠道组织中,但一些肠嗜铬细胞含有的5-HT则从顶部分泌到肠腔中,这表明肠道微生物暴露于宿主-衍生的5-HT。事实上,微生物对宿主肠嗜铬细胞的影响不仅调节肠道组织和血液中的5-HT水平,而且还调节肠腔和粪便中的5-HT水平。
一项新的研究表明,产孢肠道细菌(Turicibacter sanguinis)中的一种新型血清素传感器可能对宿主脂质和类固醇代谢很重要。这些发现支持了一个新兴概念,即双向信号通路可以影响细菌群落结构并对宿主生理产生影响。
为了解决粘膜血清素和肠道微生物组之间的串扰本质上是否是双向的,并可能导致细菌功能反应改变的问题,研究人员通过口服补充血清素或进行基因改造来限制血清素再摄取,他们发现粪便血清素水平的增加与肠道微生物群落结构的改变有关,特别是孢子形成细菌相对丰度的增加。生物信息学方法显示, Turicibacter属的孢子形成细菌表达蛋白质 CUW_0748,该蛋白质与哺乳动物血清素转运蛋白 (SERT) 具有序列和预测同源性,SERT 是一种膜转运蛋白,负责包括肠道在内的许多器官中血清素的再摄取和失活。
培养实验表明,细菌种Turicibacter sanguinis能够摄取血清素,而且这种作用可被选择性血清素再摄取抑制剂(SSRI) 氟西汀抑制。单独使用血清素或与氟西汀联合暴露时, T. sanguinis的转录组分析产生了基因表达的强烈变化,进一步支持了血清素介导的细菌反应作用。
总的来说,这些数据可能对抗抑郁药物的使用具有重要的临床意义。未来的研究将产生负责细菌对宿主血清素反应及其对宿主生理机能的后续影响的替代机制。
血清素有助于控制不同生物群体的新陈代谢。除了中枢神经系统和肠神经系统中发生的神经元交换之外,血清素还影响身体周围的组织。此外,血清素负责介导多种非神经元过程和功能,例如膀胱调节、止血、呼吸驱动、免疫反应、血管张力和肠道炎症。
血清素通过胃肠道中的5-HT受体在分泌、血管舒张、蠕动、疼痛感知和恶心中发挥关键作用。中枢血清素在调节情绪和行为以及通过降低食欲影响整体能量平衡方面发挥着至关重要的作用。
注:几种调节中枢血清素功能的药物(例如芬氟拉明、西布曲明和氯卡色林)最初被批准并用作抗肥胖治疗,但随后由于其不良心血管和致癌作用而被撤回。
在过去的十年中,人们利用特定血清素相关基因敲除的动物模型,对外周血清素在控制全身能量代谢中的作用进行了广泛的研究。以下是汇总的一些关键的相关的健康功能。
众所周知,脑干含有离散的含血清素(5-羟色胺,5-HT)神经元组,从尾髓质延伸到中脑头端。各种类型的血清素受体在整个大脑中分布不均匀,对目标部位的作用也不同。
血清素能神经元位于脑干中缝核,从那里它们投射到多个大脑区域并刺激多种血清素受体亚型。血清素能功能障碍与多种精神疾病有关,并且可能主要导致焦虑和抑郁等负面情绪。
血清素功能障碍会导致负面情绪和行为
突触内血清素的摄取受血清素转运蛋白(5-HTT)的功能和可用性的调节。血清素再摄取率的双重差异与5-HTT基因调节区域的功能多态性有关,并可能导致产生负面情绪状态的风险。
除了焦虑和抑郁等负面情绪状态外,血清素能功能障碍也可能有助于冲动行为、攻击性和过量饮酒的发病机制和维持。
脑干5-HTT可用性的增加与压力引起的血清素周转率下降相关。研究结果表明,产前和产后的压力暴露可以引起应激激素轴激活的长期改变,并可能影响血清素能神经传递。
血清素影响神经兴奋进而与一些精神疾病有关
5-HT在控制由神经网络振荡产生的节律性电活动方面至关重要,神经网络振荡是由反复兴奋和反馈以及前馈抑制的协调活动产生的兴奋和抑制平衡(E/I)之间的精确平衡决定的。血清素能功能的功能改变与多种疾病的缺陷有关,例如抑郁症、焦虑症、精神分裂症和明显的癫痫症。这些病理情况与5-HT的改变及其与不同神经递质系统的相互作用相关,例如GABA、多巴胺(DA)、大麻素(CB)等。导致E/I平衡改变并影响突触可塑性。
中枢神经系统中突触5-HT可用性的增加与情绪升高和焦虑减少相关,这构成了几类广泛使用的抗抑郁药的基础,这些抗抑郁药可通过以下方式防止5-HT从突触间隙中去除:阻断血清素转运蛋白(SERT)。
有一些证据表明血清素能系统在丛集性头痛(CH)病理生理学中的潜在作用。研究数据表明,丛集性头痛(CH)的特点是血浆血清素代谢升高,这表明中枢 5-羟色胺系统可能参与丛集性头痛的发生。
血清素的神经营养作用
在脊椎动物、线虫和果蝇等动物中,存在着一类称为星形胶质细胞的支持细胞,它们可能是最早出现的用于增强血清素营养作用的次级细胞。
1957年就有人提出血清素系统是一个”营养系统”。血清素可以通过受体介导的葡萄糖利用率和营养因子释放的变化。血清素纤维可以被认为是大脑的“滴灌系统”。只要轴突完好无损,血清素就能有效地释放到整个大脑中。而在老年和神经退行性疾病中,人脑中的血清素轴突会退化。
在哺乳动物中,血清素通过与神经胶质细胞的相互作用,形成了一种间接但重要的营养关系。高亲和力血清素受体已在星形胶质细胞、小胶质细胞、双极细胞和雪旺细胞等上发现。
血清素受体的激活可以促进神经胶质细胞的分化,诱导神经营养因子mRNA的表达,还可以刺激星形胶质细胞释放营养因子S100。
反过来,星形胶质细胞为血清素能神经元提供色氨酸,两者之间存在密切的营养相互作用,在海马体尤为明显。
季节性情感障碍和自杀
血清素的减少会对正常的大脑稳态(结构和功能)产生严重影响,并影响一个人继续生活的愿望。令人惊讶的是,阳光对人类大脑的血清素系统具有显著的作用。
几十年前就报道了情感障碍的季节性变化,并且从有记录的历史最早时期就已经注意到了。有些北半球文化制定了特殊的节日来纪念地球上的光的最低点,并举行庆祝活动来对抗冬季的阴暗(例如农神节和冬至)。
季节性情感障碍包括秋季/冬季复发性重度抑郁发作,春季/夏季缓解,可通过血清素药物和/或光疗法有效治疗。光疗法或抗抑郁药物治疗与心理社会功能和生活质量评估的显著改善相关。
光疗法对人体血清素参数有影响。研究表明,健康受试者和非季节性抑郁症患者在重复可见光照射后,血液血清素会增加。101 健康男性的颈静脉血样显示,冬季大脑中血清素的周转率最低,并且与明亮阳光的持续时间直接相关。
通过该程序测量的血清素的产生随着亮度的增加而迅速增加。无论一年中的什么时间,在明亮的日子里,血清素水平都较高,并且血清素的含量反映了特定一天暴露在阳光下的时间——前一天的条件没有影响。在一组有季节性情感障碍病史的患者中,测量到的血浆生物蝶呤和色氨酸水平显著降低,而光疗后则升高。
蓝光可有效增加叶绿体光合作用过程中色氨酸的吸收,并且这种光可有效治疗患有季节性情感障碍的患者。正如植物叶绿体系统所提到的,在人类研究中蓝光可能是最有效的。蓝光可以抑制褪黑激素水平并有助于昼夜节律相移。当使用窄带蓝光(468nm)时,光疗法可有效显著减少 HAMD21。
有人提议,应根据有关光的神经生物学效应的新知识重新评估家庭和工作场所的照明标准。这可能被认为是一个社会为实现有利于增强普通人群血清素功能的条件而采取的第一步,也是对血清素与阳光的特殊关系的承认,这种特殊关系在地球生命之初就开始出现。
外周血清素在调节肠道感觉、运动、肠腺分泌、维持肠道平衡等方面发挥着重要作用,健康状态下它不会穿过血脑屏障,影响中枢神经系统。
在人类肠道中,内皮细胞充当肠道内容物的传感器。在乙酰胆碱、腔内压力升高、低pH等一定刺激下, 肠嗜铬细胞(ECs)释放5-HT,激活肠壁内源性感觉神经元,引起肠内分泌反射和蠕动,而外源性神经元则也可被5-HT激活,引起疼痛、不适、恶心和呕吐。
血清素的分泌增加会导致肠道产生不适症状
当肠道受到刺激时,5-HT增加并与外源性初级传入神经末梢的5-HT 3受体结合,使肠神经系统(ENS)和内脏传入神经高度敏感,从而产生不适、腹痛、和腹泻。还有报道称,IBS-D 患者肠粘膜中的5-HT 和 5-HT 3受体显著高于健康对照者,表明 IBS 患者的 5-HT 系统受损。
在胃肠道中,血清素会引发恶心、肠道分泌和蠕动等反应,并且还与肠易激综合征等胃肠疾病有关。
例如,阿洛司琼(一种 5-HT 3拮抗剂)被证明可有效治疗伴有腹泻的IBS,而替加色罗(一种 5-HT 4激动剂)可有效治疗伴有便秘和慢性便秘的 IBS。5-HT 3拮抗剂阻断肠嗜铬细胞释放的 5-HT 对肌间神经丛固有初级传入神经元的影响,5-HT 4激动剂可引起蠕动反射。
这些作用机制可能涉及5-HT调节感觉神经传递和肠道反射运动。但这些药物的安全性存在问题,临床应用受限,需要进一步探索新的治疗靶标。此外,对肠嗜铬细胞5-HT作用的认识也需要重新审视。
5-羟色胺是一种肠神经系统生长因子
5-羟色胺(5-HT)不仅是肠神经系统(ENS)中的重要神经递质,也是ENS发育所需的关键生长因子。5-HT能够促进神经嵴源性前体细胞的分化和新神经元的生成,对ENS的出生后生长和维持至关重要。
缺乏神经元5-HT合成酶TPH2会导致ENS神经元数量显著降低,表明5-HT在ENS正常发育中的关键作用。此外,环境刺激可能通过改变5-HT能神经元的活动,从而对ENS的结构和功能产生持久影响,这为理解肠易激综合征等胃肠道功能障碍的发病机制提供了新线索。
血清素促进肠粘膜生长
肠神经元中的5-HT不仅影响肠粘膜的生长和维持,也影响ENS的生长和维持。缺乏5-HT再摄取转运蛋白SERT的小鼠,其肠粘膜生长和细胞增殖明显增强,因为SERT负责5-HT的失活。给予选择性5-HT再摄取抑制剂(SSRI)也会产生类似效果。这种作用主要是通过神经元5-HT而非肠嗜铬细胞5-HT介导的,因为删除TPH2(神经元5-HT合成酶)会减弱SERTKO小鼠的效果,而删除TPH1(肠嗜铬细胞5-HT合成酶)则不会。
5-HT 2A受体阻滞剂和乙酰胆碱拮抗剂都可以抑制SERTKO或SSRI增强肠粘膜生长的效果,表明这种作用是通过5-HT 2A受体介导的,而该受体主要表达在粘膜下胆碱能神经元上。这些神经元为上皮细胞提供神经支配,可能是促进粘膜干细胞/增殖细胞增殖的关键机制。
肠嗜铬细胞衍生的5-羟色胺与肠道炎症
缺失5-HT再摄取转运蛋白(SERT)会延长和增强粘膜中5-HT的作用,加重TNBS诱导的结肠炎和IL-10缺失相关的结肠炎。这是因为肠细胞通常表达SERT,缺失SERT会放大肠嗜铬细胞释放的5-HT的作用。
增强5-HT的作用会增强炎症,表明5-HT具有促炎作用。实验证实,这种促炎作用依赖于肠嗜铬细胞分泌的5-HT,因为缺失TPH1(肠嗜铬细胞5-HT合成酶)可以保护肠道免受炎症。
肠嗜铬细胞分泌的5-HT可以刺激树突状细胞上的5-HT 7受体,启动先天免疫反应,最终导致适应性免疫反应和肠道炎症。免疫系统的许多效应细胞也表达5-HT受体并对5-HT有反应。
相反,缺失TPH2(神经元5-HT合成酶)会增加炎症的严重程度,表明神经元5-HT具有抗炎作用,可能通过保护ENS免受炎症的神经毒性作用。
因此,5-HT在肠道中可以同时发挥”剑”(促炎)和”盾”(抗炎)的作用,其平衡对肠道健康非常关键。肠嗜铬细胞分泌的5-HT在肠道炎症发生和发展中起关键作用。
血清素受体及其在胃肠道中的功能
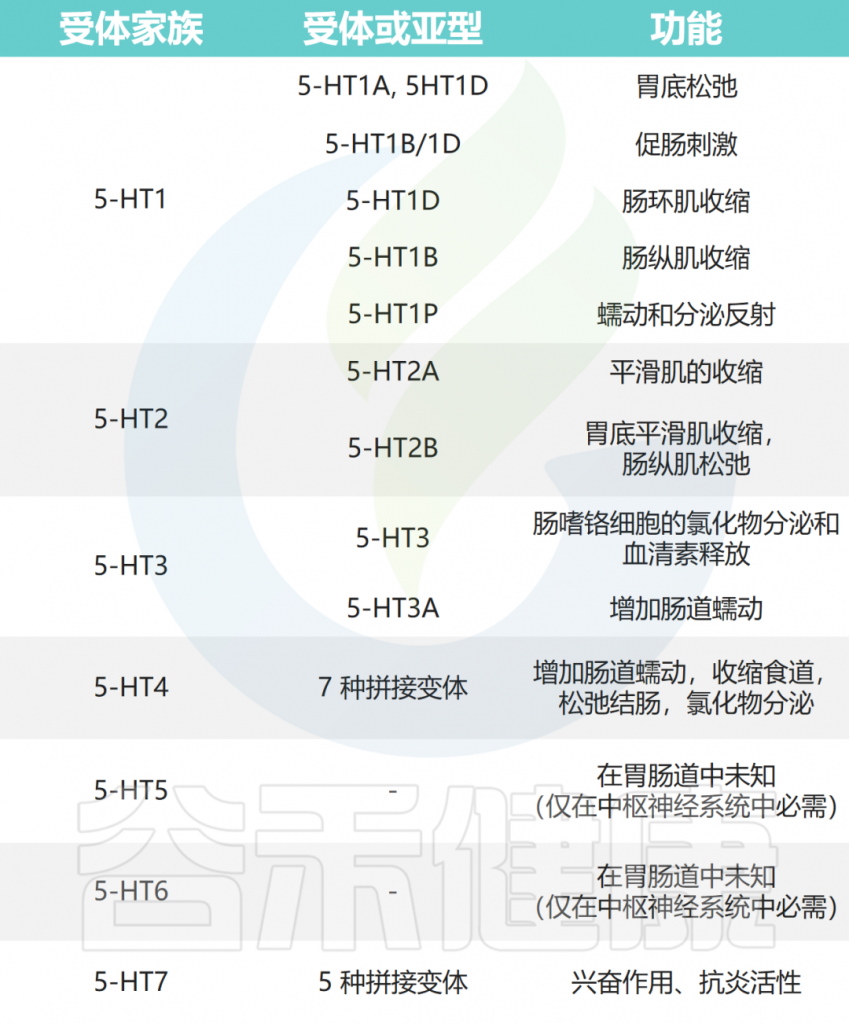
Guzel T and Mirowska-Guzel D.Molecules.2022
重点:血清素与肠脑轴
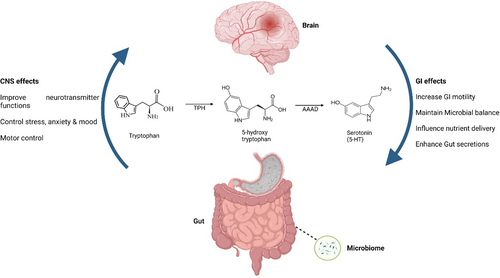
胃肠道和中枢神经系统通过称为脑肠轴的通讯途径连接。该路径允许信息双向流动。在这个网络的起点和终点,血清素作为神经递质发挥着关键作用
一项研究评估了Akkermansia muciniphila及其细胞外载体(EVs)对小鼠结肠和海马血清素能系统相关基因的影响,对Akkermansia muciniphila进行干预4周,观察结肠、海马和血清中的血清素水平通过ELISA测量小鼠以及人结肠癌细胞(Caco-2)的细胞活性。结果显示,通过肠-脑轴的血清素信号传导/代谢可能被考虑用于改善血清素相关疾病的新治疗策略。
在最近的一项研究中,衍生的齿双歧杆菌(B.dentium)已被用来调节哺乳动物的血清素能水平和肠脑轴,结果显示与齿状双歧杆菌相关的小鼠粪便中乙酸盐增加,研究结果表明齿状双歧杆菌和细菌代谢物乙酸盐是能够调节多个宿主组织中血清素能系统的关键组成部分,并与成人行为的功能变化相关。
下表显示了对益生菌补充剂通过肠-脑轴改善血清素信号传导的系统评价:

doi.org/10.1002/fsn3.3826
血清素被认为是一种重要的循环激素因子,它通过直接作用于心脏细胞或通过刺激心脏的化学敏感神经而与正常心血管功能有关。
类癌肿瘤患者血清素水平升高
类癌肿瘤(一种罕见的缓慢生长的癌症)患者心血管系统中的血清素活性水平升高,这与心律失常等某些症状有关,从而导致血流阻塞和瓣膜纤维增生。
类癌瘤又称类癌,是一组发生于胃肠道和其他器官嗜铬细胞的新生物,其临床、组织化学和生化特征可因其发生部位不同而异。此种肿瘤能分泌5-羟色胺(血清素)、激肽类、组织胺等生物学活性因子,引起血管运动障碍、胃肠症状、心脏和肺部病变等。
此外,据报道,暴露于显著升高的血清素水平(无论是由于高浓度的 5-HT 本身,还是用高水平的选择性血清素再摄取抑制剂 (SSRI) 处理)的小鼠胚胎在许多不同的部位都表现出异常生长。
血清素控制血管平滑肌的收缩
血清素被认为负责控制全身血管平滑肌细胞的收缩——这些肌肉细胞在整个循环系统中尤为突出,它们负责通过收缩或扩张血管来控制血流。据信,“S2”型血清素受体在这一功能中发挥着关键作用。
事实上,对血清素(5-HT)的一些最早的科学研究是由于它的血管收缩作用——通常直到后来它的其他生理和心理作用才变得明显。
例如,动物研究报告称,静脉注射血清素可以引起心血管系统的多种反应,导致血压升高或降低,具体取决于它在体内活跃的位置和时间。
血清素还可以通过其他“间接”机制来控制血压,例如通过放大其他血管活性物质(如NET、血管紧张素II和组胺)的反应。
血清素系统血清素(5-HT)是睡眠和清醒时大脑的关键调节剂/递质,中缝背侧(DR)和中缝(MR)是脑干的主要含5-HT核团,为前脑提供广泛的血清素能神经支配。这些中缝核涉及多种高阶功能,尤其是睡眠和意识。
血清素可用于调节睡眠和清醒
中缝背侧和中缝与脑干、下丘脑、视前区以及对清醒和睡眠至关重要的皮质结构具有相互联系。虽然血清素能DR/MR细胞的电生理学特性表明其在唤醒/觉醒中发挥作用,但血清素能传递的多样性(部分与5-HT受体的异质性相关)表明5-HT也可用于调节睡眠。
现在新出现的证据表明,5-HT DR 神经元是复杂神经回路的关键组成部分,其中(1)DR对前脑发挥兴奋作用,部分由来自外侧下丘脑的食欲素输入驱动;(2)DR在清醒时抑制腹外侧视前区(VLPO)的睡眠活跃神经元;(3)DR 与对睡眠压力做出反应的神经元相互作用,因此与腺苷一起,可以通过VLPO 神经元亚群的 5-HT 兴奋将生物体从清醒状态转变为NREM 状态;(4)DR/MR 在快速眼动(REM)睡眠中发挥着许可作用,因为它们在REM期间的虚拟沉默会抑制REM活跃神经元,从而触发REM睡眠状态。
血清素受体已在所有主要类型的骨细胞(成骨细胞、骨细胞和破骨细胞)中被发现。最近的数据表明,肠道来源的血清素可能介导低密度脂蛋白(LDL)受体相关蛋白的骨骼效应。
一些证据表明,使用SSRI(选择性血清素再摄取抑制剂)(可增加全身血清素水平)可能与骨量减少、骨质流失增加和骨折风险增加有关。
血清素过高会导致骨量减少、骨质流失增加
LRP5(LDL受体相关蛋白5)在成骨细胞和肠嗜铬细胞中表达,是Wnt信号的辅助受体。LRP5抑制肠嗜铬细胞中色氨酸羟化酶(TPH1)的表达,从而降低5-HT的分泌,导致血液和血小板中5-HT水平下降。
成骨细胞表达5-HT 1B受体,可直接响应循环中的5-HT,抑制成骨细胞增殖。因此,肠嗜铬细胞5-HT生物合成的降低,最终导致成骨细胞增殖增加,骨量增加。
而抑制肠道TPH1可增加骨量,说明使用不穿过血脑屏障的外周TPH抑制剂可能是一种治疗骨质疏松症的有效方法。
注:与外周5-HT的促骨作用不同,中枢5-HT通过抑制交感神经活动而抑制骨量增长。
总之,肠嗜铬细胞分泌的5-HT具有内分泌激素的作用,在调节骨代谢中发挥重要作用。这为开发新的治疗骨疾病的靶向药物提供了新思路。
除了对骨骼代谢的影响,肠嗜铬细胞分泌到血液中的5-HT还对肝脏再生产生作用。
在肝脏中,5-HT作为一种生长因子,可促进部分肝切除后的肝脏再生。肝脏再生的能力与血小板携带5-HT的数量直接相关。
血清素有助于推动肝脏再生
5-HT可激活肝细胞表面的5-HT2受体,从而促进肝细胞的增殖和DNA合成,推动肝脏再生。
缺乏色氨酸羟化酶1(TPH1)的小鼠,其肝脏再生能力受损,证实了肠嗜铬细胞来源的5-HT在这一过程中的关键作用。
总之,肠嗜铬细胞分泌的5-HT通过激活肝细胞上的受体,发挥了促进肝脏再生的内分泌功能。这为利用5-HT调节肝脏损伤后的再生提供了新的治疗思路。
禁食期间,内源性葡萄糖产生和脂肪分解增加,而葡萄糖摄取降低。这由激素(胰岛素、胰高血糖素等)和自主神经系统协调调节。
进食后,代谢转向合成代谢状态,胰岛素增加抑制内源性葡萄糖产生,促进肌肉和脂肪组织的葡萄糖摄取。
血清素可以提高胰岛素敏感性
下丘脑、脑干和皮质边缘区域参与葡萄糖感应,形成复杂的神经元网络,调节机体能量代谢。5-HT可通过中枢和外周机制影响葡萄糖代谢,包括调节胰岛素和胰高血糖素分泌。
5-HT1D和5-HT2A受体介导的作用可抑制胰高血糖素分泌,从而改善高血糖。5-HT可通过促进肌肉葡萄糖摄取和糖原合成来提高胰岛素敏感性。
此外,胰腺β细胞具有合成5-HT的机制,因为人类胰岛中存在编码关键酶色氨酸羟化酶(TPH)和芳香族氨基酸脱羧酶(AADC)的基因。
血清素会减少胰高血糖素分泌
5-HT1D和5-HT2A受体亚型也存在于胰腺α细胞中,表明5-HT在胰高血糖素分泌中发挥着额外作用。事实上,在人类胰岛中,研究表明5-HT会减少胰高血糖素分泌。
在体内,5-HT1D受体激动剂舒马普坦降低了人体胰高血糖素水平。从机制上讲,葡萄糖诱导邻近β细胞分泌5-HT,通过5-HT1F 受体降低α细胞中的环 AMP水平,并抑制胰高血糖素分泌。
与此一致,5-HT1F 受体的药理学激活减少了糖尿病小鼠的胰高血糖素分泌和血浆葡萄糖。据推测,α细胞的血清素控制受损可导致高胰高血糖素血症,从而导致高血糖。因此,5-HT1F 受体激动剂可能是治疗糖尿病等高血糖疾病的一种有前途的治疗方法。
5-羟色氨酸(5-HTP)被认为与主要饮食失调(例如厌食症)相关的许多心理和行为症状有关。由于这些原因,一些研究人员建议补充色氨酸可能有潜力治疗厌食症。
色氨酸是血清素的前体,也是一种只能在饮食中获得的必需氨基酸,因此,过度的饮食限制可能会导致大脑5-HT储存减少。血清素作用于多个大脑部位来调节进食行为,包括脑干中的多个核团、下丘脑亚区域(例如弓状核和室旁核)以及中皮质边缘多巴胺系统。
血清素调节饱腹感从而影响食欲
血清素和含下丘脑肽的细胞之间以及与缩胆囊素和其他肽之间存在重要的相互作用。血清素在行为水平上具有多种影响,其范围从调节短期饱腹感和饱足感以响应胃扩张和肠道营养素的存在,到调节奖赏和由条件线索引起的行为反应。
对血清素系统在控制食欲和摄食中的作用的大部分了解是从20世纪70年代到90年代初使用血清素释放剂和再摄取抑制剂芬氟拉明进行的研究中发展起来的,最初使用外消旋dl-芬氟拉明,后来使用更有效的异构体d-芬氟拉明。事实上,直到1997年,芬氟拉明因与瓣膜性心脏病相关而被撤回作为抗肥胖治疗药物,它一直是研究支持食物摄入和饱腹感的血清素机制的典型化合物。
d-芬氟拉明通过增加这些受体的5-HT可用性来间接减少食物消耗,而不是直接刺激突触后受体。然而,在大鼠中证明,d-芬氟拉明在服用一定剂量后仍然能够减少食物摄入量,并阻断 d-芬氟拉明增加下丘脑内侧区域 5-HT 传输的能力。这些发现清楚地表明d-芬氟拉明对5-HT受体有直接作用。
细胞外血清素水平升高通常会导致食物摄入量
减少,反之亦然
大脑中血清素能神经元的活动增强通常会导致食物摄入量减少和体重减轻,但也有其他研究报告了一些例外情况。据推测,大脑中5-HT容量传输通常会减少食物摄入量,因为一方面,5-HT水平升高会引起吞咽不足,另一方面,5-HT水平降低会导致食物摄入量增加,即食欲亢进。
事实上,通过脑血管内注射5,7-二羟色胺(血清素能神经元的神经毒素)或对氯苯丙氨酸(通过抑制5-羟色氨酸羟化酶减少5-HT合成)诱导的5-HT 水平降低,可诱导喂食大鼠的食欲亢进。
一些研究人员指出,某些神经元群释放到大脑中的血清素量似乎很大程度上取决于食物摄入量。这导致了这样的假设:血清素系统可能在食欲和饮食行为的调节中发挥着至关重要的作用——尽管这种潜在功能的确切性质尚不完全清楚。
在大脑中,自主神经和随意神经系统中的血清素能系统会导致饮食不足和过量。
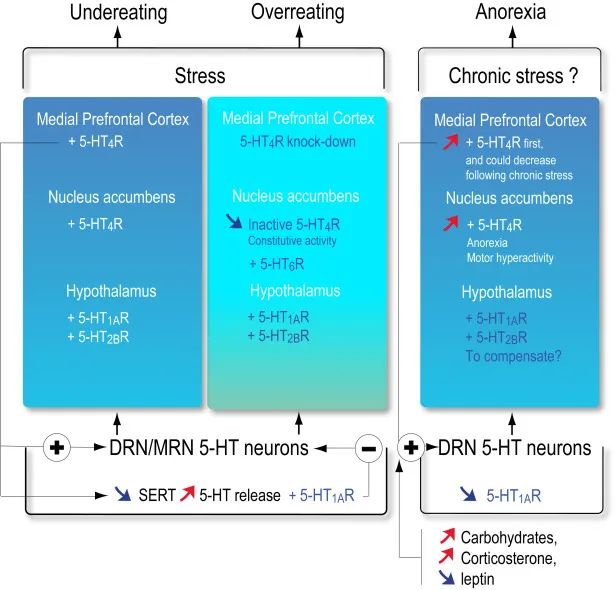
doi.org/10.1016/B978-0-444-64125-0.00028-1
药理学和遗传学之间的合作关系:特定血清素受体有助于减少和增加食物摄入量
大量药理学研究,无论是否结合使用 5-HTR KO 小鼠,收集的证据表明5-HT容量传输通常有助于减少食物摄入通过大脑特定区域的特定 5-HTR,破译了饮食行为的一些细胞内基础。
一些初步证据表明,碳水化合物的摄入尤其可能会影响血清素——可能是通过与胰岛素分泌相关的机制发挥作用。其他大量营养素,例如蛋白质,似乎没有这种作用,这表明这种作用可能特定于某些类型的营养素或食物。
血清素调节外周其他激素进而影响能量代谢
现在越来越多的证据表明外周血清素作为一种能够调节外周代谢的激素具有明显的作用。与经典的禁食激素胰高血糖素类似,由于肠道Tph1表达上调,循环 5-HT 因禁食而显著升高。禁食期间,5-HT 有效促进脂肪细胞的脂解作用,从而为肝糖异生提供底物,而5-HT也显著上调这一过程。
另一方面,肠道来源的5-HT还可以通过降低敏感性激素的激活,抑制白色脂肪组织的褐变和棕色脂肪组织的产热过程,从而有效地减少能量消耗。并减少负责产热的解偶联蛋白1的表达。因此,肠道来源的 5-HT 通过增加短期能量可用性和促进长期能量保存,在驱动对营养缺乏的多种生理适应方面发挥着关键作用。
矛盾的是,在肥胖条件下,循环5-HT水平也会升高。肥胖人类和啮齿动物高脂肪饮食后,循环和肠道来源的5-HT水平会升高。外周 5-HT 调节胰岛中葡萄糖刺激的胰岛素分泌,高脂饮食导致外周5-HT水平增加,通过肝脏中脂肪储存的增加导致肝脂肪变性。
肠道5-HT的药理学或遗传减少可预防饮食引起的肥胖、肝脂肪变性和葡萄糖不耐受,说明肠道来源的5-HT升高在驱动代谢功能障碍中的致病作用。在人类肥胖中,EC细胞的密度和TPH1的表达都会增加 ,但驱动这种变化的机制仍然未知。
先前的文献表明,5-HT及其受体升高可能作为一种有效的营养物质、促有丝分裂和抗凋亡因子,然而还可能促进致癌进展。文献进一步证明5-HT受体在许多癌症类型中表达,包括结直肠癌(CRC)、胰腺癌、肝细胞癌(HCC)、乳腺癌、肺癌和前列腺癌,它们促进肿瘤细胞的生长和存活。
多种肿瘤中血清素水平较高
较高的全身5-HT水平存在于多种肿瘤中,并且与肿瘤复发和不良生存密切相关 。肿瘤细胞和正常细胞对5-HT刺激有不同的反应。 5-HT促进CRC细胞增殖,但不增加正常结肠隐窝细胞的有丝分裂率。正常结肠隐窝的增殖受到自主神经和内分泌调节,而结肠癌细胞的分裂仅需要内分泌信号传导。
在人胆管癌组织中,TPH1表达增加和MAOA表达减少促进5-HT的分泌。通过抑制5-HT1A、2A、2B、4和6或TPH1可以特异性逆转分泌。
血清素水平会影响肿瘤血管生长
5-HT也是肿瘤血管生成中有效的血管生成因子。低浓度的5-HT在体外可诱导内皮细胞增殖、迁移和管形成,体内血管生成通过5-羟色胺受体依赖于TR3/Nur77,而与血管内皮生长因子A(VEGF-A)无关。人体内大部分5-HT储存在血小板中。在肿瘤微环境中,血小板聚集导致5-HT大量释放,促进肿瘤微血管的形成。
此外,5-HT阳性细胞的存在与较高的微血管密度和VEGF表达相关。在肿瘤发生过程中,肿瘤微环境中 VEGF(一种血管生成介质)的释放促进了血管生长的增加和异常血管重塑。
在TPH缺陷小鼠的结肠癌同种异体移植物中,与野生型小鼠相比,微血管密度降低。TPH 缺陷小鼠中 VEGF 和 VEGFR2 的表达相似,但基质金属蛋白酶12 (MMP-12) 和血管抑制素的表达较高。
MMP-12可以将纤溶酶原裂解成血管抑制素,血管抑制素是一种内源性血管生成抑制剂。小鼠的肺癌和黑色素瘤的同种异体移植物也比野生型小鼠小,这可能是由于eNOS浓度降低(导致血管舒张)以及肿瘤生长的血液补充不足所致。然而,有研究报道5-HT作为血管收缩剂,可以通过选择性地收缩肿瘤小动脉来抑制结肠癌的生长。
近年来,5-HT与肿瘤浸润免疫细胞之间的关系也被揭示。例如,5-HT通过激活5-HTR来抑制TNF-α和IL-1β的释放。在单核细胞/巨噬细胞中,5-HT调节细胞因子的分泌并介导中性粒细胞募集和T细胞激活。
与身体和大脑中的其他生物活性物质一样,血清素水平需要精心平衡,以维持整体健康的最佳状态。
但是人们常常错误地认为“更多”总是“更好”,而事实并非如此!举例来说,血清素水平升高可能导致血清素综合症,这是一种可能致命的严重疾病。
此外,血清素水平升高有时会使其他已有疾病(例如强迫症)的症状恶化。
血清素综合症是由于药物、补充剂或草药的组合导致血清素升高至不安全水平而引起的。它可能导致意识混乱、发烧、不自主的肌肉痉挛、癫痫发作甚至死亡。虽然有点罕见,但血清素综合症是一种严重的疾病,任何食用改变血清素水平的产品的人都应该意识到这一病症。
▸ 什么是血清素综合症?
当人的系统中血清素过多时,就会出现血清素综合症——无论是由于过量服用一种药物,还是由于组合使用多种药物来增加血清素水平。这可能非常危险,并会导致许多严重的并发症,从轻度(意识模糊、腹泻、颤抖)到严重(谵妄、癫痫发作、昏迷)。
尽管有些人可能更容易患血清素综合症,并且严重程度可能有所不同,但任何血清素水平升高的人都会出现症状。即使服用一剂改变血清素的药物也可能导致血清素综合征。
警告:血清素综合症是一种潜在的致命疾病,需要紧急治疗。如果您使用过精神活性药物/草药/补充剂并注意到下述任何症状,请尽快寻求医疗帮助。
▸ 症状
由于血清素会激活全身的许多受体,因此血液中过量的血清素会产生广泛的影响。这些症状从轻微到危及生命不等。
大脑中血清素过多会导致:
困惑
搅动
对刺激的敏感性增加(高度警惕)
焦躁不安
焦虑
发烧
对心脏和血管的影响包括:
心率过快
血压飙升
通过作用于肠道,过量的血清素会导致 :
腹泻
恶心
呕吐
它还可能导致:
出汗过多
肌肉痉挛或肌张力增加
瞳孔扩张
发抖
震颤(有节奏的颤抖)
危及生命的症状包括:
谵妄
代谢性酸中毒
横纹肌溶解症(肌肉组织分解,释放有毒蛋白质)
体温极高(超过41°C)
昏迷
血清素综合征最明显的症状可能是重复的、不自主的肌肉收缩。
♢症状会持续多久?
症状通常在服用改变体内血清素水平的药物后6至8小时出现,并且症状非常严重。如果治疗得当,轻微症状通常会在24-72小时内消失,但可持续长达3天。更严重的病例需要住院治疗,并且可能需要更长的时间才能康复。
♢长期影响
血清素综合征症状的持续时间完全取决于违规药物在您的系统中停留的时间。一旦治疗得当,一般不会产生长期影响。然而,如果不及时治疗,严重的血清素综合征可能会导致死亡。康复后,重新评估所有当前药物以防止血清素综合征再次发生非常重要。
▸ 血清素综合症的原因
影响血清素水平的多种药物和补充剂之间的相互作用是导致血清素综合征的最常见原因。
♢非处方药和处方药
1) 抗抑郁药和抗焦虑药
选择性5-羟色胺再摄取抑制剂(SSRI)、5-羟色胺-去甲肾上腺素再摄取抑制剂(SNRI)和三环类抗抑郁药(TCA)是治疗抑郁和焦虑的常用药物。它们通过延长大脑中血清素的活性来发挥作用。
最常与血清素综合征相关的抗抑郁药和抗焦虑药包括:
西酞普兰(Celexa)
艾司西酞普兰(Lexapro)
氟西汀(百忧解)
帕罗西汀(Paxil、Pexeva)
舍曲林(左洛复)
维拉佐酮(Viibryd)
氟伏沙明(Luvox)
文拉法辛(Effexor)
氯米帕明(Anafranil)
丙咪嗪(托法尼)
沃替西汀(Trintellix,Brintellix)
2) 单胺氧化酶抑制剂
单胺氧化酶抑制剂(MAOIs)是用于帮助治疗各种情绪障碍和帕金森病的药物。它们通过阻断单胺氧化酶发挥作用,单胺氧化酶会分解大脑中发现的几种神经递质,包括血清素。这会产生更多的血清素来作用于大脑。
滥用 MAOIs 或与其他增加血清素的药物联合使用可能会导致血清素综合征。这些包括但不限于:
司来吉兰
联非美烷
吗氯贝胺
吡林多(吡拉齐多)
托洛沙酮(胡莫酰)
利奈唑胺(Zyvox)
3) 抗生素
利奈唑胺是一种抗生素,常用于治疗对其他抗生素(如链球菌、VRE 和 MRSA)耐药的细菌感染。利奈唑胺还可以稍微阻断血清素的分解(通过阻断 MAO)。
4) 偏头痛药物(曲普坦类药物)
曲坦类药物通常是医生为中度至重度偏头痛患者开出的第一种药物。曲普坦类药物还会激活大脑中的血清素受体,并存在发生血清素综合征的风险,特别是与阿片类药物或抗抑郁药联合使用时。
他们包括:
阿莫曲坦(Axert)
那拉曲坦(Amerge)
利扎曲普坦(Maxalt)
舒马曲坦(Imitrex)
佐米曲普坦(佐米格)
5)阿片类药物
目前用于缓解疼痛的阿片类药物处方和阿片类药物滥用呈上升趋势。一些阿片类药物可以延长血清素的作用(通过阻止再摄取),从而导致大脑中产生更多的血清素。阿片类药物可引起血清素综合征,尤其是与其他改变血清素的药物联合使用时。
阿片类药物包括但不限于:
曲马多
哌替啶
美沙酮
芬太尼
吗啡
他喷他多
6) 丁螺环酮 (Buspar)
丁螺环酮通常用于改善焦虑,并与其他抗抑郁药联合治疗情绪障碍。它激活血清素受体。过量单独使用或与其他抗抑郁药联合使用可能会导致血清素中毒。
7) 治恶心药物
甲氧氯普胺 (Reglan) 通常用于治疗胃部问题,如胃灼热、恶心、呕吐和消化不良。据报道,有两例患者因联合服用甲氧氯普胺和抗抑郁药而导致血清素综合征。
任何与血清素受体相互作用的恶心药物都会增加血清素综合征的风险。示例包括:
格拉司琼(Kytril,Sancuso)
昂丹司琼(Zofran)
8) 右美沙芬
右美沙芬是一种止咳药,存在于许多非处方药中,例如 Robitussin、Delsym、NyQuil 和 Dimetapp。右美沙芬可以延长大脑中血清素的作用(阻止再摄取)。
在一份病例报告中,一名 63 岁的抑郁女性在服用右美沙芬-异丙嗪止咳糖浆与抗抑郁药艾司西酞普兰 (Lexapro) 组合两周后出现了血清素综合征 。
9) 过敏药物
在一项案例研究中,一名患者服用曲马多治疗颈部疼痛并联合苯海拉明治疗季节性过敏后出现血清素综合征。
♢草药和补品
1) 圣约翰草
圣约翰草是一种草药,几个世纪以来一直被用来治疗抑郁症,其疗效已得到临床证明。然而,圣约翰草可以与许多药物(包括 SSRI)产生负面相互作用,这些组合可能会导致血清素综合征。
2) S-腺苷-L-蛋氨酸 (SAM-e)
在多项试验中, SAMe改善了抑郁症状,也改善了对传统SSRI药物无反应的患者的抑郁症状。SAM- e可以显著提高血清素的产生,因此理论上,如果大剂量服用或与其他药物联合使用,可能会带来患血清素综合征的风险。
3) 人参
临床试验表明,人参可以降低更年期女性的抑郁症。它会增加大脑中的血清素(尤其是海马体),但是当大量服用或与影响血清素水平的其他药物联合使用时,会带来患血清素综合征的风险。
4) L-色氨酸
L-色氨酸直接增加血清素的产生。如果服用剂量过高,或与另一种增加血清素水平的药物(例如单胺氧化酶抑制剂,MAOI)联合使用,则存在发生血清素综合征的潜在风险。
♢食品
由食物引起的血清素综合症的可能性极小,因为以标准量摄入时,这些食物中的活性化合物含量相对较低。然而,重要的是要了解哪些食物有可能增加血清素水平,尤其是与血清素药物结合使用。
1)姜黄(姜黄素)
姜黄含有高含量的姜黄素,在临床试验中已被用于改善人类患者的情绪。在小鼠中,姜黄素会增加血清素水平,在服用其他增加血清素的药物时应谨慎使用。
2) 藏红花
在多项临床试验中,与服用SSRIs类似,藏红花可以减轻患者的抑郁症。对大鼠的研究表明,藏红花与血清素系统相互作用,因此它可能会影响血清素综合症 。
3)富含色氨酸的食物
当有血清素综合症的风险时,应避免食用色氨酸含量高的食物,因为色氨酸会直接增加血清素的产生。这些包括火鸡、鸡肉、大豆、鸡蛋、南瓜子、花生和一些奶酪。
一些精神疾病——例如抑郁症,与大脑中异常的血清素活动有关。由于这些联系,研究人员非常关注研究针对血清素系统的不同方法(通常是为了提高血清素的水平或整体活性)。
最著名和最广泛使用的抑郁症治疗方法之一,选择性血清素再摄取抑制剂(SSRI)可显著增加整个大脑的血清素水平(具体来说,通过防止神经元突触“清除”血清素,从而使其对整体大脑活动产生更持久、更强的影响)。
然而,SSRIs仍然有几个相当大的缺点。其一,许多抑郁症患者对此没有成功的反应。其次,即使对这些药物治疗有反应的患者,SSRIs 也经常会引起许多明显的副作用,包括恶心、皮肤反应、体重增加、睡眠障碍和性功能障碍。此外,来自动物研究的一些初步证据表明,长期使用 SSRI 可能会加重潜在的血清素缺乏症。
由于这些原因,一些人不愿意依赖药物治疗,而更愿意尝试非化学治疗。
在下面的部分中,我们将讨论一些已提出的可能增加血清素水平或活动的各种生活方式、饮食和基于补充剂的方法。然而,请记住,这些背后的科学大多仍处于初步阶段,并且这些生活方式策略或补充剂均未获得正式批准用于治疗抑郁症或任何其他精神或医疗状况。
这些只是补充方法,这意味着虽然它们可能有助于支持和增强传统治疗的有效性,但仅靠它们可能还不够。与往常一样,在采取本文讨论的任何“补充”策略之前,请务必先与你的医生讨论任何重大的生活方式、饮食或其他变化!
▸ 生活方式和行为因素
已经确定了几种可能影响大脑中血清素系统的行为方法和其他生活方式因素。
1)锻炼
锻炼对生理和心理健康有多种显着益处,包括提高血清素水平和对整体情绪产生积极影响。
例如,一些人类研究报告称,从事有氧运动会导致大脑血清素水平增加,并且如果保持良好的运动习惯,这种增加可能会持久。
如果可能的话,户外锻炼可能会更有益。例如,阳光照射与血清素水平升高有关,这反过来又可能转化为整体情绪的改善。
2)积极情绪诱导
一些证据表明,像听积极的音乐这样简单的事情,或参与其他愉快的经历,如在大自然中散步,可能会对大脑的血清素水平产生影响。
一项针对20名健康受试者的研究报告称,听愉快的音乐可以短期提高他们的血清素水平,并改善他们的情绪。此外,参加自然散步、冥想和按摩等有趣的活动都可能对血清素水平和整体情绪产生潜在的有益影响。
然而,值得注意的是,这些“情绪诱导”效应也可能产生相反的效果:例如,据报道,听“消极”或“不愉快”的音乐和其他刺激会降低人的情绪。
3)社交互动
一些证据还表明,积极的社交互动也可能对血清素水平和情绪产生潜在的有益影响。
例如,据报道,一个人经历的积极的面对面社交互动的数量与血清素水平有很强的相关性。
4)健康的睡眠习惯
毫不奇怪,睡眠对于大脑和整体心理健康非常重要。据报道,拥有健康且均衡的睡眠时间表对于维持整个大脑的血清素平衡非常重要。据信,造成这种情况的至少部分原因是大脑在睡眠期间产生并释放大量的血清素。
相反,睡眠不足会使血清素受体“脱敏”。反过来,这可能会扰乱大脑血清素系统的整体活动——睡眠不足甚至与抑郁症可能性增加有关。
▸ 饮食因素和补充剂
除了上述一些与生活方式相关的和其他“基于行为”的技术之外,研究人员还确定了许多饮食因素和基于补充剂的方法,它们也可能对一个人的血清素总体水平产生影响。
然而,值得注意的是,这些补充剂的功效仍然“没有足够的证据”,并且需要在健康人群中进行更多的后续研究来证实它们的效果。与往常一样,请务必先与您的医生讨论任何饮食改变或新的补充剂,因为这是避免与其他生活方式或健康相关因素发生任何潜在负面相互作用的最佳方法。
考虑到所有这些要点,研究表明以下一些补充剂可能有助于增加血清素并支持情绪平衡。
1) L-色氨酸和5-HTP
在体内,血清素是由5-HTP制成的,而5-HTP是由L-色氨酸制成的。因此,从理论上讲,增加这些“组成部分”(代谢前体)中的任何一个的水平都可以导致血清素总体水平的增加。
有限的研究表明,服用 L-色氨酸可能会提高血浆血清素水平,并可能改善缺乏血清素的人的某些认知、运动或肠道问题。
2)益生菌
在消化道中,益生菌恢复肠道微生物组并影响肠脑轴。肠道细菌的重要性之一是因为它们产生大量的色氨酸,而色氨酸是用来制造血清素的。一些研究表明,帕金森病等神经系统疾病与肠道细菌多样性较低或较少有关。
根据一项研究,据报道,为期8周的益生菌疗法(2.0×10^9 CFU/g瑞士乳杆菌和2.0×10^9 CFU/g长双歧杆菌)可增加110名抑郁症患者的色氨酸水平。理论上,增加色氨酸可以增加血清素的产生。
同样,一项动物研究报告称,给予大鼠14天的益生菌(婴儿双歧杆菌)可提高血液色氨酸水平。
3)维生素D
维生素D有助于身体(包括大脑)制造、释放和使用血清素。然而,补充剂的益处尚不确定。
维生素D会激活一种酶,将色氨酸转化为血清素。因此,增加维生素D的摄入量可能会增加血清素水平,从而有可能支持心理健康。
4) Omega-3 脂肪酸
虽然维生素D有助于神经元产生血清素,但omega-3多不饱和脂肪酸 EPA(二十碳五烯酸)、DHA(二十二碳六烯酸)和ALA(α-亚麻酸)可能有助于神经元释放血清素,并提高其整体活性(例如例如通过增加血清素受体的敏感性)。
在一项针对大鼠的动物研究中,低水平的omega-3脂肪酸——特别是α-亚麻酸(ALA)——与较低的血清素活性有关。相关地,DHA缺乏与仔猪大脑血清素水平降低有关。
在另一项动物研究中,几组怀孕的老鼠被喂食缺乏或富含α-亚麻酸的饮食。研究发现,与富含ALA饮食的大鼠相比,缺乏ALA饮食的大鼠前额叶皮层中的血清素水平降低了 65%,这进一步表明 omega-3 脂肪酸与血清素水平及整体健康之间存在潜在联系。
5) B族维生素
身体需要维生素B6来从其前体(例如5-HTP)产生血清素(具体而言,维生素B充当酶辅因子)。此外,维生素B12和叶酸(维生素B9)都是叶酸循环所必需的,叶酸循环有助于将色氨酸转化为血清素。
几种不同的B族维生素(包括B6、B9和B12)被认为对于血清素的产生和释放至关重要。在一些初步研究中,维生素缺乏症与认知结果不佳有关,尽管补充这些维生素是否对健康人类使用者具有直接的心理健康益处尚未完全确定。
6) 锌
根据一些早期研究,一些科学家认为锌可能靶向并激活血清素受体。根据对17项观察性研究数据的一项荟萃分析,据报道,与非抑郁个体相比,抑郁个体的血锌水平较低,这可能暗示了血清素相关机制。
另一项针对37名重度抑郁症患者的研究显示,连续12周每天补充25毫克锌可减轻抑郁症状。除了直接补充外,膳食锌还可以通过红肉、牡蛎、螃蟹、全谷物等几种常见食物获得。
7) 镁
研究人员推测,镁补充剂可能会通过增加大脑中血清素的可用性(减少再摄取)来提高血清素水平。
例如,根据一项初步研究,60名被诊断为轻度至中度抑郁症的患者每天补充500毫克镁(氯化镁)8周,可显著改善抑郁症状。据报道,这种镁治疗对焦虑症状也有显著的效果。
8) 肌醇
来自细胞和动物研究的一些早期证据表明,“类维生素”化合物肌醇可能会增加血清素受体的敏感性 。
由于其与大脑血清素系统的相互作用,一些研究人员提出,肌醇的作用可能类似于常见的血清素靶向抗抑郁药物(例如选择性血清素再摄取抑制剂 SSRI)。
根据一项针对30名患有经前综合症相关情绪障碍症状的女性的研究,据报道,在六个月经周期(约6个月)内使用肌醇治疗可减轻情绪症状并改善整体情绪。
虽然其中一些早期发现很有希望,但仍需要更多的研究来证实这些对人类的影响。
中枢血清素功能障碍与多种临床疾病的焦虑感、威胁感和不安全感增加有关。患有重度抑郁症和酒精依赖的患者中,焦虑与血清素转运蛋白可用性降低直接相关。由于威胁感和不安全感与特定性别的行为模式和荷尔蒙调节相互作用,冲动攻击可能是血清素能功能障碍的次要相关因素。在强迫症中,血清素周转率的增加而不是减少可能会干扰丘脑“噪声过滤器”和逆转学习期间的眶额功能,从而导致额-纹状体-丘脑神经回路过度激活和行为不灵活。
血清素功能障碍可能是由发育早期的社会压力因素引起的,并且似乎可以调节青少年和成年人以及非人类灵长类动物对压力和镇静药物。第一项表观遗传学研究表明,DNA 甲基化的改变可能导致五羟色胺转运蛋白基因(5-HTT) mRNA 转录减少,从而减少中枢血清素转运蛋白的表达。血清素系统的药物遗传学还需要考虑各种基因,尤其是 5-HTT、色氨酸羟化酶 2(TPH2)和A 型单胺氧化酶(MAO-A) 的基因,所有这些基因证明了功能上重要的多态性,并且发现或可能影响血清素的突触活性。这些超出了本章的范围,尽管读者需要记住它们与此处描述的血清素受体药物遗传学相互作用的潜力。
注意,血清素只是神经递质“单胺”家族的一员,该家族还包括其他主要神经递质,如去甲肾上腺素和多巴胺。研究人员目前认为所有这些神经递质共同作用来影响和调节情绪和神经疾病。
身体的所有细胞和器官,尤其是大脑,都受到血清素系统的影响。阳光的作用可能是帮助维持身心平衡。这与血清素参与人类体内平衡的观点是一致的并有助于心智的出现。
通过总结发现5-HT和其他系统建立的串扰对于每个系统都是特定的。这意味着药物作用机制的精确确定是极其复杂的,但它也代表了一个令人难以置信的来源,可以从中汲取灵感,为中枢神经系统疾病开发新的治疗策略。
主要参考文献:
Müller, C. P., & Cunningham, K. A. (Eds.). (2020). Handbook of the Behavioral Neurobiology of Serotonin. Volume 31.
Liu N, Sun S, Wang P, Sun Y, Hu Q, Wang X. The Mechanism of Secretion and Metabolism of Gut-Derived 5-Hydroxytryptamine. Int J Mol Sci. 2021 Jul 25;22(15):7931.
Li H, Wang P, Zhou Y, Zhao F, Gao X, Wu C, Wu T, Jiang L, Zhang D. Correlation between intestinal microbiotal imbalance and 5-HT metabolism, immune inflammation in chronic unpredictable mild stress male rats. Genes Brain Behav. 2022 Jul;21(6):e12806.
Kwon YH, Wang H, Denou E, Ghia JE, Rossi L, Fontes ME, Bernier SP, Shajib MS, Banskota S, Collins SM, Surette MG, Khan WI. Modulation of Gut Microbiota Composition by Serotonin Signaling Influences Intestinal Immune Response and Susceptibility to Colitis. Cell Mol Gastroenterol Hepatol. 2019;7(4):709-728.
Yano JM, Yu K, Donaldson GP, Shastri GG, Ann P, Ma L, Nagler CR, Ismagilov RF, Mazmanian SK, Hsiao EY. Indigenous bacteria from the gut microbiota regulate host serotonin biosynthesis. Cell. 2015 Apr 9;161(2):264-76.
Wu L, Ran L, Wu Y, Liang M, Zeng J, Ke F, Wang F, Yang J, Lao X, Liu L, Wang Q, Gao X. Oral Administration of 5-Hydroxytryptophan Restores Gut Microbiota Dysbiosis in a Mouse Model of Depression. Front Microbiol. 2022 Apr 28;13:864571.
Haq S, Wang H, Grondin J, Banskota S, Marshall JK, Khan II, Chauhan U, Cote F, Kwon YH, Philpott D, Brumell JH, Surette M, Steinberg GR, Khan WI. Disruption of autophagy by increased 5-HT alters gut microbiota and enhances susceptibility to experimental colitis and Crohn’s disease. Sci Adv. 2021 Nov 5;7(45):eabi6442.
Akram N, Faisal Z, Irfan R, Shah YA, Batool SA, Zahid T, Zulfiqar A, Fatima A, Jahan Q, Tariq H, Saeed F, Ahmed A, Asghar A, Ateeq H, Afzaal M, Khan MR. Exploring the serotonin-probiotics-gut health axis: A review of current evidence and potential mechanisms. Food Sci Nutr. 2023 Dec 7;12(2):694-706.
Guzel T and Mirowska-Guzel D. The Role of Serotonin Neurotransmission in Gastrointestinal Tract and Pharmacotherapy. Molecules. 2022 Mar 3;27(5):1680.
Kwon YH, Khan WI. Peripheral serotonin: cultivating companionship with gut microbiota in intestinal homeostasis. Am J Physiol Cell Physiol. 2022 Aug 1;323(2):C550-C555.

谷禾健康

随着国家卫生健康委发布2024版食养指南,以及前几天在上海举办的临床医学与营养食品论坛,越来越多的人开始重视日常膳食的营养与健康。
而说到脂肪,很多人都会“谈脂色变”,想要避免脂肪的摄入,这其实是不正确的。脂肪作为人体必需的基本营养素之一,是不可缺少的。缺乏脂肪会导致人体营养不良、激素失衡,皮肤受损、免疫力下降等一系列问题。
需要明确的是,并非所有脂肪都对健康产生相同的影响,它们之间存在着显著的差异。饱和脂肪和反式脂肪,常见于高加工食品、烘焙食品、油炸食品和一些红肉中,过量摄入这些脂肪可能会导致肥胖、增加心血管疾病和其他健康问题的风险。
而相对优质的不饱和脂肪,对人体健康有着多方面的益处。例如Omega-3脂肪酸能降低血液中的低密度脂蛋白,同时提高高密度脂蛋白水平,从而减少心血管疾病的风险。
2022年底,国家心血管病中心专家委员会心血管代谢医学专业委员会发布了《Omega-3脂肪酸在心血管疾病防治中的作用中国专家共识》,该共识全面、科学地呈现omega-3脂肪酸(高纯度鱼油)在心力衰竭、心肌病、高血压和猝死等多个方面的详细知识,为中国人群的omega-3脂肪酸在预防和治疗心血管疾病中的临床应用提供参考。
此外还具有支持大脑和神经发育、产生抗炎作用、改善认知、抗忧郁、使皮肤更显年轻、调节视网膜健康等作用。
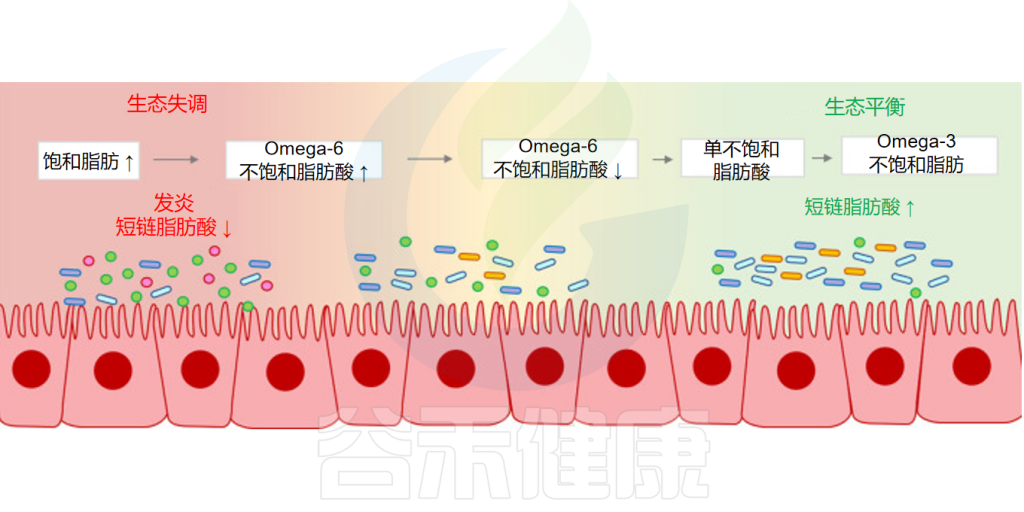
目前的研究认为功效范围从最不健康到最健康:饱和脂肪(SFA)<Omega-6不饱和脂肪酸<单不饱和脂肪酸 (MUFA)<Omega-3不饱和脂肪酸。
特别需要注意的是,人体不饱和脂肪酸Omega-6与Omega-3的比率可能是心血管疾病风险的重要标志。尽管都是人体所必需的重要不饱和脂肪酸,但是在对待炎症方面却展现出了截然不同的作用。Omega-6不饱和脂肪酸促进炎症的发生,引起身体的“失火”;Omega-3不饱和脂肪酸则恰恰相反,缓解并抑制炎症,从而预防重大疾病的发生。
可见他们两者的平衡是非常重要的。这种不平衡可能导致多种疾病,包括血栓形成、炎症、哮喘和炎症性肠病等。
肠道微生物群是我们消化系统中不可或缺的一部分,而不饱和脂肪酸作为一种重要的营养物质,其在消化和吸收的过程中必定有微生物的参与作用。
已经有一些研究发现摄入Omega-3不饱和脂肪酸有助于恢复抗炎肠道微生物群,而健康和多样化的微生物群可以在一定程度上增加Omega-3不饱和脂肪酸的体内转化和代谢。
鉴于不饱和脂肪酸对人体的重要性,以及其作为当前人们关心的重要营养素。本文将以Omega-3脂肪酸为例来讲述这类不饱和脂肪酸对人体的健康益处,可能存在的一些安全隐患。以及主要的饮食来源,日常生活中该如何补充Omega-3不饱和脂肪酸。希望能够在人们日常饮食和临床补充中提供一定的帮助,以此来更好地针对自身情况调节膳食。
我们经常在一些食品或添加剂中听到富含不饱和脂肪酸,那么究竟什么是脂肪酸?什么又是不饱和脂肪酸呢?
脂肪酸是一类含有羧基的脂肪族化合物,通常存在于动植物的脂肪和油中。脂肪酸是构成脂肪分子的基本单元,你可以简单理解为脂肪是由许许多多的脂肪酸分子构成的。
脂肪酸在人体中起着重要作用,包括提供能量、构建细胞膜、合成激素、帮助脂溶性维生素的吸收和保护身体脏器等。
▸ 脂肪酸可分为饱和脂肪酸和不饱和脂肪酸
脂肪酸根据碳氢链饱和与不饱和可分成两类:一类是分子内不带碳碳双键的饱和脂肪酸,如硬脂酸、软脂酸等;另一类是分子内带有一个或几个碳碳双键的不饱和脂肪酸,如亚麻酸、亚油酸、油酸。
饱和脂肪酸通常是固态的,而不饱和脂肪酸则通常是液态的。
饱和脂肪酸(Saturated fatty acid),指不含不饱和双键的脂肪酸。一般来说,动物性脂肪如牛油、猪油比植物性脂肪含饱和脂肪酸多。但也不是绝对的,如椰子油、可可油、棕榈油中也含有丰富的饱和脂肪酸。奶制品(如奶油、奶酪和全脂牛奶)中也有较多的饱和脂肪酸。
一般较常见的饱和脂肪酸有辛酸、癸酸、月桂酸、豆蔻酸、软脂酸、硬脂酸、花生酸等。
▸ 过量食用饱和脂肪酸会增加心血管疾病风险
饱和脂肪酸摄入过多是导致血胆固醇、三酰甘油、低密度脂蛋白胆固醇(LDL-C)升高的主要原因,继发引起动脉管腔狭窄,形成动脉粥样硬化,增加患心血管疾病的风险。
根据世界卫生组织和其他健康机构的建议,应该适度摄入饱和脂肪酸,并将其与不饱和脂肪酸(如单不饱和脂肪酸和多不饱和脂肪酸)相结合,以维持健康的饮食平衡。
不饱和脂肪酸就是指含有不饱和键的脂肪酸,是构成体内脂肪的另一种不可缺少的脂肪酸。根据双键个数的不同,分为单不饱和脂肪酸和多不饱和脂肪酸二种。
▸ 单不饱和脂肪酸
单不饱和脂肪酸(MUFA)是一类含有一个不饱和键的脂肪酸,它们在橄榄油、芥花籽油、花生油等植物油中含量丰富。单不饱和脂肪酸的主要代表是油酸(ω-9脂肪酸),它在橄榄油中的含量可达84%以上。
油酸具有多种健康益处,包括降低低密度脂蛋白(LDL)胆固醇水平,提高高密度脂蛋白(HDL)胆固醇比例,从而有助于预防动脉硬化。此外,单不饱和脂肪酸还具有抗氧化功能、降血糖功能、调节血脂功能和降低胆固醇功能。
▸ 多不饱和脂肪酸
多不饱和脂肪酸(PUFA)指含有两个或两个以上不饱和键的脂肪酸,根据双键的位置及功能又将多不饱和脂肪酸分为Omega-3系列和Omega-6系列。
Omega-3脂肪酸(Ω3)
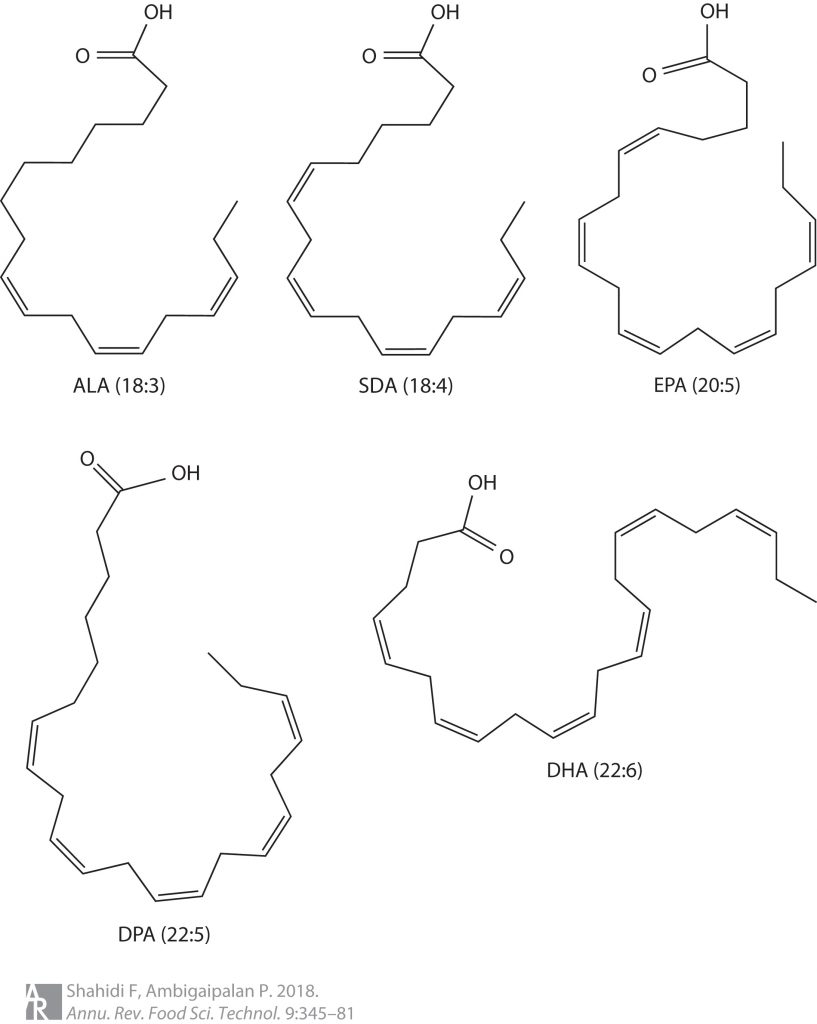
需要注意的是,Omega-3脂肪酸并不单指一种物质,而是一组多不饱和脂肪酸。因其第一个不饱和键位于甲基一端的第3个碳原子上,故名Omega-3。
Omega-3脂肪酸主要有α-亚麻酸(ALA)、十八碳四烯酸(SDA)、二十碳五烯酸(EPA)、二十二碳五烯酸(DPA)和二十二碳六烯酸(DHA)。
注:ALA是Omega-3脂肪酸的母体,可去饱和并延伸形成其他Omega-3脂肪酸。
omega-3多不饱和脂肪酸的化学结构
Omega-3必须靠食物来获取
Omega-3是一种对人体健康非常重要的不饱和脂肪酸,它对心脏健康、大脑发育和炎症反应有着重要作用。
Omega-3不饱和脂肪酸同时也是人体合成各种激素及内生性物质必要的营养素,但人体无法自行合成,因此必须通过饮食来获取。Omega-3主要存在于深海油性鱼类(如三文鱼、鲭鱼、沙丁鱼)和一些植物性食物(如亚麻籽、奇亚籽、核桃)中。
Omega-6脂肪酸(Ω6)
同理,不饱和键位于第六个碳原子上的脂肪酸,则称为Omega-6脂肪酸。Omega-6脂肪酸在人体内也至关重要,胆固醇必须与Omega-6的亚油酸(LA)相结合,才能正常运转和代谢;人脑中的不饱和脂肪酸Omega-6和Omega-3各占一半。
Omega-6不饱和脂肪酸的食物来源非常丰富,玉米、大豆等植物及其加工产品如炒菜离不开的玉米油、大豆油等植物油以及我们常吃的猪肉、牛肉、羊肉里,Omega-6不饱和脂肪酸的含量都不少。
Ω3与Ω6的平衡对于炎症至关重要!
尽管都是人体所必需的重要不饱和脂肪酸,但是在对待炎症方面却展现出了截然不同的作用。Omega-6不饱和脂肪酸促进炎症的发生,引起身体的“失火”;Omega-3不饱和脂肪酸则恰恰相反,缓解并抑制炎症,从而预防重大疾病的发生。可见他们两者的平衡是非常重要的。
▸ 拓展:反式脂肪酸又是什么?
在生活中我们还能听到一些食品因含有反式脂肪酸而被认为是不健康的产品,反式脂肪酸(trans fatty acid,TFA)是含有反式非共轭双键结构不饱和脂肪酸的总称。
如果与双键上2个碳原子结合的2个氢原子在碳链的同侧,空间构象呈弯曲状,则称为顺式不饱和脂肪酸,这也是自然界绝大多数不饱和脂肪酸的存在形式。反之, 双键上两个碳原子结合的两个氢原子分别在碳链的两侧,其空间构象呈线性,则称为反式不饱和脂肪酸。
与不饱和脂肪酸不同,反式脂肪酸往往对身体有许多危害。研究发现,反式脂肪酸与心血管疾病发生风险之间存在正相关关系。除此之外还会影响生育和胎儿发育、降低记忆、促进肥胖和血栓的形成、影响神经行为。
鉴于对人体的重要性,以及其作为当前人们关心的重要营养素。本文将具体讲述Omega-3不饱和脂肪酸对人体的健康益处,以及可能存在的一些隐患。
首先我们需要清楚的是,Omega-3脂肪酸包括了一类多不饱和脂肪酸,并不单单指一个物质。主要有α-亚麻酸(ALA)、十八碳四烯酸(SDA)、二十碳五烯酸(EPA)、二十二碳五烯酸(DPA)和二十二碳六烯酸(DHA)。而ALA是Omega-3脂肪酸的母体,可去饱和并延伸形成其他Omega-3脂肪酸。
▸ α-亚麻酸主要来自植物
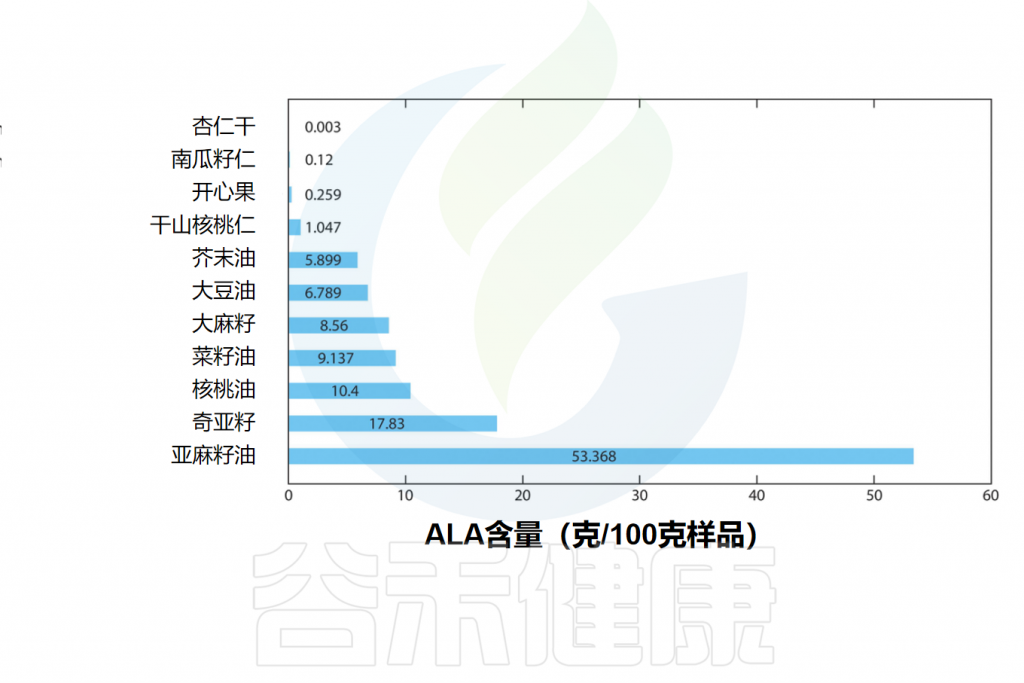
α-亚麻酸(ALA)的主要来源是植物,主要集中在一些种子和坚果以及植物油中。亚麻籽、奇亚籽、核桃和蓝蓟籽油是ALA的良好来源,而红花油、向日葵油、玉米油和大豆油则富含亚油酸(18:2 ω-6)。
亚麻籽及其油通常含有45-55%ALA形式的不饱和脂肪酸。大豆油、菜籽油和核桃含有5-10%ALA形式的不饱和脂肪酸。
一些含有α-亚麻酸(ALA)的食物
▸ 深海鱼中含有较多的EPA和DHA
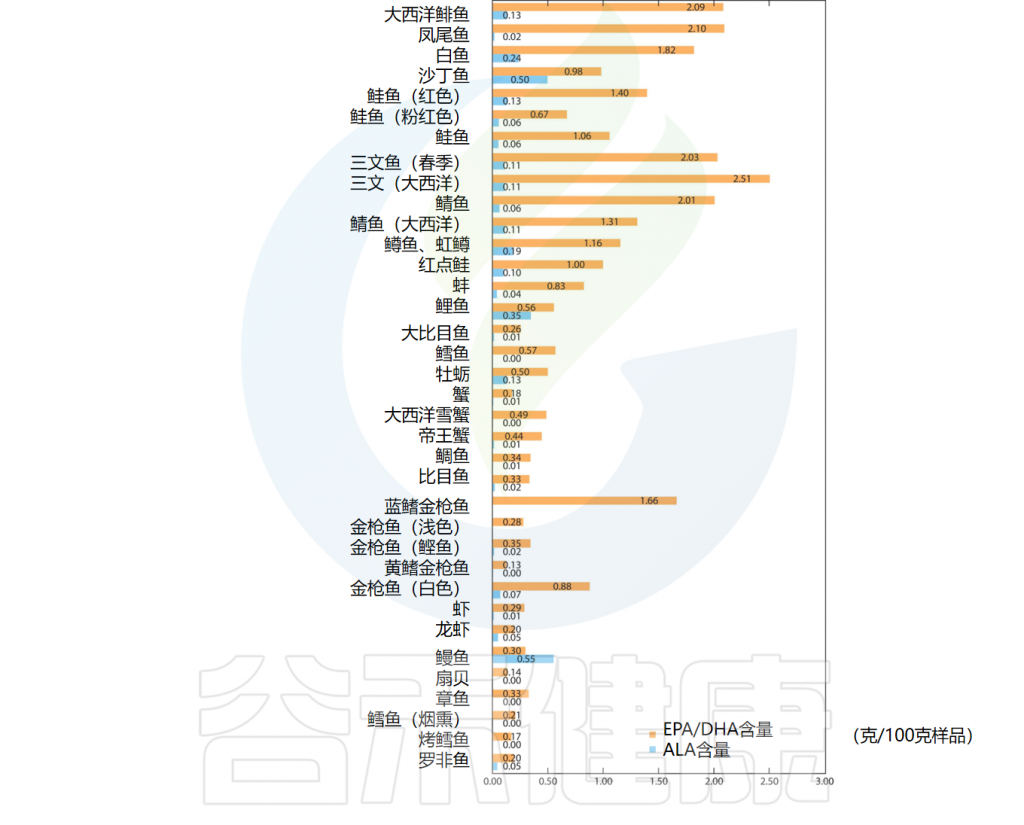
尽管人体能以ALA为前体合成EPA和DHA。然而,ALA生物转化为EPA和DHA的能力有限;因此,我们需要从饮食中摄取。
EPA和DHA最重要的饮食来源是油性深海鱼类(例如鲑鱼、金枪鱼、鲱鱼、沙丁鱼、鲭鱼)和海豹、鲸鱼等海洋哺乳动物的脂肪。除此之外,龙虾、雪蟹、扇贝、章鱼等动物也含有一定量的Omega-3脂肪酸。
一些含有DHA/EPA、ALA的食物
▸ 一些藻类和真菌也可以合成Omega-3
微藻和一些微生物(真菌)也含有Omega-3脂肪酸。据报道,海藻是生物圈中Omega-3脂肪酸(DHA)的主要生产者,许多藻类已被确定为DHA的来源。
寇氏隐甲藻(Crypthecodinium cohnii)和裂殖壶菌(Schizochytriumsp)是DHA的两个主要藻类来源,其含量分别占总脂肪酸的55%和40%。
Omega-3脂肪酸,特别是EPA和DHA,其实是由浮游植物合成,最终通过食物网转移并沉积到鱼类和海洋哺乳动物的脂质中。
注:最近,十八碳四烯酸(SDA)受到了关注,在饮食中补充SDA比补充ALA更能提高EPA水平。紫草科的植物,如玻璃苣、Echium vulgare和Buglossoides arvensis、大麻油和鱼类,都是SDA的良好来源。然而,SDA并不是人类饮食的主要成分。
Omega-3可以以乙酯(EE)、三酰甘油(TAG)、游离脂肪酸(FFA)或磷脂(PL)形式存在。研究人员表明,各种形式的Omega-3的消化和吸收高度依赖于膳食中的脂肪含量,这会增强胰酶的活性。
膳食脂肪消化
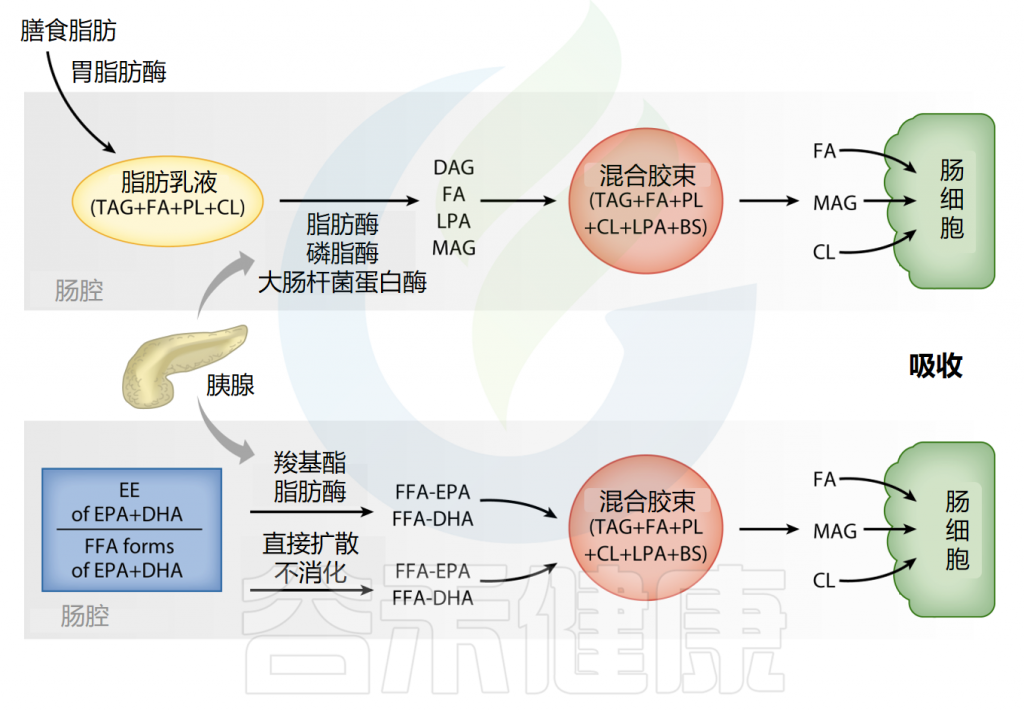
Shahidi F,et al.Annu Rev Food Sci Technol.2018
α-亚麻酸(ALA)被称为必需脂肪酸,因为人类不能从头合成ALA,植物性食品是ALA的主要膳食来源。尽管不能合成ALA,但人体可以通过进一步的去饱和和延伸过程来代谢它,这些过程被认为主要发生在肝脏中。
▸ ALA在人体可代谢转化成EPA、DHA
从膳食ALA合成其他Omega-3脂肪酸的代谢途径如图所示。SDA是从ALA合成的第一个代谢物,随后导致EPA、DPA和DHA的合成。
从ALA合成Omega-3不饱和脂肪酸的代谢途径
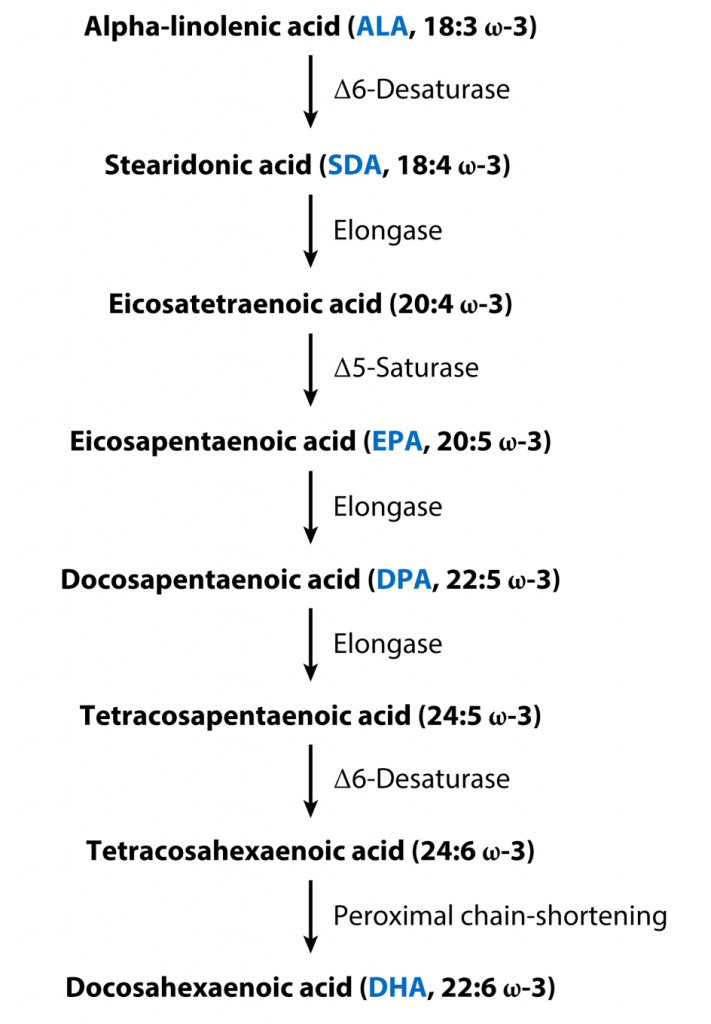
Shahidi F,et al.Annu Rev Food Sci Technol.2018
另一个主要途径涉及从亚油酸合成Omega-6不饱和脂肪酸,其中花生四烯酸是主要的最终产物。
▸ 胰岛素和矿物质水平会影响转化率
由于人类饮食中的α-亚麻酸(ALA)水平通常低于亚油酸,因此Omega-6脂肪酸的血浆和细胞水平往往高于Omega-3脂肪酸。
观察到,摄入ALA显著增加血浆和母乳中的EPA和DPA水平,而仅观察到DHA的轻微增加。另一项使用稳定同位素的研究表明,从ALA转化为EPA、DPA和DHA的效率分别为0.2%、0.13%和0.05%。
该转化需要去饱和酶(Δ5和Δ6)、微粒体系统的延长酶以及过氧化物酶体中的氧化以缩短链。一份报告显示,胰岛素水平低以及蛋白质和矿物质(铁、锌、铜和镁)缺乏可能会降低Δ6去饱和酶活性,从而抑制亚油酸和ALA转化为Omega-6和Omega-3。
▸ Ω6和Ω3对于许多激素的合成至关重要
Omega-6和Omega-3不饱和脂肪酸对于一些激素的合成至关重要,例如前列腺素(PG)、前列环素(PGI)、血栓素(TX)、白三烯、氢过氧四烯酸、羟基二十碳四烯酸等。
这些物质参与多种生理作用,包括促/抗炎、促/抗血小板聚集、血管舒张、血管收缩、免疫反应以及细胞生长和增殖。
不同脂肪酸衍生的物质其功能有时相反
例如,源自花生四烯酸的前列腺素的功能与源自 EPA的前列腺素不同。由花生四烯酸形成的PGE2和TXA2在血小板中产生,并通过有效的化学活性和血小板聚集促进炎症,并充当血管收缩剂。
然而,EPA衍生的PGE和TXA仅起到血管扩张剂和抗聚集剂的作用。因此,Omega-6和Omega-3不饱和脂肪酸在生理功能中起着重要作用,这种不平衡可能导致多种疾病,包括血栓形成、炎症、哮喘和炎症性肠病。
此外DHA已被证明是大脑灰质的主要成分,其磷脂形式已被证明是视网膜、睾丸和精子的主要成分。
作为一种重要的不饱和脂肪酸,Omega-3脂肪酸对我们的健康产生着深远的影响。它被认为是一种必需的营养物质,能够帮助维持心血管健康、影响大脑和视力功能、改善炎症、睡眠等。
了解Omega-3脂肪酸对人体健康的积极影响至关重要,跟着谷禾一起探索Omega-3脂肪酸如何成为我们健康生活的重要组成部分。
• 维护心血管健康
Omega-3可以帮助降低心脏疾病风险。它们通过降低血液中的甘油三酯水平、低密度脂蛋白(LDL)中不良胆固醇,减少血小板聚集(降低血栓形成风险)、降低血压同时提高高密度脂蛋白(HDL)中良性胆固醇量来实现这一点。这些作用共同帮助维护心血管系统的健康。
• 抗炎作用
Omega-3脂肪酸可以通过影响炎症介质的产生来调节炎症反应。具体来说,它们能够减少前列腺素E2(PGE2)和白三烯B4(LTB4)等促炎因子的生成。
Omega-3脂肪酸还通过影响多种信号通路来发挥抗炎作用,包括抑制核因子κB(NF-κB)信号通路。
• 调节大脑健康
Omega-3脂肪酸,特别是DHA,是大脑和神经系统正常发育和功能所必需的,是构成脑细胞膜的成分,也是维护脑部健康的重要功臣。它对儿童大脑发育至关重要,有助于提高学习能力和注意力。在成人中,足够的Omega-3摄入量与降低认知衰退和阿尔茨海默病的风险有关。
• 眼部健康
DHA是视网膜的主要成分,对维持视力至关重要。Omega-3的摄入与降低年龄相关的黄斑变性风险有关,这是老年人失明的一个主要原因。
黄斑变性是指由于年龄、遗传、不良环境、慢性光损伤等各种因素的影响,使眼部视网膜处的黄斑发生萎缩,或代谢异常,导致患者出现视力异常的疾病。
• 抗抑郁和焦虑、消除偏头痛
研究表明,Omega-3可以帮助改善抑郁和焦虑症状。尤其是EPA,被认为在调节情绪和抗抑郁中起着重要作用。
Omega-3还能帮助抑制导致疼痛和发炎的“不良”前列腺素的分泌。它也能减少血液的粘度,以促进脑部的血液循环。这将会减少偏头痛的发作次数,亦能减低其严重程度和待续时间。
• 使皮肤更显年轻
Omega-3能令皮肤均衡保湿及保持健康。它能强化围绕于每一个细胞周围的纤柔细胞膜,使细胞获得充足滋养,同时能有效地把细胞内的废物予以排除。它能使真皮层分泌出更强力的胶原和弹性纤维,帮助消除皱纹和细纹,并挺实渐呈松弛的皮肤。
• 改善睡眠质量
一些研究表明,Omega-3的摄入与改善睡眠质量有关,可能通过影响睡眠调节的神经传递物质和激素实现。例如DHA,被认为可以调节褪黑素的产生。褪黑素是一种重要的睡眠调节激素,它帮助调整人体的生物钟和睡眠周期。
此外,Omega-3脂肪酸还可能带来其他潜在健康益处。为了提供更有力的证据,谷禾综合了大量研究资料,探讨了Omega-3不饱和脂肪酸对各种疾病的影响,旨在帮助大家更深入了解Omega-3不饱和脂肪酸。
1
心血管疾病
由于高脂肪饮食,世界范围内的心血管疾病和相关死亡率越来越高。已经对Omega-3不饱和脂肪酸对主要心血管疾病的影响进行了大量研究,如心肌梗死、中风、先天性心脏病、心律失常、心房颤动、亚临床动脉粥样硬化、冠心病、心力衰竭、心源性猝死、瓣膜病和外周动脉疾病。
• 大量人群数据显示较高的Omega-3摄入量的心血管疾病风险较低
格陵兰岛、加拿大北部和阿拉斯加食用传统饮食的原住民,尽管膳食脂肪摄入量较高,但心血管疾病(特别是冠心病)死亡率远低于预期。饮食中的保护成分被认为是由于定期摄入鲸鱼和海豹肉、鲸脂和多脂鱼而含有大量的Omega-3不饱和脂肪酸。
日本人的传统饮食也具有较低的心血管死亡率,这种饮食富含海鲜,包括富含脂肪的鱼类,有时还包括海洋哺乳动物,其中含有大量的EPA和DHA。从前瞻性和病例对照研究中积累的大量证据表明,西方人群中较高的EPA和DHA摄入量与较低的心血管疾病风险相关。
• Omega-3降低心血管疾病风险的具体作用
Omega-3不饱和脂肪酸,尤其是DHA和EPA,通过改变脂质和止血因素(例如血小板聚集和出血时间)来降低心血管疾病的临床风险。
DHA已被证明具有抗血小板聚集、降低三酰甘油作用和抗心律失常作用。在控制高脂饮食的多变量男性模型中,饱和脂肪酸的血清水平较高与冠心病风险增加相关,而Omega-3不饱和脂肪酸中DHA和DPA与冠心病风险呈负相关。
据报道,Omega-3不饱和脂肪酸还可以降低心脏对室性心律失常的敏感性,延缓动脉粥样硬化斑块的生长(通过减少粘附分子表达和血小板衍生生长因子并具有抗炎作用)。降血压,并发挥抗血栓形成和低甘油三酯(空腹和餐后)作用,因此具有心脏保护作用。
Omega-3对心率和血压的影响归因于一氧化氮生成率的增加,减轻对去甲肾上腺素和血管紧张素II的血管收缩反应,增强血管舒张反应,改善动脉顺应性。
Ω3脂肪酸减少心血管疾病风险的机制
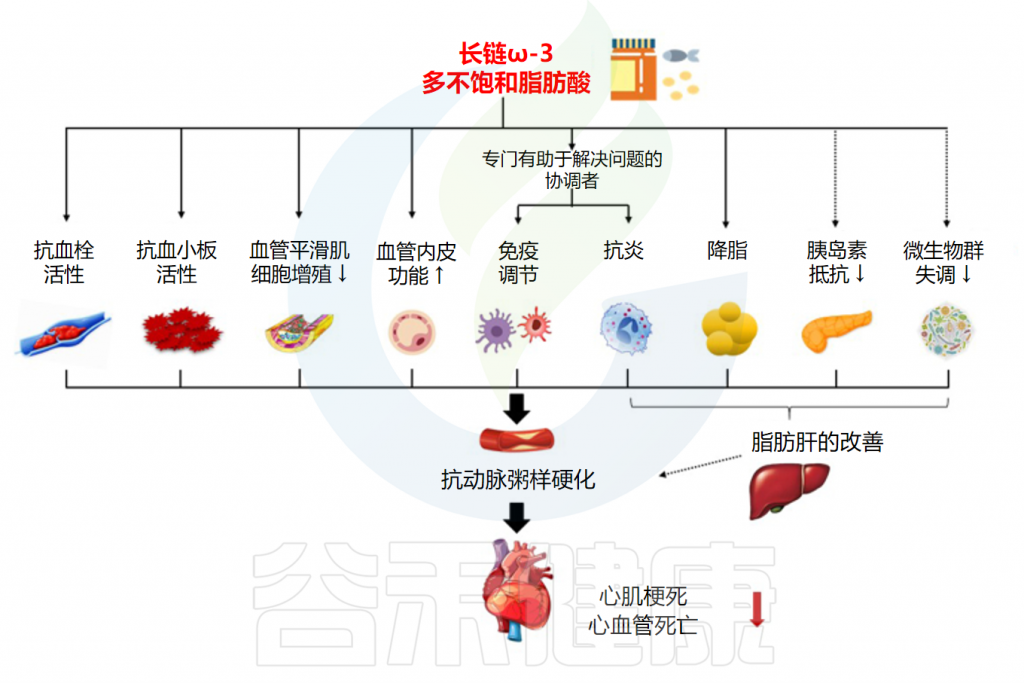
Bae JH,et al.Adv Nutr.2023
下图总结了Omega-3对心血管健康的生理影响:

编辑
Shahidi F,et al.Annu Rev Food Sci Technol.2018
• Ω6与Ω3的比率可能是心血管疾病风险的重要标志
此外,Ω6(亚油酸和花生四烯酸)与Ω3(EPA、DHA和亚麻酸)的比率被认为是分析心血管疾病风险的重要生物标志物。然而据报道,组织中的Ω3水平在心血管风险评估中可能比Ω6或AA/EPA比率具有更好的预后和诊断效用。
对之前发表的文章进行了系统综述分析,了解Omega-3不饱和脂肪酸对心血管健康的影响。谷禾将其整理在下图中。


Shahidi F,et al.Annu Rev Food Sci Technol.2018
2
糖尿病
多项研究表明,补充Omega-3不饱和脂肪酸或鱼油对2型糖尿病具有有益作用。研究发现,食用Omega-3不饱和脂肪酸饮食八周后可增加老年人的胰岛素敏感性,并显著降低血清C反应蛋白。
• Omega-3对糖尿病的影响还存在争议
回顾了以前的一些研究,发现Omega-3不饱和脂肪酸对2型糖尿病或代谢综合征患者的血浆三酰甘油(TAG)水平有有利影响,但对总胆固醇、高密度脂蛋白 (HDL)、低密度脂蛋白(LDL)、空腹血糖或糖化血红蛋白水平没有直接影响。
关于Omega-3不饱和脂肪酸在糖尿病和胰岛素抵抗中的作用仍然存在争议。因此,需要进一步的临床研究来确定Omega-3是否影响人类糖尿病和胰岛素抵抗。
omega-3与糖尿病的研究结果总结

Shahidi F,et al.Annu Rev Food Sci Technol.2018
3
癌症
在过去的十年中,多项实验和流行病学研究表明,Omega-3不饱和脂肪酸可以降低患癌症的风险。
据报道,Ω3不饱和脂肪酸具有抗癌作用,而饱和脂肪酸和Ω6不饱和脂肪酸可能会促进癌症的发展。Ω3不饱和脂肪酸已被证明可以影响多种类型的癌症,包括前列腺癌、结肠癌、乳腺癌、肺癌、结直肠癌、卵巢癌、胰腺癌、皮肤癌和胃癌。此外,Ω3被证明可以提高化疗的疗效和耐受性。
• Omega-3可能的抗癌机制
提出了一些关于Omega-3抗癌作用的分子机制:
(a)减少花生四烯酸衍生的类二十烷酸的生物合成,这导致对癌细胞的免疫反应、炎症调节、细胞增殖、细胞凋亡、转移和血管生成改变;
(b)影响导致新陈代谢、细胞生长和分化变化的转录因子的活性;
(c)改变雌激素的代谢活性,随后雌激素刺激的细胞生长减少;
(d)自由基和活性氧产生的改变;
(e)调节胰岛素敏感性和膜流动性。
据报道,Omega-3不饱和脂肪酸通过降低环加氧酶 COX-2和PGE2水平侵入并抑制肿瘤细胞生长,因此可以作为天然COX抑制剂。
此外,Ω6与Ω3的比率低于5被认为可减缓癌症进展。同时,增加Ω6的摄入量被证明会促进动物和人类患乳腺癌、前列腺癌和结肠癌。
Ω6促肿瘤作用背后的机制包括脂质过氧化、17-β-雌二醇(E2)环氧化后产生致癌物,以及通过增强其他化合物(例如染色质)的基因毒性作用而产生致癌作用。
• 每天适当补充Ω3对癌症患者有积极作用
最近的一项研究表明,将Ω3与1α,25-二羟基维生素D3结合可显著增加乳腺癌细胞系的细胞凋亡。膳食补充Ω3不饱和脂肪酸、α-生育酚、亚麻酸、纤维和植物雌激素对乳腺癌患者具有积极作用。研究表明亚麻籽对乳腺癌患者具有抗增殖活性,并建议绝经前妇女每天摄入25克亚麻籽。
还有研究发现,使用Ω3作为接受放射治疗的头颈癌患者的营养补充剂,有助于他们通过增加蛋白质热量摄入来维持体重并耐受抗癌治疗,从而提高他们的生活质量。
!
一些因素会影响Ω3对癌症的效果
某些因素可能会影响Ω3不饱和脂肪酸对癌症的不一致结果:Ω3不饱和脂肪酸的来源、类型(ALA、DHA或EPA)、形式和含量的差异以及Ω6与Ω3的比率和遗传因素,例如COX和脂氧合酶修饰基因的多态性。
需要更多的临床试验来找出针对特定癌症病理的Ω3有效剂量和配方。
4
阿尔茨海默病和认知能力
多项流行病学研究表明,较低的Ω3不饱和脂肪酸摄入量会增加认知能力下降或痴呆的风险,尤其是阿尔茨海默病。
有足够的临床证据表明Ω3不饱和脂肪酸可以预防阿尔茨海默病。DHA是大脑中膜磷脂的主要成分,特别是在大脑皮层、线粒体、突触体和突触小泡中。
• 不饱和脂肪酸影响脑功能的机制
不饱和脂肪酸对脑功能的作用机制包括改变:
(a)膜流动性;
(b)膜结合酶的活性;
(c)受体的数量和亲和力;
(d)离子通道的功能;
(e)神经递质的产生和活动,以及信号转导,控制神经递质和神经元生长因子的活动。
Omega-3不饱和脂肪酸可导致人体淋巴细胞增殖、TNFα产生、自然杀伤细胞活性以及白细胞介素IL-1 和白细胞介素IL-2产生减少。
• 不饱和脂肪酸的缺乏会影响儿童神经系统
研究人员调查了317名足月婴儿的脐动脉和脐静脉 脂肪酸组成以及早期新生儿神经系统状况,并报告说,较低的胎儿DHA、花生四烯酸(AA)和必需脂肪酸水平会对早期产后神经系统状况产生负面影响。此外,早期新生儿缺乏不饱和脂肪酸可能导致亨廷顿舞蹈症、精神分裂症、高血压和成年后食欲信号增强。
多项研究表明,必需脂肪酸,尤其是Omega-3不饱和脂肪酸的缺乏会导致注意力缺陷多动障碍 (ADHD)。而服用Omega-3不饱和脂肪酸可显著改善缺陷多动障碍儿童的生活质量、注意力集中能力、睡眠质量和血红蛋白水平。
• Ω3脂肪酸的摄入对老年人的认知有益
摄入鱼类和Ω3不饱和脂肪酸已被证明对健康老年人具有积极的认知健康作用,而在考虑阿尔茨海默病患者时,补充Ω3还可以使患有记忆障碍或轻度认知障碍和阿尔茨海默病的老年人受益。
5
抑郁症
据世界卫生组织称,抑郁症可能成为全球第二大疾病。多项流行病学研究表明,食用鱼类与降低抑郁症风险相关。
• 早期发育时缺乏DHA会增加成年后患抑郁症风险
研究发现补充Ω3(EPA+DHA的混合物)对精神分裂症孕妇有积极作用。EPA已被证明可以作为一种抗抑郁剂,引起大脑结构变化,包括大脑侧脑室容量减少和神经元周转减少。
基于28项临床试验的荟萃分析研究提供的证据表明,EPA在治疗抑郁症方面可能比DHA更有效。此外,早期发育过程中DHA的缺乏可能会影响中枢神经系统,并增加成年后患抑郁症的可能性。摄入或补充鱼油/Ω3不饱和脂肪酸已被证明可以保护青少年(15-25 岁)免受重度抑郁症。
• Ω3脂肪酸作为抗抑郁药的机制
使用Ω3脂肪酸作为抗抑郁药的可能作用机制包括:
(a)调节炎症细胞因子的分泌,因为其可能会引发重度抑郁症的体征和症状;
(b)膜流动性增加,导致内皮细胞转运血清素(5-HT)增加;
(c)额叶皮质中DHA浓度增加,这可以增加多巴胺浓度和(多巴胺)D2受体结合;
(d)与神经元细胞膜受体和第二信使相互作用,导致情绪改变。
然而,关于Ω3不饱和脂肪酸潜在抗抑郁能力的一些发现存在矛盾;因此,需要进一步的随机对照试验来研究使用EPA占主导地位的Ω3不饱和脂肪酸制剂的诊断或临床显著抑郁症患者。
6
大脑、视觉发育、妇幼保健
• Omega-3不饱和脂肪酸对大脑发育至关重要
多项研究报告了膳食Omega-3不饱和脂肪酸对大脑发育的重要作用。膳食Ω3摄入量低会增加产前或产后发育期间大脑花生四烯酸 (AA)/DHA的比例。
该比率的变化减少了神经元迁移、神经发生、胚胎皮质板扩张、突触修剪、脑葡萄糖摄取和代谢的延迟,并导致谷氨酸和单胺突触功能受损。
• Omega-3脂肪酸与孕妇及儿童健康相关
DHA是视觉系统中视网膜感光器和皮质灰质的重要结构成分;怀孕期间补充DHA有助于视觉系统的成熟。在妊娠后半期,DHA在神经皮质组织和视网膜膜突触中迅速积累。
大量流行病学研究表明Omega-3脂肪酸与孕期孕产妇健康和儿童健康相关。Omega-3脂肪酸影响妊娠时长、出生体重、围产期抑郁、妊娠高血压/先兆子痫、产后神经发育、认知发育、自闭症谱系障碍、多动症、学习障碍、特应性皮炎、过敏和呼吸系统疾病等。
怀孕期间补充Omega-3脂肪酸已被证明与高等级立体敏锐度、词汇理解力、接受性词汇、言语智商以及从婴儿期到9岁的较高认知分数呈正相关。
Omega-3脂肪酸作为一种重要的营养物质,被广泛认为对人体健康有益,而肠道微生物群则是我们消化系统中不可或缺的一部分。它们之间是否存在某种联系?让我们一起来了解下。
一项使用来自876名同时测得16S微生物组和Ω3不饱和脂肪酸的数据研究表明,在调整混杂因素后,总Ω3不饱和脂肪酸和DHA的血清浓度与微生物组α多样性(香农指数)显著相关。
在调整膳食纤维摄入量后,这些关联仍然显著。对2型糖尿病患者进行的一项随机对照试验显示,与沙丁鱼饮食相比,2型糖尿病患者的厚壁菌门与拟杆菌门的比率显著下降。
补充Ω3脂肪酸可以增加产短链脂肪酸细菌的丰度
健康志愿者补充8周的Ω3不饱和脂肪酸导致产生短链脂肪酸的肠道微生物群持续且可逆地增加。然而,发现微生物多样性缺乏显著变化,这与小鼠研究一致,其中α-多样性没有变化或只有微小变化。
值得注意的是,短期饮食干预无法改变肠道微生物组的主要个体差异。
总而言之,Omega-3不饱和脂肪酸可能通过影响肠道微生物组和连接肠道与脂肪组织、肝脏和胰腺的代谢物来减轻高血糖和胰岛素抵抗。因此,补充Omega-3不饱和脂肪酸可能有助于通过肠道器官轴的有利变化恢复葡萄糖稳态。
膳食中摄入Ω3不饱和脂肪酸(例如DHA和EPA)可以改变肠道微生物群,但膳食补充剂的持续时间或改变肠道微生物群的剂量尚不清楚。多项人类和动物研究表明,DHA和其他Ω3不饱和脂肪酸摄入量的增加与有益肠道细菌的增加相关。
然而,这些研究不仅物种组成的变化不同,而且对生物体的功能益处也不一致。尽管如此,大多数研究表明,虽然参与者和DHA来源存在异质性,但更多的DHA摄入量会增加细菌α多样性以及双歧杆菌等抗炎细菌的丰度,而促炎细菌的丰度则会减少。
Ω3脂肪酸摄入量对肠道微生物群影响的研究
编辑
编辑
Kerman BE,et al.Curr Opin Clin Nutr Metab Care.2024
有助于抑制炎症因子
此外,补充DHA可恢复肠道屏障。在患有炎症性肠病的小鼠中,摄入DHA会特异性抑制促炎细胞因子,促进血液中的抗炎细胞因子,并减少大脑中小胶质细胞的激活。
编辑
来自喂食DHA的小鼠的粪菌移植表示,微生物群赋予移植小鼠抗炎作用。在一项针对HIV感染认知障碍参与者的研究中,摄入DHA24周并没有改善认知能力,尽管它对肠道微生物群有积极作用并降低了血清炎症标志物水平。
总之,一些证据表明增加Ω3不饱和脂肪酸摄入量对人类和动物有恢复作用。
一项针对不吃海鲜的素食主义者和纯素食者的队列研究显示,尽管Ω3不饱和脂肪酸血液水平较低,但痴呆或认知能力下降的风险较低。
居住在加利福尼亚州洛马琳达的人群,食用不含红肉、鸡肉或海鲜的植物性饮食与较低的心血管疾病和神经退行性疾病有关。
与吃肉的人相比,素食主义者的黄嘌呤、组氨酸、支链脂肪酸、乙酰化肽、神经酰胺和长链酰基肉碱等代谢物的水平较低。而这些代谢物许多与胰岛素抵抗、心血管风险增加和炎症有关。
• 更稳定的肠道微生物有利于将ALA转化为其他Ω3脂肪酸
英国的一项前瞻性研究(196名杂食者、231名素食者和232名纯素食者)报告称,随着时间的推移,素食者和纯素食者中的Ω3不饱和脂肪酸水平保持稳定,这表明ALA的内源性转化为EPA和DHA可能足以在多年内保持Ω3不饱和脂肪酸水平的稳定。
植物性饮食产生这些有益效果的方法之一是促进肠道微生物组更加多样化和稳定。例如,与杂食动物相比,素食主义者和素食者的某些拟杆菌门数量明显更高。纤维可以增加乳酸菌的丰度。植物性食物中富含的多酚可以增加肠道中双歧杆菌和乳酸菌的丰度,并具有抗炎特性。高植物纤维摄入量还支持纤维发酵成短链脂肪酸。
我们推测,在海鲜摄入有限且DHA与EPA水平较低的群体中,对Omega-3脂肪酸的缺乏反应可能受到饮食习惯和肠道微生物组成的影响。
• 多样而稳定的微生物群有助于缓解Omega-3摄入不足带来的负面影响
在摄入高纤维植物性饮食的人群中,多样而稳定的微生物组有助于促进抗炎状态,其丰富的短链脂肪酸、抗氧化剂和长链脂肪酸(如Ω6)可能补偿DHA或EPA水平低下的负面效应。
相反,在缺乏Omega-3脂肪酸、偏好加工肉类、低纤维植物饮食和不健康生活方式的西方饮食背景下,较低的微生物多样性和菌群失衡可能促进炎症性疾病,如阿尔兹海默病(AD)的慢性炎症途径激活。
编辑
Kerman BE,et al.Curr Opin Clin Nutr Metab Care.2024
开展了PreventE4(NCT03613844)研究,这是一项针对365名根据APOE4基因型分层、认知正常个体进行的为期两年的2克DHA与安慰剂对照的随机双盲试验。
PreventE4的主要目标是补充DHA六个月后,根据APOE4基因型,脑脊液(CSF)DHA水平的变化。次要目标包括脑成像结果的变化,而探索性目标则包括在基线、干预后6个月和24个月时评估的肠道微生物组及脑脊液和血浆的代谢组指标。研究人员预期,DHA补充将通过肠道微生物组成和代谢组的变化,部分解释对脑脊液DHA水平、成像和认知结果的影响。
• 补充Ω3脂肪酸有助于微生物群更健康、多样化
DHA补充将把西方饮食诱导的微生物表型转变为更健康、多样化的微生物群,这将与脑脊液DHA水平的显著提升、血浆和脑脊液中炎症标志物的降低以及成像和认知测量的改善相关联。
相比之下,DHA补充后未发生变化的西方饮食微生物表型可能不会对DHA补充产生有益反应。
最后,尽管Ω3/Ω6水平在血液和脑脊液中有所提高,但在基线时就拥有多样化和健康微生物群的个体可能只会显示较小的临床结果变化。
Ω3脂肪酸,作为一种对人体至关重要的脂肪酸,它在维持人体健康方面扮演着极其重要的角色。这种脂肪酸不仅对心血管健康有益,还能在许多其他方面促进身体健康,如改善大脑功能、降低炎症等。
然而,任何物质的摄入都应当遵循一个基本原则,那就是“过犹不及”。正如所有营养素一样,Ω3脂肪酸也需要适量摄入。既不应该摄入过少,以免身体无法获得必要的营养支持,也不应该过量摄入,因为这可能会导致一些不良的健康影响。
Omega-3脂肪酸可能会影响血小板功能,减少血小板计数和反应性,延长出血时间,并增加抗凝剂与促凝代谢物(分别为前列环素和血栓素)的比例。
除了融入血小板膜外,Omega-3脂肪酸(EPA和DHA)还与花生四烯酸竞争代谢转化的环氧合酶和脂氧合酶途径,从而降低血栓素A2的产生。
血小板功能的调节取决于 EPA 和 DHA 的剂量,主要发生在剂量大于 2 克/天时。这些影响似乎主要是由 EPA 的作用介导的。由于这些影响,有人担心长链 omega-3 PUFA,尤其是高剂量使用时,会不利地促进出血并延长出血时间。
• 当前的研究还没有发现Omega-3和失血过多存在相关性
关于Omega-3脂肪酸可能导致出血过多的可能性,一项研究汇总了来自19项精心设计的临床试验的证据,这些患者接受了重大手术(冠状动脉搭桥术、颈动脉内膜切除术和股动脉插管术)。
根据这些数据,得出的结论是,无论是单独使用EPA/DHA还是使用抗血栓/抗血小板药物治疗的患者,长链Omega-3脂肪酸都不会增加临床上显著出血的风险。
2018年的出版物报告了之前未发表的8项肠内营养临床试验数据,其中包括鱼油作为Omega-3脂肪酸的来源;这些试验针对不同的患者组(N=600名患者)提供了不同剂量的 EPA+DHA(1.5-10.2 克/天),持续时间不同(8天至52周)。Omega-3不饱和脂肪酸对凝血参数没有影响,并且Omega-3不饱和脂肪酸组和安慰剂组在出血事件方面没有差异。
Omega-3不饱和脂肪酸增加出血是理论上的考虑;然而,可能还需要更多的人体临床试验来证明其安全性,以打消人们的顾虑。
一些临床试验表明,Omega-3脂肪酸可能与患房颤(AF)的可能性增加有关,特别是对于心血管风险高或血脂升高的人群。
一些试验提供了不同剂量和不同配方中Omega-3脂肪酸对房颤的影响,较高的Omega-3脂肪酸补充可能会增加房颤的风险。
基线时没有心血管疾病、癌症或心房纤颤的参与者被随机分配接受840毫克/天Omega-3 不饱和脂肪酸(460毫克EPA和380毫克DHA)或橄榄油作为安慰剂。5.3年后,两组之间的房颤事件发生率没有较大差异(3.7%与3.4%)。
然而,使用较高剂量的Omega-3不饱和脂肪酸的试验发现,房颤风险增加。例如,每天3.2克EPA+DHA作为游离脂肪酸的治疗导致3.5年后发生心房纤颤的可能性更高(2.2%对比1.3%)。
在REDUCE-IT实验中,与对照组相比,随机接受每天近4克纯化EPA乙酯的患者在中位4.9年后发生房颤的风险显著增加。OMEMI 试验中约1.6克/天的Omega-3脂肪酸(930 毫克EPA和660毫克DHA)中间剂量也导致治疗组与安慰剂相比发生更多房颤。
包括2012年至2020年间发表的7项随机对照试验。在81210名患者中,72.6%参加了每天测试≤1g Omega-3不饱和脂肪酸的试验,27.4%参加了每天测试>1g Omega-3不饱和脂肪酸的试验。随访时间为4.9年。使用较高剂量的Omega-3脂肪酸与房颤风险增加相关。
因此,大多数最近试验的荟萃分析表明,Omega-3不饱和脂肪酸可能会增加房颤的风险,特别是在高剂量使用时。
最近的研究认为,Omega-3不饱和脂肪酸对房颤的影响是U形的:中等剂量时它们会降低房颤风险,但高剂量时会增加风险。
鉴于Omega-3不饱和脂肪酸改善心血管的能力,2019年,美国心脏协会更新了之前的建议,即每天使用2-4克EPA+DHA来降低甘油三酯。
作为单一疗法或作为其他降甘油三酯疗法的辅助疗法。欧洲心脏病学会和欧洲动脉粥样硬化学会发布了《血脂异常管理临床实践指南》的更新版,特别建议“在患有甘油三酯的高危患者中尽管使用他汀类药物治疗,但其水平在1.5至5.6mmol/L(135–499 mg/dl)之间,Omega-3不饱和脂肪酸应考虑与他汀类药物一起使用。”
美国脂质协会声明称,“对于年龄≥45岁患有临床动脉粥样硬化性心血管疾病(ASCVD)的患者,或年龄≥50岁患有糖尿病且需要药物治疗且有≥1个额外危险因素的患者,空腹甘油三酯为135至499 mg/dl高强度或最大耐受他汀类药物治疗,建议使用Omega-3不饱和脂肪酸以降低ASCVD风险”。
美国心脏协会重申了之前对心血管疾病患者使用EPA+DHA的支持并扩展它,指出对于患有流行性冠心病(例如近期发生心肌梗死)的患者的建议基本保持不变:对于这些患者来说,补充Omega-3不饱和脂肪酸治疗是合理的。即使该临床人群的冠心病死亡率可能略有下降(10%),也可以证明采用相对安全的疗法进行治疗是合理的。
Omega-3可以通过饮食和补充剂获得。饮食来源主要包括富含Omega-3的鱼类,如三文鱼、鲭鱼、鲑鱼和金枪鱼。对于不常吃鱼或希望通过补充剂摄入Omega-3的人,可以考虑鱼油补充剂、藻油补充剂(适合素食者)或亚麻籽油补充剂。
定期检查健康状况,特别是心血管健康指标和血脂水平,可以帮助评估Omega-3补充的效果,并根据需要调整摄入量。
Omega-3脂肪酸,作为一类不饱和脂肪酸,主要包括α-亚麻酸(ALA)、二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),对人体健康具有重要影响。
许多研究已经证明,Omega-3脂肪酸对心血管健康具有显著益处,能有效降低心血管疾病的风险,包括降低血压、减少甘油三酯水平及抑制炎症。
此外,Omega-3脂肪酸对大脑健康也至关重要,特别是DHA,它是大脑结构的重要组成部分,对维持认知功能、预防认知衰退有重要作用,还能在一定程度抗抑郁。
在孕妇和婴儿的营养中,Omega-3脂肪酸对神经系统的发育同样不可或缺,还有助于提高视力和认知能力的发展。
尽管Omega-3脂肪酸的健康益处众多,但它们在人体内不能自主合成,必须通过饮食来获取。这就需要通过富含Omega-3的食物如三文鱼、鲭鱼、鲑鱼和沙丁鱼等深海鱼类;此外,亚麻籽、奇亚籽、核桃以及高品质的亚麻籽油和藻类油也是优质的植物性Omega-3来源,或是通过补充剂来确保足够的摄入量。
Omega-3不饱和脂肪酸与肠道微生物群的多样性相关,足量的Omega-3有助于抑制炎症因子修复肠道屏障,同时更稳定健康的肠道微生物有利于将α-亚麻酸转化为Ω3脂肪酸,维持Omega-3的稳定水平,增加健康益处。
需要注意的是,补充Omega3脂肪酸时也应适度适量,无论是饱和脂肪酸还是不饱和脂肪酸,如果摄入量超过了人体的能量需求,多余的脂肪酸就会在体内转化为脂肪储存起来,导致人体肥胖,以及可能存在的一些未被发现的隐患,重要的是根据每个人自身的需求来制定精准的日常膳食。
主要参考文献
Kerman BE, Self W, Yassine HN. Can the gut microbiome inform the effects of omega-3 fatty acid supplementation trials on cognition? Curr Opin Clin Nutr Metab Care. 2024 Mar 1;27(2):116-124.
Djuricic I, Calder PC. Pros and Cons of Long-Chain Omega-3 Polyunsaturated Fatty Acids in Cardiovascular Health. Annu Rev Pharmacol Toxicol. 2023 Jan 20;63:383-406.
Shahidi F, Ambigaipalan P. Omega-3 Polyunsaturated Fatty Acids and Their Health Benefits. Annu Rev Food Sci Technol. 2018 Mar 25;9:345-381.
Li JJ, Dou KF, Zhou ZG, Zhao D, Ye P, Zhao JJ, Guo LX. Role of omega-3 fatty acids in the prevention and treatment of cardiovascular Diseases: A consensus statement from the Experts’ Committee Of National Society Of Cardiometabolic Medicine. Front Pharmacol. 2022 Dec 12;13:1069992.
Patel D, Evanchuk J, Wang R, Dunbar CL, Munhoz J, Field CJ. Regulation of immune function in healthy adults: one-stop guide on the role of dietary fatty acids, gut microbiota-derived short chain fatty acids, and select micronutrients in combination with physical activity. Appl Physiol Nutr Metab. 2023 Aug 1;48(8):554-568.
Yan Y, Jiang W, Spinetti T, Tardivel A, Castillo R, Bourquin C, Guarda G, Tian Z, Tschopp J, Zhou R. Omega-3 fatty acids prevent inflammation and metabolic disorder through inhibition of NLRP3 inflammasome activation. Immunity. 2013 Jun 27;38(6):1154-63.
Bae JH, Lim H, Lim S. The Potential Cardiometabolic Effects of Long-Chain ω-3 Polyunsaturated Fatty Acids: Recent Updates and Controversies. Adv Nutr. 2023 Jul;14(4):612-628.
Samrit T, Osotprasit S, Chaiwichien A, Suksomboon P, Chansap S, Athipornchai A, Changklungmoa N, Kueakhai P. Cold-Pressed Sacha Inchi Oil: High in Omega-3 and Prevents Fat Accumulation in the Liver. Pharmaceuticals (Basel). 2024 Feb 7;17(2):220.
Rinninella E, Costantini L. Editorial: Polyunsaturated fatty acids and gut microbiota. Front Nutr. 2023 Jul 28;10:1256817.

谷禾健康

就在前不久,世界卫生组织将阿斯巴甜列为可能致癌物,引发了人们不小的热议。阿斯巴甜作为人工甜味剂的一种,不提供任何卡路里,就可以提供蔗糖几百倍的甜度。
人工甜味剂几乎不提供热量,或只提供极少的热量,所以深受健身人士及减肥人群的喜爱。人工甜味剂相关产业发展迅速,许多无糖饮料、无糖冰淇淋、巧克力等食品中都有其身影。
除了人工甜味剂外,乳化剂、着色剂、防腐剂等食品添加剂也是现代食品产业的重要组成部分,用于维持或提高食品的口味、安全性、新鲜度和外观。
但随着食品中的添加剂越来越多,其对健康的影响正引起人们的担忧。在此背景下,食品添加剂对微生物群的影响受到广泛研究。
事实上许多国家允许的食品添加剂并不会直接对人产生有害影响,但是会改变肠道微生物及其代谢。近年来出现的证据表明食品添加剂和微生物群之间存在相互作用,这可能会间接影响宿主健康。
例如盐是用于食品保鲜的最常见天然添加剂之一。高盐摄入会改变肠道微生物群组成和粪便短链脂肪酸的产生,通过调节辅助T细胞17影响肠道免疫轴并促进局部和全身组织炎症,可能导致高血压和肥胖。
此外,人工甜味剂有可能引起糖代谢障碍。随着人工甜味剂摄入量的增加,患心血管疾病的风险上升,尤其是阿斯巴甜与脑血管疾病,安赛蜜和三氯蔗糖与冠动脉性心脏病的风险有关。
本文主要总结了食品添加剂中的人工甜味剂、多元醇、乳化剂、色素、防腐剂对人体肠道微生物的影响,并间接导致了一些宿主代谢的变化,已有研究发现过量摄入食品添加剂与肠道炎症之间存在关联。在最后,我们提出了一些有助于减轻食品添加剂对身体的损害的小建议。
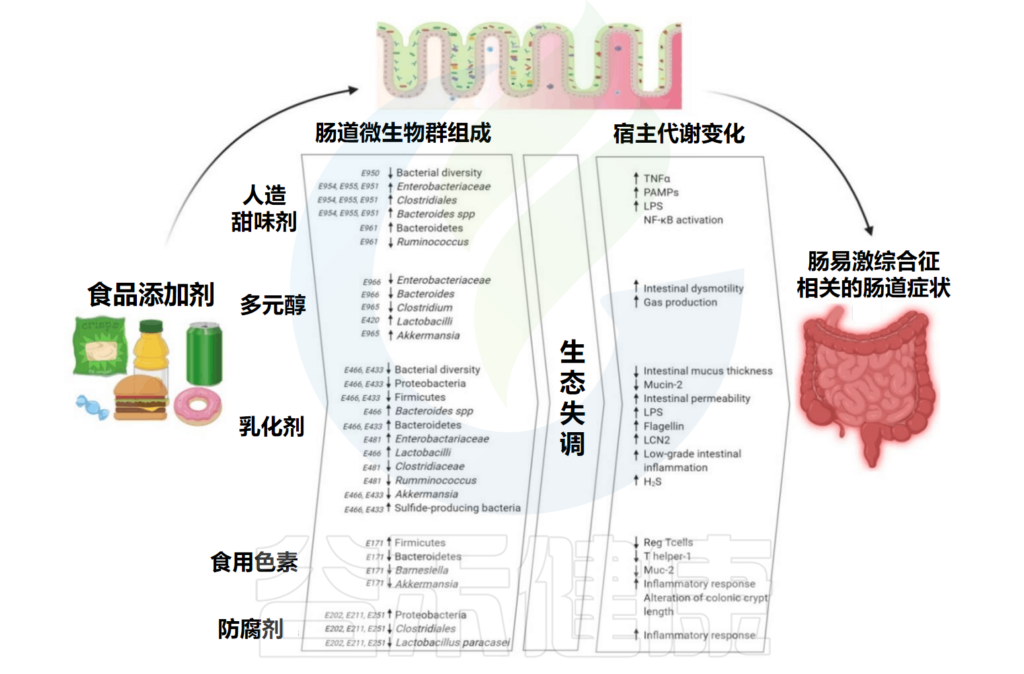
Rinninella E,et al.Int J Environ Res Public Health.2020
甜味剂与食品风味和人体健康密切相关,由于现在许多人们重视对身材的管理,无热量人工甜味剂逐渐兴起,其是蔗糖的替代品,特点是能够在不增加热量摄入的情况下具有更高的甜味强度,不会增加热量或引发血糖反应。
其中包括阿斯巴甜、安赛蜜、三氯蔗糖、糖精、纽甜和相应的化合物,主要存在于无糖饮料、无糖糖果和乳制品中。目前的研究已观察到人工甜味剂引起的肠道微生物群和代谢物的改变。
阿斯巴甜是一种低热量、强效的人造甜味剂。
•阿斯巴甜会改变人体肠道微生物的多样性
在人类中,阿斯巴甜可能不会改变粪便微生物群的丰度,但会改变其多样性。产生短链脂肪酸的细菌(例如双歧杆菌和另一项研究中检测到Blautia coccoides和拟杆菌/普雷沃氏菌比例下降。
•阿斯巴甜会影响短链脂肪酸浓度
在动物实验中,经阿斯巴甜处理后,厚壁菌门和柔嫩梭菌属(Clostridiumleptum)的丰度较高,肠球菌和副萨特氏菌 (Parasutterella)的丰度较低。
注:厚壁菌门和柔嫩梭菌都是重要的产丁酸菌属。
而在另一项人体研究中,随着阿斯巴甜的摄入,血清、粪便和盲肠内容物中的短链脂肪酸(包括丙酸和丁酸)浓度有所增加。
鉴于阿斯巴甜在不同动物和体外研究中存在一定的差异,阿斯巴甜对人体短链脂肪酸的影响还需要更多的实验研究,但目前可以确定的是,阿斯巴甜的摄入对人体短链脂肪酸的含量有影响。
阿斯巴甜存在一定的安全隐患!
需要注意的是,苯丙酮尿症患者苯丙氨酸代谢困难,应控制阿斯巴甜的摄入量。并且在此之前,美国一项研究发现,阿斯巴甜还会导致小鼠产生焦虑行为,这种影响还会跨代遗传。
阿斯巴甜对革兰氏阴性菌N-酰基高丝氨酸内酯(AHL)具有显著的抑制作用,通过群体感应抑制影响肠道微生物群落的平衡,从而促进消化系统疾病的进展。
此外,法国一项大规模前瞻性队列研究的结果表明,较高的人工甜味剂消耗量(尤其是阿斯巴甜)与心血管疾病风险增加之间存在潜在的直接关联。

安赛蜜,又称AK糖,是一种常用的人造甜味剂,也适合1-3岁儿童用于特殊医疗项目。
安赛蜜的可接受每日摄入量为9毫克/公斤体重
•安赛蜜在改变肠道微生物时具有性别特异性
在一项研究中,安赛蜜的摄入量在改变肠道微生物及其代谢物方面表现出高度的性别特异性。
在女性中,观察到乳杆菌属(Lactobacillus)和梭菌属(Clostridium)的丰度较低,Mucispirillum的丰度较高;而在男性中,拟杆菌属、萨特氏菌(Sutterella)、Anaerostipes有所增加。
•过量的安赛蜜会引起肠道炎症
在怀孕和哺乳期间将小鼠暴露于三氯蔗糖和安赛蜜会改变其后代肠道微生物群的α和β多样性,厚壁菌门增加和潜在抗炎细菌Akkermansia muciniphila的极度减少。
抗生素治疗后施用安赛蜜还会诱导硫酸盐还原菌脱硫弧菌的扩增以及结肠中促炎细胞因子的较高表达。
在炎症性肠病患者的粪便样本中,安赛蜜治疗后抗炎细菌减少,并伴有一些细菌功能改变,如脂多糖和胆汁酸合成。这表明安赛蜜诱导的肠道微生物组和代谢物扰动可能是破坏肠道稳态的因素,这可能会增加炎症性肠病的风险。
此外,安赛蜜可能会通过菌群失调引起吲哚美辛诱导的肠道损伤。
三氯蔗糖又名三氯半乳蔗糖,其甜度是蔗糖的600-650倍。
•长期摄入三氯蔗糖会改变肠道菌群并影响胰岛素水平
在人类研究中,摄入三氯蔗糖并不会在短期中影响肠道微生物,而年轻人摄入十周可能会导致Blautia coccoides增加和嗜酸乳杆菌减少,并改变肠道菌群和血清中的胰岛素和葡萄糖水平。
注:B. coccoides是一种参与促炎途径的细菌。
•三氯蔗糖的摄入导致体内多种代谢物改变
三氯蔗糖的摄入导致了多种代谢物的改变。酪氨酸水平升高,而对羟基苯乙酸和肉桂酸水平降低。这些化合物可以抑制参与色氨酸代谢的活性氧的产生。
此外,胆汁酸含量受损,盲肠内容物中胆酸浓度较高,胆酸/鹅去氧胆酸比率较高。研究人员认为这些代谢物的变化将导致引发和维持肝脏炎症。
▷大胆推测:三氯蔗糖会增加结肠炎的易感性
根据现有证据,我们认为三氯蔗糖对结肠炎有害,会增加促炎细菌的丰度。
三氯蔗糖会增加2,4,6,三硝基苯磺酸诱发的结肠炎易感性,并导致拟杆菌门和变形菌门的水平升高,厚壁菌门和放线菌门的数量减少。
最近的一项调查还发现,三氯蔗糖可能会增加患结肠炎相关结直肠癌的风险。
邻苯甲酰磺酰亚胺,俗称糖精。是一种热量为0的甜味剂,其甜度为蔗糖的300~500倍,但吃起来会有轻微的苦味和金属味。大部分糖精会被吸收并最终通过尿液排出,而未被吸收的糖精则通过粪便排出体外。
•糖精的消耗导致黏膜炎症细胞富集并改变肠道通透性
最近的一项研究发现,糖精的消耗会导致粘膜炎症细胞的富集并改变小鼠的肠道通透性。
此外,用抗生素预处理的糖精暴露小鼠可诱导较低水平的粘膜炎症和肠道屏障功能障碍。这些发现表明肠道菌群失调被认为是介导这些异常的原因。
•大量食用糖精会导致菌群失调
盲肠内容物中糖精的高含量与需氧菌群的增加有关。糖精暴露会导致严重的菌群失调,从而导致葡萄糖不耐受。许多增加的类群属于拟杆菌门和梭菌目,但厚壁菌门和蓝藻门减少了。
在无菌小鼠中无法诱导代谢变化,但在移植肠道微生物群后却发生了代谢变化。糖精还会导致肝脏炎症,导致阿克曼氏菌、棒状杆菌(Corynebacterium)和Turicibacter增加,并减少Anaerostipes、瘤胃球菌(Ruminococcus)和Dorea。
纽甜的味道比蔗糖甜7000-13000倍。纽甜的摄入降低了粪便微生物组的α多样性并改变了β多样性。
观察到厚壁菌门数量急剧下降。拟杆菌门,尤其是拟杆菌属的丰度增加。值得注意的是,毛螺菌科和瘤胃球菌科的多种成分显著减少,包括Blautia、Dorea、Oscillospira和瘤胃球菌属。
•纽甜的摄入改变了丁酸等物质的代谢
纽甜的摄入还改变了肠道微生物组的两种丁酸发酵途径。其中一条途径包括编码t4-羟基丁酰辅酶A脱水酶、丁酰辅酶A脱氢酶和乙酸辅酶A转移酶的三个基因的减少。这些基因参与了琥珀酸发酵为丁酸的过程。
另一方面,有关丙酮酸发酵丁酸的上游基因也被下调。此外,氨基酸代谢、脂多糖生物合成和抗生素生物合成增强,而脂肪酸和碳水化合物代谢途径减少。
为了方便大家观看,谷禾将一些食品添加剂与肠道微生物群之间的相互作用整理在了下表:




Liu C,et al.Nutrients.2022
人工甜味剂对肠道功能和代谢的影响
多项研究探讨了人工甜味剂对肠道微生物群和宿主生理功能的影响。他们证明人工甜味剂消耗与胰岛素抵抗和葡萄糖耐受不良增加之间的关联。
•富含人工甜味剂的饮食可能导致病态肥胖
研究表明,与对照小鼠相比,食用糖精的小鼠的聚糖降解显著增加。鉴于肠道细菌将聚糖发酵成短链脂肪酸,接触糖精可能会减少短链脂肪酸的产生。
丁酸盐通过肠-脑神经回路降低食欲和激活棕色脂肪组织而具有关键的抗肥胖作用。因此富含人工甜味剂的饮食可能与成年人的病态肥胖有关。
这些结果强调了一些人工甜味剂对聚糖发酵和短链脂肪酸产生的潜在不利影响,从而导致代谢紊乱。
•长期食用人工甜味剂会诱导炎症反应
此外,分析了给予糖精6个月后的小鼠肝脏,报告显示,与对照组相比,糖精处理的小鼠肝脏出现明显的肝脏炎症,且TNF-α基因表达升高。
注:TNF-α是炎症中的关键细胞因子,TNF-α的表达可以激活NFκB通路并诱导细胞损伤和炎症反应。
如前所述,在动物模型中,人工甜味剂的摄入可能会增加拟杆菌和肠杆菌科。肠杆菌科,如大肠杆菌、克雷伯菌属和变形杆菌属,位于粘膜上皮附近。
病原体感染、化学诱导的结肠炎或宿主免疫力不足可能导致肠道炎症,并刺激肠杆菌科的生长。因此,人工甜味剂似乎与肠道微生态失调、肠道炎症以及肠易激综合征相关的症状有关。
谷禾在下图中汇总了各种食品添加剂对肠道代谢产物的影响:



Liu C,et al.Nutrients.2022
多元醇,也叫糖醇,是一种有机物。主要种类有赤藓糖醇、异麦芽酮糖醇、山梨糖醇和木糖醇。它们天然存在于一些水果、蔬菜和蘑菇中。
其热量约为白糖的一半,并且只会导致血糖轻微变化。它们中的大多数在宿主中不能被很好地吸收或代谢,并且一部分会被结肠中的微生物群发酵。
糖醇对肠道微生物和代谢物的影响
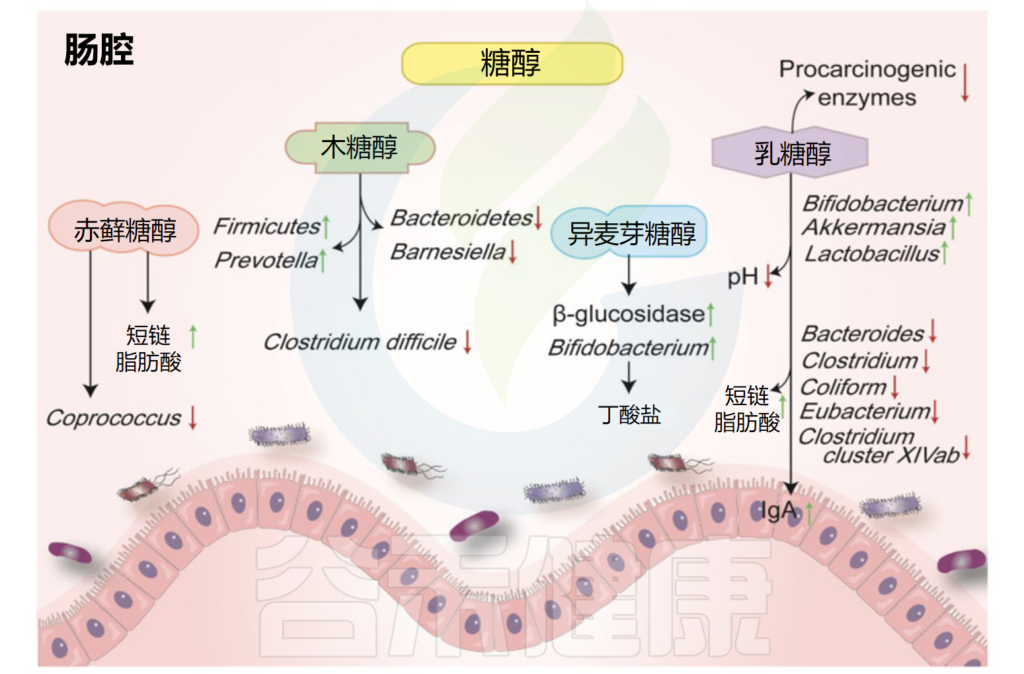
Liu C,et al.Nutrients.2022
赤藓糖醇在自然界中广泛存在,葡萄、梨、蘑菇、地衣中都有赤藓糖醇。摄入赤藓糖醇后,约90%可被小肠吸收,但代谢率很低,并主要以原形通过尿液排出体外。
•摄入赤藓糖醇增加了体内短链脂肪酸含量
在结肠中,肠道菌群可以代谢未吸收的部分。研究证明,摄入赤藓糖醇会导致丁酸和戊酸增加。考虑到到达大肠的赤藓糖醇数量有限,该化合物仅对肠道微生物群的组成产生轻微影响。
然而,赤藓糖醇会增强肠道微生物群以产生短链脂肪酸,从而减轻肠道炎症。赤藓糖醇被发现可以改善高脂肪饮食中的小肠炎症,并诱导粪球菌属丰度降低。
注:研究发现摄入赤藓糖醇后血清、粪便和白色脂肪组织中短链脂肪酸的浓度明显升高。
▷目前认为赤藓糖醇是一种对肠道稳定有利的物质
尽管缺乏赤藓糖醇对炎症性肠病的直接证据,但它被认为是一种对细菌友好的多元醇,可以稳定肠道微环境,并且可以降解为对炎症性肠病友好的代谢物。
异麦芽酮糖醇长期以来一直在食品和制药工业中用作甜味剂。微生物可以很容易地降解结肠中未吸收的异麦芽酮糖醇。
•异麦芽酮糖醇提高双歧杆菌的丰度
最近的研究认为它是一种益生元。在人类肠道中发酵的异麦芽酮糖醇可提高双歧杆菌的丰度并抑制致病菌,此外还降低了细菌β-葡萄糖苷酶的活性。
粪便中的短链脂肪酸、乳酸、胆汁酸、中性甾醇、苯酚和对甲酚也发生了变化。一些双歧杆菌菌株可以在体外发酵异麦芽,产生更高含量的丁酸盐。然而,暴露于异麦芽后没有发现不同的基因表达。
尽管很少有临床试验探讨异麦芽酮糖醇对肠道炎症的影响,但异麦芽酮糖醇可能被认为是一种双歧多元醇,是肠道稳态和微环境的“亲密朋友”。
木糖醇是是从白桦树、橡树、玉米芯、甘蔗渣等植物原料中提取出来的一种天然甜味剂。木糖醇被认为是一种非致龋性甜味剂,常被应用于口香糖中。
•木糖醇有一定的抗炎作用并能抑制变型链球菌
据报道,木糖醇会影响肠道菌群,并对脂多糖诱导的炎症细胞因子表达具有抑制作用。在一项人体研究中,摄入包括木糖醇在内的低消化性碳水化合物会导致Anaerostipes spp和粪便中的丁酸盐显著升高。
木糖醇降低了粪便拟杆菌(Bacteroidetes)和Barnesiella属的水平,而厚壁菌门和普雷沃氏菌(Prevotella)的丰度增加。较低的木糖醇浓度还可以抑制有害的变形链球菌。
注:变型链球菌是口腔天然菌群中占比例最大的链球菌属中的一种,是龋病的主要致病菌。
因此,我们认为木糖醇可能有利于肠道菌群的生长和代谢,而不会对肠道产生低有害刺激。
其他食品添加剂对肠道菌群及其功能的影响

编辑
Zhou X,et al.Molecules.2023
多元醇引起的菌群变化对肠道健康有益
多元醇属于所谓的“FODMAP”(可发酵低聚糖、二糖和单糖以及多元醇)饮食类别。近年来,FODMAP饮食已成为肠易激综合征患者的宝贵治疗选择,对其限制将改善肠易激综合征治疗的结果。
“FODMAP”一词于2004年创建,用于定义高度可发酵的碳水化合物和多元醇。
乳化剂在日常生活中被广泛应用,因为它们能够稳定乳液并通过防止储存期间分离来延长保质期。它们还可以通过食品中的脂肪分子充当胶凝剂和表面活性剂。
常见的乳化剂包括羧甲基纤维素、聚山梨酯、卡拉胶等。它们存在于各种加工食品中,如酱汁、布丁、人造黄油和冰淇淋,在西方饮食中非常普遍。研究发现乳化剂会通过肠道微生物影响人体健康。
乳化剂通过肠道微生物诱发结肠炎的机制
编辑
Liu C,et al.Nutrients.2022
羧甲基纤维素(CMC)和聚山梨酯80(P80)常见于食用油、冰淇淋、蛋糕粉、糖霜和巧克力糖浆中。然而,接触乳化剂CMC和P80会对肠道微生物群产生负面影响。
•可能通过微生物群驱动肠道炎症
有益菌如短链脂肪酸的生产菌减少
聚山梨酯80的施用引起了与炎症性肠病类似的人类肠道微生物群的改变,导致有益的双歧杆菌属、重要的短链脂肪酸生产者如粪杆菌属和罕见小球菌属 (Subdoligranulum)以及Clostridium leptum的减少。
炎症性肠病相关病原菌增长显著
在小鼠中,摄入P80会加剧吲哚美辛诱发的回肠炎,从而降低肠道微生物群的α多样性。包括肠杆菌科在内的硫化物生产者的生长和炎症性肠病相关物种奇异变形杆菌的群集行为得到显著促进。
群集是一种鞭毛介导的运动,需要营养细胞分化成一种称为群集细胞的特殊细胞类型。奇异变形杆菌的群集能力与其在炎症性肠病中的发病机制高度相关。
增加病原菌的入侵
研究发现长期摄入羧甲基纤维素或聚山梨酯80会诱发低度肠道炎症,并促进易患这种疾病的小鼠出现严重结肠炎,最终导致细菌入侵增加。
卡拉胶,又名角叉菜胶,是从麒麟菜、石花菜、鹿角菜等红藻类海草中提炼出来的亲水性胶体。它们常见于调味牛奶、冰咖啡、乳制品冰淇淋和冷冻甜点中。
卡拉胶的代谢主要由宿主肠道微生物群进行。因此,肠道微生物直接与卡拉胶相互作用,影响肠道稳态。有趣的是,不同种类和分子量的卡拉胶对宿主有不同的影响。
卡拉胶可分为低分子量或高分子量、降解或未降解卡拉胶。
•低分子量的卡拉胶会增加肠道通透性并与结肠炎相关
低分子量卡拉胶已被证明可以增加肠道通透性并与结肠炎的发生有关。据报道,角叉菜胶会诱发和加重肠道炎症,改变肠道微生物群组成。
卡拉胶的摄入导致变形菌门和脱铁杆菌门(Deferribacteres)的增加,以及厚壁菌门、放线菌门和拟杆菌门的减少。
卡拉胶的不同异构体均被认为会对肠道生态产生有害影响。对于人类肠道微生物群,每种异构体都会诱导α-多样性的变化并增加微生物群的促炎潜力。
κ-卡拉胶和λ-卡拉胶显著富集了拟杆菌,而ι-卡拉胶减少了Faecaliberium,处理后鞭毛蛋白含量更高。κ-卡拉胶在高脂饮食模型中诱导了结肠炎,显著增加了志贺菌并减少了双歧杆菌。两种炎症相关细菌Alistipes finegoldii和Bacteroides acidifaciens的丰度也显著增加。
然而,高分子量卡拉胶可能具有良好的抗肿瘤和抗氧化活性。此外,之前的研究认为,肠道微生物组的改变仅在饮用水中添加卡拉胶时观察到,而在补充卡拉胶的饮食中则未观察到,这表明与蛋白质等其他食物成分的结合可能改变其构象并消除其对某些细菌的生物利用度。
▷推测:食用卡拉胶不利于肠道炎症患者恢复
在一项研究中,两种协同菌株:Bacteroides xylanisolvens 38F6A4和E. coli 38F6C1是从健康人的粪便中获得的,并给予无菌小鼠,与卡拉胶一起食用时会加剧肠道炎症。
对于缓解期的溃疡性结肠炎患者,在含卡拉胶的饮食治疗后复发率较高。鉴于卡拉胶对炎症性肠病患者和肠道菌群的直接有害作用,我们推测卡拉胶可能由于肠道菌群和肠道稳态紊乱而对炎症性肠病患者产生有害影响。
!
乳化剂可能通过肠道微生物影响宿主心理
研究结果表明,膳食乳化剂也可能对肠脑轴产生影响,并通过微生物群依赖机制诱导暴露者的心理/行为障碍。
肠道微生物群中聚山梨酯80和羧甲基纤维素依赖性的变化也是小鼠性别特异性行为和神经改变的原因。特别是,雌性获得了反社会行为,而雄性表现出更高的焦虑水平。
这两种变化都与微生物群特征和α-黑素细胞刺激素水平的明显变化相关,这两个神经肽参与调节焦虑相关行为、食欲和能量。
小结
乳化剂中羧甲基纤维素和聚山梨酯80过量食用会导致生态失调,粘液降解细菌过度生长,以及白细胞介素10或Toll样受体5进一步缺乏。
乳化剂可能还会增加肠上皮屏障中病原微生物的易位,引起肠道炎症,从而导致炎症性肠病发病率增加。
除此之外,乳化剂等胶体还会通过肠脑轴、肠肝轴、肠道与骨骼、心血管之间的联系进一步影响人体代谢和健康。
其他乳化剂在体内的生理影响



Tan H,Nie S.FEMS Microbiol Rev.2021
乳化剂和相关微生物代谢对人体的影响
编辑
Tan H,Nie S.FEMS Microbiol Rev.2021
食品着色剂又称食品色素,是以食品着色为主要目的,赋予食品色泽和改善食品色泽的物质。
食品着色剂主要添加到奶酪、酱汁、冰淇淋、糕点、糖果、巧克力和口香糖中。
二氧化钛(TiO2)是我国常用的食品着色剂,通常用作食品中的增白剂或增亮剂。
•二氧化钛影响肠道保护细菌的丰度
近年来,各种研究试图确定口服二氧化钛对小鼠和人类肠道微生物群组成的影响。在用二氧化钛处理的小鼠中,与对照组相比,观察到厚壁菌门显著增加,拟杆菌门减少。特别是,巴恩斯氏菌(Barnesiella),一种关键的保护性肠道细菌,其丰度受到二氧化钛暴露(160mg/kg/天,持续28天)的显著影响。
巴恩斯氏菌(Barnesiella)可以清除肠道中的有害细菌。消除对万古霉素耐药的肠球菌的定植,并抑制抗生素耐药细菌的传播。它还可以改善环磷酰胺等抗癌化合物的性能。
巴恩斯氏菌(Barnesiella)的减少可能与炎症性肠病的发病机制有关。此外,它们导致结肠中的炎症浸润和线粒体异常,粪便中Turicibacter属和格氏乳杆菌(Lactobacillus gasseri)和Lactobacillus NK4A136_group的增加。
•高剂量的二氧化钛会诱导肠道炎症加剧
在人类中,添加二氧化钛会导致肠道微生物群多样性适度下降,并导致卵形拟杆菌(Bacteroides ovatus)和Clostridium cocleatum减少。
卵形拟杆菌(Bacteroides ovatus)被誉为新一代益生菌,在肠道免疫、肿瘤治疗、膳食纤维代谢方面发挥重要作用。
剂量反应实验表明,单独使用微量二氧化钛对两组巨噬细胞的吞噬作用没有影响。然而,高剂量的二氧化钛与细菌抗原协同作用,可促进巨噬细胞产生 IL-8、肿瘤坏死因子-α和IL-10,并损害其转化生长因子-β分泌/吞噬细胞活性。
据报道,喂食富含二氧化钛饮食的小鼠肠道炎症加剧。特别是,微生物群组成发生了显著变化,活性氧释放增强,NLRP3炎症小体激活。
!
食品着色剂会影响肠道稳态
二氧化钛等食品着色剂可能会影响肠道稳态。事实上,各种研究已经证明了二氧化钛暴露与对肠道微生物群功能性不利影响之间的潜在关联。
炎症反应加剧
在口服二氧化钛一周(10mg/kg体重/天)的大鼠中,在派尔贴片的免疫细胞和参与炎症反应的调节性T细胞中检测到二氧化钛。具体而言,在二氧化钛暴露后,从Peyer贴片中分离的免疫细胞的刺激显示辅助性T细胞减少,IFN-γ分泌增加,Th1/Th17炎症反应增加。
注:更进一步研究表明二氧化钛暴露与啮齿动物肠道疾病和结直肠癌的发展之间可能存在关联。
短链脂肪酸水平降低
研究了小鼠体内不同剂量的二氧化钛(2、10、50 mg/kg体重/天),并报告了高剂量暴露后短链脂肪酸水平的降低、粘液相关基因表达的降低、炎症反应的增加和结肠隐窝长度的改变。
不同食品着色剂对粘膜屏障和肠道微生态的影响
Liu C,et al.Nutrients.2022
所有这些发现表明,由于暴露于二氧化钛等食品着色剂而导致的菌群失调可能导致微生物群失调,其中特定科和属细菌的变异可能参与炎症性肠病的发病机制。
食品防腐剂可以延缓食品的降解,延长食品的保质期,限制微生物的生长,抑制食品的氧化。
防腐剂的益处和安全性存在争议,许多常见的防腐剂,如苯甲酸、山梨酸钾、亚硝酸钠和亚硫酸钠以及银纳米颗粒被报道可以诱导肠道微生物群的改变。
美国儿科学会警告说,防腐剂可能与恶化的多动行为或致癌风险有关。
苯甲酸和苯甲酸钠均可作为食品防腐剂,因为它们能够限制病原微生物的生长。所有吸收的苯甲酸均可完全降解为马尿酸。
•适量的苯甲酸会提高有益微生物的水平
最近的研究发现苯甲酸和苯甲酸钠通过调节氧化状态和免疫状态对肠道屏障功能和肠道微生物群的有益影响。
苯甲酸处理增强了回肠微生物群的生物多样性,以剂量依赖性方式降低了总需氧细菌的丰度。它还会减少十二指肠中革兰氏阴性菌的丰富度。在小猪中,苯甲酸处理增加了肠绒毛的高度,提高了有益微生物(例如双歧杆菌和乳杆菌)的水平,并减少了有害微生物的数量。
•过量摄入可能会破坏肠道屏障
然而,过量摄入苯甲酸可能会通过氧化还原状态破坏肠道屏障。
最近的研究报告称,苯甲酸增加了小鼠中诱导变形菌失调的易感性。值得注意的是,变形菌的增殖被认为是生态失调的潜在诊断标志物,并且与炎症性肠病等疾病的风险相关。
虽然现有的研究对苯甲酸表现出相互矛盾的观点,仍需要更多的研究来阐明其对肠道菌群和肠道炎症的影响。
山梨酸钾是一种低毒防腐剂,能强烈抑制腐败细菌和霉菌,其对感官特性影响轻微。
•山梨酸钾会降低肠道微生物多样性
先前的研究报道,山梨酸钾通过改变宿主免疫来抑制肠道微生物群的生存能力。暴露于山梨酸钾显著降低了斑马鱼肠道中IgG、IL-1β和TNF-α的含量,并激活了免疫系统。
在属水平上,有益菌粪杆菌(Faecalibacterium)以及病原菌气单胞菌(Aeromonas)和甲基杆菌(Methylobacterium)的含量呈现显著下降趋势。在体外,施用山梨酸钾后,普氏粪杆菌的生长也显著下降。
•革兰氏阳性菌可能阻碍山梨酸钾的传递
值得注意的是,山梨酸钾的亲脂性在调节不同类型的肠道微生物群中发挥着重要作用。革兰氏阴性细菌细胞壁中含有大量脂质,从而抑制转录和碳水化合物代谢途径。然而,革兰氏阳性菌含有较高的肽聚糖含量,可能会阻碍山梨酸钾的传递。大肠杆菌已被证明通过其外排泵机制对山梨酸钾具有抗性。
亚硫酸钠是常见的食品防腐剂之一。
•亚硫酸钠对人体有一定的危害
它强烈抑制普拉梭菌(Faecalibacterium prausnitzii)的生长。干酪乳杆菌、鼠李糖乳杆菌和植物乳杆菌因具有产生乳酸的能力而被认为是有益的肠道细菌,但它们也减少了。
在另一项研究中,亚硫酸钠持续降低奇异变形杆菌、Escherichia fergusonii、摩氏摩根菌(Morganellamorganii)的活力。亚硫酸钠对肠道有益菌较强的抗菌能力,可能诱发肠道疾病。
•具有抗炎特性的细菌可能对防腐剂更敏感
在一项体外研究中,发现人类肠道微生物对亚硝酸钠、苯甲酸钠和山梨酸钾高度敏感,尤其是酪丁酸梭菌(Clostridium tyrobutyricum)或副干酪乳杆菌(Lactobacillus paracasei),具有已知的抗炎特性,与具有促炎或致大肠杆菌特性的粪肠球菌或多形拟杆菌相比,对这三种防腐剂更敏感。
减轻食品添加剂对身体损害的一些建议
•选择天然食物:尽量选择天然食物,例如新鲜水果、蔬菜、全谷物和未经加工的肉类。这些食物通常不含添加剂。
•阅读食品标签:在购买加工食品时,仔细阅读食品标签。避免购买添加剂含量较高的食品,特别是那些含有大量人工色素和防腐剂的食品。
•自制食物:尽量选择自制食物,这样可以控制所使用的成分和添加剂的量。自制食物可以使用新鲜的食材,并尝试使用天然的调味料来增添风味。
•限制加工食品摄入量:减少加工食品的摄入量,特别是那些高度加工和包装的食品。这些食品通常含有更多的添加剂。
•多样化饮食:保持饮食的多样性,摄入各种不同类型的食物。这样可以减少对某一种食品及其潜在添加剂的过度依赖。
需要注意的是,并非所有的食品添加剂都对每个人都会产生负面影响。食品添加剂经过严格的监管和安全评估,以确保在合理摄入量下的安全性。
然而,对于敏感人群来说,或在过量摄入的情况下,某些食品添加剂可能会引起问题。因此,适度和平衡地摄入食品添加剂是很重要的。
越来越多的研究调查肠道微生物群与食品添加剂之间的相互作用,在总结当前研究中收集的信息后,我们得出结论:食品添加剂对肠道微生物群和肠道稳态产生多种影响,这可能与肠道炎症的发病和进展有关。
食品添加剂显著介导细菌功能的改变。总而言之,安赛蜜、三氯蔗糖和糖精等甜味剂可能通过提高细菌炎症潜力而诱发或加剧结肠炎。
羧甲基纤维素和聚山梨酯80等乳化剂被认为会改变肠道微生物群的多样性并增加细菌的侵入,从而对肠道健康有害。
食品着色剂的安全性应重新评估,因为其会引发肠道紊乱和菌群失调;然而,多元醇似乎通过改善肠道微生物的结构和功能而对肠道微生物群有益。
根据目前的证据和法规,必须谨慎考虑对炎症性肠病患者不利的食品添加剂,例如食品着色剂和乳化剂,包括羧甲基纤维素和聚山梨酯80。
尽管研究显示食品添加剂对肠道微生物组和肠道炎症有不同的影响,但将体外或动物模型中获得的相同结果归因于人类是不可行的。因此,未来的研究应该基于生物相关模型来复制人类的生理条件。
总之,需要更多的研究来阐明食品添加剂、肠道微生物群和人体健康之间的关系,并了解后代由于当代人的消费习惯而可能面临的炎症性肠病风险。
相关阅读:
你的焦虑可能与食品添加剂有关,警惕食品添加剂引起的微生物群变化
肠道微生物群与健康:探究发酵食品、饮食方式、益生菌和后生元的影响
主要参考文献
Zhou X, Qiao K, Wu H, Zhang Y. The Impact of Food Additives on the Abundance and Composition of Gut Microbiota. Molecules. 2023 Jan 7;28(2):631.
Rinninella E, Cintoni M, Raoul P, Gasbarrini A, Mele MC. Food Additives, Gut Microbiota, and Irritable Bowel Syndrome: A Hidden Track. Int J Environ Res Public Health. 2020 Nov 27;17(23):8816.
Tan H, Nie S. Functional hydrocolloids, gut microbiota and health: picking food additives for personalized nutrition. FEMS Microbiol Rev. 2021 Aug 17;45(4):fuaa065.
Liu C, Zhan S, Tian Z, Li N, Li T, Wu D, Zeng Z, Zhuang X. Food Additives Associated with Gut Microbiota Alterations in Inflammatory Bowel Disease: Friends or Enemies? Nutrients. 2022 Jul 25;14(15):3049.
Del Pozo S, Gómez-Martínez S, Díaz LE, Nova E, Urrialde R, Marcos A. Potential Effects of Sucralose and Saccharin on Gut Microbiota: A Review. Nutrients. 2022 Apr 18;14(8):1682.
Ravash N, Peighambardoust SH, Soltanzadeh M, Pateiro M, Lorenzo JM. Impact of high-pressure treatment on casein micelles, whey proteins, fat globules and enzymes activity in dairy products: a review. Crit Rev Food Sci Nutr. 2022;62(11):2888-2908.
Laudisi F, Stolfi C, Monteleone G. Impact of Food Additives on Gut Homeostasis. Nutrients. 2019 Oct 1;11(10):2334.
Abiega-Franyutti P, Freyre-Fonseca V. Chronic consumption of food-additives lead to changes via microbiota gut-brain axis. Toxicology. 2021 Dec;464:153001.

谷禾健康
酒精与健康

饮酒作为一种特殊的文化形式,在我们国家有其独特的地位,在几千年的发展中,酒几乎渗透到日常生活、社会经济、文化活动之中。
据2018年发表的《中国饮酒人群适量饮酒状况》白皮书数据显示,中国饮酒人群高达6亿。酒精暴露是一种环境刺激,可显著改变许多生理、心理以及周围和中枢神经系统过程。从心脏和肝功能,到对肠道微生物组和内分泌途径的影响,酒精对全身和大脑都有广泛的影响。
众多的研究表明酒精本身可以产生双重效果,当然,这取决于饮酒量和酒的生产方式。
▸ 低-中剂量
低度至中度酒精对肠道微生物组、肠道代谢物和免疫相关疾病甚至一些癌症似乎起保护和有益作用。
▸ 高剂量
高剂量酒精或长期酗酒对胃肠道、肠道微生物组、免疫细胞和营养物质起破坏和损害作用。
目前的证据还表明,不同剂量的酒精在体内不同组织部位发挥不同的作用。
总体来说,过度饮酒,尤其在青少年和部分职业人群中占比越来越高,带来的伤害和健康风险不容忽视。过度饮酒会导致许多不良的病理健康影响和沉重的医疗保健负担。
根据世界卫生组织最新的通报指出,全球每年大约有超过300万人因过量饮酒而被夺去生命,其死亡人数已经超过爱滋病、暴力和交通事故死亡人数的总和。在饮酒所造成的直接或间接的死亡事件中,男性饮酒带来的风险尤为突出。

酒精引起的胃肠道功能以及微生物群组成和代谢的变化,内毒素血症的肠道通透性与全身性炎症和组织损伤/器官病变相关。
在过去的十年中,肠道,特别是肠道微生物群与酒精性肝病之间的关联引起了研究人员的关注。酒精与消化系统密不可分。它通过肠道吸收,并在肝脏内被肝细胞代谢。过量饮酒会导致肠道微生物组和肠道上皮完整性发生改变。它会导致重要的微量营养素缺乏症,包括短链脂肪酸和微量元素,这些元素会影响免疫功能并导致肝和其它器官损伤。
而且,酒精引起的微生物组改变和肠道屏障完整性下降会对中枢神经系统产生深远影响,导致抑郁、焦虑和对酒精的渴望增加,从而增加酗酒行为,造成恶心循环。
目前,酒精的治疗干预措施主要包括药物治疗、心理治疗、社会支持等方面。然而,这些干预措施都存在着一定的局限性,例如药物治疗可能会产生副作用,心理治疗需要长时间的治疗过程,社会支持需要家庭、朋友等的积极配合。
因此,寻找一种更加有效、安全、方便的治疗方法成为了当前治疗酒精成瘾和酒精使用障碍的研究重点。近年来,越来越多的研究表明,肠道菌群可能成为新的治疗酒精成瘾和酒精使用障碍的途径。新兴研究表明,通过调节肠道菌群可以减轻酒精成瘾的症状,例如减少饮酒量、降低戒断症状等。
本文将介绍酒精摄入或饮酒与肠道菌群及其代谢,肠内外健康的关系。
↘
本文目录
01 饮酒如何影响健康
酒精进入人体过程
酒精和肠道
酒精带来的有害影响
适量酒精带来的益处
02 轻中剂量酒精对自身免疫性疾病的保护作用
短链脂肪酸
多不饱和脂肪酸
自身免疫性糖尿病
自身免疫性甲状腺疾病
系统性红斑狼疮
类风湿关节炎
多发性硬化症
03 高剂量酒精对肠道菌群及其代谢物和营养物质的促炎作用
高剂量酒精对肠道菌群组成的影响
高剂量酒精对肠道屏障功能的影响
高剂量酒精对肠道微生物代谢物的影响
长期饮酒对营养状况的影响
高剂量酒精对肠道炎症和黏膜免疫的影响
04 酒精对相关疾病的影响
酒精与肠-肝轴和肝病
-酒精代谢
-酒精相关性脂肪变性
-酒精性脂肪性肝炎
-酒精引起的纤维化和肝硬化
-肝癌
酒精与胃肠道疾病
酒精和营养不良&肥胖
-营养不良
-肥胖
酒精和心血管疾病
-血脂概括
-高血压
05 酒精与肠脑轴和酒精成瘾
06 干预措施
酒精(乙醇)是一种水溶性小分子,通过胃和近端小肠进入血流,然后分布到全身。它首先进入门静脉,门静脉直接排入肝脏,这是接触酒精最多的地方。肝脏消除了大部分酒精 (90%),而 2–5% 以原形通过尿液、汗液和呼吸排出。
身体第一个直接接触酒精的器官系统是消化系统;因此,从口腔到直肠,几乎消化系统的每个部分都会受到酒精的影响。
酒精对消化系统的病理影响部分取决于肠-肝轴。这种由肠肝循环促进的双向关系涉及消化和细菌产物从肠道到肝脏的运输,以及胆汁、抗体和细胞因子返回肠道。
过量酒精摄入已被证明会通过破坏肠道微生物组成、代谢组和肠道上皮屏障来改变这一轴。这些干扰最终会对营养吸收产生连锁反应。
酒精对肠道的影响
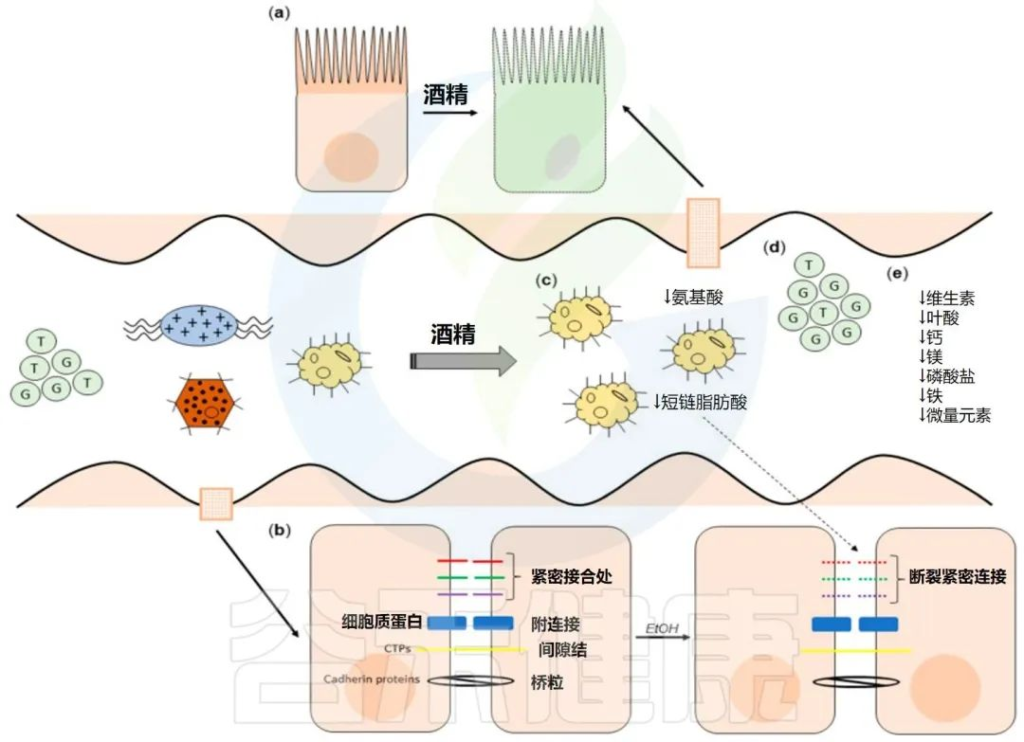
Pohl K et al. Nutrients. 2021,13(9):3170.
CTP:连接蛋白跨膜蛋白;JAM:连接粘附分子;EtOH:酒精。
( a ) 酒精对肠粘膜的组织学影响(细胞死亡、粘膜侵蚀和绒毛尖端上皮细胞丢失)。
( b ) 酒精引起的紧密连接破坏,因管腔短链脂肪酸浓度降低而加剧。
( c ) 酒精引起的生态失调导致短链脂肪酸和氨基酸浓度降低。
( d ) 次级胆汁酸浓度增加,与甘氨酸结合的比例增加。
( e ) ( a – d ) 导致的营养缺乏。
酒精对人体的影响是双重的,既有正面的作用,也有负面的作用。
▼
过量饮酒对人体各部位可能引起的有害影响
– 嘴
饮酒会刺激口腔和喉咙,这会增加患口腔癌的风险。
– 食管
酒精从口腔进入胃部时会引起刺激,从而增加患食道癌的风险。
– 胃
酒精会引起胃壁刺激和随后的炎症,这种情况也称为胃炎。胃壁过度刺激或发炎会导致受影响区域出血和溃疡。
此外,饮酒会导致营养吸收不良,从而使个人患上一系列其他疾病的风险更高。
– 大/小肠
饮酒会抑制大肠和小肠内的营养吸收。肠道蠕动也会受到影响并导致腹泻。
– 胰腺
酒精会导致胰腺发炎,也称为胰腺炎。酒精还会影响胰腺产生胰岛素的方式,如果不停止饮酒,最终会导致个体患上糖尿病。
– 肝脏
酒精是通过 ADH 和 CYP2E1 代谢的,这两种酶都是肝脏的重要功能酶。
通过干扰这些酶的正常功能并产生有害的副产物,对肝脏的影响可能包括肝脏炎症或肝炎、肝硬化、黄疸。
饮酒过多的人可能的直接有害影响
长期酗酒的危害
长期饮酒是全世界最常见的死亡原因之一。根据世界卫生组织的数据,全世界有 23 亿人饮酒,其中约 7500 万人被归类为患有酒精障碍。
酒精滥用会对多个终末器官造成损害,主要是肝脏、肠道和大脑,从而引发多系统损伤。
酒精中毒对全球发病率和死亡率有显著影响,每年约有 5.3% 的死亡是由有害饮酒造成的(世卫组织,2018 年)。一项针对印度南部农村 167,343 名成年受试者的研究发现,每天饮酒 30 年或更长时间会增加癌症相关死亡率的总体水平。
大量饮酒通常与患癌症的风险增加有关;然而,具体的剂量反应关系因癌症部位而异。
——饮酒量越多,肝癌风险越高
最近对涉及 19 组肝癌(即肝细胞癌)受试者的 16 篇文章进行的荟萃分析发现,与不饮酒者相比,饮酒量与肝癌风险之间存在线性关系。
因此,每天饮用 3 杯酒精饮料与风险增加相关,而每天饮用约 7 杯酒精饮料则风险增加高达 66%。
——不同种类乳腺癌,饮酒风险不同
乳腺癌风险也存在类似的线性关系。虽然饮酒总体上与女性患乳腺癌的风险较高有关,但这种关联并不适用于所有类型的乳腺癌。
在参加妇女健康倡议的女性中,饮酒者患雌激素阳性乳腺癌的风险增加。
而与从未饮酒的女性相比,饮酒者患三阴性乳腺癌的风险降低。
注:三阴性乳腺癌,孕激素、雌激素受体以及Her-2即表皮上皮生长因子,都是阴性,叫三阴性乳腺癌。
总之,饮酒和滥用酒精与多种癌症有关,并且这些关联的数量还在不断增加。与此同时,现在越来越清楚的是,酒精对某些慢病和癌症具有预防作用。此外,尽管酒精在预防某些癌症方面具有潜在的有益作用,但重要的是要记住,不能忽视长期酗酒的有害影响。
可能会增加以下疾病的易感性:
酒精引起的肠道菌群和代谢功能的变化可能导致
虽然酒精的新陈代谢看起来相当简单,但酒精的有害影响最常与新陈代谢过程相关,而新陈代谢过程通常会导致烟酰胺腺嘌呤二核苷酸加氢 (NADH) 的过量产生。
大量的 NADH 会导致乳酸,从而导致体内酸中毒,以及葡萄糖合成不足,从而导致低血糖。
▼
虽然大多时候我们都认为饮酒会带来许多有害影响,但过去几年进行的几项临床研究表明,适度饮酒实际上可以促进许多健康益处,例如:可能有助于降低患心脏病和死亡、缺血性中风、糖尿病的风险。这些益处的前提是要适度饮酒,那么什么是适度饮酒?
根据疾病预防控制中心的说法:
轻度饮酒:每周喝三杯或更少的酒精饮料。
适度饮酒:女性每天喝一杯酒精饮料,男性每天喝两杯。
大量饮酒:女性每天喝四杯或更多酒,男性每天喝五杯或更多酒。
注:这个定义在不同的研究中存在差异。由于参与者的主观记忆和准确的报告,准确的人类消费量很难量化。
适度饮酒具体是如何带来益处的?
适量的酒精已被证明可以提高高密度脂蛋白 (HDL) 的水平,这是一种“好”胆固醇,实际上这已经从你的身体中去除了有害的胆固醇。
当一个人的 HDL 水平较高时,它们就能更好地保护自己免受心脏病的侵害。
适度摄入不含酒精的啤酒,可以通过补充生物活性多酚和酚酸,以及通过有益菌丰富肠道微生物群多样性,对人体健康产生积极影响。
——适量饮酒与血癌发病率较低相关
有趣的是,饮酒还与几种血癌的发病率较低有关,包括非霍奇金淋巴瘤 (NHL) 和多发性骨髓瘤。对与瑞典癌症登记处相关的 420489 名被诊断患有酒精使用障碍 (AUD) 的人进行的分析还发现,他们患白血病、多发性骨髓瘤和霍奇金病的风险较低。
最近的另一项研究还表明,饮酒与白血病风险增加无关,事实上,少量饮酒(每天少于或等于一杯)与白血病发病率降低 10% 有关。
——适量饮酒与甲状腺癌和肾细胞癌风险降低有关
在肾细胞癌的案例中,男性和女性的饮酒量低至每天 1 杯,风险也会降低,而更高的酒精摄入量并没有带来进一步的好处。
——适度饮酒与直肠腺癌呈负相关
一项针对结肠和直肠腺癌的回顾性观察性研究表明,适度饮酒(每天少于 14 克)与直肠癌的发病率呈负相关。研究人员还发现,适度摄入啤酒,尤其是葡萄酒与远端结直肠癌呈负相关。
酒精在体内具有多效性
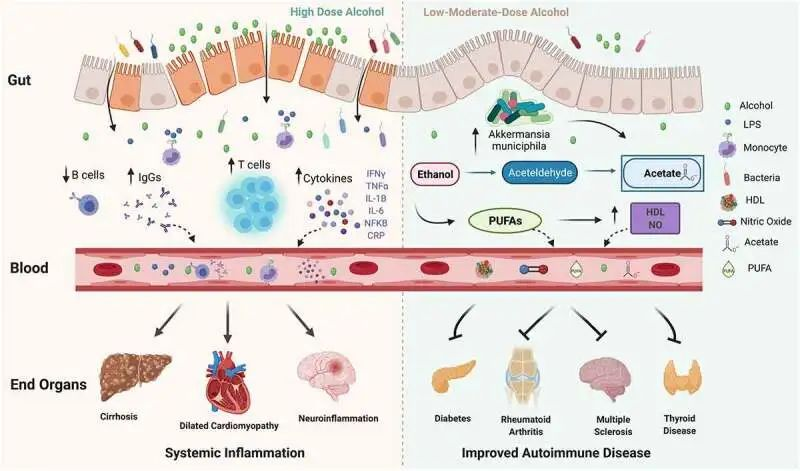
10.1080/19490976.2021.1916278
在高剂量下,酒精会破坏肠道屏障的稳定性,并可能导致肠道微生态失调、细菌壁产物、脂多糖 (LPS) 增加,后者会刺激免疫细胞上的 Toll 样受体 (TLR),并导致单核细胞、T 细胞、细胞因子和免疫球蛋白 (IgG) 水平以及 B 细胞减少。反过来,循环的炎性细胞因子、IgG 和免疫细胞会导致终末器官损伤。
在中低剂量下,酒精已被证明可以改善自身免疫性疾病的风险和进展。
低剂量酒精可能通过增加Akkermansia muciniphila对炎症产生积极影响和其他保护性肠道微生物,并有助于增加乙酸盐、多不饱和脂肪酸 (PUFA)、高密度脂蛋白 (HDL) 和一氧化氮 (NO)。
接下来展开讨论低-中剂量酒精对自身免疫性疾病的保护作用,以及高剂量酒精带来的健康危害,包括免疫系统、肠道菌群及其代谢产物、营养物质等多方面。
酒精可能对自身免疫性炎症产生有益影响的一个重要方式是通过其对肠道中脂肪酸代谢的影响。
众所周知,高剂量酒精会导致脂肪酸失调和发展为脂肪肝疾病,而在低剂量时,酒精可能有助于产生肠道衍生的抗炎脂肪酸,例如短链脂肪酸(SCFAs) 和多不饱和脂肪酸 (PUFAs)。
短链脂肪酸
低度至中度饮酒可以通过两种方式调节短链脂肪酸的产生:
1、通过改变肠道中产短链脂肪酸菌
低度至中度酒精会改变肠道中产生短链脂肪酸的微生物群,例如Akkermansia muciniphila。
短期饮酒(5 天 0.8 g/kg 胃内)会升高小鼠的Akkermansia muciniphila水平,而在消耗同等酒精强度的发酵米酒 (FRL) 的组中未观察到升高。
2、通过乙酸盐产生
酒精本身会代谢成短链脂肪酸、乙酸盐,并且喂食 Lieber-DeCarli 饮食 8 周的动物与对照组相比显示乙酸水平升高。
Lieber-DeCarli 饮食
Lieber-DeCarli 饮食是一种常用于动物实验中的饮食方案。它是由两位科学家 Lieber 和 DeCarli 在 1980 年代开发的,旨在为动物提供一种高度可控的饮食,也就是说可以根据实验需要增加或减少某种营养素的含量,以便研究不同营养素对健康和疾病的影响。
Lieber-DeCarli 饮食的特点是含有高浓度的葡萄糖和脂肪,而蛋白质含量相对较低。这种饮食的能量密度非常高,因此可以使动物快速增重。
Lieber-DeCarli 饮食在动物实验中应用广泛,特别是在研究肝脏疾病、肿瘤、代谢疾病等方面。由于该饮食的成分非常可控,可以帮助研究人员更准确地评估不同营养素对健康的影响,因此被广泛应用于基础医学和临床研究中。
需要注意的是,Lieber-DeCarli 饮食虽然在动物实验中应用广泛,但并不适合人类长期食用。这是因为该饮食的成分并不符合人类的膳食建议,长期食用可能会导致营养不良和健康问题。
多不饱和脂肪酸
低度至中度酒精保护自身免疫性疾病的另一个潜在机制,可能依赖于酒精在必需多不饱和脂肪酸代谢中的重要作用,如二十二碳六烯酸 (DHA) 和二十碳五烯酸 (EPA)。这些多不饱和脂肪酸(PUFA)可以减少活性氧的形成并充当抗炎分子。
低至中等剂量的酒精已被证明会增加多不饱和脂肪酸的产生,而在高剂量酒精下,由于脂肪酸分解代谢增加,多不饱和脂肪酸浓度会降低。
值得注意的是,多不饱和脂肪酸和多不饱和脂肪酸衍生物,如分解素、脂氧素和与自身免疫性疾病的缓解有关。
此外,多项研究还表明,多不饱和脂肪酸的增加具有心脏保护作用。由于心血管健康正在成为自身免疫性疾病结果的一个重要因素,这可能是另一种由低度至中度酒精介导的保护机制。
鉴于促炎特性,饮酒可能会导致自身免疫性疾病的风险增加或恶化。事实上,在某些炎症性疾病中,例如肠易激综合征 (IBS) 和常年性过敏,大量饮酒与疾病发作之间存在直接相关性。然而,适度饮酒似乎可以降低疾病风险、严重程度和进展。
这里介绍几种酒精相关的自身免疫性疾病,包括自身免疫性糖尿病、自身免疫性甲状腺疾病、系统性红斑狼疮、类风湿关节炎、多发性硬化症等,适度饮酒可降低其风险。
自身免疫性糖尿病
适度饮酒的有益作用已在成人非自身免疫性2 型糖尿病和自身免疫性 1 型糖尿病 (LADA) 中得到证实。
每天摄入 2–7 g 的患者风险降低了 60%
在一项自身免疫性 1 型糖尿病研究中,与每天摄入 0.01–2 g 的患者相比,每天摄入 2–7 g 的患者风险降低了 60%。这项研究还指出,与饮酒者相比,戒酒者的抗谷氨酸脱羧酶抗体 (GAD Ab) 水平更高,C 肽水平更低,对男性的影响更为明显。
注:抗谷氨酸脱羧酶抗体 (GAD-Ab) 在1型糖尿病发病前期和发病时多为阳性,而在正常人群及2型糖尿病患者中多为阴性。
葡萄酒的效果显著,可能与葡萄酒中的多酚类抗氧化物质相关
在另一项自身免疫性 1 型糖尿病研究中,发现摄入量超过 25 克/天的男性和女性的风险降低了 46%。这种效果似乎在抗 GAD 抗体水平低的患者中最强,并且与啤酒或白酒消费者相比仅限于葡萄酒饮用者。作者推测,抗 GAD 抗体水平较低的患者可能与 2 型糖尿病患者最相似,可能是葡萄酒中的多酚和羟基二苯乙烯类物质促进了酒精在自身免疫中的抗氧化或抗炎作用。
自身免疫性甲状腺疾病
与糖尿病类似,适度饮酒已被证明对自身免疫性甲状腺功能减退症和甲状腺功能亢进症均有保护作用。
例如,与对照组相比,适度饮酒与甲状腺功能减退症和格雷夫氏病的风险降低呈剂量依赖关系,无论性别或饮酒类型如何。
几项研究还发现,适度饮酒 >10 单位/周或每天至少饮酒 35 克,与自身免疫性甲状腺疾病和甲状腺过氧化物酶抗体阳性的发生概率较低有关。
系统性红斑狼疮(SLE)
多个病例对照、队列和横断面研究已经确定适度饮酒与系统性红斑狼疮风险之间存在显著的剂量依赖性关联。
在一项荟萃分析中,适度饮酒的保护作用与系统性红斑狼疮的持续时间有关,与治疗少于 5 年的患者相比,治疗少于 10 年的患者具有显著性。
另一项研究得出结论,适度饮酒可能会降低 ANA 阳性患者进展为系统性红斑狼疮的概率。
注:系统性红斑狼疮(SLE)是临床上最为常见的自身免疫性疾病之一。SLE的实验室检查包括多种项目,抗核抗体(ANA)是其中较为经常检测的项目之一。ANA阳性尤其是ANA核型为核均质性的结果往往与SLE具有较高的相关性,故临床上往往以此结果联合其他检查并结合患者症状作为诊断SLE的依据。
类风湿关节炎
与甲状腺疾病、糖尿病和系统性红斑狼疮类似,多项流行病学研究和几项机制研究支持轻度至中度酒精以 J 型或 U型剂量依赖方式在类风湿关节炎中发挥保护作用。
适度饮酒女性:较低的风险,较高的生活质量
在一项荟萃分析研究中,男性和女性的类风湿关节炎风险在10年内均有所降低,其中女性的风险降低幅度最大。
在其他研究中,与男性相比,适度饮酒的女性报告了较低的疾病活动和较高的生活质量。
然而,也有文献记载:酒精可能会阻止男性的放射学进展,并增加女性的放射学进展。与不饮酒的患者相比,中度饮酒的类风湿关节炎患者的改良健康评估问卷得分(提示功能状态改善)也显著降低。这种影响在HLA-DRB1共享表位阳性的患者中更强。
因此,类风湿关节炎患者的酒精、性别和基因构成之间可能存在有益但复杂的关系。
在类风湿关节炎中,适度饮酒与CRP 水平、IL-6水平的关联
在类风湿关节炎(RA)中,已注意到 CRP 水平呈 J 型关联:每周饮用 1-7 杯酒的患者 CRP 水平最低。
51 名适度饮酒的类风湿关节炎患者在症状出现前与 IL-6 水平呈 U 型关联,饮酒与可溶性肿瘤坏死因子受体 2 (TNFR2) 水平呈负相关。
适度饮酒:ACPA阳性患者类风湿关节炎风险降低
由于酒精会导致肝损伤,一项评估饮酒与肝脏炎症之间关系的研究报告称,每周饮酒量大于 21 单位与转氨酶相关,而每周饮酒量小于 14 单位则没有。适度饮酒还与抗瓜氨酸化蛋白抗体 (ACPA) 阳性患者的类风湿关节炎风险降低 50% 相关,并且与 ACPA 阴性类风湿关节炎患者的疾病风险降低 30% 呈反比剂量反应关系。
在类风湿关节炎小鼠模型中也注意到酒精对免疫系统的剂量依赖性影响。
适度饮酒:胶原性关节炎发病率下降
在胶原性关节炎 (CIA) 模型中,与非酒精对照组相比,适度饮酒的小鼠的 CIA 发病率降低了 40%,放射疾病严重程度降低了 50% 以上。
饮酒小鼠的 IL-21 和 IL-17A、中性粒细胞、单核细胞、浆 B 细胞和 IgG 水平也较低。酒精和乙酸盐都会影响体外和体内T 滤泡辅助 (TFH ) 细胞的功能状态,从而抑制 IL-21 的分泌。
这些发现很有趣,因为 TFH细胞通常存在于类风湿关节炎患者的滑膜关节中,也是肠道免疫的重要介质,表明肠道免疫过程与类风湿关节炎之间可能存在联系。
在另一项 CIA 研究中,适度饮酒(10% 乙醇水溶液)通过增加内源性睾酮、抑制核因子 B 活化和下调白细胞迁移来延缓 CIA 的发作并改善其进展。
多发性硬化症(MS)
同样,在多发性硬化症中,也有证据表明,适度饮酒在降低疾病风险和/或疾病进展方面具有保护作用。几项大型人口研究表明:
酒精与男女多发性硬化症风险之间存在剂量依赖性负相关
适度饮用红酒似乎与较低的扩展残疾状态量表评分相关,这表明功能有所改善,尽管适度饮酒的患者在脑部 MRI 上表现出 T2 病变体积增加。
相反,大量饮酒可能会增加患多发性硬化症的风险,尤其是男性。
也有研究认为剂量和多发性硬化症风险之间没有关联,性别可能是一个变量
一些研究指出,不同剂量的酒精与患多发性硬化症的风险之间没有关联。在这些研究中,性别可能是一个变量,可以解释酒精对多发性硬化症的影响。
例如,在一项女性护士健康研究(NHS)I和II中,不同类型的酒精与多发性麻痹症的风险没有关联。尽管这是一项针对英国国家医疗服务体系两项研究中超过90000名女性的大型研究,但258例多发性硬化症患者的队列相对较小,与男性相比,女性可能没有经历到酒精的保护作用。
例如,在多发性硬化症的动物模型,即实验性自身免疫性脑脊髓炎(EAE)中,最近的研究表明,主要是雄性小鼠在适度饮酒后疾病评分有所改善。
以上是低-中剂量酒精带来的健康益处,“凡事皆有度,过犹不及”。接下来章节来看过量饮酒可能带来哪些不利影响。
酒精与消化系统密不可分。它通过肠道吸收,并在肝脏内被肝细胞代谢。过量饮酒会导致肠道微生物组和肠道上皮完整性发生改变。它会导致重要的微量营养素缺乏症,包括短链脂肪酸和微量元素,这些元素会影响免疫功能并导致肝损伤。在某些人中,长期酗酒会导致肝病从脂肪肝发展为肝硬化和肝细胞癌。
持续酗酒会改变肠腔pH 值,促进病原体过度生长,并且还与肠道微生物群功能的改变有关,因为它会改变与肠屏障功能障碍有关的特定代谢物分泌物。酒精使用障碍患者通常表现出血浆细胞因子水平升高,例如 TNF-α、IL-10 和 CRP,这表明慢性、低度、全身性炎症。
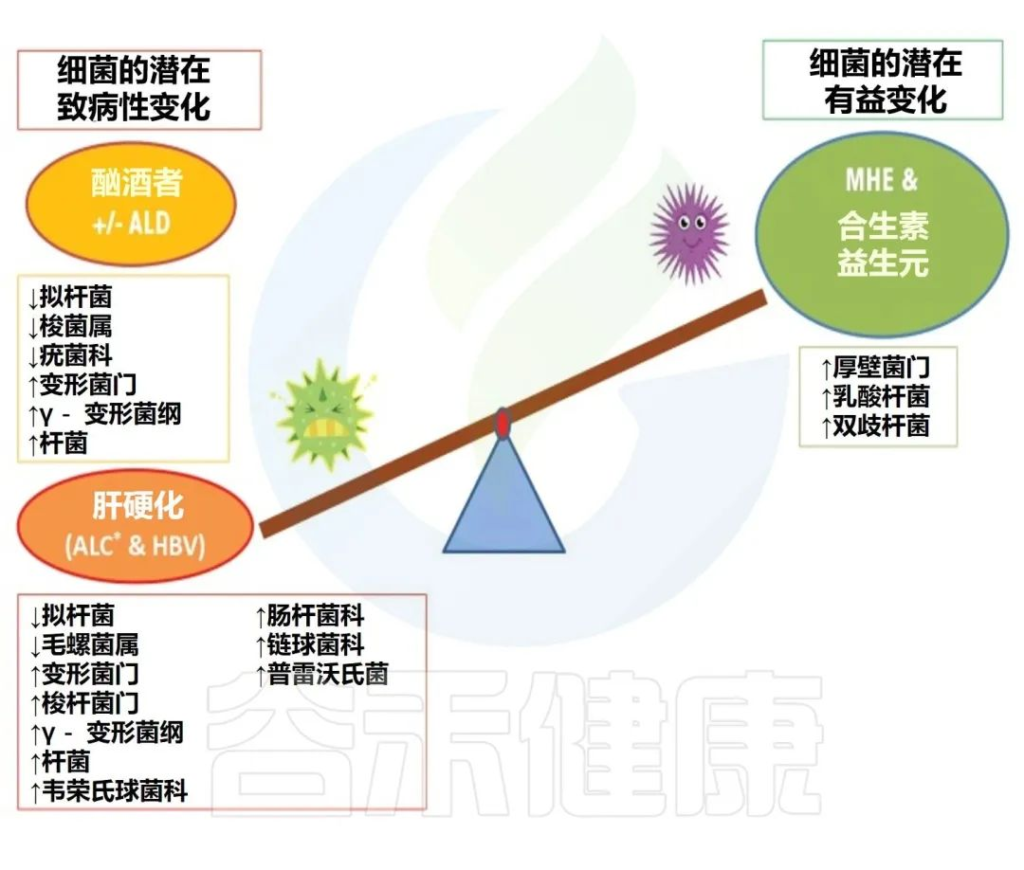
几项研究调查了饮酒对动物和人体模型的影响,并一致表明过量饮酒与肠道微生态失调的发展有关。
简而言之,酒精已被证明可以增加变形杆菌、肠杆菌和链球菌的相对丰度,并降低拟杆菌、阿克曼氏菌和粪杆菌的丰度。其他还包括抗炎细菌(如Faecalibacterium prausnitzii和双歧杆菌等)水平下降。
在人类酒精使用障碍 (AUD) 研究中,生态失调的特征是:
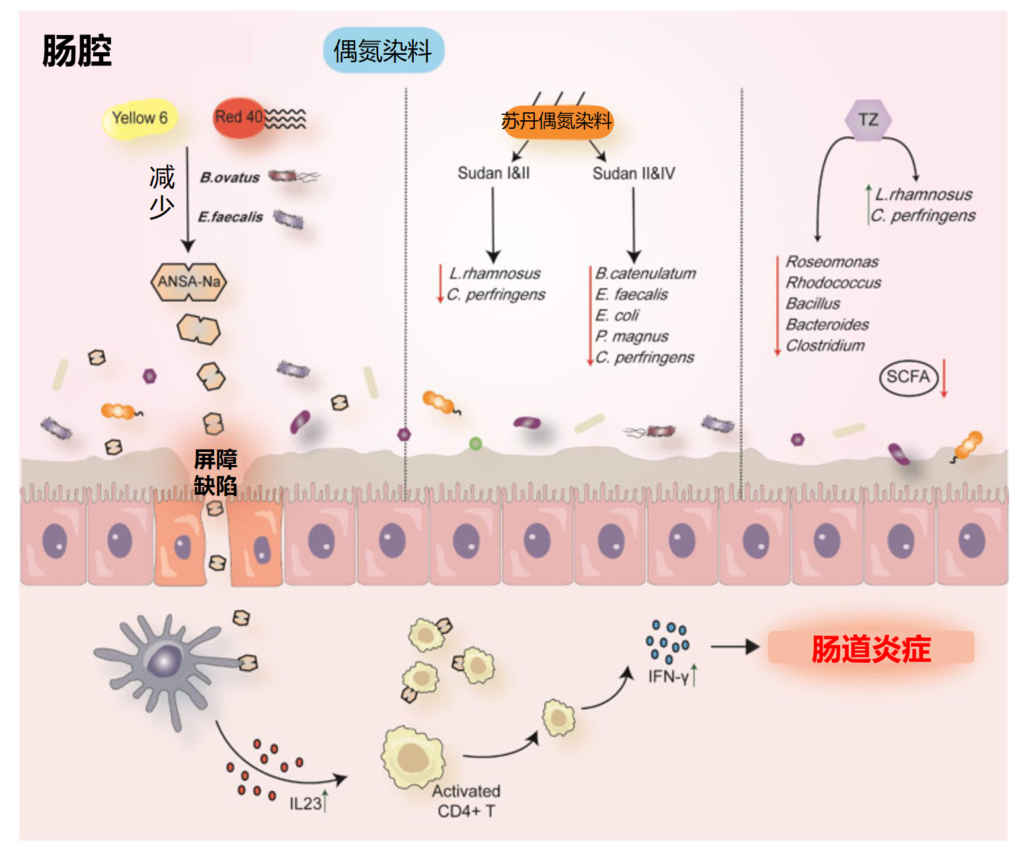
扩展阅读:
肠道细菌四大“门派”——拟杆菌门,厚壁菌门,变形菌门,放线菌门
然而,并非所有研究都注意到厚壁菌门对高剂量酒精的反应有所减少。例如,在猕猴中自愿自我给予慢性高剂量酒精会导致拟杆菌减少、厚壁菌门升高,并且在饮酒期间完全没有Akkermansia muciniphila,而戒酒则恢复了基线细菌种类。
肠道微生物群稳态的破坏与这些疾病有关
Engen PA et al., Alcohol Res. 2015;37(2):223-36.
此外,生态失调可能是由西方社会常见的环境因素引起的,包括饮食、遗传、昼夜节律紊乱和酒精饮料消费。
在酒精成瘾者中,饮酒会破坏肠道屏障功能,也称为肠漏症。肠道屏障由肠细胞、杯状细胞和影响粘液层内肠道微生物组的抗菌物质以及固有层中的众多免疫细胞组成。
酒精引起的生态失调通过其对肠道完整性的病理影响促进急性(例如,酒精性肝炎)和慢性(例如,酒精相关性肝硬化)肝病的发展。
肠粘液屏障在肠道的免疫功能中起着至关重要的作用,它的破坏会导致这些疾病状态。在这个屏障中,相邻的肠细胞被顶端“紧密连接”蛋白 claudins、occludin 和 zona occludens 结合在一起,防止病原体相关分子颗粒 (PAMP) 和细菌内毒素等管腔内容物意外转移到门脉循环中。
饮酒引起的生态失调与这些紧密连接的破坏有关。因此,随后的免疫功能障碍和循环促炎细胞因子(如肿瘤坏死因子 (TNF)-α 和IL-1β)的增加进一步破坏了肠道屏障。
扩展阅读:什么是肠漏综合征,它如何影响健康?
酒精相关的微生态失调不可避免地会影响肠道代谢,包括短链脂肪酸 (SCFA)、氨基酸和胆汁酸的显著变化。
短链脂肪酸
短链脂肪酸在维持紧密连接方面的作用越来越明显。短链脂肪酸是肠道菌群对难消化膳食纤维进行厌氧发酵的产物。
对酒精使用障碍患者的粪便代谢组分析显示,短链脂肪酸减少,这可能部分是由于生态失调对粪杆菌等产短链脂肪酸菌产生负面影响。一些小鼠模型表明,以高纤维饮食、益生菌或饮食调整形式补充短链脂肪酸,可增强肠道上皮完整性,并减少酒精模型中的肝损伤。
氨基酸
从饮食中获得的必需氨基酸(例如赖氨酸)和非必需氨基酸(例如谷氨酸)都会受到酒精影响。据推测,这是由于生态失调导致微生物-宿主共同代谢紊乱的结果。
虽然管腔氨基酸浓度会随着饮酒而下降,但一些氨基酸(如酪氨酸和苯丙氨酸)的血清水平会升高,这表明失调微生物组的代谢和吸收特征发生了改变。这种代谢失衡可能在活性氧 (ROS) 和有毒中间体水平升高的过程中发挥作用。
胆汁酸
胆汁酸已被证明在人类和大鼠饮酒后的血清和管腔内容物中都会发生变化。初级(由肝脏合成)和次级(来自细菌代谢)胆汁酸主要在小肠中发挥多种功能,并通过其类固醇结构在脂质吸收、胆固醇稳态以及激素作用中发挥关键作用。
在健康的肠肝循环中,初级胆汁酸与牛磺酸或甘氨酸结合形成分泌到肠腔中的胆汁盐。然后肠道微生物群将这些代谢为次级胆汁酸,在将它们循环回肝脏之前去除牛磺酸/甘氨酸基团。饮酒通过增加次级胆汁酸的比例和胆汁酸的总浓度,以及增加与甘氨酸而非牛磺酸结合的比例来破坏这一点。
这是由于生态失调降低了牛磺酸的生物利用度和肠肝循环率增加所致。这种破坏的后果尚不完全清楚;然而,在饮酒过程中更普遍的甘氨酸结合酸可能毒性相对更大,尽管管腔浓度高但胆汁酸的合成增加导致肝脂肪变性。
长期饮酒会减少营养吸收并导致营养不良。肠道通透性、胆汁酸概况和微生物组的改变都促成了这一点,此外,酒精代谢过程中释放的有毒代谢物和 ROS 会对肠道造成结构损伤。
特别是,长期饮酒已被证明会导致细胞死亡、粘膜侵蚀和绒毛尖端上皮细胞丢失。其后果是维生素 A、B1(硫胺素)、B2(核黄素)、B6(吡哆醇)、C、D、E 和 K 以及叶酸、钙、镁、磷酸盐、铁和微量元素锌和硒的不同程度的缺乏。
扩展阅读:如何解读肠道菌群检测报告中的维生素指标?
所有患有慢性酒精使用障碍的患者都要接受全面的营养评估,因为这些缺乏症因人而异,例如铁可能缺乏或过量。
除了上述机制外,重度饮酒者每天从营养不良的酒精饮料中获取高达 50% 的热量摄入 。此外,应该注意的是,除了慢性酒精滥用的症状影响(例如,呕吐、厌食和腹痛)之外,该群体中的社会因素(例如贫困和获得营养“完整”的饮食)也可能导致营养不良。
微生物组从高剂量酒精喂养的小鼠,转移到未接触酒精的无菌小鼠,已被证明会在受体小鼠中诱发肠道炎症。
酒精通过影响肠粘膜免疫诱发炎症
肠道炎症是由免疫系统对酒精及其代谢物产生的炎症反应引起的。酒精通过多种机制影响肠粘膜免疫。特别是,它可能首先降低粘膜中的先天免疫反应,导致对肠道病原体的易感性增加。
随后,正如在细胞培养研究中发现的那样,酒精可能会触发免疫系统反应和促进炎症反应的分子上调,包括释放炎症免疫细胞,例如白细胞和肥大细胞。
研究还表明,酒精可以直接调节先天免疫和适应性免疫,进一步促进肠道和肠道源性炎症。例如,一项针对小鼠的研究发现酒精会抑制肠道清除有害细菌的免疫反应,而其他研究发现酒精会抑制肠道粘膜免疫细胞的活性。
酒精通过引起肠道菌群失调诱发炎症
酒精相关的细菌过度生长和生态失调可能导致肠道内毒素产生增加,内毒素可与肠粘膜上的细胞结合,引起局部炎症,并易位至肠外部位,引起全身炎症。
微生物群失调可导致肠道通透性受损,并通过肠道细菌内毒素、LPS 的系统易位、免疫细胞上 TLR 和NF-kB 的激活以及炎症 iNOS 的诱导促进炎症。
酒精通过肝毒性诱发炎症
肝毒性会干扰肝脏解毒物质的能力,从而导致酒精的有毒代谢物乙醛在全身蓄积。此外,LPS 介导的肝脏驻留巨噬细胞 Kupffer 细胞的激活进一步促进了促炎细胞因子的释放和全身炎症的传播。
其他研究发现酒精影响粘膜免疫的多种方式,包括:
酒精对先天免疫系统和适应性免疫系统的影响具有剂量依赖性。
酒精对小胶质细胞(中枢神经系统的先天免疫细胞)具有显著的剂量依赖性影响
在急性酒精滥用的小鼠模型中:
酒精还以剂量依赖的方式调节适应性免疫系统
长期适度饮酒会导致 T 细胞和 B 细胞活化和增殖,而长期大量饮酒则与 T 细胞和 B 细胞耗竭和凋亡以及免疫球蛋白增加有关。
此外,长期酗酒会改变 T 细胞表型,导致幼稚 T 淋巴细胞百分比下降和记忆 T 细胞百分比升高。相反,适度饮酒与滤泡辅助性 T (T FH )细胞的调节有关。
细胞因子和炎症标志物也以剂量依赖的方式受到酒精的影响。例如,C 反应蛋白 (CRP) 和白细胞介素 6 (IL-6) 在人类重度饮酒者中升高,但与不饮酒者相比,在适度饮酒者中相对降低。
CRP 效应也可能是性别二态的,一些研究表明酒精引起的 CRP 降低是女性特有的,也有其他研究表明适度饮酒会以 U 形模式降低 CRP,而与性别无关。
以上是高剂量酒精对肠道屏障、肠道菌群及其代谢产物、营养状况、免疫系统等方面的影响。接下来章节我们具体来了解一下酒精相关疾病,包括肝病、胃肠道疾病、营养不良、肥胖、心血管疾病等。
►►►
酒精代谢
肝肠微生物轴在营养吸收和肝毒性中起着重要作用,其中肝脏是营养物质、毒素和肠道血液供应的细菌代谢产物的第一道过滤器。
酒精性肝病 (ALD) 是一种由过量饮酒引起的疾病,是全球医疗保健的负担。酒精性肝病涵盖范围广泛的肝损伤,包括无症状脂肪变性、酒精性脂肪性肝炎 (ASH)、纤维化、肝硬化和肝细胞癌 (HCC)。
酗酒患者发展为酒精性肝病的易感性是高度可变的,并且其向更晚期的进展受若干因素(即酒精滥用的量和持续时间)的强烈影响。
其中,肠道微生物群及其代谢物最近被确定为酒精性肝病病理生理学中最重要的。
酒精滥用会引发肠道菌群分类组成、粘膜炎症和肠道屏障紊乱的定性和定量改变。肠道通透性过高导致活致病菌、革兰氏阴性微生物产物和促炎性内腔代谢物转移到血液中,进一步证实了酒精引起的肝损伤。
酒精在肝脏中的代谢
酒精在肝脏中的代谢是了解其在酒精相关肝病发病机制中的作用的关键。酒精在肝细胞中主要通过乙醇脱氢酶代谢为乙醛,然后通过乙醛脱氢酶代谢为乙酸。
乙醛是一种高反应性蛋白质,会导致肝损伤。它与脂质、蛋白质和 DNA 结合形成潜在的免疫原性加合物。这些加合物可产生适应性免疫反应,导致肝细胞损伤和炎症。
线粒体结构改变可导致功能障碍,包括 ATP 生成减少、ROS 生成和乙醛脱氢酶活性降低。乙醛也是肝纤维化进程中的关键代谢物。它可以促进肝星状细胞 (hepatic stellate cells, HSCs) 中胶原 I 的合成,乙醛加合物刺激炎性细胞因子和趋化因子的释放。
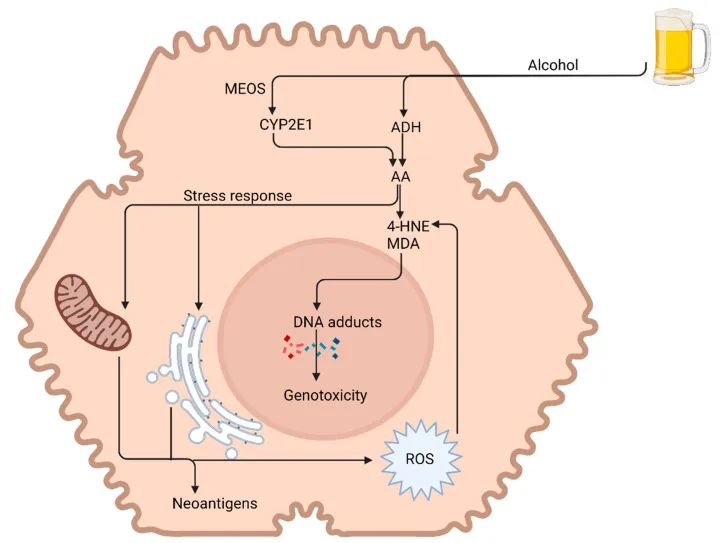
乙醇脱氢酶途径可有效代谢少量酒精,但在长期接触酒精时,该途径会变得饱和,并且会显著诱导 CYP2E1。向 CYP 途径的转变导致 ROS 的产生,从而导致氧化应激。
ROS 与蛋白质结合,改变它们的结构和功能特性,并可能充当新抗原。ROS 还可以直接与 DNA 结合,造成损伤,或导致脂质过氧化产物,如 4-羟基壬烯醛 (4-HNE) 和丙二醛 (MDA),从而产生高度致癌的 DNA 加合物。
此外,在慢性重度酒精摄入中,由于乙醛介导的谷胱甘肽减少,肝脏的抗氧化清除系统受损。氧化应激的结果是诱导肝细胞凋亡和坏死。
酒精性肝损伤
编辑
图源:biorender
乙醛 (AA) 是造成酒精对肝脏的大部分毒性作用的原因。乙醛极度亲脂,导致形成乙醛加合物——丙二醛 (MDA) 和 4-羟基壬烯醛 (4-HNE)。这与活性氧 (ROS) 一起导致 DNA 损伤和遗传毒性。
乙醛还会诱导各种细胞器(例如线粒体和内质网)的功能和结构改变。
MEOS:线粒体酶氧化系统;ADH:乙醇脱氢酶。
酒精相关性脂肪变性
脂肪变性的特征是肝细胞中脂肪(甘油三酯、磷脂和胆固醇酯)的积累,是肝脏对长期饮酒的最早反应,几乎普遍存在于慢性重度饮酒者中。
虽然它在减少饮酒后是完全可逆的,但它的存在与酒精相关肝病的进展有关,最近的一项荟萃分析发现肝硬化的年进展率为 3%。 肝脂肪变性可能通过更大的脂质过氧化和氧化应激增加肝脏炎症(脂肪性肝炎)、纤维化和肝硬化的风险。
然而,进展不仅受饮酒量的影响,还受其他因素的影响,包括性别、共存的肝病、吸烟和遗传。
慢性酒精摄入通过增加肝脂肪生成和减少肝脂肪分解导致肝脂肪变性
酒精通过多种机制诱导肝脂肪变性
图源:biorender
↑:增加;↓:减少;HSC:肝星状细胞。
酒精性脂肪性肝炎
肝脏炎症强烈影响纤维化、肝硬化和最终肝细胞癌的发展
酒精引起的肠漏症导致病原体相关分子模式(PAMP) 输送到肝脏。PAMP 与受损细胞释放的损伤相关分子模式一起激活单核细胞、巨噬细胞、枯否细胞和肝实质细胞上的先天受体【Toll 样受体 (TLR) 和 NOD 样受体 (NLR)】。
通过这些受体发出的信号导致包括 NF-κB 在内的促炎转录因子的转录增加以及促炎趋化因子和细胞因子的产生。
净效应是单核细胞、中性粒细胞和 T 细胞的流入,导致细胞死亡和肝星状细胞 (HSC) 激活的可溶性介质的释放。
除了对酒精激活的促炎性免疫反应外,酒精性肝炎患者还有免疫功能障碍的证据。肠道来源的 PAMP 对单核细胞的激活导致 T 细胞耗竭,同时产生抗炎 IL-10 的 T 细胞数量减少,单核细胞和中性粒细胞功能受损 。
酒精引起的炎症
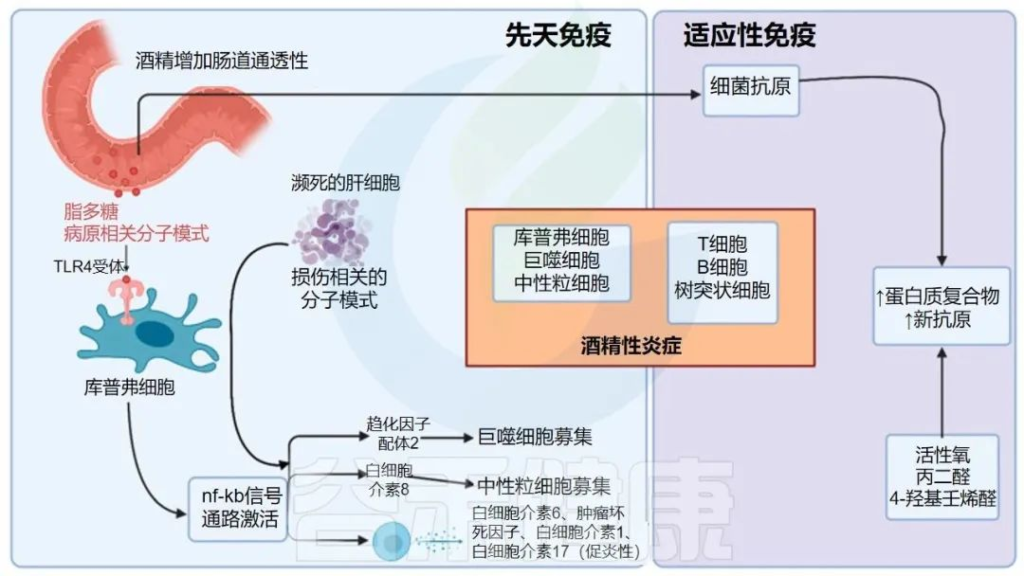
酒精对先天免疫和适应性免疫均有影响。酒精不仅会诱发肠道菌群失调,还会增加肠道通透性。病原体相关分子模式 (PAMP) 如脂多糖与 Kupffer 细胞上的 TLR4 受体相互作用,并通过 NF-κB 途径产生促炎细胞因子和趋化因子,导致肝脏炎症。
乙醛诱导各种蛋白质的结构变化并产生新抗原,从而引发适应性免疫反应并导致肝脏炎症。
CCL2:CC基序趋化因子配体2;DAMPs:损伤相关分子模式;4-HNE:4-羟基壬烯醛;IL:白细胞介素;MDA:丙二醛;NF-κB:核因子 kappa B;ROS:活性氧;TLR4:toll 样受体 4;TNFα:肿瘤坏死因子α;↑: 增加; ↓:减少。
肝细胞死亡通过多种机制发生
包括细胞凋亡、细胞焦亡、坏死和坏死性凋亡。
细胞凋亡是由直接酒精介导的肝毒性、氧化应激的诱导、存活基因 ( C-met ) 的抑制和促细胞凋亡信号分子(TNF-α 和 Fas 配体)的诱导引起的。
坏死、细胞肿胀和膜破裂也可以通过称为坏死性凋亡的程序化途径发生。
而细胞焦亡是一种依赖于 caspase-1 的程序性细胞死亡。
细胞死亡的模式可能受疾病状态的影响,早期酒精相关肝病中细胞凋亡占主导地位,但酒精性肝炎中炎性体激活驱动细胞焦亡和肝损伤扩散。
长期饮酒通过多种机制影响肝脏
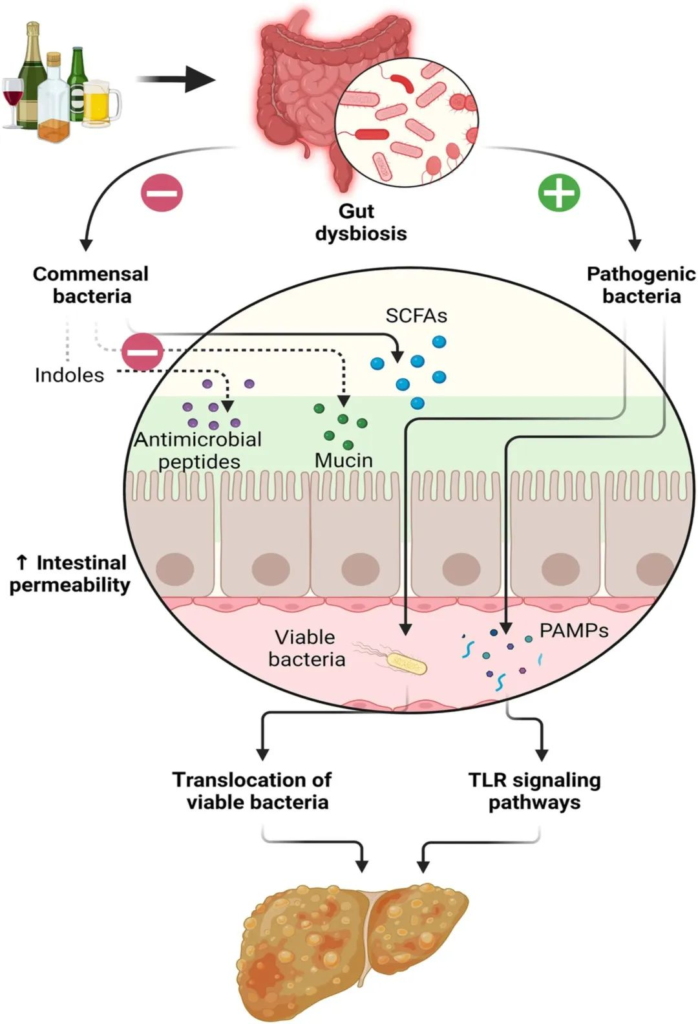
doi.org/10.1111/jgh.16199
长期饮酒会导致肠道生态失调,从而导致肠道通透性增加、肠道细菌易位和病原体相关分子模式 (PAMP),并通过 Toll 样受体 (TLR) 信号通路增加肝脏炎症和纤维化。
为什么有些人不喝酒也有可能得脂肪肝?
脂肪肝的发生与多种因素有关,包括肥胖、高血压、高血脂、糖尿病等,也与外源性酒精和内源性酒精相关。这些因素会影响肝脏的代谢功能,导致脂肪在肝脏内积累,从而引起脂肪肝。
我们一般认为的酒精摄入是指外源性酒精,是通过饮酒等途径摄入的酒精。而内源性酒精则是由人体自身产生的一种酒精,主要产生于肠道中的细菌代谢过程中。这两种酒精对人体的影响有所不同。
内源性酒精对人体的影响相对较小,因为它的产生量较少。但是,如果肠道细菌失衡,导致内源性酒精产生过多,就可能会对人体健康产生负面影响,如肝脏疾病、代谢紊乱等。
酒精引起的纤维化和肝硬化
纤维化是肝脏对破坏性刺激的伤口愈合反应,在去除刺激后可逆。在长期大量饮酒的情况下,会发生慢性炎症和纤维化,导致宽频带纤维组织沉积,扭曲肝脏结构并改变肝脏血流,导致门脉高压及其相关并发症。
当肝纤维化发展到扭曲肝脏结构并形成结节时,患者会发展为肝硬化。
活化的星形细胞 (HSC) 引起的细胞外基质沉积是肝纤维化发生和发展的关键事件。其他细胞(门静脉成纤维细胞和肌成纤维细胞)的贡献较小。HSC 被炎性细胞因子和直接被酒精及其代谢物和 ROS 激活。活化的 HSC 通过分泌趋化因子和表达粘附分子来吸引和刺激循环免疫细胞,从而使炎症反应持续存在,进而激活静止的 HSC。
肝癌
肝硬化是一种癌前状态,会增加原发性肝癌的风险,最常见的是肝细胞癌(HCC)。在全球范围内,大约 30% 的肝细胞癌是由酒精引起的。
酒精本身是一种致癌物,在肝细胞癌的背景下,通过 ROS 诱导的损伤、炎症机制及其反应性代谢物乙醛,酒精在其发展中起着特定的作用。
在大量饮酒者中,CYP 通路活性增加会产生 ROS,导致 DNA 损伤,导致细胞周期停滞和细胞凋亡并破坏基因功能,从而增加癌发生。
酒精相关性肝病患者炎症通路的激活与癌症风险增加相关
尽管机制尚未完全阐明,但可能涉及促炎细胞因子促进 ROS 积累(关于ROS平衡与健康我们准备专门搞一个主题讲下)。细胞因子的产生也与血管生成和转移发展的上调有关。此外,酒精会抑制 CD8+ T 细胞的抗肿瘤反应。
乙醛具有高反应性,并与 DNA 和蛋白质形成加合物,导致线粒体损伤和 DNA 修复机制的破坏。在具有遗传变异的人群中发现的乙醛水平升高会导致酒精脱氢酶和乙醛脱氢酶的活性改变,这与重度饮酒者患肝细胞癌的风险较高有关。
扩展阅读:深度解析 | 肠道菌群与慢性肝病,肝癌
►►►
胃肠道 (GI) 是与摄入体内任何物质的第一道接触线,特别容易受到毒素的损害。越来越多的研究表明,胃肠道健康状况不佳对身体的整体健康起着重要作用。任何可能导致胃肠道损伤的事情,其后果可能远远超出肠道。事实上,研究人员已经开始发现酒精,特别是如果长期大量饮酒,会引发肠道内启动的过程,从而促进全身炎症。
酒精使用障碍患者肠道通透性增加
对人类的研究表明,一部分酒精使用障碍 (AUD) 患者的肠道通透性实际上有所增加,这是使用称为 Cr-EDTA 的方法测量的,该方法检查口服铬的排泄。此外,那些患有酒精使用障碍且通透性增加的人更容易患肝病,表明肠道通透性可能是某些酒精使用障碍患者器官损伤的介质。
另一项研究表明,患有酒精使用障碍的人不仅肠道通透性增加,而且增加到足以让大分子通过肠道屏障。内毒素 – 也称为脂多糖 (LPS),是大分子,同一项研究发现血浆内毒素水平随着肠道通透性的增加而增加。
酒精是如何诱导肠道通透性的呢?
简短的回答是通过破坏上皮细胞本身(跨上皮通透性)和破坏上皮细胞之间的空间(细胞旁通透性),它由紧密连接、细胞骨架和一些相关蛋白组成。
跨上皮渗透性是由直接细胞损伤引起的。例如:
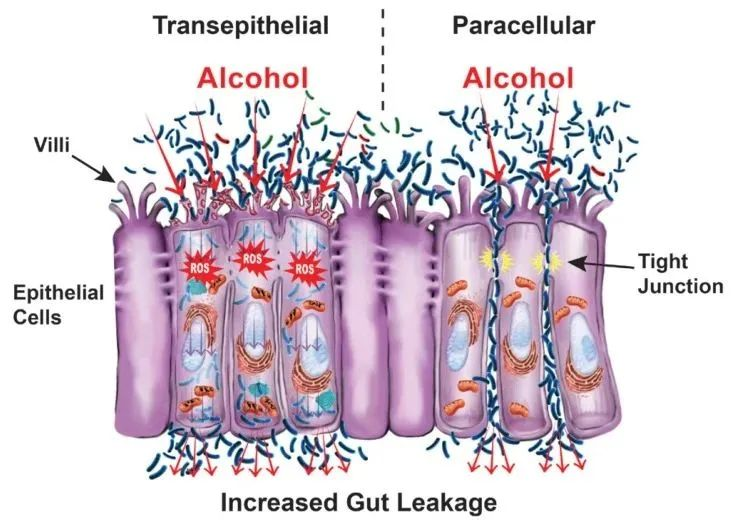
肠道屏障调节肠道内部(食物和饮料流经的地方)和肠道内部上皮细胞层另一侧的细胞和血管之间的物质通道,包括微生物产物。
破坏肠道屏障有两种方式:
肠道屏障通透性增加,使细菌及其产生的毒素离开肠道,并通过血液渗入其他器官。
酒精及代谢物如何通过触发以上两种机制?
— 酒精及其代谢物通过直接破坏细胞和通过活性氧 (ROS) 引起的氧化应激等多种机制削弱细胞膜来触发跨上皮机制。
酒精会导致细胞死亡,从而导致肠道发生变化,包括粘膜溃疡、糜烂和主要位于绒毛尖端的上皮细胞丢失;乙醛形成导致直接细胞损伤的 DNA 加合物;和酒精代谢过程中释放的活性氧 (ROS) 通过氧化应激导致直接细胞损伤。
— 酒精的代谢物通过破坏产生连接细胞和稳定细胞骨架的蛋白质的紧密连接的蛋白质,来触发细胞旁路机制。
酒精及其代谢物通过作用于将两个相邻细胞融合在一起的紧密连接复合物而引起细胞旁通透性。例如,乙醛通过重新分配蛋白质来破坏紧密连接的稳定性;酒精及其代谢物改变紧密连接蛋白的表达;和酒精的非氧化代谢物导致紧密连接再分布,破坏其屏障功能。
此外,研究表明酒精会破坏细胞的细胞骨架,即赋予它们结构的细胞边界。还有越来越多的证据表明,酒精会导致 microRNA (miRNA) 的过度表达,这些小片段的非编码 RNA 会沉默基因表达。具体而言,酒精会导致 miRNA 过度表达,从而影响与肠道屏障完整性相关的基因。
酒精和胃肠道癌症
长期饮酒会增加患主要胃肠道癌症的风险,包括食道癌、胃癌和结肠癌(结直肠癌)。这种风险通常随着饮酒量的增加以及与其他生活方式相关因素(如吸烟或代谢综合征)的增加而增加。虽然酒精最初被认为是一种直接致癌物,但研究表明酒精引起的肠道炎症可能是罪魁祸首。
代谢综合征和肥胖中出现的全身性炎症会增加多种上皮癌的风险,包括胃肠道癌,这表明酒精引起的肠道炎症造成的全身性炎症状态,也可能导致酒精引起的胃肠道和其他器官癌症发生。这个过程像滚雪球,因为随着细胞转变为癌变状态,ADH 活性会增加,而 ALDH 活性可能会降低 。
这导致氧化速率增加和清除酒精代谢物的能力降低,这反过来又可以通过对 DNA、氧化应激和肠道炎症的直接影响进一步促进癌变。
►►►
营养不良
酒精的能量价值及其对营养状况的影响
酒精是唯一提供能量 (7.1 kcal/g) 的精神药物。然而,它的卡路里被认为是“空的”,因为酒精摄入不能提供维生素和矿物质,并且它的过量摄入会导致营养状况的改变。
由于酒精的高能量值,人们普遍认为,过量饮酒会增加体重和肥胖的风险。尽管酒精密度高,但与不饮酒者相比,饮酒者的体重似乎并未增加。
当酒精摄入热量占总热量摄入的 50% 或更多时,由于微粒体乙醇氧化系统 (MEOS) 的激活,身体系统可能无法有效利用乙醇摄入提供的能量。以能量浪费为代价,MEOS 是乙醇氧化的主要肝脏途径。其诱导在戒酒后是可逆的。
饮酒与体重的关系及戒酒对营养状况的改善
在对 181 名每天消耗超过 80 克乙醇的住院男性进行观察性研究期间观察到,63.1% 的人患有厌食症,58.7% 的人体重减轻,17.8% 的人的 BMI 低于 20 kg/m2。经过三个月的戒酒期后,酗酒者的热量使用正常化,体重指数 (BMI) 和腰臀比 (WHP) 也有所增加。
作者认为,戒酒期间营养状况的改善可能是由于 MEOS 活性较低,从而减少了热量的浪费。
少量或中等程度饮酒的女性肥胖风险较低
酗酒患者因饮酒而出现代谢和营养障碍,并表现出在静息状态下大量使用能量,优先使用脂质作为能量来源,并且与对照组相比,脂肪组织比健康对照减少了 19%。
队列研究表明,与戒酒的女性相比,少量或中等程度饮酒(最多 30 克/天)的女性体重增加和肥胖的风险较低,而其他研究已经达到无论受试者的性别如何,都得出相同的结论。
研究评估了酗酒者脂肪和肌肉组织长期变化的预后价值以及戒酒对这些变化的影响。结果表明,在第一次评估后的头六个月内,原来体重较轻与较差的预后相关,无论患者是否在同一时期戒酒。然而,不禁欲与瘦体重的减少相关性更大。
低剂量饮酒是热量的重要来源
身体对酒精热量的利用可能与酒精的用量有关。酒精消耗量低于每日卡路里的 25-35% 可用作能量来源;然而,在更高的消耗量下,利用可能不完整。
在人类中,热量营养不良是世界各地数以百万计死于饥饿的人所面临的现实,并且由于价格低廉且可用性高,乙醇被摄入以代替食物。一些研究创建动物模型是为了阐明当营养不良的生物体暴露于乙醇时会发生什么。然而,结果并不是人们所期望的。
事实上,低剂量饮酒是热量的重要来源,可减轻营养不良的影响。动物研究表明,摄入低至中等剂量的酒精(最多占总热量摄入的 20%)会导致营养不良的大鼠体重增加,这表明有效利用了酒精的能量含量。然而,当酒精中的能量含量占总卡路里摄入量的 10% 或更多时,富营养化大鼠的体重就会减轻。
肥胖
个人的营养状况可能会影响酒精饮料中能量的利用。在人类中,瘦个体对酒精卡路里的利用效率可能较低,而在肥胖个体中,卡路里有助于增加体重。
酒精对体重的影响仍然是一个有争议的话题
一项长达10年的前瞻性研究表明,饮酒者的体重比不饮酒者更稳定,这表明饮酒不是肥胖的危险因素。每月长期适度饮用啤酒不会改变成年人的体重或身体成分。
一些研究表明,身体和腹部脂肪的增加与适度和频繁饮酒有关。还有证据表明,不同的饮酒方式会导致体重增加。每天摄入 ≥ 30 克酒精可能会改变能量稳态的平衡,促使食欲增加,从而导致体重增加和肥胖,无论摄入哪种类型的酒精。
为什么有可能增加肥胖的风险?
在短期内,饮酒被认为是一种食欲兴奋剂,影响用于控制食欲的神经化学和外周系统,如瘦素抑制、胰高血糖素样肽-1 和血清素,并增强γ-氨基丁酸的作用,内源性阿片类药物和神经肽 Y。因此,在没有依赖性的情况下大量饮酒以及酗酒可能会增加肥胖的风险。
饮酒与体重变化及发展为肥胖的关联因性别而异
男性将酒精添加到日常摄入的卡路里中,而女性则倾向于使用酒精替代其他能源,例如减少碳水化合物的消耗而不会增加总卡路里摄取。在考虑能量平衡时必须包括这些差异,因为它们可能会产生关于体重的不同结果。
多种肥胖风险因素与饮酒有关
例如腹部脂肪增加 、脂质氧化能力下降、高热量饮食消耗和皮质醇分泌增加。有人可能会说,与酗酒者和饮食富含脂肪的人相比,超重或肥胖的人和非日常适度饮酒者更多地利用酒精中的卡路里。
女性、饮酒者、大学生的身体、腹部和外周脂肪值也较高,表明 AUDIT 问卷中较高的分数与 BMI、体脂百分比、腰围、三头肌皮褶,手臂周长呈正相关。
喝得量少,频率高 ⇒ BMI 较低
喝得量多,频率低 ⇒ BMI 较高
一项基于 1997 – 2001 年全国健康采访调查数据的研究表明,与 BMI 相关的饮酒量和频率之间存在强烈的相反影响。喝得频率更高但喝得少(即每天喝一杯)的人 BMI 较低。另一方面,饮酒频率较低但饮酒量较大(暴饮暴食)的个体 BMI 较高。那些每天摄入 ≥ 50 g 的人的腹部肥胖风险因素增加。
与这一发现一致的是,在对英国人进行的一项研究中,有人指出,摄入 30 克或更多的酒精会增高 BMI 和体重增加的风险。
肥胖风险:当前适度饮酒者<戒酒者<酗酒者
同样,在对第三次全国健康和营养检查数据进行研究后提供的结果显示,与戒酒者相比,当前饮酒者肥胖的可能性较低,而酗酒者(一天四剂或更多剂饮酒者)肥胖的可能性更大。在报告经常饮酒但每周饮酒量少于 5 剂的人群中,肥胖风险因素显著降低。
扩展阅读:体重增长:目前为止我们所知道的一切(更新你的减肥工具箱)
►►►
血脂概况
每周饮酒三到四天与患心肌梗塞的风险较低有关
据估计,酒精的心脏保护作用可能归因于 50% 的 HDL 升高。适量饮酒(30 克乙醇/天)可使 HDL-c 浓度增加约 4 mg/dL,apoA-I 浓度增加 8.82 mg/dL,心脏病风险估计降低 24.7%。
不管饮用的饮料(葡萄酒、烈酒或啤酒)的数量或类型如何,这种改变都可能发生。此外,酒精促进 HDL (好胆固醇)的较少降解和 LDL(坏胆固醇)的更大肝脏代谢。
重度饮酒者中风风险较高
尽管饮酒会改变血脂水平并减少心血管事件,但已证明重度饮酒者中脑出血和蛛网膜下腔出血等中风的发生率高于不饮酒者 。此外,由于大量饮酒,如糖尿病、高血压性心脏病、缺血性心脏病、缺血性和出血性中风等疾病逐渐增加。
酒精的风险和益处之间的差异因人而异,科学家呼吁不应将其用作保护心血管的工具作为一项公共卫生措施加以鼓励。
在一项荟萃分析研究中描述了酒精对预防冠心病的益处的减少,其中节制和轻度和中度饮酒者显示出相同的冠心病死亡风险。
发现每天饮酒 10 克的人甘油三酯水平较高。摄入量大于 50 克/天可显著降低发生低水平 HDL-c 的风险,但会增加发生高水平胆固醇的风险。
在餐后时期,酒精会导致甘油三酯升高,并抑制游离脂肪酸 (FFA) 的氧化 。重要的是要强调,对于患有冠心病的个体,餐后高甘油三酯血症更大、持续时间更长。高甘油三酯血症或 FFA 增加与正常个体和胰岛素抵抗者的内皮血管舒张减少有关。
扩展阅读:
高血压
酒精摄入会以剂量依赖性反应升高动脉压
每天摄入超过两次的剂量是最常见的可逆性高血压原因之一 。肾素-血管紧张素系统可能参与了酒精诱发高血压的机制。
一项研究表明,急性酒精中毒改变了肾素-醛固酮系统,使人体具有正常的氢和钠平衡。血浆肾素的增加可能是由于乙醇利尿或乙醇对醛固酮分泌的抑制作用引起的脱水。渗透压、动脉压和心脏频率没有发现显著变化。后来,证实适度饮酒时肾素活性会急剧增加,从而引起液体和电解质平衡以及动脉血压的变化。
少量和适度饮酒的影响可能因性别而异
文献对这个问题的描述并不一致。在一项由女性健康研究对 28,848 名女性开展的前瞻性研究和由医生健康研究开展的另一项对 13,455 名女性开展的前瞻性研究中,少量和适度饮酒降低了女性患高血压的风险,并增加了男性患高血压的风险。
酒精成为高血压危险因素的阈值在女性中等于或大于每天 4 剂,而男性的中等水平等于或大于每天 1 剂。 然而,一些研究在考虑男性和女性的动脉血压对酒精的敏感性是否不同时存在争议。
饮酒推荐量因体重而异
由于习惯性饮酒不同,动脉血压升高在低体重个体中比在高体重个体中更为显著。因此,低体重女性预防高血压的推荐饮酒限度必须低于高体重女性。
对于重度饮酒者而言,少喝可以预防治疗高血压
在没有其他心血管疾病的健康男性和女性中调查了饮酒和当前饮酒标准与高血压风险之间的关联。与节制的人相比,那些饮酒且饮酒量很大的人患高血压的风险更高。
重度饮酒者酒精摄入量的减少显著降低了动脉收缩压和舒张压。因此,必须推荐减少饮酒作为生活方式调整措施,以预防和治疗重度饮酒者的高血压。
扩展阅读:认识肠道微生物及其与高血压的关系
以上是酒精对相关疾病的影响。长期大量饮酒后,人体对酒精容易产生依赖性,出现无法自主控制饮酒行为,也就是戒不掉、戒断症状等现象,我们通常说酒精成瘾。他们需要往往更多的酒精来获得同样的愉悦感。接下来章节,我们来看一下酒精成瘾的相关因素。
肠道和大脑是两个器官,它们在解剖学上相距甚远,但在其他方面却如此接近。我们过去的文章写过,肠道微生物组和大脑之间的代谢和神经串扰对大脑功能、情绪和行为具有重要意义。
详见:
在过去十年中,多项研究表明,全身性炎症与精神疾病(包括抑郁症和自闭症)之间存在关联。然而,全身炎症与酒精成瘾、抑郁症和自闭症等精神疾病之间相互作用的机制尚不完全清楚,肠道菌群可能是一个很好的研究目标。
全身性炎症和酒精成瘾的一个可能机制是肠道细菌产物激活外周血单核细胞,诱导细胞因子进入血流,在酒精依赖者中引起低度全身性炎症 。
肠道炎症还可以将内毒素和细胞因子传播到血液中,在那里它们可以进入中枢神经系统 (CNS),引起神经炎症。
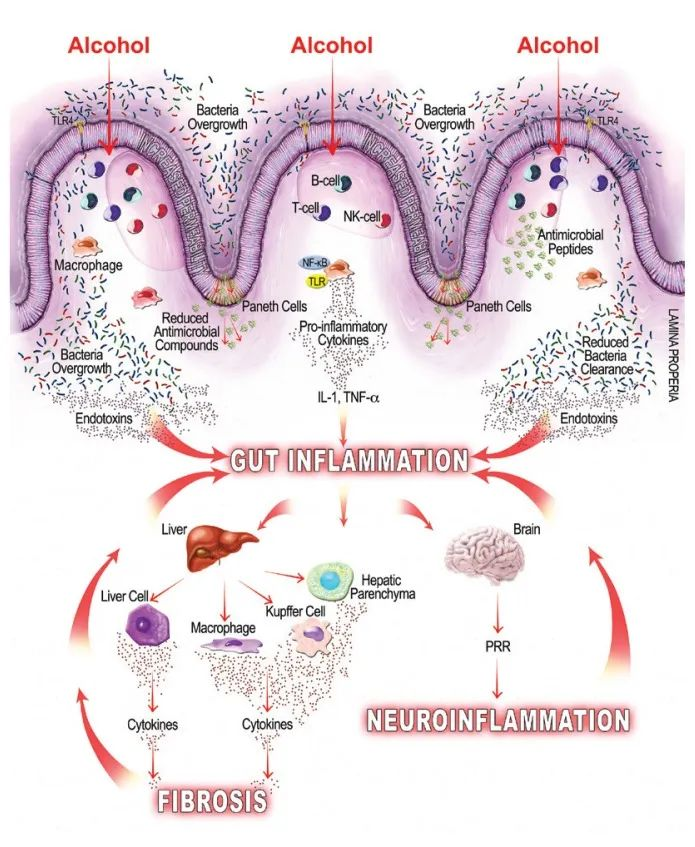
酒精成瘾与十二指肠的吸收障碍有关,导致营养不良和硫胺素的肝脏储存受损。
酒精成瘾与其他精神疾病高度相关,包括重度抑郁症、双相情感障碍以及焦虑症。重度抑郁症等情绪障碍通常先于酒瘾发作;例如,有人使用酒精来应对情绪低落。
酒精成瘾的严重程度与其渴望、认知功能障碍、焦虑和抑郁症状的强度相关
正如我们上面提到的,全身炎症可能在酒精成瘾的发展中起重要作用;肠道和肝脏的肠屏障功能障碍和炎症可能导致外周炎症并引起脑部炎症,从而诱发小胶质细胞或星形胶质细胞等脑细胞的炎症。
疾病行为理论可能将全身性炎症与酒精成瘾和情绪障碍联系起来。该理论支持外周炎症,如肠漏症,激活免疫系统并产生可到达大脑的细胞因子,导致发烧、疲劳、疲倦、无法集中注意力和退出社交;当上述行为持续存在时,可能会出现抑郁症状。
越来越多的研究将肠道微生物组的组成和功能与物质使用障碍 (SUD) 联系起来。
肠脑轴和物质使用障碍(SUD)
SUD 的特征是:尽管知道会对精神、身体和社会造成负面影响,但仍对某种物质(例如,酒精、阿片类药物和/或其他药物)长期依赖。
它们具有社会经济、生物化学、遗传以及越来越多的微生物学基础。众所周知,大脑是调节成瘾参数的重要器官,然而,通过微生物角度研究成瘾提供了一种思考:与身体相关的其他因素如何与大脑携手合作,以调解获得滥用药物的动机的新方法。
肠道和大脑通过双向、生化和神经高速公路(肠-脑轴)进行交流。肠上皮细胞下方的神经末梢接收来自肠道微生物群的代谢信号,这可能会影响行为,例如压力或焦虑。
除了与中枢神经系统发育和大脑功能有关的其他代谢物,如短链脂肪酸,肠道微生物还有助于产生一系列与情绪、认知和奖赏相关的神经递质(例如血清素和多巴胺)。
肠脑轴
图源:BioRender
这些神经递质在 SUD 的情况下特别相关;许多滥用物质通过触发大量多巴胺进入奖励途径来劫持大脑的奖励系统。这种多巴胺泛滥带来的愉悦感最终会减弱,个人可能会反复服用该物质以再次体验这些感觉。研究表明,肠道微生物参与自然(例如食物)和人工奖励(包括药物)的奖励感知,这表明 SUD 的发展/进展与肠道微生物组组成之间存在联系。
事实上,滥用酒精或药物与微生物组组成的变化有关。尽管这些改变的具体情况因物质而异,但与“健康”相关的微生物通常会减少,而具有促炎作用的微生物会增加,例如变形杆菌。这些变化伴随着关键微生物代谢物(如短链脂肪酸)的减少,具有各种全身和局部效应(例如,肠道屏障完整性的破坏)。
通常,SUD 的特征是肠道炎症增加,部分原因是这种渗漏的肠道屏障允许微生物及其产物与底层免疫细胞相互作用。激活后,这些免疫细胞会产生细胞因子,这些细胞因子不仅会引发局部炎症,还会进入循环并穿过血脑屏障。由此产生的神经炎症会改变神经元活动,包括在大脑的奖励通路内,并可能影响对物质本身的反应和耐受性。
管理物质使用障碍——肠道微生物
治疗 SUD 的策略因人和物质而异,但可能涉及药物(如阿片类拮抗剂)、咨询和行为护理。然而,这些策略可能并不总是奏效,并且可能会复发。目前药物成瘾治疗干预的成功率很低,大约40-60% 接受治疗的人最终会复发并重新使用滥用药物。
鉴于肠道微生物群和 SUD 之间出现的交叉点,发现用某些细菌补充肠道微生物群,它们的发酵产物(如短链脂肪酸)可能会减少滥用物质的影响。
例如,一项研究发现富含双歧杆菌的益生菌和Lactobacillaeae 可逆转小鼠对吗啡的耐受性。
粪便微生物群移植 (FMT) 也可能是一种选择,或许未来可以用于干预酒精成瘾或使用障碍。一项 1 期临床试验表明,与安慰剂组相比,接受富含毛螺菌科和瘤胃球菌科 FMT 的酒精使用障碍患者在 15 天后 对酒精的渴望有所减少(分别减少 90% 和 30%)。在吗啡依赖小鼠中,FMT减轻了戒断症状由阿片拮抗剂触发。由于阿片类药物耐受性容易导致剂量增加和用药过量,这些发现表明微生物可以延长药物的疗效。
以上表明肠道微生物组的未来及其对健康和福祉的影响有很大的应用,尤其是与 SUD 相关的情况。这是一个有前景的领域。
目前,酒精摄入过量的治疗干预措施主要包括药物治疗、心理治疗、社会支持等方面。以下是一些应对过度饮酒的可行性计划:
这里再介绍一些关于过量饮酒的饮食干预。
1. 豆腐
豆腐中所含的半脱氨酸是一种氨基酸,其重要性在于能解除乙醇的毒性,食用后能促进酒中乙醇的排出,从而达到解酒的目的。
2. 香蕉
香蕉还有解酒作用,因为香蕉中含有丰富的果糖,进入人体后可以稀释酒精,所以可以解酒。

3. 糖水
适量白糖和开水混合,甜度视醉度而定,稍凉片刻即可饮用。糖分进入人体后,会增加体内血糖浓度,降低血液中酒精浓度,加速体内酒精的排出,从而达到醒酒的目的。
4. 蜂蜜水
其实酒后喝点蜂蜜水可以有效减轻酒后头痛的症状,蜂蜜可以促进人体对酒精的吸收从而减轻酒后头痛的症状,此外,蜂蜜还有镇静催眠的作用. 多吃蜂蜜对皮肤和胃都有好处。

5.葛根水
葛根泡水喝,不管是喝前还是喝后,都有很好的效果。饮酒前先喝葛根水,可预防酒精对肝脏的损害。酒后饮用可起到醒酒作用。
6.番茄
番茄中的果糖、葡萄糖和维生素对肝脏和心脏都有保健作用,而且果糖还是解酒醒酒的好味道。酒后吃几个西红柿,可使头晕逐渐消失。
7.红薯
将生红薯磨碎,加入适量白糖,搅拌均匀后服用。
8.绿豆
绿豆适量,用温水冲净,捣烂,用沸水冲净或熬汤食用。
9.甘蔗
1 根甘蔗,去皮并榨汁。
10.盐水
在开水中加少许盐,喝下醒酒。
11.柑橘皮(陈皮)
将陈皮烘熟,研末,加食盐1.5克煮汤。
12.白萝卜
白萝卜1公斤,捣成泥取汁,分次服用。也可以在白萝卜汁中加入适量的红糖饮用,也可以生吃萝卜。

编辑
这些用食物解酒的方法虽然看似简单,但是却能够起到解酒作用。如果你也喜欢喝酒,经常喝醉,那么学习一些有效的解酒方法就显得非常重要了。对于喜欢喝酒的朋友而言,为了整体健康,请根据自身情况适度饮酒,尽可能避免过量饮酒。
总的来说,适量酒精可能给人体带来好处,尤其对自身免疫性疾病具有保护作用。低剂量酒精可能通过增加Akk菌等保护性肠道微生物,并有助于增加乙酸盐、多不饱和脂肪酸等,间接产生积极影响。
而高剂量酒精则可能带来不利影响,破坏肠道屏障的稳定性,增加肠道通透性,导致微生物成分进入循环系统,引发肝脏和其他器官的炎症反应;并可能导致肠道微生态失调、肠道菌群产物、脂多糖增加;导致单核细胞、T 细胞、细胞因子、IgG 水平以及 B 细胞减少;进而影响酒精性肝病、肥胖、胃肠道疾病、心血管疾病等发生和发展。
此外,饮酒还会影响肠道微生物组影响社交行为和精神障碍。因此,保持健康的肠道微生物组对于预防和治疗与饮酒相关的疾病具有重要意义。
未来的研究应该进一步探讨肠道菌群与酒精代谢和酒精成瘾之间的因果关系,肠道菌群的调节可能成为预防和治疗酒精成瘾的新靶点。
主要参考文献:
Jew MH, Hsu CL. Alcohol, the gut microbiome, and liver disease. J Gastroenterol Hepatol. 2023 Apr 25. doi: 10.1111/jgh.16199. Epub ahead of print. PMID: 37096652.
Meroni M, Longo M, Dongiovanni P. Alcohol or Gut Microbiota: Who Is the Guilty? Int J Mol Sci. 2019 Sep 14;20(18):4568.
Caslin B, Mohler K, Thiagarajan S, Melamed E. Alcohol as friend or foe in autoimmune diseases: a role for gut microbiome? Gut Microbes. 2021 Jan-Dec;13(1):1916278.
Zugravu CA, Medar C, Manolescu LSC, Constantin C. Beer and Microbiota: Pathways for a Positive and Healthy Interaction. Nutrients. 2023 Feb 7;15(4):844.
Engen PA, Green SJ, Voigt RM, Forsyth CB, Keshavarzian A. The Gastrointestinal Microbiome: Alcohol Effects on the Composition of Intestinal Microbiota. Alcohol Res. 2015;37(2):223-36.
González-Zancada N, Redondo-Useros N, Díaz LE, Gómez-Martínez S, Marcos A, Nova E. Association of Moderate Beer Consumption with the Gut Microbiota and SCFA of Healthy Adults. Molecules. 2020 Oct 17;25(20):4772
Crews FT, Sarkar DK, Qin L, Zou J, Boyadjieva N, Vetreno RP. Neuroimmune Function and the Consequences of Alcohol Exposure. Alcohol Res. 2015;37(2):331-41, 344-51.
González-Zancada N, Redondo-Useros N, Díaz LE, Gómez-Martínez S, Marcos A, Nova E. Association of Moderate Beer Consumption with the Gut Microbiota and SCFA of Healthy Adults. Molecules. 2020 Oct 17;25(20):4772.
Hernández-Quiroz F, Nirmalkar K, Villalobos-Flores LE, Murugesan S, Cruz-Narváez Y, Rico-Arzate E, Hoyo-Vadillo C, Chavez-Carbajal A, Pizano-Zárate ML, García-Mena J. Influence of moderate beer consumption on human gut microbiota and its impact on fasting glucose and β-cell function. Alcohol. 2020 Jun;85:77-94.
Doremus-Fitzwater TL, Deak T. Adolescent neuroimmune function and its interaction with alcohol. Int Rev Neurobiol. 2022;161:167-208.
Tirado-Kulieva VA, Hernández-Martínez E, Minchán-Velayarce HH, Pasapera-Campos SE, Luque-Vilca OM. A comprehensive review of the benefits of drinking craft beer: Role of phenolic content in health and possible potential of the alcoholic fraction. Curr Res Food Sci. 2023 Mar 4;6:100477.
Caslin B, Mohler K, Thiagarajan S, Melamed E. Alcohol as friend or foe in autoimmune diseases: a role for gut microbiome? Gut Microbes. 2021 Jan-Dec;13(1):1916278.