 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

癌症是重要的死亡原因之一,影响着全球至少数百万人。据世界卫生组织统计,发现全球范围内癌症负担正在迅速增加。
癌症的发展不仅仅是癌细胞的生长和增殖,其肿瘤微环境(TME)也与之共同进化,主要参与肿瘤的发生、发展、转移和治疗反应。
肿瘤微环境包含肿瘤细胞、肿瘤浸润免疫细胞、肿瘤相关其他细胞、细胞外基质、非细胞成分和非癌性宿主细胞,微生物群也是肿瘤微环境中的细胞成分之一,发挥着重要且不可替代的作用,因为微生物群落可以调节各种生物过程,包括细胞代谢、生理学和免疫反应等。
谷禾以前的文章曾多次讲述,肠道菌群与肿瘤尤其是胃肠道肿瘤的发生、发展密切相关。肠道微生物群可以通过调节细菌的特定生物活性代谢物来影响肠道微环境。例如短链脂肪酸(SCFA)作为肠道细菌发酵产生的典型代谢物,在肠道稳态和人体健康中发挥着关键作用。
短链脂肪酸可以调节能量代谢、增强肠道屏障并发挥抗炎作用。短链脂肪酸作为免疫功能的关键调节剂,可以调节T细胞、B细胞、巨噬细胞和其他免疫细胞。短链脂肪酸由于与G蛋白偶联受体(GPCRs)的结合或对组蛋白脱乙酰酶(HDACs)的抑制,可以影响免疫反应的信号转导途径,调节免疫相关炎症介质的释放,从而调节肿瘤免疫微环境。
近年来,短链脂肪酸对肿瘤微环境的影响被广泛研究。在结直肠癌和胰腺癌实验模型中,已证明丁酸盐可以增强CD8+ T细胞的抗肿瘤作用。此外,独特组成的微生物群可能还有助于诊断和定位恶性肿瘤,全面了解肠道微生物群及其代谢物与肿瘤微环境之间的相互作用有望成为诊断、治疗和预防肿瘤的新方法。
在本文中,我们(1)讲述了微生物群及其代谢物短链脂肪酸对肿瘤微环境和宿主免疫的影响;(2)短链脂肪酸在癌症发生、发展和治疗方面的相互作用;(3)介绍基于微生物群的癌症诊断和预后;(4)讨论了靶向微生物-短链脂肪酸轴调整肿瘤微环境以最大限度地提高癌症治疗效果的各种方法,包括粪便微生物移植、饮食调整和施用益生菌。这将为未来基于肠道菌群和肿瘤微环境的癌症靶向治疗奠定基础。
什么是肿瘤微环境?
肿瘤微环境(TME)是指肿瘤细胞及其周围的局部环境,包括周围的血管、免疫细胞、细胞外基质、细胞间信号分子等。
肿瘤细胞和肿瘤微环境之间永久的相互关系不仅为肿瘤细胞提供了生长和扩散所需的物质和信息,还显著影响肿瘤的发生、进展、转移和治疗反应。
肿瘤微环境的组成部分
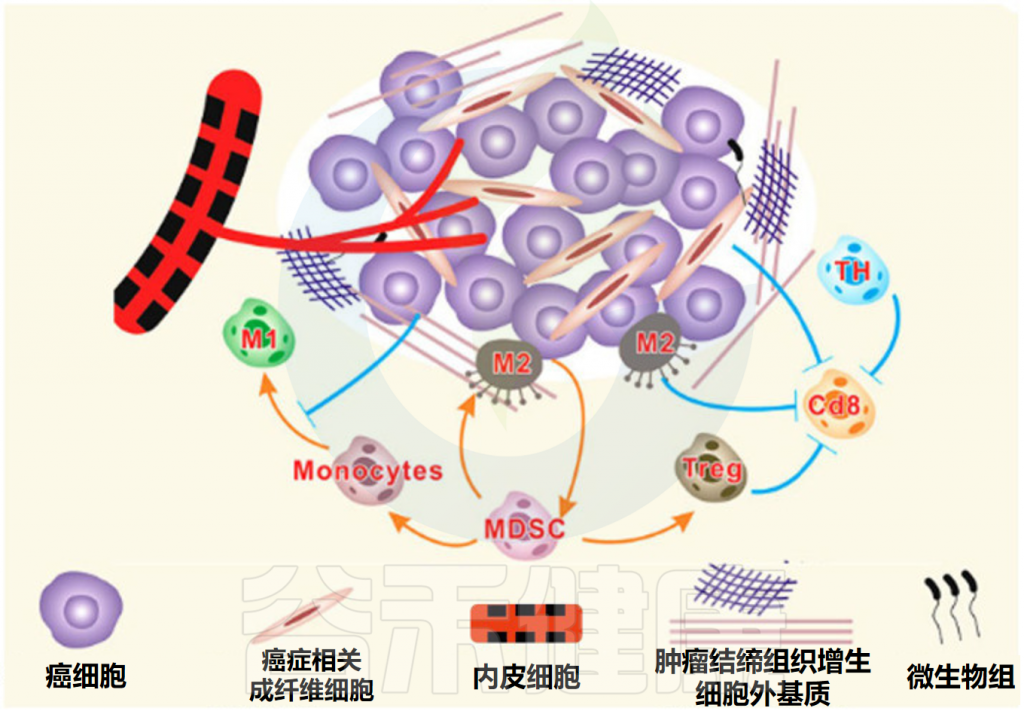
Feng P,et al.Front Microbiol.2024
▸ 前沿资料
最近,具有抗肿瘤能力的常规药物包括阿司匹林、塞来昔布、β-肾上腺素能拮抗剂、二甲双胍和他汀类药物,通过靶向肿瘤微环境成分显示出在联合治疗中的潜在用途。
★ 微生物群是肿瘤微环境的一个组成部分
肿瘤微环境是一个复杂的环境,其中微生物群被认为是一种新颖但必不可少的元素。微生物群在功能上减少肿瘤细胞代谢,例如炎症、基因毒素的产生以及具有各种特征的细菌代谢物的产生。
越来越多的证据表明,肿瘤微环境中微生物群及其代谢物之间的相互作用可以影响宿主免疫和肠上皮,最终驱动或抑制肿瘤生长。
研究报告称,肠道细菌可以调节人体免疫细胞的激活,使其迁移到肿瘤微环境来消除肿瘤细胞。此外,肠道微生物群和肿瘤微环境之间复杂的相互作用可能会使肿瘤细胞逃避免疫系统并增殖。了解这个系统将为癌症的预防、诊断和治疗带来希望。
肿瘤微环境在癌症免疫治疗中的作用
肿瘤微环境(TME)中肿瘤相关巨噬细胞(TAM)和其他免疫抑制细胞的大量积累对癌症的进展和治疗效果有重要影响。
★ 肿瘤微环境的免疫细胞影响癌症进展和治疗效果
CD163是一种标志物,主要表达在巨噬细胞表面,尤其是在肿瘤相关巨噬细胞(TAM)上。CD163阳性的TAM在肿瘤微环境中的高表达与免疫抑制环境的形成有关,这种环境可以促进肿瘤的生长和扩散,并且与病人的不良临床结果相关。
当CD163+ TAM的消耗导致免疫抑制减少,意味着通过减少这些免疫抑制性的巨噬细胞,可以增强细胞毒性T细胞(CTLs)的浸润和活性,从而有助于控制肿瘤的发展。这是当前癌症免疫治疗研究的一个重要方向,即通过调节肿瘤微环境中的免疫细胞组成来增强机体对肿瘤的免疫反应。
简而言之,CD163阳性的表达通常与肿瘤微环境中的免疫抑制状态相关,通过靶向这些细胞,可以改善免疫系统对肿瘤的攻击能力,为癌症治疗提供新的策略。
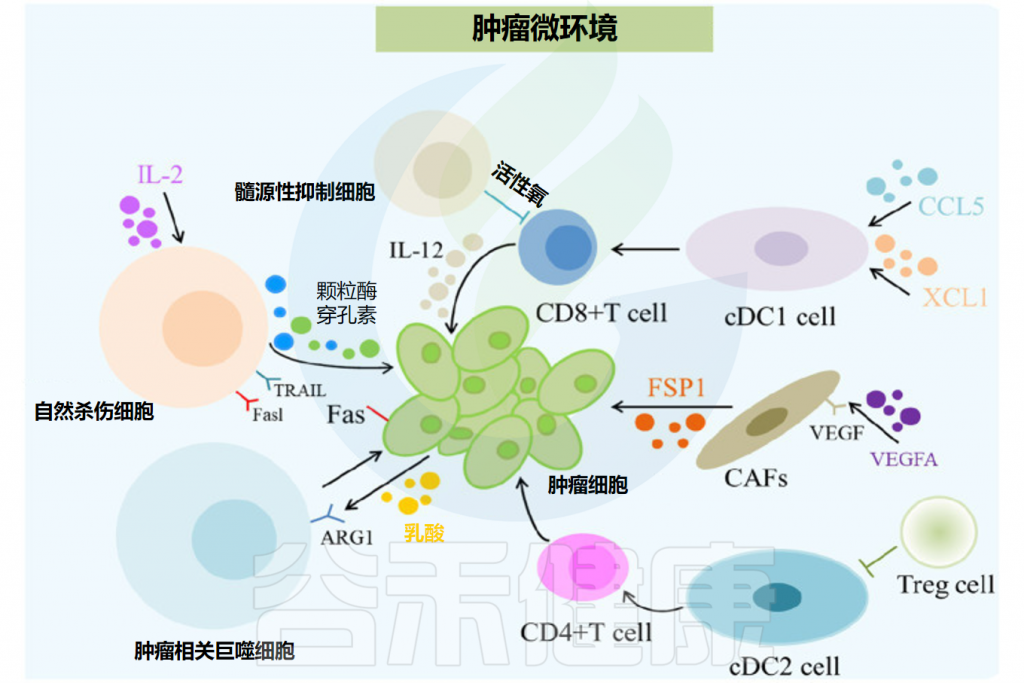
Feng P,et al.Front Microbiol.2024
★ 非细胞成分也调节癌细胞的增殖和治疗效果
肿瘤微环境的非细胞成分对于癌症进展、侵袭性和化疗耐药性也至关重要。细胞外基质的硬度促进肿瘤细胞存活和增殖,同时上调整合素信号传导。
透明质酸是一种CD44受体,在各种癌症的肿瘤微环境中含量丰富。它们的相互作用激活促癌信号通路并诱导非编码RNA种类的上调,例如miR-10b/miR-302/miR-21和lncRNA。在胰腺癌中,间质与不同的透明质酸高度反应,导致间质液压力升高,从而导致血管塌陷和化疗效果不佳。
注:使用重组透明质酸酶靶向胰腺肿瘤中的酶已被证明可以降解透明质酸并通过减少转移和提高生存率来增强治疗效果。
此外,肠道菌群的分泌成分也与肿瘤微环境有关。例如,外膜囊泡(OMV)可以将肿瘤微环境重新编程为pro-TH1模式,而代谢物(如丁酸盐和烟酸)可以介导结肠上皮中IL-18的Gpr109a依赖性诱导,抑制结肠炎和结肠癌症。
肠道微生物群对肿瘤微环境的影响
肠道微生物群对于宿主免疫系统的发育、维持和生长至关重要。肠道生态系统可以通过影响骨髓的流入、免疫环境、淋巴细胞以及炎症和代谢模式来影响局部和远处的肿瘤。
肠道微生物群参与多种细胞内信号通路的调节
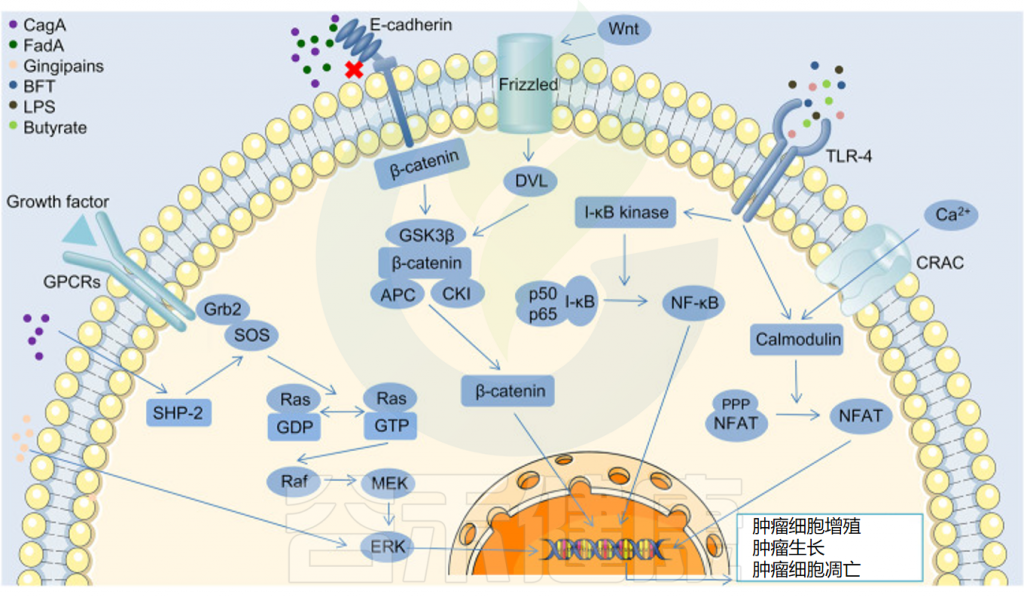
Sun J,et al.ISME J.2023
★ 肠道微生物群是肿瘤微环境的重要调节剂
肠道微生物群正在成为结直肠癌、胃癌和肝癌等各种癌症中肿瘤微环境的关键调节剂。例如,之前的一项研究报告称,具核梭杆菌(Fusobacterium nucleatum)等细菌可以通过抑制人类免疫反应来增强肿瘤生长。
此外,乳腺癌和卵巢癌与微生物群中的特定生物特征有关,例如卷曲乳杆菌(Lactobacillus crispatus)的丰度,它与癌症的发生呈负相关。
★ 肠道微生物群的代谢物影响肿瘤治疗
先前的研究发现,肠道微生物群代谢活动的产物显著影响与肥胖、血脂和能量稳态相关的宿主代谢途径。因此,揭示肠道微生物群的代谢物和亚代谢物如何影响免疫细胞并重塑肿瘤微环境可以极大地促进肿瘤治疗的发展。
肠道微生物群的代谢物进入宿主细胞并与人体免疫反应相互作用,促进各种肿瘤抑制和免疫调节分子的产生。它们还通过维持上皮屏障和肠道的完整性来抑制炎症。
肠道微生物代谢物,如短链脂肪酸和肌苷,直接或间接与肿瘤微环境相互作用,重塑它,从而影响癌症过程。短链脂肪酸有助于维持肠道稳态和调节肠道屏障功能。
肠道微生物代谢物影响抗癌免疫
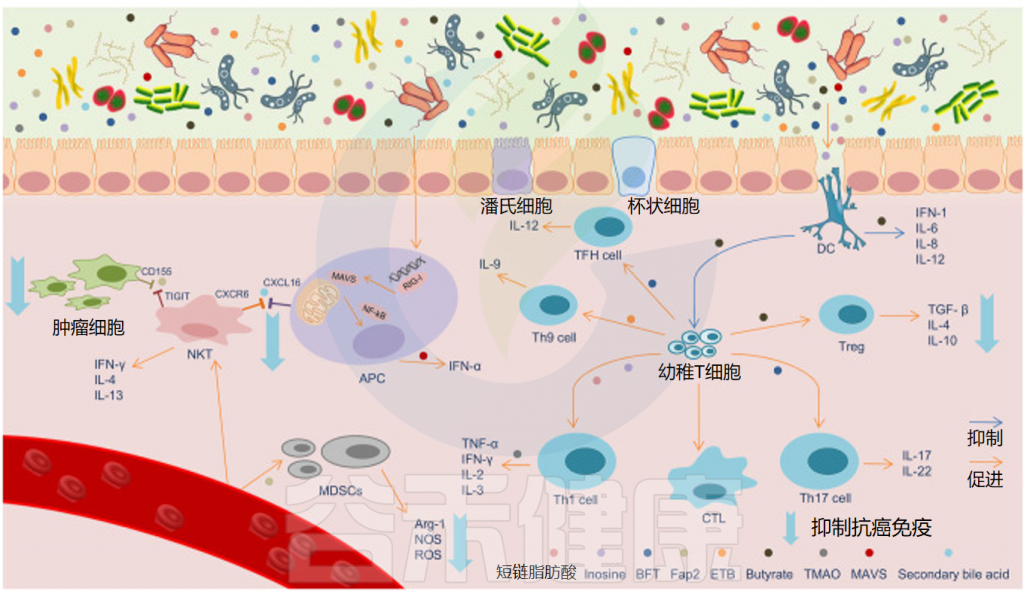
Sun J,et al.ISME J.2023
此外,一些脂肪酸和胆酸与炎症有关。丁酸盐等短链脂肪酸可由普拉梭菌(Faecalibacterium prausnitzii)产生,控制血管生成并减少促血管生成因子的表达。因此,增加丁酸盐浓度被认为可以减缓并阻止癌症的生长。
相反,脱氧胆酸和石胆酸可通过增加活性氧的产生而导致DNA损伤。最近的研究表明,肠道细菌假长双歧杆菌(B.pseudolongum)可以产生肌苷,在外源IFN-g存在的情况下驱动Th1细胞分化。
★ 影响免疫治疗的效果
此外,假长双歧杆菌(B.pseudolongum)通过与T细胞上的腺苷A2A受体相互作用,与免疫检查点治疗(例如抗CTLA-4和抗PD-L1)的反应相关。
CTLA-4和PD-L1是免疫检查点疗法的主要靶点,该疗法涉及膜结合分子,这些分子在初始刺激后会阻碍不受限制的T细胞反应。因此,癌细胞可以通过利用这种机制来逃避免疫监视。
然而,在重新激活低效T细胞的同时,免疫检查点抑制剂(ICIs)可以恢复对肿瘤抗原的反应。临床研究和临床前试验表明,肠道微生物群影响免疫检查点抑制剂的疗效,从而解释了患者对ICI反应的显著差异。因此,深入了解肠道微生物群、其代谢物和宿主免疫系统如何相互作用以重塑和调节肿瘤微环境,有望推动癌症免疫治疗的发展。
总体而言,肠道微生物群对肿瘤微环境的影响很复杂,目前尚未完全了解。然而研究表明,在控制肠道微生物以影响癌症治疗的有效性和改善患者预后方面具有潜在的应用前景。
近年来,微生物和微生物的代谢产物对宿主的影响越来越受到人们的关注。
短链脂肪酸由少于6个碳原子组成,是共生细菌通过膳食纤维在胃肠道中发酵产生的典型代谢产物,已被广泛研究。短链脂肪酸的产生是一个复杂的过程,由多种细菌在结肠中进行。在所有短链脂肪酸中,乙酸盐、丙酸盐和丁酸盐最具代表性。
短链脂肪酸对人体的基本作用
• 提供能量
当短链脂肪酸产生时,第一个功能是作为底物提供能量。大多数短链脂肪酸通过两种转运蛋白被结肠细胞吸收:单羧酸转运蛋白1(MCT-1)和钠偶联单羧酸转运蛋白1(SMCT-1)。
短链脂肪酸通过MCT-1以H+依赖性电中性方式转移,而短链脂肪酸阴离子通过SMCT-1运输。
• 调节生理反应
除了为结肠细胞提供能量外,短链脂肪酸还通过血液运输到全身的各个组织和器官,然后通过两种主要机制调节生物反应。
一方面,短链脂肪酸会降低组蛋白去乙酰化酶(HDAC)的活性或表达,从而导致组蛋白乙酰化增加。据报道,HDACs的异常激活存在于多种类型的癌症中。
另一方面,短链脂肪酸与G蛋白偶联受体(GPCR)结合,主要针对GPR41(更名为游离脂肪酸受体(FFAR)3)、GPR43(更名为FFAR2)和GPR109A,发挥相应的信号级联效应。一些研究表明GPCRs的异常表达或活性参与多种肿瘤进展。
短链脂肪酸调节炎症反应的机制
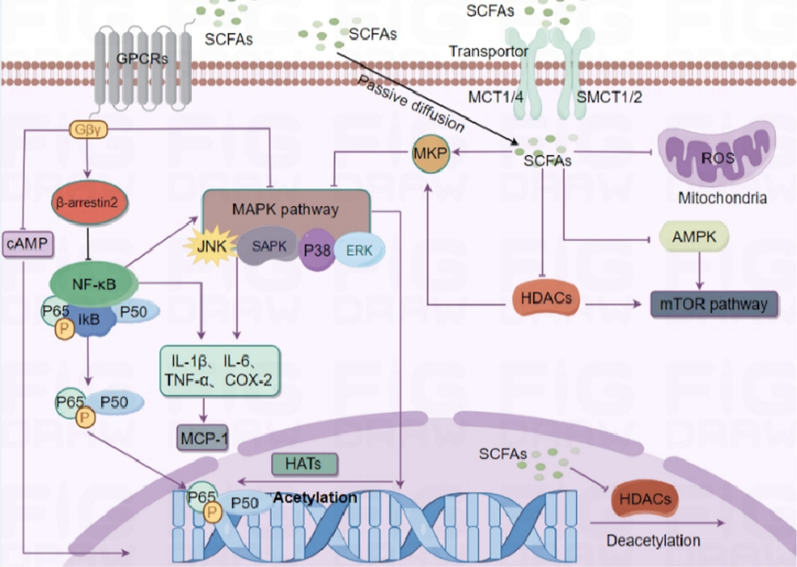
He M,et al.J Transl Med.2024
• 其他作用
既往研究总结了短链脂肪酸在调节能量代谢、保护肠道完整性、改善炎症反应等方面的作用,但短链脂肪酸对免疫系统的影响尚未引起足够的重视。一些作用罗列在下表中:


Dong Y,et al.Front Immunol.2023
短链脂肪酸对代谢稳态的影响
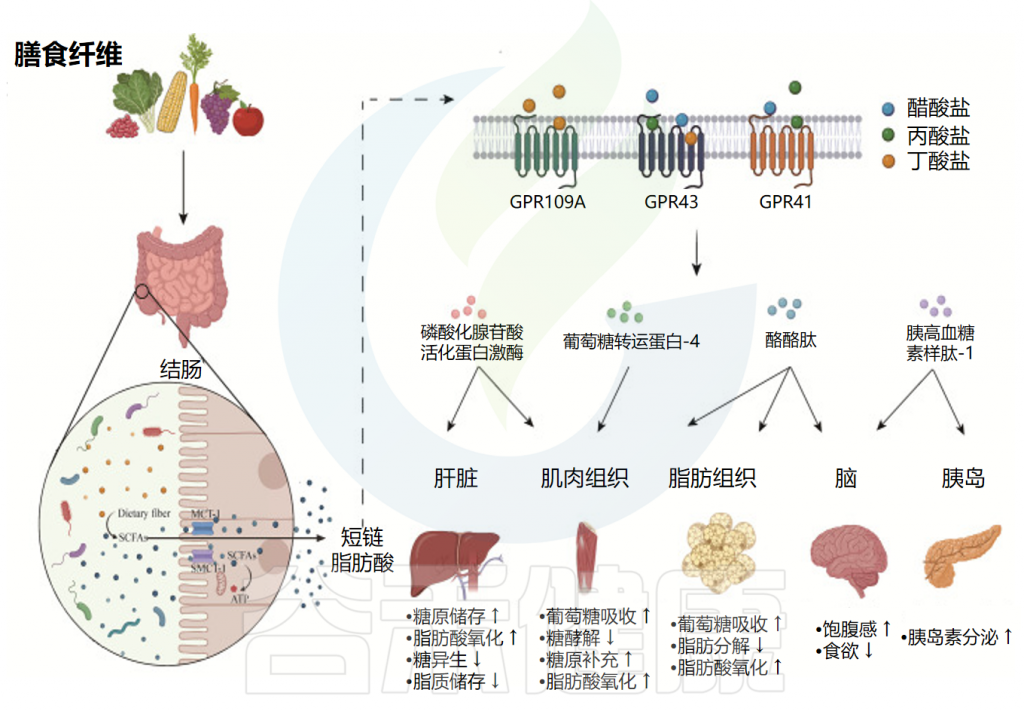
Dong Y,et al.Front Immunol.2023
在肿瘤免疫微环境中起重要作用
• 影响T细胞的分化
T细胞是肿瘤免疫微环境中的重要细胞,T细胞浸润减少或功能障碍会导致许多癌症治疗临床效果不佳。
由于幼稚T细胞在功能水平上表达时没有GPR41和GPR43,因此短链脂肪酸可以直接影响依赖于HDAC抑制剂活性的幼稚T细胞的分化。
通过这种方式,短链脂肪酸促进未成熟的CD4+ T细胞分化为不同的调节性T细胞和效应T细胞,这取决于不同的极化条件,比如细胞因子表型和免疫环境。
短链脂肪酸诱导mTOR-S6K和STAT3的激活,参与T细胞分化所需细胞因子的产生。无论极化条件如何,短链脂肪酸都会促进白细胞介素(IL)-10的表达,但只能在特定环境下促进IL-17或干扰素-γ (IFN-γ)的产生。
• 影响白细胞介素等细胞因子的含量
有趣的是,分化T细胞(例如辅助性T(Th)1细胞)中 IL-10的分泌取决于与GPR43的相互作用。此外,短链脂肪酸上调Blimp-1的表达,这与Th1细胞中IL-10的产生和T细胞功能的维持有关。
在高脂肪饮食治疗的小鼠中,IL-17和IFN-γ的水平升高,而转化生长因子-β(TGF-β)和IL-10的水平降低。这意味着T细胞向Th17和Th1细胞的分化程度较高,而向调节性T(Treg)细胞的分化程度较低,特别需要注意的是:短链脂肪酸可以扭转这种情况。
CD4+ T细胞和先天淋巴细胞中IL-22被发现可以通过短链脂肪酸进行调节。丁酸盐通过与GPR41结合增加转录因子HIF-1α和AhR的表达,同时伴随着STAT3和mTOR的激活。
同时,丁酸盐促进的HIF-1α与IL-22启动子的HRE结合涉及组蛋白乙酰化。CD4+ T细胞分化过程也受到表观遗传调控。不同的CD4+ T细胞亚群具有特定的转录因子,例如Th1细胞的T-bet、Th17细胞的RORγT和Treg细胞的FOXP3。丁酸盐通过乙酰化 H4K16增加分化的Th17细胞中RORγT的表达,但在Th17极化条件下对初始CD4+ T 细胞没有反应。
• 短链脂肪酸在抗肿瘤免疫中的其他作用
丁酸盐
低丁酸盐浓度以TGF-β1依赖性方式促进CD4+ T细胞向Foxp3+ Treg细胞分化,而高丁酸盐浓度无论在什么条件和亚群中都会诱导T-bet表达和IFN-γ释放。这似乎打破了我们对短链脂肪酸对粘膜免疫影响的传统认识。更重要的是,暴露于高浓度的短链脂肪酸,尤其是丁酸盐,可以抑制肠粘膜中CD4+ T细胞和其他CD4+ T细胞亚群的增殖和活化。这与组蛋白乙酰化和GPR43激活密切相关。
丁酸盐通过促进CD8+ T细胞作用参与抗肿瘤免疫。丁酸盐处理的细胞毒性T淋巴细胞(CTL)介导的抗肿瘤反应的促进作用依赖于一种称为ID2的转录调节因子,其水平在肿瘤微环境中的CD8+ T细胞中要高得多。丁酸通过抑制组蛋白脱乙酰酶(HDACs)的活性,诱导ID2表达并启动ID2-IL-12信号通路,从而提高奥沙利铂的化疗效果。
戊酸盐
戊酸通过抑制HDAC活性来增强CTL中IL-2、肿瘤坏死因子-α(TNF-α)、IFN-γ和其他效应分子的表达。
PVR/CD155 调节剂在恶性肿瘤中过度表达,并与具有Ig和ITIM结构域的T细胞免疫受体结合,介导免疫逃逸。
乙酸盐、丙酸盐
醋酸盐通过抑制PI3K/AKT通路抑制PVR/CD155水平,增强CD8+ T细胞的抗肿瘤能力。活化的γδ T细胞是IL-17的主要内源性来源。丙酸盐还通过抑制HDAC来抑制人γδ T细胞中IL-17、IL-22和其他细胞因子的分泌,从而防止癌症进展。
短链脂肪酸对肿瘤免疫微环境的影响
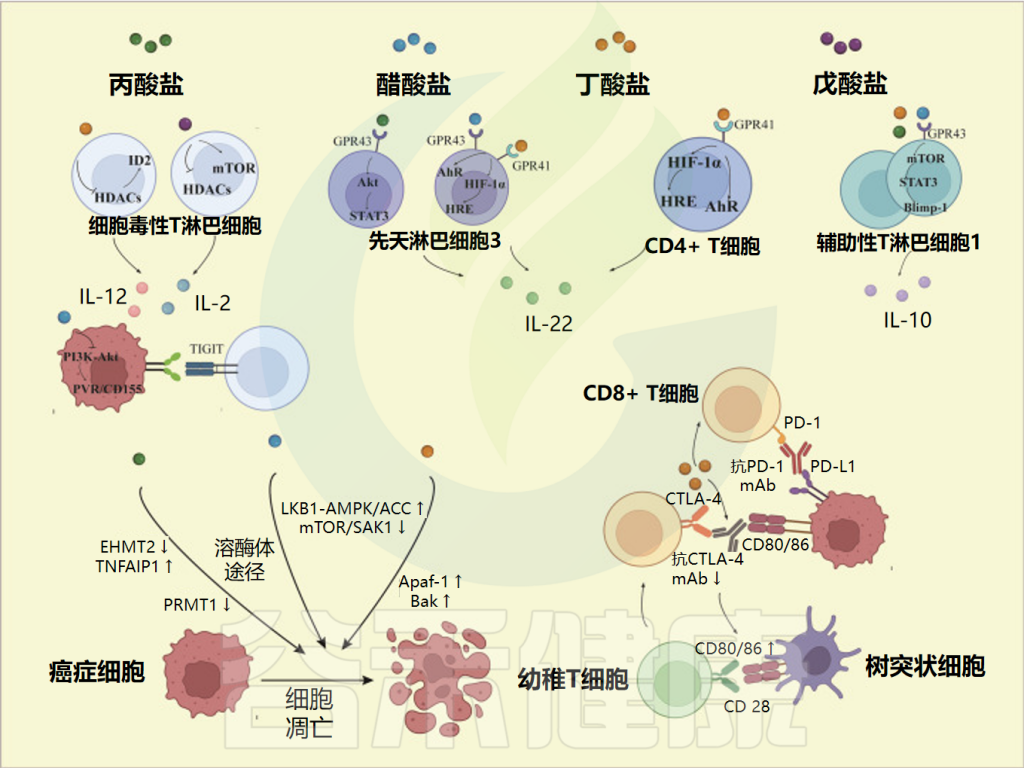
Dong Y,et al.Front Immunol.2023
密切相关的证据
实验研究和谷禾检测数据发现胃肠道肿瘤患者中短链脂肪酸和产生短链脂肪酸的细菌丰度明显较低,本节主要讲述短链脂肪酸可以通过多种机制影响胃肠道肿瘤的发展。而这也有助于未来将调节体内短链脂肪酸和肠道菌群的水平用作一种预防癌症或辅助治疗手段。
胃癌
• 短链脂肪酸可能用来评估胃癌的进展
在胃肠道化生或胃癌患者的血浆中检测到较低浓度的丙酸盐和丁酸盐。短链脂肪酸似乎可以用来评估胃癌的进展。
胃肠化生是指胃黏膜上皮转变为含有杯状细胞的肠黏膜上皮组织。肠上皮化生常见于慢性萎缩性胃炎,胃黏膜肠上皮化生属于胃的癌前病变。
此外,丁酸盐以剂量依赖性方式抑制KATO III细胞的增殖和迁移,这与其调节miRNA调控网络的作用有关。
• 影响胃癌治疗的效果
胃切除术后服用丁酸梭菌(C.butyricum)可以增加短链脂肪酸浓度,增强免疫力,减轻炎症,预防术后并发症。
体内实验证明,醋酸盐诱导胃癌细胞凋亡,随后体外实验证明氧化应激发挥了重要作用。大量摄入醋酸盐会增加胃癌细胞中活性氧的产生和MCT1的表达。
活性氧的过度表达上调了HCP1,两者均导致胃癌细胞对卟啉的摄入量增加。作为光动力疗法的光敏剂,卟啉的过度吸收增强了疗效。而作为HDAC抑制剂,丁酸盐修饰肿瘤抑制基因Per1和Per2并诱导它们在KATO III和NCI-N87中的表达。
与短链脂肪酸联合使用的传统疗法似乎具有更好的效果和更低的毒性。在裸鼠异种移植肿瘤模型中,丁酸盐-顺铂治疗抑制胃癌细胞的生长、迁移和侵袭,并依靠线粒体凋亡途径加速细胞凋亡。
此外,单独丁酸可以通过线粒体途径诱导胃癌细胞凋亡,这已在人细胞系BGC-823和SGC-7901中得到证实。
结直肠癌
先前的研究表明,结直肠癌高危人群中乙酸盐、丙酸盐和丁酸盐的浓度显著降低,并且短链脂肪酸水平较低的个体结直肠癌的发病率高于健康个体。各种短链脂肪酸均表现出抗癌行为。
注:与单独治疗相比,这些化合物具有叠加效应。
1
乙酸盐
•常规浓度下乙酸会增强癌细胞的凋亡并减少增殖
乙酸可以增强癌细胞的凋亡并减少增殖,已在不同的结直肠癌细胞系中得到证实,因此它已成为结直肠癌治疗的关键因素。
在结直肠癌患者中,短链脂肪酸减少,乙酸盐代谢转化为乙酰辅酶A。过去的研究表明,乙酸盐介导的细胞凋亡依赖于部分溶酶体膜透化触发的溶酶体途径。然而,溶酶体依赖性选择性死亡途径中随后释放的组织蛋白酶D降低了乙酸盐的敏感性。因此,组织蛋白酶D抑制剂与乙酸盐联合可能比单独使用乙酸盐效果更佳。
•注意:在缺乏氧气和葡萄糖的情况下乙酸盐可能导致癌细胞增加
然而,在没有氧气的情况下,乙酸盐会增加癌细胞的增殖,这依赖于ACSS2的上调和HIF-2的激活。
同时,在葡萄糖缺乏的情况下,乙酸盐通过激活 ACSS2/HIF-2 信号通路促进HCT-116(结肠癌细胞)和HT-29(结肠癌细胞)衍生肿瘤的生长。
因此,乙酸盐的抗癌作用可以根据环境和浓度的变化而改变。
此外,乙酸盐作为PI3K/AKT信号驱动的免疫检查点配体PVR/CD155的调节剂,可以增强肿瘤微环境中CD8+ T细胞的功能反应,促进IFN-γ的产生,有望成为促进肿瘤免疫的相关药物。基于上述讨论,免疫检查点抑制剂(ICIs)的功效可能受益于乙酸盐。
2
丙酸盐
研究发现结直肠癌组织中丙酸盐含量降低,并且向SW480细胞(人结肠腺癌细胞)中添加丙酸盐显著抑制癌细胞生长。
•丙酸盐调节免疫刺激来消灭癌细胞
短链脂肪酸调节免疫刺激和抑制配体,并参与免疫细胞介导的杀伤。丙酸盐诱导的NKG2D配体MICA/B的上调既不依赖于HDACs的抑制,也不依赖于GPR41/GPR43受体的组合,而是依赖于线粒体活性,而丁酸盐则取决于其HDACs抑制剂活性。丙酸盐的这种作用与介导肿瘤抑制蛋白p21表达的PEPCK-M酶和mTORC2/PDK1/AKT通路密切相关。
•丙酸盐通过调节表观遗传导致癌细胞凋亡
除了免疫调节之外,表观遗传调节也是短链脂肪酸发挥抗癌作用的一个有前景的靶点。丙酸盐通过阻止p70 S6激酶磷酸化导致PRMT1表达下调,从而导致结直肠癌细胞选择性死亡。
此外,丙酸盐诱导HECTD2上调,导致EHMT2降解,从而促进下游TNFAIP1的表达并最终促进癌细胞凋亡。
在丙酸盐介导的抗癌治疗中,表观遗传修饰是不可忽视的。然而,最新的孟德尔随机化分析发现,没有强有力的证据证明粪便中丙酸盐浓度与结直肠癌风险之间的相关性。可能有必要全面检测短链脂肪酸及其产生细菌。
3
丁酸盐
研究发现,丁酸盐抑制结直肠癌细胞的增殖,但滋养正常结肠细胞的生长。
•丁酸盐相比其他短链脂肪酸对癌细胞具有更强的抑制作用
与其他短链脂肪酸相比,丁酸盐对结直肠癌细胞系具有更强的抑制作用。
一方面,丁酸可以抑制促炎介质TNF-α、IL-1β、IL-6、IL-8,上调抗炎因子IL-10;另一方面,丁酸可以通过促进CD8+ T细胞发挥作用来促进抗肿瘤免疫。
此外,丁酸盐通过促进上皮细胞增殖、增加粘液层和改善紧密连接来维持肠道屏障的完整性。
在HCT 116细胞(人结肠癌细胞)中,丁酸介导的细胞凋亡与p300-Wnt信号传导密不可分。其中,致癌Wnt信号基因表达模式下的结肠癌细胞比受体介导的Wnt信号基因表达模式下对丁酸盐更敏感。
•丁酸盐影响结直肠癌细胞周期从而促进凋亡
结直肠癌中肠道微生物群的结构和稳定性发生显著改变,并与其进展密切相关。丁酸盐的施用改善了微生态紊乱,反映在病原体减少、厚壁菌门与拟杆菌门的比例减少以及益生菌丰度增加。
与乙酸盐和丙酸盐相比,丁酸盐对结直肠癌细胞周期至关重要的调节网络具有更强的影响。丁酸调节癌症相关miRNA的表达,其中miR-139和miR-542是众所周知的代表。具体来说,它们作为丁酸盐的协作对象来调节细胞周期中的EIF4G2和BIRC5基因。
丁酸盐调节c-Myc/p21通路,诱导细胞周期停滞在G2期,其中包含27个凋亡相关基因。此外,丁酸盐在G1期触发细胞周期阻滞,需要复杂的lncRNA-miRNA-mRNA调控网络。
补充丁酸盐可逆转CSE1L的过度表达,并似乎与p53表现出协同作用,最终将癌细胞抑制在G1和G2/M期。
同时,丁酸诱导的p21和γ-H2AX增加以及细胞周期蛋白B1减少导致细胞周期停滞在 G2/M 期。
•丁酸盐抑制癌细胞的迁移
不仅如此,丁酸盐还通过上调miR-200c并抑制其直接靶点BMI-1对癌细胞迁移产生抑制作用。
BMI-1是诱导依赖于AKT/GSK-3β/snail通路的上皮间质转化(EMT)驱动癌症转移的重要调节因子,丁酸盐阻止了BMI-1的作用。
丁酸盐处理还降低了结直肠癌细胞而非正常结肠细胞中Trx-1的表达。研究证明,Trx-1与S100P的相互作用通过AKT介导的S100A4上调促进EMT。通过施用丁酸盐,类器官证明细胞外基质-整合素/PI3K-Akt 轴参与结直肠癌细胞形态变化和细胞凋亡。
丁酸盐阻止结直肠癌细胞的迁移和侵袭,本质上是由于组蛋白脱乙酰酶(HDAC3)的抑制,从而阻断了AKT1和ERK1/2的激活。
•丁酸盐还改变表观遗传和代谢发挥抗癌特性
与其他短链脂肪酸不同,丁酸盐逆转前列腺素EP4受体的过度表达和环氧合酶2的产生,以减少从正常细胞到癌症的表型改变。
此外,丁酸盐通过激活LKB1-AMPK/ACC信号通路和降解β-catenin诱导结直肠癌细胞自噬。
丁酸盐致力于改变结直肠癌细胞的表观遗传学和代谢谱,发挥其抗癌特性。通过调节KEAP1的DNA甲基化,丁酸阻断NRF2-ARE信号传导,从而增强其抗癌潜力。
线粒体代谢和相关代谢物的变化参与了丁酸盐对表观遗传学的调节。丁酸激活三羧酸循环相关酶IDH1和PDH,从而下游产物α-KG水平升高。
作为一种信号分子,α-KG影响与细胞凋亡相关的MSH2和MLH1去甲基化。同时,α-KG减弱DNA和组蛋白H3K4me3的甲基化,导致结直肠癌中Wnt信号通路受到抑制。
丁酸盐通过促进PKM2的四聚化和去磷酸化来诱导有氧糖酵解的抑制,从而逆转癌细胞中的代谢优势。对于结直肠癌细胞,丁酸盐引起的代谢变化反映在促进氧化代谢而不是糖酵解。
此外,铁死亡是铁依赖性细胞程序性死亡的方式,丁酸盐通过CD44/SLC7A11信号通路诱导结直肠癌细胞中的铁死亡。
肝细胞癌
肝细胞癌是一种发生于肝脏的恶性肿瘤,它是全球范围内最常见的癌症类型之一。作为一个重要的危险因素,乙型肝炎病毒(HBV)会促进肝细胞癌(HCC)的进展。
• 丁酸盐促进肝癌细胞的凋亡和自噬
丁酸盐通过抑制SIRT-1从而促进p53乙酰化,显著抑制人肝癌细胞(Hep G2.2.15)的增殖和驻留乙型肝炎病毒的复制。
HBx是乙型肝炎病毒(HBV)编码的致癌蛋白,可能通过多种方式导致肝细胞癌的加速发生和发展。随着HBx相关途径的下调,短链脂肪酸导致肿瘤抑制因子DAB2的表达增加,从而延缓肝细胞癌的进展。
先前的研究表明,丁酸盐通过增加活性氧的产生来抑制AKT/mTOR通路,从而促进人肝癌细胞的凋亡和自噬。
• 短链脂肪酸延缓了肝癌进展
通过粪便罗伊氏乳杆菌(Lactobacillus reuteri)移植进行干预的肝细胞癌小鼠似乎也可以延缓癌症进展。相关机制是罗伊氏乳杆菌代谢产生的乙酸盐通过抑制HDAC和诱导Sox乙酰化,抑制先天淋巴细胞的效应分子IL-17A的产生。
另外,PD-1抑制剂与短链脂肪酸联合使用,在肝癌小鼠中显示出增强的抗肿瘤作用。Lachnospiracea具有减少肝纤维化的作用,部分原因是短链脂肪酸介导的。
已证明口服短链脂肪酸可以抑制万古霉素治疗的小鼠纤维化。
• 增强常规化疗药物的效果
此外,丙酸盐可以增强常规化疗药物在肝细胞癌中的化疗效果。研究表明,丙酸盐通过激活GPR41诱导TNF-α表达,并增加顺铂诱导的caspase-3激活,从而介导肝癌细胞凋亡。
肝细胞癌患者体内丁酸产生菌16s RNA表达降低,补充丁酸可促进肝癌细胞凋亡并抑制增殖。更重要的是,丁酸盐可以增强索拉非尼的治疗潜力,通过减少HK2对c-myc信号传导的依赖,丁酸盐可以抵抗糖酵解,从而增强索拉非尼的功效。
对于接受仑伐替尼治疗的肝细胞癌患者,无腹泻等不良反应的患者丁酸代谢相对丰富且活跃。最新研究表明,补充乙酸盐可以诱导人肝癌细胞中NAT2的水平,类似于葡萄糖和胰岛素,从而导致代谢相关基因的变化。
不仅如此,丁酸盐在胆管癌细胞中也表现出同样的抗癌作用。丁酸盐和HDAC6抑制剂在防止增殖、迁移和上皮间质转化方面具有协同作用。
• 短链脂肪酸改善一些癌前病变症状
酒精性脂肪肝病(AFLD)和非酒精性脂肪肝病(NAFLD)可进展为肝硬化,最终可能发展为肝癌。丁酸盐抑制gasdermin D 介导的细胞焦亡,改善肠道屏障破坏和内毒素血症,从而减轻AFLD中的肝脏脂肪变性和炎症。
此外,丁酸盐通过LKB1-AMPK-Insig信号通路的调节诱导肝脂质谱的改变并减轻肝脂肪变性来治疗 NAFLD 。
总而言之,短链脂肪酸限制了肝细胞癌前阶段的进展。
胰腺癌
研究发现,与对照组相比,胰腺癌患者的丙酸盐和丁酸盐水平降低,粪便微生物群的组成发生改变。
• 短链脂肪酸增强了对肿瘤细胞的杀伤能力
短链脂肪酸以肿瘤特异性免疫细胞为目标,无论单独使用还是与其他肿瘤疗法联合使用,都显示出强大的抗癌作用。
研究表明,与组蛋白脱乙酰酶(HDACs)抑制相关,丁酸和戊酸上调IL-2、CD25和mTOR的产生,这些物质参与T细胞激活的调节。通过触发增强的效应分子,丁酸盐和戊酸盐还增加了细胞毒性T淋巴细胞的肿瘤杀伤能力。
短链脂肪酸在过继性免疫治疗方面也显示出良好的前景。用丁酸盐或戊酸盐预处理的细胞在胰腺癌小鼠模型中显示出更好的治疗效果。
• 短链脂肪酸干扰胰腺癌的进展并减轻相关损伤
另一项研究表明,丁酸盐通过逆转胰腺腺癌患者的CD11b细胞的免疫抑制功能并增强CD8+ T细胞的免疫功能来延缓癌症的发展。
短链脂肪酸的影响不仅限于肿瘤微环境,还延伸至肿瘤相关基因。丁酸盐处理后,在AsPC-1细胞(人转移胰腺腺癌细胞)中可以观察到通过抑制组蛋白脱乙酰酶(HDACs)活性介导的p16INK4a、p14ARF和p15INK4b的上调。
在BxPC-3(人原位胰腺癌细胞)和PANC-1(胰腺癌细胞)细胞系中,丁酸盐单独或与吉西他滨联合使用可抑制增殖并诱导细胞凋亡。特别是联合用药减轻了吉西他滨引起的胃肠粘膜、肝、肾损伤。由于HDAC的抑制作用,丁酸盐还调节肿瘤微环境相关成分。
拓展:基于微生物群的癌症诊断和预后
癌症通常是在通过触诊或成像技术识别肿块后进行诊断,然后进行活检以确认细胞恶性肿瘤。断层扫描检测技术,包括PET-CT、MRI和CT,可以有效地识别体内的宏观病变。
基于微生物的癌症诊断
此外,研究已经证实,肠道微生物群动态可能有助于诊断和定位恶性肿瘤,例如根据胃肠道来源的解没食子链球菌菌血症。大多数基于微生物的癌症诊断侧重于对呼吸消化道内的肿瘤进行测序,包括结直肠癌、胰腺癌和肺癌。
有人提出,不同的癌症类型可能在呼吸消化道外具有独特组成的微生物群。一项研究了30多种癌症的瘤内微生物群,应用基于血液的诊断,并提供七种不同癌症中微生物瘤内空间分布和细胞内定位的视觉证据。
2017年的一项研究提出了结直肠癌粪便微生物组的宏基因组分析,以识别和验证不同种族群体中的细菌生物标志物。这项研究纳入了来自中国、丹麦、法国和奥地利的结直肠癌患者和对照样本,并强调了粪便宏基因组生物标志物在早期结直肠癌诊断中的潜力。
此后,更多的研究发现,粪便微生物DNA标记可以单独或与粪便免疫化学测试结合使用,作为新的测试来筛查无症状受试者的结直肠肿瘤。
此外,收集了41名肺癌患者和40名健康志愿者的粪便样本,并使用16S rRNA基因测序分析了肠道微生物群。他们发现, 肺癌患者中的放线菌属(Actinomyces)、韦荣球菌属(Veillonella)、巨球菌属(Megasphaera)、肠球菌属(Enterococcus)和梭菌属(Clostridioides)比健康个体更丰富。他们进一步证明肠道微生物及其相关代谢物是肺癌的潜在生物标志物和治疗靶点。
检查肠道微生物群的变化及其作为胰腺癌患者生物标志物的潜力。他们比较了患有癌前病变的胰腺癌患者、非酒精性脂肪肝患者和健康对照者的微生物群,发现了与胰腺癌相关的独特肠道微生物群特征。
主要特征是梭菌科、毛螺菌科的存在,瘤胃球菌科的缺乏,以及韦荣球菌科、阿克曼氏菌和Odoribacter的过度增加。
目前,已经开发了几种基于细菌的肿瘤检测策略,包括使用将肿瘤靶向细菌的特异性与生物标志物检测的敏感性相结合的工程细菌。使用远程诱导基因开关对减毒细菌进行工程改造,释放外源报告蛋白 ZsGreen。
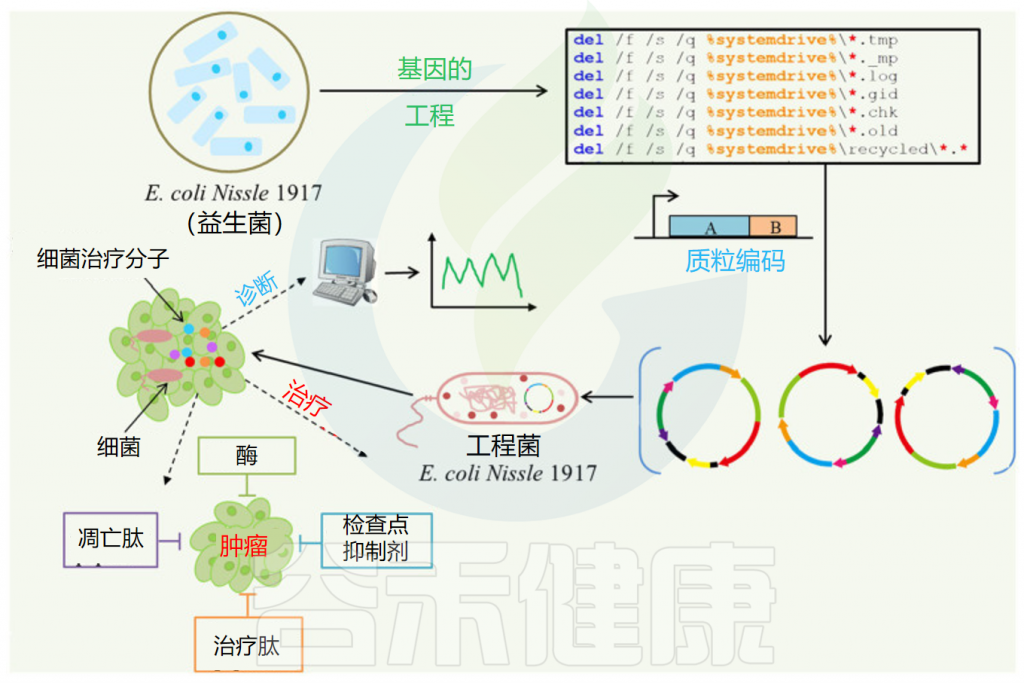
Feng P,et al.Front Microbiol.2024
体内和体外实验均表明,这些细菌可以通过对释放的ZsGreen的系统测量来识别肿瘤。尽管基于细菌的癌症诊断是一种有前景的策略,但它面临着一些挑战,例如相对于宿主的生物量较低以及试剂或环境污染物的干扰。因此,将基于肠道微生物群的方法与传统诊断技术(包括基因组测序、qPCR、免疫组织化学和电子显微镜)相结合,可以提供更准确、更有效的癌症诊断。
基于微生物的癌症诊断已成为一个新领域,专注于根据各种癌症或不同肿瘤阶段肠道微生物群的特定生物特征来设计或开发新策略。此外,深度学习和机器学习算法能够识别表明癌症的微生物特征,这是精准医学的基础。基于微生物的癌症诊断还具有改善癌症筛查和早期检测工作的潜力,有望为各种癌症开发更准确、更有效的诊断工具,并最终改善患者的治疗结果。
肠道微生物群作为潜在预后标志物
在预后方面,许多研究表明肠道微生物群可以作为癌症的潜在预后标志物。在一项结直肠癌患者预后模型的研究中,风险模型与结直肠癌患者的免疫状态和肠道微生物群相关,并且微生物组分析显示,高风险患者中拟杆菌(Bacteroidetes)和放线菌(Actinobacteria)的相对丰度低于低风险患者。
具核梭杆菌作为结直肠癌患者的预后标志物
研究发现肠道中高水平的具核梭杆菌(Fusobacterium nucleatum)和脆弱拟杆菌(Bacteroides fragilis)与结直肠癌患者术后预后不良相关。具核梭杆菌作为结直肠癌患者预后标志物的作用已被多次证明。
例如,收集了100个结直肠癌组织和72个正常粘膜组织,并确定具核梭杆菌水平有助于预测结直肠癌患者的临床结果,发现IV期结直肠癌患者具有较高水平的具核梭杆菌。
此外,研究证明特定的肠道微生物群与接受nabuliumab治疗的肝细胞癌患者的预后相关。具体而言,普雷沃氏菌/拟杆菌比率可用作纳武单抗治疗肝细胞癌的预后预测因子;该比率越高,疗效越好。
纳武单抗(nabuliumab)是一种人类免疫球蛋白G4单克隆抗体。纳武利尤单抗主要治疗三种疾病,包括非小细胞肺癌、头颈部鳞状细胞癌、胃或胃食管连接部腺癌。
治疗胃肠道肿瘤
微生物与抗癌疗法的结合早在19世纪就开始了,当时首次尝试将灭活的链球菌注射到人体肿瘤组织中来治愈癌症。此前的研究表明,微生物制剂直接注射到肿瘤组织或口服给药,可以对肿瘤细胞产生直接的细胞毒性作用或刺激机体局部抗肿瘤免疫反应。
最近的研究发现,传统的放疗、化疗和免疫疗法可以改变患者的肠道微生物群,而菌群的组成可以深刻影响这些治疗的疗效和副作用,包括癌症复发、耐药性和对肠道菌群的附带损害。
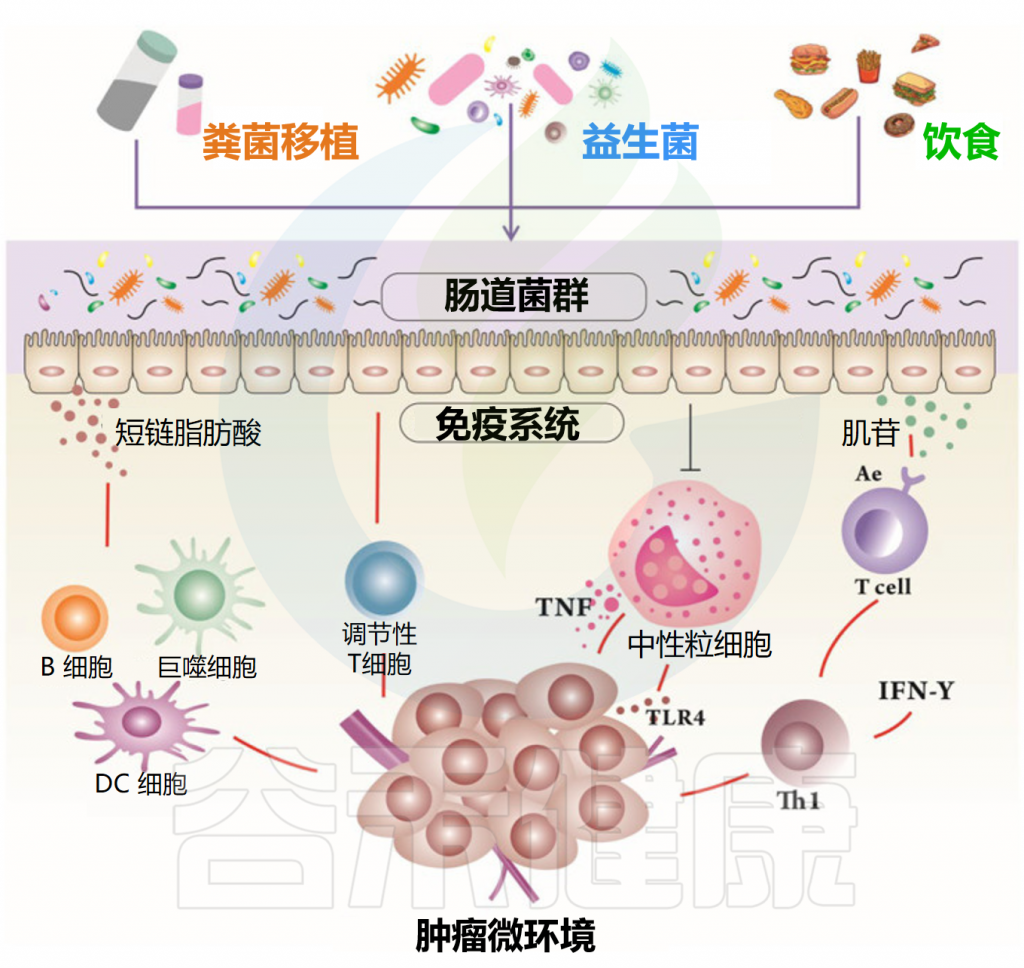
Feng P, et al.Front Microbiol.2024
施用益生菌
益生菌是一类存在于宿主体内并对宿主有益的细菌,给癌症患者服用益生菌的目的是重新激活患者受损的肠道微生物群,从而重建失败的共生微生物组的水平和功能。
益生菌在癌症辅助治疗中的作用


Sun J,et al.ISME J.2023
• 改善受损的肠道微生物群
益生菌还可以通过增加肠道微生物群的丰度、调节一些有助于产生致癌化合物的酶的活性以及改善肠道屏障来对抗胃肠道肿瘤。
23项随机对照试验表明,补充多种益生菌可改善结直肠癌患者的症状并提高生活质量,并减少传统治疗的不良反应。
• 增加短链脂肪酸的含量
增加短链脂肪酸的产量是一个关键途径。从人初乳中筛选出潜在益生菌唾液链球菌(Streptococcus salivarius),可抑制结直肠癌细胞增殖55%以上。唾液链球菌直接粘附并诱导癌细胞凋亡,促进短链脂肪酸的产生,并调节活化的B和T淋巴细胞。
丁酸梭菌(C.butyricum)依赖丁酸盐抑制胃肠道肿瘤的进展。C. butyricum调节Wnt/β-catenin的信号传导,减少高脂饮食诱导的结直肠癌,通过抑制NF-κB通路抑制结肠炎相关结肠癌,并增强免疫检查点抑制剂(ICIs)对肺癌的疗效。
一些产生短链脂肪酸的细菌有助于抗癌的例子
费氏丙酸杆菌(Propionibacterium freudenreichii)
通过产生作用于线粒体的丙酸和乙酸来诱导结直肠癌细胞的内在凋亡。
乳酸片球菌(Pediococcus acidilactici UAMS)是一种高产丁酸细菌,它能抑制人结肠癌细胞(HT29)和
SW480细胞(人结肠腺癌细胞)的增殖。
肠道Roseburia intestinalis、普拉梭菌(Faecalibacterium prausnitzii)、植物乳杆菌(Lactiplantibacillus plantarum)和Eubacterium callanderi也已被证明可增强结直肠癌中的抗癌免疫反应,同时产生丁酸盐。
用VSL#3益生菌治疗增加了丙酸盐和丁酸盐的水平,导致通过CCL20/CCR6轴募集Th17细胞,以减轻黑色素瘤的肺转移。鼠李糖乳杆菌GG ATCC 53103、罗伊氏乳杆菌DSM 17938、约氏乳杆菌LC1和其他益生菌不仅抑制结直肠癌细胞增殖,而且改善了化疗反应。
因此,补充益生菌可以在一定程度上增加短链脂肪酸,进而在癌症预防和治疗中发挥重要作用。
通过饮食成分改善
对于微生物群的组成和代谢功能,饮食可能是一种强大的调节剂。
• 摄入更多的膳食纤维可以降低结直肠癌等疾病的风险
膳食纤维作为短链脂肪酸的前体。研究证实,摄入更多膳食纤维可以降低患包括结直肠癌在内的多种疾病的风险。膳食纤维摄入量与患结直肠腺瘤和结直肠癌的几率之间存在统计学上显著且强烈的相关性。
作为代表性的膳食纤维,果胶显著增加了肠道微生物群的多样性,特别是产生丁酸的细菌,并促进肿瘤免疫微环境中的T细胞浸润,从而增强抗程序性死亡-1(抗PD-1)单克隆抗体(mAb)效果。
肥胖女性在一段时间内摄入富含菊粉和低聚果糖的混合物后,体内产生丁酸盐的细菌增多,还降低了餐后血糖水平。
• Omega-3等不饱和脂肪酸改善癌症治疗
Omega-3多不饱和脂肪酸(PUFA)人体不能合成,必须从食物中摄取,已被证明可以改善高脂血症、冠心病和动脉粥样硬化。每天服用更多的多不饱和脂肪酸时,可以观察到产生丁酸的细菌丰度增加。
与此同时,乳杆菌等益生菌增加,具核梭杆菌减少。研究表明,一些多不饱和脂肪酸可以辅助化疗药物5-氟尿嘧啶(5-FU)和奥沙利铂治疗结直肠癌并减少副作用。
• 益生元的摄入与结直肠癌呈负相关
益生元是不被宿主消化吸收、能选择性促进肠道内益生菌代谢和增殖的食物成分。常见的益生元包括菊粉、低聚果糖、半乳糖和一些藻类。益生元在癌症的发展中也发挥着重要作用。
最近进行的一项病例对照研究,包括1953名经组织学证实的结直肠癌患者和4154名对照者,发现结直肠癌风险与饮食中半乳糖摄入量呈负相关。
粪菌移植
除了补充益生菌、益生元外,粪菌移植也可能是增加短链脂肪酸、抵抗胃肠道肿瘤的一种选择。
• 粪菌移植有助于抗癌治疗的效果
在致癌物质诱导的常规小鼠或无菌小鼠中,来自结直肠癌患者的粪菌移植降低了肠道微生物群的丰富度并促进了胃肠道肿瘤的形成。
右旋糖酐硫酸钠或氧化偶氮甲烷的治疗可以在实验室小鼠中诱导结直肠癌,而从野生小鼠到实验小鼠的粪菌移植可以改善这一过程。
尽管没有临床证据表明粪菌移植可以直接治疗结直肠癌,但一项研究表明粪菌移植可以帮助提高化疗的疗效。将健康供体小鼠的粪便移植到FOLFOX治疗的小鼠体内,可以恢复FOLFOX治疗后破坏的肠道微生物群的组成,并减轻腹泻和肠粘膜炎症的严重程度。此外,粪菌移植通过增加微生物群多样性和调节免疫功能来增强抗PD-1治疗效果。
粪菌移植是塑造微生物组最直接的方式,通过粪菌移植直接增加产生短链脂肪酸的细菌,为胃肠道癌症的治疗提供了广阔的前景。
!
短链脂肪酸调节对化疗和免疫疗法的反应
短链脂肪酸还可以调节肿瘤对放化疗和免疫疗法的反应。临床研究发现,术前新辅助放化疗后,有反应的结直肠癌患者粪便中产生丁酸的细菌和短链脂肪酸水平比未接受治疗的患者更丰富。
• 丁酸盐协同增强抗癌作用
丁酸盐可作为奥沙利铂的增效剂,协同增强抗癌作用。丁酸盐通过调节CD8+ T细胞直接促进奥沙利铂的化疗疗效。
此外,与结直肠癌中无反应患者相比,有反应患者血清中的丁酸盐水平较高。与单独放疗相比,放疗-丁酸盐组合显著增强了抗癌效果。丁酸盐可以通过促进FOXO3A介导的转录来诱导细胞周期停滞,同时保护正常细胞免受辐射损伤。由于HDACs抑制剂已被证明可以增强放疗的敏感性,因此推测丁酸盐可能是因为抑制HDACs而增强了放疗的疗效。
丁酸盐还可以通过GPR109a-AKT信号通路增强5-氟尿嘧啶(5-FU)的功效。同时,短链脂肪酸降低了5-FU的促炎作用,并增加了粘膜中紧密连接蛋白的表达。
然而,产丁酸细菌的异常活性和患者体内过量的丁酸会导致对化疗药物的耐药性。结果表明,对丁酸盐具有抗性的结直肠癌细胞系表现出明显的化学抗性。
通过调节自身免疫细胞和免疫分子来靶向杀伤肿瘤细胞,同时减少对正常组织的损伤,已成为肿瘤免疫治疗的代表。
人类肠道微生物群在肿瘤生长、发展和治疗中发挥着关键作用。肠道菌群、宿主免疫系统和肿瘤之间的相互作用可以为调整肠道菌群以优化肿瘤微环境和增强癌症免疫治疗提供有价值的见解。
短链脂肪酸是肠道微生物群的重要产物,已被证明可以改变免疫细胞的分化和功能以及细胞因子的产生和释放,通过多种信号通路控制肿瘤的生长和转移并诱导细胞凋亡。此外,短链脂肪酸还有助于提高放疗和化疗的治疗效果,减少不良反应。
未来,个性化医疗可能会结合基于微生物组的诊断和治疗策略。以肿瘤免疫为目标,补充微生物源性 短链脂肪酸已成为诊断、治疗和预防肿瘤的新方法。可重点关注益生菌和粪便微生物移植以及合理的饮食,提高短链脂肪酸水平,调节胃肠道微生态,激活有效的抗癌作用。
主要参考文献
Feng P, Xue X, Bukhari I, Qiu C, Li Y, Zheng P, Mi Y. Gut microbiota and its therapeutic implications in tumor microenvironment interactions. Front Microbiol. 2024 Jan 23;15:1287077.
Dong Y, Zhang K, Wei J, Ding Y, Wang X, Hou H, Wu J, Liu T, Wang B, Cao H. Gut microbiota-derived short-chain fatty acids regulate gastrointestinal tumor immunity: a novel therapeutic strategy? Front Immunol. 2023 Apr 14;14:1158200.
Sun J, Chen F, Wu G. Potential effects of gut microbiota on host cancers: focus on immunity, DNA damage, cellular pathways, and anticancer therapy. ISME J. 2023 Oct;17(10):1535-1551.
He M, Wei W, Zhang Y, Xiang Z, Peng D, Kasimumali A, Rong S. Gut microbial metabolites SCFAs and chronic kidney disease. J Transl Med. 2024 Feb 18;22(1):172.
Hanus M, Parada-Venegas D, Landskron G, Wielandt AM, Hurtado C, Alvarez K, et al.. Immune system, microbiota, and microbial metabolites: The unresolved triad in colorectal cancer microenvironment. Front Immunol (2021) 12:612826.
Pansy K, Uhl B, Krstic J, Szmyra M, Fechter K, Santiso A, et al.. Immune regulatory processes of the tumor microenvironment under malignant conditions. Int J Mol Sci (2021) 22(24):13311.
Luu M, Riester Z, Baldrich A, Reichardt N, Yuille S, Busetti A, et al.. Microbial short-chain fatty acids modulate CD8(+) T cell responses and improve adoptive immunotherapy for cancer. Nat Commun (2021) 12(1):4077.
Kurokawa H, Ito H, Matano D, Terasaki M, Matsui H. Acetic acid enhances the effect of photodynamic therapy in gastric cancer cells via the production of reactive oxygen species. J Clin Biochem Nutr (2022) 71(3):206–11.
Marques C, Oliveira CS, Alves S, Chaves SR, Coutinho OP, Corte-Real M, et al.. Acetate-induced apoptosis in colorectal carcinoma cells involves lysosomal membrane permeabilization and cathepsin d release. Cell Death Dis (2013) 4:e507.