 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com



小编最近仔细阅读了一本书,书名是《战斗细胞:人体免疫系统奇妙之旅》(海南出版社2022年10月出版的),该书是德国科学家菲利普·德特玛(Philipp Dettmer)撰写的一本书,作者是一名信息设计师。在32岁被确诊癌症并接受了一系列手术和化疗后,他逐渐痴迷于研究免疫学,目前已成为一名科学传播者和免疫研究爱好者。
译者李超群,英国利兹大学应用翻译专业硕士,译有《饮食的迷思》《显微镜下的室友》等。
在书中,作者以亲切易懂的语言、切入场景确切的比喻,生活化的语言描绘出免疫细胞世界的模样、运行的方式、如何使我们生病或保护健康,帮助读者轻松理解复杂的免疫相关知识。
免疫系统本来是对普通人比较陌生的领域,专业名词也多,但是作者通过生动的比喻帮我们克服了概念上的障碍,例如,他将普通体细胞比作“平民”,免疫细胞则是“各种专门士兵”——肠道有益菌是可爱小兔子、抗体是小龙虾等。看书的过程就好像在看影视剧一样。就算你从未接触过医学知识,也丝毫不影响阅读和理解。
回顾我们以往的科普文章,虽然前期选定主题,查阅大量研究文献和资料,再整理撰写花费时间很多,但是没有将科普文章写得如《战斗细胞》一书一样让不同知识面的客户都可以轻而易举读懂和受益。
在此有机会阅读此书并分享书中部分关于免疫系统和肠道黏膜和肠道菌群的内容,帮助读者增进对人体免疫系统的了解,从而更好地守护自身健康。
前序:在我们生活的环境中有着不计其数的病原体,不仅有病毒,还有细菌、寄生虫等等。人类几乎每时每刻都在和环境中的危险因素接触、斗争,只不过,我们常常感知不到这个“斗争”的过程。
免疫系统的构成:一支精密完备的“老牌”军队
用作者的话说,要回答什么是人类的免疫系统,还真有点不容易,但既然叫做“系统”,也就表明它不是一个单独的东西,而是一整套完整的体系。
作者把人类免疫系统比作是“一套军队系统”,说它“是由成百上千的营地和征兵处组成的遍布全身的复杂网络”,这说的就是免疫网络,是免疫系统的“基础设施”。
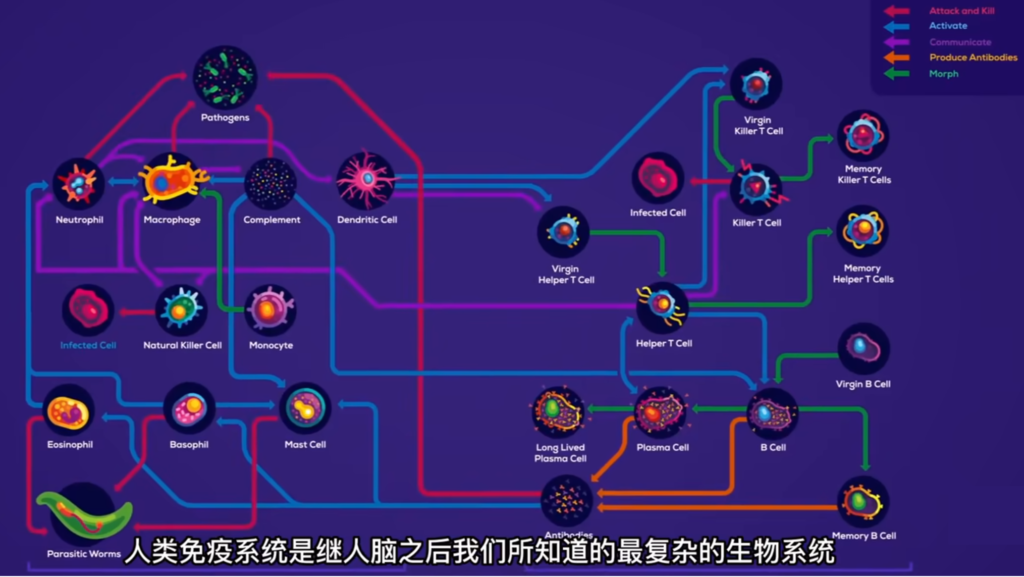
而所谓的“营地”,其实就是指免疫系统中专门的免疫器官,比如骨髓、胸腺、盲肠、扁桃体等等,这些免疫器官有些也是免疫细胞的诞生地;此外还有淋巴结。另外,免疫细胞内部还会释放出各种免疫活性物质,或者称为“细胞因子”,例如常见的有抗体、补体、免疫球蛋白等等,它们也是整个免疫系统重要的组成部分。
按照不同的免疫功能,免疫系统由两大王国组成,即先天性免疫(或说非特异性免疫),以及后天的适应性免疫(或说特异性免疫)。从名称就可以看出,两者的区别在于,先天性免疫是我们一出生就具有的,或者说不是针对特定的、单一的病原体的。
➤ 初代生命的进化与互相攻击:35亿年前,泥坑中的奇迹诞生
要是你因为每天早起上学,工作,路上堵车就觉得生活不顺,那原始的单细胞生命可以给你好好上一课。
35亿年前,地球还是一片蛮荒之地,在某个神奇的泥坑里,生命诞生了,而免疫系统要也随之出现了。我们不知道这些初代生命做过什么,又怎么活下来,但知道它们很快就开始了互相攻击。
➤ 生命的合作进化:从单细胞到多细胞
它们必须想办法把周围的化学物质转化为能为己用的东西,同时获取生成必需的能量,而其中几种细胞就盯上了“捷径”。
能偷别人干的,干嘛要自己干呢?
有几种办法实现了这一目标,比如:
可以整个同事其他细胞,或是在别的细胞上打洞并从其内部吸食营养……不过这样做颇有风险,成功了能饱餐一顿,失败了则会惨遭反噬,特别是在对手更大,更强的情况下。
风险更小的办法是潜入对手细胞内部并在此安家:分享宿主的粮食,享受它的呵护。这个办法相当成功,当然对宿主来说就很可怕了。
既然擅长“吸血”成了有效的生存技能,那么保护自己不被“吸”就成了演化上的必需。接下来的29亿年里,微生物凭借相似的招数,互相竞争厮杀。
假如有个时光机,能回到过去的微观世界一睹此类战争的宏大场面,你多半会失望,除了潮湿的石头上有一些纤薄的细胞膜之外,什么都没有。
在最初的几十亿年里,地球是个相当乏味的地方,直到生命形式的出现和飞越。
我们现在并不特别清楚,到底是什么让单打独斗的细胞开始向着密切合作并有专门分工的庞大细胞群发展的。
➤ 多细胞生物的兴起与免疫系统的重要性
大约在5亿4100万年前,多细胞动物出现了爆发性增长,体型变得肉眼可见,多样性也以极快的速度大大增加。
这当然就给刚演化出来的古代微生物们提出了一个问题:几十亿年来,生活在微型世界中的它们,无论进入任何生态系统,都要为其中的空间和资源争斗,而对这些细菌及其他微小生物来说,还有比多细胞动物更好的生态系统吗?这个系统里,从头到脚都是免费的营养!所以从一开始,多细胞生命就面临着细胞入侵者和机体寄生者的威胁。
只有能应付这种威胁的多细胞生物才能存活下来并有机会演化得越来越复杂。可惜,经过数亿年的时间,细胞和组织都没有得到好好的保存,我们看不到免疫系统的化石遗迹。但通过科技的魔法,我们可以看到生命树的各个分叉,并观察现存动物,研究它们的免疫系统。如果有些免疫特征,为生命树上差距越大的物种共同拥有,那么一般而言,这些特征也就越久远。
那么重要的问题就变成了:
➤ 免疫系统会在哪里产生区别,不同动物的免疫系统有哪些共性?
几乎所有当今的生物都有某种形式的内部防御机制,而生物越复杂,免疫系统也越复杂。选取相差悬殊的动物,比较它们的防御机制,我们就可以了解很多免疫系统的历史。
从最微小的层面来说,细菌也有抵御病毒的方法,它们不可能乖乖就范。而在动物世界中,海绵这种已经存在了5亿多年的最古老、最简单的动物,就拥有可能是最原始的动物免疫反应:“体液免疫”(“体液/humor”一词来自古希腊语,这里可不是“幽默”)。
体液免疫主要通过游离在细胞外体液中的微小蛋白来实现功能,杀伤、歼灭不该出现的外来微生物。这类防御非常有用,也非常成功,几乎所有现存的动物,包括我们人类,都有体液免疫。它没有被演化淘汰,而是变得举足轻重。原则上说,体液免疫在5亿年里都没怎么变。
但体液免疫只是个开端。多细胞动物的优势之一是就发展出了专业的防御细胞,相应的免疫就叫“细胞[介导]免疫”。
这种新型的免疫一开始就大获成功。连在蠕虫和昆虫的小小身体里,我们都发现了专门的免疫细胞卫士,它们能在小虫体内自由巡行,与入侵者正面交锋。
沿着演化之树,越是向枝头探寻,免疫系统就变得越是精妙。而在最早的脊椎动物身上,我们就已经看到了重大的创新:出现了专门的免疫器官暨细胞的“训练场”,以及最为强大的免疫原理之一——能够识别特定的敌人,并快速制造大量的针对性武器实现精准打击,还要牢牢记住它们!
即使是最原始的脊椎动物,比如样子诡异的无颌鱼,体内也有同样的免疫机制。

图源:dashangu
在数亿年的岁月里,这些防御机制变得越发复杂和精密。不过,简而言之,上面都是基本的免疫原理,它们有着出色的防御效果,所以或许在5亿年前的某些生物体内就已经存在了。因此,虽然你我的免疫系统很复杂、很强大,但其底层机制在动物界却很普遍,它擅长调动多种多样的特化细胞。
因此,从演化上来看,动物很可能没用多久其起源可以追溯回几亿年前。演化之手无须一次次地重新发明免疫系统——它发现了一套了不起的系统,并将其不断完善。
好,话题终于要回到人类,回到你我身上了。我们都在享受着数亿年来免疫系统不断演进的丰硕果实。不过,免疫系统并不只是存在于你的体内,它就是你本身。“免疫”只是对守护自身并维系生命的所有生物机制的一种表达方式。所以讨论免疫系统就是在讨论人本身。
免疫系统也不是一个单独的东西。它像一套军队系统,是由成百上千的营地和征兵处组成的遍布全身的复杂网络。它们和心血管系统一样,分布广泛,无处不在,由像高速路网一样的管道网连接起来。另外,人体还有专门的免疫器官,位于胸腔内,大小和鸡翅差不多,会随着人的衰老而逐渐退化。
基于免疫器官和免疫“基础设施”,有几百亿免疫细胞在免疫路网和血流中巡逻,可以随时应召和敌人作战。此外,人体外部组织表面也有几十上百亿的免疫细胞形成的屏障,准备抵挡入侵。

这还只是积极防御,还有1018数量级的蛋白质武器组成的防御系统,它们就像能自动组装、四处散布的地雷。免疫系统中还有专门的“大学”,供细胞学习如何识别敌人及怎样作战。这所大学有着世界上最大的生物学图书馆,可以教你识别一生中可能碰到的所有敌人并记住它们。
在最核心的意义上,免疫系统就是区分自身和异物的工具
无论对方是否恶意,并不重要,只要不是被授予自由通行证的贵宾,免疫系统都会发动攻击与歼灭,因为这些被视为潜在的威胁。对免疫系统来说,为任何“他者”冒险都不值得。没有它们的此种忠诚,我们可能活不了几天。可惜,免疫系统如果忠诚不足或忠诚过头,也会造成困扰甚至引发严重后果致人死亡,后面我们会谈到这些情况。
免疫系统的首要目标——维持稳态
虽然说区分自身和异物是免疫功能的核心,但并不是它的目标。免疫系统的首要目标是维持“稳态”,即维持体内全部细胞及物质的平衡。免疫系统真是投入了最大的努力保持平衡,也在尽心安抚自己免于反应过激,这一点我们怎么强调也不为过。
你也可以理解成,它在追求和平,追求让生存变得愉悦和轻松的稳定秩序,也就是我们所说的“健康”。健康是轻松自由地生活的基础,拥有健康,我们才能从心所欲,不受病痛的阻挡。
只有当我们失去健康时,才会真正意识到它的宝贵。健康其实是一个抽象的概念,因为它描述的并不是一种实质的存在,而是没有病痛、不受限制的状态,不是“有”而是“无”。拥有健康的时候,你觉得一切正常,感觉良好。而一旦健康离你而去,哪怕只有几天,都很难忽视人的脆弱和生命的稍纵即逝。疾病是生命中不可避免的事情。对于美好生活而言,没有什么比健康的身体更重要。
对免疫系统来说,健康就是稳态
尽管这场守护健康的战争终会不可避免地输掉,变成徒劳,但我们仍在努力夺取多一些时间,哪怕只是几个小时。总体而言,生而为人是幸福的,我们都希望自己可以活得久一点。
但维持健康殊非易事,因为我们每天都会遇到上亿的细菌和病毒,它们巴不得占领你的身体,就像几十亿年前那些单细胞生物之间发生的战争那样。
对微生物来说,你就是一套有待征服的生态系统。这片广袤无垠的土地资源丰富,适合繁殖,充满了机遇,是理想的栖居之地。当然,等我们最终离开这个世界时,它们还是会胜利的;没有了免疫系统的保护,大量疯狂的微生物组成的军团会大大加速尸体的分解过程。
预防癌症是免疫系统的头等大事之一
要担心的还不止这一大堆想要入侵的微生物,还包括可能误入歧途的身体本身,就是癌症。事实上,在你读这几页书的时候,身体里可能就有早期癌细胞正在被免疫系统悄无声息地清除掉。
免疫系统也可能出错——自身免疫性疾病、过敏
旨在保护你的免疫系统也可能出错,可能堕落。免疫系统一旦受了蒙骗,可能就会助长疾病的蔓延,或是保护癌细胞不被发现。免疫系统也可能失衡或受损,从而糊涂地攻击自身。它会把“我”误判为“他”,实实在在地攻击起它本该保护的那些身体细胞,导致一系列自身免疫性疾病,而病人不得不长期服用可能伴有严重副作用的免疫抑制药物。
过敏反应是指免疫系统对无害的物质产生了过激反应。“过敏性休克”就是一种严重的过敏反应,它凸显了免疫系统有多强大,一旦出错又多么可怕:疾病未必会马上置人于死地,而免疫系统带来的过敏性休克却能在几分钟内夺人性命。

免疫系统在帮助你的同时也会带给你痛苦
生病时的很多糟糕症状都是被激活的免疫系统引发的后果——对某些疾病来说,最严重的损伤甚至死亡都是免疫系统对入侵事件的失控反应造成的。比如,COVID-19导致的许多死亡病例都是免疫过激的结果。
伤害的累积是严重疾病的基础
免疫系统发挥防御功能的同时造成的损害会不断累积,于是今天有人认为,免疫系统的正常运转正是一些致命疾病的发展基础。因此,尽管拥有能对外界威胁做出快速有力反应的免疫系统对健康很是关键。
但同时保证它不会失控和搞破坏也很重要。就和人类社会一样,如果你的身体不得不打仗,那它至少想要快速地结束战争,赢得干净利落,而不想经历长期的被占领或冲突,那只会耗尽资源,毁坏基础设施。
人不管怎样生存和行动,都离不开世界本身及世上的一切。温馨私密的城堡,偏僻的森林木屋,遥远的社交距离,都无法让你免于和世界打交道,哪怕你是最叛逆的网瘾少年-最起码你需要稳定的食物来源,因此总要和外界有最基本的互动。

人体面临着同样的问题,因为细胞需要氧气和营养来维持生存和运转,并排出代谢产生的有害废物。就是说,资源要从外面进来,废物要从里面出去。因此,人体不可能是封闭的系统,内部总要有和外界直接接触的地方。
绝大部分病原体入侵都发生在这些内外交界之处
而这样的地方也就是人体的薄弱环节,从这里,不速之客能偷偷入侵血肉大陆。事实上,绝大部分的病原体入侵都发生在这些内外交界之处,包括从口腔一直到肛门的消化道,还有通向和外界进行交换的“洞穴系统”的多分支管道。
开头我们就说过,人体的肺和呼吸道、口腔和肠道,以及生殖道,其实是身体的外部,只是被卷到了里面。按理说,这些“管道”里铺的东西应该叫“内皮”,可惜,正确的名字是黏膜。为了听起来更酷一些,我们就叫它“沼泽之国”。
沼泽之国要解决的一大难题,方便营养进来、废物出去,同时又要让病原体难以逾越
这意味着,沼泽之国的免疫系统要和身体其他地方的不一样。肠道黏膜人体大部分都是无菌的,没有微生物,没有异物,而沼泽之国却在持续接触着各种“异物”:有待吸收的食物碎块,由此通过的可消化物质,可以自由进入并在肠道安居的有益菌,还有从空气中吸入的各种颗粒物,如污染物、灰尘等等。
这样一来,当然会有数不清的不速之客想要偷偷潜入,越过防线。其中一些是不小心闯入的无辜过客,另一些则是专门攻击人体的危险病原体。

这使得这些部位的免疫系统有着格外艰巨的职责,要维持平衡更是难上加难——因为沼泽之国的免疫系统要有一定的宽容度。
与此相反,身体多数部位的免疫系统对异物是毫不留情的。划伤之后,细菌侵入软组织,免疫系统就会发动猛烈的还击。皮下或者肌肉组织是容不得细菌的,会不惜一切代价把它们消灭掉。而这在黏膜附近就不可能了。

黏膜处的免疫系统小心处事
黏膜处的免疫系统不能像其他部位一样有攻击性,否则这些负责气体和营养交换的部位会遭到严重破坏,从而影响正常生活甚至造成死亡(许多患有自身免疫性疾病或过敏的人,就会遇到这种情况,不过我们后面再详细讲)。黏膜的免疫系统必须小心行事,被激活后要尽量把免疫反应限制在最必要的范围内。但同时,黏膜又是身体最薄弱的地方,免疫系统必须要能发挥保护作用,不能太过散漫,非常棘手。
针对入侵的第一项反制措施,就是把黏膜变成不适合危险微生物生存的死亡之地。为此,黏膜动用了一系列不同的防御系统。
如果说皮肤像广袤的荒漠,又像一道无法逾越的边境长城,黏膜就像一大片沼泽地,遍布着陷阱和巡逻的卫兵队伍。黏膜比皮肤容易入侵,但这也并不轻松。那么黏膜究竟是什么,又是怎样保护你的呢?
沼泽之国动用的第一道防线就是它本身的黏液层。黏液是细胞分泌的黏滑的物质,有点像水凝胶。你可能知道鼻涕,鼻子里面黏糊糊的东西,感冒时会流很多,看起来有点恶心。实际上黏液遍布身体里的各个地方:口腔、肠道、呼吸系统(包括肺部)、眼睑内侧等等。
与外界进行物质交换的通道表面上都有黏液。持续生产黏液的是杯状细胞,它们的样子很好玩,但我们主要讲免疫系统,就不过多介绍它们了。你可以把它们想象成被踩扁的怪虫子,不停地吐出黏液,形成了黏液层。
湿滑的黏液发挥着几方面的作用
它是一道阻止外敌入侵的物理屏障
假设你在满是污泥的泳池里游泳,还要潜到池底,而污泥有近百米深。黏液不仅是一层黏糊糊的屏障,还和皮肤荒漠一样充满了陷阱:有盐,有可以溶解微生物外部结构的酶,还有一些特殊的物质能耗尽细菌赖以为生的关键营养,从而饿死细菌。
大多数部位的黏液富含杀伤力强大的IgA抗体
所以黏液层本身就不是宜居之地。而且,黏液层不仅能为你抵御外敌,还能让你免受自身的伤害。你是否想过,胃里有那么多胃酸,你为什么没事?因为胃黏膜就是一层屏障,能保护胃壁细胞,令其不与胃酸接触。
黏液可以移动
黏膜表面是一层名为“上皮细胞”的特殊细胞,你可以把它们看成“内皮的皮肤细胞”。它的细胞膜上覆盖着形如发丝的纤毛,这种微小的细胞器聚在一起,连成大片的网。上皮细胞位于黏膜的最外层,就像“身体里的皮肤”,表面只有一层黏液。
有些地方黏液和身体内部之间只隔着薄薄的一层,一个上皮细胞的厚度。上皮可没有皮肤那么奢侈,能让好几百个细胞一层层摞在一起。也正因为这样,上皮细胞可不好对付。它们尽管不是真正的免疫细胞,但也发挥着重要的防御作用:它们特别擅长激活免疫系统,以及释放特殊的细胞因子以请求支援。它们就像民兵组织,虽不能与敌军旗鼓相当,但在身体遭遇入侵时,是非常有用的补充性防御力量。
上皮细胞的任务之一,就是借助细胞膜上的纤毛让黏液流动
有些微生物会借助纤毛移动,而上皮细胞则是摆动纤毛让表面的黏液一起有节律地流动。摆动的方向取决于上皮细胞的位置。呼吸道、鼻腔、肺里的黏液,要么从口鼻排出体外,要么绕个弯被吞进胃里。
我们在一生中会吞下相当多的黏液,虽然听起来可能有点恶心,但这种机制很是有用。毕竟,胃里充满了强酸性的胃液,绝大部分病原体都无法幸存。而肠道上皮细胞纤毛运动的方向也很清楚:从胃向肛门——吃进来的东西都从这里要排出去。
沼泽之国——合作联盟
不过黏膜形成的沼泽之国不是单一国家,而更像彼此迥然不同的多个国家,为了共同目标而结成的合作联盟。
比如在荒漠之国皮肤的情况中,脚底和腰部的皮肤厚度就有很大差异。相应的,肺部黏膜和肠道黏膜有着完全不同的功能,而女性生殖道黏膜的功能又大不一样。根据不同部位黏膜特化情况的不同,相应的免疫系统也各有特点。
在讲病毒之前,我们先看看肠道这个神奇的国度,看看它是怎么和足足几十万亿细对免疫系统来说,肠道是个非常特别的地方,因为在这里,免疫系统要应对许多复杂的挑战,才能保持身体健康和正常运转。
我们还是来把肠道想象成贯穿人体的长管道,它把一点“体外”裹进了“体内”。在这些“外”表面,即肠道黏膜上,生活着1000多种细菌,数量多达三四十万亿,还有几千种病毒,它们共同组成了“肠道微生物群”(绝大多数肠道病毒攻击的是肠道细菌而非人体)。
关于免疫系统和肠道微生物组各自的功能及其相互作用,我们还很缺乏了解。许多疾病和失调都跟两者间的失衡有关,不过要完全理解两者间的各种关系,还需要大量的研究。未来几年,我们很可能会有重大突破。
在本章中,我们会探讨免疫系统是怎样和如此众多的微生物和平共存的。
首先,肠道免疫系统是一个半封闭系统,它会试图和身体其他部位免疫系统保持一定的界线。
肠道黏膜遇到的最大挑战,就是它的防线一直在被攻破。对肠道来说,外界的侵扰永不停歇,肠道免疫系统要持续响应,分辨敌友,这和身体其他任何地方都不一样。肠道是个繁忙的地方,除了生活着组成肠道微生物组的几十万亿有机体之外,还有吃进来的所有东西。
食物消化
食物的旅程始于口腔。食物要被消化吸收,变成身体和细胞养分,第一步就是被牙齿磨碎,并被唾液浸润、炮制。唾液中含有一些可以分解食物的化学物质,从你吃第一口开始,整个消化过程就拉开了序幕。
从进食到把废物排出体外,吸收营养的时间是有限的,所以越早开始越好。嚼碎的食物接着会被吞下去,在胃酸之海里停留片刻。胃酸不仅可以帮助消化,分解结实的肉类和植物纤维,它还能淹没并杀死大量微生物,从而大大减轻免疫系统的负担。
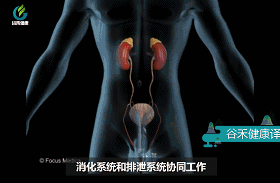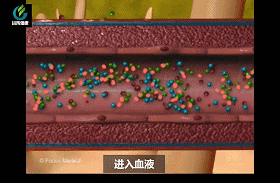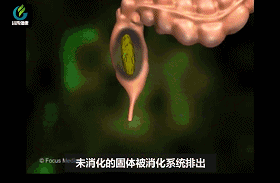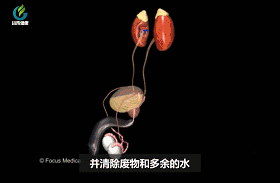
经过胃部后,食物就到了肠道。肠道长约3—7米,是最长的一段消化道。90%以上人体所需的营养都是在肠道吸收的。这里生活着大量人体必需的细菌伙伴,它们进一步分解食物,便于身体吸收营养。但这些可不是随便什么细菌。
几百万年以前,人类祖先和某些微生物群做了个小约定:
肠道细菌——租客;生成的营养物质——租金
人允许它们住在温暖的肠道里,并提供源源不断的食物;作为交换,这些微生物负责分解人类自己无法分解的碳水化合物,并生成人体自身不能合成的维生素。
肠道细菌:亦友亦敌
这些细菌就叫“[偏利]共生细菌”,“共生”(commensal)一词来自拉丁文,意为“同在一张桌前”。就和生活在皮肤表面的那些细菌“部落”一样,肠道的共生细菌也是我们的朋友。这些细菌只要不危害人体健康,免疫系统就不会攻击它们,这就是双方守约定的最理想情况。
为了维持秩序与和平,肠道细菌也像皮肤表面的细菌那样,生活在肠道黏膜的表面之上。只要肠道细菌不越线,不侵入上皮层,双方就相安无事。当然,事情不会这么简单。
细菌可不是人类真正的朋友,它们不知道什么约定,也不会去遵守任何东西。而肠道面积辽阔,细菌多得惊人,时刻都有一些共生细菌侵入肠道内壁。这就不太妙了。要是这些细菌进入血流,即进入真正的“体内”,会带来可怕的后果,甚至危及生命。而黏膜的一大目标就是防止这种情况。
肠道黏膜有三层
1
先是黏液层,内含大量抗体、防御素(前面讲皮肤时提过,它们就像微型针头,能杀死微生物)和其他一些能杀伤或杀灭细菌的蛋白质。肠道的黏液层很薄,且要有一定的通透性,好让食物中的营养物质通过,要是第一层保护太厚,你可能就要饿死了。
2
黏液层之下是肠道上皮细胞,它们是人体内外之间的真正屏障。和肺部相似,肠道的上皮层也只有一个细胞那么厚。为了更好地起保护人体内部的作用,肠道上皮细胞彼此连接得非常紧密,被特殊的蛋白紧紧粘在一起,就像真正的墙一样牢固。免疫系统严密监控着这里的情况,对于一切企图黏附到上皮细胞上的微生物,它都会毫不客气。
3
共生细菌突破防护墙的情况每时每刻都在发生,所以上皮细胞下面还有第三层,“固有层”,这里是肠道免疫系统的大本营。

在紧贴着黏膜表面的固有层之内,有特殊的巨噬细胞、B细胞和树突状细胞随时待命,等着收拾那些不速之客。
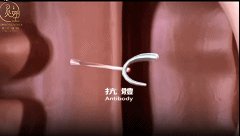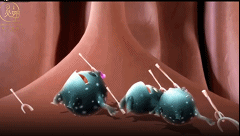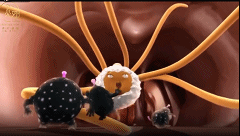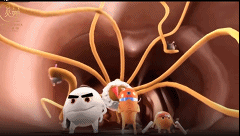
免疫系统会极力避免引发炎症
因为炎症会让肠道产生大量多余的液体,造成腹泻。腹泻不仅会使大便呈水样,还会损伤负责从食物中吸收营养的、敏感纤薄的上皮层,并迅速导致重度脱水。
很多人不知道,腹泻现在仍是重要的死因,每年约有50万儿童因此死去。所以,从几百万年前,人类这一物种登上演化的舞台开始,人体和人体免疫系统就明白要谨慎对待肠道炎症。
守卫肠道的巨噬细胞有两个特点:
一、很擅长吞噬细菌;
二、不会释放召集中性粒细胞进而引发炎症的细胞因子。
这里的巨噬细胞更像是无声的杀手,不慌不忙地吃掉越界的细菌,不会大呼小叫。

编辑
肠道的树突状细胞也很特别
大量树突状细胞直接待在上皮细胞下面,将长触手从上皮细胞之间挤过去,直接伸入肠道黏液。这样,它们就能对不安分的调皮鬼,即想侵入体内的细菌,不断进行采样。
这里就埋藏着免疫学中的一大未解之谜,将来解开谜题的人定能获得诺贝尔奖:
树突状细胞怎么知道它采样的细菌是危险的病原体,还是无害的共生细菌?
目前我们还不知道答案;我们知道的是,采样是共生细菌时,树突状细胞会让肠道免疫系统保持冷静,不要为这些细菌携带的抗原而烦恼。
肠道还有特殊的B细胞,只生成大量的IgA
这些抗体特别适合在黏液中工作,简直就是为肠道的环境而设的:
这两点对肠道来说都很重要。
IgA还有别的长处:
它们有四只钳子,伸向两个相反的方向,这让它很擅长抓住两种不同的细菌,并把它们粘在一起。于是,大量IgA可以把无法反抗的细菌黏成大团,这些菌团会成为粪便的一部分,被排出体外。毕竟,粪便有三成多都是细菌,其中相当多的细菌是被IgA粘在一起的(让人担心的是,其中约一半的细菌在被排出时仍然是活菌)。
探索肠道免疫系统的守护之路
肠道免疫系统默默地守护着你,确保内部和外界的细菌不会作乱。有了这些机制和特殊细胞,免疫系统就保证了肠道黏液不会被野心太大的共生细菌所侵扰,同时自己也不会因过激而损伤身体,如此看来,肠道免疫系统可真是一支维和部队。
但要是有真正的敌人入侵,比如有致病菌经受住了胃酸的洗礼,存活到了肠道,这些机制就成了可怕的漏洞。此时,为了尽快捕获敌人,肠道有一种名为“派尔集合淋巴结”的特殊淋巴结,它们直接长在肠道上。

会有“微皱褶细胞”直接伸入肠壁,对免疫系统可能感兴趣的对象进行采样,某种意义上它们有点像电梯,装上乘客后会直接把它们送进派尔集合淋巴结,让适应性免疫细胞能检查肠道的各种情况。这样一来,肠道就相当于拥有了超快速的免疫筛查,可以持续地密切监测肠道的细菌组成。
本文选取了《战斗细胞:人体免疫系统奇妙之旅》该书中,与肠道免疫相关的几个章节作为分享,希望大家能更轻松地了解关于肠道免疫相关的知识,进一步引发对肠道免疫的思考和探索。让我们共同努力,推动肠道免疫健康知识的普及与实践,走向更健康美好的生活。
本文用于分享和交流,部分图片如有侵权请联系我们删除。

谷禾健康

微量营养素缺乏或称之为“隐性饥饿”,是目前一个严重的公共卫生问题,会对儿童发育及成人健康造成严重后果。
传统的治疗和预防方法,有些时候并是很有效,并且可能产生不良副作用(例如补铁引起的消化问题)。
★ 肠道细菌与微量营养素间存在重要的相互作用
许多研究发现肠道中的共生细菌可以增加特定微量营养素的生物利用度,特别是通过去除抗营养化合物(例如植酸盐和多酚),或通过合成维生素。
肠道黏膜是抵御病原体的第一道防线。肠黏膜微生物群有助于增强肠上皮的完整性并更好地吸收微量营养素。
细菌代谢还依赖于从肠道环境中获取的微量营养素,常驻细菌可能会竞争或协作以维持微量营养素稳态。因此,肠道微生物群的组成可以通过微量营养素的可用性来调节。

本文汇集了有关微量营养素和肠道微生物群之间双向关系的最新知识,重点关注铁、锌、维生素A和叶酸(维生素B9),因为这些缺乏症是全球范围内的比较严重的公共卫生问题。
目录
1.微量营养素缺乏
2.微量营养素与宿主健康
3.营养素与细菌的相互作用:以铁为例
4.细菌在锌生物利用中的作用
5.微生物群与宿主叶酸间的关联
6.微生物群与维生素A的相互作用
7.改善人体微量营养素的建议
8.结语
微量营养素,包括矿物质和维生素,是每天只需要少量的物质,但对人体代谢至关重要。
▼
微量营养素缺乏在全世界范围内非常普遍,最新估计表明,3.72亿学龄前儿童和1.20亿育龄非孕妇缺乏一种或多种微量营养素。
维生素和矿物质缺乏,也被称为“隐性饥饿”,是一个严重的公共卫生问题,世界各个国家都存在,特别是低收入和中等收入国家的弱势群体。
在全球范围内,三分之二的妇女和儿童(主要来自经济不发达家庭)的饮食中至少缺乏一种微量营养素。全球最普遍的微量营养素缺乏症包括铁、锌、维生素A和叶酸。
★ 微量营养素缺乏会导致不良健康结果
微量营养素缺乏与多种不良健康结果相关,例如儿童发病率和死亡率增加、贫血、发育迟缓和认知缺陷。
虽然存在多种改善个人或人群微量营养素状况的策略,其中主食强化被认为是改善人群微量营养素状况最具成本效益的干预措施。
然而,由于多种原因,应对微量营养素缺乏症的策略并不总是有效。包括可接受性差(例如,孕妇铁补充剂)、强化水平差和质量控制不足(例如,维生素A强化食用油),强化食品未能惠及最贫困人群。
★ 不同营养素的吸收具有差异
微量营养素的吸收主要发生在小肠中,根据微量营养素的不同,具有不同的机制。
例如,锌和铁主要通过特定的运输载体在十二指肠和空肠中吸收,这些运输载体针对每种矿物质及其形式而异,而叶酸不仅在小肠中被吸收,而且在结肠中也被吸收,因为在这两个部位都鉴定出了转运蛋白。
微量营养素的吸收差异很大,例如,铁充足的男性成年人吸收的铁摄入量不到5%,而正常条件下摄入的锌吸收量大于30%。
注:大部分摄入的微量营养素会到达结肠。
★ 微生物群与微量营养素之间存在相互作用
在消化道中,有一个复杂的微生物群落,其浓度和多样性从口腔到结肠不断增加。尽管含有其他微生物(病毒、真菌),但大多数研究都重点关注细菌,其中厚壁菌门、拟杆菌门、放线菌门、变形菌门和疣微菌门是最重要的。
粪便细菌组成在个体之间存在很大差异,并且不仅取决于宿主的遗传学,还取决于包括饮食在内的许多环境因素。
注:大多数关于食物对肠道微生物群影响的研究都集中在大量营养素(脂肪、碳水化合物、蛋白质)上。
然而,细菌需要微量营养素才能生存。例如,细菌需要外部来源的铁,其中一些甚至开发出特定的机制,例如转铁蛋白来竞争铁源。
相比之下,许多细菌可以直接合成维生素,例如叶酸(维生素B9),因此不一定需要外部来源。
细菌影响微量营养素的生物利用度
常驻细菌可能对微量营养素产生直接作用,影响其对宿主的生物利用度,或者产生间接作用,例如通过产生能够改善上皮健康的代谢物,从而导致更好的吸收。
微量营养素影响肠道细菌的组成和功能
微量营养素的消耗反过来会影响肠道细菌的组成和功能。事实上,事实证明,补充铁可以导致潜在致病性肠杆菌科细菌的增加,以及被认为对健康具有积极影响的双歧杆菌科细菌和乳杆菌科细菌的减少。
微量营养素在控制人类健康的新陈代谢和组织功能维持中发挥着核心作用。
然而,尽管人们努力通过补充食品和饮食多样化来增加微量营养素的摄入量,全球微量营养素缺乏症的患病率仍然非常高,包括工业化国家。
推荐营养素摄入量和摄入上限
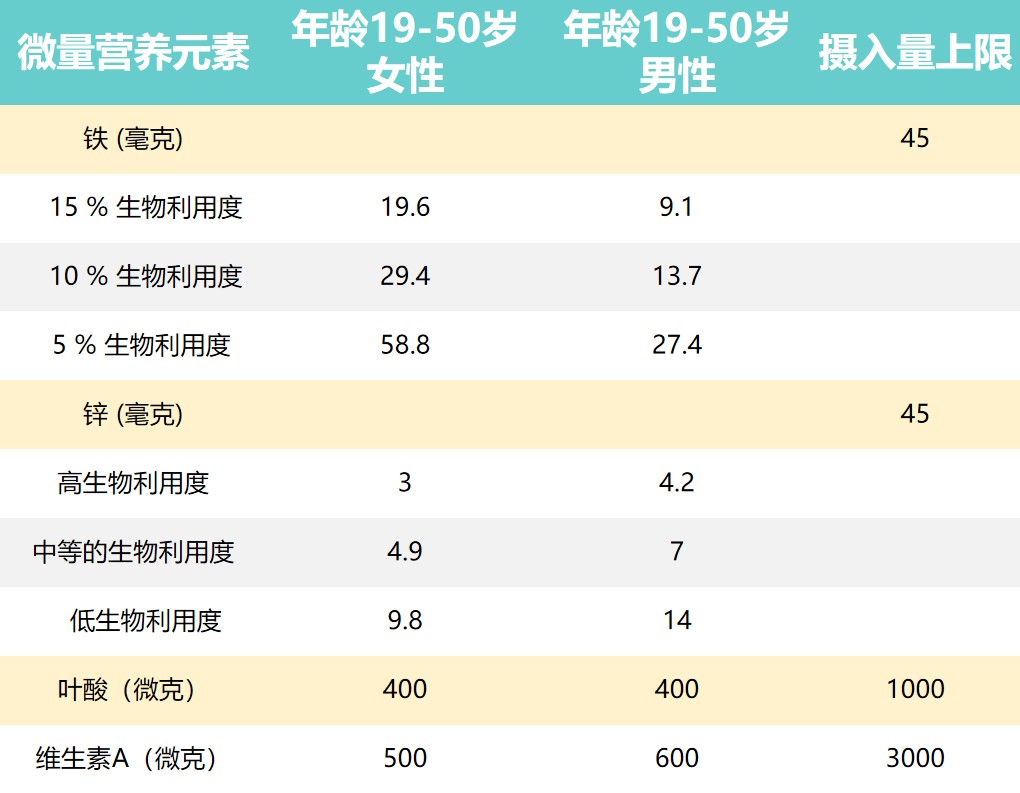
Dje Kouadio DK,et al.Crit Rev Food Sci Nutr.2023
上表提出了男性和女性一些推荐营养素摄入量和可耐受的上限摄入水平。
由于维持生长和补偿损失(例如月经)的需求更高,儿童和妇女受到的影响更大。
★ 缺乏微量营养素的症状多样且大部分在晚期
单一微量营养素缺乏的临床症状多种多样,并且通常是具有微量营养素特异性的,但一般发生在缺乏的晚期阶段。例如缺铁性贫血是缺铁的最后阶段。
▼
缺铁被认为是最常见的微量营养素缺乏症,全世界估计有超过20亿人缺铁。它会导致贫血、免疫功能受损、工作能力下降以及内分泌功能受损。
导致铁缺乏的因素包括:
(1)血红素铁摄入量低,其生物利用度高于非血红素铁
(2)富含植酸酶或酚类化合物的饮食会降低生物利用度
(3)慢性炎症,导致铁调素水平升高,下调铁吸收
▼
据估计,全球有超过10亿人缺锌,它与儿童生长迟缓相关,但也会降低免疫能力,从而增加儿童对多种疾病的易感性,包括腹泻、肺炎,也许还有疟疾。
此外,锌缺乏似乎会导致其他微量营养素缺乏。
▼
据估计,低收入和中等收入国家超过20%的育龄妇女缺乏叶酸。
怀孕期间叶酸摄入不足与胚胎最初几周的神经发育缺陷有关。在普通人群中,叶酸缺乏还会导致巨幼红细胞性贫血和神经系统症状,这些症状与维生素B12缺乏症的症状部分重叠。
▼
维生素A缺乏不仅会导致干眼症和失明,还会影响免疫功能的许多方面,导致免疫能力下降以及皮肤和上皮完整性降低。
许多低收入和中等收入国家每半年向5岁以下儿童提供高剂量维生素A补充剂,以降低儿童死亡率,但这种干预措施的有效性受到质疑。
有关铁、细菌和宿主的相互作用,参考了最近的研究,下面总结了这种复杂关系的关键要素。
铁的吸收和稳态受到严格调节
由于人类无法主动排泄铁,因此铁的吸收在十二指肠中受到严格调节。
// 血红素铁
血红素铁和非血红素铁通过两种不同的途径吸收,血红素铁被十二指肠刷膜边缘的血红素载体蛋白1(HCP1) 吸收。
// 非血红素铁
非血红素铁通常呈三价铁形式,不具有生物利用度,必须通过十二指肠细胞色素b(DCYTB) 将其还原为二价铁形式,然后再由二价金属转运蛋白 (DMT1) 转运到十二指肠刷膜上 。
注:二价金属转运蛋白的存在已被描述,铁也在回肠和结肠中被吸收,但这些吸收位点对宿主铁状态的贡献仍不清楚。
铁进入肠上皮细胞后,储存在铁蛋白中,或通过基底外侧铁转运蛋白输出到循环系统中。
铁稳态由激素铁调素调节,铁调素通过不同机制抑制铁释放到血浆中。
铁调素是由肝脏合成并分泌的富含半胱氨酸的抗菌多肽,在免疫过程中能够大量表达参与免疫反应;在机体内铁平衡的调节中起到负性调节的作用。
肠道微生物群在铁吸收中的作用示意图
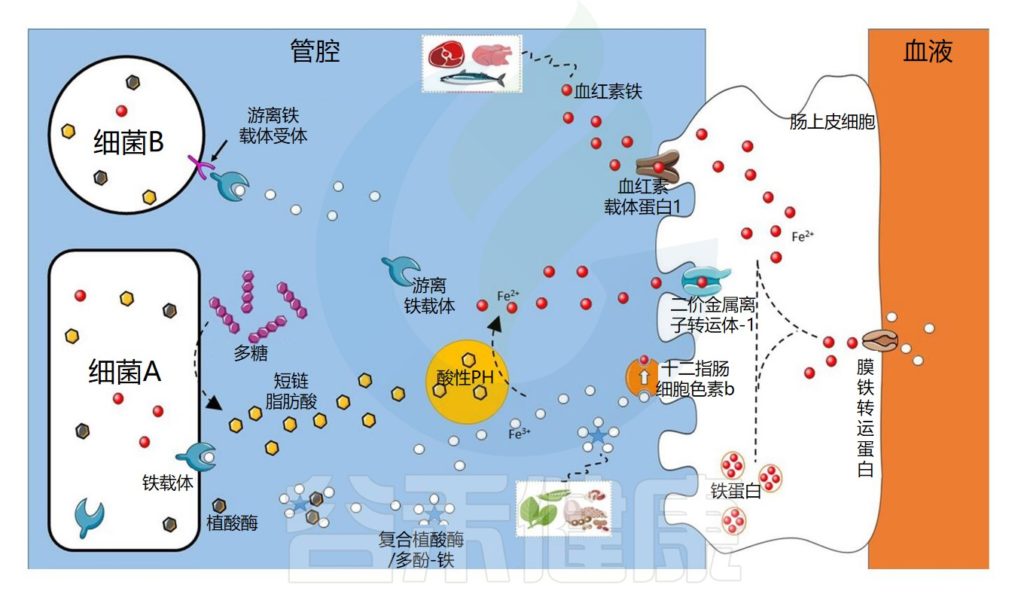
Dje Kouadio DK,et al.Crit Rev Food Sci Nutr.2023
细菌可以通过不同的机制获取铁
细菌可以通过不同的机制获取铁,例如使用称为铁载体的铁特异性螯合剂,铁载体是化学性质多样的次级代谢产物,对铁具有高亲和力。
由此产生的铁-铁载体复合物通过特定的外膜蛋白(上图中的细菌A)内化。细菌还可以通过产生具有不同配体结合位点的外膜受体来利用其他细菌产生的铁载体(上图中的细菌B)。
铁载体在细菌缺铁的情况下表达
铁载体在细菌缺铁的情况下表达,因此不在铁充足的环境中表达。在厌氧条件和低pH值下,铁主要以二价铁的形式存在,可以被细菌直接转运,主要通过专用转运系统Feo,由不同的蛋白质。
细菌可以利用宿主铁化合物
细菌还可以利用宿主铁化合物,例如血红素或转铁蛋白,它们通过特定受体转运或直接吸收。此外,尽管牛奶中存在的乳铁蛋白具有抑菌功能,但它也可以被具有特定受体的细菌利用。
铁吸收的调节对于细菌非常重要,因为铁在较高浓度下有毒。在许多细菌物种中,当铁浓度过高时,铁吸收调节蛋白 (Fur) 会抑制与铁吸收相关的基因转录。
研究细菌有助于揭示新的铁吸收途径
值得注意的是,大部分关于细菌铁吸收的知识来自对病原菌的研究。长期以来,人们一直认为一些有益菌,例如乳杆菌科的成员,不需要铁来生长。然而已经在植物乳杆菌(Lactiplantibacillus plantarum)和清酒乳杆菌(Latilactobacillus sakei)中鉴定出了特定的系统。
研究这些细菌可能会揭示新的铁吸收途径。在铁吸收的主要部位十二指肠中,大约有103 个细菌/克,低于空肠(104 个细菌/克),并且远低于结肠,结肠中的细菌数量高达1012 个细菌/克。
此外,乳杆菌科属的成员在铁吸收最多的小肠中数量众多,因此这些细菌对宿主铁吸收的作用应受到更多关注,以确定它们是否在铁的生物利用度中发挥作用。
▼
铁对于许多细菌来说是必需的,它们的生长需要铁。
据计算,结肠中的铁浓度很高,并且远远超过细菌生长的最低要求。但细菌对铁的生物利用度还取决于一系列因素(铁的形式、铁形态、pH值、氧气水平等)。
不同形式的铁可用于补充或强化,例如硫酸亚铁、富马酸亚铁或乙二胺四乙酸铁钠。由于铁补充剂中含有的铁明显多于人体可以吸收的铁,因此大量未吸收的铁会留在消化道内腔中。
•铁补充剂会导致潜在致病菌水平升高
多项人类研究表明,铁补充剂或强化铁会导致潜在致病菌水平升高,并导致通常被认为是有益细菌种类减少,例如乳杆菌科成员。
最近一项针对大鼠的研究还表明,出生后补充铁会导致肠道微生物群发生改变,这种改变会持续到成年期。此外,研究表明,抗生素治疗后服用铁剂会导致肠道细菌的组成和功能发生改变。
铁对于致病细菌至关重要,哺乳动物的免疫系统已经具备了通过表达铁结合蛋白(如脂质运载蛋白-2 或乳铁蛋白)来控制细菌对铁的可用性的能力,这种现象称为“营养免疫”。
研究了补充铁对肠道微生物群的作用,总的来说,根据所使用的模型(体外、动物或人类),结果似乎有很大不同。
事实上,在补充铁期间,乳杆菌科总是减少,这在体外、小鼠和婴儿中均观察到。所用铁的化学形式似乎对细菌组成有不同的影响。此外,出乎意料的是,补充铁的效果与缺铁的效果并不直接相反。
▼
对于细菌和人体来说,非血红素铁的生物利用度低于血红素铁的生物利用度,因为它受到食物基质的成分和管腔的物理化学成分的影响。
•肠道细菌有助于更好地吸收铁
事实上,许多食物基质中的非血红素铁与抑制剂(例如多酚、纤维或植酸盐)相连,这些抑制剂可以被专用细菌酶降解,从而导致更好的铁吸收。
细菌还可以通过发酵饮食中的不可消化碳水化合物来产生短链脂肪酸,这会降低管腔pH值,从而将三价铁还原为二价铁,从而提高其被细菌和宿主的吸收。
其他一些有机酸(例如乳酸)是由许多细菌产生的,存在于整个消化道中。酸化的肠道环境还可以降解螯合微量营养素的复合物并促进铁的吸收。
扩展阅读:
▼
考虑到补铁的依从性低以及腹泻或便秘等副作用,很多研究已经测试和发现其他改善铁状态的策略。
它们包括使用益生菌、益生元和后生元等。
•使用益生菌改善铁状况
例如,将益生菌植物乳杆菌(Lactiplantibacillus plantarum 299v)与铁、抗坏血酸和叶酸一起食用,对健康、非贫血的瑞典孕妇的铁状况是安全的,可减少铁储备的损失并改善铁状况。
在另一项研究中,将果胶组装成铁纳米颗粒作为基质,用于植物乳杆菌(Lactiplantibacillus plantarum CIDCA 83114)的递送。益生菌没有毒性,生存能力没有减弱,这为用替代的铁输送策略对抗缺铁提供了新的视角。
•使用益生元帮助铁的吸收
在大鼠模型中,食用益生元寡糖通过调节肠道微生物群来增强铁吸收。摄入益生元后肠道pH值的降低可以帮助铁的吸收,此外还能以有益的方式改变肠道微生物组成。因此,益生元可以成为改善宿主铁状况的良好选择。
•食用乳铁蛋白增加铁的吸收
在肯尼亚婴儿中,研究表明,与单独服用硫酸亚铁相比,同时食用无铁乳铁蛋白(脱铁乳铁蛋白)和硫酸亚铁能够显著增加铁的吸收。
注:考虑到乳铁蛋白对肠道微生物群的影响,一些学者认为乳铁蛋白可能在婴儿铁配方中有用,因为它可以增加铁的吸收,同时可能减轻未吸收的铁对肠道微生物群的不利影响。
•使用富铁微生物
这些预防和治疗缺铁的新策略可能包括使用富铁微生物,除了从益生菌摄入中获益之外,它还可以为宿主提供大量矿物质。
在贫血小鼠中已显示,食用在铁存在下生长的酵母能够提高小鼠的血红蛋白浓度。在人类中只进行了一些尝试,其中含有富铁酵母的奶酪的吸收效率不如单独含有硫酸铁的奶酪。
注:还应该进行补充研究来评估富铁微生物在人类中的应用的全部潜力。
小结
从上面可以明显看出,肠道细菌在调节宿主铁的生物利用度方面发挥着重要作用。然而,宿主因素可以调节细菌对铁的吸收,例如,在炎症的情况下,脂质运载蛋白将与铁载体结合,从而对抗肠道细菌对铁的捕获。
最近,有人提出,共生细菌不仅使用不同的机制来释放和捕获铁,而且还在它们自己和它们的宿主之间共享铁。事实上,细菌扩散性铁载体生产的例子可以捕获铁,但不能保证这些铁将被生产细菌利用,这表明对可用铁的共同管理。
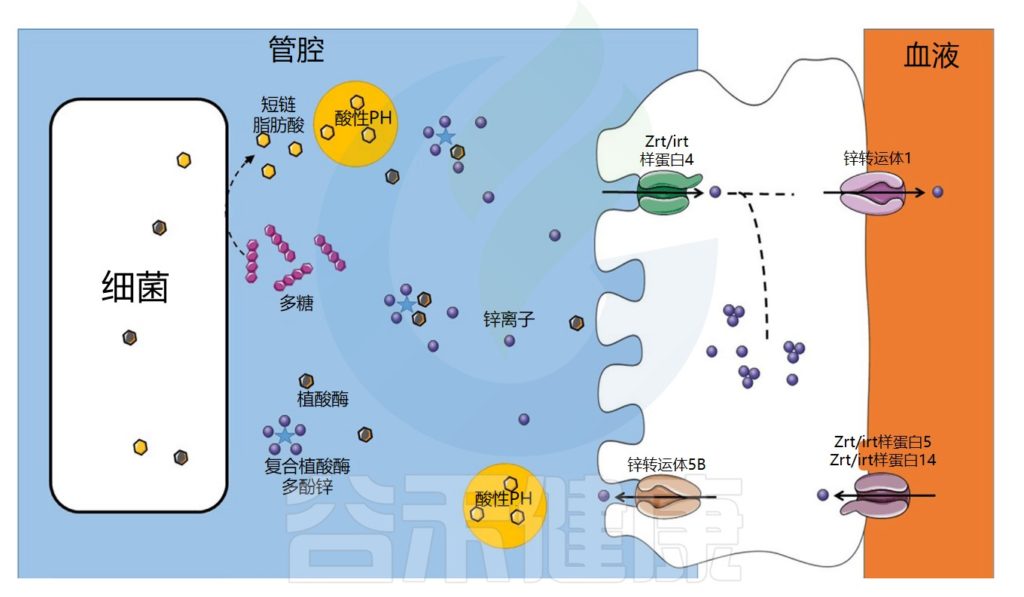
迄今为止,人类对锌、宿主和肠道微生物群之间相互作用的研究远少于铁。
★ 人体需要每日摄入锌
每日摄入锌补充剂,成人 40 毫克/天,通常被认为是安全的。
锌参与DNA合成、转录和翻译等重要过程。锌的吸收发生在十二指肠,涉及跨膜锌转运蛋白Zip4。然后,锌通过锌调节蛋白ZnT2-10转运至金属蛋白合成位点,或通过锌转运蛋白ZnT1输出至循环系统。
与铁相反,哺乳动物缺乏锌储存机制,每日摄入是必不可少的。如果过量,锌也可以主动排泄,锌通过基底外侧的 Zip5/Zip14 蛋白从循环分配到肠上皮细胞,并通过ZnT5从肠上皮细胞流出到管腔。
肠道微生物群在锌吸收中的作用示意图
Dje Kouadio DK,et al.Crit Rev Food Sci Nutr.2023
锌的转运与吸收过程
在食物中,锌可以与抗营养因子如植酸盐或多酚络合,从而减少其吸收。未被小肠吸收的锌会到达结肠,并可能被结肠细胞吸收,因为锌转运蛋白也在结肠中表达。
在细菌中,锌通过锌伴侣蛋白转运至金属蛋白合成位点。细菌对锌的吸收受锌吸收抑制因子Zur和锌流出抑制因子CzrA的调节。一些病原菌可以通过表达高亲和力转运蛋白(ZnuABC)来克服锌限制条件。
锌浓度过高可能对某些病原菌有毒。与铁的情况一样,宿主和病原微生物之间也存在竞争。事实上,宿主还利用营养免疫来通过产生钙卫蛋白来限制锌的生物利用度。
例如,钙卫蛋白在消化道中结合锌。
▼
锌缺乏与慢性腹泻相关。补锌对肠道微生物群的影响主要在动物模型中进行研究。它已在家禽和养猪业中以药物剂量用于减少胃肠道感染和腹泻。
√锌具有抗菌活性,能够减少腹泻
锌具有抗菌活性,不同的研究强调了高剂量的锌会引起肠道不同部位(从胃到结肠)细菌组成的变化。
在断奶仔猪中,使用低剂量的锌可以通过改善小肠形态和通透性、增强屏障功能,有效促进生长性能并减少腹泻。
此外,锌还能丰富肠道微生物群中的链球菌科(Streptococcaceae)和乳杆菌科(Lactobacillaceae),并减少芽孢杆菌和肠道疾病相关病原体,包括回肠腔中的梭状芽胞杆菌和克罗诺杆菌。
注:如果缺锌小鼠补充锌是有益的,那么过量的锌饮食摄入会改变肠道微生物群并降低对艰难梭菌感染的抵抗力。
√一些菌属可以预测锌的充足性
但研究结果并不一致。事实上,一项针对鸡的研究表明,瘤胃球菌属(Ruminococcus)可以预测宿主体内锌的充足性。但在一项针对小鼠的研究中,黑色素杆菌(Melainabacteria)和脱硫弧菌属(Desulfovibrio)被确定为锌状态的潜在标志物。
▼
尽管许多代谢过程都需要锌,但关于锌状态或补充剂对肠道微生物群影响的研究却很少。
√一些细菌可以作为锌缺乏的生物标志物
最近的研究表明,尽管缺锌和锌充足的学龄儿童之间的细菌多样性相似,但缺锌儿童的个体多样性更高。特别是,粪杆菌(Coprobacter)、醋酸弧菌(Acetivibrio)、副普雷沃氏菌(Paraprevotella)和梭状芽胞杆菌在缺锌组中更为丰富。它们可以用作进一步临床诊断锌缺乏的生物标志物,但需要更多的工作来推广这一结果。
锌的摄入量也会显著增加儿童粪便细菌。在同一项研究中还鉴定出了纳米颗粒抗性细菌的一些代表。
▼
由于补锌会改变肠道微生物群的组成和功能,因此许多研究已经研究了锌与益生菌一起服用的效果。
√锌与益生菌一起补充
例如,在大鼠中,施用在富锌培养基中生长的长双歧杆菌(Bifidobacterium longum CCFM1195)比单独补充锌更能有效地增加血浆锌浓度。
此外,一些细菌群(如乳杆菌科)的丰度随着富含锌的双歧杆菌的消耗而增加。使用富含硒和锌的植物乳杆菌对小鼠进行类似的设计,与对照组或补充硒锌的组相比,能够增加循环锌浓度。这种增加伴随着肠道细菌组成的改变,乳杆菌科(Lactobacillaceae)的比例增加。
√儿童单独补充锌可能更有效
最近总结了研究中获得的数据,对于24个月以下儿童的治疗,单独补充锌可能比益生菌更有效;在学龄前儿童中同时补充锌和植物乳杆菌并不比单独补充益生菌更有效。因此,锌和益生菌联合给药的有效性需要更多的人体研究。
使用益生元似乎效率较低,因为给猪施用锌和马铃薯纤维对大多数分析指标没有显示出任何交互作用。
注:锌源和纤维补充对微生物群生态的影响是独立的。
小结
与铁的情况一样,对锌状态和宿主微生物群的研究主要集中在致病条件上,而对细菌在正常情况下的作用知之甚少。
肠道细菌、锌和宿主之间的关系值得更深入地研究,尤其是在人类中。事实上,富锌益生菌等有前途的工具正在出现,它们代表了治疗锌缺乏症的替代方案。特别是大剂量、长期补锌可能会干扰铁和铜的吸收,导致铁和铜的缺乏。
叶酸,也可以称之为维生素B9,是一种水溶性维生素。叶酸在蛋白质合成及细胞分裂与生长过程中具有重要作用,对正常红细胞的形成有促进作用。
一些共生细菌已被证明可以合成某些维生素,细菌也可以成为宿主叶酸的来源,即使整体贡献的程度不清楚。同时,叶酸的摄入会影响肠道微生物群。
叶酸的转运与吸收过程
饮食中的叶酸以单谷氨酸盐和聚谷氨酸盐形式存在,它们被肠道结合物分解为单谷氨酸盐形式,然后通过特定的转运蛋白偶联叶酸转运蛋白(PCFT)在回肠中吸收。
在肠上皮细胞中,叶酸单谷氨酸转化为活性形式5-甲基四氢叶酸(5-MTHF),它可以被运输到循环系统。
注:细胞叶酸外排可能由多个耐药蛋白(MRPs)家族介导。在结肠中,已经发现了相同的一种受体。
肠道微生物群在叶酸吸收中的作用示意图
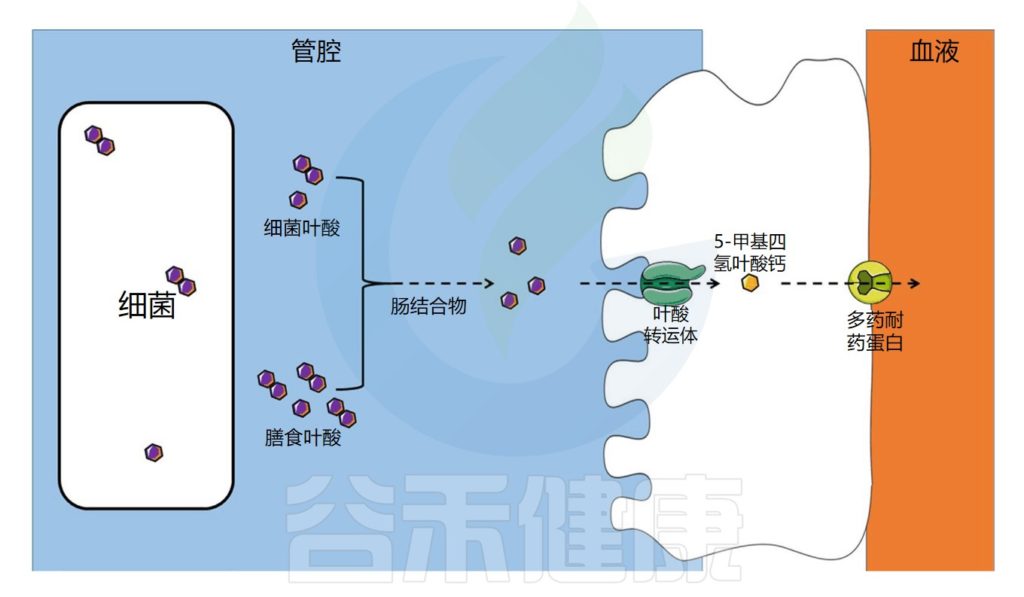
Dje Kouadio DK,et al.Crit Rev Food Sci Nutr.2023
▼
细菌的生长需要叶酸,一些细菌是原养型细菌,可以从环境中存在的前体合成叶酸,而营养缺陷型细菌必须从环境中获取叶酸。
✦肠道细菌合成叶酸
大量文献支持细菌叶酸合成对宿主叶酸状态的重要贡献。早期研究报告称,人类粪便样本中的叶酸浓度为300-500µg/天,而饮食摄入量低于100µg/天,表明肠道细菌可以合成叶酸。
事实上,512个细菌基因组的叶酸生物合成能力预测表明,其中13%的细菌基因组包含所有叶酸生物合成相关基因,而39%的细菌基因组可以在外部来源提供额外的对氨基苯甲酸的情况下合成叶酸。
总而言之,这些数据表明肠道微生物群是叶酸的重要来源,并且饮食等不同因素导致的肠道微生物群组成的变化可能会影响叶酸的需求。
✦肠道细菌可以转化叶酸以便更好地利用
由于纤维消耗而改变肠道微生物群组成可能导致结肠内容物或循环中叶酸浓度增加。此外,尽管结肠中的叶酸吸收比小肠中的叶酸吸收慢100倍,但标记的叶酸被专门包裹在结肠中并在结肠中分解,并被纳入宿主组织。
肠道细菌不仅合成可供宿主使用的叶酸,还可以将叶酸转化为更好地被宿主吸收的维生素体,正如秀丽隐杆线虫(Caenorabditis Elegans)模型所证明的那样,其中细菌可以将叶酸转化为四氢叶酸。
✦微生物代谢叶酸的能力与宿主生理状况相关
肠道微生物群的代谢能力不仅取决于其组成,还取决于宿主的生理特征。例如,与成人相比,婴儿和幼儿肠道微生物群中更频繁地发现编码参与叶酸生物合成的酶的基因。
有趣的是,受营养不良影响的儿童的微生物组显示,参与B族维生素代谢的多个途径中的基因丰度显著降低。此外,在肥胖女性中观察到叶酸水平较低,同时产生B族维生素的细菌也减少。
▼
许多产生叶酸的细菌被鉴定并成功用于增加发酵食品的叶酸含量。其中一些细菌还能够改善缺乏叶酸饮食的啮齿动物的叶酸状况。
✦产生叶酸的益生菌改善叶酸状态并调节微生物组成
使用产生叶酸的益生菌可能是改善叶酸状态并调节肠道微生物群的一种方法。在体外发现了有希望的结果,其中产生叶酸的清酒乳杆菌(Latilactobacillus sakei)被证明可以增加短链脂肪酸并改变粪便细菌组成。
在大鼠中,食用使用产生叶酸的植物乳杆菌制备的发酵奶能够恢复正常的叶酸状态,同时广泛改变肠道细菌组成。
▼
叶酸摄入量对肠道细菌的影响并不一致。
✦叶酸缺乏可能影响部分动物的肠道细菌组成
在小鼠身上发现膳食叶酸缺乏不会影响肠道细菌组成,可能是一些细菌可以在缺乏时产生叶酸,叶酸摄入量的波动对肠道微生物群的影响较小。
然而,在其他动物模型中,叶酸摄入改变了肠道微生物群的组成,例如鸡和小猪。
✦叶酸缺乏影响微生物多样性
叶酸缺乏也会影响微生物多样性,因为在限生小鼠中发现,与微量营养素充足的饮食相比,叶酸缺乏的饮食在21天后增加了β多样性,但随后的14天全饮食治疗并没有改变这一趋势。
小结
宿主的叶酸状态、食物或肠道中的叶酸产生细菌之间存在多种关联。这种关联通常是矛盾的,但有利于宿主和细菌区室之间的密切相互作用,这表明需要进行大规模人类研究,以更好地了解与叶酸可用性和改善人群叶酸状态的策略相关的宿主-微生物群相互作用。
叶酸重要天然来源有:
花生(246微克/100克)、葵花籽(238微克/100克)、芦笋(149微克/100克)、生菜(136微克/100克)、一些绿叶蔬菜和柑橘类水果等。
扩展阅读:维生素B9(叶酸)
维生素A在免疫调节中发挥着至关重要的作用,包括调节细胞因子的产生和淋巴细胞归巢至粘膜表面。它通过调节肠上皮中免疫细胞的增殖和分化,直接有助于维持肠道屏障,并在抵抗肠道病原体入侵方面发挥着至关重要的作用。
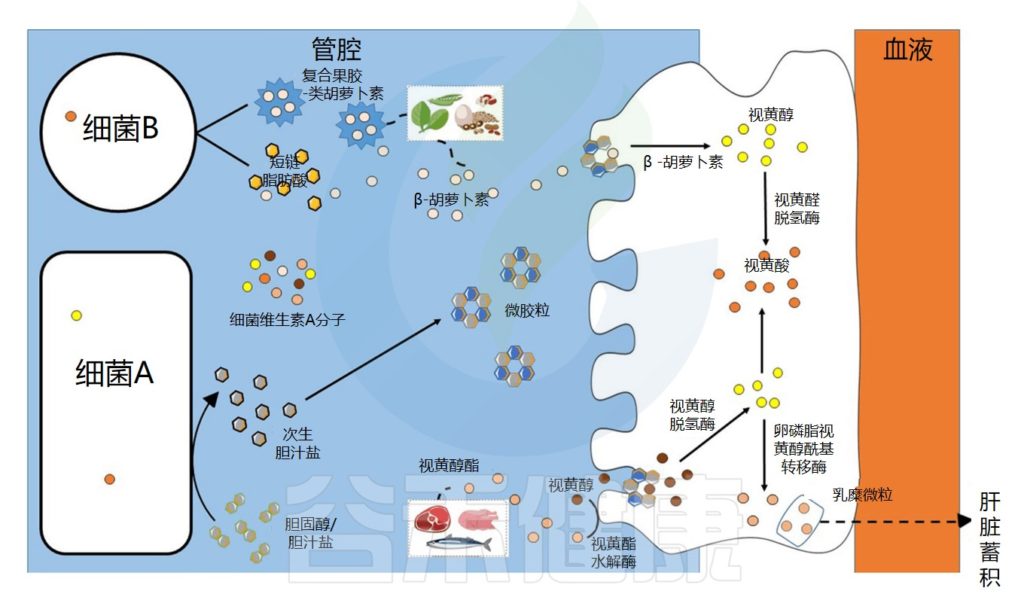
膳食维生素A以视黄醇和类胡萝卜素的形式存在,分别存在于动物和蔬菜中。
肠道微生物群在维生素A吸收中的作用示意图
Dje Kouadio DK,et al.Crit Rev Food Sci Nutr.2023
维生素A的吸收过程
视黄醇和类胡萝卜素是膳食脂溶性成分,在被肠上皮细胞吸收之前需要通过胶束溶解 。在胃和十二指肠中发生乳化成液滴的阶段,类胡萝卜素和视黄醇的摄取发生在小肠的上半部。
在肠上皮细胞中,类胡萝卜素通过胡萝卜素-15,15′-双加氧酶直接转化为全反式视黄醛。视黄醛可被视黄醛脱氢酶不可逆地转化为具有生物活性的视黄酸分子,或被转化为视黄醇酯,储存在肝脏中。
▼
肠道微生物群在维生素A代谢中的作用可能依赖于特定酶、脂多糖的产生,脂多糖可能有助于胶束形成或直接吸收,以及胆汁稳态。
•微生物通过调节胆汁酸有利于维生素A的溶解和吸收
一项以绵羊为模型的研究表明,宿主微生物群通过调节胆汁酸分泌对维生素A吸收产生影响。在该模型中,胆汁酸水平降低与维生素A吸收减少相关,并与瘤胃球菌科丰度密切相关。
由乳杆菌(Lactobacillaceae)、双歧杆菌(Bifidobacterium)、拟杆菌(Bacteroides)或梭菌属等细菌产生的二级或三级胆汁盐的分泌可能有利于维生素A的溶解并改善其吸收,因为胆汁盐对于胶束化过程至关重要。
•肠道微生物可以直接和间接影响维生素A代谢
肠道细菌的基因组具有在动物和植物中发现的不同酶的类似物,这些酶允许乙酰辅酶A通过甲羟戊酸途径合成类胡萝卜素和类维生素A。
此外,来自拟杆菌(Bacteroides)、肠球菌(Enterococcus)和链球菌(Streptococcus)的细菌具有与宿主BCMO基因相似的brp/blh基因,可以将β-胡萝卜素转化为全反式视黄醇。
因此,肠道微生物组对维生素A代谢的影响既包括直接影响(如类胡萝卜素的合成),也包括间接影响(如调节其生物利用度)。
•肠道微生物合成相关蛋白有助于维生素A转运
类胡萝卜素的生物利用度会受到各种食物成分的影响,其中食物基质中蔬菜的细胞壁结构和组成形成物理屏障,从而限制消化酶的作用。
果胶和一些多酚(例如柚皮素)已被证明可以通过结合管腔中的胆固醇和胆汁盐来降低类胡萝卜素的体外生物利用度,从而抑制胶束的形成。
相反,果胶可以被许多共生细菌降解,并且肠道中的这种降解可能会增加类胡萝卜素的生物利用度。
此外,肠道微生物群合成酶或补体蛋白,例如细菌脂质运载蛋白,这可能有助于将类维生素A转运到肠上皮细胞中。
•肠道细菌调节宿主视黄醇的代谢
肠道微生物群可以消化膳食纤维,从而释放 β-胡萝卜素或其他结合态的微量营养素。
此外,肠道细菌群还可以调节宿主视黄醇的代谢,调节驱动免疫反应的视黄酸的产生。梭状芽胞杆菌类细菌可以通过抑制基因Rdh7的表达来调节肠道上皮中的视黄酸浓度,从而启动视黄醇向视黄酸的转化。
此外,这项研究表明,共生细菌群落降低了视黄酸的产生,视黄酸的产生通过肝脏储存形式的增加来平衡,并有利于视黄酯途径,而潜在致病菌则促进视黄酸的产生。
▼
肠道中维生素A的状态和类视黄醇的可用性可以调节肠道微生物的组成。
•维生素A调节免疫球蛋白的产生帮助保持细菌稳态
类胡萝卜素摄入、免疫功能和肠道细菌稳态之间相互作用的模型,表明维生素A可以通过调节IgA的产生来有助于保持细菌稳态。
在动物中,与未缺乏维生素A的小鼠相比,缺乏维生素A的小鼠的肠道微生物组成中,以下菌属的丰度较低:
另一项研究表明,拟杆菌在维生素A缺乏小鼠中的比例较低,维生素A缺乏组和维生素A充足组之间的几个细菌比例不同。在小鼠模型中,维生素A被证明可以调节分段丝状细菌(SFB)的丰度。
分段丝状细菌是一组能够诱导Th17细胞分化的细菌。
▼
•维生素A的摄入与微生物群多样性相关
类胡萝卜素的摄入量和状态与更大的微生物群多样性和有益细菌丰度的增加有关。
例如,在孕妇中,类胡萝卜素的摄入量和血浆浓度与肠道微生物群的α多样性呈正相关。
•维生素A影响免疫反应
维生素A对肠道微生物群组成的调节可能作为调节肠道免疫反应的间接途径。
例如,维生素A在体外和体内均被证明可以抑制诺如病毒(急性胃肠炎最常见的病毒因子)的复制,并且这种抑制似乎是通过微生物组变化直接或间接发生的,特别是肠道中的乳杆菌科。
•改善疾病患者的微生物组成
在溃疡性结肠炎患者中,摄入维生素A有益,可导致微生物群组成发生显著变化。
在自闭症儿童中,维生素A补充剂增加了拟杆菌目细菌的比例,并减少了双歧杆菌属的细菌比例。
有趣的是,一项针对306名孟加拉国新生儿的研究表明,与安慰剂相比,补充维生素A增加了男孩双歧杆菌的丰度,而这种差异在女孩中并未观察到。
对这些婴儿直至2岁的随访表明,女孩中放线菌相对丰度与血浆视黄醇呈浓度依赖性正相关,但男孩中则不然。
此外,阿克曼菌(一种与粘膜相关的细菌)的相对丰度也与女孩的血浆视黄醇呈正相关。
微生物群在肠道中参与了微量营养素的代谢和吸收,并且可以影响宿主的微量营养素状态。在这方面,给出以下一些建议:
➤ 1
摄入多样化的食物可以为肠道微生物提供更广泛的营养来源,从而促进微生物群的多样性和稳定性。
建议摄入富含膳食纤维的水果、发酵食物、蔬菜、全谷类食物以及富含微量营养素的食物,如坚果和海鲜等。
例如,香蕉钾含量高,还含有大量维生素 B6 和维生素 C。西兰花不仅富含维生素 C,还富含维生素 K、铁、钙和钾。
确保摄入足够的每种维生素和矿物质的一个简单方法就是“彩虹饮食”,彩虹饮食顾名思义就是色彩缤纷的蔬菜和水果,它们含有丰富的微量营养素,是一种健康趋势。每餐可以注意一下,是否有至少三到四种不同颜色的植物性食物,对于孩子,也可以鼓励他们去寻找不同的颜色。

下表列出了常见的维生素的食物来源,可供参考。

➤2
维生素D可以增加肠道对钙的吸收能力,并促进钙的转运到骨骼和其他组织中。
维生素 C 有助于改善植物中铁的吸收,这对于素食者来说尤其重要,可以在菠菜沙拉中添加柠檬汁。维生素C通过提高铁的溶解度或作为十二指肠细胞色素B将铁从铁还原为铁的辅助因子,有助于非血红素铁的生物利用度。
维生素B12和叶酸之间存在相互依赖的关系。维生素B12参与叶酸的代谢和激活,而叶酸则有助于维生素B12的合成和利用。
其他如,维生素E是一种脂溶性维生素,需要脂肪的存在来促进其吸收。摄入适量的脂肪可以提高维生素E的吸收率。
微量营养素之间的相互作用是复杂的,并且还受到其他因素的影响,最好的方式是通过均衡的饮食来获取各种微量营养素,因为食物中的微量营养素通常以复杂的组合形式存在,相互之间的相互作用更加协调和自然。
➤3
益生菌和益生元是一些有益的微生物和它们的营养物质,可以促进肠道的健康和微生物群的平衡。
建议摄入含有益生菌的酸奶、发酵食品、益生元的食物如洋葱、大蒜和麦麸等,以支持肠道微生物的生长和活动。
益生菌和益生元可能有助于微量营养素的最佳生物利用度,减少负面影响
例如,益生元低聚半乳糖减轻了补铁对婴儿肠道的不利影响,而罗伊氏乳杆菌与泻药氧化镁结合使用可以改善儿童的慢性便秘,而不会导致微生物组失衡。
益生元可以改变肠道微生物群,促进产短链脂肪酸的菌产生(如双歧杆菌、乳酸杆菌、真杆菌等),与钙吸收(在人类和动物模型中)、骨密度和强度(在动物模型中)增加相关。
扩展阅读:
肠道微生物群与健康:探究发酵食品、饮食方式、益生菌和后生元的影响
➤4
一般来说,在小谷物食品的自然发酵中,B族维生素的利用率可能会增加,并且可能会产生一些氨基酸,虽然说谷物含有一些维生素,但在小谷物食品发酵过程中添加乳酸菌或酵母可能会提高维生素水平。
例如,添加乳酸乳球菌N8 和布拉酵母菌Saccharomyces boulardii SAA655可将 idli 面糊中核黄素和叶酸的浓度提高 40-90%。
注:Idli 是印度的一种传统发酵面包,是一种由大米和脱壳黑豆原料的混合物,经过湿磨和传统发酵制成的糕点。
尽管小米主要用于制造面粉,但其加工(发芽和发酵)会增加谷物的铁含量。
➤5
抗生素的滥用可能破坏肠道微生物群的平衡,影响微量营养素的代谢和吸收。
抗生素还可能导致肠道黏膜的炎症反应,进一步干扰微量营养素的吸收和利用。
在使用抗生素时,建议按照医生的指导使用,并且在必要时采取预防措施,如同时摄入益生菌和益生元,以减少对肠道微生物的不良影响。
扩展阅读:
➤6
过度摄入糖或长期的压力和焦虑会对肠道微生物和宿主营养吸收产生不良后果。
深加工食品通常经过多道工序,其中许多有益的营养物质可能被去除或破坏。这些食品通常富含添加剂、防腐剂和高糖分,而这些成分可能会对微量营养素的吸收和利用产生负面影响。
通过减少摄入加工食品、管理压力等干预措施,可以帮助改善营养吸收和维持良好的微量营养素水平。
扩展阅读:
你的焦虑可能与食品添加剂有关,警惕食品添加剂引起的微生物群变化
➤7
运动可以改善血液循环,增加血液流向肠道和其他组织,从而提高微量营养素的输送和吸收。
运动还可以提高新陈代谢,提高能量消耗和细胞代谢的速度。这可能会导致对微量营养素的需求增加,从而促进其吸收和利用。
➤8
定期体检可以帮助发现潜在的营养和健康问题,及早采取措施。
定期进行体检是监测体内微量营养素的一种方法,但它可能无法提供详细的微量营养素水平信息。常规体检通常包括血液检查,可以检测一些关键的营养素水平,如铁、维生素B12、维生素D等。对于有些微量营养素,可能需要进行特殊的检测。
➤9
由于每个人的肠道微生物群和微量营养素状态可能存在差异,个体化的营养咨询和评估可以帮助确定针对个体需求的饮食和营养。
肠道菌群和微量营养素之间存在着紧密的关系和相互作用。肠道菌群中的某些菌种可以帮助合成和吸收微量营养素。这些菌种通过代谢和转化,将食物中的原始形式的微量营养素转化为人体可以吸收和利用的活性形式,提供给宿主机体所需。
同时,适当的微量营养素摄取也对肠道菌群的平衡和健康至关重要。一些微量营养素,如锌、铁等,不仅是肠道菌群的生长和代谢所必需,还能影响菌群的结构和功能。缺乏这些微量营养素可能导致菌群紊乱,而菌群紊乱又可能影响微量营养素的吸收和利用。
肠道细菌对宿主微量营养素状态的影响是一个急需关注的研究领域。同时对微量营养素代谢的研究应该扩大到包括一般肠道微生物组成,而不仅仅是病原菌。
相关阅读:
主要参考文献
Dje Kouadio DK, Wieringa F, Greffeuille V, Humblot C. Bacteria from the gut influence the host micronutrient status. Crit Rev Food Sci Nutr. 2023 Jun 27:1-16.
Amimo, J., H. Michael, J. Chepngeno, S. Raev, L. Saif, and A. Vlasova. 2022. Immune impairment associated with vitamin A deficiency: Insights from clinical studies and animal model research. Nutrients 14 (23):5038.
Baldi, A. J., L. M. Larson, and S.-R. Pasricha. 2020. Balancing safety and potential for impact in universal iron interventions. Global Landscape of Nutrition Challenges in Infants and Children 93:51–62.
Cuisiniere, T., A. Calve, G. Fragoso, M. Oliero, R. Hajjar, E. Gonzalez, and M. Santos. 2021. Oral iron supplementation after antibiotic exposure induces a deleterious recovery of the gut microbiota. BMC Microbiology 21 (1):1–15.
Kang, S., R. Li, H. Jin, H. Y ou, and G. Ji. 2020. Effects of selenium and zinc-enriched Lactobacillus plantarum SeZi on antioxidant capacities and gut microbiome in an ICR mouse model. Antioxidants 9 (10):1028.
Kramer, J., Ö. Özkaya, and R. Kümmerli. 2020. Bacterial siderophores in community and host interactions. Nature Reviews. Microbiology 18 (3):152–63.
McMillen, S., S. Thomas, E. Liang, E. Nonnecke, C. Slupsky, and B. Lonnerdal. 2022. Gut microbiome alterations following postnatal iron supplementation depend on iron form and persist into adulthood. Nutrients 14 (3):412.
Qin H, Wu H, Shen K, Liu Y, Li M, Wang H, Qiao Z, Mu Z. Fermented Minor Grain Foods: Classification, Functional Components, and Probiotic Potential. Foods. 2022 Oct 11;11(20):3155. doi: 10.3390/foods11203155. PMID: 37430904; PMCID: PMC9601907.