 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

微量营养素缺乏或称之为“隐性饥饿”,是目前一个严重的公共卫生问题,会对儿童发育及成人健康造成严重后果。
传统的治疗和预防方法,有些时候并是很有效,并且可能产生不良副作用(例如补铁引起的消化问题)。
★ 肠道细菌与微量营养素间存在重要的相互作用
许多研究发现肠道中的共生细菌可以增加特定微量营养素的生物利用度,特别是通过去除抗营养化合物(例如植酸盐和多酚),或通过合成维生素。
肠道黏膜是抵御病原体的第一道防线。肠黏膜微生物群有助于增强肠上皮的完整性并更好地吸收微量营养素。
细菌代谢还依赖于从肠道环境中获取的微量营养素,常驻细菌可能会竞争或协作以维持微量营养素稳态。因此,肠道微生物群的组成可以通过微量营养素的可用性来调节。

本文汇集了有关微量营养素和肠道微生物群之间双向关系的最新知识,重点关注铁、锌、维生素A和叶酸(维生素B9),因为这些缺乏症是全球范围内的比较严重的公共卫生问题。
目录
1.微量营养素缺乏
2.微量营养素与宿主健康
3.营养素与细菌的相互作用:以铁为例
4.细菌在锌生物利用中的作用
5.微生物群与宿主叶酸间的关联
6.微生物群与维生素A的相互作用
7.改善人体微量营养素的建议
8.结语
微量营养素,包括矿物质和维生素,是每天只需要少量的物质,但对人体代谢至关重要。
▼
微量营养素缺乏在全世界范围内非常普遍,最新估计表明,3.72亿学龄前儿童和1.20亿育龄非孕妇缺乏一种或多种微量营养素。
维生素和矿物质缺乏,也被称为“隐性饥饿”,是一个严重的公共卫生问题,世界各个国家都存在,特别是低收入和中等收入国家的弱势群体。
在全球范围内,三分之二的妇女和儿童(主要来自经济不发达家庭)的饮食中至少缺乏一种微量营养素。全球最普遍的微量营养素缺乏症包括铁、锌、维生素A和叶酸。
★ 微量营养素缺乏会导致不良健康结果
微量营养素缺乏与多种不良健康结果相关,例如儿童发病率和死亡率增加、贫血、发育迟缓和认知缺陷。
虽然存在多种改善个人或人群微量营养素状况的策略,其中主食强化被认为是改善人群微量营养素状况最具成本效益的干预措施。
然而,由于多种原因,应对微量营养素缺乏症的策略并不总是有效。包括可接受性差(例如,孕妇铁补充剂)、强化水平差和质量控制不足(例如,维生素A强化食用油),强化食品未能惠及最贫困人群。
★ 不同营养素的吸收具有差异
微量营养素的吸收主要发生在小肠中,根据微量营养素的不同,具有不同的机制。
例如,锌和铁主要通过特定的运输载体在十二指肠和空肠中吸收,这些运输载体针对每种矿物质及其形式而异,而叶酸不仅在小肠中被吸收,而且在结肠中也被吸收,因为在这两个部位都鉴定出了转运蛋白。
微量营养素的吸收差异很大,例如,铁充足的男性成年人吸收的铁摄入量不到5%,而正常条件下摄入的锌吸收量大于30%。
注:大部分摄入的微量营养素会到达结肠。
★ 微生物群与微量营养素之间存在相互作用
在消化道中,有一个复杂的微生物群落,其浓度和多样性从口腔到结肠不断增加。尽管含有其他微生物(病毒、真菌),但大多数研究都重点关注细菌,其中厚壁菌门、拟杆菌门、放线菌门、变形菌门和疣微菌门是最重要的。
粪便细菌组成在个体之间存在很大差异,并且不仅取决于宿主的遗传学,还取决于包括饮食在内的许多环境因素。
注:大多数关于食物对肠道微生物群影响的研究都集中在大量营养素(脂肪、碳水化合物、蛋白质)上。
然而,细菌需要微量营养素才能生存。例如,细菌需要外部来源的铁,其中一些甚至开发出特定的机制,例如转铁蛋白来竞争铁源。
相比之下,许多细菌可以直接合成维生素,例如叶酸(维生素B9),因此不一定需要外部来源。
细菌影响微量营养素的生物利用度
常驻细菌可能对微量营养素产生直接作用,影响其对宿主的生物利用度,或者产生间接作用,例如通过产生能够改善上皮健康的代谢物,从而导致更好的吸收。
微量营养素影响肠道细菌的组成和功能
微量营养素的消耗反过来会影响肠道细菌的组成和功能。事实上,事实证明,补充铁可以导致潜在致病性肠杆菌科细菌的增加,以及被认为对健康具有积极影响的双歧杆菌科细菌和乳杆菌科细菌的减少。
微量营养素在控制人类健康的新陈代谢和组织功能维持中发挥着核心作用。
然而,尽管人们努力通过补充食品和饮食多样化来增加微量营养素的摄入量,全球微量营养素缺乏症的患病率仍然非常高,包括工业化国家。
推荐营养素摄入量和摄入上限
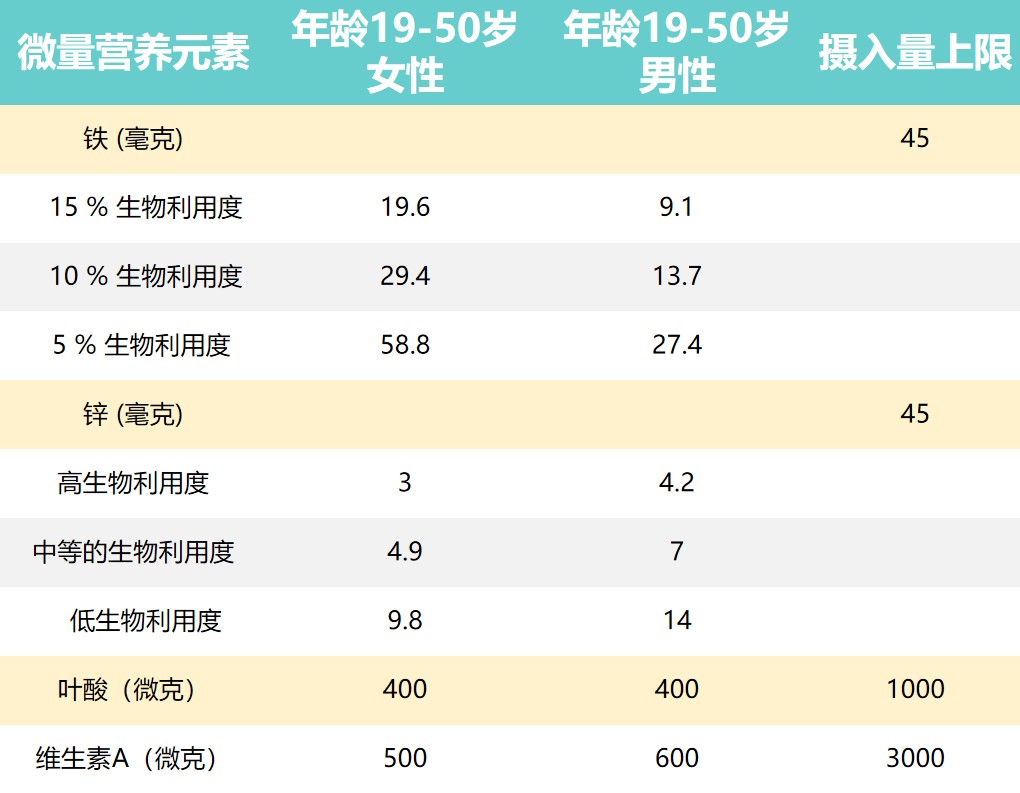
Dje Kouadio DK,et al.Crit Rev Food Sci Nutr.2023
上表提出了男性和女性一些推荐营养素摄入量和可耐受的上限摄入水平。
由于维持生长和补偿损失(例如月经)的需求更高,儿童和妇女受到的影响更大。
★ 缺乏微量营养素的症状多样且大部分在晚期
单一微量营养素缺乏的临床症状多种多样,并且通常是具有微量营养素特异性的,但一般发生在缺乏的晚期阶段。例如缺铁性贫血是缺铁的最后阶段。
▼
缺铁被认为是最常见的微量营养素缺乏症,全世界估计有超过20亿人缺铁。它会导致贫血、免疫功能受损、工作能力下降以及内分泌功能受损。
导致铁缺乏的因素包括:
(1)血红素铁摄入量低,其生物利用度高于非血红素铁
(2)富含植酸酶或酚类化合物的饮食会降低生物利用度
(3)慢性炎症,导致铁调素水平升高,下调铁吸收
▼
据估计,全球有超过10亿人缺锌,它与儿童生长迟缓相关,但也会降低免疫能力,从而增加儿童对多种疾病的易感性,包括腹泻、肺炎,也许还有疟疾。
此外,锌缺乏似乎会导致其他微量营养素缺乏。
▼
据估计,低收入和中等收入国家超过20%的育龄妇女缺乏叶酸。
怀孕期间叶酸摄入不足与胚胎最初几周的神经发育缺陷有关。在普通人群中,叶酸缺乏还会导致巨幼红细胞性贫血和神经系统症状,这些症状与维生素B12缺乏症的症状部分重叠。
▼
维生素A缺乏不仅会导致干眼症和失明,还会影响免疫功能的许多方面,导致免疫能力下降以及皮肤和上皮完整性降低。
许多低收入和中等收入国家每半年向5岁以下儿童提供高剂量维生素A补充剂,以降低儿童死亡率,但这种干预措施的有效性受到质疑。
有关铁、细菌和宿主的相互作用,参考了最近的研究,下面总结了这种复杂关系的关键要素。
铁的吸收和稳态受到严格调节
由于人类无法主动排泄铁,因此铁的吸收在十二指肠中受到严格调节。
// 血红素铁
血红素铁和非血红素铁通过两种不同的途径吸收,血红素铁被十二指肠刷膜边缘的血红素载体蛋白1(HCP1) 吸收。
// 非血红素铁
非血红素铁通常呈三价铁形式,不具有生物利用度,必须通过十二指肠细胞色素b(DCYTB) 将其还原为二价铁形式,然后再由二价金属转运蛋白 (DMT1) 转运到十二指肠刷膜上 。
注:二价金属转运蛋白的存在已被描述,铁也在回肠和结肠中被吸收,但这些吸收位点对宿主铁状态的贡献仍不清楚。
铁进入肠上皮细胞后,储存在铁蛋白中,或通过基底外侧铁转运蛋白输出到循环系统中。
铁稳态由激素铁调素调节,铁调素通过不同机制抑制铁释放到血浆中。
铁调素是由肝脏合成并分泌的富含半胱氨酸的抗菌多肽,在免疫过程中能够大量表达参与免疫反应;在机体内铁平衡的调节中起到负性调节的作用。
肠道微生物群在铁吸收中的作用示意图
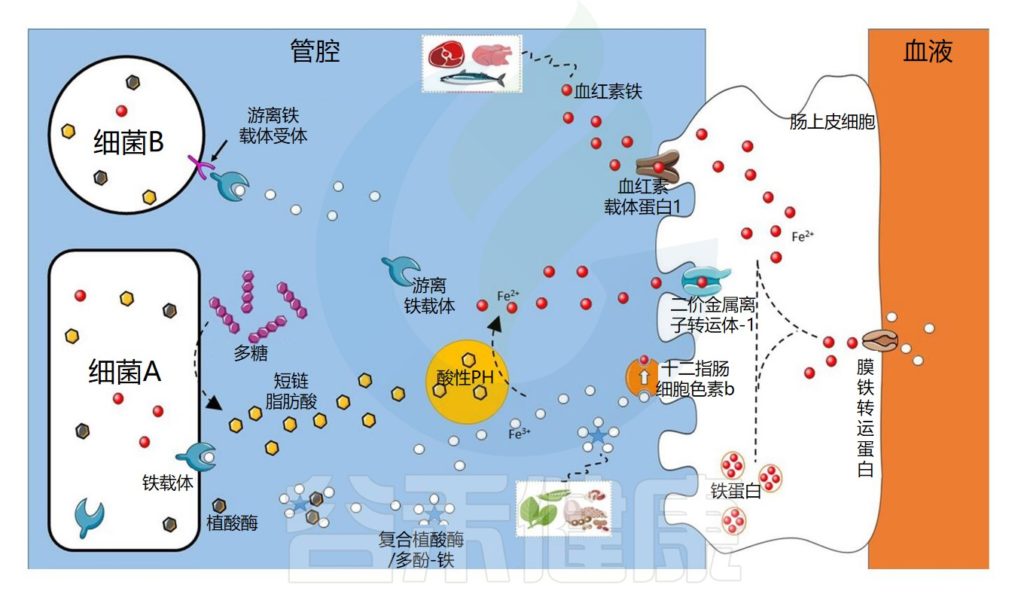
Dje Kouadio DK,et al.Crit Rev Food Sci Nutr.2023
细菌可以通过不同的机制获取铁
细菌可以通过不同的机制获取铁,例如使用称为铁载体的铁特异性螯合剂,铁载体是化学性质多样的次级代谢产物,对铁具有高亲和力。
由此产生的铁-铁载体复合物通过特定的外膜蛋白(上图中的细菌A)内化。细菌还可以通过产生具有不同配体结合位点的外膜受体来利用其他细菌产生的铁载体(上图中的细菌B)。
铁载体在细菌缺铁的情况下表达
铁载体在细菌缺铁的情况下表达,因此不在铁充足的环境中表达。在厌氧条件和低pH值下,铁主要以二价铁的形式存在,可以被细菌直接转运,主要通过专用转运系统Feo,由不同的蛋白质。
细菌可以利用宿主铁化合物
细菌还可以利用宿主铁化合物,例如血红素或转铁蛋白,它们通过特定受体转运或直接吸收。此外,尽管牛奶中存在的乳铁蛋白具有抑菌功能,但它也可以被具有特定受体的细菌利用。
铁吸收的调节对于细菌非常重要,因为铁在较高浓度下有毒。在许多细菌物种中,当铁浓度过高时,铁吸收调节蛋白 (Fur) 会抑制与铁吸收相关的基因转录。
研究细菌有助于揭示新的铁吸收途径
值得注意的是,大部分关于细菌铁吸收的知识来自对病原菌的研究。长期以来,人们一直认为一些有益菌,例如乳杆菌科的成员,不需要铁来生长。然而已经在植物乳杆菌(Lactiplantibacillus plantarum)和清酒乳杆菌(Latilactobacillus sakei)中鉴定出了特定的系统。
研究这些细菌可能会揭示新的铁吸收途径。在铁吸收的主要部位十二指肠中,大约有103 个细菌/克,低于空肠(104 个细菌/克),并且远低于结肠,结肠中的细菌数量高达1012 个细菌/克。
此外,乳杆菌科属的成员在铁吸收最多的小肠中数量众多,因此这些细菌对宿主铁吸收的作用应受到更多关注,以确定它们是否在铁的生物利用度中发挥作用。
▼
铁对于许多细菌来说是必需的,它们的生长需要铁。
据计算,结肠中的铁浓度很高,并且远远超过细菌生长的最低要求。但细菌对铁的生物利用度还取决于一系列因素(铁的形式、铁形态、pH值、氧气水平等)。
不同形式的铁可用于补充或强化,例如硫酸亚铁、富马酸亚铁或乙二胺四乙酸铁钠。由于铁补充剂中含有的铁明显多于人体可以吸收的铁,因此大量未吸收的铁会留在消化道内腔中。
•铁补充剂会导致潜在致病菌水平升高
多项人类研究表明,铁补充剂或强化铁会导致潜在致病菌水平升高,并导致通常被认为是有益细菌种类减少,例如乳杆菌科成员。
最近一项针对大鼠的研究还表明,出生后补充铁会导致肠道微生物群发生改变,这种改变会持续到成年期。此外,研究表明,抗生素治疗后服用铁剂会导致肠道细菌的组成和功能发生改变。
铁对于致病细菌至关重要,哺乳动物的免疫系统已经具备了通过表达铁结合蛋白(如脂质运载蛋白-2 或乳铁蛋白)来控制细菌对铁的可用性的能力,这种现象称为“营养免疫”。
研究了补充铁对肠道微生物群的作用,总的来说,根据所使用的模型(体外、动物或人类),结果似乎有很大不同。
事实上,在补充铁期间,乳杆菌科总是减少,这在体外、小鼠和婴儿中均观察到。所用铁的化学形式似乎对细菌组成有不同的影响。此外,出乎意料的是,补充铁的效果与缺铁的效果并不直接相反。
▼
对于细菌和人体来说,非血红素铁的生物利用度低于血红素铁的生物利用度,因为它受到食物基质的成分和管腔的物理化学成分的影响。
•肠道细菌有助于更好地吸收铁
事实上,许多食物基质中的非血红素铁与抑制剂(例如多酚、纤维或植酸盐)相连,这些抑制剂可以被专用细菌酶降解,从而导致更好的铁吸收。
细菌还可以通过发酵饮食中的不可消化碳水化合物来产生短链脂肪酸,这会降低管腔pH值,从而将三价铁还原为二价铁,从而提高其被细菌和宿主的吸收。
其他一些有机酸(例如乳酸)是由许多细菌产生的,存在于整个消化道中。酸化的肠道环境还可以降解螯合微量营养素的复合物并促进铁的吸收。
扩展阅读:
▼
考虑到补铁的依从性低以及腹泻或便秘等副作用,很多研究已经测试和发现其他改善铁状态的策略。
它们包括使用益生菌、益生元和后生元等。
•使用益生菌改善铁状况
例如,将益生菌植物乳杆菌(Lactiplantibacillus plantarum 299v)与铁、抗坏血酸和叶酸一起食用,对健康、非贫血的瑞典孕妇的铁状况是安全的,可减少铁储备的损失并改善铁状况。
在另一项研究中,将果胶组装成铁纳米颗粒作为基质,用于植物乳杆菌(Lactiplantibacillus plantarum CIDCA 83114)的递送。益生菌没有毒性,生存能力没有减弱,这为用替代的铁输送策略对抗缺铁提供了新的视角。
•使用益生元帮助铁的吸收
在大鼠模型中,食用益生元寡糖通过调节肠道微生物群来增强铁吸收。摄入益生元后肠道pH值的降低可以帮助铁的吸收,此外还能以有益的方式改变肠道微生物组成。因此,益生元可以成为改善宿主铁状况的良好选择。
•食用乳铁蛋白增加铁的吸收
在肯尼亚婴儿中,研究表明,与单独服用硫酸亚铁相比,同时食用无铁乳铁蛋白(脱铁乳铁蛋白)和硫酸亚铁能够显著增加铁的吸收。
注:考虑到乳铁蛋白对肠道微生物群的影响,一些学者认为乳铁蛋白可能在婴儿铁配方中有用,因为它可以增加铁的吸收,同时可能减轻未吸收的铁对肠道微生物群的不利影响。
•使用富铁微生物
这些预防和治疗缺铁的新策略可能包括使用富铁微生物,除了从益生菌摄入中获益之外,它还可以为宿主提供大量矿物质。
在贫血小鼠中已显示,食用在铁存在下生长的酵母能够提高小鼠的血红蛋白浓度。在人类中只进行了一些尝试,其中含有富铁酵母的奶酪的吸收效率不如单独含有硫酸铁的奶酪。
注:还应该进行补充研究来评估富铁微生物在人类中的应用的全部潜力。
小结
从上面可以明显看出,肠道细菌在调节宿主铁的生物利用度方面发挥着重要作用。然而,宿主因素可以调节细菌对铁的吸收,例如,在炎症的情况下,脂质运载蛋白将与铁载体结合,从而对抗肠道细菌对铁的捕获。
最近,有人提出,共生细菌不仅使用不同的机制来释放和捕获铁,而且还在它们自己和它们的宿主之间共享铁。事实上,细菌扩散性铁载体生产的例子可以捕获铁,但不能保证这些铁将被生产细菌利用,这表明对可用铁的共同管理。
迄今为止,人类对锌、宿主和肠道微生物群之间相互作用的研究远少于铁。
★ 人体需要每日摄入锌
每日摄入锌补充剂,成人 40 毫克/天,通常被认为是安全的。
锌参与DNA合成、转录和翻译等重要过程。锌的吸收发生在十二指肠,涉及跨膜锌转运蛋白Zip4。然后,锌通过锌调节蛋白ZnT2-10转运至金属蛋白合成位点,或通过锌转运蛋白ZnT1输出至循环系统。
与铁相反,哺乳动物缺乏锌储存机制,每日摄入是必不可少的。如果过量,锌也可以主动排泄,锌通过基底外侧的 Zip5/Zip14 蛋白从循环分配到肠上皮细胞,并通过ZnT5从肠上皮细胞流出到管腔。
肠道微生物群在锌吸收中的作用示意图
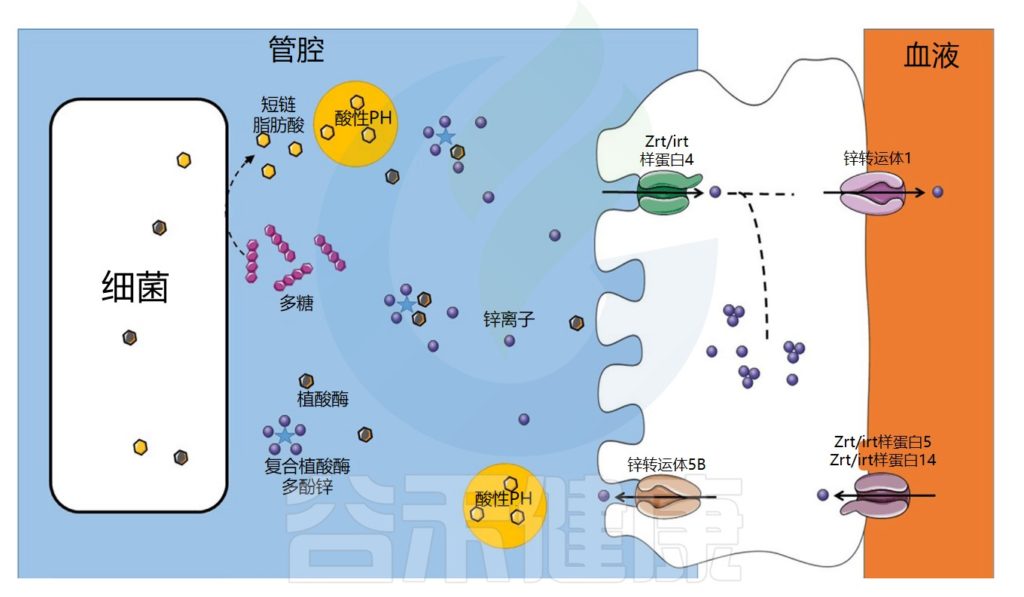
Dje Kouadio DK,et al.Crit Rev Food Sci Nutr.2023
锌的转运与吸收过程
在食物中,锌可以与抗营养因子如植酸盐或多酚络合,从而减少其吸收。未被小肠吸收的锌会到达结肠,并可能被结肠细胞吸收,因为锌转运蛋白也在结肠中表达。
在细菌中,锌通过锌伴侣蛋白转运至金属蛋白合成位点。细菌对锌的吸收受锌吸收抑制因子Zur和锌流出抑制因子CzrA的调节。一些病原菌可以通过表达高亲和力转运蛋白(ZnuABC)来克服锌限制条件。
锌浓度过高可能对某些病原菌有毒。与铁的情况一样,宿主和病原微生物之间也存在竞争。事实上,宿主还利用营养免疫来通过产生钙卫蛋白来限制锌的生物利用度。
例如,钙卫蛋白在消化道中结合锌。
▼
锌缺乏与慢性腹泻相关。补锌对肠道微生物群的影响主要在动物模型中进行研究。它已在家禽和养猪业中以药物剂量用于减少胃肠道感染和腹泻。
√锌具有抗菌活性,能够减少腹泻
锌具有抗菌活性,不同的研究强调了高剂量的锌会引起肠道不同部位(从胃到结肠)细菌组成的变化。
在断奶仔猪中,使用低剂量的锌可以通过改善小肠形态和通透性、增强屏障功能,有效促进生长性能并减少腹泻。
此外,锌还能丰富肠道微生物群中的链球菌科(Streptococcaceae)和乳杆菌科(Lactobacillaceae),并减少芽孢杆菌和肠道疾病相关病原体,包括回肠腔中的梭状芽胞杆菌和克罗诺杆菌。
注:如果缺锌小鼠补充锌是有益的,那么过量的锌饮食摄入会改变肠道微生物群并降低对艰难梭菌感染的抵抗力。
√一些菌属可以预测锌的充足性
但研究结果并不一致。事实上,一项针对鸡的研究表明,瘤胃球菌属(Ruminococcus)可以预测宿主体内锌的充足性。但在一项针对小鼠的研究中,黑色素杆菌(Melainabacteria)和脱硫弧菌属(Desulfovibrio)被确定为锌状态的潜在标志物。
▼
尽管许多代谢过程都需要锌,但关于锌状态或补充剂对肠道微生物群影响的研究却很少。
√一些细菌可以作为锌缺乏的生物标志物
最近的研究表明,尽管缺锌和锌充足的学龄儿童之间的细菌多样性相似,但缺锌儿童的个体多样性更高。特别是,粪杆菌(Coprobacter)、醋酸弧菌(Acetivibrio)、副普雷沃氏菌(Paraprevotella)和梭状芽胞杆菌在缺锌组中更为丰富。它们可以用作进一步临床诊断锌缺乏的生物标志物,但需要更多的工作来推广这一结果。
锌的摄入量也会显著增加儿童粪便细菌。在同一项研究中还鉴定出了纳米颗粒抗性细菌的一些代表。
▼
由于补锌会改变肠道微生物群的组成和功能,因此许多研究已经研究了锌与益生菌一起服用的效果。
√锌与益生菌一起补充
例如,在大鼠中,施用在富锌培养基中生长的长双歧杆菌(Bifidobacterium longum CCFM1195)比单独补充锌更能有效地增加血浆锌浓度。
此外,一些细菌群(如乳杆菌科)的丰度随着富含锌的双歧杆菌的消耗而增加。使用富含硒和锌的植物乳杆菌对小鼠进行类似的设计,与对照组或补充硒锌的组相比,能够增加循环锌浓度。这种增加伴随着肠道细菌组成的改变,乳杆菌科(Lactobacillaceae)的比例增加。
√儿童单独补充锌可能更有效
最近总结了研究中获得的数据,对于24个月以下儿童的治疗,单独补充锌可能比益生菌更有效;在学龄前儿童中同时补充锌和植物乳杆菌并不比单独补充益生菌更有效。因此,锌和益生菌联合给药的有效性需要更多的人体研究。
使用益生元似乎效率较低,因为给猪施用锌和马铃薯纤维对大多数分析指标没有显示出任何交互作用。
注:锌源和纤维补充对微生物群生态的影响是独立的。
小结
与铁的情况一样,对锌状态和宿主微生物群的研究主要集中在致病条件上,而对细菌在正常情况下的作用知之甚少。
肠道细菌、锌和宿主之间的关系值得更深入地研究,尤其是在人类中。事实上,富锌益生菌等有前途的工具正在出现,它们代表了治疗锌缺乏症的替代方案。特别是大剂量、长期补锌可能会干扰铁和铜的吸收,导致铁和铜的缺乏。
叶酸,也可以称之为维生素B9,是一种水溶性维生素。叶酸在蛋白质合成及细胞分裂与生长过程中具有重要作用,对正常红细胞的形成有促进作用。
一些共生细菌已被证明可以合成某些维生素,细菌也可以成为宿主叶酸的来源,即使整体贡献的程度不清楚。同时,叶酸的摄入会影响肠道微生物群。
叶酸的转运与吸收过程
饮食中的叶酸以单谷氨酸盐和聚谷氨酸盐形式存在,它们被肠道结合物分解为单谷氨酸盐形式,然后通过特定的转运蛋白偶联叶酸转运蛋白(PCFT)在回肠中吸收。
在肠上皮细胞中,叶酸单谷氨酸转化为活性形式5-甲基四氢叶酸(5-MTHF),它可以被运输到循环系统。
注:细胞叶酸外排可能由多个耐药蛋白(MRPs)家族介导。在结肠中,已经发现了相同的一种受体。
肠道微生物群在叶酸吸收中的作用示意图
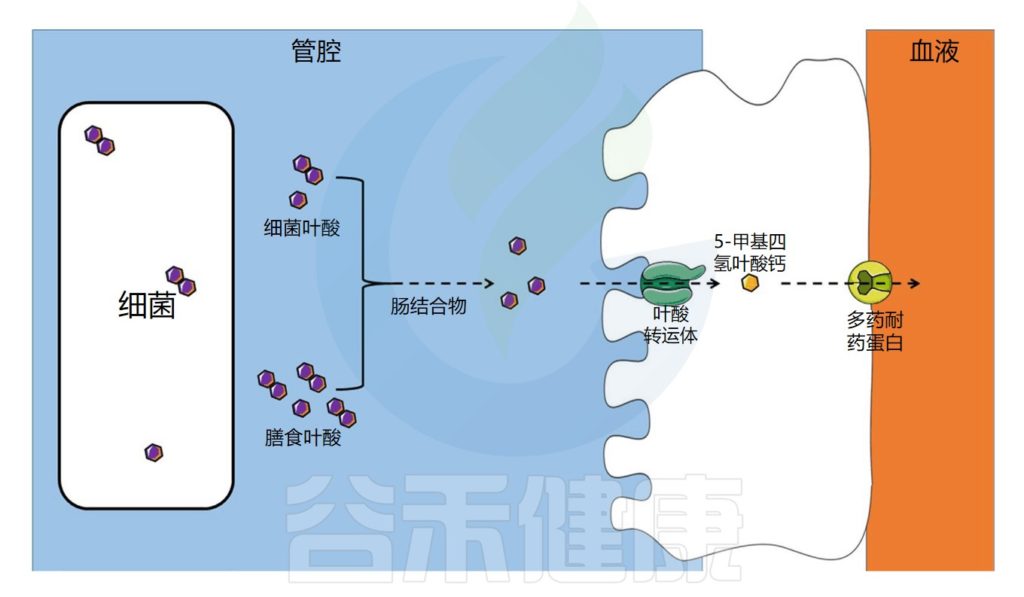
Dje Kouadio DK,et al.Crit Rev Food Sci Nutr.2023
▼
细菌的生长需要叶酸,一些细菌是原养型细菌,可以从环境中存在的前体合成叶酸,而营养缺陷型细菌必须从环境中获取叶酸。
✦肠道细菌合成叶酸
大量文献支持细菌叶酸合成对宿主叶酸状态的重要贡献。早期研究报告称,人类粪便样本中的叶酸浓度为300-500µg/天,而饮食摄入量低于100µg/天,表明肠道细菌可以合成叶酸。
事实上,512个细菌基因组的叶酸生物合成能力预测表明,其中13%的细菌基因组包含所有叶酸生物合成相关基因,而39%的细菌基因组可以在外部来源提供额外的对氨基苯甲酸的情况下合成叶酸。
总而言之,这些数据表明肠道微生物群是叶酸的重要来源,并且饮食等不同因素导致的肠道微生物群组成的变化可能会影响叶酸的需求。
✦肠道细菌可以转化叶酸以便更好地利用
由于纤维消耗而改变肠道微生物群组成可能导致结肠内容物或循环中叶酸浓度增加。此外,尽管结肠中的叶酸吸收比小肠中的叶酸吸收慢100倍,但标记的叶酸被专门包裹在结肠中并在结肠中分解,并被纳入宿主组织。
肠道细菌不仅合成可供宿主使用的叶酸,还可以将叶酸转化为更好地被宿主吸收的维生素体,正如秀丽隐杆线虫(Caenorabditis Elegans)模型所证明的那样,其中细菌可以将叶酸转化为四氢叶酸。
✦微生物代谢叶酸的能力与宿主生理状况相关
肠道微生物群的代谢能力不仅取决于其组成,还取决于宿主的生理特征。例如,与成人相比,婴儿和幼儿肠道微生物群中更频繁地发现编码参与叶酸生物合成的酶的基因。
有趣的是,受营养不良影响的儿童的微生物组显示,参与B族维生素代谢的多个途径中的基因丰度显著降低。此外,在肥胖女性中观察到叶酸水平较低,同时产生B族维生素的细菌也减少。
▼
许多产生叶酸的细菌被鉴定并成功用于增加发酵食品的叶酸含量。其中一些细菌还能够改善缺乏叶酸饮食的啮齿动物的叶酸状况。
✦产生叶酸的益生菌改善叶酸状态并调节微生物组成
使用产生叶酸的益生菌可能是改善叶酸状态并调节肠道微生物群的一种方法。在体外发现了有希望的结果,其中产生叶酸的清酒乳杆菌(Latilactobacillus sakei)被证明可以增加短链脂肪酸并改变粪便细菌组成。
在大鼠中,食用使用产生叶酸的植物乳杆菌制备的发酵奶能够恢复正常的叶酸状态,同时广泛改变肠道细菌组成。
▼
叶酸摄入量对肠道细菌的影响并不一致。
✦叶酸缺乏可能影响部分动物的肠道细菌组成
在小鼠身上发现膳食叶酸缺乏不会影响肠道细菌组成,可能是一些细菌可以在缺乏时产生叶酸,叶酸摄入量的波动对肠道微生物群的影响较小。
然而,在其他动物模型中,叶酸摄入改变了肠道微生物群的组成,例如鸡和小猪。
✦叶酸缺乏影响微生物多样性
叶酸缺乏也会影响微生物多样性,因为在限生小鼠中发现,与微量营养素充足的饮食相比,叶酸缺乏的饮食在21天后增加了β多样性,但随后的14天全饮食治疗并没有改变这一趋势。
小结
宿主的叶酸状态、食物或肠道中的叶酸产生细菌之间存在多种关联。这种关联通常是矛盾的,但有利于宿主和细菌区室之间的密切相互作用,这表明需要进行大规模人类研究,以更好地了解与叶酸可用性和改善人群叶酸状态的策略相关的宿主-微生物群相互作用。
叶酸重要天然来源有:
花生(246微克/100克)、葵花籽(238微克/100克)、芦笋(149微克/100克)、生菜(136微克/100克)、一些绿叶蔬菜和柑橘类水果等。
扩展阅读:维生素B9(叶酸)
维生素A在免疫调节中发挥着至关重要的作用,包括调节细胞因子的产生和淋巴细胞归巢至粘膜表面。它通过调节肠上皮中免疫细胞的增殖和分化,直接有助于维持肠道屏障,并在抵抗肠道病原体入侵方面发挥着至关重要的作用。
膳食维生素A以视黄醇和类胡萝卜素的形式存在,分别存在于动物和蔬菜中。
肠道微生物群在维生素A吸收中的作用示意图
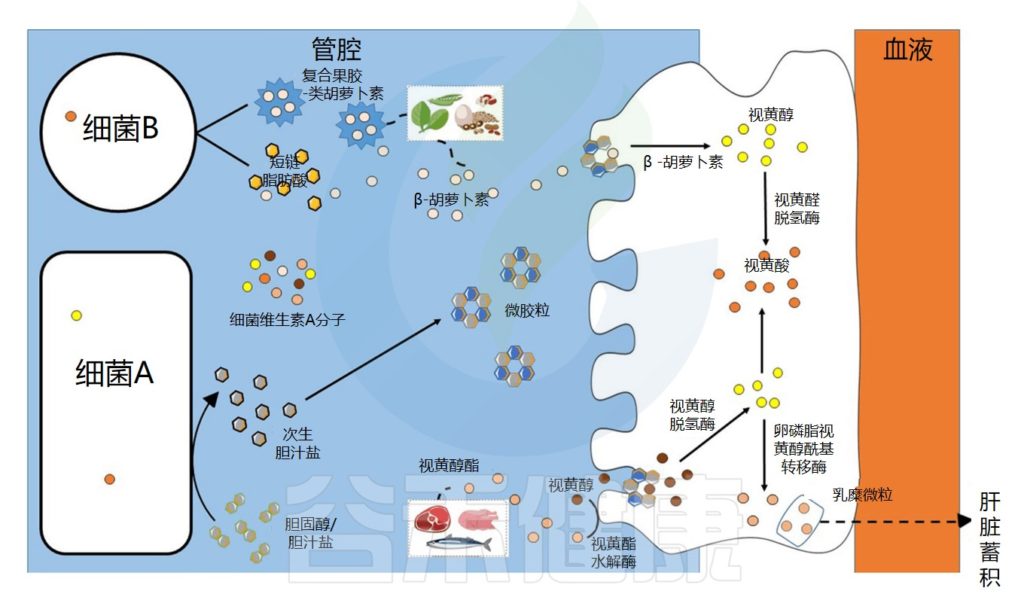
Dje Kouadio DK,et al.Crit Rev Food Sci Nutr.2023
维生素A的吸收过程
视黄醇和类胡萝卜素是膳食脂溶性成分,在被肠上皮细胞吸收之前需要通过胶束溶解 。在胃和十二指肠中发生乳化成液滴的阶段,类胡萝卜素和视黄醇的摄取发生在小肠的上半部。
在肠上皮细胞中,类胡萝卜素通过胡萝卜素-15,15′-双加氧酶直接转化为全反式视黄醛。视黄醛可被视黄醛脱氢酶不可逆地转化为具有生物活性的视黄酸分子,或被转化为视黄醇酯,储存在肝脏中。
▼
肠道微生物群在维生素A代谢中的作用可能依赖于特定酶、脂多糖的产生,脂多糖可能有助于胶束形成或直接吸收,以及胆汁稳态。
•微生物通过调节胆汁酸有利于维生素A的溶解和吸收
一项以绵羊为模型的研究表明,宿主微生物群通过调节胆汁酸分泌对维生素A吸收产生影响。在该模型中,胆汁酸水平降低与维生素A吸收减少相关,并与瘤胃球菌科丰度密切相关。
由乳杆菌(Lactobacillaceae)、双歧杆菌(Bifidobacterium)、拟杆菌(Bacteroides)或梭菌属等细菌产生的二级或三级胆汁盐的分泌可能有利于维生素A的溶解并改善其吸收,因为胆汁盐对于胶束化过程至关重要。
•肠道微生物可以直接和间接影响维生素A代谢
肠道细菌的基因组具有在动物和植物中发现的不同酶的类似物,这些酶允许乙酰辅酶A通过甲羟戊酸途径合成类胡萝卜素和类维生素A。
此外,来自拟杆菌(Bacteroides)、肠球菌(Enterococcus)和链球菌(Streptococcus)的细菌具有与宿主BCMO基因相似的brp/blh基因,可以将β-胡萝卜素转化为全反式视黄醇。
因此,肠道微生物组对维生素A代谢的影响既包括直接影响(如类胡萝卜素的合成),也包括间接影响(如调节其生物利用度)。
•肠道微生物合成相关蛋白有助于维生素A转运
类胡萝卜素的生物利用度会受到各种食物成分的影响,其中食物基质中蔬菜的细胞壁结构和组成形成物理屏障,从而限制消化酶的作用。
果胶和一些多酚(例如柚皮素)已被证明可以通过结合管腔中的胆固醇和胆汁盐来降低类胡萝卜素的体外生物利用度,从而抑制胶束的形成。
相反,果胶可以被许多共生细菌降解,并且肠道中的这种降解可能会增加类胡萝卜素的生物利用度。
此外,肠道微生物群合成酶或补体蛋白,例如细菌脂质运载蛋白,这可能有助于将类维生素A转运到肠上皮细胞中。
•肠道细菌调节宿主视黄醇的代谢
肠道微生物群可以消化膳食纤维,从而释放 β-胡萝卜素或其他结合态的微量营养素。
此外,肠道细菌群还可以调节宿主视黄醇的代谢,调节驱动免疫反应的视黄酸的产生。梭状芽胞杆菌类细菌可以通过抑制基因Rdh7的表达来调节肠道上皮中的视黄酸浓度,从而启动视黄醇向视黄酸的转化。
此外,这项研究表明,共生细菌群落降低了视黄酸的产生,视黄酸的产生通过肝脏储存形式的增加来平衡,并有利于视黄酯途径,而潜在致病菌则促进视黄酸的产生。
▼
肠道中维生素A的状态和类视黄醇的可用性可以调节肠道微生物的组成。
•维生素A调节免疫球蛋白的产生帮助保持细菌稳态
类胡萝卜素摄入、免疫功能和肠道细菌稳态之间相互作用的模型,表明维生素A可以通过调节IgA的产生来有助于保持细菌稳态。
在动物中,与未缺乏维生素A的小鼠相比,缺乏维生素A的小鼠的肠道微生物组成中,以下菌属的丰度较低:
另一项研究表明,拟杆菌在维生素A缺乏小鼠中的比例较低,维生素A缺乏组和维生素A充足组之间的几个细菌比例不同。在小鼠模型中,维生素A被证明可以调节分段丝状细菌(SFB)的丰度。
分段丝状细菌是一组能够诱导Th17细胞分化的细菌。
▼
•维生素A的摄入与微生物群多样性相关
类胡萝卜素的摄入量和状态与更大的微生物群多样性和有益细菌丰度的增加有关。
例如,在孕妇中,类胡萝卜素的摄入量和血浆浓度与肠道微生物群的α多样性呈正相关。
•维生素A影响免疫反应
维生素A对肠道微生物群组成的调节可能作为调节肠道免疫反应的间接途径。
例如,维生素A在体外和体内均被证明可以抑制诺如病毒(急性胃肠炎最常见的病毒因子)的复制,并且这种抑制似乎是通过微生物组变化直接或间接发生的,特别是肠道中的乳杆菌科。
•改善疾病患者的微生物组成
在溃疡性结肠炎患者中,摄入维生素A有益,可导致微生物群组成发生显著变化。
在自闭症儿童中,维生素A补充剂增加了拟杆菌目细菌的比例,并减少了双歧杆菌属的细菌比例。
有趣的是,一项针对306名孟加拉国新生儿的研究表明,与安慰剂相比,补充维生素A增加了男孩双歧杆菌的丰度,而这种差异在女孩中并未观察到。
对这些婴儿直至2岁的随访表明,女孩中放线菌相对丰度与血浆视黄醇呈浓度依赖性正相关,但男孩中则不然。
此外,阿克曼菌(一种与粘膜相关的细菌)的相对丰度也与女孩的血浆视黄醇呈正相关。
微生物群在肠道中参与了微量营养素的代谢和吸收,并且可以影响宿主的微量营养素状态。在这方面,给出以下一些建议:
➤ 1
摄入多样化的食物可以为肠道微生物提供更广泛的营养来源,从而促进微生物群的多样性和稳定性。
建议摄入富含膳食纤维的水果、发酵食物、蔬菜、全谷类食物以及富含微量营养素的食物,如坚果和海鲜等。
例如,香蕉钾含量高,还含有大量维生素 B6 和维生素 C。西兰花不仅富含维生素 C,还富含维生素 K、铁、钙和钾。
确保摄入足够的每种维生素和矿物质的一个简单方法就是“彩虹饮食”,彩虹饮食顾名思义就是色彩缤纷的蔬菜和水果,它们含有丰富的微量营养素,是一种健康趋势。每餐可以注意一下,是否有至少三到四种不同颜色的植物性食物,对于孩子,也可以鼓励他们去寻找不同的颜色。

下表列出了常见的维生素的食物来源,可供参考。

➤2
维生素D可以增加肠道对钙的吸收能力,并促进钙的转运到骨骼和其他组织中。
维生素 C 有助于改善植物中铁的吸收,这对于素食者来说尤其重要,可以在菠菜沙拉中添加柠檬汁。维生素C通过提高铁的溶解度或作为十二指肠细胞色素B将铁从铁还原为铁的辅助因子,有助于非血红素铁的生物利用度。
维生素B12和叶酸之间存在相互依赖的关系。维生素B12参与叶酸的代谢和激活,而叶酸则有助于维生素B12的合成和利用。
其他如,维生素E是一种脂溶性维生素,需要脂肪的存在来促进其吸收。摄入适量的脂肪可以提高维生素E的吸收率。
微量营养素之间的相互作用是复杂的,并且还受到其他因素的影响,最好的方式是通过均衡的饮食来获取各种微量营养素,因为食物中的微量营养素通常以复杂的组合形式存在,相互之间的相互作用更加协调和自然。
➤3
益生菌和益生元是一些有益的微生物和它们的营养物质,可以促进肠道的健康和微生物群的平衡。
建议摄入含有益生菌的酸奶、发酵食品、益生元的食物如洋葱、大蒜和麦麸等,以支持肠道微生物的生长和活动。
益生菌和益生元可能有助于微量营养素的最佳生物利用度,减少负面影响
例如,益生元低聚半乳糖减轻了补铁对婴儿肠道的不利影响,而罗伊氏乳杆菌与泻药氧化镁结合使用可以改善儿童的慢性便秘,而不会导致微生物组失衡。
益生元可以改变肠道微生物群,促进产短链脂肪酸的菌产生(如双歧杆菌、乳酸杆菌、真杆菌等),与钙吸收(在人类和动物模型中)、骨密度和强度(在动物模型中)增加相关。
扩展阅读:
肠道微生物群与健康:探究发酵食品、饮食方式、益生菌和后生元的影响
➤4
一般来说,在小谷物食品的自然发酵中,B族维生素的利用率可能会增加,并且可能会产生一些氨基酸,虽然说谷物含有一些维生素,但在小谷物食品发酵过程中添加乳酸菌或酵母可能会提高维生素水平。
例如,添加乳酸乳球菌N8 和布拉酵母菌Saccharomyces boulardii SAA655可将 idli 面糊中核黄素和叶酸的浓度提高 40-90%。
注:Idli 是印度的一种传统发酵面包,是一种由大米和脱壳黑豆原料的混合物,经过湿磨和传统发酵制成的糕点。
尽管小米主要用于制造面粉,但其加工(发芽和发酵)会增加谷物的铁含量。
➤5
抗生素的滥用可能破坏肠道微生物群的平衡,影响微量营养素的代谢和吸收。
抗生素还可能导致肠道黏膜的炎症反应,进一步干扰微量营养素的吸收和利用。
在使用抗生素时,建议按照医生的指导使用,并且在必要时采取预防措施,如同时摄入益生菌和益生元,以减少对肠道微生物的不良影响。
扩展阅读:
➤6
过度摄入糖或长期的压力和焦虑会对肠道微生物和宿主营养吸收产生不良后果。
深加工食品通常经过多道工序,其中许多有益的营养物质可能被去除或破坏。这些食品通常富含添加剂、防腐剂和高糖分,而这些成分可能会对微量营养素的吸收和利用产生负面影响。
通过减少摄入加工食品、管理压力等干预措施,可以帮助改善营养吸收和维持良好的微量营养素水平。
扩展阅读:
你的焦虑可能与食品添加剂有关,警惕食品添加剂引起的微生物群变化
➤7
运动可以改善血液循环,增加血液流向肠道和其他组织,从而提高微量营养素的输送和吸收。
运动还可以提高新陈代谢,提高能量消耗和细胞代谢的速度。这可能会导致对微量营养素的需求增加,从而促进其吸收和利用。
➤8
定期体检可以帮助发现潜在的营养和健康问题,及早采取措施。
定期进行体检是监测体内微量营养素的一种方法,但它可能无法提供详细的微量营养素水平信息。常规体检通常包括血液检查,可以检测一些关键的营养素水平,如铁、维生素B12、维生素D等。对于有些微量营养素,可能需要进行特殊的检测。
➤9
由于每个人的肠道微生物群和微量营养素状态可能存在差异,个体化的营养咨询和评估可以帮助确定针对个体需求的饮食和营养。
肠道菌群和微量营养素之间存在着紧密的关系和相互作用。肠道菌群中的某些菌种可以帮助合成和吸收微量营养素。这些菌种通过代谢和转化,将食物中的原始形式的微量营养素转化为人体可以吸收和利用的活性形式,提供给宿主机体所需。
同时,适当的微量营养素摄取也对肠道菌群的平衡和健康至关重要。一些微量营养素,如锌、铁等,不仅是肠道菌群的生长和代谢所必需,还能影响菌群的结构和功能。缺乏这些微量营养素可能导致菌群紊乱,而菌群紊乱又可能影响微量营养素的吸收和利用。
肠道细菌对宿主微量营养素状态的影响是一个急需关注的研究领域。同时对微量营养素代谢的研究应该扩大到包括一般肠道微生物组成,而不仅仅是病原菌。
相关阅读:
主要参考文献
Dje Kouadio DK, Wieringa F, Greffeuille V, Humblot C. Bacteria from the gut influence the host micronutrient status. Crit Rev Food Sci Nutr. 2023 Jun 27:1-16.
Amimo, J., H. Michael, J. Chepngeno, S. Raev, L. Saif, and A. Vlasova. 2022. Immune impairment associated with vitamin A deficiency: Insights from clinical studies and animal model research. Nutrients 14 (23):5038.
Baldi, A. J., L. M. Larson, and S.-R. Pasricha. 2020. Balancing safety and potential for impact in universal iron interventions. Global Landscape of Nutrition Challenges in Infants and Children 93:51–62.
Cuisiniere, T., A. Calve, G. Fragoso, M. Oliero, R. Hajjar, E. Gonzalez, and M. Santos. 2021. Oral iron supplementation after antibiotic exposure induces a deleterious recovery of the gut microbiota. BMC Microbiology 21 (1):1–15.
Kang, S., R. Li, H. Jin, H. Y ou, and G. Ji. 2020. Effects of selenium and zinc-enriched Lactobacillus plantarum SeZi on antioxidant capacities and gut microbiome in an ICR mouse model. Antioxidants 9 (10):1028.
Kramer, J., Ö. Özkaya, and R. Kümmerli. 2020. Bacterial siderophores in community and host interactions. Nature Reviews. Microbiology 18 (3):152–63.
McMillen, S., S. Thomas, E. Liang, E. Nonnecke, C. Slupsky, and B. Lonnerdal. 2022. Gut microbiome alterations following postnatal iron supplementation depend on iron form and persist into adulthood. Nutrients 14 (3):412.
Qin H, Wu H, Shen K, Liu Y, Li M, Wang H, Qiao Z, Mu Z. Fermented Minor Grain Foods: Classification, Functional Components, and Probiotic Potential. Foods. 2022 Oct 11;11(20):3155. doi: 10.3390/foods11203155. PMID: 37430904; PMCID: PMC9601907.